Настоящее изобретение относится к технологиям терапии. В частности, настоящая заявка относится к планированию протокола лучевой терапии объекта исследования с использованием излучения для подачи контролируемой терапии в заданное место и описано в дальнейшем с конкретной привязкой к указанному применению.
Онкологическая лучевая терапия служит для лечения пораженной ткани подведением ионизирующего излучения, например, высокоэнергетических фотонов, протонов, нейтронов, электронов, тяжелых заряженных частиц (например, ионов углерода) и т.п. к пораженной ткани или пораженной заболеванием области. Как правило, облучаемая здоровая ткань получает по меньшей мере некоторые поражения при лучевой терапии, и данное излучение может давать вредные побочные эффекты. Для минимизации поражения здоровой ткани, как для пораженной ткани, так и для подвергаемой риску здоровой ткани устанавливают вероятностные модели. Примерами указанных моделей являются вероятность обезвреживания опухоли (TCP) и вероятность повреждения здоровых тканей после облучения (NTCP). Модель TCP является вероятностной моделью заболевания, которая дает оценку локального обезвреживания опухоли с учетом типа опухоли и особенностей плана облучения для данного конкретного пациента. Модель NTCP является вероятностной моделью лучевого поражения, причиняемого здоровой ткани, приводящего к побочным эффектам некоторой тяжести. Тяжесть побочных эффектов, вызванных излучением, оценивают по специальным показателям, например, таким, которые предложены в Критериях количественной оценки острого лучевого поражения Европейской организации по исследованию и лечению рака/Онкологической группы по лучевой терапии ((EORTC/RTOG) Acute Radiation Morbidity Scoring Criteria). Планирование протокола лучевой терапии представляет собой поиск компромиссного решения между моделью TCP и моделью NTCP. Оптимальная опухолевая доза при данном плане лучевой терапии максимально увеличивает различие между моделью TCP и моделями NTCP для разных подвергаемых риску органов. Следовательно, модель NTCP является ограничивающим дозу фактором.
Модели NTCP являются сигмоидальными функциями, которые устанавливают взаимосвязь опухолевой дозы с вероятностью лучевого поражения в здоровой ткани. Распространенной моделью плотности вероятности побочных эффектов является Гауссова функция. Другие модели применяют отличающиеся математические функции, например, статистические модели Пуассона или регрессионные модели. Общим для всех подходов является то, что гистограмма доза-объем (DVH) оценивается для усредненной дозы, обычно в виде эквивалентной однородной дозы EUD. Наиболее широко используемой вероятностной функцией является модель Лаймана для EUD, которая дает функцию ошибок, которая прогнозирует 50% вероятность осложнений. Уравнение имеет следующий вид:
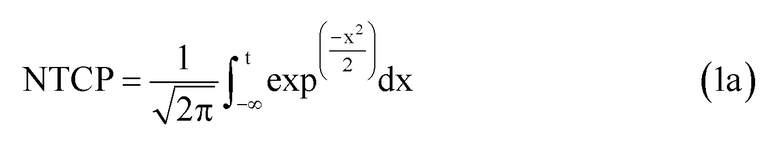


Параметр m означает наклон сигмоидальной кривой NTCP, и доза TD50 определяется 50% риском осложнения. Уравнение 1c представляет распространенный подход к вычислению дозы EUD NTCP по DVH (гистограмме доза-объем). Параметр D i означает физическую дозу для элемента объема V i, при этом суммарный расчетный объем органа равен V tot. Принцип дозы EUD связан с разными воздействиями локального лучевого поражения на функцию органа в целом. Например, позвоночник не будет функционировать даже при разрушении небольшой его части. Напротив, печень и легкое могут удовлетворительно функционировать даже при разрушении значительных частей. Позвоночник является примером так называемого последовательно функционирующего органа; легкие и печень являются так называемыми параллельно функционирующими органами. Доза EUD описывает именно данное свойство органа. В уравнении 1c параметр n модели соответствует мощности объемных эффектов для рассматриваемого органа. Если n приближается к 1, то доза EUD равна средней дозе, т.е. модель описывает идеально «параллельно функционирующий» орган, в котором присутствует большой объемный эффект. Если n приближается к 0, то доза EUD становится максимальной дозой, т.е. модель описывает идеально «последовательно функционирующий» орган, в котором отсутствует какой-либо объемный эффект. Как отмечено, сообщалось о различных моделях для средней дозы, используемой в модели NTCP.
Модели NTCP для различных побочных эффектов в разных органах основаны на данных гистограммы доза-объем (DVH). Указанные модели определяют подгонкой параметров математических моделей NTCP к фактическим профилям побочных эффектов, которые найдены в процессе соответствующих клинических исследований. Достаточно исчерпывающая оценка, данная в публикации Sohn et al. (Int. J. Rad. Oncol. Biol. Phys., 67 (2007), 1066-1073), показала, что разные модели NTCP обеспечивали разные особенности оценки вероятности конкретного побочного эффекта (в случае указанной публикации, последующего ректального кровотечения при лучевой терапии рака простаты). Однако анализ данной группы целиком основан на распределении величин (DVH) дозы облучения. Вплоть до настоящего времени клинические исследования с моделями NTCP в очень малой степени касались индивидуальных характеристик риска пациентов. Следовательно, существующие модели NTCP представляют средние по совокупности статистические данные.
Однако чувствительность к облучению может значительно различаться для разных людей. Например, пациенты с абдоминальной хирургией в анамнезе обычно менее устойчивы к облучению, чем пациенты, ранее не подвергавшиеся абдоминальному хирургическому вмешательству. Что касается дозы EUD, то посредством подразделения групп пациентов на пациентов с абдоминальной хирургией в анамнезе и пациентов без нее, были определены фактор изменения дозы 1,1 для ректального кровотечения и фактор 2,5 для энкопреза. Игнорирование указанных индивидуальных факторов риска образует систематическую погрешность существующих моделей NTCP, приводящую к ошибочным оценкам NTCP для отдельных лиц. Завышение оценки NTCP может приводить к подаче субоптимальной дозы к опухоли и, следовательно, снижает степень обезвреживания опухоли и тем самым является причиной возможного рецидива у пациента. Занижение оценки NTCP может приводить к тяжелым побочным эффектам, которые могут преждевременно остановить терапию.
Модели TCP являются сигмоидальными функциями, которые устанавливают зависимость опухолевой дозы с вероятностью обезвреживания опухоли. Распространенной моделью плотности вероятности побочных эффектов является Гауссова функция. Другие модели применяют отличающиеся математические функции, например, статистические модели Пуассона или регрессионные модели. Общим для всех подходов является то, что гистограмма доза-объем (DVH) оценивается для усредненной дозы обычно в виде эквивалентной однородной дозы EUD. Наиболее широко используемой вероятностной функцией является модель Лаймана для EUD, которая дает функцию ошибок, которая прогнозирует 50% вероятность осложнений. Уравнение имеет следующий вид:



Параметр m означает наклон сигмоидальной кривой TCP, и доза TD50 определяется 50% риском осложнения. Уравнение 2c представляет распространенный подход к вычислению дозы EUD TCP по DVH (гистограмме доза-объем). Параметр D j означает физическую дозу для элемента объема V j, при этом суммарный расчетный объем органа равен V tot. Параметр n модели соответствует мощности объемных эффектов для рассматриваемого органа. Если n приближается к 1, то доза EUD равна средней дозе, т.е. модель описывает идеально «параллельно функционирующий» орган, в котором присутствует большой объемный эффект. Если n приближается к 0, то доза EUD становится максимальной дозой, т.е. модель описывает идеально «последовательно функционирующий» орган, в котором отсутствует какой-либо объемный эффект.
Настоящее изобретение предлагает новые и усовершенствованные способ и устройство для планирования адаптивного протокола лучевой терапии, которые основаны на оптимизации вероятности повреждения здоровых тканей и вероятности обезвреживания опухоли в соответствии с индивидуальными маркерами для каждого пациента и решают вышеуказанные и другие проблемы.
В соответствии с одним аспектом способ создания индивидуального плана терапии содержит создание исходного плана терапии. Терапию проводят в соответствии с исходным планом терапии. Либо исходный план терапии основывают на значении по меньшей мере одного биомаркера, либо план терапии исправляют с учетом обновленного значения по меньшей мере одного измеренного биомаркера и терапию повторно проводят в соответствии с исправленным планом терапии.
В соответствии с другим аспектом машиночитаемый носитель информации содержит программу, которая управляет процессором для выполнения способа создания индивидуального плана терапии.
В соответствии с другим аспектом процедура планирования запрограммирована с возможностью управления устройством терапии для выполнения способа создания индивидуального плана терапии.
В соответствии с другим аспектом система терапии содержит сканер для визуализации, устройство терапии, графический пользовательский интерфейс и планирующий процессор для выполнения способа создания индивидуального плана терапии.
В соответствии с другим аспектом процессор выполнен с возможностью создания исходного плана терапии с учетом по меньшей мере одного измеренного биомаркера. Процессор управляет устройством терапии для проведения терапии по исходному плану терапии.
В соответствии с другим аспектом способ индивидуальной адаптивной подачи лучевой терапии в заданную область содержит стадию определения первого набора индивидуальных маркеров. На основании первого набора биомаркеров определяют по меньшей мере одну из модели NTCP и модели TCP и затем применяют для подачи дозы облучения в заданную область. Определяют второй набор индивидуальных маркеров. Взаимосвязь между первым набором и вторым набором индивидуальных биомаркеров служит основой для по меньшей мере одной из второй модели NTCP и второй модели TCP. Дозу облучения в заданную область подают на основании по меньшей мере одной из второй модели NTCP и второй модели TCP.
Одно из преимуществ состоит в том, что индивидуальная адаптивная подача лучевой терапии повышает вероятность обезвреживания опухоли, что подавляет ненужный рецидив у пациента.
Другое преимущество состоит в том, что индивидуальная адаптивная подача лучевой терапии ослабляет тяжелые побочные эффекты токсичности облучения.
Другое преимущество состоит в том, что дозу облучения или план лечения можно изменять с учетом реакции пациента на терапию.
Другие дополнительные преимущества настоящего изобретения станут понятными специалистам со средним уровнем компетентности в данной области техники после прочтения и изучения нижеследующего подробного описания.
Фиг.1 - схематичное изображение системы визуализации и лучевой терапии;
Фиг.2 - блок-схема последовательности операций процедуры моделирования NTCP;
Фиг.3 - блок-схема последовательности операций процедуры моделирования TCP;
Фиг.4 - графическое представление исходных моделей NTCP и TCP и их разности;
Фиг.5 - графическое представление моделей NTCP и TCP после оптимизации для максимального увеличения разности; и
Фиг.6 - графическое представление дополнительной оптимизации модели NTCP.
Изобретение может представлять собой форму различных компонентов и схем расположения компонентов и форму различных стадий и схем расположения стадий. Чертежи предназначены только для иллюстрации предпочтительных вариантов осуществления и не подлежат истолкованию в смысле ограничения изобретения.
Как показано на фиг.1, система 10 терапии, например система лучевой терапии, содержит сканер 12 для диагностической визуализации, например, сканер для визуализации методом компьютерной томографии (КТ-сканер), сканер для магнитно-резонансной визуализации (MRI) или подобное устройство для получения диагностических изображений с целью применения при планировании протокола лучевой терапии. КТ-сканер 12 содержит рентгеновский источник 14, установленный на поворотном гентри 16. Рентгеновский источник 14 генерирует рентгеновское излучение, проходящее сквозь область 18 обследования, в которой рентгеновское излучение взаимодействует с заданной зоной объекта исследования (не показанного), размещенного на опоре 20, которая позиционирует заданную зону внутри области обследования 18. Матрица 22 детекторов рентгеновского излучения расположена так, чтобы получать рентгеновский пучок после того, как данный пучок проходит сквозь область 18 обследования, в которой рентгеновское излучение взаимодействует с объектом исследования и частично поглощается последним. Поэтому зарегистрированное рентгеновское излучение содержит информацию о поглощении, относящуюся к объекту исследования.
КТ-сканер 12 работает с управлением от контроллера 30 для выполнения выбранных последовательностей визуализации выбранной заданной зоны объекта исследования, которая подлежит лечению методом лучевой терапии. Последовательности визуализации получают данные диагностической визуализации заданной зоны. Данные диагностической визуализации записываются в буфере 32 данных. Реконструирующий процессор 34 реконструирует представленные 3-мерные изображения по полученным данным визуализации, и реконструированные представленные изображения записываются в память 36 диагностических изображений.
Описанная система диагностической визуализации является всего лишь примерной. Специалистам в данной области техники будет очевидно, что КТ-сканер 12 заменим, по желанию, сканерами для диагностической визуализации других типов, например, вместо КТ-сканера 12 можно применить сканер для магнитно-резонансной визуализации (MRI), сканер позитронной эмиссионной томографии (PET), сканер однофотонной эмиссионной компьютерной томографии (SPECT) или подобное устройство.
Устройство 12 диагностической визуализации является отдельным от системы 40 подачи терапии. Система подачи терапии может быть внешней системой подачи лучевой терапии или внутренней системой подачи лучевой терапии, например, брахитерапии. Перед диагностической визуализацией, необязательно, на объект исследования наносят маркеры и оставляют в заданном месте в течение последующей лучевой терапии, чтобы обеспечивать совмещение диагностических изображений с подачей лучевой терапии. Предусмотрена возможность применения других способов пространственного совмещения полученного диагностического изображения и лучевой терапии, например, использование внутренних анатомических маркеров. Предусмотрена также возможность объединения сканера для диагностической визуализации с устройством лучевой терапии для уменьшения рассовмещения между диагностической визуализацией и лучевой терапией. Кроме того, предусмотрена также возможность других форм терапии, например, абляционной терапии, включая термотерапию, химиотерапию, терапию высокоинтенсивным сфокусированным ультразвуком (HIFU), механическую терапию и т.п., или терапию комбинированных типов, например, лучевую терапию в сочетании с химиотерапией.
Система 40 подачи излучения содержит устройство 42 для подведения излучения, которое содержит источник 44 излучения, например, линейный ускоритель, сфокусированный рентгеновский источник или подобное устройство, установленные на поворотном гентри 46. Гентри 46 поворачивает или пошагово перемещает источник 44 излучения вокруг оси 48 поворота. Опора 50 неподвижно позиционирует объект исследования, при этом заданная зона облучается пучком 52 излучения с модулируемой интенсивностью, создаваемым источником 44 излучения. Опора 50 позиционирует и перемещает объект исследования, а гентри 46 поворачивает источник 44 излучения вокруг объекта исследования. Пучок 52 излучения имеет площадь 54 поперечного сечения с регулируемой интенсивностью и/или периметром. Во время терапии пучок 52 излучения можно подводить непрерывно или включать и выключать в импульсном режиме. Необязательно, система регистрации излучения расположена относительно пациента со стороны, противоположной источнику, чтобы контролировать интенсивность излучения, проходящего через пациента. Данные из детектора можно реконструировать в изображение проекции с невысокой разрешающей способностью для контроля совмещения пучка и заданного места и дозы. Система 40 подачи излучения работает с управлением от контроллера 60 облучения для выполнения выбранного протокола облучения, назначенного планирующим процессором 70.
Планирующий процессор 70 объединяет индивидуальную информацию относительно конкретного пациента, получаемую от одного или множества биомаркеров, в вычисление модели NTCP и модели TCP, с применением индивидуального вычисления дозы EUD для каждой модели, учитывающей биомаркеры, например, длину теломера, которая связана с чувствительностью к облучению клеток. В одном варианте осуществления при введении фактора изменения дозы в формулу для дозы EUD (уравнение 1c), биомаркеры можно оценивать до и после терапии для получения индивидуальных моделей NTCP и TCP. Уравнения для адаптивной дозы EUD имеют следующий вид:
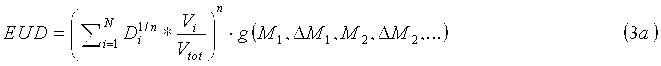

Индивидуальные факторы g NTCP и g TCP изменения дозы являются скалярными величинами, оценку которых получают на основании исходных базовых данных, а также изменений биомаркерной информации M и L во время терапии. Например, g NTCP=1,1 для пациентов с побочным эффектом кровотечения; g=2,5 для побочного эффекта в виде энкопреза и т.п. Первые базовые данные представляют собой набор биомаркерных значений, соответствующих нормальной ткани, которые получают перед терапией. Базовые значения, соответствующие нормальной ткани, M k, будут использованы для адаптации исходной модели NTCP перед терапией. Контроль биомаркеров во время терапии позволяет оптимизировать модель NTCP для каждого пациента на основании индивидуальных реакций на терапию. Обусловленные терапией изменения ΔM k сопоставляют с базовыми значениями и затем включают в фактор EUD NTCP изменения дозы. Вторые базовые данные представляют собой набор биомаркерных значений, соответствующих раковой ткани, которые получают перед терапией. Базовые значения, соответствующие раковой ткани, L k, будут использованы для адаптации исходной модели TCP перед терапией. Контроль биомаркеров во время терапии позволяет оптимизировать модель TCP для каждого пациента на основании индивидуальных реакций на терапию. Обусловленные терапией изменения ΔL k сопоставляют с базовыми значениями и затем включают в фактор EUD TCP изменения дозы. Процессор 72 биомаркеров отвечает за инициализацию факторов изменения дозы на основании базовых значений, M j и L k и оптимизацию фактора изменения дозы во время терапии на основании обусловленных терапией изменений ΔM k и ΔL k.
Маркерные значения M k, соответствующие нормальной ткани, включают различные виды, например, значения проб in vitro, масс-спектрометрические сигнатуры белков, анамнестические данные и историю болезни. Значения проб in vitro содержат клеточное, протеомное и генетическое происхождение, такие как, но без ограничения, подсчеты различных клеток, анализы Hb (гемоглобина), CRP (C-реактивного белка), PSA (простатспецифического антигена), TNF-α (факторов некроза опухоли), ферритина, трансферрина, LDH (лактатдегидрогеназы), IL-6, гепсидина, креатинина, глюкозы, HbA1c (гликированного гемоглобина) и длины теломера. Анамнестические маркеры и маркеры из истории болезни содержат предшествующую абдоминальную хирургическую операцию, гормональную или антикоагуляционную лекарственную терапию, диабет, возраст и показатели, связанные с ростом опухоли. Предполагается также возможность применения биомаркеров, не связанных с токсичностью излучения, такие как биомаркеры, соответствующие различным формам абляции или химиотерапевтических средств.
Маркерные значения L k, соответствующие раковой ткани, включают различные виды. Примеры биомаркеров содержат PSA (простат-специфический антиген) для опухолей простаты и длину теломера для чувствительности клеток к излучению, т.е. теломеры меньшей длины соответствуют повышенной чувствительности к излучению. Геномные и протеомные биомаркеры, которые отражают чувствительность клеток к излучению и способность к восстановлению, содержат анализ комплексов, связывающихся с концевыми участками ДНК (DNA-EBC). Примеры анализа комплексов DNA-EBC содержат измерение ATM, Ku70, ДНК-лигазы III, Rpa32, Rpa14, ДНК-лигазы IV, XRCC4, WRN, BLM, RAD51 и p53. Как известно, гипоксия снижает чувствительность опухоли к ионизирующему излучению. Молекулярные биомаркеры, которые указывают на гипоксию опухоли, содержат HIF-1α, галектин-1, CAP43 и NDRG1. Биомаркеры гипоксии выводятся также на основе процедур визуализации, такие как FMISO-PET (позитронная эмиссионная томография (ПЭТ) с [18F]-фторимидонидазолом) и FAZA-PET (ПЭТ с [18F]-фторазомицинарабинозидом), которые подвергают изменениям парциальное давление кислорода для отдельных пикселей изображения.
Биомаркеры, описывающие различные гистологические результаты, содержат возраст, пол, лекарственную терапию, место первичной опухоли, предшествующее лечение, индивидуальные пожелания пациента, связанные с личными ощущениями, оценки потенциальных побочных эффектов и риск рецидива. Другие биомаркеры, описывающие гистологические результаты, содержат гистологический тип, степень, стадию опухоли, степень злокачественности по шкале Глисона и данные анализа коллагена, такие как плотность клоногенных клеток, колониеобразующую способность (CFE) и чувствительность клоногенных фибробластов к излучению, например, процент выживаемости при 2 Гр (SF2).
В другом варианте осуществления в формулу для дозы EUD TCP вводится фактор p TCP локальной коррекции для модификации элемента V j объема. Уравнение для EUD TCP, содержащее фактор локальной коррекции, имеет вид:
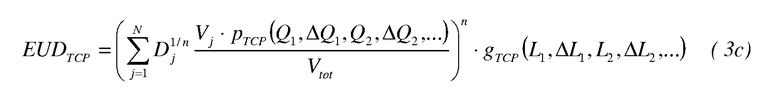
Фактор p TCP локальной коррекции осуществляет модификацию согласно базовым биомаркерам Q k и обусловленным терапией биомаркерам ΔQ k, которые определяют по данным визуализации. Биомаркеры содержат отек, перфузию и тканевую жидкость, которые можно определить различными способами визуализации, такими как магнитно-резонансный, рентгеновский, радионуклидный, ультразвуковой, оптический и т.п.
Процессор биомаркеров выводит фактор изменения дозы на вход процессора дозы EUD 74, при этом данный процессор обновляет вычисление дозы EUD (уравнение 2) с учетом оптимизированного фактора изменения дозы. Затем процессор EUD выводит оптимизированное вычисление дозы EUD на вход процессора NTCP 76 и процессора TCP 78, каждый из которых выводит соответствующую оптимизированную модель (уравнения 1a и 2a) на пульт 80.
Пульт 80 содержит графический пользовательский интерфейс, а также содержит устройство пользовательского ввода, которым может пользоваться врач для управления контроллером 30 сканера или контроллером 60 облучения, чтобы выбирать последовательности или протоколы сканирования и схемы или дозы лечения, соответственно. На пульте отображаются диагностические изображения, инструментальные средства для сегментации, графики, имеющие отношение к моделям TCP, NTCP и разности между двумя моделями и т.п. Оптимизированные модели NTCP и TCP применяются онкологом-радиологом для определения, требуется ли скорректировать план лечения в части суммарной подаваемой дозы, локализации дозы или замены схемы лечения альтернативными вариантами, например, трехмерной конформальной лучевой терапией, лучевой терапией с модуляцией интенсивности (IMRT) или другой подходящей схемой фракционирования дозы. Контроль биомаркеров во время терапии позволяет адаптировать модели NTCP и TCP с учетом конкретного пациента.
Как также показано на фиг.2, модель NTCP уточняется при выполнении итерационной процедуры, в ходе которой оптимизированный фактор изменения дозы устанавливается в качестве базовых данных для последующих итераций. Сначала получают диагностическое изображение на стадии 90 с использованием методов КТ (компьютерной томографии), MRI (магнитно-резонансной визуализации), PET (позитронной эмиссионной томографии), SPECT (однофотонной эмиссионной компьютерной томографии) или другого метода визуализации. На стадии 92 заданный участок локализуют на диагностическом изображении и после этого совмещают с системой 40 подачи излучения с использованием любого числа средств, такие как активные, пассивные или собственно анатомические маркеры. Биомаркеры оценивают на стадии 94. Биомаркеры могут быть измерены in vitro, получены на основании истории болезни, анамнестических данных, спектрометрических сигнатур белков и т.п. Отдельным биомаркерам присваивают значения, которые затем используют для вычисления оптимизированного фактора изменения дозы на стадии 96. В процессе первой итерации (при i=1) фактор изменения дозы основан на исходных базовых данных, так как при этом отсутствует априорный фактор изменения дозы. Затем фактор изменения дозы используют для взвешивания модели EUD NTCP на стадии 98 в ответ на индивидуальные биомаркеры, оцененные на стадии 94. Индивидуальную модель EUD NTCP используют при вычислении модели NTCP на стадии 100. Затем модель NTCP выводится на стадии 102 (фиг.4 и 5) на графический дисплей пульта 80 вместе с моделью TCP, и NTCP и TCP сравниваются на стадии 104. Затем онколог-радиолог определяет, требуется ли оптимизировать план лучевой терапии, на стадии 106. Указанные корректировки могут содержать коррекцию подаваемой суммарной дозы, локализации дозы или изменение режима лечения на другой режим, такие как IMRT (лучевая терапия с модуляцией интенсивности), 3-мерная конформальная лучевая терапия, или другая схема фракционирования дозы. На стадии 108 доза облучения подается в заданное место в соответствии с оптимизированным планом облучения. Оптимизированный фактор изменения дозы устанавливается в качестве базовых данных на стадии 110, и выполняются повторные итерации оптимизации, пока онколог-радиолог не сможет определить, что лечения больше не требуется.
Как показано на фиг.3, модель TCP уточняется при выполнении итерационной процедуры, в ходе которой оптимизированный фактор изменения дозы устанавливается в качестве базовых данных для последующих итераций. Сначала получают диагностическое изображение на стадии 120 с использованием методов КТ, MRI, PET, SPECT или другого метода визуализации. На стадии 122 заданный участок локализуют на диагностическом изображении и после этого совмещают с системой 40 подачи излучения, с использованием любого числа средств, таких как активные, пассивные или собственно анатомические маркеры. Биомаркеры оценивают на стадии 124. Биомаркеры могут быть измерены in vitro, получены на основании истории болезни, анамнестических данных, спектрометрических сигнатур белков и т.п. Отдельным биомаркерам присваивают значения, которые затем используют для вычисления оптимизированного фактора изменения дозы на стадии 126. В процессе первой итерации (при i=1), фактор изменения дозы основан на исходных базовых данных, так как при этом отсутствует априорный фактор изменения дозы. Затем фактор изменения дозы используют для взвешивания модели EUD TCP на стадии 128 в ответ на индивидуальные биомаркеры, оцененные на стадии 124. Индивидуальную модель EUD TCP используют при вычислении модели TCP на стадии 130. Затем модель TCP выводится на стадии 132 (фиг.4 и 5) на графический дисплей пульта 80 вместе с моделью NTCP, и NTCP и TCP сравниваются на стадии 134. Затем онколог-радиолог определяет, требуется ли оптимизировать план лучевой терапии, на стадии 136. Указанные корректировки могут содержать коррекцию подаваемой суммарной дозы, локализации дозы или изменение режима лечения на другой режим, такой как IMRT, 3-мерная конформальная лучевая терапия, или другую схему фракционирования дозы. На стадии 138 доза облучения подается в заданное место в соответствии с оптимизированным планом облучения. Оптимизированный фактор изменения дозы устанавливается в качестве базовых данных на стадии 140, и выполняются повторные итерации оптимизации, пока онколог-радиолог не сможет определить, что лечения больше не требуется.
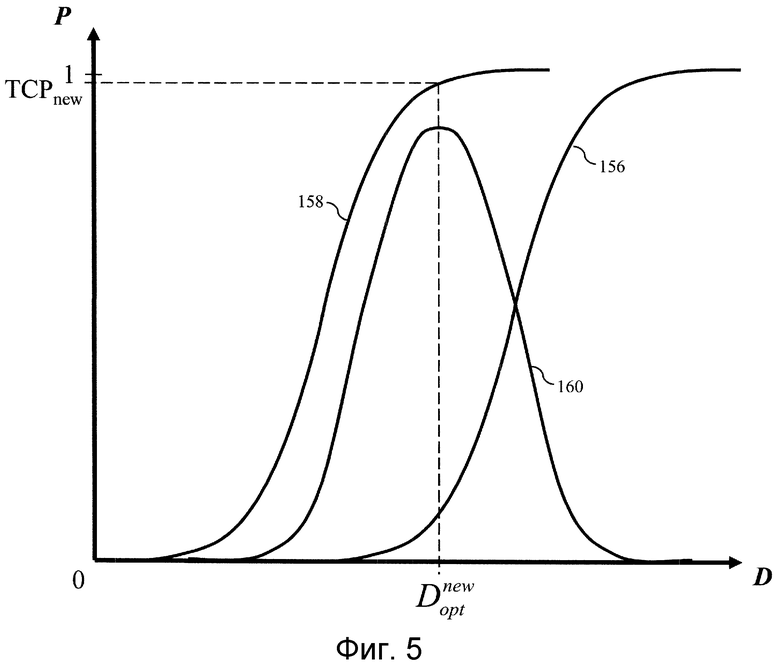
На фиг.4 показан примерный график исходной или предшествующей лечению модели NTCP 150 и модели TCP 152, выводимый на графический интерфейс пульта 80 для проверки онкологом-радиологом. Модель NTCP оптимизируют для максимального увеличения разности 154 между моделью NTCP и моделью TCP. Оптимизированная модель NTCP, показанная на фиг.5, демонстрирует оптимизированную модель NTCP 156, для которой моделируется TCP 158 и, в результате, получается большая разность 160 между оптимизированной моделью NTCP и моделью TCP. Лечение обычно вызывает воспаление здоровой ткани. Во время лучевой терапии кривую NTCP оптимизируют снова с учетом реакций тканей пациента. В примере, показанном на фиг.6, ранее оптимизированная модель NTCP повторно оптимизирована с использованием биомаркеров для различных окружающих тканей, исправленных с учетом соответствующих им степеней воспаления, чтобы сформировать повторно оптимизированную модель NTCP 162, которая имеет следствием ослабление облучения нормальной ткани, при этом новая модель TCP 164 имеет большее значение, чем предыдущая модель TCP 158, и разность 166 оказывается меньше, что приводит к усилению облучения пораженной ткани, а также здоровой ткани. Таким образом, дозу облучения можно изменять от одного сеанса лечения к другому сеансу лечения, с учетом вызванных лечением или других изменений в тканях, прилегающих к заданной области.
В другом варианте осуществления индивидуальные факторы g NTCP и g TCP вычисляют для каждого вокселя или группы вокселей. Получаемые уравнения для дозы EUD имеют следующий вид:
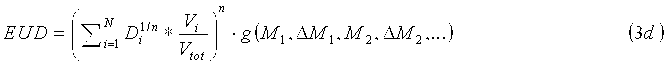
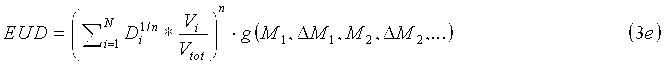
где g i и g j означают факторы изменения дозы для каждого частичного объема. Например, дозу EUD можно вычислять для множества частичных объемов интересующей области, например, почки. Кроме того, представленное изображение можно графически реконструировать с изображением дозы EUD по всей интересующей области, что позволяет системе подачи излучения подавать локализованную дозу.
В другом варианте осуществления создают неитерационный индивидуальный план адаптивной лучевой терапии. Исходный план лучевой терапии создают посредством исправления традиционной модели NTCP и/или модели TCP с использованием по меньшей мере одного измеренного биомаркера от пациента до подачи дозы облучения. Затем традиционные модели NTCP и/или TCP, созданные с использованием известных способов в соответствии с известным уровнем техники, математически изменяют на величину, соответствующую индивидуальному биомаркеру. Первоначальная и последующие дозы облучения подаются по исходному плану лучевой терапии или могут быть модифицированы в ходе последующих сеансов, как пояснялось выше.
В другом варианте осуществления создают традиционный план лучевой терапии на основании традиционной модели NTCP и/или TCP. Традиционные модели NTCP и/или TCP создают с использованием известных способов в соответствии с известным уровнем техники Первоначальную дозу облучения подают в заданную область по традиционному плану лучевой терапии. Исправленный план лучевой терапии создают посредством модификации традиционной модели NTCP и/или TCP с учетом по меньшей мере одного биомаркера от пациента. Значение, соответствующее индивидуальному биомаркеру, используют для математической модификации традиционной модели NTCP и/или TCP. Исправленный план лучевой терапии уточняют в процессе итерационной процедуры, при которой биомаркер контролируют между последовательными дозами облучения, и исправленную модель NTCP и/или TCP обновляют на основании разностей между предыдущим измерением и текущим измерением. То есть, при первой итерации для подачи дозы облучения используют традиционные модели NTCP и/или TCP. При второй итерации традиционные модели NTCP и/или TCP исправляют с учетом по меньшей мере одного измеренного биомаркера и вторую дозу облучения подают на основании исправленных моделей NTCP и/или TCP. В ходе последующих итераций исправленные модели NTCP и/или TCP дополнительно уточняют на основании математической зависимости между ранее измеренными биомаркерами и текущими измеренными биомаркерами.
В другом варианте осуществления создают традиционный план лучевой терапии на основании традиционной модели NTCP и/или TCP. Традиционную модель NTCP и/или TCP создают с использованием известных способов в соответствии с известным уровнем техники. Первоначальную дозу облучения подают в заданную область по традиционному плану лучевой терапии. Перед подачей первоначальной дозы облучения измеряют по меньшей мере один исходный биомаркер. Исправленный план лучевой терапии создают путем модификации традиционной модели NTCP и/или TCP на основании математической зависимости между обновленным биомаркером и исходным биомаркером. Исправленный план лучевой терапии уточняют в процессе итерационной процедуры, при которой биомаркеры обновляют между последовательными сеансами лучевой терапии. То есть при первой итерации для подачи дозы облучения используют традиционную модель NTCP и/или TCP и создают исходный биомаркер. При второй итерации традиционную модель NTCP и/или TCP исправляют на основании взаимосвязи между обновленным биомаркером и исходным биомаркером и вторую дозу облучения подают на основании исправленной модели NTCP и/или TCP. В ходе последующих итераций исправленную модель NTCP и/или TCP дополнительно уточняют на основании математической зависимости между ранее измеренным биомаркером и текущим измеренным биомаркером.





Группа изобретений относится к медицине, онкологии и касается формирования плана индивидуальной терапии пациента. Способ включает формирование исходного плана терапии с помощью вероятностной модели осложнения здоровой ткани (NTCP) и вероятностной модели подавления опухоли (TCP) целевой области. Модели NTCP и TCP адаптируют на основании начальных количественных значений набора биомаркеров пациента. После применения исходной терапии формируют исправленный план терапии с помощью моделей NTCP и TCP, адаптированных на основании обновленных после применения терапии количественных значений набора биомаркеров. Начальные и обновленные модели NTCP выражены в виде функции эквивалентной однородной дозы (EUD), модифицированной с использованием скалярной величины. Значения наборов биомаркеров представляют собой определяемые путем исследования значения параметров из группы: уровни Hb, CRP, PSA, TNF-α, ферритина, трансферрина, LDH, IL-6, гепсидина, креатинина, глюкозы, HbA1c, комплексов, связывающихся с концевыми участками ДНК (DNA-EBC), HIF-lα, галектина-1, САР43 и/или NDRG1; длина теломера; тип опухоли; степень опухоли; стадия опухоли; расположение первичной опухоли; степень злокачественности по шкале Глисона; данные анализа уровня коллагена; предшествующее лечение в виде абдоминальной хирургии, гормональной лекарственной терапии, антикоагуляционной лекарственной терапии; наличие диабета; возраст пациента. Используют машиночитаемый носитель информации, содержащий программу, которая управляет процессором для выполнения данного способа, и процессор, сконфигурированный для выполнения стадий способа. Изобретения обеспечивают индивидуальное адаптивное планирование терапии онкологического пациента с оптимизацией вероятности повреждения здоровых тканей и обезвреживания опухоли в соответствии с индивидуальными маркерами для каждого пациента. 3 н. и 5 з.п. ф-лы, 6 ил.
1. Способ формирования плана индивидуальной терапии, где способ содержит следующие стадии:
(a) формирование исходного плана терапии для ее применения пациенту, где исходный план терапии формируют с помощью вероятностной модели осложнения здоровой ткани (NTCP) и вероятностной модели подавления опухоли (TCP) целевой области и где модель NTCP и модель TCP адаптируют на основании начальных количественных значений набора биомаркеров пациента, и
после применения терапии пациенту на основании исходного плана терапии:
(b) формирование исправленного плана терапии для ее применения пациенту, где исправленный план терапии формируют с помощью модели NTCP и модели TCP и где модель NTCP и модель TCP адаптируют на основании обновленных количественных значений набора биомаркеров,
где обновленные количественные значения набора биомаркеров представляют собой значения после применения терапии; и
где начальные и обновленные модели NTCP выражены в виде функции эквивалентной однородной дозы (EUD), модифицированной с использованием скалярной величины,
и где значения наборов биомаркеров представляют собой определяемые путем исследования значения параметров, выбранных из группы:
уровни Hb, CRP, PSA, TNF-α, ферритина, трансферрина, LDH, IL-6, гепсидина, креатинина, глюкозы, HbA1c, комплексов, связывающихся с концевыми участками ДНК (DNA-EBC), HIF-lα, галектина-1, САР43 и/или NDRG1;
- длина теломера;
- тип опухоли;
- степень опухоли;
- стадия опухоли;
- расположение первичной опухоли;
- степень злокачественности по шкале Глисона;
- данные анализа уровня коллагена;
предшествующее лечение в виде абдоминальной хирургии, гормональной лекарственной терапии и/или антикоагуляционной лекарственной терапии;
- наличие диабета;
и/или
- возраст пациента.
2. Способ по п. 1, в котором модель TCP дополнительно выражена в виде функции эквивалентной однородной дозы (EUD) и по меньшей мере одна из стадий (а) или (b) дополнительно включает:
модификацию функции EUD с использованием скалярной величины.
3. Способ по п. 2, в котором скалярная величина является фактором изменения дозы, и способ дополнительно включает:
начальную установку фактора изменения дозы перед применением; и
модификацию фактора изменения дозы на основании математической зависимости между значениями первого и второго наборов биомаркеров, сформированных, соответственно, на стадиях (а) и (b),
где модель NTCP, адаптированную на стадии (b), определяют следующим образом:

где

где

где TDz означает дозу, которая обеспечивает Z% вероятность риска осложнения, Di означает физическую дозу для объема Vi заданной области, Vtot означает суммарный расчетный объем органа, M1, М2, … означает значения первого набора биомаркеров, ΔM1, ΔМ2, … означает разность между значениями первого и второго наборов биомаркеров, gNTCP является скалярной величиной, полученной на основании значений набора биомаркеров и разностей значений набора биомаркеров, и n изменяется от 0 для максимальной дозы до 1 для минимальной дозы, и
где модель TCP, адаптированную на стадии (b), определяют следующим образом:
где
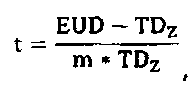
где

где TDz означает дозу, которая обеспечивает Z% вероятность риска осложнения, Di означает физическую дозу для объема заданной области, Vtot означает суммарный расчетный объем органа, L1, L2, … означает значения первого набора биомаркеров, ΔL1, ΔL2, … означает разность между значениями первого и второго наборов биомаркеров, gTCP является скалярной величиной, полученной на основании значений набора биомаркеров и разностей значений набора биомаркеров, и n изменяется от 0 для максимальной дозы до 1 для минимальной дозы.
4. Способ по любому из пп. 1-3, дополнительно включающий:
получение изображения целевой области;
сегментирование целевой области;
определение модели NTCP;
определение модели TCP;
регистрацию целевой области на диагностическом изображении для системы подачи терапии;
выполнение стадий (а) и (b);
повторную регистрацию целевой области и
повторение стадии (b), после того как терапия будет применена пациенту на основании исправленного плана терапии.
5. Способ по любому из пп. 1-3, где адаптация модели NTCP и TCP к пациенту в стадии (b) основана на математической зависимости между обновленными значениями наборов биомаркеров и соответствующими начальными значениями наборов биомаркеров.
6. Машиночитаемый носитель информации, содержащий программу, которая управляет процессором для выполнения способа по любому из пп. 1-5.
7. Процессор (70), сконфигурированный для выполнения следующих стадий:
(a) для вероятностной модели осложнения в здоровых тканях (NTCP) и вероятностной модели подавления опухоли (TCP), которая предназначена для формирования исходного плана терапии для ее применения пациенту, проводят адаптацию модели NTCP и модели TCP пациенту на основании количественных начальных значений набора биомаркеров пациента, и
после применения терапии пациенту на основании исходного плана терапии:
(b) проводят адаптацию модели NTCP и модели TCP, предназначенных для формирования исправленного плана терапии для ее применения пациенту, в стадии (b) на основании обновленных количественных значений набора биомаркеров,
где обновленные количественные значения набора биомаркеров представляют собой значения после применения терапии; и
где начальные и обновленные модели NTCP выражены в виде функции эквивалентной однородной дозы (EUD), модифицированной с использованием скалярной величины,
и где значения наборов биомаркеров представляют собой определяемые путем исследования значения параметров, выбранных из группы:
уровни Hb, CRP, PSA, TNF-α, ферритина, трансферрина, LDH, IL-6, гепсидина, креатинина, глюкозы, HbA1c, комплексов, связывающихся с концевыми участками ДНК (DNA-EBC), HIF-1α, галектина-1, САР4 3 и/или NDRG1;
- длина теломера;
- тип опухоли;
- степень опухоли;
- стадия опухоли;
- расположение первичной опухоли;
- степень злокачественности по шкале Глисона;
- данные анализа уровня коллагена;
- предшествующее лечение в виде абдоминальной хирургии, гормональной лекарственной терапии, и/или антикоагуляционной лекарственной терапии;
- наличие диабета;
и/или
- возраст пациента.
8. Процессор (70) по п. 7, где процессор сконфигурирован для применения модели NTCP и модели TCP пациенту в стадии (b) на основании математической зависимости между обновленными количественными значениями набора биомаркеров и соответствующими начальными количественными значениями набора биомаркеров.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЛИМФАДЕНОПАТИЙ РАЗЛИЧНОГО ГЕНЕЗА У ДЕТЕЙ | 2004 |
|
RU2268474C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО АБАКТЕРИАЛЬНОГО ПРОСТАТИТА/СИНДРОМА ХРОНИЧЕСКОЙ НЕВОСПАЛИТЕЛЬНОЙ ТАЗОВОЙ БОЛИ | 2003 |
|
RU2285445C2 |
| СПОСОБ ОТБОРА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ДЛЯ КОРРЕКЦИИ НАРУШЕНИЙ ИММУННОГО СТАТУСА ПРИ ОПУХОЛЕВОЙ БОЛЕЗНИ | 1992 |
|
RU2140081C1 |
| SOHN M.et al | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
Авторы
Даты
2015-09-27—Публикация
2010-02-18—Подача