Область техники, к которой относится изобретение
Настоящее изобретение относится к новым соединениям-производным циклических аминов, способам их получения, фармацевтическим композициям, содержащим такие соединения, и их применению в качестве лекарственных средств, в том числе для лечения или облегчения заболеваний, опосредованных простагландином Е, таких как острая или хроническая боль, остеоартрит, ассоциированные с воспалением нарушения, такие как артрит, ревматоидный артрит, злокачественные новообразования, мигрени и эндометриоз.
Соединения-производные циклических аминов по изобретению являются селективными антагонистами рецептора EP4.
Уровень техники
Ряд обзорных статей описывает характеристики и терапевтическую актуальность простаноидных рецепторов, а также наиболее широко используемых селективных агонистов и антагонистов; «Eicosanoids: From Biotechnology to therapeutic Applications», Folco, Samuelson, Maclouf and Velo eds, Plenum Press, New York, 1996, chap. 14, 137-154; «Molecular aspects of the structures and functions of the prostaglandin E receptors», Journal of Lipid Mediators and Cell Signalling, 1996, 14, 83-87; «Function of prostanoid receptors: studies on knockout mice», Prostaglandins & other Lipid Mediators, 2002, 68-69, 557-573 и «Prostanoid receptor antagonists: development strategies and therapeutic applications», British Journal of Pharmacology (2009), 158, 104-145. Простагландин E2 (PGE2) является представителем простаноидного семейства с множеством физиологических эффектов, включая защиту слизистой оболочки, индукцию секреции желудочного сока в желудке, формирование лихорадки, гипералгезию, воспаление и иммунитет. Эти действия простагландина PGE2 опосредованы четырьмя сопряженными с G-белками PGE2-рецепторами, EP1, EP2, EP3 и EP4. Простагландин PGE2, на самом деле, имеет аффинность ко всем этим EP-рецепторам (подтипам EP1, EP2, EP3, EP4, соответственно).
Рецептор EP4 является рецептором с 7 трансмембранными доменами, активация которого, как правило, ассоциируется с повышением уровней внутриклеточного циклического аденозинмонофосфата (цАМФ). Передача сигнала PGE2-активированным рецептором EP4 может быть вовлечена в различные патологические состояния, такие как боль (в частности, воспалительная, нейропатическая и висцеральная), воспаление, нейропротекция, злокачественные новообразования, дерматит, костные заболевания, иммунная дисфункция стимуляции сна, почечная регуляция, желудочная или кишечная секреция слизи и секреция бикарбоната в двенадцатиперстной кишке.
Исследования в The Journal of Immunology (2008, 181, 5082-5088) показывают, что PGE2 ингибирует синтез протеогликана и стимулирует деградацию матрикса в остеоартритных хондроцитах через рецептор EP4. Направленное воздействие на EP4, а не на циклооксигеназу 2, может представлять собой будущую стратегию для модификации течения остеоартрита.
Исследования European Journal of Pharmacology (2008, 580, 116-121) показывают, что фармакологическая блокада простаноидного рецептора EP4 может представлять собой новую терапевтическую стратегию для остеоартрита и/или ревматоидного артрита и их симптоматического облегчения.
Публикации патентных заявок WO 2005021508, WO 2005105732, WO 2005105733, WO 2007121578 и WO 2009139373 раскрывают соединения, пригодные при лечении заболеваний, опосредованных простагландином.
Сущность изобретения
Одна из задач настоящего изобретения заключается в получении соединений, имеющих антагонистическую активность по отношению к рецептору EP4, и специфических фармацевтических соединений, пригодных для лечения или облегчения заболеваний, опосредованных простагландином Е.
Авторы настоящего изобретения обнаружили новые соединения, которые являются селективными антагонистами подтипа EP4 рецепторов PGE2. В частности, соединения по изобретению обеспечивают анальгетическую и противовоспалительную активность.
Согласно общему аспекту, в настоящем изобретении описывается соединение циклического амина Формулы (I):
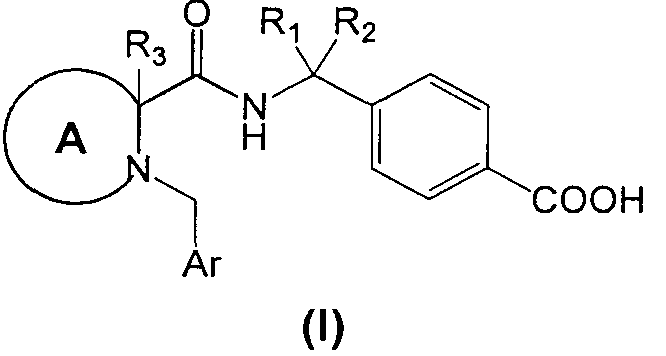
или его фармацевтически приемлемая соль или производное, в котором:
R1 и R2 независимо друг от друга являются водородом, линейным или разветвленным C1-3алкилом или объединены друг с другом с образованием циклопропильного кольца;
A выбрано из
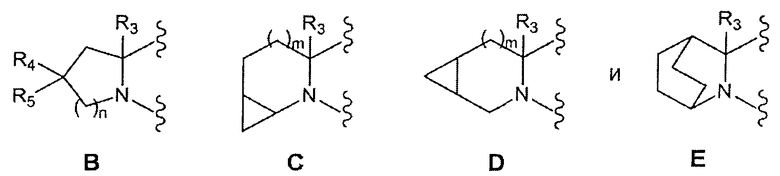
где:
n=0, 1 или 2
m=0 или 1
R3 представляет собой Н или линейный или разветвленный C1-3алкил
R4 и R5 независимо являются водородом, фтором, линейным или разветвленным C1-3алкилом или объединены друг с другом с образованием циклопропильного кольца,
Ar представляет собой
- фенил, имеющий:
i. в положении 4 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила, или
ii. в положении 3 один заместитель, выбранный из группы, состоящей из водорода, циано, трифторметила, при условии, что
ii.a. если А является В, то и R4, и R5 являются фтором, линейным или разветвленным C1-3алкилом или объединены вместе с образованием циклопропильного кольца,
ii.b. если А является С, то m равно 0
ii.c. если А является D, то m равно 1.
- 5-членное гетероароматическое кольцо, содержащее от 1 до 3 гетероатомов, в котором указанные гетероатомы независимо друг от друга являются S, О или N; или
- 6-членное гетероароматическое кольцо, содержащее от 1 до 3 атомов N.
В определенных воплощениях 6-членное гетероароматическое кольцо замещено, предпочтительно в положении 4, галогеном, циано или трифторметилом.
Термин «галоген» в данном изобретении означает атом фтора, хлора, брома или йода. В определенных воплощениях галогеном является хлор или фтор.
Термин «C1-3алкил» в данном изобретении относится к линейной или разветвленной углеводородной группе, содержащей от 1 до 3 атомов. Примеры таких групп включают метил, этил, н-пропил, изопропил.
В данном изобретении соединения Формулы (I) могут существовать в виде R и S энантиомеров и в виде рацемической смеси. Данное изобретение включает в себя все возможные изомеры и рацемические смеси. Там, где должны присутствовать дополнительные центры симметрии, данное изобретение включает все возможные диастереоизомеры, а также соответствующие смеси.
В другом аспекте настоящее изобретение относится к соединению Формулы (I), используемому в качестве лекарственного средства, в частности к его применению для лечения патологий, при которых необходим антагонист рецептора EP4, например для лечения острой и хронической боли, воспалительной боли, остеоартрита, расстройства, ассоциированного с воспалением, такого как артрит, ревматоидного артрита, злокачественных новообразований, эндометриоза и мигрени.
Подробное описание изобретения
Изобретение, таким образом, относится, в общем аспекте, к производным циклических аминов Формулы (I):
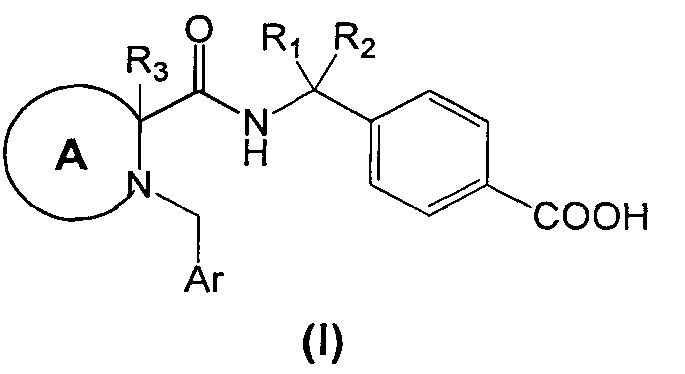
или их фармацевтически приемлемой соли, где:
R1 и R2 независимо являются водородом, линейным или разветвленным (C1-3)алкилом или объединены друг с другом с образованием циклопропильного кольца,
A выбирают из группы, состоящей из:
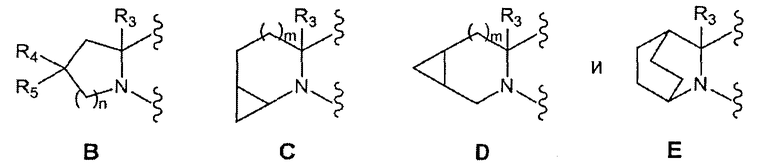
где:
n=0, 1 или 2
m=0 или 1
R3 представляет собой Н или линейный или разветвленный C1-3алкил,
R4 и R5 независимо являются водородом, фтором, линейным или разветвленным C1-3алкилом или объединены друг с другом с образованием циклопропильного кольца,
Ar представляет собой
- фенил, имеющий:
i. в положении 4 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила, или
ii. в положении 3 один заместитель, выбранный из группы, состоящей из водорода, циано, трифторметила, при условии, что
ii.a. если А является В, то и R4, и R5 являются фтором, линейным или разветвленным C1-3алкилом или объединены вместе с образованием циклопропильного кольца,
ii.b. если А является С, то m равно 0
ii.c. если А является D, то m равно 1.
- 5-членное гетероароматическое кольцо, содержащее от 1 до 3 гетероатомов, в котором указанные гетероатомы независимо друг от друга являются S, О или N; или
- 6-членное гетероароматическое кольцо, содержащее от 1 до 3 атомов N.
В определенных воплощениях Ar представляет собой фенил, замещенный в положении 4 галогеном, циано или трифторметилом.
В определенных воплощениях Ar является фенилом, замещенным в положении 4 трифторметилом.
В определенных воплощениях гетероатом 5-членного гетероароматического кольца является N.
В определенных воплощениях любое из 5-членного гетероароматического и 6-членного гетероциклического колец замещено галогеном, циано или трифторметилом. В этих воплощениях указанный галоген предпочтительно является фтором или хлором и согласно воплощению галоген является фтором.
Примеры подходящего 5-членного гетероароматического кольца, содержащего от 1 до 3 гетероатомов, выбранных из S, О и N, включают пирролил, имидазолил, пиразолил, триазолил, фуранил, оксазолил, оксадиазолил, тиенил, тиазолил, тиадиазолил и т.п.
Примеры 6-членного гетероароматического кольца, содержащего от 1 до 3 атомов N, включают пиридил, пиримидинил, пиразинил и триазинил.
В одном воплощении 6-членное гетероароматическое кольцо является пиридилом. В этом воплощении пиридиновое кольцо является замещенным, предпочтительно в положении 4, галогеном, циано или трифторметилом.
Следует понимать, что в данном изобретении ссылки на соединения Формулы (I) подразумевают включение также соединений с Формулами (IB), (IC), (ID), (IE) как описано далее в данном документе, если это уместно.
В первом аспекте изобретения производное циклического амина Формулы (I) содержит A, которое является кольцом В.
В соответствии с этим аспектом описывается подмножество соединений Формулы (IB)
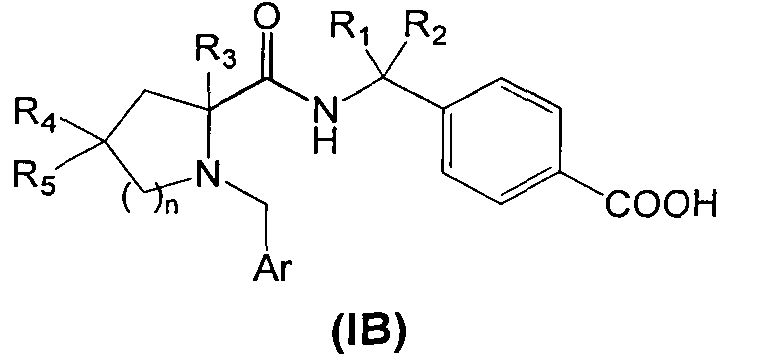
и/или их фармацевтически приемлемых производных или солей, где
n=0, 1 или 2
R1 и R2 независимо являются водородом, линейным или разветвленным C1-3алкилом или объединены друг с другом с образованием циклопропильного кольца,
R3 представляет собой Н или линейный или разветвленный (C1-3)алкил,
R4 и R5 независимо являются водородом, фтором, линейным или разветвленным (C1-3)алкилом или объединены друг с другом с образованием циклопропильного кольца,
Ar представляет собой
- фенил, имеющий:
i. в положении 4 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила, или
ii. в положении 3 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила, при условии, что как R4, так и R5 являются фтором, линейным или разветвленным C1-3алкилом или объединены вместе с образованием циклопропильного кольца,
- 5-членное гетероароматическое кольцо, содержащее от 1 до 3 гетероатомов, в котором указанные гетероатомы независимо друг от друга являются S, О или N; или
- 6-членное гетероароматическое кольцо, содержащее от 1 до 3 атомов N.
В определенных воплощениях n является 1 или 2, предпочтительно 2.
В соответствии с определенными воплощениями R4 и R5 объединены вместе с образованием циклопропильного кольца.
В определенных воплощениях R3 является Н или метилом, предпочтительно Н.
В определенных воплощениях R4 и R5 независимо являются водородом, фтором, линейным или разветвленным C1-3алкилом, обычно метилом, или объединены друг с другом с образованием циклопропильного кольца.
В определенных воплощениях R4 и R5 оба являются метилом.
В определенных воплощениях, где Ar является фенилом, галоген является фтором или хлором, и согласно одному из конкретных воплощений галоген является фтором.
В определенных воплощениях R4 и R5 являются Н, и Ar является фенилом, имеющим в положении 4 один заместитель, выбранный из группы, состоящей из галогена, циано и трифторметила.
В определенных воплощениях R4 и R5 вместе являются галогеном, предпочтительно фтором, линейным или неразветвленным C1-3алкилом, или соединены с образованием циклопропила, а Ar является фенилом, имеющим в положении 3 или 4 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила.
В определенных воплощениях Ar является фенилом, имеющим в положении 3 один заместитель, выбранный из трифторметила или фтора.
В определенных воплощениях любое из 5-членного гетероароматического и 6-членного гетероциклического колец замещено галогеном, циано или трифторметилом. В этих воплощениях указанный галоген предпочтительно является фтором или хлором.
В определенных воплощениях 6-членное гетероциклическое кольцо является пиридилом.
В определенных воплощениях n равно 1; R4 и R5 независимо выбирают из Н, фтора или метила, или R4 и R5 являются фтором или метилом.
В других воплощения n равно 2, R4 и R5 являются фтором.
Согласно одному из воплощений n равно 2, R4 и R5 объединены вместе с образованием циклопропильного кольца.
В определенных воплощениях n равно 2, Ar представляет собой фенил, замещенный в положении 4 одним заместителем, выбранным из группы, состоящей из фтора, хлора, циано, трифторметила, предпочтительно трифторметилом, a R1, R2, R3, R4, R5 являются такими, как определено выше.
Во втором аспекте настоящего изобретения производное циклического амина Формулы (I) содержит А, которое является кольцом С.
В соответствии с этим аспектом описывается подмножество соединений Формулы (IC):
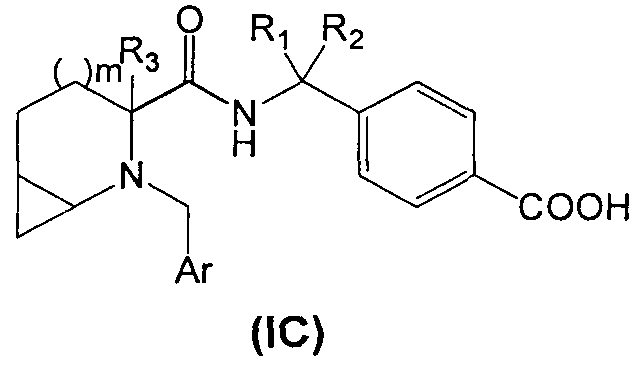
и/или его фармацевтически приемлемых солей или производных,
где m, R1 R2, R3 и Ar, в целом, такие же, как описано выше, если не указано иное.
В определенных воплощениях m равно 1.
В определенных воплощениях R1 и R2 независимо являются водородом, линейным или разветвленным C1-3алкилом, как правило метилом, или соединены друг с другом с образованием циклопропильного кольца.
В определенных воплощениях R3 представляет собой Н или линейный или разветвленный C1-3алкил, как правило, метил.
В определенных воплощениях R3 представляет собой Н.
В определенных воплощениях Ar представляет собой
- фенил, имеющий:
в положении 4 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила, где галоген, как правило, является фтором, или
в положении 3 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила, при условии, что m равно 0;
В определенных воплощениях любое из 5-членного гетероароматического и 6-членного гетероциклического колец замещено, предпочтительно в положении 4, галогеном, циано или трифторметилом.
В одном воплощении 6-членное гетероциклическое кольцо является пиридилом.
В определенных воплощениях m равно 0, а Ar представляет собой фенил, замещенный в положении 4 фтором, хлором, циано или трифторметилом, предпочтительно трифторметилом, a R1, R2, R3 такие же, как определено выше.
В третьем аспекте изобретения производное циклического амина Формулы (I) содержит А, которое является кольцом D.
В соответствии с этим аспектом описывается подмножество соединений Формулы (ID):
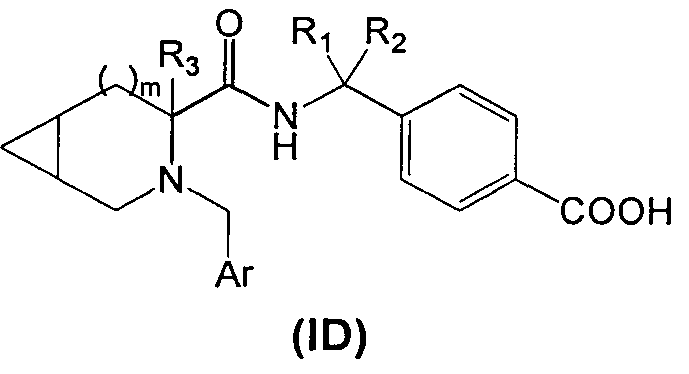
и/или их фармацевтически приемлемых производных или солей,
где m, R1 R2, R3 и Ar, в целом, такие же, как описано выше, если не указано иное.
В определенных воплощениях этого аспекта m равно 1.
В определенных воплощениях R1 и R2 независимо являются водородом, линейным или разветвленным C1-3алкилом, или соединены друг с другом с образованием циклопропильного кольца.
В определенных воплощениях R3 представляет собой Н или линейный или разветвленный C3-1алкил, как правило, метил.
В определенных воплощениях R3 представляет собой Н.
В определенных воплощениях Ar представляет собой
фенил, имеющий:
- в положении 4 один заместитель, выбранный из группы, состоящей из галогена, циано, трифтометила,
- в положении 3 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила, при условии, что m равно 1.
В определенных воплощениях Ar представляет собой фенил, как определено выше, имеющий в одном или в обоих из положений 2 и 6 фрагмент, выбранный из Н, галогена, циано, трифтометила или линейного или разветвленного C1-3алкила.
В определенных воплощениях любое из 5-членного гетероароматического и 6-членного гетероциклического колец замещено, предпочтительно в положении 4, галогеном, циано или трифторметилом.
В одном предпочтительном воплощении 6-членное гетероароматическое кольцо является пиридилом.
В определенных воплощениях m равно 1, а Ar является фенилом, замещенным в положении 4 одним заместителем, выбранным из группы, состоящей из галогенов, циано, трифторметила, предпочтительно трифторметилом, a R1, R2, R3 такие же, как определено выше.
В четвертом аспекте изобретения производное циклического амина Формулы (I) содержит А, которое является кольцом Е.
В соответствии с этим аспектом описывается подмножество соединений Формулы (IE):
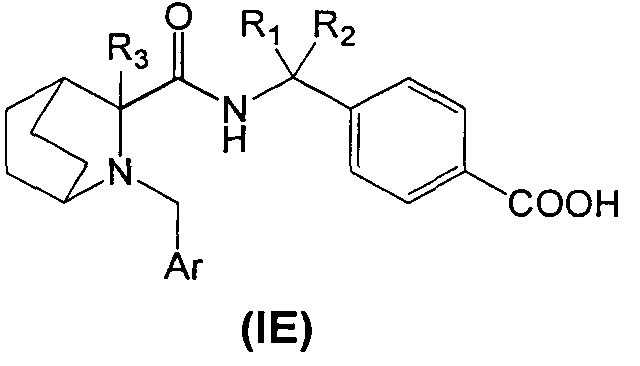
и/или их фармацевтически приемлемыми производными или солями,
где R1, R2, R3 и Ar, в общем целом, такие же, как описано выше, если не указано иное.
В определенных воплощениях R1 и R2 независимо являются водородом, линейным или разветвленным C1-3алкилом, или соединены друг с другом с образованием циклопропильного кольца.
В определенных воплощениях R3 представляет собой Н или линейный или разветвленный C1-3алкил, предпочтительно R3 представляет собой Н.
В определенных воплощениях Ar является фенилом, замещенным в положении 4 одним заместителем, выбранным из группы, состоящей из галогена, циано или трифторметила.
В определенных воплощениях Ar представляет собой
- фенил, имеющий в положении 4 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила.
В определенных воплощениях Ar представляет собой фенил, имеющий в положении 4 один заместитель, выбранный из группы, состоящей из галогена, циано и трифторметила.
В определенных воплощениях Ar представляет собой фенил, как определено выше, имеющий в одном или в обоих из положений 2 и 6 фрагмент, выбранный из Н, галогена, циано, трифтометила или линейного или разветвленного C1-3алкила.
В определенных воплощениях любое из 5-членного гетероароматического и 6-членного гетероциклического колец замещено, предпочтительно в положении 4, галогеном, циано или трифторметилом.
В одном предпочтительном воплощении 6-членное гетероароматическое кольцо является пиридилом.
Термин «фармацевтически приемлемые соли» в данном изобретении относится к солям, приготовленным из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические или органические основания и неорганические или органические кислоты, четвертичные аммониевые соли и внутренние соли.
Соли, полученные из неорганических оснований, включают соли алюминия, аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, марганца, двухвалентного марганца, калия, натрия, цинка и т.п. Предпочтительными являются соли аммония, кальция, магния, лития калия и натрия. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, такие как аргинин, бетаин, кофеин, холин, N,N′-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этил-морфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метил-глюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и т.п.
Если соединение по настоящему изобретению является основным, соли могут быть приготовлены из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Такие кислоты включают уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, бромистоводородную, хлористоводородную, изэтионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, слизевую, азотную, памоевую, пантотеновую, фосфорную, янтарную, серную, винную, п-толуолсульфоновую кислоту и т.п. Особенно предпочтительными являются лимонная, бромистоводородная, хлористоводородная, малеиновая, фосфорная, серная и винная кислоты.
Следует понимать, что в данном изобретении ссылки на соединения Формулы (I) также подразумевают включение фармацевтически приемлемых солей или производных.
Более того, соединения формулы (I) могут образовывать кислотно-аддитивные соли или соли с основанием, в зависимости от типа заместителей, и эти соли также включены в настоящее изобретение, при условии, что они являются фармацевтически приемлемыми.
Соединения (I) по изобретению могут быть в кристаллической форме. В определенных воплощениях кристаллические формы соединений (I) являются полиморфами.
Термины «соединения по изобретению» и «соединения по настоящему изобретению» относятся к каждому из соединений формул (I), (IB), (IC), (ID), (IE) и подразумевается, что они включают их фармацевтически приемлемые соли, гидраты, сольваты и кристаллические формы, а также любые другие подходящие формы, как проиллюстрировано ниже.
В определенных воплощениях соединение Формулы (I) может иногда существовать в форме различных таутомеров или геометрических изомеров, в зависимости от типов используемых заместителей. В настоящем описании соединение может быть описано с отсылкой лишь к одному из таких изомеров, однако настоящее изобретение включает все такие изомеры, выделенные формы этих изомеров или их смеси.
Более того, соединения Формулы (I) могут в некоторых случаях иметь ассиметричные атомы углерода или осевые ассиметрии, и соответственно, могут существовать в форме оптических изомеров, таких как (R)-форма, (S)-форма и т.п. Настоящее изобретение включает как смеси, так и выделенные формы этих оптических изомеров.
В объем настоящего изобретения, следовательно, включены все стереоизомерные формы, включая энантиомеры, диастереоизомеры и их смеси, включая рацематы, и общая ссылка на соединения формул (I), (IB), (IC), (ID), (IE) включает все стереоизомерные формы, если не указано иное.
Кроме того, фармацевтически приемлемые пролекарства соединений формулы (I) также включены в настоящее изобретение. Фармацевтически приемлемое пролекарство относится к соединению, имеющему группу, которая может быть преобразована в аминогруппу, ОН, СО2Н или т.п., путем сольволиза или в физиологических условиях. Примеры групп для образования пролекарств включают те, которые описаны в Prog. Med., 5, 2157-2161 (1985) или «Pharmaceutical Research and Development» (Hirokawa Publishing Company, 1990), vol. 7, Drug Design, 163-198.
Кроме того, настоящее изобретение в определенных воплощениях также включает различные гидраты или сольваты, и полиморфы соединений формулы (I) и его фармацевтически приемлемых солей. Кроме того, настоящее изобретение также включает соединения, помеченные различными радиоактивными изотопами или нерадиоактивными изотопами.
Соединения по настоящему изобретению также включают примеры 1-40, как описано в данном документе ниже, или их фармацевтически приемлемые соли.
В определенных воплощениях в настоящем изобретении описывается соединение, выбранное из группы, состоящей из:
4-((1S)-1-(1-(4-(трифторметил)бензил)пипередин-2-карбоксамидо)этил)бензоата лития
4-((S)-1-((R)-1-(4-фторбензил)пиперидин-2-карбоксамидо)этил)бензоата лития
4-((S)-1-((R)-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензоата лития
(R)-4-(1-(1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоата лития
(R)-4-(1-(1-(4-хлорбензил)пиперидин-2-карбоксамидо)циклопропил)бензоата лития
(R)-4-(1-(1-(4-цианобензил)пиперидин-2-карбоксамидо)циклопропил)бензоата лития
4-(1-(6-(4-(трифторметил)бензил)-6-азаспиро[2.5]октан-5-карбоксамидо)циклопропил)бензойной кислоты
4-(1-(6-((6-(трифторметил)пиридин-3-ил)метил)-6-азаспиро[2.5]октан-5-карбоксамидо)-циклопропил)бензойной кислоты
4-(1-(6-(3-(трифторметил)бензил)-6-азаспиро[2.5]октан-5-карбоксамидо)циклопропил)бензойной кислоты
4-((1S)-1-(6-(4-(трифторметил)бензил)-6-азаспиро[2.5]октан-5-карбоксамидо)этил)бензойной кислоты
4-((1S)-1-(5-метил-6-(4-(трифторметил)бензил)-6-азаспиро[2.5]октан-5-карбоксамидо)этил)бензойной кислоты
4-(1-(4,4-диметил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-((1S)-1-(4,4-диметил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензойной кислоты
4-((1S)-1-((2R)-4-фтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензойной кислоты
4-(1-((2R)-4-фтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-((S)-1-((R)-4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензойной кислоты
(R)-4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-(1-(4,4-дифтор-1-(3-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-(1-(4,4-дифтор-1-(3-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензойной кислоты
4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензойной кислоты
4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензойной кислоты
4-(1-(3-(3-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензойной кислоты
4-(1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[4.1.0]гептан-3-карбоксамидо)циклопропил)бензойной кислоты
4-((1S)-1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[4.1.0]гептан-3-карбоксамидо)этил)бензойной кислоты
4-((S)-1-((R)-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)-бензоата лития
4-((S)-1-((R)-1-(4-фторбензил)пирролидин-2-карбоксамидо)этил)лития
4-(1-((1R,3R,5R)-2-(3-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензойной кислоты
4-(1-((1R,3R,5R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензойной кислоты
4-(1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензойной кислоты
4-((1S)-1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)этил)бензойной кислоты
4-((1S)-1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)этил)бензойной кислоты
(R)-4-(1-(4,4-диметил-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-((1S)-1-(1-(4-(трифторметил)бензил)азетидин-2-карбоксамидо)этил)бензойной кислоты
4-((1S)-1-(1-(4-(трифторметил)бензил)азетидин-2-карбоксамидо)этил)бензойной кислоты
4-((1S)-1-(3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоксамидо)этил)бензойной кислоты
4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоксамидо)циклопропил)бензойной кислоты
4-((1S)-1-(2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоксамидо)этил)бензойной кислоты
4-(1-(2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоксамидо)циклопропил)бензойной кислоты
(R)-4-(1-(2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-((S)-1-((R)-2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензойной кислоты
(R)-4-(1-(2-метил-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-((S)-1-((2R,4S)-4-фтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)-бензоата лития
4-((S)-1-((R)-4,4-дифтор-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензойной кислоты
Предпочтительные соединения по изобретению выбирают из группы, состоящей из:
(R)-4-(1-(1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоата лития
4-(1-(6-(4-(трифторметил)бензил)-6-азаспиро[2.5]октан-5-карбоксамидо)циклопропил)бензойной кислоты
4-((1S)-1-(6-(4-(трифторметил)бензил)-6-азаспиро[2.5]октан-5-карбоксамидо)этил)бензойной кислоты
4-((1S)-1-(4,4-диметил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензойной кислоты
4-((S)-1-((R)-4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензойной кислоты
(R)-4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-(1-(4,4-дифтор-1-(3-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-(1-(4,4-дифтор-1-(3-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойной кислоты
4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензойной кислоты
4-(1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[4.1.0]гептан-3-карбоксамидо)циклопропил)бензойной кислоты
4-((1S)-1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[4.1.0]гептан-3-карбоксамидо)этил)бензойной кислоты
4-((S)-1-((R)-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензоата лития
4-(1-((1R,3R,5R)-2-(3-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензойной кислоты
4-(1-((1R,3R,5R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензойной кислоты
Дополнительный аспект этого изобретения касается способа получения соединения Формулы (I), включающего следующие стадии, представленные на общей схеме ниже:
ОБЩАЯ СХЕМА
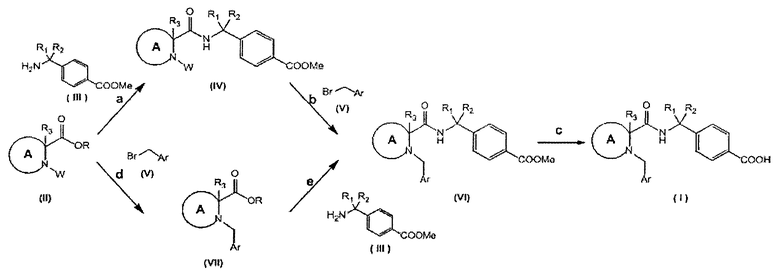
a) реакция соединения формулы (II) с соединением формулы (III) в присутствии конденсирующего реагента и основания, с получением, таким образом, соединения Формулы (IV);
b) реакция соединения (IV) с соединением (V) в присутствии подходящего основания с получением, таким образом, соединения Формулы (VI);
c) гидролиз сложноэфирного соединения (VI) с использованием сильных оснований, таких как гидроксид лития, в подходящей системе растворителей, такой как 1,4-диоксан/H2O, с получением, таким образом, соединения Формулы (I);
d) реакция соединения (II) с соединением (V) в присутствии подходящего основания, с получением, таким образом, соединения Формулы (VII);
e) реакция соединения формулы (VII) с соединением формулы (III) в присутствии конденсирующего реагента и в присутствии основания с получением, таким образом, соединения Формулы (VI).
В вышеуказанной общей схеме:
A, R1, R2, R3, Ar такие же, как определено в формуле (I),
R выбирают из группы, состоящей из водорода, линейной или разветвленной C1-3алкильной и бензильной групп,
W выбирают из группы, состоящей из водорода, бензильной группы и трет-бутилкарбаматной группы,
Следует иметь в виду, что соединения формул (II), (IV) и (VII) могут быть преобразованы в другие соединения формул (II), (IV) и (VII) с помощью синтетических способов, известных специалистам в данной области техники.
Примерами таких реакций конверсии являются:
i) Соединение Формулы (II), в котором R является C1-3алкилом, может быть получено реакцией соответствующих соединений, в которых R является водородом, со спиртами, например этанолом, в присутствии подходящего реакционно-способного реактива, такого как тионилхлорид.
ii) Соединения Формулы (II), если R является водородом, может быть получено гидролизом соответствующих соединений формулы (II), в которых R является C1-3алкилом. Гидролиз проводят в присутствии основания, например гидрохлорида лития, как правило в присутствии подходящей эфирной системы, такой как водный 1,4-диоксан.
iii) Соединения формулы (IV), где W является водородом, могут быть приготовлены из соответствующих соединений формулы (IV), в которых W является бензильной группой, путем гидрогенолиза или реакцией соединения формулы (IV), в которой W является трет-бутилкарбаматной группой, с трифторуксусной кислотой.
iv) Соединения формулы (VII), где R является водородом, может быть получено гидролизом соответствующих соединений формулы (VII), в которых R является C1-3алкилом. Гидролиз проводится в присутствии основания, например гидроксида лития в водном 1,4-диоксане.
СПОСОБ СИНТЕЗА
Как показано выше, согласно дополнительному аспекту данного изобретения описывается способ получения соединения формулы (I).
Более подробно, соединения по настоящему изобретению могут быть получены в соответствии со следующими схемами.
Если не указано иное, R1, R2, R3, W и Ar в схемах реакции и в нижеследующем обсуждении такие же, как определено в формуле (I).
Термин «защитная группа», используемый далее в настоящем изобретении, означает аминозащитную группу, которую выбирают из типичных аминозащитных групп, описанных в «Protective Groups» в «Organic Synthesis» под редакцией Т.W. Greene et al. (John Wiley & Sons, 1999);
Соединения формулы (I) могут быть получены реакцией гидролиза сложноэфирных соединений формулы (VI) согласно реакционной схеме 1.
СХЕМА 1
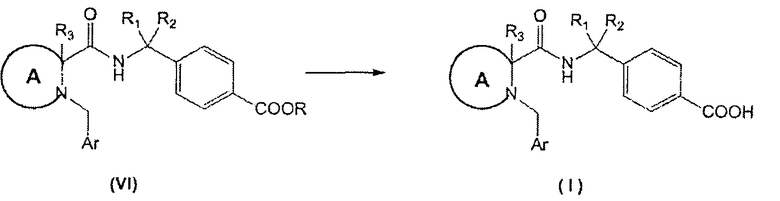
Гидролиз может быть проведен в присутствии основания, например гидроксида лития, в подходящем растворителе, таком как водный 1,4-диоксан.
В определенных воплощениях эта реакция может быть осуществлена при комнатной температуре.
Соединения формулы (VI) могут быть получены согласно реакционной схеме 2.
СХЕМА 2
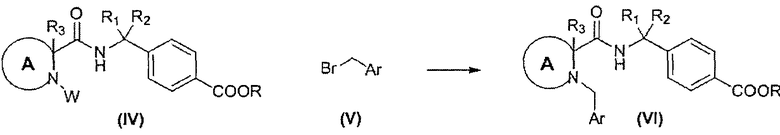
Соединения формулы (IV), в которой W является водородом, могут реагировать с соединениями формулы (V) в присутствии подходящего основания, такого как карбонат цезия, и в подходящем растворителе, таком как ацетонитрил. В определенных воплощениях реакция осуществляется при комнатной температуре или, в других случаях, при нагревании, например при 60°C.
Соединения формулы (IV), в которой W является водородом, могут быть получены из соответствующих соединений формулы (IV), в котором W предпочтительно является бензильной группой, или трет-бутилкарбаматной группой.
В определенных воплощениях, в которых W является трет-бутилкарбаматом, стадия снятия защиты может быть осуществлена в присутствии трифторуксусной кислоты в подходящем растворителе, таком как дихрометан.
В других воплощениях, в которых W является бензильной группой, стадия снятия защиты может быть осуществлена гидрогенолизом, как правило в подходящем растворителе, таком как этанол.
Соединения формулы (IVa) могут быть получены согласно реакционной схеме 3.
СХЕМА 3
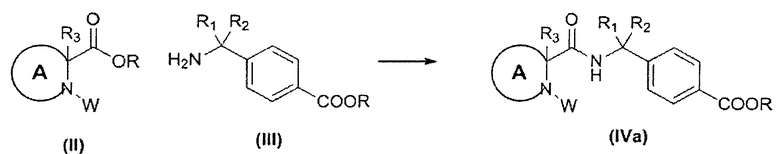
В определенных воплощениях соединения формулы (II), в которых R является водородом, W является бензильной группой или трет-бутилкарбаматом, реагируют с соединениями формул (III) в присутствии подходящего конденсирующего реагента, например выбранного из (2-(6-хлоро-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметиламиния гексафторфосфата) (HCTU), O-(7-азабензотриазол-1-ил)-N,N,N′,N′-тетраметилурония гексафторфосфата (HATU), (1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида) и 1-гидроксибензотриазола и их смесей. Как правило, реакция проводится в апротонном растворителе, например в галогенированном углеводороде, таком как дихлорметан, N,N-диметилформамид, или ацетонитрил, или их смеси, как правило, при комнатной температуре, в присутствии подходящего основания, такого как N,N-диизопропиламин.
Соединения формулы (III) известны, например, из международных патентных публикаций WO 2005105733 и WO 2008104055.
В альтернативном случае соединение формулы (VI) может быть приготовлено согласно реакционной схеме 4.
СХЕМА 4
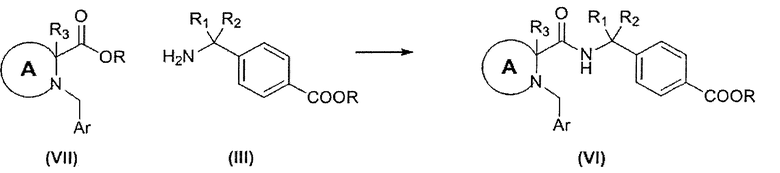
В определенных воплощениях соединения формулы (VII), в которых R является Н, реагируют с соединениями формулы (III) в присутствии подходящего конденсирующего реагента, например выбранного из (2-(6-хлор-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметиламминия гексафторфосфата) (HCTU), O-(7-азабензотриазол-1-ил)-N,N,N′,N′-тетраметилурония (HATU), (1-этил-3-(3-диметиламинопропил)карбодиимида) и 1-гидроксибензотриазола или их смесей.
В определенных воплощениях реакция осуществляется в апротонном растворителе, например галогенированном углеводороде, таком как дихлорметан, N,N-диметилформамид или ацетонитрил, или их смеси, как правило, при комнатной температуре в присутствии подходящего основания.
В определенных воплощениях соединения формулы (VII), в которых R является водородом, могут быть получены гидролизом соответствующих соединений формулы (VII), в которых R является С(1-3) алкилом. В определенных воплощениях гидролиз осуществляют в присутствии основания, например гидроксида лития, как правило в подходящем растворителе, таком как водный 1,4-диоксан.
В определенных воплощениях соединения формулы (VII) могут быть получены согласно реакционной схеме 5.
СХЕМА 5
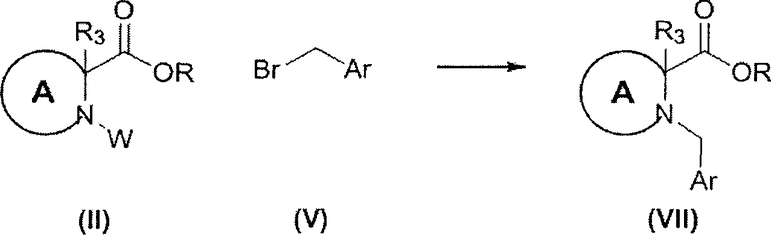
В определенных воплощениях соединения формулы (II), в которых R является С(1-3) алкилом, a W является бензильной группой или трет-бутилкарбаматом, могут реагировать с соединениями формулы (V) в присутствии подходящего основания, такого как карбонат цезия, и подходящего растворителя, такого как ацетонитрил. В определенных воплощениях реакция осуществляется при комнатной температуре, в других воплощениях реакция осуществляется при нагревании, например при около 60°C.
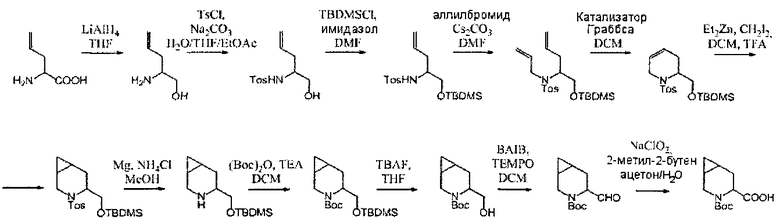
В определенных воплощениях соединения формулы (II), в которых А является D, R является водородом, W является трет-бутилкарбаматом, a m равно 1, могут быть получены согласно реакционной схеме 6.
СХЕМА 6
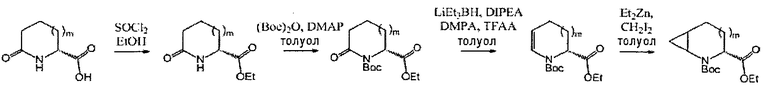
В определенных воплощениях соединения формулы (II), в которых А является С, m равно 0 или 1, R является этилом, а W является трет-бутилкарбаматом, могут быть получены согласно реакционной схеме 7.
СХЕМА 7
В других воплощениях соединения формулы (II), в которых А является С, m равно 0, R является этилом, а W является трет-бутилкарбаматом, могут быть получены согласно реакционной схеме 8.
СХЕМА 8
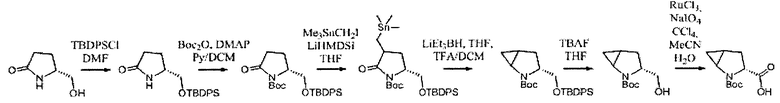
В определенных воплощениях соединения формулы (II), в которых А является В, n равно 1, R4 и R5 независимо выбираются из водорода или фтора или оба R4 и R5 являются фтором, могут быть получены согласно реакционной схеме 9.
СХЕМА 9
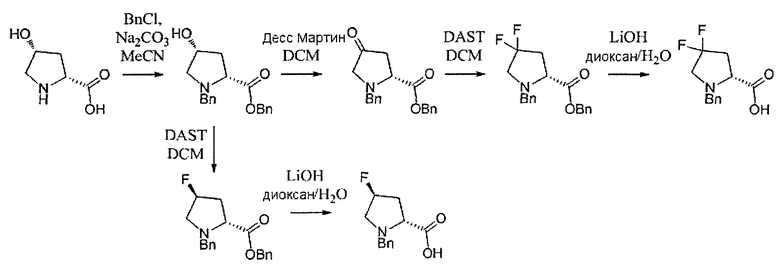
В определенных воплощениях соединения формулы (II), в которых А является В, n равно 1, R4 и R5 являются метилом, R и R3 являются водородом, a W является трет-бутил карбаматом, могут быть получены согласно реакционной схеме 10.
СХЕМА 10
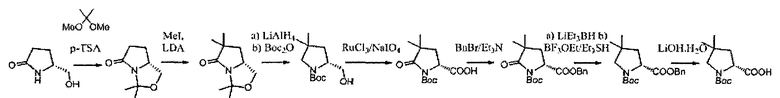
В определенных воплощениях соединения формулы (II), в которых А является В, W, R, R4 и R5 являются водородом, n равно 0, 1 и 2, R3 является метилом, могут быть получены согласно синтетическому пути, описанному в схеме 11.
СХЕМА 11
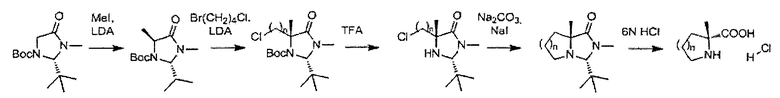
На схеме 12 описан альтернативный синтетический путь получения соединения формулы (II), в котором А является В, W, R4 и R5 являются водородом, n равно 1, R и R3 являются метилом.
СХЕМА 12
Согласно определенным воплощениям изобретения соединения (I) получают с помощью простого способа, легко масштабируемого и позволяющего избежать длительных и дорогих стадий, с достижением высокого выхода стабильного соединения формулы (I) фармацевтического качества.
Как правило, различные описанные выше способы могут использоваться для введения искомой группы на любой стадии поэтапного формирования требуемого соединения, и понятно, что эти общие способы могут объединяться различным образом в таких мультистадийных процессах. Как правило, последовательность реакций в мультистадийных процессах выбирают так, чтобы используемые реакционные условия не влияли на те группы в молекуле, которые должны присутствовать в конечном продукте.
В определенных воплощениях, в которых требуется получить энантиомер соединения общей формулы (I), он может быть получен разделением соответствующей смеси энантиомеров такого соединения формулы (I) с помощью обычных способов, таких как процедура хиральной ВЭЖХ.
В определенных воплощениях соединения общей формулы (I) находятся в форме солей, в частности фармацевтически приемлемых солей. Эти соли могут быть получены с помощью обычных способов, например реакцией соединения, имеющего общую формулу (I), в форме свободного основания с подходящей кислотой в подходящем растворителе, например спирте, таком как этанол, или простом эфире, таком как диэтиловый эфир, или сложном эфире, таком как этилацетат.
В определенных воплощениях соединения общей формулы (I) могут быть выделены в ассоциации с молекулами растворителя, например выпариванием или кристаллизацией из подходящего растворителя с получением соответствующих сольватов.
Авторы изобретения обнаружили, что общее семейство соединений формулы (I), a также подсемейства соединений формул (IB), (IC), (ID), (IE), как указано выше, имеют аффинность к (и являются их специфическими антагонистами) рецепторам PGE2, в частности рецепторов PGE2 подтипа EP4.
Соединения общей формулы (I) и конкретные соединения (IB), (IC), (ID), (IE) могут использоваться при лечении состояний и заболеваний, опосредованных простагландином Е.
Таким образом, согласно дополнительному аспекту изобретение относится к соединениям Формул (I), (IB), (IC), (ID), (IE), предназначенным для использования в качестве лекарственного средства для лечения патологий или расстройств, при которых необходим антагонист рецептора EP4.
В некоторых воплощениях патологии или расстройства выбирают из острой и хронической боли, воспалительной боли, остеоартрита, расстройства, ассоциированного с воспалением, такого как артрит, ревматоидного артрита, злокачественных новообразований, эндометриоза и мигрени.
В определенных воплощениях соединения по изобретению могут использоваться в качестве анальгетиков. Например, они могут быть пригодны при лечении хронической суставной боли (например, ревматоидного артрита, остеоартрита, ревматоидного спондилита, подагрического артрита и ювенильного артрита), включая модификацию течения заболевания и сохранение структуры суставов; скелетно-мышечной боли; боли в нижней части спины и шее; вывихов и растяжений; невропатической боли; симпатически поддерживаемой боли; миозита, боли, связанной со злокачественными заболеваниями, и фибромиалгией; боли, связанной с мигренью; боли, связанной с гриппом или другими вирусными инфекциями, такими как простуда; ревматизма; боли, связанной с функциональными расстройствами кишечника, такими как неязвенная диспепсия, несердечная боль в груди и синдром раздраженного кишечника; боли, связанной с ишемией миокарда; послеоперационной боли, головной боли, зубной боли, и дисменореи.
Соединения по изобретению пригодны при лечении нейропатической боли. Синдромы нейропатической боли могут развиться после повреждения нервов, и являющаяся результатом боль может длиться в течение месяцев или лет, даже после того, как исходное повреждение было вылечено. Повреждение нервов может случиться в периферических нервах, дорсальных корнях, спинном мозге или определенных областях в мозге. Синдромы нейропатической боли традиционно классифицируются по заболеванию или событию, которое ему предшествовало. Синдромы нейропатической боли включают: диабетическую нейропатию; радикулит; неспецифическую боль в пояснице; боль рассеянного склероза; фибромиалгию; нейропатию, связанную с ВИЧ; постгерпетическую невралгию; невралгию тройничного нерва; и боль в результате физической травмы, ампутации, злокачественного новообразования, токсинов или хронических воспалительных состояний. Эти состояния с трудом поддаются лечению, и хотя известно несколько лекарственных средств, обладающих ограниченной эффективностью, полный контроль боли достигается редко. Симптомы нейропатической боли невероятно гетерогенны и часто описываются как спонтанная стреляющая и дергающая боль, или постоянная, жгучая боль. Кроме того, боль может ассоциироваться с обычно безболезненными ощущениями, такими как ощущения покалывания (парестезия и дисестезия), повышенная чувствительность зубов (гиперестезия), болезненная чувствительность после безвредной стимуляции (динамическая, статическая или термическая аллодиния), повышенная чувствительность к болевым стимулам (термическая, холодовая, механическая гипералгезия), продолжающаяся болевая чувствительность после удаления стимула (гиперпатия) или отсутствие или дефицит селективных сенсорных путей (гипоалгезия).
Соединения по изобретению также пригодны при лечении воспаления, например при лечении кожных патологий (например, солнечного ожога, ожогов, экземы, дерматита, псориаза); офтальмологических заболеваний, таких как глаукома, ретинит, ретинопатии, увеит и острое поражение ткани глаза (например, конъюктивит); легочных расстройств (например, астма, бронхит, эмфизема, аллергический ренит, синдром острой дыхательной недостаточности, болезни голубятников, аллергический альвеолит у сельскохозяйственных рабочих, ХОБЛ); расстройств желудочно-кишечного тракта (например, афтозная язва, болезнь Крона, атопический гастрит, gastritis varialoforme, язвенный колит, глютеновая болезнь, местный илеит, синдром раздраженного кишечника, воспалительная болезнь кишечника, гастроэзофагеальная рефлюксная болезнь); трансплантации органов; других состояний с воспалительным компонентом, таких как сосудистая болезнь, мигрень, узелковый периартериит, тиреоидит, апластическая анемия, болезнь Ходжкина, склеродома, миастения гравис, рассеянный склероз, саркоидоз, нефротический синдром, синдром Бехчета, полимиозит, гингивит, ишемия миокарда, пирексия, системная красная волчанка, полимиозит, тендинит, бурсит и синдром Шегрена.
Соединения по изобретению также пригодны при лечении иммунологических заболеваний, таких как аутоиммунные заболевания, заболевания иммунологического дефицита или трансплантации органов. Соединения по изобретению также эффективны при увеличении латентности инфекции ВИЧ.
Соединения по изобретению также пригодны при лечении заболеваний аномального функционирования тромбоцитов (например, окклюзионных сосудистых заболеваний).
Соединения по изобретению также пригодны при получении лекарственного средства с диуретическим действием.
Соединения по изобретению также пригодны при лечении импотенции или эректильной дисфункции.
Соединения по изобретению также пригодны при лечении болезней костей, характеризующихся аномальным костным метаболизмом или резорбцией, например остеопороза (особенно, постменопаузного остеопороза), гиперкальцимии, гиперпаратироидизма, болезни Педжета, остеолиза, гиперкальцимии или злокачественной опухоли с или без метастазов в кость, ревматоидного артрита, периодонтита, остеоартрита, остеалгии, остеопении, опухолевой кахексии, калькулеза, литиаза (особенно уролитиаза), солидной карциномы, подагры и анкилозирующего спондило артрита, тендинита и бурсита. В дополнительном аспекте соединения по изобретению могут использоваться при ингибировании резорбции кости и/или стимуляции образования кости.
Соединения по изобретению также пригодны для аттенуации гемодинамических побочных эффектов НПВС и ингибиторов СОХ-2.
Соединения по изобретению также пригодны при лечении сердечнососудистых заболеваний, таких как гипертензия или ишемическая болезнь; функциональной или органической венозной недостаточности; при варикозной терапии; геморрое, и шоковых состояниях, ассоциированных с значительным падением артериального давления (например, септический шок).
Соединения по изобретению также пригодны при лечении нейродегенеративных заболеваний и нейродегенерации, таких как слабоумие, в частности дегенеративное слабоумие (в том числе старческое слабоумие, болезнь Альцгеймера, болезнь Пика, хорея Хантингтона, болезнь Паркинсона и болезнь Крейтцфельда-Якоба, ALS, заболевание двигательных нейронов); сосудистая деменция (включая мультиинфарктную деменцию); а также слабоумие, связанное с поражениями во внутричерепном пространстве; травмы; инфекции и связанные с ними состояния (в том числе ВИЧ-инфекции); метаболизм; токсины; кислородное голодание и недостаток витаминов, а также умеренные когнитивные нарушения, связанных со старением, особенно возрастное нарушение памяти.
Соединения Формулы (I), (IB), (IC), ID) и (IE) также пригодны для нейропротекции и при лечении нейродегенерации после инсульта, остановки сердца, легочного шунтирования, травматического поражения мозга, поражения спинного мозга и т.п. Соединения по изобретению также пригодны при лечении инсульта и рассеянного склероза.
Соединения по изобретению также пригодны при лечении тиннитуса.
Соединения по изобретению также пригодны для предотвращения или снижения зависимости от, или для предотвращения или снижения устойчивости или обратной устойчивости к индуцирующему зависимость агенту. Примеры агентов, вызывающих зависимость, включают опиоиды (например, морфин) депрессанты ЦНС (например, этанол), психостимуляторы (например, кокаин) и никотин.
Соединения по изобретению также пригодны при лечении осложнений диабета 1 типа (например, диабетической микроангиопатии, диабетической ретинопатии, диабетической нефропатии, сосудистой дегенерации глаукомы), нефротического синдрома, апластической анемии, увеита, болезни Кавасаки и саркоидоза.
Соединения по изобретению также пригодны при лечении дисфункции почек (нефрита, особенно, мезангиального пролиферативного гломерулонефрита, нефритического синдрома), дисфункции печени (гепатита, цирроза) желудочно-кишечной дисфункции (диарреи) и рака толстой кишки.
Соединения по изобретению также пригодны при лечении или профилактике неоплазии у субъекта при необходимости такого лечения или профилактики. Термин «лечение» включает частичное или полное ингибирование неопластического роста, распространения или метастазирования, а также частичное или полное разрушение неопластических клеток и/или симптомов, ассоциированных с неоплазией, включая боль, анорексию или потерю массы. Термин также включает применение соединений в качестве сенситизирующих агентов для других химиотерапии. Термин «профилактика» включает либо профилактику возникновения клинически выраженной неоплазии либо профилактику возникновения преклинически выраженной стадии неоплазии у индивидуумов, находящихся в группе риска. Также под это определение попадает профилактика инициации злокачественных клеток или аррест или обратная прогрессия предзлокачественных клеток в злокачественные клетки. Это включает профилактическое лечение индивидуумов в группе риска развития неоплазии. Термин «субъект» для целей лечения включает любого субъекта-человека или субъекта-млекопитающее, который имеет любую из известный неоплазии, и предпочтительно является субъектом-человеком. Для способов профилактики субъект является любым субъектом-человеком или субъектом-животным, а предпочтительно является субъектом-человеком, у которого есть риск развития неоплазии. Субъект может иметь риск из-за воздействия канцерогенных агентов, будучи генетически предрасположенным к неоплазии и т.п. Термин «неоплазия» включает доброкачественные и злокачественные опухоли, новообразования и полипы. Таким образом, соединения по изобретению пригодны при лечении или профилактике доброкачественных опухолей, новообразований и полипов, включая плоскоклеточную папиллому, базальноклеточную опухоль, переходно-клеточную папиллому, аденому, гастриному, холангиоцеллюлярную аденому, гепатоклеточную аденому, почечную тубулярную аденому, онкоцитому, гломусную опухоль, меланоцитарный невус, фиброму, миксому, липому, леомиому, рабдомиому, доброкачественную тератому, гемангиому, остеому, хондрому и менингиому. Соединения по изобретению также пригодны при лечении или профилактике злокачественных опухолей, новообразований и полипов, включая плоскоклеточную карциному, базально-клеточную карциному, переходно-клеточную карциному, аденокарциному, злокачественную гастриному, холангиоцеллюлярную аденому, гепатоклеточную карциному, почечно-клеточную карциному, злокачественную меланому, фибросаркому, миксосаркому, липосаркому, леймиосаркому, рабдомиосаркому, злокачественную тератому, гемангиосаркому, саркому Капоши, лимфангиосаркому, остеосаркому, хондросаркому, злокачественную менингиому, неходжкинскую лимфому, лимфому Ходжкина и лейкоз. Для целей данного описания «неоплазия» включает злокачественные новообразования мозга, злокачественные новообразования костей, эпителиально-клеточную неоплазию (эпителиальную карциному), базально-клеточную карциному, аденокарциному, желудочно-кишечное злокачественное новообразование, такое как рак губы, рак ротовой полости, рак пищевода, рак тонкой кишки и рак желудка, рак толстой кишки, рак прямой кишки, рак печени, рак мочевого пузыря, рак поджелудочной железы, рак яичника, рак шейки матки, рак легкого, рак молочной железы и рак кожи, такой как плоскоклеточный и базальноклеточный ракки, рак простаты, почечно-клеточную карциномау и другие известные злокачественные новообразования, которые затрагивают эпителиальные, мезенхимальные и кровяные клетки по всему организму. Соединения по изобретению пригодны при лечении или профилактике любого из вышеупомянутых злокачественных опухолей. Соединения по изобретению пригодны при лечении или профилактике доброкачественных и злокачественных опухолей, новообразований и полипов следующих типов клеток: плоский эпителий, базальные клетки, промежуточный эпителий, железистый эпителий, G-клетки, эпителий желчных протоков, гепатоциты, канальцевый эпителий, меланоциты, грубоволокнистая соединительная ткань, фиброзный каркас сердца, жировая ткань, гладкая мышца, скелетная мышца, зародышевые клетки, кровяные сосуды, лимфатические сосуды, кость, хрящ, мягкие мозговые оболочки, лимфоидные клетки и гематопоэтические клетки. Соединения могут быть использованы при лечении субъектов, имеющих аденоматозные полипы, включая субъектов с семейным аденоматозным полипозом (САП). Кроме того, соединения могут быть использованы для профилактики образования полипов у пациентов в группе риска САП. Предпочтительно, соединения по изобретению пригодны при лечении или профилактике следующих злокачественных новообразований: толстой и прямой кишки, пищевода, желудка, молочной железы, головы и шеи, кожи, легкого, печени, желчного пузыря, поджелудочной железы, мочевого пузыря, эндометрия, шейки матки, простаты, щитовидной железы и мозга.
Следует понимать, что ссылка на лечение включает как лечение установленных симптомов, так и профилактическое лечение, если явно не указано иное.
В дополнительном аспекте настоящее изобретение касается соединений Формул (I), (IB), (IC), (ID), (IE) для применения в качестве лекарственного средства.
В другом аспекте в изобретении предлагается фармацевтическая композиция, содержащая соединение Формулы (I), (IB), (IC), (ID), (IE) и фармацевтически приемлемый носитель.
Соединение Формулы (I) может быть использовано в комбинации с фармацевтически приемлемым носителем и, необязательно, подходящими наполнителями, для получения фармацевтических композиций.
Термин «фармацевтически приемлемый носитель» означает растворители, агенты-носители, агенты-разбавители и т.п., которые используются при введении соединений по изобретению.
В определенных воплощениях фармацевтические композиции по изобретению могут быть в твердой или в жидкой форме.
Фармацевтические композиции в твердой форме могут содержать подходящие эксципиенты, такие как наполнители, смазывающие вещества, связующие агенты, смачивающие агенты, разрыхлители, красители и вкусовые агенты и их смеси. Например, таблетки могут содержать предварительно желатинизированный крахмал, микрокристаллическую целлюлозу, натрий гликолят крахмала, тальк, лактозу, стеарат магния, сахарозу, стеариновую кислоту, маннит.
Фармацевтические композиции в жидкой форме, как правило, могут быть представлены в виде растворов, суспензий, эмульсий, сиропов, эликсиров. Как правило, композиции в жидкой форме могут содержать суспедирующие агенты, эмульгирующие агенты, носители, консерванты и красители, вкусовые агенты.
Как правило, фармацевтические композиции изобретения могут быть введены парентеральным, пероральным, буккальным, подъязычным, нозальным, ректальным, местным или трансдермальным введением. Фармацевтические композиции для пероорального введения в общем являются предпочтительными.
Фармацевтические композиции изобретения, подходящие для перорального введения, как правило, будут дискретными единицами в твердой форме, например в форме таблеток, капсул, порошков, гранул, пастилок, пластырей, суппозиториев, пеллет, или в жидкой форме, например в виде жидких препаратов, инъецируемых или инфузируемых растворов или суспензий.
Фармацевтические композиции для парентерального введения, как правило, включают стерильные препараты в форме растворов или суспензий. В определенных воплощениях композиции для парентерального введения являются растворами на водной основе, подходящей для инъекции или инфузии. В определенных воплощениях такие композиции для парентерального введения включают один или несколько адъювантов, таких как буферные агенты, консерванты, антибактериальные агенты, поверхностно-активные вещества и их смеси.
Фармацевтические композиции для местного введения могут быть составлены в виде кремов, паст, масел, мазей, эмульсий, пен, гелей, капель, растворов-спреев и трансдермальных пластырей.
В определенных воплощениях фармацевтическая композиция по изобретению включает 0,1-99% по массе соединения формулы (I) в качестве активного ингредиента. В определенных воплощениях количество соединения формулы (I) составляет от 1 до 30 масс.%.
Дозировка подлежащего введению соединения формулы (I) зависит от тяжести заболевания, массы, возраста, и общего состояния пациента, нуждающегося в лечении.
Например, подходящая единица дозирования может варьироваться от 0,01 до 1000 мг или, как правило, от 1,0 до 300 мг, и быть предназначена для введения один или несколько раз в день, например дважды в день, как правило с регулярными интервалами. Длительность терапии зависит от тяжести болезни и общего состояния пациентов и может изменяться врачом путем продления на определенное количество недель или месяцев.
Согласно другому аспекту описывается применение соединений общей формулы (I) для изготовления лекарственного средства для лечения патологий или заболеваний, которые требуют введения антагониста рецептора EP4, например для лечения воспалительной боли, остеоартрита, артрита.
В соответствии с определенными воплощениями настоящее изобретение описывает фармацевтические композиции, включающие соединения формулы (I) или (IB), (IC), (ID), (IE), в ассоциации с дополнительным активным ингредиентом и фармацевтически приемлемым носителем.
Указанные дополнительные активные ингредиенты могут быть другим соединением формулы (I) или другим химическим объектом, имеющим схожую или другую активность.
В определенных воплощениях указанные дополнительные активные ингредиенты выбирают из противовоспалительных соединений, таких как FANS или соединения кортизона.
Настоящее изобретение далее будет подробно описано с помощью представленных ниже примеров, касающихся осуществления некоторых соединений по изобретению и оценки их активности в отношении рецептора EP4.
Ниже приведены Описания, касающиеся промежуточных продуктов, и Примеры, иллюстрирующие получение конкретных соединений формулы (I) или их солей. Описания иллюстрируют получение промежуточных соединений, используемых для изготовления соединений формулы (I) или их солей.
В описываемых методиках после каждого начального материала дается ссылка на описание. Все это сделано лишь для облегчения понимания специалистами-химиками. Начальный материал необязательно должен быть получен согласно Описанию. Стереохимия Описаний и Примеров описывается, исходя из того предположения, что абсолютные конфигурации оптических центров сохраняются. Относительная стереохимия была определена на основе ядерного эффекта Оверхаузера в экспериментах ЯМР-спектроскопии, как, например, в описаниях D73a, D73b, D140a и D140b.
Когда осуществляется разделение методом хиральной ВЭЖХ, то используются термины энантиомер 1 или энантиомер 2, в зависимости от времени удержания в соответствии с разделением методом хиральной ВЭЖХ. Термин энантиомер 1 используется для одиночного стереоизомера с минимальным временем удерживания в условиях хирального разделения. И наоборот, термин энантиомер 2 используется для одиночного стереоизомера с максимальным временем удерживания в условиях хирального разделения.
Когда методом хиральной ВЭЖХ или флэш-хроматографии разделяют диастереоизомерную смесь, то используют термины дистереоизомер 1 или диастереоизомер 2, в зависимости от времени удерживания в соответствующем методе разделения хиральной ВЭЖХ, или времени удерживания в соответствующей колонке для флеш-хроматографии. Термин диастереоизомер 1 используется для одиночного диастереоизомера с минимальным временем удерживания в условиях хирального разделения или первой элюции в колонке для флэш-хроматографии. И наоборот термин диастереоизомер 2 используется для одиночного диастереоизомера с максимальным временем удерживания в условиях хирального разделения или второй элюции в колонке для флэш-хроматографии.
Выходы рассчитываются в предположении, что продукты являются 100% чистыми, если не указано иное.
Названия соединений составлялись с использованием «ChemBioDraw Ultra 12.0» («CambridgeSoft Corp.», 100 КембриджПарк Драйв, Кембридж, Массачусетс, 02140)
Реактивы, используемые в примерах ниже, поставлялись различными поставщиками (например, «Sigma-Aldrich», «Acros», «Matrix scientific», «Manchester» или «Apollo») и использовались без дополнительной очистки.
Реакции в безводной среде проводили в условиях положительного давления сухого N2, а растворители использовали в сухой форме.
Для реакции, включающей облучение микроволнами, использовали систему «Initiator 2. 5 System».
Очистку осуществляли с помощью автоматических систем флеш-хроматографии «Biotage» (системы «Sp1» и «Isolera»), автоматической флеш-хроматографии «Companion CombiFlash» («ISCO»), систем «Flash Master» или «Vac Master».
Флеш-хроматографию осуществляли на силикагеле 230-400 меш (поставляемом «Merck AG», Дармштадт, Германия), предварительно упакованных картриджах «Varian Mega Be-Si», предварительно упакованных картриджах «Biotage silica» (например, картриджах «Biotage SNAP-Si»), картриджах «Waters PoraPak RXN RP», «Biotage SNAP-CIS».
Картриджи «SPE-Si» являются силикагельными колонками для твердофазной экстракции.
Картриджи «PoraPakRXN RP» являются обращенно-фазовой смолой на полимерной основе.
Картриджи «Biotage SNAP С18 Gold» являются обращенно-фазовой колонкой на основе силикагеля.
Картриджи «SPE-SCX» являются твердофазными ионообменными колонками, которые поставляются «Varian». Элюент, используемый с картриджами «SPE-SCX», являются дихлорметаном и метанолом или только метанолом, с последующим 2N раствором аммиака в метаноле. Собирают те фракции, которые элюируются раствором аммиака в метаноле.
Тонкослойную хроматографию проводили с помощью пластин «Kieselgel 60F-254» от «Merck TLC», визуализируемых в УФ-свете, водном растворе перманганата, парах йода.
Спектры Протонного Ядерного Магнитного Резонанса (1H ЯМР) регистрировали на приборе «Bruker Avance 400 MHz» и на «Bruker Avance III plus 400 MHz». В качестве внутреннего стандарта использовали TMS. Химические сдвиги приведены в м.д. (δ) с использованием дорожки с остаточным растворителем в качестве внутреннего стандарта.
Паттерны расщепления обозначены как: s, синглет; d, дублет; t, триплет; q, квартет; m, мультиплет; b, широкий сигнал. Спектры ЯМР регистрировались при температуре в диапазоне от 25°C до 90°C. Если детектируется более чем один конформер, как правило, сообщаются химические сдвиги наиболее распространенного конформера.
В аналитической характеризации описанных соединений «MS» относится к масс-спектрам прямой инфузии или масс-спектрам, ассоциированным с пиками, полученными методом UPLC/MS или HPLC/MS, где использованный масс-спектрометр упомянут ниже.
Масс-спектры прямой инфузии (MS) получали на классическом спектрометре «Ion Trap Thermo LCQ», работающем в режимах положительной ES(+) и отрицательной ES(-) ионизации с помощью различных колонок и последовательностей действий, перечисленных ниже:
Колонка «Phenomenex Gemini-NX С18» (100×2 мм, 3µm размер частицы), Т колонки = 35°C. Подвижная фаза: А (вода + 0,1% муравьиная кислота)/ В (ацетонитрил + 0,1% муравьиная кислота). Градиент: 10% В при T=0 мин до 90% В при T=12 мин, используя различные градиентные кривые, скорость потока: 0,3 мл/мин;
Колонка «Acquity™UPLC-BEH С18» (50×21 мм, 1,7µM размер частицы), Т колонки = 35°C. Подвижная фаза: А (вода 0,1% муравьиная кислота)/В (ацетонитрил + 0,1% муравьиная кислота), Градиент: 5% В при T=0 мин до 100% В при T=4,5 мин, используя различные градиентные кривые, скорость потока: 0,5 мл/мин;
Колонка «Zorbax SB C18» (2,1×50 мм, 3,5 µm размер частицы) Т колонки = 35°C. Подвижная фаза: А (вода + 0,1% муравьиная кислота)/В (ацетонитрил + 0,1% муравьиная кислота). Градиент: 10% В при T=0 мин до 90% В при T=12 мин, используя различные градиентные кривые, скорость потока: 0,4 мл/мин;
Кривые ВЭЖХ получали на приборе «Waters Alliance 2965», оборудованном детектором «Waters 2996 UV-Vis» с использованием колонки «Phenomenex Luna C18» (150×4,6 мм, 5 µм размер частицы). [Подвижная фаза: различные смеси ацетонитрила/метанола/KH2PO4 (20 мМ pH 2,5); Время элюции: 35 мин; колонка T=30°C; скорость потока = 0,6 мл/мин. Диапазон длин волн при детекции в УФ от 220 вплоть до 300 нм]
Полный ионный ток (TIC) и DAD УФ хроматографические следы вместе с MS- и УФ-спектрами были получены с помощью системы «UPLC/MS ACQUITY™», оснащенной детектором «2996 PDA» и соединенной с масс-спектрометром «Waters Micromass ZQ™», работающем в положительном или отрицательном режиме электрораспылительной ионизации. Анализ UPLC осуществляли с помощью колонки «Acquity™UPLC-BEH C18» (50×21 мм, 1,7 µM размер частицы), Т колонки = 35°C. Подвижная фаза: А (вода 0,1% муравьиная кислота)/В (ацетонитрил 0,1% муравьиная кислота). Градиент: 5% В при T=0 мин, до 100% В при T=2 мин или 4,5 мин 0,5 мл/мин с использованием различных градиентных кривых, скорость потока: 0,5 мл/мин.
ЖХ-МС осуществляли на квадрипольном масс-спектрометре «Agilent LC/MSD 1200 Series» с использованием колонки: «Welchrom XB-C18» (50×4,6 мм, 5 µм), работающей в ES (+) или (-) режиме ионизации при T=30°C и при скорости потока = 1,5 мл/мин.
Кривые ВЭЖХ для определений хиральной чистоты получали на приборе «Agilent 1200» и детектрое DAD G1315D с использованием колонки «Daicel Chiralpack IC» [5 µм размер частицы (250×4,6 мм)] или колонке «Daicel Chiralpack AD-H» [5 µм размер частицы (250×4,6 мм)] или «DAICEL OD-H» [5 µм размер частицы (250×4,6 мм)] или «Regis Welk 01» (SS) [5 µм размер частицы (250×4,6 мм)] и следующих общих изократических условиях: Мобильные фазы: А: н-гептан или н-гексан от 90% до 50% (+0,1% DEA или +0,2% TFA) В: этанол или IPA от 10% до 50%; время: вплоть до 60 мин элюции; температура колонки: 30°C; скорость потока: 0,5 мл/мин.
Очистку посредством препаративной хиральной ВЭЖХ осуществляли на устройстве «Shimadzu Preparative Liquid Chromatograph LC-8A» и УФ-детекторе «SPD-20А» с использованием колонки «Daicel Chiralpack IC» [(250×4,6 мм), 5 µм размер частицы] или колонки «Daicel Chiralpack AD-H» [(250×4,6 мм), 5 µм размер частицы] и следующих общих изократических условий: Мобильная фаза: предварительно смешанная смесь н-гептана или н-гексана от 90% до 50%, и этанола или IPA от 10% до 50% (+0,1% DEA или +0,2% TFA); время: вплоть до 60 мин элюции; Температура Колонки: RT; скорость потока: 10 мл/мин.
Конкретные подвижная фаза и рабочие условия будут указаны для каждого конкретного случая.
СОКРАЩЕНИЯ:
BAIB - бис(ацетокси)йодбензол
BF3. OEt2 - Диэтилэфират трехфтористого бора
Вос2О - Ди-трет-бутилдикарбонат
сНех - Циклогексан
s-BuLi - втор-Бутиллитий
t-Buli - трет-Бутиллитий
DAST - Трифторид диэтиламиносеры
1,2 DCE - 1,2-Дихлорэтан
DCM - дихлорметан
DEA - диэтиламин
DMAP - 4-Диметиламинопиридин
DMF - Диметилформамид
DIPEA - N,N-Диизопропилэтиламин
EDC HCl - 1-этил-3-(3-диметиламинопропил)карбодиимид)
EtOAc - Диэтилацетат
Et2O - Диэтилэфир
Et3SiH - Триэтилсилан
HATU - O-(7-азобензотриазол-1-ил)-N,N,N′,N′-тетраметилурония гексафторфосфат
HBTU - O-Бензотриазол-N,N,N′,N′-тетраметил-урония-гексафторо-фосфат
HCTU - (2-(6-Хлоро-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметиламминия гексафторфосфат)
НОВТ - N-Гидроксибензотриазол
IPA - 2-пропанол
LDA - Диизопропиламид лития
LiEt3BH - Триэтилборгидрид лития
LiHMDS - Бис(триметилсилил)амид лития
MeCN - Ацетонитрил
МТВЕ - Метил трет-бутил эфир
NaBH(ОАс)3 - Триацетоксиборгидрид натрия
NaBH4 - Боргидрид натрия
PTSA - n-толуолсульфокислота
Py - Пиридин
RT - Комнатная температура
TBAF - Тетра-н-бутиламмония фторид
TBDMSCl - трет-бутилдиметилсилил хлорид
TBDPSCl - трет-бутилдифенилсилил хлорид
TEA - Триэтиламин
TEMPO- 2,2,6,6-Тетраметилпиперидинилокси
TFA - Трифторуксусная кислота
TFAA - Трифторуксусный ангидрид
TMEDA - Тетраметилэтилендиамин
TMSCHN2 - Триметилсилилдиазометан
p-TSA - n-Толуолсульфокислота
THF - Тетрагидрофуран
ОПИСАНИЯ
Описание 1: 6-(трет-Бутоксикарбонил)-6-азаспиро[2,5]октан-5-карбоновая кислота (рацемическая смесь) (D1)
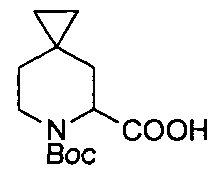
К раствору трет-бутил-6-азаспиро[2,5]октан-6-карбоновой кислоты (2,1 г, 9,9 ммоль; для методки получения см. публикацию международной патентной заявки WO 2011006960) в сухом Et2O (40 мл), охлажденному до -78°C, добавляли TMEDA (3,6 мл, 23,85 ммоль) с последующим добавлением втор-BuLi 1,4 М раствора в сНех (17,04 мл, 23,85 ммоль). Реакционную смесь перемешивали при -78°C в течение 1,5 ч, затем медленно нагревали при -25°C и дополнительно перемешивали при этой температуре в течение 30 мин. Раствор охлаждали до -78°C и останавливали реакцию пробулькиванием сухим льдом реакционной смеси через канюлю в течение 15 мин. Затем раствор дополнительно перемешивали в течение 15 мин и позволяли медленно нагреться до комнатной температуры перед добавлением насыщ. р-ра NH4Cl (40 мл). Фазы затем разделяли, водную подкисляли до pH~3 добавлением 1 М р-ра лимонной кислоты и экстрагировали этилацетатом. Собранные органические фазы после сушки и выпаривания растворителя давали остаток, который очищали с помощью картриджа «SPE-Si» (50 г), элюируя смесью DCM/MeOH от 100/0 до 98/2. Собранные фракции после упаривания растворителя давали титульное соединение (D1) (1,93 г).
MS: (ES/+) m/z: 254,1 [МН-] C13H21NO4 предусматривает 255,15
1H ЯМР (400 МГц, CHCl3-d) δ (м.д. 10,62 (br. s, 1Н), 5,15-4,70 (m, 1H), 4,23-3,86 (m, 1H), 3,37-3,02 (m, 1H), 2,29-2,14 (m, J=5,4, 13,0 Гц, 1H), 2,02-1,85 (m, J=3,4 Гц, 1H), 1,67-1,54 (m, 1H), 1,49 (br. s., 9H), 0,88-0,77 (m, 1H), 0,52-0,25 (m, 4H).
Описание 2: N-бензил-1-фенилэтанаминия 6-(трет-бутоксикарбонил)-6-азаспиро[2,5]октан-5-карбоксилат (одиночный неизвестный энантиомер) (D2)
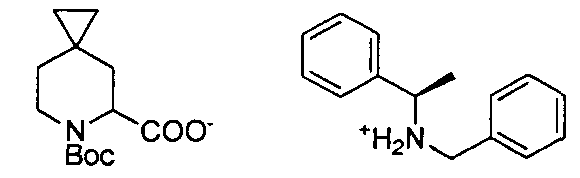
К охлажденному на льду раствору 6-(трет-бутоксикарбонил)-6-азаспиро[2,5]октан-5-карбоновой кислоты (рацемическая смесь) (D1) (41 г, 160,8 ммоль) в безводном МеОН (400 мл) добавляли (R)-N-бензил-1-фенилэтанамин. (34 г, 160,8 ммоль) и полученную реакционную смесь перемешивали при 0°C в течение 1,5 часов. Реакционную смесь нагревали при RT и дополнительно перемешивали в течение 5 часов. Растворитель упаривали в вакууме для получения (R)-N-бензил-1-фенилэтанаминия 6-(трет-бутоксикарбонил)-6-азаспиро[2,5]октан-5-карбоксилата (рацемический соль) (75 г). К раствору вышеуказанного соединения (75 г, 160,8 ммоль) в безводном EtOH (400 мл), добавляли H2O (1,2 л) и дефлегмировали полученную суспензию до превращения смеси в прозрачный раствор. Смесь медленно охлаждали до 50°C до формирования осадка, который отфильтровывали при 50°C. Водный слой дважды экстрагировали EtOAc, и сушили собранные органические слои над безводным Na2SO4, фильтровали и упаривали в вакууме, для получения 20 г соли, которую перекристалиовывали из H2O/EtOH (300/100 мл) при 50°C для получения титульного соединения (D2) (10 г).
Описание 3: 6-(трет-бутоксикарбонил)-6-азаспиро[2,5]октан-5-карбоновая кислота (одиночный неизвестный энантиомер) (D3)
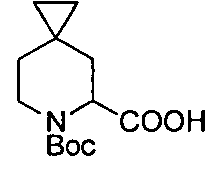
К суспензии N-бензил-1-фенилэтанаминия 6-(трет-бутоксикарбонил)-6-азаспиро[2,5]октан-5-карбоксилата (одиночный неизвестный энантиомер) (D2) (10 г, 24 ммоль) в EtOAc (100 мл), перемешанный при 0°C, медленно добавляли водный раствор HCl 0,5 N (100 мл), насыщенный NaCl. После завершения добавления наблюдалось растворение. Органический слой декантировали, промывали насыщенным NaCl, сушили (Na2SO4) и упаривали в вакууме, с получением 5 г кислоты, которую рекристаллизовали из петролейного эфира/EtOAc (60 мл/20 мл) с получением титульного соединения (D3) (2,8 г) в виде белого твердого вещества.
Описание 4: 6-трет-бутил-5-метил-6-азаспиро[2,5]октан-5,6-дикарбоксилат (рацемическая смесь) (D4)
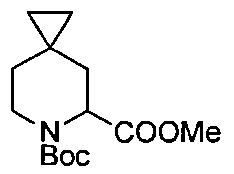
К охлажденному на льду раствору 6-(трет-бутоксикарбонил)-6-азаспиро[2,5]октан-5-карбоновой кислоты (рацемическая смесь) (D1) (500 мг, 0,78 ммоль) в Et2O/MeOH (10/5 мл), добавляли 2 М раствор TMSCHN2 в Et2O (1,5 мл, 2,94 ммоль). и перемешивали полученную смесь 2 часа при 0°C, а затем 18 часов при комнатной температуре. После выпаривания растворителя неочищенный остаток наносили в картридж «SPE-Si» (10 г) с элюированием DCM. Собранные фракции после упаривания растворителя давали титульное соединение (D4) (420 мг) в виде прозрачного масла.
MS: (ES/+) m/z: 170 [МН-Вос+] C14H23NO4 предусматривает 269,16
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 5,07-4,63 (m, 1H), 4,16-3,88 (m, 1H), 3,74 (br. s., 3H), 3,34-3,04 (m, 1H), 2,18 (dd, J=6,0, 13,6 Гц, 1H), 2,02-1,81 (m, 1H), 1,61-1,37 (m, 10H), 0,81 (br. s., 1H), 0,44-0,19 (m, 4H)
Описание 5: 6-трет-бутил-5-метил-5-метил-6-азаспиро[2,5]октан-5,6-дикарбоксилат (D5)
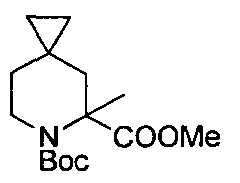
6-трет-бутил-5-метил-6-азаспиро[2,5]октан-5,6-дикарбоксилат (D4) (420 мг, 1,56 ммоль) растворяли в THF (25 мл) и охлаждали раствор при -78°C перед добавлением 2 М р-ра LDA в THF/гептане (1,16 мл, 2,34 ммоль). Красный раствор оставляли перемешиваться при -78°C в течение 40 мин перед добавлением йодометана (0,146 мл, 2,34 ммоль). Реакции позволяли нагреться до комнатной температуры и оставляли перемешиваться в течение 3 часов. Полученный желто-оранжевый раствор обрабатывали насыщ. р-ром NH4Cl (5 мл) и экстрагировали Et2O (3×50 мл). Собранные органические фазы промывали насыщ. р-ром NaCl и сушили над Na2SO4. Собранные органические вещества после упаривания растворителя давали остаток, который очищали на «Biotage SNAP-Si» (25 г) с элюированием DCM. Собранные фракции после упаривания растворителя давали титульное соединение (D5) (320 мг)
MS: (ES/+) m/z: 306,3 [MH+Na+] C15H25NO4 предусматривает 283,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,03-3,85 (m, 1H), 3,73 (s, 3H), 3,28-3,11 (m, 1H), 2.33-2,14 (m, 1H), 2,01-1,85 (m, 1H), 1,45 (s, 12H), 1,17-1,09 (m, 1H), 0,56-0,41 (m, 2H), 0,40-0,21 (m, J=6,2 Гц, 3H).
Описание 6: 6-(трет-бутоксикарбонил)-5-метил-6-азаспиро[2,5]октан-5-карбоновая кислота (D6)
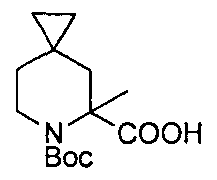
6-трет-бутил-5-метил-5-метил-6-азаспиро[2,5]октан-5,6-дикарбоксилат (D5) (320 мг, 1,13 ммоль) разделяли между диоксаном/водой (8/8 мл) до добавления LiOH H2O (190 мг, 4,52 ммоль). Смесь перемешивали при комнатной температуре в течение 18 часов, затем нагревали при 150°C в условиях микроволнового облучения в течение 40 мин (4 циклов по 10 мин каждый). Органический растворитель упаривали, промывали водный раствор EtOAc (2×10 мл), подкисляли до pH~4 с помощью насыщ. р-ра лимонной кислоты и экстрагировали EtOAc (3×10 мл). Органические фазы промывали насыщ. р-ром NaCl, сушили над Na2SO4 и упаривали под пониженным давлением с получением титульного соединения (D6) (114 мг).
MS: (ES/+) m/z: 292 [MH+Na+] C14H23N04 предусматривает 269,16
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,01-3,88 (m, 1H), 3,24-3,11 (m, 1H), 2,41-2,30 (m, 1H), 2,04-1,91 (m, 1H), 1,47 (s, 12H), 1,16 (d, J=13,2 Гц, 2H), 0,51 (br. s., 2H), 0,37 (d, J=6,4 Гц, 2H).
Описание 7: 2-аминопент-4-ен-1-ол (D7)
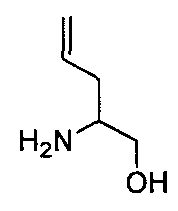
К охлажденному на льду раствору (±)-2-амино-4-пентеновой кислоты (6 г, 0,052 ммоль; поставляется «Fluka» #05960) в THF (250 мл), добавляли порционно LiAlH4 (2,37 г, 0,065 ммоль). Полученной реакционной смеси позволяли нагреться до комнатной температуры, а затем перемешивали в течение ночи. Воду (2,36 г), 1 М NaOH (3,56 г) и воду (7,2 г) добавляли последовательно к реакционной смеси, предварительно охлажденной при 0°C. Осадок фильтровали и разделяли фазы. Водный раствор упаривали под пониженным давлением для получения желто-коричневого масла (5 г). Ранее отфильтрованное твердое вещество обрабатывали кипящим THF (500 мл) в течение 30 минут перед фильтрацией. Фильтрат упаривали и полученный осадок помещали в воду и экстрагировали DCM (3×200 мл). После выпаривания растворителя, выделяли желто-коричневое масло (3,3 г). Оба полученных масла объединяли друг с другом для получения разовой партии искомого соединения (D7) (8,3 г).
MS: (ES/+) m/z: 102,1 [МН+] C5H11NO предусматривает 101,08
1H ЯМР (400 МГц, DMSO-d) δ (м.д.): 5,91-5,73 (m, 2H), 5,08-4,92 (m, 4H), 3,34-3,25 (m, 1H), 3,16-3,11 (m, 1H), 2,72-2,61 (m, 1H), 2,19-2,02 (m, 1H), 1,96-1,83 (m, 1H).
Описание 8: N-(1-гидроксипент-4-ен-2-ил)-4-метилбензолсульфонамид (D8)
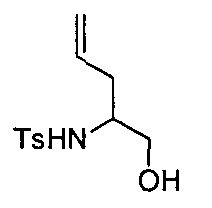
Раствор Na2CO3 (9,22 г, 86,92 ммоль) в воде (50 мл) оставляли перемешиваться при комнатной температуре в течение 20 мин перед добавлением 2-аминопент-4-ен-1-ола (D7) (8,3 г) и EtOAc (160 мл). После 30 минутного перемешивания добавляли в течение 15 минут раствор п-толуолсульфонилхлорида (12,9 г, 67,85 ммоль) в EtOAc/THF (24/24 мл). Реакционную смесь перемешивали при RT в течение выходных. Добавляли к реакционной смеси воду (30 мл) и EtOAc (100 мл), разделяли фазы и экстрагировали водный слой EtOAc (2×80 мл). Объединенные органические фазы упаривали и очищали остаток с помощью картриджа «Biotage SNAP-Si» (100 г), элюируя смесью сНех/EtOAc с 80/20 по 50/50. Собранные фракции после упаривания растворителя давали титульное соединение (D8) (5,5 г).
MS: (ES/+) m/z: 256,1 [МН+] C12H17NO3S предусматривает 255,09
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,82-7,75 (m, 2H), 7,37-7,30 (m, J=8,8 Гц, 2H), 5,57-5,44 (m, 1H), 5,05 (s, 1H), 5,04-4,98 (m, 1H), 4,79 (d, J=7,3 Гц, 1H), 3,65-3,59 (m, 1H), 3,59-3,52 (m, 1H), 3,36-3,22 (m, 1H), 2,46 (s, 3H), 2,28-2,14 (m, 2H).
Описание 9: N-(1-((трет-бутилдифенилсилил)окси)пент-4-ен-2-ил)-4-метилбензолсульфонамид (D9)
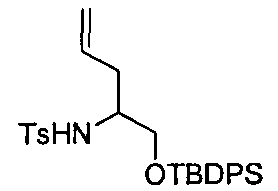
К раствору N-(1-гидроксипент-4-ен-2-ил)-4-метилбензолсульфонамида (D8) (6,5 г, 25,45 ммоль) в DMF (95 мл), добавляли имидазол (4,5 г, 66,17 ммоль) и TBDPSCl (7,9 мл, 30,54 ммоль) и перемешивали реакционную смесь при RT в течение 3 часов. Смесь разбавляли насыщенным раствором соли (50 мл) и экстрагировали EtOAc (3×60 мл). Объединенные органические фазы после упаривания растворителя давали остаток, который очищали с помощью картриджа «Biotage SNAP-Si» (100 г), элюируя смесью циклоэтан/EtOAc от 100/0 до 80/20. Собранные фракции после упаривания растворителя давали титульное соединение (D9) (13 г).
MS: (ES/+) m/z: 494,2 [МН+] C28H35NO3SSi предусматривает 493,21
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,76-7,20 (m, 14H), 5,64-5,43 (m, 1H), 5,02 (s, 1H), 5,00-4,94 (m, 1H), 4,76 (d, J=7,8 Гц, 1H), 3,62-3,54 (m, 1H), 3,50-3,40 (m, 1H), 3,39-3,25 (m, 1H), 2,43 (s, 3H), 2,34 (t, J=6,8 Гц, 2H), 1,07-1,01 (m, 9H).
Описание 10: N-аллил-N-(1-((трет-бутилдифенилсилил)окси)пент-4-ен-2-ил)-4-метилбензолсульфонамид (D10)
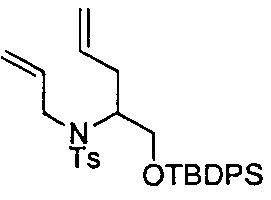
К раствору N-(1-((трет-бутилдифенилсилил)окси)пент-4-ен-2-ил)-4-метилбензолсульфонамида (D9) (13 г, 26,33 ммоль) в DMF (80 мл), добавляли Cs2CO3 (12,86 г, 39,49 ммоль) и аллилбромид (1,8 мл, 21,06 ммоль), и перемешивали смесь при RT в течение 4 часов. Реакционную смесь разбавляли водой (40 мл) и экстрагировали EtOAc (3×60 мл). Объединенные органические фазы упаривали и очищали полученный остаток с помощью картриджа «Biotage SNAP-Si» (100 г), элюируя смесью циклоэтан/EtOAc от 100/0 до 90/10. Собранные фракции после упаривания растворителя давали титульное соединение (D10) (10,7 г).
MS: (ES/+) m/z: 534,2 [МН+] C31H39NO3SSi предусматривает 533,24
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,72-7,67 (m, J=8,3 Гц, 2H), 7,64-7,57 (m, 4H), 7,50-7,43 (m, 2H), 7,43-7,35 (m, 4H), 7,23-7,17 (m, J=8,3 Гц, 2H), 5,79 (tdd, J=6,4, 10,4, 17,0 Гц, 1Н), 5,55 (tdd, J=6,8, 10,3, 17,1 Гц, 1Н), 5,14-4,89 (m, 4H), 4,03-3,92 (m, 2H), 3,87-3,78 (m, 1Н), 3,71-3,60 (m, 2H), 2,50-2,42 (m, 1Н), 2,40 (s, 3H), 2,33-2,23 (m, 1H), 1,04 (s, 9H).
Описание 11: 2-(((трет-бутилдифенилсилил)окси)метил)-1-тозил-1,2,3,6-тетрагидропиридин (D11)

К раствору N-аллил-N-(1-((трет-бутилдифенилсилил)окси)пент-4-ен-2-ил)-4-метилбензолсульфонамида (D10) (7,12 г, 13,33 ммоль) в DCM (64 мл), добавляли катализатор Граббса в (1,09 г, 1,32 ммоль) и перемешивали смесь при RT в течение ночи. После выпаривания растворителя остаток наносили в картридж «KP-Si» (100 г), элюируя смесью циклогексан/EtOAc от 100/0 до 90/10. Собранные фракции после упаривания растворителя давали титульное соединение (D11) (8,9 г).
MS: (ES/+) m/z: 506,2 [МН+] C29H35NO3SSi предусматривает 505,74
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,67-7,58 (m, 6H), 7,50-7,35 (m, 6H), 7,18 (d, J=7,8 Гц, 2H), 5,60 (dd, J=2,0, 5,4 Гц, 1Н), 5,55 (br. s., 1Н), 4,32 (d, J=7,8 Гц, 1Н), 4,04 (d, J=18,1 Гц, 1Н), 3,63-3,53 (m, 2H), 3,51-3,41 (m, 1Н), 2,40 (s, 3H), 2,33-2,24 (m, 1Н), 2,22-2,11 (m, 1Н), 1,05 (s, 9H).
Описание 12: 4-(((трет-бутилдифенилсилил)окси)метил)-3-тозил-3-азабицикло[4.1.0]гептан (рацемическая смесь) (D12)
К охлажденному на льду 1 М раствору диэтилцинка в гексане (93,64 мл) в DCM (50 мл) добавляли по каплям TFA (7,17 мл, 93,64 ммоль). После 20 минутного перемешивания добавляли дийодметан (7,54 мл, 93,64 ммоль) и перемешивали смесь в течение дополнительных 20 мин. Добавляли раствор 2-(((трет-бутилдифенилсилил)окси)метил)-1-тозил-1,2,3,6-тетрагидропиридина (D11) (5,92 г, 11,7 ммоль) в DCM (25 мл), затем позволяли реакционной смеси нагреться до RT и перемешивали в течение 6 часов. Раствор 1 М диэтилцинка в гексане (93,64 мл), трифторуксусной кислоты (7,17 мл, 93,64 ммоль) и дийодметана (7,54 мл, 93,64 ммоль) в DCM (50 мл) получали как описано выше, и добавляли к предыдущей смеси при 0°C. Полученной реакционной смеси позволяли нагреться до RT и перемешивали в течение ночи. Добавляли к реакционной смеси раствор NH4Cl (100 мл), разделяли фазы и экстрагировали дважды водный слой с помощью EtOAc (2×60 мл). После выпаривания растворителя остаток наносили в картридж «Biotage SNAP-Si» (2100 г) элюируя смесью сНех/EtOAc с 100/0 по 95/05. Собранные фракции после упаривания растворителя давали титульное соединение (D12) (5,12 г).
MS: (ES/+) m/z: 520,2 [МН+] C30H37NO3SSi предусматривает 519,23
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,68-7,61 (m, 4H), 7,61-7,55 (m, J=7,8 Гц, 2H), 7,50-7,35 (m, 6H), 7,21-7,15 (m, J=8,3 Гц, 2H), 3,92-3,83 (m, 1H), 3,71-3,59 (m, 2H), 3,42-3,26 (m, 2H), 2,40 (s, 3H), 2,26 (ddd, J=1,5, 8,3, 14,7 Гц, 1H), 1,41 (td, J=5,3, 14,3 Гц, 1H), 1,11-1,03 (m, 9H), 0,93-0,82 (m, 1H), 0,82-0,71 (m, 1H), 0,70-0,58 (m, 1H), 0,03 (q, J=4,9 Гц, 1H)
Описание 13: 4-(((трет-бутилдифенилсилил)окси)метил)-3-азабицикло[4.1.0]гептан (рацемическая смесь) (D13)
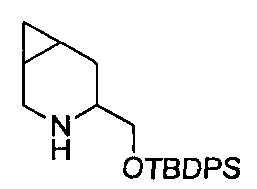
К раствору 4-(((трет-бутилдифенилсилил)окси)метил)-3-тозил-3-азабицикло[4.1.0]гептана (D12) (3,12 г, 6 ммоль) в МеОН (430 мл), в атмосфере азота, последовательно добавляли магниевые стружки (предварительно высушенные пламенем) (8,46 г, 348 ммоль) и NH4Cl (8,9 г, 168 ммоль) и смесь перемешивали при 23°C. Были сделаны два дополнительных добавления магния (4,3 г), каждое после 2 часов перемешивания. Добавляли в реакционную смесь DCM (210 мл) и насыщ. раств. NH4Cl (285 мл). Образованную эмульсию фильтровали через слой целита. Органический слой отделяли и промывали рассолом (2×55 мл). Объединенные органические слои упаривали и полученный остаток очищали с помощью картриджа «SPE-SCX» (20 г). Собранные фракции аммиака после упаривания растворителя давали титульное соединение (D13) (1,65 г).
MS: (ES/+) m/z: 365,7 [МН+] C23H31NOSi предусматривает 365,22
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,67 (d, J=6,8 Гц, 4H), 7,49-7,36 (m, 6H), 3,64-3,51 (m, 3H), 2,82 (dd, J=2,7, 12,5 Гц, 1H), 2,40 (tdd, J=3,9, 7,5, 11,1 Гц, 1H), 1,72 (dd, J=3,9, 13,2 Гц, 1H), 1,57 (ddd, J=5,6, 11,1, 13,1 Гц, 1H), 1,19-0,99 (m, 11H), 0,67 (dt, J=4,6, 8,7 Гц, 1H), 0,21 (q, J=5,4 Гц, 1H).
Описание 14: трет-бутил 4-(((трет-бутилдифенилсилил)окси)метил)-3-азабицикло[4.1.0]гептан-3-карбоновая кислота (рацемическая смесь) (D14)
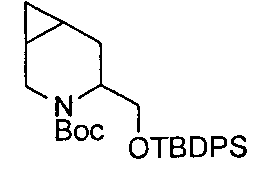
К раствору 4-(((трет-Бутилдифенилсилил)окси)метил)-3-азабицикло[4.1.0]гептана (D13) (1,65 г, 4,51 ммоль) и TEA (1,25 мл, 9,02 ммоль) в ДХМ (30 мл), добавляли Boc2O (1,08 г, 4,96 ммоль) и перемешивали реакционную смесь при RT в течение 1 часа. Раствор разбавляли H2O (50 мл), промывали 1N HCl (2×35 мл), а затем насыщ. р-ром NaHCO3 (2×35 мл). Объединенные органические слои упаривали в вакууме и полученный остаток наносили в картридж «SPE-Si» (50 г) и элюировали смесью циклогексан/EtOAc от 100/0 до 90/10. Собранные фракции после упаривания растворителя давали титульное соединение (D14) (2,10 г).
MS: (ES/+) m/z: 488,2 [MH+Na+] C28H39NO3Si предусматривает 465,7
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 7,62 (ddd, J=2,0, 3,9, 5,9 Гц, 4H), 7,54-7,36 (m, 6H), 4,09-3,84 (m, 1Н), 3,74 (d, J=12,2 Гц, 1Н), 3,70-3,55 (m, 2H), 3,32-3,26 (m, 1Н), 2,09-1,81 (m, 1Н), 1,63 (ddd, J=3,4, 6,8, 14,7 Гц, 1Н), 1,40-1,25 (m, 9H), 1,00 (s, 9H), 0,88 (br. s., 2H), 0,63-0,47 (m, 1Н), -0,02 (d, J=3,9 Гц, 1Н).
Описание 15: трет-бутпл 4-(гидроксиметил)-3-азабицикло [4.1.0] гептан-3-карбоновая кислота (рацемическая смесь) (D15)
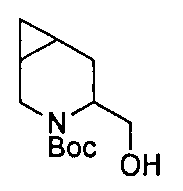
К раствору трет-бутил 4-(((трет-бутилдифенилсилил)окси)метил)-3-азабицикло[4.1.0]гептан-3-карбоксилата (D14) (2,10 г, 4,5 ммоль) в THF (80 мл), добавляли 1 М р-р TBAF в THF (9,01 мл) и перемешивали реакционную смесь при RT в течение 18 часов. Растворители упаривали в вакууме, и полученный остаток очищали на картридже «SPE-Si» (5 г), элюируя смесью циклогексан/EtOAc от 90/10 до 40/60. Собранные фракции после упаривания растворителя давали титульное соединение (D15) (0,93 г).
MS: (ES/+) m/z: 172,1 [МН-56+] C12H21NO3 предусматривает 277,15
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 4,66 (br. s., 1Н), 3,78 (br. s., 1Н), 3,71 (d, J=13,7 Гц, 1Н), 3,47-3,31 (m, 2H), 3,28 (br. s., 1Н), 1,96-1,83 (m, 1Н), 1,59-1,49 (m, 1H), 1,42-1,34 (m, 9H), 0,89 (s, 2H), 0,59 (dt, J=4,4, 8,3 Гц, 1H), -0,08 (q, J=4,9 Гц, 1H).
Описание 16: трет-бутил-4-формил-3-азабицикло[4.1.0]гептан-3-карбоновая кислота (рацемическая смесь) (D16)
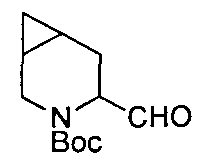
К раствору трет-бутил 4-(гидроксиметил)-3-азабицикло[4.1.0]гептан-3-карбоксилата (D15) (820 мг, 3,6 ммоль) добавляли TEMPO (112,7 мг, 0,72 ммоль) в DCM (8 мл), BAIB (1,27 г, 3,96 ммоль) и перемешивали полученную смесь при RT 4 часа. Реакционную смесь разбавляли DCM (35 мл), промывали насыщ. р-ром Na2S2O3 (35 мл) и экстрагировали DCM (2×35 мл). Объединенные органические экстракты промывали насыщ. р-ром NaHCO3 (35 мл) и рассолом (35 мл), сушили и упаривали при пониженном давлении, а оставшийся остаток наносили в картридж «SPE-Si» (25 г) и элюировали смесью циклогексан/EtOAc от 95/05 до 80/20. Собранные фракции после упаривания растворителя давали титульное соединение (D16) (0,62 г).
MS: (ES/+)m/z: 170,1 [МН-56+] C12H19NO3 предусматривает 225,14
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 9,46 (d, J=19,1 Гц, 1Н), 4,13-3,95 (m, 1H), 3,75-3,60 (m, 1H), 3,59-3,35 (m, 1H), 2,30-2,19 (m, 1H), 1,76-1,59 (m, 1H), 1,47-1,29 (m, 9H), 1,14-0,84 (m, 2H), 0,62 (dt, J=4,9, 8,3 Гц, 1H), 0,24-0,05 (m, 1H).
Описание 17: 3-(трет-Бутоксикарбонил)-3-азабицикло[4.1.0]гептан-4-карбоновая кислота (рацемическая смесь) (D17)
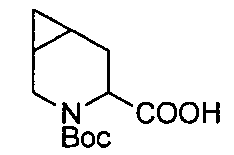
К смеси трет-бутил-4-формил-3-азабицикло[4.1.0]гептан-3-карбоксилата (D16) (615 мг, 2,73 ммоль) в ацетоне/воде (30/20 мл) добавляли NaH2PO4 0,2 H2O (426 мг, 2,73 ммоль), 2-метил-2-бутен (1,3 мл, 12,28 ммоль) и NaClO2 (864 мг, 9,55 ммоль) и перемешивали реакционную смесь при RT в течение ночи. Растворители упаривали в вакууме и растворяли полученный остаток в EtOAc (10 мл) и воде (10 мл). Фазы разделяли и экстрагировали водный слой EtOAc (2×10 мл). Объединенные органические экстракты после упаривания растворителя давали титульное соединение (D17) (0,5 г).
MS: (ES/+) m/z: 264,1 [MH+Na+] C12H19NO4 предусматривает 241,13
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 12,51 (br. s., 1H), 4,25-4,01 (m, 1H), 3,65-3,51 (m, 1H), 3,37 (dd, J=4,6, 13,4 Гц, 1H), 2,31-2,16 (m, 1H), 1,81-1,67 (m, 1H), 1,42-1,32 (m, 9H), 1,12-0,85 (m, 2H), 0,67-0,53 (m, 1H), 0,19-0,04 (m, 1H).
Описание 18: (R)-этил-6-оксопиперидин-2-карбоксилат (D18)
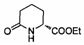
2-горлую колбу загружали EtOH (60 мл) и охлаждали до -5°C. Хлористый тионил (2,8 мл, 38,4 ммоль) добавляли по каплям таким образом, чтобы температура не превышала 0°C. D-6-оксопипеколиновую кислоту (5 г, 34,9 ммоль, поставляется «Fluorochem» #040124) добавляли порциями, оставляли полученную смесь нагреваться до RT и перемешивали в течение 18 часов. EtOH упаривали до 15% от его объема и добавляли толуол (60 мл) с последующим добавлением TEA (10,6 мл, 76,8 ммоль) таким образом, чтобы температура не превышала 10°C. Суспензию перемешивали в течение 30 мин, после чего фильтровали белую соль. Фильтрат упаривали в вакууме и полученный остаток снова растворяли в Et2O (80 мл). Белое твердое вещество отфильтровывали и фильтрат упаривали в вакууме с получением титульного соединения (D18) (6,4 г)
MS: (ES/+)m/z: 172,1 [МН+] C8H13NO3 предусматривает 171,09
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,34-7,09 (m, 2H), 6,51 (br. s., 1H), 4,24 (q, J=7,2 Гц, 2H), 4,08 (t, J=5,9 Гц, 1H), 2,51-2,29 (m, 3H), 2,26-2,12 (m, 1H), 2,02-1,70 (m, 3H).
Описание 19: (R)-1-трет-бутил-2-этил-6-оксопиперидин-1,2-дикарбоксилат (D19)
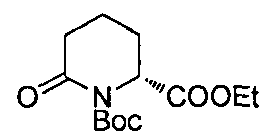
(R)-Этил-6-оксопиперидин-2-карбоксилат (D18) (5,97 г, 34,9 ммоль) растворяли в толуоле (30 мл) с предварительным добавлением DMAP (213 мг, 1,74 ммоль). Через 10 минут добавляли по каплям раствор Boc2O (7,61 г, 34,9 ммоль) в толуоле (20 мл) и оставляли полученную смесь перемешиваться при RT в течение 7 часов. Добавляли Boc2O (1,52 г, 6,97 ммоль) и дополнительно перемешивали смесь в течение 18 часов. Затем реакционную смесь загружали полунасыщенным раствором NaHCO3 (100 мл) и перемешивали в течение 10 мин, перед разделением двух фаз. Отделенную органическую фазу промывали водой (2×50 мл), сушили над Na2SO4 и упаривали в вакууме с получением титульного соединения (D19) (9,06 г).
MS: (ES/+) m/z: 294,1 [MH+Na+] C13H21NO5 предусматривает 271,14
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,77-4,63 (m, 1H), 4,24 (dd, J=2,7, 7,1 Гц, 2H), 2,68-2,42 (m, 2H), 2,26-2,13 (m, 1H), 2,12-1,97 (m, 1H), 1,88-1,69 (m, 2H), 1,59-1,44 (m, 9H), 1,30 (t, J=7,1 Гц, 3H), 1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,77-4,63 (m, 1H), 4,24 (dd, J=2,7, 7,1 Гц, 2H), 2,68-2,42 (m, 2H), 2,26-2,13 (m, 1H), 2,12-1,97 (m, 1H), 1,88-1,69 (m, 2H), 1,59-1,44 (m, 9H), 1,30 (t, J=7,1 Гц, 3H).
Описание 20: (R)-1-трет-бутил-2-этил3,4-дигидропиридин-1,2(2Н)-дикарбоксилат (D20)
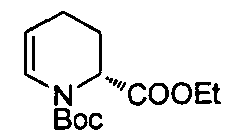
Раствор (R)-1-трет-бутил-2-этил-6-оксопиперидин-1,2-дикарбоксилата (D19) (0,5 г, 1,84 ммоль) в толуоле (5 мл) охлаждали до -50°C. 1 М раствор LiEt3BH в THF (1,93 мл, 1,93 ммоль) добавляли по каплям таким образом, чтобы температура реакции не превышала -45°C. После завершения добавления смесь перемешивали при -45°C в течение 30 минут. Добавляли к реакционной смеси DIPEA (1,38 мл, 7,92 ммоль), поддерживая температуру ниже -45°C, после чего добавляли DMAP (3,4 мг, 0,027 ммоль). Реакционную смесь затем насыщали TFAA (0,3 мл, 2,11 ммоль), поддерживая температуру ниже -45°C. После завершения добавления реакционную смесь нагревали до 20-25°C в течение одного часа и выдерживали при этой температуре в течение дополнительных 4 часов. Реакционную смесь гасили медленным добавлением воды. Фазы разделяли и органическую фазу промывали водой, сушили над Na2SO4 и концентрировали с получением прозрачного масла, которое использовали как таковое для проведения тоже процедуры еще раз с получением титульного соединения (D20) (260 мг).
MS: (ES/+) m/z: 278,1 [MH+Na+] C13H21NO4 предусматривает 255,15
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 6,98-6,71 (m, 1H), 4,99-4,86 (m, 1H), 4,86-4,65 (m, 1H), 4,32-4,12 (m, 2H), 2,44-2,24 (m, 1H), 2,08-1,76 (m, 3H), 1,65-1,44 (m, 9H), 1,38-1,17 (m, 3H).
Описание 21: (3R)-2-трет-бутил-3-этил-2-азабицикло[4.1.0]гептан-2,3-дикарбоксилат (смесь диастереоизомеров) (D21)
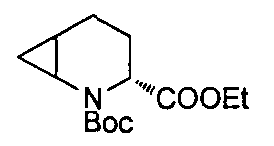
К раствору (R)-1-трет-бутил-2-этил 3,4-дигидропиридин-1,2(2H)-дикарбоксилата (D20) (260 мг, 1,02 ммоль) в толуоле (5 мл), охлажденному до -30°C, добавляли 1 М раствор диэтилового цинка в гептане (2,04 мл, 2,04 ммоль) по каплям с последующим добавлением дийодметана (0,33 мл, 4,07 ммоль) в толуоле (1 мл). (Во время добавления реагентов температура реакции поддерживалась между -25°C и -30°C). Реакционную смесь перемешивали при -20°C в течение 24 часов. Добавляли 1 М раствор диэтилового цинка в гептане (2,04 мл, 2,04 ммоль) и дийодметан (0,33 мл, 4,07 ммоль) и оставляли реакцию перемешиваться при -20°C в течение следующих 24 часов. Реакцию гасили полунасыщенным NaHCO3 (10 мл) и перемешивали в течение 30 мин. Белый осадок отфильтровывали. Органическую фазу промывали водой (2×20 мл), сушили над Na2SO4 и упаривали в вакууме с получением титульного соединения (D21) (600 мг), используемого без дополнительной очистки.
MS: (ES/+) m/z: 292,1 [MH+Na+] C14H23NO4 предусматривает 269,16
Описание 22: (3R)-2-(трет-бутоксикарбонил)-2-азабицикло[4.1.0]гептан-3-карбоновая кислота (смесь диастереомеров) (D22)
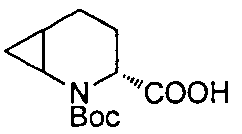
(3R)-2-трет-бутил-3-этил-2-азабицикло[4.1.0]гептан-2,3-дикарбоновую кислоту (D21) (600 мг, 2,22 ммоль) распределяли между диоксаном (10 мл) и водой (5 мл) перед добавлением LiOH H2O (370 мг, 8,9 ммоль). Смесь перемешивали при RT в течение 18 часов. Добавляли воду (10 мл) и LiOH H2O (740 мг, 18 ммоль) и оставляли смесь при RT в течение 66 ч. Диоксан упаривали и оставшийся водный раствор промывали Et2O (3×20 мл). Водный раствор подкисляли уксусной кислотой до pH 4 и экстрагировали EtOAc (3×30 мл). Собранные органические вещества промывали насыщ. NaCl, сушили над Na2SO4 и упаривали в вакууме с получением титульного соединения (D22) (210 мг).
MS: (ES/+)m/z: 264,1 [MH+Na+] C12H19NO4 предусматривает 241,13
Описание 23: (R)-этил-5-оксопирролидин-2-карбоновая кислота (D23)
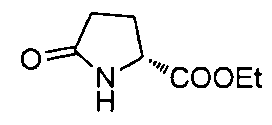
К раствору (R)-5-оксопирролидин-2-карбоновой кислоты (10 г, 69,84 ммоль, поставляется «Aldrich» #422614) в EtOH (100 мл), охлажденному до -5°C, добавляли тионилхлорид (10 мл, 139,68 ммоль) и полученную смесь перемешивали при RT в течение 3 часов. Растворители упаривали в вакууме, и полученный остаток обрабатывали EtOAc (350 мл), промывали водой/ТЕА (40/12 мл), затем водой (40 мл). Собранные органические вещества сушили над Na2SO4 и упаривали с получением остатка, который загружали в картридж «SNAP-Si» (50 г) и элюировали смесью DCM/этилацетат от 90/10 до 50/50. Собранные фракции после испарения растворителя давали первую порцию титульного соединения (D23) (6,4 г). Водный слой насыщали NaCl и экстрагировали EtOAc (400 мл). Органический слой промывали водой (20 мл), сушили над Na2SO4 и упаривали в вакууме с получением второй партии титульного соединения (D23) (3,7 г).
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 6,58 (br. s., 1H), 4,29-4,17 (m, 3H), 2,53-2,29 (m, 3H), 2,28-2,17 (m, 1H), 1,35-1,22 (m, 3H).
Описание 24: (R)-1-трет-бутил-2-этил-5-оксопирролидин-1,2-дикарбоксилат (D24)
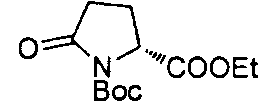
К раствору (R)-Этил-5-оксопирролидин-2-карбоновой кислоты (D23) (10 г, 63,62 ммоль) в толуоле (50 мл), добавляли DMAP (390 мг, 3,2 ммоль) перед добавлением, через 10 мин, раствора Boc2O (13,9 г, 63,62 ммоль) в толуоле (50 мл). Реакционную смесь перемешивали при RT в течение ночи, затем разбавляли EtOAc (200 мл), загружали полунасыщенным раствором NaHCO3 (60 мл) и перемешивали в течение 10 мин. Фазы разделяли и органическую фазу промывали водой (40 мл), сушили над Na2SO4 и упаривали в вакууме с получением остатка, который измельчали в гептане. После фильтрации и сушки при пониженном давлении выделили 13,7 г титульного соединения (D24).
MS: (ES/+) m/z: 280 [MH+Na+] C12H19NO5 предусматривает 257,13
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,68-4,57 (m, 1H), 4,26 (q, J=7,3 Гц, 2H), 2,72-2,58 (m, 1Н), 2,57-2,43 (m, 1H), 2,42-2,26 (m, 1H), 2,12-1,99 (m, 1H), 1,52 (s, 9H), 1,32 (t, J=7,1 Гц, 3H).
Описание 25: (R)-1-трет-бутил 2-этил-2,3-дигидро-1H-пиррол-1,2-дикарбоксилат (D25)
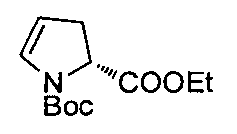
К раствору (R)-1-трет-бутил 2-этил-5-оксопирролидин-1,2-дикарбоксилата (D24) (14,3 г, 55,58 ммоль) в толуоле (100 мл), охлажденному до -50°C, по каплям добавляли 1 М р-р LiEt3BH в THF (58,4 мл, 58,36 ммоль), поддерживая температуру реакционной смеси ниже -45°C. После завершения добавления смесь перемешивали при -45°C в течение 30 мин. Последовательно добавляли DIPEA (42 мл, 239 ммоль), DMAP (102 мг, 0,83 ммоль) и TFAA (8,9 мл, 63,92 ммоль), поддерживая температуру реакционной смеси ниже -45°C. После завершения добавления реакционную смесь нагревали до 20-25°C в течение одного часа и выдерживали при этой температуре в течение дополнительных 2 часов. Реакционную смесь медленно насыщали водой (8 мл) так, чтобы температура не превышала 5°C и разбавляли EtOAc (50 мл). Водную и органическую фазы затем разделяли и органическую фазу промывали снова водой (8 мл), сушили над Na2SO4 и упаривали с получением остатка, который очищали с помощью картриджа «Biotage SNAP-Si» (50 г) с элюированием смесью циклогексан/EtOAc от 90/10 до 50/50. Собранные фракции после упаривания растворителя давали титульное соединение (D25) (10,4 г).
MS: (ES/+) m/z: 264 [МН+Na+] C12H19NO4 предусматривает 241,13
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 6,73-6,44 (m, 1Н), 4,93 (d, J=19,1 Гц, 1Н), 4,73-4,49 (m, 1Н), 4,36-4,09 (m, 2H), 3,19-2,94 (m, 1H), 2,77-2,54 (m, 1H), 1,57-1,37 (m, 9H), 1,37-1,18 (m, 3H).
Описание 26: (3R)-2-трет-бугил 3-этил-2-азабицикло[3.1.0]гексан-2,3-дикарбоксилат (смесь диастереоизомеров) (D26)
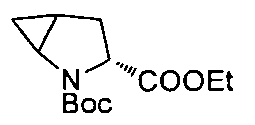
В трехгорлую колбу на огне загружали 1,0 М раствор диэтилового цинка в гексане (62 мл, 62 ммоль) и толуол (100 мл). Полученный раствор охлаждали до -10°C, насыщали покапельно дийодметаном (5 мл, 62 ммоль) и перемешивали при 0°C в течение 10 мин. Реакционную смесь охлаждали до -10°C, насыщали раствором (R)-1-трет-бутил-2-этил 2,3-дигидро-1Н-пиррол-1,2-дикарбоксилата (D25) (5 г, 21 ммоль) в толуоле (30 мл) и выдерживали при 0°C. Через 6 часов смесь гасили насыщенным раствором NaHCO3 (80 мл); образовавшийся белый осадок отфильтровывывали и промывали AcOEt (500 мл). Водную и органическую фазу разделяли и промывали органическую фазу водой (60 мл), сушили над Na2SO4 и упаривали с получением 4,5 г желтого масла. Этот материал, растворенный в толуоле (30 мл) добавляли, в течение 45 мин, к раствору 1 М диэтилцинка в гексане (62 мл) и дийодметана (5 мл) в толуоле (100 мл), полученном, как описано выше (T=-10°C), а полученную смесь перемешивали при 0°C в течение 4 часов. Через 4 часа смесь гасили полунасыщенным NaHCO3 (80 мл); образовавшийся белый осадок отфильтровывали и промывали AcOEt (500 мл). Водную и органическую фазы разделяли и органическую фазу промывали водой (60 мл), сушили над Na2SO4 и упаривали с получением 3,85 г желтого масла, которое загружали в картридж «SPE-Si» (50 г) и элюировали смесью циклогексан/AcOEt 95/5. Собранные фракции после упаривания растворителя давали титульное соединение (D26) (1,19 г) в виде смеси диастереоизомера с соотношением син-анти 8/2.
MS: (ES/+) m/z: 278 [MH+Na+] C13H21NO4 предусматривает 255,15
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,66-4,46 (m, 1H), 4,26-3,93 (m, 5H), 3,62-3,40 (m, 2H), 2,70-2,50 (m, 1H), 2,42-2,17 (m, 2H), 2,10-1,99 (m, 1H), 1,69-1,58 (m, 2H), 1,56-1,40 (m, 18H), 1,32-1,21 (m, 6H), 0,96-0,64 (m, 3H), 0,48 (br. s., 1H).
Описание 27: (3R)-2-(трет-бутоксикарбонил)-2-азабицикло[3.1.0]гексан-3-карбоновая кислота (смесь диастереоизомеров) (D27)
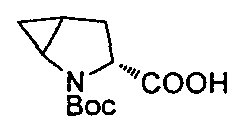
К смеси (3R)-2-трет-бутил-3-этил-2-азабицикло[3.1.0]гексан-2,3-дикарбоксилата (D26) (смесь диастереоизомеров) (3,4 г, 13,3 ммоль) в диоксане (15 мл) и воде (15 мл), добавляли LiOH H2O (2,2 г, 53 ммоль). Смесь перемешивали при RT в течение 18 часов. Диоксан упаривали, а воду вымывали Et2O (2×40 мл), затем доводили pH до ~4 добавлением лимонной кислоты и полученную водную фазу экстрагировали DCM (200 мл), промывали водой (20 мл), сушили над Na2SO4 и упаривали в вакууме с получением титульного соединения (D27) (2,75 г) как смеси диастереоизомеров с соотношением син-анти 10/2.
MS: (ES/+) m/z: 226 [M-] C11H17NO4 предусматривает 227,12
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 12,69-12,41 (m, 2H), 4,45-4,32 (m, 1H), 3,89 (br. s. 1H), 3,42-3,32 (m, 2H), 2,65-2,54 (m, 1H), 2,35-2,24 (m, 1H), 2,09 (m, 1H), 1,95-1,73 (m, 1H), 1,60-1,46 (m, 2H), 1,44-1,30 (m, 18H), 0,76-0,60 (m, 3H), 0,46 (dt, J=2,4, 4,9 Гц, 1H).
Описание 28: (R)-5-(((трет-бутилдифенилсилил)окси)метил)пирролидин-2-он (D28)
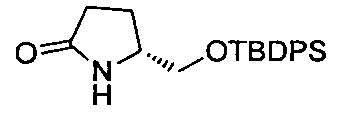
К охлажденному на льду раствору R-(5)-гидроксиметил-2-пирролидона (4 г, 34,7 ммоль, поставляется «Aldrich» #366358) в DMF (30 мл), добавляли имидазол (2,6 г, 38,2 ммоль) и TBDPSiCl (9,4 мл, 38,2 ммоль) и перемешивали полученную смесь при RT в течение 3 часов. После выпаривания растворителя добавляли воду и экстрагировали смесь МТВЕ (2×50 мл). Собранные органические вещества промывали насыщ. NaCl, сушили над Na2SO4 и упаривали. Остаток очищали на колонке «Biotage SNAP-Si» (50 г), элюируя смесью Et2O/ацетон от 100/0 до 80/20. Собранные фракции после упаривания растворителя давали титульное соединение (D28) (9,75 г).
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,72-7,59 (m, 4H), 7,53-7,37 (m, 6H), 5,82 (br. s., 1H), 3,83 (dd, J=4,2, 5,1 Гц, 1H), 3,69-3,61 (m, 1H), 3,53 (dd, J=7,8, 10,3 Гц, 1H), 2,42-2,28 (m, 2H), 1,80-1,60 (m, 2H), 1,13-1,01 (m, 9H).
Описание 29: (R)-трет-бутил 2-(((трет-бутилдифенилсилил)окси)метил)-5-оксопирролидин-1-карбоксилат (D29)
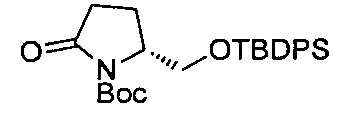
К охлажденному на льду раствору (R)-5-(((трет-бутилдифенилсилил)окси)метил)пирролидин-2-она (D28) (8 г, 22,6 ммоль) в DCM (40 мл), добавляли пиридин (2,5 мл) и DMAP (0,55 г, 4,52 ммоль) с последующим добавлением Boc2O (4,98 г, 22,8 ммоль). Раствор оставляли нагреваться до RT. После 3 часов перемешивания добавляли Boc2O (1,48 г, 6,78 ммоль) и перемешивали смесь в течение 18 часов. Добавляли нас. р-р NH4Cl (30 мл), затем подкисляли смесь до pH ~4 добавлением 2N HCl. Органическую фазу отделяли, а водную экстрагировали МТВЕ. Собирали органические фазы и промывали последовательно H3PO4, водой и рассолом, затем сушили и упаривали. Объединенные органические вещества после упаривания растворителя очищали на колонке «Biotage SNAP-Si» (25 г) с элюированием смесью Et2O. Собранные фракции после упаривания растворителя давали титульное соединение (D29) (8 г).
MS: (ES/+) m/z: 454,4 [МН+] C26H35NO4Si предусматривает 453,65
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,64 (dd, J=7,0, 12,9 Гц, 4H), 7,51-7,36 (m, 6H), 4,28-4,19 (m, 1Н), 3,96-3,86 (m, 1Н), 3,79-3,66 (m, 1Н), 2,87-2,72 (m, 1Н), 2,52-2,38 (m, 1H), 2,23-2,08 (m, 2H), 1,46 (s, 9H), 1,07 (s, 9H).
Описание 30: (5R)-трет-бутил 5-(((трет-бутилдифенилсилил)окси)метил)-2-оксо-3-((триметилстаннил)метил)пирролидин-1-карблоксилат (смесь диастереоизомеров) (D30)
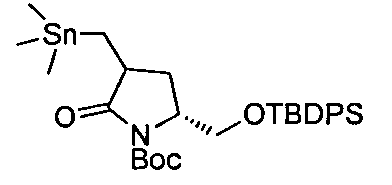
К раствору (R)-трет-бутил 2-(((трет-бутилдифенилсилил)окси)метил)-5-оксопирролидин-1-карбоксилата (D29) (6 г, 13,23 ммоль) в THF (80 мл), охлажденному при -70°C, добавляли по каплям 1 М раствор LiHMDS в THF (17,2 мл) в течение 15 минут. Реакционную смесь выдерживали при -78°C в течение 1 ч перед добавлением (иодометил)триметилстаннана (6,04 г, 19,84 ммоль) в течение 5 минут. Смеси позволяли нагреться до -35 и перемешивали при этой температуре в течение 2 часов. Добавляли насыщ. р-р NH4Cl (15 мл) и разбавляли смесь EtOAc (40 мл). Органический слой отделяли и подкисляли водную фазу до pH ~4 с помощью 0,5 N HCl, и последнюю повторно экстрагировали EtOAc (3×50 мл). Органические фазы объединяли, сушили над Na2SO4 и упаривали в вакууме. Остаток очищали хроматографией на «Biotage SNAP-Si» (50 г) с элюированием смесью циклогексан/EtOAc от 100/0 до 90/10. Собранные фракции после упаривания растворителя давали титульное соединение (D30) в виде смеси диастереоизомеров (3,2 г).
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,69-7,59 (m, 8H), 7,46-7,38 (m, 12H), 4,16-4,09 (m, 2H), 4,09-4,01 (m, 1H), 3,86 (d, J=4,4 Гц, 2H), 3,75-3,69 (m, 1H), 3,05-2,90 (m, 1H), 2,69-2,56 (m, 1H), 2,45-2,33 (m, 2H), 1,82-1,70 (m, 2H), 1,44 (s, 9H), 1,41 (s, 9H), 1,28 (s, 1H), 1,23-1,13 (m, 1H), 1,08 (s, 9H), 1,06 (s, 9H), 0,99-0,94 (m, 1H), 0,94-0,86 (m, 1H), 0,24-0,04 (m, 18H)
Описание 31: (3R)-трет-бутил 3-(((трет-бутилдифенилсилил)окси)метил)-2-азабицикло[3.1.0]гексан-2-карбоновая кислота (смесь диастереоизомеров) (D31)
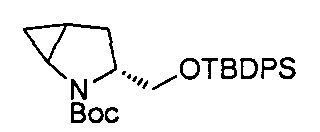
К раствору (5R)-трет-бутил 5-(((трет-бутилдифенилсилил)окси)метил)-2-оксо-3-((триметилстаннил)метил)пирролидин-1-карбоксилата (D30) (3,1 г, 6,86 ммоль) в THF (200 мл), охлажденному до -78°C, добавляли по каплям 1 М р-р LiEt3BH 1 M в THF (17,2 мл). Реакционную смесь оставляли при -78°C в течение 2 ч, затем добавляли воду (50 мл), и экстрагировали реакционную Et2O (3×100 мл). Органические фазы объединяли, сушили над Na2SO4 и упаривали в вакууме с получением остатка, который растворяли в DCM (120 мл) и охлаждали до 0°C. Добавляли TFA (1,31 мл, 17,2 ммоль) и перемешивали реакционную смесь 10 мин при этой температуре. Добавляли насыщ. р-р K2CO3 (100 мл) и экстрагировали смесь DCM (3×100 мл). Органические фазы собирали, сушили над Na2SO4 и упаривали в вакууме с получением остатка, который очищали с помощью колонки «BiotageSNAP-Si» (50 г) с элюированием смесью циклогексан/EtOAc 95/5. Собранные фракции после упаривания растворителя давали титульное соединение (D31) (2,1 г).
MS: (ES/+) m/z: 474,4 [MH+Na+] C27H37NO3Si предусматривает 451,25
1H ЯМР (400 МГц, CHCl3-d) δ м.д.: 7,78-7,56 (m, 4H), 7,48-7,35 (m, 6H), 3,88 (br. s., 1H), 3,73 (br. s., 1H), 3,21 (br.. s., 1H), 2,44-2,28 (m, 1H), 2,11-1,98 (m, 1H), 1,52 (br. s., 2H), 1,45 (s, 9H), 1,08 (s, 9H), 0,97-0,77 (m, 1H), 0,37 (br. s., 1H).
Описание 32: (3R)-трет-бутил 3-(гидроксиметил)-2-азабицикло[3.1.0]гексан-2-карбоксилат (смесь диастереоизомеров) (D32)
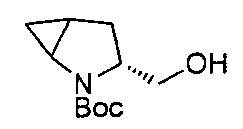
К раствору (3R)-трет-бутил-3-(((трет-бутилдифенилсилил)окси)метил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (D31) (2,1 г, 4,6 ммоль) в THF (130 мл), добавляли 1 M р-р TBAF в THF (9,2 мл) и перемешивали раствор при RT в течение 18 часов. Растворитель упаривали и очищали остаток на колонке «Biotage SNAP-Si» (50 г), элюируя смесью DCM/Et2O от 100/0 до 80/20. Собранные фракции после упаривания растворителя давали титульное соединение (D32) (490 мг).
MS: (ES/+) m/z: 236,3 [MH+Na+] C11H19NO3 предусматривает 213,14
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 3,78-3,67 (m, 1H), 3,65-3,61 (m, 2H), 3,28 (dt, J=2,4, 6,1 Гц, 1H), 3,23-2,89 (br. s., 1H), 2,17 (dd, J=8,3, 13,2 Гц, 1H), 1,88-1,78 (m, 1H), 1,54-1,43 (m, 10H), 0,78-0,69 (m, 1H), 0,42 (dt, J=2,4, 5,3 Гц, 1H).
Описание 33: (3R)-2-(трет-бутоксикарбонил)-3-азабицикло[3.1.0]гексан-2-карбоновая кислота (смесь диастереоизомеров) (D33)
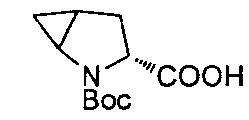
К раствору (3R)-трет-бутил 3-(гидроксиметил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (D32) (440 мг, 2,06 ммоль) в смеси MeCN/CCl4/H2O (6/6/9 мл), добавляли периодат натрия (1,76 г, 8,25 ммоль) и энергично перемешивали реакционную смесь в течение 5 мин перед добавлением трихлорида рутения (12,8 мг, 0,062 ммоль). Полученный раствор перемешивали 18 ч при RT, затем гасили добавлением изопропанола (6 мл). Полученную черную смесь разбавляли Et2O (50 мл) и фильтровали через слой целита. Фильтрат упаривали и растворяли остаток в воде, pH доводили до pH ~9-10 с K2CO3 и промывали водный слой Et2O (3×30 мл). Водный слой затем подкисляли до pH ~4-5 и повторно экстрагировали EtOAc (3×30 мл). Собранные органические вещества после упаривания растворителя давали титульное соединение (D33) (216 мг).
MS: (ES/+) m/z: 250,2 [МН+] C11H17NO4 предусматривает 227,12
Описание 34: (R)-3,3-диметилтетрагидропирроло[1,2-с]оксазол-5(3H)-он (D34)
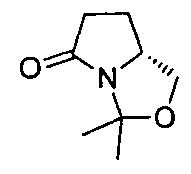
К перемешиваемой суспензии (R)-(-)-5-(гидроксиметил)пирролидин-2-она (2 г, 17,4 ммоль, поставляется «Aldrich» #366358) и p-TSA (16 мг, 0,08 ммоль) в толуоле (50 мл), добавляли 2,2-диметоксипропан (6,4 мл, 52,1 ммоль) одной порцией и дефлегмировали реакционную смесь в течение 2 часов. Реакционную колбу оборудовали аппаратом Дина-Старка, затем добавляли 2,2-диметоксипропан (6,4 мл, 52,1 ммоль) и дефлегмировали реакционную смесь в течение ночи. Растворитель упаривали в вакууме, получая титульное соединение (D34) (2,4 г).
MS: (ES/+) m/z: 156,1 [МН+] C8H13NO2 предусматривает 155,09
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,26 (ddd, J=2,7, 5,9, 9,0 Гц, 1Н), 4,14-4,02 (m, 1Н), 3,53-3,37 (m, 1Н), 2,88-2,71 (m, 1Н), 2,62-2,47 (m, 1Н), 2,27-2,11 (m, 1H), 1,86-1,69 (m, 1H), 1,67 (d, J=2,9 Гц, 3H), 1,47 (d, J=2,9 Гц, 3H).
Описание 35: (R)-3,3,6,6-тетраметилтетрагидропирроло[1,2-с]оксазол-5(3H)-он (D35)
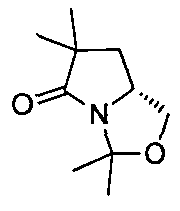
К раствору (R)-3,3-диметилтетрагидропирроло[1,2-с]оксазол-5(3H)-она (D34) (1,3 г, 8,37 ммоль) в сухом THF (120 мл), охлажденном до -78°C, добавляли 2 М р-р LDA в THF/гептан (6,28 мл, 12,6 ммоль). Красный раствор перемешивали при этой температуре в течение 40 мин перед добавлением йодметана (0,78 мл, 12,6 ммоль). Реакционную смесь нагревали до комнатной температуры (40 мин), затем охлаждали до -78°C перед добавлением 2 М р-ра LDA в THF/гептан (6,28 мл, 12,6 ммоль). Смесь перемешивали при -78°C в течение 1 ч перед добавлением йодметана (0,78 мл, 12,6 ммоль), затем смесь медленно нагревали до RT и перемешивали в течение ночи. Полученный раствор обрабатывали насыщ. р-ром NH4Cl (10 мл) и экстрагировали Et2O (3×10 мл). Органические фазы собирали и промывали насыщ. р-ром NaCl сушили над Na2SO4 и упаривали в вакууме, получая титульное соединение (D35) (1,2 г).
MS: (ES/+)m/z: 184,1 [МН+] C10H17NO2 предусматривает 183,13
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,24-4,10 (m, 2H), 3,42 (t, J=8,6 Гц, 1Н), 2,04 (dd, J=5,9, 12,2 Гц, 1Н), 1,68 (s, 3H), 1,60 (dd, J=3,2, 8,6 Гц, 1Н), 1,49 (s, 3H), 1,26 (s, 3H), 1,21 (s, 3H).
Описание 36: (R)-5-(гидроксиметил)-3,3-диметилпирролидин-2-он (D36)
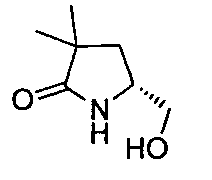
К перемешиваемой суспензии (R)-3,3,6,6-тетраметилтетрагидропирроло[1,2-с]оксазол-5(3H)-она (D35) (714 мг, 3,89 ммоль) в МеОН (15 мл), добавляли p-TSA (74 мг, 0,39 ммоль) и полученную смесь нагревали с обратным холодильником в течение 2 часов. Растворитель упаривали и загружали остаток в картридж «SPE-SCX» (5 г). Картридж промывали МеОН (3 объема колонки). Метанольную фазу собирали и упаривали с получением титульного соединения (D36) (690 мг)
MS: (ES/+) m/z: 144,1 [МН+] C7H13NO2 предусматривает 143,09
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 3,91-3,82 (m, 1H), 3,77 (dd, J=2,4, 11,6 Гц, 1H), 3,51-3,44 (m, 2H), 2,02 (dd, J=7,5, 12,7 Гц, 1H), 1,71 (dd, J=7,8, 12,7 Гц, 1H), 1,24 (s, 6H).
Описание 37: (R)-трет-бутил-бутил 2-(гидроксиметил)-4,4-диметилпирролидин-1-карбоксилат (D37)
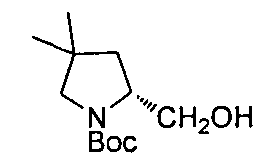
К охлажденной на льду суспензии LiAlH4 (219 мг, 5,78 ммоль) в THF (10 мл) в атмосфере N2, добавляли по каплям раствор (R)-5-(гидроксиметил)-3,3-диметилпирролидин-2-она (D36) (690 мг, 4,82 ммоль) в THF (10 мл). Реакционную смесь оставляли нагреваться до RT в течение 30 мин, затем дефлегмировали в течение 5 часов. Добавляли LiAlH4 (219 мг, 5,78 ммоль) к смеси и перемешивали реакционную смесь в течение 18 ч, затем дополнительно добавляли LiAlH4 (219 мг, 5,78 ммоль), и дефлегмировали в течение дополнительных 5 часов. Реакционную смесь охлаждали до 0°C перед последовательным добавлением воды (0,87 мл), 15% NaOH (0,87 мл) и воды (2,58 мл). Полученный суспензионный раствор отфильтровывали; фильтрат разбавляли водой (10 мл) и подщелачивали до pH ~12 с помощью Na2CO3 перед добавлением по каплям раствора Вос2О (1,37 г, 6,26 ммоль) в THF (10 мл). Полученную смесь перемешивали в течение 24 ч, затем экстрагировали EtOAc (3×30 мл). Органические фазы промывали насыщ. NaCl, сушили на Na2SO4 и упаривали в вакууме с получением титульного соединения (D37) (435 мг).
MS: (ES/+) m/z: 252,2 [MH+Na+] C12H23NO3 предусматривает 229,17
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 5,25-5,09 (m, 1H), 4,13-3,99 (m, 1H), 3,62 (d, J=7,9 Гц, 2H), 3,39-3,23 (m, 1H), 3,08-2,92 (m, 1H), 1,87-1,73 (m, 1H), 1,49 (s, 9H), 1,38-1,25 (m, 1H), 1,09 (s, 3H), 1,03 (s, 3H)
Описание 38: (R)-1-(трет-бутоксикарбонил)-4,4-диметил-5-оксопирролидин-2-карбоновая кислота (D38)
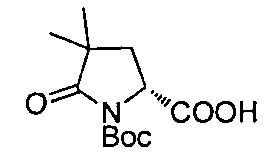
К раствору (R)-трет-бутил 2-(гидроксиметил)-4,4-диметилпирролидин-1-карбоксилата (D37) (385 мг, 1,68 ммоль) в CH3CN/CCl4/H2O (6/6/9 мл) добавляли NaIO4 (1,43 г, 6,71 ммоль) и полученную смесь энергично перемешивали в течение 5 мин перед добавлением RuCl3 (10 мг, 0,05 ммоль). Полученный коричневый раствор перемешивали 18 часов при комнатной температуре, затем реакционную смесь гасили изопропанолом (0,6 мл) и разбавляли Et2O (10 мл). Смесь фильтровали через слой целита и промывали фильтрат Et2O (4×20 мл), а затем DCM (2×5 мл). Объединенные органические фазы после сушки над Na2SO4 и упаривания растворителя давали титульное соединение (D38) (293 мг).
MS: (ES/+) m/z: 280,2 [MH+Na+] C12H19NO5 предусматривает 257,13
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,63-4,54 (m, 1H), 2,34-2,22 (m, 1H), 2,04-1,95 (m, 1H), 1,53 (s, 9H), 1,25 (d, J=4,9 Гц, 6H).
Описание 39: (R)-2-бензил 1-трет-бутил 4,4-диметил-5-оксопирролидин-1,2-дикарбоксилат (D39)
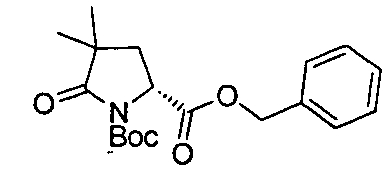
К раствору (R)-1-(трет-бутоксикарбонил)-4,4-диметил-5-оксопирролидин-2 карбоновой кислоты (D38) (320 мг, 1,24 ммоль) в ацетоне (10 мл) добавляли TEA (0,35 мл 2,49 ммоль) и бензилбромид (0,23 мл, 1,86 ммоль) и перемешивавали полученную смесь при RT в течение 18 часов. Добавляли TEA (0,35 мл, 2,49 ммоль) и бензилбромид (0,23 мл 1,86 ммоль) и перемешивали реакционную смесь в течение 24 часов перед добавлением дополнительного TEA (0,35 мл, 2,49 ммоль) и бензилбромида (0,23 мл, 1,86 ммоль). Конечную смесь затем дефлегмировали в течение 18 часов. Растворители упаривали, полученный остаток снова растворяли в EtOAc, промывали водой (3×10 мл), сушили над Na2SO4 и упаривали в вакууме, получали остаток, который очищали хроматографией на колонке «Biotage SNAP-Si» (25 г), элюируя смесью DCM/EtOAc от 100/0 до 90/10. Собранные фракции после упаривания растворителя давали титульное соединение (D39) (260 мг).
MS: (ES/+) m/z: 248,2 [МН-Вос+] C19H25NO5 предусматривает 347,17
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,38 (br. s., 5H), 5,25 (d, J=1,0 Гц, 1Н), 5,20 (d, J=1,0 Гц, 1Н), 4,63-4,55 (m, 1H), 2,27-2,18 (m, 1H), 1,95-1,87 (m, 1H), 1,47 (s, 9H), 1,20 (d, J=14,5 Гц, 6H).
Описание 40: (R)-2-бензил 1-трет-бутил 4,4-диметилпирролидин-1,2-дикарбоксилат (D40)
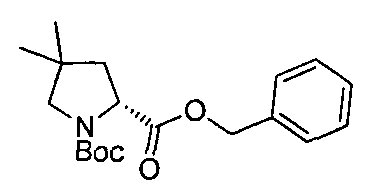
К раствору (R)-2-бензил 1-трет-бутил 4,4-диметил-5-оксопирролидин-1,2-дикарбоксилата (D39) (210 мг, 0,6 ммоль) в THF (10 мл), охлажденному при -78°C, добавляли 1 М р-р LiEt3BHв THF (0,6 мл) и перемешивали смесь 2 часа при -78°C. Реакционную смесь нагревали до 0°C и гасили медленным добавлением насыщ. р-ра NaHCO3 (4 мл) и 1 капли H2O2. Перемешивание продолжали в течение 20 мин, затем THF удаляли при пониженном давлении и полученный остаток растворяли в воде (5 мл) и экстрагировали DCM (3×10 мл). Органические фазы собирали, сушили над Na2SO4 и упаривали в вакууме. Полученный остаток растворяли в DCM (10 мл) и охлаждали до -78°C в атмосфере N2. Добавляли Et3SiH (0,09 мл, 0,6 ммоль) с последующим добавлением BF3OEt2 (0,1 мл, 0,63 ммоль) и перемешивали реакционную смесь 30 мин перед дальнейшим добавлением Et3SiH (0,09 мл, 0,6 ммоль) и BF3OEt2 (0,1 мл, 0,63 ммоль). Конечную реакционную смесь перемешивали при -78°C в течение 3 часов, затем гасили медленным добавлением насыщенного NaHCO3 и воды. Реакционную смесь экстрагировали DCM (3×10 мл), промывали органические слои насыщ. р-ром NaCl, сушили над Na2SO4 и упаривали с получением титульного соединения (D40) (168 мг).
MS: (ES/+) m/z: 356,3 [MH+Na+] C19H27NO4 предусматривает 333,19
Описание 41: (R)-1-(трет-бутоксикарбонил)-4,4-диметилпирролидин-2-карбоновая кислота (D41)
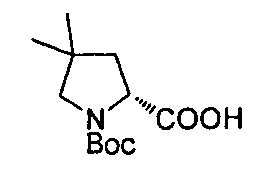
К смеси (R)-2-бензил 1-трет-бутил 4,4-диметилпирролидин-1,2-дикарбоксилата (D40) (198 мг, 0,59 ммоль) в диоксане/воде (4/4 мл), добавляли LiOH H2O (100 мг, 2,37 ммоль) и оставляли смесь перемешиваться при RT в течение 18 часов. Органический растворитель упаривали и разбавляли реакционную смесь водой (8 мл), промывали Et2O (2×10 мл), подкисляли уксусной кислотой до pH ~4-5 и экстрагировали Et2O (3×10 мл). Органические фазы собирали, сушили над Na2SO4 и упаривали в вакууме с получением титульного соединения (D41) (84 мг).
MS: (ES/+) m/z: 144,1 [МН-Вос+] C12H21NO4 предусматривает 243,15
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,51-4,20 (m, 1H), 3,45-3,05 (m, 2H), 2,32-1,81 (m, 2H), 1,62-1,39 (m, 9H), 1,19-1,03 (m, 6H)
Описание 42: метил-3-азабицикло[3.1.0]гексан-2-карбоксилата гидрохлорид (рацемическая смесь) (D42)
К охлажденному на льду раствору 3-азабицикло[3.1.0]гексан-2-карбоновой кислоты (рацемическая смесь с относительной стереохимией син) (500 мг, 3,93 ммоль; поставляется «ABCR» #АВ 156920), добавляли тионилхлорид (0,57 мл, 7,86 ммоль) по каплям и полученную смесь перемешивали при RT в течение ночи. Упариванием растворителя при пониженном давлении дает титульное соединение (D42) (700 мг) в виде рацемической смеси с относительной стереохимией син.
MS: (ES/+) m/z: 142,1 [МН-Вос+] C7H11NO2 предусматривает 141,08
1H ЯМР (400 МГц, METHANOL-d4) δ (м.д.): 4,67 (d, J=4,2 Гц, 1H), 3,90 (s, 3H), 3,54 (d, J=3,6 Гц, 1H), 3,51-3,42 (m, 1H), 2,23-2,10 (m, 1H), 1,94 (d, J=3,4 Гц, 1H), 0,86 (d, J=7,5 Гц, 1H), 0,61 (d, J=6,0 Гц, 1H).
Описание 43: (2S,5S)-трет-бутил 2-(трет-бутил)-3,5-лиглетил-4-оксоимидазолидин-1-карбоксилат (D43)
К раствору (S)-трет-бутил 2-(трет-бутил)-3-метил-4-оксоимидазолидин-1-карбоксилата (0,5 г, 1,95 ммоль; поставляется «Aldrich» #337595) в сухом THF (15 мл), охлажденному до -78°С, добавляли 2 М LDA в THF/гептане (0,97 мл, 1,95 ммоль) и перемешивали реакционную смесь при этой температуре в течение 40 мин перед добавлением йодметана (0,146 мл, 2,34 ммоль). Реакционную смесь оставляли нагреваться до RT и перемешивали в течение 18 часов. THF/Реакционную смесь снова охлаждали до -78°С, затем последовательно добавляли 2 М LDA в THF/гептане (0,3 мл) и йодметан (0,04 мл, 0,6 ммоль). Смеси позволяли достичь RT и дополнительно перемешивали в течение 5 часов. Полученный раствор обрабатывали насыщ. р-ром NH4Cl (5 мл) и экстрагировали Et2O. Органические фазы собирали и промывали насыщ. р-ром NaCl, сушили над Na2SO4 и упаривали в вакууме с получением остатка, который очищали на колонке «Biotage SNAP-Si» (25 г) при элюировании cHex/Et2O 60/40. Собранные фракции после упаривания растворителя давали титульное соединение (D43) (430 мг).
MS: (ES/+) m/z: 271,2 [МН+] C14H26N2O3 предусматривает 270,19
Описание 44: (2S,5R)-трет-бутил 2-(трет-бутил)-5-(4-хлорбутил)-3,5-диметил-4-оксоимидазолидин-1-карбоксилат (D44)
К раствору (2S,5S)-трет-бутил 2-(трет-бутил)-3,5-диметил-4-оксоимидазолидин-1-карбоксилата (D43) (430 мг, 1,59 ммоль) в сухом THF (15 мл), охлажденному до -78°C, добавляли LDA 2M в THF/гептан (1,2 мл, 2,38 ммоль) и перемешивали реакционную смесь при этой температуре в течение 40 мин перед добавлением 1-бром-4-хлор-бутана (0,27 мл, 2,38 ммол). Реакционную смесь оставляли нагреваться до RT и перемешивали в течение 3 часов. Полученный раствор обрабатывали насыщ. р-ром NH4Cl (5 мл) и экстрагировали Et2O (3×10 мл). Органические фазы собирали и промывали насыщ. р-ром NaCl, сушили над Na2SO4 и упаривали в вакууме с получением остатка, который очищали на колонке «Biotage SNAP-Si» (25 г) с элюированием cHex/Et2O 60/40. Собранные фракции после упаривания растворителя давали титульное соединение (D44) (465 мг).
MS: (ES/+) m/z: 361,3 [МН+] C18H33C1N2O3 предусматривает 360,22
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 3,56-3,37 (m, 2H), 3,02 (s, 3H), 2,28-2,15 (m, 1H), 1,86-1,60 (m, 4H), 1,51 (s, 11H), 1,28-0,80 (m, 12H).
Описание 45: (2S,5R)-2-(трет-бутил)-5-(4-хлорбутил)-3,5-диметилимидазолидин-4-он (D45)
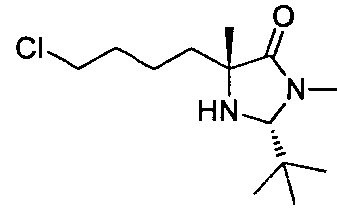
К охлажденному на льду (2S,5R)-трет-бутил 2-(трет-бутил}-5-(4-хлорбуткл)-3,5-диметил-4-оксоимидазолидин-1-карбоксилату (D44) (465 мг, 1,28 ммоль) в сухом DCM (2 мл), добавляли трифторуксусную кислоту (1 мл, 12,8 ммоль) и перемешивали раствор в течение 12 часов при комнатной температуре. Реакционную смесь обрабатывали насыщ. р-ром NaHCO3 при интенсивном перемешивании до pH ~7. Полученную смесь выливали в воду и экстрагировали водную фазу DCM (3×10 мл), сушили над Na2SO4 и упаривали в вакууме для получения титульного соединения (D45) (310 мг).
MS: (ES/+) m/z: 261,2 [MH+] C13H25C1N2O предусматривает 260,22
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,11 (s, 1H), 3,54 (t, J=6,5 Гц, 2H), 2,94 (s, 3H), 1,86-1,73 (m, 2H), 1,59 (br. s., 5H), 1,33 (s, 3H), 1,01 (s, 9H).
Описание 46: (3R,8aR)-3-(трет-бутил)-2,8-диметилгексагидроимидазо[1,5-а]пиридин-1(5H)-он (D46)
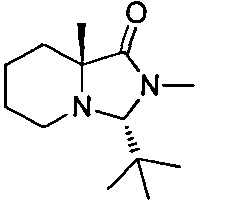
К раствору (2R,5R)-2-(трет-бутил)-5-(4-хлорбутил)-3,5-диметилимидазолидин-4-она (D45) (310 мг, 1,18 ммоль) в сухом MeCN (4 мл), последовательно добавляли безводный Na2CO3 (63 мг, 0,6 ммоль) и NaI (178 мг, 1,18 ммоль). Раствор нагревали при 80°C в течение 12 часов. Реакционную смесь оставляли охлаждаться при RT, выливали в воду (10 мл) и экстрагировали Et2O (3×10 мл). Органические фазы собирали, промывали насыщ. р-ром NaCl, сушили над Na2SO4 и упаривали в вакууме с получением титульного соединения (D46) (220 мг)
MS: (ES/+) m/z: 225,2 [МН+] C13H24N2O предусматривает 224,19
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,10-3,90 (m, 1H), 3,79 (d, J=5,3 Гц, 1H), 3,74-3,60 (m, 1H), 3,02 (br. s., 3H), 2,97-2,79 (m, 1H), 1,95-1,32 (m, 11H), 1,10 (br. s., 6H).
Описание 47: гидрохлорид (R)-2-метилпиперидин 2-карбоновой кислоты (D47)
(3R,8aR)-3(трет-бутил)-2,8-диметилгексагидроимидазоло[1,5-а]пиридин-1(5Н)-он (D46) (220 мг, 0,98 ммоль) растворяли в 6 М HCl (2 мл) в толстостенной стеклянной пробирке, которую закрывали и нагревали при 108°C в течение 70 часов. Реакционную смесь охлаждали и экстрагировали DCM (3×5 мл). Водный раствор упаривали с получением титульного соединения (D47) (180 мг).
MS: (ES/+) m/z: 144,1 [MH+] C7H13NO2 предусматривает 143,09
1H ЯМР (400 МГц, METHANOL-d4) δ (м.д.): 3,27 (br. s., 2H), 2,57 (s, 3H), 2,32-2,21 (m, 1H), 1,91-1,68 (m, 4H), 1,57 (m, 1H).
Описание 48: (7aR)-3-(трихлорметил)тетрагидропирроло[1,2-с]оксазол-1(3H)-он (D48)
К раствору D-пролина (0,4 г, 3,48 ммоль) в MeCN (8 мл) добавляли трифторацетальдегид (0,68 мл, 6,94 ммоль) и полученную смесь перемешивали при RT в течение 8 часов. Растворители упаривали, а остаток растирали с диэтиловым эфиром. После фильтрации и сушки растворителя, выделили 0,23 г титульного соединения (D48).
MS: (ES/+) m/z: 244,0 [МН+] C7H8C13NO2 предусматривает 242,96
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 4,15 (dd, J=4,5, 8,6 Гц, 1Н), 3,52-3,36 (m, J=7,0, 7,0, 10,5 Гц, 1Н), 3,22-3,07 (m, 1Н), 2,33-2,20 (m, 1Н), 2,19-2,08 (m, 1Н), 1,96 (quind, J=5,9, 12,1 Гц, 1Н), 1,84-1,69 (m, 1Н), 1,61 (br. s., 1Н).
Описание 49: (7aR)-7а-метил-3-(трихлорметил)тетрагидропирроло[1,2-с]оксазол-1(3H)-он (D49)
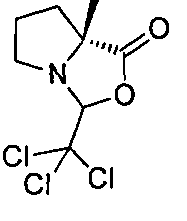
К раствору (7aR)-3-(трихлорметил)тетрагидропирроло[1,2-с]оксазол-1(3H)-она (D48) (0,2 г, 0,82 моль) в THF (10 мл), охлажденному до -78°C, добавляли раствор 2 М LDA в THF/гептане (0,58 мл, 1,17 моль) и перемешивали смесь в течение 30 мин. Добавляли дийодметан (0,185 мл, 2,97 моль) и температуре давали возможность повыситься до -40°C в течение 2 часов, затем оставляли при этой температуре в течение еще одного часа. Полученную смесь разделяли между DCM и H2O. Водную фазу экстрагировали DCM (2×10 мл), органические фазы собирали, сушили над Na2SO4 и упаривали в вакууме. Остаток очищали с помощью картриджа «SPE-Si» (25 г) с элюированием DCM. Собранные фракции после упаривания растворителя давали титульное соединение (D49) в смеси (4:1) с исходным веществом (110 мг).
MS: (ES/+) m/z: 258,0 [МН+] C8H10C13NO2 предусматривает 256,98
Описание 50: гидрохлорид (R)-метил-2-метилпирролидин-2-карбоксилата (D50)
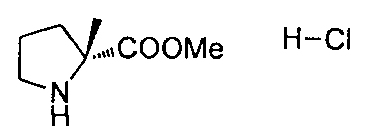
К раствору (7aR)-7а-метил-3-(трихлорметил)тетрагидропирроло[1,2-с]оксазол-1(3H)-она (D49) (0,11 г, 0,42 моль) в сухом МеОН (2 мл), добавляли 1 М р-р HCl в МеОН (0,3 мл, 0,85 моль) и дефлегмировали смесь при постоянном токе азота в течение 1 часа. Растворитель упаривали для получения 60 мг титульного соединения (D50).
MS: (ES/+) m/z: 144,1 [MH+] C7H13NO2 предусматривает 143,09
Общий порядок получения амидов
Способ А
Выбранную кислоту (1 экв.), НОВТ.H2O (1 экв.) и EDC.HCl (1,5 экв.) суспендировали в DCM и перемешивали полученную смесь 1 ч при комнатной температуре. Добавляли раствор выбранного амина (1 экв.) и TEA (1 экв.) в DCM и перемешивали смесь при RT в течение 1/48 часа. Растворители упаривали в вакууме и полученный остаток повторно растворяли в DCM. Затем добавляли смесь к насыщенному водному раствору NaHCO3 и экстрагировали дихлорметаном. Органическую фазу сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенное вещество очищали на картридже «SPE-Si» или «SNAP-Si» с элюированием смесью DCM/MeOH 98:2 или DCM/EtOAc от 100:0 до 70:30, получая титульное амидное соединение.
Способ Б
К раствору выбранной кислоты (1 экв.) в DMF последовательно добавляли HATU (1,2 экв.) и DIPEA (2,5 экв.). Смесь перемешивали 30 мин перед добавлением выбранного амина (1,2 экв.). Оставляли смесь перемешиваться при RT в течение 18 часов. Реакционную смесь разделяли между EtOAc и H2O и промывали водную фазу EtOAc. Органические фазы собирали и несколько раз промывали H2O, сушили над Na2SO4 и упаривали при пониженном давлении. Неочищенное вещество очищали на картридже «SPE-Si» или «Biotage SNAP-Si» с элюированием смесью DCM/EtOAc от 100:0 до 80:20, получая титульное амидное соединение.
Способ С
К раствору выбранной кислоты (1 экв.) в DMF последовательно добавляли HCTU (1,1 экв.) и DIPEA (2,5 экв.) и перемешивали полученную смесь 30 мин перед добавлением выбранного амина (1,1 экв.). Смесь оставляли перемешиваться при RT в течение 1-18 часов, затем реакционную смесь разделяли между EtOAc и H2O, и отделяли органическую фазу. Водную фазу промывали EtOAc. Все собранные органические фазы промывали насыщ. р-ром NaCl, сушили над Na2SO4, и удаляли растворитель при пониженном давлении. Остаток очищали на картридже «SPE-Si» или колонке «Biotage SNAP-Si», элюируя смесью DCM/EtOAc от 100:0 до 95:5, получая титульное амидное соединение.
Описание 51: трет-бутил 2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)пиперидин-1-карбоксилат (смесь диастереоизомеров) (D51)
Титульное соединение (D51) (1,95 г) получали в соответствии с общей процедурой получения амидов (способ А), начиная с 1-(трет-бутоксикарбонил)пиперидин-2-карбоновой кислоты (1,17 г, поставляется «Sigma Aldrich» #495875) и (S)-метил 4-(1-аминоэтил)-бензойной кислоты (1,1 г, метод получения см. в публикации международной заявки на патент WO 2005/105733). Время реакции: 18 часов.
MS: (ES/+) m/z: 391,3 [МН+] C21H30N2O5 предусматривает 390,22
Хиральная ВЭЖХ [«Phenomenex Lux Cellulose-1»; Подвижная фаза: 90% н-гексан (0,1% DEA), В: 10% IPA; DAD: 237 нм]: Время удерживания пика 1: 11,6 мин. Время удерживания пика 2: 16,16 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,01 (d, 4H) 7,36 (t, 4H) 6,12-6,82 (m, 2H) 5,17 (br. s., 2H) 4,74 (br. s., 2H) 3,81-4,25 (m, 8H) 2,81 (br. s., 1H) 2,66 (t, 1H) 2,28 (br. s., 2H) 1,42-1,75 (m, 4H).
Описание 52: (R)-трет-бутил 2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)пиперидин-1-карбоксилат (D52)
Титульное соединение (D52) (405 мг) получали в соответствии с общей процедурой получения амидов (способ А) начиная с (R)-1-(трет-бутоксикарбонил)пиперидин-2-карбоновой кислоты (250 мг, поставляюется «Sigma Aldrich» #516341) и (S)-метил 4-(1-аминоэтил)-бензойной кислоты (235 мг). Время реакции: 18 часов.
MS: (ES/+) m/z: 391,3 [МН+] C21H30N2O5 предусматривает 390,22
Хиральная ВЭЖХ [«Phenomenex Lux Cellulose-1»; Подвижная фаза: 90% н-гексан (0,1% DEA), В: 10% EtOH; DAD: 237 нм]: Время удерживания пика: 9,6 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,02 (d, J=8,3 Гц, 2H), 7,36 (d, J=7,8 Гц, 2H), 6,75-6,40 (m, 1H), 5,23-5,11 (m, 1H), 4,81-4,70 (m, 1H), 4,10-3,95 (m, 1H), 3,93 (s, 3H), 2,72-2,60 (m, 1H), 2,36-2,20 (m, 1H), 1,67-1,61 (m, 1H), 1,58-1,47 (m, 15H), 1,46-1,36 (m, 1H).
Описание 53: (R)-трет-бутил 2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)пиперидин-1-карбоксилат (D53)
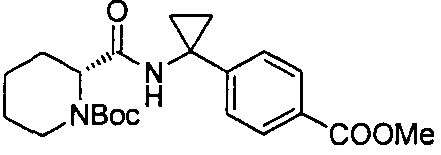
Титульное соединение (D53) (650 мг) получали в соответствии с общей процедурой получения амидов (способ А), начиная с (R)-1-(трет-бутоксикарбонил)пиперидин-2-карбоновой кислоты (500 мг, поставляется «Sigma Aldrich» #516341) и гидрохлорида метил 4-(1-аминоциклопропил)бензоата (470 мг). Время реакции: 18 часов.
MS: (ES/+) m/z: 403 [МН+] C22H30N2O5 предусматривает 402,22
Хиральная ВЭЖХ [«DAICEL OD-H»; Подвижная фаза: 80% н-гексан (0,1% DEA), В: 20% IPA; DAD: 248 нм]: Время удерживания пика: 13,04 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,96 (d, J=8,1 Гц, 2H), 7,24 (d, J=8,1 Гц, 2H), 7,02-6,74 (m, 1Н), 4,81-4,68 (m, 1Н), 4,19-4,00 (m, 1Н), 3,92 (s, 3H), 2,88-2,69 (m, 1Н), 2,39-2,17 (m, 1Н), 1,66 (br. s., 3H), 1,52 (s, 9H), 1,34 (d, J=18,6 Гц, 6H).
Описание 54: трет-бутил 5-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-6-азаспиро[2,5]октан-6-карбоксилат (рацемическая смесь) (D54)

Титульное соединение (D54) (290 мг) получали в соответствии с общей процедурой получения амидов (способ В), начиная с 6-(трет-бутоксикарбонил)-азаспиро[2,5]октан-5-карбоновой кислоты (D1) (200 мг) и гидрохлорида метил 4-(1-аминокциклопропил)бензоата (214 мг). Время реакции: 18 часов.
MS: (ES/+) m/z: 429 [MH+] C24H32N2O5 предусматривает 428,52
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,97 (d, J=8,1 Гц, 2H), 7,28 (d, J=2,7 Гц, 2H), 6,76 (br. s., 1Н), 4,90-4,76 (m, 1Н), 4,17 (br. s., 1Н), 3,92 (s, 3H), 3,08-2,88 (m, 1H), 2,05-1,99 (m, 1H), 1,97-1,86 (m, 1H), 1,83-1,75 (m, 1H), 1,51 (s, 9H), 1,45-1,31 (m, 4H), 0,88-0,79 (m, 1H), 0,60-0,44 (m, 1H), 0,43-0,27 (m, 2H), 0,28-0,20 (m, 1H).
Описание 55: трет-бутил 5-((1-(4-(метоксикарбонил)фенил)циклопропил) карбамоил)-6-азаспиро[2,5]октан-6-карбоксилат (одиночный неизвестный энантиомер) (D55)
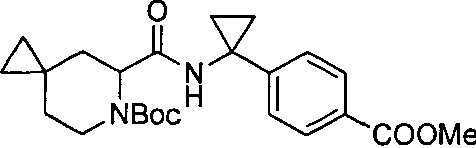
6-(Трет-бутоксикарбонил)-6-азаспиро[2,5]октан-5-карбоновую кислоту (D3) (16 г, 62,6 моль), НОВТ. H2O (9,59 г, 62,6 моль) и EDC. HCl (18,00 г, 94 моль) суспендировали в DCM (225 мл) и перемешивали полученную смесь 30 мин при RT. Добавляли раствор гидрохлорида метил 4-(1-аминоциклопропил)бензоата (14,3 г, 62,6 моль) и TEA (8,73 мл, 62,6 ммоль) в DCM (96 мл) и перемешивали смесь при RT в течение 3 часов. Раствор промывали водой (1×100 мл), NaHCO3 (2×100 мл), 1 М лимонной кислотой (1×100 мл), насыщ. NaCl (500 мл), сушили над Na2SO4 и упаривали с получением 29 г желтого твердого вещества, которое растирали в смеси Et2O/cHex 9/1, с получением титульного соединения (D55) (19,7 г).
MS: (ES/+) m/z: 429,3 [МН+] C24H32N2O5 предусматривает 428,52
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,97 (d, J=8,3 Гц, 2H), 7,28 (d, 5H под растворителем), 6,74 (br. s., 1Н), 4,96-4,70 (m, 1Н), 4,32-4,11 (m, 1Н), 3,92 (s, 3H), 3,08-2,88 (m, 1Н), 2,12-1,97 (m, 1Н), 1,97-1,84 (m, 1Н), 1,84-1,73 (m, 1Н), 1,52 (s, 9H), 1,43-1,31 (m, 4H), 0,90-0,77 (m, 1Н), 0,62-0,46 (m, 1Н), 0,43-0,29 (m, 2H), 0,28-0,19 (m, 1H).
Описание 56: трет-бутил 5-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-6-азаспиро[2,5]октан-6-карбоксилат (смесь диастереоизомеров) (D56)
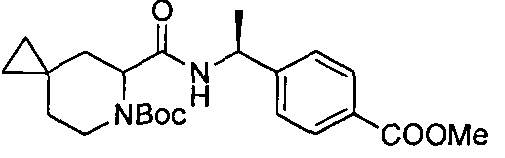
Титульное соединение (D56) (130 мг) получали в соответствии с общей процедурой получения амидов (способ А), начиная с 6-(трет-бутоксикарбонил)-азаспиро[2,5]октан-5-карбоновой кислоты (D1) (80 мг) и гидрохорида (S)-метил 4-(1-аминоэтил)-бензоата (67,6 мг). Время реакции: 18 часов.
MS: (ES/+) m/z: 317 [MH-Boc+] C23H32N2O5 предусматривает 416,23
Хиральная ВЭЖХ [«Phenomens LUX-1»; Подвижная фаза: 90% н-гексан (0,1% DEA), В: 10% IPA; DAD: 248 нм]: Время удерживания пика 1: 13,01 мин, время удерживания пика 2: 19,4 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,03 (t, 4H) 7,39 (dd, 4H) 6,29 (br. s., 2H) 5,16-5,28 (m, 2H) 4,82 (br. s., 2H) 4,14 (d, 1H) 3,93 (d, 6H) 3,00 (br. s., 1H) 2,84-2,95 (m, 1H) 2,01 (dt, 2H) 1,73-1,96 (m, 4H) 1,41-1,57 (m, 24 H) 0,72-0,95 (m, 3H) 0,58 (d, 1H) 0,21-0,45 (m, 6H) 0,09 (br. s., 1H).
Описание 57: трет-бутил 5-(((S)-1-(4-(метоксикарбонил) фенил)этил)карбамоил)-5-метил-6-азаспиро[2,5]октан-6-карбоксилат (смесь диастереомеров) (D57)
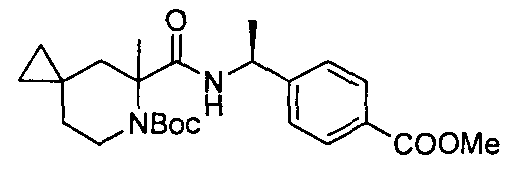
Титульное соединение (D57) (25 мг) получали в соответствии с общей процедурой получения амидов (способ А), начиная с 6-(трет-бутоксикарбонил)-5-метил-6-азаспиро[2,5]октан-5-карбоновой кислоты (D6) (57 мг) и гидрохлорида (S)-метил 4-(1-аминоэтил)-бензоата (46 мг). EDC. HCl: 1,1 экв. Время реакции: 48 ч.
MS: (ES/+) m/z: 431 [MH+] C24H34N2O5 предусматривает 430,25
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,09-7,94 (m, 2H), 7,52-7,31 (m, 2H), 5,33-5,07 (m, 1H), 3,93 (s, 3H), 3,91-3,79 (m, 1H), 3,28-2,83 (m, 1H), 2,07 (s, 1H), 1,98-1,84 (m, 1H), 1,66-1,42 (m, 12H), 1,36-1,29 (m, 3H), 1,19 (d, J=13,9 Гц, 1H), 1,00-0,74 (m, 1H), 0,65-0,12 (m, 4H).
Описание 58: трет-бутил 2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-4,4-диметилпиперидин-1-карбоксилат (рацемическая смесь) (D58)
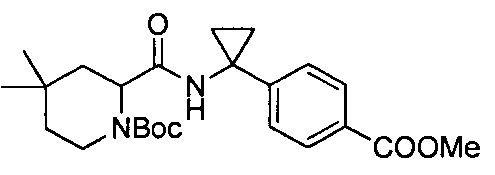
Титульное соединение (D58) (250 мг) получали в соответствии с общей процедурой получения амидов (способ С), начиная с 1-(трет-бутоксикарбонил)-4,4-диметилпиперидин-2-карбоновой кислоты (320 мг; описано в J. Med Chem 1997, 40, 2491-2501) и гидрохлорида метил 4-(1-аминоциклопропил)бензоата (312 мг). Время реакции: 18 часов.
MS: (ES/+) m/z: 431,4 [MH+] C24H34N2O5 предусматривает 430,25
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,96 (d, J=8,2 Гц, 2H), 7,32-7,29 (m, 2H), 6,82-6,59 (m, 1H), 4,65 (d, J=4,4 Гц, 1H), 4,02 (br. s., 1H), 3,92 (s, 3H), 3,00 (d, J=10,6 Гц, 1H), 2,18 (d, J=12,9 Гц, 1H), 1,50 (s, 9H), 1,43-1,29 (m, 7H), 0,96 (s, 3H), 0,84 (s, 3H).
Описание 59: трет-бутил 2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-4,4-диметилпиперидин-1-карбоксилат (смесь диастереоизомеров) (D59)
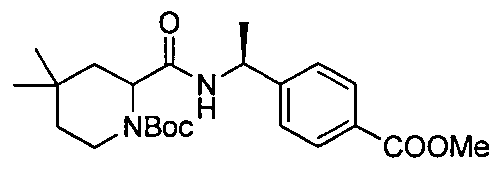
Титульное соединение (D59) (230 мг) получали в соответствии с общей процедурой получения амидов (способ С), начиная с 1-(трет-бутоксикарбонил)-4,4-диметилпиперидин-2-карбоновой кислоты (320 мг; описано в J. Med Chem 1997, 40, 2491-2501) и гидрохлорида (S)-метил 4-(1-аминоэтил)-бензоата (295 мг). Время реакции: 18 часов.
MS: (ES/+) m/z: 419,4 [МН+] C23H34N2O5 предусматривает 418,25
Описание 60: (R)-трет-бутил 2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-4-оксопиперидин-1-карбоксилат (D60)
Титульное соединение (D60) (300 мг) получали в соответствии с общей процедурой получения амидов (способ С), начиная с (R)-1-(трет-бутоксикарбонил)-4-оксопиперидин-2-карбоновой кислоты (200 мг; доступен от «Aldrich» #701130) и гидрохлорида (S)-метил 4-(1-аминоэтил)-бензоата (195 мг). Время реакции: 1 ч.
MS: (ES/+) m/z: 405,5 [МН+] C21H28N2O6 предусматривает 404,19
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,99 (d, J=7,6 Гц, 2H), 7,32 (d, J=7,9 Гц, 2H), 7,25-7,09 (m, 1Н), 5,17-5,02 (m, 1Н), 5,02-4,85 (m, 1Н), 3,93 (s, 3H), 3,89-3,73 (m, 1Н), 3,57-3,36 (m, 1Н), 2,66-2,46 (m, 2H), 2,46-2,31 (m, 1Н), 1,51 (br. s., 13H).
Описание 61; (2R)-трет-бутил-4-гидрокси-2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)пиперидин-1-карбоксилат (D61) (смесь диастереоизомеров)
К охлажденному на льду раствору (R)-трет-бутил 2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-4-оксопиперидин-1-карбоксилата (D60) (300 мг, 0,75 ммоль) в МеОН (25 мл) в атмосфере азота, добавляли порциями NaBH4 (142 мг, 3,75 ммоль) и перемешивали полученную смесь при RT в течение 18 часов. Смесь разбавляли водой (10 мл) и экстрагировали этилацетатом (3×10 мл). Органические фазы собирали, промывали насыщ. NaCl (20 мл), сушили над Na2SO4 и упаривали в вакууме, получая титульное соединение (D61) (261 мг).
MS: (ES/+) m/z: 407,2 [MH+] C21H30N2O6 предусматривает 406,21
Описание 62: (2R)-трет-бутил 4-фтор-2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)пиперидин-1-карбоксилат (смесь диастереоизомеров) (D62)
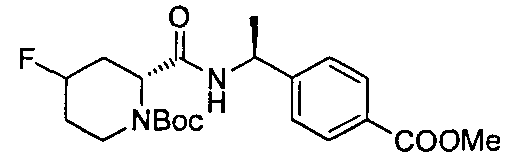
Раствор (2R)-трет-бутил-4-гидрокси-2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)пиперидин-1-карбоксилата (D61) (261 мг, 0,64 ммоль) в DCM (10 мл), охлажденный до -20°C, обрабатывали DAST (0,17 мл, 1,28 ммоль) и перемешивали реакционную смесь в течение 1 ч при -20°C, затем при RT в течение 18 часов. Добавляли DAST (0,17 мл, 1,28 ммоль) и дополнительно перемешивали смесь в течение 24 часов. Реакцию гасили насыщ. р-ром NaHCO3 и экстрагировали DCM (3×10 мл), сушили над MgSO4 и упаривали в вакууме. Остаток наносили в картридж «SPE-Si» (20 г), элюируя смесью DCM/EtOAc 90/10. Собранные фракции после упаривания растворителя давали титульное соединение (D62) (89 мг).
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,96 (d, J=8,2 Гц, 2H), 7,21 (d, J=8,1 Гц, 2H), 5,27-4,96 (m, 1Н), 4,96-4,80 (m, 1Н), 4,20-4,02 (m, 1Н), 3,92 (s, 3H), 2,97-2,77 (m, 1Н), 2,63-2,47 (m, 1Н), 2,07 (s, 1Н), 1,75-1,46 (m, 12H), 1,44-1,21 (m, 4H)
Описание 63: (R)-трет-бутил 2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-4-оксопиперидин-1-карбоксилат (D63)
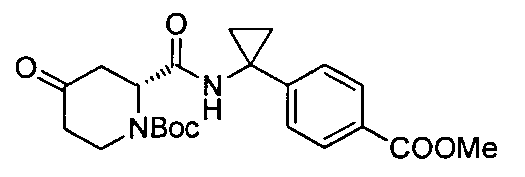
Титульное соединение (D63) (295 мг) получали в соответствии с общей процедурой получения амидов (способ С), начиная с (R)-1-(трет-бутоксикарбонил)-4-оксопиперидин-2-карбоновой кислоты (200 мг) и гидрохлорида метил 4-(1-аминоциклопропил) бензоата (206 мг). Время реакции: 18 часов.
MS: (ES/+) m/z: 417,5 [МН+] C22H28N2O6 предусматривает 416,19
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,95 (d, J=7,9 Гц, 2H), 7,51-7,37 (m, 1Н), 7,22 (d, J=7,6 Гц, 2H), 4,97-4,80 (m, 1Н), 3,92 (s, 4H), 3,66-3,54 (m, 1Н), 2,58 (d, J=5,6 Гц, 2H), 2,52-2,37 (m, 1Н), 1,55 (s, 9H), 1,46-1,24 (m, 5H)
Описание 64: (2R)-трет-бутил 4-гидрокси-2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)пиперидин-1-карбоксилат (смесь диастереоизомеров) (D64)
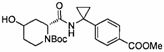
Титульное соединение (D64) (266 мг) получали в соответствии с экспериментальной процедурой, представленной в Описании 61, начиная с (R)-трет-бутил 2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-4-оксопиперидин-1-карбоксилата (D63) (300 мг, 0,72 ммоль).
MS: (ES/+) m/z: 419,2 [МН+] C22H30N2O6 предусматривает 418,21
Описание 65: (2R)-трет-бутил 4-фтор-2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)пиперидин-1-карбоксилат (смесь диастереоизомеров) (D65)
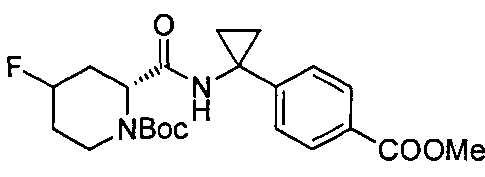
Титульное соединение (D65) (39 мг) получали в соответствии с экспериментальной процедурой, представленной в Описании 59, начиная с (R)-2-трет-бутил 4-гидрокси-2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)пиперидин-1-карбоксилата (D64) (266 мг, 0,63 ммоль).
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,00 (d, J=7,8 Гц, 2H), 7,34-7,26 (m, 2H), 5,18-5,03 (m, 1Н), 4,96-4,86 (m, 1Н), 4,08-3,96 (m, 1Н), 3,93 (s, 3H), 2,77-2,64 (m, 1 Н), 2,64-2,49 (m, 1H), 2,05-1,96 (m, 1H), 1,73-1,53 (m, 3H), 1,53-1,44 (m, 13H).
Описание 66: (R)-трет-бутил 4,4-дифтор-2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)пиперидин-1-карбоксилат (D66)
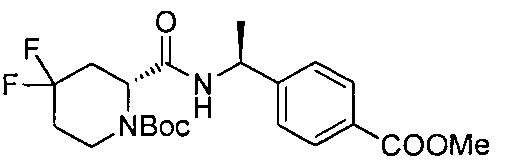
Раствор (R)-трет-бутил 2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-4-оксопиперидин-1-карбоксилата (D60) (300 мг, 0,74 ммоль) в DCM (30 мл), охлажденный до -20°C, обрабатывали DAST (0,49 мл, 3,71 ммоль) и перемешивали реакционную смесь в течение 1 ч при -20°C и при RT в течение 18 часов. Реакцию гасили насыщ. р-ром NaHCO3, экстрагировали DCM (3×5 мл), сушили над MgSO4, и упаривали в вакууме. Остаток наносили в картридж «SPE-Si» (15 г), элюируя смесью DCM/EtOAc от 100/0 до 95/5. Собранные фракции после упаривания растворителя давали титульное соединение (D66) (98 мг).
MS: (ES/+) m/z: 427,4 [МН+] C21H28F2N2O5 предусматривает 426,45
Описание 67: (R)-трет-бутил 4,4-дифтор-2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)пиперидин-1-карбоксилат (одиночный энантиомер) (D67)
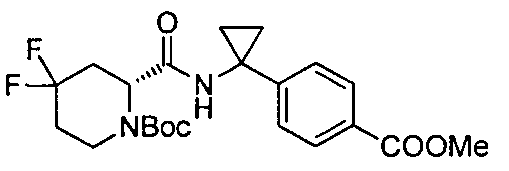
Титульное соединение (D67) (68 мг) получали в соответствии с экспериментальной процедурой, представленной в описании 66, начиная с (R)-трет-бутил 2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-4-оксопиперидин-1-карбоксилата (D63) (295 мг, 0,70 ммоль).
MS: (ES/+) m/z: 339,4 [МН-Вос+] C22H28F2N2O5 предусматривает 438,20
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,96 (d, J=8,1 Гц, 2H), 7,22 (d, J=8,1 Гц, 2H), 6,67 (br. s., 1H), 5,06-4,93 (m, 1H), 4,33-4,22 (m, 1H), 3,91 (s, 4H), 3,26-3,05 (m, 1H), 3,05-2,88 (m, 1H), 2,01-1,85 (m, 2H), 1,59-1,31 (m, 13H)
Описание 68: трет-бутил 4,4-дифтор-2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)пиперидин-1-карбоксилат (рацемическая смесь) (D68)
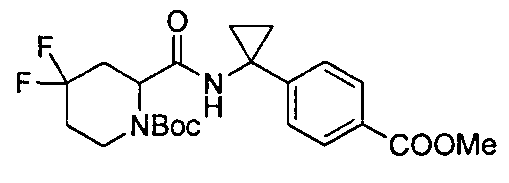
Титульное соединение (D68) (688 мг) получали в соответствии с общей процедурой получения амидов (способ С), начиная с 1-(трет-бутоксикарбонил)-4,4-дифторпиперидин-2-карбоновой кислоты (600 мг; описано в WO 2010148197) и гидрохлорида метил 4-(1-аминоциклопропил) бензоата (566,5 мг). Время реакции: 5 часов.
MS: (ES/+) m/z: 439,2 [MH+] C22H28F2N2O5 предусматривает 438,46.
Хиральная ВЭЖХ [«Daicel IC»; Подвижная фаза: 70% н-гептан (+0,1% DEA), В: 30% этанол; DAD: 248 нм]: Время удерживания пика 1: 11,46 мин; Время удерживания пика 2: 13,48 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,97 (d, J=8,3 Гц, 2H), 7,23 (d, J=8,3 Гц, 2H), 6,63 (s, 1Н), 4,97 (d, J=6,8 Гц, 1Н), 4,29 (br. s., 1Н), 3,92 (s, 3H), 3,20-3,06 (m, 1Н), 3,04-2,89 (m, 1Н), 2,13-1,83 (m, 3H), 1,52 (s, 9H), 1,47-1,32 (m, 4H).
Описание 69: трет-бутил 4-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-3-азабицикло[4.1.0]гептан-3-карбоксилат (рацемическая смесь) (D69)
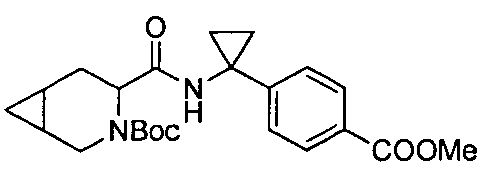
Титульное соединение (D69) (270 мг) получали в соответствии с общей процедурой получения амидов (способ А), начиная с 3-(трет-бутоксикарбонил)-3-азабицикло[4.1.0]гептан-4-карбоновой кислоты (D17) (200 мг) и гидрохлорида метил 4-(1-аминоциклопропил)бензоата (157 мг). НОВТ.H2O: 1,2 экв.; Время реакции: 3 часа.
MS: (ES/+) m/z: 415,2 [МН+] C23H30N2O5 предусматривает 414,22
Хиральная ВЭЖХ [«Daicel AD-H»; Подвижная фаза: 60% н-гептан (+0,1% DEA), В: 40% IPA; DAD: 248 нм]: Время удерживания пика 1: 13,36 мин. Время удерживания пика 2: 19,18 мин.
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,64-8,47 (m, 1Н), 7,89-7,70 (m, 2H), 7,28 (d, J=7,8 Гц, 2H), 4,04-3,92 (m, 1Н), 3,83 (s, 3H), 3,77-3,62 (m, 1Н), 3,47-3,20 (m, 1H, под пиком воды), 2,22-2,12 (m, 1H), 1,83-1,66 (m, 1H), 1,45-1,34 (m, 9H), 1,30-1,06 (m, 5H), 0,85 (br. s., 1H), 0,61 (d, J=4,9 Гц, 1H), 0,19 (d, J=3,9 Гц, 1H).
Описание 70: (3R)-трет-бутил 3-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-2-азабицикло[4.1.0]гептан-2-карбоксилат (смесь диастереомеров) (D70)
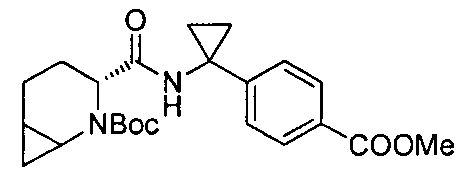
Титульное соединение (D70) (28 мг) получали в соответствии с общей процедурой получения амидов (способ С), начиная с (3R)-2-(трет-бутоксикарбонил)-2-азабицикло[4.1.0]гептан-3-карбоновой кислоты (D22) (100 мг) и гидрохлорида метил 4-(1-аминоциклопропил)бензоата (103 мг). Время реакции: 1 ч.
MS: (ES/+) m/z: 415,3 [MH+] C24H30N2O5 предусматривает 414,22
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,95 (d, J=7,7 Гц, 2H), 7,34-7,14 (m, 2H), 4,67-4,14 (m, 1H), 3,91 (br. s., 3H), 2,99-2,76 (1H под остаточным растворителем), 2,27-1,08 (m, 18H), 0,88 (d, J=7,3 Гц, 1H), 0,53-0,20 (m, 1H).
Описание 71: (3R)-трет-бутил 3-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-2-азабицикло[4.1.0]гептан-2-карбоксилат (смесь диастереоизомеров) (D71)
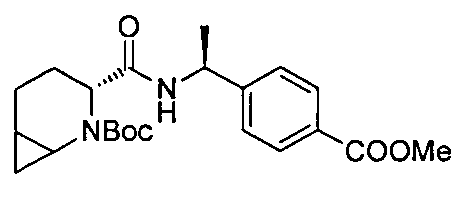
Титульное соединение (D71) (46 мг) получали в соответствии с общей процедурой получения амидов (способ С), начиная с (3R)-2-(трет-бутоксикарбонил)-2-азабицикло[4.1.0]гептан-3-карбоновой кислоты (D22) (100 мг) и гидрохлорида (S)-метил 4-(1-аминоэтил)-бензоата(115 мг). Время реакции: 1 ч.
MS: (ES/+) m/z: 403,2 [МН+] C22H30N2O5 предусматривает 402,22
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,01 (d, J=6,4 Гц, 2H), 7,38 (d, J=6,9 Гц, 2H), 5,28-5,04 (m, 1H), 4,66-4,21 (m, 1H), 3,93 (s, 3H), 3,06-2,66 (m, 1H), 2,25-1,11 (m, 17H), 1,02-0,64 (m, 1H), 0,56-0,15 (m, 1H).
Описание 72: (R)-трет-бутил 2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)пирролидин-1-карбоксилат (D72)
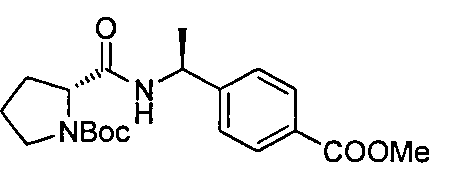
Титульное соединение (D72) (815 мг) получали в соответствии с общей процедурой получения амидов (способ А), начиная с (R)-1-трет-бутоксикарбонил)пирролидин-2-карбоновой кислоты (500 мг, поставляется «Sigma Aldrich» #433818) и гидрохлорида (S)-метил 4-(1-аминоэтил)-бензоата (501 мг). Время реакции: 18 часов.
MS: (ES/+) m/z: 377 [МН+] C20H28N2O5 предусматривает 376,20
Хиральная ВЭЖХ [«Phenomenex Lux Cellulose-1»; Подвижная фаза: 70% н-гексан (0,1% DEA), В: 30% EtOH; DAD: 254 нм]: Время удерживания пика: 7,93 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,00 (d, J=7,3 Гц, 2H), 7,80-7,53 (m, 1H), 7,35 (d, J=8,3 Гц, 2H), 5,15 (br. s., 1H), 4,35 (br. s., 1H), 3,93 (s, 3H), 3,37 (br. s., 2H), 2,07 (s, 4H), 1,50 (s, 12H).
Описания 73а и 73b:
(1R,3R,5R)-трет-бутил 3-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-2-азабицикло[3.1.0]гексан-2-карбоксилат (син диастереоизомер) (D73a) и
(1S,3R,S)5-трет-бутил 3-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-2-азабицикло[3.1.0]гексан-2-карбоксилат (анти диастереоизомер) (D73b)

К раствору (3R)-2-(трет-бутоксикарбонил)-2-азабицикло[3.1.0]гексан-3-карбоновой кислоты (смесь син-анти диастереоизомеров 10/2) (D27) (3,06 г, 13,5 ммоль) в сухом DMF (15 мл) в атмосфере N2 добавляли один за другим НОВТ.H2O (2,06 г, 13,46 ммоль), EDC.HCl (3,87 г, 20,20 ммоль), гидрохлорид метил 4-(1-аминоциклопропил)бензоата (3,06 г, 13,46 ммоль) и TEA (4,7 мл, 33,7 ммоль). Смесь перемешивали в течение 2 ч при RT, затем растворитель упаривали в вакууме и остаток растворяли в этилацетате (500 мл), дважды промывали водой (50 мл), сушили над Na2SO4 и упаривали с получением остатка, который наносили в картридж «SNAP-Si» (100 г) и элюировали смесью DCM/AcOEt от 10/0 до 9/1. Собранные фракции после упаривания растворителя давали два титульных диастереоизомера (D73a) (2,55 г) и (D73b) (880 мг).
(D73a) (син диастереоизомер)
MS: (ES/+) m/z: 401,4 [МН+] C22H28N2O5 предусматривает 400,20
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,70 (s, 1H), 7,90-7,76 (m, 2H), 7,34-7,19 (m, 2H), 4,52-4,35 (m, 1H), 3,84 (s, 3H), 3,43-3,32 (m, 1H), 2,67-2,39 (m, 1H), 1,88-1,74 (m, 1H), 1,52-1,33 (m, 10H), 1,27-1,12 (m, 4H), 1,09-0,92 (m, 1H), 0,66-0,53 (m, 1H).
(D73b) (анти диастереоизомер)
MS: (ES/+) m/z: 401,4 [MH+] C22H28N2O5 предусматривает 400,20
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,69-8,52 (s, 1H), 7,90-7,73 (m, 2H), 7,35-7,19 (m, 2H), 3,93-3,75 (m, 4H), 3,36-3,30 (m, 1H), 2,35-2,19 (m, 1H), 2,12-2,02 (m, 1H), 1,90-1,74 (m, 1H), 1,47-1,30 (m, 9H), 1,25-1,07 (m, 4H), 0,73 (td, J=5,4, 8,8 Гц, 1H), 0,39 (br. s., 1H).
Описания 74а и 74b;
(3R)-трет-бутил 3-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-2-азабицикло[3.1.0]гексан-2-карбоксилат (смесь диастереоизомеров) (D74a) и 3-(((S)-1-(4-(метоксикярбонил)фенил)этил)карбамоил)-2-азабицикло[3.1.0]гексан-2-карбоксилат (одиночный диастереомер) (D74b)
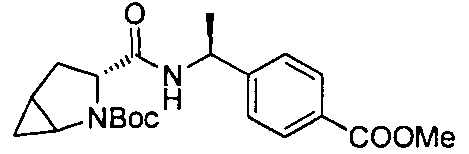
Титульные соединения (D74a) (15 мг) и (D74b) (65 мг) получали в соответствии с общей процедурой получения амидов (способ С), начиная с (3R)-2-(трет-бутоксикарбонил)-2-азабицикло[3.1.0]гексан-3-карбоновой кислоты (D33) (108 мг) и гидрохлорида метил 4-(1-аминоциклопропил)бензоата (113 мг). Время реакции: 18 часов.
(D74a) (смесь диастереоизомеров)
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,00 (d, J=8,1 Гц, 4H), 7,36 (d, J=8,1 Гц, 4H), 5,27-5,05 (m, 2H), 4,13 (2H, под остаточным растворителем), 3,92 (s, 6H), 3,35-3,12 (m, 2H), 2,65-2,38 (m, 2H), 2,35-2,12 (m, 2H), 1,69-1,58 (m, 2H), 1,49 (s, 24H), 0,94-0,74 (m, 2H), 0,50-0,34 (m, 2H)
(D74b) (Одиночный диастереоизомер)
MS: (ES/+) m/z: 289,3 [MH-Boc+] C21H28N2O5 предусматривает 388,20
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,01 (d, J=8,0 Гц, 2H), 7,37 (d, J=8,0 Гц, 2H), 5,23-5,07 (m, 1Н), 4,22-4,06 (m, 1Н), 3,93 (s, 3H), 3,33-3,18 (m, 1Н), 2,62-2,42 (m, 1Н), 2,32-2,12 (m, 1Н), 1,67-1,57 (m, 1Н), 1,50 (s, 12H), 0,90-0,79 (m, 1Н), 0,47-0,36 (m, 1H)
Описание 75: (R)-трет-бутил 2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-4,4-диметилпирролидин-1-карбоксилат (D75)
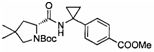
Титульное соединение (D75) (94 мг) получали в соответствии с общей процедурой получения амидов (способ С), начиная с (R)-1-(трет-бутоксикарбонил)-4,4-диметилпирролидин-2-карбоновой кислоты (D41) (84 мг) и гидрохлорида метил 4-(1-аминоциклопропил)бензоата (79 мг). HCTU: 1,05 экв.; Время реакции: 2 часа.
MS: (ES/+) m/z: 417,3 [МН+] C23H32N2O5 предусматривает 416,23
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,04 (s, 1Н), 7,95 (d, J=8,0 Гц, 2H), 7,28 (s, 2H, под растворителем), 4,32 (br. s., 1Н), 3,91 (s, 3H), 3,65-3,25 (m, 1H), 3,08 (d, J=10,7 Гц, 1H), 2,35-2,07 (m, 1H), 1,95-1,74 (m, 1H), 1,49 (br. s., 9H), 1,34 (d, J=12,3 Гц, 4H), 1,18-0,95 (m, 6H).
Описание 76: метил 4-((1S)-1-(1-бензилазетидин-2-карбоксамидо)этил)-бензоат (смесь диастереоизомеров) (D76)
Титульное соединение (D76) (98 мг) получали в соответствии с общей процедурой получения амидов (способ С), начиная с 1-бензилазетидин-2-карбоновой кислоты (100 мг, поставляется Apollo #OR7040) и гидрохлорида (S)-метил 4-(1-аминоэтил)-бензоата (113 мг). Время реакции: 1 ч.
MS: (ES/+) m/z: 353,3 [МН+] C21H24N2O3 предусматривает 352,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,02 (d, J=8,1 Гц, 2H), 7,94 (d, J=8,1 Гц, 2H), 7,39-7,21 (m, 14H), 7,06 (d, J=8,1 Гц, 2H), 5,07-4,87 (m, 2H), 3,93 (s, 6H), 3,78-3,67 (m, 3H), 3,65-3,56 (m, 3H), 3,44 (d, J=8,1 Гц, 2H), 3,11 (d, J=8,0 Гц, 2H), 2,48 (br. s., 2H), 2,15 (br. s., 1Н), 2,07 (s, 1Н), 1,47 (d, J=6,9 Гц, 3H), 1,16 (d, J=6,9 Гц, 3H).
Общий порядок получения замещенных бензиламинов
К раствору выбранной циклического аминокислоты, циклического аминоэфира или циклического аминоамида (1 экв.) в ACN добавляли последовательно Na2CO3 или Cs2CO3 (1,2-8 экв.) и выбранный бензилбромид (2 экв.), и нагревали полученную смесь при 60-68°C в течение 4-24 часов или перемешивали при комнатной температуре 18 часов. После фильтрации твердых веществ, фильтрат выпиривали в вакууме. Полученный остаток растворяли в EtOAc и промывали органическую фазу водой, сушили над Na2SO4 и упаривали в вакууме. Неочищенное вещество очищали на картридже «SPE-Si» или «Biotage SNAP-Si» с элюированием смесью сНех/EtOAc или cHex/DCM, с получением титульного замещенного соединения бензиламина.
Описание 77: метил 3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоксилат (син относительная стереохимия) (D77)
Титульное соединение (D77) (345 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с гидрохлорида метил 3-азабицикло[3.1.0]гексан-2-карбоксилата (D42) (300 мг). (Na2CO3: 6 экв.; Время реакции: 18 часов; 68°C)
MS: (ES/+) m/z: 300,0 [МН+] C15H16F3NO2 предусматривает 299,11
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,57 (d, J=7,8 Гц, 2H), 7,46 (d, J=7,6 Гц, 2H), 3,96 (d, J=13,4 Гц, 1Н), 3,74 (s, 3H), 3,52-3,41 (m, 2H), 3,00 (d, J=7,5 Гц, 1Н), 2,49 (d, J=4,9 Гц, 1Н), 1,72 (d, J=3,1 Гц, 1Н), 1,50-1,36 (m, 1Н), 1,11-0,96 (m, 1H), 0,41 (d, J=4,7 Гц, 1H).
Описание 78: этил 2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоксилат (D78)
Титульное соединение (D78) (430 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с этил 2-азабицикло[2.2.2]октан-3-карбоксилата (300 мг; методику получения см. в публикации заявки на патент US 2005009808). (Cs2CO3: 3 экв.; Время реакции: 18 часов; 68°C)
MS: (ES/+) m/z: 342 [МН+] C18H22F3NO2 предусматривает 341,16
Описание 79: (R)-4-(трифторметил)бензил 2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксилат (D79)
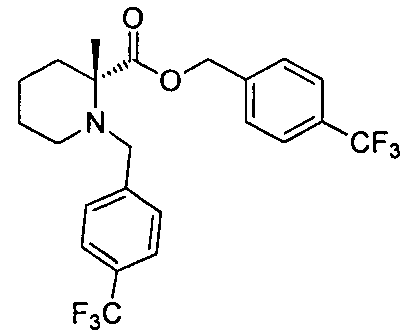
Титульное соединение (D79) (70 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с (R)-2-метилпиперидин-2-карбоновой кислоты (D47) (60 мг) и 4-(трифторметил)бензилбромида (0,126 мл). (Na2CO3: 8 экв.; время реакции 48 часов; 68°C)
MS: (ES/+) m/z: 460,3 [МН+] C23H23F6NO2 предусматривает 459,16
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,78-7,40 (m, 8H), 5,24 (d, J=4,3 Гц, 2H), 4,00 (d, J=15,4 Гц, 1Н), 3,82-3,53 (m, 2H), 2,79-2,56 (m, 1H), 2,55-2,39 (m, 1H), 2,31-2,11 (m, 1H), 1,72-1,45 (m, 7H)
Описание 80: (R)-метил 2-метил-1-(4-(трифторметил)бензил)пирролидин-2-карбоксилат (D80)
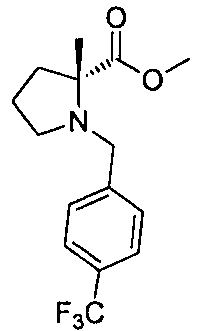
Титульное соединение (D80) (50 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с гидрохлорида (R)-метил-2-метилпирролидин-2-карбоксилата (D50) (60 мг) и 4-(трифторметил) бензилбромида (0,126 мл). (Na2CO3: 4 экв.; время реакции 18 часов; 68°C)
MS: (ES/+) m/z: 302,2 [МН+] C15H18F3NO2 предусматривает 301,13
Описание 81: (2R,4R)-3-(трифторметил)бензил 4-гидрокси-1-(3-(трифторметил)бензил)пирролидин-2-карбоксилат (D81)
Титульное соединение (D81) (1,02 г) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с цис-4-гидрокси-В-пролина (4,0 г, поставляется «Aldrich» #H5877) и 3-(трифторметил)бензилбромида (9,37 мл). (Na2CO3: 2,5 экв.; Время реакции: 24 часа, 60°C).
MS: (ES/+) m/z: 448,2 [МН+] C21H19F6NO3 предусматривает 447,13
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,70-7,34 (m, 8H), 5,28-5,06 (m, 2H), 4,51 (br. s., 1H), 4,02 (d, J=13,3 Гц, 1H), 3,81-3,64 (m, 2H), 3,34 (dd, J=5,4, 10,1 Гц, 1H), 2,52 (dd, J=2,9, 10,1 Гц, 1H), 2,30 (td, J=7,0, 13,6 Гц, 1H), 2,23-2,10 (m, 1H), 1,76 (br. s., 1Н).
Описание 82: (2R,4S)-3-(трифгорметил)бензил 4-фтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксилат (D82)
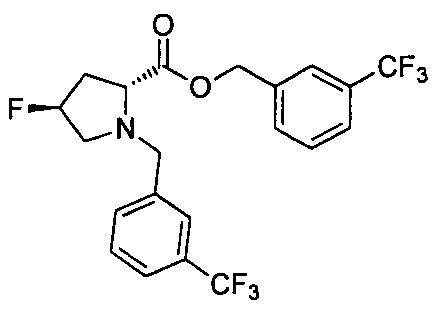
Раствор (2R,4R)-3-(трифторметил)бензил 4-гидрокси-1-(3-(трифторметил)бензил)пирролидин-2-карбоксилата (D81) (200 мг, 0,45 ммоль) в DCM (20 мл) охлаждали при -20°C, обрабатывали DAST (0,148 мл, 1,11 ммоль) и смесь перемешивали сначала 1 ч при температуре -20°C, затем 18 часов при комнатной температуре. Реакцию гасили раствором насыщ. р-ром NaHCO3 и экстрагировали водную фазу DCM (3×5 мл), сушили над MgSO4 и упаривавали. Остаток очищали на колонке «Biotage SNAP-Si» (25 г) с элюированием смесью петролейный эфир/EtOAc от 90/10 до 80/20. Собранные фракции после упаривания растворителя давали титульное соединение (D82) (110 мг).
MS: (ES/+) m/z: 450,2 [МН+] C21H18F7NO2 предусматривает 449,12
Хиральная ВЭЖХ [«Daicel OD-H»; Подвижная фаза: 80% н-гексан (0,1% DEA), В: 20% IPA; DAD: 265 нм]: Время удерживания пика: 10,82 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,77-7,36 (m, 8H), 5,37-5,04 (m, 3H), 4,14 (d, J=13,3 Гц, 1H), 3,77-3,58 (m, 1H), 3,46 (br. s., 1H), 3,38-3,17 (m, 1H), 2,86-2,49 (m, 2H), 2,49-2,25 (m, 1H).
Описание 83: (R)-3-(трифторметил)бензил 4-оксо-1-(3-(трифторметил)бензил)пирролидин-2-карбоксилат (D83)
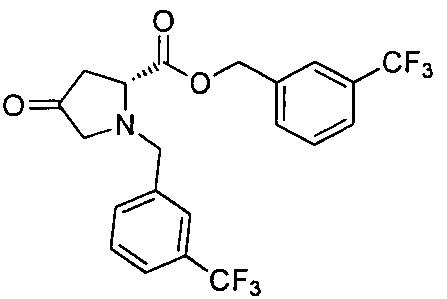
Раствор (2R,4R)-3-(трифторметил)бензил 4-гидрокси-1-(3-(трифторметил)бензил)пирролидин-2-карбоксилата (D81) (469 мг, 1,05 ммоль) в сухом DCM (10 мл) обрабатывали периодинаном Десса-Мартина (0,57 мг, 1,34 ммоль) и перемешивали при RT 4 часа. Реакцию гасили 10% водным раствором сульфита натрия (10 мл) и экстрагировали EtOAc (3×10 мл). Органические фазы собирали, промывали насыщ. р-ром NaCl, сушили над Na2SO4 и упаривали с получением остатка, который очищали на картридже «SPE-Si» (10 г) с элюированием смесью сНех/EtOAc 90/10. Собранные фракции после упаривания растворителя давали титульное соединение (D83) (290 мг).
MS: (ES/+) m/z: 446,2 [МН+] C21H17F6NO3 предусматривает 445,11
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,75-7,37 (m, 8H), 5,25 (s, 2H), 4,06-3,87 (m, 2H), 3,78 (d, J=13,4 Гц, 1H), 3,36 (d, J=17,1 Гц, 1H), 3,06 (d, J=17,1 Гц, 1H), 2,80 (dd, J=7,9, 18,1 Гц, 1H), 2,69-2,47 (m, 1H).
Описание 84: (R)-3-(трифторметил)бензил 4,4-дифтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксилат (D84)
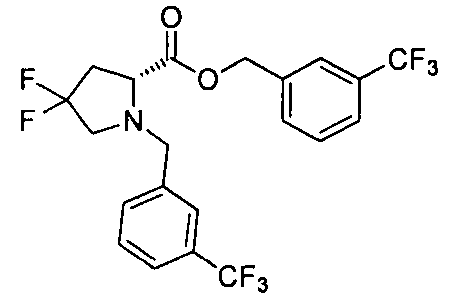
Раствор (R)-4-(трифторметил)бензил 4-оксо-1-(4-(трифторметил)бензил)пирролидин-2-карбоксилата (D83) (90 мг, 0,20 ммоль) в DCM (10 мл), охлажденный до -20°C, обрабатывали DAST (0,133 мл, 1,01 ммоль) и смесь сначала перемешивали 1 ч при температуре -20°C, затем 18 часов при комнатной температуре. Реакцию гасили насыщ. р-ром NaHCO3 и экстрагировали водную фазу DCM (3×5 мл), сушили над MgSO4 и упаривали. Остаток очищали с помощью картриджа «SPE-Si» (10 г) с элюированием cHex/DCM 50/50. Собранные фракции, после испарения растворителя давали титульное соединение (D84) (87 мг)
MS: (ES/+) m/z: 468,2 [МН+] C21H17F8NO2 предусматривает 467,11
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,78-7,36 (m, 8H), 5,31-5,14 (m, 2H), 4,07 (d, J=13,4 Гц, 1Н), 3,77-3,59 (m, 2H), 3,37 (q, J=12,2 Гц, 1Н), 2,91 (td, J=10,9, 16,4 Гц, 1H), 2,75-2,43 (m, 2H).
Общая процедура отщепления трет-бутил карбамата (Boc).
К охлажденному на льду раствору защищенного Boc амина в DCM добавляли смесь TFA:DCM 3:1 и полученную смесь перемешивали при комнатной температуре 1 ч перед упариванием растворителей. Остаток наносили в картридж «SCX SPE». Собранные аммиачные фракции после упаривания растворителя давали титульные соединения.
Описание 85: метил 4-((1S)-1-(пиперидин-2-карбоксамидо)этил) (смесь диастереоизомеров) (D85)
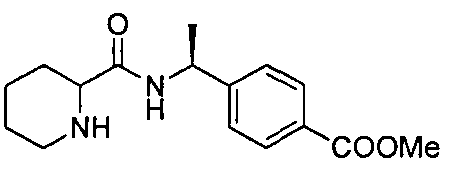
Титульное соединение (D85) (1,37 г) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с трет-бутил 2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)пиперидин-1-карбоксилата (D51) (1,95 г).
MS: (ES/+) m/z: 291,3 [МН+] C16H22N2O3 предусматривает 290,16
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,01 (d, 2H) 7,38 (d, 2H) 7,13-7,27 (m, 1Н) 5,08-5,24 (m, 1H) 3,93 (s, 3H) 3,22-3,38 (m, 1H) 3,05 (d, 1H) 2,72 (t, 1H) 2,50 (br. s., 1H) 1,98 (d, 1H) 1,80 (d, 1H) 1,60 (br. s., 1H) 1,50 (d, 3H) 1,38-1,48 (m, 3H).
Описание 86: метил 4-((S)-1-((R)-пиперидин-2-карбоксамидо)этил)бензоат (D86)
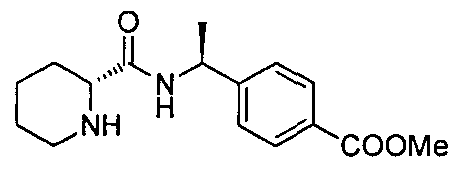
Титульное соединение (D86) (286 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (R)-трет-бутил 2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)пиперидин-1-карбоксилата (D52) (405 мг).
MS: (ES/+) m/z: 291,3 [МН+] C16H22N2O3 предусматривает 290,16
Хиральная ВЭЖХ [«Phenomenex Lux Cellulose-1»; Подвижная фаза: 90% н-гексан (0,1% DEA), В: 10% EtOH; DAD: 237 нм]: Время удерживания пика: 15,93 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,02 (d, 2H) 7,39 (d, 2H) 7,15 (d, 1Н) 5,17 (t, 1Н) 3,93 (s, 3H) 3,17-3,33 (m, 1H) 3,03 (d, 1H) 2,71 (br. s., 1H) 1,89-2,08 (m, 1H) 1,72-1,86 (m, 1H) 1,54-1,67 (m, 2H) 1,50 (d, 3H) 1,30-1,46 (m, 3H).
Описание 87: (R)-метил 4-(1-(пиперидин-2-карбоксамидо)-циклопропил)-бензоат (D87)
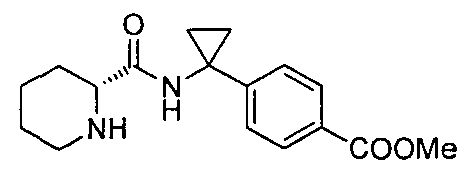
Титульное соединение (D87) (490 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (R)-трет-бутил 2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)пиперидин-1-карбоксилата (D53) (650 мг).
MS: (ES/+) m/z: 303,2 [МН+] C17H22N2O3 предусматривает 302,16
Описание 88: метил 4-(1-(6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоат (Рацемическая смесь) (D88)
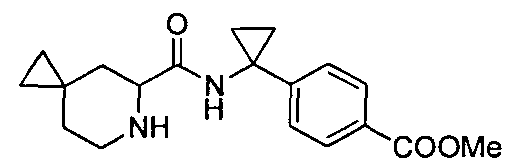
Титульное соединение (D88) (230 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с трет-бутил-5-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-6-азаспиро[2,5]октан-6-карбоксилата (рацемическая смесь) (D54) (290 мг).
МС: (ES/+) м/з: 329,3 [МН+] C19H24N2O3 предусматривает 328,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,08 (br. s., 1H), 7,92 (d, J=8,2 Гц, 2H), 7,19 (d, J=8,1 Гц, 2H), 3,91 (s, 3H), 3,74 (d, J=9,4 Гц, 1Н), 3,11 (d, J=12,0 Гц, 1Н), 2,98-2,84 (m, 1H), 2,02-1,78 (m, 2H), 1,39-1,24 (m, 5H), 0,88 (d, J=13,5 Гц, 1H), 0,51-0,32 (m, 3H), 0,26 (d, J=6,1 Гц, 1H).
Описание 89: метил 4-(1-(6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоат 2,2,2-трифторацетат (одиночный неизвестный энантиомер) (D89)
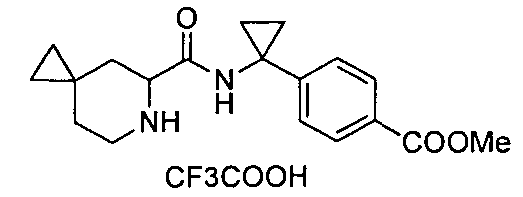
Трет-бутил 5-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-6-азаспиро[2,5]октан-6-карбоксилат (D55) (19,7 г) растворяли в DCM (220 мл) перед добавлением TFA (35 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. После упаривания растворителя выделяли титульное соединение (D89) (27 г).
MS: (ES/+) m/z: 329,3 [МН+] C19H24N2O3 предусматривает 328,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 9,89-9,40 (m, 1Н), 7,94 (d, J=7,9 Гц, 2H), 7,79-7,51 (m, 1Н), 7,12 (d, J=7,9 Гц, 2H), 4,41 (br. s., 1Н), 3,94 (s, 3H), 3,47-3,27 (m, J=10,5 Гц, 1H), 3,24-3,02 (m, 1H), 2,16 (t, J=12,6 Гц, 1H), 2,12-2,06 (m, 1H), 1,44-1,17 (m, 5H), 0,93 (d, J=14,2 Гц, 1Н), 0,67-0,31 (m, 4H).
Описание 90: метил 4-(1-(6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоат (одиночный неизвестный энантиомер) (D90)
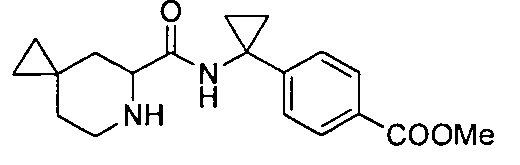
Титульное соединение (D90) (310 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с трет-бутил-5-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-6-азаспиро[2,5]октан-6-карбоксилата (D55) (405 мг).
MS: (ES/+) m/z: 329,2 [МН+] C19H24N2O3 предусматривает 328,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,95 (d, J=8,2 Гц, 2H), 7,80-7,61 (m, 1H), 7,24 (d, J=8,2 Гц, 2H), 3,91 (s, 3H), 3,61-3,47 (m, 1H), 3,19-3,05 (m, 1H), 2,99-2,81 (m, 1H), 1,98-1,72 (m, 2H), 1,33 (d, J=5,7 Гц, 5H), 1,03-0,88 (m, 1H), 0,38 (d, J=6,0 Гц, 3H), 0,34-0,21 (m, 1H).
Описание 91: метил 4-((1S)-1-(6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D91)
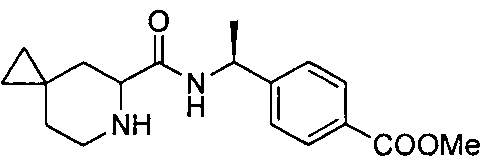
Титульное соединение (D91) (96 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с отрет-бутил-5-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-6-азаспиро[2,5]октан-6-карбоксилата (D56) (130 мг).
MS: (ES/+) m/z: 317 [МН-Вос+] C18H24N2O3 предусматривает 316,18
Хиральная ВЭЖХ [«Phenomens LUX-1»; Подвижная фаза: 90% н-гексан (0,1% DEA), В: 10% IPA; DAD: 248 нм]: Время удерживания пика 1: 13,6 мин, время удерживания пика 2: 15,7 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,02 (dd, 4H) 7,40 (d, 4H) 7,18 (t, 2H) 5,17 (t, 2H) 3,93 (s, 6H) 3,36 (ddd, 2H) 2,97-3,16 (m, 2H) 2,74-2,93 (m, 2H) 1,64-1,87 (m, 5H) 1,45-1,55 (d, 7H) 1,34 (t, 2H) 0,91 (d, 2H) 0,17-0,49 (m, 8H)
Описание 92: метил 4-((1S)-1-(5-метил-6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D92)
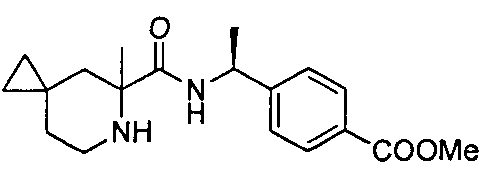
Титульное соединение (D92) (19 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Вое), начиная с трет-бутил-5-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-5-метил-6-азаспиро[2,5]октан-6-карбоксилата (D57) (25 мг)
MS: (ES/+) m/z: 331,3 [МН+] C19H26N2O3 предусматривает 330,19
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,07-7,94 (m, 2H), 7,92-7,74 (m, 1H), 7,49-7,33 (m, 2H), 5,15 (t, J=7,1 Гц, 1H), 3,92 (s, 3H), 3,25-2,72 (m, 3H), 1,94 (t, J=12,7 Гц, 1H), 1,55-1,46 (m, 3H), 1,37-1,24 (m, 3H), 1,01-0,81 (m, 2H), 0,62-0,18 (m, 4H).
Описание 93: метил 4-(1-(4,4-диметилпиперидин-2-карбоксамидо)-циклопропил)-бензоат (D93)
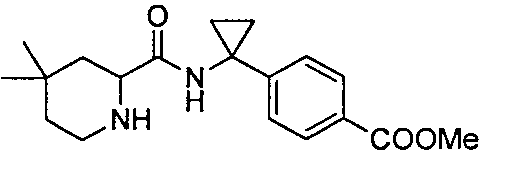
Титульное соединение (D93) (150 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с трет-бутил 2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-4,4-диметилпиперидин-1-карбоксилата (D58) (250 мг)
MS: (ES/+) m/z: 331,3 [МН+] C19H26N2O3 предусматривает 330,19
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,95 (d, J=8,2 Гц, 2H), 7,47 (br. s., 1H), 7,24 (d, J=8,3 Гц, 2H), 3,91 (s, 3H), 3,39 (dd, J=2,7, 11,5 Гц, 1H), 3,00-2,78 (m, 2H), 1,78-1,67 (m, 3H), 1,33 (d, J=6,7 Гц, 4H), 1,29-1,20 (m, 1H), 0,98 (d, J=5,2 Гц, 6H).
Описание 94: метил 4-((1S)-1-(4,4-диметилпиперидин-2-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D94)
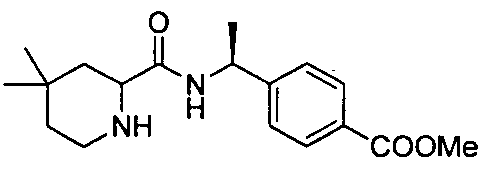
Титульное соединение (D94) (150 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с трет-бутил 2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-4,4-диметилпиперидин-1-карбоксилата (смесь диастереоизомеров) (D59) (230 мг)
MS: (ES/+) m/z: 319,3 [МН+] C18H26N2O3 предусматривает 318,25
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,09-7,96 (m, 2H), 7,40 (d, J=7,0 Гц, 2H), 5,15 (br. s., 1H), 3,93 (s, 3H), 3,48 (d, J=12,1 Гц, 1H), 2,95 (br. s., 2H), 1,82-1,69 (m, 1H под растворителем), 1,51 (d, J=6,5 Гц, 3H), 1,44-1,28 (m, 3H), 1,04-0,91 (m, 6H).
Описание 95: метил 4-((1S)-1-((2R)-4-фторпиперидин-2-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D95)
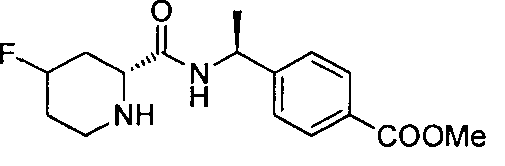
Титульное соединение (D95) (75 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (R) 2-трет-бутил 4-фтор-2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)пиперидин-1-карбоксилата (D62) (89 мг).
MS: (ES/+) m/z: 309,2 [МН+] C16H21FN2O3 предусматривает 308,15
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,03 (d, J=8,1 Гц, 2H), 7,38 (d, J=8,1 Гц, 2H), 7,20-7,07 (m, 1Н), 5,22-5,12 (m, 1Н), 5,00-4,80 (m, 1Н), 3,93 (s, 3H), 3,70-3,62 (m, 1Н), 3,13-3,01 (m, 1Н), 2,96-2,83 (m, 1Н), 2,28-2,14 (m, 1Н), 1,88-1,61 (m, 4H), 1,52 (d, J=6,9 Гц, 3H).
Описание 96: метил 4-(1-((2R)-4-фторпиперидин-2-карбоксамидо)циклопропил)бензоата (смесь диастереоизомеров) (D96)
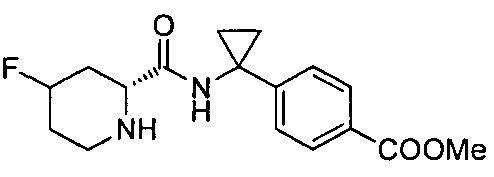
Титульное соединение (D96) (26 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (2R)-трет-бутил-4-фтор-2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)пиперидин-1-карбоксилата (D65) (39 мг).
MS: (ES/+) m/z: 321,1 [МН+] C17H21FN2O3 предусматривает 320,15
1H ЯМР (400 МГц, CHCl3-d) δ (м.д. 8,05-7,86 (m, J=8,0 Гц, 2H), 7,55 (br. s., 1Н), 7,33-7,17 (m, 2H), 5,06-4,77 (m, 1Н), 3,90 (s, 3H), 3,71-3,58 (m, 1Н), 3,06 (d, J=11,0 Гц, 1Н), 2,98-2,83 (m, 1Н), 2,19 (d, J=9,9 Гц, 1Н), 1,98-1,43 (m, 3H), 1,40-1,09 (m, J=6,5 Гц, 4H).
Описание 97: метил 4-((S)-1-((R)-4,4-дифторпиперидин-2-карбоксамидо)этил)бензоат (D97)
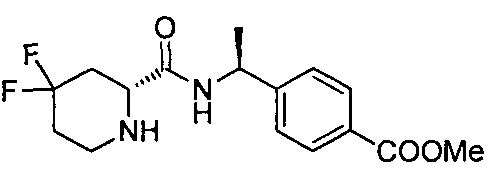
Титульное соединение (D97) (66 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (R)-трет-бутил 4,4-дифтор-2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)пиперидин-1-карбоксилата (D66) (98 мг).
MS: (ES/+) m/z: 327,4 [МН+] C16H20F2N2O3 предусматривает 326,14
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,03 (d, J=7,8 Гц, 2H), 7,38 (d, J=7,8 Гц, 2H), 6,98 (d, J=5,9 Гц, 1Н), 5,27-5,05 (m, 1Н), 3,93 (s, 3H), 3,43-3,13 (m, 1Н), 2,93-2,78 (m, 1Н), 2,56-2,33 (m, 1Н), 2,15-1,94 (m, 1Н), 1,90-1,66 (m, 2H), 1,63-1,44 (m, 4H).
Описание 98: (R)-метил 4-(1-(4,4-дифторпиперидин-2-карбоксамидо)циклопропил)бензоат (D98)
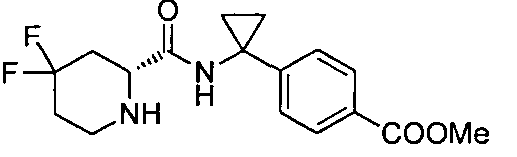
Титульное соединение (D98) (47 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (R)-трет-бутил 4,4-дифтор-2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)пиперидин-1-карбоксилата (D67) (68 мг).
MS: (ES/+) m/z: 339,4 [МН+] C17H20F2N2O3 предусматривает 338,14
Описание 99: метил 4-(1-(4,4-дифторпиперидин-2-карбоксамидо)-циклопропил)-бензоат (рацемическая смесь) (D99)
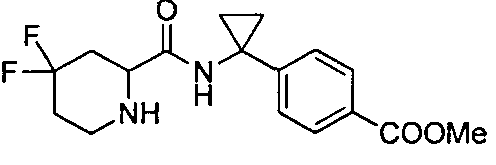
Титульное соединение (D99) (500 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с трет-бутил 4,4-дифтор-2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)пиперидин-1-карбоксилата (D68) (685 мг)
MS: (ES/+) m/z: 339,2 [MH+] C17H20F2N2O3 предусматривает 338,46
Хиральная ВЭЖХ [«Daicel IC»; Подвижная фаза: 70% н-гептан (+0,1% DEA), В: 30% этанол; DAD: 248 нм]: Время удерживания пика 1: 12,71 мин. Время удерживания пика 2: 16,05 мин.
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,69 (s, 1H), 7,85 (d, J=8,3 Гц, 2H), 7,24 (d, J=8,3 Гц, 2H), 3,84 (s, 3H), 3,34-3,31 (m, 1Н), 3,09 (d, J=12,2 Гц, 1Н), 2,70-2,57 (m, 1Н), 2,25-2,07 (m, 1H), 1,99-1,70 (m, 3H), 1,35-1,16 (m, 4H).
Описание 100: метил 4-(1-(3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензоат (смесь диастереоизомеров) (D100)
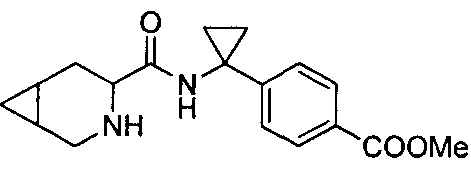
Титульное соединение (D100) (155 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с трет-бутил 4-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-3-азабицикло[4.1.0]гептан-3-карбоксилата (D69) (260 мг).
МС: (ES/+) м/з: 314,7 [МН+] C18H22N2O3 предусматривает 314,16
Хиральная ВЭЖХ [Daicel AD-H; Подвижная фаза: 60% н-гептан (+0,1% DEA), 40% МПА; DAD: 248 нм]: Время удерживания пика 1: 13,36 мин. Время удерживания пика 2: 19,18 мин.
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,46 (s, 1H), 7,88-7,81 (m, 2H), 7,26-7,19 (m, 2H), 3,83 (s, 3H), 3,33-3,31 (m, 1H), 2,86 (dd, J=4,9, 9,8 Гц, 1H), 2,69-2,65 (m, 1H), 1,91-1,83 (m, 1H), 1,83-1,73 (m, 1H), 1,30-1,24 (m, 2H), 1,24-1,17 (m, 2H), 1,05-0,87 (m, 2H), 0,59 (dt, J=4,4, 8,6 Гц, 1H), 0,27 (q, J=4,9 Гц, 1H).
Описание 101: метил 4-(1-((3R)-2-азабицикло[4.1.0]гептан-3-карбоксамидо)-циклопропил)-бензоат (Диастереоизомеры смесь) (D101)
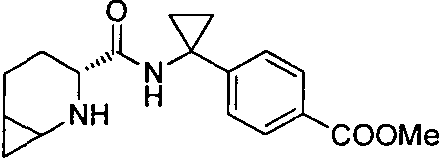
Титульное соединение (D101) (20 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (3R)-трет-бутил 3-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-2-азабицикло[4.1.0]гептан-2-карбоксилата (D70) (28 мг).
MS: (ES/+) m/z: 315,2 [МН+] C18H22N2O3 предусматривает 314,16
Описание 102: метил 4-((1S)-1-((3R)-2-азабицикло[4.1.0]гептан-3-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D102)
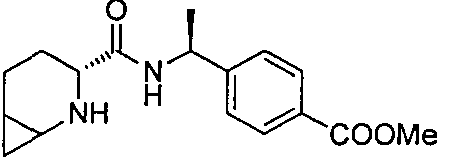
Титульное соединение (D102) (17,5 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (3R)-трет-бутил 3-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-2-азабицикло[4.1.0]гептан-2-карбоксилата (смесь диастереоизомеров) (D71) (46 мг).
MS: (ES/+) m/z: 303,1 [МН+] C17H22N2O3 предусматривает 302,16
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,13-7,93 (m, 2H), 7,57-7,33 (m, 2H), 5,29-5,04 (m, 1H), 3,92 (s, 3H), 3,35-3,19 (m, 1H), 2,41 (m, 1H), 2,21-0,83 (m, 8H), 0,77-0,61 (m, 1H), 0,38 (m, 1H).
Описание 103: метил 4-((S)-1-((R)-пирролидин-2-карбоксамидо)этил)бензоат (D103)
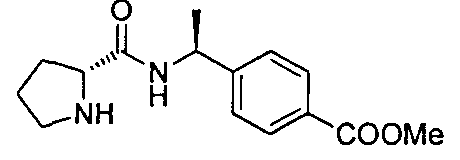
Титульное соединение (D103) (550 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (R)-трет-бутил 2-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)пирролидин-1-карбоксилата (D72) (815 мг).
MS: (ES/+)m/z: 277,6 [MH+] C15H20N2O3 предусматривает 276,15
Хиральная ВЭЖХ [«Phenomenex Lux Cellulose-1»; Подвижная фаза: 70% н-гексан (0,1% DEA), 30% EtOH; DAD: 240 нм]: Время удерживания пика: 8,65 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,00 (d, J=7,3 Гц, 2H), 7,80-7,53 (m, 1H), 7,35 (d, J=8,3 Гц, 2H), 5,15 (br. s., 1H), 4,35 (br. s., 1H), 3,93 (s, 3H), 3,37 (br. s., 2H), 2,07 (s, 4H), 1,50 (s, 12H).
Описание 104: метил 4-(1-((1R,3R,5R)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)-циклопропил)-бензоат (син диастереоизомер) (D104)
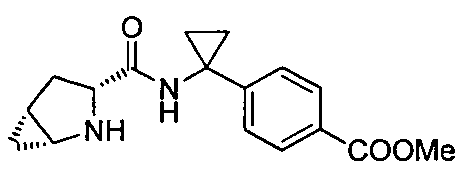
Титульное соединение (D104) (1,8 г) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (1R,3R,5R)-трет-бутил 3-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (син диастереоизомер) (D73a) (2,6 г).
МС: (ES/+) м/з: 301 [МН+] C17H20N2O3 предусматривает 300,15
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,51 (s, 1Н), 7,88-7,81 (m, 2H), 7,23 (d, J=8,3 Гц, 2H), 4,08 (s, 1H), 3,87-3,78 (m, 4H), 2,77 (dt, J=2,7, 6,2 Гц, 1H), 2,15-1,99 (m, 2H), 1,34-1,23 (m, 3H), 1,21-1,13 (m, 2H), 0,47-0,37 (m, 1H), -0,06 (ddd, J=2,9, 4,3, 5,5 Гц, 1H)
Описание 105: метил 4-(1-((1S,3R,5S)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензоат (анти диастереоизомер) (D105)
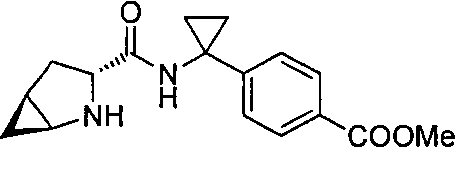
Титульное соединение (D106) (71,9 мг) получали в соответствии с общей процедурой отщепления трет-бутил карбамата (Boc), начиная с (1S,3R,5S) трет-бутил 3-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (анти диастереоизомер) (D73b) (D76) (96 мг)
MS: (ES/+) m/z: 301,3 [MH+] C17H20N2O3 предусматривает 300,15
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,03 (br. s., 1Н), 7,95 (d, J=8,2 Гц, 2H), 7,24 (d, J=8,3 Гц, 2H), 3,91 (s, 3H), 3,62-3,41 (m, 1H), 3,01-2,79 (m, J=2,3 Гц, 1H), 2,44 (dd, J=8,4, 12,7 Гц, 1H), 2,04-1,90 (m, 1H), 1,54-1,40 (m, 1H), 1,40-1,25 (m, 4H), 0,60-0,34 (m, 2H).
Описание 106: метил 4-((1S)-1-((3R)-2-язябицикло[3.1.0]гексан-3-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D106)
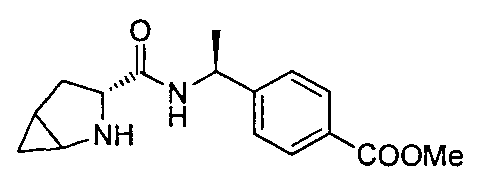
Указанные в заголовке соединения (D106) (11 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (3R)-трет-бутил 3-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (смесь диастереоизомеров) (D74a) (15 мг)
MS: (ES/+) m/z: 289,3 [MH+] C16H20N2O3 предусматривает 288,15
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,06 (d, J=7,8 Гц, 1Н), 8,00 (d, J=7,1 Гц, 4H), 7,93-7,85 (m, 1Н), 7,37 (dd, J=4,2, 7,7 Гц, 4H), 5,08 (t, J=7,2 Гц, 2H), 4,11 (d, J=7,2 Гц, 1Н), 3,92 (s, 6H), 3,64 (s, 1Н), 2,93-2,87 (m, 2H), 2,44-2,34 (m, 1Н), 2,28 (m, 1Н), 1,99-1,87 (m, 1Н), 1,61-1,35 (m, 9H), 0,56-0,44 (m, 3H), 0,05 (br. s., 1H).
Описание 107: метил 4-((1S)-1-((3R)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)этил)бензоат (одиночный диастереомер) (D107)
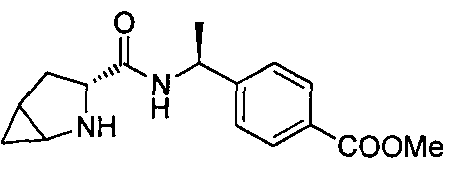
Указанные в заголовке соединения (D107) (48 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (3R)-трет-бутил 3-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-2-азабицикло[3.1.0]гексан-2-карбоксилата (одиночный диастереомер) (D74b) (65 мг).
МС: (ES/+) м/з: 289,3 [МН+] C16H20N2O3 предусматривает 288,15.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,99 (d, J=8,1 Гц, 2H), 7,89 (d, J=7,7 Гц, 1Н), 7,36 (d, J=8,1 Гц, 2H), 5,07 (t, J=7,3 Гц, 1Н), 3,90 (s, 3H), 3,60 (t, J=8,7 Гц, 1Н), 2,90-2,80 (m, J=2,5 Гц, 1H), 2,36 (dd, J=8,3, 12,7 Гц, 1H), 1,97-1,81 (m, J=4,1, 4,1, 8,3 Гц, 1H), 1,48 (d, J=7,0 Гц, 3H), 1,45-1,39 (m, J=7,0 Гц, 1H), 0,53-0,39 (m, 2H).
Описание 108: (R)-метил 4-(1-(4,4-диметилпирролидин-2-карбоксамидо)циклопропил)бензоат (D108)
Титульное соединение (D108) (70 мг) получали в соответствии с общей процедурой отщепления трет-бутилкарбамата (Boc), начиная с (R)-трет-бутил 2-((1-(4-(метоксикарбонил)фенил)циклопропил)карбамоил)-4,4-диметилпирролидин-1-карбоксилата (D75) (94 мг).
MS: (ES/+) m/z: 317,3 [МН+] C18H24N2O3 предусматривает 316,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,51 (br. s., 1Н), 7,96 (d, J=8,0 Гц, 2H), 7,25 (br. d, J=1,0 Гц, 2H), 4,13-4,00 (m, 1H), 3,91 (s, 3H), 2,86 (d, J=10,7 Гц, 1Н), 2,72 (d, J=10,6 Гц, 1H), 2,22-2,07 (m, 1H), 1,66 (dd, J=7,9, 12,8 Гц, 1H), 1,35 (s, 4H), 1,09 (d, J=8,8 Гц, 6H).
Описание 109: метил 4-((1S)-1-(азетидин-2-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D109)
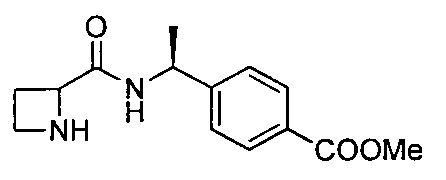
К раствору метилового эфира 4-((1S)-1-(1-бензилазетидин-2-карбоксамидо)этил)бензоата (D76) (98 мг, 0,278 ммоль в EtOH (20 мл) добавляли Pd/C 10% (90 мг, 0,083 ммоль) и формиат аммония (52 мг, 0,83 ммоль) и перемешивали гетерогенный раствор при RT в течение 20 часов. Добавляли дополнительно 10% Pd/C (90 мг, 0,083 ммоль) и формиат аммония (52 мг, 0,83 ммоль) и полученную смесь перемешивали при RT в течение 5 часов. Катализатор отфильтровывали, а растворитель упаривали, получая титульное соединение (D109) (60 мг).
MS: (ES/+) m/z: 263,2 [МН+] C14H18N2O3 предусматривает 262,13
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,24 (s, 1H), 8,09-7,96 (m, 2H), 7,46-7,33 (m, 2H), 5,39-5,22 (m, 1H), 5,22-5,05 (m, 1H), 3,93 (d, J=2,8 Гц, 3H), 3,89-3,70 (m, 1H), 2,78 (dd, J=5,9, 9,2 Гц, 1H), 2,65-2,34 (m, 1H), 1,51 (q, J=6,8 Гц, 3H), 1,43-1,34 (m, 1Н).
Общая процедура гидролиза сложных эфиров
Способ А
К раствору выбранного эфира (1 экв.) в смеси диоксан/вода (1:1) добавляли LiOH H2O (1,2-4 экв.) и перемешивали полученную смесь при RT. Упаривали органический растворитель и промывали водный раствор DCM и упаривали его в вакууме. Остаток наносили в картридж «С18» и элюировали смесью H2O/МеОН 9/1, затем МеОН. Собранные метанольные фазы упаривали с получением титульного соединения в виде литиевой соли.
Способ Б
К раствору выбранного эфира (1 экв.) в смеси диоксан/вода (1:1) добавляли LiOH H2O (1,2-4 экв.) и перемешивали полученную смесь при RT. Диоксан упаривали, и водный раствор наносили на обращенно-фазовую колонку «Biotage SNAP-C18», элюируя смесью H2O/MeCN, содержащей 0,1% СН3СО2Н от 90/10 до 80/20. Собранные фракции после упаривания растворителя давали титульное соединение.
Способ С
К раствору выбранного эфира (1 экв.) в смеси диоксан/вода (1:1) добавляли LiOH H2O (1,5 экв.) и перемешивали полученную смесь при комнатной температуре в течение 18 часов или нагревали микроволновым облучением. Органический растворитель упаривали, и водный раствор подкисляли уксусной кислотой и наносили на обращенно-фазовую колонку «Biotage SNAP-C18», элюируя сначала H2O, а затем МеОН. Метанольную фазу упаривали в вакууме с получением титульного соединения.
Способ D
К раствору выбранного эфира (1 экв.) в смеси диоксан/вода (1:1) добавляли LiOH H2O (1,5-4 экв.) и перемешивали полученную смесь при комнатной температуре или нагревали микроволновым облучением. Упаривали органический растворитель, и промывали водный раствор DCM перед добавлением уксусной кислоты, до достижения значения pH раствора, равного 4. Водный раствор экстрагировали этилацетатом. Органические фазы собирали и промывали насыщ. р-ром NaCl, сушили над Na2SO4 и упаривали с получением титульного соединения.
Способ Е
К раствору выбранного эфира (1 экв.) в смеси диоксан/вода (1:1) добавляли LiOH H2O (1,5-4 экв.) и полученную смесь перемешивали при RT или нагревали при микроволновом облучении. Органический растворитель упаривали, и водный раствор промывали DCM перед добавлением уксусной кислоты, до достижения значения pH, равного 4. Твердый осадок экстрагировали этилацетатом. Органические фазы собирали, сушили над Na2SO4 и упаривали в вакууме с получением титульного соединения.
Описание 110: 3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоновая кислота (относительная стереохимия син) (D110)
Титульное соединение (D110) (110 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с метил 3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоксилата (D77) (180 мг). (LiOH: 1,5 экв.; температура реакции: 150°C при микроволновом облучении, время реакции: 5 мин).
MS: (ES/+) m/z: 286,3 [МН+] C14H14F3NO2 предусматривает 285,10
1H ЯМР (400 МГц, METHANOL-d4) δ (м.д.): 7,77-7,72 (m, 2H), 7,72-7,66 (m, 2H), 4,42 (d, J=1,0 Гц, 1H), 4,17 (d, J=1,0 Гц, 1H), 4,05 (d, J=4,0 Гц, 1H), 3,38 (br. s., 2H), 2,14-2,04 (m, 1H), 1,81-1,70 (m, 1H), 0,96-0,84 (m, 1H), 0,73-0,59 (m, 1H).
Описание 111: 2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоновая кислота (D111)
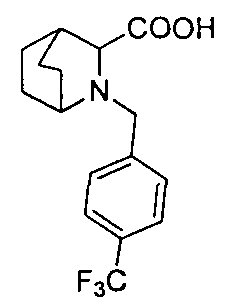
Титульное соединение (D111) (45 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с этил 2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоксилата (D78) (420 мг). (LiOH: 2 экв.; Время реакции: 18 часов; RT).
MS: (ES/+) m/z: 314,3 [МН+] C16H18F3NO2 предусматривает 313,13
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,85-7,79 (m, 2H), 7,77-7,72 (m, 2H), 4,48-4,36 (m, 2H), 3,56-3,47 (m, 2H), 2,41-2,28 (m, 2H), 2,19-2,03 (m, 1H), 1,98-1,88 (m, 2H), 1,88-1,77 (m, 2H), 1,71-1,56 (m, 2H).
Описание 112: (R)-2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксилат лития (D112)
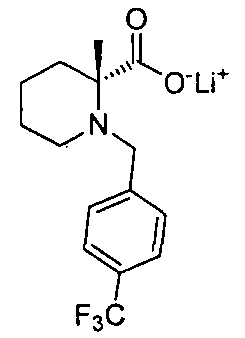
Титульное соединение (D112) (10 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (метод А) начиная с (R)-4-(трифторметил)бензил 2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксилата (D79) (70 мг). (LiOH: 3 экв.; Время реакции: 48 часов; RT затем 140°C в условиях микроволнового излучения в течение 2 часов).
MS: (ES/+) m/z: 302,2 [M-Li+2H+] C15H17F3LiNO2 предусматривает 307,14
Описание 113: (R)-2-метил-1-(4-(трифторметил)бензил)пирролидин-2-карбоксилат лития (D113)
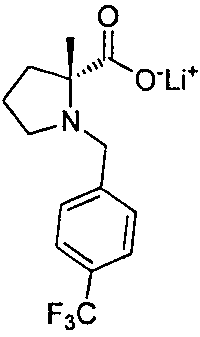
Титульное соединение (D113) (42 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (метод А) начиная с (R)-метил 2-метил-1-(4-(трифторметил)бензил)пирролидин-2-карбоксилата (D80) (50 мг). (LiOH: 3 экв.; Время реакции: 18 часов; RT)
MS: (ES/+) m/z: 288,2 [M-Li+2H+] C14H15F3LiNO2 предусматривает 293,12
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,72 (s, 4H), 4,35 (d, J=12,7 Гц, 1Н), 4,02 (d, J=12,7 Гц, 1Н), 3,25-2,96 (m, 2H), 2,31 (d, J=10,3 Гц, 1H), 2,13-1,80 (m, 3H), 1,54 (s, 3H)
Описание 114: (2R,4S)-4-фтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксилат лития (D114)
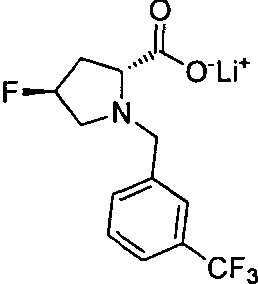
Титульное соединение (D114) (60 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (метод А), начиная с (2R,4S)-3-(трифторметил)бензил 4-фтор-1-(4-(трифторметил)бензил)пирролидин-2-карбоксилата (D82) (110 мг). (LiOH: 2 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 292,2 [M-Li+2H+] C13H12F4LiNO2 предусматривает 297,10
Описание 115: (R)-4,4-дифтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксилат лития (D115)
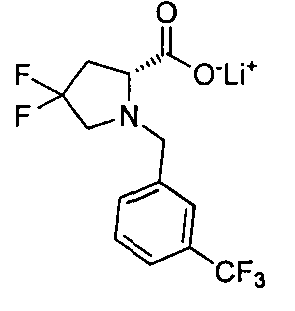
Титульное соединение (D115) (51 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (Способ А), начиная с (R)-4-(трифторметил)бензил 4,4-дифтор-1-(4-(трифторметил)бензил)пирролидин-2-карбоксилата (D84) (81 мг). Время реакции: 18 часов; RT.
MS: (ES/+) m/z: 310,1 [M-Li+2H+] C13H11F5LiNO2 предусматривает 315,09
Описание 116: метил 4-((1S)-1-(1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D116)

К смеси метилового эфира 4-((1S)-1-(пиперидин-2-карбоксамидо)этил) (смесь диастереоизомеров) (D85) (50,0 мг, 0,172 ммоль) и 4-(трифторметил) бензальдегида (0028 мл, 0207 ммоль) в DCE (1,7 мл), добавляли каталитическую АсОН и перемешивали смесь 1 ч при RT. Добавляли NaBH(OAc)3 (43,8 мг, 0,207 ммоль) и перемешивали полученную смесь при RT в течение ночи. Растворители упаривали в вакууме, и остаток очищали с помощью «SPE-Si» (2 г), элюируя смесью DCM/MeOH 98/2. Собранные фракции после упаривания растворителя давали титульное соединение (D116) (75 мг).
MS: (ES/+) m/z: 449 [МН+] C16H22N2O3 предусматривает 290,16
Хиральная ВЭЖХ [«Phenomenex Lux Cellulose-1»; Подвижная фаза: 90% н-гексан (0,1% DEA), В: 10% IPA; DAD: 237 нм]: Время удерживания пика 1: 16,08 мин, время удерживания пика 2: 17,5 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,04 (d, 2H) 7,84 (d, 2H) 7,63 (d, 2H) 7,50 (d, 2H) 7,45 (d, 2H) 7,39 (s, 2H) 7,25 (d, 2H) 7,20 (s, 2H) 7,00 (d, 1H) 6,95 (d, 1H) 5,13-5,25 (m, 2H) 3,88-4,01 (m, 7H) 3,69 (d, 1H) 3,32 (d, 1H) 3,19 (d, 1H) 2,81-2,95 (m, 4H) 1,95-2,14 (m, 4H) 1,78 (br. s., 2H) 1,47-1,67 (m, 9H) 1,43 (d, 3H) 1,27-1,40 (m, 2H).
Описание 117: метил 4-((S)-1-((R)-1-(4-фторбензил)пиперидин-2-карбоксамидо)этил) бензоат (D117)
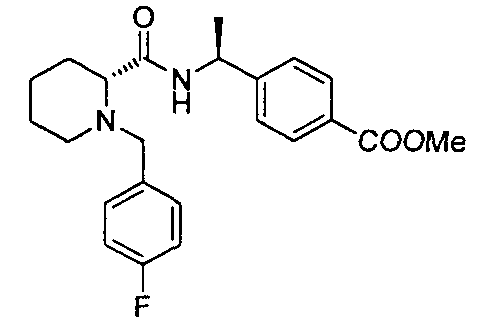
Титульное соединение (D117) (20 мг) получали в соответствии с в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-((S)-1-((R)-пиперидин-2-карбоксамидо)этил)бензоата (D86) (50 мг) и 4-фторбензил бромида (0,043 мл, 0,34 ммоль). (Na2CO3: 2,5 экв.; время реакции: 4 часа, 60°C)
MS: (ES/+) m/z: 399,3 [МН+] C23H27FN2O3 предусматривает 398,20
Хиральная ВЭЖХ [«Phenomenex Lux Cellulose-1»; Подвижная фаза: 80% н-гексан (0,1% DEA), В: 20% EtOH; DAD: 237 нм]: Время удерживания пика: 8,98 мин.
Описание 118: метил 4-((S)-1-((R)-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензоат (D118)
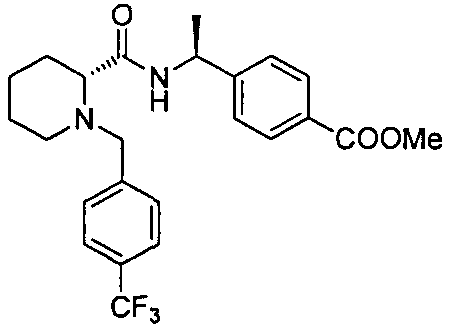
Титульное соединение (D118) (24 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-((S)-1-((R)-пиперидин-2-карбоксамидо)этил)бензоата (D86) (40 мг) и 4-(трифторметил)бензилбромида (0,032 мл). (Na2CO3: 2,5 экв.; время реакции: 4 часа, 60°C)
MS: (ES/+) m/z: 449,3 [MH+] C24H27F3N2O3 предусматривает 448,20
Описание 119: (R)-метил 4-(1-(1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил) бензоат (D119)
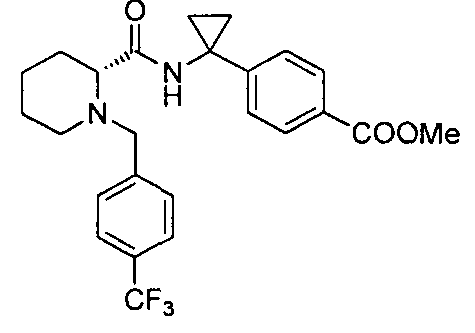
Титульное соединение (D119) (74 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с (R)-метил 4-(1-(пиперидин-2-карбоксамидо)циклопропил)бензоата (D87) (50 мг) и 4-(трифторметил)бензилбромида (0,039 мл). (Na2CO3: 2,5 экв.; время реакции: 6 часов, 60°C)
MS: (ES/+) m/z: 461,3 [МН+] C25H27F3N2O3 предусматривает 460,20
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,92 (d, J=8,1 Гц, 2H), 7,62 (d, J=7,8 Гц, 2H), 7,48-7,34 (m, 3H), 7,25 (d, J=8,2 Гц, 2H), 3,90 (s, 3H), 3,79 (d, J=14,4 Гц, 1Н), 3,27 (d, J=14,5 Гц, 1Н), 2,97-2,82 (m, 2H), 2,16-1,97 (m, 2H), 1,80 (d, J=12,7 Гц, 1Н), 1,64 (t, J=12,3 Гц, 2H), 1,49 (d, J=12,2 Гц, 1Н), 1,43-1,26 (m, 4H), 1,13 (t, J=7,2 Гц, 1Н)
Описание 120: (R)-метил 4-(1-(1-(4-хлорбензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (D120)
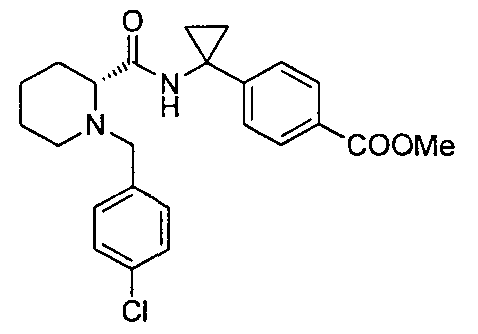
Титульное соединение (D120) (45 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с (R)-метил 4-(1-(пиперидин-2-карбоксамидо)циклопропил)бензоата (D87) (34 мг) и 4-(хлор)бензилбромида (35 мг). (Na2CO3: 4 экв.; Время реакции: 18 часов; 68°C)
MS: (ES/+) m/z: 427,3 [МН+] C24H27C1N2O3 предусматривает 426,17
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,93 (d, J=8,1 Гц, 2H), 7,40 (br. s., 1Н), 7,33 (d, J=8,1 Гц, 2H), 7,27-7,17 (m, 4H), 3,91 (s, 3H), 3,72 (d, J=14,1 Гц, 1Н), 3,18 (d, J=14,1 Гц, 1Н), 2,94-2,82 (m, 2H), 2,13-1,96 (m, 2H), 1,85-1,73 (m, 1Н), 1,63 (br. s., 2H), 1,50-1,44 (m, 1H), 1,43-1,27 (m, 4H), 1,15 (br. s., 1H).
Описание 121: (R)-метил 4-(1-(1-(4-цианобензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (D121)
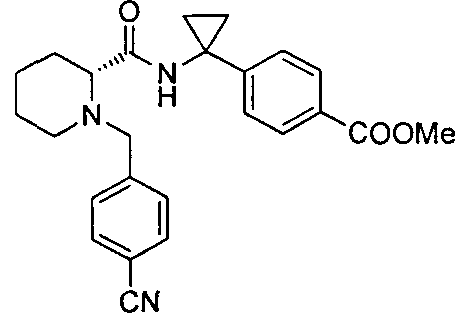
Титульное соединение (D121) (35 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с (R)-метил 4-(1-(пиперидин-2-карбоксамидо)-циклопропил)-бензоата (D87) (34 мг) и 4-цианобензилбромида (33 мг). (Na2CO3: 4 экв.; Время реакции: 18 часов; 68°C)
MS: (ES/+) m/z: 418,3 [МН+] C25H27N3O3 предусматривает 417,21
Описания 122а и 122b
метил 4-(1-(6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоат (энантиомер 1) (D122a) и
метил 4-(1-(6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоат (энантиомер 2) (D122b)
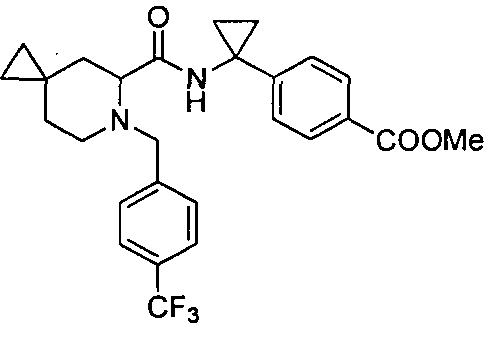
К раствору метилового эфира 4-(1-(6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоата (рацемическая смесь) (D88) (230 мг, 0,70 ммоль) в сухом MeCN (10 мл), добавляли друг за другом Na2CO3 (223 мг, 2,1 ммоль) и 4-(трифторметил)-бензилбромид (200 мг, 0,84 ммоль). Смесь нагревали при 68°C в течение 18 часов. Твердое вещество отфильтровывавали, MeCN упаривали и очищали остаток с помощью картриджа «SPE-Si» (10 г), элюируя смесью DCM/EtOAc от 100/0 до 90/10. Собранные фракции после упаривания растворителя давали 250 мг рацемической смеси, которая была подвергнута разделению хиральной ВЭЖХ (Условия препаративной хроматографии: Колонка: «DAICEL AD-H»; Подвижная фаза: н-гексан/EtOH/DEA 60%/40%/0,1% об/V; Расход 10 мл/мин; DAD: 246 нм). Собранные фракции, после упаривания растворителя из отделенных фракций, давали два энантиомерных соединения (D122a) (83,1 мг) и (D122b) (98,9 мг).
(D122a) (энантиомер 1) время удерживания: 8,15 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,92 (d, J=8,1 Гц, 2H), 7,63 (d, J=7,8 Гц, 2H), 7,47-7,37 (m, 3H), 7,25 (d, J=8,2 Гц, 2H), 3,90 (s, 3H), 3,84 (d, J=14,4 Гц, 1Н), 3,35 (d, J=14,4 Гц, 1Н), 3,09-3,00 (m, 1Н), 2,88 (br. s., 1Н), 2,26 (br. s., 1Н), 2,02 (br. s., 1Н), 1,89-1,78 (m, 1Н), 1,45-1,29 (m, 4H), 1,13 (br. s., 1Н), 0,99 (br. s., 1Н), 0,49-0,35 (m, 3H), 0,30 (d, J=6,6 Гц, 1Н).
(D122b) (энантиомер 2) время удерживания: 11,12 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,92 (d, J=8,1 Гц, 2H), 7,62 (d, J=7,8 Гц, 2H), 7,48-7,39 (m, 3H), 7,25 (d, J=8,2 Гц, 2H), 3,90 (s, 3H), 3,84 (d, J=14,4 Гц, 1Н), 3,35 (d, J=14,4 Гц, 1Н), 3,05 (dd, J=3,1, 10,1 Гц, 1Н), 2,89 (d, J=11,5 Гц, 1Н), 2,26 (br. s., 1Н), 2,02 (t, J=11,7 Гц, 1Н), 1,83 (br. s., 1Н), 1,44-1,27 (m, 4H), 1,13 (t, J=7,0 Гц, 1Н), 0,97 (d, J=13,0 Гц, 1Н), 0,49-0,35 (m, 3H), 0,30 (d, J=6,7 Гц, 1Н).
Описание 123: метил 4-(1-(6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоат (одиночный неизвестный энантиомер) (D123)
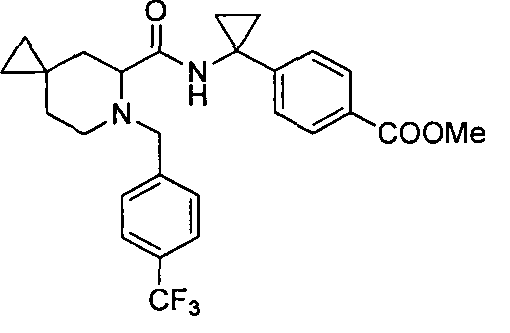
К раствору метилового эфира 4-(1-(6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензойной кислоты 2,2,2-трифторацетат (D89) (27 г, 61,03 ммоль) в сухом MeCN (900 мл) последовательно добавляли Cs2CO3 (39,7 г, 122,05 ммоль) и раствор 4-(трифторметил)-бензилбромида (14,6 г, 61,03 ммоль) в MeCN (50 мл). Смесь перемешивали при комнатной температуре в течение 18 часов. Твердое вещество отфильтровывали и упаривали растворители. Остаток снова растворяли в DCM (200 мл) и промывали H2O (3×100 мл) и насыщ. р-ром NaCl (50 мл). Органические фазы сушили над Na2S04 и упаривали с получением белого твердого вещества, которое растирали в циклогексане с получением титульного соединения (D123) (19,7 г).
MS: (ES/+) m/z: 488,2 [МН+] C27H29F3N2O3 предусматривает 486,21
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,79-8,69 (m, 1Н), 7,87-7,76 (m, 2H), 7,68 (s, 2H), 7,64 (s, 2H), 7,28-7,17 (m, 2H), 3,89-3,71 (m, 4H), 3,28-3,22 (m, 1Н), 2,98-2,88 (m, 1Н), 2,79-2,69 (m, 1Н), 2,16-1,99 (m, 2H), 1,85-1,71 (m, 1Н), 1,35-1,09 (m, 5H), 0,92-0,83 (m, 1Н), 0,43-0,20 (m, 4H).
Описание 124: метил 4-(1-(6-((6-(трифторметил)пиридин-3-ил)метил)-6-азаспиро[2,5]октан-5-карбоксамидо)циклопропил)бензоат (одиночный неизвестный энантиомер) (D124)
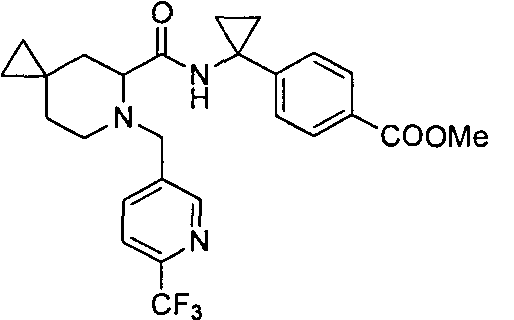
Титульное соединение (D124) (47 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-(1-(6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоата (D90) (50 мг) и 3-хлорметил-6-(трифторметил) пиридина (38 мг). (Cs2CO3: 1,3 экв.; Время реакции: 18 часов; RT)
MS: (ES/+) m/z: 488,2 [МН+] C26H28F3N3O3 предусматривает 487,21
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,68 (s, 1Н), 7,91 (d, J=8,1 Гц, 2H), 7,77 (d, J=7,8 Гц, 1Н), 7,67 (d, J=7,9 Гц, 1Н), 7,33 (br. s., 1Н), 7,29-7,24 (m, 2H), 3,89 (s, 3H), 3,84 (d, J=14,5 Гц, 1Н), 3,38 (d, J=14,4 Гц, 1Н), 3,05 (dd, J=2,8, 10,0 Гц, 1Н), 2,84 (d, J=11,4 Гц, 1Н), 2,26 (t, J=10,5 Гц, 1Н), 2,05-1,95 (m, 1Н), 1,81 (t, J=10,9 Гц, 1Н), 1,45-1,24 (m, 4H), 1,22-1,13 (m, 1Н), 0,97 (d, J=13,1 Гц, 1Н), 0,51-0,33 (m, 3H), 0,30 (d, J=5,1 Гц, 1Н).
Описание 125: метил 4-(1-(6-(3-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоат (одиночный неизвестный энантиомер) (D125)
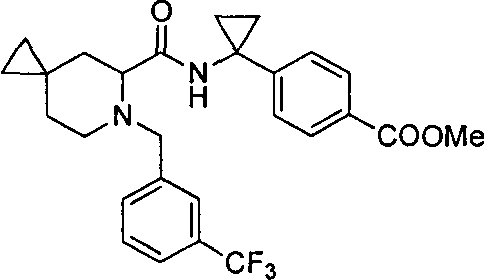
Титульное соединение (D125) (60,7 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-(1-(6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензойной кислоты 2,2,2-трифторацетата (одиночный неизвестный энантиомер) (D90) (50 мг, 0,11 ммоль) и 3-(трифторметил) бензилбромида (0,020 мл, 0,12 ммоль). (Cs2CO3: 2 экв.; Время реакции: 4 часа; температура реакции: RT.
MS: (ES/+) m/z: 487,6 [MH+] C27H29F3N2O3 предусматривает 486,21
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,88-8,70 (m, 1Н), 7,86-7,78 (m, 2H), 7,77-7,68 (m, 2H), 7,65-7,56 (m, 2H), 7,29-7,19 (m, 2H), 3,82 (s, 3H), 3,81-3,75 (m, 1H), 3,29-3,24 (m, 1H), 2,96-2,88 (m, 1H), 2,79-2,70 (m, 1H), 2,18-1,97 (m, 2H), 1,82-1,69 (m, 1H), 1,33-1,22 (m, 2H), 1,22-1,08 (m, 3H), 0,94-0,84 (m, 1H), 0,44-0,19 (m, 4H).
Описание 126: метил 4-((1S)-1-(6-(4-фторбензил)-6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D126)
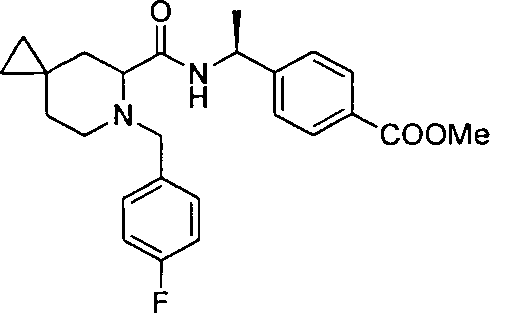
Титульное соединение (D126) (30 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-((1S)-1-(6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензоата (D91) (60 мг) и 4-фторбензилбромида (0,074 мл). (Na2CO3: 2,5 экв.; время реакции: 4 часа, 60°C)
MS: (ES/+) m/z: 425,3 [МН+] C25H29FN2O3 предусматривает 424,22
Хиральная ВЭЖХ [«Phenomenex Lux Cellulose-2»; Подвижная фаза: 80% н-гексан (0,1% DEA), В: 20% IPA; DAD: 237 нм]: Время удерживания пика 1 19,73 мин. Время удерживания пика 2 21,35 мин.
Описания 127а и 127b:
4-((1S)-1-(6-(4-фторбензил)-6-азаспиро[2,5]октан-5-карбоксамидо)этил) бензойная кислота (диастереоизомер 1) (D127a) и
4-((1S)-1-(6-(4-фторбензил)-6-азаспиро[2,5]октан-5-карбоксамидо)этил)-бензойная кислота (диастереоизомер 2) (D127b)
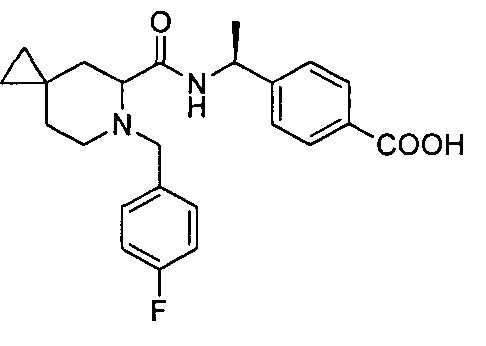
К раствору метил 4-((1S)-1-(6-(4-фторбензил)-6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензоата (D126) (80 мг, 0,19 ммоль) в смеси H2O/диоксана (1/2 мл) добавляли LiOH H2O (11,8 мг, 0,28 ммоль) и перемешивали полученную смесь в течение 8 часов перед выпариванием диоксана. Водный раствор загружали на колонку «С18» (10 г). Собранные метанольные фракции после упаривания растворителя, давали 80 мг смеси диастереоизомеров, которую подвергали разделению хиральной ВЭЖХ (Условия препаративной хроматографии: Колонка: «Phenomenex Lux-1»; Подвижная фаза: н-гексан/EtOH/TFA 65%/35%/0,5% об./об.; Расход 10 мл/мин; DAD: 235 нм). Собранные фракции, после упаривания растворителя давали два отдельных пика, каждый из которых упаривали в вакууме, вновь растворяли в H2O/MeOH (5/1 мл), подщелачивали до pH 8 с ~ NaHCO3 и наносили на колонку «SPE-C18» (10 г). Метанольные фазы упаривали и полученный остаток фильтровали на колонке «SPE-Si» (1 г) с элюированием смесью DCM/MeOH 90/10. Собранные фракции после упаривания растворителя из отделенных фракций давали два диастереоизомера (D127a) (23 мг) и (D127b) (13 мг).
(D127a) (диастереоизомер 1): время удерживания: 6,7 мин
MS: (ES/+) m/z: 411,3 [МН+] C24H27FN2O3 предусматривает 410,20
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,99 (d, J=8,0 Гц, 2H), 7,46 (d, J=8,0 Гц, 2H), 7,40-7,31 (m, 2H), 7,05 (t, J=8,5 Гц, 2H), 5,16-5,05 (m, 1Н), 3,87 (d, J=13,1 Гц, 1Н), 3,37 (m, 1Н), 3,16-3,07 (m, 1Н), 3,01-2,91 (m, 1Н), 2,40-2,28 (m, 1Н), 2,22-2,09 (m, 1Н), 2,03-1,90 (m, 1Н), 1,49 (d, J=7,0 Гц, 3H), 1,19-1,13 (m, 1Н), 0,97-0,87 (m, 1H), 0,39 (d, J=5,1 Гц, 4H).
(D127b) (диастереоизомер 2): время удерживания 14,42 мин
MS: (ES/+) m/z: 411,3 [MH+] C24H27FN2O3 предусматривает 410,20
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,92 (d, J=8,0 Гц, 2H), 7,48-7,28 (m, 4H), 7,05 (t, J=8,5 Гц, 2H), 5,15 (m, 1Н), 3,86 (d, J=13,2 Гц, 1Н), 3,37 (1H, under solvent), 3,20-3,07 (d, J=8,6 Гц, 1Н), 2,96 (d, J=11,4 Гц, 1Н), 2,33 (m, 1H), 2,11 (m, 1H), 1,96 (br. s., 1H), 1,53 (d, J=6,9 Гц, 3H), 1,20-1,10 (m, 1H), 0,91 (d, J=12,8 Гц, 1H), 0,48-0,24 (m, 4H).
Описания 128: 4-((1S)-1-(6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензойная кислота (одиночный неизвестный диастереоизомер) (D128)

4-((1S)-1-(6-(4-фторбензил)-6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензойную кислоту (одиночный неизвестный диастереоизомер) (D127a) (14 мг, 0,034 ммоль) растворяли в EtOH (3 мл) до добавления Pd/C 10% (18 мг, 0,017 ммоль) и формиата аммония (6,5 мг, 0,102 ммоль). Гетерогенный раствор перемешивали при RT в течение 24 ч. Затем катализатор отфильтровывывали, и упаривали растворитель в вакууме с получением титульного соединения (D128) (10 мг).
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,87 (d, J=7,9 Гц, 2H), 7,36 (d, J=7,9 Гц, 2H), 5,12-4,99 (m, 1H), 4,00-3,89 (m, 1H), 3,45-3,35 (m, 1H), 3,26-3,04 (m, 1H), 2,26 -2,08 (m, 2H), 1,55-1,40 (m, J=6,7 Гц, 4H), 1,32 (d, J=6,8 Гц, 1H), 1,16-1,04 (m, 1H), 0,69-0,22 (m, 4H).
Описания 129: 4-(трифторметил) бензил 4-((1S)-1-(6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)этил)-бензоат (одиночный неизвестный диастереоизомер) (D129)
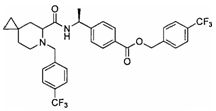
К раствору 4-((1S)-1-(6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензойной кислоты (D128) (10 мг, 33,1 µмоль) в сухом MeCN, последовательно добавляли Na2CO3 (17,5 мг, 165,4 µмоль) и 4-(трифторметил)-бензилбромид (24 мг, 99,2 µмоль). Смесь нагревали при 68°C в течение 18 часов. Твердое вещество отфильтровывали, MeCN упаривали и очищали остаток на колонке «Biotage SNAP-Si» (10 г), элюируя смесью DCM/EtOAc от 100/0 до 80/20. Собранные фракции после упаривания растворителя давали титульные соединения (D129) (14,8 мг).
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,08 (d, J=8,0 Гц, 2H), 7,66 (dd, J=8,0, 14,4 Гц, 4H), 7,58 (d, J=7,9 Гц, 2H), 7,47 (d, J=7,8 Гц, 2H), 7,39 (d, J=7,9 Гц, 2H), 7,05 (d, J=7,7 Гц, 1Н), 5,23-5,11 (m, 1Н), 4,00 (d, J=14,4 Гц, 1Н), 3,37 (d, J=14,4 Гц, 1Н), 3,06 (dd, J=3,1, 10,6 Гц, 1Н), 2,89 (d, J=11,4 Гц, 1Н), 2,31-2,18 (m, 1Н), 2,01-1,80 (m, 2H), 1,59-1,54 (m, 1Н), 1,43 (d, J=6,8 Гц, 3H), 0,90 (d, J=12,9 Гц, 1Н), 0,44-0,33 (m, 3H), 0,28 (d, J=6,8 Гц, 1Н).
Описание 130: метил 4-((1S)-1-(3-метил-6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D130)
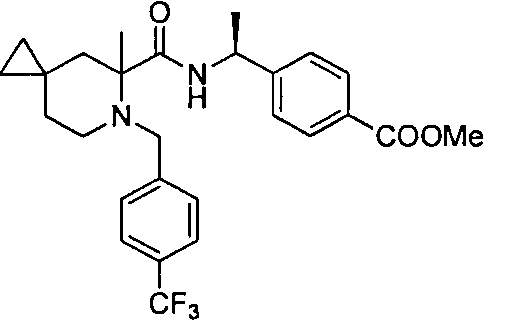
Титульное соединение (D130) (19 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-((1S)-1-(5-метил-6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензоата (D92) (16 мг) и 4-(трифторметил) бензилбромида (0,011 мл). (Na2CO3: 3 экв.; Время реакции: 18 часов; 68°C)
MS: (ES/+) m/z: 489 [МН+] C27H31F3N2O3 предусматривает 488,23
Описания 131а и 131b:
метил 4-(1-(4,4-диметил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (энантиомер 1) (D131a) и
метил 4-(1-(4,4-диметил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (энантиомер 2) (D131b)
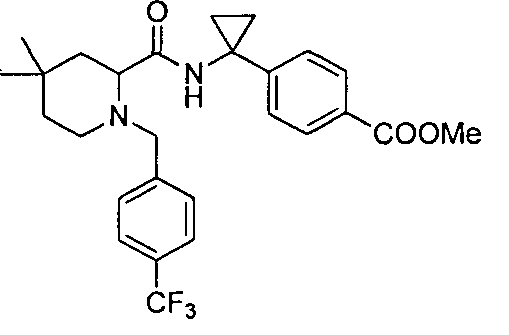
К раствору метил 4-(1-(4,4-диметилпиперидин-2-карбоксамидо)-циклопропил)-бензоата (рацемическая смесь) (D93) (190 мг, 057 ммоль) в сухом MeCN (5 мл), последовательно добавляли Cs2CO3 (606 мг, 1,8 ммоль) и 4-(трифторметил)-бензилбромид (0,115 мл, 0,74 ммоль) и перемешивали смесь при RT в течение 18 часов. Твердое вещество отфильтровывали, MeCN упаривали и остаток очищали с помощью картриджа «SPE-Si» (10 г), элюируя смесью DCM/EtOAc от 100/0 до 95/5. Собранные фракции после упаривания растворителя давали 236 мг рацемической смеси, которая была подвергнута разделению хиральной ВЭЖХ (Условия препаративной хроматографии: Колонка: «DAICEL AD-H»; Подвижная фаза: н-гексан/ETOH/DEA 80%/20%/0,1% об/V; Расход 10 мл/мин; DAD: 246 нм). Собранные фракции, после упаривания растворителя, давали два энантиомерных соединения (D131a) (147 мг) и (D131b) (141 мг).
(D131a) (энантиомер 1): время удерживания: 11,43 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,92 (d, J=8,2 Гц, 2H), 7,61 (d, J=7,9 Гц, 2H), 7,39 (d, J=7,8 Гц, 2H), 7,34 (br. s., 1Н), 7,25 (d, J=8,3 Гц, 2H), 3,90 (s, 3H), 3,80 (d, J=14,4 Гц, 1Н), 3,26 (d, J=14,4 Гц, 1Н), 3,07 (d, J=9,2 Гц, 1Н), 2,71 (d, J=11,8 Гц, 1Н), 2,21 t, 1Н), 1,79 (d, J=13,1 Гц, 1Н), 1,46 (t, J=12,5 Гц, 2H), 1,40-1,24 (m, 4H), 1,12 (d, J=7,0 Гц, 1Н), 0,99 (d, J=10,0 Гц, 6H).
(D131b) (энантиомер 2); время удерживания: 16,66 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,92 (d, J=8,1 Гц, 2H), 7,61 (d, J=7,8 Гц, 2H), 7,39 (d, J=7,8 Гц, 2H), 7,34 (br. s., 1Н), 7,25 (d, J=8,4 Гц, 2H), 3,90 (s, 3H), 3,80 (d, J=14,5 Гц, 1Н), 3,26 (d, J=14,5 Гц, 1Н), 3,07 (d, J=9,1 Гц, 1Н), 2,70 (br. d, J=1,0 Гц, 1Н), 2,21 (t, J=1,0 Гц, 1Н), 1,78 (d, J=1,0 Гц, 1Н), 1,46 (t, J=12,5 Гц, 2H), 1,40-1,24 (m, 4H), 1,17-1,08 (m, 1Н), 0,99 (d, J=9,9 Гц, 6H).
Описания 132а, 132b:
метил 4-((1S)-1-(4,4-диметил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)-бензоат (диастереоизомер 1) (D132a) и
метил 4-((1S)-1-(4,4-диметил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)-бензоат (диастереоизомер 2) (D132b)
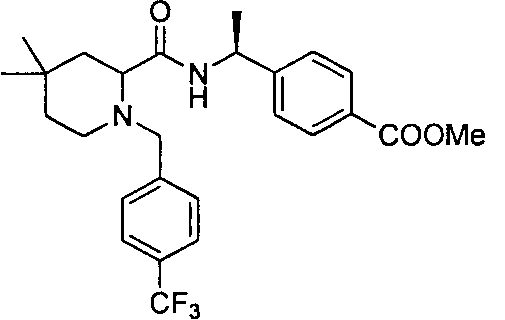
К раствору метил 4-((1S)-1-(4,4-диметилпиперидин-2-карбоксамидо)этил)-бензоата (смесь диастереоизомеров) (D94) (150 мг, 047 ммоль) в сухом MeCN (5 мл), добавляли последовательно Cs2CO3 (462 мг, 1,4 ммоль) и 4-(трифторметил)-бензилбромид (0,08 мл, 0,56 ммоль) и смесь перемешивали при комнатной температуре в течение 18 часов. Твердое вещество отфильтровывали, MeCN упаривали и остаток очищали с помощью картриджа «SPE-Si» (10 г), элюируя смесью DCM/EtOAc от 100/0 до 95/5. Собранные фракции после упаривания растворителя давали 140 мг смеси диастереомеров, которая была подвергнута разделению хиральной ВЭЖХ (Условия препаративной хроматографии: Колонка: DAICEL AD-H; Подвижная фаза: н-гексан/EtOH/DEA 80%/20%/0,1% об/V; Расход 10 мл/мин; DAD: 246 нм). Собранные фракции, после упаривания растворителя из отделенных фракций давали два диастереоизомерных соединения (D132a) (71 мг) и (D132b) (68 мг).
(D132a) (диастереоизомер 1): время удерживания: 8,95 мин
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,83 (d, J=8,0 Гц, 2H), 7,48 (d, J=7,9 Гц, 2H), 7,25 (d, J=8,1 Гц, 2H), 7,16 (d, J=7,8 Гц, 2H), 6,97-6,87 (m, 1Н), 5,26-5,13 (m, 1Н), 3,90 (s, 3H), 3,75-3,65 (m, 1Н), 3,23-3,12 (m, 1Н), 3,09-3,01 (m, 1Н), 2,74-2,63 (m, 1Н), 2,25-2,12 (m, 1Н), 1,85-1,74 (m, 1Н), 1,54-1,38 (m, 5H), 1,37-1,28 (m, 1H), 0,98 (d, J=9,8 Гц, 6H).
(D132b) (диастереоизомер 2): время удерживания: 17,94 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,05 (d, J=8,1 Гц, 2H), 7,63 (d, J=7,9 Гц, 2H), 7,45 (d, J=7,8 Гц, 2H), 7,37 (d, J=8,1 Гц, 2H), 6,98 (d, J=7,9 Гц, 1Н), 5,17 (t, J=7,2 Гц, 1Н), 4,07-3,81 (m, 4H), 3,31 (d, J=14,4 Гц, 1H), 3,09 (dd, J=2,7, 11,7 Гц, 1H), 2,72 (d, J=11,8 Гц, 1H), 2,23 (br. s., 1H), 1,72 (d, J=13,1 Гц, 1H), 1,51-1,25 (m, 6H), 0,96 (s, 6H).
Описание 133: метил 4-((1S)-1-((2R)-4-фтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D133)
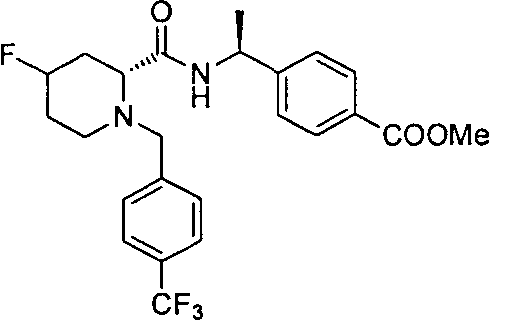
Титульное соединение (D133) (62 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-((1S)-1-((2R)-4-фторпиперидин-2-карбоксамидо)этил)бензоата (D95) (75 мг) и 4-(трифторметил)-бензилбромида (0,045 мл). (Cs2CO3: 1,3 экв.; Время реакции: 18 часов; RT).
MS: (ES/+) m/z: 467,0 [МН+] C24H26F4N2O3 предусматривает 466,19.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,03 (d, J=7,4 Гц, 2H), 7,63 (d, J=7,3 Гц, 2H), 7,44 (d, J=7,7 Гц, 2H), 7,36 (d, J=7,9 Гц, 2H), 6,98 (d, J=6,2 Гц, 1Н), 5,17 (t, J=7,1 Гц, 1Н), 4,99-4,72 (m, 1Н), 4,03-3,86 (m, 4H), 3,41 (d, J=14,1 Гц, 1Н), 3,30 (d, J=8,0 Гц, 1Н), 2,71 (d, J=12,2 Гц, 1Н), 2,50 (t, J=11,3 Гц, 1Н), 2,22 (br. s., 1Н), 1,97-1,63 (m, 3H), 1,45 (d, J=6,7 Гц, 3H).
Описание 134: метил 4-(1-((2R)-4-фтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (смесь диастереоизомеров) (D134)
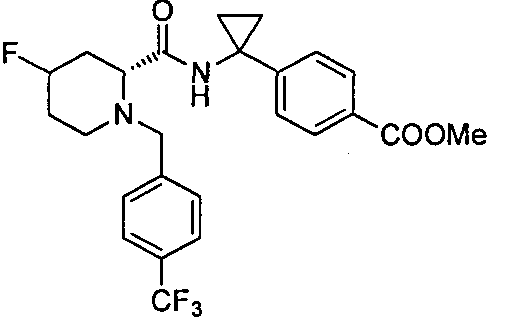
Титульное соединение (D134) (26 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-(1-((2R)-4-фторпиперидин-2-карбоксамидо)циклопропил)бензоата (D96) (39 мг) и 4-(трифторметил)-бензилбромида (0,015 мл). (Cs2CO3: 1,3 экв.; Время реакции: 18 часов; RT).
MS: (ES/+) m/z: 479,2 [MH+] C25H26F4N2O3 предусматривает 478,19
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,93 (d, J=8,1 Гц, 2H), 7,63 (d, J=7,8 Гц, 2H), 7,42 (d, J=7,8 Гц, 2H), 7,33 (br. s., 1Н), 7,25 (br. s., 2H), 5,03-4,75 (m, 1H), 3,91 (s, 3H), 3,82 (d, J=14,2 Гц, 1H), 3,39 (d, J=14,2 Гц, 1H), 3,29 (dd, J=3,1, 9,8 Гц, 1H), 2,78-2,66 (m, 1H), 2,57-2,45 (m, 1H), 2,27 (br. s., 1H), 2,01-1,68 (m, 3H), 1,41-1,27 (m, 3H), 1,22-1,12 (m, 1H).
Описание 135: метил 4-((S)-1-((R)-4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензоат (одиночный диастереомер) (D135)
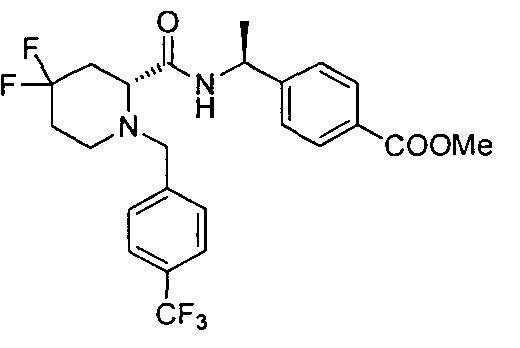
К раствору метил 4-((S)-1-((R)-4,4-дифторпиперидин-2-карбоксамидо)этил)бензоата (D97) (66 мг, 0,20 ммоль) в сухом MeCN (4 мл), добавляли последовательно Cs2CO3 (198 мг, 0,60 ммоль) и 4-(трифторметил) бензилбромид (0,037 мл, 0,24 ммоль) и перемешивали полученную смесь при RT в течение 18 часов. Твердое вещество отфильтровывали, упаривали ацетонитрил и очищали сырой продукт флэш-хроматографией «SNAP HP_SiO2» (10 г) с элюированием градиентом DCM/EtOAc от 100/0 до 90/10. Собранные фракции после упаривания растворителя очищали на обращенно-фазной колонке «GOLD-C18» (15 г) с элюированием градиентом H2O/MeCN (содержащей 0,1% уксусной кислоты) от 10/90 до 80/20. Собранные фракции после упаривания растворителя давали титульное соединение (D135) (20 мг).
MS: (ES/+) m/z: 485.5 [МН+] C24H25F5N203 предусматривает 484,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,03 (d, J=8,1 Гц, 2H), 7,64 (d, J=7,9 Гц, 2H), 7,42 (d, J=7,8 Гц, 2H), 7,35 (d, J=8,0 Гц, 2H), 6,85 (d, J=7,9 Гц, 1Н), 5,19 (t, J=7,2 Гц, 1Н), 3,98 (d, J=14,4 Гц, 1Н), 3,95-3,89 (m, 3H), 3,39 (d, J=14,2 Гц, 1Н), 3,27 (dd, J=3,3, 10,6 Гц, 1Н), 2,94 (d, J=11,1 Гц, 1Н), 2,51-2,30 (m, 2H), 2,05-1,86 (m, 3H), 1,57-1,52 (m, J=6,8 Гц, 1Н), 1,48 (d, J=6,8 Гц, 3H).
Описание 136: (R)-метил 4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (одиночный энантиомер) (D136)
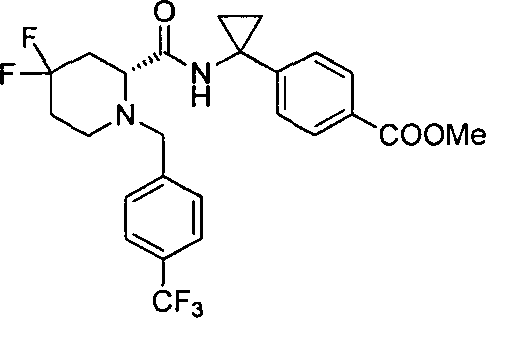
Титульное соединение (D136) (30 мг) получали в соответствии с общей процедурой, описанной в описании 135, начиная с (R)-метил 4-(1-(4,4-дифторпиперидин-2-карбоксамидо)циклопропил)бензоата (D98) (47 мг) и 4-(трифторметил)-бензилбромида (0,027 мл).
MS: (ES/+) m/z: 497,4 [МН+] C25H25F5N2O3 предусматривает 496,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,92 (d, J=8,2 Гц, 2H), 7,64 (d, J=7,8 Гц, 2H), 7,44-7,37 (m, 2H), 7,26 (d, J=8,6 Гц, 2H), 3,91 (s, 3H), 3,84 (d, J=14,2 Гц, 1Н), 3,38 (d, J=14,2 Гц, 1Н), 3,31-3,19 (m, 1H), 2,96 (d, J=11,4 Гц, 1Н), 2,54-2,33 (m, 2H), 2,25-2,11 (m, 1H), 2,02 (br. s., 1H), 1,98-1,85 (m, 1H), 1,43-1,31 (m, 3H), 1,24-1,14 (m, 1H).
Описания 137а и 137b:
метил 4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (энантиомер 1) (D137a) и
метил 4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (энантиомер 2) (D137b)
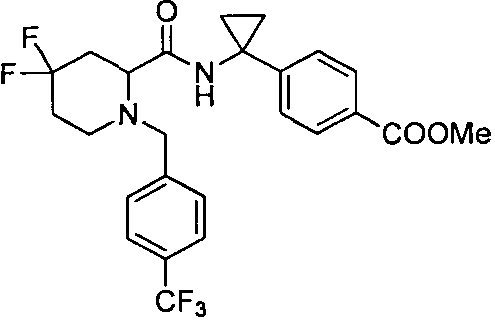
К раствору метил 4-(1-(4,4-дифторпипередин-2-карбоксамидо)циклопропил) бензоата (D99) (500 мг, 1,47 ммоль) в сухом MeCN (20 мл), добавляли последовательно Cs2CO3 (1,4 г, 4,43 ммоль) и 4-(трифторметил)-бензилбромид (0,27 мл, 1,77 ммоль) и перемешивали полученную смесь при RT в течение 12 часов. Твердое вещество отфильтровывали и растворитель упаривали с получением остатка, который загружали в картридж «Biotage SNAP-Si» (25 г), элюируя смесью сНех/EtOAc от 90/10 до 70/30. Собранные фракции после упаривания растворителя давали 490 мг рацемической смеси, которая была подвергнута разделению хиральной ВЭЖХ (Условия препаративной хроматографии: Колонка: «DAICEL IC»; Подвижная фаза: н-гептан/IPA/DEA 60%/40%/0,1% об./об. Скорость потока 10 мл/мин; DAD: 248 нм). Собранные фракции, после испарения растворителя из отделенных фракций давали два энантиомерных соединения (D137a) (143 мг) и (D137b) (130 мг).
(D137a) (энантиомер 1); время удерживания: 10,86 мин.
MS: (ES/+) m/z: 497,4 [МН+] C25H25F5N2O3 предусматривает 496,18
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,97 (s, 1H), 7,86-7,77 (m, J=8,3 Гц, 2H), 7,74-7,67 (m, J=7,8 Гц, 2H), 7,65-7,55 (m, J=7,8 Гц, 2H), 7,27-7,17 (m, J=8,8 Гц, 2H), 3,87-3,77 (m, 4H), 3,39 (d, J=14,2 Гц, 1H), 3,22-3,12 (m, 1H), 2,86-2,76 (m, 1H), 2,33-2,15 (m, J=7,8 Гц, 3H), 2,00 (br. s., 2H), 1,31-1,13 (m, 4H).
(D137b) (энантиомер 2): время удерживания: 13,81 мин.
MS: (ES/+) m/z: 496,8 [MH+] C25H25F5N2O3 предусматривает 496,18
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,97 (s, 1Н), 7,81 (d, J=8,3 Гц, 2H), 7,76-7,66 (m, J=8,3 Гц, 2H), 7,66-7,56 (m, J=8,3 Гц, 2H), 7,23 (d, J=8,3 Гц, 2H), 3,86-3,74 (m, 4H), 3,39 (d, J=14,2 Гц, 1H), 3,20-3,14 (m, 1H), 2,82 (d, J=12,2 Гц, 1H), 2,35-2,16 (m, 3H), 2,07-1,81 (m, 2H), 1,34-1,13 (m, 4H)
Описания 138а и 138b:
метил 4-(1-(4,4-дифтор-1-(3-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (энантиомер 1) (D138a) и
метил 4-(1-(4,4-дифтор-1-(3-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (энантиомер 2) (D138b)
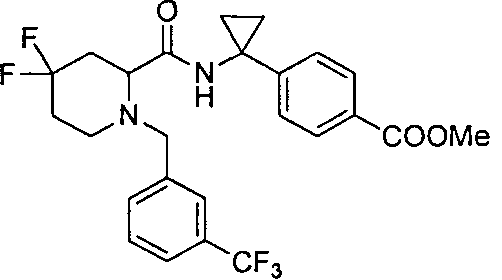
К раствору метил 4-(1-(4,4-дифторпипередин-2-карбоксамидо)циклопропил) бензоата (D99) (50 мг, 0,15 ммоль) в сухом MeCN (5 мл), добавляли последовательно Cs2CO3 (73 мг, 0,22 ммоль) и 3-(трифторметил)-бензилбромид (42 мг, 0,18 ммоль) и перемешивали полученную смесь при комнатной температуре в течение 12 часов. Твердое вещество отфильтровывали и растворитель упаривали с получением остатка, который загружали в картридж «Biotage SNAP-Si» (100 г) с элюированием смесью DCM/EtOAc от 100/0 до 90/10. Собранные фракции после испарения растворителя давали 83 мг рацемической смеси, которую подвергали разделению хиральной ВЭЖХ (Условия препаративной хроматографии: Колонка: DAICEL IC; Подвижная фаза: н-гептан/IPA/DEA 60%/40%/0,1% об/об; Расход 10 мл/мин; DAD: 248 нм). Собранные фракции, после упаривания растворителя из отделенных фракций, давали два энантиомерных соединения (D138a) (35 мг) и (D138b) (45 мг).
(D138a) (энантиомер 1): время удерживания: 10,18 мин
(D138b) (энантиомер 2); время удерживания: 15,06 мин
Описание 139:
метил 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)-циклопропил)-бензоат (рацемическая смесь) (D139)
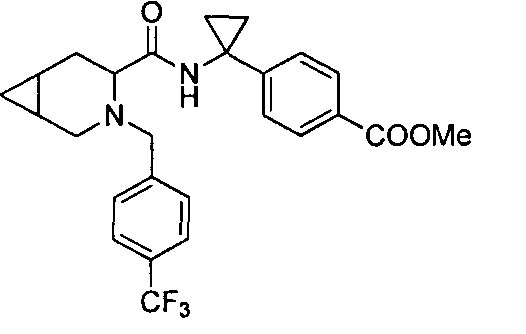
К раствору метил 4-(1-(3-азабицикло[4.1.0]гептан-4-карбоксамидо)-циклопропил)-бензойной кислоты (рацемическая смесь) (D100) (155 мг, 0,49 ммоль) в сухом MeCN (4 мл), добавляли последовательно Cs2CO3 (241 мг, 0,74 ммоль) и 4-(трифторметил)-бензилбромид (0,09 мл, 0,59 ммоль) и перемешивали полученную смесь при RT в течение 4 часов. Остаток, полученный после упаривания растворителя, загружали на колонку «Biotage SNAP-Si» (25 г) с элюированием смесью сНех/EtOAc от 65/35 до 40/60. Собранные фракции после упаривания растворителя дают титульное соединение (D139) (рацемическая смесь) (215 мг).
MS: (ES/+) m/z: 472,7 [МН+] C26H27F3N2O3 предусматривает 472,20
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,64 (s, 1H), 7,80 (d, J=8,3 Гц, 2H), 7,72-7,65 (m, J=7,8 Гц, 2H), 7,59 (d, J=7,8 Гц, 2H), 7,22-7,15 (m, J=8,3 Гц, 2H), 3,82 (s, 3H), 3,70 (d, J=13,7 Гц, 1Н), 3,56 (d, J=14,2 Гц, 1Н), 3,17 (dd, J=7,1, 12,5 Гц, 1Н), 2,99 (t, J=6,1 Гц, 1Н), 2,32 (dd, J=4,2, 12,5 Гц, 1Н), 2,18 (td, J=6,7, 13,9 Гц, 1Н), 1,68 (td, J=4,3, 9,0 Гц, 1Н), 1,30-1,20 (m, 2H), 1,20-1,08 (m, 2H), 1,08-0,90 (m, 2H), 0,67 (dt, J=4,2, 8,2 Гц, 1H), 0,22 (q, J=4,4 Гц, 1H)
Описания 140а и 140b:
метил 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензоат (энантиомер 1) (D140a) и
метил 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензоат (энантиомер 2) (D140b)
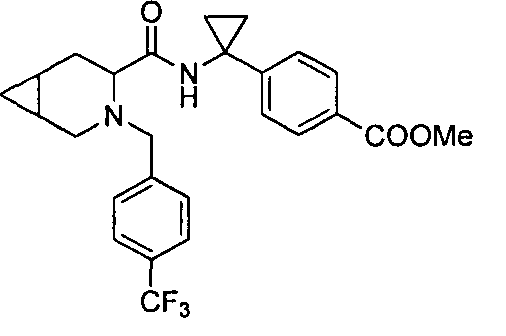
Метил 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензоат (рацемическая смесь) (189 мг) (D139) подвергали разделению хиральной ВЭЖХ (Условия препаративной хроматографии: Колонка: «DAICEL IC»; Подвижная фаза: н-гептан/IPA/DEA 60%/40%/0,1% об/об Расход 10 мл/мин; DAD: 248 нм). Собранные фракции, после упаривания растворителя из отделенных фракций давали два диастереоизомерных соединений (D140a) (78 мг) и (D140b) (82 мг).
(D140a) (энантиомер 1 с относительной стереохимией транс): время удерживания: 12,89 мин.
MS: (ES/+) m/z: 472,7 [MH+] C26H27F3N2O3 предусматривает 472,20
Хиральная ВЭЖХ: [DAICEL AD-H; Подвижная фаза: 70% н-гептан (+0,1% DEA), В: 30% IPA; DAD: 248 нм]: Время удерживания пика: 12,9 мин.
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,65 (s, 1Н), 7,80 (d, J=8,3 Гц, 2H), 7,72-7,65 (m, J=7,8 Гц, 2H), 7,62-7,56 (m, J=7,8 Гц, 2H), 7,19 (d, J=8,3 Гц, 2H), 3,82 (s, 3H), 3,70 (d, J=13,7 Гц, 1Н), 3,56 (d, J=14,2 Гц, 1Н), 3,17 (dd, J=7,1, 12,5 Гц, 1Н), 2,99 (t, J=6,1 Гц, 1Н), 2,32 (dd, J=4,2, 12,5 Гц, 1Н), 2,23-2,14 (m, 1H), 1,69 (br. s., 1H), 1,30-1,22 (m, 2H), 1,20-1,13 (m, 1H), 1,11 (dd, J=3,2, 6,1 Гц, 1Н), 1,05-0,93 (m, 2H), 0,70-0,64 (m, 1H), 0,22 (d, J=4,9 Гц, 1H).
(D140b) (энантиомер 2 с относительной стереохимией транс): время удерживания: 18,26 мин.
MS: (ES/+) m/z: 473,6 [MH+] C26H27F3N2O3 предусматривает 472,20
Хиральная ВЭЖХ: [DAICEL AD-H; Подвижная фаза: 60% н-гептан (+0,1% DEA), В: 40% IPA; DAD: 248 нм]: Время удерживания пика: 18,2 мин
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,65 (s, 1H), 7,83-7,77 (m, J=8,3 Гц, 2H), 7,71-7,64 (m, J=7,8 Гц, 2H), 7,62-7,54 (m, J=8,3 Гц, 2H), 7,22-7,14 (m, J=8,8 Гц, 2H), 3,82 (s, 3H), 3,70 (d, J=13,7 Гц, 1H), 3,56 (d, J=14,2 Гц, 1H), 3,17 (dd, J=7,1, 12,5 Гц, 1H), 2,99 (t, J=6,1 Гц, 1H), 2,32 (dd, J=4,2, 12,5 Гц, 1H), 2,23-2,11 (m, 1H), 1,68 (d, J=12,7 Гц, 1H), 1,30-1,21 (m, 2H), 1,16 (dd, J=4,2, 6,1 Гц, 1H), 1,11 (dd, J=3,2, 6,1 Гц, 1H), 1,05-0,92 (m, 2H), 0,68 (td, J=4,3, 8,1 Гц, 1H), 0,22 (d, J=4,9 Гц, 1H).
Описание 141: метил 4-(1-(3-(3-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензоат (D141)
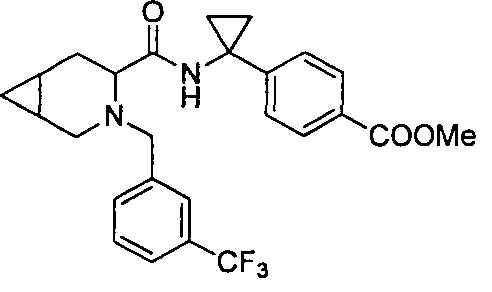
Титульное соединение (D141) (53 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-(1-(3-азабицикло[4.1.0]гептан-4-карбоксамидо)-циклопропил)-бензоата (смесь диастереоизомеров) (D100) (48 мг, 0,15 ммоль) и 3-(трифторметил)бензилбромида (0,040 мл, 0,17 ммоль). (Cs2CO3: 2 экв.; Время реакции: 4 часа; температура реакции: RT.
MS: (ES/+) m/z: 473 [MIT] C26H27F3N2O3 предусматривает 472,20
Описание 142: метил 4-(1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[4.1.0]гептан-3-карбоксамидо)циклопропил)бензоат (смесь диастереоизомеров) (D142)
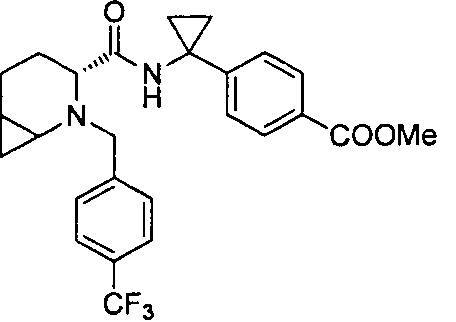
Титульное соединение (D142) (6,8 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-(1-((3R)-2-азабицикло[4.1.0]гептан-3-карбоксамидо)циклопропил)-бензоата (смесь диастереоизомеров) (D101) (17,5 мг) и 4-(трифторметил)-бензилбромида (0,01 мл). (Cs2CO3: 1,5 экв.; Время реакции: 20 часов; RT).
MS: (ES/+) m/z: 473,2 [МН+] C26H27F3N2O3 предусматривает 472,20
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,01-7,84 (m, J=8,3 Гц, 2H), 7,66-7,60 (m, J=8,8, 8,8 Гц, 2H), 7,57-7,39 (m, 3H), 7,28-7,09 (m, J=8,1 Гц, 2H), 4,03-3,65 (m, 5H), 3,13-2,81 (m, 1Н), 2,06 (m, 2H), 1,80-0,98 (8H, под остаточным растворителем), 0,71-0,24 (m, 2H).
Описание 143: метил 4-((1S)-1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[4.1.0]гептано-3-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D143)
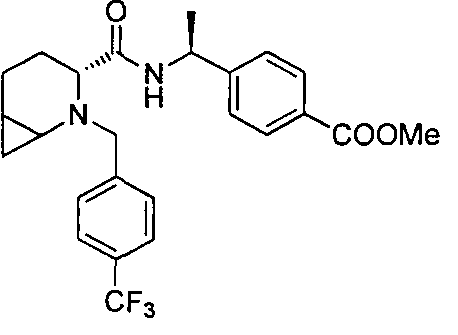
Титульное соединение (D143) (10 мг) получали в соответствии соответствии с общей методикой получения замещенных бензиламинов, начиная с метилового эфира 4-((1S)-1-((3R)-2-азабицикло[4.1.0]гептан-3-карбоксамидо)этил)бензоата (смесь диастереоизомеров) (D102) (20 мг) и 4-(трифторметил)-бензилбромида (0,012 мл). (Cs2CO3: 1,5 экв.; Время реакции: 20 часов; RT).
MS: (ES/+) m/z: 461,1 [МН+] C25H27F3N2O3 предусматривает 460,20
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,02 (d, J=7,0 Гц, 2H), 7,89-7,06 (m, 7H), 5,24-5,04 (m, 1Н), 4,19-3,69 (m, 5H), 3,13-2,76 (m, 1Н), 2,43-1,81 (m, 2H), 1,81-1,06 (7H под остаточным растворителем), 0,66-0,16 (m, 2H).
Описание 144: метил 4-((S)-1-((R)-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил) бензоат (D144)
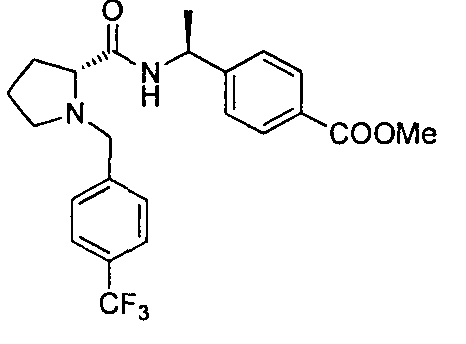
Титульное соединение (D144) (60 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-((S)-1-((R)-пирролидин-2-карбоксамидо)этил)бензоата (D103) (50 мг) и 4-(трифторметил)-бензилбромида (0,056 мл). (Na2CO3; время реакции: 5 часов, 70°C).
MS: (ES/+) m/z: 434,8 [MH+] C23H25F3N2O3 предусматривает 434,18
Хиральная ВЭЖХ [«Phenomenex Lux Cellulose-1»; Подвижная фаза: 70% н-гексан (0,1% DEA), В: 30% IPA; DAD: 235 нм]: Время удерживания пика: 10,50 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,07 (d, J=8,3 Гц, 1Н), 8,04-7,99 (m, J=7,8 Гц, 2H), 7,40-7,34 (m, J=8,3 Гц, 2H), 5,14 (quin, J=7,3 Гц, 1Н), 3,93 (s, 3H), 3,83 (dd, J=5,1, 9,0 Гц, 1Н), 3,06 (td, J=6,8, 10,3 Гц, 1Н), 2,92 (td, J=6,1, 10,3 Гц, 1Н), 2,22-2,10 (m, 1Н), 1,91 (qd, J=6,4, 12,7 Гц, 1Н), 1,77-1,67 (m, 2H), 1,51 (d, J=7,3 Гц, 3H).
Описание 145: метил 4-((S)-1-((R)-1-(4-фторбензил)пирролидин-2-карбоксамидо)этил) бензоат (D145)
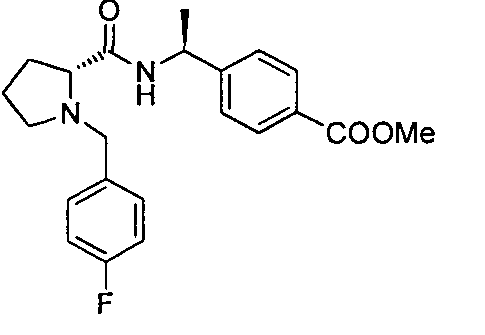
Титульное соединение (D145) (22 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-((S)-1-((R)-пирролидин-2-карбоксамидо)этил)бензоата (D103) (50 мг) и 4-фторбензилбромида (0,045 мл). (Na2CO3; время реакции: 5 часов, 70°C).
MS: (ES/+) m/z: 385 [MH+] C22H25FN2O3 предусматривает 384,18
Хиральная ВЭЖХ [«Phenomenex Lux Cellulose-1»; Подвижная фаза: 80% н-гексан (0,1% DEA), В: 20% IPA; DAD: 235 нм]: Время удерживания пика 14,18 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,02 (d, J=7,8 Гц, 2H), 7,64 (d, J=7,8 Гц, 1Н), 7,34 (d, J=8,3 Гц, 2H), 7,28-7,24 (m, 2H), 7,10-7,02 (m, 2H), 5,15-5,05 (m, 1H), 3,93 (s, 3H), 3,85 (d, J=13,2 Гц, 1H), 3,58 (d, J=12,7 Гц, 1H), 3,25 (dd, J=4,6, 10,5 Гц, 1H), 3,08 (br. s., 1H), 2,43 (d, J=5,9 Гц, 1H), 2,29-2,16 (m, 1H), 1,84 (d, J=10,8 Гц, 2H), 1,74-1,61 (m, 1H), 1,42 (d, J=6,8 Гц, 3H)
Описание 146: метил 4-(1-((3R)-2-(3-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензоат (D146)
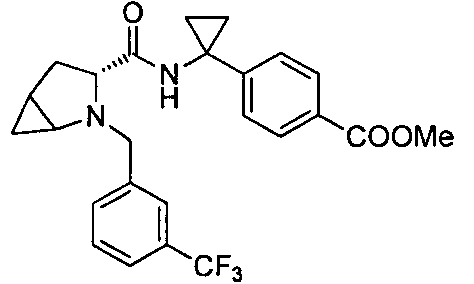
Титульное соединение (D146) (67 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-(1-((3R)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензоата (D104) (37 мг, 0,12 ммоль) и 3-(трифторметил)бензилбромида (0,029 мл, 0,19 ммоль). (Cs2CO3: 2 экв.; Время реакции: 6 часов; температура реакции: RT.
MS: (ES/+) m/z: 459 [MH+] C25H25F3N2O3 предусматривает 458,18
Описание 147: метил 4-(1-((1R,3R,5R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензоат (син диастереоизомер) (D147)
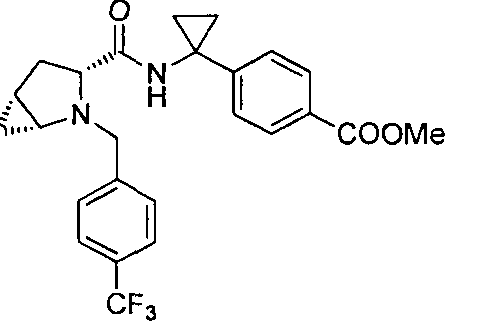
К раствору метил 4-(1-((1R,3R,5R)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензоата (D104) (1,7 г, 5,7 ммоль) в MeCN (80 мл) добавляли Cs2CO3 (2,8 г, 8,5 ммоль) и 4-(трифторметил)бензилбромид (1,6 г, 6,8 ммоль) и перемешивали полученную смесь при RT в течение 4 часов. Растворитель упаривали и наносили остаток на картридж «SNAP-Si» (100 г), элюируя смесью DCM/AcOEt от 10/0 до DCM/AcOEt 9/1. Собранные фракции после упаривания растворителя давали титульное соединение (D147) (2,41 г).
MS: (ES/+) m/z: 459 [МН+] C25H25F3N2O3 предусматривает 458,18
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,35 (s, 1H), 7,81-7,74 (m, 4H), 7,73-7,68 (m, 2H), 7,03 (d, J=8,3 Гц, 2H), 4,04-3,97 (m, 1H), 3,86-3,75 (m, 4H), 3,54 (dd, J=2,2, 10,0 Гц, 1H), 2,77-2,69 (m, 1H), 2,25-2,12 (m, 1H), 2,05-1,95 (m, 1H), 1,49-1,26 (m, 2H), 1,22-1,04 (m, 3H), 0,47 (q, J=7,0 Гц, 1H), 0,22-0,14 (m, 1H).
Описание 148: метил 4-(1-((1S,3R,5R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензоат (анти диастереоизомер) (D148)
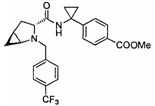
Титульное соединение (D148) (100,8 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-(1-((1S,3R,5S)-2-азабицикло[3,1,0]гексан-3-карбоксамидо)-циклопропил)-бензоата (транс диастереоизомер) (D105) (71,9 мг) и 4-(трифторметил)-бензилбромида (0,047 мл). (Na2CO3: 3 экв.; Время реакции: 18 часов; 68°C)
MS: (ES/+) m/z: 459,4 [МН+] C25H25F3N203 предусматривает 458,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,96 (d, J=8,3 Гц, 2H), 7,85-7,72 (m, 1H), 7,65 (d, J=7,8 Гц, 2H), 7,48 (d, J=7,5 Гц, 2H), 7,26 (d, J=8,3 Гц, 2H), 3,91 (s, 3H), 3,82-3,71 (m, 1Н), 3,62-3,47 (m, 1H), 2,98-2,85 (m, 1H), 2,76-2,64 (m, 1H), 2,59-2,46 (m, 1H), 2,06-1,91 (m, 1H), 1,53-1,44 (m, 1H), 1,38 (br. s., 1H), 1,34-1,13 (m, 3H), 0,64 (br. s., 1H), 0,32-0,19 (m, 1H).
Описание 149: метил 4-((1S)-1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D149)
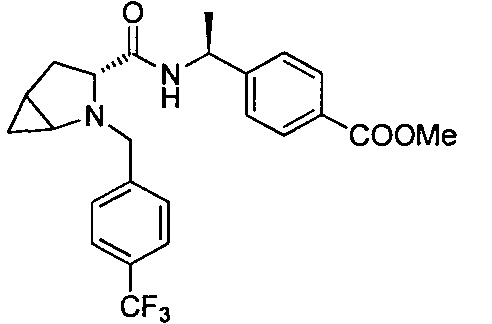
Титульные соединения (D149) (14 мг) получали в соответствии соответствии с общей методикой получения замещенных бензиламинов, начиная с метил 4-((1S)-1-((3R)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)этил)бензоата (D106) (11 мг) и 4-(трифторметил)-бензилбромида (0,007 мл). (Na2CO3: 3 экв.; Время реакции: 18 часов; 68°C)
MS: (ES/+) m/z: 447,4 [MH+] C24H25F3N2O3 предусматривает 446,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,03 (d, J=8,1 Гц, 4H), 7,80-7,70 (m, 1H), 7,69-7,58 (m, 4H), 7,56-7,47 (m, 4H), 7,47-7,41 (m, 1H), 7,37 (d, J=8,0 Гц, 4H), 5,13-5,04 (m, 1H), 5,04-4,95 (m, 1H), 3,98 (d, J=13,3 Гц, 1H), 3,93 (s, 6H), 3,87-3,79 (m, 1H), 3,75 (d, J=13,3 Гц, 1H), 3,54 (d, J=7,2 Гц, 2H), 2,96-2,87 (m, 1H), 2,73-2,60 (m, 2H), 2,49-2,41 (m, 1H), 2,26-2,20 (m, 2H), 1,95-1,84 (m, 1H), 1,49 (d, J=4,0 Гц, 1H), 1,45 (d, J=7,0 Гц, 3H), 1,40 (d, J=6,9 Гц, 4H), 0,68-0,58 (m, 1H), 0,42 (d, J=7,6 Гц, 1H), 0,30-0,19 (m, 1H), 0,05--0,05 (m, 1H).
Описание 150: метил 4-((1S)-1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)этил)-бензоат (одиночный диастереоизомер) (D150)
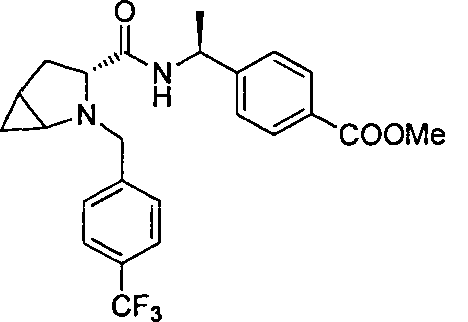
Титульные соединения (D150) (72 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-((1S)-1-((3R)-2-азабицикло[3.1.0]гексан-3-арбоксамидо)этил)бензоата (D107) (48 мг) и 4-(трифторметил)-бензилбромида (0,031 мл) (Na2CO3: 3 экв.; Время реакции: 18 часов; 68°C)
МС: (ES/+) м/з: 447,4 [МН+] C24H25F3N2O3 предусматривает 446,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.); 8,04 (d, J=8,1 Гц, 2H), 7,66 (d, J=7,7 Гц, 2H), 7,51 (d, J=7,3 Гц, 2H), 7,46-7,41 (m, 1Н), 7,37 (d, J=8,1 Гц, 2H), 5,14-5,03 (m, 1H), 3,94 (s, 3H), 3,88-3,78 (m, 1H), 3,64-3,51 (m, 1H), 2,97-2,88 (m, 1H), 2,74-2,65 (m, 1H), 2,51-2,37 (m, 1H), 1,97-1,84 (m, 1H), 1,56-1,51 (m, 1H), 1,45 (d, J=6,9 Гц, 3H), 0,68-0,59 (m, 1H), 0,31-0,20 (m, 1H).
Описание 151: (R)-метил 4-(1-(4,4-диметил-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)циклопропил)бензоат (D151)
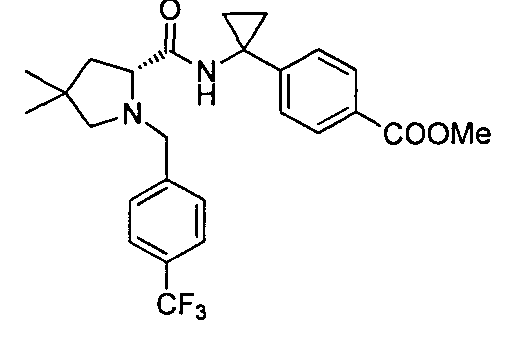
Титульное соединение (D151) (100 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с (R)-метил 4-(1-(4,4-диметилпирролидин-2-карбоксамидо)циклопропил) бензоата (D108) (70 мг) и 4-(трифторметил)-бензилбромида (0,041 мл). (Cs2CO3: 1,5 экв.; Время реакции: 20 часов, RT)
MS: (ES/+) m/z: 475,4 [МН+] C26H29F3N2O3 предусматривает 474,21
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,95 (d, J=8,1 Гц, 2H), 7,88 (br. s., 1H), 7,63 (d, J=7,7 Гц, 2H), 7,41 (d, J=7,6 Гц, 2H), 7,23 (d, J=8,1 Гц, 2H), 3,91 (s, 4H), 3,57 (d, J=13,5 Гц, 1Н), 3,37 (dd, J=6,5, 9,7 Гц, 1Н), 2,84 (d, J=9,2 Гц, 1Н), 2,29 (d, J=9,2 Гц, 1Н), 2,23-2,12 (m, 1H), 1,73 (dd, J=6,2, 13,1 Гц, 1H), 1,43-1,35 (m, 1H), 1,34-1,28 (m, 2H), 1,25-1,19 (m, 1H), 1,11 (d, J=19,4 Гц, 6H)
Описания 152а и 152b:
метил 4-((1S)-1-(1-(4-(трифторметил)бензил)азетидин-2-карбоксамидо)этил)бензоат (смесь диастереоизомеров) (D152a) и
метил 4-((1S)-1-(1-(4-(трифторметил)бензил)азетидин-2-карбоксамидо)этил)бензоат (одиночный диастереомер) (D152b)
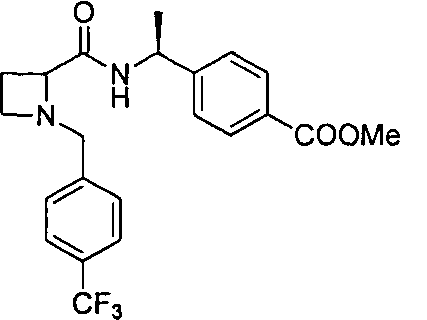
К раствору метилового эфира 4-((1S)-1-(азетидин-2-карбоксамидо)этил)бензоата (смесь диастереоизомеров) (D109) (60 мг, 0,23 ммоль) в сухом MeCN (5 мл), добавляли последовательно Cs2CO3 (223,6 мг, 0,68 ммоль) и 4-(трифторметил) бензилбромид (0,042 мл, 0,27 ммоль) и перемешивали полученную смесь при RT в течение 18 часов. Твердое вещество отфильтровывали, упаривали растворитель и очищали остаток на колонке «Biotage SNAP HP-Si» (10 г) с элюированием градиентом DCM/EtOAc от 100/0 до 90/10. Собранные фракции после упаривания растворителя давали 23 мг смеси диастереоизомеров, которую подвергали разделению хиральной ВЭЖХ (Условия препаративной хроматографии: Колонка: DAICEL AD-H; Подвижная фаза: н-гептан/EtOH/DEA 70%/30%/0,1% об/об Скорость потока 10 мл/мин; DAD: 235 нм). Собранные фракции, после упаривания растворителя давали титульное соединение (D152a) (смесь диастереоизомеров) (6 мг) и (D152b) (диастереоизомер 2) (7 мг)
(D152b) (одиночный диастереоизомер): время удерживания: 15,8 мин
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,03 (d, J=8,1 Гц, 2H), 7,63 (d, J=7,8 Гц, 2H), 7,41 (d, J=7,8 Гц, 2H), 7,34 (d, J=8,1 Гц, 2H), 7,20 (d, J=7,9 Гц, 1Н), 5,04-4,92 (m, 1Н), 3,94 (s, 3H), 3,82-3,65 (m, 3H), 3,44 (t, J=6,6 Гц, 1Н), 3,11 (d, J=8,0 Гц, 1Н), 2,45 (d, J=8,6 Гц, 1Н), 2,14-1,99 (m, 1Н), 1,19 (d, J=6,8 Гц, 3H).
Описание 153: метил 4-((1S)-1-(3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоксамидо)этил)-бензоат (смесь син диастереоизомеров) (D153)
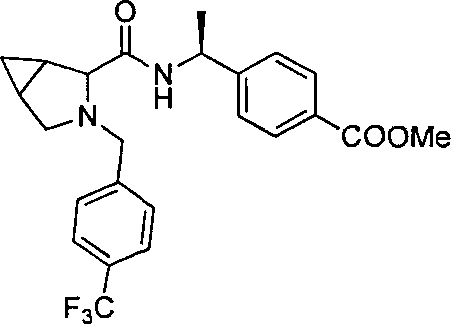
Титульное соединение (D153) (85 мг) получали в соответствии с общей процедурой получения амидов (способ А) исходя из 3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоновой кислоты (D110) (55 мг) и гидрохлорида (S)-метил 4-(1-аминоэтил)-бензоата (43,3 мг). (EDC. HCl: 1,05 экв.; Время реакции: 18 часов; RT)
MS: (ES/+) m/z: 447,3 [МН+] C24H25F3N2O3 предусматривает 446,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,04 (d, J=8,0 Гц, 2H), 7,97 (d, J=8,0 Гц, 2H), 7,63 (d, J=7,7 Гц, 2H), 7,49 (d, J=7,8 Гц, 2H), 7,44-7,31 (m, 6H), 7,27-7,05 (m, 4H), 5,30-5,09 (m, 2H), 3,93 (d, J=6,0 Гц, 7H), 3,77 (d, J=13,8 Гц, 1Н), 3,55-3,39 (m, 3H), 3,34 (d, J=13,6 Гц, 1Н), 3,05 (dd, J=9,5, 13,1 Гц, 2H), 2,56 (t, J=9,4 Гц, 2H), 1,86 (d, J=17,4 Гц, 2H), 1,57 (d, J=6,8 Гц, 3H), 1,53 (d, J=3,1 Гц, 2H), 1,44 (d, J=6,8 Гц, 3H), 0,76-0,59 (m, 2H), 0,58-0,40 (m, 2H).
Описания 154а и 154b:
метил 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоксамидо)циклопропил)бензоат (энантиомер 1) (D154a) и
метил 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло [3.1.0] гексан-2-карбоксамидо)циклопропил)бензоат (энантиомер 2) (D154b)
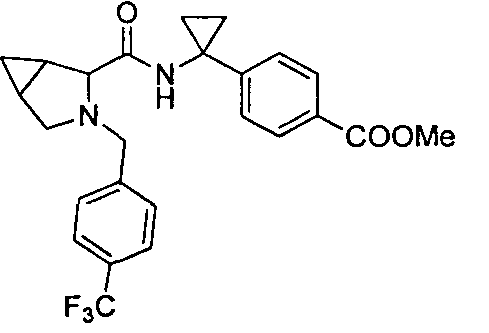
К раствору 3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоновой кислоты (D110) (55 мг, 0,19 ммоль) в DCM (5 мл), добавляли НОВТ.Н2O (39 мг, 0,19 ммоль) EDC HCl (35 мг, 0,20 ммоль) и перемешивали смесь в течение 30 мин до RT. Добавляли гидрохлорид метил-4 (1-аминоциклопропил) бензоат (43,3 мг, 0,19 ммоль) и перемешивали полученную смесь в течение 18 часов при RT. Затем смесь разбавляли DCM и промывали насыщ. р-ром NaHCO3 (2×10 мл), а затем водой (10 мл). Собранные органические фазы после сушки над Na2SO4 и выпаривания растворителя давали остаток, который очищали с помощью картриджа «SPE-Si» (5G9, элюция смесью DCM/EtOAc 80/20. Собранные фракции после упаривания растворителя давали 50 мг рацемической смеси титульного соединения, которую подвергали разделению хиральной ВЭЖХ (Условия препаративной хроматографии: Колонка: «DAICEL AD-H», подвижная фаза: н-гептан/EtOH/DEA 60%/40%/0,1% об./об. Скорость потока 10 мл/мин; DAD: 249 нм). Собранные фракции после упаривания растворителя давали два энантиомера (D154a) (10 мг) и (D154b) (15 мг).
(D154a) (энантиомер 1 с относительной стереохимией син): время удерживания: 10,1 мин.
MS: (ES/+) m/z: 459 [МН+] C25H25F3N2O3 предусматривает 458,18
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,96 (d, J=8,3 Гц, 2H), 7,63 (d, J=7,8 Гц, 2H), 7,48-7,32 (m, 2H), 7,26 (d, J=8,8 Гц, 2H), 3,91 (s, 4H), 3,55-3,35 (m, 2H), 3,19-3,00 (m, 1H), 2,69-2,47 (m, 1H), 2,03-1,83 (m, 1H), 1,49-1,37 (m, 1H), 1,36-1,24 (m, 2H), 1,21-1,14 (m, 1H), 0,88-0,72 (m, 1H), 0,68-0,50 (m, 1H)
(D154b) (энантиомер 2 с относительной стереохимией син): время удерживания: 18,1 мин.
MS: (ES/+) m/z: 459 [МН+] C25H25F3N2O3 предусматривает 458,18
Описание 155: метил 4-((1S)-1-(2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоксамидо)этил)бензоат (D155)
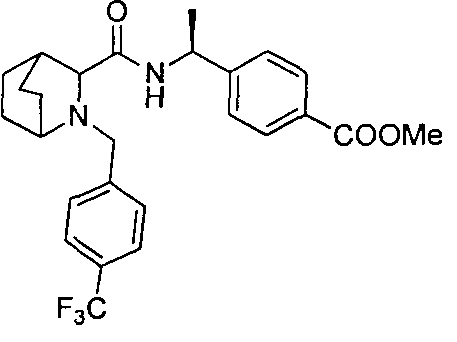
Титульное соединение (D155) (12 мг) получали в соответствии с общей процедурой получения амидов (способ С), начиная с 2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоновой кислоты (D111) (22,5 мг) и гидрохлорида (S)-метил 4-(1-аминоэтил)-бензоата (17 мг). (Время реакции: 2 часа, 60°C)
MS: (ES/+) m/z: 475,1 [МН+] C26H29F3N2O3 предусматривает 474,21
Описание 156: метил 4-(1-(2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоксамидо)циклопропил)бензоат (D156)
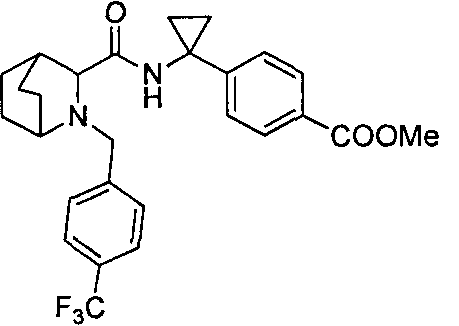
Титульное соединение (D156) (12 мг) получали в соответствии с общей процедурой получения амидов (способ С), начиная с 2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоновой кислоты (D111) (22,5 мг) и гидрохлорида метил 4-(1-аминоциклопропил)бензоата (18 мг). (Время реакции: 2 часа, 60°C)
MS: (ES/+) m/z: 487,4 [МН+] C27H29F3N2O3 предусматривает 486,21
Описание 157: (R)-метил 4-(1-(2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (D157)
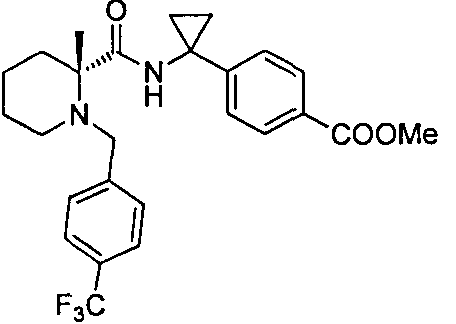
Титульное соединение (D157) (5 мг) получали в соответствии с общей процедурой получения амидов (способ В), начиная с (R)-2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксилата лития (D112) (20 мг) и гидрохлорида метил 4-(1-аминоциклопропил)бензоата (17,2 мг).
MS: (ES/+) m/z: 475,4 [МН+] C26H29F3N2O3 предусматривает 474,21
Описание 158: метил 4-((S)-1-((R)-2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензоат (D158)
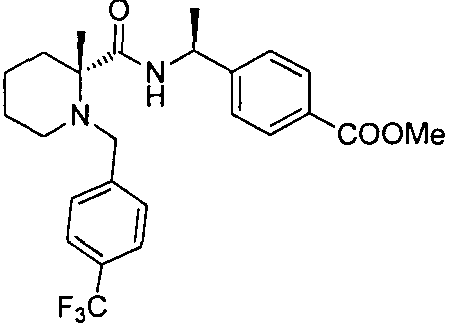
Титульное соединение (D158) (10 мг) получали в соответствии с общей процедурой получения амидов (способ В), начиная с (R)-2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксилата лития (D112) (20 мг) и гидрохлорида (S)-метил 4-(1-аминоэтил)-бензоата (16,32 мг).
MS: (ES/+) m/z: 463,4 [МН+] C25H29F3N2O3 предусматривает 462,21
Описание 159: (R)-метил 4-(1-(2-метил-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)циклопропил)бензоат (D159)
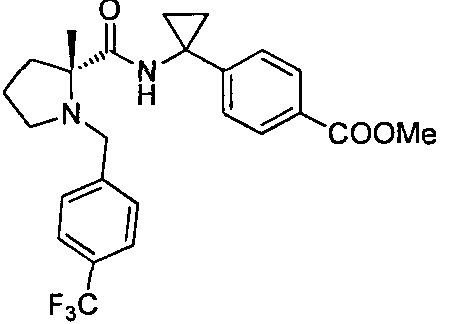
Титульное соединение (D159) (13 мг) получали в соответствии с общей процедурой получения амидов (способ А), начиная с (R)-2-метил-1-(4-(трифторметил)бензил)пирролидин-2-карбоксилата лития (D113) (21 мг) и гидрохлорида (S)-метил 4-(1-аминоэтил)-бензоата (16,3 мг).
MS: (ES/+) m/z: 461,3 [МН+] C25H27F3N2O3 предусматривает 460,20
Описание 160: метил 4-((S)-1-((2R,4S)-4-фтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензоат (D160)
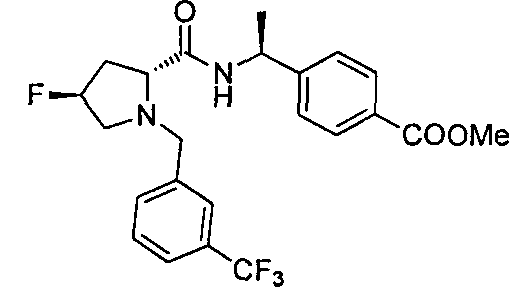
Титульное соединение (D160) (67,3 мг) получали в соответствии с общей процедурой получения амидов (способ А), начиная с (2R,4S)-4-фтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксилата лития (D114) (60 мг) и гидрохлорида (S)-метил 4-(1-аминоэтил)-бензоата (43,5 мг). (Время реакции: 18 часов; RT)
MS: (ES/+) m/z: 475,2 [MH+Na+] C23H24F4N2O3 предусматривает 452,17
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,01 (d, J=8,1 Гц, 2H), 7,75-7,46 (m, 5H), 7,36 (d, J=8,1 Гц, 2H), 5,32-5,00 (m, 2H), 4,01 (d, J=13,2 Гц, 1Н), 3,92 (s, 3H), 3,70 (d, J=13,2 Гц, 1Н), 3,54-3,33 (m, 2H), 2,73-2,41 (m, 2H), 2,31-2,11 (m, 1H), 1,42 (d, J=6,8 Гц, 3H)
Описание 161: 4-((S)-1-((2R,4S)-4-фтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензоат лития (D161)
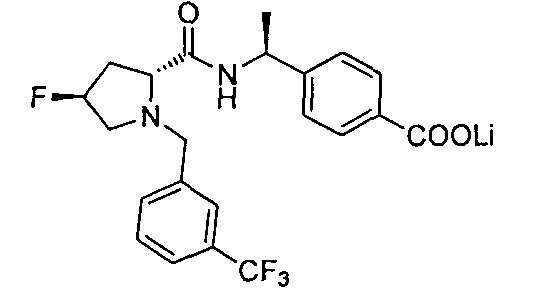
Титульное соединение (D161) (50 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ А), начиная с метил 4-((S)-1-((2R,4S)-4-фтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензоата (D160) (67,3 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов).
MS: (ES/+) m/z: 439,2 [M-Li+2H+] C22H21F4LiN2O3 предусматривает 444,16
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,90 (d, J=7,9 Гц, 2H), 7,71 (s, 4H), 7,27 (d, J=8,1 Гц, 2H), 5,28-5,07 (m, 1H), 4,95-4,88 (1H под растворителем), 4,00-3,90 (m, 1H), 3,83 (s, 1H), 3,43-3,35 (m, 2H), 2,83-2,50 (m, 2H), 2,16-1,98 (m, 1H), 1,34 (d, J=7,0 Гц, 3H)
Описание 162: 4-((S)-1-((2R,4S)-4-фторпирролидин-2-карбоксамидо)этил)бензоат (D162)
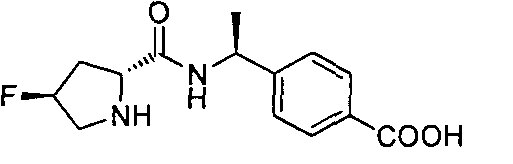
Суспензию 4-((S)-1-(2R,4S)-4-фтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензоата лития (D161) (47 мг) и 10% мас Pd/C (5 мг) в МеОН (5 мл) и 1 М HCl (0,5 мл) перемешивали при постоянном токе H2 в течение 3 часов. Отфильтровывали катализатор и упаривали растворитель с получением остатка, который растирали с сНех и фильтровали с получением титульного соединения (D162) (22 мг).
MS: (ES/+) m/z: 281,2 [МН+] C14H17FN4O3 предусматривает 280,12
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 8,99-8,87 (m, 1H), 8,09-7,98 (m, 2H), 7,52-7,46 (m, 2H), 5,60-5,36 (m, 1H), 5,20-5,06 (m, 1H), 4,55-4,44 (m, 1H), 3,86-3,72 (m, 1H), 3,66-3,47 (m, 1H), 2,94-2,72 (m, 1H), 2,65-2,45 (m, 1H), 1,54 (d, J=7,0 Гц, 3H).
Описание 163: 4-(трифторметил)бензил 4-((S)-1-((2R,4S)-4-фтор-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)-бензоат (D163)
Титульное соединение (D163) (31 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с 4-((S)-1-((2R,4S)-фторпирролидин-2-карбоксамидо)этил)бензойной кислоты (D162) (22 мг). (Na2CO3: 4 экв.; Время реакции: 18 часов; 68°C).
MS: (ES/+) m/z: 597,4 [МН+] C30H27F7N2O3 предусматривает 596,54
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,05 (d, J=8,1 Гц, 2H), 7,72-7,52 (m, 7H), 7,45 (d, J=7,8 Гц, 2H), 7,37 (d, J=8,1 Гц, 2H), 5,42 (s, 2H), 5,27-4,99 (m, 2H), 4,01 (d, J=13,3 Гц, 1H), 3,71 (d, J=13,3 Гц, 1H), 3,47-3,32 (m, 2H), 2,72-2,45 (m, 2H), 2,29-2,09 (m, 1H), 1,40 (d, J=7,0 Гц, 3H).
Описание 164: метил 4-((S)-1-((R)-4,4-дифтор-1-(3-(трифторметил)бензил) пирролидин-2-карбоксамидо)этил)бензоат (D164)
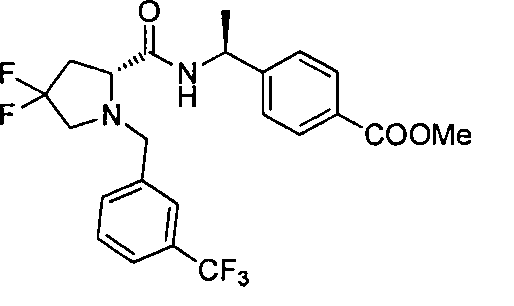
Титульное соединение (D164) (37 мг) получали в соответствии с общей процедурой получения амидов (способ А), начиная с (R)-4,4-дифтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксилата лития (D115) (51 мг) и гидрохлорида (S)-метил 4-(1-аминоэтил)-бензоата (35 мг). (Время реакции: 48 часов; RT).
MS: (ES/+) m/z: 471,2 [MH+] C23H23F5N2O3 предусматривает 470,16
Описание 165: метил 4-((S)-1-((R)-4,4-дифторпирролидин-2-карбоксамидо)этил)бензоат (D165)
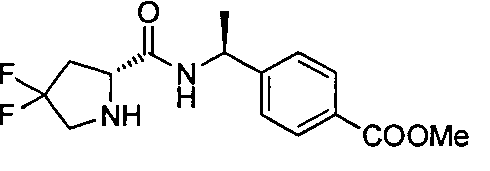
Суспензию метил 4-((S)-1-((R)-4,4-дифтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензоата (D164) (33 мг) и 10% мае Pd/C (5 мг) в МеОН (5 мл) и 1 М HCl (0,5 мл) перемешивали при постоянном токе Н2 в течение 3 часов. Катализатор отфильтровывали и растворитель упаривали с получением остатка, который растирали с сНех и фильтровали с получением титульного соединения (D165) (30 мг).
MS: (ES/+) m/z: 313,2 [MH+] C23H23F5N2O3 предусматривает 312,13
Описание 166: метил 4-((S)-1-((R)-4,4-дифтор-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензоат (D166)
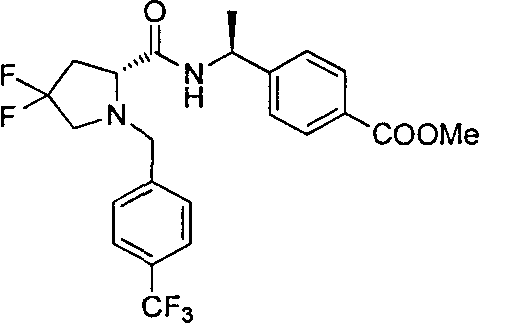
Титульное соединение (D166) (16,5 мг) получали в соответствии с общей процедурой получения замещенных бензиламинов, начиная с метил 4-((S)-1-((R)-4,4-дифторпирролидин-2-карбоксамидо)этил)бензоата (D165) (30 мг) и 4-(трифторметил)бензилбромида (33 мг). (Na2CO3: 2,5 экв.; Время реакции: 18 часов; 68°C)
MS: (ES/+) m/z: 471 [МН+] C23H23F5N2O3 предусматривает 470,16
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,04 (d, J=7,8 Гц, 2H), 7,67 (d, J=7,8 Гц, 2H), 7,43 (d, J=7,8 Гц, 2H), 7,35 (d, J=7,8 Гц, 3H), 5,10 (t, J=7,1 Гц, 1Н), 4,01 (d, J=13,7 Гц, 1Н), 3,94 (s, 3H), 3,68 (d, J=13,2 Гц, 1Н), 3,61-3,54 (m, 1Н), 3,36 (d, J=6,8 Гц, 1Н), 2,87 (d, J=17,1 Гц, 2H), 2,29 (br. s., 1Н), 1,45 (d, J=6,8 Гц, 3H)
ПРИМЕРЫ
Пример 1: 4-((1S)-1-(1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензоат лития (смесь диастереоизомеров) (Е1)
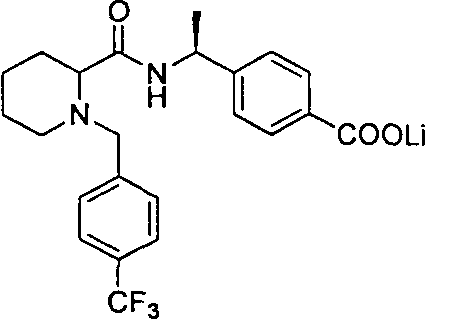
Титульное соединение (Е1) (70 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ А), начиная с метил 4-((1S)-1-(1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензоата (D116) (75 мг).
(LiOH: 1,2 экв.; Время реакции: 3 часа; RT)
MS: (ES/+) m/z: 435 [M-Li+2H+] C23H24F3LiN2O3 предусматривает 440,19
Хиральная ВЭЖХ [«Phenomenex Lux Cellulose-1»; Подвижная фаза: 70% н-гексан (0,5% TFA), В: 30% EtOH; DAD: 230 нм]: Время удерживания пика 1: 7,51 мин. Время удерживания пика 2: 38,92 мин.
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,20 (br. s., 2H) 7,81 (d, 2H) 7,75 (d, 2H) 7,66 (d, 4H) 7,50-7,61 (m, 4H) 7,10-7,31 (m, 4H) 4,98 (br. s., 2H) 3,73 (t, 2H) 3,20 (d, 2H) 2,83 (d, 2H) 2,74 (d, 2H) 1,93 (br. s., 2H) 1,56-1,82 (m, 6H) 1,46 (d, 3H) 1,41 (br. s., 1Н) 1,35 (dd, 6H) 1,25 (br. s., 2H).
Пример 2: 4-((S)-1-((R)-1-(4-фторбензил)пиперидин-2-карбоксамидо)этил)-бензоат лития (Е2)
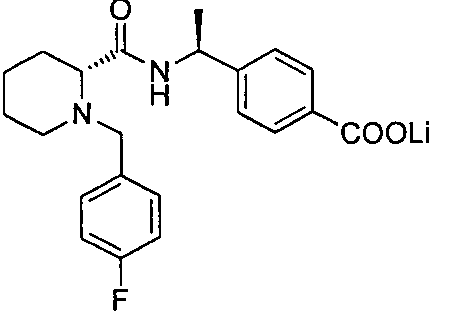
Титульное соединение (Е2) (8 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ А), начиная с метил 4-((S)-1-((R)-1-(4-фторбензил)пиперидин-2-карбоксамидо)этил)бензоата (D117) (10 мг).
(LiOH: 1,5 экв.; Время реакции: 3 часа; RT)
MS: (ES/+) m/z: 385,3 [M-Li+2H+] C22H24FLiN2O3 предусматривает 390,19
Хиральная ВЭЖХ [DAICEL OD-H; Подвижная фаза: 60% н-гексан (0,5% TFA), В: 40% EtOH; DAD: 235 нм]: Время удерживания пика: 5,68 мин.
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,94 (d, J=7,9 Гц, 2H), 7,45-7,27 (m, 4H), 7,03 (t, J=8,5 Гц, 2H), 5,11 (d, J=6,9 Гц, 1H), 3,75 (d, J=13,1 Гц, 1H), 3,17 (d, J=13,2 Гц, 1H), 2,81 (br. s., 2H), 2,05-1,94 (m, 1H), 1,91-1,64 (m, 3H), 1,58 (br. s., 2H), 1,48 (d, J=6,9 Гц, 3H), 1,40-1,25 (m, 1H)
Пример 3: 4-((S)-1-((R)-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)-бензоат лития (Е3)
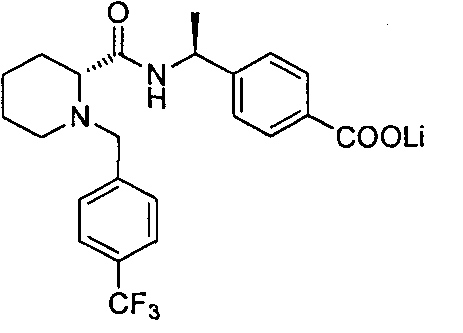
Титульное соединение (Е3) (21,3 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ А), начиная с метил 4-((S)-1-((R)-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензоата (D118) (24 мг).
(LiOH: 1,5 экв.; Время реакции: 3 часа; RT)
MS: (ES/+) m/z: 435,2 [M-Li+2H+] C23H24F3L1N2O3 предусматривает 440,19
Хиральная ВЭЖХ [DAICEL OD-H; Подвижная фаза: 60% н-гексан (0,5% TFA), В: 40% EtOH; DAD: 235 нм]: Время удерживания пика: 6,09 мин.
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,93 (d, J=7,9 Гц, 2H), 7,65-7,57 (m, 2H), 7,57-7,49 (m, 2H), 7,36 (d, J=7,9 Гц, 2H), 5,16-5,04 (m, 1H), 3,88-3,78 (m, 1H), 3,27 (s, 1H), 2,86 (d, J=10,3 Гц, 2H), 2,09-1,95 (m, 1H), 1,94-1,65 (m, 3H), 1,59 (br. s., 2H), 1,46 (d, J=6,9 Гц, 3H), 1,41-1,26 (m, 1H).
Пример 4: (R)-4-(1-(1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоат лития (Е4)
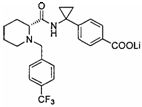
Титульное соединение (Е4) (50 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ А), начиная с (R)-метил 4-(1-(1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоата (D119) (74 мг). (LiOH: 3 экв.; Время реакции: 18 часов; RT)
MS: (ES/+) m/z: 447,2 [M-Li+2H+] C24H24F3LiN2O3 предусматривает 452,19
Хиральная ВЭЖХ [DAICEL OD-H; Подвижная фаза: 80% н-гексан (+0,2% TFA), В: 20% EtOH; DAD: 243 нм]: Время удерживания пика: 22,92 мин.
Пример 5: (R)-4-(1-(1-(4-хлорбензил)пиперидин-2-карбоксамидо)-циклопропил)-бензоат лития (Е5)
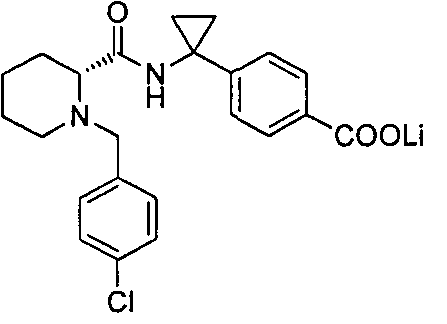
Титульное соединение (Е5) (31 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ А), начиная с (R) -метил 4-(1-(1-(4-хлорбензил)пиперидин-2-карбоксамидо)циклопропил)бензоата (D120) (45 мг). (LiOH: 3 экв.; Время реакции: 18 часов; RT)
MS: (ES/+) m/z: 413 [M-Li+2H+] C23H24C1UN2O3 предусматривает 418,16
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,85 (d, J=8,0 Гц, 2H), 7,33 (d, J=4,9 Гц, 4H), 7,23 (d, J=8,1 Гц, 2H), 4,90-4,82 (1H под пиком растворителя), 3,79-3,65 (m, 1Н), 3,21-3,07 (m, 1Н), 2,93-2,75 (m, 2H), 2,06-1,86 (m, 2H), 1,86-1,68 (m, 2H), 1,66-1,50 (m, 2H), 1,41-1,15 (m, 4H).
Пример 6: (R)-4-(1-(1-(4-цианобензил)пиперидин-2-карбоксамидо)-циклопропил)-бензоат лития (Е6)
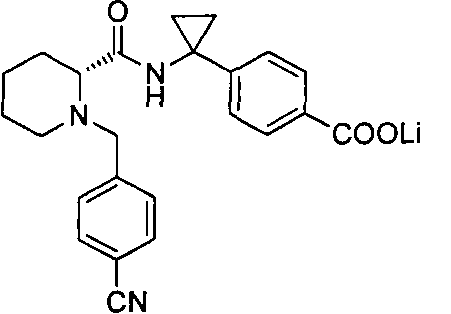
Титульное соединение (Е6) (34 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ А), начиная с (R)-метил 4-(1-(1-(4-цианобензил)пиперидин-2-карбоксамидо)циклопропил)бензоата (D121) (35 мг). (LiOH: 3 экв.; Время реакции: 18 часов; RT)
MS: (ES/+) m/z: 404 [M-Li+2H+] C24H24LiN3O3 предусматривает 409,20
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,90-7,79 (m, 2H), 7,74-7,65 (m, 2H), 7,62-7,54 (m, 2H), 7,28-7,17 (m, 2H), 4,90-4,82 (1H under solvent peak), 3,84-3,72 (m, 1H), 3,28-3,19 (m, 1H), 2,92-2,77 (m, 2H), 2,07-1,89 (m, 2H), 1,87-1,68 (m, 2H), 1,65-1,53 (m, 2H), 1,43-1,10 (m, 4H).
Пример 7: 4-(1-(6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)циклопропил)бензойная кислота (одиночный неизвестный энантиомер) (Е7)
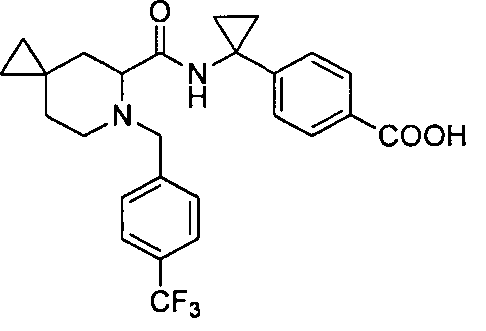
Процедура А:
Титульное соединение (Е7) (54 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ В), начиная с метил 4-(1-(6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоата (D122b) (100 мг). (LiOH: 3 экв.; Время реакции: 18 часов; RT)
MS: (ES/+) m/z: 473,4 [МН+] C26H27F3N2O3 предусматривает 472,20
Хиральная ВЭЖХ: [DAICEL AD-H; Подвижная фаза: 90% н-гептан (+0,2% TFA), В: 10% этанола; DAD: 245 нм]: Время удерживания пика: 18,97 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,97 (d, J=8,0 Гц, 2H), 7,74-7,35 (m, 5H), 7,26 (br. s., 1H), 3,86 (d, J=14,1 Гц, 1H), 3,38 (d, J=14,1 Гц, 1H), 3,08 (d, J=7,8 Гц, 1H), 2,91 (d, J=9,8 Гц, 1H), 2,27 (br. s., 1H), 2,05 (t, J=11,2 Гц, 1H), 1,84 (br. s., 1H), 1,50-1,24 (m, 4H), 1,14 (br. s., 1H), 0,98 (d, J=12,7 Гц, 1H), 0,53-0,23 (m, 4H)
Процедура В:
метил 4-(1-(6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоат (D123)) (17,7 г, 36,38 ммоль) распределяли между диоксаном (485 мл) и водой (242 мл) перед добавлением LiOH H2O (6,1 г, 145,5 ммоль). Смесь перемешивали при RT в течение 18 часов. Добавляли воду (200 мл) с последующим добавлением уксусной кислоты (5,27 мл). Диоксан упаривали и добавляли уксусную кислоту до тех пор, пока pH водного раствора не достигала значения ~4. Белое твердое вещество отфильтровывали из реакционной смеси и сушили в вакууме в течение ночи затем 24 ч в вакууме при 40°C, получая титульное соединение (Е7) (16,7 g).
MS: (ES/+) m/z: 473,3 [MH+] C26H27F3N2O3 предусматривает 472,20
Хиральная ВЭЖХ: [DAICEL AD-H; Подвижная фаза: 90% н-гептан (+0,2% TFA), В: 10% этанола; DAD: 245 нм]: Время удерживания пика: 19,07 мин.
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 12,92-12,51 (m, 1H), 8,83-8,62 (m, 1H), 7,85-7,75 (m, 2H), 7,74-7,57 (m, 4H), 7,26-7,14 (m, 2H), 3,87-3,72 (m, 1H), 3,27-3,20 (m, 1H), 2,99-2,86 (m, 1H), 2,79-2,69 (m, 1H), 2,19-1,98 (m, 2H), 1,86-1,70 (m, 1H), 1,32-1,07 (m, 5H), 0,94-0,82 (m, 1H), 0,46-0,17 (m, 4H).
Пример 8: 4-(1-(6-((6-(трифторметил)пиридин-3-ил)метил)-6-азаспиро[2,5]октан-5-карбоксамидо)циклопропил)бензойная кислота (одиночный неизвестный энантиомер) (Е8)
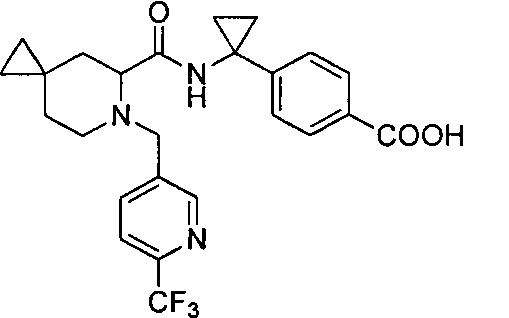
Титульное соединение (Е8) (35 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (Способ D), начиная с метил 4-(1-(6-((6-(трифторметил)пиридин-3-ил)метил)-6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоата (D124) (47 мг). (LiOH: 4 экв.; Время реакции: 5 часов; RT)
MS: (ES/+) m/z: 474,2 [МН+] C25H26F3N3O3 предусматривает 473,19
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 8,74 (s, 1H), 8,10 (d, J=8,3 Гц, 1H), 7,90 (d, J=8,3 Гц, 2H), 7,79 (d, J=7,8 Гц, 1Н), 7,31 (d, J=8,3 Гц, 2H), 3,88 (d, J=14,2 Гц, 1Н), 3,39 (d, J=14,2 Гц, 2H), 3,06 (dd, J=2,7, 10,5 Гц, 1Н), 2,84 (d, J=11,2 Гц, 1Н), 2,37-2,12 (m, 2H), 2,04-1,88 (m, 1H), 1,45-1,14 (m, 6H), 0,94 (d, J=11,2 Гц, 1H), 0,51-0,28 (m, 4H).
Пример 9: 4-(1-(6-(3-(трифторметил)бензи)-6-азаспиро[2,5]октан-5-карбоксамидо)циклопропил)бензойная кислота (одиночный неизвестный энантиомер) (Е9)
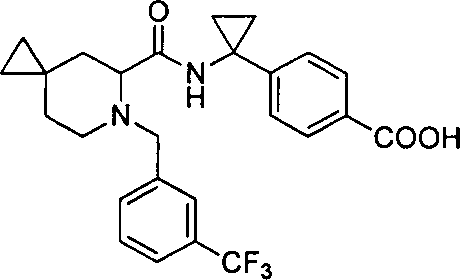
Титульное соединение (Е9) (39 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (Способ D), начиная с метил 4-(1-(6-(3-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)-циклопропил)-бензоата (одиночный неизвестный энантиомер) (D125) (60,7 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 473,2 [MH+] C26H27F3N2O3 предусматривает 472,20
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 12,90-12,63 (m, 1H), 8,71-8,64 (m, 1H), 7,81-7,74 (m, 2H), 7,72-7,66 (m, 2H), 7,64-7,55 (m, 2H), 7,22-7,11 (m, 2H), 3,77-3,66 (m, 1H), 3,60-3,47 (m, 1H), 3,22-3,11 (m, 1H), 3,03-2,95 (m, 1H), 2,39-2,29 (m, 1H), 2,25-2,11 (m, 1H), 1,76-1,64 (m, 1H), 1,31-1,19 (m, 3H), 1,19-1,07 (m, 3H), 1,07-0,91 (m, 2H), 0,73-0,59 (m, 1H), 0,26-0,17 (m, 1H).
Пример 10: 4-((1S)-1-((6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензойная кислота (одиночный неизвестный диастереоизомер) (Е10)
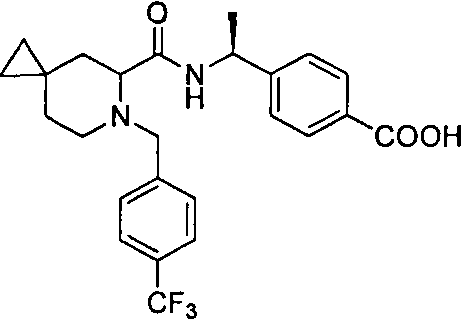
Титульное соединение (Е10) (6,4 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ В), начиная с 4-(трифторметил) бензил 4-((1S)-1-(6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензоата (D129) (15 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 461,3 [МН+] C25H27F3N2O3 предусматривает 460,20
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,98 (d, J=7,8 Гц, 2H), 7,71-7,51 (m, 4H), 7,44 (d, J=7,6 Гц, 2H), 5,21-5,02 (m, 1H), 4,00-3,79 (m, 1H), 3,11-2,96 (m, 1H), 2,95-2,79 (m, 1H), 2,34-2,06 (m, 2H), 2,04-1,87 (m, 1H), 1,47 (d, J=6,9 Гц, 3H), 1,38-1,23 (m, 1H), 1,23-1,08 (m, 1H), 1,00-0,81 (m, 2H), 0,48-0,24 (m, 4H)
Пример 11: 4-((1S)-2-(5-метил-6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензойная кислота (смесь диастереоизомеров) (E11)
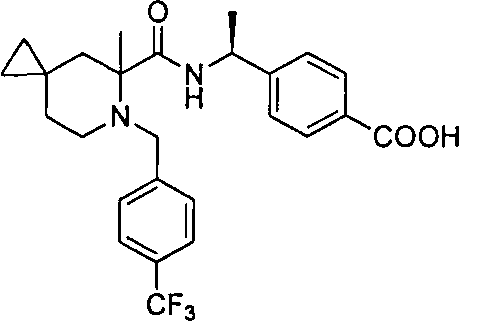
Титульное соединение (E11) (4,5 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ В), начиная с метил 4-((1S)-1-(5-метил-6-(4-(трифторметил)бензил)-6-азаспиро[2,5]октан-5-карбоксамидо)этил)бензоата (D 130) (19 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 475,4 [МН+] C26H29F3N2O3 предусматривает 474,21
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,96 (d, J=7,8 Гц, 1Н), 7,76 (d, J=7,8 Гц, 1Н), 7,68 (s, 2H), 7,56 (d, J=7,8 Гц, 1Н), 7,47-7,31 (m, 2H), 7,15 (d, J=7,8 Гц, 1Н), 5,11-4,94 (m, 1Н), 3,51 (t, J=13,4 Гц, 1Н), 2,73 (dd, J=12,0, 19,8 Гц, 1Н), 2,65-2,46 (m, 1Н), 2,37-2,18 (m, 1Н), 2,05 (t, J=12,0 Гц, 1Н), 1,58-1,24 (m, 7H), 1,18-1,00 (m, 1H), 0,94 (d, J=11,2 Гц, 1H), 0,49 (br. s., 2H), 0,27 (d, J=6,8 Гц, 2H).
Пример 12: 4-(1-(4,4-диметил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (одиночный неизвестный энантиомер) (Е12)
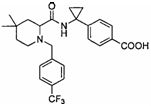
Титульное соединение (Е12) (88,4 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с метил 4-(1-(4,4-диметил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоата (энантиомер 2) (D131b) (141 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 475,4 [MH+] C26H29F3N2O3 предусматривает 474,21
Хиральная ВЭЖХ: [DAICEL AD-H; Подвижная фаза: 70% н-гептан (+0,1% АсОН), В: 30% этанол; DAD: 245 нм]: Время удерживания пика: 11,4 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 7,97 (d, J=8,1 Гц, 2H), 7,62 (d, J=7,8 Гц, 2H), 7,41 (d, J=7,4 Гц, 3H), 7,27 (br. s., 2H), 3,82 (d, J=14,0 Гц, 1Н), 3,29 (d, J=13,5 Гц, 1Н), 3,10 (d, J=7,7 Гц, 1Н), 2,73 (d, J=10,0 Гц, 1Н), 2,23 (br. s., 1Н), 1,81 (d, J=13,1 Гц, 1Н), 1,49 (t, J=12,1 Гц, 2H), 1,42-1,27 (m, 4H), 1,13 (br. s., 1H), 1,05-0,92 (m, 6H)
Пример 13: 4-((1S)-1-(4,4-диметил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензойная кислота (одиночный неизвестный диастереоизомер) (Е13)
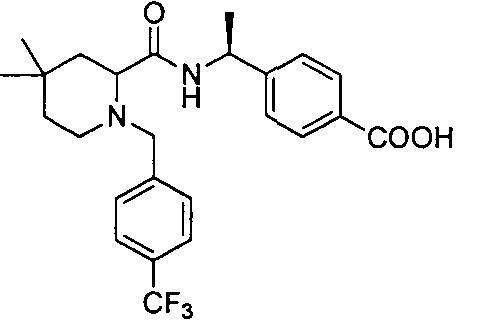
Титульное соединение (Е13) (54,6 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с метил 4-((1S)-1-(4,4-диметил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)-бензоата (диастереоизомер 2) (D132b) (69 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 463,4 [МН+] C25H29F3N2O3 предусматривает 462,21
Хиральная ВЭЖХ: [DAICEL AD-H; Подвижная фаза: 70% н-гептан (+0,1% DEA), В: 30% этанол; DAD: 235 нм]: Время удерживания пика: 10,4 мин.
Пример 14: 4-((1S)-1-((2R)-4-фтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензойная кислота (смесь диастереоизомеров) (Е14)
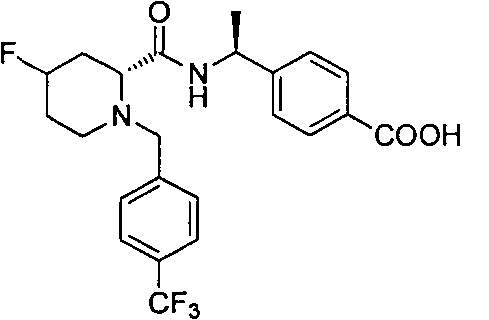
Титульное соединение (Е14) (42 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (Способ D), начиная с метил 4-((1S)-1-((2R)-4-фтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензоата (D133) (62 мг). (LiOH H2O: 4 экв.; Время реакции: 5 часов)
MS: (ES/+) m/z: 471,3 [МН+] C23H24F4N2O3 предусматривает 452,17
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,99 (d, J=8,1 Гц, 2H), 7,66-7,36 (m, 6H), 5,18-5,04 (m, 1H), 3,88-3,76 (m, 1H), 2,80-2,67 (m, 1H), 2,55-2,35 (m, 1H), 2,19-1,75 (m, 4H), 1,49 (d, J=7,0 Гц, 3H), 1,14 (d, J=6,1 Гц, 3H).
Пример 15: 4-(1-((2R)-4-фтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойная кислота (смесь диастереоизомеров) (Е15)
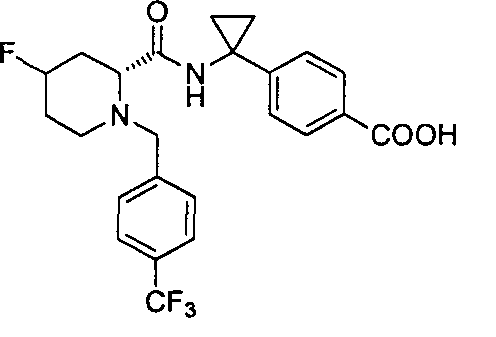
Титульное соединение (Е15) (15,8 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ D), начиная с метил 4-(1-((2R)-4-фтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоата (D134) (25 мг). (LiOH H2O: 4 экв.; Время реакции: 5 часов)
MS: (ES/+) m/z: 471,3 [МН+] C23H24F4N2O3 предусматривает 452,17
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,91 (d, J=8,1 Гц, 2H), 7,69-7,53 (m, 4H), 7,31 (d, J=8,1 Гц, 2H), 5,06-4,91 (m, 1H), 3,84 (d, J=13,7 Гц, 1H), 3,24 (br. s., 1H), 2,72 (d, J=11,8 Гц, 1Н), 2,42 (br. s., 1H), 2,22-1,77 (m, 3H), 1,47-1,16 (m, 6H).
Пример 16: 4-((S)-1-((R)-4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензойная кислота (Е16)
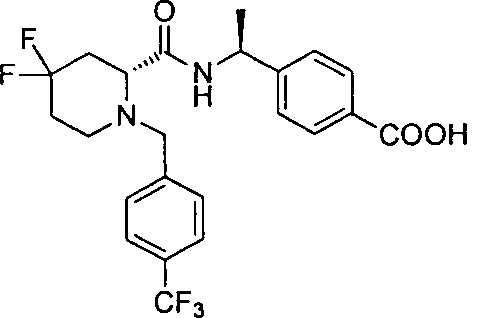
Титульное соединение (Е16) (15 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (Способ D), начиная с метил 4-((S)-1-((R)-4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензоата (D135) (20 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 471,3 [МН+] C23H23F5N2O3 предусматривает 470,16
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,63-8,54 (m, 1H), 7,87-7,77 (m, 2H), 7,74-7,63 (m, 2H), 7,60-7,51 (m, 2H), 7,40-7,27 (m, 2H), 5,06-4,92 (m, 1H), 3,76 (d, J=13,8 Гц, 1H), 3,37-3,32 (1H под остаточным растворителем, 3,23-3,10 (m, J=7,1 Гц, 1H), 2,85-2,74 (m, J=11,7 Гц, 1H), 2,32-2,04 (m, 3H), 2,05-1,83 (m, 2H), 1,37 (d, J=6,8 Гц, 3H).
Пример 17: (R)-4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойная кислота (E17)
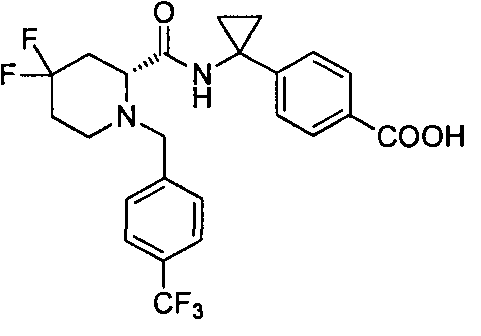
Процедура А:
(R)-метил 4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоат (D136) (30 мг, 60,4 ммоль) подвергали разделению между диоксаном (2 мл) и водой (2 мл) перед добавлением LiOH H2O (10 мг, 242 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч, затем диоксан упаривали. Водный раствор наносили на обращенно-фазовый картридж «Porapak» (5 г), элюирая смесью H2O (с 0,1% СН3СО2Н), а затем с MeCN (0,1% CH3CO2H). Собранные фракции после упаривания растворителя давали 19 мг рацемической смеси, которую подвергали разделению хиральной ВЭЖХ (Условия препаративной хроматографии: Колонка: DAICEL AD-H; Подвижная фаза: н-гептан/EtOH/TFA 60%/40%/0,1% об./об. Расход 10 мл/мин; DAD: 245 нм). Собранные фракции, после упаривания растворителя давали титульное соединение (Е17) (11 мг).
MS: (ES/+) m/z: 483,3 [MH+] C24H23F5N2O3 предусматривает 482,16
Хиральная ВЭЖХ [DAICEL AD-H; Подвижная фаза: 60% н-гептан (+0,2% TFA), В: 40% IPA; DAD: 245 нм]: Время удерживания пика: 15,6 мин.
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 13,00-12,49 (m, 1H), 9,18-8,93 (m, 1H), 7,81 (d, J=8,1 Гц, 2H), 7,72 (br. s., 2H), 7,64 (br. s., 2H), 7,22 (d, J=8,1 Гц, 2H), 3,99-3,84 (m, 1H), 3,38-3,23 (m, 2H), 2,97-2,80 (m, 1H), 2,44-2,12 (m, 3H), 2,10-1,89 (m, 2H), 1,38-1,13 (m, 4H)
Процедура В:
К раствору метил 4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)-циклопропил)-бензоата (энантиомер 2) (D137b) (127 мг, 0,25 ммоль) в диоксане (3 мл) и воде (3 мл) добавляли LiOH H2O (43 мг, 1,02 ммоль) и смесь оставляли перемешиваться при RT в течение 16 часов. Диоксан упаривали, затем к водному слою добавляли уксусную кислоту, пока pH раствора не достигало значения ~4. Твердое вещество отфильтровывали и растворяли в DMF/DMSO. Смесь загружали в картридж «SNAP-C18 gold» (15 г) и элюировали смесью H2O, содержащей АсОН (0,1%)/CH3CN, содержащий АсОН (0,1%) с 10/90 до 0/100. Собранные фракции упаривали в вакууме, получая остаток, который растворяли в смеси насыщ. р-ра NH4Cl/EtOAc (15/15 мл) и экстрагировали этилацетатом (2×20 мл). Объединенные органические слои упаривали в вакууме с получением титульного соединения (Е17) (85 мг).
MS: (ES/+) m/z: 483 [МН+] C24H23F5N2O3 предусматривает 482,16
Хиральная ВЭЖХ [DAICEL AD-H; Подвижная фаза: 60% н-гептан (+0,2% TFA), В: 40% IPA; DAD: 245 нм]: Время удерживания пика: 15,6 мин.
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 12,74 (br. s., 1H), 8,96 (s, 1H), 7,82-7,75 (m, J=8,8 Гц, 2H), 7,74-7,66 (m, J=7,8 Гц, 2H), 7,66-7,58 (m, J=7,8 Гц, 2H), 7,26-7,15 (m, J=8,8 Гц, 2H), 3,82 (d, J=14,2 Гц, 1H), 3,39 (d, J=14,2 Гц, 1H), 3,20-3,09 (m, 1H), 2,82 (m, 1H), 2,36-2,15 (m, 3H), 1,96 (m, 2H), 1,30-1,11 (m, 4H).
Пример 18: 4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил) бензойная кислота (одиночный энантиомер) (Е18)
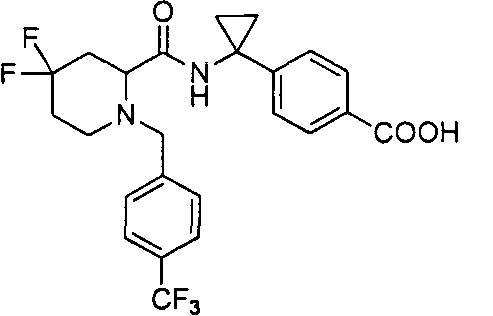
К раствору метил 4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)-циклопропил)-бензоата (энантиомер 1) (D137a) (140 мг, 0,28 ммоль) в диоксане (3 мл) и воде (3 мл) добавляли LiOH H2O (47 мг, 1,12 ммоль) и смесь оставляли перемешиваться при RT в течение 16 часов. Диоксан упаривали, затем к водному слою добавляли уксусную кислоту, пока раствор не достигал значения pH ~4. Твердое вещество отфильтровывали и высушивали под вакуумом с получением титульного соединения (Е18) (90 мг)
MS: (ES/+) m/z: 482,8 [МН+] C24H23F5N2O3 предусматривает 482,16
Хиральная ВЭЖХ [DAICEL AD-H; Подвижная фаза: 60% н-гептан (+0,2% TFA), В: 40% IPA; DAD: 245 нм]: Время удерживания пика: 9,1 мин.
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 8,95 (s, 1H), 7,77 (d, J=8,3 Гц, 2H), 7,74-7,67 (m, J=8,3 Гц, 2H), 7,67-7,58 (m, J=7,8 Гц, 2H), 7,17 (d, J=7,8 Гц, 2H), 3,82 (d, J=13,7 Гц, 1Н), 3,38 (d, J=14,2 Гц, 1Н), 3,16 (dd, J=5,4, 8,8 Гц, 1Н), 2,82 (d, J=12,2 Гц, 1Н), 2,36-2,14 (m, 3H), 2,03-1,88 (m, 2H), 1,30-1,21 (m, 2H), 1,21-1,07 (m, 2H)
Пример 19: 4-(1-(4,4-дифтор-1-(3-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойная кислота (одиночный энантиомер) (Е19)
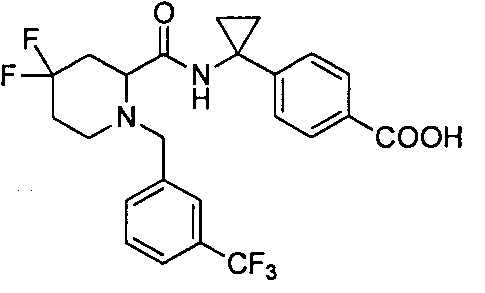
К раствору метил 4-(1-(4,4-дифтор-1-(3-(трифторметил)бензил)пиперидин-2-карбоксамидо)-циклопропил)-бензоата (энантиомер 1) (D138a) (35 мг, 0,07 ммоль) в диоксане (3 мл) и воде (1 мл) добавляли LiOH H2O (12 мг, 0,28 ммоль) и смесь оставляли перемешиваться при RT в течение 4 часов. Диоксан упаривали, затем добавляли к водному слою 2 М HCl, до достижения значения pH раствора, равного ~4. Вододную фазу экстрагировали этилацетатом (40 мл), органическую фазу промывали водой (10 мл), сушили над Na2SO4 и упаривали в титульное соединение (Е19) (34 мг)
MS: (ES/+) m/z: 483 [МН+] C24H23F5N2O3 предусматривает 482,16
Хиральная ВЭЖХ [DAICEL AD-H; Подвижная фаза: 60% н-гептан (+0,2% TFA), В: 40% IPA; DAD: 245 нм]: Время удерживания пика: 9,0 мин.
1H ЯМР (400 МГц, CDCl3) δ (м.д.): 7,98 (d, J=8,8 Гц, 2H), 7,60 (s, 1Н), 7,57-7,44 (m, 3H), 7,36 (s, 1H), 7,31 (s, 1H), 3,83 (s, 1H), 3,43 (s, 1H), 3,32-3,24 (m, 1H), 3,04-2,95 (m, 1H), 2,52 (t, J=10,3 Гц, 1H), 2,45-2,33 (m, 1H), 2,31-2,14 (m, 1H), 2,06-1,90 (m, 2H), 1,41-1,35 (m, 2H), 1,33-1,21 (m, 3H)
Пример 20: 4-(1-(4,4-дифтор-1-(3-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил) бензойная кислота (одиночный энантиомер) (Е20)
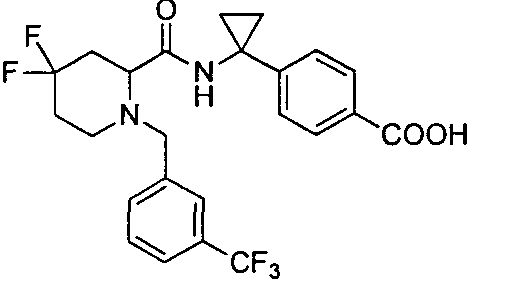
Титульное соединение (Е20) (37 мг) получали, следуя той же процедуре, что и описанная в примере 19, начиная с метил 4-(1-(4,4-дифтор-1-(3-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоата (энантиомер 2) (D138b) (45 мг).
MS: (ES/+) m/z: 483 [MH+] C24H23F5N2O3 предусматривает 482,16
Хиральная ВЭЖХ [DAICEL AD-H; Подвижная фаза: 70% н-гептан (+0,2% TFA), В: 30% IPA; DAD: 245 нм]: Время удерживания пика: 10,2 мин.
1H ЯМР (400 МГц, CDCl3) δ (м.д.): 7,98 (d, J=8,3 Гц, 2H), 7,63-7,58 (m, 1H), 7,56-7,44 (m, 3H), 7,36 (s, 1H), 7,31 (s, 1H), 3,88-3,80 (m, 1H), 3,45-3,37 (m, 1H), 3,31-3,22 (m, 1H), 3,04-2,93 (m, 1H), 2,57-2,47 (m, 1H), 2,44-2,32 (m, 1H), 2,31-2,17 (m, 1H), 2,05-1,90 (m, 2H), 1,42-1,34 (m, 2H), 1,33-1,20 (m, 4H)
Пример 21: 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензойная кислота (рацемическая смесь) (Е21)
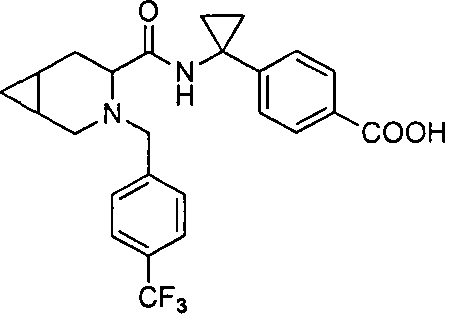
Титульное соединение (Е21) (19 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (Способ D), начиная с метил 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензоата (D139) (25 мг). (LiOH H2O: 4 экв.; Время реакции: 10 часов)
MS: (ES/+) m/z: 457,1 [МН+] C25H25F3N2O3 предусматривает 458,18
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 12,74 (br. s., 1H), 8,63 (s, 1H), 7,78 (dd, J=1,5, 8,3 Гц, 2H), 7,68 (d, J=7,8 Гц, 2H), 7,59 (d, J=7,8 Гц, 2H), 7,20-7,04 (m, 2H), 3,70 (d, J=13,7 Гц, 1H), 3,56 (d, J=13,7 Гц, 1H), 3,16 (dd, J=5,6, 12,5 Гц, 1H), 2,98 (t, J=5,4 Гц, 1H), 2,35-2,29 (m, 1H), 2,18 (td, J=6,8, 13,3 Гц, 1H), 1,68 (d, J=14,2 Гц, 1H), 1,27-1,22 (m, 2H), 1,19-1,06 (m, 2H), 0,98 (d, J=18,6 Гц, 2H), 0,67 (dt, J=4,4, 7,6 Гц, 1H), 0,22 (d, J=4,4 Гц, 1H).
Пример 22: 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензойная кислота (одиночный неизвестный диастереоизомер с относительной стереохимией анти) (Е22)
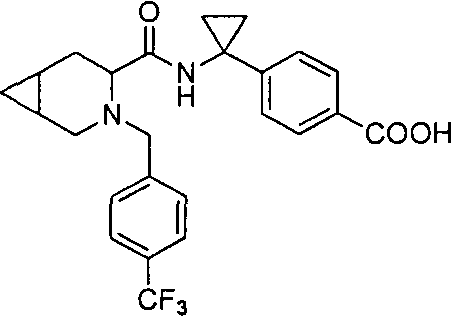
Титульное соединение (Е22) (65 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (Способ D), начиная с метил 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензоата (D140a) (72 мг). (LiOH H2O: 4 экв.; Время реакции: 10 часов)
MS: (ES/+) m/z: 457,1 [MH+] C25H25F3N2O3 предусматривает 458,18
Хиральная ВЭЖХ: [«Regis Welk 01 (SS)»; Подвижная фаза: 70% н-гептан (+0,1% АсОН), В: 30% IPA; DAD: 254 нм]: Время удерживания пика: 30 мин
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 13,31-12,10 (m, 1H), 8,69-8,59 (m, 1H), 7,78 (d, J=8,8 Гц, 2H), 7,74-7,65 (m, J=7,8 Гц, 2H), 7,65-7,55 (m, J=8,3 Гц, 2H), 7,16 (d, J=8,3 Гц, 2H), 3,70 (d, J=14,2 Гц, 1H), 3,56 (d, J=14,2 Гц, 1H), 3,16 (dd, J=6,8, 12,2 Гц, 1H), 2,98 (t, J=6,1 Гц, 1H), 2,31 (dd, J=3,9, 12,2 Гц, 1H), 2,18 (td, J=6,7, 13,9 Гц, 1H), 1,73-1,64 (m, 1H), 1,28-1,20 (m, 2H), 1,19-1,12 (m, 1H), 1,09 (dt, J=3,2, 6,2 Гц, 1H), 1,06-0,92 (m, 2H), 0,67 (dt, J=4,4, 8,3 Гц, 1H), 0,22 (q, J=4,4 Гц, 1H)
Пример 23: 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензойная кислота (одиночный неизвестный диастереоизомер с относительной стереохимией анти) (Е23)
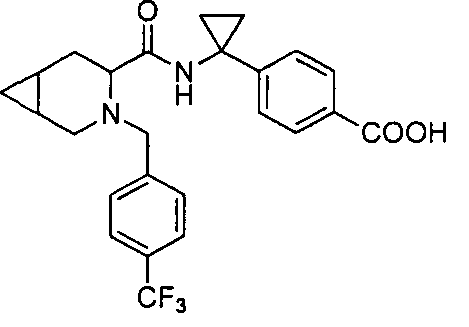
Титульное соединение (Е23) (56 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (Способ D), начиная с метил 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензоата (D140b) (74 мг). (LiOH H2O: 4 экв.; Время реакции: 10 часов)
MS: (ES/+) m/z: 457,1 [МН+] C25H25F3N2O3 предусматривает 458,18
Хиральная ВЭЖХ: [«Regis Welk 01 (SS)»; Подвижная фаза: 70% н-гептан (+0,1% АсОН), В: 30% IPA; DAD: 254 нм]: Время удерживания пика: 30,3 мин
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 12,64 (br. s., 1H), 8,63 (s, 1H), 7,78 (d, J=8,8 Гц, 2H), 7,72-7,65 (m, J=8,3 Гц, 2H), 7,63-7,55 (m, J=8,3 Гц, 2H), 7,16 (d, J=8,3 Гц, 2H), 3,74-3,66 (m, 1H), 3,61-3,53 (m, 1H), 3,16 (dd, J=6,8, 12,2 Гц, 1H), 2,98 (t, J=6,1 Гц, 1Н), 2,31 (dd, J=4,2, 12,5 Гц, 1Н), 2,18 (td, J=6,7, 13,9 Гц, 1Н), 1,73-1,64 (m, 1H), 1,28-1,21 (m, 2H), 1,19-1,13 (m, 1Н), 1,12-1,06 (m, 1Н), 1,06-0,92 (m, 2H), 0,67 (dt, J=4,2, 8,2 Гц, 1H), 0,22 (q, J=4,6 Гц, 1H).
Пример 24: 4-(1-(3-(3-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензойная кислота (рацемическая смесь) (Е24)
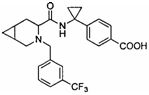
Титульное соединение (Е24) (32 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ D) исходя из (метил 4-(1-(3-(3-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-карбоксамидо)циклопропил)бензоата (D141) (53 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 459,2 [MH+] C25H25F3N2O3 предусматривает 458,18
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 12,81-12,62 (m, 1Н), 8,77-8,56 (m, 1Н), 7,99-7,45 (m, 5H), 7,27-7,08 (m, 2H), 3,80-3,66 (m, 1H), 3,61-3,49 (m, 1H), 3,24-3,11 (m, 1H), 3,03-2,94 (m, 1H), 2,39-2,29 (m, 1H), 2,26-2,10 (m, 1H), 1,75-1,58 (m, 1H), 1,33-1,21 (m, 2H), 1,19-1,07 (m, 2H), 1,05-0,90 (m, 2H), 0,73-0,61 (m, 1H), 0,26-0,17 (m, 1H).
Пример 25: 4-(1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[4.1.0]гептан-3-карбоксамидо)циклопропил)бензойная кислота (смесь диастереоизомеров) (Е25)
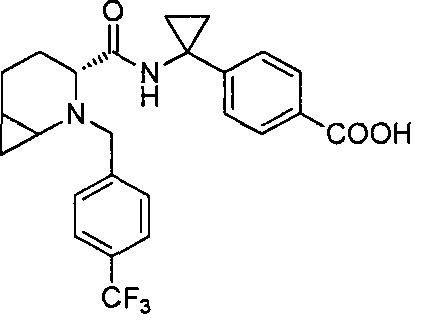
Титульное соединение (Е25) (4,9 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (Способ D), начиная с метил 4-(1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло [4.1.0]гептано-3-карбоксамидо)циклопропил)бензоата (смесь диастереоизомеров) (D142) (6,8 мг). (LiOH H2O: 4 экв.; Время реакции: 10 часов)
MS: (ES/+) m/z: 459,1 [МН+] C25H25F3N2O3 предусматривает 458,18
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 8,02-7,84 (m, 2H), 7,67 (m, 5H), 7,31-7,16 (m, 2H), 3,92 (s, 1H), 3,85 (s, 1H), 3,15-2,91 (m, 1H), 2,66-0,82 (m, 10 H under residual solvent), 0,64-0,39 (m, 2H).
Пример 26 4-((1S)-1-((3R)-2-(4-(трнфторметил)бензил)-2-азабицикло[4.1.0]гептан-3-карбоксамидо)этил)бензойная кислота (смесь диастереоизомеров) (Е26)

Титульное соединение (Е26) (7,2 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ D), начиная с метил 4-((1S)-1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[4.1.0]гептано-3-карбоксамидо)этил)бензоата (смесь диастереоизомеров) (D143) (10 мг). (LiOH H2O: 4 экв.; Время реакции: 10 часов)
MS: (ES/+) m/z: 447,2 [МН+] C24H25F3N2O3 предусматривает 446,18
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,99 (t, J=9,2 Гц, 2H), 7,74-7,29 (m, 7H), 5,06 (m, 1H), 4,03-3,69 (m, 2H), 3,11-2,93 (m, 1H), 2,58-0,77 (9H под остаточным растворителем), 0,52 (m, 2H).
Пример 27: 4-((S)-1-((R)-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)-бензоат лития (Е27)
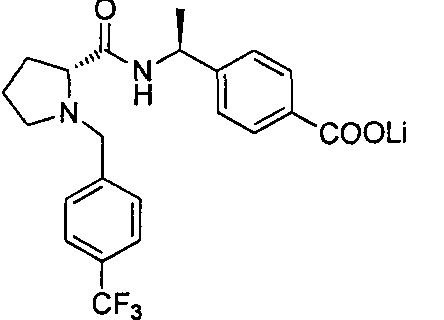
Титульное соединение (Е27) (47 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ А), начиная с метил 4-((S)-1-((R)-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензоата (D144) (50 мг). (LiOH H2O: 1,2 экв.; Время реакции: 5 часов, 70°C)
MS: (ES/+) m/z: 421,2 [M-Li+2H+] C22H22F3LiN2O3 предусматривает 426,17
Хиральная ВЭЖХ [«Phenomenex Lux Cellulose-1»; Подвижная фаза: 70% н-гексан (0,5% TFA), В: 30% EtOH; DAD: 230 нм]: Время удерживания пика: 8,15 мин.
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,95-7,90 (m, J=8,3 Гц, 2H), 7,69-7,63 (m, J=7,8 Гц, 2H), 7,60-7,55 (m, J=8,3 Гц, 2H), 7,33-7,27 (m, J=7,8 Гц, 2H), 4,97-4,90 (m, 1Н), 3,88 (d, J=13,2 Гц, 1Н), 3,74 (d, J=12,7 Гц, 1Н), 3,22 (dd, J=4,4, 9,8 Гц, 1Н), 3,18-3,11 (m, 1H), 2,49 (d, J=6,8 Гц, 1H), 2,21 (br. s,, 1H), 1,87-1,76 (m, 3H), 1,36 (d, J=6,8 Гц, 3H)
Пример 28: 4-((S)-1-((R)-1-(4-фторбензил)пирролидин-2-карбоксамидо)этил)-бензоата лития (Е28)
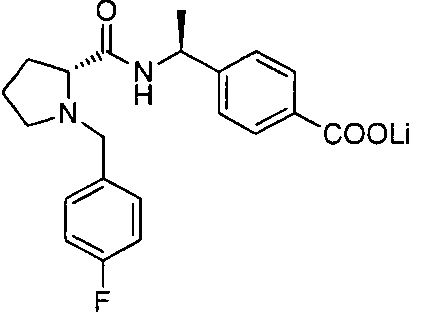
Титульное соединение (Е28) (13 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ А), начиная метил 4-((S)-1-((R)-1-(4-фторбензил)пирролидин-2-карбоксамидо)этил)бензоата (D145) (22 мг). (LiOH H2O: 1,2 экв.; Время реакции: 5 часов, 70°C)
MS: (ES/+) m/z: 370,9 [M-Li+2H+] C21H22FLiN2O3 предусматривает 376,18
Хиральная ВЭЖХ [DAICEL OD-H; Подвижная фаза: 70% н-гексан (0,5% TFA), В: 30% EtOH; DAD: 230 нм]: Время удерживания пика: 8,7 мин.
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,97-7,89 (m, J=7,8 Гц, 2H), 7,37 (dd, J=5,9, 8,3 Гц, 2H), 7,32-7,26 (m, J=8,3 Гц, 2H), 7,07 (t, J=8,8 Гц, 2H), 4,96-4,90 (m, 1Н), 3,77 (d, J=12,7 Гц, 1Н), 3,66 (d, J=12,7 Гц, 1Н), 3,23-3,06 (m, 2H), 2,57-2,37 (m, 1H), 2,27-2,10 (m, 1H), 1,89-1,68 (m, 3H), 1,39 (d, J=6,8 Гц, 3H)
Пример 29: 4-(1-((1R,3R,5R)-2-(3-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензойная кислота (син диастереоизомер) (Е29)
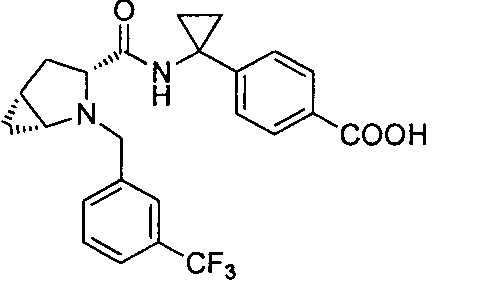
Титульное соединение (Е29) (52 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (Способ D), начиная с метил 4-(1-((3R)-2-(3-(трифторметил)бензил)-2-азабицикло[3.1,0]гексан-3-карбоксамидо)циклопропил)бензоата (D146) (60 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 445,2 [МН+] C24H23F3N2O3 предусматривает 444,17
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 12,85-12,69 (m, 1Н), 8,41-8,32 (m, 1Н), 7,91-7,81 (m, 2H), 7,80-7,71 (m, 2H), 7,70-7,54 (m, 2H), 7,06-6,96 (m, 2H), 4,08-3,95 (m, 1H), 3,87-3,75 (m, 1H), 3,59-3,48 (m, 1H), 2,80-2,70 (m, 1H), 2,20-2,08 (m, 1H), 2,04-1,94 (m, 1H), 1,48-1,38 (m, 1H), 1,32-1,23 (m, 1H), 1,22-1,13 (m, 1H), 1,12-1,01 (m, 2H), 0,53-0,41 (m, 1H), 0,25-0,12 (m, 1H).
Пример 30: 4-(1-((1R,3R,5R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензойная кислота (Е30)
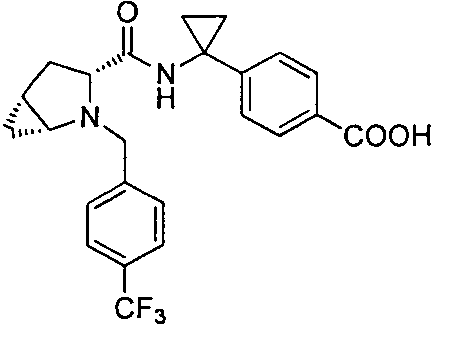
Титульное соединение (Е30) (2,25 г) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ D), начиная с метил 4-(1-((1R,3R,5R)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензоата (D147) (2,4 г)
MS: (ES/+) m/z: 445 [МН+] C23H23F3N2O3 предусматривает 444,17
Хиральная ВЭЖХ [«Regis Welk 01 (SS)»; Подвижная фаза: 70% н-гептан (+0,1% АсОН), В: 30% IPA; DAD: 245 нм]: Время удерживания пика: 32,8 мин.
1H ЯМР (400 МГц, DMSO-d6) δ (м.д.): 12,73 (br. s., 1H), 8,34 (s, 1H), 7,92-7,62 (m, 6H), 7,01 (d, J=8,2 Гц, 2H), 4,01 (d, J=13,8 Гц, 1H), 3,79 (d, J=13,3 Гц, 1H), 3,54 (d, J=9,5 Гц, 1H), 2,82-2,65 (m, 1H), 2,28-2,11 (m, 1H), 2,09-1,92 (m, 1H), 1,50-1,37 (m, J=3,5 Гц, 1H), 1,35-1,24 (m, J=5,9 Гц, 1H), 1,23-0,99 (m, 3H), 0,55-0,38 (m, J=7,0 Гц, 1H), 0,28-0,09 (m, 1H)
Пример 31: 4-(1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензойная кислота (одиночный неизвестный диастереоизомер) (Е31)
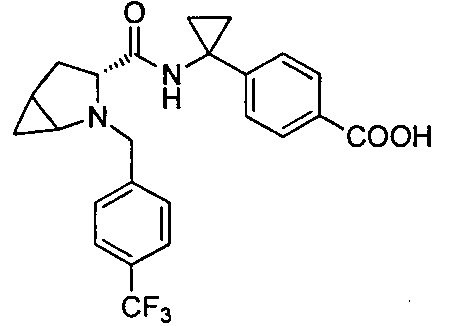
Титульное соединение (Е31) (46 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с метил 4-(1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензоата (Диастереоизомер 2) (D148) (100 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 445,3 [МН+] C24H23F3N2O3 предусматривает 444,17
Хиральная ВЭЖХ [«DAICEL AD-H»; Подвижная фаза: 60% н-гептан (+0,1% TFA), В: 40% IPA; DAD: 245 нм]: Время удерживания пика: 12,91 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,50-8,09 (br. s., 1H), 7,98 (d, J=8,1 Гц, 2H), 7,91-7,78 (m, 1H), 7,63 (d, J=7,8 Гц, 2H), 7,48 (d, J=7,7 Гц, 2H), 7,31-7,14 (m, 2H), 3,77 (d, J=13,0 Гц, 1H), 3,66-3,41 (m, 1H), 2,97 (t, J=8,7 Гц, 1H), 2,70 (br. s., 1H), 2,54 (dd, J=8,1, 12,5 Гц, 1Н), 2,09-1,93 (m, 1H), 1,54-1,35 (m, 2H), 1,36-1,21 (m, 2H), 1,21-1,11 (m, 1H), 0,63 (br. s., 1H), 0,36-0,20 (m, 1H)
Пример 32 4-((1S)-1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)этил)бензойная кислота (смесь диастереоизомеров) (Е32)
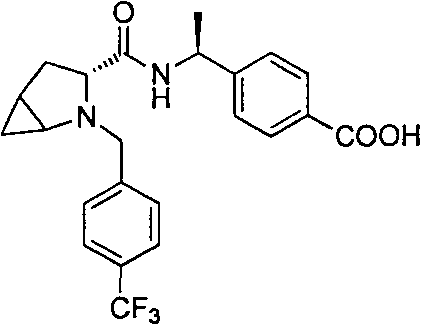
Титульное соединение (Е32) (12,3 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с метил 4-((1S)-1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)этил)бензоата (D149) (14 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 433,4 [МН+] C23H23F3N2O3 предусматривает 432,17
Хиральная ВЭЖХ [DAICEL AD-H; Подвижная фаза: 70% н-гептан 0,2% (+TFA), В: 30% этанол; DAD: 245 нм]: Время удерживания пика 1; 10,28 мин; Время удерживания пика 2: 11,35 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,09 (d, J=7,8 Гц, 4H), 7,80 (d, J=8,4 Гц, 1H), 7,71-7,61 (m, 4H), 7,57-7,46 (m, 5H), 7,44-7,36 (m, 4H), 5,17-4,93 (m, 2H), 3,99 (d, J=13,3 Гц, 1H), 3,83 (d, J=13,0 Гц, 1H), 3,76 (d, J=13,3 Гц, 1H), 3,64-3,47 (m, 2H), 2,97 (t, J=8,8 Гц, 1H), 2,75-2,60 (m, 2H), 2,48 (dd, J=8,0, 12,6 Гц, 1H), 2,33-2,15 (m, 2H), 1,99-1,85 (m, 1H), 1,54-1,48 (m, J=4,3 Гц, 1H), 1,45 (d, J=6,7 Гц, 4H), 1,41 (d, J=6,9 Гц, 3H), 0,64 (br. s., 1H), 0,44 (q, J=7,3 Гц, 1H), 0,33-0,16 (m, 1H), 0,02 (br. s., 1H).
Пример 33: 4-((1S)-1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)этил)бензойной кислоты (одиночный неизвестный диастереоизомер) (Е33)
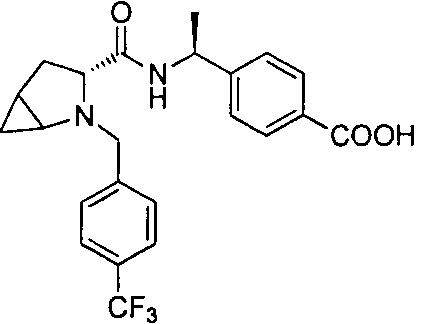
Титульное соединение (Е33) (62 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с метил 4-((1S)-1-((3R)-1-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)этил)-бензоата (одиночный диастереоизомер 1) (D150) (72 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 433,4 [MH+] C23H23F3N2O3 предусматривает 432,17
Хиральная ВЭЖХ [DAICEL AD-H; Подвижная фаза: 70% н-гептан (+0,2% TFA), В: 30% этанол; DAD: 245 нм]: Время удерживания пика: 10,77 мин.
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,08 (d, J=8,0 Гц, 2H), 7,67 (d, J=7,7 Гц, 2H), 7,57-7,34 (m, 5H), 5,18-4,97 (m, 1Н), 3,95-3,74 (m, 1Н), 3,70-3,46 (m, 1Н), 3,04-2,87 (m, 1Н), 2,83-2,61 (m, 1Н), 2,58-2,37 (m, 1Н), 1,98-1,87 (m, 1Н), 1,66-1,60 (m, 1Н), 1,46 (d, J=6,9 Гц, 3H), 0,73-0,54 (m, 1Н), 0,34-0,18 (m, 1H)
Пример 34: (R)-4-(1-(4,4-диметил-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)циклопропил)бензойная кислота (Е34)
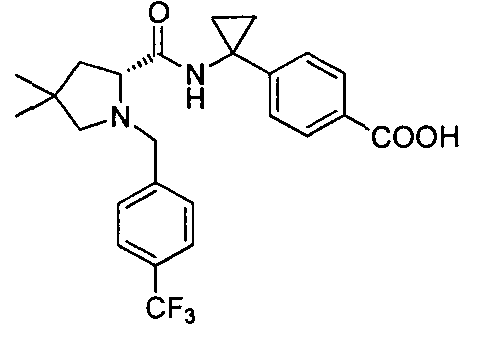
(R)-метил 4-(1-(4,4-диметил-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)циклопропил)бензоат (D151) (100 мг, 0,21 ммоль) разделяли между диоксаном (2 мл) и водой (2 мл) перед добавлением LiOH H2O (35 мг, 0,84 ммоль) и перемешивали полученную смесь при RT в течение 18 часов. Диоксан упаривали и водный раствор подкисляли уксусной кислотой до pH ~4-5. Белый твердый осадок отфильтровывали, сушили в вакууме, затем повторно растворяли в диоксане (2 мл) и воде (2 мл) и гидролизовали в течение дополнительных 5 часов после добавления LiOH H2O (18 мг, 0,42 ммоль). Диоксан упаривали, и водный раствор подкисляли уксусной кислотой до pH ~4-5. Белый твердый осадок фильтровали и сушили в вакууме, получая титульное соединение (Е34) (35,5 мг).
MS: (ES/+) m/z: 461,3 [МН+] C25H27F3N2O3 предусматривает 460,20
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,91 (d, J=8,3 Гц, 2H), 7,70-7,54 (m, 4H), 7,22 (d, J=7,8 Гц, 2H), 4,92-4,74 (m, 1H), 3,97-3,84 (m, 1H), 3,83-3,71 (m, 1H), 3,00-2,89 (m, 1H), 2,48-2,37 (m, 1H), 2,22-2,06 (m, 1H), 1,82-1,66 (m, 1H), 1,38-1,24 (m, 2H), 1,19 (s, 3H), 1,11 (s, 5H)
Пример 35: 4-((1S)-1-(1-(4-(трифторметил)бензил)азетидин-2-карбоксамидо)этил)бензойная кислота (смесь диастереоизомеров) (Е35)
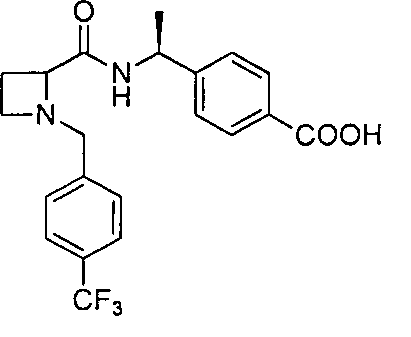
Титульное соединение (Е35) (1,6 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с метил 4-((1S)-1-(1-(4-(трифторметил)бензил)азетидин-2-карбоксамидо)этил)бензоата (D152a) (6 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+)m/z: 407,3 [MH+] C21H21F3N2O3 предусматривает 406,15
Пример 36: 4-((1S)-1-(1-(4-(трифторметил)бензил)азетидин-2-карбоксамидо)этил)бензойная кислота (одиночный неизвестный диастереоизомер) (Е36)
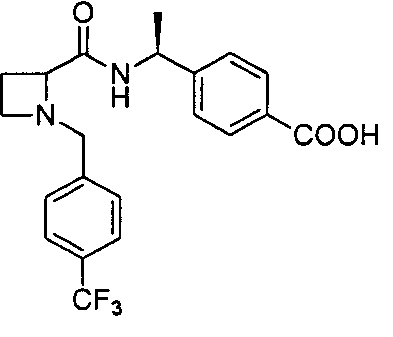
Титульное соединение (Е36) (2 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с метил 4-((1S)-1-(1-(4-(трифторметил)бензил)азетидин-2-карбоксамидо)этил)-бензоата (диастереоизомер 2) (D152b) (7 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 407,3 [МН+] C21H21F3N2O3 предусматривает 406,15
1H ЯМР (400 МГц, CHCl3-d) δ (м.д.): 8,02 (br. s., 2H), 7,61 (br. s., 2H), 7,41 (d, J=5,4 Гц, 3H), 7,21 (br. s., 2H), 4,96 (br. s., 1H), 3,86-3,71 (m, 3H), 3,43 (br. s., 1H), 3,11 (br. s., 1H), 2,43 (br. s., 1H), 2,07 (br. s., 1H), 1,16 (br. s., 3H)
Пример 37: 4-((1S)-1-(3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоксамидо)этил)-бензойная кислота (диастереоизомер 2 с относительной стереохимией син)
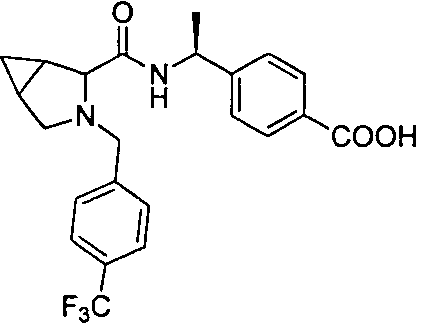
К смеси метил 4-((1S)-1-(3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоксамидо)этил)бензоата (D153) (84 мг, 0,19 ммоль) в смеси диоксан/вода 1:1 добавляли LiOH H2O (12 мг, 0,28 ммоль) и нагревали реакционную смесь при 150°C при микроволновом облучении в течение 5 мин. Диоксан упаривали и водную фазу подкисляли CH3CO2H. Осадок (58 мг) отфильтровывали и подвергали разделению хиральной ВЭЖХ (Условия препаративной хроматографии: Колонка: «DAICEL AD-H»; Подвижная фаза: н-гептан/EtOH/TFA 60%/40%/0,2% объем/объем; DAD: 235 нм). Выпаривание растворителя второго пика, элюированного с хиральной колонки, давало титульное соединение (Е37) (30 мг)
(Е37) (диастереоизомер 2 с относительной конфигурацией син): время удерживания: 9,28 мин.
MS: (ES/+) m/z: 433 [MH+] C23H23F3N2O3 предусматривает 432,17
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 8,03 (s, 2H), 7,66-7,55 (m, 4H), 7,38 (s, 2H), 5,00-4,92 (m, 1H), 4,55-4,47 (m, 1H), 4,45-4,38 (m, 1H), 4,37-4,30 (m, 1H), 3,68 (br. s., 2H), 2,31-2,21 (m, 1H), 2,02-1,90 (m, 1H), 1,47 (d, J=6,9 Гц, 3H), 0,96-0,88 (m, 1H), 0,88-0,79 (m, 1H).
Пример 38: 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоксамидо)циклопропил)бензойная кислота (одиночный неизвестный энантиомер с относительной стереохимией син)
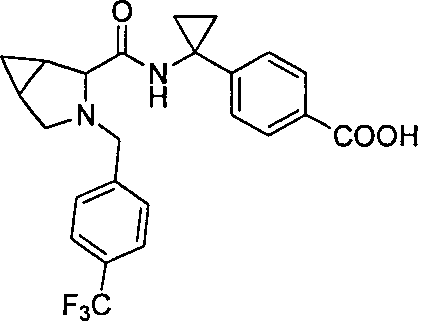
Титульное соединение (Е38) (4,8 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с метил 4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[3.1.0]гексан-2-карбоксамидо)-циклопропил)-бензоата (диастереоизомер 1) (D154a) (5 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 445 [МН+] C24H23F3N2O3 предусматривает 444,17
Хиральная ВЭЖХ: [ADH-Подвижная фаза: 70% н-гептан (+0,2% TFA), В: 30% IPA; DAD: 235 нм]: Время удерживания пика: 10,5 мин
1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.): 7,88 (d, J=8,3 Гц, 2H), 7,64 (d, J=8,3 Гц, 2H), 7,53 (d, J=7,8 Гц, 2H), 7,24 (d, J=8,3 Гц, 2H), 3,82 (d, J=13,2 Гц, 1H), 3,51 (d, J=13,7 Гц, 1H), 3,09 (d,J=8,8 Гц, 1H), 2,59 (dd, J=4,4, 8,8 Гц, 1H), 1,82 (tt, J=3,9, 7,4 Гц, 1H), 1,62-1,53 (m, 1H), 1,41-1,22 (m, 4H), 1,20-1,12 (m, 2H), 1,10-1,04 (m, 1H), 0,55 (dt, J=4,9, 7,8 Гц, 1H)
Пример 39: 4-((1S)-1-(2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоксамидо)этил)бензойная кислота (смесь диастереоизомеров) (Е39)
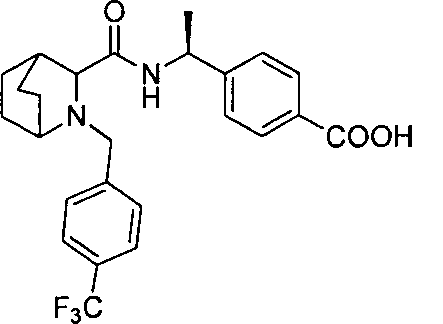
Титульное соединение (Е39) (11,04 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с метил 4-((1S)-1-(2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоксамидо)этил)-бензоата (D155) (11,3 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 461,4 [МН+] C25H27F3N2O3 предусматривает 460,20
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,98 (d, J=7,5 Гц, 2H), 7,69 (d, J=7,5 Гц, 2H), 7,64-7,58 (m, 2H), 7,37 (d, J=7,6 Гц, 2H), 4,89 (d, J=7,2 Гц, 1Н), 3,96 (d, J=1,0 Гц, 1Н), 3,73 (d, J=1,0 Гц, 1Н), 3,13 (br. s., 1Н), 2,83 (br. s., 1Н), 2,24-2,09 (m, 1Н), 1,89-1,56 (m, 5H), 1,54-1,34 (m, 3H), 1,27 (d, J=6,7 Гц, 3H).
Пример 40: 4-(1-(2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоксамидо)циклопропил)бензойная кислота (смесь диастереоизомеров) (Е40)
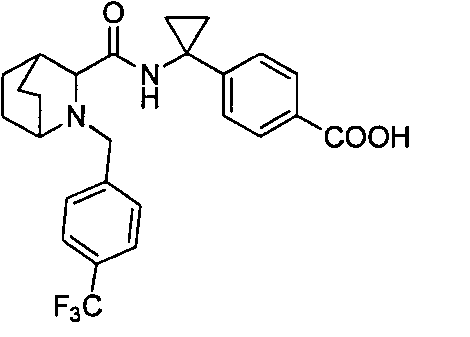
Титульное соединение (Е40) (8,03 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с метил 4-(1-(2-(4-(трифторметил)бензил)-2-азабицикло[2.2.2]октан-3-карбоксамидо)циклопропил)бензоата (D156) (7,6 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 473,4 [МН+] C26H27F3N2O3 предусматривает 472,20
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,91-7,82 (m, J=1,0 Гц, 2H), 7,71-7,57 (m, 4H), 7,19-7,10 (m, 2H), 3,94 (d, J=1,0 Гц, 1Н), 3,73 (d, J=1,0 Гц, 1Н), 3,13-3,08 (m, 1Н), 2,90-2,82 (m, 1Н), 2,24-2,13 (m, 1Н), 2,02-1,91 (m, 1Н), 1,90-1,56 (m, 4H), 1,55-1,45 (m, 3H), 1,23-1,11 (m, 2H), 1,06-0,97 (m, 1Н), 0,96-0,91 (m, 1H).
Пример 41: (R)-4-(1-(2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензойная кислота (Е41)
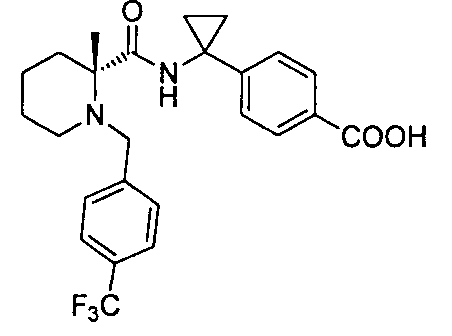
Титульное соединение (Е41) (3,9 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ С), начиная с (R)-метил. 4-(1-(2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоата (D157) (5 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов).
MS: (ES/+) m/z: 461 [МН+] C25H27F3N2O3 предусматривает 460,20
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,87-7,78 (m, 2H), 7,64 (s, 4H), 7,22-7,07 (m, 2H), 3,62-3,55 (m, 1H), 3,43-3,37 (m, 1H), 2,75-2,63 (m, 1H), 2,43-2,31 (m, 1H), 2,08-1,91 (m, 1H), 1,80-1,54 (m, 5H), 1,31 (s, 3H), 1,25-0,85 (m, 4H).
Пример 42: 4-((S)-1-((R)-2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензойная кислота (Е42)
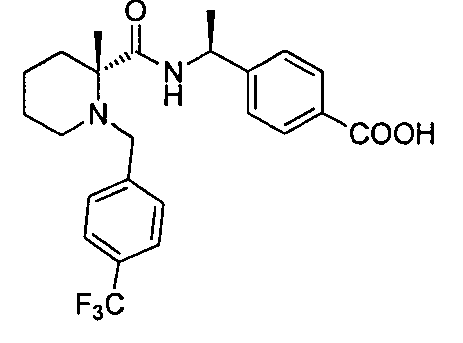
Титульное соединение (Е42) (4 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ В), начиная с метил 4-((S)-1-((R)-2-метил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензоата (D158) (10 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов).
MS: (ES/+) m/z: 449,4 [МН+] C24H27F3N2O3 предусматривает 448,20
1H ЯМР (400 МГц. MeOH-d4) δ (м.д.): 7,76 (d, J=7,8 Гц, 2H), 7,54 (br. s., 2H), 7,40 (br. s., 2H), 7,16 (d, J=7,8 Гц, 2H), 5,11-5,00 (m, 1H), 3,55-3,42 (m, 1H), 2,77-2,62 (m, 1H), 2,40-2,26 (m, 1H), 1,95-1,83 (m, 1H), 1,78-1,70 (m, 1H), 1,65 (br. s., 4H), 1,50 (d, J=6,8 Гц, 3H), 1,30 (s, 3H), 0,97-0,85 (m, 1H)
Пример 43: (R)-4-(1-(2-метил-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)циклопропил)бензойная кислота (Е43)
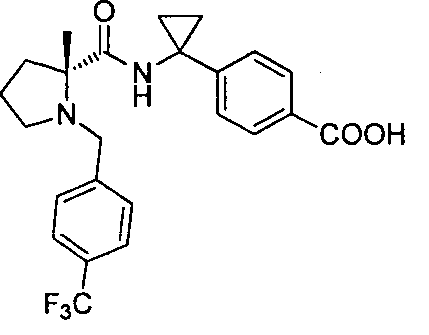
Титульное соединение (Е43) (11,2 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (Способ D), начиная с (R) -метил 4-(1-(2-метил-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)циклопропил)бензоата (D159) (13 мг). (LiOH H2O: 4 экв.; Время реакции: 18 часов).
MS: (ES/+) m/z: 449,4 [МН+] C24H27F3N2O3 предусматривает 448,20
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,90 (d, J=7,8 Гц, 2H), 7,71-7,63 (m, 2H), 7,62-7,57 (m, 2H), 7,25 (d, J=7,8 Гц, 2H), 3,90 (d, J=14,2 Гц, 1H), 3,58 (d, J=13,7 Гц, 1H), 3,05 (d, J=4,4 Гц, 1H), 2,54 (d, J=8,3 Гц, 1H), 2,27-2,14 (m, 1H), 1,96-1,82 (m, 3H), 1,45-1,17 (m, 8H)
Пример 44: 4-((S)-1-((2R,4S)-4-фтор-1-(3-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензоат лития (Е44)
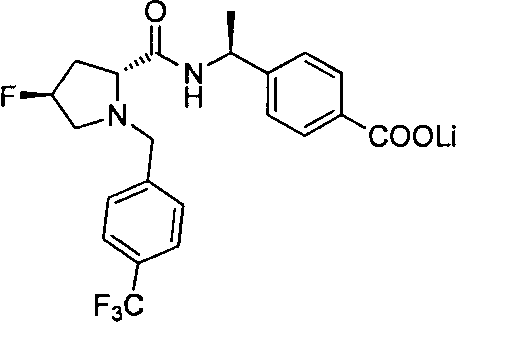
Титульное соединение (Е44) (50 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (способ А), начиная с 4-(трифторметил)бензил 4-((S)-1-((2R,4S)-4-фтор-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензоата (D163) (67,3 мг). (LiOH H2O: 3 экв.; Время реакции: 18 часов).
MS: (ES/+) m/z: 439,3 [M-Li+2H+] C22H21F4LiN2O3 предусматривает 444,16
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 7,91 (d, J=8,1 Гц, 2H), 7,67 (s, 2H), 7,60 (s, 2H), 7,29 (s, 2H), 5,27-5,06 (m, 1Н), 4,93-4,89 (m, 1H), 3,99-3,89 (m, 1H), 3,87-3,77 (m, 1H), 3,40-3,36 (m, 1H), 2,84-2,50 (m, 2H), 2,16-1,98 (m, 1H), 1,33 (d, J=7,0 Гц, 3H).
Пример 45: 4-((S)-1-((R)-4,4-дифтор-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензойная кислота (Е45)
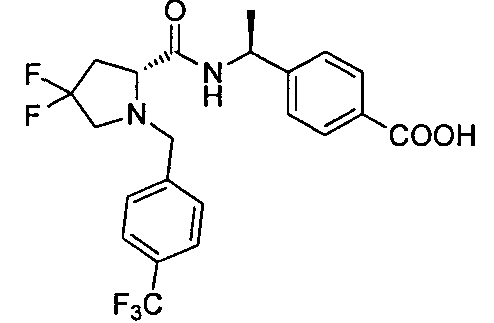
Титульное соединение (Е45) (12 мг) получали в соответствии с общей процедурой гидролиза сложных эфиров (Способ D), начиная с метил 4-((S)-1-((R)-4,4-дифтор-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамвдо)этил)бензоата (D166) (16,8 мг). (LiOH H2O: 3 экв.; Время реакции: 18 часов)
MS: (ES/+) m/z: 457,3 [MH+] C22H21F5N2O3 предусматривает 456,15
1H ЯМР (400 МГц, MeOH-d4) δ (м.д.): 8,00-7,88 (m, 2H), 7,71-7,48 (m, 6H), 7,40-7,25 (m, 2H), 5,07-4,92 (br. s., 1H), 3,97-3,47 (m, 4H), 2,98-2,58 (m, 2H), 2,42-2,18 (m, 1H), 1,49-1,25 (m, 3H).
Пример 46: Определение in vitro эффективности соединений по изобретению
Стабильная экспрессия человеческих рецепторов EP4 в клеточной пинии человеческой эмбриональной почки (HEK293).
кДНК клон человеческого рецептора EP4 (NM_000958.2) получили из «InvitrogenTM: Ultimate™ ORF Clone Collection» - Clone ID IOH46525. Кодирующую последовательность субклонировали в экспрессирующий вектор pcDNATM6,2/V5-DEST по технологии «Gateway» («InvitrogenTM»).
Человеческие клетки эмбриональной почки (HEK-293) стабильно трансфецировали экспрессирующим вектором с человеческим рецептором EP4 согласно способу, описанному в руководстве «FuGENE®6 Transfection Reagent′s manual» («Roche Applied Science®»).
Получение мембранной фракции:
Трансфецированные EP4 клетки выращивали в среде Дульбекко, модифицированной по Иглу, содержащей 10% эмбриональную бычью сыворотку и 10 мкг/мл Бластицидина S HCl (селекционная среда) при 37°C в увлажненной атмосфере с 5% CO2 в воздухе.
Для получения мембран клетки в культуральном флаконе собирали гипотоническим/механическим лизисом с охлажденным (4°C) буфером ТЕ (5 мМ TRIS, 5 мМ этилендиаминтетрауксусная кислота (EDTA), pH 7,4).
Клетки снимали и лизировали с помощью 10 мл гипотонического лизисного буфера и скребка. Клеточный лизат перемешивали на вибрационном смесителе в течение 30 секунд и центрифугировали при 40000 g при 4°C в течение 22 мин.
а) анализ связывания мембраны [3Н]-Простагландин Е2
Мембранный осадок ресуспендировали в том же буфере (5 мМ TRIS, мМ этилендиаминтетрауксусная кислота (EDTA), pH 7,4), и концентрацию белка определяли по методу Бредфорда (тест «Bio-Bad®»).
Этот мембранный препарат хранили в холодильнике на -80°C до применения в анализе связывания.
([3H]-PGE2) анализы связывания мембраны по отношению к hEP4 рецепторам (человеческий EP4/HEK293 трансфектант, см. выше) и hEP2 рецепторам (человеческий EP2/HEK.293 трансфектант, приобретенный у «PerkinElmer Inc») осуществляли в 10 мМ MES-KOH буфере pH 6, содержащем 10 мМ MgCl2 и 1 мМ CaCl2 для анализа связывания EP4 и 50 мМ Tris-Cl, BSA 0,5% для анализа связывания EP2 (согласно указаниям поставщика).
Десять микрограммов белка из мембранных фракций инкубировали в общем объеме 0,1 мл (EP4) или 0,2 мл (EP2) с 1 нМ (EP4) Или 3 нМ (EP2) [3H]-PGE2 («PerkinElmer Inc», 171 Ки/ммоль). В обоих тестах определения общего связывания или неспецифического связывания 1% DMSO или 1 мкМ простагландин E2 (EP4) или 100 мкМ (EP2) добавляли в соответствующие реакционные смеси. Инкубацию проводили в полипропиленовом 96-луночном планшете в течение 90 мин (EP4) или 60 мин (EP2) при комнатной температуре перед разделением связанного и свободного радиолиганда вакуумной одновременной быстрой фильтрацией на стекловолоконных фильтрах («Unifilter GFB96», «PerkinElmer Inc»), предварительно замоченных в 0,3% полиэтиленимине. Фильтры отмывали ледяным буфером pH 7,4 (50 мМ HEPES, NaCl 500 мМ, BSA 0,1% для анализа связывания EP4 или 50 мМ Tris-Cl для анализов связывания EP2) и остаточное связывание [3H]-PGE2 определяли твердофазным сцинциляционным счетчиком («TopCount», «PerkinElmer Inc»).
В стандартных конкурентных экспериментах соединения тестировали в диапазоне концентраций от 1 нМ до 1 мкМ, и определяли IC50. Аффинность (Ki) каждого соединения рассчитывали согласно уравнению Ченга-Прусова: Ki=IC50/(1+([C]/Kd)). Результаты выражали как pKi (- log 10 Ki (M))
Соединения из примеров 1-45 тестировали согласно способу примера 41 а в диапазоне конечных концентраций от 1 нМ до 1 мкМ. Все соединения демонстрировали аффинность с EP4 от хорошей до отличной, имея значения pKi от 6 до 8,9 для рецептора EP4.
b) анализ цАМФ на мембранах клеток, трансфецированных человеческим EP4.
Тест основан на конкуренции между эндогенным цАМФ и экзогенно добавленным биотинилированным цАМФ. Захват цАМФ достигается путем использования специфического антитела, конъюгированного с донорными микроносителями.
Клеточные мембраны, приготовленные как описано выше, ресуспендировали в 1 мл стимуляционного буфера (HBSS 1X + BSA 0,1% + IBMX 0,5 мМ + HEPES 5 мМ + MgCl2 10 мМ + GTP 1 нМ + GDP 10 µM + АТР 100 µМ - pH 7,4). Клеточные мембраны разливали в белые 384-луночные микропланшеты в конечной концентрации 1 мкг/лунку и использовали для определения цАМФ с помощью функционального теста «AlphaScreen® cAMP Assay» («EnVision» - «PerkinElmer»). Смесь клеточных мембран/микроносителей с анти-цАМФ акцептором (5 мкл) и смесь анализируемых соединений (растворенных в 100% ДМСО до конечной максимальной концентрации 0,01% ДМСО)/PGE2 (5 мкл) инкубировали при комнатной температуре (22-23°C) в течение 30 мин в темноте. Микроносители с биотинилированным цАМФ и донорные микроносители (15 мкл) распределяли в каждую лунку для начала реакции конкуренции. После 1 ч инкубации при RT (22-23°C) в темноте планшет считывали с помощью платформы «EnVision» для определения уровня цАМФ (возбуждение: 680 нм; эмиссия: 520, 620 нм).
В каждом эксперименте:
Стандартная кривая цАМФ (диапазон концентраций от 1×10-6 до 1×10-11 М в log интервалах) с отрицательным контролем (без цАМФ)
положительный контроль: форсколин 10 мкМ
Исследования антагонизма осуществляли путем стимуляции клеточной мембраны HEK293 с помощью PGE2 3 нМ. Сигнал «AlphaScreen» наносили на график как функцию log-концентрации цАМФ и определяли функциональное значение IC50. Значение IC50 рассчитывали линейной регрессией.
Некоторые соединения тестировали согласно способу примера 41b. Все соединения демонстрировали антагонизм к EP4 от хорошего до отличного, имея функциональные значения IC50 от 3 мкМ до 4 нМ для рецептора EP4.
Результаты анализа связывания мембран и анализа цАМФ на мембране клеток, трансфецированных человеческим EP4, для предпочтительных соединений суммированы в таблице 1.
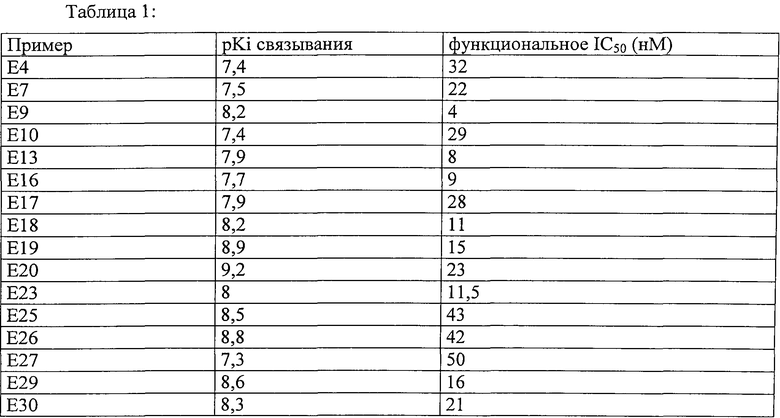
Пример 47: Определение PK соединений изобретения
Фармакокинетику соединений Е7, Е17 и Е18 исследовали на самцах крыс Хан Вистар. Крыс обрабатывали внутривенно и перорально (n=3 для каждого пути введения дозы) соединениями, приготовленными в растворах. Крыс оснащали канюлей, введенной в яремную вену, для последовательного отбора проб. Полный профиль получали для каждой крысы. Экстракты плазмы количественно анализировали с помощью специфического и чувствительного биоаналитического метода ЖХ-МС/МС. Межиндивидуальная изменчивость между тремя крысами в каждой группе была ограничена (CV для фармакокинетических параметров была ниже 50%).
После внутривенной инъекции все соединения демонстрируют средний объем распределения (Vss) в диапазоне от 400 до 2000 мл. Диапазон значений клиренса был получен для другой структуры, начиная от низкого до среднего значений (от 43 до 250 мл/ч).
После перорального введения, абсорбция была достаточно быстрой с четкой максимальной концентраций, достигнутой до временной точки первого отбора образцов, соответствующей 15 минутам, для всех соединений. Абсолютная пероральная биодоступность была хорошей для всех соединений с F% около 80% или выше.
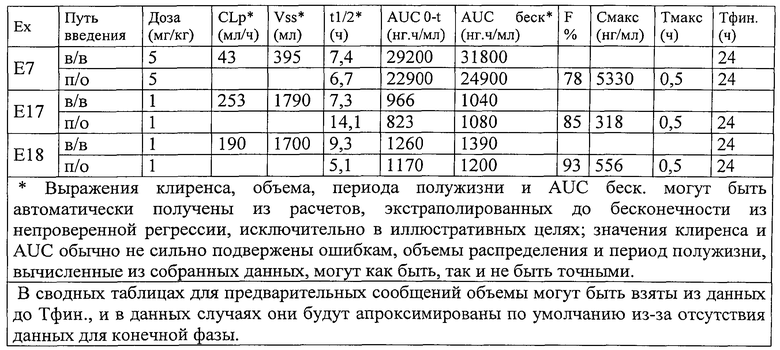
| название | год | авторы | номер документа |
|---|---|---|---|
| 5-ЗАМЕЩЕННЫЕ ИНДАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2008 |
|
RU2487873C2 |
| НОВЫЕ ЗАМЕЩЕННЫЕ БИАРИЛОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ИНДОЛАМИН-2,3-ДИОКСИГЕНАЗЫ (IDO) | 2018 |
|
RU2786586C2 |
| СПОСОБ ЛЕЧЕНИЯ | 2012 |
|
RU2621148C2 |
| АНТАГОНИСТЫ ЕР4 | 2016 |
|
RU2761341C2 |
| МОДУЛЯТОРЫ ЯДЕРНЫХ РЕЦЕПТОРОВ | 2016 |
|
RU2715897C2 |
| Соединения 1-циано-пирролидинов в качестве ингибиторов USP30 | 2016 |
|
RU2717238C2 |
| НОВЫЕ СОЕДИНЕНИЯ - АНТАГОНИСТЫ РЕЦЕПТОРА НЕЙРОКИНИНА 1 | 2013 |
|
RU2631319C2 |
| ИЗОИНДОЛИНОНОВЫЕ ИНГИБИТОРЫ ВЗАИМОДЕЙСТВИЯ MDM2-P53, ОБЛАДАЮЩИЕ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2794333C1 |
| АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP | 2015 |
|
RU2672722C2 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
Изобретение относится к новым производным циклических аминов, обладающих активностью антагонистов рецептора ЕР4, способам их получения, фармацевтическим композициям, содержащим такие соединения, и их применению в качестве лекарственных средств, для лечения или облегчения заболеваний, опосредованных простагландином Е, таких как острая или хроническая боль, остеоартрит, ассоциированные с воспалением нарушения, такое как артрит, ревматоидный артрит, злокачественное новообразование, мигрень и эндометриоз. 4 н. и 25 з.п. ф-лы, 2 табл., 47 пр.
1. Соединение циклического амина Формулы (I):
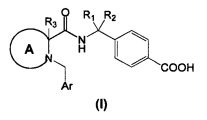
или его фармацевтически приемлемая соль или производное,
где А выбрано из группы, состоящей из
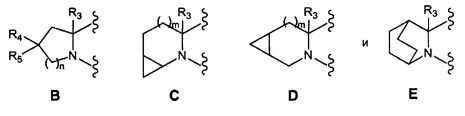
где n=0, 1 или 2,
m=0 или 1,
R1 и R2 независимо представляют собой водород, линейный или разветвленный C1-3алкил или объединены друг с другом с образованием циклопропильного кольца;
R3 представляет собой Н или линейный или разветвленный C1-3алкил;
R4 и R5 независимо представляют собой водород, фтор, линейный или разветвленный C1-3алкил или объединены друг с другом с образованием циклопропильного кольца,
Ar представляет собой
- фенил, содержащий:
i) в положении 4 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила, или
ii) в положении 3 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила, при условии, что
ii.a) если А является В, то и R4, и R5 являются фтором, линейным или разветвленным C1-3алкилом или объединены вместе с образованием циклопропильного кольца,
ii.b) если А представляет собой С, то m равно 0,
ii.c) если А представляет собой D, то m равно 1,
- 5-членное гетероароматическое кольцо, содержащее от 1 до 3 гетероатомов, где указанные гетероатомы независимо друг от друга представляют собой S, О или N; или
- 6-членное гетероароматическое кольцо, содержащее от 1 до 3 атомов N.
2. Соединение циклического амина формулы (I) по п. 1, где Ar представляет собой фенил, содержащий в положении 4 один заместитель, выбранный из фтора, циано или трифторметила.
3. Соединение циклического амина формулы (I) по п. 2, где R1 представляет собой водород, a R2 представляет собой метил, или R1 и R2 соединены вместе с образованием циклопропильного кольца.
4. Соединение циклического амина по п. 1, где А представляет собой В, имеющее формулу IB
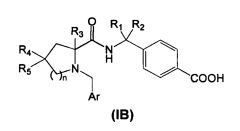
и/или его фармацевтически приемлемые производные или соли,
где n=0, 1 или 2,
R1 и R2 независимо друг от друга являются водородом, линейным или разветвленным C1-3алкилом или объединены друг с другом с образованием циклопропильного кольца,
R3 представляет собой Н или линейный или разветвленный C1-3алкил,
R4 и R5 независимо являются водородом, фтором, линейным или разветвленным C1-3алкилом или объединены друг с другом с образованием циклопропильного кольца,
Ar представляет собой
- фенил, имеющий:
i) в положении 4 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила, или
ii) в положении 3 один заместитель, выбранный из группы, состоящей из галогена, циано, трифторметила, при условии, что и R4, и R5 являются фтором, линейным или разветвленным C1-3алкилом или объединены вместе с образованием циклопропильного кольца,
- 5-членное гетероароматическое кольцо, содержащее от 1 до 3 гетероатомов, где указанные гетероатомы независимо друг от друга представляют собой S, О или N; или
- 6-членное гетероароматическое кольцо, содержащее от 1 до 3 атомов N.
5. Соединение циклического амина формулы (IB) по п. 4, где Ar представляет собой фенил, содержащий в положении 4 заместитель, выбранный из фтора, циано и трифторметила.
6. Соединение циклического амина формулы (IB) по п. 4 или 5, в котором R1 и R2 представляют собой метил или соединены друг с другом с образованием циклопропильного кольца.
7. Соединение циклического амина формулы (IB) по п. 4, где R3 представляет собой водород.
8. Соединение циклического амина формулы (IB) по п. 4, в котором R4 и R5 независимо выбраны из водорода, фтора, метила или объединены друг с другом с образованием циклопропильного кольца.
9. Соединение циклического амина формулы (IB) по п. 4, где n равно 1, и R4 и R5 независимо выбраны из водорода, фтора, метила.
10. Соединение циклического амина формулы (IB) по п. 4, где n равно 2, а Ar представляет собой фенил, замещенный в положении 4 одним заместителем, выбранным из фтора, циано или трифторметила.
11. Соединение циклического амина формулы (IB) по п. 4 или 10, в котором n равно 2, и как R4, так и R5 представляют собой фтор или объединены друг с другом с образованием циклопропильного кольца.
12. Соединение циклического амина по п. 1, где А представляет собой С, и имеющее формулу IC
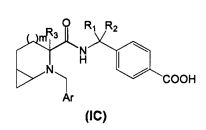
и/или его фармацевтически приемлемые соли или их производные,
где m=0 или 1,
R1 и R2 независимо представляют собой водород, линейный или разветвленный C1-3алкил, или объединены друг с другом с образованием циклопропильного кольца,
R3 представляет собой Н или линейный или разветвленный (C1-3)алкил,
Ar представляет собой
- фенил, имеющий
i) в положении 4 галоген, циано или трифторметил, или
ii) в положении 3 галоген, циано, трифторметил, при условии, что m=0,
- 5-членное гетероароматическое кольцо, содержащее от 1 до 3 гетероатомов, где указанные гетероатомы независимо друг от друга представляют собой S, О или N; или
- 6-членное гетероароматическое кольцо, содержащее от 1 до 3 атомов N.
13. Соединение циклического амина формулы (IC) по п. 12, где Ar представляет собой фенил, содержащий в положении 4 один заместитель, выбранный из фтора, циано или трифторметила.
14. Соединение циклического амина формулы (IC) по п. 12 или 13, в котором R1 и R2 объединены друг с другом с образованием циклопропильного кольца.
15. Соединение циклического амина формулы (IC) по п. 12, где R3 представляет собой водород или метил.
16. Соединение циклического амина формулы (IC) по п. 12, в котором m равно 0, а Ar представляет собой фенил, замещенный в положении 4 одним заместителем, выбранным из фтора, циано или трифторметила.
17. Соединение циклического амина по п. 1, где А представляет собой D, имеющее формулу (ID)
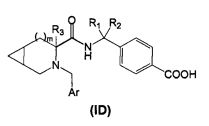
и/или его фармацевтически приемлемые соли или их производные,
где m=0 или 1,
R1 и R2 независимо друг от друга представляют собой водород, линейный или разветвленный C1-3алкил, или объединены друг с другом с образованием циклопропильного кольца,
R3 представляет собой Н или линейный или разветвленный C1-3алкил,
Ar представляет собой
- фенил, имеющий
i) в положении 4 галоген, циано или трифторметил, или
ii) в положении 3 галоген, циано или трифторметил, при условии, что m=1,
- 5-членное гетероароматическое кольцо, содержащее от 1 до 3 гетероатомов, где указанные гетероатомы независимо друг от друга представляют собой S, О или N; или
- 6-членное гетероароматическое кольцо, содержащее от 1 до 3 атомов N.
18. Соединение циклического амина формулы (ID) по п. 17, где Ar представляет собой фенил, содержащий в положении 4 фтор, циано или трифторметил.
19. Соединение циклического амина формулы (ID) по п. 17 или 18, где R1 и R2 объединены друг с другом с образованием циклопропильного кольца.
20. Соединение циклического амина формулы (ID) по п. 17, где R3 представляет собой водород или метил.
21. Соединение циклического амина формулы (ID) по п. 17, где m равно 1, а Ar представляет собой фенил, замещенный в положении 4 одним заместителем, выбранным из группы, состоящей из фтора, хлора, циано или трифторметила.
22. Соединение циклического амина по п. 1, где А представляет собой Е, имеющее формулу (IE)
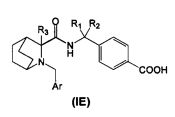
и/или его фармацевтически приемлемые соли или его производные,
где R1 и R2 независимо представляют собой водород, линейный или разветвленный C1-3алкил, или объединены друг с другом с образованием циклопропильного кольца,
R3 представляет собой Н или линейный или разветвленный C1-3 алкил,
Ar представляет собой
- фенил, содержащий в положении 3 или 4 галоген, циано или трифторметил,
- 5-членное гетероароматическое кольцо, содержащее от 1 до 3 гетероатомов, где указанные гетероатомы независимо друг от друга представляют собой S, О или N; или
- 6-членное гетероароматическое кольцо, содержащее от 1 до 3 атомов N.
23. Соединение циклического амина формулы (IE) по п. 22, где Ar представляет собой фенил, содержащий в положении 4 один заместитель, выбранный из фтора, циано или трифторметила.
24. Соединение циклического амина формулы (IE) по п. 22, где R1 представляет собой водород, a R2 представляет собой метил, или R1 и R2 объединены друг с другом с образованием циклопропильного кольца.
25. Соединение циклического амина формулы (IE) по п. 22, где R3 представляет собой водород или метил.
26. Соединение по п. 1, выбранное из группы, состоящей из
(R)-4-(1-(1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)циклопропил)бензоата лития,
4-(1-(6-(4-(трифторметил)бензил)-6-азаспиро[2.5]октан-5-карбоксамидо)циклопропил)бензойной кислоты,
4-((1S)-1-(6-(4-(трифторметил)бензил)-6-азаспиро[2.5]октан-5-карбоксамидо)этил)бензойной кислоты,
4-((1S)-1-(4,4-диметил-1-(4-(трифторметил)бензил)пиперидин-2-карбоксамидо)этил)бензойной кислоты,
4-((S)-1-((R)-4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-
карбоксамидо)этил)бензойной кислоты,
(R)-4-(l-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-
карбоксамидо)циклопропил)бензойной кислоты,
4-(1-(4,4-дифтор-1-(4-(трифторметил)бензил)пиперидин-2-
карбоксамидо)циклопропил)бензойной кислоты,
4-(1-(4,4-дифтор-1-(3-(трифторметил)бензил)пиперидин-2-
карбоксамидо)циклопропил)бензойной кислоты,
4-(1-(4,4-дифтор-1-(3-(трифторметил)бензил)пиперидин-2-
карбоксамидо)циклопропил)бензойной кислоты,
4-(1-(3-(4-(трифторметил)бензил)-3-азабицикло[4.1.0]гептан-4-
карбоксамидо)циклопропил)бензойной кислоты,
4-(1-((3R)-2-(4-(трифторметил)бензил)-2-азабицикло[4.1.0]гептано-3-
карбоксамидо)циклопропил)бензойной кислоты,
4-((1S)-1-(3R)-2-(4-(трифторметил)бензил)-2-азабицикло[4.1.0]гептан-3-карбоксамидо)этил)бензойной кислоты,
4-((S)-1-((R)-1-(4-(трифторметил)бензил)пирролидин-2-карбоксамидо)этил)бензоата лития,
4-(1-((1R,3R,5R)-2-(3-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил)бензойной кислоты,
4-(1-((1R,3R,5R)-2-(4-(трифторметил)бензил)-2-азабицикло[3.1.0]гексан-3-карбоксамидо)циклопропил) бензойной кислоты.
27. Фармацевтическая композиция для лечения или облегчения заболеваний, опосредованных простагландином Е, содержащая от 1,0 до 300 мг соединения формулы (I) по любому из пп. 1, 12, 17 или 22, или его фармацевтически приемлемую соль, а также содержащая фармацевтически приемлемый носитель и/или наполнитель.
28. Лекарственное средство для лечения расстройства, выбранного из острой и хронической боли, воспалительной боли, ассоциированных с воспалением заболеваний, остеоартрита и ревматоидного артрита, содержащее соединение формулы (I) по п. 1.
29. Применение соединения формулы (I) по п. 1 для изготовления лекарственного средства для лечения расстройства, выбранного из острой и хронической боли, воспалительной боли, ассоциированных с воспалением заболеваний, остеоартрита и ревматоидного артрита.
| СПОСОБ РАННЕЙ УЛЬТРАЗВУКОВОЙ ДИАГНОСТИКИ ПЕРИОСТИТА ТРУБЧАТЫХ КОСТЕЙ | 2004 |
|
RU2277858C2 |
| WO 2004037786 A2, 06.05.2004 | |||
| ПРОИЗВОДНЫЕ 2-ПИПЕРИДОНА В КАЧЕСТВЕ АГОНИСТОВ ПРОСТАГЛАНДИНА | 2004 |
|
RU2311409C2 |
| Замок | 1929 |
|
SU15931A1 |
Авторы
Даты
2015-10-20—Публикация
2011-07-04—Подача