Перекрестные ссылки на родственные заявки
Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США No. 62/242734, поданной 16 октября 2015 г., и предварительной заявке на патент США No. 62/242748, поданной 16 октября 2015 г. Эти заявки включены в настоящее описание в качестве ссылки.
Уровень техники
Простагландин E2 (PGE2) является основным медиатором воспаления. Остро, PGE2 способствует провоспалительному иммунному ответу; но устойчивые уровни в микроокружении опухоли способствуют накоплению и повышению активности множественных иммуносупрессорных клеток, включая опухоль-ассоциированные макрофаги (TAM), клетки Treg и cупрессорные клетки миелоидного происхождения (MDSC) и, следовательно, способствуют ускользанию опухоли от иммунного ответа (Kaidi A, et al. Direct transcriptional up-regulation of cyclooxygenase-2 by hypoxia-inducible factor (HIF)-1 promotes colorectal tumor cell survival and enhances HIF-1 transcriptional activity during hypoxia. Cancer Res, 2006, 66:6683-6691; Nakanishi Y et al. COX-2 inhibition alters the phenotype of tumor-associated macrophages from M2 to M1 in APCmin/+ mouse polyps. Carcinogenesis, 2011, 32:1333-1339; Mahic M et al. FOXP3+CD4+CD25+ adaptive regulatory T cells express cyclooxygenase-2 and suppress effector T cells by a prostaglandin E2-dependent mechanism. J Immunol, 2011, 177:246-254; Adams JL et al. Big opportunities for small molecules in immune-oncology. Nat Rev Drug Disc, 2015, dol:10.1038/nrd4596).
Передача сигнала PGE2 опосредуется набором из четырех EP-рецепторов (EP1, EP2, EP3 и EP4), которые связаны с различными путями передачи сигнала в различных клеточных линиях. Накопление доказательств показало, что повышенные уровни цАМФ через EP4 являются основным сигналом, ведущим к иммуносупрессии в иммунных клетках (Yokoyama U et al. The prostanoid EP4 receptor and its signaling pathway. Pharmacol Rev, 2013, 65:1010-1052). Нокаут EP4 у мышей показал задержанное опухолеобразование по сравнению с животными дикого типа на фоне APCmin мутации, что указывает на опухоль-стимулирующую активность сигнального пути PGE2-EP4 в иммунных клетках хозяина (Mutoh M et al. Involvment of prostaglandin E receptor subtype EP(4) in colon carcinogenesis. Cancer Res, 2002, 62:28-32). Соответственно, было показано, что селективные антагонисты рецептора EP4 замедляют прогрессирование опухоли в различных доклинических опухолевых моделях, не влияя на пролиферацию раковых клеток in vitro (Yang et al. Host and direct anti-tumor effects of profound reduction in tumor metastasis with selective EP4 receptor antagonism. Cancer Res, 2006, 66:9665-9672; Mao Y et al. Inhibition of tumor-derived prostaglandin e2-blocks the induction of myeloid-derived suppressor cells and recovers natural killer cell activity. Clin Cancer Res, 2014, 20:4096-4106).
Эти результаты свидетельствуют о том, что супрессия PGE2/EP4 передачи сигнала может иметь терапевтическое значение при раке и других хронически воспалительных заболеваниях, таких как рассеянный склероз и ревматоидный артрит. Следовательно, существует потребность в новых соединениях, способных подавлять PGE2/EP4 передачу сигналов.
Краткое описание
В настоящем описании представлены новые антагонисты EP4. Антагонисты ЕР4, описанные в настоящем документе, могут быть применимы для дальнейшей разработки лечения заболеваний, связанных с передачей сигнала ЕР4, включая рак или хронические воспалительные заболевания, такие как рассеянный склероз и ревматоидный артрит.
В качестве примера и без ограничения, соединения, описанные в настоящем документе, могут быть использованы для иммунной терапии рака, нацеленной на иммуносупрессивные клетки хозяина в микроокружении опухоли, которая может быть либо миелоидной, либо лимфоидной линии. В одном варианте осуществления, соединения, описанные в настоящем документе, могут использоваться для лечения пациентов с различными типами опухолей, включая те, которые содержат высокие уровни миелоидного инфильтрата. Такие уровни миелоидного инфильтрата могут быть идентифицированы, например, на основе Атласа ракового генома (TCGA) и других источников. Такие типы опухолей также могут быть идентифицированы на основе анализа экспрессии белка или генетического (например, мРНК) анализа экспрессии.
Типы опухолей могут включать, но не ограничиваются ими, аденокарциному поджелудочной железы, светлоклеточный рак почки, плоскоклеточную карциному головы и шеи (SCCHN), немелкоклеточный рак легкого (NSCLC), колоректальный рак (CRC), гепато-целлюлярную карциному (HCC), серозный эпителиальный рак яичников, рак шейки матки, переходно-клеточный рак мочевого пузыря и трижды негативный рак молочной железы (TNBC). Один вариант осуществления включает соединение формулы (I):
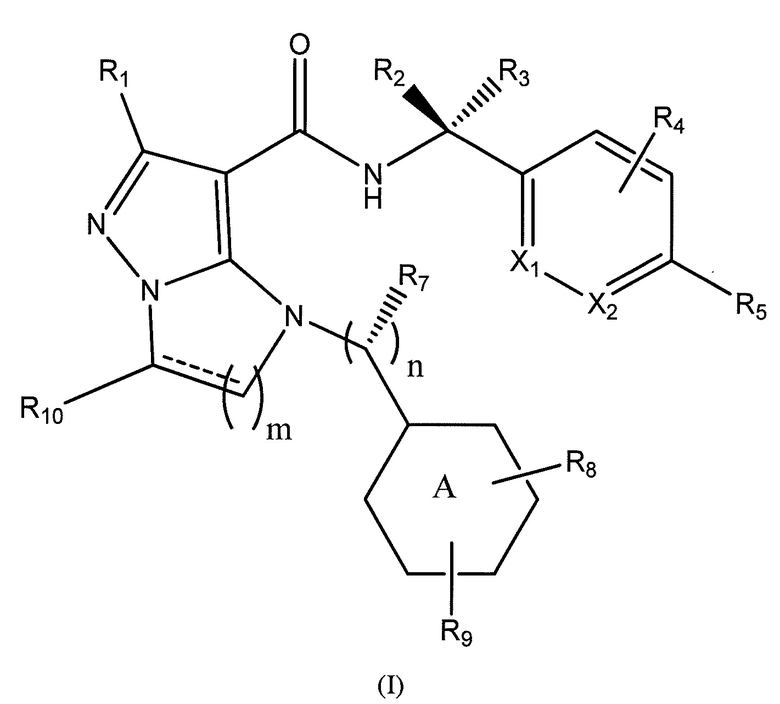
или его фармацевтически приемлемую соль,
где
R1 представляет собой -CH3, -CF3, -CH2CH3, -CH2F, CF2CH2OH, -CHF2, -CH=CH2, -CH2OH или фенил;
R2 представляет собой -H, -CH2OH, или -CH3;
R3 представляет собой -H;
или R2 и R3 взятые вместе, образуют циклопропил с углеродом, к которому они прикреплены;
R4 представляет собой -H, -F или -CH3;
R5 представляет собой -C(O)OH, -C(O)OCH3, -CH2C(O)OH, циклопропил, -C(O)NHCN,
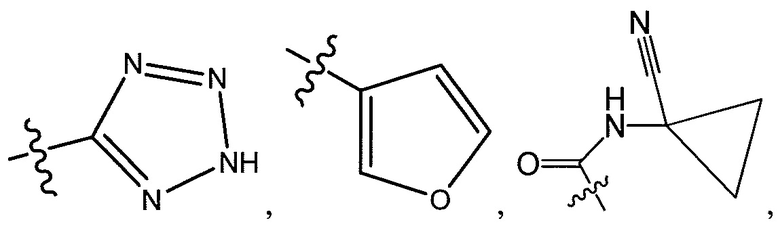
или 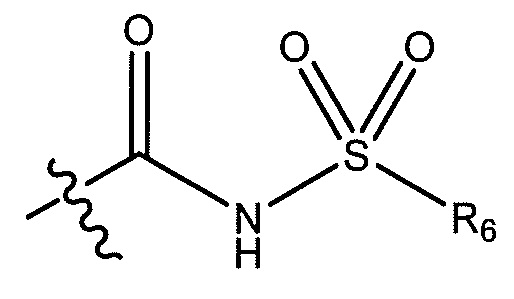 ;
;
где R6 представляет собой фенил, -CH3, циклопропил,
 или
или 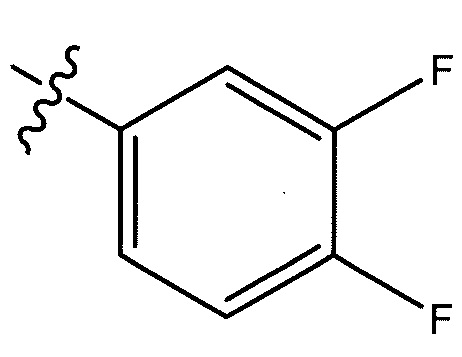 ;
;
n равен 0-1;
m равен 1-2;
R7 представляет собой -H, -CH3, или отсутствует, когда n равен 0;
R8 представляет собой -CF3, -H, -Cl, -F, -CH2CH3, -OCH3, -CH3, -SCH3, -CH2OH, -CH2F, -CH2Cl, -I, -Br, -NH2, -CH2OCH2CH2F, -OCH2CH2F, -CH2CH2CH2F, -OH, -OCF3, -N(CH3)2, -CF2CH2OH,
 , или связь, соединяющая R8 и кольцо A, представляет собой двойную связь и R8 представляет собой CH2;
, или связь, соединяющая R8 и кольцо A, представляет собой двойную связь и R8 представляет собой CH2;
R9 представляет собой -H, -Cl, или -CF3;
R10 представляет собой -H, -CH3, -CH2F, -CH2OH или -CH2OCH2-фенил;
X1 и X2 представляют собой или оба C, или один представляет собой C, а другой представляет собой N;
 представляет собой одинарную связь или двойную связь; и
представляет собой одинарную связь или двойную связь; и
кольцо А представляет собой фенил или циклогексил.
Один вариант осуществления включает соединение формулы (II):
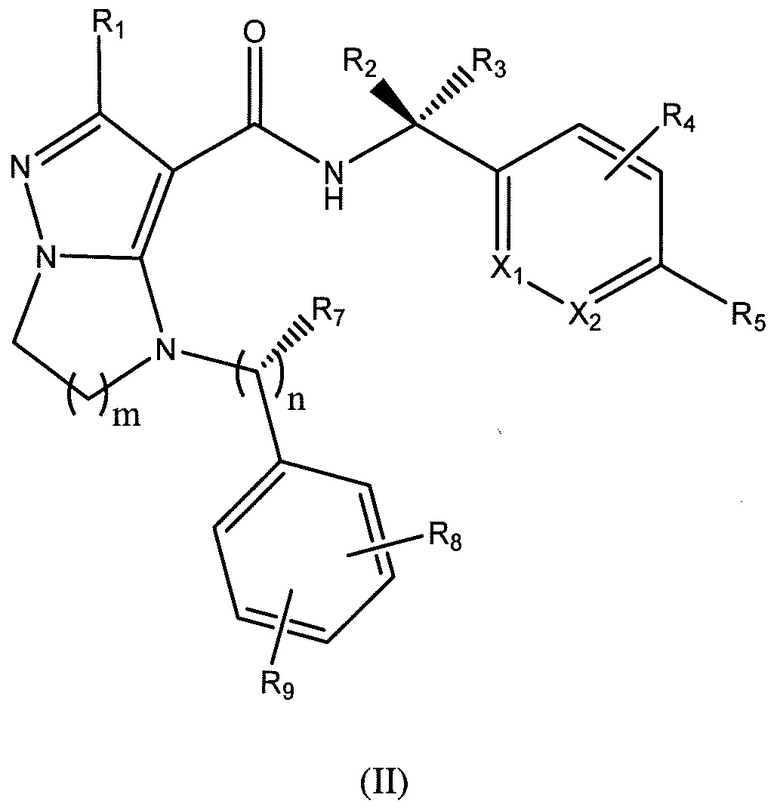
или их фармацевтически приемлемые соли,
где R1 представляет собой -CH3, -CF3, -CH2CH3, или фенил;
R2 представляет собой -H, или -CH3;
R3 представляет собой -H;
или R2 и R3 взятые вместе, образуют циклопропил с углеродом, к которому они прикреплены;
R4 представляет собой -H, -F, или -CH3;
R5 представляет собой -C(O)OH, -C(O)OCH3, -CH2C(O)OH, циклопропил, -C(O)NHCN,
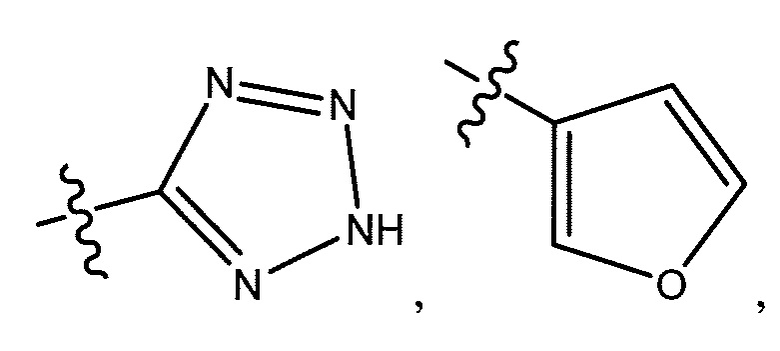
или  ;
;
где R6 представляет собой фенил, -CH3, циклопропил, или
 ;
;
m равен 1-2;
n равен 0-1;
R7 представляет собой -H, -CH3, или отсутствует, когда n равен 0;
R8 представляет собой -CF3, -H, -Cl, -F, -CH2CH3, -OCH3, -CH3 или -OCF3;
R9 представляет собой -H, -Cl или -CF3; и
X1 и X2 представляют собой или оба C, или один представляет собой C, а другой представляет собой N.
В некоторых вариантах осуществления, R1 представляет собой -CF3. В некоторых вариантах осуществления, m равен 1. В других вариантах осуществления, R2 представляет собой метил и R3 представляет собой -H. В еще дополнительных вариантах осуществления X1 и X2 оба являются C. В некоторых вариантах осуществления, R4 представляет собой -H. В некоторых вариантах осуществления, n равен 1. В некоторых вариантах осуществления, R7 представляет собой -H. В некоторых вариантах осуществления, R9 представляет собой -H. В других вариантах осуществления, R8 представляет собой -CF3. В некоторых вариантах осуществления, R5 представляет собой -C(O)OH. В еще дополнительных вариантах осуществления, R4 представляет собой -F. В других вариантах осуществления, R8 представляет собой -Cl. В некоторых вариантах осуществления,  представляет собой одинарную связь. В других вариантах осуществления, R10 представляет собой -H. В еще дополнительных вариантах осуществления, кольцо A представляет собой фенил. В других вариантах осуществления, X1 и X2 оба представляют собой углерод.
представляет собой одинарную связь. В других вариантах осуществления, R10 представляет собой -H. В еще дополнительных вариантах осуществления, кольцо A представляет собой фенил. В других вариантах осуществления, X1 и X2 оба представляют собой углерод.
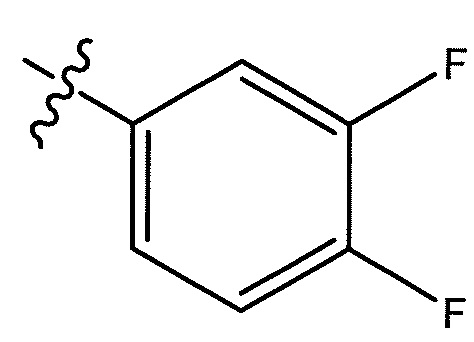
В некоторых вариантах осуществления, R5 представляет собой -C(O)OH, -C(O)OCH3, -CH2C(O)OH, -C(O)NHCN,
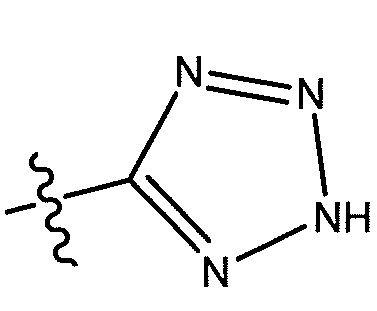 или
или  . В некоторых вариантах осуществления, m равен 2 и где R8 и R9, если они присутствуют, находятся в мета-положении или в пара-положении. В одном варианте осуществления соединение представляет собой (S)-4-(1-(1-(3-хлор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойную кислоту. В другом варианте осуществления соединение представляет собой (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойную кислоту.
. В некоторых вариантах осуществления, m равен 2 и где R8 и R9, если они присутствуют, находятся в мета-положении или в пара-положении. В одном варианте осуществления соединение представляет собой (S)-4-(1-(1-(3-хлор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойную кислоту. В другом варианте осуществления соединение представляет собой (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойную кислоту.
Варианты осуществления могут обеспечивать фармацевтическую композицию, содержащую соединение, как указано выше, и фармацевтически приемлемый эксципиент. Варианты осуществления могут обеспечивать способ лечения рака, включающий введение пациенту фармацевтической композиции, описанной в настоящем документе. В некоторых вариантах осуществления, рак представляет собой рак поджелудочной железы, почечно-клеточный рак, плоскоклеточную карциному головы и шеи, немелкоклеточный рак легкого, колоректальный рак, гепатоцеллюлярную карциному, карциному яичника, рак шейки матки, рак мочевого пузыря или рак молочной железы. В некоторых вариантах осуществления, рак молочной железы представляет собой трижды негативный рак молочной железы.
Варианты осуществления могут обеспечивать использование соединения, описанного в настоящем документе, для получения лекарственного средства для лечения рака. В некоторых вариантах осуществления рак представляет собой рак поджелудочной железы, почечно-клеточный рак, плоскоклеточную карциному головы и шеи, немелкоклеточный рак легкого, колоректальный рак, гепато-целлюлярную карциному, карциному яичника, рак шейки матки, рак мочевого пузыря или рак молочной железы.
Некоторые варианты могут обеспечить соединение, выбранное из следующей группы:
(S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
Метил (S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат;
(S)-4-(1-(6-(трифторметил)-1-(2-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3,5-бис(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-хлор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3,5-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(4-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(4-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3,4-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(4-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(2-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(4-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(2-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(4-этилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-2-фтор-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-3-фтор-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-3-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-2-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
Метил (S)-2-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат;
(S)-2-(4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)фенил)уксусная кислота;
(S)-2-(4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)фенил)уксусная кислота;
4-(1-(6-метил-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойная кислота;
4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойная кислота;
4-(1-(1-(4-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойная кислота;
(S)-4-(1-(1-(4-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(4-хлорбензил)-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
4-((1-(4-хлорбензил)-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)метил)бензойная кислота;
(R)-4-(1-(6-метил-1-(1-(4-(трифторметил)фенил)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойная кислота;
4-((S)-1-(6-метил-1-((R)-1-(4-(трифторметил)фенил)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-N-(1-(4-(2H-тетразол-5-ил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
(S)-N-(1-(4-(2H-тетразол-5-ил)фенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
(S)-5-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)пиколиновая кислота;
(S)-6-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)никотиновая кислота;
(S)-4-(1-(4-(4-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(4-(3-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(4-(2-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(2-(трифторметил)-4-(3-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(2-(трифторметил)-4-(4-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(2-(трифторметил)-4-(2-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(4-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(2-(трифторметил)-4-(4-(трифторметил)фенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота;
(S)-N-(1-(4-(цианокарбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
(S)-N-(1-(4-(((3,4-дифторфенил)сульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
(S)-N-(1-(4-((фенилсульфонил)карбамоил)фенил)этил)-1-(3-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
(S)-N-(1-(4-((метилсульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
(S)-N-(1-(4-((циклопропилсульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
(S)-N-(1-(4-(фуран-3-ил)фенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
(S)-N-(1-(4-циклопропилфенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
(S)-N-(1-(3-метил-4-(2H-тетразол-5-ил)фенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
(S)-4-(1-(6-этил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(2-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(6-фенил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-(метилтио)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-(фторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-(хлорметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
4,4'-((1S,1'S)-((1,1'-(1,3-фениленбис(метилен))бис(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-диил-7-карбонил))бис(азанедиил))бис(этан-1,1-диил))дибензойная кислота;
(S)-4-(1-(1-(4-иод-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-бензил-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-N-(1-(4-(((4-нитрофенил)сульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
(S)-4-(1-(1-(4-аминобензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-N-(1-(4-(((4-аминофенил)сульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
(S)-4-(1-(1-(3-((2-фторэтокси)метил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-(2-фторэтокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
7-(((S)-1-(4-карбоксифенил)этил)карбамоил)-1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол 1-оксид;
(S)-4-(1-(1-(3-гидрокси-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-фтор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-((4-(фторметил)циклогексил)метил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-((4-метиленциклогексил)метил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-(3-фторпропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(4-(3-фторпропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-(3-фторпропил)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(4-(3-фторпропил)-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(6-(фторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(3-метил-6-(трифторметил)-1-(3-(трифторметил)бензил)-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
4-((S)-1-((S)-3-(фторметил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(4-гидроксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(R)-4-(2-гидрокси-1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(4-(диметиламино)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-(диметиламино)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-(диметиламино)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(6-(1,1-дифтор-2-гидроксиэтил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-N-(1-(4-((1-цианоциклопропил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид;
4-((S)-1-((S)-3-(гидроксиметил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
4-((S)-1-((S)-3-((бензилокси)метил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-бром-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(6-(дифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-(трифторметил)бензил)-6-винил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(6-(гидроксиметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота;
(S)-4-(1-(1-(3-(1,1-дифтор-2-гидроксиэтил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота; и
метил (S)-4-(1-(1-(2-фторбензоил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат.
Краткое описание чертежей
Фиг. 1A и фиг. 1B показано ингибирование соединения 1 при связывании радиолиганда с EP4. Доза-зависимое ингибирование при связывании 3H-меченной PGE2 с человеческой (фиг. 1A) и мышиной (фиг. 1B) EP4-экспрессирующей фракции клеточной мембраны. Значения Ki указаны.
Фиг. 2A и фиг. 2B, соответственно, показывают противоопухолевое действие соединения 1 в мышиных 4T1 сингенных опухолях и действие на массу тела животного. На фиг.2А показаны кривые роста опухоли. Данные представляют среднее значение±SEM. Статистически значимое ингибирование роста опухоли наблюдали после обработки 25 и 150 мг/кг соединения 1 на 27-й день после инъекции опухолевых клеток. На фиг.2В показаны кривые массы тела животных. NS, незначимый; **, p <0,01; ****, p <0,0001, однофакторный дисперсионный анализ (ANOVA).
Фиг. 3 показывает формулу (I).
Подробное описание
В настоящем описании представлены новые антагонисты EP4. Эти соединения могут быть использованы для лечения рака.
Вариант осуществления включает соединение формулы (I):
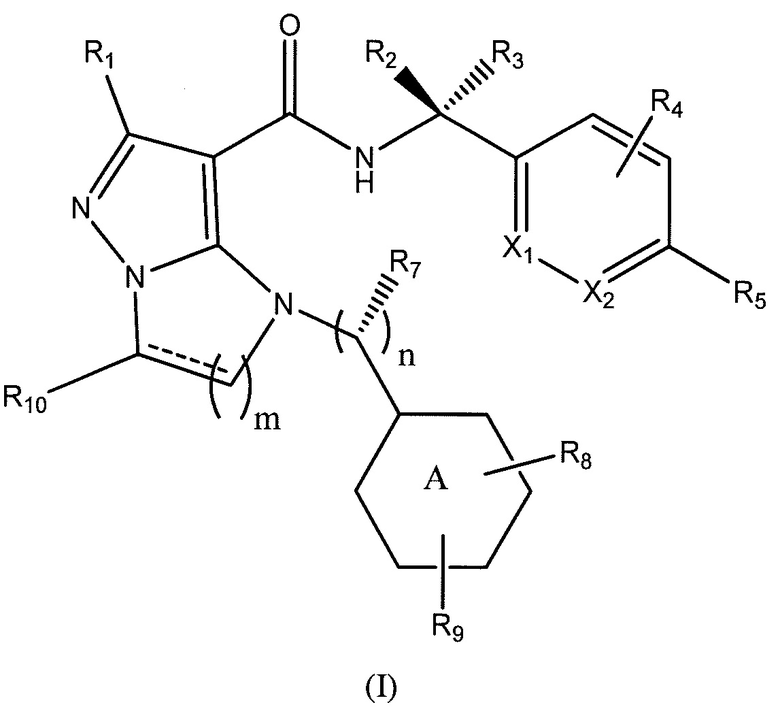
или его фармацевтически приемлемую соль,
где
R1 представляет собой -CH3, -CF3, -CH2CH3, -CH2F, CF2CH2OH, -CHF2, -CH=CH2, -CH2OH или фенил;
R2 представляет собой -H, -CH2OH или -CH3;
R3 представляет собой -H;
или R2 и R3 взятые вместе, образуют циклопропил с углеродом, к которому они прикреплены;
R4 представляет собой -H, -F или -CH3;
R5 представляет собой -C(O)OH, -C(O)OCH3, -CH2C(O)OH, циклопропил, -C(O)NHCN,
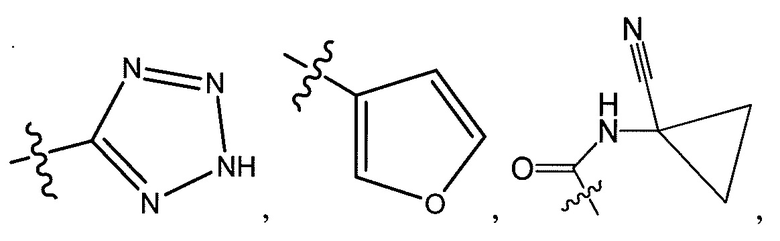
или 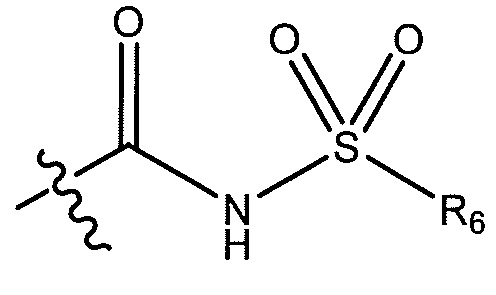
где R6 представляет собой фенил, -CH3, циклопропил,
 или
или  ;
;
n равен 0-1;
m равен 1-2;
R7 представляет собой -H, -CH3, или отсутствует, когда n равен 0;
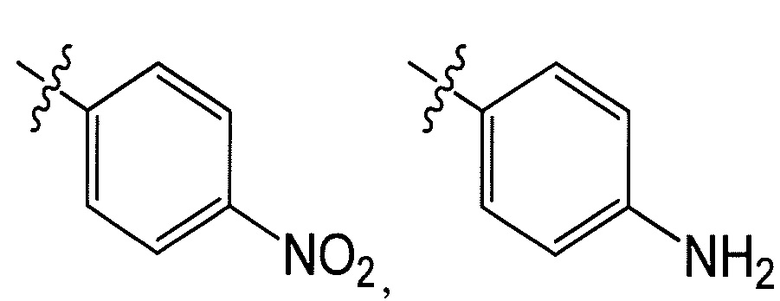
R8 представляет собой -CF3, -H, -Cl, -F, -CH2CH3, -OCH3, -CH3, -SCH3, -CH2OH, -CH2F, -CH2Cl, -I, -Br, -NH2, -CH2OCH2CH2F, -OCH2CH2F, -CH2CH2CH2F,
-OH, -OCF3, -N(CH3)2, -CF2CH2OH, или  , или связь, соединяющая R8 и кольцо A, представляет собой двойную связь и R8 представляет собой CH2;
, или связь, соединяющая R8 и кольцо A, представляет собой двойную связь и R8 представляет собой CH2;
R9 представляет собой -H, -Cl, или -CF3;
R10 представляет собой -H, -CH3, -CH2F, -CH2OH или -CH2OCH2- фенил;
X1 и X2 представляют собой или оба C, или один представляет собой C, а другой представляет собой N;
 представляет собой одинарную связь или двойную связь; и
представляет собой одинарную связь или двойную связь; и
кольцо А представляет собой фенил или циклогексил.
В дополнительном варианте осуществления предлагается соединение, имеющее структуру, показанную в формуле II:

или его фармацевтически приемлемые соли. В типичных вариантах осуществления R1 представляет собой -CH3, -CF3, -CH2CH3, или фенил; R2 представляет собой -Н или -CH3; R3 представляет собой -H; или R2 и R3 взятые вместе, образуют циклопропил с углеродом, к которому они прикреплены; R4 представляет собой -H, -F или -CH3; R5 представляет собой -C(O)OH, -C(O)OCH3, -CH2C(O)OH, циклопропил, -C(O)NHCN,  ,
, 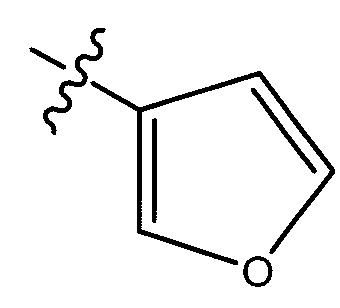 ,
,
или 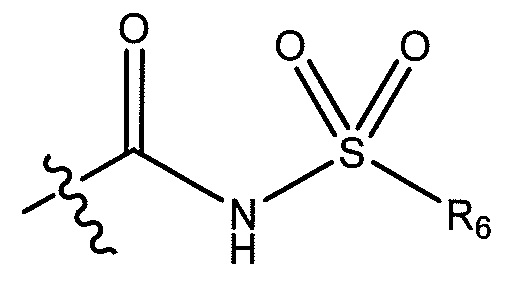 ;
;
где R6 представляет собой фенил, -CH3, циклопропил, или
 ;
;
m равен 1-2; n равен 0-1; R7 представляет собой -H, -CH3, или отсутствует, когда n равно 0;
R8 представляет собой -CF3, -Cl, -F, -CH2CH3, -OCH3, -CH3, или -OCF3; R9 представляет собой -H, -Cl, или -CF3; и X1 и X2 представляют собой или оба C, или один представляет собой C, а другой представляет собой N.
Варианты осуществления включают соединение, имеющее структуру, показанную в формуле V:
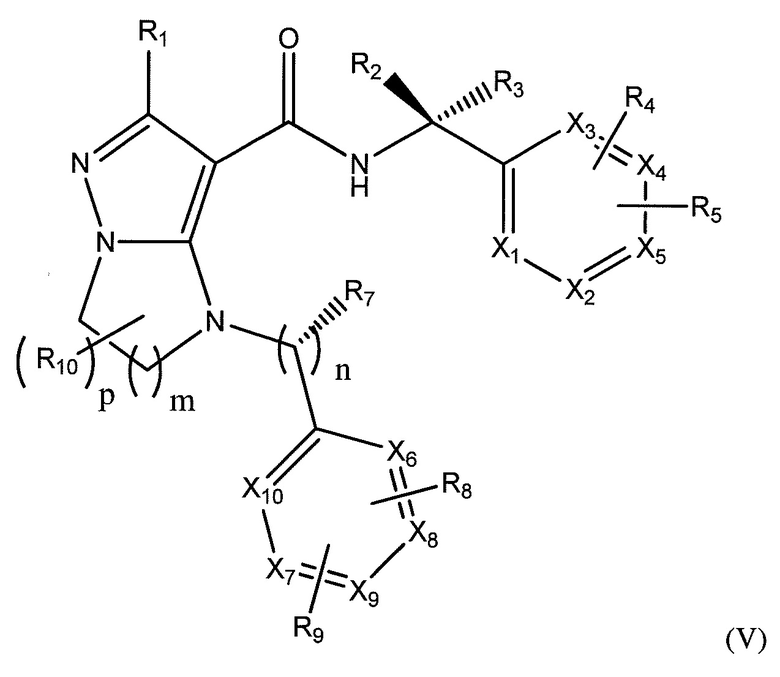
или его фармацевтически приемлемые соли. В типичных вариантах осуществления R1 представляет собой -CF3, C1-C6 алкил, C1-C6 алкокси, циано, арил, арилокси, амино, C1-C6 алкиламино, карбонил, или фенил; R2 и R3 независимо выбраны из -H, -CH3, или -CH3-zFz, где z равен 1-3; или R2 и R3 взятые вместе, образуют циклопропил или циклобутил с углеродом, к которому они присоединены; R4 представляет собой -H, галоген, -CF3 C1-C3 алкил, необязательно замещенный одним или несколькими -F или C1-C3 алкокси; R5 представляет собой -C(O)OH, -C(O)OCH3, -CH2C(O)OH, циклопропил, -C(O)NHCN,  ,
, 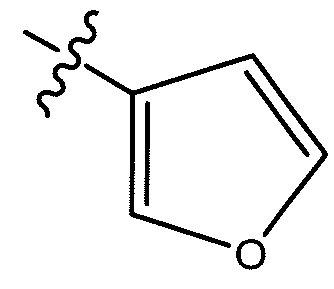 ,
,
или 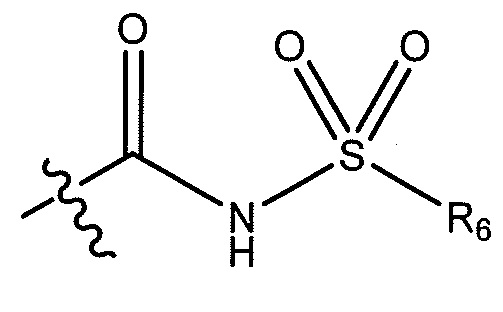 ;
;
где R6 представляет собой фенил, -CH3, циклопропил, или
 ;
;
m равен 1-3; n равен 0-5; R7 представляет собой -H, -CH3, или отсутствует, когда n равно 0;
R8 и R9 независимо выбраны из -Н, -CF3, галогена, амино, OCH3, C1-C6 алкокси, необязательно замещенного одним или несколькими фтором, или C1-C6 алкила, необязательно замещенного по меньшей мере одним фтором и по меньшей мере одним углеродом C1-C6 алкила, необязательно замещенного O или N; и X1, X2, X3, X4 и X5 представляют собой или C, или N, где ноль, один или два из X1, X2, X3, X4, и X5 одновременно представляют собой N; где X6, X7, X8, X9, и X10 представляют собой C или N, где ноль, один или два из X6, X7, X8, X9, и X10 одновременно представляют собой N; где R10 представляет собой C1-C3 алкил, необязательно замещенный одним или несколькими фтором, и где p равно 0-3.
Как используется в настоящем описании, «алкил», «C1, C2, C3, C4, C5 или C6 алкил» или «C1-C6 алкил» предполагает включение C1, C2, C3, C4, C5 или C6 неразветвленных (линейных) насыщенных алифатических углеводородных групп и C3, C4, C5 или C6 разветвленных насыщенных алифатических углеводородных групп. Например, C1-C6 алкил включает C1, C2, C3, C4, C5 и C6 алкильные группы. Примеры алкила включают фрагменты, имеющие от одного до шести атомов углерода, такие как, но не ограничиваясь ими, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил, втор-пентил или н-гексил.
В некоторых вариантах осуществления линейный или разветвленный алкил имеет шесть или меньше атомов углерода (например, C1-C6 для прямой цепи, C3-C6 для разветвленной цепи), и в другом варианте осуществления алкил с прямой или разветвленной цепью имеет четыре или менее атомов углерода.
Как используется в настоящем описании, термин «циклоалкил» относится к насыщенному или ненасыщенному неароматическому углеводородному кольцу, имеющему 3-7 атомов углерода (например, C3-C7). Примеры циклоалкила включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопентенил, циклогексенил и циклогептенил.
Термин «гетероциклоалкил» относится к насыщенному или ненасыщенному неароматическому 3-8-членному моноциклическому, 7-10-членному конденсированному бициклическому кольцу, имеющему один или несколько гетероатомов (таких как O, N или S), если не указано иное. Примеры гетероциклоалкильных групп включают, но не ограничиваются ими, пиперидинил, пиперазинил, пирролидинил, диоксанил, тетрагидрофуранил, изоиндолинил, индолинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, оксиранил, азетидинил, оксетанил, тиетанил, 1,2,3,6-тетрагидропиридинил, тетрагидропиранил, тетрагидротиенил, дигидропиранил, пиранил, морфолинил, 1,4-диазепанил, 1,4-оксазепанил и тому подобное.
Дополнительные примеры гетероциклоалкильных групп включают, но не ограничиваются ими, акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензоксазолинил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбазолил, 4аН-карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуранил, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3H-индолил, изатионил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, метилендиоксифенил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,4-оксадиазол-5-(4H)-он, оксазолидинил, оксазолил, оксиндолил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, пиперидонил, 4-пиперидонил, пиперонил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2Н-пирролил, пирролил, хиназолинил, хинолинил, 4Н-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, тетразолил, 6Н-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил и ксантенил.
Термин «необязательно замещенный алкил» относится к незамещенному алкилу или алкилу, имеющему обозначенные заместители, замещающие один или несколько атомов водорода на одном или нескольких атомах углерода углеводородного скелета. Такие заместители могут включать, например, алкил, алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонил, фосфинил, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонил, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил или ароматический или гетероароматический фрагмент.
«Арилалкил» или «аралкильный» фрагмент представляет собой алкил, замещенный арилом (например, фенилметил (бензил)). «Алкиларильный» фрагмент представляет собой арил, замещенный алкилом (например, метилфенил).
«Алкенил» включает ненасыщенные алифатические группы, аналогичные по длине, и возможному замещению алкилами, описанными выше, но которые содержат по меньшей мере одну двойную связь. Например, термин «алкенил» включает алкенильные группы с прямой цепью (например, этенил, пропенил, бутенил, пентенил, гексенил) и разветвленные алкенильные группы. В некоторых вариантах осуществления неразветвленная или разветвленная алкенильная группа имеет шесть или меньше атомов углерода в ее основной цепи (например, C2-C6 для прямой цепи, C3-C6 для разветвленной цепи). Термин «C2-C6» включает алкенильные группы, содержащие от двух до шести атомов углерода. Термин «C3-C6» включает алкенильные группы, содержащие от трех до шести атомов углерода.
Термин «необязательно замещенный алкенил» относится к незамещенному алкенилу или алкенилу, имеющему указанные заместители, замещающие один или несколько атомов водорода на одном или нескольких атомах углерода основной углеводородной цепи. Такие заместители могут включать, например, алкил, алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонил, фосфинил, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано, гетероциклил, алкиларил или ароматическую или гетероароматическую группу.
"Алкинил" включает ненасыщенные алифатические группы аналогичные по длине и возможному замещению алкилам, описанным выше, но которые содержат по меньшей мере одну тройную связь. Например, "алкинил" включает линейные алкинильные группы (например, этинил, пропинил, бутинил, пентинил, гексинил) и разветвленные алкинильные группы. В некоторых вариантах осуществления, линейная или разветвленная алкинильная группа содержит шесть или меньше атомов углерода в своей основной цепи (например, C2-C6 для прямой цепи, C3-C6 для разветвленной цепи). Термин "C2-C6" включает алкинильные группы, содержащие от двух до шести атомов углерода. Термин "C3-C6" включает алкинильные группы, содержащие от трех до шести атомов углерода.
Термин "необязательно замещенный алкинил" относится к незамещенному алкинилу или алкинилу, содержащему указанные заместители, замещающие один или несколько атомов водорода на одном или нескольких атомах углерода основной углеводородной цепи. Такие заместители могут включать, например, алкил, алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонил, фосфинил, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил или ароматическую или гетероароматическую группу.
Другие необязательно замещенные группы (такие как необязательно замещенный циклоалкил, гетероциклоалкил, арил или гетероарил) включают как незамещенные группы, так и группы, содержащие один или несколько из указанных заместителей. Например, замещенный гетероциклоалкил включает группы, замещенные одной или несколькими алкильными группами, такие как 2,2,6,6-тетраметил-пиперидинил и 2,2,6,6-тетраметил-1,2,3,6-тетрагидропиридинил.
"Арил" включает группы с ароматичностью, включая "сопряженные" или полициклические системы с по меньшей мере одним ароматическим кольцом, и не содержат никаких гетероатомов в кольцевой структуре. Примеры включают фенил, бензил, 1,2,3,4-тетрагидронафталенил и т.п.
"Гетероарильные" группы представляют собой арильные группы, определенные выше, за исключением содержащих от одного до четырех гетероатомов в кольцевой структуре, и также могут быть указаны как "арилгетероциклы" или "гетероароматические группы". Как используется в настоящем описании, термин "гетероарил" предполагает включение стабильного 5-, 6- или 7-членного моноциклического или 7-, 8-, 9-, 10-, 11- или 12-членного бициклического ароматического гетероциклического кольца, которое состоит из атомов углерода и одного или нескольких гетероатомов, например, 1 или 1-2 или 1-3 или 1-4 или 1-5 или 1-6 гетероатомов или, например, 1, 2, 3, 4, 5 или 6 гетероатомов, независимо выбранных из группы, состоящей из азота, кислорода и серы. Атом азота может быть замещенным или незамещенным (т.е. N или NR', где R' представляет собой H или другие заместители, которые определены). Гетероатомы азота и серы, необязательно, могут быть окислены (т.е. N→O и S(O)p, где p=1 или 2). Следует отметить, что общее количество S и О атомов в ароматическом гетероцикле составляет не более чем 1.
Примеры гетероарильных групп включают пиррол, фуран, тиофен, тиазол, изотиазол, имидазол, триазол, тетразол, пиразол, оксазол, изоксазол, пиридин, пиразин, пиридазин, пиримидин и подобные.
Кроме того, термины «арил» и «гетероарил» включают полициклические арильные и гетероарильные группы, например, бициклические. Неограничивающий пример таких арильных групп включает, например, нафталин, бензоксазол, бензодиоксазол, бензотиазол, бензоимидазол, бензотиофен, метилендиоксифенил, хинолин, изохинолин, нафтридин, индол, бензофуран, пурин, бензофуран, дезазапурин, индолизин.
В случае полициклических ароматических колец, только одно из колец обязательно должно быть ароматическим (например, 2,3-дигидроиндол), хотя все кольца могут быть ароматическими (например, хинолин).
Циклоалкильное, гетероциклоалкильное, арильное или гетероарильное кольцо может быть замещено по одному или нескольким положениям в кольце (например, образующему кольцо углероду или гетероатому, такому как N) такими заместителями, которые описаны выше, например, алкил, алкенил, алкинил, галоген, гидроксил, алкокси, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, алкиламинокарбонил, аралкиламинокарбонил, алкениламинокарбонил, алкилкарбонил, арилкарбонил, аралкилкарбонил, алкенилкарбонил, алкоксикарбонил, аминокарбонил, алкилтиокарбонил, фосфат, фосфонил, фосфинил, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонил, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил или ароматическая или гетероароматическая группа. Арильные и гетероарильные группы также могут быть конденсированными с алициклическими или гетероциклическими кольцами, которые не являются ароматическими, с образованием полициклической системы (например, тетралин, метилендиоксифенил).
Когда связь с заместителем показана как пересекающая связь, соединяющая два атома в кольце (как показано примерами ниже с заместителем R), тогда такой заместитель может быть связан с любым атомом в кольце. 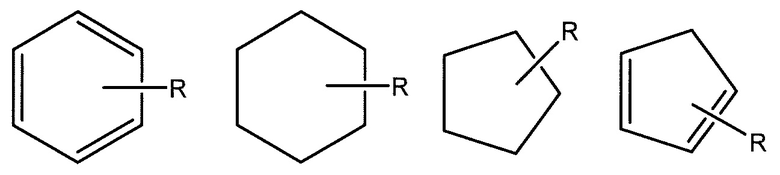
Когда любая переменная (например, R1) встречается более одного раза в любой составляющей или формуле для соединения, ее определение в каждом случае является независимым от ее определения в каждом другом случае. Так, например, если показано, что группа замещена 0-2 группами R1, тогда группа может быть необязательно замещена до двух групп R1 и R1 в каждом случае выбран независимо из определения R1.
Термин "гидрокси" или "гидроксил" включает группы с -OH или -O-.
Как используется в настоящем описании, "гало" или "галоген" относится к фтору, хлору, брому и иоду. Термин "пергалогенированный", как правило, относится к группе, где все атомы водорода замещены атомами галогена. Термин "галогеналкил" или "галогеналкоксил" относится к алкилу или алкоксилу, замещенному одним или несколькими атомами галогена.
"Алкоксиалкил", "алкиламиноалкил", и "тиоалкоксиалкил" включают алкильные группы, описанные выше, где атомы кислорода, азота или серы замещают один или несколько атомов углерода основной углеводороднной цепи.
Термин "алкокси" или "алкоксил" включает замещенные и незамещенные алкильные, алкенильные и алкинильные группы, ковалентно связанные с атомом кислорода. Примеры алкокси групп или алкоксил радикалов включают, но не ограничиваются ими, метокси, этокси, изопропилокси, пропокси, бутокси и пентокси группы. Примеры замещенных алкокси групп включают галогенированные алкокси группы. Алкокси группы могут быть замещены группами, такими как алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонил, фосфинил, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонил, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил или ароматическая или гетероароматическая группа. Примеры галоген-замещенных алкокси групп включают, но не ограничиваются ими, фторметокси, дифторметокси, трифторметокси, хлорметокси, дихлорметокси и трихлорметокси.
"Изомерия" означает соединения, которые имеют одинаковые молекулярные формулы, но различаются последовательностью связывания их атомов или расположением их атомов в пространстве. Изомеры, которые различаются расположением их атомов в пространстве, называют "стереоизомерами". Стереоизомеры, которые не являются зеркальными отражениеми друг друга, называют "диастереоизомерами", и стереоизомеры, которые не являются совпадающими при наложении зеркальными отражениеми друг друга, называют "энантиомерами" или иногда оптическими изомерами. Смесь, содержащую равные количества индивидуальных энантиомерных форм противоположной хиральности, называют "рацемической смесью".
Углеродный атом, связанный с четырьмя неидентичными заместителями, называют "хиральным центром".
"Хиральный изомер" означает соединение с по меньшей мере одним хиральным центром. Соединения с более чем одним хиральным центром могут существовать либо в виде индивидуального диастереомера, либо в виде смеси диастереомеров, называемой "диастереомерной смесью". Когда присутствует один хиральный центр, стереоизомер может быть охарактеризован абсолютной конфигурацией (R или S) этого хирального центра. Абсолютная конфигурация относится к расположению в пространстве заместителей, связанных с хиральным центром. Рассматриваемые заместители, связанные с хиральным центром, расположены в порядке соответствия с Правилом Последовательности Кана, Ингольда и Прелога. (Calm et al., Angew. Chem. Inter. Edit. 1966, 5, 385; errata 511; Cahn et al., Angew. Chem. 1966, 78, 413; Cahn and Ingold, J. Chem. Soc. 1951 (London), 612; Calm et al., Experientia 1956, 12, 81; Cahn, J. Chem. Educ. 1964, 41, 116).
В настоящем описании, в каждом случае хиральный центр в структурной формуле, такой как неограничивающий пример, показанный ниже:
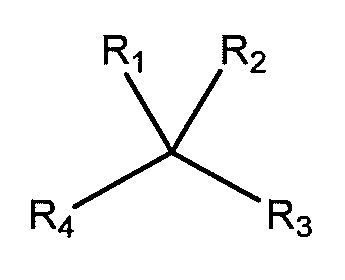
предназначен для описания всех возможных стереоизомеров. Наоборот, хиральный центр, показанный в виде клина или штриховыми линиями, такой как неограничивающий пример, показанный ниже:
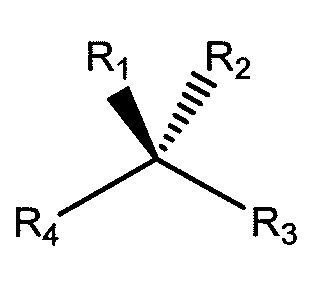
предназначен для описания стереоизомера, такого как указано (здесь, в этом sp3 гибридизованном углеродном хиральном центре R3 и R4 находятся в плоскости листа, R1 находится над плоскостью листа, и R2 находится за плоскостью листа).
"Геометрический изомер" означает диастереомеры, которые существуют благодаря затрудненному вращению вокруг двойных связей или циклоалкильного линкера (например, 1,3-циклобутила). Эти конфигурации отличаются по названиям с помощью префиксов цис и транс или Z и E, которые указывают, что группы находятся на одной и той же или на противоположных сторонах двойной связи в молекуле в соответствии с правилами Кана-Ингольда-Прелога.
В настоящем описании в каждом случае в структурной формуле, включающей волнистую линию, смежную с двойной связью, как показано:
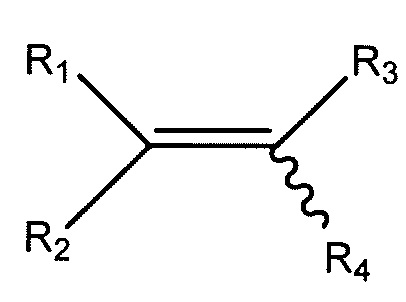 или нарисовано со всеми прямыми связями, предназначено для отображения также геометрических изомеров. Напротив, такие структуры, выполненные без волнистой линии, предназначены для отображения соединения, имеющего геометрическую конфигурацию, как показано на рисунке.
или нарисовано со всеми прямыми связями, предназначено для отображения также геометрических изомеров. Напротив, такие структуры, выполненные без волнистой линии, предназначены для отображения соединения, имеющего геометрическую конфигурацию, как показано на рисунке.
"Таутомер" представляет собой один из двух или более структурных изомеров, которые существуют в равновесии и легко преобразовываются из одной изомерной формы в другую. Это преобразование приводит к формальной миграции атома водорода, сопровождаемой переключением смежных сопряженных двойных связей. Таутомеры существуют в виде смеси ряда таутомеров в растворе. В растворах, где возможна таутомеризация, будет достигаться химическое равновесие таутомеров. Точное соотношение таутомеров зависит от различных факторов, включая температуру, растворитель и pH. Когда таутомеры являются взаимопреобразуемыми путем таутомеризации это понятие называют таутомерией.
Если в настоящей заявке указано соединение, подверженное таутомеризации, но только изображает один из таутомеров, понятно, что все таутомеры включены как часть значения изображаемого химического вещества. Следует понимать, что соединения по настоящему изобретению могут быть представлены как различные таутомеры. Следует также понимать, что когда соединения имеют таутомерные формы, все таутомерные формы предназначены для включения в объем настоящего раскрытия, а обозначение соединений не исключает какой-либо таутомерной формы.
Из различных типов таутомерии, которые возможны, обычно наблюдают два типа. В кето-енольной таутомерии происходит одновременный сдвиг электронов и атома водорода. Кольцевая-цепочечная таутомерия возникает в результате взаимодействия альдегидной группы (-CHO) в сахарной цепи молекулы с одной из гидрокси групп (--OH) в этой же молекуле с приданием ей циклической (кольцевой) формы, как продемонстрировано на примере глюкозы.
Обычные таутомерные пары представляют собой следующие: кетон-енол, амид-нитрил, лактам-лактим, амид-имидная кислота таутомерия в гетероциклических кольцах (например, в основаниях нуклеиновых кислот, таких как гуанин, тимин и цитозин), имин-енамин и енамин-енамин.
Кроме того, структуры и другие соединения, обсуждаемые в этом описании, включают все их атропические изомеры, при этом понятно, что не все атропические изомеры могут иметь одинаковый уровень активности. "Атропические изомеры" являются типом стереоизомера, в котором атомы двух изомеров различно расположены в пространстве. Атропические изомеры обязаны своим существованием ограниченному вращению, вызванному затрудненностью вращения больших групп вокруг центральной связи. Такие атропические изомеры обычно существуют как смесь, однако в результате последних достижений в методах хроматографии стало возможным разделять смеси двух атропических изомеров в избранных случаях.
Термин "кристаллические полиморфы", "полиморфы" или "кристаллические формы" означает кристаллические структуры, где соединение (или его соль или сольват) может кристаллизоваться в различные кристаллические упаковки, которые все имеют одинаковый состав элементов. Разные кристаллические формы обычно имеют разные рентгеновские дифрактограммы, данные инфракрасного спектрального анализа, температуры плавления, плотность, твердость, кристаллическую форму, оптические и электрические свойства, стабильность и растворимость. Растворитель перекристаллизации, скорость кристаллизации, температура хранения и другие факторы могут привести к доминированию одной кристаллической формы. Кристаллические полиморфы соединений можно получить путем кристаллизации в различных условиях. Понятно, что соединения по настоящему изобретению могут существовать в кристаллической форме, в смеси кристаллической формы или в виде его ангидрида или гидрата.
Соединения, описанные в настоящей заявке, включают соединения как таковые, а также их соли и сольваты, когда это является подходящим. Соль, например, может быть образована между анионом и положительно заряженной группой (например, амино) в арил- или гетероарил-замещенном бензольном соединении. Подходящие анионы включают хлорид, бромид, иодид, сульфат, бисульфат, сульфамат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат, глутамат, глюкуронат, глутарат, малат, малеат, сукцинат, фумарат, тартрат, тозилат, салицилат, лактат, нафталинсульфонат и ацетат (например, трифторацетат). Термин "фармацевтически приемлемый анион" относится к аниону, подходящему для образования фармацевтически приемлемой соли. Подобным образом, соль также может быть образована между катионом и отрицательно заряженной группой (например, карбоксилат) в арил- или гетероарил-замещенном бензольном соединении. Подходящие катионы включают натриевый ион, калиевый ион, магниевый ион, кальциевый ион и аммониевый катион, такой как ион тетраметиламмония. Арил- или гетероарил-замещенные бензольные соединения также включают такие соли, которые содержат четвертичные атомы азота.
Кроме того, соединения по настоящему изобретению, например, соли соединений, могут существовать либо в гидратированной, либо в негидратированной (безводной) форме, или в виде сольватов с другими молекулами растворителя. Неограничивающие примеры гидратов включают моногидраты, дигидраты и т.п. Неограничивающие примеры сольватов включают этанольные сольваты, ацетоновые сольваты и т.п.
Как используется в настоящем описании, «фармацевтически приемлемые соли» относятся к производным раскрытых соединений, где исходное соединение модифицировано посредством получения его кислой или основной соли. Примеры фармацевтически приемлемых солей включают, но не ограничены ими, соли неорганических или органических кислот основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты, и тому подобное. Фармацевтически приемлемые соли включают обычные нетоксичные соли или четвертичные аммониевые соли исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Например, такие обычные нетоксичные соли включают, но ими не ограничиваются, соли, образованные из неорганических и органических кислот, выбранных из 2-ацетоксибензойной, 2-гидроксиэтансульфоновой, уксусной, аскорбиновой, бензолсульфоновой, бензойной, бикарбоновой, карбоновой, лимонной, эдетовой, этандисульфоновой, 1,2-этансульфоновой, фумаровой, глюкогептоновой, глюконовой, глутаминовой, гликолевой, гликолиларсаниловой, гексилрезорциновой, гидрабаминовой, бромистоводородной, хлористоводородной, иодистоводородной, гидроксималеиновой, гидроксинафтойной, изэтионовой, молочной, лактобионовой, лаурилсульфоновой, малеиновой, яблочной, миндальной, метансульфоновой, напсиловой, азотной, щавелевой, памовой, пантотеновой, фенилуксусной, фосфорной, полигалактуроновой, пропионовой, салициловой, стеариновой, субуксусной, янтарной, сульфаминовой, сульфаниловой, серной, дубильной, винной, толуолсульфоновой кислот и общераспространенных аминокислот, например, глицина, аланина, фенилаланина, аргинина и т.д.
Другие примеры фармацевтически приемлемых солей включают соли гексановой кислоты, циклопентанпропионовой кислоты, пировиноградной кислоты, малоновой кислоты, 3-(4-гидроксибензоил)бензойной кислоты, коричной кислоты, 4-хлорбензолсульфоновой кислоты, 2-нафталинсульфоновой кислоты, 4-толуолсульфоновой кислоты, камфорсульфоновой кислоты, 4-метилбицикло-[2.2.2]-окт-2-ен-1-карбоновой кислоты, 3-фенилпропионовой кислоты, триметилуксусной кислоты, трет-бутилуксусной кислоты, муконовой кислоты и т.п. Настоящее изобретение охватывает также соли, образованные в случае, если в исходном соединении присутствует кислотный протон, и он либо замещен ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; либо координирован с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и тому подобное. В солевой форме, понятно, что отношение соединения к катиону или аниону соли может составлять 1:1, или любое отношение, отличное от 1:1, например, 3:1, 2:1, 1:2 или 1:3.
Следует понимать, что все ссылки на фармацевтически приемлемые соли включают в себя формы присоединения растворителя (сольваты) или кристаллические формы (полиморфы), как определено в настоящем описании, той же соли.
"Сольват" означает формы добавления растворителя, которые содержат либо стехиометрические, либо нестехиометрические количества растворителя. Некоторые соединения имеют тенденцию улавливать фиксированное молярное отношение молекул растворителя в кристаллическическом твердом состоянии с образованием, таким образом, сольвата. Когда растворитель представляет собой воду, образуемый сольват представляет собой гидрат; и когда растворитель представляет собой спирт, образуемый сольват представляет собой алкоголят. Гидраты получают путем объединения одной или нескольких молекул воды с одной молекулой вещества, где вода сохраняет свое молекулярное состояние как H2O.
Названные или изображенные химические вещества предназначены для включения всех природных изотопов атомов, встречающихся в настоящих соединениях. Изотопы включают те атомы, которые имеют одинаковый атомный номер, но разные массовые числа. В качестве общего примера и без ограничения, изотопы 1H водорода включают тритий и дейтерий, а изотопы углерода 12C включают 13C и 14C.
Соединения по настоящему изобретению также могут быть получены в качестве радиоактивных индикаторов для позитронно-эмиссионной томографии (ПЭТ). Такие ПЭТ-индикаторы могут включать радиоизотоп, такой как 11C, 13N, 15O или предпочтительно 18F. Такими радиоизотопами можно заменить соответствующий нерадиоизотопный атом C, N, O или F, уже присутствующий в соединении, или можно заменить атом водорода в соединении.
Следует понимать, что некоторые соединения и их изомеры, соли, сольваты и полиморфы по настоящему изобретению могут проявлять большую активность in vivo или in vitro, чем другие. Также будет понятно, что некоторые заболевания или состояния могут быть подвегнуты лечению более эффективно, чем другие, с использованием соединений и их изомеров, солей, сольватов, полиморфов, по настоящему изобретению.
Как используется в настоящем описании, «лечение» означает введение субъекту фармацевтической композиции для улучшения, уменьшения или облегчения симптомов заболевания. Как используется в настоящем описании, «лечение» или «лечить» описывает лечение и уход за субъектом с целью борьбы с заболеванием, состоянием или нарушением и включает введение соединения по настоящему изобретению или его фармацевтически приемлемой соли, полиморфа или сольвата, для облегчения симптомов или осложнений заболевания, состояния или нарушения или для устранения заболевания, состояния или нарушения. Термин «лечение» также может включать лечение клетки in vitro или модели животного.
Лечение рака может привести к уменьшению размера опухоли. Уменьшение размера опухоли также можно назвать «регрессией опухоли». Предпочтительно после обработки размер опухоли уменьшается на 5% или более по сравнению с ее размером до обработки; более предпочтительно, размер опухоли уменьшается на 10% или более; более предпочтительно, уменьшается на 20% или более; более предпочтительно, уменьшается на 30% или более; более предпочтительно, уменьшается на 40% или более; еще более предпочтительно, уменьшается на 50% или более; и наиболее предпочтительно уменьшается более чем на 75% или более. Размер опухоли может быть измерен с помощью любых воспроизводимых средств измерения.
Лечение рака может привести к уменьшению объема опухоли. Предпочтительно после обработки объем опухоли уменьшается на 5% или более по сравнению с ее размером до обработки; более предпочтительно объем опухоли уменьшается на 10% или более; более предпочтительно, уменьшается на 20% или более; более предпочтительно, уменьшается на 30% или более; более предпочтительно, уменьшается на 40% или более; еще более предпочтительно, уменьшается на 50% или более; и наиболее предпочтительно уменьшается на более чем на 75% или более. Объем опухоли можно быть измерен с помощью любых воспроизводимых средств измерения.
Лечение рака может привести к уменьшению числа опухолей. Предпочтительно после обработки количество опухолей уменьшается на 5% или более по сравнению с количеством до лечения; более предпочтительно, количество опухолей уменьшается на 10% или более; более предпочтительно, уменьшается на 20% или более; более предпочтительно, уменьшается на 30% или более; более предпочтительно, уменьшается на 40% или более; еще более предпочтительно, уменьшается на 50% или более; и наиболее предпочтительно уменьшается на более чем на 75%. Количество опухолей может быть измерено с помощью любых воспроизводимых средств измерения. Количество опухолей может быть измерено путем подсчета опухолей, видимых невооруженным глазом, или при указанном увеличении. Предпочтительно указанное увеличение составляет 2x, 3x, 4x, 5x, 10x или 50x.
Лечение рака может привести к уменьшению числа метастатических поражений в других тканях или органах, удаленных от расположения первичной опухоли. Предпочтительно после лечения количество метастатических поражений уменьшается на 5% или более по сравнению с числом до лечения; более предпочтительно, количество метастатических поражений уменьшается на 10% или более; более предпочтительно, уменьшается на 20% или более; более предпочтительно, уменьшается на 30% или более; более предпочтительно, уменьшается на 40% или более; еще более предпочтительно, уменьшается на 50% или более; и наиболее предпочтительно уменьшается на более чем на 75%. Количество метастатических поражений может быть измерено с помощью любых воспроизводимых средств измерения. Количество метастатических поражений может быть измерено путем подсчета метастатических поражений, видимых невооруженным глазом, или при указанном увеличении. Предпочтительно указанное увеличение составляет 2x, 3x, 4x, 5x, 10x или 50x.
Как используется в настоящем описании, «субъект» или «субъекты» относится к любому животному, например млекопитающим, включая грызунов (например, мышей или крыс), собак, приматов, лемуров или людей.
Лечение рака может привести к увеличению среднего времени выживания популяции субъектов, получающих лечение, по сравнению с популяцией, получающей только носитель. Предпочтительно, среднее время выживания увеличивается более чем на 30 дней; более предпочтительно, более чем на 60 дней; более предпочтительно, более чем на 90 дней; и наиболее предпочтительно, более чем на 120 дней. Увеличение среднего времени выживания популяции может быть измерено с помощью любых воспроизводимых средств. Увеличение среднего времени выживания популяции может быть измерено, например, путем вычисления для популяции средней продолжительности выживания после начала лечения активным соединением. Увеличение среднего времени выживания популяции также может быть измерено, например, путем вычисления для популяции средней продолжительности выживания после завершения первого этапа лечения активным соединением.
Лечение рака может привести к увеличению среднего времени выживания популяции субъектов, получающих лечение, по сравнению с популяцией субъектов, не получающих лечение. Предпочтительно, среднее время выживания увеличивается более чем на 30 дней; более предпочтительно, более чем на 60 дней; более предпочтительно, более чем на 90 дней; и наиболее предпочтительно, более чем на 120 дней. Увеличение среднего времени выживания популяции может быть измерено с помощью любых воспроизводимых средств. Увеличение среднего времени выживания популяции может быть измерено, например, путем вычисления для популяции средней продолжительности выживания после начала лечения активным соединением. Увеличение среднего времени выживания популяции также может быть измерено, например, путем вычисления для популяции средней продолжительности выживания после завершения первого этапа лечения активным соединением.
Лечение рака может привести к увеличению среднего времени выживания популяции субъектов, получающих лечение, по сравнению популяцией, получающей монотерапию лекарственным средством, которое не является соединением по настоящему изобретению, или его фармацевтически приемлемой солью. Предпочтительно, среднее время выживания увеличивается более чем на 30 дней; более предпочтительно, более чем на 60 дней; более предпочтительно, более чем на 90 дней; и наиболее предпочтительно, более чем на 120 дней. Увеличение среднего времени выживания популяции может быть измерено с помощью любых воспроизводимых средств. Увеличение среднего времени выживания популяции может быть измерено, например, путем вычисления для популяции средней продолжительности выживания после начала лечения активным соединением. Увеличение среднего времени выживания популяции также может быть измерено, например, путем вычисления для популяции средней продолжительности выживания после завершения первого этапа лечения активным соединением.
Лечение рака может привести к уменьшению уровня смертности популяции субъектов, получающих лечение, по сравнению с популяцией, получающих только носитель. Лечение рака может привести к снижению уровня смертности популяции субъектов, получающих лечение, по сравнению с популяцией, не получающих лечение. Лечение рака может привести к снижению уровня смертности популяции субъектов, получающих лечение, по сравнению с популяцией, получающей монотерапию с лекарственным средством, которое не является соединением по настоящему изобретению, или его фармацевтически приемлемой солью, пролекарством, метаболитом, аналогом или производным. Предпочтительно, уровень смертности снижается более чем на 2%; более предпочтительно более чем на 5%; более предпочтительно более чем на 10%; и наиболее предпочтительно более чем на 25%. Снижение уровня смертности популяции субъектов, получающих лечение, может быть измерено любыми воспроизводимыми средствами. Снижение уровня смертности популяции может быть измерено, например, путем вычисления для популяции среднего числа смертельных случаев, связанных с заболеванием, в единицу времени после начала лечения активным соединением. Снижение уровня смертности популяции также может быть измерено, например, путем вычисления для популяции среднего числа смертельных случаев, связанных с заболеванием, в единицу времени после завершения первого этапа лечения активным соединением.
Лечение рака может привести к снижению скорости роста опухоли. Предпочтительно после лечения скорость роста опухоли снижается, по меньшей мере, на 5% относительно количества до лечения; более предпочтительно, скорость роста опухоли снижается по меньшей мере на 10%; более предпочтительно, снижается по меньшей мере на 20%; более предпочтительно, снижается по меньшей мере на 30%; более предпочтительно, снижается по меньшей мере на 40%; более предпочтительно, снижается по меньшей мере на 50%; еще более предпочтительно, снижается по меньшей мере на 50%; и наиболее предпочтительно снижается по меньшей мере на 75%. Скорость роста опухоли может быть измерена с помощью любых воспроизводимых средств измерения. Скорость роста опухоли можно измерить в соответствии с изменением диаметра опухоли в единицу времени.
Лечение рака может привести к уменьшению в возобновлении роста опухоли, например, после попыток удалить ее хирургическим путем. Предпочтительно, после лечения, возобновление роста опухоли составляет менее 5%; более предпочтительно, возобновлении роста опухоли составляет менее 10%; более предпочтительно менее 20%; более предпочтительно менее 30%; более предпочтительно менее 40%; более предпочтительно менее 50%; еще более предпочтительно менее 50%; и наиболее предпочтительно менее 75%. Возобновление роста опухоли может быть измерено с помощью любых воспроизводимых средств измерения. Возобновление роста опухоли измеряют, например, путем измерения увеличения диаметра опухоли после предшествующего уменьшения размеров опухоли, котороое следовало за лечением. Уменьшение возобновления роста опухоли указывает на то, что опухоль не восстанавливается после прекращения лечения.
Лечение или профилактика клеточного пролиферативного нарушения может привести к снижению скорости клеточной пролиферации. Предпочтительно после лечения скорость клеточной пролиферации снижается по меньшей мере на 5%; более предпочтительно по меньшей мере на 10%; более предпочтительно по меньшей мере на 20%; более предпочтительно по меньшей мере на 30%; более предпочтительно по меньшей мере на 40%; более предпочтительно по меньшей мере на 50%; еще более предпочтительно по меньшей мере на 50%; и наиболее предпочтительно по меньшей мере на 75%. Скорость клеточной пролиферации может быть измерено с помощью любых воспроизводимых средств измерения. Скорость клеточной пролиферации измеряется, например, путем измерения количества делящихся клеток в образце ткани в единицу времени.
Лечение или профилактика клеточного пролиферативного нарушения может приводить к уменьшению доли пролиферирующих клеток. Предпочтительно после лечения доля пролиферирующих клеток снижается по меньшей мере на 5%; более предпочтительно по меньшей мере на 10%; более предпочтительно по меньшей мере на 20%; более предпочтительно по меньшей мере на 30%; более предпочтительно по меньшей мере на 40%; более предпочтительно по меньшей мере на 50%; еще более предпочтительно по меньшей мере на 50%; и наиболее предпочтительно по меньшей мере на 75%. Доля пролиферирующих клеток может быть измерена с помощью любых воспроизводимых средств измерения. Предпочтительно, долю пролиферирующих клеток измеряли, например, путем количественного определения количества делящихся клеток относительно количества неделящихся клеток в образце ткани. Доля пролиферирующих клеток может быть эквивалентна митотическому индексу.
Лечение или профилактика клеточного пролиферативного нарушения может приводить к уменьшению размера области или зоны клеточной пролиферации. Предпочтительно после лечения размер области или зоны клеточной пролиферации уменьшается по меньшей мере на 5% по сравнению с ее размером до лечения; более предпочтительно уменьшается по меньшей мере на 10%; более предпочтительно уменьшается по меньшей мере на 20%; более предпочтительно уменьшается по меньшей мере на 30%; более предпочтительно уменьшается по меньшей мере, на 40%; более предпочтительно уменьшается по меньшей мере на 50%; еще более предпочтительно уменьшается по меньшей мере на 50%; и наиболее предпочтительно уменьшается по меньшей мере на 75%. Размер области или зоны клеточной пролиферации может быть измерен с помощью любых воспроизводимых средств измерения. Размер области или зоны клеточной пролиферации может быть измерен как диаметр или ширина области или зоны клеточной пролиферации.
Лечение или профилактика клеточного пролиферативного нарушения может приводить к уменьшению количества или доли клеток, имеющих аномальный внешний вид или морфологию. Предпочтительно после лечения количество клеток, имеющих аномальную морфологию, уменьшается по меньшей мере на 5% по сравнению с его размером до лечения; более предпочтительно уменьшается по меньшей мере на 10%; более предпочтительно уменьшается по меньшей мере на 20%; более предпочтительно уменьшается по меньшей мере на 30%; более предпочтительно уменьшается по меньшей мере на 40%; более предпочтительно уменьшается по меньшей мере на 50%; еще более предпочтительно уменьшается по меньшей мере на 50%; и наиболее предпочтительно уменьшается по меньшей мере на 75%. Аномальный внешний вид или морфология клеток может быть измерена с помощью любых воспроизводимых средств измерения. Аномальная клеточная морфология может быть измерена с помощью микроскопии, например, с использованием инвертированного микроскопа для тканевой культуры. Аномальная клеточная морфология может иметь форму ядерного плеоморфизма.
Как используется в настоящем описании, термин «облегчение» предназначен для описания процесса, при котором уменьшается тяжесть признака или симптома нарушения. Важно отметить, что признак или симптом можно облегчить без его устранения. В предпочтительном варианте осуществления введение фармацевтических композиций по изобретению приводит к устранению признака или симптома, однако, устранение не требуется. Ожидается, что эффективные дозы уменьшат тяжесть признака или симптома. Например, признак или симптом нарушения, такого как рак, который может возникать в нескольких местах, облегчается, если степень тяжести рака снижается внутри, по меньшей мере, одного из нескольких участков.
Как используется в настоящем описании, термин «тяжесть» предназначен для описания потенциала рака превращаться из предракового или доброкачественного состояния в злокачественное состояние. Альтернативно, или, кроме того, тяжесть предназначена для описания стадии рака, например, в соответствии с системой TNM (принятой Международным союзом против рака (UICC) и Американским объединенным комитетом по изучению рака (AJCC)) или другими принятыми в данной области методами. Стадия рака относится к степени или тяжести рака, основанной на таких факторах, как местоположение первичной опухоли, размер опухоли, количество опухолей и вовлечение лимфатических узлов (распространение рака в лимфатические узлы). Альтернативно, или, в дополнение, тяжесть предназначена для описания степени опухоли с помощью принятых в данной области методов (см., National Cancer Institute, www.cancer.gov). Степень опухоли представляет собой систему, используемую для классификации раковых клеток с точки зрения того, насколько они ненормальны под микроскопом и насколько быстро опухоль, вероятно, будет расти и распространяться. При определении степени опухоли учитываются многие факторы, включая структуру и характер роста клеток. Конкретные факторы, используемые для определения степени опухоли, различаются для каждого типа рака. Тяжесть также описывает гистологическая форма, также называемая дифференцирование, которая относится к тому, насколько опухолевые клетки напоминают нормальные клетки того же типа ткани (см., National Cancer Institute, www.cancer.gov). Кроме того, тяжесть описывает степень полиморфизма ядер, которая относится к размеру и форме ядра в опухолевых клетках и к проценту опухолевых клеток, которые делятся (см., National Cancer Institute, www.cancer.gov).
В другом аспекте, описанном здесь, тяжесть описывает степень, до которой опухоль секретировала факторы роста, разрушила внеклеточный матрикс, стала васкуляризированной, потеряла адгезию с соседними тканями или метастазировала. Кроме того, тяжесть описывает количество мест, в которые метастазировала первичная опухоль. Наконец, тяжесть включает сложность лечения опухолей различных типов и локализаций. Например, неоперабельные опухоли, те типы рака, которые имеют больший доступ к множеству систем организма (гематологические и иммунологические опухоли), и те, которые являются наиболее устойчивыми к традиционным методам лечения, считаются наиболее тяжелыми. В этих ситуациях продление ожидаемой продолжительности жизни субъекта и/или уменьшение боли, уменьшение доли раковых клеток или ограничение клеток одной системой и улучшение стадии рака/степени опухоли/ гистологической оценки/степени полиморфизма ядер считаются смягчающими признак или симптом рака.
Как используется в настоящем описании термин "симптом" определяется как признак заболевания, болезни, травмы или того, что что-то не так в организме. Симптомы ощущаются или замечены индивидуумом, испытывающим симптом, но не могут легко быть замечены не медицинскими работниками.
«Фармацевтическая композиция» представляет собой состав, содержащий соединение по настоящему изобретению в форме, подходящей для введения субъекту. В одном из вариантов осуществления фармацевтическая композиция находится в насыпной форме (ангро) или в стандартной лекарственной форме. Стандартная лекарственная форма представляет собой любую из множества форм, включая, например, капсулу, IV мешок, таблетку, один насос для подачи разовой дозы на аэрозольном ингаляторе или флакон. Количество активного ингредиента (например, состава раскрытого соединения или его соли, гидрата, сольвата или изомера) в дозированной форме композиции является эффективным количеством и меняется в зависимости от конкретного вида лечения, в котором применяется эта дозированная форма. Специалист в данной области поймет, что в некоторых случаях необходимо осуществлять стандартные изменения дозировки в зависимости от возраста и состояния пациента. Доза будет также зависеть от пути введения. Рассматриваются различные пути введения, включая пероральный, легочный, ректальный, парентеральный, трансдермальный, подкожный, внутривенный, внутримышечный, интраперитонеальный, ингаляционный, буккальный, сублингвальный, интраплевральный, интратекальный, интраназальный и т.п. Лекарственные формы для местного или трансдермального введения соединения по настоящему изобретению включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и устройства для ингаляции. В одном из вариантов осуществления активное соединение в стерильных условиях смешивают с фармацевтически приемлемым носителем и с любыми консервантами, буферами или пропеллентами, которые являются необходимыми.
Как используется в настоящем описании, выражение «фармацевтически приемлемый» относится к таким соединениям, анионам, катионам, материалам, композициям, носителям и/или лекарственным формам, которые в рамках здравого медицинского суждения подходят для использования в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соразмерного с целесообразным соотношением пользы/риска.
«Фармацевтически приемлемый эксципиент» означает эксципиент, который применим для получения фармацевтической композиции, которая является в основном безопасной, нетоксичной и не является нежелательной ни с биологической, ни с какой-либо другой точки зрения, и включает эксципиент, который подходит для ветеринарного применения, а также для фармацевтического применения в лечении людей. Термин «фармацевтически приемлемый эксципиент», как используется в описании и формуле изобретения, включает как один, так и более чем один такой эксципиент.
Варианты осуществления, представленные в настоящем описании, могут содержать фармацевтические композиции, содержащие любое соединение, раскрытое в настоящем описании, в комбинации с по меньшей мере одним фармацевтически приемлемым эксципиентом или носителем.
Фармацевтическая композиция, описанная в настоящему документе, обычно формулируется так, чтобы быть совместимой с ее предполагаемым путем введения. Примеры путей введения включают парентеральный, например, внутривенный, интрадермальный, подкожный, пероральный (например, ингаляционный), трансдермальный (местный) и трансмукозальный путь введения. Растворы или суспензии, используемые для парентерального, интрадермального или подкожного применения, могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, солевой раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатообразующие агенты, такие как этилендиаминтетрауксусная кислота; буферные средства, такие как ацетаты, цитраты или фосфаты, а также средства для регулирования тоничности, такие как хлорид натрия или декстроза. Значение pH можно регулировать кислотами или основаниями, такими как, хлористоводородная кислота или гидроксид натрия. Парентеральный препарат можно помещать в ампулы, одноразовые шприцы и флаконы, содержащие несколько доз, изготовленные из стекла или пластмассы.
Соединение или фармацевтическую композицию можно вводить субъекту во многих из хорошо известных методов, используемых в настоящее время для химиотерапевтического лечения. Например, для лечения рака соединение, описанное в настоящем документе, можно вводить непосредственно в опухоли, вводить в кровоток или полости тела или принимать перорально или наносить через кожу с помощью пластырей. Выбранная доза должна быть достаточной для эффективного лечения, но не настолько высокой, чтобы вызвать неприемлемые побочные эффекты. Состояние заболевания (например, рак, предраковое состояние и тому подобное) и состояние здоровье пациента предпочтительно следует тщательно контролировать во время и в течение целесообразного периода времени после лечения.
Термин «терапевтически эффективное количество», как используется в настоящем описании, относится к количеству фармацевтического средства для лечения, улучшения или предотвращения идентифицированного заболевания или состояния или для проявления заметного терапевтического или ингибирующего действия. Эффект может быть обнаружен любым способом анализа, известным в данной области техники. Точное значение эффективного количества для субъекта будет зависеть от массы тела, его размера и здоровья; природы и тяжести состояния; и терапевтического средства или комбинации терапевтических средств, выбранных для введения. Терапевтически эффективное количество для данной ситуации можно определить с помощью стандартных экспериментов, которые находятся в пределах навыков и компетенции клинициста. В предпочтительном аспекте подвергаемое лечению заболевание или состояние представляет собой рак. В другом аспекте заболевание или состояние, подлежащее лечению, представляет собой клеточное пролиферативное нарушение.
Для любого соединения терапевтически эффективное количество можно первоначально определить либо с помощью исследований на клеточных культурах, например, неопластических клетках, либо на животных моделях, обычно крысах, мышах, кроликах, собаках или свиньях. Животные модели могут также использоваться для определения соответствующего диапазона концентраций и пути введения. Эту информацию затем можно использовать для определения подходящих доз и путей введения людям. Терапевтическую/профилактическую эффективность и токсичность можно определить по стандартным фармацевтическим методикам на клеточных культурах или экспериментальных животных, например, ED50 (дозу, которая проявляет терапевтическую эффективность для 50% популяции) и LD50 (дозу, которая оказывается летальной для 50% популяции). Соотношение между дозами, проявляющими токсический и терапевтический эффекты, представляет собой терапевтический индекс, и этот индекс можно выразить как отношение LD50/ED50. Предпочтительными являются фармацевтические композиции, которые демонстрируют высокие значения терапевтического индекса. Дозировка может меняться в указанном диапазоне в зависимости от применяемой дозированной формы, восприимчивости пациента и пути введения.
Дозировку и путь введения подбирают таким образом, чтобы обеспечить желаемые уровни активного средства (средств) или чтобы поддержать желаемый эффект. Факторы, которые могут быть приняты во внимание, включают тяжесть болезненного состояния, общее состояние здоровья субъекта, его возраст, массу тела и пол субъекта, рацион питания, время и частоту введения, комбинацию (комбинации) лекарственных средств, чувствительность реакции и переносимость/восприимчивость к терапии. Фармацевтические композиции длительного действия можно вводить каждые 3-4 дня, каждую неделю или раз в две недели, в зависимости от периода полужизни и скорости выведения конкретного состава.
Фармацевтические композиции, содержащие активные соединения, описанные в настоящем документе, могут быть получены хорошо известным способом, например, посредством обычного смешивания, растворения, гранулирования, дражирования, растирания в порошок, эмульгирования, инкапсулирования, включения или лиофилизации. Фармацевтические композиции могут быть приготовлены обычным способом с использованием одного или нескольких фармацевтически приемлемых носителей, включая эксципиенты и/или вспомогательные вещества, которые облегчают переработку активных соединений в препараты, которые могут быть использованы в фармацевтических целях. Подходящий состав, безусловно, будет зависеть от выбранного пути введения.
Фармацевтические композиции, подходящие для применения в форме инъекций, включают стерильные водные растворы (в случае, если компоненты состава растворимы в воде) или дисперсии, и стерильные порошки для получения стерильных растворов или дисперсий для немедленного введения. В случае внутривенного введения, подходящие носители включают физиологический солевой раствор, бактериостатическую воду, Cremophor EL™ (BASF, Parsippany, N.J.) или фосфатный буферный солевой раствор (PBS). Во всех случаях композиция должна быть стерильной и должна иметь такую текучесть, чтобы ее можно было легко вводить с помощью шприца. Она должна сохранять устойчивость в условиях производства и хранения, и ее необходимо защитить от загрязняющего действия микроорганизмов, таких как бактерии и грибки. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), и их подходящие смеси. Может поддерживаться необходимая текучесть, например, путем использования покрытия, такого как лецитин, сохранением требуемого размера частиц в случае дисперсии, а также с помощью поверхностно-активных веществ. Предотвратить действие микроорганизмов можно с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. Во многих случаях будет предпочтительно включение в композицию изотонических средств, например, сахаров, полиспиртов, таких как манит, сорбит и хлорида натрия. Продолжительной абсорбции композиций для инъекции можно добиться включением в композицию средства, которое замедляет абсорбцию, например, моностеарата алюминия и желатина.
Стерильные растворы для инъекций могут быть получены путем включения активного соединения, взятого в необходимом количестве, в подходящем растворителе с одним из или комбинации ингредиентов, перечисленных выше, при необходимости, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают введением активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие необходимые ингредиенты из числа перечисленных выше. В случае стерильных порошков для получения стерильных растворов для инъекции, способами их получения являются вакуумная сушка и лиофилизация, что позволяет получить порошок активного ингредиента в комбинации с любым дополнительным желаемым ингредиентом, образовавшимися из их раствора, полученного ранее стерильным фильтрованием.
Пероральные композиции обычно включают инертный разбавитель или пригодный в пищу фармацевтически приемлемый носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Для целей перорального терапевтического введения активное соединение может быть объединено с эксципиентами и использовано в форме таблеток, пастилок или капсул. Пероральные композиции можно также получать с использованием жидкого носителя, с целью применения в качестве полоскания для рта, причем соединение в жидком носителе применяют перорально, полоща рот, и выплевывают или проглатывают. В композицию в качестве ее составной части можно включать фармацевтически приемлемые связующие агенты и/или адъюванты. Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любой из следующих ингредиентов или соединений сходной природы: связующий компонент, такой как микрокристаллическая целлюлоза, смола трагаканта или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, Primojel® поперечно сшитый карбоксиметилированный крахмал или кукурузный крахмал; смазывающее средство, такое как стеарат магния или Sterotes; средство для улучшения скольжения, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или вкусовое средство, такое как перечная мята, метилсалицилат или апельсиновая добавка.
Для введения с помощью ингаляции соединения доставляют в форме аэрозоля из контейнера, находящегося под давлением, или распылителя, который содержит подходящий пропеллент, например, газ, такой как диоксид углерода, или ингалятора.
Системное введение можно также осуществлять трансмукозальным или трансдермальным путем. С целью трансмукозального или трансдермального введения в составе используются проникающие средства (пенетранты), которые подходят для того барьера, который необходимо преодолеть. Такие пенетранты широко известны в данной области и включают, например, в случае трансмукозального введения, детергенты, соли желчных кислот и производные фусидовой кислоты. Трансмукозальное введение можно осуществить с помощью назальных спреев или суппозиториев. Для трансдермального введения активные соединения включают в состав мазей, бальзамов, гелей или кремов, которые хорошо известны в данной области.
Активные соединения можно включать в состав вместе с фармацевтически приемлемыми носителями, которые будут препятствовать быстрому выведению соединения из организма, как в случае составов с регулируемым высвобождением, в число которых входят имплантаты и микроинкапсулированные системы доставки. Можно применять биоразрушаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы получения таких составов должны быть очевидны специалисту в данной области техники.
Как правило, предпочтительно получать пероральные или парентеральные композиции в единичной дозированной форме для легкости введения и однородности дозировки. Дозированная лекарственная форма, как используется в настоящем описании, относится к физически дискретным единицам, предназначенным для введения разовой дозы субъекту, подвергаемому лечению; причем каждая единица содержит заранее определенное количество активного соединения, рассчитанное на получение желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Конкретные характеристики дозированных лекарственных форм, как указано здесь, определяются и непосредственно зависят от индивидуальных характеристик активного соединения и конкретного терапевтического эффекта, которого необходимо добиться.
При терапевтическом применении дозировки фармацевтических композиций, используемых в соответствии с представленными в настоящем описании вариантами осуществления, варьируются в зависимости от средства, возраста, массы и клинического состояния пациента-реципиента, причем опыт и мнение клинициста или практикующего врача, назначающего терапию, среди прочих факторов влияет на выбор дозировки. Как правило, доза должна быть достаточной, чтобы приводить к замедлению и, предпочтительно, регрессии, роста опухолей, а также предпочтительно вызывать полную регрессию рака. Дозы могут находиться в пределах от примерно 0,01 мг/кг в день до примерно 5000 мг/кг в день. В предпочтительных аспектах дозы могут находиться в пределах от примерно 1 мг/кг в день до примерно 1000 мг/кг в день. В одном аспекте доза будет находиться в диапазоне от примерно 0,1 мг/день до примерно 50 г/день; от примерно 0,1 мг/день до примерно 25 г/день; от примерно 0,1 мг/день до примерно 10 г/день; от примерно 0,1 мг до примерно 3 г/день; или от примерно 0,1 мг до примерно 1 г/день в виде однократных, разделенных или непрерывных доз (доза может быть скорректирована с учетом массы пациента в кг, площади поверхности тела в м2 и возраста в годах). Эффективным количеством фармацевтического средства является такое, которое обеспечивает объективно определяемое улучшение, отмечаемое клиницистом или другим квалифицированным наблюдателем. Например, регрессия опухоли у пациента может быть измерена со ссылкой на диаметр опухоли. Уменьшение диаметра опухоли указывает на регрессию. Регрессия также показана неспособностью опухолей повторяться после прекращения лечения. Как используется в настоящем описании, термин «эффективная дозировка» относится к количеству активного соединения, которое вызывает желаемый биологический эффект у субъекта или в клетке.
Фармацевтические композиции могут быть включены в контейнер, упаковку или дозатор вместе с инструкциями для введения.
Способы получения и введения раскрытых соединений можно найти в Remington: the Science and Practice of Pharmacy, 19.sup.th edition, Mack Publishing Co., Easton, Pa. (1995). В одном варианте осуществления соединения, описанные в настоящем документе, и их фармацевтически приемлемые соли могут быть использованы в фармацевтических препаратах в комбинации с фармацевтически приемлемым носителем или разбавителем. Подходящие фармацевтически приемлемые носители включают твердые инертные наполнители или разбавители и стерильные водные или органические растворы. Соединения должны присутствовать в таких фармацевтических композициях в количествах, достаточных для обеспечения желаемого количества дозы в описанных в настоящем документе диапазоне.
В качестве примера и без ограничения, соединения, описанные в настоящем документе, могут быть использованы для иммунной терапии рака, нацеленной на иммуносупрессивные клетки хозяина в микроокружении опухоли, которая может быть либо миелоидной, либо лимфоидной линии. Типичные виды рака, которые могут быть подвергнуты лечению с использованием одного или нескольких соединений по настоящему изобретению, включают, но не ограничиваются ими, типы опухолей, которые содержат высокие уровни миелоидного инфильтрата на основе Атласа ракового генома (TCGA). Типы опухолей могут включать аденокарциному поджелудочной железы, светлоклеточный рак почки, плоскоклеточную карциному головы и шеи (SCCHN), немелкоклеточный рак легкого (NSCLC), колоректальный рак (CRC), гепато-целлюлярную карциному (HCC), серозный эпителиальный рак яичников, рак шейки матки, переходно-клеточный рак мочевого пузыря и трижды негативный рак молочной железы (TNBC).
Рак, который подлежит лечению, может быть стадирован в соответствии с системой классификации TNM Американского объединенного комитета по изучению рака (AJCC), где опухоли (T) присваивают стадию TX, T1, T1mic, T1a, T1b, T1c, T2, T3, T4, T4a, T4b, T4c или T4d; и где регионарным лимфатическим узлам (N) присваивают стадию NX, N0, N1, N2, N2a, N2b, N3, N3a, N3b или N3c; и где отдаленным метастазам (M) присваивают стадию MX, M0 или M1. Рак, который подлежит лечению, может быть стадирован в соответствии с классификацией Американским объединенным комитетом по изучению рака (AJCC) как стадия I, стадия IIA, стадия IIB, стадия IIIA, стадия IIIB, стадия IIIC, или стадия IV. Раку, подлежащему лечению, может быть присвоена степень в соответствии с классификацией AJCC как степень GX (например, степень не может быть оценена), степень 1, степень 2, степень 3 или степень 4. Рак, подлежащий лечению, может быть стадирован в соответствии с патологической классификацией AJCC (pN) pNX, pN0, PN0 (I-), PN0 (I+), PN0 (mol-), PN0 (mol+), PN1, PN1(mi), PN1a, PN1b, PN1c, pN2, pN2a, pN2b, pN3, pN3a, pN3b или pN3c.
Рак, подлежащий лечению, может включать опухоль, которая, как было определено, меньше или равна примерно 2 сантиметрам в диаметре. Рак, подлежащий лечению, может включать опухоль, которая, как было определено, составляет от примерно 2 до примерно 5 сантиметров в диаметре. Рак, подлежащий лечению, может включать опухоль, которая, как было установлено, больше или равна примерно 3 сантиметров в диаметре. Рак, подлежащий лечению, может включать опухоль, которая, как было установлено, больше 5 сантиметров в диаметре. Рак, который можно лечить, можно классифицировать в соответствии с микроскопическим исследованием как высоко дифференцированный, умеренно дифференцированный, слабодифференцированный или недифференцированный. Рак, подлежащий лечению, можно классифицировать в соответствии с микроскопическим исследованием по отношению к количеству митозов (например, количество клеточного деления) или ядерному плейоморфизму (например, изменение в клетках). Рак, подлежащий лечению, можно классифицировать в соответствии с микроскопическим исследованием как связанный с областями некроза (например, области умирающих или дегенерирующих клеток). Рак, подлежащий лечению, можно классифицировать как имеющий аномальный кариотип, содержащий аномальное количество хромосом или, содержащий одну или несколько хромосом, которые являются аномальными по внешнему виду. Рак, подлежащий лечению, можно классифицировать как являющийся анэуплоидным, триплоидным, тетраплоидным или как имеющий чередующуюся плоидность. Рак, подлежащий лечению, можно классифицировать как имеющий хромосомную транслокацию или делецию или дупликацию всей хромосомы или участок делеции, дупликации или амплификации части хромосомы.
Соединения или их фармацевтически приемлемые соли вводят перорально, назально, трансдермально, пульмонально, ингаляционно, буккально, сублингвально, интраперитонеально, подкожно, внутримышечно, внутривенно, ректально, интраплеврально, интратекально и парентерально. В одном варианте осуществления соединение вводят перорально. Специалист в данной области поймет преимущества определенных путей введения.
Схему введения соединений по настоящему изобретению выбирают в соответствии с рядом факторов, включая тип, вид, возраст, массу, пол и медицинское состояние пациента; тяжесть состояния, подвергаемого лечению; путь введения; функцию печени и почек пациента; и конкретное применяемое соединение или его соль. Рядовой врач или ветеринар способен легко определить и назначить эффективное количество лекарственного средства, необходимого для предотвращения, противодействия или остановки прогрессирования данного состояния.
В качестве примера и без ограничения, соединения, описанные в настоящем документе, могут быть использованы для иммунной терапии рака, нацеленной на иммуносупрессивные клетки хозяина в микроокружении опухоли, которая может быть либо миелоидной, либо лимфоидной линии.
Типы опухолей могут включать аденокарциному поджелудочной железы, светлоклеточный рак почки, плоскоклеточную карциному головы и шеи (SCCHN), немелкоклеточный рак легкого (NSCLC), колоректальный рак (CRC), гепато-целлюлярную карциному (HCC), серозный эпителиальный рак яичников, рак шейки матки, переходно-клеточный рак мочевого пузыря и трижды негативный рак молочной железы (TNBC).
ПРИМЕРЫ
ПРИМЕРЫ I-LXV
Общее:
Нагрев микроволновым излучением проводили с использованием микроволновой печи Biotage Emrys Liberator или Initiator. Колоночную хроматографию проводили с использованием Biotage SP4. Удаление растворителя проводили с использованием либо роторного испарителя Büchii, либо центробежного испарителя Genevac. Препаративную LC/MS проводили с использованием автоочистителя Waters и колонки 19×100 мм XTerra 5 микрон MS C18 в условиях кислотной подвижной фазы. Спектры ЯМР регистрировали с использованием спектрометра Varian 400 МГц.
Когда термин «инертный» используется для описания реактора (например, реакционный сосуд, колба, стеклянный реактор и тому подобное), подразумевается, что воздух в реакторе заменен по существу не содержащим влаги или сухим, инертным газом (таким как азот, аргон и тому подобное).
Общие способы и эксперименты для получения соединений по настоящему изобретению приведены ниже. В некоторых случаях конкретное соединение описано в качестве примера. Однако, следует иметь в виду, что в каждом случае ряд соединений по настоящему изобретению получают в соответствии со схемами и экспериментами, описанными ниже.
Общие экспериментальные методы:
Следующие аббревиатуры используются в экспериментальных процедурах.
AcOH - уксусная кислота
водн. - водный
tBuOK - трет-бутоксид калия
Cbz - бензилоксикарбонил
CDCl3 - дейтерированный хлороформ
CH2Cl2 - дихлорметан
DCM - дихлорметан
DIPEA - диизопропилэтиламин
DMAP - диметиламинопиридин
DMF - N,N-диметилформамид
DMSO - диметилсульфоксид
E - этилацетат
EDC - 1-этил-3-(3-диметиламинопропил)карбодиимид
EtOAc - этилацетат
HCl - хлористый водород
ВЭЖХ - высокоэффективная жидкостная хроматография
H - гептан
HATU - 1-[Бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат
iPrOH - изопропанол
K2CO3 - карбонат калия
MgSO4 - сульфат магния
MeI - метилиодид
MsCl - метансульфонил хлорид
MS 3Å - 3Å молекулярные сита
MTBE - Метил-трет-бутиловый эфир
NaOH - гидроксид натрия
NaHCO3 - гидрокарбонат натрия
Na2CO3 - бикарбонат натрия
Na2SO4 - сульфат натрия
Na2S2O3 - Тиосульфат натрия
Pd(OH)2 - дигидроксид палладия
Pd(PPh3)4 - тетракис(трифенилфосфин)палладий(0)
PyBOP - бензотриазол-1-ил-окситрипирролидинофосфоний гексафторфосфат
PTLC - препаративная тонкослойная хроматография
комн. темпер.- комнатная температура
TBME - трет-бутил метиловый эфир
TBTU - O-(Бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний тетрафторборат
TEA - триэтиламин
TFA - трифторуксусная кислота
THF - тетрагидрофуран
TLC - тонкослойная хроматография
ЯМР: 1НЯМР спектры были сняты с использованием CDCl3, если не указано иное, и были записаны при 400 или 500 МГц с использованием приборов Varian. Указанные мультиплетности представляют собой с=синглет, д=дублет, т=триплет, кв=квартет, квин=квинтет, секс=секстет, м=мультиплет, дд=двойной дублет, дт=двойной триплет, ш= широкий сигнал. Масса: Waters Acquity Ultra Performance LC.
Пример I
(S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 1)
Триэтиламмоний (E)-3-циано-1,1,1-трифтор-4-метокси-4-оксобут-2-ен-2-олат (203):
К раствору метил 2-цианоацетата (201) (35,5 мл, 404 ммоль) и 2,2,2-трифторуксусного ангидрида (202) (61,7 мл, 444 ммоль) в DCM (519 мл) при 0°C медленно добавляли TEA (121 мл, 868 ммоль) таким образом, чтобы температура внутренней реакции поддерживалась ниже 18°C. Удаляли охлаждающую баню и красный прозрачный раствор перемешивали при комнатной температуре в течение ночи. Анализ TLC (70% E/H) показал два сильных УФ активных пятна при Rf=0,1 и 0,2. Если образец разбавляли и определяли анализом TLC, было только одно пятно при Rf=0,2. LCMS показала только в отрицательном режиме для желаемого [M-H]=194. Реакцию гасили добавлением насыщ. NaHCO3 (400 мл), и разделенную водную фазу экстрагировали 6×150 мл DCM, пока анализ TLC не показал, что продукта больше нет. Объединенную органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением красного цвета прозрачного липкого масла в качестве желаемого продукта (120 г, 100% выход). Этот неочищенный продукт использовали на следующей стадии без дополнительной очистки. 1НЯМР (400 МГц): δ ppm 3,65 (с, 3H), 3,18 (кв, J=7,4 Гц, 6H), 1,29 (т, J=7,4 Гц, 9H). LCMS (ES) (M-H)=194,1.
Метил 5-амино-1-(2-гидроксиэтил)-3-(трифторметил)-1H-пиразол-4-карбоксилат (206):

К раствору 2-гидразинилэтанола (205) (46,2 г, 608 ммоль) в 1,4-диоксане (200 мл) при 0°C добавляли метансульфоновую кислоту (47,3 мл, 729 ммоль) по каплям (экзотермическую), а затем TFA (62,4 мл, 810 ммоль). После удаления охлаждающей бани, смесь перемешивали в течение 10 мин, и затем добавляли триэтиламмоний (E)-3-циано-1,1,1-трифтор-4-метокси-4-оксобут-2-ен-2-олат (203) (120 г, 405 ммоль) промывая 1,4-диоксаном (280 мл). Полученную смесь перемешивали в течение 10 мин при комнатной температуре, нагревали до 80°C и перемешивали в течение 1 ч. Анализ TLC (70% E/H) показал в основном следы SM при Rf=0,25 и новые пятна при Rf=0,45 и 0,7 (очень незначительные). Анализ LCMS показал желаемый пик [M+H]=254. И отрицательный режим анализа LCMS не показал исходный материал. Смесь охлаждали до комнатной температуры, концентрировали, охлаждали до 0°C, осторожно гасили насыщ.. NaHCO3 до тех пор, пока не будет больше пузырьков и pH~8. Это затем экстрагировали 5×150 мл EtOAc до тех пор, пока TLC не обнаружит больше продукта. Объединенную органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением желтого масла. Хроматографическая очистка на силикагеле (20%-50%, а затем 50% изократический) дает желаемый продукт в виде светло-желтого твердого вещества, (12,2 г, 12% выход). 1НЯМР (400 MГц, CD3OD): δ ppm 4,08 (т, J=5,1 Гц, 2H), 3,86 (т, J=5,1 Гц, 2H), 3,79 (с, 3H). LCMS (ES) (M+H)=254,0.
Метил 5-амино-1-(2-((метилсульфонил)окси)этил)-3-(трифторметил)-1H-пиразол-4-карбоксилат (207):

К раствору метил 5-амино-1-(2-гидроксиэтил)-3-(трифторметил)-1H-пиразол-4-карбоксилата (206) (14,8 г, 58,5 ммоль) и TEA (16,3 мл, 117 ммоль) в DCM (100 мл) и THF (100 мл) при 0°C добавляли метансульфонилхлорид (5,02 мл, 64,5 ммоль) по каплям в течение 10 мин и перемешивали в течение 15 мин. Анализ TLC (50% E/H) не обнаружил разницы в Rf между исходным материалом и продуктом. Анализ LCMS показал, что реакция была осуществлена, показав [M+H]=332 и без пика исходного материала [M+H]=254. Реакцию гасили добавлением насыщ. NaHCO3, экстрагировали 3×50 мл EtOAc, сушили (Na2SO4), фильтровали и концентрировали с получением желтого масла. Хроматографическая очистка на силикагеле (20%-50% и затем 50% изократический) дает желаемый продукт (18,1 г, 93% выход). 1НЯМР (400 MГц, CD3OD): δ ppm 4,55 (т, J=5,3 Гц, 2H), 4,32 (т, J=5,3 Гц, 2H), 3,79 (с, 3H), 2,98 (с, 3H). LCMS (ES) (M+H)=332,0.
Метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (208):
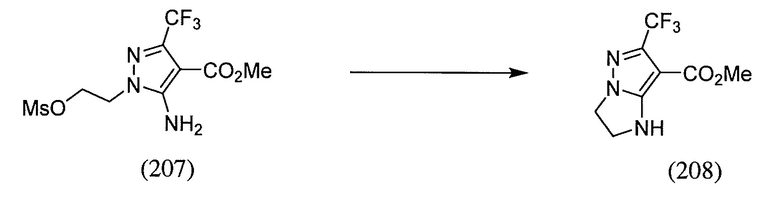
Безводную суспензию метил 5-амино-1-(2-((метилсульфонил)окси)этил)-3-(трифторметил)-1H-пиразол-4-карбоксилат (207) (2,10 г, 6,33 ммоль) и карбонат калия (2,63 г, 19,0 ммоль) в DMF (103 мл) перемешивали и нагревали до 140°C и перемешивали в течение 30 мин при 140°C. Анализ LCMS показал, что реакция завершена, показанный только [M+H]=236 и следовый SM пик 332 (M+H). Анализ TLC (70% E/H) показал новое пятно при Rf=0,4 и следовое пятно исходного материала при Rf=0,42 (почти наложение, но со-пятна показали разницу). Смесь охлаждали до 0°C, гасили добавлением 150 мл насыщ. NaHCO3, экстрагировали 7×80 мл EtOA:эфир (2:1) и затем 3×50 мл 10% MeOH/EtOAc пока анализ TLC показал, что продукта больше нет. Объединенную органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением неочищенного масла. Хроматографическая очистка на силикагеле (10%-30% E/H и затем 30% изократический) дает желаемый продукт (1,31 г, 88% выход). 1НЯМР (400 MГц, CD3OD): δ ppm 4,20 (шир.м, 2H), 4,07 (ддд, J=9,0, 1,6, 0,8 Гц, 2H), 3,75 (с, 3H). LCMS (ES) (M+H)=236,1.
Метил 2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксилат (212):
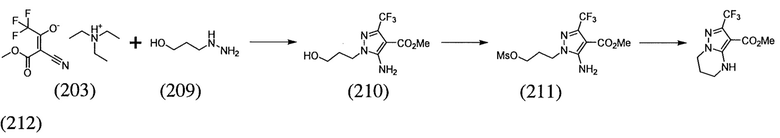
Следуя тем же методикам получения метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208), соединение 212 получали из триэтиламмоний (E)-3-циано-1,1,1-трифтор-4-метокси-4-оксобут-2-ен-2-олата (203) и 3-гидразинилпропан-1-ола (209).
Метил 5-амино-1-(3-гидроксипропил)-3-(трифторметил)-1H-пиразол-4-карбоксилат (210): 1НЯМР (400 МГц): δ ppm 5,78 (шир.с, 2H), 4,14 (дд, J=6,4, 6,0 Гц, 2H), 3,85 (с, 3H), 3,63 (т, J=5,6 Гц, 2H), 2,04 (м, 2H).
Метил 5-амино-1-(3-((метилсульфонил)окси)пропил)-3-(трифторметил)-1H-пиразол-4-карбоксилат (211): 1НЯМР (400 МГц): δ ppm 5,71 (шир.с, 2H), 4,27 (дд, J=5,2, 6,0 Гц, 2H), 4,12 (м, 2H), 3,83 (с, 3H), 3,07 (с, 3H), 2,30 (м, 2H).
Метил 2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксилат (212): 1НЯМР (400 МГц): 6,07 (шир.с, 1H), 4,12 (дд, J=6,0, 6,4 Гц, 2H), 3,82 (с, 3H), 3,45 (м, 2H), 2,20 (м, 2H).
Метил 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (213):
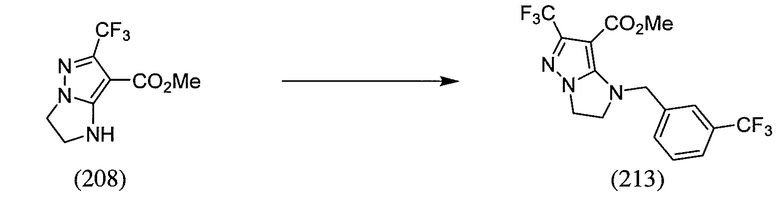
К раствору метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) (580 мг, 2,47 ммоль) и 1-(хлорметил)-3-(трифторметил)бензола (214) (554 мг, 2,85 ммоль) в DMF (15 мл) добавляли при комнатной температуре карбонат калия (1,02 г, 7,40 ммоль) и полученную суспензию перемешивали при комнатной температуре в течение ночи. Затем смесь помещали в предварительно нагретую масляную баню при 140°C и перемешивали в течение 25 мин и, реакция была завершена, показанная с помощью LCMS, с только желательным пиком [M+H]=394. Анализ TLC (50% E/H) показал одно новое пятно при Rf=0,65. Смесь охлаждали до комнатной температуры, разбавляли насыщ. NaHCO3 (50 мл), экстрагировали 3×50 мл, сушили (Na2SO4), фильтровали и концентрировали с получением масла, которое после очистки хроматографией на силикагеле (10%-20% и затем 20% изократический) давало желаемый продукт в виде белого твердого вещества (821 мг, 85% выход). 1НЯМР (400 МГц): δ ppm 7,60-7,45 (м, 4H), 4,99 (с, 2H), 4,20 (дд, J=9,0, 8,2 Гц, 2H), 3,81 (дд, J=9,7, 7,4 Гц, 2H), 3,81 (с, 3H). LCMS (ES) (M+H)=393,9.
6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (215):
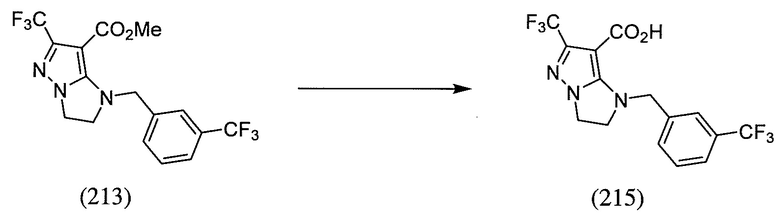
К раствору метил 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (213) (821 мг, 2,09 ммоль) в метаноле (4 мл) и THF (1 мл) при комнатной температуре добавляли раствор гидроксида лития (500 мг, 20,9 ммоль) в воде (6 мл) и смесь перемешивали и нагревали при 45°C в течение ночи и анализ TLC (30% E/H) показал завершение реакции. Реакционную смесь охлаждали до 0°C, нейтрализовали добавлением 1M HCl (20,9 мл, 20,9 ммоль) до pH~5, экстрагировали 3×30 мл EtOAc, сушили (Na2SO4), фильтровали и концентрировали с получением белого твердого желаемого продукта в виде неочищенного продукта (781 мг, 99% выход). Этот неочищенный продукт использовали на следующей стадии непосредственно без дополнительной очистки. 1НЯМР (400 MГц, CD3OD): δ ppm 7,70-7,50 (м, 4H), 5,01 (с, 2H), 4,18 (дд, J=9,0, 8,2 Гц, 2H), 3,85 (дд, J=8,2, 7,1 Гц, 2H). LCMS (ES) (M+H)=380,2.
Метил (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (217):
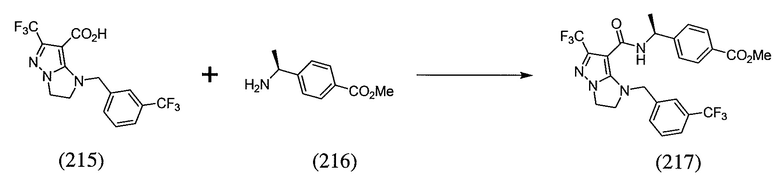
К раствору 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215) (781 мг, 2,06 ммоль), (S)-метил 4-(1-аминоэтил)бензоата (216) (443 мг, 2,47 ммоль) и HATU (1,18 г, 3,09 ммоль) в DCM (10 мл) при комнатной температуре добавляли TEA (4,31 мл, 30,9 ммоль) и полученный раствор перемешивали в течение ночи. Анализ LCMS показал завершение реакции, на основании только желательного пика [M+H]=541. Анализ TLC (50% E/H) показал новое основное пятно при Rf=0,45. Реакционную смесь концентрировали и остаток непосредственно очищали при помощи хроматографии на силикагеле (загружали колонку раствором DCM и заполняли гептаном, 10%-20% E/H, а затем 20% изократический) с получением желаемого продукта в виде белого твердого вещества (1,05 г, 94% выход). 1НЯМР (400 МГц): δ ppm 7,98 (д, J=8,2 Гц, 2H), 7,56-7,40 (м, 4H), 7,39 (д, J=8,2 Гц, 2H), 6,26 (шир.с, 1H), 5,23 (дкв, J=7,0, 7,0 Гц, 1H), 4,87 (д, J=14,8 Гц, 1H), 4,80 (д, J=14,8 Гц, 1H), 4,17 (дд, J=8,6, 8,6 Гц, 2H), 3,90 (с, 3H), 3,76 (дд, J=8,6, 8,2 Гц, 2H), 1,53 (J=7,0 Гц, 3H). LCMS (ES) (M+H)=541,2.
(S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 1):
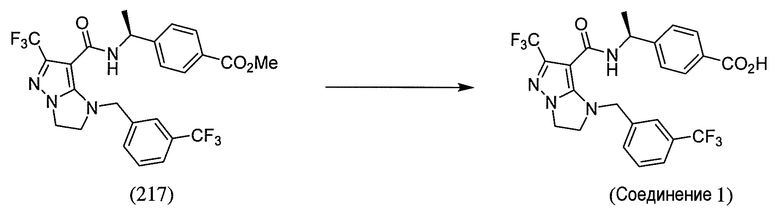
К раствору (S)-метил 4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (217) (950 мг, 1,76 ммоль) в THF (10 мл), метанола (10 мл) и воды (10 мл) при комнатной температуре добавляли гидроксид лития (808 мг, 33,7 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 2,5 ч. Аализ LCMS показал только желательный пик [M+H]=527. Анализ TLC (50% E/H) показал, что нет SM при Rf=0,50 и только одно новое пятно при Rf=0,05. Анализ TLC (5% MeOH/EtOAc) показал, что было только одно пятно при Rf=0,75. Реакцию нейтрализовали добавлением 1 М раствора HCl (33,7 мл, 33,7 ммоль) и концентрировали для удаления органических растворителей. Остаток экстрагировали 3×50 мл EtOAc до тех пор, пока анализ TLC больше yt j,yfhe;bk продукта. Объединенную органическую фазу сушили (Na2SO4), фильтровали и концентрировали. Масляный бесцветный остаток очищали при помощи хроматографии на силикагеле (EtOAc затем 5% MeOH/EtOAc изократический) с получением желаемого продукта в виде бесцветного стекловидного твердого вещества (925 мг, 100% выход). 1НЯМР (400 МГц): δ ppm 8,04 (д, J=8,2 Гц, 2H), 7,58-7,40 (м, 4H), 7,42 (д, J=8,2 Гц, 2H), 6,30 (шир.м, 1H), 5,24 (дкв, J =7,0, 7,0 Гц, 1H), 4,88 (д, J=14,8 Гц, 1H), 4,81 (д, J=14,8 Гц, 1H), 4,18 (дд, J=8,6, 8,2 Гц, 2H), 3,77 (дд, J=9,0, 8,2 Гц, 2H), 1,54 (J=7,0 Гц, 3H). LCMS (ES) (M+H)=527,2.
Пример II
Метил (S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (Соединение 2) и
(S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 3)
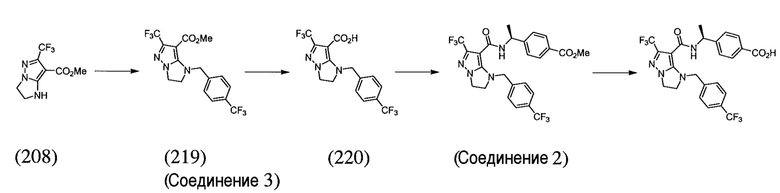
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) и 1-(хлорметил)-3-(трифторметил)бензола (214), описанной в примере I, соединения 2 и 3 аналогичным образом получали из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) и 1-(хлорметил)-4-(трифторметил)бензола (218).
Метил 6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (219): 1НЯМР (400 МГц): δ ppm 7,62 (J=8,0 Гц, 2H), 7,46 (д, J=8,0 Гц, 2H), 5,00 (с, 2H), 4,19 (т, J=8,0 Гц, 2H), 3,80 (т, J=8,0 Гц, 2H), 3,80 (с, 3H). LCMS (ES) (M+H)=394.
6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (220): 1НЯМР (400 MГц, CD3OD): δ ppm 7,66 (J=8,0 Гц, 2H), 7,56 (д, J=8,0 Гц, 2H), 5,03 (с, 2H), 4,18 (т, J=8,0 Гц, 2H), 3,86 (т, J=8,0 Гц, 2H). LCMS (ES) (M+H)=380.
Метил (S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (Соединение 2): 1НЯМР (400 МГц): δ ppm 7,99 (д, J=8,0 Гц, 2H), 7,56 (д, J=8,0 Гц, 2H), 7,38 (д, J=8,0 Гц, 4H), 6,26 (шир.с, 1H), 5,22 (м, 1H), 4,86 (д, J=15,0 Гц, 1H), 4,81 (д, J=15,0 Гц, 1H), 4,17 (т, J= 8,0 Гц, 2H), 3,90 (с, 3H), 3,77 (т, J=8,0 Гц, 2H), 1,53 (д, J=8,0 Гц, 3H). LCMS (ES) (M+H)=541.
(S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 3): 1НЯМР (400 МГц): δ ppm 8,07 (д, J=8,0 Гц, 2H), 7,58 (д, J=8,0 Гц, 2H), 7,44 (д, J=8,0 Гц, 2H), 7,41 (д, J=8,0 Гц, 2H), 6,31 (шир.с, 1H), 5,26 (м, 1H), 4,88 (дд, J=15,0 Гц, 1H), 4,84 (дд, J=15,0 Гц, 1H), 4,19 (т, J=8,0 Гц, 2H), 3,78 (т, J=8,0 Гц, 2 H), 1,56 (д, J=7,0 Гц, 3H). LCMS (ES) (M+H)=527.
****************
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) и 1-(хлорметил)-3-(трифторметил)бензола (214), описанной в примере I, соединения 4-20 аналогичным образом получали из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) и соответствующего замещенного бензилгалогенида.
Пример III
(S)-4-(1-(6-(трифторметил)-1-(2-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 4)
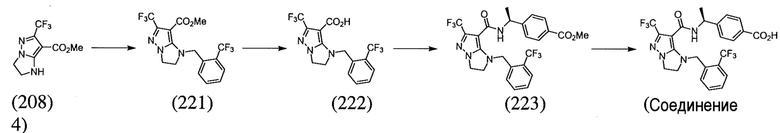
Метил 6-(трифторметил)-1-(2-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (221): 1НЯМР (400 MГц, CD3OD): δ ppm 7,62 (м, 3H), 7,41 (м, 1H), 5,08 (с, 2H), 4,18 (т, J=8,0 Гц, 2H), 3,85 (дд, J=7,2, 9,2 Гц, 2H), 3,57 (с, 3H). LCMS (ES) (M+H)=394,3.
6-(трифторметил)-1-(2-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (222): 1НЯМР (400 MГц, CD3OD): δ ppm 7,65 (д, J=7,6 Гц, 2H), 7,57 (т, J=7,6 Гц, 1H), 7,40 (т, J=7,6 Гц, 1H), 5,13 (с, 2H), 4,16 (т, J=8,0 Гц, 2H), 3,82 (дд, J=7,2, 9,2 Гц, 2H). LCMS (ES) (M+H)=380,2.
Метил (S)-4-(1-(6-(трифторметил)-1-(2-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (223): 1НЯМР (400 МГц): δ ppm 7,90 (д, J=8,0 Гц, 2H), 7,58 (т, J=7,2 Гц, 2H), 7,45 (д, J=8,0 Гц, 1H), 7,31 (м, 3H), 6,17 (шир.д, J=4,8 Гц, 1H), 5,16 (м, 1H), 4,96 (д, J=16,0 Гц, 1H), 4,89 (д, J=16,0 Гц, 1H), 4,10 (т, J=8,4 Гц, 2H), 3,83 (с, 3H), 3,67 (т, J=8,4 Гц, 2H), 1,45 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=541,4.
(S)-4-(1-(6-(трифторметил)-1-(2-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 4): 1НЯМР (400 MГц, CD3OD): δ ppm 7,69 (д, J=8,4 Гц, 2H), 7,61 (д, J=8,0 Гц, 2H), 7,53 (т, J=7,6 Гц, 1H), 7,39 (т, J=7,6 Гц, 1H), 7,24 (т, J=8,4 Гц, 2H), 5,02 (м, 1H), 4,54 (д, J=16,0 Гц, 1H), 4,46 (д, J=16,0 Гц, 1H), 4,15 (м, 2H), 3,71 (м, 2H), 1,35 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=527,3.
Пример IV
(S)-4-(1-(1-(3,5-бис(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 5)

Метил 1-(3,5-бис(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (224): 1НЯМР (400 МГц): δ ppm 7,77 (с, 3H), 5,01 (с, 2H), 4,19 (т, J=8,4 Гц, 2H), 3,77 (т, J=8,0 Гц, 2H), 3,74 (с, 3H). LCMS (ES) (M+H)=462,2.
1-(3,5-бис(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (225): 1НЯМР (400 MГц, CD3OD): δ ppm 7,95 (с, 2H), 7,85 (с, 1H), 5,02 (с, 2H), 4,16 (т, J=8,4 Гц, 2H), 3,84 (дд, J=6,8, 8,8 Гц, 2H). LCMS (ES) (M+H)=448,2.
Метил (S)-4-(1-(1-(3,5-бис(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (226): 1НЯМР (400 МГц): δ ppm 7,93 (д, J=8,8 Гц, 2H), 7,75 (с, 1H), 7,73 (с, 2H), 7,31 (д, J=8,0 Гц, 1H), 6,25 (шир.д, J=4,0 Гц, 1H), 5,14 (м, 1H), 4,97 (д, J=14,8 Гц, 1H), 4,80 (д, J=15,2 Гц, 1H), 4,16 (т, J=8,8 Гц, 2H), 3,84 (с, 3H), 3,72 (т, J=8,8 Гц, 2H), 1,47 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=609,3.
(S)-4-(1-(1-(3,5-бис(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 5):
1НЯМР (400 MГц, CD3OD): δ ppm 7,84 (с, 2H), 7,81 (с, 1H), 7,72 (д, J=8,0 Гц, 2H), 7,29 (д, J=8,4 Гц, 2H), 5,06 (м, 1H), 4,44 (д, J=15,2 Гц, 1H), 4,35 (д, J=15,2 Гц, 1H), 4,16 (м, 2H), 3,74 (м, 2H), 1,39 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=595,3.
Пример V
(S)-4-(1-(1-(3-хлор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 6)
Метил 1-(3-хлор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (227): 1НЯМР (400 МГц): δ ppm 7,50 (шир.с, 1H), 7,49 (шир.с, 1H), 7,42 (шир.с, 1H), 4,92 (с, 2H), 4,17 (т, J=8,4 Гц, 2H), 3,76 (т, J=8,8 Гц, 2H), 3,74 (с, 3H). LCMS (ES) (M+H)=428,2.
1-(3-хлор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (228): 1НЯМР (400 МГц): δ ppm 7,64 (шир.с, 1H), 7,58 (шир.с, 2H), 4,94 (с, 2H), 4,15 (т, J=8,0 Гц, 2H), 3,82 (т, J=8,0 Гц, 2H). LCMS (ES) (M+H)=414,2.
Метил (S)-4-(1-(1-(3-хлор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (229): 1НЯМР (400 МГц): δ ppm 7,94 (д, J=8,4 Гц, 2H), 7,47 (шир.с, 1H), 7,45 (шир.с, 1H), 7,38 (шир.с, 1H), 7,32 (д, J=8,0 Гц, 2H), 6,23 (шир.д, J=3,6 Гц, 1H), 5,15 (м, 1H), 4,84 (д, J=15,2 Гц, 1H), 4,73 (д, J=14,8 Гц, 1H), 4,17 (т, J=8,4 Гц, 2H), 3,84 (с, 3H), 3,72 (т, J=8,4 Гц, 2H), 1,47 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=577,2.
(S)-4-(1-(1-(3-хлор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 6):
1НЯМР (400 MГц, CD3OD): δ ppm 7,76 (д, J=8,0 Гц, 2H), 7,54 (шир.с, 1H), 7,51 (шир.с, 1H), 7,49 (шир.с, 1H), 7,31 (д, J=8,0 Гц, 2H), 5,07 (м, 1H), 4,38 (д, J=15,2 Гц, 1H), 4,26 (д, J=15,6 Гц, 1H), 4,20 (м, 2H), 3,73 (м, 2H), 1,41 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=561,2.
Пример VI
(S)-4-(1-(1-(3,5-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 7)
Метил 1-(3,5-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (230): 1НЯМР (400 МГц): δ ppm 7,25 (т, J=2,0 Гц, 1H), 7,17 (д, J=2,0 Гц, 2H), 4,84 (с, 2H), 4,16 (т, J=8,4 Гц, 2H), 3,76 (т, J=8,4 Гц, 2H), 3,75 (с, 3H). LCMS (ES) (M+H)=394,1.
1-(3,5-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (231): 1НЯМР (400 MГц, CD3OD): δ ppm 7,31 (м, 3H), 4,86 (с, 2H), 4,14 (т, J=7,6 Гц, 2H), 3,81 (т, J=8,0 Гц, 2H). LCMS (ES) (M+H)=380,1.
Метил (S)-4-(1-(1-(3,5-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (232): 1НЯМР (400 МГц): δ ppm 7,93 (д, J=8,4 Гц, 2H), 7,32 (д, J=8,0 Гц, 2H), 7,22 (т, J=1,6 Гц, 1H), 7,12 (д, J=1,6 Гц, 2H), 6,21 (шир.с, 1H), 5,16 (м, 1H), 4,72 (д, J=14,8, Гц, 1H), 4,65 (д, J=14,8, Гц, 1H), 4,13 (т, J=8,4 Гц, 2H), 3,84 (с, 3H), 3,72 (т, J=8,4 Гц, 2H), 1,47 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=541,2.
(S)-4-(1-(1-(3,5-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 7): 1НЯМР (400 MГц, CD3OD): δ ppm 7,79 (д, J=8,4 Гц, 2H), 7,32 (д, J=8,4 Гц, 2H), 7,27 (с, 1H), 7,17 (шир.с, 2H), 5,06 (м, 1H), 4,30 (д, J=15,2 Гц, 1H), 4,16 (м, 3H), 3,75 (м, 2H), 1,41 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=527,2.
Пример VII
(S)-4-(1-(1-(4-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 8)
Метил 1-(4-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (233): 1НЯМР (400 MГц, CD3OD): δ ppm 7,19 (д, J=8,4 Гц, 2H), 6,84 (д, J=8,8 Гц, 2H), 4,77 (д, J=7,2 Гц, 2H), 4,06 (т, J=8,4 Гц, 2H), 3,75 (т, J=8,4 Гц, 2H), 3,72 (с, 3H), 3,71 (с, 3H). LCMS (ES) (M+H)=356,2.
1-(4-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (234): 1НЯМР (400 MГц, DMSO-d6): δ ppm 7,15 (т, J=8,8 Гц, 2H), 6,82 (дд, J=8,8, 22,0, 2H), 4,72 (с, 2H), 4,32 (д, J=5,2 Гц, 1H), 4,06 (т, J=8,4 Гц, 2H), 3,67 (т, J=8,8 Гц, 2H), 3,65 (с, 3H). LCMS (ES) (M+H)=342,3.
Метил (S)-4-(1-(1-(4-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (235): 1НЯМР (400 МГц): δ ppm 7,93 (д, J=8,0 Гц, 2H), 7,35 (д, J=8,4 Гц, 2H), 7,08 (д, J=8,8 Гц, 2H), 6,74 (д, J=8,8 Гц, 2H), 6,18 (шир.с, 1H), 5,20 (м, 1H), 4,63 (д, J=14,4 Гц, 1H), 4,56 (д, J=14,4 Гц, 1H), 4,04 (т, J=8,4 Гц, 2H), 3,84 (с, 3H), 3,72 (с, 3H), 3,68 (т, J=8,4 Гц, 2H), 1,46 (шир.с, 3H). LCMS (ES) (M+H)=503,4.
(S)-4-(1-(1-(4-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 8): 1НЯМР (400 MГц, CD3OD): δ ppm 7,81 (д, J=8,4 Гц, 2H), 7,36 (д, J=8,4 Гц, 2H), 7,04 (д, J=8,8 Гц, 2H), 6,76 (дд, J=2,0, 6,4 Гц, 2H), 5,11 (м, 1H), 4,27 (д, J=14,8 Гц, 1H), 4,12 (д, J=14,8 Гц, 1H), 4,06 (м, 2H), 3,71 (с, 3H), 3,66 (м, 2H), 1,43 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=489,3.
Пример VIII
(S)-4-(1-(1-(3-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 9)
Метил 1-(3-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (236): 1НЯМР (400 MГц, CD3OD): δ ppm 7,18 (м, 1H), 6,83 (м, 3H), 7,08 (м, 2H), 4,80 (с, 2H), 4,08 (т, J=8,0 Гц, 2H), 3,78 (т, J=8,4 Гц, 2H), 3,70 (с, 3H), 3,69 (с, 3H).. LCMS (ES) (M+H)=356,2.
1-(3-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (237): 1НЯМР (400 MГц, CD3OD): δ ppm 7,18 (м, 1H), 6,84 (м, 2H), 6,77 (м, 1H), 4,83 (с, 2H), 4,08 (т, J=8,4 Гц, 2H), 3,77 (т, J=8,0 Гц, 2H), 3,70 (с, 3H). LCMS (ES) (M+H)=342,3.
Метил (S)-4-(1-(1-(3-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (238): 1НЯМР (400 МГц): δ ppm 7,92 (д, J=8,4 Гц, 2H), 7,32 (д, J=8,0 Гц, 2H), 7,14 (м, 1H), 6,75 (м, 3H), 6,18 (шир.д, J=5,2 Гц, 1H), 5,19 (м, 1H), 4,68 (д, J=15,2 Гц, 1H), 4,63 (д, J=14,4 Гц, 1H), 4,07 (т, J=8,4 Гц, 2H), 3,84 (с, 3H), 3,72 (т, J=8,8 Гц, 2H), 3,69 (с, 3H), 1,47 (д, J=6,4 Гц, 3H). LCMS (ES) (M+H)=503,4.
(S)-4-(1-(1-(3-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 9): 1НЯМР (400 MГц, CD3OD): δ ppm 7,78 (д, J=8,4 Гц, 2H), 7,33 (д, J=8,0 Гц, 2H), 7,15 (м, 2H), 6,75 (м, 3H), 5,08 (м, 1H), 4,31 (д, J=14,8 Гц, 1H), 4,18 (д, J=14,8 Гц, 1H), 4,10 (м, 2H), 3,72 (м, 2H), 3,70 (с, 3H), 1,42 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=489,3.
Пример IX
(S)-4-(1-(1-(4-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 10)
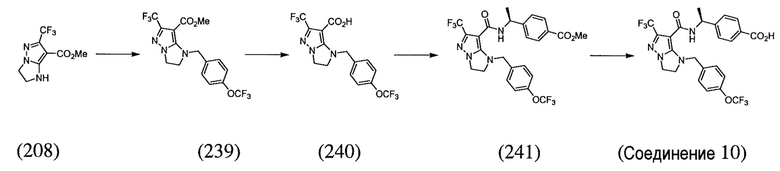
Метил 1-(4-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (239): 1НЯМР (400 МГц): δ ppm 7,30 (д, J=8,8 Гц, 2H), 7,15 (д, J=7,6 Гц, 2H), 4,88 (с, 2H), 4,12 (т, J=8,4 Гц, 2H), 3,75 (с, 3H), 3,74 (т, J=8,0 Гц, 2H). LCMS (ES) (M+H)=410,3.
1-(4-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (240): 1НЯМР (400 MГц, CD3OD): δ ppm 7,41 (дд, J=2,0, 6,8 Гц, 2H), 7,21 (д, J=8,0, 2H), 4,91 (с, 2H), 4,11 (т, J=8,4 Гц, 2H), 3,67 (дд, J=6,8, 7,2 Гц, 2H). LCMS (ES) (M+H)=395,3.
Метил (S)-4-(1-(1-(4-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (241): 1НЯМР (400 МГц): δ ppm 7,89 (д, J=8,0 Гц, 2H), 7,29 (д, J=8,4 Гц, 2H), 7,18 (д, J=8,4 Гц, 2H), 7,03 (д, J=7,6 Гц, 2H), 6,16 (шир.с, 1H), 5,13 (м, 1H), 4,69 (д, J=14,8 Гц, 1H), 4,63 (д, J=14,4 Гц, 1H), 4,06 (т, J=8,0 Гц, 2H), 3,80 (с, 3H), 3,66 (т, J=8,4 Гц, 2H), 1,43 (д, J=6,4 Гц, 3H). LCMS (ES) (M+H)=556,4.
(S)-4-(1-(1-(4-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 10): 1НЯМР (400 MГц, CD3OD): δ ppm 7,80 (д, J=8,4 Гц, 2H), 7,35 (д, J=8,0 Гц, 2H), 7,25 (д, J=8,8 Гц, 2H), 7,13 (д, J=8,0 Гц, 2H), 5,08 (м, 1H), 4,35 (д, J=14,8 Гц, 1H), 4,23 (д, J=14,8 Гц, 1H), 4,13 (м, 2H), 3,71 (м, 2H), 1,41 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=543,3.
Пример X
(S)-4-(1-(1-(3-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 11)
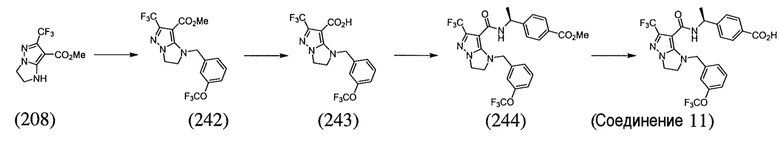
Метил 1-(3-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (242): 1НЯМР (400 MГц,): δ ppm 7,33 (т, J=8,0 Гц, 1H), 7,20 (д, J=8,4 Гц, 1H), 7,13 (шир.с, 2H), 4,89 (с, 2H), 4,13 (т, J=8,8 Гц, 2H), 3,76 (т, J=8,8 Гц, 2H), 3,75 (с, 3H). LCMS (ES) (M+H)=410,2.
1-(3-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (243): 1НЯМР (400 MГц, CD3OD): δ ppm 7,40 (т, J=8,0 Гц, 1H), 7,32 (д, J=7,6 Гц, 1H), 7,25 (с, 1H), 7,15 (д, J=7,6 Гц, 1H), 4,92 (с, 2H), 4,12 (т, J=8,0 Гц, 2H), 3,81 (т, J=8,0 Гц, 2H). LCMS (ES) (M+H)=395,3.
Метил (S)-4-(1-(1-(3-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (244): 1НЯМР (400 МГц): δ ppm 7,93 (м, 2H), 7,32 (д, J=8,0 Гц, 2H), 7,26 (м, 1H), 7,17 (шир.д, J=8,0 Гц, 1H), 7,07 (шир.д, J=6,0 Гц, 2H), 6,20 (шир.с, 1H), 5,16 (м, 1H), 4,76 (д, J=14,8, Гц, 1H), 4,70 (д, J=15,2, Гц, 1H), 4,11 (т, J=8,0 Гц, 2H), 3,84 (с, 3H), 3,71 (т, J=8,4 Гц, 2H), 1,47 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=556,3.
(S)-4-(1-(1-(3-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 11): 1НЯМР (400 MГц, CD3OD): δ ppm 7,79 (д, J=8,4 Гц, 2H), 7,33 (д, J=8,4 Гц, 2H), 7,36 (м, 1H), 7,15 (м, 3H), 5,07 (м, 1H), 4,36 (д, J=15,2 Гц, 1H), 4,27 (д, J=15,2 Гц, 1H), 4,12 (м, 2H), 3,71 (м, 2H), 1,41 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=543,3.
Пример XI
(S)-4-(1-(1-(3-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 12)
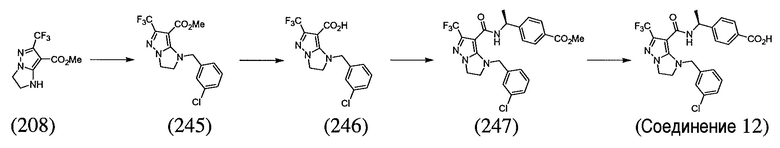
Метил 1-(3-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (245): 1НЯМР (400 MГц, CD3OD): δ ppm 7,25 (м, 4H), 4,83 (с, 2H), 4,12 (т, J=8,4 Гц, 2H), 3,80 (т, J=8,4 Гц, 2H), 3,69 (с, 3H). LCMS (ES) (M+H)=360,2.
1-(3-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (246): 1НЯМР (400 MГц, DMSO-d6): δ ppm 7,30 (м, 3H), 7,23 (м, 1H), 4,81 (с, 2H), 4,12 (т, J=8,0 Гц, 2H), 3,74 (т, J=8,0 Гц, 2H). LCMS (ES) (M+H)=346,2.
Метил (S)-4-(1-(1-(3-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (247): 1НЯМР (400 МГц): δ ppm 7,93 (дд, J=2,0, 6,8 Гц, 2H), 7,32 (д, J=8,0 Гц, 2H), 7,18 (м, 3H), 7,07 (шир.д, J=4,8 Гц, 1H), 6,19 (шир.с, 1H), 5,17 (м, 1H), 4,68 (с, 2H), 4,10 (т, J=8,0 Гц, 2H), 3,84 (с, 3H), 3,70 (т, J=8,0 Гц, 2H), 1,47 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=507,3.
(S)-4-(1-(1-(3-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 12): 1НЯМР (400 MГц, CD3OD): δ ppm 7,80 (д, J=8,4 Гц, 2H), 7,34 (д, J=8,0 Гц, 2H), 7,22 (м, 3H), 7,09 (м, 1H), 5,08 (м, 1H), 4,32 (д, J=14,8 Гц, 1H), 4,21 (д, J=15,2 Гц, 1H), 4,11 (м, 2H), 3,71 (м, 2H), 1,42 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=493,3.
Пример XII
(S)-4-(1-(1-(3,4-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 13)

Метил 1-(3,4-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (248): 1НЯМР (400 МГц): δ ppm 7,38 (м, 2H), 7,12 (м, 1H), 4,84 (с, 2H), 4,14 (т, J=8,0 Гц, 2H), 3,74 (т, J=8,0 Гц, 2H), 3,75 (с, 3H). LCMS (ES) (M+H)=394,1.
1-(3,4-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (249): 1НЯМР (400 MГц, CD3OD): δ ppm 7,45 (м, 2H), 7,21 (ддд, J=2,0, 8,4, 22,0 Гц, 1H), 4,85 (с, 2H), 4,11 (т, J=8,4 Гц, 2H), 3,79 (т, J=8,4 Гц, 2H). LCMS (ES) (M+H)=380,1.
Метил (S)-4-(1-(1-(3,4-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (250): 1НЯМР (400 МГц): δ ppm 7,85 (д, J=8,0 Гц, 2H), 7,23 (м, 4H), 6,97 (дд, J=2,0, 8,4 Гц, 1H), 6,12 (шир.с, 1H), 5,08 (м, 1H), 4,59 (с, 2H), 4,03 (т, J=8,0 Гц, 2H), 3,76 (с, 3H), 3,62 (т, J=8,0 Гц, 2H), 1,39 (д, J=6,4 Гц, 3H). LCMS (ES) (M+H)=541,2.
(S)-4-(1-(1-(3,4-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 13): 1НЯМР (400 MГц, CD3OD): δ ppm 7,79 (д, J=8,4 Гц, 2H), 7,34 (м, 4H), 7,06 (дд, J=3,0, 8,4 Гц, 1H), 5,06 (м, 1H), 4,28 (д, J=14,8 Гц, 1H), 4,16 (д, J=15,2 Гц, 1H), 4,12 (м, 2H), 3,71 (м, 2H), 1,41 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=527,2.
Пример XIII
(S)-4-(1-(1-(4-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 14)
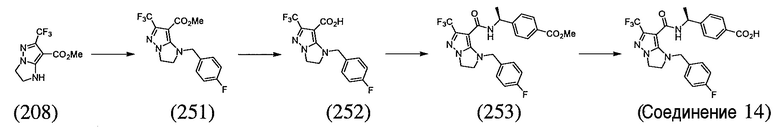
Метил 1-(4-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (251): 1НЯМР (400 MГц, CD3OD): δ ppm 7,30 (м, 2H), 7,01 (м, 2H), 4,80 (д, J=17,2 Гц, 2H), 4,10 (т, J=8,0 Гц, 2H), 3,78 (т, J=8,0 Гц, 2H), 3,70 (с, 3H). LCMS (ES) (M+H)=344,2.
1-(4-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (252): 1НЯМР (400 MГц, DMSO-d6): δ ppm 7,29 (дд, J=5,6, 8,8 Гц, 2H), 7,13 (т, J=8,8 Гц, 2H), 4,79 (с, 2H), 4,10 (т, J=8,0 Гц, 2H), 3,71 (т, J=8,4 Гц, 2H). LCMS (ES) (M+H)=330,2.
Метил (S)-4-(1-(1-(4-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (253): 1НЯМР (400 МГц): δ ppm 7,94 (д, J=8,0 Гц, 2H), 7,34 (д, J=8,4 Гц, 2H), 7,18 (дд, J=5,6, 8,8 Гц, 2H), 6,93 (т, J=8,8 Гц, 2H), 6,20 (шир.д, J=4,4 Гц, 1H), 5,19 (м, 1H), 4,68 (д, J=14,4 Гц, 1H), 4,64 (д, J=14,4 Гц, 1H), 4,08 (т, J=8,4 Гц, 2H), 3,85 (с, 3H), 3,68 (т, J=8,4 Гц, 2H), 1,48 (д, J=6,4 Гц, 3H). LCMS (ES) (M+H)=491,4.
(S)-4-(1-(1-(4-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 14): 1НЯМР (400 MГц, CD3OD): δ ppm 7,82 (д, J=7,6 Гц, 2H), 7,37 (д, J=8,4 Гц, 2H), 7,19 (т, J=6,0 Гц, 2H), 6,97 (т, J=8,4 Гц, 2H), 5,11 (м, 1H), 4,31 (д, J=14,8 Гц, 1H), 4,19 (д, J=14,4 Гц, 1H), 4,11 (м, 2H), 3,68 (м, 2H), 1,44 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=477,3.
Пример XIV
(S)-4-(1-(1-(3-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 15)
Метил 1-(3-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (254): 1НЯМР (400 MГц, CD3OD): δ ppm 7,30 (м, 1H), 7,10 (шир.д, J=7,2 Гц, 1H), 7,04 (шир.д, J=10,0 Гц, 1H), 6,96 (ддд, J=2,4, 8,4, 17,2 Гц, 1H), 4,78 (с, 2H), 4,17 (т, J=8,8 Гц, 2H), 3,81 (т, J=9,6 Гц, 2H), 3,68 (с, 3H). LCMS (ES) (M+H)=344,2.
1-(3-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (255): 1НЯМР (400 MГц, CD3OD): δ ppm δ ppm 7,30 (м, 1H), 7,11 (шир.д, J=8,0 Гц, 1H), 7,06 (шир.д, J=9,6 Гц, 1H), 6,96 (ддд, J=2,8, 8,4, 16,8 Гц, 1H), 4,79 (с, 2H), 4,11 (т, J=8,4 Гц, 2H), 3,79 (т, J=8,4 Гц, 2H). LCMS (ES) (M+H)=326,2.
Метил (S)-4-(1-(1-(3-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (256): 1НЯМР (400 МГц): δ ppm 7,92 (дд, J=2,0, 6,8 Гц, 2H), 7,32 (д, J=8,0 Гц, 2H), 7,20 (м, 1H), 6,93 (м, 3H), 6,19 (шир.д, J=4,4 Гц, 1H), 5,17 (м, 1H), 4,70 (с, 2H), 4,09 (т, J=8,0 Гц, 2H), 3,83 (с, 3H), 3,71 (т, J=8,0 Гц, 2H), 1,47 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=491,4.
(S)-4-(1-(1-(3-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 15): 1НЯМР (400 MГц, CD3OD): δ ppm 7,78 (д, J=8,0 Гц, 2H), 7,33 (д, J=8,4 Гц, 2H), 7,24 (м, 1H), 6,95 (м, 3H), 5,07 (м, 1H), 4,33 (д, J=15,2 Гц, 1H), 4,22 (д, J=15,2 Гц, 1H), 4,12 (м, 2H), 3,67 (м, 2H), 1,41 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=477,3.
Пример XV
(S)-4-(1-(1-(2-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 16)

Метил 1-(2-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (257): 1НЯМР (400 МГц): δ ppm 7,36 (м, 1H), 7,27 (м, 1H), 7,08 (м, 2H), 4,95 (с, 2H), 4,11 (т, J=8,4 Гц, 2H), 3,83 (т, J=8,4 Гц, 2H), 3,69 (с, 3H). LCMS (ES) (M+H)=344,2.
1-(2-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (258): 1НЯМР (400 MГц, DMSO-d6): δ ppm 7,31 (м, 2H), 7,13 (м, 2H), 4,90 (с, 2H), 4,10 (т, J=8,0 Гц, 2H), 3,73 (т, J=8,0 Гц, 2H). LCMS (ES) (M+H)=330,2.
Метил (S)-4-(1-(1-(2-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (259): 1НЯМР (400 МГц): δ ppm 7,94 (д, J=8,4 Гц, 2H), 7,35 (д, J=8,0 Гц, 2H), 7,21 (м, 2H), 6,96 (м, 2H), 6,19 (шир.с, 1H), 5,21 (м, 1H), 4,81 (д, J=15,2 Гц, 1H), 4,74 (д, J=14,8 Гц, 1H), 4,06 (т, J=8,0 Гц, 2H), 3,84 (с, 3H), 3,75 (т, J=8,0 Гц, 2H), 1,48 (д, J=6,4 Гц, 3H). LCMS (ES) (M+H)=491,4.
(S)-4-(1-(1-(2-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 16): 1НЯМР (400 MГц, CD3OD): δ ppm 7,82 (д, J=8,4 Гц, 2H), 7,36 (д, J=8,4 Гц, 2H), 7,22 (м, 2H), 7,02 (м, 2H), 5,10 (м, 1H), 4,43 (д, J=15,2 Гц, 1H), 4,37 (д, J=15,2 Гц, 1H), 4,11 (м, 2H), 3,75 (м, 2H), 1,43 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=477,3.
Пример XVI
(S)-4-(1-(1-(4-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 17)
Метил 1-(4-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (260): 1НЯМР (400 MГц, CD3OD): δ ppm 7,15 (д, J=8,4 Гц, 2H), 7,10 (д, J=8,0 Гц, 2H), 4,79 (д, J=2,8 Гц, 2H), 4,08 (т, J=8,4 Гц, 2H), 3,77 (т, J=8,0 Гц, 2H), 3,71 (с, 3H), 2,26 (с, 3H). LCMS (ES) (M+H)=340,2.
1-(4-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (261): 1НЯМР (400 MГц, DMSO-d6): δ ppm 7,12 (д, J=8,0 Гц, 2H), 7,09 (д, J=8,4 Гц, 2H), 4,75 (с, 2H), 4,08 (т, J=8,8 Гц, 2H), 3,69 (т, J=8,8 Гц, 2H), 2,21 (с, 3H). LCMS (ES) (M+H)=326,2.
Метил (S)-4-(1-(1-(4-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (262): 1НЯМР (400 МГц): δ ppm 7,92 (д, J=8,0 Гц, 2H), 7,32 (д, J=8,0 Гц, 2H), 7,05 (д, J=9,6 Гц, 2H), 7,02 (д, J=9,6 Гц, 2H), 6,16 (шир.д, J=5,6 Гц, 1H), 5,19 (м, 1H), 4,65 (д, J=14,4 Гц, 1H), 4,59 (д, J=14,4 Гц, 1H), 4,04 (т, J=8,4 Гц, 2H), 3,83 (с, 3H), 3,68 (т, J=8,4 Гц, 2H), 2,26 (с, 3H), 1,47 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=487,4.
(S)-4-(1-(1-(4-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 17): 1НЯМР (400 MГц, CD3OD): δ ppm 7,78 (д, J=8,8 Гц, 2H), 7,34 (д, J=8,0 Гц, 2H), 7,05 (д, J=8,8 Гц, 2H), 7,02 (д, J=8,4 Гц, 2H), 5,09 (м, 1H), 4,29 (д, J=14,4 Гц, 1H), 4,13 (д, J=14,4 Гц, 1H), 4,06 (м, 2H), 3,67 (м, 2H), 2,25 (с, 3H), 1,42 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=473,4.
Пример XVII
(S)-4-(1-(1-(3-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 18)
Метил 1-(3-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (263): 1НЯМР (400 MГц, CD3OD): δ ppm 7,15 (м, 2H), 7,06 (м, 3H), 4,78 (д, J=6,0 Гц, 2H), 4,08 (т, J=8,0 Гц, 2H), 3,77 (т, J=8,8 Гц, 2H), 3,70 (с, 3H), 2,26 (с, 3H). LCMS (ES) (M+H)=340,2.
1-(3-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (264): 1НЯМР (400 MГц, DMSO-d6): δ ppm 7,10 (м, 5H), 4,83 (с, 2H), 4,49 (с, 1H), 4,07 (т, J=8,4 Гц, 2H), 3,75 (т, J=8,4 Гц, 2H), 2,26 (с, 3H). LCMS (ES) (M+H)=326,2.
Метил (S)-4-(1-(1-(3-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (265): 1НЯМР (400 МГц): δ ppm 7,91 (д, J=8,4 Гц, 2H), 7,32 (д, J=8,0 Гц, 2H), 7,12 (т, J=7,6 Гц, 1H), 7,00 (м, 2H), 6,20 (шир.д, J=5,2 Гц, 1H), 5,19 (м, 1H), 4,63 (с, 2H), 4,06 (т, J=8,0 Гц, 2H), 3,83 (с, 3H), 3,69 (т, J=8,4 Гц, 2H), 2,24 (с, 3H), 1,47 (д, J=6,4 Гц, 3H). LCMS (ES) (M+H)=487,4.
(S)-4-(1-(1-(3-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 18): 1НЯМР (400 MГц, CD3OD): δ ppm 7,77 (д, J=8,0 Гц, 2H), 7,33 (д, J=8,4 Гц, 2H), 7,12 (т, J=8,0 Гц, 2H), 6,97 (т, J=8,0 Гц, 2H), 5,09 (м, 1H), 4,28 (д, J=15,2 Гц, 1H), 4,13 (д, J=14,4 Гц, 1H), 4,09 (м, 2H), 3,68 (м, 2H), 2,24 (с, 3H), 1,42 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=473,4.
Пример XVIII
(S)-4-(1-(1-(2-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 19)

Метил 1-(2-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (266): 1НЯМР (400 MГц, CD3OD): δ ppm 7,20 (д, J=6,8 Гц, 1H), 7,11 (м, 3H), 4,88 (с, 2H), 4,09 (т, J=8,4 Гц, 2H), 3,69 (т, J=8,0 Гц, 2H), 3,66 (с, 3H), 2,31 (с, 3H). LCMS (ES) (M+H)=340,2.
1-(2-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (267): 1НЯМР (400 MГц, CD3OD): δ ppm 7,17 (д, J=30,0 Гц, 1H), 7,11 (м, 3H), 4,93 (с, 2H), 4,09 (т, J=8,0 Гц, 2H), 3,67 (т, J=8,4 Гц, 2H), 2,32 (с, 3H). LCMS (ES) (M+H)=326,2.
Метил (S)-4-(1-(1-(2-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (268): 1НЯМР (400 МГц): δ ppm 7,91 (д, J=8,0 Гц, 2H), 7,29 (д, J=8,4 Гц, 2H), 7,10 (м, 4H), 6,13 (шир.д, J=5,6 Гц, 1H), 5,16 (м, 1H), 4,69 (с, 2H), 4,07 (т, J=8,4 Гц, 2H), 3,83 (с, 3H), 3,61 (т, J=8,0 Гц, 2H), 2,25 (с, 3H), 1,44 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=487,4.
(S)-4-(1-(1-(2-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 19): 1НЯМР (400 MГц, CD3OD): δ ppm 7,78 (д, J=8,4 Гц, 2H), 7,30 (д, J=8,0 Гц, 2H), 7,21 (д, J=8,0 Гц, 1H), 7,10 (м, 3H), 5,06 (м, 1H), 4,32 (д, J=14,8 Гц, 1H), 4,27 (д, J=14,8 Гц, 1H), 4,12 (т, J=8,4 Гц, 2H), 3,66 (м, 2H), 2,11 (с, 3H), 1,39 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=473,4.
Пример XIX
(S)-4-(1-(1-(4-этилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 20)
Метил 1-(4-этилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (269): 1НЯМР (400 MГц, CD3OD): δ ppm 7,17 (д, J=8,0 Гц, 2H), 7,13 (д, J=8,0 Гц, 2H), 4,79 (д, J=6,4 Гц, 2H), 4,07 (т, J=8,4 Гц, 2H), 3,76 (т, J=8,0 Гц, 2H), 3,70 (с, 3H), 2,56 (кв, J=8,0 Гц, 2H), 1,15 (т, J=8,0 Гц, 3H). LCMS (ES) (M+H)=354,3.
1-(4-этилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (270): 1НЯМР (400 MГц, DMSO-d6): δ ppm 7,13 (м, 4H), 4,76 (с, 2H), 4,09 (т, J=8,4 Гц, 2H), 3,70 (т, J=9,2 Гц, 2H), 2,49 (кв, J=7,6 Гц, 2H), 1,09 (т, J=7,6 Гц, 3H). LCMS (ES) (M+H)=340,3.
Метил (S)-4-(1-(1-(4-этилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (271): 1НЯМР (400 МГц): δ ppm 7,93 (дд, J=2,0, 6,8 Гц, 2H), 7,34 (шир.т, J=8,8 Гц, 4H), 6,17 (шир.д, J=4,8 Гц, 1H), 5,19 (м, 1H), 4,66 (д, J=14,4 Гц, 1H), 4,60 (д, J=14,4 Гц, 1H), 4,05 (т, J=8,0 Гц, 2H), 3,84 (с, 3H), 3,70 (т, J=8,0 Гц, 2H), 2,56 (кв, J=7,6 Гц, 2H), 1,47 (д, J=6,8 Гц, 3H), 1,15 (т, J=7,2 Гц, 3H). LCMS (ES) (M+H)=501,4.
(S)-4-(1-(1-(4-этилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 20): 1НЯМР (400 MГц, CD3OD): δ ppm 7,79 (д, J=8,4 Гц, 2H), 7,35 (д, J=8,0 Гц, 2H), 7,07 (д, J=8,8 Гц, 2H), 7,05 (д, J=8,8 Гц, 2H), 5,10 (м, 1H), 4,31 (д, J=14,4 Гц, 1H), 4,11 (д, J=14,4 Гц, 1H), 4,08 (м, 2H), 3,68 (м, 2H), 2,56 (кв, J=7,6 Гц, 2H), 1,42 (д, J=6,8 Гц, 3H), 1,15 (т, J=7,6 Гц, 3H). LCMS (ES) (M+H)=487,3.
Пример XX
(S)-2-фтор-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 21)
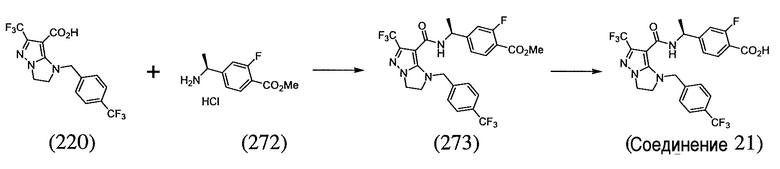
Следуя методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 21 получали из 6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (220) и метил (S)-4-(1-аминоэтил)-2-фторбензоат гидрохлорида (272).
Метил (S)-2-фтор-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (273): 1НЯМР (400 МГц): δ ppm 7,89 (дд, J=7,8, 7,4 Гц, 1H), 7,57 (д, J=7,8 Гц, 2H), 7,39 (д, J=7,8 Гц, 2H), 7,15 (дд, J=8,2, 1,5 Гц 1H), 7,09 (дд, J=11,8, 1,5 Гц, 1H), 6,25 (шир.с, 1H), 5,17 (дкв, J=7,0, 7,0 Гц, 1H), 4,84 (с, 2H), 4,18 (дд, J=8,6, 8,2 Гц, 2H), 3,91 (с, 3H), 3,77 (дд, J=9,0, 8,2 Гц, 2H), 1,52 (J=7,1 Гц, 3H). LCMS (ES) (M+H)=559,2.
(S)-2-фтор-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 21): 1НЯМР (400 МГц): δ ppm 7,89 (дд, J=7,8, 7,4 Гц, 1H), 7,56 (д, J=7,4 Гц, 2H), 7,39 (д, J=7,4 Гц, 2H), 7,14 (дд, J=8,9, 1,5 Гц, 1H), 7,08 (дд, J=11,5, 1,5 Гц, 1H), 6,27 (шир.с, 1H), 5,15 (дкв, J=7,0, 7,0 Гц, 1H), 4,88 (д, J=15,0, 1H), 4,78 (д, J=15,0 Гц, 1H), 4,17 (дд, J=9,4, 7,8 Гц, 2H), 3,75 (дд, J=8,4, 8,2 Гц, 2H), 1,50 (J=7,0 Гц, 3H). LCMS (ES) (M+H)=543,3.
Пример XXI
(S)-3-фтор-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 22)
Метил (S)-4-(1-аминоэтил)-3-фторбензоат гидрохлорид (275)
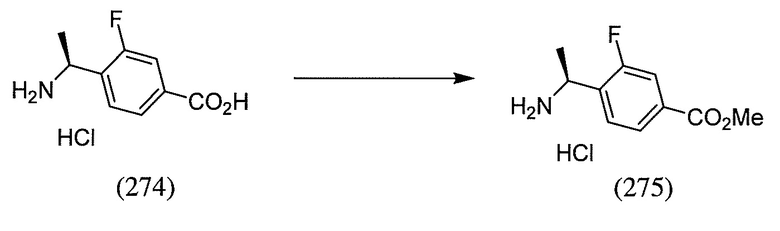
Раствор (S)-4-(1-аминоэтил)-3-фторбензойной кислоты гидрохлорида (274) (500 мг, 2,28 ммоль) в метаноле (20 мл, 494 ммоль) и 4 M хлористоводородной кислоты (2,5 мл, 10,0 ммоль) в 1,4-диоксане нагревали с обратным холодильником в течение 1,5 ч. Анализ LCMS через 1 ч показал, что реакция завершилась на основании сильного пика [M-NH3+H]=181 и малого пика [M+H]=198. Смесь концентрировали до розового камедеобразного остатка. Затем его растворяли в EtOAc и концентрировали до стеклообразного твердого вещества. Повторяли это дважды, и это привело к желаемому продукту в виде розового твердого вещества (538 мг, 100% выход). 1НЯМР (400 MГц, CD3OD): δ ppm 7,93 (дд,, дд, J=7,8, 1,4 Гц, 1H), 7,81 (дд, J=11,0, 1,5 Гц, 1H), 7,63 (дд, J=7,8, 7,8 Гц, 1H), 4,78 (кв, J=7,0 Гц, 1H), 3,93 (с, 3H), 1,66 (д, J=6,6 Гц, 3H), LCMS (ES) (M+H)=198,0 and (M-NH3+H)=181,0.
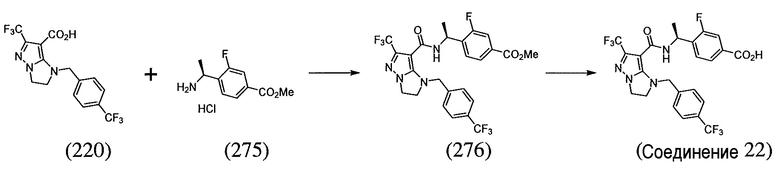
Следуя методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), как описано в примере 1, соединение 22 получали из 6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (220) и метил (S)-4-(1-аминоэтил)-3-фторбензоат гидрохлорида (275).
Метил (S)-3-фтор-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (276): 1НЯМР (400 MГц, CD3OD): δ ppm 7,62 (дд, J=8,2, 1,3 Гц, 1H), 7,59 (д, J=7,8 Гц, 2H), 7,52 (дд, J=10,9, 1,5 Гц 1H), 7,45-7,40 (м, 3H), 5,33 (кв, J=7,0 Гц, 1H), 4,53 (д, J=14,8 Гц, 1H), 4,36 (д, J=14,8 Гц, 1H), 4,20 (дд, J=7,8, 7,8 Гц, 2H), 3,87 (с, 3H), 3,79 (м 2H), 1,46 (д, J=7,0 Гц, 3H). LCMS (ES) (M+H)=559,0.
(S)-3-фтор-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 22): 1НЯМР (400 MГц, CD3OD): δ ppm 8,36 (шир.д, J=7,9 Гц, 1H), 7,65 (дд, J=7,8, 1,5 Гц, 1H), 7,60 (д, J=8,2 Гц, 2H), 7,53 (дд, J=10,9, 1,5 Гц 1H), 7,43 (J=8,2 Гц, 2H), 7,42 (дд, J=7,8, 7,8 Гц 1H), 5,34 (дкв, J=7,4, 7,1 Гц, 1H), 4,53 (д, J=15,8 Гц, 1H), 4,39 (д, J=15,8 Гц, 1H), 4,19 (м, 2H), 3,80 (м, 2H), 1,46 (J=7,0 Гц, 3H). LCMS (ES) (M+H)=545,2.
Пример XXII
(S)-3-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 23)
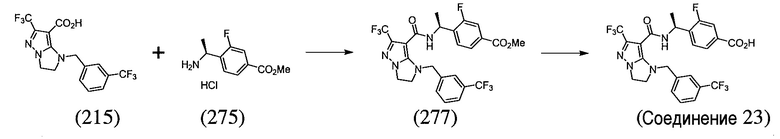
Следуя методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 23 получали из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215) и метил (S)-4-(1-аминоэтил)-3-фторбензоат гидрохлорида (275).
Метил (S)-3-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (277): 1НЯМР (400 MГц, CD3OD): δ ppm 7,64-7,56 (м, 3H), 7,55-7,47 (м, 3H), 7,43 (дд, J=7,9, 7,4 Гц 1H), 5,34 (кв, J=7,0 Гц, 1H), 4,49 (д, J=14,8 Гц, 1H), 4,36 (д, J=14,8 Гц, 1H), 4,20 (ддд, J=8,6, 8,2,, 7,4 Гц, 2H), 3,87 (с, 3H), 3,77 (ддд, J=9,4, 9,0,, 8,2 Гц, 2H), 1,47 (д, J=7,0 Гц, 3H). LCMS (ES) (M+H)=558,9.
(S)-3-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 23): 1НЯМР (400 MГц, CD3OD): δ ppm 8,42 (д, J=7,9 Гц, 1H), 7,66-7,56 (м, 3H), 7,55-7,47 (м, 3H), 7,42 (дд, J=7,8, 7,8 Гц, 1H), 5,35 (дкв, J=7,5, 7,0 Гц, 1H), 4,50 (д, J=15,1 Гц, 1H), 4,39 (д, J=15,1 Гц, 1H), 4,20 (ддд, J=8,2, 7,1, 7,0 Гц, 2H), 3,78 (м, 2H), 1,47 (д, J=7,0 Гц, 3H). LCMS (ES) (M+H)=543,3.
Пример XXIII
Метил (S)-2-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (Соединение 24), и (S)-2-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 25)
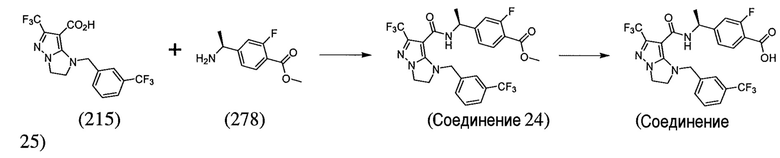
Следуя методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединения 24 и 25 получали из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215) и метил (S)-4-(1-аминоэтил)-2-фторбензоата (278).
Метил (S)-2-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (Соединение 24): 1НЯМР (400 MГц,): δ ppm 7,89 (т, J=7,8 Гц, 1H), 7,55 (д, J=9,8 Гц, 2H), 7,49 (д, J=9,8 Гц, 1H), 7,45(д, J=7,4 Гц, 1H), 7,16 (дд, J=6,64, 1,6 Гц, 1H), 7,09 (дд, J=10,2, 1,6 Гц, 1H), 6,26 (шир.с, 1H), 5,21-5,14 (м, 1H), 4,88 (д, J=14,9 Гц, 1H), 4,80 (д, J=14,9 Гц, 1H), 4,18 (т, J=8,6 Гц, 2H), 3,91 (с, 3H), 3,76 (дд, J=7,4, 7,8 Гц, 2H), 1,52 (д, J=7,0 Гц, 3H). LCMS (ES) (M+H)=559.
(S)-2-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 25): 1НЯМР (400 МГц): δ ppm 7,95 (дд, J=7,4, 7,0 Гц, 1H), 7,54 (д, J=9,0 Гц, 2H), 7,49 (д, J=7,4 Гц, 1H), 7,45 (д, J=7,4 Гц, 1H), 7,18 (д, J=7,8 Гц, 1H), 7,11 (д, J=11,3 Гц, 1H), 6,28 (шир.с, 1H), 5,22-5,15 (м, 1H), 4,88 (д, J=14,9 Гц, 1H), 4,80 (д, J=14,9 Гц, 1H), 4,19 (т, J=9,0 Гц, 2H), 3,77 (т, J=8,2 Гц, 2H), 1,52 (д, J=7,0 Гц, 3H). LCMS (ES) (M+H)=545.
Пример XXIV
(S)-2-(4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)фенил)уксусная кислота (Соединение 26)
(S)-метил 2-(4-(1-аминоэтил)фенил)ацетат (284):
(S)-(9H-флуорен-9-ил)метил(1-(4-бромфенил)этил)карбамат (280): К раствору N-(9-фторенилметоксикарбонилокси)-сукцинимида (1,69 г, 5,00 ммоль) и (S)-1-(4-бромфенил)этанамина (279) (1,00 г, 5,00 ммоль) в ацетонитриле (52,2 мл) добавляли воду (18,0 мл) и бикарбонат натрия (1,01 г, 12,0 ммоль) при 20°C. Смесь перемешивали в течение 1 ч. Анализ TLC (50% H/E) показал, что реакция завершилась. Реакционную смесь суспензии фильтровали через фильтровальную бумагу. Осадок на фильтре промывали водой и сушили под вакуумом с получением желаемого продукта. (2,10 г, 99% выход). 1НЯМР (500 МГц): δ ppm 7,77 (д, J=7,5 Гц, 2H), 7,58 (шир.с, 2H), 7,46 (д, J=7,5 Гц, 2H), 7,41 (т, J=8,0 Гц, 2H), 7,31 (шир.с, 2H), 7,16 (шир.с, 2H), 4,98 (шир.с, 1H), 4,80 (шир.с, 1H), 4,44 (шир.с, 2H), 4,20 (шир.с, 1H), 1,46 (шир.с, 3H).
(S)-(9H-флуорен-9-ил)метил (1-(4-аллилфенил)этил)карбамат (281) К смеси Pd(PPh3)4 (0,58 г, 0,50 ммоль) и (S)-(9H-флуорен-9-ил)метил (1-(4-бромфенил)этил)карбамата (280) (2,10 г, 4,97 ммоль) в толуоле (63,6 мл) добавляли аллилтри-н-бутилолово (3,08 мл, 9,95 ммоль) при 20°C. Смесь перемешивали при 110°C в течение 16 ч. Анализы TLC (50% H/E) и LCMS показали, что реакция завершилась. Реакцию гасили насыщ. NaHCO3 и насыщенным солевым раствором и экстрагировали EtAOc. Органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (E/H 0%-40% и затем 40% изократический) с получением желаемого продукта (1,10 г, 58% выход). 1НЯМР (500 МГц): δ ppm 7,79 (J=7,5 Гц, 2H), 7,61 (шир.с, 2H), 7,42 (т, J=8,0 Гц, 2H), 7,32 (шир.с, 2H), 7,25 (шир.с, 2H), 7,19 (д, J=7,5 Гц, 2H), 6,03-5,95 (м, 1H), 5,15-5,09 (м, 2H), 5,06 (шир.с, 1H), 4,88 (шир.с, 1H), 4,44 (д, J=6,5, 2H), 4,23 (т, J=7,0, 1H), 3,41 (д, J=7,0, 2H), 1,51 (шир.с, 3H).
(S)-(9H-флуорен-9-ил)метил (1-(4-(2-оксоэтил)фенил)этил)карбамат (282): Раствор (S)-(9H-флуорен-9-ил)метил (1-(4-аллилфенил)этил)карбамата (281) (1,00 г, 2,61ммоль) в DCM (101 мл) барботировали O3 при -78°C пока раствор не стал синим. Смесь перемешивали при -78°C в течение 10 мин перед добавлением трифенилфосфина (1,37 г, 5,22 ммоль). Реакционную смесь нагревали до комнатной температуры. TLC (33% E/H) и LCMS показали, что реакция завершилась. Реакционную смесь концентрировали и остаток очищали при помощи колоночной хроматографии на силикагеле (E/H 0%-40% и затем 40% изократический) с получением желаемого продукта (950 мг, 95% выход). 1НЯМР (500 МГц): δ ppm 9,76 (т, J=2,5, 1H), 7,77 (д, J=8,0 Гц, 2H), 7,59 (шир.с, 2H), 7,41 (т, J=7,5, 2H), 7,31 (шир.с, 4H), 7,20 (д, J=8,0 Гц, 2H), 5,04 (шир.с, 1H), 4,87 (шир.с, 1H), 4,43 (д, J=6,5 Гц, 2H), 4,21 (шир.с, 1H), 3,69 (д, J=2,5, 2H), 1,49 (шир.с, 3H). LCMS (ES) (M+H)=386.
(S)-2-(4-(1-((((9H-флуорен-9-ил)метокси)карбонил)амино)этил)фенил)уксусная кислота (283): К раствору (S)-(9H-флуорен-9-ил)метил (1-(4-(2-оксоэтил)фенил)этил)карбамата (282) (1,10 г, 2,85 ммоль) в THF (19,6 мл) и трет-бутанола (98 мл) добавляли раствор перманганата калия (0,451 г, 2,85 ммоль) в воде (47,6 мл) при 20°C. Смесь перемешивали при 20°C в течение 1 ч. TLC (EtOAc) и LCMS показали, что реакция завершилась. Реакционная смесь разбавляли насыщ. Na2S2O3 и насыщенным солевым раствором и экстрагировали EtAOc. Органический слой сушили над (Na2SO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (E/H 0%-100% и затем MeOH/DCM=1:9) с получением желаемого продукта (1,14 г, 100% выход). LCMS (ES) (M+H)=402.
(S)-метил 2-(4-(1-аминоэтил)фенил)ацетат (284): К раствору (S)-2-(4-(1-((((9H-флуорен-9-ил)метокси)карбонил)амино)этил)фенил)уксусной кислоты (283) (1,00 г, 2,49 ммоль) в метаноле (40,3 мл) и толуола (37,1 мл) добавляли 2,0 М триметилсилилдиазометан в гексане (3,74 мл, 7,47 ммоль) при 20°C. Смесь перемешивали при 20°C в течение 5 ч. TLC (50% E/H) и LCMS показали, что реакция завершилась. Реакционную смесь концентрировали и остаток очищали при помощи колоночной хроматографии на силикагеле (E/H 10%-50%, и затем 50% изократический, и затем DCM/MeOH/Et3N=6:1:0,1) с получением желаемого продукта (420 мг, 87% выход). 1НЯМР (400 МГц): δ ppm 7,29 (д, J=8,2 Гц, 2H), 7,22 (д, J=8,2 Гц, 2H), 4,08 (кв=6,8 Гц, 1H), 3,66 (с, 3H), 3,59 (с, 2H), 2,21 (шир.с, 2H), 1,36 (д, J=6,6 Гц, 3H). LCMS (ES) (M+H)=194.
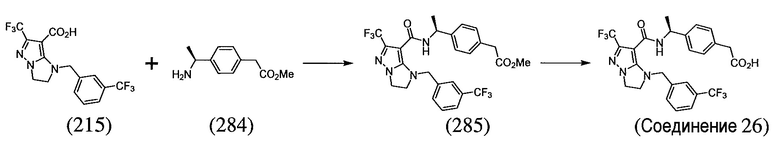
Следуя методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 26 получали из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215) и (S)-метил 2-(4-(1-аминоэтил)фенил)ацетата (284).
Метил (S)-2-(4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)фенил)ацетат (285): 1НЯМР (500 МГц): δ ppm 7,57 (с, 1H), 7,56 (д, J=6,9 Гц, 1H), 7,52 (д, J=7,8 Гц, 1H), 7,45 (т, J=7,3 Гц, 1H), 7,30 (д, J=8,3 Гц, 2H), 7,25 (д, J=8,3 Гц, 2H), 6,26 (шир.д, J=4,9 Гц, 1H), 5,24-5,18 (м, 1H), 4,90 (д, J=14,7 Гц, 1H), 4,82 (д, J=14,7 Гц, 1H), 4,17 (т, J =8,8 Гц, 2H), 3,76 (дт, J=7,8, 2,5 Гц, 2H), 3,69 (с, 3H), 3,61 (с, 2H), 1,53 (д, J=6,9 Гц, 3H). LCMS (ES) (M+H)=555.
(S)-2-(4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)фенил)уксусная кислота (Соединение 26): 1НЯМР (400 MГц, CDCl3): δ ppm 7,54 (с, 1H), 7,53 (д, J=6,3 Гц, 1H), 7,48 (д, J=7,8 Гц, 1H), 7,41 (т, J=8,2 Гц, 1H), 7,28 (д, J=8,2 Гц, 2H), 7,23 (д, J=8,2 Гц, 2H), 6,26 (шир.д, J=5,5, 1H), 5,22-5,15 (м, 1H), 4,86 (д, J=14,9 Гц, 1H), 4,78 (д, J=14,9 Гц, 1H), 4,15 (т, J =8,2 Гц, 2H), 3,74 (дт, J=8,6, 2,0 Гц, 2H), 3,60 (с, 2H), 1,51 (д, J=6,6 Гц, 3H). LCMS (ES) (M+H)=541.
Пример XXV
(S)-2-(4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)фенил)уксусная кислота (Соединение 27)
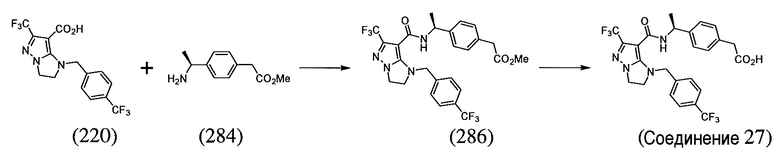
Следуя методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 27 получали из 6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (220) и (S)-метил 2-(4-(1-аминоэтил)фенил)ацетата (284).
Метил (S)-2-(4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)фенил)ацетат (286): 1НЯМР (500 МГц): δ ppm 7,58 (д, J=8,3 Гц, 2H), 7,42 (д, J=8,3 Гц, 2H), 7,30 (д, J=8,3 Гц, 2H), 7,25 (д, J=8,3 Гц, 2H), 6,25 (шир.д, J=5,4 Гц, 1H), 5,24-5,18 (м, 1H), 4,88 (д, J=15,2 Гц, 1H), 4,85 (д, J=15,2 Гц, 1H), 4,18 (т, J=8,3 Гц, 2H), 3,78 (тд, J=8,3, 2,0 Гц, 2H), 3,69 (с, 3H), 3,61 (с, 2H), 1,53 (д, J=6,9 Гц, 3H). LCMS (ES) (M+H)=555.
(S)-2-(4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)фенил)уксусная кислота (Соединение 27): 1НЯМР (500 МГц): δ ppm 7,57 (д, J=7,8 Гц, 2H), 7,41 (д, J=7,8 Гц, 2H), 7,30 (д, J=8,3 Гц, 2H), 7,26 (д, J=8,3 Гц, 2H), 6,25 (шир.д, J=5,4 Гц, 1H), 5,24-5,18 (м, 1H), 4,86 (с, 2H), 4,18 (т, J=8,3 Гц, 2H), 3,78 (тд, J=8,8, 2,5 Гц, 2H), 3,63 (с, 2H), 1,53 (д, J=6,9 Гц, 3H). LCMS (ES) (M+H)=541.
Пример XXVI
4-(1-(6-метил-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойная кислота (Соединение 28)
Этил 5-амино-1-(2-гидроксиэтил)-3-метил-1H-пиразол-4-карбоксилат (289):
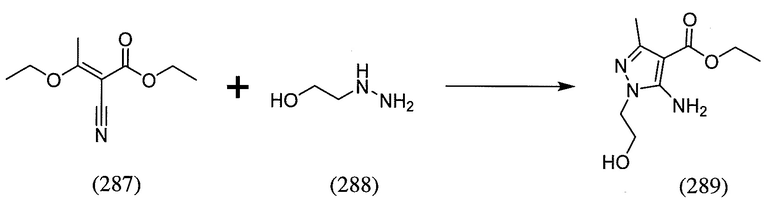
Раствор этил (E)-2-циано-3-этоксибут-2-еноата (500 мг, 2,73 ммоль) и 2-гидроксиэтилгидразина (288) (0,24 мл, 3,51 ммоль) в этаноле (4 мл) нагревали при 120°С под микроволновым излучением в течение 20 мин. Смесь охлаждали до комнатной температуры, выливали в воду и экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали с получением желаемого продукта в виде белого твердого вещества (483 мг, 83% выход). Это твердое вещество использовали без дополнительной очистки для следующей стадии реакции. 1НЯМР (400 МГц): δ ppm 5,33 (шир.с, 2H), 4,26 (кв, J=6,8 Гц, 2H), 3,97 (с, 4H), 2,31 (с, 3H), 1,33 (т, J=6,8 Гц, 3H).
Этил 5-амино-3-метил-1-(2-((метилсульфонил)окси)этил)-1H-пиразол-4-карбоксилат (290):
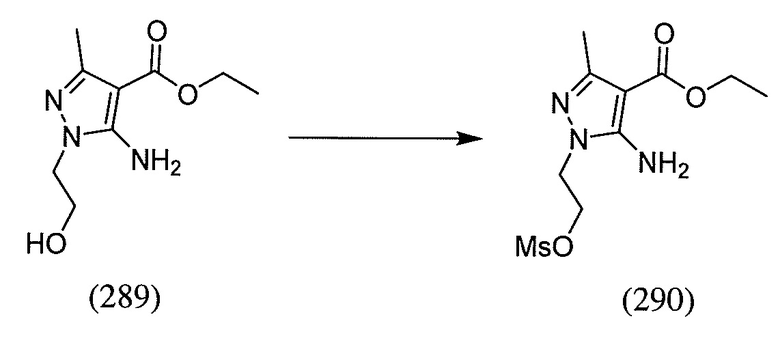
К раствору этил 5-амино-1-(2-гидроксиэтил)-3-метил-1H-пиразол-4-карбоксилата (289) (483 мг, 2,27 ммоль) и TEA (0,51 мл, 3,66 ммоль) в DCM (5 мл) при 0°C добавляли метансульфонилхлорид (0,21 мл, 2,71 ммоль) и перемешивали в течение 1 ч. Реакционную смесь выливали в ледяную воду. Отделенный органический слой промывали 1 н HCl и насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением желаемого соединения в виде бледно-желтого твердого вещества (358 мг, 54% выход). Это твердое вещество использовали без дополнительной очистки для следующей стадии реакции. 1НЯМР (400 МГц): δ ppm 5,30 (шир.с, 2H), 4,57 (т, J=4,8 Гц, 2H), 4,26 (кв, J=7,2 Гц, 2H), 4,18 (т, J=4,8 Гц, 2H), 2,95 (с, 3H), 2,32 (с, 3H), 1,33 (т, J=7,0 Гц, 3H).
Этил 5-формамидо-3-метил-1-(2-((метилсульфонил)окси)этил)-1H-пиразол-4-карбоксилат (291):
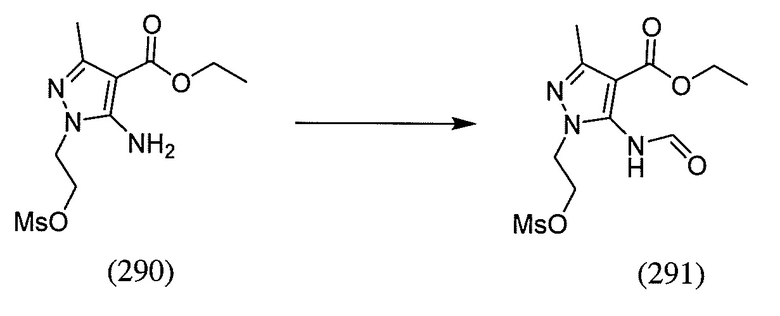
Смесь уксусного ангидрида (0,21 мл, 2,18 ммоль) и муравьиной кислоты (0,10 мл, 2,65 ммоль) перемешивали при комнатной температуре в течение 30 мин и затем охлаждали до 0°C. Затем эту холодную смесь добавляли к этил 5-амино-3-метил-1-(2-((метилсульфонил)окси)этил)-1H-пиразол-4-карбоксилату (290) (302 mg. 1,04 ммоль) и полученную смесь перемешивали в течение 2 ч при 0°С и затем в течение выходных при комнатной температуре. Затем смесь концентрировали и полученное твердое вещество промывали MTBE, сушили под вакуумом с получением желаемого соединения в виде белого твердого вещества (227 мг, 69% выход). 1НЯМР (400 МГц): δ ppm 8,66 (шир.с, 1H), 8,34 (с, 1H), 4,62 (т, J=5,6 Гц, 2H), 4,42 (т, J=5,6 Гц, 2H), 4,29 (кв, J=7,0 Гц, 2H), 2,95 (с, 3H), 2,38 (с, 3H), 1,35 (т, J=7,0 Гц, 3H).
Этил 1-формил-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (292):

К раствору этил 5-формамидо-3-метил-1-(2-((метилсульфонил)окси)этил)-1H-пиразол-4-карбоксилата (291) (227 мг, 0,71 ммоль) в DMF (2 мл) при 0°С добавляли NaH (28,4 мг, 0,71 ммоль, 60% в минеральном масле) и полученную смесь перемешивали в течение 3 ч. Реакцию гасили добавлением насыщ. NH4Cl, нагревали до комнатной температуры и экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Остаток очищали при помощи хроматографии на силикагеле (E/H 10%-80%) с получением желаемого соединения (103 мг, 65% выход). 1НЯМР (400 МГц): δ ppm 9,75 (с, 1H), 4,48 (дд, J=8,8, 7,6 Гц, 2H), 4,32-4,25 (м, 4H), 2,42 (с, 3H), 1,35 (т, J=7,2 Гц, 3H).
Этил 6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (293):
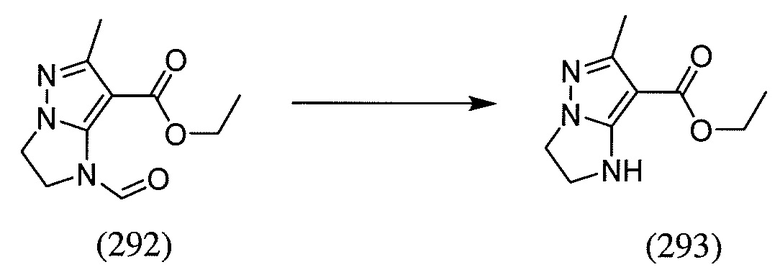
К раствору этил 1-формил-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (292) (103 мг, 0,46 ммоль) в метаноле (2 мл) и THF (2 мл) при 0°C добавляли 12 M раствор HCl в воде (0,082 мл) и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь выливали в 10 мл льда/воды и нейтрализовали насыщ. NaHCO3. Смесь концентрировали до примерно 5 мл и экстрагировали EtOAc дважды. Объединенную органическую фазу промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали с получением желаемого соединения в виде белого твердого вещества (81 мг, 90% выход). 1НЯМР (400 МГц): δ ppm 4,52 (шир.с, 1H), 4,22 (кв, J=7,2, Гц, 2H), 4,13 (м, 2H), 4,04 (м, 2H), 2,38 (с, 3H), 1,31 (т, J=7,2 Гц, 3H).
6-метил-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (295):

Следуя аналогичной методике получения 6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (220), соединение 295 получали из этил 6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (293).
Этил 6-метил-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (294): 1НЯМР (400 МГц): δ ppm 7,57 (д, J=8,0, Гц, 2H), 7,42 (д, J=8,0, Гц, 2H), 4,95 (с, 2H), 4,22 (кв, J=7,2, Гц, 2H), 4,04 (дд, J=8,8, 8,0, Гц, 2H), 3,67 (дд, J=8,8, 8,0, Гц, 2H), 2,39 (с, 3H), 1,27 (т, J=7,2 Гц, 3H).
6-метил-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (295): 1НЯМР (400 МГц): δ ppm 7,57 (д, J=8,0, Гц, 2H), 7,45 (д, J=8,0, Гц, 2H), 4,96 (с, 2H), 4,05 (дд, J=8,8, 8,0, Гц, 2H), 3,70 (дд, J=8,4, 8,4, Гц, 2H), 2,40 (с, 3H).
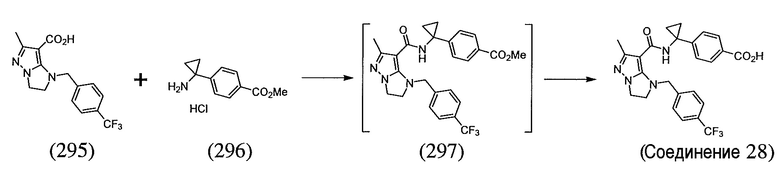
4-(1-(6-метил-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойная кислота (Соединение 28):
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 28 получали из 6-метил-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (295) и метил 4-(1-аминоциклопропил)бензоат гидрохлорида (296). Соединение 28: 1H ЯМР (400 MГц, CD3OD): δ ppm 7,82 (д, J=8,4 Гц, 2H), 7,58 (д, J=8,4 Гц, 2H), 7,46 (д, J=8,4 Гц, 2H), 7,23 (д, J=8,4 Гц, 2H), 4,69 (с, 2H), 4,01 (дд, J=8,4, 8,0 Гц, 2H), 3,73 (дд, J=8,8, 7,2 Гц, 2H), 2,33 (с, 3H), 1,33 (м, 4H).
Пример XXVII
4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойная кислота (Соединение 29)
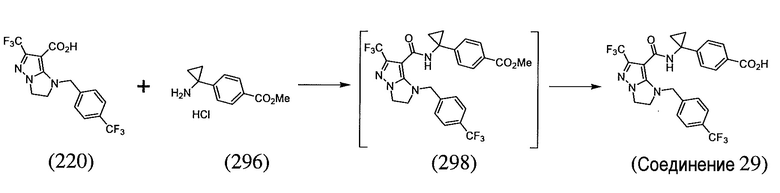
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 29 получали из 6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (220) и метил 4-(1-аминоциклопропил)бензоат гидрохлорида (296). 1НЯМР (400 MГц, CD3OD): δ ppm 7,75 (д, J=8,4 Гц, 2H), 7,62 (д, J=8,0 Гц, 2H), 7,47 (д, J=8,0 Гц, 2H), 7,22 (д, J=8,4 Гц, 2H), 4,53 (с, 2H), 4,20 (дд, J=8,8, 8,4 Гц, 2H), 3,82 (дд, J=8,8, 7,6 Гц, 2H), 1,30 (ддд, J=8,4, 6,0, 4,4 Гц, 2H), 1,19 (ддд, J=8,4, 6,4, 4,4 Гц, 2H).
Пример XXVIII
4-(1-(1-(4-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойная кислота (Соединение 30)
1-(4-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (301):
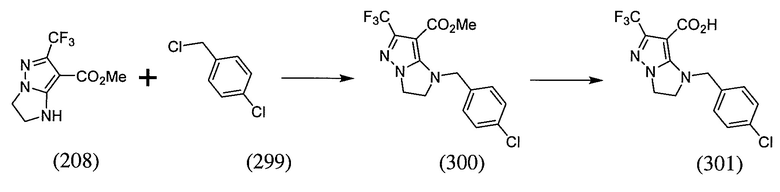
Следуя аналогичной методике получения 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), соединение 301 получали из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) и 1-хлор-4-(хлорметил)бензола (299).
Метил 1-(4-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (300): 1НЯМР (400 МГц): δ ppm 7,32 (д, J=8,4 Гц, 2H), 7,25 (д, J=8,4 Гц, 2H), 4,88 (с, 2H), 4,15 (дд, J=8,8, 8,0 Гц, 2H), 3,80 (с, 3H), 3,77 (дд, J=8,8, 8,4 Гц, 2H).
1-(4-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (301): 1НЯМР (400 MГц, CD3OD): δ ppm 7,35 (д, J=8,4 Гц, 4H), 4,92 (с, 2H), 4,15 (дд, J=8,8, 8,0 Гц, 2H), 3,82 (дд, J=8,8, 8,4 Гц, 2H).
4-(1-(1-(4-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойная кислота (Соединение 30):
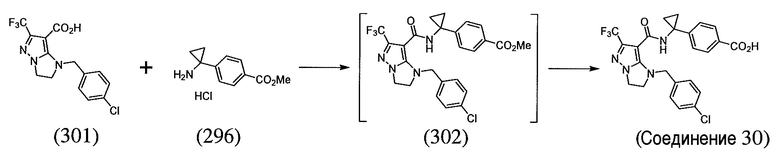
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 30 получали из 1-(4-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (301) и метил 4-(1-аминоциклопропил)бензоат гидрохлорида (296). 1НЯМР (400 MГц, CD3OD): δ ppm 7,81 (д, J=8,0 Гц, 2H), 7,56 (д, J=8,0 Гц, 2H), 7,37 (д, J=8,0 Гц, 2H), 7,36 (д, J=8,0 Гц, 2H), 4,90 (с, 2H), 4,15 (дд, J=8,8, 8,0 Гц, 2H), 3,82 (дд, J=8,8, 8,4 Гц, 2H), 1,30 (ддд, J=8,4, 6,0, 4,4 Гц, 2H), 1,19 (ддд, J=8,4, 6,4, 4,4 Гц, 2H).
Пример XXIX
(S)-4-(1-(1-(4-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 31)
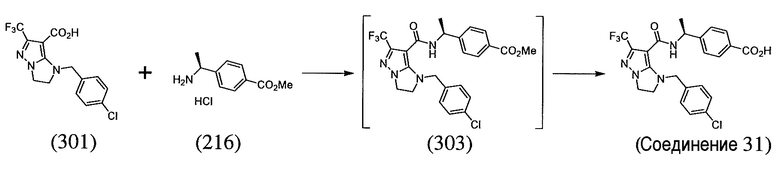
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 31 получали из 1-(4-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (301) и метил (S)-4-(1-аминоэтил)бензоат гидрохлорида (216). 1НЯМР (400 MГц, CD3OD): δ ppm 7,83 (д, J=8,0 Гц, 2H), 7,37 (д, J=8,0 Гц, 2H), 7,26 (д, J=8,4 Гц, 2H), 7,17 (д, J=8,4 Гц, 2H), 5,10 (дкв, J =7,6, 7,2 Гц, 1H), 4,33 (д, J=15,0 Гц, 1H), 4,21 (д, J=15,0 Гц, 1H), 4,14 (ддд, J=8,8, 8,0, 4,8 Гц, 2H), 3,72 (ддд, J=8,8, 8,4, 2,4 Гц, 2H), 1,44 (д, J=7,2 Гц, 3H).
Пример XXX
(S)-4-(1-(1-(4-хлорбензил)-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 32)
1-(4-хлорбензил)-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (305):
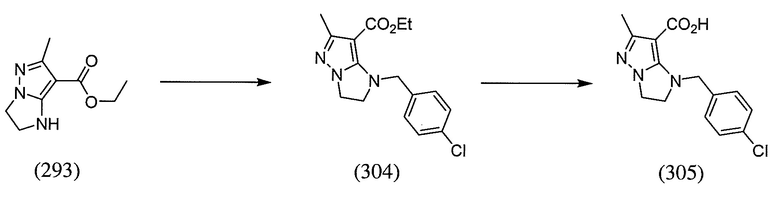
Следуя аналогичной методике получения 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), соединение 305 получали из этил 6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (293) и 1-хлор-4-(хлорметил)бензола (299).
Этил 1-(4-хлорбензил)-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (304): 1НЯМР (400 МГц): δ ppm 7,29 (д, J=8,0 Гц, 2H), 7,25 (д, J=8,0 Гц, 2H), 4,86 (с, 2H), 4,23 (кв, J=7,2 Гц, 2H), 4,01 (дд, J=8,8, 7,6 Гц, 2H), 3,65 (ддд, J=8,8, 7,6, 1,6 Гц, 2H), 2,38 (с, 3H), 1,28 (т, J=7,2 Гц, 3H).
1-(4-хлорбензил)-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (305): 1НЯМР (400 МГц): δ ppm 7,29 (д, J=8,0 Гц, 2H), 7,23 (д, J=8,0 Гц, 2H), 4,86 (с, 2H), 4,02 (дд, J=8,8, 8,0 Гц, 2H), 3,67 (дд, J=8,8, 7,6Гц, 2H), 2,39 (с, 3H).
(S)-4-(1-(1-(4-хлорбензил)-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 32):
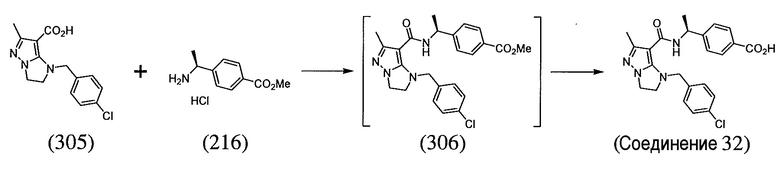
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 32 получали из 1-(4-хлорбензил)-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (305) и метил (S)-4-(1-аминоэтил)бензоат гидрохлорида (216). 1НЯМР (400 MГц, CD3OD): δ ppm 7,89 (д, J=8,8 Гц, 2H), 7,41 (д, J=8,8 Гц, 2H), 7,23 (д, J=8,4 Гц, 2H), 7,18 (д, J=8,4 Гц, 2H), 5,13 (кв, J=7,4 Гц, 1H), 4,53 (д, J=14,8 Гц, 1H), 4,38 (д, J=14,8 Гц, 1H), 3,96 (ддд, J=8,0, 7,2, 1,8 Гц, 2H), 3,66 (дд, J=9,2, 8,0 Гц, 2H), 2,30 (с, 3H), 1,49 (д, J=7,0 Гц, 3H).
Пример XXXI
4-((1-(4-хлорбензил)-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)метил)бензойная кислота (Соединение 33)
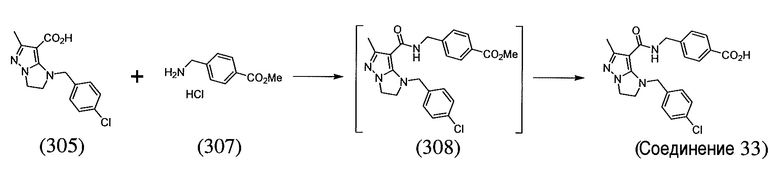
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 33 получали из 1-(4-хлорбензил)-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (305) и метил 4-(аминометил)бензоат гидрохлорида (307). 1НЯМР (400 MГц, CD3OD): δ ppm 7,98 (шир.т, J=6,4 Гц, 1H), 7,89 (д, J=8,0 Гц, 2H), 7,37 (д, J=8,0 Гц, 2H), 7,25 (д, J=8,4 Гц, 4H), 4,56 (с, 2H), 4,52 (д, J=6,4 Гц, 2H), 3,97 (дд, J=8,8, 7,6 Гц, 2H), 3,67 (ддд, J=8,4, 8,0, 2,0 Гц, 2H), 2,31 (с, 3H).
Пример XXXII
(R)-4-(1-(6-метил-1-(1-(4-(трифторметил)фенил)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойная кислота (Соединение 34)
(S)-1-(4-(трифторметил)фенил)этил метансульфонат (309):
К раствору (S)-1-(4-(трифторметил)фенил)этан-1-ола (308) (100 мг, 0,53 ммоль) и TEA (0,15 мл, xx ммоль) в DCM (2 мл) при 0°C добавляли по каплям метансульфонилхлорид (0,53 мл, xx ммоль) и полученную смесь перемешивали в течение 3 ч. Реакцию гасили добавлением воды и экстрагировали DCM. Органический слой последовательно промывали 1 н. HCl, 10% NaHCO3 и насыщенным солевым раствором, сушили (MgSO4) фильтровали и концентрировали с получением желаемого продукта в виде бледно-коричневого масла (125 мг). Этот неочищенный материал использовали без дополнительной очистки для следующей стадии реакции.
(R)-6-метил-1-(1-(4-(трифторметил)фенил)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (312):
Этил (R)-6-метил-1-(1-(4-(трифторметил)фенил)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (311): К раствору этил 6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (293) (77 мг, 0,39 ммоль) в DMF (2 мл) при комнатной температуре добавляли NaH (20,4 мг, 0,51 ммоль, 60% в минеральном масле) и перемешивали в течение 30 мин. Реакционную смесь затем охлаждали до 0°C и раствор (S)-1-(4-(трифторметил)фенил)этил метансульфоната (309) (125 мг) в 1 мл DMF вводили по каплям. Охлаждающую баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакцию гасили добавлением насыщ. NH4Cl и экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором (×2), сушили (MgSO4), фильтровали и концентрировали. Маслянистый остаток очищали при помощи колонки с силикагелем (20%-80% E/H) с получением желаемого соединения белого твердого вещества (110 мг, 76% выход). 1НЯМР (400 МГц): δ ppm 7,59 (д, J=8,4 Гц, 2H), 7,47 (д, J=8,4 Гц, 2H), 6,35 (кв, J=6,8 Гц, 1H), 4,26 (кв, J=7,2 Гц, 2H), 4,00 (ддд, J=7,6, 7,2, 2,4 Гц, 1H), 3,93 (ддд, J=7,2, 6,8, 2,0 Гц, 1H), 3,79 (ддд, J=9,2, 7,2, 2,4 Гц, 1H), 3,37 (ддд, J=9,2, 7,6, 2,0 Гц, 1H), 2,39 (с, 3H), 1,58 (д, J=6,8 Гц, 3H), 1,33 (т, J=7,2 Гц, 3H).
(R)-6-метил-1-(1-(4-(трифторметил)фенил)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (312): Соединение 312 получали следуя аналогичной методике получения 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215) из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208), но реакция при 140°С в течение 1,5 ч с использованием микроволнового излучения. Желаемое соединение представляло собой бледно-розовое твердое вещество как неочищенное (45 мг, 44% выход). 1НЯМР (400 MГц, CD3OD): δ ppm 7,62 (д, J=8,4 Гц, 2H), 7,57 (д, J=8,4 Гц, 2H), 6,35 (кв, J=7,2 Гц, 1H), 3,94-3,82 (м, 3H), 3,40 (ддд, J=7,6, 7,2, 2,4 Гц, 1H), 2,30 (с, 3H), 1,57 (д, J=7,6 Гц, 3H).
(R)-4-(1-(6-метил-1-(1-(4-(трифторметил)фенил)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойная кислота (Соединение 34):
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 34 получали из (R)-6-метил-1-(1-(4-(трифторметил)фенил)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (312) и метил 4-(1-аминоциклопропил)бензоат гидрохлорида (296). 1НЯМР (400 MГц, CD3OD): δ ppm 7,86 (д, J=8,4 Гц, 2H), 7,57 (д, J=8,4 Гц, 2H), 7,47 (д, J=8,4 Гц, 2H), 7,28 (д, J=8,4 Гц, 2H), 5,63 (кв, J=7,6 Гц, 1H), 3,95-3,84 (м, 3H), 3,49 (ддд, J=9,6, 7,2, 6,8 Гц, 1H), 2,31 (с, 3H), 1,54 (д, J=7,6 Гц, 3H), 1,40-1,28 (м, 4H).
Пример XXXIII
4-((S)-1-(6-метил-1-((R)-1-(4-(трифторметил)фенил)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 35)
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 35 получали из (R)-6-метил-1-(1-(4-(трифторметил)фенил)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (312) и метил (S)-4-(1-аминоэтил)бензоат гидрохлорида (216). 1НЯМР (400 MГц, CD3OD): δ ppm 7,90 (д, J=8,0 Гц, 2H), 7,46 (д, J=8,0 Гц, 4H), 7,31 (д, J=8,0 Гц, 2H), 5,41 (кв, J=7,2 Гц, 1H), 5,15 (ддд, J=8,0, 8,0, 7,2 Гц, 1H), 3,94-3,82 (м, 3H), 3,50 (ддд, J=8,8, 8,0, 8,0 Гц, 1H), 2,30 (с, 3H), 1,52 (д, J=7,2 Гц, 3H), 1,49 (д, J=7,2 Гц, 3H).
Пример XXXIV
(S)-N-(1-(4-(2H-тетразол-5-ил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 36)
Следуя методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 36 получали из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215) и (S)-1-(4-(2H-тетразол-5-ил)фенил)этан-1-амина (315). 1НЯМР (500 MГц, CD3OD): δ ppm 7,87 (д, J=8,3 Гц, 2H), 7,60 (шир.с, 1H), 7,52 (д, J=7,83 Гц, 2H), 7,51 (д, J=7,83 Гц, 2H), 7,45 (т, J=7,83 Гц, 1H), 5,17 (кв, J=7,0 Гц, 1H), 4,46 (д, J=15,2 Гц, 1H), 4,39 (д, J=15,2 Гц, 1H), 4,24-4,16 (м, 2H), 3,81-3,73 (м, 2H), 1,51 (д, J=7,3 Гц, 3H). LCMS (ES) (M+H)=551.
Пример XXXV
(S)-N-(1-(4-(2H-тетразол-5-ил)фенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 37)
Следуя методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединение 37 получали из 6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (220) и (S)-1-(4-(2H-тетразол-5-ил)фенил)этан-1-амина (315). 1НЯМР (500 MГц, CD3OD): δ ppm 7,93 (д, J=8,3 Гц, 2H), 7,53 (д, J=8,3 Гц, 2H), 7,50 (д, J=8,3 Гц, 2H), 7,40 (д, J=8,3 Гц, 2H), 5,20-5,15 (м, 1H), 4,62 (д, J=14,7 Гц, 1H), 4,57 (д, J=14,7 Гц, 1H), 4,22-4,14 (м, 2H), 3,81 (т, J=8,3 Гц, 2H), 1,52 (д, J=7,3 Гц, 3H). LCMS (ES) (M+H)=551.
Пример XXXVI
(S)-5-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)пиколиновая кислота (Соединение 38)
Метил (S)-5-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)пиколинат (317): К раствору 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215) (30 мг, 0,079 ммоль) и метил (S)-5-(1-аминоэтил)пиколинат гидрохлорида (316) в DMF (1,07 мл) добавляли DIPEA (69,1 мкл, 0,40 ммоль) и HATU (40,6 мг, 0,107 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение ночи. Реакционную смесь концентрировали для удаления DMF и остаток очищали с помощью PTLC (E/H 65%) с получением желаемого соединения (26,9 мг, 63% выход). 1НЯМР (400 МГц): δ ppm 8,73 (с, 1H), 8,08 (д, J=8,0 Гц, 1H), 7,78 (д, J=8,0 Гц, 1H), 7,56-7,50 (м, 2H), 7,50-7,36 (м, 2H), 6,29 (шир.с, 1H), 5,25 (дкв, J=7,2, 6,4, 6,4 Гц, 1H), 4,87 (д, J=15,0 Гц, 1H), 4,75 (д, J=15,0 Гц, 1H), 4,17 (дд, J=8,4, 8,4 Гц, 2H), 3,98 (с, 3H), 3,76 (дд, J=8,4, 8,4 Гц, 2H), 1,56 (д, J=6,8 Гц, 3H). LCMS (ES) [M+H]=542,3.
(S)-5-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)пиколиновая кислота (Соединение 38): К (S)-метил 5-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)пиколинату (317) (22 мг, 0,041 ммоль) в метаноле (822 мкл) добавляли 1 M LiOH (406 мкл, 0,406 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 4 ч. Реакционную смесь нейтрализовали 1M HCl и экстрагировали EtOAc (3×15 мл). Объединенную органическую фазу сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали с помощью PTLC (8% MeOH/EtOAc) с получением желаемого соединения (18,2 мг, 85% выход). 1НЯМР (400 МГц): δ ppm 8,08 (д, J=8,0 Гц, 1H), 7,78 (д, J=8,0 Гц, 1H), 7,56=7,50 (м, 3H), 7,50-7,36 (м, 2H), 6,29 (шир.с, 1H), 5,25 (дкв, J=7,2, 6,4 Гц, 1H), 5,00 (д, J=15,0 Гц, 1H), 4,42 (д, J=15,0 Гц, 1H), 4,07 (дд, J=8,4, 8,4 Гц, 2H), 3,63 (дд, J=8,4, 8,4 Гц, 2H), 1,25 (д, J=6,8 Гц, 3H). LCMS (ES) [M+H]= 528,1.
Пример XXXVII
(S)-6-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)никотиновая кислота (Соединение 39)
Следуя методике получения (S)-5-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)пиколиновой кислоты (Соединение 38), как описано в примере XXXVI, соединение 39 получали из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215) и метил (S)-6-(1-аминоэтил)никотинат гидрохлорида (318).
Метил (S)-6-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)никотинат (319): 1НЯМР (400 МГц): δ ppm 9,13 (с, 1H), 8,27 (д, J=8,0 Гц, 1H), 7,60-7,30 (м, 5H), 5,31 (дкв, J=7,2, 6,8 Гц, 1H), 4,82 (д, J=14,8 Гц, 1H), 4,76 (д, J=14,8 Гц, 1H), 4,17 (дд, J=8,2, 8,2 Гц, 2H), 3,94 (с, 3H), 3,76 (дд, J=8,4, 8,2 Гц, 2H), 1,55 (д, J=6,8 Гц, 3H). LCMS (ES) [M+H]=542,2.
(S)-6-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)никотиновая кислота (Соединение 39): 1НЯМР (400 МГц): δ ppm 8,92 (с, 1H), 8,80 (д, J=8,0 Гц, 1H), 7,60-7,30 (м, 5H), 5,36 (дкв, J=7,2, 6,8 Гц, 1H), 4,82 (д, J=14,8 Гц, 1H), 4,50 (д, J=14,8 Гц, 1H), 4,06 (дд, J=8,2, 8,2 Гц, 2H), 3,62 (дд, J=8,4, 8,2 Гц, 2H), 1,55 (д, J=6,8 Гц, 3H). LCMS (ES) [M+H]= 528,1.
Пример XXXVIII
(S)-N-(1-(4-(фуран-3-ил)фенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 40)
(S)-N-(1-(4-бромфенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (321)
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1), соединение 321 получали из 6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (220) и (S)-1-(4-бромфенил)этан-1-амина (320). 1НЯМР (400 МГц): δ ppm 7,57 (д, J=7,8 Гц, 2H), 7,43 (д, J=7,8 Гц, 2H), 7,39 (д, J=7,8 Гц, 2H), 7,19 (д, J=7,8 Гц, 2H), 6,22 (шир.с, 1H), 5,16-5,09 (м, 1H), 4,84 (с, 2H), 4,16 (т, J=8,6 Гц, 2H), 3,76 (т, J=8,2 Гц, 2H), 1,50 (д, J=7,0 Гц, 3H). LCMS (ES) [M+H]= 561/563.
(S)-N-(1-(4-(фуран-3-ил)фенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 40)
В пробирку для реакций, содержащую фуран-3-илбороновую кислоту (1,3 экв.) добавляли раствор (S)-N-(1-(4-бромфенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида (321) (20 мг, 0,036 ммоль) в 1,4-диоксане (0,5 мл), раствор Pd(PPh3)4 (0,1 экв.) в 1,4-диоксане (0,5 мл) и раствор Na2CO3 (4 экв.) в воде (0,5 мл). Реакционную смесь дегазировали путем барботирования N2 и герметизировали. Реакционную смесь нагревали при 80°С в течение 20 ч. После охлаждения до комнатной температуры, реакционную смесь концентрировали и остаток очищали с помощью PTLC (50% AcOEt/гептан) с получением соединения 40 (17,2 мг, 88% выход). 1НЯМР (400 МГц): δ ppm 7,70 (с, 1H), 7,56 (д, J=8,4 Гц, 2H), 7,47-7,20 (м, 3H), 7,39 (д, J=8,0 Гц, 2H), 7,33 (д, J=8,0 Гц, 2H), 6,67 (дд, J=1,6 и 0,8 Гц, 1H), 6,26 (шир.д, J=5,2 Гц, 1H), 5,20 (дт, J=7,2 и 6,8 Гц, 1H), 4,88 (д, J=14,8 Гц, 1H), 4,82 (д, J=14,8 Гц, 1H), 4,16 (т, J=8,6 Гц, 2H), 3,77 (т, J=8,6 Гц, 2H), 1,54 (д, J=6,4 Гц, 3H). LCMS (ES) [M+H]= 549,3.
Пример XXXIX
(S)-4-(1-(4-(4-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 41)
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) и 1-(хлорметил)-3-(трифторметил)бензола (214), описанной ранее в примере I, соединение 41 аналогичным образом получали из метил 2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксилата (212) и 1-хлор-4-(хлорметил)бензола.
Метил 4-(4-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксилат (323) использовали в качестве неочищенного для гидролиза на следующей стадии 4-(4-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоновой кислоты (324): 1НЯМР (400 MГц, CD3OD): δ ppm 7,31 (д, J=8,6 Гц, 2H), 7,26 (д, J=8,6 Гц, 2H), 4,64 (с, 2H), 4,01 (дд, J=6,0, 5,6 Гц, 2H), 3,10 (дд, J=5,2, 5,6 Гц, 2H), 2,00 (м, 2H).
Метил (S)-4-(1-(4-(4-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензоат (325): 1НЯМР (400 MГц, CD3OD): δ ppm 7,84 (д, J=8,8 Гц, 2H), 7,20 (д, J=8,0 Гц, 2H), 7,17 (д, J=8,8 Гц, 2H), 7,04 (д, J=8,8 Гц, 2H), 5,99 (шир.д, J=8,0 Гц, 1H), 5,10 (м, 1H), 4,50 (д, J=16,0 Гц, 1H), 4,34 (д, J=16,0 Гц, 1H), 4,05 (м, 2H), 3,84 (с, 3H), 3,11 (м, 2H), 2,05 (м, 2H), 1,38 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=521,2.
(S)-4-(1-(4-(4-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 41): 1НЯМР (400 MГц, CD3OD): δ ppm 7,74 (д, J=8,4 Гц, 2H), 7,24 (д, J=8,0 Гц, 2H), 7,19 (д, J=8,4 Гц, 2H), 7,07 (д, J=8,4 Гц, 2H), 4,97 (м, 1H), 4,25 (д, J=16,0 Гц, 1H), 4,16 (д, J=16,4 Гц, 1H), 4,02 (м, 2H), 3,06 (м, 2H), 2,04 (м, 2H), 1,31 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=507,2.
***************
Следуя аналогичной методике получения (S)-4-(1-(4-(4-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойной кислоты (Соединение 41) из метил 2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксилата (212) и 1-хлор-4-(хлорметил)бензола, описанной выше в примере XXXIX, соединения 42 и 44-46 аналогичным образом получали из метил 2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксилата (212) и соответствующего замещенного бензилхлорида или бензилбромида.
Пример XL
(S)-4-(1-(4-(3-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 42)

4-(3-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоновая кислота (327): 1НЯМР (400 МГц): δ ppm 7,2-7,45 (м, 4H, м), 4,70 (с, 2H), 4,14 (дд, J=6,0, 6,0 Гц, 2H), 3,18 (дд, J=5,2, 5,6 Гц, 2H), 2,09 (м, 2H).
Метил (S)-4-(1-(4-(3-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензоат (328): 1НЯМР (400 МГц): δ ppm 7,84 (д, J=8,8 Гц, 2H), 7,20 (д, J=8,0 Гц, 2H), 7,14 (м, 3H), 6,99 (д, J=7,2 Гц, 2H), 5,99 (шир.д, J=3,6 Гц, 1H), 5,09 (м, 1H), 4,52 (д, J=16,0 Гц, 1H), 4,39 (д, J=16,0 Гц, 1H), 4,05 (м, 2H), 3,84 (с, 3H), 3,13 (м, 2H), 2,06 (м, 2H), 1,37 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=521,3.
(S)-4-(1-(4-(3-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 42): 1НЯМР (400 MГц, CD3OD): δ ppm 7,73 (д, J=8,4 Гц, 2H), 7,24 (д, J=8,8 Гц, 2H), 7,18 (м, 2H), 7,14 (с, 1H), 7,03 (м, 1H), 4,96 (м, 1H), 4,25 (д, J=16,0 Гц, 1H), 4,18 (д, J=16,0 Гц, 1H), 4,02 (т, J=6,0 Гц, 2H), 3,04 (м, 2H), 2,03 (м, 2H), 1,29 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=507,2.
Пример XLI:
(S)-4-(1-(1-(2-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 43)
Метил 1-(2-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (329): 1НЯМР (400 MГц, CD3OD): δ ppm 7,39 (дд, J=7,6, 16,0 Гц, 1H), 7,25 (м, 3H), 5,00 (с, 2H), 4,15 (т, J=8,8 Гц, 2H), 3,87 (т, J=8,0 Гц, 2H), 3,61 (с, 3H). LCMS (ES) (M+H)=360,2.
1-(2-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (330): 1НЯМР (400 MГц, DMSO-d6): δ ppm 7,39 (д, J=7,2 Гц, 1H), 7,27 (м, 3H), 4,96 (с, 2H), 4,15 (т, J=8,0 Гц, 2H), 3,78 (т, J=8,4 Гц, 2H). LCMS (ES) (M+H)=346,2.
Метил (S)-4-(1-(1-(2-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (331): 1НЯМР (400 МГц): δ ppm 7,92 (д, J=8,8 Гц, 2H), 7,31 (м, 3H), 7,14 (м, 3H), 6,17 (шир.д, J=5,2 Гц, 1H), 5,19 (м, 1H), 4,90 (д, J=14,8 Гц, 1H), 4,84 (д, J=14,8 Гц, 1H), 4,09 (т, J=8,0 Гц, 2H), 3,84 (с, 3H), 3,74 (т, J=8,4 Гц, 2H), 1,46 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=507,3.
(S)-4-(1-(1-(2-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 43): 1НЯМР (400 MГц, CD3OD): δ ppm 7,78 (д, J=8,4 Гц, 2H), 7,33 (м, 2H), 7,29 (д, J=8,8 Гц, 2H), 7,22 (м, 2H), 5,05 (м, 1H), 4,47 (д, J=15,2 Гц, 1H), 4,43 (д, J=15,2 Гц, 1H), 4,15 (т, J=8,8 Гц, 2H), 3,77 (м, 2H), 1,38 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=493,3.
Пример XLII
(S)-4-(1-(2-(трифторметил)-4-(3-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 44)
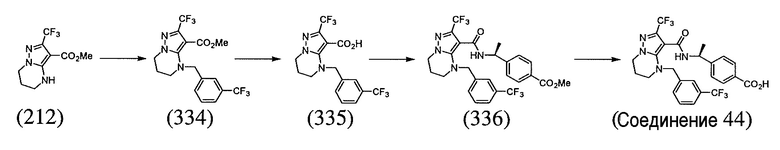
2-(трифторметил)-4-(3-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоновая кислота (335): 1НЯМР (400 МГц): δ ppm 7,63 (с, 1H), 7,55 (м, 2H), 7,46 (м, 1H), 4,75 (с, 2H), 4,15 (дд, J=6,0, 6,0 Гц, 2H), 3,17 (дд, J=5,6, 5,2 Гц, 2H), 2,11 (2H, дд, J=6,0, 4,8 Гц, 2H).
Метил (S)-4-(1-(2-(трифторметил)-4-(3-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензоат (336): 1НЯМР (400 МГц): δ ppm 7,81 (д, J=8,4 Гц, 2H), 7,45 (м, 1H), 7,38 (с, 1H), 7,34 (м, 2H), 7,19 (м, 2H), 6,00 (шир.д, J=7,6 Гц, 1H), 5,07 (м, 1H), 4,55 (д, J=16,0 Гц, 1H), 4,48 (д, J=15,6 Гц, 1H), 4,06 (м, 2H), 3,82 (с, 3H), 3,11 (м, 2H), 2,06 (м, 2H), 1,35 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=555,3.
(S)-4-(1-(2-(трифторметил)-4-(3-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 44): 1НЯМР (400 MГц, CD3OD): δ ppm 7,69 (д, J=8,0 Гц, 2H), 7,48 (д, J=6,8 Гц, 1H), 7,44 (с, 1H), 7,38 (м, 2H), 7,23 (д, J=8,4 Гц, 2H), 4,95 (м, 1H), 4,31 (д, J=16,0 Гц, 1H), 4,26 (д, J=15,6 Гц, 1H), 4,02 (м, 2H), 3,04 (м, 2H), 2,05 (м, 2H), 1,27 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=541,2.
Пример XLIII
(S)-4-(1-(2-(трифторметил)-4-(4-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 45)
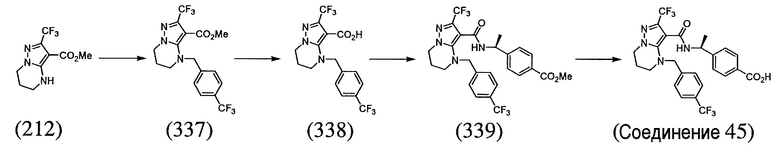
Метил 2-(трифторметил)-4-(4-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксилат (337): 1НЯМР (400 МГц): δ ppm 7,63 (д, J=8,0 Гц, 2H), 7,51 (д, J=8,0 Гц, 2H), 4,76 (с, 2H), 4,15 (т, J=6,0 Гц, 2H), 3,73 (с, 3H), 3,16 (дд, J=5,6, 5,2 Гц, 2H), 2,12 (м, 2H).
2-(трифторметил)-4-(4-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоновая кислота (338): 1НЯМР (400 МГц): δ ppm 7,60 (д, J=8,0 Гц, 2H), 7,46 (д, J=8,0 Гц, 2H), 4,78 (с, 2H), 4,15 (дд, J=6,4, 5,6 Гц, 2H), 3,18 (дд, J=5,4, 6,0 Гц, 2H), 2,11 (дд, J=6,0, 6,0 Гц, 2H).
Метил (S)-4-(1-(2-(трифторметил)-4-(4-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензоат (339): 1НЯМР (400 МГц): δ ppm 7,82 (д, J=8,0 Гц, 2H), 7,46 (д, J=8,4 Гц, 2H), 7,23 (д, J=8,0 Гц, 2H), 7,19 (д, J=8,0 Гц, 2H), 5,99 (шир.д, J=7,2 Гц, 1H), 5,07 (м, 1H), 4,61 (д, J=16,0 Гц, 1H), 4,44 (д, J=16,0 Гц, 1H), 4,05 (м, 2H), 3,83 (с, 3H), 3,13 (м, 2H), 2,08 (м, 2H), 1,36 (д, J=6,4 Гц, 3H). LCMS (ES) (M+H)=555,3.
(S)-4-(1-(2-(трифторметил)-4-(4-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 45): 1НЯМР (400 MГц, CD3OD): δ ppm 7,71 (д, J=8,4 Гц, 2H), 7,49 (д, J=8,0 Гц, 2H), 7,27 (д, J=8,0 Гц, 2H), 7,22 (д, J=8,0 Гц, 2H), 4,93 (м, 1H), 4,35 (д, J=16,4 Гц, 1H), 4,27 (д, J=16,4 Гц, 1H), 4,03 (м, 2H), 3,06 (м, 2H), 2,06 (м, 2H), 1,26 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=541,2.
Пример XLIV
(S)-4-(1-(2-(трифторметил)-4-(2-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 46)
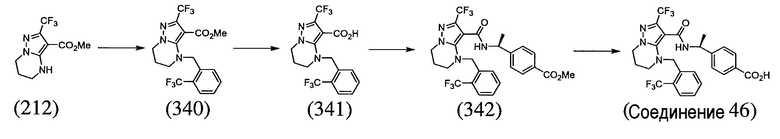
2-(трифторметил)-4-(2-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоновая кислота (341): 1НЯМР (400 МГц): δ ppm 7,72 (д, J=8,0 Гц, 1H), 7,66 (д, J=8,0 Гц, 1H), 7,53 (дд, J=8,0, 8,0 Гц, 1H), 7,32 (дд, J=8,0, 8,0 Гц, 1H), 4,88 (с, 2H), 4,18 (дд, J=5,6, 6,0 Гц, 2H), 3,18 (дд, J=5,2, 5,6 Гц, 2H), 2,16 (м, 2H).
Метил (S)-4-(1-(2-(трифторметил)-4-(2-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензоат (342): 1НЯМР (400 МГц): δ ppm 7,79 (д, J=8,0 Гц, 2H), 7,56 (д, J=8,0 Гц, 1H), 7,48 (д, J=7,6 Гц, 1H), 7,42 (т, J=7,6 Гц, 1H), 7,29 (т, J=7,6 Гц, 1H), 7,14 (д, J=8,0 Гц, 2H), 5,96 (шир.д, J=8,0 Гц, 1H), 5,07 (м, 1H), 4,68 (д, J=16,8 Гц, 1H), 4,55 (д, J=16,8 Гц, 1H), 4,06 (м, 2H), 3,82 (с, 3H), 3,05 (м, 2H), 2,06 (м, 2H), 1,32 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=555,3.
(S)-4-(1-(2-(трифторметил)-4-(2-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 46): 1НЯМР (400 MГц, CD3OD): δ ppm 7,66 (д, J=8,8 Гц, 2H), 7,58 (д, J=8,0 Гц, 1H), 7,48 (м, 2H), 7,35 (м, 1H), 7,13 (д, J=8,4 Гц, 2H), 4,89 (м, 1H), 4,54 (д, J=17,2 Гц, 1H), 4,44 (д, J=17,2 Гц, 1H), 4,05 (м, 2H), 3,08 (м, 2H), 2,09 (м, 2H), 1,17 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=541,2.
Пример XLV
Промежуточные соединения, используемые в примерах XLVI-L ниже
Метил 6-(трифторметил)-1-(4-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (344):

В микроволновый флакон (50 мл) загружали метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (208) (2,13 ммоль), 1-иод-4-(трифторметил)бензол (343) (1,4 экв.) и 28 мл сухого толуола в атмосфере азота. Затем добавляли Pd2(dba)3 (65 мг) и DPPF (225 мг), а затем трет-бутоксид натрия (300 мг, 1,6 эквив.). Реакционную смесь кепировали и нагревали при 120 C в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали и очищали при помощи колоночной хроматографии с получением соединения 344 (180 мг, 22% выход). 1НЯМР (400 МГц): δ ppm 7,61 (д, J=9,0 Гц, 2H), 7,14 (д, J=9,0 Гц, 2H), 4,59 (дд, J=8,0, 8,8 Гц, 2H), 4,44 (дд, J=8,8, 7,6 Гц, 2H), 3,58 (с, 3H).
Следуя вышеупомянутым методикам получения метил 6-(трифторметил)-1-(4-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (344), следующие соединения получали из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) и соответствующего арилйодида.
Метил 6-(трифторметил)-1-(3-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (346):
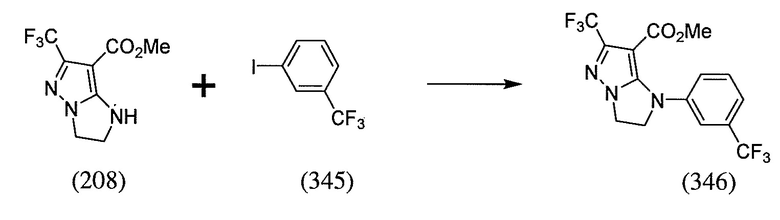
1НЯМР (400 МГц): δ ppm 7,48-7,32 (м, 4H), 4,58-4,43 (м, 4H), 3,52 (с, 3H).
Метил 1-(3-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (348):
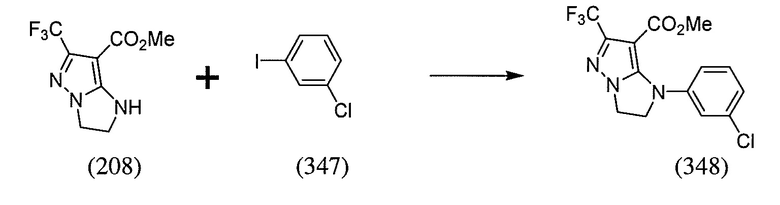
1НЯМР (400 МГц): δ ppm 7,28 (дд, J=8,0, 7,6 Гц, 1H), 7,19-7,17 (м,1H), 7,09 (дд, J=2,4, 2,0 Гц, 1H), 7,00-6,97 (м, 1H), 4,53-4,48 (м, 2H), 4,43-4,39 (м, 2H), 3,54 (с, 3H).
Метил 1-(4-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (350):
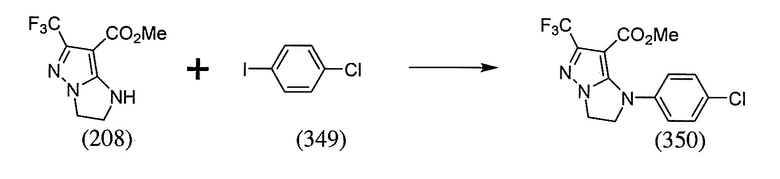
1НЯМР (400 МГц): δ ppm 7,33 (д, J=8,6 Гц, 2H), 7,05 (д, J=8,6 Гц, 2H), 4,48-4,40 (м 4H), 3,52 (с, 3H).
Следуя вышеупомянутым методикам получения метил 6-(трифторметил)-1-(4-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (344), следующее соединение получали из метил 2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксилата (212) и 1-иод-4-(трифторметил)бензола (343).
Метил 2-(трифторметил)-4-(4-(трифторметил)фенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксилат (351):
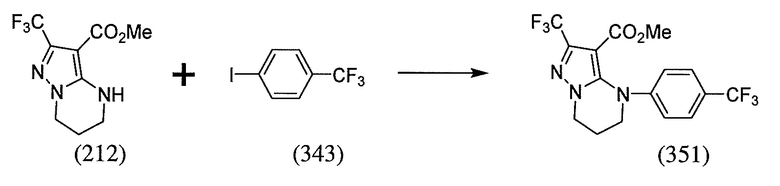
1НЯМР (400 МГц): δ ppm 7,58 (д, J=8,2 Гц, 2H), 7,20 (д, J=8,2 Гц, 2H), 4,31 (дд, J=6,4, 6,0 Гц, 2H), 3,87 (дд, J=5,6, 5,2 Гц, 2H), 3,36 (с, 3H), 2,27 (м, 2H).
Следуя той же методике гидролиза метил 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (213) с 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислотой (215), были получены следующие соединения.
6-(трифторметил)-1-(4-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (352):
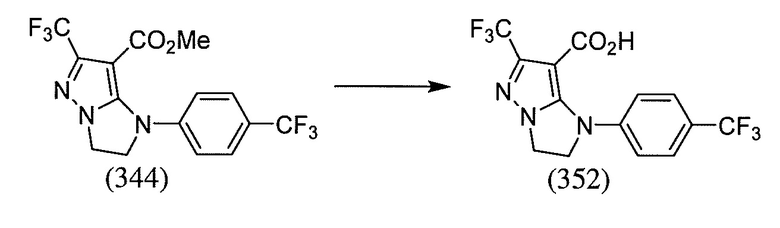
1НЯМР (400 МГц): δ ppm 7,58 (д, J=8,8 Гц, 2H), 7,14 (д, J=8,8 Гц, 2H), 4,60 (м, 2H), 4,47 (м, 2H).
6-(трифторметил)-1-(3-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (353):
1НЯМР (400 MГц, CD3OD): δ ppm 7,62-7,48 (м, 4H), 4,95 (с, 2H), 4,12 (дд, J=8,4, 8,4 Гц, 2H), 3,79 (дд, J=9,2, 8,0 Гц, 2H).
1-(3-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (354):
1НЯМР (400 МГц): δ ppm 7,24 (д, J=8,0 Гц, 1H), 7,16 (д, J=8,0 Гц, 1H), 7,08 (дд, J=2,0, 2,0 Гц, 1H), 6,97 (дд, J=8,0, 1,6 Гц, 1H), 4,52 (дд, J=1,6, 7,2 Гц, 2H), 4,41 (дд, J=9,2, 1,6 Гц, 2H).
1-(4-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (355):
1НЯМР (400 МГц): δ ppm 7,29 (д, J=8,8 Гц, 2H), 7,03 (д, J=8,8 Гц, 2H), 4,41-4,5 (м, 4H).
2-(трифторметил)-4-(4-(трифторметил)фенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоновая кислота (356):

1НЯМР (400 МГц): δ ppm 7,56 (д, J=8,8 Гц, 2H), 7,19 (д, J=8,8 Гц, 2H), 4,31 (дд, J=6,4, 6,0 Гц, 2H), 3,87 (дд, J=6,0, 5,6 Гц, 2H), 2,26 (м, 2H).
***********
Следуя методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215), описанной в примере I, соединения 47-51 получали в соответствии с каждой из соответствующих схем реакции.
Пример XLVI
(S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 47)
Метил (S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (357): 1НЯМР (400 МГц): δ ppm 7,93 (д, J=8,4 Гц, 2H), 7,29 (д, J=8,8 Гц, 2H), 7,25 (д, J=8,0 Гц, 2H), 6,87 (д, J=8,4 Гц, 2H), 6,01 (шир.д, J=7,2 Гц, 1H), 5,09 (м, 1H), 4,58 (м, 1H), 4,38 (м, 3H), 3,86 (с, 3H), 1,39 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=527,2.
(S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 47): 1НЯМР (400 MГц, CD3OD): δ ppm 7,83 (д, J=8,4 Гц, 2H), 7,27 (д, J=8,4 Гц, 2H), 7,22 (д, J=8,0 Гц, 2H), 6,99 (д, J=8,8 Гц, 2H), 5,96 (м, 1H), 4,56 (м, 1H), 4,46 (м, 1H), 4,37 (м, 2H), 1,20 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=513,2.
Пример XLVII
(S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 48)
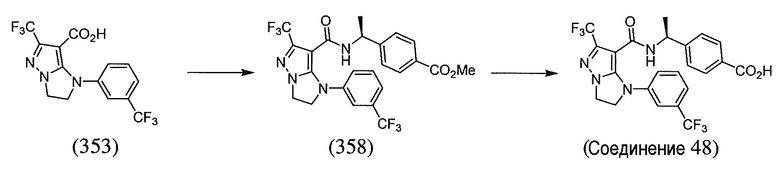
Метил (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (358): 1НЯМР (400 МГц): δ ppm 7,83 (д, J=8,4 Гц, 2H), 7,15 (м, 4H), 7,07 (шир.с, 1H), 6,98 (д, J=7,6 Гц, 1H), 5,89 (шир.д, J=7,2 Гц, 1H), 5,00 (м, 1H), 4,41 (м, 2H), 4,28 (т, J=8,0 Гц, 2H), 3,78 (с, 3H), 1,29 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=527,2.
(S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 48): 1НЯМР (400 MГц, CD3OD): δ ppm 7,79 (д, J=8,4 Гц, 2H), 7,27 (м, 2H), 7,20 (м, 2H), 7,13 (д, J=8,4 Гц, 2H), 4,89 (м, 1H), 4,52 (м, 2H), 4,37 (т, J=8,4 Гц, 2H), 1,10 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=513,2.
Пример XLVIII
(S)-4-(1-(1-(3-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 49)
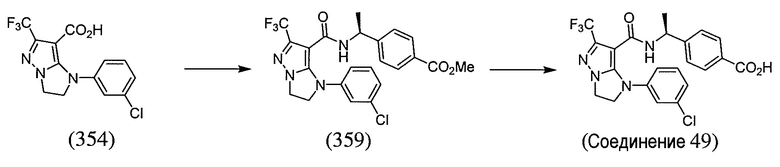
Метил (S)-4-(1-(1-(3-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (359): 1НЯМР (400 МГц): δ ppm 7,89 (д, J=8,0 Гц, 2H), 7,19 (д, J=8,0 Гц, 2H), 7,06 (т, J=8,0 Гц, 1H), 6,98 (д, J=8,0 Гц, 1H), 6,93 (шир.д, J=4,0 Гц, 1H), 6,80 (дд, J=1,2, 8,0 Гц, 1H), 5,82 (шир.д, J=7,2 Гц, 1H), 5,09 (м, 1H), 4,43 (м, 2H), 4,34 (м, 2H), 3,85 (с, 3H), 1,34 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=493,2.
(S)-4-(1-(1-(3-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 49): 1НЯМР (400 MГц, CD3OD): δ ppm 7,81 (д, J=7,6 Гц, 2H), 7,16 (д, J=8,0 Гц, 2H), 7,06 (т, J=8,0 Гц, 1H), 7,04 (шир.с, 1H), 6,91 (д, J=8,4 Гц, 2H), 4,94 (м, 1H), 4,47 (т, J=9,2 Гц, 2H), 4,35 (т, J=8,8 Гц, 2H), 1,17 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=479,2.
Пример XLIX
(S)-4-(1-(1-(4-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 50)
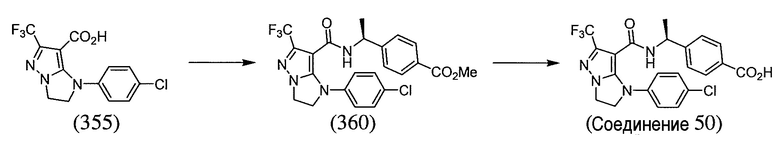
Метил (S)-4-(1-(1-(4-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (360): 1НЯМР (400 МГц): δ ppm 7,90 (д, J=8,0 Гц, 2H), 7,16 (д, J=8,0 Гц, 2H), 7,06 (д, J=8,8 Гц, 2H), 6,83 (д, J=8,8 Гц, 2H), 5,77 (шир.д, J=7,2 Гц, 1H), 5,06 (м, 1H), 4,38 (м, 2H), 4,34 (м, 2H), 3,85 (с, 3H), 1,31 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=493,2.
(S)-4-(1-(1-(4-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 50): 1НЯМР (400 MГц, CD3OD): δ ppm 7,83 (д, J=8,4 Гц, 2H), 7,16 (д, J=8,4 Гц, 2H), 7,02 (д, J=8,4 Гц, 2H), 6,92 (д, J=9,2 Гц, 2H), 4,92 (м, 1H), 4,42 (м, 2H), 4,33 (т, J=8,4 Гц, 2H), 1,17 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=479,2.
Пример L
(S)-4-(1-(2-(трифторметил)-4-(4-(трифторметил)фенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 51)
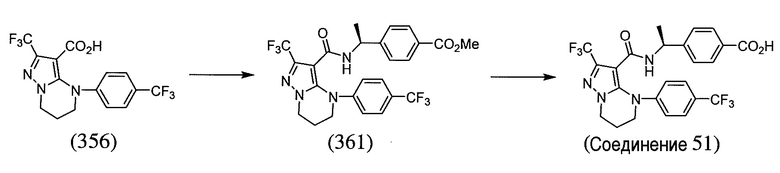
Метил (S)-4-(1-(2-(трифторметил)-4-(4-(трифторметил)фенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензоат (361): 1НЯМР (400 МГц): δ ppm 7,85 (д, J=8,0 Гц, 2H), 7,39 (д, J=8,8 Гц, 2H), 7,04 (дд, J=6,0, 8,4 Гц, 4H), 5,87 (шир.д, J=7,6 Гц, 1H), 4,84 (м, 1H), 4,21 (т, J=6,4 Гц, 2H), 3,84 (с, 3H), 3,76 (м, 2H), 2,15 (м, 2H), 1,14 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=541,3.
(S)-4-(1-(2-(трифторметил)-4-(4-(трифторметил)фенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 51): 1НЯМР (400 MГц, CD3OD): δ ppm 7,83 (д, J=8,8 Гц, 2H), 7,43 (д, J=8,4 Гц, 2H), 7,21 (д, J=8,4 Гц, 2H), 7,10 (д, J=8,0 Гц, 2H), 4,58 (м, 1H), 4,20 (т, J=6,4 Гц, 2H), 3,81 (м, 2H), 2,20 (м, 2H), 1,01 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=527,2.
Пример LI
(S)-N-(1-(4-(цианокарбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 52)

К раствору (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) (22,0 мг, 0,042 ммоль) и цианамида (3,5 мг, 0,084 ммоль) в DCM при комнатной температуре добавляли DMAP (10,2 мг, 0,084 ммоль), затем EDC (16,0 мг, 0,084 ммоль), полученную смесь перемешивали при комнатной температуре в течение 1 ч. Анализ LCMS показал, что реакция завершена. Реакционную смесь концентрировали и остаток очищали с помощью ВЭЖХ (0,1% муравьиная кислота, 80%-100% CH3CN-H2O) с получением бесцветного стекловидного твердого вещества (15,8 мг, 69% выход). 1НЯМР (400 MГц, CD3OD): δ ppm 7,73 (д, J=8,0 Гц, 2H), 7,57 (шир.с, 1H), 7,52 (м, 1H), 7,43 (м, 2H), 7,30 (д, J=8,0 Гц, 2H), 5,06 (м, 1H), 4,36 (д, J=2,0 Гц, 2H), 4,13 (т, J=8,0 Гц, 2H), 3,70 (т, J=8,0 Гц, 2H), 1,39 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=551,2.
Пример LII
(S)-N-(1-(4-(((3,4-дифторфенил)сульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 53)
К раствору (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) (22,4 мг, 0,043 ммоль) и 3,4-дифторбензолсульфонамида (16,4 мг,,085 ммоль) в DCM при комнатной температуре добавляли DMAP (10,4 мг, 0,085 ммоль), затем EDC (16,3 мг, 0,085 ммоль), полученную смесь перемешивали при комнатной температуре в течение 24 ч. LCMS показала, что реакция завершена. Реакционную смесь концентрировали и остаток очищали при помощи препар. TLC с силикагелем (1% AcOH-EtOAc) с получением бесцветного стекловидного твердого вещества (24,4 мг, 82% выход). 1НЯМР (400 MГц, CD3OD): δ ppm 7,89 (т, J=8,4 Гц, 1H), 7,79 (шир.д, J=8,8 Гц, 1H), 7,68 (д, J=8,0 Гц, 2H), 7,55 (с, 1H), 7,37 (д, J=4,8 Гц, 1H), 7,38 (м, 3H), 7,28 (д, J=8,4 Гц, 2H), 5,04 (м, 1H), 4,37 (д, J=14,8 Гц, 1H), 4,32 (д, J=14,8 Гц, 1H), 4,12 (т, J=8,4 Гц, 2H), 3,70 (т, J=8,4 Гц, 2H), 1,38 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=702,2.
Пример LIII
(S)-N-(1-(4-((фенилсульфонил)карбамоил)фенил)этил)-1-(3-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 54)
Методика, аналогичная синтезу (S)-N-(1-(4-(((3,4-дифторфенил)сульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида (Соединение 53), описанному в примере LII. 1НЯМР (400 MГц, CD3OD): δ ppm 7,99 (д, J=7,6 Гц, 2H), 7,65 (д, J=8,4 Гц, 2H), 7,57 (м, 1H), 7,49 (м, 2H), 7,29 (м, 2H), 7,25 (д, J=8,4 Гц, 1H), 7,17 (с, 1H), 7,09 (дд, J=7,6, 16,4 Гц, 2H), 5,04 (м, 1H), 4,33 (д, J=15,2 Гц, 1H), 4,27 (д, J=15,2 Гц, 1H), 4,12 (м, 2H), 3,70 (м, 2H), 1,38 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=682,6.
Пример LIV
(S)-N-(1-(4-((метилсульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 55)

Методика, аналогичная синтезу (S)-N-(1-(4-(((3,4-дифторфенил)сульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида (Соединение 53), описанному в примере LII. 1НЯМР (400 MГц, CD3OD): δ ppm 7,71 (д, J=8,4 Гц, 2H), 7,58 (с, 1H), 7,54 (м, 1H), 7,44 (м, 2H), 7,35 (д, J=8,0 Гц, 2H), 5,06 (м, 1H), 4,39 (д, J=16,0 Гц, 1H), 4,34 (д, J=16,0 Гц, 1H), 4,13 (т, J=8,0 Гц, 2H), 3,71 (т, J=8,0 Гц, 2H), 3,22 (с, 3H), 1,39 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=605,2.
Пример LV
(S)-N-(1-(4-((циклопропилсульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 56)

К раствору (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (22,6 мг, 0,043 ммоль) и циклопропансульфонамида (365) (10,4 мг, 0,086 ммоль) в DCM при комнатной температуре добавляли DMAP (10,5 мг, 0,086 ммоль) затем EDC (16,5 мг, 0,086 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 17 ч. Реакционную смесь загружали непосредственно на PTLC, с 1% AcOH-EtOAc, основную полосу экстрагировали 20% MeOH-DCM и концентрировали с получением соединения 56 в виде бесцветного масла (26,1 мг, 97% выход). 1НЯМР (400 MГц, CD3OD): δ ppm 7,70 (д, J=8,0 Гц, 2H), 7,58 (шир.с, 1H), 7,53 (м, 1H), 7,45 (м, 2H), 7,36 (д, J=8,0 Гц, 2H), 5,06 (м, 1H), 4,37 (дд, J=15,2, 21,6 Гц, 2H), 4,13 (т, J=8,4 Гц, 2H), 3,70 (т, J=8,0 Гц, 2H), 3,04 (м, 1H), 1,39 (д, J=6,8 Гц, 3H), 1,20 (м, 2H), 1,01 (м, 2H). LCMS (ES) (M+H)=630,3.
Пример LVI
(S)-N-(1-(4-циклопропилфенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 57)
В пробирку для реакций, содержащую циклопропилбороновую кислоту (1,3 экв.) добавляли раствор (S)-N-(1-(4-бромфенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида (321) (20 мг, 0,036 ммоль) в 1,4-диоксане (0,5 мл), раствор Pd(PPh3)4 (0,1 экв.) в 1,4-диоксане (0,5 мл) и раствор Na2CO3 (4 экв.) в воде (0,5 мл). Реакционную смесь дегазировали путем барботирования N2 и герметизировали. Реакционную смесь нагревали при 80°С в течение 20 ч. После охлаждения до комнатной температуры, реакционную смесь концентрировали и остаток очищали с помощью PTLC (50% AcOEt/Гептан) с получением соединения 57 (9,0 мг, 48% выход). 1НЯМР (400 МГц): δ ppm 7,55 (д, J=8,0 Гц, 2H), 7,38 (д, J=8,0 Гц, 2H), 7,21 (д, J=8,4 Гц, 2H), 7,02 (д, J=8,0 Гц, 2H), 6,22 (шир.д, J=5,6 Гц, 1H), 5,16 (дт, J=7,2 и 6,8 Гц, 1H), 4,88 (д, J=14,8 Гц, 1H), 4,84 (д, J=14,8 Гц, 1H), 4,16 (т, J=8,4 Гц, 2H), 3,76 (т, J=8,2 Гц, 2H), 1,86 (м, 1H), 1,53 (м, 1H), 1,51 (д, J=6,8 Гц, 3H), 1,24 (м, 1H), 0,94 (м, 1H), 0,65 (м, 1H). LCMS (ES) [M+H]= 523,3
Пример LVII
(S)-N-(1-(3-метил-4-(2H-тетразол-5-ил)фенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 58)
К 6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоте (220) (120 мг, 0,32 ммоль) и (S)-4-(1-аминоэтил)-2-метилбензонитрилу (366) (60,8 мг, 0,38 ммоль) в DMF (4,3 мл, 55,1 ммоль) добавляли основание Хунига (276 мкл, 1,6 ммоль) и HATU (162 мг, 0,43 ммоль) при комнатной температуре. Реакционную смесь концентрировали и остаток очищали с помощью препаративной PTLC (50% AcOEt/Гептан) с получением (S)-N-(1-(4-циано-3-метилфенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида (367) (134 мг, 81% выход). 1НЯМР (400 МГц): δ ppm 7,57 (д, J=7,2 Гц, 2H), 7,54 (д, J=8,4 Гц, 1H), 7,41 (с 1H), 7,40 (д, J=7,2 Гц, 2H), 7,21 (д, J=8,4 Гц, 1H), 6,26 (шир,с, 1H), 5,13 (дт, J=7,2 и 6,8 Гц, 1H), 4,87 (д, J=14,8 Гц, 1H), 4,81 (, J=14,8 Гц, 1H), 4,18 (дд, J=8,8 и 8,0 Гц, 2H), 3,77 (т, J=8,4 Гц, 2H), 2,51 (с, 3H), 1,49 (д, J=7,6 Гц, 3H). LCMS (ES) [M+Na]= 522,3.
Раствор (S)-N-(1-(4-циано-3-метилфенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида (367) (50 мг, 0,10 ммоль), азида натрия (59,2 мг, 0,91 ммоль) и хлорида аммония (48,7 мг, 0,91 ммоль) в DMF (0,9 мл) нагревали при 120°С в течение 89 ч. Реакционную смесь охлаждали до комнатной температуры, фильтровали и промывали DMSO (2×0,5 мл). Остаток очищали с помощью ВЭЖХ с получением соединения 58 (30 мг, 55% выход). 1НЯМР (400 MГц, CD3OD): δ ppm 7,56 (д, J=7,8 Гц, 2H), 7,49 (д, J=8,2 Гц, 1H), 7,44 (д, J=7,8 Гц, 2H), 7,37 (с, 1H), 7,31 (д, J=8,2 Гц, 1H), 5,11 (дт, J=7,2 и 6,8 Гц, 1H), 4,48 (д, J=15,2 Гц, 1H), 4,40 (д, J=15,2 Гц, 1H), 4,19 (т, J=8,4 Гц, 2H), 3,78 (т, J=8,4 Гц, 2H), 2,38 (с, 3H), 1,47 (д, J=6,8 Гц, 3H). LCMS (ES) [M+Na]= 565,3.
Пример LVII
(S)-4-(1-(6-этил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 59)
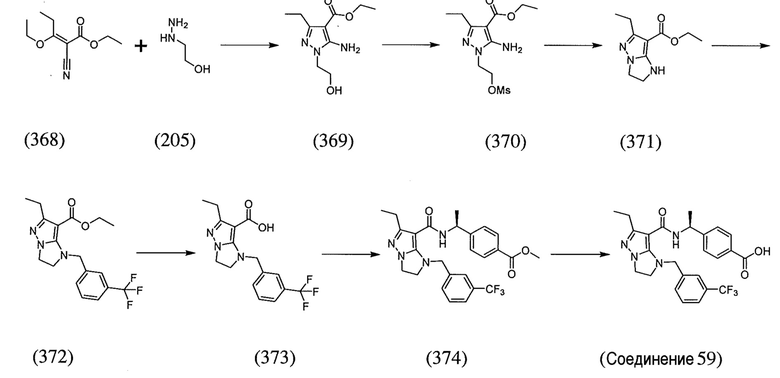
Раствор (E)-этил 2-циано-3-этоксипент-2-еноата (368) (100 мг, 0,51 ммоль), 2-гидразинилэтанола (205) (46,3 мг, 0,61 ммоль) и TEA (0,353 мл, 2,5 ммоль) в метаноле (3 мл, 74,2 ммоль) нагревали с обратным холодильником в течение 4 ч. Смесь концентрировали и очистка с помощью хроматографии (EtOAc/гептан, 50%-85%) давала этил 5-амино-3-этил-1-(2-гидроксиэтил)-1H-пиразол-4-карбоксилат (369) (62 мг, 54% выход). 1НЯМР (400 MГц, CD3OD): δ ppm 4,19 (кв, J=7,2 Гц, 2H), 3,90 (т, J=5,5 Гц, 2H), 3,75 (дд, J=5,5 и 5,0 Гц, 2H), 2,65 (кв, J=7,6 Гц, 2H), 1,27 (т, J=7,0 Гц, 3H), 1,12 (т, J=7,6 Гц, 3H). LCMS (ES) [M+H]= 228,3.
Этил 5-амино-3-этил-1-(2-((метилсульфонил)окси)этил)-1H-пиразол-4-карбоксилат (370): 1НЯМР (400 МГц): δ ppm 5,26 (шир,с, 1H), 4,52 (т, J=4,9 Гц, 2H), 4,22 (кв, J=7,2 Гц, 2H), 4,14 (т, J=4,9 Гц, 2H), 2,88 (с, 3H), 2,69 (кв, J=7,6 Гц, 2H), 1,28 (т, J=7,2 Гц, 3H), 1,15 (т, J=7,4 Гц, 3H). LCMS (ES) [M+H]= 306,1.
Этил 6-этил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (371): 1НЯМР (400 МГц): δ ppm 4,24 (кв, J=7,2 Гц, 2H), 4,12 (м, 2H), 4,06 (дт, J=7,0 и 2,3 Гц, 2H), 2,83 (кв, J=7,4 Гц, 2H), 1,32 (т, J=7,0 Гц, 3H), 1,26 (т, J=7,4 Гц, 3H). LCMS (ES) [M+H]= 210,1.
Этил 6-этил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (372): 1НЯМР (400 МГц): δ ppm 7,53 (с, 1H), 7,48 (д, J=7,8 Гц, 2H), 7,40 (т, J=7,6 Гц, 1H), 4,88 (с, 2H), 4,16 (кв, J=7,2 Гц, 2H), 3,99 (т, J=8,6 Гц, 2H), 3,61 (т, J=7,8 Гц, 2H), 2,75 (т, J=7,1 Гц, 3H), 1,18 (т, J=7,5 Гц, 3H). LCMS (ES) [M+H]= 368,2.
6-этил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (373): Материал использовали в качестве неочищенного вещества для реакции следующей стадии. LCMS (ES) [M+H]= 340,4.
Метил (S)-4-(1-(6-этил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (374): 1НЯМР (400 MГц, CD3OD): δ ppm 7,81 (д, J=8,2 Гц, 2H), 7,56 (с, 1H), 7,54-7,40 (м, 3H), 7,38 (д, J=7,4 Гц, 2H), 5,11 (кв, J=7,0 Гц, 1H), 4,52 (д, J=15,2 Гц, 1H), 4,41 (д, J=15,2 Гц, 1H), 3,98 (м, 2H), 3,82 (с, 3H), 3,64 (м, 2H), 2,70 (кв, J=7,6 Гц, 2H), 1,44 (д, J=7,0 Гц, 3H), 1,13 (т, J=7,4 Гц, 3H). LCMS (ES) [M+H]= 501,1.
(S)-4-(1-(6-этил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 59): 1НЯМР (400 MГц, CD3OD): δ ppm 7,77 (д, J=8,2 Гц, 2H), 7,53 (с, 1H), 7,47 (д, J=7,1 Гц, 1H), 7,40 (м, 2H), 7,30 (д, J=8,6 Гц, 2H), 5,07 (кв, м, 1H), 4,47 (д, J=15,2 Гц, 1H), 4,40 (д, J=15,2 Гц, 1H), 3,92 (т, J=7,5 Гц, 2H), 3,59 (т, J=7,6 Гц, 2H), 2,65 (кв, J=7,6 Гц, 2H), 1,39 (д, J=7,0 Гц, 3H), 1,13 (т, J=7,0 Гц, 3H). LCMS (ES) [M+H]= 486,9.
Пример LIX
(S)-4-(1-(6-фенил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 60)
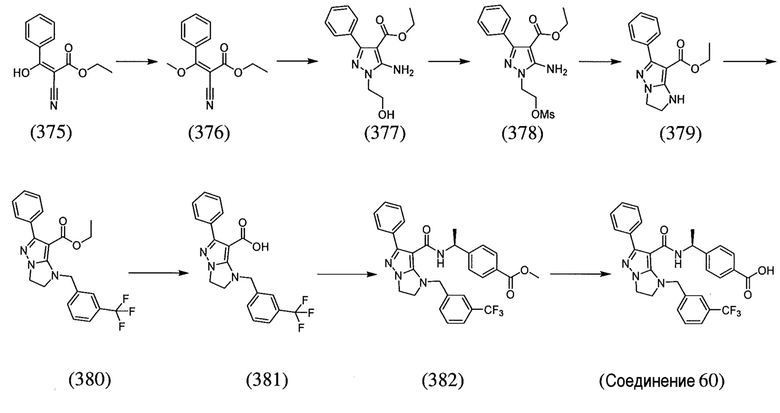
Этил (E)-2-циано-3-метокси-3-фенилакрилат (376):
К раствору (E)-этил 2-циано-3-гидрокси-3-фенилакрилата (375) (950 мг, 4,27 ммоль) в толуоле (15 мл) и метаноле (5 мл) при комнатной температуре добавляли триметилсилилдиазометан (383) (0,276 мл, 0,552 ммоль) (2 M раствор в гексанах). Через 1 ч времени реакции и TLC (70% E/H) и LCMS показали, что реакция завершена. Смесь концентрировали и неочищенный этил (E)-2-циано-3-метокси-3-фенилакрилат (376) непосредственно переносили на следующую стадию. LCMS (ES) [M+H]= 232,1.
Следуя вышеупомянутым методикам получения (S)-4-(1-(6-этил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 59) из (E)-этил 2-циано-3-этоксипент-2-еноата (368) и 2-гидразинилэтанола (205) (как в примере LIX), Соединение 60 получали из этил (E)-2-циано-3-метокси-3-фенилакрилата и 2-гидразинилэтанола.
Этил 5-амино-1-(2-гидроксиэтил)-3-фенил-1H-пиразол-4-карбоксилат (377): 1НЯМР (400 MГц, CD3OD): δ ppm 7,48 (м, 2H), 7,30 (м, 3H), 4,08 (кв, J=7,0 Гц, 2H), 4,02 (т, J=5,1 Гц, 2H), 3,83 (т, J=5,5 и 5,0 Гц, 2H), 1,08 (т, J=7,2 Гц, 3H). LCMS (ES) [M+H]= 276,0.
Этил 5-амино-1-(2-((метилсульфонил)окси)этил)-3-фенил-1H-пиразол-4-карбоксилат (378): 1НЯМР (400 MГц, CD3OD): δ ppm 7,45 (м, 2H), 7,28 (м, 3H), 4,50 (дд, J=5,5 и 5,0 Гц, 2H), 4,24 (дд, J=5,5 и 5,0 Гц, 2H), 4,06 (кв, J=7,2 Гц, 2H), 2,90 (с, 3H), 1,06 (т, J=7,2 Гц, 3H). LCMS (ES) [M+H]= 354,4.
Этил 6-фенил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (379): 1НЯМР (400 МГц): δ ppm 7,71 (м, 2H), 7,30 (м, 3H), 4,15 (м, 4H), 4,01 (дд, J=8,1 и 7,8 Гц, 2H), 1,20 (т, J=7,2 Гц, 3H). LCMS (ES) [M+H]= 258,1.
Этил 6-фенил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (380): 1НЯМР (400 МГц): δ ppm 7,56-7,30 (м, 5H), 4,92 (с, 2H), 4,10 (дд, J=8,4 и 7,1 Гц, 2H), 4,02 (кв, J=7,2 Гц, 2H), 3,69 (т, J=8,2 Гц, 2H), 0,96 (т, J=7,2 Гц, 3H). LCMS (ES) [M+H]= 416,0.
6-фенил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (381): Вещество использовали как неочищенное для следующей стадии реакции. LCMS (ES) [M+H]= 388,1.
Метил (S)-4-(1-(6-фенил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (382): 1НЯМР (400 MГц, CD3OD): δ ppm 7,79 (д, J=8,2 Гц, 2H), 7,62 (с, 1H), 7,58-7,43 (м, 5H), 7,37-7,30 (м, 3H), 7,18 (д, J=8,2 Гц, 2H), 5,03 (м, 1H), 4,66 (д, J=15,2 Гц, 1H), 4,60 (д, J=15,2 Гц, 1H), 4,08 (дд, J=8,2 и 7,3 Гц, 2H), 3,83 (с, 3H), 3,71 (дд, J=8,6 и 7,9 Гц, 2H), 1,23 (д, J=7,0 Гц, 3H). LCMS (ES) [M+H]= 549,2.
(S)-4-(1-(6-фенил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 60): 1НЯМР (400 MГц, CD3OD): δ ppm 7,78 (д, J=8,2 Гц, 2H), 7,61 (с, 1H), 7,52 (м, 2H), 7,47-7,38 (м, 3H), 7,36-7,28 (м, 3H), 7,13 (д, J=8,6 Гц, 2H), 5,00 (м, 1H), 4,66 (д, J=14,8 Гц, 1H), 4,60 (д, J=14,8 Гц, 1H), 4,09 (дд, J=8,6 и 7,8 Гц, 2H), 3,70 (дд, J=8,6 и 7,9 Гц, 2H), 1,20 (д, J=7,7 Гц, 3H). LCMS (ES) [M+H]= 535,0.
Пример LX
(S)-4-(1-(4-(2-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 61)
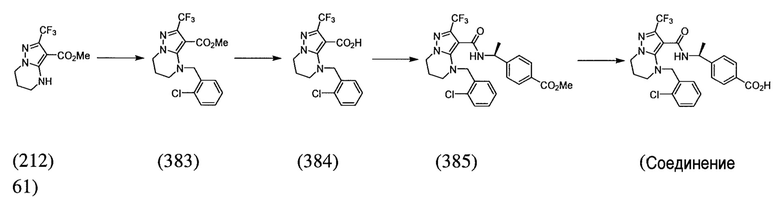
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) и 1-(хлорметил)-3-(трифторметил)бензола (214), описанной ранее в примере I, соединение 61 аналогичным образом получали из метил 2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксилата (212) и 1-хлор-2-(хлорметил)бензола.
Метил 4-(2-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксилат (Соединение 383): Метил 4-(2-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксилат использовали как неочищенный на следующей стадии гидролиза для 4-(2-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоновой кислоты (Соединение 384): 1НЯМР (400 MГц, CD3OD): δ ppm 7,45 (дд, J=7,6 и 1,2 Гц, 1H), 7,31 (дд, J=7,2 и 1,4 Гц, 1H), 7,23 (дт, J=7,2 и 1,6 Гц, 1H), 7,18 (дт, J=7,6 и 1,6 Гц, 1H), 4,79 (с, 2H), 4,04 (дд, J=6,4 и 6,0 Гц, 2H), 3,15 (дд, J=5,6 и 5,6 Гц, 2H), 2,04 (м, 2H). LCMS (ES) [M+H]= 360,07.
Метил (S)-4-(1-(4-(2-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензоат (Соединение 385): 1НЯМР (400 МГц): δ ppm 7,84 (д, J=8,8 Гц, 2H), 7,18 (м, 4H), 7,04 (д, J=8,8 Гц, 2H), 5,99 (шир.д, J=8,0 Гц, 1H), 5,10 (м, 1H), 4,50 (д, J=16,0 Гц, 1H), 4,34 (д, J=16,0 Гц, 1H), 4,06 (м, 2H), 3,84 (с, 3H), 3,11 (м, 2H), 2,05 (м, 2H), 1,38 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=521,2.
(S)-4-(1-(4-(2-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойная кислота (Соединение 61): 1НЯМР (400 MГц, CD3OD): δ ppm 7,73 (д, J=8,0 Гц, 2H), 7,28 (м, 2H), 7,20 (м, 4H), 4,90 (м, 1H), 4,40 (с, 2H), 4,05 (м, 2H), 3,12 (м, 2H), 2,10 (м, 2H), 1,20 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=507,2.
Пример LXI
(S)-4-(1-(1-(3-(метилтио)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 62)

(S)-4-(1-(1-(3-бром-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойную кислоту (5 мг, 8,26 мкмоль) смешивали в DMSO (1 мл) с Cryptand 222 (9,33 мг, 0,025 ммоль). Добавляли CsF (12,55 мг, 0,083 ммоль). Полученную суспензию нагревали до 200°С с микроволновым излучением в течение 2 ч. Полученный неочищенное вещество очищали с помощью препаративной ВЭЖХ с получением соединения 62 (3 мг, 63,4% выход). 1НЯМР (400 MГц, CDCl3) δ ppm 8,03-8,01 (м, 3H), 7,39-7,36 (м, 4H), 6,3 (шир.с, 1H), 5,20 (т, J=6,8 Гц, 1H), 4,88 (д, J=15,6 Гц, 1H), 4,75 (д, J=14,8 Гц, 1H), 4,18 (т, J=8,8 Гц, 2H), 3,76 (т, J=8,4 Гц, 2H), 2,46 (с, 3H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=573.
Пример LXII
метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (387)
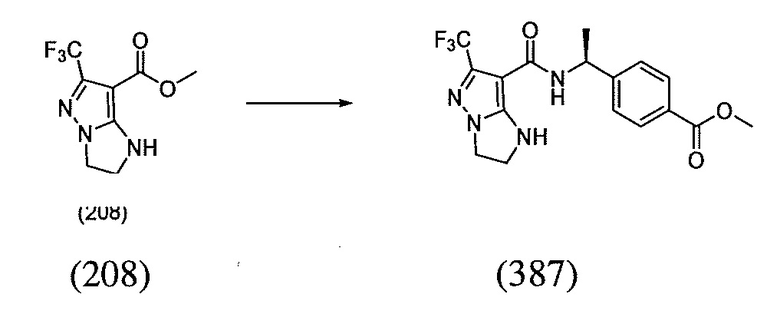
Метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (208) (0,79 г, 3,359 ммоль) растворяли в смеси THF (3,95 мл), MeOH (3,95 мл) и воды (3,95 мл). К этому раствору добавляли литий гидроксид моногидрат (0,705 г, 16,797 ммоль) и смесь нагревали до 45°C в течение 20 ч до завершения реакции. Смесь охлаждали до комнатной температуры и подкисляли 1 н HCl (16,80 мл, 16,797 ммоль) до pH 4-5 и затем экстрагировали EtOAc (3×20 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме. Неочищенное вещество смешивали с (S)-метил 4-(1-аминоэтил)бензоатом (216) (0,723 г, 4,032 ммоль) в CH2Cl2 (14,86 мл), и смесь обрабатывали Et3N (1,873 мл, 13,44 ммоль) и HATU (1,661 г, 4,368 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 17 ч до завершения реакции. Добавляли воду (7,43 мл) для гашения реакции. Органический слой отделяли и водный слой экстрагировали EtOAc (3×15 мл). Органические слои объединяли, сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии с получением метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) в виде бесцветного масла (1,4 г, 100% выход). 1НЯМР (400 MГц, CDCl3) δ ppm 7,98 (т, J=8,4 Гц, 2H), 7,35 (т, J=8,4 Гц, 2H), 6,21 (шир.с, 1H), 5,16 (т, J=6,4 Гц, 1H), 4,18 (дд, J=8,0, 8,4 Гц, 2H), 4,08 (кв, J=7,2 Гц, 2H), 4,01 (дд, J=8,0, 8,4 Гц, 2H), 1,51 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=383.

(S)-метил 4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (390): Смесь (S)-метил 4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) (238 мг, 0,52 ммоль) и 4-хлор-3-(трифторметил)бензил бромидом (389) (172 мг, 0,63 ммоль) в DMF (2 мл) обрабатывали карбонатом цезия (511 мг, 1,57 ммоль) и перемешивали при 100°C в течение 30 мин. После охлаждения до комнатной температуры, смесь разбавляли водой (4 мл) и экстрагировали дважды этилацетатом (4 мл). Органические слои объединяли, промывали насыщенным солевым раствором (2 мл), и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии (этилацетат в н-гептане=10%-40%) с получением (S)-метил 4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (390) (182 мг, 61%). 1H ЯМР (400 MГц, CDCl3): δ 8,01 (д, 2H), 7,61 (с, 1H), 7,38-7,45 (м, 4H), 6,28 (м, 1H), 5,21 (м, 1H), 4,82 (д, 1H), 4,78 (д, 2H), 4,19 (м, 2H), 3,91 (с, 3H), 3,76 (м, 2H), 1,56 (д, 3H). LCMS (ES) (M+H)=575.
(S)-4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 63): Раствор (S)-метил 4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (390) (0,16 г, 0,28 ммоль) в смеси THF (1,3 мл), MeOH (1,3 мл) и воды (1,3 мл) обрабатывали LiOH (35 мг, 1,5 ммоль), и перемешивали при комнатной температуре в течение 7 ч. Реакционную смесь подкисляли 1 н HCl (1,5 мл, 1,5 ммоль) и три раза экстрагировали этилацетатом (8 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии (этилацетат в гептане=10%-70%) с получением (S)-4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты, соединение 63 (102 мг, 65%). 1H ЯМР (400 MГц, CDCl3): δ 8,04 (д, 2H), 7,61 (с, 1H), 7,40-7,43 (м, 4H), 6,32 (м, 1H), 5,23 (м, 1H), 4,86 (д, J=14,8 Гц, 1H), 4,75 (д, J=14,8 Гц, 1H), 4,19 (м, 2H), 4,12 (кв, J=7,2 Гц, 1H), 3,75 (м, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=561.
(3-(((трет-бутилдиметилсилил)окси)метил)фенил)метанол
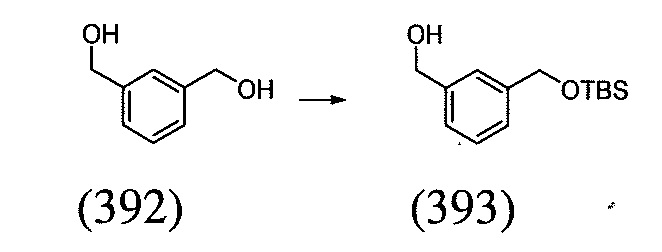
1,3-фенилендиметанол (2,18 г, 15,778 ммоль) растворяли в DMF (21,80 мл) и охлаждали до 0°С, добавляли имидазол (2,148 г, 31,557 ммоль), с последующим добавлением трет-бутилдиметилхлорсилана (2,378 г, 15,778 ммоль). Смесь перемешивали при 0°C в течение 1 часа и оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. После завершения реакции, смесь гасили насыщ. водн. NH4Cl (10 мл), экстрагировали EtOAc (2×100 мл). Органический слой промывали насыщ. водн. раствором NaHCO3 (10 мл), сушили над Na2SO4 и концентрировали. Остаток очищали с помощью флэш-хроматографии с получением (3-(((трет-бутилдиметилсилил)окси)метил)фенил)метанола (393) в виде бесцветного масла (1,73 г, 43,4% выход). 1НЯМР (400 MГц, CDCl3) δ ppm 7,35-7,23 (м, 4H), 4,75 (с, 2H), 4,68 (д, J=5,6 Гц, 2H), 0,95 (с, 9H), 0,12 (с, 6H).
((3-(бромметил)бензил)окси)(трет-бутил)диметилсилан (395):
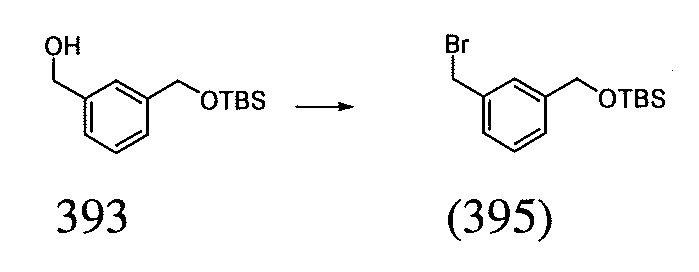
(3-(((трет-бутилдиметилсилил)окси)метил)фенил)метанол (393) (0,293 г, 1,161 ммоль) растворяли в DCM (6,0 мл) и смешивали с CBr4 (0,385 г, 1,161 ммоль). Добавляли Ph3P (0,304 г, 1,161 ммоль) при комнатной температуры и смесь продолжали перемешивать при комнатной температуре в течение 2 ч до завершения реакции. Реакционную смесь непосредственно загружали на колонку с силикагелем и очищали с помощью флэш-хроматографии с получением ((3-(бромметил)бензил)окси)(трет-бутил)диметилсилана (395) в виде бесцветного масла (319 мг, 87% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,37-7,26 (м, 4H), 4,76 (с, 2H), 4,51 (с, 2H), 0,98 (с, 9H), 0,13 (с, 6H).
Метил (S)-4-(1-(1-(3-(((трет-бутилдиметилсилил)окси)метил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (396)
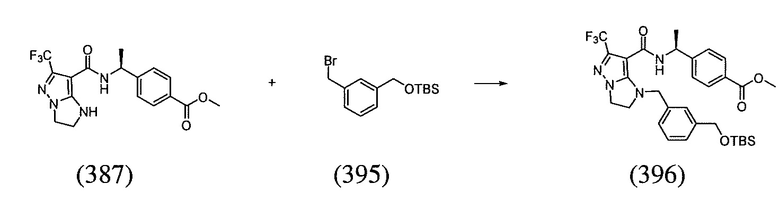
Следуя аналогичной методике получения (S)-метил 4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (390), соединение 396 получали (208 мг, 64,5% выход) из метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и ((3-(бромметил)бензил)окси)(трет-бутил)диметилсилана (395) 1НЯМР (400 MГц, CDCl3): δ ppm 7,98 (д, J=8,0 Гц, 2H), 7,39 (д, J=8,4 Гц, 2H), 7,28-7,21 (м, 3H), 7,11 (д, J=6,4 Гц, 1H), 6,24 (д, J=5,2 Гц, 1H), 5,24 (т, J=7,2 Гц, 1H), 4,75 (с, 2H), 4,70 (с, 2H), 4,11 (т, J=8,4 Гц, 2H), 3,89 (с, 3H), 3,74 (т, J=8,4 Гц, 1H), 1,53 (д, J=6,8 Гц, 3H), 0,90 (с, 9H), 0,07 (с, 6H). LCMS (ES) (M+Na)=639.
Пример LXIII
Метил (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (397)
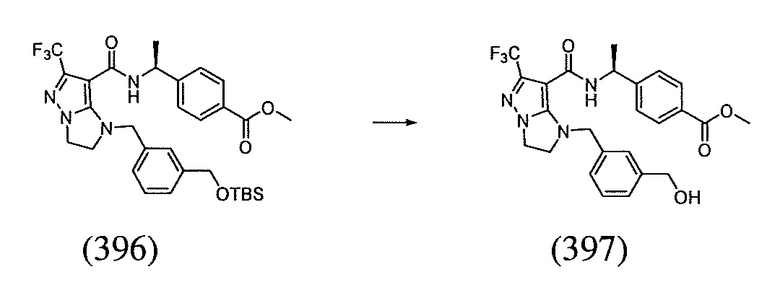
(S)-метил 4-(1-(1-(3-(((трет-бутилдиметилсилил)окси)метил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (396) (0,208 г,,337 ммоль) растворяли в THF (4,16 мл) и добавляли TBAF (0,506 мл,,506 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 0,5 ч. После завершения реакции, смесь гасили NH4Cl (5 мл), экстрагировали EtOAc (50 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4 и концентрировали. Неочищенное вещество очищали с помощью флэш-хроматографии с получением соединения 397 в виде бесцветного масла (154 мг, 91% выход). 1НЯМР (500 MГц, CDCl3): δ ppm 7,95 (д, J=8,5 Гц, 2H), 7,37 (д, J=8,5 Гц, 2H), 7,29-7,25 (м, 3H), 7,16 (дд, J=2,0, 3,5 Гц, 1H), 6,25 (д, J=5,0 Гц, 1H), 5,23 (т, J=7,5 Гц, 1H), 4,76 (д, J=14,5 Гц, 2H), 4,68 (д, J=14,5 Гц, 2H), 4,64 (с, 3H), 4,12 (дд, J=8,0, 12,0 Гц, 2H), 3,89 (с, 3H), 3,75 (дд, J=8,0, 9,5 Гц, 2H), 1,53 (д, J=7,0 Гц, 3H). LCMS (ES) (M+Na)=525.
(S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 64)
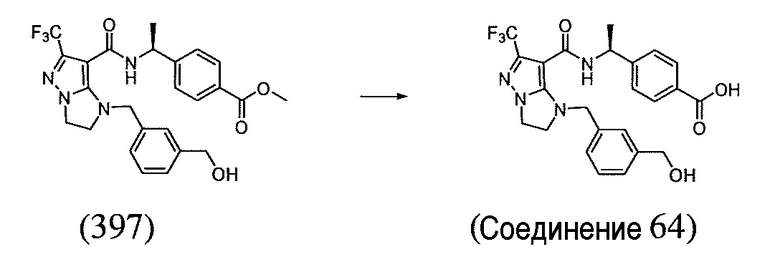
(S)-метил 4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (397) (10 мг, 0,02 ммоль) растворяли в трет-амиловом спирте (1 мл) и добавляли 3M раствор NaOH (66,3 мкл,,199 ммоль). Смесь затем перемешивали при 90°С в течение 1 часа до завершения реакции. Смесь охлаждали до комнатной температуры и добавляли 1 н. раствор HCl (259 мкл,,259 ммоль) для получения pH <4. Реакционную смесь экстрагировали EtOAc 3×15 мл. Органический слой концентрировали и очищали с помощью флэш-хроматографии с получением соединения 64 в виде белого твердого вещества (8,4 мг, 86%). 1НЯМР (400 MГц, CDCl3): δ ppm 7,99 (д, J=8,0 Гц, 2H), 7,39 (д, J=8,0 Гц, 2H), 7,30-7,24 (м, 3H), 7,14 (д, J=6,4 Гц, 1H), 6,30 (д, J=4,8 Гц, 1H), 5,24 (т, J=7,2 Гц, 1H), 4,78 (д, J=14,8 Гц, 1H), 4,68 (д, J=16,4 Гц, 1H), 4,64 (м, 3H), 4,16-4,10 (м, 2H), 3,76 (дд, J=7,6, 9,2 Гц, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=489.
Пример LXIV
Промежуточные соединения, используемые в примерах LXV-LXVI, ниже
Метил (S)-4-(1-(1-(3-(хлорметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (399) и диметил 4,4'-((1S,1'S)-((1,1'-(1,3-фениленбис(метилен))бис(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-диил-7-карбонил))бис(азанедиил))бис(этан-1,1-диил))дибензоат (400):
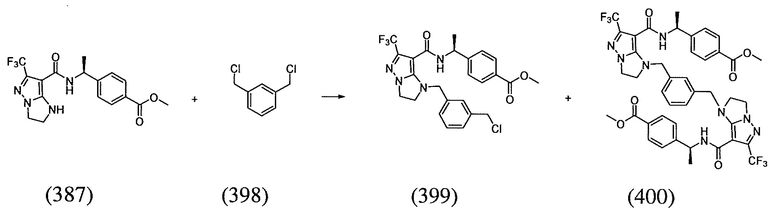
(S)-метил 4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (387) (0,048 г,,105 ммоль) и 1,3-бис(хлорметил)бензол (398) (0,037 г,,211 ммоль) смешивали в DMF (0,8 мл), и к этой смеси добавляли K2CO3 (0,044 г,,316 ммоль) в атмосфере N2. Полученную суспензию перемешивали при 100°С в течение 20 мин до полного расхода SM. Смесь охлаждали до комнатной температуры, гасили раствором NaHCO3 (5 мл), экстрагировали EtOAc (2×50 мл). Органический слой промывали водой (2×10 мл), насыщенным солевым раствором (2×10 мл), сушили и концентрировали. Остаток очищали с помощью флэш-хроматографии с получением (S)-4-(1-(1-(3-(хлорметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (399) в виде белого твердого вещества (37 мг, 67,4% выход), и диметил 4,4'-((1S,1'S)-((1,1'-(1,3-фениленбис(метилен))бис(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-диил-7-карбонил))бис(азанедиил))бис(этан-1,1-диил))дибензоата (400) в виде белого твердого вещества (9,8 мг, 10,7% выход).
(S)-4-(1-(1-(3-(хлорметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (399) 1НЯМР (400 MГц, CDCl3): δ ppm 7,99 (д, J=8,4 Гц, 2H), 7,39 (д, J=8,0 Гц, 2H), 7,31-7,26 (м, 3H), 7,22-7,20 (м, 1H), 6,26 (д, J=4,8 Гц, 1H), 5,24 (т, J=7,2 Гц, 1H), 4,76 (с, 2H), 4,54 (с, 2H), 4,15 (дд, J=8,0, 8,8 Гц, 2H), 3,90 (с, 3H), 3,76 (дд, J=8,0, 8,8 Гц, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=521.
Диметил 4,4'-((1S,1'S)-((1,1'-(1,3-фениленбис(метилен))бис(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-диил-7-карбонил))бис(азанедиил))бис(этан-1,1-диил))дибензоат (400): 1НЯМР (400 MГц, CDCl3): δ ppm 7,97 (д, J=8,4 Гц, 4H), 7,38 (д, J=8,0 Гц, 4H), 7,25-7,16 (м, 4H), 6,32 (д, J=4,4 Гц, 2H), 5,22 (т, J=7,2 Гц, 2H), 4,67 (с, 4H), 4,10 (дд, J=8,0, 8,8 Гц, 4H), 3,89 (с, 6H), 3,69 (дд, J=8,0, 8,8 Гц, 4H), 1,51 (д, J=7,2 Гц, 6H). LCMS (ES) (M+H)=867.
Пример LXV
(S)-4-(1-(1-(3-(хлорметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 65):
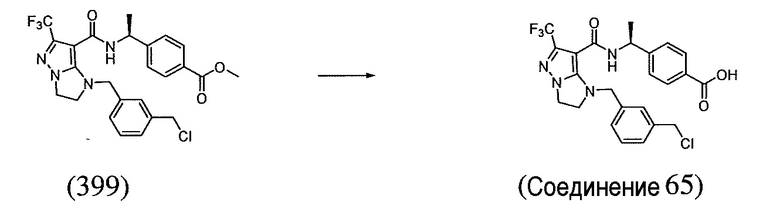
Следуя той же методике получения (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 64), соединение 65 получали (8,3 мг, 32,8% выход) из (S)-4-(1-(1-(3-(хлорметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (399). 1НЯМР (400 MГц, CDCl3): δ ppm 8,04 (д, J=8,0 Гц, 2H), 7,42 (д, J=8,0 Гц, 2H), 7,31-7,29 (м, 3H), 7,22-7,20 (м, 1H), 6,29 (д, J=4,8 Гц, 1H), 5,26 (т, J=7,2 Гц, 1H), 4,76 (с, 2H), 4,54 (с, 2H), 4,16 (дд, J=8,0, 8,8 Гц, 2H), 3,77 (дд, J=8,0, 8,8 Гц, 2H), 1,55 (д, J= 7,2 Гц, 3H). LCMS (ES) (M+H)=507.
Пример LXVI
4,4'-((1S,1'S)-((1,1'-(1,3-фениленбис(метилен))бис(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-диил-7-карбонил))бис(азанедиил))бис(этан-1,1-диил))дибензойная кислота (Соединение 66):
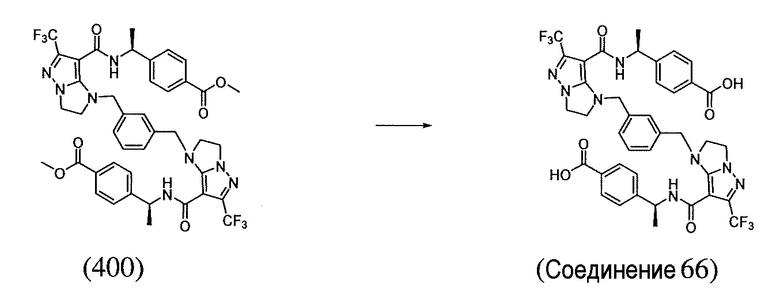
Следуя той же методике получения (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 64), соединение 66 получали (7,9 мг, 42,5% выход) из диметил 4,4'-((1S,1'S)-((1,1'-(1,3-фениленбис(метилен))бис(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-диил-7-карбонил))бис(азанедиил))бис(этан-1,1-диил))дибензоата (400).
1НЯМР (400 MГц, CDCl3): δ ppm 7,89 (д, J=8,0 Гц, 4H), 7,30 (д, J=8,0 Гц, 4H), 7,19-7,09 (м, 4H), 6,48 (д, J=6,8 Гц, 2H), 5,14 (т, J=7,2 Гц, 2H), 4,55 (д, J=14,4 Гц, 2H), 4,50 (д, J=14,8 Гц, 2H), 4,06 (дд, J=8,0, 8,8 Гц, 4H), 3,63 (дд, J=8,0, 8,8 Гц, 4H), 1,45 (д, J=7,2 Гц, 6H). LCMS (ES) (M+Na)=861.
Пример LXVII
Метил (S)-4-(1-(1-(3-(фторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (401)

(S)-метил 4-(1-(1-(3-(хлорметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (399) (6 мг,,012 ммоль) растворяли в трет-амиловом спирте (300 мкл) и добавляли раствор 1M TBAF в THF (57,6 мкл). Смесь затем перемешивали при 150°С в течение 10 мин до завершения реакции. Смесь охлаждали до комнатной температуры, экстрагировали EtOAc (3×10 мл), промывали водой (5 мл), насыщенным солевым раствором (5 мл), органический слой сушили и концентрировали. Остаток очищали с помощью флэш-хроматографии с получением соединения 401 в виде белого твердого вещества (5,4 мг, 93% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 8,01-7,98 (м, 2H), 7,41-7,26 (м, 6H), 6,26 (д, J=4,8 Гц, 1H), 5,34 (д, J=47,6 Гц, 2H), 5,25 (т, J=6,8 Гц, 1H), 4,78 (с, 2H), 4,15 (дд, J=8,0, 8,8 Гц, 2H), 3,90 (с, 3H), 3,76 (дд, J=8,0, 8,8 Гц, 2H), 1,54 (д, J=6,8 Гц, 3H). LCMS (ES) (M+Na)=527.
(S)-4-(1-(1-(3-(фторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 67)
Следуя той же методике получения (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 64), соединение 67 получали (54 мг, 79% выход) из метил (S)-4-(1-(1-(3-(фторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (401) 1НЯМР (400 MГц, CDCl3): δ ppm 8,04 (д, J=8,4 Гц, 2H), 7,42 (д, J=8,4 Гц, 2H), 7,33-7,24 (м, 4H), 6,30 (д, J=4,8 Гц, 1H), 5,33 (д, J=47,6 Гц, 2H), 5,28-5,24 (м, 1H), 4,77 (с, 2H), 4,17-4,09 (м, 2H), 3,76 (дд, J=8,0, 8,8 Гц, 2H), 1,55 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=491.
Пример LXVIII
Метил (S)-4-(1-(1-(4-иод-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (403) и (S)-4-(1-(1-(4-иод-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 68)
Следуя аналогичной методике получения (S)-4-(1-(1-(3-(хлорметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 65) из (S)-метил 4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и 1,3-бис(хлорметил)бензола (398), описанной в примере LXV, соединения 403 и 68 аналогичным образом получали из (S)-метил 4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и 4-(бромметил)-1-иод-2-(трифторметил)бензола (402).
Метил (S)-4-(1-(1-(4-иод-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (403) 1НЯМР (400 MГц, CDCl3): δ ppm 8,02-7,93 (м, 3H), 7,57 (с, 1H), 7,38 (д, J=8,4 Гц, 2H), 7,13 (д, J=8,4 Гц, 1H), 6,29 (д, J=4,0 Гц, 1H), 5,21 (т, J=6,8 Гц, 1H), 4,82 (д, J=14,8 Гц, 1H), 4,75 (д, J=14,8 Гц, 1H), 4,18 (дд, J=8,0, 8,8 Гц, 2H), 3,91 (с, 3H), 3,76 (дд, J=8,0, 8,8 Гц, 2H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=667.
(S)-4-(1-(1-(4-иод-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 68) 1НЯМР (400 MГц, CDCl3): δ ppm 8,04 (д, J=8,4 Гц, 2H), 7,94 (д, J=7,6 Гц, 1H), 7,56 (с, 1H), 7,39 (д, J=8,0 Гц, 2H), 7,15 (д, J=7,2 Гц, 1H), 6,34 (шир.с, 1H), 5,21 (т, J=6,8 Гц, 1H), 4,85 (д, J=14,8 Гц, 1H), 4,72 (д, J=14,8 Гц, 1H), 4,18 (т, J=8,4 Гц, 2H), 3,79 (т, J=8,4 Гц, 2H), 1,53 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=653.
Пример LXIX
Метил (S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (405) и (S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 69)
Следуя аналогичной методике получения (S)-4-(1-(1-(3-(хлорметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 65) из (S)-метил 4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и 1,3-бис(хлорметил)бензола (398), описанной в примере LXV, соединения 405 (265 мг, 85%) и 69 (33 мг, 67%) аналогичным образом получали из метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и 1-(бромметил)-3-иодбензола (404).
Метил (S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (405) 1НЯМР (400 MГц, CDCl3): δ ppm 8,04 (д, J=8,4 Гц, 2H), 7,62 (д, J=8,0 Гц, 2H), 7,41 (д, J=8,4 Гц, 2H), 7,26-7,05 (м, 2H), 6,28 (шир.с, 1H), 5,23 (т, J=6,8 Гц, 1H), 4,72 (м, 2H), 4,18 (т, J=8,4 Гц, 2H), 3,92 (с, 3H), 3,76 (т, J=8,4 Гц, 2H), 1,57 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=599.
(S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 69) 1НЯМР (400 MГц, CDCl3): δ ppm 7,93 (д, J=8,4 Гц, 2H), 7,57-7,52 (м, 2H), 7,32 (д, J=8,0 Гц, 2H), 7,16 (д, J=7,6 Гц, 1H), 6,98 (дд, J=7,2, 7,6 Гц, 1H), 6,35 (шир.с, 1H), 5,15 (т, J=6,8 Гц, 1H), 4,59 (д, J=14,8 Гц, 1H), 4,58 (д, J=14,8 Гц, 1H), 4,10 (т, J=8,4 Гц, 2H), 3,71 (т, J=8,4 Гц, 2H), 1,47 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=585.
Пример LXX
Метил (S)-4-(1-(1-бензил-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (407) и (S)-4-(1-(1-бензил-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 70)
Следуя аналогичной методике получения (S)-4-(1-(1-(3-(хлорметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 65) из (S)-метил 4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и 1,3-бис(хлорметил)бензола (398), описанной в примере LXV, соединения 407 (53 мг, 86%) и 70 (36 мг, 84%) аналогичным образом получали из метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и (бромметил)бензола (406).
Метил (S)-4-(1-(1-бензил-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (407) 1НЯМР (400 MГц, CDCl3): δ ppm 8,00 (д, J=8,4 Гц, 2H), 7,40 (д, J=8,4 Гц, 2H), 7,31-7,23 (м, 5H), 6,25 (д, J=4,8 Гц, 1H), 5,25 (т, J=7,2 Гц, 1H), 4,77 (д, J=14,8 Гц, 1H), 4,72 (д, J=14,8 Гц, 1H), 4,13 (т, J=8,4 Гц, 2H), 3,90 (с, 3H), 3,76 (т, J=8,4 Гц, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=473.
(S)-4-(1-(1-бензил-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 70) 1НЯМР (400 MГц, CDCl3): δ ppm 8,05 (д, J=8,4 Гц, 2H), 7,42 (д, J=8,4 Гц, 2H), 7,26-6,97 (м, 5H), 6,30 (шир.с, 1H), 5,27 (т, J=6,8 Гц, 1H), 4,76 (с, 2H), 4,17-4,11 (м, 2H), 3,80-3,76 (м, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=459.
Пример LXXI
(S)-N-(1-(4-(((4-нитрофенил)сульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 71)
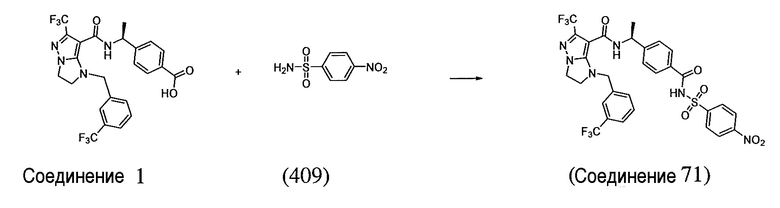
(S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойную кислоту (Соединение 1) (100 мг, 0,19 ммоль) растворяли в DCM (2 мл) и смешивали с 4-нитробензолсульфонамидом (409) (77 мг, 0,38 ммоль) и DMAP (46,4 мг,,38 ммоль). К этой смеси добавляли EDC (72,8 мг,,38 ммоль) и смесь перемешивали при комнатной температуре в течение 20 ч до завершения реакции. Реакцию гасили водой (2 мл), экстрагировали DCM (2×30 мл). Органический слой промывали насыщенным солевым раствором (5 мл), сушили и концентрировали, остаток очищали с помощью флэш-хроматографии с получением соединения 71 в виде белого твердого вещества (93 мг, 68,9% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 8,20-8,10 (м, 4H), 7,57-7,26 (м, 7H), 7,19 (д, J=8,4 Гц, 2H), 6,33 (шир.с, 1H), 5,11 (т, J=6,8 Гц, 1H), 4,86-4,83 (м, 1H), 4,72 (д, J=14,8 Гц, 1H), 4,21-4,10 (м, 2H), 3,75 (т, J=8,4 Гц, 2H), 1,42 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=711.
Пример LXXII
(S)-N-(1-(4-(((4-аминофенил)сульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 72)

(S)-N-(1-(4-(((4-нитрофенил)сульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 71) (0,046 г,,065 ммоль) растворяли в MeOH (2,3 мл) и смешивали с Pd-C (6,89 мг, 6,473 мкмоль) в атмосфере N2. Колбу продували H2 и реакционную смесь перемешивали в атмосфере H2 в течение 1 часа до завершения реакции. Смесь фильтровали через слой целита и фильтрат концентрировали с получением соединения 72 в виде белого твердого вещества (41 мг, 93% выход). (400 MГц, CDCl3): δ ppm 7,77 (д, J=7,6 Гц, 2H), 7,63 (д, J=7,6 Гц, 2H), 7,50-7,36 (м, 4H), 7,22 (д, J=7,2 Гц, 2H), 6,54 (д, J=5,2 Гц, 2H), 6,28 (д, J=3,6 Гц, 1H), 5,11 (т, J=6,4 Гц, 1H), 4,83-4,71 (м, 2H), 4,32 (шир.с, 1H), 4,14 (т, J=8,3 Гц, 2H), 3,73 (т, J=8,4 Гц, 2H), 1,43 (д, J=6,4 Гц, 3H). LCMS (ES) (M+H)=681.
Пример LXXIII
Метил (S)-4-(1-(1-(4-нитробензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (411)
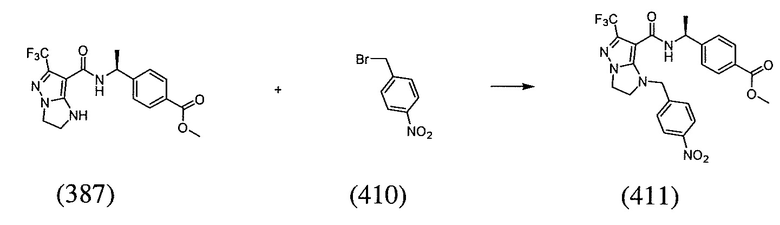
Следуя той же методике получения (S)-метил 4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (390), соединение 411 получали (14 мг, 51,7% выход) из метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и 1-(бромметил)-4-нитробензола (410). 1НЯМР (400 MГц, CDCl3): δ ppm 8,15 (д, J=8,4 Гц, 2H), 7,99 (д, J=8,4 Гц, 2H), 7,44 (д, J=8,0 Гц, 2H), 7,37 (д, J=8,4 Гц, 2H), 6,30 (д, J=4,4 Гц, 1H), 5,20 (т, J=6,8 Гц, 1H), 4,93 (д, J=14,8 Гц, 1H), 4,88 (д, J=14,8 Гц, 1H), 4,20 (т, J=8,4 Гц, 2H), 3,91 (с, 3H), 3,79 (т, J=8,4 Гц, 2H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=518.
(S)-4-(1-(1-(4-аминобензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 73)
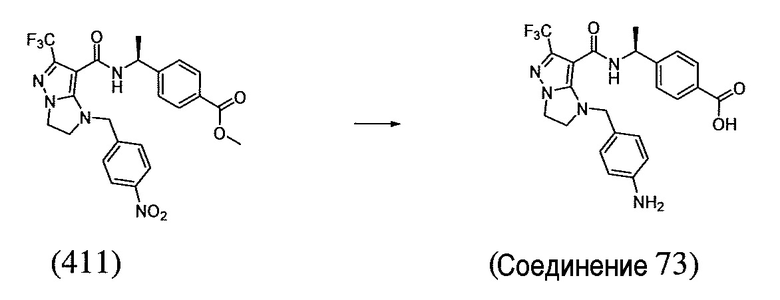
(S)-метил 4-(1-(1-(4-нитробензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (411) (7 мг,,014 ммоль) растворяли в MeOH (1,4 мл) и смешивали с Pd-C (1,440 мг, 1,353 мкмоль) в атмосфере N2. Колбу продували H2 и реакционную смесь перемешивали в атмосфере H2 в течение 30 мин до завершения реакции. Смесь фильтровали через слой целита, промывали MeOH (3×1 мл). Фильтрат концентрировали и повторно растворяли в трет-амиловом спирте (659 мкл), добавляли 3 н раствор NaOH (45,1 мкл,,135 ммоль). Смесь затем перемешивали при 90°С в течение 30 мин до завершения реакции. Смесь затем охлаждали до комнатной температуры и добавляли 1 н HCl (176 мкл,,176 ммоль) для получения значения pH <4. Вещество подвергали очистке препар. ВЭЖХ с получением соединения 73 в виде светло-желтого масла (3,5 мг, 54,7% выход). 1НЯМР (400 MГц, CDCl33): δ ppm 7,95-7,85 (м, 2H), 7,32-7,24 (м, 2H), 6,98-6,84 (м. 2H), 6,60-6,24 (м, 3H), 5,18-5,09 (м, 1H), 4,62 (шир.с, 1H), 4,38 (шир.с, 1H), 4,14 (шир.с, 1H), 4,03 (с, 2H), 3,69 (т, J=8,4 Гц, 2H), 3,40-3,22 (м, 2H), 1,47 (д, J=7,2 Гц, 3H). LCMS (ES) (M+Na)=496.
Пример LXXIV
Метил (S)-4-(1-(1-(3-((2-гидроксиэтокси)метил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (412)
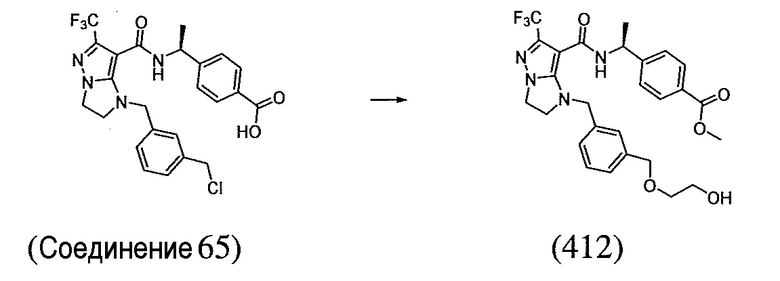
(S)-4-(1-(1-(3-(хлорметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойную кислоту (Соединение 65) (0,2 г,,395 ммоль) растворяли в полиэтиленгликоле (1,0 мл) и толуоле (2,0 мл). Добавляли KOH (0,221 г, 3,946 ммоль) и полученную смесь кипятили с обратным холодильником в течение 30 мин до завершения реакции. Смесь охлаждали до комнатной температуры, нейтрализовали до pH=4 с помощью 3 н HCl (1,558 мл, 5,129 ммоль) и экстрагировали DCM (3×20 мл). Органический слой концентрировали и неочищенный продукт растворяли в MeOH (2 мл) при комнатной температуре и затем смешивали с толуолом (3 мл). К этой смеси добавляли триметилсилилдиазометан (0,986 мл, 1,972 ммоль) (2M раствор в гексанах) до сохранения желтого цвета. Смесь затем перемешивали при комнатной температуре в течение 1 часа до концентрации. Остаток очищали с помощью флэш-хроматографии с получением соединения 412 в виде светло-желтого масла (146 мг, 67,7%). 1НЯМР (400 MГц, CDCl3): δ ppm 7,97 (д, J=8,4 Гц, 2H), 7,39 (д, J=8,4 Гц, 2H), 7,31-7,24 (м, 3H), 7,17 (д, J=6,8 Гц, 1H), 6,30 (д, J=4,2 Гц, 1H), 5,24 (т, J=6,8 Гц, 1H), 4,76 (д, J=14,4 Гц, 1H), 4,70 (д, J=14,8 Гц, 1H), 4,51 (с, 2H), 4,14-4,09 (м, 2H), 3,89 (с, 3H), 3,78-3,58 (м, 4H), 3,56 (д, J=6,4 Гц, 2H), 1,53 (д, J=7,2 Гц, 3H). LCMS (ES) (M+Na)=569.
Метил (S)-4-(1-(1-(3-((2-((метилсульфонил)окси)этокси)метил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (413)

(S)-метил 4-(1-(1-(3-((2-гидроксиэтокси)метил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (412) (0,125 г,,229 ммоль) растворяли в DCM (2,84 мл), охлаждали до -10°C, добавляли Et3N (0,080 мл,,572 ммоль), затем медленно добавляли MsCl (0,027 мл,,343 ммоль). Смесь перемешивали при -5°C в течение 30 мин до завершения реакции. Реакцию гасили NaHCO3 (1 мл), экстрагировали DCM (2×20 мл), промывали насыщенным солевым раствором (3 мл). Органический слой сушили Na2SO4, концентрировали и очищали с помощью флэш-хроматографии с получением соединения 413 в виде белой пены (134 мг, 94% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,97 (д, J=8,2 Гц, 2H), 7,39 (д, J=8,2 Гц, 2H), 7,31-7,23 (м, 3H), 7,18 (д, J=7,2 Гц, 1H), 6,29 (д, J=4,2 Гц, 1H), 5,23 (т, J=7,2 Гц, 1H), 4,76 (д, J=14,4 Гц, 1H), 4,70 (д, J=14,8 Гц, 1H), 4,53 (с, 2H), 4,35 (дд, J=4,4, 8,8 Гц, 2H), 4,16-4,10 (м, 2H), 3,89 (с, 3H), 3,77-3,71 (м, 4H), 3,00 (с, 3H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=625.
(S)-4-(1-(1-(3-((2-фторэтокси)метил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 74)
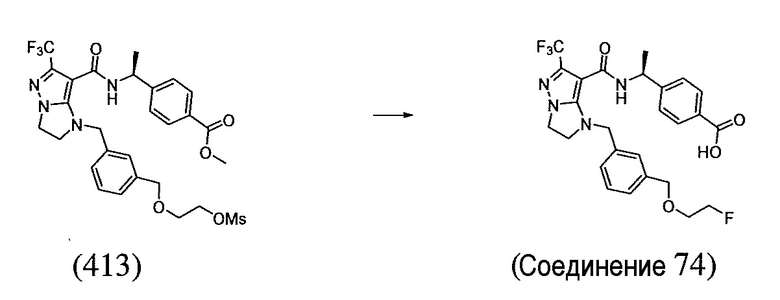
(S)-метил 4-(1-(1-(3-((2-((метилсульфонил)окси)этокси)метил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (413) (37 мг,,059 ммоль) смешивали с Cryptand 222 (44,6 мг,,118 ммоль) и CsF (18,00 мг,,118 ммоль) в трет-амиловом спирте (1,8 мл). Полученную суспензию перемешивали при 120°C в течение 20 мин до завершения реакции. Смесь охлаждали до 90°C, смешивали с 3 н NaOH (197 мкл,,592 ммоль) и продолжали перемешивание при 90°С в течение 20 мин. Смесь охлаждали до комнатной температуры, гасили 1 н HCl (889 мкл,,889 ммоль) до pH 4. Смесь экстрагировали DCM (3×10 мл), промывали насыщенным солевым раствором (3 мл). Органический слой сушили и концентрировали и остаток очищали с помощью флэш-хроматографии с получением соединения 74 в виде бесцветного масла (29,8 мг, 94% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 8,04 (д, J=8,0 Гц, 2H), 7,43 (д, J=8,4 Гц, 2H), 7,32-7,26 (м, 3H), 7,18 (д, J=7,2 Гц, 1H), 6,29 (д, J=4,8 Гц, 1H), 5,26 (т, J=7,2 Гц, 1H), 4,78 (д, J=14,8 Гц, 1H), 4,72 (д, J=14,8 Гц, 1H), 4,63 (дд, J=4,0, 4,4 Гц, 1H), 4,55 (с, 2H), 4,51 (дд, J=4,0, 4,4 Гц, 1H), 4,16-4,10 (м, 2H), 3,79-3,73 (м, 3H), 3,67 (т, J=4,0 Гц, 1H), 1,55 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=535.
Пример LXXV
Метил (S)-4-(1-(1-(3-(2-((метилсульфонил)окси)этокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (416)
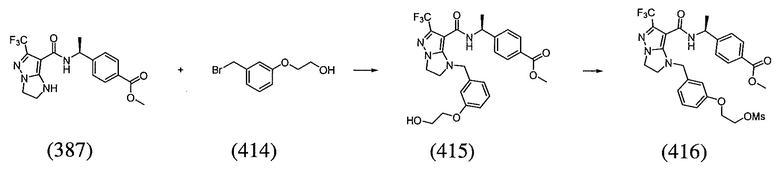
Метил (S)-4-(1-(1-(3-(2-гидроксиэтокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (415)
Следуя той же методике получения (S)-метил 4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (390), соединение (415) получали (128 мг, 92% выход) из метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и 2-(3-(бромметил)фенокси)этан-1-ола (414). LCMS (ES) (M+H)=533.
Метил (S)-4-(1-(1-(3-(2-((метилсульфонил)окси)этокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (416)
Следуя той же методике получения (метил (S)-4-(1-(1-(3-((2-((метилсульфонил)окси)этокси)метил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (413), соединение 416 получали (140 мг, 94% выход) из метил (S)-4-(1-(1-(3-(2-гидроксиэтокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (415). 1НЯМР (400 MГц, CDCl3): δ ppm 7,96 (д, J=8,4 Гц, 2H), 7,38 (д, J=8,0 Гц, 2H), 7,22 (т, J=8,4 Гц, 1H), 7,20-6,85 (м, 2H), 6,80 (дд, J=3,6, 8,0 Гц, 1H), 6,28 (д, J=4,8 Гц, 1H), 5,22 (т, J=7,2 Гц, 1H), 4,72 (д, J=14,8 Гц, 1H), 4,66 (д, J=14,8 Гц, 1H), 4,52 (дд, J=4,8, 6,0 Гц, 2H), 4,19-4,11 (м, 4H), 3,88 (с, 3H), 3,75 (т, J=8,8 Гц, 2H), 3,04 (с, 3H), 1,52 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=611.
(S)-4-(1-(1-(3-(2-фторэтокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 75)

Следуя той же методике получения (S)-4-(1-(1-(3-((2-фторэтокси)метил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 74), соединение 75 получали (30 мг, 88% выход) из метил (S)-4-(1-(1-(3-(2-((метилсульфонил)окси)этокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (416). 1НЯМР (400 MГц, CDCl3): δ ppm 8,03 (д, J=8,0 Гц, 2H), 7,41 (д, J=7,6 Гц, 2H), 7,23-7,20 (м, 1H), 6,85-6,82 (м, 3H), 6,28 (шир.с, 1H), 5,27 (т, J=7,2 Гц, 1H), 4,74 (д, J=12,4 Гц, 2H), 4,68 (д, J=12,0 Гц, 2H), 4,19-4,12 (м, 4H), 3,79-3,75 (м, 2 H), 1,54 (д, J=6,4 Гц, 3H). LCMS (ES) (M+H)=521.
Пример LXXVI
1-(3-иодбензил)-7-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол 1-оксид (417)

(S)-метил 4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (405) (10 мг,,017 ммоль) растворяли в уксусной кислоте (200 мкл) и смешивали с перборат натрия тетрагидратом (25,7 мг,,167 ммоль). Смесь перемешивали при 50°С в течение 2 ч прежде чем ее гасили раствором NaHCO3 (pH 7). Смесь экстрагировали DCM (3×10 мл), промывали насыщенным солевым раствором (5 мл), органический слой концентрировали и очищали при помощи флэш-хроматографии с получением соединения 417 в виде светло-желтого масла (6,5 мг, 64% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 10,8 (д, J=11,2 Гц, 1H), 8,00 (д, J=8,4 Гц, 2H), 7,78 (д, J=7,6 Гц, 1H), 7,66-7,55 (м, 2H), 7,42 (д, J=8,4 Гц, 1H), 7,13 (шир.с, 1H), 7,02 (т, J=8,0 Гц, 1H), 5,30-5,25 (м, 1H), 5,00-4,83 (м, 2H), 4,74-4,58 (м, 2H), 4,38-4,31 (м, 1H), 3,89 (с, 3H), 3,35-3,26 (м, 1H), 1,59 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=615.
7-(((S)-1-(4-карбоксифенил)этил)карбамоил)-1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол 1-оксид (Соединение 76)
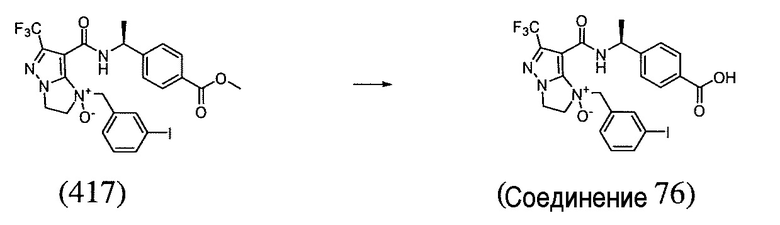
Следуя той же методике получения (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 64), соединение 76 получали (4,5 мг, 70,8% выход) из 1-(3-иодбензил)-7-(((S)-1-(4-(метоксикарбонил)фенил)этил)карбамоил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол 1-оксида (417). 1НЯМР (400 MГц, CDCl3): δ ppm 8,05 (д, J=8,4 Гц, 2H), 7,68 (шир.с, 2H), 7,44 (д, J=8,0 Гц, 2H), 7,26-7,23 (м, 1H), 7,07 (т, J=8,0 Гц, 1H), 6,57 (д, J=7,2 Гц, 1H), 5,37 (т, J=6,8 Гц, 1H), 4,88 (д, J=11,2 Гц, 1H), 4,84 (д, J=11,6 Гц, 1H), 4,23-4,19 (м, 2H), 3,99 (дд, J=7,2, 8,0 Гц, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+Na)=623.
Пример LXXVII
Бензил 3-(бензилокси)-5-(трифторметил)бензоат (419)
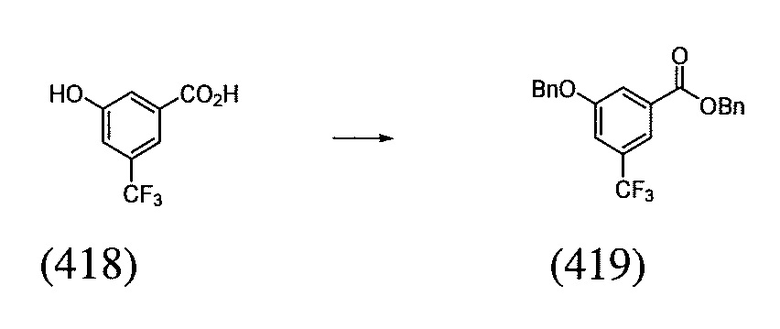
3-гидрокси-5-(трифторметил)бензойную кислоту (418) (0,5 г, 2,426 ммоль) растворяли в DMF (5,00 мл) и смешивали с бензил бромид (1,154 мл, 9,703 ммоль) и карбонатом цезия (7,90 г, 24,258 ммоль). Смесь перемешивали при 50°C в течение 4 ч. После завершения реакции, смесь охлаждали до комнатной температуры, гасили NH4Cl (10 мл), экстрагировали EtOAc (2×30 мл), промывали насыщенным солевым раствором (10 мл), органический слой концентрировали и очищали флэш-хроматографией с получением соединения 419 в виде белого твердого вещества (724 мг, 77% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,98 (шир.с, 1H), 7,86 (шир.с, 1H), 7,50-7,38 (м, 11H), 5,42 (с, 2H), 5,15 (с, 2H).
(3-(бензилокси)-5-(трифторметил)фенил)метанол (420)
Бензил 3-(бензилокси)-5-(трифторметил)бензоат (419) (0,72 г, 1,864 ммоль) растворяли в THF (14 мл) и охлаждали до 0°С в атмосфере N2. Медленно добавляли боргидрид лития (0,932 мл, 3,727 ммоль) и смесь затем перемешивали при комнатной температуре в течение 18 ч. После завершения реакции, смесь гасили добавлением по каплям NH4Cl (5 мл), смесь экстрагировали EtOAc (2×30 мл), промывали NaHCO3 (5 мл), насыщенным солевым раствором (5 мл), органический слой концентрировали и очищали при помощи флэш-хроматографии с получением соединения 420 в виде бесцветного масла (524 мг, количественный выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,45-7,34 (м, 5H), 7,22 (с, 1H), 7,17 (с, 1H), 7,14 (с, 1H), 5,09 (с, 2H), 4,70 (д, J=6,0 Гц, 2H), 1,82 (т, J=6,0 Гц, 1H). LCMS (ES) (M+Na)=306.
1-(бензилокси)-3-(бромметил)-5-(трифторметил)бензол (421)
(3-(бензилокси)-5-(трифторметил)фенил)метанол (420) (0,205 г,,726 ммоль) растворяли в DCM (4,10 мл) и смешивали с CBr4 (0,265 г,,799 ммоль). Добавляли Ph3P (0,210 г,,799 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 2 ч до завершения реакции. Смесь непосредственно загружали в колонку и очищали с помощью флэш-хроматографии с получением соединения 421 в виде бесцветного масла (155 мг, 61,8% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,45-7,31 (м, 5H), 7,22 (с, 1H), 7,18 (с, 1H), 7,16 (с, 1H), 5,10 (с, 2H), 4,46 (с, 2H).
Метил (S)-4-(1-(1-(3-(бензилокси)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (422)
Следуя той же методике получения (S)-метил 4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (390), соединение 422 получали (210 мг, 49,7% выход) из метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и 1-(бензилокси)-3-(бромметил)-5-(трифторметил)бензола (421). 1НЯМР (400 MГц, CDCl3): δ ppm 7,99-7,97 (м, 2H), 7,41-7,25 (м, 6H), 7,14 (с, 1H), 7,11 (с, 2H), 6,26 (шир.с, 1H), 5,22 (т, J=6,8 Гц, 1H), 5,20 (с, 2H), 4,83 (д, J=14,8 Гц, 1H), 4,75 (д, J=14,8 Гц, 1H), 4,74 (д, J=5,2 Гц, 1H), 4,16-4,12 (м, 2H), 3,90 (с, 3 H), 3,71 (т, J=8,0 Гц, 2H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=647.
Метил (S)-4-(1-(1-(3-гидрокси-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (423)
(S)-метил 4-(1-(1-(3-(бензилокси)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (422) (0,21 г,,325 ммоль) растворяли в MeOH (21,00 мл) и смешивали с 10% Pd/C (0,035 г,,032 ммоль) в атмосфере N2. Осуществлили H2 газообмен и полученную суспензию перемешивали при комнатной температуре в атмосфере H2 в течение 30 мин. После завершения реакции, смесь фильтровали через слой целита, промывали MeOH (3×2 мл). Фильтрат концентрировали и очищали с помощью флэш-хроматографии с получением соединения 423 в виде бесцветного масла (155 мг, 86% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,96 (д, J=8,4 Гц, 2H), 7,37 (д, J=8,0 Гц, 2H), 6,94 (с, 1H), 6,90 (с, 1H), 6,85 (с, 1H), 6,82 (с, 1H), 6,37 (д, J=4,0 Гц, 1H), 5,18 (т, J=7,2 Гц, 1H), 4,63-4,60 (м, 2H), 4,19-4,13 (м, 2H), 3,89 (с, 3H), 3,76-3,72 (м, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=557.
(S)-4-(1-(1-(3-гидрокси-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 77)
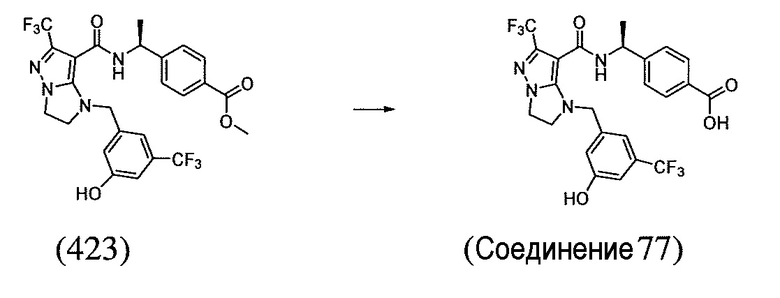
Следуя той же методике получения (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 64), соединение 77 получали (11 мг, 81% выход) из (S)-метил 4-(1-(1-(3-гидрокси-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (423). 1НЯМР (400 MГц, CDCl3): δ ppm 7,86 (д, J=4,0 Гц, 2H), 7,38 (д, J=4,0 Гц, 2H), 6,95 (с, 1H), 6,85 (с, 2H), 6,41 (шир.с, 1H), 5,17 (шир.с, 1H), 4,65 (д, J=12,0 Гц, 1H), 4,55 (д, J=12,0 Гц, 1H), 4,19-4,11 (м, 3H), 3,76 (шир.с, 2H), 1,54 (шир.с, 3H). LCMS (ES) (M+H)=543.
Пример LXXVIII
Метил (S)-4-(1-(1-((4-(бромметил)циклогексил)метил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (425)

Следуя той же методике получения (S)-метил 4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (390), соединение 425 получали (27,5 мг, 36,8% выход) из метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и 1,4-бис(бромметил)циклогексана (424). 1НЯМР (400 MГц, CDCl3): δ ppm 8,01 (д, J=8,4 Гц, 2H), 7,41 (д, J=8,4 Гц, 2H), 6,15 (д, J=5,6 Гц, 1H), 5,23 (д, J=7,2 Гц, 1H), 4,17 (т, J=8,4 Гц, 2H), 3,91 (с, 3H), 3,89-3,82 (м, 2H), 3,44 (дд, J=7,6, 13,6 Гц, 2H), 3,24 (дд, J=6,4, 12,4 Гц, 2H), 1,86-1,66 (м, 4H), 1,52 (с, 3H), 1,56-1,42 (м, 2H), 0,99-0,88 (м, 4H). LCMS (ES) (M+H)=571/573.
(S)-4-(1-(1-((4-(фторметил)циклогексил)метил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 78) и (S)-4-(1-(1-((4-метиленциклогексил)метил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 79)

Метил (S)-4-(1-(1-((4-(бромметил)циклогексил)метил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (425) (27 мг,,047 ммоль) смешивали с Cryptand 222 (89 мг,,236 ммоль) и KF (13,73 мг,,236 ммоль) в трет-амиловом спирте (1,4 мл) в маленьком флаконе. Полученную суспензию перемешивали при 120°C в течение 1,5 ч до полного расхода SM. К этой смеси добавляли 3 н раствор NaOH (162 мкл,,486 ммоль) и смесь продолжали перемешивать при 120°С в течение 5 мин до полного гидролиза сложного эфира. После завершения реакции, смесь охлаждали до комнатной температуры, гасили 1 н раствором HCl (709 мкл,,709 ммоль), экстрагировали EtOAc (2×10 мл), промывали насыщенным солевым раствором (5 мл). Органический слой сушили и концентрировали и остаток очищали с помощью препарат. ТСХ с получением (S)-4-(1-(1-((4-(фторметил)циклогексил)метил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 78) (10,5 мг, 44,7% выход) и (S)-4-(1-(1-((4-метиленциклогексил)метил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 79) (1,1 мг, 4,9% выход).
(S)-4-(1-(1-((4-(фторметил)циклогексил)метил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 78) LCMS (ES) (M+H)=497.
(S)-4-(1-(1-((4-метиленциклогексил)метил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 79) 1НЯМР (400 MГц, CDCl3): δ ppm 8,07 (д, J=8,0 Гц, 2H), 7,44 (д, J=8,0 Гц, 2H), 6,15 (д, J=5,2 Гц, 1H), 5,25 (т, J=7,2 Гц, 1H), 4,61 (с, 2H), 4,19 (т, J=8,4 Гц, 2H), 3,90 (т, J=8,8 Гц, 2H), 3,43 (дд, J=7,6, 13,6 Гц, 1H), 3,31 (дд, J=7,2, 13,6 Гц, 1H), 2,31-2,24 (м, 2H), 2,04-1,90 (м, 2H), 1,71-1,66 (м, 3H), 1,54 (д, J=7,2 Гц, 3H), 1,10-0,98 (м, 2H). LCMS (ES) (M+H)=477.
Пример LXXVIII
Трет-бутил (R)-(3-(бензилокси)-2-гидроксипропил)карбамат (429)

(R)-2-((бензилокси)метил)оксиран (428) (10 г, 60,901 ммоль) растворяли в 2-пропаноле (750 мл) и смешивали с гидроксидом аммония (750 мл, 19260,511 ммоль). Смесь перемешивали при комнатной температуре в течение ночи до завершения раскрытия эпоксидного цикла. Органический растворитель выпаривали при пониженном давлении, остаток (~15 мл) экстрагировали DCM (2×30 мл). Объединенный органический слой концентрировали с получением неочиенного вещества (11,9 г), который смешивали с Et3N (12,69 мл, 91,044 ммоль) в DCM (220 мл). Добавляли Boc2O (18,32 мл, 78,905 ммоль) при 0°С в атмосфере N2 и полученной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. После завершения реакции, реакцию гасили насыщ. водн. раствором NH4Cl (15 мл), экстрагировали DCM (100 мл). Органический слой промывали насыщенным солевым раствором (10 мл), сушили и концентрировали и остаток очищали с помощью флэш-хроматографии с получением соединения 429 в виде бесцветного масла (13,3 г, 78% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,29-7,20 (м, 5H), 5,12 (шир.с, 1H), 4,46 (с, 2H), 3,81 (шир.с, 1H), 3,42 (дд, J=4,0, 9,6 Гц, 1H), 3,35 (дд, J=4,0, 9,6 Гц, 1H), 3,37-3,32 (м, 1H), 3,29-3,25 (м, 1H), 3,09-3,03 (м, 1H), 1,37 (с, 9H). LCMS (ES) (M+Na)=304.
(R)-1-(бензилокси)-3-((трет-бутоксикарбонил)амино)пропан-2-ил 4-метилбензолсульфонат (430)

(R)-трет-бутил (3-(бензилокси)-2-гидроксипропил)карбамат (429) (5 г, 17,772 ммоль) смешивали с Et3N (12,39 мл, 88,858 ммоль) и DMAP (0,217 г, 1,777 ммоль) в DCM (100 мл) и охлаждали до 0°С. Добавляли п-толуолсульфонил хлорид (3,56 г, 18,66 ммоль) в атмосфере N2. Смесь перемешивали при комнатной температуре в течение 3 ч до завершения реакции. Реакцию гасили насыщ. водн. раствором NaHCO3 (10 мл), экстрагировали EtOAc (2×50 мл). Органический слой промывали водой (10 мл), насыщенным солевым раствором (10 мл), сушили и концентрировали и остаток очищали с помощью флэш-хроматографии с получением соединения 430 в виде белого твердого вещества (5,5 г, 71% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,78 (д, J=8,0 Гц, 2H), 7,34-7,26 (м, 5H), 7,21 (д, J=8,0 Гц, 2H), 4,79 (шир.с, 1H), 4,69 (шир.с, 1H), 4,41 (д, J=11,6 Гц, 1H), 4,37 (д, J=11,6 Гц, 1H), 3,54-3,31 (м, 4H), 3,42 (с, 3 H), 1,42 (с, 9H). LCMS (ES) (M+Na)=458.
1-(трет-бутил) 7-этил (S)-3-((бензилокси)метил)-6-бром-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-дикарбоксилат (432)
(R)-1-(бензилокси)-3-((трет-бутоксикарбонил)амино)пропан-2-ил 4-метилбензолсульфонат (430) (5,47 г, 12,553 ммоль) смешивали с этил 3,5-дибром-1H-пиразол-4-карбоксилатом (431) (3,4 г, 11,412 ммоль) в DMF (68,0 мл). Добавляли Cs2CO3 (4,46 г, 13,694 ммоль) и полученную суспензию перемешивали при 100°C в течение 2 ч до полного расхода (R)-1-(бензилокси)-3-((трет-бутоксикарбонил)амино)пропан-2-ил 4-метилбензолсульфоната (430). Неочищенное вещество охлаждали до комнатной температуры и фильтровали через небольшой участок хлопка, промывали DMF (3×1 мл). К фильтрату добавляли Cs2CO3 (4,46 г, 13,694 ммоль) и полученную смесь перемешивали при 120°С в течение 1 часа до полного превращения промежуточного продукта в желаемый продукт. Реакционную смесь затем охлаждали до комнатной температуры, гасили водой (10 мл), экстрагировали EtOAc (2×100 мл). Органический слой промывали водой (20 мл), насыщенным солевым раствором (20 мл), сушили и концентрировали и остаток очищали с помощью флэш-хроматографии с получением соединения 432 в виде бесцветного масла (1,9 г, 34,7% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,40-7,23 (м, 5H), 4,60-4,57 (м, 1H), 4,51 (с, 2H), 4,47 (д, J=10,8 Гц, 2H), 4,35 (д, J=7,2 Гц, 2H), 3,83 (д, J=10,0 Гц, 1H), 3,78 (д, J=10,0 Гц, 1H), 1,51 (с, 9H), 1,39 (т, J=7,2 Гц, 3H). LCMS (ES) (M+Na)=502/504.
Этил (S)-3-((бензилокси)метил)-6-бром-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (433)
(S)-1-трет-бутил 7-этил 3-((бензилокси)метил)-6-бром-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-дикарбоксилат (432) (1,9 г, 3,955 ммоль) растворяли в DCM (9,50 мл), и затем смешивали с TFA (6,09 мл, 79,109 ммоль). Смесь перемешивали при комнатной температуре в течение 10 мин. После завершения реакции, растворитель удаляли выпариванием и остаток разбавляли EtOAc (100 мл), промывали насыщ. водн. NaHCO3 (10 мл). Водный слой снова экстрагировали EtOAc (2×30 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили и концентрировали. Остаток очищали с помощью флэш-хроматографии с получением соединения 433 в виде бесцветного масла (1,15 г, 76% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,34-7,23 (м, 5H), 4,69 (м, 1H), 4,58-4,53 (м, 1H), 4,51 (с, 2H), 4,30-4,21 (м, 2H), 4,10 (т, J=9,6 Гц, 1H), 4,01 (дд, J=6,0, 9,2 Гц, 1H), 3,75 (дд, J=7,6, 10,0 Гц, 2H), 1,32 (т, J=6,8 Гц, 3H). LCMS (ES) (M+H)=380/382.
Этил (S)-3-((бензилокси)метил)-6-бром-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (435)
(S)-этил 3-((бензилокси)метил)-6-бром-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (433) (1,612 г, 4,239 ммоль) смешивали с 3-трифторметилбензил бромидом (434) (0,777 мл, 5,087 ммоль) в DMF (16 мл) и добавляли Cs2CO3 (4,14 г, 12,718 ммоль). Полученную суспензию перемешивали при 100°C в течение 30 мин до завершения реакции. Реакцию гасили насыщ. водн. раствором NH4Cl (10 мл), экстрагировали EtOAc (2×30 мл), промывали насыщенным солевым раствором (5 мл). Органический слой сушили и концентрировали и остаток очищали с помощью флэш-хроматографии с получением соединения 435 в виде бесцветного масла (2,22 г, 97% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,57-7,20 (м, 9H), 4,97 (д, J=15,6 Гц, 1H), 4,89 (д, J=15,2 Гц, 1H), 4,48 (с, 2H), 4,51-4,47 (м, 1H), 4,26 (дд, J=6,8, 14,4 Гц, 2H), 3,83 (т, J=10,0 Гц, 1H), 3,77-3,68 (м, 3H), 1,26 (т, J=6,8 Гц, 3H). LCMS (ES) (M+H)=538/540.
Этил (S)-3-((бензилокси)метил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (437)
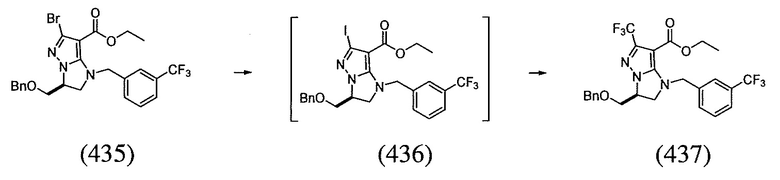
(S)-этил 3-((бензилокси)метил)-6-бром-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (435) (2,22 г, 4,124 ммоль) растворяли в 1,4-диоксане (44,4 мл), NaI (1,545 г, 10,309 ммоль), транс-1,2-бис(метиламино)циклогексан (0,130 мл, 0,825 ммоль) и CuI (0,314 г, 1,649 ммоль) добавляли в атмосфере N2. Смесь перемешивали при 100°C для иодирования бромидного субстрата. Через 3 ч, реакцию гасили водой (10 мл), экстрагировали EtOAc (3×50 мл). Объединенные органические слои промывали водой (10 мл), сушили над MgSO4 и концентрировали. Остаток очищали с помощью флэш-хроматографии с получением иодированного промежуточного соединения (436), который смешивали с CuI (0,696 г, 3,656 ммоль) в DMF (64,2 мл). Добавляли 2,6-лутидин (0,085 мл,,731 ммоль) с последующим добавлением метил фторсульфонилдифторацетата (0,931 мл, 7,312 ммоль). Полученную смесь затем перемешивали при 100°С в течение 1 ч, до полного потребления йодированного промежуточного соединения (436). Вещество охлаждали до комнатной температуры, гасили насыщ. водн. раствором NaHCO3 (20 мл), экстрагировали EtOAc (2×100 мл). Объединенные органические слои промывали водой (2×20 мл), насыщенным солевым раствором (20 мл), сушили над Na2SO4 и концентрировали. Остаток очищали с помощью флэш-хроматографии с получением соединения 437 в виде бесцветного масла (705 мг, 35% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,58-7,18 (м, 9H), 5,01 (д, J=15,2 Гц, 1H), 4,95 (д, J=15,2 Гц, 1H), 4,54 (шир.с, 1H), 4,49 (с, 2H), 4,26 (дд, J=7,2, 14,4 Гц, 2H), 3,90 (т, J=10,0 Гц, 1H), 3,81-3,76 (м, 2H), 3,70 (дд, J=3,6, 10,0 Гц, 1H), 1,29 (т, J=6,8 Гц, 3H). LCMS (ES) (M+H)=528.
Метил 4-((S)-1-((S)-3-((бензилокси)метил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (439)
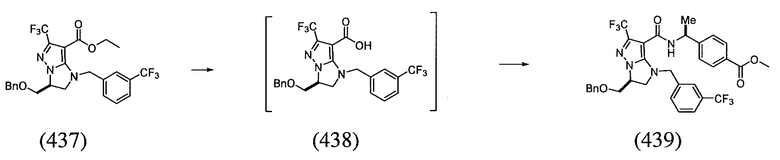
(S)-этил 3-((бензилокси)метил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (437) (0,705 г, 1,337 ммоль) растворяли в трет-амиловом спирте (3,53 мл) и MeOH (7,05 мл) и смешивали с 3 н раствором NaOH (4,46 мл, 13,366 ммоль). Полученный раствор перемешивали при 90°С в течение 1 часа до завершения гидролиза. Смесь охлаждали до комнатной температуры, гасили 10% HCl (4,87 мл, 16,039 ммоль) до pH < 4, экстрагировали EtOAc (2×50 мл). Объединенный органический слой промывали водой (5 мл), насыщенным солевым раствором (5 мл), сушили над Na2SO4 и концентрировали. Остаток очищали с помощью флэш-хроматографии с получением кислоты (438) (680 мг количественный выход). Кислоту (438) смешивали с (S)-метил 4-(1-аминоэтил)бензоатом (216) (0,313 г, 1,744 ммоль) в DMF (6,70 мл, 86,53 ммоль) и обрабатывали Et3N (0,748 мл, 5,366 ммоль) и HATU (0,765 г, 2,012 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи до завершения реакции. Реакцию затем гасили насыщ. водн. раствором NH4Cl (10 мл), экстрагировали EtOAc (2×50 мл). Объединенные органические слои промывали водой (10 мл), насыщенным солевым раствором (10 мл), сушили над Na2SO4 и концентрировали. Остаток очищали с помощью флэш-хроматографии с получением соединения 439 в виде белого твердого вещества (735 мг, 83% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,98 (д, J=8,4 Гц, 2H), 7,53 (д, J=5,6 Гц, 2H), 7,47-7,19 (м, 9H), 6,25 (д, J=4,8 Гц, 1H), 5,22 (т, J=6,8 Гц, 1H), 4,87 (д, J=14,8 Гц, 1H), 4,75 (д, J=15,6 Гц, 1H), 4,55-4,52 (м, 1H), 4,45 (с, 2H), 3,89 (с, 3H), 3,90-3,79 (м, 1H), 3,77-3,69 (м, 3H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=661.
4-((S)-1-((S)-3-((бензилокси)метил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 80)
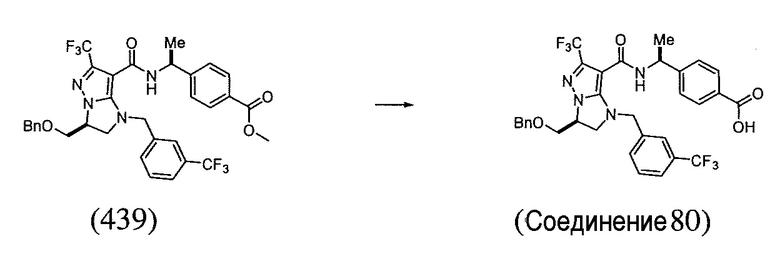
Следуя той же методике получения (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 64), соединение 80 получали (9,8 мг, 66,8% выход) из метил 4-((S)-1-((S)-3-((бензилокси)метил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (439). 1НЯМР (400 MГц, CDCl3): δ ppm 8,04 (д, J=8,4 Гц, 2H), 7,54-7,18 (м, 11H), 6,27 (д, J=4,0 Гц, 1H), 5,24 (т, J=6,8 Гц, 1H), 4,88 (д, J=14,8 Гц, 1H), 4,75 (д, J=14,8 Гц, 1H), 4,56-4,53 (м, 1H), 4,48 (с, 2H), 3,88 (т, J=10,0 Гц, 1H), 3,79-3,69 (м, 3H), 1,54 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=647.
Пример LXXIX
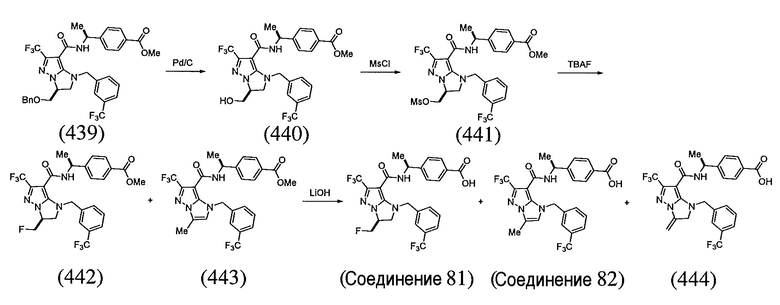
Метил 4-((S)-1-((S)-3-(гидроксиметил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (440): Раствор метил 4-((S)-1-((S)-3-((бензилокси)метил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (439) (16 мг, 24 мкмоль) в этилацетате (3 мл) обрабатывали 5% Pd-C (5,2 мг, 1,2 мкмоль) (Evonik E107 MA/W, 64% вода) и перемешивали под газообразным водородом (баллон) в течение 17 ч. Добавляли дополнительный Pd-C (10,4 мг, 2,4 мкмоль) и перемешивание продолжали в газообразном водороде еще 8 ч. Смесь фильтровали через слой целита и промывали этилацетатом. Фильтрат концентрировали в вакууме с получением соединения 440 (14 мг, количественный). 1H ЯМР (400 MГц, CDCl3): δ 7,98 (д, 2H), 7,4-7,6 (м, 4H), 7,30 (д, 2H), 6,27 (м, 1H), 5,21 (м, 1H), 4,96 (д, 1H), 4,66 (д, 1H), 4,50 (м, 1H), 4,04 (дд, 1H), 3,88 (с, 3H), 3,87 (дд, 1H), 3,76 (дд, 1H), 3,69 (дд, 1H), 1,52 (д, 3H). LCMS (ES) (M+H)=571.
Метил 4-((S)-1-((S)-3-(((метилсульфонил)окси)метил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (441): раствор метил 4-((S)-1-((S)-3-(гидроксиметил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (440) (14 мг, 25 мкмоль) в THF (1 мл) охлаждали до 0°C и обрабатывали MsCl (13 мкл, 172 мкмоль) и Et3N (68 мкл, 491 мкмоль). Смесь перемешивали при 0°C в течение 30 мин и гасили водой (1,4 мл). Смесь три раза экстрагировали этилацетатом (1,4 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме с получением соединения 441. Продукт использовали на следующей стадии без дополнительной очистки. 1H ЯМР (400 MГц, CDCl3): δ 7,96 (д, 2H), 7,4-7,6 (м, 4H), 7,36 (д, 2H), 6,28 (м, 1H), 5,20 (м, 1H), 4,90 (д, J=14,8 Гц, 1H), 4,76 (д, J=14,8 Гц, 1H), 4,69 (м, 1H), 4,49 (дд, J=4,0, 11,2 Гц, 1H), 4,40 (дд, J=4,0, 11,2 Гц, 1H), 3,96 (дд, J=9,6, 10,0 Гц, 1H), 3,87 (с, 3H), 3,72 (дд, J=6,4, 10,0 Гц, 1H), 2,93 (с, 3H), 1,51 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=649.
Метил 4-((S)-1-((S)-3-(фторметил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (442): вышеуказанный продукт (441) растворяли в трет-амиловом спирте (1 мл) и обрабатывали 1M TBAF в THF (74 мкл, 74 мкмоль). Смесь нагревали до 60°C в течение 30 мин и 80°C в течение 30 мин. Добавляли дополнительно 1 М TBAF в THF (49 мкл, 49 мкмоль) и перемешивание продолжали при 80°С еще 30 мин. После охлаждения до комнатной температуры, смесь обрабатывали водой (1,4 мл) и три раза экстрагировали MTBE (1,4 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме с получением соединения 442 в виде смеси с метил (S)-4-(1-(3-метил-6-(трифторметил)-1-(3-(трифторметил)бензил)-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоатом (443). 1H ЯМР (400 MГц, CDCl3): δ 7,98 (д, 2H), 7,4-7,6 (м, 4H), 7,37 (д, 2H), 6,28 (м, 1H), 5,22 (м, 1H), 4,95 (д, J=14,8 Гц, 1H), 4,82 (ддд, J=3,6, 10,4, 47,6 Гц, 1H), 4,72 (д, J=14,8 Гц, 1H), 4,60 (м, 1H), 4,55 (ддд, J=2,8, 10,4, 47,6 Гц, 1H), 3,95 (т, J=9,2 Гц, 1H), 3,90 (с, 3H), 3,76 (дд, J=5,6, 9,6 Гц, 1H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=573.
4-((S)-1-((S)-3-(фторметил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 81) и (S)-4-(1-(3-метил-6-(трифторметил)-1-(3-(трифторметил)бензил)-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 82): вышеуказанную смесь, содержаую соединения 442 и 443 растворяли в смеси THF (1 мл), метанола (1 мл) и воды (1 мл), обрабатывали LiOH-H2O (5,1 мг, 122 мкмоль), и перемешивали при комнатной температуре в течение 17 ч. Добавляли дополнительное количество LiOH-H2O (5,1 мг, 122 мкмоль) и перемешивание продолжали при комнатной температуре в течение еще 22 ч. Реакционную смесь подкисляли 1 н HCl (245 мкл, 245 мкмоль) и три раза экстрагировали этилацетатом (2,8 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме. Остаток очищали с помощью препар. ВЭЖХ с получением соединения 81 (4,1 мг, 30%) и смеси 2:1 (S)-4-(1-(3-метил-6-(трифторметил)-1-(3-(трифторметил)бензил)-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 82) и (S)-4-(1-(3-метилен-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (444) (2,4 мг, 18%).
Соединение 81: 1H ЯМР (400 MГц, CDCl3): δ 8,01 (д, 2H), 7,4-7,6 (м, 4H), 7,39 (д, 2H), 6,27 (м, 1H), 5,22 (м, 1H), 4,95 (д, J=14,8 Гц, 1H), 4,85 (ддд, J=3,6, 10,4, 47,2 Гц, 1H), 4,85 (ддд, J=2,8, 10,4, 47,2 Гц, 1H), 4,72 (д, J=14,8 Гц, 1H), 4,60 (м, 1H), 3,95 (т, J=10,0 Гц, 1H), 3,75 (дд, J=7,2, 10,0 Гц, 1H), 1,53 (д, J=6,4 Гц, 3H). LCMS (ES) (M+H)=559.
Смесь (S)-4-(1-(3-метил-6-(трифторметил)-1-(3-(трифторметил)бензил)-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 82) и (S)-4-(1-(3-метилен-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (444): 1H ЯМР (400 MГц, CDCl3): δ 8,04 (д, 2H), 7,41 (д, 2H), 7,3-7,6 (м, 4H), 6,59 (д, J=1,6 Гц, 0,7H), 6,39 (м, 0,7H), 6,29 (м, 0,3H), 5,66 (д, J=14,4 Гц, 0,7H), 5,58 (д, J=14,4 Гц, 0,7H), 5,23 (м, 1,3H), 4,94 (д, J=14,4 Гц, 0,3H), 4,88 (д, J=14,4 Гц, 0,3H), 4,59 (м, 0,3H), 4,39 (м, 0,6H), 1,54 (д, J=6,4 Гц, 2,1H). LCMS (ES) (M+H)=539.
Пример LXXX
4-((S)-1-((S)-3-(гидроксиметил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 83)

Следуя той же методике получения (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 64), соединение 83 получали (13,3 мг, 87% выход) из метил 4-((S)-1-((S)-3-(гидроксиметил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (440). 1НЯМР (400 MГц, CDCl3): δ ppm 8,03 (д, J=8,0 Гц, 2H), 7,54-7,39 (м, 6H), 6,30 (д, J=4,4 Гц, 1H), 5,23 (т, J=7,2 Гц, 1H), 4,98 (д, J=15,2 Гц, 1H), 4,68 (д, J=14,8 Гц, 1H), 4,53-4,50 (м, 1H), 4,06 (дд, J=3,6, 12,4 Гц, 1H), 3,89 (т, J=10,0 Гц, 1H), 3,78 (дд, J=4,0, 12,0 Гц, 1H), 3,70 (дд, J=7,2, 9,6 Гц, 1H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=557.
Пример LXXXI
(S)-4-(1-(1-(3-фтор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 84)
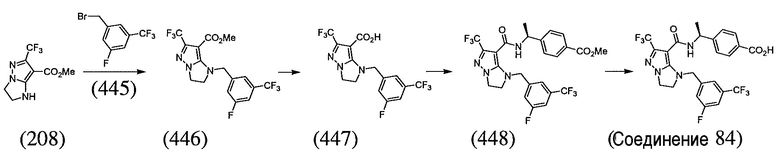
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) и 1-(хлорметил)-3-(трифторметил)бензола (214), описанных ранее, соединение 84 аналогичным образом получали из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) и 1-(бромметил)-3-фтор-5-(трифторметил)бензола (445).
Метил 1-(3-фтор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (446): 1НЯМР (400 МГц): δ ppm 7,40 (с, 1H), 7,30 (с, 1H), 7,28 (с, 1H), 5,00 (с, 2H), 4,23 (т, J=8,8 Гц, 2H), 3,83 (т, J=8,8 Гц, 2H), 3,81 (с, 3H). LCMS (ES) (M+H)=412.
1-(3-фтор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (447): LCMS (ES) (M+H)=398.
Метил (S)-4-(1-(1-(3-фтор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (448): 1НЯМР (400 МГц): δ ppm 7,99 (д, J=8,4 Гц, 2H), 7,38 (д, J=8,4 Гц, 2H), 7,34 (с, 1H), 7,26 (с, 1H), 7,24 (с, 1H), 6,29 (шир.с, 1H), 5,21 (м, 1H), 4,86 (д, J=15,3 Гц, 1H), 4,81 (д, J=15,0 Гц, 1H), 4,20 (т, J= 8,4 Гц, 2H), 3,90 (с, 3H), 3,79 (т, J=8,4 Гц, 2H), 1,53 (д, J=8,0 Гц, 3H). LCMS (ES) (M+H)=559.
(S)-4-(1-(1-(3-фтор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 84): 1НЯМР (400 MГц, CD3OD): δ ppm 7,83 (д, J=8,2 Гц, 2H), 7,44 (с, 1H), 7,37 (д, J=8,2 Гц, 2H), 7,33 (с, 1H), 7,30 (с, 1H), 5,12 (м, 1H), 4,44 (д, J=15,4 Гц, 1H), 4,34 (д, J=15,4 Гц, 1H), 4,22 (м, 2H), 3,79 (м, 2 H), 1,46 (д, J=7,0 Гц, 3H). LCMS (ES) (M+H)=545.
Пример LXXXII
(S)-4-(1-(1-(3-бром-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 85)
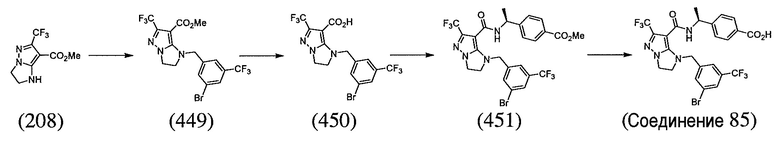
Следуя аналогичной методике получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) и 1-(хлорметил)-3-(трифторметил)бензола (214), описанных ранее, соединение 85 аналогичным образом получали из метил 6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (208) и 1-бром-3-(бромметил)-5-(трифторметил)бензола.
Метил 1-(3-бром-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (449): 1НЯМР (400 МГц): δ ppm 7,72 (с, 1H), 7,71 (с, 1H), 7,54 (с, 1H), 4,98 (с, 2H), 4,24 (дд, J=8,2 и 9,0 Гц, 2H), 3,82 (дд, J=8,2 и 9,0 Гц, 2H), 3,81 (с, 3H). LCMS (ES) (M+H)=472/474.
1-(3-бром-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (450): 1НЯМР (400 МГц): δ ppm 7,71 (с, 1H), 7,68 (с, 1H), 7,52 (с, 1H), 4,95 (с, 2H), 4,24 (дд, J=8,2 и 9,0 Гц, 2H), 3,83 (дд, J=8,2 и 9,0 Гц, 2H). LCMS (ES) (M+H)=458/460.
Метил (S)-4-(1-(1-(3-бром-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (451): 1НЯМР (400 МГц): δ ppm 8,00 (д, J=8,4 Гц, 2H), 7,69 (с, 1), 7,67 (с, 1H), 7,49 (с, 1H), 7,38 (д, J=8,4 Гц, 2H), 6,29 (шир.с, 1H), 5,21 (м, 1H), 4,90 (д, J=15,0 Гц, 1H), 4,78 (д, J=15,0 Гц, 1H), 4,21 (дд, J= 8,3 и 8,6 Гц, 2H), 3,90 (с, 3H), 3,78 (дд, J=8,3 и 8,6 Гц, 2H), 1,53 (д, J=8,0 Гц, 3H). LCMS (ES) (M+H)=619/621.
(S)-4-(1-(1-(3-бром-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 85): 1НЯМР (400 MГц, CD3OD): δ ppm 7,82 (д, J=8,4 Гц, 2H), 7,73 (с, 2H), 7,58 (с, 1H), 7,37 (д, J=8,4 Гц, 2H), 5,11 (м, 1H), 4,42 (д, J=15,6 Гц, 1H), 4,32 (д, J=15,6 Гц, 1H), 4,22 (м, 2H), 3,80 (м, 2 H), 1,46 (д, J=7,0 Гц, 3H). LCMS (ES) (M+H)=605/607.
Пример LXXXIII
Метил (S)-4-(1-(1-(4-(бензилокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (452)
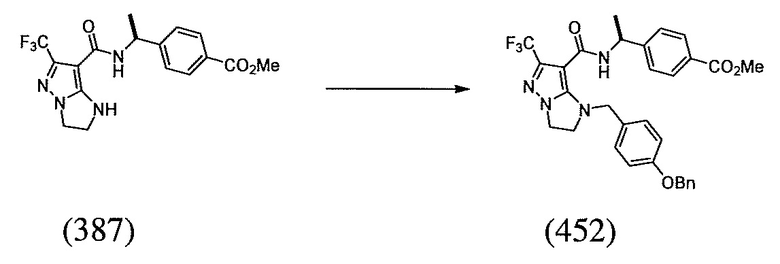
К раствору метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) (82,0 мг, 0,214 ммоль) и 1-(бензилокси)-4-(бромметил)-бензола (71,3 мг, 0,257 ммоль) в DMF (0,83 мл) добавляли карбонат цезия (210 мг, 0,643 ммоль) и суспензию перемешивали при комнатной температуре в течение 3,0 ч. Анализ LCMS показал только желательный пик [M+H]=579,3. Реакционную смесь концентрировали в вакууме для удаления органических растворителей. Белое твердое вещество очищали с помощью хроматографии на силикагеле (10%-70% E/H и затем 70% изократический E/H) с получением соединения 452 в виде белого твердого вещества (86,6 мг, 70% выход). 1НЯМР (400 МГц): δ ppm 8,00 (д, J=8,2 Гц, 2H), 7,43-7,32 (м, 7H), 7,14 (д, J=8,6 Гц, 2H), 6,88 (д, J=8,6 Гц, 2H), 6,25 (шир.м, 1H), 5,26 (дкв, J=7,0 Гц, 1H), 5,03 (с, 2H), 4,66 (дд, J=14,5, 14,5 Гц, 2H), 4,10 (дд, J=8,2, 8,2 Гц, 2H), 3,83 (с, 3H), 3,74 (дд, J=8,6, 8,6 Гц, 2H), 1,54 (д, J=7,0 Гц, 3H). LCMS (ES) (M+H)=579,3.
Метил (S)-4-(1-(1-(4-гидроксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (453)
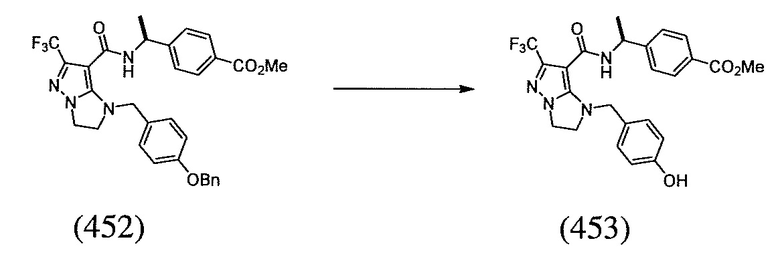
Метил (S)-4-(1-(1-(4-(бензилокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (452) (800 мг, 1,38 ммоль) растворяли в EtOAc (18 мл) и метаноле (15 мл), добавляли 10% Pd/углерод в атмосфере N2. Затем газообразный H2 продували в течение 15 мин и смесь перемешивали в атмосфере H2 в течение 3,0 ч. Анализ LCMS показал только желательный пик [M+H]=489,3. Реакционную смесь фильтровали через целит и элюировали EtOAc и концентрировали для удаления органических растворителей. Белое твердое вещество очищали с помощью хроматографии на силикагеле (20%-80% E/H и затем 80% изократический E/H) с получением желаемого продукта (453) в виде белого твердого вещества (500 мг, 74% выход). 1НЯМР (400 МГц): δ ppm 7,98 (д, J=8,4 Гц, 2H), 7,39 (д, J=8,0 Гц, 2H), 7,00 (д, J=8,4 Гц, 2H), 6,67 (д, J=8,4 Гц, 2H), 6,30 (шир.м, 1H), 5,23 (дкв, J=6,8, 6,8 Гц, 1H), 4,65 (д, J=14,8 Гц, 1H), 4,50 (д, J=14,8 Гц, 1H), 4,10 (дд, J=8,8, 8,8 Гц, 2H), 3,89 (с, 3H), 3,72 (дд, J=9,2, 7,6 Гц, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=489,36.
(S)-4-(1-(1-(4-гидроксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 86)
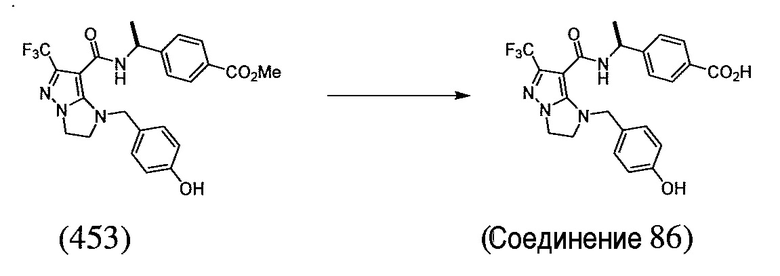
Следуя той же методике получения (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 64), используя реагент, показанный на схеме выше, соединение 86 получали (22,0 мг, 60% выход) из метил (S)-4-(1-(1-(4-гидроксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (453). 1НЯМР (400 МГц): δ ppm 8,02 (д, J=8,0 Гц, 2H), 7,42 (д, J=8,4 Гц, 2H), 7,04 (д, J=8,8 Гц, 2H), 6,70 (д, J=8,4 Гц, 2H), 6,28 (шир.м, 1H), 5,25 (дкв, J=8,8, 8,8 Гц, 1H), 4,71 (д, J=14,4 Гц, 1H), 4,52 (д, J=14,4 Гц, 1H), 4,12 (дд, J=8,8, 8,8 Гц, 2H), 3,75 (прибл. дт, J=7,6, 1,6 Гц, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=475,3.
Пример LXXXIV
Метил (R)-4-(2-гидрокси-1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (455)
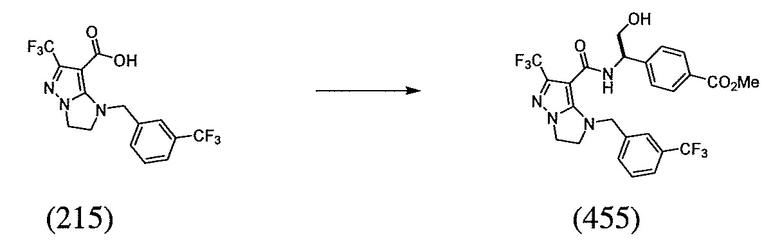
Следуя той же методике получения метил (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (217) с использованием реагента, показанного выше, соединение 455 получали в виде белого твердого вещества (57,0 мг, 86% выход) из 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (215). 1НЯМР (400 МГц): δ ppm 8,01 (д, J=8,4 Гц, 2H), 7,56-7,39 (м, 6H), 6,86 (шир.м, 1H), 5,24-5,20 (шир.м, 1H), 4,84 (с, 2H), 4,19 (дд, J=8,4, 8,4 Гц, 2H), 3,99-3,90 (м, 2H), 3,90 (с, 3H), 3,77 (дд, J=8,4, 8,4 Гц, 2H). LCMS (ES) (M+H)=557,3.
(R)-4-(2-гидрокси-1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 87)

Следуя той же методике получения (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 64) с использованием реагента, показанного выше, соединение 87 получали в виде белого твердого вещества (11,5 мг, 37% выход) из метил (R)-4-(2-гидрокси-1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (455). 1НЯМР (400 МГц): δ ppm 8,05 (д, J=8,4 Гц, 2H), 7,56-7,42 (м, 6H), 6,90 (шир.м, 1H), 5,26-5,22 (шир.м, 1H), 4,84 (с, 2H), 4,18 (дд, J=8,0, 8,0 Гц, 2H), 3,95 (ддд, J=26,8, 11,1, 4,0 Гц, 2H), 3,77 (дд, J=8,8, 8,8 Гц, 2H). LCMS (ES) (M+H)=543,3.
Пример LXXXV
Метил (S)-4-(1-(1-(4-(диметиламино)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (456)
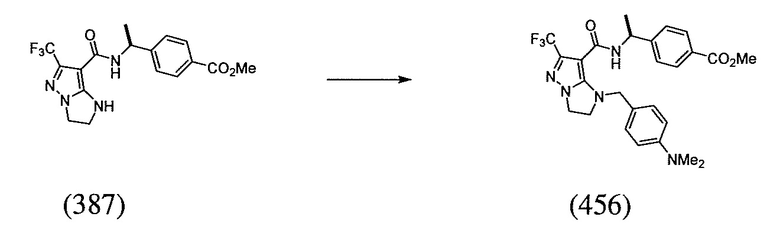
Следуя той же методике получения метил (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (217) с использованием реагента, показанного выше, соединение 456 получали в виде белого твердого вещества (103,0 мг, 76% выход) из метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387). 1НЯМР (400 МГц): δ ppm 8,00 (д, J=8,4 Гц, 2H), 7,42 (д, J=8,4 Гц, 2H), 7,0 (шир.м, 2H), 6,62 (шир.м, 2H), 6,26 (шир.м, 1H), 5,28 (дкв, J=8,8 Гц, 1H), 4,66 (д, J=13,6 Гц, 1H), 5,55 (д, J=15,2 Гц, 1H), 4,09 (дд, J=8,0, 8,0 Гц, 2H), 3,89 (с, 3H), 3,75 (дд, J=8,8, 8,8 Гц, 2H), 2,93 (с, 6H), 1,55 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=516,1.
(S)-4-(1-(1-(4-(диметиламино)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 88)
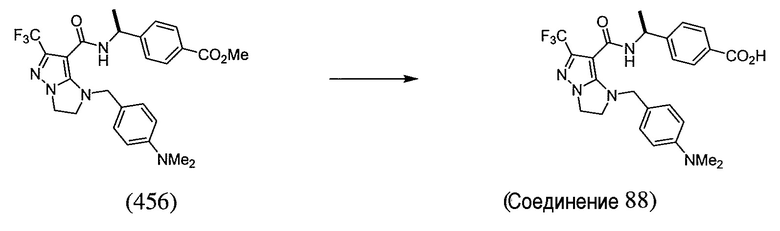
Следуя той же методике получения (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 64) с использованием реагента, показанного выше, (Соединение 88) получали в виде белого твердого вещества (15,0 мг, 38% выход) из метил (S)-4-(1-(1-(4-(диметиламино)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (456). 1НЯМР (400 МГц): δ ppm 8,06 (д, J=8,0 Гц, 2H), 7,45 (д, J=8,0 Гц, 2H), 7,06 (д, J=14,4 Гц, 1H), 6,65 (шир.д, J=7,2 Гц, 2H), 6,26 (шир.м, 1H), 5,29 (дкв, J=6,8 Гц, 1H), 4,66 (д, J=14,4 Гц, 1H), 4,52 (д, J=14,4 Гц, 1H), 4,09 (дд, J=8,4, 8,4 Гц, 2H), 3,76 (прибл. дт, J=7,6, 1,2 Гц, 2H), 2,93 (с, 6H), 1,55 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=502,7.
Пример LXXXVI
Метил (S)-4-(1-(1-(3-(диметиламино)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (457)

Следуя той же методике получения (S)-метил 4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (390) с использованием реагента, показанного выше, соединение 457 получали в виде белого твердого вещества (103,0 мг, 76% выход) из метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387). 1НЯМР (400 МГц): δ ppm 7,97 (д, J=8,0 Гц, 2H), 7,38 (д, J=8,4 Гц, 2H), 7,15 (дд, J=8,4, 8,4 Гц, 1H), 6,65-6,55 (м, 3H), 6,23 (шир.м, 1H), 5,25 (дкв, J=8,8 Гц, 1H), 4,68 (с, 2H), 4,11 (дд, J=8,8, 8,8 Гц, 2H), 3,90 (с, 6H), 3,79 (дд, J=8,8, 8,8 Гц, 2H), 2,89 (с, 3H), 1,52 (д, J=6,8 Гц, 3H). LCMS (ES) (M+2H)=517,6.
(S)-4-(1-(1-(3-(диметиламино)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 89)
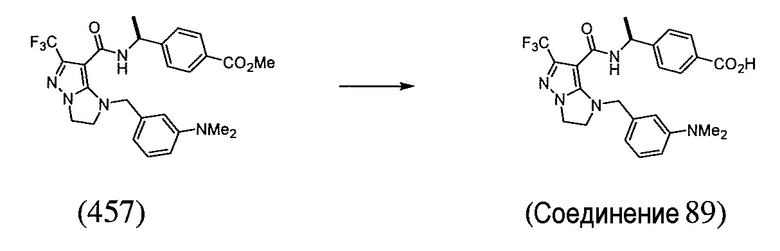
Следуя той же методике получения (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 64) с использованием реагента, показанного выше, соединение 89 получали в виде белого твердого вещества (20,0 мг, 56% выход) из метил (S)-4-(1-(1-(3-(диметиламино)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (457). 1НЯМР (400 МГц): δ ppm 8,02 (д, J=8,4 Гц, 2H), 7,40 (д, J=8,0 Гц, 2H), 7,17 (дд, J=7,6, 7,6 Гц, 1H), 6,65 (шир.м, 3H), 6,25 (шир.м, 1H), 5,26 (дкв, J=7,2 Гц, 1H), 4,68 (дд, J=14,8, 14,8 Гц, 2H), 4,11 (дд, J=8,8, 8,8 Гц, 2H), 3,79 (дд, J=9,2, 9,2 Гц, 2H), 2,90 (с, 6H), 1,53 (д, J=7,2 Гц, 3H). LCMS (ES) (M+2H)=503,4.
Пример LXXXVII
Метил (S)-4-(1-(1-(3-(диметиламино)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (458)

Следуя той же методике получения (S)-метил 4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (390) с использованием реагента, показанного выше, соединение 458 получали в виде белого твердого вещества (20,5 мг, 84% выход) из метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387). 1НЯМР (400 МГц): δ ppm 7,97 (д, J=8,0 Гц, 2H), 7,38 (д, J=8,4 Гц, 2H), 6,81-6,76 (м, 3H), 6,25 (шир.м, 1H), 5,23 (дкв, J=7,2 Гц, 1H), 4,73 (дд, J=14,8, 14,8 Гц, 2H), 4,15 (дд, J=8,4, 8,4 Гц, 2H), 3,90 (с, 3H), 3,77 (дд, J=8,8, 8,8 Гц, 2H), 2,93 (с, 6H), 1,52 (д, J=6,8 Гц, 3H). LCMS (ES) (M+2H)=585,6.
(S)-4-(1-(1-(3-(диметиламино)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 90)
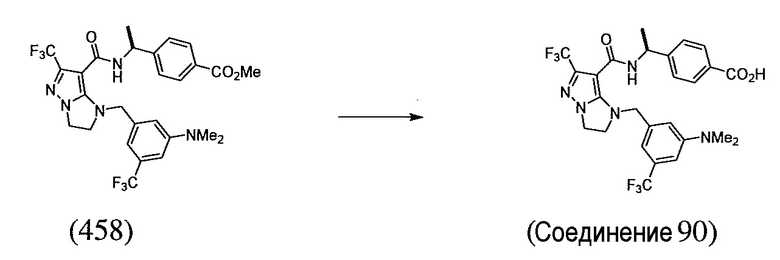
Следуя той же методике получения (S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 64) с использованием реагента, показанного выше, (Соединение 90) получали в виде белого твердого вещества (30,0 мг, 58% выход) из метил (S)-4-(1-(1-(3-(диметиламино)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (458). 1НЯМР (400 МГц): δ ppm 8,03 (д, J=8,0 Гц, 2H), 7,40 (д, J=8,0 Гц, 2H), 6,84-6,82 (м, 3H), 6,28 (шир.м, 1H), 5,24 (дкв, J=6,8 Гц, 1H), 4,74 (с, 3H), 4,16 (дд, J=8,4, 8,4 Гц, 2H), 3,78 (дд, J=8,8, 8,8 Гц, 2H), 2,94 (с, 6H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+2H)=571,4.
Пример LXXXVIII
Промежуточные соединения, используемые в примерах LXXXIX-XCII, ниже
1-трет-бутил 7-этил 6-бром-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-дикарбоксилат
Раствор этил 3,5-дибром-1H-пиразол-4-карбоксилата (431) (10,0 г, 33,6 ммоль) и трет-бутил (2-бромэтил)карбамата (9,78 г, 43,6 ммоль) в DMF (150 мл) при комнатной температуре обрабатывали Cs2CO3 (13,1 г, 40,3 ммоль, порошок) при 80°C в течение 1,5 ч; После охлаждения до комнатной температуры, неорганическую соль фильтровали через песок (предварительно промывали ацетонитрилом) в атмосфере N2. Осадок промывали сухим DMF (5 мл). Затем, фильтрат обрабатывали Cs2CO3 (13,1 г, 40,3 ммоль), и выдерживали в течение 2 часов при 120°C. После охлаждения до комнатной температуры, полученные реакционные смеси разбавляли этилацетатом (250 мл) и водой (200 мл). После фазового разделения, водный слой снова экстрагировали этилацетатом (150 мл). Объединенные органические слои промывали последовательно водой (150 мл), насыщ. водным раствором хлорида аммония (200 мл) и насыщенным солевым раствором (200 мл). После разделения фаз, органическую фазу сушили (MgSO4), фильтровали и концентрировали. Масляный бесцветный остаток очищали с помощью хроматографии на Biotage (н-Гептан-EtOAc) с получением желаемого продукта в виде твердого вещества (8,6 г, 71% выход). Очищенный продукт (459) затвердевал в виде твердого вещества (при стоянии). 1H ЯМР (400 MГц, CDCl3): δ ppm 4,33 (дд, J=9,7, 7,8 Гц, 2H), 4,20 (кв, J=7,1 Гц, 2H), 4,15 (дд, J=8,9, 7,8 Гц, 2H), 1,24 (т, J=7,1 Гц, 3H). LCMS (ES) (M+H)=359,99.
Этил 6-бром-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (460)
К раствору 1-(трет-бутил) 7-этил 6-бром-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-дикарбоксилата (459) (1,60 г, 4,44 ммоль) в DCM (32 мл) добавляли трифторуксусную кислоту (6,40 мл) при температуре окружающей среды. После перемешивания при температуре окружающей среды в течение 3 ч, анализ LCMS показал завершение реакции. Реакционный раствор концентрировали. Твердый остаток смешивали с EtOAc (100 мл) и насыщ. раствором NaHCO3 (80 мл). Слои разделяли. Водный слой снова экстрагировали EtOAc (80 мл). Объединенные органические слои сушили над MgSO4. Высушенный раствор фильтровали и концентрировали с получением желаемого продукта (460) (1,12 г, 97%), который использовали на следующей стадии без дополнительной очистки. LCMS (ES) (M+H)=260,2.
Этил 6-бром-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (461)
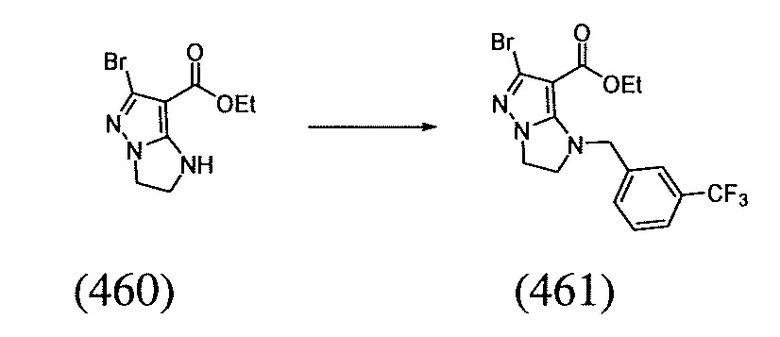
К смеси этил 6-бром-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (460) (1,11 г, 4,27 ммоль) и 1-(бромметил)-3-(трифторметил)бензола (0,78 мл, 5,12 ммоль) в DMF (11 мл) добавляли карбонат цезия (4,17 г, 12,80 ммоль) при температуре окружающей среды. Реакционную колбу нагревали на масляной бане при 100°C. Через 1 ч, добавляли дополнительное количество 1-(бромметил)-3-(трифторметил)бензола (0,10 мл, 0,66 ммоль). Через 20 минут нагревательную ванну удаляли и реакционной смеси давали охладиться до 23°C. Смесь разбавляли насыщ. NaHCO3 (20 мл) и разделяли между водой (20 мл) и MTBE/EtOAc (25 мл/35 мл). Водный слой снова экстрагировали MTBE/EtOAc (25 мл/15 мл). Объединенные органические слои промывали 18% водным раствором NaCl (30 мл). Промытый раствор концентрировали. Остаток очищали с помощью хроматографии на силикагеле (5%-30% EtOAc в гептане и затем 30% изократический) с получением желаемого продукта (461) в виде белого твердого вещества (1,46 г, 82% выход). LCMS (ES) (M+H)=418,2.
Этил 1-(3-(трифторметил)бензил)-6-винил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилат (462)
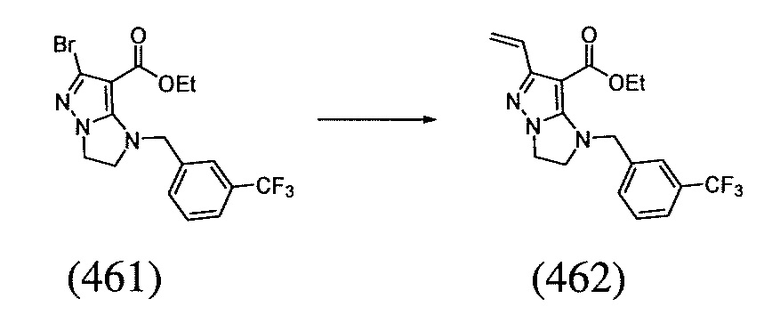
Реакционную колбу, содержащую раствор этил 6-бром-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (461) (1,46 г, 3,49 ммоль) в толуоле (36,5 мл) откачивали под вакуумом и заполняли азотом (два раза). При температуре окружающей среды, добавляли Pd(PPh3)4 (0,24 г, 0,21 ммоль) и трибутил(винил)олово (1,22 мл, 4,19 ммоль). Полученную смесь перемешивали на масляной бане 100°C. После перемешивания в течение 17 ч, добавляли дополнительный Pd(PPh3)4 (0,24 г, 0,21 ммоль) и трибутил(винил)олово (1,22 мл, 4,19 ммоль). Через еще 17 ч нагревательную баню удаляли и реакционной смеси давали охладиться до 23°С. Объем реакционной смеси уменьшали до примерно 3 мл с помощью концентрирования. Остаток очищали с помощью хроматографии на силикагеле (5%-30% EtOAc в гептане и затем 30% изократический) с получением желаемого продукта (462) в виде белого твердого вещества (891 мг, 70% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,57 (с, 1H), 7,55-7,51 (м, 2H), 7,45 (дд, J=8,0, 8,0 Гц, 1H), 7,14 (дд, J=18, 11 Гц, 1H), 5,97 (дд, J=18, 2,4 Гц, 1H), 5,28 (дд, J=11, 2,0 Гц, 1H), 4,93 (с, 2H), 4,24 (кв, J=7,6 Гц, 2H), 4,11 (т, J=7,6 Гц, 2H), 3,70 (т, J=8,0 Гц, 2H), 1,26 (т, J=7,6 Гц, 3H). LCMS (ES) (M+H)=366,3.
1-(3-(Трифторметил)бензил)-6-винил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота
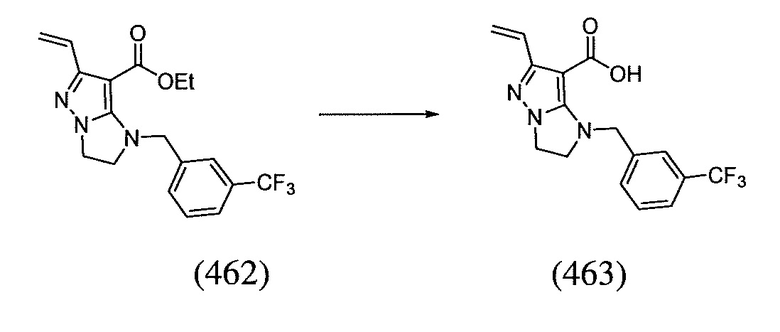
К раствору этил 1-(3-(трифторметил)бензил)-6-винил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксилата (462) (880 мг, 2,41 ммоль) в метаноле (5,3 мл) и THF (5,3 мл) при температуре окружающей среды добавляли раствор моногидрата гидроксида лития (505 мг, 12,0 ммоль) в воде (5,3 мл). Реакционную смесь перемешивали в масляной бане с температурой 60°C. Через 3 ч, добавляли дополнительное количество раствора моногидрата гидроксида лития (250 мг, 6,0 ммоль) в воде (2,5 мл). Через еще 17 ч нагревательную баню удаляли и реакционной смеси давали охладиться до 23°C. Смесь разбавляли водой (30 мл) и подкисляли 1 н HCl (25 мл). Подкисленный раствор экстрагировали EtOAc (2×100 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали с получением неочищенного целевого продукта (463) в виде белого твердого вещества (815 мг, 99% выход), который использовали на следующей стадии без дополнительной очистки. 1H ЯМР (400 MГц, DMSO-d6): δ ppm 12,2 (шир.с, 1H), 7,69 (с, 1H), 7,66-7,57 (м, 3H), 7,09 (дд, J=18, 11 Гц, 1H), 5,81 (дд, J=18, 2,4 Гц, 1H), 5,17 (дд, J=11, 2,4 Гц, 1H), 4,92 (с, 2H), 4,07 (т, J=8,0 Гц, 2H), 3,72 (т, J=8,0 Гц, 2H). LCMS (ES) (M+H)=339,2.
Метил (S)-4-(1-(1-(3-(трифторметил)бензил)-6-винил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (465)
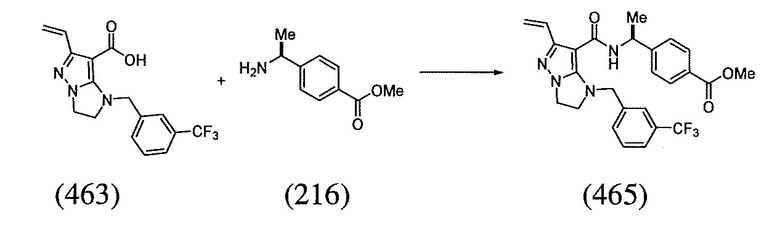
К суспензии 1-(3-(трифторметил)бензил)-6-винил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (463) (412 мг, 1,22 ммоль) и (S)-метил 4-(1-аминоэтил)бензоата (216) (443 мг, 2,47 ммоль) в DCM (12 мл) добавляли TEA (0,68 мл, 4,87 ммоль) и HATU (604 мг, 1,59 ммоль). Готовую смесь перемешивали при температуре окружающей среды в течение ночи. Через 16 ч, реакцию гасили добавлением воды (4 мл). Реакционную смесь разделяли между 10% водным раствором NaCl (70 мл) и EtOAc (100 мл). Органический слой концентрировали. Остаток очищали с помощью хроматографии на силикагеле (30%-70% EtOAc/гептан и затем 70% изократический) с получением желаемого продукта (465) в виде белого твердого вещества (495 мг, 81% выход). 1H ЯМР (400 MГц, CDCl3): δ ppm 7,96 (д, J=8,4 Гц, 2H), 7,52-7,37 (м, 4H), 7,35 (д, J=8,0 Гц, 2H), 6,73 (дд, J=18, 12 Гц, 1H), 5,96 (шир.д, J=8,0 Гц, 1H), 5,88 (дд, J=18, 1,6 Гц, 1H), 5,43 (дд, J=11, 1,6 Гц, 1H), 5,25 (дкв, J=7,2, 7,2 Гц, 1H), 4,85 (д, J=14,8 Гц, 1H), 4,81 (д, J=14,8 Гц, 1H), 4,09 (дд, J=8,8, 8,8 Гц, 2H), 3,88 (с, 3H), 3,66 (дд, J=8,8, 8,8 Гц, 2H), 1,51 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=500,3.
Метил (S)-4-(1-(6-формил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (466)
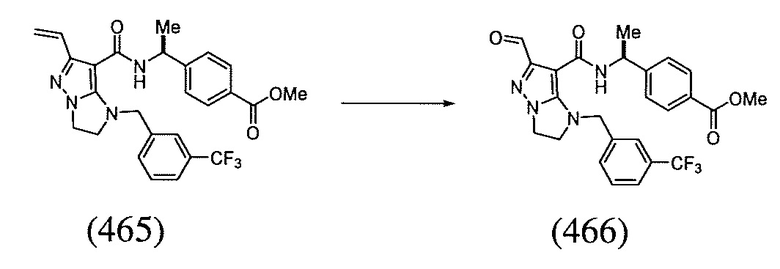
К раствору метил (S)-4-(1-(1-(3-(трифторметил)бензил)-6-винил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (465) (250 мг, 0,50 ммоль) в THF (3,8 мл) и воды (3,8 мл) добавляли 4% мас. водный раствор тетраоксида осмия(48 мкл, 7,52 мкмоль) при температуре окружающей среды. После перемешивания в течение 15 минут, добавляли перйодат натрия (215 мг, 1,00 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Через 16 ч, реакционную смесь разделяли между водой (40 мл) и EtOAc (50 мл). Водный слой снова экстрагировали EtOAc (50 мл). Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали с получением неочищенного целевого продукта (466) в виде темного масла (251 мг, 99% выход), который использовали на следующей стадии без дополнительной очистки. 1H ЯМР (400 MГц, CDCl3): δ ppm 9,85 (шир.д, J=7,2 Гц, 1H), 9,69 (с, 1H), 7,98 (д, J=8,0 Гц, 2H), 7,54-7,39 (м, 4H), 7,44 (д, J=8,0 Гц, 2H), 5,24 (д, J=14,4 Гц, 1H), 5,22 (м, 1H), 5,09 (д, J=15 Гц, 1H), 4,24 (дд, J=8,4, 8,4 Гц, 2H), 3,88 (с, 3H), 3,80 (дд, J=8,4, 8,4 Гц, 2H), 1,56 (д, J=7,0 Гц, 3H). LCMS (ES) (M+H)=501,3.
Метил (S)-4-(1-(6-(гидроксиметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (467)
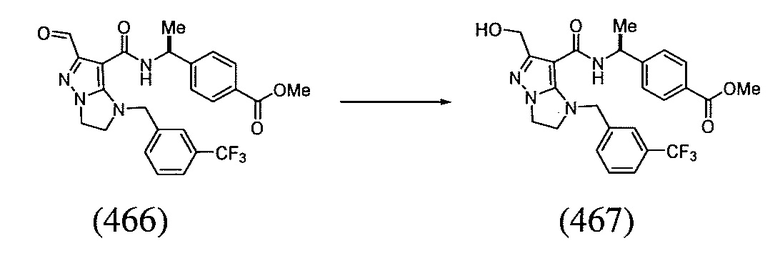
К раствору метил (S)-4-(1-(6-формил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (466) (83 мг, 0,17 ммоль) в MeOH (2,5 мл) добавляли боргидрид натрия (12,6 мг, 0,33 ммоль) при -5°C. После перемешивания при этой температуре в течение 2 ч, реакция была завершена (контролировали с помощью TLC) и реакцию гасили добавлением 6% масс. водный раствор лимонной кислоты. Погашенную смесь разделяли между 18% масс. водным раствором NaC (20 мл) и EtOAc (30 мл). Водный слой снова экстрагировали EtOAc (30 мл). Объединенные органические слои концентрировали. Остаток очищали с помощью хроматографии на силикагеле (30%-70% EtOAc/гептан и затем 70% изократический) с получением желаемого продукта (467) в виде масла (81 мг, 97% выход). 1H ЯМР (400 MГц, CDCl3): δ ppm 8,22 (шир.д, J=8,0 Гц, 1H), 7,97 (д, J=8,4 Гц, 2H), 7,55-7,48 (м, 3H), 7,43-7,39 (м, 2H), 5,25 (дкв, J=7,2, 7,2 Гц, 1H), 4,96 (дд, J=14,8, 14,8 Гц, 1H), 4,92 (дд, J=14,8, 14,8 Гц, 1H), 4,70 (д, J=16 Гц, 1H), 4,67 (д, J=16 Гц, 1H), 4,05 (дд, J=8,0, 8,0 Гц, 2H), 3,89 (с, 3H), 3,67 (дд, J=8,4, 8,4 Гц, 2H), 1,51 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=503,2.
Пример LXXXIX
Метил (S)-4-(1-(6-(фторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (468)
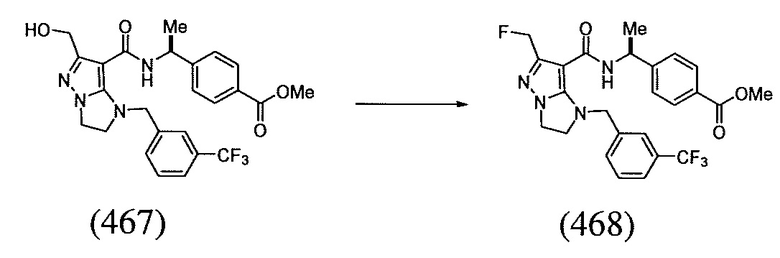
К смеси метил (S)-4-(1-(6-(гидроксиметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (467) (17 мг, 0,034 ммоль) в толуоле (0,6 мл) добавляли 2-пиридинсульфонил фторид (PyFluor) (7,1 мг, 0,044 ммоль) и 7-метил-1,5,7-триазабицикло[4.4.0]дец-5-ен (MTBD) (7,29 мкл, 0,051 ммоль) при температуре окружающей среды. После перемешивания в течение 3 ч, реакция была завершена (контролировали с помощью LCMS) и реакцию гасили добавлением MeOH (0,3 мл). Погашенную смесь разделяли между водой (15 мл) и EtOAc (20 мл). Водный слой снова экстрагировали EtOAc (20 мл). Объединенные органические слои промывали насыщенным солевым раствором (15 мл), сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (5%-30% EtOAc/гептан, 30% изократический, 30%-70% EtOAc/гептан, и затем 70% изократический) с получением желаемого продукта (468) (8,6 мг, 50% выход). 1H ЯМР (400 MГц, CDCl3): δ ppm 8,01-7,97 (м, 2H), 7,55-7,48 (м, 3H), 7,43-7,38 (м, 3H), 6,83 (дд, J=12,8, 7,6 Гц, 1H), 5,48 (дд, J=16, 11 Гц, 1H), 5,36 (дд, J=16, 11 Гц, 1H), 5,25 (м, 1H), 4,94 (д, J=15 Гц, 1H), 4,88 (д, J=15 Гц, 1H), 4,14-4,08 (м, 2H), 3,89 (с, 3H), 3,70 (дд, J=8,8, 8,8 Гц, 2H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=505,3.
(S)-4-(1-(6-(Фторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 91)
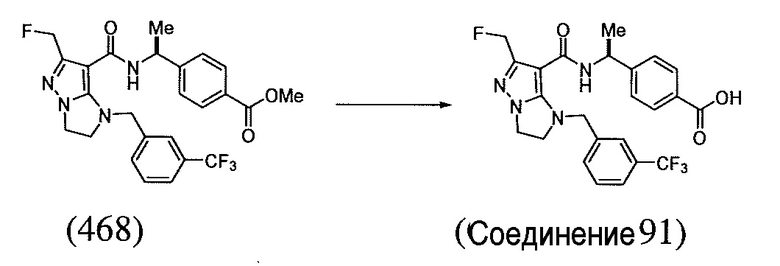
К раствору метил (S)-4-(1-(6-(фторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (468) (8,6 мг, 0,017 ммоль) в метаноле (0,5 мл) и THF (0,5 мл) при температуре окружающей среды добавляли раствор моногидрата гидроксида лития (7,2 мг, 0,17 ммоль) в воде (0,5 мл). Реакционную смесь перемешивали в масляной бане с температурой 60°C. Через 2 ч нагревательную баню удаляли и реакционной смеси давали охладиться до 23°C. Смесь подкисляли 1 н HCl (0,26 мл). Подкисленный раствор разделяли между водой (15 мл) и CH2Cl2 (20 мл). Водный слой снова экстрагировали CH2Cl2 (20 мл). Объединенные органические слои промывали насыщенным солевым раствором (15 мл), сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (50%-80% EtOAc/гептан, 80% изократический, 2% MeOH/EtOAc изократический) с получением желаемого продукта (Соединение 91) (3,5 мг, 41% выход). 1H ЯМР (400 MГц, CDCl3): δ ppm 8,05 (д, J=8,4 Гц, 2H), 7,56-7,49 (м, 3H), 7,45-7,40 (м, 3H), 6,86 (дд, J=12,8, 7,6 Гц, 1H), 5,51 (дд, J=15, 11 Гц, 1H), 5,39 (дд, J=15, 11 Гц, 1H), 5,27 (м, 1H), 4,96 (д, J=15 Гц, 1H), 4,89 (д, J=15 Гц, 1H), 4,15-4,09 (м, 2H), 3,71 (дд, J=8,4, 8,4 Гц, 2H), 1,55 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=491,3.
Пример XC
(S)-4-(1-(1-(3-(Трифторметил)бензил)-6-винил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 92)
К раствору метил (S)-4-(1-(1-(3-(трифторметил)бензил)-6-винил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (465) (50 мг, 0,10 ммоль) в метаноле (1,5 мл) и THF (1,5 мл) при температуре окружающей среды добавляли раствор моногидрата гидроксида лития (21,1 мг, 0,50 ммоль) в воде (1,5 мл). Реакционную смесь перемешивали при температуре окружающей среды. Через 16 ч, смесь разбавляли водой (5 мл) и подкисляли 1 н HCl (0,7 мл). Подкисленный раствор разделяли между водой (5 мл) и EtOAc (20 мл). Водный слой снова экстрагировали EtOAc (20 мл). Объединенные органические слои концентрировали. Остаток очищали с помощью хроматографии на силикагеле (50%-100% EtOAc/гептан, 100% изократический) с получением желаемого продукта (Соединение 92) (32 мг, 66% выход) в виде белого твердого вещества. 1H ЯМР (400 MГц, CD3OD): δ ppm 8,27 (д, J=7,6 Гц, 1H), 7,84 (д, J=8,0 Гц, 2H), 7,60 (с, 1H), 7,54 (м, 1H), 7,47-7,43 (м, 2H), 7,38 (д, J=8,0 Гц, 2H), 6,70 (дд, J=18, 11 Гц, 1H), 5,80 (дд, J=18, 1,6 Гц, 1H), 5,28 (дд, J=11, 1,6 Гц, 1H), 5,14 (м, 1H), 4,53 (д, J=15 Гц, 1H), 4,43 (д, J=15 Гц, 1H), 4,12-4,02 (м, 2H), 3,73-3,63 (м, 2H), 1,46 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=485,3.
Пример XCI
(S)-4-(1-(6-(Гидроксиметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 93)
К раствору метил (S)-4-(1-(6-(гидроксиметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (467) (50 мг, 0,10 ммоль) в метаноле (1,5 мл) и THF (1,5 мл) при температуре окружающей среды добавляли раствор моногидрата гидроксида лития (21,1 мг, 0,50 ммоль) в воде (1,5 мл). Реакционную смесь перемешивали при температуре окружающей среды. Через 16 ч, смесь разбавляли водой (5 мл) и подкисляли 1 н HCl (0,7 мл). Подкисленный раствор разделяли между водой (5 мл) и EtOAc (20 мл). Водный слой снова экстрагировали EtOAc (20 мл). Объединенные органические слои концентрировали. Остаток очищали с помощью хроматографии на силикагеле (50%-100% EtOAc/гептан, 100% изократический) с получением желаемого продукта (Соединение 93) (35 мг, 72% выход) в виде белого полутвердого вещества. 1H ЯМР (400 MГц, CD3OD): δ ppm 9,22 (д, J=7,6 Гц, 1H), 7,99-7,95 (м, 2H), 7,64 (с, 1H), 7,58-7,54 (м, 2H), 7,50-7,44 (м, 3H), 5,15 (м, 1H), 4,94-4,80 (м, 2H), 4,63 (д, J=15 Гц, 1H), 4,60 (д, J=15 Гц, 1H), 4,07-4,02 (м, 2H), 3,74-3,69 (м, 2H), 1,51 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=489,3.
Пример XCII
Метил (S)-4-(1-(6-(дифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (469)

К раствору метил (S)-4-(1-(6-формил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (466) (83 мг, 0,17 ммоль) в CH2Cl2 (1,7 мл) добавляли 1 M раствор DAST в CH2Cl2 (0,37 мл, 0,37 ммоль) при температуре окружающей среды. После перемешивания в течение 2 ч, добавляли дополнительное количество раствора DAST в CH2Cl2 (0,37 мл, 0,37 ммоль). Через 16 ч, анализ LCMS показал приблизительно 60% превращения. Добавляли дополнительное количество раствора DAST в CH2Cl2 (0,37 мл, 0,37 ммоль). Реакционную колбу помещали на масляную баню 40°C. После перемешивания при 40°C в течение 7 ч, дополнительное количество раствора DAST в CH2Cl2 (0,37 мл, 0,37 ммоль). Через еще 16 ч нагревательную баню удаляли и реакционной смеси давали охладиться до 23°C. Реакцию гасили добавлением насыщ. NaHCO3, осторожно. Погашенную смесь разделяли между 5% масс. водным раствором NaHCO3 (20 мл) и EtOAc (30 мл). Водный слой снова экстрагировали EtOAc (30 мл). Объединенные органические слои концентрировали. Остаток очищали с помощью хроматографии на силикагеле (10%-30% EtOAc/гептан, 30% изократический, 30%-50% EtOAc/гептан) с получением желаемого продукта (469) (57 мг, 65% выход). 1H ЯМР (400 MГц, CDCl3): δ ppm 8,00-7,97 (м, 2H), 7,54-7,48 (м, 3H), 7,43-7,39 (м, 3H), 6,73 (м, 1H), 6,60 (т, J=54 Гц, 1H), 5,22 (м, 1H), 4,98 (д, J=15 Гц, 1H), 4,89 (д, J=15 Гц, 1H), 4,14-4,09 (м, 2H), 3,88 (с, 3H), 3,75-3,70 (м, 2H), 1,52 (д, J=6,4 Гц, 3H). LCMS (ES) (M+H)=523,3.
(S)-4-(1-(6-(Дифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 94)
К раствору метил (S)-4-(1-(6-(дифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (469) (56 мг, 0,11 ммоль) в метаноле (1,6 мл) и THF (1,6 мл) при температуре окружающей среды добавляли раствор моногидрата гидроксида лития (22,5 мг, 0,54 ммоль) в воде (1,6 мл). Реакционную смесь перемешивали при температуре окружающей среды. Через 16 ч, смесь разбавляли водой (5 мл) и подкисляли 1 н HCl (0,7 мл). Подкисленный раствор разделяли между водой (5 мл) и EtOAc (20 мл). Водный слой снова экстрагировали EtOAc (20 мл). Объединенные органические слои концентрировали. Остаток очищали с помощью хроматографии на силикагеле (30%-66% EtOAc/гептан, 66% изократический, 66%-80%) с получением желаемого продукта (Соединение 94) (53 мг, 96% выход) в виде белого полутвердого вещества. 1H ЯМР (400 MГц, CDCl3): δ ppm 8,04 (д, J=8,4 Гц, 2H), 7,54-7,39 (м, 6H), 6,76 (м, 1H), 6,62 (т, J=54 Гц, 1H), 5,23 (м, 1H), 4,99 (д, J=15 Гц, 1H), 4,89 (д, J=15 Гц, 1H), 4,15-4,10 (м, 2H), 3,75-3,71 (м, 2H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=509,3
Пример XCIII
Метил (S)-4-(1-(1-(3-(2-этокси-1,1-дифтор-2-оксоэтил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (471)
К раствору метил (S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (405) (200 мг, 0,33 ммоль) и этил 2-бром-2,2-дифтоацетата (470) (0,22 мл, 1,67 ммоль) в DMSO (6,0 мл) добавляли Cu/Sn сплав (106 мг) при температуре окружающей среды. Реакционную колбу помещали на масляную баню 90°С. После перемешивания при 90°C в течение 16 ч, нагревательную баню удаляли и реакционной смеси давали охладиться до 23°C. Реакцию гасили добавлением поливины насыщ. водного раствора NH4Cl (50 мл). Погашенную смесь экстрагировали EtOAc (50 мл). Водный слой снова экстрагировали EtOAc (50 мл). Объединенные органические слои промывали насыщенным солевым раствором (25 мл) и промытый органический слой концентрировали. Остаток очищали с помощью хроматографии на силикагеле (10%-30% EtOAc/гептан, 30% изократический, 30%-50% EtOAc/гептан) с получением желаемого продукта (471) (144 мг, 72% выход) в виде белого твердого вещества. 1H ЯМР (400 MГц, CDCl3): δ ppm 7,99 (д, J=8,4 Гц, 2H), 7,54-7,50 (м, 2H), 7,44-7,38 (м, 4H), 6,29 (м, 1H), 5,23 (м, 1H), 4,86 (д, J=15 Гц, 1H), 4,78 (д, J=15 Гц, 1H), 4,27 (кв, J=7,2 Гц, 2H), 4,16 (дд, J=8,4, 8,4 Гц, 2H), 3,90 (с, 3H), 3,75 (дд, J=8,4, 8,4 Гц, 2H), 1,54 (д, J=7,2 Гц, 3H), 1,28 (т, J=7,2 Гц, 3H). LCMS (ES) (M+H)=595,3.
Метил (S)-4-(1-(1-(3-(1,1-дифтор-2-гидроксиэтил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (472)
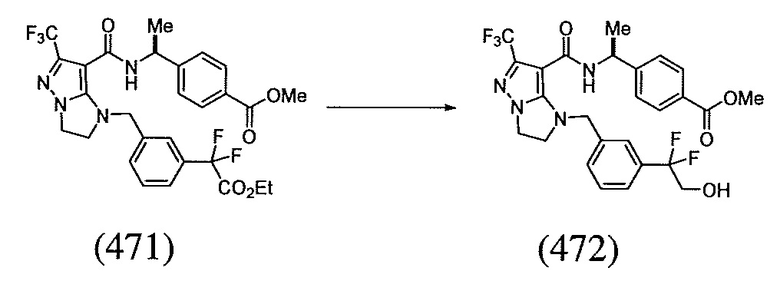
К раствору метил (S)-4-(1-(1-(3-(2-этокси-1,1-дифтор-2-оксоэтил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (471) (110 мг, 0,19 ммоль) в MeOH (6,6 мл) добавляли боргидрид натрия (56 мг, 1,48 ммоль) в трех равных частях при -5°C. После перемешивания при этой температуре в течение 2 ч, добавляли дополнительный боргидрид натрия (30 мг, 0,79 ммоль). Через 2 ч, реакция была завершена (контролировали с помощью LCMS) и реакцию гасили добавлением 6% масс. водного раствора лимонной кислоты(6 мл). Погашенную смесь разделяли между водой (20 мл) и EtOAc (25 мл). Водный слой снова экстрагировали EtOAc (25 мл). Объединенные органические слои концентрировали. Остаток очищали с помощью хроматографии на силикагеле (30%-50% EtOAc/гептан и затем 50% изократический) с получением желаемого продукта (472) в виде масла (95 мг, 93% выход). 1H ЯМР (400 MГц, CDCl3): δ ppm 7,95 (д, J=8,4 Гц, 2H), 7,43-7,33 (м, 6H), 6,24 (м, 1H), 5,19 (м, 1H), 4,81 (д, J=15 Гц, 1H), 4,72 (д, J=15 Гц, 1H), 4,16-4,12 (м, 2H), 3,94-3,88 (м, 2H), 3,88 (с, 3H), 3,77-3,73 (м, 2H), 1,51 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=553,3.
(S)-4-(1-(1-(3-(1,1-Дифтор-2-гидроксиэтил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 95)
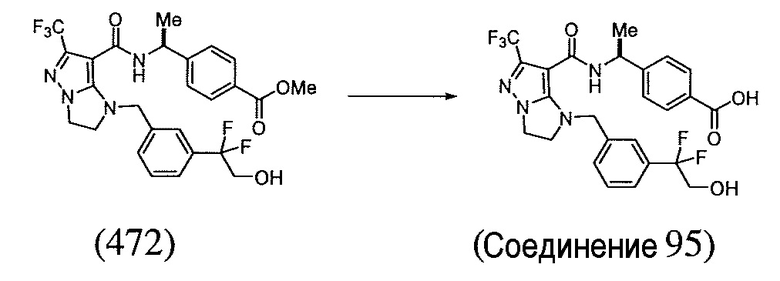
К раствору метил (S)-4-(1-(1-(3-(1,1-дифтор-2-гидроксиэтил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (472) (23 мг, 0,042 ммоль) в метаноле (0,70 мл) и THF (0,70 мл) при температуре окружающей среды добавляли раствор моногидрата гидроксида лития (8,7 мг, 0,21 ммоль) в воде (0,70 мл). Реакционную смесь перемешивали при температуре окружающей среды. Через 16 ч, смесь разбавляли водой (5 мл) и подкисляли 1 н HCl (0,7 мл). Подкисленный раствор разделяли между водой (5 мл) и EtOAc (20 мл). Водный слой снова экстрагировали EtOAc (20 мл). Объединенные органические слои концентрировали. Остаток очищали с помощью хроматографии на силикагеле (50%-100% EtOAc/гептан, 100% EtOAc изократический) с получением желаемого продукта (Соединение 95) (9,8 мг, 44% выход) в виде масла. 1H ЯМР (400 MГц, CDCl3): δ ppm 8,00 (д, J=8,4 Гц, 2H), 7,42-7,32 (м, 6H), 6,28 (м, 1H), 5,20 (м, 1H), 4,80 (д, J=15 Гц, 1H), 4,72 (д, J=15 Гц, 1H), 4,17-4,12 (м, 2H), 3,89 (т, J=13,2 Гц, 2H), 3,77-3,73 (м, 2H), 1,52 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=539,3.
Пример XCIV
Метил (S)-4-(1-(1-(3-(3-оксопропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (475)
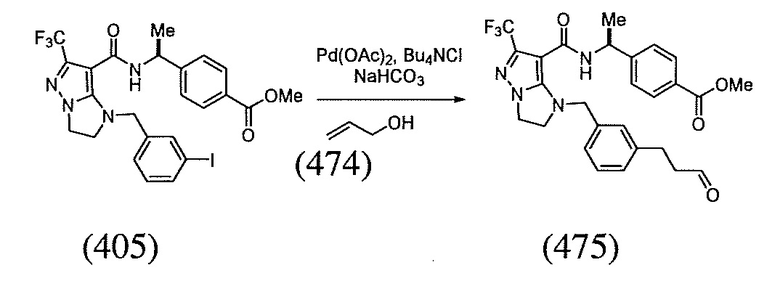
Реакционную колбу загружали метил (S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоатом (405) (60 мг, 0,10 ммоль), тетра-н-бутиламмоний хлоридом (474) (31 мг, 0,11 ммоль), бикарбонатом натрия (21 мг, 0,25 ммоль) и толуолом (2,4 мл). Реакционную смесь удаляли и заполняли азотом (два раза). Добавляли аллиловый спирт (11 мкл, 0,15 ммоль) и палладий(II) ацетат (2,3 мг, 10 мкмоль). Реакционную колбу помещали на масляную баню 80°C. После перемешивания при 80°C в течение 16 ч, нагревательную баню удаляли и реакционной смеси давали охладиться до 23°C. Объем реакционной смеси уменьшали до примерно 1 мл с помощью концентрирования. Остаток очищали с помощью хроматографии на силикагеле (30%-50% EtOAc/гептан, 50% изократический EtOAc/гептан) с получением желаемого продукта (475) (52 мг, 98% выход), который был загрязнен побочным продуктом (~10%). 1H ЯМР (400 MГц, CDCl3): δ ppm 9,77 (д, J=1,2 Гц, 1H), 8,00-7,97 (м, 2H), 7,41-7,38 (м, 2H), 7,23 (м, 1H), 7,11-7,07 (м, 3H), 6,28 (м, 1H), 5,25 (м, 1H), 4,73 (д, J=15 Гц, 1H), 4,69 (д, J=15 Гц, 1H), 4,19-4,12 (м, 2H), 3,90 (с, 3H), 3,77-3,73 (м, 2H), 2,91 (т, J=7,6 Гц, 2H), 2,74 (т, J=7,6 Гц, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=529,2.
Метил (S)-4-(1-(1-(3-(3-гидроксипропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (476)
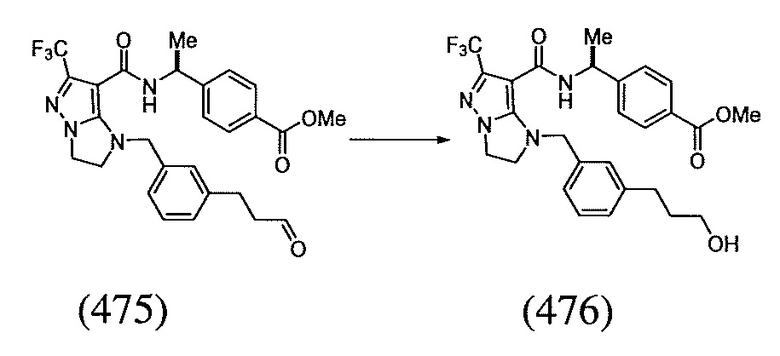
К раствору метил (S)-4-(1-(1-(3-(3-оксопропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (475) (49 мг, 0,093 ммоль) в MeOH (2,0 мл) добавляли боргидрид натрия (5,3 мг, 0,14 ммоль) при 0°C. После перемешивания при этой температуре в течение 2 ч, реакция была завершена (контролировали с помощью TLC) и реакцию гасили добавлением 10% масс. водного раствора лимонной кислоты (0,6 мл). Погашенную смесь разделяли между водой (15 мл) и EtOAc (25 мл). Водный слой снова экстрагировали EtOAc (25 мл). Объединенные органические слом промывали насыщенным солевым раствором (20 мл) и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (50%-70% EtOAc/гептан и затем 70% изократический) с получением желаемого продукта (476)_в виде белого твердого вещества (31 мг, 63% выход из иодного соединения). 1H ЯМР (400 MГц, CDCl3): δ ppm 7,98 (д, J=8,0 Гц, 2H), 7,39 (д, J=8,4 Гц, 2H), 7,22 (дд, J=8,0, 8,0 Гц, 1H), 7,12-7,05 (м, 3H), 6,29 (м, 1H), 5,25 (м, 1H), 4,72 (д, J=14,4 Гц, 1H), 4,66 (д, J=14,4 Гц, 1H), 4,12 (дд, J=8,8, 7,6 Гц, 2H), 3,89 (с, 3H), 3,75 (дд, J=8,8, 8,4 Гц, 2H), 3,63-3,60 (м, 2H), 2,66 (т, J=7,6 Гц, 2H), 1,86-1,80 (м, 2H), 1,53 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=531,2.
Метил (S)-4-(1-(1-(3-(3-((метилсульфонил)окси)пропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (477)
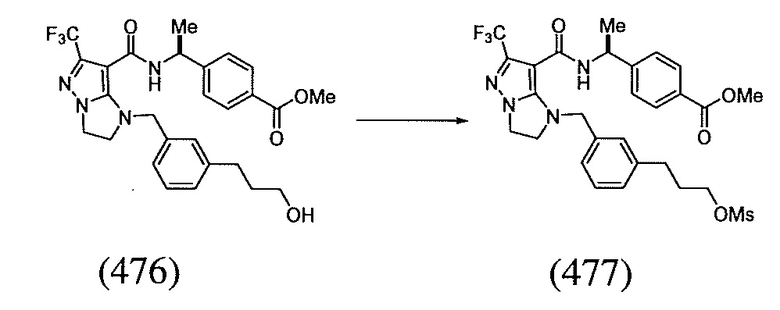
К раствору метил (S)-4-(1-(1-(3-(3-гидроксипропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (476) (37 мг, 0,070 ммоль) в CH2Cl2 (1,5 мл) добавляли Et3N (0,03 мл, 0,21 ммоль), затем раствор матансульфонилхлорида (8,2 мкл, 0,105 ммоль) в CH2Cl2 (0,19 мл) при 0°C. После перемешивания при этой температуре в течение 1 часа, реакция была завершена (контролировали с помощью LCMS) и реакцию гасили добавлением насыщ. водным раствором NaHCO3 (1,0 мл). Погашенную смесь разделяли между 5% масс. водным раствором NaHCO3 (15 мл) и CH2Cl2 (20 мл). Водный слой снова экстрагировали CH2Cl2 (20 мл). Объединенные органические слои концентрировали. Остаток очищали с помощью хроматографии на силикагеле (50%-70% EtOAc/гептан и затем 70% изократический) с получением желаемого продукта (477) в виде белого твердого вещества (29 мг, 68% выход). 1H ЯМР (400 MГц, CDCl3): δ ppm 7,98 (д, J=8,0 Гц, 2H), 7,39 (д, J=8,0 Гц, 2H), 7,23 (м, 1H), 7,11-7,08 (м, 3H), 6,27 (м, 1H), 5,25 (м, 1H), 4,74 (д, J=14,4 Гц, 1H), 4,69 (д, J=14,8 Гц, 1H), 4,19-4,12 (м, 4H), 3,89 (с, 3H), 3,75 (дд, J=8,4, 8,4 Гц, 2H), 2,97 (с, 3H), 2,71 (т, J=7,6 Гц, 2H), 2,07-2,00 (м, 2H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=609,1.
(S)-4-(1-(1-(3-(3-Фторпропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 96)
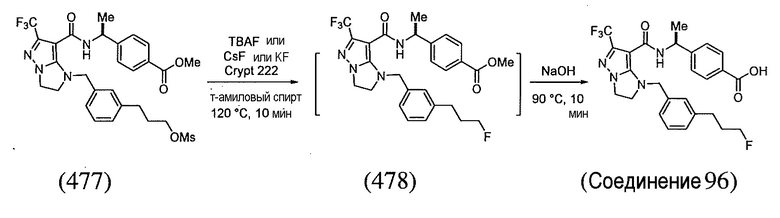
К смеси метил (S)-4-(1-(1-(3-(3-((метилсульфонил)окси)пропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (477) (8 мг, 0,013 ммоль) в трет-амиловом спирте (0,8 мл) добавляли гидрат TBAF (18 мг, 0,066 ммоль) при температуре окружающей среды. Реакционный флакон помещали на масляную баню 110-120°C. После перемешивания при этой температуре в течение 10-15 минут, температуру нагревательной бани доводили до 90°C. Добавляли 3 М водный раствор NaOH (48 мкл, 0,14 ммоль). После нагревания при 90°C в течение 15-20 минут, нагревательную баню удаляли и реакционной смеси давали охладиться до 23°C. Реакцию гасили добавлением 1 M водного раствора HCl (0,2 мл, 0,20 ммоль). Погашенную смесь разделяли между водой (5 мл) и CH2Cl2 (5 мл). Водный слой снова экстрагировали CH2Cl2 (2×5 мл). Объединенные органические слои концентрировали. Остаток очищали с помощью хроматографии на силикагеле (50%-80% EtOAc/гептан, 80% изократический, 0%-5% MeOH/EtOAc, 5% изократический) с получением желаемого продукта (Соединение 96) в виде белого твердого вещества (4,5 мг, 66% выход). 1H ЯМР (400 MГц, CDCl3): δ ppm 8,04 (д, J=8,8 Гц, 2H), 7,43 (д, J=8,4 Гц, 2H), 7,23 (м, 1H), 7,13-7,07 (м, 3H), 6,28 (м, 1H), 5,27 (м, 1H), 4,72 (с, 2H), 4,41 (ддд, J=6,0, 6,0, 47 Гц, 2H), 4,16-4,11 (м, 2H), 3,76 (дд, J=8,4, 8,4 Гц, 2H), 2,70 (т, J=8,0 Гц, 2H), 2,03-1,89 (м, 2H), 1,55 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=519,1.
Пример XCV
(S)-4-(1-(1-(4-(3-фторпропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 97)
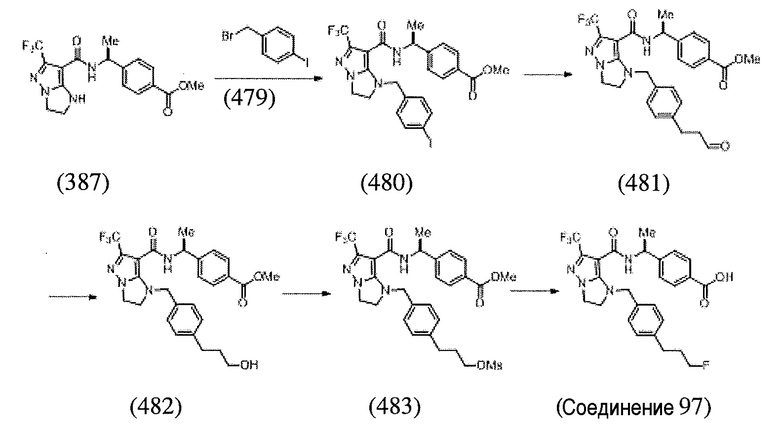
Следуя аналогичной методике получения (S)-4-(1-(1-(3-(3-фторпропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 96) из метил (S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (405), описанной в Примере XCIV, соединение 97 аналогичным образом получали из метил (S)-4-(1-(1-(4-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (480), который получали из метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и 1-(бромметил)-4-иодбензола (479), следуя аналогичной методике получения метил (S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (405), описанной в Примере LXIX.
Метил (S)-4-(1-(1-(4-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (480): 1H ЯМР (400 MГц, CDCl3): δ ppm 8,00 (д, J=8,4 Гц, 2H), 7,62 (д, J=8,0 Гц, 2H), 7,39 (д, J=8,4 Гц, 2H), 7,00 (д, J=8,4 Гц, 2H), 6,25 (м, 1H), 5,23 (м, 1H), 4,72 (д, J=14,8 Гц, 1H), 4,67 (д, J=14,8 Гц, 1H), 4,14 (дд, J=8,8, 8,0 Гц, 2H), 3,91 (с, 3H), 3,74 (дд, J=8,8, 8,0 Гц, 2H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=599,4.
Метил (S)-4-(1-(1-(4-(3-оксопропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (481): 1H ЯМР (400 MГц, CDCl3): δ ppm 9,81 (с, 1H), 7,99 (д, J=8,0 Гц, 2H), 7,40 (д, J=8,0 Гц, 2H), 7,15 (д, J=7,6 Гц, 2H), 7,11 (д, J=7,6 Гц, 2H), 6,24 (м, 1H), 5,25 (м, 1H), 4,74 (д, J=14,4 Гц, 1H), 4,67 (д, J=14,4 Гц, 1H), 4,12 (дд, J=8,8, 8,4 Гц, 2H), 3,90 (с, 3H), 3,75 (дд, J=8,4, 8,4 Гц, 2H), 2,94 (т, J=7,6 Гц, 2H), 2,76 (т, J=7,6 Гц, 2H), 1,54 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=529,2.
Метил (S)-4-(1-(1-(4-(3-гидроксипропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (482): LCMS (ES) (M+H)=531,2.
Метил (S)-4-(1-(1-(4-(3-((метилсульфонил)окси)пропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (483): 1H ЯМР (400 MГц, CDCl3): δ ppm 7,99 (д, J=8,0 Гц, 2H), 7,40 (д, J=8,0 Гц, 2H), 7,17 (д, J=8,0 Гц, 2H), 7,11 (д, J=8,0 Гц, 2H), 6,25 (м, 1H), 5,25 (м, 1H), 4,74 (д, J=14,4 Гц, 1H), 4,68 (д, J=14,4 Гц, 1H), 4,21 (т, J=6,8 Гц, 2H), 4,13 (дд, J=8,8, 8,0 Гц, 2H), 3,89 (с, 3H), 3,76 (дд, J=8,4, 8,4 Гц, 2H), 3,00 (с, 3H), 2,73 (т, J=6,8 Гц, 2H), 2,09-2,02 (м, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=609,1.
(S)-4-(1-(1-(4-(3-Фторпропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 97): 1H ЯМР (400 MГц, CDCl3): δ ppm 8,05 (д, J=7,6 Гц, 2H), 7,43 (д, J=8,0 Гц, 2H), 7,15-7,12 (м, 4H), 6,26 (м, 1H), 5,27 (м, 1H), 4,75 (д, J=14,4 Гц, 1H), 4,67 (д, J=14,4 Гц, 1H), 4,44 (ддд, J=6,0, 6,0, 47 Гц, 2H), 4,15-4,11 (м, 2H), 3,79-3,74 (м, 2H), 2,72 (т, J=7,6 Гц, 2H), 2,04-1,93 (м, 2H), 1,55 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=519,1.
Пример XCVI
(S)-4-(1-(1-(4-(3-Фторпропил)-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 98)
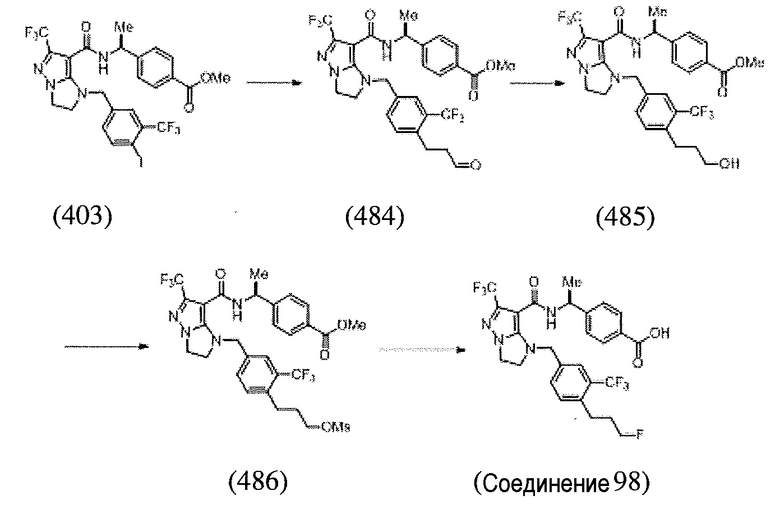
Следуя аналогичной методике получения (S)-4-(1-(1-(3-(3-фторпропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 96) из метил (S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (405), описанной в примере XCIV, соединение 98 аналогичным образом получали из метил (S)-4-(1-(1-(4-иод-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (403).
Метил (S)-4-(1-(1-(4-(3-оксопропил)-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (484): 1H ЯМР (400 MГц, CDCl3): δ ppm 9,82 (с, 1H), 7,99 (д, J=8,4 Гц, 2H), 7,53 (с, 1H), 7,39 (д, J=8,4 Гц, 2H), 7,27-7,24 (м, 2H), 6,29 (м, 1H), 5,22 (м, 1H), 4,82 (д, J=14,8 Гц, 1H), 4,76 (д, J=14,8 Гц, 1H), 4,20-4,14 (м, 2H), 3,90 (с, 3H), 3,78-3,73 (м, 2H), 3,10 (т, J=7,2 Гц, 2H), 2,77 (т, J=7,6 Гц, 2H), 1,54 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=597,2.
Метил (S)-4-(1-(1-(4-(3-гидроксипропил)-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (485): LCMS (ES) (M+H)=599,2.
Метил (S)-4-(1-(1-(4-(3-((метилсульфонил)окси)пропил)-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (486): 1H ЯМР (400 MГц, CDCl3): δ ppm 7,99 (д, J=8,4 Гц, 2H), 7,53 (с, 1H), 7,42-7,38 (м, 3H), 7,27 (м, 1H), 6,28 (м, 1H), 5,23 (м, 1H), 4,82 (д, J=14,8 Гц, 1H), 4,76 (д, J=14,8 Гц, 1H), 4,27 (т, J=6,4 Гц, 2H), 4,19-4,14 (м, 2H), 3,90 (с, 3H), 3,78-3,74 (м, 2H), 2,89 (т, J=8,0 Гц, 2H), 2,08-2,02 (м, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=677,2.
(S)-4-(1-(1-(4-(3-Фторпропил)-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 98): 1H ЯМР (400 MГц, CDCl3): δ ppm 8,05 (д, J=8,4 Гц, 2H), 7,52 (с, 1H), 7,44-7,38 (м, 3H), 7,27 (м, 1H), 6,30 (м, 1H), 5,24 (м, 1H), 4,82 (д, J=14,8 Гц, 1H), 4,76 (д, J=14,8 Гц, 1H), 4,48 (ддд, J=6,0, 6,0, 48 Гц, 2H), 4,19-4,15 (м, 2H), 3,78-3,74 (м, 2H), 2,89 (т, J=8,4 Гц, 2H), 2,05-1,92 (м, 2H), 1,55 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=587,3.
Пример XCVI
(S)-4-(1-(1-(3-(3-Фторпропил)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 99)
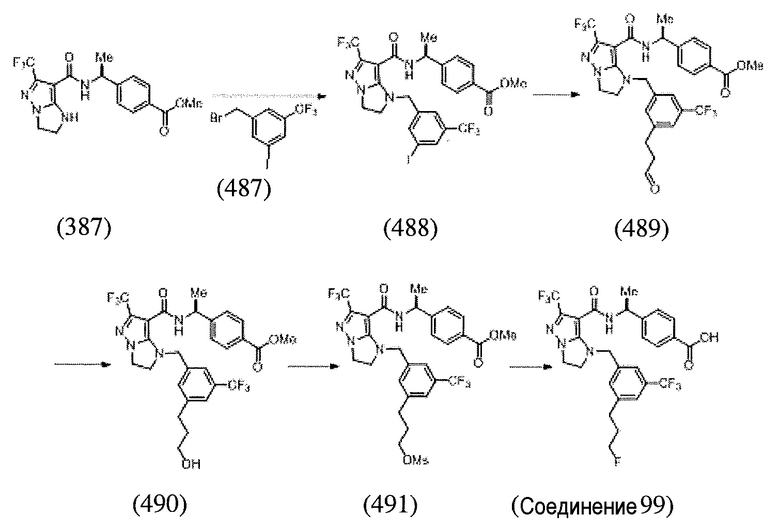
Следуя аналогичной методике получения (S)-4-(1-(1-(3-(3-фторпропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 96) из метил (S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (405), описанной в примере XCIV, соединение 99 аналогичным образом получали из метил (S)-4-(1-(1-(3-иод-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (488), который получали из метил (S)-4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (387) и 1-(бромметил)-3-иод-5-(трифторметил)бензола (487), следуя аналогичной методике получения метил (S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (405), описанной в примере LXIX.
Метил (S)-4-(1-(1-(3-иод-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (488): 1H ЯМР (400 MГц, CDCl3): δ ppm 8,00 (д, J=8,4 Гц, 2H), 7,87-7,86 (м, 2H), 7,52 (с, 1H), 7,38 (д, J=8,4 Гц, 2H), 6,29 (м, 1H), 5,21 (м, 1H), 4,88 (д, J=14,8 Гц, 1H), 4,75 (д, J=14,8 Гц, 1H), 4,23-4,18 (м, 2H), 3,90 (с, 3H), 3,79-3,75 (м, 2H), 1,54 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=677,3.
Метил (S)-4-(1-(1-(3-(3-оксопропил)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (489): 1H ЯМР (400 MГц, CDCl3): δ ppm 9,78 (с, 1H), 7,98 (д, J=8,0 Гц, 2H), 7,40-7,34 (м, 5H), 6,31 (м, 1H), 5,23 (м, 1H), 4,84 (д, J=14,8 Гц, 1H), 4,76 (д, J=14,8 Гц, 1H), 4,20-4,16 (м, 2H), 3,90 (с, 3H), 3,77-3,73 (м, 2H), 2,97 (т, J=7,6 Гц, 2H), 2,79 (т, J=7,2 Гц, 2H), 1,54 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=597,2.
Метил (S)-4-(1-(1-(3-(3-гидроксипропил)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (490): LCMS (ES) (M+H)=599,3.
Метил (S)-4-(1-(1-(3-(3-((метилсульфонил)окси)пропил)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (491): 1H ЯМР (400 MГц, CDCl3): δ ppm 8,00-7,96 (м, 2H), 7,39-7,34 (м, 5H), 6,29 (м, 1H), 5,21 (м, 1H), 4,83 (д, J=14,8 Гц, 1H), 4,76 (д, J=14,8 Гц, 1H), 4,20-4,14 (м, 4H), 3,89 (с, 3H), 3,77-3,73 (м, 2H), 2,80 (с, 3H), 2,78 (т, J=7,6 Гц, 2H), 2,08-2,01 (м, 2H), 1,53 (д, J=6,8 Гц, 3H). LCMS (ES) (M+H)=677,3.
(S)-4-(1-(1-(3-(3-Фторпропил)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 99): 1H ЯМР (400 MГц, CDCl3): δ ppm 8,05 (д, J=8,4 Гц, 2H), 7,42 (д, J=8,8 Гц, 2H), 7,38-7,32 (м, 3H), 6,32 (м, 1H), 5,24 (м, 1H), 4,86 (д, J=14,8 Гц, 1H), 4,76 (д, J=14,8 Гц, 1H), 4,42 (ддд, J=6,0, 6,0, 48 Гц, 2H), 4,20-4,16 (м, 2H), 3,78-3,74 (м, 2H), 2,77 (т, J=7,6 Гц, 2H), 2,04-1,91 (м, 2H), 1,55 (д, J=7,2 Гц, 3H). LCMS (ES) (M+H)=587,2.
Пример XCVII
1-трет-бутил 7-этил 6-(2-этокси-1,1-дифтор-2-оксоэтил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-дикарбоксилат (493)
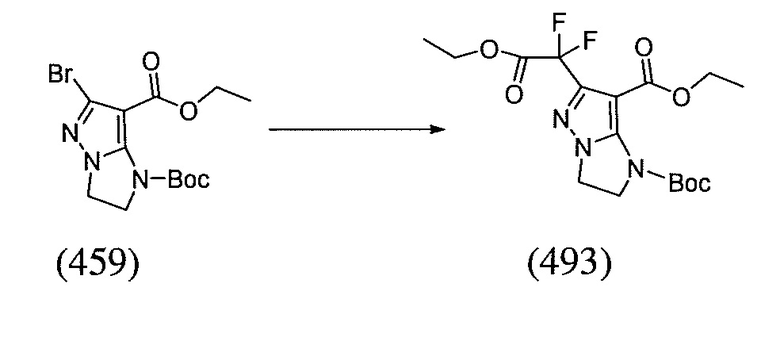
Неоднородный раствор порошка Cu (0,88 г, 13,88 ммоль) в DMSO (20 мл) дегазировали при комнатной температуре (вакуум-продувка N2, 3 раза), и выдерживали в течение 30 мин при 80°C. Затем добавляли 1-трет-бутил 7-этил 6-бром-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-дикарбоксилат (459) (1,0 г, 2,78 ммоль) и этил 2-бром-2,2-дифтоацетат (470) (1,5 мл, 11,7 ммоль).
После дегазации полученную реакционную смесь выдерживали в течение 6 часов при этой температуре. После охлаждения до комнатной температуры реакцию гасили добавлением насыщ. водного раствора хлорида аммония (10 мл). После разбавления этилацетатом (50 мл) и 4:1 (об/об) смесью насыщенный водный хлорид аммония - 28% гидроксид аммония (25 мл), фазы разделяли. После обратной экстракции водного слоя, объединенную органическую фазу сушили (MgSO4), фильтровали и концентрировали. Полученный неочищенное вещество очищали с помощью хроматографии на Biotage (н-Гептан-EtOAc) с получением желаемого продукта (493) в виде масла (1,2 г, 86% выход). 1H ЯМР (400 MГц, CDCl3): δ ppm 4,5~4,4 (м, 2H), 4,4~4,1 (м, 6H), 1,5 (шир.с, 9H), 1,4~1,2 (м, 6H). LCMS (ES) (M+H)=404,15.
1-трет-бутил 7-этил 6-(1,1-дифтор-2-гидроксиэтил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-дикарбоксилат (494)
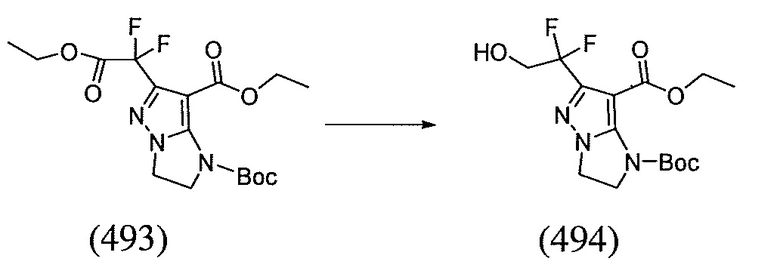
К перемешиваемому раствору 1-трет-бутил 7-этил 6-(2-этокси-1,1-дифтор-2-оксоэтил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-дикарбоксилата (493) (0,2 г, 0,59 ммоль) в растворе 10:1 THF-MeOH (5 мл-0,5 мл) добавляли NaBH4 (75 мг, 1,98 ммоль, гранулы) при комнатной температуре. Полученный раствор выдерживали в течение 4 часов. В это время реакцию гасили насыщ. водным раствором хлорида аммония (2 мл), и экстрагировали этилацетатом (3×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (15 мл), и сушили над MgSO4. После фильтрации фильтрат концентрировали и остаток непосредственно очищали с помощью Biotage (загружали колонку раствором DCM и элюировали 10%-50% E/H) с получением желаемого продукта (494) в виде масла (160 мг, 89% выход). 1H ЯМР (400 MГц, CDCl3): δ ppm 4,50~4,40 (м, 2H), 4,35~4,25 (д, 4H), 4,2~4,10 (м, 3H), 1,50 (шир.с, 9H), 1,4~1,3 (м, 3H). LCMS (ES) (M+H)=362,12.
1-(трет-бутоксикарбонил)-6-(1,1-дифтор-2-гидроксиэтил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновая кислота (495)
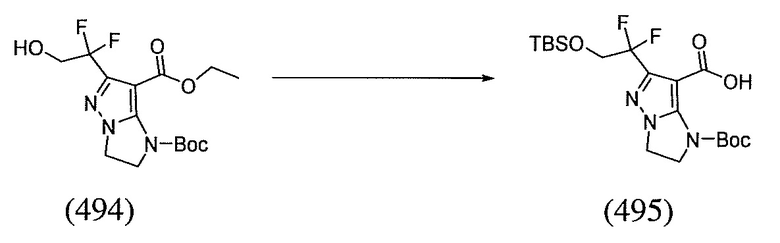
К перемешиваемому раствору 1-трет-бутил 7-этил 6-(1,1-дифтор-2-гидроксиэтил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-дикарбоксилата (494) (0,2 г, 1,24 ммоль) в MeOH- THF-H2O (1:1:1, 2 мл каждый) добавляли LiOH (53 мг, 2,21 ммоль). После выдерживания в течение 13 ч при комнатной температуре, реакционную смесь нагревали до 40°C и выдерживали в течение дополнительных 6 часов. Реакционную смесь разбавляли этилацетатом (20 мл), и доводили pH до значения 4 с помощью 1н HCl. После фазового разделения, водный слой снова экстрагировали этилацетатом (2×15 мл). Объединенный органический слой сушили над MgSO4, концентрировали и азеотропно сушили ацетонитрилом (2x). Неочищенный продукт использовали на следующей реакции без дальнейшей очистки (175 мг в виде неочищенного, выход 95% без регулировки чистоты).
Азеотропно высушенную 1-(трет-бутоксикарбонил)-6-(1,1-дифтор-2-гидроксиэтил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновую кислоту (495) (170 мг, 0,51 ммоль) растворяли в DMF (6 мл) и обрабатывали TBSCl (200 мг, 1,31 ммоль) и имидазолом (107 мг, 1,57 ммоль) при 5°C. Реакционную смесь нагревали до комнатной температуры, и выдерживали в течение 15 часов при этой температуре. По окончании реакции реакцию гасили добавлением водн. бикарбоната натрия (5 мл). После разбавления водн. раствором бикарбоната натрия, продукт реакции (495) экстрагировали этилацетатом (3×20 мл). После сушки MgSO4, объединенные органические слои выпаривали с получением неочищенного продукта (200 мг). Полученный неочищенный эфир бис-TBS сложного эфира повторно растворяли в THF (6 мл), и обрабатывали NaOH (0,63 мл, 0,63 ммоль). После выдерживания в течение 8 ч при комнатной температуре, реакционную смесь разбавляли этилацетатом (15 мл), и pH доводили до 4 с помощью добавления 1 н HCl. Экстракционная обработка этилацетатом (2×20 мл) с последующей сушкой (MgSO4), фильтрацией и концентрацией органического слоя давала неочищенный продукт. Фильтрация через силикагель и элюирование этилацетатом давали продукт (495) (200 мг, 80% общий выход). 1H ЯМР (400 MГц, CDCl3): δ ppm 4,55~4,45 (м, 2H), 4,354,20 (м, 4H), 1,55 (шир.с, 9H), 0,85 (шир.с, 9H), 0,0 (с, 6H). LCMS (ES) (M+H)=448,22.
Метил (S)-4-(1-(6-(2-((трет-бутилдиметилсилил)окси)-1,1-дифторэтил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (496)
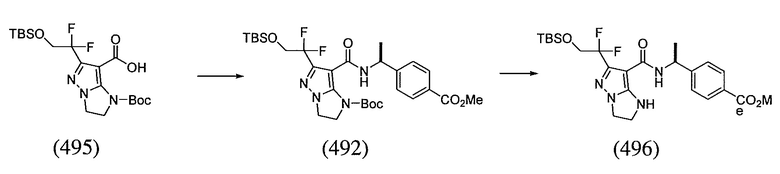
Перемешиваемую 1-(трет-бутоксикарбонил)-6-(1,1-дифтор-2-((2-(триметилсилил)пропан-2-ил)окси)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновую кислоту (495) (350 мг, 0,78 ммоль) в DMF (5 мл) подвергали обработке (S)-метил 4-(1-аминоэтил)бензоатом (216) (250 мг, 1,39 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлоридом (300 мг, 1,56 ммоль), TEA (0,27 мл, 1,95 ммоль), и каталитическим количеством DMAP (19 мг, 0,16 ммоль).
После выдерживания 14 ч при комнатной температуре, реакционную смесь разбавляли хлоридом аммония (10 мл) и этилацетатом (20 мл). После разделения фаз органический слой снова экстрагировали этилацетатом (15 мл). Объединенный органический слой промывали насыщенным солевым раствором (15 мл), и сушили над MgSO4. После фильтрации фильтрат концентрировали с получением неочищенного продукта в виде масла. Этот неочищенный продукт использовали на следующей стадии без дополнительной очистки.
К перемешиваемому раствору (S)-трет-бутил 6-(2-((трет-бутилдиметилсилил)окси)-1,1-дифторэтил)-7-((1-(4-(метоксикарбонил)фенил)этил)карбамоил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1-карбоксилату (492) (400 мг) в дихлорметане (3 мл), и обрабатывали TFA (1,5 мл) при 0°C, затем нагревали до комнатной температуры. После выдерживания 16 ч при комнатной температуре, органические растворители удаляли при пониженном давлении, и остаток разбавляли метиленхлоридом (20 мл). После экстракции насыщенным водным раствором NaHCO3 (15 мл), водный слой снова экстрагировали метиленхлоридом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над MgSO4. Удаление растворителя и фильтрация через небольшую пробку на слое силикагеля с последующей промывкой этилацетатом давали аминоспирт. Полученный TBS незащищенный спирт подвергали предварительно описанному условию с использованием TBSCl (300 мг, 0,91 ммоль), имидазола (150 мг, 2,2 ммоль) в DMF (6 мл). В конце реакции добавляли насы. водный хлорид аммония (15 мл). Затем, реакционную смесь разбавляли этилацетатом (15 мл). После экстракционной обработки, органический слой сушили над MgSO4, и концентрировали. Неочищенный продукт очищали снова Biotage с получением желаемого продукта (496) в виде масла (260 мг, 65% общий выход).
1H ЯМР (400 MГц, CDCl3): δ ppm 8,10-7,90 (м, 2H), 7,40-7,0 (м, 3H), 5,25-5,10 (м, 1H), 4,20-4,00 (м, 3H), 3,90 (с, 3H), 3,84-3,74 (м, 2H), 2,94-2,76 (м,1H), 1,50-1,40 (м, 3H), 0,90 (шир.с, 9H), 0,10 (шир.с, 6H). LCMS (ES) (M+H)=509,33.
(S)-4-(1-(6-(1,1-Дифтор-2-гидроксиэтил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойная кислота (Соединение 100)
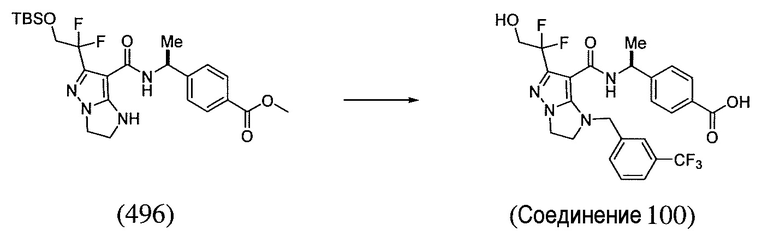
К перемешиваемому раствору (S)-метил 4-(1-(6-(2-((трет-бутилдиметилсилил)окси)-1,1-дифторэтил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата (496) (110 мг, 0,222 ммоль) в DMF (3 мл) добавляли 1-(хлорметил)-3-(трифторметил)бензол (214) (43 мг, 0,238 ммоль) и карбонат цезия (106 мг, 0,324 ммоль) при комнатной температуре. После выдерживания в течение 15 ч при комнатной температуре, полученную реакционную смесь гасили добавлением насыщ. водного раствора хлорида аммония (3 мл) и этилацетата (20 мл). После экстракции этилацетатом (2×20 мл), объединенный органический слой промывали насыщенным солевым раствором (15 мл), и сушили над MgSO4. После фильтрации фильтрат концентрировали досуха (неочищенный, 150 мг).
Часть неочищенного сложного эфира (20 мг, 0,039 ммоль) обрабатывали водн. 1 н NaOH (0,4 мл, 0,4 ммоль) в THF (2 мл). После выдерживания в течение 16 ч при комнатной температуре. рН реакции регулировали с помощью 1 н HCl до pH 4, реакционные смеси непосредственно очищали с помощью ВЭЖХ с обращенной фазой с получением желаемого продукта (Соединение 100) (0,4 мг, 3% выход, 100% чистота). 1H ЯМР (500 MГц, CDCl3): δ ppm 7,89 (шир.с, 2H), 7,52-7,06 (м, 6H), 5,37-5,35 (м, 1H), 5,12 (шир.с,1H), 4,91 (м, 1H), 4,70-4,68 (шир.с, 1H), 4,15-4,04 (м, 3H), 3,65 (шир.с, 2H), 3,54-3,52 (м, 1H). 2,95-2,93 (м, 1H), 1,32-1,25 (м, 3H). LCMS (ES) (M+H)=529,2.
Пример XCVIII
(S)-N-(1-(4-((1-Цианоциклопропил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамид (Соединение 101)
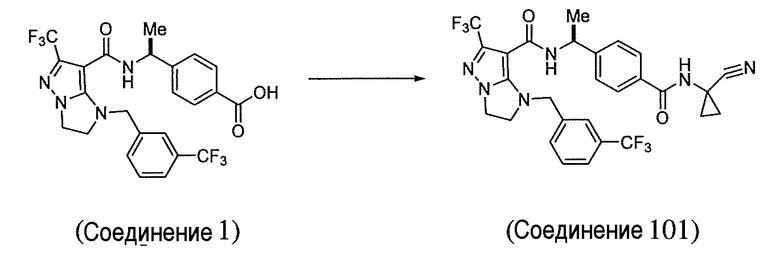
К перемешиваемому раствору 6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоновой кислоты (Соединение 1) (25 мг, 0,047 ммоль), 1-аминоциклопропанкарбонитрил гидрохлорида (12,9 мг, 0,11 ммоль) и 4-этилморфолина (20 мкл, 0,166 ммоль) в ацетонитриле (3 мл) добавляли 1-пропанфосфоновой кислоты циклический ангидрид (85 мкл, 0,142 ммоль, 50% раствор в этилацетате) при комнатной температуре. Полученный раствор выдерживали в течение 14 часов при комнатной температуре. В это время, реакцию гасили добавлением насыщ. водного NaHCO3 (2 мл). Неочищенный продукт экстрагировали этилацетатом (2×10 мл), и органические слои сушили над MgSO4. После фильтрации фильтрат концентрировали и непосредственно очищают с помощью ВЭЖХ с обращенной фазой с получением желаемого продукта (Соединение 101) (10 мг, 35% выход). 1H ЯМР (400 MГц, CDCl3): δ ppm 7,59 (д, J=8,1 Гц, 2H), 7,46 (м, 2H), 7,39-7,27 (м, 4H), 5,55 (шир.с,1H), 6,18 (д, J=3,9 Гц, 1H), 5,10 (дд, J =13,1, 7,1 Гц, 1H), 4,73 (м, 2H), 4,10 (дд, J =8,5, 7,3 Гц, 2H), 3,76 (дд, J=8,5, 8,2 Гц, 2H), 1,54-1,41 (м, 5H), 1,23 (м, J=7,2 Гц, 2H). LCMS (ES) (M+H)=591,21.
Пример XCIX
Метил (S)-4-(1-(1-(2-фторбензоил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (Соединение 105)
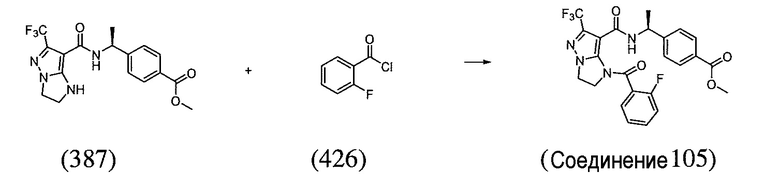
(S)-метил 4-(1-(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоат (387) (30 мг,,078 ммоль) растворяли в THF (0,6 мл) и охлаждали до 0°С. Добавляли Et3N (32,8 мкл,,235 ммоль) с последующим добавлением 2-фторбензоил хлорида (14,05 мкл,,118 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции, ее гасили раствором NaHCO3 (5 мл), экстрагировали DCM (30 мл), промывали насыщенным солевым раствором (5 мл). Органический слой концентрировали и очищали при помощи флэш-хроматографии с получением соединения 105 в виде бесцветного масла (35,2 мг, 89% выход). 1НЯМР (400 MГц, CDCl3): δ ppm 7,97 (д, J=8,8 Гц, 2H), 7,60 (д, J=8,8 Гц, 1H), 7,59-7,52 (м, 1H), 7,43 (д, J=8,0 Гц, 2H), 7,31 (т, J=6,4 Гц, 1H), 7,18 (т, J=9,2 Гц, 1H), 7,06 (шир.с, 1H), 5,25 (т, J=7,2 Гц, 1H), 4,56-4,50 м, 2H), 4,37 (т, J=8,0 Гц, 2H), 3,90 (с, 3H), 1,54 (д, J=6,8 Гц, 3H). LCMS (ES) (M+Na)=527.
Пример C
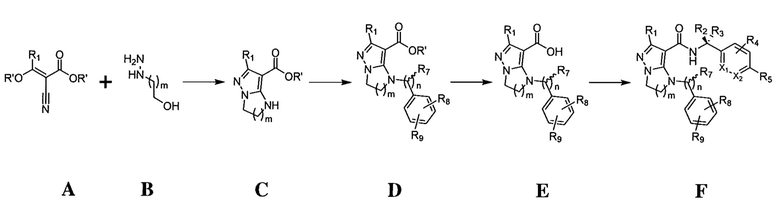
Следуя аналогичным методикам получения (S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 1) или (S)-4-(1-(6-этил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты (Соединение 59), общую структуру композиции F можно получить из подходящих соединений А и В с использованием подходящих замещенных (R8 и R9) ароматических или бензиловых галогенидов и соответственно замещенных (R4 и R5) производных (гетеро)ароматических кислот или предшественников (гетеро)ароматических кислот или (гетеро)ароматического тетразола (здесь n=0-1). Следует отметить, что «(гетеро)ароматическая» обозначает ароматическую группу, которая необязательно имеет одну или несколько замен гетероатомов в ароматическом кольце.
В некоторых вариантах осуществления, заместители могут быть выбраны, где R1 представляет собой -CH3, -CF3, -CH2CH3 или фенил; R2 представляет собой -Н или -CH3; R3 представляет собой -H; или R2 и R3 взятые вместе, образуют циклопропил с углеродом, к которому они прикреплены; R4 представляет собой -H, -F или -CH3; R5 представляет собой -C(O)OH, -C(O)OCH3, -CH2C(O)OH, циклопропил, -C(O)NHCN,
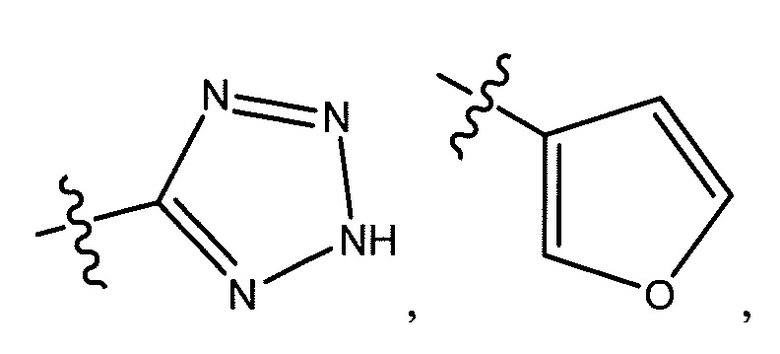
или 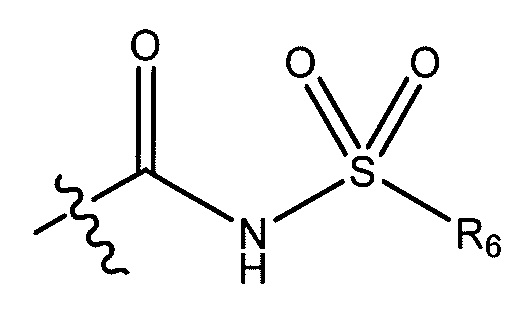 ;
;
где R6 представляет собой фенил, -CH3, циклопропил,
или 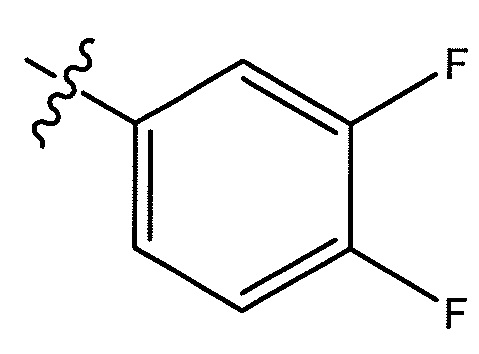 ;
;
m равен 1-2; n равен 0-1; R7 представляют собой -H, -CH3, или отсутствует, когда n равно 0; R8 представляют собой -CF3, -H, -Cl, -F, -CH2CH3, -OCH3, -CH3 или -OCF3; R9 представляют собой -H, -Cl или -CF3; и X1 и X2 представляют собой или оба C, или один представляет собой C, а другой представляет собой N.
Пример CI
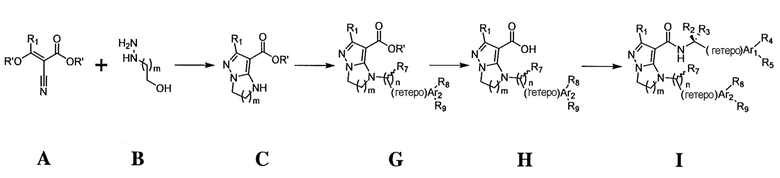
Следуя аналогичным методикам получения соединения F, общую структуру соединения I можно получить из подходящих соединений А и В с использованием подходящих замещенных (R8 и R9) гетероароматических, ароматических, бензильных или гетеробензильных галогенидов и соответственно замещенных (R4 и R5) производных гетероароматических кислот, производных ароматических кислот, предшественников гетероароматических кислот, предшественников ароматических кислот, ароматического тетразола или гетероароматического тетразола. (здесь n=0-2). Следует отметить, что в реакционной схеме примера CIII «(гетеро)Ar» обозначает арильную группу или, необязательно, гетероарильную группу.
В типичных вариантах осуществления R1 представляет собой -CF3, C1-C6 алкил, C1-C6 алкокси, циано, арил, арилокси, амино, C1-C6 алкиламино, карбонил или фенил; R2 и R3 независимо выбраны из -H, -CH3 или -CH3-zFz, где z равен 1-3; или R2 и R3 взятые вместе, образуют циклопропил или циклобутил с углеродом, к которому они присоединены; R4 представляют собой -H, галоген, -CF3 C1-C3 алкил, необязательно замещенный одним или несколькими -F или C1-C3 алкокси; R5 представляют собой -C(O)OH, -C(O)OCH3, -CH2C(O)OH, циклопропил, -C(O)NHCN,  ,
,
или  ;
;
где R6 представляет собой фенил, -CH3, циклопропил, или
 ;
;
m равен 1-3; n равен 0-5; R7 представляет собой -H, -CH3, или отсутствует, когда n равно 0;
R8 и R9 независимо выбраны из -Н, -CF3, галогена, амино, OCH3, C1-C6 алкокси, необязательно замещенного одним или несколькими фтором, или C1-C6 алкила, необязательно замещенного по меньшей мере одним фтором и по меньшей мере одним углеродом C1-C6 алкила, необязательно замещенного O или N; и (гетеро) Ar1 и (гетеро) Ar2 представляют собой арил или, необязательно, гетероарил;; где R10 представляет собой C1-C3 алкил, необязательно замещенный одним или несколькими фтором, и где p равен 0-3.
Пример CII
Если не указано иное, реагенты, клетки и животные, используемые в экспериментах, описанных в настоящем документе, являются следующими.
PGE2 и [3H]-меченные PGE2 были приобретены у Cayman Chemical (Ann Arbor, MI) и Perkin Elmer (Waltham, MA), соответственно. Клетки молочной железы мыши 4T1 (CRL-2539) были получены из American Tissue Culture Collection. Клеточная линия SE302 является клоном клеток HEK293, содержащим промотор с элементами цАМФ-ответа (CRE), который, когда активируется, вызывает секрецию плацентарной щелочной фосфатазы (PLAP). Клетки HEK293 экспрессируют эндогенный EP4 и оказывают индуцирующее воздействие на PLAP в ответ на агонисты PGE2 и EP4, но не на агонисты EP1, 2 или 3 (Chen Q, Muramoto K, Masaaki N, Ding Y, Yang H, Mackey M, Li W, Inoue Y, Ackermann K, Shrota H, Matsumoto I, Spyvee M, Schiller S, Sumida T, Gusovsky F, and Lamphier M. A novel antagonist of the prostaglandin E2 EP4 receptor inhibits Th1 differentiation and Th17 expansion and is orally active in arthritis models. British J Pharmacol, 2010, 160: 292-310). Самцы мышей BalB/C в возрасте 7-8 недель были приобретены в Jackson Laboratory (Bar Harbor, ME). Мышей содержали в особых стерильных условиях.
Антагонизм EP4 по анализу CRE-PLAP-репортера: Клетки SE302 содержали в среде DMEM/F12 (50:50) (MediaTech), дополненной 10% FBS (Tissue Culture Biologicals) плюс пенициллин/стрептомицин. Когда использовали для анализов, клетки помещали на 96-луночный планшет при 2×104 клеток/100 мкл/лунка, в не содержащую сыворотку среду для анализа (DMEM/F12, дополненная 0,1% бычьим сывороточным альбумином (BSA) плюс пенициллин/стрептомицин) и инкубировали в течение 4-6 часов. Клетки затем стимулировали с помощью 3 нг/мл PGE2, в присутствии или в отсутствие различных концентраций тестируемого соединения, в течение ночи и активность PLAP измеряли путем смешения 15 мкл культуральных супернатантов с 75 мкл Lumi-phos (Lumigen, Inc.) и 60 мкл буфера для анализа, содержащего 8 ммоль/л MgSO4 в 0,1 моль/л карбонат-бикарбонатного буфера, с рН 11, на новом 96-луночном планшете черного цвета и инкубирования в течение 2 часов при комнатной температуре. Интенсивность люминесценции, которая отражала активность PLAP в супернатанте, определяли количественно с помощью ридера Envision 2101 Multilabel. Значения, полученные из обработанных DMSO образцов в присутствии PGE2, определяли как 100% контроля, тогда как значения, полученные из обработанных DMSO образцов в отсутствие PGE2, определялись как 0% контроля. % контроля для обработанных композицией образцов рассчитывали следующим образом: (фактическое показание - 0% контроля)/(100% контроля - 0% контроля)×100. Значение IC50 для каждого отдельного эксперимента было рассчитано с использованием GraphPad Prism 6.02 (Lake Forest, CA)с % контрольных значений.
Соединения по настоящему изобретению анализировали в соответствии со способами, описанными выше, и значения IC50, которые могут быть единичными значениями анализа или кратными средними значениями анализа, суммированы в таблице 1. Соединения с маркировкой «ABS» показывают абсолютную стереохимию.
Таблица 1
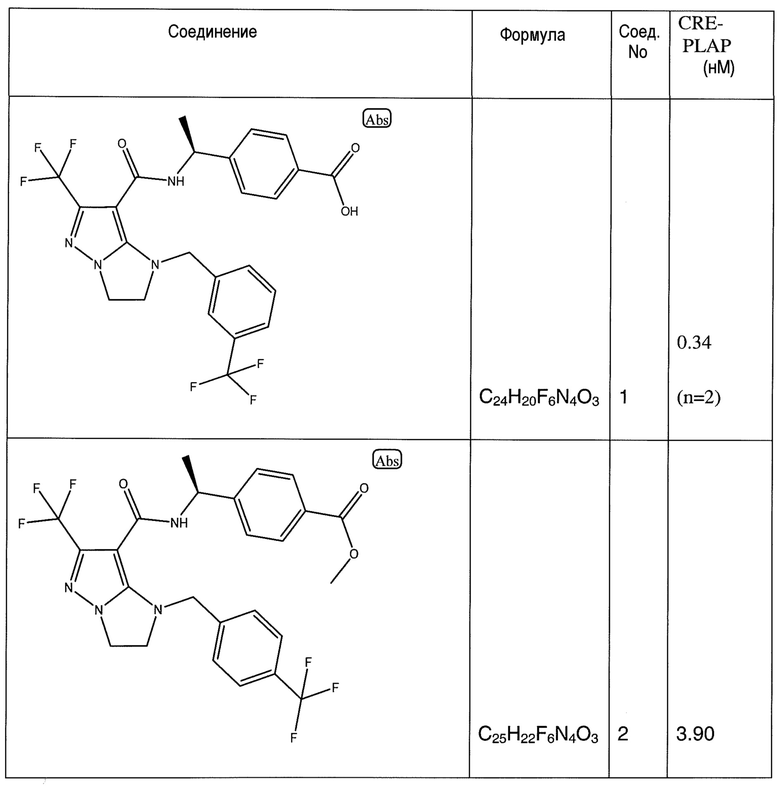
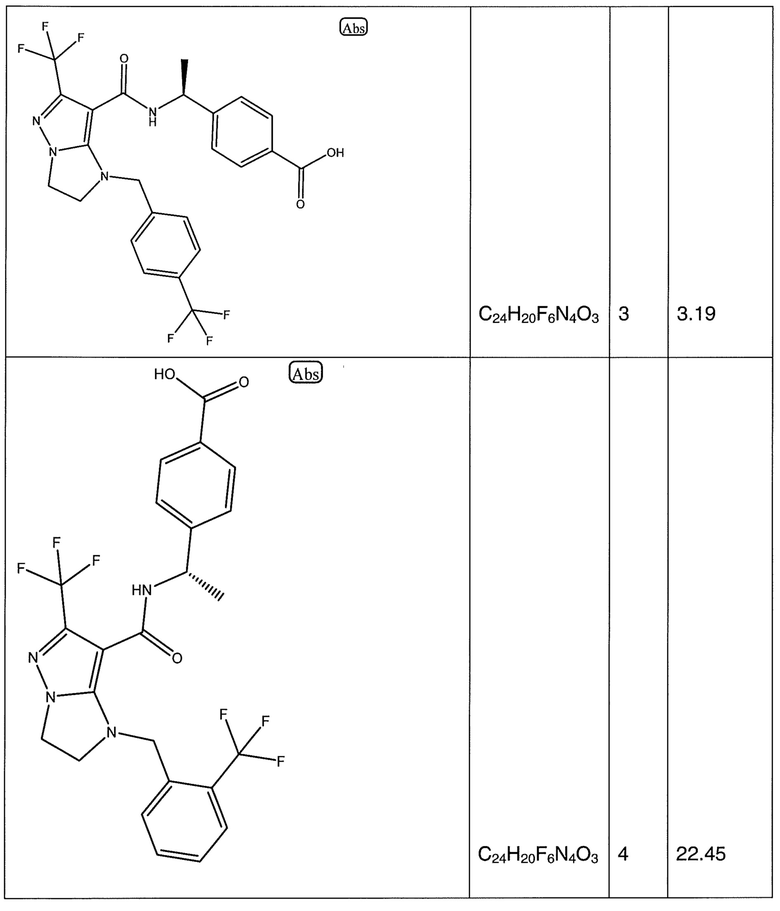
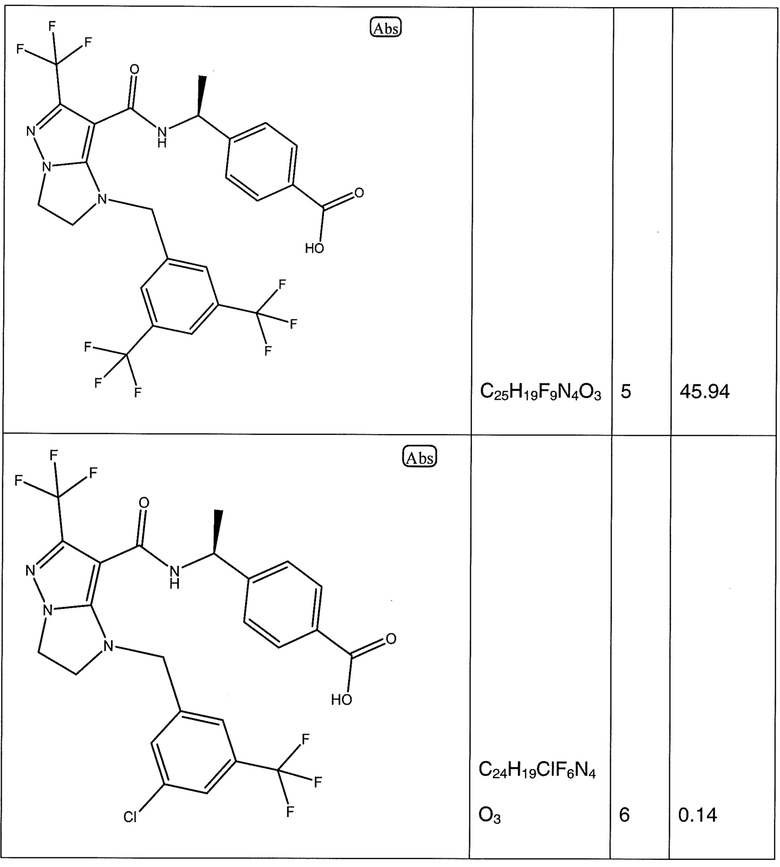
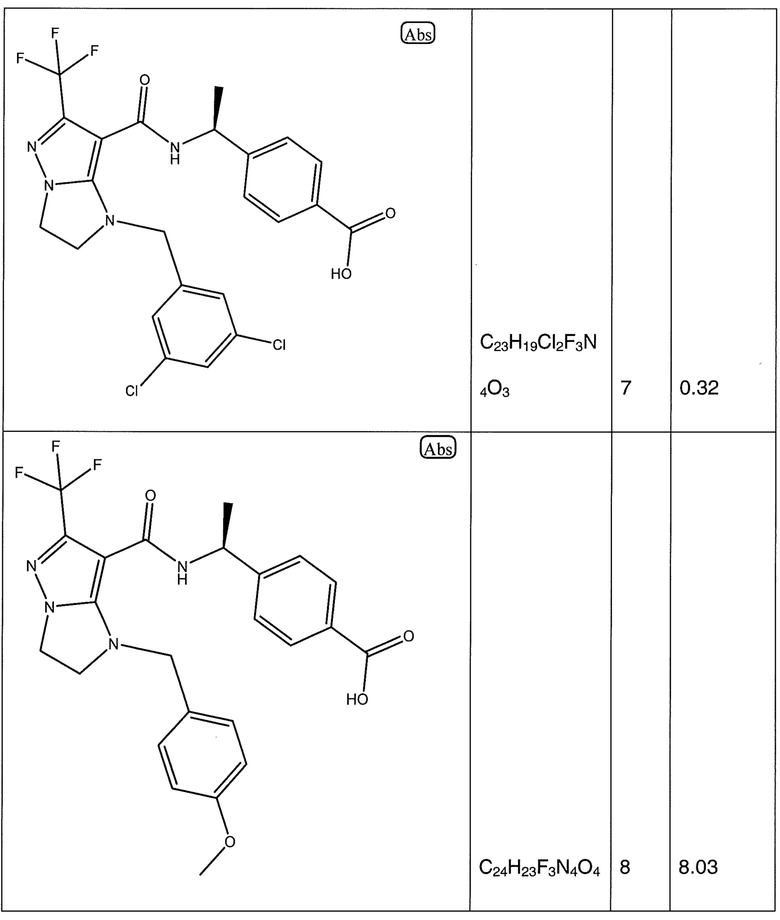





Пример CV
Анализ конкурентного связывания EP4-рецептора с радиолигандом: Анализ проводили с использованием мембранных препаратов ChemiScreen рекомбинантного человеческого рецептора EP4 от Millipore с использованием клеток Chem-1 и мембранных препаратов мышиного рецептора EP4 от Genscript с использованием клона U2OS в соответствии с инструкциями производителя. Для связывания с EP4 человека 10 мкг клеточных мембран Chem-1, сверхэкспрессирующих кДНК EP4 человека, смешивали с 12 нМ [3H]-PGE2 и 5 мкмоль/л немеченого PGE2 или 0,1% DMSO в присутствии или в отсутствие различных концентраций тестируемых соединений в буфере для связывания (50 мМ HEPES, pH 7,4, 5 мМ MgCl2, 1 мМ CaCl2, 0,2% BSA) на несвязывающем 96-луночном планшете и инкубировали в течение 2 ч при комнатной температуре. Для связывания с EP4 мышей использовали 60 мкг мембран U2OS в тех же условиях. Перед фильтрацией на 96-луночный фильтр-планшет GF/C наносили на 30 минут покрытие с использованием 0,33% раствора полиэтиленимина, затем промывали с помощью 50 мM HEPES, pH 7,4, 0,5% BSA. Продукты реакции связывания переносили на фильтр-планшет и 3 раза промывали буфером для промывки (50 мM HEPES, pH7,4, 500 мM NaCl, 0,1% BSA). Планшет высушивали и подсчитывали радиоактивность. Данные обрабатывали с использованием программного обеспечения PRISM, а значения IC50 и Ki рассчитывали с использованием того же программного обеспечения.
Конкурентное связывание соединения 1 с EP4-рецептором: Соединение 1 дополнительно оценивали по его ингибирующей активности при связывании меченого радиоизотопом PGE2 с человеческими или мышиными EP4-сверхэкспрессирующими фракциями клеточной мембраны in vitro. Как показано на фиг. 1А и фиг. 1B, тестируемое соединение ингибировало связывание меченого радиоизотопом PGE2 с человеческим или мышиным EP4 дозозависимым образом. Значения Ki ингибирования для человеческого и мышиного EP4 составляли 4,2 нМ и 26,3 нМ, соответственно.
Пример CVI
In vivo Противоопухолевая фармакология: Клетки 4T1 поддерживали в среде RPMI 1640, дополненной 10% FBS при 37°C и 5% CO2 атмосфере. Отщепление клеток было получен с использованием стандартных методов трипсинизации, количественной оценки количества клеток и информации о жизнеспособности с использованием автоматизированного счетчика клеток NC-200. Соединение 1 тщательно суспендировали в 0,5% метилцеллюлозе (МС) путем обработки ультразвуком при 4°С в течение 15 мин перед пероральным введением (п.в.) животным. Мышам BALB/c вводили подкожно (s.c.) живые клетки 4T1 1×105. У мышей развились опухоли около 36 мм3 через 5 дней. Мышей, несущих опухоль 4T1, рандомизировали и распределяли в 5 групп по 10 мышей, каждая: группа А, получавшая носитель (0,5% МС); группа В, получавшая 0,1 мг/кг соединения 1; группа С, получавшая 1 мг/кг соединения 1, группа D, получавшая 25 мг/кг соединения 1; и группа E, получавшая 150 мг/кг соединения 1. Все получали лечение п.в. ежедневно в течение 21 дня подряд. Объемы опухолей и массы тела измеряли два раза в неделю. Исследование прекращали через 27 дней после инъекции опухолевых клеток. Объемы опухолей были выражены как среднее±SEM. Различия в объеме опухоли среди обработанных групп мыши на 27-й день были проанализированы однофакторным дисперсионным анализос с последующим критерием Тьюки. Значения P ≤ 0,05 считали значимыми.
In vivo противоопухолевая активность : Как описано выше, соединение 1 исследовали на его активность в опухолевом росте с использованием мышиной сингенной опухолевой модели молочной железы 4T1. Ежедневное пероральное введение соединения ингибировало рост опухоли дозозависимым образом в целом в диапазоне 0,1 мг/кг - 150 мг/кг (фиг.2А). При тестировании в обеих дозах (0,1 и 1,0 мг/кг) наблюдалось некоторое ингибирование, но без статистической значимости. С другой стороны, значительная и сопоставимая противоопухолевая активность была обнаружена для доз при 25 и 150 мг/кг, что указывает на то, что оптимальная эффективная доза была достигнута при 25 мг/кг в условиях проведения эксперимента. Ни одна из тестируемых доз не показала большую токсичность, судя по массе тела животного и общему поведению животных (фиг.2В), что свидетельствует о превосходной переносимости у испытуемых видов животных.
Все публикации и патентные документы, приведенные в настояем описании, включены в настоящее описание в качестве ссылки, как если бы каждая такая публикация или документ была конкретно и индивидуально указана для включения сюда в качествессылки. В случае конфликта между настоящим раскрытием и одним или несколькими документами, включенными в качестве ссылки, настоящее раскрытие должно быть главным. Цитирование публикаций и патентных документов не является признанием того, что какое-либо из них относится к предшествующему уровню техники, равно как и не является признанием содержания или даты публикации. Описанные в настоящем документе варианты осуществления, описанные посредством письменного описания, специалисты в данной области поймут, что описанные в настоящем документе варианты осуществления могут быть осуществлены на практике во множестве вариантов осуществления и что описание и примеры, представленные в настоящем описании, предназначены для иллюстрации, а не ограничения формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PRMT5 | 2018 |
|
RU2797822C2 |
| Соединения 1-циано-пирролидинов в качестве ингибиторов USP30 | 2016 |
|
RU2717238C2 |
| АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP | 2015 |
|
RU2672722C2 |
| ЦИКЛОАЛКИЛНИТРИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ЯНУС-КИНАЗЫ | 2014 |
|
RU2655380C2 |
| СОЕДИНЕНИЕ НА ОСНОВЕ ДИГИДРОНАФТИРИДИНОНА, И СПОСОБ ЕГО ПОЛУЧЕНИЯ, И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2021 |
|
RU2809869C1 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617988C2 |
| СПОСОБ ЛЕЧЕНИЯ | 2012 |
|
RU2621148C2 |
| Спироконденсированные пирролидиновые производные в качестве ингибиторов деубиквитилирующих ферментов (DUB) | 2017 |
|
RU2730552C2 |
| 6, 6-БИЦИКЛИЧЕСКИЕ КОЛЬЦЕВЫЕ ЗАМЕЩЕННЫЕ ГЕТЕРОБИЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ПРОТЕИНКИНАЗ | 2005 |
|
RU2379308C2 |


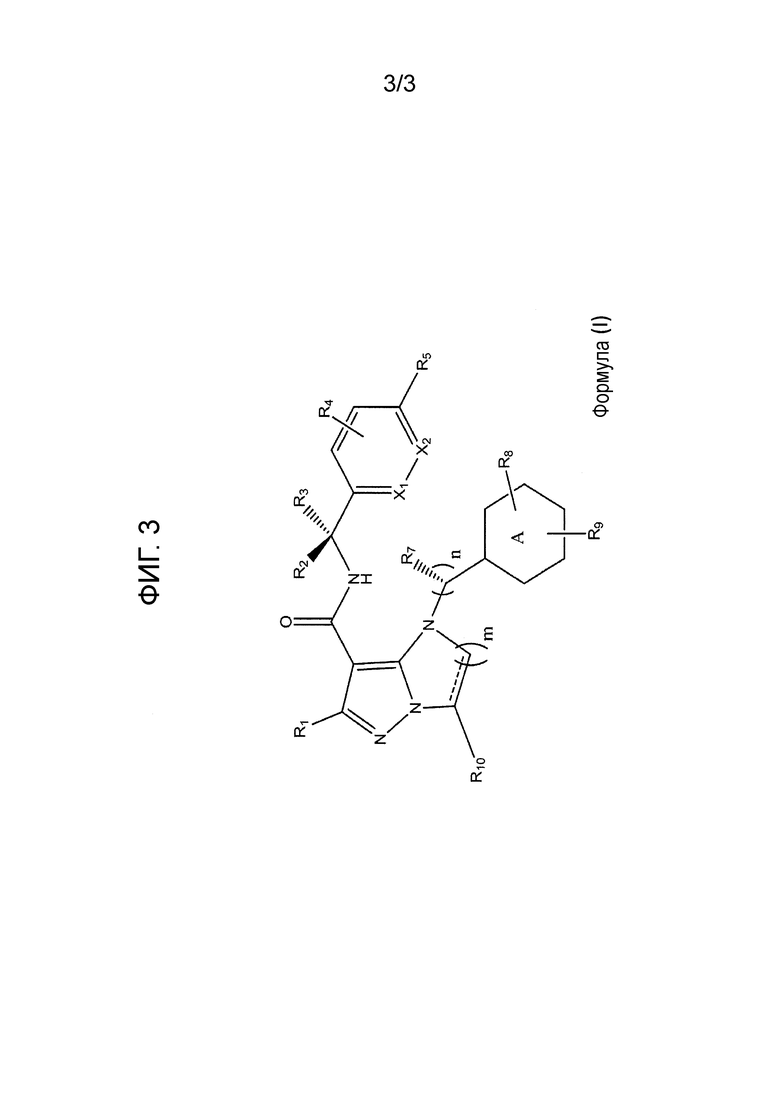
Изобретение относится к области органической химии, а именно к гетероциклическому соединению формулы (I) или его фармацевтически приемлемой соли, где R1 представляет собой -CH3, -CF3, -CH2CH3, -CH2F, CF2CH2OH, -CHF2, -CH=CH2, -CH2OH или фенил; R2 представляет собой -H, -CH2OН или -CH3; R3 представляет собой -H или R2 и R3, взятые вместе, образуют циклопропил с углеродом, к которому они прикреплены; R4 представляет собой -H, -F или -CH3; R5 представляет собой -C(O)OH, -C(O)OCH3, -CH2C(O)OH, циклопропил, -C(O)NHCN, 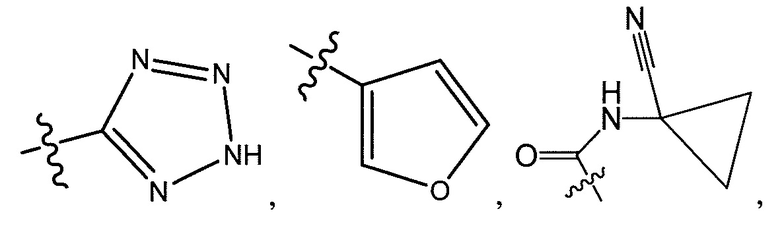 или
или  ; где R6 представляет собой фенил, -CH3, циклопропил,
; где R6 представляет собой фенил, -CH3, циклопропил,  или
или  ; n равен 0-1; m равен 1-2; R7 представляет собой -H, -CH3 или отсутствует, когда n равно 0; R8 представляет собой -CF3, -H, -Cl, -F, -CH2CH3, -OCH3, -CH3, -SCH3, -CH2OH, -CH2F, -CH2Cl, -I, -Br, -NH2, -CH2OCH2CH2F, -OCH2CH2F, -CH2CH2CH2F, -OCF3, -OH, -N(CH3)2, -CF2CH2OН или
; n равен 0-1; m равен 1-2; R7 представляет собой -H, -CH3 или отсутствует, когда n равно 0; R8 представляет собой -CF3, -H, -Cl, -F, -CH2CH3, -OCH3, -CH3, -SCH3, -CH2OH, -CH2F, -CH2Cl, -I, -Br, -NH2, -CH2OCH2CH2F, -OCH2CH2F, -CH2CH2CH2F, -OCF3, -OH, -N(CH3)2, -CF2CH2OН или  , или связь, соединяющая R8 и кольцо A, представляет собой двойную связь и R8 представляет собой CH2; R9 представляет собой -H, -Cl или -CF3; R10 представляет собой -H, -CH3, -CH2F, -CH2OН или -CH2OCH2-фенил; X1 и X2 представляют собой или оба C, или один представляет собой C, а другой представляет собой N;
, или связь, соединяющая R8 и кольцо A, представляет собой двойную связь и R8 представляет собой CH2; R9 представляет собой -H, -Cl или -CF3; R10 представляет собой -H, -CH3, -CH2F, -CH2OН или -CH2OCH2-фенил; X1 и X2 представляют собой или оба C, или один представляет собой C, а другой представляет собой N;  представляет собой одинарную связь или двойную связь и кольцо А представляет собой фенил или циклогексил. Также изобретение относится к фармацевтической композиции на его основе. Технический результат: получены новые гетероциклические соединения, обладающие антагонистической активностью в отношении рецептора 4 простагландина Е (ЕР4). 2 н. и 27 з.п. ф-лы, 5 ил., 1 табл., 104 пр.
представляет собой одинарную связь или двойную связь и кольцо А представляет собой фенил или циклогексил. Также изобретение относится к фармацевтической композиции на его основе. Технический результат: получены новые гетероциклические соединения, обладающие антагонистической активностью в отношении рецептора 4 простагландина Е (ЕР4). 2 н. и 27 з.п. ф-лы, 5 ил., 1 табл., 104 пр.
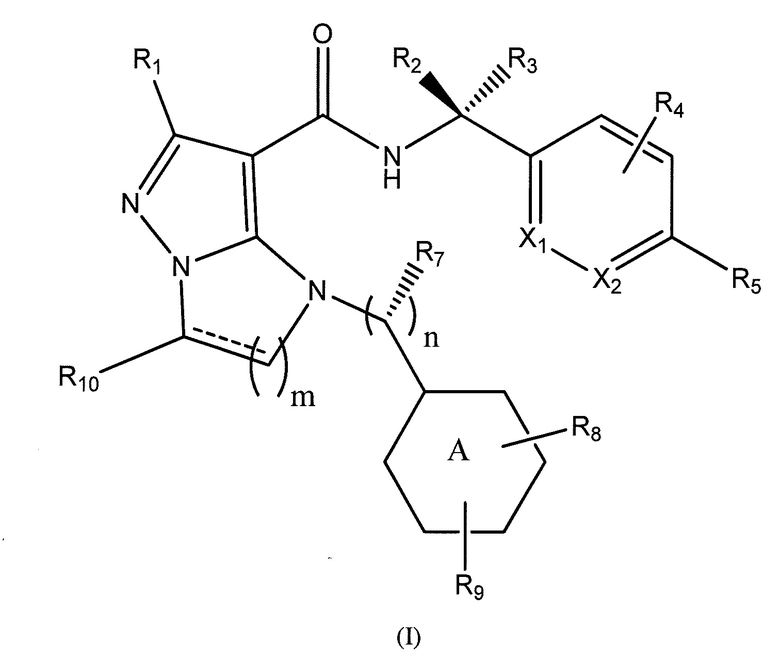
1. Соединение по формуле (I):
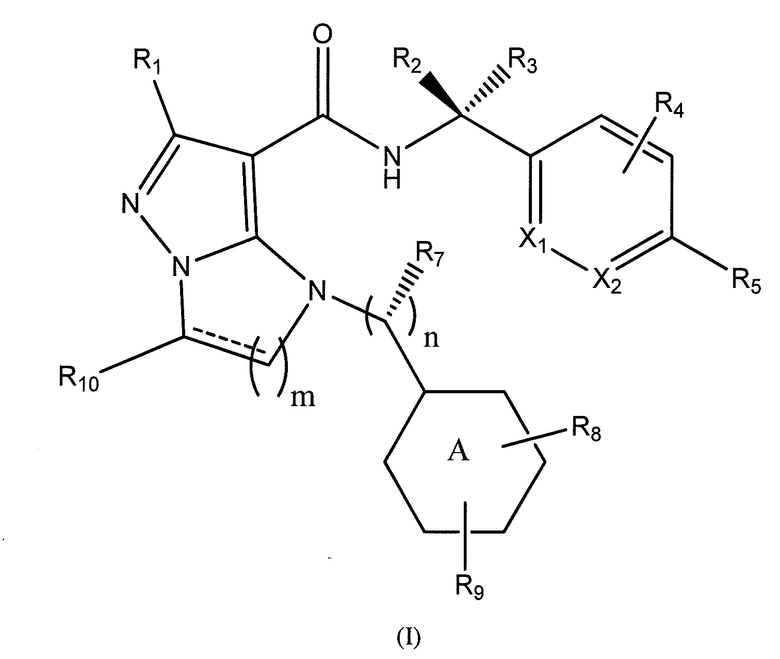
или его фармацевтически приемлемая соль,
где
R1 представляет собой -CH3, -CF3, -CH2CH3, -CH2F, CF2CH2OH, -CHF2, -CH=CH2, -CH2OH или фенил;
R2 представляет собой -H, -CH2OН или -CH3;
R3 представляет собой -H;
или R2 и R3, взятые вместе, образуют циклопропил с углеродом, к которому они прикреплены;
R4 представляет собой -H, -F или -CH3;
R5 представляет собой -C(O)OH, -C(O)OCH3, -CH2C(O)OH, циклопропил, -C(O)NHCN,
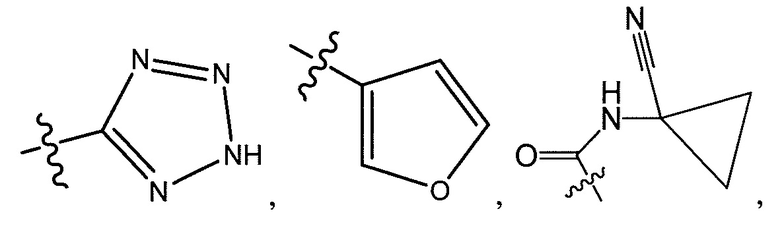
или 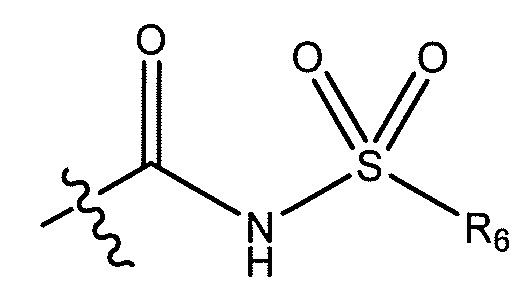 ;
;
где R6 представляет собой фенил, -CH3, циклопропил,
 или
или  ;
;
n равен 0-1;
m равен 1-2;
R7 представляет собой -H, -CH3 или отсутствует, когда n равно 0;
R8 представляет собой -CF3, -H, -Cl, -F, -CH2CH3, -OCH3, -CH3, -SCH3, -CH2OH, -CH2F, -CH2Cl, -I, -Br, -NH2, -CH2OCH2CH2F, -OCH2CH2F, -CH2CH2CH2F, -OCF3, -OH, -N(CH3)2, -CF2CH2OН или 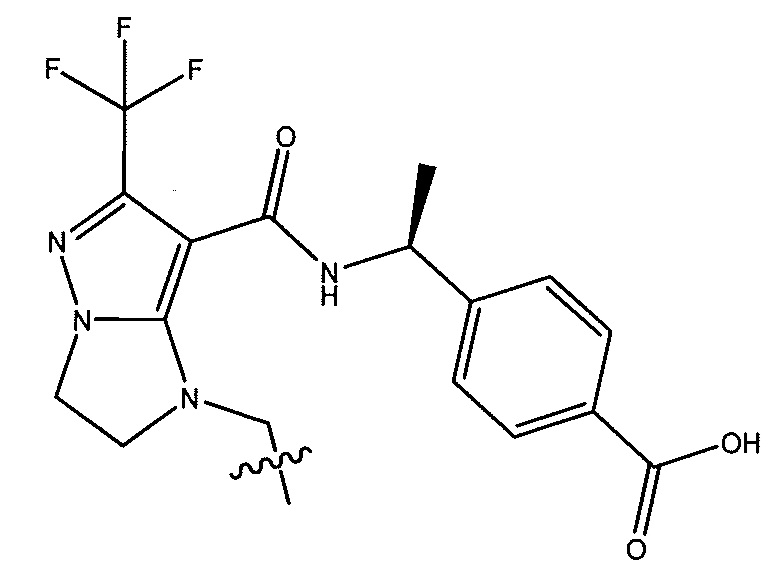 , или связь, соединяющая R8 и кольцо A, представляет собой двойную связь и R8 представляет собой CH2;
, или связь, соединяющая R8 и кольцо A, представляет собой двойную связь и R8 представляет собой CH2;
R9 представляет собой -H, -Cl или -CF3;
R10 представляет собой -H, -CH3, -CH2F, -CH2OН или -CH2OCH2-фенил;
X1 и X2 представляют собой или оба C, или один представляет собой C, а другой представляет собой N;
 представляет собой одинарную связь или двойную связь; и
представляет собой одинарную связь или двойную связь; и
кольцо А представляет собой фенил или циклогексил.
2. Соединение по п. 1, где соединение дано формулой (II):
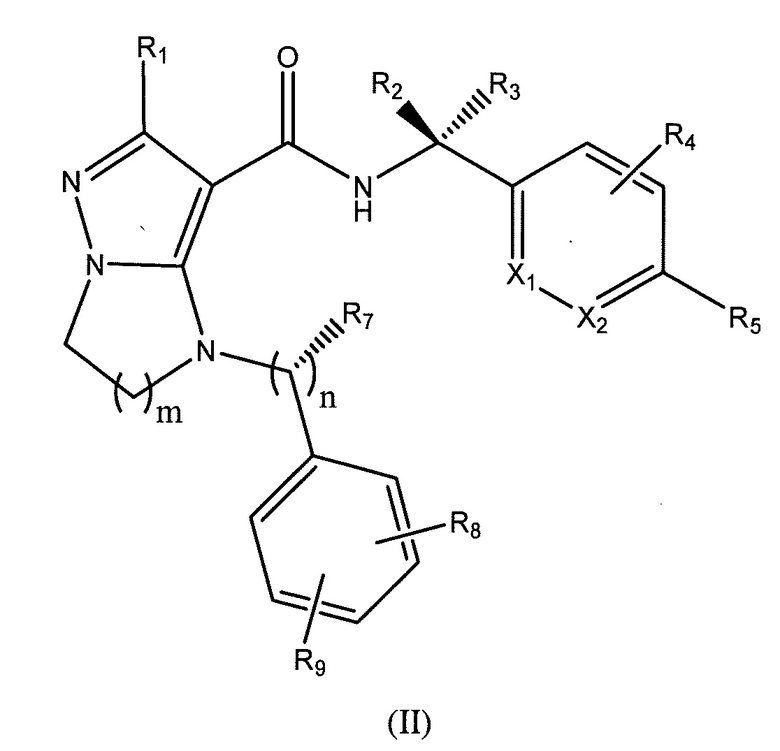
или его фармацевтически приемлемая соль,
где
R1 представляет собой -CH3, -CF3, -CH2CH3 или фенил;
R2 представляет собой -Н или -CH3;
R3 представляет собой -H;
или R2 и R3, взятые вместе, образуют циклопропил с углеродом, к которому они прикреплены;
R4 представляет собой -H, -F или -CH3;
R5 представляет собой -C(O)OH, -C(O)OCH3, -CH2C(O)OH, циклопропил, -C(O)NHCN,
или  ;
;
где R6 представляет собой фенил, -CH3, циклопропил или
 ;
;
m равен 1-2;
n равен 0-1;
R7 представляет собой -H, -CH3 или отсутствует, когда n равен 0;
R8 представляет собой -CF3, -H, -Cl, -F, -CH2CH3, -OCH3, -CH3 или -OCF3;
R9 представляет собой -H, -Cl или -CF3; и
X1 и X2 представляют собой или оба C, или один представляет собой C, а другой представляет собой N.
3. Соединение по п. 1, где R10 представляет собой -H.
4. Соединение по п. 1, где 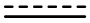 представляет собой одинарную связь.
представляет собой одинарную связь.
5. Соединение по п. 1, где X1 и X2 представляют собой углерод.
6. Соединение по п. 1, где R1 представляет собой -CF3.
7. Соединение по п. 1, где m равен 1.
8. Соединение по п. 1, где R2 представляет собой метил и R3 представляет собой -H.
9. Соединение по п. 1, где X1 и X2 оба представляют собой C.
10. Соединение по п. 1, где R4 представляет собой -H.
11. Соединение по п. 1, где n равен 1.
12. Соединение по п. 1, где R7 представляет собой -H.
13. Соединение по п. 1, где R9 представляет собой -H.
14. Соединение по п. 1, где R8 представляет собой -CF3.
15. Соединение по п. 1, где R5 представляет собой -C(O)OH.
16. Соединение по п. 1, где R4 представляет собой -F.
17. Соединение по п. 1, где R8 представляет собой -Cl.
18. Соединение по п. 1, где R5 представляет собой -C(O)OH, -C(O)OCH3, -CH2C(O)OH, -C(O)NHCN,
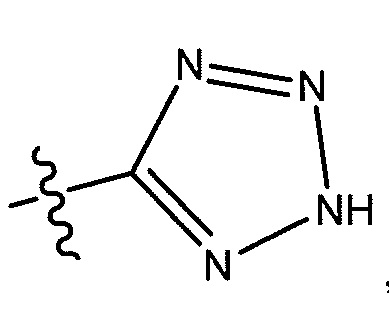 или
или 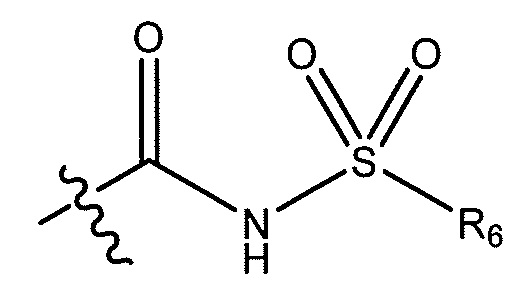 .
.
19. Соединение по п. 1, где m равен 2 и где R8 и R9, если они присутствуют, находятся в мета-положении или в пара-положении.
20. Соединение по п. 1 или его фармацевтически приемлемая соль, указанное соединение, выбранное из группы, состоящей из:
(S)-4-(1-(1-(3-(метилтио)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-(гидроксиметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-(фторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-(хлорметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
4,4'-((1S,1'S)-((1,1'-(1,3-фениленбис(метилен))бис(6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-1,7-диил-7-карбонил))бис(азанедиил))бис(этан-1,1-диил))дибензойной кислоты;
(S)-4-(1-(1-(4-иод-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-иодбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-бензил-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-N-(1-(4-(((4-нитрофенил)сульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
(S)-4-(1-(1-(4-аминобензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-N-(1-(4-(((4-аминофенил)сульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
(S)-4-(1-(1-(3-((2-фторэтокси)метил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-(2-фторэтокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-гидрокси-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-фтор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-((4-(фторметил)циклогексил)метил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-((4-метиленциклогексил)метил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-(3-фторпропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(4-(3-фторпропил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-(3-фторпропил)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(4-(3-фторпропил)-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(6-(фторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(4-хлор-3-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(3-метил-6-(трифторметил)-1-(3-(трифторметил)бензил)-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
4-((S)-1-((S)-3-(фторметил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(4-гидроксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(R)-4-(2-гидрокси-1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(4-(диметиламино)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-(диметиламино)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-(диметиламино)-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(6-(1,1-дифтор-2-гидроксиэтил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-N-(1-(4-((1-цианоциклопропил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
4-((S)-1-((S)-3-(гидроксиметил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
4-((S)-1-((S)-3-((бензилокси)метил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-бром-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(6-(дифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-(трифторметил)бензил)-6-винил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(6-(гидроксиметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты; и
(S)-4-(1-(1-(3-(1,1-дифтор-2-гидроксиэтил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты.
21. Соединение по п. 2 или его фармацевтически приемлемая соль, указанное соединение, выбранное из группы, состоящей из:
(S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
метил (S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата;
(S)-4-(1-(6-(трифторметил)-1-(2-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3,5-бис(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-хлор-5-(трифторметил)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3,5-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(4-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-метоксибензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(4-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3,4-дихлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(4-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(2-фторбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(4-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(2-метилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(4-этилбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-2-фтор-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-3-фтор-4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-3-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-2-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
метил (S)-2-фтор-4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензоата;
(S)-2-(4-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)фенил)уксусной кислоты;
(S)-2-(4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)фенил)уксусной кислоты;
4-(1-(6-метил-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойной кислоты;
4-(1-(6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойной кислоты;
4-(1-(1-(4-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойной кислоты;
(S)-4-(1-(1-(4-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(4-хлорбензил)-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
4-((1-(4-хлорбензил)-6-метил-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)метил)бензойной кислоты;
(R)-4-(1-(6-метил-1-(1-(4-(трифторметил)фенил)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)циклопропил)бензойной кислоты;
4-((S)-1-(6-метил-1-((R)-1-(4-(трифторметил)фенил)этил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-N-(1-(4-(2H-тетразол-5-ил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
(S)-N-(1-(4-(2H-тетразол-5-ил)фенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
(S)-5-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)пиколиновой кислоты;
(S)-6-(1-(6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)никотиновой кислоты;
(S)-4-(1-(4-(4-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(4-(3-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(4-(2-хлорбензил)-2-(трифторметил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(2-(трифторметил)-4-(3-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(2-(трифторметил)-4-(4-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(2-(трифторметил)-4-(2-(трифторметил)бензил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(6-(трифторметил)-1-(4-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(6-(трифторметил)-1-(3-(трифторметил)фенил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(3-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(4-хлорфенил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(2-(трифторметил)-4-(4-(трифторметил)фенил)-4,5,6,7-тетрагидропиразоло[1,5-a]пиримидин-3-карбоксамидо)этил)бензойной кислоты;
(S)-N-(1-(4-(цианокарбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
(S)-N-(1-(4-(((3,4-дифторфенил)сульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
(S)-N-(1-(4-((фенилсульфонил)карбамоил)фенил)этил)-1-(3-(трифторметокси)бензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
(S)-N-(1-(4-((метилсульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
(S)-N-(1-(4-((циклопропилсульфонил)карбамоил)фенил)этил)-6-(трифторметил)-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
(S)-N-(1-(4-(фуран-3-ил)фенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
(S)-N-(1-(4-циклопропилфенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
(S)-N-(1-(3-метил-4-(2H-тетразол-5-ил)фенил)этил)-6-(трифторметил)-1-(4-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамида;
(S)-4-(1-(6-этил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты;
(S)-4-(1-(1-(2-хлорбензил)-6-(трифторметил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты; и
(S)-4-(1-(6-фенил-1-(3-(трифторметил)бензил)-2,3-дигидро-1H-имидазо[1,2-b]пиразол-7-карбоксамидо)этил)бензойной кислоты.
22. Соединение п. 1, где соединение имеет структуру формулы (III):
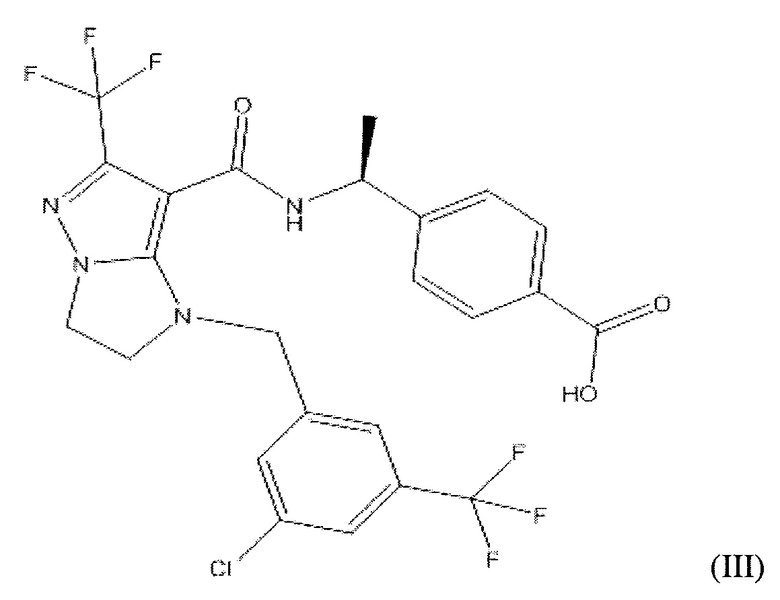
или его фармацевтически приемлемая соль.
23. Соединение п. 1, где соединение имеет структуру формулы (IV):
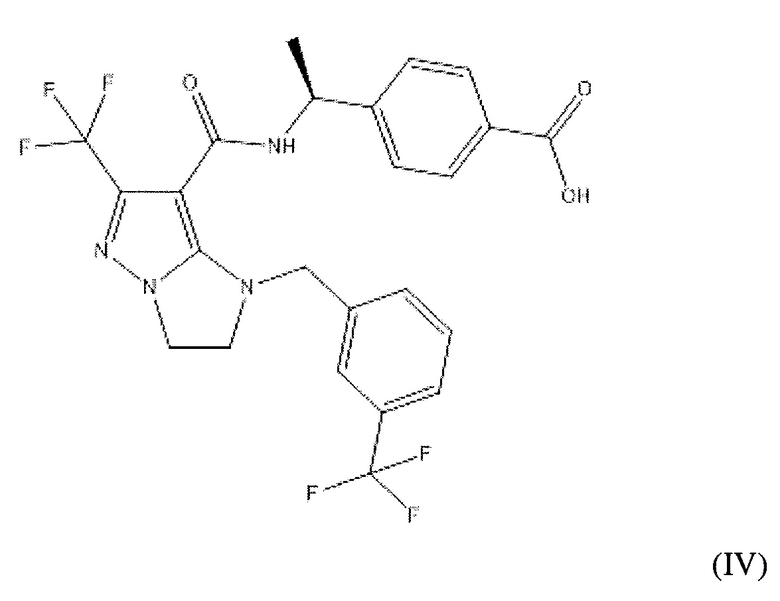
или его фармацевтически приемлемая соль.
24. Соединение п. 1, где соединение имеет следующую структуру:
или его фармацевтически приемлемая соль.
25. Соединение по п. 1, где соединение имеет следующую структуру:
или его фармацевтически приемлемая соль.
26. Соединение по п. 23, представляющее собой соединение следующей структуры:
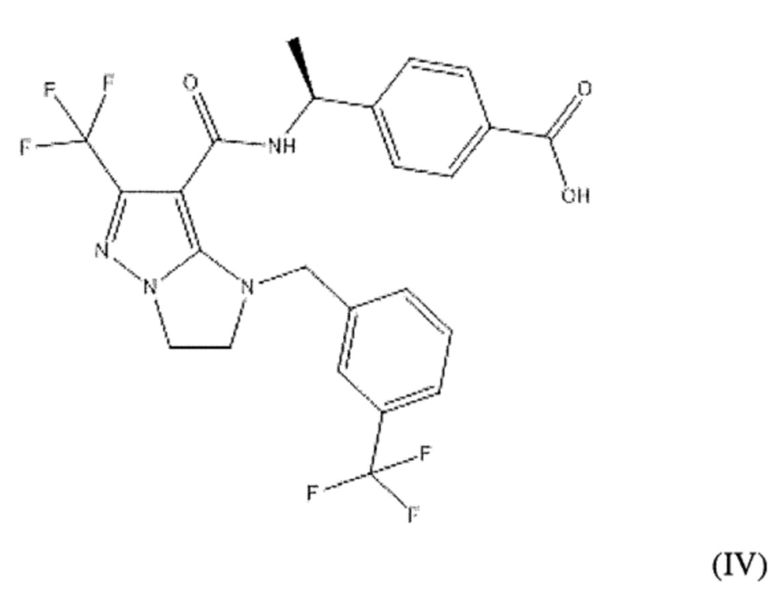
27. Соединение по п. 24, представляющее собой соединение следующей структуры:

28. Соединение по п. 25, представляющее собой соединение следующей структуры:

29. Фармацевтическая композиция, обладающая антагонистической активностью в отношении рецептора 4 простагландина E (EP4), содержащая эффективное количество соединения или его фармацевтически приемлемой соли по любому из пп. 1-28 и фармацевтически приемлемый эксципиент.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| JP 2004277337 A, 07.10.2004 | |||
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE10 | 2011 |
|
RU2543386C2 |
Авторы
Даты
2021-12-07—Публикация
2016-10-14—Подача