Изобретение относится к медицине, сосудистой хирургии, может быть использовано для пластики магистральных сосудов у экспериментальных животных.
Известен способ пластики кровеносных сосудов, заключающийся в закрытии дефекта аорты или магистральных артерий трансплантатом из вены пуповины человека, который закрепляют на области дефекта обвивным швом из шелковой или синтетической нити. Однако данный способ имеет следующие недостатки: необходимо полное выделение сосуда в экстремальных условиях, наличие консервированного трансплантата, частое образование аневризм в месте анастомоза или прорезывание швов с последующим кровотечением, что чревато геморрагическим шоком или летальным исходом [1].
Известен способ протезирования ветвей почечной артерии с использованием внутренней подвздошной артерии [2]. Техника операции заключается в следующем. Сосуды почки пересекают с сохранением максимально возможной длины. Накладывают дистальные анастомозы ветвей почечной артерии с ветвями внутренней подвздошной артерии "конец в конец" с одновременным проведением трансартериальной гипотермической перфузии /Т8-12С/. Выполняют проксимальный анастомоз ствола внутренней подвздошной артерии с аортой "конец в бок", сшивают почечную вену.
Недостатками этого способа являются ограниченность использования внутренней подвздошной артерии в связи с сочетанными поражениями почечных артерий и подвздошно-бедренных сегментов, функциональной значимостью в кровоснабжении нижней конечности и органов таза, большая травматичность и удлинение времени операции.
Также известен способ пластики почечной артерии U-образным венозным трансплантатом [3]. Техника заключается в следующем. Выполняют забор большой подкожной вены бедра с притоком, выделяют почечную артерию, осуществляют ее резекцию, инверсионно аутовену анастомозируют с ветвями почечной артерии "конец в конец" после разрушения венозных клапанов, накладывают проксимальный анастомоз ствола большой подкожной вены с аортой "конец в бок".
Однако известный способ имеет значительные ограничения при его осуществлении из-за трудностей в подборе U-образного трансплантата и его вшивании. Кроме того, наличие венозных клапанов, разрушаемых в период подготовки аутотрансплантата для пластики почечной артерии, усложняет выполнение операции и не гарантирует от осложнений в послеоперационном периоде, связанных с недостаточно полным разрушением клапанов и травматизацией интимы.
Наиболее близким по технической сущности является способ пластики сонной артерии, заключающийся в замещении дефекта с помощью аутотрансплантата, выкроенного из височного апоневроза. Однако данный способ имеет недостатки: необходимо дополнительное время для выкраивания лоскута из височного апоневроза, полное выделение сосуда в условиях обильного кровотечения, частое тромбирование сосудистой конструкции по причине контакта тромбоцитов с инородной поверхностью трансплантата, рубцовое сужение сосуда [4].
Новый технический результат - сокращение времени закрытия дефекта, снижение числа осложнений, связанных с кровопотерей, несостоятельностью шва, образованием стриктур, тромбированием сосудов.
Для достижения нового технического результата в способе пластики магистральных сосудов, включающем закрытие дефекта аутотрансплантатом, закрывают дефект лоскутом слизистой щеки, соразмерным по величине дефекту, при этом лоскут сшивают «край в край» прерывным узловым швом с краем сосуда.
Для подтверждения осуществления изобретения при указанном выше техническом результате проведены испытания на 17 беспородных кроликах весом 4500-5200 кг.
Операцию проводили в одно и то же время суток натощак. В качестве вводного и базисного наркоза применяли Золетил 0.2 мл, Ксилавет 0.4 мл внутривенно. Эксперимент проводили на абдоминальном отделе аорты, а именно: заброшенным доступом слева выделяли аорту в нижней ее трети. Остроконечным скальпелем наносили разрез по передней стенке аорты длиной, как и поперечный, так и продольный, диаметром от 1.5 до 2 мм. Заранее приготовленный лоскут слизистой щеки размером, не превышающим площадь дефекта в аорте, накладывали на сосуд.
Лоскут пришивали край в край прерывным узловым швом, после чего кровоток восстанавливался через 15-20 секунд. После остановки аортального кровотечения и тщательного гемостаза рану ушивали послойно наглухо. В ближайшем послеоперационном периоде (до 10 суток) осложнений не наблюдалось. Кормить начинали на вторые сутки.
Животных выводили из эксперимента в различные сроки после пластики кровеносных сосудов. Повторную операцию осуществляли под внутривенным наркозом Золетил 0.2 мл, Ксилавет 0.4 мл. После срединной лапаротомии производили резекцию терминального отдела брюшной аорты, отступали 8-10 мм дистально и проксимально от сосудистой конструкции из лоскута слизистой щеки. Забор материала осуществляли через 1, 2, 4, 6 месяцев от момента сосудистой пластики. Резецированную аорту помещали в раствор формалина с последующей окраской препаратов гематоксилин-эозином, по ван-Гизону, орсеином, серебром.
Результаты представлены на Фиг. 1-8.
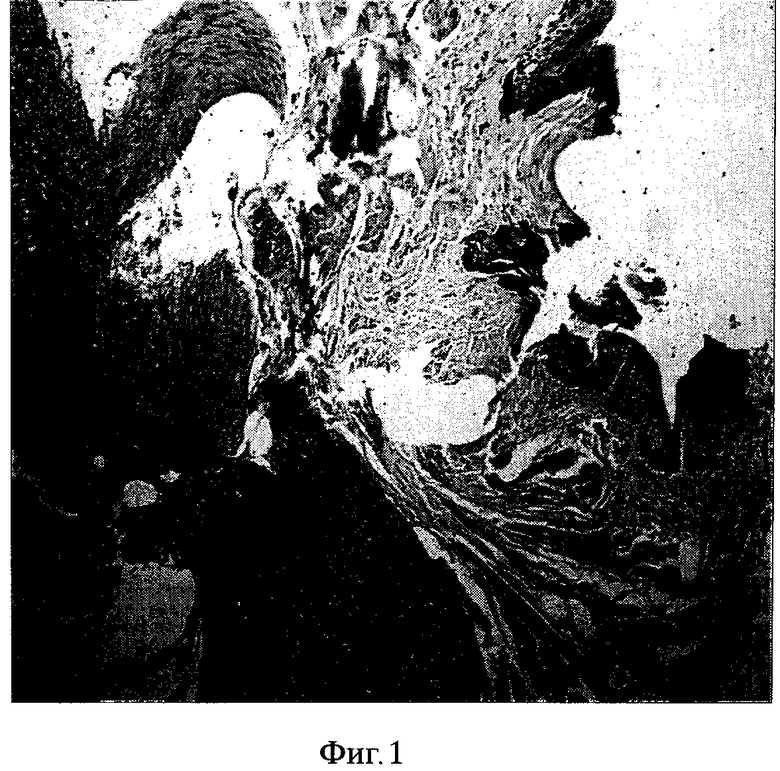
Фиг. 1. Окраска гематоксилином и эозином. Ув. XI50. (2 месяца после операции) В области дефекта стенки аорты определяется подшитый участок слизистой оболочки щеки с подслизистой основой с умеренно выраженным фиброзом и слабой неравномерной лимфоцитарной инфильтрацией. В пласте многослойного плоского неороговевающего эпителия выявляется гиперплазия клеток базального слоя. Морфологические признаки воспалительного процесса отсутствуют.
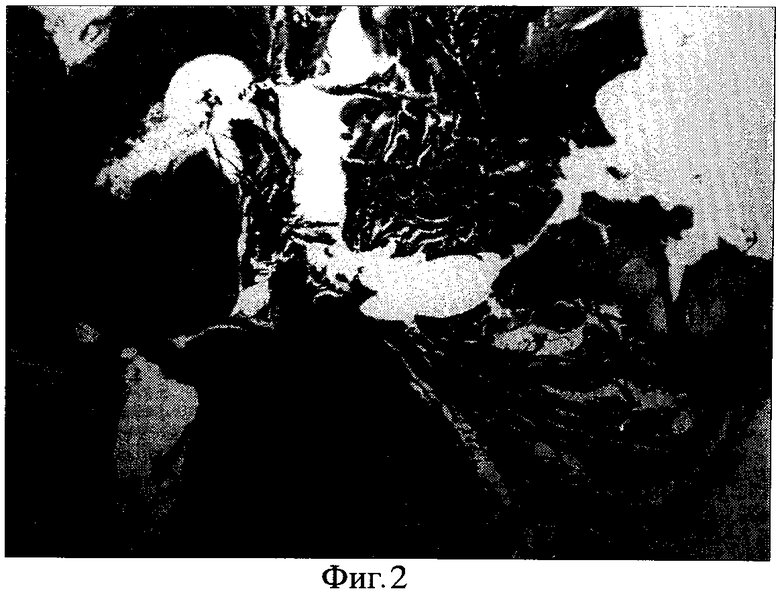
Фиг. 2. Окраска по Ван-Гизону. Ув. XI50. Фрагмент того же участка - определяется зрелая волокнистая соединительная ткань в подслизистой основе щеки, ярко окрашенная в интенсивный малиновый цвет. В зоне оперативного вмешательства в стенке сосуда также обнаруживается фиброз.
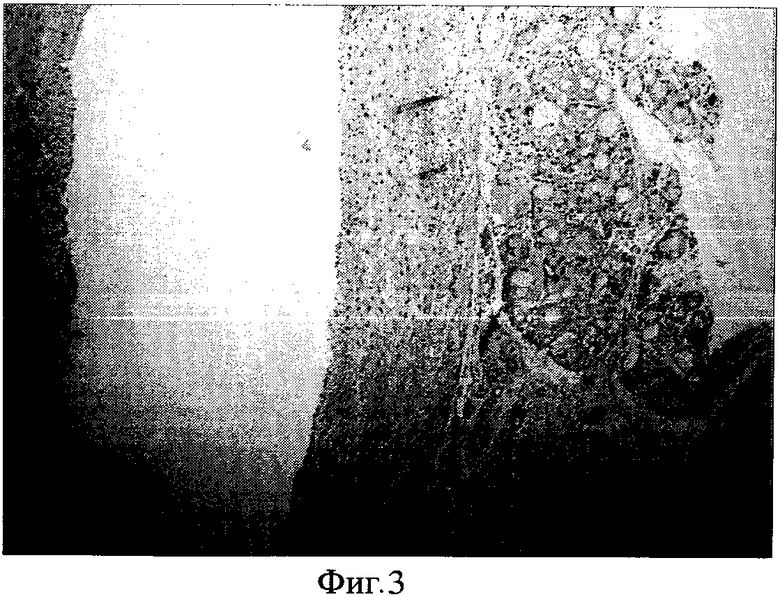
Фиг. 3. Окраска гематоксилином и эозином. Ув. XI50. (4 месяца после операции) В зоне оперативного вмешательства определяется созревающая отечная грануляционная ткань, богатая новообразованными сосудами капиллярного типа с неравномерной умеренно выраженной лимфогистиоцитарной и макрофагальной инфильтрацией. В правом нижнем углу препарата обнаруживаются неизмененные гладкомышечные элементы мышечной пластинки слизистой оболочки щеки.
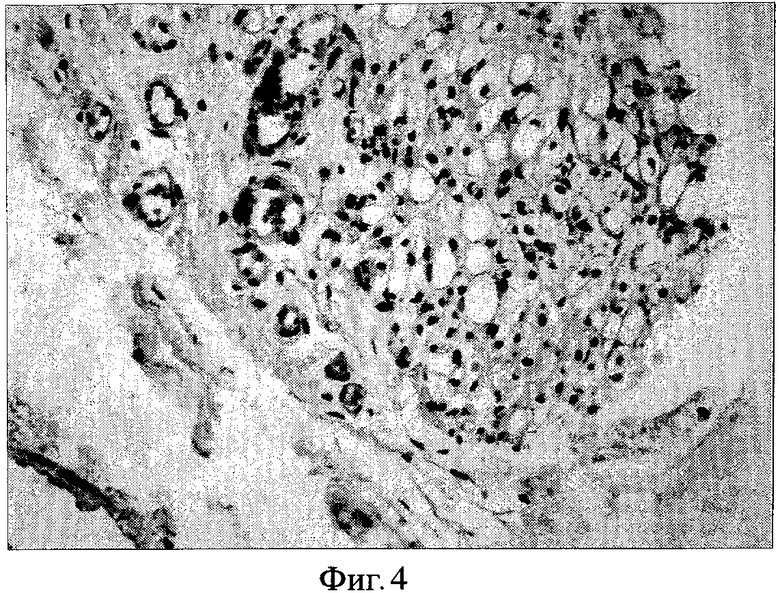
Фиг. 4. Окраска гематоксилином и эозином. Ув. Х400. (6 месяцев после операции) В адвентиции аорты обнаруживается созревающая грануляционная ткань с обилием капилляров, заполненных эритроцитами и отечной нежноволокнистой стромой с наличием лимфогистиоцитарных элементов, плазмоцитов и единичных лейкоцитов. Также заметны признаки регенерации жировой ткани в виде образования липобластов различного размера.
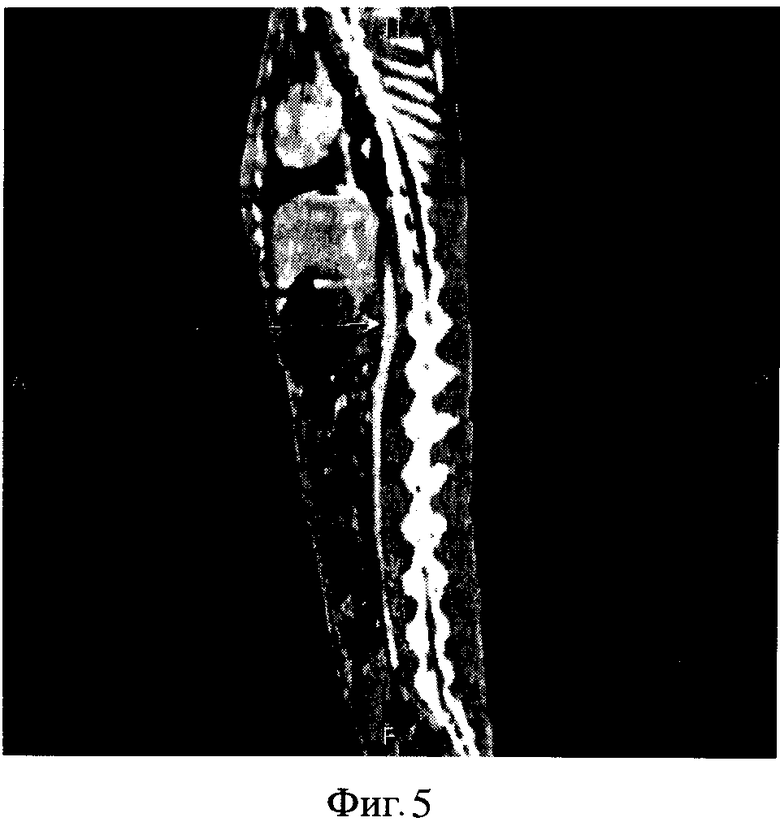
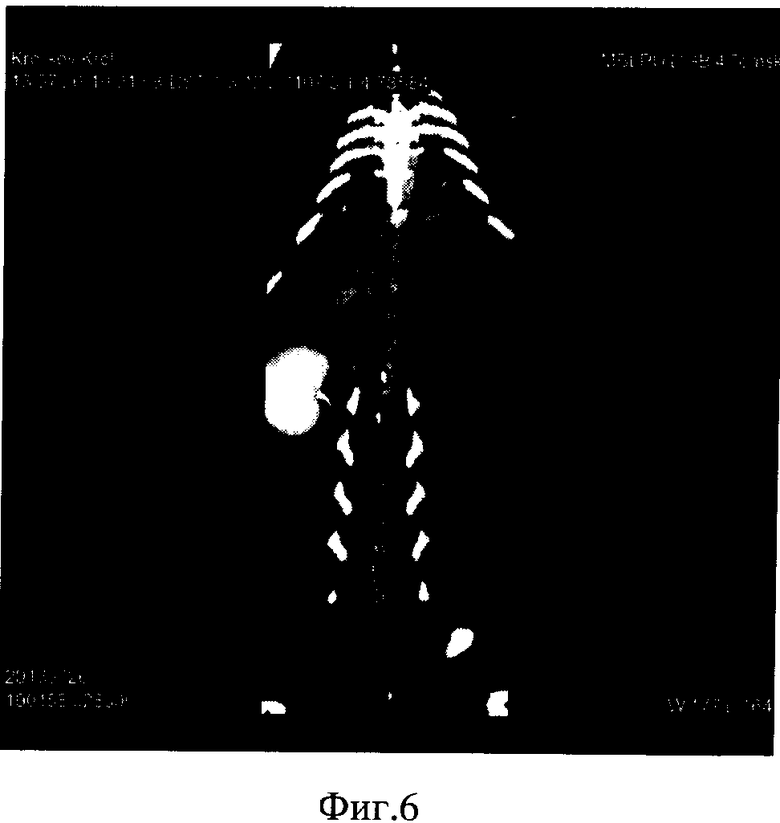
Фиг 5-7. СКТА проводили через 5 месяцев после операции.
СКТА грудной и брюшной аорты выполнено на фоне ручного введения урографина в дозе 4 мл толщиной среза до 1,5 мм. Уровни сканирования: от дуги аорты до подвздошных артерий. Положение: на спине. Скорость введения рассчитать затруднительно, введение выполнено ручным способом.
Аорта в восходящей дуге с четкими и ровными контурами диаметром до 8 мм, расположена типично. Дуга аорты диаметром до 6 мм, нисходящяя часть дуги аорты до 6 мм в диаметре.
Грудная аорта диаметром до 5 мм, прослеживается на всем протяжении до диафрагмы, стенозов и деформации контуров стенки не выявлено.
Брюшная аорта диаметром до 5 мм, прослеживается на всем протяжении без признаков наличия стенозов или аневризматических расширений.
Нижняя полая вена контрастировала хорошо, не расширена, диаметром до 4-6 мм, дефектов наполнения не выявлено, контуры ровные.
Исследование проведено через 6 месяцев после операции.
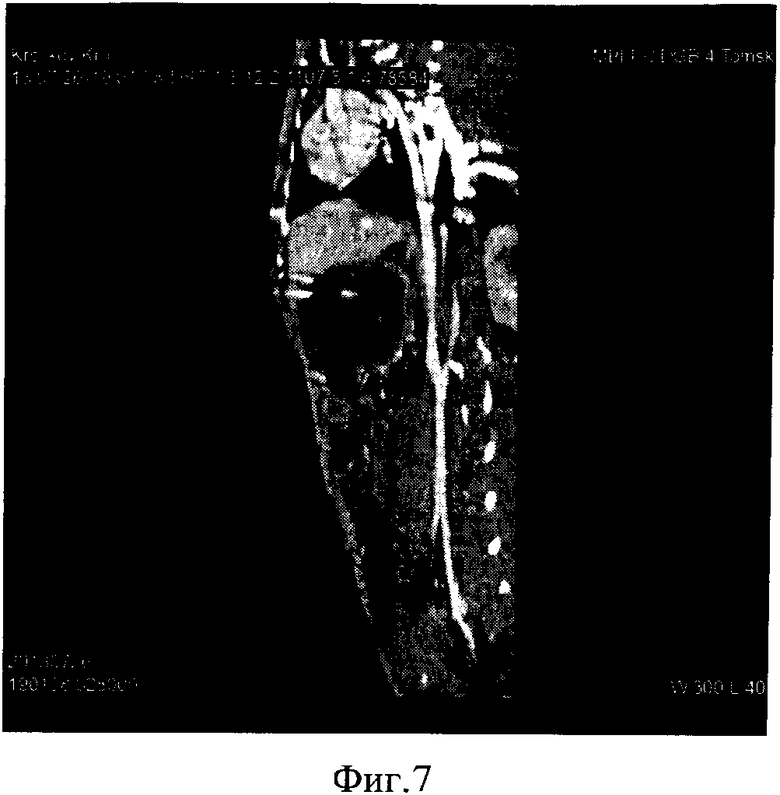
Фиг. 8. МРА аорты выполнена 29.05.2013 с болюсным контрастным усилением омнисканом в дозе 0,2 ммоль/мл (1,6 мл). Получены три фазы прохождения парамагнетика в режиме 3DFFE толщиной среза до 1,4 мм с интерполяцией. Кроме того, получены Т2 ВИ в сагиттальной проекции толщиной до 3 мм. Исследование выполнено в положении на спине.
На полученных ангиограммах визуализирован нисходящий отдел грудной аорты, брюшная аорта и начальные отделы подвздошных артерий. Грудная аорта диаметром до 4 мм с четкими и ровными контурами без признаков наличия в просвете дефектов, стенотических или аневризматических изменений.
Просвет верхнего отдела брюшной аорты с четкими и ровными контурами диаметром до 3-4 мм, в просвете дефектов усиления, стенозов или аневризматических расширений не выявлено.
Контрастное усиление просвета грудной и верхнего отдела брюшной аорты снижено, имеется артефакт от раннего сбора данных.
Начиная от уровня передней брыжеечной артерии, контрастное усиление удовлетворительное, четко определяются устья почечных артерий, их просветы диаметром 2-3 мм прослеживаются на всем протяжении до почечных синусов с обеих сторон. Нижний отдел брюшной аорты имеет минимальные гемодинамически незначимые дефекты по передней и левой боковой поверхности.
Подвздошные артерии не изменены. Таким образом, преимущество предлагаемого способа пластики артериального сосуда с помощью трансплантата из лоскута слизистой щеки заключается в следующем.
1. Повышается скорость закрытия дефекта.
2. Достигается полная остановка кровотечения из пораженного сосуда в течение 20-30 секунд.
3. Слизистая щеки представляет собой многослойный плоский эпителий. Она устойчива к растяжению и разрыву за счет большого количества соединительных связей и Lamina Propria и эпителием слизистой. Имеет благоприятные иммунологические свойства, резистентность к инфекциям.
6. Постоянная доступность, легкость забора лоскута. При надежном закреплении исключает деформацию сосуда.
Источники информации, принятые во внимание при составлении описания
1. Патент РФ №2099016, опубл. 20.12.1997. «Способ пластики кровеносных сосудов».
2. Kuestner L.М., Stoney R.J. The case for renal revascularization // Cardiovascular Surgery, 1995, vol. 3, N 2, p.141-154.1 Способ протезирования ветвей почечной артерии с использованием внутренней подвздошной артерии.
3. Novick A.C., Straffon R.A. Aortorenal Bypass with a Broached Saphenous Vein Graft for Renal Artery Disease Extending into this Branches // Surgery, 1979, vol. 85, N 2, p. 225-229. Способ пластики почечной артерии U-образным венозным трансплантатом.
4. Патент SU 935084, опубл 15.06.1982.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПЛАСТИКИ ЦИРКУЛЯРНЫХ ДЕФЕКТОВ АОРТЫ В ЭКСПЕРИМЕНТЕ | 1998 |
|
RU2147419C1 |
| СПОСОБ РЕКОНСТРУКЦИИ ВЕРХНИХ ОТДЕЛОВ АЭРОДИГЕСТИВНОГО ТРАКТА | 2014 |
|
RU2565830C1 |
| СПОСОБ ПЛАСТИЧЕСКОГО УКРЫТИЯ ЦИРКУЛЯРНЫХ ДЕФЕКТОВ НИЖНЕЙ ПОЛОЙ ВЕНЫ | 2004 |
|
RU2283622C2 |
| СПОСОБ ПЛАСТИКИ КРОВЕНОСНЫХ СОСУДОВ | 1996 |
|
RU2099016C1 |
| СПОСОБ РЕКОНСТРУКЦИИ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ИЛИ ПИЩЕВАРИТЕЛЬНЫХ ПУТЕЙ | 2012 |
|
RU2523659C1 |
| СПОСОБ ФАРИНГОПЛАСТИКИ В УСЛОВИЯХ ДЕФИЦИТА ПЛАСТИЧЕСКОГО МАТЕРИАЛА | 2010 |
|
RU2427339C1 |
| СПОСОБ УРЕТЕРОПИЕЛОПЛАСТИКИ БУККАЛЬНЫМ ЛОСКУТОМ ПРИ СТРИКТУРЕ ВЕРХНЕЙ ТРЕТИ МОЧЕТОЧНИКА И ЛОХАНОЧНО-МОЧЕТОЧНИКОВОГО СЕГМЕНТА У ПАЦИЕНТОВ С ЕДИНСТВЕННОЙ ПОЧКОЙ ПРИ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК | 2024 |
|
RU2841225C1 |
| Способ хирургического лечения протяженных стриктур верхней трети мочеточника и лоханочно-мочеточникового сегмента | 2020 |
|
RU2738002C1 |
| Способ хирургического лечения рецидивных и постлучевых протяженных стриктур и облитераций нижней трети мочеточника | 2019 |
|
RU2709167C1 |
| СПОСОБ ФОРМИРОВАНИЯ ТОЛСТОКИШЕЧНО-САЛЬНИКОВОГО АУТОТРАНСПЛАНТАТА | 2003 |
|
RU2254066C1 |

Изобретение относится к медицине, сосудистой хирургии. Выполняют закрытие дефекта аутотрансплантатом. При этом в качестве аутотрансплантата используют лоскут слизистой щеки, соразмерный по величине дефекту. Лоскут пришивают «край в край» прерывным узловым швом с краем сосуда. Способ позволяет сократить время закрытия дефекта, снизить число осложнений, связанных с кровопотерей, предотвратить несостоятельность шва и образование стриктур. 8 ил.
Способ пластики магистральных сосудов, включающий закрытие дефекта аутотрансплантатом, отличающийся тем, что закрывают дефект лоскутом слизистой щеки, соразмерным по величине дефекту, при этом лоскут сшивают «край в край» прерывным узловым швом с краем сосуда.
| Способ пластики кровеносных сосудов | 1978 |
|
SU935084A1 |
| СПОСОБ УРЕТРОПЛАСТИКИ | 2009 |
|
RU2391921C1 |
| Гончаров Д В и др., Сравнительная оценка репарации роговицы при конъюнктивальной кератопластике собак, Материалы Всероссийского ветеринарного конгресса, 13-го Международного Московского ветеринарного конгресса по болезням мелких домашних животных, М., 2005 - С 120 | |||
| Kuestner L | |||
| M., Stoney R | |||
| J. | |||
Авторы
Даты
2015-11-20—Публикация
2014-04-30—Подача