Перекрестная ссылка на родственные заявки
[0001] Настоящая заявка заявляет приоритет предварительной Заявки США № 61/301181, поданной 3 февраля 2010 года, и предварительной Заявки США № 61/412734, поданной 11 ноября 2010 года, полное содержание которых включено в настоящую заявку посредством ссылки.
Предпосылки изобретения
[0002] Амид-гидролаза жирных кислот (FAAH), также называемая олеамидгидролазой и анандамид-амидогидролазой, представляет собой цельный мебранный белок, ответственный за гидролиз некоторых важных эндогенных нейромодулирующих амидов жирных кислот (FAA), включая анандамид, олеоилэтаноламид и пальмитоилэтаноламид, и тесно вовлечена в их регуляцию. Поскольку эти FAA взаимодействуют с каннабиноидными и валлиноидными рецепторами, их часто называют "эндоканнабиноидами" или "эндоваллиноидами". Первоначально интерес в этой области был сфокусирован на разработке ингибиторов FAAH для усиления действия FAA и снижения боли. Дальнейшие исследования выявили, что ингибиторы FAAH, через взаимодействия FAA с уникальными внеклеточными и внутриклеточными рецепторами, можно использовать для лечения различных состояний, которые включают, но не ограничиваются этим, воспаление, метаболические расстройства (например, связанные с ожирением состояния и состояния истощения, такие как кахексии и анорексия), расстройства центральной нервной системы (например, расстройства, связанные с нейротоксичностью и/или нейротравмой, удар, рассеянный склероз, повреждение спинного мозга, двигательные расстройства, такие как расстройства, связанные с базальными ганглиями, амиотрофический боковой склероз, болезнь Альцгеймера, эпилепсия, психические расстройства, такие как беспокойство, депрессия, нарушения познавательной способности и шизофрения, расстройства сна, такие как бессонница, тошнота и/или рвота и наркомания), сердечные расстройства (например, гипертензия, шок, вызванный нарушением кровообращения, реперфузионнное поражение миокарда и атеросклероз) и глаукома (Pacher et al., "The Endocannabinoid System as an Emerging Target of Pharmacotherapy" Pharmacological Reviews (2006) 58:389-462; Pillarisetti et al., "Pain and Beyond: Fatty Acid Amides and Fatty Acid Amide Hydrolase Inhibitors in Cardiovascular and Metabolic Diseases" Drug Discovery Today (2009) 597: 1-14).
Краткое описание изобретения
[0003] Соединение 1 является сильным ингибитором FAAH, и поэтому является полезным для лечения состояний, опосредованных FAAH.
[0004] В настоящей заявке представлены, среди прочего, кристаллическое Соединение 1, его фармацевтически приемлемые соли, гидраты или сольваты и/или его ангидриды, улучшенные способы получения Соединения 1, фармацевтические композиции, включающие Соединение 1 и/или его ангидриды, и способы их применения для лечения FAAH-опосредованных состояний. Такие и другие варианты воплощения описаны в настоящей заявке.
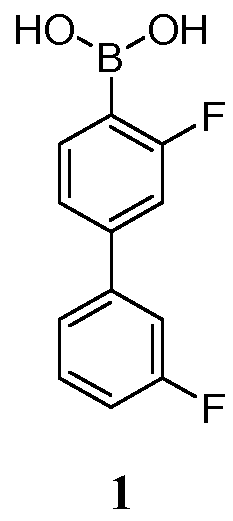
[0005] Например, в одном аспекте, обеспечивается кристаллическое Соединение 1 или его фармацевтически приемлемая соль, гидрат или сольват.
[0006] В некоторых вариантах воплощения, кристаллическое Соединение 1, по существу, свободно от любого из следующих соединений:
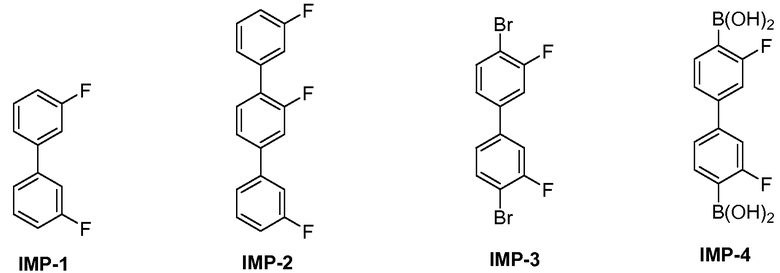
[0007] В некоторых вариантах воплощения, кристаллическое Соединение 1, по существу, свободно от аморфного Соединения 1.
[0008] В некоторых вариантах воплощения, кристаллическое Соединение 1, по существу, свободно от других кристаллических форм Соединения 1.
[0009] В некоторых вариантах воплощения, кристаллическое Соединение 1, по существу, свободно от одного или нескольких ангидридов Соединения 1.
[0010] В некоторых вариантах воплощения, один или несколько ангидридов выбраны из Соединения 2:
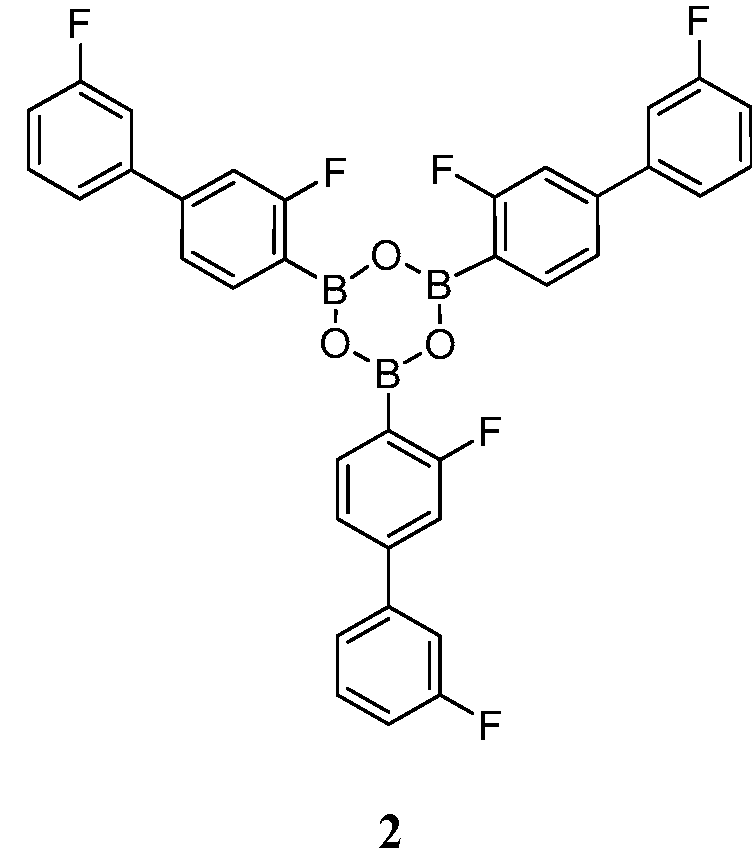
или его фармацевтически приемлемой соли, гидрата или сольвата.
[0011] В некоторых вариантах воплощения, кристаллическое Соединение 1 является чистым и отдельно выделенным.
[0012] В некоторых вариантах воплощения, кристаллическое Соединение 1 представляет собой кристаллическую Форму A, имеющую, по меньшей мере, одну из следующих характеристик:
(i) одну или несколько температур перехода, выбранных из около 128±5°C и около 244±2°C, как определено методом дифференциальной сканирующей калориметрии (ДСК);
(ii) один или несколько пиков на рентгеновской порошковой дифрактограмме (XRPD), выбранный из 9,68±0,10, 17,26±0,10, 21,60±0,10, 24,68±0,10, 25,48±0,10, 27,73±0,10 и 29,08±0,10 θ 2θ (градусов);
(iii) рентгеновскую порошковую дифрактограмму (XRPD), по существу, аналогичную той, которая представлена на Фиг.1, 19A, 22 или 23; и/или
(iv) сканограмму, полученную методом дифференциальной сканирующей калориметрии (ДСК), по существу, аналогичную той, которая представлена на Фиг.2.
[0013] В другом аспекте, также обеспечивается ангидрид Соединения 1, также указанный в настоящей заявке как Соединение 2:
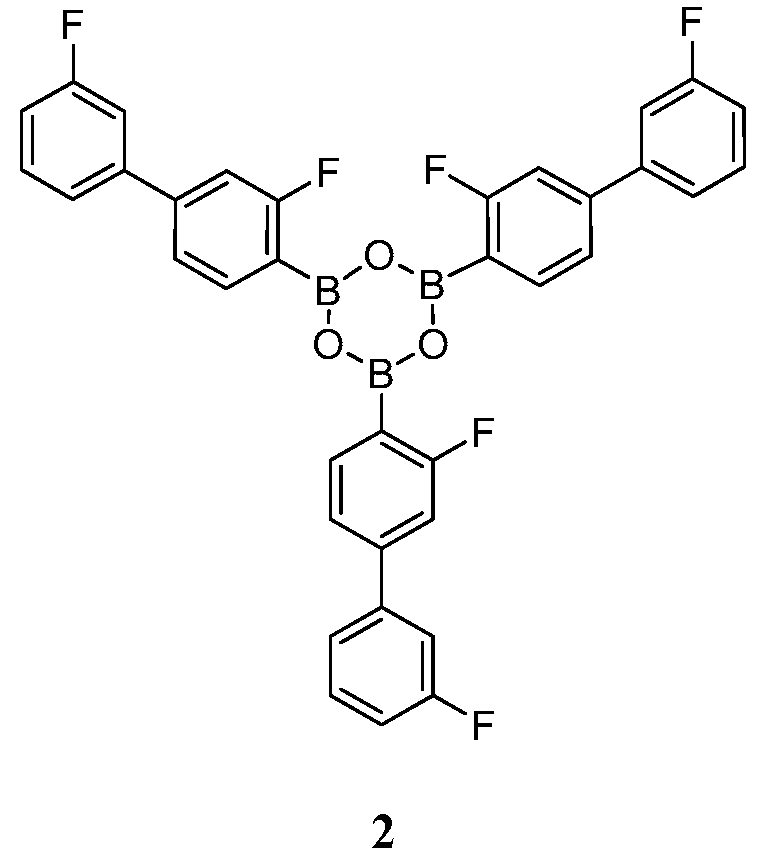
или его фармацевтически приемлемая соль, гидрат или сольват.
[0014] В некоторых вариантах воплощения, Соединение 2 обеспечивается как кристаллическое Соединение 2 или его фармацевтически приемлемая соль, гидрат или сольват.
[0015] В некоторых вариантах воплощения, кристаллическое Соединение 2, по существу, свободно от любого из следующих соединений:
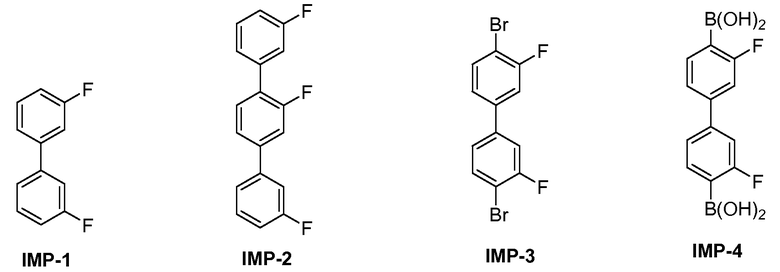
[0016] В некоторых вариантах воплощения, кристаллическое Соединение 2, по существу, свободно от аморфного Соединения 2.
[0017] В некоторых вариантах воплощения, кристаллическое Соединение 2, по существу, свободно от других кристаллических форм Соединения 2.
[0018] В некоторых вариантах воплощения, кристаллическое Соединение 2, по существу, свободно от Соединения 1 или его других ангидридов.
[0019] В некоторых вариантах воплощения, кристаллическое Соединение 2 является чистым и выделенным.
[0020] В некоторых вариантах воплощения, кристаллическое Соединение 2 представляет собой кристаллическую Форму I, имеющую, по меньшей мере, одну из следующих характеристик:
(i) одну или несколько температур перехода, выбранных из около 112±5°C и около 241±2°C, как определено методом дифференциальной сканирующей калориметрии (ДСК);
(ii) один или несколько пиков на рентгеновской порошковой дифрактограмме (XRPD), выбранный из 6,32±0,10, 12,69±0,10, 17,69±0,10, и 26,77±0,10;
(iii) рентгеновскую порошковую дифрактограмму (XRPD), по существу, аналогичную той, которая представлена на Фиг.8, 28 или 29; и/или
(iv) сканограмму, полученную методом дифференциальной сканирующей калориметрии (XRPD), по существу, аналогичную той, которая представлена на Фиг.18.
[0021] В другом аспекте, обеспечивается фармацевтическая композиция, включающая кристаллическое Соединение 1:
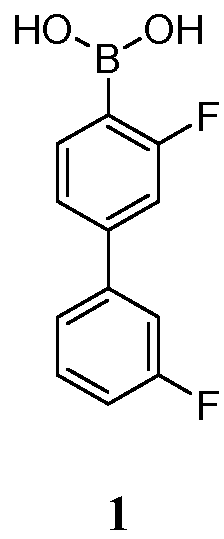
или его фармацевтически приемлемую соль, гидрат или сольват, и фармацевтически приемлемый эксципиент.
[0022] В некоторых вариантах воплощения, фармацевтическая композиция дополнительно включает кристаллическое Соединение 2:
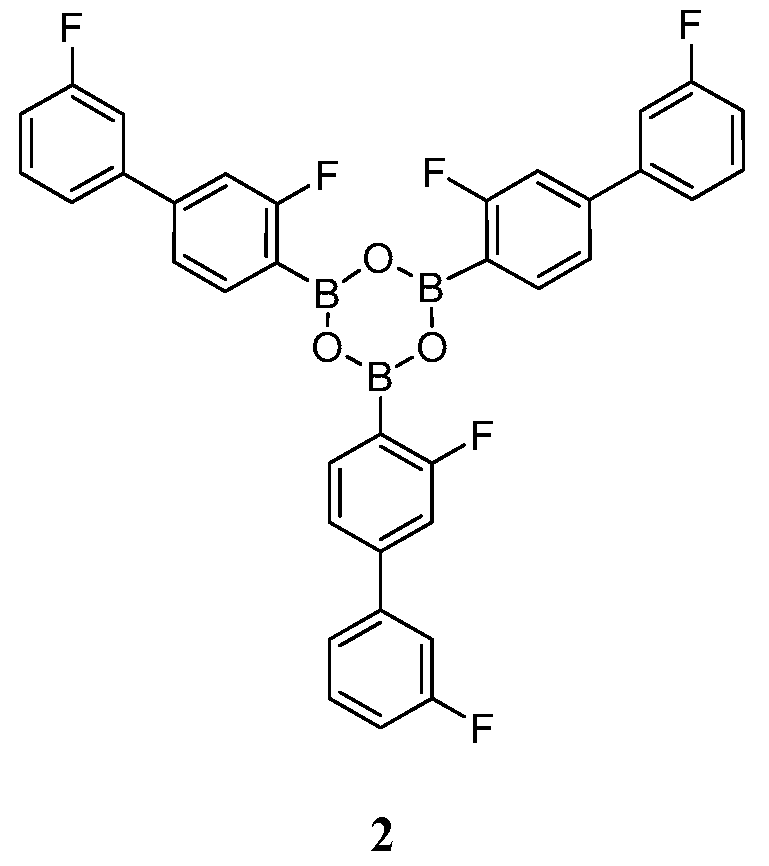
или его фармацевтически приемлемую соль, гидрат или сольват.
[0023] Еще в одном аспекте, обеспечивается способ получения Соединения 1:
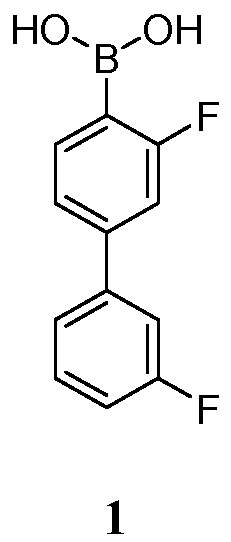
или его фармацевтически приемлемой соли, гидрата или сольвата;
включающий следующие стадии:
(a) взаимодействие соединения формулы E-1:
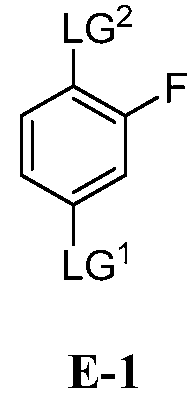
где:
LG1 и LG2 независимо выбраны из галогена или сульфоната;
с соединением формулы E-2:
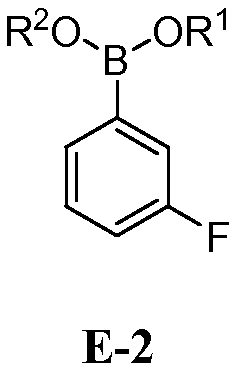
где каждый R1 и R2 независимо выбран из водорода или C1-6 алкильной, C2-6 алкенильной, C2-6 алкинильной, C6-12 арильной или C6-12 гетероарильной группы, или R1 и R2 объединены с образованием 5-8-членного кольца;
для получения соединения формулы E-3:
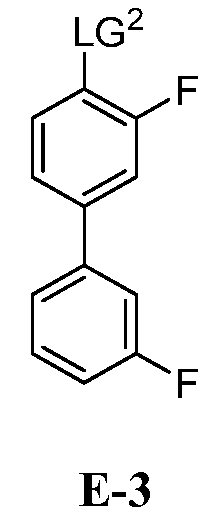
где:
LG2 выбран из галогена или сульфоната; и
(b) взаимодействие E-3 с боронообразующим реагентом и металлическим реагентом для получения Соединения 1.
[0024] В некоторых вариантах воплощения, способ дополнительно включает кристаллизацию Соединения 1 со стадии (b) с получением кристаллического Соединения 1.
[0025] В некоторых вариантах воплощения, стадия кристаллизации включает кристаллизацию Соединения 1 из полярного раствора, включающего воду, полярный апротонный растворитель или их смесь.
[0026] В некоторых вариантах воплощения, стадия кристаллизации включает кристаллизацию Соединения 1 из смеси воды и ацетона.
[0027] В некоторых вариантах воплощения, кристаллическое Соединение 1 дополнительно промывают неполярным раствором.
[0028] В некоторых вариантах воплощения, неполярный раствор включает гексаны, гептаны или их смесь.
[0029] В некоторых вариантах воплощения, E-1 представляет собой E-1b:
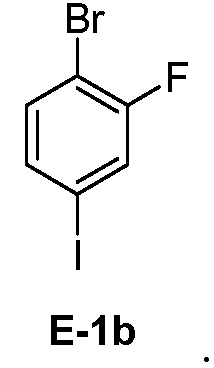
[0030] В некоторых вариантах воплощения, E-2 представляет собой E-2а:
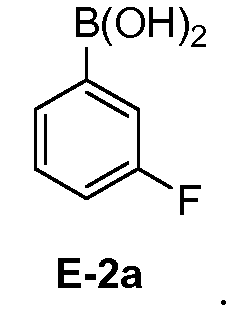
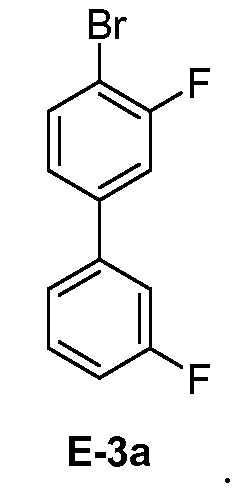
[0031] В некоторых вариантах воплощения, E-3 представляет собой E-3a:
[0032] В некоторых вариантах воплощения, стадия взаимодействия включает палладиевый катализатор. В некоторых вариантах воплощения, палладиевый катализатор выбран из Pd(PPh3)4, Pd(OAc)2, Pd2(dba)3, Pd(dppf)2Cl2, и PdCl2(PPh3)2.
[0033] В некоторых вариантах воплощения, стадия взаимодействия включает основание. В некоторых вариантах воплощения, основание выбрано из триэтиламина, диизопропилэтиламина, карбоната калия, карбоната натрия, карбоната цезия, бикарбоната калия, бикарбоната натрия, бикарбоната цезия, ацетата калия, ацетата натрия, фосфата калия, гидроксида лития, гидроксида натрия и гидроксида магния.
[0034] В некоторых вариантах воплощения, боронообразующий реагент представляет собой боронатный сложный эфир. В некоторых вариантах воплощения, боронатный сложный эфир выбран из триметилбората, триэтилбората, триаллилбората, триизопропилбората, трибутилбората, три-трет-бутилбората, трипентилбората, тригексилбората, тритолилбората, трибензилбората, трифенилбората, триметиленбората, триэтаноламинбората, триметаллилбората, 2-метокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана, 2-метокси-4,4,6-триметил-1,3,2-диоксаборинана, 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана, 2-изопропокси-4,4,6-триметил-1,3,2-диоксаборинана, 2-(2-диметиламиноэтокси)-4-метил-1,3,2-диоксаборинана, 2-бутокси-4,4,6-триметил-1,3,2-диоксаборинана, трис(2,2,2-трифторэтил)бората, трис(1-изопропил-2-метилпропил)бората и 2,2'-(2-метил-2,4-пентандиилдиокси)бис(4,4,6-триметил-1,3,2-диоксаборинан).
[0035] В некоторых вариантах воплощения, металлический реагент представляет собой алкиллитиевый реагент. В некоторых вариантах воплощения, алкиллитиевый реагент представляет собой н-бутиллитий или гексиллитий. В некоторых вариантах воплощения, металлический реагент представляет собой алкилмагнийгалогенид. В некоторых вариантах воплощения, алкилмагнийгалогенид представляет собой метилмагнийбромид.
[0036] В некоторых вариантах воплощения, стадия (b) способа дополнительно включает стадии дегидратации Соединения 1 для получения ангидрида Соединения 1, с последующим гидролизом ангидрида Соединения 1 для получения Соединения 1. В некоторых вариантах воплощения, стадию дегидратации осуществляют in situ (т.е. Соединение 1 не является выделенным). В некоторых вариантах воплощения, стадию гидролиза осуществляют путем добавления воды к ангидриду Соединения 1.
[0037] В некоторых вариантах воплощения, ангидрид Соединения 1 представляет собой Соединение 2:
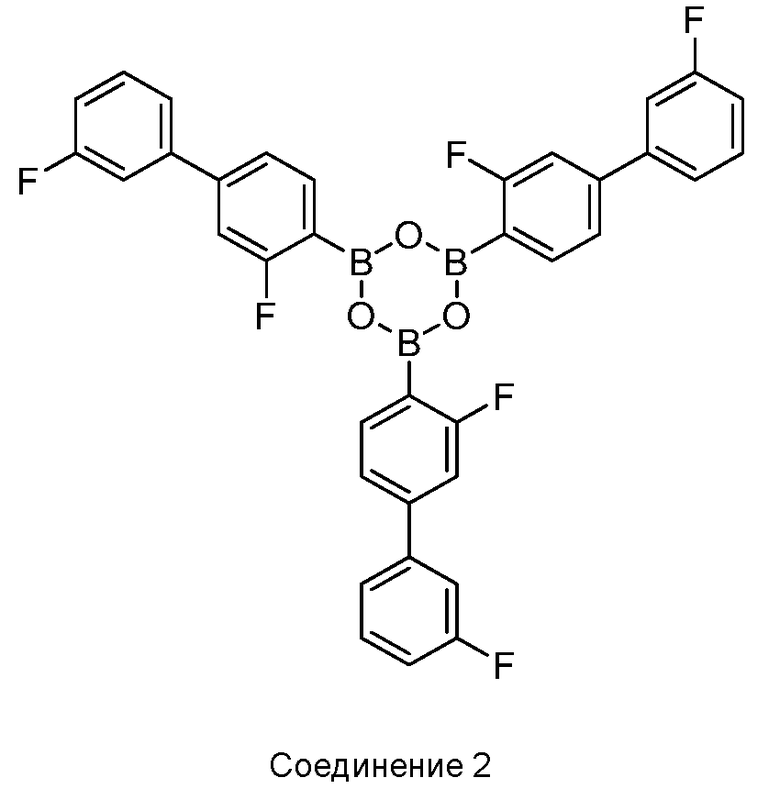
или его фармацевтически приемлемую соль, гидрат или сольват.
[0038] В некоторых вариантах воплощения, этот способ обеспечивает чистое и выделенное кристаллическое Соединение 1. В некоторых вариантах воплощения, эти дополнительные стадии (т.е. дегидратация с последующим гидролизом) обеспечивают чистое и выделенное кристаллическое Соединение 1.
[0039] Еще в одном аспекте, обеспечивается способ лечения FAAH-опосредованного состояния, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества кристаллического Соединения 1, определенного в настоящей заявке.
[0040] В некоторых вариантах воплощения, FAAH-опосредованное состояние выбрано из болезненного состояния, воспалительного состояния, иммунного расстройства, расстройства центральной нервной системы, метаболического расстройства, сердечного расстройства и глаукомы.
[0041] В некоторых вариантах воплощения, FAAH-опосредованное состояние представляет собой болезненное состояние, выбранное из невропатической боли, центральной боли, недифференцированной боли, хронической боли, послеоперационной боли, предоперационной боли, ноцицептивной боли, острой боли, невоспалительной боли, воспалительной боли, боли, связанной с раком, травматической боли, ожоговой боли, боли, связанной с медицинскими процедурами, боли, возникающей в результате зуда, синдрома болезненного мочевого пузыря, боли, связанной с предменструальным дисфорическим расстройством, боли, связанной с предменструальным синдромом, боли, связанной с синдромом хронической усталости, боли, связанной с преждевременными родами, боли, связанной с симптомами отмены от наркозависимости, боли в суставах, артритной боли, пояснично-крестцовой боли, мышечно-скелетной боли, головной боли, мигрени, мышечной боли, боли внизу спины, боли в области шеи, зубной боли зубной/челюстно-лицевой боли и висцеральной боли.
[0042] В некоторых вариантах воплощения, FAAH-опосредованное состояние представляет собой воспалительное состояние или иммунное расстройство.
[0043] В некоторых вариантах воплощения, воспалительное состояние или иммунное расстройство представляет собой желудочно-кишечное расстройство.
[0044] В некоторых вариантах воплощения, воспалительное состояние или иммунное расстройство представляет собой кожное состояние.
[0045] В некоторых вариантах воплощения, FAAH-опосредованное состояние представляет собой расстройство центральной нервной системы, выбранное из нейротоксичности и/или нейротравмы, удара, рассеянного склероза, повреждения спинного мозга, эпилепсии, психического расстройства, состояния сна, двигательного расстройства, тошноты и/или рвоты, амиотрофического бокового склероза, болезни Альцгеймера и наркомании.
[0046] В некоторых вариантах воплощения, FAAH-опосредованное состояние представляет собой метаболическое расстройство, выбраное из состояния истощения или связанного с ожирением состояния или осложнения такого состояния.
[0047] В некоторых вариантах воплощения, FAAH-опосредованное состояние представляет собой сердечное расстройство, выбранное из гипертензии, шока, вызванного нарушением кровообращения, реперфузионнного поражения миокарда и атеросклероза.
[0048] В некоторых вариантах воплощения, FAAH-опосредованное состояние представляет собой глаукому.
[0049] Еще в одном аспекте, обеспечивается соединение формулы:
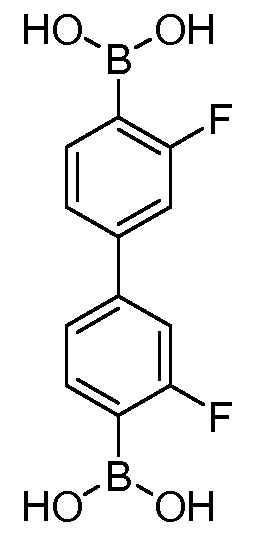
или его фармацевтически приемлемая соль, сольват или гидрат.
Краткое описание рисунков
[0050] Фиг.1 представляет рентгеновскую дифрактограмму Формы A Соединения 1.
[0051] Фиг.2 представляет данные дифференциальной сканирующей калориметрии (ДСК) Формы A Соединения 1.
[0052] Фиг.3 представляет картину наложения нескольких хроматограмм реакции перекрестного взаимодействия по методу Сузуки в восьми разных растворителях. Пик в точке 5 минут представляет собой исходное вещество. Пик в точке 6 минут представляет собой продукт.
[0053] Фиг.4 представляет картину наложения нескольких хроматограмм отбора исходного основания для реакции перекрестного взаимодействия по методу Сузуки. Для всех экспериментов добавляли 3 эквивалента основания относительно ограничивающего тригалогенидного исходного вещества.
[0054] Фиг.5 представляет картину наложения нескольких хроматограмм отбора органического основания для реакции перекрестного взаимодействия по методу Сузуки. Все реакции осуществляли с использованием 1-PrOH в качестве единственного растворителя. Катализатор, если не указано иное, представлл собой PdCl2(PPh3)2. Если не указано иное, использовали 3 эквивалента основания в каждом эксперименте.
[0055] Фиг.6 представляет картину наложения нескольких хроматограмм отбора катализатора для реакции перекрестного взаимодействия по методу Сузуки, (a) Pd(PPh3)4/K2CO3; (b) Pd(OAc)2/PPh3; (c) Pd(OAc)2; (d) Pd2(dba)3/PPh3; (e) Pd2(dba)3; (f) Pd(dppf)2Cl2; (g) Pd(PPh3)4. (dba = дибензилиденацетон; dppf = (дифенилфосфорил)ферроцен). Во всех реакциях, за исключением (a), использовали NaHCO3 в качестве основания. Растворитель во всех реакциях представлял собой смесь 1-PrOH/вода. Использовали 3 моль% Pd для всех реакций за исключением (b) и (d).
[0056] Фиг.7 показывает примеси, образованные в процессе синтеза Соединения 1.
[0057] Фиг.8 представляет рентгеновскую порошковую дифрактограмму репрезентативной партии ангидрида Формы I Соединения 1 (например, Форма I Соединения 2).
[0058] Фиг.9 представляет сравнение Соединения 1, выделенного из 1) н-гептана (a; 20 X увеличение); и 2) ацетона/воды (b; 10 X увеличение) с паузой после образования центров кристаллизации для обеспечения возможности роста кристаллов.
[0059] Фиг.10 представляет сравнение ВЭЖХ время удерживания для (a) синтезированной примеси против (b) выделенной примеси IMP4.
[0060] Фиг.11 представляет сравнение УФ спектров выделенного (внизу) и синтезированного (вверху) IMP4.
[0061] Фиг.12 представляет сравнение масс-спектров выделенного (внизу) и синтезированного (вверху) IMP4.
[0062] Фиг.13 представляет сравнение полных ЯМР спектров выделенного (внизу) и синтезированного (вверху) IMP4 (400 МГц в ацетоне-d6).
[0063] Фиг.14 представляет сравнение ароматической области ЯМР спектров выделенного (внизу) и синтезированного (вверху) IMP4 (400 МГц в ацетоне-d6).
[0064] Фиг.15 представляет типичную реакцию IPC для преобразования E-3a в Соединение 1 (завершенная реакция).
[0065] Фиг.16 представляет типичную реакцию IPC (14 часов) для образования E-3a (завершенная реакция).
[0066] Фиг.17 представляет типичную IPC для преобразования E-3a в Соединение 1/Соединение 1 ангидрид (например, Соединение 2) (завершенная реакция).
[0067] Фиг.18 представляет данные дифференциальной сканирующей калориметрии (ДСК) Формы I Соединения 2.
[0068] Фиг.19 представляет картину XRPD наложения Формы A и Вещества B Соединения 1. Фиг.19A представляет иллюстративную рентгеновскую порошковую дифрактограмму кристаллической формы, представляющей собой Форму A. Фиг.19B представляет иллюстративную представляет иллюстративную рентгеновскую порошковую дифрактограмму кристаллической формы, представляющей собой Вещество B. Фиг.19C-D представляют иллюстративные рентгеновские порошковые дифрактограммы для смеси кристаллических форм Формы A и Вещества B.
[0069] Фиг.20 представляет ORTEP схематическое изображение Соединения 1.
[0070] Фиг.21 представляет водородное связывание в Соединении 1.
[0071] Фиг.22 представляет расчетную рентгеновскую порошковую дифрактограмму Формы A Соединения 1.
[0072] Фиг.23 представляет экспериментальную рентгеновскую порошковую дифрактограмму Формы A Соединения 1.
[0073] Фиг.24 представляет схему упаковки кристаллического Соединения 1, вид вниз от кристаллографической оси a.
[0074] Фиг.25 представляет схему упаковки кристаллического Соединения 1, вид вниз от кристаллографической оси b.
[0075] Фиг.26 представляет схему упаковки кристаллического Соединения 1, вид вниз от кристаллографической оси c.
[0076] Фиг.27 представляет сравнение расчетной рентгеновской порошковой дифрактограммы с экспериментальной картиной Формы A Соединения 1.
[0077] Фиг.28 представляет Pananalytical рентгеновскую порошковую дифрактограмму Формы I Соединения 2.
[0078] Фиг.29 представляет рентгеновскую порошковую дифрактограмму Формы I Соединения 2.
[0079] Фиг.30 представляет данные протонного ЯМР кристаллического Соединения 2.
[0080] Фиг.31 представляет рентгеновскую порошковую дифрактограмму Формы A1 Соединения 1.
[0081] Фиг.32 представляет рентгеновскую порошковую дифрактограмму Вещества B Соединения 1.
[0082] Фиг.33 представляет рентгеновскую порошковую дифрактограмму смеси, включающей Вещество B Соединения 1 и второй компонент.
[0083] Фиг.34 представляет картину наложения ДСК и TGA Вещества B Соединения 1.
[0084] Фиг.35 представляет рентгеновскую порошковую дифрактограмму Вещества B Соединения 1.
ИДЕНТИФИКАЦИОННЫЕ НОМЕРА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0085] SEQ ID NO. 1: Homo sapiens FAAH аминокислотная последовательность

Определения
Химические определения
[0086] Определения конкретных функциональных групп и химических терминов представлены более подробно ниже. Для целей настоящего изобретения, химические элементы указаны в соответствии с Периодической Таблицей Элементов, CAS version, Handbook of Chemistry and Physics, 75th Ed., внутренняя страница обложки, и конкретные функциональные группы, в основном, определяются, как описано в указанном ссылочном документе. Кроме того, общие принципы органической химии, а также конкретные функциональные группы и реакционная способность описаны в Organic Chemistry, Thomas Sorrell, University Science Books, Sausalito, 1999; Smith and March March's Advanced Organic Chemistry, 5th Edition, John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; Carruthers, Some Modern Methods of Organic Synthesis, 3rd Edition, Cambridge University Press, Cambridge, 1987.
[0087] Термин "алкил", как он используется в настоящей заявке, относится к насыщенным, необязательно замещенным углеводородным радикалам с линейной или разветвленной цепью, образованным из алифатической группы, содержащей от одного до шести атомов углерода (например, C1-6 алкил), путем удаления одного атома водорода. В некоторых вариантах воплощения, алкильная группа, используемая в настоящем изобретении, содержит 1-5 атомов углерода. В другом варианте воплощения, используемая алкильная группа содержит 1-4 атомов углерода. В следующих вариантах воплощения, алкильная группа содержит 1-3 атомов углерода. В некоторых других вариантах воплощения, алкильная группа содержит 1-2 атомов углерода. Примеры алкильных радикалов включают, но не ограничиваются этим, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, втор-пентил, изопентил, трет-бутил, н-пентил, неопентил, н-гексил, втор-гексил, н-гептил, н-октил, н-децил, н-ундецил, додецил и подобные.
[0088] Термин "алкенил", как он используется в настоящей заявке, означает одновалентную группу, образованную из необязательно замещенной алифатической группы с линейной или разветвленной цепью, содержащей, по меньшей мере, одну углерод-углеродную двойную связь, путем удаления одного атома водорода. В некоторых вариантах воплощения, алкенильная группа, используемая в настоящем изобретении, содержит 2-6 атомов углерода (например, C2-6 алкенил). В некоторых вариантах воплощения, алкенильная группа, используемая в настоящем изобретении, содержит 2-5 атомов углерода. В некоторых вариантах воплощения, алкенильная группа, используемая в настоящем изобретении, содержит 2-4 атомов углерода. В другом варианте воплощения, используемая алкенильная группа содержит 2-3 атомов углерода. Алкенильные группы включают, например, этенил, пропенил, бутенил, 1-метил-2-бутен-1-ил и подобные.
[0089] Термин "алкинил", как он используется в настоящей заявке, относится к одновалентной группе, образованной из необязательно замещенной алифатической группы с линейной или разветвленной цепью, содержащей, по меньшей мере, одну углерод-углеродную тройную связь, путем удаления одного атома водорода. В некоторых вариантах воплощения, алкинильная группа, используемая в настоящем изобретении, содержит 2-6 атомов углерода (например, C2-6 алкинил). В некоторых вариантах воплощения, алкинильная группа, используемая в настоящем изобретении, содержит 2-5 атомов углерода. В некоторых вариантах воплощения, алкинильная группа, используемая в настоящем изобретении, содержит 2-4 атомов углерода. В другом варианте воплощения, используемая алкинильная группа содержит 2-3 атомов углерода. Репрезентативные алкинильные группы включают, но не ограничиваются этим, этинил, 2-пропинил (пропаргил), 1-пропинил и подобные.
[0090] Термин "арил", используемый отдельно или как часть более крупной группы, как в "аралкиле", "аралкокси" или "арилоксиалкиле", относится к моноциклическим и бициклическим необязательно замещенным кольцевым системам, содержащим в целом от пяти до двенадцати кольцевых членов, где, по меньшей мере, одно кольцо в системе является ароматическим, и где каждое кольцо в системе содержит от трех до семи кольцевых членов. В некоторых вариантах воплощения, "арил" относится к моноциклическим и бициклическим необязательно замещенным кольцевым системам, содержащим в целом от шести до двенадцати кольцевых членов (например, C6-12 арил), где, по меньшей мере, одно кольцо в системе является ароматическим, и где каждое кольцо в системе содержит от трех до семи кольцевых членов. Термин "арил" можно использовать взаимозаменяемо с термином "арильное кольцо". В некоторых вариантах воплощения настоящего изобретения, "арил" относится к ароматической кольцевой системе, которая включает, но не ограничивается этим, фенил, бифенил, нафтил, антрацил и подобные, которая может содержать один или несколько заместителей. Также термин “арил” охватывает, как это используется в настоящей заявке, группу, в которой ароматическое кольцо является конденсированным с одним или несколькими неароматическими кольцами, такими как инданил, фталимидил, нафтимидил, фенантриидинил или тетрагидронафтил и подобные.
[0091] Термины "гетероарил", используемые отдельно или как часть более крупной группы, например, "гетероаралкил" или "гетероаралкокси", относятся к необязательно замещенным группам, содержащим от 5 до 10 кольцевых атомов, предпочтительно 5, 6 или 9 кольцевых атомов; содержащим 6, 10 или 14 π электронов, распределенных в циклическом порядке; и содержащим, помимо атомов углерода, от одного до пяти гетероатомов. В некоторых вариантах воплощения, термин "гетероарил" относится к необязательно замещенным группам, определенным выше, содержащим от 6 до 10 кольцевых атомов (например, C6-12 гетероарил). Термин "гетероатом" относится к азоту, кислороду или сере, и включает любую окисленную форму азота или серы и любую кватернизированную форму основного азота. Гетероарильные группы включают, без ограничения, тиенил, фуранил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, индолизинил, пуринил, нафтиридинил, и птеридинил. Термины "гетероарил" и "гетероар-", как они используются в настоящей заявке, также включают группы, в которых гетероароматическое кольцо является конденсированным с одним или несколькими арильными, циклоалифатическими или гетероциклическими кольцами, где радикал или точка присоединения находится на гетероароматическом кольце. Неограничивающие примеры включают индолил, изоиндолил, бензотиенил, бензофуранил, дибензофуранил, индазолил, бензимидазолил, бензтиазолил, хинолилил, изохинолилил, циннолинил, фталазинил, хиназолинил, хиноксалинил, 4H-хинолизинил, карбазолил, акридинил, феназинил, фенотиазинил, феноксазинил, тетрагидрохинолинил, тетрагидроизохинолинил, и пиридо[2,3-b]-1,4-оксазин-3(4H)-он. Гетероарильная группа может быть моно- или бициклической. Термин "гетероарил" можно использовать взаимозаменяемо с терминами "гетероарильное кольцо", "гетероарильная группа" или "гетероароматический", и любые из этих терминов включают кольца, которые являются необязательно замещенными. Термин "гетероаралкил" относится к алкильной группе, замещенной гетероарилом, где алкильная и гетероарильная части, независимо, являются необязательно замещенными.
[0092] Как описано в настоящей заявке, соединения по настоящему изобретению могут содержать "необязательно замещенные" группы. Как правило, термин "замещенный", независимо от того, предшествует ему термин "необязательно" или нет, означает, что один или несколько атомов водорода указанной группы замещены подходящим заместителем. Если не указано иное, "необязательно замещенная" группа может содержать подходящий заместитель в каждом замещаемом положении группы, и когда более чем одно положение в любой рассматриваемой структуре может быть замещено более чем одним заместителем, выбранным из указанной группы, такие заместители могут быть либо одинаковыми, либо отличными друг от друга в каждом положении. Комбинации заместителей, предусмотренных настоящим изобретением, предпочтительно представляют собой такие, которые приводят к образованию стабильных или химически достижимых соединений. Термин "стабильный", как он используется в настоящей заявке, относится к соединениям, которые, по существу, не изменяются, когда их подвергают условиям, делающим возможным их получение, детекцию и, в некоторых вариантах воплощения, их выделение, очистку и применение по одному или нескольким назначениям, раскрытым в настоящей заявке.
[0093] Подходящие одновалентные заместители по замещаемому атому углерода "необязательно замещенной" группы независимо представляют собой галоген; -(CH2)0-4R°; -(CH2)0-4OR°; -O-(CH2)0-4C(О)OR°; -(CH2)0-4CH(OR°)2; -(CH2)0-4SR°; -(CH2)0-4Ph, который может быть замещен R°; -(CH2)0-4О(CH2)0-1Ph, который может быть замещен R°; -CH=CHPh, который может быть замещен R°; -NO2; -CN; -N3; -(CH2)0-4N(R°)2; -(CH2)0-4N(R°)C(О)R°; -N(R°)C(S)R°; -(CH2)0-4N(R°)C(О)NR°2; -N(R°)C(S)NR°2; -(CH2)0-4N(R°)C(O)OR°; -N(R°)N(R°)C(О)R°; -N(R°)N(R°)C(О)NR°2; -N(R°)N(R°)C(О)OR°; -(CH2)0-4C(О)R°; -C(S)R°; -(CH2)0-4C(О)OR°; -(CH2)0-4C(О)SR°; -(CH2)0-4C(О)OSiR°3; -(CH2)0-4OC(О)R°; -OC(O)(CH2)0-4SR-, SC(S)SR°; -(CH2)0-4 SC(О)R°; -(CH2)0-4C(О)NR°2; -C(S)NR°2; -C(S)SR°; -SC(S)SR°, -(CH2)0-4OC(О)NR°2; -C(О)N(OR°)R°; -C(О)C(О)R°; -C(О)CH2C(О)R°; -C(NOR°)R°; -(CH2)0-4SSR°; -(CH2)0-4S(О)2R°; -(CH2)0-4S(О)2OR°; -(CH2)0-4OS(О)2R°; -S(О)2NR°2; -(CH2)0-4S(О)R°; -N(R°)S(О)2NR°2; -N(R°)S(О)2R°; -N(OR°)R°; -C(NH)NR°2; -P(О)2R°; -P(О)R°2; -OP(О)R°2; -OP(О)(OR°)2; SiR°3; -(C1-4 линейный или разветвленный алкилен)О-N(R°)2; или -(C1-4 линейный или разветвленный алкилен)C(О)О-N(R°)2, где каждый R° может быть замещен, как определено ниже, и независимо представляет собой водород, C1-6алифатическую группу, -CH2Ph, -O(CH2)0-1Ph или 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы, или, независимо от определения, представленного выше, два независимо присутствующих R°, взятые вместе с их промежуточным атомом(атомами), образуют 3-12-членное насыщенное, частично ненасыщенное или арильное моно- или бициклическое кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы, которое может быть замещено, как определено ниже.
[0094] Подходящие одновалентные заместители по R° (или кольцу, образованному путем объединения вместе двух независимо присутствующих R° с их промежуточными атомами), независимо представляют собой галоген, -(CH2)0-2R•, -(галогенR•), -(CH2)0-2OH, -(CH2)0-2OR•, -(CH2)0-2CH(OR•)2; -O(галогенR•), -CN, -N3, -(CH2)0-2C(О)R•, -(CH2)0-2C(О)OH, -(CH2)0-2C(О)OR•, -(CH2)0-2SR•, -(CH2)0-2SH, -(CH2)0-2NH2, -(CH2)0-2NHR•, -(CH2)0-2NR• 2, -NO2, -SiR• 3, -OSiR• 3, -C(О)SR•, -(C1-4 линейный или разветвленный алкилен)C(О)OR• или -SSR•, где каждый R• является незамещенным, или если ему предшествует слово "галоген", замещен только одним или несколькими атомами галогена, и независимо выбран из C1-4 алифатической группы, -CH2Ph, -O(CH2)0-1Ph или 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатома, независимо выбранных из азота, кислорода или серы. Подходящие двухвалентные заместители по насыщенному атому углерода в R° включают =О и =S.
[0095] Подходящие двухвалентные заместители по насыщенному атому углерода "необязательно замещенной" группы включают следующие: =О, =S, =NNR*2, =NNHC(О)R*, =NNHC(О)OR*, =NNHS(О)2R*, =NR*, =NOR*, -О(C(R*2))2-3О- или -S(C(R*2))2-3S-, где каждый независимо присутствующий R* выбран из водорода, C1-6алифатической группы, которая может быть замещена, как определено ниже, или незамещенного 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатома, независимо выбранных из азота, кислорода или серы. Подходящие двухвалентные заместители, которые связаны со смежными замещаемыми атомами углерода "необязательно замещенной" группы, включают: -О(CR*2)2-3О-, где каждый независимо присутствующий R* выбран из водорода, C1-6алифатической группы, которая может быть замещена, как определено ниже, или незамещенного 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
[0096] Подходящие заместители в алифатической группе R• включают галоген, -R•, -(галогенR•), -OH, -OR•, -O(галогенR•), -CN, -C(О)OH, -C(О)OR•, -NH2, -NHR•, -NR• 2 или -NO2, где каждый R• является незамещенным, или если ему предшествует слово "галоген", замещен только одним или несколькими амтомами галогена, и независимо представляет собой C1-4 алифатическую группу, - CH2Ph, -O(CH2)0-1Ph или 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
[0097] Подходящие заместители по замещаемому азоту "необязательно замещенной" группы включают -R†, -NR† 2, -C(О)R†, -C(О)OR†, -C(О)C(О)R†, -C(О)CH2C(О)R†, -S(О)2R†, -S(О)2NR† 2, -C(S)NR† 2, -C(NH)NR† 2 или -N(R†)S(О)2R†; где каждый R† независимо представляет собой водород, C1-6алифатическую группу, которая может быть замещена, как определено ниже, незамещенный -OPh или незамещенное 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы, или, независимо от определения, представленного выше, два независимо присутствующих R†, взятые вместе с их промежуточным атомом(ами), образуют незамещенное 3-12-членное насыщенное, частично ненасыщенное или арильное моно- или бициклическое кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы. Подходящие заместители по алифатической группе R† независимо представляют собой галоген, -R•, -(галогенR•), -OH, -OR•, -O(галогенR•), -CN, -C(О)OH, -C(О)OR•, -NH2, -NHR•, -NR• 2 или -NO2, где каждый R• является незамещенным или, если ему предшествует слово "галоген", замещен только одним или несколькими атомами галогена и независимо представляет собой C1-4 алифатическую группу, - CH2Ph, -O(CH2)0-1Ph или 5-6-членное или арильное кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
[0098] Как он используется в настоящей заявке, термин "бороновая кислота" относится к любому химическому соединению, включающему -B(OH)2 группу. Соединения арилбороновой кислоты легко образуют ангидриды путем дегидратации группы бороновой кислоты (см., например, Snyder et al., J. Am. Chem. Soc. (1958) 80: 3611). "Ангидрид" бороновой кислоты включает, но не ограничивается этим, димеры, тримеры и олигомеры бороновой кислоты и их смеси.
[0099] Как он используется в настоящей заявке, термин "фармацевтически приемлемая соль" относится к таким солям, которые, согласно взвешенной медицинской оценке, являются подходящими для использования в контакте с тканями человека и низших животных без излишней токсичности, раздражения, аллергической реакции и т.п. и соответствуют разумному соотношению польза/риск. Фармацевтически приемлемые соли хорошо известны из уровня техники. Например, S. M. Berge et al., подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 1-19, который включен в настоящую заявку посредством ссылки. Фармацевтически приемлемые соли соединений по настоящему изобретению включают соли, образованные из подходящих неорганических и органических кислот и оснований. Примеры фармацевтически приемлемых нетоксичных кислотно-аддитивных солей включают соли аминогруппы, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с использованием других способов, известных из уровня техники, таких как ионообмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептаноат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и подобные соли. Соли, образованные из подходящих оснований, включают соли щелочных металлов, щелочноземельных металлов, аммония и N+(C1-4алкил)4. Репрезентативные соли щелочных металлов, щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и подобные. Кроме того, фармацевтически приемлемые соли включают, если это является подходящим, нетоксичные катионы аммония, четвертичного аммония и амина, образованные с использованием противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
[00100] Соединение указывается как "выделенное" (например, "выделенное Соединение 1" или "выделенное Соединение 2"), если соединение свободно от реакционной смеси, из которой оно было синтезировано. Выделение соединения можно осуществить любым способом, известным специалистам в данной области, включая хроматографию (например, высокоэффективную жидкостную хроматографию (ВЭЖХ)), растирание в порошок, осаждение, кристаллизацию, дистилляцию и/или экстракцию или любую последовательную комбинацию таких способов. Соединения могут быть выделены в виде твердых веществ. При достаточно высокой температуре твердое вещество может плавиться, и, таким образом, соединение также может быть выделено в его жидкой фазе.
[00101] Как это используется в настоящей заявке, "аморфный" относится к твердой форме соединения, где отсутствует дальний порядок положений атомов. Аморфную природу твердого вещества можно подтвердить, например, путем анализа рентгеновской порошковой дифрактограммы (XRPD). Если XRPD не показывает каких-либо резких пиков интенсивности и/или имеет один или несколько "гало" (широкие выступы) в XRPD, тогда соединение является аморфным.
[00102] Как это используется в настоящей заявке, "кристаллический" относится к твердой форме соединения, где существует дальний порядок в положениях атомов. Природу твердого вещества можно подтвердить, например, путем анализа рентгеновской порошковой дифрактограммы. Если XRPD показывает резкие пики интенсивности в XRPD, тогда соединение является кристаллическим.
[00103] Как это используется в настоящей заявке, "полиморф" относится к кристаллическому соединению, имеющему более чем одну кристаллическую структуру, например, в результате различий в молекулярной упаковке и/или молекулярной конформации соединения в твердом состоянии. Когда полиморфизм существует в результате различий в кристаллической упаковке, это называется полиморфизмом упаковки. Полиморфизм также может присутствовать как результат существования различных конформеров одной и той же молекулы в конформационном полиморфизме. В псевдополиморфизме различные кристаллические типы являются результатом гидратации или сольватации. Один иллюстративный путь характеризации полиморфа - через его уникальную рентгеновскую порошковую дифрактограмму (XRPD).
[00104] Термин "сольват" относится к кристаллическому соединению, где стехиометрическое или нестехиометрическое количество растворителя или смеси растворителей включено в кристаллическую структуру.
[00105] Термин "гидрат" относится к кристаллическому соединению, где стехиометрическое или не стехиометрическое количество воды включено в кристаллическую структуру.
[00106] Как это используется в настоящей заявке, "химически стабильный" относится к соединению, которое демонстрирует общее количество органических примесей меньше чем около 10%, меньше чем около 5%, меньше чем около 4%, меньше чем около 3%, меньше чем около 2%, меньше чем около 1%, меньше чем около 0,5%, меньше чем около 0,25% или меньше чем около 0,1%, когда соединение подвергается определенным условиям, включая, например, стрессовые условия в течение определенного периода времени. Как это используется в настоящей заявке, "физически стабильный" относится к кристаллическим формам или смеси кристаллических и/или аморфных форм, которые не претерпевают изменений кристаллической формы, когда их подвергают определенным условиям, включая, например, стрессовые условия в течение определенного периода времени, с или без влагопоглотителя. В некоторых вариантах воплощения, стрессовые условия включают относительную влажность, хранение при температуре в пределах 1-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-70, 70-80, 80-90 или 90-100°C. В некоторых вариантах воплощения, период времени составляет по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 10 или по меньшей мере 20 недель.
[00107] Как они используются в настоящей заявке, термины "около" и "приблизительно", при использовании в комбинации с цифровым значением или диапазоном значений, используемые для характеристики конкретной кристаллической формы, аморфной формы или смеси таких форм соединения, означают, что значение или диапазон значений могут отклоняться до такой степени, которую специалист в данной области считает разумной при описании конкретной кристаллической формы, аморфной формы или их смеси.
Подробное описание изобретения
[00108] Соединение 1, также указанное как 3,3'-дифторбифенил-4-илбороновая кислота, является особенно полезным для лечения состояний, опосредованных FAAH. Соединение 1 представлено в классе молекул, описанных в US2009/0099131 и WO2008/63300, полное содержание которых включено в настоящую заявку посредством ссылки.
Способы получения Соединения 1
[00109] Настоящее изобретение обеспечивает различные улучшенные способы получения Соединения 1 и получаемых из него ангидридов.
[00110] Например, в одном аспекте, обеспечивается способ получения Соединения 1, включающий стадию перекрестного взаимодействия биарила (S-1), с последующей стадией металлирования/введения бороно-группы (S-2), как показано на Схеме 1, где переменные LG1 и LG2 представляют собой удаляемые группы, и группа -BOR1OR2 соответствует бороновой кислоте (т.е. -B(OH)2) или ее защищенной форме.
Схема 1
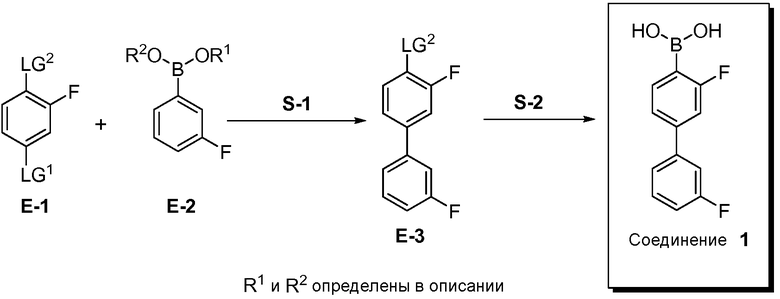
(i) Стадия S-1. Реакция перекрестного связывания биарила
[00111] Реакция сочетания между E-1 и E-2 происходит, в основном, через замещение LG1 Соединения E-1, где оба LG1 и LG2 представляют собой удаляемые группы. "Удаляемая группа" представляет собой группу, которую подвергают нуклеофильному замещению, т.е. химическую группу, которая легко замещается вводимой химической группой (например, катализатор перекрестного связывания, способный к окислительному присоединению). Удаляемые группы хорошо известны из уровня техники, например, см. Advanced Organic Chemistry, Jerry March, 5th Ed., pp. 351-357, John Wiley and Sons, N.Y. Примеры удаляемых групп включают, но не ограничиваются этим, галогены (например, хлор, иод, бром, фтор) и сульфонаты (например, метансульфонилокси (мезилокси), толуолсульфонилокси, трифторметансульфонилокси).
[00112] В некоторых вариантах воплощения, LG1 и LG2 независимо выбраны из галогена и сульфоната. В некоторых вариантах воплощения, LG1 и LG2 независимо выбраны из галогена. В некоторых вариантах воплощения, LG1 и LG2 независимо выбраны из -Br или -I. В некоторых вариантах воплощения, LG1 представляет собой -Br. В некоторых вариантах воплощения, LG1 представляет собой -I. В некоторых вариантах воплощения, LG2 представляет собой -Br. В некоторых вариантах воплощения, LG2 представляет собой -I. В некоторых вариантах воплощения, LG1 представляет собой -Br, и LG2 представляет собой -Br (например, 1,4-дибром-2-фторбензол, "E-1a"). В некоторых вариантах воплощения, LG1 представляет собой -I, и LG2 представляет собой -Br (например, 1-бром-2-фтор-4-иодбензол, "E-1b"). Как описано в общем виде выше, соединение E-2 соответствует бороновой кислоте (где R1 и R2 представляют собой водород), ее защищенной форме или боронатному сложному эфиру. В некоторых вариантах воплощения, R1 и R2 независимо выбраны из водорода или C1-6алкила, C2-6 алкенила, C2-6 алкинила, C6-12 арила или C6-12 гетероарильной группы, или R1 и R2 объединены с образованием 5-8-членного кольца, при условии, что R1 и R2 не могут оба представлять собой водород. В некоторых вариантах воплощения, E-2 представляет собой бороновую кислоту, где R1 и R2 представляют собой водород (например, 3-фторфенилбороновая кислота, "E-2a". В некоторых вариантах воплощения, E2 представляет собой боронатный сложный эфир. Примеры боронатных сложных эфиров включают, без ограничения, этиловые сложные эфиры, сложные эфиры маннита, пиколинаты и пинаколовые сложные эфиры.
[00113] В некоторых вариантах воплощения, реакцию перекрестного связывания биарила на стадии S-1 осуществляют в присутствии одного или нескольких катализаторов (например, органических или неорганических катализаторов). В некоторых вариантах воплощения, катализатор представляет собой органический катализатор. В некоторых вариантах воплощения, катализатор представляет собой неорганический катализатор. В некоторых вариантах воплощения, неорганический катализатор представляет собой катализатор на основе переходного металла Группы 10 (например, никелевый катализатор, палладиевый катализатор, платиновый катализатор). В некоторых вариантах воплощения, неорганический катализатор представляет собой металлоорганический катализатор (например, включающий неорганический металл и, по меньшей мере, один органический лиганд). В некоторых вариантах воплощения, неорганический металл представляет собой переходный металл Группы 10 (например, никель, палладий, платина).
[00114] В некоторых вариантах воплощения, неорганический катализатор представляет собой палладиевый катализатор. В некоторых вариантах воплощения, неорганический катализатор представляет собой палладиевый катализатор, и реакция представляет собой реакцию Сузуки. В некоторых вариантах воплощения, палладиевый катализатор включает один или несколько типов лигандов. Примеры лигандов включают фосфиновые лиганды (например, PPh3, P(tBu)3, дифенилфосфорилферроцен (dppf), диизопропилфосфорилферроцен (dipf)), галогены (например, фтор, хлор, бром, иод), карбоксилаты (например, ацетаты), органические соединения, способные к лигированию с металлом с образованием комплекса (например, дибензилиденацетон (dba), 1,3- или 1,5-циклооктадиен (COD)), и донорные растворители (например, ТГФ, диэтиловый эфир и т.п.). Примеры палладиевых катализаторов включают, но не ограничиваются этим, Pd(PPh3)4, Pd(OAc)2, Pd2(dba)3, Pd(dppf)2Cl2 и PdCl2(PPh3)2. В некоторых вариантах воплощения, катализатор представляет собой PdCl2(PPh3)2.
[00115] В некоторых вариантах воплощения, загрузка катализатора на стадии S-1 составляет от около 0,01 моль% до около 10 моль% катализатора по отношению к субстрату (т.е. по отношению к соединению E-1). В некоторых вариантах воплощения, загрузка катализатора составляет от около 0,1 моль% до около 5 моль%. В некоторых вариантах воплощения, загрузка катализатора составляет от около 0,1 моль% до около 4 моль%. В некоторых вариантах воплощения, загрузка катализатора составляет от около 0,1 моль% до около 3 моль%. В некоторых вариантах воплощения, загрузка катализатора составляет от около 0,1 моль% до около 2 моль%. В некоторых вариантах воплощения, загрузка катализатора составляет от около 0,1 моль% до около 1 моль%. В некоторых вариантах воплощения, загрузка катализатора составляет от около 0,1% до около 0,5 моль%. В некоторых вариантах воплощения, загрузка катализатора составляет от около 0,2 до около 0,5 моль%.
[00116] В некоторых вариантах воплощения, загрузка катализатора составляет меньше чем около 5 моль%, меньше чем около 4 моль%, меньше чем около 3 моль%, меньше чем около 2 моль%, меньше чем около 1 моль%, меньше чем около 0,9 моль%, меньше чем около 0,8 моль%, меньше чем около 0,7 моль%, меньше чем около 0,6 моль%, меньше чем около 0,5 моль%, меньше чем около 0,4 моль%, меньше чем около 0,3 моль%, меньше чем около 0,2 моль% или меньше чем около 0,1 моль%. В некоторых вариантах воплощения, катализатор используют в количестве меньше чем около 3,0 моль%.
[00117] В некоторых вариантах воплощения, стадию S-1 осуществляют в присутствии одного или нескольких оснований, например, органических или неорганических оснований. Примеры органических оснований включают, но не ограничиваются этим, третичные амины (например, триэтиламин, диизопропилэтиламин). Примеры неорганических оснований включают, но не ограничиваются этим, карбонаты (например, карбонат калия, карбонат натрия, карбонат цезия), бикарбонаты (например, бикарбонат калия, бикарбонат натрия, бикарбонат цезия), ацетаты (например, ацетат калия, ацетат натрия), фосфаты (например, фосфат калия), гидроксиды (например, гидроксид лития, гидроксид натрия, гидроксид магния). В некоторых вариантах воплощения, основание представляет собой неорганическое основание. В некоторых вариантах воплощения, основание представляет собой бикарбонат натрия (NaHCO3). В некоторых вариантах воплощения, основание представляет собой карбонат натрия (Na2CO3).
[00118] В некоторых вариантах воплощения, основание на стадии S-1 обеспечивается в количестве от около 1 до около 6 эквивалентов или от около 2 до около 4 эквивалентов основания по отношению к субстрату. В некоторых вариантах воплощения, основание на стадии S-1 обеспечивается в количестве меньше чем около 6 эквивалентов, меньше чем около 5 эквивалентов или меньше чем около 4 эквивалентов основания по отношению к субстрату. В некоторых вариантах воплощения, используют около 3 эквивалентов основания.
[00119] В некоторых вариантах воплощения, стадию S-1 осуществляют в присутствии одного или нескольких растворителей. Примеры растворителей включают, но не ограничиваются этим, органические растворители, воду и/или их смеси. Примеры органических растворителей включают, но не ограничиваются этим, спиртовые растворители (например, метанол, этанол, 1-пропанол, изопропанол, 1,2-пропандиол, н-бутанол, трет-бутанол, трет-амиловый спирт), простые эфиры (например, тетрагидрофуран, 2-метилтетрагидрофуран, диэтиловый эфир, 1,4-диоксан, 1,2-диметоксиэтан, метил трет-бутиловый эфир, диэтоксиметан), ароматические растворители (например, бензол, толуол, ксилолы), ацетонитрил, диметилсульфоксид, диметилформамид, н-метилпирролидинон, галогенированные растворители (например, дихлорметан, хлороформ, дихлорэтан), сложные эфиры (например, метилацетат, этилацетат, 2-пропилацетат), кетоны (например, метилизобутилкетон, ацетон) и углеводороды (например, гексаны, н-гептан, циклогексан).
[00120] В некоторых вариантах воплощения, растворитель представляет собой смесь органического растворителя и воды. В некоторых вариантах воплощения, растворитель представляет собой смесь спиртового растворителя и воды. В некоторых вариантах воплощения, смесь растворителей представляет собой смесь 1-пропилового спирта (1-PrOH) и воды. Примеры процентного содержания органического растворителя в воде для этих смесей включают, но не ограничиваются этим, от около 10% до около 90% органического растворителя в воде, от около 20% до около 90% органического растворителя в воде, от около 25% до около 90% органического растворителя в воде, от около 30% до около 80% органического растворителя в воде, от около 40% до около 80% органического растворителя в воде или от около 50% до около 80% органического растворителя в воде (например, 1-PrOH в воде). Примеры отношений органического растворителя к воде для этих смесей включают, но не ограничиваются этим, 10:1, 9:1, 8:1, 7:1, 6:1, 5:1, 4:1, 3:1, 2:1 и 1:1 органического растворителя к воде (например, 1-PrOH к H2O). В некоторых вариантах воплощения, отношение 1-PrOH:H2O составляет около 4:1 (т.е. около 75% 1-PrOH в воде). В некоторых вариантах воплощения, отношение 1-PrOH:Н2О составляет около 8:3 (т.е. около 62,5% 1-PrOH в воде).
[00121] В некоторых вариантах воплощения, для стадии S-1 требуется такое количество растворителя, чтобы концентрация в реакции составляла от около 0,01 M до около 10 M. В некоторых вариантах воплощения, концентрация в реакции составляет от около 0,1 M до около 5 M. В некоторых вариантах воплощения, концентрация в реакции составляет от около 0,1 M до около 2,5 M. В некоторых вариантах воплощения, концентрация в реакции составляет от около 0,1 M до около 1,5 M. В некоторых вариантах воплощения, концентрация в реакции составляет от около 0,5 M до около 1,5 M.
[00122] В некоторых вариантах воплощения, для стадии S-1 требуется количество растворителя в пределах от около 8 объемов растворителя до около 12 объемов растворителя. В некоторых вариантах воплощения, для стадии S-1 требуется количество растворителя в пределах от около 8 объемов растворителя до около 11 объемов растворителя. В некоторых вариантах воплощения, для стадии S-1 требуется количество растворителя в пределах от около 9 объемов растворителя до около 11 объемов растворителя. В некоторых вариантах воплощения, для стадии S-1 требуется количество растворителя в пределах от около 9,5 объемов растворителя до около 11 объемов растворителя. В некоторых вариантах воплощения, для S-1 требуется количество растворителя в пределах от около 10 объемов растворителя до около 11 объемов растворителя. В некоторых вариантах воплощения, для стадии S-1 требуется количество растворителя, составляющее около 10,0, 10,1, 10,2, 10,3, 10,4, 10,5, 10,6, 10,7, 10,8, 10,9 или 11,0 объемов растворителя. В некоторых вариантах воплощения, для стадии S-1 требуется количество растворителя, составляющее около 10,7 объемов растворителя. В некоторых вариантах воплощения, для стадии S-1 требуется количество растворителя, составляющее около 10,0 объемов растворителя.
[00123] В некоторых вариантах воплощения, для стадии S-1 необходима температура от около 50°C до около 100°C. В некоторых вариантах воплощения, температура реакции составляет от около 70°C до около 90°C. В некоторых вариантах воплощения, температура реакции составляет от около 75°C до около 90°C. В некоторых вариантах воплощения, температура реакции составляет от около 75°C до около 85°C. В некоторых вариантах воплощения, температура реакции составляет около 83°C.
[00124] Время реакции для стадии S-1 составляет от около 10 до около 30 часов. В некоторых вариантах воплощения, время реакции составляет от около 12 до около 24 часов. В некоторых вариантах воплощения, время реакции составляет от около 14 до около 20 часов.
[00125] Продукт на стадии S-1 можно подвергнуть обработке для удаления примесей до осуществления стадии S-2. В некоторых вариантах воплощения, обработка включает обработку подходящим твердым носителем, чтобы уменьшить количество присутствующего остаточного катализатора. В некоторых вариантах воплощения, обработка подходящим твердым носителем включает обработку силикагелем. В некоторых вариантах воплощения, обработку силикагелем можно осуществить как периодически осуществляемую процедуру или как процедуру поточного фильтрования. В некоторых вариантах воплощения, обработку силикагелем осуществляют как процедуру поточного фильтрования до осуществления стадии S-2.
(ii) Стадия S-2. Реакция металлирования - введения бороно-группы
[00126] Как показано выше на Схеме 1, E-3 используют для образования Соединения 1 через металлирование/введение бороно-группы. Как это используется в настоящей заявке, для реакции металлирования/введения бороно-группы на стадии S-2 требуется боронообразующий реагент и металлический реагент, способный к обмену с LG2 в E-3. Такой металлический реагент способен к металлированию (например, при помощи лития или магния) E3. В некоторых вариантах воплощения, LG2 в E-3 представляет собой бром (т.е. 4-бром-3,3'-дифторбифенил, "E-3a").
[00127] В некоторых вариантах воплощения, металлический реагент на стадии S-2 представляет собой алкиллитиевый реагент. В некоторых вариантах воплощения, алкиллитиевый реагент представляет собой н-бутиллитий или гексиллитий. В некоторых вариантах воплощения, алкиллитиевый реагент представляет собой гексиллитий.
[00128] В некоторых вариантах воплощения, металлический реагент на стадии S-2 представляет собой металлический магний или алкилмагнийгалогенид (например, метилмагнийбромид).
[00129] В некоторых вариантах воплощения, боронообразующий реагент на стадии S-2 представляет собой сложный боратный эфир, например, B(OR3)3, где каждый R3 независимо представляет собой C1-6 алкильную, C2-6 алкенильную, C2-6 алкинильную, C6-12 арильную или C6-12 гетероарильную группу, или две R3 группы объединены с образованием 5-8-членного кольца. В некоторых вариантах воплощения, боронообразующий реагент представляет собой B(OR3)3, где каждый R3 независимо представляет собой метил, этил, пропил, изопропил, бутил, циклогексил. Примеры боратных реагентов в форме сложного эфира включают, но не ограничиваются этим, триметилборат, триэтилборат, триаллилборат, триизопропилборат, трибутилборат, три-трет-бутилборат, трипентилборат, тригексилборат, тритолилборат, трибензилборат, трифенилборат, триметиленборат, триэтаноламинборат, триметаллилборат, 2-метокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан, 2-метокси-4,4,6-триметил-1,3,2-диоксаборинан, 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан, 2-изопропокси-4,4,6-триметил-1,3,2-диоксаборинан, 2-(2-диметиламиноэтокси)-4-метил-1,3,2-диоксаборинан, 2-бутокси-4,4,6-триметилL-1,3,2-диоксаборинан, трис(2,2,2-трифторэтил)борат, трис(1-изопропил-2-метилпропил)борат и 2,2'-(2-метил-2,4-пентандиилдиокси)бис(4,4,6-триметил-1,3,2-диоксаборинан). В некоторых вариантах воплощения, боратный реагент в форме сложного эфира представляет собой B(OiPr)3 (триизопропилборат).
[00130] В некоторых вариантах воплощения, алкиллитиевый реагент на стадии S-2 представляет собой гексиллитий, и боронообразующий реагент на стадии S-2 представляет собой B(OiPr)3.
[00131] В некоторых вариантах воплощения, боронообразующий реагент обеспечивается в количестве от около 1 эквивалента до около 1,5 эквивалентов относительно E-3. В некоторых вариантах воплощения, боронообразующий реагент обеспечивается в количестве от около 1 эквивалента до около 1,4 эквивалентов, в около 1 эквивалента до около 1,3 эквивалентов, от около 1 эквивалента до около 1,2 эквивалентов или от около 1 эквивалента до около 1,1 эквивалентов, по отношению к E-3. В некоторых вариантах воплощения, боронообразующий реагент обеспечивается в количестве от около 1 эквивалента до около 1,3 эквивалентов по отношению к E-3.
[00132] В некоторых вариантах воплощения, металлический реагент обеспечивается в количестве от около 1 эквивалента до около 1,5 эквивалентов относительно E-3. В некоторых вариантах воплощения, металлический реагент обеспечивается в количестве от около 1 эквивалента до около 1,4 эквивалентов, от около 1 эквивалента до около 1,3 эквивалентов, от около 1 эквивалента до около 1,2 эквивалентов или от около 1 эквивалента до около 1,1 эквивалентов, по отношению к E-3. В некоторых вариантах воплощения, металлический реагент обеспечивается в количестве от около 1 эквивалента до около 1,2 эквивалентов по отношению к E-3.
[00133] В некоторых вариантах воплощения, металлический реагент подвергают титрованию перед использованием. Способы титрования хорошо известны специалистам в области химии. В некоторых вариантах воплощения, в целях избежания какого-либо избыточного добавления, в реакционную смесь загружают сначала неполную порцию металлического реагента, определяют степень преобразования (с использованием, например, ВЭЖХ анализа) и добавляют, по необходимости, дополнительную порцию металлического реагента для доведения реакции до завершения.
[00134] В некоторых вариантах воплощения, стадию S-2 металлирования/введения бороно-группы осуществляют в присутствии одного или нескольких органических растворителей. Примеры органических растворителей включают, но не ограничиваются этим, ароматические растворители (например, бензол, толуол, ксилолы), простые эфиры (например, тетрагидрофуран, 2-метилтетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан, метил трет-бутиловый эфир, диэтоксиметан) и углеводороды (например, гексаны, н-гептан, циклогексан). В некоторых вариантах воплощения, растворитель выбран из простого эфира, углеводорода или их смеси. В некоторых вариантах воплощения, растворитель представляет собой комбинацию 2-метилтетрагидрофурана и углеводорода. В некоторых вариантах воплощения, растворитель представляет собой комбинацию 2-метилтетрагидрофурана и н-гептана. В некоторых вариантах воплощения, обеспечивается комбинированный растворитель, состоящий из простого эфира (например, 2-метилтетрагидрофуран) и углеводорода (например, н-гептан) при 2:1 отношении простого эфира к углеводороду.
[00135] В некоторых вариантах воплощения, температура реакции на стадии S-2 находится в пределах от около -78°C до около 0°C в процессе добавления металлического реагента. В некоторых вариантах воплощения, температура находится в пределах от около -78°C до около -10°C. В некоторых вариантах воплощения, температура находится в пределах от около -78°C до около -20°C. В некоторых вариантах воплощения, температура находится в пределах от около -78°C до около -30°C. В некоторых вариантах воплощения, температура находится в пределах от около -60°C до около -30°C. В некоторых вариантах воплощения, температура находится в пределах от около -50°C до около -30°C. В некоторых вариантах воплощения, температура составляет около -78°C, около -65°C, около -60°C, около -55°C, около -50°C, около -45°C, около -40°C, около -35°C или около -30°C. В некоторых вариантах воплощения, температура составляет около -35°C.
[00136] В некоторых вариантах воплощения, металлический реагент на стадии S-2 добавляют медленно, чтобы свести к минимуму образование побочных продуктов. Специалистам должно быть понятно, что скорость добавления может меняться в зависимости от масштаба осуществляемой реакции. В некоторых вариантах воплощения, металлический реагент добавляют в течение периода времени не меньше чем около 60 минут. В некоторых вариантах воплощения, необходимое количество металлического реагента добавляют в течение около 60, 80 или 120 минут. В некоторых вариантах воплощения, металлический реагент добавляют в течение не меньше чем около 120 минут. В некоторых вариантах воплощения, металлический реагент добавляют в течение времени от около 60 минут до около 120 минут.
[00137] После завершения реакции, стадию S-2 гасят водой. В некоторых вариантах воплощения, где боронообразующий реагент представляет собой сложноэфирный боратный реагент, используемое гашение представляет собой кислотное гашение (с использованием, например, 1 M HCl) для гидролиза сложного эфира бороновой кислоты, образованного in situ, до бороновой кислоты, Соединение 1. В некоторых вариантах воплощения, водный слой затем отделяют и отбрасывают и органический слой концентрируют с получением Соединения 1. Однако, в некоторых вариантах воплощения, Соединение 1 получают после гашения на стадии S-2 с использованием дополнительных стадий и способов, описанных ниже и в настоящем разделе (например, получают после стадий S-3 и S-4)·
(iii) Кристаллизация Соединения 1
[00138] В некоторых вариантах воплощения, конкретные кристаллические или аморфные формы, или их смеси, Соединения 1 или его производного можно получить с использованием способов, описанных в настоящей заявке, а также других способов, известных специалистам в данной области, имеющим среднюю квалификацию. В некоторых вариантах воплощения, такие способы обеспечивают Соединение 1 в виде кристаллической формы, "Формы A", которая, в некоторых вариантах воплощения, демонстрирует характеристики и свойства, описанные в настоящей заявке. В некоторых вариантах воплощения, такие способы обеспечивают Соединение 1 в виде "Вещества B" в кристаллической форме, которая, в некоторых вариантах воплощения, демонстрирует характеристики и свойства, описанные в настоящей заявке. В некоторых вариантах воплощения, такие способы обеспечивают смесь Формы A и Вещества B.
[00139] Кристаллические формы можно получить способами, описанными в настоящей заявке, или способами, известными из уровня техники, включая нагревание, охлаждение, сушку вымораживанием, лиофилизацию, гашение путем охлаждения расплава, быстрое выпаривание растворителя, медленное выпаривание растворителя, перекристаллизацию из растворителя, добавление антирастворителя, перекристаллизацию из суспензии, кристаллизацию из расплава, десольватацию, перекристаллизацию в замкнутых объемах, таких как, например, в нанопорах или капиллярных трубках, перекристаллизацию на поверхностях или матрицах, таких как, например, полимеры, перекристаллизацию в присутствии добавок, таких как, например, ко-кристаллы противомолекул, десольватацию, дегидратацию, быстрое охлаждение, медленное охлаждение, воздействие растворителя и/или воды, сушка, включая, например, вакуумную сушку, диффузию из паровой фазы, сублимацию, измельчение (включая, например, низкотемпературное измельчение и измельчение с использованием капающего растворителя), микроволновое осаждение, осаждение ультразвуком, лазерное осаждение и осаждение из сверхкритической жидкости. Размер частиц получаемых кристаллических форм, который может варьировать, (например, от нанометровых размеров до миллиметровых размеров), можно контролировать, например, путем изменения условий кристаллизации, таких как, например, скорость кристаллизации и/или система растворителя кристаллизации, или путем уменьшения размера частиц, например, путем измельчения, помола, микронного измельчения или обработки ультразвуком.
[00140] В некоторых вариантах воплощения, способ обеспечивает дополнительную стадию кристаллизации Соединения 1 из неполярного или полярного раствора.
[00141] В некоторых вариантах воплощения, Соединение 1 кристаллизуют из неполярного раствора. Примеры неполярных растворов включают углеводородные растворители (например, гексаны, гептаны), ароматические растворители (например, бензол, толуол, ксилолы) или их смеси. Например, в некоторых вариантах воплощения, стадию S-2 гасят водой, обрабатывают неполярным раствором и реакционную смесь подвергают перегонке в условиях вакуума с получением кристаллического Соединения 1. В некоторых вариантах воплощения, температура перегонки ниже около 45°C.
[00142] В некоторых вариантах воплощения, Соединение 1 кристаллизуют из полярного раствора (например, вода, полярный апротонный органический растворитель или их смесь). В некоторых вариантах воплощения, Соединение 1 кристаллизуют из смеси воды и полярного апротонного органического растворителя. В некоторых вариантах воплощения, смесь полярного апротонного органического растворителя в воде включает от около 5% до около 95% полярного апротонного органического растворителя в воде, от около 10% до около 90% полярного апротонного органического растворителя в воде, от около 15% до около 85% полярного апротонного органического растворителя в воде, от около 20% до около 80% полярного апротонного органического растворителя в воде, от около 25% до около 75% полярного апротонного органического растворителя в воде, от около 30% до около 70% полярного апротонного органического растворителя в воде, от около 35% до около 65% полярного апротонного органического растворителя в воде или от около 40% до около 70% полярного апротонного органического растворителя в воде.
[00143] Примеры полярных апротонных органических растворителей включают, но не ограничиваются этим, ацетон и ацетонитрил или их смесь. В некоторых вариантах воплощения, полярный апротонный органический растворитель представляет собой ацетон.
[00144] Например, в некоторых вариантах воплощения, Соединение 1, выделенное из реакционной смеси на стадии S-2, кристаллизуют из полярного раствора ацетона и воды. В некоторых вариантах воплощения, полярный раствор включает от около 5% до около 95% ацетона в воде, от около 10% до около 90% ацетона в воде, от около 15% до около 85% ацетона в воде, от около 20% до около 80% ацетона в воде, от около 25% до около 75% ацетона в воде, от около 30% до около 70% ацетона в воде, от около 35% до около 65% ацетона в воде или от около 40% до около 70% ацетона в воде.
В некоторых вариантах воплощения, стадия кристаллизации включает растворение Соединения 1 в первом растворителе (например, в ацетоне) и нагревание до желаемой температуры (например, температуры кипения с обратным холодильником), при этом подходящее количество второго растворителя (например, воды) добавляют таким образом, чтобы раствор при охлаждении до температуры окружающей среды образовывал перекристаллизованное Соединение 1. В некоторых вариантах воплощения, чередующиеся порции первого и второго растворителей (например, ацетона и воды) добавляют к доведенному до температуры кипения с обратным холодильником раствору несколько раз перед охлаждением раствора. В некоторых вариантах воплощения, охлаждение раствора осуществляют в течение определенного периода времени (например, больше чем около 8 часов) и/или при определенной температуре (например, от около 20°C до около 30°C или около 25 плюс или минус 5°C). В некоторых вариантах воплощения, кристаллическое Соединение 1 выделяют фильтрованием и сушат с использованием любого способа, известного в области химии, с получением Соединения 1, по существу, не содержащего воду, как определено с использованием способов, известных из уровня техники для измерения содержания воды (например, титрование по методу Карла Фишера). В некоторых вариантах воплощения, Соединение 1, кристаллизованное из полярного раствора, дополнительно промывают неполярным раствором. В некоторых вариантах воплощения, неполярный раствор включает углеводородный растворитель, например, гексаны или гептаны или их смесь. В некоторых вариантах воплощения, кристаллическое Соединение 1, полученное этим способом, имеет рентгеновскую порошковую дифрактограмму, по существу аналогичную той, которая представлена на Фиг.1, Форма А.
[00145] В некоторых вариантах воплощения, образование кристаллической формы, Формы А, Соединения 1 осуществляют путем кристаллизации в растворителе, выбранном из ацетона, ацетонитрила, хлороформа, дихлорметана, диэтилового эфира, диметилформамида, п-диоксана, этилацетата, гептана, тетрагидрофурана, изопропилового эфира, метилэтилкетона, 2-метилтетрагидрофурана, метилизобутилкетона, трет-бутилметилового эфира, нитрометана, толуола или воды. В некоторых вариантах воплощения, кристаллизацию Формы A осуществляют в смеси одного или нескольких из указанных растворителей. В некоторых вариантах воплощения, кристаллизацию осуществляют в следующей смеси растворителей: 1:1 гептан/хлороформ, 2:1 гептан/ТГФ, 1:1 ацетон/вода, 1:1 ацетонитрил/вода, 1:1 диметилформамид/вода; 1:1 п-диоксан/вода или 1:1 ТГФ/вода.
[00146] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие (a) растворение Соединения 1 в 50:50 смеси ацетона и воды при температуре около 51°C; (b) фильтрование полученного раствора; (c) обеспечение возможности охлаждения раствора до температуры окружающей среды; и (d) выстаивание раствора при температуре окружающей среды, по меньшей мере, в течение 1 дня. В некоторых вариантах воплощения, фильтрование на стадии (b) осуществляют путем горячего фильтрования. В конкретном варианте воплощения, фильтрование на стадии (b) осуществляют путем горячего фильтрования в теплом контейнере. В некоторых вариантах воплощения, температуру около 51°C на стадии (a) получают путем нагревания раствора в контейнере на горячей плите. В дополнительных вариантах воплощения, на стадии (c) раствор охлаждают до температуры окружающей среды при выключении горячей плиты, и раствору дают выстояться на горячей плите, пока горячая плита охлаждается. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00147] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из ацетона. В одном варианте воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы включают краш-преципитацию гептаном. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00148] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из ацетонитрила. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы включают нагревание до 51°C, медленное охлаждение от температуры около 51°C до около комнатной температуры и, в некоторых вариантах воплощения, раствору дают выстояться при комнатной температуре в течение примерно 1 дня. В некоторых вариантах воплощения, способы включают диффузию из паровой фазы при помощи воды в течение, в некоторых вариантах воплощения, около 8 дней. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00149] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из хлороформа. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы включают нагревание до 51°C, медленное охлаждение от температуры около 51°C до около комнатной температуры, и в дополнительных вариантах воплощения раствору дают выстояться при комнатной температуре в течение примерно 1 дня, и в других дополнительных вариантах воплощения затем осуществляют охлаждение до около 0°C. В следующих вариантах воплощения, раствор выдерживают при около 0°C в течение примерно 11 дней. В некоторых вариантах воплощения, способы включают диффузию из паровой фазы при помощи гептана в течение, в некоторых вариантах воплощения, около 13 дней. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00150] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из дихлорметана. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы включают краш-преципитацию гептаном. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00151] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из диэтилового эфира. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00152] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из диметилформамида. В некоторых вариантах воплощения, способы включают быстрое испарение. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00153] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из п-диоксана. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00154] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из этилацетата. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы включают краш-преципитацию из гептана. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00155] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из гептана. В некоторых вариантах воплощения, способы включают суспендирование при комнатной температуре в течение, в некоторых вариантах воплощения, около 14 дней. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00156] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из смеси 2:1 гептан/хлороформ. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00157] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из смеси 2:1 гептан/ТГФ. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00158] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из изопропилового эфира. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы включают суспендирование при комнатной температуре в течение, в некоторых вариантах воплощения, около 14 дней. В некоторых вариантах воплощения, способы включают нагревание до 51°C, медленное охлаждение от температуры около 51°C до около комнатной температуры, и в дополнительных вариантах воплощения раствору дают выстояться при комнатной температуре в течение примерно 1 дня. В некоторых вариантах воплощения, способы включают краш-преципитацию гептаном. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00159] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из метилэтилкетона. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы включают краш-преципитацию гептаном. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00160] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из 2-метил ТГФ. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00161] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из метилизобутилкетона. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00162] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из трет-бутилметилового эфира. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы включают краш-преципитацию гептаном. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00163] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из нитрометана. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы включают суспендирование при комнатной температуре в течение, в некоторых вариантах воплощения, около 14 дней. В некоторых вариантах воплощения, способы включают нагревание до 51°C, медленное охлаждение от температуры около 51°C до около комнатной температуры, и в дополнительных вариантах воплощения раствору дают выстояться при комнатной температуре в течение примерно 1 дня, и в других дополнительных вариантах воплощения затем осуществляют охлаждение до около 0°C. В следующем варианте воплощения, раствор выдерживают при около 0°C в течение примерно 11 дней. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00164] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из толуола. В некоторых вариантах воплощения, способы включают быстрое испарение. В некоторых вариантах воплощения, способы включают суспендирование при комнатной температуре в течение, в некоторых вариантах воплощения, около 14 дней. В некоторых вариантах воплощения, способы включают нагревание до 51°C, медленное охлаждение от температуры около 51°C до около комнатной температуры, и в дополнительных вариантах воплощения раствору дают выстояться при комнатной температуре в течение примерно 1 дня. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00165] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из воды. В некоторых вариантах воплощения, способы включают суспендирование при комнатной температуре в течение, в некоторых вариантах воплощения, около 14 дней. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00166] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из смеси 50:50 ацетон/вода. В некоторых вариантах воплощения, способы включают частичное медленное испарение. В некоторых вариантах воплощения, способы включают суспендирование при комнатной температуре в течение, в некоторых вариантах воплощения, около 14 дней. В некоторых вариантах воплощения, способы включают нагревание до 51°C, медленное охлаждение от температуры около 51°C до около комнатной температуры, и в дополнительных вариантах воплощения раствору дают выстояться при комнатной температуре в течение примерно 1 дня. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00167] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из смеси 50:50 ацетонитрил/вода. В некоторых вариантах воплощения, способы включают частичное медленное испарение. В некоторых вариантах воплощения, способы включают суспендирование при комнатной температуре в течение, в некоторых вариантах воплощения, около 14 дней. В некоторых вариантах воплощения, способы включают нагревание до 51°C, медленное охлаждение от температуры около 51°C до около комнатной температуры, и в дополнительных вариантах воплощения раствору дают выстояться при комнатной температуре в течение примерно 1 дня. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00168] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из смеси 50:50 диметилформамид/вода. В некоторых вариантах воплощения, способы включают быстрое испарение. В некоторых вариантах воплощения, способы включают суспендирование при комнатной температуре в течение, в некоторых вариантах воплощения, около 14 дней. В некоторых вариантах воплощения, способы включают нагревание до 51°C, медленное охлаждение от температуры около 51°C до около комнатной температуры, и в дополнительных вариантах воплощения раствору дают выстояться при комнатной температуре в течение примерно 1 дня. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00169] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из смеси 50:50 п-диоксан/вода. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы включают нагревание до 51°C, медленное охлаждение от температуры около 51°C до около комнатной температуры, и в дополнительных вариантах воплощения раствору дают выстояться при комнатной температуре в течение примерно 1 дня, и в других дополнительных вариантах воплощения затем осуществляют охлаждение до около 0°C. В следующих вариантах воплощения, раствор выдерживают при около 0°C в течение примерно 11 дней. В некоторых вариантах воплощения, способы обеспечивают Форму A, кристаллическую форму Соединения 1.
[00170] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования кристаллической формы Соединения 1, включающие кристаллизацию из ТГФ. В некоторых вариантах воплощения, способы включают медленное испарение. В некоторых вариантах воплощения, способы включают диффузию из паровой фазы. В некоторых вариантах воплощения, способы включают диффузию из паровой фазы при помощи гептана или воды. В некоторых вариантах воплощения, способы включают диффузию из паровой фазы в течение 1, 2, 3, 4, 5, 6, 7 или 8 дней. В некоторых вариантах воплощения, способы обеспечивают Форму А, кристаллическую форму Соединения 1. В некоторых вариантах воплощения, способы обеспечивают Вещество B, кристаллическую форму Соединения 1. В некоторых вариантах воплощения, способы обеспечивают смесь кристаллических форм, Формы B и Вещества B.
[00171] В некоторых вариантах воплощения, в настоящей заявке представлены способы образования Формы А, кристаллической формы Соединения 1, путем хранения кристаллической формы Вещества B при температуре от 15-50°C, 20-35°C или около 25°C.
[00172] В некоторых вариантах воплощения, стадия кристаллизации обеспечивает кристаллическое Соединение 1, имеющее чистоту больше чем около 90% (например, как определено анализом ВЭЖХ). В некоторых вариантах воплощения, стадия кристаллизации обеспечивает кристаллическое Соединение 1, имеющее чистоту больше чем около 95%. В некоторых вариантах воплощения, стадия кристаллизации обеспечивает кристаллическое Соединение 1, имеющее чистоту больше чем около 98%. В некоторых вариантах воплощения, стадия кристаллизации обеспечивает кристаллическое Соединение 1, имеющее чистоту больше чем около 99%. В некоторых вариантах воплощения стадия кристаллизации обеспечивает кристаллическое Соединение 1, имеющее чистоту больше чем около 99,1%, около 99,2%, около 99,3%, около 99,4%, около 99,5%, около 99,6%, около 99,7%, около 99,8% или 99,9%. В некоторых вариантах воплощения, стадия кристаллизации обеспечивает кристаллическое Соединение 1, имеющее чистоту больше чем около 90% до около 100%, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, настоящее изобретение обеспечивает Соединение 1, отличающееся тем, что оно содержит меньше чем около 400 ч/млн ацетона, присутствующего в качестве остаточного растворителя. В некоторых вариантах воплощения, настоящее изобретение обеспечивает Соединение 1, отличающееся тем, что оно содержит меньше чем около 300 ч/млн ацетона, присутствующего в качестве остаточного растворителя. В некоторых вариантах воплощения, настоящее изобретение обеспечивает Соединение 1, отличающееся тем, что содержание ацетона, присутствующего в качестве остаточного растворителя, составляет от 0 до около 400 ч/млн. В некоторых вариантах воплощения, настоящее изобретение обеспечивает Соединение 1, отличающееся тем, что оно содержит от около 200 ч/млн до около 400 ч/млн ацетона, присутствующего в качестве остаточного растворителя. В некоторых вариантах воплощения, настоящее изобретение обеспечивает Соединение 1, отличающееся тем, что оно содержит от около 250 ч/млн до около 350 ч/млн ацетона, присутствующего в качестве остаточного растворителя.
[00173] Было обнаружено, например, что либо путем кристаллизации Соединения 1 из неполярного раствора (например, гексаны, н-гептан), либо путем промывки кристаллического Соединения 1 неполярным раствором обеспечивают Соединение 1, по существу, не содержащее одну или несколько неполярных примесей, выбранных из IMP-1 и IMP-2 и IMP-3 (Фиг.7).
[00174] В некоторых вариантах воплощения, обеспечивается кристаллическое Соединение 1, по существу, не содержащее неполярную примесь IMP-1 (Фиг.7). Как это используется в настоящей заявке, "по существу, не содержащее IMP-1" относится к кристаллическому Соединению 1, содержащему меньше чем около 0,1% a/a IMP-1, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,09% a/a, меньше чем около 0,08% a/a, меньше чем около 0,07% a/a, меньше чем около 0,06% a/a, меньше чем около 0,05% a/a, меньше чем около 0,04% a/a, меньше чем около 0,03% a/a, меньше чем около 0,02% a/a или меньше чем около 0,01% a/a IMP-1, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,1% a/a до около 0,01% a/a IMP-1, как определено анализом ВЭЖХ.
[00175] В некоторых вариантах воплощения, обеспечивается кристаллическое Соединение 1, по существу, не содержащее неполярную примесь IMP-2 (Фиг.7). Как это используется в настоящей заявке, "по существу, не содержащее IMP-2" относится к кристаллическому Соединению 1, содержащему меньше чем около 0,1% a/a IMP-2, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,09% a/a, меньше чем около 0,08% a/a, меньше чем около 0,07% a/a, меньше чем около 0,06% a/a, меньше чем около 0,05% a/a, меньше чем около 0,04% a/a, меньше чем около 0,03% a/a, меньше чем около 0,02% a/a или меньше чем около 0,01% a/a IMP-2, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,1% a/a до около 0,01% a/a IMP-2, как определено анализом ВЭЖХ.
[00176] В некоторых вариантах воплощения, обеспечивается кристаллическое Соединение 1, по существу, не содержащее неполярную примесь IMP-3 (Фиг.7). Как это используется в настоящей заявке, "по существу, не содержащее IMP-3" относится к кристаллическому Соединению 1, содержащему меньше чем около 0,1% a/a IMP-3, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,09% a/a, меньше чем около 0,08% a/a, меньше чем около 0,07% a/a, меньше чем около 0,06% a/a, меньше чем около 0,05% a/a, меньше чем около 0,04% a/a, меньше чем около 0,03% a/a, меньше чем около 0,02% a/a или меньше чем около 0,01% a/a IMP-3, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,1% a/a до около 0,01% a/a IMP-3, как определено анализом ВЭЖХ.
[00177] Также было обнаружено, что кристаллизация из полярного раствора (например, из смеси полярного апротонного органического растворителя и воды) обеспечивает Соединение 1, по существу, не содержащее полярную примесь IMP-4 (Фиг.7).
[00178] Как это используется в настоящей заявке, "по существу, не содержащее IMP-4" относится к кристаллическому Соединению 1, содержащему меньше чем около 0,1% a/a IMP-4, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,09% a/a, меньше чем около 0,08% a/a, меньше чем около 0,07% a/a, меньше чем около 0,06% a/a, меньше чем около 0,05% a/a, меньше чем около 0,04% a/a, меньше чем около 0,03% a/a, меньше чем около 0,02% a/a или меньше чем около 0,01% a/a IMP-4, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,1% a/a до около 0,01% a/a IMP-4, как определено анализом ВЭЖХ.
[00179] В некоторых вариантах воплощения, кристаллическое Соединение 1 далее перекристаллизовывают из полярного раствора (например, из смеси воды и полярного апротонного органического растворителя). В некоторых вариантах воплощения, кристаллическое Соединение 1 далее перекристаллизовывают из смеси ацетона и воды.
(iv) Образование промежуточного соединения в форме ангидрида
В некоторых вариантах воплощения, описанная выше стадия S-2 способа дополнительно включает, после водного гашения и разделения водного и органического слоев: (i) азеотропную перегонку органического слоя с получением ангидрида Соединения 1 (например, образованного через дегидратацию Соединения 1), с последующим (ii) гидролизом ангидрида, являющегося промежуточным соединением, через обработку водой с получением Соединения 1 (Схема 2).
Схема 2
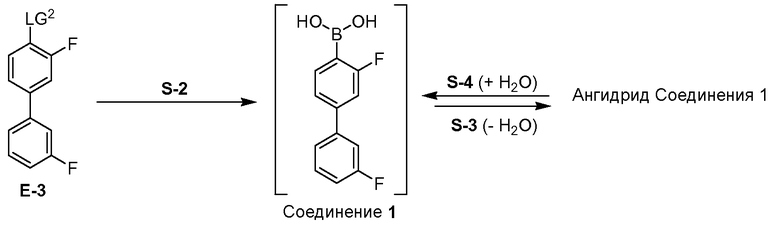
Стадия S-3. Азеотропная перегонка
[00180] В некоторых вариантах воплощения, стадия азеотропной перегонки представляет собой стадию обмена растворителями (например, необязательно, сначала осуществление отгонки органической фазы из реакционной смеси, с последующей обработкой концентрата растворителем для азеотропной перегонки, с последующей дополнительной перегонкой). В некоторых вариантах воплощения, стадия обмена растворителями может, необязательно и дополнительно, включать следующие стадии: (1) пополнение органической фазы растворителем для азеотропной перегонки и (2) отгонку части полученной органической фазы. Стадии обмена растворителями (1) и (2) можно повторить, если это необходимо. В некоторых вариантах воплощения, растворитель для азеотропной перегонки способствует удалению воды и/или других органических растворителей, присутствующих в реакционной смеси, с получением ангидрида Соединения 1 (также указанного в настоящей заявке как "Соединение 1, ангидрид"). В некоторых вариантах воплощения, растворитель для азеотропной перегонки представляет собой неполярный раствор (например, гексаны, н-гептан). В некоторых вариантах воплощения, ангидрид Соединения 1 отфильтровывают из реакционной смеси с получением твердого кристаллического вещества. В некоторых вариантах воплощения, кристаллический ангидрид Соединения 1, полученный этим способом, имеет рентгеновскую порошковую дифрактограмму, по существу аналогичную той, которая представлена на Фиг.8, Форма I.
[00181] Специалистам в данной области должно быть понятно, что "ангидрид Соединения 1" может существовать в виде димера, тримера, тетрамера, олигомера или их смесей, и может включать линейные или циклические ангидриды. Такие формы ангидридов предусматриваются и включают, но не ограничиваются этим, формы, показанные на Схеме 3. В некоторых вариантах воплощения, "Соединение 1, ангидрид" представляет собой циклический триммер, показанный на Схеме 3, также указанный в настоящей заявке как "Соединение 2".
Схема 3
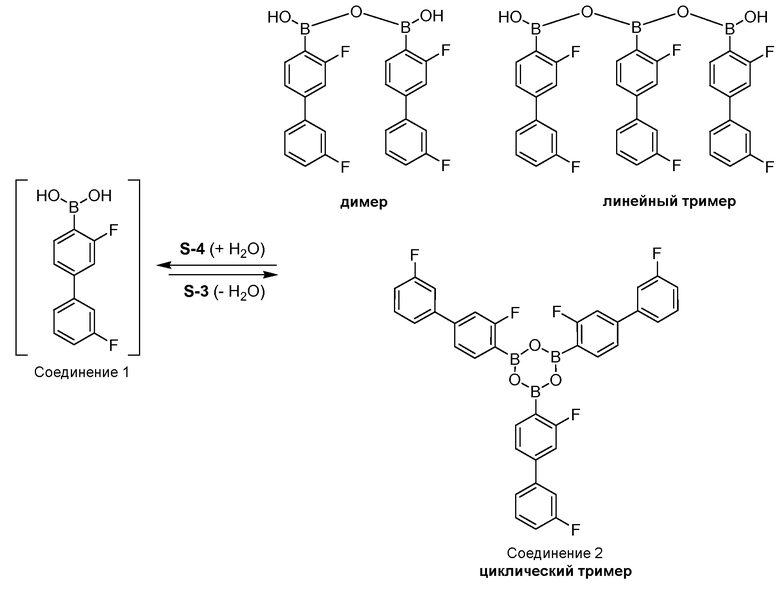
Стадия S-4. Гидролиз ангидрида
[00182] "Ангидрид Соединения 1" получают путем дегидратации Соединения 1 со стадии S-3 и его снова гидролизуют до Соединения 1, подвергая воздействию воды (т.е. стадия S-4). Таким образом, в некоторых вариантах воплощения, после стадии S-3, на которой получают ангидрид Соединения 1, следует гидролиз ангидрида Соединения 1 путем обработки водой, с получением кристаллического Соединения 1 (стадия S-4).
[00183] Например, в некоторых вариантах воплощения, стадия гидролиза включает нагревание (например, нагревание до температуры кипения с обратным холодильником) ангидрида Соединения 1 в смеси воды и полярного апротонного органического растворителя (например, ацетон, ацетонитрил или их смесь) с получением кристаллического Соединения 1 (например, таким образом, что Соединение 1 осаждается из смеси). В некоторых вариантах воплощения, полярный апротонный органический растворитель представляет собой ацетон, ацетонитрил или их смесь. В некоторых вариантах воплощения, полярный апротонный органический растворитель представляет собой ацетон.
[00184] В некоторых вариантах воплощения, смесь полярного апротонного органического растворителя в воде представляет собой от около 5% до около 95% полярного апротонного органического растворителя в воде, от около 10% до около 90% полярного апротонного органического растворителя в воде, от около 15% до около 85% полярного апротонного органического растворителя в воде, от около 20% до около 80% полярного апротонного органического растворителя в воде, от около 25% до около 75% полярного апротонного органического растворителя в воде, от около 30% до около 70% полярного апротонного органического растворителя в воде, от около 35% до около 65% полярного апротонного органического растворителя в воде или от около 40% до около 70% полярного апротонного органического растворителя в воде.
[00185] В некоторых вариантах воплощения, порции полярного раствора и воды добавляют к раствору при кипячении с обратным холодильником поочередно в несколько приемов перед охлаждением раствора. В некоторых вариантах воплощения, охлаждение раствора осуществляют в течение определенного периода времени (например, больше чем около 8 часов) и/или при определенной температуре (например, около 25°C). В некоторых вариантах воплощения, Соединение 1 выделяют фильтрованием и сушат с использованием любого способа, известного в области химии.
[00186] В некоторых вариантах воплощения, Соединение 1, полученное на описанной выше стадии гидролиза, представляет собой кристаллическое Соединение 1, описанное в настоящей заявке. В некоторых вариантах воплощения, кристаллическое Соединение 1, полученное этим способом, имеет рентгеновскую порошковую дифрактограмму, по существу аналогичную той, которая представлена на Фиг.1 как Форма А.
[00187] В некоторых вариантах воплощения, кристаллическое Соединение 1, полученное на описанной выше стадии гидролиза, имеет чистоту больше чем около 90% (например, как определено анализом ВЭЖХ). В некоторых вариантах воплощения, кристаллическое Соединение 1, полученное на описанной выше стадии гидролиза, имеет чистоту больше чем около 95%. В некоторых вариантах воплощения, кристаллическое Соединение 1, полученное на описанной выше стадии гидролиза, имеет чистоту больше чем около 98%. В некоторых вариантах воплощения, кристаллическое Соединение 1, полученное на описанной выше стадии гидролиза, имеет чистоту больше чем около 99%. В некоторых вариантах воплощения, кристаллическое Соединение 1, полученное на описанной выше стадии гидролиза, имеет чистоту больше чем около 99,1%, около 99,2%, около 99,3%, около 99,4%, около 99,5%, около 99,6%, около 99,7%, около 99,8% или около 99,9%. В некоторых вариантах воплощения, кристаллическое Соединение 1, полученное на описанной выше стадии гидролиза, имеет чистоту больше чем около 90% до около 100%, как определено анализом ВЭЖХ.
[00188] В некоторых вариантах воплощения, настоящее изобретение обеспечивает кристаллическое Соединение 1 с описанной выше стадии гидролиза, содержащее меньше чем около 400 ч/млн ацетона, присутствующего в качестве остаточного растворителя. В некоторых вариантах воплощения, настоящее изобретение обеспечивает кристаллическое Соединение 1 с описанной выше стадии гидролиза, содержащее меньше чем около 300 ч/млн ацетона, присутствующего в качестве остаточного растворителя. В некоторых вариантах воплощения, настоящее изобретение обеспечивает кристаллическое Соединение 1 с описанной выше стадии гидролиза, содержащее ацетон, который присутствует в качестве остаточного растворителя, в количестве от 0 до около 400 ч/млн. В некоторых вариантах воплощения, настоящее изобретение обеспечивает кристаллическое Соединение 1 с описанной выше стадии гидролиза, содержащее от около 200 ч/млн до около 400 ч/млн ацетона, присутствующего в качестве остаточного растворителя. В некоторых вариантах воплощения, настоящее изобретение обеспечивает кристаллическое Соединение 1 с описанной выше стадии гидролиза, содержащее от около 250 ч/млн до около 350 ч/млн ацетона, присутствующего в качестве остаточного растворителя.
[00189] Было обнаружено, что промывка кристаллического Соединения 1 неполярным раствором после описанной выше стадии гидролиза обеспечивает Соединение 1, по существу, не содержащее одну или несколько неполярных примесей, выбранных из IMP-1 и IMP-2 и IMP-3 (Фиг.7).
[00190] В некоторых вариантах воплощения, обеспечивается кристаллическое Соединение 1 с описанной выше стадии гидролиза, по существу, не содержащее неполярную примесь IMP-1 (Фиг.7). Как это используется в настоящей заявке, "по существу, не содержащее IMP-1" относится к кристаллическому Соединению 1, содержащему меньше чем около 0,1% a/a IMP-1, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,09% a/a, меньше чем около 0,08% a/a, меньше чем около 0,07% a/a, меньше чем около 0,06% a/a, меньше чем около 0,05% a/a, меньше чем около 0,04% a/a, меньше чем около 0,03% a/a, меньше чем около 0,02% a/a или меньше чем около 0,01% a/a IMP-1, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,05% a/a IMP-1, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,1% a/a до около 0,01% a/a IMP-1, как определено анализом ВЭЖХ.
[00191] В некоторых вариантах воплощения, обеспечивается кристаллическое Соединение 1 с описанной выше стадии гидролиза, по существу, не содержащее неполярную примесь IMP-2 (Фиг.7). Как это используется в настоящей заявке, "по существу, не содержащее IMP-2" относится к кристаллическому Соединению 1, содержащему меньше чем около 0,1% a/a IMP-2, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,09% a/a, меньше чем около 0,08% a/a, меньше чем около 0,07% a/a, меньше чем около 0,06% a/a, меньше чем около 0,05% a/a, меньше чем около 0,04% a/a, меньше чем около 0,03% a/a, меньше чем около 0,02% a/a или меньше чем около 0,01% a/a IMP-2, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,05% a/a IMP-2, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,1% a/a до около 0,01% a/a IMP-2, как определено анализом ВЭЖХ.
[00192] В некоторых вариантах воплощения, обеспечивается кристаллическое Соединение 1 с описанной выше стадии гидролиза, по существу, не содержащее неполярную примесь IMP-3 (Фиг.7). Как это используется в настоящей заявке, "по существу, не содержащее IMP-3" относится к кристаллическому Соединению 1, содержащему меньше чем около 0,1% a/a IMP-3, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,09% a/a, меньше чем около 0,08% a/a, меньше чем около 0,07% a/a, меньше чем около 0,06% a/a, меньше чем около 0,05% a/a, меньше чем около 0,04% a/a, меньше чем около 0,03% a/a, меньше чем около 0,02% a/a или меньше чем около 0,01% a/a IMP-3, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,05% a/a IMP-3, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,1% a/a до около 0,01% a/a IMP-3, как определено анализом ВЭЖХ.
[00193] Также было обнаружено, что кристаллизация из полярного раствора (например, из смеси полярного апротонного органического растворителя и воды) после описанной выше стадии гидролиза обеспечивает Соединение 1, по существу, не содержащее полярную примесь IMP-4 (Фиг.7). Как это используется в настоящей заявке, "по существу, не содержащее IMP-4" относится к кристаллическому Соединению 1, содержащему меньше чем около 0,1% a/a IMP-4, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,09% a/a, меньше чем около 0,08% a/a, меньше чем около 0,07% a/a, меньше чем около 0,06% a/a, меньше чем около 0,05% a/a, меньше чем около 0,04% a/a, меньше чем около 0,03% a/a, меньше чем около 0,02% a/a или меньше чем около 0,01% a/a IMP-4, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,05% a/a IMP-4, как определено анализом ВЭЖХ. В некоторых вариантах воплощения, Соединение 1 содержит меньше чем около 0,1% a/a до около 0,01% a/a IMP-4, как определено анализом ВЭЖХ.
[00194] В некоторых вариантах воплощения, кристаллическое Соединение 1 далее перекристаллизовывают из полярного раствора (например, из смеси воды и полярного апротонного органического растворителя). В некоторых вариантах воплощения, кристаллическое Соединение 1 далее перекристаллизовывают из смеси ацетона и воды.
(v) Другие варианты воплощения способа получения
[00195] В некоторых вариантах воплощения, настоящее изобретение обеспечивает способ получения Соединения 1:
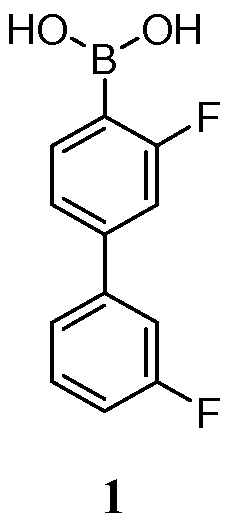
или его фармацевтически приемлемой соли, гидрата или сольвата и/или его ангидрида;
включающий следующие стадии:
(a) взаимодействие соединения формулы E-1:
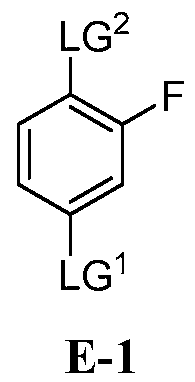
где:
LG1 и LG2 независимо выбраны из галогена или сульфоната;
с соединением формулы E-2:
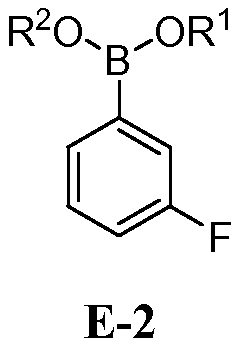
где каждый R1 и R2 независимо выбран из водорода или C1-6 алкильной, C2-6 алкенильной, C2-6 алкинильной, C6-12 арильной или C6-12 гетероарильной группы, или R1 и R2 объединены с образованием 5-8-членного кольца;
для получения соединение формулы E-3:
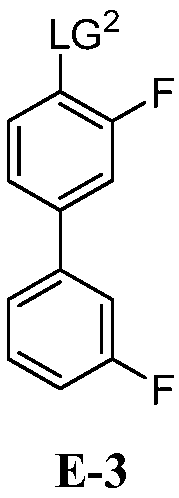
где:
LG2 выбран из галогена или сульфоната;
(b) взаимодействие E-3 с бороно-образующим реагентом и металлическим реагентом для получения Соединения 1.
[00196] В некоторых вариантах воплощения, E-1 представляет собой E-1b:
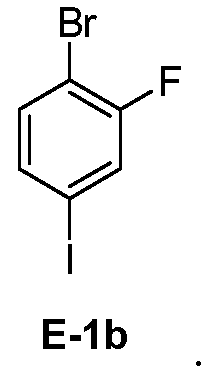
[00197] В некоторых вариантах воплощения, E-2 представляет собой E-2а:
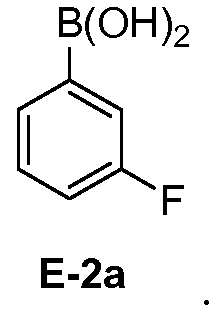
[00198] В некоторых вариантах воплощения, E-3 представляет собой E-3a:
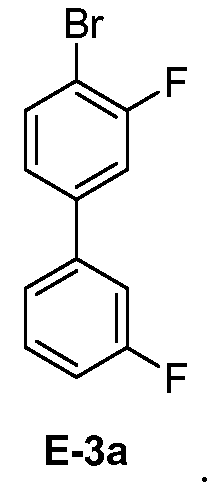
[00199] В некоторых вариантах воплощения, стадия взаимодействия включает палладиевый катализатор.
В некоторых вариантах воплощения, палладиевый катализатор выбран из Pd(PPh3)4, Pd(OAc)2, Pd2(dba)3, Pd(dppf)2Cl2 и PdCl2(PPh3)2.
[00200] В некоторых вариантах воплощения, стадия взаимодействия включает основание. В некоторых вариантах воплощения, основание выбрано из триэтиламина, диизопропилэтиламина, карбоната калия, карбоната натрия, карбоната цезия, бикарбоната калия, бикарбоната натрия, бикарбоната цезия, ацетата калия, ацетата натрия, фосфата калия, гидроксида лития, гидроксида натрия и гидроксида магния.
[00201] В некоторых вариантах воплощения, бороно-образующий реагент представляет собой боронатный сложный эфир. В некоторых вариантах воплощения, боронатный сложный эфир выбран из триметилбората, триэтилбората, триаллилбората, триизопропилбората, трибутилбората, три-трет-бутилбората, трипентилбората, тригексилбората, тритолилбората, трибензилбората, трифенилбората, триметиленбората, триэтаноламинбората, триметаллилбората, 2-метокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана, 2-метокси-4,4,6-триметил-1,3,2-диоксаборинана, 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана, 2-изопропокси-4,4,6-триметил-1,3,2-диоксаборинана, 2-(2-диметиламиноэтокси)-4-метил-1,3,2-диоксаборинана, 2-бутокси-4,4,6-триметилL-1,3,2-диоксаборинана, трис(2,2,2-трифторэтил)бората, трис(1-изопропил-2-метилпропил)бората и 2,2'-(2-метил-2,4-пентандиилдиокси)бис(4,4,6-триметил-1,3,2-диоксаборинан).
[00202] В некоторых вариантах воплощения, металлический реагент представляет собой алкиллитиевый реагент. В некоторых вариантах воплощения, алкиллитиевый реагент представляет собой н-бутиллитий или гексиллитий.
[00203] В некоторых вариантах воплощения, способ дополнительно включает кристаллизацию Соединения 1 на стадии (b) с получением кристаллического Соединения 1. Примеры способов кристаллизации и перекристаллизации Соединения 1 описаны выше и в настоящей заявке.
[00204] Например, в некоторых вариантах воплощения, стадия кристаллизации включает кристаллизацию Соединения 1 из полярного раствора, включающего воду, полярный апротонный растворитель или их смесь. В некоторых вариантах воплощения, стадия кристаллизации включает кристаллизацию Соединения 1 из смеси воды и ацетона. В некоторых вариантах воплощения, кристаллическое Соединение 1 дополнительно промывают неполярным раствором. В некоторых вариантах воплощения, неполярный раствор включает гексаны, гептаны или их смесь. В некоторых вариантах воплощения, кристаллическое Соединение 1 далее перекристаллизовывают из смеси воды и ацетона.
[00205] Примеры кристаллического Соединения 1, полученного описанными способами, более подробно описаны в следующем разделе и в примерах.
[00206] В некоторых вариантах воплощения, стадия (b) способа дополнительно включает стадии дегидратации Соединения 1 для получения ангидрида Соединения 1 и затем гидролиза ангидрида Соединения 1 для получения Соединения 1. В некоторых вариантах воплощения, стадию дегидратации осуществляют in situ (т.е. Соединение 1 не является выделенным). В некоторых вариантах воплощения, стадия дегидратации представляет собой стадию азеотропной перегонки. В некоторых вариантах воплощения, азеотропную перегонку осуществляют путем обмена растворителями реакционной смеси. В некоторых вариантах воплощения, стадию гидролиза осуществляют путем добавления воды к ангидриду Соединения 1. Примеры способов дегидратации, азеотропной перегонки и гидролиза также описаны выше и далее в настоящей заявке.
[00207] В некоторых вариантах воплощения, ангидрид Соединения 1 ("Соединение 1, ангидрид") представляет собой Соединение 2:
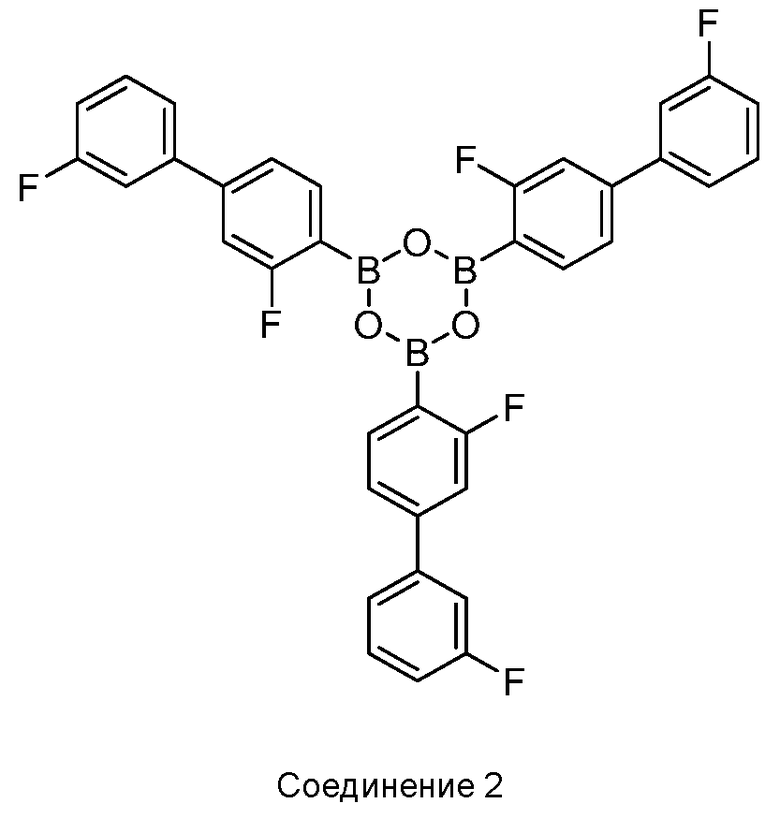
или его фармацевтически приемлемую соль, гидрат или сольват.
[00208] В некоторых вариантах воплощения, Соединение 2 является кристаллическим. Примеры кристаллического Соединения 2, полученного такими способами, более подробно описаны в следующем разделе и в примерах.
Твердые формы Соединения 1 и их ангидриды
[00209] Потенциальные фармацевтические твердые вещества включают кристаллические твердые вещества и аморфные твердые вещества. Аморфные твердые вещества характеризуются отсутствием дальнего структурного порядка, тогда как кристаллические твердые вещества характеризуются структурной периодичностью. Желаемый класс фармацевтического твердого вещества зависит от конкретного применения; аморфные твердые вещества иногда выбирают на основании, например, улучшенного профиля растворения, тогда как кристаллические твердые вещества могут быть желательными для таких целей, как, например, физическая или химическая стабильность (см., например, S. R. Vippagunta et al, Adv. Drug. Deliv. Rev., (2001) 48:3-26; L. Yu, Adv. Drug. Deliv. Rev., (2001) 48:27-42). Изменение твердой формы может повлиять на различные физические и химические свойства, что может быть выгодным или неблагоприятным с точки зрения обработки, формулирования, стабильности и биодоступности, среди других важных фармацевтических характеристик.
[00210] Независимо от того, являются они кристаллическими или аморфными, потенциальные твердые формы фармацевтического соединения могут включать однокомпонентные и многокомпонентные твердые вещества. Однокомпонентные твердые вещества состоят, по существу, из фармацевтического соединения в отсутствие другого соединения. Разнообразие среди однокомпонентных кристаллических веществ потенциально может возникать из такого явления как полиморфизм, где существует множество трехмерных структур для конкретного фармацевтического соединения (см., например, S. R. Byrn et al, Solid State Chemistry of Drugs, (1999) SSCI, West Lafayette).
[00211] Дополнительное разнообразие среди потенциальных твердых форм фармацевтического соединения может возникать из возможности многокомпонентных твердых веществ. Твердые кристаллические вещества, включающие два или более ионных видов, называются солями (см., например, Handbook of Pharmaceutical Salts: Properties, Selection and Use. P. H. Stahl and C. G. Wermuth, Eds., (2002), Wiley, Weinheim). Дополнительные типы многокомпонентных твердых веществ, которые потенциально могут обеспечить другие улучшения свойств для фармацевтического соединения или его соли, среди прочего, включают, например, гидраты, сольваты, ко-кристаллы и клатраты (см., например, S. R. Byrn et al, Solid State Chemistry of Drugs, (1999) SSCI, West Lafayette). Более того, многокомпонентные кристаллические формы потенциально могут быть восприимчивы к полиморфизму, где данная многокомпонентная композиция может существовать в более чем одной трехмерной кристаллической структуре. Открытие твердых форм имеет важное значение для разработки безопасного, эффективного, стабильного и пользующегося спросом на рынке фармацевтического соединения.
[00212] Твердые формы, представленные в настоящей заявке, являются полезными в качестве активных фармацевтических ингредиентов для получения композиций, применяемых для животных или человека. Таким образом, варианты воплощения, описанные в настоящей заявке, охватывают применение этих твердых форм в качестве конечного лекарственного продукта. Некоторые варианты воплощения обеспечивают твердые формы, полезные для получения конечных лекарственных форм с улучшенными свойствами, такими как, среди прочего, свойства текучести порошка, свойства прессуемости, свойства таблетирования, свойства стабильности и свойства совместимости с эксципиентами, которые необходимы для получения, обработки, формулирования и/или хранения конечных лекарственных продуктов. Некоторые варианты воплощения, описанные в настоящей заявке, обеспечивают фармацевтические композиции, включающие однокомпонентную кристаллическую форму, многокомпонентную кристаллическую форму, однокомпонентную аморфную форму и/или многокомпонентную аморфную форму, включающую соединение формулы (I) и фармацевтически приемлемый разбавитель, эксципиент или носитель.
[00213] Твердая форма и соответствующие термины относятся к физической форме, которая не находится преимущественно в жидком или газообразном состоянии. Твердые формы могут быть кристаллическими, аморфными или смешанными. "Однокомпонентая" твердая форма, включающая конкретное соединение, состоит, по существу, из этого соединения. "Многокомпонентая" твердая форма, включающая конкретное соединение, включает это соединение и существенное количество одного или нескольких дополнительных видов, таких как ионы и/или молекулы, в этой твердой форме. Твердые формы, представленные в настоящей заявке, могут быть кристаллическими, аморфным или иметь промежуточную форму. Кристаллические формы, описанные в настоящей заявке, поэтому могут иметь различные степени кристалличности или порядок решетки. Твердые формы, описанные в настоящей заявке, не ограничиваются какими-либо конкретными степенями кристалличности или порядком решетки и могут быть 0-100% кристаллическими. Способы определения степени кристалличности известны специалистам со средней квалификацией, например, способы, описанные в Suryanarayanan, R., X-Ray Power Diffractometry, Physical Characterization of Pharmaceutical Salts, H.G. Brittain, Editor, Mercel Dekkter, Murray Hill, N.J., 1995, pp. 187-199, который включен в настоящую заявку посредством ссылки во всей полноте. В некоторых вариантах воплощения, твердые формы, описанные в настоящей заявке, являются кристаллическими на около 0, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100%.
[00214] Твердые формы могут демонстрировать разные характеризующие их физические данные, которые являются уникальными для конкретной твердой формы, например, кристаллических форм, описанных в настоящей заявке. Эти характеризующие данные можно получить различными способами, известными специалистам в данной области, включая, например, рентгеновскую порошковую дифракцию, дифференциальную сканирующую калориметрию, термический графиметрический анализ и спектроскопию ядерного магнитного резонанса. Данные, полученные этими методами, можно использовать для идентификации конкретной твердой формы. Специалист в данной области может определить, является ли твердая форма одной из форм, описанных в настоящей заявке, путем осуществления одного из этих методов идентификации и определения, являются ли полученные данные "по существу аналогичными" базовым контрольным данным, представленным в настоящей заявке, которые определяют как характерные для конкретной твердой формы. Характеристические данные, которые "по существу аналогичны" данным для контрольной твердой формы, рассматриваются специалистами в данной области как соответствующие такой же твердой форме, как контрольная твердая форма. При анализе, являются или нет данные "по существу аналогичными", специалист в данной области должен понимать, что конкретные характеристические точки данных могут варьировать в определенной степени, оставаясь при этом характеристиками, описывающими данную твердую форму, из-за, например, экспериментальной ошибки и рутинного расхождения от образца к образцу в анализе.
Соединение 1
[00215] Предполагается, что Соединение 1 может существовать в различных твердых формах. Такие твердые формы включают твердые кристаллические вещества, такие как полиморфы, сольваты и гидраты кристаллического Соединения 1, а также аморфные твердые вещества или их смеси. Все такие твердые формы Соединения 1 предусматриваются настоящим изобретением.
[00216] В некоторых вариантах воплощения, в настоящей заявке представлено кристаллическое Соединение 1:
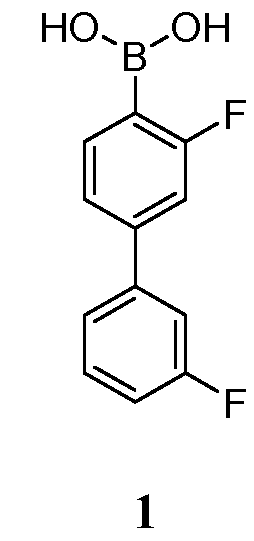
или его фармацевтически приемлемая соль, гидрат или сольват.
[00217] В некоторых вариантах воплощения, кристаллическое Соединение 1, по существу, свободно от любого из следующих соединений:
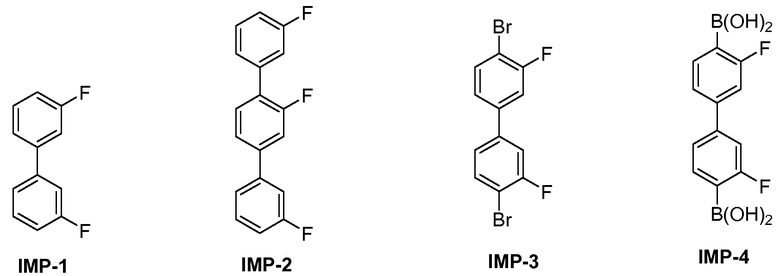
[00218] В некоторых вариантах воплощения настоящего изобретения, Соединение 1 обеспечивается в виде твердого кристаллического вещества ("кристаллическое Соединение 1"). В некоторых вариантах воплощения, кристаллическое Соединение 1 представляет собой твердую форму, по существу, не содержащую аморфное Соединение 1. В некоторых вариантах воплощения, кристаллическое Соединение 1 представляет собой твердую форму, по существу, не содержащую другие кристаллические формы (т.е. полиморфы) Соединения 1. В некоторых вариантах воплощения, кристаллическое Соединение 1 представляет собой твердую форму, по существу, не содержащую один или несколько ангидридов Соединения 1 (например, димер, тример или олигомер Соединения 1, например, Соединение 2). В некоторых вариантах воплощения, Соединение 1 обеспечивается в виде чистого и выделенного кристаллического Соединения 1.
[00219] Как определено в настоящей заявке, "чистое и выделенное" относится к выделенному кристаллическому Соединению 1, имеющему, по меньшей мере, одну из следующих характеристик:
(i) твердое кристаллическое вещество, имеющее чистоту больше чем 90% (например, как определено анализом ВЭЖХ);
(ii) твердое кристаллическое вещество, содержащее меньше чем около 400 ч/млн ацетона, присутствующего в качестве остаточного растворителя;
(iii) твердое кристаллическое вещество, по существу, не содержащее неполярные примеси IMP-1 и IMP-2 и IMP-3, определенные выше и далее в настоящей заявке;
(iv) твердое кристаллическое вещество, по существу, не содержащее полярную примесь IMP-4, определенную выше и далее в настоящей заявке;
(v) твердое кристаллическое вещество, по существу, не содержащее аморфное Соединение 1;
(vi) твердое кристаллическое вещество, по существу, не содержащее один или несколько ангидридов Соединения 1; и/или
(vii) твердое кристаллическое вещество, по существу, не содержащее другие кристаллические формы Соединения 1.
[00220] В некоторых вариантах воплощения, "чистое и выделенное" относится к выделенному кристаллическому Соединению 1, имеющему, по меньшей мере, две из перечисленных выше (i)-(vii) характеристик. В некоторых вариантах воплощения, "чистое и выделенное" относится к выделенному кристаллическому Соединению 1, имеющему, по меньшей мере, три из перечисленных выше (i)-(vii) характеристик. В некоторых вариантах воплощения, "чистое и выделенное" относится к выделенному кристаллическому Соединению 1, имеющему, по меньшей мере, четыре из перечисленных выше (i)-(vii) характеристик. В некоторых вариантах воплощения, "чистое и выделенное" относится к выделенному кристаллическому Соединению 1, имеющему, по меньшей мере, пять из перечисленных выше (i)-(vii) характеристик. В некоторых вариантах воплощения, "чистое и выделенное" относится к выделенному кристаллическому Соединению 1, имеющему, по меньшей мере, шесть из перечисленных выше (i)-(vii) характеристик. В некоторых вариантах воплощения, "чистое и выделенное" относится к выделенному кристаллическому Соединению 1, имеющему все семь из перечисленных выше (i)-(vii) характеристик.
[00221] Фраза "по существу, не содержащее аморфное Соединение 1" означает, что около 90% до около 100% масс., около 95% до около 100% масс., около 98% до около 100% масс., или около 99% до около 100% масс. Соединения 1 является кристаллическим (т.е. не аморфным).
[00222] Фраза "по существу, не содержащее один или несколько ангидридов Соединения 1" означает, что около 90% до около 100% масс., около 95% до около 100% масс., около 98% до около 100% масс. или около 99% до около 100% масс. Соединения 1 обеспечивается в виде мономера (т.е. не ангидрида этого соединения).
[00223] Фраза "по существу, не содержащее одну или несколько других кристаллических форм Соединения 1" означает, что от около 90% до около 100% масс., от около 95% до около 100% масс., от около 98% до около 100% масс., или от около 99% до около 100% масс. Соединения 1 обеспечивается в виде конкретной кристаллической формы, например, "Формы А", "Формы А1" или "Вещества B".
Форма А, Соединение 1
[00224] "Форма А" в некоторых вариантах воплощения относится к конкретной кристаллической форме Соединения 1, имеющей, в некоторых вариантах воплощения, по меньшей мере, одну из следующих характеристик:
(i) одну или несколько температур перехода, выбранных из около 128±5°C и около 244±2°C, как определено методом дифференциальной сканирующей калориметрии (ДСК);
(ii) один или несколько пиков на рентгеновской порошковой дифрактограмме (XRPD), выбранный из 9,68±0,10, 17,26±0,10, 21,60±0,10, 24,68±0,10, 25,48±0,10, 27,73±0,10 и 29,08±0,10 θ 2 θ градусов);
(iii) рентгеновскую порошковую дифрактограмму (XRPD), по существу, аналогичную той, которая представлена на Фиг.1, Фиг.19A, 22 или 23; и/или
(iv) сканограмму, полученную методом дифференциальной сканирующей калориметрии (ДСК), по существу, аналогичную той, которая представлена на Фиг.2.
В некоторых вариантах воплощения, Форма А является выделенной. В некоторых вариантах воплощения, "Форма А" характеризуется пиками на рентгеновской порошковой дифрактограмме, расположенными в 1, 2, 3, 4, 5, 6 или всех следующих приблизительных положениях пиков: 9,68±0,10, 17,26±0,10, 21,60±0,10, 24,68±0,10, 25,48±0,10, 27,73±0,10 и 29,08±0,10 θ 2θ (градусов). В некоторых вариантах воплощения, "Форма А" характеризуется двумя или более пиками, выбранными из 9,68±0,10, 17,26±0,10, 21,60±0,10, 24,68±0,10, 25,48±0,10, 27,73±0,10 и 29,08±0,10. В некоторых вариантах воплощения, "Форма А" характеризуется тремя или более пиками, выбранными из 9,68±0,10, 17,26±0,10, 21,60±0,10, 24,68±0,10, 25,48±0,10, 27,73±0,10 и 29,08±0,10. В некоторых вариантах воплощения, "Форма А" характеризуется четырьмя или более пиками, выбранными из 9,68±0,10, 17,26±0,10, 21,60±0,10, 24,68±0,10, 25,48±0,10, 27,73±0,10 и 29,08±0,10. В некоторых вариантах воплощения, "Форма А" характеризуется пятью или более пиками, выбранными из 9,68±0,10, 17,26±0,10, 21,60±0,10, 24,68±0,10, 25,48±0,10, 27,73±0,10 и 29,08±0,10. В некоторых вариантах воплощения, "Форма А" характеризуется шестью или более пиками, выбранными из 9,68±0,10, 17,26±0,10, 21,60±0,10, 24,68±0,10, 25,48±0,10, 27,73±0,10 и 29,08±0,10. В некоторых вариантах воплощения, "Форма А" характеризуется всеми из следующих пиков: 9,68±0,10, 17,26±0,10, 21,60±0,10, 24,68±0,10, 25,48±0,10, 27,73±0,10 и 29,08±0,10. В некоторых вариантах воплощения, "Форма А" характеризуется рентгеновской порошковой дифрактограммой, по существу аналогичной той, которая показана на Фиг.1, 19A, 22 или 23.
[00225] В некоторых вариантах воплощения, в настоящем изобретении обеспечивается кристаллическая форма Соединения 1, имеющая рентгеновскую порошковую дифрактограмму, включающую пики при приблизительно 17,26, 21,60 и 27,73 градусов 2θ. В дополнительных вариантах воплощения, рентгеновская порошковая дифрактограмма дополнительно включает пики при приблизительно 24,68 и 25,48 градусов 2θ. В других дополнительных вариантах воплощения, рентгеновская порошковая дифрактограмма дополнительно включает пики при приблизительно 9,68 и 29,08 градусов 2θ.
[00226] В некоторых вариантах воплощения, в настоящем изобретении обеспечивается кристаллическая форма, имеющая по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23 или все из следующих приблизительных XRPD пиков: 4,8, 9,7, 16,1, 16,9, 17,3, 17,8, 18,6, 18,9, 19,3, 19,7, 21,0, 21,6, 22,5, 23,7, 24,3, 24,7, 25,2, 25,5, 26,0, 26,5, 27,7, 29,0, 29,4 и 29,8 градусов 2θ. В некоторых вариантах воплощения, кристаллическая форма имеет по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 пиков. В некоторых вариантах воплощения, кристаллическая форма имеет по меньшей мере 10 пиков.
[00227] В некоторых вариантах воплощения, в настоящем изобретении обеспечивается Форма А, кристаллическая форма Соединения 1. В некоторых вариантах воплощения, выделенная кристаллическая форма, Форма А, имеет рентгеновскую порошковую дифрактограмму, которая по существу аналогична той, которая представлена на Фиг.1, 19A, 22 или 23. В некоторых вариантах воплощения, в настоящем изобретении обеспечивается Форма А, кристаллическая форма Соединения 1, которая имеет рентгеновскую порошковую дифрактограмму, включающую пики при приблизительно 17,3, 21,6 и 27,7 градусов 2θ, как определено анализом с использованием медного источника Kα излучения.
[00228] В некоторых вариантах воплощения, "Форма А" характеризуется одной или несколькими температурами перехода, выбранными из около 128±5°C и около 244±2°C, как определено методом дифференциальной сканирующей калориметрии (ДСК). В некоторых вариантах воплощения, "Форма А" характеризуется температурой перехода около 244±2°C, как определено методом дифференциальной сканирующей калориметрии (ДСК). В некоторых вариантах воплощения, "Форма А" характеризуется температурой перехода около 128±5°C, как определено методом дифференциальной сканирующей калориметрии (ДСК). В некоторых вариантах воплощения, "Форма А" характеризуется двумя температурами перехода, выбранными из около 128±5°C и около 244±2°C, как определено методом дифференциальной сканирующей калориметрии (ДСК). В некоторых вариантах воплощения, "Форма А" характеризуется сканограммой, полученной методом дифференциальной сканирующей калориметрии (ДСК), по существу, аналогичной той, которая представлена на Фиг.2.
[00229] В некоторых вариантах воплощения, "Форма А" относится к конкретной кристаллической форме Соединения 1, имеющей по меньшей мере две из перечисленных выше (i)-(iv) характеристик. В некоторых вариантах воплощения, "Форма А" относится к конкретной кристаллической форме Соединения 1, имеющей по меньшей мере три из перечисленных выше (i)-(iv) характеристик. В некоторых вариантах воплощения, "Форма А" относится к конкретной кристаллической форме Соединения 1, имеющей все четыре из перечисленных выше (i)-(iv) характеристик.
[00230] В некоторых вариантах воплощения, Форма А может иметь одну или несколько предпочтительных ориентаций. Такие предпочтительные ориентации можно наблюдать на рентгеновских порошковых дифрактограммах высокого разрешения, которые могут, в некоторых вариантах воплощения, демонстрировать эффекты предпочтительной ориентации, подтвержденные небольшим количеством пиков высокой интенсивности.
[00231] В некоторых вариантах воплощения, Форма А, кристаллическая форма Соединения 1, имеет следующие приблизительные параметры моноклинной ячейки и рассчитанный объем: a=5,45 Ǻ; b=5,16 Ǻ; c=36,12 Ǻ; a=90°; β=90°; γ=90°; V=1016,5 Ǻ3. В некоторых вариантах воплощения, молекулярная масса асимметрической элементарной ячейки Формы A, кристаллической формы Соединения 1, составляет около 234,0 г/моль с Z=4. В некоторых вариантах воплощения, рассчитанная плотность указанной элементарной ячейки около 1,5 г/см3.
[00232] В некоторых вариантах воплощения, Форма А, кристаллическая форма Соединения 1, является химически стабильной. В некоторых вариантах воплощения, Форма А, кристаллическая форма Соединения 1, является физически стабильной.
[00233] В некоторых вариантах воплощения, Форма А, кристаллическая форма Соединения 1, по существу, свободна от других кристаллических форм Соединения 1.
[00234] В некоторых вариантах воплощения, Форма А является стабильной в стрессовых условиях при приблизительно 75%, 80%, 85%, 90%, 95%, 97% или 99% относительной влажности. В некоторых вариантах воплощения, Форма А является стабильной при приблизительно 75%, 80%, 85%, 90%, 95%, 97% или 99% относительной влажности при около 40°C. В некоторых других вариантах воплощения, Форма А является стабильной при приблизительно 75%, 80%, 85%, 90%, 95%, 97% или 99% относительной влажности при около 40°C в течение примерно 1 недели.
[00235] Термин "по существу аналогичный", когда он используется в настоящей заявке в контексте сравнения рентгеновской порошковой дифрактограммы или сканограммы, полученной методом дифференциальной сканирующей калориметрии для твердой формы соединения, например, Соединения 1, означает, что два спектра имеют общие для них отличительные характеристики, достаточные для их отличия от спектра, полученного для другой формы этого соединения. В некоторых вариантах воплощения, термин "по существу аналогичный" означает, что два спектра являются одинаковыми, т.е. визуально перекрываются. В некоторых вариантах воплощения, спектры или характеристические данные, которые по существу аналогичны контрольной кристаллической форме, аморфной форме или их смеси, рассматриваются специалистами как соответствующие такой же кристаллической форме, аморфной форме или их смеси, как этот конкретный контроль. При определении, являются ли спектры или характеристические данные по существу аналогичными, специалист в данной области учитывает, что конкретные характеристические точки данных могут варьировать в разумных пределах, оставаясь при этом характеристиками, описывающими данную твердую форму, из-за, например, экспериментальной ошибки и рутинного расхождения от образца к образцу в анализе или из-за эффектов предпочтительной ориентации.
[00236] В некоторых вариантах воплощения, анализ указанных выше XRPD пиков (градусы 2θ) осуществляли с использованием медного источника Kα излучения.
[00237] В некоторых вариантах воплощения, Форму А получают путем кристаллизации из ацетона, ацетонитрила, хлороформа, дихлорметана, диэтилового эфира, DMF, п-диоксана, этилацетата, гептана, смеси 2:1 гептан:хлороформ, 2:1 гептан:ТГФ, изопропилового эфира, метилэтилкетона, 2-метилтетрагидрофурана, метилизобутилкетона, трет-бутил метилового эфира, нитрометана, ТГФ, толуола, воды, смеси 1:1 ацетон:вода, смеси 1:1 ацетонитрил:вода, смеси 1:1 DMF:вода или смеси 1:1 диоксан:вода.
[00238] В некоторых вариантах воплощения, Форму А получают путем медленного испарения из ацетона, в некоторых вариантах воплощения, Форму А получают путем краш-преципитации гептаном из ацетона.
[00239] В некоторых вариантах воплощения, Форму А получают путем медленного испарения из ацетонитрила. В некоторых вариантах воплощения, Форму А получают путем диффузии из паровой фазы при помощи воды из ацетонитрила. В конкретных вариантах воплощения, парофазную диффузию осуществляют в течение около 8 дней.
[00240] В некоторых вариантах воплощения, Форму А получают путем медленного испарения из диэтилового эфира.
[00241] В некоторых вариантах воплощения, Форму А получают путем быстрого испарения из DMF. В некоторых вариантах воплощения, Форму А получают путем медленного испарения из п-диоксана.
[00242] В некоторых вариантах воплощения, Форму А получают путем медленного испарения или краш-преципитации гептаном из этилацетата.
[00243] В некоторых вариантах воплощения, Форму А получают путем суспендирования в гептане. В конкретных вариантах воплощения, суспендирование осуществляют при комнатной температуре. В другом варианте воплощения, суспендирование осуществляют при комнатной температуре в течение примерно 14 дней.
[00244] В некоторых вариантах воплощения, Форму А получают путем медленного испарения из смеси 2:1 гептан:хлороформ.
[00245] В некоторых вариантах воплощения, Форму А получают путем медленного испарения из смеси 2:1 гептан:ТГФ.
[00246] В некоторых вариантах воплощения, Форму А получают путем медленного испарения из изопропилового эфира.
[00247] В некоторых вариантах воплощения, Форму А получают путем медленного охлаждения из изопропилового эфира. В некоторых вариантах воплощения, раствор Формы A и изопропилового эфира охлаждают от около 51°C до комнатной температуры и дают выстояться в течение 1 дня. В некоторых вариантах воплощения, Форму А получают путем краш-преципитации гептаном из изопропилового эфира.
[00248] В некоторых вариантах воплощения, Форму А получают путем медленного испарения из метилэтилкетона. В некоторых вариантах воплощения, Форму А получают путем краш-преципитации гептаном из метилэтилкетона.
[00249] В некоторых вариантах воплощения, Форму А получают путем медленного испарения из 2-метил ТГФ.
[00250] В некоторых вариантах воплощения, Форму А получают путем медленного испарения из MTBE. В некоторых вариантах воплощения, Форму А получают путем краш-преципитации гептаном из MTBE.
[00251] В некоторых вариантах воплощения, Форму А получают путем медленного испарения из нитрометана.
[00252] В некоторых вариантах воплощения, Форму А получают путем быстрого испарения, суспендирования или медленного охлаждения из толуола. В некоторых вариантах воплощения, суспендирование осуществляют при около комнатной температуре в течение около 14 дней. В некоторых вариантах воплощения, раствор толуола и соединения 1 охлаждают от температуры около 51°C до комнатной температуры и дают выстояться в течение 1 дня.
[00253] В некоторых вариантах воплощения, Форму А получают путем суспендирования из воды. В некоторых вариантах воплощения, суспендирование осуществляют при комнатной температуре в течение примерно 14 дней.
[00254] В некоторых вариантах воплощения, Форму А получают путем медленного испарения, суспендирования или медленного охлаждения из смеси 1:1 ацетон:вода. В некоторых вариантах воплощения, суспендирование осуществляют при около комнатной температуре в течение около 14 дней. В некоторых вариантах воплощения, раствор Соединения 1 и смеси ацетон/вода охлаждают от температуры около 51°C до комнатной температуры и дают выстояться в течение 1 дня.
[00255] В некоторых вариантах воплощения, Форму А получают путем медленного испарения, суспендирования или медленного охлаждения из смеси 1:1 ацетонитрил:вода. В некоторых вариантах воплощения, суспендирование осуществляют при около комнатной температуре в течение около 14 дней. В некоторых вариантах воплощения, раствор Соединения 1 и смеси ацетон/вода охлаждают от температуры около 51°C до комнатной температуры и дают выстояться в течение 1 дня.
[00256] В некоторых вариантах воплощения, Форму А получают путем быстрого испарения, суспендирования или медленного охлаждения из смеси 1:1 DMF:вода. В некоторых вариантах воплощения, суспендирование осуществляют при около комнатной температуре в течение около 14 дней. В некоторых вариантах воплощения, раствор Соединения 1 и смеси ацетон/вода охлаждают от температуры около 51°C до комнатной температуры и дают выстояться в течение 1 дня.
[00257] В некоторых вариантах воплощения, Форму А получают путем медленного испарения или суспендирования из смеси 1:1 п-диоксан:вода. В некоторых вариантах воплощения, суспендирование осуществляют при температуре около комнатной температуры в течение около 14 дней. В некоторых вариантах воплощения, раствор Соединения 1 и смеси ацетон/вода охлаждают от температуры около 51°C до комнатной температуры и дают выстояться в течение 1 дня.
Форма А1, Соединение 1
[00258] В некоторых вариантах воплощения, в настоящем изобретении обеспечивается Форма А1, кристаллическая форма Соединения 1. Репрезентативная рентгеновская порошковая дифрактограмма Формы A1 представлена на Фиг.31. В некоторых вариантах воплощения, в настоящем изобретении обеспечивается Форма А1, кристаллическая форма Соединения A1, которая имеет рентгеновскую порошковую дифрактограмму, по существу аналогичную той, которая представлена на Фиг.31. В некоторых вариантах воплощения, Форма А1, кристаллическая форма Соединения 1, является выделенной.
[00259] В некоторых вариантах воплощения, Форму А1 получают путем кристаллизации Соединения 1 из хлороформа, дихлорметана, изопропилового эфира или метилизобутилового эфира. В некоторых вариантах воплощения, Форму А1 получают путем медленного испарения из хлороформа. В некоторых вариантах воплощения, Форму А1 получают путем медленного испарения или краш-преципитации гептаном из дихлорметана.
Вещество B, Соединение 1
[00260] В некоторых вариантах воплощения, в настоящем изобретении обеспечивается Вещество B, кристаллическая форма Соединения 1. В некоторых вариантах воплощения, форма B, кристаллическая форма Соединения 1, является выделенной. Репрезентативная рентгеновская порошковая дифрактограмма Вещества B представлена на Фиг.19B, 32 или 35. В некоторых вариантах воплощения, в настоящем изобретении обеспечивается Вещество B, кристаллическая форма Соединения 1, которое имеет рентгеновскую порошковую дифрактограмму, по существу аналогичную той, которая представлена на Фиг.19B, 32 или 35.
[00261] В некоторых вариантах воплощения, Вещество B характеризуется ДСК термограммой, включающей один, два, три или более термических событий при около 119°C или выше.
[00262] В некоторых вариантах воплощения, Вещество B претерпевает потерю массы около 10,14% при нагревании от 25 до 130°C. В некоторых вариантах воплощения, такую потерю массы определяют при помощи TGA анализа.
[00263] В некоторых вариантах воплощения, Вещество B характеризуется TGA или ДСК термограммой, по существу аналогичной той, которая показана на Фиг.34.
[00264] В некоторых вариантах воплощения, в настоящем изобретении обеспечивается выделенное Вещество B, кристаллическая форма Соединения 1. В некоторых вариантах воплощения, выделенное Вещество B, кристаллическая форма Соединения 1, имеет рентгеновскую порошковую дифрактограмму, по существу аналогичную той, которая представлена на Фиг.19B или 32.
[00265] В некоторых вариантах воплощения, Вещество B, кристаллическая форма Соединения 1, является химически стабильным. В некоторых вариантах воплощения, Вещество B, кристаллическая форма Соединения 1, является физически стабильным.
[00266] В некоторых вариантах воплощения, Вещество B кристаллическая форма, по существу, свободна от других кристаллических форм Соединения 1.
[00267] В некоторых вариантах воплощения, в настоящем изобретении обеспечивается смесь, включающая Вещество B и второй компонент. Иллюстративная рентгеновская порошковая дифрактограмма этой смеси представлена на Фиг.33.
[00268] В некоторых вариантах воплощения, Вещество B является гидратированным. В некоторых вариантах воплощения, Вещество B не является сольватированным или гидратированным.
[00269] В некоторых вариантах воплощения, Вещество B получают путем кристаллизации из ТГФ. В некоторых вариантах воплощения, Вещество B получают путем медленного испарения Соединения 1 из ТГФ. В конкретных вариантах воплощения, медленное испарение осуществляют в масштабе около 30 мг Соединения 1 или меньше. В некоторых вариантах воплощения, Вещество B получают путем диффузии из паровой фазы при помощи гептана в течение одного дня из ТГФ.
[00270] В некоторых вариантах воплощения, Вещество B получают, обрабатывая смесь Формы A и Вещества B водой и/или нагреванием. В некоторых вариантах воплощения, Вещество B получают, подвергая смесь Формы A и Вещества B условиям около 80%, 85%, 90%, 95%, 97% или 99% относительной влажности при повышенных температурах. В некоторых вариантах воплощения, повышенная температура составляет около 40°C.
Смесь Формы А/Вещества B Соединения 1
[00271] В некоторых вариантах воплощения, в настоящем изобретении обеспечиваются смеси кристаллических форм, Формы A и Вещества B. Фиг.19C и 19D представляют иллюстративные рентгеновские порошковые дифрактограммы такой смеси. В некоторых вариантах воплощения, смеси являются выделенными. В некоторых вариантах воплощения, в настоящем изобретении обеспечивается выделенная смесь Формы A и Вещества B, кристаллических форм Соединения 1, которая имеет рентгеновскую порошковую дифрактограмму, по существу аналогичную представленной на Фиг.19C или 19D.
Соединение 2
[00272] Как описано выше и далее в настоящей заявке, путем дегидратации Соединения 1 получают ангидриды, например, димеры, тримеры и/или олигомерные ангидриды Соединения 1. Можно использовать анализы, чтобы разграничить различные ангидриды от Соединения 1 (мономер) и друг от друга. Примеры таких анализов включают, но не ограничиваются этим, элементный анализ, рентгеноструктурный анализ, рентгеновскую порошковую дифракцию (XRPD), 1H ядерный магнитный резонанс (ЯМР) и испарительное кулонометрическое титрование по методу Карла Фишера.
[00273] В некоторых вариантах воплощения, настоящее изобретение обеспечивает ангидрид Соединения 1, где в ангидриде присутствует димер, тример и/или олигомер Соединения 1 или их смесь, в виде твердого кристаллического вещества ("кристаллический ангидрид Соединения 1"). В некоторых вариантах воплощения настоящего изобретения обеспечивается кристаллический ангидрид Соединения 1 в виде тримера (например, линейный или циклический тример). В некоторых вариантах воплощения, настоящее изобретение обеспечивает кристаллический ангидрид Соединения 1 в виде циклического тримера, т.е. Соединения 2, определенного в настоящей заявке.
[00274] В некоторых вариантах воплощения, обеспечивается кристаллическое Соединение 2:
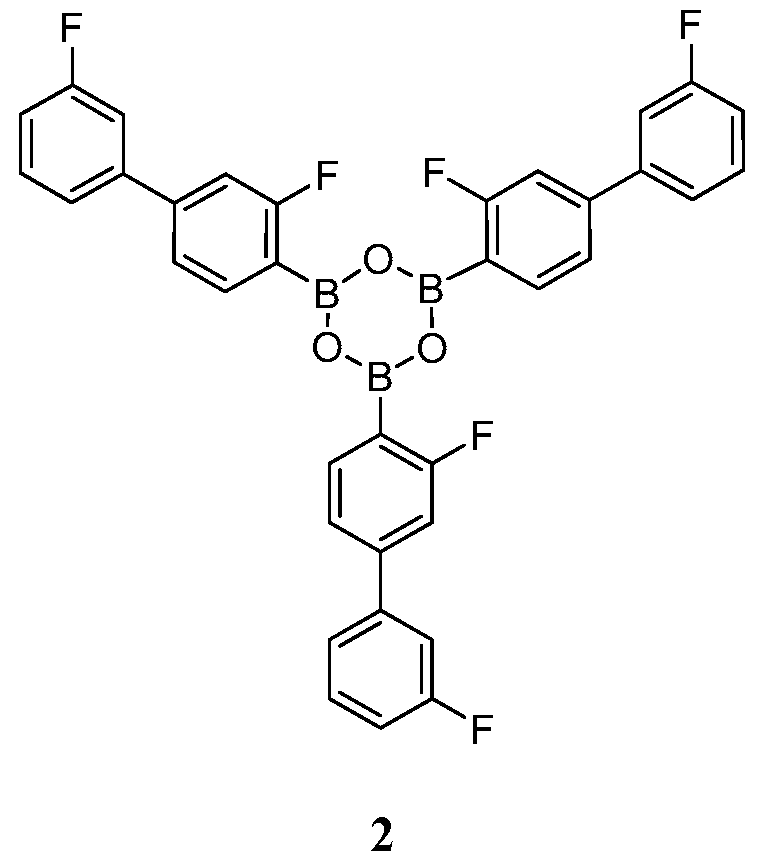
или его фармацевтически приемлемая соль, гидрат или сольват.
[00275] В некоторых вариантах воплощения, кристаллическое Соединение 2, по существу, свободно от любого из следующих соединений:
[00276] В некоторых вариантах воплощения, кристаллическое Соединение 2, по существу, свободно от Соединения 1 или других его ангидридов.
[00277] В некоторых вариантах воплощения, кристаллическое Соединение 2 представляет собой твердую форму, по существу, не содержащую аморфное Соединение 2. В некоторых вариантах воплощения, кристаллическое Соединение 2 представляет собой твердую форму, по существу, не содержащую одну или несколько других кристаллических форм Соединения 2. В некоторых вариантах воплощения, кристаллическое Соединение 2 представляет собой твердую форму, по существу, не содержащую кристаллическое Соединение 1. В некоторых вариантах воплощения, кристаллическое Соединение 2 представляет собой твердую форму, по существу, не содержащую другие ангидриды Соединения 1 (например, димер, линейный тример, олигомеры Соединения 1). В некоторых вариантах воплощения, Соединение 2 обеспечивается в виде чистого и выделенного кристаллического Соединения 2.
[00278] Как определено в настоящей заявке, "чистое и выделенное" относится к выделенному кристаллическому Соединению 2, имеющему, по меньшей мере, одну из следующих характеристик:
(i) твердое кристаллическое вещество, имеющее чистоту больше чем 90% (например, как определено анализом ВЭЖХ);
(ii) твердое кристаллическое вещество, содержащее меньше чем около 400 ч/млн ацетона, присутствующего в качестве остаточного растворителя;
(iii) твердое кристаллическое вещество, по существу, не содержащее неполярные примеси IMP-1 и IMP-2 и IMP-3, определенные выше и далее в настоящей заявке;
(iv) твердое кристаллическое вещество, по существу, не содержащее полярную примесь IMP-4, определенную выше и далее в настоящей заявке;
(v) твердое кристаллическое вещество, по существу, не содержащее аморфное Соединение 2;
(vi) твердое кристаллическое вещество, по существу, не содержащее Соединение 1 или другие его ангидриды; и/или
(vii) твердое кристаллическое вещество, по существу, не содержащее другие кристаллические формы Соединения 2.
[00279] В некоторых вариантах воплощения, "чистое и выделенное" относится к выделенному кристаллическому Соединению 2, имеющему, по меньшей мере, две из перечисленных выше (i)-(vii) характеристик. В некоторых вариантах воплощения, "чистое и выделенное" относится к выделенному кристаллическому Соединению 2, имеющему, по меньшей мере, три из перечисленных выше (i)-(vii) характеристик. В некоторых вариантах воплощения, "чистое и выделенное" относится к выделенному кристаллическому Соединению 2, имеющему, по меньшей мере, четыре из перечисленных выше (i)-(vii) характеристик. В некоторых вариантах воплощения, "чистое и выделенное" относится к выделенному кристаллическому Соединению 2, имеющему, по меньшей мере, пять из перечисленных выше (i)-(vii) характеристик. В некоторых вариантах воплощения, "чистое и выделенное" относится к выделенному кристаллическому Соединению 2, имеющему, по меньшей мере, шесть из перечисленных выше (i)-(vii) характеристик. В некоторых вариантах воплощения, "чистое и выделенное" относится к выделенному кристаллическому Соединению 2, имеющему все семь из перечисленных выше (i)-(vii) характеристик.
[00280] Фраза "по существу, не содержащее аморфное Соединение 2" означает, что от около 90% до около 100% масс., от около 95% до около 100% масс., от около 98% до около 100% масс. или от около 99% до около 100% масс. Соединения 2 является кристаллическим (т.е. не аморфным).
[00281] Фраза “по существу не содержащий Соединение 1 или другой его ангидрид” означает, что от около 90% до около 100% масс., от около 95% до около 100% масс., от около 98% до около 100% масс. или от около 99% до около 100% масс. Соединения 2 обеспечивается в виде циклического тримера (т.е. не в виде мономера или димера, линейного тримера или других олигомеров Соединения 1).
[00282] Фраза "по существу, не содержащее одну или несколько других кристаллических форм Соединения 2" означает, что от около 90% до около 100% масс., от около 95% до около 100% масс., от около 98% до около 100% масс. или от около 99% до около 100% масс. Соединения 2 обеспечивается в конкретной кристаллической форме, например, в виде "Формы I".
[00283] В некоторых вариантах воплощения, "Форма I" Соединения 2 имеет, по меньшей мере, одну из следующих характеристик:
(i) одну или несколько температур перехода, выбранных из около 112±5°C и около 241±2°C, как определено методом дифференциальной сканирующей калориметрии (ДСК);
(ii) один или несколько пиков на рентгеновской порошковой дифрактограмме (XRPD), выбранный из 6,32±0,10, 12,69±0,10, 17,69±0,10 и 26,77±0,10;
(iii) рентгеновскую порошковую дифрактограмму (XRPD), по существу, аналогичную той, которая представлена на Фиг.8, 29 или 29; и/или
(iv) сканограмму, полученную методом дифференциальной сканирующей калориметрии (ДСК), по существу аналогичную той, которая показана на Фиг.18.
[00284] В некоторых вариантах воплощения, Форма I, кристаллическая форма Соединения 2, является выделенной.
[00285] В некоторых вариантах воплощения, "Форма I" характеризуется пиками на рентгеновской порошковой дифрактограмме, расположенными в 1, 2, 3 или всех следующих приблизительных положениях пиков: 6,32±0,10, 12,69±0,10, 17,69±0,10 и 26,77±0,10 θ 2θ (градусов). В некоторых вариантах воплощения, "Форма I" определяется двумя или более пиками 6,32±0,10, 12,69±0,10, 17,69±0,10 и 26,77±0,10. В некоторых вариантах воплощения, "Форма I" определяется тремя или более пиками 6,32±0,10, 12,69±0,10, 17,69±0,10 и 26,77±0,10. В некоторых вариантах воплощения, "Форма I" определяется рентгеновской порошковой дифрактограммой, по существу аналогичной той, которая показана на Фиг.8.
[00286] В некоторых вариантах воплощения, в настоящем изобретении обеспечивается кристаллическая форма Соединения 2, имеющая рентгеновскую порошковую дифрактограмму, включающую пики при приблизительно 6,32, 12,69 и 26,77 градусов 2θ. В дополнительных вариантах воплощения, рентгеновская порошковая дифрактограмма дополнительно включает пики при приблизительно 17,69 градусов 2θ.
[00287] В некоторых вариантах воплощения, в настоящем изобретении обеспечивается кристаллическая форма, имеющая, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23, по меньшей мере 24, по меньшей мере 25, по меньшей мере 26, по меньшей мере 27, по меньшей мере 28, по меньшей мере 29, по меньшей мере 30 или все из следующих приблизительных XRPD пиков: 6,3, 9,6, 11,2, 11,5, 12,7, 13,1, 14,7, 15,2, 16,9, 17,3, 17,4, 17,7, 18,0, 18,6, 19,0, 19,4, 20,4, 20,8, 21,6, 22,5, 22,7, 23,0, 23,4, 24,5, 24,7, 25,1, 25,5, 26,8, 27,7, 28,3, 29,0 градусов 2θ. В некоторых вариантах воплощения, кристаллическая форма имеет, по меньшей мере, 8, по меньшей мере, 9 или, по меньшей мере, 10 из указанных пиков. В некоторых вариантах воплощения, кристаллическая форма имеет по меньшей мере 10 из указанных пиков. В некоторых вариантах воплощения, в настоящем изобретении обеспечивается кристаллическая форма, имеющая рентгеновскую порошковую дифрактограмму, включающую пики в следующих приблизительных положениях: 6,3, 12,7, 17,7, 18,6, 19,4, 21,6, 23,4, 24,5, 26,8 и 27,7 градусов 2θ.
[00288] В некоторых вариантах воплощения, в настоящем изобретении обеспечивается кристаллическая форма, имеющая, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23, по меньшей мере 24, по меньшей мере 25, по меньшей мере 26, по меньшей мере 27, по меньшей мере 28 или все из следующих приблизительных XRPD пиков: 6,3, 11,2, 11,5, 12,7, 13,1, 14,7, 16,9, 17,3, 17,4, 17,7, 18,0, 18,6, 19,0, 19,4, 20,4, 20,8, 21,6, 22,5, 22,7, 23,0, 23,4, 24,5, 24,7, 25,1, 25,5, 26,8, 27,7, 28,3, 29,0 градусов 2θ.
[00289] В некоторых вариантах воплощения, указанные выше XRPD пики (в градусах 2θ) определены анализом с использованием медного источника Kα излучения.
[00290] В некоторых вариантах воплощения, в настоящем изобретении обеспечивается выделенная Форма I, кристаллическая форма Соединения 2. В некоторых вариантах воплощения, Форма I, кристаллическая форма Соединения 2, имеет рентгеновскую порошковую дифрактограмму, по существу аналогичную той, которая представлена на Фиг.8. В некоторых вариантах воплощения, в настоящем изобретении обеспечивается выделенная Форма I, кристаллическая форма Соединения 2, которая имеет рентгеновскую порошковую дифрактограмму, включающую пики при приблизительно 6,32, 12,69 и 26,77 градусов 2θ, как определено анализом с использованием медного источника Kα излучения.
[00291] В некоторых вариантах воплощения, "Форма I" характеризуется одной или несколькими температурами перехода, выбранными из около 112±5°C и около 241±2°C, как определено методом дифференциальной сканирующей калориметрии (ДСК). В некоторых вариантах воплощения, "Форма I" характеризуется температурой перехода около 241±2°C, как определено методом дифференциальной сканирующей калориметрии (ДСК). В некоторых вариантах воплощения, "Форма I" характеризуется температурой перехода около 112±5°C, как определено методом дифференциальной сканирующей калориметрии (ДСК). В некоторых вариантах воплощения, "Форма I" характеризуется двумя температурами перехода, выбранными из около 112±5°C и около 241±2°C, как определено методом дифференциальной сканирующей калориметрии (ДСК). В некоторых вариантах воплощения, "Форма I" характеризуется сканограммой, полученной методом дифференциальной сканирующей калориметрии (ДСК), по существу, аналогичной той, которая представлена на Фиг.18.
[00292] В некоторых вариантах воплощения, Форма I является химически стабильной. В некоторых вариантах воплощения, Форма I является физически стабильной.
[00293] В некоторых вариантах воплощения, Форма I, кристаллическая форма Соединения 2, по существу, свободна от других кристаллических форм Соединения 2.
[00294] Термин "по существу аналогичный", как он используется в настоящей заявке в контексте сравнения рентгеновской порошковой дифрактограммы или сканограммы, полученной методом дифференциальной сканирующей калориметрии для твердой формы Соединения 2, означает, что два спектра имеют общие для них отличительные характеристики, достаточные для их отличия от спектра, полученного для другой формы Соединения 2. В некоторых вариантах воплощения, термин "по существу аналогичный" означает, что два спектра являются одинаковыми, т.е. визуально перекрываются.
[00295] В некоторых вариантах воплощения, "Форма I" относится к конкретной кристаллической форме Соединения 2, имеющей, по меньшей мере, две из перечисленных выше (i)-(iv) характеристик. В некоторых вариантах воплощения, "Форма I" относится к конкретной кристаллической форме Соединения 2, имеющей, по меньшей мере, три из перечисленных выше (i)-(iv) характеристик. В некоторых вариантах воплощения, "Форма I" относится к конкретной кристаллической форме Соединения 2, имеющей все четыре из перечисленных выше (i)-(iv) характеристик.
[00296] Также предусматривается, что Соединение 2 может существовать в различных твердых формах. Такие твердые формы включают твердые кристаллические вещества, такие как полиморфы, сольваты и гидраты кристаллического Соединения 2, а также аморфные твердые вещества. Все такие твердые формы Соединения 2 предусматриваются настоящим изобретением.
Фармацевтические композиции
[00297] Термины "фармацевтическая композиция" и "композиция" относятся к композиции, включающей, по меньшей мере, одно фармацевтически активное соединение, описанное в настоящей заявке (например, кристаллическое Соединение 1 или его ангидрид), и фармацевтически приемлемый эксципиент.
[00298] В некоторых вариантах воплощения, настоящее изобретение обеспечивает фармацевтическую композицию, включающую Соединение 1 и ангидрид Соединения 1 и фармацевтически приемлемый эксципиент.
[00299] В некоторых вариантах воплощения, настоящее изобретение обеспечивает фармацевтическую композицию, включающую смесь Соединения 1 и Соединения 2 и фармацевтически приемлемый эксципиент.
[00300] В некоторых вариантах воплощения, настоящее изобретение обеспечивает фармацевтическую композицию, включающую смесь Соединения 1, Соединения 2 и, по меньшей мере, одного другого ангидрида Соединения 1 (например, димера, линейного тримера, олигомера) и фармацевтически приемлемый эксципиент.
[00301] В некоторых вариантах воплощения, в настоящем изобретении обеспечиваются фармацевтические композиции, включающие любое из соединений, кристаллических форм, веществ или смесей, описанных в настоящей заявке. В некоторых вариантах воплощения, в настоящем изобретении обеспечиваются фармацевтические композиции, включающие кристаллическое соединение 1, которое, по существу, свободно от IMP-1, IMP-2, IMP-3 или IMP-4. В некоторых вариантах воплощения, в настоящем изобретении обеспечиваются фармацевтические композиции, включающие Форму А, Вещество B или Форму А1 Соединения 1, или включающие смесь Формы A и Вещества B Соединения 1. В одном варианте воплощения, фармацевтическая композиция, включающая Форму А, по существу, свободна от других кристаллический форм Соединения 1. В одном варианте воплощения, фармацевтическая композиция, включающая Вещество B, по существу, свободна от других кристаллических форм Соединения 1. В одном варианте воплощения, фармацевтическая композиция, включающая Форму А1, по существу, свободна от других кристаллический форм Соединения 1. В некоторых вариантах воплощения, в настоящем изобретении обеспечиваются фармацевтические композиции, включающие Соединение 2. В некоторых вариантах воплощения, в настоящем изобретении обеспечиваются фармацевтические композиции, включающие Форму I Соединения 2. В некоторых вариантах воплощения, фармацевтические композиции, включающие Форму I Соединения 2, по существу, не содержат другие кристаллические формы Соединения 2.
[00302] В некоторых вариантах воплощения, настоящее изобретение обеспечивает фармацевтическую композицию, включающую Соединение 1, по существу, не содержащее ангидрид Соединения 1, и фармацевтически приемлемый эксципиент. В некоторых вариантах воплощения, настоящее изобретение обеспечивает фармацевтическую композицию, включающую Соединение 1, по существу, не содержащее Соединения 2, и фармацевтически приемлемый эксципиент.
[00303] Фразы "фармацевтическая композиция, включающая Соединение 1, по существу, не содержащее ангидрид Соединения 1" или "фармацевтическая композиция, включающая Соединение 1, по существу, не содержащее Соединения 2" означают, что от около 90% до около 100% масс., от около 95% до около 100% масс., от около 98% до около 100% масс. или от около 99% до около 100% масс. соединения, присутствующего в композиции, представляет собой мономер Соединения 1.
[00304] В некоторых вариантах воплощения, настоящее изобретение обеспечивает фармацевтическую композицию, включающую смесь Соединения 2 и, по меньшей мере, одного другого ангидрида Соединения 1 и один или несколько фармацевтически приемлемых эксципиентов.
[00305] Настоящее изобретение также обеспечивает способы введения фармацевтических композиций. В некоторых вариантах воплощения, настоящее изобретение обеспечивает фармацевтические композиции, которые являются подходящими для перорального, местного и/или парентерального введения Соединения 1. В некоторых вариантах воплощения, настоящее изобретение обеспечивает фармацевтические композиции для перорального введения. Например, в некоторых вариантах воплощения, Соединение 1 обеспечивается в виде порошка в фармацевтической композиции, например, для пероральной суспензии (например, где порошок суспендирован в носителе, включающем компоненты, которые будут обеспечивать стабильное пероральное дозирование, например, коммерчески доступная USP натрий карбоксиметилцеллюлоза (CMC) в стерильной воде для инъекций (sWFI)), для инкапсулирования в капсулу или для прессования в таблетку. В некоторых вариантах воплощения, порошок необязательно включает смесь кристаллического Соединения 1 и фармацевтически приемлемого эксципиента.
[00306] Например, в некоторых вариантах воплощения, порошок, включающий кристаллическое Соединение 1 и необязательно содержащий один или несколько эксципиентов, подвергают переработке для образования частиц одинакового размера. В некоторых вариантах воплощения, обработка порошка (т.е. кристаллического Соединения 1) включает измельчение порошка в течение времени, подходящего для получения желаемого размера частиц ("измельченный порошок").
[00307] В некоторых вариантах воплощения, размер частиц измельченного порошка меньше чем около 400 мкм. В некоторых вариантах воплощения, размер частиц измельченного порошка меньше чем около 350 мкм. В некоторых вариантах воплощения, размер частиц измельченного порошка меньше чем около 300 мкм. В некоторых вариантах воплощения, размер частиц измельченного порошка меньше чем около 275 мкм. В некоторых вариантах воплощения, размер частиц измельченного порошка меньше чем около 250 мкм. В некоторых вариантах воплощения, размер частиц измельченного порошка находится в пределах от около 50 мкм до около 500 мкм. В некоторых вариантах воплощения, размер частиц измельченного порошка находится в пределах от около 50 мкм до около 400 мкм. В некоторых вариантах воплощения, размер частиц измельченного порошка находится в пределах от около 50 мкм до около 350 мкм. В некоторых вариантах воплощения, размер частиц измельченного порошка находится в пределах от около 75 мкм до около 350 мкм. В некоторых вариантах воплощения, размер частиц измельченного порошка находится в пределах от около 100 мкм до около 300 мкм. В некоторых вариантах воплощения, размер частиц измельченного порошка находится в пределах от около 100 мкм до около 275 мкм. В некоторых вариантах воплощения, размер частиц измельченного порошка находится в пределах от около 100 мкм до около 250 мкм. В некоторых вариантах воплощения, размер частиц измельченного порошка находится в пределах от около 50 мкм до около 500 мкм. Термин "около", как он используется в настоящей заявке, в отношении размера частиц, означает +/- 5 мкм.
[00308] В некоторых вариантах воплощения, по меньшей мере, 90% репрезентативного образца измельченного порошка имеет размер частиц меньше чем около 400, около 375, около 350, около 300, около 290, около 280, около 270, около 260 или около 250 мкм. В некоторых вариантах воплощения, по меньшей мере, около 90% репрезентативного образца измельченного порошка имеет размер частиц меньше чем около 244 мкм.
[00309] В некоторых вариантах воплощения, по меньшей мере, 50% репрезентативного образца измельченного порошка имеет размер частиц меньше чем около 200, около 175, около 150, около 140, около 130, около 120, около 115, около 110 или около 105 мкм. В некоторых вариантах воплощения, по меньшей мере, около 50% репрезентативного образца измельченного порошка имеет размер частиц меньше чем около 105 мкм.
[00310] В некоторых вариантах воплощения, измельченный порошок необязательно содержит эксципиенты и сформулирован в виде порошка для пероральной суспензии, капсулы или таблетки.
[00311] В некоторых вариантах воплощения, кристаллическое Соединение 1 присутствует в фармацевтической композиции в количестве в пределах от около 10 мг на стандартную дозу до около 4000 мг на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в композиции в количестве в пределах от около 10 мг на стандартную дозу до около 2000 мг на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в фармацевтической композиции в количестве в пределах от около 10 мг на стандартную дозу до около 1500 мг на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в фармацевтической композиции в количестве в пределах от около 25 мг на стандартную дозу до около 1500 мг на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в фармацевтической композиции в количестве в пределах от около 50 мг на стандартную дозу до около 1500 мг на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в фармацевтической композиции в количестве в пределах от около 75 мг на стандартную дозу до около 1500 мг на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в фармацевтической композиции в количестве в пределах от около 100 мг на стандартную дозу до около 1500 мг на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в фармацевтической композиции в количестве в пределах от около 100 мг на стандартную дозу до около 1000 мг на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в фармацевтической композиции в количестве в пределах от около 500 мг на стандартную дозу до около 1000 мг на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в фармацевтической композиции в количестве около 10, около 25, около 50, около 100, около 250, около 500, около 750, около 1000 или около 2000 мг на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в суспензии для перорального введения в количестве около 10, около 25, около 50, около 100, около 250, около 500, около 750, около 1000 или около 2000 мг на стандартную дозу.
[00312] Выражение "стандартная доза", как оно используется в настоящей заявке, относится к физически дискретной единице фармацевтической композиции, подходящей для субъекта, подлежащего лечению. Однако должно быть понятно, что общее суточное количество фармацевтической композиции по настоящему изобретению определяет лечащий врач на основании взвешенной медицинской оценки. Конкретный эффективный уровень доз для любого конкретного субъекта или организма зависит от различных факторов, включая состояние, которое лечат, и тяжесть состояния; активность конкретного используемого активного соединения; конкретную используемую композицию; возраст, массу тела, общее состояние здоровья, пол и режим питания субъекта; время введения и скорость выведения из организма конкретного используемого активного соединения; продолжительность лечения; лекарственные средства и/или дополнительные лечения, используемые в комбинации или одновременно с конкретным используемым соединением(ями), и подобные факторы, хорошо известные в медицине.
[00313] В некоторых вариантах воплощения, Соединение 1 присутствует в фармацевтической композиции в эффективном количестве для обеспечения воздействия на субъекта от около 2 до около 100 нг-час/мл в расчете на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в фармацевтической композиции в эффективном количестве для обеспечения воздействия на субъекта от около 5 до около 75 нг-час/мл в расчете на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в фармацевтической композиции в эффективном количестве для обеспечения воздействия на субъекта от около 10 до около 50 нг-час/мл в расчете на стандартную дозу. В некоторых вариантах воплощения, Соединение 1 присутствует в фармацевтической композиции в эффективном количестве для обеспечения воздействия на субъекта от около 23 до около 43 нг-час/мл в расчете на стандартную дозу.
[00314] В некоторых вариантах воплощения, настоящее изобретение обеспечивает лекарственные формы, подходящие для введения одной или нескольких стандартных доз. Например, настоящее изобретение обеспечивает лекарственные формы для введени 2, 3, 4, 5, 6, 7, 8, 9 или 10 стандартных доз (т.е. несколько стандартных доз для введения содержатся в одном контейнере). Выражение "лекарственная форма" относится к средству, при помощи которого фармацевтическую композицию хранят и/или вводят субъекту. Например, фармацевтическую композицию можно хранить во флаконе или шприце. Фармацевтическую композицию также можно хранить в контейнере, который защищает фармацевтическую композицию от света (например, УФ света). Альтернативно, контейнер или флакон, который необязательно сам является защищающим от света, можно хранить во втором контейнере для хранения (например, внешней коробке, пакете и т.п.), который защищает фармацевтическую композицию от света.
[00315] В некоторых вариантах воплощения, растворимость Соединения 1 в фармацевтической композиции можно улучшить путем добавления одного или нескольких солюбилизирующих веществ. Солюбилизирующие вещества известны специалистам в данной области, и включают любое из веществ, описанных ниже и в настоящем разделе. В некоторых вариантах воплощения, Соединение 1 суспендируют в носителе для суспензии, включающем солюбилизирующее вещество, перед введением субъекту. В некоторых вариантах воплощения, носитель для суспензии включает 0,5% натрий карбоксиметилцеллюлозу (CMC) средней вязкости, растворенную в стерильной воде для инъекций (sWFI), и введение осуществляют пероральным путем.
[00316] Как описано выше, фармацевтические композиции по настоящему изобретению, необязательно, могут включать фармацевтически приемлемый эксципиент, который, как используется в настоящей заявке, включает любой и все растворители, разбавители или другие жидкие носители, вещества, способствующие диспергированию или суспендированию, поверхностно-активные вещества, изотонические агенты, загустители или эмульгаторы, консерванты, твердые связующие, смазывающие вещества и подобные, подходящие для конкретной желательной лекарственной формы. Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) раскрывает различные носители, используемые в фармацевтических композициях, и известные способы их получения. За исключением тех случаев, когда какая-либо традиционная среда-носитель несовместима с соединениями по настоящему изобретению, например, дает какой-либо нежелательный биологический эффект, либо нежелательным образом взаимодействует с каким-либо другим компонентом(ами) фармацевтически приемлемой композиции, применение такого носителя предусматривается как охватываемое объемом настоящего изобретения. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не ограничиваются этим, ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота или сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, динатрий гидрофосфат, гидрофосфат калия, хлорид натрия, цинковые соли, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, полиакрилаты, воски, полиэтилен-полиоксипропиленовые блок-полимеры, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, масло семян хлопчатника; сафлоровое масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатно-буферные растворы, а также другие нетоксичные совместимые смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, вещества, способствующие высвобождению, вещества покрытия, подсластители, отдушки и ароматизаторы, консерванты и антиоксиданты также могут присутствовать в композиции, в соответствии с выбором специалиста, занимающегося формулированием композиции.
[00317] Фармацевтические композиции, описанные в настоящей заявке, можно получить любым способом, известным или разрабатываемым в фармакологии. Как правило, такие способы получения включают стадию приведения активного ингредиента в ассоциацию с носителем и/или одним или несколькими другими вспомогательными ингредиентами и затем, если это необходимо и/или желательно, формование и/или упаковку продукта в желаемую одно- или многодозовую лекарственную форму.
[00318] Фармацевтическую композицию по настоящему изобретению можно получить, упаковать и/или продавать без упаковки в виде одной стандартной дозы и/или в виде нескольких отдельных стандартных доз. Как это используется в настоящей заявке, "стандартная доза" представляет собой дискретное количество фармацевтической композиции, включающей предварительно определенное количество активного ингредиента. Количество активного ингредиента, как правило, равно дозе активного ингредиента, которую необходимо ввести субъекту, и/или удобной части такой дозы, например, половине или одной трети такой дозы.
[00319] Относительные количества активного ингредиента, фармацевтически приемлемого носителя и/или любых дополнительных ингредиентов в фармацевтической композиции по настоящему изобретению варьируют в зависимости от индивидуальности, размеров и/или состояния субъекта, подлежащего лечению, а также в зависимости от пути введения композиции. В качестве примера, композиция может включать от 0,1% до 100% (масс/масс) активного ингредиента.
[00320] В некоторых вариантах воплощения, фармацевтически приемлемый эксципиент имеет чистоту, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100%. В некоторых вариантах воплощения, эксципиент одобрен для применения для человека и для ветеринарного применения. В некоторых вариантах воплощения, эксципиент одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. В некоторых вариантах воплощения, эксципиент имеет степень чистоты для использования в фармацевтике. В некоторых вариантах воплощения, эксципиент соответствует стандартам Фармакопеи США (USP), Европейской Фармакопеи (EP), Фармакопеи Великобритании и/или Международной Фармакопеи.
[00321] Фармацевтически приемлемые эксципиенты, используемые для получения фармацевтических композиций, включают, но не ограничиваются этим, инертные разбавители, диспергирующие и/или гранулирующие вещества, поверхностно-активные вещества и/или эмульгаторы, разрыхлители, связующие, консерванты, буферные вещества, смазывающие вещества и/или масла. Такие эксципиенты, необязательно, могут быть включены в композицию по настоящему изобретению. Эксципиенты, такие как масло какао и воски для суппозиториев, красители, вещества покрытия, подсластители, отдушки и ароматизаторы могут присутствовать в композиции, в соответствии с выбором специалиста, занимающегося формулированием композиции.
[00322] Примеры разбавителей включают, но не ограничиваются этим, карбонат кальция, карбонат натрия, фосфат кальция, дикальций фосфат, сульфат кальция, гидрофосфат кальция, фосфат натрия, лактозу, сахарозу, целлюлозу, микрокристаллическую целлюлозу, каолин, маннит, сорбит, инозит, хлорид натрия, сухой крахмал, кукурузный крахмал, порошкообразный сахар и т.п. и комбинации таких веществ.
[00323] Примеры гранулирующих и/или диспергирующих веществ включают, но не ограничиваются этим, картофельный крахмал, кукурузный крахмал, тапиоковый крахмал, натрий крахмалгликолят, глины, альгиновую кислоту, гуаровую камедь, мякоть цитрусовых, агар, бентонит, целлюлозу и продукты древесины, природную губку, катионо-обменные смолы, карбонат кальция, силикаты, карбонат натрия, сшитый поливинилпирролидон (кросповидон), натрий карбоксиметилкрахмал (натрийкрахмалгликолят), карбоксиметилцеллюлозу, сшитую натрий карбоксиметилцеллюлозу (кроскармелозу), метилцеллюлозу, предварительно желатинизированный крахмал (крахмал 1500), микрокристаллический крахмал, нерастворимый в воде крахмал, кальций карбоксиметилцеллюлозу, магнийалюминийсиликат (Veegum), лаурилсульфат натрия, четвертичные аммониевый соединения и т.п. и комбинации таких веществ.
[00324] Примеры поверхностно-активных веществ и/или эмульгаторов включают, но не ограничиваются этим, природные эмульгаторы (например, аравийская камедь, агар, альгиновая кислота, альгинат натрия, трагакант, хондракс, холестерин, ксантановая камедь, пектин, желатин, яичный желток, казеин, ланолин, холестерин, воск и лецитин), коллоидные глины (например, бентонит [силикат алюминия] и Veegum [магнийалюминийсиликат]), длинноцепочечные аминокислотные производные, высокомолекулярные спирты (например, стеариловый спирт, цетиловый спирт, олеиловый спирт, триацетинмоностеарат, этиленгликоль дистеарат, глицерилмоностеарат и пропиленгликоль моностеарат, поливиниловый спирт), карбомеры (например, карбоксиполиметилен, полиакриловая кислота, полимер акриловой кислоты и карбоксивиниловый полимер), каррагенин, производные целлюлозы (например, натрий карбоксиметилцеллюлоза, порошкообразная целлюлоза, гидроксиметилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза), сложные эфиры жирных кислот сорбитана (например, полиоксиэтиленсорбитанмонолаурат [Tween 20], полиоксиэтиленсорбитан [Tween 60], полиоксиэтиленсорбитанмоноолеат [Tween 80], сорбитанмонопальмитат [Span 40], сорбитанмоностеарат [Span 60], сорбитантристеарат [Span 65], глицерилмоноолеат, сорбитанмоноолеат [Span 80]), сложные эфиры полиоксиэтилена (например, полиоксиэтиленмоностеарат [Myrj 45], полиоксиэтилен-гидрированное касторовое масло, полиэтоксилированное касторовое масло, полиоксиметиленстеарат и Solutol), сложные эфиры жирных кислот сахарозы, сложные эфиры жирных кислот полиэтиленгликоля (например, Cremophor), полиоксиэтиленовые простые эфиры, (например, полиоксиэтиленлауриловый эфир [Brij 30]), поли(винилпирролидон), диэтиленгликоль монолаурат, триэтаноламинолеат, олеат натрия, олеат калия, этилолеат, олеиновую кислоту, этиллаурат, лаурилсульфат натрия, Pluronic F 68, Poloxamer 188, цетримонийбромид, цетилпиридинийхлорид, бензалконийхлорид, докузатнатрий и т.п. и/или комбинации таких веществ.
[00325] Примеры связующих включают, но не ограничиваются этим, крахмал (например, кукурузный крахмал и крахмальную пасту); желатин; сахара (например, сахароза, глюкоза, декстроза, декстрин, меласса, лактоза, лактит, маннит и т.п.); природные и синтетические смолы (например, аравийская камедь, альгинат натрия, экстракт каррагена, камедь панвар, камедь гхатти, клейкое вещество из шелухи изапол, карбоксиметилцеллюлоза, метилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, микрокристаллическая целлюлоза, ацетат целлюлозы, поли(винилпирролидон), магнийалюминийсиликат (Veegum) и арабогалактан лиственницы); альгинаты; полиэтиленоксид; полиэтиленгликоль; неорганические кальциевые соли; кремневую кислоту; полиметакрилаты; воски; воду; спирт; и т.п.; и комбинации таких веществ.
[00326] Примеры консервантов могут включать антиоксиданты, хелатообразующие вещества, антибактериальные консерванты, противогрибковые консерванты, спиртовые консерванты, кислотные консерванты и другие консерванты. Примеры антиоксидантов включают, но не ограничиваются этим, альфа токоферол, аскорбиновую кислоту, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, монотиоглицерин, метабисульфит калия, пропионовую кислоту, пропилгаллат, аскорбат натрия, бисульфит натрия, метабисульфит натрия и сульфит натрия. Примеры хелатообразующих веществ включают этилендиаминтетрауксусную кислоту (EDTA), моногидрат лимонной кислоты, динатрий эдетат, дикалий эдетат, эдетиновую кислоту, фумаровую кислоту, яблочную кислоту, фосфорную кислоту, эдетат натрия, винную кислоту и тринатрий эдетат. Примеры антибактериальных консервантов включают, но не ограничиваются этим, бензалконийхлорид, бензетонийхлорид, бензиловый спирт, бронопол, цетримид, цетилпиридинийхлорид, хлоргексидин, хлорбутанол, хлоркрезол, хлорксиленол, крезол, этиловый спирт, глицерин, гексетидин, имидмочевину, фенол, феноксиэтанол, фенилэтиловый спирт, нитрат фенилртути, пропиленгликоль и тимеросал. Примеры противогрибковых консервантов включают, но не ограничиваются этим, бутилпарабен, метилпарабен, этилпарабен, пропилпарабен, бензойную кислоту, гидроксибензойную кислоту, бензоат калия, сорбат калия, бензоат натрия, пропионат натрия и сорбиновую кислоту. Примеры спиртовых консервантов включают, но не ограничиваются этим, этанол, полиэтиленгликоль, фенол, фенольные соединения, бисфенол, хлорбутанол, гидроксибензоат и фенилэтиловый спирт. Примеры кислотных консервантов включают, но не ограничиваются этим, витамин A, витамин C, витамин E, бета-каротин, лимонную кислоту, уксусную кислоту, дегидроуксусную кислоту, аскорбиновую кислоту, сорбиновую кислоту и фитиновую кислоту. Другие консерванты включают, но не ограничиваются этим, токоферол, токоферолацетат, детероксиммезилат, цетримид, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), этилендиамин, лаурилсульфат натрия (SLS), лаурилэфирсульфат натрия (SLES), бисульфит натрия, метабисульфит натрия, сульфит калия, метабисульфит калия, Glydant Plus, Phenonip, метилпарабен, Germall 115, Germaben II, Neolone, Kathon и Euxyl. В некоторых вариантах воплощения, консервант представляет собой антиоксидант. В других вариантах воплощения, консервант представляет собой хелатообразующее вещество.
[00327] Примеры буферных веществ включают, но не ограничиваются этим, цитратные буферные растворы, ацетатные буферные растворы, фосфатные буферные растворы, хлорид аммония, карбонат кальция, хлорид кальция, цитрат кальция, глубионат кальция, глуцептат кальция, глюконат кальция, D-глюконовую кислоту, глицерофосфат кальция, лактат кальция, пропановую кислоту, левулинат кальция, пентановую кислоту, вторичный кислый фосфат кальция, фосфорную кислоту, трехосновный кальций фосфат, гидроксифосфат кальция, ацетат калия, хлорид калия, глюконат калия, калиевые смеси, вторичный кислый фосфат калия, первичный кислый фосфат калия, смеси фосфатов калия, ацетат натрия, бикарбонат натрия, хлорид натрия, цитрат натрия, лактат натрия, вторичный кислый фосфат натрия, первичный кислый фосфат натрия, смеси фосфатов натрия, трометамин, гидроксид магния, гидроксид алюминия, альгиновую кислоту, апирогенную воду, изотонический солевой раствор, раствор Рингера, этиловый спирт и т.п. и комбинации таких веществ.
[00328] Примеры смазывающих веществ включают, но не ограничиваются этим, стеарат магния, стеарат кальция, стеариновую кислоту, диоксид кремния, тальк, солод, глицерилбегенат, гидрированные растительные масла, полиэтиленгликоль, бензоат натрия, ацетат натрия, хлорид натрия, лейцин, лаурилсульфат магния, лаурилсульфат натрия и т.п. и комбинации таких веществ.
[00329] Примеры масла включают, но не ограничиваются этим, миндальное, абрикосовое косточковое, масло авокадо, бабассу, бергамота, из зерен черной смородины, огуречника аптечного, можжевеловое, ромашки, канолы, тмина, карнаубы, касторовое, коричное, масло какао, кокосовое, печени трески, кофейное, кукурузное, из семян хлопчатника, эму, эвкалиптовое, энотеры, рыбий жир, из льняного семени, гераниоловое, тыквенное, из виноградных косточек, лесного ореха, иссопа, изопропилмиристат, жожоба, плодов свечного дерева, лавандиновое, лавандовое, лимонное, кубебы, ореха макадамия, мальвы, манговое, семян пенника лугового, норковый жир, масло мускатного ореха, оливковое, апельсиновое, рыбий жир исландского берикса, пальмовое, косточковое пальмовое, косточковое персиковое, арахисовое, маковое, из тыквенных семечек, рапсовое, из рисовых отрубей, розмариновое, саффлоровое, сандаловое, саскваны, из ароматических трав, облепиховое, кунжутное, из плодов масляного дерева, силиконовое, соевое, подсолнечное, чайного дерева, артишоковое, тсубаки, ветиверовое, грецкого ореха и проростков пшеницы. Примеры масел включают, но не ограничиваются этим, бутилстеарат, триглицерид каприловой кислоты, триглицерид каприновой кислоты, циклометикон, диэтилсебацинат, диметикон 360, изопропилмиристат, минеральное масло, октилдодеканол, олеиловый спирт, силиконовое масло и комбинации таких веществ.
[00330] Жидкие лекарственные формы для перорального и парентерального введения включают, но не ограничиваются этим, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных ингредиентов, жидкие лекарственные формы могут включать инертные разбавители, обычно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие вещества и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, масло семян хлопчатника, арахисовое, кукурузное, из проростков семян, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана, и смеси таких веществ. Помимо инертных разбавителей, пероральные композиции могут включать адъюванты, такие как смачивающие вещества, эмульгаторы и суспендирующие вещества, подсластители, отдушки и ароматизаторы. В некоторых вариантах воплощения для парентерального введения, конъюгаты по настоящему изобретению смешивают с солюбилизирующими веществами, такими как Cremophor, спирты, масла, модифицированные масла, гликоли, полисорбаты, циклодекстрины, полимеры и комбинации таких веществ.
[00331] Препараты для инъекций, например, стерильные водные или масляные суспензии для инъекций можно сформулировать в соответствии со способами, известными из уровня техники, с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих веществ. Стерильный препарат для инъекций может представлять собой стерильный раствор, суспензию или эмульсию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Из приемлемых носителей и растворителей, которые можно использовать, можно указать воду, раствор Рингера U.S.P. и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла традиционно используют в качестве растворителя или среды для суспендирования. Для этой цели можно использовать любое светлое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, в препаратах для инъекций используют жирные кислоты, такие как олеиновая кислота.
[00332] Фармацевтические композиции для инъекций можно стерилизовать, например, путем фильтрования через удерживающий бактерии фильтр или путем включения стерилизующих веществ в форме стерильных твердых композиций, которые можно растворить или диспергировать в стерильной воде или другой стерильной среде для инъекций перед использованием.
[00333] Чтобы продлить эффект лекарственного средства, часто желательно замедлить абсорбцию лекарственного средства из подкожной или внутримышечной инъекции. Это можно осуществить путем использования жидкой суспензии кристаллического или аморфного вещества с плохой водорастворимостью. Скорость абсорбции лекарственного средства зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленную абсорбцию парентерально вводимой лекарственной формы получают путем растворения или суспендирования лекарственного средства в масляном носителе.
[00334] Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и введения включают гранулы. В таких твердых лекарственных формах активный ингредиент, необязательно, может быть смешан с одним или несколькими инертными, фармацевтически приемлемыми эксципиентами или носителями, такими как цитрат натрия или дикальций фосфат, и/или a) наполнителями или добавками, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремневая кислота, b) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и аравийская камедь, c) увлажнителями, такими как глицерин, d) разрыхлителями, такими как агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, e) замедляющими растворение веществами, такими как парафин, f) ускорителями абсорбции, такими как четвертичные аммониевые соединения, g) смачивающими веществами, такими как, например, цетиловый спирт и глицеринмоностеарат, h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и их смеси. В случае капсул, таблеток и пилюль, лекарственная форма может включать буферные вещества.
[00335] Твердые композиции подобного типа можно использовать в качестве наполнителей в мягких и твердых желатиновых капсулах, с использованием таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярных полиэтиленгликолей и подобных. Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы, могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области формулирования фармацевтических препаратов. Они, необязательно, могут включать вещества, делающие композицию непрозрачной, и могут иметь композицию, которая делает возможным высвобождение активного ингредиента(ов), только или преимущественно, в определенной части кишечного тракта, необязательно замедленным образом. Примеры композиций покрытий, которые можно использовать, включают полимерные вещества и воски. Твердые композиции подобного типа можно использовать в качестве наполнителей в мягких и твердых желатиновых капсулах, с использованием таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярных полиэтиленгликолей и подобных.
[00336] Активные ингредиенты могут быть в микроинкапсулированной форме и, необязательно, могут содержать один или несколько эксципиентов, указанных выше. Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы, могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия, контролирующие высвобождение покрытия и другие покрытия, хорошо известные в области формулирования фармацевтических препаратов. В таких твердых лекарственных формах активный ингредиент может быть смешан с, по меньшей мере, одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут включать, как это имеет место в обычной практике, дополнительные вещества, отличные от инертных разбавителей, например, смазывающие вещества для таблетирования и другие вспомогательные вещества для таблетирования, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль, лекарственные формы могут включать буферные вещества. Они, необязательно, могут включать вещества, делающие композицию непрозрачной, и могут иметь композицию, которая делает возможным высвобождение активного ингредиента(ов), только или преимущественно, в определенной части кишечного тракта, необязательно замедленным образом. Примеры композиций покрытий, которые можно использовать, включают полимерные вещества и воски.
[00337] Общие сведения, касающиеся фармацевтических композиций и/или получения фармацевтических средств, можно найти, например, в Remington: The Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, 2005.
[00338] Хотя описание фармацевтических композиций, представленное в настоящей заявке, главным образом направлено на фармацевтические композиции, которые являются подходящими для введения человеку, специалистам должно быть понятно, что такие композиции, как правило, являются подходящими для введения животным всех видов. Модификация фармацевтических композиций, подходящих для введения человеку, чтобы сделать такие композиции подходящими для введения различным животным, хорошо известна, и специалист со средней квалификацией в области ветеринарной фармакологии сможет разработать и/или осуществить такую модификацию при помощи обычного, если это вообще потребуется, экспериментирования.
[00339] Также, настоящим изобретением охватываются фармацевтические упаковки и/или наборы. Обеспечиваемые фармацевтические упаковки и/или наборы могут включать представленную композицию и контейнер (например, флакон, ампулу, бутыль, шприц и/или упаковку с дозатором или другой подходящий контейнер). В некоторых вариантах воплощения представленные наборы, необязательно, могут дополнительно включать второй контейнер, включающий подходящий водный носитель для разбавления или суспендирования содержащейся в наборе композиции для подготовки для введения субъекту. В некоторых вариантах воплощения, содержимое входящих в набор контейнера с композицией и контейнера с растворителем объединяют с получением, по меньшей мере, одной стандартной лекарственной формы.
[00340] В некоторых вариантах воплощения, обеспечиваемая композиция по настоящему изобретению может быть полезной вместе с контролируемыми пациентом обезболивающими устройствами (PCA), где пациент может вводить, например, опиоидный анальгетик, если это необходимо, для обезболивания.
[00341] Необязательно, отдельный контейнер может включать одно или несколько отделений для содержания обеспечиваемой композиции и/или подходящего водного носителя для суспендирования или разбавления. В некоторых вариантах воплощения, отдельный контейнер может быть подходящим для модификации, например, для возможности физической модификации, чтобы обеспечить возможность комбинирования отделений и/или компонентов отдельных отделений. Например, пакет из фольги или пластика может включать два или более отделений, разделенных перфорированной перегородкой, которую можно разорвать, чтобы можно было объединить содержимое двух отделений сразу после сигнала разорвать перегородку. Фармацевтическая упаковка или набор, таким образом, могут включать такие контейнеры с несколькими отделениями, включающими обеспечиваемую композицию и подходящий растворитель и/или подходящий водный носитель для суспендирования. Необязательно, такие наборы дополнительно включают инструкции по применению.
[00342] Необязательно, такие наборы по настоящему изобретению дополнительно включают инструкции по применению. Так, инструкции могут, как правило, включать, например, инструкции, касающиеся дозирования и введения. В других вариантах воплощения, инструкции могут также содержать дополнительные подробности, относящиеся к специальным инструкциям для конкретных контейнеров и/или систем для введения. И, кроме того, инструкции могут обеспечивать специальные инструкции для применения вместе с и/или в сочетании с дополнительной терапией. В одном неограничивающем примере, фармацевтические композиции по настоящему изобретению можно использовать вместе с введением опиоидного обезболивающего средства, которое, необязательно, может включать использование контролируемого пациентом обезболивающего устройства (PCA). Таким образом, инструкции по применению обеспечиваемых фармацевтических композиций могут включать инструкции по применению вместе с использованием PCA устройств.
Способы применения и введения
[00343] Как описано выше, Соединение 1 представляет собой ингибитор FAAH. Как таковое, оно является полезным для лечения состояний, опосредованных FAAH.
[00344] Настоящее изобретение обеспечивает способы лечения FAAH-опосредованного состояния, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества Соединения 1, описанного в настоящей заявке.
[00345] "Субъект", введение которому предусматривается, включает, но не ограничивается этим, человека (т.е. мужчину или женщину любой возрастной группы, например, педиатрического субъекта (например, младенца, ребенка, подростка) или взрослого субъекта (например, взрослого молодого возраста, взрослого среднего возраста или взрослого пожилого возраста)) и/или других приматов (например, обезьян cynomolgus, обезьян rhesus); млекопитающих, включая коммерческих млекопитающих, таких как крупный рогатый скот, свиньи, лошади, овцы, козы, кошки и/или собаки; и/или птиц, включая коммерческих птиц, таких как куры, утки, гуси и/или индюшки.
[00346] Как они используются в настоящей заявке, если не указано иное, термины "лечить", "лечащий" и "лечение" предусматривают действие, которое осуществляют, когда субъект страдает от указанного заболевания, расстройства или состояния, которое уменьшает тяжесть этого заболевания, расстройства или состояния или сдерживает или замедляет прогрессирование этого заболевания, расстройства или состояния.
[00347] Как они используются в настоящей заявке, если не указано иное, термины "предотвращать", "предотвращающий" и "профилактика" предусматривают действие, которое осуществляют до того, как субъект начинает страдать от указанного заболевания, расстройства или состояния, которое ингибирует или уменьшает тяжесть этого заболевания, расстройства или состояния.
[00348] Как они используются в настоящей заявке, если не указано иное, термины "справляться" и "умение справляться"(с заболеванием) охватывают предупреждение рецидива указанного заболевания, расстройства или состояния у субъекта, который уже страдал от указанного заболевания, расстройства или состояния, и/или продление времени, в течение которого субъект, который уже страдал от указанного заболевания, расстройства или состояния, находится в ремиссии. Термины охватывают модуляцию порога, развития и/или продолжительности заболевания, расстройства или состояния или изменения того, как субъект отвечает на заболевание, расстройство или состояние.
[00349] Как это используется в настоящей заявке, если не указано иное, "терапевтически эффективное количество" соединения представляет собой количество, достаточное для обеспечения терапевтической пользы в лечении или действиях, предпринимаемых, чтобы справиться с заболеванием, расстройством или состоянием, или для отсрочки или сведения к минимуму одного или нескольких симптомов, связанных с заболеванием, расстройством или состоянием. Терапевтически эффективное количество соединения означает количество терапевтического средства, отдельно или в сочетании с другими лечениями, которое обеспечивает терапевтическую пользу в лечении или действиях, предпринимаемых, чтобы справиться с заболеванием, расстройством или состоянием. Термин "терапевтически эффективное количество" может охватывать количество, которое усиливает общую терапию, уменьшает или уничтожает симптомы или причины заболевания или состояния, или усиливает терапевтическую эффективность другого терапевтического средства.
[00350] Как это используется в настоящей заявке, если не указано иное, "профилактически эффективное количество" соединения представляет собой количество, достаточное для предупреждения заболевания, расстройства или состояния или одного или нескольких симптомов, связанных с заболеванием, расстройством или состоянием, или предупреждает его рецидив. Профилактически эффективное количество соединения означает количество терапевтического средства, отдельно или в сочетании с другими средствами, которое обеспечивает профилактическую пользу в профилактике такого заболевания, расстройства или состояния. Термин "профилактически эффективное количество" может охватывать количество, которое улучшает общую профилактику или усиливает профилактическую эффективность другого профилактического средства.
[00351] Как это используется в настоящей заявке, "ингибирование", "ингибирующий", "ингибировать" и "ингибитор" и т.п., относятся к способности соединения к снижению, замедлению, остановке или предупреждению активности конкретного биологического процесса (например, FAAH активности) в клетке по сравнению с носителем.
[00352] "FAAH-опосредованное состояние", как это используется в настоящей заявке, относится к заболеванию, расстройству или состоянию, которое можно лечить путем ингибирования FAAH активности. "Заболевание", "расстройство" или "состояние" являются терминами, которые используются в настоящей заявке взаимозаменяемо. FAAH-опосредованные состояния включают, но не ограничиваются этим, болезненные состояния, воспалительные состояния, иммунные расстройства, расстройства центральной нервной системы, метаболические расстройства, сердечные расстройства и глаукому.
[00353] В некоторых вариантах воплощения, FAAH-опосредованное состояние представляет собой болезненное состояние. Как это используется в настоящей заявке, "болезненное состояние" включает, но не ограничивается этим, невропатическую боль (например, периферическую невропатическую боль), центральную боль, недифференцированную боль, хроническую боль (например, хроническую ноцицептивную боль и другие формы хронической боли, такие как послеоперационная боль, например, боль, возникающая после пластической хирургии бедра, колена и т.п.), предоперационную боль, раздражение ноцицептивных рецепторов (ноцицептивная боль), острую боль (например, фантомную и преходящую острую боль), невоспалительную боль, воспалительную боль, боль, связанную с раком, травматическую боль, ожоговую боль, послеоперационную боль, боль, связанную с медицинскими процедурами, боль, возникающую в результате зуда, синдром болезненного мочевого пузыря, боль, связанную с предменструальным дисфорическим расстройством и/или предменструальным синдромом, боль, связанную с синдромом хронической усталости, боль, связанную с преждевременными родами, боль, связанную с симптомами отмены от наркозависимости, боль в суставах, артритную боль (например, боль, связанную с кристаллическим артритом, остеоартритом, псориатическим артритом, подагрическим артритом, реактивным артритом, ревматоидным артритом или артритом Рейтера), пояснично-крестцовую боль, мышечно-скелетную боль, головную боль, мигрень, мышечную боль, боль внизу спины, боль в области шеи, зубную боль, зубную/челюстно-лицевую боль, висцеральную боль и подобные.
[00354] Одно или несколько болезненных состояний, рассматриваемых в настоящей заявке, могут включать смеси различных типов боли, указанных выше и далее в настоящей заявке (например, ноцицептивную боль, воспалительную боль, невропатическую боль и т.п.). В некоторых вариантах воплощения, определенная боль может доминировать. В других вариантах воплощения, болезненное состояние включает два или более типов боли, без доминирования одной боли. Опытный клиницист сможет определить дозу для достижения терапевтически эффективного количества для конкретного субъекта в соответствии с болезненным состоянием.
[00355] В некоторых вариантах воплощения, болезненное состояние представляет собой невропатическую боль. Термин "невропатическая боль" относится к боли в результате поражения нерва. Невропатическую боль отличают от ноцицептивной боли, которая представляет собой боль, вызванную острым поражением ткани с вовлечением малых кожных нервов или малых нервов в мышечной или соединительной ткани. Невропатическая боль типично является длительной или хронической и часто длится днями или месяцами после начального острого поражения ткани. Невропатическая боль может включать стойкую спонтанную боль, а также аллодинию, которая представляет собой болезненный ответ на раздражение, которое обычно не является болезненным. Невропатическая боль также может характеризоваться гипералгезией, при которой имеет место усиленный ответ на болезненное раздражение, которое обычно является тривиальным, таким как укол булавкой. Состояния невропатической боли могут развиваться после поражение нервных клеток, и возникшая боль может длиться в течение нескольких месяцев или лет, даже после излечения начального поражения. Нейронное поражение может возникать в периферических нервах, задних корешках, спинном мозге или некоторых областях головного мозга. Состояния невропатической боли включают, но не ограничиваются этим, диабетическую невропатию (например, периферическую диабетическую невропатию); ишиас; неспецифическую боль внизу спины; боль, вызванную рассеянным склерозом; синдром канала запястья, фибромиалгию; связанную с ВИЧ невропатию; невралгию (например, постгерпетическую невралгию, невралгию тройничного нерва); боль в результате физической травмы (например, ампутации; хирургической операции, инвазивных медицинских процедур, токсинов, ожогов, инфекции), боль, вызванную раком или химиотерапией (например, вызванная химиотерапией боль, такая как вызванная химиотерапией периферическая невропатия), и боль в результате воспалительного состояния (например, хронического воспалительного состояния). Невропатическая боль может быть результатом периферического нервного расстройства, такого как неврома; сжатие нерва; разрыв нерва, растяжение нерва или неполное рассечение нерва; мононевропатия или полиневропатия. Невропатическая боль также может быть результатом расстройства, такого как сжатие дорсального корешкового ганглия; воспаление спинного мозга; контузия, опухоль или гемисекция спинного мозга; опухоли ствола головного мозга, таламуса или коры головного мозга; или травма ствола головного мозга, таламуса или коры головного мозга.
[00356] Симптомы невропатической боли являются гетерогенными, и их часто описывают как спонтанную стреляющую и режущую боль или продолжительную жгучую боль. Кроме того, существует боль, ассоциируемая с обычно неболезненными ощущениями, такими как "булавочные и иголочные уколы" (парестезии и дисестезии), повышенная чувствительность к прикосновениям (гиперестезия), болезненное ощущение после безобидного стимула (динамическая, статическая или термальная аллодиния), повышенная чувствительность к вредным стимулам (термальная, холодовая, механическая гипералгезия), продолжительное болезненное ощущение после удаления стимула (гиперпатия) или отсутствия, или дефицит селективных сенсорных путей (гипоалгезия).
[00357] В некоторых вариантах воплощения, болезненное состояние представляет собой невоспалительную боль. Типы невоспалительной боли включают, без ограничения, периферическую невропатическую боль (например, боль, вызванную поражением или дисфункцией периферической нервной системы), центральную боль (например, боль, вызванную поражениеи или дисфункцией центральной нервной системы), деафферентированную боль (например, боль в результате потери сенсорного входа в центральную нервную систему), хроническую ноцицептивную боль (например, некоторые типы раковой боли), вредное раздражение ноцицептивных рецепторов (например, боль, ощущаемая в ответ на поражение ткани или грозящее поражение ткани), фантомную боль (например, боль, ощущаемая в части тела, которой больше не существует, такой как ампутированная конечность), боль, ощущаемая психиатрическими субъектами (например, боль, где может не существовать никакой физической причины), и блуждающая боль (например, где боль постоянно меняет место в организме).
[00358] В некоторых вариантах воплощения, болезненное состояние представляет собой воспалительную боль. В некоторых вариантах воплощения, болезненное состояние (например, воспалительная боль) связано с воспалительным состоянием и/или иммунным расстройством.
[00359] В некоторых вариантах воплощения, FAAH-опосредованное состояние представляет собой воспалительное состояние. Термин "воспалительное состояние" относится к таким заболеваниям, расстройствам или состояниям, которые характеризуются признаками боли (например, боль в результате образования вредных веществ и раздражения нервов), жара (например, боль в результате вазодилатации), покраснения (например, покраснение кожи в результате вазодилатации и усиления кровотока), опухания (например, опухоль в результате чрезмерного притока или ограниченного оттока жидкости) и/или потери функции (например, потеря функции, которая может быть частичной или полной, временной или постоянной). Воспаление принимает различные формы и включает, но не ограничивается этим, острое, адгезивное, атрофическое, катаральное, хроническое, цирротическое, диффузное, диссеминированное, эксудативное, фибринозное, фиброзирующее, очаговое, грануломатозное, гиперпластическое, гипертрофическое, интерстициальное, метастатическое, некротическое, облитерирующее, паренхиматозное, пластическое, продуктивное, пролиферативное, псевдомембранное, гнойное, склерозирующее, серопластическое, серозное, простое, специфическое, подострое, гноеродное, токсическое, травматическое и/или язвенное воспаление.
[00360] Примеры воспалительных состояний включают, но не ограничиваются этим, воспаление, связанное с акне, анемию (например, апластическую анемию, гемолитическую аутоиммунную анемию), астму, артериит (например, полиартериит, височный артериит, узелковый периартериит, артериит Такаясу), артрит (например, кристаллический артрит, остеоартрит, псориатический артрит, подагрический артрит, реактивный артрит, ревматоидный артрит и артрит Рейтера), анкилозирующий спондилит, амилоз, амиотрофический боковой склероз, аутоиммунные заболевания, аллергии или аллергические реакции, атеросклероз, бронхит, бурсит, хронический простатит, конъюнктивит, болезнь Чагаса, хроническое обструктивное легочное заболевание, церматомиозит, дивертикулит, диабет (например, сахарный диабет типа I, сахарный диабет типа 2), кожное состояние (например, псориаз, экзема, ожоги, дерматит, зуд (чесотка)), эндометриоз, синдром Гильена-Барре, инфекцию, ишемическое заболевание сердца, болезнь Кавасаки, гломерулонефрит, гингивит, гиперчувствительность, головные боли (например, мигреневые головные боли, головные боли при напряжении), кишечную непроходимость (например, послеоперационную кишечную непроходимость и кишечную непроходимость при сепсисе), идиопатическую тромбоцитопеническую пурпуру, интерстициальный цистит (синдром болезненного мочевого пузыря), желудочно-кишечное расстройство (например, выбранное из пептических язв, регионального энтерита, дивертикулита, желудочно-кишечного кровотечения, эозинофильного желудочно-кишечного расстройства (например, эозинофильный эзофагит, эозинофильный гастрит, эозинофильный гастроэнтерит, эозинофильный колит), гастрита, диареи, гастроэзофагеального рефлюкса (GORD или его синоним GERD), воспалительного заболевания кишечника (IBD) (например, болезнь Крона, язвенный колит, коллагеновый колит, лимфоцитарный колит, ишемический колит, воспаление в отключенной кишке, Синдром Бехета, недифференцированный колит) и синдрома воспаленной толстой кишки (IBS)), волчанку, рассеянный склероз, очаговую склеродермию, злокачественную миастению, ишемическое заболевание миокарда, нефротический синдром, обыкновенную пузырчатку, пернициозную анемию, пептические язвы, полимиозит, первичный билиарный цирроз, нейровоспаление, связанное с расстройствами головного мозга (например, болезнь Паркинсона, болезнь Гентингтона и болезнь Альцгеймера), простатит, хроническое воспаление, связанное с краниальным лучевым поражением, воспаление почечных лоханок, реперфузионное поражение, региональный энтерит, ревматическую лихорадку, системную красную волчанку, склеродерму, сциеродому, саркоидоз, спондилоартропатии, синдром Шегрена, тиреоидит, отторжение трансплантата, тендонит, травму или поражение (например, обморожение, химические раздражители, токсины, рубцы, ожоги, физическое поражение), васкулит, витилиго и грануломатоз Вегенера. В некоторых вариантах воплощения воспалительное расстройство выбрано из артрита (например, ревматоидного артрита), воспалительного заболевания кишечника, синдрома воспаленной толстой кишки, астмы, псориаза, эндометриоза, интерстициального цистита и простатита. В некоторых вариантах воплощения воспалительное состояние представляет собой острое воспалительное состояние (например, воспаление в результате инфекции). В некоторых вариантах воплощения воспалительное состояние представляет собой хроническое воспалительное состояние (например, состояния, являющиеся результатом астмы, артрита и воспалительного заболевания кишечника). Соединения также могут быть полезными для лечения воспаления, связанного с травмой, и невоспалительной миалгии. Соединения также могут быть полезными для лечения воспаления, связанного с раком.
[00361] В некоторых вариантах воплощения, FAAH-опосредованное состояние представляет собой иммунное расстройство. Иммунные расстройства, такие как аутоиммунные расстройства, включают, но не ограничиваются этим, артрит (включая ревматоидный артрит, спондилоартропатии, подагрический артрит, дегенеративные заболевания суставов, такие как остеоартрит, системную красную волчанку, синдром Шегрена, анкилозирующий спондилит, недифференцированный спондилит, болезнь Бехета, гемолитические аутоиммунные анемии, рассеянный склероз, амиотрофический боковой склероз, амилоз, острую плечевую боль, псориатический и юношеский артрит), астму, атеросклероз, остеопороз, бронхит, тендонит, бурсит, кожное состояние (например, псориаз, экзема, ожоги, дерматит, зуд (чесотка)), энурез, эозинофильное заболевание, желудочно-кишечное расстройство (например, выбранное из пептических язв, регионального энтерита, дивертикулита, желудочно-кишечного кровотечения, эозинофильного желудочно-кишечного расстройства (например, эозинофильный эзофагит, эозинофильный гастрит, эозинофильный гастроэнтерит, эозинофильный колит), гастрита, диареи, гастроэзофагеального рефлюкса (GORD или его синоним GERD), воспалительного заболевания кишечника (IBD) (например, болезнь Крона, язвенный колит, коллагеновый колит, лимфоцитарный колит, ишемический колит, воспаление в отключенной кишке, синдром Бехета, недифференцированный колит) и синдрома воспаленной толстой кишки (IBS)) и расстройства, которые можно лечить гастропрокинетическим средством (например, кишечная непроходимость, послеоперационная кишечная непроходимость и кишечная непроходимость при сепсисе; гастроэзофагеальный рефлюкс (GORD или его синоним GERD); эозинофильный эзофагит, гастропарез, такой как диабетический гастропарез; непереносимость пищи и пищевые аллергии и другие функциональные кишечные расстройства, такие как не-язвенная диспепсия (NUD), и не-сердечная боль в области грудной клетки (NCCP, включая косто-хондрит)).
[00362] В некоторых вариантах воплощения, воспалительное расстройство и/или иммунное расстройство представляет собой желудочно-кишечное расстройство. В некоторых вариантах воплощения, желудочно-кишечное расстройство выбрано из желудочно-кишечного расстройства (например, выбранного из пептических язв, регионального энтерита, дивертикулита, желудочно-кишечного кровотечения, эозинофильного желудочно-кишечного расстройства (например, эозинофильный эзофагит, эозинофильный гастрит, эозинофильный гастроэнтерит, эозинофильный колит), гастрита, диареи, гастроэзофагеального рефлюкса (GORD или его синоним GERD), воспалительного заболевания кишечника (IBD) (например, болезнь Крона, язвенный колит, коллагеновый колит, лимфоцитарный колит, ишемический колит, воспаление в отключенной кишке, синдром Бехета, недифференцированный колит) и синдрома воспаленной толстой кишки (IBS)). В некоторых вариантах воплощения, желудочно-кишечное расстройство представляет собой воспалительное заболевание кишечника (IBD).
[00363] В некоторых вариантах воплощения, воспалительное состояние и/или иммунное расстройство представляет собой кожное состояние. В некоторых вариантах воплощения, кожное состояние представляет собой зуд (чесотку), псориаз, экзему, ожоги или дерматит. В некоторых вариантах воплощения, кожное состояние представляет собой псориаз. В некоторых вариантах воплощения, кожное состояние представляет собой зуд.
[00364] В некоторых вариантах воплощения, FAAH-опосредованное состояние представляет собой расстройство центральной нервной системы (ЦНС) ("расстройство ЦНС"). Примеры расстройства ЦНС включают, но не ограничиваются этим, нейротоксичность и/или нейротравму, удар, рассеянный склероз, повреждение спинного мозга, эпилепсию, психическое расстройство, состояние сна, двигательное расстройство, тошноту и/или рвоту, амиотрофический боковой склероз, болезнь Альцгеймера и наркоманию.
[00365] В некоторых вариантах воплощения, расстройство ЦНС представляет собой нейротоксичность и/или нейротравму, например, в результате острого поражения нервных клеток (например, травматическое поражение головного мозга (TBI), удар, эпилепсия), или хроническое нейродегенеративное расстройство (например, рассеянный склероз, болезнь Паркинсона, болезнь Гентингтона, амиотрофический боковой склероз, болезнь Альцгеймера). В некоторых вариантах воплощения, соединение по настоящему изобретению обеспечивает нейрозащитный эффект, например, против острого поражения нервных клеток или хронического нейродегенеративного расстройства.
[00366] В некоторых вариантах воплощения, расстройство ЦНС представляет собой инсульт (например, ишемический инсульт).
[00367] В некоторых вариантах воплощения, расстройство ЦНС представляет собой рассеянный склероз.
[00368] В некоторых вариантах воплощения, расстройство ЦНС представляет собой повреждение спинного мозга.
[00369] В некоторых вариантах воплощения, расстройство ЦНС представляет собой эпилепсию.
[00370] В некоторых вариантах воплощения, расстройство ЦНС представляет собой психическое расстройство, например, депрессию, беспокойство или связанные с беспокойством состояния, неспособность к запоминанию или шизофрению.
[00371] В некоторых вариантах воплощения, расстройство ЦНС представляет собой депрессию. "Депрессия", как этот термин используется в настоящей заявке, включает, но не ограничивается этим, депрессивные расстройства или состояния, такие как, например, сильные депрессивные расстройства (например, униполярная депрессия), дистимические расстройства (например, хроническая слабовыраженная депрессия), биполярные расстройства (например, маниакальная депрессия), сезонное аффективное расстройство и/или депрессию, связанную с наркотической зависимостью (например, синдром отмены). Депрессия может представлять собой клиническую или субклиническую депрессию. Депрессия может быть связана с предменструальным синдромом и/или предменструальным дисфорическим расстройством.
[00372] В некоторых вариантах воплощения, расстройство ЦНС представляет собой беспокойство. "Беспокойство", как этот термин используется в настоящей заявке, включает, но не ограничивается этим, беспокойство и связанные с беспокойством состояния, такие как, например, клиническое беспокойство, паническое расстройство, агарофобии, генерализированное состояние беспокойства, специфические фобии, социальные фобии, обсессивно-компульсивное расстройство, острое стрессовое расстройство, посттравматическое стрессовое расстройство, адаптационные расстройства с признаками беспокойства, беспокойство, связанное с депрессией, беспокойство в результате общего медицинского состояния и вызванное каким-либо веществом беспокойство, беспокойство, связанное с наркотической зависимостью (например, синдром отмены, зависимость, восстановление), и беспокойство, связанное с тошнотой и/или рвотой. Это лечение также может быть направлено на индукцию или промотирование сна у субъекта (например, субъекта с беспокойством).
[00373] В некоторых вариантах воплощения, расстройство ЦНС представляет собой расстройство познавательной способности (например, расстройство с дефицитом внимания (ADD)).
[00374] В некоторых вариантах воплощения, расстройство ЦНС представляет собой шизофрению.
[00375] В некоторых вариантах воплощения, расстройство ЦНС представляет собой состояния сна. "Состояния сна" включают, но не ограничиваются этим, бессонницу, нарколепсию, синдром апноэ во сне, синдром усталых ног (RLS), синдром фазы замедленного сна (DSPS), расстройство периодического движения конечностей (PLMD), синдром резкого уменьшения частоты и глубины дыхания, поведенческое расстройство быстрого движения глаз (RBD), состояние сна при сменной работе (SWSD) и проблемы сна (например, парасомнии), такие как страшные сны, ночные ужасы, разговоры во сне, удары головой, храп и зажатые челюсти и/или скрежетание зубами (бруксизм).
[00376] В некоторых вариантах воплощения, расстройство ЦНС представляет собой двигательные расстройства, например, расстройства, связанные с базальными ганглиями, такие как, например, болезнь Паркинсона, леводопа-индуцированная дискинезия, болезнь Гентингтона, синдром Жилль де ля Туретта, поздняя дискинезия и дистония.
[00377] В некоторых вариантах воплощения, расстройство ЦНС представляет собой болезнь Альцгеймера.
[00378] В некоторых вариантах воплощения, расстройство ЦНС представляет собой амиотрофический боковой склероз (ALS).
[00379] В некоторых вариантах воплощения, расстройство ЦНС представляет собой тошноту и/или рвоту.
[00380] В некоторых вариантах воплощения, расстройство ЦНС представляет собой наркотическую зависимость (например, зависимость от опиатов, никотина, кокаина, психостимуляторов или алкоголя).
[00381] В следующих вариантах воплощения, FAAH-опосредованное состояние представляет собой сердечное расстройство, например, выбранное из гипертензии, шока, вызванного нарушением кровообращения, реперфузионнного поражения миокарда и атеросклероза.
[00382] В некоторых вариантах воплощения, FAAH-опосредованное состояние представляет собой метаболическое расстройство (например, состояние истощения, связанное с ожирением состояние или осложнение такого состояния).
[00383] В некоторых вариантах воплощения, метаболическое расстройство представляет собой состояние истощения. "Состояние истощения", как это используется в настоящей заявке, включает, но не ограничивается этим, анорексию и кахексии различной природы (например, потерю массы, связанную с раком, потерю массы, связанную с другими общими медицинскими состояниями, потерю массы, связанную с неудачными попытками достижения успеха и т.п.).
[00384] В некоторых вариантах воплощения, метаболическое расстройство связано с состоянием ожирения или осложнением такого состояния. "Связанное с ожирением состояние", как это используется в настоящей заявке, включает, но не ограничивается этим, ожирение, нежелательную прибавку в весе (например, медикаментозно-индуцированная прибавка в весе, из-за отказа от курения) и переедание (например, неконтролируемое переедание, булимия, компульсивное переедание или отсутствие контроля аппетита, каждое из которых необязательно может привести к нежелательной прибавке в весе или ожирению). "Ожирение" и "страдающий ожирением", как это используется в настоящей заявке, относится к классу I ожирения, классу II ожирения, классу III ожирения и состоянию предожирения (например, "чрезмерный вес"), как определено Всемирной Организацией Здравоохранения.
[00385] Уменьшение накопления жировой массы, как ожидают, может дать различные первичные и/или вторичные преимущества субъекту (например, субъекту, у которого диагностировано осложнение, связанное с ожирением), такие как, например, повышенная чувствительность к инсулину (например, у субъекта, у которого диагностирован сахарный диабет типа II); снижение повышенного кровяного давления; снижение повышенного уровня холестерина; и/или уменьшение (пониженный риск или прогрессирование) ишемического заболевания сердца, артериального сосудистого заболевания, стенокардии, инфаркта миокарда, удара, мигрени, застойной сердечной недостаточности, глубокого венозного тромбоза, легочной эмболии, желче-каменной болезни, гастроэзофагеального рефлюкса, синдрома обструктивного апноэ во сне, синдрома ожирения с гиповентиляцией легких, астмы, подагры, малоподвижности, боли в спине, эректильной дисфункции, недержания мочи, поражения печени (например, ожирения печени, цирроза печени, алкогольного цирроза, опосредованного эндотоксинами поражения печени) или хронической почечной недостаточности. Таким образом, способ по настоящему изобретению применим к страдающим ожирением субъектам, страдающим диабетом субъектам и страдающим алкоголизмом субъектам.
[00386] В некоторых вариантах воплощения, лечение связанного с ожирением состояния или осложнения такого состояния включает снижение массы тела у субъекта. В некоторых вариантах воплощения, лечение связанного с ожирением состояния или осложнения такого состояния включает контроль аппетита у субъекта.
[00387] В других вариантах воплощения, FAAH-опосредованное состояние представляет собой глаукому. Точное количество Соединения 1 и/или композиций, включающих Соединение 1, необходимое для достижения терапевтически эффективного количества, будет варьировать от субъекта к субъекту, в зависимости от вида, возраста и общего состояния субъекта, тяжести побочных эффектов или расстройства, способа введения и т.п. Желаемую дозу можно доставлять три раза в день, два раза в день, раз в день, через день, раз в три дня, раз в неделю, два раза в неделю, раз в две недели, раз в три недели или раз в четыре недели. В некоторых вариантах воплощения, желаемую дозу можно доставлять с использованием нескольких введений (например, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать или более введений).
[00388] В некоторых вариантах воплощения настоящего изобретения, терапевтически эффективное количество Соединения 1 и/или композиций, включающих Соединение 1, для введения один или несколько раз в день взрослому человеку с массой тела 70 кг может включать около 1 мг, около 5 мг, около 10 мг, около 25 мг, около 50 мг, около 100 мг, около 250 мг, около 500 мг, около 750 мг, около 1000 мг, около 2000 мг, около 2200 мг, около 2400 мг, около 2500 мг, около 2600 мг, около 2700 мг, около 2800 мг, около 2900 мг или около 3000 мг Соединения 1 на дозу. В некоторых вариантах воплощения настоящего изобретения, терапевтически эффективное количество Соединения 1 и/или композиций, включающих Соединение 1, для введения один или несколько раз в день взрослому человеку с массой тела 70 кг может включать от около 1 мг до около 3000 мг, от около 1 мг до около 2900 мг, от около 1 мг до около 2800 мг, от около 1 мг до около 2700 мг, от около 1 мг до около 2600 мг, от около 1 мг до около 2500 мг, от около 1 мг до около 2400 мг, от около 1 мг до около 2300 мг, от около 1 мг до около 2200 мг, от около 1 мг до около 2100 мг, от около 1 мг до около 2000 мг, от около 1 мг до около 1000 мг, от около 1 мг до около 900 мг, от около 1 мг до около 800 мг, от около 1 мг до около 700 мг, от около 1 мг до около 600 мг, от около 1 мг до около 500 мг, от около 1 мг до около 400 мг, от около 1 мг до около 300 мг, от около 1 мг до около 200 мг, от около 1 мг до около 100 мг, от около 1 мг до около 75 мг, от около 1 мг до около 50 мг, от около 1 мг до около 25 мг, от около 1 мг до около 10 мг и от около 10 мг до около 800 мг Соединения 1 на дозу. Должно быть понятно, что диапазоны доз, описанные в настоящей заявке, являются руководством для введения фармацевтических композиций по настоящему изобретению взрослым. Количество для введения, например, ребенку или подростку может определить лечащий врач или специалист в данной области, и оно может быть меньше или таким же, как для введения взрослым.
[00389] Настоящее изобретение также направлено на способы лечения FAAH-опосредованного заболевания, включающие введение конкретных доз Соединения 1. Такие дозы можно вводить один раз или больше чем один раз. В одном варианте воплощения, такую дозу или дозы вводят в соответствии со схемами, описанными в настоящей заявке. Также предусматриваются композиции Соединения 1, сформулированные таким образом, что они содержат подходящее количество Соединения 1, чтобы можно было легко ввести такую дозу.
[00390] В другом аспекте, изобретение направлено на способ лечения FAAH-опосредованного заболевания у пациента, включающий введение пациенту, имеющему FAAH-опосредованное заболевание, эффективного количества Соединения 1.
[00391] В другом аспекте, изобретение направлено на способ лечения FAAH-опосредованного заболевания у пациента, включающий введение пациенту количества от около 10 мг/м2 до около 3000 мг/м2 Соединения 1, по меньшей мере, один раз в неделю. В некоторых вариантах воплощения, способ включает введение пациенту количества от около 50 мг/м2 до около 2000 мг/м2 Соединения 1, по меньшей мере, один раз в неделю. В некоторых вариантах воплощения, способ включает введение пациенту количества от около 100 мг/м2 до около 1500 мг/м2 Соединения 1, по меньшей мере, один раз в неделю. В некоторых вариантах воплощения, способ включает введение пациенту количества от около 200 мг/м2 до около 1000 мг/м2 Соединения 1, по меньшей мере, один раз в неделю. В некоторых вариантах воплощения, способ включает введение пациенту количества от около 400 мг/м2 до около 800 мг/м2 Соединения 1, по меньшей мере, один раз в неделю. В некоторых вариантах воплощения, способ включает введение пациенту количества от около 600 мг/м2 Соединения 1, по меньшей мере, один раз в неделю. Такое количество можно вводить в виде композиции, включающей Соединение 1 и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. Частоту и продолжительность введения определяет лечащий врач или специалист в данной области.
[00392] Дозы Соединения 1, используемые в соответствии с настоящим изобретением, могут варьировать в зависимости от формы введения и/или от конкретного субъекта, которого лечат. Как правило, наиболее желательно введение Соединения 1 в концентрации на уровне, позволяющем достичь эффективных результатов, не вызывая при этом никаких вредных или опасных побочных эффектов. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 0,01 до около 100 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 0,05 до около 100 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 0,1 до около 100 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 1 до около 100 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 5 до около 100 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 10 до около 100 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 10 до около 90 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 10 до около 80 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 10 до около 70 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 10 до около 60 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 10 до около 50 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 10 мг/кг/день до около 40 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 10 мг/кг/день до около 30 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 10 мг/кг до около 20 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 1 мг/кг/день до около 20 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 1 мг/кг/день до около 10 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах меньше чем около 10 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах меньше чем около 5 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах меньше чем около 2 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах меньше чем около 1 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах меньше чем около 0,1 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах меньше чем около 0,01 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах меньше чем около 0,001 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах около 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах около 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08 или 0,09 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 0,1 мг/кг/день до около 1 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 0,01 мг/кг/день до около 0,1 мг/кг/день. В некоторых вариантах воплощения, Соединение 1 вводят в дозах в пределах от около 0,001 мг/кг/день до около 0,01 мг/кг/день.
[00393] В некоторых вариантах воплощения, доза представляет собой дозу, описанную выше, и ее вводят 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз в день. В некоторых вариантах воплощения, доза представляет собой дозу, описанную выше, и ее вводят 1, 2, 3 или 4 раза в день. В некоторых вариантах воплощения доза представляет собой дозу, описанную выше, и ее вводят через день. В некоторых вариантах воплощения, доза представляет собой дозу, описанную выше, и ее вводят раз в два дня. В некоторых вариантах воплощения, доза представляет собой дозу, описанную выше, и ее вводят раз в три дня. В некоторых вариантах воплощения доза представляет собой дозу, описанную выше, и ее вводят раз в четыре дня. В некоторых вариантах воплощения, доза представляет собой дозу, описанную выше, и ее вводят раз в пять дней. В некоторых вариантах воплощения, доза представляет собой дозу, описанную выше, и ее вводят раз в шесть дней. В некоторых вариантах воплощения, доза представляет собой дозу, описанную выше, и ее вводят один раз в неделю. В некоторых вариантах воплощения, доза представляет собой дозу, описанную выше, и ее вводят один раз в две, три, четыре, пять, шесть, семь, восемь, девять или десять недель.
[00394] В некоторых вариантах воплощения, Соединение 1 и/или композиции, включающие Соединение 1, можно вводить с едой. "Еда" типично означает твердую пищу или смешанную твердую/жидкую пищу с достаточным объемом и содержанием жира, которая не может быстро растворяться и абсорбироваться в желудке. В одном варианте воплощения, еда означает прием пищи, такой как завтрак, ланч или обед. Термины "принимаемый с пищей", "накормленный" и "неголодный" являются эквивалентными и соответствуют руководящим указаниям и критериям FDA. В одном варианте воплощения, "с пищей" означает, что введение осуществляют в пределах времени около 30 минут до - около 2 часов после приема пищи. В другом варианте воплощения, "с пищей" означает, что введение осуществляют, по существу, в то же время, когда принимают пищу.
[00395] В некоторых вариантах воплощения, Соединение 1 можно вводить в условиях голодания. Термины "без приема пищи", "голодный" и "пустой желудок" являются эквивалентными и соответствуют руководящим указаниям и критериям FDA. В одном варианте воплощения, "условия голодания" означает состояние в отсутствие приема какой-либо пищи в течение 1 часа перед введением или 2 часов после введения. В другом варианте воплощения, "условия голодания" означает состояние в отсутствие приема какой-либо пищи в течение периода времени 1 час перед введением - 2 часа после введения.
[00396] Эффективность Соединения 1 в лечении FAAH-опосредованного заболевания, расстройства или состояния в соответствии с настоящим изобретением можно оценить и с использованием любого способа, известного в медицине. Примеры таких способов включают физическое обследование, лабораторные испытания, исследования методами визуализации и т.п. В некоторых вариантах воплощения, лечение FAAH-опосредованного заболевания, расстройства или состояния можно оценить путем наблюдения субъекта, которого лечат. В некоторых вариантах воплощения, субъекта наблюдают один, два, три, четыре или пять раз в день. В некоторых вариантах воплощения, субъекта наблюдают один, два, три, четыре или пять раз в неделю. В некоторых вариантах воплощения субъекта наблюдают два раза в неделю. В некоторых вариантах воплощения, наблюдение является непрерывным. В некоторых вариантах воплощения, наблюдение осуществляют на протяжении периода времени, в течение которого субъект проходит лечение FAAH-опосредованного заболевания, расстройства или состояния. В некоторых вариантах воплощения, наблюдение осуществляют на протяжении всей жизни субъекта. В некоторых вариантах воплощения, субъектом является человек, и наблюдение осуществляют с использованием любого из способов, известных в области медицины, подходящих для наблюдения людей, проходящих лечение FAAH-опосредованного заболевания, расстройства или состояния.
Комбинированная терапия
[00397] Также должно быть понятно, что Соединение 1 или композицию на его основе, описанные выше и далее в настоящей заявке, можно вводить в сочетании с одним или несколькими дополнительными терапевтически активными веществами.
[00398] Под "в сочетании с" подразумевается, что средства следует вводить одновременно, и/или они должны быть сформулированы для совместной доставки, хотя эти способы доставки, безусловно, охватываются объемом настоящего изобретения. Композиции можно вводить одновременно с, до или после одного или нескольких других дополнительных терапевтически активных веществ. Как правило, каждое средство можно вводить в дозе и/или по схеме, определенной для этого средства. Кроме того, должно быть также понятно, что дополнительное терапевтически активное средство, используемое в такой комбинации, можно вводить вместе в одной композиции, или можно вводить отдельно в разных композициях. В конкретной комбинации для использования в таком режиме введения следует учитывать совместимость соединения по настоящему изобретению с дополнительным терапевтически активным средством и/или желаемый терапевтический эффект, достижение которого необходимо.
[00399] Как правило, ожидают, что дополнительные терапевтически активные вещества, используемые в комбинации, необходимо использовать в количествах, которые не превышают их уровни в случае индивидуального использования. В некоторых вариантах воплощения, уровни использования в комбинации будут ниже, чем уровни при индивидуальном использовании.
[00400] "Терапевтически активное вещество" или "активное вещество" относится к любому веществу, которое является полезным для терапии, включая профилактическое и терапевтическое лечение.
[00401] Настоящее изобретение охватывает доставку Соединения 1 и/или композиций, включающих Соединение 1, в сочетании с веществами, которые могут улучшить биодоступность, понизить и/или модифицировать метаболизм, ингибировать экскрецию и/или модифицировать дистрибуцию Соединения 1 в организме. Также должно быть понятно, что используемая терапия может достигать желаемого эффекта для того же самого расстройства (например, Соединение 1 можно вводить в сочетании с противовоспалительным средством, средством против беспокойства и/или антидепрессивным средством и т.п.), и/или могут достигаться другие эффекты (например, контроль каких-либо неблагоприятных побочных эффектов).
[00402] Примеры активных веществ включают, но не ограничиваются этим, противораковые средства, антибиотики, противовирусные средства, анестетики, противокоагулянты, ингибиторы фермента, стероидные средства, стероидные или нестероидные противовоспалительные средства, антигистаминовое средство, иммуносупрессанты, противоопухолевые средства, антигены, вакцины, антитела, противоотечные средства, седативные средства, опиоиды, болеутоляющие средства, анальгетики, жаропонижающие средства, гормоны, простагландины, гестагенные средства, средства от противоглаукомы, глазные средства, антихолинэргические средства, антидепрессанты, антипсихотические средства, снотворные, транквилизаторы, противосудорожные средства, мышечные релаксанты, спазмолитические средства, мышечные контрактанты, блокаторы каналов, миотические средства, антисекреторные средства, антитромботические средства, антикоагулянты, антихолинэргетические средства, β-адренергические блокирующие средства, диуретики, сердечнососудистые активные средства, вазоактивные средства, вазодилататоры, гипотензивные средства, ангиогенные средства, модуляторы взаимодействий клетка-внеклеточный матрикс (например, ингибиторы клеточного роста и антиадгезивные молекулы) или ингибиторы/интеркаляторы ДНК, РНК, белок-белковых взаимодействий, белок-рецепторных взаимодействий и т.п. Активные вещества включают малые органические молекулы, такие как лекарственные соединения (например, соединения, одобренные Управлением по контролю за продуктами и лекарствами в Своде Федеральных Нормативных Актов (CFR)), пептиды, белки, углеводы, моносахариды, олигосахариды, полисахариды, нуклеопротеины, мукопротеины, липопротеины, синтетические полипептиды или белки, малые молекулы, связанные с белками, гликопротеины, стероиды, нуклеиновые кислоты, ДНК, РНК, нуклеотиды, нуклеозиды, олигонуклеотиды, антисмысловые олигонуклеотиды, липиды, гормоны, витамины и клетки.
[00403] В некоторых вариантах воплощения, дополнительное терапевтически активное средство представляет собой болеутоляющее средство. Примеры болеутоляющих средств включают, но не ограничиваются этим, анальгетики, такие как ненаркотические анальгетики [например, салицилаты, такие как аспирин, ибупрофен (MOTRIN®, ADVIL®), кетопрофен (ORUDIS®), напроксен (NAPROSYN®), ацетаминофен, индометацин] или наркотические анальгетики [например, опиоидные анальгетики, такие как трамадол, фентенил, суфентанил, морфин, гидроморфон, кодеин, оксикодон и бупренорфин]; нестероидные противовоспалительные средства (NDAIDs) [например, аспирин, ацетаминофен, ингибиторы COX-2]; стероиды или противоревматические средства; препараты от мигрени, такие как бета адренергические блокирующие средства, производные спорыньи; трициклические антидепрессанты (например, амитриптилин, дезипрамин, имипрамин); анти-эпилептические средства (например, клонаксепам, валпроевая кислота, фенобарбитал, фенитоин, тиагаин, габапентин, карбамазепин, топирамат, валпроат натрия); α2 агонисты; селективные ингибиторы повторного поглощения серотонина (SSRI), селективные ингибиторы поглощения норэпинефрина; бензодиазепины; мексилетин (MEXITIL); флекаинид (TAMBOCOR); антагонисты NMDA рецептора [например, кетамин, детрометорфан, метадон]; и местные средства [например, каспаицин (Zostrix), EMLA крем, лидокаин, прилокаин].
[00404] В других вариантах воплощения, дополнительное терапевтически активное средство представляет собой противовоспалительное средство. Примеры противовоспалительных средств включают, но не ограничиваются этим, аспирин; ибупрофен; кетопрофен; напроксен; эдотолак (LODINE®); ингибиторы COX-2, такие как целекоксиб (CELEBREX®), рофекоксиб (VIOXX®), валдекоксиб (BEXTRA®), парекоксиб, эторикоксиб (MK663), деракоксиб, 2-(4-этоксифенил)-3-(4-метансульфонилфенил)-пиразоло[1,5-b] пиридазин, 4-(2-оксо-3-фенил-2,3-дигидрооксазол-4-ил)бензолсульфонамид, дарбуфелон, флосулид, 4-(4-циклогексил-2-метил-5-оксазолил)-2-фторбензолсульфонамид), мелоксикам, нимесулид, 1-метилсульфонил-4-(1,1-диметил-4-(4-фторфенил)циклопента-2,4-диен-3-ил)бензол, 4-(1,5-дигидро-6-фтор-7-метокси-3-(трифторметил)-(2)-бензотиопирано(4,3-c)пиразол-1-ил)бензолсульфонамид, 4,4-диметил-2-фенил-3-(4-метилсульфонил)фенил)циклобутенон, 4-амино-N-(4-(2-фтор-5-трифторметил)тиазол-2-ил)бензолсульфонамид, 1-(7-трет-бутил-2,3-дигидро-3,3-диметил-5-бензофуранил)-4-циклопропилбутан-1-он или их физиологически приемлемые соли, сложные эфиры или сольваты; сулиндак (CLINORIL®); диклофенак (VOLTAREN®); пироксикам (FELDENE®); дифлунизал (DOLOBID®), набуметон (RELAFEN®), оксапрозин (DAYPRO®), индометацин (INDOCIN®); или стероиды, такие как PEDIAPED® преднизолон фосфатно-натриевый пероральный раствор, SOLU-MEDROL® метилпреднизолон натрий сукцинат для инъекций, преднизолон в виде сиропа марки PRELONE®.
[00405] Дополнительные примеры противовоспалительных средств включают напроксен, который является коммерчески доступным в форме EC-NAPROSYN® таблеток замедленного высвобождения, NAPROSYN®, ANAPROX® и ANAPROX® DS таблеток и NAPROSYN® суспензии от компании Roche Labs, таблетки целекоксиба под торговой маркой CELEBREX®, рофекоксиб под торговой маркой VIOXX®, бетаметазон под торговой маркой CELESTONE®, капсулы пеницилламина под торговой маркой CUPRAMINE®, титруемые таблетки пеницилламина под торговой маркой DEPEN®, метилпреднизолон ацетат в виде суспензии для инъекций под торговой маркой DEPO-MEDROL, таблетки лефлуномида ARAVA™, сульфасалазин в виде таблеток замедленного высвобождения под торговой маркой AZULFIDIINE EN-tabs®, пироксикам в виде капсул под торговой маркой FELDENE®, диклофенак калий в виде таблеток CATAFLAM®, диклофенак натрий в виде таблеток замедленного высвобождения VOLTAREN®, диклофенак натрий в виде таблеток пролонгированного высвобождения VOLTAREN®-XR или этанерсепт в виде продуктов ENBREL®.
IMP4 в качестве ингибитора FAAH
[00406] Было обнаружено, что IMP-4 также является ингибитором FAAH.
[00407] Соответственно, в некоторых вариантах воплощения, настоящее изобретение обеспечивает композицию, включающую IMP-4 и фармацевтически приемлемый носитель, адъювант или наполнитель.
[00408] В некоторых вариантах воплощения, настоящее изобретение обеспечивает способ ингибирования FAAH у пациента, включающий введение пациенту IMP-4 или содержащей его фармацевтически приемлемой композиции. В некоторых вариантах воплощения, настоящее изобретение обеспечивает способ лечения FAAH-опосредованного расстройства у пациента, включающий введение пациенту IMP-4 или содержащей его фармацевтически приемлемой композиции. Такие расстройства включают боль и расстройства, подробно описанные в настоящей заявке ниже.
[00409] Настоящее раскрытие, описанное в общем виде выше, можно будет легче понять при рассмотрении следующих далее примеров, которые включены просто в целях иллюстрации некоторых аспектов и вариантов воплощения настоящего изобретения и не предназначены для ограничения содержащегося в настоящей заявке раскрытия.
Иллюстративные примеры
[00410] Оригинальная процедура синтеза Соединения 1, раскрытая в Публикации PCT № WO2008/63300, включенная в настоящую заявку посредством ссылки, представлена на Схеме 4. Первая стадия опубликованного синтеза включала реакцию Сузуки 1,4-дибром-2-фторбензола E-1a и 3-фторфенилбороновой кислоты E-2a, с последующим концентрированием и хроматографической очисткой, с получением E-3a. Реакция Сузуки соединения E-3a и бис(пинаколято)диборона, с последующей обработкой и хроматографической очисткой, давала боронатный сложный эфир E-4a. Гидролиз сложного эфира E-4a в окислительных условиях, с последующей обработкой и растиранием в порошок с гексаном, давал бороновую кислоту, Соединение 1, в виде белого твердого вещества.
Схема 4
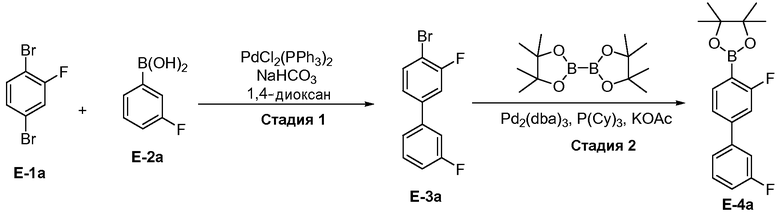
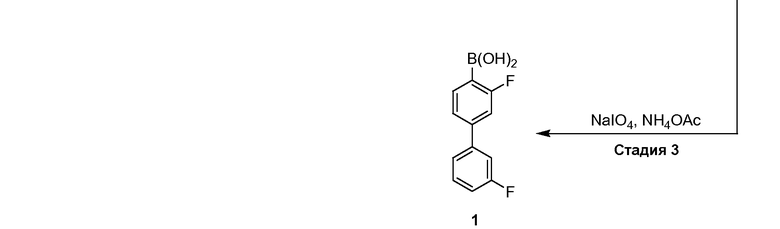
ПРИМЕР 1. ОПТИМИЗАЦИЯ СИНТЕЗА СОЕДИНЕНИЯ 1
Стадия 1: Реакция Сузуки
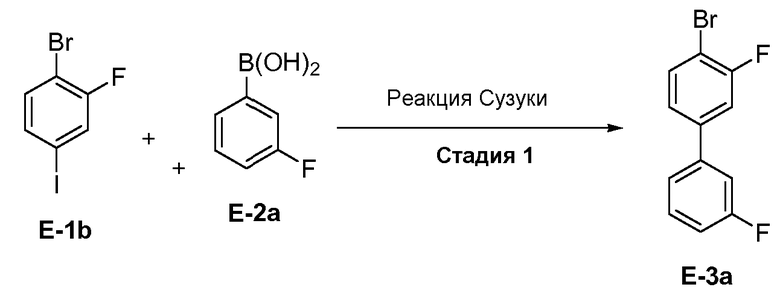
[00411] Исходное вещество для реакции Сузуки: Учитывая улучшенную реакционную способность арилгалогенидов в следующем порядке Cl<Br<I (арилиодиды взаимодействуют с Pd наиболее эффективно), реакция Сузуки для образования E-3a была вспоследствии улучшена при использовании исходного вещества E-1b (X=I). Это обеспечило существенно улучшенный выход реакции.
[00412] Образование примесей: Две наиболее типичные примеси для реакцим Сузуки представляли собой 3,3'-дифторбифенил IMP1 и трифенил IMP2, образующиеся в реакции Сузуки как по иоду, так и по брому в исходном веществе (Фиг.7). Интересно, что 3,3'-дифторбифенил IMP1 может образовываться как в результате гомовзаимодействия E-2a или протодебромирования E-3a. Тогда как некоторые литературные источники предполагают, что окисление Pd(0) до Pd(II) при помощи растворенного кислорода лежит в основе гомовзаимодействия, не наблюдали никакого изменения профиля реакции, когда реакционную смесь дегазировали и выдерживали в инертной атмосфере, по сравнению с тем, когда реакцию осуществляли в условиях окружающей среды. В присутствии избыточного количества катализатора и в отсутствие галогенидного взаимодействующего партнера было продемонстрировано, что E-2a будет обеспечивать IMP1 в небольших количествах. Однако также было обнаружено, что при повышенных температурах и продолжительном времени реакции, E-3a также будет преобразовываться в IMP1 независимо. Не желая привязывать это к какой-либо теории, это является подтверждением, что образование IMP1 нельзя относить за счет одного или другого механизма, и считают, что они оба способствуют образованию примесей в этом способе.
[00413] Также в реакции Сузуки образовывался дибромид IMP3 (Фиг.7). Исследовали возможность загрязнения 3-фторфенилбороновой кислоты E-2a 4-бром-3-фторбензолбороновой кислотой, но в испытанных партиях не было обнаружено никакого бромида. Вместо этого, не желая привязывать это к какой-либо теории, было обосновано, что IMP3 образовывался через гомовзаимодействие E-1a в не содержащей меди реакции Ульмана. Не желая привязывать это к какой-либо теории, присутствие IMP4 относят, частично, за счет взаимодействия IMP3 на стадии металлирования/введения бороно-группы (Фиг.7). Дополнительное обсуждение IMP4 представлено в Примере 3.
[00414] Выбор растворителей для реакции Сузуки: Реакцию Сузуки для получения бифенила E-3a оптимизировали поэтапно. Растворители сначала выбирали из ограниченного количества благоприятных для данного процесса растворителей для реакции с использованием PdCl2(PPh3)2 в качестве катализатора и NaHCO3 в качестве основания. Иллюстративная накладная хроматограмма восьми смесей растворителей представлена на Фиг.3. Из этой иллюстративной картины наложения, к удивлению, было обнаружено, что 1-PrOH давал существенно меньше примесей по сравнению с другими растворителями (например, 1-PrOH:вода приблизительно в соотношении 8:3).
[00415] Выбор оснований для реакции Сузуки: Органические и неорганические основания (Фиг.4 и 5) затем подвергали тщательному отбору с использованием 1-PrOH или смеси 1-PrOH и воды в качестве растворителя и PdCl2(PPh3)2 в качестве катализатора. В результате такого тщательного отбора оснований, NaHCO3 был выбран для дальнейшей разработки на основании его превосходной конверсии.
[00416] Выбор катализаторов для реакции Сузуки: Ряд палладиевых катализаторов подвергали тщательному отбору при загрузке 3 моль% по отношению к субстрату. Фиг.6 представляет картину наложения нескольких хроматограмм иллюстративного скрининга катализаторов для реакции перекрестного взаимодействия по методу Сузуки: (a) Pd(PPh3)4/K2CO3; (b) Pd(OAc)2/PPh3; (c) Pd(OAc)2; (d) Pd2(dba)3/PPh3; (e) Pd2(dba)3; (f) Pd(dppf)2Cl2; (g) Pd(PPh3)4. (dba = дибензилиденацетон; dppf = (дифенилфосфорил)ферроцен). Во всех реакциях, за исключением (a), использовали NaHCO3 в качестве основания. Растворитель для всех реакций представлял собой 1-PrOH/воду. 3 моль% Pd использовали для всех реакций за исключением (b) и (d).
[00417] Выбор температур для реакции Сузуки: Эффект температуры и загрузки PdCl2(PPh3)2 катализатора исследовали, изменяя как температуру реакции, так и загрузку PdCl2(PPh3)2 катализатора (например, от около 50 до около 85°C и от около 0,5 до около 5,0 моль%, соответственно) и отслеживая конверсию через 14 часов, чистоту реакции, которую определяли анализом ВЭЖХ, процентный выход E-3a (например, с использованием масс/масс анализа) и образование побочного продукта (например, образование IMP1). Исходя из этих экспериментов, использовали загрузку катализатора от около 0,3 до около 0,5 моль% PdCl2(PPh3)2 и температуру кипения с обратным холодильником около 83±5°C, и было продемонстрировано, что это работает в масштабе реакций от 100 г до 2 кг.
[00418] Обработка в реакции сочетания по методу Сузуки: Процедуру обработки оптимизировали в целях удаления 1-PrOH и следовых количеств палладия из реакционной смеси. Было обнаружено, что н-гептан хорошо работал в качестве растворителя экстракции для этой реакции. Обработка включала начальное гашение водным раствором 1 M NaOH с последующим экстрагированием продукта E3a в органической (н-гептан) фазе. Водное гашение способствовало растворению неорганических твердых веществ и обеспечивало чистое фазовое разделение с небольшим межфазным неровным слоем эмульсии. После удаления этой первой водной фазы и вместе с ней неровного слоя эмульсии, органическую фазу снова промывали водным раствором 1 M NaOH. Для уменьшения эмульсий, наблюдаемых в процессе конечной водной промывки начального увеличения масштаба, осуществляли конечную (третью) промывку с использованием 2% (масс/масс) водного раствора NaCl. Уменьшение объема органической фазы указывало на то, что промывки были очень эффективными для удаления 1-PrOH из органической фазы, как было определено методом ГХ. Последующая концентрация н-гептанового слоя делала возможным практически полное удаление 1-PrOH (типично <200 ч/млн 1-PrOH остается после дистилляции). Было обнаружено, что уровни Pd в концентрированном н-гептановом слое составляли >2000 ч/млн. Силикагель, суспендированный в н-гептане, с последующим фильтрованием, обеспечивали продукт E-3a с уровнями Pd меньше чем 16 ч/млн. В целях дальнейшего облегчения получения промежуточного соединения E-3a и генерации процесса, более равномерно интегрированного в синтез Соединения 1 в целом, были осуществлены два следующих улучшения в синтезе: 1) обработку силикагелем для удаления следовых количеств Pd оптимизировали, чтобы ее можно было осуществить как поточную процедуру фильтрования (ранее это осуществляли как периодическую процедуру); и 2) выход E-3a определяли с использованием масс/масс анализа, чтобы лучше определить загрузку реагентов для последующей стадии.
[00419] Для очистки реактора от исходных веществ, продуктов и палладиевых примесей использовали комбинацию промывок. Реактор последовательно промывали дихлорметаном, ацетоном, водой и разбавленными растворами азотной кислоты/хлористоводородной кислоты. Последние делали возможным полное удаление палладия, который прилипал к стенкам реактора, и устраняли необходимость промывки системы вручную. Затем, как обычно, использовали конечные промывки для удаления следовых количеств кислот и воды из реактора и дальнейшей его эксплуатации.
Стадия 2: Металлирование/введение бороно-группы
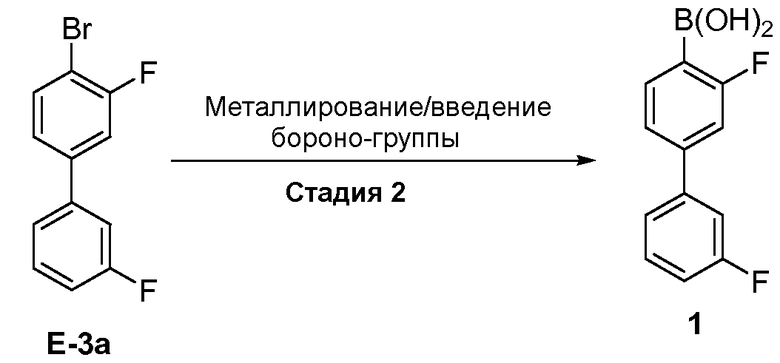
[00420] Новая стадия металлирования/введения бороно-группы: При масштабировании синтеза Соединения 1, двухстадийное палладий-опосредованное образование пинаколборонатного промежуточного соединения E-4a с последующим окислительным гидролизом (как показано на Схеме 3) стало менее эффективным по сравнению с маломасштабным способом. Также, второй Pd-опосредованный синтез на конечной стадии синтеза включает дополнительные стадии для очищения лекарственного продукта от Pd. Рассматривали осуществляемый в одном реакционном сосуде литий-галогеновый обмен с последующим боронообразованием и гидролизом из E-3a (например, см. W. Li et al., J. Org. Chem. 2002, 67, 5394-5397). Дополнительные исследования привели к дальнейшему улучшению стехиометрии реагентов в реакции, используемого в реакции растворителя, температуры реакции и условий обработки для процедуры, описанной ниже.
[00421] Условия выбора растворителя для металлирования/введения бороно-группы: Исходные условия требовали использования толуола и ТГФ в качестве растворителей для реакции, с использованием MTBE в качестве растворителя для обработки. Эта комбинация растворителей требовала значительной концентрации в дополнение к обмену растворителями, и, таким образом, были рассмотрены альтернативные системы растворителей для обеспечения лучшего протекания процесса от стадии 1 до выделения Соединения 1.
[00422] Поскольку было бы идеальным телескопировать бромид E-3a с первой стадии в виде раствора в н-гептане, были осуществлены эксперименты для демонстрации, что он будет подходящим растворителем для использования с MTBE и ТГФ в качестве сорастворителя для обработки и реакции, соответственно. В целях дальнейшего упрощения обработки реакционной смеси для преобразования, смешиваемый с водой ТГФ заменяли не смешиваемым с водой 2-МеТГФ в качестве реакционного сорастворителя с н-гептаном, таким образом, устраняя необходимость в MTBE для обработки. График растворимости показывал, что растворимость > 100 мг/мл Соединения 1 можно получить, по меньшей мере, при 2:1 соотношении смеси 2-МеТГФ:н-гептан. Это позволяло получить относительно широкие пределы растворимости как для реакции, так и для обработки, с сохранением при этом объемов растворителей на приемлемых уровнях для телескопически объединенных стадий.
[00423] Стехиометрия агента литиирования и боронообразующего реагента B(OiPr) 3: Было разработано несколько экспериментов для испытания, играет или нет локальный избыток алкиллития важную роль в этой реакции. Конечно, низкие количества (недостаточная загрузка) триизопропилбората (B(OiPr)3) и н-бутиллития приводили к неполной конверсии. Также использовали обратный подход к процедуре добавления, где исходное вещество и борат добавляли к раствору н-бутиллития при -45°C. При сравнении с контрольной реакцией (медленное добавление н-бутиллития), обратный подход к добавлению приводил к избытку непрореагировавшего исходного вещества (7% a/a E-3a (контроль) против 45% a/a E-3a, соответственно). Добавление дополнительного количества н-бутиллития приводило к повышенному образованию IMP1 и снижению общего выхода. Подход с использованием модели Расчета Эксперимента (DoE) предполагал, что приблизительно 1,0 эквивалент или меньше алкиллития было бы оптимальным для этой реакции. Кроме того, было обосновано, что избыток бората, добавляемого в реакцию, мог бы эффективно "защищать" образуемый продукт Соединения 1 от побочной реакции in situ c алкиллитием.
[00424] Было обнаружено, что осторожное добавление правильно выбранного количества алкиллития на основании титрования раствора и анализа исходного вещества делают возможным более контролируемое использование реагента. Начальная недостаточная загрузка алкиллития с последующим контролем в процессе обработки (IPC) при помощи ВЭЖХ (с микро-обработкой с использованием 1 M HCl) позволяли определить количество оставшегося исходного вещества относительно продукта, а также рассчитать необходимое количество н-бутиллития для достижения полной конверсии без какой-либо побочной реакции.
[00425] Выбор температуры для металлирования/введения бороно-группы: Хотя реакцию литиирования/введения бороно-группы изначально осуществляли при -78°C, в целях увеличения масштаба реакции температуру повышали до -40°C. Не наблюдали никакой разницы при осуществлении реакции при этих двух температурах. Дополнительные эксперименты, которые осуществляли при более высоких температурах (например, -20°C, -10°C и 0°C) давали несколько поздние элюирующие примеси, наблюдаемые при помощи ВЭЖХ. Выбор алкиллитиевого реагента: Изначально в работе использовали н-бутиллитий в качестве реагента для этой реакции. Полагали, что пирофорная природа н-бутиллития не может сделать его желательным реагентом для увеличения масштаба реакции выше отметки 2 кг (увеличение масштаба, для которого потребуется стационарное оборудование). Вместо этого был предложен гексиллитий в качестве более подходящего реагента для увеличения масштаба реакции по причинам безопасности, поскольку он демонстрирует два преимущества, связанные с безопасностью, по сравнению с н-бутиллитием: (1) при формулировании в гексане он не является пирофорным, даже при концентрациях вплоть до 85%; и (2) побочный продукт реакции (в этом случае, 1-бромгексан) имеет существенно более высокую температуру кипения по сравнению с его бутиловым аналогом. Эксперименты как в лабораторном, так и в килограммовом масштабе подтвердили, что гексиллитий является хорошей заменой для этой реакции и во многих случаях превосходит н-бутиллитий из-за простоты использования.
[00426] Водостойкость литиирования: Хотя количество воды в реакционной смеси до добавления алкиллитиевого реагента было определенно как низкое (<500 ч/млн; все реагенты за исключением гексиллития/н-бутиллития), было интересно определить "предел прочности" этой реакции и последствия избыточного количества воды в реакционной смеси. Был разработан эксперимент по искусственному загрязнению реакционной смеси вплоть до ~1 экв. воды, отслеживанию содержания воды (ч/млн) и отслеживанию эффекта на развитие реакции с использованием гексиллития в качестве основания. Было обнаружено, что больше чем 1000 ч/млн воды (приблизительно 0,15 экв.) ухудшали чистоту реакции. Наиболее существенная выявленная примесь из этой реакции представляла собой IMP1, образованный в результате литиирования и протонирования промежуточного соединения E-3a.
[00427] Скорость добавления алкиллития: Помимо количества алкиллития и содержания воды в реакционной смеси, также было обнаружено, что более медленные скорости добавления позволяют использовать меньше алкиллития. Типичное время добавления было установлено, независимо от масштаба не менее чем около 1 часа, при этом правильное смешивание и теплообмен являются важными параметрами.
[00428] Выделение и очистка Соединения 1: Как описано в Схеме 3, предпринимаемые изначально попытки достижения положительных результатов привели к получению реакционной смеси, содержащей Соединение 1, которую, после обработки, титровали с использованием гексана с получением белого твердого вещества. Были попытки использования хроматографической очистки, но они оказались неудачными по причине осаждения Соединения 1 на колонке, вероятно из-за плохой растворимости в элюенте и высокого сродства с силикагелем.
[00429] Испытывали несколько комбинаций растворителей (2-пропанол/вода, ацетонитрил/вода, этанол/вода, ацетон/вода, гексаны, циклогексан, толуол, этилацетат/гексаны и т.п.) для кристаллизации Соединения 1. Было обнаружено, что все спиртовые растворители образовывали соответствующие боронатные сложные эфиры в различных количествах. В дальнейших попытках, Соединение 1 перекристаллизовывали из смеси ацетон/вода и затем промывали н-гептаном для удаления неполярных примесей (например, IMP1, IMP2 и IMP3) с получением кристаллического Соединения 1. Некоторые партии кристаллического Соединения 1 содержали минорные количества IMP4; например, для сравнения Пример A и Пример B ниже (LOQ=0,13% a/a; LOD=0,05% a/a), как определено анализом ВЭЖХ (Таблица 1). Не желая привязывать это к какой-либо теории, плохая растворимость IMP-4 в ацетоне (приводящая к удалению примеси на стадии очистки) и лучший контроль кристаллизации являются факторами, способствующими получению низких уровней примеси, наблюдаемой в получаемых партиях.
до кристализации
после кристализации
[00430] Для использования преимущества плохой растворимости Соединения 1 и высокой растворимости образуемых в реакции примесей в н-гептане, было разработано прямое выделение через обмен растворителей из реакционного раствора. Например, после обработки на стадии литиирования/введения бороно-группы органический раствор концентрировали до небольшого объема (2,5 об. в целом) и к образовавшейся суспензии добавляли н-гептан. Перегонку повторяли для обеспечения полного обмена растворителей (т.е. для минимизации количества 2-МеТГФ в растворе). Полученное вещество в конце суспендировали в н-гептане и фильтровали. Эту перегонку осуществляли с использованием роторного испарителя (20 л). Однако для дальнейшего увеличения масштаба (в частности, с использованием стационарного оборудования) более прямое выделение было бы выгодным.
[00431] В целях исключения роторного испарителя и лучшего понимания Соединения 1, предпринимали попытки осуществления атмосферной перегонки и обмена растворителями. Было обнаружено, что повышенная температура и более эффективный азеотроп, образованный в отсутствие пониженного давления, приводили к количественной дегидратации Соединения 1 до ангидрида (например, структура, приписываемая Соединению 2) (Схема 5).
Схема 5
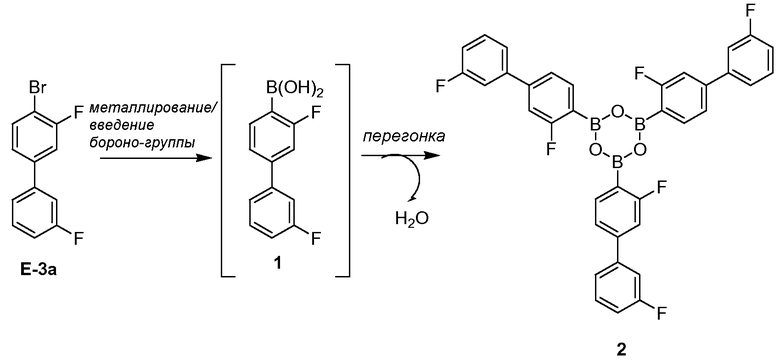
[00432] Образование ангидрида позволяло осуществить прямую перегонку летучих компонентов реакции непосредственно из реакционного сосуда (типично реактора). Не наблюдали никакого разложения Соединения 1 или его ангидрида в процессе этой атмосферной перегонки, при которой достигаются температуры внутри реактора приблизительно 100°C. Полярную примесь IMP4 полностью удаляли из Соединения 1 с использованием этой процедуры, как было определено анализом ВЭЖХ, см., например, Примеры C и D ниже (LOQ=0,13% a/a; LOD=0,05% a/a) (Таблица 2).
[00433] Преобразование ангидрида (например, структура, приписываемая Соединению 2) обратно в Соединение 1 требовало добавления водного растворителя для осуществления гидролиза олигомера. Ацетон в комбинации с водой давали лучшие результаты. К удивлению, было обнаружено, что кристаллизация из ацетона/воды давала только мономерную форму Соединения 1, что было подтверждено испарительным титрованием по методу Карла Фишера. Осторожное добавление воды и профиль нагревания/охлаждения обеспечивали твердое вещество, которое имело высокую чистоту (основное количество примесей удалено), обеспечивали постоянный размер частиц и легко осуществляемое фильтрование для конечного выделения. Сушку осуществляли в вакуумной печи с установленной температурой 40±5°C, чтобы избежать нового образования ангидрида.
[00434] В зависимости от протокола очистки, используемого для Соединения 1, можно наблюдать разные размеры частиц. Однако следует отметить, что независимо от процедуры (например, органическая или водная кристаллизация), выделяли одну и ту же кристаллическую форму (Форма А, подтверждено идентичными рентгеновскими порошковыми дифрактограммами). Визуальное сравнение кристаллической формы и размера с использованием микроскопии в поляризованном свете представлено на Фиг.9. В целом, кристаллы, выделенные из смеси ацетон/вода с более контролируемым ростом, намного крупнее тех, рост которых не контролировали.
[00435] Общая Схема, обобщающая улучшенную обработку и синтез Соединения 1, представлена на Схеме 6.
Схема 6
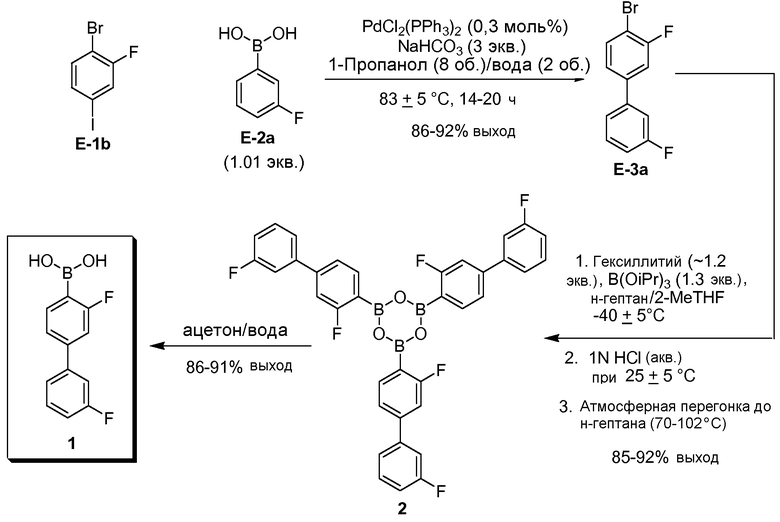
Экспериментальная часть
[00436] Используемый метод ВЭЖХ: Информация, относящаяся к колонке: YMC-Pack Ph, 50×2,0 мм, PH12S05-0502WT; Растворитель A: Вода с 0,1% (об/об) муравьиной кислоты; Растворитель B: Ацетонитрил с 0,1% (об/об) муравьиной кислоты; Скорость потока: 1,5 мл/мин; Температура колонки: 50°C; Длина волны: 220 нм; Градиент: 95% A в течение 1 мин, затем от 95 до 50% A в течение 8 мин, от 50 до 20% A в течение 1 мин, удерживание в течение 1 мин и возвращение к 95% A в течение 0,5 мин. Время останова: 14 мин. Относительную чистоту (% a/a) определяли методом обращенно-фазовой высокоэффективной жидкостной хроматографии с УФ детекцией (254 нм) с использованием колонки C18-4,6×30 мм, 1,8 мкм и градиентного элюирования (Растворитель A: 0,1 муравьиной кислоты (FA) в воде с чистотой для ВЭЖХ. Растворитель B: 0,1 FA в ацетонитриле с чистотой для ВЭЖХ (CAN)). Испытываемые образцы растворяли в 100% диметилсульфоксиде (DMSO) приблизительно до концентрации 0,4 мг/мл. Предел количественного определения (LOQ) для этого способа теперь составляет ≤ 0,13% a/a.
[00437] В подробном описании эксперименов ниже представлены иллюстративные процедуры для получения Соединения 1. Представленный масштаб является исключительно иллюстративным, и эти процедуры были успешно адаптированы для осуществления в килограммовом масштабе с получением Соединения 1 в килограммовых количествах.
[00438] Получение 4-бром-3,3'-дифторбифенила E-3a. В реактор подходящего размера загружали 1-бром-2-фтор-4-иодбензол (600,55 г, 1,996 моль, 1,0 экв.), 3-фторфенилбороновую кислоту (282,60 г, 2,020 моль, 1,01 экв.), бикарбонат натрия (503,91 г, 5,998 моль, 3,0 экв.), транс-дихлорбис(трифенилфосфин)палладий(II) (4,1947 г, 5,98 ммоль, 0,003 экв.), н-пропанол (4,8 л, 8 об. относительно количества тригалогенида) и воду (2 об. относительно количества тригалогенида). Смесь перемешивали при скорости, необходимой для получения равномерно диспергированной суспензии. Реакционный раствор вакуумировали и дегазировали, снова заполняли азотом или аргоном. Реакционную смесь нагревали до нужной температуры 83±5°C. Как только достигали нужной температуры, температуру поддерживали в течение 14-20 часов. Завершение реакции определяли с использованием ВЭЖХ (тригалогенид RT: 5,9 мин; продукт RT: 7,6 мин), при этом намеченной целью, когда реакция считается завершенной, является <1% оставшегося исходного вещества. После завершенная реакции смесь охлаждали до 25±5°C. Смесь затем гасили раствором 1 M NaOH (водн.) (6 л, 10 об.) и перемешивали для тщательного смешивания фаз. Добавляли н-гептан (6 л, 10 об.) и перемешивали для тщательного смешивания фаз. Перемешивание останавливали и фазам давали разделиться. Водную фазу сливали и не использовали. Органическую фазу (верхнюю) промывали раствором 1 M NaOH (водн.) (6 л, 10 об.) и 2% (масс/масс) NaCl (водн.) (6 л, 0 об.) последовательно, сливая водную фазу. Органическую фазу концентрировали в реакционном сосуде с использованием пониженного давления до приблизительно 2 объемов; температура в реакционном сосуде не превышала 45°C; типичный вакуум для перегонки составлял 70-110 тор. К смеси добавляли н-гептан (3 л, 5 об.) и перемешивали для охлаждения до 25±5°C. Раствор фильтровали через колонку с набивкой из силикагеля (8,5 см в высоту × 5,5 см в диаметре слой силикагеля, полученный с использованием 72 г; загрузка: 120 г силикагеля на кг добавленного тригалогенида). Реакционную колбу промывали н-гептаном (0,6 л, 1 об.) и раствор фильтровали через колонку с силикагелем. Промывку повторяли один раз. Раствор неочищенного E-3a в н-гептане переносили в перегонную колбу. Раствор подвергали перегонке в целом до приблизительно 2 (~1,2 л) объемов относительно количества тригалогенида. Температура реактора не превышала 45°C. Типичный вакуум для перегонки составлял 70-110 тор. Концентрацию раствора определяли с использованием масса/масса анализа. Для получения контрольного маркера (E-3a высокой чистоты) неочищенный раствор после обработки и фильтрования очищали с использованием вакуумной перегонки, и продукт кипятили при приблизительно 180°C и 21 мм рт.ст. Эту реакцию можно осуществить в килограммовом масштабе. Например, эта реакция была успешно осуществлена с получением приблизительно 20 кг продукта.
[00439] Характеризация: 1H ЯМР (400 МГц, ацетон-d6) δ 7,71 (т, J=8,4 Гц, 1H), 7,58 (дд, J=1,8, 10,2 Гц, 1H), 7,52-7,44 (м, 4H), 7,17 (м, 1H) м.д. 13C ЯМР (100 МГц, ацетон-d6) δ 165,4, 162,9, 161,4, 159,0, 142,0 (ддд), 134,9, 131,8 (д), 125,1 (д), 123,7 (д), 115,9 (дд), 114,5 (д), 108,8 (д) м.д., температура плавления (с помощью DSC) 35-38°C. Анал. рассчитано для C12H7BrF2: C, 53,56; H, 2,62. Найдено: C, 53,62; H, 2,63.
[00440] Получение 2,4,6-трис(3,3'-дифторбифенил-4-ил)-1,3,5,2,4,6-триоксатриборинан (2). В инертный реактор загружали раствор E-3a (1,5 л/1,32307 кг 37,0% масс. раствора, 1,819 моль; 1,0 экв.) в н-гептане. Затем в реактор добавляли триизопропилборат (0,55 л, 2,369 моль, 1,3 экв. относительно E-3a на основании масс/масс анализа) и 2-МеТГФ (3 л). Смесь перемешивали со скоростью, необходимой для получения гомогенного раствора. Раствор затем вакуумировали и дегазировали, снова заполняли азотом или аргоном. Реакционную смесь охлаждали до около -45±5°C. Раствор гексиллития (33% масс. раствор в гексане) титровали непосредственно перед реакцией и добавляли к реакционной смеси (0,820 л 2,44 M раствора в гексане; 1,1 экв. относительно IPI-487552 на основании масс/масс анализа) при такой скорости, чтобы (a) TRXN<-35°C и (b) общее время добавления >1 час, но предпочтительно не более 3 часов. После завершения добавления реакционную смесь перемешивали в течение 5 минут при охлаждении. Осуществляли отбор проб реакционной смеси для определения конверсии. Брали аликвоту (1-2 мл) из реакционной смеси и гасили при помощи 1 M HCl (водн.) (2 мл). Фазы смешивали и затем давали осадиться. Из (верхней) органической фазы 10 мкл разбавляли при помощи 1 мл MeCN. Образец анализировали при помощи ВЭЖХ. Только пики исходного вещества и продуктов интегрировали для определения конверсии. Реакция была завершена, когда пик исходного вещества представлял собой <1% относительно пика продукта. Если определяли, что реакция не завершена, определяли количество дополнительного гексиллития, необходимое для доведения конверсии до завершения с использованием прямой аппроксимации на основании данных ВЭЖХ: % a/a исходного вещества был почти идентичным относительной стехиометрии в реакционной смеси. К реакционной смеси добавляли дополнительное количество гексиллития (40 мл 2,44 M раствора в гексане; 0,05 экв.) при такой же скорости (мл/мин), как скорость добавления, используемая для основного объема раствора. После завершения добавления реакционную смесь перемешивали в течение 5 минут и анализировали для подтверждения завершения реакции. Смесь затем гасили путем добавления 1 M раствора HCl (водн.) (3 л). В процессе гашения температуру реакции поддерживали на уровне <0°C. Бифазную реакционную смесь затем нагревали до 25±5°C и перемешивание прекращали. Слоям давали разделиться и водную фазу затем отбрасывали. Органическую фазу промывали водой (3 л) и оставляли в реакторе, чтобы начать перегонку в атмосфере азота (атмосферное давление) для концентрирования смеси. Собирали около 3 л дистиллята. Добавляли н-гептан (3 л) и перегонку продолжали до тех пор, пока не собрали приблизительно 3 л дистиллята. Эту стадию повторяли еще один раз, после этого добавляли одну последнюю порцию н-гептана (3 л) и перегонку останавливали. Полученную суспензию охлаждали до комнатной температуры в виде взвеси, и твердые вещества фильтровали, промывали н-гептаном (1,5 л тремя порциями) и сушили в вакуумной печи при 40±5°C и 25-30 мм рт.ст. до достижения постоянной массы. Полученные сухие твердые частицы использовали на стадии кристаллизации.
[00441] Характеризация: 1H ЯМР (400 МГц, ацетон-d6) δ 8,28 (т, J=12 Гц, 1H), 7,87 (т, J=7,2 Гц, 1H), 7,69 (д, J=7,6 Гц, 1H), 7,64 (д, J=7,6 Гц, 1H), 7,60-7,45 (м, 7H), 7,42 (д, J=1,2, 10,8 Гц, 1H), 7,28 (шир.с, 1H), 7,20 (м, 2 H) м.д., температура плавления (с помощью DSC) 238-241°C. Анал. рассчитано для С36Н21В3Р6О3: С, 66,73; H, 3,27. Найдено: С, 65,88; H, 3,32. Точный анализ данных показывает, что Соединение 2 частично гидролизуется в процессе осуществления анализа (ЯМР, элементный), с образованием смеси линейного тримера и Соединения 2 (циклический тример), давая разные результаты. Анал. Рассчитано для C36H23B3F6O4 (линейный тример Соединения 2):C, 64,92; H, 3,48. Найдено: C, 65,88; H, 3,32. Испарительное титрование по методу Карла Фишера: 0,8% воды.
[00442] Не желая привязывать это к какой-либо теории, элементный анализ для Соединения 2 предполагает, что Соединение 2 может быть представлено в виде 1:1 смеси линейного и циклического тримеров, т.е. для углерода: Рассчитано: (66,73+64,82)/2=65,82 Найдено: 65,88 и для водорода: Рассчитано:(3,27+3,48)/2=3,375, Найдено:3,32.
[00443] Соединение 2, XRPD параметры: INEL XRG-3000; Рентгеновская трубка: 1,54187000 Å; напряжение: 40 (кВ); сила тока (в амперах): 30 (мА); время обнаружения: 300 сек; Вращающаяся капиллярная трубка. Величина шага: приблизительно 0,03°2θ. Указано в настоящей заявке как "Форма I". Рентгеновская порошковая дифрактограмма Соединения 2, Форма I, заметно отличается от Соединения 1 (ср. Фиг.8 с Фиг.1).
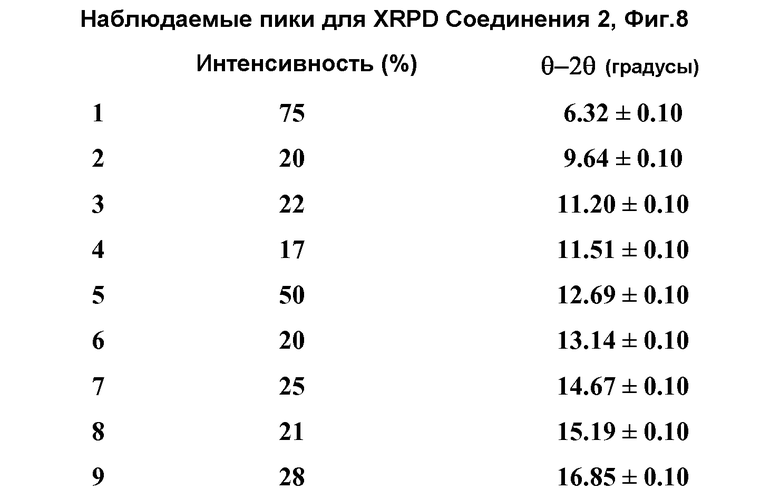

[00444] Получение 3,3'-дифторбифенил-4-илбороновой кислоты (Соединение 1) из Соединения 2. Соединение 2 (333,73 г, 515 ммоль, 1 экв.) загружали в подходящий реактор/колбу, снабженную сверху мешалкой, термопарой, обратным холодильником и нагревательной рубашкой. Затем добавляли ацетон (2,34 л, 7 об.) и начинали перемешивание для получения суспензии. Реактор вакуумировали и создавали инертную атмосферу. Раствор/суспензию дегазировали, перемешивали и нагревали до нужной температуры 50±5°C. Затем добавляли воду (30 мл, 1,665 моль, 3,2 экв. относительно Соединения 2) с получением прозрачного раствора. Температуру поддерживали в течение 20-60 мин. Раствор затем очищали через 1,0 мкм PTFE фильтр в реактор кристаллизации и нагревали до температуры кипения с обратным холодильником (55-60°C). Добавляли воду (3 л, 9 об.) по порциям и нагрев усиливали для поддержания температуры (т.е. для возврата к температуре кипения с обратным холодильником (65-70°C)). Затем добавляли ацетон (0,33 л, 1 об.) и продолжали нагревание для достижения снова температуры кипения с обратным холодильником (65-70°C), затем добавляли дополнительную порцию воды (0,33 л, 1 об.) с получением прозрачного раствора. Температуру кипения с обратным холодильником поддерживали в течение 15-30 минут и затем прекращали нагревание, давая смеси медленно охладиться (т.е. в течение, по меньшей мере, 8 часов) до 25±5°C. При 62°C смесь начинала образовывать центры кристаллизации (затемнение). Смесь фильтровали для сбора твердого кристаллического вещества и фильтровальную лепешку промывали смесью 6:4 вода:ацетон (0,33 л, 1 об.) три раза. Полученное вещество затем сушили до постоянной массы в вакуумной печи, уравновешенной при 40±5°C и 25-30 мм рт.ст. потоком азота. Эту процедуру можно адаптировать для килограммового масштаба.
[00445] Получение 3,3'-дифторбифенил-4-илбороновой кислоты (Соединение I) из Получения 4-бром-3,3'-дифторбифенила E-3a. В инертный реактор загружали раствор E-3a (4,610 кг 33,7% масс. раствора в н-гептане; 5 л; 5,77 моль, 1,0 экв.) в н-гептане. Затем в реактор добавляли триизопропилборат (1,412 кг, 7,51 моль, 1,3 экв. относительно E-3a на основании масс/масс анализа) и 2-МеТГФ (5,3 масс.). Смесь перемешивали со скоростью, необходимой для получения гомогенного раствора. Раствор затем вакуумировали и дегазировали, снова заполняли азотом или аргоном. Реакционную смесь охлаждали до около -45±5°C. Раствор н-бутиллития (2,5 M раствор в гексане) титровали непосредственно перед реакцией и добавляли к реакционной смеси (1,735 кг 24,7% масс. раствора в гексане, 6,69 моль, 1,16 экв.) при такой скорости, чтобы (a) TRXN < -35°C и (b) общее время добавления >1 час, но предпочтительно не более 3 часов. После завершения добавления реакционную смесь перемешивали в течение 5 минут при охлаждении. Осуществляли отбор проб реакционной смеси для определения конверсии. Брали аликвоту (1-2 мл) из реакционной смеси и гасили при помощи 1 M HCl (водн.) (2 мл). Фазы смешивали и затем давали осадиться. Из (верхней) органической фазы 10 мкл разбавляли при помощи 1 мл MeCN. Образец анализировали методом ВЭЖХ. Только пики исходного вещества и продуктов интегрировали для определения конверсии. Определяли завершение реакции, поскольку пик исходного вещества составлял <1% относительно пика продукта. Смесь затем гасили путем добавления 1 M HCl (водн.) (10 л). В процессе гашения температуру реакции поддерживали при <0°C. Бифазную реакционную смесь затем нагревали до 25±5°C и перемешивание прекращали. Слоям давали разделиться и водную фазу затем сливали. Органическую фазу промывали водой (6,3 масс.), затем концентрировали в условиях вакуума (на роторном испарителе или в подходящем реакторе) при пониженном давлении (<100 тор) и при температуре меньше чем около 45°C до общего объема приблизительно 5 л. Добавляли н-гептан (10 л) и перегонку продолжали до тех пор, пока не было собрано приблизительно 10 л дистиллята. Эту стадию повторяли еще один раз, после чего добавляли последнюю порцию н-гептана (10 л) и перегонку прекращали. Полученную суспензию охлаждали до комнатной температуры и взвесь и твердые вещества фильтровали, промывали н-гептаном (5 л) и сушили в вакуумной печи при 40±5°C и 25-30 мм рт.ст. до достижения постоянной массы.
[00446] Характеризация: 1H ЯМР (400 МГц, ацетон-d6) δ 7,85 (дд, J=6,9, 7,5 Гц, 1H), 7,56 (м, 1H), 7,54 (м, 2H), 7,50 (м, 1H), 7,41 (дд, J=1,7, 11,1 Гц, 1H), 7,25 (д, J=2,1 Гц, 2H-B(OH)2), 7,18 (дддд, J=1,5, 2,6, 7,8, 8,8 Гц, 1H) м.д. 13C ЯМР (100 МГц, ацетон-d6) δ 167,5 (д), 163,3 (д), 143,8 (дд), 141,8 (дд), 136,9 (д), 130,8 (д), 122,9 (д), 122,3 (д), 119,7 (шир), 114,8 (д), 113,6 (д), 113,2 (д) м.д. Анал. рассчитано для C12H9BF2O2: C, 61,59; H, 3,88. Найдено: C, 61,60, H, 3,73. Содержание воды по Карлу Фишеру (испарительный метод Карла Фишера): 7,88% (Теоретически: 7,7%). Содержание металла в конечном выделенном продукте типично <1 ч/млн Pd.
[00447] 1 Н и 13 С Химические сдвиги и определение структуры Соединения 1:
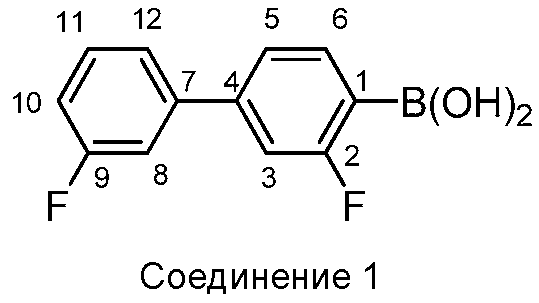
Расщеплениеb (Гц)
Расщеплениеb (Гц)
b1H мультиплетность получали из HSQC спектра для Н-11, Н-12, Н-5 и Н-8 из-за перекрытия в 1Н спектре.
[00448] Элементный Анализ: Соединение 1 анализировали для определения содержания C, H и F (Таблица 4). Было обнаружено, что процент углерода, водорода и фтора соответствовал предполагаемой структуре Соединения 1 (т.е. C12H9BF2O2). Элементный анализ осуществляли с использованием стандартного анализа сжиганием (для определения углерода и водорода). Количество фтора рассчитывали путем поглощения азотной кислоты с последующей ионной хроматографией.
[00449] Соединение 1 XRPD параметры: INEL XRG-3000; Рентгеновская трубка: 1,54187000 Å; напряжение: 40 (кВ); сила тока (в амперах): 30 (мА); время обнаружения: 300 сек; Вращающаяся капиллярная трубка. Величина шага: прибл. 0,03°2θ. Указано в настоящей заявке как "Форма А". Рентгеновская порошковая дифрактограмма Соединения 1, Формы А, была воспроизведена для всех кристаллических партий, независимо от выделения (из гептана/2-МеТГФ или ацетона/воды) и размера частиц (см. Фиг.1).
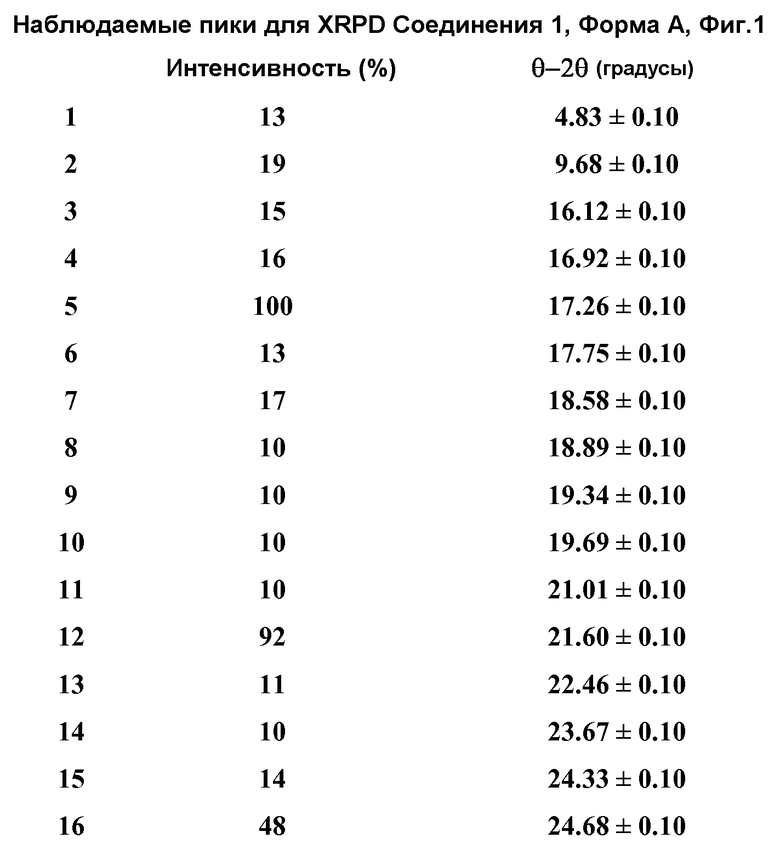


ПРИМЕР 2. ПРИМЕРЫ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ СОЕДИНЕНИЯ 1
(i) Пероральные суспензии
[00450] Соединение 1 ("лекарственный продукт") поставляют в виде порошка для пероральной суспензии в бутылях из янтарного стекла USP Типа III. В клинических условиях определенную протоколом порцию порошка отвешивают в подходящий контейнер и суспендируют со свежеприготовленным носителем. Лекарственный продукт представляет собой одноразовый флакон, содержащий 1,00 +/- 0,05 г активного ингредиента, который можно использовать для получения дозы для нескольких пациентов в тот же день. Оставшуюся во флаконе неиспользованную порцию лекарственного продукта затем выбрасывают. Закрывающийся контейнер для лекарственного продукта состоит из стеклянных бутылей USP типа III емкостью 1 унция (28,4 см3) с имеющими тефлоновое покрытие полипропиленовыми крышками.
[00451] Лекарственный продукт представляет собой твердое кристаллическое вещество, труднорастворимое в воде. Лекарственный продукт свободен от эксципиентов. В клинических условиях определенные протоколом порции лекарственного продукта суспендируют в носителе, состоящем из коммерчески доступной имеющей среднюю вязкость USP натриевой соли карбоксиметилцеллюлозы (CMC) в стерильной воде для инъекций (SWFI). CMC представляет собой химически стабильное соединение, которое обычно используют в пероральных фармацевтических композициях, и указана в FDA перечне веществ, которые общепризнаны как безопасные (GRAS). Проводимые в последнее время исследования совместимости показали, что стабильность лекарственного продукта, суспендированного в CMC, сохраняется по меньшей мере 48 часов, что превышает клинический интервал дозирования (12 часов).
[00452] Препарат, включающий лекарственный продукт, был выбран из-за его способности смачивать порошок и образовывать суспензию с CMC в SWFI, делая возможным равномерное пероральное дозирование. Никаких лишних веществ не использовали для получения лекарственного продукта. В процессе изготовления лекарственного продукта, лекарственный продукт измельчают перед наполнением для образования частиц одинакового размера. Лекарственный продукт подвергают испытанию на предельное микробное загрязнение, что является частью промышленного испытания.
[00453] Изготовление лекарственного продукта осуществляли в соответствии с “Современной надлежащей производственной практикой” (cGMP). Процесс изготовления включал измельчение лекарственного продукта, пропускание измельченного лекарственного продукта через 500 мкм сито, с последующим отвешиванием 1,00±0,05 г в бутыли из янтарного стекла USP Типа III емкостью 1 унция (28,4 см3) и закрытием емкостей. После мечения этикеткой и упаковки лекарственный продукт хранили при -20°C±5°C у изготовителя в клинических условиях. Вещество транспортировали в подходящем контейнере на сухом льду.
(ii) Капсулы
[00454] Лекарственный продукт (Соединение 1) формулируют в капсулу с непосредственным заполнением капсулы порошковой смесью, с использованием эксципиентов, которые включают различные компоненты, такие как наполнитель, разрыхлитель и агент скольжения/смазывающее вещество, например:
Соединение 1: от около 25 до около 45% масс/масс
Наполнитель: Avicel® (Микрокристаллическая Целлюлоза) (от около 49 до около 75% масс/масс)
Разрыхлитель: Acdisol® (Натрий Кроскармелоза) (0%> до около 6% масс/масс)
Агент скольжения: Pruv® (стеарилфумарат натрия) (0%> до около 2% масс/масс)
[00455] Другие предусматриваемые эксципиенты, которые используют, включают, но не ограничиваются этим, наполнители, такие как лактоза, маннит, крахмал, сорбит, сахароза, дикальцийфосфат; разрыхлители, такие как коповидон и натрий крахмалгликолят; агенты скольжения, такие как коллоидный диоксид кремния, диоксид кремния, силикат магния, тальк; смазывающие вещества, такие как стеарат магния и стеариновая кислота; и поверхностно-активные вещества, такие как лаурилсульфат натрия, додецилсульфат натрия, Tween 80, Lutrol®. Выбор эксципиентов основан на анализе совместимости эксципиентов, выполненном в ускоренных условиях. Выбор и процентное содержание наполнителя был основан на текучести смеси. Выбор и процентное содержание суперразрыхлителя был основан на профиле высвобождения капсулы в 0,1н хлористоводородной кислоте с 0,8% (капсулы низкой концентрации)/1,5% (капсулы высокой концентрации) Tween 80. Конкретные отношения API к наполнителю/разрыхлителю/смазывающему веществу были выбраны таким образом, чтобы улучшить текучесть порошка, процесс смешивания и процесс заполнения капсул.
[00456] Целевой размер частиц D(0,5) от около 40 до около 80 микрон.
[00457] Непосредственно смешиваемые композиции получали в концентрациях от около 25 мг до около 200 мг Соединения 1 на стандартную лекарственную форму; например,
(iii) Таблетки
[00458] Лекарственный продукт может быть преобразован в форму таблетки либо путем прямого прессования непосредственно смешанной композиции, либо путем сухого гранулирования или мокрого гранулирования. Можно добавить другие эксципиенты, такие как связующие и/или поверхностно-активные вещества и пленочные покрытия, способствующие сохранению целостности таблетки, вещества, которые маскируют вкус и делают привлекательным внешний вид продукта.
ПРИМЕР 3. ИДЕНТИФИКАЦИЯ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ IMP4
[00459] Партии, содержащие высокие уровни примесей, анализировали с использованием ЖХМС анализа в режиме ESI(электро-спреевой ионизации), и был определен исходный пик m/z 277,1 [M-H]- для этого вещества.
[00460] Примесь выделяли с использованием препаративной жидкостной хроматографии. После подтверждения, что выделенная примесь соответствовала времени удерживания целевой примеси, выделенные твердые вещества анализировали методом Жидкостной Хроматографии/Масс-Спектрометрии (ЖХ-МС) и Ядерного Магнитного Резонанса (ЯМР).
[00461] Ионная масса выделенной примеси соответствовала ионной массе примеси, присутствующей в DS партиях соединения 1, по данным ЖХ-МС с использованием электро-спреевой ионизации в отрицательном режиме (ESI-MS). Примесь имела исходный/базовый пик при m/z 277 и кажущийся пик димера при m/z 536.
[00462] По данным ЯМР (400 МГц в ацетоне-d6), только три резонанса наблюдали в протонном спектре. Все три были одинаково интегрированными и находились в ароматической области. Из этих трех резонансов, один представлял собой синглет, показывающий выделенный протон (отсутствие взаимодействия). На основании данных ЯМР, раннего времени удерживания примеси и масс-спектрометрических данных выделенной примеси, симметричное производное дибороновой кислоты Соединения 1 было предложено в качестве структуры для этой примеси.
[00463] Синтез предполагаемой примеси представлен ниже на Схеме 7. Реакция Сузуки с E1b и E2a обеспечивала симметричный 4,4'-дибром-3,3'-дифторбифенил, IMP3, с последующим двойным литиированием и введением бороно-группы с получением желаемой дибороновой кислоты IMP4. Самая крупная примесь в этой второй реакции введения бороно-группы представляла собой Соединение 1, которое образовывалось в результате быстрого добавления гексиллития к исходному веществу.
Схема 7
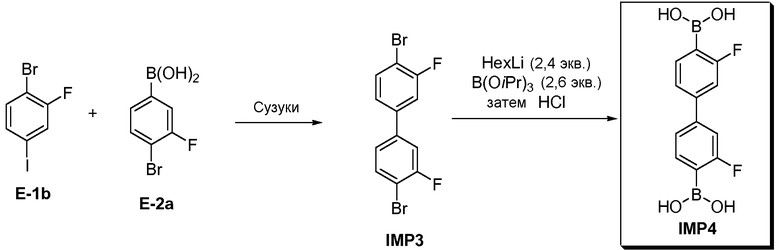
[00464] Синтезированная примесь соответствовала выделенной примеси, в соответствии с временем удерживания ВЭЖХ (Фиг.10), УФ абсорбцией (Фиг.11), ЖХМС (Фиг.12) и 1H-ЯМР (Фиг.13, Фиг.14).
[00465] Происхождение IMP4 определяли как происходящее из IMP3, и было обосновано, что IMP3 образовывался либо: (1) в виде продукта гомоприсоединения 1-бром-2-фтор-4-иодбензола (например, реакция Ульмана, для которой обычно требуются стехиометрические количества меди), либо (2) в результате загрязнения 4-бром-3-фторбензолбороновой кислотой в исходной 3-фторфенилбороновой кислоте (Схема 8).
Схема 8
[00466] Когда 1-бром-2-фтор-4-иодбензол обрабатывали при помощи PdCl2(PPh3)2 и NaHCO3 при температуре кипения с обратным холодильником в 1-PrOH и воде, но в отсутствие 3-фторфенилбороновой кислоты (партнер для реакции Сузуки для получения E-3a), IMP3 был образован с высокой конверсией, но продукт не выделяли для подтверждения отдельного выхода (Схема 9).
Схема 9
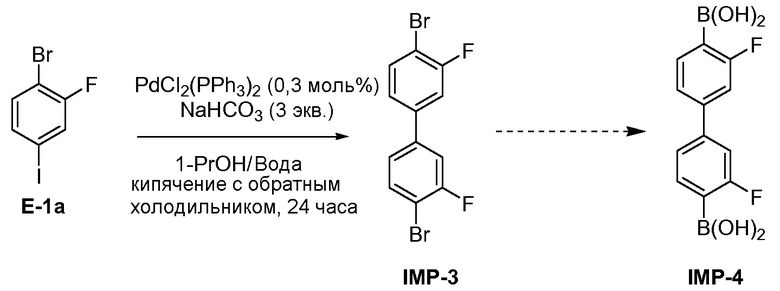
[00467] С качественной точки зрения наблюдали, что реакция Ульмана, в которой образуется IMP3, протекала более медленно, чем соответствующая реакция Сузуки, используемая для получения E-3a. Считают, что меньшее количество катализатора, используемое для реакци Сузуки (от 5 моль% для начально образованных партий до 0,3 моль% для текущего синтеза), в сочетании с разными скоростями реакций для реакций Сузуки и Ульмана в этой процедуре синтеза являются существенными факторами, способствующими получению низких уровней IMP3, а затем IMP4, наблюдаемых в последних партиях.
[00468] IMP4 испытывали на активность ингибирования FAAH. С использованием FAAH анализа, описанного ниже, было определено следующее значение Ki для IMP4: Ki (человек): 14,1 нМ; Ki (крыса): 5,1 нМ.
[00469] Экспрессия и выделение человеческого FAAH. кДНК клон человеческого FAAH (hFAAH) закупали у Origen (Catalog # TC119221, Accession # NM_001441,1). Клон был в Origene pCMV6-XL5 с размером вставки ~ 2,2 т.п.н. Секвенирование клона показало консервативную мутацию K48R. Эта точечная мутация, возможно, представляет собой аллельное расхождение и находится далеко от активного сайта и вряд ли может влиять на активность. Эту плазмиду амплифицировали в E. coli и выделяли путем преципитации.
[00470] Трансфекцию и очистку hFAAH модифицировали, исходя из опубликованных процедур (см. Patricelli et al, Biochemistry (1998) 37:15177-15187; Maurelli et al, FEBS Letters (1995) 377:82-86; Hillard et al, Biochim Biophy Acta. (1995) 1257(3):249-256; и Giang et al, Proc. Natl. Acad. Aci. USA. (1997) 94:2238-2242), и адаптировали для суспензии клеток 293 (Invitrogen, cat# R790-07) для более крупного масштаба. Вкратце, 60 мл 293 клеток культивировали до плотности 1×106 клеток/мл в FreeStyle 293 среде для экспрессии (Invitrogen, Gibco Catalogue # 12338026) [без пенициллина/стрептомицина или фетальной бычьей сыворотки (FBS)] при 37°C с 8% CO2. Трансформирующую ДНК получали путем предварительного смешивания 75 мкг hFAAH 1,2 мл OptiPro SFM (бессывороточная среда) с 75 мкл FreeStyle Max реагента для трансфекции в 1,2 мл OptiPro SFM. Конечные 2,4 мл OptiPro смеси с 75 мкг hFAAH кДНК и 75 мкл FreeStyle Max реагента для трансфекции инкубировали в течение 20 минут и затем добавляли медленно при перемешивании к 60 мл 293 клеточной культуре. Клетки 293 культивировали в течение 2,5 дней после трансфекции, собирали центрифугированием при 5000×g и полученный клеточный осадок после центрифугирования сразу замораживали жидким азотом и хранили при -80°C.
[00471] Замороженные клеточные осадки оттаивали на льду и ресуспендировали в: 12,5 мМ HEPES (pH 8,0), 100 мМ NaCl и 1 мМ EDTA при соотношении 25 мл на грамм клеток. Все последующие стадии осуществляли на льду. Клеточную суспензию гомогенизировали в гомогенизаторе Даунса на 30 ударов и обрабатывали ультразвуком для образования клеточного лизата. Полученный клеточный лизат центрифугировали при 1000×g для осаждения клеточного дебриса. Супернатант удаляли и центрифугировали при 13000×g для образования микросомального мебранного осадка. Супернатант сливали и микросомальный осадок ресуспендировали в 20 мМ HEPES (pH 7,8), 10% об/об глицерина, 1 мМ EDTA и 1% Triton X-100, в течение 1 часа для растворения связанного с мебраной hFAAH. Обогащенный hFAAH препарат очищали с использованием дополнительной стадии центрифугирования при 13000×g для осаждения каких-либо мебранных компонентов. Супернатант содержал солюбилизированный обогащенный hFAAH. Общие концентрации белка определяли с использованием Bio-Rad Protein Assay (Protein Assay Dye Reagent Concentrate, cat# 500-0006)ref5. Образцы разделяли на аликвоты и сразу же замораживали жидким азотом для хранения вплоть до последующего использования.
[00472] Экспрессия и очистка FAAH крысы. FAAH крысы (rFAAH) с делецией N-концевого трансмебраного домена, клонированный, как описано в Patricelli et al. Biochemistry (1998) 37:15177-15187, кодирующий аминокислоты 32-579 и N-концевой His-tag, в настоящей заявке указан как rFAAH. E. coli BL21 (DE3) трансформировали в соответствии с протоколами изготовителя (Invitrogen) и rFAAH экспрессировали и очищали в соответствии с модифицированной процедурой, описанной Patricelli et al, 1998.
[00473] Вкратце, 8 л клеток культивировали до OD600нм 0,6 при 37°C и экспрессию FAAH индуцировали при помощи 1 мМ IPTG, с последующими 4 часами роста. Клетки подвергали центрифугированию при 5000×g для образования клеточной пасты. Клеточную пасту ресуспендировали при соотношении 32 г на 65 мл лизисного буфера [50 мМ Трис pH 8,0, 200 мМ NaCl и 1% н-октоил-β-D-глюкопиранозид (LDAO)] плюс 10 мМ имидазола. Лизозим добавляли до конечной концентрации 1 мг/мл и образец инкубировали на льду в течение 30 минут. Клеточный лизат получали путем обработки ультразвуком с последующим центрифугированием при 17000×g для осаждения клеточного дебриса.
[00474] Растворимый rFAAH очищали из супернатанта с использованием никеля (Ni), гепарина и хроматографических колонок с вытеснением по размеру (SEC). Сначала супернатант добавляли к 10 мл Ni смолы, которая была предварительно уравновешена лизисным буфером. Супернатант инкубировали со смолой в течение 30 минут при постоянном перемешивании. Смолу выливали в 20 мл колонку и неспецифически связанные белки удаляли путем промывки лизисным буфером плюс 20 мМ имидазола. Элюирование rFAAH осуществляли периодически с использованием лизисного буфера плюс 500 мМ имидазола. Пиковые фракции объединяли и загружали на колонку с 20 мл гепарина, предварительно уравновешенную в гепариновом буфере [20 мМ HEPES (pH 7,5), 1 мМ EDTA, 10% глицерина и 0,015% LDAO]. Гепариновую колонку промывали до базовой линии гепариновым буфером плюс 150 мМ NaCl и элюирование rFAAH (32-579aa) осуществляли с использованием линейного градиента от 150 мМ NaCl до 1M NaCl в гепариновом буфере. Объединенные rFAAH (32-579aa) образцы диализовали против SEC буфера (20 мМ EDTA, 1 мМ EDTA, 150 мМ NaCl, 0,015% LDAO, 1 мМ DTT). После диализа rFAAH концентрировали до 10 мг/мл через установку для ультрафильтрации amicon c 30 кДа отсечкой молекулярной массы. Концентрированные образцы загружали на колонку Superdex 200 16/60 SEC (GE catalogue # 17-1069-01), предварительно уравновешенную SEC буфером. Осуществляли изократическое элюирование колонки в SEC буфере, при этом rFAAH элюировал в виде 600 кДа олигомера. Полученные в результате элюирования образцы объединяли, концентрировали до ~5 мг/мл и конечные концентрации rFAAH определяли путем измерения поглощения при 280 нм, с использованием коэффициента экстинкции ε=60850 M-1см-1. Объединенные фракции, содержащие rFAAH, разделяли на аликвоты и сразу же замораживали жидким азотом для хранения вплоть до последующего использования.
[00475] Определение Ki. Ki испытываемого соединения определяли для крысиного и человеческого FAAH путем измерения дозо-зависимого ингибирования гидролиза AMC-арахидоноиламида как значения конечной точки. Анализы осуществляли в 384-луночных микротитровальных планшетах Corning Costar с плоским черным дном (Catalog # 3654) и контролировали в Envision 2100 планшет-ридере (Perkin Elmer-Wallac), с 355 нм (40 нм полоса пропускания) фильтром возбуждения и 460 нм (25 нм полоса пропускания) фильтром эмиссии. Испытываемое соединение серийно разводили 3-кратно в DMSO, из этого разведения 1 мкл добавляли к 24 мкл 2x исходного раствора крысиного или человеческого FAAH и полученную смесь ингибитора фермента инкубировали в течение 30 минут при комнатной температуре. Ферментативную реакцию инициировали путем добавления 25 мкл AMC-арахидоноиламида с получением конечных концентраций rFAAH, hFAAH и субстрата 6 нМ, 108 мкг/мл и 20 мкМ, соответственно. Конечная концентрация DMSO составляла 2%, и концентрация испытываемого соединения изменялась 3-кратно от 12,5 мкМ до 0,21 нМ. Конечную реакционную смесь инкубировали в течение 4 часов при комнатной температуре после добавления субстрата и затем прекращали инкубирование путем добавления 25 мкл ингибитора FAAH CAY 10435 (Cayman Chemical Company, catalog # 10005102) для достижения конечной концентрации 4 мкМ. Аналитические планшеты центрифугировали и затем считывали на планшет-ридере Envision. Дозо-зависимое уменьшение интенсивности флуоресценции относительно концентрации испытываемого соединения подгоняли к Уравнению 1 с получением Ki, где: Fi представляет собой экспериментально определенную интенсивность флуоресценции при данной концентрации испытываемого соединения; Fmax представляет собой теоретическую максимальную интенсивность флуоресценции в отсутствие испытываемого соединения и при концентрации насыщения субстрата, которая была определена методом нелинейной регрессии; и B представляет собой базовый уровень флуоресценции при 100% ингибировании. Концентрацию субстрата (S) ограничивали до 20 мкМ и Km ограничивали экспериментально определенным значением до 9 мкМ как для крысиного, так и для человеческого FAAH. Константа ингибирования Ki была плавающей, и ее определяли методом нелинейной регрессии.
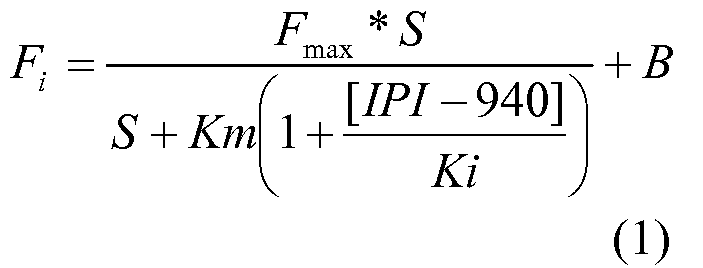
ПРИМЕР 4: ХАРАКТЕРИЗАЦИЯ И СВОЙСТВА ТВЕРДЫХ ФОРМ
A. Общие сведения
XRPD
[00476] Если не указано иное, рентгеновские порошковые дифрактограммы, представленные на Фигурах и в примерах, получали на основании одной из следующих процедур.
1: Inel XRG-3000 Дифрактометр
[00477] Рентгеновские порошковые дифрактограммы получали с использованием Inel XRG-3000 дифрактометра. Падающий луч Cu Kα излучения обеспечивали с использованием трубки с точной фокусировкой и параболического мультислойного зеркала. Перед анализом анализировали силиконовый стандарт (NIST SRM 640c) для выверки положения пика Si 111. Небольшое количество образца упаковывали в тонкостенную стеклянную капиллярную трубку и использовали прерывание луча для минимизации фонового излучения из воздуха. Дифрактограммы получали в трансмиссионной геометрии с использованием программы Windif v. 6.6 и позиционно-чувствительного к искривлению детектора Equinox с 2θ диапазоном 120°.
2: PANalytical EXPERT Pro MPD Дифрактометр
[00478] Рентгеновские порошковые дифрактограммы получали при помощи PANalytical X'Pert PRO MPD дифрактометра с использованием падающего луча Cu излучения, обеспечиваемого дистационным источником Optix с точной фокусировкой. Эллиптическое многослойное зеркало использовали для фокусировки Cu Kα рентгеновских лучей через образец и на детектор. Перед анализом анализировали силиконовый стандарт (NIST SRM 640c) для выверки положения пика Si 111. Небольшое количество образца размещали в виде сэндвичевой конструкции между пленками толщиной 3 мкм и анализировали в трансмиссионной геометрии. Использовали прерывание луча и короткое антирассеивающее удлинение для минимизации фонового излучения, генерируемого воздухом. Использовали щели Соллера для падающего и дифрагированного лучей для минимизации рассеяния от аксиальной дивергенции. Дифрактограммы получали с использованием сканирующего позиционно-чувствительного детектора (X'Celerator), расположенного на расстоянии 240 мм от образца, и программы Data Collector v. 2.2b.
[00479] Для образцов с ограниченным материалом рентгеновскую порошковую дифрактограмму получали при помощи PANalytical X'Pert PRO MPD дифрактометра с использованием падающего луча Cu Kα излучения, обеспечиваемого с использованием дистационного источника с точной фокусировкой и никелевого фильтра. Дифрактометр был сконфигурирован с использованием симметричной системы Bragg-Brentano. Перед анализом анализировали силиконовый стандарт (NIST SRM 640c) для выверки положения пика Si 111. Небольшое количество образца получали в виде тонкого кругового слоя, центрированного на силиконовом субстрате с нулевым фоном. Использовали антирассеивающие щели (SS) для минимизации фонового излучения, генерируемого воздухом. Использовали щели Соллера для падающего и дифрагированного лучей для минимизации рассеяния от аксиальной дивергенции. Дифрактограммы получали с использованием сканирующего позиционно-чувствительного детектора (X'Celerator), расположенного на расстоянии 240 мм от образца, и программы Data Collector v. 2.2b.
3: PANalytical EXPERT Pro MPD дифрактометр (изменяющаяся температура/анализ влажности)
[00480] Рентгеновскую порошковую дифрактограмму получали при помощи PANalytical X'Pert PRO MPD дифрактометра с использованием падающего луча Cu Kα излучения, обеспечиваемого с использованием дистационного источника с точной фокусировкой и никелевого фильтра. Дифрактометр был сконфигурирован с использованием симметричной системы Bragg-Brentano. Данные собирали и анализировали, перед анализом анализировали силиконовый стандарт (NIST SRM 640c) для выверки положения пика Si 111. Небольшое количество образца упаковывали в медную ячейку с никелевым покрытием. Использовали антирассеивающие щели (SS) для минимизации фонового излучения, генерируемого воздухом. Использовали щели Соллера для падающего и дифрагированного лучей для минимизации рассеяния от аксиальной дивергенции. Дифрактограммы получали с использованием сканирующего позиционно-чувствительного детектора (X'Celerator), расположенного на расстоянии 240 мм от образца, и программы Data Collector v. 2.2b. Использовали камеру Энтона Паара с контролем температуры-влажности (THC) для получения in-situ рентгеновских порошковых дифрактограмм как функции влажности и температуры. Образец нагревали с использованием термоэлектрического устройства Пельтье, расположенного непосредственно под держателем образца и температуру контролировали при помощи платинового 100 термометра сопротивления, расположенного непосредственно под образцом. Осуществляли подачу электроэнергии к нагревателю и контролировали с использованием устройства Anton Paar TCU 50, соединенного с устройством сбора данных. Для создания атмосферы влажности использовали устройство RH-200 от компании VTI Inc. с использованием потока газообразного азота. Влажность и температуру контролировали при помощи HygroClip сенсора, изготовленного компанией Rotronic, расположенного в непосредственной близости от образца внутри THC.
Дифференциальная сканирующая калориметрия (ДСК)
[00481] Если не указано иное, данные ДСК, представленные на фигурах и в примерах, получали на основании следующих процедур.
[00482] ДСК осуществляли с использованием дифференциального сканирующего калориметра TA Instruments Q2000. Калибровку температуры осуществляли с использованием NIST отслеживаемого металлического индия. Образец помещали в алюминиевую чашу для ДСК, закрывали крышкой и точно определяли массу. Взвешенную алюминиевую чашу, сконфигурированную как чашу с образцом, размещали на контрольной стороне камеры.
1D 1 Н ЯМР Спектроскопия в растворе
[00483] Если не указано иное, ЯМР спектры в растворе, представленные на фигурах и в примерах, получали на основании следующих процедур. Образцы получали путем растворения приблизительно 4-10 мг образца в CDCl3, содержащем TMS. Спектры затем получали с использованием спектрометра Varian UNITY INOVA-400.
Термогравиметрия (TGA)
[00484] Если не указано иное, TGA термограммы, представленные на фигурах и в примерах, получали на основании следующих процедур. TG анализы осуществляли с использованием термогравиметрического анализатора TA Instruments Q5000 IR. Калибровку температуры осуществляли с использованием никеля и Alumel™. Каждый образец помещали в алюминиевую чашу. Образец герметично закрывали, крышку прокалывали, затем помещали в TG печь. Печь нагревали в атмосфере азота.
B. ОТБОР ПОЛИМОРФОВ СОЕДИНЕНИЯ 1
[00485] Соединение 1 подвергали различным условиям кристаллизации. Использовали следующие процедуры.
Краш-преципитация
[00486] Растворы Соединения 1 получали в различных растворителях и фильтровали через 0,2-мкм найлоновый фильтр. Аликвоты различных антирастворителей добавляли при перемешивании до тех пор, пока не происходило осаждение. Твердые вещества собирали вакуумным фильтрованием или путем декантирования жидкой фазы, давая твердым частицам высохнуть в условиях окружающей среды или под потоком газообразного азота.
Быстрое испарение
[00487] Растворы Соединения 1 получали в различных растворителях, в которых образцы обрабатывали ультразвуком с добавлением растворителя. Как только достигали полного растворения смеси, что оценивали путем визуального наблюдения, раствор фильтровали через 0,2-мкм найлоновый фильтр. Раствор оставляли для испарения из открытого флакона в условиях окружающей среды. Растворам давали испариться досуха, если только не требовалось частичное испарение (твердое вещество присутствует с небольшим количеством оставшегося растворителя), в этом случае твердые вещества выделяли вакуумным фильтрованием или путем декантирования жидкой фазы, давая твердым частицам высохнуть в условиях окружающей среды или под потоком газообразного азота.
Медленное охлаждение
[00488] Насыщенные растворы Соединения 1 получали в различных растворителях при повышенной температуре и фильтровали теплыми через 0,2-мкм найлоновый фильтр в теплый флакон. Флакон закрывали крышкой и оставляли на горячей плите и горячую плиту выключали, давая образцу медленно охладиться до температуры окружающей среды. Если после охлаждения до температуры окружающей среды присутствовало мало или вообще не присутствовало никаких твердых частиц, образец помещали в холодильник (приблизительно 2-8°C) для дальнейшего охлаждения. Твердые вещества собирали вакуумным фильтрованием или путем декантирования жидкой фазы, давая твердым частицам высохнуть в условиях окружающей среды или под потоком газообразного азота.
Медленное испарение
[00489] Растворы Соединения 1. Как только достигали полного растворения смеси, что оценивали путем визуального наблюдения, раствор фильтровали через 0,2-мкм найлоновый фильтр. Раствор оставляли для испарения в условиях окружающей среды из флакона, закрытого алюминиевой фольгой с перфорацией в виде булавочных отверстий (или в некоторых случаях неплотно закрытый флакон). Растворам давали испариться досуха, если только не требовалось частичное медленное испарение (твердое вещество присутствует с небольшим количеством оставшегося растворителя), в этом случае твердые вещества выделяли вакуумным фильтрованием или путем декантирования жидкой фазы, давая твердым частицам высохнуть в условиях окружающей среды или под потоком газообразного азота.
Суспендирование
[00490] Растворы Соединения 1 получали путем добавления достаточного количества твердых веществ к данному растворителю в условиях окружающей среды так, чтобы присутствовали нерастворенные твердые частицы. Смесь затем помещали на орбительный вибростенд в герметично закрытом флаконе при температуре окружающей среды на продолжительный период времени, типично приблизительно на 1 неделю. Твердые вещества собирали вакуумным фильтрованием или путем декантирования жидкой фазы, давая твердым частицам высохнуть в условиях окружающей среды или под потоком газообразного азота.
Диффузия из паровой фазы
[00491] Концентрированные растворы Соединения 1 получали в различных растворителях и фильтровали через 0,2-мкм найлоновый фильтр. Отфильтрованный раствор распределяли в флакон емкостью 1 драхма (3,55 мл), который затем помещали внутрь 20-мл флакона, содержащего антирастворитель. 1-драхмовый флакон оставляли незакрытым, а 20-мл флакон закрывали крышкой для осуществления диффузии из паровой фазы. Твердые вещества собирали вакуумным фильтрованием или путем декантирования жидкой фазы, давая твердым частицам высохнуть в условиях окружающей среды или под потоком газообразного азота.
система растворителей
13 дней
агломерированные пластины, двоякопреломляющие (PS)
кристаллы, прямоугольные пластины и агломераты, двоякопреломляющие (PS)
прямоугольные пластины неизвестной морфологии и дендритные образования, двоякопреломляющие (PS)
(PS)
PO
1 день
пластины и агломераты, двоякопреломляющие (PS)
С. ЭКСПЕРИМЕНТЫ ПО ОПРЕДЕЛЕНИЮ СТОЙКОСТИ К НАГРУЗКАМ, ФОРМА А, СОЕДИНЕНИЕ 1
[00492] Форму А, кристаллическую форму Соединения 1, подвергали испытаниям в (1) экспериментах с механическими нагрузками и (2) экспериментах в стрессовых условиях относительной влажности, где вещество подвергали воздействию разных уровней относительной влажности (R.H.) и температуре. Было определено, что Форма А является влагостойкой при 75% и 97% R.H. при комнатной температуре в течение 7 дней, и при 75% R.H. при около 40°С в течение 7 дней. Результаты обобщенно представлены в таблице ниже.
система растворителей
влажности, комнатная температура
D. ОПРЕДЕЛЕНИЕ СТРУКТУРЫ МОНОКРИСТАЛЛА, ФОРМЫ А, СОЕДИНЕНИЯ 1
[00493] Анализ монокристалла осуществляли на Форме А Соединения 1. Структуру определяли методом рентгеновской дифракции на монокристалле. В общем, структуру монокристалла определяли для подтверждения молекулярной структуры. Структура была определена как безводная кристаллическая форма. Кристаллическая структура состояла из одной молекулы в виде асимметрической элементарной ячейки. Все пики на экспериментальных диаграммах представлены в расчетной рентгеновской порошковой дифрактограмме, показывающей, что основное вещество, по-видимому, является однофазным.
Описание эксперимента
Подготовка образца
[00494] Соединение 1 растворяли в 50:50 смеси ацетона и воды при перемешивании при 51°С. Затем раствор подвергали горячему фильтрованию в теплый флакон, закрывали крышкой и оставляли на горячей плите, которую затем выключали, давая образцу медленно охладиться до температуры окружающей среды. После выстаивания при температуре окружающей среды в течение 1 дня кристаллы собирали.
Сбор данных
[00495] Бесцветную пластину C12H9BF2O2, имеющую размеры приблизительно 0,20×0,20×0,04 мм, закрепляли на волоконном держателе в произвольной ориентации. Предварительное исследование и сбор данных осуществляли с использованием Cu Kα излучения (λ=1,54184 Ǻ) на дифрактометре Rigaku Rapid II, снабженном конфокальной оптикой. Уточнения структуры осуществляли на LINUX PC с использованием SHELX 97. Sheldrick, G.M. Acta Cryst., 2008, A64, 112.
[00496] Постоянные элементов и ориентационную матрицу для сбора данных получали из уточнения методом наименьших квадратов с использованием установочных углов 11613 отражений в диапазоне 7°<θ<66°. Уточненная мозаичность по данным CrystalClear составляет 0,72°, указывая на средние свойства кристалла. CrystalClear: An Integrated Program for the Collection and Processing of Area Detector Data, Rigaku Corporation, © 1997-2002. Пространственную группу определяли с использованием программы XPREP. Bruker, XPREP in SHELXTL v. 6.12., Bruker AXS Inc., Madison, WI, USA, 2002. Исходя из систематического присутствия следующих условий: h0l l=2n; 0k0 k=2n, и из последующего уточнения методом наименьших квадратов, пространственную группу определяли как Р21/с (no.14). Данные собирали до максимального 2θ значения 133,18°, при температуре 150±1 К.
Обработка данных
[00497] Каркасные структуры интегрировали с использованием CrystalClear. В целом, было собрано 11613 отображений, из которых 1786 были уникальными. Для обработки данных использовали поправку Лоренца и поправку на поляризацию. Линейный коэффициент поглощения составлял 1,041 мм-1 для Cu Kα излучения. Вводили эмпирическую поправку на поглощение с использованием CrystalClear. Коэффициенты пропускания находились в пределах от 0,743 до 0,959. Вводили вторичную поправку на поглощение. Scheldrik, G.M. Acta Cryst., 2008, A64, 112. Конечный коэффициент, уточненный методом наименьших квадратов, составил 0,0063000 (в абсолютных единицах). Интенсивности эквивалентных реакций усредняли. Согласованный коэффициент усреднения составлял 3,84% в расчете на интенсивность.
Разрешение и уточнение структуры
[00498] Разрешение структуры осуществляли прямыми методами с использованием SIR2004. Burla, M.C., Caliandro, R., Camalli, M., Carrozzini, B., Cascarano, G.L., De Caro, L., Giacovazzo, C., Polidori, G., and Spagna, R., J.Appl.Cryst. 2005, 38, 381. Остальные атомы размещали в порядке разности Фурье-синтезов. Атомы водорода были включены в уточнение, но ограничены размещением по атому, с которым они связаны. Структуру уточняли с использованием методов полной матрицы и наименьших квадратов путем минимизации функции:
[00499] 
[00500] Массу w определяли как 1/[σ 2(F o 2)+(0,0702Р)2+(0,0000Р)], где Р=(F o 2 + 2F c 2)/3.
[00501] Коэффициенты рассеяния брали из “International Tables for Crystallography”. International Tables for Crystallography, Vol. C, Kluwer Academic Publishers: Dordrecht, The Netherlands, 1992, Tables 4.2.6.8 and 6.1.1.4. Из 1786 отражений, используемых в уточнениях, только отражения с F o 2>2σ(F o 2) использовали для расчета R. В целом, для расчетов использовали 1378 отражений. Конечный цикл уточнений включал 163 изменяющихся параметра и сходился (наибольший сдвиг параметра составлял <0,01 от его расчетного стандартного отклонения) с невзвешенными и средневзвешенными согласованными коэффициентами:
[00502] 
[00503] 
[00504] Стандартное отклонение наблюдаемой удельной массы (степень согласия) составляло 1,123. Наивысший пик в конечном расхождении Фурье имел высоту 0,23 е/Ǻ3. Минимальный отрицательный пик имел высоту -0,27 е/Ǻ3.
Расчетная рентгеновская порошковая дифрактограмма (XRPD)
[00505] Расчетную XRPD получали для Cu излучения с использованием PowderCell 2.3 и атомных координат, пространственной группы и параметров элементарной ячейки из данных для монокристалла. PowderCell for Windows Version 2.3 Kraus, W.; Nolze, G. Federal Institute for Materials Research and Testing, Berlin Germany, EU, 1999. Поскольку данные для монокристалла собирали при низких температурах (150 К), возможны некоторые отклонения между расчетной и экспериментальной рентгеновской порошковой дифрактограммой.
Диаграммы ORTEP и упаковки
[00506] ORTEP диаграмму получали с использованием ORTEP III (Johnson, C.K., ORTEPIII, Report ORNL-6895, Oak Ridge National Laboratory, TN, U.S.A. 1996. OPTEP-3 for Windows V1.05, Farrugia, L.J., J.Appl.Cryst. 1997, 30, 565.) программы в рамках пакета программ PLATON (Spek, A.L. PLATON. Molecular Graphics Program. Utrecht University, Utrecht, The Netherlands, 2008. Spek, A.L., J.Appl.Cryst. 2003, 36, 7). Атомы представлены с 50% вероятностью анизотропными термическими эллипсоидами. Диаграммы упаковки получали с использованием программы моделирования CAMERON 9[i]. Дополнительные изображения получали с использованием пакета программ PLATON и с использованием пакета программ визуализации Mercury 2.3 (Macrae, C.F.Edgington, P.R.McCabe, P.Pidcock, E.Shields, G.P.Taylor, R.Towler M. and van de Streek, J.; J.Appl.Cryst., 2006, 39, 453-457). Водородные связи представлены пунктирными линиями.
Рентгеновская порошковая дифрактограмма (XRPD)
[00507] Анализы методом рентгеновской порошковой дифракции (XRPD) осуществляли с использованием дифрактометра Inel XRG-3000, снабженного CPS(позиционно-чувствительным к искривлению) детектором с 2θ диапазоном 120°. Данные в режиме реального времени собирали с использованием Cu Kα излучения, начиная приблизительно 4 °2θ при разрешении 0,03 °2θ. Для трубки устанавливали напряжение и силу тока 40 кВ и 30 мА, соответственно. Щель монохроматора была установлена 5 мм на 160 мкм. Изображение выводили на экран дисплея из 2,5-40 °2θ. Образцы подготавливали для анализа, упаковывая их в тонкостенные стеклянные капиллярные трубки. Каждую капиллярную трубку закрепляли на гониометрической головке, которую контролировали для возможности центрифугирования капиллярной трубки в процессе сбора данных. Образцы анализировали в течение 300 секунд. Калибровку оборудования осуществляли с использованием силиконового стандарта. Экспериментальную XRPD получали в SSCI, подразделении Aptuit, в соответствии с cGMP спецификациями.
Результаты
[00508] Параметры моноклинной ячейки и расчетный объем были следующими: a=5,44850(10)Ǻ, b=5,16460(10)Ǻ, c=36,124(3)Ǻ, α=90,00°, β=90,490(6)°, γ=90,00°, V=1016,48(8)Ǻ3. Молекулярная масса асимметрической элементарной ячейки в кристаллической структуре Соединения 1 составляет 234,01 г моль-1 с Z=4, что дает расчетную плотность 1,529 г см-3. Пространственная группа была определена как Р21/с. Обобщенные данные, относящиеся к характеристикам кристалла и сбору данных кристаллографических параметров, представлены в таблице ниже.
1/[σ
2(F
o 2)+(0,0702Р)2+(0,0000Р)], где Р=(F
o 2+2F
c 2)/3
[00509] Качество структуры показано при помощи R-значения 0,042 (4,2%).
[00510] ORTEP изображение представлено на Фиг.20. Одна из фенильных групп повернута на 180 градусов от показанной на рисунке молекулы. Асимметрическая элементарная ячейка, показанная на Фиг.20, содержит одну молекулу Соединения 1.
[00511] Диаграммы упаковки, представляющие изображение вдоль a, b и c кристаллографических осей, представлены на Фиг.24-26, соответственно. Водородная связь между смежными группами бороновой кислоты создает бесконечные одномерные цепи, которые проходят вдоль b оси, как показано на Фиг.21. Не желая ограничиваться какой-либо теорией, это обычно наблюдаемая конфигурация водородной связи между Ph-B-(OH)2 группами. Цепи проходят параллельно друг другу в приблизительной (106) плоскости.
[00512] На Фиг.22 представлена расчетная XRPD Соединения 1, полученная на основании данных для монокристалла. Экспериментальная XRPD Соединения 1 представлена на Фиг.23. Фиг.27 показывает сравнение расчетной XRPD с экспериментальной XRPD Соединения 1. Все пики в экспериментальных дифрактограммах представлены в расчетной XRPD, подтверждая однофазное вещество. Полученная ранее элементарная ячейка из XRPD индексирования экспериментальной XRPD находится в соответствии с элементарной ячейкой монокристалла, что может указывать на такую же кристаллическую форму.
[00513] Различия в интенсивностях между расчетной и экспериментальной рентгеновскими порошковыми дифрактограммами может быть из-за предпочтительной ориентации. Предпочтительная ориентация, в некоторых вариантах воплощения, может быть определена как тенденция для кристаллов, в некоторых случаях пластинчатых или игольчатых, выравниваться в некоторой степени по порядку. Эта предпочтительная ориентация образца, в некоторых вариантах воплощения, может существенно изменять интенсивности пиков, но не положения пиков, в экспериментальной рентгеновской порошковой дифрактограмме. Не желая ограничиваться какой-либо теорией, может быть некоторый небольшой сдвиг в положении пика между расчетной и экспериментальной рентгеновскими порошковыми дифрактограмми, поскольку экспериментальную рентгеновскую порошковую дифрактограмму получали при температуре окружающей среды, а данные для монокристалла получали при 150 К.
[00514] Обобщая вышесказанное, структура монокристалла была подтверждена как безводная кристаллическая форма. Структура кристалла состояла из одной молекулы Соединения 1 в асимметрической элементарной ячейке. Все пики в экспериментальных дифрактограммах представлены в расчетной XRPD, указывая на то, что вещество, по видимому, является однофазным.
[00515] Таблицы, включающие позиционные параметры и их расчетные стандартные отклонения, анизотропные температурные коэффициенты, длину связей, углы связей, водородные связи и углы и торсионные углы, представлены ниже.
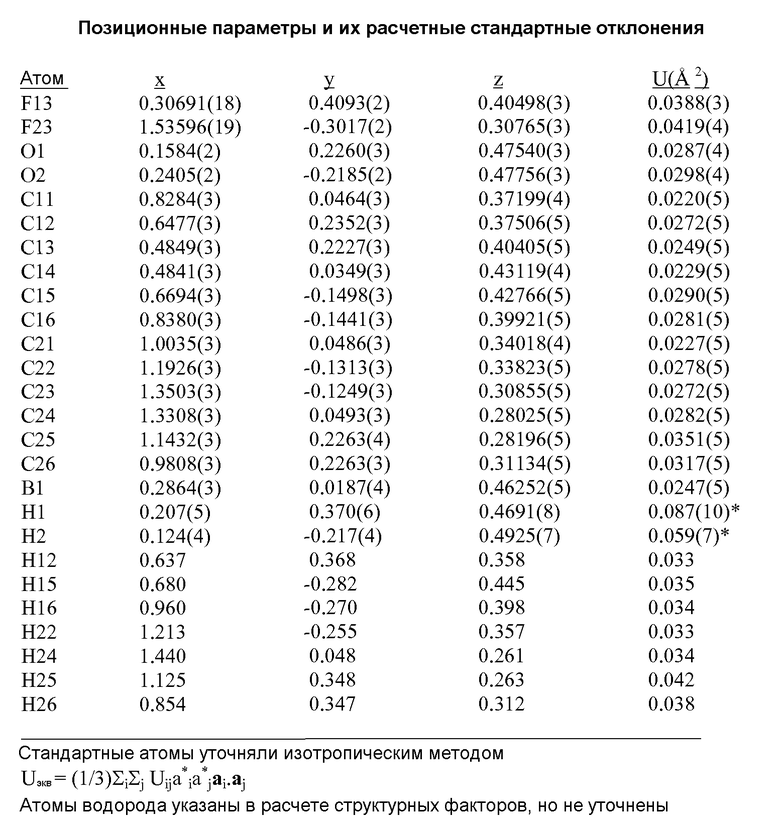

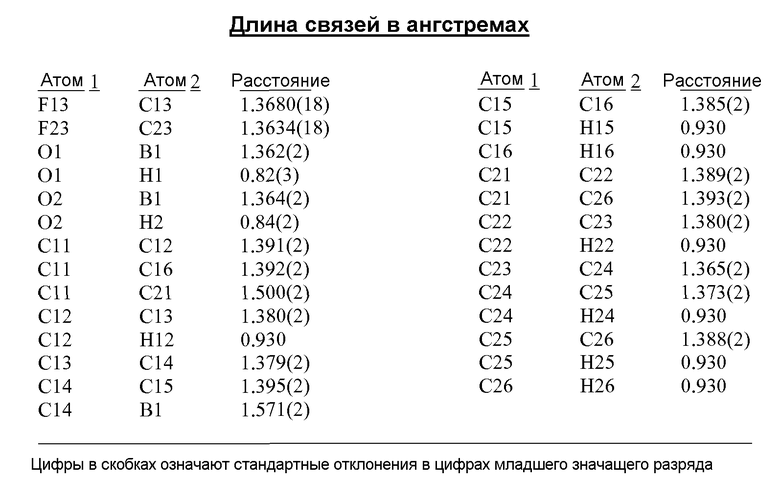
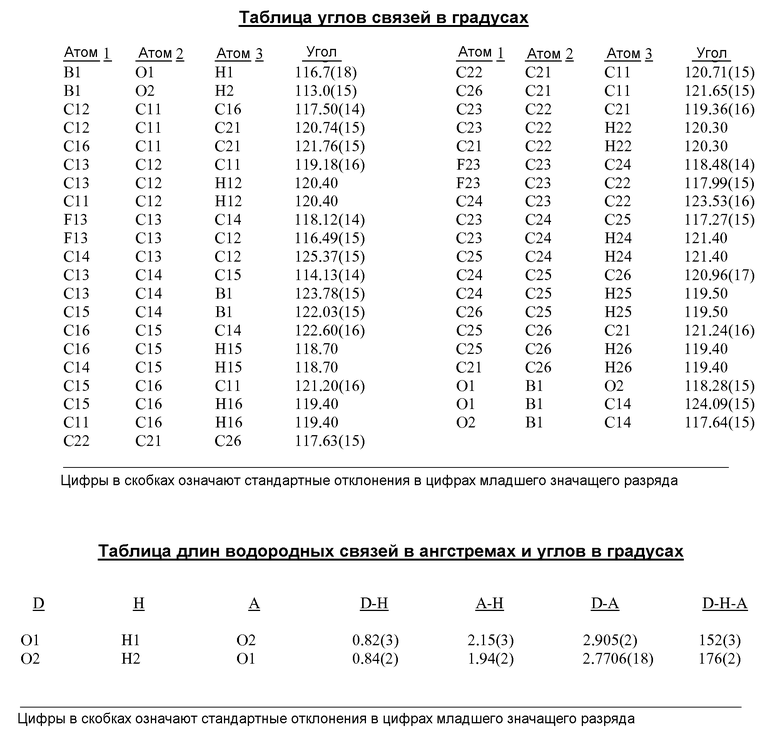


Е. ХАРАКТЕРИЗАЦИЯ СОЕДИНЕНИЯ 2, ФОРМЫ I
XRPD анализ
[00516] Рентгеновские порошковые дифрактограммы получали при помощи PANalytical X'Pert PRO MPD дифрактометра с использованием падающего луча Cu излучения, обеспечиваемого дистационным источником Optix с точной фокусировкой. Эллиптическое многослойное зеркало использовали для фокусировки Cu Kα рентгеновских лучей через образец и на детектор. Перед осуществлением анализа анализировали силиконовый стандарт (NIST SRM 640c) для выверки положения пика Si 111. Небольшое количество образца размещали в виде сэндвичевой конструкции между пленками толщиной 3 мкм и анализировали в трансмиссионной геометрии. Использовали прерывание луча и короткое антирассеивающее удлинение для минимизации фонового излучения, генерируемого воздухом. Использовали щели Соллера для падающего и дифрагированного лучей для минимизации рассеяния от аксиальной дивергенции. Дифрактограммы получали с использованием сканирующего позиционно-чувствительного детектора (X'Celerator), расположенного на расстоянии 240 мм от образца, и программы Data Collector v. 2.2b. Параметры сбора данных для каждой дифрактограммы представлены выше в разделе “Сбор данных” настоящего сообщения, включая щель дивергенции (DS) перед зеркалом и антирассеивающую щель для падающего луча (SS).
[00517] XRPD индексировали с использованием X'Pert High Score Plus 2.2a (2.2.1).
[00518] XRPD получали с использованием Inel XRG-3000 дифрактометра. Падающий луч Cu Kα излучения обеспечивали с использованием трубки с точной фокусировкой и параболического мультислойного зеркала. Перед осуществлением анализа анализировали силиконовый стандарт (NIST SRM 640c) для выверки положения пика Si 111. Небольшое количество образца упаковывали в тонкостенную стеклянную капиллярную трубку и использовали прерывание луча для минимизации фонового излучения из воздуха. Дифрактограммы получали в трансмиссионной геометрии с использованием программы Windif v. 6.6 и позиционно-чувствительного к искривлению детектора Equinox с 2θ диапазоном 120°.
[00519] XRPD высокого разрешения (Panalytical) Соединения 2 индексировали, и результат представлен на Фиг.28. Объем ячейки, полученный из индексированного решения, согласуется с тремя мономерами в асимметрической элементарной ячейке.
[00520] INEL XRPD дифрактограмма представлена на Фиг.29.
Протонный ЯМР анализ
[00521] ЯМР спектры в растворе получали с использованием спектрометра Varian UNITY INOVA-400. Образцы подготавливали путем растворения приблизительно 4-10 мг образца в CDCl3, содержащем TMS.
[00522] Полученный спектр подтверждал присутствие Соединения 2, а также Соединения 1. Соединение 1 и Соединение 2 различимы посредством протонного ЯМР на основании присутствия или отсутствия гидроксильных протонов при приблизительно 5,1 м.д. в дейтерированном хлороформе. Не будучи связанным какой-либо теорией, небольшое количество воды может присутствовать в ЯМР растворителе, и эта вода может прореагировать с Соединением 2 в ЯМР образце, с образованием, таким образом, Соединения 1. Спектр протонного ЯМР представлен на Фиг.30.
F. ХАРАКТЕРИЗАЦИЯ СОЕДИНЕНИЯ 1 ВЕЩЕСТВА В
[00523] Иллюстративные XRPD Вещества В представлены на Фиг.19В, 32 и 35.
[00524] Иллюстративные TGA и DSC термограммы Вещества В представлены на Фиг.34. TGA показывает потерю массы приблизительно 10% от 25 до 130°С.
G. ИСПЫТАНИЯ КОНВЕРСИИ ВЕЩЕСТВО В/ФОРМА А(СОЕДИНЕНИЕ 1)
Стрессовые условия относительной влажности
[00525] Смесь Формы А и Вещества В подвергали условиям 97% относительной влажности в течение одной недели. Конверсию этой смеси до Вещества В наблюдали через одну неделю. В другом эксперименте было обнаружено, что Вещество В преобразуется в смесь Вещества В и Формы А всего за 1 день при приблизительно 75% относительной влажности и 41°С. Такую же смесь (с постоянным отношением Вещества В к Форме А на основании относительных XRPD интенсивностей) наблюдали через 4, 7 и 14 дней в таких же условиях.
Испытания взаимного превращения
[00526] Насыщенный раствор Соединения 1, Формы А, получали путем добавления достаточного количества твердых веществ к данной системе растворителей в условиях окружающей среды так, чтобы присутствовали нерастворенные твердые частицы. Смесь затем оставляли для перемешивания в герметично закрытом флаконе при температуре окружающей среды в течение 3 дней для обеспечения насыщения. Твердые вещества из смеси Формы А и Вещества В добавляли к аликвотам насыщенного раствора (фильтровали через 0,2-мкм найлоновый фильтр) так, чтобы присутствовали нерастворенные твердые частицы. Смесь затем оставляли для перемешивания в герметично закрытом флаконе при температуре окружающей среды на продолжительный период времени. Твердые вещества выделяли вакуумным фильтрованием и анализировали. Форму А наблюдали при помощи XRPD.
ЭКВИВАЛЕНТЫ
[00527] Конкретные примеры, представленные выше, являются исключительно иллюстративными, а не ограничивающими. Хотя представлен ряд вариантов воплощения настоящего изобретения, очевидно, что основное раскрытие может быть изменено для обеспечения других вариантов воплощения с использованием соединений и способов по настоящему изобретению. Поэтому должно быть понятно, что объем настоящего изобретения должен определяться прилагаемой формулой изобретения, а не конкретными вариантами воплощения, которые представлены в качестве примера.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ КРИСТАЛЛИЧЕСКИЕ ФОРМЫ НАТРИЕВОЙ СОЛИ(4-{ 4-[5-(6-ТРИФТОРМЕТИЛ-ПИРИДИН-3-ИЛАМИНО) ПИРИДИН-2-ИЛ] ФЕНИЛ} ЦИКЛОГЕКСИЛ) УКСУСНОЙ КИСЛОТЫ | 2011 |
|
RU2612556C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ (R)-5-[3-ХЛОР-4-(2, 3-ДИГИДРОКСИПРОПОКСИ)БЕНЗ[Z]ИЛИДЕН]-2-([Z]-ПРОПИЛИМИНО)-3-о-ТОЛИЛТИАЗОЛИДИН-4-ОНА | 2009 |
|
RU2519548C2 |
| ИНГИБИТОРЫ FAAH ПЕРИФЕРИЧЕСКИ-ОГРАНИЧЕННОГО ДЕЙСТВИЯ | 2011 |
|
RU2583435C2 |
| ТВЕРДЫЕ ФОРМЫ 3-(5-АМИНО-2-МЕТИЛ-4-ОКСО-4Н-ХИНАЗОЛИН-3-ИЛ)ПИПЕРИДИН-2, 6-ДИОНА И ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ПРИМЕНЕНИЕ | 2012 |
|
RU2611007C2 |
| ИЗОКСАЗОЛИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ АМИДГИДРОЛАЗЫ ЖИРНЫХ КИСЛОТ | 2010 |
|
RU2539595C2 |
| ФЕНИЛКАРБАМАТЫ И ИХ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА ГИДРОЛАЗЫ АМИДОВ ЖИРНЫХ КИСЛОТ (FAAH) И МОДУЛЯТОРОВ D3 ДОПАМИНОВОГО РЕЦЕПТОРА (D3DR) | 2014 |
|
RU2693457C2 |
| СПОСОБ ПОЛУЧЕНИЯ МОДУЛЯТОРОВ РЕГУЛЯТОРА ТРАНСМЕМБРАННОЙ ПРОВОДИМОСТИ КИСТОЗНОГО ФИБРОЗА | 2010 |
|
RU2553989C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ { [1-ЦИАНО-5-(4-ХЛОРОФЕНОКСИ)-4-ГИДРОКСИИЗОХИНОЛИН-3-КАРБОНИЛ]-АМИНО} -УКСУСНОЙ КИСЛОТЫ | 2014 |
|
RU2666144C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА АНАЛОГА Y-АМИНОМАСЛЯНОЙ КИСЛОТЫ | 2004 |
|
RU2412162C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ, СОЛИ И ПОЛИМОРФЫ ТРАНСНОРСЕРТРАЛИНА И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2578956C2 |
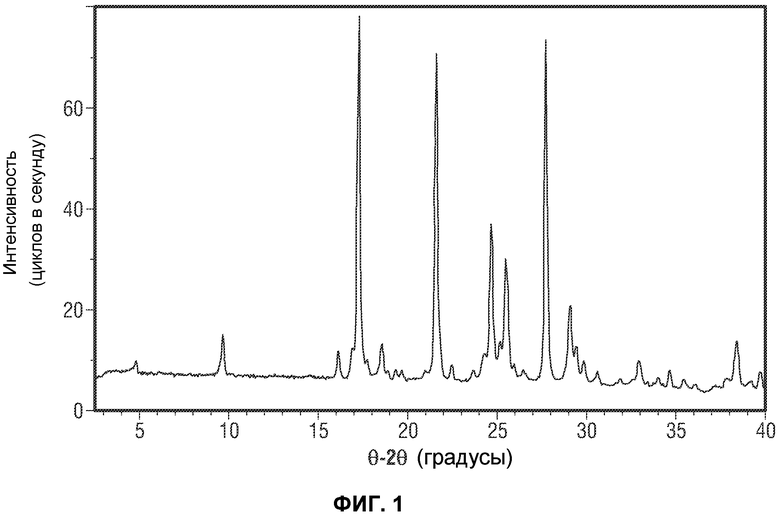
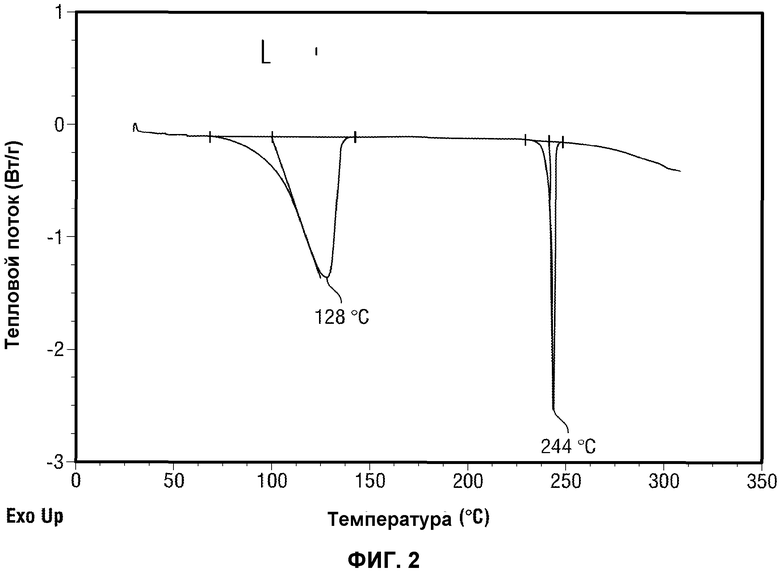
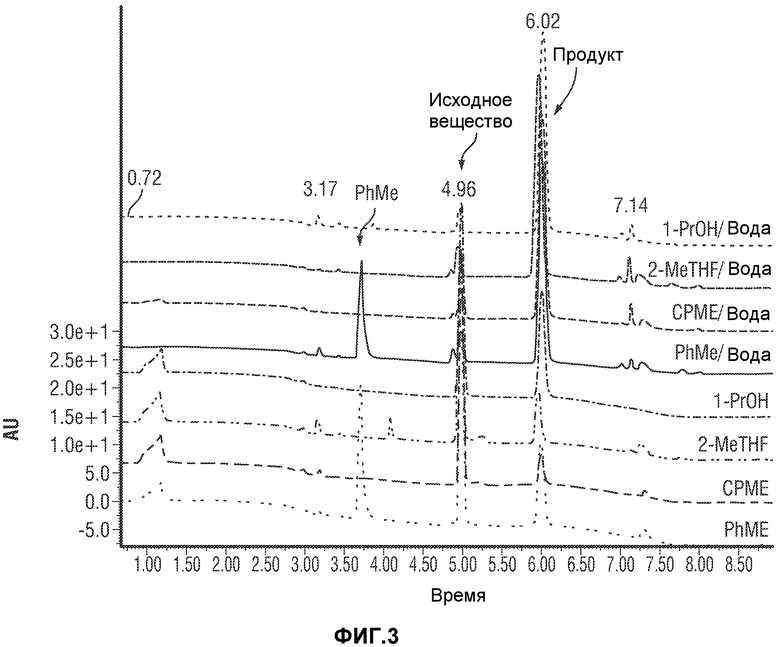
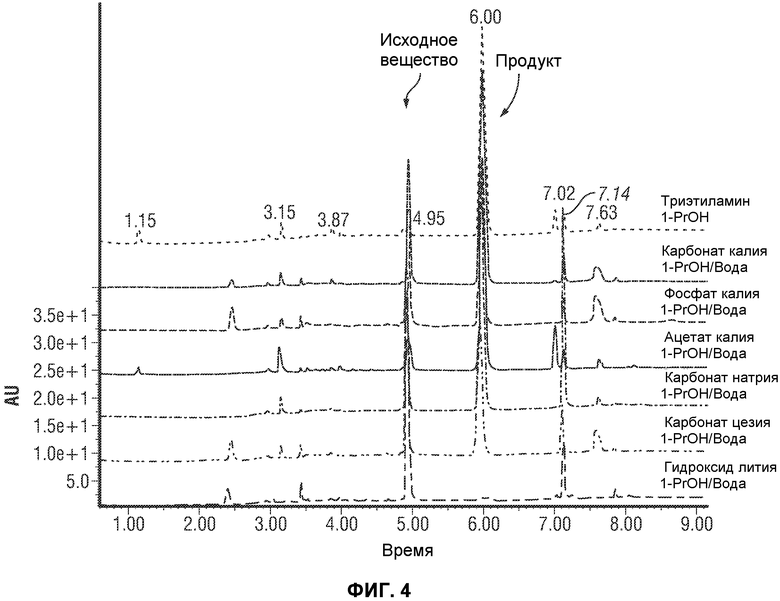
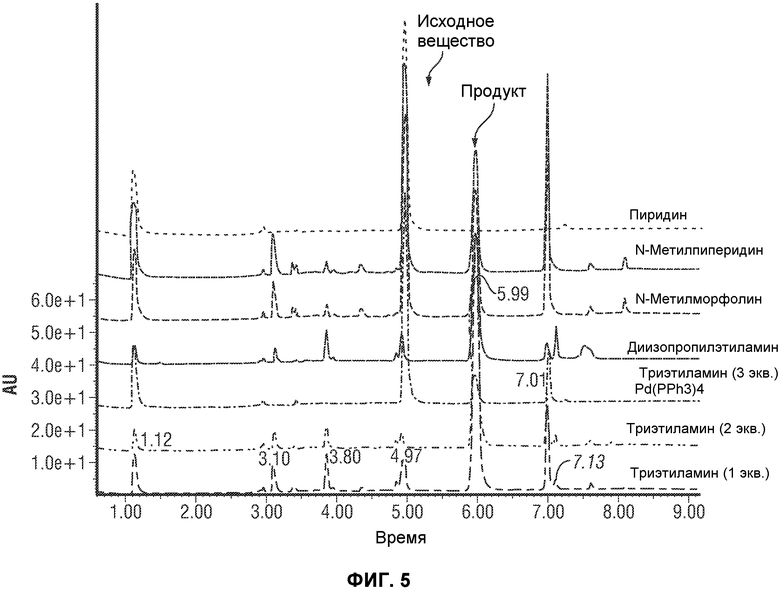
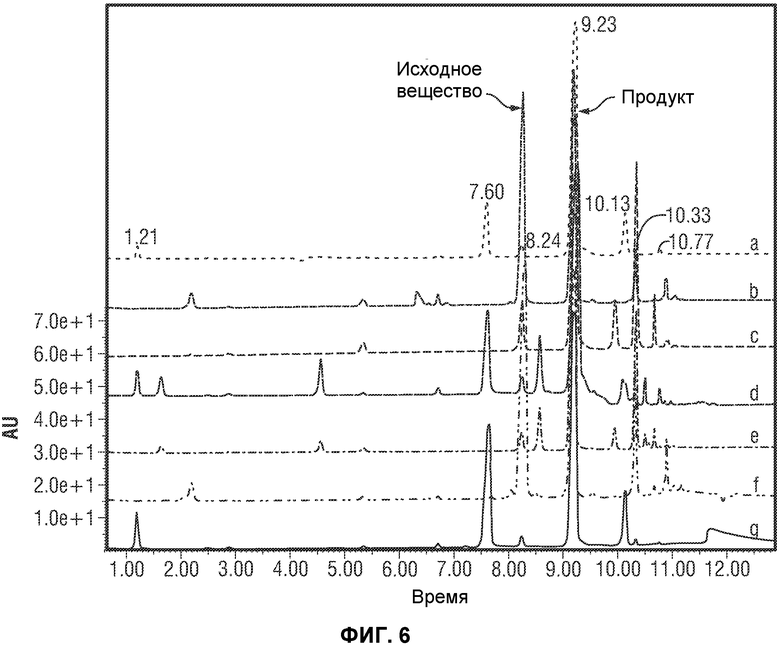
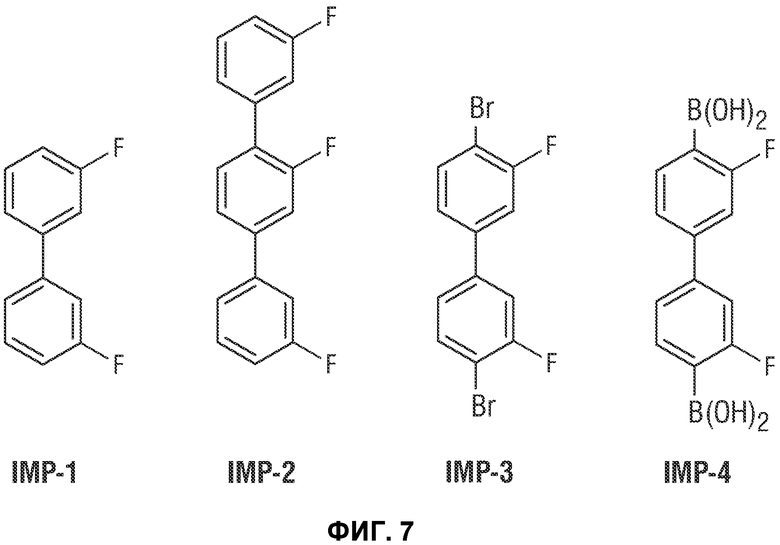
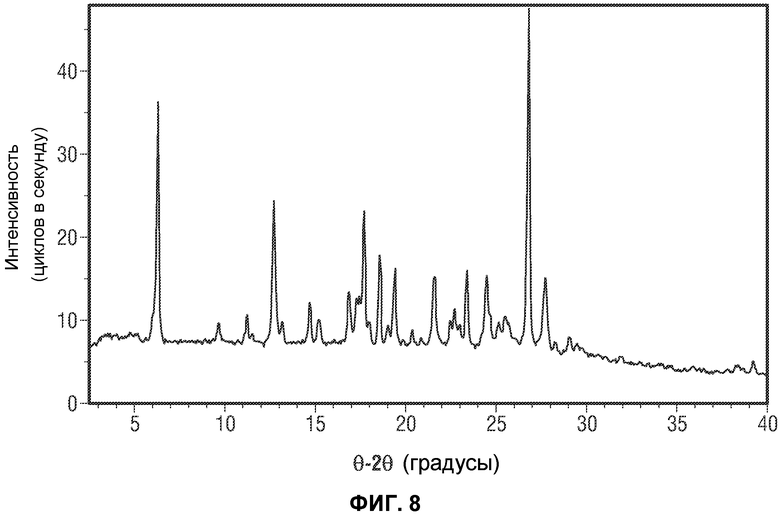

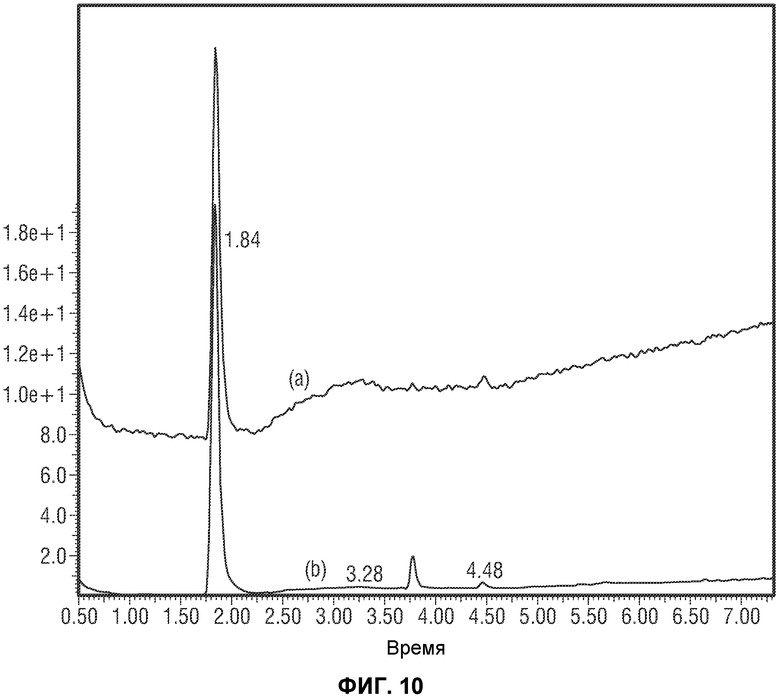
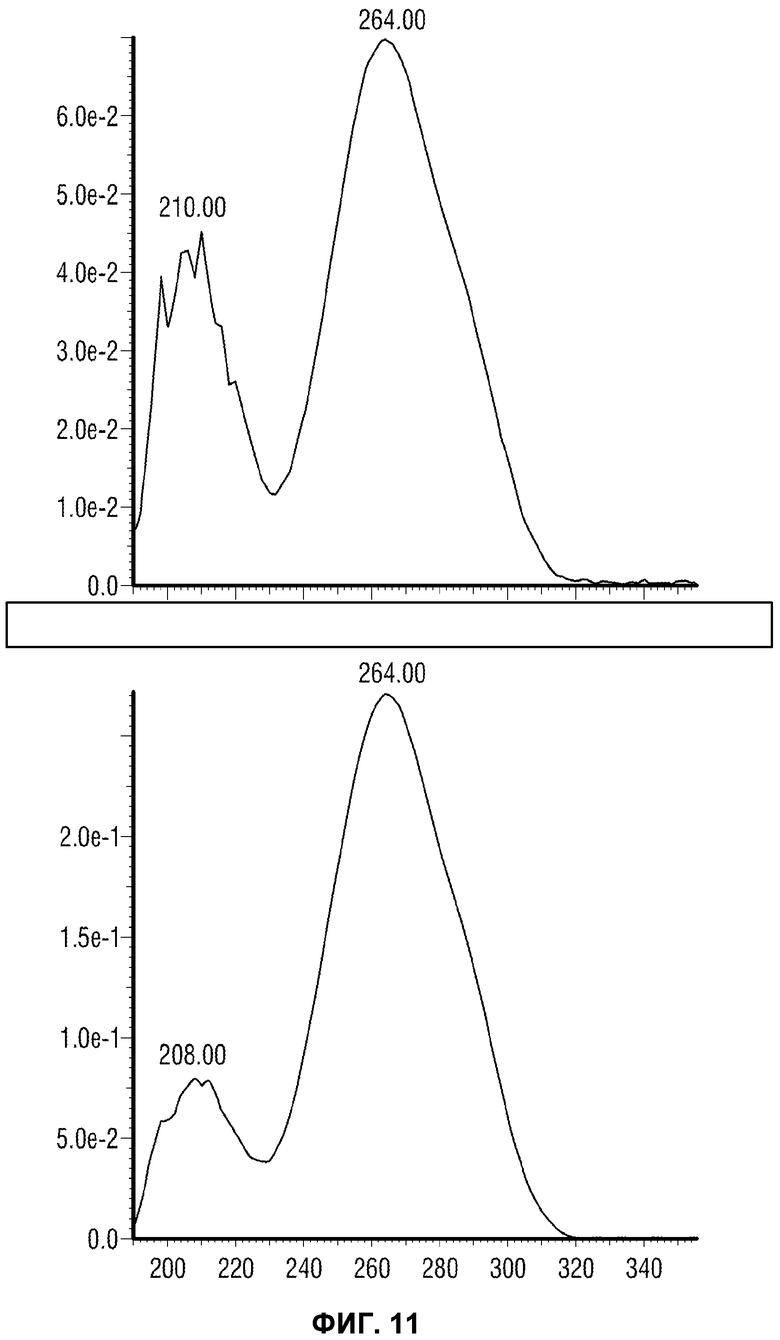
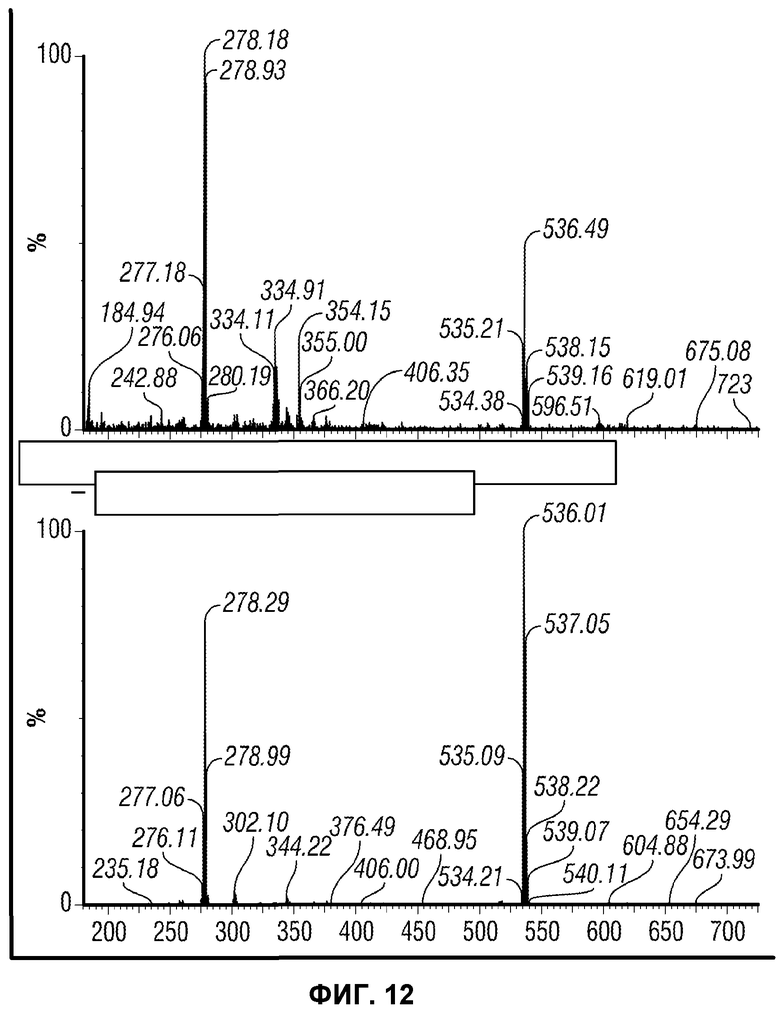
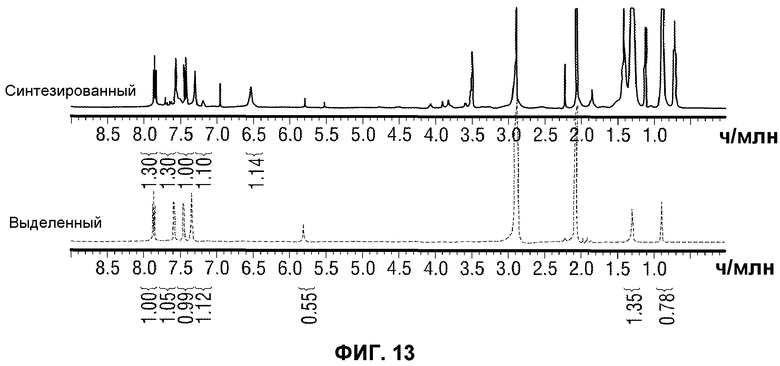
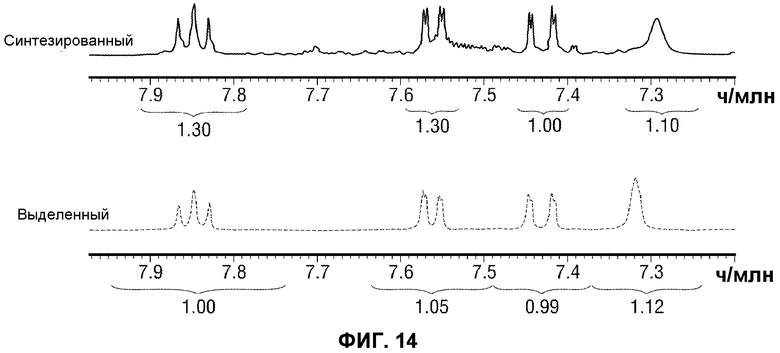
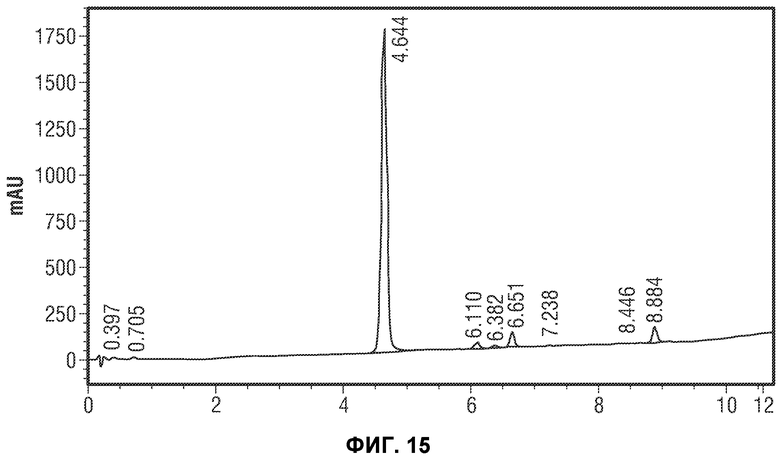
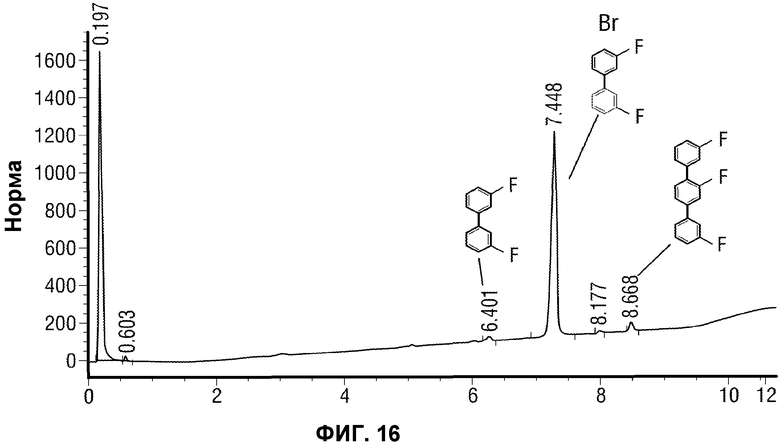
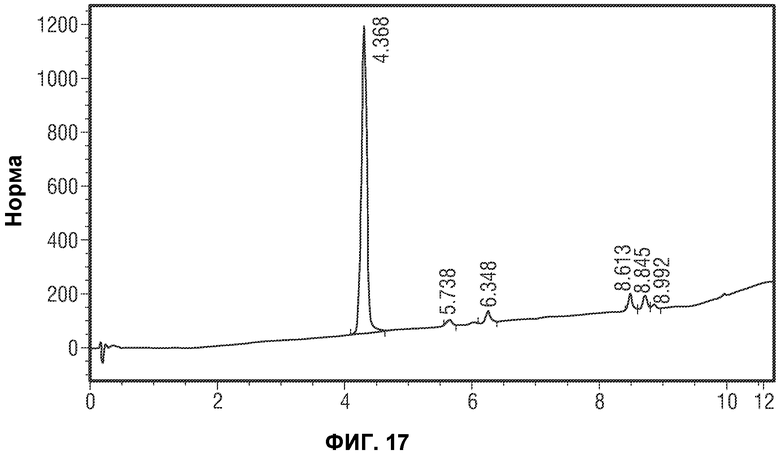
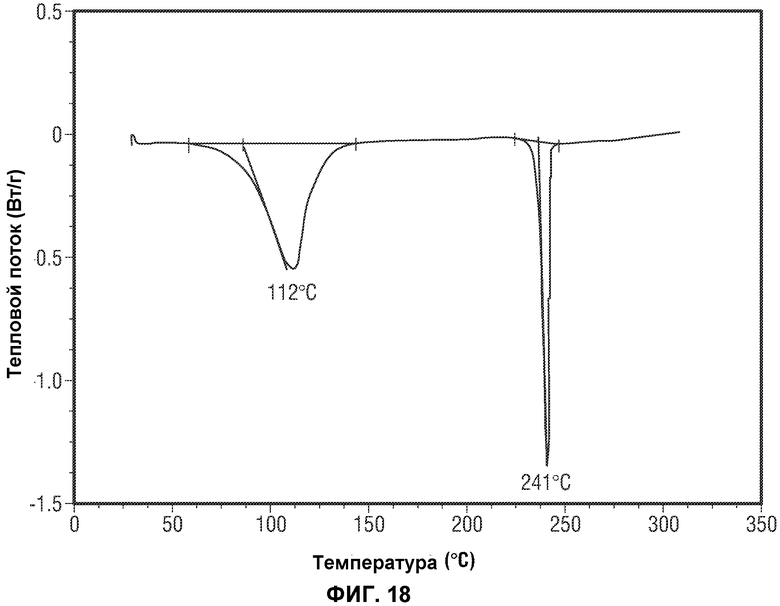
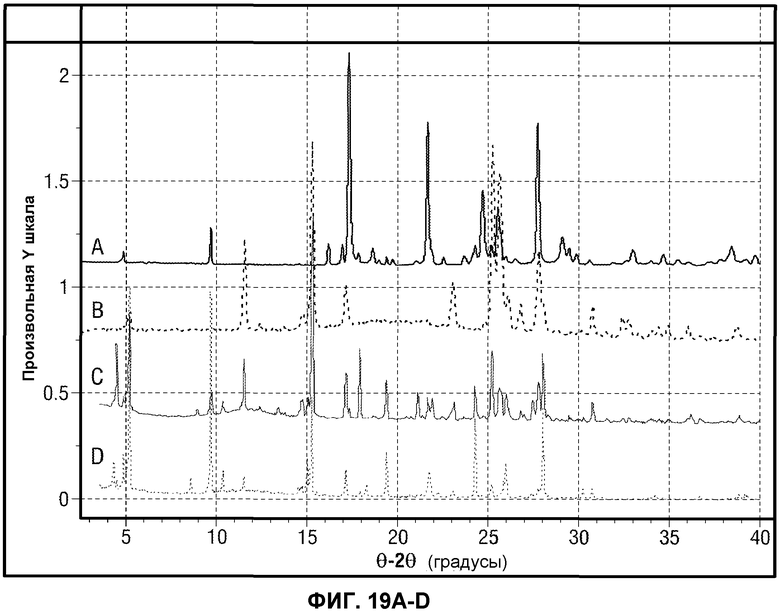
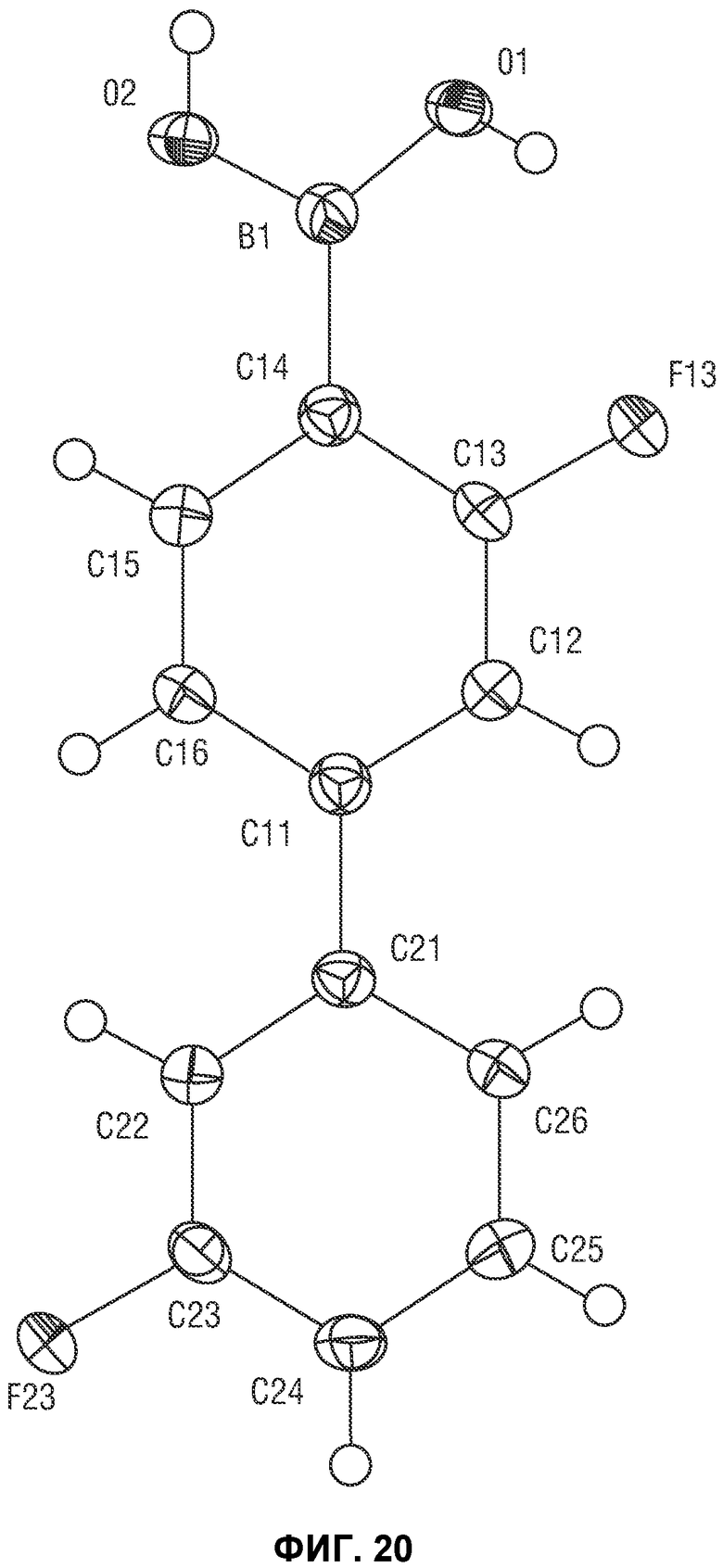
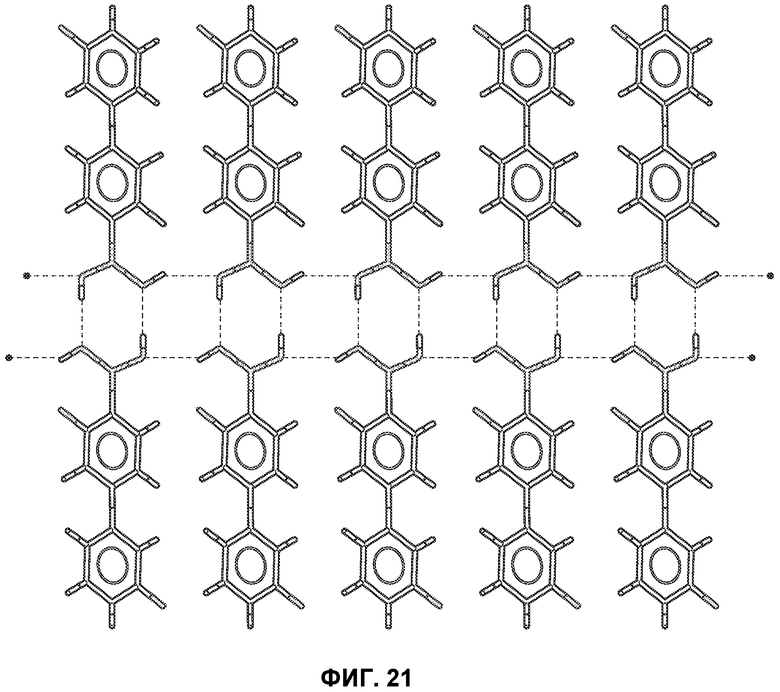
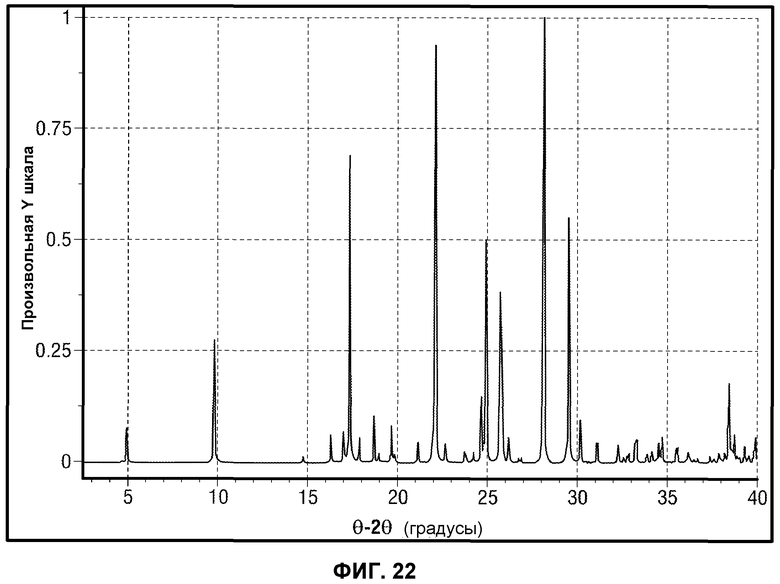
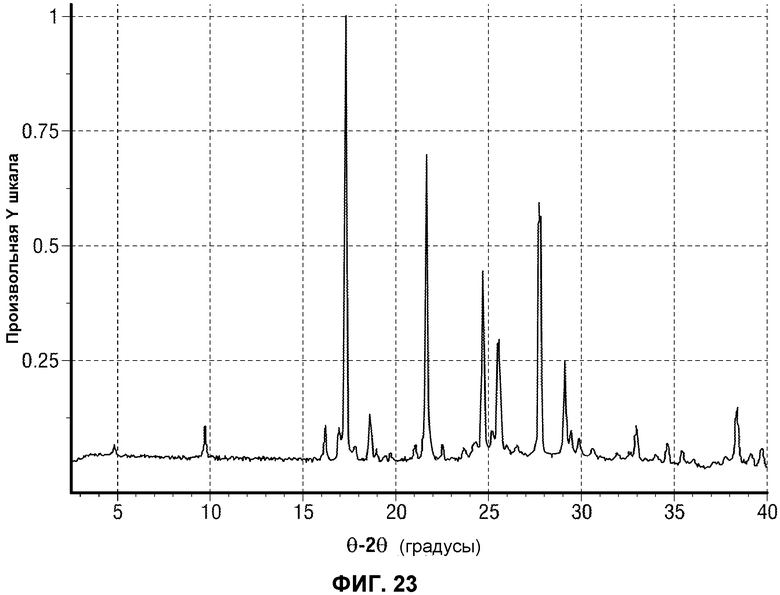
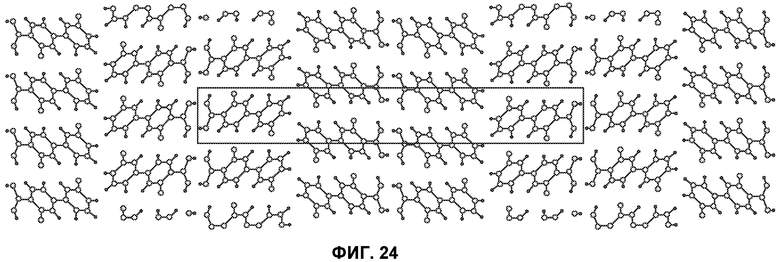
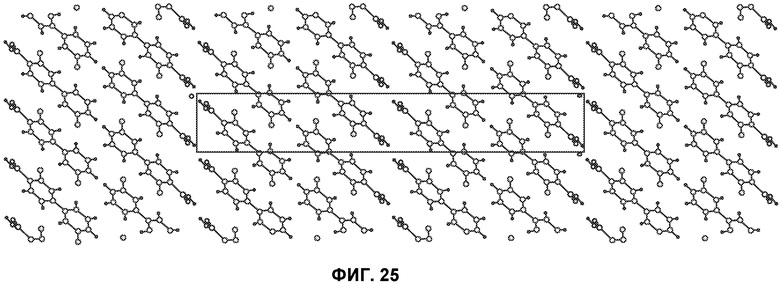
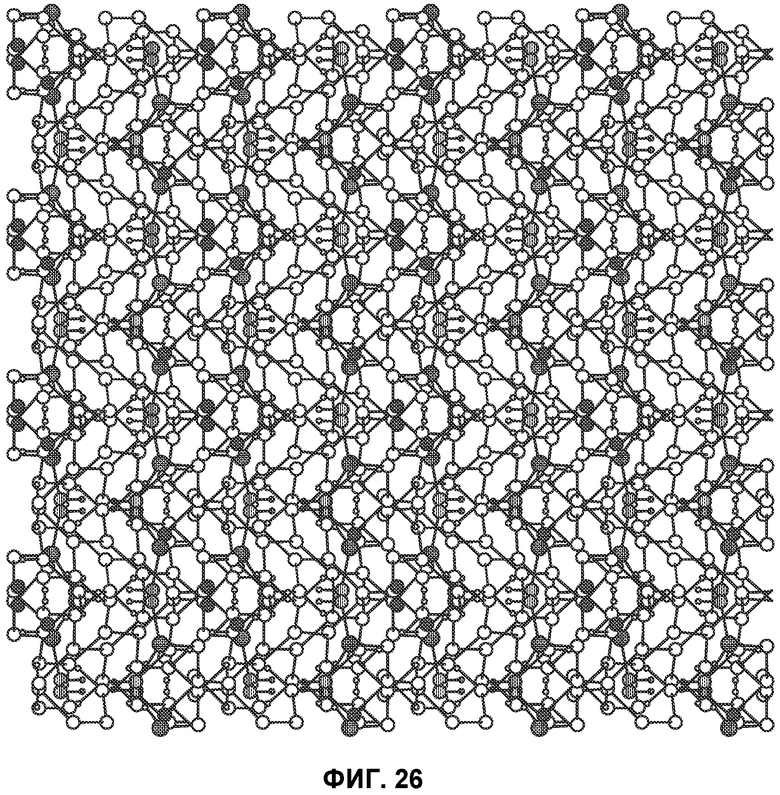
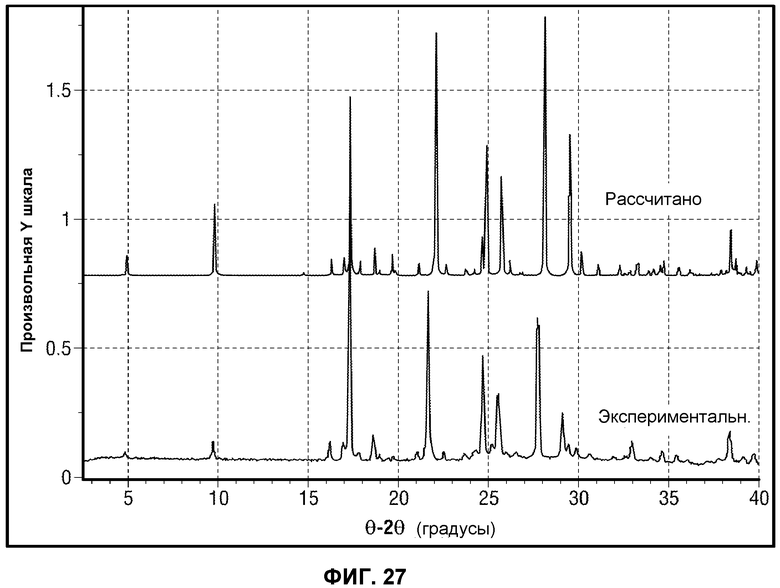
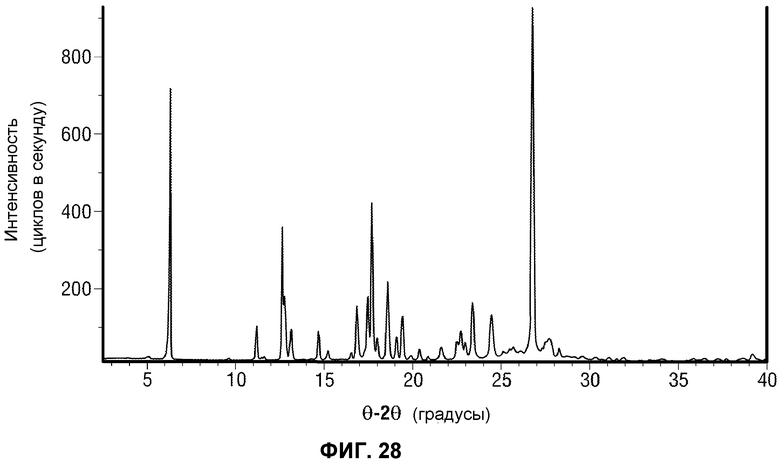
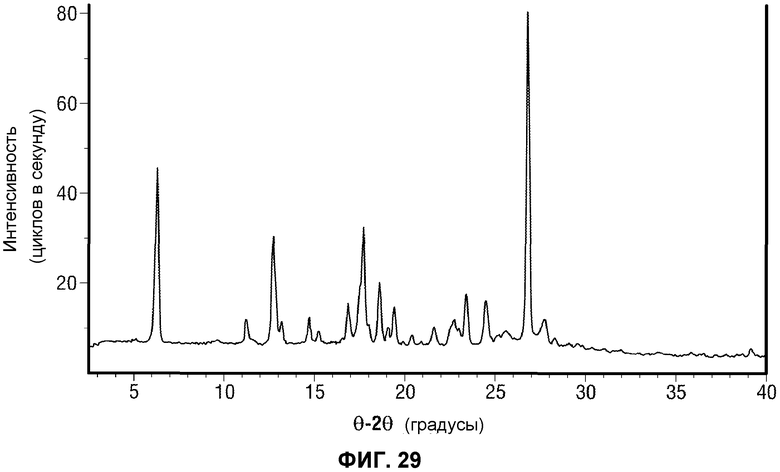
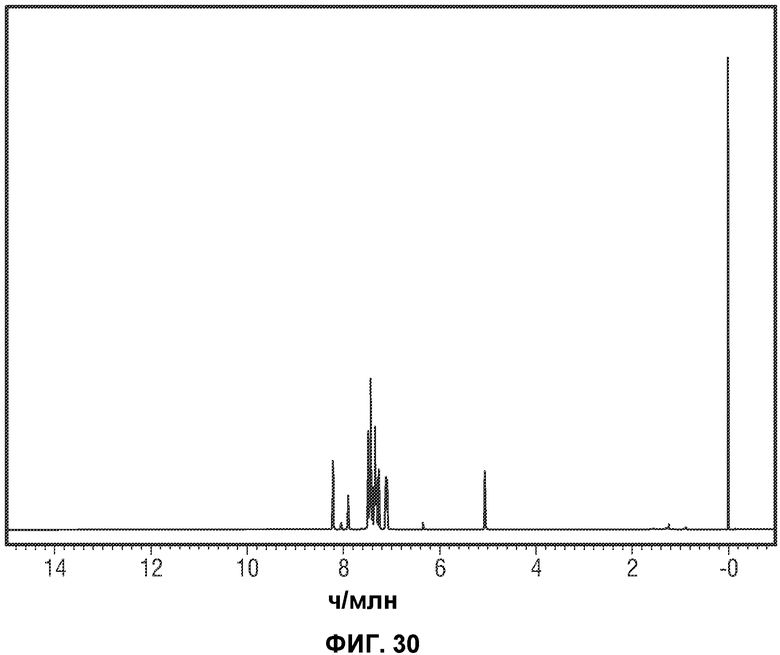
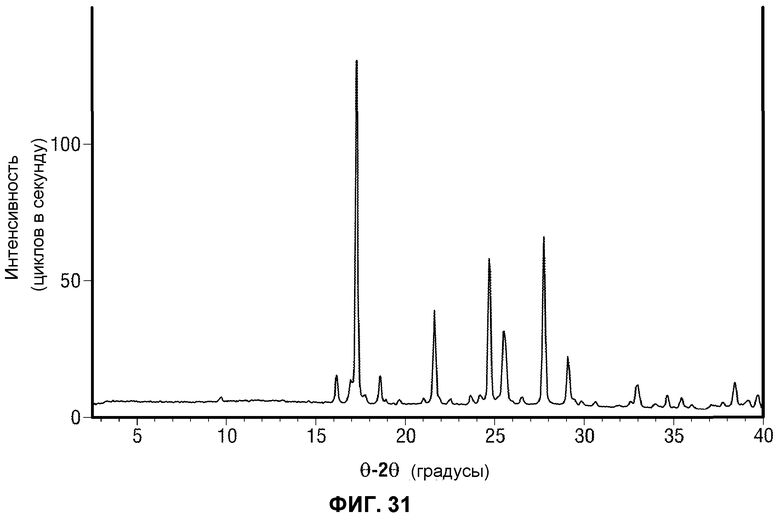
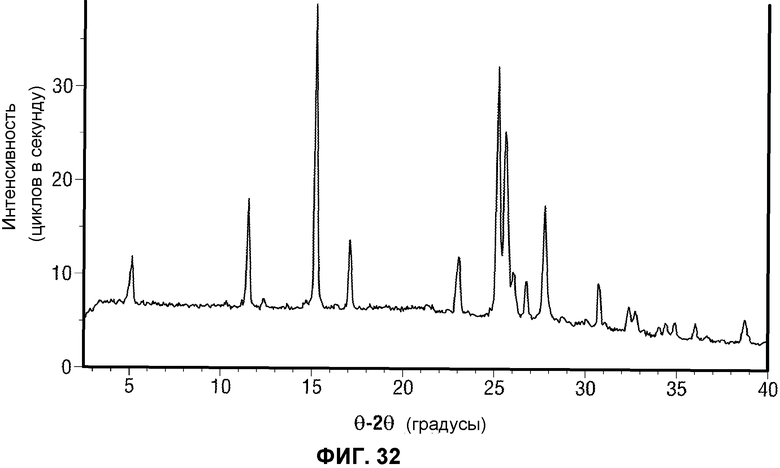
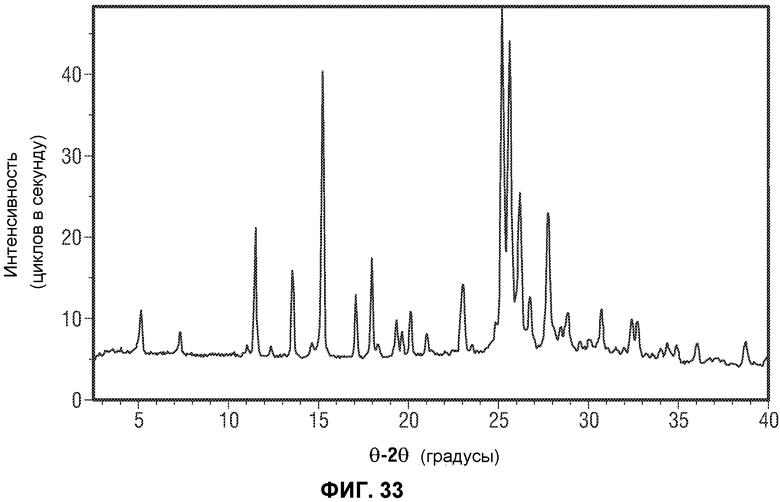
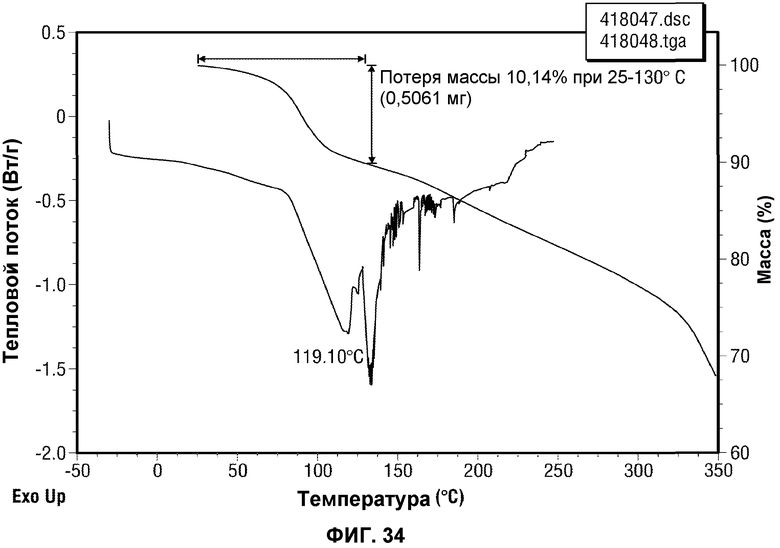
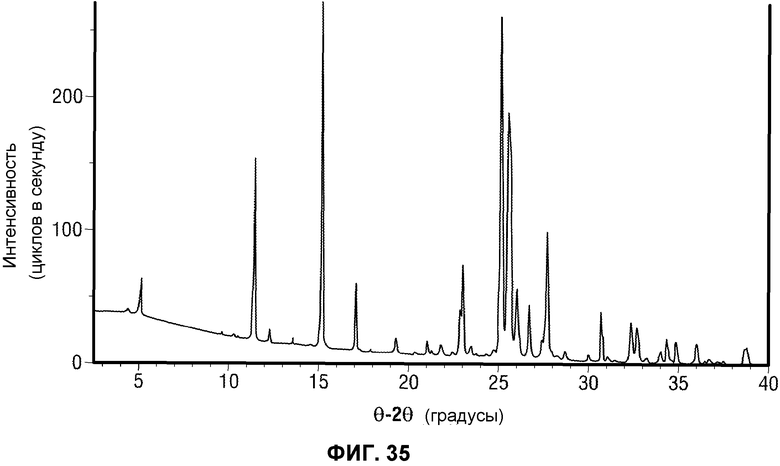
Изобретение относится к твердой форме, включающей кристаллическое соединение формулы 1:
или его фармацевтически приемлемой соли, гидрату или сольвату. Кристаллическое соединение формулы 1 представляет собой кристаллическую форму А формулы 1 и имеет рентгеновскую порошковую дифрактограмму, содержащую пики, в приблизительных положениях пиков: 17,26±0,10, 21,60±0,10 и 27,73±0,10 градусов 2θ и по меньшей мере в приблизительных положениях пиков: 9,68±0,10, 24,68±0,10, 25,48±0,10 и 29,08±0,10 градусов 2θ. Также предложены фармацевтические композиции для лечения FAAH-опосредованного состояния, способ получения твердой формы, включающей кристаллическое Соединение формулы 1 или его фармацевтически приемлемой соли, гидрата или сольвата, и способ лечения FAAH-опосредованного состояния. Изобретение позволяет получить твердую форму, включающую кристаллическое соединение формулы 1, полезную для получения конечных лекарственных форм с улучшенными свойствами. 6 н. и 47 з.п. ф-лы, 35 ил., 5 табл., 2 пр.
1. Твердая форма, включающая кристаллическое соединение формулы 1:
или его фармацевтически приемлемую соль, гидрат или сольват, где кристаллическое соединение формулы 1 представляет собой кристаллическую форму А формулы 1, имеющую рентгеновскую порошковую дифрактограмму, содержащую пики, в приблизительных положениях пиков: 17,26±0,10, 21,60±0,10 и 27,73±0,10 градусов 2θ и по меньшей мере в приблизительных положениях пиков: 9,68±0,10, 24,68±0,10, 25,48±0,10 и 29,08±0,10 градусов 2θ.
2. Твердая форма по п.1, где твердая форма, по существу, свободна от соединения формулы IMP-1, формулы IMP-2, формулы IMP-3 или формулы IMP-4:
3. Твердая форма по п.2, где твердая форма, по существу, свободна от аморфного Соединения 1.
4. Твердая форма по п.2, где твердая форма, по существу, свободна от Соединения формулы IMP-1.
5. Твердая форма по п.4, где твердая форма содержит меньше чем около 0,05% а/а Соединения формулы IMP-1.
6. Твердая форма по п.2, где твердая форма, по существу, свободна от Соединения формулы IMP-2.
7. Твердая форма по п.6, где твердая форма содержит меньше чем около 0,05% а/а Соединения формулы IMP-2.
8. Твердая форма по п.2, где твердая форма, по существу, свободна от Соединения формулы IMP-3.
9. Твердая форма по п.8, где твердая форма содержит меньше чем около 0,05% а/а Соединения формулы IMP-3.
10. Твердая форма по п.2, где твердая форма, по существу, свободна от Соединения формулы IMP-4.
11. Твердая форма по п.10, где твердая форма содержит меньше чем около 0,05% а/а Соединения формулы IMP-4.
12. Твердая форма по п.1, где твердая форма, по существу, свободна от других кристаллических форм Соединения 1.
13. Твердая форма по п.1, имеющая рентгеновскую порошковую дифрактограмму, содержащую пики, расположенные в следующих приблизительных положениях пиков: 9,68±0,10, 17,26±0,10, 21,60±0,10, 24,68±0,10, 25,48±0,10, 27,73±0,10 и 29,08±0,10 градусов 2θ.
14. Твердая форма по п.1, имеющая рентгеновскую порошковую дифрактограмму, включающую пики при приблизительно 17,26±0,10, 21,60±0,10 и 27,73±0,10 градусов 2θ.
15. Твердая форма по п.14, имеющая рентгеновскую порошковую дифрактограмму, дополнительно включающую пики при приблизительно 9,68±0,10 и 29,08±0,10 градусов 2θ.
16. Твердая форма по п.1, имеющая рентгеновскую порошковую дифрактограмму, которая по существу аналогична рентгеновской порошковой дифрактограмме, представленной на Фиг.1, Фиг.19А, Фиг.22, Фиг.23.
17. Твердая форма по п. 1, которая имеет параметры элементарной ячейки, согласующиеся со следующими приблизительными параметрами элементарной ячейки: a=5,45Å; b=5,16Å; c=36,12Å; α=90°; β=90°; γ=90°; V=1016,5Å 3 и Z=4.
18. Твердая форма по п.1, имеющая одну или несколько температур перехода, выбранных из 128±5°C и около 244±2°C, как определено методом дифференциальной сканирующей калориметрии.
19. Твердая форма по п.1, имеющая термограмму, полученную методом дифференциальной сканирующей калориметрии, которая по существу аналогична термограмме, полученной методом дифференциальной сканирующей калориметрии, представленной на Фиг.2.
20. Твердая форма по п.1, где твердая форма, по существу, свободна от одного или нескольких ангидридов Соединения формулы 1.
21. Твердая форма по п.20, где один или несколько ангидридов представляет собой Соединение 2:
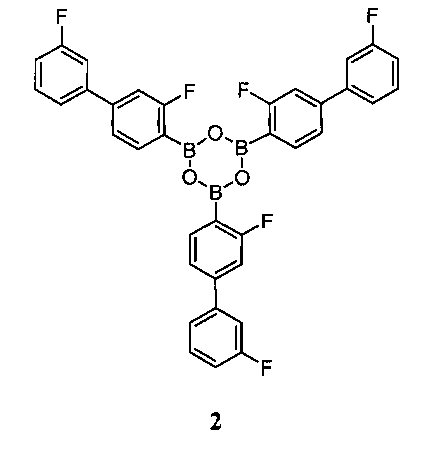
или его фармацевтически приемлемую соль, гидрат или сольват.
22. Фармацевтическая композиция для лечения FAAH-опосредованного состояния, включающая твердую форму по п.1 и фармацевтически приемлемый эксципиент.
23. Фармацевтическая композиция для лечения FAAH-опосредованного состояния, включающая твердую форму по п.2 и фармацевтически приемлемый эксципиент.
24. Фармацевтическая композиция для лечения FAAH-опосредованного состояния, включающая твердую форму по п.14 и фармацевтически приемлемый эксципиент.
25. Способ получения твердой формы, включающей кристаллическое Соединение формулы 1:
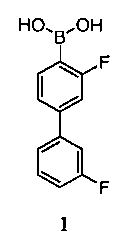
или его фармацевтически приемлемой соли, гидрата или сольвата; включающий следующие стадии:
(а) взаимодействие соединения формулы Е-1:
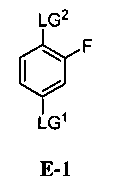
где:
LG1 и LG2 независимо выбраны из галогена или сульфоната;
с соединением формулы Е-2:
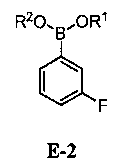
где каждый R1 и R2 независимо выбран из водорода или C1-6 алкильной, C2-6 алкенильной, C2-6 алкинильной, C6-12 арильной или C6-1 гетероарильной группы, или R1 и R2 объединены с образованием 5-8-членного кольца;
для получения соединения формулы Е-3:
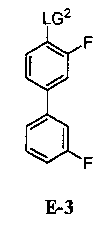
где:
LG2 выбран из галогена или сульфоната; и
(b) взаимодействие Е-3 с боронообразующим реагентом и металлическим реагентом для получения Соединения формулы 1 или его фармацевтически приемлемой соли, гидрата или сольвата или его ангидрида и
кристаллизацию Соединения формулы 1 или его фармацевтически приемлемой соли, гидрата или сольвата или его ангидрида с получением кристаллического Соединения формулы 1 или его фармацевтически приемлемой соли, гидрата или сольвата.
26. Способ по п.25, где стадия кристаллизации включает кристаллизацию Соединения формулы 1 из полярного раствора, включающего воду, полярный апротонный растворитель или их смесь.
27. Способ по п.25, где стадия кристаллизации включает кристаллизацию Соединения формулы 1 из смеси воды и ацетона.
28. Способ по п.25, где кристаллическое Соединение формулы 1 дополнительно промывают неполярным раствором.
29. Способ по п.28, где неполярный апротонный раствор включает гексаны, гептаны или их смесь.
30. Способ по п.25, где Е-1 представляет собой E-1b:
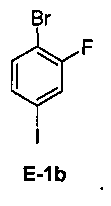
31. Способ по п.25, где Е-2 представляет собой Е-2а:
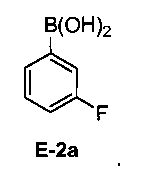
32. Способ по п.25, где Е-3 представляет собой Е-3а:
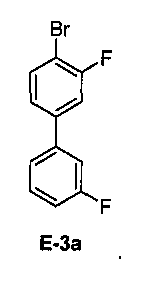
33. Способ по п.25, где взаимодействие соединения формулы Е-1 с соединением формулы Е-2 для получения соединения формулы Е-3 включает использование палладиевого катализатора.
34. Способ по п. 33, где палладиевый катализатор выбран из Pd(PPh3)4, Pd(OAc)2, Pd2(dba)3, Pd(dppf)2Cl2 и PdCl2(PPh3)2.
35. Способ по п.25, где взаимодействие соединения формулы Е-1 с соединением формулы Е-2 для получения соединения формулы Е-3 включает использование основания.
36. Способ по п.35, где основание выбрано из триэтиламина, диизопропилэтиламина, карбоната калия, карбоната натрия, карбоната цезия, бикарбоната калия, бикарбоната натрия, бикарбоната цезия, ацетата калия, ацетата натрия, фосфата калия, гидроксида лития, гидроксида натрия и гидроксида магния.
37. Способ по п.25, где боронообразующий реагент представляет собой боронатный сложный эфир.
38. Способ по п.37, где боронатный сложный эфир выбран из триметилбората, триэтилбората, триаллилбората, триизопропилбората, трибутилбората, три-трет-бутилбората, трипентилбората, тригексилбората, тритолилбората, трибензилбората, трифенилбората, триметиленбората, триэтаноламинбората, триметаллилбората, 2-метокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана, 2-метокси-4,4,6-триметил-1,3,2-диоксаборинана, 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолана, 2-изопропокси-4,4,6-триметил-1,3,2-диоксаборинана, 2-(2-диметиламиноэтокси)-4-метил-1,3,2-диоксаборинана, 2-бутокси-4,4,6-триметил-1,3,2-диоксаборинана, трис(2,2,2-трифторэтил)бората, трис(1-изопропил-2-метилпропил)бората и 2,2′-(2-метил-2,4-пентандиил-диокси)бис(4,4,6-триметил-1,3,2-диоксаборинан).
39. Способ по п.25, где металлический реагент представляет собой алкиллитиевый реагент.
40. Способ по п.39, где алкиллитиевый реагент представляет собой н-бутиллитий или гексиллитий.
41. Способ по п.25, где кристаллизация соединения формулы 1 включает дегидратацию соединения формулы 1 для получения ангидрида соединения формулы 1 и гидролиз ангидрида соединения формулы 1 с получением кристаллического соединения 1 или его фармацевтически приемлемой соли, гидрата или сольвата.
42. Способ по п.41, где ангидрид соединения формулы 1 представляет собой Соединение 2:
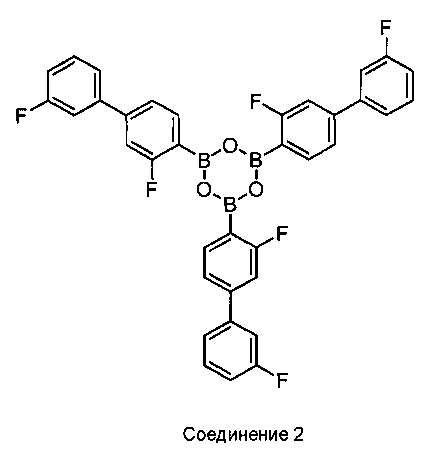
или его фармацевтически приемлемую соль, гидрат или сольват.
43. Способ лечения FAAH-опосредованного состояния, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества твердой формы по п.1.
44. Способ по п.43, где FAAH-опосредованное состояние выбрано из болезненного состояния, воспалительного состояния, иммунного расстройства, расстройства центральной нервной системы, метаболического расстройства, сердечного расстройства и глаукомы.
45. Способ по п.44, где FAAH-опосредованное состояние представляет собой болезненное состояние, выбранное из невропатической боли, центральной боли, деафференцированной боли, хронической боли, послеоперационной боли, предоперационной боли, ноцицептивной боли, острой боли, невоспалительной боли, воспалительной боли, боли, связанной с раком, травматической боли, ожоговой боли, боли, связанной с медицинскими процедурами, боли, возникающей в результате зуда, синдрома болезненного мочевого пузыря, боли, связанной с предменструальным дисфорическим расстройством, боли, связанной с предменструальным синдромом, боли, связанной с синдромом хронической усталости, боли, связанной с преждевременными родами, боли, связанной с симптомами отмены от наркозависимости, боли в суставах, артритной боли, пояснично-крестцовой боли, мышечно-скелетной боли, головной боли, мигрени, мышечной боли, боли внизу спины, боли в области шеи, зубной боли, зубной/челюстно-лицевой боли и висцеральной боли.
46. Способ по п.43, где FAAH-опосредованное состояние представляет собой воспалительное состояние или иммунное расстройство.
47. Способ по п.46, где воспалительное состояние или иммунное расстройство представляет собой желудочно-кишечное расстройство.
48. Способ по п.46, где воспалительное состояние или иммунное расстройство представляет собой кожное состояние.
49. Способ по п.43, где FAAH-опосредованное состояние представляет собой расстройство центральной нервной системы, выбранное из нейротоксичности и/или нейротравмы, удара, рассеянного склероза, повреждения спинного мозга, эпилепсии, психического расстройства, состояния сна, двигательного расстройства, тошноты и/или рвоты, амиотрофического бокового склероза, болезни Альцгеймера и наркомании.
50. Способ по п.43, где FAAH-опосредованное состояние представляет собой метаболическое расстройство, выбранное из состояния истощения, или связанного с ожирением состояния, или осложнения такого состояния.
51. Способ по п.43, где FAAH-опосредованное состояние представляет собой сердечное расстройство, выбранное из гипертензии, шока, вызванного нарушением кровообращения, реперфузионного поражения миокарда и атеросклероза.
52. Способ по п.43, где FAAH-опосредованное состояние представляет собой глаукому.
53. Способ по п.43, где FAAH-опосредованное состояние представляет собой постгерпетическую невралгию.
| WO 2008063300 A2, 29.05.2008 | |||
| DE 4014488 A, 14.11.1991 | |||
| EP 440082 A2, 07.08.1991 | |||
| WO 2003105860 A1, 24.12.2003 | |||
| RU 2004139087 A, 10.07.2005. |
Авторы
Даты
2015-11-20—Публикация
2011-02-01—Подача