°Настоящая заявка испрашивает приоритет по предварительной патентной заявке США №61/451806, поданной 11 марта 2011 г., полное содержание которой включено в настоящее описание путем ссылки.
1. ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к твердым формам 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона, их фармацевтическим композициям и способам их применения для лечения заболеваний или расстройств.
2. ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
2.1 ПАТОБИОЛОГИЯ РАКА И ДРУГИХ ЗАБОЛЕВАНИЙ
Рак характеризуется прежде всего увеличением числа аномальных клеток, происходящих из данной здоровой ткани, проникновением этих аномальных клеток в окружающие ткани или распространением через лимфатическую или кровеносную системы злокачественных клеток в регионарных лимфатических узлах и в отдаленных участках организма (метастазирование). Клинические данные и молекулярно-биологические исследования показывают, что рак представляет собой многостадийный процесс, который начинается с незначительных пренеопластических изменений, которые при определенных условиях могут прогрессировать в неоплазию. Неопластическое поражение может эволюционировать клонально и развиваться с увеличением способности к инвазии, росту, метастазированию и гетерогенности, особенно в условиях, когда опухолевые клетки избегают иммунного надзора хозяина. Roitt I., Brostoff J. and Kale D., Immunology, 17.1-17.12 (3rd ed., Mosby, St. Louis, Mo., 1993).
Существует огромное количество различных видов рака, которые подробно описаны в медицинской литературе. Примеры включают рак легких, толстой кишки, прямой кишки, простаты, молочных желез, головного мозга и кишечника. Заболеваемость раком продолжает расти по мере роста общего возраста населения, возникновения новых видов рака, а также восприимчивых групп населения (например, больных СПИД или подверженных избыточному воздействию солнечного света). Однако возможности лечения рака ограничены. Например, в случае различных видов рака крови (например, множественной миеломы), доступно небольшое количество вариантов лечения, особенно когда традиционная химиотерапия не дает результатов и нет возможности проведения трансплантации костного мозга. Поэтому существует огромная потребность в новых способах и композициях, которые можно использовать для лечения раковых пациентов.
Многие виды рака связаны с образованием новых кровеносных сосудов, процессом, известным как ангиогенез. Выявлены некоторые из механизмов, участвующих в индуцированном опухолью ангиогенезе. Наиболее прямой из этих механизмов представляет собой секрецию опухолевыми клетками цитокинов с ангиогенными свойствами. Примеры таких цитокинов включают кислотный и основный фактор роста фибробластов (a,b-FGF), ангиогенин, фактор роста эндотелия сосудов (VEGF) и TNF-α. В альтернативном варианте опухолевые клетки могут высвобождать ангиогенные пептиды путем экспрессии протеаз и последующего расщепления внеклеточного матрикса, в котором содержатся некоторые цитокины (например, b-FGF). Ангиогенез также можно индуцировать косвенным образом путем привлечения воспалительных клеток (в частности, макрофагов) и последующего высвобождения ими ангиогенных цитокинов (например, TNF-α, b-FGF).
Множество других заболеваний и расстройств также связаны с нежелательным ангиогенезом или характеризуются им. Например, усиленный или нерегулируемый ангиогенез участвует в ряде заболеваний и патологических состояний, включая, но не ограничены ими, глазные неоваскулярные заболевания, хориоидальные неоваскулярные заболевания, неоваскулярные заболевания сетчатки, рубеоз (неоваскуляризацию радужки), вирусные заболевания, генетические заболевания, воспалительные заболевания, аллергические заболевания и аутоиммунные заболевания. Примеры таких заболеваний и состояний включают, но не ограничены ими, диабетическую ретинопатию, ретинопатию недоношенных, отторжение трансплантата роговицы, неоваскулярную глаукому, ретролентальную фиброплазию, артрит и пролиферативную витреоретинопатию.
Соответственно, соединения, которые могут регулировать ангиогенез или ингибировать продукцию некоторых цитокинов, включая TNF-α, могут быть полезны в лечении и предотвращении различных заболеваний и состояний.
2.2 СПОСОБЫ ЛЕЧЕНИЯ РАКА
Современная противораковая терапия для удаления опухолевых клеток из организма пациента может включать хирургическое вмешательство, химиотерапию, гормональную терапию и/или лучевую терапию (см., например, Stockdale, 1998, Medicine, vol. 3, Rubenstein and Federman, eds., Chapter 12, Section IV). В последнее время противораковая терапия может также включать биологическую терапию или иммунотерапию. Все эти подходы имеют значительные недостатки для пациентов. Хирургическое вмешательство, например, может быть противопоказано по состоянию здоровья пациента или может быть неприемлемо для пациента. Кроме того, операция не может полностью удалить неопластическую ткань. Лучевая терапия эффективна только тогда, когда неопластическая ткань проявляет более высокую чувствительность к облучению, чем здоровая ткань. Лучевая терапия также может часто вызывать тяжелые побочные эффекты. Гормональная терапия редко применяется в виде монотерапии. Хотя гормональная терапия может быть эффективной, ее часто применяют, чтобы предупредить или отсрочить рецидив рака после того, как большинство раковых клеток были удалены с помощью других методов лечения. Число вариантов биологической терапии и иммунотерапии ограничено, и они могут вызывать побочные эффекты, такие как сыпь или отек, гриппозные симптомы, включая лихорадку, озноб и усталость, проблемы с пищеварительным трактом или аллергические реакции.
Что касается химиотерапии, то существует множество химиотерапевтических средств для лечения рака. Большинство противораковых химиотерапевтических препаратов действуют путем ингибирования синтеза ДНК, непосредственно или косвенно путем ингибирования биосинтеза предшественников дезоксирибонуклеотидтрифосфатов, чтобы предотвратить репликацию ДНК и сопутствующее деление клеток. Gilman et al., Goodman and Gilmanʹs: The Pharmacological Basis of Therapeutics, Tenth Ed. (McGraw Hill, New York).
Несмотря на наличие различных химиотерапевтических агентов, химиотерапия имеет много недостатков. Stockdale, Medicine, vol. 3, Rubenstein and Federman, eds., ch. 12, sect. 10, 1998. Почти все химиотерапевтические препараты являются токсичными, и химиотерапия вызывает значительные и часто опасные побочные эффекты, включая сильную тошноту, угнетение функции костного мозга и иммуносупрессию. Кроме того, даже при введении комбинаций химиотерапевтических агентов, многие опухолевые клетки устойчивы или развивают устойчивость к химиотерапевтическим агентам. Фактически, эти клетки, устойчивые к конкретным химиотерапевтическим агентам, используемым в протоколе лечения, часто оказываются устойчивыми к другим лекарственным средствам, даже если эти агенты действуют по другому механизму, чем лекарственные средства, используемые в конкретном методе лечения. Это явление называется плейотропной лекарственной или мультилекарственной резистентностью. Из-за лекарственной резистентности многие виды рака устойчивы или становятся невосприимчивыми к стандартным протоколам химиотерапевтических методов лечения.
Другие заболевания или состояния, ассоциированные с или отличающиеся нежелательным ангиогенезом, также трудно поддаются лечению. Однако некоторые соединения, такие как протамин, гепарин и стероиды, были предложены как пригодные для лечения некоторых конкретных заболеваний. Taylor et al., Nature 297:307 (1982); Folkman et al., Science 221:719 (1983); и патенты США №5001116 и 4994443.
Тем не менее, существует значительная потребность в безопасных и эффективных методах лечения, предупреждения и контроля рака и других заболеваний и состояний, в том числе болезней, которые не восприимчивы к стандартным методам лечения, таким как хирургическое вмешательство, лучевая терапия, химиотерапия и гормональная терапия, с одновременным снижением или полным исключением токсичности и/или побочных эффектов, связанных с обычными методами лечения.
2.3 ТВЕРДЫЕ ФОРМЫ
Получение и выбор твердой формы фармацевтического соединения является сложным процессом, учитывая то, что изменение твердой формы может повлиять на различные физические и химические свойства, которые могут обеспечить преимущества и недостатки в получении, введении в рецептуру, стабильности и биодоступности среди других важных фармацевтических характеристик. Потенциальные фармацевтические твердые формы включают кристаллические твердые вещества и аморфные твердые вещества. Аморфные твердые вещества отличаются отсутствием протяженной структурной упорядоченности, тогда как кристаллические твердые вещества отличаются структурной периодичностью. Предпочтительный класс фармацевтических твердых форм зависит от конкретного применения: аморфные твердые вещества иногда выбирают, исходя, например, из лучшего профиля растворимости, в то время как кристаллические твердые вещества могут быть предпочтительными из-за таких свойств, как, например, физическая или химическая стабильность (см., например, S.R. Vippagunta et al., Adv. Drug. Deliv. Rev., (2001) 48:3-26; L. Yu, Adv. Drug. Deliv. Rev., (2001) 48:27-42).
Кристаллические или аморфные, потенциальные твердые формы фармацевтического соединения включают однокомпонентные и многокомпонентные твердые вещества. Однокомпонентные твердые вещества состоят по существу из фармацевтического соединения при отсутствии других соединений. Разнообразие среди однокомпонентных кристаллических веществ потенциально может возникнуть, например, вследствие явления полиморфизма, когда для конкретного фармацевтического соединения существует несколько вариантов трехмерной структуры (см., например, S.R. Byrn et al., Solid State Chemistry of Drugs, (1999) SSCI, West Lafayette). Важность изучения полиморфных форм подчеркнул случай с ритонавиром, ингибитором ВИЧ-протеазы, который изготавливали в виде мягких желатиновых капсул. Примерно через два года после выпуска продукта в продажу, непредвиденное выпадение в осадок новой, менее растворимой полиморфной формы в фармацевтическом составе потребовало вывода продукта с рынка до разработки более однородного состава (см. S.R. Chemburkar et al., Org. Process Res. Dev., (2000) 4:413-417).
Дополнительное разнообразие среди потенциальных твердых форм фармацевтического соединения может возникнуть, например, из-за возможности использования многокомпонентных твердых веществ. Кристаллические твердые вещества, содержащие два или несколько видов ионов, можно назвать солями (см., например, Handbook of Pharmaceutical Salts: Properties, Selection and Use, P.H. Stahl and C. G. Wermuth, Eds., (2002), Wiley, Weinheim). Дополнительные типы многокомпонентных твердых веществ, которые потенциально могут обеспечить дополнительное улучшение свойств фармацевтического соединения или его соли, включают, например в числе прочих, гидраты, сольваты, сокристаллы и клатраты (см., например, S.R. Byrn et al., Solid State Chemistry of Drugs, (1999) SSCI, West Lafayette). Более того, многокомпонентные кристаллические формы могут потенциально быть чувствительными к полиморфизму, когда данная многокомпонентная композиция может существовать более чем в одной трехмерной кристаллической структуре. Получение твердых форм имеет большое значение при разработке безопасного, эффективного, стабильного и пользующегося спросом фармацевтического соединения.
В настоящем документе приведены варианты осуществления изобретения, решающие проблему потребности в твердых формах 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона («соединения А»). Соединение A было описано в патенте США №7635700, полное содержание которого включено в настоящий документ путем ссылки.
3. КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам лечения заболеваний и расстройств с использованием твердой формы 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона или его стереоизомера, или их фармацевтически приемлемой соли, сольвата, гидрата, сокристалла, клатрата или полиморфа.
Настоящее изобретение относится к твердым формам 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона или его стереоизомера, или их фармацевтически приемлемой соли, сольвата, гидрата, сокристалла, клатрата или полиморфа. В одном из вариантов осуществления изобретения твердая форма является кристаллической формой А. В другом варианте осуществления изобретения твердая форма является кристаллической формой В. В еще одном варианте осуществления изобретения твердая форма является кристаллической формой С. В еще одном варианте осуществления изобретения твердая форма является формой D. В еще в одном варианте осуществления изобретения твердой формой является кристаллическая форма Е. В еще одном варианте осуществления изобретения твердой формой является кристаллическая форма F. В еще одном варианте осуществления изобретения твердой формой является твердая форма гидрохлорида 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона. В еще одном варианте осуществления изобретения твердой формой является кристаллическая форма A1.
Кроме того, изобретение относится к фармацевтическим композициям, стандартным лекарственным формам, режимам дозирования и наборам, которые включают твердую форму 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона или его стереоизомера, или их фармацевтически приемлемой соли, сольвата, гидрата, сокристалла, клатрата или полиморфа и фармацевтически приемлемый носитель.
Дополнительно, изобретение относится к способам лечения и контроля различных заболеваний или расстройств, которые включают введение пациенту терапевтически эффективного количества твердой формы 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона или его стереоизомера, или их фармацевтически приемлемой соли, сольвата, гидрата, сокристалла, клатрата или полиморфа.
Также, изобретение относится к способам предупреждения различных заболеваний и расстройств, которые включают введение пациенту профилактически эффективного количества твердой формы 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона или его стереоизомера, или их фармацевтически приемлемой соли, сольвата, гидрата, сокристалла, клатрата или полиморфа.
В некоторых вариантах осуществления изобретения твердыми формами являются однокомпонентные кристаллические формы 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона. В некоторых вариантах осуществления изобретения твердыми формами являются многокомпонентные кристаллические формы 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона, в том числе, но без ограничения, соли, сокристаллы и/или сольваты (включая гидраты), содержащие 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион. В некоторых вариантах осуществления изобретения твердыми формами являются однокомпонентные аморфные формы 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона. В некоторых вариантах осуществления изобретения твердыми формами являются многокомпонентные аморфные формы 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона. Без ограничения какой-либо конкретной теорией, некоторые твердые формы по настоящему изобретению имеют конкретные предпочтительные физические и/или химические свойства, что делает их пригодными, например, для производства, получения, введения в рецептуру и/или хранения, одновременно обладая особенно предпочтительными биологическими свойствами, такими как, например, биодоступность и/или биологическая активность.
В некоторых вариантах осуществления изобретения твердые формы, приведенные в настоящем документе, включают твердые формы, содержащие 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион, включая, но без ограничения, однокомпонентные и многокомпонентные твердые формы, содержащие 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион. В некоторых вариантах осуществления изобретения твердые формы, приведенные в настоящем документе, включают соли, полиморфы, сольваты (включая гидраты) и сокристаллы, содержащие 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион. Некоторые варианты осуществления настоящего изобретения относятся к способам изготовления, выделения и/или описания твердых форм по настоящему изобретению.
Твердые формы, приведенные в настоящем документе, пригодны в качестве активных фармацевтических ингредиентов для получения фармацевтических составов для применения у пациентов. Таким образом, варианты осуществления настоящего изобретения охватывают применение этих твердых форм в качестве конечного лекарственного продукта. Некоторые варианты осуществления изобретения относятся к твердым формам, пригодным для изготовления конечных лекарственных форм с улучшенными свойствами, например, среди прочих - текучестью порошка, прессуемостью, таблетируемостью, стабильностью и совместимостью со вспомогательными веществами, которые необходимы для изготовления, получения, введения в рецептуру и/или хранения конечных лекарственных средств. Некоторые варианты осуществления настоящего изобретения относятся к фармацевтическим композициям, содержащим однокомпонентную кристаллическую форму, многокомпонентную кристаллическую форму, однокомпонентную аморфную форму и/или многокомпонентную аморфную форму, содержащие 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион и фармацевтически приемлемый разбавитель, вспомогательное вещество или носитель. Твердые формы и конечные лекарственные средства, приведенные в настоящем документе, пригодны, например, для лечения, предупреждения или лечения заболеваний и расстройств, указанных в настоящем документе.
3.1. КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 представлена порошковая рентгенограмма («XRPD») формы А 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 2 представлен график, полученный дифференциальной сканирующей калориметрией («DSC») формы А 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 3 представлен график, полученный термогравиметрическим анализом («TGA») формы А 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 4 представлена порошковая рентгенограмма формы В 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 5 представлен график, полученный DSC формы В 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 6 представлен график, полученный TGA формы В 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 7 представлена порошковая рентгенограмма формы С 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 8 представлен график, полученный DSC формы С 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 9 представлен график, полученный TGA формы С 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 10 представлена порошковая рентгенограмма формы D 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 11 представлен график, полученный DSC формы D 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 12 представлен график, полученный TGA формы D 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 13 представлена порошковая рентгенограмма формы Е 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 14 представлен график, полученный DSC формы Е 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 15 представлен график, полученный TGA формы Е 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 16 представлена порошковая рентгенограмма формы F 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 17 представлен график, полученный DSC формы F 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 18 представлена порошковая рентгенограмма формы А1 гидрохлорида 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 19 представлен график, полученный DSC формы А1 гидрохлорида 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 20 представлен график, полученный TGA формы А1 гидрохлорида 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 21 представлен график динамической сорбции паров («DVS») формы A1 гидрохлорида 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
фиг. 22 представляет собой полученное под микроскопом изображение кристаллов формы A1 гидрохлорида 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
На фиг. 23 изображены взаимопревращения между различными твердыми формами 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона.
3.2. ОПРЕДЕЛЕНИЯ
В контексте настоящего документа термин «соединение А» относится к 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диону. 1H ЯМР-спектр соединения А по существу является следующим: δ (DMSO-d6): 2,10-2,17 (мультиплет, 1H), 2,53 (синглет, 3H), 2,59-2,69 (мультиплет, 2H), 2,76-2,89 (мультиплет, 1H), 5,14 (двойной дублет, J=6,11 Гц, 1H), 6,56 (дублет, J=8 Гц, 1H), 6,59 (дублет, J=8 Гц, 1H), 7,02 (синглет, 2H), 7,36 (триплет, J=8 Гц, 1H), 10,98 (синглет, 1H). 13C ЯМР-спектр соединения А по существу является следующим: δ (DMSO-d6): 20,98, 23,14, 30,52, 55,92, 104,15, 110,48, 111,37, 134,92, 148,17, 150,55, 153,62, 162,59, 169,65, 172,57.
Не ограничиваясь какой-либо теорией, полагают, что соединение А является 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил) пиперидин-2,6-дионом, имеющим следующую структуру:
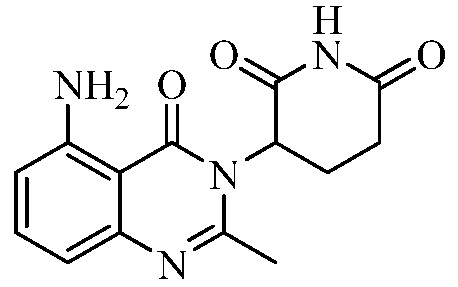 .
.
В контексте настоящего документа термин «пациент» относится к млекопитающему, в частности, к человеку.
В контексте настоящего документа термин «фармацевтически приемлемая соль» относится к соли, полученной из фармацевтически приемлемых нетоксичных кислоты или основания, включая неорганические кислоты и основания и органические кислоты и основания.
В контексте настоящего документа термин «побочные эффекты» включает, но без ограничения, желудочно-кишечную, почечную и печеночную токсичность, лейкопению, увеличение времени кровотечения вследствие, например, тромбоцитопении, и увеличение срока беременности, тошноту, рвоту, сонливость, астению, головокружение, тератогенность, симптомы экстрапирамидных расстройств, акатизию, кардиотоксичность, включая сердечно-сосудистые нарушения, воспаление, мужскую сексуальную дисфункцию и повышение уровня печеночных ферментов. Термин «желудочно-кишечная токсичность» включает, но без ограничения, желудочные и кишечные язвы и эрозии. Термин «почечная токсичность» включает, но без ограничения, такие состояния, как папиллярный некроз и хронический интерстициальный нефрит.
В контексте настоящего документа и если не указано иное, фразы «снизить или исключить побочные эффекты» и «снижающий или исключающий побочные эффекты» означает снижение тяжести одного или нескольких побочных эффектов, указанных в настоящем документе.
Следует отметить, что если существует расхождение между изображенной структурой и названием, данным этой структуре, изображенная структура должна соответствовать большему весу. Кроме того, если стереохимия структуры или участка структуры не указана, например, полужирным шрифтом или пунктирными линиями, то структуру или участок структуры следует интерпретировать как охватывающие все стереоизомеры.
В контексте настоящего документа и если не указано иное, термины «твердая форма» и родственные термины относятся к физической форме, которая преимущественно не находится в жидком или газообразном состоянии. В контексте настоящего документа и если не указано иное, термин «твердая форма» и родственные термины, когда они используются в настоящем документе в отношении соединения А, относятся к физической форме, содержащей соединение А, которое преимущественно не находится в жидком или газообразном состоянии. Твердые формы могут быть кристаллическими, аморфными или их смесями. В конкретных вариантах осуществления изобретения твердые формы могут являться жидкими кристаллами. «Однокомпонентная» твердая форма, содержащая соединение А, по существу состоит из соединения А. «Многокомпонентная» твердая форма, содержащая соединение А, содержит в твердой форме значительное количество одного или нескольких дополнительных соединений, таких как ионы и/или молекулы. В некоторых вариантах осуществления изобретения «многокомпонентная» твердая форма, содержащая соединение А, представляет собой гидрохлорид соединения А. Например, в конкретных вариантах осуществления изобретения кристаллическая многокомпонентная твердая форма, содержащая соединение А, дополнительно содержит одно или несколько соединений, нековалентно связанных в регулярных положениях в кристаллической решетке. Многокомпонентные твердые формы, содержащие соединение А, включают сокристаллы, сольваты (например, гидраты) и клатраты соединения А. В конкретных вариантах осуществления изобретения термин «твердая форма, содержащая соединение А» и родственные термины включают однокомпонентные и многокомпонентные твердые формы, содержащие соединение А. В конкретных вариантах осуществления изобретения термин «твердые формы, содержащие соединение А» и родственные термины включают кристаллические формы, содержащие соединение А, аморфные формы, содержащие соединение А, и их смеси.
В контексте настоящего документа и если не указано иное, термин «кристаллический» и родственные термины, используемые в настоящем документе, при их использовании для описания соединения, вещества, модификации, материала, компонента или продукта, если не указано иное, означают, что соединение, вещество, модификация, материал, компонент или продукт являются существу кристаллическими, как определено с помощью рентгеновской дифракции. См., например, Remington: The Science and Practice of Pharmacy, 21st edition, Lippincott, Williams and Wilkins, Baltimore, MD (2005); The United States Pharmacopeia, 23rd ed., 1843-1844 (1995).
В контексте настоящего документа и если не указано иное, термин «формы кристаллов», «кристаллические формы» и родственные термины в настоящем документе относятся к твердым формам, которые являются кристаллическими. Кристаллические формы включают однокомпонентные кристаллические формы и многокомпонентные кристаллические формы, и они включают, но без ограничения, соли (например, гидрохлориды), полиморфы, сольваты, гидраты и/или другие молекулярные комплексы. В некоторых вариантах осуществления изобретения кристаллическая форма вещества может быть по существу свободна от аморфных форм и/или других кристаллических форм. В некоторых вариантах осуществления изобретения кристаллическая форма вещества может содержать менее чем примерно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50% одной или нескольких аморфных форм и/или других кристаллических форм по весу. В некоторых вариантах осуществления изобретения кристаллическая форма вещества может быть физически и/или химически чистой. В некоторых вариантах осуществления изобретения кристаллическая форма вещества может быть примерно на 99%, 98%, 97%, 96%, 95%, 94%, 93%, 92%, 91% или 90% физически и/или химически чистой.
В контексте настоящего документа и если не указано иное, термины «полиморфы», «полиморфные формы» и родственные термины в настоящем документе относятся к двум или нескольким кристаллическим формам, которые состоят по существу из одной и той же молекулы, молекул и/или ионов. Как разные кристаллические формы, разные полиморфные формы могут иметь разные физические свойства, такие как, например, температура плавления, теплота плавления, растворимость, свойства при растворении и/или колебательный спектр, в результате организации или конформации молекулы и/или ионов в кристаллической решетке. Различия в физических свойствах могут повлиять на фармацевтические параметры, такие как стабильность при хранении, прессуемость и плотность (важно при введении в рецептуру и производстве продукта), а также скорость растворения (важный фактор для биодоступности). Различия в стабильности могут являться результатом изменений в химической реакционной способности (например, неодинакового окисления, так что лекарственная форма обесцвечивается быстрее, когда состоит из одной полиморфной формы, чем когда состоит из другой полиморфной формы) или механических изменений (например, таблетки крошатся при хранении, так как кинетически предпочтительная полиморфная форма превращается в термодинамически более стабильную полиморфную форму), или их обоих (например, таблетки из одной полиморфной формы более подвержены разрушению при высокой влажности). В крайнем случае, в результате различий в растворимости/растворении некоторые твердофазные переходы могут привести к отсутствию активности или, напротив, к токсичности. Кроме того, физические свойства могут быть важны для получения (например, одна полиморфная форма может с большей вероятностью образовывать сольваты, или ее может быть трудно фильтровать и отмывать от примесей, а также форма частиц и распределение по размерам могут различаться между полиморфными формами).
В контексте настоящего документа и если не указано иное, термины «сольват» и «сольватированный» относятся к кристаллической форме вещества, которая содержит растворитель. Термины «гидрат» и «гидратированный» относятся к сольвату, в котором растворитель содержит воду. Термин «полиморфы сольватов» относится к существованию более одной кристаллической формы для конкретной композиции сольватов. Аналогичным образом, термин «полиморфы гидратов» относится к существованию более одной кристаллической формы для конкретной композиции гидратов. Термин «десольватированный сольват» в контексте настоящего документа относится к кристаллической форме вещества, которая может быть получена удалением растворителя из сольвата.
В контексте настоящего документа и если не указано иное, термины «аморфный», «аморфная форма» и связанные с ними термины, используемые в настоящем документе, означают, что вещество, компонент или продукт, о котором идет речь, по существу не является кристаллическим, как определено рентгеновской дифракцией. В частности, термин «аморфная форма» описывает неупорядоченные твердые формы, т.е. твердые формы, в которых отсутствует протяженная кристаллическая упорядоченность. В некоторых вариантах осуществления изобретения аморфная форма вещества может быть по существу свободна от других аморфных форм и/или кристаллических форм. В других вариантах осуществления изобретения аморфная форма вещества может содержать примерно менее 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50% одной или нескольких других аморфных форм и/или кристаллических форм по весу. В некоторых вариантах осуществления изобретения аморфная форма вещества может быть физически и/или химически чистой. В некоторых вариантах осуществления изобретения аморфная форма вещества может быть примерно на 99%, 98%, 97%, 96%, 95%, 94%, 93%, 92%, 91% или 90% физически и/или химически чистой.
Методики характеристики кристаллических форм и аморфных форм включают, но без ограничения, термогравиметрический анализ (TGA), дифференциальную сканирующую калориметрию (DSC), порошковую рентгеновскую дифрактометрию (XRPD), рентгеновскую дифрактометрию монокристаллов, колебательную спектроскопию, например, инфракрасную (IR) спектроскопию и Рамановскую спектроскопию, ядерную магнитно-резонансную спектроскопию (ЯМР) твердого тела и в растворе, оптическую микроскопию, высокотемпературную оптическую микроскопию, сканирующую электронную микроскопию (SEM), электронную кристаллографию и количественный анализ, анализ размера частиц (PSA), анализ площади поверхности, исследования растворимости, исследования растворения, элементный анализ и анализ Карла Фишера. Характеристические параметры элементарной ячейки могут быть определены с использованием одного или нескольких методов, таких как, но без ограничения, рентгеновская дифракция и нейтронная дифракция, включая дифракцию на монокристаллах и порошковую дифракцию. Методы, пригодные для анализа данных порошковой дифракции, включают уточнение профиля, такое как уточнение методом Ритвельда, который можно использовать, например, для анализа дифракционных пиков, ассоциированных с одной фазой в образце, содержащем более одной твердой фазы. Другие способы, пригодные для анализа данных порошковой дифракции, включают индексацию элементарных ячеек, что позволяет специалисту в данной области определить параметры элементарной ячейки из образца, содержащего кристаллический порошок.
В контексте настоящего документа и если не указано иное, термины «примерно» и «приблизительно» при использовании в связи с числовым значением или диапазоном значений, которые приведены для описания конкретной твердой формы, например, конкретной температуры или диапазона температур, таких как, например, описывающие DSC или TGA термическое событие, включая, например, плавление, дегидратацию, десольватацию или стеклование; изменения массы, такого как, например, изменение массы в зависимости температуры или влажности; содержания растворителя или воды, например, массовым или процентным; или положения пиков, таких как, например, в анализе методами ИК-спектроскопии или Рамановской спектроскопии, или XRPD; указывают, что значение или диапазон значений могут отклоняться в такой степени, которая специалистом в данной области считается разумной, при этом все еще описывая конкретную твердую форму. Например, термины «примерно» и «приблизительно» при использовании в данном контексте и если не указано иное, указывают, что числовое значение или диапазон значений может варьировать в пределах 25%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1,5%, 1%, 0,5% или 0,25% от указанного значения или диапазона значений.
В контексте настоящего документа и если не указано иное, образец, содержащий конкретную кристаллическую форму или аморфную форму, которая является «по существу чистой», например, по существу свободной от других твердых форм и/или других химических соединений, содержит, в частных вариантах осуществления изобретения, примерно менее 25%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,75%, 0,5%, 0,25% или 0,1% (по весу) одной или нескольких других твердых форм и/или других химических соединений.
В контексте настоящего документа и если не указано иное, образец или композиция которые «по существу свободны» от одной или нескольких других твердых форм и/или других химических соединений, означает, что композиция содержит, в частных вариантах осуществления изобретения, примерно менее 25%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,75%, 0,5%, 0,25% или 0,1% по весу одной или нескольких других твердых форм и/или других химических соединений.
В контексте настоящего документа и если не указано иное, термины «лечить», «лечащий» и «лечение» относятся к устранению или ослаблению заболевания или расстройства, или одного или нескольких симптомов, ассоциированных с заболеванием или расстройством. В некоторых вариантах осуществления изобретения термины относятся к минимизации распространения или ухудшения заболевания или расстройства в результате введения одного или нескольких профилактических или терапевтических средств пациенту с таким заболеванием или расстройством. В некоторых вариантах осуществления изобретения термины относятся к введению соединения, приведенного в настоящем документе, совместно или без другого дополнительного активного средства после появления симптомов конкретного заболевания.
В контексте настоящего документа и если не указано иное, термины «предупредить», «предупреждающий» и «предупреждение» относятся к предотвращению появления, рецидива или распространения заболевания или расстройства или одного или нескольких их симптомов. В некоторых вариантах осуществления изобретения термины относятся к лечению соединением или к введению соединения, приведенного в настоящем документе, совместно или без другого дополнительного активного соединения до появления симптомов, особенно пациентам, которые имеют риск заболеваний или расстройств, указанных в настоящем документе. Термины охватывают подавление или уменьшение симптома конкретного заболевания. В частности, в некоторых вариантах осуществления изобретения пациенты с заболеванием в семейным анамнезе являются кандидатами для применения профилактических схем. Кроме того, пациенты, которые имеют в анамнезе рецидив симптомов, также являются потенциальными кандидатами для профилактики. В этом смысле термин «предупреждение» может использоваться взаимозаменяемо с термином «профилактика».
В контексте настоящего документа и если не указано иное, термины «контролировать», «контролирующий» и «контроль» относятся к предупреждению или замедлению развития, распространения или ухудшения заболевания или расстройства или одного или нескольких его симптомов. Часто полезные эффекты, которые пациент получает от профилактического и/или терапевтического средства, не приводят к излечению заболевания или расстройства. В связи с этим термин «контролирующий» охватывает лечение пациента, который имел конкретное заболевание, для того чтобы попытаться предупредить или минимизировать рецидив заболевания.
В контексте настоящего документа и если не указано иное, «терапевтически эффективное количество» соединения представляет собой количество, достаточное для обеспечения терапевтической пользы при лечении или контроле заболевания или расстройства, или для замедления или минимизации одного или нескольких симптомов, ассоциированных с заболеванием или расстройством. Терапевтически эффективное количество соединения означает количество терапевтического средства, отдельно или в сочетании с другими терапевтическими средствами, которое обеспечивает терапевтическую пользу при лечении или контроле заболевания или расстройства. Термин «терапевтически эффективное количество» может охватывать количество, которое улучшает общую терапию, снижает или устраняет симптомы или причины заболевания или расстройства, или усиливает терапевтическую эффективность другого терапевтического средства.
В контексте настоящего документа и если не указано иное, «профилактически эффективное количество» соединения представляет собой количество, достаточное для предупреждения заболевания или расстройства или предупреждения его рецидива. Профилактически эффективное количество соединения означает количество терапевтического средства, отдельно или в сочетании с другими средствами, которое обеспечивает профилактическую пользу в отношении предупреждения заболевания. Термин «профилактически эффективное количество» может охватывать количество, которое улучшает общую профилактику или усиливает профилактическую эффективность другого профилактического средства.
Предполагается, что термин «композиция» в контексте настоящего документа охватывает продукт, содержащий указанные ингредиенты (и в указанных количествах, если указано), а также продукт, который прямо или опосредованно является результатом сочетания указанных ингредиентов в указанных количествах. Под «фармацевтически приемлемым» подразумевают, что разбавитель, вспомогательные вещество или носитель должны быть совместимы с другими ингредиентами препарата и не должны быть опасными для его реципиента.
4. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к твердым формам соединения А, которое представляет собой 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион и его стереоизомеры, и их фармацевтически приемлемые соли, сольваты, гидраты, сокристаллы, клатраты и полиморфы, а также к способам применения и композициям, содержащим твердую форму соединения А или его стереоизомера, или их фармацевтически приемлемой соли, сольвата, гидрата, сокристалла, клатрата или полиморфа. Например, настоящее изобретение охватывает in vitro и in vivo применение твердой формы соединения А и включение твердой формы соединения А в фармацевтические композиции и стандартные лекарственные формы, пригодные для лечения и предупреждения различных заболеваний и расстройств.
4.1. ТВЕРДЫЕ ФОРМЫ СОЕДИНЕНИЯ А
В одном варианте осуществления изобретение относится к твердым формам соединения А или его стереоизомера, или их фармацевтически приемлемой соли, сольвата, гидрата, сокристалла, клатрата или полиморфа.
Соединение А легко получают с использованием способов, описанных в патенте США №7635700, полное содержание которого включено в настоящий документ путем ссылки.
Твердые формы, содержащие соединение А, включают однокомпонентные и многокомпонентные формы, в том числе кристаллические формы и аморфные формы, включая, но без ограничения ими, соли, полиморфы, сольваты, гидраты, сокристаллы и клатраты. Конкретные варианты осуществления настоящего изобретения относятся к однокомпонентным аморфным твердым формам соединения А. Конкретные варианты осуществления настоящего изобретения относятся к однокомпонентным кристаллическим твердым формам соединения А. Конкретные варианты осуществления настоящего изобретения относятся к многокомпонентным аморфным формам, содержащим соединение А. Конкретные варианты осуществления настоящего изобретения относятся к многокомпонентным кристаллическим твердым формам, содержащим соединение А. Многокомпонентные твердые формы, представленные в настоящем документе, включают твердые формы, которые могут быть описаны терминами «соль», «сокристалл», «гидрат», «сольват», «клатрат» и/или «полиморф», и включают твердые формы, которые могут быть описаны одним или несколькими из этих терминов.
Твердые формы, содержащие соединение А, могут быть получены способами, описанными в настоящем документе, включая способы, описанные ниже в примерах, или по методикам, известным в данной области, включая нагрев, охлаждение, сушку при замораживании, лиофилизацию, резкое охлаждение расплава, быстрое испарение растворителя, медленное испарение растворителя, перекристаллизацию из растворителя, добавление антирастворителя, перекристаллизацию из суспензии, кристаллизацию из расплава, десольватацию, перекристаллизацию в ограниченном пространстве, например, в нанопорах или капиллярах, перекристаллизацию на поверхности носителя, например, на полимерах, перекристаллизацию в присутствии добавок, таких как, например, противомолекулы в сокристалле, десольватацию, дегидратацию, быстрое охлаждение, медленное охлаждение, контакт с растворителем и/или водой, сушку, включая, например, вакуумную сушку, диффузию паров, сублимацию, измельчение (в том числе, например, крио-измельчение, измельчение в минимальном количестве растворителя или измельчение с помощью жидкости), осаждение, вызываемое микроволновым излучением, осаждение, вызываемое ультразвуковым излучением, осаждение, вызываемое лазерным излучением, и осаждение из сверхкритических жидкостей. Размер частиц полученных твердых форм, который может варьировать, например, от нанометрового до миллиметрового диапазона, можно контролировать, например, с помощью изменения условий кристаллизации, таких как, например, скорость кристаллизации и/или система растворителей для кристаллизации, или с помощью методик уменьшения размеров частиц, например, с помощью измельчения, перемалывания, микронизации или обработки ультразвуком.
Без связи с какой-либо конкретной теорией, некоторые твердые формы отличаются физическими свойствами, например, стабильностью, растворимостью и скоростью растворения, подходящими для фармацевтических и терапевтических лекарственных форм. Кроме того, хотя и без связи с какой-либо конкретной теорией, некоторые твердые формы отличаются физическими свойствами (например, плотностью, прессуемостью, твердостью, морфологией, распадаемостью, липкостью, растворимостью, поглощением воды, электрическими свойствами, температурными свойствами, реакционной способностью в твердом состоянии, физической стабильностью и химической стабильностью), влияющими на конкретные процессы (например, выход продукта, фильтрацию, промывку, сушку, измельчение, смешивание, таблетирование, текучесть, растворение, введение в рецептуру и лиофилизацию), которые делают некоторые твердые формы пригодными для изготовления твердой лекарственной формы. Такие свойства могут быть определены с использованием конкретных методов аналитической химии, включая методы анализа твердого вещества (например, рентгеновскую дифракцию, микроскопию, спектроскопию и термический анализ), описанные в настоящем документе и известные в данной области.
Некоторые варианты осуществления изобретения относятся к композициям, содержащим одну или несколько твердых форм. Некоторые варианты осуществления изобретения относятся к композициям одной или нескольких твердых форм в комбинации с другими действующими ингредиентами. Некоторые варианты осуществления относятся к способам применения этих композиций для лечения, предотвращения или контроля заболеваний и расстройств, включая, но без ограничения, заболевания и нарушения, приведенные в настоящем документе.
Твердые формы по настоящему изобретению могут также содержать неприродные соотношения изотопов одного или нескольких атомов в соединении А. Например, соединение может быть радиоактивномеченным радиоактивными изотопами, такими как, например, тритий (3H), йод-125 (125I), сера-35 (35S) или углерод-14 (14С). Радиоактивномеченные соединения пригодны в качестве терапевтических средств, например, противораковых терапевтических средств, аналитических реагентов, например, реагентов для методов анализа связывания, и диагностических средств, например, контрастных веществ. Предполагается, что все изотопные варианты соединения А, независимо от того, радиоактивные они или нет, входят в объем вариантов осуществления изобретения, приведенных в настоящем документе.
4.1.1. ФОРМА A СОЕДИНЕНИЯ A
Некоторые варианты осуществления настоящего изобретения относятся к кристаллической форме А соединения А. Форма А может быть получена кристаллизацией из смеси DMSO:вода при комнатной температуре путем растворения соединения А в смеси DMSO:вода в соотношении 95:5 (по объему) и кристаллизации путем добавления воды до объемного соотношения DMSO:вода 50:50. Обширное исследование растворителей привело к выбору системы DMSO:вода, причем вода является антирастворителем. В таблице 1 показана растворимость формы А в системе DMSO:вода по мере увеличения относительного количества DMSO.
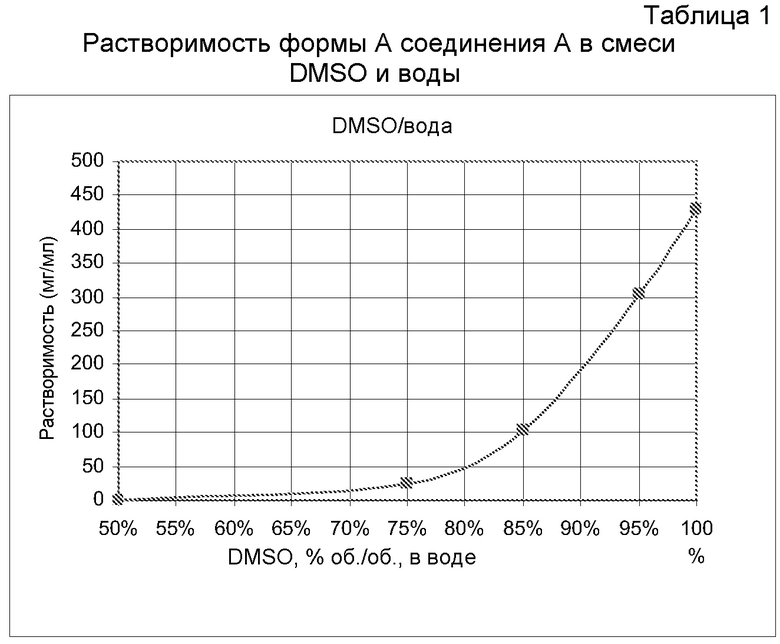
В некоторых вариантах осуществления изобретения форма А соединения А может быть охарактеризована с помощью порошковой рентгеновской дифракции. Типичная XRPD-дифрактограмма формы А соединения А приведена на фиг. 1. В некоторых вариантах осуществления изобретения форма А соединения А отличается XRPD-пиками, расположенными в одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати или тринадцати из следующих приблизительных позиций: 9,2, 13,4, 14,0, 14,6, 15,6, 16,7, 18,5, 21,9, 22,7, 24,8, 28,1, 30,0 и 37,0 градусов 2θ. В одном варианте осуществления изобретения форма А соединения А отличается XRPD-пиками, расположенными в следующих приблизительных позициях: 14,6, 15,6, 16,7, 21,9 и 30,0 градусов 2θ. В некоторых вариантах осуществления изобретения форма А соединения А отличается XRPD-дифрактограммой, которая соответствует дифрактограмме, представленной на фиг. 1. В некоторых вариантах осуществления изобретения форма А соединения А отличается XRPD-дифрактограммой, имеющей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 пиков, соответствующих пикам на типичной дифрактограмме формы А, приведенной в настоящем документе.
В некоторых вариантах осуществления изобретения форма А соединения А может быть охарактеризована с помощью термического анализа. Типичный DSC-график для формы А соединения А показан на фиг. 2. В некоторых вариантах осуществления изобретения форма А характеризуется DSC-графиком, включающим эндотермическое событие с начальной температурой около 282°С. В некоторых вариантах осуществления изобретения характеристический DSC-график формы А дополнительно содержит одно или несколько дополнительных событий, таких как, например, эндотермический пик при температуре примерно 145°С, и/или экзотермическое событие с пиковой температурой около 161°С. Типичный TGA-график для формы А соединения А показан на фиг. 3. В некоторых вариантах осуществления изобретения форма А характеризуется TGA-графиком, включающим потерю массы примерно менее чем на 10%, примерно менее чем на 8% или примерно менее чем на 6%, например, примерно на 5,9% от общей массы образца при нагревании от примерно 40°С до примерно 110°С. В одном варианте осуществления изобретения форма А характеризуется TGA-графиком, включающим потерю массы от примерно 5% до примерно 6% от общей массы образца при нагревании приблизительно от примерно 40°С до примерно 110°С. В некоторых вариантах осуществления изобретения форма А соединения А содержит либо воду, либо другой растворитель в кристаллической решетке. В некоторых вариантах осуществления изобретения событие потери массы в TGA включает потерю воды. В некоторых вариантах осуществления изобретения форма А является сольватированной. В некоторых вариантах осуществления изобретения форма А является моногидратом. В некоторых вариантах осуществления изобретения кристаллическая решетка формы А содержит примерно один молярный эквивалент воды на моль соединения А.
В некоторых вариантах осуществления изобретения после дегидратации форма А превращается в форму D соединения А. В одном варианте осуществления изобретения форма А превращается в форму D соединения А при высушивании при температуре примерно 55°С в течение 3 дней. Форма А соединения А может быть получена из формы D путем суспендирования формы D в воде при 22°С или 50°С в течение ночи.
В одном варианте осуществления изобретения форма А соединения А физически и химически стабильна при 40°С в течение 5 дней в вакууме. В другом варианте осуществления изобретения форма А соединения А физически и химически стабильна при 40°С в течение 4 дней в атмосфере азота.
В некоторых вариантах осуществления изобретения форма А соединения А может быть охарактеризована с помощью анализа сорбции влаги. В некоторых вариантах осуществления, когда относительная влажность («RH») увеличивается от примерно 0% до примерно 95% RH, масса формы А изменяется в диапазоне от примерно 1% до примерно 10%, от примерно 2% до примерно 5% или от примерно 3% до примерно 4% от исходной массы образца. В некоторых вариантах осуществления изобретения масса, полученная при адсорбции, теряется при снижении RH обратно до примерно 0% RH.
Некоторые варианты осуществления изобретения относятся к форме А соединения А, которая является по существу чистой. Некоторые варианты осуществления изобретения относятся к форме А соединения А, которая по существу является свободной от других твердых форм, содержащих соединение А, включая, например, формы B, C, D, E и F и/или аморфную твердую форму, содержащую соединение А по настоящему изобретению, а также форму A1 и аморфную твердую форму, включающие гидрохлорид соединения А по настоящему изобретению. Некоторые варианты осуществления изобретения относятся к форме А в виде смеси твердых форм, содержащих соединение А, в том числе, например, смеси, содержащей одну или несколько из следующих форм: формы B, C, D, E, F и аморфную твердую форму, содержащие соединение А по настоящему изобретению, а также форму A1 и аморфную твердую форму, содержащие гидрохлорид соединения А по настоящему изобретению.
4.1.2. ФОРМА В СОЕДИНЕНИЯ А
Некоторые варианты осуществления изобретения относятся к кристаллической форме В соединения А. В некоторых вариантах осуществления изобретения форма B соединения А может быть получена из различных растворителей, включая, но без ограничения, систему растворителей, содержащую ацетон, ацетонитрил, метанол и их смеси. В некоторых вариантах осуществления изобретения форма B может быть получена с использованием способа перекристаллизации из суспензии. В некоторых вариантах осуществления изобретения форму В получают с использованием способа перекристаллизации из суспензии в ацетоне, ацетонитриле, метаноле или их смесях, при температуре около 50°С.
В некоторых вариантах осуществления изобретения форма В соединения А может быть охарактеризована с помощью порошковой рентгеновской дифракции. Типичная XRPD-дифрактограмма формы В соединения А приведена на фиг. 4. В некоторых вариантах осуществления изобретения форма В соединения А отличается XRPD-пиками, расположенными в одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати или шестнадцати из следующих приблизительных позиций: 10,6, 11,4, 12,6, 13,7, 14,7, 19,1, 20,3, 20,9, 21,2, 22,9, 24,9, 25,3, 25,9, 26,9, 29,5 и 33,8 градусов 2θ. В одном варианте осуществления изобретения форма В соединения А отличается XRPD-пиками, расположенными в следующих приблизительных позициях: 10,6, 14,7, 19,1 и 25,9 градусов 2θ. В некоторых вариантах осуществления изобретения форма В соединения А отличается XRPD-дифрактограммой, которая соответствует дифрактограмме, представленной на фиг. 4. В некоторых вариантах осуществления изобретения форма В соединения А отличается XRPD-дифрактограммой, имеющей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 пиков, соответствующих пикам на типичной дифрактограмме формы В, приведенной в настоящем документе.
В некоторых вариантах осуществления изобретения форма В соединения А может быть охарактеризована с помощью термического анализа. Типичный DSC-график для формы В соединения А показан на фиг. 5. В некоторых вариантах осуществления изобретения форма В характеризуется DSC-графиком, включающим эндотермическое событие с начальной температурой около 279°С. Типичный TGA-график для формы В соединения А показан на фиг. 6. В некоторых вариантах осуществления изобретения форма В характеризуется TGA-графиком, включающим потерю массы примерно менее чем на 1%, примерно менее чем на 0,5%, примерно менее чем на 0,1% или примерно менее чем на 0,05% от общей массы образца при нагревании от примерно 25°С до примерно 200°С. В некоторых вариантах осуществления изобретения форма В соединения А не содержит существенного количества воды или другого растворителя в кристаллической решетке. В некоторых вариантах осуществления изобретения форма В является безводной. В некоторых вариантах осуществления форма В является несольватированной.
В некоторых вариантах осуществления изобретения форма В соединения А может быть охарактеризована с помощью анализа сорбции влаги. В некоторых вариантах осуществления, когда RH увеличивается от примерно 0% до примерно 95% RH, масса формы В изменяется менее чем примерно на 1%, менее чем примерно на 0,5% или менее чем примерно на 0,2%, например, примерно на 0,1%, от исходной массы образца. В некоторых вариантах осуществления изобретения масса, набранная при адсорбции, теряется при снижении RH обратно до примерно 0% RH. В некоторых вариантах осуществления изобретения форма В по существу негигроскопична. В некоторых вариантах осуществления изобретения XRPD-дифрактограмма вещества формы В по существу не изменяется после анализа адсорбции/десорбции. В некоторых вариантах осуществления изобретения форма B устойчива к влажности.
Некоторые варианты осуществления изобретения относятся к форме В соединения А, которая является по существу чистой. Некоторые варианты осуществления изобретения относятся к форме В соединения А, которая по существу является свободной от других твердых форм, содержащих соединение А, включая, например, формы А, C, D, E, F и/или аморфную твердую форму, содержащие соединение А по настоящему изобретению, а также форму A1 и аморфную твердую форму, содержащие гидрохлорид соединения А по настоящему изобретению. Некоторые варианты осуществления изобретения относятся к форме В в виде смеси твердых форм, содержащих соединение А, в том числе, например, смеси, содержащей одну или несколько из следующих форм: формы А, C, D, E, F и аморфную твердую форму, содержащие соединение А по настоящему изобретению, а также форму A1 и аморфную твердую форму, содержащие гидрохлорид соединения А по настоящему изобретению.
4.1.3. ФОРМА C СОЕДИНЕНИЯ A
Некоторые варианты осуществления изобретения относятся к кристаллической форме С соединения А. В некоторых вариантах осуществления изобретения форма C соединения А может быть получена из различных растворителей, включая, но без ограничения, системы растворителей, содержащих этилацетат, этанол, 2-пропанол, метилэтилкетон, н-бутанол, тетрагидрофуран и смеси, содержащие два или несколько из них. В некоторых вариантах осуществления изобретения форма С может быть получена с использованием перекристаллизации из суспензии. В некоторых вариантах осуществления изобретения форму C получают с использованием перекристаллизации из суспензии из этилацетата, этанола, 2-пропанола, метилэтилкетона, н-бутанола, тетрагидрофурана или смеси, содержащей два или несколько из них, при температуре примерно 50°С.
В некоторых вариантах осуществления изобретения форма С соединения А может быть охарактеризована с помощью порошковой рентгеновской дифракции. Типичная XRPD-дифрактограмма формы С соединения А приведена на фиг. 7. В некоторых вариантах осуществления изобретения форма С соединения А отличается XRPD-пиками, расположенными в одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти или одиннадцати из следующих приблизительных позиций: 10,8, 11,9, 15,1, 18,8, 19,2, 19,3, 22,0, 24,9, 25,1, 26,6 и 29,2 градусов 2θ. В одном варианте осуществления изобретения форма С соединения А отличается XRPD-пиками, расположенными в следующих приблизительных позициях: 10,8, 15,1, 25,1 и 26,6 градусов 2θ. В некоторых вариантах осуществления изобретения форма С соединения А отличается XRPD-дифрактограммой, которая соответствует дифрактограмме, представленной на фиг. 7. В некоторых вариантах осуществления изобретения форма С соединения А отличается XRPD-дифрактограммой, имеющей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 пиков, соответствующих пикам на типичной дифрактограмме формы С, приведенной в настоящем документе.
В некоторых вариантах осуществления изобретения форма С соединения А может быть охарактеризована с помощью термического анализа. Типичный DSC-график для формы С соединения А показан на фиг. 8. В некоторых вариантах осуществления изобретения форма С характеризуется DSC-графиком, включающим эндотермическое событие с начальной температурой около 281°С. Типичный TGA-график для формы С соединения А показан на фиг. 9. В некоторых вариантах осуществления изобретения форма С характеризуется TGA-графиком, включающим потерю массы примерно менее чем на 1%, примерно менее чем на 0,5% или примерно менее чем на 0,1%, например, примерно на 0,07% от общей массы образца при нагревании от примерно 25°С до примерно 150°С. В некоторых вариантах осуществления изобретения форма С соединения А не содержит существенного количества воды или другого растворителя в кристаллической решетке. В некоторых вариантах осуществления изобретения форма С является безводной. В некоторых вариантах осуществления форма С является несольватированной.
В некоторых вариантах осуществления изобретения форма С соединения А может быть охарактеризована с помощью анализа сорбции влаги. В некоторых вариантах осуществления, когда RH увеличивается от примерно 0% до примерно 95% RH, масса формы С изменяется менее чем примерно на 1%, менее чем примерно на 0,5% или менее чем примерно на 0,2%, например, примерно на 0,17%, от исходной массы образца. В некоторых вариантах осуществления изобретения масса, набранная при адсорбции, теряется при снижении RH обратно до примерно 0% RH. В некоторых вариантах осуществления изобретения форма С по существу негигроскопична. В некоторых вариантах осуществления изобретения XRPD-дифрактограмма вещества формы С по существу не изменяется после анализа адсорбции/десорбции. В некоторых вариантах осуществления изобретения форма С устойчива к влажности.
Некоторые варианты осуществления изобретения относятся к форме С соединения А, которая является по существу чистой. Некоторые варианты осуществления изобретения относятся к форме С соединения А, которая по существу является свободной от других твердых форм, содержащих соединение А, включая, например, формы А, В, D, E, F и/или аморфную твердую форму, содержащие соединение А по настоящему изобретению, а также форму A1 и аморфную твердую форму, содержащие гидрохлорид соединения А по настоящему изобретению. Некоторые варианты осуществления изобретения относятся к форме С в виде смеси твердых форм, содержащих соединение А, в том числе, например, смеси, содержащей одну или несколько из следующих форм: формы А, В, D, E, F и аморфную твердую форму, содержащие соединение А по настоящему изобретению, а также форму A1 и аморфную твердую формы, содержащие гидрохлорид соединения А по настоящему изобретению.
4.1.4. ФОРМА D СОЕДИНЕНИЯ A
Некоторые варианты осуществления изобретения относятся к форме D соединения А. В определенных вариантах осуществления изобретения форма D соединения А может быть получена путем сушки формы А соединения А в печи. В некоторых вариантах осуществления изобретения форму D получают путем сушки формы А в печи при температуре около 70°С.
В некоторых вариантах осуществления изобретения форма D соединения А может быть охарактеризована с помощью порошковой рентгеновской дифракции. Типичная XRPD-дифрактограмма формы D соединения А приведена на фиг. 10. В некоторых вариантах осуществления изобретения форма D соединения А отличается XRPD-пиками, расположенными в одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати или четырнадцати из следующих приблизительных позиций: 10,6, 14,0, 14,6, 15,7, 16,3, 16,7, 18,8, 21,7, 21,9, 24,8, 25,1, 25,8, 28,1 и 28,6 градусов 2θ. В одном варианте осуществления изобретения форма D соединения А отличается XRPD-пиками, расположенными в следующих приблизительных позициях: 16,7, 21,7, 21,9 и 25,8 градусов 2θ. В некоторых вариантах осуществления изобретения форма D соединения А отличается XRPD-дифрактограммой, имеющей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 пиков, соответствующих пикам на типичной дифрактограмме формы D, приведенной в настоящем документе.
В некоторых вариантах осуществления изобретения форма D соединения А может быть охарактеризована с помощью термического анализа. Типичный DSC-график для формы D соединения А показан на фиг. 11. В некоторых вариантах осуществления изобретения форма D характеризуется DSC-графиком, включающим эндотермическое событие с начальной температурой около 283°С. В некоторых вариантах осуществления изобретения характеристический DSC-график формы D дополнительно содержит одно дополнительное событие, такое как, например, эндотермическое событие с пиковой температурой примерно 114°С. Типичный TGA-график для формы D соединения А показан на фиг. 12. В некоторых вариантах осуществления изобретения форма D характеризуется TGA-графиком, включающим потерю массы примерно менее чем на 10%, примерно менее чем на 8%, примерно менее чем на 6%, примерно менее чем на 4%, например, примерно на 3% от общей массы образца при нагревании от примерно 25°С до примерно 150°С. В некоторых вариантах осуществления изобретения событие потери массы в TGA включает потерю воды. В некоторых вариантах осуществления изобретения форма D соединения А является сольватированной. В некоторых вариантах осуществления изобретения форма D является гидратированной.
В некоторых вариантах осуществления изобретения форма D соединения А может быть охарактеризована с помощью анализа сорбции влаги. В некоторых вариантах осуществления, когда RH увеличивается от примерно 0% до примерно 95% RH, масса формы D изменяется менее чем примерно на 5%, например, примерно на 4%, от исходной массы образца. В некоторых вариантах осуществления изобретения масса, набранная при адсорбции, теряется при снижении RH обратно до примерно 0% RH.
Некоторые варианты осуществления изобретения относятся к форме D соединения А, которая является по существу чистой. Некоторые варианты осуществления изобретения относятся к форме D соединения А, которая по существу является свободной от других твердых форм, содержащих соединение А, включая, например, формы А, В, С, D, E, F и/или аморфную твердую форму, содержащие соединение А по настоящему изобретению, а также форму A1 и аморфную твердую форму, содержащие гидрохлорид соединения А по настоящему изобретению. Некоторые варианты осуществления изобретения относятся к форме D в виде смеси твердых форм, содержащих соединение А, в том числе, например, смеси, содержащей одну или несколько из следующих форм: формы А, В, С, E, F и аморфную твердую форму, содержащие соединение А по настоящему изобретению, а также форму A1 и аморфную твердую форму, содержащие гидрохлорид соединения А по настоящему изобретению.
4.1.5. ФОРМА E СОЕДИНЕНИЯ A
Некоторые варианты осуществления изобретения относятся к кристаллической форме E соединения А. В некоторых вариантах осуществления изобретения форма Е соединения А может быть получена из различных растворителей, включая, но без ограничения ими, системы растворителей, включающие ацетонитрил или изопропанол, и их смеси. В некоторых вариантах осуществления изобретения форма Е может быть получена с использованием способа перекристаллизации из суспензии. В некоторых вариантах осуществления изобретения форма Е может быть получена с использованием способа перекристаллизации из суспензии при комнатной температуре. Форма Е также может быть получена путем способом перекристаллизации из антирастворителя путем растворения соединения А в DMF или NMP и быстрого добавления воды в качестве антирастворителя.
В некоторых вариантах осуществления изобретения форма Е соединения А может быть охарактеризована с помощью порошковой рентгеновской дифракции. Типичная XRPD-дифрактограмма формы Е соединения А приведена на фиг. 13. В некоторых вариантах осуществления изобретения форма Е соединения А отличается XRPD-пиками, расположенными в одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати или тринадцати из следующих приблизительных позиций: 7,3, 9,3, 12,2, 14,0, 14,6, 15,7, 16,8, 21,0, 22,0, 22,7, 29,4, 30,0 и 37,0 градусов 2θ. В одном варианте осуществления изобретения форма Е соединения А отличается XRPD-пиками, расположенными в следующих приблизительных позициях: 7,3, 14,6, 22,0, 30,0 и 37,0 градусов 2θ. В некоторых вариантах осуществления изобретения форма Е соединения А отличается XRPD-дифрактограммой, которая соответствует дифрактограмме, представленной на фиг. 13. В некоторых вариантах осуществления изобретения форма Е соединения А отличается XRPD-дифрактограммой, имеющей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 пиков, соответствующих пикам на типичной дифрактограмме формы Е, приведенной в настоящем документе.
В некоторых вариантах осуществления изобретения форма Е соединения А может быть охарактеризована с помощью термического анализа. Типичный DSC-график для формы Е соединения А показан на фиг. 14. В некоторых вариантах осуществления изобретения форма Е характеризуется DSC-графиком, включающим эндотермическое событие с начальной температурой около 279°С. В некоторых вариантах осуществления изобретения характеристический DSC-график формы Е дополнительно содержит одно дополнительное событие, такое как, например, эндотермическое событие с пиковой температурой примерно 146°С. Типичный TGA-график для формы Е соединения А показан на фиг. 15. В некоторых вариантах осуществления изобретения форма Е характеризуется TGA-графиком, включающим потерю массы примерно менее чем на 10%, примерно менее чем на 8%, примерно менее чем на 6%, например, примерно на 5,97% от общей массы образца при нагревании от примерно 25°С до примерно 150°С. В некоторых вариантах осуществления изобретения событие потери массы в TGA включает потерю воды. В некоторых вариантах осуществления изобретения форма Е соединения А является сольватированной. В некоторых вариантах осуществления изобретения форма Е является гидратированной.
В некоторых вариантах осуществления изобретения форма Е соединения А может быть охарактеризована с помощью анализа сорбции влаги. В некоторых вариантах осуществления, когда RH увеличивается от примерно 0% до примерно 95% RH, масса формы Е изменяется менее чем примерно на 2%, менее чем примерно на 1% или менее чем примерно на 0,5%, например, примерно на 0,4%, от исходной массы образца. В некоторых вариантах осуществления изобретения масса, набранная при адсорбции, теряется при снижении RH обратно до примерно 0% RH. В некоторых вариантах осуществления изобретения форма Е по существу негигроскопична. В некоторых вариантах осуществления изобретения XRPD-дифрактограмма вещества формы Е по существу не изменяется после анализа адсорбции/десорбции. В некоторых вариантах осуществления изобретения форма Е устойчива к влажности.
Некоторые варианты осуществления изобретения относятся к форме Е соединения А, которая является по существу чистой. Некоторые варианты осуществления изобретения относятся к форме Е соединения А, которая по существу является свободной от других твердых форм, содержащих соединение А, включая, например, формы А, В, С, D, F и/или аморфную твердую форму, содержащие соединение А по настоящему изобретению, а также форму A1 и аморфную твердую форму, содержащие гидрохлорид соединения А по настоящему изобретению. Некоторые варианты осуществления изобретения относятся к форме Е в виде смеси твердых форм, содержащих соединение А, в том числе, например, смеси, содержащей одну или несколько из следующих форм: формы А, В, С, D, F и аморфную твердую форму, содержащие соединение А по настоящему изобретению, а также форму A1 и аморфную твердую форму, содержащие гидрохлорид соединения А по настоящему изобретению.
4.1.6. ФОРМА F СОЕДИНЕНИЯ A
Некоторые варианты осуществления изобретения относятся к кристаллической форме F соединения А. В некоторых вариантах осуществления изобретения форма F соединения А может быть получена из различных растворителей, включая, но без ограничения ими, системы растворителей, содержащие воду. В некоторых вариантах осуществления изобретения форма F может быть получена с использованием способа перекристаллизации из суспензии.
В некоторых вариантах осуществления изобретения форма F соединения А может быть охарактеризована с помощью порошковой рентгеновской дифракции. Типичная XRPD-дифрактограмма формы F соединения А приведена на фиг. 16. В некоторых вариантах осуществления изобретения форма F соединения А отличается XRPD-пиками, расположенными в одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти из следующих приблизительных позиций: 7,2, 9,1, 14,5, 15,7, 16,8, 18,3, 21,9, 22,7, 29,9 и 36,9 градусов 2θ. В одном варианте осуществления изобретения форма F соединения А отличается XRPD-пиками, расположенными в следующих приблизительных позициях: 14,5, 15,7, 22,7 и 29,9 градусов 2θ. В некоторых вариантах осуществления изобретения форма F соединения А отличается XRPD-дифрактограммой, которая соответствует дифрактограмме, представленной на фиг. 16. В некоторых вариантах осуществления изобретения форма F соединения А отличается XRPD-дифрактограммой, имеющей 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 пиков, соответствующих пикам на типичной дифрактограмме формы F, приведенной в настоящем документе.
В некоторых вариантах осуществления изобретения форма F соединения А может быть охарактеризована с помощью термического анализа. Типичный DSC-график для формы Е соединения А показан на фиг. 17. В некоторых вариантах осуществления изобретения форма F характеризуется DSC-графиком, включающим эндотермическое событие с начальной температурой около 267°С. В некоторых вариантах осуществления изобретения характеристический DSC-график формы F дополнительно содержит одно дополнительное событие, такое как, например, экзотермическое событие с пиковой температурой примерно 170°С. В некоторых вариантах осуществления изобретения форма F соединения А является сольватированной. В некоторых вариантах осуществления изобретения форма F является гидратированной.
Некоторые варианты осуществления изобретения относятся к форме F соединения А, которая является по существу чистой. Некоторые варианты осуществления изобретения относятся к форме F соединения А, которая по существу является свободной от других твердых форм, содержащих соединение А, включая, например, формы А, В, С, D, Е и/или аморфную твердую форму, содержащие соединение А по настоящему изобретению, а также форму A1 и аморфную твердую форму, содержащие гидрохлорид соединения А по настоящему изобретению. Некоторые варианты осуществления изобретения относятся к форме F в виде смеси твердых форм, содержащих соединение А, в том числе, например, смеси, содержащей одну или несколько из следующих форм: формы А, В, С, D, Е и аморфную твердую форму, содержащие соединение А по настоящему изобретению, а также форму A1 и аморфную твердую форму, содержащие гидрохлорид соединения А по настоящему изобретению.
4.1.7. ФОРМА A1 ГИДРОХЛОРИДА СОЕДИНЕНИЯ A
Некоторые варианты осуществления изобретения относятся к кристаллической форме A1 гидрохлорида соединения А. В некоторых вариантах осуществления изобретения форма A1 может быть получена из различных растворителей, включая, но без ограничения ими, системы растворителей, содержащие ацетон, ацетонитрил, н-бутанол, этанол, этилацетат, гептан, метанол, метиленхлорид, метилэтилкетон, метил трет-бутиловый эфир, 2-пропанол, толуол, тетрагидрофуран, воду и их смеси. В некоторых вариантах осуществления изобретения форма A1 может быть получена с использованием способа кристаллизации быстрым или медленным охлаждением. В некоторых вариантах осуществления изобретения форма A1 может быть получена с использованием способа кристаллизации добавлением антирастворителя.
Форма A1 гидрохлорида соединения А является стабильной кристаллической формой. Например, найдено, что форма A1 химически стабильна в течение 6 недель при хранении при комнатной температуре, воздействии воздуха и света. Также найдено, что форма A1 химически стабильна при хранении при 40°С в вакууме. Также найдено, что форма A1 химически стабильна при хранении при 40°С в атмосфере азота. Также найдено, что форма A1 химически стабильна при хранении при 40°С и относительной влажности (RH) 75%. Также найдено, что форма A1 химически стабильна при хранении при 60°С в закрытом контейнере. На основании этих данных было определено, что форма A1 соединения А достаточно стабильна для крупномасштабного производства (пример 5.4.3.2).
В некоторых вариантах осуществления изобретения форма А1 может быть охарактеризована с помощью порошковой рентгеновской дифракции. Типичная XRPD-дифрактограмма формы А1 приведена на фиг. 18. В некоторых вариантах осуществления изобретения форма А1 отличается XRPD-пиками, расположенными в одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти из следующих приблизительных позиций: 8,6, 11,3, 13,1, 15,3, 17,3, 20,5, 22,7, 23,6, 26,3 и 31,4 градусов 2θ. В одном варианте осуществления изобретения форма А1 отличается XRPD-пиками, расположенными в следующих приблизительных позициях: 8,6, 13,1, 20,5 и 26,3 градусов 2θ. В некоторых вариантах осуществления изобретения форма А1 отличается XRPD-дифрактограммой, которая соответствует дифрактограмме, представленной на фиг. 18. В некоторых вариантах осуществления изобретения форма А1 отличается XRPD-дифрактограммой, имеющей 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 пиков, соответствующих пикам на типичной дифрактограмме формы А1, приведенной в настоящем документе.
В некоторых вариантах осуществления изобретения форма A1 гидрохлорида соединения А может быть охарактеризована термическим анализом. Типичный DSC-график для формы A1 показан на фиг. 19. В некоторых вариантах осуществления изобретения форма A1 характеризуется DSC-графиком, включающим эндотермическое событие с начальной температурой примерно 276°С. В некоторых вариантах осуществления изобретения форма A1 имеет температуру разложения примерно 276°С. Типичный TGA-график для формы A1 соединения А показан на фиг. 20. В некоторых вариантах осуществления изобретения форма A1 характеризуется TGA-графиком, включающим потерю массы менее чем примерно на 1%, менее чем примерно на 0,5%, менее чем примерно на 0,2%, менее чем примерно на 0,1%, менее чем примерно на 0,05%, менее чем примерно на 0,01%, например, примерно на 0,0008%, от общей массы образца при нагревании приблизительно от 25°С до примерно 150°С. В некоторых вариантах осуществления изобретения форма A1 соединения А не содержит существенного количества воды или другого растворителя в кристаллической решетке. В некоторых вариантах осуществления изобретения форма A1 является несольватированной. В некоторых вариантах осуществления изобретения форма A1 является безводной.
В некоторых вариантах осуществления изобретения форма А1 может быть охарактеризована с помощью анализа сорбции влаги. Типичная изотерма сорбции влаги показана на рис. 21. В некоторых вариантах осуществления, когда относительная влажность («RH») увеличивается от примерно 0% до примерно 95% RH, масса формы А1 изменяется менее чем примерно на 1%, менее чем примерно на 0,5%, менее чем примерно на 0,2% (например, примерно на 0,15%) от исходной массы образца. В некоторых вариантах осуществления изобретения масса, набранная при адсорбции, теряется при снижении RH обратно до примерно 0% RH. Соответственно, в некоторых вариантах осуществления изобретения форма А1 по существу негигроскопична. В некоторых вариантах осуществления изобретения XRPD-дифрактограмма вещества формы А1 по существу не изменяется после анализа адсорбции/десорбции. В некоторых вариантах осуществления изобретения форма А1 устойчива к влажности.
В некоторых вариантах осуществления изобретения форма A1 гидрохлорида соединения А может быть охарактеризована ее профилем стабильности. В некоторых вариантах осуществления изобретения вещество формы A1 является стабильным, например, его XRPD-дифрактограмма остается по существу неизменной при воздействии повышенной температуры, при воздействии повышенной влажности, при воздействии одного или нескольких растворителей, и/или при сжатии. Например, в некоторых вариантах осуществления изобретения форма A1 стабильна при примерно 40°С и относительной влажности 75% в течение примерно четырех недель. Например, в некоторых вариантах осуществления изобретения форма A1 стабильна при комнатной температуре и примерно 95%-й относительной влажности в течение примерно четырех дней. В некоторых вариантах осуществления изобретения форма A1 стабильна после воздействия одного или нескольких растворителей, включая, например, ацетон, ацетонитрил, н-бутанол, этанол, этилацетат, гептан, метанол, метиленхлорид, метилэтилкетон, метил трет-бутиловый эфир, 2-пропанол, толуол и/или тетрагидрофуран, при температуре около 50°С в течение по меньшей мере около 24 часов. В некоторых вариантах осуществления изобретения форма A1 стабильна при давлении около 2000 psi (13,79 МПа) в течение примерно одной минуты.
В некоторых вариантах осуществления изобретения форма А1 может быть охарактеризована анализом частиц. В некоторых вариантах осуществления изобретения образец формы А1 содержит частицы, имеющие игольчатую морфологию.
Некоторые варианты осуществления изобретения относятся к форме A1 соединения А, которая является по существу чистой. Некоторые варианты осуществления изобретения относятся к форме A1 гидрохлорида соединения А, которая является по существу свободной от других твердых форм, содержащих соединение А, включая, например, аморфную твердую форму, содержащую гидрохлорид соединения А по настоящему изобретению, и формы A, B, C, D, E, F и/или аморфную твердую форму, содержащие соединение А по настоящему изобретению. Некоторые варианты осуществления изобретения относятся к форме A1 в качестве смеси твердых форм, содержащих соединение А, включая, например, смесь, содержащую одну или несколько из следующих форм: формы A, B, C, D, E, F и аморфную твердую форму А1, содержащие соединение А по настоящему изобретению, и аморфную твердую форму, содержащую гидрохлорид соединения А по настоящему изобретению.
Некоторые варианты осуществления изобретения относятся к форме А1 гидрохлорида соединения А, причем молярное соотношение соединения А и гидрохлорида в форме А варьирует от примерно 0,1 до примерно 10, от примерно 0,2 до примерно 5, от примерно 0,5 до примерно 2, от примерно 0,6 до примерно 1,5, от примерно 0,7 до примерно 1,3, от примерно 0,8 до примерно 1,2, от примерно 0,9 до примерно 1,1 или от примерно 0,95 до примерно 1,05. В некоторых вариантах осуществления изобретения молярное соотношение соединения и гидрохлорида в форме А1 составляет примерно 0,5, примерно 0,6, примерно 0,7, примерно 0,8, примерно 0,9, примерно 0,95, примерно 1, примерно 1,05, примерно 1,1, примерно 1,2, примерно 1,3, примерно 1,4 или примерно 1,5.
4.2. СПОСОБЫ ЛЕЧЕНИЯ
Изобретение охватывает способы лечения, предупреждения и/или контроля различных заболеваний или расстройств с использованием твердой формы соединения А или его стереоизомера, или их фармацевтически приемлемой соли, сольвата, гидрата, сокристалла, клатрата или полиморфа, которые включают введение терапевтически или профилактически эффективного количества одной или нескольких твердых форм, содержащих соединение А, таких как, например, форма А, B, C, D, E или аморфная форма соединения А, или форма А1 или аморфная форма гидрохлорида соединения А по настоящему изобретению.
Не ограничиваясь какой-либо теорией, соединение А может контролировать ангиогенез или может ингибировать синтез некоторых цитокинов, включая, но без ограничения ими, TNF-α, IL-1β, IL-12, IL-18, GM-CSF и/или IL-6. Без ограничения какой-либо конкретной теорией, соединение А может стимулировать синтез некоторых других цитокинов, в том числе IL-10; а также может действовать как вспомогательный сигнал для активации Т-клеток, что приводит к повышенному синтезу цитокинов, таких как, но без ограничения ими, IL-12 и/или IFN-γ. Кроме того, соединение А может усиливать эффекты NK-клеток и опосредованную антителами клеточную цитотоксичность (ADCC). Кроме того, соединение А может быть иммуномодулирующим и/или цитотоксичным и, следовательно, может быть пригодным в качестве химиотерапевтического средства. Следовательно, без ограничения какой-либо конкретной теорией, некоторые или все такие характеристики, которыми обладает соединение А могут сделать его полезным для лечения, контроля и/или предупреждения различных заболеваний или расстройств.
Примеры заболеваний или расстройств включают, но без ограничения ими, рак, заболевания, ассоциированные с ангиогенезом, боли, в том числе, но без ограничения этим, комплексный региональный болевой синдром (CRPS), дегенерацию желтого пятна (MD) и сопутствующие синдромы, кожные заболевания, легочные заболевания, связанные с асбестом заболевания, паразитарные заболевания, иммунодефицитные расстройства, расстройства ЦНС, поражения ЦНС, атеросклероз и сопутствующие расстройства, нарушение сна и сопутствующие расстройства, гемоглобинопатию и сопутствующие расстройства (например, анемию), TNFα-связанные расстройства и другие различные заболевания и расстройства.
Примеры рака и предраковых состояний включают, но без ограничения этим, рак и предраковые состояния, описанные в патентах США №6281230 и 5635517, Muller et al., в различных патентных публикациях на имя Zeldis, включая публикации № 2004/0220144А1, опубликованную 4 ноября 2004 г. (Treatment of Myelodysplastic Syndrom), 2004/00298332А1, опубликованную 12 февраля 2004 г. (Treatment of Various Types of Cancer); и 2004/0087546, опубликованную 6 мая 2004 г. (Treatment of Myeloproliferative Diseases). Примеры также включают рак и предраковые состояния, описанные в WO 2004/103274, опубликованной 2 декабря 2004 г. Полное содержание указанных ссылок включено в настоящий документ путем ссылки.
Конкретные примеры рака включают, но без ограничения этим, раковые заболевания кожи, например, меланому; лимфатических узлов; молочных желез; шейки матки; матки; желудочно-кишечного тракта; легких; яичников; простаты; толстой кишки; прямой кишки; ротовой полости; головного мозга; головы и шеи; горла; семенников; почек; поджелудочной железы; кости; селезенки; печени; мочевого пузыря; гортани; носовых проходов и раковые заболевания, связанные со СПИД. Соединения также могут быть пригодны для лечения раковых заболеваний крови и костного мозга, таких как множественная миелома, и острая и хроническая лейкемии, например лимфобластная, миелогенная, лимфоцитарная и миелоцитарная лейкемии. Соединения по изобретению могут использоваться для лечения, предупреждения или контроля либо первичных, либо метастатических опухолей.
Другие конкретные виды раковых заболеваний включают, но без ограничения ими, злокачественные новообразования на поздней стадии, амилоидоз, нейробластому, менингиому, гемангиоперицитому, множественные метастазы мозга, мультиформную глиобластому, глиобластому, глиому ствола мозга, плохо прогнозируемую злокачественную опухоль мозга, злокачественную глиому, рецидивирующую злокачественную глиому, анапластическую астроцитому, анапластическую олигодендроглиому, нейроэндокринную опухоль, ректальную аденокарциному, колоректальный рак на стадиях Dukes C и D, неоперируемую колоректальную карциному, метастатическую гепатоцеллюлярную карциному, саркому Капоши, кариотипную острую нейробластную лейкемию, хроническую лимфоцитарную лейкемию (CLL), ходжкинскую лимфому, неходжкинскую лимфому, Т-клеточную лимфому кожи, В-клеточную лимфому кожи, диффузную крупно-В-клеточную лимфому, высокодифференцированную фолликулярную лимфому, метастатическую меланому (локализованную меланому, включая, но без ограничения этим, глазную меланому), злокачественную мезотелиому, синдром плеврального выпота при злокачественной мезотелиоме, перитонеальную карциному, папиллярную серозную карциному, гинекологическую саркому, саркому мягких тканей, склеродерму, васкулит кожи, гистиоцитоз клеток Лангерганса, лейомиосаркому, прогрессивную оссифицирующую фибродисплазию, устойчивый к гормонам рак простаты, удаленную саркому мягкой ткани высокого риска, неоперабельную печеночно-клеточную карциному, макроглобулинемию Вальденстрема, вялотекущую миелому, медленно растущую миелому, рак фаллопиевых труб, андроген-независимый рак простаты, андроген-зависимый неметастазирующий рак простаты IV стадии, устойчивый к гормонам рак простаты, невосприимчивый к химиотерапии рак простаты, папиллярную карциному щитовидной железы, фолликулярную карциному щитовидной железы, медуллярную карциному щитовидной железы и лейомиому. В конкретном варианте осуществления изобретения рак является метастатическим. В другом варианте осуществления изобретения рак является невосприимчивым или устойчивым к химиотерапии или лучевой терапии.
В одном из вариантов осуществления изобретения предложены способы лечения, предупреждения или контроля различных форм лейкемии, таких как хроническая лимфоцитарная лейкемия, хроническая миелоцитарная лейкемия, острая лимфобластная лейкемия, острая миелогенная лейкемия и острая миелобластная лейкемия, включая лейкемии, являющиеся рецидивирующими, невосприимчивыми или устойчивыми, которые описаны в публикации США 2006/0030594, опубликованной 9 февраля 2006 г., полное содержание которой включено в настоящий документ путем ссылки.
Термин «лейкемия» относится к злокачественным новообразованиям кроветворных тканей. Термин «лейкемия» включает, но без ограничения ими, хроническую лимфоцитарную лейкемию, хроническую миелоцитарную лейкемию, острую лимфобластную лейкемию, острую миелогенную лейкемию и острую миелобластную лейкемию. Лейкемия может быть рецидивирующей, невосприимчивой или устойчивой к обычной терапии. Определение «рецидивирующая» относится к ситуации, когда у пациентов с лейкемией, находящихся в ремиссии после терапии, наблюдается повторное появление лейкемических клеток в костном мозге и снижение количества нормальных клеток крови. Термин «невосприимчивый или устойчивый» относится к ситуации, когда пациенты, даже после интенсивного лечения, имеют остаточные лейкемические клетки в костном мозге.
В других вариантах осуществления изобретения предложены способы лечения, предупреждения или контроля различных типов лимфом, включая неходжкинскую лимфому (NHL). Термин «лимфома» относится к гетерогенной группе новообразований, возникающих в ретикулоэндотелиальной и лимфатической системах. «NHL» относится к злокачественной моноклональной пролиферации лимфоидных клеток в тканях иммунной системы, включая лимфоузлы, костный мозг, селезенку, печень и желудочно-кишечный тракт. Примеры NHL включают, но без ограничения ими, лимфому из клеток мантийной зоны (MCL), лимфоцитарную лимфому промежуточной степени дифференцировки, промежуточную лимфоцитарную лимфому (ILL), диффузную низкодифференцированную лимфоцитарную лимфому (PDL), центроцитарную лимфому, диффузную мелкоклеточную лимфому с расщепленными ядрами (DSCCL), фолликулярную лимфому и любой тип лимфом клеток мантийной зоны, который можно увидеть под микроскопом (нодулярную, диффузную, бластную и мантийной зоны).
Примеры заболеваний и расстройств, ассоциированных с или отличающихся нежелательным ангиогенезом, включают, но без ограничения ими, воспалительные заболевания, аутоиммунные заболевания, вирусные заболевания, генетические заболевания, аллергические заболевания, бактериальные заболевания, глазные неоваскулярные заболевания, хориоидальные неоваскулярные заболевания, неоваскулярные заболевания чувствительной оболочки глаза и рубеоз (неоваскуляризацию угла передней камеры). Конкретные примеры заболеваний и расстройств, ассоциированных с или отличающихся нежелательным ангиогенезом, включают, но но без ограничения ими, артрит, эндометриоз, болезнь Крона, сердечную недостаточность, тяжелую сердечную недостаточность, почечную недостаточность, эндотоксемию, синдром токсического шока, остеоартрит, ретровирусную репликацию, зашлакованность, менингит, индуцированный диоксидом кремния фиброз, индуцированный асбестом фиброз, ветеринарные нарушения, связанную со злокачественной опухолью гиперкальциемию, инсульт, циркуляторный шок, периодонтит, гингивит, макроцитарную анемию, невосприимчивую анемию и синдром 5q-делеции.
Примеры болей включают, но без ограничения ими, боли, описанные в патентной публикации США 2005/0203142, опубликованной 15 сентября 2005 г., которая включена в настоящий документ путем ссылки. Конкретные типы болей включают, но без ограничения ими, ноцицептивную боль, нейропатическую боль, смешанную боль из ноцицептивной боли и нейропатической боли, висцеральную боль, мигрень, головную боль и послеоперационную боль.
Примеры ноцицептивной боли включают, но без ограничения ими, боль, сопутствующую химическим или термическим ожогам, порезам кожи, ушибам кожи, остеоартриту, ревматоидному артриту, тендониту и миофасциальной боли.
Примеры нейропатической боли включают, но без ограничения ими, CRPS I типа, CRPS II типа, рефлекторную симпатическую дистрофию (RSD), рефлекторную нейроваскулярную дистрофию, рефлекторную дистрофию, удерживаемый симпатической частью нервной системы болевой синдром, каузалгию, костную атрофию Зудека, алгонейродистрофию, плечевой синдром, посттравматическую дистрофию, тригеминальную невралгию, постгерпетическую невралгию, боль, сопутствующую раку, ложное ощущение ампутированной конечности, фибромиалгию, синдром хронической усталости, боль от травмы спинного мозга, центральную послешоковую боль, радикулопатию, диабетическую невропатию, послешоковую боль, люэтическую невропатию и другие причиняющие боль невропатические состояния, например состояния, вызванные лекарственными средствами, такими как винкристин и велкейд.
В контексте настоящего документа термины «комплексный региональный болевой синдром», «CRPS» и «CRPS и связанные синдромы» означают хронические болевые расстройства, отличающиеся одним или несколькими следующими признаками: боль, или спонтанная или спровоцированная, в том числе, аллодиния (вызывающая боль реакция на стимул, который обычно не является болезненным) и гипералгезия (преувеличенная реакция на стимул, который обычно является только умеренно болезненным); боль, которая является непропорциональной для провоцирующего события (например, годы сильной боли после растяжения связок голеностопного сустава); региональная боль, которая не ограничена распространением в одном периферическом нерве; и расстройство вегетативной нервной системы (например, отек, альтерация кровяного потока и гипергидроз), ассоциированное с трофическими изменениями кожи (ненормальность роста волос и ногтей и кожное изъязвление).
Примеры MD и сопутствующих синдромов включают, но без ограничения ими, примеры, описанные в патентной публикации США 2004/0091455, опубликованной 13 мая 2004 г., которая включена в настоящий документ путем ссылки. Конкретные примеры включают, но без ограничения ими, атрофическую (сухую) MD, экссудативную (влажную) MD, возрастную макулопатию (ARM), хориоидальную неоваскулизацию (CNVM), отслоение пигментного эпителия сетчатки (PED) и атрофию пигментного эпителия сетчатки (RPE).
Примеры кожных заболеваний включают, но без ограничения ими, примеры, описанные в публикации США 2005/0214328А1, опубликованной 29 сентября 2005 г., которая включена в настоящий документ путем ссылки. Конкретные примеры включают, но без ограничения ими, кератоз и сопутствующие симптомы, кожные заболевания и расстройства, характеризующиеся чрезмерным ростом эпидермиса, угри и морщины.
В контексте настоящего документа термин «кератоз» относится к любому повреждению эпидермиса, отмеченному присутствием очагового чрезмерного роста ороговевшего слоя, включая, но без ограничения этим, актинический кератоз, себорейный кератоз, кератоакантому, фолликулярный кератоз (болезнь Дарье), ретроградный фолликулярный кератоз, ладонно-подошвенный кератоз (PPR, кератоз ладоней и подошв), кератоз волосяной и штукатурный кератоз. Термин «актинический кератоз» также относится к старческому кератозу, сенильному кератозу, старческой кератоме, юношеской кератоме, старческой бородавке, кератодермии или кератоме. Термин «себорейный кератоз» также относится к себорейной бородавке, старческой бородавке или базальноклеточной папилломе. Кератоз характеризуется одним или несколькими следующими симптомами: неприятный внешний вид, эритематозные папулы, бляшки, спикулы или наросты на открытых поверхностях (например, на лице, руках, ушах, шее, ногах и грудной клетке), патологическое разрастание кератина, называемое кожными рогами, гиперкератоз, телангиэктазия, эластоз, пигментированный лентигиноз, акантоз, паракератоз, дискератоз, папилломатоз, гиперпигментация базальных клеток, клеточная атипия, митотические фигуры, аномальная межклеточная адгезия, плотные воспалительные инфильтраты и небольшое преобладание сквамозно-клеточных карцином.
Примеры кожных заболеваний или расстройств, характеризующихся чрезмерным ростом эпидермиса, включают, но без ограничения ими, любые состояния, заболевания или расстройства, отмеченные присутствуем чрезмерно разросшегося эпидермиса, включая, но без ограничения ими, инфекции, связанные с папилломавирусом, мышьяковистый кератоз, симптом Лезера-Трелата, бородавчатую дискератому (WD), волосы пучкообразные (trichostasis spinulosa, TS), фигурную вариабельную эритрокератодермию (EKV), врожденный ихтиоз (арлекиновый ихтиоз), врожденную узловатость пальцев кисти, кожную меланоакантому, порокератоз, псориаз, сквамозно-клеточную карциному, сливной и ретикулярный папилломатоз (CRP), акрохордон, кожный рог, болезнь Каудена (синдром множественной гамартомы), дерматическую папулезную сыпь (dermatosis papulosa nigra, DPN), синдром эпидермального невуса (ENS), простой ихтиоз, контагиозный моллюск, узелковую почесуху и акантокератодермию (AN).
Примеры легочных заболеваний включают, но без ограничения ими, примеры, описанные в публикации патентной заявки США 2005/0239842А1, опубликованной 27 октября 2005 г., которая включена в настоящий документ путем ссылки. Конкретные примеры включают легочную гипертензию и сопутствующие расстройства. Примеры легочной гипертензии и сопутствующих расстройств включают, но не ограничены ими, первичную легочную гипертензию (РРН); вторичную легочную гипертензию (SPH); семейную РРН; спорадическую РРН; прекапиллярную легочную гипертензию; легочную артериальную гипертензию (РАН); легочную системную гипертензию; идиопатическую легочную гипертензию; тромботическую легочную артериопатию (ТРА); плексогенную легочную артериопатию; легочную гипертензию функциональных классов I-IV и легочную гипертензию, связанную с, сопутствующую или вторичную по отношению к дисфункции левого желудочка, митральному пороку сердца, констриктивному перикардиту, стенозу устья аорты, кардиомиопатии, медиастинальному фиброзу, аномальному легочному венозному оттоку, легочной веноокклюзионной болезни, сосудистому коллагенозу, врожденному пороку сердца, инфицированию ВИЧ, лекарственным средствам и токсинам, таким как фенфлурамины, врожденному пороку сердца, легочной венозной гипертензии, хроническому обструктивному легочному заболеванию, интерстициальному заболеванию легких, нарушенному во сне дыханию, альвеолярной гиповентиляции, хроническому воздействию высокого положения над уровнем моря, болезни легких новорожденного, альвеолярно-капиллярной дисплазии, серповидно-клеточной болезни, другим нарушениям свертывания крови, хронической тромбоэмболии, болезни соединительных тканей, волчанке, включая системную и кожную волчанку, шистосомозу, саркоидозу или легочному капиллярному гемангиоматозу.
Примеры заболеваний, связанных с асбестом, включают, но без ограничения ими, примеры, описанные в публикации патентной заявки США 2005/0100529, опубликованной 12 мая 2005 г., которая включена в настоящий документ путем ссылки. Типичные примеры включают, но без ограничения ими, мезотелиому, асбестоз, злокачественный плевральный выпот, доброкачественный экссудативный выпот, плевральные бляшки, кальциноз плевры, диффузное плевральное наслоение, округлый ателектаз, фиброзные массы и рак легких.
Примеры паразитарных заболеваний включают, но без ограничения ими, примеры, описанные в публикации патентной заявки США 2006/0154880, опубликованной 13 июля 2006 г., которая включена в настоящий документ путем ссылки. Паразитарные заболевания включают заболевания и расстройства, вызванные внутриклеточными паразитами человека, такими как, но без ограничения ими, P. falcifarium, P. ovale, P. vivax, P. malariae, L. donovari, L. infantum, L. aethiopica, L. major, L. tropica, L. mexicana, L. braziliensis, T. Gondii, B. microti, B. divergens, B. coli, C. parvum, C. cayetanensis, E. histolytica, I. belli, S. mansonii, S. haematobium, Trypanosoma ssp., Toxoplasma ssp. и O. volvulus. Также охвачены другие заболевания и нарушения, вызванные внутриклеточными паразитами других биологических видов, кроме человека, такими как, но без ограничения ими, Babesia bovis, Babesia canis, Babesia Gibsoni, Besnoitia darlingi, Cytauxzoon felis, Eimeria ssp., Hammondia ssp. и Theileria ssp. Конкретные примеры включают, но без ограничения ими, малярию, бабезиоз, сонную болезнь, лейшманиоз, токсоплазмоз, менингоэнцефалит, кератит, амебиоз, гиардиоз, криптоспоридоз, изоспоридиоз, циклоспориоз, микроспоридиоз, аскаридоз, трихиуриаз, анкилостомоз, стронгилоидоз, токсокароз, трихинеллез, лимфатический филяриатоз, онхоцеркоз, филяриатоз, шистосомоз и дерматит, вызванный шистосомами животных.
Примеры нарушений иммунодефицита включают, но без ограничения ими, примеры, описанные в патентной заявке США 11/289723, зарегистрированной 30 ноября 2005 г. Конкретные примеры включают, но без ограничения ими, недостаточность аденозиндезаминазы, недостаточность антител с нормальным или повышенным уровнем иммуноглобулинов, атаксию-телеангиэктазию, синдром «голых» лимфоцитов, общую вариабельную иммунную недостаточность, недостаточность иммуноглобулинов с синдромом повышенных IgM, делеции тяжелых цепочек Ig, недостаточность IgA, иммунодефицит с тимомой, ретикулярную дисгенезию, синдром Незелофа, селективный дефицит подкласса IgG, младенческую гипогаммаглобулинемию, синдром Вискотта-Олдриджа, сцепленную с Х-хромосомой агаммаглобулинемию, сцепленную с Х-хромосомой тяжелую комбинированную агаммаглобулинемию.
Примеры расстройств ЦНС включают, но без ограничения ими, примеры, описанные в патентной публикации США 2005/0143344, опубликованной 30 июня 2005 г., которая включена в настоящий документ путем ссылки. Конкретные примеры включают, но не ограничены ими, боковой амиотрофический склероз, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, рассеянный склероз и другие нейроиммунологические расстройства, такие как синдром Туретта, делирий или нарушения сознания, которые происходят в течение короткого периода времени, и амнестическое расстройство, или разрозненное нарушение памяти, которое происходит в отсутствие других нарушений центральной нервной системы.
Примеры поражений ЦНС и сопутствующих синдромов включают, но без ограничения ими, примеры, описанные в патентной публикации США 2006/0122228, опубликованной 8 июня 2006 г., которая включена в настоящий документ путем ссылки. Конкретные примеры включают, но без ограничения ими, поражение/повреждение ЦНС и сопутствующие синдромы, которые включают, но без ограничения ими, первичную травму головного мозга, вторичную травму головного мозга, травматическое повреждение мозга, фокальное повреждение мозга, диффузное аксональное повреждение, травму головы, постконтузионный синдром, сотрясение и разрыв головного мозга, субдуральную гематому, эпидермальную гематому, посттравматическую эпилепсию, хроническое вегетативное состояние, полную травму спинного мозга, неполную травму спинного мозга, острую травму спинного мозга, подострую травму спинного мозга, хроническую травму спинного мозга, центральный спинальный синдром, синдром Броун-Секара, синдром переднего хорда, синдром мозгового конуса, синдром поражения конского хвоста, нейрогенный шок, спинальный шок, измененные уровни сознания, головную боль, тошноту, рвоту, потерю памяти, головокружение, диплопию, размытое зрение, эмоциональную неустойчивость, нарушения сна, раздражительность, неспособность к концентрации, нервозность, поведенческие нарушения, нарушение познавательной способности и припадки.
Другие заболевания и нарушения включают, но не ограничены ими, вирусные, генетические, аллергические и аутоиммунные заболевания. Конкретные примеры включают, но не ограничены ими, ВИЧ, гепатит, респираторный дистресс-синдром у взрослых, резорбцию кости, хронические легочные воспалительные заболевания, дерматиты, кистозный фиброз, септический шок, сепсис, эндотоксический шок, гемодинамический шок, септический синдром, постишемическое реперфузионное повреждение, менингит, псориаз, фиброзное заболевание, кахексию, реакцию трансплантат-против-хозяина, отторжение трансплантата, аутоиммунное заболевание, ревматоидный спондилит, болезнь Крона, язвенный колит, воспалительное заболевание кишечника, рассеянный склероз, системную красную волчанку, ENL (лепрозную узловую эритему) при проказе, радиационное поражение, рак, астму или альвеолярную гипоксию.
Примеры атеросклероза и сопутствующих состояний включают, но без ограничения ими, примеры, описанные в патентной публикации США 2002/0054899, опубликованной 9 мая 2002 г., которая включена в настоящий документ путем ссылки. Конкретные примеры включают, но без ограничения ими, все формы состояний, включающие атеросклероз, в том числе рестеноз после сосудистого вмешательства, такого как ангиопластика, эндопротезирование, атерэктомия и трансплантация. В данном документе предусмотрены все формы сосудистого вмешательства, включая вмешательства при сердечно-сосудистых и почечных заболеваниях, такие как, но без ограничения ими, ангиопластика почечных артерий, подкожное коронарное вмешательство (PCI), подкожная транслуминальная коронарная ангиопластика (PTCA), транслуминальная коронарная ангиопластика сонной артерии (РТА), коронарное шунтирование, ангиопластика с имплантацией стента, периферическая подкожная транслуминальная интервенция подвздошной, бедренной или подколенной артерии и хирургическое вмешательство с использованием импрегнированных искусственных трансплантатов.
Примеры нарушений сна и сопутствующих синдромов включают, но не ограничены ими, примеры, описанные в патентной публикации США 2005/0222209А1, опубликованной 6 октября 2005 г., которая включена в настоящий документ путем ссылки. Конкретные примеры включают, но не ограничены ими, храп, апноэ во сне, бессонницу, нарколепсию, синдром усталых ног, ужасы во время сна, лунатизм, синдром ночного аппетита, а также нарушенный сон, сопутствующий хроническим неврологическим или воспалительным состояниям. Хронические неврологические или воспалительные состояния включают, но не ограничены ими, синдром комплексной региональной боли, хроническую поясничную боль, скелетно-мышечную боль, артрит, радикулопатию, боль, сопутствующую раковому заболеванию, фибромиалгию, синдром хронической усталости, висцеральную боль, боль в мочевом пузыре, хронический панкреатит, невропатии (диабетическую, постгерпетическую, травматическую или воспалительную) и нейродегенеративные расстройства, такие как болезнь Паркинсона, болезнь Альцгеймера, боковой амиотрофический склероз, рассеянный склероз, болезнь Хантингтона, брадикинезия; мышечная ригидность; паркинсонов тремор; паркинсонова походка; задержка движения; депрессия; нарушенная долговременная память, синдром Рубинштейна-Тейби (RTS); деменция; постуральная нестабильность; гипокинетические расстройства; синуклеиновые расстройства; множественная системная атрофия; стриатонигральная дегенерация; оливопонтоцеребеллярная атрофия; синдром Шая-Дрейджера; заболевание моторных нервов с признаками паркинсонизма; деменция с тельцами Леви; патологические расстройства Тау; прогрессирующий супрануклеарный паралич; кортико-базальная дегенерация; лобно-височная деменция; амилоидные патологические расстройства; средние нарушения познавательной способности; болезнь Альцгеймера с паркинсонизмом; болезнь Вильсона; болезнь Галлервордена-Шпатца; болезнь Чедиака-Хигаси; спиноцеребеллярная атаксия 3 (SCA-3); дистония-паркинсонизм, сцепленные с Х-хромосомой; прионная инфекция; гиперкинетические нарушения; хорея; крупноразмашистый гиперкинез конечностей (ballismus); дистонический тремор; боковой амиотрофический склероз (ALS); травма ЦНС и миоклонус.
Примеры гемоглобинопатии и сопутствующих расстройств включают, но не ограничены ими, примеры, описанные в публикации США 2005/0143420А1, опубликованной 30 июня 2005 г., которая включена в описание в качестве ссылки. Конкретные примеры включают, но не ограничены ими, гемоглобинопатию, серповидно-клеточную анемию и любые другие расстройства, связанные с дифференцировкой CD34+ клеток.
Примеры TNFα-связанных расстройств включают, но не ограничены ими, примеры, описанные в WO 98/03502 и WO 98/54170, полное содержание которых включено в настоящий документ путем ссылки. Конкретные примеры включают, но не ограничены ими, эндотоксемию или синдром токсического шока; кахексию; респираторный дистресс-синдром у взрослых; резорбцию костей, такую как артрит; гиперкальциемию; реакцию трансплантат-против-хозяина; мозговую форму малярии; воспаление; рост опухоли; хронические легочные воспалительные заболевания; реперфузное повреждение; инфаркт миокарда; удар; циркуляторный шок; ревматоидный артрит; болезнь Крона; ВИЧ инфекцию и СПИД; другие расстройства, такие как ревматоидный артрит, ревматоидный спондилит, остеоартрит, псориатический артрит и другие артритные состоянию, септический шок, сепсис, эндотоксический шок, реакцию трансплантат-против-хозяина, зашлакованность, болезнь Крона, язвенный колит, рассеянный склероз, системную красную волчанку, ENL (лепрозную узловую эритему) при проказе, ВИЧ, СПИД и оппортунистические инфекции при ВИЧ; расстройства, такие как септический шок, сепсис, эндотоксический шок, гемодинамический шок и септический синдром, постишемическое реперфузное поражение, малярия, микобактериальная инфекция, менингит, псориаз, застойная сердечная недостаточность, фиброзные заболевания, кахексия, отторжение трансплантата, онкогенные или канцерогенные состояния, астма, аутоиммунное заболевание, лучевые поражения и альвеолярные повреждения, вызванные гипероксией; вирусные инфекции, такие как инфекции, вызванные вирусом герпеса; вирусные конъюнктивиты; или атопический дерматит.
В других вариантах осуществления изобретения охвачено также применение соединения А в иммунологии, в частности, в качестве вакцинных адъювантов, в особенности, противораковых вакцинных адъювантов, которые раскрыты в предварительной заявке США №60/712823, зарегистрированной 1 сентября 2005 г., полное содержание которой включено в настоящий документ путем ссылки. Такие варианты осуществления изобретения также относятся к применению соединения А в комбинации с вакцинами для лечения или предупреждения раковых или инфекционных заболеваний и к другим различным вариантам применения иммуномодулирующих соединений, таким как снижение или десенсибилизация аллергических реакций.
Дозы соединения А варьируют в зависимости от таких факторов, как конкретные показания для лечения, предупреждения или контроля; возраст и состояние пациента; а также количество используемого второго активного средства, если оно используется. В общем, соединение А может использоваться в количестве от примерно 0,1 мг до примерно 500 мг в день, и его количество может корректироваться стандартным образом (например, одинаковое количество вводят ежедневно в течение времени лечения, предупреждения или контроля), циклами (например, одна неделя приема, одна неделя без приема) или в количестве, которое повышается или понижается по ходу курса лечения, предупреждения или контроля. В других вариантах осуществления изобретения доза может составлять от примерно 1 мг до примерно 300 мг, от примерно 0,1 мг до примерно 150 мг, от примерно 1 мг до примерно 200 мг, от примерно 10 мг до примерно 100 мг, от примерно 0,1 мг до примерно 50 мг, от примерно 1 мг до примерно 50 мг, от примерно 10 мг до примерно 50 мг, от примерно 20 мг до примерно 30 мг или от примерно 1 мг до примерно 20 мг.
Твердая форма соединения А по настоящему изобретению может быть смешана с другими фармакологически активными соединениями («вторыми действующими средствами») в способах и композициях по изобретению. Некоторые комбинации могут действовать синергетически при лечении определенных типов заболеваний или расстройств, а также патологических состояний и симптомов, ассоциированных с такими заболеваниями или расстройствами. Твердая форма соединения А по настоящему изобретению также может действовать, смягчая побочные эффекты, ассоциированные с некоторыми вторыми действующими средствами, и наоборот.
В способах и композициях по изобретению могут использоваться один или несколько вторых активных ингредиентов или средств. Вторые активные средства могут представлять собой большие молекулы (например, белки) или небольшие молекулы (например, синтетические неорганические, металлорганические или органические молекулы).
Примеры активных средств, представляющих собой большие молекулы, включают, но не ограничены ими, гемопоэтические ростовые факторы, цитокины и моноклональные и поликлональные антитела. Конкретными примерами активных средств являются моноклональные анти-CD40-антитела (такие как, например, SGN-40); ингибиторы гистондеацетилазы (такие как, например, SAHA и LAQ 824); ингибиторы белка теплового шока 90 (такие как, например, 17-AAG); ингибиторы киназы рецептора инсулиноподобного фактора роста-1; ингибиторы киназы сосудистого эндотелиального фактора роста (такие как, например, PTK787); ингибиторы рецептора инсулинового фактора роста; ингибиторы ацилтрансферазы лизофосфатидиловой кислоты; ингибиторы киназы IkB; ингибиторы p38MAPK; ингибиторы EGFR (такие как, например, гефитиниб и эрлотиниб HCL); антитела к HER-2 (такие как, например, трастузумаб (Herceptin®) и пертузумаб (Omnitarg™)); антитела к VEGFR (такие как, например, бевацизумаб (Avastin™)); ингибиторы VEGFR (такие как, например, ингибиторы киназ, специфичные к flk-1, SU5416 и ptk787/zk222584); ингибиторы PI3K (такие как, например, вортманнин); ингибиторы C-Met (такие как, например, PHA-665752); моноклональные антитела (такие как, например, ритуксимаб (Rituxan®), тозитумомаб (Bexxar®), эдреколомаб (Panorex®) и G250); и анти-TNF-α антитела. Примеры низкомолекулярных активных средств включают, но не ограничены ими, противораковые средства и антибиотики (например, кларитромицин).
Конкретные вторые активные соединения, которые можно объединить с твердой формой соединения А по изобретению, зависят от конкретного показания для лечения, предупреждения или контроля.
Например, для лечения, предупреждения или контроля раковых заболеваний вторые активные средства включают, но не ограничены ими, семаксаниб; циклоспорин; этанерсепт; доксициклин; бортезомиб; ацивицин; акларубицин; акодазол гидрохлорид; акронин; адозелецин; альдеслейкин; альтретамин; амбомицин; аметантрона ацетат; амсакрин; анастрозол; антрамицин; аспарагиназу; асперлин; азацитидин; азетепа; азотомицин; батимастат; бензодепу; бикалутамид; бисантрена гидрохлорид; биснафида димезилат; бизелезин; блеомицина сульфат; бреквинар натрий; бропиримин; бусульфан; кактиномицин; калустерон; карацемид; карбетимер; карбоплатин; кармустин; карубицина гидрохлорид; карзелезин; цедефингол; целекоксиб; хлорамбуцил; циролемицин; цисплатин; кладрибин; криснатола мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицина гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанина мезилат; диазиквон; доцетаксел; доксорубицин; доксорубицина гидрохлорид; дролоксифен; дролоксифена цитрат; дромостанолона пропионат; дуазомицин; эдатрексат; эфлорнитина гидрохлорид; элсамитруцин; энлоплатин; энпромат; эпипропидин; эпирубицина гидрохлорид; эрбулозол; эзорубицина гидрохлорид; эстрамустин; эстрамустин натрий фосфат; этанидазол; этопозид; этопозида фосфат; этоприн; фадрозола гидрохлорид; фазарабин; фенретинид; флоксуридин; флударабина фосфат; фторурацил; фторцитабин; фосхидон; фостриецин натрий; гемцитабин; гемцитабина гидрохлорид; гидроксимочевину; идарубицина гидрохлорид; ифосфамид; илмофозин; ипроплатин; иринотекан; иринотекана гидрохлорид; ланреотида ацетат; летрозол; леупролида ацетат; лиарозола гидрохлорид; лометрексол натрий; ломустин; лозоксантрона гидрохлорид; мазопрокол; майтанзин; мехлоретамина гидрохлорид; мегестрола ацетат; меленгестрола ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрий; метоприн; метуредепа; митиндомид; митокарцин; митокромин; митогиллин; митомалцин; митомицин; митоспер; митотан; митоксантрона гидрохлорид; микофеноловую кислоту; нокодазол; ногаламицин; ормаплатин; оксисуран; паклитаксел; пегаспаргазу; пелиомицин; пентамустин; пепломицина сульфат; перфосфамид; пипоброман; пипосульфан; пироксантрона гидрохлорид; пликамицин; пломестан; порфимер натрий; порфиромицин; преднимустин; прокарбазина гидрохлорид; пуромицин; пуромицина гидрохлорид; пиразофурин; рибоприн; сафингол; сафингола гидрохлорид; семустин; симтразен; спарфосат натрий; спарсомицин; спирогермания гидрохлорид; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенур; тализомицин; текогалан натрий; таксотер; тегафур; телоксантрона гидрохлорид; темопорфин; тенипозид; тероксирон; тестолактон; тиамиприн; тиогуанин; тиотепу; тиазофурин; тирапазамин; торемифена цитрат; трестолона ацетат; трицирибина фосфат; триметрексат; триметрексата глюкуронат; трипторелин; тубулозола гидрохлорид; урамустин; уредепу; вапреотид; вертепорфин; винбластина сульфат; винкристина сульфат; виндезин; виндезина сульфат; винепидина сульфат; винглицината сульфат; винлейрозина сульфат; винорелбина тартрат; винрозидина сульфат; винзолидина сульфат; ворозол; зениплатин; зиностатин и зорубицина гидрохлорид.
Другие вторые средства включают, но не ограничены ими, 29-эпи-1,25-дигидроксивитамин D3; 5-этинилурацил; абиратерон; акларубицин; ацилфульвен; адеципенол; адозелецин; альдезлейкин; антагонисты ALL-TK; альтретамин; амбамустин; амидокс; амифостин; аминолевулиновую кислоту; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; ингибиторы ангиогенеза; антагонист D; антагонист G; антареликс; антидорсальный морфогенетический белок-1; антиандроген для лечения карциномы предстательной железы; антиэстроген; антинеопластон; антисмысловые олигонуклеотиды; афидиколина глицинат; модуляторы апоптотических генов; регуляторы апоптоза; апуриновую кислоту; ara-CDP-DL-PTBA; аргининдеаминазу; асулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; производные баккатина III; баланол; батимастат; антагонисты BCR/ABL; бензохлорины; бензоилстауроспорин; бета-лактамные производные; бета-алетин; бетакламицин В; бетулиновую кислоту; ингибитор bFGF; бикалутамид; бисантрен; бисазиридинилспермин; биснафид; бистратен А; бизелезин; брефлат; бропиримин; будотитан; бутионина сульфоксимин; кальципотриол; калфостин С; производные камптотецина; капецитабин; карбоксамидаминотриазол; карбоксиаминотриазол; CaRest M3; CARN 700; ингибитор, полученный из хряща; карзелезин; ингибиторы казеинкиназы (ICOS); кастаноспермин; цекропин В; цетрореликс; хлорины; хлорхиноксалина сульфонамид; цикапрост; цис-порфирин; кладрибин; аналоги кломифена; клотримазол; коллисмицин А; коллисмицин В; комбретастатин А4; аналоги комбретастатина; конагенин; крамбесцидин 816; криснатол; криптофицин 8; производные криптофицина А; курацин А; циклопентантрахиноны; циклоплатам; ципемицин; цитарабина ocfosfate; цитолитический фактор; цитостатин; дакликсимаб; децитабин; дегидродидемнин В; деслорелин; дексаметазон; дексифосфамид; дексразоксан; дексверапамил; диазиквон; дидемнин В; дидокс; диэтилнорспермин; дигидро-5-азацитидин; 9-дигидротаксол; диоксамицин; дифенилспиромустин; доцетаксел; докозанол; долазетрон; доксифлуридин; доксорубицин; дролоксифен; дронабинол; дуокармицин SA; эбселен; экомустин; эделфозин; эдреколомаб; эфлорнитин; элемене; эмитефур; эпирубицин; эпристерид; аналоги эстрамустина; агонисты эстрогена; антагонисты эстрогена; этанидазол; этопозида фосфат; эксеместан; фадрозол; фазарабин; фенретинид; филграстим; финастерид; флавопиридол; флезеластин; флуастерон; флударабин; флуородаунорубицина гидрохлорид; форфенимекс; форместан; фостриецин; фотемустин; гадолиния тексафурин; галлия нитрат; галоцитабин; ганиреликс; ингибиторы гелатиназы; гемцитабин; ингибиторы глутатиона; гепсульфам; герегулин; гексаметилена бисацетамид; гиперицин; ибандроновую кислоту; идарубицин; идоксифен; идрамантон; илмофозин; иломастат; иматиниб (Gleevec®), имиквимод; иммуностимулирующие пептиды; ингибиторы рецептора инсулиноподобного фактора роста 1; агонисты интерферона; интерфероны; интерлейкины; йобенгуан; йододоксорубицин; 4-ипомеанол; иропласт; ирсогладин; изобенгазол; изогомогаликондрин В; итасетрон; джасплакинолид; кахалалид F; ламелларин-N-триацетат; ланреотид; леинамицин; ленограстим, лентинана сульфат; лептолстатин; летрозол; фактор, ингибирующий активность лейкозных клеток; интерферон-альфа лейкоцитов; лейпролин+эстроген+прогестерон; лейпрорелин; левамизол; лиарозол; аналоги линейного полиамина; липофильный дисахаридный пептид; липофильные соединения платины; лиссоклинамид 7; лобаплатин; ломбрицин; лометрексол; лонидамин; лозоксантрон; локсорибин; луртотекан; тексафирин лютеция; лизофуллин; литические пептиды; майтанзин; манностатин А; маримастат; мазопрокол; маспин; ингибиторы матрилизина; ингибиторы матричных металлопротеиназ; меногарил; мербарон; метерелин; метиониназа; метоклопрамид; ингибитор MIF; мифепристон; милтефозин; миримостим; митогуазон; митолактол; аналоги митомицина; митонафид; митотоксиновый фактор роста фибробластов сапорина; митоксантрон; мофаротен; молграмостим; эрбитукс; человеческий хорионический гонадотропин; монофосфорил-липид А+стенка микобактериальных клеток sk; мопидамол; горчичный противоканцерогенный агент; микапероксид В; экстракт стенок микобактериальных клеток; мириапорон; N-ацетилдиналин; N-замещенные бензамиды; нафарелин; нагрестип; налоксон+пентазоцин; напавин; нафтерпин; нартограстим; недаплатин; неморубицин; неридроновую кислоту; нилутамид; низамицин; модуляторы оксида азота; антиоксидант нитроксида; нитруллин; облимерсен (Genasense®); О6-бензилгуанин; октреотид; окиценон; олигонуклеотиды; онапристон; ондансетрон; орацин; пероральный цитокиновый индуктор; ормаплатин; осатерон; оксалиплатин; оксауномицин; паклитаксел; аналоги паклитаксела; производные паклитаксела; палауамин; пальмитоилризоксин; памидроновую кислоту; панакситриол; паномифен; парабактин; пазеллиптин; пегаспаргаз; пелдесин; пентосан-натрий полисульфат; пентостатин; пентрозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; пицибанил; пилокарпин-гидрохлорид; пирарубицин; пиритрексим; плацетин А; плацетин В; ингибитор активатора плазминогена; платиновый комплекс; соединения платины; комплекс платина-триамин; порфимер натрий; порфиромицин; преднизон; пропил-бисакридон; простагландин J2; ингибиторы протеасомы; иммуномодулятор на основе белка А; ингибитор протеинкиназы С; микроалгал; ингибиторы протеинтирозинфосфатазы; ингибиторы пуриннуклеозидфосфорилазы; пурпурины; пиразолакридин; пиридоксилированный гемоглобинполиоксиэтиленовый конъюгат; антагонисты raf; ралтитрексед; рамосетрон; ингибиторы raf фарнезил-протеинтрансферазы; ингибиторы ras; ингибитор ras-GAP; ретеллиптин деметилированный; этидронат рения (186Re); ризоксин; рибозимы; RII ретинамид; рохитукин; ромуртид; роквинимекс; рубигинон В1; рубоксил; сафингол; саинтопин; SarCNU; саркофитол А; сарграмостин; миметики Sdi 1; семустин; ингибитор 1, полученный из стареющих клеток; смысловые олигонуклеотиды; ингибиторы сигнальной трансдукции; сизофиран; собузоксан; борокаптат натрия; фенилацетат натрия; солверол; соматомедин-связывающий белок; сонермин; спарфозовую кислоту; спикамицин D; спиромустин; спленопентин; спонгистатин 1; скваламин; стипиамид; ингибиторы стромелизина; сульфинозин; антагонисты гиперактивного вазоактивного интестинального пептида; сурадиста; сурамин; сваинсонин; таллимустин; тамоксифена метиодид; тауромустин; тазаротен; текогалан натрий; тегафур; теллурапирилий; ингибиторы теломеразы; темопорфин; тенипозид; тетрахлородекаоксид; тетразомин; талибластин; тиокоралин; тромбопоэтин; тромбопоэтиновый миметик; тималфазин; агонист рецептора тимопоэтина; тимотринан; тиреостимулирующий гормон; олово этилэтиопурпурин; тирапазамин; титаноцена дихлорид; топсентин; торемифен; ингибиторы трансляции; третиноин; триацетилуридин; трицирибин; триметрексат; трипторелин; трописетрон; туростерид; ингибиторы тирозинкиназ; тирфостины; ингибиторы UBC; убенимекс; полученный из мочеполовой пазухи фактор, ингибирующий рост; антагонисты рецептора урокиназы; вапреотид; вариолин В; веларезол; верамин; вердины; вертепорфин; винорелбин; винксалтин; витаксин; ворозол; занотерон; зениплатин; зиласкорб и зиностатин стималамер.
Конкретные вторые активные средства включают, но не ограничены ими, 2-метоксиэстрадиол, теломестатин, индукторы апоптоза в клетках множественной миеломы (такие как, например, TRAIL), статины, семаксаниб, циклоспорин, этанерсепт, доксициклин, бортезомиб, облимерсен (Genasense®), ремикад, доцетаксел, целекоксиб, мелфалан, дексаметазон (Decadron®), стероиды, гемцитабин, цисплатин, темозоломид, этопозид, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, Arisa®, таксол, таксотер, фторурацил, лейковорин, иринотекан, кселоду, СРТ-11, интерферон-альфа, пегилированный интерферон-альфа (например, PEG INTRON-A), капецитабин, цисплатин, тиотепу, флударабин, карбоплатин, липосомальный даунорубицин, цитарабин, доксетаксол, паклитаксел, винбластин, IL-2, GM-CSF, дакарбазин, винорелбин, золедроновую кислоту, палмитронат, биаксин, бусульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, эстрамустин натрий фосфат (Emcyt®), сулиндак и этопозид.
В другом варианте осуществления изобретения примеры конкретных вторых средств в соответствии с показаниями к лечению, предупреждению или контролю можно найти в приведенных ниже ссылках, полное содержание которых включено в настоящий документ путем ссылки: патентах США №6281230 и 5635517; патентных публикациях США №2004/0220144, 2004/0190609, 2004/0087546, 2005/0203142, 2004/0091455, 2005/0100529, 2005/0214328, 2005/0239842, 2006/0154880, 2006/0122228 и 2005/0143344; и в предварительной патентной заявке США № 60/631870.
Примеры вторых активных средств, которые могут использоваться для лечения, предупреждения и/или контроля боли, включают, но не ограничены ими, обычные терапевтические средства, используемые для лечения или предупреждения боли, такие как антидепрессанты, антиконвульсанты, антигипертензивные средства, анксиолитические средства, блокаторы кальциевых каналов, мышечные релаксанты, ненаркотические анальгетики, опиоидные анальгетики, противовоспалительные средства, ингибиторы СОХ-2, иммуномодулирующие агенты, агонисты или антагонисты альфа-адренергического рецептора, иммунодепрессивные средства, кортикостероиды, гипербарический кислород, кетамин, другие анестезирующие средства, антагонисты NMDA и другие терапевтические средства, приведенные, например, в публикации Physicianʹs Desk Reference 2003. Конкретные примеры включают, но не ограничены ими, ацетат салициловой кислоты (Aspirin®), целекоксиб (Celebrex®), Enbrel®, кетамин, габапентин (Neurontin®), фенитоин (Dilantin®), карбамазепин (Tegretol®), окскарбазепин (Trileptal®), валпроевую кислоту (Depakene®), морфина сульфат, гидроморфон, преднизон, гризеофульвин, пентониум, алендронат, дифенгидрамид, гуанетидин, кеторолак (Acular®), тирокальцитонин, диметилсульфоксид (DMSO), клонидин (Catapress®), бретилиум, кетансерин, резерпин, дроперидол, атропин, фентоламин, бупивакаин, лидокаин, ацетаминофен, нортриптилин (Pamelor®), амитриптилин (Elavil®), имипрамин (Tofranil®), доксепин (Sinequan®), кломипрамин (Anafranil®), флуоксетин (Prozac®), сертралин (Zoloft®), напроксен, нефазодон (Serzone®), венлафаксин (Effexor®), тразодон (Desyrel®), бупропион (Wellbutrin®), мексилетин, нифедипин, пропранолол, трамадол, ламотригин, виокс, зиконотид, кетамин, декстрометорфан, бензодиазепины, баклофен, тизанидин и феноксибензамин.
Примеры вторых активных средств, которые могут использоваться для лечения, предупреждения и/или контроля дегенерации желтого пятна и сопутствующих синдромов, включают, но не ограничены ими, стероид, световой сенсибилизатор, интегрин, антиоксидант, интерферон, производное ксантина, гормон роста, нейротрофический фактор, регулятор неоваскуляризации, анти-VEGF антитело, простагландин, антибиотик, фитоэстроген, противовоспалительное соединение или антиангиогенное соединение, или их комбинацию. Конкретные примеры включают, но не ограничены ими, вертепорфин, пурлитин, ангиостатический стероид, rhuFab, интерферон-2α, пентоксифиллин, олово этиопурпурин, мотексафин, люцентис, лютеций, 9-фтор-11,21-дигидрокси-16, 17,1-метилэтилидинбис(окси)прегна-1,4-диен-3,20-дион, латанопрост (см. патент США №6225348), тетрациклин и его производные, рифамицин и его производные, макролиды, метронидазол (патенты США №6218369 и 6015803), генистеин, генистин, 6ʹ-О-Mal генистин, 6ʹ-О-Ас генистин, даидзеин, даидзин, 6ʹ-О-Mal даидзин, 6ʹ-О-Ас даидзин, глицитеин, глицитин, 6ʹ-О-Mal глицитин, биоханин А, формононетин (патент США №6001368), триамцинолона ацетомид, дексаметазон (патент США №5770589), талидомид, глутатион (патент США №5632984), основной фактор роста фибробластов (bFGF), трансформирующий фактор роста b (TGF-b), нейротропный фактор мозга (BDNF), фактор активатора плазминогена 2 типа (PAI-2), EYE101 (Eyetech Pharmaceuticals), LY333531 (Eli Lilly), Miravant и имплант RETISERT (Bausch & Lomb). Полное содержание всех ссылок, цитируемых в в настоящем документе, включено в него путем ссылки.
Примеры вторых активных средств, которые могут использоваться для лечения, предупреждения и/или контроля кожных заболеваний, включают, но не ограничены ими, кератолитики, ретиноиды, α-гидроксикислоты, антибиотики, коллаген, ботулинический токсин, интерферон, стероиды и иммуномодулирующие средства. Конкретные примеры включают, но не ограничены ими, 5-фторурацил, мазопрокол, трихлоруксусную кислоту, салициловую кислоту, молочную кислоту, лактат аммония, мочевину, третиноин, изотретиноин, антибиотики, коллаген, ботулинический токсин, интерферон, кортикостероид, транс-ретиноевую кислоту и коллагены, такие как человеческий плацентарный коллаген, животный плацентарный коллаген, Dermalogen, AlloDerm, Fascia, Cymetra, Autologen, Zyderm, Zyplast, Resoplast и Isolagen.
Примеры вторых активных средств, которые могут использоваться для лечения, предупреждения и/или контроля легочной гипертензии и сопутствующих расстройств, включают, но не ограничены ими, антикоагулянты, диуретики, сердечные гликозиды, блокаторы кальциевых каналов, вазодилататоры, аналоги простациклина, антагонисты эндотелина, ингибиторы фосфодиэстеразы (например, ингибиторы PDE V), ингибиторы эндопептидазы, липидопонижающие средства, ингибиторы тромбоксана и другие терапевтические средства, снижающие давление в легочной артерии. Конкретные примеры включают, но не ограничены ими, варфарин (Coumadin®), диуретик, сердечный гликозид, дигоксин-кислород, дилтиазем, нифедипин, вазодилатор, такой как простациклин (например, простагландин I2 (PGI2), эпопростенол (ЕРО, Floran®), трепростинил (Remodulin®), оксид азота (NO), бозентан (Tracleer®), амлодипин, эпопростенол (Floran®), трепростинил (Remodulin®), простациклин, тадалафил (Cialis®), симвастатин (Zocor®), омапатрилат (Vanlev®), ирбесартан (Avapro®), правастатин (Pravachol®), дигоксин, L-аргинин, илопрост, бетапрост и силденафил (Viagra®).
Примеры вторых активных средств, которые могут использоваться для лечения, предупреждения и/или контроля расстройств, связанных с асбестом, включают, но не ограничены ими, антрациклин, платин, алкилирующий агент, облимерсен (Genasense®), цисплатин, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, таксотер, иринотекан, капецитабин, цисплатин, тиотепу, флударабин, карбоплатин, липосомальный даунорубицин, цитарабин, доксетаксол, пацилитаксел, винбластин, IL-2, GM-CSF, дакарбазин, винорелбин, золедроновую кислоту, пальмитронат, биаксин, бусульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, блеомицин, гиалуронидазу, митомицин С, мепакрин, тиотепу, тетрациклин и гемцитабин.
Примеры вторых активных средств, которые могут использоваться для лечения, предупреждения и/или контроля паразитарных заболеваний, включают, но не ограничены ими, хлорохин, хинин, хинидин, пириметамин, сульфадиазин, доксициклин, клиндамицин, мефлоквин, галофантрин, примаквин, гидроксихлороквин, прогуанил, атоваквон, азитромицин, сурамин, пентамидин, меларсопрол, нифуртимокс, бензнидазол, амфотерицин В, пентавалентные соединения сурьмы (например, стибоглюкуронат натрия), интерферон-гамма, итраконазол, комбинацию убитых промастигот и BCG, лейковорин, кортикостероиды, сульфонамид, спирамицин, IgG (серология), триметоприм и сульфаметоксазол.
Примеры вторых активных средств, которые могут использоваться для лечения, предупреждения и/или контроля иммунодефицитных состояний, включают, но не ограничены ими, антибиотики (терапевтические или профилактические), такие как, но не ограничены ими, ампициллин, тетрациклин, пенициллин, цефалоспорины, стрептомицин, канамицин и эритромицин; противовирусные средства, такие как, но не ограничены ими, амантадин, римантадин, ацикловир и рибавирин; иммуноглобулин; плазму; лекарственные средства, усиливающие иммунитет, такие как, но не ограничены ими, левамизол и изопринозин; биологические препараты, такие как, но не ограничены ими, гаммаглобулин, фактор переноса, интерлейкины и интерфероны; гормоны, такие как, но без ограничения ими, тимические гормоны; и другие иммунологические средства, такие как, но без ограничения ими, стимуляторы В-клеток (например, BAFF/BlyS), цитокины (например, IL-2, IL-4 и IL-5), факторы роста (например, TGF-α), антитела (например, анти-CD40 и IgM), олигонуклеотиды, содержащие неметилированные CpG-мотивы, и вакцины (например, вакцины против вирусных и опухолевых пептидов).
Примеры вторых активных средств, которые могут использоваться для лечения, предупреждения и/или контроля расстройств ЦНС, включают, но без ограничения ими, опиоиды, агонисты или антагонисты допамина, такие как, но без ограничения ими, леводопа, L-DOPA, кокаин, α-метилтирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолпама мезилат, каберголин, прамипексола дигидрохлорид, ропинорол, амантадина гидрохлорид, селегилина гидрохлорид, карбидопа, перголида мезилат, Sinemet CR и Symmetrel; ингибиторы МАО, такие как, но без ограничения ими, ипрониазид, клоргилин, фенелзин и изокарбоксазид; ингибиторы COMT, такие как, но без ограничения ими, толкапон и энтакапон; ингибиторы холинэстеразы, такие как, но без ограничения ими, физостигмина салицилат, физостигмина сульфат, физостигмина бромид, неостигмина бромид, меостигмина метилсульфат, амбенония хлорид, эдрофония хлорид, такрин, пралидоксима хлорид, обидоксима хлорид, тримедоксима бромид, диацетилмонооксим, эндрофоний, пиридостигмин и демекарий; противовоспалительные средства, такие как, но без ограничения ими, напроксен натрий, дихлофенак натрий, диклофенак калий, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho(D) иммуноглобулин, микофенолят мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловая кислота, ацетилсалициловая кислота, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенаминовая кислота, меклофенамат натрий, толметин, кеторолак, диклофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилейтон, ауротиоглюкоза, тиомалат золото натрий, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон или бетаметазон и другие глюкокортикоиды; и противорвотные средства, такие как, но без ограничения ими, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцина моноэтаноламин, ализаприд, азасетрон, бензхинамид, биэтанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопимазин, набилон, оксиперндил, пипамазин, скополамин, сулпирид, тетрагидроканнабинол, триэтилперазин, тиопроперазин, тропизетрон и их смеси.
Примеры вторых активных средств, которые могут использоваться для лечения, предупреждения и/или контроля расстройств ЦНС и сопутствующих синдромов, включают, но не ограничены ими, иммуномодулирующие средства, иммунодепрессивные средства, антигипертензивные средства, антиконвульсанты, фибринолитические средства, антитромботические средства, антипсихотические средства, антидепрессанты, бензодиазепины, буспирон, амантадин и другие известные или обычные средства, используемые для лечения пациентов с травмой/поражением ЦНС и сопутствующими синдромами. Конкретные примеры включают, но не ограничены ими, стероиды (например, глюкокортикоиды, такие как, но без ограничения ими, метилпреднизолон, дексаметазон и бетаметазон); противовоспалительные агенты, включая, но без ограничения ими, напроксен натрий, диклофенак натрий, диклофенак калий, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho(D) иммуноглобулин, микофенолят мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенаминовую кислоту, меклофенамат натрия, толметин, кеторолак, диклофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилейтон, ауротиоглюкоза, тиомалат золото натрий, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон; аналоги цАМФ, включая, но без ограничения этим, db-цАМФ; средство, содержащее препарат на основе метилфенидата, который включает l-трео-метилфенидат, d-трео-метилфенидат, dl-трео-метилфенидат, l-эритро-метилфенидат, d-эритро-метилфенидат, dl-эритро-метилфенидат, а также их смесь; и диуретическое средство, такое как, но без ограничения этим, маннит, фуросемид, глицерин и мочевину.
Примеры вторых активных средств, которые могут использоваться для лечения, предупреждения и/или контроля нарушений сна и сопутствующих синдромов, включают, но без ограничения ими, трициклический антидепрессант, селективный ингибитор обратного захвата серотонина, противоэпилептическое средство (габапентин, прегабалин, карбамазепин, окскарбазепин, левитирацетам, топирамат), антиаритмическое средство, блокатор натриевых каналов, селективный ингибитор медиатора воспалительного ответа, опиоидный агент, второе иммуномодулирующее соединение, комбинированное средство, а также другие известные или стандартные средства, используемые в терапии сна. Конкретные примеры включают, но не ограничены ими, нейронтин, оксиконтин, морфин, топирамат, амитриптилин, нортриптилин, карбамазепин, леводопу, L-DOPA, кокаин, α-метилтирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолпама мезилат, каберголин, прамипексола дигидрохлорид, ропинорол, амантадина гидрохлорид, селегилина гидрохлорид, карбидопу, перголид-мезилат, Sinemet CR, Symmetrel, ипрониазид, клоргилин, фенелзин, изокарбоксазид, толкапон, энтакапон, физостигмина салицилат, физостигмина сульфат, физостигмина бромид, меостигмина бромид, неостигмина метилсульфат, амбенония хлорид, эдрофония хлорид, такрин, пралидоксима хлорид, обидоксима хлорид, тримедоксима бромид, диацетилмонооксим, эндрофоний, пиридостигмин, демекарий, напроксен натрий, дихлофенак натрий, диклофенак калий, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho(D) иммуноглобулин, микофенолят мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенаминовую кислоту, меклофенамат натрий, толметин, кеторолак, диклофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилейтон, ауротиоглюкозу, тиомалат золото натрий, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон, бензбромарон, бетаметазон и другие глюкокортикоиды, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцина моноэтаноламин, ализаприд, азасетрон, бензхинамид, биэтанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопимазин, набилон, оксиперндил, пипамазин, скополамин, сульпирид, тетрагидроканнабинол, тиэтилперазин, тиопроперазин, трописетрон и их смеси.
Примеры вторых активных средств, которые можно применять для лечения, предупреждения и/или контроля гемоглобинопатии и связанных с ней расстройств, включают, но не ограничены этим, интерлейкины, такие как IL-2 (включая рекомбинантный IL-II («rIL2») и канарипокс IL-2), IL-10, IL-12 и IL-18; интерфероны, такие как интерферон альфа-2a, интерферон альфа-2b, интерферон альфа-n1, интерферон альфа-n3, интерферон бета-Ia и интерферон гамма-Ib; и G-CSF; гидроксимочевину; бутираты или бутиратные производные; оксид азота; гидроксимочевину; HEMOXIN™ (NIPRISAN™; см. патент США №5800819); антагонисты каналов Гардоса, такие как клотримазол и триарилметановые производные; дефероксамин; белок C; и переливание крови или заменителя крови, такого как Hemospan™ или Hemospan™ PS (Sangart).
Введение твердой формы соединения А по изобретению и вторых активных средств пациенту можно осуществлять одновременно или последовательно с использованием одного и разных путей введения. Приемлемость конкретного пути введения, используемого для конкретного активного средства, будет зависеть от самого активного средства (например, может ли оно вводиться перорально, не деградируя до поступления в кровоток) и от заболевания, против которого проводится лечение. Одним из путей введения твердой формы соединения А по изобретению является пероральный путь. Пути введения вторых активных средств или ингредиентов известны специалистам в данной области техники (см., например, Physiciansʹ Desk Reference (60th ed., 2006)).
В одном варианте осуществления второе активное средство вводят внутривенно или подкожно и один или два раза в день в количестве от примерно 1 до примерно 1000 мг, от примерно 5 до примерно 500 мг, от примерно 10 до примерно 350 мг или от примерно 50 до примерно 200 мг. Конкретное количество второго активного средства будет зависеть от конкретного используемого средства, типа заболевания, в отношении которого проводится лечение или осуществляется контроль, тяжести и стадии заболевания и количеств(а) соединений по изобретению, а также от любых необязательных дополнительных активных средств, одновременно вводимых пациенту.
Как уже обсуждалось в данном документе, изобретение также охватывает способ снижения, лечения и/или предупреждения побочных или нежелательных эффектов, связанных с общепринятой терапией, включающей, но без ограничения этим, хирургическое вмешательство, химиотерапию, лучевую терапию, гормональную терапию, биологическую терапию и иммунотерапию. Соединения по изобретению и другие активные ингредиенты можно вводить пациенту до, во время или после возникновения побочного эффекта, ассоциированного с общепринятой терапией.
В некоторых вариантах осуществления изобретения профилактические или терапевтические средства по изобретению вводят пациенту циклическим образом. Циклическая терапия включает введение активного средства в течение некоторого периода времени, за которым следует отдых (т.е. отмена введения) в течение некоторого периода времени, и повторение такого последовательного введения. Циклическая терапия может снизить развитие устойчивости к одному или нескольким видам терапии, исключить или уменьшить побочные эффекты от одного из видов терапии, и/или повысить эффективность лечения.
Следовательно, в одном варианте осуществления изобретения твердую форму соединения А по изобретению вводят ежедневно в разовой или дробных дозах в течение цикла, составляющего от четырех до шести недель с периодом отдыха, составляющим примерно одну или две недели. Циклическая терапия дополнительно дает возможность увеличения частоты, числа и продолжительности циклов лечения. Таким образом, другой вариант осуществления изобретения охватывает введение соединения по изобретению в течение большего числа циклов, чем обычно, когда оно вводится отдельно. В еще одном варианте осуществления соединение по изобретению вводят в течение большего числа циклов, чем число циклов, которое, как правило, вызвало бы дозолимитирующую токсичность у пациента, которому второй активный ингредиент также не вводится.
В одном варианте осуществления изобретения твердую форму соединения А по изобретению вводят ежедневно и непрерывно в течение трех или четырех недель в дозе, составляющей от примерно 0,1 мг до примерно 500 мг в день, с последующим отдыхом в течение одной или двух недель. В других вариантах осуществления изобретения доза может составлять от примерно 1 мг до примерно 300 мг, от примерно 0,1 мг до примерно 150 мг, от примерно 1 мг до примерно 200 мг, от примерно 10 мг до примерно 100 мг, от примерно 0,1 мг до примерно 50 мг, от примерно 1 мг до примерно 50 мг, от примерно 10 мг до примерно 50 мг, от примерно 20 мг до примерно 30 мг или от примерно 1 мг до примерно 20 мг с последующим отдыхом.
В одном варианте осуществления изобретения твердую форму соединения А по изобретению и второе активное средство вводят перорально, причем соединения по изобретению вводят за 30-60 минут до введения второго активного ингредиента в течение цикла, составляющего от четырех до шести недель. В другом варианте осуществления изобретения комбинацию соединения по изобретению и второй активный ингредиент вводят внутривенным вливанием в течение примерно 90 минут каждого цикла.
Как правило, число циклов, во время которых проводят комбинированное лечение больного, будет составлять от примерно одного до примерно 24 циклов, от примерно двух до примерно 16 циклов или от примерно четырех до примерно трех циклов.
4.3. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Настоящее изобретение относится к фармацевтическим композициям и стандартным лекарственным формам, содержащим одну или несколько твердых форм, содержащих соединение А. Также изобретение относится к способам получения фармацевтических композиций и стандартных лекарственных форм, содержащих одну или несколько твердых форм, содержащих соединение А. Например, в некоторых вариантах осуществления изобретения отдельные лекарственные формы, содержащие твердую форму по изобретению или полученные с использованием твердой формы по изобретению, могут использоваться для перорального, через слизистые (в том числе ректального, назального или вагинального), парентерального (включая подкожное, внутримышечное, с помощью болюсной инъекции, внутриартериального или внутривенного), сублингвального, трансдермального, буккального или местного введения.
В некоторых вариантах осуществления изобретения фармацевтические композиции и лекарственные формы по изобретению содержат одну или несколько твердых форм, содержащих соединение А. Некоторые варианты осуществления изобретения относятся к фармацевтическим композициям и лекарственным формам, содержащим твердую форму, содержащую соединение А, таким как, например, формы А, В, C, D, E, F или аморфная твердая форма, содержащие соединение А по изобретению, или форма A1 или аморфная твердая форма, содержащие гидрохлорид соединения А по изобретению, причем твердая форма, содержащая соединение А, является по существу чистой. Некоторые варианты осуществления изобретения относятся к фармацевтическим композициям и лекарственным формам, содержащим твердую форму, содержащую соединение А, такую как, например, формы А, В, C, D, E, F или аморфная твердая форма, содержащие соединение А по изобретению, или форма A1 или аморфная твердая форма, содержащие гидрохлорид соединения А по изобретению, которая по существу свободна от других твердых форм, содержащих соединение А, включая, например, формы A, B, C, D, E, F и/или аморфную твердую форму, содержащие соединение А по изобретению, или форму A1 или аморфную твердую форму, содержащие гидрохлорид соединения А по изобретению. Некоторые варианты осуществления изобретения относятся к фармацевтическим композициям и лекарственным формам, содержащим смеси твердых форм, содержащих соединение А, в том числе, например, смесь, содержащую одну или несколько из следующих форм: формы A, B, C, D, E, F и аморфную твердую форму, содержащие соединение А по изобретению, и форму A1 и аморфную твердую форму, содержащие гидрохлорид соединения А по изобретению. Фармацевтические композиции и лекарственные формы по изобретению, как правило, также содержат одно или несколько фармацевтически приемлемых вспомогательных веществ, разбавителей или носителей.
Конкретная фармацевтическая композиция по настоящему изобретению, включает одну или несколько твердых форм, содержащих соединение А, и по меньшей мере одно дополнительное терапевтическое средство. Примеры дополнительных терапевтических средств включают, но не ограничены ими, противораковые лекарственные средства и противовоспалительные препараты, включая, но без ограничения ими, приведенные в настоящем документе.
Стандартные лекарственные формы по изобретению подходят для перорального, через слизистые (например, назального, сублингвального, вагинального, буккального или ректального введения), парентерального (например, подкожного, внутривенного введения, с помощью болюсной инъекции, внутримышечного или внутриартериального) или трансдермального введения пациенту. Примеры лекарственных форм включают, но не ограничены ими, таблетки; каплеты; капсулы, такие как мягкие эластичные желатиновые капсулы; саше; пастилки; лекарственные леденцы; дисперсии; суппозитории; мази; компрессы (примочки); пасты; порошки; повязки; кремы; пластыри; растворы; наклейки; аэрозоли (например, назальные спреи или ингаляторы); гели; жидкие лекарственные формы, подходящие для перорального введения пациенту или введения через слизистые оболочки, включая суспензии (например, водные или неводные жидкие суспензии, эмульсии типа масло-в-воде или жидкие эмульсии типа вода-в-масле), растворы и эликсиры; жидкие лекарственные формы, подходящие для парентерального введения пациенту; и стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), которые можно растворять, получая жидкие лекарственные формы, подходящие для парентерального введения пациенту.
Композиция, форма и тип лекарственных форм по изобретению, как правило, будут варьировать в зависимости от их применения. Например, лекарственная форма, используемая для неотложного лечения воспаления или облегчения заболевания, может содержать большее количество одного или нескольких активных ингредиентов, которые она содержит, по сравнению с лекарственной формой, используемой для постоянного лечения такого же заболевания. Аналогичным образом, парентеральная лекарственная форма может содержать меньшее количество одного или нескольких активных ингредиентов, которые она содержит, по сравнению с пероральной лекарственной формой, используемой для лечения такого же заболевания или расстройства. Специалистам в данной области будут очевидны эти и другие признаки, по которым конкретные дозированные формы по изобретению будут отличаться друг от друга. См., например, Remingtonʹs Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990).
Типичные фармацевтические композиции и лекарственные формы содержат одно или несколько вспомогательных веществ. Подходящие вспомогательные вещества хорошо известны специалистам в области фармацевтики, и неограничивающие примеры подходящих вспомогательных вещества приведены в настоящем документе. Подходит ли конкретное вспомогательное вещество для введения в фармацевтическую композицию или лекарственную форму, зависит от ряда факторов, хорошо известных в данной области, включая, но без ограничения ими, путь, по которому лекарственная форма будет вводиться пациенту. Например, пероральные лекарственные формы, такие как таблетки, могут содержать вспомогательные вещества, неприемлемые для использования в парентеральных дозированных формах. Приемлемость конкретного вспомогательного вещества может также зависеть от конкретных активных ингредиентов в лекарственной форме.
Безлактозные композиции по изобретению могут включать вспомогательные вещества, которые хорошо известны в данной области и перечислены, например, в Фармакопее США (USP) SP (XXI)/NF(XVI). Обычно безлактозные композиции содержат активные ингредиенты, связующее вещество/наполнитель и смазывающее вещество в фармацевтически совместимых и фармацевтически приемлемых количествах. Предпочтительные безлактозные лекарственные формы содержат активный ингредиент, микрокристаллическую целлюлозу, прежелатинизированный крахмал и стеарат магния.
Это изобретение дополнительно охватывает безводные фармацевтические композиции и лекарственные формы, содержащие активные ингредиенты, поскольку вода может ускорять разложение некоторых соединений. Например, добавление воды (например, 5%) принято в области фармацевтики в качестве средства, моделирующего долговременное хранение, для определения характеристик, таких как срок хранения или стабильность рецептур во времени. См., например, Jens T. Carstensen, Drug Stability: Principles & Practice, 2d Ed., Marcel Dekker, NY, NY, 1995, pp. 379-80). Действительно, вода и тепло ускоряют разложение некоторых соединений. Следовательно, влияние воды на рецептуру может быть достаточно значимым, так как влага и/или влажность часто встречаются во время производства, обработки, упаковки, хранения, транспортировки и применения препаратов.
Безводные фармацевтические композиции и лекарственные формы по изобретению могут быть получены с использованием безводных или имеющих низкое содержание влаги ингредиентов и в условиях с низким содержанием влаги или с низкой влажностью. Фармацевтические композиции и лекарственные формы, которые содержат лактозу и по меньшей мере один активный ингредиент, включающий первичный или вторичный амин, предпочтительно должны быть безводными, если ожидается существенный контакт с влагой и/или с влажными условиями во время производства, упаковки и/или хранения.
Безводную фармацевтическую композицию необходимо изготавливать и хранить так, чтобы сохранить ее безводное состояние. Соответственно, безводные композиции предпочтительно упаковывать с использованием материалов, которые, как известно, предотвращают воздействие воды, так что они могут быть включены в подходящие рецептурные наборы. Примеры подходящих упаковок включают, но не ограничены ими, герметично запаянную фольгу, пластмассы, контейнеры для стандартных доз (например, ампулы), блистерные упаковки и контурные упаковки.
Изобретение дополнительно охватывает фармацевтические композиции и лекарственные формы, содержащие одно или несколько соединений, которые снижают скорость разложения активного ингредиента. Такие соединения, которые в контексте настоящего документа называют «стабилизаторами», включают, но не ограничены ими, антиоксиданты, такие как аскорбиновая кислота, рН-буферы или солевые буферы.
Подобно количеству и типам вспомогательных веществ, количество и конкретные типы активных ингредиентов в лекарственной форме могут меняться в зависимости от ряда факторов, таких как, но без ограничения ими, путь, по которому они должны вводиться пациентам. Однако типичные лекарственные формы по изобретению варьируют в диапазоне от примерно 1 мг до примерно 1000 мг в день, вводимые в виде однократной ежедневной дозы утром, но, предпочтительно, дробными дозами в течение дня. Более конкретно, ежедневную дозу вводят дважды в день равными дробными дозами. Более конкретно, диапазон ежедневных доз может составлять от примерно 5 мг до примерно 500 мг в день, более конкретно, от примерно 10 мг до примерно 200 мг в день. При лечении пациента терапия может начинаться с меньшей дозы, возможно, от примерно 1 мг до примерно 25 мг, и увеличиваться при необходимости от примерно 200 мг до примерно 1000 мг в день либо в виде однократной дозы, либо в виде дробных доз, в зависимости от общего ответа пациента.
4.3.1. ОРАЛЬНЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ
Фармацевтические композиции по изобретению, которые подходят для перорального введения, могут быть получены в виде дискретных лекарственных форм, таких как, но без ограничения ими, таблетки (например, жевательные таблетки), каплеты, капсулы и жидкости (например, сиропы с определенным вкусом). Такие лекарственные формы содержат заданное количество активных ингредиентов и могут быть получены фармацевтическими способами, хорошо известными специалистам в данной области (см., например, Remingtonʹs Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990)).
Типичные пероральные лекарственные формы по изобретению получают путем объединения активных ингредиентов в однородную смесь с по меньшей мере одним вспомогательным веществом в соответствии с обычными фармацевтическими методиками составления смесей. Вспомогательные вещества могут принимать большое число форм в зависимости от необходимой формы препарата. Например, вспомогательные вещества, подходящие для применения в пероральных жидких или аэрозольных лекарственных формах, включают, но не ограничены ими, воду, гликоли, масла, спирты, ароматизаторы, консерванты и красители. Примеры вспомогательных веществ, подходящих для использования в твердых пероральных лекарственных формах (например, порошках, таблетках, капсулах и каплетах), включают, но не ограничены ими, крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, гранулирующие вещества, смазывающие вещества, связующие вещества и дезинтегрирующие вещества.
Вследствие легкости своего введения таблетки и капсулы представляют собой наиболее предпочтительные пероральные стандартные лекарственные формы, в случае которых используются твердые вспомогательные вещества. При желании, на таблетки может быть нанесено покрытие с помощью стандартных водных или неводных методик. Такие лекарственные формы могут быть получены с помощью любых фармацевтических способов. Обычно, фармацевтические композиции и лекарственные формы получают, равномерно и тщательно смешивая активные ингредиенты с жидкими носителями, тонкоизмельченными твердыми носителями или с ними обоими, а затем, если это необходимо, придавая продукту желаемую форму.
Например, таблетка может быть изготовлена путем прессования или формования. Прессованные таблетки могут быть получены путем прессования в подходящей машине активных ингредиентов в свободно текучей форме, такой как порошок или гранулы, необязательно смешанных со вспомогательным веществом. Формованные таблетки могут быть получены путем формования в подходящей машине смеси порошкообразного соединения, увлажненного инертным жидким разбавителем.
Примеры вспомогательных веществ, которые могут использоваться в пероральных лекарственных формах по изобретению, включают, но не ограничены ими, связующие вещества, наполнители, диспергирующие агенты и смазывающие вещества. Связующие вещества, подходящие для применения в фармацевтических композициях и лекарственных формах, включают, но не ограничены ими, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические камеди, такие как аравийская камедь, альгинат натрия, альгиновая кислота, другие альгинаты, порошкообразный трагакант, гуаровая камедь, целлюлозу и ее производные (например, этилцеллюлозу, ацетат целлюлозы, кальций-карбоксиметилцеллюлозу, натрий-карбоксиметилцеллюлозу), поливинилпирролидон, метилцеллюлозу, прежелатинизированный крахмал, гидроксипропилметилцеллюлозу (например, №2208, 2906, 2910), микрокристаллическую целлюлозу и их смеси.
Примеры наполнителей, подходящих для применения в фармацевтических композициях и дозированных лекарственных формах по изобретению, включают, но не ограничены ими, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраты, каолин, маннит, кремниевую кислоту, сорбит, крахмал, прежелатинизированный крахмал и их смеси. Связующее вещество или наполнитель в фармацевтической композиции в одном из вариантов изобретения присутствует в количестве от приблизительно 50 до приблизительно 99% вес. из расчета на фармацевтическую композицию или лекарственную форму.
Подходящие формы микрокристаллической целлюлозы включают, но не ограничены ими, материалы, продаваемые как AVICEL-PH-101™, AVICEL-PH-103™, AVICEL RC-581™, AVICEL-PH-105™ (продаваемые FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, PA), а также их смеси. Конкретным связующим веществом является смесь микрокристаллической целлюлозы и натрий-карбоксиметилцеллюлозы, продаваемая как AVICEL RC-581™. Подходящие безводные или с низким содержанием влаги вспомогательные вещества или добавки включают AVICEL-РН-103™ и Starch 1500 LM™.
В композициях по изобретению используются дезинтегрирующие вещества, чтобы получить таблетки, которые распадаются при воздействии водной среды. Таблетки, которые содержат слишком много дезинтегрирующего вещества, могут распадаться при хранении, тогда как таблетки, которые содержат слишком мало дезинтегрирующего вещества, не могут распадаться с желаемой скоростью или в желаемых условиях. Поэтому для получения твердых пероральных лекарственных форм по изобретению следует использовать достаточное количество дезинтегрирующего вещества, которое ни слишком велико, ни слишком мало, чтобы пагубно изменить высвобождение активных ингредиентов. Количество используемого дезинтегрирующего вещества варьирует, исходя из типа состава, и легко определяется специалистами в данной области. Типичные фармацевтические композиции содержат от примерно 0,5 до примерно 15% вес. дезинтегрирующего вещества, конкретно, от примерно 1 до примерно 5% вес. дезинтегрирующего вещества.
Дезинтегрирующие вещества, которые могут использоваться в фармацевтических композициях и лекарственных формах, включают, но не ограничены ими, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, кроскармеллозу натрия, кросповидон, полакриллин калия, натрий-крахмалгликолят, картофельный крахмал или крахмал из тапиоки, прежелатинизированный крахмал, другие крахмалы, глины, другие альгины, другие целлюлозы, камеди и их смеси.
Смазывающие вещества, которые могут использоваться в фармацевтических композициях и лекарственных формах по изобретению, включают, но не ограничены ими, стеарат кальция, стеарат магния, минеральное масло, светлое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурилсульфат натрия, тальк, гидрированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, этилолеат, этиллаурат, агар и их смеси. Дополнительные смазывающие вещества включают, например, силоидный силикагель (AEROSIL 200™, производимый W.R. Grace Co., Baltimore, MD), коагулированный аэрозоль синтетического диоксида кремния (продаваемый Degussa Co., Plano, TX), CAB-O-SIL™ (пирогенный диоксид кремния, продаваемый Cabot Co., Boston, MA) и их смеси. Если смазывающие вещества вообще используют, то их количество, как правило, составляет менее чем примерно 1% вес. из расчета на фармацевтическую композицию или лекарственную форму, в которую они включены.
4.3.2. ЛЕКАРСТВЕННЫЕ ФОРМЫ С ОТЛОЖЕННЫМ ВЫСВОБОЖДЕНИЕМ
Твердые формы, содержащие соединение А по изобретению, могут вводиться с помощью контролирующих высвобождение средств или с помощью устройств для доставки, которые хорошо известны средним специалистам в данной области. Примеры включают, но не ограничены ими, примеры, описанные в патентах США №3845770; 3916899; 3536809; 3598123; 4008719; 5674533; 5059595; 5591767; 5120548; 5073543; 5639476; 5354556 и 5733566, каждый из которых включен в настоящий документ путем ссылки. Такие лекарственные формы могут использоваться для обеспечения медленного или контролируемого высвобождения одного или нескольких активных ингредиентов с использованием, например, гидроксипропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, осмотических систем, многослойных покрытий, микрочастиц, липосом, микросфер или их комбинаций в различных пропорциях, чтобы получить желаемый профиль высвобождения. Для применения с действующими ингредиентами по изобретению можно легко подобрать подходящие контролирующие высвобождение составы, известные средним специалистам в данной области, включая описанные в настоящем документе. Поэтому настоящее изобретение охватывает стандартные лекарственные формы, подходящие для перорального введения, такие как, но без ограничения ими, таблетки, капсулы, гелькапы и каплеты, которые адаптированы для контролируемого высвобождения.
Все фармацевтические продукты с контролируемым высвобождением имеют общую цель улучшения лекарственной терапии по сравнению с терапией, достигаемой с помощью аналогов без контролируемого высвобождения. В идеальном варианте использование препарата с контролируемым высвобождением при лечении характеризуется минимальным количеством лекарственного вещества, которое используют для излечения или контроля состояния, за минимальное время. Преимущества составов с контролируемым высвобождением включают продленную активность лекарственного средства, сниженную частоту введения и улучшенное соблюдение пациентом схемы лечения. Кроме того, составы с контролируемым высвобождением можно использовать, чтобы повлиять на время наступления эффекта или на другие характеристики, такие как уровень лекарственного средства в крови, и, таким образом, могут влиять на проявление побочных (например, отрицательных) эффектов.
Большинство составов с контролируемым высвобождением созданы таким образом, чтобы вначале высвободить количество лекарственного средства (активного ингредиента), которое сразу дает желаемый терапевтический или профилактический эффект, и затем постепенно и постоянно высвобождать другие количества лекарственного средства для поддержания такого же уровня терапевтического или профилактического эффекта в течение продолжительного периода времени. Для того чтобы сохранить этот постоянный уровень лекарственного средства в крови, лекарственное средство должно высвобождаться из лекарственной формы со скоростью, которая будет замещать количество лекарства, подвергшееся метаболизму и выведенное из организма. Контролируемое высвобождение активного ингредиента может стимулироваться различными условиями, включающими, но без ограничения ими, рН, температуру, ферменты, воду или другие физиологические условия или соединения.
4.3.3. ПАРЕНТЕРАЛЬНЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ
Парентеральные лекарственные формы могут вводиться пациентам различными путями, включающими, но без ограничения ими, подкожный, внутривенный (в том числе, болюсную инъекцию), внутримышечный и внутриартериальный. Поскольку введение парентеральной лекарственной формы обходит естественные защитные механизмы пациентов от инфекций, парентеральные лекарственные формы, предпочтительно, должны быть стерильными или должны иметь возможность стерилизации перед введением пациенту. Примеры парентеральных лекарственных форм включают, но не ограничены ими, растворы, готовые для инъекции, сухие продукты, готовые для растворения или суспендирования в фармацевтически приемлемом носителе для инъекций, суспензии, готовые для инъекций, и эмульсии.
Подходящие носители, которые могут использоваться для создания парентеральных лекарственных форм по изобретению, хорошо известны специалистам в данной области. Примеры включают, но не ограничены ими, воду для инъекций фармакопейного качества; водные носители, такие как, но без ограничения этим, раствор хлористого натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлористого натрия для инъекций и раствор Рингера-лактат для инъекций; смешивающиеся с водой носители, такие как, но без ограничения этим, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, но без ограничения этим, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
Соединения, которые повышают растворимость одного или нескольких активных ингредиентов, раскрытых в настоящем документе, также могут быть включены в парентеральные лекарственные формы по изобретению.
4.3.4. ТРАНСДЕРМАЛЬНЫЕ И МЕСТНЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ, А ТАКЖЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ ДЛЯ ВВЕДЕНИЯ ЧЕРЕЗ СЛИЗИСТЫЕ
Трансдермальные и местные лекарственные формы, а также лекарственные формы для введения через слизистые по изобретению включают, но не ограничены ими, офтальмические растворы, спреи, аэрозоли, кремы, лосьоны, мази, гели, растворы, эмульсии, суспензии или другие формы, известные специалистам в данной области. См., например, Remingtonʹs Pharmaceutical Sciences, 16th & 18th eds., Mack Publishing, Easton PA (1980 & 1990); и Introduction to Pharmaceutical Dosage Forms, 4th ed., Lea & Febiger, Philadelphia (1985). Лекарственные формы, подходящие для лечения слизистых тканей в полости рта могут быть составлены в виде полосканий для рта или оральных гелей. Кроме того, трансдермальные лекарственные формы включают пластыри «резервуарного типа» или «матричного типа», которые можно наносить на кожу и носить в течение определенного периода времени, чтобы позволить проникнуть в организм заданному количеству активных ингредиентов.
Подходящие вспомогательные вещества (например, носители и разбавители) и другие материалы, которые могут использоваться для создания трансдермальных и местных лекарственных форм, а также лекарственных форм для слизистых, охватываемых настоящим изобретением, хорошо известны в фармацевтической области и зависят от конкретной ткани, на которую данная фармацевтическая композиция или лекарственная форма будут наноситься. С учетом вышесказанного, для создания лосьонов, настоек, кремов, эмульсий, гелей или мазей, которые нетоксичны и фармацевтически приемлемы, вспомогательные вещества включают, но не ограничены ими, воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси. Увлажнители или смачивающие вещества также могут быть добавлены к фармацевтическим композициям или лекарственным формам, если это целесообразно. Примеры таких дополнительных ингредиентов хорошо известны в данной области. См., например, Remingtonʹs Pharmaceutical Sciences, 16th & 18th eds., Mack Publishing, Easton PA (1980 & 1990).
В зависимости от конкретной ткани, подлежащей лечению, могут использоваться дополнительные компоненты до лечения действующими ингредиентами по изобретению, совместно с ними или после них. Например, для усиления доставки активных ингредиентов в ткань могут использоваться усилители проникновения. Подходящие усилители проникновения включают, но не ограничены ими, ацетон; различные спирты, такие как этанол, олеил или тетрагидрофурил; алкильные сульфоксиды, такие как диметилсульфоксид; диметилацетамид; диметилформамид; полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; виды коллидона (повидон, поливидон); мочевину и различные водорастворимые и нерастворимые сложные эфиры сахаров, такие как Tween 80™ (полисорбат 80) и Span 60™ (моностеарат сорбитана).
Значение рН фармацевтической композиции или лекарственной формы, или ткани, на которую наносятся фармацевтическая композиция или лекарственная форма, также может быть скорректировано, для того чтобы улучшить доставку одного или нескольких активных ингредиентов. Аналогичным образом, для улучшения доставки можно корректировать полярность растворителя-носителя, его ионную силу или тоничность. Соединения, такие как стеараты, также могут быть добавлены к фармацевтическим композициям или лекарственным формам для изменения гидрофильности или липофильности одного или нескольких активных ингредиентов с тем, чтобы улучшить доставку. В этом отношении стеараты могут служить в качестве липидного носителя для состава, в качестве эмульгирующего агента или поверхностно-активного вещества, или в качестве улучшающего доставку или усиливающего проникновение средства. Для того чтобы дополнительно скорректировать свойства конечной композиции можно использовать другие твердые формы, содержащие активные ингредиенты.
4.3.5. НАБОРЫ
Данное изобретение охватывает наборы, которые при использовании медицинскими работниками, могут упростить введение пациенту соответствующих количеств активных ингредиентов.
Типичный набор по изобретению включает стандартную лекарственную форму соединения А или его фармацевтически приемлемую твердую форму или пролекарство, и стандартную лекарственную форму второго активного ингредиента. Примеры вторых активных ингредиентов включают, но не ограничены ими, перечисленные в настоящем документе.
Наборы по изобретению дополнительно могут включать устройства, которые используют для введения активного ингредиента (активных ингредиентов). Примерами таких устройств являются, но без ограничения ими, шприцы, капельные пакеты, пластыри и ингаляторы.
Наборы по изобретению могут дополнительно включать фармацевтически приемлемые носители, которые могут использоваться для введения одного или нескольких активных ингредиентов. Например, если активный ингредиент представлен в твердой форме, которая должна быть восстановлена для парентерального введения, набор может содержать герметичный контейнер с подходящим носителем, в котором активный ингредиент может быть растворен с образованием подходящего для парентерального введения стерильного раствора, не содержащего материал в форме частиц. Примеры фармацевтически приемлемых носителей включают, но не ограничены ими, воду для инъекций по USP; водные носители, такие как, но без ограничения ими, раствор хлористого натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлористого натрия для инъекций и Рингера-лактат раствор для инъекций; смешивающиеся с водой носители, такие как, но без ограничения ими, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, но без ограничения ими, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
5. ПРИМЕРЫ
5.1. ПРИМЕР 1: МЕТОДЫ АНАЛИЗА
5.1.1. АНАЛИЗ ИНГИБИРОВАНИЯ TNFα В PBMC
Мононуклеарные клетки периферической крови (PBMC) от здоровых доноров получали центрифугированием в градиенте плотности Ficoll Hypaque (Pharmacia, Piscataway, NJ, USA). Клетки культивировали в RPMI 1640 (Life Technologies, Grand Island, NY, USA), дополненной 10% AB + человеческой сывороткой (Gemini Bio-products, Woodland, CA, USA), 2 мМ L-глутамином, 100 Ед./мл пенициллина и 100 мкг/мл стрептомицина (Life Technologies).
PBMC (2×105 клеток) высевали в 96-луночные плоскодонные планшеты для тканевых культур фирмы Costar (Corning, NY, USA) в трех повторах. Клетки стимулировали липополисахаридами (LPS) (из Salmonella abortus equi, Sigma cat. no. L-1887, St.Louis, MO, USA) с конечной концентрацией 1 нг/мл в отсутствие или в присутствии тестируемых соединений. Соединения по изобретению растворяли в DMSO (Sigma) и дополнительно разбавляли в культуральной среде непосредственно перед использованием. Конечная концентрация DMSO во всех анализах может составлять примерно 0,25%. Соединения добавляли к клеткам за 1 час до стимуляции LPS. Затем клетки выдерживали в течение 18-20 часов при 37°C в 5% CO2, затем собирали супернатанты, разбавляли культуральной средой и анализировали на содержание TNFα с помощью ELISA (Endogen, Boston, MA, USA). IC50 вычисляли, используя нелинейную регрессию, сигмоидальный дозозависимый эффект, принимая верхнее значение за 100% и нижнее значение за 0%, допуская переменный наклон (GraphPad Prism v3,02). В двух экспериментах соединение А имело IC50, составляющую 10 и 85 нM.
5.1.2. ПРОДУКЦИЯ IL-2 и MIP-3α T-КЛЕТКАМИ
PBMC освобождали от адгезионных моноцитов, помещая 1х108 PBMC в 10 мл полной среды (RPMI 1640, дополненной 10% фетальной бычьей сыворотки, инактивированной нагреванием, 2 мМ L-глутамином, 100 Ед./мл пенициллина и 100 мкг/мл стрептомицина) в чашку диаметром 10 см, при 37°C и 5% CO2 в инкубаторе в течение 30-60 минут. Чашку промывали средой для того, чтобы удалить все неприкрепившиеся PBMC. T-клетки очищали отрицательной селекцией, используя следующую смесь антител (Pharmingen) и Dynabead (Dynal) для каждых 1×108 неприкрепившихся PBMC: 0,3 мл овечьих антимышиных IgG шариков, 15 мкл анти-CD16, 15 мкл анти-CD33, 15 мкл анти-CD56, 0,23 мл анти-CD19 шариков, 0,23 мл анти-HLA класса II шариков и 56 мкл анти-CD14 шариков. Клетки и смесь шариков/антител вращали, переворачивая пробирку, в течение 30-60 минут при 4°C. Очищенные T-клетки отделяли от шариков, используя магнит Dynal. Средний выход составлял примерно 50% T-клеток, 87-95% CD3+, по данным проточной цитометрии.
96-луночные плоскодонные планшеты для тканевых культур покрывали анти-CD3 антителами OKT3 с концентрацией 5 мкг/мл в PBS, 100 мкл на лунку, выдерживали при 37°C в течение 3-6 ч, затем промывали четыре раза полной средой по 100 мкл на лунку непосредственно перед добавлением T-клеток. Соединения разбавляли до 20-кратной конечной концентрации в 96-луночном круглодонном планшете для тканевых культур. Конечные концентрации составляли от примерно 10 мкМ до примерно 0,00064 мкМ. 10 мМ концентрированный раствор соединений по изобретению разбавляли 1:50 в полной среде для первого 20× разбавления (200 мкМ) в 2%-ном DMSO и последовательно разбавляли 1:5 в 2%-ном DMSO. Соединения добавляли в количестве 10 мкл на 200 мкл культуры, что давало конечную концентрацию DMSO, составляющую 0,1%. Культуры инкубировали при 37°C и 5% CO2 в течение 2-3 дней, и супернатанты среды анализировали на содержание IL-2 и MIP-3α с помощью ELISA (R&D Systems). Концентрации IL-2 и MIP-3α нормализовали на количество, продуцируемое в присутствии количества соединения по изобретению, и EC50 вычисляли, используя нелинейную регрессию, сигмоидальный дозозависимый эффект, принимая верхнее значение за 100% и нижнее значение за 0%, допуская переменный наклон (GraphPad Prism v3.02).
5.1.3. АНАЛИЗ КЛЕТОЧНОЙ ПРОЛИФЕРАЦИИ
Клеточные линии Namalwa, MUTZ-5 и UT-7 получали ОТ Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (Braunschweig, Germany). Клеточную линию KG-1 получали от American Type Culture Collection (Manassas, VA, USA). Клеточную пролиферацию, определяемую включением 3H-тимидина, измеряли во всех клеточных линиях следующим образом.
Клетки высевали в 96-луночные планшеты в количестве 6000 клеток на лунку в среде. Клетки предварительно обрабатывали соединениями с концентрациями, составляющими примерно 100, 10, 1, 0,1, 0,01, 0,001, 0,0001 и 0 мкм, в конечной концентрацией DMSO, составляющей примерно 0,25%, в трех повторах при 37°C во влажной атмосфере при 5% CO2 в течение 72 ч. Затем в каждую лунку добавляли один микрокюри 3H-тимидина (Amersham), и клетки инкубировали снова при 37°C во влажной атмосфере при 5% CO2 в течение 6 ч. Клетки собирали на UniFilter GF/C фильтровальных планшетах (Perkin Elmer), применяя устройство для сбора клеток (Tomtec), и оставляли планшеты сушиться в течение ночи. Добавляли Microscint 20 (Packard) (25 мкл/лунка), и планшеты анализировали в TopCount NXT (Packard). Радиоактивность каждой лунки считали в течение одной минуты. Процент ингибирования пролиферации клеток рассчитывали усреднением всех трех повторов и нормализуя на DMSO-контроль (0 % ингибирования). Каждое соединение тестировали на каждой клеточной линии в трех отдельных экспериментах. Конечные значения IC50 вычисляли, используя нелинейную регрессию, сигмоидальный дозозависимый эффект, принимая верхнее значение за 100% и нижнее значение за 0%, допуская переменный наклон (GraphPad Prism v3.02).
5.1.4. ИММУНОПРЕЦИПИТАЦИЯ И ИММУНОБЛОТ
Клетки Namalwa обрабатывали DMSO или определенным количеством соединения по изобретению в течение 1 ч, затем стимулировали 10 Ед./мл Epo (R&D Systems) в течение 30 мин. Получали клеточные лизаты и либо иммунопреципитировали с антителами к Epo-рецептору, либо незамедлительно разделяли электрофорезом в ДСН-ПААГ. Иммуноблоты окрашивали антителами к Akt, фосфо-Akt (Ser473 или Thr308), фосфо-Gab1 (Y627), Gab1, IRS2, актину и IRF-1 и анализировали на Storm 860 Imager, используя программное обеспечение ImageQuant (Molecular Dynamics).
5.1.5. АНАЛИЗ КЛЕТОЧНОГО ЦИКЛА
Клетки обрабатывали DMSO или определенным количеством соединения по изобретению в течение ночи. Окрашивание пропидий йодидом на клеточный цикл осуществляли, используя CycleTEST PLUS (Becton Dickinson) согласно протоколу производителя. После окрашивания клетки анализировали на цитометре FACSCalibur, используя программное обеспечение ModFit LT (Becton Dickinson).
5.1.6. АНАЛИЗ АПОПТОЗА
Клетки обрабатывали DMSO или определенным количеством соединения по изобретению в течение различных периодов времени, затем промывали аннексин V-промывочным буфером (BD Biosciences). Клетки инкубировали с аннексином V и пропидий йодидом (BD Biosciences) в течение 10 мин. Образцы анализировали с использованием проточной цитометрии.
5.1.7. ЛЮЦИФЕРАЗНЫЙ АНАЛИЗ
Клетки Namalwa трансфецировали, используя 4 мкг AP1-люциферазы (Stratagene) и 3 мкл реагента Lipofectamin 2000 (Invitrogen) на 1х106 клеток согласно инструкции изготовителя. Через 6 ч после трансфекции клетки обрабатывали DMSO или определенным количеством соединения по изобретению. Люциферазную активность анализировали, используя люциферазный лизирующий буфер и субстрат (Promega) и измеряя ее на люминометре (Turner Designs).
5.2. ПРИМЕР 2: ПОЛУЧЕНИЕ 3-(5-АМИНО-2-МЕТИЛ-4-ОКСО-4Н-ХИНАЗОЛИН-3-ИЛ)ПИПЕРИДИН-2,6-ДИОНА (СОЕДИНЕНИЯ А)
Стадия 1: К раствору гидроксида калия (16,1 г, 286 ммоль) в воде (500 мл) добавляли 3-нитрофталимид (25,0 г, 130 ммоль) порциями при 0°С. Суспензию перемешивали при 0°С в течение 3 ч и затем нагревали до 30°С в течение 3 ч. К раствору добавляли HCl (100 мл, 6N). Полученную суспензию охлаждали до 0°С в течение 1 ч. Суспензию фильтровали и промывали холодной водой (2Ч10 мл), получая 3-нитрофталаминовую кислоту в виде белого твердого вещества (24,6 г, выход 90%): 1H-ЯМР (DMSO-d6) δ 7,69 (ушир.с, 1H, NHH), 7,74 (т, J=8 Гц, 1H, Ar), 7,92 (дд, J=1,8 Гц, 1H, Ar), 8,13 (дд, J=1,8 Гц, 1H, Ar), 8,15 (ушир.с, 1H, NHH), 13,59 (с, 1Η, OH); 13C-ЯМР (DMSO-d6) δ 125,33, 129,15, 130,25, 132,54, 136,72, 147,03, 165,90, 167,31.
Стадия 2: К смеси 3-нитрофталаминовой кислоты (24,6 г, 117 ммоль) и гидроксида калия (6,56 г, 117 ммоль) в воде (118 мл) добавляли смесь брома (6 мл), гидроксида калия (13,2 г, 234 ммоль) в воде (240 мл) при 0°С, затем добавляли раствор гидроксида калия (19,8 г, 351 ммоль) в воде (350 мл). После выдерживания в течение 5 мин при 0°С смесь нагревали на масляной бане с температурой 100°С в течение 1 ч. Реакционный раствор охлаждали до комнатной температуры, а затем на водяной бане со льдом в течение 30 минут. К смеси по каплям добавляли раствор HCl (240 мл, 2N) при 0°С и полученную смесь оставляли на 1 час. Суспензию фильтровали и промывали водой (5 мл), получая 2-амино-6-нитробензойную кислоту в виде желтого твердого вещества (15,6 г, выход 73%): ВЭЖХ: колонка Waters Symmetry C18, 5 мкм, 3,9Ч150 мм, скорость потока 1 мл/мин, 240 нм, CH3CN/0,1% Н3РО4 с градиентом от 5 до 95% в течение 5 мин, 5,83 мин (85%); 1H-ЯМР (DMSO-d6) δ 6,90 (дд, J=1,8 Гц, 1H, Ar), 7,01 (дд, J=1,9 Гц, 1H, Ar), 7,31 (т, J=8 Гц, 1H, Ar), 8,5-9,5 (ушир.с, 3H, OH, NH2); 13C-ЯМР (DMSO-d6) δ 105,58, 110,14, 120,07, 131,74, 149,80, 151,36, 166,30; ЖХ-МС: ΜΗ=183.
Стадия 3: Смесь 2-амино-6-нитробензойной кислоты (1,5 г, 8,2 ммоль) в уксусном ангидриде (15 мл) нагревали при 200°С в течение 30 мин в микроволновой печи. Смесь фильтровали и промывали этилацетатом (20 мл). Фильтрат концентрировали в вакууме. Твердое вещество перемешивали в эфире (20 мл) 2 ч. Суспензию фильтровали и промывали эфиром (20 мл), получая 2-метил-5-нитробензо[d][1,3]оксазин-4-он в виде светло-коричневого твердого вещества (1,4 г, выход 85%): ВЭЖХ: колонка Waters Symmetry C18, 5 мкм, 3,9Ч150 мм, скорость потока 1 мл/мин, 240 нм, CH3CN/0,1% Н3РО4 с градиентом от 5 до 95% в течение 5 мин, 5,36 мин (92%); 1H-ЯМР (DMSO-d6) δ 2,42 (с, 3H, CH3), 7,79 (дд, J=1,8 Гц, 1H, Ar), 7,93 (дд, J=1,8 Гц, 1H, Ar), 8,06 (т, J=8 Гц, 1H, Ar); 13C-ЯМР (DMSO-d6) δ 20,87, 107,79, 121,54, 128,87, 137,19, 147,12, 148,46, 155,18, 161,78; ЖХ-МС: ΜΗ=207.
Стадия 4: Две ампулы, каждая с суспензией 5-нитро-2-метилбензо[d][1,3]оксазин-4-она (0,60 г, 2,91 ммоль) и гидрохлорида 3-аминопиперидин-2,6-диона (0,48 г, 2,91 ммоль) в пиридине (15 мл), нагревали в микроволновой печи при 170°С в течение 10 мин. Суспензию фильтровали и промывали пиридином (5 мл). Фильтрат концентрировали в вакууме. Полученную смесь перемешивали в HCl (30 мл, 1N), этилацетате (15 мл) и эфире (15 мл) в течение 2 ч. Суспензию фильтровали и промывали водой (30 мл) и этилацетатом (30 мл), получая темно-коричневое твердое вещество, которое перемешивали с метанолом (50 мл) при комнатной температуре в течение ночи. Суспензию фильтровали и промывали метанолом, получая 3-(2-метил-5-нитро-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде черного твердого вещества (490 мг, выход 27%). Твердое вещество использовали на следующей стадии без дополнительной очистки.
Стадия 5: Смесь 3-(2-метил-5-нитро-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (250 мг) и Pd(ОН)2 на угле (110 мг) в ДМФА (40 мл) встряхивали в атмосфере водорода (50 psi (0,34 МПа)) в течение 12 ч. Суспензию фильтровали через слой целита и промывали DMF (10 мл). Фильтрат концентрировали в вакууме и полученное масло очищали колоночной флэш-хроматографией (силикагель, метанол/метиленхлорид), получая 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (156 мг, выход 69%): ВЭЖХ: колонка Waters Symmetry C18, 5 мкм, 3,9Ч150 мм, скорость потока 1 мл/мин, 240 нм, CH3CN/0,1%Н3РО4 с градиентом от 10 до 90%, 3,52 мин (99,9%); температура плавления: 293-295°C; 1H-ЯМР (DMSO-d6) δ 2,10-2,17 (м, 1H, CHH), 2,53 (с, 3H, CН3), 2,59-2,69 (м, 2H, CН2), 2,76-2,89 (CН3, 1H, CHH), 5,14 (дд, J=6,11 Гц, 1H, NCH), 6,56 (д, J=8 Гц, 1H, Ar), 6,59 (д, J=8 Гц, 1H, Ar), 7,02 (с, 2H, NH2), 7,36 (т, J=8 Гц, 1H, Ar), 10,98 (с, 1H, NH); 13C-ЯМР (DMSO-d6) δ 20,98, 23,14, 30,52, 55,92, 104,15, 110,48, 111,37, 134,92, 148,17, 150,55, 153,62, 162,59, 169,65, 172,57; ЖХ-МС: MH=287; вычислено для C14Н14N4O3+0,3Н2О: C, 57,65; H, 5,05; N, 19,21. Найдено: C, 57,50; H, 4,73; N, 19,00.
5.3. ПРИМЕР 3: ПОЛУЧЕНИЕ ГИДРОХЛОРИДА СОЕДИНЕНИЯ А
В стеклянной колбе с мешалкой ресуспендировали приблизительно 19 г соединения А (свободного основания) приблизительно в 200 мл ацетонитрила и 200 мл воды. Добавляли приблизительно 5 мл 12N соляной кислоты и суспензию растворяли при нагревании выше 55°С. Раствор охлаждали до приблизительно 45°С и в колбу добавляли затравочные кристаллы формы A1 соединения А (например, гидрохлорида). Затем по каплям добавляли 6N соляную кислоту, что приводило к дальнейшей кристаллизации. Полученную суспензию медленно охлаждали. Затем суспензию фильтровали и осадок на фильтре промывали ацетонитрилом. Продукт затем сушили в вакуумной печи. Полученный сухой продукт соответствует форме A1 соединения А.
5.4. ПРИМЕР 4: СКРИНИНГОВЫЕ ИССЛЕДОВАНИЯ ТВЕРДЫХ ФОРМ
5.4.1. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДИКИ
Описанные в настоящем документе способы проиллюстрированы на гидрохлориде соединения А. Эти способы могут быть использованы непосредственно или с некоторыми изменениями для других твердых форм соединения А, описанного в настоящем документе.
Растворимость: взвешенный образец гидрохлорида соединения А (около 50 мг) обрабатывали известным объемом тестируемого растворителя. Растворители были либо химической, либо ВЭЖХ-чистоты. Полученную смесь перемешивали в течение по меньшей мере 24 ч при температуре около 25°С. Если визуально казалось, что все твердые частицы растворились, то предполагаемую растворимость вычисляли на основе общего объема растворителя, используемого для получения истинного раствора. Фактическая растворимость может быть выше вычисленной вследствие большого количества растворителя или медленной скорости растворения. Если присутствует твердое вещество, то растворимость измеряли гравиметрически. Известный объем фильтрата выпаривали до сухости и измеряли вес остатка.
Уравновешивание/суспензия и испарение: эксперименты по уравновешиванию и испарению проводили путем добавления избытка гидрохлорида соединения А к примерно 2 мл тестируемого растворителя. Полученную смесь перемешивали в течение по меньшей мере 24 ч при температуре около 25°С или около 50°С. После достижения равновесия насыщенный раствор удаляли и оставляли медленно испаряться в открытом флаконе в атмосфере азота при температуре около 25°С и около 50°С, соответственно. Твердые частицы, полученные в результате уравновешивания, фильтровали и сушили на воздухе.
Перекристаллизация при охлаждении: отдельные растворители (THF/вода, MeCN/вода, MeOH/0,1N HCl и EtOH/0,1N HCl) насыщали гидрохлоридом соединения А при температуре около 50-70°C. После полного растворения твердого вещества раствор быстро охлаждали, помещая его в холодильник (температура около 0-5°C). Твердые вещества выделяли через 1-3 дня.
Перекристаллизация из растворителя/антирастворителя: выбранный растворитель (MeCN/вода) насыщали гидрохлоридом соединения А при комнатной температуре. После полного растворения твердого вещества к раствору добавляли антирастворитель (ацетон или изопропанол). Смесь перемешивали при комнатной температуре в течение ночи. Если осадок не образовался, то ампулу дополнительно охлаждали, помещая ее в холодильник (с температурой около 0-5°C). Твердые вещества, образовавшиеся в результате перекристаллизации, фильтровали и сушили на воздухе.
Исследования измельчения: эксперименты по измельчению проводили, используя шейкер Wig-L-Bug shaker. Примерно 50 мг гидрохлорида соединения А добавляли в полистироловую пробирку (1"×½") с плексигласовыми шариками (3/8"). Пробирку закрывали и помещали на шейкер примерно на 50 с. Для влажного измельчения в пробирку добавляли капли воды, и получалась влажная паста до помещения на шейкер.
Исследования влажности: примерно 30 мг гидрохлорида соединения А помещали в ампулы темного стекла в двух повторах. Ампулы помещали в камеру с температурой 40°C и 75%-й относительной влажностью, причем одно ампулу оставляли закрытой, а одну - открытой. Твердые вещества затем анализировали с помощью XRPD через четыре недели. Дополнительный эксперимент стрессового воздействия влажности проводили, помещая примерно 10 мг гидрохлорида соединения А в DVS-аппарат при 95%-ный влажности и комнатной температуре на четыре дня.
5.4.2. МЕТОДИКИ ХАРАКТЕРИСТИКИ
Рентгеновская дифракция порошка (XRPD): XRPD-анализ проводили на порошковом дифрактометре Thermo ARL XʹTRA™ используя излучение CuKα (1,54 Å). Прибор снабжен тонкосфокусированной рентгеновской трубкой. Напряжение и ток генератора рентгеновских лучей были установлены на 45 кВ и 40 мА, соответственно. Рассеивающие щели были установлены на 4 мм и 2 мм, а приемные щели устанавливали на 0,5 мм и 0,2 мм. Рассеянное излучение регистрировали с помощью твердотельного Si(Li)-детектора с охлаждающими элементами Пелтье. Использовали непрерывное сканирование тета-2 тета со скоростью 2,40°/мин (0,5 с/0,02° шаг) от 1,5° 2θ до 40° 2θ. Корундовый стандарт применяли для проверки юстировки прибора. В общем, ожидалось, что позиции XRPD-пиков будут индивидуально варьировать между измерениями примерно на ±0,2° 2θ. В общем, как понятно в данной области, две дифрактограммы совпадают друг с другом, если характеристические пики первой дифрактограммы расположены приблизительно в тех же позициях, что и характеристические пики второй дифрактограммы. Как очевидно в данной области, определение, совпадают ли две дифрактограммы или совпадают ли индивидуальные пики на двух дифрактограммах, может требовать учета таких индивидуальных переменных и параметров, как, среди прочего, но без ограничения ими, предпочтительная ориентация, фазовые примеси, степень кристаллизации, размер частиц, изменение в приборных настройках дифрактометра, изменение в параметрах сбора XRPD-данных и/или изменение в обработке XRPD-данных. Определение соответствия двух дифрактограмм может проводиться визуально и/или с помощью компьютерного анализа.
Дифференциальная сканирующая калориметрия (DSC): DSC-анализы проводили на дифференциальном сканирующем калориметре TA Instruments Q2000™. Индий использовали в качестве калибровочного стандарта. Примерно 2-5 мг образца помещали в тигель для DSC. Образец нагревали в атмосфере азота со скоростью 10°/мин от примерно 25°C до конечной температуры 300°C. Точки плавления указывали как экстраполированные начальные температуры.
Термогравиметрические анализы (TGA): TGA-анализы проводили на термогравиметрическом анализаторе TA Instruments Q5000™. Оксалат кальция использовали для калибровки. Примерно 5-20 мг точно взвешенного образца помещали в тигель и загружали в печь TGA. Образец нагревали в атмосфере азота со скоростью 10°/мин до конечной температуры примерно 300°C.
Оптическая микроскопия: морфологический анализ образца проводили на микроскопе Olympus. Небольшие количества образца диспергировали в минеральном масле на стеклянном слайде с покровными стеклами и наблюдали при 20-кратном увеличении.
Динамическая сорбция паров (DVS): гигроскопичность определяли на Surface Measurement Systems DVS. Как правило, образец примерно 2-10 мг помещали в лоток для образца в DVS-инструменте. Образец анализировали на автоматизированном анализаторе сорбции DVS при комнатной температуре. Относительную влажность увеличивали от 0 до 95% RH с шагом в 10%RH, затем при 95%RH. Относительную влажность затем снижали аналогичным образом, чтобы выполнить полный цикл адсорбции/десорбции.
Растворимость по ВЭЖХ: растворимость формы А в отдельных водных и органических растворителях определяли, смешивая твердое вещество с растворителями при комнатной температуре. Образцы фильтровали через 24 ч интенсивного перемешивания и количественно определяли с помощью ВЭЖХ за исключением DMSO, для которого растворимость измеряли через 1 час после перемешивания.
5.4.3. РЕЗУЛЬТАТЫ СКРИНИНГА ТВЕРДЫХ ФОРМ
Твердые формы, содержащие соединение А, которые были получены в течение скрининга твердых форм, включали формы A, B, C, D, E, F и A1, и аморфные формы. Типичные XRPD-дифрактограммы, DSC-графики, TGA-графики и DVS-графики для форм A, B, C, D, E, F и I приведены в настоящем документе на фиг. 1-21.
5.4.3.1. ТВЕРДЫЕ ФОРМЫ СОЕДИНЕНИЯ А
Взаимопревращения между различными твердыми формами соединений А приведены на фиг. 22. Физические свойства форм A, B, C, D, Е и F представлены в таблице 2.
161,2 (экзо)
281,1 (начало)
283,3 (начало)
279,4 (начало)
266,5 (начало)
В стеклянной колбе с мешалкой 3,5 г свободного основания соединения А растворяли приблизительно в 14 мл DMSO и приблизительно 0,7 мл воды при комнатной температуре. Добавили приблизительно 2 мл воды, и началось образование кристаллов формы А соединения А. По каплям добавили дополнительную воду для дальнейшей кристаллизации реакционной смеси. Затем реакционную смесь отфильтровали. Осадок промыли раствором воды и DMSO (1:1, об./об.) и чистой водой. Сырой осадок высушили в вакуумной печи. Конечный сухой продукт соответствовал форме А соединения А.
В альтернативном варианте форма А соединения А может быть получена путем затравки. В стеклянной колбе с мешалкой 3,5 г свободного основания соединения А растворяли приблизительно в 14 мл DMSO и приблизительно 0,7 мл воды при комнатной температуре. Добавили приблизительно 1,3 мл воды и затравочные кристаллы формы А соединения А, и началось образование кристаллов формы А соединения А. По каплям добавили дополнительную воду для дальнейшей кристаллизации реакционной смеси. Затем реакционную смесь отфильтровали. Осадок промыли раствором воды и DMSO (1:1, об./об.) и чистой водой. Сырой осадок высушили в вакуумной печи. Конечный сухой продукт соответствовал форме А соединения А.
Форму В соединения А получали из формы А посредством перекристаллизации из суспензии в метаноле, ацетоне или ацетонитриле. Перекристаллизацию из суспензии проводили, добавляя избыток соединения А к 2 мл метанола, ацетона или ацетонитрила. Полученную смесь интенсивно перемешивали в течение по меньшей мере 24 ч при температуре около 50°C. После достижения равновесия твердое вещество отфильтровывали и высушивали на воздухе.
Форму С соединения А получали из формы А посредством перекристаллизации из суспензии в EtOAc, EtOH, изопропаноле (IPA), MEK, n-BuOH или THF при температуре около 50°C. Перекристаллизацию из суспензии проводили, добавляя избыток соединения А к 2 мл EtOAc, EtOH, IPA, MEK, n-BuOH или THF. Полученную смесь интенсивно перемешивали в течение по меньшей мере 24 ч при температуре около 50°C. После достижения равновесия твердое вещество отфильтровывали и высушивали на воздухе.
Форму D соединения А получали из формы А посредством высушивания формы А в вакуумной печи при температуре около 80-90°C.
Форму Е соединения А получали из формы А посредством перекристаллизации из суспензии в ацетонитриле, этаноле или изопропаноле при комнатной температуре. Перекристаллизацию из суспензии проводили, добавляя избыток соединения А к 2 мл ацетонитрила, этанола или изопропанола. Полученную смесь интенсивно перемешивали в течение по меньшей мере 24 ч при комнатной температуре. После достижения равновесия твердое вещество отфильтровывали и высушивали на воздухе.
Форму F соединения А получали из формы А посредством перекристаллизации из суспензии в воде при комнатной температуре. Перекристаллизацию из суспензии проводили, добавляя избыток соединения А к 2 мл воды. Полученную смесь интенсивно перемешивали в течение по меньшей мере 16 ч при комнатной температуре. После достижения равновесия твердое вещество отфильтровывали и высушивали на воздухе.
5.4.3.2. ТВЕРДАЯ ФОРМА A1 ГИДРОХЛОРИДА СОЕДИНЕНИЯ A
Форму А1 гидрохлорида соединения А получали следующим способом. В стеклянной колбе с мешалкой смешивали 2 г гидрохлорида соединения А со смесью растворителей, содержащей приблизительно 20 мл ацетонитрила и 20 мл воды, и растворяли при нагревании выше 55°C. Раствор охлаждали до 45°С и добавляли приблизительно 3,3 мл 6N соляной кислоты, что вызывало кристаллизацию. Полученную суспензию медленно охлаждали и фильтровали. Осадок промывали ацетонитрилом и высушивали в вакуумной печи. Полученный сухой продукт соответствовал форме A1 соединения А.
Крупномасштабный способ. Крупномасштабное получение формы А1 осуществляли, смешивая 100 г гидрохлорида соединения А, 960 мл ацетонитрила и 960 мл деионизированной воды в реакторе. Смесь нагревали при интенсивном перемешивании до 60-70°C и перемещали во второй реактор через встроенный фильтр (0,45 мкм). Первый реактор промывали 100 мл смеси ацетонитрил:вода (1:1), которую переносили во второй реактор через встроенный фильтр. Во время переноса температуру во втором реакторе поддерживали 65°C. Температуру во втором реакторе затем снижали до 45°C и инициировали кристаллизацию, добавляя 3 г кристаллов формы А1. Реакционная смесь начинала кристаллизоваться, ее оставляли для завершения процесса на 30 минут при 45°C. К полученной суспензии добавляли 171 мл 6N HCl через встроенный фильтр в течение 1 ч, поддерживая температуру реакции около 45°C. Реакционную смесь оставляли на 1,5 ч при 45°C и охлаждали до 0°C линейным градиентом за 4 ч. Реакционную смесь оставляли на 1 ч при 0°C. Надосадочную жидкость разделяли для UPLC-концентрирования. Концентрация формы А1 в супернатанте составляла 5 мг/мл. Суспензии отфильтровывали через пористый стеклянный фильтр под вакуумом. Осадок промывали 2х300 мл ацетонитрила. Осадок высушивали в вакуумной печи при 40°C до тех пор, пока содержание ацетонитрила не стало меньше 400 ч/млн. Сухой осадок формы А1 представлял собой белый/не совсем белый порошок.
Было установлено, что смесь ацетонитрила и воды является единственной системой растворителей, которая обеспечивала приемлемые свойства для масштабирования, например, растворимость выше примерно 50 г/мл продукта. Избыток HCl был добавлен для предупреждения образования свободного основания соединения А. В некоторых случаях было найдено, что отсутствие HCl в процессе приводило к образованию свободного основания. Также полагают, что избыток HCl улучшает выход формы А1 в ходе кристаллизации.
Физические свойства гидрохлорида были одинаковыми от партии к партии. TGA-анализ показывает небольшое количество остаточного растворителя (также, по ЯМР остаточный ацетонитрил может быть снижен до менее чем 400 ppm). DSC показывает единственное событие при ~280°C, которое, как полагают, является разложением (аналогично температуре разложения свободного основания). Микроскопические исследования показывают морфологию длинных палочек.
Исследования растворимости. Была определена приблизительная растворимость формы А1 гидрохлорида соединения А в различных растворителях при температуре около 25°C. Было найдено, что форма А1 является наиболее растворимой (>25 мг/мл) в смесях MeCN/вода (1:1) и THF/вода (1:1). Было найдено, что форма А1 имеет умеренную растворимость (3-10 мг/мл) в смеси EtOH/вода (1:1), MeOH, CH2Cl2, THF и воде. Было найдено, что форма А1 имеет низкую растворимость (<3 мг/мл) в других протестированных органических растворителях. Растворимость формы А1 в отдельных растворителях была также протестирована с помощью ВЭЖХ, и результаты приведены в таблице 3.
Суспензионные эксперименты проводили при комнатной температуре и 50°C с использованием формы А1 гидрохлорида соединения А в качестве исходного материала. Результаты суммированы в таблицах 4 и 5. С помощью XRPD было подтверждено, что все твердые вещества, выделенные из чистых органических растворителей после 24 ч нахождения в суспензии, являются формой А1. Также было подтверждено, что твердые вещества, выделенные из суспензии в смеси THF/вода при 50°C, является формой А1. Было показано, что твердые вещества, выделенные из суспензии в других водных/органических или водных растворителях, представляют собой смеси формы А1 и свободного основания соединения А, что позволяет предположить частичную диссоциацию гидрохлорида.
Проводили эксперименты по выпариванию. Результаты приведены в таблицах 6 и 7. При выпаривании при комнатной температуре было подтверждено, что твердые вещества, полученные из воды, EtOH/воды и MeCN/воды, представляли собой форму А1. Частичная или полная диссоциация соли наблюдалась в MeOH, THF и THF/воде. Для выпаривания при 50°C было подтверждено, что твердые вещества, полученные из MeOH, воды, EtOH/воды и MeCN/воды, представляли собой форму А1. Было показано, что твердое вещество из THF/воды являлось аморфным.
Перекристаллизацию проводили в нескольких смесях органических/водных растворителей. Результаты приведены в таблице 8. Было подтверждено, что твердые вещества из MeCN/вода, MeOH/0,1N HCl или EtOH/0,1N HCl представляют собой форму А1. Полная диссоциация соли наблюдалась в THF/вода.
Кристаллизацию из антирастворителя также проводили с использованием MeCN/вода в качестве исходной системы растворителей и с использованием ацетона или IPA в качестве антирастворителя. Форму А1 получали при использовании ацетона в качестве антирастворителя, а при использовании IPA в качестве антирастворителя наблюдалась частичная диссоциация соли.
Эксперименты по измельчению проводили с добавлением и без добавления воды в качестве дополнительной попытки получения полиморфных форм. Было найдено, что форма А1 не изменяется при измельчении. Результаты приведены в таблице 9.
Характеристика формы А1
Форма A1 имела кристаллическую XRPD дифрактограмму, как показано на фиг. 18, и игольчатую структуру кристалла. TGA- и DSC-термограммы формы A1 показаны на фиг. 19 и 20, соответственно. Незначительное снижение веса наблюдалось до разложения, начальная температура которого составляла приблизительно 276°С, что было определено методом DSC.
Сорбция/десорбция влаги формой A1 была определена с помощью DVS, и результаты приведены на фиг. 21. Масса формы A1 изменялась на 0,15% по отношению к сухой массе при увеличении относительной влажности с 0 до 95%, что свидетельствует о том, что материал не гигроскопичен. После прохождения полного цикла адсорбции/десорбции XRPD-дифрактограмма образца показала, что вещество не изменилось по сравнению с исходной формой A1.
Стабильность формы A1 определяли путем воздействия на образец окружающих условий 40°С/75% RH в течение четырех недель и 95% RH при комнатной температуре в течение четырех дней. Твердая форма вещества не изменилась по сравнению с исходным образцом, не подвергающимся воздействию окружающей среды (таблица 10). Также было найдено, что форма A1 стабильна при давлении 2000 psi (13,79 МПа) в течение примерно 1 мин.
Исходя из исследований характеристик было найдено, что форма А1 является стабильным, безводным и негигроскопичным кристаллическим веществом.
Хотя изобретение описано на конкретных вариантах осуществления, для опытных специалистов в данной области будет очевидно, что можно провести различные изменения и модификации, не отклоняясь от сути и объема изобретения, определенных в формуле изобретения. Также предполагается, что такие модификации входят в объем приложенной формулы изобретения.
Все патенты, патентные заявки и публикации, цитируемые в настоящем изобретении, полностью включены в настоящий документ. Цитирование или указание любой ссылки в настоящей заявке не является признанием того, что данная ссылка является прототипом заявленного изобретения. Полный объем изобретения будет лучше понят на основании прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СИНТЕЗ И НОВЫЕ СОЛЕВЫЕ ФОРМЫ (R)-5-((E)-2-(ПИРРОЛИДИН-3-ИЛВИНИЛ)ПИРИМИДИНА | 2009 |
|
RU2533819C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ (R)-5-[3-ХЛОР-4-(2, 3-ДИГИДРОКСИПРОПОКСИ)БЕНЗ[Z]ИЛИДЕН]-2-([Z]-ПРОПИЛИМИНО)-3-о-ТОЛИЛТИАЗОЛИДИН-4-ОНА | 2009 |
|
RU2519548C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА МОНОГИДРАТА ГИДРОХЛОРИДА (R)-7-ХЛОР-N-(ХИНУКЛИДИН-3-ИЛ)БЕНЗО[b]ТИОФЕН-2-КАРБОКСАМИДА | 2011 |
|
RU2577334C2 |
| СИНТЕЗ И НОВЫЕ СОЛЕВЫЕ ФОРМЫ (R)-5-((Е)-2-ПИРРОЛИДИН-3-ИЛВИНИЛ)ПИРИМИДИНА | 2014 |
|
RU2700796C2 |
| СОЛИ 1-(4-(2-((1-(3,4-ДИФТОРФЕНИЛ)-1Н-ПИРАЗОЛ-3-ИЛ)МЕТОКСИ)ЭТИЛ)ПИПЕРАЗИН-1-ИЛ)ЭТАНОНА | 2016 |
|
RU2727974C2 |
| КРИСТАЛЛИЧЕСКИЕ СОЛЬВАТЫ ГИДРОХЛОРИДА 6-(ПИПЕРИДИН-4-ИЛОКСИ)-2Н-ИЗОХИНОЛИН-1-OHA | 2012 |
|
RU2619129C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ { [1-ЦИАНО-5-(4-ХЛОРОФЕНОКСИ)-4-ГИДРОКСИИЗОХИНОЛИН-3-КАРБОНИЛ]-АМИНО} -УКСУСНОЙ КИСЛОТЫ | 2014 |
|
RU2666144C2 |
| ТВЁРДЫЕ ФОРМЫ ИНГИБИТОРА КИНАЗЫ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 2013 |
|
RU2673077C2 |
| ПОЛУЧЕНИЕ 2-(5-БРОМ-4-(4-ЦИКЛОПРОПИЛНАФТАЛИН-1-ИЛ)-4H-1,2,4-ТРИАЗОЛ-3-ИЛТИО)УКСУСНОЙ КИСЛОТЫ | 2013 |
|
RU2666549C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 3-[5-(2-ФТОРФЕНИЛ)-[1,2,4]ОКСАДИАЗОЛ-3-ИЛ]БЕНЗОЙНОЙ КИСЛОТЫ, ИХ ПРИМЕНЕНИЕ И СПОСОБЫ ПОЛУЧЕНИЯ | 2007 |
|
RU2474577C2 |
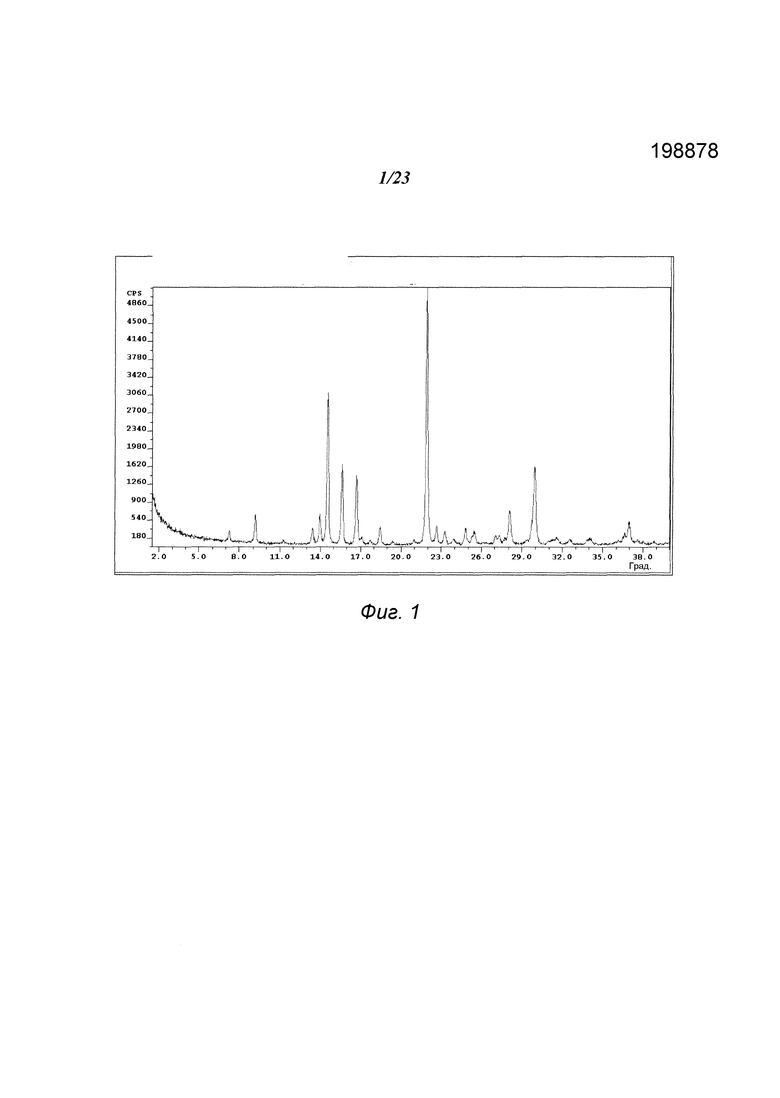
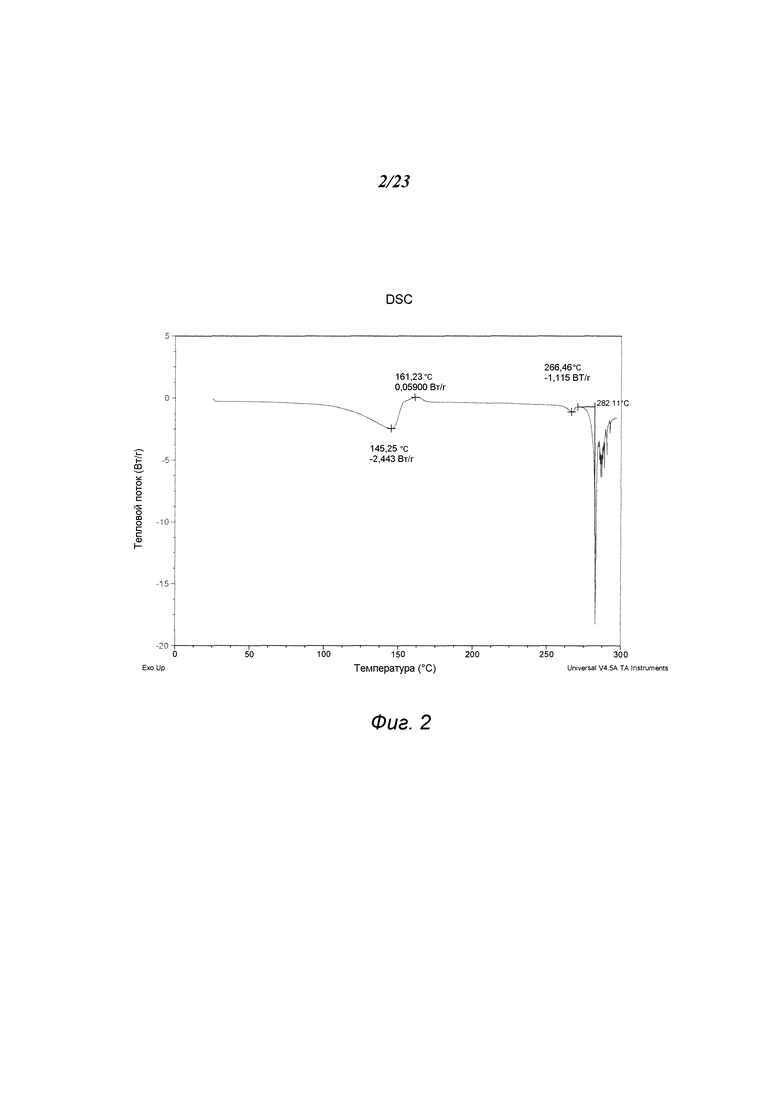
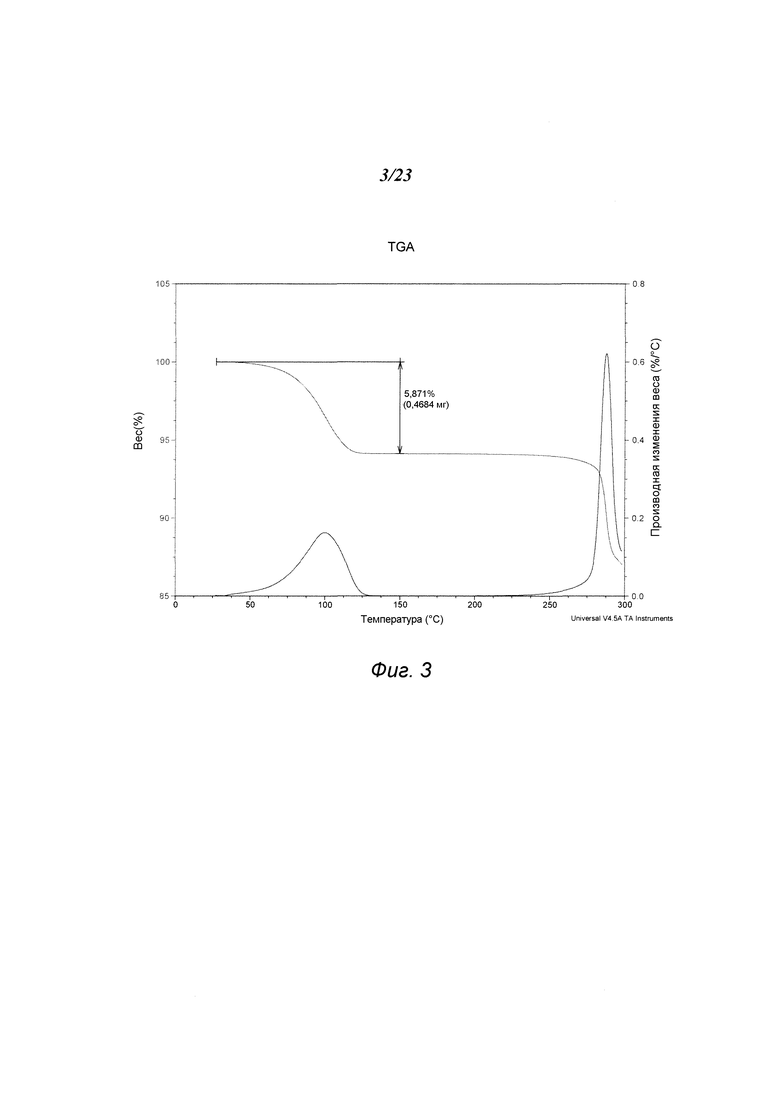
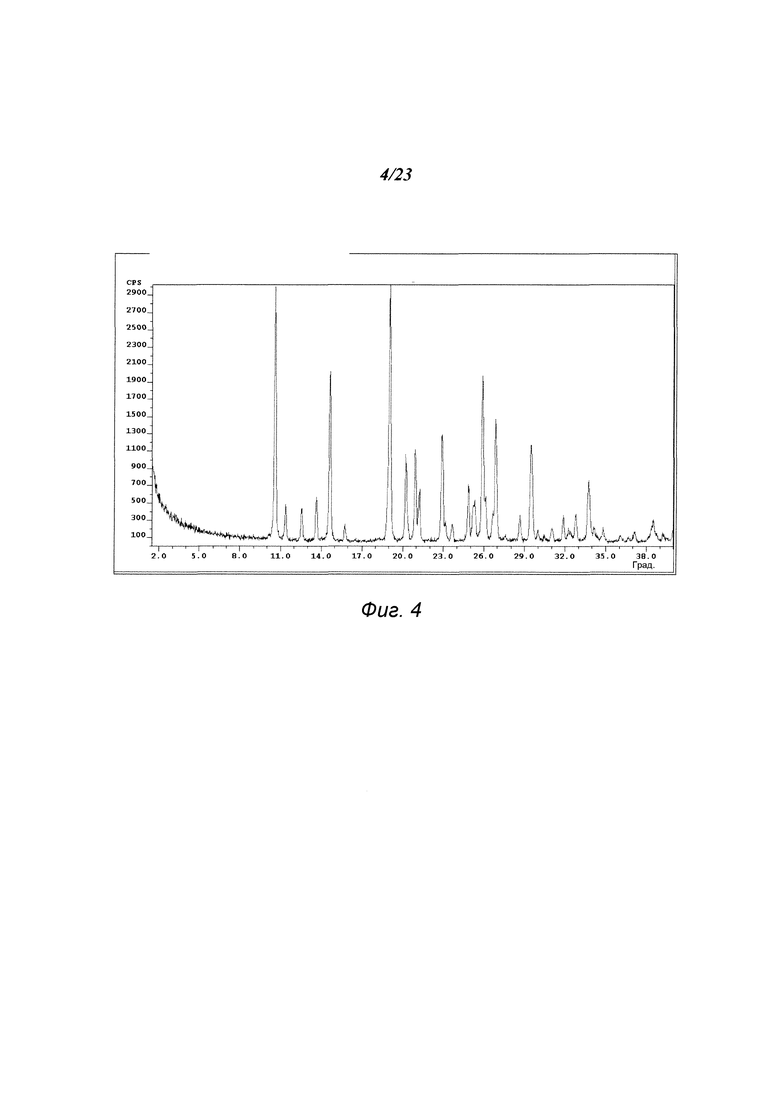
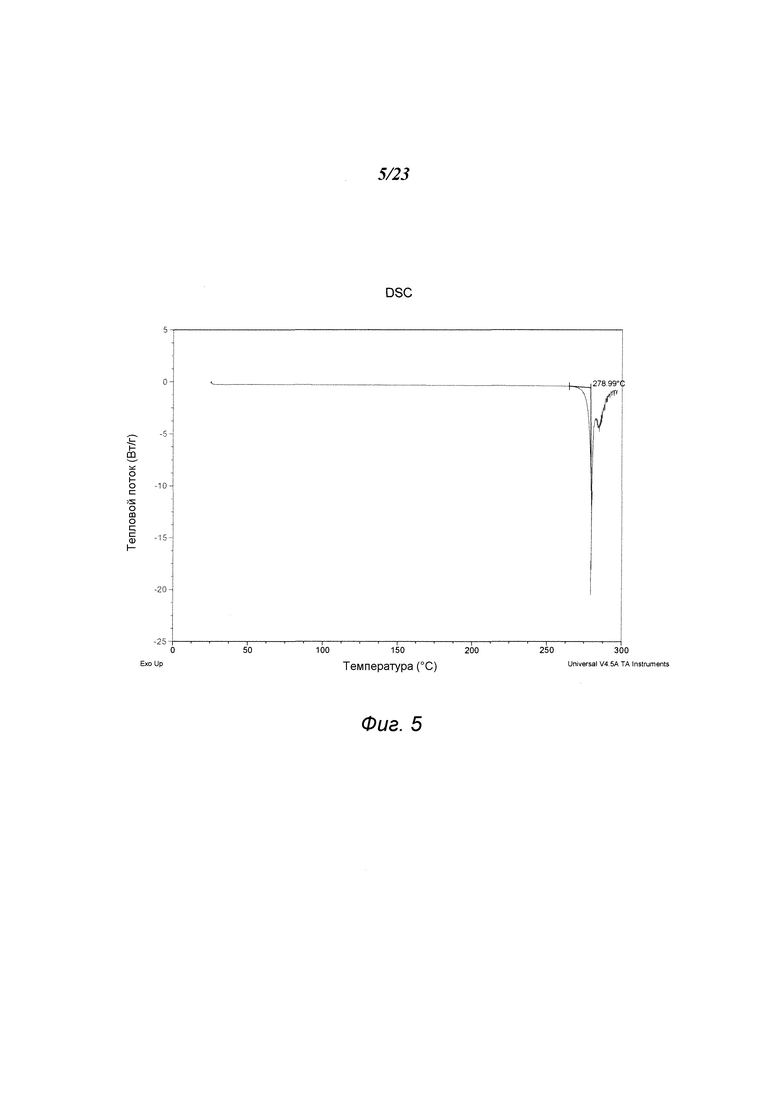
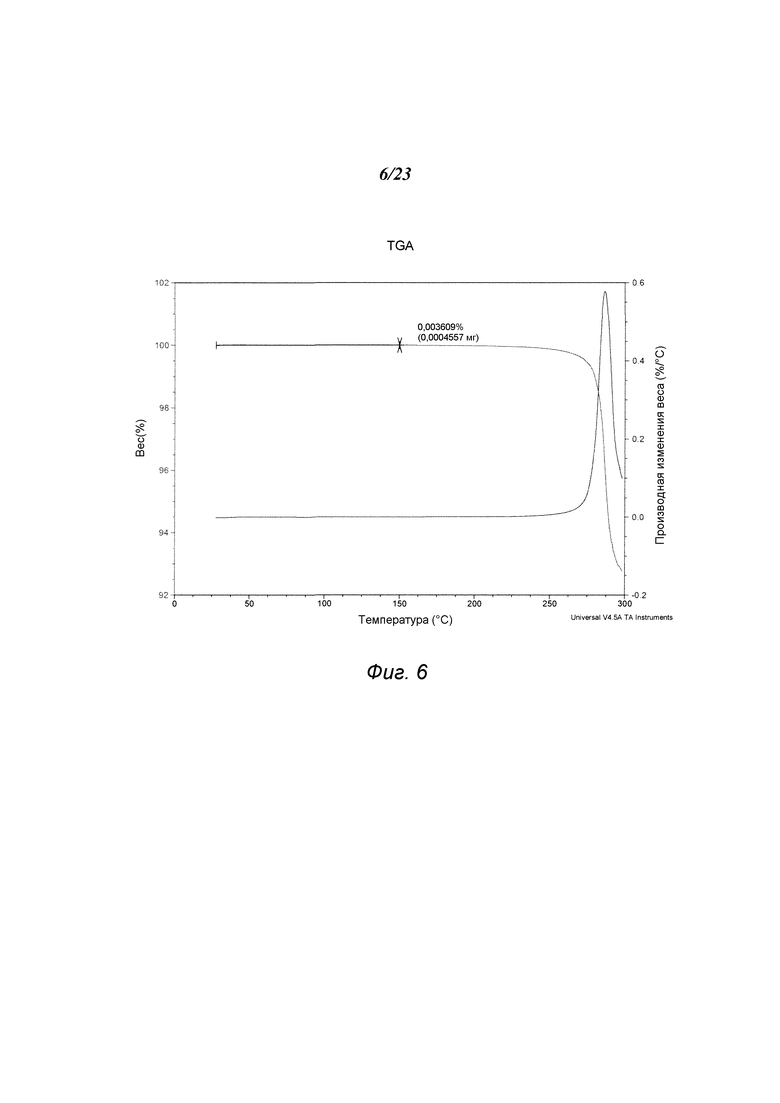
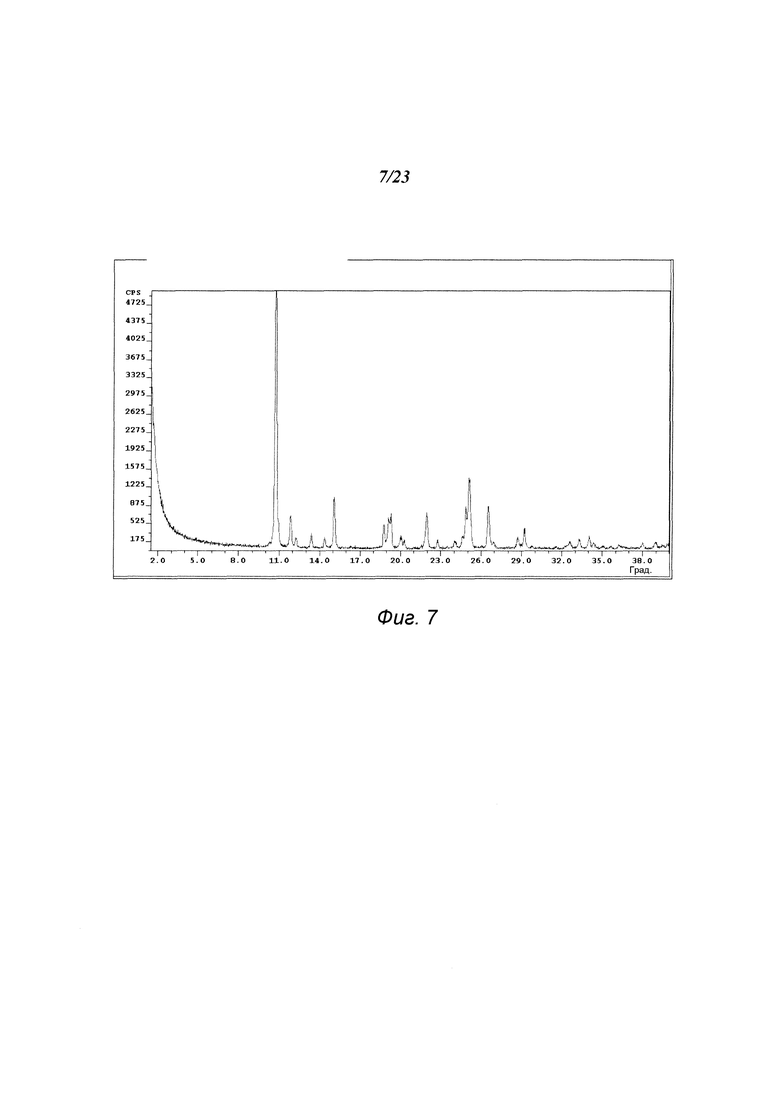
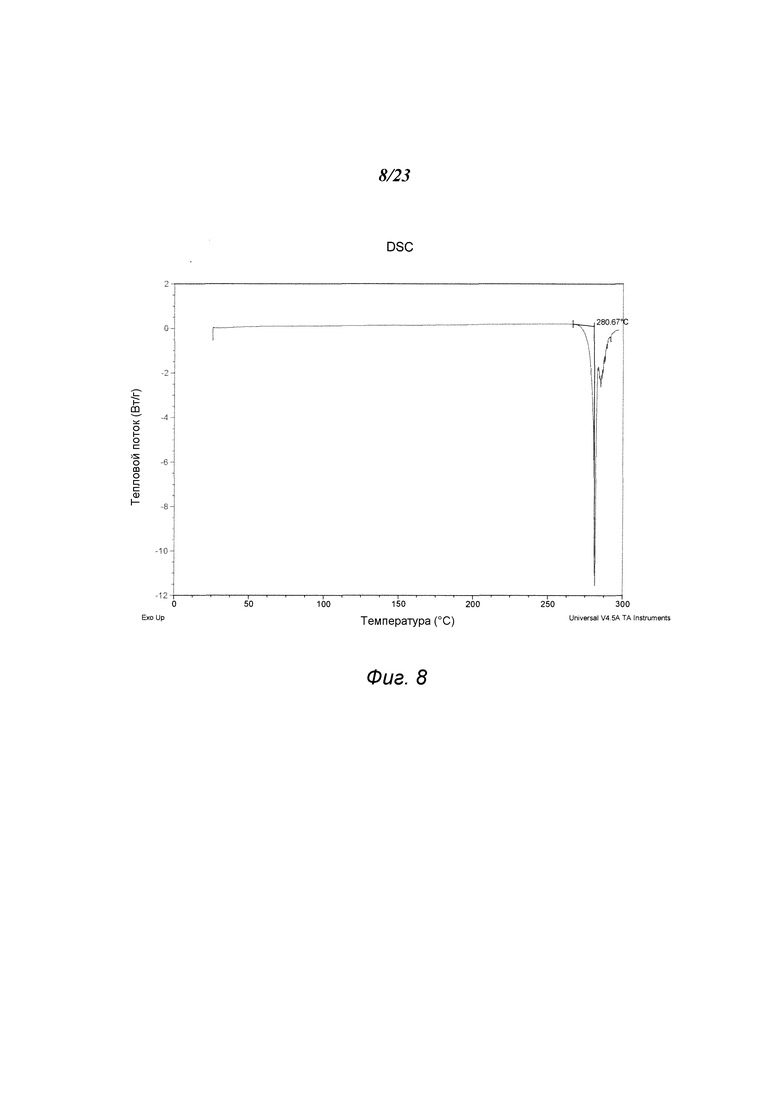

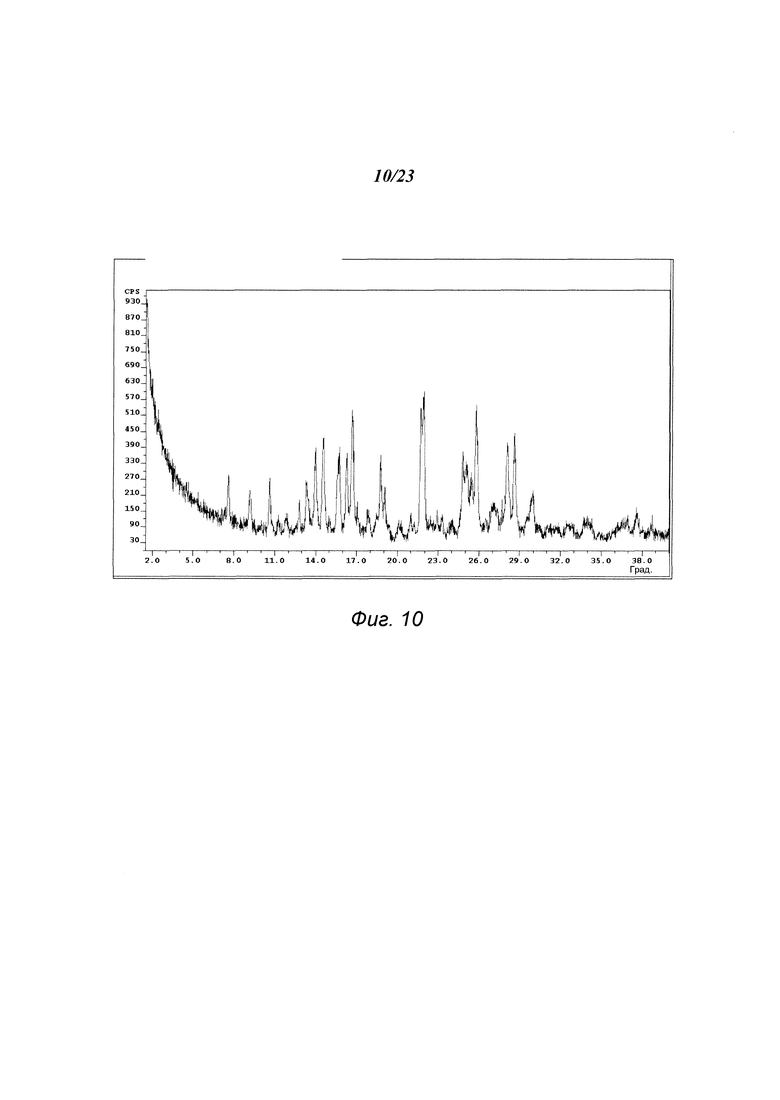
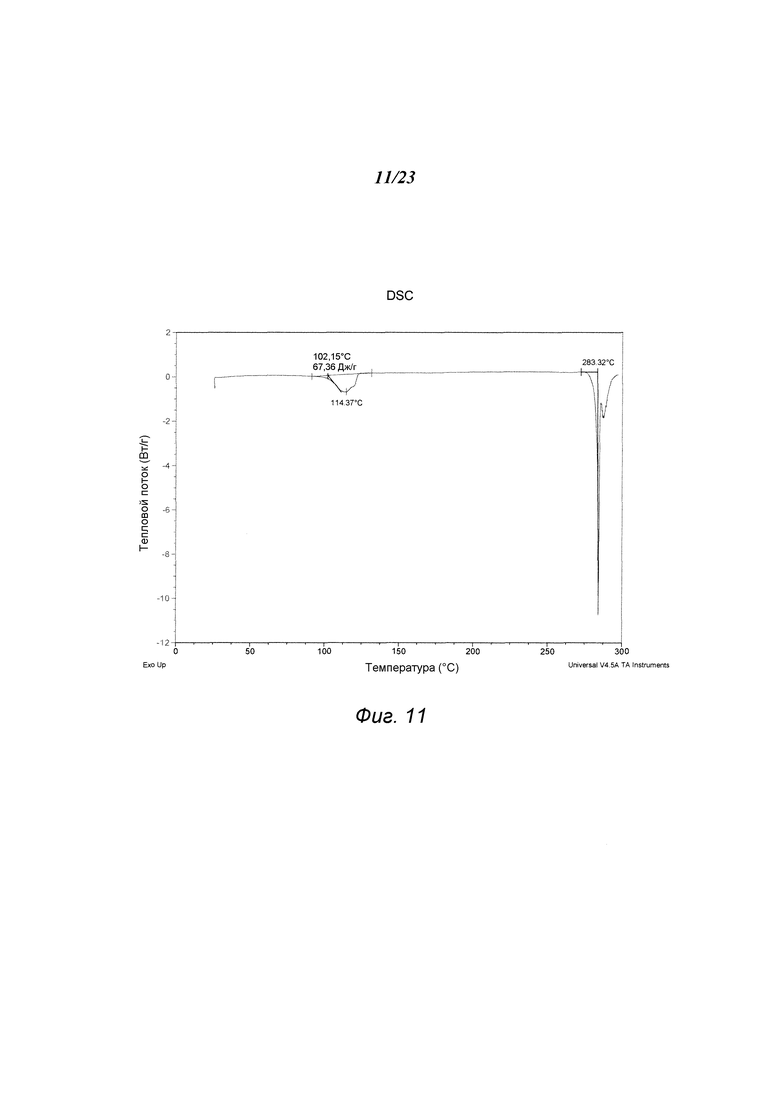
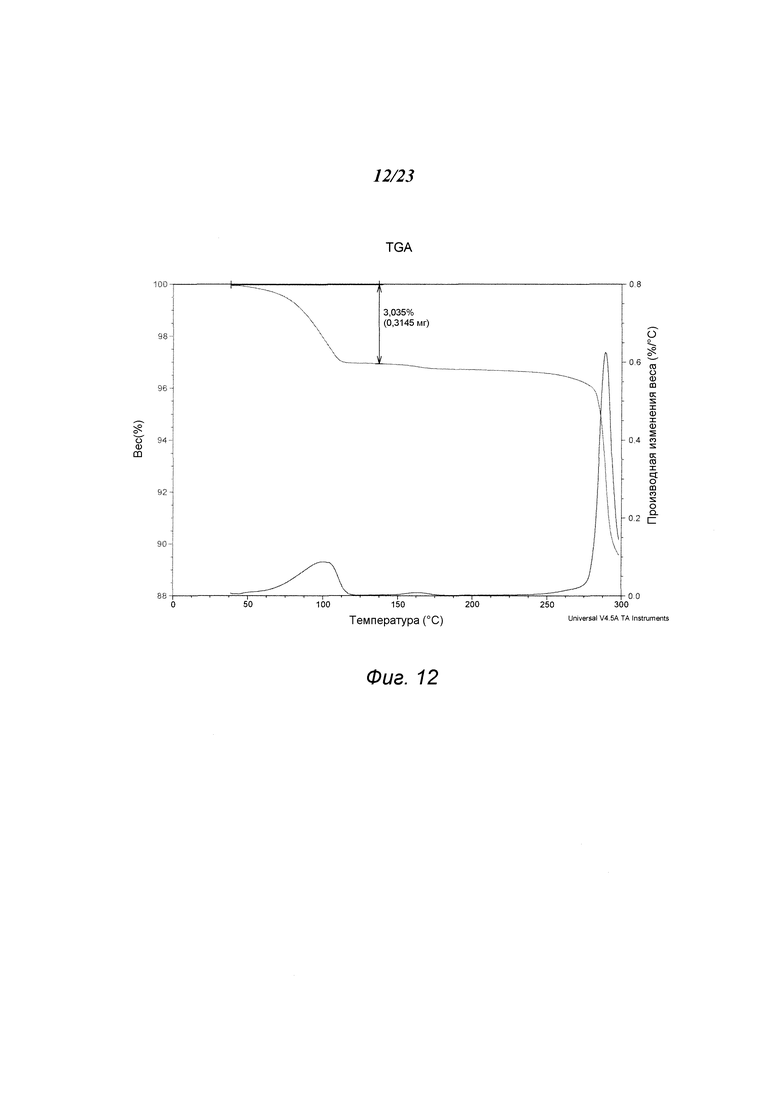
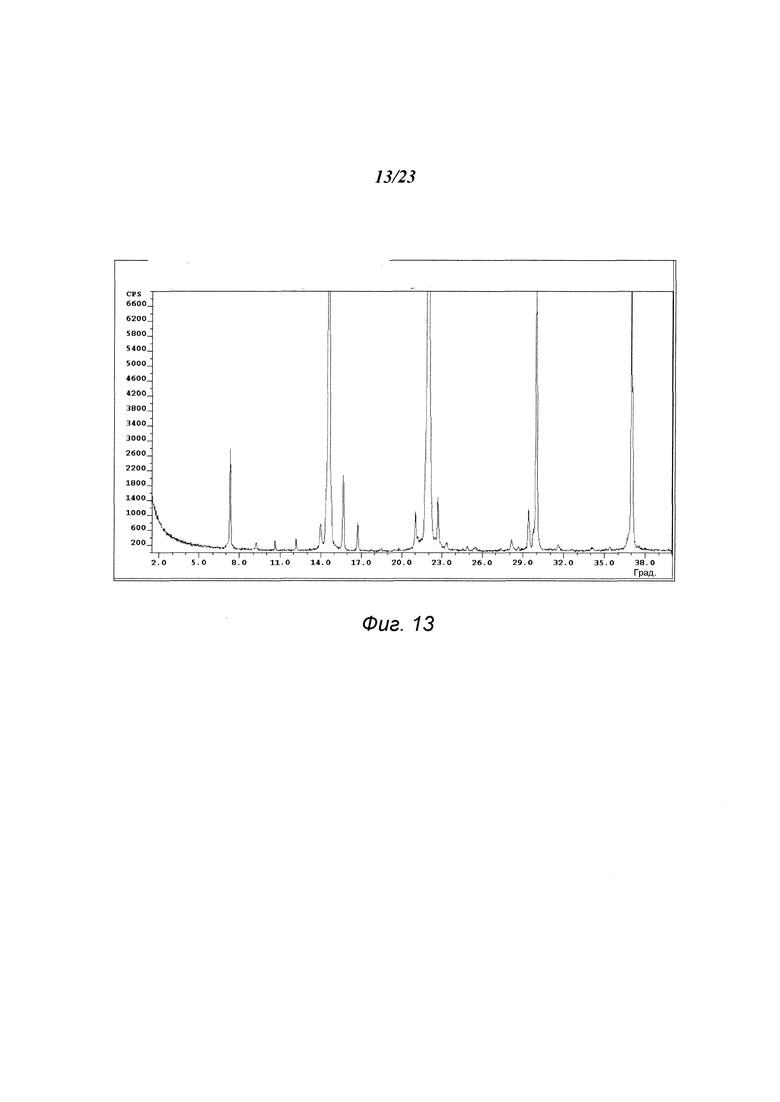
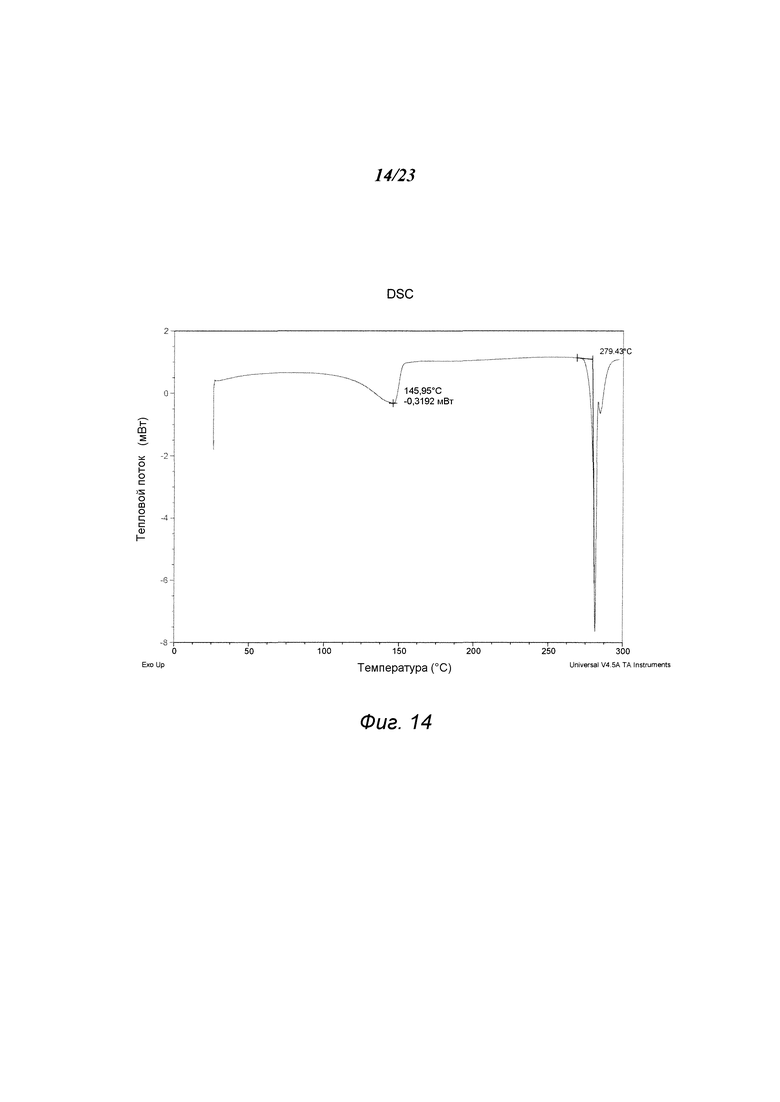
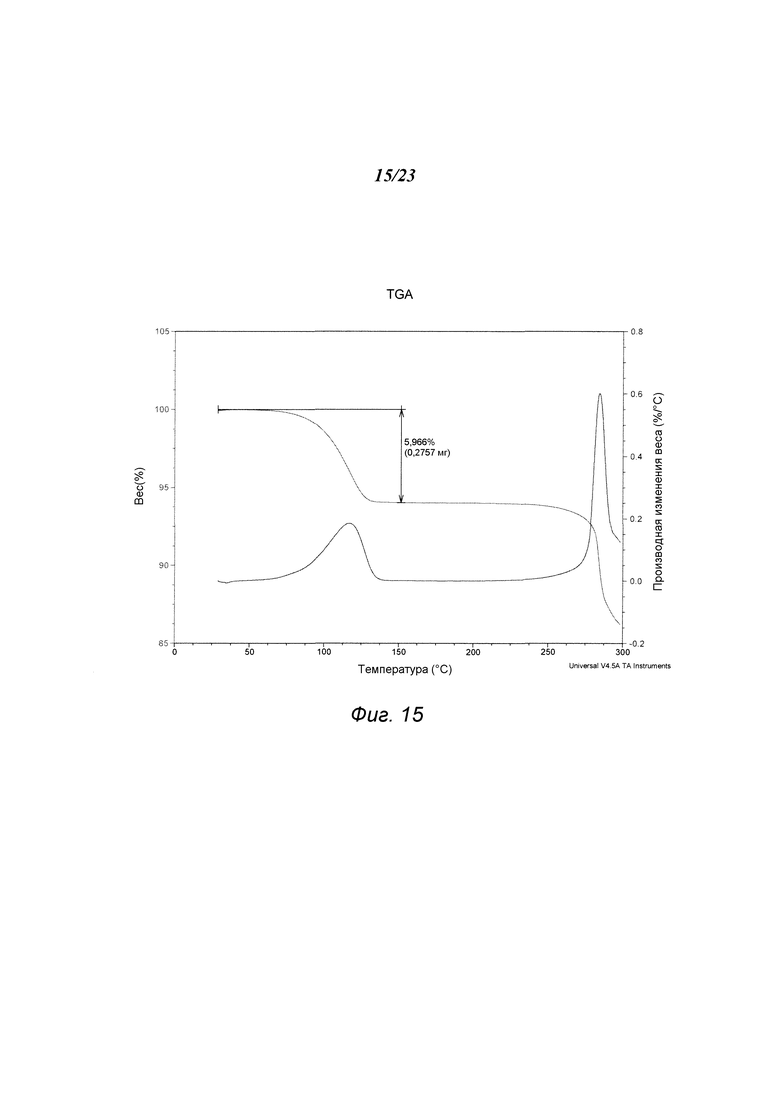
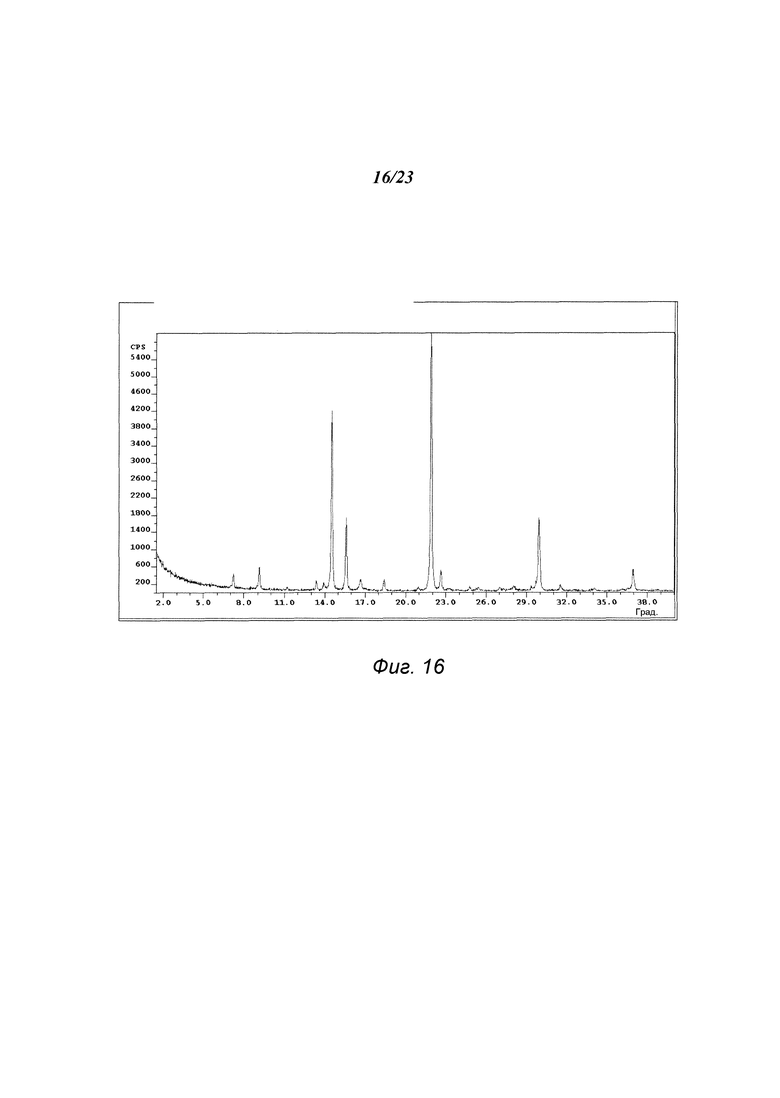
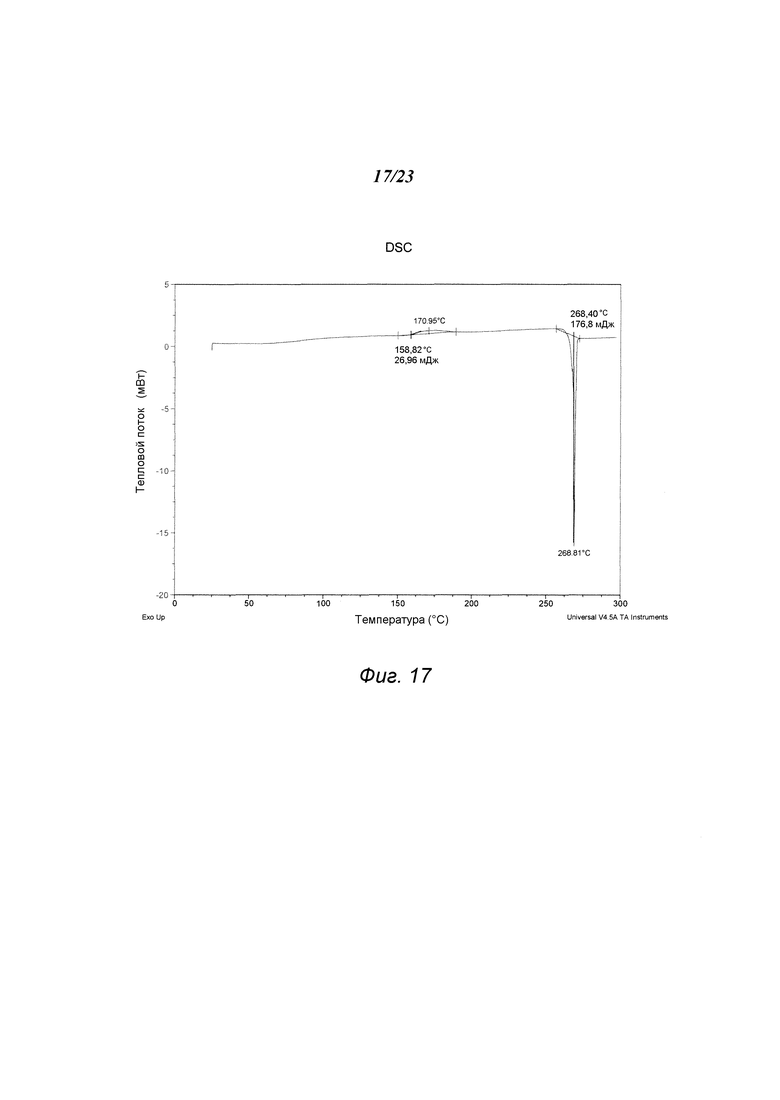
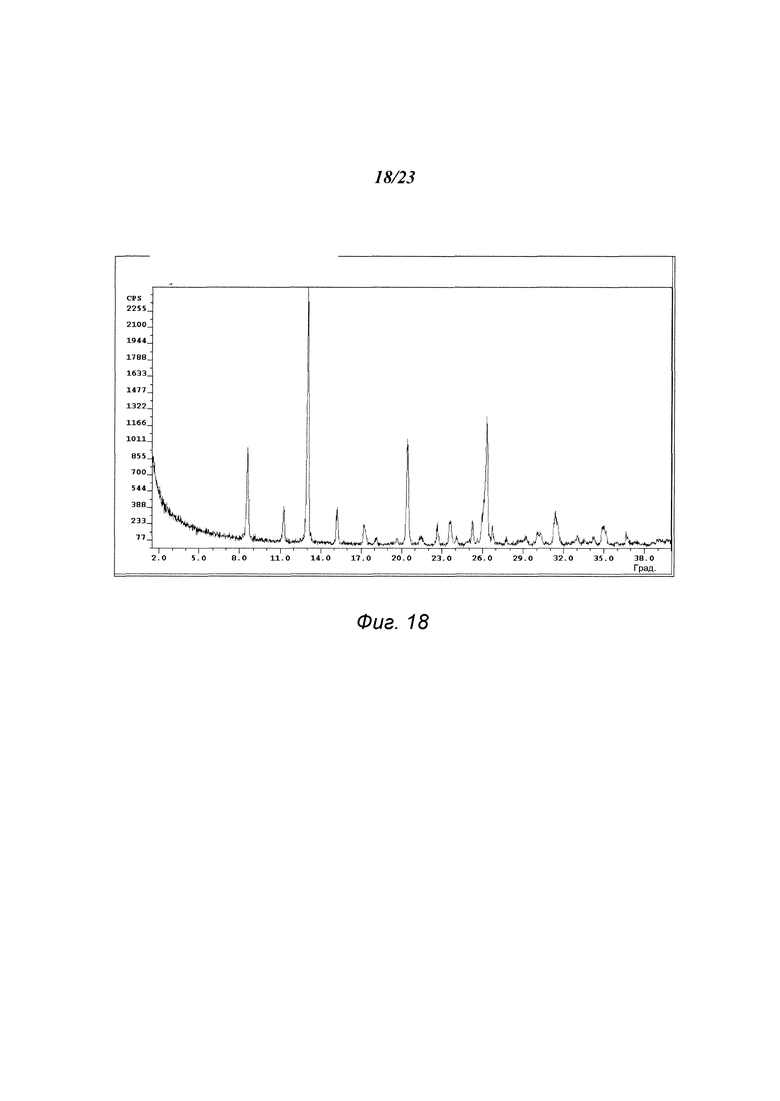
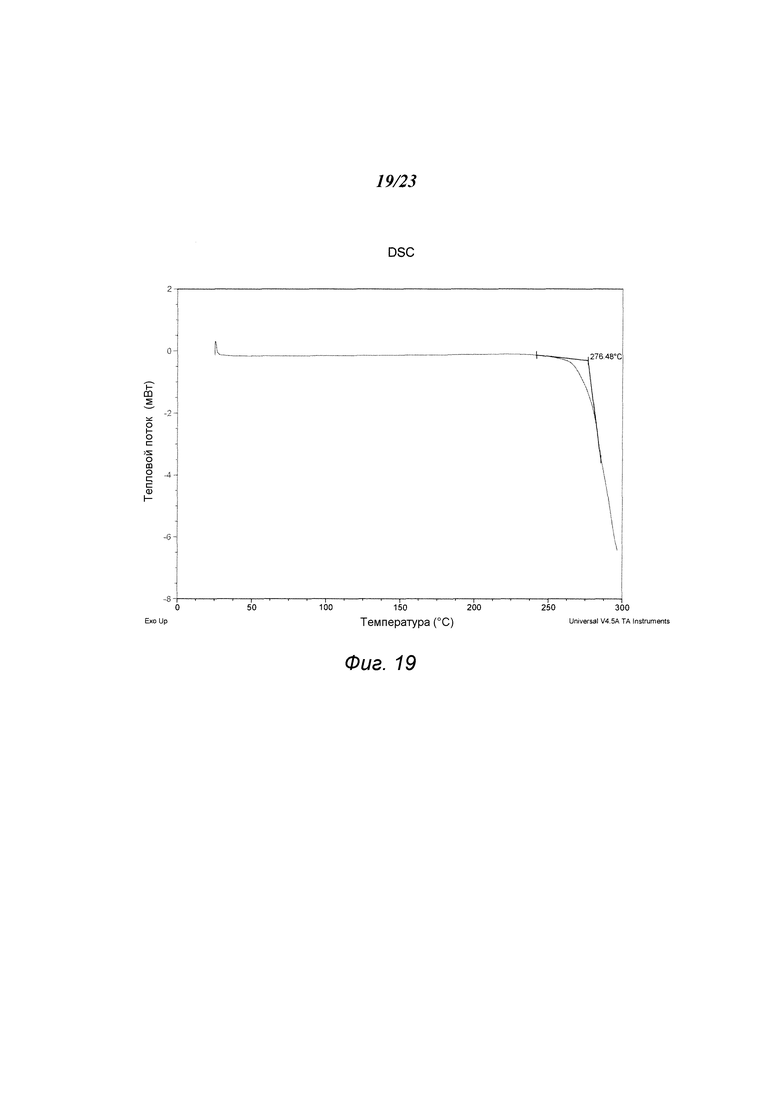
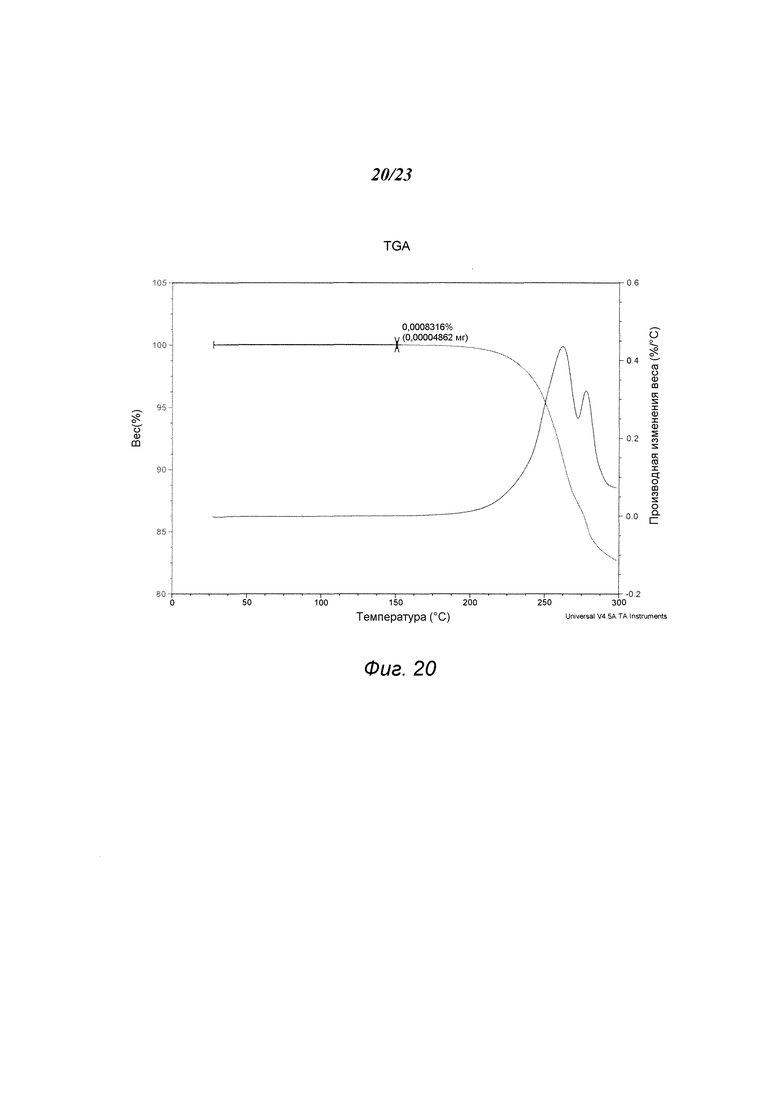
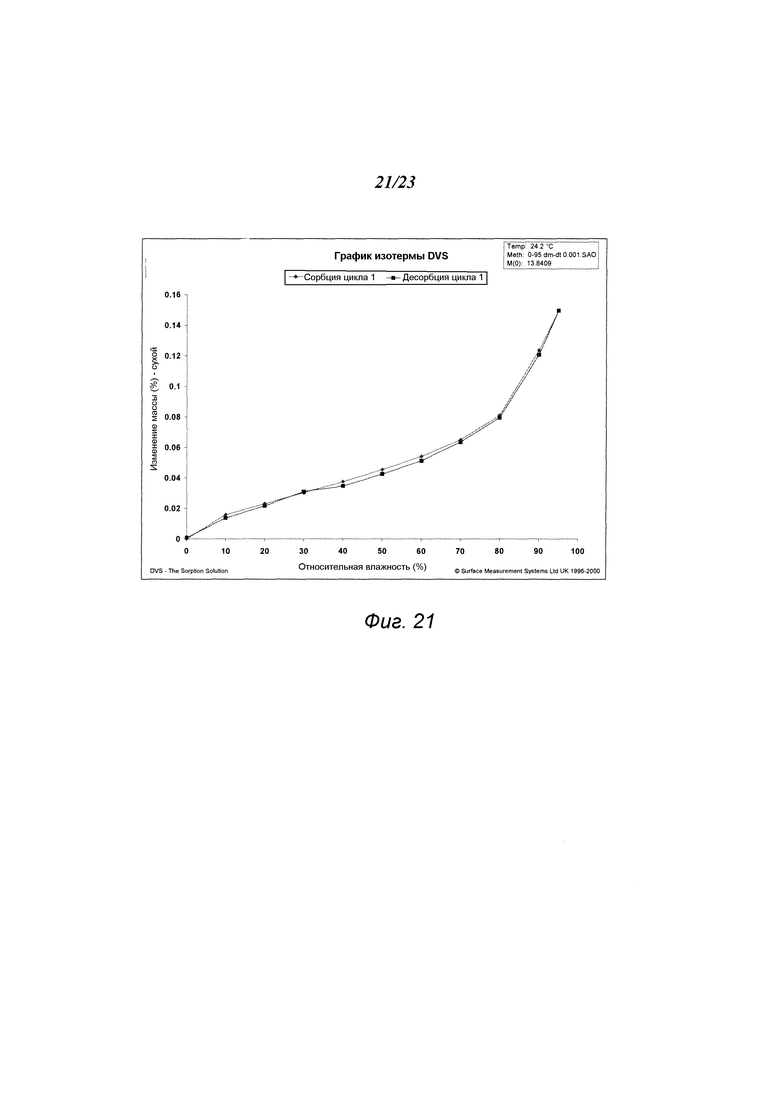


Изобретение относится к полиморфным твердым кристаллическим формам 3-(5-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион указанной ниже структурной формулы. Соединение обладает свойствами ингибитора TNF-α и может использоваться для лечения различных форм рака, ангиогенеза, дегенерации желтого пятна и сопутствующего синдрома, боли и др. расстройств и заболеваний, ассоциируемых с TNF-α. Твердые кристаллические формы соединения, соответствующего структурной формуле
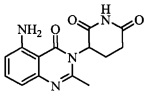 ,
,
представляют собой кристаллическую форму А1 гидрохлоридной соли указанного соединения с показателями пик порошковой рентгенограммы при примерно 8,6, 13,1, 20,5 и 26,3 градусах 2θ; либо кристаллическую форму А моногидрата указанного соединения, имеющего порошковую рентгенограмму, включающую пики при примерно 14,6, 15,6, 16,7, 21,9 и 30,0 градусах 2θ; кристаллическую форму В, имеющую порошковую рентгенограмму, включающую пики при примерно 10,6, 14,7, 19,1 и 25,9 градусах 2θ; кристаллическую форму С, имеющую порошковую рентгенограмму, включающую пики при примерно 10,8, 15,1, 25,1 и 26,6 градусах 2θ; кристаллическую форму Е гидрата, имеющую порошковую рентгенограмму, включающую пики при примерно 7,3, 14,6, 22,0, 30,0 и 37,0 градусах 2θ; кристаллическую форму F, имеющую порошковую рентгенограмму, включающую пики при примерно 14,5, 15,7, 22,7 и 29,9 градусах 2θ. Приведены также данные дифференциальной сканирующей калориметрии, данные термогравиметрического анализа, показатели гигроскопичности и стабильности полученных твердых кристаллических форм. Изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество твердой формы и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. 7 н. и 35 з.п. ф-лы, 23 ил., 10 табл., 4 пр.
1. Твердая форма, представляющая собой кристаллическую форму А1 гидрохлоридной соли 3-(5-амино-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-диона формулы
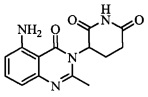 ,
,
имеющая порошковую рентгенограмму, включающую пики при примерно 8,6, 13,1, 20,5 и 26,3 градусах 2θ.
2. Твердая форма по п. 1, имеющая порошковую рентгенограмму, включающую пики при примерно 8,6, 11,3, 13,1, 15,3, 17,3, 20,5, 22,7, 23,6, 26,3 и 31,4 градусах 2θ.
3. Твердая форма по п. 1, имеющая порошковую рентгенограмму по существу, как показано на фиг. 18.
4. Твердая форма по любому одному из пп. 1-3, имеющая график дифференциальной сканирующей калориметрии, включающий эндотермическое событие с начальной температурой примерно 276°С.
5. Твердая форма по любому одному из пп. 1-3, имеющая график термогравиметрического анализа, включающий потерю массы менее чем примерно 0,5% при нагревании от примерно 25 до примерно 150°С.
6. Твердая форма по любому одному из пп. 1-3, масса которой увеличивается менее чем примерно на 0,5% при увеличении относительной влажности от примерно 0 до примерно 95%.
7. Твердая форма по любому одному из пп. 1-3, которая по существу негигроскопична.
8. Твердая форма по любому одному из пп. 1-3, которая стабильна при воздействии примерно 40оС и примерно 75%-ной относительной влажности в течение четырех недель.
9. Твердая форма, представляющая собой кристаллическую форму А моногидрата 3-(5-амино-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-диона формулы
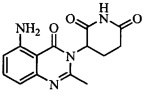 ,
,
имеющая порошковую рентгенограмму, включающую пики при примерно 14,6, 15,6, 16,7, 21,9 и 30,0 градусах 2θ.
10. Твердая форма по п. 9, имеющая порошковую рентгенограмму, включающую пики при примерно 9,2, 13,4, 14,0, 14,6, 15,6, 16,7, 18,5, 21,9, 22,7, 24,8, 28,1, 30,0 и 37,0 градусах 2θ.
11. Твердая форма по п. 9, имеющая порошковую рентгенограмму по существу, как показано на фиг. 1.
12. Твердая форма по любому одному из пп. 9-11, имеющая график дифференциальной сканирующей калориметрии, включающий эндотермическое событие с начальной температурой примерно 282°С.
13. Твердая форма по любому одному из пп. 9-11, имеющая график термогравиметрического анализа, включающий потерю массы менее чем примерно 6% при нагревании от примерно 40 до примерно 110°С.
14. Твердая форма по любому одному из пп. 9-11, масса которой увеличивается менее чем примерно на 6% или примерно на 6% при увеличении относительной влажности от примерно 0% до примерно 95%.
15. Твердая форма, представляющая собой кристаллическую форму В 3-(5-амино-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-диона формулы
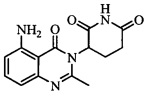 ,
,
имеющая порошковую рентгенограмму, включающую пики при примерно 10,6, 14,7, 19,1 и 25,9 градусах 2θ.
16. Твердая форма по п. 15, имеющая порошковую рентгенограмму, включающую пики при примерно 10,6, 11,4, 12,6, 13,7, 14,7, 19,1, 20,3, 20,9, 21,2, 22,9, 24,9, 25,3, 25,9, 26,9, 29,5 и 33,8 градусах 2θ.
17. Твердая форма по п. 15, имеющая порошковую рентгенограмму по существу, как показано на фиг. 4.
18. Твердая форма по любому одному из пп. 15-17, имеющая график дифференциальной сканирующей калориметрии, включающий эндотермическое событие с начальной температурой примерно 279°С.
19. Твердая форма по любому одному из пп. 15-17, имеющая график термогравиметрического анализа, включающий потерю массы менее чем примерно 0,1% при нагревании от примерно 25 до примерно 200°С.
20. Твердая форма по любому одному из пп. 15-17, масса которой увеличивается менее чем примерно на 0,2% при увеличении относительной влажности от примерно 0 до примерно 95%.
21. Твердая форма по любому одному из пп. 15-17, которая является по существу негигроскопичной.
22. Твердая форма, представляющая собой кристаллическую форму С 3-(5-амино-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-диона формулы
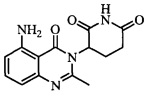 ,
,
имеющая порошковую рентгенограмму, включающую пики при примерно 10,8, 15,1, 25,1 и 26,6 градусах 2θ.
23. Твердая форма по п. 22, имеющая порошковую рентгенограмму, включающую пики при примерно 10,8, 11,9, 15,1, 18,8, 19,2, 19,3, 22,0, 24,9, 25,1, 26,6 и 29,2 градусах 2θ.
24. Твердая форма по п. 22, имеющая порошковую рентгенограмму по существу, как показано на фиг. 7.
25. Твердая форма по любому одному из пп. 22-24, имеющая график дифференциальной сканирующей калориметрии, включающий эндотермическое событие с начальной температурой примерно 281°С.
26. Твердая форма по любому одному из пп. 22-24, имеющая график термогравиметрического анализа, включающий потерю массы менее чем примерно 0,1% при нагревании от примерно 25 до примерно 150°С.
27. Твердая форма по любому одному из пп. 22-24, масса которой увеличивается менее чем примерно на 0,2% при увеличении относительной влажности от примерно 0 до примерно 95%.
28. Твердая форма по любому одному из пп. 22-24, которая является по существу негигроскопичной.
29. Твердая форма, представляющая собой кристаллическую форму Е гидрата 3-(5-амино-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-диона формулы
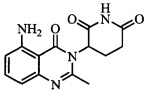 ,
,
имеющая порошковую рентгенограмму, включающую пики при примерно 7,3, 14,6, 22,0, 30,0 и 37,0 градусах 2θ.
30. Твердая форма по п. 29, имеющая порошковую рентгенограмму, включающую пики при примерно 7,3, 9,3, 12,2, 14,0, 14,6, 15,7, 16,8, 21,0, 22,0, 22,7, 29,4, 30,0 и 37,0 градусах 2θ.
31. Твердая форма по п. 29, имеющая порошковую рентгенограмму по существу, как показано на фиг. 13.
32. Твердая форма по любому одному из пп. 29-31, имеющая график дифференциальной сканирующей калориметрии, включающий эндотермическое событие с начальной температурой примерно 279°С.
33. Твердая форма по любому одному из пп. 29-31, имеющая график термогравиметрического анализа, включающий потерю массы менее чем примерно 6% при нагревании от примерно 25 до примерно 150°С.
34. Твердая форма по любому одному из пп. 29-31, масса которой увеличивается менее чем примерно на 0,5% при увеличении относительной влажности от примерно 0 до примерно 95%.
35. Твердая форма по любому одному из пп. 29-31, которая является по существу негигроскопичной.
36. Твердая форма, представляющая собой кристаллическую форму F гидрата 3-(5-амино-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-диона формулы
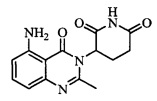 ,
,
имеющая порошковую рентгенограмму, включающую пики при примерно 14,5, 15,7, 22,7 и 29,9 градусах 2θ.
37. Твердая форма по п. 36, имеющая порошковую рентгенограмму, включающую пики при примерно 7,2, 9,1, 14,5, 15,7, 16,8, 18,3, 21,9, 22,7, 29,9 и 36,9 градусах 2θ.
38. Твердая форма по п. 36, имеющая порошковую рентгенограмму по существу, как показано на фиг. 16.
39. Твердая форма по любому одному из пп. 36-38, имеющая график дифференциальной сканирующей калориметрии, включающий эндотермическое событие с начальной температурой примерно 267°С.
40. Фармацевтическая композиция для ингибирования TNF-α, содержащая терапевтически эффективное количество твердой формы по любому одному из пп. 1-39 и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
41. Фармацевтическая композиция по п. 40 для применения при получении лекарственной формы, которая пригодна для перорального, парентерального или внутривенного введения.
42. Фармацевтическая композиция по п. 40 или 41 для применения при получении стандартной лекарственной формы, причем лекарственной формой является таблетка или капсула.
| US 7635700 B2, 22.12.2009 & RU2463298 C2 | |||
| CAIRA M R, CRYSTALLINE POLYMORPHISM OF ORGANIC COMPOUNDS,TOPICS IN CURRENT CHEMISTRY, 1998, Vol:198, Page(s):163 - 208 | |||
| RU 2009115653 A, 10.11.2009. |
Авторы
Даты
2017-02-17—Публикация
2012-03-09—Подача