Область изобретения
Изобретение относится к азотсодержащим соединениям, их получению и их применению в профилактике или лечении бактериальных инфекций.
Обоснование изобретения
Опасность бактериальной устойчивости к известным антибактериальным агентам становится основной проблемой в лечении бактериальных инфекций. Одним из путей к лечению бактериальных инфекций, особенно тех, которые вызваны устойчивыми бактериями, является создание более новых антибактериальных агентов, которые могут преодолеть бактериальную резистентность. Coats и др. (Br. J. Pharmacol. 2007, 152, №8, 1147-1154) опубликовали обзор современных подходов к созданию новых антибиотиков. Тем не менее, создание новых антибактериальных агентов - сложная задача. Так, например, Gwynn и др. (Annals of the New York Academy of Sciences, 2010, 1213, 5-19) опубликовал обзор, касающийся проблем создания новых антибиотиков.
Другим подходом к преодолению бактериальной резистентности к известным антибактериальным агентам является воздействие на бактериальные механизмы, создающие и поддерживающие резистентность. Так, например, известно, что некоторые бактерии продуцируют ферменты (бета-лактамазные ферменты), которые гидролизуют бета-лактамное кольцо в типичном бета-лактамном антибактериальном агенте. Как только бета-лактамное кольцо гидролизуется, антибактериальные агенты становятся неэффективными против этих бактерий. Известно, что бактерии продуцируют несколько типов бета-лактамазных ферментов. В зависимости от их аминокислотной гомологической последовательности бета-лактамазные ферменты объединяют в четыре класса: A, B, C и D (Ambler R. P., Phil. Trans. R. Soc. Lon., B289, 321-331, 1980). В бета-лактамазных ферментах, принадлежащих к классам A, С и D, серин выступает как активный центр, способствующий катализу, в то время как те, которые принадлежат к классу В, содержат один или более ионов металлов (например, ионов цинка) в качестве активных центров, способствующих бета-лактамному расщеплению.
Некоторые соединения, обычно известные как бета-лактамазные ингибиторы, способны ингибировать активность одного или более бета-лактамазных ферментов, восстанавливая, таким образом, эффективность традиционных бета-лактамных антибактериальных агентов. Типичные примеры бета-лактамазных ингибиторов включают сулбактам, тазобактам и клавулановую кислоту. Drawz и др. (Clinical Microbiology Reviews, янв. 2010, т.23, №1, стр.160-201) описали явление бета-лактамазного ингибирования. В патенте США №7112592 описано несколько гетероциклических соединений и их применение как антибактериальных агентов.
Заявители обнаружили азотсодержащие соединения, которые полезны в профилактике или лечении бактериальных инфекций.
Краткое описание изобретения
Описываются, соответственно, азотсодержащие соединения, способы получения этих соединений, фармацевтические композиции, содержащие эти соединения и метод профилактики или лечения бактериальной инфекции у субъекта, применяющего эти соединения.
В одном разделе, описывается соединение Формулы (I):
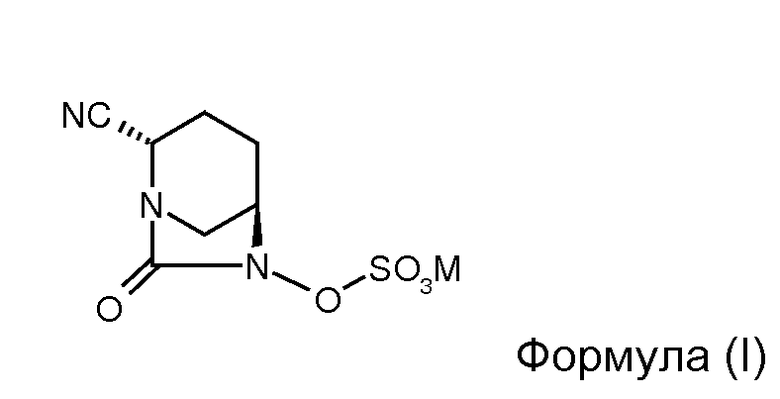 ,
,
или его стереоизомер, или его фармацевтически приемлемая соль; М означает катион.
В другом общем разделе описываются фармацевтические композиции, содержащие соединение формулы (I), или его стереоизомер, или его фармацевтически приемлемую соль.
В другом общем разделе описывается метод профилактики или лечения бактериальной инфекции у субъекта, при этом указанный метод включает введение указанному субъекту фармацевтически эффективного количества соединения Формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли.
В другом общем разделе описывается метод профилактики или лечения бактериальной инфекции у субъекта, при этом указанная инфекция вызвана бактерией, продуцирующей один или более бета-лактамазных ферментов, а метод включает введение указанному субъекту фармацевтически приемлемого количества соединения Формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли.
В другом общем разделе описывается метод профилактики или лечения бактериальной инфекции у субъекта, при этом указанный метод включает введение указанному субъекту фармацевтически эффективного количества фармацевтической композиции, содержащей соединение Формулы (I), или его стереоизомер, или его фармацевтически приемлемую соль.
В еще одном общем разделе описывается метод профилактики или лечения бактериальной инфекции у субъекта, при этом указанная инфекция вызвана бактерией, продуцирующей один или более бета-лактамазных ферментов, а метод включает введение указанному субъекту фармацевтически эффективного количества фармацевтической композиции, содержащей соединение Формулы (I), или его стереоизомер, или его фармацевтически приемлемую соль.
В еще одном общем разделе описываются фармацевтические композиции, содержащие: (а) соединение Формулы (I), или его стереоизомер, или его фармацевтически приемлемую соль, и (b) по крайней мере, один антибактериальный агент или его фармацевтически приемлемую соль.
В другом общем разделе описывается метод профилактики или лечения бактериальной инфекции у субъекта, при этом указанный метод включает назначение указанному субъекту фармацевтически эффективного количества: (а) соединения Формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли и (b) по крайней мере, одного антибактериального агента или его фармацевтически приемлемой соли.
В еще одном общем разделе описывается метод профилактики или лечения бактериальной инфекции у субъекта, при этом указанная инфекция вызвана бактерией, продуцирующей один или более бета-лактамазных ферментов, а метод включает введение указанному субъекту фармацевтически эффективного количества: (а) соединения Формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли и (b) по крайней мере, одного антибактериального агента или его фармацевтически приемлемой соли.
В еще одном общем разделе описываются способы повышения антибактериальной эффективности антибактериального агента у субъекта, при этом указанный способ включает совместное введение указанного антибактериального агента или его фармацевтически приемлемой соли с фармацевтически эффективным количеством соединения формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли.
Детали одного или более разделов изобретения приведены в описании, данном ниже. Другие характерные черты, цели и успехи изобретения будут ясны из дальнейшего описания, включая формулу изобретения.
Детальное описание изобретения
Здесь будет отсылка к разделам, приведенным как примеры, и использован специфический язык для описания. Это ни в коей мере не следует понимать как ограничение объема изобретения. Изменения и дальнейшие модификации предлагаемых характерных черт изобретения, иллюстрируемых здесь, и дополнительных приложений принципов изобретения, как они проиллюстрированы здесь, которые могут встречаться у специалистов в данной области и у лиц, компетентных в этом изобретении, следует рассматривать в объеме изобретения. Также должно быть отмечено, что, как это используется в спецификации и приложенной формуле изобретения, единичные формы неопределенных и определенного артиклей включают отсылки к множественным, если из текста определенно не явствует иное. Все ссылки, включая патенты, патентные приложения и литературу, цитируемую в спецификации, введены как ссылки во всей полноте.
Заявители раскрывают новые азотсодержащие соединения, обладающие антибактериальными свойствами.
Термин «стереоизомеры», как он употребляется здесь, относится к соединениям, которые имеют одинаковое химическое строение, но отличаются расположением атомов или групп в пространстве. Соединения формулы (I) могут содержать асимметрические или хиральные центры и, таким образом, существовать в различных стереоизомерных формах. Предполагается, если не оговорено другое, что все стереоизомерные формы соединений формулы (I), также как их смеси, включая рацемические смеси, образуют часть настоящего изобретения. Кроме того, все геометрические и позиционные изомеры (включая цис- и транс- формы), также как их смеси охватываются настоящим изобретением. В основном, ссылка на соединение предполагает охват его стереоизомеров и смесей различных стереоизомеров.
Термин «фармацевтически приемлемая соль», как он употребляется здесь, относится к одной или более солям данного соединения, которые обладают желаемой фармакологической активностью свободного соединения, и которые не являются нежелательными ни с биологической, ни с иной точки зрения. В основном, «фармацевтически приемлемые соли» относятся к солям, которые приемлемы для использования в контакте с тканью человека и животного без чрезмерной токсичности, раздражения, аллергической реакции и тому подобного, и соответствуют разумному соотношению успех/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Так, например, статья S. M. Berge и др. (J. Pharmaceutical Sciences, 66:1-19, 1977), введенная здесь в виде ссылки во всей ее полноте, описывает в деталях различные фармацевтически приемлемые соли.
В основном, соединения, соответствующие изобретению, содержат основную (например, атом азота) и кислотную единицы (например, соединения формулы (I), где М означает водород). Специалист в данной области поймет, что такие соединения, таким образом, могут образовывать кислотные соли (образованные с неорганическими и/или органическими кислотами), а также основные соли (образованные с неорганическими и/или органическими основаниями). Такие соли могут быть получены с использованием процедур, описанных в данной области. Например, основная единица может быть переведена в ее соль обработкой соединения подходящим количеством кислоты. Типичные, не лимитирующие примеры таких подходящих кислот включают хлористоводородную кислоту, трифторуксусную кислоту, метансульфоновую кислоту и тому подобное. Альтернативно, кислотная единица может быть переведена в ее соль обработкой подходящим основанием. Типичные, не лимитирующие примеры таких оснований включают карбонат натрия, бикарбонат натрия, карбонат калия, бикарбонат калия и тому подобное. В том случае, когда соединения содержат более одной функциональных групп, способных к переводу в соль, каждая такая функциональная группа может быть переведена в соль независимо. Например, если соединение содержит два основных атома азота, один основный атом азота может образовывать соль с одной кислотой, в то время как другой основный азот может образовывать соль с другой кислотой. Несколько соединений, соответствующих изобретению, содержат обе, кислотную и основную единицы, и, таким образом, могут образовывать внутренние соли или соответствующие цвиттер-ионы. В общем, все фармацевтически приемлемые солевые формы соединения формулы (I), соответствующего изобретению, включающие кислотно-аддитивные соли, основно-аддитивные соли, цвиттер-ионы и тому подобное, рассматриваются как находящиеся в рамках настоящего изобретения и определяются как фармацевтически приемлемые соли.
Термин «инфекция» или «бактериальная инфекция», как он используется здесь, включает присутствие бактерий, в или на субъекте, ингибирование роста которых приводит к улучшению состояния субъекта. Как таковой, термин «инфекция» в добавление к указанному присутствию бактерии также относится к нормальной флоре, которая нежелательна. Термин «инфекция» включает инфекцию, вызванную бактерией.
Термин «лечить» или «лечение», как он используется здесь, относится к введению лекарства, включая фармацевтическую композицию или один или более фармацевтически активных ингредиентов, с профилактическими и/или терапевтическими целями. Термин «профилактическое лечение» относится к лечению субъекта, который еще не инфицирован, но у которого подозревается или существует риск инфицирования (предупреждение бактериальной инфекции). Термин «терапевтическое лечение» относится к проведению лечения у субъекта, уже страдающего от инфекции. Термины «лечить» или «лечение», как они используются здесь, относятся также к введению композиций или одного или нескольких фармацевтически активных ингредиентов, обсуждаемых здесь, с или без дополнительных фармацевтически активных или инертных ингредиентов, для: (i) снижения или удаления бактериальной инфекции или одного или более симптомов бактериальной инфекции, или (ii) для замедления развития бактериальной инфекции, или одного или более симптомов бактериальной инфекции, или (iii) снижения остроты бактериальной инфекции или одного или более симптомов бактериальной инфекции, или (iv) подавления клинического проявления бактериальной инфекции, или (v) подавления проявления неблагоприятных симптомов бактериальной инфекции.
Термин «фармацевтически эффективное количество» или «терапевтически эффективное количество» или «эффективное количество», как он используется здесь, относится к количеству, которое оказывает терапевтический эффект или к количеству, которое требуется для проявления терапевтического эффекта у субъекта. Например, терапевтически или фармацевтически эффективное количество антибактериального агента или фармацевтической композиции - это количество антибактериального агента или фармацевтической композиции, требуемой для проявления желаемого терапевтического эффекта, как это может быть установлено результатами клинической оценки, изучениями на модели инфекции у животных и/или исследованиями in vitro (например, в среде агар-агара или бульона). Фармацевтически эффективное количество зависит от нескольких факторов, включая, но не ограничиваясь этим, вовлеченный микроорганизм (например, бактерию), характеристики субъекта (например, рост, вес, пол, возраст и историю болезни), остроту инфекции и частный тип используемого антибактериального агента. Для профилактического лечения терапевтически или профилактически эффективное количество - это количество, которое эффективно в предупреждении микробной (например, бактериальной) инфекции.
Термин «введение» включает доставку композиции или одного или более фармацевтически активных ингредиентов субъекту, включая, например, любые подходящие способы, которые служат для доставки композиции или ее активных ингредиентов или других фармацевтически активных ингредиентов к месту инфекции. Способ введения может варьироваться в зависимости от различных факторов, таких, например, как компоненты фармацевтической композиции или тип/природа фармацевтически активных или инертных ингредиентов, место потенциальной или реальной инфекции, вовлеченный микроорганизм, острота инфекции, возраст и физическое состояние субъекта и тому подобное. Некоторые не ограничивающие примеры путей введения композиции или фармацевтически активного ингредиента к субъекту, в соответствии с этим изобретением, включают оральный, внутривенный, топикальный, вдыханием, внутрибрюшинный, внутримышечный, парентеральный, подъязычный, трансдермальный, внутриназальный, аэрозольный, внутриглазной, интратрахеальный, ректальный, вагинальный, генную пушку, кожную бляшку, глазные капли, ушные капли или полоскание для рта. В случае фармацевтической композиции, содержащей один или более ингредиентов (активных или инертных), одним из путей введения такой композиции является смешивание ингредиентов (например, в форме подходящей единичной дозовой формы, такой как таблетка, капсула, раствор, порошок и тому подобное) и затем прием дозовой формы. Альтернативно, ингредиенты могут также вводиться раздельно (одновременно или один после другого) так долго, пока эти ингредиенты ни достигнут терапевтических уровней, таких, что композиция как целое будет обеспечивать синергетический и/или желаемый эффект.
Термин «рост», как он используется здесь, относится к росту одного или более микроорганизмов и включает репродукцию или распространение популяции микроорганизма (например, бактерии). Термин также включает обеспечение протекания метаболических процессов микроорганизма, включая процессы, которые поддерживают жизнь микроорганизма.
Термин «эффективность», как он используется здесь, относится к способности композиции или одного или более фармацевтически активных ингредиентов вызывать желаемый биологический эффект у субъекта. Так, например, термин «антибактериальная эффективность» композиции или антибактериального агента относится к способности композиции или антибактериального агента предотвращать или лечить микробную (например, бактериальную) инфекцию у субъекта.
Термин «синергетический» или «синергизм», как он используется здесь, относится к взаимодействию двух или более агентов, так что их объединенный эффект оказывается большим, чем индивидуальные эффекты.
Термин «антибактериальный агент», как он используется здесь, относится к любой субстанции, соединению или комбинации субстанций или комбинации соединений, способной: (i) ингибировать, снижать или предотвращать рост бактерии; (ii) ингибировать или понижать способность бактерии вызывать инфицирование субъекта; или (iii) ингибировать или понижать способность бактерии к размножению или ее способность оставаться инфицирующей в окружении. Термин «антибактериальный агент» относится также к соединениям, способным понижать инфицирующую способность или вирулентность бактерии.
Термин «бета-лактамный антибактериальный агент», как он используется здесь, относится к соединениям с антибактериальными свойствами, содержащими бета-лактамные ядра в их молекулярной структуре.
Термин «бета-лактамаза», как он используется здесь, относится любому ферменту или белку или другой субстанции, которая разрывает бета-лактамное кольцо. Термин «бета-лактамаза» включает ферменты, продуцируемые бактерией и имеющие способность гидролизовать бета-лактамное кольцо в бета-лактамном соединении, частично или полностью.
Термин «бета-лактамазный ингибитор», как он используется здесь, относится к соединению, способному ингибировать активность одного или более бета-лактамазных ферментов, частично или полностью.
Термин «фармацевтически инертный ингредиент» или «носитель» или «наполнитель» относится к соединению или материалу, используемому для облегчения введения соединения, например, для повышения растворимости соединения. Твердые носители включают, например, крахмал, лактозу, дикальций фосфат, сукрозу и каолин. Жидкие носители включают, например, стерильную воду, солевой раствор, буферы, неионные поверхностно-активные соединения и пищевые масла, такие как арахисовое и кунжутное масла. Кроме того, могут быть включены различные адьюванты, обычно применяемые в данной области. Эти и другие такие соединения описаны в литературе, например, в Merk Index, Merk & Company, Rahway, N.J. Введение различных компонентов в фармацевтические композиции описано, например, в Gilman и др. (редакторы) (1990); Goodman and Gilman's: The Pharmalogical basis of therapeutics, 8 изд., Pergamon Press, приведенной здесь в виде ссылки во всей полноте.
Термин «субъект», как он используется здесь, относится к позвоночным или не позвоночным, включая млекопитающих. Термин «субъект» включает людей, животных, птиц, рыб или амфибий. Типичные не лимитирующие примеры «субъекта» включают людей, кошек, собак, лошадей, овец, коров, свиней, ягнят, крыс, мышей и морских свинок.
Термин «цефтолозан», как он используется здесь, относится к соединению, известному как CXA-101 (CAS регистрационный №689293-68-3; химическое название: (6R,7R)-3-[(5-амино-4-{[(2-аминоэтил)карбамоил]амино}-1-метил-1Н-пиразол-2-иум-2-ил)метил]-7-({(2Z)-2-(5-амино-1,2,4-тиадиазол-3-ил)-2-[(1-карбокси-1-метилэтокси)имино]ацетил}амино)-8-оксо-5-тиа-1-азабицикло[4.2.0]-окт-2-ен-2-карбоксилат). Ссылка на цефтолозан предполагает включение его фармацевтически приемлемых солей, про-лекарств, метаболитов, простых и сложных эфиров, гидратов, полиморфов, сольватов, комплексов, энантиомеров, аддуктов и его любых других фармацевтически приемлемых производных.
В одном общем разделе представлено соединение формулы (I)
 ,
,
или его стереоизомер, или его фармацевтически приемлемая соль, М означает катион.
В общем, соединения изобретения могут быть получены в соответствии с общими процедурами, представленными на схемах 1-3. Специалистам в данной области понятно, что описанные способы могут варьироваться или оптимизироваться для получения желаемых и аналогичных соединений. В последующих процедурах все вариабельности соответствуют приведенным выше.
В другом общем разделе приведены фармацевтические композиции, содержащие соединение формулы (I), или его стереоизомер, или его фармацевтически приемлемая соль.
В другом общем аспекте приведен способ предупреждения или лечения бактериальной инфекции у субъекта, и указанный способ включает введение указанному субъекту фармацевтически эффективного количества соединения формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли.
В другом общем аспекте приведен способ предотвращения или лечения бактериальной инфекции у субъекта, и указанная инфекция вызвана бактерией, продуцирующей один или более бета-лактамазных ферментов, а метод включает введение указанному субъекту фармацевтически эффективного количества соединения формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли.
В другом общем аспекте приведен способ предупреждения или лечения бактериальной инфекции у субъекта, и указанный способ включает введение указанному субъекту фармацевтически эффективного количества фармацевтической композиции, содержащей соединение формулы (I), или его стереоизомер, или его фармацевтически приемлемую соль.
В другом общем аспекте приведен способ предупреждения или лечения бактериальной инфекции у субъекта, и указанная инфекция вызвана бактерией, продуцирующей один или более бета-лактамазных ферментов, а метод включает введение указанному субъекту фармацевтически эффективного количества фармацевтической композиции, содержащей соединение формулы (I), или его стереоизомер, или его фармацевтически приемлемую соль.
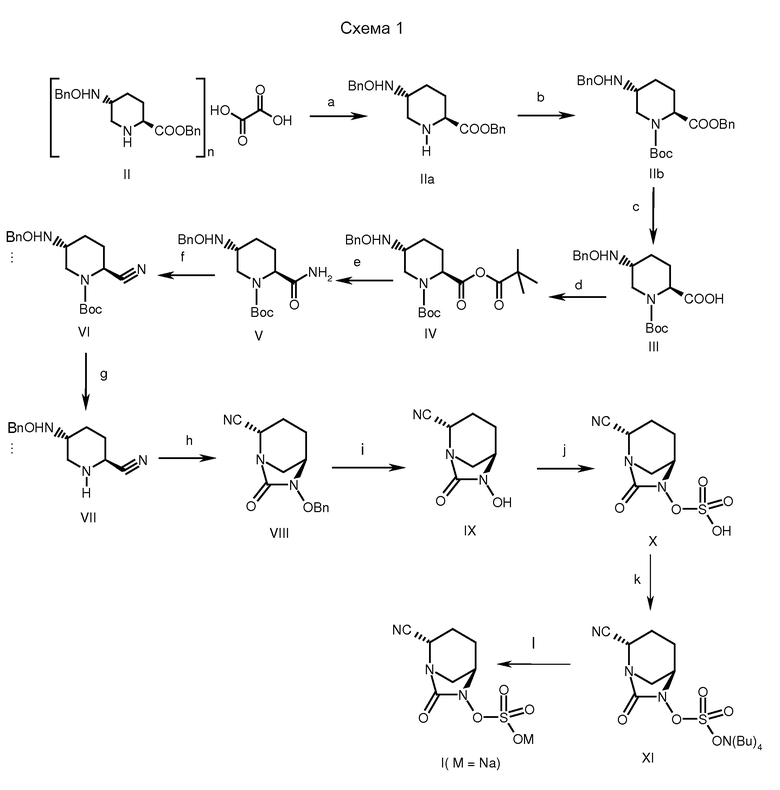
a: основание, вода, комн. температура; b: Вос-ангидрид, ТЭА, DMAP, ДХМ, комн. температура; c: LiOH, ацетон; d: пивалоилхлорид, ТЭА; e: аммиак (газ); f: трифторуксусный ангидрид, ТЭА, ДХМ; g: ТФУ, ДХМ; h: трифосген, ТЭА, DMAP, ДХМ; i: Н2, Pd/C; j: SO3-ДМФ; k: тетрабутиламмоний ацетат, ДХМ; l: смола Dowex 50WX8 200 Na+.
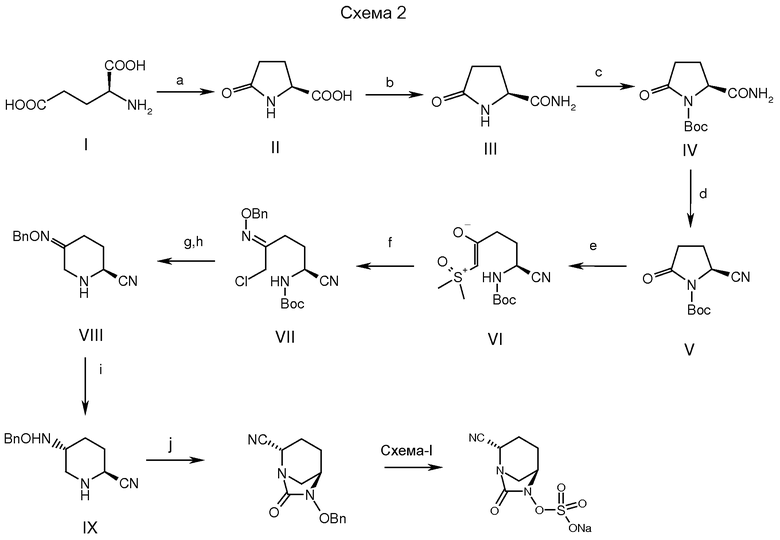
а: вода, кипячение, 24 часа; b: аммониевая соль 1-гидроксибензотриазола, DCC, ДМФ; c: Вос-ангидрид, ТЭА, DMAP, ДХМ, комн. температура; d: трифторуксусный ангидрид, ТЭА, ДХМ; е: TMSOl, NaH, ДМСО, ТГФ, -10°С 1 час; f: О-бензилгидроксиламин.HCl, EtOAc, 60°С, 2,5 часа; g: метансульфоновая кислота, этилацетат (EtOAc), 40°С; h: КНСО3, вода, 55°С; i: триацетокси натрий боргидрид, STABH, H2SO4; j: трифосген, ТЭА, DMAP, ДХМ; Схема-1: дальнейшие стадии как описано в схеме 1.
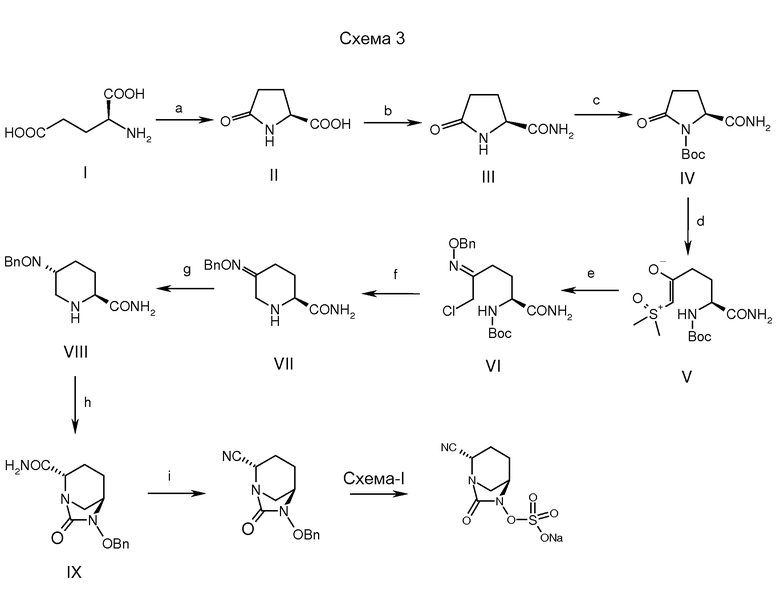
а: вода, кипячение, 24 часа; b: аммониевая соль 1-гидроксибензотриазола, DCC, ДМФ; c: Вос-ангидрид, ТЭА, DMAP, ДХМ, комн. температура; d: TMSOl, NaH, ДМСО, ТГФ, -10°С, 1 час; e: О-бензилгидроксиламин.HCl, EtOAc, 60°С, 2,5 часа; f: метансульфоновая кислота, этилацетат, 40°С; g: КНСО3, вода, 55°С; g: триацетокси натрий боргидрид, STABH, H2SO4; h: трифосген, ТЭА, DMAP, ДХМ; i: трифторуксусный ангидрид, ТЭА, ДХМ; Схема-1: дальнейшие стадии как описано в схеме 1.
В некоторых разделах соединение формулы (I), где М означает натрий, получали с использованием общей процедуры, приведенной на схеме 1. Как правило, оксалат бензилового эфира (S)-5-(бензилоксиамино)-пиперидин-2-карбоновой кислоты (II) превращали в свободное основание обработкой подходящим основанием при комнатной температуре с получением соединения (IIa). Из него по реакции с Вос-ангидридом в присутствии основания и подходящего катализатора, подобного DMAP, при температуре от -5 до 40°С получали соединение (IIb). Это соединение после гидролиза с основанием типа гидроксида лития при температуре от -5 до 25°С давало 1-третбутиловый эфир транс-5-бензилоксиаминопиперидин-1,2-дикарбоновой кислоты (соединение III).
Соединение (III) вводили в реакцию с ацилхлоридом, таким как пивалоилхлорид, в присутствии подходящего основания, такого как N-метилморфолин, триэтиламин или диизопропилэтиламин, в растворителе, таком как дихлорметан (ДХМ), тетрагидрофуран (ТГФ), 1,4-диоксан или хлороформ, при температуре от -5 до 35°С в течение примерно 1-2 часов с получением ангидрида (IV).
Ангидрид (IV) затем обрабатывали газообразным аммиаком при температуре от -50 до 5°С в течение примерно 0,5-2 часов, получая промежуточное амидное соединение (V).
Дегидрирование промежуточного соединения (V) осуществляли обрабатывая интермедиат (V) трифторуксусным ангидридом в растворителе типа толуола, хлороформа, тетрагидрофурана или дихлорметана при температуре от -5 до 35°С в течение примерно 1-24 часов, получая нитрильный интермедиат (VI).
С промежуточного соединения (VI) снимали защиту, получая промежуточное соединение (VII), используя депротектирующий агент, такой как трифторуксусная кислота или хлористоводородная кислота в растворителе, таком как дихлорметан, хлороформ, ацетонитрил или вода при температуре от -25 до 50°С в течение примерно 1-24 часов. Циклизацию промежуточного соединения (VII) осуществляли обработкой интермедиата (VII) таким реагентом как раствор фосгена или дифосгена или трифосгена в растворителе, таком как толуол, хлороформ, ацетонитрил и в присутствии основания, такого как триэтиламин или диизопропилэтиламин при температуре от -5 до 50°С в течение примерно 1-24 часов, получая циклизованное промежуточное соединение (VIII).
Циклизованное промежуточное соединение (VIII) подвергали гидрогенолизу с использованием катализатора, такого как 5% или 10% палладий на угле или 20% гидроксид палладия на угле, в присутствии источника водорода, такого как газообразный водород, формиат аммония, муравьиная кислота или циклогексен, в растворителе, таком как метанол, этанол, смесь метанол-дихлорметан или смесь N,N-диметилформамид-дихлорметан, при температуре от 25 до 60°С в течение примерно 1-24 часов, получая N-гидрокси промежуточное соединение (IX).
Промежуточное соединение (IX) сульфонировали, вводя его в реакцию с сульфонирущим агентом, таким как комплекс пиридин-трехокись серы, или комплекс N,N-диметилформамид-трехокись серы, в растворителе, таком как пиридин, N,N-диметилформамид, дихлорметан или их смесь, при температуре от -5 до 50°С в течение примерно 0,5-24 часов, получая пиридиниевую соль сульфоновой кислоты (Х), которую затем обрабатывали тетрабутиламмоний ацетатом, получая тетрабутиламмониевую соль сульфоновой кислоты (промежуточное соединение XI).
Соединение изобретения выделяли в виде натриевой соли, пропуская промежуточное соединение (XI) через натриевую форму смолы Dowex 50WX8 200 в водном тетрагидрофуране с последующим упариванием фракций растворителя при пониженном давлении и получением соединения (I), где М означает натрий.
Альтернативно, это соединение может быть получено обработкой соединения (XI) этил натрий гексаноатом (когда М=Na) в растворителе типа ацетона, этилацетата, тетрагидрофурана, этанола, изопропанола при температуре от комнатной до 80°С.
Были получены различные полиморфы этих соединений (где М=Na).
В другом общем аспекте были получены фармацевтические композиции, содержащие: (а) соединение формулы (I), или его стереоизомер, или его фармацевтически приемлемую соль, и (b) по крайней мере, один антибактериальный агент или его фармацевтически приемлемую соль.
Другой общий аспект представляет способ предупреждения или лечения бактериальной инфекции у субъекта, где указанный способ включает введение указанному субъекту фармацевтически эффективного количества: (а) соединения формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли, и (b) по крайней мере, одного антибактериального агента или его фармацевтически приемлемой соли.
Другой общий аспект представляет способ предупреждения или лечения бактериальной инфекции у субъекта, где указанная инфекция вызвана бактерией, продуцирующей один или более бета-лактамазных ферментов, а указанный способ включает введение указанному субъекту фармацевтически эффективного количества: (а) соединения формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли, и (b) по крайней мере, одного антибактериального агента или его фармацевтически приемлемой соли.
В другом общем аспекте представлены способы повышения антибактериальной эффективности антибактериального агента у субъекта, где указанный способ включает одновременное введение указанного антибактериального агента или его фармацевтически приемлемой соли с фармацевтически эффективным количеством соединения формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли.
В некоторых разделах в композициях и способах, соответствующих изобретению, используются соединения формулы (I) или их стереоизомер или их фармацевтически приемлемая соль в комбинации с, по крайней мере, одним антибактериальным агентом. Можно применять широкий спектр антибактериальных агентов. В типичных случаях, нелимитирующие примеры антибактериальных агентов включают одно или более антибактериальных соединений, обычно классифицируемых как аминогликозиды, ансамицины, карбацефемы, цефалоспорины, цефамицины, линкозамиды, липопептиды, макролиды, монобактамы, нитрофураны, пенициллины, полипептиды, хинолоны, сульфонамиды, тетрациклины, оксазолидинон и тому подобное.
Обычно нелимитирующие примеры аминоглкозидых антибактериальных агентов включают амикацин, гентамицин, канамицин, неомицин, нетилмицин, тобрамицин, парамомицин, арбекацин, стрептомицин, апрамицин и подобное.
Обычно нелимитирующие примеры ансамициновых антибактериальных агентов включают гелданамицин, хербимицин и подобное.
Обычно нелимитирующие примеры карбацефемовых антибактериальных агентов включают лоракарбеф и подобное.
Обычно нелимитирующие примеры карбапенемовых антибактериальных агентов включают эртапенем, дорипенем, имипенем, меропенем и подобное.
Обычно нелимитирующие примеры цефалоспориновых и цефамициновых антибактериальных агентов включают цефазолин, цефацетрил, цефадроксил, цефалексин, цефалоглицин, цефалонум, цефалоридин, цефалотин, цефапирин, цефатризин, цефазедон, цефазафлур, цефрадин, цефроксадин, цефтезол, цефаклор, цефамандол, цефминокс, цефоницид, цефоранид, цефотиам, цефпрозил, цефбуперазон, цефуроксим, цефузонам, цефамицин, цефокситин, цефотетан, цефметазол, карбацефем, цефиксим, цефтазидим, цефтриаксон, цефкапен, цефдалоксим, цефдинир, цефдиторен, цефетамет, цефменоксим, цефодизим, цефоперазон, цефотаксим, цефпимизол, цефпирамид, цефподоксим, цефсулодин, цефтерам, цефтибутен, цефтиолен, цефтизоксим, оксацефем, цефепим, цефозопран, цефпиром, цефхином, цефтобипрол, цефтиофур, цефовецин, СХА-101, цефтаролин, цефтобипрол и т.д.
Обычно нелимитирующие примеры линкозамидных антибактериальных агентов включают клиндамицин, линкомицин и подобное.
Обычно нелимитирующие примеры макролидных антибактериальных агентов включают азитромицин, кларитромицин, диритромицин, эритромицин, рокситромицин, тролеандомицин, телитромицин, спектиномицин и подобное.
Обычно нелимитирующие примеры монобактамных антибактериальных агентов включают азтреонам и подобное.
Обычно нелимитирующие примеры нитрофурановых антибактериальных агентов включают фуразолидон, нитрофурантоин и подобное.
Обычно нелимитирующие примеры пенициллиновых антибактериальных агентов включают амоксициллин, ампициллин, азлоциллин, карбенициллин, клоксациллин, диклоксациллин, флуклоксациллин, мезлоциллин, метициллин, нафциллин, оксациллин, пенициллин G, пенициллин V, пиперациллин, темоциллин, тикарциллин и подобное.
Обычно нелимитирующие примеры полипептидных антибактериальных агентов включают бацитрацин, колистин, полимиксин В и подобное.
Обычно нелимитирующие примеры хинолоновых антибактериальных агентов включают ципрофлоксацин, эноксацин, гатифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, налидиксиновую кислоту, норфлоксацин, офлоксацин, тровафлоксацин, грепафлоксацин, спарфлоксацин, темафлоксацин и подобное.
Обычно нелимитирующие примеры сульфонамидных антибактериальных агентов включают мафенид, сульфонамидохризоидин, сульфацетамид, сульфадиазин, сульфаметизол, сульфаметоксазол, сульфасалазин, сульфизоксазол, триметоприм и подобное.
Обычно нелимитирующие примеры тетрациклиновых антибактериальных агентов включают демеклоциклин, доксициклин, миноциклин, окситетрациклин, тетрациклин, тигециклин и подобное.
Обычно нелимитирующие примеры оксазолидиноновых антибактериальных агентов включают линезолид, ранбезолид, торезолид, радезолид и т.д.
Фармацевтические композиции, соответствующие настоящему изобретению, могут содержать один или более фармацевтически приемлемых носителей или наполнителей или подобное. Типичные нелимитирующие примеры таких носителей или наполнителей включают маннитол, лактозу, крахмал, стеарат магния, сахарин натрия, тальк, целлюлозу, кросскармелозу натрия, глюкозу, желатин, сукрозу, карбонат магния, увлажняющие агенты, эмульсифицирующие агенты, солюбилизирующие агенты, рН буферные агенты, лубриканты, стабилизирующие агенты, связующие агенты и т.д.
Фармацевтические композиции, соответствующие настоящему изобретению, могут существовать в различных формах. В некоторых разделах фармацевтическая композиция существует в форме порошка или раствора. В некоторых других разделах фармацевтические композиции согласно изобретению существуют в форме порошка, который может быть переформирован добавлением совместимого разбавителя перед парентеральным введением. Не лимитирующий пример такого совместимого разбавителя включает воду.
В некоторых других разделах фармацевтические композиции согласно изобретению существуют в форме замороженной композиции, которая может быть разбавлена совместимым разбавителем перед парентеральным введением.
В некоторых других разделах фармацевтические композиции согласно изобретению существуют в форме, готовой для употребления для парентерального введения.
В методах согласно изобретению фармацевтическая композиция и/или другие фармацевтически активные ингредиенты, предложенные здесь, могут быть введены любым подходящим способом, который служит для введения композиции или ее составляющих или активных ингредиентов в желаемое место. Способ введения может варьироваться в зависимости от различных факторов, таких как, например, компоненты фармацевтической композиции и природа активных ингредиентов, место потенциальной или существующей инфекции, вовлеченный микроорганизм (например, бактерия), тяжесть инфекции, возраст и физическое состояние субъекта. Некоторые нелимитирующие примеры введения композиции субъекту согласно настоящему изобретению включают оральное, внутривенное, топикальное, внутриреспираторное, внутрибрюшинное, внутримышечное, парентеральное, подъязычное, трансдермальное, интраназальное, аэрозольное, внутриглазное, интратрахеальное, ректальное, вагинальное введение, генную пушку, кожную бляшку, глазные капли, ушные капли или полоскание для рта.
Композиции, соответствующие изобретению, могут быть сформированы в различных дозовых формах, в которых активные ингредиенты и/или наполнители могут присутствовать или вместе (например, в виде совместной смеси) или как раздельные компоненты. Когда различные ингредиенты в композиции сформированы в виде смеси, такая композиция может доставляться путем введения такой смеси. Композиция или дозовая форма, в которую ингредиенты не входят в виде смеси, но доставляются как раздельные компоненты, такая композиция/дозовая форма может быть введена несколькими путями. В одном возможном пути ингредиенты могут быть смешаны в желательных пропорциях, и затем смесь может быть введена так, как требуется. Альтернативно, компоненты или ингредиенты (активные или инертные) могут быть введены раздельно (одновременно или друг за другом) в подходящей пропорции с тем, чтобы достичь того же или эквивалентного терапевтического уровня или эффекта, который достигается введением эквивалентной смеси.
Аналогично, в способах, соответствующих изобретению, активные ингредиенты, предложенные здесь, могут быть введены субъекту несколькими путями, в зависимости от требований. В некоторых разделах, активные ингредиенты смешиваются в подходящих количествах, и затем смесь вводится субъекту. В некоторых других разделах активные ингредиенты вводятся раздельно. Поскольку изобретение предполагает, что активные ингредиенты могут вводиться раздельно, изобретение далее представляет комбинированные раздельные фармацевтические композиции в форме наборов. Набор может включать одну или более раздельных фармацевтических композиций, где каждая содержит один или более активных ингредиентов. Каждая из таких раздельных композиций может присутствовать в отдельном контейнере, таком как бутылка, пузырек, шприцы, коробочки, мешочки и тому подобное. Обычно форма набора включает инструкции по введению отдельных компонентов. Форма набора особенно удачна в тех случаях, когда отдельные компоненты предпочтительно вводить в различных дозовых формах (например, орально и парентерально) или вводить через различные дозовые интервалы. Когда активные ингредиенты вводят раздельно, они могут вводиться одновременно или последовательно.
Фармацевтическая композиция или активные ингредиенты, соответствующие настоящему изобретению, могут быть сформированы во множество различных дозовых форм. Обычно нелимитирующие примеры дозовых форм включают твердые, полутвердые, жидкие и аэрозольные дозовые формы, такие как таблетки, капсулы, порошки, растворы, суспензии, суппозитории, аэрозоли, гранулы, эмульсии, сиропы, эликсиры и тому подобное.
В общем, фармацевтические композиции и способ, предложенные здесь, применимы для предотвращения или лечения бактериальных инфекций. Удачно, что композиции и способы, предложенные здесь, эффективны также в предупреждении или лечении инфекций, вызванных бактерией, рассматриваемой как мало или совсем не поддающейся одному или более известным антибактериальным агентам или их известным композициям. Некоторые нелимитирующие примеры таких бактерий, известных способностью к развитию резистентности к различным антибактериальным агентам, включают Acinetobacter, E.coli, Pseudomonas aeruginosa, Staphylococcus aureus, Enterobacter, Klebsilla, Citrobacter и тому подобное. Другие нелимитирующие примеры инфекций, которые могут быть предупреждены или пролечены с использованием композиций и/или способов изобретения, включают: инфекции кожи или мягких тканей, лихорадочную нейропению, инфекции мочевого тракта, внутрибрюшинные инфекции, инфекции дыхательных путей, пневмонию (внутрибольничную), бактериальный менингит, хирургические инфекции и т.д.
Неожиданно оказалось, что соединения, композиции и методы, соответствующие изобретению, являются также эффективными в профилактике или лечении бактериальных инфекций, вызываемых бактерией, продуцирующей один или более бета-лактамазных ферментов. Способность композиций и методов, соответствующих настоящему изобретению, лечить такие устойчивые бактерии типичными бета-лактамными антибиотиками представляет значительный прогресс в данной области.
В общем, соединения формулы (I) или их стереоизомер или фармацевтически приемлемая соль, соответствующие изобретению, применимы также в повышении антибактериальной эффективности антибактериального агента у субъекта. Антибактериальная эффективность одного или более антибактериальных агентов может быть повышена, например, путем совместного введения указанного антибактериального агента или его фармацевтически приемлемой соли с фармацевтически эффективным количеством соединения формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли в соответствии с изобретением.
Специалистам ясно, что в изобретении могут варьироваться заместители или модификации, предложенные здесь, без исключения из содержимого изобретения и его идеи. Так, например, специалисты в данной области поймут, что изобретение может применяться с использованием различных соединений в рамках описанного корневого описания.
Примеры
Следующие примеры иллюстрируют разделы изобретения, которые к настоящему времени наиболее известны. Следует, однако, понимать, что они представляют собой только примеры или иллюстрации применения принципов настоящего изобретения. Различные модификации и альтернативные композиции, методы и системы могут быть использованы специалистами без исключения из содержимого изобретения и его идеи. Приложенная формула изобретения предполагает охват таких модификаций и переделок. Таким образом, хотя выше изобретение подробно описано, следующие примеры предоставляют дальнейшие детали того, что представляется наиболее практически значимым в предпочтительных разделах изобретения.
Получение натриевой соли транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]-октан-2-карбонитрила (I)
Стадия 1: Получение свободного основания и Вос-защита.
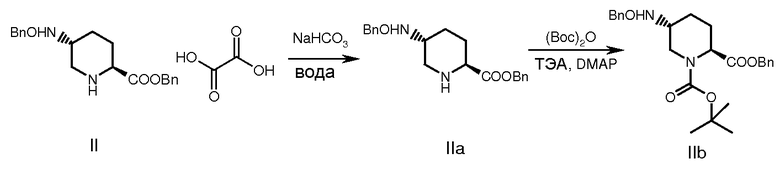
Оксалат II (30 г, 0,0697 моль) распределяли между водой (300 мл) и этилацетатом (300 мл) с последующим добавлением при перемешивании бикарбоната натрия (11,7 г, 0,139 моль). Через 1 час органический слой отделяли, и водный слой экстрагировали этилацетатом (150 мл). Объединенные органические фазы промывали водой (150 мл), солевым раствором (150 мл), высушивали (над Na2SO4), и растворитель выпаривали при пониженном давлении с получением свободного основания IIa, 24 г.
К охлажденному до 5-10°С раствору свободного основания (24 г, 0,0705 моль) в ДХМ (дихлорметан) (240 мл) добавляли при перемешивании триэтиламин (ТЭА) (19,68 мл, 0,141 моль) и Вос-ангидрид (17,8 мл, 0,0775 моль). Через 30 мин добавляли DMAP (диметиламинопиридин) (0,86 г, 0,00705 моль), и полученный раствор оставляли нагреваться до комнатной температуры при перемешивании еще 16 часов. Реакционную смесь разбавляли насыщенным водным раствором хлорида аммония (10 мл), хорошо перемешивали и отделяли слой ДХМ, промывали его водой (10 мл) и затем солевым раствором (10 мл). Растворитель выпаривали при пониженном давлении, и остаток хроматографировали на колонке с силикагелем (60-120 меш), элюировали смесью этилацетат:гексан 25-50% и после концентрирования объединенных фракций получали продукт в виде бесцветного масла, 25 г (80% выход).
МС: 439 [М+]; молекулярная формула C26H33NO5; МВ: 439
Стадия 2: Гидролиз бензилового эфира
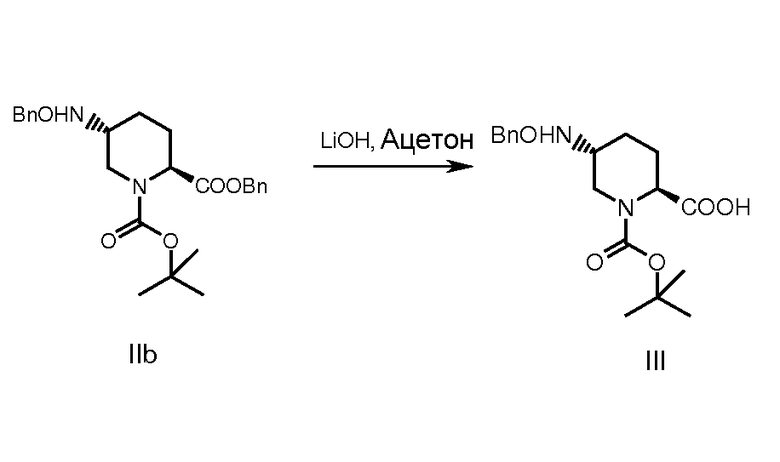
К раствору соединения (IIb) (25 г, 0,0567 моль) в ацетоне (500 мл) при 0°С добавляли по каплям при сильном перемешивании раствор гидроксида лития (3,81 г, 0,0908 моль в смеси 228,6 мл воды и 76,2 мл ацетона). Реакционную смесь доводили до комнатной температуры, и перемешивание продолжали еще 5 час. Полученную смесь охлаждали до 0°С и доводили рН до 8-8,5 с помощью 2н. HCl (примерно 10 мл). Реакционную смесь при перемешивании разбавляли солевым раствором (75 мл) и толуолом (250 мл) и спустя 10 мин отделяли органическую фазу. Водную фазу ре-экстрагировали толуолом (2×120 мл). Подкисляли водный слой до рН 3-4 2н. HCl, и раствор экстрагировали этилацетатом (3×200 мл). Объединенные органические фазы промывали водой (200 мл) и солевым раствором (200 мл), высушивали (над Na2SO4), и растворитель выпаривали при пониженном давлении с получением продукта в виде плотного масла, 21 г (количественный выход).
МС: 349 (М+), молекулярная формула: C19H27NO5; МВ: 349
Стадия 3: Превращение кислоты в амид

К перемешиваемому раствору соединения (IV) (21 г, 0,06 моль) в ДХМ (210 мл) добавляли при 0°С ТЭА (25,12 мл, 0,18 моль) с последующим медленным добавлением пивалоилхлорида (11,07 мл, 0,09 моль). Полученную смесь перемешивали еще 1,5 часа. Охлаждали реакционную смесь до -40°С, и пробулькивали через реакционную смесь газообразный аммиак в течение 30 мин. Реакционную смесь доводили до комнатной температуры, и отфильтровывали твердую белую суспензию. Растворитель упаривали при пониженном давлении, и остаток хроматографировали на колонке с силикагелем (60-120 меш). После элюирования смесью ацетон:гексан (1:4) и концентрирования объединенных растворов получали продукт в виде плотного масла, 10,2 г (выход 49%).
МС: 348 [М+]; молекулярная формула: C19H28N2O4; МВ: 348
Стадия 4: Превращение амида в цианосоединение
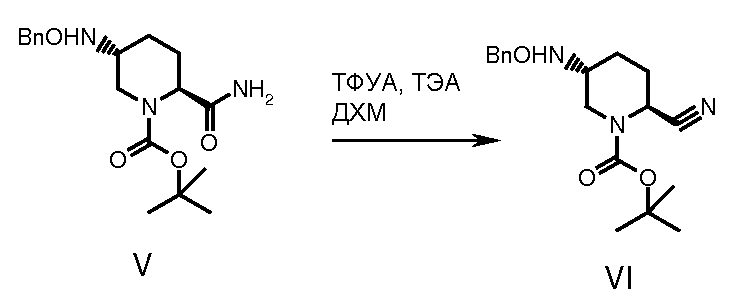
К охлажденному (0°С) и перемешиваемому раствору соединения V (10,2 г, 0,0286 моль) в ДХМ (306 мл) добавляли триэтиламин (17,99 мл, 1,289 моль) с последующим медленным добавлением трифторуксусного ангидрида (ТФУА) (12,08 г, 0,0573 моль). Полученный раствор доводили до комнатной температуры и перемешивали еще 6 часов. Реакционную смесь промывали водой (3×100 мл), насыщенным раствором хлорида аммония (100 мл) и солевым раствором (100 мл). Органический слой сушили (Na2SO4), и растворитель упаривали при пониженном давлении. Остаток хроматографировали на колонке с силикагелем (60-120 меш), используя смесь ацетон:гексан (1:19). После концентрирования объединенных фракций получали продукт в виде твердого белого вещества, 9,7 г (выход - количественный).
МС: 331 [М+]; молекулярная формула: C18H25N3O3; МВ: 331
Стадия 5: Снятие защиты в цианосоединении
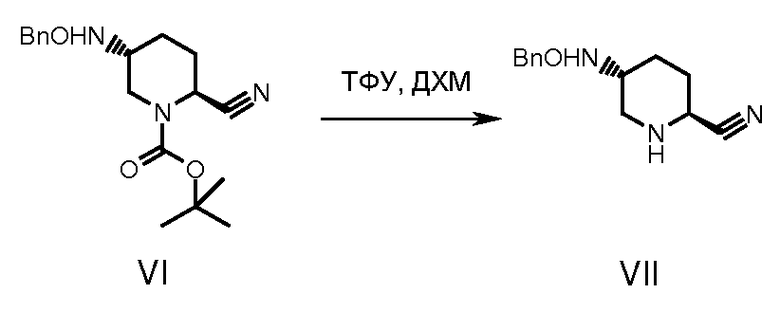
К замороженному (-15°С) и перемешиваемому раствору соединения VII (6 г) в ДХМ (150 мл) добавляли трифторуксусную кислоту (12 мл), и смесь оставляли нагреваться до комнатной температуры, а затем перемешивали еще 4 часа. Упаривали растворитель при пониженном давлении и температуре 40±5°С, остаток разбавляли насыщенным водным раствором бикарбоната натрия (60 мл), и смесь экстрагировали ДХМ (2×60 мл). Объединенные экстракты промывали водой (60 мл), сушили (над сульфатом натрия) и упаривали при пониженном давлении при 35±5°С, получая 4,2 г соединения VIII.
Стадия 6: Получение бициклического соединения.
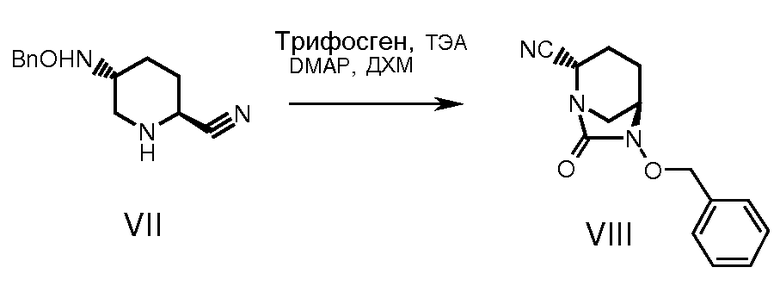
К охлажденному (0-5°С) и перемешиваемому раствору соединения VIII (4,2 г) в ацетонитриле (63 мл) добавляли триэтиламин (5,28 мл) с последующим медленным добавлением раствора трифосгена (1,9 г) в ацетонитриле (16,8 мл). Продолжали перемешивать еще 30 мин, а затем добавляли диметиламинопиридин (DMAP) (0,178 г). Реакционную смесь доводили до комнатной температуры и перемешивали еще 16 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия (33,6 мл) и полученную смесь перемешивали 30 мин. Затем смесь концентрировали до 1/3 объема при пониженном давлении. Остаток разбавляли водой (42 мл), и полученную смесь экстрагировали ДХМ (2×42 мл). Упаривали растворитель при пониженном давлении, и остаток очищали на колонке с силикагелем (60-120 меш). После элюирования смесью 1:4 ацетон:гексан и концентрирования объединенных фракций получали продукт в виде твердого белого вещества, 2,3 г (выход: 48%).
МС: 314 (М+); молекулярная формула: C16H18N4O3; МВ: 314
Стадия 7: Синтез сульфатной соли TBA
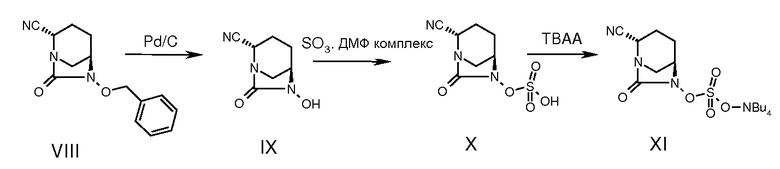
К раствору бензильного соединения VIII (6 г, 0,0233 моль) в смеси 1:1 ДХМ (30 мл) и ДМФ (30 мл) добавляли 1,5 г сухого 10% палладия на угле, и смесь гидрировали при давлении водорода 3 кг в течение 3 часов при 25-30°С. Реакционную смесь фильтровали через микронный фильтр для удаления катализатора, и фильтрат концентрировали при пониженном давлении, получая де-бензилированное соединение IX.
Де-бензилированное соединение (IX) растворяли в N,N-диметилформамиде (30 мл) в атмосфере аргона, и раствор охлаждали до 0°С. К охлажденному раствору добавляли ДМФ:SO3 (4,26 г, 0,0278 моль) и продолжали перемешивание еще 30 мин при 0°С. Затем смесь доводили до комнатной температуры и перемешивали еще 1 час. ТСХ регистрировала полное превращение N-гидрокси соединения в продукт Х.
Раствор, содержащий сульфат (Х), вновь охлаждали до 0°С и добавляли к нему тетрабутиламмоний ацетат (9 г, 0,0301 моль, растворенный в 30 мл воды). Реакционную смесь доводили до 25°С и перемешивали в течение 1 часа. Летучие продукты удаляли при пониженном давлении, и остаток упаривали с 2×50 мл ксилола для удаления следов N,N'-диметилформамида. Остаток распределяли между смесью 1:1 вода:дихлорметан (120 мл). Водный слой ре-экстрагировали дихлорметаном (30 мл). Объединенные органические экстракты промывали водой (2×30 мл), солевым раствором (30 мл), сушили над Na2SO4 и растворитель упаривали при пониженном давлении, получая сырой сульфат TBA (5,2 г). Сырое соединение растирали с гексаном (2×30 мл) и сушили на роторном испарителе при 4 мм рт.ст., получая соль ТВА (XI), 5,0 г, выход 44%.
масс: 246 (М-Н) сульфата; МВ:488, молекулярная формула: C23H44N4O5S.
Стадия 8: Синтез натриевой соли транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]-октан-2-карбонитрила (I)
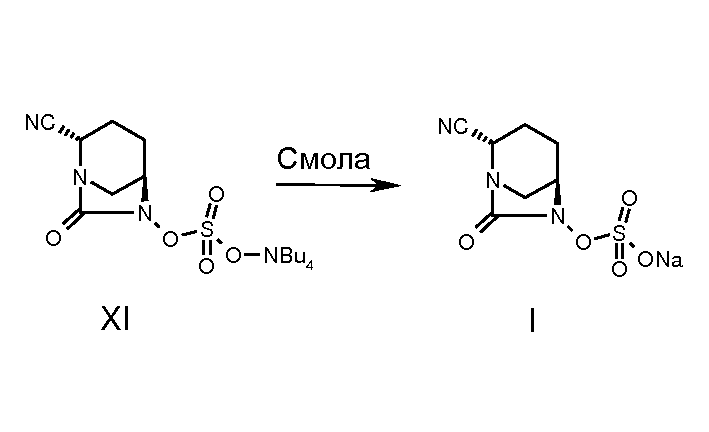
ТВА сульфат (4,4 г, 0,009 моль) растворяли в 5% ТГФ в воде (2 мл), и раствор пропускали через колонку (45 см длина и 2,0 см диаметр), наполненную смолой Dowex 50WX8 200 Na+. Колонку промывали 5% смесью ТГФ-вода (100 мл). Объединенные фракции упаривали при пониженном давлении (4 мм рт.ст.), получая белое полутвердое вещество. 1,5 г. Выход 62%.
МС: 246 (М-Н) сульфата; МВ:269, молекулярная формула: C7H8N3O5SNa,
1Н ЯМР (ДМСО): δ 4,54 (д, 1Н), 4,06 (с, 1Н), 3,22 (м, 2Н), 1,96 (м, 2Н), 1,84 (м, 2Н).
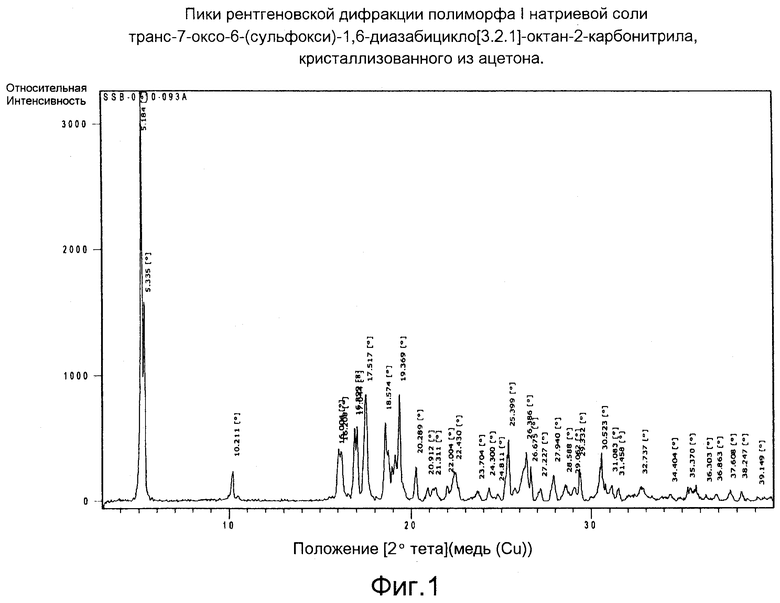
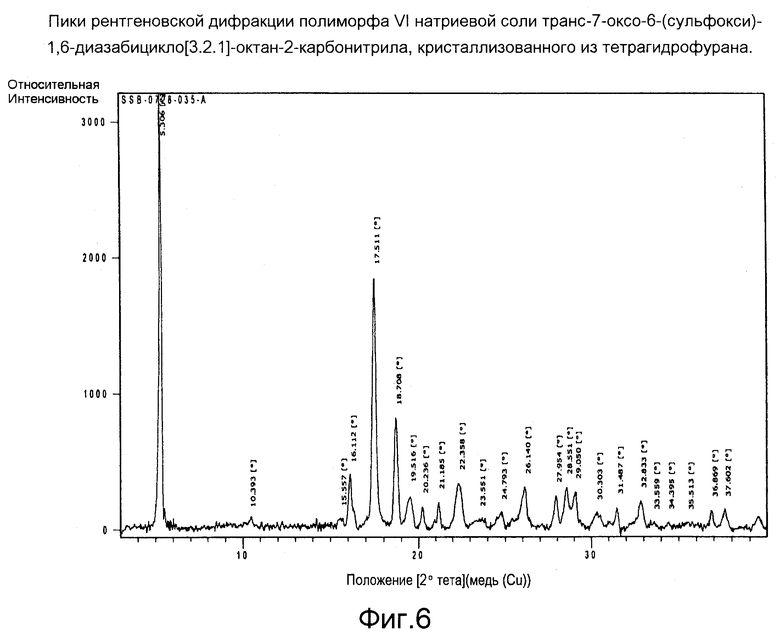
Пики рентгеновской диффракции различных полиморфов этого соединения, кристаллизованных из различных растворителей, приведены на Фигурах 1-6 (описание дано ниже).
Фигура 1: Пики рентгеновской дифракции полиморфа I натриевой соли транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]-октан-2-карбонитрила, кристаллизованного из ацетона.
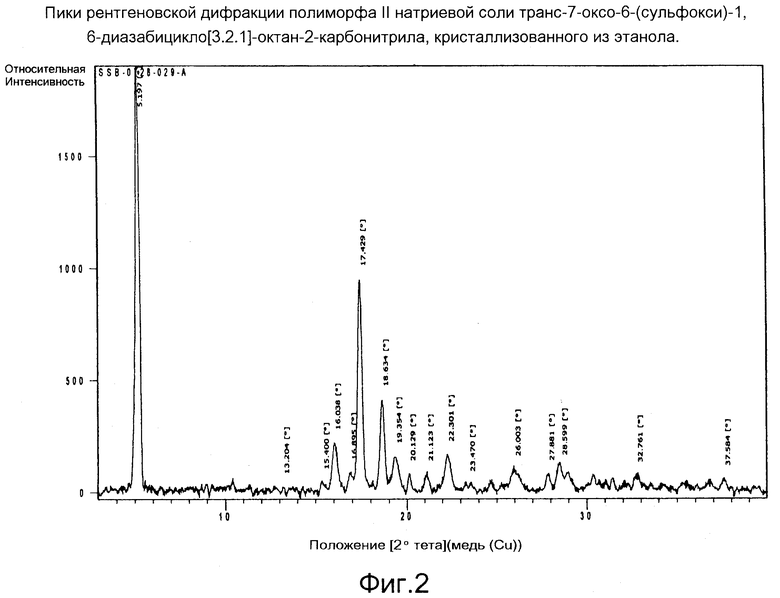
Фигура 2: Пики рентгеновской дифракции полиморфа II натриевой соли транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]-октан-2-карбонитрила, кристаллизованного из этанола.
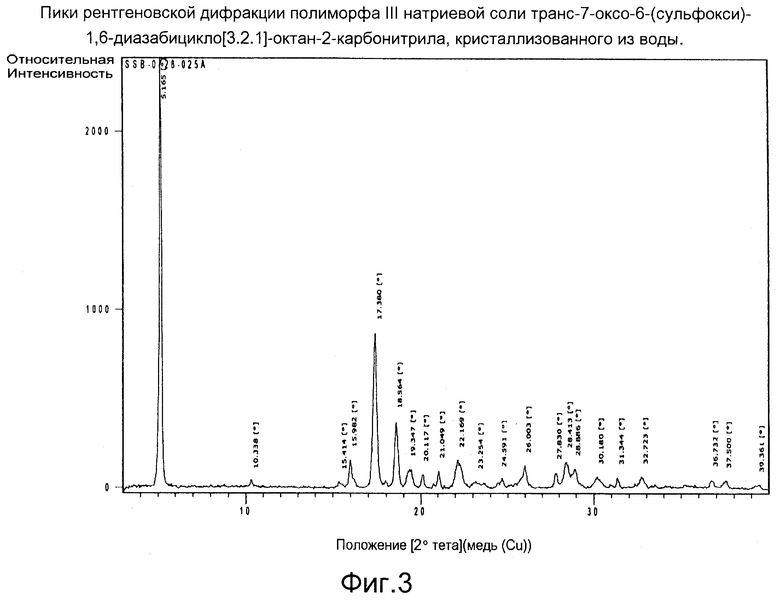
Фигура 3: Пики рентгеновской дифракции полиморфа III натриевой соли транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]-октан-2-карбонитрила, кристаллизованного из воды.
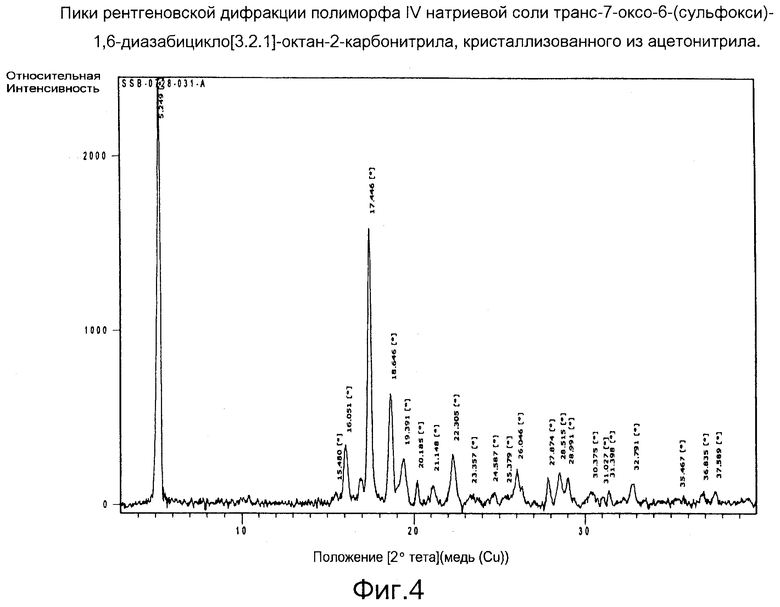
Фигура 4: Пики рентгеновской дифракции полиморфа IV натриевой соли транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]-октан-2-карбонитрила, кристаллизованного из ацетонитрила.
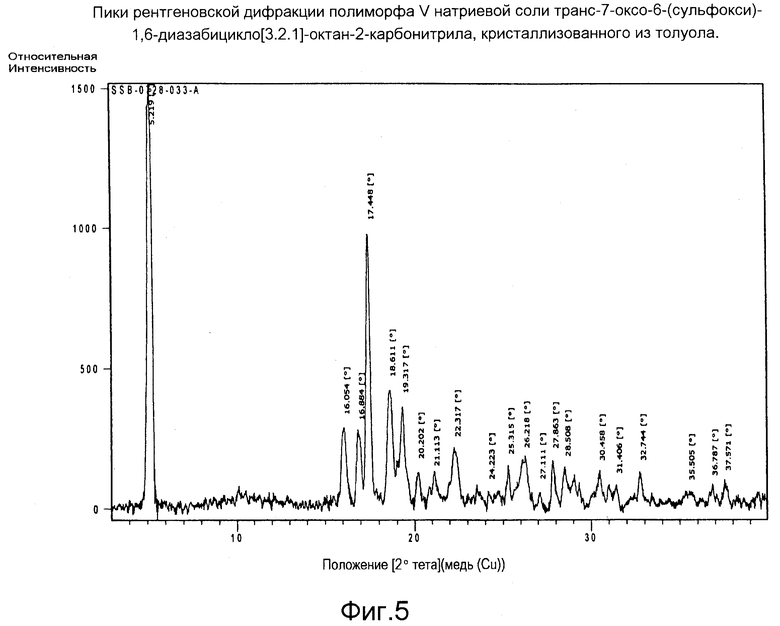
Фигура 5: Пики рентгеновской дифракции полиморфа V натриевой соли транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]-октан-2-карбонитрила, кристаллизованного из толуола.
Фигура 6: Пики рентгеновской дифракции полиморфа VI натриевой соли транс-7-оксо-6-(сульфокси)-1,6-диазабицикло[3.2.1]-октан-2-карбонитрила, кристаллизованного из тетрагидрофурана.
Данные биологической активности
Исследовали биологическую активность характерных соединений изобретения против различных штаммов бактерий (в комбинации с другим антибактериальным агентом). В типичном исследовании бактериальные культуры, выращенные в течение ночи, подходящим образом разбавляли и прививали на среду агар-агара, содержащую удвоенные разбавления антибиотиков. Наблюдения за ростом или отсутствием роста осуществляли после 16-20 часов инкубации при 35±2°С в среде обычного воздуха. Полная процедура осуществлялась согласно рекомендациям Института Клинических и Лабораторных Стандартов (Институт Клинических и Лабораторных Стандартов, Стандарты тестирования антимикробной чувствительности, 20-е Информационное приложение, М 100-S20, т.30, №1, 2010). Результаты этих изучений суммированы в Таблицах 1 и 2. Таблица 1 детализирует способность цефтазидима в комбинации с типичным соединением, соответствующим изобретению (соединение формулы (I), где М означает натрий), противодействовать различным МЛР (мульти-лекарственная резистентность) грамм-отрицательных штаммов, продуцирующих бета-лактамазные ферменты классов A, C и D. Активность выражена в MIC (минимальная ингибирующая концентрация, мкг/мл). Для сравнения была также определена активность различных других известных бета-лактамазных ингибиторов, таких как клавулановая кислота, тазобактам, МК-7655 и NXL-104. Как можно видеть, использование соединений, соответствующих изобретению, существенно снижает значения MIC антибактериального агента (например, в случае цефтазидима). Результаты также предполагают, что соединения, соответствующие изобретению, повышают антибактериальную эффективность антибактериального агента, когда указанный антибактериальный агент вводится вместе с фармацевтически эффективным количеством соединения формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли.
Сравнительная активность соединения формулы (I) (где М означает натрий) против штаммов, продуцирующих ESBL класса А, класса С и класса D, в комбинации с цефтазидимом
ESBL
Клавулановая кислота
Тазобактам
MK 7655
NXL
104
[3.2.1]-октан-2-карбонитрила
ESBL
ATCC 700603
NCTC 13351
NCTC 13352
ESBL
M 50
7 MP
B 89
ESBL
NCTC 13301
NCTC 13304
NCTC 13305
Все ингибиторы тестировали при концентрации 4 мкг/мл, при которой они не проявляют собственную активность, будучи проверены сами.
Таблица 2 приводит подробные данные, соответствующие комбинации меропенема с соединением формулы (I), где М означает натрий, против штаммов, продуцирующих ESBL класса D. Патогены, продуцирующие ESBL класса D и проявляющие высокий уровень резистентности к карбапенемам, представляют терапевтическую проблему в клиническом применении, поскольку чрезвычайно ограниченный выбор лечения является возможным для их лечения. Как можно видеть, применение соединений, соответствующих изобретению, существенно понижает значения MIC антибактериального агента (например, в случае меропенема). Результаты также предполагают, что соединения, соответствующие изобретению, повышают антибактериальную эффективность антибактериального агента, когда указанный антибактериальный агент вводится вместе с фармацевтически эффективным количеством соединения формулы (I), или его стереоизомера, или его фармацевтически приемлемой соли.
Сравнительная активность WCK 4234 против штаммов, продуцирующих ESBL класса D, в комбинации с меропенемом
ESBL
Клавулановая кислота
Тазобактам
MK 7655
NXL
104
[3.2.1]-октан-2-карбонитрила
ESBL
NCTC 13301
NCTC 13304
NCTC 13305
Все ингибиторы тестировали при концентрации 4 мкг/мл, при которой они не проявляют собственную активность, будучи проверены сами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ | 2015 |
|
RU2705375C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ | 2014 |
|
RU2702361C2 |
| ПРОИЗВОДНЫЕ 1,6- ДИАЗАБИЦИКЛО [3,2,1] ОКТАН-7-ОНА И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ БАКТЕРИАЛЬНЫХ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ | 2012 |
|
RU2578370C2 |
| ПРОИЗВОДНЫЕ 1,6-ДИАЗАБИЦИКЛО[3.2.1]ОКТАН-7-ОНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2013 |
|
RU2614418C2 |
| ПРОИЗВОДНЫЕ 1,6-ДИАЗАБИЦИКЛО[3,2,1]ОКТАН-7-ОНА И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ БАКТЕРИАЛЬНЫХ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ | 2012 |
|
RU2636147C1 |
| ПРОИЗВОДНЫЕ 1,6-ДИАЗАБИЦИКЛО[3.2.1]ОКТАН-7-ОНА И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2012 |
|
RU2570423C2 |
| АНТИБАКТЕРИАЛЬНЫЕ КОМПОЗИЦИИ | 2013 |
|
RU2646798C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ БЕТА-ЛАКТАМНЫЙ АНТИБИОТИК, СУЛЬБАКТАМ И ИНГИБИТОР БЕТА-ЛАКТАМАЗ | 2011 |
|
RU2569059C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2014 |
|
RU2676482C2 |
| АНТИБАКТЕРИАЛЬНЫЕ КОМПОЗИЦИИ И СПОСОБЫ | 2017 |
|
RU2779346C2 |
Изобретение относится к соединению формулы (I)
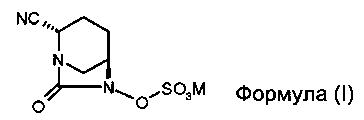
или его стереоизомеру, или его фармацевтически приемлемой соли, где М означает катион, и его использованию в предупреждении и лечении бактериальных инфекций. 9 н. и 6 з.п. ф-лы, 6 ил., 2 табл., 1 пр.
1. Соединение формулы (I)
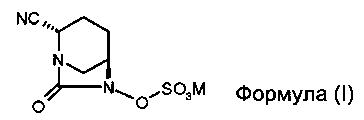
или его стереоизомер, или его фармацевтически приемлемая соль, где М означает катион.
2. Соединение по п. 1, где М означает водород, натрий или калий.
3. Фармацевтическая композиция для лечения бактериальной инфекции, содержащая соединение по п. 1 или 2.
4. Способ предотвращения или лечения бактериальной инфекции у субъекта, включающий введение указанному субъекту фармацевтически эффективного количества соединения по п. 1 или 2.
5. Способ предотвращения или лечения бактериальной инфекции у субъекта, при этом указанная инфекция вызвана бактерией, продуцирующей один или более бета-лактамазных ферментов, где указанный способ включает введение указанному субъекту фармацевтически эффективного количества соединения по п. 1 или 2.
6. Способ предотвращения или лечения бактериальной инфекции у субъекта, включающий введение указанному субъекту фармацевтически эффективного количества фармацевтической композиции по п. 3.
7. Способ предотвращения или лечения бактериальной инфекции субъекта, при этом указанная инфекция вызвана бактерией, продуцирующей один или более бета-лактамазных ферментов, где указанный способ включает введение указанному субъекту фармацевтически эффективного количества фармацевтической композиции по п. 3.
8. Фармацевтическая композиция по п. 3, содержащая, кроме того, по меньшей мере, один антибактериальный агент или его фармацевтически приемлемую соль.
9. Способ предотвращения или лечения бактериальной инфекции у субъекта, включающий введение указанному субъекту фармацевтически эффективного количества: (а) соединения формулы (I) по п. 1, или его стереоизомера, или его фармацевтически приемлемой соли, и (b), по меньшей мере, одного антибактериального агента или его фармацевтически приемлемой соли.
10. Способ предотвращения или лечения бактериальной инфекции у субъекта, при этом указанная инфекция вызвана бактерией, продуцирующей один или более бета-лактамазных ферментов, включающий введение указанному субъекту фармацевтически эффективного количества: (а) соединения формулы (I) по п. 1, или его стереоизомера, или его фармацевтически приемлемой соли, и (b) по крайней мере, одного антибактериального агента или его фармацевтически приемлемой соли.
11. Способ повышения антибактериальной эффективности антибактериального агента у субъекта, включающий совместное введение указанного антибактериального агента, или его фармацевтически приемлемой соли с фармацевтически эффективным количеством соединения формулы (I) по п. 1, или его стереоизомера, или его фармацевтически приемлемой соли.
12. Фармацевтическая композиция по п. 8 или способ по любому из пп. 9-11, где антибактериальный агент является бета-лактамным антибактериальным агентом.
13. Фармацевтическая композиция по п. 8 или способ по любому из пп. 9-11, где указанный антибактериальный агент выбран из группы, состоящей из пенициллинов, пенемов, карбапенемов, цефалоспоринов и монобактамов.
14. Фармацевтическая композиция по п. 8 или способ по любому из пп. 9-11, где антибактериальный агент является антибиотиком цефалоспоринового ряда, выбранным из группы, состоящей из цефалотина, цефалоридина, цефаклора, цефадроксила, цефамандола, цефазолина, цефалексина, цефрадина, цефтизоксима, цефокситина, цефацетрила, цефотиама, цефотаксима, цефсулодина, цефоперазона, цефтизоксима, цефменоксима, цефметазола, цефалоглицина, цефоницида, цефодизима, цефпирома, цефтазидима, цефриаксона, цефпирамида, цефбуперазона, цефозопрана, цефепима, цефоселиза, цефлупренама, цефузонама, цефпимизола, цефклидина, цефиксима, цефтибутена, цефдинира, цефподоксим аксетила, цефподоксим проксетила, цефтерам пивоксила, цефетамет пивоксила, цефкапен пивоксила или цефдиторен пивоксила, цефуроксима, цефуроксим аксетила, лоракарбацефа, цефтаролина, цефтолозана и латамоксефа.
15. Фармацевтическая композиция по п. 8 или способ по любому из пп. 9-11, где антибактериальный агент выбран из группы, состоящей из цефтазидима, цефепима, цефпирома, пиперациллина, эртапенема, дорипенема, меропенема, имипенема, цефтаролина и цефтолозана.
| WO 2011042560, A, 14.04.2011 | |||
| US 7112592, B2, 26.09.2006 | |||
| ДИАЗАБИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2124014C1 |
| WO 2003063864,A2,07.08.2003. | |||
Авторы
Даты
2015-11-20—Публикация
2012-09-11—Подача