ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к новой синергической фармацевтической композиции для топического нанесения. Конкретнее, изобретение относится к новой синергической фармацевтической композиции для получения топических составов для применения при профилактике и лечении ран, ожоговых ран, кожных трансплантатов, пролежней, диабетических язв стоп и других кожных заболеваний. Новый состав по изобретению содержит один или более синергически активных ингредиентов и один или более неактивных ингредиентов. Синергически активные ингредиенты включают митогенный белок (фактор роста) в синергической комбинации с одним или более бактерицидными и бактериостатическими средствами. Конкретнее, синергически активные ингредиенты включают рекомбинантный человеческий эпидермальный фактор роста (rh-EGF) (REGEN-D™, выпускаемый компанией Bharat Biotech International Limited) и/или происходящий из тромбоцитов фактор роста (rh-PDGF-BB), сульфадиазин серебра (SSD) и хлоргексидин глюконат (CHG), тогда как один или более неактивных ингредиентов могут включать носители, консерванты, эмульгаторы, средства для смягчения кожи и средства, облегчающие боль, и один или более других компонентов. Новая композиция по изобретению может применяться для получения топических составов для нанесения в форме крема или геля или в жидкой форме на раны, ожоговые раны, кожные трансплантаты, пролежни, диабетические язвы стоп и другие поражения кожи.
УРОВЕНЬ ТЕХНИКИ
Ожог представляет собой крайнюю степень поражения кожи, вызванного термическими воздействиями, холодом (обморожения), электричеством, химическими веществами, трением или радиацией. Ожоговая травма в целом связана с дисбалансом тканевой жидкости и электролитов, замедленным заживлением обожженной области, метаболическим расстройством, катаболизмом мышечной ткани и различными другими осложнениями со стороны жизненно важных органов и может, кроме того, вызвать вторичные осложнения, подобные инфекции бактериями и/или микроорганизмами. Каждое из этих осложнений требует применения различных средств/лекарственных препаратов для обеспечения всестороннего лечения ожогов для спасения жизни.
Травмы и случаи смерти, связанные с ожогами, являются большой проблемой в регионе юго-восточной Азии, особенно, в развивающихся странах, подобных Индии. По отчетам ВОЗ на долю юго-восточной Азии приходится около 10% всех случаев ожогов в мире, причем только в Индии число случаев смерти, связанных с ожогами, составляет 35000 в год. Даже в развитой стране, такой как США, по оценкам 2,1 миллиона американцев ежегодно требуют медицинского лечения по поводу ожогов. Одной из основных причин смертности у ожоговых пациентов является тяжелая системная инфекция. Первичным путем поступления этих инфекций является воздействие на необработанную ожоговую поверхность различных бактерий и патогенов. Такие факторы как разрушение кожного барьера, большая кожная бактериальная нагрузка, возможность превращения нормальной бактериальной флоры в оппортунистические патогены и тяжелое подавление иммунной системы способствуют развитию сепсиса у жертвы ожога, что обычно угрожает жизни [1]. Соответствующее ведение раны ожоговой поверхности и ранняя реэпителизация с закрытием раны является жизненно важной стадией в лечении и прогнозе ожоговых пациентов.
Борьба с инфекцией является очень важным процессом в профилактике вторичных инфекций, а также в поддержании должного процесса заживления ожоговых ран. Хотя применение топических противомикробных средств является существенным в установлении бактериального баланса в ожоговых ранах, это было связано с отсроченным заживлением ожоговых ран, при котором процесс пролиферации кожи и отложения коллагена играют основную роль [2]. Некоторые исследования показали, что процесс заживления ран отсрочен, что значимо для ожогов второй и третьей степени вследствие отсроченной и меньшей продукции способствующих росту факторов, подобных рекомбинантному человеческому эпидермальному фактору роста (rh-EGF) или происходящему из тромбоцитов фактору роста (rh-PDGF-BB), использующих их рецепторы.
Рекомбинантный человеческий эпидермальный фактор роста rh-EGF относится к семейству факторов роста, которые регулируют клеточную пролиферацию, миграцию и дифференциацию посредством связывания с рецепторной киназой на клетках-мишенях [3]. Было показано, что rh-EGF действует в качестве мощного митогена, а также в качестве фактора дифференциации для многих типов клеток, включая гладкомышечные клетки [4]. Экспериментальные исследования на животных продемонстрировали, что топическое нанесение rh-EGF повышает скорость эпидермальной регенерации ран частичной толщины и ожогов второй степени [5]. rh-EGF представляет собой состоящий из 53 аминокислот белок с молекулярной массой 6,2 кДа, и его получают технологией создания рекомбинантных генов. Был сконструирован новый вектор, кодирующий полинуклеотидную последовательность синтетического rh-EGF, которая была сверхэкспрессирована у E. coli и очищена для получения белка с чистотой >98% [6].
В процессе заживления ран сигнал для клеточной пролиферации подается rh-EGF через рецепторы EGF. Рецепторы EGF имеют трансмембранные домены тирозинкиназы с цитоплазматическим доменом и внеклеточным доменом, которые участвуют в связывании rh-EGF. Это приводит к димеризации рецептора EGF, аутофосфорилированию рецептора и фосфорилированию тирозина других белков. Это активирует путь активированной митогеном протеинкиназы (MAP киназы), в конечном счете вызывая фосфорилирование транскрипционных факторов, таких как C-Fs, для создания AP-1 и ELK-1, которые способствуют пролиферации. Активация транскрипционных факторов STAT-1 и STAT-3 JAK-киназой в ответ на rh-EGF способствует пролиферативной сигнализации. Кроме того, передача сигналов фосфатидилинозитола и высвобождение кальция, вызванное активной протеинкиназой C rh-EGF, представляет собой другой компонент передачи сигналов EGF. Указанный выше процесс привлекает клетки в раны и стимулирует их пролиферацию, повышает скорость образования грануляционной ткани и увеличение продукции коллагена [7, 8].
Хотя факторы роста, подобные rh-EGF, способствуют заживлению ожоговых ран, важно предотвратить инфекцию, вызванную во время ведения ожоговой раны. Рекомбинантный человеческий эпидермальный фактор роста rh-EGF (REGEN-D, Bharat Biotech International Limited), который был клонирован и сверхэкспрессирован у E. coli, показал усиленное заживление ожоговых ран путем значительного уменьшения длительности заживления. Но риском, связанным с ожоговыми ранами, является внедрение инфекции, вызванной микроорганизмами. Это тот аспект, где противомикробные средства играют существенную роль в ведении ожоговой раны.
В уровне техники доступны различные топические антибактериальные/антимикробные средства для лечения ран, такие как бацитрацин, полимиксин B сульфат, неомицин, повидон-йод, крем мафенида ацетата, нитрофуразон, гентамицин и т.д.
Бацитрацин представляет собой полипептидный антибиотик, который эффективен против грамположительных кокков и бацилл. Бацитрацин может также усилить реэпителизацию раны, хотя он не воздействует на пролиферацию кератиноцитов. Маловероятно, что появление устойчивых штаммов увеличится, потому что бацитрацин действует на свойства бактериальной плазматической мембраны, а не на молекулярный синтез [9].
Полимиксин B сульфат представляет собой основной пептидный антибиотик, который эффективен против грамотрицательных организмов. Полимиксин B сульфат вызывает большее снижение пролиферации кератиноцитов [10].
Неомицин представляет собой антибиотик широкого спектра, и он особенно эффективен против грамотрицательных организмов. Однако побочные эффекты, подобные реакциям гиперчувствительности, в частности кожные сыпи, чаще возникают при применении неомицина [11].
Повидон-йод обладает бактерицидным эффектом против грамположительных и грамотрицательных бактерий. Было показано, что повидон-йод в клинической концентрации является токсичным для человеческих фибробластов и кератиноцитов in vitro. Сообщалось также, что повидон-йод инактивируется раневыми экссудатами. Топическое средство скорее может сделать струп более твердым, чем размягчить его, таким образом, затрудняя и делая более дискомфортным очистку раны [1].
Мафенид ацетат представляет собой метилированное топическое сульфонамидное соединение. Это лекарственное средство обладает широким диапазоном антибактериальной активности против большинства грамотрицательных и грамположительных патогенов. Однако применение мафенида может оказывать ингибирующее действие на реэпителизацию. Мафенид подавляет полиморфоядерные лейкоциты (PMN) и активность лимфоцитов [16].
Соединение нитрофуразона представляет собой антибактериальное средство широкого спектра, эффективное против S. aureus, Enterobactor и E. coli, но он менее эффективен против P. aeruginosa и не обладает значимой фунгицидной активности. Было показано, что нитрофуразон оказывает неблагоприятный эффект на рост и миграцию кератиноцитов в культуре [17]. Нитрофуразон нечасто применяется в ожоговых центрах в США.
Гентамицин очень эффективен против грамотрицательных микроорганизмов. Может развиться устойчивость к гентамицину, и эта устойчивость действительно ограничивает применение этого медикаментозного средства. Было показано, что гентамицин ингибирует активность PMN. Сообщалось о кожной гиперчувствительности при использовании гентамицина [20].
Сульфадиазин серебра (SSD) представляет собой топическое сульфонамидное соединение нитрата серебра и сульфадиазина натрия, полученное в виде 1% смешиваемого с водой крема. Сульфадиазин серебра эффективен против широкого диапазона флоры, в частности грамотрицательных бактерий, подобных E coli, Enterobacter, видов Klebsiella, P. aeruginosa и грамположительных бактерий, подобных S. aureus и Candida albicans.
Среди различных топических антимикробных средств, доступных для лечения ожоговых ран, некоторые из которых указаны выше, производные сульфонамида приобрели заслуженную репутацию в последние годы для лечения различных степеней ожоговых ран, инфицированных грамположительными и грамотрицательными бактериальными инфекциями, а также являются эффективными против дрожжей. Среди сульфонамидов лекарственным средством выбора для профилактики и лечения у большинства пациентов с ожогами был сульфадиазин серебра (SSD). SSD представляет собой эффективное антимикробное средство широкого спектра, включенное в топические кремы, применяемые по поводу ожоговых ран. Действительно, в течение последних пяти десятилетий SSD традиционно применялся для лечения ожоговых ран различных степеней, инфицированных микроорганизмами.
Прошлые исследования показали, что SSD ингибирует бактерии, которые устойчивы к другим антимикробным средствам, и что соединение превосходит многие другие антимикробные средства. Он действует на клеточную мембрану и клеточную стенку микроорганизмов для получения его бактерицидного эффекта. Серебро медленно высвобождается из препарата в концентрациях, которые являются избирательно токсическими для бактерий. Серебро также повреждает ДНК бактериальной клетки. Сульфадиазин, как и другие сульфонамиды, ингибирует бактериальный синтез дигидрофолевой кислоты конкурированием с парааминобензойной кислотой (PABA). Он не действует на человеческие клетки.
Другое антимикробное средство, а именно хлоргексидин глюконат (CHG), представляет собой мощный, относительно нетоксичный антисептик, который нашел широкое одобрение в современной клинической практике [18]. CHG является важным антисептиком, дезинфицирующим средством, антибактериальным стоматологическим споласкивающим средством и консервантом. Он имеет широкий антимикробный спектр и эффективен против грамположительных, грамотрицательных бактерий, вирусов и грибов. CHG связывается со стенкой бактериальной клетки и цитоплазматическими компонентами, приводя к измененному осмотическому равновесию, а также осаждению цитоплазматических компонентов. В низких концентрациях хлоргексидин оказывает бактериостатическое действие; в более высоких концентрациях он оказывает бактерицидный эффект. Хлоргексидин глюконат представляет собой бигуанид, который связывается с ороговевающим слоем, обеспечивая длительную бактерицидную и фунгицидную активность. Он не утрачивает свою эффективность в присутствии органического материала, такого как цельная кровь. CHG адсорбируется на клеточные стенки микроорганизмов, вызывая утечку абсорбирующего материала из широкого разнообразия бактерий, и воздействует на структуру белков, ингибируя, например, связанную с мембраной АТФазу [19], изменяя конфигурацию белков, и содействуя захвату полимиксина клетками.
Хотя SSD представляет собой стандартное средство для лечения ожоговых ран в течение последних 50 лет, некоторые исследования показали, что соединение задерживает процесс заживления ран, что значимо при ожогах второй и третьей степени, вследствие отсроченной или меньшей продукции факторов, способствующих росту, с использованием их рецепторов. Также, абсорбция серебра из ожоговых ран приводила к токсическому воздействию серебра, ведущему к нарушению дермальной регенерации и сниженной механической прочности дермальной ткани. Несколько исследований in vitro с использованием человеческих дермальных фибробластов показали прогрессирующую клеточную цитотоксичность с увеличением концентраций SSD и мафенида ацетата. В тех же исследованиях предварительное воздействие на человеческие дермальные фибробласты EGF, основного фактора роста фибробластов или происходящего из тромбоцитов фактора роста, привело к цитопротекции человеческих дермальных фибробластов против воздействия SSD [29].
Сообщалось о случаях бактериальной устойчивости к серебру. Cason et al. сообщали об этом у грамотрицательных бацилл в ожоговых ранах еще в 1966 г. [21]. В конце 1970-х годов было несколько сообщений о вспышках инфекции или колонизации ожоговых ран грамотрицательных изолятов, устойчивых к SSD (Enterobacter cloacae, Providencia stuartii, и P. aeruginosa). Ясно, что воздействие серебра может выбрать устойчивые микроорганизмы и это может играть важную роль в преобладании эндогенно устойчивых к серебру бактерий, где серебро широко используется.
Li et al. сообщили о развитии бактериальной устойчивости к высокой концентрации серебра (>1024 м.д.) при повторном воздействии увеличивающихся концентраций in vitro [27].
Недостатки, связанные с применением SSD для лечения ожоговых ран, привели к разработке состава компанией Bharat Biotech International Limited (BBIL), содержащей SSD с rh-EGF. Эта комбинация содействует высвобождению rh-EGF в течение продолжительного периода и ограничению доставки серебра, необходимых для оптимального эффекта заживления ран. Самой важной функцией комбинации SSD и rh-EGF является цитопротективный эффект rh-EGF против SSD, а также содействие обратимости нарушенного процесса заживления ран совместным добавлением EGF. Полученные результаты свидетельствовали о том, что эта комбинация содействует устранению цитотоксического эффекта серебра в ней ускорением процесса заживления ран у ожоговых пациентов. Но возникло опасение в отношении возможности развития бактериальной устойчивости к SSD и устойчивых к серебру организмов, отмеченных в клинических образцах, вследствие барьера проницаемости.
Были проведены исследования для выявления проникновения EGF в кровоток с использованием комбинации rh-EGF, выпускаемого компанией BBIL, и SSD, и были обнаружены отрицательные результаты, которые ясно показали, что rh-EGF, получаемый в компании BBIL, не попадает в кровоток. Испытания комбинации SSD с rh-EGF от компании BBIL у ожоговых пациентов показали эффективность применения rh-EGF в отношении ускорения процесса рубцевания дермальных и гиподермальных ожогов, что приводит к образованию кожи, имеющей внешний вид, эластичность и цвет, идентичные нормальной коже, причем основным достижением является отсутствие гипертрофических рубцов. Эти свидетельства показывают воздействие rh-EGF на рубцевание, возможно, благодаря его митогенному эффекту.
Хотя комбинация rh-EGF и SSD решила проблему отсроченного заживления ран путем устранения эффекта SSD, наиболее важным недостатком этого состава является то, что часто отмечается устойчивость к сульфонамидам вследствие неспособности SSD к проникновению. Несмотря на медицинские выгоды применения ионного серебра для борьбы с инфекциями, возникла озабоченность в отношении возможного развития бактериальной устойчивости, и подразумевалась ее связь с перекрестной устойчивостью к антибиотикам. Сообщалось о наличии устойчивых к серебру организмов в клинических и экзогенных образцах. Комбинация SSD с EGF может только предотвратить цитотоксический эффект благодаря серебру и содействует устранению нарушенного процесса заживления ран. Но эта комбинация не может быть эффективной против устойчивости микроорганизмов к SSD вследствие барьера проницаемости. Эта комбинация недостаточна для предотвращения инфекции микроорганизмами, устойчивыми к серебру, и это может привести к развитию вторичной инфекции, которая может удлинить процесс заживления ран, а также серьезно угрожать ожоговым ранам.
В уровне техники тестировалось и применялось большое число антимикробных средств. Одним из наиболее распространенных средств среди них был сульфадиазин серебра (SSD), который применялся отдельно или в комбинации с другими антимикробными средствами, подобными хлоргексидину глюконату (CHG) или комбинации SSD с rh-EGF, используемой компанией Bharat Biotech International Limited.
Однако ни один из составов уровня техники не был способен обеспечить гораздо более широкий спектр охвата микроорганизмов, более быстрое заживление ран без риска развития их устойчивости, токсичности ионов металлов, цитотоксичности и т.д.
ЗАДАЧА ИЗОБРЕТЕНИЯ
Первичной задачей изобретения является разработка фармацевтической композиции широкого спектра для получения топических составов, предназначенных для применения в профилактике и лечении ран, ожоговых ран, кожных трансплантатов, пролежней, диабетических язв стоп и других кожных заболеваний.
Другой задачей изобретения является получение нового топического фармацевтического состава, содержащего антимикробные/антибактериальные средства и митогенные белки с более широким антимикробным/антибактериальным спектром и который эффективен против устойчивых к SSD микроорганизмов при отсутствии или незначительности побочных эффектов.
Другой задачей изобретения является получение нового топического фармацевтического состава со свойствами лучшего и более быстрого заживления ран с любым из факторов роста. Дополнительной задачей изобретения является получение нового топического фармацевтического состава с широким спектром действия в форме крема, геля или жидкости, которая имеет более длительную устойчивость и срок хранения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Описана новая синергическая фармацевтическая композиция широкого спектра для получения топических составов для применения при профилактике и лечении ран, ожоговых ран, кожных трансплантатов, пролежней, диабетических язв стоп и других кожных заболеваний, причем состав может быть представлен в форме крема, геля или жидкости.
Новая синергическая композиция по изобретению содержит по меньшей мере три синергически активных ингредиента и один или более неактивных ингредиентов. Синергически активные ингредиенты включают один или более бактерицидных средств широкого спектра, один или более бактериостатических средств широкого спектра и митогенный фактор роста.
Неактивные ингредиенты используются для обеспечения основы, проницаемости и устойчивости состава и включают носители, консерванты, эмульгаторы, средства для смягчения кожи и средства, облегчающие боль, и один или более других компонентов.
В одном предпочтительном варианте осуществления изобретения митогенный белок представляет собой рекомбинантный человеческий эпидермальный фактор роста (rh-EGF), разработанный компанией Bharat Biotech International Limited (REGEN-D™) или происходящий из тромбоцитов фактор роста (rh-PDGF-BB).
Бактерицидные и бактериостатические средства выбраны из группы, состоящей из бацитрацина, сульфадиазина серебра (SSD), нитрофуразона, хлоргексидина глюконата (CHG), полимиксин B сульфата, неомицина, повидон-йода, мафенида, нитрофуразона и гентамицина.
В предпочтительном варианте осуществления изобретения бактерицидное средство широкого спектра представляет собой сульфадиазин серебра (SSD), бактериостатическое средство широкого спектра представляет собой хлоргексидин глюконат (CHG).
Синергически неактивные ингредиенты состава выбраны из группы, состоящей из PEG-30 диполигидроксистеарата, изогексадекана, C-12-15 алкил бензоата, диоксида титана, полигидроксистеариновой кислоты, стеарата алюминия, глинозема, сульфата магния, стеариновой кислоты, сорбита, метилпарабена натрия, пропилпарабена натрия, гидроксида натрия, динатрий ЭДТА, сополимера аммония акрилоилдиметилтаурата/VP (винилпирролидона), дипальмитоил гидроксипролина, Bois II™, цетилового спирта, C12-15 алкил бензоата, каприлового/капринового триглицерида, токоферила ацетата, полиакриламида, C13-14 изопарафина, этоксидигликоля, феноксиэтанола, метил-, бутил-, этил- и пропилпарабена, триэтаноламина, светлого жидкого парафина, пемулена TR-1, карбопола Ultrez, маннита и очищенной воды.
Новая синергическая композиция по изобретению оказывает синергические эффекты, подобные более широкому антимикробному и/или антибактериальному спектру, эффективности против устойчивых к SSD микроорганизмов, лучшее и более быстрое заживление ран, устранение цитотоксичности SSD, более длительная устойчивость и срок хранения состава с длительной антибактериальной/антимикробной активностью.
Различные испытания и результаты тестов показали, что эта композиция лучше всего подходит для ожоговых ран при ожогах различных степеней и эта новая синергическая композиция может также применяться по другим показаниям, подобным ранам, кожным трансплантатам, пролежням и диабетическим язвам стоп.
Полученные в исследованиях результаты ясно указывают на то, что новый состав был очень эффективен при ожогах различных степеней, а также для быстрого заживления ожогов без какой-либо инфекции. Для этих новых составов были проведены исследования устойчивости и в реальном масштабе времени, и в ускоренных исследованиях устойчивости, и они показали, что комбинация была устойчива и более эффективна при быстром заживлении ожоговых ран без какой-либо инфекции.
Новая синергическая композиция состава, содержащего rh-EGF, сульфадиазин серебра (SSD) и хлоргексидин глюконат (CHG) предотвращает воздействие микроорганизмов, устойчивых к серебру, и содействует проникновению серебра в ожоговые раны. CHG даже в низких концентрациях в составе содействует проникновению серебра в ожоговые раны, посредством этого повышая эффективность серебра против устойчивых микроорганизмов.
Обоснованием выбора этой синергической комбинации rh-EGF BBIL, SSD и CHG являлось то, что устойчивость к сульфонамиду часто вызвана барьером проницаемости, и хорошо известно, что хлоргексидин способен воздействовать на этот барьер, во-вторых, комбинация имеет профилактические свойства при лечении ожогов, сравнимые со свойствами SSD, и не возникает устойчивость ни к одному из указанных выше препаратов, и процесс заживления ран при использовании трех средств состава протекает быстрее, чем при использовании только rh-EGF+SSD.
Эта новая синергическая композиция содействует устранению воздействия rh-EGF на серебро и также эффективна против широкого спектра микроорганизмов, устойчивых к серебру, причем эта устойчивость предотвращается увеличением проницаемости серебра добавлением CHG в низких концентрациях. Синергические результаты действия композиции получаются вследствие синергического взаимодействия между CHG и SSD. CHG состава увеличивает антибактериальную эффективность SSD. Дополнительно, микроорганизмы, устойчивые к крайне высокой концентрации SSD, могут также уничтожаться, когда SSD применяется в комбинации с CHG в составе по настоящему изобретению. Устойчивость некоторых видов штаммов Pseudomonas и Staphylococcus к сульфонамиду вызвана барьерным механизмом, как объясняется выше. Но сделано заключение, что при использовании комбинации CHG и SSD, CHG не изменяет мембрану в степени, достаточной для обеспечения возможности истечения азотистых оснований, нуклеотидов или нуклеозидов, но изменение достаточно для обеспечения возможности входа молекул сульфадиазина, посредством этого обеспечивая возможность полной ликвидации микроорганизмов в ожоговых ранах.
Поэтому синергический эффект CHG и SSD наряду с rh-EGF BBIL в новом составе по настоящему изобретению обеспечивает самый эффективный контроль над инфекцией в ожоговых ранах топическим профилактическим действием, а также для лечения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 является геометрическим представлением, показывающим процентную долю заживления ран относительно числа животных при использовании различных концентраций rh-EGF в составах.
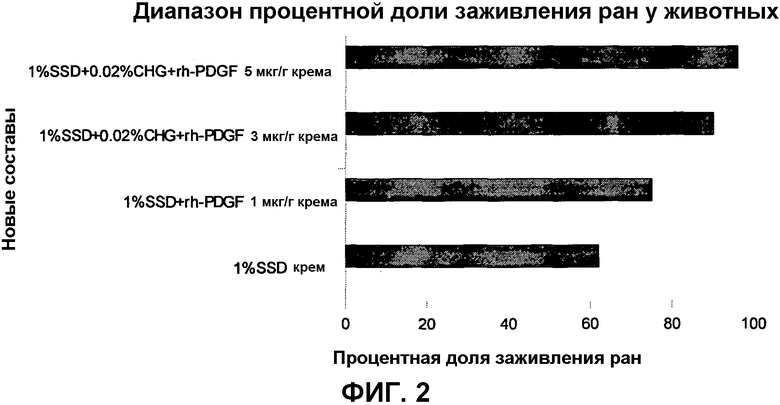
Фиг.2 является геометрическим представлением, показывающим процентную долю заживления ран относительно числа животных при использовании различных концентраций rh-PDGF-BB в составах.
Фиг.3 является геометрическим представлением, показывающим процентную долю заживления ран у ожоговых пациентов при использовании различных композиций состава.
Фиг.4 является геометрическим представлением, показывающим оценку содержания rh-EGF в новых составах способом ELISA (иммуноферментным анализом).
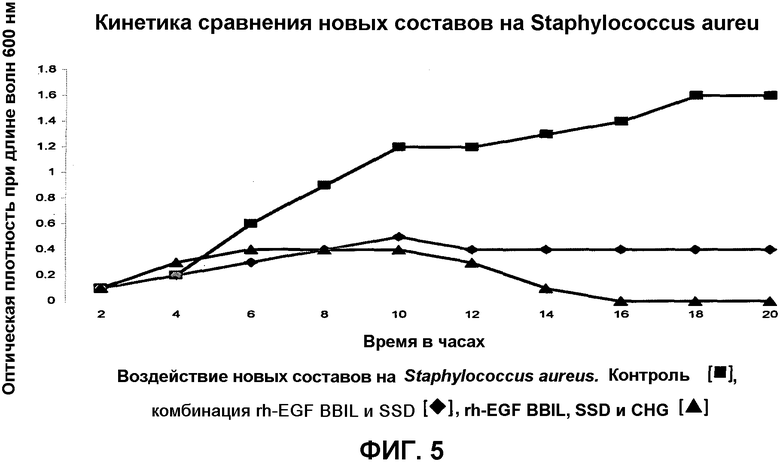
Фиг.5 является геометрическим представлением кинетики сравнения новых составов на Staphylococcus aureus.
Фиг.6 является геометрическим представлением ускоренных исследований устойчивости состава по изобретению.
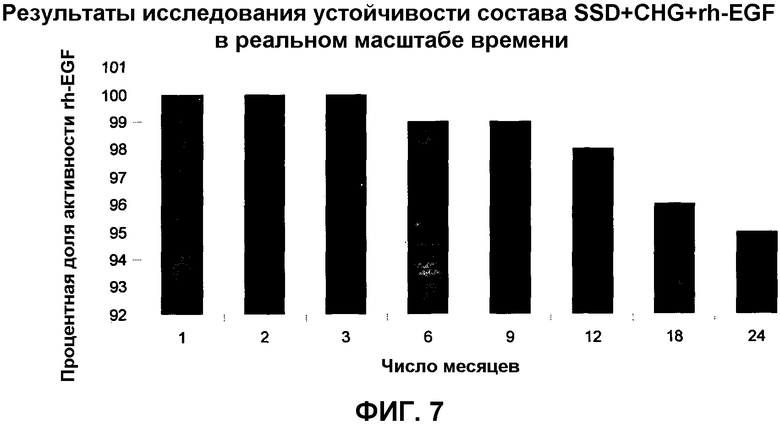
Фиг.7 является геометрическим представлением исследований устойчивости в реальном масштабе времени состава по изобретению.
ПОДРОБНОЕ ОПИСАНИЕ
В настоящей заявке подробно описаны варианты осуществления настоящего изобретения, однако следует понимать, что описанные варианты осуществления являются просто примерами реализации изобретения, которые могут осуществляться в различных формах. Поэтому описанные в настоящей заявке определенные структурные и функциональные детали не должны интерпретироваться как ограничивающие, а просто как основание для формулы изобретения и как репрезентативная основа для обучения специалиста в данной области использования настоящего изобретения по существу в любой соответствующим образом детализованной структуре. Кроме того, термины и фразы, используемые в настоящем описании, не предназначены для ограничения, а скорее для обеспечения понятного описания изобретения.
Изобретение относится к новой синергической фармацевтической композиции широкого спектра для получения топических составов в виде крема или геля или жидкости для профилактики и лечения ран, ожоговых ран, кожных трансплантатов, пролежней, диабетических язв стоп и других заболеваний кожи.
Новая синергическая композиция по изобретению содержит по меньшей мере три синергически активных ингредиента и один или более неактивных ингредиентов. Синергически активные ингредиенты включают один или более бактерицидных агентов широкого спектра, одно или более бактериостатических средств широкого спектра и митогенный фактор роста.
Неактивные ингредиенты используются для обеспечения основы, проницаемости и устойчивости состава и включают носители, консерванты, эмульгаторы, средства для смягчения кожи и средства, облегчающие боль, и один или более других компонентов.
В одном предпочтительном варианте осуществления изобретения митогенный белок представляет собой рекомбинантный человеческий эпидермальный фактор роста (rh-EGF), разработанный компанией Bharat Biotech International Limited (REGEN-D™) или фактор роста, подобный происходящему из тромбоцитов фактору роста (rh-PDGF-BB).
Бактерицидные и бактериостатические средства выбраны из группы, состоящей из бацитрацина, сульфадиазина серебра (SSD), нитрофуразона, хлоргексидина глюконата (CHG), полимиксина B сульфата, неомицина, повидон-йода, мафенида, нитрофуразона и гентамицина.
В предпочтительном варианте осуществления изобретения выбранное бактерицидное средство широкого спектра представляет собой сульфадиазин серебра (SSD). А бактериостатическое средство широкого спектра представляет собой хлоргексидин глюконат (CHG).
Синергически неактивные ингредиенты состава выбраны из группы, состоящей из PEG-30 диполигидроксистеарата, изогексадекана, C-12-15 алкил бензоата, диоксида титана, полигидроксистеариновой кислоты, стеарата алюминия, глинозема, сульфата магния, стеариновой кислоты, сорбита, метилпарабена натрия, пропилпарабена натрия, гидроксида натрия, динатрий ЭДТА, сополимера аммония акрилоилдиметилтаурата/VP, дипальмитоил гидроксипролина, Bois II™, цетилового спирта, C12-15 алкил бензоата, каприлового/капринового триглицерида, токоферила ацетата, полиакриламида, C13-14 изопарафина, этоксидигликоля, феноксиэтанола, метил-, бутил-, этил- и пропилпарабена, триэтаноламина, светлого жидкого парафина, пемулена TR-1, карбопола Ultrez, маннита и очищенной воды.
В одном предпочтительном варианте осуществления новая синергическая композиция содержит митогенный белок (rh-EGF), бактерицидное средство (SSD) и бактериостатическое средство (CHG) в желательном соотношении, дающем синергические эффекты, подобные более широкому микробному и/или бактериальному охвату, эффективности против устойчивых к серебру микроорганизмов, лучшему и более быстрому заживлению ран, устранению цитотоксичности SSD, устранению воздействия SSD на серебро и более длительному сроку хранения состава при длительной антибактериальной/антимикробной активности.
Рекомбинантный человеческий эпидермальный фактор роста (rh-EGF) (REGEN D от компании Bharat Biotech International Limited) представляет собой хорошо известный фактор роста, который использовался для лечения и ведения пациентов по таким показаниям как раны, кожные трансплантаты, ожоговые раны, пролежни и диабетические язвы стоп. rh-EGF относится к семейству факторов роста, который, как известно, регулирует клеточную пролиферацию, миграцию и дифференциацию. Было показано, что rh-EGF действует в качестве митогена, а также в качестве фактора дифференциации для многих типов клеток. Хотя rh-EGF содействует заживлению ран, важно предотвратить инфекцию во время ведения ожоговых ран.
SSD представляет собой стандартное средство для лечения по поводу ожогов. Но некоторые исследования показали, что это соединение задерживает процесс заживления ран, что существенно при ожогах второй и третьей степени вследствие отсроченной или меньшей продукции стимулирующих рост факторов, использующих их рецепторы.
Для предотвращения воздействия устойчивых к серебру микроорганизмов и содействия проникновению серебра против устойчивых микроорганизмов был разработан новый состав по настоящему изобретению, где к комбинации SSD и rh-EGF добавлено дополнительное средство CHG. Обоснованием использования комбинации является то, что CHG даже в низких концентрациях содействует проницаемости серебра в устойчивые микроорганизмы в ожоговых ранах, посредством этого содействуя эффективности серебра против устойчивых микроорганизмов.
Хлоргексидин глюконат представляет собой бисгуанид, который связывается с ороговевающим слоем, обеспечивая длительную бактерицидную и фунгицидную активность в течение более 6 часов, даже при стирании с пораженной области. Он не утрачивает свою эффективность в присутствии органического материала, такого как цельная кровь, он является важным антисептиком, дезинфицирующим средством, антибактериальным стоматологическим ополаскивающим средством и консервантом. Он обладает антимикробным спектром действия против грамположительных, грамотрицательных бактерий, вирусов и грибов. CHG хорошо связывается со стенкой бактериальной клетки и цитоплазматическими компонентами, приводя к измененному осмотическому равновесию, а также осаждению цитоплазматических компонентов.
Полученные результаты с использованием этой новой синергической композиции показали устранение воздействия серебра предотвращением цитотоксичности серебра добавлением rh-EGF. Добавление CHG сделало эту новую комбинацию эффективной против широкого спектра микроорганизмов путем увеличения проницаемости серебра в устойчивые микроорганизмы.
Этот новый синергический состав также проявил воздействие на ликвидацию микроорганизмов в их комбинации в анализе in vitro, где эта синергическая комбинация была эффективна против широкого спектра устойчивых к антибиотикам микроорганизмов. Полученные результаты свидетельствуют о том, что новая синергическая композиция была очень устойчива при хранении более чем два года и может использоваться в качестве топического фармацевтического состава для лечения ран различной степени тяжести, вызванных ожогами, а также по другим показаниям, подобным обычным ранам, кожным трансплантатам, пролежням и диабетическим язвам стоп.
В настоящем изобретении концентрацию каждого компонента в составе измеряли, используя стандартные доступные способы. Об эффективности rh-EGF судили, выполняя испытание на животных с использованием различных концентраций rh-EGF начиная с 5 мкг, 10 мкг и 15 мкг и удерживая оптимальную концентрацию SSD и CHG [пример 1] и в испытаниях у ожоговых пациентов [пример 3].
Об эффективности rh-PDGF-BB судили, выполняя испытание на животных с использованием различных концентраций rh-PDGF-BB начиная с 1 мкг, 3 мкг и 5 мкг и удерживая оптимальную концентрацию SSD и CHG [пример 2].
Концентрацию rh-EGF оценивали обоснованным способом ELISA [пример 4].
Для оценки SSD в новых составах анализ выполняли на основании способа анализа, имеющегося в Фармакопее США. Результат этой оценки показал, что можно было оценить точное количество SSD, добавляемое к крему [пример 5].
Для оценки CHG в новых составах проводили анализ на основании способа анализа, имеющегося в Фармакопее Великобритании [пример 5].
Этот новый синергический состав, содержащий rh-EGF, SSD и CHG, также проявил эффект их комбинации в виде ликвидации микроорганизмов в анализе in vitro, причем кинетические эффекты этой синергической комбинации впервые эффективны против широкого спектра устойчивых к антибиотикам микроорганизмов [пример 6].
В настоящем изобретении проводили исследование устойчивости новых составов, включающих SSD, CHG и rh-EGF, в реальном масштабе времени и в ускоренном режиме, и результаты ясно показали, что эти три ингредиента устойчивы без какого-либо снижения их концентрации или уменьшения содержания в добавленных композициях всех составов и эти новые составы устойчивы в течение более чем двух лет.
ПРИМЕРЫ
Пример 1: Выбор различных концентраций rh-EGF для тестирования эффективности на экспериментальной модели
Для нового синергического состава, включающего комбинацию SSD, CHG, добавляемое количество третьего средства, а именно rh-EGF BBIL, варьировалось, составляя 5 мкг, 10 мкг и 15 мкг, для выбора наилучшей комбинации этих трех средств. Проводили исследования устойчивости этих новых составов. Устойчивые составы применяли на предназначенных экспериментальных моделях для контроля эффективности этих новых составов.
На экспериментальных моделях провели тестирование восьми комбинаций составов для выявления эффективности новых составов:
1. 1% крем сульфадиазина серебра
2. 1% крем сульфадиазина серебра + 10 мкг rh-EGF/г крема
3. 1% крем сульфадиазина серебра + 0,02% хлоргексидин глюконат + 5 мкг rh-EGF/г крема
4. 1% крем сульфадиазина серебра + 0,02% хлоргексидин глюконат + 10 мкг rh-EGF/г крема
5. 1% крем сульфадиазина серебра + 0,02% хлоргексидин глюконат + 15 мкг rh-EGF/г крема
6. 1% гель сульфадиазина серебра + 0,02% хлоргексидин глюконат + rh-EGF 5 мкг/г геля
7. 1% гель сульфадиазина серебра + 0,02% хлоргексидин глюконат + rh-EGF 10 мкг/г геля
8. 1% гель сульфадиазина серебра + 0,02% хлоргексидин глюконат + rh-EGF 15 мкг/г геля
Всего 96 крыс [48 самцов и 48 самок] были выбраны для тестирования эффективности новых составов rh-EGF. Всю популяцию животных разделили на две основные группы, группу I в качестве тестируемой группы и группу II в качестве контрольной группы. Каждая группа была подразделена на 8 подгрупп, причем у восьми групп применяли 8 различных составов указанной выше комбинации с варьирующейся концентрацией rh-EGF начиная с 5 мкг/г, 10 мкг/г и 15 мкг/г крема и геля.
Создание ожоговых ран на экспериментальных моделях
Тестируемую и контрольную группы животных использовали для создания ожоговых ран. Специально изготовленные медные стержни использовали для создания ожоговых ран у крыс. Медные стержни держали в нагревающей водяной бане при 75±2°C в течение 15±1 мин. У животных выбривали площадь размером 2×2×2 см в предыдущий день перед началом эксперимента. Медный стержень извлекали из водяной бани, и прижимали к коже крыс в течение короткого периода времени 15-20 сек, и сразу убирали. Диаметр стержня выбирали таким образом, чтобы при прикосновении стержня к коже животного создавалась рана размером примерно 1 см. Для каждого животного использовали отдельный стерильный стержень для предотвращения у животных любой инфекции в случае ее присутствия или любой передачи инфекций от одного животного другому. Через 30 мин после создания ожоговой раны у крыс на рану наносили указанные выше пять новых составов на кремовой основе. И исследуемый состав, и контрольную группу равномерно распределяли по площади ожога стерильным хлопковым тампоном дважды в день до заживления раны или до истечения 6 недель. Перед нанесением у животных проводили базовую обработку ожоговой раны, если ее применяли.
Первичной целью настоящего исследования была длительность заживления, которая была значительно снижена в случае группы I более чем на 40% по сравнению с группой II. Вторичный исход в виде эпителизации наблюдали в группе нового состава по сравнению с контрольной группой. Имелось гораздо меньшее различие эффективности между кремовыми и гелевыми составами. Составы на основе крема более эффективны по сравнению с составами на основе геля и оба состава на основе и крема, и геля превосходят другие два обычных состава. В подгруппах с третьей по восьмую не наблюдали значительной рубцовой гипертрофии или какие-либо изменения в виде пигментации. Длительность заживления ожоговых ран была неодинаковой у всех животных, получавших лечение новым составом, но время заживления в процентах было более чем на 50% меньше по сравнению с животными контрольной группы.
Из 96 животных, на которых испытывали новые составы, длительность заживления ожоговых ран была неодинаковой у всех животных, получавших лечение новыми составами, но результаты ясно указывают на то, что эти составы стимулируют более быстрое заживление, чем в контрольных группах.
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
[6 крыс]
На основании указанной процентной доли времени заживления был сделан вывод, что топический состав, содержащий композицию 1% крема SSD+0,02%CHG+10 мкг/г rh-EGF, представлял собой наилучший состав для применения у ожоговых пациентов. Состав с указанной композицией был подвергнут исследованиям устойчивости и в ускоренном режиме, и в реальном масштабе времени при температуре +25°C±2°C для ускоренного времени и температуре 5°±3°C для реального масштаба времени соответственно, и результаты показали, что эта комбинация очень устойчива при температуре хранения от +2°C до 8°C в течение более чем двух лет.
На фиг.1 показана процентная доля заживления ран у животных при использовании различных композиций активных ингредиентов, т.е. rh-EGF, SSD и CHG в составах. Результаты применения кремовых составов показало, что процентная доля заживления составила только примерно 60%, когда в составе использовали лишь 1% SSD. Заживление ран улучшилось примерно до 78% при использовании комбинации 1% SSD и 10 мкг/г rh-EGF. Процентная доля заживления ран составила примерно 95% при использовании комбинации 1% SSD, 0,02% CHG и 5 мкг/г rh-EGF. В то же время процентная доля заживления ран составила почти 100% при использовании состава, содержащего 1% SSD, 0,02% CHG и 10 мкг/г rh-EGF. При сравнении составов в виде крема и геля с одинаковой композицией, результаты показали, что кремовые составы обеспечивают несколько более высокую частоту заживления, чем гелевые составы.
Пример 2: Выбор различных концентраций rh-PDGF-BB для тестирования на экспериментальной модели
Для нового синергического состава комбинацию SSD, CHG и и добавление третьего средства, а именно, rh-PDGF-BB, варьировали от 1 мкг/г до 3 мкг/г и 5 мкг/г для выбора наилучшей комбинации этих трех средств. Эти составы применяли в предназначенных моделях на животных для контроля эффективности этих новых составов созданием ожоговых ран, как объяснялось выше.
Тестировали пять комбинаций составов на моделях у животных для определения эффективности новых составов:
1. 1% крем сульфадиазина серебра
2. 1% крем сульфадиазина серебра + rh-PDGF-BB 5 мкг/г
3. 1% крем сульфадиазина серебра + 0,02% хлоргексидин глюконат + rh-DGF-BB 1 мкг/г
4. 1% крем сульфадиазина серебра + 0,02% хлоргексидин глюконат + rh-PDGF-BB 3 мкг/г
5. 1% крем сульфадиазина серебра + 0,02% хлоргексидин глюконат + rh-PDGF-BB 5 мкг/г
Всего 60 крыс [30 самцов и 30 самок] были выбраны для тестирования эффективности новых синергических составов rh-PDGF-BB. Всю популяцию животных делили на две основные группы. Группу I использовали в качестве тестируемой группы и группу II в качестве контрольной группы. Каждую группу подразделяли на 5 подгрупп. Причем пяти группам наносили на участок поражения пять различных составов указанной выше комбинации с варьирующейся концентрацией rh-PDGF-BB начиная с 1 мкг/г до 3 мкг/г и 5 мкг/г крема.
Первичной целью данного исследования является длительность заживления, которая была значительно снижена в случае группы I более чем на 30% по сравнению с группой II. Длительность заживления ожоговых ран не была одинаковой у всех животных, леченных новым составом, но процентная доля времени заживления была более чем на 30% меньше по сравнению с животными контрольной группы.
На фиг.2 показана процентная доля заживления ран у животных при использовании различных композиций активных ингредиентов, т.е. rh-PDGF-BB, SSD и CHG в составах. Результаты применения кремового состава с 5 мкг/г rh-PDGF-BB, SSD и CHG показали процентную долю заживления ран, лучшую по сравнению с другими группами.
Пример 3: Безопасность и эффективность новых составов у ожоговых пациентов
Несколько факторов роста, подобных EGF, FGF и TGF, были идентифицированы в качестве регуляторных белков, которые координируют процесс заживления и участвуют в регуляции клеточной пролиферации, дифференциации и росте органов. Различные исследования у людей были проведены для оценки ускорения заживления ожоговых ран при топическом нанесении мази с rh-EGF. Пять комбинаций составов тестировали у ожоговых пациентов для определения эффективности новых составов:
1. 1% сульфадиазин серебра (контроль)
2. 1% сульфадиазин серебра + rh-EGF 10 мкг/г (группа I)
3. 1% сульфадиазин серебра + 0,02% хлоргексидин глюконат + rh-EGF 5 мкг/г (группа II)
4. 1% сульфадиазин серебра + 0,02% хлоргексидин глюконат + rh-EGF 10 мкг/г (группа III)
5. 1% сульфадиазин серебра + 0,02% хлоргексидин глюконат + rh-EGF 15 мкг/г (группа IV)
В настоящем исследовании сравнительное исследование нового синергического состава проводили для оценки безопасности и эффективности этих составов в сравнении с контрольной группой пациентов с поверхностными ожогами (ожогами первой степени с поражением только наружного слоя кожи) и с ожогами частичной толщины (ожогами второй степени с поражением и наружных, и подлежащих слоев кожи). Всего 50 пациентов, которые включали и женщин, и мужчин, были включены и в группы с I по IV (новые комбинации) из 40 пациентов, и в контрольную группу из 10 пациентов. Для оценки и сравнения доли индивидов с полным закрытием ран в тестируемой группе ожоговых пациентов относительно контрольной группы изучали следующие параметры:
(a) Частота заживления (измерением заживления ран).
(b) Время, требуемое для полного закрытия раны (число дней).
Стерилизованный прозрачный листок помещали на рану и ее периметр отмечали, используя постоянную маркерную ручку. Отметку делали на верхнем листке; нижний листок, который находился в контакте с ранами, удаляли после использования. Прозрачный листок помещали на миллиметровую бумагу, которая позволяет подсчитывать количество квадратов площадью 1 мм2. Исследуемые лекарственные средства, т.е. тестируемые и контрольные, были предоставлены в кремовой основе. И исследуемые, и контрольные лекарственные средства равномерно распределяли по площади ожога стерильным хлопковым тампоном дважды в день до заживления раны или до истечения шести недель. Перед нанесением проводили базовую обработку ожоговых ран, подобную удалению некротических или гнойных масс, если они присутствуют. Количественные переменные величины были представлены в виде средних величин (+SD (стандартное отклонение)), и другие характерные особенности в сравнении контрольной группы и группы лечения анализировали различными путями.
Всего 50 пациентов были включены и в контрольную, и в тестируемую группы. Исследуемая когорта представлена в таблице 6. Первичная цель, т.е. длительность заживления, была значительно снижена в группе III (SSD+CHG+rh-EGF 10 мкг/г) более чем на 50% по сравнению с контрольной группой. Площадь поверхности ожогов у любого из пациентов и в контрольной, и в тестируемой группе (SSD+CHG+rh-EGF 10 мкг/г) составляла не более чем 20% всей площади поверхности тела. Среднее время заживления в тестируемой группе составило 5 дней в сравнении с 12 днями в контрольной группе.
Вторую цель, т.е. качество эпителизации, наблюдали биопсией ран, выполняемой после полного заживления, которая показала лучшую эпителизацию в группе III (группе, получавшей SSD+CHG+rh-EGF 10 мкг/г) по сравнению с контрольной группой. Регенерация придатков кожи и зрелость коллагена были также лучше по сравнению с контрольными областями. Был один случай раздражения раневой поверхности в группе III (SSD+CHG+rh-EGF 10 мкг/г), который разрешился через 24 ч без какого-либо медикаментозного лечения. В этой группе не отмечали значимой рубцовой гипертрофии или пигментных изменений.
Из представленных выше результатов очевидно, что новый синергический состав (SSD+CHG+rh-EGF 10 мкг/г) ускоряет эпителизацию в поверхностных ожогах и ожогах частичной толщины, приводя к более быстрому закрытию ожоговых ран, уменьшенному пребыванию в стационаре и лучшему прогнозу у ожоговых пациентов. Все больше данных свидетельствует о том, что экзогенные факторы роста необходимы для репарации ткани. Они могут действовать в качестве стимулятора для эндогенных факторов роста и экспрессии их генов или действовать в качестве стимулятора для клеток репарации ткани в ускорении заживления ран. Ожидается, что в сценарии почти эпидемического увеличения случаев ожоговых поражений, высокотехнологичные способы лечения, включающие применение факторов роста, таких как rh-EGF, которые усиливают клиническое заживление, будут в будущем играть важную роль.
Фиг.3 представляет собой геометрическое представление результатов, показанных в таблице 8, иллюстрирующих процентную долю заживления ран у ожоговых пациентов (данные, полученные у людей). Геометрическое представление фиг.3 подтверждает, что наилучшие результаты заживления ран были получены при использовании состава, содержащего SSD+CHG+rh-EGF, вследствие синергического взаимодействия ингредиентов, усиливающего антимикробные и заживляющие раны свойства друг друга.
Основное преимущество комбинации этого нового синергического состава заключается в предотвращении инфекций, вызванных вследствие инвазии бактерий в ожоговую рану, и в то же время rh-EGF заживляет ожоги без инвазии бактериальной инфекции, обеспечивая возможность быстрого заживления ожогов. Кроме предотвращения инфекции самым важным преимуществом было устранение нарушенного заживления ран вследствие воздействия SSD путем обеспечения возможности воздействия на клетки регенерации тканей до оптимальных уровней в присутствии фактора роста rh-EGF. Эта новая синергическая композиция состава более значима в снижении инфекции и посредством этого обеспечивает возможность большой скорости заживления ран в целом и заживления ран, вызванных ожогами, в частности. Обоснованием эффективности комбинации является то, что хлоргексидин глюконат даже в низких концентрациях способствует проницаемости серебра в ожоговые раны, посредством этого содействуя эффективности серебра против устойчивых микроорганизмов.
Пример 4: Оценка rh-EGF в новых составах
rh-EGF оценивали, используя «сэндвич»-вариант твердофазного иммуноферментного анализа (ELISA). Лунки микротировочных планшетов покрывали специфическим поликлональным антителом к человеческому rh-EGF. Образцы, включая стандарты rh-EGF (контроль), пипеткой набирали в эти лунки. Основной принцип состоит в том, что во время первой инкубации антиген rh-EGF связывается с иммобилизованным (захваченным) антителом на одном участке. После промывания добавляли биотинилированное специфическое моноклональное антитело к rh-EGF. Во время второй инкубации это антитело связывалось с иммобилизованным rh-EGF, захваченным во время первой инкубации. После удаления избытка второго антитела добавляли стрептавидин-пероксидазу (фермент). Она связывалась с биотинилированным антителом. После третьей инкубации и промывания для удаления всего несвязанного фермента добавляли раствор субстрата, на который воздействовал связанный фермент для получения окрашивания. Интенсивность окрашивания этого продукта прямо пропорциональна концентрации rh-EGF, присутствующего в первоначальном образце. Используя этот способ, оценивали содержание rh-EGF в указанных выше новых составах. Результаты ясно показывают, что добавленное содержание rh-EGF такое же, как по спецификации, и белок активен.
Фиг.4 представляет собой геометрическое представление, показывающее оценку содержания rh-EGF в новых составах методом ELISA, описанным в примере 3 в предыдущих абзацах.
Пример 5: Оценка сульфадиазина серебра в новых составах и оценка хлоргексидина глюконата в новых составах
Анализ SSD выполняли в соответствии со способом, технические условия которого оговорены на стр. 1740-1741 27-ой Фармакопеи США. Результат этой оценки показал, что можно было рассчитать точное количество SSD, добавленного к крему.
Анализ CHG также выполняли в соответствии с процедурой, технические условия которой оговорены в III томе Фармакопеи Великобритании 2005 г., Formulation preparations: Specific Monographs Lidocaine and Chlorhexidine gel (Получение составов: Специальные фармакопейные статьи по получению гелей лидокаина и хлоргексидина). Результаты этой оценки показали, что можно было рассчитать точное количество CHG, добавленного к крему.
Пример 6: Кинетика синергизма с новыми составами
Синергизм rh-EGF от компании BBIL с SSD и CHG исследовали in vitro анализом воздействий этой новой композиции на растущие культуры тестируемых организмов. Использовали выращенную в течение ночи культуру Staphylococcus aureus с величиной OD600 (оптической плотностью при длине волн 600 нм) на уровне от 0,1 до 0,2. Всю экспериментальную процедуру выполняли в условиях поддержания температуры на уровне 37°C. Новую синергическую композицию, имеющую три компонента, а именно rh-EGF BBIL, SSD и CHG, сравнивали с комбинацией rh-EGF BBIL и SSD. Время инокуляции принимали за нулевое время и после добавления комбинации в культуру, показания снимали через равные интервалы времени. Строили график оптической плотности культуры как функцию времени для измерения кинетики нового синергического состава. По результатам сделан вывод, что новая композиция, имеющая три компонента, а именно rh-EGF BBIL, SSD и CHG, была эффективнее при уменьшении микробного числа по сравнению с комбинацией rh-EGF BBIL и SSD. Этот результат ясно указывает на преимущество этой новой синергической комбинации rh-EGF of BBIL, SSD и CHG, которая может применяться по поводу ожоговых ран.
Фиг.5 является графическим представлением сравнительной кинетики новых составов в отношении Staphylococcus aureus, как объясняется в примере 6, при использовании составов контроля (1% SSD), комбинации rh-EGF BBIL+SSD и комбинации rh-EGF BBIL+SSD+CHG.
Пример 7: Исследования устойчивости нового состава с использованием комбинации сульфадиазина серебра, хлоргексидина глюконата и rh-EGF
Устойчивость новых составов, содержащих SSD, хлоргексидин глюконат и rh-EGF в виде крема, оценивали в условиях определения устойчивости в реальном масштабе времени и ускоренного режима. Исследования в реальном масштабе времени проводили при температуре хранения от +2°C до +8°C в течение 24 месяцев, а ускоренные исследования проводили при температуре хранения +25°±2°C и 60% RH (относительной влажности) ±5% в течение 6 месяцев. Рациональным обоснованием этого исследования устойчивости является установление срока хранения новых составов, содержащих SSD, хлоргексидин глюконат и rh-EGF, в виде крема в течение 24 месяцев при температуре хранения 2-8°C.
По полученным результатам сделан вывод о том, что новые составы, полученные в виде фармацевтической композиции для применения при ожоговых ранах, устойчивы в течение более чем двух лет при температуре хранения 2-8°C.
Фиг.6 является геометрическим представлением, показывающим ускоренные исследования устойчивости состава новой композиции по изобретению, содержащей SSD+CHG+rh-EGF. Ускоренные тесты устойчивости показали, что состав с новой композицией по изобретению имел 95% активности rh-EGF даже по истечении шести месяцев. Эти результаты показали, что новый состав был устойчив при активности rh-EGF 95% или более в условиях ускоренного исследования, как объяснено выше в примере 7.
Фиг.7 является геометрическим представлением исследований устойчивости в реальном масштабе времени, проведенных с использованием новой композиции SSD+CHG+rh-EGF в составе. Результаты теста показали, что новый состав имеет активность rh-EGF 95% или более через 24 месяца в условиях хранения, описанных выше в примере 7. Поэтому новый состав более устойчив и имеет более длительный срок хранения.
Пример 8: Получение различных составов для топического нанесения с использованием новых композиций по изобретению
Различные топические составы в виде крема могут быть получены с использованием новой композиции по изобретению, содержащей rh-EGF, SSD и CHG, такой как описанная выше в настоящей заявке в предыдущих параграфах, для нанесения на раны, ожоговые раны, кожные трансплантаты, пролежни, диабетические язвы стоп. Новая композиция может использоваться для получения топических составов, где другие ингредиенты могут добавляться в виде основы, носителя, консерванта, эмульгаторов, средств для смягчения кожи и средств, облегчающих боль, и т.д. в соответствии с потребностями. Ниже приводятся несколько примеров составов в виде крема, которые могут быть получены с варьирующимися градиентами в комбинации с новой композицией по изобретению.
Следует понимать, что составы в виде крема, представленные в следующих таблицах, приведены только для лучшего понимания специалистом в данной области и для целей иллюстрации, показывающие только различные варианты осуществления изобретения. Объем формулы изобретения не должен ограничиваться только этими составами в виде крема, поскольку несколько других кремовых составов могут также быть получены в комбинации с новой композицией по изобретению без отхода от сущности и объема изобретения.
ССЫЛКИ
1. Kucan JO. Robson MC, Heggers JP. et al. Comparison of silver sulfadiazine, povidoneiodine and physiologic saline in the treatment of chronic pressure ulcers. J Am GeriatrSoc. 1981:29:232-235.
2. McCauley RL, Li YY, Chopra V, Herndon DN, Robson MC. Cytoprotection of human dermal fibroblasts against silver sulfadiazine using recombinant growth factors. J Sure Res. 1994 Apr; 56(4):378-84.
3. Vijay Viswanathan, MD, PhD; Sharad Pendsey, MD, MDDG; N. Sekar, MS, MNAMS, MCh, FICS; GS.R. Murthy, PhD. A Phase III Study to Evaluate the Safety and Efficacy of Recombinant Human Epidermal Growth Factor (REGEN-D™ 150) in healing Diabetic Foot ulcers. Wounds 2006; 18(7): 186-196.
4. Lev-Ran A, Hwang DL: Epidermal growth factor and platelet-derived growth factor in blood in diabetes mellitus. Acta Endocrinol (copenh) 1990; 123(3) (September): 326-330.
5. Brown GL, Nannoy LB, Gritten J, Cramer AB, Yancey JM, Curtsinger LJ 3rd et al. Enhancement of wound healing by topical treatment with Epidermal growth factor. N Eng J Med 1989; 321(2) (July (13)): 76-9.
6. K. Sharma, P.V. Cherish Babu, P. Sasidhar, V.K.Srinivas, V. Krishna Mohan, Ella Krishna. Recombinant human epidermal growth factor inclusion body solubilization and refolding at large scale using expanded-bed adsorption chromatography from Escherichia coli, Protein Expression and Purification, 2008, 60, 7-14.
7. Greenhalgh, DG The Role of Growth Factors in Wound Healing. Journal of Trauma-Injury Infection & Critical Care 1996; 41(1): 159-7.
8. Buckley A, Davidson JM, Kamerath CD, Woodward SC. Epidermal growth factor increases granulation tissue formation dose dependency. J. Surg Res. 1987; 43(4) 322-328.
9. Eaglstein WH, Mertz PM, Alvarez OM. Effect of topically applied agents on healing wounds. Clin Dermatol. 1984; 2: 112-115.
10. Brown MRW, Wood SM. Relation between cation and lipid content of cell walls of Pseudomonas aeruginosa, Proteus vulgaris and Klebsiella aerogenes and their sensitivity to polymyxin B and other antibacterial agents. JPharm Pharmacol. 1972; 24:215-228.
11. Cooper ML, Boyce ST, Hansbrough JF, et al. Cytotoxicity to cultured human keratinocytes of topical antimicrobial agents. JSurg Res. 1990; 48:190-195,
12. Monafo WW, West MA. Current treatment recommendations for topical bum therapy. Drugs. 1990; 40:364-373.
13. Lineaweaver W, McMorris S, Soucy D, Howard R. Cellular and bacterial toxicities of topical antimicrobials. Plast Reconstr Sulg. 1985:75:394-396.
14. Cooper ML. Laxer JA, Hansbrough JF. The cytotoxic effects of commonly used topical antimicrobial agents on human fibroblasts and keratinocytes. J Trauma. 1991; 31:775-784.
15. McCauley RL, Linares HA, Pelligrini V, et al. In vitro toxicity of topical antimicrobial agents to human fibroblasts. J SUT Res. 1989; 46:267-274.
16. Lindberg RB, Moncrief JA, Mason AD Jr. Control of experimental and clinical burn wound sepsis by topical application of sulfamylon compounds. Ann NY Acad Sci. 1968; 150:950-960.
17. Taddonio TE, Thomson PD, Smith DJ Jr, Prasad JK. A survey of wound monitoring and topical antimicrobial therapy practices in the treatment of burn injury. J Bum Care Rehabil. 1990; 11:423-427.
18. LOWBURYE, J.L., LILLEYH, A. & BULL, J.P. 1960 Disinfection of the skin of operation sites. British Medical Journal 2, 1039-1044.
19. HAROLD, F.M., BAARDAJ, R., BARON, C. & ABRAMS, A. 1969 Dio 9 and chlorhexidine; Inhibition of membrane-bound ATPase and of cation transport in Streptococcus faecalis. Biochemica et Biophysica Acta 183, 129-136.
20. Hansbrough JF, Zapata-Sirvent RL, Cooper ML. Effects of topical antimicrobial agents on the human neutrophil respiratory burst. Arch Sulg. 1991; 126:603-608.
21. Cason JS, Jackson DM, Lowbury EJ, Ricketts CR. Antiseptic and aseptic prophylaxis for burns: use of silver nitrate and of isolators. Br MedJ 1966; 2(525): 1288-94.
22. Gayle WE, Mayhall CG, Lamb VA, Apollo E, Haynes BW. Resistant Enterobacter cloacae in a burn center: the ineffectiveness of silver sulfadiazine. J Trauma 1978; 18(5): 317-23.
23. Wenzel RR Hunting KJ, Osterman CA, Sande MA. Providencia stuartii, a hospital pathogen: potential factors for its emergence and transmission. Am J Epidemiol 1976; 104(2): 170-80.
24. Klasen HJ. A historical review of the use of silver in the treatment of burns. II. Renewed interest for silver. Burns 2000; 26(2): 131-8.
25. Bridges K, Lowbury EJ. Drug resistance in relation to use of silver sulphadiazine cream in a burns unit. JClin Pathol 1977; 30(2): 160-4.
26. Silver S. Bacterial silver resistance: molecular biology and uses and misuses of silver compounds. FEMS Microbiol Rev 2003; 27(2-3): 341-53.
27. Li XZ, Nikaido H, Williams KE. Silver-resistant mutants of Escherichia coli display active efflux of Ag+ and are deficient in porins. JBacteriol 1997; 179(19): 6127-32.
28. Fuller FW, Parrish M, Nance FC. A review of the dosimetry of 1% silver sulfadiazine cream in burn wound treatment. J Burn Care Rehabil 1994; 15(3):213-23
29. Ae-Ri Cho Lee, Hyunju Leem, Jaegwan Lee, Kyung Chan Park. Reversal of silver sulfadiazine-impaired wound healing by epidermal growth factor. Biomaterials 2005; 26:4670-4676
30. HUGO, W.B. & LONGWORTHA, R. 1964 Some aspects of the mode of action of chlorhexidine. Journal of Pharmacy and Pharmacology 16,655-662.
31. Annear DI, Mee BJ, Bailey M. Instability and linkage of silver resistance, lactose fermentation, and colony structure in Enterobacter cloacae from burn wounds. J Clin Pathol. 1976; 29(5):441-443.
32. Carr HS, Rosenkranz HS. R factor in Enterobacter cloacae resistant to silver sulfadiazine. Chemotherapy. 1975; 21(1):41-44.
33. Belly RT, Kydd GC. Silver resistance in microorganisms. Develop Industrial Microbiol. 1982; 23:567-577.
34. Choudhury P, Kumar R. Multidrug- and metal-resistant strains of Klebsiella pneumoniae isolated from Penaeus monodon of the coastal waters of deltaic Sundarban. Can J Microbiol. 1998; 44(2): 186-189.
35. Robb EC, Fitz DG, Nathan P. Delivery of topical antimicrobial agents silver sulfadiazine, gentamicin and nystain to infected burn wounds in rats from preloaded synthetic dressings. Trans Am SocArtif Inter Organs 1980; 26:533-6.
36. Robb EC, Nathan P. Control of experimental burn wound infection: comparative delivery of antimicrobial agent (silver sulfadiazine) either from a cream base or from a solid synthetic dressing. J Trauma 1981; 21:889-93.
Предыдущее подробное описание вариантов осуществления относится к сопровождающим чертежам, примерам и таблицам, которые иллюстрируют определенные варианты осуществления изобретения. Другие варианты осуществления, имеющие различные составы и композиции, не отклоняются от объема настоящего изобретения. Термин «изобретение» или тому подобные используется со ссылкой на определенные конкретные примеры многих альтернативных аспектов или вариантов осуществления изобретения заявителя, изложенных в настоящем описании, и ни его использование, ни его отсутствие не предназначено для ограничения объема изобретения заявителя или объема формулы изобретения. Настоящее описание разделено на два раздела только для удобства читателя. Заголовки не следует рассматривать как ограничивающие объем изобретения. Определения предназначены быть частью описания изобретения. Следует понимать, что различные детали настоящего изобретения могут изменяться без отклонения от объема настоящего изобретения. Кроме того, приведенные выше «ссылки» и описание предназначены только для цели иллюстрации, а не для цели ограничения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ ТОПИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ И/ИЛИ В ПРЕДОТВРАЩЕНИИ ИНФЕКЦИЙ ПОВРЕЖДЕНИЙ КОЖИ | 2012 |
|
RU2591832C2 |
| ГЕЛЬ-ОСНОВА ДЛЯ РАНОЗАЖИВЛЯЮЩИХ И КОСМЕТИЧЕСКИХ СРЕДСТВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2485938C1 |
| Способ первичной обработки комбинированных ран с использованием фармацевтической композиции на основе биополимера хитозана | 2024 |
|
RU2830804C1 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОТИВОМИКРОБНЫЕ ИОНЫ МЕТАЛЛА И ЧЕТВЕРТИЧНОЕ КАТИОННОЕ ПОВЕРХНОСТНО-АКТИВНОЕ ВЕЩЕСТВО | 2012 |
|
RU2672107C2 |
| БИС(5-АМИНО-1,4-ДИОКСО-1,2,3,4-ТЕТРАГИДРОФТАЛАЗИН-2-ИЛ)ЦИНК, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, ЛЕЧЕБНЫЕ СРЕДСТВА НА ЕГО ОСНОВЕ, СПОСОБ ЛЕЧЕНИЯ КОЖНЫХ ЗАБОЛЕВАНИЙ И СПОСОБ ЛЕЧЕНИЯ ГАСТРИТА | 2013 |
|
RU2577849C2 |
| ПРОТИВОМИКРОБНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ФОТОХИМИЧЕСКИ СТАБИЛЬНЫЕ КОМПЛЕКСЫ СЕРЕБРА | 2012 |
|
RU2577338C1 |
| Антисептическое средство | 2018 |
|
RU2682711C1 |
| Способ лечения ожоговых ран с использованием раневого покрытия с цитопротективной активностью | 2024 |
|
RU2828521C1 |
| КОМПОЗИЦИИ ДЛЯ СОДЕЙСТВИЯ ЗАЖИВЛЕНИЮ КОЖНЫХ ЯЗВ И РАН | 2015 |
|
RU2712635C1 |
| Фармацевтическая композиция для лечения ран и ожогов | 2016 |
|
RU2636530C2 |




Группа изобретений относится к медицине и касается фармацевтической композиции для профилактики и лечения ран или ожоговых ран, содержащей митогенный белок, бактерицидное средство сульфадиазин серебра и бактериостатическое средство хлоргексидина глюконат. Группа изобретений также касается фармацевтической композиции для профилактики и лечения ран или ожоговых ран, содержащей rh-EGF, серебра сульфадиазин, хлоргексидина глюконат, светлый жидкий парафин, пемулен TR-1, карбопол Ultrez, метилпарабен натрия, пропилпарабен натрия, маннит, триэтаноламин и воду. Группа изобретений обеспечивает синергический эффект заживления ран. 2 н. и 3 з.п. ф-лы, 7 ил., 8 табл., 8 пр.
1. Фармацевтическая композиция для профилактики и лечения ран или ожоговых ран, содержащая митогенный белок в концентрации от 1 мкг/г до 15 мкг/г, где указанный митогенный белок выбран из рекомбинантного человеческого эпидермального фактора роста (rh-EGF), рекомбинантного человеческого происходящего из тромбоцитов фактора роста АА или рекомбинантного человеческого происходящего из тромбоцитов фактора роста ВВ (rh-PDGF-AA или BB), бактерицидное средство сульфадиазин серебра в количестве 1% масс./масс. и бактериостатическое средство хлоргексидина глюконат в количестве 0,02% масс./масс., причем указанная композиция также содержит один или более других ингредиентов.
2. Фармацевтическая композиция по п. 1, где указанный митогенный белок представляет собой рекомбинантный человеческий эпидермальный фактор роста (rh-EGF).
3. Фармацевтическая композиция по п. 1, где указанные один или более другие ингредиенты выбраны из PEG-30 диполигидроксистеарата, изогексадекана, C-12-15 алкил бензоата, диоксида титана, полигидроксистеариновой кислоты, стеарата алюминия, глинозема, сульфата магния, стеариновой кислоты, сорбита, метилпарабена натрия, пропилпарабена натрия, гидроксида натрия, динатрий ЭДТА, сополимера аммония акрилоилдиметилтаурата/VP (винилпирролидона), дипальмитоил гидроксипролина, Bois II™, цетилового спирта, C12-15 алкил бензоата, каприлового/капринового триглицерида, токоферила ацетата, полиакриламида, С13-14 изопарафина, этоксидигликоля, феноксиэтанола, метил-, бутил-, этил- и пропилпарабена, триэтаноламина, светлого жидкого парафина, пемулена TR-1, карбопола Ultrez, маннита и очищенной воды.
4. Фармацевтическая композиция по п. 1, где композиция представляет собой топический состав, представленный в виде крема, или геля, или жидкости.
5. Фармацевтическая композиция для профилактики и лечения ран или ожоговых ран, содержащая рекомбинантного эпидермального фактора роста (rh-EGF) 10 мкг, серебра сульфадиазина 1% масс./масс., хлоргексидина глюконата 0,2% масс./масс., светлого жидкого парафина 10% масс./масс, пемулена TR-1 0,5% масс./масс., карбопола Ultrez 1,3% масс./масс., метилпарабена натрия 0,18% масс./масс., пропилпарабена натрия 0,02% масс./масс., маннита 5% масс./масс., триэтаноламин (достаточное количество) и воду (достаточное количество).
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| INMAN R.J., et al., Prospective comparison of silver sulfadiazine 1 per cent plus chlorhexidine digluconate 0.2 per cent (Silvazine) and silver sulfadiazine 1 per cent (Flamazine) as prophylaxis against burn wound infection | |||
| Burns Incl Therm Inj | |||
| Колосниковая решетка с чередующимися неподвижными и движущимися возвратно-поступательно колосниками | 1917 |
|
SU1984A1 |
| HONG JP., et al., The effect of continuous release | |||
Авторы
Даты
2015-12-20—Публикация
2010-07-14—Подача