ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в общем относится к области стабилизации FSH композиций, в частности жидких FSH-композиций. Стабилизация достигается путем добавления соли, в предпочтительных воплощениях путем добавления солей с катионами щелочного металла фармацевтически приемлемых солей, а то есть солей Na или K или их комбинаций.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Гонадотропины представляют собой семейство гормонов, которые по существу вовлечены главным образом в период плодовитости женщин и мужчин. Гонадотропины можно получать из мочи, как для исследовательских, так и для лечебных целей, однако некоторые гонадотропины могут быть получены рекомбинантно.
В частности, гонадотропины можно применять в лечении бесплодия.
Четыре основных гонадотропина, которые рассматриваются здесь и все из которых принадлежат одному и тому же семейству гликопротеинов, представляют собой фолликулостимулирующий гормон (FSH), тиреостимулирующий гормон (TSH), лютеинизирующий гормон (LH) и хорионический гонадотропин (hCG). Все эти гонадотропины состоят из альфа- и бета-субъединицы; альфа-субъединица является общей для всех, то есть одинаковой для всех вышеуказанных четырех гонадотропинов, в то время как бета-субъединицы, соответственно, различаются.
Как указано выше, гонадотропины представляют собой группу гетеродимерных гликопротеиновых гормонов, которые регулируют гонадную функцию у мужчин и женщин. Они включают фолликулостимулирующий гормон (FSH), лютеинизирующий гормон (LH), тиреостимулирующий гормон (TSH) и (человеческий) хорионический гонадотропин (hCG).
FSH естественным образом выделяется передней долей гипофиза и выполняет функцию обеспечения развития фолликула и овуляции. FSH содержит альфа-субъединицу из 92 аминокислот, также общую для других гликопротеиновых гормонов, например LH и hCG, и бета-субъединицу из 111 аминокислот, присущую только FSH, которая обеспечивает биологическую специфичность гормона (Pierce and Parsons, 1981, Glycoprotein hormones: structure and function, Ann Rev Biochem., 50: 465-495). Каждую субъединицу посттрансляционно модифицируют путем добавления остатков сложных углеводов. Обе субъединицы имеют две участка для присоединения N-связанных гликанов, альфа-субъединица на аминокислотах 52 и 78, а бета-субъединица на аминокислотных остатках 7 и 24 (Rathnam и Saxena, (1975) Primary amino acid sequence of follicle stimulating hormone from human pituitary glands. I. alpha subunit, J Biol Chem. 250 (17): 6735-6746; Saxena and Rathnam, (1976) Amino acid sequence of the beta subunit of follicle-stimulating hormone from human pituitary glands, J Biol Chem. 251(4); 993-1005)). FSH гликолизируют таким образом примерно на 30% по массе (Dias and Van Roey, (2001) Structural biology of human follitropin and its receptor. Arch Med Res. 32(6): 510-519; Fox et al. (2001) Three-dimensional structure of human follicle-stimulating hormone. Mol Endocrinol. 15(3), 379-89).
Очищенный FSH из мочи человека после наступления менопаузы применяли в течение многих лет в лечении бесплодия; как для стимулирования овуляции при естественном воспроизводстве, так и для получения ооцитов для вспомогательных репродуктивных технологий. Два рекомбинантных варианта FSH, Gonal-f (Merck Serono) и Puregon (Schering-Plough) появились в продаже в середине 1990-х годов. Оба варианта экспрессировались в клетках яичника китайского хомячка (СНО) cells (Howies, СМ. (1996), Genetic engineering of human FSH (Gonal-f), Hum Reprod. Update, 2: 172-191). CG часто применяют в лечении бесплодия, так как это соединение обладает активностью LH.
Оба человеческих FSH и hCG представляют собой гетеродимеры, состоящие из альфа- и бета-субъединицы. Альфа-субъединица в том и другом гормоне является идентичной. Различия между двумя гормонами обеспечивает бета-субъединица. Зрелая бета-субъединица FSH состоит из 111 аминокислот, в то время как в hCG она состоит из 145 аминокислот, кроме того первичная аминокислотная последовательность бета-субъединицы FSH и hCG отличается на протяжении всей бета-цепи. Бета-цепь как FSH, так и hCG содержит шесть дисульфидных мостиков, однако вследствие их различающейся аминокислотной последовательности они отличаются своей структурой более высокого порядка, что приводит к разному свертыванию и распределению заряженных, полярных и гидрофобных областей (Fox et al. (2001) Three-dimensional structure of human follicle-stimulating hormone. Mol Endocrinol. 15(3), 379-89).
Хотя обе бета-субъединицы FSH и hCG гликолизированы, бета-субъединица FSH содержит только N-гликолизирование (N-7 и N-24), в то время как бета-субъединица hCG содержит как N- так и О-гликолизирование (N-13, N-30, O-121, O-127, O-132 и O-138). Дополнительное гликолизирование в бета-субъединице hCG делает его более гидрофильным, чем FSH. β-субъединицы обеспечивают специфичность взаимодействия с рецептором.
Клетки СНО обычно используют для продуцирования фармацевтических рекомбинантных белков. Структурный анализ показал, что сиаловая кислота присоединяется исключительно посредством α2,3-связи. Многие гликопротеины человека содержат смесь как α2,3-, так и α2,6-связей для остатков сиаловой кислоты. Следовательно, рекомбинантные белки, экспрессированные с применением системы CHO, будут отличаться от своих природных аналогов типом связей концевой сиаловой кислоты.
БЕСПЛОДИЕ
В данном контексте «бесплодие» должно быть определено как пониженная способность или неспособность забеременеть и иметь потомство. Женщин, которые способны забеременеть, но потом имеют неоднократные выкидыши, также называют бесплодными. Бесплодие также определено специальными терминами как неспособность забеременеть после года регулярных половых актов без контрацепции. Бесплодие может быть обусловлено многими причинами. Исследования показали, что чуть более половины случаев бесплодия являются результатом состояния здоровья женщины. Оставшаяся часть вызвана нарушениями сперматозоидов и невыясненными факторами. В настоящее время существует несколько возможностей для лечения бесплодия. Это рассчитанный по времени половой акт, применение вспомогательных репродуктивных технологий (ART), медицинское лечение эндометриоза, фибром и женской половой дисфункции (FSD) и хирургическое вмешательство для коррекции аномалий. Во вспомогательной репродуктивной технологии применяют лекарственные средства для стимулирования овуляции. Наряду с LH и hCG, FSH является одним из соединений, которые применяют в этом случае.
Жидкие композиции этих соединений являются подходящими для введения. К сожалению, ранее было доказано, что консерванты, добавленные к жидким композициям, в частности бензиловый спирт (ВА), фенол и м-крезол, оказывают дестабилизирующее действие на белок (Маа, Y.F. и Chung, С.Н. 1996, Aggregation of recombinant human growth hormone induced by phenolic compounds. Int. J. Pharm. 140:155-168; Lam, X.M., Patapoff, T.W., and Nguyen, Т.Н. 1997, The effect of benzyl alcohol on recombinant human interferon-gamma. Pharm. Res. 14:725-729; Hoffmann, J.A. and Lu, J. 2002, FSH and FSH variant formulations comprising benzyl alcohol as preservative. EP 0974359B1, 1-50).
Следовательно, важно предложить стабилизированную композицию, в частности ввиду того, что дозировка FSH, подлежащая введению, должна снижать риск побочных эффектов диссоциированных или агрегированных форм, подобных иммуногенным реакциям, если присутствует ненативный FSH. Однако дестабилизирующие явления, обусловленные консервантами, снижают фактический уровень активного гонадотропина, то есть FSH, в жидкой композиции. Таким образом, целью настоящего изобретения является предложение композиций, в частности жидких композиций FSH, которые являются стабильными, а также способа их стабилизации.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению солей, содержащих фармацевтически приемлемые катионы щелочных металлов, для стабилизации жидкой композиции FSH так, чтобы стабилизировать жидкую композицию FSH. Жидкая композиция, которую нужно стабилизировать, может представлять собой композицию с консервантом или без него.
Следующие воплощения являются предпочтительными:
1. Применение солей, содержащих фармацевтически приемлемые катионы щелочных металлов для стабилизации жидкой композиции FSH, где соль выбрана из группы, состоящей из фармацевтически приемлемых солей Na+ и солей K+ или их комбинации.
2. Применение согласно аспекту 1, где соли представляют собой соли Na+.
3. Применение согласно любому из аспектов 1 или 2, где соль представляет собой NaCl или Na2SO4.
4. Применение согласно любому из аспектов 1 или 2, где соль представляет собой Na2SO4.
5. Применение согласно любому из аспектов 1 или 2, где соль представляет собой комбинацию NaCl и Na2SO4.
6. Применение согласно любому из аспектов 1-5, где соль содержится в количестве от 20 до 500 мм, или в количестве 30-300 мм, или в количестве 50-200 мм.
7. Применение согласно любому из аспектов 1-6, где композиция FSH представляет собой композицию rFSH.
8. Применение согласно любому из аспектов 1-7, где композиция дополнительно содержит консервант.
9. Применение согласно аспекту 8, где композиция содержит бензиловый спирт, фенол и/или м-крезол.
10. Применение согласно любому из аспектов 1-9, где композиция представляет собой инъекционную композицию.
11. Способ стабилизации жидкой композиции FSH, включающий стадию добавления солей, содержащих фармацевтически приемлемые катионы щелочного металла, в указанную композицию, где указанные соли выбраны из группы, состоящей из солей Na+- и солей K+ или их комбинации.
12. Способ согласно аспекту 11, где соли определены как в аспектах 2-6 выше.
13. Способ согласно аспектам 11 и/или 12, где FSH, который нужно стабилизировать, представляет собой rFSH.
14. Способ согласно любому из аспектов 11-13, где композиция дополнительно содержит консервант.
15. Способ согласно аспекту 14, где консервант выбран из группы, состоящей из бензилового спирта, фенола и м-крезола.
16. Применение согласно любому из аспектов 1-10, где жидкая композиция представляет собой восстановленную жидкую композицию, которая была получена из лиофилизированной композиции.
17. Способ согласно любому из аспектов 11-15, где стадию добавления соли осуществляют до стадии лиофилизации.
18. Способ согласно аспекту 17, где стадию восстановления осуществляют после стадии лиофилизации.
19. Способ согласно аспекту 17 и/или 18, где соль содержится в лиофилизированной композиции, или где соль содержится в жидкости для восстановления.
Композиция, которая снабжена стабилизирующей солью, входит, таким образом, в альтернативное воплощение, хранящееся в лиофилизированном состоянии. Лиофилизацию осуществляют как общеизвестно специалисту в данной области техники. Затем лиофилизированную композицию можно хранить до окончательного применения пациентом. Затем перед введением лиофилизированную композицию восстанавливают любой из известных сред для восстановления, например стерилизованной водой. Соль содержится или в лиофилизированной композиции или в жидкости для восстановления.
20. Применение или способ согласно любому из аспектов 1-19, где жидкая композиция представляет собой композицию для однократного применения или многодозовую композицию, предпочтительно для инъекции.
В предпочтительном воплощении соль содержится непосредственно в жидкой композиции самой по себе, которая не лиофилизирована, а хранится в виде жидкости на складе.
В частности, в предпочтительном воплощении настоящее изобретение относится к стабилизации жидкой композиции FSH, где катион щелочного металла выбран из группы, состоящей из Na+ и K+. Особенно предпочтительно соль представляет собой NaCl или Na2SO4.
Как описано выше, жидкие композиции FSH пригодны для лечения бесплодия. В связи с этим становится ясно, что жидкие композиции FSH могут быть нестабильными; это верно для всех жидких композиций FSH, включая композиции, предназначенные для однократного применения. Нестабильность может быть еще более выраженной, если жидкие композиции FSH содержат консервант, который является необходимым, например, для всех многодозовых композиций. Данный консервант может представлять собой любой консервант, полезный для консервирования композиции FSH; таким образом, консервантом может являться консервант, который одобрен FDA (Управление по контролю за продуктами и лекарствами (США)) для композиций FSH, в частности, например, одобренный FDA консервант, одобренный для парентеральных композиций FSH, такой как, например, бензиловый спирт, фенол и/или м-крезол; консервант, однако, не ограничен данными примерами. Стабильность FSH снижается, например, бензиловым спиртом, фенолом и/или м-крезолом.
Таким образом, заявленные и описанные сейчас соли, содержащие фармацевтически приемлемые катионы, применяют для стабилизации композиций FSH однократного применения.
Кроме того, заявленные и описанные сейчас соли, содержащие фармацевтически приемлемые катионы, применяют для стабилизации многодозовых композиций FSH; такие композиции не нуждаются во включении консерванта, но могут также содержать консервант.
Добавление заявленных и описанных в данном описании изобретения солей, содержащих фармацевтически приемлемые катионы, то есть солей Na+- и K+-, стабилизирует жидкую композицию FSH. В особенно предпочтительном воплощении соли представляют собой фармацевтически приемлемые соли. Стабилизация достигается в композициях для однократного применения или многодозовых композициях, в частности в течение более продолжительного периода хранения, и может в еще одном возможном воплощении быть полезной в качестве меры противодействия дестабилизирующему эффекту консервантов, таких как бензиловый спирт, фенол и/или м-крезол.
Соли, которые можно применять согласно настоящему изобретению, включают в предпочтительном воплощении NaCl или Na2SO4.
Соль предпочтительно содержится в количестве от 20 до 500 мм, еще более предпочтительно она содержится в количестве 30-300 мм; в конкретном предпочтительном воплощении она содержится в количестве 50-200 мм.
Максимальное количество добавленной соли ограничено осмоляльностью раствора. Для минимизации боли при инъекции раствор предпочтительно должен быть изотоническим или по меньшей мере не гипертоническим. Так как все эксципиенты в растворе вносят вклад в осмоляльность, максимальное количество соли, которое может быть добавлено в раствор, зависит от количества других присутствующих компонентов.
Соль предпочтительно содержится в количестве, приводящем к максимальной осмоляльности 350 миллиосмоль/кг, еще более предпочтительно в количестве, приводящем к максимальной осмоляльности 320 миллиосмоль/кг; в конкретном предпочтительном воплощении она содержится в количестве, приводящем к максимальной осмоляльности 300 миллиосмоль/кг.
Теория осмоляльности
Осмоляльность представляет собой практическое средство для общей оценки вклада различных растворенных веществ, присутствующих в растворе, в осмотическое давление раствора. Осмоляльность может быть измерена в соответствии с Ph. Eur. (Европейская фармакопея) 2.2.35, 7-е издание, Приложение 2011 (7.2), раздел "Osmolality", 01/2008: 20235.
«Соль» в контексте настоящего изобретения представляет собой химической соединение, полученное из кислоты путем замены водорода, полностью или частично, металлом или электроположительным радикалом.
Определение «солей с (или содержащих) катионами(ы) фармацевтически приемлемых солей» относится ко всем солям, которые образованы с катионами, одобренными для в/м (внутримышечной) или п/к (подкожной) доставки, согласно перечню инертных ингредиентов FDA; катионами щелочных металлов в данной группе являются натрий (Na+) и калий (K+).
Авторы изобретения неожиданно обнаружили, что два очень конкретных катиона являются особенно подходящими для стабилизации композиции FSH. Таким образом, соли могут быть образованы следующими фармацевтически приемлемыми катионами: калия (моно-, двух- или трехосновные) или натрия (моно- или двух- или трехосновные). Предпочтительно соли представляют собой соли натрия. Особенно предпочтительными являются NaCl и Na2SO4.
Гонадотропин, который можно стабилизировать согласно настоящему изобретению, представляет собой FSH, то есть фолликулостимулирующий гормон, возможно в комбинации с дополнительными активными ингредиентами.
FSH представляет собой полученный из мочи или плазмы или рекомбинантный FSH (rFSH). В предпочтительном воплощении FSH представляет собой FSH из мочи или rFSH; особенно предпочтительно он представляет собой rFSH.
Как указано выше, сейчас является возможно получать FSH рекомбинантно. Таким образом, ссылка здесь на FSH в общем всегда включает как полученный из мочи, так и рекомбинантный (r) гонадотропин. Таким образом, ссылка на FSH также включает rFSH.
В предпочтительном воплощении изобретения композиция представляет собой жидкую композицию rFSH, наиболее предпочтительно инъекционную, которая стабилизирована Na2SO4 или NaCl.
В предпочтительном воплощении изобретения композиция представляет собой жидкую композицию rFSH, наиболее предпочтительно инъекционную, которая стабилизирована Na2SO4 или NaCl.
В альтернативном воплощении rFSH во всех воплощениях представляет собой FSH длительного действия. Композиции FSH длительного действия могут быть получены, как общеизвестно специалисту в данной области техники, например путем модифицирования молекулы FSH или путем модифицирования композиции.
Таким образом, в данном изобретении FSH охватывает все возможные полученные из мочи или рекомбинантные формы вышеуказанного FSH, а также все возможные комбинации форм FSH. Также охвачена композиция для однократного применения и одна или более других композиций (одного и того же или другого гонадотропина) для многодозового применения.
Одним возможным продуктом может быть композиция, включающая FSH (возможно с CG, LH, LH-активностью и так далее), все в разных флаконах. LH-Активность, если присутствует, может возникать от LH или CG. LH можно замещать эквивалентной дозой CG и наоборот; «эквивалентную дозу» в данном контексте можно вычислить на основании того, что 1 ME (международная единица) CG эквивалентна 5-7 ME LH в Pharmacopeia Van Hell Bioassay (Van Hell, H et al, Acta Endocrin. 47, 409-418, 1964).
Предпочтительная комбинация представляет собой комбинацию (r)FSH, (r)LH и (r)hCG, все в разных флаконах.
Возможные комбинации в разных флаконах также включают: мочевой (и) FSH и uhCG или uFSH и uLH; кроме того (rhCG или rLH или rFSH) и (uhCG или uLH или rhCG или rLH) и все возможные их перестановки.
Другая предпочтительная комбинация представляет собой комбинацию (r)FSH и (r)hCG в разных флаконах соответственно.
Другая предпочтительная комбинация представляет собой комбинацию (r)FSH и (r)LH в разных флаконах соответственно.
Препарат FSH по настоящему изобретению представляет собой жидкий препарат. Предпочтительно препарат является инъекционным. Препараты могут поставляться в виде продукта, содержащего одну, две или более фармацевтическую(их) композицию(й), включающую(их) FSH или FSH/hCG, для введения раздельно или вместе. При раздельном введении, введение может быть последовательным. Продукт может поставляться в любой подходящей упаковке. Например, продукт может содержать несколько предварительно заполненных шприцев, каждый из которых включает FSH (композицию FSH), или дополнительно hCG (композицию hCG), например, где шприцы могут быть упакованы в блистерную упаковку или другие средства для сохранения стерильности. Продукт, возможно, может содержать инструкции для применения композиций FSH. Согласно еще одному аспекту препарат FSH по изобретению предлагается в виде многодозового препарата. Настоящее изобретение, однако, также прямо направлено на препараты, предназначенные для однократного применения. Настоящее изобретение также относится к стабилизации композиций как части набора. Такой набор будет включать по меньшей мере один контейнер, содержащий одну или более суточных доз FSH, или например два контейнера (например флакон), каждый из которых содержит другой гонадотропин и, например, дополнительные инструкции (например по введению) и, например, дополнительные устройства для инъекции. В предпочтительном воплощении применяют шприц-ручку для многократных инъекций, при помощи которого раствор FSH заполняют в соответствующие картриджи.
В предпочтительном воплощении FSH содержится в количестве 35-850 МЕ/мл, предпочтительно 50-800 МЕ/мл, еще более предпочтительных 100-600 МЕ/мл.
Особенно предпочтительный препарат, например, 600 МЕ/мл rFSH, имеет следующую композицию: 600 МЕ/мл rFSH.
От 0,001-0,05, предпочтительно 0,005 мг/мл Полисорбата 20 От 0,1 до 10, предпочтительно 1,0 мг/мл L-метионина От 0,5 до 50, предпочтительно 5,0 мг/мл фенола.
От 1 до 100, предпочтительно 14 мг/мл двухосновного сульфата натрия (то есть 0,1 М).
От 0,1 до 10, предпочтительно 1 мМ натрий-фосфатного буфера (pH от 6 до 8, предпочтительно pH 6,5).
Осмоляльность раствора предпочтительно равна 300 миллиосмоль/кг (pH относится к pH всего раствора).
Инъекционные депо-формы могут быть изготовлены путем формирования микрокапсульных матриц FSH (и других агентов, если они присутствуют) в биоразлагаемых полимерах. Депо-формы/системы замедленного высвобождения на основе полимера могут, в зависимости от их химической природы, представлять собой, например, микро- или наночастицы, гидрогели, мицеллы, эмульсии или импланты. В зависимости от соотношения FSH и полимера и природы конкретного используемого полимера, можно контролировать скорость высвобождения FSH. Примеры биоразлагаемых полимеров включают системы сополимеров полилактид/полигликолид, поливинилпирролидон, поли(ортоэфиры), поли(ангидриды), поли(этиленгликоль), полиаминокислоты, полисахариды, например гиалуронат натрия (NaHA) или другие его соли, желатин, хитозан и так далее. Все указанные полимеры могут быть получены или модифицированы для оптимизации доставки белкового лекарственного средства или его стабильности. Инъекционные депо-препараты также получают посредством захвата FSH в липидные системы или полимер-липидные смеси, такие как мицеллы, липосомы или микроэмульсии, которые совместимы с тканями организма.
Инъекционные препараты можно стерилизовать, например посредством фильтрации через фильтр, удерживающий бактерии, или путем включения стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной инъекционной среде непосредственно перед применением. Инъекционные композиции могут поставляться в любом подходящем контейнере, например флаконе, предварительно заполненном шприце, инъекционных картриджах и подобном, как описано выше.
pH и точную концентрацию разных компонентов фармацевтической композиции регулируют в соответствии с установившейся в этой области практикой. Смотри GOODMAN and GILMAN's THE PHARMACOLOGICAL BASIS FOR THERAPEUTICES, 7th edition. В предпочтительном воплощении композиции по изобретению поставляют в виде композиций для парентерального введения. Основные способы получения парентеральных композиций известны в данной области техники и описаны в REMINGTON; THE SCIENCE AND PRACTICE OF PHARMACY, см. выше, на с.780-820. Парентеральные композиции могут поставляться в жидком препарате или в виде твердого вещества, которое смешивают со стерильной инъекционной средой непосредственно перед введением. В особенно предпочтительном воплощении парентеральные композиции поставляют в форме дозированных единиц для облегчения введения и обеспечения однородности дозирования.
FSH по настоящему изобретению можно получать обычными способами из мочи или можно получить рекомбинантно. Возможные способы получения также указаны, например, в WO 2009/127826.
hCG может быть получен любыми способами, известными в данной области техники. hCG, при использовании в данном описании изобретения, включает человеческий и рекомбинантный hCG. Человеческий hCG может быть очищен от любого соответствующего источника (например мочи и плаценты) любым способом, известным в данной области техники. Способы экспрессирования и очистки рекомбинантного hCG хорошо известны в данной области техники.
LH может быть получен любыми способами, известными в данной области техники. LH, при использовании в данном описании изобретения, включает человеческий и рекомбинантный LH. Человеческий LH может быть очищен от любого соответствующего источника (например мочи) любым способом, известным в данной области техники. Способы экспрессирования и очистки рекомбинантного LH известны в данной области техники.
Фармацевтическая композиция может быть предназначена для лечения бесплодия, например для применения, например, во вспомогательных репродуктивных технологиях (ART), индукции овуляции (OI) или внутриматочном оплодотворении (IUI). Фармацевтическую композицию можно применять, например, при медицинских показаниях, когда применяются известные препараты FSH. В настоящем изобретении также предлагается применение стабилизированного препарата FSH, описанного в данном описании изобретения (согласно аспектам изобретения) для, или в изготовлении лекарственного средства для лечения бесплодия. Фармацевтические композиции могут быть изготовлены в виде хорошо известных композиций для любого пути введения лекарственного средства, например перорального, ректального, парентерального, чрескожного (например, пластырная технология), внутривенного, внутримышечного, подкожного, интрацистернального, внутривагинального, внутрибрюшинного, местного (порошки, мази или капли) или в виде букального или назального спрея. Типичная композиция содержит фармацевтически приемлемый носитель, такой как водный раствор, нетоксичные эксципиенты, включая соли и консерванты, буферы и тому подобное, как описано, наряду с прочими, в пятнадцатом издании Remington's Pharmaceutical Science (Matt Publishing Company, 1975) на страницах 1405-1412 и 1461-87, и в четырнадцатом издании Национального формуляра XIV (American Pharmaceutical Association, 1975).
Примеры подходящих водных и неводных фармацевтических носителей, разбавителей, растворителей или средств доставки включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и тому подобные), карбоксиметилцеллюлозу и подходящие их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры, такие как этилолеат.
Композиции могут также содержать добавки, такие как, но без ограничения ими, консерванты, увлажнители, эмульгаторы, буферные агенты и диспергирующие агенты. Антибактериальные и противогрибковые агенты могут быть включены для предупреждения роста микробов и включают, например, парабены, хлорбутанол, фенолы, сорбиновую кислоту и тому подобное. Кроме того, может быть желательно включать агенты, регулирующие тоничность.
В некоторых случаях для продолжительного действия желательно замедлить абсорбцию FSH (и других активных ингредиентов, если они присутствуют) при подкожной или внутримышечной инъекции. Этого можно достичь применением жидкой суспензии кристаллического или аморфного вещества с плохой растворимостью в воде. Скорость поглощения, например, FSH тогда зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, отложенное поглощение парентерально введенной комбинированной формы FSH достигается путем растворения или суспендирования комбинации FSH в масляном носителе.
Согласно настоящему изобретению, авторами изобретения была сделана попытка изучить влияние некоторых соединений на стабильность жидкой композиции гонадотропина; в данном изобретении изучался стабилизирующий, а также дестабилизирующий эффект некоторых соединений.
Термин «стабильность» может относиться к химической стабильности, включающей ковалентную модификацию аминокислотной последовательности, но в контексте стабильности белка он также может относиться к физической стабильности, которая включает изменения свернутого состояния белка (то есть нативное состояние), не включая расщепление ковалентной связи.
В настоящем изобретении термин «стабильность» относится к физической стабильности композиций гонадотропинов, в частности FSH по настоящему изобретению. Физическая нестабильность белковой композиции может быть вызвана агрегацией молекул белка с образованием агрегатов более высокого порядка, диссоциацией гетеродимеров на мономеры, или любым другим конформационным изменением, которое снижает по меньшей мере одну биологическую активность FSH-белков, включенных в настоящее изобретение.
«Стабильный» раствор или препарат представляет собой такой раствор или препарат, где степень агрегации, диссоциации, конформационной модификации, потери биологической активности и подобного белков в нем контролируется удовлетворительным образом и не увеличивается неприемлемо со временем. Стабильность можно оценить способами, хорошо известными в данной области техники, включающими измерение светорассеяния образца, визуальный контроль прозрачности и/или окрашивания, поглощения или оптической плотности, определения размера молекул (например посредством эксклюзионной хроматографии или фракционирования в потоке при наличии поля), биологической активности in vitro или in vivo и/или посредством дифференциальной сканирующей калориметрии (DSC). Другие способы оценки стабильности хорошо известны в данной области техники и также могут применяться согласно настоящему изобретению.
Известно, что некоторые консерванты обладают выраженным дестабилизирующим влиянием на препараты гонадотропина, и в данном изобретении неожиданно было обнаружено, что соли, в частности соли, содержащие фармацевтически приемлемые катионы щелочных металлов, которые, как было показано здесь, являются подходящими для стабилизации жидкой композиции FSH, в частности Na+ или K+, такие как NaCl или Na2SO4, дополнительно полезны для противодействия дестабилизирующим эффектам консерванта, такого как бензиловый спирт, фенол и м-крезол, который должен содержаться в жидкой многодозовой композиции FSH для медицинского применения. Заявленные здесь соли обладают стабилизирующим воздействием на жидкую композицию FSH, которое выгодным и неожиданным образом даже более выражено, чем стабилизирующие эффекты известных стабилизаторов, таких как, например, сахароза. Улучшенный стабилизационный эффект по сравнению с известными стабилизаторами, такими как сахароза, особенно удивителен. Кроме того, совершенно неожиданно стабилизирующие эффекты солей по изобретению могут быть продемонстрированы для композиций FSH, хотя для очень похожего hCG не может быть показано никакого стабилизирующего эффекта. Также было неожиданным то, что наблюдаемые стабилизирующие эффекты не подчиняются так называемому ряду Гофмейстера (смотри также ниже), а фактически действуют вопреки ему.
Из предшествующего уровня техники было известно, что в фармацевтических композициях FSH происходит разложение FSH, и это было подтверждено первой серией примеров в данной заявке.
FSH будет разлагаться и в зависимости от времени, и в зависимости от температуры. В частности, при температурах выше комнатной температуры будут изменяться вторичная, третичная и четвертичная структуры.
Очевидно, что конформационное развертывание третичной и вторичной структур FSH, происходящее при нагревании, представляет собой переход между двумя состояниями (когда агрегации белка ограничена). Это развертывание может быть независимым от диссоциации субъединиц (изменений в четвертичной структуре).
Кроме того, из настоящего изобретения становится ясно, что FSH, содержащий консервант, подобный бензиловому спирту или фенолу, когда такие консерванты необходимы, например, в качестве противомикробных агентов в жидких препаратах FSH, очевидным образом влияет на стабильность многодозовых композиций FSH негативным образом. При этом долговременная стабильность FSH понижается, температура денатурации FSH становится ниже, и уже денатурированные формы имеют более низкий уровень вторичных структур, чем препараты FSH, не содержащие консерванты.
В настоящем изобретении также впервые показано, что соли, содержащие фармацевтически приемлемые катионы щелочных металлов для стабилизации жидкого препарата FSH, а именно Na и K, оказывают значительное влияние на стабильность жидких препаратов FSH. Можно видеть, что вторичная структура FSH в жидких препаратах FSH, содержащих эти соли, не будет значительно меняться при нагревании до 76,5°C. Денатурированная форма является относительно структурированной в присутствие, например, Na2SO4, что делает денатурацию более обратимой и, таким образом, значительно увеличивает кинетическую стабильность белка. Это подтверждается приведенными сейчас данными по стабильности в реальном времени, показывающими выраженный стабилизирующий эффект на гетеродимерную структуру FSH.
Результаты ясно показывают, что заявленные сейчас соли, например сульфат натрия и хлорид натрия, могут ограничивать тенденцию молекул FSH к диссоциации и таким образом значительно увеличивают стабильность при хранении.
Настоящее изобретение также относится к способу стабилизации жидкой композиции FSH, включающему стадию добавления указанных выше солей к указанной композиции.
Все исследования были подтверждены дополнительно осуществленными данными в реальном времени.
Краткое описание графических материалов
Фиг.1:
Сигнал CD (кругового дихроизма, смотри ниже) (мградус) в зависимости от длины волны (нм) показан для rFSH при разных температурах. Не наблюдалось значительного различия между спектрами 24,0°C→45,9°C, но наблюдалось зависимое от температуры уменьшение CD-сигнала выше 50°C. Белок rFSH (0,93 мг/мл) растворяли в 3,57 мМ фосфатном буфере pH 6,3, содержащем 0,0036 мг/мл Полисорбата 20. Сканирование при 24,0°C (сплошная жирная линия), 50,3°C (штриховая линия), 54,7°C (пунктирная линия), 59,0°C (штрихпунктирная линия), 63,4°C (звездочки), 67,8°C (ромбы) и 76,5°C (сплошная линия).
Фиг.2:
Сигнал CD (мградус) в зависимости от длины волны (нм) показан для rFSH, содержащего Na2SO4, при различных температурах. Не наблюдалось значительного различия между спектрами 24,0°C→45,9°C. Белок rFSH растворяли в 3,57 мМ фосфатном буфере pH 6,3, содержащем 0,0036 мг/мл Полисорбата 20 и 8,6 мг/мл сульфата натрия (Na2SO4). Сканирование при 2,0°C (сплошная жирная линия), 50,3°C (штриховая линия), 54,7°C (пунктирная линия), 59,0°C (штрихпунктирная линия) и 76,5°C (сплошная линия).
Фиг.3:
Сигнал CD (мградус) в зависимости от длины волны (нм) показан для rFSH, содержащего бензиловый спирт, при различных температурах. Не наблюдалось значительного различия между спектрами 24,0°C→45,9°C. Белок rFSH (0,93 мг/мл) растворяли в 3,57 мМ фосфатном буфере pH 6,3, содержащем 0,0036 мг/мл Полисорбата 20 и 0,17 мг/мл бензилового спирта. Сканирование при 24,0°C (сплошная жирная линия), 45,9°C (кружки), 50,3°C (штриховая линия), 54,7°C (пунктирная линия), S9,0°C (штрихпунктирная линия), 63,4°C (звездочки), 67,8°C (ромбы) и 76,5°C (сплошная линия).
Фиг.4
Последовательные DSC-термограммы hCG и rFSH. Данные DSC для 5 мг/мл hCG в смеси 0,005 мг/мл Полисорбата 20, 0,5 мг/мл L-метионина, 1 мМ фосфатного буфера, pH 6,5 и 2,4 мг/мл rFSH в смеси 0,005 мг/мл Полисорбата 20, 0,5 мг/мл L-метионина, 0,24 М NaCl, 1 мМ фосфатного буфера, pH 6,5. Скорость сканирования 2,0°C/мин. Первое сканирование rFSH (сплошная линия), второе сканирование rFSH (штрихпунктирная линия), первое сканирование hCG (штриховая линия) и второе сканирование hCG (пунктирная линия). После первого сканирования образец охлаждали до 20°C перед вторым сканированием.
Фиг.5:
DSC-термограммы hCG с разными сахарами или солями. Данные DSC для 5 мг/мл hCG в смеси 0,005 мг/мл Полисорбата 20, 0,5 мг/мл L-метионина и 1 мМ фосфатного буфера, pH 6,5. Без добавления сахара или соли (сплошная жирная линия), 0,1 М Na2SO4 (сплошная линия), 0,1 М NaCl (пунктирная линия), 0,1 M NaClО4 (штриховая линия) и 0,1 М сахароза (штрихпунктирная линия). Скорость сканирования 2,0°C/мин.
Фиг.6:
DSC-термограммы rFSH с разными сахарами и солями. Данные DSC для 2,4 мг/мл rFSH в смеси 0,005 мг/мл Полисорбата 20, 0,5 мг/мл L-метионина и 1 мМ фосфатного буфера, pH 6,5. Без добавления сахара или соли (сплошная жирная линия), 0,1 М Na2SO4 (сплошная линия), 0,1 М NaCl (пунктирная линия), 0,1 М NaClО4 (штриховая линия) и 0,1 М сахароза (штрихпунктирная линия). Скорость сканирования 1,0°C/мин.
Настоящее изобретение дополнительно пояснено посредством следующих примеров, которые, однако, никоим образом не следует истолковывать, как ограничение объема изобретения.
ПРИМЕРЫ
Пример 1 - Спектроскопия кругового дихроизма с использованием синхротронного излучения (SRCD) СПОСОБ
Спектроскопию кругового дихроизма выполняли, используя синхротронное оборудование в Орхуском Университете, Дания. Все спектры CD регистрировали, используя Suprasil-кварцевую ячейку с длиной оптического пути 0,1 мм (Hellma GmbH, Germany) в диапазоне длины волны 180-270 нм с шагом 1 нм и со временем задержки 3 секунды на длину волны. Регистрировали три идентичных развертки CD для каждого экспериментального исследования как для rFSH, так и для контрольных проб (плацебо). Спектр CD rFSH, представленный в этом отчете, получали вычитанием усредненной развертки соответствующего плацебо из усредненной развертки белка. Для каждой серии CD-разверток использовали приблизительно 120 мкл раствора (соответствует приблизительно 112 мкг rFSH).
Во время исследований влияния температуры на CD-спектр rFSH, температуру в камере для нагрева меняли от 25°C до 85°C с интервалами 5°C и временем установления равновесия 5 минут. Из файла калибровки определяли фактическую температуру эксперимента (температуру в Suprasil-кварцевой ячейке).
CD измеряет разницу поглощения света с левой и правой круговой поляризацией, которое имеет место из-за структурной асимметрии.
Вторичные структуры белков можно изучать при помощи CD-спектроскопии в дальней ультрафиолетовой области (приблизительно 180-250 нм). В общем случае более упорядоченной структуре соответствуют более интенсивные CD-сигналы (положительные или отрицательные). Однако разные вторичные структуры имеют разные спектры CD, и так как α-спирали имеют более интенсивные CD-сигналы, чем β-структуры, нельзя выполнить непосредственные сравнения между разными белками, чтобы сделать вывод об уровне упорядоченных структур.
Из-за высокой чувствительности к структурным изменениям спектроскопия CD является мощным инструментом изучения физической стабильности белков. Такие исследования обычно выполняют путем определения CD-спектра в зависимости от изменений внешних факторов, например температуры, pH, концентрации денатурирующих агентов, поверхностно-активных веществ или стабилизаторов. В настоящем исследовании CD-спектр rFSH изучают в зависимости от температуры. Дополнительно изучали воздействия бензилового спирта и сульфата натрия (Na2SO4) на вторичную структуру rFSH.
Гонадотропин, используемый в данном примере, а также в Примерах 2 и 3, представляет собой рекомбинантный фолликулостимулирующий гормон (rFSH), человеческий гормон, который экспрессируется клеточной линией PER.CS* человека при использовании технологии рекомбинантных ДНК. rFSH представляет собой гетеродимерный белок, состоящий из двух гликолизированных мономеров: альфа-субъединицы из 92 аминокислот, которая является общей для FSH, лютеинизирующего гормона (LH), человеческого хорионического гонадотропина (hCG) и тиреостимулирующего гормона (TSH), и бета-субъединицы из 111аминокислот, которая является специфической для FSH. Гликопротеиновые гормоны, содержащие FSH, все утрачивают свою биоактивность при диссоциации нековалентно связанных мономеров. Предыдущие результаты показали, что нестабильность rFSH основана главным образом на диссоциации димеров (разрушении четвертичной структуры и сопутствующем уменьшении ответа иммуносвязывания).
Имеющиеся в настоящее время в продаже композиции rFSH предлагаются в разных концентрациях в диапазоне от 37,5 МЕ/мл (соответствующей приблизительно 2,8 мкг/мл для Gonal-f) вплоть до по меньшей мере 833 МЕ/мл (соответствующей приблизительно 83,3 мкг/мл для Puregona) в зависимости от предполагаемого применения.
rFSH, используемый в исследованиях, предназначен для жидкого лекарственного препарата, 600 ME rFSH/мл для подкожной инъекции. Так как этот продукт предназначен для многодозовых инъекций, необходимо добавление консерванта.
Исследованные композиции получали смешиванием исходных растворов разных ингредиентов. Исследованный интервал концентраций как белка, так и эксципиентов ограничен из-за используемого способа, то есть концентрацию белка требуется сохранять относительно высокой по сравнению с концентрациями эксципиентов. Из-за УФ-поглощения ароматических соединений в исследуемой области длин волн, требуется поддерживать низкую концентрацию бензилового спирта. В таблице ниже представлены три разных препарата, которые были изучены в первом экспериментальном проекте авторами настоящего изобретения.
Образец 1
CD-спектр регистрировали для образца 1 rFSH (смотри таблицу 1), при тринадцати различных температурах от 24°C до 77°C. Для ясности только семь из этих спектров показаны на Фиг.1. Образец 1, как следует из Таблицы 1, не содержал ни соль, ни консервант. Спектры показаны на Фиг.1. Результаты ясно показывают, что интенсивность сигнала CD уменьшается в зависимости от температуры, и указывают на разрушение вторичных структур при высокой температуре (выше 50°C). Не было обнаружено значительных различий между спектрами 24,0°C→45,9°C, что указывает на то, что во время измерения (примерно 20 минут) вторичная структура белка остается неповрежденной при нагревании приблизительно до 46°C. SRCD-спектры FSH при нагревании показывают изодихроичную точку приблизительно при 193 нм, которая также обнаружена для спектров Образца 2, смотри Фиг.2.
Образец 2
CD-спектр регистрировали для образца 2 rFSH (таблица 1), содержащего Na2SO4. Спектры получали при тринадцати различных температурах от 24°C до 77°C, и они представлены на Фиг.2. Для ясности только пять из этих спектров показаны на Фиг.2. Результаты показывают разрушение вторичных структур в зависимости от температуры. Данные демонстрируют, что вторичная структура rFSH в образце 2 остается неповрежденной при нагревании до приблизительно 46°C (в ходе эксперимента). Важно также, что эти данные показывают, что денатурированная форма является относительно структурированной в присутствии Na2SO4.
Образец 3
CD-спектр регистрировали для образца 3 rFSH (таблица 1), содержащего бензиловый спирт (ВА). Бензиловый спирт является противомикробным консервантом, который довольно часто выбирают для жидкой композиции FSH. Из-за относительно слабой консервирующей способности по сравнению, например, с м-крезолом, ВА следует применять в высоких концентрациях (примерно 10-15 мг/мл). Консервант необходим, так как rFSH предполагается применять для нескольких инъекций в течение периода времени вплоть до 1 месяца и так как rFSH обычно хранят при комнатной температуре.
Спектры rFSH в присутствии 0,17 мг/мл ВА получали при тринадцати разных температурах от 24°C до 77°C и они представлены на Фиг.3. Для ясности только восемь из этих спектров показаны на Фиг.3. Из-за очень высокого УФ-поглощения бензилового спирта (и сопутствующего низкого сигнала CD) исследуемую концентрацию ВА нельзя увеличивать и, таким образом, она не может стать близкой к концентрации, которую используют для консервации композиций rFSH. Тем не менее наблюдался отчетливый дестабилизирующий эффект ВА. Результаты CD показывают, что вторичная структура rFSH в образце 3 остается неповрежденной при нагревании до 42°C, которая немного ниже, чем температура начала денатурации rFSH в образцах 1 и 2.
Кроме того, и это важно, данные показывают, что денатурированные формы утрачивают упорядоченную структуру в заметно более высокой степени, чем FSH, в отсутствие консерванта.
Влияние эксципиентов на структурные изменения, индуцированные температурой
Соль Na2SO4, которую применяли здесь в качестве типичного примера заявленных здесь солей, продемонстрировала значительное влияние на структуру денатурированных посредством температуры белков. Это, безусловно, является важными данными. Так как денатурированные (развернутые или частично развернутые) белки более склонны к объединению с образованием агрегатов, чем нативные белки (Fink, A.L., 1998, Fold Des. 3 (1): R9-23), результаты показывают, что сульфат натрия может ограничивать тенденцию молекул rFSH денатурировать и, значит, риск агрегации и, таким образом, значительно увеличивает стабильность при хранении. Бензиловый спирт (ВА), с другой стороны, индуцирует значительную структурную декомпозицию при высоких температурах. Упорядоченные вторичные структуры не были обнаружены посредством SRCD. Наблюдаемые эффекты ВА (более развернутые структуры) могут являться частью объяснения повышенной агрегации, обнаруженной в других белковых системах при добавлении бензилового спирта (Маа, Y. and Hsu, С.С, 1996, Int. J. Pharm. 140:155-168; Zhang, Y. et al., 2004, J. Pharm. Sci. 93(12): 3076-3089).
Однако добавление консервантов играет ключевое значение в создании многодозовых композиций, и из существования продуктов rFSH на рынке известно, что необходимо разрабатывать более стабильные композиции даже с относительно высоким содержанием бензилового спирта (Puregon® содержит 10 мг/мл бензилового спирта).
Обнаружено, что бензиловый спирт уменьшает стабильность rFSH и способствует утрате упорядоченных вторичных структур при нагревании. Однако добавление консервантов является важным. Данное исследование показало, что заявленные соли здесь увеличивают уровень упорядоченных структур в нагретых композициях rFSH. Таким образом, эти соли хорошо подходят в качестве стабилизатора(ов) в жидкой композиции rFSH, например для компенсации эффектов бензилового спирта или других фенольных консервантов.
Пример 2 - Дифференциальная сканирующая калориметрия (DSC)
FSH, репрезентативно применяемый в данном примере, является таким же, как в Примере 1. В общем случае нативная (биоактивная) структура белков очень чувствительна к их окружению, например составу композиции, контейнерным системам, pH и температуре. В данном примере температура денатурации rFSH, Tm, была изучена при помощи дифференциальной сканирующей калориметрии (DSC) в жидкой среде. Температура денатурации rFSH является индикатором стабильности белка в растворе, где более высокая Tm указывает на более стабильный белок.
Третичная и четвертичная структура белков стабилизирована главным образом посредством нековалентных взаимодействий. Так как многие из этих внутримолекулярных взаимодействий заменяются нековалентными взаимодействиями с молекулами воды во время развертывания, термодинамический баланс между разными структурными формами (то есть нативными и денатурированными) является едва уловимым. В общем случае это означает, что стабильность нативных белков ограничена. Множество белков термически развертываются примерно при 70°C. Свертывание белка или денатурацию можно описать термодинамическими параметрами, которые могут быть непосредственно исследованы и определены количественно с использованием DSC. Следовательно, DSC является важным инструментом исследования влияния эксципиентов на стабильность белка, и, таким образом, определения оптимальных композиций для белковых терапевтических средств.
ДИФФЕРЕНЦИАЛЬНАЯ СКАНИРУЮЩАЯ КАЛОРИМЕТРИЯ В ЖИДКОЙ СРЕДЕ (DSC)
Теория
При нагревании белкового образца (то есть при повышении температуры образца) во время DSC в жидкой среде, получают только незначительное повышение исходного уровня, но когда нагревание продолжается (то есть продолжающееся повышение температуры), тепло поглощается белком, заставляя его термически развертываться в диапазоне температур, характерном для исследуемого белка. Это порождает эндометрический пик. Во время развертывания белка молекулы воды, окружающие этот белок, перестраиваются, так как экспонируются более гидрофобные цепи. Когда развертывание завершается, поглощение тепла уменьшается и формируется новый исходный уровень.
Интегрирование теплоемкости, Cp, образца приводит к изменению энтальпии, ΔН, ассоциированному с процессом развертывания, согласно уравнению (1). Наблюдаемое изменение энтальпии возникает из эндометрических процессов, таких как разрыв водородных связей, и экзотермических процессов, таких как образование водородных связей между белком и окружающей средой. Средняя точка теплового перехода или средняя точка перехода, Tm (часто называемая температурой денатурации белка), представляет собой температуру, при которой половина молекул белка свернута и половина белок молекул развернута.
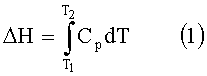
Необработанные данные DSC-измерений, то есть тепловую мощность (в Ваттах) в зависимости от температуры, легко можно пересчитать в парциальную молярную теплоемкость (в Дж/моль·К), зная молярную массу и концентрацию используемого белка.
Способ тестирования
Температуру денатурации белка, Tm, измеряли, используя DSC в жидкой среде, Nano DSC от ТА Instruments, оборудованный 300 мкл двойными капиллярными ячейками, и используя следующие параметры:
Скорость сканирования: 0,5-2,0°C/мин, если не установлено иное, использовали скорость сканирования 1,0°C/мин (2,0°C/мин для примера 4)
Начальная температура: 20°C
Конечная температура: 100°C
Равновесие: 900 с (или 900 с (первое сканирование) 600 с (второе сканирование) для примера 4)
Постоянное давление: 3 атм (0,3 МПа)
Все образцы перед измерением дегазировали в течение 15 мин. Ячейки для образца очищали 50%-ной муравьиной кислотой после каждого белкового образца. Дополнительно ячейки ополаскивали 1000 мл очищенной воды после каждого прогона образца. Все образцы измеряли с соответствующим плацебо в ячейке сравнения. Результаты отдельного сканирования с раствором плацебо, заполняющим и ячейку сравнения, и ячейку для образца, вычитали из данных перед оценкой, то есть производили вычитание растворителя.
MALDI-TOF MS
Образцы rFSH до и после обработки ферментом сиалидазой анализировали посредством времяпролетной масс-спектроскопии с лазерной десорбцией/ионизацией из матрицы (MALDI-TOF MS) для оценки степени реакции десиалилирования. Спектры получали на Autoflex II MALDI ToF масс-спектрометре (Bruker Daltonics). Синаповую кислоту использовали в качестве матрицы. Анализ выполняли в линейном режиме определения положительных ионов с задержанной экстракцией. Использовали диапазон сканирования 4000-20893 Да с внешней калибровкой.
ЦЕЛЬ ДАННОГО ПРИМЕРА
Целью данного примера являлось изучение термической стабильности rFSH посредством дифференциальной сканирующей калориметрии (DSC) в жидкой среде и исследование стабилизирующего действия различных солей на rFSH с добавлением и без добавления консерванта (фенола или бензилового спирта).
Данное исследование вместе с предшествующими исследованиями посредством спектроскопии кругового дихроизма (CD) (Пример 1 выше) и исследованиями стабильности в реальном времени (Пример 3 ниже), все имеют целью изучение влияния солей и консервантов на стабильность rFSH в растворах.
ПРОДУКТЫ ДЛЯ ИССЛЕДОВАНИЯ
ИНФОРМАЦИЯ О ПАРТИИ rFSH
rFSH, партия лекарственного вещества №08800020 и партия №09PD80010 были изготовлены Bio-Technoligy General (BTG), Израиль.
Определение биологической активности rFSH выполняют согласно Ph. Eur. (Европейская Фармакопея). Концентрацию определили равной 13,223 МЕ/мг (что приводит к 9,256 МЕ/мл) для партии 08800020 и 15,109 МЕ/мг (что приводит к 10,576 МЕ/мл) для партии 09PD80010 соответственно, для двух используемых партий rFSH.
ВЕЩЕСТВА
Эксципиенты
Перечень эксципиентов, используемых в растворах rFSH в данном исследовании, приведен в Таблице 2.
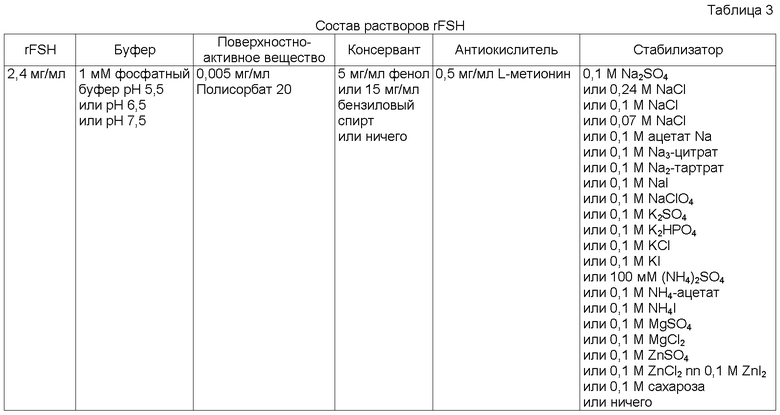
СОСТАВ ТЕСТИРУЕМЫХ РАСТВОРОВ
Составы тестируемых растворов rFSH и плацебо приведены в Таблице 3, Таблице 4 и Таблице 5. Тестируемые концентрации консервантов выбирают на основании концентрации, необходимой для выполнения требований Ph. Eur. «Критерии, касающиеся эффективности консервирования композиции, предназначенной для парентерального применения».
Тестируемые концентрации солей основаны на концентрации сульфата натрия, необходимой для получения изотоничности тестируемых растворов, то есть 0,1 М сульфат натрия. Все другие соли тестировали в такой же молярной концентрации как сульфат натрия. Кроме того тестируют более высокую и более низкую концентрацию хлорида натрия, чтобы оценить влияние концентрации соли на температуру денатурации rFSH, Tm.
Концентрацию натрий-фосфатного буфера в тестируемых растворах поддерживают низкой, чтобы минимизировать риск
стабилизирующих/дестабилизирующих эффектов буферных солей как таковых.
СПОСОБ ИЗГОТОВЛЕНИЯ
Все растворы (Таблица 3, Таблица 4 и Таблица 5) изготавливают в лабораторном масштабе в Ferring Pharmaceuticals A/S, Copenhagen, Denmark. Способ изготовления обобщен ниже:
Получение исходного раствора rFSH
Исходные растворы rFSH в фосфатном буфере получают путем добавления стадии концентрирования, используя в качестве исходного вещества партию 08800020 или партию 09PD80010 раствора лекарственного вещества rFSH. Повышение концентрации выполняют, используя устройство Vivaspin 20 с мембраной с номинальным отсечением по молекулярной массе (MWCO) 10 кДа от Vivascience. Мембрану предварительно промывают путем центрифугирования 15 мл соответствующего раствора плацебо, содержащего 0,5 мг/мл L-метионина, 0,005 мг/мл Полисорбата 20 в 1 мМ фосфатном буфере, pH 5,5, 6,5 или 7,5, через фильтр. Центрифугирование выполняют при 3000 × g в течение 20 минут, используя поворотно-откидной ротор.
Для выполнения стадии концентрирования используют суммарно 80 мл образца rFSH для заполнения четырех устройств Vivaspin 20 (20 мл на устройство) и центрифугируют при 3000 × g в течение 15 мин. Каждый ретенат переносят в мерную колбу объемом 20 мл. Фильтры промывают небольшими аликвотами нужного раствора плацебо. Промывающий раствор переносят в мерную колбу, которую в заключение доводят до нужного объема, используя тот же самый раствор плацебо. Это приводит к исходному раствору 2,8 мг/мл rFSH, содержащему 0,5 мг/мл L-метионина, 0,005 мг/мл Полисорбата 20 в 1 мМ фосфатном буфере, pH 5,5, 6,5 или 7,5 соответственно.
Получение растворов rFSH и плацебо
Исходные растворы всех эксципиентов, за исключением консервантов, получают в воде Milli-Q.
Для получения растворов rFSH и плацебо, исходные растворы каждого эксципиента смешивают с получением нужных концентраций, приведенных в Таблице 3, Таблице 4 и Таблице 5. Консервант добавляют непосредственно в растворы.
Десиалилирование rFSH
Концентрированный раствор rFSH с концентрацией rFSH 2,8 мг/мл, содержащий 0,5 мг/мл L-метионина, 0,005 мг/мл Полисорбата 20 в 1 мМ фосфатном буфере, pH 6,5, используют для удаления сиаловой кислоты из сахарных группировок, присоединенных к rFSH. Удаление осуществляют ферментативно, используя α(2→3,6,8,9) нейраминидазу (сиалидазу) от Sigma. rFSH обрабатывают нейраминидазой в течение ночи, встряхивая при 37°C. Реагенты удаляют, используя устройства Vivaspin, как описано выше, для концентрирования rFSH. Раствор rFSH, содержащий ферменты, переносят в предварительно промытое устройство Vivaspin. Устройство центрифугируют, фильтрат выливают и ретенат ресуспендируют в растворе плацебо, содержащем 0,5 мг/мл L-метионина, 0,005 мг/мл Полисорбата 20 в 1 мМ фосфатном буфере pH 6,5. Раствор снова центрифугируют. Эту процедуру повторяют три раза, затем переносят итоговый ретенат в мерную колбу и разбавляют до объема раствором плацебо. Это дает исходный раствор 2,8 мг/мл десиалилированного rFSH, содержащий 0,5 мг/мл L-метионина, 0,005 мг/мл Полисорбата 20 в 1 мМ фосфатном буфере, pH 6,5.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ВЛИЯНИЕ СКОРОСТИ СКАНИРОВАНИЯ ПРИ DSC НА Tm rFSH
Для изучения влияния скорости DSC-сканирования на температуру денатурации rFSH, выполняют измерения Tm при трех разных скоростях сканирования. Как можно видеть в Таблице 6, Tm rFSH варьируется со скоростью DSC-сканирования, используемой во время измерения.
Поскольку сравнивают температуры денатурации, полученные из измерений, выполненных при одинаковых скоростях сканирования, тот факт, что Tm варьируется со скоростью сканирования, не влияет на интерпретацию данных, смотри, например, Таблицу 7.
Повторные DSC-термограммы вплоть до 100°C показали, что денатурация rFSH является частично необратимой в экспериментальных условиях (смотри Фиг.4). Это означает, что повторное свертывание происходит медленнее, чем время установления равновесия между двумя DSC-термограммами, или что развертывание ассоциировано с необратимой стадией, как показано в уравнении (2).
Нативный ↔ Развернутый → Необратимо денатурированный (2)
ВЛИЯНИЕ ДОБАВЛЕНИЯ КОНСЕРВАНТА НА Tm rFSH
Как можно видеть в Таблице 7, добавление консерванта к раствору rFSH снижает температуру денатурации, Tm, на 2-6°C, в зависимости от используемого консерванта. Это хорошо согласовывается с ранее представленными данными как для других рекомбинантных белков, так и для FSH, полученного из мочи.
Значительное уменьшение Tm, полученное для растворов rFSH с бензиловым спиртом, по сравнению с растворами rFSH с фенолом (смотри Таблицу 7) можно объяснить более высокой концентрацией бензилового спирта (15 мг/мл), чем фенола (5 мг/мл), используемой в экспериментах.
** Вычислена из DSC-измерений, выполненных при скорости сканирования 2,07 мин.
ВЛИЯНИЕ ДОБАВЛЕНИЯ РАЗЛИЧНЫХ СОЛЕЙ НА Tm rFSH
Ранжирование солей в соответствии с их общим влиянием на растворимость и стабильность белка известно как ряд Гофмейстера или лиотропный ряд, уравнение (3) ниже. Известно, что высаливающие агенты в левой части, так называемые космотропные ионы, оказывают стабилизирующее влияние на белки. В то же время хаотропные или всаливающие ионы в правой части, как известно, дестабилизируют белки.
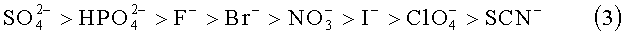
Влияние добавления различных солей к растворам без консерванта на Tm rFSH
При измерении влияния различных солей натрия на Tm rFSH совершенно неожиданно не наблюдался стабилизирующий/дестабилизирующий эффект, ожидаемый в соответствии с рядом Гофмейстера, как описано выше, при варьировании катионов, смотри Таблицу 8 и Таблицу 9. Независимо от того, использовался ли наиболее космотропный ион, сульфат, или хаотропный ион, перхлорат, повышение температуры денатурации было приблизительно одинаковым. Фактически наибольшее повышение Tm rFSH было получено для солей перхлоратных ионов, когда дестабилизирующее влияние на rFSH является ожидаемым. Повышение Tm находилось в одном диапазоне как для различных неорганических анионов, таких как сульфат, хлорид и перхлорат, а также для органических анионов, таких как цитрат, ацетат и тартрат.
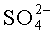
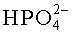
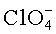
Без добавления соли: Tm составляла 72,9°C, другие эксципиенты согласно заголовку таблицы
0,1 М сахароза: Tm составляла 73,3°C, другие эксципиенты согласно заголовку таблицы
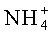
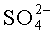
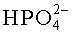
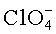
0,1 М Сахароза: 0,4°C, другие эксципиенты согласно заголовку таблицы Наблюдаемая тенденция того, что положение анионов в ряду Гофмейстера не оказывает влияние на повышение Tm rFSH при добавлении разных солей натрия, так же обнаружена для калия (смотри Таблицу 8 и Таблицу 9). Имея одинаковый катион, анион в общем случае только в незначительной степени влияет на изменение Tm rFSH и никогда в соответствии с рядом Гофмейстера.
Совершенно неожиданно, катионы, с другой стороны, оказывают влияние на Tm rFSH. Более конкретно, соли с одновалентным катионом демонстрируют в общем случае более высокую Tm rFSH, чем двухвалентные ионы (смотри Таблицу 8). Главным образом, одновалентные ионы щелочного металла обусловливают высокую Tm rFSH. Другими словами, наблюдаемые стабилизирующие эффекты (то есть повышение Tm rFSH) при добавлении соли являются совершенно независимыми от тестируемых анионов (смотри Таблицы 8 и 9), в то время как катионы оказывают значительное влияние на степень стабилизации. Соли калия и натрия демонстрируют особенно значительный стабилизирующий эффект. Все вышеуказанные тестируемые растворы имеют концентрацию соли 0,1 М. Для изучения влияния концентрации соли на Tm rFSH, изучали DSC-измерения растворов rFSH, содержащих три разные концентрации хлорида натрия. Стабилизирующий эффект при добавлении соли в раствор rFSH наблюдается во всем исследованном диапазоне концентрации соли (смотри Таблицу 10).
** Вычислена из DSC-измерений, выполненных при скорости сканирования 2,0°C/мин.
В существующих патентах на композиции FSH используют, например, сахарозу в качестве стабилизатора для FSH. Добавление 0,1 М сахарозы к раствору rFSH обеспечивает незначительное изменение Tm rFSH (смотри Таблицу 8 и Таблицу 9), показывая, что стабилизирующий rFSH эффект при добавлении солей калия или натрия является заметно более высоким, чем эффект, полученный при добавлении сахарозы.
Влияние на Tm rFSH добавления различных солей к растворам с добавленным консервантом
Хорошо известно, что добавление консервантов к белковым растворам уменьшает стабильность белка в растворе. Однако для водной многодозовой композиции, предназначенной для парентерального применения, консервант является необходимым условием. Поэтому очень важно компенсировать уменьшение стабильности белка при добавлении консерванта путем добавления стабилизаторов, таких как соли, к растворам rFSH.
Как можно видеть в Таблице 11, добавление консерванта к раствору rFSH приводит к снижению температуры денатурации rFSH на 2-3°C. Добавление соли к консервированным растворам rFSH повышает температуру денатурации rFSH приблизительно на 5°C. Другими словами, дестабилизирующий эффект, наблюдаемый при добавлении консерванта к раствору rFSH, хорошо компенсируется добавлением соли, как определено данным изобретением. Действительно, добавление соли к растворам rFSH, содержащим фенол, не только нейтрализует влияние консерванта на Tm rFSH, оно действительно увеличивает Tm по сравнению с rFSH в водном растворе без добавления консерванта или соли (смотри Таблицу 11).
ВЛИЯНИЕ ИЗМЕНЕНИЯ pH НА Tm rFSH
Для изучения воздействия pH на Tm rFSH без добавления и с добавлением стабилизирующих солей определяли температуру денатурации rFSH при pH 5,5, 6,5 и 7,5 с добавлением и без добавления трех разных натриевых солей (смотри Таблицу 12).
Как можно видеть в Таблице 12, общая тенденция Tm rFSH при добавлении разных натриевых солей остается одинаковой во всем диапазоне pH от 5,5 до 7,5, то есть наблюдается отклонение от стабилизирующего/дестабилизирующего эффекта солей в соответствии с рядом Гофмейстера при всех протестированных pH.
В изученном диапазоне pH наблюдаемые температуры денатурации rFSH повышаются с увеличением pH растворов, как при добавлении, так и без добавления соли (смотри Таблица 12). Фактическое повышение температуры денатурации rFSH при добавлении солей, ΔTm(соль), немного ниже при более высоком pH (смотри Таблицу 12).
ВЛИЯНИЕ СИАЛИЛИРОВАНИЯ rFSH НА Tm rFSH
Как было показано выше, влияние добавления солей к раствору rFSH совершенно не подчиняется описанному выше ряду Гофмейстера, где ожидается, что соли перхлорат-ионов дестабилизируют белки (обеспечивают более низкую Tm белка), а соли сульфат-ионов, как ожидается, стабилизируют белки (обеспечивают более высокую Tm белка).
Так как rFSH представляет собой гликолизированный белок, имеющий многочисленные остатки сиаловой кислоты, присоединенные к группировкам Сахаров, и поэтому довольно высокий отрицательный результирующий заряд, изучали влияние сиаловой кислоты на неожиданное стабилизирующее поведение солей.
Для изучения влияния сиаловой кислоты на Tm rFSH при добавлении разных солей сиаловую кислоту ферментативно удаляли. Затем анализировали десиалилированный rFSH посредством DSC с добавлением и без добавления соли.
Для подтверждения того, что остатки сиаловой кислоты успешно удалены, образец rFSH до и после ферментативного удаления сиаловой кислоты анализировали посредством MALDI-TOF MS.
В кислых для образца условиях MALDI-TOF MS альфа- и бета-субъединицы диссоциированы и поэтому измеряются отдельно. Средняя молекулярная масса альфа-субъединицы перед обработкой сиалидазой равна 15000 Да. После обработки сиалидазой средняя молекулярная масса равна 14000 Да. Средняя молекулярная масса бета-субъединицы перед обработкой сиалидазой равна 18000 Да и составляет 17000 Да после обработки сиалидазой. Сдвиг массы обеих субъединиц является результатом удаления сиаловых кислот, что приводит к снижению массы. Практически все остатки сиаловой кислоты были удалены из rFSH во время десиалилирования.
Повышение Tm rFSH при добавлении сульфата натрия или перхлората натрия имеет одинаковую тенденцию для немодифицированного rFSH и десиалилированного rFSH, то есть наблюдаемый стабилизирующий эффект (повышение 7~m rFSH) не следует описанному выше ряду Гофмейстера. В общем случае наблюдаемая Tm на 2-6°C ниже для десиалилированного rFSH, чем для немодифицированного rFSH (смотри Таблицу 13). Стабилизирующий эффект, наблюдаемый при добавлении соли, также ниже для десиалилированного rFSH, чем для немодифицированного rFSH (смотри Таблицу 13).
Ожидается более низкая Гт, полученная для десиалилированного rFSH, по сравнению с немодифицированным rFSH, так как полагают, что присутствие сиаловой кислоты на группировках Сахаров в rFSH увеличивает стабильность rFSH.
Тот факт, что как немодифицированный rFSH, так и десиалилированный rFSH следует одинаковой тенденции (отклонение от стабилизирующего/дестабилизирующего эффекта согласно ряду Гофмейстера) при добавлении различных солей, доказывает, что не присутствие сиаловых кислот на rFSH само по себе вызывает этот эффект.
ВЫВОДЫ
Дестабилизирующий эффект (понижение Tm rFSH), наблюдаемый для rFSH при добавлении консерванта, хорошо согласовывается с уровнем техники в данной области.
Наблюдаемое отклонение от ряда Гофмейстера для температуры денатурации rFSH при добавлении солей с разными анионами является, однако, неожиданным. В соответствии с рядом Гофмейстера (где соли располагаются согласно их обычному влиянию на растворимость и стабильность белка), космотропные анионы, подобные сульфату, обычно стабилизируют белки (обеспечивают более высокую Tm), тогда как хаотропные анионы, подобные перхлорату, дестабилизируют белки (обеспечивают более низкую Tm). В данном исследовании все тестируемые анионы, имеющие одинаковый катион, демонстрируют аналогичное повышение температуры денатурации rFSH. Совершенно противоположно прогнозу согласно ряду Гофмейстера, соли с перхлорат-ионами демонстрируют наибольшее повышение температуры денатурации rFSH.
Другими словами, наблюдаемый стабилизирующий эффект (то есть повышение Гт rFSH) при добавлении соли совершенно не зависит от тестируемых анионов. Соли натрия и калия демонстрируют особенно значительный стабилизирующий эффект. Особенно добавление перхлората натрия к раствору rFSH вызывает значительное повышение температуры денатурации rFSH. Однако перхлораты являются обычно чрезвычайно реакционно-способными и являются окислителями, и поэтому перхлораты не одобрены в качестве инертных ингредиентов в фармацевтических композициях.
Неожиданный стабилизирующий эффект, полученный для rFSH при добавлении солей, не может быть объяснен присутствием сиаловой кислоты в группировках Сахаров в rFSH. Определения температуры денатурации rFSH для десиалилированного rFSH показывают такие же тенденции в стабилизирующем воздействии на rFSH при добавлении солей, как и для немодифицированного rFSH.
Пример 3 - Стабильность растворов rFSH в реальном времени
ЦЕЛЬ ИССЛЕДОВАНИЯ
Цель данного исследования заключалась в том, чтобы установить, следует ли стабильность rFSH в различных композициях в реальном времени той же самой тенденции, которая наблюдалась при измерениях температуры денатурации rFSH посредством DSC в жидкой среде, как описано в Примере 2, а также изменения во вторичной структуре rFSH при нагревании, которые измеряли посредством спектроскопии CD, как описано в Примере 1. В данном исследовании определяют структурную стабильность rFSH во время хранения, измеряемую как склонность rFSH диссоциировать на мономеры.
Стабильность композиций 600 МЕ/мл rFSH после хранении при двух разных температурах хранения изучали в условиях продолжительного исследования 5±3°C/относительная влажность (отн. вл.) окружающей среды и ускоренного исследования 30±2°C/65±5% отн. вл. в течение 6-12 месяцев. Все флаконы хранили в перевернутом положении. Контроли с плацебо, содержащие соответствующие композиции, но без добавленного rFSH, хранили в таких же условиях, как описано для активного rFSH.
ПРОДУКТ, ПОДЛЕЖАЩИЙ ИЗУЧЕНИЮ
ИНФОРМАЦИЯ О ПАРТИИ
rFSH, партия лекарственного вещества №08800060 и партия №09800020, был изготовлен Bio-Technoogy General (BTG), Израиль.
Определение биологической активности вышеуказанных партий rFSH выполняли согласно Ph. Eur.
ВЕЩЕСТВА
Эксципиенты
Перечень эксципиентов, используемых в данном исследовании, представлен в Таблице 14.
Контейнерная система и система укупорки
Применяемые первичные упаковочные материалы представлены в Таблице 15.
Состав исходных растворов rFSH и разных препаратов (rFSH и плацебо) приведены в Таблице 16, Таблице 17 и Таблице 18. За исключением композиции, не содержащей никакого стабилизатора/агента тоничности, концентрацию стабилизатора/агента тоничности регулируют для получения изотонических растворов.
СПОСОБ ИЗГОТОВЛЕНИЯ
Все растворы (Таблица 17 и Таблица 18) готовили в лабораторном масштабе в Ferring Pharmaceuticals A/S, Копенгаген, Дания. Способ изготовления обобщен ниже.
Получение композиций rFSH и плацебо
Исходные растворы всех эксципиентов готовят в воде Milli-Q.
Для получения композиций плацебо исходные растворы каждого эксципиента смешивают с получением концентраций, приведенных в Таблице 18. Перед разбавлением до нужного объема регулируют pH каждой композиции, если это необходимо.
Для получения композиций rFSH разбавляющий раствор готовят из исходного раствора каждого эксципиента. Регулируют pH разбавляющих растворов. Разбавляющие растворы смешивают с исходным раствором rFSH (смотри Таблицу 16) с получением конечных концентраций, приведенных в Таблице 17.
Стерильная фильтрация и асептическое заполнение
Конечные композиции стерильно фильтруют, используя фильтры PVDF 0,22 мкм (Millipore). Композиции плацебо стерильно фильтруют в стерилизованные в автоклаве стеклянные бутыли, используя фильтры Stericup. Композиции rFSH стерильно фильтруют в стерилизованные в автоклаве стеклянные стаканы, используя фильтры Sterivex-GV и стерильные шприцы 20 мл Luer Lock (Braun). Стерильную фильтрацию, заполнение и герметизацию флаконов выполняют на рабочем столе с ламинарным потоком воздуха (LAF bench), используя стерилизованные в автоклаве флаконы и резиновые пробки. До и после заполнения флаконы продувают газообразным азотом, пропуская через фильтр Millex-FG PFTE 0,20 мкм (Millipore) в течение по меньшей мере 6 секунд. Флаконы заполняют 1,5 мл образца на флакон. Все флаконы асептически заполняют и немедленно закрывают резиновыми пробками и алюминиевыми съемными колпачками.
Условия хранения
Образцы, содержащие rFSH 600 МЕ/мл и плацебо, хранят в течение 6-18 месяцев при 5+3°C/отн. вл. окружающей среды. Кроме того, образцы хранят в течение 6-18 месяцев в условиях ускоренного исследования, 30±2°C/65±5% отн. вл. При каждой температуре хранения флаконы хранят в перевернутом положении. Все флаконы защищают от света.
ПРОГРАММЫ СТАБИЛЬНОСТИ
Программы изучения стабильности для rFSH 600 МЕ/мл и плацебо представлены в Таблице 19 ниже.
* Тестировали только для некоторых композиций
АНАЛИТИЧЕСКИЕ МЕТОДЫ
Аналитический метод, используемый в данном исследовании, описан ниже. В каждом случае тестирования для каждой композиции анализировали 2 флакона rFSH и 1 флакон соответствующего плацебо.
Низкомолекулярные (LMW) формы
LMW-формы rFSH определяют посредством LC-UV (жидкостная хроматография с ультрафиолетовым обнаружением), применяя изократическое элюирование на колонке для эксклюзионной хроматографии (SEC). Анализ выполняют, используя колонку на основе диоксида кремния с буфером TRIS в качестве подвижной фазы и УФ-обнаружением. LMW-формы rFSH представляют собой пики, элюируемые с молекулярной массой ниже (после), чем масса главного пика rFSH. LMW-формы определяют как процент площади пика от суммарной площади пиков.
Для образцов, содержащих консервант, этот консервант удаляют из раствора образца перед вводом в колонку для эксклюзионной хроматографии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ ДИССОЦИАЦИИ rFSH ВО ВРЕМЯ ХРАНЕНИЯ
Так как rFSH теряет свою биологическую активность при диссоциации нековалентно связанных мономеров, простым способом отслеживания потери активности rFSH из-за диссоциации на мономеры является измерение количества LMW-формы rFSH в растворе. Эту информацию можно получить посредством SEC-хроматографии, где пики LMW-форм, элюирующиеся после главного пика rFSH, как известно, образованы диссоциированным rFSH.
Как можно видеть в Таблице 20, свежеприготовленный раствор rFSH, содержащий разные стабилизаторы, в присутствии и в отсутствие добавленного консерванта, показывает аналогичное относительное количество диссоциированного rFSH (LMW-формы). Так как предел количественного определения метода SEC равен 3%, ниже этого предела не может быть однозначно установлены различия между композициями, что означает, что наблюдаемые различия среди LMW-форм в начальный момент времени находятся в пределах отклонений данного метода.
Уже после одного месяца хранения при 30±2°C/отн. вл. 65±5%, относительное количество диссоциированного rFSH увеличивалось в образцах, содержащий фенол вместе с сахарозой или без стабилизатора, тогда как образцы, содержащие сульфат натрия или хлорид натрия, не демонстрировали какого-либо значительного увеличения диссоциированного rFSH (смотри Таблицу 20).
Через шесть месяцев хранения при 30±2°C/отн. вл. 65+5% образец rFSH, содержащий фенол без добавленного стабилизатора, содержит более 20% диссоциированного rFSH (LMW-формы). Образцы rFSH, содержащие фенол и имеющие сахарозу в качестве стабилизатора, также показывают заметное увеличение диссоциированного rFSH (более 10% диссоциированного rFSH), тогда как образцы, содержащие фенол и стабилизированные или хлоридом натрия или сульфатом натрия, просто показывают незначительное увеличение диссоциированного rFSH (смотри Таблицу 20). Образцы, не содержащие никакого консерванта, являются наиболее стабильными по отношению к диссоциации во время хранения; однако для водной многодозовой композиции, предназначенной для парентерального применения, требуется добавление консерванта, поэтому эта композиция добавлена только в качестве сравнения.
Через шесть месяцев хранения при 5±3°C/отн. вл. окружающей среды ни одна из тестированных композиций rFSH не показывает увеличение относительного количества диссоциированного rFSH (смотри Таблицу 21). Однако, по меньшей мере 24 месяца хранения при 5°C и затем один месяц, предпочтительно 3-4 месяца хранения при комнатной температуры, требуются для того, чтобы коммерческий продукт rFSH был успешным.
ТЕМПЕРАТУРА ДЕНАТУРАЦИИ rFSH, ИЗМЕНЕНИЯ ВО ВТОРИЧНОЙ СТРУКТУРЕ И СТЕПЕНЬ ДИССОЦИАЦИИ
Так как целью данного примера являлось определение корреляции между данными исследования стабильности в реальном времени, определениями температуры денатурации rFSH посредством DSC и данными о вторичной структуре rFSH, определенные посредством спектроскопии CD, часть данных DSC (смотри Пример 2) и часть данных CD (смотри Пример 1) представлена ниже. Все подробности, касающиеся представленных результатов DSC, приведены в Примере 2 и подробности, касающиеся данных CD, приведены в Примере 1.
Как можно видеть в Таблице 22, температура денатурации rFSH, полученная посредством DSC, хорошо коррелирует с данными о стабильности в реальном времени через шесть месяцев хранения при 30±2°C/отн. вл. 65±5%, аналогичная корреляция между DSC и стабильностью в реальном времени, проанализированная посредством SEC, была представлена ранее для рекомбинантных антител и рекомбинантных гликопротеинов (смотри, например, Burton et al (2007), Pharm, Dev. Technol. 12:265-273 и Remmele et al. (1998), Pharm. Res. 15:200-208). Раствор rFSH без добавленного консерванта, стабилизированный сульфатом натрия показывает только низкую степень диссоциированного rFSH после хранения в течение шести месяцев, он также показывает значительно более высокую температуру денатурации, чем растворы, содержащие консервант. Кроме того, можно видеть, что для растворов, содержащих консервант (фенол), добавление соли, либо хлорида натрия, либо сульфата натрия, обеспечивает значительно более низкую степень диссоциированного rFSH через шесть месяцев хранения, чем в растворах, содержащих сахарозу или без стабилизатора. Температура денатурации rFSH без добавленного стабилизатора также значительно ниже, чем Гт rFSH для растворов, содержащих соль. Температура денатурации rFSH для растворов, содержащих сахарозу с добавлением фенола, не была определена, однако, как можно видеть в Таблице 23, измерения Tm rFSH для растворов без добавленного консерванта демонстрируют ту же тенденцию, что и данные по стабильности в реальном времени через шесть месяцев хранения при 30+2°C/отн. Вл. 65±5% (смотри Таблицу 22). В заключение, NaCl и Na2SO4 являются значительно лучшими стабилизаторами, чем сахароза, по отношению к разрушению структуры. Это продемонстрировано как посредством измерений Tm (смотри Таблицу 23), так и данными по стабильности в реальном времени (смотри Таблицу 22).
Данные по стабильности в реальном времени для растворов, содержащих бензиловый спирт в качестве консерванта, не были определены, однако при сравнении температуры денатурация rFSH, определенной посредством DSC, и изменений вторичной структуры rFSH при нагревании, определенных посредством спектроскопии CD, наблюдают такую же тенденцию (смотри Таблицу 24). Была определена вторичная структура rFSH для разных образцов белка; вторичную структуру, определенную при 24°C, можно рассматривать как нативную структуру, и здесь наблюдается отсутствие различий во вторичной структуре rFSH в растворах rFSH при добавлении либо бензилового спирта (0,17 мг/мл), либо сульфата натрия. Однако при нагревании растворов до 76,5°C наблюдаемая потеря вторичной структуры rFSH изменяется вместе с добавленными эксципиентами. Добавление консерванта (бензилового спирта) вызывает более значительную потерю вторичной структуры rFSH, чем в растворах rFSH, не содержащих никакого консерванта, в то время как добавление соли (сульфат натрия) обеспечивает меньшую потерю вторичной структуры rFSH, чем для растворов rFSH без добавленной соли. Потерю упорядоченной вторичной структуры rFSH можно интерпретировать как частичную или полную денатурацию белка.
Пример 4 - Данные дифференциальной сканирующей калориметрии (DSC) для hCG
Хорионический гонадотропин человека (hCG) представляет собой гетеродимерный белок, состоящий из двух гликолизированных мономеров: α-субъединицы из 92 аминокислот, которая является общей для hCG, фолликулостимулирующего гормона (FSH), лютеинизирующего гормона (LH) и тиреостимулирующего гормона (TSH), и β-субъединицы из 145 аминокислот, которая является специфической для hCG. Все гликопротеиновые гормоны, включающие FSH и hCG, утрачивают свою биологическую активность при диссоциации нековалентно связанных мономеров. Результаты анализов стабильности показали, что нестабильность рекомбинантного FSH (rFSH) главным образом основана на диссоциации димера (разрушение четвертичной структуры и сопутствующее уменьшение ответа иммуносвязывания).
Целью данного примера является установить наблюдается ли обнаруженная ранее зависимость температуры денатурации rFSH, определенной посредством DSC, описанная в примерах 1-3 выше, от различных Сахаров и солей, для очень похожего белка hCG. Кроме того, температуру денатурации hCG, определенную посредством DSC в данном исследовании, сравнивают с ранее опубликованными данными по стабильности в реальном времени (Samaritani, F. 1995, hCG liquid formulations. EP 0814841).
Температуру денатурации hCG изучали в присутствии и в отсутствие 0,1 М различных солей натрия или сахарозы в 1 мМ фосфатном буфере, содержащем 0,5 мг/мл L-метионина и 0,005 мг/мл полисорбата 20. Изучают четыре различные соли и сахар; сахарозу, сульфат натрия, хлорид натрия и перхлорат натрия.
Полученный из мочи хорионический гонадотропин человека (hCG)
Используют hCG, лекарственное вещество, партия №2823287510 (7059 МЕ/мг), очищенное из мочи человека, от Massone S.A., Argentina. Вещество хранили охлажденным при 2-8°C.
Определение биологической активности указанной выше партии hCG выполняли согласно Ph. Eur.
Использовали rFSH и дополнительные вещества, как описано в Примерах 2-3.

Состав разных композиций hCG приведен в Таблице 26
СПОСОБ ИЗГОТОВЛЕНИЯ
Все растворы (Таблица 26) изготавливают в лабораторном масштабе в Ferring Pharmaceuticals A/S, Копенгаген, Дания.
Получение композиций hCG
Исходные растворы всех эксципиентов готовят в воде Milli-Q. Растворы плацебо с различными эксципиентами получают из исходного раствора. Лекарственное вещество hCG растворяют в растворах плацебо с получением концентраций, приведенных в Таблице 26. Так как данные по стабильности этих композиции не были доступны, анализы DSC всегда выполняют на свежеприготовленных образцах; в пределах одного часа с момента получения образца.
Как можно видеть на Фиг.4 и в Таблице 27, температура денатурации, Гт, для hCG ниже, чем Tm для rFSH. Кроме того, энтальпия процесса денатурации (то есть величина пика денатурации) заметно меньше для hCG, чем для rFSH. В отличие от rFSH, где процесс денатурации является почти полностью необратимым после нагревания образцов rFSH до 100°C, процесс денатурации после нагревания hCG до 100°C является в значительной степени обратимым (2).
Нативный ↔ Развернутый → Необратимо денатурированный (2)
Объяснением того факта, что процесс денатурации hCG в значительной степени является обратимым в пределах периода времени DSC-измерений, хотя это и не является верным для rFSH, могло бы быть то, что две субъединицы в hCG менее расположены к диссоциации, чем в rFSH. Если субъединицы не диссоциируют при нагревании образцов hCG, нативная структура может легче восстановиться снова при охлаждении до комнатной температуры. Амплитуда ДН перехода при нагревании до 100°C заметно больше для rFSH, чем для hCG, в то время как амплитуда ЛН перехода в сопутствующем сканировании (то есть нагревание образца до 100°C, охлаждение до 25°C и выполнение второго сканирования до 100°C) находится в том же диапазоне величин для rFSH и hCG.
ВЛИЯНИЕ ДОБАВЛЕНИЯ САХАРА ИЛИ СОЛИ НА Tm hCG И rFSH
Ожидается, что добавление соли к водным растворам белка будет влиять на стабильность белка в растворе и, следовательно, оказывать влияние на температуру денатурации белка.
При измерении влияния различных солей натрия на Tm hCG и rFSH совершенно неожиданно при варьировании анионов не наблюдается стабилизирующий/дестабилизирующий эффект, ожидаемый в соответствии с рядом Гофмейстера, смотри Фиг.5, Фиг.6 и Таблицу 27. Для hCG и сульфат натрия, и хлорид натрия действительно дестабилизируют белок, в то время как для rFSH эти соли стабилизируют белок. Как для hCG, так и для rFSH перхлорат натрия, который, как ожидается, обладает дестабилизирующим влиянием на белки, в действительности увеличивает Tm больше всех тестируемых Сахаров и солей.
ВЛИЯНИЕ ДОБАВЛЕНИЯ САХАРА ИЛИ СОЛИ НА ЧИСТОТУ HCG И rFSH
Диссоциация субъединиц rFSH, чистота rFSH во время хранения
Так как rFSH утрачивает свою биологическую активность при диссоциации нековалентно связанных мономеров, простым путем отслеживания потери активности rFSH из-за диссоциации на мономеры является измерение количества LMW-форм rFSH в растворе. Эту информацию можно получить из SEC-хроматографии, где LMW-формы, элюирующиеся после главного пика rFSH, как известно, образованы диссоциированным rFSH.
В изученной композиции не наблюдаются другие родственные белковые соединения, таких как агрегаты rFSH. Следовательно, чистота белка rFSH может быть рассчитана как
Как можно видеть в Таблице 28, свежеприготовленные растворы rFSH, содержащие разные сахара или соли, в присутствии и в отсутствие добавленного консерванта демонстрируют аналогичную чистоту, то есть аналогичное относительное количество диссоциированного rFSH (LMW-формы).
Уже через один месяц хранения при 30°C чистота rFSH уменьшается для образцов, содержащих фенол вместе с сахарозой или без сахара или соли, тогда как образцы, содержащие фенол и сульфат натрия или хлорид натрия, наряду с образцами без добавленного фенола, не показывают какого-либо значительного уменьшения чистоты rFSH (смотри Таблицу 28). Через шесть месяцев хранения при 30°C образцы rFSH, содержащие фенол без добавленного сахара или соли, показывают чистоту rFSH менее 80%. Образцы rFSH, содержащие фенол и имеющие сахарозу в качестве стабилизатора, также показывают заметное уменьшение чистоты rFSH, тогда как образцы, содержащие фенол и стабилизированные либо хлоридом натрия, либо сульфатом натрия, показывают только незначительное уменьшение чистоты rFSH (смотри Таблицу 28). Образцы, не содержащие никакого консерванта, являются наиболее стабильными в отношении диссоциации во время хранения, то есть они показывают самую высокую чистоту, однако для водной многодозовой композиции, предназначенной для парентерального применения, требуется добавление консерванта.
Чистота hCG во время хранения
Опубликованные ранее данные об изменениях чистоты hCG при хранении используют в качестве сравнения с представленными выше данными по стабильности rFSH (Samaritani, выше). Уже через один месяц хранения при 50°C чистота hCG заметно уменьшается. Это уменьшение является значительно более высоким для образцов, содержащих хлорид натрия, чем для образцов, содержащих сахарозу (смотри Таблицу 29). Через шесть недель хранения при 50°C чистота образцов hCG, содержащих хлорид натрия, более чем на 10% ниже, чем для образцов, содержащих сахарозу.
СРАВНЕНИЕ Tm И ЧИСТОТЫ hCG И rFSH
Как можно видеть в Таблице 30, и для rFSH, и для hCG температура денатурации, полученная посредством DSC, хорошо коррелирует с чистотой rFSH и hCG, полученной из данных по стабильности в реальном времени. Аналогичная корреляция между DSC и стабильностью в реальном времени, проанализированная посредством SEC, присутствовала ранее для рекомбинантных антител и рекомбинантных гликопротеинов.
Данные по стабильности в реальном времени для rFSH определяют при 30°C. Так как продукт rFSH предназначен для длительного хранения в охлажденном состоянии, 25-30°C являются подходящим диапазоном для ускоренных исследований стабильности. Данные по стабильности в реальном времени для hCG доступны только в течение вплоть до 12 недель хранения при 50°C, 11 недель хранения при 25°C и 40°C и 6 недель хранения при 50°C. Для температур 40°C или ниже уменьшение чистоты hCG во время хранения составляет менее 6% как для композиций с сахарозой, так и с хлоридом натрия, и поэтому трудно разграничить эффекты различных сахаров и солей уже через 11-12 недель хранения. Только при 50°C разные композиции можно ясно дифференцировать, хотя тенденции, наблюдаемые при более низких температурах, такие же, как при 50°C.
** Образцы, содержащие 5 мг/мл (35300 МЕ/мл) hCG, 0,1 М сахара или соли, 0,5 мг/мл L-метионина, 0,005 мг/мл Полисорбата 20, 1 мМ натрий-фосфатный буфер, pH 6,5.
## Образцы, содержащие 2,4 мг/мл (36 300 МЕ/мл) rFSH, 0,1 М сахара или соли, 0,5 мг/мл L-метионина, 0,005 мг/мл Полисорбата 20, 1 мМ натрий-фосфатный буфер pH 6,5.
ВЫВОДЫ
Исследования стабильности hCG и rFSH в различных растворах с использованием температур денатурации hCG и rFSH, а также чистоты hCG и rFSH после хранения при повышенных температурах однозначно свидетельствуют о влиянии разных Сахаров и солей на стабильность hCG и rFSH в растворе. Два используемых метода, DSC в жидкой среде и SEC-хроматография, оба показывают согласующиеся результаты. Эти результаты были ясно подтверждены настоящими данными о стабильности в реальном времени.
Исследования стабильности rFSH в разных растворах с использованием изменений во вторичной структуре rFSH (посредством спектроскопии CD -Пример 1), температуры денатурации rFSH (изменения в третичной и четвертичной структуре согласно DSC - Пример 2) или относительного количества диссоциированного rFSH, образовавшегося после хранения при 30±2°C/отн. вл. 65±5% (изменения в четвертичной структуре согласно SEC - Пример 3) однозначно свидетельствуют о влиянии консервантов и стабилизаторов на стабильность rFSH в растворе. Три используемых метода, CD, DSC и SEC-хроматография, все показывают согласующиеся результаты. Делая вывод из результатов всех Примеров 1-3, ясно видно, что добавление консерванта, фенола или бензилового спирта, уменьшает стабильность rFSH в растворе. Другие фенольные консерванты, такие как м-крезол и хлоркрезол, как ожидается, вызывают аналогичные дестабилизирующие эффекты. Дестабилизирующий эффект, наблюдаемый для rFSH при добавлении консерванта, соответствует современному состоянию знаний в данной области.
Добавление фармацевтически приемлемой соли щелочного металла Na+ или K+ к растворам rFSH нейтрализует дестабилизирующее влияние консервантов на rFSH и - наиболее благоприятно - увеличивает стабильность rFSH в растворе по сравнению с растворами rFSH, не содержащими ни консервант, ни соль. Все тестируемые соли натрия и калия обеспечивают повышенную стабильность rFSH независимо от используемых анионов; например неорганических анионов, таких как сульфат, хлорид и перхлорат, а также использования органических анионов, таких как цитрат, ацетат и тартрат. Варьирование катиона солей оказывает значительное влияние на степень стабилизации rFSH; одновалентные катионы, конкретно соли с катионами натрия или калия, оказывают выраженное стабилизирующее влияние на rFSH. Добавление перхлората натрия к раствору rFSH обеспечивает наиболее стабильные растворы rFSH, однако перхлораты обычно являются чрезвычайно реакционно-способными и окисляющими агентами и поэтому перхлораты не одобрены в качестве инертных ингредиентов в фармацевтических композициях. Поэтому соли натрия или соли калия с сульфатом и хлоридом являются наиболее подходящими стабилизирующими агентами.
Добавление сахарозы к растворам hCG или rFSH обеспечивает незначительное повышение стабильности белка, как hCG, так и rFSH, в то время как добавление хлорида натрия оказывает дестабилизирующее влияние на hCG и стабилизирующее влияние на rFSH (смотри пример 4). Добавление перхлората натрия к растворам hCG и rFSH оказывает стабилизирующее влияние как на hCG, так и на rFSH (пример 4). Стабилизирующее влияние этих солей на растворы rFSH неожиданно является несомненно лучшим, чем стабилизирующий эффект, наблюдаемый для сахарозы.
Выводы из этих результатов следующие:
1) в исследуемых условиях влияние солей на стабильность hCG и rFSH не следует ряду Гофмейстера.
2) несмотря на то, что hCG и FSH структурно являются очень похожими (то есть они принадлежат к одному и тому же классу белков, они оба являются гликолизированными, и они оба состоят из двух субъединиц, из которых α-субъединица является идентичной в двух белках), влияние различных Сахаров и солей, таких как сахароза и хлорид натрия, на стабильность белка различно для hCG и rFSH. Очень неожиданно, для очень похожих белков, таких как hCG и rFSH, соли не оказывают одинакового стабилизирующего влияния.
3) соли Na+ и K+ оказывают свое стабилизирующее влияние на растворы FSH, независимо от используемых анионов.
4) стабилизирующее влияние солей Na+- и K+ на растворы FSH может противодействовать дестабилизирующему эффекту консервантов.
СОКРАЩЕНИЯ И ОПРЕДЕЛЕНИЯ
Следующие сокращения и определения использованы в тексте и в Примерах:
ΔTm - изменение температуры денатурации при добавлении консерванта или соли, смотри далее Tm
ART - вспомогательные репродуктивные технологии
ВА - бензиловый спирт
BTG - Bio-Technology General
CD - круговой дихроизм
СНО - яичники китайского хомяка
СоА - сертификат анализа
ДНК - Дезоксирибонуклеиновая кислота
DSC - дифференциальная сканирующая калориметрия
FSD - женская половая дисфункция
FSH - фолликулостимулирующий гормон
hCG - хорионический гонадотропин человека
ME - Международные Единицы. Измерение биологической активности rFSH, определенной посредством биотеста Стилман-Поули (Sleelman-Pohley) согласно Ph. Eur. и USP.
IUI - внутриматочная инсеминация
LC-UV - жидкостная хроматография с ультрафиолетовым обнаружением
LH - лютеинизирующий гормон
LMW - низкомолекулярная форма, состоит главным образом или только из диссоциированного мономерного белка.
OI - индукция овуляции
ч.д.а. - Чистый для анализа
Ph. Eur. - Европейская Фармакопея
отн.вл. - Относительная влажность
rFSH - Рекомбинантный фолликулостимулирующий гормон человека
SEC - эксклюзионная хроматография
SRCD - спектроскопия кругового дихроизма с применением синхротронного излучения
Tm - Средняя точка теплового перехода или средняя точка перехода или температура денатурации
Температура, при которой половина молекул белка свернута, а половина молекул белка развернута.
TRIS - 2-амино-2-гидроксиметил-пропан-1,3-диол
TSH - тиреостимулирующий гормон
USP - Фармакопея Соединенных Штатов
УФ - Ультрафиолетовое излучение.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЖИДКИЙ СОСТАВ ФОЛЛИКУЛОСТИМУЛИРУЮЩЕГО ГОРМОНА | 2011 |
|
RU2553375C2 |
| Способы очистки и/или вирусной инактивации | 2016 |
|
RU2719468C2 |
| ЖИДКИЙ СОСТАВ ПОЛИПЕПТИДОВ, СОДЕРЖАЩИХ FC-ДОМЕН ИММУНОГЛОБУЛИНА | 2011 |
|
RU2600847C2 |
| СТАБИЛЬНАЯ ЖИДКАЯ КОМПОЗИЦИЯ ЭТАНЕРЦЕПТА | 2012 |
|
RU2575619C2 |
| Жидкая композиция конъюгата инсулинотропного пептида длительного действия | 2013 |
|
RU2671576C2 |
| Композиция для лечения бесплодия | 2016 |
|
RU2704252C2 |
| ВОДНАЯ КОМПОЗИЦИЯ РЕКОМБИНАНТНОГО ФОЛЛИКУЛОСТИМУЛИРУЮЩЕГО ГОРМОНА ЧЕЛОВЕКА (ВАРИАНТЫ) | 2015 |
|
RU2599031C1 |
| ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ КОМБИНАЦИИ hGH И rhIGF-1 | 2010 |
|
RU2558821C2 |
| СТАБИЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ОСНОВЕ АНТИТЕЛА К PD-1 И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2016 |
|
RU2731418C2 |
| ЖИДКИЕ СОСТАВЫ ДЛЯ КОНЪЮГАТА ЭРИТРОПОЭТИНА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2011 |
|
RU2682720C2 |

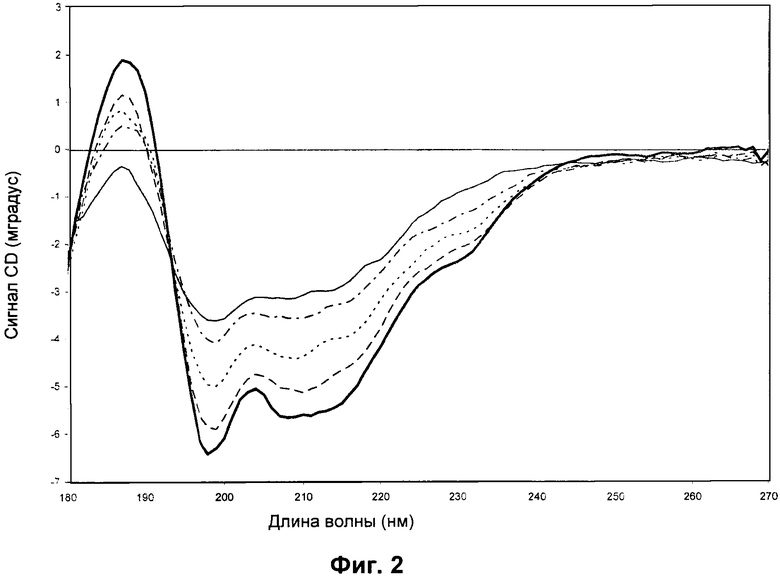
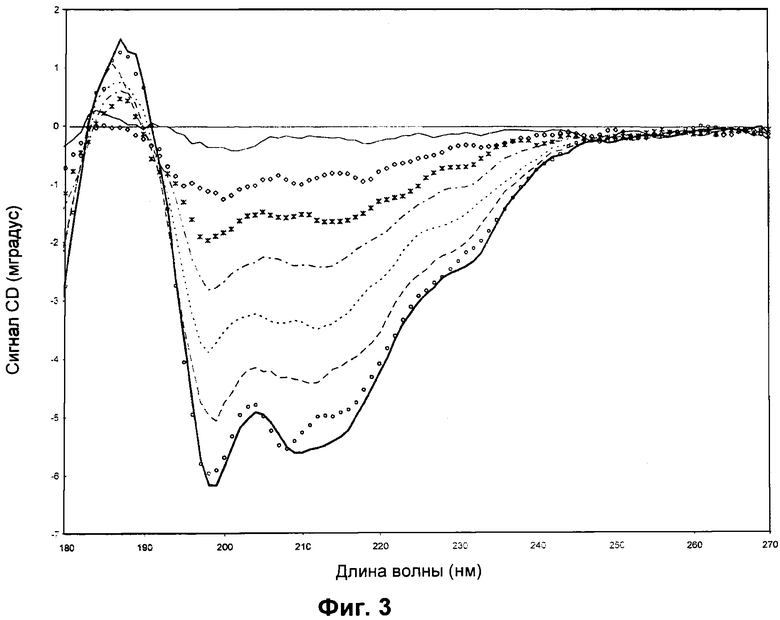
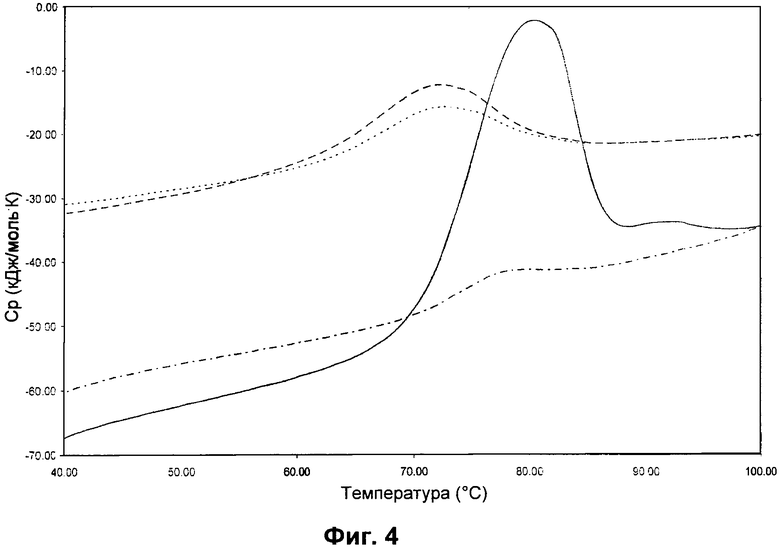
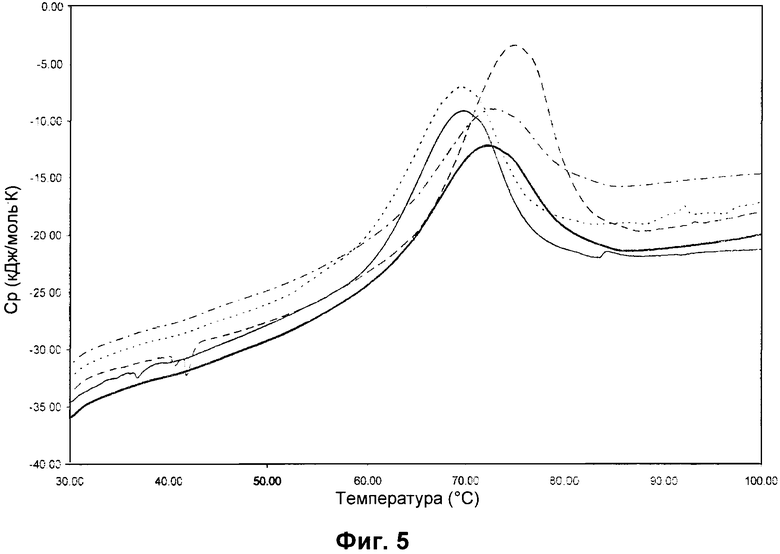
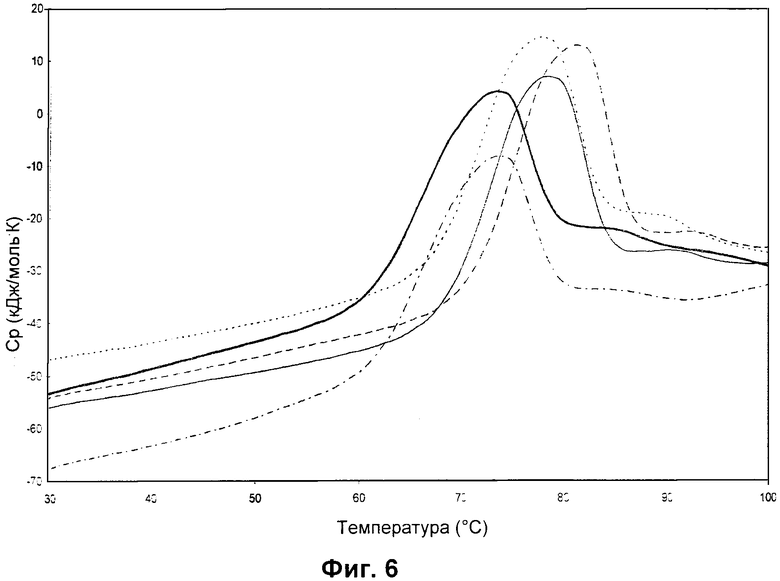
Группа изобретений относится к области стабилизации жидких композиций фолликулостимулирующего гормона (FSH). Предложено применение сернокислого натрия или его комбинации с хлористым натрием для стабилизация жидкой композиции FSH и способ ограничения тенденции FSH к диссоциации в жидкой композиции. FSH теряет биологическую активность при диссоциации нековалентно связанных мономеров. Технический результат состоит в реализации заявленных назначений, что обеспечивает сохранность готовых композиций FSH по меньшей мере 24 месяца при хранении при температуре 5°С или 3-4 месяца при хранении при комнатной температуре. 2 н. и 11 з.п. ф-лы, 6 ил., 30 табл.
1. Применение солей, содержащих фармацевтически приемлемые катионы щелочных металлов, для ограничения тенденции фолликулостимулирующего гормона (FSH) к диссоциации в жидкой композиции FSH, где соль выбрана из группы, состоящей из Na2SO4 или комбинации Na2SO4 и NaCl.
2. Применение по п. 1, где соль представляет собой Na2SO4.
3. Применение по п. 1, где соль представляет собой комбинацию Na2SO4 и NaCl.
4. Применение по п. 1, где соль содержится в количестве от 20 до 500 мМ, или в количестве 30-300 мМ, или в количестве 50-200 мМ.
5. Применение по п. 1, где композиция FSH представляет собой композицию рекомбинантного фолликулостимулирующего гормона (rFSH).
6. Применение по п. 1, где композиция дополнительно содержит консервант.
7. Применение по п. 6, где композиция содержит бензиловый спирт, фенол и/или мета-крезол.
8. Применение по любому из пп. 1-7, где композиция представляет собой инъекционную композицию.
9. Способ ограничения тенденции фолликулостимулирующего гормона (FSH) к диссоциации в жидкой композиции FSH, включающий стадию добавления солей, содержащих фармацевтически приемлемые катионы щелочных металлов, к указанной композиции, где указанные соли выбраны из группы, состоящей из Na2SO4 или комбинации Na2SO4 и NaCl.
10. Способ по п. 9, где соли определены, как в пп. 2-4 выше.
11. Способ по п. 9, где FSH представляет собой рекомбинантный фолликулостимулирующий гормон (rFSH).
12. Способ по любому из пп. 9-11, где композиция дополнительно содержит консервант.
13. Способ по п. 12, где консервант выбран из группы, состоящей из бензилового спирта, фенола и м-крезола.
| Импульсный стабилизатор постоянного напряжения | 1981 |
|
SU974359A2 |
| ЖИДКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ГОНАДОТРОПИН | 1998 |
|
RU2203086C2 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Способ получения кислотного раствора | 1976 |
|
SU607001A1 |
| СРЕДСТВО ДЛЯ ДОСТАВКИ, ОБЕСПЕЧИВАЮЩЕЕ НЕПРЕРЫВНОЕ И/ИЛИ РЕГУЛИРУЕМОЕ ВЫСВОБОЖДЕНИЕ БИОЛОГИЧЕСКИ АКТИВНЫХ АГЕНТОВ | 1997 |
|
RU2208582C2 |
Авторы
Даты
2016-01-27—Публикация
2011-07-28—Подача