ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к ингибитору тирозиназы, полученному с использованием сухого порошка из дождевых червей, и к способу получения ингибитора тирозиназы. Более конкретно, настоящее изобретение относится к безопасному и высокоэффективному ингибитору тирозиназы, полученному с использованием сухого порошка из дождевых червей, и к способу получения ингибитора тирозиназы.
УРОВЕНЬ ТЕХНИКИ
В то время как средства против старения кожи становятся все более востребованными в связи с продолжающимся в последнее время старением общества, интерес к красоте собственной кожи значительно возрастает и у молодых людей. В связи с этим возрастает важность косметических средств, особенно средств для отбеливания кожи.
Внутренние факторы, такие как старение, и внешние факторы, такие как ультрафиолет и активный кислород, вызывают истощение различных функций кожи, которые изначально поддерживались, что приводит к возникновению различных проблем. Примером кожных проблем является пигментация кожи, обусловленная пятнами, веснушками, солнечными ожогами и тому подобным. Считают, что основной причиной пигментации является образование предшественника меланина в результате ферментативной реакции тирозина, присутствующего в коже, с последующим образованием меланина вследствие окисления.
Вещества, подавляющие выработку меланина, можно условно разделить на два вида. Одним из них является тот, который непосредственно подавляет саму активность фермента тирозиназы, влияющего на выработку меланина, а другим является тот, который не подавляет непосредственно активность тирозиназы, но подавляет образование меланина в пигментных клетках. Существуют также вещества, проявляющие обе активности. Примеры общеизвестных компонентов, которые обладают подавляющей выработку меланина активностью и эффективны для предотвращения или уменьшения пигментации, включают аскорбиновую кислоту, глутатион и гидрохинон, а также различные другие натуральные компоненты растительного происхождения, предложенные до настоящего времени (например, патентные документы 1 и 2).
С другой стороны, экстракты из дождевых червей и сухие порошки из дождевых червей использовали с древних времен, главным образом, в восточных странах в качестве профилактических средств и лекарственных средств против различных заболеваний, и примеры известных на сегодняшний день вариантов их применения включают использование в качестве средств для уменьшения камней в мочевом пузыре и средств, способствующих выведению камней из мочевого пузыря, лекарственных средств против желтухи, средств, стимулирующих родовую деятельность, тонизирующих средств, средств, способствующих росту волос, афродизиаков, жаропонижающих средств, противосудорожных лекарственных средств, средств, стимулирующих кровообращение, лекарственных средств против гемиплегии, непрямых анальгетиков, диуретиков, лекарственных средств против бронхиальной астмы и лекарственных средств против гипертензии.
В патентном документе 3 раскрыто, что экстракты из дождевых червей, полученные путем гидротермальной обработки с последующей экстракцией органическим растворителем или путем гидролитической экстракции, обладают способностью подавлять активность тирозиназы.
ДОКУМЕНТЫ, ИСПОЛЬЗОВАННЫЕ ПРИ ЭКСПЕРТИЗЕ ЗАЯВКИ
[Патентные документы]
[Патентный документ 1] Публикация японской нерассмотренной патентной заявки №2011-032173
[Патентный документ 2] Публикация японской нерассмотренной патентной заявки №2011-037764
[Патентный документ 3] Публикация японской нерассмотренной патентной заявки №S63-238009
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ С ПОМОЩЬЮ ИЗОБРЕТЕНИЯ
Однако среди веществ, которые подавляют выработку меланина, аскорбиновые кислоты являются проблематичными с точки зрения их стабильности. Они нестабильны в водных системах и могут вызывать изменения цвета или изменения запаха. Проблемы с тиоловыми соединениями, такими как глутатион, заключаются в том, например, что они имеют неприятный запах и легко окисляются. Кроме того, гидрохинон небезопасен для кожи.
Помимо этого, среди экстрактов из дождевых червей, описанных в вышеуказанном патентном документе 3, те, которые получены путем нагревания и измельчения дождевых червей с последующей экстракцией органическим растворителем, имеют проблему, связанную с остаточным органическим растворителем, а те, которые получены путем гидролитической экстракции (обработки ферментом), не являются предпочтительными с точки зрения смешивания с косметическими средствами или с наружными препаратами для кожи, которые наносят на кожу в течение длительного периода времени, поскольку, в конечном счете, экстракты получают путем обработки раствором цетилпиридиния хлорида или этанола. Кроме того, ингибирующая тирозиназу активность экстрактов дождевых червей, полученных способом, описанным в патентном документе 3, по-прежнему является неудовлетворительной.
Таким образом, целью настоящего изобретения является предложение способа получения ингибитора тирозиназы, позволяющего получать высокобезопасный ингибитор тирозиназы, обладающий превосходной ингибирующей тирозиназу активностью, и косметических средств, полученных с использованием ингибитора тирозиназы, полученного указанным способом.
В результате интенсивных исследований для решения вышеупомянутой проблемы авторы настоящего изобретения установили, что компонент из дождевых червей, полученный путем специальной обработки живых дождевых червей с последующим измельчением полученного продукта, обладает превосходной ингибирующей тирозиназу активностью, и тем самым осуществили настоящее изобретение.
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМ
Таким образом, способ получения ингибитора тирозиназы по настоящему изобретению включает этапы создания контакта живых дождевых червей с порошком гидроксикарбоновой кислоты, разбавления полученной смеси водой для доведения рН до 2-5 и последующего выдерживания полученной разведенной смеси в течение 3-180 минут, или создания контакта живых дождевых червей с водным раствором гидроксикарбоновой кислоты, имеющим рН 2-5, и последующего выдерживания полученной смеси в течение 3-180 минут; с последующим промыванием живых дождевых червей водой, измельчением промытых дождевых червей, и последующей лиофилизацией полученного измельченного продукта.
Способ получения ингибитора тирозиназы по настоящему изобретению предпочтительно включает этап создания контакта живых дождевых червей с хлорид(ами) по меньшей мере одного металла, выбранного из группы, состоящей из калия, натрия, магния и кальция, где этот этап выполняют до создания контакта живых дождевых червей с порошком гидроксикарбоновой кислоты или водным раствором гидроксикарбоновой кислоты.
Кроме того, способ получения ингибитора тирозиназы по настоящему изобретению предпочтительно включает этап выдерживания живых дождевых червей в освещенном месте в течение 10-50 часов и последующего отделения грязи, приставшей к поверхности их тела, где этот этап выполняют до создания контакта живых дождевых червей с порошком гидроксикарбоновой кислоты или водным раствором гидроксикарбоновой кислоты.
В способе получения ингибитора тирозиназы по настоящему изобретению лиофилизацию предпочтительно проводят путем замораживания измельченного продукта при температуре от -18°C до -35°C в течение 20-240 часов с последующей лиофилизацией полученного продукта в вакууме.
Кроме того, способ получения ингибитора тирозиназы по настоящему изобретению предпочтительно включает этап растворения лиофилизированного измельченного продукта в воде или водном растворе этанола с последующим удалением или отделением нерастворимой фракции.
Косметические средства по настоящему изобретению получают с использованием ингибитора тирозиназы, полученного любым из вышеуказанных способов получения ингибитора тирозиназы.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу получения ингибитора тирозиназы без применения органического растворителя или тому подобного, позволяющему получать высокобезопасный ингибитор тирозиназы, обладающий превосходной ингибирующей тирозиназу активностью.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
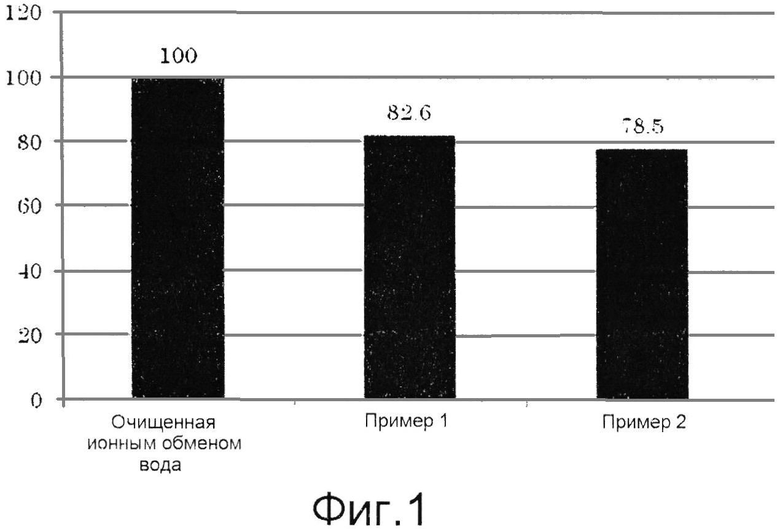
Фиг.1 представляет собой графическую диаграмму, демонстрирующую результаты примеров 1 и 2.
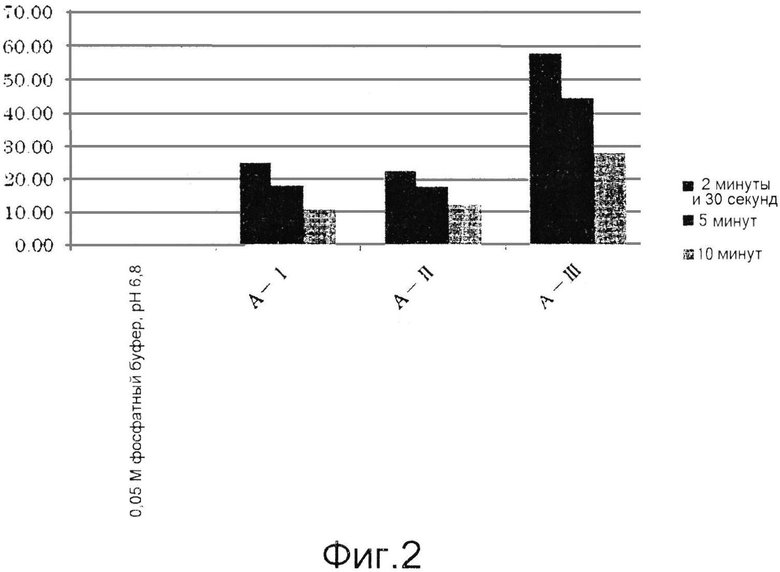
Фиг.2 представляет собой графическую диаграмму, демонстрирующую результаты примера 6.
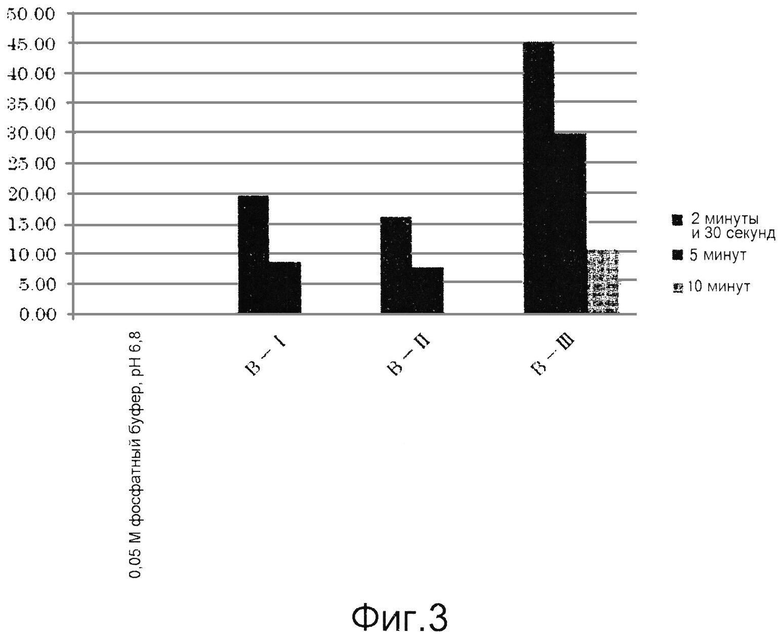
Фиг.3 представляет собой графическую диаграмму, демонстрирующую результаты примера 7.
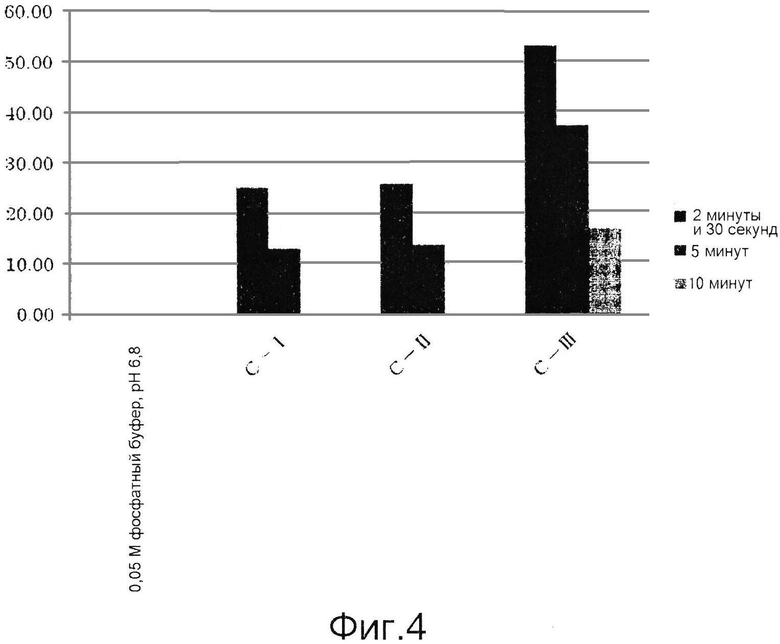
Фиг.4 представляет собой графическую диаграмму, демонстрирующую результаты примера 8.
Фиг.5 представляет собой графическую диаграмму, демонстрирующую результаты примера 9.
Фиг.6 представляет собой графическую диаграмму, демонстрирующую результаты примера 10.
Фиг.7 представляет собой графическую диаграмму, демонстрирующую результаты примера 10.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Способ получения ингибитора тирозиназы по настоящему изобретению включает этапы создания контакта живых дождевых червей с порошком гидроксикарбоновой кислоты, разбавления полученной смеси водой для доведения рН до 2-5 и последующего выдерживания полученной разведенной смеси в течение 3-180 минут, или создания контакта живых дождевых червей с водным раствором гидроксикарбоновой кислоты, имеющим рН 2-5, и последующего выдерживания полученной смеси в течение 3-180 минут; с последующим промыванием живых дождевых червей водой, измельчением промытых дождевых червей, и последующей лиофилизацией полученного измельченного продукта.
Кроме того, способ получения ингибитора тирозиназы по настоящему изобретению предпочтительно включает этапы создания контакта живых дождевых червей с хлоридом(ами) по меньшей мере одного металла, выбранного из группы, состоящей из калия, натрия, магния и кальция; а затем
создания контакта живых дождевых червей с порошком гидроксикарбоновой кислоты, разбавления полученной смеси водой для доведения рН до 2-5 и последующего выдерживания полученной разведенной смеси в течение 3-180 минут, или создания контакта живых дождевых червей с водным раствором гидроксикарбоновой кислоты, имеющим рН 2-5, и последующего выдерживания полученной смеси в течение 3-180 минут; с последующим промыванием живых дождевых червей водой, измельчением промытых дождевых червей, и последующей лиофилизацией полученного измельченного продукта.
Способ получения ингибитора тирозиназы по настоящему изобретению представляет собой способ, позволяющий получать высокобезопасный ингибитор тирозиназы, обладающий превосходной ингибирующей тирозиназу активностью, с использованием живых дождевых червей.
В способе получения по настоящему изобретению перед обработкой, заключающейся в помещении живых дождевых червей в дискомфортные условия, то есть перед созданием контакта живых дождевых червей с хлоридом(ами) металла или гидроксикарбоновой кислотой(ами), живых дождевых червей предпочтительно переносят в плоский контейнер, такой как контейнер для хлеба, и оставляют в освещенном месте на 10-50 часов, с последующим удалением грязи с поверхности их тел. Срок, в течение которого дождевых червей оставляют в освещенном месте, составляет, более предпочтительно, от 12 до 24 часов. Что касается количества дождевых червей, выдерживаемых в течение данного периода времени, то дождевых червей предпочтительно укладывают так, чтобы толщина слоя составляла примерно от 30 до 60 мм, предпочтительно примерно от 40 до 50 мм. В этот плоский контейнер не допускают попадания чужеродных веществ, таких как песок и грязь, и внутри контейнера предпочтительно поддерживают освещенность в ночное время за счет искусственного освещения или тому подобного, поскольку дождевые черви ведут ночной образ жизни и становятся активными в темное время суток, что может приводить к физическому истощению. В результате этой процедуры живые дождевые черви проявляют свой инстинкт самосохранения и выделяют продукты пищеварения, остающиеся в пищеварительном тракте, которыми полностью покрываются их тела для предотвращения испарения влаги и поддержания тем самым их среды обитания. Таким образом, путем периодического удаления этой покрывающей их грязи, то есть, экскрементов, соответствующим способом, можно в конечном итоге удалить продукты пищеварения из пищеварительного тракта и грязь, приставшую к поверхности тела.
Грязь, приставшую к поверхности тела дождевых червей, можно удалять, например, покрывая живых дождевых червей нетканым материалом, впитывающим грязь. За счет сочетания такого выдерживания дождевых червей в освещенном месте с последующим удалением грязи, приставшей к поверхности их тела, и создания контакта дождевых червей с хлоридом(ами) металла и/или гидроксикарбоновой кислотой(ами), можно ожидать дальнейшей экскреции и удаления токсических веществ из организма дождевых червей.
Хлорид(ы) металла, используемые в другом способе получения ингибитора тирозиназы по настоящему изобретению, представляет/представляют собой хлорид(ы) по меньшей мере одного металла, выбранного из группы, состоящей из калия, натрия, магния и кальция. То есть хлорид(ы) металла представляет/представляют собой по меньшей мере один вид, выбранный из группы, состоящей из хлорида калия, хлорида натрия, хлорида магния и хлорида кальция. Кроме того, хлорид(ы) металла могут представлять собой смесь двух или более из них, или могут представлять собой смесь одного или более из них и одного или более безвредных компонентов, которые можно добавлять к пище. Примеры такой смеси включают диетические соли, каменные соли и осадочные морские соли. Вышеописанный(е) хлорид(ы) металла можно использовать путем посыпания его/их порошком живых дождевых червей, и в результате этого создается контакт дождевых червей с хлоридом(ами) металла.
В другом способе получения ингибитора тирозиназы по настоящему изобретению предпочтительно, чтобы был создан контакт живых дождевых червей с гидроксикарбоновой кислотой(ами) после создания контакта живых дождевых червей с хлоридом(ами) металла. Альтернативно, способ получения ингибитора тирозиназы по настоящему изобретению можно осуществлять путем создания контакта живых дождевых червей с гидроксикарбоновой кислотой(ами) без создания контакта живых дождевых червей с хлоридом(ами) металла.
Контакт с гидроксикарбоновой кислотой(ами) можно также создавать путем посыпания порошком гидроксикарбоновой кислоты(кислот) живых дождевых червей. Альтернативно, живых дождевых червей можно погружать в водной раствор гидроксикарбоновой кислоты, имеющий рН 2-5. В случаях, когда контакт с гидроксикарбоновой кислотой(ами) создают после контакта с хлоридом(ами) металла, контакт с гидроксикарбоновой кислотой(ами) создают сразу после контакта с вышеописанным хлоридом(ами) металла.
Кроме того, перед созданием контакта живых дождевых червей с гидроксикарбоновой кислотой(ами) дождевых червей предпочтительно промывают водой. Удаление хлорида(ов) металла путем промывания водой с последующим созданием контакта живых дождевых червей с гидроксикарбоновой кислотой(ами) позволяет получать сухой порошок из дождевых червей, обладающий высокой ферментативной активностью. В случаях, когда дождевых червей промывают водой перед контактом с гидроксикарбоновой кислотой(ами), дождевых червей промывают водой предпочтительно в течение 30 минут, более предпочтительно в течение 20 минут после контакта с хлоридом(ами) металла. Способ промывания водой не имеет ограничений, и можно использовать любой известный способ.
В случаях, когда живые дождевые черви находятся в контакте с порошком гидроксикарбоновой кислоты(кислот) в течение длительного времени, их жизненные функции утрачиваются и продукты пищеварения из пищеварительного тракта не экскретируются. Вследствие этого, гидроксикарбоновую кислоту(ы) следует разводить водой как можно скорее, предпочтительно в течение 30 секунд, более предпочтительно в течение 20 секунд, чтобы довести рН до 2-5.
Поскольку гидроксикарбоновая (ые) кислота(ы) создает(ют) дискомфортную среду обитания для дождевых червей, живые дождевые черви пытаются улучшить среду обитания путем экскреции из организма жидкостей и экскрементов, следуя инстинкту самосохранения. Кроме того, поскольку гидроксикарбоновые кислоты обладают бактерицидными свойствами, предполагается, что они не только играют роль в стимуляции экскреции продуктов пищеварения и тому подобного из пищеварительного тракта, как описано выше, но также уничтожают бактерий на поверхности дождевых червей.
Кристаллическая гидроксикарбоновая кислота, используемая в способе по настоящему изобретению, не имеет ограничений по числу в ней гидрокси-групп и карбоксильных групп при условии, что гидроксикарбоновая кислота находится в виде кристаллического тела в условиях ее использования. То есть кристаллическая гидроксикарбоновая кислота может быть любой из моногидроксимонокарбоновой кислоты, моногидроксиполикарбоновой кислоты, полигидроксимонокарбоновой кислоты и полигидроксиполикарбоновой кислоты.
Примеры гидроксикарбоновой кислоты(кислот), используемой(мых) по настоящему изобретению, включают гликолевую кислоту, молочную кислоту, уксусную кислоту, β-гидроксипропионовую кислоту, α-гидрокси-н-масляную кислоту, β-гидрокси-н-масляную кислоту, α-гидрокси-н-валериановую кислоту, β-гидрокси-н-валериановую кислоту, яблочную кислоту, α-метиляблочную кислоту, α-гидроксиглутаровую кислоту, β-гидроксиглутаровую кислоту, лимонную кислоту, малоновую кислоту и янтарную кислоту. Среди них, молочная кислота, уксусная кислота, яблочная кислота, лимонная кислота, малоновая кислота и янтарная кислота являются предпочтительными в связи с тем, их можно использовать в пищу и можно легко получать. Один вид гидроксикарбоновой кислоты можно использовать самостоятельно, или можно использовать смесь из двух или более ее видов.
Вода составляет 65% всех компонентов тканей живых дождевых червей. Хотя защитные функции живых дождевых червей активны в течение определенного периода времени, гибель живых дождевых червей позволяет ферментам действовать, так что срок, на который живых дождевых червей помещают в дискомфортные условия, необходимо тщательно контролировать. Продолжительность этого срока варьирует в зависимости от условий и, как правило, находится в диапазоне 3-180 минут.
В настоящем изобретении живых дождевых червей, обработанных гидроксикарбоновой кислотой(ами), промывают водой и затем измельчают, получая измельченный продукт в виде жидкости или пасты. Промывание предпочтительно проводить чистой водой. Способ промывания не имеет ограничений и можно использовать любой известный способ промывания водой. Кроме того, общее количество времени, затраченное на этапы до измельчения, то есть, общее количество времени, затраченное на этапы от посыпания хлоридом(ами) металла живых дождевых червей до завершения вымывания гидроксикарбоновой кислоты(кислот) водой, предпочтительно составляет не более 240 минут.
Способ вышеописанного измельчения не имеет ограничений и, например, измельчение проводят при помощи гомогенизатора, блендера, смесителя-гомогенизатора, аппарата для измельчения, френч-пресса или тому подобного, как правило, при температуре от 1 до 25°C. С точки зрения подавления деградации составляющих компонентов дождевых червей, измельчение предпочтительно проводят при низкой температуре, предпочтительно при температуре от 2 до 15°C.
Измельченный продукт, полученный путем измельчения дождевых червей, помещают в лоток из нержавеющей стали и подвергают лиофилизации. Хотя ферменты, содержащиеся в организме живых дождевых червей, не действуют на живые клетки, они немедленно начинают действовать на мертвые клетки. Таким образом, в описанном выше способе существует риск образования септических газов. Для предотвращения образования септических газов измельченный продукт предпочтительно сразу же замораживают быстрым охлаждением до температуры от -18°C до -35°C, чтобы подавить действие ферментов, а затем подвергают лиофилизации.
Таким образом, измельчение дождевых червей без потери фармакологической активности требует быстрого замораживания, однако, с другой стороны, слишком быстрое замораживание не является предпочтительным, поскольку, в случаях, когда дождевые черви заморожены слишком быстро, примеси, присутствующие вместе с белками, которые являются основными компонентами пасты из дождевых червей, могут образовывать незамерзшие участки и не могут быть отделены. Вследствие этого, замораживание предпочтительно проводят при низкой температуре от -18°C до -35°C в течение 20-240 часов, более предпочтительно 50-170 часов.
Для лиофилизации важно выбирать условия, при которых примеси можно удалять без остатка вместе с водой. Таким образом, лиофилизацию предпочтительно проводят под контролем при давлении не более 50 Па и температуре от -60°C до +90°C, при этом температура повышается ступенчато в течение 10-60 часов.
Примеры способа лиофилизации включают способ, в котором измельченный продукт замораживают, как описано выше, при температуре от -18°C до -35°C в течение 20-240 часов, а затем температура повышается в несколько этапов в диапазоне от -60°C до +90°C и давление снижается в несколько этапов в диапазоне от 25 до 40 Па, при этом продукт лиофилизируется в вакууме в течение 10-60 часов, в результате получается стерильный бледно-желтый сухой порошок из дождевых червей.
Способ получения ингибитора тирозин-азы по настоящему изобретению предпочтительно дополнительно включает этап растворения лиофилизированного измельченного продукта в воде или водном растворе этанола с последующим удалением или отделением нерастворимой фракции. Удаление или отделение нерастворимой фракции можно проводить осаждением, оставляя раствор стоять таким же образом, как описано выше, или центрифугированием, фильтрованием или тому подобным. Растворение лиофилизированного измельченного продукта в воде или водном растворе этанола предпочтительно проводят при перемешивании или встряхивании. Количество времени, необходимое для растворения продукта в воде, предпочтительно составляет от 1 до 120 минут, более предпочтительно от 5 до 80 минут. Концентрация этанола в водном растворе этанола не имеет ограничений, и предпочтительно составляет от 10 до 70% (об./об.), более предпочтительно от 30 до 60%.
Форма ингибитора тирозиназы, полученного способом по настоящему изобретению, не имеет ограничений. То есть супернатант, полученный после растворения в воде или водном растворе этанола, как описано выше, можно использовать как есть, в состоянии водного раствора, или можно использовать после испарения воды для получения концентрата, или можно использовать после высушивания в форме порошка. Порошок, полученный путем высушивания супернатанта, можно использовать после растворения его в воде. Альтернативно, порошок, полученный лиофилизацией пасты из дождевых червей, можно использовать как есть, без растворения в воде или водном растворе этанола.
Дождевые черви, используемые в качестве сырья в способе по настоящему изобретению, не имеют ограничений, и примеры дождевых червей включают Lumbricus rubellus, Lumbricus terrestris, Eisenia foetida, Allolobophora caliginosa, Dendrobaena octaedra, Allolobophora japonica Michaelsen, Drawida hattamimizu Hatai, Pheretima divergens Michaelsen, Pheretima communissima, Pheretima agrestis, Pheretima sieboldi Horst, Pheretima hilgendorfi, Pontodrilus matsushimensis Iizuka, Tubifex hattai Nomura и Limnodrilus gotoi Hatai = L. Socialis Stephenson.
Косметические средства по настоящему изобретению содержат ингибитор тирозиназы, полученный способом получения ингибитора тирозиназы по настоящему изобретению. В результате действия ингибитора тирозиназы выработка меланина может быть подавлена, и можно ожидать эффекта улучшения внешнего вида кожи и эффекта предотвращения пигментации.
Виды косметических средств по настоящему изобретению не имеют ограничений. В зависимости от активности и эффектов активных компонентов ингибитора тирозиназы, ингибитор тирозиназы можно применять в любом косметическом средстве, в котором может проявляться его активность/эффект. Путем смешивания активного компонента(ов) по настоящему изобретению с основами для различных косметических средств, активный компонент(ы) можно применять в таких формах, как различные основные продукты по уходу за кожей, включая кремы, молочко для кожи, лосьоны для кожи, косметические маски и очищающие средства для лица; различные средства для макияжа, включая тональные кремы, помады, румяна и пудры; различные косметические средства по уходу за волосами, включая средства для мытья волос, средства для укрепления волос, шампуни и кондиционеры для волос; мыла; средства для маникюра; одеколоны; лосьоны; эмульсии; мази; золи; гели; порошки; спреи и твердые средства.
Содержание ингибитора тирозиназы по настоящему изобретению в каждом косметическом средстве не имеет ограничений, поскольку его можно изменять в зависимости от, например, вида косметического средства и способа применения косметического средства, В принципе, ингибитор тирозиназы может содержаться в эффективном количестве и, как правило, содержание ингибитора тирозиназы в композиции косметического средства составляет от 0,0001 до 100% по массе, предпочтительно от 0,01 до 10% по массе в пересчете на сухой вес.
Кроме того, ингибитор тирозиназы можно смешивать с добавками, обычно используемыми в косметических средствах, и/или другими активными компонентами. Примеры добавок и активных компонентов включают воду, этанол, масляные компоненты, увлажнители, загустители, антисептики, эмульгаторы, фармакологически активные компоненты, порошки, поглотители ультрафиолетового излучения, ароматизирующие вещества и стабилизаторы эмульсии.
ПРИМЕРЫ
Настоящее изобретение далее описано более подробно с помощью примеров.
Настоящее изобретение никоим образом не ограничивается приведенными ниже примерами.
[Получение сухого порошка из дождевых червей]
(Пример 1)
После выдерживания 30 кг живых червей Lumbricus rubellus в освещенном месте в течение 24 часов удаляли грязь, приставшую к поверхности их тел, с последующим распределением дождевых червей слоем толщиной примерно 5 см в плоскодонной кювете и посыпанием их 250 г лимонной кислоты. Через 15 секунд полученную смесь разбавляли, добавляя 30 литров чистой воды.
После посыпания порошком лимонной кислоты дождевые черви немедленно выпускали из тела желтую жидкость. После разбавления водой дождевых червей выдерживали в таком состоянии в течение 20 минут.
Затем живых дождевых червей вынимали из грязного водного раствора лимонной кислоты и промывали водой, после чего измельчали в гомогенизаторе при 10°C, получая пасту из дождевых червей. Затем эту пасту из дождевых червей дегазировали путем аспирации для удаления содержащегося в ней газа и переносили на лоток из нержавеющей стали, после чего сразу же быстро охлаждали до -35°C, при этой температуре пасту из дождевых червей выдерживали в течение 50 часов для медленного замораживания.
Замороженную пасту из дождевых червей выдерживали при -35°C и давлении 0 Па в течение 2 часов, а затем температуру повышали до 25°C с последующим высушиванием пасты при 40 Па в течение 10 часов; при 40°C и давлении 35 Па в течение 14 часов; при 65°C и давлении 35 Па в течение 12 часов и, наконец, при температуре 80°C и давлении 25 Па в течение 6 часов, тем самым проводя вакуумную лиофилизацию. Путем такой обработки получали бледно-желтый сухой порошок из дождевых червей с содержанием влаги 8% по массе.
(Пример 2)
После выдерживания 30 кг живых червей Lumbricus rubellus в освещенном месте в течение 24 часов удаляли грязь, приставшую к поверхности их тел, с последующим распределением дождевых червей слоем толщиной примерно 5 см в плоскодонной кювете и равномерным посыпанием их 250 г хлорида натрия. Через 20 минут дождевых червей промывали водой.
Затем таким же образом дождевых червей посыпали 250 г лимонной кислоты и через 15 секунд полученную смесь разбавляли добавлением 30 литров чистой воды. В это время значение рН сразу после добавления воды составляло 2,25, а после полного растворения значение рН составляло 2,74.
После посыпания порошком лимонной кислоты дождевые черви немедленно выпускали из тела желтую жидкость. После разбавления водой дождевых червей выдерживали в таком состоянии в течение 20 минут.
Затем живых дождевых червей вынимали из грязного водного раствора лимонной кислоты и промывали водой, после чего измельчали в гомогенизаторе при 10°C, получая пасту из дождевых червей. Затем эту пасту из дождевых червей дегазировали путем аспирации для удаления, содержащегося в ней газа и переносили на лоток из нержавеющей стали, после чего сразу же быстро охлаждали до -35°C, при этой температуре пасту из дождевых червей выдерживали в течение 50 часов для медленного замораживания.
Замороженную пасту из дождевых червей выдерживали при -35°C и давлении 0 Па в течение 2 часов, а затем температуру повышали до 25°C с последующим высушиванием пасты при 40 Па в течение 10 часов; при 40°C и давлении 35 Па в течение 14 часов; при 65°C и давлении 35 Па в течение 12 часов и наконец, при температуре 80°C и давлении 25 Па в течение 6 часов, тем самым проводя вакуумную лиофилизацию. Путем такой обработки получали бледно-желтый сухой порошок из дождевых червей с содержанием влаги 8% по массе.
К 1 г каждого сухого порошка из дождевых червей, полученному как описано выше, добавляли 20 мл очищенной ионным обменом воды, и полученную смесь перемешивали в течение 1 часа. Затем проводили центрифугирование (10000×g, комнатная температура, 15 минут) для отделения супернатанта, получая образец для измерений.
[Реагенты для измерений]
Для измерения ингибирующей тирозиназу активности использовали следующие реагенты.
Фосфатный буфер (фосфорная кислота + фосфат натрия, 0,05 М, рН 6,8)
Тирозиназа (из грибов, 50 Ед/мл в фосфатном буфере)
L-DOPA (2,5 мМ в фосфатном буфере)
[Метод измерения]
К 500 мкл фосфатного буфера добавляли 200 мкл тирозиназы и полученную смесь перемешивали. Затем туда добавляли 100 мкл вышеуказанного образца для измерения или очищенной ионным обменом воды (контроль), и полученную смесь инкубировали при 25°C в течение 3 минут. Затем 250 мкл L-DOPA добавляли к смеси, и полученную смесь перемешивали, после чего измеряли оптическую плотность при 490 нм. После начала измерения показатель оптической плотности наносили на график каждые 30 секунд на протяжении 10 минут измерения. Вычерчивали приблизительную линию от момента начала измерения до минуты 10 измерения, и рассчитывали наклон этой линии. Отношение наклона данной приблизительной линии к наклону, полученному в результате реакции с очищенной ионным обменом водой (контроль), представляли в виде графика, принимая последний наклон за 100. График приведен на фиг.1.
Как видно на фиг.1, ингибиторы тирозиназы по настоящему изобретению сильно ингибировали функцию тирозиназы. Тирозиназа обладает способностью превращать L-тирозин в L-DOPA и затем в L-допахинон. Поскольку затем пигмент меланин синтезируется из L-допахинона в процессе нескольких этапов реакций, ингибирование активности тирозиназы приводит к ингибированию синтеза меланина. Таким образом, ингибитор тирозиназы по настоящему изобретению подходит для применения в косметических средствах, особенно отбеливающих кожу косметических средствах.
(Справочный пример 1)
Способом, описанным в японской патентной публикации №2090412, получали лиофилизированный порошок из дождевых червей.
То есть после выдерживания 30 кг живых червей Lumbricus rubellus в освещенном месте в течение 24 часов, удаляли грязь, приставшую к поверхности их тел, с последующим распределением дождевых червей слоем толщиной примерно 5 см в плоскодонной кювете и добавлением туда 30 литров воды. Вслед за этим полученную смесь выдерживали в таком состоянии в течение 20 минут. Затем живых дождевых червей вынимали из воды и промывали водой, после чего измельчали в гомогенизаторе при 10°C, получая пасту из дождевых червей. Затем эту пасту из дождевых червей дегазировали путем аспирации для удаления содержащегося в ней газа и переносили на лоток из нержавеющей стали, после чего сразу же быстро охлаждали до -35°C, при этой температуре пасту из дождевых червей выдерживали в течение 50 часов для медленного замораживания.
Замороженную пасту из дождевых червей выдерживали при -35°C и давлении 0 Па в течение 2 часов, а затем температуру повышали до 25°C с последующим высушиванием пасты при 40 Па в течение 10 часов; при 40°C и давлении 35 Па в течение 14 часов; при 65°C и давлении 35 Па в течение 12 часов и наконец, при температуре 80°C и давлении 25 Па в течение 6 часов, тем самым проводя вакуумную лиофилизацию. Путем такой обработки получали бледно-желтый сухой порошок из дождевых червей с содержанием влаги 8% по массе.
Лиофилизированный порошок растворяли в 50% водном растворе этанола так, что соотношение этанол:лиофилизированный порошок составляло 20:1 (об./масс.), и полученный раствор встряхивали при комнатной температуре (25°C) со скоростью 1500 об/мин в течение 1 часа. Затем проводили центрифугирование при температуре 4°C при 10000×g в течение 15 минут для отделения супернатанта, и полученный супернатант концентрировали при пониженном давлении и температуре 75°C в течение 15 минут с последующей лиофилизацией полученного концентрата, получая лиофилизированный порошок A-I.
(Справочный пример 2)
Лиофилизированный порошок B-I получали таким же образом, как и в справочном примере 1, описанном выше, за исключением того, что очищенную ионным обменом воду использовали вместо 50% водного раствора этанола.
(Справочный пример 3)
Лиофилизированный порошок C-I получали таким же образом, как и в справочном примере 1, описанном выше, за исключением того, что очищенную ионным обменом воду использовали вместо 50% водного раствора этанола и не проводили завершающего концентрирования при пониженном давлении.
(Пример 3)
После промывания 30 кг живых червей Lumbricus rubellus водой для удаления приставшей к поверхности их кожи грязи дождевых червей распределяли слоем толщиной примерно 5 см в плоскодонной кювете и равномерно посыпали их 250 г лимонной кислоты. Через 15 секунд полученную смесь разбавляли, добавляя 30 литров чистой воды.
Затем дождевых червей, погруженных в разбавленную лимонную кислоту, выдерживали при 20°C в течение 60 минут. Вслед за этим живых дождевых червей вынимали из грязного водного раствора лимонной кислоты и промывали водой, после чего измельчали в гомогенизаторе при 10°C, получая пасту из дождевых червей. Затем эту пасту из дождевых червей дегазировали путем аспирации для удаления, содержащегося в ней газа и переносили на лоток из нержавеющей стали, после чего сразу же быстро охлаждали до -35°C, при этой температуре пасту из дождевых червей выдерживали в течение 50 часов для медленного замораживания.
Замороженную таким образом пасту из дождевых червей выдерживали при -30°C и пониженном давлении 5 Па в течение 10 часов, а затем высушивали при повышенной температуре 20°C и давлении 10 Па в течение 10 часов и затем при 40°C в течение 10 часов. И, наконец, пасту из дождевых червей выдерживали при температуре 80°C и давлении 5 Па в течение 5 часов для завершения вакуумной лиофилизации. Путем такой обработки получали бледно-желтый сухой порошок из дождевых червей с содержанием влаги 8% по массе.
Лиофилизированный порошок растворяли в 50% водном растворе этанола так, что соотношение этанол : Лиофилизированный порошок составляло 20:1 (об./масс.), и полученный раствор встряхивали при комнатной температуре (25°C) со скоростью 1500 об/мин в течение 1 часа. Затем проводили центрифугирование при температуре 4°C при 10000×g в течение 15 минут для отделения супернатанта, и полученный супернатант концентрировали при пониженном давлении и температуре 75°C в течение 15 минут с последующей лиофилизацией полученного концентрата, получая Лиофилизированный порошок А-II.
(Пример 4)
Лиофилизированный порошок В-II получали таким же образом, как и в примере 3, описанном выше, за исключением того, что очищенную ионным обменом воду использовали вместо 50% водного раствора этанола.
(Пример 5)
Лиофилизированный порошок С-II получали таким же образом, как и в примере 3, описанном выше, за исключением того, что очищенную ионным обменом воду использовали вместо 50% водного раствора этанола и не проводили завершающего концентрирования при пониженном давлении.
(Пример 6)
Таким же образом, как и в примере 2, описанном выше, получали бледно-желтый лиофилизированный порошок.
Лиофилизированный порошок растворяли в 50% водном растворе этанола так, что соотношение этанол : Лиофилизированный порошок составляло 20:1 (об./масс.), и полученный раствор встряхивали при комнатной температуре (25°C) со скоростью 1500 об/мин в течение 1 часа. Затем проводили центрифугирование при температуре 4°C при 10000×g в течение 15 минут для отделения супернатанта, и полученный супернатант концентрировали при пониженном давлении и температуре 75°C в течение 15 минут с последующей лиофилизацией полученного концентрата, получая Лиофилизированный порошок А-III.
(Пример 7)
Лиофилизированный порошок B-III получали таким же образом, как и в примере 6, описанном выше, за исключением того, что очищенную ионным обменом воду использовали вместо 50% водного раствора этанола.
(Пример 8)
Лиофилизированный порошок С-III получали таким же образом, как и в примере 6, описанном выше, за исключением того, что очищенную ионным обменом воду использовали вместо 50% водного раствора этанола и не проводили завершающего концентрирования при пониженном давлении.
К 0,1 г каждого из лиофилизированных порошков A-I, А-II, А-III, B-I, B-II, B-III, C-I, C-II и C-III добавляли фосфатный буфер так, что порошок содержался в нем в концентрации 0,05 г/мл. Полученный раствор встряхивали (1500 об/мин, 25°C, 1 час) и затем центрифугировали (10000×g, 4°C, 15 минут), собирая супернатант в качестве образца для измерения.
Готовили растворы тирозиназы (Sigma-Aldrich Co., из грибов) и L-DOPA (NACALAI TESQE, INC.) в фосфатном буфере так, что была достигнута заранее определенная концентрация (2,5 мМ). Смесь 0,5 мл фосфатного буфера, 0,2 мл тирозиназы (250 Ед/мл) и 0,1 мл образца для измерения инкубировали с использование спектрофотометра при 37°C в течение 3 минут.
Измерение начинали через 2 минуты и 48 секунд после начала инкубации, и 0,25 мл L-DOPA (2,5 мМ) добавляли к смеси в минуту 3 с последующей инкубацией полученной смеси при 37°C в течение 10 минут, при этом измеряя оптическую плотность при 490 нм (каждые 10 секунд).
На основании результатов измерения рассчитывали степень ингибирования (%) активности тирозиназы с помощью уравнений, приведенных ниже (приведенные ниже уравнения демонстрируют случай со значением, измеренным в минуту 5).
At: Увеличение оптической плотности раствора для измерения, содержащего тирозиназу и L-DOPA, на протяжении периода времени от 30 секунд после начала измерения до 5 минут и 30 секунд после начала измерения.
Ас: Увеличение оптической плотности раствора для измерения, содержащего тирозиназу, но не содержащего L-DOPA, на протяжении периода времени от 30 секунд после начала измерения до 5 минут и 30 секунд после начала измерения.
At0: Увеличение оптической плотности раствора для измерения, не содержащего тирозиназу, но содержащего L-DOPA, на протяжении периода времени от 30 секунд после начала измерения до 5 минут и 30 секунд после начала измерения.
Ас0: Увеличение оптической плотности раствора для измерения, не содержащего ни тирозиназу, ни L-DOPA, на протяжении периода времени от 30 секунд после начала измерения до 5 минут и 30 секунд после начала измерения.
Степень активности (%)=([At]-[At0])/([Ас]-[Ас0])×100
Степень ингибирования активности тирозиназы (%) = 100-степень активности.
Полученные результаты приведены ниже в таблицах 1-3 и на фиг.2-4. В каждой таблице «0,05 М фосфатный буфер, рН 6,8» соответствует контролю, полученному с использованием фосфатного буфера вместо образца для измерения.
Как видно из таблиц 1-3, приведенных выше, и фиг.2-4, ингибиторы тирозиназы, состоящие из лиофилизированного порошка из дождевых червей, полученного способом по настоящему изобретению, проявляли ингибирующую активность в отношении тирозиназы. Ингибиторы, полученные способами, включающими этап создания контакта живых дождевых червей с солью металла и гидроксикарбоновой кислотой до их измельчения, обладали особенно высокими ингибирующими тирозиназу активностями.
(Сравнительный пример 1)
Способом, описанным в публикации японской нерассмотренной патентной заявки № S63-238009, живых дождевых червей (90,0 г) нагревали в горячей воде примерно при 80°C в течение 20 минут и промывали водопроводной водой. После слива воды дождевых червей обрабатывали при помощи миксера, получая пасту из дождевых червей.
Пасту растворяли в 50% водном растворе этанола так, что соотношение этанол : паста составляло 10:1 (об./масс.), и полученную смесь выдерживали при низкой температуре 5-10°C при перемешивании в течение 2 недель. Затем проводили центрифугирование при температуре 4°C при 10000×g в течение 15 минут. Супернатант отделяли и затем концентрировали при пониженном давлении при 75°C в течение 15 минут с последующей лиофилизацией полученного концентрата, получая лиофилизированный порошок D-I.
(Пример 9)
Таким же образом, как и в примере 2, описанном выше, получали бледно-желтый лиофилизированный порошок.
Лиофилизированный порошок растворяли в 50% водном растворе этанола так, что соотношение этанол : лиофилизированный порошок составляло 10:1 (об./масс.), и полученную смесь выдерживали при низкой температуре 5-10°C при перемешивании в течение 2 недель. Затем проводили центрифугирование при температуре 4°C при 10000×g в течение 15 минут. Супернатант отделяли и затем концентрировали при пониженном давлении при 75°C в течение 15 минут с последующей лиофилизацией полученного концентрата, получая лиофилизированный порошок D-II.
(Справочный пример 4)
Таким же образом, как и в справочном примере 1, получали лиофилизированный порошок из дождевых червей способом, описанным в японской патентной публикации №2090412.
Лиофилизированный порошок растворяли в 50% водном растворе этанола так, что соотношение этанол : лиофилизированный порошок составляло 10:1 (об./масс.), и полученную смесь выдерживали при низкой температуре 5-10°C при перемешивании в течение 2 недель. Затем проводили центрифугирование при температуре 4°C при 10000×g в течение 15 минут. Супернатант отделяли и затем концентрировали при пониженном давлении при 75°C в течение 15 минут с последующей лиофилизацией полученного концентрата, получая лиофилизированный порошок D-III.
К 0,1 г каждого из лиофилизированных порошков D-I, D-II и D-III добавляли фосфатный буфер так, что порошок содержался в нем в концентрации 0,05 г/мл. Полученный раствор встряхивали (1500 об/мин, 25°C, 1 час) и затем центрифугировали (10000×g, 4°C, 15 минут), собирая Супернатант в качестве образца для измерения.
Готовили растворы тирозиназы (Sigma-Aldrich Co., из грибов) и L-DOPA (NACALAI TESQE, INC.) в фосфатном буфере так, что была достигнута заранее определенная концентрация (2,5 мМ). Смесь 0,5 мл фосфатного буфера, 0,2 мл тирозиназы (250 Ед/мл) и 0,1 мл образца для измерения инкубировали с использованием спектрофотометра при 37°C в течение 3 минут.
Измерение начинали через 2 минуты и 48 секунд после начала инкубации, и 0,25 мл L-DOPA (2,5 мМ) добавляли к смеси в минуту 3 с последующей инкубацией полученной смеси при 37°C в течение 10 минут, при этом измеряя оптическую плотность при 490 нм (каждые 10 секунд).
На основании результатов измерения рассчитывали степень ингибирования (%) активности тирозиназы с помощью уравнений, приведенных ниже (приведенные ниже уравнения демонстрируют случай со значением, измеренным в минуту 5).
At: Увеличение оптической плотности раствора для измерения, содержащего тирозиназу и L-DOPA, на протяжении периода времени от 30 секунд после начала измерения до 5 минут и 30 секунд после начала измерения.
Ас: Увеличение оптической плотности раствора для измерения, содержащего тирозиназу, но не содержащего L-DOPA, на протяжении периода времени от 30 секунд после начала измерения до 5 минут и 30 секунд после начала измерения.
At0: Увеличение оптической плотности раствора для измерения, не содержащего тирозиназу, но содержащего L-DOPA, на протяжении периода времени от 30 секунд после начала измерения до 5 минут и 30 секунд после начала измерения.
Ас0: Увеличение оптической плотности раствора для измерения, не содержащего ни тирозиназу, ни L-DOPA, на протяжении периода времени от 30 секунд после начала измерения до 5 минут и 30 секунд после начала измерения.
Степень активности (%)=([At]-[At0])/([Ac]-[Ac0])×100
Степень ингибирования активности тирозиназы (%) = 100 степень активности.
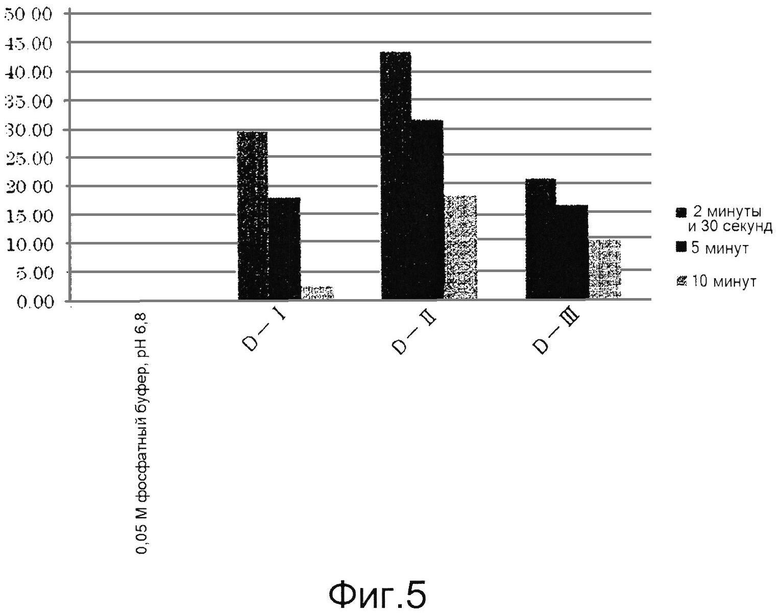
Результаты приведены ниже в таблице 4 и на фиг.5. В каждой таблице «0,05 М фосфатный буфер, рН 6,8» соответствует контролю, полученному с использованием фосфатного буфера вместо образца для измерения.
Как видно из таблицы 4, приведенной выше, и фиг.5, ингибиторы тирозиназы, состоящие из лиофилизированного порошка из дождевых червей, полученного способом по настоящему изобретению, особенно способом, включающим этап создания контакта живых дождевых червей с солью металла и гидроксикарбоновой кислотой (D-II) до их измельчения, обладали более высокими ингибирующими тирозиназу активностями, чем ингибитор тирозиназы, полученный способом, описанным в публикации японской нерассмотренной патентной заявки № S63-238009 (D-I).
(Сравнительный пример 2)
Способом, описанным в публикации японской нерассмотренной патентной заявки № S63-238009, живых дождевых червей (90,0 г) нагревали в горячей воде примерно при 80°C в течение 20 минут и промывали водопроводной водой. После слива воды дождевых червей обрабатывали при помощи миксера, получая пасту из дождевых червей.
Пасту растворяли в очищенной ионным обменом воде так, чтобы соотношение очищенная ионным обменом вода : паста составляло 10:1 (об./масс.), с последующим добавлением в смесь хлороформа в количестве 50% по отношению к добавленной очищенной ионным обменом воде. Полученную смесь встряхивали и затем выдерживали при низкой температуре 5-10°C в течение 24 часов. Затем водный слой удаляли, и в смесь добавляли 50% водный раствор этанола в количестве 90% по отношению к количеству водного слоя. Полученную смесь перемешивали и выдерживали при низкой температуре 5-10°C в течение 24 часов. Затем проводили центрифугирование при температуре 4°C при 10000×g в течение 15 минут. Слой осадка отделяли и лиофилизировали, получая лиофилизированный порошок E-I. С другой стороны, супернатант концентрировали при пониженном давлении при 75°C в течение 15 минут с последующей лиофилизацией полученного концентрата, получая лиофилизированный порошок F-I.
(Пример 10)
Используя 90,0 г живых дождевых червей, получали бледно-желтый лиофилизированный порошок таким же образом, как и в примере 2, описанном выше.
Лиофилизированный порошок растворяли в очищенной ионным обменом воде так, чтобы соотношение очищенная ионным обменом вода : лиофилизированный порошок составляло 10:1 (об./масс.), с последующим добавлением в смесь хлороформа в количестве 50% по отношению к добавленной очищенной ионным обменом воде. Полученную смесь встряхивали и затем выдерживали при низкой температуре 5-10°C в течение 24 часов. Затем водный слой удаляли, и в смесь добавляли 50% водный раствор этанола в количестве 90% по отношению к количеству водного слоя. Полученную смесь перемешивали и выдерживали при низкой температуре 5-10°C в течение 24 часов. Затем проводили центрифугирование при температуре 4°C при 10000×g в течение 15 минут. Слой осадка отделяли и лиофилизировали, получая лиофилизированный порошок Е-II. С другой стороны, супернатант концентрировали при пониженном давлении при 75°C в течение 15 минут с последующей лиофилизацией полученного концентрата, получая лиофилизированный порошок F-II.
(Справочный пример 5)
Таким же образом, как и в справочном примере 1, получали лиофилизированный порошок из дождевых червей способом, описанным в японской патентной публикации №2090412.
Лиофилизированный порошок растворяли в очищенной ионным обменом воде так, чтобы соотношение очищенная ионным обменом вода : лиофилизированный порошок составляло 10:1 (об./масс.), с последующим добавлением в смесь хлороформа в количестве 50% по отношению к добавленной очищенной ионным обменом воде. Полученную смесь встряхивали и затем выдерживали при низкой температуре 5-10°C в течение 24 часов. Затем водный слой удаляли, и в смесь добавляли 50% водный раствор этанола в количестве 90% по отношению к количеству водного слоя. Полученную смесь перемешивали и выдерживали при низкой температуре 5-10°C в течение 24 часов. Затем проводили центрифугирование при температуре 4°C при 10000×g в течение 15 минут. Слой осадка отделяли и лиофилизировали, получая лиофилизированный порошок Е-III. С другой стороны, супернатант концентрировали при пониженном давлении при 75°C в течение 15 минут с последующей лиофилизацией полученного концентрата, получая лиофилизированный порошок F-III.
К 0,1 г каждого из лиофилизированных порошков E-I, Е-II, Е-III, F-I, F-II и F-III добавляли фосфатный буфер так, что порошок содержался в нем в концентрации 0,05 г/мл. Полученный раствор встряхивали (1500 об/мин, 25°C, 1 час) и затем центрифугировали (10000×g, 4°C, 15 минут), собирая супернатант в качестве образца для измерения.
Готовили растворы тирозиназы (Sigma-Aldrich Co., из грибов) и L-DOPA (NACALAI TESQE, INC.) в фосфатном буфере так, что была достигнута заранее определенная концентрация (2,5 мМ). Смесь 0,5 мл фосфатного буфера, 0,2 мл тирозиназы (250 Ед/мл) и 0,1 мл образца для измерения инкубировали с использованием спектрофотометра при 37°C в течение 3 минут.
Измерение начинали через 2 минуты и 48 секунд после начала инкубации, и 0,25 мл L-DOPA (2,5 мМ) добавляли к смеси в минуту 3 с последующей инкубацией полученной смеси при 37°C в течение 10 минут, при этом измеряя оптическую плотность при 490 нм (каждые 10 секунд).
На основании результатов измерения рассчитывали степень ингибирования (%) активности тирозиназы с помощью уравнений, приведенных ниже (приведенные ниже уравнения демонстрируют случай со значением, измеренным в минуту 5).
At: Увеличение оптической плотности раствора для измерения, содержащего тирозиназу и L-DOPA, на протяжении периода времени от 30 секунд после начала измерения до 5 минут и 30 секунд после начала измерения.
Ас: Увеличение оптической плотности раствора для измерения, содержащего тирозиназу, но не содержащего L-DOPA, на протяжении периода времени от 30 секунд после начала измерения до 5 минут и 30 секунд после начала измерения.
At0: Увеличение оптической плотности раствора для измерения, не содержащего тирозиназу, но содержащего L-DOPA, на протяжении периода времени от 30 секунд после начала измерения до 5 минут и 30 секунд после начала измерения.
Ас0: Увеличение оптической плотности раствора для измерения, не содержащего ни тирозиназу, ни L-DOPA, на протяжении периода времени от 30 секунд после начала измерения до 5 минут и 30 секунд после начала измерения.
Степень активности (%)=([At]-[At0])/([Ас]-[Ас0])×100
Степень ингибирования активности тирозиназы (%) = 100 - степень активности.
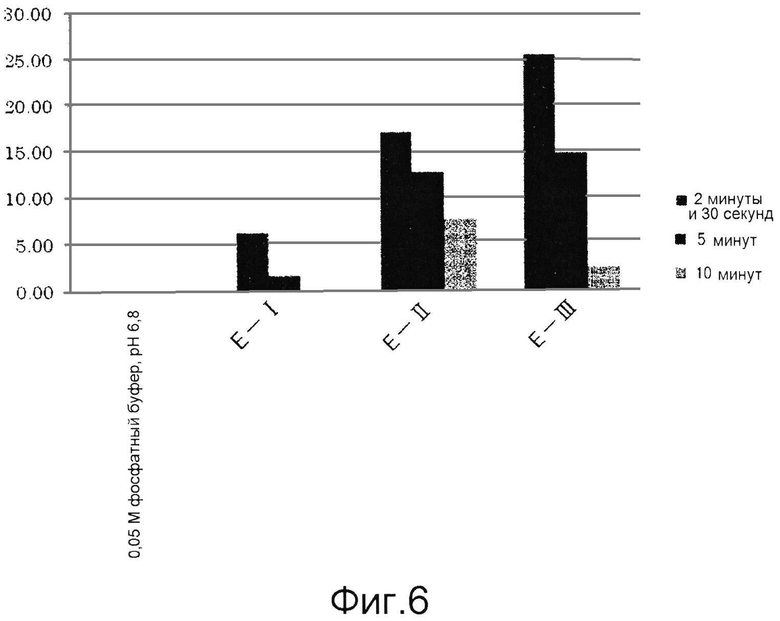
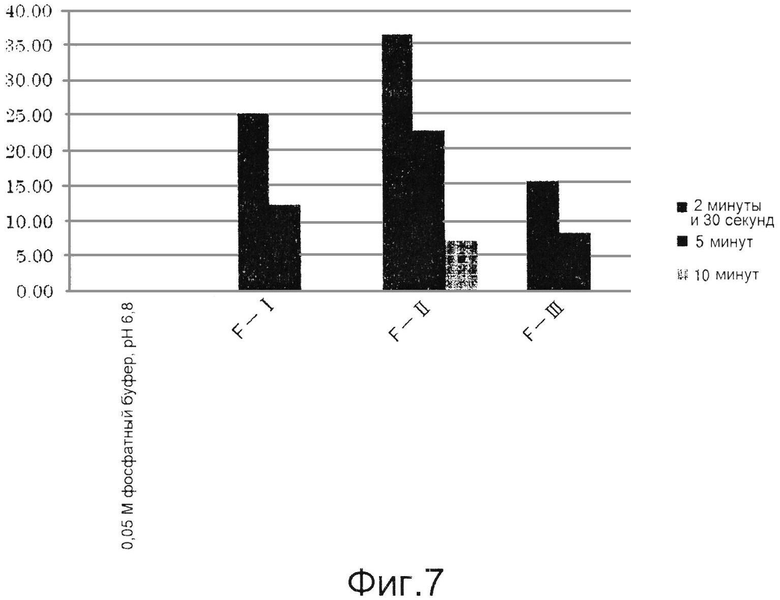
Результаты приведены ниже в таблицах 5 и 6 и на фиг.6 и 7. В каждой таблице «0,05 М фосфатный буфер, рН 6,8» соответствует контролю, полученному с использованием фосфатного буфера вместо образца для измерения.
Как видно из таблиц 5 и 6, приведенных выше, и фиг.6 и 7, ингибиторы тирозиназы, состоящие из лиофилизированного порошка из дождевых червей, полученного способом по настоящему изобретению, особенно способом, включающим этап создания контакта живых дождевых червей с солью металла и гидроксикарбоновой кислотой (E-II, F-II) до их измельчения, обладали более высокими ингибирующими тирозиназу активностями, чем ингибиторы тирозиназы, полученные способом, описанным в публикации японской нерассмотренной патентной заявки № S63-238009 (E-I, F-I).
Изобретение относится к фармацевтической промышленности, в частности к способу получения ингибитора тирозиназы. Способ получения ингибитора тирозиназы включает этапы создания контакта живых дождевых червей с порошком гидроксикарбоновой кислоты, разбавления полученной смеси водой для доведения рН до 2-5 и последующего выдерживания полученной разведенной смеси в течение 3-180 минут, или создания контакта живых дождевых червей с водным раствором гидроксикарбоновой кислоты, имеющим рН 2-5, и последующего выдерживания полученной смеси в течение 3-180 минут; с последующим промыванием живых дождевых червей водой, измельчением промытых дождевых червей и последующей лиофилизацией полученного измельченного продукта. Косметическое средство, содержащее ингибитор тирозиназы. Вышеописанный способ позволяет получить высокобезопасный ингибитор тирозиназы, обладающий повышенной ингибирующей тирозиназу активностью. 2 н. и 3 з.п. ф-лы, 7 ил., 6 табл., 10 пр.
1. Способ получения ингибитора тирозиназы, включающий этапы:
создания контакта живых дождевых червей с хлоридом(ами) по меньшей мере одного металла, выбранного из группы, состоящей из калия, натрия, магния и кальция; с последующим
созданием контакта этих живых дождевых червей с порошком гидроксикарбоновой кислоты, разбавлением полученной смеси водой для доведения pH до 2-5 и последующим выдерживанием полученной разведенной смеси в течение 3-180 минут, или созданием контакта этих живых дождевых червей с водным раствором гидроксикарбоновой кислоты, имеющим pH 2-5, и последующим выдерживанием полученной смеси в течение 3-180 минут; с последующим
промыванием живых дождевых червей водой, измельчением промытых дождевых червей, и последующей лиофилизацией полученного измельченного продукта.
2. Способ получения ингибитора тирозиназы по п. 1, включающий этап выдерживания живых дождевых червей в освещенном месте в течение 10-50 часов, отделения грязи, приставшей к поверхности их тела, с последующим созданием контакта живых дождевых червей с указанным хлоридом(ами) металла(ов), где данный этап выполняют до создания контакта живых дождевых червей с указанным хлоридом(ами).
3. Способ получения ингибитора тирозиназы по п. 1, в котором указанную лиофилизацию проводят путем замораживания измельченного продукта при температуре от -18°C до -35°C в течение 20-240 часов с последующей лиофилизацией полученного продукта в вакууме.
4. Способ получения ингибитора тирозиназы по п. 1, включающий этап растворения указанного лиофилизированного измельченного продукта в воде в течение от 1 до 120 минут с последующим удалением или отделением нерастворимой фракции.
5. Косметическое средство, содержащее ингибитор тирозиназы, полученный способом по любому из пп. 1-4.
| Многокамерный электрокоагулятор | 2020 |
|
RU2747770C1 |
| JP 2009249362 A, 29.10.2009 | |||
| US 5024844 A, 18.06.1991. | |||
Авторы
Даты
2016-03-10—Публикация
2012-07-24—Подача