Изобретение относится к области молекулярной биологии и может быть использовано в ветеринарной практике при диагностике мутаций, вызывающих две наследственные болезни: комплекс аномалий позвоночника (CVM - Complex Vertebral Malformation) и дефицит лейкоцитарной адгезии (BLAD - Bovine Leucocyte Adhesion Deficiency) у крупного рогатого скота. Набор последовательности праймеров и аллель-специфических зондов позволяет одновременно идентифицировать CV и BL мутации соответственно в локусах SLC35A3 и CD 18 ДНК с помощью ПЦР в режиме реального времени (ПЦР-РВ).
В настоящее время у крупного рогатого скота описано около 60 наследственных заболеваний, которые выявляются на уровне ДНК (ICAR Guidelines…, 2011). Они вызывают морфологические и функциональные аномалии, негативно влияют на здоровье и продуктивность животного. Поэтому важной задачей ветеринарных врачей является своевременная диагностика и искоренение источника, вызывающего данную болезнь. Знание молекулярной структуры, определение гетерозиготного носителя является основой для эффективной борьбы с наследственным заболеванием.
Быстрота и точность диагностики комплекса аномалий позвоночника (CVM) и дефицита лейкоцитарной адгезии (BLAD) значительно повысилась благодаря установлению генетической природы данных молекулярных болезней (Kehrli M.E.Jr. et al., 1990; Tammen I., 1994; Batt C.A. et al., 1994; Марзанов Н.С. и др., 1997; Амерханов Х.А., Марзанов Н.С., 1999; Agerholm et al., 2001; Яковлев А.Ф. и др., 2004; Eggen A. et al., 2004; Oguni T. et al., 2004; Rusc A., Kaminski S., 2007; Калашникова Л.А., 2010; Марзанова С.Н. и др., 2011; 2012).
В развитых странах Европы и Северной Америки созданы специальные программы по элиминации мутантных аллелей CVM и BLAD в популяциях черно-пестрой породы (Shuster D.E. et al., 1992a,b; Czarnik U. et al., 2007; Schutz E. et al., 2008).
В Российской Федерации выдающихся производителей и ремонтный молодняк проверяют на носительство мутантных аллелей, а результаты в обязательном порядке, наряду с группами крови и каппа-казеином, регулярно публикуют в каталогах по племенным быкам (Шапочкин В.В., Ескин Г.В., 2004; Попов Н.А. и др., 2004; Савенко Н.А. и др., 2007; Ескин Г.В., 2010).
В открытой печати предложены ряд методов диагностики CVM и BLAD (Kehrli M.E.Jr. et al., 1990; Shuster D.E. et al., 1992a; Tammen I., 1994; Nagahata H. et al., 1997; Kanae Y. et al., 2005; Rusc A., Kaminski S., 2007). Однако диагностика при раздельном их выявлении занимает много времени.
Из уровня техники известен генетический тест для идентификации носителей рецессивного гена комплексных вертебральных мальформаций у крупного рогатого скота (Патент на изобретение №2276690, опубл. 20.05.2006). Данное изобретение принято в качестве ближайшего аналога. Отличительной особенностью заявленного изобретения от выявленного аналога является возможность определения CVM вместе с BLAD, т.е. идет одновременное определение двух мутаций по методике ПЦР в реальном времени (ПЦР-РВ), с помощью праймеров и аллель-специфических зондов. Точка мутации CV та же, что и в указанном аналоге, однако подход детекции принципиально иной.
В заявленном изобретении осуществляется идентификация полиморфизма в локусе SLC35A3 (G/T) с помощью ПЦР-РВ и использованием TaqMan зондов. Время исследования данного полиморфизма занимает не более 3-х часов. В ближайшем аналоге диагностируют CVM с помощью микросателлитов, с использованием электрофоретического метода детекции, что является принципиально другим методом диагностики данного полиморфизма и занимает больше времени и необходимого оборудования.
Предлагаемый к патентованию набор праймеров и зондов в сравнении со всеми изученными аналогами имеет следующие преимущества:
специфическая структура праймеров и зондов, а также с помощью предлагаемого к патентованию набора праймеров и зондов можно одновременно в одной пробирке провести полимеразную цепную реакцию в режиме реального времени (ПЦР-РВ), что обеспечивает быстроту проведения диагностики и получение результата сразу по двум представленным мутациям.
Техническим результатом заявленного изобретения является возможность одновременной диагностики комплекса аномалии позвоночника (CVM - Complex Vertebral Malformation) и дефицита лейкоцитарной адгезии (BLAD - Bovine Leucocyte Adhesion Deficiency) у крупного рогатого скота методом ПЦР в реальном времени, сокращение времени выполнения полимеразной цепной реакции в реальном времени (ПЦР-РВ) (через 3 часа получен результат); нетрудоемкость; возможность выполнять повторности; проводить контроль правильности исследования.
Для осуществления одновременной генодиагностики CV и BL аллелей у крупного рогатого скота с помощью ПЦР в реальном времени (ПЦР-РВ) использовали праймеры и аллель-специфические зонды, имеющие следующие последовательности:
В настоящем изобретении представлен набор праймеров и зондов для одновременной диагностики мутантных CV и BL аллелей у чёрно-пестрого генеалогического корня, куда относятся такие известные породы, как голштинская, черно-пестрая, холмогорская, ярославская, тагильская, кроме того красно-пестрая порода, а также синтетические популяции с примесью голштинской крови.
Экспериментально установлен оптимальный состав реакционной смеси для проведения полимеразной цепной реакции в режиме реального времени, подобрано сочетание праймеров, необходимое и достаточное соотношение компонентов реакционной смеси и определен режим постановки ПЦР, что является важным при проведении ПЦР-анализа. Система рассчитана на проведение 100 реакций объемом 25 мкл (20 мкл +5 мкл исследуемого образца).
Подбор праймеров и аллель-специфических зондов проводили при помощи пакета прикладных программ «Oligo 6.0» на основании анализа нуклеотидных последовательностей локусов SLC35A3 и CD 18 ДНК, опубликованных в базе NSBI.
Пример проведения полимеразной реакции с использованием заявленного набора.
Источником для проведения диагностики служит предварительно выделенная ДНК из образцов биологического материала (цельной крови, спермы, эмбрионов, молока или кожи).
Реакционная смесь для ПЦР-анализа имеет следующий состав: 50 мМ KCl, 50 мМ TRIS-HCl, 250 нМ dNTP, 2,5 мМ MgCl2, 2,5 ед. ДНК-полимеразы, праймеры в концентрации 200 нМ, флуоресцентные зонды - в концентрации 100 нМ, имеющие определенные последовательности:
Подготовку к проведению реакции осуществляли следующим образом.
Необходимый объем компонентов рассчитывали исходя из количества исследуемых образцов плюс 4 (три положительных контрольных образца и один отрицательный контрольный образец). Набор компонентов для реакции представлен в таблице №1.
п/п
Условия хранения: №1-7, -16 -20°C
Компоненты разморозили, перемешали и центрифугировали. Приготовили смесь компонентов, добавляя их в порядке, указанном в таблице 2, перемешали и центрифугировали.
ПЦР пробирки маркировали. В подготовленные для ПЦР пробирки внесли по 20 мкл смеси компонентов. Затем в каждую ПЦР пробирку внесли по 5 мкл контрольных и исследуемых образцов в соответствии с маркировкой, перемешали многократным пипетированием и плотно закрыли крышку. Пробирки поместили в карусель амплификатора Rotor Gene Q (Corbett Research, Австралия), затем программировали прибор.
Профиль реакции:
1. Удержание температуры 94°С - 3 мин, один повтор.
2. Циклирование 1
94°С - 20 с
61°С - 20 с
64°С - 30 с
Цикл повторить 10 раз.
3. Циклирование 2 (с детекцией)
94°С - 20 с
61°С - 20 с
64°С - 30 с - детекция по каналам: Green, Yellow, Orange, Red
Цикл повторить 30 раз.
В процессе циклирования денатурация, отжиг праймеров и синтез новой цепи ДНК происходит при температуре 64°С. При первом циклировании провели 10 повторов - детекции нет, так как данные не репрезентативны. При втором циклировании провели повторов 30 - в результате получили стабильные данные, которые являются окончательными в плане диагностики.
Создание шаблона ПЦР-РВ, а также анализ результатов исследования проводили при помощи программного обеспечения «Rotor-Gene 6000 1.8» к прибору Rotor Gene Q (Corbett Research, Австралия).
Результатом анализа является определение мутантных аллелей, вызывающих комплекс аномалий позвоночника (CVM) и дефицит лейкоцитарной адгезии (BLAD) у крупного рогатого скота.
В заявленном изобретении использована технология аллель-специфических TaqMan зондов. В данном случае флуоресцентным зондом является олигонуклеотид, комплементарный продукту ПЦР.
Зонд метят флуорофором и гасителем флуоресценции, при этом возможно использование как концевого, так и внутреннего мечения олигонуклеотида. При отсутствии мишени, т.е. последовательности, комплементарной зонду, флуорофор и гаситель сближаются, в результате подавляется флуоресценция зонда. Процесс тушения основан на механизме флуоресцентно-резонансного переноса энергии. При наличии комплементарного зонду фрагмента ДНК, зонд гибридизуется с ампликоном, что ведет к его расщеплению в процессе синтеза за счет 5'-экзонуклеазной активности Taq-полимеразы. Интенсивность сигнала возрастает на соответствующем флуорофору канале флуоресценции с каждым циклом ПЦР, пропорционально накоплению ампликонов.
Аллель-специфические зонды эффективны при детекции CV и BL мутаций в исследуемом фрагменте генома. Для локуса с мутацией подбирают пару зондов, так чтобы один из них специфически гибридизовался при температуре проведения синтеза цепей с аллелем нормального (дикого) типа, а второй зонд - с аллелем мутантного типа.
Эти зонды метят разными флуорофорами, а результаты реакций с ними регистрируют на двух различных каналах детекции прибора для ПЦР-РВ. Для определения CT и CV аллелей используют 2 канала - Green и Yellow. Нормальный CT аллель дает рост сигнала по каналу Green, детектируемый флуорофором FAM, а мутантный аллель CV - по каналу Yellow, детектируемый флуорофором R6G.
Что касается TL и BL аллелей, то для их определения используют тоже 2 канала, только Orange и Red. Нормальный TL аллель дает рост сигнала по каналу Orange, детектируемый флуорофором ROX, а мутантный аллель BL - по каналу Red, детектируемый флуорофором Cy5.
Результаты интерпретируются на основании наличия или отсутствия пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией.
Переход порога - это характеристика количества копий ДНК отдельного гена. При оптимальном количестве копий ДНК кривая располагается между двумя пороговыми значениями 10 и 15 циклами амплификации.
При перемещении кривой влево по оси абсцисс это говорит о высокой концентрации ДНК, если вправо - о ее недостатке в реакции.
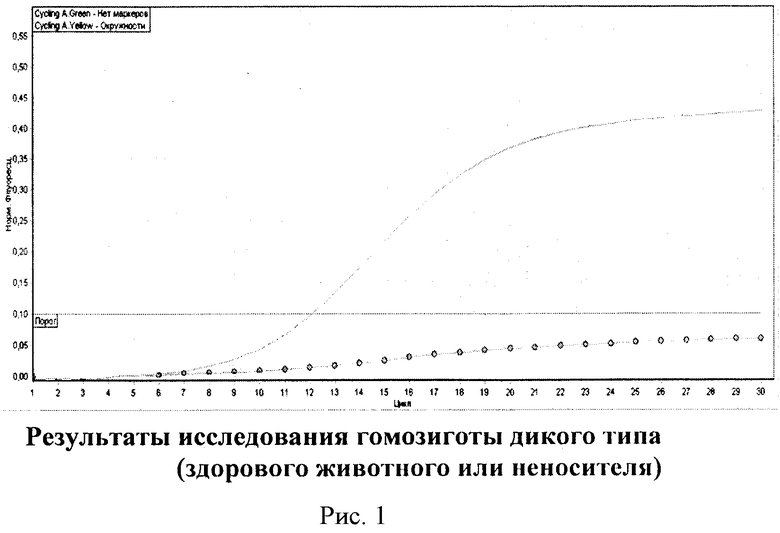
На рис. 1 представлены результаты исследований гомозиготного дикого типа или здорового животного или неносителя, флуоресценция представлена двумя линиями.
Кривая без маркеров располагается между 10 и 15 циклами над красной пороговой линией. Вторая кривая с окружностями ниже пороговой линии. Данная ситуация характерна для здорового исследуемого животного.
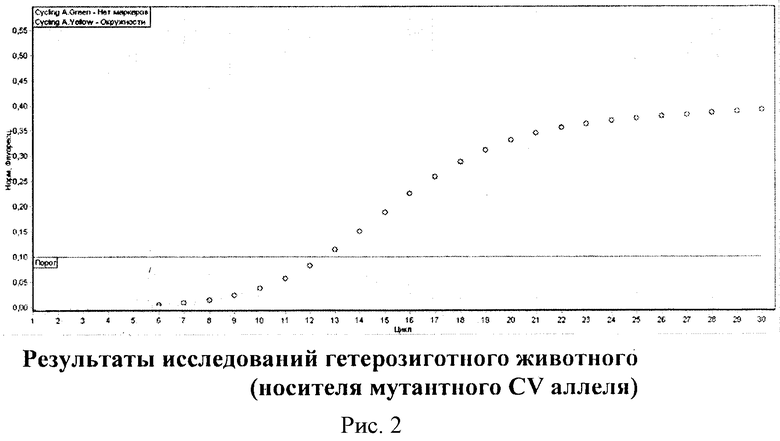
На рис. 2 представлены результаты исследования гетерозиготного животного или носителя мутантного CV аллеля. Как видно на рис. 2, обе кривые флуоресценции пересекают установленную на соответствующем уровне пороговую линию в обозначенном районе, между 10 и 15 циклами ПЦР-РВ.
В то же время следует отметить, что кривая с окружностями располагается выше кривой без маркеров. Данная картина характерна для гетерозиготного животного или носителя мутации.
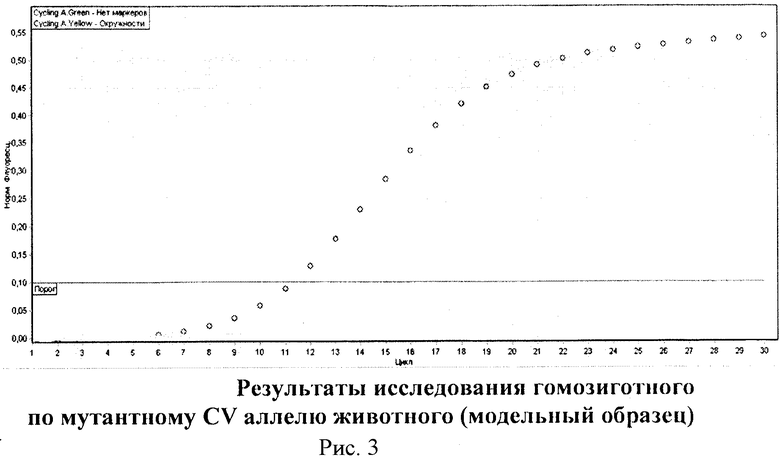
При налаживании данного способа не было возможности получения больных телят опытным путем в хозяйственных условиях. В этой связи, впервые удалось смоделировать синтетические рецессивные генотипы больных телят по локусам SLC35A3 и CD 18, в лабораторных условиях, на основе знания структур мутантных CV и BL аллелей.
На рис. 3 представлен модельный образец животного, гомозиготного по мутантному CV аллелю. Как видно на рис. 3, модельный образец отражает ситуацию характерную для больного теленка. В данном случае кривая с окружностями располагается выше порога, кривая флуоресценции без окружностей, характерная для здорового животного, оказывается под пороговой линией.
Что касается принципа определения BL аллеля, то он аналогичен тому, что описано в отношении диагностики CV мутации. Анализ проводится по описанной выше методике, только по каналам Orange и Red, и вся процедура осуществляется одновременно.
Прогноз получаемого потомства в зависимости от присутствия или отсутствия мутантных CV и BL аллелей. Наличие CV, как и BL аллеля, является ярким примером носительства мутации с одной стороны, а с другой - проявления однонуклеотидного полиморфизма или SNP (single nucleotide polymorphism) в ДНК у крупного рогатого скота.
Основными преимуществами заявляемого изобретения являются:
1. Одновременная аттестация элитных животных черно-пестрого генеалогического корня и красно-пестрой породы по двум мутациям (CV и BL) при помощи набора представленных последовательностей праймеров и зондов позволит направленно формировать аллелофонд быков-производителей, быковоспроизводящих групп коров, ремонтный молодняк, а также накапливать племенной материал (банк семени и эмбрионов) от здоровых животных.
2. Наличие генетического паспорта на CV и BL мутации элитных животных позволит эффективно вести селекционно-племенную работу в племенных стадах черно-пестрого генеалогического корня и красно-пестрой породы.
3. При завозе племенного материала в Российскую Федерацию из-за рубежа обязательно наличие генетического паспорта. С целью купирования двух наследственных болезней закупленные животные после карантина должны пройти повторную аттестацию на наличие мутантных CV и BL аллелей.
Литература:
1. Амерханов Х.А., Марзанов Н.С. Генетики смотрят в будущее // Племенное дело. - 1999. - №1. - С. 7-9.
2. Калашникова Л.А. Геномная оценка молочного скота // Молочное и мясное скотоводство. - 2010. - N1. - С. 10-12.
3. Каталог быков-производителей ОАО «Головной центр по воспроизводству сельскохозяйственных животных» / под ред. Ескина Г.В. Быково. - 2010. - 36 с.
4. Марзанов Н.С., Попов А.Н., Зиновьева Н.А., Полежаева В.А., Игнатьев В.М., Брем Г. Скрининг BLAD-синдрома у животных черно-пестрого корня // Вестник РАСХН. - 1997. - №4. - С. 59-61.
5. Марзанова С.Н., Алексеев Я.И., Коновалова Н.В., Турбина И.С., Девришов Д.А., Сочивко Д.Г., Марзанов Н.С. Разработка метода диагностики комплексной аномалии позвоночника (CVM) методом ПЦР в реальном времени у черно-пестрого скота. Научно-практическая конференция: «Практическое использование современных научных разработок в воспроизводстве и селекции крупного рогатого скота» // Научно-теоретический журнал: Проблемы биологии продуктивных животных. - 2011. - №4. Спецвыпуск. - С. 79-82.
6. Марзанова С.Н., Алексеев Я.И., Коновалова Н.В., Турбина И.С., Девришов Д.А., Сочивко Д.Г., Марзанов Н.С. Диагностика CVM и BLAD у черно-пестрого скота. Материалы международной научно-практической конференции: «Роль ветеринарной науки и практики в эффективном развитии животноводства». Алматы. - 2012. - С.348-353.
7. Попов Н.А., Червяков Н.А., Белявин Н.А. и др. Каталог быков-производителей ОАО «Кировское». - Киров. - 2004. - 73 с.
8. Савенко Н.А., Бошляков В.Н., Жуков В.Ф. и др. Каталог быков-производителей ОАО «Московское» по племенной работе. - Москва: МСХиП МО. - 2007. - 104 с.
9. Шапочкин В.В., Ескин Г.В. Каталог быков-производителей ФГУП «ЦСИО». Подольск. - 2002. - 51 с.
10. Яковлев А., Терлецкий В., Митрофанова О., Дементьева Н. Определение носителей генетических дефектов среди быков-производителей // Молочное и мясное скотоводство. - 2004. - №7. - С. 31-32.
11. Agerholm J.S., Bendixen C., Arnbjerg J., Anderson O. Complex vertebral malformation in Holstein calves // J. Vet. Diagn. Invest. - 2001. - Vol.13. - P. 283-289.
12. Batt C.A., Wagner P., Wiedmann M., Luo J., Gilbert R.O. Detection of bovine leukocyte adhesion deficiency by nonisotopic ligase chain reaction // Anim. Genet. - 1994. - Vol.25. - P. 95-98.
13. Czarnik U., Grzybovski G., Kaminski S., Prusak B, Zabolewicz T. Effectiveness of a program aimed at the elimination of BLAD-carrier bulls from Polish Holstein-Friesian cattle // J. Appl. Genet. - 2007. - Vol. 48. - P. 375-377.
14. Eggen A., Duchesne A., Laurent P., Grohs C., Denis C., Gautier M., Boichard D., Ducos A. Controlling genetic disorders in the French dairy cattle population // 29th International Conference on Animal Genetics. Tokyo. Japan. - 2004. - P. 35.
15. ICAR Guidelines approved by the General Assembly held in Riga, Latvia on June 2010. Copyright ICAR. - 2011. - 485 p.
16. Kanae Y., Endoh D., Nagahata H., Hayashi M. A method for detecting complex vertebral malformation in Holstein calves using polymerase chain reaction-primer introduced restriction analysis // J. Vet. Diagn. Invest. - 2005. - Vol.17. - P.258-262.
17. Kehrli M.E., Schmalstieg C., Anderson D.C., Van Der Maaten M.J., Hughes B.J., Akermann M.R., Wilhemsen C.L., Brown G.B., Stevens M.G., Whetstone C.A. Molecular identification of deficiency of the Mac-1 (CD11b/CD18) glycoprotein // Am. J. Vet. Res. - 1990. - Vol.51. - P.1826-1836.
18. Nagahata H., Miura T., Tagaki K., Ohtake M., Noda H., Yasuda T., Nioka K. Prevalence and allele frequency estimation of bovine leukocyte adhesion deficiency (BLAD) in Holstein-Friesian cattle in Japan // J. Vet. Med. Sci. - 1997. - Vol. 59. - P. 233-238.
19. Oguni T., Takeda Ray M., Tsuji T., Sugimoto Y., Moritomo Y., Matsumoto M., Mishina Y., Kunieda T. Identification and control of a dwarfism gene in Japanese brown cattle // 29th International Conference on Animal Genetics. Tokyo. Japan, 2004. P. 35.
20. Rusc A., Kaminski S. Prevalence of complex vertebral malformation carriers among Polish Holstein-Friesian bull // J. Appl. Genet. - 2007. - Vol.48. - P. 247-252.
21. Shuster D.E., Kehrli M.E.Jr., Ackermann M.R., Gilbert R.O. Identification and prevalence of a genetic defect that causes leukocyte adhesion deficiency in Holstein cattle // Proc. Nat. Acad. Sci. USA. - 1992a. - Vol.89. - P. 9225-9229.
22. Shuster D.E., Bosworth B.T., Kehrli M.E.Jr. Sequence of the bovine CD18-encoding cDNA: comparison with the human and murine glycoproteins // Gene. - 1992b. - Vol.114. - P. 267-271.
23. Schutz E., Scharfenstein M., Brenig B. Implication of complex vertebral malformation and bovine leukocyte adhesion deficiency DNA-based Testing on disease frequency in the Holstein population // J. Dairy Sci. - 2008. - Vol.91. - P.4854-4859.
24. Tammen I. Weiterentwicklung des DNA-Tests auf BLAD (Bovine Leukozyten Adhasions defizienz) fur den Einsatz in Rinderzucht und klinischer Diagnostik. Hannover. - 1994. - 128s.
Изобретение относится к области биотехнологии, а именно к набору последовательностей праймеров и аллель-специфических зондов для одновременной генодиагностики двух мутантных аллелей, вызывающих комплекс аномалий позвоночника (CVM) и дефицит лейкоцитарной адгезии (BLAD) у крупного рогатого скота. Набор включает последовательности праймеров и аллель-специфических зондов, которые имеют следующую структуру: CVM_up gattctcaagagcttaattctaagga, CVM_low aagtaaaccccagcaaagccac, CVM_Wt (FAM)-aggtctcatggcagttct-(BHQ1), CVM_m (R6G)-catggcatttctcacagcat-(BHQ2), BLAD_up ttaggcagttgcgttc, BLAD_low acgttgacgaggtcatccacca, BLAD_Wt (ROX)-accccatcgacctgtacta-(BHQ1), BLAD_m (Cy5)-ccatcggcctgtactacct-(BHQ2). Предложенное изобретение позволяет одновременно диагностировать CVM и BLAD у крупного рогатого скота методом ПЦР в реальном времени, а также сократить время выполнения полимеразной цепной реакции в реальном времени. 3 ил., 2 табл., 1 пр.
Набор последовательностей праймеров и аллель-специфических зондов для одновременной генодиагностики двух мутантных аллелей, вызывающих комплекс аномалий позвоночника (CVM) и дефицит лейкоцитарной адгезии (BLAD) у крупного рогатого скота путем проведения полимеразной цепной реакции в режиме реального времени, имеющих следующую структуру:
Авторы
Даты
2016-03-20—Публикация
2015-02-11—Подача