Настоящее изобретение относится к новым нуклеиновокислотным конструктам, полезным в протоколах вакцинации нуклеиновой кислотой для лечения и профилактики опухолей, экспрессирующих MUC1. В частности, нуклеиновая кислота представляет собой ДНК, и ДНК-конструкты содержат ген, кодирующий производное MUC1, имеющее менее чем 10 полностью повторяющихся блоков. Это изобретение дополнительно предлагает фармацевтические композиции, содержащие вышеуказанные конструкты, в частности фармацевтические композиции, адаптированные для доставки посредством частиц, способы для их получения и их применение в медицине. Также предложены новые протеины, кодируемые этой нуклеиновой кислотой, и фармацевтические композиции, содержащие их.
Предшествующий уровень техники
Муцин эпителиальных клеток MUC1 (также известный как эписиалин или полиморфный эпителиальный муцин, РЕМ) представляет собой высокомолекулярный гликопротеин, экспрессирующийся на многих эпителиальных клетках. Этот протеин состоит из цитоплазматического хвоста, трансмембранного домена и варьирующего числа тандемных повторов мотива из 20 аминокислот (называемого здесь VNTR-мономер, он также может быть известным как VNTR-эпитоп или VNTR-повтор), содержащего большую долю остатков пролина, серина и треонина. Число повторов варьирует из-за генетического полиморфизма в локусе MUC1 и чаще всего находится в диапазоне 30-100 (Swallow et al., 1987, Nature 328:82-84). В нормальных эпителиях протоков протеин MUC1 найден только на апикальной поверхности клетки, обращенной к просвету протока (Graham et al., 1996, Cancer Immunol Immunother 42:71-80; Barratt-Boyes et al., 1996, Cancer Immunol Immunother 43:142-151). Одним из наиболее поразительных свойств молекулы MUC1 является ее обширное гликозилирование по атомам кислорода. Имеется пять предполагаемых мест гликозилирования по кислороду, доступных в пределах каждого VNTR-мономера MUC1. В соответствии с нижеприведенной системой нумерации, ими являются Thr-4, Ser-10, Thr-11, Thr-19 и Ser-20.
VNTR можно характеризовать как типичные или полные повторы, имеющие последовательность, показанную ниже, или минорные отклонения от этого полного повтора, содержащие два или три отличия на 20 аминокислот.
Нижеследующее представляет собой последовательность полного повтора:
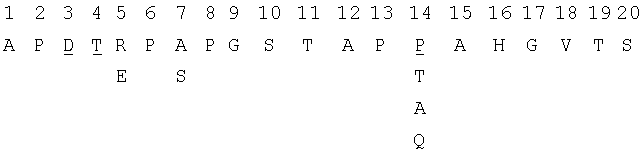
Подчеркнутые аминокислоты могут быть заменены показанными аминокислотными остатками.
Неполные повторы имеют разные аминокислотные замены в консенсусной последовательности при идентичности 55-90% на уровне аминокислот. Четыре неполных повтора показаны ниже, причем замены подчеркнуты:

Неполные повторы в MUC1 дикого типа фланкируют область полных повторов. В злокачественных карциномах, возникающих при неопластической трансформации этих эпителиальных клеток, несколько изменений влияют на экспрессию MUC1. Поляризованная экспрессия протеина теряется, и его находят распространенным по всей поверхности трансформированной клетки. Суммарное количество MUC1 также увеличено, часто в 10 раз или больше, чем в 10 раз (Strous&Dekker, 1992, Crit Rev Biochem Mol Biol 27:57-92). Самое важное, заметно меняется количество и качество присоединенных по кислороду углеводородных цепей. Гликозилировано меньше остатков серина и треонина. Те углеводородные цепи, которые находят, анормально укорочены, что создает опухолеассоциированный углеводный антиген STn (Lloyd et al., 1996, J Biol Chem, 271:33325-33334). В результате этих изменений гликозилирования различные эпитопы на пептидной цепи MUC1, которые ранее экранировали углеводные цепи, становятся доступными. Один из эпитопов, который становится доступным таким путем, образован последовательностью APDTR (Ala 8 - Arg 12 на Фиг.2), присутствующей в каждом полностью повторяющемся мономере VNTR, состоящем из 20 аминокислот (Burchell et al., 1989, IntJ Cancer 44:691-696).
Очевидно, что эти изменения в MUC1 означают, что вакцина, которая может активировать иммунную систему против этой формы MUC1, экспрессирующейся на опухолях, может быть эффективной против опухолей из эпителиальных клеток и, на самом деле, клеток других типов, у которых найдены MUC1, таких как Т-клеточные лимфоциты. Одним из главных эффекторных механизмов, используемых иммунной системой для уничтожения клеток, экспрессирующих ненормальные белки, является иммунный ответ цитотоксических Т-лимфоцитов, и этот ответ желателен в вакцине для лечения опухолей так же, как и антительный ответ. Хорошая вакцина должна активировать все стороны иммунного ответа. Однако существующие углеводные и пептидные вакцины, такие как Theratope или BLP25 (Biomira Inc, Эдмонтон, Канада), предпочтительно активируют одну сторону иммунного ответа - гуморальный и клеточный ответ, соответственно, и для генерирования более сбалансированного ответа желателен более хороший дизайн вакцины.
Нуклеиновокислотные вакцины дают множество преимуществ над общепринятой вакцинацией белками в том отношении, что их просто получать в большом количестве. Сообщалось, что даже при малых дозах они индуцируют сильные иммунные ответы и могут индуцировать иммунный ответ цитотоксических Т-лимфоцитов, а также антительный ответ.
С полноразмерным MUC1, однако, очень трудно работать из-за сильно повторяющейся последовательности, поскольку она сильно подвержена рекомбинации, причем такие случаи рекомбинации причиняют значительные трудности в биофармацевтической разработке. Дополнительно, обогащенность VNTR-области ОС-парами затрудняет секвенирование. Далее по юридическим причинам необходимо полностью охарактеризовать ДНК-конструкт. Весьма проблематично секвенировать молекулу со структурой, имеющей такую высокую частоту повторности. В такой ситуации неизвестно в точности, как много повторяющихся блоков имеется в MUC1 дикого типа, причем эта неспособность точно охарактеризовать полноразмерный MUC1 делает его неприемлемым для юридического одобрения.
Считается, что VNTR-области MUC1 содержат иммунодоминантные эпитопы. К удивлению, данные изобретатели нашли, что можно снизить число VNTR с получением иммуногенного конструкта, который имеет эквивалентную противоопухолевую активность при сравнении с полноразмерным MUC1 дикого типа. Конструкт по настоящему изобретению стабилен. В частности, эти конструкты стабильны в смысле ростовых характеристик, удержания плазмиды и качества плазмиды при выращивании в виде культур E.Coli в течение 9 пересевов, каждый длительностью 10-14 часов.
Краткое описание изобретения
Настоящее изобретение предлагает нуклеиновокислотную последовательность, кодирующую антиген MUC1, который способен вызывать иммунный ответ in vivo и является стабильным и имеет сниженную подверженность рекомбинации в сравнении с полноразмерным MUC1. Стабильность представляет собой меру количества плазмиды в определенной форме. Предпочтительным является то, что загрязнение рекомбиногенной формой после крупномасштабного выращивания составляет менее чем 2,0% при определении на агарозном или полиакриламидном геле с визуализацией на глаз. Крупномасштабное в типичных случаях означает выращивание в масштабе больше, чем один литр. Отдельной мерой стабильности является то, что копия плазмиды остается стабильной в течение периода пересевов. Предпочтительно, число копий плазмиды увеличивается с числом пересевов, особенно от пересева 1 до пересева 9. Предпочтительно, число копий плазмиды увеличивается на около 10%, 20%, 30%, 35%, 40%, наиболее предпочтительно на около 50%, в течение 9 пересевов. В конкретных воплощениях это изобретение предлагает конструкты, имеющие от 1 до 15, предпочтительно между 1 и 10, полных повторов VNTR-блоков. Предпочтительным является то, что имеется менее чем 8 полных повторов. Предпочтительные воплощения предлагают ДНК-конструкты с одним, двумя, тремя, четырьмя, пятью, шестью и семью повторами, соответственно. В определенных воплощениях этого изобретения, область неполного повтора сохранена. Предпочтительными являются конструкты, содержащие один или семь полных повторов. Белки, кодируемые такими конструктами, являются новыми и образуют аспект этого изобретения.
В еще одном аспекте этого изобретения нуклеиновокислотная последовательность представляет собой последовательность ДНК в форме плазмиды. Предпочтительно, плазмида является сверхскрученной.
В еще одном аспекте этого изобретения предложена фармацевтическая композиция, содержащая нуклеиновокислотную последовательность, какая раскрыта здесь, и фармацевтически приемлемый эксципиент, разбавитель или носитель.
Предпочтительно, носитель представляет собой гранулу золота, и фармацевтическая композиция поддается доставке путем доставки лекарственного средства посредством частиц.
И в еще одном дополнительном воплощении это изобретение предлагает фармацевтическую композицию и нуклеиновокислотные конструкты для применения в медицине. В частности, предложен нуклеиновокислотный конструкт по этому изобретению в изготовлении медикамента для применения в лечении или профилактике опухолей, экспрессирующих MUC1.
Это изобретение дополнительно предлагает способы лечения пациента, страдающего от или подверженного опухоли, экспрессирующей MUC1, особенно от карциномы груди, легких, яичников, простаты (особенно немелкоклеточной карциномы легких), желудка и других желудочно-кишечных локализаций, введением безопасного и эффективного количества композиции или нуклеиновой кислоты, какая описана здесь.
И в еще одном дополнительном воплощении это изобретение предлагает способ получения фармацевтической композиции, какая описана здесь, смешиванием нуклеиновокислотного конструкта или протеина по этому изобретению с фармацевтически приемлемым эксципиентом, разбавителем или носителем.
Подробное описание изобретения
Как описано здесь, нуклеиновокислотные конструкты по этому изобретению в типичных случаях имеют меньше чем 15, в более типичных случаях менее чем 10, полных повторов. Молекула MUC1 дикого типа (см. Фиг.1) содержит сигнальную последовательность, лидерную последовательность, неполный или нетипичный VNTR, область полных VNTR, дополнительный нетипичный VNTR, внеклеточный домен, не относящийся к VNTR, трансмембранный домен и цитоплазматический домен.
Предпочтительные воплощения этого изобретения имеют менее чем 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 повторов. Особенно предпочтительные конструкты имеют 1, 2 или 7 полных повторов.
Внеклеточный домен, не относящийся к VNTR, состоит из приблизительно 80 аминокислот с 5'-конца VNTR и 190-200 аминокислот с 3'-конца VNTR. Все конструкты по этому изобретению содержат по меньшей мере один эпитоп из этой области. Эпитоп в типичных случаях образован последовательностью по меньшей мере семи аминокислот. Соответственно, конструкты по настоящему изобретению включают в себя по меньшей мере один эпитоп внеклеточного домена, не относящегося к VNTR. Предпочтительно, они включают в себя по существу все или, более предпочтительно, все из доменов, не относящихся к VNTR. Особенно предпочтительным является то, что этот конструкт содержит по меньшей мере один эпитоп, содержащийся в последовательности FLSFHISNL, NSSLEDPSTDYYQELQRDISE или NLTISDVSV. Более предпочтительным является то, что в конструкт инкорпорированы две, предпочтительно три, эпитопных последовательности.
В предпочтительном воплощении конструкты содержат N-концевую лидерную последовательность. Сигнальная последовательность, трансмембранный домен и цитоплазматический домен каждый индивидуально являются необязательными в конструкте. Все они могут присутствовать или один или более чем один из них могут быть исключены.
Предпочтительные конструкты в соответствии с этим изобретением представляют собой:
1) 7 VNTR MUC1 (т.е. полный Muс1 только с 7 полными повторами);
2) 7 VNTR MUC1 Δss (такой же, как и 1, но к тому же лишен сигнальной последовательности);
3) 7 VNTR MUC1 ΔТМ ΔCYT (такой же, как и 1, но лишенный трансмембранного и цитоплазматического доменов);
4) 7 VNTR MUC1 Δss ΔТМ ΔCYT (такой же, как и 3, но к тому же лишенный сигнальной последовательности).
Также предпочтительными являются конструкты, эквивалентные вышеописанным от 1 до 4, но содержащие только 2 VNTR или 1 VNTR. VNTR в таких конструктах имеют последовательность полного повтора, какая описана здесь ранее. В одном из воплощений один или более чем один из VNTR-блоков мутированы для снижения потенциала гликозилирования изменением участка гликозилирования. Эта мутация представляет собой предпочтительно замену, но может быть вставкой или делецией. В типичных случаях по меньшей мере один треонин или серин заменен валином, изолейцином, аланином, аспарагином, фенилаланином или триптофаном. В мономере VNTR дикого типа имеется 5 предполагаемых участков гликозилирования по кислороду, доступных в пределах каждого VNTR-мономера MUC1. Ими являются (см. нумерацию) Thr-4, Ser-10, Thr-11, Thr-19 и Ser-20. Таким образом, предпочтительным является то, что по меньшей мере один, предпочтительно 2 или 3 или более чем три, предпочтительно по меньшей мере четыре, остаток заменен аминокислотой, как отмечено выше.
Предпочтительные замены включают в себя:
Thr 4 → Val
Ser 10 → Ala
Thr 11 → lle или Val
Thr 19 → Val
Ser 20 → Ala
В еще одном воплощении конструкты MUC1 снабжены нуклеиновокислотной последовательностью, кодирующей гетерологичный Т-клеточный эпитоп. Такие эпитопы включают в себя Т-клеточные эпитопы из бактериальных белков и токсинов, таких как столбнячный и дифтерийный токсины, например эпитопы Р2 и Р30 из столбнячного токсина. Такие эпитопы могут быть частью более длинной последовательности. Эти эпитопы могут быть инкорпорированными в молекуле нуклеиновой кислоты на 3' - или 5'-конце последовательности в соответствии с этим изобретением.
Можно иметь в виду другие партнеры по слиянию, такие как те, что происходят из корового антигена гепатита В или из туберкулеза. В одном из воплощений партнер по слиянию происходит из Mycobacterium tuberculosis, RA12, подпоследовательности МТВ32А (аминокислоты от 192 до 323) (Skeiky et al., Infection and Immunity (1999) 67:3998-4007).
Другие иммунологические партнеры по слиянию включают в себя, например, протеин D из Haemophilus influenza В (WO 91/18926) или часть (в типичных случаях С-концевую часть) LYTA из Streptococcus pneumoniae (Biotechnology 10:795-798, 1992).
В соответствии с еще одним аспектом этого изобретения предложен экспрессионный вектор, который содержит полинуклеотидную последовательность в соответствии с этим изобретением и способен направлять ее экспрессию. Этот вектор может быть подходящим для управления экспрессией гетерологичной ДНК в клетках бактерии, насекомого или млекопитающего, конкретно в клетках человека.
В соответствии с еще одним аспектом этого изобретения предложена хозяйская клетка, содержащая полинуклеотидную последовательность в соответствии с этим изобретением или экспрессионный вектор в соответствии с этим изобретением. Эти хозяйские клетки могут быть бактериальными, например E.coli, клетками млекопитающего, например человека, или могут быть клетками насекомого. Клетки млекопитающего, содержащие вектор в соответствии с настоящим изобретением, могут быть клетками к культуре, трансфицированными in vitro или могут быть трансфицированными in vivo введением вектора млекопитающему.
Настоящее изобретение дополнительно предлагает фармацевтическую композицию, содержащую полинуклеотидную последовательность в соответствии с этим изобретением. Предпочтительно, эта композиция содержит ДНК-вектор. В предпочтительном воплощении эта композиция содержит совокупность частиц, предпочтительно частиц золота, покрытых ДНК, содержащей вектор, кодирующий полинуклеотидную последовательность по этому изобретению, причем эта последовательность кодирует аминокислотную последовательность MUC1, какая описана здесь. В альтернативных воплощениях композиция содержит фармацевтически приемлемый эксципиент и ДНК-вектор в соответствии с настоящим изобретением.
Композиция может также включать в себя адъювант или быть вводимой либо одновременно, либо последовательно с адъювантом или иммуностимулирующим агентом.
Таким образом, в этом воплощении этого изобретения векторы по этому изобретению должны быть использованы с иммуностимулирующим агентом. Предпочтительно, этот иммуностимулирующий агент вводят в то же время, что и нуклеиновокислотный вектор по этому изобретению, и в предпочтительных воплощениях их вводят в состав препарата вместе. Такие иммуностимулирующие агенты включают в себя (но этот список ни коим образом не является исчерпывающим и не исключает другие агенты): синтетические имидазохинолины, такие как имиквимод [S-26308, R-837], (Harrison, et al. Reduction of recurrent HSV disease using imiquimod alone or combined with glycoprotein vaccine', Vaccine 19:1820-1826, (2001)); и резиквимод [S-28463, R-848] (Vasilakos, et al. «Adjuvant activites of immune response modifier» R-84 8: Comparison with CpG ODN5, Cellular Immunology 204:64-74 (2000)), шиффовы основания карбонилов и аминов, которые конститутивно экспрессированы на поверхностях антиген-представляющих клеток и Т-клеток, такие как тукаресол (Rhodes, J. et al. «Therapeutic potentiation of the immune system by costimulatory Schiff-base-forming drugs». Nature 377:71-75 (1995)), цитокиновые, хемокиновые и костимулирующие молекулы как протеиновые, так и пептидные, что должно включать в себя провоспалительные цитокины, такие как интерфероны, в частности интерфероны и GM-CSF, IL-1a, IL-1p, TGFα и TGFβ, ТМ-индукторы, такие как интерферон-у, IL-2, IL-12, IL-15, IL-18 и IL-21, Тh2-индукторы, такие как IL-4, IL-5, IL-6, IL-10 и IL-13, и другие гены хемокинов и костимуляторов, таких как МСР-1, MIP-1α, MIP-1β, RANTES, ТСА-3, CD80, CD86 и CD40L, другие иммуностимулирующие нацеливающие лиганды, такие как CTLA-4 и L-селектин, белки и пептиды, стимулирующие апопотоз, такие как Fas, (49), адъюванты на основе синтетических липидов, такие как ваксфектин (Reyes et al., «Vaxfectin enhances antigen specific antibody titres and maintains Th1 type immune responses to plasmid DNA immunization». Vaccine 19; 3778-3786), сквален, α-токоферол, полисорбат 80, DOPC и холестерин, эндотоксин [LPS], Beutler, В., Endotoxin, Toll-like receptor 4, and the afferent limb of innate immunity'. Current Opinion in Microbiology 3:23-30 (2000)); олиго- и динуклеотиды CpG, Sato, Y. et al., «Immunostimulatory DNA sequences necessary for effective intradermal gene immunization». Science 273 (5273):352-354 (1996). Hemmi, H. et al., «A Toll-like receptor recognizes bacterial DNA», Nature 408:740-745, (2000) и другие потенциальные лиганды, которые включают Toll-рецепторы для продукции Th1-индуцирующих цитокинов, такие как синтетические микобактериальные липопротеины, микобактериальный протеин р19, пептидогликан, тейхоевая кислота и липид А. Другие бактериальные иммуностимулирующие белки включают в себя холерный токсин, токсин E.Coli и их мутантные токсоиды.
Конкретные предпочтительные адъюванты для того, чтобы вызывать преимущественно ответ Th1-типа, включают в себя, например, производное Липида А, такое как монофосфорил липида А, или, предпочтительно, 3-дез-O-ацилированный монофосфорил липида А. Адъюванты MPL® доступны от Corixa Corporation (Seattle, WA; см., например, Патенты США №№ 4436727; 4877611; 4866034 и 4912094). CpG-содержащие олигонуклеотиды (в которых динуклеотид CpG не метилирован) также индуцируют преимущественно Тh1-ответ. Такие олигонуклеотиды хорошо известны и раскрыты, например, в WO 96/02555, WO 99/33488 и Патентах США №№ 6008200 и 5856462. Иммуностимулирующие последовательности ДНК также описаны, например, в Sato et al., Science 275:352, 1996. Другой предпочтительный адъювант содержит сапонин, такой как Quil А или его производные, в том числе QS21 и QS7 (Aquila BioPharmaceuticals Inc., Framingharn, MA); Эсцин, Дигитонин; или сапонины Gypsophila или Chenopodium quinoa.
Также предложено применение полинуклеотида или протеина в соответствии с этим изобретением или вектора в соответствии с этим изобретением в лечении или профилактике опухоли или метастазов, экспрессирующих MUC1.
Настоящее изобретение также предлагает способы лечения или предотвращения опухолей, экспрессирующих MUC1, любых симптомов или заболеваний, ассоциированных с ними, в том числе метастазов, причем при этих способах вводят эффективное количество полинуклеотида, вектора или фармацевтической композиции в соответствии с этим изобретением. Введение фармацевтической композиции может приобретать форму одной или более чем одной из индивидуальных доз, например в режиме терапевтической вакцинации «первичная вакцинация - поддерживающая вакцинация». В определенных случаях «первичная вакцинация» может быть осуществлена опосредованной частицами для доставки ДНК доставкой полинуклеотида в соответствии с настоящим изобретением, предпочтительно инкорпорированного в производимый из плазмиды вектор, а «поддерживающая вакцинация» может быть осуществлена введением рекомбинантного вирусного вектора, содержащего ту же полинуклеотидную последовательность, или осуществлением поддерживающей вакцинации протеином в адъюванте. Или же первичная вакцинация может быть осуществлена вирусным вектором или протеиновым препаратом, в типичных случаях протеиновый препарат выполнен с адъювантом, а поддерживающая - ДНК-вакциной по настоящему изобретению.
Как обсуждено выше, настоящее изобретение включает в себя экспрессионные векторы, которые содержат нуклеотидные последовательности по этому изобретению. В области молекулярной биологии такие экспрессионные векторы конструируют рутинным образом, и это может, например, включать в себя применение плазмидной ДНК и надлежащих инициаторов, промоторов, энхансеров и других элементов, таких как, например, сигналы полиаденилирования, которые могут быть необходимыми и которые позиционируют в правильной ориентации, чтобы сделать возможной экспрессию протеина. Другие подходящие векторы должны быть очевидными специалистам. За дополнительными примерами в связи с этим мы отсылаем к Sambrook et al. Molecular Cloning: a Laboratory Manual. 2nd Edition. CSH Laboratory Press, (1989).
Предпочтительно, полинуклеотид по этому изобретению или для применения в этом изобретении в векторе является работоспособным образом связанным с контрольной последовательностью, которая способна обеспечивать экспрессию кодирующей последовательности хозяйской клеткой, то есть вектор представляет собой экспрессионный вектор. Термин «работоспособным образом связанный» относится к юкстапозиции, в которой описанные компоненты находятся во взаимоотношении, позволяющем им функционировать предназначенным образом. Регуляторная последовательность, такая как промотор, «работоспособным образом связанный» с кодирующей последовательностью, позиционирована таким образом, что этим достигают экспрессию кодирующей последовательности в условиях, совместимых с регуляторной последовательностью.
Векторами могут быть, например, плазмиды, искусственные хромосомы (например, ВАС, РАС, YAC), вирусные или фаговые векторы, снабженные нулевыми точками репликации, возможно промотором для экспрессии полинуклеотида и возможно регулятором промотора. Векторы могут содержать один или более чем один из селектируемых маркерных генов, например ген устойчивости к ампициллину или канамицину в случае бактериальной плазмиды или ген устойчивости для грибкового вектора. Векторы можно применять in vitro, например для продукции ДНК или РНК или применять для трансфекции или трансформации хозяйской клетки, например, хозяйской клетки млекопитающего, например, для продукции протеина, кодируемого вектором. Векторы можно также адаптировать для применения in vivo, например, в способе ДНК-вакцинации или генной терапии.
Промоторы и другие сигналы регуляции экспрессии можно выбирать так, чтобы они были совместимы с хозяйской клеткой, для которой предназначена экспрессия. Например, промоторы млекопитающих включают в себя промотор металлотионеина, который можно индуцировать в ответ на тяжелые металлы, такие как кадмий, и промотор β-актина. Также можно использовать вирусные промоторы, такие как промотор большого Т-антигена SV40, немедленный ранний (immediate early, IE) промотор цитомегаловируса (CMV) человека, промотор длинных концевых повторов (LTR) вируса саркомы Рауса, промотор аденовируса или промотор вируса папилломы человека (HPV), особенно вышележащую регуляторную область HPV (URR). Все эти промоторы хорошо описаны и легко доступны в данной области техники.
Предпочтительным промоторным элементом является немедленный ранний промотор CMV, лишенный интрона А, но включающий в себя экзон 1. Соответственно, предложен вектор, содержащий полинуклеотид по этому изобретению под контролем IE-промотора HCMV.
Примеры подходящих вирусных векторов включают в себя вирусные векторы, представляющие собой вирус простого герпеса, вирус осповакцины, альфа-вирусные векторы и ретровирусы, в том числе лентивирусы, аденовирусы и аденоассоциированные вирусы. Методики переноса генов при использовании этих вирусов известны специалистам. Ретровирусные векторы, например, можно использовать для стабильной интеграции полинуклеотида по этому изобретению в хозяйский геном, хотя такая гекомбинация не является предпочтительной. Дефективные по репликации аденовирусные векторы, напротив, остаются эписомальными и поэтому делают возможной преходящую экспрессию. Векторы, способные управлять экспрессией в клетках насекомого (например, бакуловирсные векторы), в клетках человека или в бактериях, можно использовать для получения некоторых количеств протеина ВИЧ, кодируемого полинуклеотидами по настоящему изобретению, например, для применения в качестве субъединичных вакцин или в иммунных анализах. Полинуклеотиды по этому изобретению имеют особое применение в вирусных вакцинах, поскольку прежние попытки генерировать полноразмерные конструкты вируса осповакцины были безуспешными.
Полинуклеотиды в соответствии с этим изобретением имеют применение в продукции кодируемых белков экспрессией, которая может иметь место in vitro, in vivo или ex vivo. Поэтому эти нуклеотиды можно вовлекать в синтез рекомбинантных протеинов, например, для увеличения выхода или они в сущности могут найти применение в качестве терапевтических агентов в своем роде, используемых в методиках ДНК-вакцинации. В случаях, когда полинуклеотиды по настоящему изобретению используют в получении кодируемых белков in vitro или ex vivo, клетки, например клетки в культуре, надо модифицировать включением в них полинуклеотида, подлежащего экспрессированию. Такие клетки включают в себя нестабильные или предпочтительно стабильные линии клеток млекопитающего. Конкретные примеры клеток, которые можно модифицировать вставкой векторов, кодирующих полипептид в соответствии с этим изобретением, включают в себя клетки млекопитающего НЕК293Т, СНО, HeLa, 293 и COS. Предпочтительно, выбранная клеточная линия должна быть такой, которая является не только стабильной, но также позволяющей полноценное гликозилирование полипептида и его экспрессию на клеточной поверхности. Экспрессию можно достигать в трансформированных ооцитах. Полипептид можно экспрессировать с полинуклеотида по настоящему изобретению в клетках трансгенного животного, которое не является человеком, предпочтительно мыши. Трансгенное животное, которое не является человеком, экспрессирующее полипептид с полинуклеотида по этому изобретению, включено в объем этого изобретения.
Это изобретение предлагает еще и способ вакцинации млекопитающего субъекта, причем ему вводят эффективное количество такой вакцины или вакцинной композиции. Наиболее предпочтительно то, что экспрессионные векторы для применения в ДНК-вакцинах, вакцинных композициях и иммунотерапевтических средствах должны быть плазмидными векторами.
ДНК-вакцины можно вводить в форме «голой ДНК», например, в жидком препарате, вводимом при использовании шприца или струи высокого давления, или в форме ДНК, введенной в состав липосом или раздражающего агента для улучшения трансфекции, или доставкой ДНК с помощью частиц (particle mediated DNA delivery, PMDD). Все эти системы доставки хорошо известны в данной области. Вектор можно внедрить млекопитающему, например, системой доставки, представляющей собой вирусный вектор.
Композиции по настоящему изобретению можно доставлять множеством путей, таких как внутримышечный, подкожный, внутрибрюшинный или внутривенный.
В предпочтительном воплощении композицию доставляют в кожу. В частности, композицию доставляют методиками введения генным пистолетом (особенно бомбардировкой частицами), при которых наносят вектор на гранулу (например, золотую), которую затем вводят под высоким давлением в эпидермис, например, так, как описано в Haynes et al., J Biotechnology 44:37-42 (1996).
В одном иллюстративном примере ускорение частиц под действием газа можно достигать устройствами, такими как те, что производит Powderject Pharmaceuticals PLC (Oxford, UK) и Powderject Vaccines Inc. (Madison, W1), некоторые примеры которых описаны в Патентах США №№ 5846796, 6010478, 5865796, 5584807 и в Европейском Патенте №0500799. Этот подход делает возможной доставку без использования игл, причем препарат микроскопических частиц, таких как полинуклеотидные, представляющий собой сухой порошок, ускоряют до высокой скорости в струе газа гелия, которую генерируют устройством, которое держат в руке, внедряющим эти частицы в целевую ткань, представляющую интерес, в типичных случаях в кожу. Эти частицы представляют собой предпочтительно гранулы золота с диаметром 0,4-4,0 мкм, более предпочтительно 0,6-2,0 мкм, с нанесенным на них конъюгатом ДНК, которые заключают в картридж или кассету для помещения в «генный пистолет».
В родственном воплощении другие устройства и способы, которые могут быть полезными для инъекции композиции по настоящему изобретению под действием газа и без иглы, включают в себя те, которыми снабжает Bioject, Inc. (Portland, OR), некоторые примеры которых описаны в Патентах США №№ 4790824, 5064413, 5312335, 5383851, 5399163, 5520639 и 5993412.
Векторы, которые содержат нуклеотидные последовательности, кодирующие антигенные пептиды, вводят в таком количестве, которое должно быть профилактически или терапевтически эффективным. Количество нуклеотида на дозу для введения находится, в общем, в диапазоне от одного пикограмма до 1 миллиграмма, предпочтительно от 1 пикограмма до 10 микрограмм для доставки посредством частиц и от 10 микрограмм до 1 миллиграмма для других путей. Точное количество может значительно варьировать в зависимости от массы пациента, которого иммунизируют, и от пути введения.
Можно вводить иммуногенный компонент, содержащий нуклеотидную последовательность, кодирующую антигенный пептид, однократно или многократно, например от 1 до 7 раз, предпочтительно от 1 и 4 раз, при интервалах между около 1 дня и около 18 месяцев. Однако опять же этот режим лечения должен значительно варьировать в зависимости от размера пациента, заболевания, от которого лечат/защищают, количества вводимой нуклеотидной последовательности пути введения и других факторов, которые должны быть очевидными опытному практикующему медику. Пациент может получать один или более чем один из других противораковых лекарственных средств в качестве части их общего режима лечения.
Подходящие методики для введения голого полинуклеотида или вектора в пациента также включают в себя местное нанесение с надлежащим носителем. Нуклеиновую кислоту можно вводить местным образом на кожу или на слизистые поверхности, например введением в нос, пероральным путем, в вагину или в прямую кишку. Голый полинуклеотид или вектор можно давать вместе с фармацевтически приемлемым эксципиентом, таким как забуференный фосфатами физраствор (phosphate buffered saline, PBS). Поглощению ДНК можно дополнительно способствовать способствующими агентами, такими как бупивакаин, либо в отдельности, либо при включении в препарат ДНК. Другие способы введения нуклеиновой кислоты прямо реципиенту включают в себя ультразвук, электрическую стимуляцию, электропорацию и микропосев, который описан в Патенте США 5697901.
Поглощению конструктов нуклеиновой кислоты можно способствовать несколькими известными методиками трансфекции, например теми, которые включают в себя применение агентов трансфекции. Примеры этих агентов включает в себя катионные агенты, например фосфат кальция и ДЭАЭ-декстран, и липофектанты, например липофектам и трансфектам. Дозировку нуклеиновой кислоты для введения можно изменять.
Нуклеиновокислотную последовательность по настоящему изобретению можно также вводить трансформированными клетками. Такие клетки включают в себя клетки, полученные из субъекта. Голый полинуклеотид или вектор по настоящему изобретению можно интродуцировать в такие клетки in vitro, и эти трансформированные клетки можно позже возвращать субъекту. Полинуклеотид по этому изобретению можно интегрировать в нуклеиновую кислоту, уже присутствующую в клетке, в результате событий, представляющих собой гомологичную рекомбинацию. Трансформированные клетки можно, если это желательно, выращивать in vitro, и одну или более чем одну из получившихся клеток можно использовать в данном изобретении. Клетки можно доставлять в надлежащее место в пациенте известными хирургическими или микрохирургическими методиками (например, трансплантацией, микроинъекцией и т.д.).
Примеры
1.1 Генерирование конструктов
Схему соотношений между всеми конструктами, детализированными ниже, можно найти на Фиг.1.
1.2 Конструирование кассеты экспрессии полноразмерного MUC1
Начальной точкой для конструирования кассеты экспрессии MUC1 была плазмида pcDNA3-FL-MUC1 (ICRF, Лондон). Эта плазмида имеет скелет pcDNA3 (Invitrogen), содержащий кДНК-вую кассету полноразмерного MUC1 (FL-MUC1), клонированную в BamHI-сайте. На основании рестрикционного картирования, выполненного в ICRF, ген MUC1 имеет приблизительно 32 блока VNTR (варьирующее число тандемных повторов). Присутствие MUC1 подтвердили флуоресцентным секвенированием при использовании праймеров 2004MUC1-2014MUC1 (Приложение А). Последовательность MUC1, на которой основана последовательность FL-MUC1, показана на Фиг.2. На первой стадии этого способа клонирования BamHI-фрагмент, содержащий кДНК-вую последовательность полноразмерного MUC1, изолировали и клонировали в BamHI-сайт экспрессионного вектора pcDNA3.1(+)/Hygro (Invitrogen), генерируя плазмиду JNW278. Корректную ориентацию фрагмента относительно промотора CMV подтвердили методом ПЦР и флуоресцентным секвенированием.
На следующей стадии клонирования удаляли 3'-нетранслируемую область (UTRs) и заменяли улучшенными сайтами для рестрикционных ферментов для облегчения будущих процедур клонирования. Фрагмент MUC1 амплифицировали в ПЦР с праймерами 2062MUC1 и 2063MUC1 (Приложение А) при использовании JNW278 в качестве матрицы и подвергали рестрикции при использовании BstXI и Xhol. Параллельно плазмиду JNW278 подвергали рестрикции при использовании BstXI и Xhol. Очищенный векторный скелет лигировали с ПЦР-фрагментом, генерируя плазмиду JNW314. Рестрикционный анализ и флуоресцентное секвенирование подтвердили присутствие корректного фрагмента.
Параллельно удаляли 5'-UTR и заменяли оптимальной Kozak-последовательностью и улучшенными сайтами для рестрикционных ферментов. JNW278 подвергали действию рестриктаз Nhel и Xhol, удаляя целиком последовательность кДНК MUC1. Фрагмент MUC1 амплифицировали в ПЦР с ПЦР-праймерами 2060MUC1 и 2061 MUC1 (Приложение А), подвергали рестрикции рестриктазами Nhel и Xhol и лигировали в скелет вектора, генерируя плазмиду JNW294.
На следующей стадии клонирования подвергали JNW294 действию рестриктазы BsaMI, высвобождая два фрагмента (приблизительно 2,3 тысяч пар оснований и 3,2 тысяч пар оснований). Больший из этих двух фрагментов (Фрагмент А) изолировали и очищали. Параллельно подвергали JNW314 действию рестриктазы BsaMI и больший из двух фрагментов (Фрагмент В, размером приблизительно 7 тысяч пар оснований), изолировали и очищали. Фрагменты А и В лигировали вместе, генерируя плазмиду JNW340. Корректную ориентацию подтвердили рестрикционным картированием при использовании Nhe-Xhol и, отдельно, Xbal.
На конечной стадии клонирования экспрессионную кассету изолировали из JNW340 расщеплением рестриктазами Nhel и Xhol, высвобождая фрагмент приблизительно в 4 тысячи пар оснований. Экспрессионную плазмиду pVAC1 (Thomson Immunology 95: 510Р106, 1998) подвергали действию рестриктаз Nhel и Xhol и лигировали с кассетой MUC1, генерируя плазмиду JNW358 для экспрессии полноразмерного MUC1. Корректную ориентацию последовательности MUC1 относительно промотора CMV подтвердили рестрикционным расщеплением и флуоресцентным секвенированием. Последовательность кассеты экспрессии MUC1 показана на Фиг.3.
1.3 Конструирование вектора MUC1, содержащего один VNTR-блок
Начальной точкой для конструирования кассеты для экспрессии MUC1, содержащего один VNTR-блок, является JNW278. Уникальным свойством последовательности ДНК с высоким числом VNTR-повторов является присутствие сайта для рестриктазы Fsel в каждом из повторяющихся блоков. JNW278 подвергали полному рестрикционному расщеплению при использовании Fsel, скелет вектора изолировали и снова лигировали, генерируя плазмиду JNW283. Присутствие единственного VNTR-блока подтвердили рестрикционным анализом, ПЦР и флуоресцентным секвенированием. Последовательность MUC1 в JNW283 показана на Фиг.2.
1.4 Конструирование вектора для экспрессии MUC1, содержащего один VNTR-блок
Для переноса кассеты MUC1, содержащего один VNTR-блок, из JNW283 в экспрессионную плазмиду pVAC осуществляли нижеследующие стадии клонирования. На первой стадии клонирования удаляли 5'- и 3'-нетранслируемые области (UTRs) и заменяли их улучшенными сайтами для рестрикционных ферментов для облегчения будущих процедур клонирования. Фрагмент MUC1 амплифицировали в ПЦР с праймерами 2060MUC1 и 2062MUC1 при использовании JNW283 в качестве матрицы и подвергали действию рестриктаз Nhel и Xhol. Параллельно плазмиду pVAC подвергали рестрикции при использовании Nhel и Xhol. Очищенный скелет вектора лигировали с ПЦР-фрагментом, генерируя плазмиду JNW322. Рестрикционный анализ и флуоресцентное секвенирование подтвердили присутствие корректного фрагмента.
1.5 Конструирование кассеты MUC1, содержащего малое число VNTR-блоков
Начальной точкой для конструирования кассеты для экспрессии MUC1, содержащего малое число VNTR-блоков, является JNW283, которую линеаризовали при использовании Fsel. Генерировали VNTR-блоки частичным расщеплением плазмиды JNW278 рестриктазой Fsel с высвобождением серии коротких фрагментов с размерами, варьирующими от 60 пар оснований (эквивалент одного VNTR-блока) до приблизительно 420 пар оснований, что соответствует семи VNTR-блокам. Серия фрагментов VNTR, генерированных частичным расщеплением JNW278, показана на Фиг.7. Фрагменты размером 60-500 пар оснований очищали экстракцией гелем и лигировали с Fsel-линеаризованной JNW283. Сначала подвергали клоны скринингу в ПЦР при использовании праймеров 2005MUC1 и 2013MUC1, которые позиционированы с 5'- и 3'-стороны, соответственно, VNTR-области последовательности MUC1. ПЦР настраивали так, что клоны, которые содержали множественные VNTR-блоки, давали ПЦР-фрагменты, более крупные, чем ПЦР-фрагменты, соответствующие одному VNTR-блоку последовательности JNW283. ПЦР-позитивные клоны подвергали дополнительному анализу рестрикционным расщеплением и флуоресцентным секвенированием для подтверждения числа присутствующих VNTR-блоков. При использовании этого протокола получали множество разных плазмид, в том числе JNW319, которая имеет в сумме семь VNTR-блоков, и JNW321, которая имеет два VNTR-блока. Последовательности JNW319 и JNW321 показаны на Фиг.4 и 5. VNTR-блоки в JNW319 демонстрируют полиморфизмы, которые присутствуют в более обширной популяции (обозначены звездочками).
1.6 Конструирование вектора для экспрессии MUC1, содержащего семь VNTR-блоков
Для переноса кассеты MUC1, содержащего семь VNTR-блоков, в экспрессионную плазмиду pVAC осуществляли нижеследующие стадии клонирования. На первой стадии клонирования удаляли 3'-нетранслируемую область (UTRs) и заменяли ее улучшенными сайтами для рестрикционных ферментов для облегчения будущих процедур клонирования. Фрагмент MUC1 амплифицировали в ПЦР с праймерами 2062MUC1 и 2063MUC1 при использовании JNW278 в качестве матрицы и подвергали действию рестриктаз BstXI и Xhol. Параллельно плазмиду JNW319 подвергали действию рестриктаз BstXI и Xhol. Очищенный скелет вектора лигировали с ПЦР-фрагментом, генерируя плазмиду JNW622. Рестрикционный анализ и флуоресцентное секвенирование подтвердили присутствие корректного фрагмента.
На следующей стадии клонирования подвергали JNW294 рестрикции при использовании BsaMI, высвобождая два фрагмента (приблизительно 2,3 тысяч пар оснований и 3,2 тысяч пар оснований). Больший из этих двух фрагментов (Фрагмент А) изолировали и очищали. Параллельно подвергали JNW622 действию рестриктазы BsaMI и больший из двух фрагментов (Фрагмент С, размером приблизительно 4 тысячи пар оснований), изолировали и очищали. Фрагменты А и С лигировали вместе, генерируя плазмиду JNW640. Корректную ориентацию подтвердили рестрикционным картированием при использовании Xbal и флуоресцентным секвенированием. На конечной стадии клонирования кассету MUC1 из JNW640 изолировали с последующей обработкой рестриктазами Nhel и Xhol и лигировали с pVAC (также линеаризованной рестриктазами Nhel и Xhol), генерируя плазмиду JNW656. Последовательность кассеты для экспрессии MUC1 подтвердили флуоресцентным секвенированием, и она показана на Фиг.6.
1.7 Очистка VNTR-блоков
После расщепления JNW278 (FL-MUC1) рестриктазой Fsel высвобождалась серия VNTR в диапазоне от 60 пар оснований (эквивалент одного VNTR-блока) до 420 пар оснований (эквивалент семи VNTR-блоков). После электрофореза изолировали эти фрагменты из агарозного геля и очищали их. Фиг.8 показывает две серии VNTR-блоков. Маркеры ДНК показаны на дорожках А и D. Дорожка В показывает серию, представляющую VNTR-блоки в диапазоне 60-240 пар оснований. Дорожка С показывает серию, представляющую VNTR-блоки в диапазоне 180-420 пар оснований. Эти фрагменты далее лигировали в Fsel-линеаризованную JNW283 для построения гена MUC1, содержащего 2 и 7 VNTR-блоков. Аналогичным образом можно получать другие конструкты, содержащие 3, 4, 5 или 6 VNTR-блоков (см. Фиг.7).
2. Получение конструктов для кожной иммунизации генным пистолетом
Плазмидную ДНК преципитировали на гранулы золота диаметром 2 мкм при использовании хлорида кальция и спермидина. Нагруженные гранулы наносили на трубки Tefzel, как описано (Eisenbraum et al., 1993; Pertmer et al., 1996). Бомбардировку частицами выполняли при использовании системы доставки генов Accell (PCT WO 95/19799). В случае каждой плазмиды иммунизировали самок мышей С56В 1/6 3-кратным введением плазмиды в дни 0, 21 и 42. Каждое введение состояло из двух бомбардировок ДНК на золоте, что давало суммарную дозу приблизительно в 4-5 мкг плазмиды.
2.1 Внутримышечная (i.m.) ДНК-иммунизация
Самок мышей С57В1/6 иммунизировали внутримышечно в заднюю ногу дозой в 50 мкг ДНК в PBS в дни 0, 21 и 42.
2.2 Инъекция опухолевых клеток
Выполнили две серии экспериментов по регрессии опухоли, в которых, в первом эксперименте, инъецировали 0,5×106 опухолевых клеток подкожно в правый бок анестезированной мыши через две недели после последней иммунизации. Во втором эксперименте использовали гораздо более агрессивную модель, в которой животное получало 1,0×106 опухолевых клеток. Рост опухоли мониторировали дважды в неделю при использовании штангенциркуля в двух измерениях. Объемы опухоли вычисляли как (а×b2)/2, где а представляет больший диаметр, и b представляет меньший диаметр. Конечную точку эксперимента (смерть) определяли как момент времени, когда диаметр опухоли достигает 15 мм.
3. Тестирование конструктов
3.1.1 Материалы и методы
Опухолевые клетки B16FO и B16FO-MUC1
B16FO (мышиная метастатическая меланома), трансфицированные экспрессионным вектором для кДНК MUC1 человека, получали от GlaxoWellcome U.S. Клетки культивировали в виде адгезивных монослоев в среде DMEM, обогащенной 10%-ой термически инактивированной фетальной телячьей сывороткой (FCS), 2 мМ L-глутамина, 100 ед/мл пенициллина, 100 ед/мл стрептомицина и 1 мг/мл антибиотика неомицина (G148). Для применения в анализе методом ELISPOT удаляли клетки из флаконов при использовании Версена и облучали (16000 рад).
3.1.2 Конструирование опухолевых клеток EL4, экспрессирующих MUC1
Культивировали клетки EL4 в полной среде RPMI, содержащей 10%-ую FCS, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ L-глутамина, 50 мкМ 2-меркаптоэтанола. JNW278 (полноразмерный MUC1) линеаризовали рестриктазой Fspl, очищали экстракцией смесью фенол:хлороформ:изоамиловый спирт (25:24:1) с последующей преципитацией этанолом. 2×107 клеток в 0,5 мл полной среды RPMI смешивали с 20 мкг линеаризированной ДНК в кювете BIORAD на 0,4 мм. Клетки трансфицировали электропорацией при 320 В, 960 мкФ. После электропорации суспензию клеток переносили в 30 мл предварительно нагретой полной среды RPMI и инкубировали 24 часа для восстановления состояния. Клетки помещали в условия селекции в полную среду RPMI, содержащую 500 мкг/мл гигромицина, и инкубировали 7-10 дней. Выжившие клетки разбавляли в планшетах на 96 лунок с U-образным дном до 0,5 клеток/лунка в 200 мкл полной среды RPMI, содержащей 500 мкг/мл гигромицина. 8-10 дней спустя переносили клоны в 24-луночные планшеты. На этой стадии проверяли проточной цитометрией профиль экспрессии MUC1 и сохраняли позитивные однородные клоны для дальнейшего анализа.
3.2 Анализы Т-клеточных ответов на продукт гена MUC1 методом Elispot
3.2.1 Получение спленоцитов
Получали селезенки из иммунизированных животных на 7-й день после поддерживающей иммунизации, что происходило либо в день 28, или день 49. Обрабатывали селезенки измельчением между стеклянными слайдами и получали клеточную суспензию. Лизировали красные клетки крови хлоридом аммония и удаляли обломки с получением чистой суспензии спленоцитов. Клетки повторно суспендировали при концентрации 8×106 /мл в полной среде RPMI для применения в анализах методом ELISPOT.
3.3 Скрининг пептидной библиотеки
Пептидную библиотеку, охватывающую полную последовательность MUC1, получали от Mimotopes. Библиотека содержала 116 15-мерных пептидов, перекрывающихся пептидами из 11 аминокислот, что охватывало всю последовательность MUC1 (что включает в себя 1 копию области тандемных повторов). Пептиды представлены числами от 184 до 299. Для скрининга этой пептидной библиотеки в ELISPOT с IFNγ и IL-2 использовали пептиды в конечной концентрации 10 мкМ, применяя протокол, описанный ниже. Для ELISPOTS на IFNγ к анализу добавляли IL-2 при 10 нг/мл. Спленоциты, использованные в скрининге, брали в день 49 от мышей C57BL/6 или мышей СВА, иммунизированных при использовании FL MUC1 в дни 0, 21 и 42.
3.4 Картирование эпитопа
Для дополнительного исследования выбирали две области MUC1, демонстрирующих хорошую реактивность у мышей C57BL/6. Это были области, охватываемые пептидами 222-225 и 238-239. Проточной цитометрией (протокол описан ниже) показывали, что клетками, продуцирующими IFNγ в ответ на эти пептиды, были CDS-клетки. Для дальнейшего картирования этих эпитопов заказывали у Mimotopes 8- и 9-мерные пептиды, перекрывающиеся на 7 или 8 аминокислот, соответственно. Их тестировали в ELISPOT с IFNγ при использовании спленоцитов из животных, иммунизированных как детализировано выше. Идентифицировали два иммунодоминантных пептида:
SAPDNRPAL и PTTLASHS.
3.5 Анализ методом ELISPOT
Покрывали планшеты крысиными антителами против мышиного IFNγ или мышиного IL-2 (Phamingen, 15 мкг/мл в PBS) в течение ночи при +4°С. Перед использованием промывали планшеты три раза в PBS. Добавляют к планшетам спленоциты при 4×105 клеток/лунка. Пептид SAPDNKPAL использовали в анализах в конечной концентрации 10 нг/мл. Пептид PAHGVTSAPDTRPAPGSTAPPAHGV (25-мерный пептид) использовали в конечной концентрации 25 мкМ. Эти пептиды получали от Genemed Synthesis. Также в анализах методом ELISPOT использовали пептиды, идентифицированные в скрининге библиотеки и исследованиях по картированию эпитопов: 203 (DVTLAPATEPATEPA) в концентрации 10 мкМ, 299 (LSYTNPAVAATSANL) в концентрации 10 мкМ, PTTLASHS в концентрации 1 мкм (Mimotopes). Облученные опухолевые клетки В16, B16-MUC1, EL4 и EL4-278 использовали при соотношении опухолевые клетки:эффектор, составляющем 1:4. Анализы методом ELISPOT проводили в присутствии IL-2 (10 нг/мл) или IL-7 (10 нг/мл) или без цитокина. Суммарный объем в каждой лунке был 200 мкл. Планшеты, содержащие клетки, стимулированные пептидом, инкубировали 16 часов в увлажненном инкубаторе при 37°С, тогда как планшеты, которые содержали в качестве стимуляторов опухолевые клетки, инкубировали 40 часов.
3.5.1 Проявление планшетов для анализа методом ELISPOT
Клетки удаляли из планшетов однократной промывкой в воде (погружение на 1 минуту для обеспечения лизиса клеток) и трехкратной промывкой в PBS. Конъюгированные с биотином крысиные антитела против мышиного IFNγ или IL-2 (Phamingen) добавляли до 1 мкг/мл в PBS. Планшеты инкубировали при встряхивании 2 часа при комнатной температуре. Затем промывали планшеты три раза в PBS перед добавлением комплекса стрептавидина со щелочной фосфатазой (Caltag) при разведении 1/1000. После трех промывок в PBS выявляли пятна инкубацией с BCICP (Biorad) в качестве субстрата в течение 15-45 минут. Субстрат отмывали при использовании воды и планшетам давали высохнуть. Пятна подсчитывали при использовании системы анализа изображений, которую разработал Brian Hayes из Asthma Cell Biology unit, GSK.
3.6 Проточная цитометрия для детектирования продукции IFNγ из Т-клеток в ответ на стимуляцию пептидом
Повторно суспендировали спленоциты в концентрации 4×106/мл. Добавляли пептид до конечной концентрации 10 мкМ и IL-2 до конечной концентрации 10 нг/мл. Клетки инкубировали при 37°С 3 ч. Добавляли брефелдин А в концентрации 10 мкг/мл и продолжали инкубацию в течение ночи. Клетки промывали буфером FACS (PBS+2,5%-ая FCS+0,1%-ый азид) и окрашивали цихромом с антителами против CD4 и FITC с антителами против CDS (Pharmingen). Промывали клетки и фиксировали Средой А из набора Fix and Perm (Caltag) 15 минут с последующей промывкой и добавлением антител против IFNγ РЕ (Pharmingen), разбавленных в Среде В из набора Fix and Perm. После 30 минут инкубации промывали клетки и анализировали при использовании FACSCAN. В сумме собирали 500000 клеток из пробы и затем разделяли CD4- и CDS-клетки для определения популяций клеток, секретирующих IFNγ в ответ на каждый пептид.
3.7 Анализ на антитела к продукту гена MUC1 методом ELISA
Получали пробы сыворотки из животных пункцией вены в дни - 1, 21, 49 и 56 и анализировали на присутствие антител против MUC1. ELISA выполняли при использовании планшетов Nunc Maxisorp, которые покрывали в течение ночи при 4°С при использовании 3 мкг/мл последовательности пептида MUC-01 дикого типа (40-мерного, соответствующего последовательности 2 тандемных повторов, PAHGVTSAPDTRPAPGSTAPPAHGVTSAPDTRPAPGSTAP). После промывки при использовании TBS-Tween (забуференный Трисом физраствор, рН 7,4, содержащий Tween 20, 0,05%) планшеты блокировали 3%-ым бычьим сывороточным альбумином (BSA) в буфере TBS-Tween в течение 2 ч при комнатной температуре. Все сыворотки инкубировали при разведении 1:100 в течение 1 ч при комнатной температуре в буфере TBS-Tween. Связывание антител детектировали при использовании конъюгированных с пероксидазой хрена противомышиных кроличьих иммуноглобулинов (№Р0260, Dako) при разведении 1:2000 в буфере TBS-Tween. Планшеты промывали снова и связанный конъюгат детектировали при использовании цветных реагентов Fast OPD (Sigma, UK). Останавливали реакцию добавлением 3 М серной кислоты и определяли продукт OPD количественно измерением поглощения при 490 нм.
3.8 Анализ сывороток из иммунизированных мышей проточной цитометрией
Для того чтобы продемонстрировать, что антитела, вызванные этими вакцинами, способны распознавать опухолевые клетки, пробы антисывороток из PMID-иммунизированных мышей использовали, чтобы метить различные линии опухолевых клеток, и метки визуализировали проточной цитометрией. Клетки (T47-D, MCF-7, EL4, EL4-278, B16FO и B16FOMUC1; 1х106) промывали в буфере PBS, обогащенном 5%-ой FCS, и инкубировали при 4°С в течение 15 мин с мышиными сыворотками при разведении 1:100. После промывки инкубировали клетки со вторым антителом (овечьи противомышиные IgG, Dako, Дания, при разведении 1:50) в тех же условиях. Контрольные клетки инкубировали с буфером для FACS вместо антител первой стадии перед тем, как окрашивать реагентом второй стадии. FACS-анализ выполняли при использовании FACScan (Becton Dickinson). 1000-10000 клеток в пробе одновременно промеряли на переднеугловое светорассеяние, интегральное светорассеяние, а также на зеленую (FL1) флуоресценцию (выражаемую как логарифм интегрального флуоресцентного света). Запись производили, исключая агрегаты, чье переднеугловое светорассеяние зашкаливало. Данные выражали в виде гистограмм числа клеток (Y-ось) против интенсивности флуоресценции (Х-ось) для разных типов мышиных сывороток, связанных с поверхностью опухолевых клеток.
3.9 Анализы методом кратковременной трансфекции
Экспрессию MUC1 с различных ДНК-конструктов анализировали методом кратковременной трансфекции плазмид в клетки СНО (яичник китайского хомячка) с последующим вестерн-блоттингом с суммарным белком клеток или анализом MUC1, экспрессирующегося на клеточных мембранах, проточной цитофлуорометрией. Кратковременную трансфекцию осуществляли реагентом Transfectam (Promega) в соответствии с указаниями изготовителя. Вкратце, в 24-луночные планшеты для культуры тканей высевали 5×104 клеток СНО на лунку в 1 мл полной среды DMEM (DMEM, 10%-ая FCS, 2 мМ L-глутамин, 100 МЕ/мл пенициллина, 100 мкг/мл стрептомицина) и инкубировали 16 часов при 37°С. Добавляли 0,5 мкг ДНК к 25 мкл 0,3 М NaCl (достаточно для одной лунки) и добавляли Transfectam (2 мкл) к 25 мкл Milli-Q. Растворы ДНК и Transfectam осторожно смешивали и инкубировали при комнатной температуре в течение 15 минут. Во время этой стадии инкубации клетки промывали один раз в PBS и покрывали бессывороточной средой (150 мкл, DMEM, 2 мМ L-глутамин). Раствор с ДНК и Transfectam добавляли каплями к клеткам, планшеты мягко встряхивали и инкубировали 4-6 часов при 37°С. Добавляли 500 мкл полной среды DMEM и инкубировали клетки еще 48-72 часов при 37°С.
3.10 Анализ клеток СНО, кратковременно трансфицированных плазмидами MUC1, проточной цитометрией
После кратковременной трансфекции промывали клетки СНО один раз в PBS и обрабатывали смесью Версен (1:5000)/0,025%-ый раствор трипсина для переведения клеток в суспензию. После трипсинизации осаждали клетки СНО и снова суспендировали в буфере FACS (PBS, 4%-ый PCS, 0,01%-ый азид натрия). Первичные антитела, ATR1, добавляли до конечной концентрации 15 мкг/мл и пробы инкубировали на льду в течение 15 минут. Контрольные клетки инкубировали с буфером FACS в отсутствие ATR1. Клетки промывали три раза в буфере FACS, снова суспендировали в 100 мкл буфера FACS, содержащего 10 мкл вторичных антител, представляющих собой козьи противомышиные иммуноглобулины, конъюгированные с FITC, F(ab')2 (Dako, F0479), и инкубировали на льду в течение 15 минут. После окрашивания вторичными антителами промывали клетки три раза в буфере для FACS. Анализ FACS выполняли при использовании FACScan (Becton Dickinson), 1000-10000 клеток в пробе одновременно промеряли на переднеугловое светорассеяние, на интегральное светорассеяние, а также на зеленую (FL1) флуоресценцию (выражаемую как логарифм интегрального флуоресцентного света). Запись производили, исключая агрегаты, чье переднеугловое светорассеяние зашкаливало. Данные выражали в виде гистограмм числа клеток (Y-ось) против интенсивности флуоресценции (Х-ось).
3.11 Анализ клеток СНО, кратковременно трансфицированных плазмидами MUC1, вестерн-блоттингом
Кратковременно трансфицированные клетки СНО промывали в PBS и обрабатывали смесью Версен (1:5000)/0,025%-ый раствор трипсина для переведения клеток в суспензию. После трипсинизации осаждали клетки СНО и снова суспендировали в 50 мкл PBS. Добавляли равный объем буфера для пробы, представляющего собой 2×трисглицин с додецилсульфатом натрия (Invitrogen), содержащего 50 мМ дитиотрейтола, и нагревали этот раствор до 95°С в течение 5 минут. 1-20 мкл пробы наносили на 4-20% трисглициновый гель толщиной 1,5 мм (Invitrogen) и подвергали электрофорезу при постоянном напряжении (125 В) в течение 90 мин в однократном трисглициновом буфере (Invitrogen). Для шкалирования проб использовали предварительно окрашенный маркер широкого диапазона (New England Biolabs, #P7708S). После электрофореза переносили пробы на PVDF-мембрану Immobilon-P (Millipore), предварительно смоченную метанолом, при использовании модуля Xcell III Blot (Invitrogen), однократного Transfer-буфера (Invitrogen), содержащего 20% метанола, постоянного напряжения 25 В в течение 90 минут. Мембрану блокировали в течение ночи при 4°С в TBS-Tween (забуференный Трисом физраствор, рН 7,4, содержащий 0,05%-ый Tween 20), содержащем 3% сухого обезжиренного молока (Marvel). Первичные антитела (ATR1) разбавляли до 1:100 и инкубировали с мембраной в течение 1 часа при комнатной температуре. После обильной промывки в TBS-Tween вторичные антитела разбавляли до 1:2000 в TBS-Tween, содержащем 3% сухого обезжиренного молока, и инкубировали с мембраной в течение одного часа при комнатной температуре. После обильной промывки мембрану инкубировали с субстратом Supersignal West Pico Chemiluminescent (Pierce) в течение 5 минут. Избыток жидкости удаляли и мембрану запечатывали между двумя листками липкой пленки и экспонировали пленке Hyperfilm ECL (AmershamPharmaciaBiotech) в течение 1-30 мин.
4. Результаты
4.1 Сравнение генного пистолета и внутримышечной инъекции
Кассету для экспрессии FL-MUC1 в плазмиде pcDNA3-FL-MUC1 вводили мышам при использовании PMID и внутримышечной инъекции.
4.2 Сравнение антительных ответов
Ответы по антителам против MUC1 после иммунизации внутримышечной инъекцией (мышь А-С) и при использовании PMID (мышь D-F) показаны на Фиг.9. Результаты показывают, что введение с помощью PMID индуцирует более устойчивый антительный ответ с более быстрой кинетикой, причем 3 из 3 мышей дают ответ в день 41. Напротив, только одна мышь, иммунизированная внутримышечным путем, показала хорошие антительные ответы в день 41. Даже после дополнительной поддерживающей иммунизации в день 42 только 2 из 3 мышей показали уровни антител против MUC1, сравнимые с таковыми у PMID-иммунизированных мышей.
4.3 Сравнение клеточных ответов
Клеточные ответы после PMID- или внутримышечной (IM) иммунизации плазмидой pcDNA3 (пустой вектор) или pcDNA3-FL-MUC1 анализировали методом ELISPOT после первичной иммунизации в день 0 и двух поддерживающих иммунизаций в день 21 и день 42. Анализ проводили в день 13 после 2-й поддерживающей иммунизации. Спленоциты стимулировали пептидом SAPDTRPAP (9.1), который был ранее описан в литературе как хороший эпитоп Н-2Кb. Относительно ответов по IFNy, Фиг.10 показывает, что у 100% PMID-иммунизированных мышей есть детектируемые ответы на пептид, тогда как у мышей, иммунизированных внутримышечно, ответов не выявили.
4.4 Экспрессия конструктов MUC1 in vitro - вестерн-блоттинг
Фиг.11 показывает результаты вестерн-блоттинга на MUC1 с суммарным белком клеток после кратковременной трансфекции различных конструктов MUC1 в клетки СНО. Эти данные показывают, что конструкт FL-MUC1 (JNW358) генерирует размытое пятно при 83-175 кДа, что соответствует предсказанной молекулярной массе 108 кДа и гетерогенному, но обильному гликозилированию структуры VNTR. Конструкт 7×VNTR-MUC1 (JNW656) продуцирует более фокусированное пятно, центрированное вокруг ˜65 кДа, что соответствует предсказанной молекулярной массе (61 кДа) и гетерогенному гликозилированию структуры VNTR. Конструкт 1×VNTR-MUC1 (JNW332) продуцирует единственную бледную полосу 40 кДа, что соответствует присутствию только одного VNTR-блока.
4.5 Экспрессия конструктов MUC1 in vitro - проточная цитометрия
После кратковременной трансфекции конструктов MUC1 в клетки СНО экспрессию MUC1 на поверхности клеток проверяли проточной цитометрией при использовании специфичных антител ATR1 против VNTR в MUC1. Процент клеток, позитивных по MUC1, был 9,6% для проб, трансфицированных при использовании FL-MUC1 (JNW358), 8,8% для проб, трансфицированных при использовании 7×VNTR-MUC1, и 9,8% для проб, трансфицированных при использовании 1×VNTR-MUC1 (JNW332). Из этих данных следует, что число VNTR не влияет на способность MUC1 перемещаться к клеточной поверхности и на его выявляемость антителами ATR1
4.6 Антительные ответы на FL-MUC1, 7×VNTR-MUC1 и 1×VNTR-MUC1 после PMID-иммунизации
Антительные ответы после иммунизации плазмидами pVAC (пустой вектор), JNW358 (FL-MUC1), JNW656 (7×VNTR-MUC1) и JNW332 (1×VNTR-MUC1) анализировали методом ELISA после первичной PMID-иммунизация в день 0 и двух поддерживающих иммунизаций в день 21 и день 42. Фиг.12 показывает антительные ответы в сыворотках, взятых в день 56. В то время как на пустой вектор MUC1 специфичных ответов не было, конструкт FL-MUC1 и конструкт 7×VNTR-MUC1 продуцировали устойчивые и сравнимые титры MUC1 специфичных антител, и, напротив, конструкт 1×VNTR-MUC1 индуцировал более низкий титр антительного ответа. Фиг.12b показывает, что кинетики антительного ответа на FL-MUC1 и 7×VNTR-MUC1 также очень похожие, в то время как ответ на 1×VNTR-MUC1 развивается более медленно и для достижения плато требует второй поддерживающей иммунизации в день 42. Эти данные подтверждают, что делеция большинства VNTR-блоков не является губительной для индукции сильного антительного ответа, специфичного к MUC1. Однако антительный ответ на 1×VNTR-MUC1 является субоптимальным в смысле его силы и кинетики его начала.
4.7 Распознавание опухолевых клеток, экспрессирующих MUC1, сыворотками из мышей, иммунизированных при использовании MUC1
Для подтверждения того, что антитела, индуцируемые FL-MUC1, 7×VNTR-MUC1 и 1×VNTR-MUC1, способны к распознаванию той формы человеческого MUC1, которая экспрессируется на опухолевых клетках, сыворотки из иммунизированных мышей тестировали проточной цитометрией. Целевыми клетками были B16FOMUC1, линия опухолевых клеток, намеренно измененных так, что они экспрессируют MUC1 человека. Результаты, показанные на Фиг.13, подтверждают, что сыворотки из мышей, иммунизированных при использовании FL-MUC1 (JNW358), мышей, иммунизированных при использовании 7×VNTR-MUC1 (JNW656), и мышей, иммунизированных при использовании 1×VNTR-MUC1 (JNW332), эквивалентны по их способности распознавать MUC1, экспрессирующийся на B16FOMUC1, откуда следует предположение, что удаление большого числа VNTR-блоков не является губительным для индукции физиологически состоятельного антительного ответа.
4.8 Идентификация новых Т-клеточных эпитопов из MUC1 в мышах C57BL/6 скринингом библиотеки пептидов MUC1
После PMID-иммунизации с использованием JNW358 (FL-MUC1) в день 0 и двух поддерживающих иммунизации в день 21 и день 42 проводили анализы методом ELISPOT в день 49. Пептиды из библиотеки FL-MUC1 тестировали при конечной концентрации 10 мкМ. При этом исходном скрининге было найдено, что несколько групп 15-мерных пептидов стимулируют секрецию IFNγ или IL-2. Области, представляющие интерес, отмечены на Фиг.14b, c. Пептиды, стимулирующие секрецию IFNγ, были изучены далее внутриклеточным окрашиванием на цитокин и проточной цитометрией для определения, содержат ли эти области CD4- или СD8-эпитопы. Было найдено, что пептиды 223, 224, 225, 238 и 239 индуцируют хорошую секрецию IFNγ из СD8-клеток. Для того чтобы картировать СD8-эпитопы далее, получали 8- и 9-мерные пептиды, перекрывающиеся на 7 или 8 аминокислот. Их тестировали в анализе на IFNy методом ELISPOT и затем несколько из них, демонстрирующих реактивность, тестировали проточной цитометрией. Область 223-225 содержала кластеры СD8-эпитопов. Титрованием показали, что доминантным пептидом был SAPDNRPAL, пептид, который уже использовали другие авторы для измерения ответов, специфичных к MUC1. Однако в этой области идентифицировали несколько новых пептидов, которые индуцировали секрецию IFNγ СD8-клетками при 10 мкМ и более низкой концентрации. Мы показали, что один из них, TSAPDNRPA, способен индуцировать цитотоксические Т-клетки in vitro (данные не показаны). Показано, что область 238-239 содержит один сильный CD8-эпитоп, PTTLASHS, который мы использовали для последующих анализов MUC1, а также несколько более слабых СD8-эпитопов.
4.9 Клеточные ответы на FL-MUC1, 7×VNTR-MUC1 и 1×VNTR-MUC1 после PMID-иммунизации
Клеточные ответы после иммунизации плазмидами pVAC (пустой вектор), JNW358 (FL-MUC1), JNW656 (7×VNTR-MUC1) и JNW332 (1×VNTR-MUC1) анализировали методом ELISPOT после первичной PMID-иммунизации в день 0 и двух поддерживающих иммунизаций в день 21 и день 42. Анализы проводили через 7 дней после поддерживающей иммунизации. Применяли три варианта анализа: 1) опухолевые клетки B16-MUC1 и EL4-MUC1, экспрессирующие MUC1, которые использовали для демонстрации широкого противоопухолевого клеточного ответа, 2) высокоаффинный пептид SAPDNRJPAL вне VNTR-области MUC1 (представлен один раз во всех использованных конструктах), 3) 25-мерный пептид, кодирующий последовательность, которая включает в себя целый повтор из VNTR-области и дополнительно 5 аминокислот из смежного повтора. Этот пептид индуцирует преимущественно продукцию IL-2 из иммунизированных спленоцитов. Конструкты FL-MUC1, 7×VNTR-MUC1 и 1×VNTR-MUC1 продуцировали устойчивые и сравнимые клеточные ответы, специфичные к MUC1, на все тестированные стимулы (Фиг.14). В случае пептида SAPDNRPAL мы показали, что IFNγ продуцируют СD8-клетки, тогда как продукция IFNγ в ответ на опухолевые клетки и продукция IL-2 в ответ на 25-мерные пептиды возможна из CD4- или СD8-клеток. Эти данные подтверждают, что делеция большинства VNTR-блоков не является губительной для индукции сильного клеточного ответа, специфичного к MUC1, на эпитопы как внутри, так и вне VNTR-области.
4.10 Сравнение защиты (PMID в сравнении с IM) после опухолевого воздействия
После трех введений плазмиды pcDNA3-FL-MUC1, экспрессирующей MUC1, или пустого вектора pcDNA3.1 при использовании PMID или внутримышечной инъекции на мышей подействовали опухолевыми клетками, экспрессирующими MUC1 (B16FOMUC1). Процент мышей без опухолей показывает Фиг.15, ясно демонстрирующая, что PMID индуцирует защиту от последующего опухолевого воздействия у большего числа мышей при сравнении с доставкой той же плазмиды внутримышечной инъекцией. Из этих данных в сочетании с антительным и клеточным ответами, детализированными выше, следует, что PMID при сравнении с внутримышечной доставкой индуцирует более устойчивый клеточный и антительный ответы, что коррелирует с улучшенным профилем защиты от опухоли.
4.11 Эффективность конструктов кДНК MUC1 (F/L MUC1 и 7 VNTR) в противоопухолевой защите
Мышей иммунизировали три раза как описано в материалах и методах пустым вектором (pVAC, пустой) или вектором, кодирующим полноразмерный MUC1 (JNW358). Через две недели после последней поддерживающей иммунизации мышей подвергали опухолевому воздействию клетками B16FOMUC1 и мониторировали рост опухоли. При наличии опухолей они появлялись приблизительно через 10-15 дней после опухолевого воздействия в группе, подвергнутой пустой вакцинации, и приблизительно через 22 дня в группе, вакцинированной при использовании FL-MUC1. Фиг.16А сопоставляет выживание мышей, иммунизированных либо пустым вектором, либо вектором, кодирующим полноразмерный MUC1, в обеих группах. Имеет место значительно лучшее выживание у мышей, иммунизированных с использованием FL-MUC1 (60% без опухолей), в сравнении с таковым у мышей, иммунизированных пустым вектором (20% без опухолей). Фиг.16B показывает противоопухолевую защиту, сопоставляя группы с FL-MUC1 и 7×VNTR и контрольную группу при двухкратном количестве опухолевых клеток (1,0×106) в сравнении с предыдущими экспериментами. Оба конструкта MUC1 вызывают заметные и сравнимые задержки опухолевого роста относительно контрольной вакцинированной группы до приблизительно дня 25. Позже этот эффект уменьшался, возможно, из-за истощения иммунного ответа на опухолевый антиген.
В заключение, конструкт 7×VNTR-MUC1 давал такой же защитный противоопухолевый ответ, как и FL-MUC1, даже в весьма жестких условиях.
4.12 FL-MUC1 в сравнении с 7×VNTR-MUC1: стабильность в системе, представляющей собой рекомбинантный вирус осповакцины
Полноразмерный MUC1 человека вставляли в вектор pSClinker в виде BamHI-фрагмента. Этот конструкт использовали для создания рекомбинантного вируса осповакцины гомологичной гекомбинацией вектора в ген ТК (тимидинкиназы) генома вирус осповакцины.
Наносили рекомбинантный вирус на клеточный слой НТК-клеток и анализировали бляшки на бета-галактозидазную активность способом bluo-gal. Ген бета-галактозидазы переносится вектором и, таким образом, синие бляшки указывают на наличие рекомбинантного вируса. Выбирали и клонировали множество синих бляшек до того, как 100% бляшек стали продуцировать синее окрашивание при выполнении анализа bluo-gal.
6 из этих клонов использовали для инфицирования НТК-клеток при кратности инфицирования, равной 10, и собирали клетки через 6 ч, 24 ч и 32 ч после инфицирования. Повторно суспендировали эти клетки в 200 мкл среды и удаляли 40 мкл и смешивали с буфером для нанесения пробы при электрофорезе в полиакриламидном геле с додецилсульфат натрия.
Эти клеточные экстракты подвергали электрофорезу в полиакриламидном геле с додецилсульфат натрия и анализировали вестерн-блоттингом при использовании моноклональных антител ATR1 и HMPG1, причем и те, и другие распознают эпитопы в пределах VNTR-области MUC1. Ни одна из проб, инфицированных рекомбинантным вирусом, не давала какого-либо окрашивания с этими антителами. Контрольный клеточный экстракт клеток, трансфицированных плазмидой pVAC-7VNTRMUC1, окрашивался с получением яркой полосы, указывающей на присутствие TR-эпитопов.
Окрашивание антителами против бета-галактозидазы указывает на экспрессию бета-галактозидазы во всех пробах, инфицированных рекомбинантным вирусом, но не вирусом дикого типа, или не в клеточном контроле.
Молекулярный анализ собранных инфицированных клеток выполняли методом ПЦР. Выбирали пары праймеров, которые должны указывать на присутствие различных частей конструкта pSCHnuHKep-FLMUCI в геноме рекомбинантного вируса. Выбрали следующие пары праймеров:
FMC101+2014MUC1 - место соединения вектора и 5'-конца MUC1
2008MUC1+FMC102 - место соединения вектора и 3'-конца MUC1
2004MUC1+2014MUC1 - часть MUC1 с 5'-стороны от VNTR-области
2007MUC1+2009MUC1 - часть MUC1 с 3'-стороны от VNTR-области
FMC101 и FMC102 представляют собой праймеры в векторной последовательности, которые находятся с 5'-стороны и 3'-стороны, соответственно, линкерной последовательности.
FMC101: - CATAAATAATAAATACAATAATTAATTTCTCG
FMC102: - GCCTCCTTAAAGCATTTCATACACACAGC
Осуществляли показанные выше 4 ПЦР при использовании 1 мкл собранных клеток, инфицированных рекомбинантным вирусом (32 ч после инфицирования) после нагревания до 80°С в течение 10 мин. Реакцию проводили также на пробах клеток, инфицированных вирусом дикого типа, и неинфицированных клеток. Сюда включали и позитивный контроль, представляющий собой 1 нгДНК плазмиды pSслинкер-FLMUC1.
Позитивный контроль продуцировал амплифицированные фрагменты корректного размера при электрофорезе на агарозном геле. Ни одна из других проб не продуцировала специфические продукты, из чего следует, что в вирусном геноме конструкт уже не был интактным.
Затем аналогичным образом продуцировали рекомбинантный вирус, содержащий 7УМТК-вариант человеческого MUC1, и после обеспечения клональной популяции использовали его для инфицирования НТК-клеток, которые собирали как и ранее. Клеточные экстракты этих инфицированных клеток ясно демонстрировали экспрессию MUC1 при вестерн-блоттинге с ATR1 и также при FACS-анализе инфицированных клеток через два дня после инфицирования. Мышиные МС57-клетки, инфицированные вирусом, рекомбинатным с 7VNTR, использовали для стимуляции клеток селезенки из мышей, которых вакцинировали при использовании MUC1, в ELISPOT-анализе. Было показано, что после инкубации в течение ночи клетки селезенки секретируют IL-2 в ответ на клетки, инфицированные 7VNTR-BnpycoM осповакцины, но не на клетки, инфицированные вирусом осповакцины дикого типа.
Из этих результатов следует, что использование конструкта MUC1 с 7-ю тандемными повторами улучшает стабильность конструкта. Из того факта, что вирус осповакцины, рекомбинантный с полноразмерным MUC1, был неспособным индуцировать экспрессию MUC1 в инфицированных клеток, явно следует, что этот конструкт нестабилен в этих сильно рекомбиногенных условиях. Ни один из 6 вирусных клонов не экспрессировал MUC1, и они, по видимому, не содержали ген MUC1, однако все они экспрессировали бета-галактозидазу, которую переносил тот же вектор. Однако 7×МТР-вариант с меньшим числом повторов ясно демонстрировал экспрессию в 3 разных анализах, что указывает на более высокую стабильность без потери распознавания как антителами, так и антиген-специфичными Т-клетками.
5. Стабильность FL- MUC1, 7VNTR и 1VNTR при выращивании в E.Coli DH1
Для трансформирования E.Coli DH1 использовали соответствующий вектор. Для контроля трансформировали также пустым вектором.
Для того чтобы определить, влияет ли число повторов в VNTR-области на стабильность, выполняли анализ стабильности во встряхиваемом флаконе при использовании плазмид FL-MUC1, 7×VNTR-MUC1 и 1×VNTR-MUC1.
При исследовании стабильности наблюдали рост, продукцию плазмиды и удержание плазмиды для каждого из конструктов в культуре во встряхиваемом флаконе на протяжение 9 пересевов, каждый длительностью между 10 и 14 ч.
Исследование стабильности используют для определения того, меняется ли продукция и качество плазмиды в результате повторных пересевов клеток во встряхиваемых флаконах. Поскольку условия во встряхиваемых флаконах являются неконтролируемыми (например, рН, аэрация), поддержание качества и продукции плазмиды на протяжении исследования является хорошим показателем того, что эти характеристики должны оставаться стабильными.
5. РЕЗУЛЬТАТЫ
5.2.1. Рост культур
Хотя имело место некоторое варьирование между конечной оптической плотностью при 600 нм, достигнутой клетками из каждого пересева, из-за легких вариаций в объеме инокулята, в целом не было значительных различий в скоростях роста как во время анализа, так и между разными конструктами MUC1.
5.2.2. Продукция плазмид
Величины числа копий плазмиды (ЧКП) получали на 1-м, 5-м и 9-м (конечном) пересеве. В случае полноразмерного конструкта ЧКП снижалось на 54% на протяжении этого периода, тогда как в случаях других трех конструктов оно увеличивалось на ˜40%. Объемный выход (мг плазмиды/л культуры) оставался стабильным на протяжении исследования в случае 7VNTR, тогда как в случае полноразмерного конструкта он снижался на 64%. Небольшое уменьшение объемного выхода наблюдали в случае пустого вектора (21%) и конструкта с единственным VNTR (24%), хотя это ни коим образом не было столь же заметным, как в случае полноразмерного конструкта.
5.2.3. Удержание плазмиды
Удержание плазмида измеряли при использовании анализа высевания реплики, и оно на протяжении исследования стабильности оставалось у всех конструктов между 80% и 100%. Более того, не было значительных различий между конструктами.
5.2.4. Стабильность плазмиды
Для изучения стабильности плазмид на протяжении длительности этого исследования с помощью вращательных колонок Qiagen Mini-prep, Plasmide Extraction получали экстракты плазмид как в начальной точке (сбор в день 0), так и в конечной точке (сбор в день 5). Эти экстракты затем анализировали электрофоретическим разделением на агарозном геле перед последующим окрашиванием при использовании Sybr-Gold. Этот метод окрашивания, основанный на Sybr-Gold, считают особенно подходящим для анализа стабильности плазмид по причине предыдущей работы, продемонстрировавшей, что он способен детектировать 1 нг «пика» рекомбинанта в 1000 нг пробы. Результаты этого исследования показаны ниже (см. Фиг.6), и из этих результатов следует три вывода:
1. Конструкты с 7×VNTR и 1×VNTR содержат ожидаемое количество повторов VNTR на протяжении эксперимента при отсутствии свидетельств нестабильности, выявленных либо в скелете плазмиды, либо в структуре VNTR-повтора в любой момент времени.
2. Пустой вектор р7313, который использовали в анализе стабильности, не имеет ожидаемого профиля и отличается от стандартной плазмиды р7313.
3. Пробы полноразмерного Mud, взятые в конечной точке времени (день 5; 9-й пересев) содержат следы плазмид неизвестного происхождения.
Вследствие неясности относительно профиля р7313, а также из-за идентификации следовых разновидностей плазмид в случае конструкта FL-МUС1 в день 5 была выполнена дополнительная исследовательская работа.
Для исследования наблюдаемых различий между пустым вектором р7313, использованным в исследовании стабильности, и стандартной плазмидой р7313 провели анализ рестрикционными ферментами. Результаты этого анализа показали, что область в ˜800 пар оснований конструкта р7313, содержащая рестрикционные сайты для BamHI (1926 пар оснований) и Sapl (2422 пар оснований), была утеряна. Затем разработали праймеры, фланкирующие эту область, и после этого секвенировали плазмиду. Получившиеся данные о последовательности подтвердили, что область между 1866 и 2589 была утеряна. Эта область плазмиды содержит Cer-последовательность. Из-за того, что эти Cer-последовательности помогают разделять конкатемеры, их отсутствием можно объяснить множественность полос у разновидностей плазмиды р7313, которую наблюдали в исследовании стабильности.
Дополнительная исследовательская работа: аализ следовых плазмид в пробах с FL-MUC1
Следовые плазмиды, которые наблюдали только в конечной точке в пробах с FL-Mud, анализировали дополнительно. Этот анализ обнаружил, что эти следы нельзя было выявить до дня 4. Наряду с этим открытием, с этими следовыми плазмидами еще и проводили очистку в геле, повторную трансформацию, повторную очистку и секвенирование. Такой анализ затем идентифицировал эти плазмиды как примесные, а не рекомбинантные, причем они представляли собой именно тот 7×VNTR, который использовали в анализе стабильности (р7656), р7313 с делецией в Cer-области (обрисован выше), а также предположительный конкатемер этой Cer-делеции в р7313.
Из этих результатов сделали вывод, что пробы с FL-MUC1 имели примеси в виде пустого вектора р7313 и конструктов 7xVNTR (р7656) и что рекомбинанты в конечной точке в пробах с FL-Mud отсутствуют. Считается, что эти примеси попали в часть Е.coli DH1 с FL-Mud во время исходной трансформации плазмид. Из-за того, что эти следовые плазмиды не появляются на агарозных гелях до дня 4, одной из возможностей является то, что они прошли селекцию в течение исследования из-за их меньшего размера относительно плазмиды FL-Mud.
3. ЗАКЛЮЧЕНИЕ
Данные исследования стабильности показали, что плазмида 7×VNTR-MUC1 стабильна в смысле ростовых характеристик, удержания плазмиды и качества плазмиды. В смысле ростовых характеристик, удержания плазмиды и качества плазмиды не было заметных различий между векторами 1×VNTR, 7×VNTR и FL-MUC1. Однако данные о числе копий высветили значительные различия между этими конструктами. У полноразмерного конструкта при сравнении с 7×VNTR в течение исследования табильности значительно снижались и число копий плазмиды, и объемный выход. Хотя удержание плазмиды, как видно, оставалось на уровне 100% на протяжении эксперимента с полноразмерным конструктом, это только указывает на то, что все клетки в популяции все еще содержат достаточно плазмид для придания устойчивости к канамицину. Если бы этот эксперимент проводили дольше, возможно, что число копии могло уменьшиться до такого уровня, что устойчивость к канамицину стала бы недостаточной для того, чтобы дать возможность для роста на селективных планшетах, что привело бы к уменьшению наблюдаемого удержания плазмиды. Из этих данных следует, что конструкт 7×VNTR может иметь значительные преимущества в смысле благоприятного профиля развития, поскольку содержание плазмиды может влиять на очистку клеточной массы. При наличии этих различий между конструктами 7VNTR и FL-MUC1 вероятно, что 7VNTR будет легче очищать и получать с более высоким выходом.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОСТИМУЛИРУЮЩИЕ И ВАКЦИННЫЕ КОМПОЗИЦИИ | 2011 |
|
RU2578420C2 |
| ИММУНОТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ОСНОВЕ ДРОЖЖЕЙ-MUC1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2642300C2 |
| Антитела, связывающие опухолеассоциированный MUC1, и способы их получения | 2016 |
|
RU2652901C1 |
| МИКРООРГАНИЗМЫ В КАЧЕСТВЕ НОСИТЕЛЕЙ НУКЛЕОТИДНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, КОДИРУЮЩИХ КЛЕТОЧНЫЕ АНТИГЕНЫ, ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2003 |
|
RU2319741C2 |
| ПРОСТАТОАССОЦИИРОВАННЫЕ АНТИГЕНЫ И ИММУНОТЕРАПЕВТИЧЕСКИЕ СХЕМЫ НА ОСНОВЕ ВАКЦИН | 2013 |
|
RU2609651C2 |
| КОМПОЗИЦИЯ ДНК ДЛЯ ВЫЗОВА ИММУННОГО ОТВЕТА ПРОТИВ ОПУХОЛЕАССОЦИИРОВАННЫХ МАКРОФАГОВ | 2007 |
|
RU2459631C2 |
| ПРОСТАТОАССОЦИИРОВАННЫЕ АНТИГЕНЫ И ИММУНОТЕРАПЕВТИЧЕСКИЕ СХЕМЫ НА ОСНОВЕ ВАКЦИН | 2013 |
|
RU2737765C2 |
| ПРОФИЛАКТИЧЕСКАЯ ПРОТИВОРАКОВАЯ ВАКЦИНА | 2004 |
|
RU2385163C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К КЛАУДИНУ 6 (CLDN6) | 2010 |
|
RU2675997C2 |
| ПРОФИЛАКТИЧЕСКАЯ ПРОТИВОРАКОВАЯ ВАКЦИНА | 2004 |
|
RU2556128C2 |
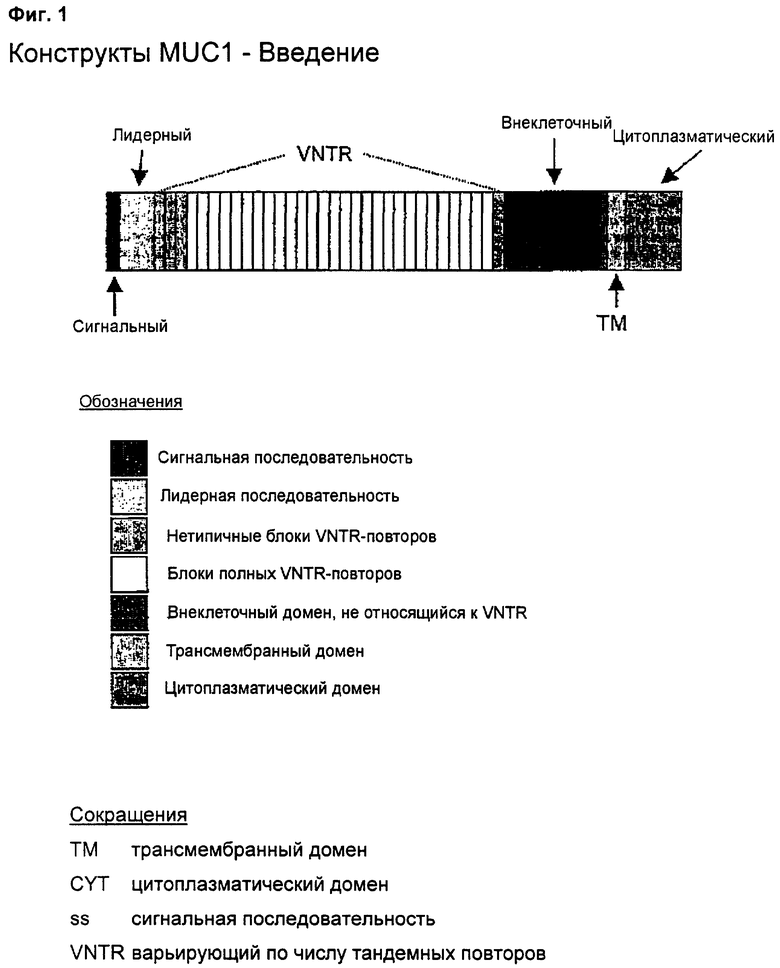










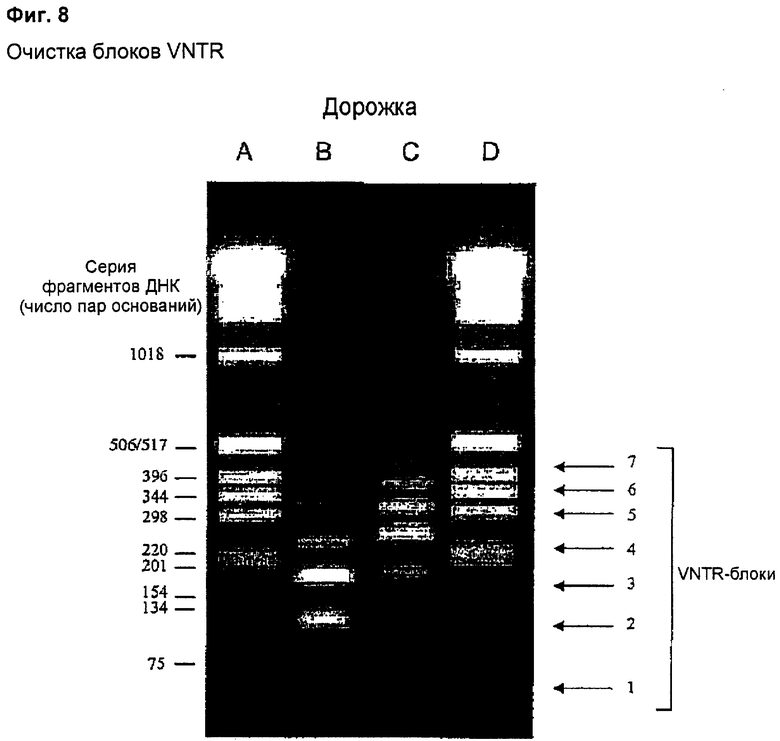
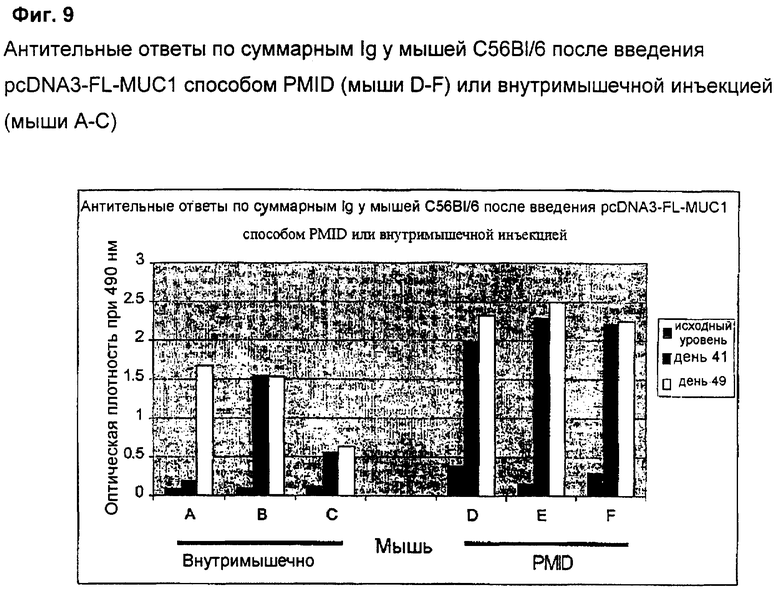
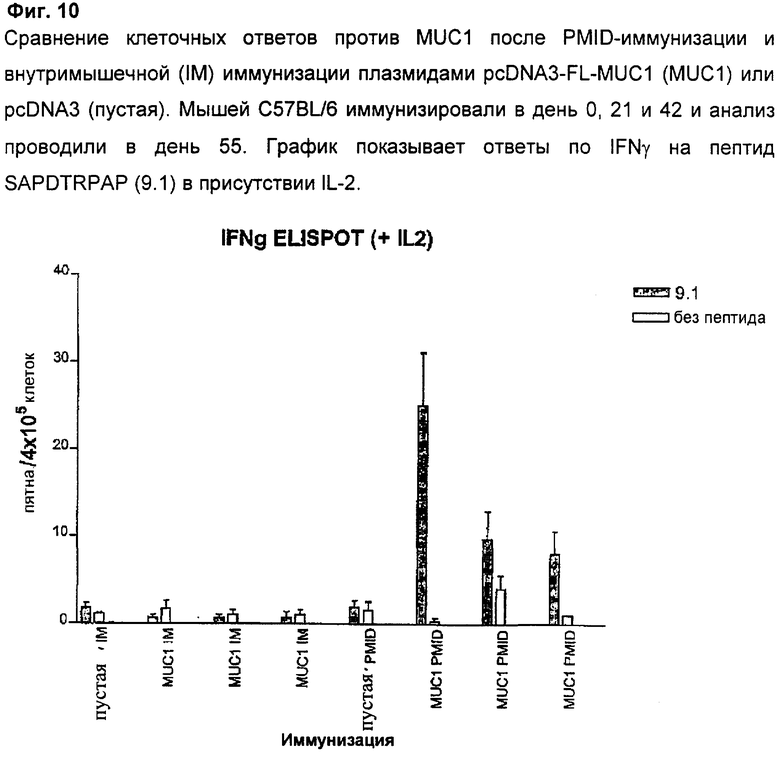
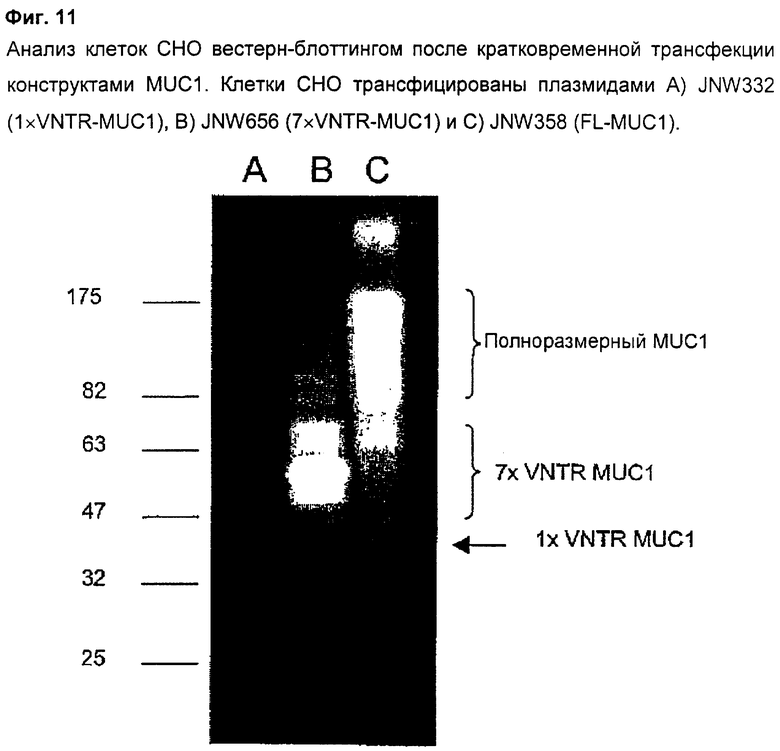
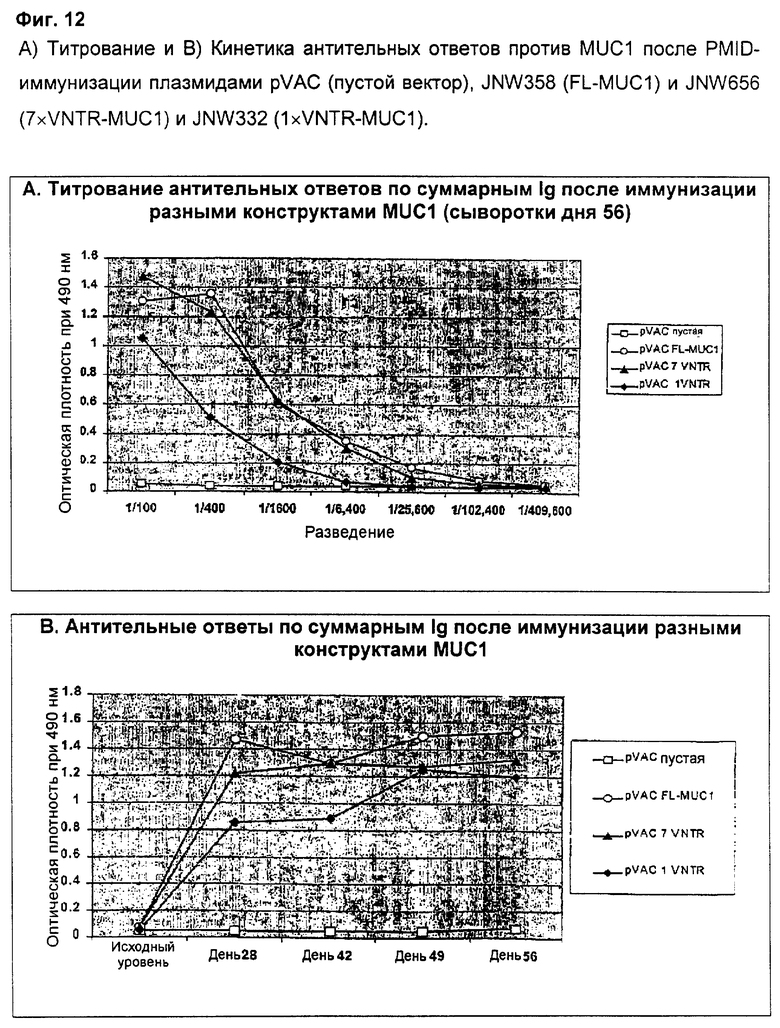
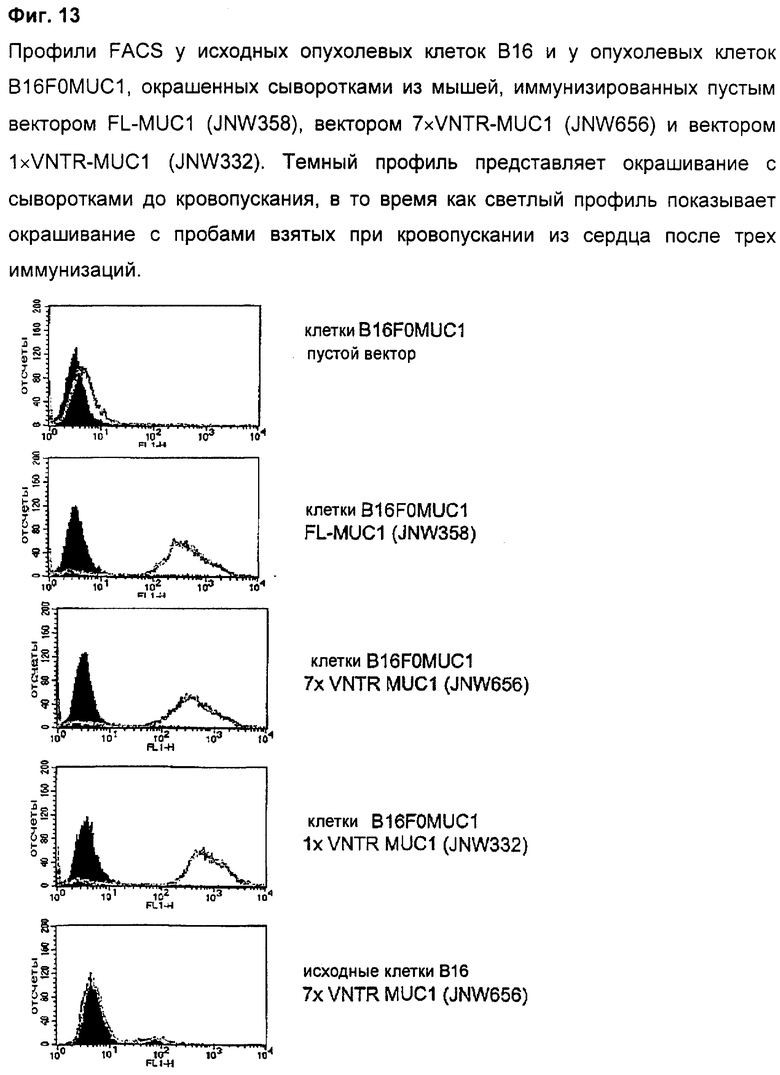
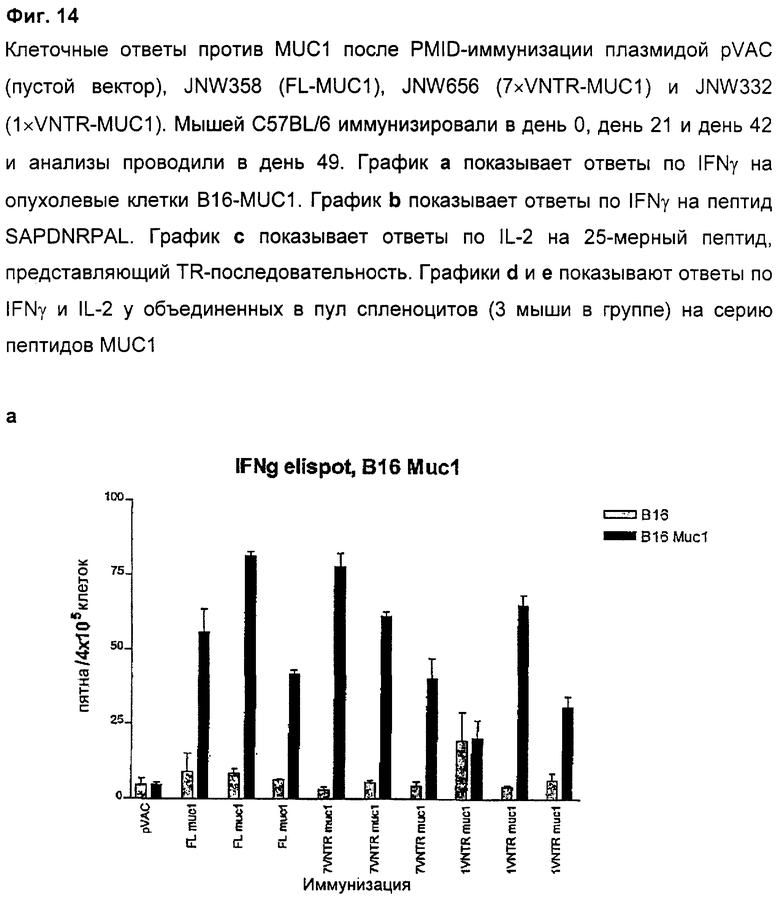
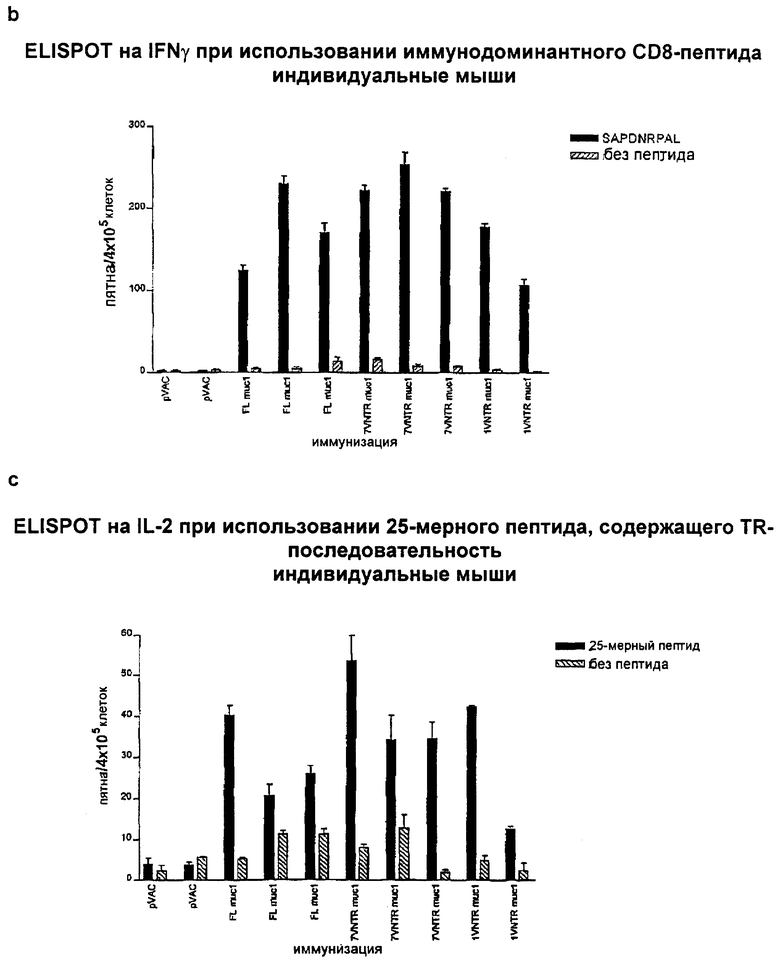
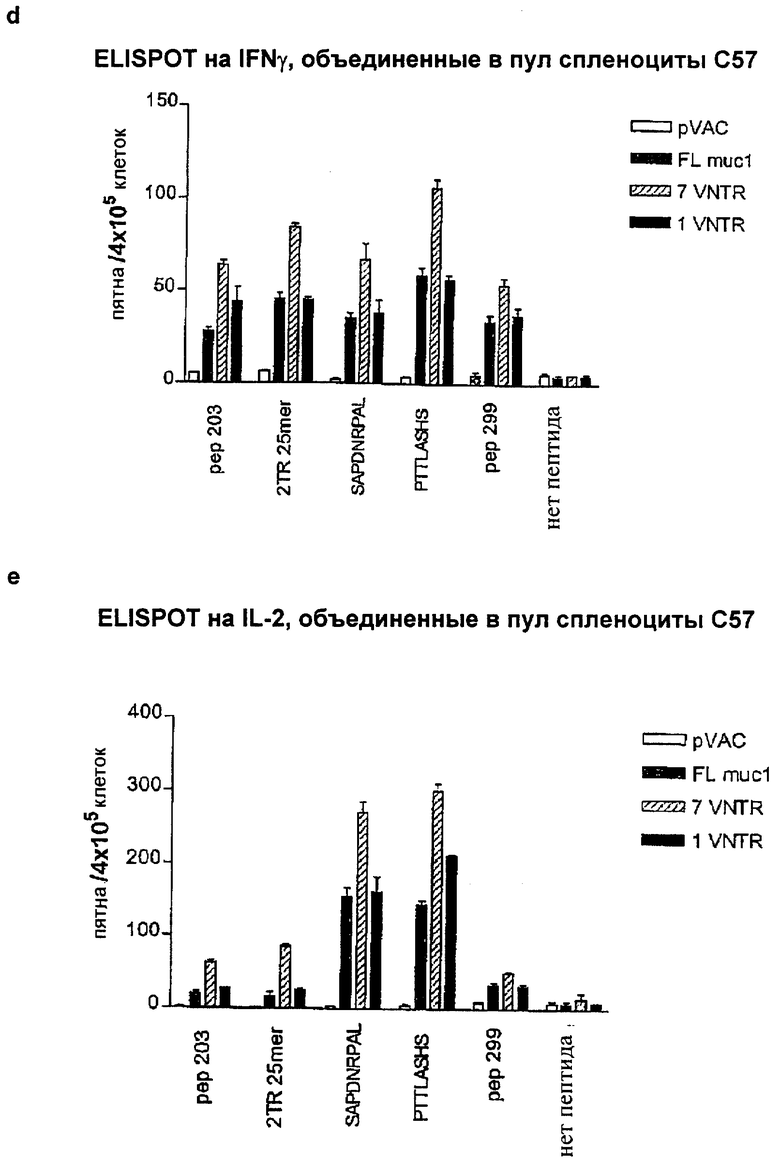
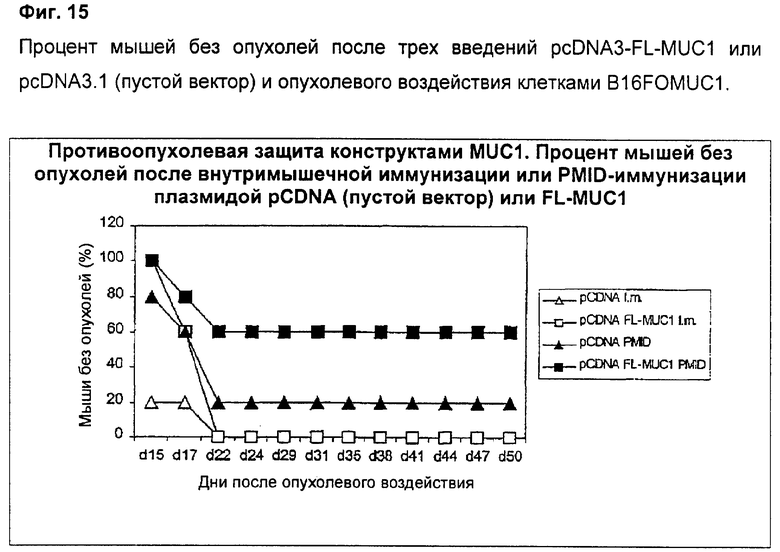
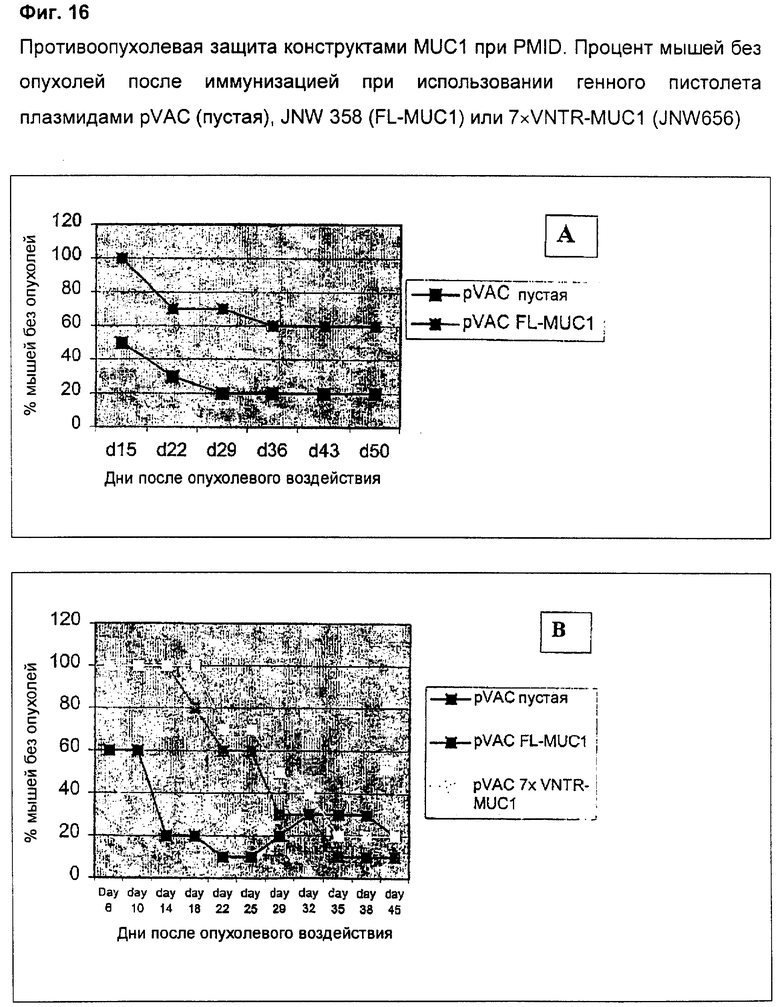

Изобретение относится к иммунологии и биотехнологии. В изобретении раскрыты варианты нуклеиновокислотного конструкта (НК конструкта), кодирующего антиген MUC1 на основе семи полных повторяющихся блоков VNTR. Варианты включают НК конструкты, выбранные из группы: полный MUC1 из семи полных повторяющихся блоков VNTR; MUC1 из семи полных VNTR без сигнальной последовательности; MUC1 из семи полных VNTR без сигнальной последовательности, трансмембранного и цитоплазматического доменов; полный MUC1 из семи полных VNTR без трансмембранного и цитоплазматического доменов, а также мутанты указанных вариантов, где по меньшей мере один VNTR мутирован для снижения потенциала гликозилирования. Раскрыты НК конструкты, дополнительно включающие эпитопы, выбранные из группы: FLSFHISNL, NLTISDVSV или NSSLEDPSTDYYQELQRDISE. Описаны варианты экспрессирующей плазмиды, несущей НК конструкт, представленный в виде ДНК, протеин с противоопухолевой активностью, кодируемый НК конструктом и фармацевтическая композиция с противоопухолевой активностью на основе указанного протеина, НК конструкта или плазмиды. Описаны: применение НК конструкта, и протеина в изготовлении медикамента для лечения или предотвращения опухолей, экспрессирующих MUC1; способ лечения с использованием НК конструкта, протеина или плазмиды. НК конструкты обладают противоопухолевой активностью, эквивалентной активности при введении полноразмерного MUC1 (с числом VNTR от 30 до 100), индуцируют устойчивые титры антител к MUC1. Плазмиды на основе НК конструктов обладают стабильными ростовыми характеристиками. Количество копий плазмиды при конечном - девятом пересеве увеличивается на 40%. 8 н. и 12 з.п. ф-лы, 16 ил.
(а) 7 VNTR MUC-1 (то есть полный MUC-1 только с 7 полными повторами);
(б) 7 VNTR MUC-1 Δss (такой же, как (а), но лишенный сигнальной последовательности);
(в) 7 VNTR MUC-1 ΔTM ΔCYT (такой же, как (а), но лишенный трансмембранного и цитоплазматического доменов); или
(г) 7 VNTR MUC-1 Δss ΔTM ΔCYT (такой же, как (в), но лишенный сигнальной последовательности).
(а) 7 VNTR MUC-1 (то есть полный MUC-1 только с 7 полными повторами);
(б) 7 VNTR MUC-1 Δss (такой же, как (а), но лишенный сигнальной последовательности);
(в) 7 VNTR MUC-1 ΔTM ΔCYT (такой же, как (а), но лишенный трансмембранного и цитоплазматического доменов); или
(г) 7 VNTR MUC-1 Δss ΔTM ΔCYT (такой же, как (в), но лишенный сигнальной последовательности),
где по меньшей мере один VNTR мутирован для снижения потенциала гликозилирования.
| AKAGI et al., «Therapeutic antitumor response after immunization with an admixture of recombinant vaccinia viruses expressing a modified MUC1 gene and murine T-cell costimulatory molecule B7», J | |||
| Immunother., 1997; vol.20 no.1, стр.38-47 | |||
| Muller et al, «Recombinant MUC1 prohe authentically reflects cell-specific O-glycosylation profiles of |
Авторы
Даты
2007-07-20—Публикация
2003-05-23—Подача