ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка испрашивает приоритет по заявке США с временным номером 60/513827, дата подачи 23.10.2003.
ПРЕДПОСЫЛКИ ДАННОГО ИЗОБРЕТЕНИЯ
Область данного изобретения
[0002] Данное изобретение касается области вирусологии и иммунологии. В частности, но не исключительно, оно касается способа индуцирования иммунного ответа и субстанции, основанной на слитом белке (или белке F) для достижения индуцирования иммунного ответа.
Описание известного уровня техники
[0003] Вирус иммунодефицита человека (ВИЧ) является ретровирусом медленной или лентивирусной группы и вызывает Синдром Приобретенного Иммунного Дефицита (СПИД). Подобно многим вирусам, имеющим оболочку, для ВИЧ необходимо слияние вирусной и клеточной мембраны, что приводит к инфекции и репликации вируса. Как только ВИЧ сливается с клеткой хозяина, он переносит свой геном через вирусную и клеточную мембраны в клетку хозяина.
[0004] ВИЧ использует свою РНК как матрицу для образования вирусной ДНК в клетках-мишенях путем обратной транскрипции. Вирусная ДНК затем может объединиться с ДНК инфицированного хозяина. ВИЧ инфицирует клетки, имеющие поверхностный CD4, такие как лимфоциты и макрофаги, и разрушает CD4+ хелперные Т-лимфоциты. CD4 представляет кластер антигенной дифференцировки №4, который является частью клеток Th1 и Th2. Молекулы клеточной мембраны используются для дифференциации лейкоцитов различных эффекторных подклассов. В общем, описаны четыре типа молекул клеточных мембран, известных как кластер дифференцировки (КД). Тип I и II представляют собой трансмембранные белки (ТБ) с полярностью, противоположной плазматической мембране. ТБ типа III несколько раз пересекают плазматическую мембрану, и поэтому могут образовывать поры или каналы. ТБ типа IV являются сцепленными с гликозилфосфатидилинозитолом (ГФИ). CD4 является трансмембранным белком типа I, выраженным в различных клетках, включая хелперные/индукторные Т-клетки, моноциты, макрофаги и представляющие антиген клетки.
[0005] Этот процесс частично зависит от сшитых белков, которые являются компонентами гликопротеина gp41. Структура белка F устойчива к протеазам (Weissenhom, Nature Vol.387, p.426-430 (1997)). С помощью рентгеновской кристаллографии установили трехмерную структуру белка F.
[0006] Наружные мембранные белки ВИЧ, gp41 и gp120 связаны друг с другом нековалентной связью. На поверхности вириона ВИЧ gp120 и gp41 объединены в трехмерную единицу. Три молекулы gp120 объединены с тремя молекулами gp41.
[0007] Молекула gp120 связывается с рецептором CD4 на поверхности хелперных Т-клеток, а также макрофагов и моноцитов. Это связывание характеризуется высокой аффинностью между двумя молекулами. Высокое содержание сиаловой кислоты на поверхности вируса снижает пороговое значение энергии связывания, необходимое для преодоления отталкивающих электростатических сил. Таким образом, полагают, что мембранное слияние частицы ВИЧ с клеткой-мишенью хозяина включает следующие этапы:
1. взаимодействие вирусного связанного СурА (циклофилина А) с гепарином клетки хозяина;
2. прикрепление вируса к клетке-мишени путем взаимодействия СурА с гепарином;
3. связывание gp120 с молекулой CD4 клетки-мишени; для этого процесса необходимы корецепторные белки, известные как рецепторы хемокинов (CCR5 для Т-клеток и CXCR4 для макрофагов); затем эти вирусы начинают сливаться с клеткой, производя структурные или конформационные изменения и экспонируя другие рецепторы;
4. экспонирование слитого домена или белка F gp41 конформационными изменениями трехмерной и/или четырехмерной структуры молекулы gp120;
5. диссоциация молекулы gp120 от gp41 как результат конформационного изменения и отделение gp120;
6. сворачивание gp41 непосредственно перед проникновением в плазматическую мембрану клетки-мишени;
7. разворачивание белка F; и
8. слияние мембран вирусной частицы и клетки хозяина.
Вставка слитого пептида разрушает целостность липидов в мембране клетки-мишени хозяина. Белок F связывает вирусную и клеточную мембраны так, что при разворачивании сшивающего белка плазматическая мембрана клетки-мишени и вирусная мембрана соединяются вместе.
[0008] Вирусная мембрана ВИЧ образована из плазматической мембраны инфицированной клетки хозяина, когда вирус проникает сквозь клеточную мембрану. Таким образом, оболочка включает некоторые липидные и белковые компоненты клетки хозяина (Stoiber, 1996; Stoiber, 1997). Некоторые вирусы, имеющие оболочку, используют белки шипов для имитации молекул хозяина, для того чтобы связаться с рецепторами клетки хозяина и проникновения в другие клетки-мишени. Однако эти шипы могут также быть антигенными поверхностями для распознавания и разрушения вируса иммунной системой. ВИЧ защищается от иммунной идентификации (гуморальной и с помощью CD8) хозяином. В добавок к изменчивости конформационных изменений gp120 предусматривает другие свойства поверхности, которые маскируют его от иммунного узнавания и атаки, такие как покрытие гликопротеинами, ковалентно связанные остатки сиаловой кислоты или пространственное смыкание (Haurum, 1993). ВИЧ активирует различные иммунные ответы для своей собственной пользы.
Иммунный ответ
[0009] Таким образом, первичное действие ВИЧ заключается в уничтожении CD4 Т-клеток, которое снижает общую иммунную активность. Как описано выше, инфекция ВИЧ сосредотачивается на CD4 Т-клетках, но также поражает В-клетки, тромбоциты, эндотелиальные клетки, эпителиальные клетки, макрофаги и т.д. Поскольку CD4 Т-клетки уничтожены, ответ В-клеток становится разрегулированным. Прогрессирование ВИЧ отличает гипергаммаглобулинемия с неэффективными антителами. Кроме того, цитотоксические CD8 Т-клетки находятся в состоянии некомпетентности и не способны к распознаванию и разрушению вирусной инфекции. Это частично обуславливает трансфекцию неэффективных CD8 клеток белком tat, образованным в инфицированных CD4 клетках.
[0010] CD4 хелперные Т-клетки (Th) продуцируют цитокины и могут быть отнесены к Th1 клеткам или Th2 клеткам. Th1 клетки обеспечивают клеточно-опосредованный иммунитет, в то время как Th2 клетки индуцируют гуморальный иммунитет. Цитокины являются химическими посредниками или белковыми аттрактантами, которые регулируют иммунологический ответ. Уничтожение CD4+ хелперных клеток при ВИЧ заболевании приводит к снижению синтеза вирусных цитокинов. Дисрегуляция цитокинов угнетает активность природных клеток-киллеров и макрофагов. Кроме того, потеря интерлейкина-2 замедляет размножение клона и активацию зрелых Т-клеток.
[0011] Различные особенности вируса усиливают или ослабляют клеточно-опосредованный или гуморальный ответ. В зависимости от некоторых штаммов и фаз развития, ВИЧ можно охарактеризовать как нарушающий Th1 ответ, сопровождаемый сверхактивным, но не эффективным Th2 ответом. Полагают, что баланс между Th1 и Th2 иммунным ответом частично зависит от штамма (штаммов) ВИЧ, а частично от генетической среды инфицированного животного. Например, у носителей с непрогрессирующей инфекцией усиливается эффективный Th1 ответ на ВИЧ заболевание (Pantaleo, 1995).
[0012] Иммуногенное соединение, направленное на создание сбалансированного иммунного ответа и укрепление или усиление вида иммунного ответа, подавленного конкретным вирусом, имело бы важное значение (Hogan, 2001).
Клеточный ответ
[0013] Предполагают, что ВИЧ запускает начальный устойчивый клеточный ответ, который долго не поддерживается и, в конечном счете, не в состоянии управлять инфекцией (McMichael, 2001).
[0014] CD8 цитотоксические Т-клетки (Тк) распознают клетку, представляющую чужеродный антиген с помощью молекул МНС (главного комплекса гистовсовместимости) класса I на поверхности, и разрушают ее. CD4 хелперные клетки (Th) стимулируют макрофаги, которые поглощают вирус для того, чтобы убить его. Цитокины или интерлейкины, продуцируемые CD4 клетками, частично определяют, какими клетками в основном, Th1 или Th2, осуществляется иммунологический ответ на патоген. При некоторых инфекциях CD4 клетки продуцируют интерлейкин-4 и интерлейкин-5, которые отбираются для В-клеток. В-клетки представляют антиген, связанный с молекулами МНС класса II. При других инфекциях CD4 клетки продуцируют интерлейкин-2 (IL-2), который отбирается для цитотоксических Т-клеток. Это разделение или ограничение функций в распознавании антигенов иногда упоминается как рестрикция МНС. МНС класса I обычно представляет эндогенно-синтезируемые антигены, такие как вирусные белки, в то время как МНС класса II обычно представляет внеклеточные микроорганизмы или антигены, такие как бактериальные или вирусные белки, которые фагоцитируются антиген-представляющими клетками. Антиген-представляющие клетки затем связывают антиген с белками МНС II на их поверхности. CD4 клетка взаимодействует с этим антигеном через свой Т-клеточный рецептор и активируется. Это вносит свой вклад в неэффективность инактивированных вакцин для образования Тк цитотоксического ответа (Levinson, 2002).
[0015] Как указывалось выше, Т-клетки опосредуют клеточный ответ. Антиген-презентирующие клетки, наряду с молекулами МНС (или антигена лейкоцита человека - HLA), представляют части пептида антигена ВИЧ (или эпитопы) соответствующим Т-клеткам, вызывая Т-клеточный ответ.Тип эпитопа, представленного Т-клеткам, зависит от типа молекулы HLA (например, HLA А, В, С, DR, DQ, DP) и аминокислот в пептидах. Генетические недостатки в молекулах HLA или мутантные эпитопы могут привести к потере эпитопа и персистенции ВИЧ (McMichael, 2001). Как отмечено выше, Th клетки продуцируют цитокины для общего (т.е., Th1 и Th2) иммунного ответа, но в случае с ВИЧ он подавляется инфицированием Th клеток. ВИЧ специфические Th клетки, которые отвечают на антигены ВИЧ, в конце концов, инфицируются и разрушаются или подавляются. Это приводит к вторичному действию на Тс-клетки. Тс-клетки демонстрируют различные антивирусные воздействия (такие как продуцирование перфоринов и цитокинов), включая распознавания и разрушения чужеродных антигенов и инфицированных клеток, которых связываются молекулами МНС класса I. ВИЧ может снижать экспрессию молекул HLA класса I в инфицированных клетках, уменьшая способность Тс-клеток к распознаванию или поражению инфицированных Th клеток. Кроме того, инфекция и уничтожение Th клеток нарушают способность Тс-клеток к созреванию и ответу на мутантные вирионы (McMichael, 2001). Типично, при вирусной инфекции цитотоксические Т-клетки уничтожают или супрессируют вирус. Но ВИЧ противостоит клеточному иммунному ответу, инфицируя иммунные клетки и нарушая ответ Th клеток и Тс-клеток.
[0016] Таким образом, иммуногенное соединение, которое стимулирует активность Th 1, обеспечит благоприятный иммунный ответ на ВИЧ.
Гуморальный ответ
[0017] Гуморальное звено иммунной системы состоит из В-клеток, которые при возбуждении дифференцируются на клетки плазмы, продуцирующие антитела. Первыми появляются антитела IgM, за которыми следуют IgG в крови или IgA в секреторных тканях. Главной функцией этих антител является защита от инфекционных болезней и их токсинов. Антитела не только нейтрализуют вирусы и токсины, а также опсонизируют микроорганизмы. Опсонизация является процессом, при котором антитела облегчают поглощение и разрушение вирусов или бактерий фагоцитарными клетками. Фагоцитарные клетки включают полиморфно-ядерные нейтрофилы (ПМН) и тканевые макрофаги. ПМН включают около 60% лейкоцитов в крови неинфицированного пациента. Число ПМН и тканевых макрофагов может увеличиваться или уменьшаться при определенных инфекционных нарушениях. Например, брюшной тиф характеризуется уменьшением числа лейкоцитов (т.е., лейкопенией). ПМН и макрофаги фагоцитируют или поглощают бактерии и вирусы. ПМН, в отличие от макрофагов и дендритных клеток, не презентируют антиген хелперным Т-клеткам.
[0018] Фагоцитоз включает (1) миграцию, (2) поглощение и (3) цитолиз. Клетки ткани инфицированной области продуцируют небольшие полипептиды, известные как хемокины. Хемокины привлекают ПМН и макрофаги к участку инфекции. Затем бактерии поглощаются выпячиванием клеточной мембраны ПМН вокруг бактерий, образующим вакуоль или фагосому. Это поглощение усиливается связыванием IgG антител (опсонинов) с бактериальной поверхностью. Компонент C3b системы комплемента также усиливает опсонизацию (Hoffman, R. Hematology Basic Principles and Practice Ch. 37 (3rd ed. 2000)). Клеточные мембраны ПМН и макрофага несут рецепторы для C3b и части Fc IgG.
[0019] С поглощением приводится в действие метаболизм, известный как дыхательный взрыв. В результате в фагосомах образуются два микробоцидных агента - супероксидный радикал и перекись водорода. Эти высокореакционные соединения, часто называемые реакционными промежуточными продуктами кислорода, образуются при следующих реакциях:
O2 + е- → O2-
2O2- + 2H+ → H2O2 (Перекись водорода) + O2.
[0020] При первой реакции восстанавливается молекулярный кислород с образованием супероксидного радикала, который является слабым микробоцидом. При второй реакции, которая катализируется ферментом супероксидной дисмутазой, в фагосоме образуется перекись водорода. В общем, перекись водорода является более эффективным микробоцидом, чем супероксид. При дыхательном взрыве также образуется оксид азота (NO), другой микробоцид. NO содержит свободный радикал, который участвует в окислительном цитолизе поглощенных нейтрофилами и макрофагами вирусов и бактерий. Синтез NO в фагосоме катализируется ферментом NO синтазой, которая индуцируется процессом фагоцитоза.
[0021] Цитолиз организма в фагосоме является двухэтапным процессом, состоящим из дегрануляции, за которой следует образование гипохлоритных ионов, являющихся наиболее эффективными микробоцидными агентами. В цитоплазме нейтрофилов или макрофагов обнаружены два типа гранул. Эти гранулы соединяются с фагосомой для образования фаголизосомы. Затем содержимое гранул выпускается. Эти гранулы являются лизосомами, содержащими различные ферменты, существенно важные для цитолиза и разрушения. Идентифицировали два типа лизосомальных гранул, которые различаются по размеру. Большая лизосомальная гранула, которая составляет около 15% общего количества, содержит несколько ферментов, включая миелопероксидазу, лизоцим и другие деструктивные ферменты. Остальные 85% являются меньшими гранулами, содержащими лактоферрин и другие деструктивные ферменты, такие как протеаза, нуклеаза и липаза. Фактически цитолиз или деструкция микроорганизмов происходит путем различных механизмов, зависимых от кислорода и независимых от кислорода. Наиболее важный зависимый от кислорода механизм заключается в образовании гипохлоритного иона, что катализируется миелопероксидазой:
Cl-+H2O2→ClO+Н2О.
[0022] CD8 цитотоксические Т-клетки (Tc) распознают клетку, представляющую чужеродный антиген с помощью молекул МНС (главного комплекса гистовсовместимости) класса I на поверхности, и разрушают ее. CD4 хелперные клетки (Th) стимулируют макрофаги, которые поглощают вирусы, чтобы убить. Цитокины или интерлейкины, продуцируемые CD4 клетками, частично определяют, какими клетками в основном, Th1 или Th2, осуществляется иммунологический ответ на патоген. При некоторых инфекциях CD4 клетки продуцируют интерлейкин-4 и интерлейкин-5, которые отбираются для В-клеток. В-клетки представляют антиген, связанный с молекулами МНС класса II. При некоторых инфекциях CD4 клетки продуцируют интерлейкин-2 (IL-2), который отбирается для цитотоксических Т-клеток. Это разделение или ограничение функций в распознавании антигенов иногда определяется как рестрикция МНС. МНС класса I обычно представляет эндогенно-синтезируемые антигены, такие как вирусные белки, в то время как МНС класса II обычно представляет внеклеточные микроорганизмы или антигены, такие как бактериальные или вирусные белки, которые фагоцитируются антиген-представляющими клетками. Антиген-представляющие клетки затем связывают антиген с белками МНС II на их поверхности. CD4 клетка взаимодействует с этим антигеном через свой Т-клеточный рецептор и активируется. Это вносит свой вклад в неэффективность инактивированных вакцин для образования Тс цитотоксического ответа (Levinson, 2002).
[0023] Вариабельные области и L- и Н-цепей имеют три высоковариабельные (или гипервариабельные) аминокислотные последовательности на амино-концевой части, которая составляет антигенсвязывающий участок. В каждой гипервариабельной области этот участок образован только 5-10 аминокислотами. Взаимодействие антиген-антитело включает электростатические силы и силы Ван дер Ваальса. Кроме того, между антигеном и гипервариабельными областями антитела образуются водородные и гидрофобные связи. Специфичность или "уникальность" каждого антитела заключается в гипервариабельной области; гипервариабельная область является "отпечатком пальца" антитела.
[0024] В связывании антигена участвует амино-концевая часть каждой L-цепи. Карбоксиконцевая часть входит в Fc-фрагмент. Fc-фрагмент (образованный протеолитическим отщеплением шарнирной области молекулы антитела, отделяющей участки связывания антигена от остальной части молекулы или Fc-фрагмента) экспрессирует биологические действия постоянной области, специфическую фиксацию комплемента. Н-цепи различны для каждого из пяти иммунологических классов. Тяжелые цепи IgG, IgA, IgM, IgE и IgD обозначаются γ, α, µ, є и δ, соответственно. Класс иммуноглобулина IgG опсонизирует микроорганизмы; таким образом, этот класс Ig (иммуноглобулинов) усиливает фагоцитоз (Hoffman, Ronald, et al., Hematology Basic Principles & Practice, ch.36 & 39 (3rd ed. 2000); Levinson, Warren, Medical Microbiology & Immunology, Ch. 59 & 63 (7th ed. 2002)). На поверхности ПМН и макрофагов обнаружены рецепторы γ Н-цепи IgG. IgM непосредственно не опсонизирует микроорганизмы, потому что на поверхности фагоцита нет рецепторов для µ Н-цепи. Однако IgM активирует комплемент, и C3b белок может опсонизировать, потому что на поверхности фагоцитов имеются участки связывания для C3b (Levinson, 2002). IgG и IgM способны вызвать каскад комплемента. Фактически, одна молекула IgM может активировать комплемент. Для активации комплемента с помощью IgG необходимо две перекрестносшитые молекулы IgG (подклассов IgGI, IgG2 или IgG3; IgG4 не способен активировать комплемент). Непосредственно активировать систему комплемента также могут неиммунологические молекулы, такие как бактериальный эндотоксин.
[0025] Система комплемента состоит приблизительно из двадцати белков, которые обычно находятся в сыворотке. Выражение "комплемент" означает белки комплемента или увеличение других компонентов в иммунной системе, таких как антитела и иммуноглобулин. Каскад комплемента имеет три важных иммунных эффекта: (1) лизис микроорганизмов; (2) образование медиаторов, которые участвуют в воспалении и привлекают ПМН, и (3) опсонизация.
[0026] Каскад комплемента идет по одному из трех путей: (1) классическому; (2) пектиновому и (3) альтернативному (Prodinger, Wm., et al., Fundamental Immunology, Ch. 29 (1998)). Эти пути схематически показаны на Фигуре 1. Пунктирная линия показывает, что произошло протеолитическое расщепление молекулы (на конце стрелки). Линия над комплексом указывает на то, что он ферментативно активный. Хотя большой фрагмент С2 иногда попеременно по договоренности обозначается С2а или C2b, в данном описании маленькие фрагменты обозначаются "а", а все большие фрагменты "b". Следовательно, С3 конвертазой является C4b, 2b. Отмечено, что протеазы, ассоциированные с лектином, связывающим маннозу, расщепляют С4, а также С2. Каждый из этих путей ведет к образованию Мембраноатакующего Комплекса (МАК).
[0027] С антителом, прикрепленным к специфическому компоненту вируса или бактерии, МАК способен перфорировать защитную оболочку микроорганизма и позволяет плазме крови и электролитам попадать в микроорганизм, и в то же время обеспечивает выход внутренних структуральных компонентов микроорганизма.
[0028] При классическом пути комплексы антиген-антитело активизируют С1 для образования протеазы, которая расщепляет С2 и С4 для образования комплекса C4b, 2b. С1 состоит из трех белков: C1q, C1r и C1s, C1q состоит из 18 полипептидов, которые связываются с Fc-фрагментом IgG и IgM. Fc является многовалентным и может сшивать несколько молекул иммуноглобулина. C1s является проферментом, который расщепляется для образования активной протеазы. Для активации С1 как кофактор необходим кальций. Далее, для активации С1 необходимо многоточечное присоединение, по меньшей мере, двух глобулярных головок C1q к Fc-доменам IgG и/или IgM. Изменения, вызванные в C1q при связывании множественных Fc иммуноглобулинов, передаются C1r субъединицам, приводя к протеолитической аутоактивации димера C1r, который затем протеолитически активирует или расщепляет C1s. Как отмечено выше, активированный C1s имеет каталитический участок для протеолитического сплайсинга С4 и С2. Образуется ферментативный комплекс C4b, 2b. Он функционирует как С3 конвертаза, расщепляющая молекулы С3 на два фрагмента С3а и C3b. C3b формирует комплекс с C4b и C2b, образуя новый фермент (C4b, 2b, 3b), который является С5 конвертазой.
[0029] При лектиновом пути маннан-связывающий лектин (МСЛ, или маннозо-связывающий белок (МСБ)) связывается с поверхностью микробов, экспрессирующих маннан. МСБ является лектином С-типа в плазме, структура которого подобна структуре C1q, и связывается рецепторами C1q, усиливая фагоцитоз. Манноза, являющаяся альдогексозой, обнаружена на поверхности множества микроорганизмов. Первый компонент пектинового пути называют маннозо-(или маннано-)связывающим белком. С-концевой домен узнавания углевода имеет сродство к N-ацетилглюкозамину и придает способность МСБ непосредственно опсонизировать микроорганизмы, экспрессируя богатые маннозой поверхности оболочек. В крови МСБ циркулирует как стабильный комплекс с C1r-подобным проферментом и C1s-подобным проферментом (обозначаемым как МСБ-ассоциированная сериновая протеаза, или МАСП-1 и МАСП-2 соответственно). Комплекс МСБ-МАСП-1, МАСП-2 связывается с соответствующей поверхностью углевода. Это вызывает конформационное изменение в МСБ, которое приводит к аутоактивации МАСП-1 путем внутреннего расщепления пептида, преобразующей МАСП-1 в активную сериновую протеазу. Подобно C1r, активный МАСП-1 расщепляет МАСП-2, активируя его. Активный МАСП-2 проявляет способность протеолитически активировать С4 и С2 для инициации сборки ферментативного комплекса C4b, 2b (С3 конвертазы). Как и при классическом пути, это приводит к образованию С5 конвертазы.
[0030] При альтернативном пути множество чужеродных для клеточной поверхности структур, таких как бактериальные липополисахариды (эндотоксин), клеточные стенки грибов и вирусные капсулы, могут инициировать процесс, связываясь с С3(Н2О) и Фактором В. Этот комплекс расщепляется протеазой. Фактором D, с образованием C3b,Bb, который действует как С3 конвертаза для образования большего количества C3b. В отличие от последовательного ферментного каскада классического пути, альтернативный путь использует позитивную обратную связь; основной продукт активации C3b действует как кофактор для C3b, Bb, который также отвечает за свое собственное продуцирование. Таким образом, альтернативный путь непрерывно примируется для взрывной активации С3. Интенсивность активации С3 определяется стабильностью ферментативного комплекса C3b, Bb. Фактор D протеолизом расщепляет Фактор В на маленький фрагмент (Ва) и большой фрагмент (Bb). Большой фрагмент Bb объединяется либо с С3(Н2О), либо с C3b. Через каталитический участок в Bb комплекс С3(H2O), Bb может протеолитически преобразовывать С3 в С3а и C3b. Образующийся по данному механизму C3b способен связывать дополнительный Фактор В. Поэтому альтернативный путь комплемента имеет, по меньшей мере, две петли позитивной обратной связи, усиливающие продуцирование C3b. Как показано на Фигуре 1, этот путь также приводит к продуцированию С5 конвертазы.
[0031] В каждом пути С5 конвертаза (C4b, 2b, 3b или C3b, Bb, C3b) расщепляет С5 на С5а и C5b. C5b связывается с С6 и С7 для образования комплекса, который взаимодействует с С8 и С9, в конечном счете образуя МАК (C5b, 6, 7, 8, 9) (Hoffman, 2000).
[0032] Независимо от того, по какому пути активирован комплемент, комплекс C3b является центральной молекулой каскада комплемента. Иммунологически C3b выполняет три функции:
1. последовательная комбинация с другими компонентами комплемента для образования С5 конвертаз, ферментов, которые приводят к образованию МАК (C5b, 6, 7, 8, 9);
2. опсонизация микроорганизмов; фагоциты на своей клеточной поверхности имеют рецепторы для C3b;
3. связывание с их рецепторами на поверхности активированных В-клеток, которое значительно усиливает продуцирование антител (Parham, Peter, The Immune System, ch. 7 (2nd ed. 2004)).
Гуморальный ответ включает определенные регуляторы этой системы, такие как Фактор Н комплемента, который является чувствительным к эксплуатации ВИЧ. Любой микроорганизм со способностью ограничивать активность каскада комплемента теоретически мог бы защитить себя от гуморального звена иммунной системы (Stoiber, Herbert, "Role of Complement in the control of HIV dynamics and pathogenis," Vaccine 21: S2/77-S2/82 (2003)). Таким образом, каскад комплемента является "ахиллесовой пятой" гуморального звена.
Взаимодействие ВИЧ с гуморальным ответом
[0033] Ретровирусы могут активировать систему комплемента при отсутствии антител (Haurum, J., AIDS, Vol.7(10), p.1307-13 (1993)). Установлено, что активация комплемента гликопротеинами оболочки ВИЧ опосредована связыванием МСБ с углеводами в белках природной оболочки, продуцируемых в клетках, инфицированных вирусом, а также в гликозилированных рекомбинантных белках оболочки (Haurum, 1993; Speth, С, Immunology Reviews, Vol.157, p.49-67 (1997)). Активация классического пути и пектинового пути комплемента ретровирусной оболочкой может инициироваться связыванием МСБ с углеводной стороной цепи гликопротеинов оболочки. Показано, что трансмембранный белок ВИЧ-1, gp41, связан с gp120 нековалентной связью. Комплементный компонент C1q также связывается с gp41. Во внешней клеточной части (эктодомене) gp41 три участка (аа 526-538, аа 601-613 и аа 625-655) связаны с gp120 и с C1q. Таким образом, C1q и gp120 структурально и функционально гомологичны. Взаимодействие между gp41 и C1q зависит от кальция, в отличие от ассоциации gp41 и gp120, которая не зависит от кальция.
[0034] Когда ВИЧ запускает классический и лектиновый пути способом, не зависимым от антитела, это повышает ВИЧ-инфицирование комплементных рецептор-позитивных клеток. Связывание C1q с gp41 может облегчить инфицирование различными путями. C1q связывается непосредственно с ВИЧ инфицированными клетками, которые также поражены ВИЧ-1. C1q сохраняет свою способность связываться с рецептором C1q, также известным как коллектиновый рецептор. Кроме того, gp41 непосредственно взаимодействует с C1q, закрепленным на плазматической мембране макрофагов. В обоих случаях, ВИЧ имеет возможность для C1q-опосредованного СВ4-независимого контакта с клетками.
[0035] Гомология gp120 и C1q повышает возможность непосредственного взаимодействия gp120 с рецептором C1q, и, тем самым, облегчает поглощение ВИЧ макрофагами СD4-независимым способом (Stoiber, Heribert, European Journal of Immunology, Vol 24, p.294-300 (1994)). Антитела к gp120 способны перекрестно реагировать с C1q и могут, по меньшей мере, частично отвечать за очень низкую концентрацию C1q у пациентов, инфицированных ВИЧ-1. C1q является одним из факторов, ответственным за клиренс нерастворимых иммунных комплексов, и его отсутствие могло бы внести свой вклад в очень высокие концентрации нерастворимых иммунных комплексов, отмеченных у индивидуумов, инфицированных ВИЧ (Procaccia, S., AIDS Vol 5, p.1441 (1991)). Гипокомплементемия, которая характеризует заболевание ВИЧ, коррелирует с ВИЧ-ассоциированными инфекциями, вызванными условно-патогенными микроорганизмами и связанными с вирусом злокачественными новообразованиями.
[0036] Регуляторы активности комплемента можно обнаружить прикрепленными к плазматическим мембранам. Остальные свободно циркулируют в плазме и лимфе человека. Охарактеризованы многие регуляторы активности комплемента (РАК), и фактически каждый этап во всех трех путях зависит от положительного и отрицательного контролей. Три ферментных комплекса (С3 конвертазы, С5 конвертазы, МАК) являются центральными в каскаде комплемента и зависят от многочисленных ингибиторов или катализаторов.
[0037] Несколько белков, которые управляют путями активации комплемента, циркулируют в плазме как свободно растворимые молекулы и могут или управлять С3 активацией в жидкой фазе, или ингибировать формирование МАК на клеточных поверхностях. Показано, что этой функции способствуют регуляторы комплемента, такие как Фактор Н и белок, подобный Фактору Н, с низкой молекулярной массой. Фактор Н взаимодействует с gp120, усиливая формирование синцития и индуцированную растворимым CD4 (sCD4) диссоциацию капсульного гликопротеинового (env) комплекса. Фактор Н связывает активированный gp120 только после того, как он связывается с CD4, предполагают, что участок связывания скрыт в env комплексе и оголяется только после взаимодействия gp120 с CD4 (Pinter, С, AIDS Research in Human Retrovimses, Vol.11, (1995)). Молекула gp120 связывается с рецептором CD4 на хелперных Т-клетках. Затем вирус сливается с Т-клеткой. Домен слияния расположен на gp41. При слиянии "слущивается" фрагмент gp120. Эктодомен gp41 оголяется после "слущивания" gp120. Участки связывания C1q и Фактора Н на gp41 становятся открытыми.
[0038] ВИЧ активирует системы комплемента человека даже при отсутствии специфических антител (Stoiber, Heribert, Journal Ann. Rev. Immunology, Vol 15, page 649-674 (1997)). Это приведет к инактивации вируса, если комплементу не препятствовать. Если бы комплемент был свободным, это привело бы к образованию МАК, запускающего лизис вируса. Однако ВИЧ избегает лизис вируса, включая в свою структуру различные молекулы хозяина (например, ФУД (фактор ускорения диссоциации)/CD55), которые регулируют комплемент. ВИЧ включает эти молекулы из инфицированной клетки в вирусную мембрану после активной репликации в результате проникновения в клетку или присоединением к структурам gp41 и gp120 (Stoiber, H.J. Ann. Rev. Immunology, Vol.15, 649-674 (1997)). Это взаимодействие с компонентами комплемента облегчает ВИЧ использование в своих целях компонентов комплемента для усиления инфекционности, фоликулярной локализации и расширения своего диапазона клеток-мишеней. В то же время ВИЧ защищается от гуморального звена.
[0039] Белки, такие как Фактор Н и CR1, обладают кофакторной активностью и ускоряют диссоциацию по отношению к С3 конвертазам (Stoiber, Н, J. Ann. Rev. Immunology, Vol.15, 649-674 (1997)). Целостность C3b существенна для достижения каскадом комплемента клеточного лизиса. C3b быстро расщепляется сериновой протеазой (комплемент Фактор 1-CF1) после взаимодействия с соответствующими рецепторами комплемента. Белки, содействующие этой реакции, обладают кофакторной активностью по отношению к CF1. Некоторые белки снижают активацию комплемента, ингибируя сборку и/или способствуя диссоциации ферментов, образующих C3b и C4b (конвертаз). Эту активность называют ускорением диссоциации, она характерна для молекулы белка CD55 (ФУД).
[0040] Сыворотка, лишенная Фактора Н, будет лизировать ВИЧ и инфицированные, а не здоровые клетки (Stoiber, H.J. Exp.Med., 183: 307-310 (1996)). Показано, что в присутствии Фактора Н лизис ВИЧ происходит, если связывание Фактора Н ингибировалось моноклональным антителом, направленным на участок связывания Фактора Н в gp41. Но до сих пор неизвестно, как применить эти расширяющиеся сведения взаимосвязи ВИЧ и Фактора Н к человеческой системе комплемента.
Известный уровень техники
[0041] Вопреки напряженным усилиям, не создана лечебная вакцина к ВИЧ. Изобретатели направляют свои усилия на различные этапы жизненного цикла ВИЧ. До настоящего времени исследователи не получили композицию, которая способствовала бы эффективному иммунному ответу на иммуносупрессивный ретровирус ВИЧ-1. Большинство вакцин ВИЧ используют части гликопротеинов оболочки (gp160, gp120 и gp41) при попытке индуцировать образование нейтрализующих антител против шипов оболочки вируса (Johnston, et al., 2001). Некоторые добивались успеха в создании высоких титров нейтрализующих антител. Идея этого подхода заключается в том, что антитела, которые связываются с этими гликопротеинами, нейтрализовали бы вирус и предотвратили бы инфекцию. Затем функционирующая иммунная система могла бы активировать систему комплемента, которая каскадно лизировала бы и разрушала вирус. Однако ослабление гуморального ответа, описанного выше, ограничивает эффективность этих вакцин. Множество лекарственных препаратов или композиций (AZT, dd1, ddC, d4T и 3ТС) ингибирует обратную транскрипцию. Аналоги 2',3'-дидеоксинуклеозида могут быть эффективными против определенных штаммов, но являются чувствительными к изменчивости генома ВИЧ (Deeks, Steven, The Medical Management of Aids, Ch. 6 (6th ed. 1999)). Эти лекарственные препараты также имеют проблемы с токсичностью, стоимостью, сложностями получения, взаимодействия с другими лекарственными препаратами, а также устойчивостью патогена к лекарственному препарату.
[0042] Нацеливание инвариантных белков имеет премущество избегания продуктов генетической мутабильности. Некоторые изобретатели стремились разработать композиции, которые мешают процессу вирусного слияния с клеточной мембраной, или "ингибиторы проникновения". Однако большинство попыток сосредоточены на рецепторе CD4 или корецепторе CCR5. Некоторые попытки, такие как патент США №6060065 Barney и др., раскрывает использование пептида для блокирования слияния вириона США; иммунный ответ не был раскрыт. Аналогично, в патенте США №6747126 Eckert и др., предусматривают пептиды для нарушения процесса процесса слияния. Однако сохраняется потребность в иммуногенных композициях и способах, которые направлены на стимулирование отдельных элементов клеточного и гуморального иммунных ответов для процесса слияния.
КРАТКОЕ ОПИСАНИЕ ДАННОГО ИЗОБРЕТЕНИЯ
[0043] Как описано выше, для ВИЧ необходимо слияние вирусной и клеточной мембраны, что приводит к инфекции и вирусной репликации. Кроме того, ВИЧ ослабляет иммунный ответ регуляторами разрушения или связывания комплемента. Следовательно, данное изобретение заключается в иммуногенной композиции, основанной на субъединице слияния или белке F, и в способе получения и применения данной композиции. В данном изобретенипи рассмотрены три категории вариантов осуществления: белок или фрагменты белка, информационная РНК или ДНК/РНК. Композиции ДНК/РНК могут быть или оголенными, или рекомбинантными. Данное изобретение также рассматривает применение с различными иммунными стимуляторами.
Краткое описание графических материалов
[0044] На Фигуре 1 показана схема путей каскада комплемента человека.
[0045] На Фигуре 2 изображены категории вариантов осуществления данной иммуногенной композиции с белком слияния.
[0046] Фигура 3 является графиком типичных носителей, приемлемых для рекомбинантной ДНК.
[0047] На Фигуре 4 показан сплайсинг генетического материала, кодирующего белок слияния в рекомбинантных бактериальных композициях или вакцинах.
[0048] На Фигуре 5 показана схема сплайсинга генетического материала, кодирующего белок слияния в рекомбинантных вирусных композициях или вакцинах.
[0049] На фигуре 6 представлен список иммунных стимуляторов для применения с оголенной ДНК.
[0050] На Фигуре 7 описаны традиционные способы введения ДНК.
[0051] Фигура 8 представляет схематический рисунок, на котором показаны структуры цепей С3 и CVF и их взаимосвязь.
Описание данного изобретения
А. Введение
[0052] Данное изобретение является иммуногенной композицией, основанной на субъединице белка слияния ВИЧ. Можно использовать зрелую и незрелую белка. Кроме того, кодирование генетической последовательности белка слияния можно также использовать для получения рекомбинантного бактериального или вирусного варианта осуществления или варианта осуществления экспрессированной информационной РНК.
[0053] В дополнение к описанным выше иммунным функциям, еще одной функцией является создание антигенной "памяти". Более позднее воздействие того же антигена могло бы затем вызвать более эффективный ранний ответ. Эта память создается антиген специфическими лимфоцитами. Таким образом, лимфоциты памяти, наряду с другими клетками и факторами, обеспечивают непосредственную защиту в периферийной ткани и обеспечивают вторичные иммунные ответы во вторичных лимфоидных органах. При активировании лимфоциты распространяются, что расширяет популяцию клонов антиген-специфических лимфоцитов как части иммунного ответа. Новые антиген-специфические лимфоциты будут или эффекторными клетками или клетками памяти, которые способны отвечать в случае более позднего воздействия. Иммунная память дает возможность применять иммуногенные композиции в качестве вакцин.
[0054] Вирион ВИЧ представляет собой икосаэдрическую структуру, или 20-стороннюю структуру с 72 гликопротеиновыми шипами на внешней поверхности. Как описано выше, gp41 способствует слиянию вирусной и клеточной мембран. Гликопротеин gp41 прокалывает двойной липидный слой, окружающий вирион ВИЧ. Частица gp41 менее гликолизирована (имеет меньше сахара), чем сопутствующий ей белок gp120. Он также является мутагенным. Область гликопротеина gp41 схожа с белками F парамиксовирусов, таких как вирус кори и вирус свинки, и известна как домен, способствующий слиянию, (область присоединения вириона липидной мембраны вириона ВИЧ к липидной мембране клетки хозяина) (Weissenhorn, W., Nature, Vol.387, p.426-430, (1997)). Молекула gp41 несет области, которые являются высоко консервативными среди различных штаммов ВИЧ. В частности, белок F является менее мутагенным, чем другие последовательности ВИЧ. Следовательно, белок F привлекателен для использования в вакцине из субъединицы.
[0055] Недавно была определена функция белка gp41. Первоначально белок F gp41 разворачивается, изменяя структурную конформацию, что позволяет белку F прокалывать мембрану клетки-мишени. Гликопротеин gp41, который имеет один конец, заякоренный на вирусной поверхности, подобно складному ножу, складывается по середине и соединяет вместе клеточную мембрану хозяина и мембрану вируса. Это приводит к соприкосновению двух мембран, обеспечивая их слияние и проникновение вируса в клетку хозяина (Harrison, 1999). Полагают, что триггерное образование конформации, способствующей слиянию, белка вирусной оболочки является общим механизмом инфекции несколькими вирусами, имеющими оболочку (Hughson, 1997).
[0056] Перед прорастанием через мембрану клетки хозяина gp41 (который включает домен, способствующий слиянию, или F домен) соединяется с предшественником белка вирусного ядра gag в незрелом вирионе, регулируя способность вириона сливаться с клетками-мишенями путем задерживания этого слияния, пока не произойдет полное созревание (Aiken, 2003). Следовательно, начальный и завершающий этапы репликации вируса контролируются gp41.
[0057] gp41 является α-спиральным доменом, состоящим из тримера двух взаимодействующих пептидов, которые соответствуют белку F. Кристаллическая структура этого комплекса представляет собой пучок из шести спиралей, состоящий из пептидов N36 и С34. Три спирали N36 образуют внутренний тример из двух параллельных спиралей, в то время как три спирали С34 упакованы наклонно непараллельно в высоко консервативные, гидрофобные углубления на поверхности этого тримера. Структура проявляет поразительное сходство с конформацией гемагглютинина гриппа, индуцированной низким рН, и представляет ядро gp41, действующего при слиянии (Chan, 1997).
[0058] Белок F подвергается процессу созревания как и большинство вирусных белков. Все способные репродуцироваться незрелые и зрелые белки F можно использовать по данному изобретению. Незрелый белок F можно выделить из вирусных изолятов, используя любую из нескольких описанных методик или методик для нуклеиновых кислот.
В. Композиции из субъединицы
[0059] Данный субъединичный иммуноген состоит из белка или его частей, или генетических последовательностей, кодирующих белок или участки белка для создания иммунного ответа и иммунной памяти. В данном изобретении необходимый иммунный ответ направлен на критическую поверхность слияния белка ВИЧ или на его части, такие как пептиды N36 и С34. Важно, чтобы композиция была должным образом презентирована иммунной системе. Способы выделения и применения нуклеиновых кислот, пептидов и белков, представленные в описании, известны специалистам данной области.
[0060] Одним из преимуществ композиции из субъединицы является недостаточная инфекционность терапевтических внесений. Следовательно, композиции из субъединицы могут работать, если вирус является чрезвычайно вирулентным, таким как ВИЧ. Некоторые вирусы, такие как ВИЧ, претерпевают основательную мутацию и, следовательно, аттеньюированный штамм, применяемый в вакцине или терапии, может подвергаться спонтанной реверсии в более вирулентный штамм. Поэтому, использование живых вирусных векторов ВИЧ было бы опасным. Также композиции из субъединицы или вакцины можно применять, если вирус сложно выращивать в культуре. Композиции из субъединицы можно изготовить быстро и относительно недорого.
[0061] Например, в настоящее время существует вакцина из субъединицы, в которой применяется поверхностный антиген вируса гепатита В, полученный экспрессией клонированного гена в дрожжевых клетках. Эта вакцина успешно используется в Тайване и, по-видимому, снижает распространение первичного рака печени у маленьких детей (Wagner, 1999).
[0062] Прямое введение белка не будет индуцировать клеточно-опосредованный ответ тем же способом, что и вакцина из живого вируса. Все же преимущества вакцины из субъединицы заключаются в недостаточной потенциальной инфекционности, или мягкой, в случае аттеньюированного штамма, или сильной, в случае вирулентных штаммов. Кроме того, данное изобретение рассматривает использование в соединении с иммунными стимуляторами и другими иммуногенными композициями.
[0063] Вскоре после инфекции становится очевидной сильная стимуляция В-клеток и ответа антитела на все главные белки ВИЧ (Goudsmit, 1988). По неизвестным причинам, это не ведет к продуцированию эффективных нейтрализующих антител. Напротив эти антитела могут усилить поглощение ВИЧ клетками, отличными от CD4 лимфоцитов, и, таким образом, содействовать более эффективной локализации на антигенпрезентирующих клетках (АПС) из-за отложения фрагментов комплемента на вирусной поверхности (Stoiber, 1997). Фолликулярные дендритные клетки могут играть важную роль в превращении нейтрализующих антител в стимулирующие антитела. До настоящего времени, усилия генерировать нейтрализующие антитела вакцинацией были неудачными (Hecht, Frederick., The AIDS Knowledge Base, Ch 22 (3rd ed. 1999)).
[0064] Таким образом, композиция по данному изобретению включает способ индуцирования иммунного ответа у человека или животного. Общие ссылки на "животное" включают людей. Способ включает приготовление композиции и введение животному, способному проявить гуморальный или клеточный иммунный ответ. Иммунный ответ можно обнаружить, применяя общие способы измерения, известные в данной области. Данное изобретение можно использовать для разработки лабораторных средств и исследований иммунного ответа. Кроме того, данное изобретение поможет в разработке вакцины для введения ВИЧ-инфицированному субъекту или для вырабатывания иммунного ответа у субъекта, который не инфицирован, но нуждается в иммунном ответе.
С. Способ изготовления
[0065] Данное изобретение рассматривает различные способы разработки, изготовления и введения. Предполагается, что такие способы будут выбираться на основе эффективности конкретного штамма и ответа у подопытного животного. Как показано на Фигуре 2, по изготовлению данную композицию из субъединицы можно разделить на классы - с выделением белка или пептида, с экспрессированием информационной РНК или с экспрессированием нуклеиновой кислоты ДНК/РНК. Таким образом, слияние белка F включает белок, пептиды, такие как пептиды N36 и С34, или генетические экспрессии или их участки.
[0066] Таким образом, данное изобретение можно осуществить с использованием какого-либо одного или более различного способа, приемлемого в данной области, включающего, но не ограничивающегося:
1. очистку и выделение слитого белка ВИЧ;
2. клонирование информационной РНК; и экспрессирование слитого белка в приемлемой бактерии, такой как Escherichia coli, в дрожжах, или в вирусе, или
3. клонирование оголенной или рекомбинантной ДНК/РНК и экспрессирование слитого белка в приемлемой бактерии, такой как Escherichia coli, в дрожжах, или в вирусе (Aroeti, 1993).
Антигенпрезентирующие клетки поглощают экзогенные белки фагоцитозом, что приводит к представлению иммуногена и иммунного ответа. Согласно вышеприведенному списку в варианте осуществления 1 используются фрагменты белка, в то время как в вариантах осуществления 2 и 3 используются нуклеиновые кислоты и методика рекомбинации. Варианты осуществления 2 и 3 могут также включать синтетическое получение in vitro нуклеиновой кислоты (Aroeti, 1993).
C.1. Композиции на основе белка
[0067] Слитый белок можно выделить из отдельной вирусной частицы или вирусной культуры. В случае отдельной частицы может использоваться ферментативное (протеолитическое) расщепление. Например, белок F можно выделить из вирусных частиц расщеплением и ферментативным гидролизом зрелых вирусных частиц на отдельные белковые компоненты. "Очистка" означает, что белок достаточно свободен для терапевтического применения от других клеточных субъединиц или контаменантов. Композиция может быть не полностью чистой. Слитый белок можно также выделить из культуры вирусов. Каждый белок вирусной структуры продуцируется in vivo в количествах, превышающих необходимые для вирусной репликации. Следовательно, индивидуальные вирусные белки можно выделить и разделить из вирусных изолятов по характерному для них размеру, форме, характеристикам растворимости, электростатическому потенциалу, плотности и/или плавучести и скорости осаждения в различных средах. Поэтому, данный подход включает использование специфических белковых фрагментов или пептидов для выявления иммунного ответа.
С.2. Композиции на основе нуклеиновой кислоты
[0068] В общем, композиции на основе нуклеиновой кислоты могут включать оголенную ДНК/РНК, рекомбинантную ДНК/РНК или информационную РНК. В композиции на основе оголенной ДНК использовалась бы ДНК вирусного антигена, кодирующая слитый белок, который лишен гистонов (небольших развернутых хромосомных белков) или белков, обычно, воздействием детергентов или фенолов. Рекомбинантная ДНК получена генно-инженерным способом с помощью рекомбинирования фрагментов ДНК различных организмов, как детально описывается ниже. ДНК/РНК или мРНК в обоих вариантах осуществления можно выделить, очистить и амплифицировать, используя методики, известные в данной области и частично приведенные в данном описании.
[0069] В общем, в иммуногенных композициях или вакцинах, основанных на ДНК/РНК, используются гены вирусных антигенов вместо непосредственного выделения антигена. В композициях на основе нуклеиновой кислоты может использоваться генетическая последовательность для белка F ВИЧ, которая дает белок (белки) F, неспособный к завершающим этапам созревания, которые происходят во время и после сборки целой вирусной частицы. В данном варианте осуществления не происходит образование полного вириона ВИЧ, таким образом, не образуется полностью созревший белок F. Однако ферменты клетки хозяина будут гликозилироваться и изменять третичную структуру белка, таким же образом, каким происходит модификация белка индивидуума, инфецированного ВИЧ. Следовательно, в одном варианте осуществления слитый белок или его иммуногенный фрагмент можно выбрать из группы геномных сегментов, которые кодируют последовательности слитого белка. Предпочтительно, штамм ВИЧ будет сравниваться со штаммом, вызывающим наибольшее опасение по инфекции или вероятности заражения.
[0070] Кроме того, как описано ниже, иммуногенные композиции на основе мРНК и вакцины могут быть альтернативной концепцией использованию оголенной ДНК/РНК или последовательности рДНК, кодирующей белок. Информационная РНК является посредником между ДНК и белком и может использоваться в трансфектных клетках и транслироваться в клетке хозяина для образования рассматриваемых вирусных белков.
С.2.1. Выделение ДНК и РНК
[0071] Получение нуклеиновой кислоты (кислот) происходит в три этапа: (1) лизирование клеток для выделения нуклеиновых кислот, предпочтительно, процессингом; (2) отделение нуклеиновых кислот от других клеточных компонентов; и (3) извлечение нуклеиновой кислоты в чистом виде (Nichollss, Desmond, An Introduction to Genetic Engineering, Ch. 3 (2d ed. 2002)). "Очистка" означает, что белок достаточно свободен для терапевтического применения от других клеточных субъединиц или контаменантов.
[0072] Для восстановления нуклеиновых кислот можно использовать множество методик. Многие достаточно просты и состоят всего из нескольких этапов. Более сложные методики комплексной очистки, состоящие из нескольких различных стадий, являются стандартными для промышленности. Коммерчески доступные наборы облегчают очистку нуклеиновых кислот из группы источников.
[0073] Первый этап любой методики выделения состоит в разрушении исходного материала. Способ, используемый для разрушения клеточных стенок, должен быть настолько мягким, насколько это возможно, предпочтительно, с использованием ферментативного расщепления материала клеточных стенок и лизиса клеточных мембран с помощью детергента. При более интенсивных способах разрушения клеток существует опасность расслоения больших молекул ДНК, и это может препятствовать продуцированию характерных рекомбинантных молекул во время последующего процессинга.
[0074] После разрушения клеток удаляются клеточные белки. В методике экстракции часто используют фенол или смесь фенола с хлороформом. При центрифугировании для разделения фаз белковые молекулы разделяются на фенольную фазу и аккумулируются в пограничном слое. Благодаря присущей им гидрофильности, нуклеиновые кислоты располагаются, главным образом, в верхней части водного слоя и могут быть осаждены из раствора изопропанолом или этанолом.
[0075] Если необходимо получить ДНК, то при получении для гидролиза РНК можно использовать фермент рибонуклеазу (RNase). Если необходимо получить мРНК для синтеза кДНК, дальнейшая очистка может выполняться с применением олиго(dT)-целлюлозы для связывания с поли(А)-хвостами эукариотических мРНК. Это дает существенное повышение концентрации мРНК и облегчает удаление большинства контаминантных ДНК, рРНК и тРНК.
[0076] Для выделения ДНК, в частности плазмидной (пДНК), часто применяют градиентное центрифугирование. ДНК растворяют в растворе хлорида цезия (CsCl) и центрифугируют при высокой скорости. Через некоторое время (в некоторых случаях - до 48 часов) образуется градиент плотности. Плазмидная ДНК образует хорошо заметную полосу или линию при одном положении в центрифужной пробирке. Эта полоса лишена клеточных контаменантов и может быть удалена. CsCl удаляют диализом для получения чистой композиции пДНК. Как альтернатива ультрацентрифугированию может использоваться эксклюзионная хроматография. Однако в продаже имеется множество плазмидных ДНК (Nicholls, 2002).
[0077] Амплификацию предпочтительной последовательности ДНК можно выполнять полимеразной цепной реакцией (ПНР) (Nicholls, 2002). ПЦР, заменившая традиционную методику клонирования, характеризуется простотой, элегантностью и высокой специфичностью. В процессе ПНР двухцепочечную ДНК денатурируют нагреванием, раскручивают двойную спираль и разделяют на нити. Каждая отдельная нить копируется полимеразой ДНК. Процесс многократно повторяют, что приводит к экспоненциальному увеличению числа копий.
С.2.2. Методики рекомбинирования
[0078] Способы получения рекомбинантной ДНК являются концептуально эффективными и известны в данной области. Гены слитого белка ВИЧ можно генно-инженерным способом поместить в носитель ДНК, такой как Escherichia coli; список предлагаемых носителей представлен на Фигуре 3. Как показано на Фигуре 4 бактериальные носители могут включать рДНК с помощью плазмиды, хромосомной интеграции или комбинации. Как показано на Фигуре 5 в методике рекомбинации можно использовать вирусные носители с помощью хромосомной интеграции, включения белков в вирусную оболочку или комбинаций того и другого. Если иммуноген вставлен в хромосому хозяина, то во время репродукции носителя иммуноген размножается. Плазмидная ДНК может претерпевать репликацию в нереплицирующейся клетке. Отщепление или выделение генов ферментами рестрикции известны и приведены в данном описании.
Получение рДНК
[0079] Электрофорез позволяет разделить, идентифицировать и очистить фрагменты ДНК. Пористость матрицы определяет степень достигнутого разделения. В данной области обычно применяют два типа геля, агарозу и полиакриламид. Агароза, экстрагированная из морской водоросли, является коммерчески доступной в виде сухого порошка, который растворяется в буфере при соответствующей концентрации. При охлаждении агароза затвердевает или превращается в гель. Полиакриламидные гели применяются для отделения небольших молекул нуклеиновых кислот, потому что размер пор полиакриламида меньше, чем агарозы. Полиакриламид может отделять молекулы ДНК, которые отличаются по длине только на один нуклеотид. Электрофорез выполняют, помещая образцы нуклеиновой кислоты в гель и создавая на нем электрический потенциал. ДНК содержит отрицательно заряженные фосфатные группы и, следовательно, будет перемещаться по направлению к положительному электроду. Когда маркерное красящее вещество, обычно бромфенол голубой, добавленное к образцу до погружения, достигает конца геля, электрический потенциал убирают. Нуклеиновые кислоты в геле можно визуализировать окрашиванием с интеркалирующим красителем бромидом этидия и исследовать под ультрафиолетовым излучением (Nicholls, 2002). Большие фрагменты ДНК, содержащие как минимум 100000 пар оснований, можно отделить другим способом, известным как пульсирующий гель-электрофорез.
[0080] Гель-электрофорез в градиенте пульсирующего поля (PFGE) и простой гель-электрофорез разделяет фрагменты ДНК по размеру: меньший фрагмент перемещается быстрее. Суммарная скорость перемещения и оптимальный диапазон размера для разделения определяется химической природой геля и степенью связывания его поперечными межмолекулярными связями. Гели с большим количеством поперечных межмолекулярных связей оптимизируют разделение небольших фрагментов ДНК. Краситель бромид этидия образует ярко флуоресцентный продукт, поскольку он связывается с ДНК. Небольшие количества отделенных фрагментов ДНК можно выделить на гелях. Этот краситель встраивается между основаниями ДНК (интеркалирует) и при отражении ультрафиолета светится оранжевым светом (Nicholls, 2002). Идентификацию специфического фрагмента ДНК можно выполнять в пробах, содержащих комплементарные последовательности.
[0081] Все методы электрофореза основаны на полианионной природе нуклеиновых кислот (РНК и ДНК, одноцепочечных и двухцепочечных) при нейтральной рН, т.е., на том, что нуклеиновые кислоты несут множественные отрицательные заряды на фосфатных группах. Это означает, что молекулы в электрическом поле будут перемещаться по направлению положительного электрода. Поскольку отрицательные заряды равномерно распределены по молекуле ДНК, соотношение заряд/масса постоянное, то подвижность зависит от длины фрагмента. Методика предпочтительно заключается в использовании гелевой матрицы, которая разделяет молекулы нуклеиновой кислоты по размеру (Nicholls, 2002).
[0082] Ферменты рестрикции или эндонуклеазы позволяют бактериям различать гомологичные и гетерологичные ДНК. Эти ферменты гидролизуют и расщепляют ДНК на определенных участках, известных как участки рестрикции. Эта специфичность узнавания последовательности обеспечивает точную селективность получения фрагментов ДНК, что является основой вакцин из ДНК. Бактерии, обладающие системой ферментов рестрикции, маскируют участки узнавания на своей собственной ДНК, модифицируя их. Добавление метильной группы к остаткам аденина или цитозина рядом или на участке расщепления защищает ее нуклеиновую кислоту (Brooks, Geo., Medical Microbiology 102 (23rd ed. 2004)).
[0083] Системы рестрикции и модификации бактерии разделяются на два обширных класса: системы Типа 1, в которых активности рестрикции и модификации объединены в отдельном мультисубъединичном белке, и системы Типа 2, которые состоят из отдельных эндонуклеаз и метилаз (Brooks, 2004).
[0084] Рестрикционные эндонуклеазы, которые стали стандартными лабораторными средствами, сравнивают с хирургическим ножом. Рестрикционные эндонуклеазы обычно обозначают аббревиатурой из трех или четырех букв названия организма, из которого выделили фермент (Brooks, 2004). Первой буквой обозначения является первая буква родового названия организма, в котором образовался фермент, а во второй части обозначения используют первые две буквы видового названия. Таким образом, фермент штамма Escherichia coli обозначается Есо, а фермент Bacillus amyloliquefaciens - Bam.
[0085] Рестрикционные эндонуклеазы расщепляют фосфодиэфирные связи в нитях ДНК в зеркальном отображении. Рестрикционный фермент распознает и расщепляет одну и туже последовательность ДНК и расщепляет только эту специфическую последовательность. Большинство последовательностей ДНК, распознаваемых рестрикционными ферментами, являются палиндромными; т.е. обе нити ДНК имеют одинаковую последовательность оснований, расходящуюся в противоположных направлениях по обеим сторонам оси симметрии, если читать в направлении от 5' до 3' (самокомплементарная). Иссечения, выполненные этими ферментами, обычно являются "липкими", т.е. концы продуктов состоят из отдельных нитей, при этом одна нить нависает над другой. Однако иногда продукты являются двухнитевыми с "тупыми" концами. Выделено и охарактеризовано свыше пятисот рестрикционных ферментов с различными особенностями. Большинство успешно применяются как лабораторные инструменты.
[0086] Рестриктированные фрагменты ДНК можно использовать для идентификации вариаций в последовательности оснований в гене. Однако их также можно использовать для синтеза рекомбинантной ДНК, также именуемой химерной ДНК, состоящей из молекул ДНК из различных источников, которые рекомбинированы in vitro. "Липкие" концы двух несвязанных фрагментов ДНК можно соединить друг с другом, если они комплиментарные. Комплементарные концы можно получить расщеплением несвязанных цепочек ДНК тем же рестрикционным ферментом, если рестрикционный фермент распознает палиндромные цепочки. После того как "липкие" концы фрагмента из пар оснований соединились друг с другом, фрагменты могут соединяться ковалентной связью с помощью ДНК лигазы (Smith, Coleen, Basic Medical Biochemistry: A Clinical Approach, Ch. 17 (2d ed. 1996)). ДНК лигаза является клеточным ферментом, репарирующим нарушенные фосфодиефирные связи, что может произойти случайно или как следствие репликации или рекомбинации ДНК (Nicholls, 2002). Наиболее часто применяемой ДНК лигазой является Т~4 ДНК лигаза, которую можно выделить из клеток Е. coli, инфицированных бактериофагом Т4. Хотя фермент наиболее эффективен при запечатывании промежутков в фрагментах, которые скрепляются "липкими" концами, при соответствующих условиях он также будет соединять вместе молекулы ДНК с "тупыми" концами. ДНК лигаза образует фосфодиэфирную связь между 5' фосфатом и 3' гидроксильной группой (ОН). Фермент наиболее активен при 37°С, но может использоваться при более низких температурах. Термоденатурация концов отдельных нитей, однако, происходит при более высоких температурах (37°С). Следовательно, для достижения более высокой чистоты этот ферментативный процесс часто проводят при более низких температурах, хотя весь процесс протекает медленнее (Nicholls, 2002).
[0087] Длина фрагментов ДНК, образованных рестрикционными ферментами, очень сильно отличается из-за индивидуальности последовательностей ДНК. Большинство рестрикционных ферментов распознают палиндромные последовательности, которые встречаются несколько беспорядочно. Кроме того, средняя длина фрагмента ДНК определяется, в значительной степени, числом специфических пар оснований, распознаваемых рестрикционным ферментом. Были охарактеризованы рестрикционные ферменты, распознающие последовательности до 15 оснований, однако, большинство распознают последовательности из четырех, шести или восьми оснований. Распознавание четырех оснований дает фрагменты со средней длиной 250 пар оснований, и, следовательно, обычно применяется для анализа или манипулирования фрагментами гена. Поскольку число пар оснований, распознаваемых рестрикционным ферментом, увеличивается, средняя длина нуклеотидной последовательности увеличивается логарифмически. Например, рестрикционные ферменты, которые распознают шесть оснований, продуцируют фрагменты со средней длиной около 4000 пар оснований. Рестрикционные ферменты, распознающие восемь оснований, образуют фрагменты с типичным размером 64000 пар оснований, и, следовательно, применяются для анализа большей генетической области (Brooks, 2004).
[0088] При получении вакцин из ДНК часто как донорный вектор применяется плазмидная ДНК, полученная из эукариотических клеток, таких как бактериальные и дрожжевые. Плазмида является генетической частицей, физически отделенной от ядра клетки хозяина. Ядра эукариотических клеток не имеют оболочки. Плазмида может независимо функционировать и реплицироваться независимо от ядра клетки. Плазмиды обычно придают некоторое преимущество выживания или роста клетке хозяина, но существенно не влияют на основную клеточную функцию. Например, устойчивая плазмида несет гены, ответственные за устойчивость к антибиотикам или противобактериальным лекарственным препаратам. Плазмиды представляют собой небольшие кольца ДНК; однако, трехмерная структура часто имеет вид восьмерки или более сложной структуры. Тем не менее, небольшой размер плазмид делает их пригодными для генетических манипуляций in vitro. Кроме того, после генетической манипуляции их небольшой размер позволяет введение в другие клетки. Поэтому, плазмиды часто используются в генной инженерии и являются основой для большинства вакцин из ДНК (Brooks, 2004).
[0089] Поскольку многие рестрикционные ферменты расщепляют асимметрично и продуцируют фрагменты ДНК с "липкими" концами, возможна гибридизация ДНК. Эту ДНК можно использовать как донорную для плазмидных реципиентов для образования генетически измененных рекомбинантных плазмид. Расщепление плазмиды тем же рестрикционным ферментом дает линейный фрагмент с "липкими" концами, которые идентичны друг другу. Для предотвращения повторной ренатурации двух концов плазмиды выполнили ферментативное удаление свободных фосфатных групп из этих концов. Это гарантирует структуральную некомпетентность и невозможность функционирования исходной кольцевой плазмиды. Лигирование в присутствии других фрагментов ДНК из других источников, содержащих свободные фосфатные группы, дает рекомбинантные плазмиды или химерные плазмиды, содержащие фрагменты ДНК, как вставки в замкнутую с помощью ковалентных связей ДНК. Плазмиды должны иметь кольцевую форму, чтобы реплицироваться в бактериальном хозяине (Brooks, 2004).
[0090] Установили аминокислотные последовательности (ELDKWA) данной субъединицы, белок F. Каждая аминокислота кодируется отдельным кодоном. Кодон представляет собой ряд трех последовательных нуклеотидов на цепочке ДНК или РНК, обеспечивающий генетическую информацию кодирования определенной аминокислоты, которая будет включена в белковую цепь или служить сигналом терминации. Поэтому, знание данной субъединицы позволяет считывать нуклеотидную последовательность ДНК и/или РНК для белка F. Источник удлинения последовательности ДНК определяется ДНК праймером, который можно синтезировать известными нуклеотидным синтезирующим устройством для химического олигонуклеотидного синтеза. Такие устройства могут образовывать цепочки ДНК, состоящие из 75 или более олигонуклеотидов (Brooks, 2004).
[0091] Химически синтезируемые олигонуклеотиды могут служить праймерами для полимеразной цепной реакции (ПЦР), которая позволяет амплифицировать и секвинировать ДНК между праймерами. Таким образом, в большинстве случаев, нет необходимости клонировать ДНК для того, чтобы секвенировать ее или сделать приемлемой для инженерии.
[0092] Секвинирование ДНК можно также выполнить с применением метода Максама-Джильберта, который рассчитан на относительную химическую помеху различных нуклеотидных связей, и метода Сангера (дидезокситерминации), который нарушает удлинение последовательностей ДНК, включением дидезоксинуклеотидов в последовательности. Кроме того, метод, известный как механическое фрагментирование ДНК, позволяет секвенировать и анализировать полные геномы в вирусах. При этом методе ДНК беспорядочно фрагментируется для создания библиотеки свободных фрагментов. Эти неупорядоченные фрагменты секвинируются автоматическими секвенаторами ДНК и могут быть повторно собранными в правильном порядке с использованием программного обеспечения, приемлемого для данной области (Brooks, 2004).
[0093] Неотъемлемые компоненты плазмидной ДНК, разработанной для вакцинации, включают стартовый сигнал (промотор-усилитель) и стоп-сигнал (сигнал полиаденилирования/последовательность терминации транскрипции). Стартовый и стоп-сигналы можно выбрать из различных источников - вирусов, бактерий или млекопитающих. Может быть включен и может быть полезен маркер активности плазмиды, такой как антибиотическая устойчивость или специфическая ферментативная активность, если только показать, что разработана вполне функционирующая плазмида. Также выгодно включить последовательности, содержащие интроны, которые показали значительно повышенное экспрессирование в трансфектных клеточных линиях для многих структур, даже через последовательности, содержащие интроны, которые, в конечном счете, не транслированы в белке. Промоторы/усилители, которые по большей части использовались для вакцин из ДНК, являются немедленным ранним промотором CMV (цитомегаловируса) (pCMVIE), усилителем и длинным концевым повтором (LTR) вируса саркомы Рауса (RSV). Коммерчески доступны сотни плазмид от различных поставщиков. Основной плазмидный вектор вакцины известен как V1J. Он включает pCMVIE, интрон А, производный от CMV, последовательность полиаденилирования/терминации транскрипции гормона роста крупного рогатого скота (BGH) и ген (ampr), кодирующий устойчивость к ампицилину. Последовательность ДНК плазмиды pUC, из которой удалены lac-оперон и мультиклонирующий участок, служит основной конструкцией для этой рекомбинантной плазмидной структуры. Для вставки донорной ДНК картированы два отдельных участка рестрикционного фермента. V1J не реплицируется в клетках млекопитающих и не содержит последовательности, известные как способствующие плазмидной интеграции в геномной ДНК хозяина, обеспечивающие широкий предел безопасности. Кроме того, его можно получать в больших количествах выращиванием в Е. coli. Эти особенности помогают обеспечить безопасность образования рекомбинантной ДНК минимизацией вероятности интеграционных явлений, изменяющих клетки.
[0094] Наилучшие результаты вакцинации животных получены с использованием нормальных солевых растворов плазмиды. Использовались другие носители, включая растворы 25% сахарозы и бупивикаина, но при этих методиках у животных не усиливалась иммуногенность (Kaufman, Stefen, Concepts in Vaccine Development, ch 2.3.7, (1996)). Небольшой процент мышечных трубочек поглощают и экспрессируют ДНК после внутримышечной инъекции плазмидной солевой композиции. Этого, однако, достаточно для получения существенных иммунных ответов (Kaufmann, Stefan, Concepts in Vaccine Development, Ch.Ch. 3.7 (1996)).
[0095] При вакцинах из оголенной ДНК возникают и гуморальный и цитотоксический Т-клеточный ответы. На животных моделях наблюдали интенсивную пролиферацию Т-клеток при низких дозах ДНК, вплоть до одного микрограмма, даже в отсутствие заметных антиген-специфических ответов сывороточных антител. Это означает, что для элиситирования Т-клеточных ответов вакцинами ДНК может потребоваться меньшее количество антигенов, чем для образования антител. Поскольку наиболее удовлетворительным показателем иммунитета к ВИЧ заболеванию может быть устойчивый цитотоксический Т-клеточный ответ, направленный на ВИЧ заболевание, то, чем меньше количество (антигена) при ВИЧ вакцинной методике, тем лучше. Формирование устойчивого гуморального ответа при ВИЧ заболевании связано с неблагоприятным прогнозом. Низкодозовые вакцины из ДНК стимулируют продуцирование хелперных Т-клеток Типа 1 (TH1). TH1 клетки вырабатывают цитокины IL-2 и гамма-интерферон, которые, как показано, активизируют клеточные иммунные ответы стимулированием CD8+ активности (Kaufmann, 1996).
[0096] При ВИЧ инфекциях для поддержания высоких количеств клеток CD4 и низких вирусных титров, а также для предупреждения вторичных инфекций, вызванных условно-патогенными организмами, важны мощные ответы, подобные TH1 (Kaufmann, 1996).
[0097] Преимущества экспрессирующих антигенов у хозяина вместо введения антигенов, таких как инактивированные вирусы, рекомбинантные белки или пептиды, включают следующее: (1) преодоление потенциальной потери антигенности процессом инактивации (например, химическим образованием поперечных межмолекулярных связей), свойственной клетке хозяина; (2) синтез белков с конформацией и посттрансляционными модификациями, включая углеводные и липидные связи, кодированными клеткой хозяина; (3) внутриклеточное процессирование антигена и представление молекулами МНС (главного комплекса гистосовместимости) класса I, что ведет к индуцированию цитотоксических Т-лимфоцитарных (ЦТЛ) ответов; и (4) разрешение МНС детерминантной селекции (Kiyono, Hiroshi, Mucosal Vaccines Ch. 8 (1996)).
[0098] Представление антигена после внутримышечной вакцинации ДНК приводит к устойчивому цитотоксическому Т-клеточному ответу. Были предложены три модели индуцирования ЦТЛ ответа внутримышечными вакцинами ДНК:
1. поглощение ДНК и экспрессирование антигенов антигенпрезентирующими клетками, включая дендритные клетки, макрофаги и макрофаги дермы;
2. представление антигена трансфектными миоцитами, действующими как антигенпрезентирующие клетки или играющими их роль; и
3. перенос антигенов от трансфектных миоцитов к антигенпрезентирующим клеткам, которые в свою очередь представляют антиген соответствующей Т-клетке (Kiyono, 1996).
[0099] Вакцины из ДНК использовались для элиситирования специфических иммунных ответов, антитела, СD8-клетки и СD4-клетки, против разнообразных антигенов видов животных, включая, но не ограничиваясь, следующие:
1. поверхностный антиген Гепатита В у мышей (Davis, et. al., 1993, 1994);
2. гликопротеин В вируса 1 простого герпеса у мышей (Manickan et. al., 1995);
3. гликопротеин IV бычьего герпесвируса 1 у крупного рогатого скота (Cox et. al, 1993);
4. гликопротеин вируса бешенства у мышей (Xiang, et. al., 1994, 1995);
5. белок, окружающий спорозоит малярии мышей (Sedegah, et. al., 1994; Hoffman et. al., 1994);
6. лейшмания gp63 у мышей (Xu и Liew 1995);
7. НП (нуклеопротеин) вируса лимфоцитарного хориоменингита (LCMV) у мышей (Pedroz Martins, et al. 1995; Yokoyama et. al., 1995);
8. карциноэмбриональный антиген у мышей (Conry, et. al., 1994);
9. антиген МНС класса I у крыс (Geissler, et. al., 1994);
10. вирус папилломы американского кролика (CRPV) L1 у кроликов (Donnelly et. al., 1996);
11. комплексные белки М туберкулезного антигена 85 у мышей (Huygen et. al., 1996; Kaufmann, 1996).
[0100] Конкретнее, способность вакцин из ДНК индуцировать ЦТЛ ответы демонстрировалась несколько раз. Сначала это было показано с использованием нуклеопротеина (НП) гриппа. НП является консервативным внутренним белком вируса и мишенью для перекрестно реагирующих ЦТЛ. Нуклеопротеиновая ДНК индуцировала ЦТЛ ответ у мышей, которые обладали живучестью, означающей потенциал для вакцинации. Клеточно-опосредованный иммунитет индуцировался ДНК, кодирующей НП гриппа или матричный белок, также играющий роль в защите хорьков, которая определяется снижением выделения вируса в носовых секретах. Продемонстрирован ЦТЛ ответ, индуцированный вакциной из ДНК, на:
1. гликопротеин вируса бешенства (Xiang, et al., 1994);
2. белок, окружающий спорозоит малярии (Sedegah, et al., 1994);
3. НП вируса лимфоцитарного хориоменингита (Pedroz Martins, et al., 1995; Yokoyama, et. al., 1995; Zarozinski et al., 1995);
4. капсульный белок ВИЧ (Wang, et al., 1994; Shiver et al., 1995);
5. Фактор IX человека (Katsumi, et al., 1994);
6. MHC класса I (Geissler, et al., 1994; Plautz, et al., 1994; Hui et al., 1994).
[0101] У некоторых из вышеупомянутых моделей ЦТЛ ответы были выявлены в течение одного-двух лет после иммунизации. Дозирование вакцины из ДНК нужно начать с 1 мкг. Необходимо проанализировать ЦТЛ, и самая низкая доза, при которой отмечен достаточный ЦТЛ ответ, является предпочтительной дозой для введения.
[0102] Как обсуждалось выше, катионные липиды, образованные после внутримышечной вакцины из ДНК, фактически привели к более низкому уровню экспрессирования генов. Однако использование катионных липидов для облегчения поглощения ДНК отмечено с мукозальными системами доставки. Катионные липиды облегчают поглощение ДНК на слизистых поверхностях путем неспецифического или специфического механизмов переноса через плазматическую мембрану, которые еще предстоит охарактеризовать. Мукозальная доставка ДНК может потенциально трансфектировать множество типов клеток, выстилающих желудочно-кишечный и мочеполовой тракты, а также клетки под их соответствующими базальными мембранами, включая пейеровы бляшки, которые являются предпочтительными участками репликации ВИЧ. Кроме потенциального облегчения клеточного поглощения на мукозальных поверхностях, катионные липиды также защищают ДНК от расщепления. Исследования in vitro показали, что ДНК/катионные липиды имеют более длинный период полужизни, чем несвязанная ДНК (Puyal, et al., 1995). Следовательно, предпочтительный вариант осуществления для мукозальных вакцин из ДНК будет включать катионные липиды.
[0103] Парентеральное введение вакцин из ДНК индуцирует устойчивые системные гуморальный и клеточно-опосредованные зависимые от дозы иммунные ответы, но не приводит к образованию существенных мукозальных иммунных ответов. Следовательно, в определенных случаях может быть желательной разработка вакцины, которая могла бы индуцировать и мукозальный и системный иммунные ответы (Kiyono, 1996). Это можно достигнуть вакцинами из ДНК, доставленными различными путями (парентеральным и мукозальным). Этот метод изучили на нескольких системах, используя парентеральное примирование, за которым следует мукозальная иммунизация (Keren, et al., Infect. Immun., 56:910-915 (1988)) и наоборот (Forrest, et al., Infect. Immun. 60:465-471 (1992)). С некоторыми векторами мукозальное введение ДНК/катионных липидов привело к локальному и к системному иммунным ответам. Рекомбинантная противотуберкулезная (BCG) вакцина индуцировала локальные IgA и сывороточные IgG антитела к гетерологичному антигену (Langerman, et al., 1994), а рекомбинантный вектор сальмонеллы, введенный орально, индуцировал клеточно-опосредованный иммунитет (Aggarwal, et al., 1990).
[0104] Предпочтительный вариант осуществления, использующий методику вакцины из ДНК, был бы комбинацией вакцины из оголенной ДНК, которую вводят парентерально (предпочтительно внутримышечно), и вакцины из катионного липида/ДНК, применяемой мукозально.
[0105] Следовательно, вкратце, для получения вакцины из рДНК, необходимо провести следующие этапы:
1. отбор приемлемого плазмидного вектора из коммерчески доступных источников;
2. выделение у субъекта ДНК ВИЧ;
3. осуществление расщепления/модификации рестрикционным ферментом плазмидной ДНК и ДНК ВИЧ;
4. выделение определенного гена (генов) из ВИЧ;
5. амплифицирование ПЦР ДНК выбранного гена (генов) ВИЧ;
6. ферментативное удаление свободных фосфатных групп (РО4) из плазмидной ДНК;
7. трансформирование плазмидной ДНК в бактериальную клетку, такую как Е. coli;
8. введение лигазы для скрепления цепочек ДНК вместе.
[0106] Чтобы выполнить процесс трансформирования, реципиентные клетки должны быть компетентными. Компетентность касается способности клетки ассимилировать чужеродную РНК или ДНК. Этапы этого процесса:
1. помещение реципиентных клеток в ледяной раствор хлорида кальция (что индуцирует компетентность в механизме, который полностью еще не изучен);
2. смешивание плазмидной ДНК с клетками и инкубирование их на льду в течение 20-30 минут;
3. воздействие тепловым ударом (2 минуты при 42°С) для облегчения проникновения ДНК в клетки;
4. инкубирование трансформированных клеток в питательном бульоне при 37°С 60-90 минут; это позволяет плазмиде стать стабильной и, в конечном счете, дает возможность фенотипического экспрессирования плазмидной нуклеиновой кислоты; и
5. помещение клеток с плазмидным вектором на селективную среду, приемлемую для репликации.
Как показано на Фигуре 3, рДНК/РНК можно доставить бактериальным или вирусным носителями.
С.2.3 Рекомбинантные носители
С.2.3.1 Бактериальные носители
[0107] Живые аттеньюированные бактерии могут служить носителями ДНК/РНК. Бактерии могут нести и экспрессировать гены, которые кодируют слитый белок или его части. Бактерии предоставляют среду, в которой капсидный белок ДНК/РНК можно амплифицировать, очистить и ввести. Бактериальные носители могут включать принятые в данной области виды, такие как Salmonella, BCG, E.coli. Streptococcus gordonii, Lactocci/Lactobacilli, Vibrio Cholera, Yersinia enterocholitica, Shigella flexneri и Listeria monocytogenes. Salmonella, BCG и E.coli являются предпочтительными.
[0108] Среди бактерий, исследованных на сегодняшний день для рекомбинации, наиболее интенсивно изучается аттеньюированная Salmonella sp.Также исследовались другие бактерии, включая Bacillus Calmette-Guerin (BCG). В методике рекомбинантной вакцины как среды использовались аттеньюированные кишечные патогены, включая E.coli. Vibrio, Yersinia и Shigella. В методиках рекомбинации использовались другие организмы, обычно рассматриваемые как комменсалы, включая грамположительные Streptococcus gordonii, Staphylococcus xylosus и лактококк или лактобациллу. Недавно как потенциальный рекомбинантный вакцинный вектор ввели Listeria monocytogenes. Большинство из этих организмов, благодаря их способности колонизировать и/или инфицировать мукозальные поверхности, пригодны для доставки на эти поверхности. Следовательно, лимфоидная ткань кишечника (GALT) стимулируется при непосредственно мукозальной иммунизации скорее, чем диффузия антител из сыворотки при парентеральной инокуляции. GALT, включая Пейеровы бляшки, является первичным участком ВИЧ инфекции и репликации при передаче болезни половым путем.
[0109] Особое внимание уделяется кишечным патогенам, в частности сальмонелле. Бактерии подвергают процессу аттеньюирования прежде, чем может произойти рекомбинация. При этом бактерии становятся авирулентными и неспособными вызвать брюшной тиф или другие болезни, вызываемые сальмонеллой. Первое описание такой мутации появилось в 1951 в метаболизме р-аминобензойной кислоты (pab). Впоследствии выделили gal E мутаны S. typhimurium и S. typhi (штамм Ту21а), которые вызвали накопление в цитоплазме галактоза-1-фосфата, приводящего к лизису клетки. Hoiseth и Stacker в S. typhimurium вводили широко используемый ауксотрофный мутант сальмонеллы аrо А, который кодирует фермент 5-энолпирувил-шикимат-3-фосфат синтетазу, существенный элемент в ароматическом пути. Дополнительные мутации, произошедшие в этом пути, вовлекающем aro С и aro D гены в S. typhimurium, приводят к образованию высоко аттеньюированных организмов. Были успешно подтверждены мутации в регуляторных генах суа, crp, которые кодируют аденилатциклазу и циклический аденозин-3',5'-монофосфатный (АМФ) рецепторный белок, соответственно. Кроме того, суа и crp мутации часто используются в сопряжении с мутациями в asd, кодирующем аспартатную гамма-полуальдегиддегидрогеназу, которая играет существенную роль в пептидогликановом синтезе. Кроме того, мутации других регуляторных генов, таких как phoP (фосфатаза) и ompR (внешние мембранные белки) оказались успешными как аттеньюаторы вакцинных векторных штаммов (Hughes, Huw, Bacterial Vectors for Vaccine Delivery, Designer Vaccines Principles for Successful Prophylaxis, Ch. 8 (1998)).
[0110] Определили три отдельных способа, используемых для экспрессирования гетерологичных антигенов у сальмонеллы: (1) плазмиды; (2) интеграция чужеродного гена в хромосоме сальмонеллы; и (3) перенос чужеродных антигенов на клеточную поверхность различными несущими белками сальмонеллы, включающими флагеллин, Neisseria, предшественник IgA протеазы, 1 anB, phoE, ompA. Другие носители эпитопов, которые предназначаются для альтернативных клеточных участков, включают слияния с мальтозо-связывающими белками (malE), LTB, С фрагментами токсина столбняка (tetC), галактозидазой, pagC и ядерным антигеном (HBcAg) гепатита В (Hughes, 1998).
[0111] Рекомбинантная сальмонелла успешно использовалась для экспрессии множества вирусных антигенов с индукцией гуморального и клеточно-опосредованного ответов на гетерологичные антигены при исследовании животных. Различные белки гриппа успешно экспрессировались с использованием сальмонеллезного бактериального вектора у животных, включая нуклеопротеин (НП) и эпитоп гемагглютининового белка (ГА). Другие последовательности вирусной ДНК, успешно встроенные в сальмонеллу, включают вирус гепатита В, ВИЧ и простой герпес.
[0112] В большинстве исследований использовалась оральная система доставки чужеродных антигенов, а в некоторых других использовалась схема парентеральной иммунизации. Обе могут использоваться совместно или последовательно с рекомбинантными вакцинами. Другие переменные, которые нужны для рекомбинантных бактериальных вакцин при ВИЧ заболевании, включают нацеливание чужеродных антигенов на определенные участки клетки. По-видимому, BCG и Listeria более выгодны для элиситирования клеточного ответа и, следовательно, были бы предпочтительными путями в методике рекомбинантной вакцины при ВИЧ заболевании (Hughes, 1998).
[0113] Преимущество использования аттеньюированной сальмонеллы на самом деле состоит в том, что она сначала реплицируется в толстом кишечнике, а иммунный ответ происходит в пейеровых бляшках, которые являются иммунологическими носителями, выстилающими конечную часть толстой кишки и являющимися участками начальной репликации ВИЧ в большинстве случаев передачи вируса половым путем. Поэтому, сальмонелла предложена для предпочтительной рекомбинантной вакцинной методики при ВИЧ заболевании.
[0114] Методики трансформирования и трансфекции представляют простейшие способы, приемлемые для получения рекомбинантной ДНК в клетках. В контексте клонирования клетки Е. coli трансформирование относится к поглощению плазмидной ДНК, а трансфектирование к поглощению бактериофаговой ДНК. Бактериофаг является вирусом, который поражает бактерию. Подобно другим вирусам они содержат или РНК, или ДНК (но никогда не содержат обе) и их структура изменяется, по-видимому, от простого нитевидного бактериального вируса до относительно сложной формы со втягивающимися хвостами. Их взаимосвязи с бактерией-хозяином являются высоко специфическими. Трансформирование используется также более широко для описания поглощения какой-либо ДНК любой клеткой (Nicholls, 2003).
[0115] Только небольшой процент компетентных клеток претерпевают трансформирование. Таким образом, процесс может стать нормой, лимитирующей этап клонирующего эксперимента, где требуется большое число индивидуальных рекомбинантов или когда ограничен стартовый материал. Можно должным образом получить 109 трансформированных клеток (транформантов) на мкг веденной ДНК, хотя более реальными являются частоты трансформирования около 106 или 107 транформантов на мкг (Nicholls, 2003).
[0116] Альтернативой методикам трансформирования является введение ДНК в клетку физическим способом. При одной экспериментальной методике с использованием микроинъекции или очень тонкой иглы ДНК вводят непосредственно в ядро. Эта методика успешно используется и для растительных и для животных клеток. Клетку осторожным всасыванием помещают в стеклянную трубку и иглой прокалывают мембрану. Методика выполняется вручную, для нее необходим механический микроманипулятор и микроскоп (Nicholls, 2003). Микроинъекция представляет собой предпочтительный вариант осуществления получения вакцины из бактериальной рекомбинантной ДНК при ВИЧ заболевании.
С.2.3.2 Вирусные носители
[0117] Рекомбинантные вирусные вакцины можно разработать для экспрессирования генов патогена, от которого должен быть защищен хозяин. Вектор служит носителем для переноса чужеродного гена в организм хозяина, и после транскрипции и трансляции нуклеиновой кислоты, представляющей белок, кодируемый нуклеиновой кислотой для иммунной системы хозяина. Как и для любой вакцины, главным критерием приемлемости являются безопасность и эффективность. Безопасность можно обеспечить двумя способами. Во-первых, применением вирусных векторов, принятых в данной области, для обеспечения безопасности часто путем аттеньюирования штамма или применением его как вакцины. Во-вторых, вирусы можно рекомбинировать для улучшения безопасности рациональным и надежным способом (Hughes, 1998). Безопасность иммуногена можно обеспечить применением вирусных векторов с хорошими характеристиками безопасности, полученными предварительным аттеньированием или предварительной вакцинацией хозяина против вируса-носителя. Последний способ имеет недостаток, заключающийся в быстром разрушении иммуногена иммунологической памятью. Тем не менее, происходила бы некоторая транскрипция и трансляция рекомбинантной ДНК или РНК. Предпочтительная методика заключалась бы в использовании аттеньюированного невирулентного вируса (без предварительной иммунизации к носителю вируса) как носителя для рекомбинантной вакцины.
[0118] Таким образом, вирусы, как и бактерии или дрожжи, могут также использоваться в методике рекомбинирования. Как носители, вирусы легко инфицируют клетки и стимулируют цитотоксические Т-клеточные иммунные ответы. Поскольку вирус-носитель может быть способен к репликации, может произойти полный и завершенный иммунный ответ. Затем могут быть активированы гуморальное и клеточное звенья иммунной системы. Обычно вирусные носители могут включать полиовирус, аденовирус штаммов 2, 4, 5, 7 и поксвирусы. Поксвирусы, используемые в рекомбинантной методике, включают vaccinia, canarypox, ALVAC (производный от canarypox), fowlpox, pigeonpox, swinepox. Другие вирусные векторы для использования в рекомбинантной методике включают herpesvirus (HSV-1 (вирус простого герпеса-1), VZV (опоясывающий герпес), EBV (вирус Эпштейна-Барра)), альфавирусы, парамиксовирусы, вирус гриппа и гепатита D. Предпочтительный вариант осуществления основан на применении полиовируса, благодаря наличию обширной информации о структуре вируса и жизненном цикле. Предварительная иммунизация к полиомиелиту рассматривалась бы как ограничение иммунного ответа. Хронические вирусные инфекции, такие как HSV-1, представляют собой привлекательную альтернативу, поскольку иммунная система хозяина получила бы фоновый иммуноген, стимулирующий цитотоксическую активность при низкой дозе.
[0119] Введение генов одного микроорганизма в геном другого микроорганизма может привести к образованию вирулентных штаммов. Во избежание этого, вирус-носитель должен быть модифицирован для гарантии того, что любая применяемая в лечении композиция является фактически авирулентной. Это повлекло бы появление огромного количества вирусных мозаичных комбинаций. Введенный ген (гены) может заменить гены, не нужные для репликации вируса-носителя, если он применяется в качестве вакцины или мог быть добавлен в вирусный геном (Wagner, 1999). В настоящее время в данной области известны и приемлемы способы осуществления рекомбинантной методики для получения и применения иммуногенных композиций или вакцин для вирусных инфекций (Porter, 1995; Stahl, 1997).
[0120] Среди вирусов, используемых в качестве векторов рекомбинантной вирусной вакцины, находятся поксвирусы (вирус vaccinia, включающий fowlpox, canarypox, pigeonpox, myxoma и swinepox), аденовирус (в частности, типы 2 и 5, которые секвинированы, и аденовирус типов 4 и 7, широко применяемых в качестве вакцин в вооруженных силах США без побочных эффектов), вирус герпеса, вирус полиомиелита и вирус гриппа. Гены ВИЧ сплайсированы в вектор вируса vaccinia с некоторым ограниченным успехом у животных. В аденовирусе гены можно вставить в несущественную область Е3 (до четырех тысяч пар нуклеотидов) или в существенную область E1. McDermott и др. выполнили построение рекомбинантного аденовируса, экспрессирующего гликопротеин В вируса простого герпеса (HSV), от области Е3. Мыши, инокулированные этим рекомбинантным вирусом, продуцировали специфические для gB антитела, которые нейтрализовали HSV in vitro. Кроме того, мыши были защищены от летального инфицирования HSV после единичной инокуляции аденовирусной рекомбинантой. Jacobs и др. использовали для экспрессии область Е1 и не структуральный ген NS1 вируса клещевого энцефалита (ТВЕ). Они показали защиту против летального инфицирования мышей с использованием этой системы с поврежденной репликацией. Аденовирусы с удаленной областью Е1 содержат особо безопасный фактор, введенный с помощью их особенности поврежденной репликации. Ген Е3 придает иммунологическую защиту вирусу. Следовательно, рекомбинантные аденовирусные векторы, потерявшие ген Е3, являются аттеньюированными и авирулентными и представляют предпочтительный вариант осуществления, использующий аденовирусные векторы в методике рекомбинантного вируса. Белок gp19, кодируемый областью Е3, снижает экспрессирование антигенов класса I главного комплекса гистосовместимости (МНС) в инфицированных клетках. Белок gp19 может действовать на уровне транскрипции, трансляции, модификации белка в эндоплазматическом ретикулуме или аппарате Гольджи или их комбинации. Аденовирусные векторы, дефицитные по этому гену, могут быть способны презентировать белки, кодируемые в их чужеродных генах, иммунной системе, более эффективным способом, вызывающим более устойчивый CD8 цитотоксический ответ. Кроме того, поверхность антигена гепатита В экспрессирована аденовирусом штаммов 4 и 7, с делениями и без делеций Е3, и на животных моделях отмечен удовлетворительный ответ антител на векторах, лишенных последовательности Е3. Векторы, содержащие функциональную последовательность Е3, вызвали только слабые или незначительные ответы (Hughes, 1998).
[0121] Вирусы герпеса имеют большой геном, а несколько генов идентифицированы как несущественные in vitro и более важные in vivo. Деления несущественных генов обеспечила бы рекомбинацию на нескольких участках и обеспечила более чем одну рекомбинацию на вирион. Исследования ограниченного числа примеров векторов вакцины из вируса герпеса на естественном хозяине принесли некоторый успех. Например, Dan Ziji и др. сообщили о защите свиней от вируса псевдобешенства, а также от вируса холеры свиней.
[0122] К списку потенциальных векторов вирусных вакцин в рекомбинантной вакцинной методике был недавно добавлен грипп. Грипп у неподверженного заболеванию хозяина является относительно невирулентным. Манипуляцию с нуклеиновой кислотой гриппа можно производить, используя методы обратной генетики. Castrucci и др. создали рекомбинантный вирус гриппа, экспрессирующий ЦТЛ эпитоп от LCMV нуклеопротеина в стебле фермента нейраминидазы гриппа, который расщепляет сиаловую кислоту. Разовая доза этой рекомбинантной вакцины защитила мышей от последующего инфицирования вирулентным не аттеньюированным LCMV. Охарактеризованы многие штаммы гриппа, и многие из них варьируют только по белкам гемагглютинину и нейраминидазе, которые они экспрессируют. Следовательно, различные штаммы гриппа могут использоваться последовательно для вакцинации хозяина к специфическому вирусному белку без проблемы развития иммунитета к вирусному вектору, который ограничил бы эффективность повторных инокуляций. В течение многих лет широко как вакцины использовались холодовые аттеньюированные вирусы. Исходные материалы этих вакцин могли бы использоваться для рекомбинантных вирусных вакцин, в частности, если необходимо несколько инокуляций.
[0123] Rodriguez и др. исследовали эффективность рекомбинантных векторов гриппа. Эпитоп CD8+ Т-клеточного белка, окружающего спорозоит Plasmodium yoelii, возбудителя малярии грызунов, экспрессировали в двух различных белках гриппа гемагглютинине и нейроминидазе в том же вирионе. Кроме того, была создана рекомбинанта вируса vaccinia, экспрессирующая только одну копию того же эпитопа. Обнаружили, что обе системы векторов индуцировали сопоставимые уровни эпитоп-специфических Т-клеток. Самая эффективная методика заключалась в примировании рекомбинантого гриппа, за которым следовала иммунизация рекомбинантым vaccinia (Hughes, 1998).
[0124] Два отдельных рекомбинантных вирусных вектора можно применять последовательно или вместе для оптимального иммунного ответа при ВИЧ заболевании.
[0125] Живые вакцины против полиомиелита (Сэбина) являются аттеньюированными штаммами вируса. Хотя эти вакцины, впервые введенные в 1961 году, оказались чрезвычайно безопасными и эффективными, случайный возврат к вирулентности усложнил методику. Американская Академия Педиатрии одобрила более раннюю вакцину Солка, которая не способна к активной репликации. Однако, несмотря на ее безопасность, вакцина Солка вызывает менее компетентный иммунологический ответ. Из-за жесткой компартментализации полиовирусного вириона только небольшие последовательности ДНК, кодирующие несколько аминокислот, могут расщепляться в вирусном геноме.
[0126] Вирус полиомиелита классифицирован как энтеровирус из-за его фекального/орального способа передачи. Вирус полиомиелита, как и ВИЧ, является вирусом с положительной РНК. Хотя оба вируса представлены положительной смысловой РНК, отличаются тем, что для ретровирусов необходимо, чтобы РНК была преобразована в ДНК вирион-ассоциированным ферментом (обратной транскриптазой), а вирус полиомиелита положительно смысловую РНК. РНК вируса полиомиелита функционирует подобно клеточной информационной РНК. Оба вируса заключены в икосаэдрические структуры. Полиомиелит не капсулирован, а ВИЧ является капсулированным вирусом.
[0127] Недавно были изучены клеточные иммунные ответы, специфические к полиомиелиту. Образование клеточно-опосредованного ответа на вирус полиомиелита отмечен у орально вакцинированных добровольцев (Simmons, et al., 1993; Graham et al., 1993). Это является важным, так как упомянутый выше Т-клеточный иммунитет будет лучшим показателем иммунной защиты от ВИЧ заболевания (Kiyono, 1996).
[0128] Вирус полиомиелита для стимулирования системных и мукозальных антител можно ввести не только орально, но и назально. Разработка рекомбинантного вакцинного вектора, основанного на вирусе полиомиелита, облегчена огромным количеством имеющихся сведений о вирусе. Секвенировали полный вирусный РНК геном и идентифицировали вирусные белки (Kitamura, 1981; Racaniello, 1981). Получили инфекционную кДНК вирусного генома, что позволило производить с вирусом генетические манипуляции (Racaniello, 1981; Semler, 1984). Известна трехмерная структура полного вируса, а главные антигенные эпитопы идентифицированы на молекулярном уровне (Hogle, 1985). Клонировали рецептор (PVR), который вирус полиомиелита использует для проникновения в клетки, и определили последовательность нуклеиновой кислоты (Mendelsohn, 1989; Ren, 1992). Кроме того, вывели трансгенных мышей с экспрессированным рецептором вируса полиомиелита и, следовательно, восприимчивых к инфекции вируса полиомиелита. Поэтому, для изучения рекомбинантных векторов вируса полиомиелита при всех болезнях, особенно при ВИЧ заболевании, используется животная модель.
[0129] Обширная информация, имеющаяся по вирусу полиомиелита, делает его идеальной мишенью для разработки рекомбинантных векторов полиовируса/ВИЧ. Поскольку полиовирусные вакцины можно вводить в участки слизистых оболочек, и так как вирус полиомиелита реплицируется в Пейеровых бляшках после начального инокулирования тонзиллярной ткани, рекомбинантные полиомиелитные вакцины являются предпочтительным вариантом осуществления рекомбинантных вирусных вакцин против ВИЧ заболевания.
[0130] Наличие кДНК инфекционного вируса полиомиелита вызвало продолжение исследования в области генома полиомиелитного вируса, который можно удалить без угрозы для способности репликации РНК (Racaniello, 1981; Semler, 1984). Эти молекулы РНК или репликоны при введении в клетки сохраняют свойство саморепликации. В ранних исследованиях Kaplan и Racaniello описаны репликоны вируса полиомиелита с делециями, охватывающими большую часть области P1 (Kaplan, 1988). Репликоны полиомиелитного вируса, содержащие фрагменты до 1,5 тысячи пар нуклеотидов генов gag, pol или env ВИЧ-1, явились предметом лабораторных исследований (Choi, 1991). Чужеродные гены вставили так, что трансляционная рамка считывания удерживается между оставшимися капсульными последовательностями, кодирующими Р2- и Р3-белки. Трансфекция этих РНК в клетках привела к репликации этих геномов, а также к экспрессированию чужеродных белков, как сшитого белка с фланкирующими капсидными белками (Kiyono, 1996).
[0131] Кольцевую ДНК вируса полиомиелита модифицировали для размещения больших генов для экспрессирования рекомбинантных белков. В этих векторах удалили полную область Р1 вируса полиомиелита и сформировали репликон, содержащий полный ген gag ВИЧ-1 (приблизительно 1,5 тысяч пар нуклеотидов). Трансфекция этого репликона в клетки привела к продуцированию белка-предшественника gag ВИЧ-1, Pr55gag, который элюировали из клеточного супернатанта после центрифугирования и наблюдения под электронным микроскопом (Porter, 1996; Kiyono, 1996).
[0132] В заключение, существует возможность с помощью системы репликонов вируса полиомиелита экспрессировать обширный ряд чужеродных генов, включая гены, кодирующие гликозилированные белки (Kiyono, 1996).
С.2.4 Экспрессирование мРНК
[0133] Активация клетки хозяина приводит к ВИЧ транскрипции вирусной ДНК на информационную РНК (мРНК). В ВИЧ вирусная РНК действует как информационная и как геномная РНК. Вирусная ДНК записана на мРНК. Вирусная мРНК переходит в цитоплазму, где связывается с клеточными рибосомами и клеточным переносчиком РНК для продуцирования вирусного белка. Информационная РНК является стабильной цепочкой генетического материала, которая передает генетическую информацию вируса. Информационная РНК приемлема для применения в иммуногенной композиции для ее стабильности, и мРНК эффективнее ДНК в кодировании белка.
[0134] РНК или ДНК кодирует различные белки. Промежуточным этапом является продуцирование мРНК. Информационная РНК белка или группы белков идентична цепочке ДНК (или цепочке РНК), кодирующей ее, за исключением того, что тимидин в ДНК замещен на урацил в РНК. Информационная РНК подвергается процессу кэппинга, где на 5'-конце добавлен 7-метилгуанозина трифосфат, а к не транслированному участку на 3'-конце добавлен поли(А) хвост из около 100 оснований. Кэп необходим для правильного связывания рибосомы, а хвост сигнализирует об окончании рибосомальной трансляции. Транскрипция представляет собой процесс, при котором ДНК "записывается" на мРНК. Трансляция представляет собой процесс, при котором информация с мРНК "переносится" на белки.
[0135] Существует много теоретических преимуществ мРНК в иммуногенной композиции. Они заключаются, но не ограничиваются, в следующих фактах: (1) мРНК не должна проходить сквозь ядерную мембрану; (2) мРНК не должна входить в нуклеоплазму; (3) мРНК не должна соединяться с ДНК хозяина; (4) мРНК не должна претерпевать процесс транскрипции; (5) трансляционные ферменты и рибосомы хозяина приемлемы для мРНК в клеточной цитоплазме, учитывая трансляцию мРНК на белок; (6) с мРНК должен отмечаться более быстрый иммунный ответ, по сравнению с внутриклеточной ДНК, потому что в продуцировании вирусного белка обходятся многие этапы; (7) мРНК может повторно использоваться несколько раз, так что с одного шаблона мРНК могут быть транслированы много последовательностей белков; следовательно, в цитоплазму клетки должны поступать лишь небольшие количества мРНК; и (8) так как внутриклеточное продуцирование белков будет осуществляться с мРНК, эти белки будут ассоциированы с белками МНС класса I на клеточной поверхности и будут вызывать CD8+ цитотоксический Т-клеточный ответ.
[0136] Продуцирование мРНК происходит напрямую. Если известна специфическая аминокислотная последовательность специфического белка ВИЧ, то можно вывести комплементарную ей последовательность РНК. Тогда последовательность РНК может начинаться и заканчиваться на 5'- и 3'-концах, соответственно. Информационную РНК можно получить автоматическим секвенирующим синтезом нуклеиновых кислот, известным в данной области. Разница между ДНК и РНК заключается в том, что в РНК находится рибоза, а в ДНК - дезоксирибоза.
С.2.5 Усиление CD8+ Т-клеточного ответа для композиций на основе оголенных ДНК/РНК
[0137] Композиции на основе ДНК могут обладать рядом потенциальных преимуществ над традиционными вакцинами. Однократное введение, длительный иммунитет, клеточно-опосредованный иммунитет, а также гуморальные ответы могут осуществляться с внутриклеточным продуцированном вирусных частиц, введенных методикой рекомбинантной ДНК. В различных вакцинах из субъединицы, основанных на белках, интернализированных эндоцитозом, обычно применяют несенсибилизированные клетки для CD8+ Т-клеточного распознавания.
[0138] Стратегия ускользания ВИЧ и других вирусных патогенов состоит в том, чтобы проникнуть и реплицироваться в неиммунологических клетках. Например, эпителиальные клетки заполняются Chlamydia sp.и Rickettsia sp., в то время как гепатоциты являются мишенями для Plasmodium sp. и L. monocytogenes. Как описано выше, хотя ВИЧ нацеливается, прежде всего, на CD4 клетки, заполняются другие не иммунологические ткани, такие как ткани центральной нервной системы. При стимулировании усиливается CD8 цитотоксический ответ, иммунная система может распознавать более широкий круг клеток-мишеней. Как описано выше, CD8+ Т-клетки распознают антигены в окружение молекул МНС класса I, которые присутствуют во всех ядерных клетках и облегчают CD8+ Т-клеткам выявлять инфицированные клетки хозяина любого типа. Напротив, CD4+ Т-клетки рестриктированы по МНС класса II, экспрессирующим клетки хозяина, и, таким образом, много более ограничены в возможностях. Макрофаги, дендритные клетки и В-клетки производят молекулы МНС класса I, а также МНС класса II. Кроме того, эпидермальные дендритные клетки кожи обладают белками МНС класса I и класса II (Kaufmann, 1996). Соответственно, в данном изобретении рассмотрены компоненты, усиливающие CD8+ Т-клеточный ответ. Как показано на Фигуре 6, множество компонентов могут быть составлены в вариантах осуществления с оголенной ДНК/РНК для усиления CD8+ Т-клеточного ответа, некоторые из которых описаны здесь.
[0139] Например, показано, что специфические гипометилированные CpG мотивы в ДНК бактериального происхождения могут проявить мощный адъювантный эффект, то есть частично ответственный за индукцию ответа Th1-типа, который является характерной особенностью вакцин, основанных на ДНК. Существенная особенность вакцин, основанных на ДНК, в отличие от большинства традиционных вакцин заключается в уникальной способности стимулировать гуморальный, клеточно-опосредованный и CD8 цитотоксический ответы у иммунизированных животных. Способность индуцировать мощный иммунный ответ Th1-типа очень важна, потому что защита от многих патогенов (вирусных, бактериальных и паразитарных болезней) зависит от клеточно-опосредованного иммунитета, а не наличия антител (Lewis, 1999).
[0140] Дополнительный способ усиления цитотоксической Т-клеточной активности должен связать белок теплового шока 70 (HSP70) туберкулезной микобактерии с активной оголенной ДНК/РНК, которая кодирует субъединицу. HSP70 является цитозольным HSP (белок теплового шока), который функционирует при сворачивании белков, переносе и расщеплении (Chen, 2000). HSP реакционные Т-клетки могут проявлять сильный хелперный эффект взаимодействием с коньюгированными пептидами; HSP могут индуцировать Т-хелперный провоспалительный ответ и индуцировать секрецию TNF-α и IFN (Chen, 2000). К HSP относится калретикулин (CRT), который является белком, связывающим Са2+, и расположен в эндоплазматическом ретикулуме. Он связывается с пептидами, доставленными в эндоплазматический ретикулум переносчиком, ассоциированным с процессированием антигена и представлением (Wen-fang Cheng, 2002). CRT усиливает активность CD8.
[0141] Протеасомное расщепление антигена может усилить представление МНС класса I (Chien-fu-hung, 2003). Таким образом, дополнительный способ усиления цитотоксической Т-клеточной активности заключается в связывании гамма-тубулина с последовательностью ДНК/РНК. Центросома является субклеточным участком, богатым протеасомами. Центросомы важны в митозе и образовании канальцев. Центросомы также являются важным локусом для процессирования антигена МНС класса I. Связывание гамма-тубулина с ДНК/РНК приведет к клеточной локализации белка у центросом, усиливающей CD8+ Т-клеточный иммунный ответ (Chan, 2000). Аналогично, данная композиция может использовать последовательность ДНК/РНК, кодирующую белок, находящийся в мембранах лизосом (LAMP-1), связанный с последовательностью ДНК/РНК для слитого белка, чтобы усилить В-клеточный ответ (Chen, 2000; Chien-fu-hung, 2003).
С.2.6 Усиление CD8+ Т-клеточного ответа для композиций из субъединицы
[0142] Как отмечено выше, вакцины из белковой субъединицы могут не сенсибилизировать клетки для CD8 Т-клеточного распознавания. Однако примирование ЦТЛ ответов с интактными белками достигли включением антигена в иммуностимулирующие комплексы, такие как ISCOM (матрица липидных мицелл, содержащая вирусные белки, которые доставляют антигены в цитозоль и обеспечивают индукцию цитотоксических Т-клеток) или липосомы. Кроме того, катионные липиды использовались для усиления путей МНС класса I антигенпрезентирующих клеток у животных. Один используемый катионный липид является DOTAP (ТМ-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмоний метил сульфат), коммерчески доступным катионным липидом, который используется для трансфекции ДНК. Коммерчески доступны и другие катионные липиды, которые могут сенсибилизировать клетки-мишени. Эти липиды подобны по строению DOTAP с двумя длинными гидрофобными алкилированными цепями, сцепленными с одной или больше положительно заряженными группами аммония. Предложенный механизм действия для катионных липидов включает взаимодействие между комплексом макромолекула-липид, несущим суммарный положительный заряд, и отрицательно заряженной клеточной поверхностью, с последующим сшиванием с клеточной мембраной. Напротив, рН чувствительные липосомы, как полагают, дестабилизируются после контакта с кислой средой эндосомы и лопаются и/или сливаются с эндосомальной мембраной для высвобождения их содержимого в цитоплазму (Walker, 1992).
[0143] ISCOM содержат сапонин, который является сложным гликозидом, обнаруженным у растений. Сапонин обладает свойством адъюванта. Сапонин имеет гидрофильную олигосахаридную последовательность около 8-10 моносахаридов. Получение ISCOM известно специалистам данной области. Поскольку ISCOM также содержат стероид или тритерпен, их основная структура является амфифатической. Это позволяет ISCOM формировать липидную матрицу, связанную с гидрофобными протеинами. Свойство липида ISCOM способствует слиянию мембраны с клеткой-мишенью. Белки, суспендированные в липидной матрице ISCOM, становятся интернализированными в клетке-мишени и подвергаются иммунологическому клиренсу (Kiyono, 1996).
[0144] Формирование комплексов между растворимым белком вакцины из субъединицы и DOTAP происходит посредством ионных взаимодействий между отрицательно заряженным белком и катионным липидом. Таким образом, созревания или модификации вакцины из субъединицы не требуется. Поэтому, для связывания необходимо только смешивание субъединичного белка с раствором DOTAP или другим катионным липидом перед внесением в клетки или инъекцией экспериментальным животным или людям. Таким образом, катионные липиды являются приемлемыми средствами доставки для изучения внутриклеточных явлений, которые приводят к представлению антигена МНС класса I, и они могут служить альтернативой рекомбинантным вирусам для усиления CD8+ Т-клеточного ответа на вирусы (Walker, 1992).
[0145] ISCOM или липидные носители действуют как адъюванты, но с минимальной токсичностью. Они доставляют белки и пептиды в клеточную цитоплазму, обеспечивая ответы рестриктированных по классу I Т-клеток на пептиды. Следовательно, их можно использовать с вакцинами из субъединицы для усиления активности CD8. Чтобы получить доступ внутрь клетки, липидные мицеллы ISCOM соединяются с клеточными мембранами, как отмечено выше, и частицы, захваченные в ISCOM, могут доставляться в эндоплазматический ретикулум. После того, как частицы попадают внутрь эндоплазматического ретикулума, они связываются с ново синтезируемыми молекулами МНС класса I. После прохождения через через аппарат Гольджи они транспортируются к клеточной поверхности комплексов пептидов и МНС класса I (Parham, Peter, The Immune System, Ch. 12 (2004)).
[0146] Следовательно, для усиления Т-клеточной активности или для примирования ЦТЛ ответа данная композиция предпочтительно должна быть включена в ISCOM, липосомы и/или растворена в катионных липидах.
С.3. Заключение - Способ получения
[0147] Таким образом, данное изобретение включает композицию на основе белка и композицию на основе нуклеиновой кислоты, которые можно применять для индуцирования иммунного ответа на слитый белок и создавать к нему иммунную память. В композициях на основе нуклеиновой кислоты можно использовать ДНК, РНК или мРНК. Носителями рекомбинантной нуклеиновой кислоты могут быть бактерии или вирусы. Предпочтительно, композиция включает один или более компонентов для усиления CD8+ Т-клеточного ответа.
[0148] Композиции на основе белка можно разрабатывать и вводить с использованием способов, известных в данной области. В этих целях коммерчески приемлемым способом доставки для композиций или вакцин на основе нуклеиновых кислот, вводимых животным, является "генное ружье". При этой методике используют инструмент, разработанный для введения золотых частиц, покрытых ДНК, непосредственно в клетки эпидермиса и кожи. ДНК вводится непосредственно в дендритные клетки, что приводит к прямому примированию CD8+ Т-клеток (Chen, 2000). В частности, доставка "генным ружьем" золотых гранул, покрытых ДНК, может, таким образом, быть предпочтительной для применения с компонентами композиции из субъединицы на основе нуклеиновой кислоты, усиливающими CD8+ Т-клеточный иммунный ответ (Chien-Fu Hung, 2003). Способы введения композиций на основе нуклеиновой кислоты приведены на Фигуре 7 и ниже.
D. Описание дополнительных альтернативных вариантов осуществления и иммунных стимуляторов
[0149] Иммунный ответ по данному изобретению можно усилить применением неспецифических или специфических веществ, стимулирующих иммунный ответ. Объект данного изобретения можно смешать с соответствующим стимулятором иммунитета или адъювантом, включая ниже описанные альтернативные варианты осуществления. Такие композиции можно использовать как подходящие для аппликации. Традиционные стимуляторы или адъюванты, известные в данной области, включают неполный адъювант Фрэйнда, липосомы и т.д. Предпочтительный вариант осуществления включает один или более стимулятор, выбранный из традиционных адъювантов и/или композиций, также описанных здесь.
[0150] Для усиления иммуногенности рекомбинантного бактериального или вирусного вектора необходимо удалить сиаловую кислоту из плазматической мембраны бактерии или белкового покрытия и/или капсулы вируса (если вирус имеет капсулу). Обработка нейроминидазой эффективно удалила бы остатки сиаловой кислоты, не изменяя структуру белка бактерии или вируса.
[0151] В следующем варианте осуществления композиция может быть связанной ковалентными или другими связями с полисахаридами, состоящими из маннозы или маннана. Связывание или соединение можно осуществить способами, известными в данной области. Манноза является сахаром, обнаруженным только у микроорганизмов и патогенов, который обычно не находят в организме человека. Белок, связывающий маннозу (МСБ), является коллектином, пектином С-типа, который имеет области коллагеновой структуры. Он присутствует в нормальной сыворотке человека и состоит из субъединиц, каждая из которых имеет три полипептидных цепи, образующих подобно коллагену тройную спираль и три С-концевых глобулярных домена, распознающих углеводы, (CRD). Вместе шесть субъединиц составляют полную структуру, напоминающую букет тюльпанов, C1q классического пути активации комплемента. Связывание МСБ с углеводом инициирует классический путь активации комплемента Clrr Cls2. Это может привести к комплементу, убивающему или непосредственно через вставку концевого мембраноатакующего комплекса, или через опсонизацию отложением комплемента на поверхности микроорганизма. МСБ может также активировать С2 и С4 через другие, недавно описанные сериновые протеазы, названные МАСП (1 и 2) сериновые протеазы. Таким образом, МСБ также проявляет комплемент-независимую опсонизирующую активность, вероятно опосредованную связыванием коллагеновых стеблей с коллектиновым рецептором фагоцитарных клеток (Presanis J.S., et al., Biochemistry and Genetics of Mannan-binding Lectin (MBL), Biochemical Society Transactions, Vol.31, p.748-752 (2003)). Любой организм, несущий маннозу или маннан на своей поверхности, будет стимулировать пектиновый путь активации комплемента. Композиция, связанная с такими полисахаридами, в сыворотке свяжется с лектином, связывающим маннозу, активируя пектиновый путь системы комплемента. Таким образом, данный альтернативный вариант осуществления усилит, таким образом, полный иммунологический ответ на вакцину.
[0152] В другом варианте осуществления композицию можно скомбинировать с веществами, стимулирующими или активирующими альтернативный путь комплемента. Например, известно, что определенные формы тейхоевой кислоты являются мощными активаторами альтернативного пути комплемента (Winkelstein J.A., "Activation of the Alternative Pathway by Pneumoccal Cell Wall Teichoic Acid," J. of Immun., Vol.120, p.174-178 (1978)). Кроме того, зимозан, который можно получить из клеток дрожжей, может индуцировать цитокины и стимулировать иммунный ответ совместно с альтернативным путем системы комплемента. Зимозан фагоцитируется макрофагами с опсонизацией или без опсонизации, и поэтому обладает полезной иммунологической способностью активации альтернативного пути комплемента. Взаимодействие зимозана и макрофага, как полагают, усиливает Th-1 ответ. Клетки CD4 можно разделить на клетки Th-1 и Th-2. Клетки Th-1, продуцируя IL-2, активируют цитотоксические Т-клетки; в свою очередь клетки Th-2, первично продуцируя IL-4 и IL-5, активируют В-клетки. Уровень Th-1 ответа, произведенного зимозаном, регулируется фрагментами C3b и iC3b расщепленной С3. Амплифицированный C3b откладывается на соответствующей поверхности зимозана и собирает макрофаги, дендритные клетки или другие антиген-презентирующие клетки. Макрофаги, дендритные клетки и антиген-презентирующие клетки представляют антиген Th-1 клеткам после опсонизации зимозана и после того, как происходит активация антиген-специфических макрофагов (Fearon D.T., et al., Proc. Natl. Acad. Sci, Vol.74, p.1683-1687 (1977)). Таким образом, композиция может быть связана ковалентной или другими связями с веществами, стимулирующими альтернативный путь комплемента, такими как тейхоевая кислота или зимозан.
[0153] Используя плазменный вектор (pCMV160 IIIb), недавно показали адъювантное действие зимозана в ВИЧ специфической вакцине из ДНК. Лабораторных мышей инокулировали плазмидной вакциной с зимозаном и без зимозана. После введения зимозана совместно с плазмидным вектором наблюдали более высокие уровни гуморального иммунного ответа и ВИЧ специфического гиперчувствительного ответа замедленного типа (DTH), по сравнению с использованием плазмидного вектора в чистом виде. Также усиливается активность ВИЧ специфических цитотоксических Т-клеточных лимфоцитов. Предполагают, эффекты основаны на результатах его (зимозана) рекрутинга и активации макрофагов, дендритных клеток или антиген-презентирующих клеток путем активации комплемента и особенно альтернативным путем. Эти результаты говорят о зимозане, как об эффективном иммунологическом стимуляторе (Ara, 2001).
[0154] Следовательно, для усиления иммуногенности композиции манноза, тейхоевая кислота, зимозан или какая-либо их комбинация могут связываться с белковым компонентом вакцины из субъединицы. Предпочтительно, полисахариды могут состоять из шестнадцати отдельных сахаридных единиц (Pangburn, Michael K., Immun., Vol.142, p.2766-2770 (1989)). Предпочтительным источником для углеводного/адъювантного компонента вакцины из субъединицы будет капсульный полисахарид дрожжевой клетки Cryptococcus neoformans серотипа С (Sahu Arvind, et al., Biochem. J., Vol.302, p.429-436 (1994)). Эта дрожжевая клетка представляет четыре разветвленных ксилозных сахара от каждой повторяющейся трисахаридной единицы, включающей три остатка маннозы. Тиоэфирный участок компонента С3 комплемента показывает особое предпочтение этой специфической углеводной последовательности. Это приводит к расщеплению С3 на фрагменты С3а и C3b. Молекула C3b является центральным элементом во всех трех путях комплемента.
[0155] Кроме того, все молекулы глюкозы и полисахаридов должны быть удалены из композиции. Добавление инсулина к клеточной культуре облегчит транспорт внеклеточной глюкозы через плазменную мембрану и в цитоплазму клеток. Глюкоза ингибирует скорость и степень отложения C3b (Sahu Arvind, 1994).
[0156] В дополнительном варианте осуществления можно ингибировать действие гепарина. Гепарин является кофактором, необходимым для эффективной функции Фактора Н (Maillet, Francoise, et al., Mol. Immun., Vol.25, p.917-923 (1988); Maillet, Francoise, et al., Molecular Immun., Vol.20, p.1401-1404 (1983)). Как отмечено выше. Фактор Н является главным лимитирующим белком в альтерантивном пути комплемента. Как отмечено выше, Фактор Н является главным лимитирующим белком в альтернативном пути активации комплемента. Альтернативный путь активации комплемента является первым звеном иммунной системы для ответа на микроорганизмы или вакцины (Furie, Bruce, Oral Anticoagulant Therapy, Hematology Basic Principles & Practice, Ch. 121 (3rd ed. 2000)). Недавно стал доступным протамин с низкой молекулярной массой (LMWP), который является менее токсичным антагонистом гепарина. Протамин, или предпочтительно LMWP для данного варианта осуществления, может включаться как компонент композиции для снижения активности Фактора Н в ограничении альтернативного пути комплемента (Liang J.F, et al., Biochemistry, Vol.68, p.116-120 (2002)). Альтернативно, гепариназа, как известно, ферментативно разрушает гепарин.
[0157] В качестве эффективных плазматических расширителей применяли частично гидролизованные разветвленные глюкозные полисахариды, известные как декстраны (Hoffman, Ronald, Hematology Basic Principles and Practice, 2177 (3rd ed. 2000)). Сульфат декстрана представляет собой натриевую соль сернокислых эфиров полисахарида декстрана. Растворимый сульфат декстрана с молекулярной массой более чем 5×103 является индуктором альтернативного пути комплемента. Число сульфатных групп на сто глюкозных остатков в декстране определяет потенциал активации декстрана в альтернативном пути. Оптимальная степень сульфатирования составляла 50-60 SO4/100 молекул глюкозы (Burger, R., et al., Immunology, Vol.29. p.549-554 (1975)).
[0158] Сульфат сефадекса (СС) является перекрестно сшитой нерастворимой формой декстрана. Подобно растворимому декстрану, СС активирует альтернативный, а также классический путь комплемента. Активность СС в обоих путях активации комплемента зависит от трех показателей:
(1) количество сульфатов; более высокое содержание сульфатов вплоть до 15,6% по весу приводит к более сильной активации комплемента; при содержании сульфатов менее чем 2,43% активация комплемента не отмечена;
(2) концентрация СС; более высокие концентрации приводят к активации комплемента с максимальной интенсивностью С3 при 40-50 мкг/мл; и
(3) температура; максимальная интенсивность С3 отмечена при 37°С, с полным прекращением активности при 4°С (Burger, R., et al., Immunology 33:827 (1977)). Растворимая и нерастворимая формы декстрана (с молекулярной массой >5000) активируют альтернативный путь комплемента. Это достигается блокированием действия Фактора Н (Burger, R., et al., European J. Immunology, pp.291-295 (1981)). Низко молекулярный сульфат декстрана (<5000) усиливает связывание Фактора Н, следовательно, он лимитирует активность альтернативного пути комплемента (Seppo Meri, et. al., Proc. Natl. Acad. Sci, Vol.87, p.3982-3986 (1990). ДНК, подобно гепарину, также увеличивает связывание Фактора Н (Gardner, William D., Biochemical and Biophysical Research Communications, Vol.94, p.61-67 (1980)).
[0159] Следовательно, для усиления иммуногенности в композицию можно включать сульфат декстрана с молекулярной массой >5000 при 50-60 SO4/100 молекул глюкозы. Аналогично СС усилил бы иммуногенность композиции с 15,6% SO4 по весу при концентрации 40-50 мкг/мл при температуре 37°С. Декстран с низкой молекулярной массой не был бы включен в композицию, поскольку он увеличивает связывание Фактора Н и уменьшает активацию комплемента. Наконец, ДНК усиливает активность комплемента и, следовательно, может использоваться одновременно с вакциной из ДНК. (КДС вакцина (вакцина для профилактики коклюша, дифтерии и столбняка) состоит из трех отдельных вакцинных компонентов. Коклюшный компонент действует как адъювант для двух других (Parham, 2004). Аналогичная ситуация существует и в данном изобретении, где вакцина из ДНК против ВИЧ заболевания будет действовать как адъювант для псораленовой вакцины.)
[0160] В следующем варианте осуществления данного изобретения могут использоваться вещества, стабилизирующие конвертазу С3. Все три пути комплемента ведут к продуцированию C3b, который ковалентной связью соединяется с поверхностью микроорганизмов или с компонентами микроорганизмов, представленными в такой иммуногенной композиции. C3b образуется ферментами, известными как С3 конвертаза. Фактор яда кобры (CVF), полученный от змеи Naja kaouthia, стабилизирует этот фермент (Alper, С.А., et al. Science, Vol.191, p.1275-1276 (1976) Период полужизни CVFC3b, Bb С3/С5 конвертазы составляет семь часов, в отличие от эндогенно образованной в альтернативном пути комплемента С3 конвертазы (C3b, Bb), период полужизни которой составляет 1,5 минуты. C3b, Bb дезассемблирован Фактором Н, а C3b инактивирован комбинированным действием Фактора Н и Фактора I. Напротив, Фактор CVFC3, Bb устойчив ко всем регуляторным комплементным белкам (Kock, Michael A., et al., J. of Biol. Chemistry, Vol.279 p.30836-30843 (2004)). Для воздействия на С5 для C3b, Bb необходим дополнительный C3b, тогда как CVF, Bb может расщеплять С5 непосредственно. Следовательно, фермент CVF, Bb непрерывно активирует С3 и С5 (Kock, 2004).
[0161] Полагают, что биологическая функция CVF в яде кобры облегчает попадание токсических компонентов яда в кровяное русло. Это достигается за счет активации комплемента, вызывающей высвобождение анафилотоксинов С3а, С5а и Bb, которые увеличивают проницаемость сосудов (Vogel, Carl W., Immunoconjugates, Ch. 9 (1987)). CVF, несмотря на его происхождение из яда кобры, является нетоксичным белком; CVF можно выделить из других ферментов, полипептидов и т.д. из яда кобры, который включает токсины.
[0162] Таким образом, введение CVF приводит к взрывному продуцированию C3b (Vogel, 1987; Kock, 2004). На Фигуре 8 показана структуральная гомологичность между С3 и CVF. C3b на поверхности микроорганизмов распознается фолликулярными дендритными клетками в лимфатических узлах, а также Т-клетками и В-клетками в периферическом кровотоке и в зародышевых центрах лимфатических узлов. C3b является мощным опсонином. Опсонины запускают одновременно несколько звеньев иммунной системы (Hoffman, Ronald, Hematology Basic Principles and Practice, Ch. 27 (3rd ed. 2000)). Таким образом, в альтернативном варианте осуществления CVF может использоваться как компонент композиции.
[0163] Предпочтительной формой CVF является dCVF (де-α-галактозилированная CVF) (Gowda D.C., et al., J. of Immun., p.2977-2986, (Dec 21, 1993)). CVF, природного происхождения, характеризуется несвойственным полисахаридом, который является фукозилированной цепочкой сложного типа, состоящей из двух ветвей со связью через атом азота, содержащий α-галактозилированный Lex антигенный эпитоп, Galαl-3Galβ1-4 (Fucαl-3) GicNAcβl. Удалить этот полисахарид можно инкубированием CVF с пептид-N-глюкозидазой F (N-глюконазой) при 37°С в течение 18-23 часов при рН 8,0. Удалить этот несвойственный полисахарид из CVF необходимо, поскольку 1% IgG человека реагирует с концевой последовательностью Galαl-3Galβl CVF. Однако удаление этого полисахарида не влияет на характер фиксации комплемента молекулы и не приводит к сокращению периода полужизни молекулы. dCVF будет связан ковалентной связью с полисахаридной единицей (единицами), включающей иммуногенную композицию.
[0164] В другом варианте осуществления к композиции могут быть добавлены соединения никеля. Показано, что никель эффективен в усилении активности С3 конвертазы при лектиновом и альтернативном пути комплемента (Fishelson, Z., et al., J. of Immun., Vol.129, p.2603-2607 (1982)). Считают, естественное потребление никеля для среднестатистического взрослого человека составляет 60-260 мкг в день со стандартной дозой 0,02 мг на кг веса тела в день (мг/кг/день) (США Ассоциация охраны окружающей среды (ЕРА), 1986). Предполагается, что данное изобретение будет включать никель предпочтительно в форме хлорида никеля согласно среднему суточному потреблению значительно ниже стандартной дозы. Следовательно, данное изобретение можно осуществить с использованием никеля для усиления иммунного ответа.
Е. Краткое изложение
[0165] Для приготовления композиции, которая основывается на вакцинном агенте по данному изобретению, возможно применение известных способов очистки, синтеза или генной инженерии. Специалисты в данной области могут выделить и очистить фрагмент или получить последовательность, кодирующую такой слитый белок. В фармацевтические композиции, соответствующие определенному способу введения, как носители или наполнители могут быть включены фрагменты белка, оголенная ДНК/РНК, рекомбинантная ДНК/РНК или информационная РНК. Композицию можно вводить животному или человеку, для которого желателен иммунный ответ по данному изобретению; терапевтически эффективная доза будет включать количество, необходимое для отмены супрессии специфического иммунитета до желательной степени, и определяться с использованием стандартных способов, таких как анализ с радиоактивным хромом, внутриклеточный анализ цитокинов, лимфо-пролиферативный анализ (LPA), ELISpot анализы гамма-интерферона (IFN-γ) и анализы связывания тетрамера МНС. Предпочтительным является анализ связывания тетрамера МНС. Эти же лабораторные анализы можно было бы применять для измерения иммунного ответа неинфицированного субъекта.
[0166] Анализ и разработка иммуногенной композиции должны включать оценивание широкого диапазона доз инактивированной частицы. Опыты на животных должны учитывать различия в размере, видовые различия и иммунологические особенности; ожидается, что иммунологические различия между людьми и животными могут снизить значение опытов на животных при анализе токсичности. Клинические испытания будут включать, по меньшей мере, стандартную трехфазную модель, включающую в первой фазе анализ безопасности и дозировки на небольшой группе, во второй фазе анализ безопасности и иммуногенности на нескольких сотнях добровольцев, в третьей фазе крупномасштабный анализ эффективности. Клинические испытания должны включать соответствующие общепринятые исключающие критерии, такие как исключения других условий иммунной супрессии, беременность, применение лекарственного препарата и т.д. Начальная доза для испытаний субъединичных белков может оставлять 10 мкг/штамм для подростков и 20 мкг/штамм для взрослых. Для вакцин из оголенной ДНК соответствует начальная доза 1 мкг/штамм для всех возрастов.
[0167] Введение можно осуществлять различными способами, например, орально, трансбукально, трансмукозально, подъязычно, назально, ректально, вагинально, внутрь глаза, внутримышечно, внутрь лимфатического узла, внутривенно, подкожно, трансдермально, внутрикожно, внутрь опухоли, местным применением, через легкие, ингаляцией, инъекцией или имплантацией и т.д. Различные формы композиции могут включать, без ограничения, капсулу, гелевую капсулу, таблетку, кишечную капсулу, капсулированную частицу, порошок, суппозиторий, инъекцию, мазь, крем, имплантат, пластырь, жидкость, средство для ингаляции или спрэй, системное, местное или другое оральное средство, растворы, суспензии, инфузии и т.д. Поскольку одними из первых мишеней инфекции ВИЧ являются эпителиальные клетки и макрофаги кожи, ректальной и вагинальной слизистой оболочки, значит предпочтительным вариантом осуществления доставки является дермальный способ в комбинации с ректальным и/или вагинальным суппозиториями. ВИЧ передается, главным образом, через ректальную и вагинальную слизистые оболочки. Следовательно, способ введения вакцины ректальным и/или вагинальным суппозиторием будет предпочтительным способом введения. Кроме того, данное изобретение может совмещаться с другими терапевтическими агентами, такими как цитокины, включая цитокины природного происхождения, рекомбинантные и мутирующие формы, фрагменты, сшитые белки и другие аналоги и производные цитокинов, смеси, другие биологически активные агенты и композиционные добавки и т.д. Специалисты в данной области признают, что для инъекции подойдет композиция в водных растворах, таких как раствор Рингера или солевой буфер. Липосомы, эмульсии и растворители являются следующими примерами доставляющих носителей. Для орального введение необходимы носители, приемлемые для капсул, таблеток, жидкостей, драже и т.д., такие как сахароза, целлюлоза и т.д.
[0168] В то время как приведенное выше описание рассматривает специфические варианты осуществления данного изобретения, будет понятно, что может быть сделано множество модификаций без отступления от его содержания. Приведенная формула изобретения охватывает такие модификации, которые находятся в пределах сущности и объема данного изобретения.
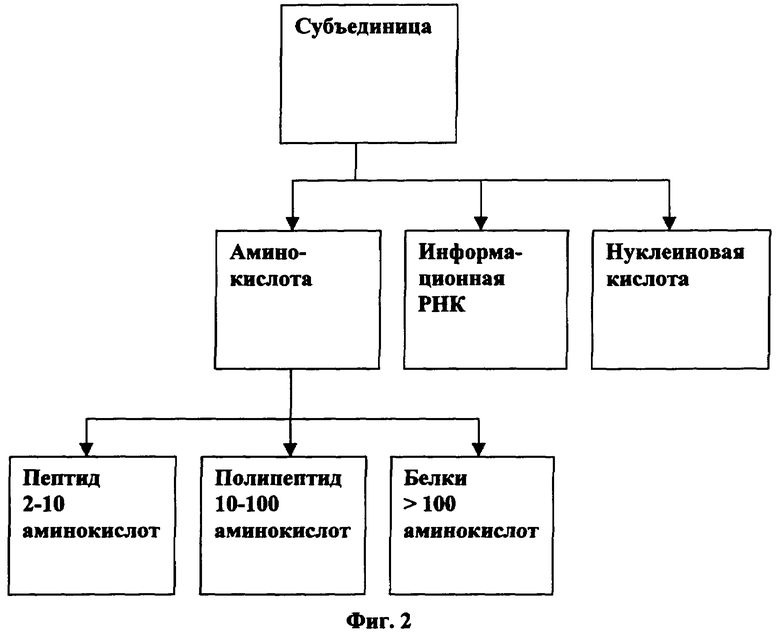
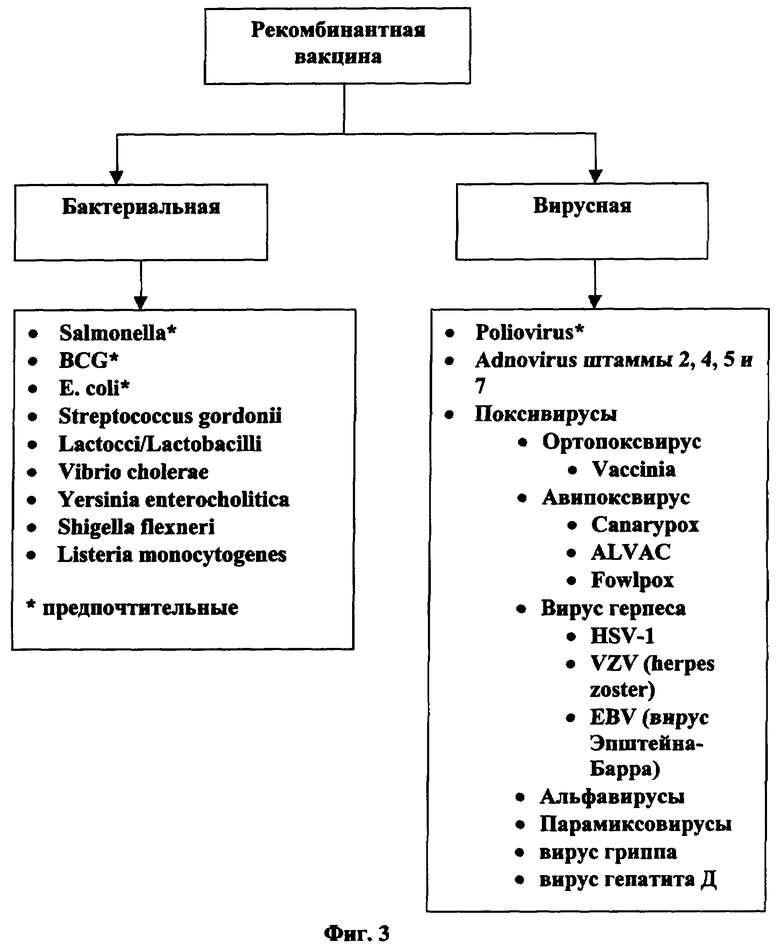
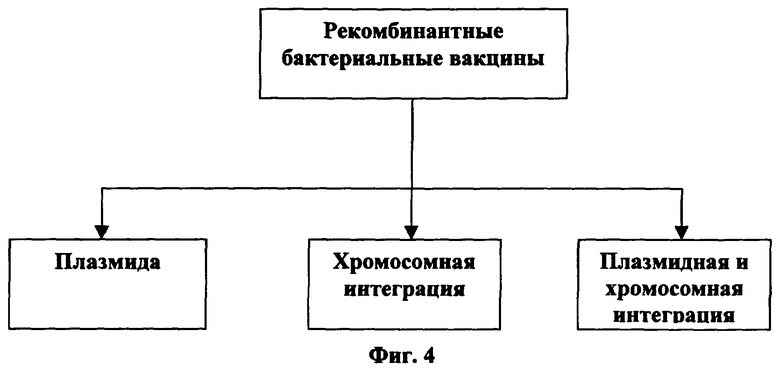
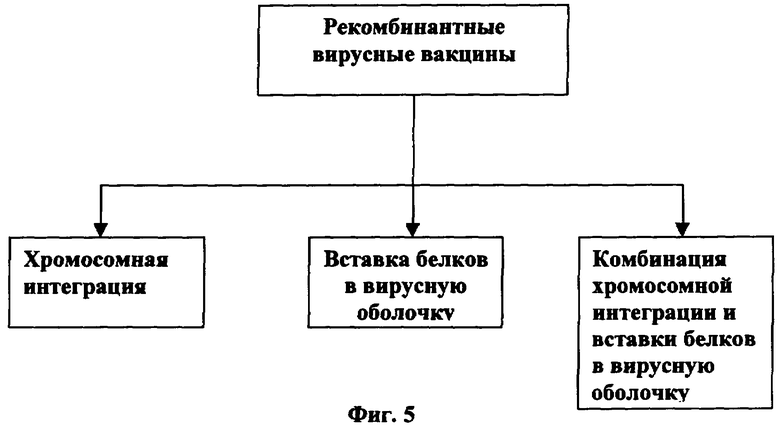
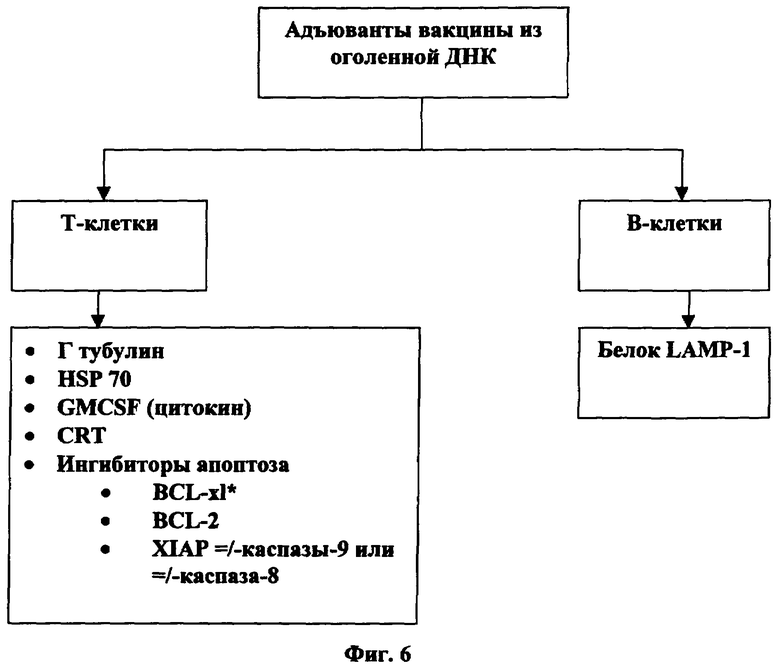
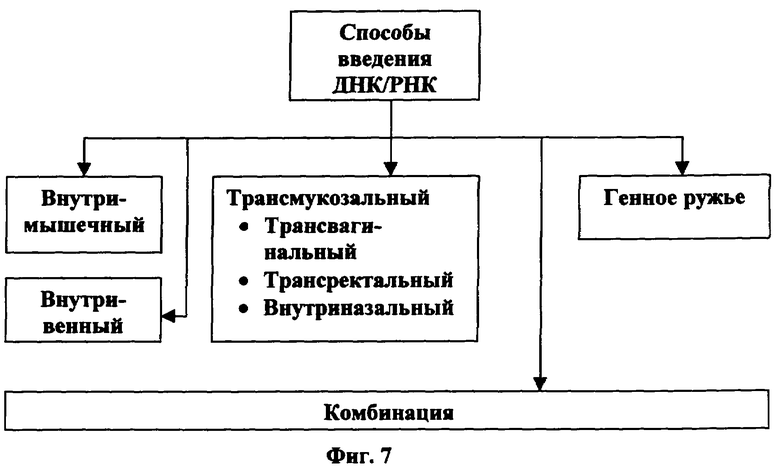
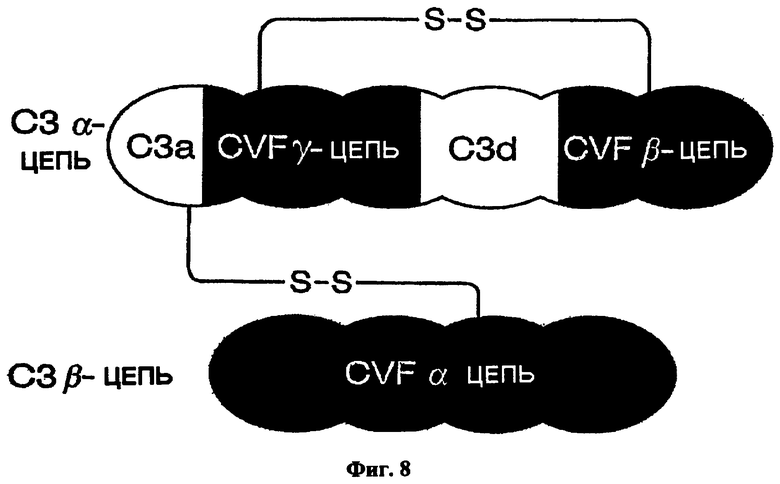
Изобретение относится к области биотехнологии, вирусологии и медицины. Раскрыта композиция, направленная на элиситирование иммунного ответа против ВИЧ. Композиция содержит белок слияния ВИЧ. Раскрыто также применение такой композиции для изготовления лекарственного средства для элиситирования иммунного ответа на ВИЧ и способ элиситирования иммунного ответа с ее использованием. Изобретение может быть использовано в медицине. 3 н. и 28 з.п. ф-лы, 8 ил.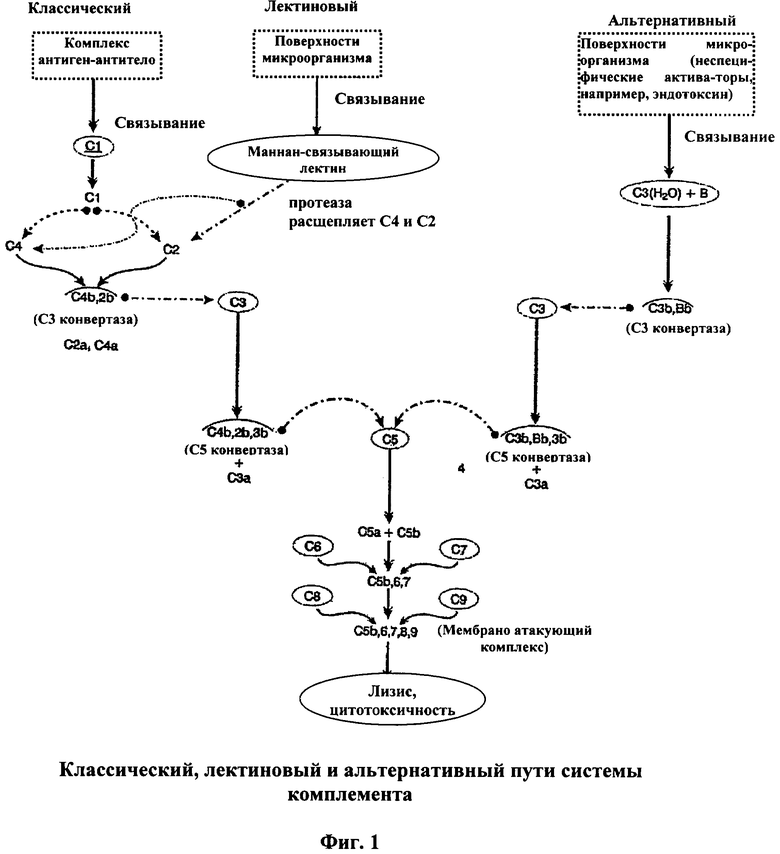
1. Композиция для элиситирования иммунного ответа на ВИЧ, включающая в фармацевтически приемлемом носителе эффективное количество белка слияния ВИЧ.
2. Композиция по п.1, где указанный белок слияния экспрессирован рекомбинантным носителем.
3. Композиция по п.2, где указанным рекомбинантным носителем является вирус.
4. Композиция по п.3, где указанным вирусом является вирус герпеса.
5. Композиция по п.4, где указанным вирусом герпеса является вирус Эпштейна-Барра.
6. Композиция по п.3, где указанным вирусом является вирус полиомиелита.
7. Композиция по п.3, где указанная композиция обрабатывается нейраминидазой, трипсином или другим соответствующим ферментом для удаления сиаловой кислоты.
8. Композиция по п.2, где указанным рекомбинантным носителем является бактерия.
9. Композиция по п.8, где указанной бактерией является бацилла Кальмета-Герена.
10. Композиция по п.8, где указанной бактерией является Listeria monocytogenes.
11. Композиция по п.8, где указанная композиция обрабатывается нейраминидазой, трипсином или другим соответствующим ферментом для удаления сиаловой кислоты.
12. Композиция по п.2, где указанным рекомбинантным носителем являются дрожжи.
13. Композиция по п.12, где указанными дрожжами являются Saccharomyces cerevisiae.
14. Композиция по п.1, где указанный белок слияния экспрессирован информационной РНК.
15. Композиция по п.1, где указанная композиция комбинирована со стимулятором иммунитета.
16. Композиция по п.15, где указанным стимулятором иммунитета является адъювант.
17. Композиция по п.15, где указанный стимулятор иммунитета включает полисахариды, состоящие из, по меньшей мере, одной маннозы в форме, способной связываться с указанной композицией.
18. Композиция по п.15, где указанный стимулятор иммунитета включает тейхоевую кислоту в форме, способной связываться с указанной композицией.
19. Композиция по п.15, где указанный стимулятор иммунитета включает зимозан в форме, способной связываться с указанной композицией.
20. Композиция по п.15, где указанный стимулятор иммунитета включает Cryptococcus neoformans серотипа С, имеющий полисахаридную капсулу, способную связываться с указанной композицией.
21. Композиция по п.15, где указанный стимулятор иммунитета включает протамин в форме, способной связываться с гепарином.
22. Композиция по п.15, где указанный стимулятор иммунитета включает гепариназу.
23. Композиция по п.15, где указанный стимулятор иммунитета включает фактор яда кобры в форме, адаптированной к усилению продуцирования C3b.
24. Композиция по п.23, где указанным фактором яда кобры является dCVF.
25. Композиция по п.15, где указанный стимулятор иммунитета включает никель в форме, адаптированной к усилению активности С3 конвертазы.
26. Композиция по п.15, где указанный стимулятор иммунитета включает сульфатированные полианионы, способные адсорбировать Фактор Н.
27. Композиция по п.1, где полианионы, содержавшиеся в композиции, способные потенцировать Фактор Н, в основном удалены из композиции.
28. Применение композиции по п.1 для изготовления лекарственного средства для элиситирования иммунного ответа на ВИЧ.
29. Способ элиситирования иммунного ответа у животных, при котором вводят композицию, содержащую в фармацевтически приемлемом носителе эффективное количество белка слияния ВИЧ.
30. Способ по п.29, где композицию вводят орально, трансбукально, трансмукозально, подъязычно, назально, ректально, вагинально, внутрь глаза, внутримышечно, внутрь лимфатического узла, внутривенно, подкожно, трансдермально, внутрикожно, внутрь опухоли, местным применением, через легкие, ингаляцией, инъекцией или имплантацией.
31. Способ по п.29, при котором композицию вводят капсулой, гелевой капсулой, таблеткой, кишечной капсулой, капсулированной частицей, порошком, суппозиторием, инъекцией, мазью, кремом, имплантатом, пластырем, жидкостью, средством для ингаляции или спреем.
| HONDA M | |||
| et al., "Protective immune responses induced by secretion of a chimeric soluble protein from a recombinant Mycobacterium bovis bacillus Calmette-Guérin vector candidate vaccine for human immunodeficiency virus type 1 in small animals", Proc Nail Acad Sci USA | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| EVANS D.J | |||
| et al., "An engineered | |||
Авторы
Даты
2010-12-27—Публикация
2004-10-25—Подача