Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтическому препарату, вводимому дозирующими ингаляторами под давлением (ДИпД) или распылителями, содержащему соединение общей формулы (I).
Изобретение также относится к способу получения и к дозирующему ингалятору под давлением или к однодозовым и многодозовым флаконам для распылителя, заполненным указанным фармацевтическим препаратом.
Уровень техники
Нарушение проходимости дыхательных путей характеризуется рядом серьезных респираторных заболеваний, включающих астму и хроническое обструктивное заболевание легких (ХОЗЛ). События, приводящие к нарушению проходимости дыхательных путей, включают отек стенок дыхательных путей, повышенное выделение слизи и воспаление.
Лекарственные средства для лечения респираторных заболеваний, таких как астма и ХОЗЛ, в настоящее время вводят посредством ингаляции. Одно из преимуществ ингаляционного способа введения в сравнении с системным способом является возможность высвобождения лекарственного средства непосредственно у места действия, исключение любых системных побочных эффектов, что обеспечивает в результате более быструю клиническую реакцию и более высокий терапевтический индекс.
Ингалируемые кортикостероиды представляют собой современную предпочтительную поддерживающую терапию в случае астмы и вместе с бронходилататорными β2-агонистами для снятия острого симптома они образуют основу современной терапии заболевания. Современная терапия ХОЗЛ в значительной степени имеет клинические проявления бронходилатирующей терапии за счет ингалируемых антихолинергетиков и ингалируемых агонистов β2-адренорецептора. Однако кортикостероиды не уменьшают воспалительную реакцию при ХОЗЛ, как они это делают при астме.
Другой класс терапевтических средств, которые исследуют с точки зрения их противовоспалительных эффектов для лечения воспалительных респираторных заболеваний, таких как астма и ХОЗЛ, представлен ингибиторами ферментов фосфодиэстеразы (ФДЭ), в частности фосфодиэстеразы 4 типа (далее называемой ФДЭ4).
Раскрыты различные соединения, действующие в качестве ингибиторов ФДЭ4. Однако практическая значимость некоторых ингибиторов ФДЭ4 первого поколения, таких как ролипрам и пикламиласт, ограничена из-за их нежелательных побочных эффектов, таких как тошнота, выделение желудочного сока и рвота, вследствие их действия на ФДЭ4 в центральной нервной системе и вследствие их действия на ФДЭ4 в париетальных клетках в пищеварительном канале.
Причина указанных побочных эффектов была широко исследована.
Было обнаружено, что ФДЭ4 существует в двух отличающихся формах, соответствующих разным конформациям, которые обозначают как высокоаффинный ролипрамсвязывающий сайт или ВФДЭ4, особенно присутствующий в центральной нервной системе и в париетальных клетках, и низкоаффинный ролипрамсвязывающий сайт или НФДЭ4 (Jacobits S. et al., Mol. Pharmacol., 1996, 50, 891-899), который обнаружен в иммунных и воспалительных клетках. Хотя обе формы, как оказывается, проявляют каталитическую активность, они отличаются по своей чувствительности к ингибиторам. В частности, соединения с более высокой аффинностью для НФДЭ4, как оказывается, менее склонны давать побочные эффекты, такие как тошнота, рвота и повышенное выделение желудочного сока.
Попытка направленной доставки к НФДЭ4 привела к незначительному улучшению селективности в случае ингибиторов ФДЭ4 второго поколения, таких как циломиласт и рофлумиласт. Однако даже такие соединения не обеспечивают хорошую селективность в отношении НФДЭ4.
Соединения с активностью селективного ингибирования НФДЭ4 раскрыты в публикации WO 2009/018909.
Другие ингибиторы ФДЭ4, обладающие высокой эффективностью, являются объектом находящейся на одновременном рассмотрении заявки № РСТ/ЕР2010/000676, в которой неожиданно было обнаружено, что присутствие сульфонамидо-заместителей на бензоатном остатке значительно улучшает эффективность и что (-)-энантиомеры более эффективны, чем соответствующие (+)-энантиомеры и рацематы.
Следовательно, такие соединения могут обеспечивать значительное терапевтическое преимущество при лечении респираторных заболеваний, таких как астма и ХОЗЛ, при введении путем ингаляции перорально или интраназально.
Задача настоящего изобретения состоит в разработке аэрозольной композиции на основе гидрофторалкана (ГФА) для дозирующего ингалятора под давлением (ДИпД), которая содержит соединение общей формулы (I), действующее в качестве ингибитора ФДЭ4, в качестве активного ингредиента.
Задача настоящего изобретения также состоит в разработке не содержащей пропеллента композиции для распыления, содержащей соединение общей формулы (I), действующее как ингибитор ФДЭ4, которую вводят с помощью подходящих устройств.
Задача настоящего изобретения также состоит в получении химически и физически стабильного аэрозольного препарата для ингаляции ФДЭ4 в форме ДИпД или препарата для распыления.
Сущность изобретения
Изобретение относится к фармацевтическому суспензионному препарату, который вводят дозирующими ингаляторами под давлением (ДИпД), содержащему частицы микронизированного кристаллического соединения общей формулы (I) и пропеллент.
Изобретение также относится к способу получения и к дозирующему ингалятору под давлением, заполненному указанным фармацевтическим препаратом.
Настоящее изобретение также предоставляет жидкий не содержащий пропеллент фармацевтический препарат для введения путем распыления, содержащий соединение общей формулы (I), растворенное или суспендированное в воде, необязательно в присутствии одного или нескольких со-растворителей.
Подробное описание изобретения
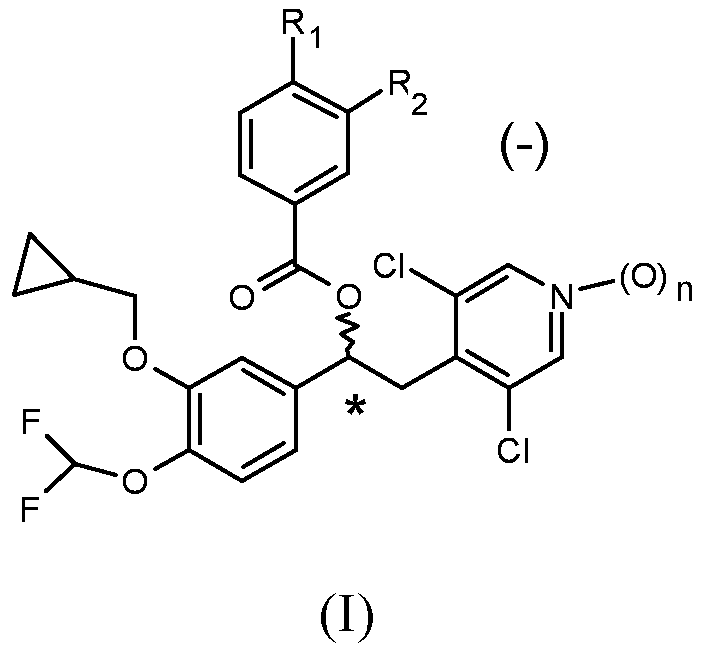
Изобретение относится к фармацевтическому препарату, который вводят дозирующими ингаляторами под давлением (ДИпД) или распылителями, содержащему соединение общей формулы (I) в виде (-)-энантиомеров, представленное приведенной ниже общей формулой (I):
 ,
,
где n равен 0 или 1;
R1 и R2 могут быть одинаковыми или различными и выбраны из группы, включающей:
линейный или разветвленный (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена;
OR3, где R3 представляет собой линейный или разветвленный (С1-С6)алкил, необязательно замещенный одним или несколькими атомами галогена или (С3-С7)циклоалкильными группами; и
HNSO2R4, где R4 представляет собой линейный или разветвленный (С1-С4)алкил, необязательно замещенный одним или несколькими атомами галогена;
где, по меньшей мере, один из R1 и R2 представляет собой HNSO2R4.
Предпочтительно используют (-)-энантиомеры, по существу, в чистой форме.
Термины «соединения», «активное лекарственное средство», «активный ингредиент», «действующее вещество», «активное соединение», «активное вещество» и «терапевтическое средство» используют как синонимы.
Выражения «мас./мас.%» и «мас./об.%» означают массовый процент компонента относительно общей массы или общего объема композиции соответственно. Под «безводным этанолом» понимают содержание этанола не менее 99,5 об./об.%.
Под «суточной терапевтически эффективной дозой» понимают количество активного ингредиента, введенного за один раз путем ингаляции при приведении в действие ингалятора.
При введении с помощью ДИпД указанная суточная доза может быть выпущена за одно или несколько приведений в действие, предпочтительно за одно приведение в действие (впрыск) ингалятора.
«Приведение в действие» означает высвобождение активного ингредиента из устройства за счет однократного приведения в действия (например, механического или вдохом).
Определение «по существу, чистый» означает активный ингредиент, имеющий оптическую чистоту больше чем 95 мас./мас.%, предпочтительно больше чем 98 мас./мас.%.
Определение «масс-медианный диаметр» означает медианный диаметр, который делит массу частиц на две равные части.
«Выпущенную дозу» (ВД) рассчитывают из кумулятивного осадка на стадиях каскадного импактора Андерсена (Andersen Cascade Impactor (КИА)) или импактора следующего поколения (Next Generation Impactor (ИСП)), поделенного на число приведений в действие в одном эксперименте.
Термин «масса мелкодисперсных частиц» (ММЧ) означает общую массу выпущенного лекарственного средства, уловленного на стадиях КИА или ИСП, которые захватывают частицы в интервале респирабельных частиц (аэродинамический диаметр <5 мкм). Аэродинамический диаметр является физическим свойством частицы в вязкой текучей среде, такой как воздух. В общем случае частицы имеют неправильные конфигурации с фактическим геометрическим диаметром, который трудно измерить. Аэродинамический диаметр является выражением аэродинамического поведения частиц, как если бы они были правильной сферической формы с одинаковой плотностью и диаметром, равным аэродинамическому диаметру.
Термин «фракция мелкодисперсных частиц» (ФМЧ) означает процентное соотношение между респирабельной дозой и выпущенной дозой.
Выражение «химически стабильный препарат» означает препарат, где стабильность и срок годности активного ингредиента соответствуют требованиям руководства ICH Quideline Q1B, которое относится к испытаниям стабильности лекарственных продуктов для целей регистрации лекарственного средства.
В контексте суспензионных препаратов выражение «физически стабилен» относится к препаратам, которые показывают, по существу, отсутствие роста размера частиц или изменения кристаллической морфологии активного ингредиента в течение продолжительного периода времени, являются легко повторно диспергируемыми и при повторном диспергировании не флоккулируют так быстро, чтобы препятствовать воспроизводимому дозированию активного ингредиента.
Термин «готовый к употреблению препарат для введения путем распыления» относится к препарату, который вводят напрямую без дополнительного манипулирования и диспергируют в воздухе с образованием аэрозоля с помощью распылителя, например устройства, которое способно генерировать очень мелкие жидкие капельки для ингаляции в легкие.
В одном аспекте настоящее изобретение предоставляет фармацевтический препарат, подходящий для аэрозольного введения с помощью ДИпД, в данном описании называемый препаратом ДИпД, содержащий соединение общей формулы (I) и пропеллент.
В конкретном варианте осуществления указанный препарат ДИпД может находиться в форме суспензии частиц микронизированного кристаллического соединения общей формулы (I) в указанном пропелленте с тем, чтобы обеспечить ингаляцию активного ингредиента в легкие при введении аэрозольного препарата.
Преимущественно частицы активного ингредиента будут иметь масс-медианный диаметр (ММД) менее чем 10 мкм, предпочтительно в интервале от 1 до 10 мкм, более предпочтительно от 1 до 6 мкм.
Любой сжиженный под давлением пропеллент может быть использован, предпочтительно гидрофторалкановый (ГФА) пропеллент. Примеры ГФА пропеллента включают 1,1,1,2-тетрафторэтан (HFA134a), 1,1,1,2,3,3,3-гептафторпропан (HFA227) и их смеси.
В некоторых вариантах осуществления пропеллент может состоять из HFA134a, тогда как в других вариантах осуществления пропеллент может состоять из HFA227 или их смеси в любом соотношении.
В конкретном варианте осуществления суспензионные препараты ДИпД могут содержать поверхностно-активное вещество, которое может действовать в качестве смазывающего вещества клапана.
Подходящие поверхностно-активные вещества известны в данной области техники и включают: сложные эфиры сорбитана, такие как триолеат сорбитана, монолаурат сорбитана, моноолеат сорбитана и их этоксилированные производные, такие как полисорбат 20, полисорбат 80; этиленоксид/пропиленоксидные сополимеры и другие агенты, такие как природный или синтетический лецитин, олеиновая кислота, поливинилпирролидон (ПВП), предпочтительно ПВП (K25), и поливиниловый спирт, оливковое масло, глицерилмонолаурат, кукурузное масло, масло семян хлопчатника или подсолнечное масло, изопропилмиристат, олеиловый спирт, монолаурат полиоксиэтилен(20)сорбитана, моноолеат полиоксиэтилен(20)сорбитана, эфир олеилполиоксиэтилена(2), эфир стеарилполиоксиэтилена(2), эфир лаурилполиоксиэтилена(4), блок-сополимеры оксиэтилена и оксипропилена, диэтиленгликольдиолеат, тетрагидрофурфурилолеат, этилолеат, глицерилмоноолеат, глицерилмоностеарат, глицерилмонорицинолеат, цетиловый спирт, стеариловый спирт, цетилпиридинийхлорид, этиленоксид/пропиленоксидный сополимер и этоксилированные спирты, такие как полиэтиленгликоль (ПЭГ) 300-1000, моноэтиловый эфир диэтиленгликоля, Antarox и Brij.
В предпочтительном варианте осуществления поверхностно-активное вещество представляет собой ПЭГ 600, или ПВП (K25), или их смесь.
Количество поверхностно-активного вещества, которое может присутствовать в препарате ДИпД согласно изобретению, обычно находится в интервале от 0,001 до 3,0 мас./мас.%, предпочтительно от 0,005 до 1,0 мас./мас.%.
В предпочтительном варианте осуществления изобретения препарат ДИпД может содержать со-растворитель.
Указанный со-растворитель включает, но не ограничивается ими, полярные соединения, которые содержат одну или более гидроксильных групп или других полярных групп. Например, со-растворитель включает: спирт, такой как этанол, предпочтительно безводный этанол, изопропанол; гликоль, такой как пропиленгликоль, полиэтиленгликоль, полипропиленгликоль или глицерин; гликолевый эфир и полиоксиэтилированный спирт.
Предпочтительно безводный этанол используют в концентрации ниже чем 20 мас./мас.%, более предпочтительно ниже 15%, еще более предпочтительно в интервале от 1 до 5 мас./мас.%), наиболее предпочтительно 1 или 5 мас./мас.%.
В других вариантах осуществления препараты ДИпД согласно изобретению могут дополнительно содержать другие эксципиенты. Примерами эксципиентов являются: сахара, такие как лактоза, аминокислоты, такие как аланин, бетаин, цистеин, и/или антиоксиданты, такие как аскорбиновая кислота, лимонная кислота, эдетат натрия, эдетовая кислота, токоферолы, бутилгидрокситолуол, бутилгидроксианизол и аскорбилпальмитат.
Массовое отношение лекарственного средства к наполнителю обычно находится в интервале от 1:0,1 до 1:100.
Фармацевтический препарат ДИпД изобретения может содержать, по меньшей мере, активный ингредиент, выбранный из группы, включающей С1, С2, С3, С4, С5 и С6, в количестве, составляющем от 0,02 до 0,7 мас./мас.%, предпочтительно от 0,05 до 0,5%, безводный этанол в количестве от 1 до 5 мас./мас.%, один или более поверхностно-активных веществ в количестве от 0,001 до 3 мас./мас.%. Пропеллентом является HFA134a, или HFA227, или их смесь.
Для получения суспензионного препарата ДИпД согласно изобретению кристаллическое соединение, выбранное из группы, включающей С1, С2, С3, С4, С5 и С6, получают, как представлено в находящейся на одновременном рассмотрении патентной заявке № РСТ/ЕР2010/000676, и микронизируют способами, которые сами по себе известны в данной области техники, с получением активного вещества в форме частиц, имеющих конкретный размер частиц, подходящих для ингаляции, <3 мкм.
В соответствии с другим аспектом настоящее изобретение предоставляет ДИпД, включающий баллон, заполненный фармацевтическим препаратом изобретения, и дозирующий клапан для выпуска суточной терапевтически эффективной дозы активного ингредиента.
Препаратом ДИпД изобретения будут заполнять ДИпД.
Указанные ДИпД включают баллон, снабженный дозирующим клапаном. Приведение в действие дозирующего клапана дает возможность высвобождать небольшую порцию распыленного продукта.
Часть или все внутренние поверхности баллона могут быть изготовлены из стекла или металла, например из алюминия, или нержавеющей стали, или анодированного алюминия.
С другой стороны, металлический баллон может иметь часть или все внутренние поверхности, покрытые инертным органическим покрытием. Примерами предпочтительных покрытий являются эпоксифенольные смолы, перфторированные полимеры, такие как перфторалкоксиалканы, перфторалкоксиалкилены, перфторалкилены, такие как политетрафторэтилен (тефлон), фторированный-этиленпропилен, полиэфирсульфон и смеси фторированный-этиленпропилен/полиэфирсульфон (ФЭП-ПЭС) или их комбинация. Другими подходящими покрытиями могут быть полиамид, полиимид, полиамидимид, полифениленсульфид или их комбинации.
В некоторых вариантах осуществления предпочтительно могут быть использованы баллоны, имеющие внутреннюю поверхность, покрытую тефлоном.
В других конкретных вариантах осуществления предпочтительно могут быть использованы баллоны, изготовленные из нержавеющей стали.
Баллон закрывают дозирующим клапаном для выпуска суточной терапевтически эффективной дозы активного ингредиента.
Обычно в комплект дозирующего клапана входят манжета, имеющая образованное в ней отверстие, бортик баллона, прикрепленный к манжете, который удерживает дозирующую камеру, шток, состоящий из сердечника и удлинителя сердечника, внутреннюю и наружную прокладки вокруг дозирующей камеры, пружину вокруг сердечника и уплотнительное кольцо для предупреждения утечки пропеллента через клапан.
Уплотнительное кольцо может состоять из любого подходящего эластомерного материала, такого как, например, полиэтилен низкой плотности, хлорбутил, черные и белые бутадин-акрилонитрильные каучуки, бутилкаучук, неопрен, ЭПДМ (полимер этиленпропилендиенового мономера) и ТПЭ (термопластичный эластомер). Особенно предпочтительными являются ЭПДМ-каучуки.
Подходящие клапаны коммерчески доступны от хорошо известных в индустрии аэрозолей производителей, например Valois, France, Bespak, plc UK и 3M, Neotechnic Ltd UK.
В целом уплотнения клапана, в особенности уплотнительное кольцо, а также прокладки, предпочтительно должны производиться из материалов, которые инертны к препарату и противостоят экстракции в содержимое препарата, особенно когда содержимое включает этанол.
Преимущественно материал дозирующей камеры является инертным и может противостоять разрушению содержимым препарата. Особенно подходящими материалами для использования при производстве дозирующей камеры являются ацетали и сложные полиэфиры, например полибутилентерефталат (ПБТФ).
В соответствии с предпочтительным вариантом осуществления изобретения материал всей внутренней поверхности баллона, а также материал дозирующей камеры, сердечника, удлинителя сердечника, пружины и корпуса клапана может быть, по существу, или полностью изготовлен из металла, предпочтительно из нержавеющей стали.
Подходящие клапана коммерчески доступны от производителей, хорошо известных в индустрии аэрозолей, например от Valois, France (например, DF10, DF30, DF31, DF60), Bespak pic, UK (например, ВК300, ВК356, ВК357) и 3M-Neotechnic Ltd, UK (например, Spraymiser).
Препарат должен приводиться в действие с помощью дозирующего клапана, способного выпускать объем от 25 до 100 мкл, например 25, 63 или 100 мкл.
Преимущественно, дозирующее ингалирующее (ДИ) устройство, заполненное составом, может быть оснащено счетчиком доз.
Обычные способы переработки сыпучих материалов и известное оборудование могут быть использованы для получения крупных партий для промышленного производства заполненных баллонов.
Например, суспензионные препараты ДИпД согласно изобретению могут быть получены путем добавления активного ингредиента к охлажденному пропелленту или необязательно предварительно смешанной смеси пропеллента и необязательно других эксципиентов, и затем путем диспергирования полученной суспензии с использованием подходящего смесителя. После гомогенизации суспензия может быть заправлена в баллон ДИ, который закрывают путем запрессовки дозирующего клапана на баллоне.
С другой стороны, активный ингредиент и необязательно другие эксципиенты могут быть добавлены в емкость. Затем сжиженный пропеллент вводят в емкость под давлением, и активный ингредиент диспергируют и гомогенизируют с использованием подходящего смесителя и гомогенизатора. После гомогенизации сыпучий препарат может быть перенесен в отдельные баллоны ДИ с использованием метода переноса из клапана в клапан.
С другой стороны, со-растворитель, если он присутствует, вводят в емкость при комнатном давлении. Добавляют активный ингредиент и необязательные другие эксципиенты и гомогенизируют с использованием подходящего гомогенизатора. Этанольную суспензию выдерживают при перемешивании. Затем этанольное сыпучее вещество дозируют в открытый баллон. Клапан помещают на контейнер и запрессовывают. И, наконец, баллон заполняют под давлением препаратом конечного раствора через клапан.
Препараты ДИпД согласно изобретению в зависимости от объема дозирующего клапана, который должен быть использован, могут соответствующим образом содержать от 0,1 до 80 мг соединения формулы (I) на мл, предпочтительно от 0,5 до 25 мг на мл.
Препараты ДИпД в форме суспензий, содержащих частицы микронизированного кристаллического соединения общей формулы (I) и пропеллент, содержат активный ингредиент в таком количестве, чтобы в случае введения путем ингаляции из ингаляторов суточная терапевтически эффективная доза (далее - суточная доза) соединения формулы (I) преимущественно составляла от 10 до 2000 мкг, предпочтительно от 20 до 1000 мкг, еще более предпочтительно от 50 до 800 мкг, еще более предпочтительно от 80 до 700 мкг и наиболее предпочтительно от 300 до 600 мкг.
В соответствии с предпочтительным вариантом осуществления однократная доза может содержать от 100 до 300 мкг, тогда как в соответствии с другим предпочтительным вариантом осуществления однократная доза может содержать от 200 до 800 мкг, более предпочтительно от 300 до 600 мкг.
В других вариантах осуществления однократная доза может составлять 100 мкг, 200 мкг, или 400 мкг, или 600 мкг.
Указанная доза будет зависеть от типа и серьезности заболевания и состояний (масса, пол, возраст) пациента и будет вводиться один или несколько раз в день, предпочтительно один раз в день.
В одном варианте осуществления суточная доза может быть достигнута однократным и двукратным введением.
В другом предпочтительном варианте осуществления суточная доза может быть достигнута однократным введением и выпущена за одно приведение в действие ингалятора.
В другом предпочтительном варианте осуществления суточная доза может быть достигнута однократным введением и выпущена за несколько приведений в действие ингалятора, предпочтительно двух.
В другом предпочтительном варианте осуществления суточная доза может быть достигнута двукратным введением и выпущена за одно приведение в действие ингалятора.
В другом предпочтительном варианте осуществления суточная доза может быть достигнута двукратным введением и выпущена за несколько приведений в действие ингалятора, предпочтительно двух.
Суточная доза может быть выпущена за одно, или два, или несколько приведений в действие (впрысков) ингалятора, в котором находится фармацевтический препарат. Например, суточная доза 400 мкг может быть введена за один впрыск 400 мкг или в виде двух впрысков дозы по 200 мкг.
В другом аспекте соединение общей формулы (I) может быть растворено или суспендировано с получением распыляемых водного раствора или суспензии, называемых в данном описании распыляемым препаратом, доступным в виде препарата или для однодозовых или для многодозовых флаконов.
Указанный распыляемый препарат может иметь рН и/или тоничность, скорректированные с помощью подходящих буферов и/или изотонических агентов, и необязательно он также может содержать стабилизирующие и/или консервирующие агенты.
В более предпочтительном варианте осуществления указанный распыляемый препарат может содержать растворитель.
В предпочтительном варианте осуществления указанный распыляемый препарат может содержать растворитель, выбранный из воды или водного раствора и смешивающегося с водой со-растворителя.
Указанные со-растворители включают, но не ограничиваются ими, полярные соединения, которые содержат одну или более гидроксильных групп или других полярных групп. Например, со-растворители включают спирты, такие как этанол, безводный этанол, изопропанол и гликоли, включая пропиленгликоль, полиэтиленгликоль, полипропиленгликоль, гликолевый эфир глицерина и полиоксиэтилированные спирты.
Настоящее изобретение также предоставляет однодозовый или многодозовый флакон, заполненный указанным распыляемым препаратом для выпуска суточной терапевтически эффективной дозы активного ингредиента с помощью распылителя.
Жидкий не содержащий пропеллент фармацевтический препарат в форме готового к применению препарата для введения путем распыления настоящего изобретения содержит соединение формулы (I) в таком количестве, что суточная доза преимущественно содержит приблизительно от 35 до 7000 мкг, предпочтительно от 70 до 3500 мкг, еще более предпочтительно приблизительно от 175 до 2800 мкг, еще более предпочтительно приблизительно от 280 до 2100 мкг и наиболее предпочтительно приблизительно от 350 до 1750 мкг.
В соответствии с предпочтительным вариантом осуществления однократная доза может содержать приблизительно от 350 до 700 мкг, тогда как в другом предпочтительном варианте осуществления однократная доза может содержать приблизительно от 700 до 1400 мкг.
В других вариантах осуществления однократная доза может составлять приблизительно 350 мкг, приблизительно 700 мкг или 1400 мкг.
Препарат предпочтительно используют в виде готового к применению препарата.
Однако указанные распыляемые препараты также могут быть реализованы в лиофилизированной форме в единичных дозах для восстановления в растворе. В таком альтернативном варианте однократная доза лиофилизированного препарата перед применением может быть восстановлена в растворе с помощью флакона с растворителем.
Такие распыляемые препараты также могут распространяться в подходящих контейнерах, таких как многодозовые флаконы или предпочтительно однодозовые флаконы для введения однократной дозировки. Указанные однодозовые флаконы могут быть предварительно стерилизованы или предпочтительно могут быть асептически заполнены с использованием технологии «продувка, заполнение и герметизация».
Препараты раствора могут быть преимущественно стерилизованы путем фильтрации. Однодозовые флаконы предпочтительно имеют объем 2 мл. Для суспензионных препаратов процесс стерилизации проводят с помощью известных методик.
Такие препараты предназначены для введения с использованием подходящих распыляющих устройств, таких как струйные распылители, ультразвуковые распылители, распылители мягкого аэрозоля, такие как Respimat®, или другие.
Таким образом, изобретение также относится к набору, включающему распыляемый препарат, предоставленный в данном случае заполненным во флаконы для введения однократной дозировки, и распылитель.
В соответствии с предпочтительным вариантом осуществления препараты ДИпД и распыляемые препараты настоящего изобретения содержат соединение общей формулы (I), выбранное из соединений С1, С2, С3, С4, С5 и С6, которые представлены ниже:
В варианте осуществления изобретения предпочтительным соединением препарата ДИпД или распыляемого препарата является С1. В другом варианте осуществления соединением является С2. В других предпочтительных вариантах осуществления соединением может быть С3, С4, С5 или С6.
Все препараты ДИпД и распыляемые препараты изобретения дополнительно могут содержать другие терапевтические средства, используемые в настоящее время при лечении респираторных заболеваний, например кортикостероиды, такие как триамцинолона ацетонид, флутиказона пропионат, флутиказона фуроат, флунизолид, мометазона фуроат, рофлепонид и циклезонид; антихолинергические или антимускариновые агенты, такие как ипратропия бромид, окситропия бромид, гликопиррония бромид и тиотропия бромид; β2-агонисты долговременного действия, такие как вилантерол, индакатерол, милветерол, сальбутамол, левалбутерол, тербуталин, AZD-3199, BI-1744-CL, LAS-100977, бамбутерол, изопротеренол, прокатерол, кленбутерол, репротерол, фенотерол и ASF-1020, и их соли.
Изобретение также относится к любому из препаратов, описанных выше, для применения в качестве лекарственного средства.
В другом аспекте настоящее изобретение включает любой из препаратов, описанных выше, предназначенных для предупреждения и/или лечения воспалительного или обструктивного заболевания дыхательных путей, такого как астма или хроническое обструктивное заболевание легких (ХОЗЛ).
В другом аспекте настоящее изобретение включает применение любого из препаратов, описанных выше, при предупреждении и/или лечении воспалительного или обструктивного заболевания дыхательных путей, такого как астма или хроническое обструктивное заболевание легких (ХОЗЛ).
В еще одном аспекте настоящее изобретение включает способ предупреждения и/или лечения воспалительного или обструктивного заболевания дыхательных путей, такого как астма или хроническое обструктивное заболевание легких (ХОЗЛ), включающий введение путем ингаляции эффективного количества одного из препаратов, описанных выше.
Введение всех препаратов настоящего изобретения может быть предназначено для предупреждения и/или лечения слабых, умеренных или серьезных острых или хронических симптомов или для профилактического лечения респираторных заболеваний, таких как астма и хроническое обструктивное заболевание легких (ХОЗЛ). Другие респираторные заболевания, характеризующиеся нарушением проходимости периферических дыхательных путей в результате воспаления и наличием слизи, такие как хронический обструктивный бронхиолит и хронический бронхит, также могут быть облегчены с помощью такого типа препарата.
Изобретение лучше иллюстрируют приведенные ниже примеры.
Пример 1
Фармацевтическую аэрозольную композицию, содержащую С2, безводный этанол в качестве со-растворителя, ПВП (K25) в качестве поверхностно-активного вещества и пропеллент HFA227, получают, как представлено в таблице 1.
Эффективность устройства ДИ является функцией дозы, осажденной на соответствующем участке в легких. На осаждение влияет аэродинамическое распределение частиц по размерам препарата, которое может быть охарактеризовано in vitro по нескольким параметрам.
Аэродинамическое распределение частиц по размерам препарата изобретения может быть охарактеризовано с использованием каскадного импактора в соответствии с методикой, описанной в European Pharmacopeia, 6-th edition, 2009 (6.5), часть 2.09.18. Прибор Е, работающий при скорости потока в интервале от 30 до 100 л/мин, или прибор D КИА, работающий при скорости потока 28,3 л/мин. Осаждение лекарственного средства на каждой пластине КИА определяют с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ).
Могут быть определены следующие параметры частиц, выпущенных с помощью ДИ под давлением:
i) масс-медианный аэродинамический диаметр (ММАД) представляет собой диаметр, вокруг которого массовые аэродинамические диаметры выпущенных частиц распределены поровну;
ii) выпущенная доза рассчитана из кумулятивного осадка в КИА, поделенного на число приведений в действие в одном эксперименте;
iii) респирабельная доза (доза мелкодисперсных частиц = ДМЧ) получена из осадка от стадий 3 (S3) до фильтра (АФ) КИА, соответствующего частицам диаметра ≤4,7 мкм, поделенного на число приведений в действие в одном эксперименте;
iv) респирабельная фракция (фракция мелкодисперсных частиц = ФМЧ), которая представляет собой процентное соотношение между респирабельной дозой и выпущенной дозой.
Физическую и химическую стабильность препарата, представленного в табл.1, оценивают при изучении стабильности через 1 и 3 месяца в условиях 25°С/(60% относительная влажность (ОВ)).
Свойства препарата, представленные в таблице 1, охарактеризованы с использованием ИСП.
Химическая стабильность и данные по свойствам препарата приведены в табл.2, где «средняя выпущенная доза внутри контейнера» означает среднюю выпущенную дозу десяти приведений в действие на одном и том же контейнере (3 приведения в действие в начале, 4 приведения в действие в середине и 3 приведения в действие в конце срока эксплуатации контейнера).
25°С/60% ОВ
разложение продуктов (%)
Данные, представленные в таблице 2, показывают хорошую химическую стабильность С2 (нет разложения во время изучения стабильности). Препарат показывает хорошую равномерность выпущенной дозы и высокую фракцию мелкодисперсных частиц.
Физическая стабильность препарата, представленного в табл.1, оценена с использованием оборудования Turbiscan® Lab Expert в течение периода времени 10 мин.
Turbiscan дает возможность получать быстрое и объективное измерение седиментационного поведения суспензионных лекарственных средств, и, следовательно, является предпочтительным относительно визуального наблюдения.
Различные явления нестабильности (расслоение, седиментация, флокуляция, коалесценция) могут быть идентифицированы и количественно определены по различным параметрам, давая возможность провести объективный анализ.
Основным компонентом оптического сканирующего анализатора Turbiscan® является головка приемника излучения, которая двигается вверх и вниз вдоль плоскодонной цилиндрической стеклянной ячейки. Головка приемника излучения состоит из источника, работающего в импульсном режиме близко к инфракрасному свету (λ=880 нм), и двух синхронизированных детекторов.
Turbiscan® может быть использован в двух разных режимах: режим обратного рассеивания и режим пропускания. Анализатор Turbiscan® в представленных примерах используют в режиме пропускания; то есть для измерения проходящего света как функции времени.
В случае систем под давлением требуется ячейка, способная удерживать образцы под давлением. Такую ячейку используют для оценок рассматриваемых ГФА-препаратов.
Дельта Т представляет собой параметр, используемый для физического описания препаратов, представленных в примерах. Дельта Т измеряет % изменения света, прошедшего через образец в предопределенный период времени. В частности, в случае представленных примеров дельту Т измеряют в течение периода времени 10 мин, временное окно, которое широко охватывает время, требуемое пациенту для применения устройства. Физически стабильная суспензия имеет низкое значение этого параметра (<1%), тогда как в случае нестабильной суспензии этот процент растет значительно.
Дельта Т для препарата, представленного в табл.1, через 10 мин составляет менее чем 0,2%, что подтверждает его физическую стабильность.
Пример 2
Фармацевтическую аэрозольную композицию, содержащую С2, безводный этанол в качестве со-растворителя, ПВП (K25) в качестве поверхностно-активного вещества и пропеллент HFA227, получают, как показано в табл.3.
Свойства препарата, представленного в табл.3, охарактеризованы с использованием ИСП. Данные представлены в табл.4.
Дельта Т для препарата, представленного в табл.3, через 10 мин составляет менее чем 0,2%, что подтверждает его физическую стабильность.
Пример 3
Фармацевтическую аэрозольную композицию, содержащую С2, безводный этанол в качестве со-растворителя, ПВП (K25) в качестве поверхностно-активного вещества, ПЭГ600 в качестве поверхностно-активного вещества и пропеллент HFA227, получают, как показано в табл.5.
Дельта Т для препарата, представленного в табл.5, через 10 мин составляет менее чем 0,2%, что подтверждает его физическую стабильность.
Пример 4
Фармацевтическую аэрозольную композицию, содержащую С2, безводный этанол в качестве со-растворителя, ПВП (K25) в качестве поверхностно-активного вещества и пропеллент HFA134a, получают, как показано в табл.6.
Аэрозоль охарактеризован с использованием ИСП.
Дельта Т для препарата, представленного в табл.6, через 10 мин составляет менее чем 0,2%, что подтверждает его физическую стабильность.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ ДЛЯ ИНГАЛЯЦИИ | 2003 |
|
RU2301673C2 |
| ГЕМИНАПАДИЗИЛАТ 5-(2-{[6-(2,2-ДИФТОР-2-ФЕНИЛЭТОКСИ)ГЕКСИЛ]АМИНО}-1-ГИДРОКСИЭТИЛ)-8-ГИДРОКСИХИНОЛИН-2(1H)-ОНА КАК АГОНИСТ β2 АДРЕНЕРГИЧЕСКОГО РЕЦЕПТОРА | 2008 |
|
RU2495029C2 |
| ФАРМАЦЕВТИЧЕСКИЕ АЭРОЗОЛЬНЫЕ ПРЕПАРАТЫ ФОРМОТЕРОЛА И БЕКЛОМЕТАЗОНА ДИПРОПИОНАТА | 2010 |
|
RU2650175C2 |
| ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ | 2001 |
|
RU2292890C2 |
| НОВАЯ ДОЗА И ПРЕПАРАТИВНАЯ ФОРМА | 2009 |
|
RU2608713C2 |
| КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ ХРОНИЧЕСКОГО ОБСТРУКТИВНОГО ЗАБОЛЕВАНИЯ ЛЕГКИХ | 2010 |
|
RU2561052C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2011 |
|
RU2642624C2 |
| КОМБИНАЦИИ, СОДЕРЖАЩИЕ АНТИМУСКАРИНОВЫЕ СРЕДСТВА И КОРТИКОСТЕРОИДЫ | 2005 |
|
RU2385156C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО И ФАРМАЦЕВТИЧЕСКИЙ НАБОР, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ АСТМЫ | 2000 |
|
RU2270670C2 |
| КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ФОРМОТЕРОЛ И СОЛЬ ТИОТРОПИЯ | 2000 |
|
RU2238085C2 |
Изобретение относится к области фармацевтики. Описывается фармацевтический препарат, содержащий 1-(3-циклопропилметокси-4-дифторметоксифенил)-2-(3,5-дихлор-1-оксипиридин-4-ил)этиловый эфир (-)-3-циклопропилметокси-4-метансульфониламинобензойной кислоты, поверхностно-активное вещество (ПАВ), со-растворитель и пропеллент. ПАВ выбрано из полиэтиленгликоля 600 (ПЭГ600), или поливинилпирролидона (ПВП), или их смеси. Со-растворитель представляет собой этанол. Пропеллент представляет собой гидрофторалкан, выбранный из группы, включающей 1,1,1,2-тетрафторэтан (HFA134a), 1,1,1,2,3,3,3-гептафтор-н-пропан (HFA227) и их смеси. Изобретение обеспечивает реализацию указанного назначения. 5 з. п. ф-лы, 7 табл., 4 пр.
1. Фармацевтический препарат для введения в форме аэрозоля, содержащий 1-(3-циклопропилметокси-4-дифторметоксифенил)-2-(3,5-дихлор-1-оксипиридин-4-ил)этиловый эфир (-)-3-циклопропилметокси-4-метансульфониламинобензойной кислоты;
поверхностно-активное вещество, представляющее собой полиэтиленгликоль 600 (ПЭГ600), или поливинилпирролидон (ПВП), или их смесь;
со-растворитель, представляющий собой этанол; и
пропеллент, представляющий собой гидрофторалкан, выбранный из группы, включающей 1,1,1,2-тетрафторэтан (HFA134a), 1,1,1,2,3,3,3-гептафтор-н-пропан (HFA227) и их смеси.
2. Фармацевтический препарат по п. 1, который находится в форме суспензии.
3. Фармацевтический препарат по п. 1, где количество 1-(3-циклопропилметокси-4-дифторметоксифенил)-2-(3,5-дихлор-1-оксипиридин-4-ил)этилового эфира (-)-3-циклопропилметокси-4-метансульфониламинобензойной кислоты составляет от 0,02 до 0,7 мас./мас.%.
4. Фармацевтический препарат по п. 1, где 1-(3-циклопропилметокси-4-дифторметоксифенил)-2-(3,5-дихлор-1-оксипиридин-4-ил)этиловый эфир (-)-3-циклопропилметокси-4-метансульфониламинобензойной кислоты вводят в суточной терапевтически эффективной дозе, составляющей 200 мкг.
5. Фармацевтический препарат по любому из пп. 1-4, помещенный в дозирующий ингалятор под давлением (ДИпД).
6. Фармацевтический препарат по п. 1, предназначенный для предупреждения и/или лечения воспалительного или обструктивного заболевания дыхательных путей.
| Колосоуборка | 1923 |
|
SU2009A1 |
| ВСЕСОЮЗНАЯ ПШ11ТШ-11;а!.Г:Г'НАг1 | 0 |
|
SU372777A1 |
| ЧУЕШОВ В.И., Промышленная технология лекарств, Т.2, Х.:МТК-Книга, 2002г., стр.639-657. | |||
Авторы
Даты
2016-03-27—Публикация
2011-07-21—Подача