Изобретение относится к области органической химии, в частности к новому способу получения 2-аминометилстиролов.
2-Аминометилстиролы применяются для получения катализаторов на основе карбеновых комплексов рутения для полимеризации цикло- и бициклоолефинов с раскрытием кольца по реакции метатезиса (RU 2374269 C2, 20.07.2009, RU 2393171 C1, 27.08.2010, RU 2462308 C1, 27.09.2012, RU 2436801 C1, 20.12.2011).
В настоящее время известно несколько способов получения 2-(N,N-диалкиламинометил)стиролов.
Известен способ получения 2-аминометилстиролов кросс-сочетанием производных 2-галогензамещенных бензиламинов и 2,4,6-тривинилциклотрибороксана или винил трибутилстаннатов, катализируемым соединениями палладия (WO 2011/079799 A1, 07.07.2011 и US 2007/0027071 A1, 01.02.2007).
К недостаткам способа можно отнести сложность аппаратурного оформления синтеза, а также высокую стоимость реагентов.
Известен способ получения 2-аминометилстиролов из о-винилбензилхлорида (А. Padwa, W. Dent. On the use of N-[(trimethylsilyl)methyl]amino ethers as capped azomethine ylide equivalents. J.Org.Chem., 1987, 52, 235-244).
Недостатком метода является высокая стоимость исходного о-винилбензилхлорида.
Расщепление четвертичных солей 1,2,3,4-тетрагидроизохинолинов по Гофману является эффективным методом синтеза 2-(N,N-диалкиламинометил)стиролов.
Известен способ получения 2-аминометилстиролов из солей диалкилтетрагидроизохинолинов с использованием оксида серебра (S. Kafka, P. Trska, J. Kytner, P. Taufmann, M. Ferles. Hydroboration of unsaturated amines. Part XIX. Hydroboration of N,N-dimethyl(2-vinylbenzyl)amine. Collection of Czechoslovak Chemical Communications, 1987, 52 (8), 2047-2056, A. Rheiner, A. Brossi. Syntheses in the isoquinoline series. Hofmann degradation of 1-phenyl-substituted 1,2,3,4-tetrahydroisoquinolines. Helvetica Chimica Acta, 1962,45, 2590-600).
К недостатком способа можно отнести необходимость использовать дорогостоящие соли серебра.
Известен способ получения 2-(N,N-диметиламинометил)стирола из диметилтетрагидроизохинолиний иодида нагреванием в DMSO в присутствии KCN (G.A. Molander, S.K. Pack. Determining the scope of the lanthanide mediated, sequential hydroamination/C-C cyclization reaction: formation of tricyclic and tetracyclic aromatic nitrogen heterocycles, Tetrahedron, 2003, 59, 10581-10591).
Недостатком этого метода является использование токсичного цианида калия.
Известен способ однореакторного получения [N-метил-N-(2-метоксиметил)]-2-винилбензиламина кипячением бензольного раствора N-(2-гидроксиэтил)-1,2,3,4-тетрагидроизохинолина, метилиодида и AliquatR 336 с гидроксидом калия (Silyl modification of biologically active compounds. 10. Lipid type organosilicon derivatives of 8-hydroxyquinoline and N-(2-hydroxyethyl)-1,2,3,4-tetrahydro(sila, iso)quinolones. Chemistry of Heterocyclic Compounds, 2005, 41 (5), 613-624).
К недостаткам данного метода можно отнести низкий (32%) выход целевого соединения.
Известен способ однореакторного получения 2-винил-N,N-диметилбензиламина из метилиодида N-метил-4-(триметилсилил)-1,2,3,4-тетрагидроизохинолина при комнатной температуре в ацетонитриле в присутствии ТБАФ и метилакрилата (Y. Ito, М. Nakatsuka, Т. Saegusa. Syntheses of Polycyclic Ring Systems Based on the New Generation of o-Quinodimethanes, J. Am. Chem. Soc, 1982, 104, 7609-7622).
Недостатком этого метода является труднодоступность исходного тетрагидроизохинолина и высокая стоимость и токсичность реагентов.
Известен способ расщепления метилсульфата производного 1,2,3,4-тетрагидроизохинолина, в котором его переводят в гидроксипроизводное на ионообменной смоле IRA-401, которое затем претерпевает расщепление по Гофману (Т. Suzuki, М. Takarnoto, Т. Okarnoto, Н. Takayarna. Acid-catalyzed double-cyclization reactions of N,N-dibenzylamino-acetaldehyde dialkyl acetals and related compounds: general synthesis of 7,12-dihydro-5H-6,12-methanodibenz[c,f]azocines and related compounds. Chemical & Pharmaceutical Bulletin, 1986, 34 (5), 1888-1900).
Недостатком этого способа можно назвать невысокий выход конечного стирола.
Наиболее близким к данному изобретению является способ получения 2-аминометилстиролов из 2-(2-бромоэтил)бензилбромида его реакцией с вторичными аминами в диоксане под действием микроволнового облучения с последующим кипячением в системе трет-бутанол/трет-бутилат калия (N.M. Shcheglova, V.D. Kolesnik, and R.V. Ashirov N.M. General Procedure for the Synthesis of ortho-Vinylbenzyl-Substituted Amines, Ethers, and Sulfide. Zhurnal Organicheskoi Khimii, 2013, 49 (9), 1344-1349).
К недостаткам данного метода можно отнести относительно низкие выходы 42-65%, необходимость применения микроволнового облучения и ограниченность рядом вторичных аминов.
Технической задачей способа является разработка простого способа получения 2-(N,N-диалкиламинометил)стиролов, позволяющего получать широкий ряд аминометилстиролов, проводить синтез в мягких условиях, с хорошими выходами и высокой чистотой.
Технический результат от реализации заявленного изобретения заключается в улучшении технологического процесса получения 2-(N,N-диалкиламинометил)стиролов, проводимого в мягких условиях, не требующих сложного оборудования, инертной атмосферы, дорогих и токсичных реагентов, с выходом 75-88% на исходный изохинолин.
Указанная техническая задача решается за счет того, что синтез проводят в соответствии с уравнениями реакций:
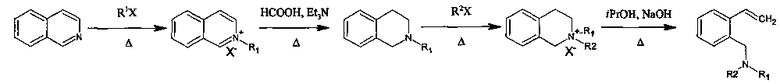
В результате получены 2-(N,N-диалкиламинометил)стиролы общей формулы:
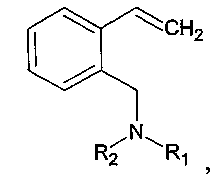
где R1=R2=Et; R1=R2=Me; R1=Me, R2=Et; R1=Me, R2=Bn; R1=Me, R2=n-Bu; R1=Me, R2=i-Pr; R1=Et, R2=i-Pr; R1=Et, R2=Bn или R1=Et, R2=n-Bu, предусматривая проведение реакции изохинолина с алкилгалогенидом или диалкилсульфатом с получением соответствующей изохинолиниевой соли, которую восстанавливают в присутствии муравьиной кислоты и триэтиламина с получением N-алкил-1,2,3,4,-тетрагидроизохинолина, который вновь подвергают реакции с алкилгалогенидом или диалкилсульфатом с получением соответствующей тетрагидроизохинолиниевой соли, которую расщепляют по реакции Гофмана под действием щелочи с выходом целевого соединения 75-88%. При этом алкилгалогенид выбирают из бензилхлорида, 1-бромбутана или 2-йодпропана, а диалкилсульфат выбирают из диэтилсульфата или диметилсульфата.
Ниже приведены примеры способа получения 2-(N,N-диалкиламинометил)стиролов общей формулы:
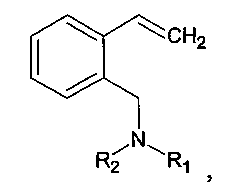 выбранных из ряда:
выбранных из ряда:
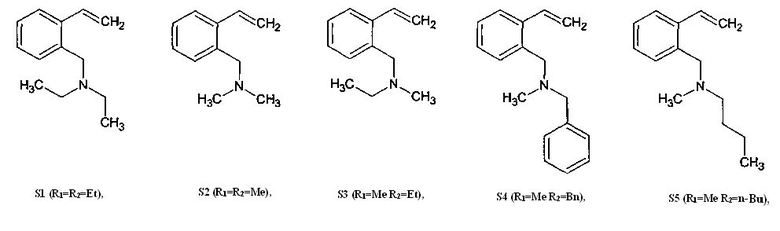
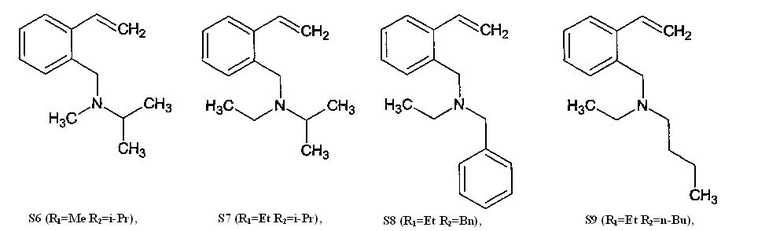
Пример 1
Получение 2-(N,N-диэтиламинометил)стирола S1.
Стадия 1
В колбу объемом 100 мл, снабженную обратным холодильником и магнитным якорем, помещают 5 г (0,039 моль) изохинолина и 3,4 мл (6,0 г, 0,039 моль) диэтилсульфата. Реакционную смесь нагревают при перемешивании в масляной бане при температуре 100°C в течение 1 ч. Затем реакционную смесь охлаждают до комнатной температуры и через воронку прибавляют 6,0 мл (7,4 г, 0,16 моль) муравьиной кислоты и 6,0 мл (4,3 г, 0,043 моль) триэтиламина. Далее перемешивают при температуре 100°C до момента прекращения выделения газа (примерно 4 ч). Затем реакционную массу охлаждают до комнатной температуры и в колбу через воронку при охлаждении и перемешивании прибавляют охлажденный водный 35 г 20% раствор NaOH (6,4 г, 0,16 моль), перемешивают в течение 15 мин и прибавляют при комнатной температуре в колбе 20 мл МТБЭ, перемешивают в течение 10 мин и переносят в делительную воронку. Разделяют слои, водный раствор еще раз экстрагируют 20 мл МТБЭ. Объединенные органические слои промывают 30 мл воды, сушат над сульфатом натрия, растворитель упаривают на роторе, остаток без дополнительной очистки запускают в следующую стадию. Получают 6,0 г N-этил-1,2,3,4-тетрагидроизохинолина.
Стадия 2
N-этил-1,2,3,4-тетрагидроизохинолин, полученный на предыдущей стадии, помещают в 100 мл колбу, снабженную обратным холодильником и магнитным якорем, и к нему прибавляют 3,4 мл (6,0 г, 0,039 моль) диэтилсульфата. Реакционную смесь нагревают при перемешивании в масляной бане при температуре 100°C в течение 1 ч. Затем реакционную смесь охлаждают до комнатной температуры и через воронку прибавляют 40 мл изопропанола, затем к полученному раствору при перемешивании 3,2 г (0,08 моль) NaOH. Далее перемешивают при температуре 80°C в течение 1,5 ч. Реакционную колбу переносят на ротор и упаривают растворитель досуха, к остатку прибавляют 40 мл МТБЭ и перемешивают в течение 30 мин. Осадок отфильтровывают, промывают на фильтре 10 мл МТБЭ, фильтрат упаривают, остаток перегоняют под вакуумом (0,01 mbar 57°C), получают 5,8 г (80% на исходный изохинолин) 2-(N,N-диэтиламинометил)стирола S1.
lH NMR (400 MHz, chloroform-d), δ, ppm: 1,11 (6Н, т, J=7,2 Гц, NCH2CH 3), 2,60 (4Н, кв, J=6,99 Гц, NCH 2CH3), 3,66 (2Н, с, NCH 2Ph), 5,35 (1Н, d, J=10,8 Гц, СН=СН 2), 5,71 (1H, д, J=17,4 Гц, СН=СН 2), 7,20-7,45 (4Н, м, СН=СН2+HAr) 7,61 (1H, д, J=7,4 Гц, HAr). GC/MS, М+: 189.
Пример 2
Осуществляют аналогично Примеру 1, но вместо диэтилсульфата используют диметилсульфат, получают 2-(N,N-диметиламинометил)стирол S2 с выходом 81% на исходный изохинолин.
1Н NMR (400 MHz, chloroform -d), δ, ppm: 2,17 (6Н, с, N(CH 3)2), 3,51 (2Н, с, NCH 2Ph), 5,38 (1H, d, J=10,8 Гц, CH=CH 2), 5,75 (1H, д, J=17,4 Гц, СН=СН 2), 7,20-7,45 (4Н, м, СН=СН2+HAr) 7,62 (1Н, д, J=7,4 Гц, HAr). GC/MS, М+: 161.
Пример 3
Осуществляют аналогично Примеру 1, но вместо диэтилсульфата на Стадии 2 используют диметилсульфат, получают 2-(N-метил-N-этиламинометил)стирол S3 с выходом 78% на исходный изохинолин.
Н NMR (400 MHz, chloroform -d), δ, ppm: 1,10 (3H, т, J=7,2 Гц, NCH2CH 3), 2,16 (3Н, с, NCH 3), 2,60 (2Н, кв, J=6,99 Гц, NCH 2CH3), 3,53 (2Н, с, NCH 2Ph), 5,37 (1H, d, J=10,8 Гц, СН=СН 2), 5,76 (1H, д, J=17,4 Гц, СН=CH 2), 7,21-7,46 (4Н, м, СН=СН2+HAr) 7,61 (1Н, д, J=7,4 Гц, HAr). GC/MS, М+: 175.
Пример 4
Получение 2-(N-бензил-N-метиламинометил)стирола S4.
Стадия 1
В кругло донную колбу объемом 100 мл, снабженную обратным холодильником и магнитным якорем, помещают 5 г (0,039 моль) изохинолина и 4,5 мл (4,9 г, 0,039 моль) бензилхлорида. Реакционную смесь нагревают при перемешивании в масляной бане при температуре 110°C в течение 1 ч. Затем реакционную смесь охлаждают до комнатной температуры и через воронку прибавляют 6,0 мл (7,4 г, 0,16 моль) муравьиной кислоты и 6,0 мл (4,3 г, 0,043 моль) триэтиламина. Далее перемешивают при температуре 110°C до момента прекращения выделения газа. Затем реакционную массу охлаждают до комнатной температуры и в колбу через воронку при охлаждении и перемешивании прибавляют охлажденный водный 35 г 20% раствор NaOH (6,4 г, 0,16 моль), перемешивают в течение 15 мин и прибавляют при комнатной температуре в колбе 20 мл МТБЭ, перемешивают в течение 10 мин и переносят в делительную воронку. Разделяют слои, водный раствор еще раз экстрагируют 20 мл МТБЭ. Объединенные органические слои промывают 30 мл воды, сушат над сульфатом натрия, растворитель упаривают на роторе, остаток без дополнительной очистки запускают в следующую стадию. Получают 7,8 г N-бензил-1,2,3,4-тетрагидроизохинолина.
Стадия 2
N-бензил-1,2,3,4-тетрагидроизохинолин, полученный на предыдущей стадии, помещают в 100 мл круглодонную колбу, снабженную обратным холодильником и магнитным якорем, и к нему прибавляют 3,7 мл (4,9 г, 0,039 моль) диметилсульфата. Реакционную смесь нагревают при перемешивании в масляной бане при температуре 100°C в течение 1 ч. Затем реакционную смесь охлаждают до комнатной температуры и через воронку прибавляют 40 мл изопропанола, затем к полученному раствору при перемешивании 3,2 г (0,08 моль) NaOH. Далее перемешивают при температуре 80°C в течение 1,5 ч. Реакционную колбу переносят на ротор и упаривают растворитель досуха, к остатку прибавляют 30 мл воды и 40 мл гексана и перемешивают в течение 30 мин. Отделяют органический слой, водный раствор экстрагируют еще 40 мл гексана. Объединенные органические вытяжки пропускают на фильтре через слой основного Al2O3, промывают 80 мл гексана, растворитель упаривают, получают 7,1 г (77% на исходный изохинолин) 2-(N-бензил-N-метиламинометил)стирола S4.
1H NMR (400 MHz, chloroform -d), δ, ppm: 2,17 (3H, c, NCH 3), 3,55 (2H, c, NCH 2Ph), 3,58 (2H, c, NCH 2Ph), 5,30 (1H, д, J=10,8 Гц, СН=СН 2), 5,68 (1H, д, J=17,8 Гц, CH=CH 2) 7,19-7,41 (9H, м, СН=СН2+HAr), 7,57 (1H, д, J=7,4 Гц, HAr). GC/MS, М+: 237.
Пример 5
Осуществляют аналогично Примеру 4, но вместо бензилхлорида на Стадии 1 используют 1-бромбутан, получают 2-(N-бутил-N-метиламинометил)стирол S5 с выходом 78% на исходный изохинолин.
1H NMR (400 MHz, chloroform -d), δ, ppm: 0,92 (3Н, т, J=7,3 Гц, СН2СН2СН 3), 1,32-1,39 (2Н, м, CH2CH 2CH3) 1.52 (2Н, м, CH 2CH2CH3), 2,18 (3Н, с, NCH 3), 2,40 (2Н, т, J=7,3 Гц, NCH 2CH2), 3,51 (2Н, с, NCH 2Ph), 5.31 (1H, дд, J=11,0, 1,4 Гц, СН=СН 2), 5,68 (1Н, дд, J=17.6, 1.2 Гц, СН=СН 2), 7,22-7,31 (4Н, м, СН=СН2+HAr), 7,55 (1H, д, J=7,4 Гц, HAr). GC/MS, М+: 203.
Пример 6
Осуществляют аналогично Примеру 4, но вместо бензилхлорида на Стадии 1 используют диметилсульфат и вместо диметилсульфата на Стадии 2 используют 2-иодпропан, получают N-(2-винилбензил)-N-метилпропил-2-амин S6 с выходом 88% на исходный изохинолин.
1H NMR (400 MHz, chloroform -d), δ, ppm: 0,91 (6H, д, J=6,1 Гц, СН(СН 3)2), 2,22 (3Н, с, NCH 3), 2,65 (1Н, м, СН(СН3)2), 3,50 (2Н, с, NCH 2Ph), 5.28 (1H, дд, J=11,0, 1,4 Гц, СН=СН 2), 5,67 (1H, дд, J=17.6, 1.2 Гц, CH=CH 2), 7,25-7,33 (4Н, м, СН=СН2+HAr), 7,52 (1H, д, J=7,4 Гц, HAr). GC/MS, М+: 189.
Пример 7
Осуществляют аналогично Примеру 4, но вместо бензилхлорида на Стадии 1 используют диэтилсульфат и вместо диметилсульфата на Стадии 2 используют 2-иодпропан, получают N-(2-винилбензил)-N-этилпропил-2-амин S7 с выходом 84% на исходный изохинолин.
1H NMR (400 MHz, chloroform -d), δ, ppm: 0,90 (6H, д, J=6,1 Гц, СН(СН 3)2), 1,07 (3Н, т, J=6.99 Гц, NCH2CH 3), 2,51 (2Н, к, J=6.99 Гц, NCH 2CH3), 2,64 (1Н, м, СН(СН3)2), 3,49 (2Н, с, NCH 2Ph), 5.27 (1Н, дд, J=11,0, 1,4 Гц, СН=СН 2), 5,66 (1Н, дд, J=17.6, 1.2 Гц, СН=СН 2), 7,25-7,33 (4Н, м, СН=СН2+HAr), 7,52 (1Н, д, J=7,4 Гц, HAr). GC/MS, М+: 203.
Пример 8
Осуществляют аналогично Примеру 4, но вместо диметилсульфата на Стадии 2 используют диэтилсульфат, получают 2-(N-бензил-N-этиламинометил)стирол S8 с выходом 75% на исходный изохинолин.
1H NMR (400 MHz, chloroform -d), δ, ppm: 1,09 (3Н, т, J=6.99 Гц, NCH2CH 3), 2,51 (2H, к, J=6.99 Гц, NCH 2CH3), 3,56 (2Н, с, NCH 2Ph), 3,64 (2Н, с, NCH 2Ph), 5,27 (1H, дд, J=10,8, 1,3 Гц, СН=СН 2), 5,64 (1H, дд, J=17,5, 1,6 Гц, СН=СН 2) 7,19-7,44 (9Н, м, СН=СН2+HAr), 7,54 (1H, д, J=7,4 Гц, HAr). GC/MS, М+: 251.
Пример 9
Осуществляют аналогично Примеру 4, но вместо бензилхлорида на Стадии 1 используют диэтилсульфат и вместо диметилсульфата на Стадии 2 используют 1-бромбутан, получают 2-(N-бутил-N-этиламинометил)стирол S9 с выходом 77% на исходный изохинолин.
1Н NMR (400 MHz, chloroform -d), δ, ppm: 0,88 (3Н, т, J=7,3 Гц, СН2СН2СН 3), 1,04 (3Н, т, J=6.99 Гц, NCH2CH 3), 1,32-1,39 (2Н, м, CH2CH 2CH3), 1.52 (2Н, м, CH 2CH2CH3), 2,40 (2Н, т, J=7,3 Гц, NCH 2CH2), 2,51 (2Н, к, J=7,0 Гц, NCH 2CH3), 3,59 (2Н, с, NCH 2Ph), 5,29 (1Н, дд, J=10,8, 1,3 Гц, СН=СН 2), 5,65 (1H, дд, J=17,5, 1,6 Гц, СН=СН 2), 7,25-7,33 (4Н, м, СН=СН2+HAr), 7,55 (1H, д, J=7,4 Гц, HAr). GC/MS, М+: 217.
Использование в предлагаемом способе доступных реагентов и условий (изохинолин, как исходный реагент, диалкилсульфаты, в качестве алкилирующего агента, муравьиная кислота - для восстановления изохинолиниевых солей, система гидроксид натрия/изопропанол - для расщепления четвертичных аминов) упрощает процесс и повышает его технологичность, позволяет получать различные диалкиламинометилстиролы с высокими выходами и чистотой.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2-(N,N-ДИАЛКИЛАМИНОМЕТИЛ)СТИРОЛОВ, СОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИЙ ФРАГМЕНТ | 2015 |
|
RU2575176C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АМИНОМЕТИЛСТИРОЛОВ, СОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИЙ ФРАГМЕНТ | 2014 |
|
RU2562775C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АМИНОМЕТИЛСТИРОЛОВ, СОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИЙ ФРАГМЕНТ | 2015 |
|
RU2596198C1 |
| КАТАЛИЗАТОР МЕТАТЕЗИСНОЙ ПОЛИМЕРИЗАЦИИ ДИЦИКЛОПЕНТАДИЕНА, СОДЕРЖАЩИЙ АЦЕТАМИДНЫЙ ФРАГМЕНТ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2574718C1 |
| N,N-ДИЗАМЕЩЕННЫЕ НИКОТИНАМИД-(Z)-O-МЕТИЛОКСИМЫ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2442784C1 |
| N, N', N'-ТРИЗАМЕЩЕННЫЕ ИЗОСЕЛЕНОМОЧЕВИНЫ | 2010 |
|
RU2434852C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-(1Н-ИНДОЛ-3-ИЛ)-БУТ-3-ЕН-2-ОНА | 2009 |
|
RU2409564C1 |
| (Z)-2((4-R-5-R-3-(ЭТОКСИКАРБОНИЛ)ТИОФЕН-2-ИЛ)АМИНО)-4-ОКСО-4-R-БУТ-2-ЕНОВЫЕ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ | 2019 |
|
RU2722176C1 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОИЗОХИНОЛИНА, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ СИНАПТИЧЕСКОГО ЗАХВАТА ДОПАМИНА И СПОСОБ ЛЕЧЕНИЯ | 2000 |
|
RU2293728C2 |
| АРИЛ- И ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ТЕТРАГИДРОИЗОХИНОЛИНЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ БЛОКИРОВАНИЯ ОБРАТНОГО ЗАХВАТА НОРЭПИНЕФРИНА, ДОПАМИНА И СЕРОТОНИНА | 2005 |
|
RU2388751C2 |
Изобретение относится к усовершенствованному способу получения 2-(N,N-диалкиламинометил)стиролов общей формулы:
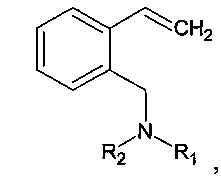
где R1=R2=Et; R1=R2=Me; R1=Me, R2=Et; R1=Me, R2=Bn; R1=Me, R2=n-Bu; R1=Me, R2=i-Pr; R1=Et, R2=i-Pr; R1=Et, R2=Bn или R1=Et, R2=n-Bu. Способ заключается в том, что изохинолин подвергают реакции с алкилгалогенидом или диалкилсульфатом с получением соответствующей изохинолиниевой соли. Последнюю восстанавливают в присутствии муравьиной кислоты и триэтиламина с получением N-алкил-1,2,3,4-тетрагидроизохинолина, который вновь подвергают реакции с алкилгалогенидом или диалкилсульфатом с получением соответствующей тетрагидроизохинолиниевой соли. Последнюю расщепляют по реакции Гофмана под действием щелочи. Алкилгалогенид предпочтительно выбирают из бензилхлорида, 1-бромбутана или 2-йодпропана, а диалкилсульфат - из диэтилсульфата или диметилсульфата. Изобретение позволяет улучшить технологичность процесса получения 2-(N,N-диалкиламинометил)стиролов и проводится в мягких условиях, не требующих сложного оборудования, инертной атмосферы, дорогих и токсичных реагентов. Способ позволяет повысить выход целевых продуктов до 75-88% в расчете на исходный изохинолин. 2 з.п. ф-лы, 9 пр.
1. Способ получения 2-(N,N-диалкиламинометил)стиролов общей формулы:
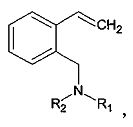
где R1=R2=Et; R1=R2=Me; R1=Me, R2=Et; R1=Me, R2=Bn; R1=Me, R2=n-Bu; R1=Me, R2=i-Pr; R1=Et, R2=i-Pr; R1=Et, R2=Bn или R1=Et, R2= n-Bu, заключающийся в том, что изохинолин подвергают реакции с алкилгалогенидом или диалкилсульфатом с получением соответствующей изохинолиниевой соли, которую восстанавливают в присутствии муравьиной кислоты и триэтиламина с получением N-алкил-1,2,3,4-тетрагидроизохинолина, который вновь подвергают реакции с алкилгалогенидом или диалкилсульфатом с получением соответствующей тетрагидроизохинолиниевой соли, которую расщепляют по реакции Гофмана под действием щелочи.
2. Способ по п. 1, отличающийся тем, что алкилгалогенид выбирают из бензилхлорида, 1-бромбутана или 2-йодпропана.
3. Способ по п. 1, отличающийся тем, что диалкилсульфат выбирают из диэтилсульфата или диметилсульфата.
| IX.Mitteilung:Arch.Pharm.,1911,v.249,371, Emde,Abbay des Chinolins, Abbau des Chinolins und des Isochinolins durch Reduction,von Hermann Emde | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Н.М.Щеглова и др.,Общий способ получения орто-винилбензилзамещенных аминов, | |||
Авторы
Даты
2016-03-27—Публикация
2015-03-04—Подача