ОБЛАСТЬ ТЕХНИКИ
В настоящей заявке предложены биоактивные композиции и метаболиты, полученные из Chromobacterium, в частности из культуры Chromobacterium substugae, ответственные за регулирование численности вредителей, а также способы их применения для регулирования численности вредителей.
УРОВЕНЬ ТЕХНИКИ
Натуральными продуктами являются вещества, которые вырабатываются микроорганизмами, растениями и другими организмами. Натуральные продукты микробного происхождения являются распространенным источником различных химических веществ, и применение натуральных продуктов в фармацевтических целях имеет длинную историю. Несмотря на широкое применение натуральных продуктов в качестве терапевтических средств для человека, более 50% из которых получают из натуральных продуктов, лишь 11% пестицидов получают из натуральных источников. Тем не менее, пестициды на основе натуральных продуктов могут играть важную роль для регулирования численности вредителей в традиционном земледелии и земледелии с использованием органических удобрений. Вторичные метаболиты, вырабатываемые микроорганизмами (бактериями, актиномицетами и грибками), обеспечивают получение новых химических соединений, которые можно применять по отдельности или в комбинации с известными соединениями для эффективного контроля численности насекомых-вредителей и для снижения риска развития резистентности у вредителей. Существует несколько широко известных примеров натуральных продуктов микробного происхождения, которые успешно применяют в качестве сельскохозяйственных инсектицидов (Thompson et al., 2000; Arena et al., 1995; Krieg et al., 1983).
Разработку микробных пестицидов начинают с выделения чистой культуры микроорганизмов. Затем проводят скрининг для определения эффективности и спектра действия с применением in vitro, in vivo исследований или опытно-промышленных испытаний в теплицах и в поле. В это же время активные соединения, вырабатываемые микроорганизмами, выделяют и идентифицируют. Для успешной коммерческой реализации микробного пестицида необходима возможность экономичного получения микроорганизма путем ферментации в промышленных масштабах и введения микроорганизмов в составы совместно с биосовместимыми и одобренными добавками для увеличения эффективности, максимально возможного упрощения применения, а также для обеспечения стабильности при хранении в полевых условиях.
Поскольку фермеры стараются расширить свой арсенал инсектицидов, и на рынке появляются новые продукты микробного происхождения, возникают различные варианты взаимного применения новых и уже существующих инсектицидов. Часто применяют комбинации, состоящие из 2 или более инсектицидов, которыми одновременно или последовательно обрабатывают монокультуру. Для решения этих вопросов ученые исследовали взаимодействие масел, грибков и химических пестицидов на вредителей и полезных насекомых путем их местного введения, а также введения совместно с пищей (см., например, Chalvet-Monfray, Sabatier et al. 1996; Meunier, Carubel et al. 1999; Hummelbrunner and Isman 2001; Wirth, Jiannino et al. 2004; Farenhorst, Knols et al. 2010; Shapiro-Ilan, Cottrell et al. 2011); тем не менее, еще не все взаимодействия были исследованы.
Chromobacterium
Штамм бета-протеобактерий, Chromobacterium subtsugae, обладает инсектицидной активностью в отношении широкого ряда насекомых (Martin, Blackburn et al. 2004; Martin 2004; Martin, Gundersen-Rindal et al. 2007; Martin, Hirose et al. 2007; Martin, Shropshire et al. 2007). Полагают, что действие обусловлено комбинацией антифидинговой активности и активности токсина, при этом ингибирование питания наблюдают в сублетальных дозах (Martin, Gundersen-Rindal et al. 2007). В частности, обнаружили, что Chromobacterium substugae являются эффективными в отношении взрослых особей колорадского картофельного жука (Leptinotarse decemlineata), взрослых особей западного кукурузного жука (Diabrotica virgifera), взрослых особей и личинок южного кукурузного жука (Diabrotica undecimpunctata), личинок малого ульевого жука (Aethina tumida), личинок капустной моли (Plutella xyllostella), взрослых особей и личинок белокрылки сладкого картофеля (Bernisia tabaci) и взрослых особей зеленого овощного клопа (Nezara viridula).
Со времени открытия С.substugae Мартин с сотрудниками были выделены и охарактеризованы по меньшей мере три новых вида Chromobacteria; Янг с соавторами (Young et al., 2008) выделили новый вид Chromobacterium, С.aquaticum, из родниковой воды на Тайване, а Кампфер с соавторами (Kampfer et al., 2009) выделили два вида, С.piscinae и С.pseudovilaceum, из природных образцов, собранных в Малайзии.
Вторичные метаболиты рода Chromobacterium
Среди всех известных видов Chromobacteria Chromobacterium violaceum исследовали в наибольшей степени, и опубликованная информация о вторичных метаболитах, вырабатываемых Chromobacteria, основана на исследованиях исключительно Chromobacterium violaceum. Дюран и Менк (Duran and Menck, 2001) опубликовали комплексный обзор фармакологических и промышленных перспектив применения Chromobacterium violaceum, грамотрицательного сапрофита, содержащегося в почве и воде. Обычно считается, что эта бактерия является непатогенной для человека, но так как она является условно-патогенным микроорганизмом, то может вызывать септицемию и фатальные инфекции у человека и животных. Известно, что Chromobacterium violaceum вырабатывает фиолетовый пигмент виолацеин, который представляет собой молекулу бис-индола, полученную в результате конденсации двух молекул L-триптофана в присутствии кислорода (Hoshino et al., 1987; Ryan and Drennan; 2009). Биосинтез виолацеина регулируется за счет чувства кворума, общего механизма, регулирующего различные другие вторичные пути метаболизма грамотрицательных бактерий (McClean et al., 1997).
Другие известные метаболиты Chromobacterium violaceum, приведенные в обзоре Дюрана и Менка (2001), включают цианид водорода, ферриоксамин E, бета-лактамные гликопептиды SQ 28504 и SQ 28546, антибиотики, такие как аэроцианидин, аэрокавин, 3,6-дигидроксиидоксазен и монобактам SB-26180, и противоопухолевый депсипептид FR 901228. Согласно обзору Дюрана и Менка (2001) Chromobacterium violaceum также вырабатывает необычные сахаристые соединения, такие как внеклеточные полисахариды и липополисахариды.
Нематоды и нематоциды
Нематоды представляют собой несегментированных двусторонне симметричных червеобразных беспозвоночных, у которых имеются полости тела и полная пищеварительная система, но отсутствуют дыхательные и кровеносные системы. Кожно-мускульный мешок состоит из многослойной кутикулы, гиподермы с четырьмя продольными тяжами и внутренней мускулатуры (Chitwood, 2003). Тело, главным образом, занято пищеварительной и репродуктивной системами. Большинство нематод являются свободноживущими, но небольшое число видов являются распространенными паразитами животных и растений.
Галловые нематоды (root-knot nematode) (Meloidogyne spp.) паразитируют в большом числе однолетних и многолетних культур, воздействуя на качество и количество товарного урожая. Нематоды этого рода считаются наиболее опасными с точки зрения экономических потерь нематодами, паразитирующими в растениях (Whitehead, 1998). Потери урожая однолетних культур, вызванные нематодами, паразитирующими в растениях, оценивались более чем в 100 миллиардов долларов США (Koenning et al., 1999), причем более половины потерь были вызваны нематодами рода Meloidogyne. Высеиваемые культуры этого штамма образуются в яйцах, из которых в благоприятных условиях вылупляются инфицированные личинки второй стадии (J2), которые мигрируют в почве в направлении корня растения-хозяина. Инфицирование происходит в результате проникновения через корневые кончики, после чего личинка перемещается в проводящую ткань, где нематода оседает и получает питание непосредственно из клеток растения. Ответ растения заключается в выработке гигантских клеток, которые образуют галлы (корневые наросты). На протяжении репродуктивного периода самки остаются скрытыми в ткани растения, и только отложенные яйца выводятся из корня.
Наиболее эффективными средствами регулирования численности галловых нематод являются нематоциды, которые подавляют вылупливание яиц, подвижность особей и/или инфицирующую активность в отношении растений. Разработка химических средств для регулирования численности нематод, паразитирующими в растениях, является сложной с учетом экологических и физиологических причин: 1. Большинство фитопаразитических нематод живет в ограниченном пространстве почвы около корней, и, следовательно, доставка химических нематоцидов затруднена. 2. Внешняя поверхность нематод является плохой биохимической мишенью и непроницаема для многих органических молекул (Chitwood, 2003). Кроме того, пероральная доставка токсичных соединений практически невозможна, так как большинство видов нематод, паразитирующих в растениях, поглощают вещество только после того, как они проникают в корни растений и инфицируют их. Таким образом, нематоциды должны представлять собой токсины широкого спектра с высокой летучестью или другими химическими и физическими свойствами, способствующими их перемещению в почве.
В последнее десятилетие галогенированные углеводороды (например, этилендибромид, метилбромид) наиболее широко применяли в качестве нематоцидов по всему миру. Вследствие высокой токсичности для человека и отрицательного воздействия на озоновый слой стратосферы эти соединения были запрещены монреальским протоколом, но разрешение на применение метилбромида для регулирования численности нематод и патогенами растений продлили в Соединенных Штатах из-за отсутствия заменителей. Наряду с органофосфатами карбаматы являются наиболее эффективными нематоцидами, для применения которых не требуется фумигация. К сожалению, большинство карбаматов, таких как алдикарб и оксамил, также являются высокотоксичными. По состоянию на август 2010 года производитель алдикарба, Bayer, согласился аннулировать свидетельство о регистрации продукции, применяемой для обработки картофеля и цитрусовых в США, и алдикарб полностью снимут с производства к концу августа 2018 года. В последнее время абамектин - смесь двух авермектинов, вырабатываемых актиномицетом почвы, Streptomyces avermitilis - был зарегистрирован для применения в качестве нематоцида (Faske and Starr, 2006). Syngenta реализует указанный активный ингредиент в качестве средства обработки семян хлопка и овощей под торговой маркой Avicta®.
Сообщалось, что некоторые микробные патогены растений/патогены нематод обладают активностью в отношении нематод, паразитирующих в растениях (Guerena, 2006). Эти биологические регуляторы включают бактерии Bacillus thuringiensis, Burkholderia cepacia, Pasteuria penetrans и Р.usgae. Pausteria Biosciences запустила производство Р.usgae, обладающих активностью в отношении жалящих нематод, обитающих в торфяных почвах на юго-востоке США. Нематоцидные грибки включают Trichoderma harzianum, Hirsutella rhossiliensis, H.minnesotensis, Verticillium chlamydosporum, Arthrobotrys dactyloides и Paecilomyces lilanicus (реализуются под торговыми марками BioAct® и Melcon® компанией Prophyta). Другой грибок, Myrothecium verrucaria, который коммерчески доступен в виде состава, DiTera®, производства Valent Biosciences, представляет собой мертвый грибок; следовательно его активность вызвана нематоцидными соединениями. Другие коммерческие бионематоциды включают Deny® и Blue Circle (A cepacia). Activate® (Bacillus chitinosporus) (Quarles, 2005) и BioNem (Bacillus firmus) производства Israeli (в настоящее время реализуемый Bayer в качестве средства обработки семян Votivo®) (Terefe et al. 2009). Были выдвинуты предположения, что отрицательное воздействие штаммов микроорганизмов на вылупливание яиц нематод, подвижность особей и инфицирующую активность можно связывать с выработкой токсинов в указанных организмах (Hallman and Sikora, 1996; Marrone et al, 1998; Siddiqui and Mahmood, 1999; Saxena et al., 2000; Meyer and Roberts, 2002), со способностью паразитировать в нематодах или даже захватывать их (Siddiqui and Mahmood, 1996; Kerry, 2001; Jaffee and Muldoon, 1995), с возникновением резистентности хозяина (Hasky-Gunther et al. 1998), с изменением поведения нематод (Sikora and Hoffman-Hergarter, 1993) или с препятствованием распознаванию растений нематодами (Oostendorp and Sikora, 1990).
Растительные нематоциды, такие как растительные экстракты и эфирные масла, можно применять для регулирования численности нематод (Kokalis-Burrelle and Rodriguez-Kabana, 2006). Читвуд (Chitwood) обобщил возможности применения соединений, полученных из растений, для регулирования численности нематод в последнем обзоре (Chitwood, 2002). Сиддики и Алам (Siddiqui and Alam, 2001) показали, что применение почвы для выращивания горшечных растений, содержащей части нима (Azadirachta indica) и китайской ягоды (Melia azidarah) подавляли развитие галловых нематод в томатах. Тем не менее, в настоящее время продукты на основе нима не зарегистрированы в США для регулирования численности нематод. Новый растительный продукт чилийского производства (Nema-Q®) на основе экстракта дерева Quillaja saponaria, содержащего сапонины (бидесмозидные производные квиллаевой кислоты, замещенные трисахаридом в положении С-3 и олигосахаридом в положении С-28), недавно был зарегистрирован в качестве органического нематоцида в US EPA (агентстве по охране окружающей среды США) и одобрен для земледелия с использованием органических удобрений Институтом экспертизы органических материалов (Organic Materials Review Institute, OMRI). Этот продукт реализуется компанией Monterey AgResources.
Севооборот с использованием культур, которые не могут быть хозяевами нематод, сам по себе часто является достаточной мерой для предотвращения разрастания популяций нематод до угрожающего экономике уровня (Guerena, 2006). Аллелохимикаты представляют собой соединения растительного происхождения, которые воздействуют на поведение организмов в среде растения. Примеры нематоцидных аллелохимикатов включают политиенилы, глюкозинолаты, алкалоиды, липиды, терпеноиды, стероиды, тритерпеноиды и фенолики (Kokalis-Burrelle and Rodriguez-Kabana, 2006; Chitwood, 2002). При использовании покровных насаждений биоактивные соединения аллелопатических растений выделяются во время роста и/или высвобождаются в почву при разложении биомассы. Культуры рода Brassica можно применять для биофумигации - стратегии регулирования численности вредителей, основанной на высвобождении биоцидных летучих веществ при разложении тканей, попадающих в почву (Kirkegaard and Sarwar, 1998). Тем не менее, в исследованиях Рубцовой с соавторами (Roubtsova et al., 2007) действия гниения брокколи на число М. incognita было показано, что для успешной борьбы требовалось тщательное смешение тканей растения со всеми фрагментами почвы, инфицированной нематодами.
Развитие новых средств для регулирования численности нематод в сельскохозяйственных почвах основано на двух факторах: на разработке культур, устойчивых к нематодам, и открытии и разработке новых менее токсичных нематоцидов широкого спектра. Стоимость исследований, разработки и регистрации новых химических нематоцидов чрезвычайно высока (>200 миллионов долларов США), что ограничивает разработку. Среди 497 новых активных ингредиентов, зарегистрированных для применения в качестве пестицидов с 1967 по 1997 год, только семь было зарегистрировано в качестве нематоцидов (Aspelin and Grube, 1999). Помимо традиционных химических способов было предложено применение РНК-интерференции (РНКи) в качестве способа регулирования численности нематод. Применение сайленсинга генов путем РНКи впервые было показано на Caenorhabditis elegans и сравнительно недавно на нематодах, паразитирующих в растениях, таких как Meloidogyne spp. (Bakhetia et al., 2005). Поиск новых штаммов микроорганизмов для применения в качестве источников биологических нематоцидов является важным для снижения значительных экономических потерь, вызванных нематодами, паразитирующими в растениях, а также для снижения применения токсичных соединений, зарегистрированных в настоящее время для регулирования численности нематод.
Согласно Сассеру и Фрекману (Sasser and Freckman, 1987) потери урожая, вызванные нематодами, составляют от 8 до 20% для основных культур по всему миру. Нематоды, паразитирующие в растениях, могут приводить к значительным потерям урожая, ежегодные экономические потери по оценкам составляют 87 миллиардов долларов США по всему миру (Dong and Zhang, 2006). Измененные культуры, устойчивые к нематодам, и химические нематоциды в настоящее время являются основным выбором средств регулирования численности нематод. Фумиганты, такие как метилбромид, являются очень эффективными для борьбы с заболеваниями растений, передаваемыми через почву, и нематодами, но вследствие высокой токсичности для млекопитающих, разрушения озонового слоя и других эффектов последействия применение метилбромида было запрещено в ряде стран, и полное прекращение его реализации планируется в соответствии с международным соглашением (Oka et al., 2000). Применение химических альтернатив, таких как метилйодид, 1,3-дихлорпропен и хлорпикрин, также сталкивается с проблемами, связанными с безопасностью человека и окружающей среды. Химические нематоциды, для применения которых не требуется фумигация, были выведены из производства и запрещены. Совсем недавно USEPA объявило о прекращении производства алдикарба.
КРАТКОЕ ОПИСАНИЕ
В настоящей заявке предложены новые применения и комбинации и, в частности, композиции, содержащие штамм Chromobacterium sp., в частности, штамм Chromobacterium substugae, более конкретно, штамм Chromobacterium substagae sp. nov., еще более конкретно штамм Chromobacterium substagae sp. nov., имеющий отличительные характеристики NRRL В-30655, описанные в патенте США №7244607.
Таким образом, в настоящей заявке предложен способ модулирования заражения нематодами растений, включающий нанесение на растение и/или его семена и/или в субстрат, применяемый для выращивания указанного растения количества супернатанта, фильтрата и/или экстракта и/или одного или более метаболитов штамма Chromobacterium sp., в частности, штамма Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., имеющего отличительные характеристики NRRL В-30655, описанные в патенте США №7244607, входящих в состав указанного супернатанта, фильтрата и/или экстракта, и возможно другого нематоцидного вещества в количестве, эффективном для модулирования указанного заражения нематодами.
Также в настоящей заявке предложена пестицидная комбинация, обладающая синергическим действием в отношении по меньшей мере одного вредителя, содержащая в качестве активных компонентов: (а) супернатант, фильтрат и/или экстракт штамма Chromobacterium sp., в частности, штамма Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., имеющего отличительные характеристики NRRL В-30655, описанные в патенте США №7244607, и/или одного или более метаболитов, входящих в состав указанного супернатанта, фильтрата и/или экстракта Chromobacterium sp., в частности, Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., имеющего отличительные характеристики NRRL В-30655, описанные в патенте США №7244607, и (b) другое пестицидное вещество, где (a) и (b) присутствуют в синергических количествах. Вредитель согласно конкретному варианту реализации может представлять собой насекомое-вредителя, но также может включать, не ограничиваясь ими, нематоды, грибки растений, вирусы растений, бактерии растений и сорняки. Кроме того, комбинация может иметь форму композиции. Пестицидное вещество может (a) быть получено из микроорганизма; (b) представлять собой натуральный продукт и/или (c) представлять собой химический пестицид, в частности химический нематоцид.
В частности, комбинация может содержать супернатант, фильтрат и/или экстракт штамма Chromobacterium sp., в частности, штамма Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., имеющего отличительные характеристики NRRL В-30655, описанные в патенте США №7244607, и пестицидное вещество, полученное из микроорганизма, включая, но не ограничиваясь ими. Bacillus sp. (например, Bacillus thuringiensis или Bacillus thuringiensis kurstaki) и спиносад. В качестве альтернативы комбинация может содержать супернатант, фильтрат и/или экстракт штамма Chromobacterium sp., в частности штамма Chromobacterium substugae, и более конкретно штамма Chromobacterium substagae sp. nov., и еще более конкретно штамма Chromobacterium substagae sp. nov., обладающего отличительными характеристиками NRRL B-30655, описанными в патенте США №7244607, и пестицидное вещество, полученное из натурального продукта, такого как пиретрум. В качестве альтернативы комбинация может содержать супернатант, фильтрат и/или экстракт штамма Chromobacterium sp., в частности штамма Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., обладающего отличительными характеристиками NRRL B-30655, описанными в патенте США №7244607, и пестицидное вещество, которое представляет собой химический пестицид, в частности, инсектицид, где инсектицид включает, но не ограничивается ими, пиретрины, спиротетрамет и диамид антраниловой кислоты.
Согласно родственному аспекту в настоящей заявке предложен способ синергической модулирования заражения по меньшей мере одним вредителем или видом вредителя растения, включающий нанесение на растение и/или его семена и/или на субстрат для выращивания указанного растения комбинаций, приведенных выше, где количество комбинации является эффективным для модулирования заражения указанным вредителем или видом вредителя. Также в настоящей заявке предложены выделенные соединения, которые можно получать или которые вырабатываются штаммами различных видов Chromobacterium, в частности штаммом Chromobacterium substugae, более конкретно штаммом Chromobacterium substagae sp. nov., еще более конкретно штаммом Chromobacterium substagae sp. nov., обладающим отличительными характеристиками NRRL В-30655, описанными в патенте США №7244607, или в качестве альтернативы организмами, способными вырабатывать указанные соединения, которые можно применять для регулирования численности вредителей, в частности, вредителей, которые чувствительны к нематоцидам.
В одном из вариантов реализации соединение может представлять собой соединений, которое (a) обладает пестицидной активностью; (b) имеет молекулярную массу, составляющую примерно 840-900, определенную путем жидкостной хроматографии/масс-спектроскопии (ЖХ/МС); и (c) имеет время удерживания высокоэффективной жидкостной хроматографии (ВЭЖХ), составляющее примерно 7-12 минут на ВЭЖХ-колонке С-18 с обращенной фазой с применением градиентной системы растворителей вода:ацетонитрил (CH3CN) (0-20 мин; 90-0% водный CH3CN, 20-24 мин; 100% CH3CN, 24-27 мин; 0-90% водный СН3CN, 27-30 мин; 90% водный CH3CN), при расходе 0,5 мл/мин и УФ-детектировании при 210 нм; и (d) необязательно может быть получено из штамма Chromobacterium sp., в частности штамма Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., обладающего отличительными характеристиками NRRL В-30655, описанными в патенте США №7244607. Соединение согласно одному из вариантов реализации может представлять собой пептид.
В конкретном варианте реализации соединение содержит 43 атома углерода, семь метальных, десять метиленовых атомов углерода, двенадцать метиновых, 6 олефиновых метиновых и восемь четвертичных атомов углерода согласно 13С ЯМР.
В одном из конкретных вариантов реализации соединение «A»: (а) можно получать из штамма Chromobacterium sp., в частности штамма Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., обладающего отличительными характеристиками NRRL В-30655, описанными в патенте США №7244607; (b) является токсичным для вредителя; (с) имеет молекулярную массу, составляющую примерно 840-890, более конкретно 860, определенную путем жидкостной хроматографии/масс-спектроскопии (ЖХ/МС); (d) имеет пики 1H ЯМР со значениями δ 8,89, 8,44, 8,24, 8,23, 7,96, 7,63, 6,66, 5,42, 5,36, 5,31, 5,10, 4,13, 4,07, 4,05, 3,96, 3,95, 3,88, 3,77, 3,73, 3,51, 3,44, 3,17, 2,40, 2,27, 2,11, 2,08, 2,03, 2,01, 1,97, 1,95, 1,90, 1,81, 1,68, 1,63, 1,57, 1,53, 1,48, 1,43, 1,35, 1,24, 1,07, 1,02, 0,96, 0,89, 0,88, 0,87, 0,80 и пики 13C ЯМР со значениями δ 173,62, 172,92, 172,25, 172,17, 171,66, 171,28, 170,45, 132,13, 130,04. 129,98, 129,69, 129,69, 125,48, 98,05, 70,11, 69,75, 68,30, 68,25, 64,34, 60,94, 54,54, 52,82, 49,72, 48,57, 45,68, 40,38, 39,90, 38,18, 36,60, 31,98, 31,62, 31,58, 29,53, 28,83, 27,78, 24,41, 23,06, 22,09, 20,56, 19,31, 18,78, 17,66, 15,80; (e) имеет время удерживания высокоэффективной жидкостной хроматографии (ВЭЖХ), составляющее примерно 7-12 минут, более конкретно примерно 9 минут, еще более конкретно 9,08 минуты на ВЭЖХ-колонке колонке С-18 с обращенной фазой (Phenomenex, Luna, 5 мкм, С18(2), 100А, 100×4,60 мм) с применением градиентной системы растворителей вода:ацетонитрил (CH3CN) (0-20 мин; 90-0% водный CH3CN, 20-24 мин; 100% CH3CN, 24-27 мин; 0-90% водный СН3СН 27-30 мин; 90% водный CH3CN), при расходе 0,5 мл/мин и УФ-детектировании при 210 нм;. В частности, на спектре 13C ЯМР видны сигналы 43 атомов углерода, семи метальных, десяти метиленовых атомов углерода, двенадцати метиновых, 6 олефиновых метиновых, восьми четвертичных атомов углерода и/или на спектре 1H ЯМР изображены пики, характерные для типичного пептида, соответствующие сигналам пяти амидных NH групп [δH: 8,89, 8,44, 8,23, 8,22, 7,96], сигналу одной NH2 аминогруппы [δH: 7,64, 6,65], сигналам шести α-аминопротонов [δH: 4,07, 4,06, 3,96, 3,95, 3,88, 3,72], и на спектре 13C ЯМР изображены резонансы шести/семи атомов углерода амидных или сложноэфирных групп [δC: 173,62, 172,92, 172,25, 172,17, 171,66, 171,28, 170,45].
В другом конкретном варианте реализации соединение «B» имеет следующие характеристики: (a) его можно получать из штамма Chromobacterium sp., в частности штамма Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., обладающего отличительными характеристиками NRRL B-30655, описанными в патенте США №7244607; (b) оно является токсичным для вредителя; (c) имеет молекулярную массу, составляющую примерно 850-900, более конкретно 874, определенную путем жидкостной хроматографии/масс-спектроскопии (ЖХ/МС); (d) имеет время удерживания высокоэффективной жидкостной хроматографии (ВЭЖХ), составляющее примерно 7-12 минут, более конкретно примерно 9 минут, еще более конкретно 9,54 минуты на ВЭЖХ-колонке С-18 с обращенной фазой (Phenomenex, Luna, 5 мкм, С 18(2), 100А, 100×4,60 мм) с применением градиентной системы растворителей вода:ацетонитрил (CH3CN) (0-20 мин; 90-0% водный CH3CN 20-24 мин; 100% CH3CN, 24-27 мин; 0-90% водный CH3CN, 27-30 мин; 90% водный CH3CN), при расходе 0,5 мл/мин и УФ-детектировании при 210 нм.
В более конкретном варианте реализации предложены соединения, включая, но не ограничиваясь ими:
(A) соединение, имеющее структуру ##STR001##
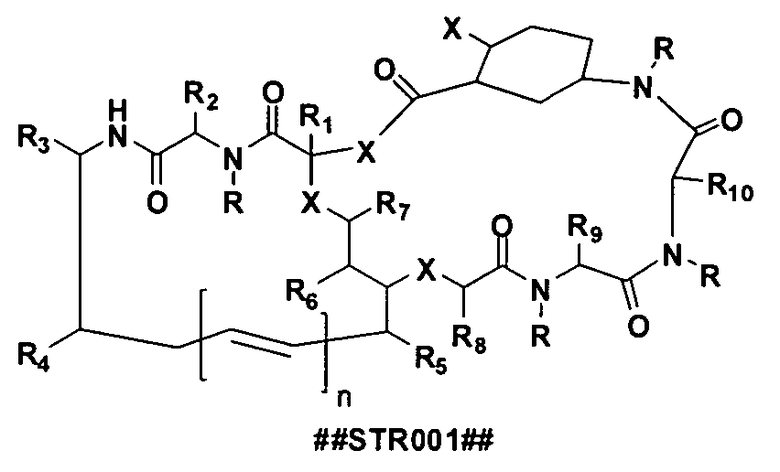
или его пестицидно приемлемую соль или стереоизомеры, где R представляет собой -H, низший алкил, содержащий 1, 2, 3, 4, 5, 6, 7, 8 или 9 алкильных фрагментов, арильный или арилалкильный фрагмент, замещенный низший алкил; Х представляет собой O, NH, NR или S; n равен 0, 1, 2, 3, 4, 5, 6, 7, 8 или 9; R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11 независимо представляют собой H, могут быть одинаковыми или различными и независимо представляют собой фрагмент боковой цепи аминокислоты или производное боковой цепи аминокислоты, алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероцикл, замещенный гетероцикл, циклоалкил, замещенный циклоалкил, алкокси, замещенный алкокси, тиоалкил, замещенный тиоалкил, гидроксил, галоген, амино, амидо, карбоксил, -C(O)H, ацил, оксиацил, карбамат, сульфонил, сульфонамид или сульфурил;
(B) соединение, имеющее структуру ##STR001a##

где R представляет собой -H, низший алкил, содержащий 1, 2, 3, 4, 5, 6, 7, 8 или 9 алкильных фрагментов, арильный или арилалкильный фрагмент, замещенный низший алкил; X представляет собой О, NH, NR или S; R2a и R2b независимо выбраны из группы, состоящей из -H, алкила, низшего алкила, замещенного алкила и замещенного низшего алкила; R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11 независимо представляют собой H, могут быть одинаковыми или различными и независимо представляют собой фрагмент боковой цепи аминокислоты или производное боковой цепи аминокислоты, алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероцикл, замещенный гетероцикл, циклоалкил, замещенный циклоалкил, алкокси, замещенный алкокси, тиоалкил, замещенный тиоалкил, гидроксил, галоген, амино, амидо, карбоксил, -C(O)H, ацил, оксиацил, карбамат, сульфонил, сульфонамид или сульфурил;
(C) соединение, имеющее структуру ##STR001b##
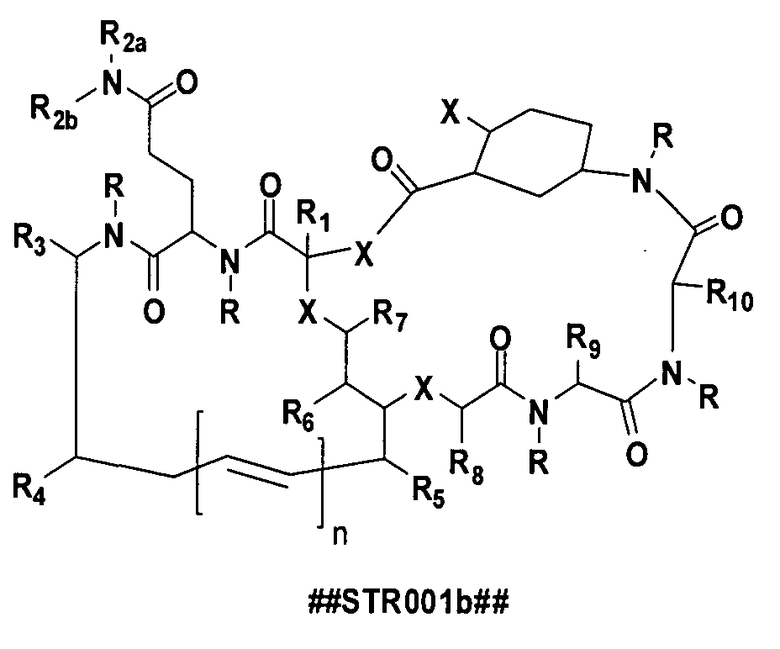
где R представляет собой -H, низший алкил, содержащий 1, 2, 3, 4, 5, 6, 7, 8 или 9 алкильных фрагментов, арильный или арилалкильный фрагмент, замещенный низший алкил; X представляет собой O, NH, NR или S; n равен 0, 1, 2, 3, 4, 5, 6, 7, 8 или 9; R2a и R2b независимо выбраны из группы, состоящей из -H, алкила, низшего алкила, замещенного алкила и замещенного низшего алкила; R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11 независимо представляют собой H, могут быть одинаковыми или различными и независимо представляют собой фрагмент боковой цепи аминокислоты или производное боковой цепи аминокислоты, алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероцикл, замещенный гетероцикл, циклоалкил, замещенный циклоалкил, алкокси, замещенный алкокси, тиоалкил, замещенный тиоалкил, гидроксил, галоген, амино, амидо, карбоксил, -C(O)Н, ацил, оксиацил, карбамат, сульфонил, сульфонамид или сульфурил;
(D) соединение, имеющее структуру ##STR001c##

где R представляет собой H, низший алкил, арил или арилалкильный фрагмент, замещенный низший алкил, содержащий 1, 2, 3, 4, 5, 6, 7, 8 или 9 алкильных фрагментов; X представляет собой O, NH, NR или S; n равен 0, 1, 2, 3, 4, 5, 6, 7, 8 или 9; R2a и R2b независимо выбраны из группы, состоящей из -H, алкила, низшего алкила, замещенного алкила и замещенного низшего алкила; R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11 независимо представляют собой H, могут быть одинаковыми или различными и независимо представляют собой фрагмент боковой цепи аминокислоты или производное боковой цепи аминокислоты, алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероцикл, замещенный гетероцикл, циклоалкил, замещенный циклоалкил, алкокси, замещенный алкокси, тиоалкил, замещенный тиоалкил, гидроксил, галоген, амино, амидо, карбоксил, -C(O)Н, ацил, оксиацил, карбамат, сульфонил, сульфонамид или сульфурил.
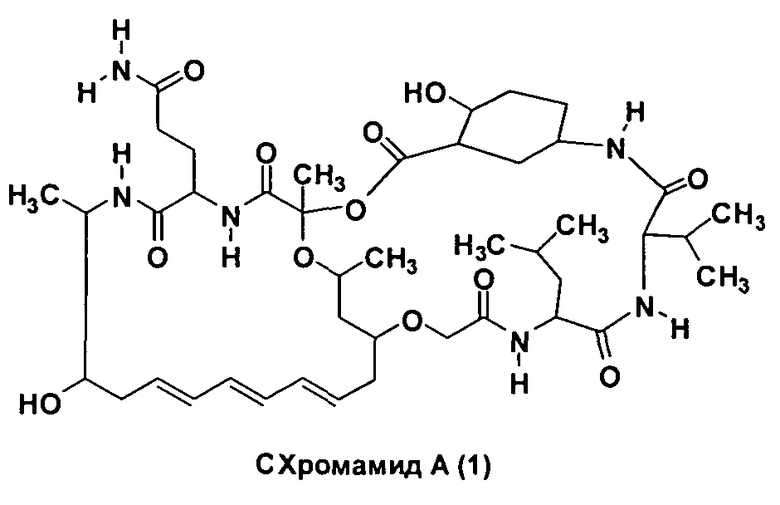
В более конкретном варианте реализации соединение представляет собой хромамид A(1).
Указанные соединения можно получать путем (a) выращивания штамма Chromobacterium sp., в частности штамма Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., обладающего отличительными характеристиками NRRL В-30655, описанными в патенте США №7244607, в питательной среде или в цельноклеточном бульоне в условиях, достаточных для получения указанного соединения, с получением культуры Chromobacterium и (b) выделения указанного полученного соединения из цельноклеточного бульона, применяемого на стадии (a). В частности, соединение на стадии (b) можно выделять путем (i) применения цельноклеточного бульона на по меньшей мере одном из ионообменной колонки, колонки эксклюзионной хроматографии или колонки обращенно-фазовой ВЭЖХ с получением колоночных фракций; (ii) исследования колоночных фракций на предмет пестицидной активности и (iii) концентрирования колоночных фракций согласно (ii) с получением выделенного соединения.
Дополнительно предложены композиции, в частности, пестицидные композиции, содержащие указанные соединения, а также другие соединения, которые можно получать из штамма Chromobacterium sp., в частности штамма Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., обладающего отличительными характеристиками NRRL В-30655, описанными в патенте США №7244607, обладающие пестицидной активностью. Указанные другие соединения могут иметь следующие характеристики: (a) молекулярную массу, составляющую примерно 315-360, определенную путем жидкостной хроматографии/масс-спектроскопии (ЖХ/МС); (b) время удерживания высокоэффективной жидкостной хроматографии (ВЭЖХ), составляющее примерно 8-15 минут на ВЭЖХ-колонке С-18 с обращенной фазой с применением градиентной системы растворителей вода:ацетонитрил (CH3CN) (0-20 мин; 90-0% водный CH3CN, 20-24 мин; 100% CH3CN, 24-27 мин; 0-90% водный CH3CN, 27-30 мин; 90% водный CH3CN), при расходе 0,5 мл/мин и УФ-детектировании при 210 нм; и которые можно получать путем (A) выращивания штамма Chromobacterium sp., в частности штамма Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., обладающего отличительными характеристиками NRRL В-30655, описанными в патенте США №7244607, в питательной среде в условиях, достаточных для получения указанного соединения, с получением культуры штамма Chromobacterium sp., в частности штамма Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., обладающего отличительными характеристиками NRRL В-30655, описанными в патенте США №7244607, и (B) выделения указанного полученного соединения из цельноклеточного бульона, полученного на стадии (A).
В конкретном варианте реализации одно из соединение, применяемое в указанной композиции, приведенной выше, соединение «С», имеет следующие характеристики: (a) его можно получать из штамма Chromobacterium sp., в частности штамма Chromobacterium substugae, более конкретно штамма Chromobacterium substagae sp. nov., еще более конкретно штамма Chromobacterium substagae sp. nov., обладающего отличительными характеристиками NRRL В-30655, описанными в патенте США №7244607; (b) оно является токсичным для вредителей; (c) имеет молекулярную массу, составляющую примерно 325-360, более конкретно примерно 343, определенную путем жидкостной хроматографии/масс-спектроскопии (ЖХ/МС); (d) имеет время удерживания высокоэффективной жидкостной хроматографии (ВЭЖХ), составляющее примерно 8-14 минут, более конкретно примерно 10 минут, еще более конкретно 10,88 минуты на ВЭЖХ-колонке С-18 с обращенной фазой (Phenomenex, Luna, 5 мкм, С 18(2), 100А, 100×4,60 мм) с применением градиентной системы растворителей вода:ацетонитрил (CH3CN) (0-20 мин; 90-0% водный CH3CN, 20-24 мин; 100% CH3CN, 24-27 мин; 0-90% водный CH3CN, 27-30 мин; 90% водный CH3CN), при расходе 0,5 мл/мин и УФ-детектировании при 210 нм. В конкретном варианте реализации соединение «C» может представлять собой виолацеин (2), известное соединение, ранее выделенное из Chromobacterium violaceum.
В другом варианте реализации другое соединение, применяемое в композиции, приведенной выше, соединение «D», имеет следующие характеристики: (a) его можно получать из бактерий различных видов Chromobacterium; (b) оно является токсичным для вредителей; (c) имеет молекулярную массу, составляющую примерно 315-350, более конкретно примерно 327, определенную путем жидкостной хроматографии/масс-спектроскопии (ЖХ/МС); (d) имеет время удерживания высокоэффективной жидкостной хроматографии (ВЭЖХ), составляющее примерно 10-15 минут, более конкретно примерно 12 минут, еще более конкретно 12,69 минуты на ВЭЖХ-колонке С-18 с обращенной фазой (Phenomenex, Luna, 5 мкм, С 18(2), 100А, 100×4,60 мм) с применением градиентной системы растворителей вода:ацетонитрил (CH3CN) (0-20 мин; 90-0% водный CH3CN, 20-24 мин; 100% CH3CN, 24-27 мин; 0-90% водный CH3CN, 27-30 мин; 90% водный CH3CN), при расходе 0,5 мл/мин и УФ-детектировании при 210 нм. В конкретном варианте реализации соединение «D» можно охарактеризовать как дезоксивиолацеин (3), известное соединение, ранее выделенное из Chromobacterium violaceum.
Указанные композиции могут дополнительно содержать второе вещество, где указанное второе вещество представляет собой химический или биологический пестицид, и/или по меньшей мере один носитель, разбавитель, поверхностно активное вещество или адъювант.
Также предложен способ применения соединений (например, соединений «A», «B», «C» и «D») и композиций, приведенных выше, для модулирования заражения растения вредителями, в частности, вредителями, чувствительными к нематоцидам, включающий нанесение на растение количества соединения или композиции и возможно второго химического или биологического пестицида, которое является эффективным для модулирования указанного заражения вредителями. Кроме того предложено применение соединений, приведенных выше, для приготовления композиции для модулирования заражения растения вредителями.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На ФИГ.1 представлена примерная схема очистки для получения соединений согласно настоящему изобретению из культурального бульона.
На ФИГ.2 изображена ИЭР-ЖХМС хроматограмма хромамида A (1).
На ФИГ.3 изображены данные МСВР хромамида A (1).
На ФИГ.4 изображен спектр 1H ЯМР хромамида A (1), полученный в ДМСО-d6 при 600 МГц.
На ФИГ.5 изображен спектр 13C ЯМР хромамида A (1), полученный в ДМСО-d6 при 600 МГц.
На ФИГ.6 изображена хроматограмма ВЭЖХ соединения B (ММ 874).
На ФИГ.7 изображены химические структуры хромамида A (1), виолацеина (2) и дезоксивиолацеина (3).
На ФИГ.8 показано процентное содержание подвижных нематод через 24 часа после обработки стерилизованным путем фильтрации бульоном, содержащим С.substugae (1x-неразбавленный, 0,1х-разбавленный в 10 раз).
На ФИГ.9 показано процентное содержание подвижных нематод через 48 часов после обработки стерилизованным путем фильтрации бульоном, содержащим С.substugae (1x-неразбавленный, 0,1х-разбавленный в 10 раз).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Несмотря на то, что композиции и способы, описанные выше, допускают применение модификаций и альтернативных форм, типовые варианты реализации будут описаны более подробно. Следует понимать, тем не менее, что изобретение не ограничено конкретными описанными формами, напротив, изобретение охватывает все модификации, эквиваленты и альтернативы, которые включены в рамки объема и сущности изобретения, определенного прилагаемой формулой изобретения.
Понимают, что если приведен диапазон значений, то каждое промежуточное значение с точностью до одной десятой значения нижнего предела, если в контексте явно не указано иное, в диапазоне между верхним и нижним пределом и любое другое указанное или промежуточное значение, входящее в указанный диапазон, включены в диапазон. Более узкие диапазоны, входящие в данный диапазон, также включены. Верхний и нижний пределы указанных более узких диапазонов также включены в указанный диапазон за исключением любых конкретных значений, исключенных из указанного диапазона.
Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют традиционное значение, общепринятое специалистами в области техники, к которой относится изобретение. Несмотря на то, что любые способы и вещества, аналогичные или эквивалентные описанным в настоящей заявке, также можно применять для реализации или исследования настоящего изобретения, предпочтительные способы и вещества описаны в настоящей заявке.
Необходимо отметить, что используемые в настоящем описании и прилагаемой формуле изобретения формы единственного числа включают ссылки на множество объектов, если в контексте явно не указано иное.
Согласно определению в настоящем описании «полученный из» означает непосредственно выделенный или полученный из конкретного источника или, в качестве альтернативы, обладающий отличительными характеристиками вещества или организма, выделенного или полученного из конкретного источника. В случае если «источник» представляет собой организм, «полученный из» означает, что объект может быть выделен или получен из организма, как такового, или из среды, применяемой для выращивания указанного организма.
Согласно определению в настоящем описании «цельная бульонная культура» относится к жидкой культуре, содержащей клетки и среду. Если бактерии выращивают в планшете, то клетки можно собирать из воды или другой жидкости, т.е. из цельной культуры.
Термин «супернатант» относится к остаточной жидкости после того, как клетки, выращиваемые в бульоне или в другой жидкости на агаровой пластине, удаляют путем центрифугирования, фильтрования, седиментации или при помощи других средств, хорошо известных в данной области техники.
Согласно определению в настоящем описании «фильтрат» относится к жидкости, полученной из цельной бульонной культуры после пропускания культуры через мембрану.
Согласно определению в настоящем описании «экстракт» относится к жидкому веществу, удаленному из клеток с применением растворителя (воды, моющего средства, буфера) и отделенному от клеток путем центрифугирования, фильтрования или при помощи другого способа.
Согласно определению в настоящем описании «метаболит» относится к соединению, веществу или побочному продукту ферментации микроорганизма или к супернатанту, фильтрату или экстракту, полученному из микроорганизма, которые обладают пестицидной, в частности, инсектицидной активностью. Согласно определению в настоящем описании «выделенное соединение» по существу не содержит других соединений или веществ, например, имеет по меньшей мере примерно 20% чистоту, предпочтительно по меньшей мере примерно 40% чистоту, более предпочтительно примерно 60% чистоту, еще более предпочтительно примерно 80% чистоту, более предпочтительно примерно 95% чистоту, наиболее предпочтительно примерно 95% чистоту, определенную при помощи аналитических способов, включая, но не ограничиваясь ими, способы хроматографии, электрофореза.
Согласно определению в настоящем описании «носитель» представляет собой инертное органическое или неорганическое вещество, с которым активный ингредиент смешивают или объединяют с получением состава для упрощения его введения в растение или другой объект, подвергающийся обработке, или его хранения, перевозки и/или применения.
Термин «модулировать» используют для обозначения изменения уровня заражения вредителем или скорости распространения заражения вредителем.
Согласно определению в настоящем описании термин «заражение вредителем» означает присутствие вредителя в количестве, которое приводит к возникновению вредного эффекта, включая заболевание или инфекцию хозяина или появление нежелательных сорняков в растительной системе.
Согласно определению в настоящем описании «пестицид» представляет собой вещество, полученное из биологического продукта, или химическое вещество, которые повышает смертность или подавляет рост вредителей растений, и включает, но не ограничивается ими, нематоциды, инсектициды, фунгициды растений, бактерициды растений и вирициды растений.
Согласно определению в настоящем описании термин «алкил» относится к одновалентной линейной или разветвленной углеводородной группе, содержащей от одного до 12 атомов углерода, включая метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-гексил и т.д.
Согласно определению в настоящем описании «замещенный алкил» относится к алкильным группам, дополнительно содержащим один или более заместителей, выбранных из гидрокси, алкокси, меркапто, циклоалкила, замещенного циклоалкила, гетероцикла, замещенного гетероцикла, арила, замещенного арила, гетероарила, замещенного гетероарила, арилокси, замещенного арилокси, галогена, циано, нитро, амино, амидо, -C(O)Н, ацила, оксиацила, карбоксила, сульфонила, сульфонамида, сульфурила и т.д.
Согласно определению в настоящем описании «алкенил» относится к линейным или разветвленным углеводородным группам, содержащим одну или более углерод-углеродных двойных связей и примерно от 2 до 12 атомов углерода, а «замещенный алкенил» относится к алкенильным группам, дополнительно содержащим один или более заместителей, приведенных выше.
Согласно определению в настоящем описании «алкинил» относится к линейным или разветвленным углеводородным группам, содержащим по меньшей мере одну углерод-углеродную тройную связь и примерно от 2 до 12 атомов углерода, а «замещенный алкинил» относится к алкинильным группам, дополнительно содержащим один или более заместителей, приведенных выше.
Согласно определению в настоящем описании «арил» относится к ароматическим группам, содержащим от 6 до 14 атомов углерода, а «замещенный арил» относится к арильным группам, дополнительно содержащим один или более заместителей, приведенных выше.
Согласно определению в настоящем описании «гетероарил» относится к ароматическим кольцам, содержащим один или более гетероатомов (например, N, О, S и т.д.) в качестве части структуры кольца и от 3 до 14 атомов углерода, а «замещенный гетероарил» относится к гетероарильным группам, дополнительно содержащим один или более заместителей, приведенных выше.
Согласно определению в настоящем описании «алкокси» относится к фрагменту -O-алкил, где алкил такой, как определено выше, а «замещенный алкокси» относится к алкоксигруппам, дополнительно содержащим один или более заместителей, приведенных выше.
Согласно определению в настоящем описании «тиоалкил» относится к фрагменту -S-алкил, где алкил такой, как определено выше, а «замещенный тиоалкил» относится к тиоалкильным группам, дополнительно содержащим один или более заместителей, приведенных выше.
Согласно определению в настоящем описании «циклоалкил» относится к содержащим кольцо алкильным группам, содержащим от 3 до 8 атомов углерода, а «замещенный циклоалкил» относится к циклоалкильным группам, дополнительно содержащим один или более заместителей, приведенных выше.
Согласно определению в настоящем описании «гетероцикл» относится к циклическим (т.е. содержащим кольцо) группам, содержащим один или более гетероатомов (например, N, О, S и т.д.) в качестве части структуры кольца и от 3 до 14 атомов углерода, а «замещенный гетероцикл» относится к гетероциклическим группам, дополнительно содержащим один или более заместителей, приведенных выше.
СПОСОБЫ ПОЛУЧЕНИЯ
Как отмечалось выше, соединения или метаболиты получают или можно получать или получены из организма, имеющего отличительные характеристики различных видов Chromobacterium, более конкретно из организма, имеющего отличительные характеристики штамма Chromobacterium substsugae, более конкретно штамма Chromobacterium substugae sp. nov., который может иметь отличительные характеристики NRRL В-30665, или в качестве альтернативы из любого другого микроорганизма. Способы включают выращивание указанных организмов и получение соединений и/или композиций согласно настоящему изобретению путем выделения указанных соединений из культуры указанных организмов.
В частности, организмы выращивают в питательной среде при помощи способов, известных в данной области техники. Организмы можно выращивать путем культивации во встряхиваемой колбе, микро- или крупномасштабной ферментации (включая, но не ограничиваясь ими, непрерывную, периодическую, периодическую ферментацию с добавлением субстрата или твердофазную ферментацию) в лаборатории или в промышленных ферментерах в подходящей среде в условиях, обеспечивающих рост клеток. Выращивание можно проводить в подходящей питательной среде, содержащей источники углерода и азота и неорганические соли, при помощи способов, известных в данной области техники. Подходящие среды могут быть доступны из коммерческих источников или их можно получать в соответствии с опубликованными составами.
После выращивания супернатант, фильтрат и/или экстракт Chromobacterium sp. или их производных можно применять для получения пестицидной композиции.
В качестве альтернативы после выращивания соединения и/или метаболиты можно выделять из культурального бульона.
Экстракт можно фракционировать путем хроматографии. После хроматографии можно исследовать токсическую активность полученных фракций в отношении, например, совки ни (Trichoplusia ni) или малой наземной совки (Spodoptera exigua), при помощи способов, известных в данной области техники. Этот процесс можно повторять один или более раз при помощи одинаковых или различных хроматографических способов.
Композиции
Композиции могут содержать цельные бульонные культуры, жидкие культуры или суспензии штамма Chromobacterim sp., например, штамма, обладающего отличительными характеристиками Chromobacterium substugae sp. nov., более конкретно, имеющего отличительные характеристики NRRL В-30665 (см. патент США №7244607), а также супернатанты, фильтраты или экстракты, полученные из штамма Chromobacterim sp., например, штамма, обладающего отличительными характеристиками Chromobacterium substugae sp. nov., более конкретно, имеющего отличительные характеристики NRRL В-30665 (см. патент США №7244607), или супернатант, фильтрат и/или экстракт одного или более метаболитов или выделенных соединений, полученных из штамма Chromobacterim sp., или комбинации вышеуказанных веществ, которые, в частности, обладают нематоцидной активностью.
Композиции, приведенные выше, можно вводить в составы при помощи любых способов. Неограничивающие примеры составов включают, но не ограничиваются ими, эмульгируемые концентраты (ЕС), смачиваемые порошки (WP), растворимые жидкости (SL), аэрозоли, концентрированные растворы со сверхнизким объемом (ULV), растворимые порошки (SP), микроинкапсулированные составы, диспергируемые в воде гранулы, текучие составы (FL), микроэмульсии (ME), наноэмульсии (NE) и т.д. В любом составе, описанном в настоящей заявке, процентное содержание активного ингредиента находится в диапазоне от 0,01% до 99,99%.
Композиции могут иметь форму жидкости, геля или твердого вещества.
Твердую композицию можно получать путем суспендирования твердого носителя в растворе, содержащем активный(е) ингредиент(ы), и сушки суспензии в мягких условиях, такой как выпаривание при комнатной температуре или выпаривание в вакууме при 65°C или менее.
Композиция может содержать инкапсулированный(е) в гель активный(е) ингредиент(ы). Указанные вещества, инкапсулированные в гель, можно получать путем смешения гелеобразующего агента (например, желатина, целлюлозы или лигнина) и культуры или суспензии живых или инактивированных Chromobacterium или бесклеточного фильтрата или фракции клеток культуры или суспензии Chromobacterium или высушенной распылением или замораживанием культуры, клеткок или фракции клеток или раствора пестицидных соединений, применяемых в способе согласно настоящему изобретению; и инициирования гелеобразования агента.
Композиция может дополнительно содержать поверхностно активное вещество, которое применяют для эмульгации, диспергирования, увлажнения, распределения, введения, контроля распадания, стабилизации активных ингредиентов и улучшения текучести или подавления ржавления. В конкретном варианте реализации поверхностно активное вещество представляет собой нефитотоксичное неионное поверхностно активное вещество, которое предпочтительно включено в перечень 4B EPA. В другом конкретном варианте реализации неионное поверхностно активное вещество представляет собой полиоксиэтилена (20) монолаурат. Концентрация поверхностно активных веществ может находиться в диапазоне 0,1-35% от общего количества состава, предпочтительно в диапазоне 5-25%. Выбор диспергирующих агентов и эмульгаторов, таких как неионные, анионные, амфотерные и катионные диспергирующие агенты и эмульгаторы, и применяемого количества определяется природой композиции и способностью агента улучшать диспергирование композиций согласно настоящему изобретению.
Композиции, приведенные выше, можно объединять с другим микроорганизмом и/или пестицидом (например, с нематоцидом, фунгицидом, инсектицидом). Микроорганизм может включать, но не ограничивается ими, агент, полученный из Bacillus sp., Pseudomonas sp., Brevabacillus sp., Lecanicillium sp., видов, отличных от Ampelomyces, Pseudozyma sp., Streptomyces sp, Burkholderia sp, Trichoderma sp, Gliocladium sp. В качестве альтернативы агент может представлять собой натуральное масло или масляный продукт, обладающий фунгицидной и/или инсектицидной активностью (например, парафиновое масло, масло чайного дерева, лемонграссовое масло, гвоздичное масло, коричное масло, цитрусовое масло, розмариновое масло, пиретрам). Кроме того, пестицид может представлять собой противогрибковый агент с одним активным центром, который может включать, но не ограничивается ими, бензимидазол, ингибитор деметилирования (ИДМ) (например, имидазол, пиперазин, пиримидин, триазол), морфолин, гидроксипиримидин, анилинопиримидин, фосфоротиоат, ингибитор внешнего хинон-связывающего центра, хинолин, дикарбоксимид, карбоксимид, фениламид, анилинопиримидин, фенилпиррол, ароматический углеводород, коричную кислоту, гидроксианилид, антибиотик, полиоксин, ациламин, фталимид, бензолоид (ксилилаланин), ингибитор деметилирования, выбранный из группы, состоящей из имидазола, пиперазина, пиримидина и триазола (например, битертанол, миклобутанил, пенконазол, пропиконазол, триадимефон, бромуконазол, ципроконазол, диниконазол, фенбуконазол, гексаконазол, тебуконазол, тетраконазол), миклобутанил, диамид антраниловой кислоты (например, хлорантранилипрол) и ингибитор внешнего хинон-связывающего центра (например, стробилурин). Стробилурин может включать, но не ограничивается ими, азоксистробин, крезоксимметоил или трифлоксистробин. В другом конкретном варианте реализации противогрибковые агент представляет собой хинон, например, хиноксифен (4-фторфениловый простой эфир 5,7-дихлор-4-хинолила). Противогрибковый агент также может быть получен из экстракта Reynoutria.
Фунгицид также может представлять собой неорганический химический фунгицид с несколькими активными центрами, выбранный из группы, состоящей из хлорнитрила, хиноксалина, сульфамида, фосфоната, фосфита, дитиокарбамата, хлоралкилтиолов, фенилпиридинамина, оксима цианоацетамида.
Композиция, как отмечалось выше, может дополнительно содержать инсектицид. Инсектицид может включать, но не ограничивается ими, авермектин, Bt (например, Bacillus thuringiensis var. kurstaki), масло нима, спиносады, Burkhoderdia sp., приведенные в WO 2011/106491, энтомопатогенные грибки, такие как Beauveria bassiana, и химические инсектициды, включая, но не ограничиваясь ими, хлорорганические соединения, фосфорорганические соединения, карбаматы, пиретроиды, пиретрины и неоникотиноиды.
Как отмечалось выше, композиция может дополнительно содержать нематоцид. Указанный нематоцид может включать, но не ограничивается ими, авермектин, продукты микробного происхождения, такие как Biome (Bacillus firmus), Pasteuria spp., и органические продукты, такие как сапонины.
Композиции можно применять при помощи способов, известных в данной области техники. В частности, указанные композиции можно вводить в растения или в части растений. Следует понимать, что под растениями в контексте настоящего изобретения понимают все растения и популяции растений, такие как желаемые и нежелательные дикорастущие растения или культурные растения (включая неодомашненные культурные растения). Культурные растения могут представлять собой растения, которые можно получать при помощи традиционных способов разведения и оптимизации селекции растений или при помощи биотехнологических способов и способов генной инженерии или при помощи комбинации указанных способов, включая трансгенные растения и культивары растений, находящихся или не находящихся под защитой в рамках права растениеводов-селекционеров. Под частями растения понимают все части и органы растений, расположенные над и под землей, такие как побег, лист, цветок и корень, среди примеров которых можно отметить листья, иголки, цветоножки, цветки, плодовые тела, плоды, семена, корни, клубни и корневища. Части растений также включают собранный урожай, а также части, полученные в результате вегетативного или генеративного размножения, например, срезанные побеги, клубни, корневища, боковые побеги и семена.
Обработку растений и частей растений композициями, приведенными выше, можно проводить напрямую или за счет действия композиций на окружение, среду обитания или место хранения путем, например, обрызгивания, распыления, выпаривания, опрыскивания, разбрызгивания, нанесения кистью или инъекции. В случае если композицию вводят в семя, то композицию можно применять в качестве одной или более оболочек перед выращиванием растения при помощи способов нанесения одной или более оболочек, известных в данной области техники.
Применения
Композиции, культуры, супернатанты, метаболиты и пестицидные соединения, приведенные выше, можно применять в качестве пестицидов. В частности, соединения, культуры, супернатанты, метаболиты и пестицидные соединения, приведенные выше, можно применять в качестве инсектицидов и нематоцидов, отдельно или в комбинации с одним или более пестицидными веществами, приведенными выше.
В частности, нематоды, с которыми можно бороться при помощи способа, приведенного выше, включают, но не ограничиваются ими, паразитические нематоды, такие как галловые, цистообразующие и корневые нематоды, включая, но не ограничиваясь ими, Meloidogyne sp. Tylenchorhynchus sp, Hoplolaimus sp., Helicotylenchus sp., Pratylenchus sp., Heterodera sp., Globodera, sp., Trichodorus sp. Paratrichodorus sp., Xiphinema sp. и Criconema sp.; в частности Meloidogyne incognita (галловые нематоды), а также Globodera rostochiensis и globodera pailida (картофельные цистообразующие нематоды); Heterodera glycines (цистообразующие нематоды сои); Heterodera schachtii (свекловичные нематоды); и Heterodera avenae (злаковые цистообразующие нематоды).
Фитопатогенные насекомые, с которыми можно бороться при помощи способа, приведенного выше, включают, но не ограничиваются ими, личинки насекомых, отличных от семейства Culicidae, принадлежащих к отрядам (a) Lepidoptera (чешуекрылые), например, Acleris spp., Adoxophyes spp., Aegeria spp., Agrotis spp., Alabama argillaceae, Amylois spp., Anticarsia gemmatalis, Archips spp., Argyrotaenia spp., Autographa spp., Busseola fusca, Cadra cautella, Carposina nipponensis, Chilo spp., Choristoneura spp., Clysia ambiguella, Cnaphalocrocis spp., Cnephasia spp., Cochylis spp., Coleophora spp., Crocidolomia binotalis, Cryptophlebia leucotreta, Cydia spp., Diatraea spp., Diparopsis castanea, Earias spp., Ephestia spp., Eucosma spp., Eupoecilia ambiguella, Euproctis spp., Euxoa spp., Grapholita spp., Hedya nubiferana, Heliothis spp., Hellula undalis, Hyphantria cunea, Keiferia lycopersicella, Leucoptera scitella, Lithocollethis spp., Lobesia botrana, Lymantria spp., Lyonetia spp., Malacosoma spp., Mamestra brassicae, Manduca sexta, Operophtera spp., Ostrinia nubilalis, Pammene spp., Pandemis spp., Panolis flammea, Pectinophora gossypiella, Phthorimaea operculella, Pieris rapae, Pieris spp., Plutella xylostella, Prays spp., Scirpophaga spp., Sesamia spp., Sparganothis spp., Spodoptera spp., Synanthedon spp., Thaumetopoea spp., Tortrix spp., Trichoplusia ni и Yponomeuta spp.; (b) Coleoptera (жесткокрылые), например, Agriotes spp., Anthonomus spp., Atomaria linearis, Chaetocnema tibialis, Cosmopolites spp., Curculio spp., Dermestes spp., Diabrotica spp., Epilachna spp., Eremnus spp., Leptinotarsa decemlineata, Lissorhoptrus spp., Melolontha spp., Orycaephilus spp., Otiorhynchus spp., Phlyctinus spp., Popillia spp., Psylliodes spp., Rhizopertha spp-, Scarabeidae, Sitophilus spp., Sitotroga spp., Tenebrio spp., Tribolium spp.и Trogoderma spp.; (c) Orthoptera (прямокрылые), например, Blatta spp., Blattella spp., Gryllotalpa spp., Leucophaea maderae, Locusta spp., Periplaneta spp. и Schistocerca spp.; (d) Isoptera (термиты), например, Reticulitermes spp.; (e) Psocoptera (сеноеды), например, Liposcelis spp.; (f) Anoplura (вши), например, Haematopinus spp., Linognathus spp., Pediculus spp., Pemphigus spp. и Phylloxera spp.; (g) Mallophaga (пухоеды), например, Damalinea spp. и Trichodectes spp.; (h) Thysanoptera (трипсы), например, Frankliniella spp., Hercinotnrips spp., Taeniothrips spp., Thrips palmi, Thrips tabaci и Scirtothrips aurantii; (i) Heteroptera (полужесткокрылые), например, Cimex spp., Distantiella theobroma, Dysdercus spp., Euchistus spp., Eurygaster spp., Leptocorisa spp., Nezara spp., Piesma spp., Rhodnius spp., Sahlbergella singularis, Scotinophara spp.и Tniatoma spp.; (j) Homoptera (равнокрылые), например, Aleurothrixus floccosus, Aleyrodes brassicae, Aonidiella spp., Aphididae, Aphis spp., Aspidiotus spp., Bemisia tabaci, Ceroplaster spp., Chrysomphalus aonidium, Chrysomphalus dictyospermi, Coccus hesperidum, Empoasca spp., Eriosoma larigerum, Erythroneura spp., Gascardia spp., Laodelphax spp., Lecanium corni, Lepidosaphes spp., Macrosiphus spp., Myzus spp., Nephotettix spp., Nilaparvata spp., Paratoria spp., Pemphigus spp., Planococcus spp., Pseudaulacaspis spp., Pseudococcus spp., Psylla spp., Pulvinaria aethiopica, Quadraspidiotus spp., Rhopalosiphum spp., Saissetia spp., Scaphoideus spp., Schizaphis spp., Sitobion spp., Trialeurodes vaporariorum, Trioza erytreae и Unaspis citri; (k) Hymenoptera (перепончатокрылые), например, Acromyrmex, Atta spp., Cephus spp., Diprion spp., Diprionidae, Gilpinia polytoma, Hoplocampa spp., Lasius spp., Monomorium pharaonis, Neodiprion spp., Solenopsis spp.и Vespa spp.; (l) Diptera (двукрылые), например, Aedes spp., Antherigona soccata, Bibio hortulanus, Calliphora erythrocephala, Ceratitis spp., Chrysomyia spp., Culex spp., Cuterebra spp., Dacus spp., Drosophila melanogaster, Fannia spp., Gastrophilus spp., Glossina spp., Hypoderma spp., Hyppobosca spp., Liriomyza spp., Lucilia spp., Melanagromyza spp., Musca spp., Oestrus spp., Orseolia spp., Oscinella frit, Pegomyia hyoscyami, Phorbia spp., Rhagoletis pomonella, Sciara spp., Stomoxys spp., Tabanus spp., Tannia spp.и Tipula spp.; (m) Siphonaptera (блохи), например, Ceratophyllus spp.и Xenopsylla cheopis и (n) отряда Thysanura (щетинохвостки), например, Lepisma saccharina. Активные ингредиенты согласно настоящему изобретению можно дополнительно применять для регулирования численности крестоцветных блошек (Phyllotreta spp.), капустных мух (Delia spp.), семенных рапсовых скрытнохоботников (Ceutorhynchus spp.) и тлей масличных культур, таких как канола (рапс), семена горчицы и их гибриды, а также риса и кукурузы. В конкретном варианте реализации насекомое может представлять собой члена рода Spodoptera, более конкретно, Spodoptera exigua, Myzus persicae, Plutella xylostella или Euschistus sp.
Предложено применение эффективного для регулирования численности пестицидного количества супернатанта, фильтрата или экстракта, содержащего обладающий пестицидной активностью метаболит или выделенное соединение, произведенное Chromobacterium sp. или применение комбинаций вышеуказанных веществ. Штамм или супернатант или фильтрат или экстракт, метаболит и/или соединение применяют отдельно или в комбинации с другим пестицидным веществом в эффективном для регулирования численности вредителей или пестицидно эффективном количестве. Эффективное количество определяют количество клеток микроорганизмов, супернатанта, фильтрата или экстракта, метаболита и/или соединения, применяемых отдельно или в комбинации с другим пестицидным веществом, которое является достаточным для модулирования заражения вредителями. На эффективное количество могут влиять виды присутствующих вредителей, стадия развития вредителя, плотность популяции вредителя и факторы окружающей среды, такие как температура, скорость ветра, наличие дождя, время суток и сезонные факторы. Количество, которое попадает в эффективный диапазон в конкретном случае, можно определять при помощи лабораторных или полевых исследований.
ПРИМЕРЫ
Композиция и способы, приведенные выше, дополнительно проиллюстрированы в следующих неограничивающих примерах. Примеры только иллюстрируют различные варианты реализации и не ограничивают заявленное изобретение веществами, условиями, массовыми соотношениями, параметрами процессов и прочими перечисленными факторами.
Пример 1: ЭКСТРАКЦИЯ СОЕДИНЕНИЙ ИЗ CHROMOBACTERIUM SUBSTUGAE
Следующий способ применяли для очистки соединений, экстрагированных из культуры Chromobacterium substugae:
Культуральный бульон, полученный в результате ферментации С.substugae в 10 л бульона, экстрагировали на смоле Amberlite XAD-7 (Asolkar et al., 2006) путем встряхивания клеточной суспензии со смолой с частотой 225 раз/мин, в течение двух часов при комнатной температуре. Смолу и клеточную массу собирали путем фильтрования через марлю и промывали ДИ (деионизованной) водой для удаления солей. Смолу, клеточную массу и марлю затем вымачивали в течение 2 часов в смеси ацетон/метанол (50/50), после чего смесь ацетон/метанол фильтровали и сушили в вакууме на роторном испарителе с получением неочищенного экстракта. Неочищенный экстракт затем фракционировали путем эксклюзионной хроматографии на Sephadex LH20 (CH2Cl2/CH3OH; 50/50) с получением 7 фракций (ФИГ.1). Указанные фракции затем концентрировали насухо на роторном испарителе и проводили скрининг полученных сухих остатков по биологической активности путем исследования их введения с кормом совке ни (Trichoplusia ni) или наземной малой совке (Spodoptera exigua). Активные фракции затем подвергали обращенно-фазовой ВЭЖХ (Spectra System P4000, Thermo Scientific) с получением чистых соединений, после чего проводили скрининг при помощи вышеуказанных биоисследований для определения/идентификации активных соединений. Для подтверждения структуры соединения получали дополнительные спектроскопические данные, такие как спектры ЖХ/МС и ЯМР.
Хромамид A (1) и соединение В выделяли из фракций 1 и 2, соответственно, в то же время виолацеин (2) и дезоксивиолацеин (3) выделяли из фракции 5, все из которых получали путем хроматографии на Sephadex LH20. Структуры указанных соединений приведены на ФИГ.7.
Очистка соединений
Очистку хромамида A (1) проводили на колонке C-18 для ВЭЖХ (Phenomenex, Luna 10 мкм, C18(2) 100 А, 250×10) с применением градиентной системы растворителей вода:ацетонитрил (0-10 мин, 80-75% водный CH3CN; 10-45 мин, 75-60% водный CH3CN; 45-55 мин, 60-50% водный CH3CN; 55-65 мин, 50-100% водный CH3CN; 65-70 мин, 100% водный CH3CN; 55-70 мин, 0-80% водный CH3CN), при расходе 2,5 мл/мин, и УФ детектировании при 210 нм. Активное соединение, хромамид А (1), имело время удерживания 23,19 мин.
Очистку соединения В согласно настоящему изобретению проводили на колонке С-18 для ВЭЖХ (Phenomenex, Luna 10 мкм, C18(2) 100 A, 250×10) с применением градиентной системы растворителей вода:ацетонитрил (0-10 мин, 80-75% водный CH3CN; 10-45 мин, 75-60% водный CH3CN; 45-55 мин, 60-50% водный CH3CN; 55-65 мин, 50-100% водный CH3CN; 65-70 мин, 100% CH3CN; 55-70 мин, 0-80% водный CH3CN), при расходе 2,5 мл/мин, и УФ детектировании при 210 нм, активное соединение B имело время удерживания 26,39 мин (см. ФИГ.6).
Очистку виолацеина (2) и дезоксивиолацеина (3) проводили на колонке С-18 для ВЭЖХ (Phenomenex, Luna 10 мкм, C18(2) 100 А, 250×10) с применением градиентной системы растворителей вода:ацетонитрил (0-10 мин, 70-60% водный CH3CN; 10-40 мин, 60-20% водный CH3CN; 40-60 мин, 20-0% водный CH3CN; 60-65 мин, 100% CH3CN; 65-75 мин, 0-70% водный CH3CN), при расходе 2,5 мл/мин, УФ детектирование при 210 нм, активное соединение виолацеин (2) имело время удерживания 7,86 мин, деоксивиолацеин (3) имел время удерживания 12,45 мин.
Масс-спектроскопический анализ соединений
Масс-спектроскопический анализ активных пиков проводили с применением инструмента ионизации электронным распылением (ИЭР) Thermo Finnigan LCQ Deca XP Plus в режимах положительной и отрицательной ионизации на масс-спектрометре LCQ DECA XPplus (Thermo Electron Corp., San Jose, CA) в режиме полного сканирования (m/z 100-1500 Да). Применяли инструмент для высокоэффективной жидкостной хроматографии (ВЭЖХ) производства Thermo, оборудованный детектором Finnigan Surveyor PDA plus, авто дозатором, насосом для МС и колонкой Luna C18 4,6 мм × 100 мм, 5 мкм 100 A (Phenomenex). Система растворителей состояла из воды (растворитель A) и ацетонитрила (растворитель B). Мобильная фаза на старте содержала 10% растворителя B, затем содержание растворителя В линейно повышали до 100% в течение 20 минут, выдерживали в течение 4 минут и, наконец, снижали содержание растворителя В до 10% в течение 3 минут и выдерживали в течение 3 минут. Расход составлял 0,5 мл/мин. Объем вводимой пробы составлял 10 мкл, образцы выдерживали при комнатной температуре в автодозаторе. Соединения анализировали путем ЖХМС с применением ЖХ и обращенно-фазовой хроматографии. Масс-спектроскопический анализ соединений согласно настоящему изобретению проводили в следующих условиях: расход газообразного азота составлял 30 и 15 arb (относительных единиц) для расхода поддувочного и вспомогательного газа, соответственно. Ионизацию электронным распылением проводили с применением напряжения распыления 5000 В и напряжения капилляра 35,0 В. Температура капилляра составляла 400°C. Данные анализировали при помощи программного обеспечения Xcalibur. Хромамид А (1) имел молекулярную массу 860 в режиме положительной ионизации (см. ФИГ.2). Согласно хроматограмме другого активного соединения В его молекулярная масса составляет 874 в режиме положительной ионизации. Виолацеин (2) и дезоксивиолацеин (3) имели молекулярные массы 313 и 327, соответственно, в режиме положительной ионизации.
ЯМР-спектроскопический анализ соединений
ЯМР-ЯМР спектры получали на спектрометре с градиентным полем Bruker 600 МГц. Для установки точки отсчета в качестве внутреннего стандарта применяли триметилсилан (ТМС, 0,00 ppm). Анализ аминокислот проводили на анализаторе аминокислот Hitachi 8800.
Для выявления структуры очищенный хромамид A с молекулярной массой 860 дополнительно анализировали на оборудовании ЯМР, 600 МГц, хромамид A имел пики 1H ЯМР со значениями δ 8,89, 8,44, 8,24, 8,23, 7,96, 7,63, 6,66, 5,42, 5,36, 5,31, 5,10, 4,13, 4,07, 4,05, 3,96, 3,95, 3,88, 3,77, 3,73, 3,51, 3,44, 3,17, 2,40, 2,27, 2,11, 2,08, 2,03, 2,01, 1,97, 1,95, 1,90, 1,81, 1,68, 1,63, 1,57, 1,53, 1,48, 1,43, 1,35, 1,24, 1,07, 1,02, 0,96, 0,89, 0,88, 0,87, 0,80 (см. ФИГ.4) и пики 13C ЯМР при 173,62, 172,92, 172,25, 172,17, 171,66, 171,28, 170,45, 132,13, 130,04, 129,98, 129,69, 129,69, 125,48, 98,05, 70,11, 69,75, 68,30, 68,25, 64,34, 60,94, 54,54, 52,82, 49,72, 48,57, 45,68, 40,38, 39,90, 38,18, 36,60, 31,98, 31,62, 31,58, 29,53, 28,83, 27,78, 24,41, 23,06, 22,09, 20,56, 19,31, 18,78, 17,66, 15,80 (см. ФИГ.5). Хромамид A выделяли в виде белого твердого вещества, которое имело молекулярную формулу C43H68N6O12 (степень ненасыщенности 13) согласно анализу ИЭР масс-спектрометрии высокого разрешения (наблюдаемое M+ m/z 861,5376, расчет M+ m/z 861,5343) (ФИГ.3). 1H ЯМР спектр хромамида A в ДМСО-d6 содержал сигналы 68 протонов, среди которых девять протонов [δH: 8,89, 8,44, 8,23, 8,22, 7,96, 7,64, 6,65, 5,10, 4,13] соответствовали NH или OH, так как плохо коррелировали с сигналами углерода в анализе гетероядерной корреляции ЯМР (HMQC). В спектре 13C ЯМР присутствовали сигналы семи карбонилов [δC: 173,62, 172,92, 172,25, 1,72,17, 171,66, 171,28, 170,45], а на спектре 1H ЯМР наблюдали шесть характеристических сигналов α-аминопротонов [δH: 4,07, 4,06, 3,96, 3,95, 3,88, 3,72], что свидетельствует о том, что хромамид А представляет собой пептид.
Интерпретация 2D ЯМР данных позволила определить три аминокислотных звена из шести, один лейцин (Leu), один валин (Val) и один глютамин (Gin). Наличие этих аминокислот подтверждалось результатами анализа аминокислот, который так же показал присутствие трех вышеуказанных аминокислот. При помощи дополнительного анализа DEPT и 2D ЯМР спектров (COSY, HSQC и HMBC) устанавливали наличие трех подструктур I, II и III, показанных ниже.
Места соединений трех подструктур в соединении 1 определяли путем традиционного НМВС ЯМР анализа с использованием корреляции резонансов α-аминопротона и/или протонов вторичного амида и атома углерода карбонила и исследования химических сдвигов. Связь С-9 подструктуры I и C-10 подструктуры II устанавливали с использованием корреляций HMBC CH3-40 [δH: 1,00] и α-аминопротона аланина [δH: 3,42] с атомом углерода С-10 [δC: 70,11]. Связь дополнительно подтверждали по корреляции HMBC через три связи гидроксила [δH: 5,10] и C-9 [δC: 49,78]. Метилен [δH: 3,50] подструктуры III имел корреляцию HMBC через три связи с C-19 [δC: 68,31], который соединяет подструктуры I и II. Четвертичный атом углерода C-3 [δC: 98,09] соединен с C-21 [δC: 64,40] с учетом слабой корреляции с H-21 [δH: 3,95], а также значений их химических сдвигов, с образованием одной системы колец. Наконец, наличие связи, замыкающей кольцо, подтверждали по корреляции НМВС через три связи H3-36 [δH: 1,43] и C-1 [δC: 172,17], что позволяло предположить плоскую структуру хромамида A (1).
Соединение B с молекулярной массой 874 имело аналогичные данные ЯМР и УФ-спектроскопии, что позволило сделать предположение о том, что указанное соединение B также принадлежит к классу пептидов.
Структуры виолацеина (2) и дезоксивиолацеина (3) определяли путем сравнения данных, полученных для указанных соединений, с опубликованными в литературе. Структуры хромамида A, виолацеина и дезоксивиолацеина показаны на ФИГ.7.
Пример 2: Аминокислотный анализ хромамида A
Хромамид A (0,05 мг) подвергали гидролизу в жидкой фазе (6н. HCl, 1% фенол, 110°C, 24 ч, вакуум). После охлаждения реакционную смесь сушили и продукт гидролиза растворяли в буфере NorLeu до достижения объема 1,0 мл. 50 мкл образца помещали в ионообменную колонку для анализа.
В качестве стандартов для калибровки стандартные растворы аминокислот в буферах на основе Na (Sigma, A-9906) для исследования гидролизатов белков на анализаторе Hitachi 8800 применяли для определения коэффициента отклика и, таким образом, калибровали анализатор Hitachi 8800 по всем аминокислотам. Каждая проба содержала норлейцин в качестве внутреннего стандарта для возможности корректировки результатов с учетом изменения объема образца и переменных хроматографии. В системе использовали буферы Na Pickering, HCl особой чистоты (Pierce Sequanal grade) (для гидролиза), ионообменную колонку Transgenomic и оптимизированный способ, разработанный Molecular Structure Facility (MSF), UC Davis, в результатах содержалась информация о присутствии конкретных аминокислот в образце. Определили, что в состав образца (хромамида A) входили Glx (глютамин/глютаминовая кислота). Leu (лейцин) и Val (валин).
Пример 3: Подтверяодение токсичности в отношении совки ни (Trichoplusia ni)
Токсичность исследуемого соединения, входящего в состав фракции 1 (F1), подтверждали в исследовании in vitro с применением личинок совки ни в первой личиночной стадии в качестве объектов исследования.
Двести микролитров коммерчески доступного корма совки ни помещали в каждую лунку 96-луночного микропланшета. После отверждения корма 100 мкл раствора, содержащего 50 мкл экстракта (содержащего компоненты, соответствующие четырем основным пикам, полученным для фракции 1; H1-H4), 350 мкл EtOH и 600 мкл стерильной ДИ воды, вводили при помощи пипетки в каждую лунку, после чего планшет сушили с применением ручного фена. Количество экстракта в каждой лунке составляло 10 микрограммов. Каждую обработку проводили в восьми повторностях, смесь чистого этанола и воды применяли в качестве отрицательного контроля.
По одному исследуемому насекомому (личинка совки ни в первой личиночной стадии) помещали в каждую лунку, и планшет накрывали клейкой пленкой. Пленку прокалывали для доступа воздуха и запечатанный планшет инкубировали при 26°C в течение четырех дней.
Результаты, представленные в Таблице 1, показывают хорошую активность (смертность >60%) соединения, соответствующего пику HI. Этот пик соответствует хромамиду А (1) (ФИГ.1).
Пример 4 - Определение LC50 виолацеина в отношении совки ни (Trichoplusia ni)
Систему для исследования, включающую 96-луночный планшет, описанную в предыдущем примере, применяли для определения концентрации чистого виолацеина, требуемой для уничтожения 50% личинок совки ни в первой личиночной стадии. Значения смертности, полученные после 4-дневной инкубации при 26°C, представлены ниже в Таблице 2. С учетом указанных данных виолацеин представляет собой высокоактивный инсектицид с оценочным значением LC50, составляющим 7×10-6 микрограммов на лунку в in vitro исследовании введения с кормом личинкам совки ни.
ПРИМЕР 5 - Нематоцидная активность бульона Chromobacterim substugae (MBI-203) в отношении галловых нематод на второй личиночной стадии
Для определения действия стерилизованных путем фильтрации С.substugae на подвижность (и последующее восстановление) галловых нематод на второй личиночной стадии (J2) {Meloidogyne incognita VW6) проводили следующее исследование в 24-луночных пластиковых планшетах для клеточных культур: 300 мкл аликвоту каждого исследуемого раствора (1x или 0,1x стерилизованный фильтрацией бульон) добавляли в соответствующие лунки, после чего пятнадцать нематод, помещенных в 10 мкл ДИ воды, добавляли в каждую лунку, планшет запечатывали и инкубировали при 25°C в течение 24 часов. Воду и Avid (авермектин), разбавленный до 20000x, применяли в качестве отрицательного и положительного контроля, соответственно. Действие каждого соединения на подвижность нематод проверяли через 24 часа путем ощупывания каждой нематоды при помощи иглы и долю неподвижных нематод для каждой обработки записывали в журнал с использованием % шкалы. Для определения восстановления подвижности после каждой обработки 200 мкл раствора удаляли из каждой лунки и оставшийся раствор разбавляли 2 мл ДИ воды. Планшеты снова инкубировали в течение 24 часов согласно приведенному выше описанию, после чего проводили вторую оценку подвижности (суммарно через 48 часов).
Результаты, представленные на ФИГ.8 и 9, показывают, что неразбавленный стерилизованный фильтрацией бульон может подавлять подвижность свободноживущих галловых нематод во второй личиночной стадии. Продолжительность этого действия составляет по меньшей мере 48 часов, что позволяет сделать предположение о том, что бульон С.substugae обладает нематоцидной активностью.
Пример 6: Действие бульона Chromobacterium substigae (MBI-203) на галлообразование на корнях огурцов
Исследовали собственную активность MBI-203 в отношении галловых нематод Meloidogyne sp. в двух исследованиях пропиточных растворов (mini drench).
Материалы и способы
В частности, MBI-203 исследовали в теплице в 45 мл горшках. Семена огурцов сорта Тошка (Toshka) высеивали непосредственно в горшки, заполненные супесчаным грунтом. Через десять дней в каждый горшок вводили 5 мл суспензии. Затем в горшки инокулировали 3000 яиц М.incognita. Каждую обработку при каждой концентрации суспензии проводили в четырех повторностях. Опытные образцы собирали через четырнадцать дней после введения исследуемых соединений и инокулята. Галлообразование на корнях определяли согласно индексу галлообразования Зека (Zeck, 1971). Конкретные условия приведены ниже в Таблице 3.
Фитотоксичность измеряли по снижению роста проросших семян огурцов по сравнению с контролем.
Результаты
Исследование пропиточного раствора №1
Эффективность обработки была очень высокой и снижение практически на 100% наблюдали при применении MBI-203 в концентрации 50 мл/л. Наблюдали незначительную фитотоксичность MBI-203. Данные фостиазата были традиционными (100% эффективность при 20 ppm).
Исследование пропиточного раствора №2
MBI-203 было фитотоксичным в высоких концентрациях, составляющих 50 и 25 мл/л, для этих концентраций измерения не проводили.
В концентрации 12,5 мл/л эффективность борьбы с нематодами составляла более 95%, но она снижалась до 33% для концентрации 3 мл/л. При концентрации 1,5 мл/л MBI-203 было неактивным.
Данные фостиазата были традиционными (100% эффективность при 20 ppm).
Пример 8: Синергические исследования бульона Chromobacterium substugae (MBI-203)
Синергические исследования проводили путем обработки искусственной питательной среды в 96-луночных планшетах и скармливания обработанной среды новорожденным личинкам. 100 мкл исследуемых растворов вводили при помощи пипетки в несколько лунок каждого планшета. MBI-203 (цельноклеточный бульон, концентрированный до достижения 7,6% сухой массы клеток) отдельно, коммерчески доступный инсектицид отдельно и комбинацию 2 веществ исследовали с использованием предварительно определенных LC50 концентраций или долей указанных концентраций. Питательную среду сушили феном для удаления избытка влаги. Новорожденных малых наземных совок, Spodoptera exigua, или совок ни, Trichoplusia ni, переносили в каждую лунку многолуночного планшета. Зараженные планшеты запечатывали клейкой пленкой и небольшие отверстия проделывали в пленке над каждой лункой для доступа воздуха. Планшеты хранили в инкубаторе при 26°C с режимом 16 часов свет/8 часов тьма в течение 3 дней. На третий и четвертый день после заражения подсчитывали смертность.
Синергическое, антагонистическое или аддитивное действие определяли при помощи способов, предложенных Колби (Colby, 1967). Вследствие различий в биоисследованиях были предложены следующие определения: соотношения в диапазоне от 0 до 0,9 соответствовали антагонистическому действию, соотношения в диапазоне 0,9-1,1 соответствовали аддитивному действию, и соотношения более 1,1 соответствовали синергическому действию.
Исследовали синергию MBI-203 и инсектицидов в отношении совок ни. Хлорантранилипрол (реализуемый под торговой маркой Coragen®, Dupont), Bacillus thuringiensis var. kurstaki (Dipel®, Valent Biosciences), спиносад (реализуемый под торговой маркой Entrust®, Dow Agro Sciences), спиротетрамет (реализуемый под торговой маркой Movento®, Bayer Crop Science) и пиретрум/пиретрины (реализуемые под торговой маркой Pyganic®, Arbico Organics) исследовали совместно с MBI-203. Как отмечалось выше, если не указано иное, применяли LC50 концентрации MBI-203 и инсектицидов. Результаты показаны в Таблице 4. Все вещества за исключением Bt var. kurstaki и 1 вещества в LC50 концентрации оказывали синергическое действие.
Исследовали синергию MBI-203 и инсектицидов в отношении малой наземной совки (BAW, Beet Army Worm). Хлорантранилипрол (реализуемый под торговой маркой Coragen®, Dupont), Bacillus thuringiensis var. kurstaki (Dipel®, Valent Biosciences), спиносад (реализуемый под торговой маркой Entrust®, Dow Agro Sciences), спиротетрамет (реализуемый под торговой маркой Movento®, Bayer Crop Science) и пиретрум/пиретрины (реализуемые под торговой маркой Pyganic®, Arbico Organics) исследовали совместно с MBI-203. Как отмечалось выше, если не указано иное, применяли LC50 концентрации MBI-203 и инсектицидов. Результаты показаны в Таблице 5. MBI-203 и хлорантранилипрол оказывали аддитивное действие, в то же время Bacillus thuringiensis var. kurstaki и спиносад оказывали синергическое действие в отношении BAW при введении совместно с MBI-203. Комбинации пиретрума и MBI-203 обладали антагонистичным действием. Большинство комбинаций спиротетрамета и MBI-203 обладали антагонистичным действием в отношении малой наземной совки.
Несмотря на то, что настоящее изобретение описано при помощи ссылок на конкретные варианты реализации, их подробное описание не следует рассматривать, как ограничивающее, очевидно, что можно применять различные эквиваленты, изменения и модификации, не выходя за рамки объема настоящего изобретения.
В настоящем описании приведены различные ссылки, каждая из которых включена в настоящую заявку по всей полноте посредством ссылки.
Ссылки
Asolkar, R.N., Jensen, P.R., Kauffman, C.A., Fenical, W. 2006. Daryamides A-C, Weakly Cytotoxic Polyketides from a Marine-Derived Actinomycete of the Genus Streptomyces strain CNQ-085 J. Nat. Prod. 69: 1756-1759.
Arena, J.P., К.К. Liu, et al. (1995). "The mechanism of action of avermectins in Caenorhabditis elegans - correlation between activation of glutamate-sensitive chloride current, membrane binding and biological activity." Journal of Parasitology 81: 286-294.
Balibar, C.J. and C.T. Welsh (2006). "In Vitro Biosynthesis of Violacein from L-Tryptophan by the Enzymes Vio A-E from Chromobacterium violaceum." Biochemistry 45: 15444-15457.
Chalvet-Monfray, K., P. Sabatier, et al. (1996). "Synergy between deltamethrin and prochloraz in bees: Modeling approach." Environmental Toxicology and Chemistry 15(4): 525-534.
Chitwood, D.J. (2003). Nematicides. Encyclopedia of Agrochemicals, vol 3. J.R. Plimmer. New York, John Wiley & Sons. 3: 1104-1115.
Colby, S.R. (1967). "Calculating Synergistic and Antagonistic Responses of Herbicide Combinations." Weeds 15(1): 20-22.
Durán, N., G.Z. Justo, et al. (2007). "Minireview. Violacein: properties and biological activities." Biotechnol. Appl. Biochem. 48: 127-133.
Durán, N. and C.F.M. Menck (2001). "Chromobacterium violaceum: a review of pharmacological and industrial perspectives." Crit. Rev. Microbiol. 27: 201-222.
Farenhorst, M., B.G.J. Knols, et al. (2010). "Synergy in Efficacy of Fungal Entomopathogens and Permethrin against West African Insecticide-Resistant Anopheles gambiae Mosquitoes." PLoS ONE 5(8): el 2081.
Hoshino, Т., Т. Takano, et al. (1987). "Biosynthesis of violacein: origins of the hydrogen, nitrogen and oxygen atoms in the 2-pyrrolidone nucleus." Agric. Biol. Chem. 51: 2733-2741.
Hummelbrunner, L.A. and M.B. Isman (2001). "Acute, Sublethal, Antifeedant, and Synergistic Effects of Monoterpenoid Essential Oil Compounds on the Tobacco Cutworm, Spodoptera litura (Lep., Noctuidae)." Journal of Agricultural and Food Chemistry 49(2): 715-720.
Hungria, M., S. Astolfi-Filho, et al. (2005). "Genetic characterization of Chromobacterium isolates from black water environments in the Brazilian Amazon." Lett. Appl. Microbiol. 41: 17-23.
Krieg, A., A.M. Huger, et al. (1983). "Bacillus thuringiensis var. tenebrionis: Ein neuer, gegenuber Larven von Coleopteren wirksamer Pathotyp." Z. Angew. Entomol. 96: 500-508.
Kämpfer, P., H. - J. Busse, et al. (2009). "Chromobacterium piscinae sp. nov. and Chromobacterium pseudoviolaceum sp. nov., from environmental samples." Int. J. Syst. Evol. Microbiol. 59: 2486-2490.
Martin, P.A.W., D. Gundersen-Rindal, et al. (2007a). "Chromobacterium substugae sp. nov., a betaproteobacterium toxic to Colorado potato beetle and other insect pests." Int. J. Syst. Evol. Microbiol. 57: 993-999.
Martin, P.A., A.D.S. Shropshire, et al., (2007b). "Chromobacterium substugae sp. nov for control of insect pests", патент США №7244607 B2.
Martin, P.A.W., Hirose, E., and Aldrich, J.R. 2007 с. "Toxicity of Chromobacterium substugae to southern green stink bug (Heteroptera:Pentatomidae) and corn rootworm (Coleoptera:Chrysomelidae)". J. Econ. Entomol. 100: 680-684.
Martin, P.A.W. (2004). "A freeze-dried diet to test pathogens of Colorado potato beetle." Biological Control 29(1): 109-114.
McClean, K.H., M.K. Winson, et al. (1997). "Quorum sensing and Chromobacterium violaceum: exploitation of violacein production and inhibition for the detection of N-acyi homoserine lactones" Microbiology 143: 3703-3711.
Meunier, L., P. Carubel, et al. (1999). Insecticidal combinations including an insecticide from the family chloronicotinyl family and an insecticide having pyrazole, pyrrole, or phenylimidazole group. U. States. United States, Rhone-Poulene Agrochimie: 6.
Pederson, M. and H.S. Woldum. Synergistic Combination of Glutamate-and-Gaba-Gated Chloride Against Pesticide and at Least One Vitamin E, Niacin, or Derivatives Thereof, заявка на патент США №2009/0111579, опубликованная 30 апреля 2009 года.
Puritch, G. and G. Salloum. Environmentally Safe Insecticide, патент США №5047424, выданные 10 сентября 1991 года.
Shapiro-Ilan, D.I., T.E. Cottrell, et al. (2011). "Effects of combining microbial and chemical insecticides on mortality of the Pecan Weevil (Coleoptera: Curculionidae). "J Econ Entomol 104(1): 14-20.
Ryan, K.S. and C.L. Drennan (2009). "Divergent pathways in the biosynthesis of bisindole natural products." Chemistry & Biology 16: 351-364.
Shapiro-Ilan, D.I., T.E. Cottrell, et al. (2011). "Effects of combining microbial and chemical insecticides on mortality of the Pecan Weevil (Coleoptera: Curculionidae)." J Econ Entomol 104(1): 14-20.
Thompson, G.D., R. Dutton, et al. (2000). "Spinosad - a case study: an example from a natural products discovery programme." Pest Management Science 56: 696-702.
Whitehead, A.G. (1998). Plant nematode control. Wallingford, UK, CAB International.
Wirth, M.C., J.A. Jiannino, et al. (2004). "Synergy between Toxins of Bacillus thuringiensis subsp. israelensis and Bacillus sphaericus." Journal of Medical Entomology 41: 935-941.
Young, C. - C., A.B. Arun, et al. (2008). "Chromobacterium aquaticum sp. nov., isolated from spring water samples." Int. J. Svst. Evol. Microbiol. 58: 877-880.
Zeck W.M. (1971) Ein Bonitierungsschema zur Feldauswertung von Wurzelgallenbefall. Pflanzenschutznachrichten Bayer 24,1: 144-147.
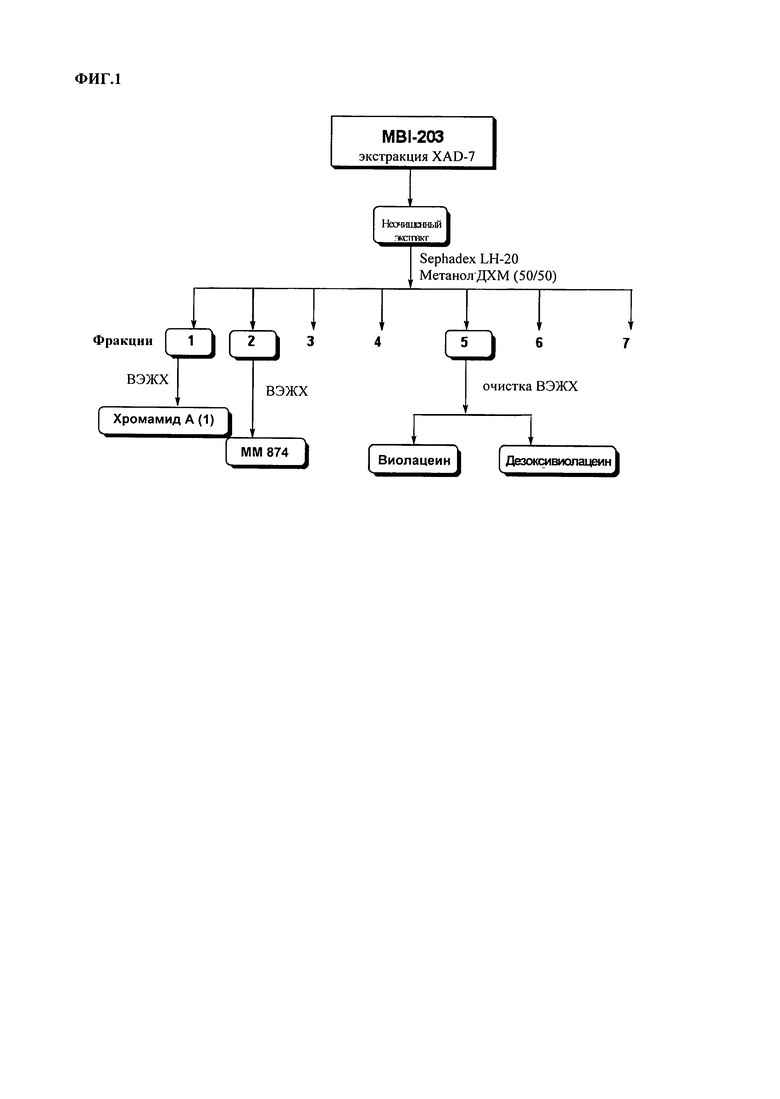
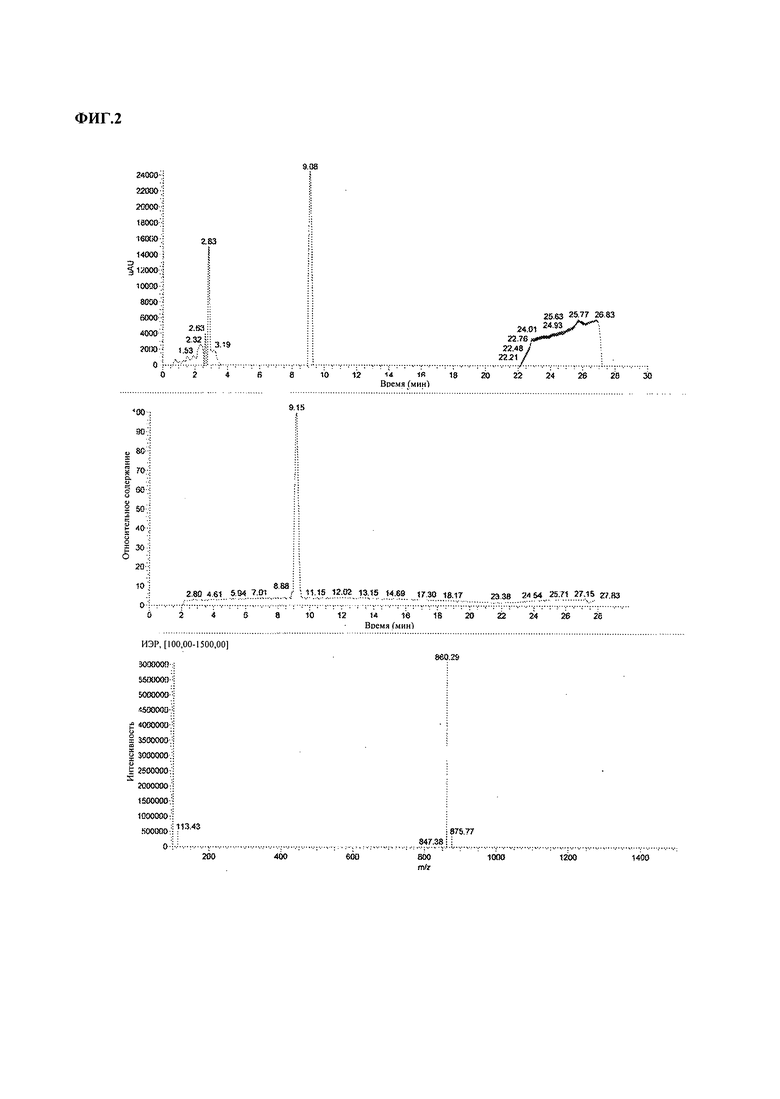
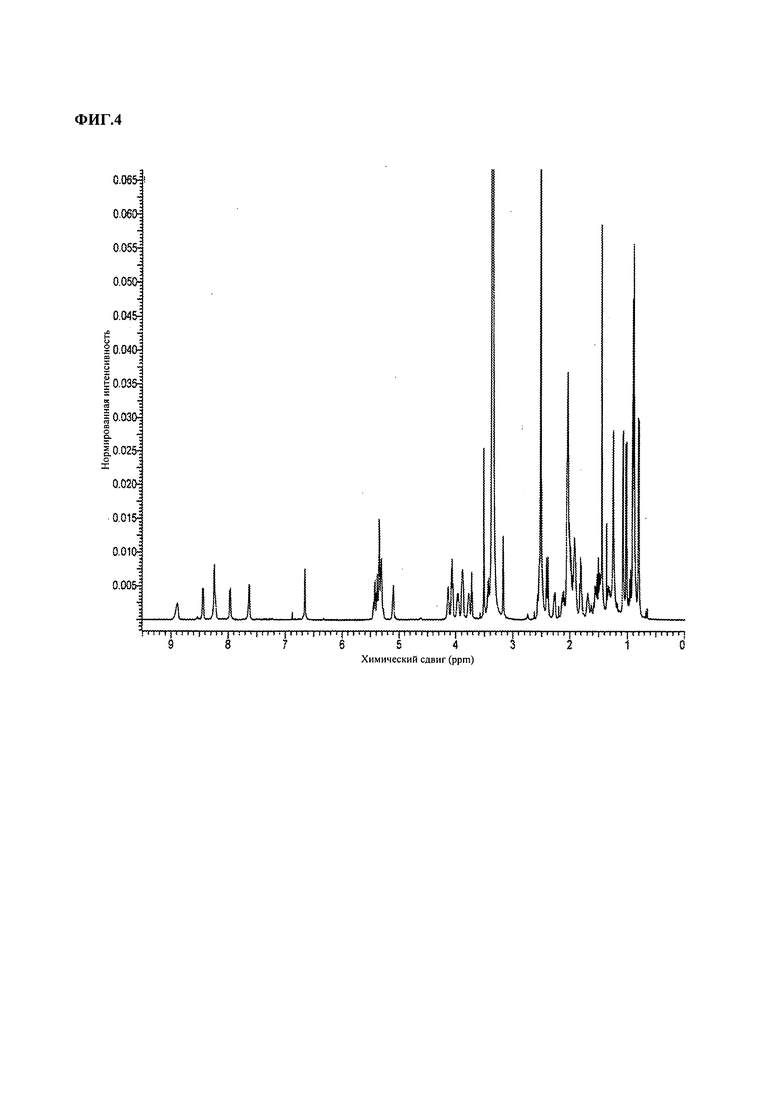
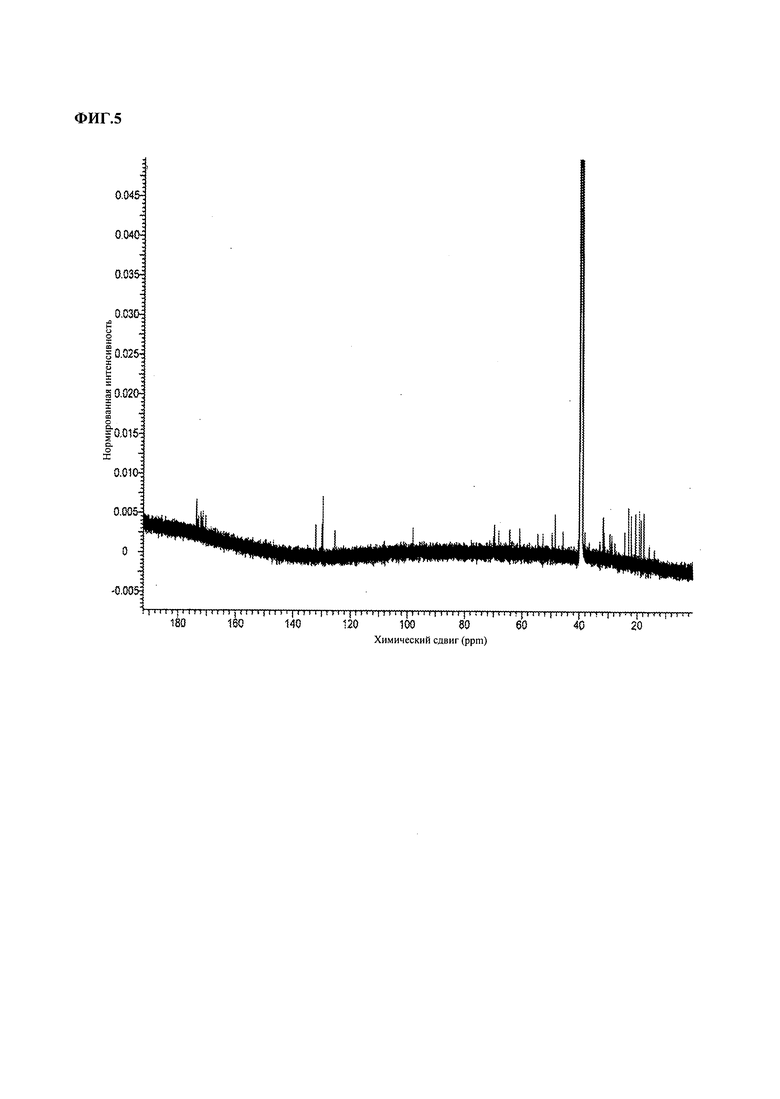
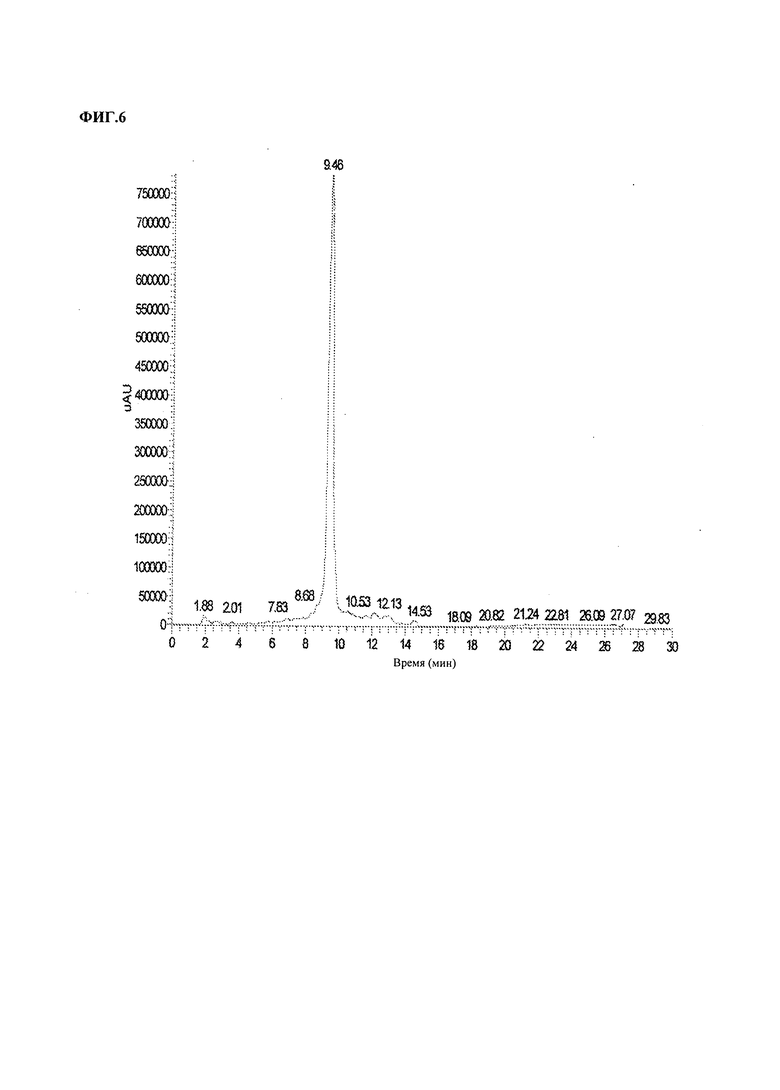

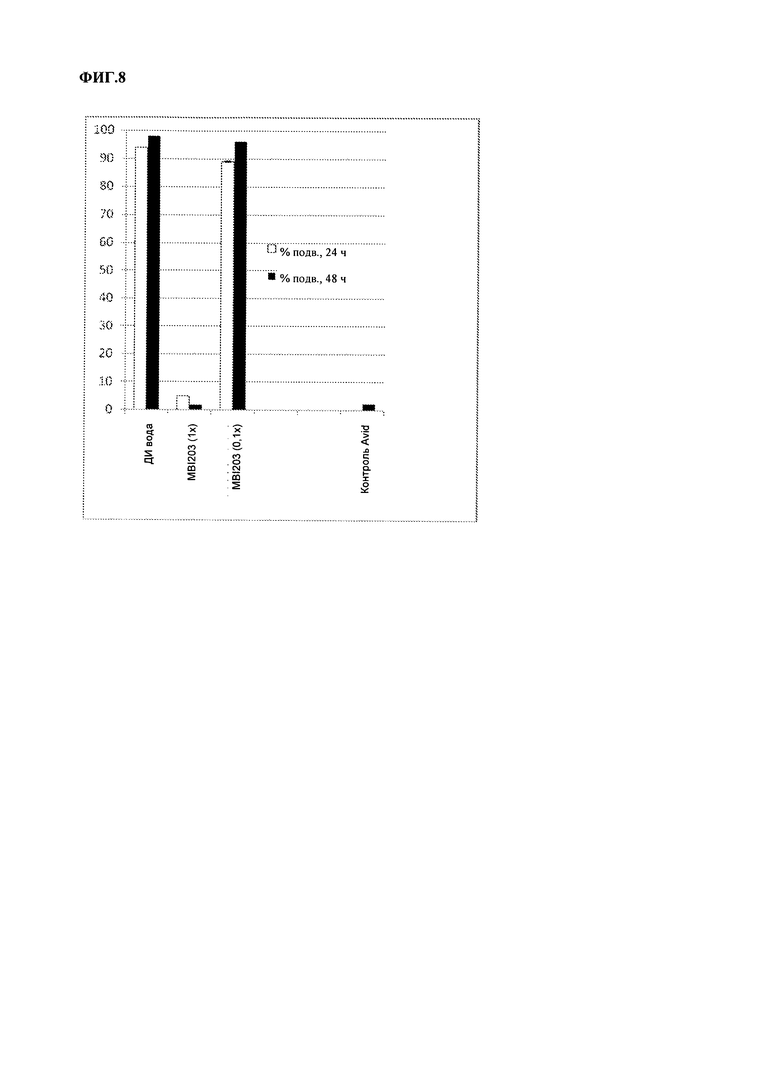
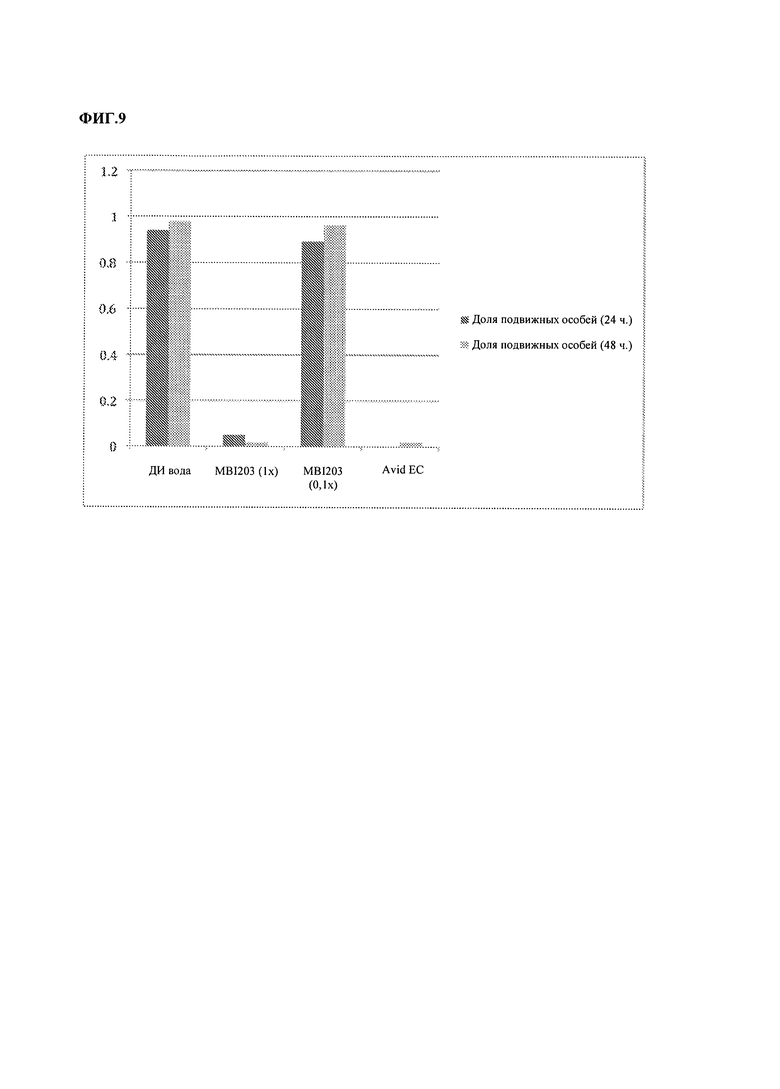
Изобретение относится к биоактивному соединению, полученному из культур вида Chromobacterium, инсектицидной композиции, содержащей указанное соединение, и способам получения соединения. Соединение предназначено для эффективного регулирования численности насекомых вредителей. 4 н. и 16 з.п. ф-лы, 9 ил., 5 табл., 8 пр.
1. Выделенное соединение, имеющее структуру:

Хромамид А (1)
и имеющее инсектицидную активность.
2. Выделенное соединение по п. 1, которое выделено из вида рода Chromobacterium.
3. Выделенное соединение по п. 2, где вид рода Chromobacterium представляет собой Chromobacterium subtsugae.
4. Выделенное соединение по п. 3, где вид Chromobacterium subtsugae представляет собой штамм Chromobacterium subtsugae sp. nov. (NRRL B-30655).
5. Инсектицидная композиция, содержащая эффективное количество выделенного соединения по п. 1.
6. Инсектицидная композиция по п. 5, дополнительно содержащая по меньшей мере один из носителя, разбавителя, поверхностно-активного вещества или адъюванта.
7. Инсектицидная композиция по п. 5, где выделенное соединение выделено из вида рода Chromobacterium.
8. Инсектицидная композиция по п. 7, где вид рода Chromobacterium представляет собой Chromobacterium subtsugae.
9. Инсектицидная композиция по п. 8, где вид Chromobacterium subtsugae представляет собой штамм Chromobacterium subtsugae sp. nov. (NRRL B-30655).
10. Способ получения соединения из вида рода Chromobacterium, включающий:
(A) выращивание штамма вида рода Chromobacterium в цельноклеточном бульоне в условиях, достаточных для получения указанного соединения; и
(B) выделение указанного соединения, полученного на стадии (А), из указанного цельноклеточного бульона; причем соединение имеет структуру:
Хромамид А (1).
11. Способ по п. 10, где вид рода Chromobacterium представляет собой Chromobacterium subtsugae.
12. Способ по п. 11, где вид Chromobacterium subtsugae представляет собой штамм Chromobacterium subtsugae sp. nov. (NRRL B-30655).
13. Способ изменения уровня заражения растения насекомыми-вредителями, включающий нанесение на растение, и/или его семена, и/или субстрат, применяемый для выращивания указанного растения, количества выделенного соединения, имеющего структуру:
Хромамид А (1),
и имеющего инсектицидную активность, эффективного для регулирования численности насекомых-вредителей.
14. Способ по п. 13, где выделенное соединение выделено из вида рода Chromobacterium.
15. Способ по п. 14, где вид рода Chromobacterium представляет собой Chromobacterium subtsugae.
16. Способ по п. 15, где вид Chromobacterium subtsugae представляет собой штамм Chromobacterium subtsugae sp. nov. (NRRL B-30655).
17. Способ по п. 13, где выделенное соединение наносят на субстрат.
18. Способ по п. 17, где субстрат представляет собой грунт.
19. Способ по п. 13, где выделенное соединение наносят на растение.
20. Способ по п. 13, где выделенное соединение наносят на семена.
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ОБРАБОТКИ СЕМЯН | 2008 |
|
RU2517857C2 |
| WO 2005032250 A2, 14.04.2005 | |||
| CRONIN, D | |||
| ET AL.: 'Inhibition of egg hatch of the potato cyst nematode Globodera rostochiensis by chitinase-producing bacteria' EUROPEAN JOURNAL OF PLANT PATHOLOGY vol | |||
| Клапанный регулятор для паровозов | 1919 |
|
SU103A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| MARTIN, P | |||
| A | |||
| M | |||
| ET AL.: 'Chromobacterium subtsugae sp | |||
| nov., a betaproteobacterium | |||
Авторы
Даты
2016-04-10—Публикация
2011-10-24—Подача