Область техники, к которой относится изобретение
Настоящее изобретение относится к ароматическим соединениям бутан-2-ола или к их оптическим изомерам, рацематам, диастереомерам или их фармацевтически приемлемым солям. Настоящее изобретение также относится к способу получения соединения формулы I, фармацевтической композиции, содержащей такие соединения, и к применению таких соединений для борьбы с туберкулезной бациллой.
Уровень техники
Подобно СПИДу, туберкулез представляет собой другое серьезное инфекционное заболевание, угрожающее миру и вызывающее смерть 2-3 миллионов пациентов. В мире имеется примерно 11 миллионов пациентов, инфицированных одновременно ВИЧ и туберкулезной бациллой. Когда у пациентов возникает СПИД, из-за ослабления иммунитета, находящаяся до этого в неактивном состоянии туберкулезная бацилла избыточно пролиферирует, и с ростом количества пациентов, инфицированных ВИЧ, доля инфицирования туберкулезом опять возрастает. Однако по различным причинам в течение последних 40 лет на рынке не появилось новых лекарственных средств. Хотя современные противотуберкулезные агенты могут замедлять распространение туберкулезной бациллы до некоторой степени, они не являются перспективными, когда увеличивается количество штаммов, устойчивых к лекарственным средствам, и появляются штаммы с перекрестной устойчивостью к лекарственным средствам. В дополнение к этому, цикл лечения с помощью современных противотуберкулезных агентов при клиническом использовании обычно занимает более 6 месяцев, так что пациенты могут и не соглашаться с таким продолжительным периодом лечения, и количество штаммов, устойчивых к лекарственным средствам, может постоянно увеличиваться. Следовательно, необходимо разрабатывать противотуберкулезные агенты для быстрого лечения. В этой связи, в данной области имеется необходимость в разработке противотуберкулезных агентов, имеющих новую структуру и действующих на новую целевую точку.
АТФ синтетаза представляет собой новую мишень для противотуберкулезных агентов и имеет многообещающую перспективу использования. Новые ароматические соединения бутан-2-ола представляют собой соединения против туберкулезной бациллы и создаются для этой цели. Раскрытие изобретения
Целью настоящего изобретения является обнаружение и разработка нового ингибитора АТФ синтетазы туберкулезной бациллы, который является пригодным для лечения или предотвращения туберкулеза, туберкулеза, устойчивого к лекарственным средствам, и туберкулеза, устойчивого к множеству лекарственных средств, посредством ингибирования АТФ синтетазы туберкулезной бациллы.
После осуществления широких исследований, авторы обнаружили, что новые ароматические соединения бутан-2-ола формулы I, как предлагается в настоящем изобретении, обладают превосходным воздействием против туберкулезной бациллы. На основании этого открытия, настоящее изобретение было завершено.
Первый аспект настоящего изобретения обеспечивает соединения формулы I,
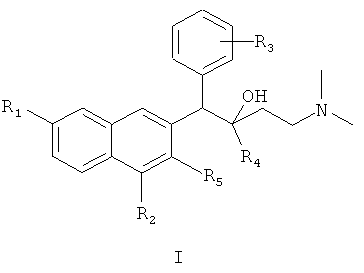
или его оптического изомера, рацемата, диастереомера, фармацевтически приемлемой соли или сольвата, где
R1 представляет собой водород или группу, выбранную из группы, состоящей из: фтора, хлора, брома, йода, гидрокси, алкокси, метокси, нитро, амино и алкила;
R2 представляет собой водород, фтор, хлор, бром, йод, алкил, нитро или амино;
R3 представляет собой атом водорода или представляет собой 1-5 (например, 1-4, 1-3 или 1-2) заместителей, независимо выбранных из группы, состоящей из: фтора, хлора, брома, йода, гидрокси, алкокси, метокси, нитро, амино и алкила;
R4 представляет собой фенильную, нафтильную и гетероциклическую группу, где фенильная, нафтильная и гетероциклическая группы являются необязательно замещенными одним или несколькими (например, 1-5, 1-4, 1-3 или 1-2) заместителями, независимо выбранными из группы, состоящей из: фтора, хлора, брома, йода, гидрокси, алкокси, метокси, нитро, амино и алкила; и
R5 представляет собой гидрокси, тиол, алкокси, алкилтио или галоген.
В одном из вариантов осуществления этого аспекта, настоящее изобретение предлагает соединение формулы I или его оптический изомер, рацемат, диастереомер, фармацевтически приемлемую соль или сольват, где
R1 представляет собой водород, фтор, хлор, бром, йод или метокси;
R2 представляет собой водород, фтор, хлор, бром или йод;
R3 представляет собой водород, фтор, хлор, бром, йод или C1-8 алкил, расположенный в о-, м- или п-положении фенильного кольца;
R4 представляет собой фенил, замещенный фенил или нафтил и
R5 представляет собой гидрокси, тиол, C1-8 алкокси или метилтио.
В другом варианте осуществления этого аспекта, настоящее изобретение предлагает соединение формулы I или его оптический изомер, рацемат, диастереомер, фармацевтически приемлемую соль или сольват, где
R1 представляет собой водород, фтор, хлор, бром или йод;
R3 представляет собой водород, фтор, хлор, бром, йод или C1-6 алкил, расположенный в о-, м- или п-положении фенильного кольца;
R4 представляет собой фенил, фенил, замещенный одним или несколькими атомами галогена, или нафтил и
R5 представляет собой гидрокси или C1-6 алкокси.
В другом варианте осуществления этого аспекта, настоящее изобретение предлагает соединение формулы I или его оптический изомер, рацемат, диастереомер, фармацевтически приемлемую соль или сольват, где
R1 представляет собой водород, хлор или бром;
R2 представляет собой водород, хлор или бром;
R3 представляет собой водород, хлор, бром или C1-4 алкил, расположенный в о-, м- или п-положении фенильного кольца;
R4 представляет собой фенил, 2-бромфенил, 3-бромфенил, 4-бромфенил, 2,4-дифторфенил, 3,5-дифторфенил или нафтил и
R5 представляет собой гидрокси или C1-4 алкокси.
В другом варианте осуществления этого аспекта, настоящее изобретение предлагает соединение формулы I или его оптический изомер, рацемат, диастереомер, фармацевтически приемлемую соль или сольват, где
R1 представляет собой водород или бром;
R2 представляет собой водород или бром;
R3 представляет собой водород, хлор, бром или метил, расположенный в о-, м- или п-положении фенильного кольца; и
R5 представляет собой гидрокси или метокси.
В конкретном варианте осуществления этого аспекта, настоящее изобретение предлагает соединение, выбранное из группы, состоящей из:
(1) 1-фенил-2-(1-нафтил)-1-[2-(3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(2) 1-(4-хлорфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(3) 1-(4-хлорфенил)-2-(1-нафтил)-1-[2-(3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(4) 1-(4-хлорфенил)-2-(4-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(5) 1-фенил-2-(4-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(6) 1-фенил-2-(3-бромфенил)-1-(2-[7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(7) 1-(4-хлорфенйл)-2-(2,4-дифторфенил)-1-[2-(3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(8) 1-(4-хлорфенил)-2-(3-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(9) 1-(4-хлорфенил)-2-фенил-1-(2-[7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(10) 1,2-дифенил-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(11) 1-(4-хлорфенил)-2-(2-бромфенил)-1-[2-(7-бром-3-метокси) нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(12) 1-фенил-2-(2-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(13) 1-фенил-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(14) 1-(4-метилфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(15) 1-фенил-2-(1-нафтил)-1-[2-(4,7-дибром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(16) 1,6-дибром-3-[1-фенил-2-(1-нафтил)-2-гидрокси-4-(N,N-диметиламино)]бутил-2-нафтола,
(17) 1-(3-хлорфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(18) 1-(3-метилфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
(19) 1-(2-метилфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола и
(20) 1-(4-хлорфенил)-2-(1-нафтил)-1-[2-(3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола гидрохлорида,
или их оптических изомеров, рацематов, диастереомеров, фармацевтически приемлемых солей или сольватов.
В другом варианте осуществления этого аспекта, настоящее изобретение относится к оптическим изомерам, рацематам или диастереомерам соединений.
В другом варианте осуществления этого аспекта, настоящее изобретение относится к фармацевтически приемлемым солям соединений, включая, но, не ограничиваясь этим, гидрохлорид, гидробромид, гидройодид и сульфат.
Второй аспект настоящего изобретения предлагает фармацевтическую композицию, содержащую соединение формулы I, как определено выше, или его оптический изомер, рацемат, диастереомер, фармацевтически приемлемую соль или сольват и, необязательно, один или несколько фармацевтически приемлемых носителей или наполнителей.
В одном из вариантов осуществления этого аспекта, настоящее изобретение предлагает фармацевтическую композицию, содержащую соединение формулы I, как определено выше, или его оптический изомер, рацемат, диастереомер, фармацевтически приемлемую соль или сольват; дополнительный агент, пригодный для лечения и/или профилактики заболевания или расстройства, вызываемого инфекцией туберкулезной бациллы; и, необязательно, один или несколько фармацевтически приемлемых носителей или наполнителей.
Третий аспект настоящего изобретения предлагает применение соединения формулы I, как определено выше, или его оптического изомера, рацемата, диастереомера, фармацевтически приемлемой соли или сольвата, или фармацевтической композиции по настоящему изобретению для получения лекарственного средства для лечения и/или профилактики заболевания или расстройства, вызываемого инфекцией туберкулезной бациллы. В одном из вариантов осуществления, заболевание или расстройство, вызываемое инфекцией туберкулезной бациллы, представляет собой туберкулез, такой как туберкулез легких.
Альтернативно, настоящее изобретение предлагает способ лечения и/или профилактики заболевания или расстройства, вызываемого инфекцией туберкулезной бациллы, у субъекта, нуждающегося в этом, способ включает введение субъекту терапевтически и/или профилактически эффективного количества соединения формулы I, как определено выше, или его оптического изомера, рацемата, диастереомера, фармацевтически приемлемой соли или сольвата, или фармацевтической композиции по настоящему изобретению. В одном из вариантов осуществления, заболевание или расстройство, вызываемое инфекцией туберкулезной бациллы, представляет собой туберкулез, такой как туберкулез легких.
Четвертый аспект настоящего изобретения предлагает соединение формулы I, как определено выше, или его оптический изомер, рацемат, диастереомер, фармацевтически приемлемую соль или сольват для лечения и/или профилактики заболевания или расстройства, вызываемого инфекцией туберкулезной бациллы. В одном из вариантов осуществления, заболевание или расстройство, вызываемое инфекцией туберкулезной бациллы, представляет собой туберкулез, такой как туберкулез легких.
Термины и фразы, используемые в настоящем документе, имеют общие значения, хорошо известные специалистам в данной области. Тем не менее, хотелось бы проиллюстрировать и объяснить некоторые из терминов и фраз. Когда рассмотренные термины и фразы имеют значения, несовместимые с широко принятыми значениями, значения, как определено в настоящем документе, имеют преимущества. Определения некоторых терминов, используемых в настоящем изобретении, приводятся ниже, и эти определения применяются в описании настоящей заявки, если только в конкретных ситуациях не указано иного.
В контексте настоящего изобретения, например, как описано в общей формуле соединений или конкретных соединений, одна атомная группа может связываться с несколькими атомами водорода, так что атомная группа может удовлетворять требованиям химической валентности, даже если атомы водорода на соответствующей атомной группе не показаны в структурной формуле.
Когда термин "алкил" рассматривается сам по себе, он может относиться к любому линейному или разветвленному алкилу, имеющему любое количество атомов углерода, и в частности к линейному или разветвленному алкилу, имеющему 1-20 (например, 1-15, 1-10, 1-8, 1-6, 1-5, 1-4, 1-3 или 1-2) атомов углерода. В конкретном варианте осуществления, термин "алкил" как он рассматривается, сам по себе, в настоящем изобретении относится к линейному или разветвленному алкилу, имеющему 1-8 (например, 1-6, 1-5, 1-4, 1-3 или 1-2) атомов углерода. Например, когда рассматривается "C1-6 алкил", он может дополнительно включать подмножество групп, представленных с помощью C1-5 алкила, C1-4 алкила, C2-6 алкила, C2-4 алкила, и тому подобное, и конкретные группы, такие как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, пентил и гексил.
Термин "алкокси" относится к алкил-O-, где алкил имеет значение, как определено выше.
Как используется в настоящем документе, термин "галоид", "галоген", "атом галогена" или "галогенированный", и тому подобное, представляет собой фтор, хлор, бром или йод и, в частности, представляет собой фтор, хлор или бром.
В соединении формулы I по настоящему изобретению, когда заместитель изображается внутри кольца, это означает, что заместитель может быть расположен в любых замещаемых положениях кольца. Например, относительно 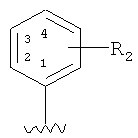 , эта формула представляет один или несколько заместителей R2, которые могут замещать 2-, 3-, 4-, 5- или 6-положения кольца.
, эта формула представляет один или несколько заместителей R2, которые могут замещать 2-, 3-, 4-, 5- или 6-положения кольца.
Как используется в настоящем документе, термин "эффективное количество" относится к дозе, которая может обеспечивать лечение и/или профилактику заболевания или расстройства у субъекта.
Как используется в настоящем документе, термин "субъект" относится к пациенту или другому животному, в частности, к млекопитающему, такому как человек, собака, обезьяна, крупный рогатый скот, лошадь, и тому подобное, которому вводят соединение формулы I по настоящему изобретению или его фармацевтическую композицию для лечения и/или профилактики заболевания или расстройства по настоящему изобретению.
Как используется в настоящем документе, термин "заболевание и/или расстройство" относится к состоянию организма субъекта, и состояние организма относится к заболеванию и/или расстройству.
Как используется в настоящем документе, процент "%" относится к проценту масс/масс, в частности, когда его используют для описания твердого вещества, если только конкретно не рассмотрено иного. Однако когда его используют для описания жидкого вещества, процент "%" может относиться к проценту масс/объем (для ситуаций, в которых твердый продукт растворяют в жидкости) или относиться к проценту объем/объем (для ситуаций, в которых жидкость растворяют в жидкости).
Как используется в настоящем документе, термин "фармацевтически приемлемый", например, в термине "фармацевтически приемлемая соль", означает, что соль представляет собой синтетическое вещество, которое не только является физиологически приемлемым для субъекта, но также имеет ценность для применения в фармацевтике. Например, соль как промежуточное соединение, образовавшееся во время хирального разделения, может быть пригодным для использования при получении конечного продукта по настоящему изобретению, хотя промежуточное соединение не может непосредственно вводиться субъекту.
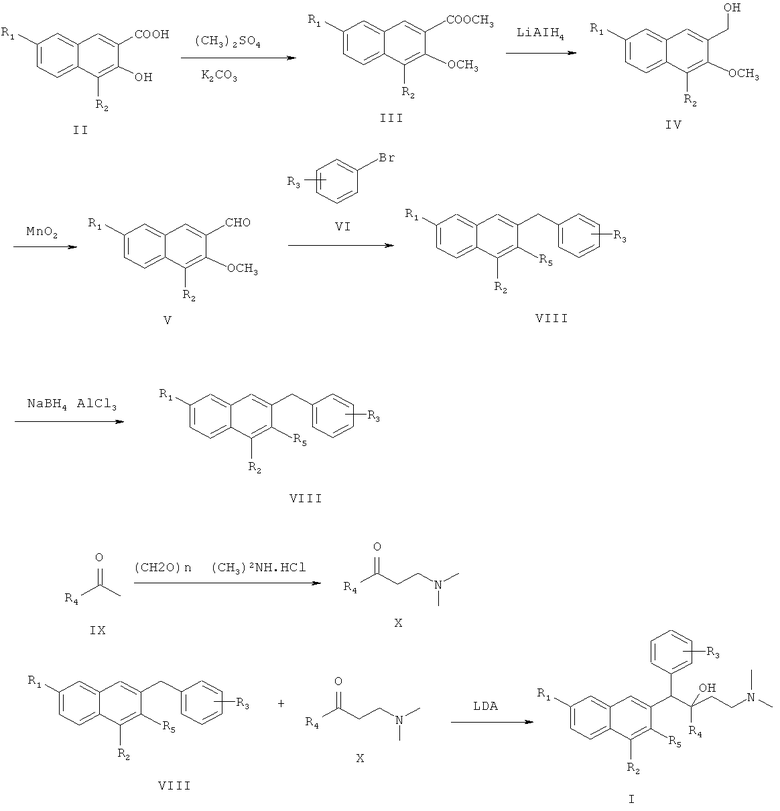
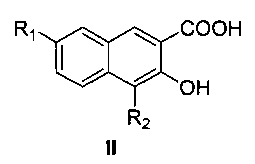
Пятый аспект настоящего изобретения предлагает способ получения соединения формулы I или его оптического изомера или фармацевтически приемлемой соли, включающий метилирование производного 4,7-замещенной-3-гидрокси-2-нафтойной кислоты формулы II
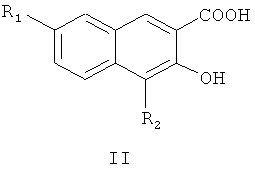
где R1 и R2 являются такими, как определено для соединения формулы I в пункте 1 формулы изобретения, диметилсульфатом с получением соединения формулы III
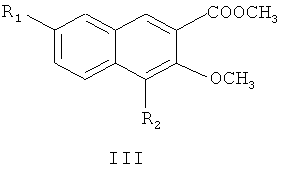
где R1 и R2 являются такими, как определено для соединения формулы I в пункте 1 формулы изобретения,
затем восстановление алюмогидридом лития с получением соединения формулы
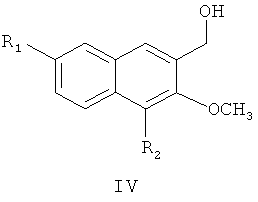
где R1 и R2 являются такими, как определено для соединения формулы I в пункте 1 формулы изобретения,
затем окисление диоксидом марганца с получением соединения формулы V
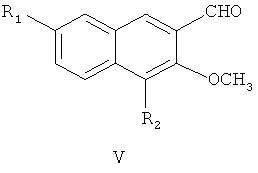
где R1 и R2 являются такими, как определено для соединения формулы I в пункте 1 формулы изобретения,
затем нуклеофильное присоединение замещенного бромбензола формулы VI в присутствии магниевой стружки,
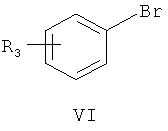
где R3 является таким, как определено для соединения формулы I в пункте 1 формулы изобретения, с получением соединения формулы VII
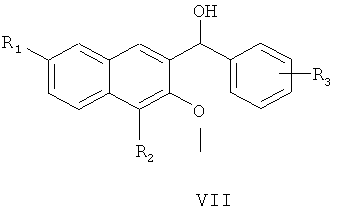
где R1, R2 и R3 являются такими, как определено для соединения формулы I в пункте 1 формулы изобретения,
восстановление соединения формулы VII смесью трихлорида алюминия и боргидрида натрия с получением соединения формулы VIII
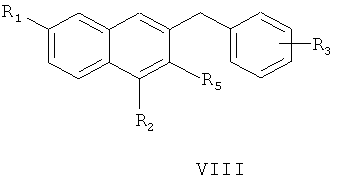
где R1, R2, R3 и R5 являются такими, как определено для соединения формулы I в пункте 1 формулы изобретения,
реакция Манниха с замещенным ацетильным производным формулы IX
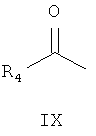
где R4 является таким, как определено для соединения формулы I в пункте 1 формулы изобретения, затем подщелачивание с получением соединения формулы X
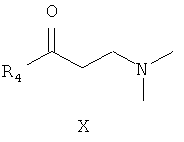
где R4 является таким, как определено для соединения формулы I в пункте 1 формулы изобретения,
нуклеофильное присоединение между соединением формулы VIII и соединением формулы X с получением соединения формулы I
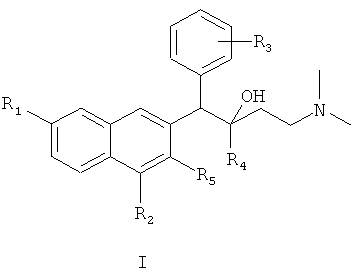
где R1, R2, R3, R4 и R5 являются такими, как определено для соединения формулы I в пункте 1 формулы изобретения; и, если необходимо,
осуществление реакции солеобразования между соединением формулы I и избытком кислоты с получением соединения формулы XI
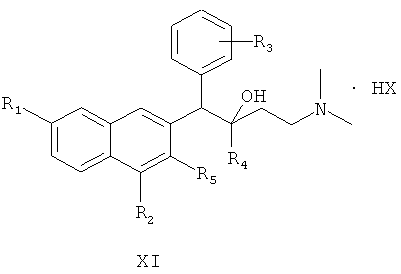
где R1, R2, R3, R4 и R5 являются такими, как определено для соединения формулы I в настоящем изобретении, и НХ представляет собой фармацевтически приемлемую соль.
Иллюстративная схема синтеза соединения по настоящему изобретению показана ниже:
После указанных выше процедур синтеза полученные соединения по настоящему изобретению дополнительно подвергают следующей реакции солеобразования с получением солей соединений по настоящему изобретению:
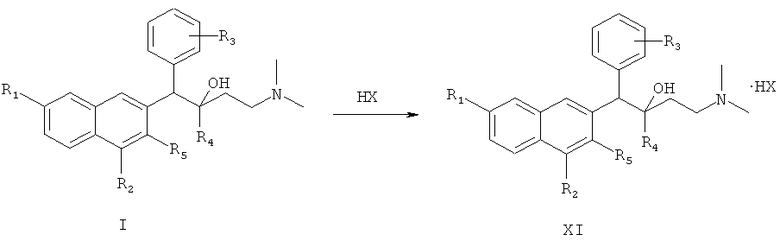
где HX представляет собой хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту и серную кислоту.
Способ получения соединения по настоящему изобретению может включать следующие стадии:
(1) получения метил 4,7-замещенного-3-метокси-2-нафтоата (III)
4,7-замещенную-3-гидрокси-2-нафтойную кислоту (II), диметилсульфат и карбонат калия энергично перемешивают в ацетоне и нагревают с обратным холодильником в течение 10 часов с образованием сложного метилового эфира 4,7-замещенной-3-метокси-2-нафтойной кислоты (III);
(2) получения 4,7-замещенного-3-метокси-2-нафтилкарбинола (IV)
метил 4,7-замещенный-3-метокси-2-нафтоат (III) растворяют в простом этиловом эфире, раствор медленно добавляют по каплям к реакционной смеси алюмотетрагидрида лития, суспендированного в простом этиловом эфире, и после окончания добавления по каплям, смесь подогревают и нагревают с обратным холодильником в течение 48 час с образованием 4,7-замещенного-3-метокси-2-нафтилкарбинола (IV);
(3) получения 4,7-замещенного-3-метокси-2-нафтальдегида (V)
4,7-замещенный-3-метокси-2-нафтилкарбинол (IV) и диоксид марганца перемешивают в ацетоне при комнатной температуре в течение 48 часов с образованием 4,7-замещенного-3-метокси-2-нафтальдегида (V);
(4) получения 1-замещенного фенил-1-[2-(4,7-замещенного-3-метокси)нафтил]метанола (VII)
замещенный бромбензол (VI) растворяют в тетрагидрофуране, раствор медленно добавляют к тетрагидрофурану, содержащему магниевую стружку и маленький кусочек йода, и смесь нагревают с обратным холодильником в течение 3 час с образованием реагента Гриньяра, охлаждают, к реакционной смеси медленно добавляют по каплям 4,7-замещенный-3-метокси-2-нафтальдегид (V), растворенный в тетрагидрофуране, и смесь подогревают и кипятят с обратным холодильником в течение 1,5 часа с образованием 1-замещенного фенил-1-[2-(4,7-замещенного-3-метокси)нафтил]метанола (VII);
(5) получения 1,6-замещенного-2-замещенного-3-замещенного бензилнафталина (VIII)
1-замещенный фенил-1-[2-(4,7-замещенный-3-метокси)нафтил]метанол (VII) и боргидрид натрия растворяют в тетрагидрофуране. К раствору добавляют безводный трихлорид алюминия на ледяной бане, перемешивают при температуре не выше чем 20°C в течение 0,5 часа, подогревают и кипятят с обратным холодильником в течение 20 часов с образованием 1,6-замещенного-2-замещенного-3-замещенного бензилнафталина (VIII);
(6) получения 1-замещенного-3-(N,N-диметиламино)-1-ацетона (X) замещенный ацетил (IX), параформальдегид и диметиламина гидрохлорид нагревают с обратным холодильником в 95% этаноле, содержащем малое количество концентрированной хлористоводородной кислоты, в течение 2 часов. Смесь разбавляют с помощью добавления ацетона и замораживают для осаждения 1-замещенного-3-(N,N-диметиламино)-1-ацетона гидрохлорида (X), который затем подщелачивают с помощью карбоната натрия с получением 1-замещенного-3-(N,N-диметиламино)-1-ацетона (X);
(7) получения целевого соединения 1-замещенного фенил-2-замещенного-1-[2-(4,7-замещенного-3-замещенного)нафтил]-4-(N,N-диметиламино)бутан-2-ола (I)
Диизопропиламин растворяют в тетрагидрофуране при -40°C, к раствору медленно добавляют по каплям н-бутиллитий с образованием лития диизопропиламида, охлаждают до -78°C, и к реакционной смеси добавляют 1,6-замещенный-2-замещенный-3-замещенный бензилнафталин (VIII), растворенный в тетрагидрофуране. Смесь перемешивают в течение 40 минут, затем к ней по каплям добавляют 1-замещенный-3-(N,N-диметиламино)-1-ацетон (X), растворенный в тетрагидрофуране, и они взаимодействуют при -78°С в течение 8 часов с образованием 1-замещенного фенил-2-замещенного-1-[2-(4,7-замещенного-3-замещенного)нафтил]-4-(N,N-диметиламино)бутан-2-ола (I); и
(8) получения целевого соединения (XI)
1-замещенный фенил-2-замещенный-1-[2-(4,7-замещенный-3-замещенный)нафтил]-4-(N,N-диметиламино)бутан-2-ол (I) взаимодействует с избыточным количеством кислоты при комнатной температуре в течение 3 часов с образованием целевого соединения (XI).
Дополнительные детали получения соединений формулы I приводятся в следующих далее Примерах.
Соединения формулы I по настоящему изобретению или их фармацевтически приемлемые соли могут использоваться сами по себе или использоваться вместе с фармацевтически приемлемым носителем или наполнителем в форме фармацевтической композиции, когда их используют в форме фармацевтической композиции, эффективное количество соединения формулы I по настоящему изобретению или его фармацевтически приемлемой соли или гидрата и один или несколько фармацевтически приемлемых носителей или разбавителей объединяют с образованием соответствующей формы для введения или дозированной формы, и эта процедура включает смешивание, гранулирование, прессование или растворение компонентов соответствующим способом. Следовательно, настоящее изобретение предлагает фармацевтическую композицию, которая содержит соединение формулы I, как определено выше, или все его возможные оптические изомеры, рацематы, диастереомеры или фармацевтически приемлемые соли или сольваты, или гидраты и, по меньшей мере, один фармацевтически приемлемый носитель.
Фармацевтическая композиция по настоящему изобретению может вводиться любым из следующих способов: перорального введения, ингаляции спрея, ректального введения, назального введения, вагинального введения, местного введения, парентерального введения, такого как подкожное, внутривенное, внутримышечное, внутрибрюшинное, интратекальное, интравентрикулярное, интрастернальная, интракраниальная инъекция или вливание, или введения с помощью эксплантированного резервуара, предпочтительно, с помощью перорального введения, внутримышечного, внутрибрюшинного или внутривенного введения.
Соединение по настоящему изобретению или фармацевтическая композиция, содержащая его, могут вводиться в виде стандартной дозированной формы. Дозированная форма может представлять собой жидкую дозированную форму, твердую дозированную форму. Жидкая дозированная форма может представлять собой истинные растворы, коллоиды, мелкодисперсные гранулы, эмульсии, суспензии, иные дозированные формы, такие как таблетки, капсулы, жидкие пилюли, аэрозоли, пилюли, порошки, растворы, суспензии, эмульсии, гранулы, суппозитории, лиофилизированные порошки для инъекций, комплексы для инклюзии, импланты, пластыри и растирания и тому подобное.
Фармацевтическая композиция по настоящему изобретению может дополнительно содержать обычные носители, среди которых, фармацевтически приемлемые носители включают, но, не ограничиваясь этим: ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточный белок, такой как альбумин человека, буферное вещество, такое как фосфат, глицерол, сорбиновую кислоту, сорбат калия, смесь частичных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протамин сульфат, динатрий гидрофосфат, калий гидрофосфат, хлорид натрия, соль цинка, коллоидный оксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий карбоксиметилцеллюлозу, полиакрилаты, пчелиный воск, ланолин. Количество носителей в фармацевтической композиции может составлять от 1% масс до 98% масс, обычно оно составляет примерно 80% масс. Для удобства, местный анестетик, консервант, буферный агент могут непосредственно растворяться в носителе.
Таблетки и капсулы для перорального введения могут содержать наполнители, такие как связующий агент, такой как сироп, аравийская камедь, сорбитол, смола трагаканта или поливинилпирролидон, наполнители, такие как лактоза, сахароза, кукурузный крахмал, фосфат кальция, сорбитол, аминокислоты, смазывающие вещества, такие как стеарат магния, тальк, полиэтиленгликоль, оксид кремния, разрыхлители, такие как картофельный крахмал, или приемлемый смачивающий агент, такой как натрий лауринолсульфат. Таблетки могут снабжаться покрытием в соответствии с хорошо известным в фармацевтике способом.
Жидкости для перорального введения могут быть приготовлены в виде суспензий в воде и масле, растворов, эмульсий, сиропов или эликсиров, они могут также быть переработаны в сухие продукты, которые могут быть дополнены водой или другой соответствующей средой перед использованием. Этот вид жидкого препарата может содержать обычные добавки, такие как суспендирующие агенты, сорбитол, метилцеллюлозу, сироп глюкозы, гели, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия, гидрированное съедобное масло и жир, эмульсифицирующие агенты, такие как лецитин, сорбитан моноолеат, аравийская камедь; или неводные носители, такие как миндальное масло, жиры, такие как глицерол, этиленгликоль или этанол; консерванты, такие как метил- или пропил-п-гидроксибензоат, сорбиновая кислота. Если это необходимо, могут быть добавлены ароматизирующие агенты, подкрашивающие агенты.
Суппозитории могут содержать обычную основу для суппозиториев, такую как масло какао или другие глицериды.
Относительно парентерального введения, жидкие дозированные формы обычно получают из соединения и стерилизованного носителя. Носитель предпочтительно представляет собой воду. В соответствии с выбранным носителем и концентрацией лекарственного средства, соединение может либо растворяться в носителе, либо перерабатываться в форму раствора с суспензией, и когда приготавливают раствор для инъекции, соединение сначала растворяют в воде, фильтруют, стерилизуют и упаковывают в герметичные флаконы или ампулы.
Нужно понимать, что оптимизированная доза и интервал введения соединения формулы I зависят от свойств соединения и внешних условий, таких как способ введения, путь и место поступления в организм, и от конкретного млекопитающего, которое должно лечиться, и эта оптимизированная доза может быть определена с использованием обычной технологии. Нужно также понимать, что оптимизированный курс лечения, то есть, ежедневная доза соединения формулы I в указанный период времени, может быть определен с помощью способов, хорошо известных в данной области.
Соединения формулы I по настоящему изобретению могут дополнительно содержать изомеры, рацематы, энантиомеры, диастереомеры, энантиомерно-обогащенные субстанции, сольваты и сложные эфиры; соединение формулы I и его изомеры, рацематы, энантиомеры, диастереомеры, энантиомерно-обогащенные субстанции, сольваты и сложные эфиры могут дополнительно образовывать сольваты, такие как гидраты, алкоголяты. Указанное выше соединение может, кроме того, представлять собой пролекарство или находиться в форме, которая может высвобождать активный компонент после метаболизма in vivo. Для специалистов в данной области существует хорошо известная методика выбора и получения соответствующих производных пролекарств. Как правило, с точки зрения целей настоящего изобретения, сольваты, образовавшиеся с помощью фармацевтически приемлемых растворителей, таких как вода и этанол, эквивалентны несольватированной форме.
Реальные уровни дозирования различных активных компонентов в фармацевтической композиции по настоящему изобретению являются такими, чтобы полученное количество активного соединения могло достигать желаемых терапевтических воздействий для конкретных пациентов, композиций и способов введения. Уровень дозирования должен выбираться в соответствии с активностью конкретного соединения, со способом введения, тяжестью заболевания и состоянием и историей болезни пациента. Однако принятый в данной области способ заключается в том, что дозирование соединения начинают с уровня более низкого, чем уровень, необходимый для достижения желаемых терапевтических воздействий, затем доза постепенно увеличивается, пока не будут достигнуты желаемые воздействия.
Как правило, доза соединения формулы I по настоящему изобретению, используемая для млекопитающего, в частности человека, может составлять 0,001-1000 мг/кг массы тела/день, например, 0,01-100 мг/кг массы тела/день, например, 0,01-10 мг/кг массы тела/день. Например, в соответствии с различными способами введения, композиция может содержать 0,1%, удобнее, 10-60% активных компонентов в массовой пропорции. Когда речь идет о стандартной дозе композиции, каждая стандартная доза предпочтительно содержит 50-500 мг активного компонента. Например, в одном из вариантов осуществления, в соответствии со способом и частотой, соответствующая терапевтическая доза для взрослого составляет 100-3000 мг, например 1500 мг, в день. Эта доза соответствует 1,5-50 мг/кг/день, соответствующая доза составляет 5-20 мг/кг/день.
Авторы продемонстрировали с помощью экспериментов, что соединения формулы I, как предлагается настоящим изобретением, имеют активность, эффективную против туберкулезной бациллы, и таким образом, они могут быть использованы для лечения различных заболеваний или состояний, вызываемых туберкулезной бациллой, например, туберкулеза, такого как туберкулез легких.
Осуществление изобретения
Настоящее изобретение дополнительно описывается с помощью следующих далее примеров, но рамки настоящего изобретения не ограничиваются этими примерами. Специалисты в данной области заметят, что настоящее изобретение может быть подвергнуто различным изменениям и модификациям без отклонения от духа и рамок настоящего изобретения.
Настоящее изобретение предлагает общие и/или конкретные описания используемых материалов и экспериментальных методов в экспериментах. Хотя многие материалы и процедуры, используемые для достижения цели настоящего изобретения, известны в данной области, они описаны настолько подробно, насколько это возможно, в следующих далее примерах.
Температуры плавления соединений измеряют с помощью инструмента для измерения температуры плавления RY-1, и термометры не калибруют. Масс-спектры измеряют с помощью масс-спектрометра высокого разрешения Micromass ZabSpec (разрешение: 1000). 1H ЯМР измеряют с помощью сверхпроводящего ЯМР спектрометра JNM-ECA-400, рабочая частота: 1H ЯМР 400 МГц.
Пример 1: Получение 4,7-дибром-3-гидрокси-2-нафтойной кислоты
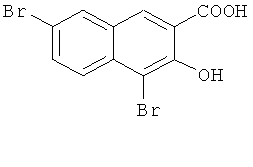
В 1-л трехгорлую колбу добавляют 50 г 3-гидрокси-2-нафтойной кислоты (0,27 моль) и 600 мл ледяной уксусной кислоты, и смесь перемешивают с получением раствора. 34 мл элементарного брома (0,67 моль) разбавляют 100 мл ледяной уксусной кислоты, медленно добавляют по каплям к реакционной смеси, и поддерживают температуру при 20-30°C. После окончания добавления по каплям, температуру повышают до 125°C, и кипятят с обратным холодильником в течение 10 часов. Нагрев прекращают, и смесь перемешивают и медленно охлаждают до комнатной температуры с преципитацией большого количества твердого продукта. Твердый продукт отфильтровывают и лепешку на фильтре промывают водой (200 мл-2) и сушат в печи с получением 82,75 г твердого продукта с выходом 90%.
Пример 2: Получение 7-бром-3-гидрокси-2-нафтойной кислоты
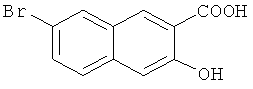
В 1-л трехгорлую колбу добавляют 40 г 4,7-дибром-3-гидрокси-2-нафтойной кислоты (0,116 моль) и 500 мл ледяной уксусной кислоты и перемешивают до получения гомогенной смеси. Затем к смеси добавляют 18 г порошкообразного олова (0,153 моль) и 130 мл концентрированной хлористоводородной кислоты в указанном порядке, подогревают до 125°C и кипятят с обратным холодильником в течение 12 часов. К смеси добавляют 300 мл воды, перемешивают с охлаждением до комнатной температуры, фильтруют и лепешку на фильтре промывают водой (200 мл-2) и сушат в печи с получением 29,9 г твердого продукта с выходом 96,5%.
Пример 3: Получение сложного метилового эфира 7-бром-3-метокси-2-нафтойной кислоты
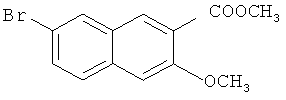
В 250-мл трехгорлую колбу добавляют 4,54 г 7-бром-3-гидрокси-2-нафтойной кислоты (0,017 моль), 11,69 г карбоната калия (0,085 моль) и 70 мл ацетона и перемешивают до получения гомогенной смеси. К смеси добавляют 2,3 мл метилйодида, энергично перемешивают, подогревают до 60°C и кипятят с обратным холодильником в течение 10 часов. После охлаждения до комнатной температуры и выпаривания в вакууме на роторном испарителе для удаления ацетона, к смеси добавляют 100 мл воды, экстрагируют этилацетатом (100 мл-3), и органические слои объединяют. Полученный органический слой промывают водой (30 мл-2) и насыщенным солевым раствором (20 мл-2) и сушат над безводным сульфатом магния в течение 3 часов. Сульфат магния удаляют посредством фильтрования, и фильтрат сушат в вакууме на роторном испарителе с получением сырого продукта, который подвергают воздействию колоночной хроматографии (элюент: этилацетат/простой петролейный эфир=1/10) с получением 4,29 г продукта с выходом 86%.
Пример 4: Получение 7-бром-3-метокси-2-нафтилкарбинола
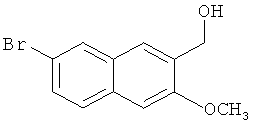
В атмосфере азота, в 1,5-л трехгорлую колбу добавляют 16 г лития алюминия гидрида (0,421 моль) и 200 мл безводного диэтилового эфира, и смесь перемешивают при комнатной температуре в течение 20 мин. 116,2 г сложного 7-бром-3-метокси-2-нафтилметилового эфира (0,395 моль), растворенного в 1 л безводного диэтилового эфира, медленно добавляют к реакционной смеси по каплям, и реакционную смесь поддерживают в состоянии легкого кипения. После завершения добавления, смесь нагревают с обратным холодильником в течение 48 часов для завершения реакции. Смесь охлаждают до комнатной температуры, к ней медленно добавляют по каплям 200 мл воды для завершения реакции, после отделения слоя диэтилового эфира, экстрагируют диэтиловым эфиром (200 мл-2), и органические слои объединяют. Органический слой промывают водой (300 мл-2) и насыщенным солевым раствором (200 мл-2) и сушат над безводным сульфатом магния в течение 3 часов. Сульфат магния удаляют посредством фильтрования, и фильтрат сушат в вакууме в барабанной сушилке с получением 104,9 г относительно чистого сырого продукта, который можно непосредственно использовать на следующей стадии.
Пример 5: Получение 7-бром-3-метокси-2-нафтальдегида
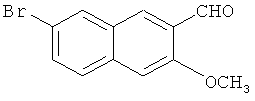
В 500-мл трехгорлую колбу добавляют 34,1 г 7-бром-3-метокси-2-нафтилкарбинола (0,128 моль) и 350 мл ацетона, и смесь энергично перемешивают с получением раствора. К раствору добавляют 167 г активного диоксида марганца (1,92 моль), и смесь перемешивают при комнатной температуре в течение 48 часов до завершения реакции. Смесь фильтруют и лепешку диоксида марганца на фильтре промывают этилацетатом (200 мл-6). Фильтраты объединяют, и сушат в вакууме в барабанной сушилке с получением сырого продукта в виде желтого твердого продукта, который перекристаллизуют из метанола с получением 29,3 г с выходом от двух стадий 86%.
Пример 6: Получение 1-фенил-1-[2-(7-бром-3-метокси)нафтил]метанола
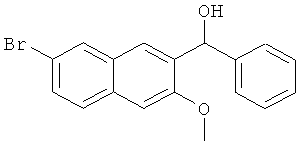
В атмосфере азота, в 500-мл трехгорлую колбу добавляют 6 г магниевой стружки (0,25 моль) и 50 мл безводного тетрагидрофурана, и добавляют маленький кусочек йода. 26,3 мл бромбензола (0,25 моль) и 40 мл безводного тетрагидрофурана смешивают до получения гомогенной смеси, 10 мл этой смеси добавляют в одной загрузке к реакционной смеси. Полученную смесь слегка нагревают без перемешивания для генерирования газовых пузырьков, нагревание прекращают, и йодная окраска постепенно исчезает. Когда реакция не является интенсивной, оставшийся раствор бромбензола и тетрагидрофурана добавляют по каплям при перемешивании, и реакционную смесь поддерживают слегка кипящей. После завершения добавления, смесь кипятят с обратным холодильником в течение 3 часов. Реакционную смесь естественным образом охлаждают до комнатной температуры, по каплям медленно добавляют 26,4 г 7-бром-3-метокси-2-нафтальдегида (0,1 моль), смешанного с 150 мл безводного тетрагидрофурана, и непрерывно нагревают с обратным холодильником в течение 1,5 часа. Реакционную смесь охлаждают, и реакцию прекращают, добавляя по каплям 50 мл 5% разбавленной хлористоводородной кислоты. Смесь выпаривают в роторном испарителе в вакууме для удаления тетрагидрофурана, экстрагируют этилацетатом (100 мл-3), и все органические слои объединяют. Органический слой промывают насыщенным раствором карбоната натрия (50 мл-2), промывают водой (50 мл-2), промывают насыщенным солевым раствором (50 мл-2) и сушат над безводным сульфатом магния в течение 3 часов. Сульфат магния удаляют посредством фильтрования, и фильтрат сушат в вакууме в барабанной сушилке с получением 36 г сырого продукта, который непосредственно используют на следующей стадии.
Пример 7: Получение 6-бром-2-метокси-3-бензилнафталина
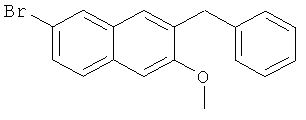
В атмосфере азота, в 500-мл трехгорлую колбу добавляют 36 г 1-фенил-1-[2-(7-бром-3-метокси)нафтил]метанола (0,1 моль) и 200 мл безводного тетрагидрофурана, и смесь перемешивают до получения раствора. Затем к раствору добавляют 20 г боргидрида натрия (0,5 моль), перемешивают на ледяной бане в течение 1 часа и добавляют 42 г трихлорида алюминия (0,3 моль) в нескольких загрузках, так что температура реакции не превышает 20°C. После завершения добавления, смесь непрерывно перемешивают на ледяной бане в течение 20 минут и нагревают с обратным холодильником в течение 20 часов. К смеси добавляют 50 мл воды для завершения реакции, выпаривают в роторном испарителе при пониженном давлении для удаления тетрагидрофурана, экстрагируют этилацетатом (100 мл-3), и органические слои объединяют. Полученный органический слой промывают 5% хлористоводородной кислотой (50 мл-2), насыщенным раствором карбоната натрия (50 мл-2), водой (50 мл-2) и насыщенным солевым раствором (50 мл-2) и сушат над безводным сульфатом магния в течение 3 часов. Сульфат магния удаляют посредством фильтрования, и фильтрат сушат в вакууме в барабанной сушилке с получением сырого продукта, который подвергают воздействию колоночной хроматографии (элюент: простой петролейный эфир) с получением 25,5 г продукта с выходом от двух стадий 78%.
Пример 8: Получение 1-(α-нафтил)-3-(N,N-диметиламино)-1-ацетона
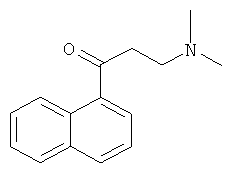
В 500-мл круглодонную колбу добавляют 85 г 1-ацетилнафталина (0,5 моль), 52,7 г диметиламина гидрохлорида (0,65 моль) и 19,8 г параформальдегида (0,22 моль). 1 мл концентрированной хлористоводородной кислоты и 80 мл 95% этанола перемешивают до растворения, и раствор выливают в колбу, перемешивают и нагревают с обратным холодильником в течение 2 часов. 400 мл ацетона выливают в колбу, поддерживая ее теплой, и смесь медленно охлаждают до комнатной температуры, помещают в холодильник и замораживают в течение ночи для преципитации твердого продукта, который фильтруют, промывают ацетоном (50 мл-2) с получением 1-(α-нафтил)-3-(N,N-диметиламино)-1-ацетона гидрохлорида. Эту соль растворяют в воде, и раствор доводят с помощью водного раствора карбоната натрия до щелочных значений pH и экстрагируют этилацетатом (100 мл-3). Все органические слои объединяют, промывают насыщенным раствором карбоната натрия (50 мл-2), водой (50 мл-2) и насыщенным солевым раствором (50 мл-2) и сушат над безводным сульфатом магния в течение 3 часов. Сульфат магния удаляют посредством фильтрования, и фильтрат сушат в вакууме в барабанной сушилке с получением сырого 81,7 г продукта, который непосредственно используют на следующей стадии.
Пример 9: Получение 2-бензил-3-метоксинафталина
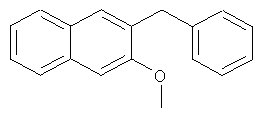
Используя 3-гидрокси-2-нафтойную кислоту в качестве исходных веществ, процедуры примеров 3-7 повторяют с получением соединения 2-бензил-3-метоксинафталина.
Пример 10: Получение 2-(4-хлорбензил)-3-метоксинафталина
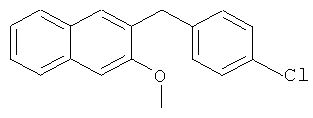
Используя 3-гидрокси-2-нафтойную кислоту в качестве исходных веществ и 4-хлорбромбензол вместо бромбензола, процедуры примеров 3-7 повторяют с получением соединения 2-(4-хлорбензил)-3-метоксинафталин.
Пример 11: Получение 6-бром-2-метокси-3-(4-хлорбензил) нафталина
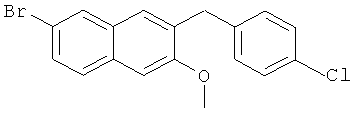
Используя 4-хлорбромбензол вместо бромбензола, процедуры примеры 6-7 повторяют с получением соединения 6-бром-2-метокси-3-(4-хлорбензил)нафталина.
Пример 12: Получение 1-(2-бромфенил)-3-(N,N-диметил амино)-1-ацетона
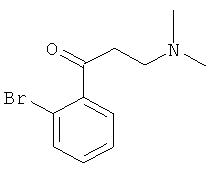
Используя 2-бромацетофенон вместо 1-ацетилнафталина, процедуры примера 8 повторяют с получением соединения 1-(2-бромфенил)-3-(N,N-диметиламино)-1-ацетона.
Пример 13: Получение 1-(3-бромфенил)-3-(N,N-диметиламино)-1-ацетона
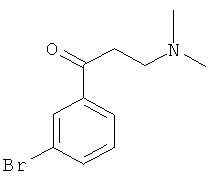
Используя 3-бромацетофенон вместо 1-ацетилнафталина, процедуры примера 8 повторяют с получением соединения 1-(3-бромфенил)-3-(N,N-диметиламино)-1-ацетона.
Пример 14: Получение 1-(4-бромфенил)-3-(N,N-диметиламино)-1-ацетона
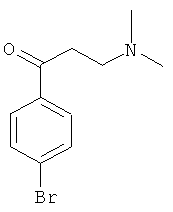
Используя 4-бромацетофенон вместо 1-ацетилнафталина, процедуры примера 8 повторяют с получением соединения 1-(4-бромфенил)-3-(N,N-диметиламино)-1-ацетона.
Пример 15: Получение 1-фенил-3-(N,N-диметиламино)-1-ацетона
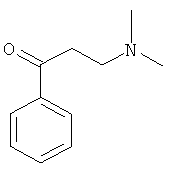
Используя ацетофенон вместо 1-ацетилнафталина, процедуры примера 8 повторяют с получением соединения 1-фенил-3-(N,N-диметиламино)-1-ацетона.
Пример 16: Получение 1-(2,4-дифторфенил)-3-(N,N-диметиламино)-1-ацетона
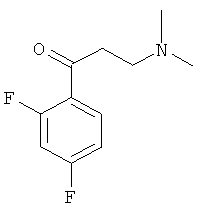
Используя 2,4-дифторацетофенон вместо 1-ацетилнафталина, процедуры примера 8 повторяют с получением соединения 1-(2,4-дифторфенил)-3-(N,N-диметиламино)-1-ацетона.
Пример 17: Получение 1-фенил-2-(1-нафтил)-1-[2-(3-метокси)-нафтил]-4-(N,N-диметиламино)бутан-2-ола
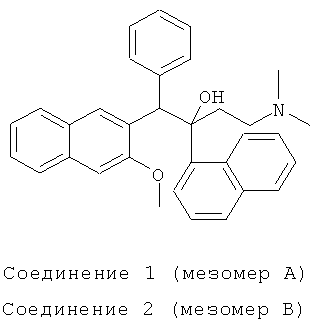
В атмосфере азота, в 250-мл трехгорлую колбу добавляют 2,8 мл диизопропиламина (0,02 моль) и 20 мл безводного тетрагидрофурана, и смесь перемешивают при -40°C в течение 0,5 часа. К реакционной смеси добавляют по каплям 8 мл 2,5М н-бутиллития (0,02 моль) с использованием шприца, и непрерывно перемешивают при -40°C в течение 0,5 часа. Реакционную смесь охлаждают до -78°C, и медленно добавляют по каплям 2,46 г 2-бензил-3-метоксинафталина (0,01 моль), растворенного в 20 мл безводного тетрагидрофурана. После завершения добавления, реакционную смесь непрерывно перемешивают при -78°C в течение 40 мин. К реакционной смеси медленно добавляют по каплям в течение 1 часа 3,9 г полученного in situ 1-(α-нафтил)-3-(N,N-диметиламино)-1-ацетона (0,017 моль), растворенного в 20 мл безводного тетрагидрофурана, и после завершения добавления, перемешивают при -78°C течение 8 часов. Реакционную смесь нагревают до -40°C, к ней добавляют 20 мл насыщенного водного раствора хлорида аммония для гидролиза в течение 0,5 часа, нагревают до комнатной температуры, выпаривают на роторном испарителе при пониженном давлении для удаления тетрагидрофурана, к ней добавляют 50 мл воды, экстрагируют этилацетатом (50 мл-3), и все органические слои объединяют. Полученный органический слой промывают водой (30 мл-2), насыщенным солевым раствором (20 мл-2) и сушат над безводным сульфатом магния в течение 3 часов. Сульфат магния удаляют посредством фильтрования, и фильтрат сушат в вакууме в барабанной сушилке с получением сырого продукта, который подвергают воздействию колоночной хроматографии (элюент: дихлорметан/метанол/водный раствор аммиака=400/1/0,1) с получением, последовательно, двух компонентов, которые по отдельности перекристаллизовывают из изопропилового эфира с получением соединения 1 (т.пл.: 154,0-154,8°C) и соединения 2 (т.пл.: 185,7-187,7°C).
Соединение 1: 1H-ЯМР (400 МГц, CDCl3) δ=1,563 (с, 1Н); 1,979 (м, 7Н); 2,267 (м, 1Н); 2,460 (м, 1Н); 4,068 (с, 3H); 6,067 (с, 1Н); 6,881 (м, 3H); 7,102 (с, 2Н); 7,202 (с, 1Н); 7,341 (м, 2Н); 7,427 (т, J=7,2 Гц, 1H); 7,497 (т, J=7,2 Гц, 1Н); 7,608 (м, 1Н); 7,688 (д, J=7,6 Гц, 1Н); 7,750 (д, J=8,0 Гц, 1Н); 7,891 (м, 3H); 8,372 (с, 1Н); 8,668 (д, J=8,0 Гц, 1Н); 8,853 (с, 1Н).
ESI MS (масс-спектрометрия с электрораспылительной ионизацией): m/z=476,4[M++1]
Соединение 2: 1H-ЯМР (400 МГц, CDC13) δ=1,565 (с, 1Н); 1,989 (с, 7Н); 2,358 (м, 1Н); 2,497 (м, 1H); 3,022 (с, 3H); 5,886 (с, 1Н); 6,531 (с, 1Н); 7,213 (м, 5Н); 7,387 (м, 4Н); 7,536 (м, 2Н); 7,712 (д, J=7,6 Гц, 1Н); 7,777 (д, J=8,0 Гц, 1Н); 7,937 (д, J=7,6 Гц, 2Н); 7,976 (д, J=6,4 Гц, 1Н); 8,193 (с, 1H); 8,394 (с, 1Н); 8,540 (д, J=8,4 Гц, 1H).
ESI MS: m/z=476,3[M++1]
Пример 18: Получение 1-(4-хлорфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола
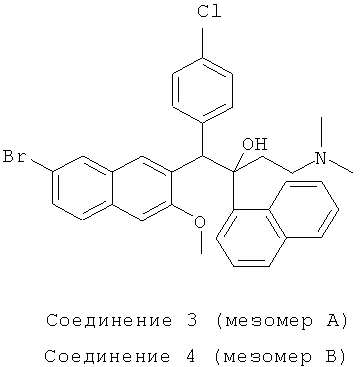
Используя 6-бром-2-метокси-3-(4-хлорбензил)нафталин вместо 2-бензил-3-метоксинафталина, процедуры примера 12 повторяют с получением соединения 3 (т.пл.: 185,1-185,5°C) и соединения 4 (т.пл.: 149,0-149,9°C).
Соединение 3: 1H-ЯМР (400М Гц, DMSO-d6) δ=1,884 (м, 9Н); 2,154 (м, 1Н); 3,280 (с, 3H); 5,821 (с, 1Н); 6,787 (с, 1Н); 7,372 (м, 6Н); 7,581 (м, 2Н); 7,810 (м, 4Н); 7,915 (д, J=l,6 Гц, 1Н); 8,098 (д, J=7,6 Гц, 1Н); 8,475 (с, 1Н); 8,570 (д, J=9,2 Гц, 1Н).
ESI MS: m/z=590,3 [M++1]
Соединение 4: 1H-ЯМР (400 МГц, CDCl3) δ=1,601 (с, 1Н); 1,964 (м, 7Н); 2,174 (м, 1Н); 2,451 (с, 1Н); 4,069 (с, 3H); 6,008 (с, 1Н); 6,838 (д, J=8,4 Гц, 2Н); 7,063 (д, J=8,4 Гц, 2Н); 7,164 (с, 1Н); 7,346 (т, J=8,0 Гц, 2Н); 7,491 (м, 2Н); 7,601 (м, 2Н); 7,694 (д, J=7,6 Гц, 2Н); 7,904 (м, 2Н); 8,021 (с, 1Н); 8,387 (с, 1Н); 8,594 (д, J=8,4 Гц, 1Н); 8,667 (с, 1H).
ESI MS: m/z=590,3[M++1]
Пример 19: Получение 1-(4-хлорфенил)-2-(1-нафтил)-1-[2-(3-метокси)нафтил]-4-(N,N-диметиламино)-бутан-2-ола (соединения 5 и 6)
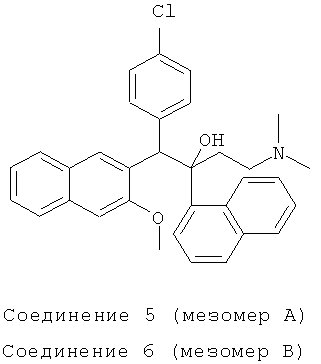
Используя 3-метокси-2-(4-хлорбензил)нафталин вместо 2-бензил-3-метоксинафталина, процедуры примера 12 повторяют с получением соединения 5 (т.пл.: 215,4-215,9°C) и соединения 6 (т.пл.: 180,5-181,2°C).
Соединение 5: 1H-ЯМР (400М Гц, CDCl3) δ=2,004 (с, 8Н); 2,272 (м, 1Н); 2,480 (м, 1Н); 3,092 (с, 3H); 5,848 (с, 1Н); 6,544 (с, 1H); 7,209 (м, 3H); 7,318 (д, J=8,0 Гц, 2Н); 7,397 (м, 2Н); 7,526 (м, 2Н); 7,694 (д, J=8,0 Гц, 1Н); 7,764 (д, J=8,0 Гц, 1Н); 7,863 (д, J=8,4 Гц, 2Н); 8,016 (д, J=6,8 Гц, 1H); 8,244 (с, 1Н); 8,370 (с, 1Н); 8,482 (д, J=8,8 Гц, 1Н);
ESIMS: m/z=510,4[M++1]
Соединение 6: 1H-ЯМР (400 МГц, CDCl3) δ=1,559 (с, 1Н); 1,980 (с, 7Н); 2,235 (м, 1Н); 2,434 (м, 1Н); 4,065 (с, 3H); 6,025 (с, 1Н); 6,833 (д, J=8,4 Гц, 2Н); 7,055 (д, J=7,6 Гц, 2Н); 7,202 (с, 1Н); 7,351 (м, 2Н); 7,430 (т, J=7,2 Гц, 1Н); 7,492 (т, J=7,2 Гц, 1Н); 7,597 (т, J=7,6 Гц, 1Н); 7,697 (д, J=8,0 Гц, 1Н); 7,748 (д, J=8,4 Гц, 1Н); 7,886 (д, J=9,6 Гц, 3H); 8,408 (с, 1Н); 8,617 (д, J=8,0 Гц, 1Н); 8,761 (с, 1Н).
ESIMS: m/z=510,4[M++1]
Пример 20: Получение 1-(4-хлорфенил)-2-(4-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 7 и 8)
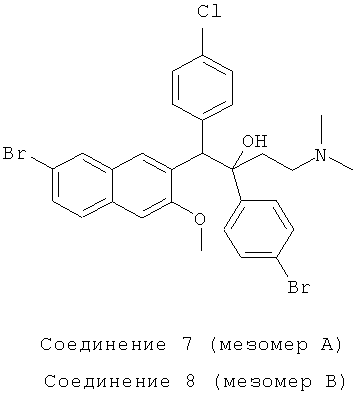
Используя 6-бром-2-метокси-3-(4-хлорбензил)нафталин вместо 2-бензил-3-метоксинафталина и 1-(4-бромфенил)-3-(N,N-диметиламино)-1-ацетон вместо 1-(α-нафтил)-3-(N,N-диметиламино)-1-ацетона, процедуры примера 12 повторяют с получением соединения 7 (т.пл.: 219,5-220,4°C) и соединения 8 (т.пл.: 213,5-214,2°C).
Соединение 7: 1H-ЯМР (400 МГц, CDCl3) δ=1,567 (с, 1Н); 2,049 (с, 8Н); 2,226 (м, 1Н); 3,698 (с, 1Н); 4,898 (с, 1Н); 6,751 (с, 1Н); 7,256 (м, 4Н); 7,367 (м, 4Н); 7,649 (д, J=8,4 Гц, 2Н); 7,843 (д, J=l,6 Гц, 1Н); 8,163 (с, 1Н); 8,348 (с, 1Н).
ESI MS: m/z=618,3[M++1]
Соединение 8: 1H-ЯМР (400 МГц, CDCl3) δ=1,554 (с, 1Н); 1,680 (м, 1Н); 2,040 (с, 6Н); 2,187 (м, 2Н); 3,944 (с, 3H); 4,949 (с, 1Н); 6,961 (д, J=8,4 Гц, 2Н); 7,078 (с, 1H); 7,176 (д, J=8,4 Гц, 2Н); 7,324 (д, J=8,8 Гц, 2Н); 7,373 (д, J=9,2 Гц, 2Н); 7,459 (дд, J,=2,0 Гц, J2=8,4 Гц, 1H); 7,571 (д, J=8,8 Гц, 1H); 7,960 (д, J=1,2 Гц, 1H); 8,204 (с, 1H); 8,624 (с, 1H).
ESIMS: m/z=618,3[M++1]
Пример 21: Получение 1-фенил-2-(4-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 9 и 10)
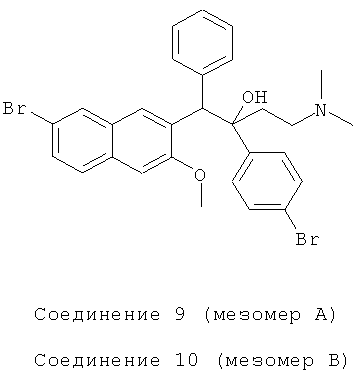
Используя 6-бром-2-метокси-3-бензилнафталин вместо 2-бензил-3-метоксинафталина, 1-(4-бромфенил)-3-(N,N-диметиламино)-1-ацетон вместо 1-(α-нафтил)-3-(N,N-иметиламино)-1-ацетона, процедуры примера 12 повторяют с получением соединения 9 (т.пл.: 189,8-190,7°C и соединения 10 (т.пл.: 228,2-229,9°C.
Соединение 9: 1H-ЯМР (400 МГц, CDCl3) δ=1,560 (с, 1Н); 1,698 (с, 1Н); 2,036 (с, 6Н); 2,193 (м, 2Н); 3,951 (с, 3H); 4,996 (с, 1H); 6,991 (м, 3H); 7,077 (с, 1H); 7,232 (д, J=7,2 Гц, 2Н); 7,344 (дд, J,=8,8 Гц, J2=12,0 Гц, 4Н); 7,449 (дд, J,=2,0 Гц, J2=8,8 Гц, 1Н); 7,567 (д, J=8,8 Гц, 1Н); 7,964 (д, J=l,6 Гц, 1H); 8,147 (с, 1Н); 8,669 (с, 1Н).
ESI MS: m/z=584,2[M++1]
Соединение 10: 1H-ЯМР (400 МГц, CDCl3) δ=1,564 (м, 2Н); 2,102 (м, 8Н); 3,687 (с, 3H); 4,939 (с, 1Н); 6,742 (с, 1Н); 7,295 (м, 9Н); 7,713 (д, J=6,8 Гц, 2Н); 7,855 (д, J=l,6 Гц, 1Н); 8,083 (с, 1Н); 8,376 (с, 1H).
ESI MS: m/z=584,2[M++1]
Пример 22: Получение 1-фенил-2-(3-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 11 и 12)
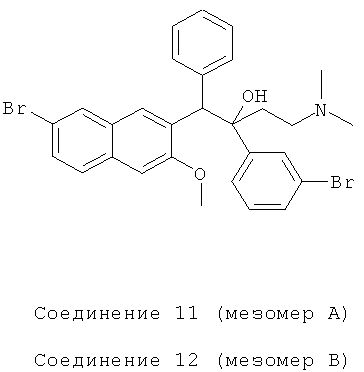
Используя 6-бром-2-метокси-3-бензилнафталин вместо 2-бензил-3-метоксинафталина и 1-(3-бромфенил)-3-(N,N-диметиламино)-1-ацетон вместо 1-(а-нафтил)-3-(N,N-диметиламино)-1-ацетона, процедуры примера 12 повторяют с получением соединения 11 (т.пл.: 212,3-212,8°C) и соединения 12 (т.пл.: 200,2-200,6°C).
Соединение 11: 1Н-ЯМР (400 МГц, CDCl3) δ=1,556 (с, 1H); 1,695 (д, J=6,8 Гц, 1Н); 2,044 (с, 6Н); 2,195 (м, 2Н); 3,959 (с, 3H); 4,985 (с, 1Н); 7,029 (м, 5Н); 7,235 (д, J=7,6 Гц, 3H); 7,386 (д, J=7,6 Гц, 1H); 7,449 (дд, Ji=l,6 Гц, J2=8,4 Гц, 1Н); 7,567 (д, J=8,4 Гц, 1Н); 7,600 (с, 1H); 7,965 (д, J=1,6 Гц, 1Н); 8,197 (с, 1Н); 8,673 (с, 1Н).
ESI MS: m/z=584,3[M++1]
Соединение 12: 1H-ЯМР (400 МГц, CDCl3) δ=1,563 (м, 2Н); 2,046 (м, 8Н); 3,725 (с, 3H); 4,978 (с, 1Н); 6,744 (с, 1Н); 6,981 (т, J=8,0 Гц, 1Н); 7,141 (д, J=7,6 Гц, 1Н); 7,304 (м, 6Н); 7,639 (с, 1Н); 7,746 (м, 2Н); 7,864 (д, J=l,6 Гц, 1Н); 8,151 (с, 1Н); 8,338 (с, 1Н)
ESI MS: m/z=584,2[M++1]
Пример 23: Получение 1-(4-хлорфенил)-2-(2,4-дифторфенил)-1-[2-(3-метокси)нафтил]-4-(N,N-диметиламино)-бутан-2-ола (соединения 13 и 14)
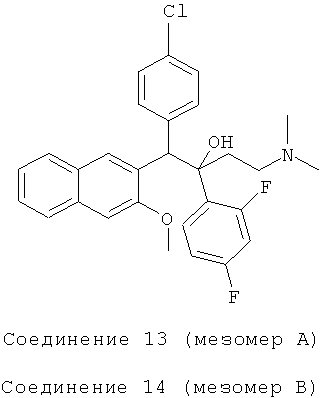
Используя 3-метокси-2-(4-хлорбензил)нафталин вместо 2-бензил-3-метоксинафталина и 1-(2,4-дифторфенил)-3-(N,N-диметиламино)-1-ацетон вместо 1-(α-нафтил)-3-(N,N-диметиламино)-1-ацетона, процедуры примера 12 повторяют с получением соединения 13 (масла) и соединения 14 (т.пл.: 190,6-192,4°C).
Соединение 13:
ESI MS: m/z=496,0 [M++1]
Соединение 14: 1H-ЯМР(400 МГц, CDCl3) δ=2,139 (м, 10H); 3,943 (с, 3H); 5,293 (с, 1Н); 6,736 (м, 2Н); 6,964 (д, J=8,4 Гц, 2Н); 7,116 (с, 1Н); 7,254 (м, 2Н); 7,328 (дт, Ji=l,2 Гц, J2=6,8 Гц, 1Н); 7,402 (дт, J,=l,2 Гц, J2=6,8 Гц, 1Н); 7,508 (м, 1Н); 7,702 (д, J=8,4 Гц, 1H); 7,824 (д, J=7,6 Гц, 2Н); 8,434 (с, 1Н); 8,756 (с, 1Н).
ESI MS: m/z=496,3[M++1]
Пример 24: Получение 1-(4-хлорфенил)-2-(3-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 15 и 16)
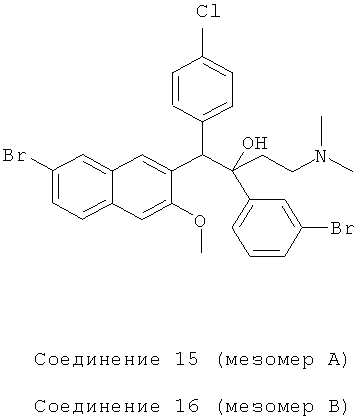
Используя 6-бром-2-метокси-3-(4-хлорбензил)нафталин вместо 2-бензил-3-метоксинафталина и 1-(3-бромфенил)-3-(N,N-диметиламино)-1-ацетон вместо 1-(α-нафтил)-3-(N,N-диметиламино)-1-ацетона, процедуры примера 12 повторяют с получением соединения 15 (т.пл.: 177,1-177,6°C) и соединения 16 (т.пл.: 183,9-184,9°C).
Соединение 15: 1H-ЯМР (400 МГц, CDCl3) δ=1,566 (м, 2Н); 2,063 (м, 7Н); 2,243 (м, 1Н); 3,727 (с, 3H); 4,931 (с, 1Н); 6,747 (с, 1Н); 6984 (т, J=8,0 Гц, 1Н); 7,140 (дд, J1=0,8 Гц, J2=8,0 Гц, 1H); 7,258 (д, J=8,8 Гц, 2Н); 7,357 (м, 3H); 7,628 (с, 1Н); 7,688 (д, J=8,4 Гц, 2Н); 7,853 (д, J=l,6 Гц, 2Н); 8,233 (с, 1Н); 8,308 (с, 1Н).
ESI MS: m/z=618,l[M++1]
Соединение 16: 1H-ЯМР (400 МГц, CDCl3) δ=1,659 (м, 2Н); 2,104 (м, 8Н); 3,956 (с, 3H); 4,952 (с, 1Н); 6,967 (д, J=8,4 Гц, 2Н); 7,110 (м, 2Н); 7,189 (д, J=8,8 Гц, 2Н); 7,276 (д, J=8,8 Гц, 1Н); 7,384 (д, J=7,6 Гц, 1Н); 7,460 (дд, J,=2,0 Гц, J2=8,4 Гц, 1Н); 7,573 (д, J=8,8 Гц, 1H); 7,602 (с, 1Н); 7,963 (д, J=l,6 Гц, 1Н); 8,271 (с, 1H); 8,617 (с, 1Н).
ESI MS: m/z=618,2 [M++1]
Пример 25: Получение 1-(4-хлорфенил)-2-фенил-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 17 и 18)
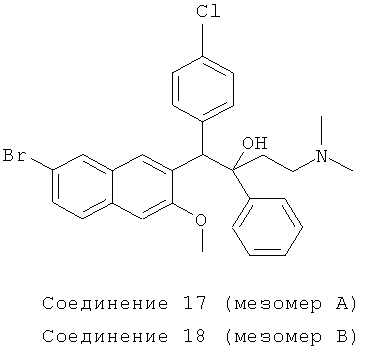
Используя 6-бром-2-метокси-3-(4-хлорбензил)нафталин вместо 2-бензил-3-метоксинафталина и 1-фенил-3-(N,N-диметиламино)-1-ацетон вместо 1-(α-нафтил)-3-(N,N-диметиламино)-1-ацетона, процедуры примера 12 повторяют с получением соединения 17 (т.пл.: 196,8-197,3°C) и соединения 18 (т.пл.: 182,2-182,8°C).
Соединение 17: 1H-ЯМР (400 МГц, CDCl3) δ=1,565 (м, 2Н); 2,046 (м, 7Н); 2,219 (м, 1Н); 3,691 (с, 3H); 4,961 (с, 1Н); 6,728 (с, 1Н); 7,006 (т, J=7,2 Гц, 1Н); 7,150 (т, J=7,6 Гц, 2Н), 7,236 (с, 1Н); 7,257 (с, 1Н); 7,315 (дд, J,=2,0 Гц, J2=8,8 Гц, 1H); 7,364 (д, J=8,8 Гц, 1Н); 7,485 (д, J=6,8 Гц, 2Н); 7,651 (д, J=8,4 Гц, 2Н); 7,842 (д, J=l,6 Гц, 1Н); 8,062 (с, 1Н); 8,383 (с, 1Н).
ESI MS: m/z=540,2 [M++1]
Соединение 18: 1H-ЯМР(400 МГц, CDCl3) δ=1,559 (с, 1Н); 1,724 (д, J=10,0 Гц, 1Н); 2,043 (с, 6Н); 2,1875 (м, 2Н); 3,947 (с, 3H); 5,020 (с, 1Н); 6,932 (д, J=8,4 Гц, 2Н); 7,082 (с, 1Н); 7,147 (м, 3H); 7,255 (м, 2Н); 7,451 (м, 3H); 7,576 (д, J=8,4 Гц, 1Н); 7,969 (д, J=l,6 Гц, 1Н); 8,137 (с, 1Н); 8,681 (с, 1H).
ESI MS: m/z=540,2 [M++1]
Пример 26: Получение 1,2-дифенил-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 19 и 20)
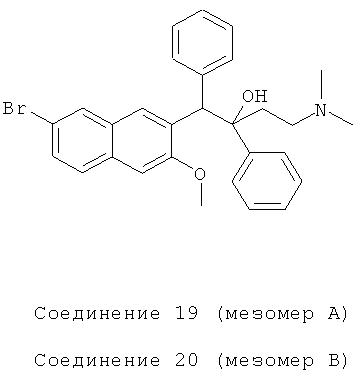
Используя 6-бром-2-метокси-3-бензилнафталин вместо 2-бензил-3-метоксинафталина и 1-фенил-3-(N,N-диметиламино)-1-ацетон вместо 1-(α-нафтил)-3-(N,N-диметиламино)-1-ацетона, процедуры примера 12 повторяют с получением соединения 19 (т.пл.: 170,9-171,6°C) и соединения 20 (т.пл.: 201,9-203,7°C).
Соединение 19: 1H-ЯМР (400 МГц, CDCl3) δ=1,552 (с, 1Н); 1,734 (д, J=10,8 Гц, 1Н); 2,037 (с, 6Н); 2,220 (м, 2Н); 3,946 (с, 3H); 5,059 (с, 1H); 6,960 (м, 3H); 7,107 (м, 2Н); 7,225 (м, 3H); 7,448 (м, 3H); 7,568 (д, J=8,8 Гц, 1H); 7,973 (д, 2 Гц, 1Н); 8,078 (с, 1Н); 8,733 (с, 1Н).
ESIMS: m/z=504,3 [M++1]
Соединение 20: 1H-ЯМР (400 МГц, CDCl3) δ=1,556 (с, 1Н); 1,736 (д, J=10,8 Гц, 1H); 2,019 (с, 6Н); 2,200 (м, 2Н); 3,679 (с, 3H); 5,001 (с, 1Н); 6,716 (с, 1H); 7,001 (т, J=7,2 Гц, 1H); 7,164 (м, 3H); 7,326 (м, 3H); 7,495 (д, J=8 Гц, 2Н); 7,725 (д, J=7,2 Гц, 2Н); 7,856 (д, 1,6 Гц, 1Н); 8,001 (с, 1H); 8,424 (с, 1Н).
ESIMS: m/z=504,3 [М++1]
Пример 27: Получение 1-(4-хлорфенил)-2-(2-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 21 и 22)
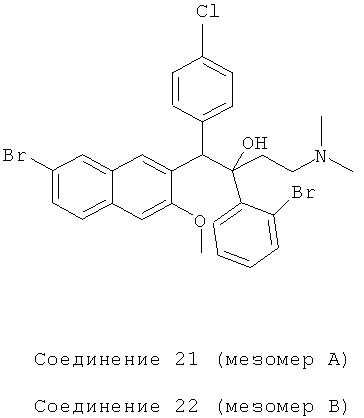
Используя 6-бром-2-метокси-3-(4-хлорбензил)нафталин вместо 2-бензил-3-метоксинафталина и 1-(2-бромфенил)-3-(N,N-диметиламино)-1-ацетон вместо 1-(α-нафтил)-3-(N,N-диметиламино)-1-ацетона, процедуры примера 12 повторяют с получением соединения 21 (т.пл.: 219,1-219,8°C) и соединения 22 (т.пл.: 180,8-181,6°C).
Соединение 21: 1H-ЯМР (400 МГц, CDCl3) δ=1,568 (с, 1Н); 2,022 (м, 9Н); 3,664 (с, 3H); 5,889 (с, 1Н); 6,728 (с, 1H); 6,885 (дт, J1=l,6 Гц, J2=6,8 Гц, 1Н); 7,100 (дт, J1=l,2 Гц, J2=8,0 Гц, 1Н); 7,264 (м, 2Н); 7,371 (м, 3H); 7,684 (д, J=8,4 Гц, 2Н); 7,836 (с, 1Н); 7,984 (д, J=7,6 Гц, 1Н); 8,296 (с, 1Н).
ESI MS: m/z=618,3 [M++1]
Соединение 22: 1H-ЯМР (400 МГц, CDCl3) δ=1,569 (с, 1Н); 2,024 (м, 8Н); 2,738 (с, 1Н); 3,966 (с, 3H); 6,080 (с, 1H); 6,975 (м, 3H); 7,085 (с, 1Н); 7,163 (т, J=7,6 Гц, 1Н); 7,285 (д, J=7,2 Гц, 2Н); 7,454 (д, J=8,4 Гц, 1Н); 7,556 (м, 2Н); 7,825 (д, J=7,6 Гц, 1Н); 7,971 (с, 1Н); 8,359 (с, 1Н); 8,632 (с, 1Н).
ESI MS:m/z=618,5 [М++1]
Пример 28: Получение 1-фенил-2-(2-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 23 и 24)
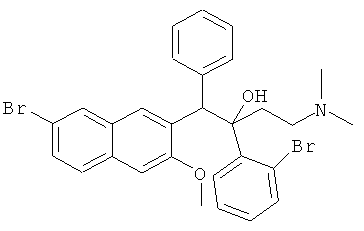
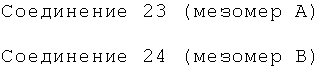
Используя 6-бром-2-метокси-3-бензилнафталин вместо 2-бензил-3-метоксинафталина и 1-(2-бромфенил)-3-(N,N-диметиламино)-1-ацетон вместо 1-(α-нафтил)-3-(N,N-диметиламино)-1-ацетона, процедуры примера 12 повторяют с получением соединения 23 (т.пл.: 210,8-212,1°C) и соединения 24 (т.пл.: 200,2-200,7°C).
Соединение 23: 1H-ЯМР (400 МГц, CDCl3) δ=1,569 (с, 1Н); 2,095 (м, 8Н); 2,816 (с, 1Н); 3,641 (с, 3H); 5,900 (с, 1H); 6,710 (с, 1Н); 6,878 (дт, J,=l,6 Гц, J2=7,6 Гц, 1Н); 7,072 (дт, J1=l,2 Гц, J2=8,0 Гц, 1H); 7,206 (м, 1H); 7,323 (м, 4Н); 7,428 (дд, J,=l,6 Гц, J2=8,0 Гц, 1Н); 7,765 (д, J=7,6 Гц, 2Н); 7,849 (д, J=l,2 Гц, 1Н); 7,913 (д, J=7,2 Гц, 1Н); 8,145 (с, 1Н); 8,322 (с, 1Н).
ESIMS: m/z=584,3 [M++1]
Соединение 24: 1H-ЯМР (400 МГц, CDCl3) δ=2,097 (м, 9Н); 2,746 (с, 1Н); 3,969 (с, 3H); 6,090 (с, 1Н); 7,031 (м, 6Н); 7,455 (м, 5Н); 7,810 (д, J=7,6 Гц, 1Н); 7,980 (д, J=l,6 Гц, 1H); 8,294 (с, 1Н); 8,695 (с, 1Н).
ESIMS: m/z=584,0[M++1]
Пример 29: Получение 1-фенил-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 25 и 26)
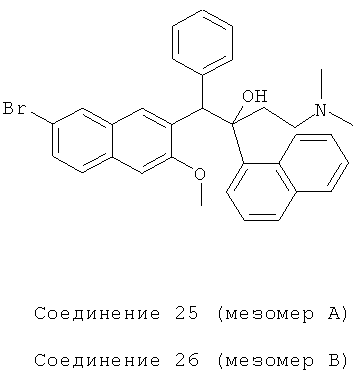
Используя 6-бром-2-метокси-3-бензилнафталин вместо 2-бензил-3-метоксинафталина, процедуры примера 12 повторяют с получением соединения 25 (т.пл.: 168,1-169,1°C) и соединения 26 (т.пл.: 200,9-201,6°C).
Соединение 25: 1H-ЯМР (400 МГц, CDCl3) δ=1,567 (с, 1Н); 1,997 (с, 7Н); 2,347 (с, 1Н); 2,505 (с, 1Н); 3,014 (с, 3H); 5,870 (с, 1Н); 6,482 (с, 1Н); 7,240 (м, 4Н); 7,394 (м, 3H); 7,545 (м, 2Н); 7,783 (д, J=8,0 Гц, 1Н); 7,859 (с, 1Н); 7,929 (м, 3H); 8,211 (с, 1H); 8,328 (с, 1Н); 8,514 (д, J=8,4 Гц, 1H).
ESI MS: m/z=554,5 [M++1]
Соединение 26: 1H-ЯМР (400 МГц, CDCl3) δ=1,562 (с, 1Н); 1,920 (с, 1Н); 1,983 (с, 6Н); 2,177 (т, J=9,6 Гц, 1Н); 2,449 (с, 1Н); 4,065 (с, 3H); 6,045 (с, 1Н); 6,881 (т, J=3,2 Гц, 3H); 7,105 (с, 2Н); 7,156 (с, 1Н); 7,320 (т, J=8,0 Гц, 1Н); 7,487 (м, 2Н); 7,602 (т, J=8,8 Гц, 2Н); 7,679 (д, J=8,0 Гц, 1Н); 7,892 (д, J=8,0 Гц, 1Н); 8,027 (с, 1Н); 8,337 (с, 1Н); 8,641 (д, J=8,4 Гц, 1Н); 8,753 (с, 1Н).
ESI MS: m/z=554,5 [M++1]
Пример 30: Получение 1-(4-хлорфенил)-2-(1-нафтил)-1-[2-(3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола гидрохлорида (соединение 27)
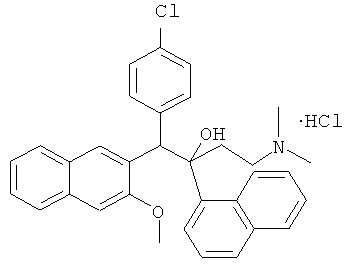
В 50-мл колбе, 100 мг соединения 6 (0,2 ммоль) растворяют в 5 мл ацетона, и к раствору медленно добавляют по каплям 20 мл раствора хлористоводородной кислоты в простом этиловом эфире, герметизируют и перемешивают при комнатной температуре в течение 3 часов с преципитацией твердого продукта, который фильтруют, промывают ацетоном (5 мл-2) и сушат с получением 70 мг твердого продукта с выходом 65,4% (т.пл.: больше чем 258°C).
1H-ЯМР (400 МГц, DMSO-d6) δ=2,036 (с, 2Н); 2,372 (с, 3H); 2,413 (с, 3H); 2,973 (с, 1Н); 3,103 (с, 1H); 4,161 (с, 3H); 5,871 (с, 1Н); 5,944 (с, 1Н); 6,958 (д, J=8,4 Гц, 2Н); 7,202 (д, J=7,6 Гц, 2Н); 7,363 (м, 2Н); 7,454 (м, 2Н); 7,557 (т, J=6,8 Гц, 1Н); 7,747 (д, J=8,0 Гц, 2Н); 7,851 (м, 3H); 7,944 (д, J=8,4 Гц, 1H); 8,252 (с, 1Н); 8,658 (д, J=8,0 Гц, 1Н), 9,531 (с, 1Н).
Пример 31: Получение 6-бром-2-метокси-3-(3-хлорбензил)-нафталина
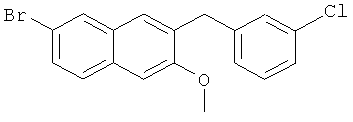
Используя 3-хлорбромбензол вместо бромбензола, процедуры примера 6-7 повторяют с получением соединения 2-метокси-3-(3-хлорбензил)-6-бромнафталина.
Пример 32: Получение 6-бром-2-метокси-3-(4-метилбензил)нафталина
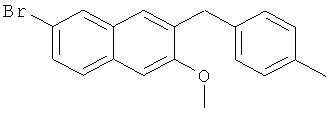
Используя 4-бромтолуол вместо бромбензола, процедуры примера 6-7 повторяют с получением соединения 2-метокси-3-(4-метилбензил)-6-бромнафталина.
Пример 33: Получение 6-бром-2-метокси-3-(3-метилбензил)нафталина
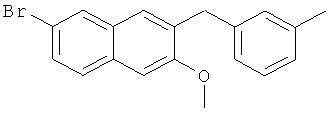
Используя 3-бромтолуол вместо бромбензола, процедуры примера 6-7 повторяют с получением соединения 2-метокси-3-(3-метилбензил)-6-бромнафталина.
Пример 34: Получение 6-бром-2-метокси-3-(2-метилбензил)нафталина
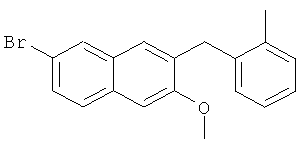
Используя 2-бромтолуол вместо бромбензола, процедуры примера 6-7 повторяют с получением соединения 2-метокси-3-(2-метилбензил)-6-бромнафталина.
Пример 35: Получение 1,6-дибром-2-метокси-3-бензилнафталина и 1,6-дибром-3-бензил-2-нафтола
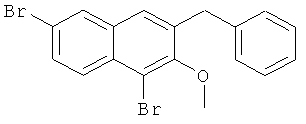
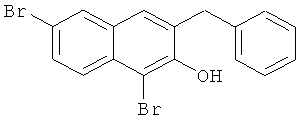
Используя соединение 4,7-дибром-3-гидрокси-2-нафтойной кислоты из Примера 1 в качестве исходных веществ, процедуры примеров 3-7 повторяют с получением соединения 1,6-дибром-2-метокси-3-бензилнафталина и 1,6-дибром-3-бензил-2-нафтола.
Пример 36: Получение 1,6-дибром-2 метокси-3-(4-метилбензил)нафталина и 1,6-дибром-3-(4-метилбензил)-2-нафтола
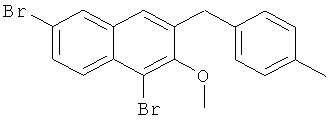
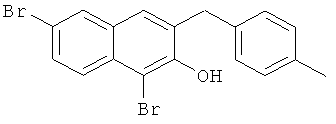
Используя соединение 4,7-дибром-3-гидрокси-2-нафтойной кислоты из Примера 1 в качестве исходных веществ и 4-бромтолуол вместо бромбензола, процедуры примеров 3-7 повторяют с получением соединения 1,6-дибром-2 метокси-3-бензилнафталин и 1,6-дибром-3-бензил-2-нафтола.
Пример 37: Получение 1,6-дибром-2 метокси-3-(4-хлорбензил)нафталина и 1,6-дибром-3-(4-хлорбензил)-2-нафтола
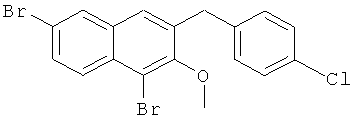
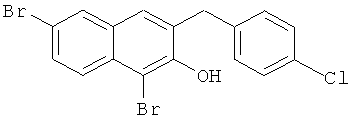
Используя соединение 4,7-дибром-3-гидрокси-2-нафтойной кислоты из Примера 1 в качестве исходных веществ и 4-хлорбромбензол вместо бромбензола, процедуры примера 3-7 повторяют с получением соединения 1,6-дибром-2-метокси-3-бензилнафталина и 1,6-дибром-3-бензил-2-нафтола.
Пример 38: Получение 1-(4-метилфенил)-2-(1-нафтил)-1-[2-(7-бром-3-
метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 29 и 30)
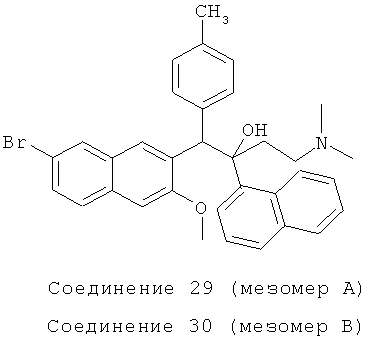
Используя 2-метокси-3-(4-метилбензил)-6-бромнафталин вместо 2-бензил-3-метоксинафталина, процедуры примера 24 повторяют с получением соединения 29 (масло) и соединения 30 (т.пл.: 189,5-190,8°C).
Соединение 29: 1H-ЯМР (400 МГц, CDCl3): δ=1,900-2,190 (м, 12Н), 2,546 (д, J=12,4 Гц, 1H), 4,058 (с, 3H), 6,022 (с, 1H), 6,688 (д, J=7,6 Гц, 2Н), 7,005 (д, J=6,8 Гц, 2Н), 7,141 (с, 1H), 7,315-7,366 (м, 1H), 7,446-7,497 (м, 2Н), 7,585 (д, J=7,6 Гц, 2Н), 7,678 (д, J=7,6 Гц, 1Н), 7,879 (д, J=8,0 Гц, 1Н), 7,924 (д, J=6,8 Гц, 1Н), 8,008 (с, 1Н), 7,628 (с, 1Н), 8,646 (с, 1Н).
MS (ESI): [M+1]+=568,0.
Соединение 30: 1H-ЯМР (400 МГц, DMSO-d6): δ=1,856-2,107 (м, 9Н), 2,280 (с, 3H), 2,497 (м, 1H), 3,204 (с, 3H), 5,774 (с, 1Н), 6,754 (с, 1Н), 7,137 (д, J=8,0 Гц, 2Н), 7,267-7,355 (м, 2Н), 7,423-7,456 (м, 2Н), 7,586 (д, J=8,0 Гц, 2Н), 7,694 (д, J=7,6 Гц, 2Н), 7,803 (д, J=7,6 Гц, 1H), 7,923 (с, 1Н), 8,044 (д, J=7,2 Гц, 1Н), 8,480 (с, 1Н), 8,567 (д, J=8,4 Гц, 1Н). MS (ESI): [М+1]+=568,1.
Пример 39: Получение 1-фенил-2-(1-нафтил)-1-[2-(4,7-дибром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 31 и 32)
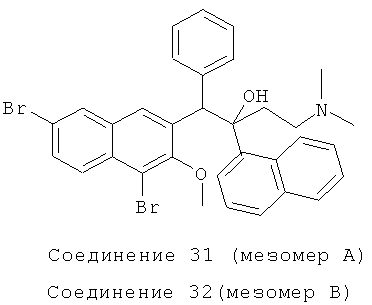
Используя 1,6-дибром-2 метокси-3-бензилнафталин вместо 2-бензил-3-метоксинафталина, процедуры примера 24 повторяют с получением соединения 31 (т.пл.: 181,2-181,5°C) и соединения 32 (т.пл.: 189,9-190,5°C).
Соединение 31: 1H-ЯМР (400 МГц, CDCl3): δ=1,940-2,081 (м, 9Н), 2,475 (м, 1Н), 3,847 (с, 3H), 5,906 (с, 1H), 6,889-6,906 (м, 3H), 7,024-7,044 (м, 2Н), 7,297 (т, J=8,0 Гц, 1Н), 7,517 (т, J=7,6 Гц, 1Н), 7,614-7,708 (м, 3H), 7,808 (д, J=7,2 Гц, 1Н), 7,920 (д, J=8,4 Гц, 1Н), 8,109 (д, J=9,2 Гц, 2Н), 8,453 (ушир. с, 1Н), 8,639 (д, J=8,8 Гц, 1H), 8,959 (с, 1Н). MS (ESI): [M+1]+=632,6.
Соединение 32: 1H-ЯМР (400 МГц, CDCl3): δ=1,967-2,029 (м, 8Н), 2,222 (м, 1H), 2,487 (м, 1Н), 3,234 (с, 3H), 5,709 (с, 1Н), 7,218-7,252 (м, 1Н), 7,319-7,426 (м, 5Н), 7,531-7,569 (м, 1Н), 7,588 (д, J=8,0 Гц, 1Н), 7,727-7,796 (м, 4Н), 7,931 (д, J=l,6 Гц, 1Н), 8,306 (д, J=7,2 Гц, 1Н), 8,369 (ушир. с, 1Н), 8,510 (д, J=8,8 Гц, 1Н), 8,805 (с, 1Н).
MS (ESI): [M+1]+=632,5.
Пример 40: Получение 1,6-дибром-3-[1-фенил 2-(1-нафтил)-2-гидрокси-4-(N,N-диметиламино)]бутил-2-нафтола (соединения 33 и 34)
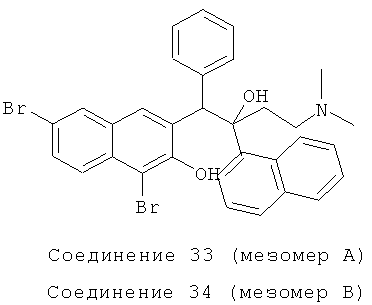
Используя 1,6-дибром-3-бензил-2-нафтол вместо 2-бензил-3-метоксинафталина, процедуры примера 24 повторяют с получением соединения 33 (т.пл.: 186,7-187,2°C) и соединения 34 (т.пл.: 185,8-186,4°C).
Соединение 33: 1H-ЯМР (400 МГц, CDCl3): δ=2,136 (м, 8Н), 2,303-2,378 (м, 1Н), 2,595 (д, J=12,8 Гц, 1Н), 5,454 (с, 1Н), 6,811-6,972 (м, 5Н), 7,375 (т, J=8,0 Гц, 1Н), 7,550-7,591 (м, 2Н), 7,676 (т, J=7,6 Гц, 2Н), 7,768-7,821 (м, 2Н), 7,928 (с, 1Н), 7,988 (д, J=8,0 Гц, 1Н), 8,067 (д, J=9,2 Гц, 1H), 8,355 (д, J=7,2 Гц, 1Н), 12,107 (ушир. с, 1Н). MS (ESI): [M+1]+=618,3.
Соединение 34: 1H-ЯМР (400 МГц, CDCl3): δ=2,084-2,194 (м, 8Н), 2,381 (м, 1Н), 2,554 (м, 1Н), 5,397 (с, 1Н), 7,273-7,384 (м, 6Н), 7,483 (т, J=7,6 Гц, 1Н), 7,597-7,660 (м, 2Н), 7,735 (д, J=8,8 Гц, 1Н), 7,802-7,851 (м, 3H), 8,159 (д, J=7,2 Гц, 1Н), 8,447 (д, J=8,8 Гц, 1H), 12,290 (ушир. с, 1H). MS (ESI): [M+1]+=618,3.
Пример 41: Получение 1-(3-хлорфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 35 и 36)
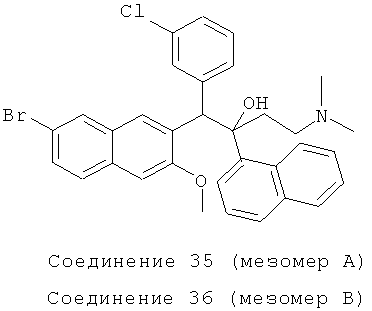
Используя 2-метокси-3-(3-хлорбензил)-6-бромнафталин вместо 2-бензил-3-метоксинафталин, процедуры примера 24 повторяют с получением соединения 35 (т.пл.: 176,8-177,3°C) и соединения 36 (т.пл.: 194,7-195,1°C).
Соединение 35: 1H-ЯМР (400 МГц, CDCl3): δ=1,882-2,157 (м, 9Н), 2,461 (д, J=14,4 Гц, 1Н), 4,084 (с, 3H), 5,999 (с, 1H), 6,781 (т, J=8,0 Гц, 1Н), 6,846 (д, J=8,0 Гц, 1Н), 7,012 (д, J=7,6 Гц, 1Н), 7,166 (с, 1Н), 7,242 (с, 1Н), 7,359 (т, J=8,0 Гц, 1Н), 7,473-7,499 (м, 2Н), 7,580 (д, J=7,6 Гц, 1H), 7,617 (д, J=8,4 Гц, 1Н), 7,688 (д, J=8,0 Гц, 1Н), 7,890 (д, J=8,0 Гц, 1Н), 7,985 (д, J=7,6 Гц, 1Н), 8,031 (д, J=l,2 Гц, 1Н), 8,331 (ушир. с, 1Н), 8,603 (д, J=8,8 Гц, 1H), 8,629 (с, 1H). MS (ESI): [M+1]+=588,6.
Соединение 36: 1H-ЯМР (400 МГц, CDCl3): δ=2,016 (м, 8Н), 2,284 (м, 1Н), 2,492 (д, J=14,0 Гц, 1H), 3,032 (с, 3H), 5,826 (с, 1Н), 6,485 (с, 1Н), 7,204-7,307 (м, 6Н), 7,412 (д, J=7,6 Гц, 1Н), 7,521-7,562 (м, 2Н), 7,779 (д, J=8,0 Гц, 1Н), 7,836 (д, J=7,6 Гц, 1Н), 7,870 (с, 1Н), 7,950 (д, J=7,6 Гц, 2Н), 8,308 (с, 2Н), 8,462 (д, J=8,4 Гц, 1Н). MS (ESI): [M+1]+=588,5.
Пример 42: Получение 1-(3-метилфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 37 и 38)
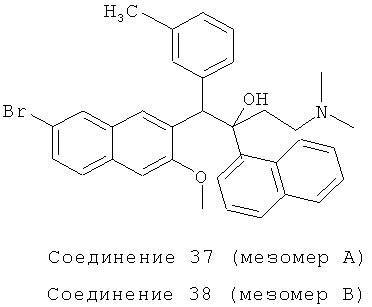
Используя 2-метокси-3-(3-метил бензил)-6-бромнафталин вместо 2-бензил-3-метоксинафталина, процедуры примера 24 повторяют с получением соединения 37 (т.пл.: 190,7-192,3°C) и соединения 38 (т.пл.: 185,6-186,9°C).
Соединение 37: 1H-ЯМР (400 МГц, CDCl3): δ=1,866-1,990 (м, 8Н), 2,009 (с, 3H), 2,089-2,156 (м, 1Н), 2,456 (д, J=14,4 Гц, 1Н), 4,071 (с, 3H), 6,003 (с, 1Н), 6,682 (д, J=7,2 Гц, 1Н), 7,772 (т, J=7,6 Гц, 1Н), 6,889 (с, 1Н), 6,962 (д, J=7,6 Гц, 1Н), 7,151 (с, 1Н), 7,336 (т, J=7,6 Гц, 1Н), 7,457-7,494 (м, 2Н), 7,567-7,619 (м, 2Н), 7,672 (д, J=8,0 Гц, 1Н), 7,883 (д, J=8,0 Гц, 1Н), 7,948 (д, J=7,2 Гц, 1Н), 8,022 (с, 1H), 8,237 (ушир. с, 1Н), 7,646 (д, J=8,8 Гц, 1Н), 8,692 (с, 1Н). MS (ESI): [M+1]+=568,7.
Соединение 38: 1H-ЯМР (400 МГц, CDCl3): δ=1,945-2,004 (м, 8Н), 2,361-2,511 (м, 5Н), 2,922 (с, 3H), 5,822 (с, 1Н), 6,460 (с, 1H), 7,071 (д, J=7,6 Гц, 1Н), 7,197 (т, J=7,6 Гц, 1H), 7,258-7,291 (м, 3H), 7,419 (т, J=7,2 Гц, 1H), 7,530-7,564 (м, 2Н), 7,698 (с, 1Н), 7,781-7,828 (м, 2Н), 7,875-7,894 (м, 2Н), 8,170 (ушир. с, 1Н), 8,298 (с, 1H), 8,519 (д, J=8,8 Гц, 1Н). MS (ESI): [M+1]+=568,5.
Пример 43: Получение 1-(3-метилфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола (соединения 39 и 40)
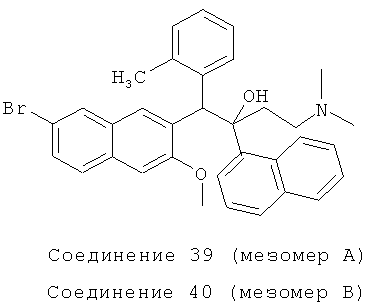
Используя 2-метокси-3-(2-метилбензил)-6-бромнафталин вместо 2-бензил-3-метоксинафталина, процедуры примера 24 повторяют с получением соединения 39 (т.пл.: 198,6-199,8°C) и соединения 40 (т.пл.: 207,8-208,1°C).
Соединение 39: 1H-ЯМР (400 МГц, CDCl3): δ=1,787 (с, 3H), 1,892-2,004 (м, 9Н), 2,615 (д, J=9,6 Гц, 1Н), 4,197 (с, 3H), 6,179 (с, 1Н), 6,610 (д, J=7,2 Гц, 1H), 7,770 (т, J=7,6 Гц, 1H), 6,989 (т, J=7,2 Гц, 1H), 7,188 (с, 1H), 7,366-7,454 (м, 3H), 7,540 (дт, J=l,6, 7,2 Гц, 1Н), 7,614 (т, J=8,0 Гц, 2Н), 7,808 (д, J=7,2 Гц, 1Н), 7,926 (д, J=l,6 Гц, 1Н), 8,119 (с, 1Н), 8,203 (ушир. с, 1Н), 8,222 (д, J=6,4 Гц, 1Н), 8,466 (д, J=7,6 Гц, 1Н), 8,741 (д, J=9,2 Гц, 1H). MS (ESI): [М+1]+=568,7.
Соединение 40: 1H-ЯМР (400 МГц, CDCl3): δ=2,006-2,048 (м, 8Н), 2,399-2,589 (м, 5Н), 2,875 (с, 3H), 6,104 (с, 1Н), 6,458 (с, 1Н), 7,128-7,231 (м, 3H), 7,277-7,293 (м, 3H), 7,425 (т, J=7,6 Гц, 1Н), 7,517-7,588 (м, 2Н), 7,816 (д, J=7,2 Гц, 1Н), 7,856-7,888 (м, 2Н), 8,202 (ушир. с, 1Н), 8,237 (с, 1Н), 8,489-8,539 (м, 2Н). MS (ESI): [M+1]+=568,6.
Пример 44: Определение минимальной ингибиторной концентрации (MIC) соединений против стандартного штамма H37Rv mycobacterium tuberculosis с использованиием Microplate Alamar Blue Assay (микропланшетного анализа с красителем аламар голубой) (МАВА).
Метод: используют стерильный 96-луночный планшет (Falcon3072; Becton Dickinson, Lincoln Park, N.J.). Исследуемое соединение растворяют в диметилсульфоксиде с получением первичного раствора с концентрацией 5 мг/мл. В лунки для самой высокой концентрации добавляют 199 мкл среды для культивирования 7Н9, 1 мкл первичного раствора соединения, и после перемешивания до получения гомогенной смеси, смесь разбавляют дважды в других лунках, последовательно, с тем, чтобы конечные концентрации соединения составляли: 12,5, 6,25, 3,125, 1,56, 0,78, 0,39, 0,2, 0,1, 0,05, 0,025, 0,0125 мкг/мл. Культуру, получаемую от культивирования mycobacterium tuberculosis H37RV в течение 2-3 недель, выбирают для приготовления бактериальной суспензии, инокулируемой в среду для культивирования 7Н9, содержащую 0,05% Tween 80, 10% ADC, статически культивируют при 37°C в течение 1-2 недель, выращивают до тех пор, пока мутность не станет равна 1 по Макфарланду (эквивалент 107 КОЕ/мл), разбавляют 1:20, добавляют в каждую лунку в количестве 100 мкл, конечная концентрация бактериального раствора составляет 106 КОЕ/мл. На каждом планшете 2 лунки, не содержащие антибактериального лекарственного средства, устанавливают как лунки для контроля роста, и 96-луночный планшет инкубируют при 37°C. Через 7 дней, 50 мкл раствора смеси 20 мкл 10× Alamar Blue (продукт Setotec Company) и 5% Tween 80 добавляют в лунки для контроля роста, инкубируют при 37°C в течение 24 час, если цвет изменяется с голубого на розовый, в лунки для различных исследуемых лекарственных средств добавляют указанное выше количество раствора смеси Alamar Blue и Tween 80, инкубируют при 37°C в течение 24 часов и регистрируют цвета лунок, MIC определяют как минимальную концентрацию лекарственного средства, способную предотвратить изменение цвета (с голубого на розовый).
Результаты: Минимальные ингибиторные концентрации (MIC), как определено с помощью МАВА, показаны в таблице 1.
Пример 45: Определение минимальной ингибиторной концентрации (MIC) соединений против клинических штаммов, устойчивых к лекарственным средствам, mycobacterium tuberculosis с использованием Microplate Alamar Blue Assay (MABA)
Процедуры идентичны процедурам примера 44. Клинические штаммы, устойчивые к лекарственным средствам, представляют собой 040 (устойчивый к изониазиду, рифампицину, протионамиду, рифапентину, офлоксацину и оксцину) и 004 (устойчивый к стрептомицину, рифампицину, рифапентину, офлоксацину и канамицину).
Результаты: Минимальные ингибиторные концентрации (MIC), как определено с помощью МАВА, показаны в Таблице 2.
Примечание: 040 (устойчивый к изониазиду, рифампицину, протионамиду, рифапентину, офлоксацину и оксцин) и 004 (устойчивый к стрептомицину, рифампицину, рифапентину, офлоксацину и канамицину).
Пример 46: Эксперименты по острой токсичности соединений
Острую токсичность соединений 4, 16 и 25 предварительно оценивают in vivo на мышах. Животные: самцы мышей BALB/C, 18-20 г/мышь, 3 мыши для контрольной группы и по 5 мышей для каждой из исследуемых групп.
Метод: Суспензии соединения 25: 49 мг/мл (в зависимости от общего количества вводимого соединения); соединения 4 и 16: 50 мг/мл приготавливают в 0,5% CMC по отдельности. Каждой мыши из 3 групп осуществляют пероральное внутрижелудочное введение 0,2 мл лекарственного средства, и дозы, по-отдельности, являются следующими: соединение 25: 490 мг/кг; и соединения 4 и 16: 500 мг/кг. Контрольной группе вводят воду. Сознание, поведение и гибель мышей наблюдают каждый день после введения до окончания 7 дней введения, и выживших мышей вскрывают после 7 дней для наблюдения патологических изменения в тканях. Результаты:
1. Ни одно из животных из 3 групп не погибло в течение 7 дней после однократного введения, и все животные имели хорошее состояние сознания и вели себя нормально.
2. Массы тела животных в группах через 7 дней после однократного введения показаны в таблице 3.
3. При вскрытии не наблюдалось изменений размеров и формы важных органов, таких как печень, селезенка, легкие, сердце, и они не отличались значительно от животных из контрольной группы.
Вывод: В предварительных исследованиях острой токсичности на мышах показано, что не наблюдается гибели или аномалий у животных для соединения 25 при дозе 490 мг/кг, однократно; и для соединений 4 и 16, 500 мг/кг, однократно. Значение LD50 для соединения 25 у мышей равно или больше чем 490 мг/кг; и значения LD50 для соединений 4 и 16 у мышей равны или больше чем 500 мг/кг.
Все документы, как цитируется в настоящей заявке, включаются в текст в качестве ссылок, и когда значения этих документов отличаются от значений настоящего изобретения, должны использоваться значения настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРИДИНА И ИХ ПРИМЕНЕНИЕ ПРОТИВ МИКОБАКТЕРИЙ | 2015 |
|
RU2664587C1 |
| СОЕДИНЕНИЯ ТИЕНИЛ[3, 2-d]ПИРИМИДИН-4-ОН, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2624021C2 |
| СОЕДИНЕНИЕ 2-АМИНОПИРИМИДИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ ДАННОГО СОЕДИНЕНИЯ | 2015 |
|
RU2704129C2 |
| Соединения С,O-спиро-арил-гликозидов, их приготовление и их использование | 2016 |
|
RU2746858C2 |
| ПРОСТОЕ ЭФИРНОЕ ПРОИЗВОДНОЕ НИКОТИНИЛОВОГО СПИРТА, ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЯ | 2017 |
|
RU2735541C2 |
| КЛАСС КОНДЕНСИРОВАННЫХ КОЛЬЦЕВЫХ СОЕДИНЕНИЙ И ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2021 |
|
RU2831125C1 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2010 |
|
RU2581367C2 |
| N-(ФЕНИЛСУЛЬФОНИЛ) БЕНЗАМИДЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ BCL-2 | 2017 |
|
RU2744358C2 |
| N-(ФЕНИЛСУЛЬФОНИЛ) БЕНЗАМИДЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ BCL-2 | 2020 |
|
RU2831159C2 |
| БЕНЗОПРОИЗВОДНЫЕ С ШЕСТИЧЛЕННЫМ КОЛЬЦОМ В КАЧЕСТВЕ ИНГИБИТОРА DPP-4 И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2702644C2 |
Настоящее изобретение относится к новым ароматическим соединениям бутан-2-ола формулы I, к способу их получения, фармацевтической композиции и применению для получения лекарственного средства для лечения и/или профилактики заболевания или расстройства, вызываемого инфекцией туберкулезной бациллы. Соединение формулы I по настоящему изобретению имеют преимущества при лечении и/или профилактике заболевания или расстройства, вызываемого инфекцией туберкулезной бациллы. В соединении формулы I:
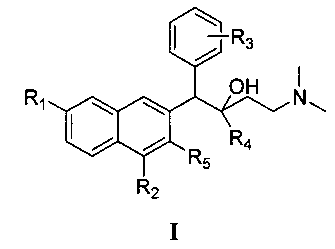
R1 означает водород, фтор, хлор, бром, йод или метокси; R2 означает водород, фтор, хлор, бром или йод; R3 означает водород, фтор, хлор, бром, йод или С1-8-алкил, вставленный в о-, м- или п-положении фенильного кольца; R4 означает фенил, замещенный фенил или нафтил и R5 означает гидрокси или метокси. 6 н. и 5 з.п. ф-лы, 3 табл., 46 пр.
1. Соединение формулы I:

либо его оптический изомер, рацемат, диастереомер, фармацевтически приемлемая соль, при этом:
R1 означает водород, фтор, хлор, бром, йод или метокси;
R2 означает водород, фтор, хлор, бром или йод;
R3 означает водород, фтор, хлор, бром, йод или С1-8-алкил, вставленный в о-, м- или п-положении фенильного кольца;
R4 означает фенил, замещенный фенил или нафтил и
R5 означает гидрокси или метокси;
при условии, что исключается 1-фенил-2-(1-нафтил)-1-[2-(7-бром-3-метокси)-нафтил]-4-(N,N-диметиламино)бутан-2-ол.
2. Соединение формулы I по п. 1 либо его оптический изомер, рацемат, диастереомер, фармацевтически приемлемая соль, при этом:
R1 означает водород, фтор, хлор, бром или йод;
R3 означает водород, фтор, хлор, бром, йод или С1-6-алкил, вставленный в о-, м- или п-положении фенильного кольца;
R4 означает фенил, фенил, замещенный одним или несколькими галогенами, или нафтил и
R5 означает гидрокси или метокси.
3. Соединение формулы I по п. 2 либо его оптический изомер, рацемат, диастереомер, фармацевтически приемлемая соль, при этом:
R1 означает водород, хлор или бром;
R2 означает водород, хлор или бром;
R3 означает водород, хлор, бром или С1-4-алкил, вставленный в о-, м- или п-положении фенильного кольца;
R4 означает фенил, 2-бромфенил, 3-бромфенил, 4-бромфенил, 2, 4-дифторфенил,
3,5-дифторфенил или нафтил и
R5 означает гидрокси или метокси.
4. Соединение формулы I по п. 3 либо его оптический изомер, рацемат, диастереомер, фармацевтически приемлемая соль, при этом:
R1 означает водород или бром;
R2 означает водород или бром;
R3 означает водород, хлор, бром или метил, вставленный в о-, м- или п-положении фенильного кольца;
R5 означает гидрокси или метокси.
5. Соединение, выбранное из группы, состоящей из:
1-(4-хлорфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
1-фенил-2-(4-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
1-фенил-2-(3-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
1-(4-хлорфенил)-2-(3-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
1-(4-хлорфенил)-2-фенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
1,2-дифенил-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
1-(4-хлорфенил)-2-(2-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
1-фенил-2-(2-бромфенил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
1-(4-метилфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
1-фенил-2-(1-нафтил)-1-[2-(4,7-дибром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
1-(3-хлорфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
1-(3-метилфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
1-(3-метилфенил)-2-(1-нафтил)-1-[2-(7-бром-3-метокси)нафтил]-4-(N,N-диметиламино)бутан-2-ола,
либо его оптический изомер, рацемат, диастереомер, фармацевтически приемлемая соль.
6. Соединение по любому из пп. 1-5, которое представляет собой фармацевтически приемлемую соль.
7. Способ получения соединения по п. 1, который включает стадии:
метилирование диметилсульфатом 4,7-замещенного производного 3-гидрокси-2-нафтойной кислоты формулы II:
где R1 и R2 определяются как для соединения формулы I по п. 1,
с получением соединения формулы III:
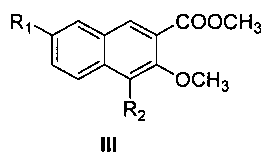
где R1 и R2 определяются как для соединения формулы I по п. 1,
затем восстановление алюмогидридом лития с получением соединения формулы IV:
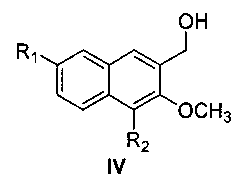
где R1 и R2 определяются как для соединения формулы I по п. 1,
затем окисление диоксидом марганца с получением соединения формулы V:
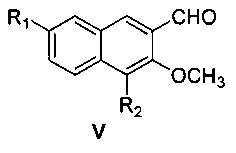
где R1 и R2 определяются как для соединения формулы I по п. 1,
затем реакция нуклеофильного присоединения с замещенным бромбензолом формулы VI в присутствии магниевой стружки:
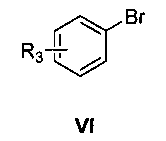
где R3 определяется как для соединения формулы I по п. 1,
с получением соединения формулы VII:
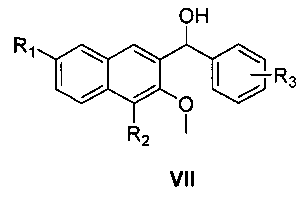
где R1, R2 и R3 определяются как для соединения формулы I по п. 1,
затем восстановление соединения формулы VII смесью трихлорида алюминия и боргидрида натрия с получением соединения формулы VIII:
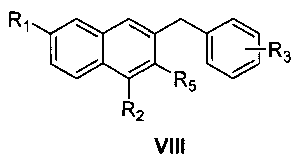
где R1, R2, R3 и R5 определяются как для соединения формулы I по п. 1,
далее реакция Манниха с замещенным ацетильным производным формулы IX:
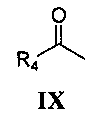
где R4 определяется как для соединения формулы I по п. 1,
а затем подщелачивание с получением соединения формулы X:
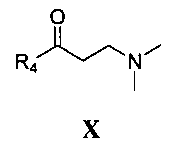
где R4 определяется как для соединения формулы I по п. 1,
после чего реакция нуклеофильного присоединения между соединением формулы VIII и соединением формулы X с получением соединения формулы I:
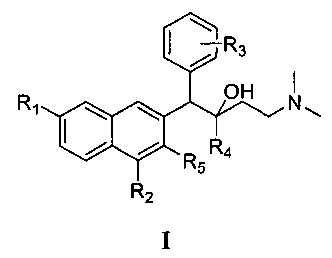
где R1, R2, R3, R4 и R5 определяются как для соединения формулы I по п. 1.
8. Фармацевтическая композиция для лечения и/или профилактики заболевания или расстройства, вызванного инфекцией туберкулезной бациллы, включающая в себя соединение по любому из пп. 1-6 либо его оптический изомер, рацемат, диастереомер, фармацевтически приемлемую соль, а также необязательно один или несколько фармацевтически приемлемых носителей или наполнителей.
9. Применение соединения по любому из пп. 1-6 либо его оптического изомера, рацемата, диастереомера, фармацевтически приемлемой соли либо фармацевтической композиции по п. 8 при получении лекарственного средства для лечения и/или профилактики заболевания или расстройства, вызванного инфекцией туберкулезной бациллы.
10. Способ лечения и/или профилактики заболевания или расстройства, вызванного инфекцией туберкулезной бациллы, у нуждающегося в этом субъекта, который включает введение субъекту терапевтически и/или профилактически эффективного количества соединения формулы I по любому из пп. 1-6 либо его оптического изомера, рацемата, диастереомера, фармацевтически приемлемой соли либо фармацевтической композиции по п. 8.
11. Соединение по любому из пп. 1-6 либо его оптический изомер, рацемат, диастереомер, фармацевтически приемлемая соль для лечения и/или профилактики заболевания или расстройства, вызванного инфекцией туберкулезной бациллы.
| LUI Ping et al., (1R*,2R*)-1-(4-Chlorophenyl)-4-dimethylamino-1-(3-methoxy-2-naphthyl)-2-(1-naphthyl)butan-2-ol, Acta Cryst, 05.06.2010, E66, p.1571 and sup-1-sup-9 expecially p.1571 and sup-1 | |||
| LUI Ping et al., (1R*,2R*)-1-(7-Bromo-3-methoxy- naphthalene-2-yl) -4-(dimethylamino)-2-( naphthalene-1-yl)-1-phenylbutan-2-ol, Acta Cryst,13.feb.2010, E66, |
Авторы
Даты
2016-04-10—Публикация
2011-05-16—Подача