Область техники, к которой относится изобретение
Настоящее изобретение раскрывает простое эфирное производное никотинилового спирта, способ его получения и фармацевтическую композицию и ее применения. В частности, изобретение относится к простым эфирным производным никотинилового спирта, представленным формулой (I), их фармацевтически приемлемой соли, их стереоизомеру, способу их получения, фармацевтической композиции, содержащей одно или более соединений, и применениям соединений в лечении заболеваний, ассоциированных с сигнальными каналами PD-1/PD-L1, таких как рак, инфекционные заболевания и аутоиммунные заболевания.
Уровень техники
С углублением исследований в области иммунологии рака было установлено, что микросреда опухоли может защитить опухолевые клетки от распознавания и гибели под действием иммунной системы человека. Избегание опухолевыми клетками иммунного надзора играет очень важную роль в возникновении и развитии опухолей. В 2013 г. журнал «Science» назвал иммунотерапию опухолей первым из десяти наиболее важных достижений, вновь сделав иммунотерапию «центром внимания» в области лечения рака. Активация или ингибирование иммунных клеток регулируется положительными и отрицательными сигналами, где лиганд-1 программируемой клеточной гибели (PD-1)/PD-1 (PD-L1) является отрицательным иммунорегуляторным сигналом, который ингибирует иммунную активность опухолеспецифических CD8+ T-клеток и опосредует избегание иммунного надзора.
Опухолевые клетки избегают иммунного надзора посредством связывания лиганда программируемой клеточной гибели (PD-L1), экспрессированного на их поверхности, с белком PD-1 Т-клеток. Микросреда опухоли индуцирует высокую экспрессию молекул PD-1 в опухольинфильтрирующих Т-клетках, и опухолевые клетки экспрессируют лиганды PD-1, PD-L1 и PD-L2, на высоком уровне, что приводит к непрерывной активации пути PD-1 в микросреде опухоли. Ингибированные Т-клетки не могут обнаружить опухоль для того, чтобы генерировать сигнал иммунной системе атаковать и привести к гибели опухолевые клетки. Анти-PD-1-антитело против PD-1 или PD-L1 блокирует данный путь посредством предотвращения связывания двух белков и частично восстанавливает функцию Т-клеток, позволяя им убивать опухолевые клетки.
Иммунотерапия на основе PD-1/PD-L1 представляет высокопрофильную иммунотерапию нового поколения, направленную на использование собственной иммунной системы организма для борьбы с опухолями. Она обладает потенциалом лечить многочисленные типы опухолей посредством блокирования сигнального пути PD-1/PD-L1 для индукции апоптоза. Недавно результаты серии интересных исследований подтвердили, что антитела, ингибирующие PD-1/PD-L1, обладают высокой противоопухолевой активностью в отношении различных опухолей, что особенно привлекательно. 4 сентября 2014 г. препарат Кейтруда® (пембролизумаб) от Merck, США, стал первым одобренным FDA моноклональным антителом к PD-1 для лечения пациентов с распространенной или неоперабельной меланомой, которые не отвечали на лечение другими препаратами. В настоящее время MSD исследует потенциальную активность препарата Кейтруда® при более чем 30 различных типах рака, включая различные типы рака крови, рака легких, рака молочной железы, рака мочевого пузыря, рака желудка и рака головы и шеи. 22 декабря 2014 г. фармацевтический гигант Bristol-Myers Squibb взял на себя инициативу для ускоренного получения одобрения Управления по контролю качества пищевых продуктов и лекарственных средств (FDA). Его противораковое иммунотерапевтическое лекарственное средство ниволумаб было занесено под торговым названием Опдиво для лечения пациентов с неоперабельной или метастатической меланомой, которые не отвечали на лечение другими препаратами, и оно является вторым в США ингибитором PD-1 после препарата Кейтруда® от MSD. 4 марта 2015 г. FDA одобрило ниволумаб для лечения метастатического плоскоклеточного немелкоклеточного рака легкого, прогрессировавшего во время проведения химиотерапии на основе препаратов платины или после химиотерапии. Согласно результатам клинического исследования фазы Ib KEYNOTE-028 лечения солидных опухолей препаратом Кейтруда® (пембролизумаб), опубликованным MSD, лечение препаратом Кейтруда® привело к общей частоте ответа на уровне 28% (ORR) у 25 пациентов с мезотелиомой плевры (PM). И 48% пациентов имели стабильное заболевание, и уровень контроля заболеваемости достиг 76%. Пациенты с распространенной лимфомой Ходжкина (HL), у которых отсутствовал ответ на лечение ни одним из одобренных препаратов, смогли достичь полной ремиссии после получения лечения препаратом Кейтруда® от MSD и Опдиво от Bristol-Myers. На ежегодном собрании AACR в 2015 г. Лейша А. Эменс, доктор медицинских наук, доцент в Онкологическом центре Джона Хопкинса Киммела сообщил, что моноклональное антитело к PD-L1 MPDL3280A от Roche оказывает продолжительный противоопухолевый эффект при распространенном тройном негативном раке молочной железы.
Иммунотерапия опухолей считается революцией в лечении рака после терапии, нацеленной на опухоль. Однако терапевтическое лекарственное средство на основе моноклонального антитела имеет свои недостатки: оно легко расщепляется протеазами, следовательно, оно нестабильно в организме, и его нельзя принимать перорально; оно часто вызывает иммунную перекрестную реакцию; качество продукта трудно контролировать, и технология производства является сложной; получение и очистка большого количества затруднены, и стоимость высока; оно неудобно в применении, и его можно только вводить инъекционно или капельно. Следовательно, низкомолекулярные ингибиторы взаимодействия PD-1/PD-L1 являются более хорошим выбором для иммунотерапии опухолей.
Сущность изобретения
Техническая проблема, решаемая настоящим изобретением, заключается в обеспечении простого эфирного производного никотинилового спирта со структурной формулой (I), которое ингибирует взаимодействие PD-1/PD-L1, его стереоизомера и его фармацевтически приемлемой соли, и способа его получения и его фармацевтических композиций и их применения в профилактике или лечении заболевания, ассоциированного с сигнальным путем PD-1/PD-L1.
Технические решения, приведенные ниже, обеспечиваются настоящим изобретением для решения вышеуказанной технической проблемы.
Первым аспектом технического решения является обеспечение простого эфирного производного никотинилового спирта, представленного формулой (I), его стереоизомера и его фармацевтически приемлемой соли:

где:
R1 выбран из  и
и  ;
;
R3 выбран из замещенного C1-C8 насыщенного алкиламино, замещенного C2-C6 ненасыщенного алкиламино, замещенного N-содержащего C2-C6 гетероцикл-1-ила, где каждый является моно-, ди-, три- или тетразамещенным заместителем(ми), выбранным из атома водорода, фтора, хлора, брома, йода, гидрокси, C1-C5 алкила, C1-C5 алкокси, амино, C1-C6 алкиламино, ацетиламино, циано, уреидо (-NH(C=O)NH2), гуанидино (-NH(C=NH)NH2), уреидоамино (-NH-NH(C=O)NH2), гуанидиноамино (-NH-NH(C=NH)NH2), сульфониламино (-NHSO3H), сульфамоила (-SO2NH2), метансульфониламино (-NH-SO2CH3), гидроксиформила (-COOH), C1-C8 алкоксилкарбонила, сульфгидрила, имидазолила, тиазолила, оксазолила, тетразолила,  ,
,
 и
и  ;
;
Х выбран из атома водорода, фтора, хлора, брома, йода, С1-С4 алкила, этенила, трифторметила и метокси.
Предпочтительными являются простые эфирные производные никотинилового спирта, их стереоизомеры и их фармацевтически приемлемые соли, где соединение представлено формулой (IA):

где:
R1 выбран из  и
и  ;
;
R3 выбран из замещенного C1-C8 насыщенного алкиламино, замещенного C2-C6 ненасыщенного алкиламино, замещенного N-содержащего C2-C6 гетероцикл-1-ила, где каждый является моно-, ди-, три- или тетразамещенным заместителем(ми), выбранным из атома водорода, фтора, хлора, брома, йода, гидрокси, C1-C5 алкила, C1-C5 алкокси, амино, C1-C6 алкиламино, ацетиламино, циано, уреидо (-NH(C=O)NH2), гуанидино (-NH(C=NH)NH2), уреидоамино (-NH-NH(C=O)NH2), гуанидиноамино (-NH-NH(C=NH)NH2), сульфониламино (-NHSO3H), сульфамоила (-SO2NH2), метансульфониламино (-NH-SO2CH3), гидроксиформила (-COOH), C1-C8 алкоксилкарбонила, сульфгидрила, имидазолила, тиазолила, оксазолила, тетразолила,  ,
,
 и
и  ;
;
Х выбран из атома водорода, фтора, хлора, брома, йода, С1-С4 алкила, этенила, трифторметила и метокси.
Предпочтительными являются простые эфирные производные никотинилового спирта, их стереоизомеры и их фармацевтически приемлемые соли, где соединение представлено формулой (IA-1):

где:
R3 выбран из замещенного C1-C8 насыщенного алкиламино, замещенного C2-C6 ненасыщенного алкиламино, замещенного N-содержащего C2-C6 гетероцикл-1-ила, где каждый является моно-, ди-, три- или тетразамещенным заместителем(ми), выбранным из атома водорода, фтора, хлора, брома, йода, гидрокси, C1-C5 алкила, C1-C5 алкокси, амино, C1-C6 алкиламино, ацетиламино, циано, уреидо (-NH(C=O)NH2), гуанидино (-NH(C=NH)NH2), уреидоамино (-NH-NH(C=O)NH2), гуанидиноамино (-NH-NH(C=NH)NH2), сульфониламино (-NHSO3H), сульфамоила (-SO2NH2), метансульфониламино (-NH-SO2CH3), гидроксиформила (-COOH), C1-C8 алкоксилкарбонила, сульфгидрила, имидазолила, тиазолила, оксазолила, тетразолила, 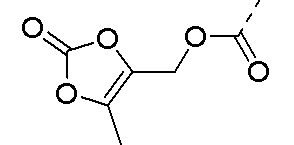 ,
,
 и
и 
Х выбран из атома водорода, фтора, хлора, брома, йода, С1-С4 алкила, этенила, трифторметила и метокси.
Предпочтительными являются простые эфирные производные никотинилового спирта, их стереоизомеры и их фармацевтически приемлемые соли, где соединение представлено формулой (IA-2):

где:
R3 выбран из замещенного C1-C8 насыщенного алкиламино, замещенного C2-C6 ненасыщенного алкиламино, замещенного N-содержащего C2-C6 гетероцикл-1-ила, где каждый является моно-, ди-, три- или тетразамещенным заместителем(ми), выбранным из атома водорода, фтора, хлора, брома, йода, гидрокси, C1-C5 алкила, C1-C5 алкокси, амино, C1-C6 алкиламино, ацетиламино, циано, уреидо (-NH(C=O)NH2), гуанидино (-NH(C=NH)NH2), уреидоамино (-NH-NH(C=O)NH2), гуанидиноамино (-NH-NH(C=NH)NH2), сульфониламино (-NHSO3H), сульфамоила (-SO2NH2), метансульфониламино (-NH-SO2CH3), гидроксиформила (-COOH), C1-C8 алкоксилкарбонила, сульфгидрила, имидазолила, тиазолила, оксазолила, тетразолила, 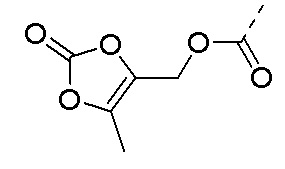 ,
, 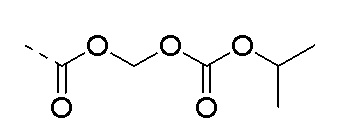 и
и 
Х выбран из атома водорода, фтора, хлора, брома, йода, С1-С4 алкила, этенила, трифторметила и метокси.
Предпочтительными являются простые эфирные производные никотинилового спирта, их стереоизомеры и их фармацевтически приемлемые соли, где соединение представлено вышеуказанными формулами, где R3 выбран из:

где R выбран из метила, этила, пропила, изопропила, бутила, пентила, гексила, гептила, октила; и
Х выбран из атома водорода, фтора, хлора, брома, метила, этенила и трифторметила.
Наиболее предпочтительные соединения выбраны из следующего:
этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината дигидрохлорида

N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серина

(S)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)серината

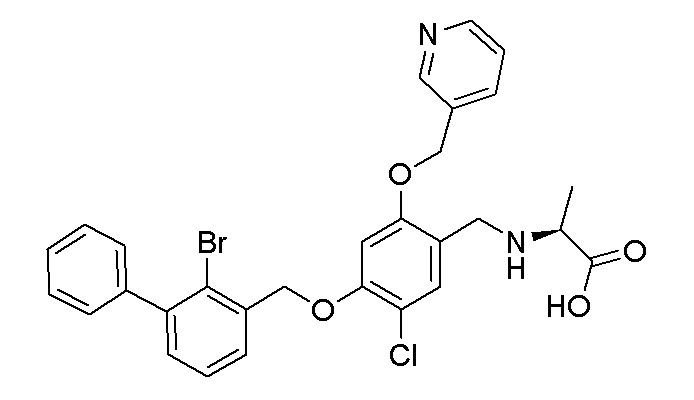
(S)-N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серина

(S)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)серината дигидрохлорида

(S)-изопропил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)серината дигидрохлорида

(R)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината

(R)-N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серина
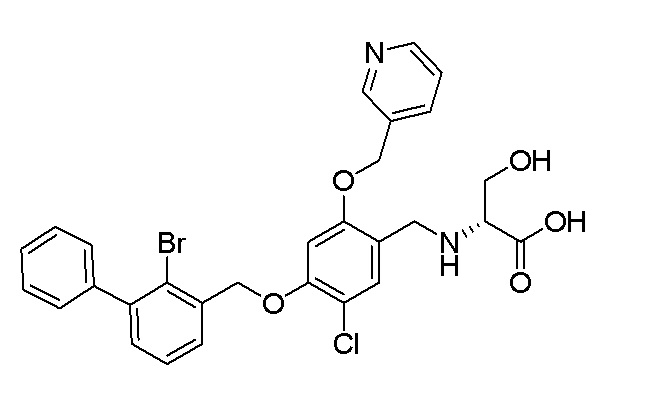
N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)глицина
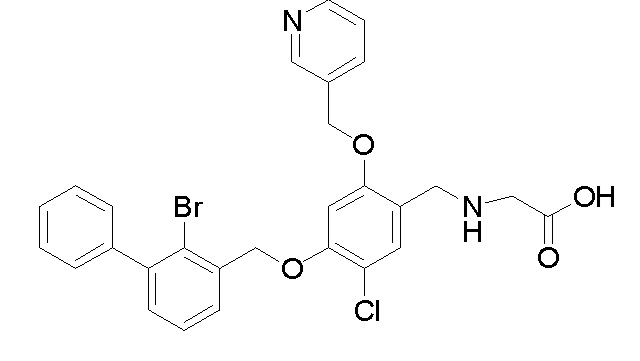
N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)валина

(E)-3-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламино)бут-2-ененитрила

N,N-бис(гидроксиэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламина
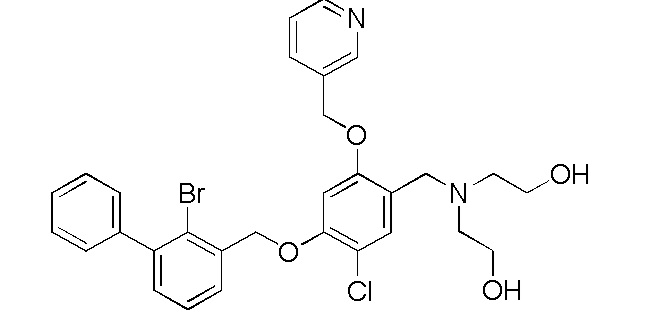
N-(2-метансульфонаминоэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламина

N-(2-ацетиламиноэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламина

(E)-3-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламино)бут-2-еноевой кислоты

2-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламино)этансульфоновой кислоты

N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)лейцина

N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)тирозина

N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)изолейцина
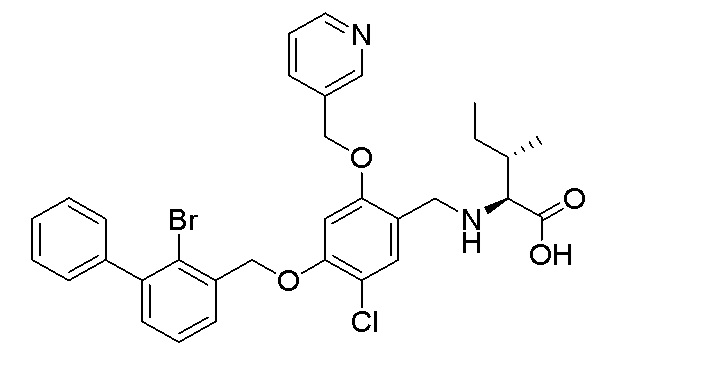
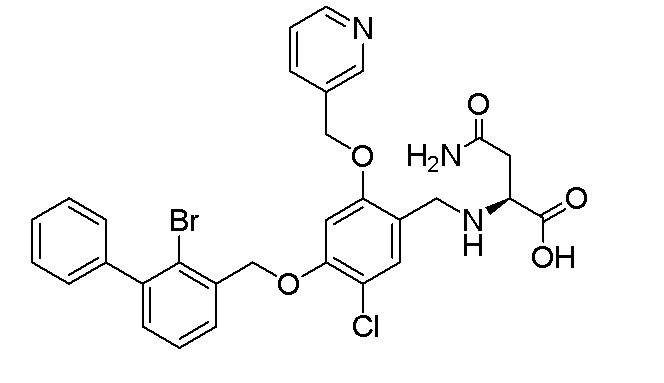
N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)аспарагина
N-(гидроксиэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламина
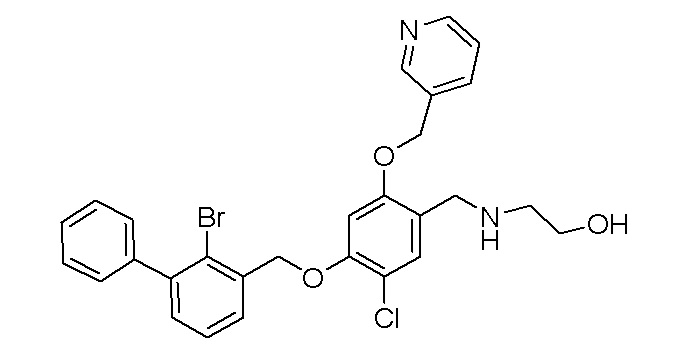
N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)аланина
N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)пролина

(S)-N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината натрия

(S)-(N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината кальция

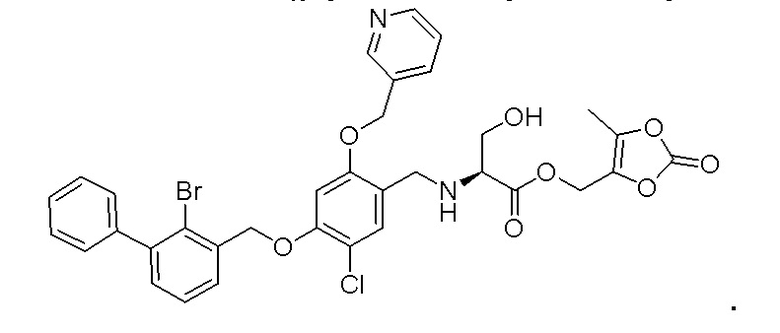
(S)-(5-метил-2-оксо-1,3-диоксол-4-ил)метил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-ил-метиленокси)бензил)серината
Простое эфирное производное никотинилового спирта вышеуказанных формул, его стереоизомер и его фармацевтически приемлемая соль отличаются тем, что фармацевтически приемлемая соль включает соль, образованную неорганической кислотой, соль, образованную органической кислотой, соль иона щелочного металла, соль иона щелочноземельного металла или соль, образованную органическим основанием, которое обеспечивает физиологически приемлемый катион, и соль аммония.
Указанная неорганическая кислота выбрана из хлористоводородной кислоты, бромистоводородной кислоты, фосфорной кислоты или серной кислоты; указанная органическая кислота выбрана из метансульфоновой кислоты, п-толуолсульфоновой кислоты, трифторуксусной кислоты, лимонной кислоты, малеиновой кислоты, винной кислоты, фумаровой кислоты, лимонной кислоты или молочной кислоты; указанный ион щелочного металла выбран из иона лития, иона натрия, иона калия; указанный ион щелочноземельного металла выбран из иона кальция, иона магния; указанное органическое основание, которое обеспечивает физиологически приемлемый катион, выбрано из метиламина, диметиламина, триметиламина, пиперидина, морфолина или трис(2-гидроксиэтил)амина.
Второй аспект настоящего изобретения обеспечивает способ получения соединений по первому аспекту.
Для получения соединений формулы (I), согласно их структуре, способ получения разделяется на пять стадий.

(а) 2-бром-3-иодтолуол 1 и бензолбороновую кислоту или замещенную бензолбороновую кислоту или сложный эфир борной кислоты и бензола или замещенного бензола в качестве исходных соединений подвергают взаимодействию посредством реакции сочетания Сузуки с получением промежуточного соединения 2;
(b) промежуточное соединение 2 в качестве исходного соединения подвергают бромированию метильной группы реагентом для бромирования с получением промежуточного бромсодержащего соединения 3;
(c) промежуточное соединение 3 в качестве исходного соединения подвергают взаимодействию с 2,4-дигидрокси-X-замещенным бензальдегидом в щелочных условиях с получением промежуточного соединения простого бензиларилового эфира 4;
(d) промежуточное соединение 4 в качестве исходного соединения подвергают взаимодействию с пиридин-3-илметиленгалогенидом в щелочных условиях с получением промежуточного соединения 5;
(e) промежуточное соединение 5, содержащее альдегидную группу, в качестве исходного соединения конденсируют с HR3, содержащим аминогруппу или иминогруппу, и полученный продукт восстанавливают с получением целевого соединения I.
R1, R3 и X каждый имеет значения, определенные в первом аспекте.
Кроме того, исходные соединения и промежуточные соединения в вышеуказанной реакции легко получают, и каждую стадию реакции можно легко осуществить в соответствии с методами, опубликованными в литературе, или квалифицированным специалистом в данной области техники обычным способом органического синтеза. Соединение формулы I может находиться в сольватированной или несольватированной формах, и кристаллизация из разных растворителей может привести к получению различных сольватов. Фармацевтически приемлемые соли формулы (I) включают различные кислотно-аддитивные соли, такие как кислотно-аддитивные соли следующих неорганических или органических кислот: хлористоводородной кислоты, бромистоводородной кислоты, фосфорной кислоты, серной кислоты, метансульфоновой кислоты, п-толуолсульфоновой кислоты, трифторуксусной кислоты, лимонной кислоты, малеиновой кислоты, винной кислоты, фумаровой кислоты, лимонной кислоты, молочной кислоты. Фармацевтически приемлемые соли формулы I также включают различные соли щелочных металлов, такие как соли лития, натрия, калия; различные соли щелочноземельных металлов, такие как соли кальция, магния и соли аммония; и различные соли органических оснований, которые обеспечивают физиологически приемлемые катионы, такие как соли метиламина, диметиламина, триметиламина, пиперидина, морфолина и соли трис(2-гидроксиэтил)амина. Все эти соли в пределах объема изобретения могут быть получены обычными способами. Во время получения соединений формулы (I) и их сольватов или солей, поликристаллическая или эвтектическая форма может образоваться при различных условиях кристаллизации.
Третий аспект настоящего изобретения обеспечивает фармацевтическую композицию, содержащую простое эфирное производное никотинилового спирта по первому аспекту настоящего изобретения и его стереоизомер, и фармацевтически приемлемую соль в качестве активного ингредиента и фармацевтически приемлемый носитель или эксципиент.
Изобретение также относится к фармацевтической композиции, содержащей соединение по изобретению в качестве активного ингредиента. Фармацевтическая композиция может быть приготовлена в соответствии со способами, хорошо известными в данной области. Любая лекарственная форма, подходящая для применения человеку или животному, может быть получена объединением соединения по изобретению с одним или более фармацевтически приемлемыми эксципиентами и/или адъювантами в твердом или жидком состоянии. Содержание соединения по настоящему изобретению в его фармацевтической композиции обычно составляет от 0,1% до 95% по массе.
Соединение по настоящему изобретению или фармацевтическую композицию, содержащую его, можно вводить в разовой лекарственной форме, энтеральным или парентеральным путем, таким как пероральный, внутривенный, внутримышечный, подкожный, интраназальный путь, через слизистую оболочку ротовой полости, при введении в глаз, легкие и дыхательные пути, кожу, влагалище, прямую кишку и т. д.
Лекарственная форма может представлять собой жидкую лекарственную форму, твердую лекарственную форму или полутвердую лекарственную форму. Жидкие лекарственные формы могут представлять раствор (включая истинный раствор и коллоидный раствор), эмульсию (включая типа масло-в-воде, вода-в-масле и двойную эмульсию), суспензию, инъекцию (включая водную инъекцию, порошковую инъекцию и инфузию), глазные капли, назальные капли, лосьоны, линименты и т.д.; твердые лекарственные формы могут представлять таблетки (включая обычные таблетки, таблетки с энтеросолюбильным покрытием, пастилки, диспергируемые таблетки, жевательные таблетки, шипучие таблетки, перорально распадающиеся таблетки), капсулы (включая твердые капсулы, мягкие капсулы, капсулы с энтеросолюбильным покрытием), гранулы, порошки, пилюли, каплевидные таблетки, суппозитории, пленки, пластыри, газовые (порошковые) спреи, спреи и т.д.; полутвердые лекарственные формы могут представлять мази, гель, пасту и т.д.
Соединения по настоящему изобретению можно формулировать в виде обычных препаратов, а также препаратов с замедленным высвобождением, препаратов с контролируемым высвобождением, нацеленных препаратов и различных систем доставки на основе микрочастиц.
Для формования таблеток на основе соединения по настоящему изобретению можно использоваться различные эксципиенты, известные в данной области, включая разбавители, связующие, смачивающие агенты, дезинтегрирующие агенты, смазывающие вещества и скользящие вещества. Разбавителем может быть крахмал, декстрин, сахароза, глюкоза, лактоза, маннит, сорбит, ксилит, микрокристаллическая целлюлоза, сульфат кальция, гидрофосфат кальция, карбонат кальция и т.д.; смачивающий агент может представлять воду, этанол или изопропанол и т.д.; связующим веществом может быть крахмальный сироп, декстрин, сироп, мед, раствор глюкозы, микрокристаллическая целлюлоза, смола акации, желатин, натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, этилцеллюлоза, акриловая смола, карбомер, поливинилпирролидон, полиэтиленгликоль и т.д.; дезинтегрирующие агенты могут представлять сухой крахмал, микрокристаллическую целлюлозу, низкозамещенную гидроксипропилцеллюлозу, сшитый поливинилпирролидон, кроскармеллозу натрия, натрия карбоксиметилкрахмал, гидрокарбонат натрия и лимонную кислоту, сложный эфир полиоксиэтиленсорбитана и жирной кислоты, додецилсульфонат натрия и т.д.; смазывающим веществом и скользящим веществом могут быть тальк, диоксид кремния, стеарат, винная кислота, жидкий парафин, полиэтиленгликоль и т.д.
Таблетки также могут быть дополнительно формулированы в виде таблеток с покрытием, таких как таблетки с сахарной оболочкой, таблетки с пленочной оболочкой, таблетки с энтеросолюбильной оболочкой или двухслойные таблетки и многослойные таблетки.
Для приготовления разовой лекарственной формы в виде капсулы, активный ингредиент, представляющий соединение по настоящему изобретению, может быть смешан с разбавителем, скользящим веществом, и смесь может быть непосредственно помещена в твердую капсулу или мягкую капсулу. Активный ингредиент также можно формулировать в виде гранулы или пилюли с разбавителем, связующим веществом, дезинтегрирующими агентами и затем помещен в твердую или мягкую капсулу. Также для приготовления капсул на основе соединения по изобретению можно использовать различные разбавители, связующие, смачивающие агенты, дезинтегрирующие агенты и скользящие агенты, которые применяются для приготовления таблеток на основе соединения по изобретению.
Для получения соединения по настоящему изобретению в виде инъекционной формы в качестве растворителя можно использовать воду, этанол, изопропанол, пропиленгликоль или их смесь. Кроме того, может быть добавлено соответствующее количество солюбилизирующего агента, сорастворителя, агента, регулирующего рН, и агента, регулирующего осмотическое давление, которые обычно используются в данной области. Солюбилизирующий агент или сорастворитель может представлять собой полоксамер, лецитин, гидроксипропил-β-циклодекстрин и т.д.; агент, регулирующий рН, может представлять фосфат, ацетат, соляную кислоту, гидроксид натрия и т.д.; агент, регулирующий осмотическое давление, может представлять хлорид натрия, маннит, глюкозу, фосфат, ацетат и т. д. Для приготовления лиофилизированного порошка для инъекций в качестве наполнителя также могут быть добавлены маннит, глюкоза и т.д.
Кроме того, красители, консерванты, отдушки, ароматизаторы или другие добавки также могут быть добавлены к фармацевтическим препаратам при необходимости.
Соединение или фармацевтическую композицию по настоящему изобретению можно вводить любым известным способом введения с целью введения и усиления терапевтического эффекта.
Дозировка соединения или фармацевтической композиции по настоящему изобретению может широко варьироваться, в зависимости от природы и тяжести заболевания, которое нужно профилактировать или лечить, индивидуального состояния пациента или животного, пути введения и лекарственной формы и т. д. В общем, подходящая суточная доза соединения по изобретению будет варьироваться от 0,001 до 150 мг/кг массы тела, предпочтительно от 0,01 до 100 мг/кг массы тела. Вышеуказанные дозировки могут вводиться в виде разовой лекарственной формы или в виде разделенных доз в зависимости от клинического опыта врача и режима дозирования, включая использование других терапевтических средств.
Соединения или композиции по изобретению можно вводить самостоятельно или в комбинации с другими терапевтическими или симптоматическими препаратами. Когда соединение по настоящему изобретению обладает синергическим эффектом с другими терапевтическими агентами, то его дозировку следует корректировать в соответствии с реальной ситуацией.
Четвертый аспект настоящего изобретения относится к простому эфирному производному никотинилового спирта или его стереоизомеру или его фармацевтически приемлемой соли, которые используются для получения лекарственного средства, пригодного для профилактики и/или лечения заболевания, ассоциированного с сигнальным путем PD-1/PD-L1.
Заболевание, ассоциированное с сигнальным путем PD-1/PD-L1, выбрано из рака, инфекционных заболеваний и аутоиммунных заболеваний. Рак выбран из рака кожи, рака легкого, опухоли органов мочевой системы, гематологической опухоли, рака молочной железы, глиомы, опухоли органов пищеварительной системы, опухоли органов репродуктивной системы, лимфомы, опухоли нервной системы, опухоли головного мозга, рака головы и шеи. Инфекционное заболевание выбрано из бактериальной инфекции и вирусной инфекции. Аутоиммунное заболевание выбрано из органоспецифического аутоиммунного заболевания, системного аутоиммунного заболевания, где органоспецифическое аутоиммунное заболевание включает хронический лимфоцитарный тиреоидит, гипертиреоз, инсулинозависимый сахарный диабет, миастению, язвенный колит, злокачественную анемию с хроническим атрофическим гастритом, геморрагический легочно-почечный синдром, первичный билиарный цирроз, рассеянный цереброспинальный склероз и острый идиопатический полиневрит. И системные аутоиммунные заболевания включают ревматоидный артрит, системную красную волчанку, системный васкулит, склеродермию, пемфигус, дерматомиозит, смешанное заболевание соединительной ткани, аутоиммунную гемолитическую анемию.
Преимущественные технические эффекты
Соединения по настоящему изобретению обладают высокой ингибирующей активностью в отношении взаимодействия PD-1/PD-L1, которая существенно выше, чем у соединений, о которых имеются сообщения. Они обладают сильной способностью связывать белок PD-L1, и значение KD аффинности может достигать 2,025E-11, что даже выше, чем для антител к PD-L1, о которых имеются сообщения в литературе. Данные соединения также обладают способностью ослаблять ингибирование IFN-γ под действием PD-L1, значение IC50 которого может достигать уровня 1,8 × 10-10 моль/л. Фармакодинамические исследования in vivo показали, что соединения могут достоверно ингибировать рост подкожных опухолей как по объему, так и по массе опухолей. Количество лимфоцитов в крови и селезенке мышей может быть явно увеличено.
Примеры
Изобретение далее иллюстрируется следующими примерами; однако изобретение не ограничивается иллюстративными примерами, приведенными ниже.
Измерительный прибор. Спектроскопию ядерного магнитного резонанса проводили с использованием спектрометра ядерного магнитного резонанса Vaariaan Mercury 300. Масс-спектрометрию проводили с использованием масс-спектрометра ZAD-2F и масс-спектрометра VG300.
Пример 1: этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат дигидрохлорид

2-Бром-3-метил-1,1'-бифенил:
В колбу емкостью 100 мл при перемешивании добавляли 2-бром-3-иодтолуол (700 мг) и смесь диоксан/вода (объемное соотношение 5/1). Раствор барботировали аргоном в течение 10 мин для удаления растворенного кислорода. Затем последовательно добавляли фенилбороновую кислоту (350 мг), карбонат цезия (1800 мг) и тетракис(трифенилфосфин)палладий (80 мг). Смесь перемешивали в течение 12 ч при 80-100°C в атмосфере аргона. Реакцию останавливали. После охлаждения до комнатной температуры смесь фильтровали через диатомитовый фильтр. Фильтрат концентрировали при пониженном давлении и трижды экстрагировали водой и этилацетатом. Органическую фазу объединяли, промывали насыщенным раствором соли и высушивали над безводным сульфатом натрия. Органический слой фильтровали и упаривали при пониженном давлении досуха с получением 2-бром-3-метил-1,1'-бифенила в виде бесцветного масла (480 мг). 1H ЯМР (400 МГц, ДМСО-d6), δ 7,49-7,29 (м, 7H, Ar-H), 7,14 (д, 1H, Ar-H), 2,42 (с, 3H, Ar-CH3). МС (FAB): 248 (М+1).
2-Бром-3-(бромметил)-1,1'-бифенил:
2-Бром-3-метил-1,1'-бифенил (450 мг) в качестве исходного вещества взвешивали и растворяли в 40 мл CCl4 в колбе емкостью 100 мл. К этому раствору добавляли NBS (360 мг) при перемешивании. И смесь нагревали до 80°С и кипятили с обратным холодильником. Затем добавляли пероксид бензоила (8 мг) и через 2 ч снова добавляли пероксид бензоила (8 мг), и реакцию продолжали в течение еще 2 ч. Реакция останавливали. После охлаждения до комнатной температуры смесь гасили водой, экстрагировали дихлорметаном и водой. Органическую фазу промывали насыщенным раствором соли и высушивали над безводным сульфатом натрия. Органический слой фильтровали и упаривали при пониженном давлении досуха с получением 2-бром-3-(бромметил)-1,1'-бифенила в виде желтого масла (380 мг), которое использовали на следующей стадии без дополнительной очистки.
4-(2-Бром-3-фенилбензилокси)-5-хлор-2-гидроксибензальдегид:
5-Хлор-2,4-дигидроксибензальдегид (160 мг) взвешивали и растворяли в 12 мл безводного ацетонитрила в колбе емкостью 50 мл и добавляли гидрокарбонат натрия (200 мг). После перемешивания при комнатной температуре в течение 40 мин к реакционной смеси медленно добавляли по каплям через капельную воронку при постоянном давлении 2-бром-3-фенилбензилбромид (380 мг, растворенный в 16 мл ДМФА) и нагревали до температуры кипения с обратным холодильником до окончания реакции. После охлаждения до комнатной температуры смесь экстрагировали водой и этилацетатом. Органическую фазу промывали насыщенным раствором соли и высушивали над безводным сульфатом натрия, затем фильтровали и упаривали при пониженном давлении досуха. Неочищенный остаток очищали колоночной хроматографией на силикагеле с получением 4-(2-бром-3-фенилбензилокси)-5-хлор-2-гидроксибензальдегида (300 мг) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 10,99 (с, 1H, -OH), 10,03 (с, 1H, -CHO), 7,64 (д, 1H, Ar-H), 7,57 (д, 1H, Ar-H), 7,45 (м, 4H, Ar-H), 7,37 (д, 2H, Ar-H), 6,67 (д, 1H, Ar-H), 6,59 (с, 1H, Ar-H), 5,25 (с, 2Н, -СН2-). МС (FAB): 418 (М+1).
4-(2-Бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензальдегид:
4-(2-Бром-3-фенилбензилокси)-5-хлор-2-гидроксибензальдегид (100 мг) растворяли в 6 мл ДМФА в колбе емкостью 50 мл, и затем добавляли карбонат цезия (127,53 мг). После перемешивания при комнатной температуре в течение 15 мин по каплям добавляли раствор 3-бромметиленпиридина (76,65 мг) в ДМФА (4 мл). После перемешивания смеси при 80°С в течение 2 ч, реакцию останавливали. После охлаждения до комнатной температуры смесь экстрагировали водой и этилацетатом. Органическую фазу промывали насыщенным раствором соли и высушивали над безводным сульфатом натрия, затем фильтровали и упаривали при пониженном давлении досуха. Неочищенный остаток очищали колоночной хроматографией на силикагеле с получением белого твердого вещества (70 мг). 1H ЯМР (400 МГц, ДМСО-d6) δ 10,26 (с, 1H, -CHO), 8,00 (с, 1H, Ar-H) 7,83 (дд, 2H, Ar-H), 7,72 (д, 1H, Ar-H), 7,61 (т, 2H, Ar-H), 7,55-7,23 (м, 6H, Ar-H), 6,95 (с, 1H, Ar-H), 6,81 (д, 1H, Ar-H), 5,35 (с, 2H, -CH2-), 5,30 (с, 2H, -CH2-). МС (FAB): 510 (М+1).
Этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат дигидрохлорид:
4-(2-Бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензальдегид (80 мг) растворяли в 5 мл ДМФА, и затем добавляли рацемический этиловый эфир серина (59 мг) и ледяную уксусную кислоту (57 мг). После перемешивания при комнатной температуре в течение 20 мин добавляли цианоборогидрид натрия (25 мг) и смесь перемешивали при 25°C в течение 14 ч. Реакцию останавливали. Смесь экстрагировали водой и этилацетатом. Органическую фазу промывали насыщенным раствором соли и высушивали над безводным сульфатом натрия, затем фильтровали и упаривали при пониженном давлении досуха. Остаток растворяли в этаноле, нагревали до температуры кипения с обратным холодильником до завершения реакции. Смесь упаривали досуха. Неочищенный остаток очищали колоночной хроматографией на силикагеле с получением этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината (60 мг) в виде желтого масла. Затем продукт подвергали взаимодействию с раствором хлористого водорода в этиловом спирте с получением N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината дигидрохлорида в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,65 (с, 1H, -HCl), 9,41 (с, 1H, -HCl), 9,06 (с, 1H, -ArH), 8,88-8,76 (м, 1H, - ArH), 8,56 (д, J=7,9 Гц, 1H, -ArH), 8,01-7,86 (м, 1H, -ArH), 7,64 (д, J=13,4 Гц, 2H, -ArH), 7,56-7,30 (м, 7H, -ArH), 7,12 (с, 1H, -ArH), 5,42 (с, 2H, -CH2-), 5,32 (с, 2H, -CH2-), 4,18 (с, 2H, -CH2-), 4,13-4,07 (м, 1H, -CH-), 4,04 (м, 2H, -CH2-), 3,94 (дд, 1H, -CH2-), 3,82 (дд, 1H, -CH2-), 1,15 (т, J=7,1 Гц, 3H, -CH3). МС (FAB): 626 (М).
Пример 2: N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)серин
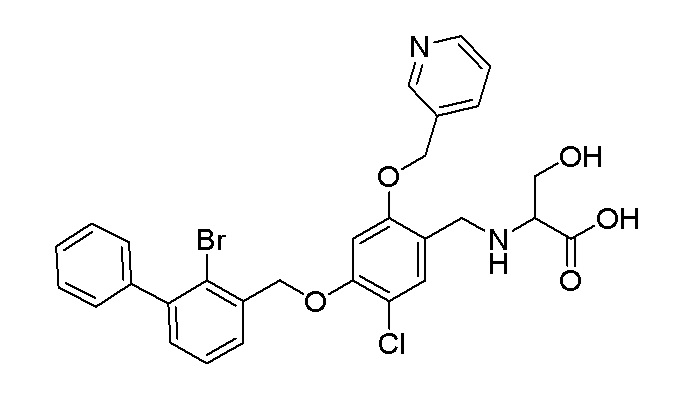
Этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат в виде бледно-желтого масла (60 мг) растворяли в смеси метанол/H2O (4 мл/1 мл), и затем добавляли моногидрат гидроксида лития (20 мг). После перемешивания при комнатной температуре в течение 2 ч к смеси на ледяной бане добавляли несколько капель уксусной кислоты для доведения рН до кислого значения. Смесь фильтровали при пониженном давлении с получением N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серина (45 мг) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,73 (с, 1H, -ArH), 8,55 (д, 1H, -ArH), 7,97 (д, 1H, -ArH), 7,65 (д, 1H, -ArH) 7,54-7,51 (м, 2H, -ArH), 7,47 (д, 2H, -ArH), 7,44 (д, 1H, -ArH), 7,42-7,40 (м, 2H, -ArH), 7,39-7,36 (м, 2H, -ArH), 7,11 (с, 1H, -ArH), 5,32 (с, 2H, -CH2-), 5,28 (м, 2H, -CH2-), 3,94 (с, 2H, -CH2-), 3,69 (дд, 1H, -CH2-), 3,62 (дд, 1H, -CH2-), 3,16 (т, 1H, -CH-). МС (FAB): 599 (М+1).
Пример 3: (S)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат

Процедура была аналогичной описанной в примере 1, за исключением того, что этиловый эфир L-серина использовали вместо рацемического этилового эфира серина с получением (S)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,68 (д, J=2,1 Гц, 1H, -ArH), 8,55 (дд, J=4,8, 1,7 Гц, 1H, -ArH), 7,88 (д, J=7,9 Гц, 1H, -ArH), 7,65 (дд, J=7,6, 1,7 Гц, 1H, -ArH), 7,54-7,45 (м, 3H, -ArH), 7,45-7,35 (м, 6H, -ArH), 7,06 (с, 1H, -ArH), 5,30 (с, 2H, -CH2-), 5,24 (с, 2H, -CH2-), 4,81 (т, J=5,8 Гц, 1H, -CH-), 3,99 (кв., J=7,1 Гц, 2H, -CH2-), 3,74-3,57 (м, 2H, -CH2-), 3,54 (т, J=5,6 Гц, 2H, -CH2-), 1,12 (т, J=7,1 Гц, 3Н, -СН3). МС (FAB): 626 (М).
Пример 4: (S)-N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серин

Процедура была аналогичной описанной в примере 2, за исключением того, что (S)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат использовали вместо рацемического этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)серината с получением (S)-N-(4)-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,73 (с, 1H, -ArH), 8,55 (д, J=4,7 Гц, 1H, -ArH), 7,97 (д, J=7,9 Гц, 1H, -ArH), 7,65 (д, J=8,7 Гц, 1H, -ArH), 7,54-7,51 (м, 2H, -ArH), 7,47 (д, J=7,7 Гц, 2H, -ArH), 7,44 (д, J=1,7 Гц, 1H, -ArH), 7,42-7,40 (м, 2H, -ArH), 7,39-7,36 (м, 2H, -ArH), 7,11 (с, 1H, -ArH), 5,32 (с, 2H, -CH2-, 5,28 (м, 2H, -CH2-), 3,94 (с, 2H, -CH2-), 3,69 (дд, J=11,1, 4,7 Гц, 1H, -CH2-), 3,62 (дд, J=11,1, 6,2 Гц, 1H, -CH2-), 3,16 (т, J=5,4 Гц, 1H, -CH-). МС (FAB): 599 (М+1). [α]27D=-1,84 (С=0,434, ДМСО).
Пример 5: (S)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат дигидрохлорид

(S)-N-(4-(2-Бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серин (598 мг) и 60 мл безводного этанола помещали в круглодонную колбу емкостью 100 мл. К смеси добавляли 6 мл дихлорсульфоксида и две капли ДМФА при перемешивании на бане с ледяной водой. И после того, как смесь перемешивали при комнатной температуре в течение 2 ч, ее нагревали до кипения с обратным холодильником до завершения реакции. Смесь концентрировали при пониженном давлении для удаления растворителя, и получали (S)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил) серината дигидрохлорида в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,65 (с, 1H, -HCl), 9,41 (с, 1H, -HCl), 9,06 (с, 1H, -ArH), 8,88-8,76 (м, 1H, -ArH), 8,56 (д, J=7,9 Гц, 1H, -ArH), 8,01-7,76 (м, 1H, -ArH), 7,64 (д, J=13,4 Гц, 2H, -ArH), 7,56-7,30 (м, 7H, -ArH), 7,12 (с, 1H, -ArH), 5,42 (с, 2H, -CH2-), 5,32 (с, 2H, -CH2-), 4,18 (с, 2H, -CH2-), 4,13-4,07 (м, 1H, -CH-), 4,04 (м, 2H, -CH2-), 3,94 (дд, J=12,1, 2,9 Гц, 1H, -CH2-), 3,82 (дд, J=12,1, 3,8 Гц, 1H, -CH2-), 1,15 (т, J=7,1 Гц, 3H, -CH3). МС (FAB): 626 (М). [α]27D=-1,90 (C=0,422, этанол).
Пример 6: (S)-изопропил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат дигидрохлорид
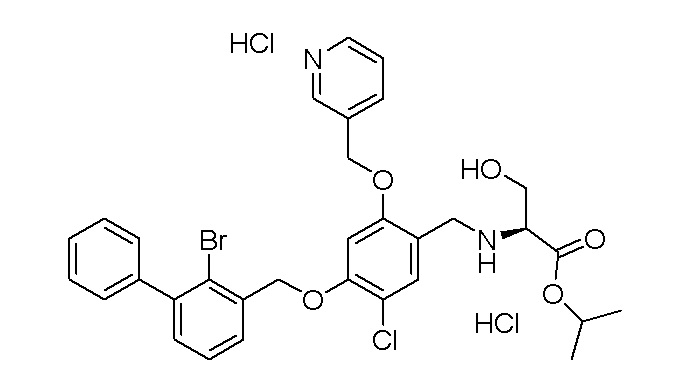
(S)-N-(4-(2-Бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серин (598 мг) и 60 мл безводного изопропанола помещали в круглодонную колбу емкостью 100 мл. К смеси добавляли 6 мл дихлорсульфоксида и две капли ДМФА при перемешивании на бане с ледяной водой. И после того, как смесь перемешивали при комнатной температуре в течение 2 ч, ее нагревали до кипения с обратным холодильником до завершения реакции. Смесь концентрировали при пониженном давлении для удаления растворителя, и получали (S)-изопропил N- (4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси) бензил)серината дигидрохлорида в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,62 (с, 1H, -HCl), 9,40 (с, 1H, -HCl), 9,10 (с, 1H, -ArH), 8,86 (д, 1H, -ArH), 8,59 (д, J=7,6 Гц, 1H, -ArH), 8,01-7,91 (м, 1H, -ArH), 7,73-7,64 (м, 2H, -ArH), 7,57-7,46 (м, 3H, -ArH), 7,46-7,37 (м, 4H, -ArH), 7,16 (с, 1H, -ArH), 5,47 (с, 2H, -CH2-), 5,36 (с, 2H, -CH2-), 4,92 (м, 1H, -CH-), 4,30-4,15 (м, 2H, -CH2-), 4,05 (с, 1H, -CH-), 3,97 (дд, J=12,0, 3,0 Гц, 1H, - CH2-), 3,84 (дд, J=12,0, 3,8 Гц, 1H, -CH2-), 1,20 (д, J=6,4 Гц, 3H, -CH3), 1,18 (д, J=6,4 Гц, 3H, -CH3). МС (FAB): 640 (M). [α]27D=-5,33 (C=0,075, метанол).
Пример 7: (R)-Этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат

Процедура была аналогичной описанной в примере 1, за исключением того, что этиловый эфир D-серина использовали вместо рацемического этилового эфира серина с получением (R)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,68 (д, 1H, -ArH), 8,55 (дд, 1H, -ArH), 7,88 (д, 1H, -ArH), 7,65 (дд, J=7,6, 1,7 Гц, 1H, -ArH), 7,54-7,45 (м, 3H, -ArH), 7,45-7,35 (м, 6H, -ArH), 7,06 (с, 1H, -ArH), 5,30 (с, 2H, -CH2), 5,24 (с, 2H, -CH2-), 4,81 (т, J=5,8 Гц, 1H, -CH-), 3,99 (кв, J=7,1 Гц, 2H, -CH2-), 3,74-3,57 (м, 2H, -CH2-), 3,54 (т, 2H, -CH2-), 1,12 (т, J=7,1 Гц, 3H, -CH3). МС (FAB): 626 (М).
Пример 8: (R)-N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)серин

Процедура была аналогичной описанной в примере 2, за исключением того, что (R)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат использовали вместо рацемического этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината с получением (R) -N-(4)-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,73 (с, 1H, -ArH), 8,55 (д, J=4,7 Гц, 1H, -ArH), 7,97 (д, J=7,9 Гц, 1H, -ArH), 7,65 (д, J=8,7 Гц, 1H, -ArH), 7,54-7,51 (м, 2H, -ArH), 7,47 (д, J=7,7 Гц, 2H, -ArH), 7,44 (д, J=1,7 Гц, 1H, -ArH), 7,42-7,40 (м, 2H, -ArH), 7,39-7,36 (м, 2H, -ArH), 7,11 (с, 1H, -ArH), 5,32 (с, 2H, -CH2-), 5,28 (м, 2H, -CH2-), 3,94 (с, 2H, -CH2-), 3,69 (дд, J=11,1, 4,7 Гц, 1H, -CH2-), 3,62 (дд, J=11,1, 6,2 Гц, 1H, -CH2-), 3,16 (т, J=5,4 Гц, 1H, -CH-). МС (FAB): 599 (М+1). [α]
Пример 9: (S)-N-(4-(2-хлор-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)серин
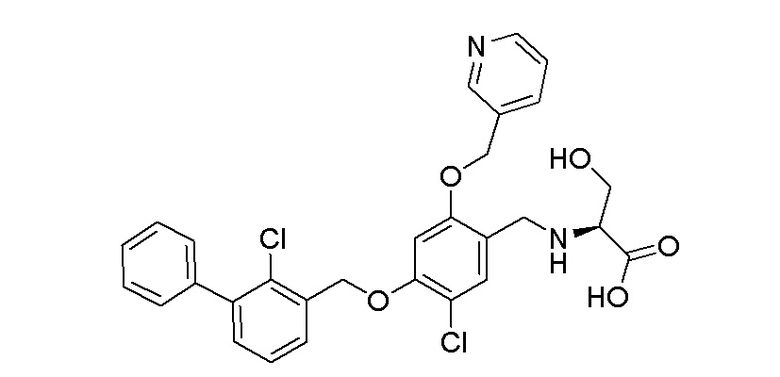
Процедура была аналогичной описанной в примере 1, за исключением того, что 4-(2-хлор-3-фенилбензилокси)-5-хлор-(пиридин-3-илметиленокси)бензальдегид использовали вместо 4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензальдегида и этиловый эфир L-серина использовали вместо рацемического этилового эфира серина с получением (S)-этил N-(4)-(2-хлор-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината.
Процедура была аналогичной описанной в примере 2, за исключением того, что (S)-этил N-(4-(2-хлор-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат использовали вместо этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината с получением (S)-N-(4-(2-хлор-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,69 (с, 1H, -ArH), 8,51 (д, J=4,6 Гц, 1H, -ArH), 7,93 (д, J=7,6 Гц, 1H, -ArH) 7,63 (д, J=7,4 Гц, 1H, -ArH), 7,54-7,33 (м, 9H, -ArH), 7,12 (с, 1H, -ArH), 5,31 (с, 2H, -CH2-), 5,25 (м, 2H, -CH2-), 3,91 (с, 2H, -CH2-), 3,66 (дд, J=11,0, 4,0 Гц, 1H, -CH2-), 3,59 (дд, J=11,0, 6,0 Гц, 1H, -CH2-), 3,14 (т, J=4,8 Гц, 1H, -CH-). МС (FAB): 554 (М+1).
Пример 10: (S)-N-(4-(2-фтор-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)серин

Процедура была аналогичной описанной в примере 1, за исключением того, что 4-(2-фтор-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензальдегид использовали вместо 4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси) бензальдегида и этиловый эфир L-серина использовали вместо рацемического этилового эфира серина с получением (S)-этил N- (4-(2-фтор-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси) бензил)серината.
Процедура была аналогичной описанной в примере 2, за исключением того, что (S)-этил N-(4-(2-фтор-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат использовали вместо этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината с получением (S)-N-(4)-(2-фтор-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,72 (дд, J=8,0, 1,9 Гц, 1H, -ArH), 8,56 (дд, J=4,8, 1,5 Гц, 1H, -ArH), 7,97 (д, J=7,9 Гц, 1H, -ArH), 7,72-7,30 (м, 10H, -ArH), 7,16 (д, J=15,1 Гц, 1H, -ArH), 5,35 (д, J=6,7 Гц, 2H, -CH2 -), 5,27 (дд, J=15,2, 3,2 Гц, 2H, -CH2-), 3,95 (с, 2H, -CH2-), 3,70 (дд, J=11,2, 4,5 Гц, 1H, -CH2-), 3,63 (дд, J=11,2, 6,2 Гц, 1H, -CH2-), 3,18 (т, J=5,3 Гц, 1H, -CH-). МС (FAB): 538 (М+1).
Пример 11: (S)-N-(4-(3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серин
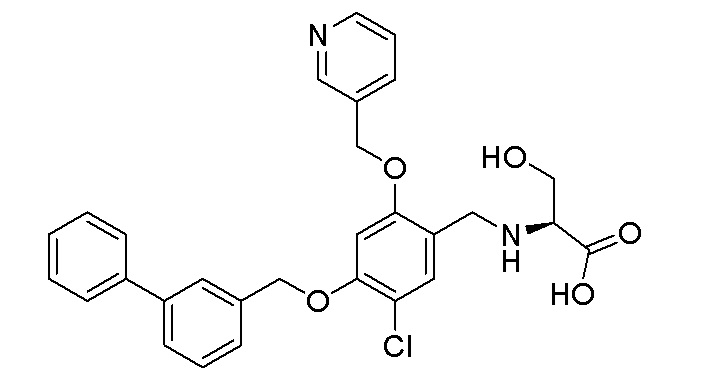
Процедура была аналогичной описанной в примере 1, за исключением того, что 4-(3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензальдегид использовали вместо 4-(2-бром-3-)-5-хлор-2-(пиридин-3-илметиленокси)бензальдегида и этиловый эфир L-серина использовали вместо рацемического этилового эфира серина с получением (S)-этил N-(4-(3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)серината.
Процедура была аналогичной описанной в примере 2, за исключением того, что (S)-этил N-(4-(3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат использовали вместо этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината с получением (S)-N-(4-(3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,67 (с, 1H, Ar-H), 8,50 (с, 1H, Ar-H), 7,91 (д, J=5,6 Гц, 1H, Ar-H), 7,75 (с, 1H, Ar-H), 7,61 (д, J=13,2 Гц, 3H, Ar-H), 7,44 (д, J=15,2 Гц, 5H, Ar-H), 7,36 (д, J=8,4 Гц), 2H, Ar-H), 7,09 (с, 1H, Ar-H), 5,29 (с, 2H, -CH2-), 5,19 (м, 2H, -CH2-), 3,90 (с, 2H, -CH2-), 3,69-3,55 (м, 2Н, -СН2-), 3,12 (м, 1Н, -СН-). МС (FAB): 520 (М+1).
Пример 12: N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)глицин

(1) 2-бром-3-фенилтолуол:
2-Бром-3-иодтолуол (350 мг) помещали в колбу емкостью 50 мл и при перемешивании добавляли смесь диоксан/вода. И раствор барботировали аргоном в течение 10 мин для удаления растворенного кислорода. Затем добавляли фенилбороновую кислоту (172,65 мг), карбонат цезия (961,2 мг) и трифенилфосфинпалладий (40,91 мг) и полученную смесь перемешивали при 80-100°C в течение 12 ч в атмосфере аргона. Реакцию останавливали. После охлаждения до комнатной температуры смесь фильтровали через диатомитовый фильтр. Фильтрат концентрировали при пониженном давлении и трижды экстрагировали водой и этилацетатом. Органическую фазу объединяли, промывали насыщенным раствором соли и высушивали над безводным Na2SO4. Раствор фильтровали и упаривали при пониженном давлении досуха. Остаток очищали колоночной хроматографией на силикагеле (петролейный эфир) с получением бесцветного масла (221 мг). 1H ЯМР (400 МГц, ДМСО-d6), δ 7,49-7,29 (м, 7H, Ar-H), 7,14 (д, 1H, Ar-H), 2,42 (с, 3H, Ar-CH3).
(2) 2-Бром-3-(бромметил)-1,1'-бифенил:
2-Бром-3-фенилтолуол (234 мг) взвешивали и помещали в колбу емкостью 100 мл и добавляли 20 мл CCl4. После полного растворения 2-бром-3-фенилтолуола при перемешивании добавляли NBS (178 мг). И полученную смесь нагревали до 80°С для нагревания с обратным холодильником. Затем добавляли пероксид бензоила (4 мг) и через 2 ч добавляли еще 4 мг пероксида бензоила, и реакцию продолжали в течение еще 2 ч. Реакцию останавливали. Реакционную смесь охлаждали до комнатной температуры и добавляли соответствующее количество воды и смесь экстрагировали дихлорметаном. Органическую фазу промывали насыщенным раствором соли и высушивали над безводным Na2SO4. Раствор фильтровали и упаривали при пониженном давлении досуха с получением желтого масла (192 мг). Вещество использовали на следующей стадии без дополнительной очистки.
(3) 2-Гидрокси-4-(2-бром-3-фенилбензокси)-5-хлорбензальдегид:
К безводному ацетонитрилу (6 мл) в колбе емкостью 50 мл добавляли 2,4-дигидрокси-5-хлорбензальдегид (73,94 мг) и бикарбонат натрия (98,88 мг). После перемешивания в течение 40 мин при комнатной температуре к реакционной смеси медленно по каплям добавляли через капельную воронку при постоянном давлении раствор 2-бром-3-(бромметил)-1,1'-бифенила (192 мг) в 8 мл ДМФА. Полученную смесь кипятили с обратным холодильником до завершения реакции. После охлаждения до комнатной температуры смесь экстрагировали водой и этилацетатом. Органическую фазу промывали насыщенным раствором соли, высушивали над безводным сульфатом натрия, фильтровали и упаривали при пониженном давлении досуха. Неочищенный остаток очищали колоночной хроматографией на силикагеле с получением 2-гидрокси-4-(2-бром-3-фенилбензокси)-5-хлорбензальдегида (152 мг) в виде белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6) δ 11,18 (с, 1H, -OH), 10,09 (с, 1H, -CHO), 7,74 (с, 1H, -ArH), 7,66 (д, 1H, -ArH) 7,57 (т, 1H, -ArH), 7,51 (м, 2H, -ArH), 7,46 (д, 1H, -ArH), 7,42 (д, 3H, -ArH), 6,85 (с, 1H, -ArH) 5,37 (с, 2Н, -СН2-).
(4) 4-(2-Бром-3-фенилбензокси)-5-хлор-2-(пиридин-3-илметиленокси)бензальдегид:
2-Гидрокси-4-(2-бром-3-фенилбензокси)-5-хлорбензальдегид (100 мг) растворяли в 6 мл ДМФА в колбе емкостью 50 мл, и затем добавляли карбонат цезия (127,53 мг). После перемешивания при комнатной температуре в течение 15 мин добавляли по каплям раствор 3-бромметиленоксипиридин (76,65 мг) в ДМФА (4 мл). После перемешивания смеси при 80°С в течение 2 ч реакцию останавливали. После охлаждения до комнатной температуры смесь экстрагировали водой и этилацетатом. Органическую фазу промывали насыщенным раствором соли и высушивали над безводным сульфатом натрия, затем фильтровали и упаривали при пониженном давлении досуха. Неочищенный остаток очищали колоночной хроматографией на силикагеле с получением белого твердого вещества (60 мг). 1H ЯМР (400 МГц, ДМСО-d6) δ 10,14 (с, 1H, -CHO), 8,71 (д, J=1,6 Гц, 1H, -ArH), 8,54 (д, J=4,8 Гц, 1H, -ArH) 7,94 (д, J=7,8 Гц, 1H, -ArH), 7,83 (с, 1H, -ArH), 7,66 (д, J=7,6 Гц, 1H, -ArH), 7,50 (т, J=7,6 Гц, 1H, -ArH), 7,48-7,32 (м, 7H, -ArH), 7,20 (с, 1H, -ArH), 5,42 (с, 2H, -CH2-), 5,41 (с, 2H, -CH2-).
(5) N-(4-(2-Бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)глицин:
4-(2-Бром-3-фенилбензокси)-5-хлор-2-(пиридин-3-илметиленокси)бензальдегид (80 мг) растворяли в 5 мл ДМФА и затем добавляли этилглицинат (49 мг, 0,472 ммоль) и ледяную уксусную кислоту (57 мг). После перемешивания при комнатной температуре в течение 20 мин добавляли цианоборогидрид натрия (25 мг) и смесь перемешивали при 25°C в течение 14 ч. Реакцию останавливали. Смесь экстрагировали водой и этилацетатом. Органическую фазу промывали насыщенным раствором соли и высушивали над безводным сульфатом натрия, затем фильтровали и упаривали при пониженном давлении досуха. Остаток растворяли в этаноле, нагревали до температуры кипения с обратным холодильником до завершения реакции. Смесь упаривали досуха. Неочищенный остаток очищали колоночной хроматографией на силикагеле с получением этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)глицината (70 мг) в виде желтого масла. Продукт растворяли в смеси метанол/H2O (4 мл/1 мл) и затем добавляли моногидрат гидроксида лития (20 мг). После перемешивания при комнатной температуре в течение 2 ч к смеси на ледяной бане добавляли несколько капель уксусной кислоты для доведения рН до кислого значения. Смесь фильтровали при пониженном давлении с получением N-(4-(2-бром-3-фенилбензилокси) -5-хлор-2-(пиридин-3-илметиленокси)бензил)глицина (45 мг) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО) δ 8,73 (д, J=1,7 Гц, 1H, -ArH), 8,55 (дд, J=4,8, 1,6 Гц, 1H, ДМСО), 7,96 (дт, J=7,9, 1,9 Гц), 1H, ДМСО), 7,65 (дд, J=7,6, 1,6 Гц, 1H, -ArH), 7,55-7,35 (м, 9H, -ArH), 7,12 (с, 1H, -ArH), 5,33 (с, 2H, -CH2-), 5,29 (с, 2H, -CH2-), 3,91 (с, 2H, -CH2-), 3,11 (с, 2H, -CH2-). МС (FAB): 569 (М+1).
Пример 13: N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)валин

Процедура была аналогичной описанной в примере 12, за исключением того, что этиловый эфир валина использовали вместо этилового эфира глицина с получением N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)валина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО) δ 8,69 (с, 1H, -ArH), 8,56 (д, J=3,9 Гц, 1H, -ArH), 7,88 (д, J=7,8 Гц, 1H, -ArH), 7,66 (д, J=7,4 Гц, 1H, -ArH), 7,55-7,33 (м, 9H, -ArH), 7,06 (с, 1H, -ArH), 5,31 (с, 2H, -CH2-), 5,22 (д, J=11,2 Гц, 2H, -CH2-), 3,52 (с, 2H, -CH2-), 2,91 (д, J=6,4 Гц, 1H, -CH-), 1,80 (дкв, J=13,2, 6,5 Гц, 1H, -CH-), 0,86 (дд, J=18,9, 6,7 Гц, 6H, -CH3). МС (FAB): 611 (М+1).
Пример 14: (Е)-3-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензиламино)бут-2-ененитрил
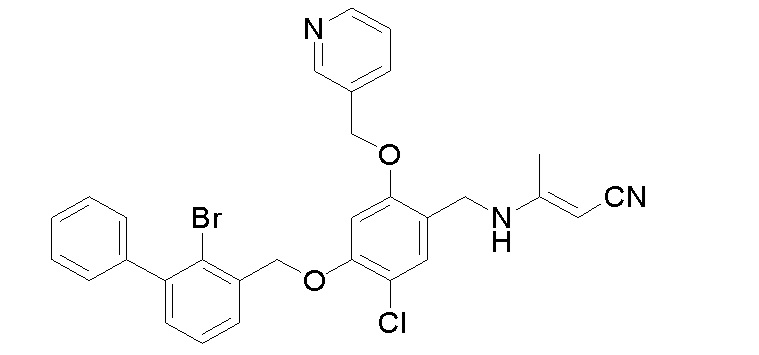
Процедура была аналогичной описанной в примере 12, за исключением того, что (E)-3-аминобут-2-ененитрил использовали вместо этилового эфира глицина без гидролиза с получением (E)-3- (4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси) бензиламино)бут-2-ененитрила в виде белого твердого вещества. 1H ЯМР (400 МГц,) δ 8,70 (с, 1H, -ArH), 8,55 (д, J=4,2 Гц, 1H, -ArH), 7,99-7,81 (м, 1H, -ArH), 7,65 (д, J=7,0 Гц, 1H, -ArH), 7,58-7,31 (м, 9H, -ArH), 7,11 (д, J=33,8 Гц, 1H), 6,30 (с, 1H, =CH), 5,28 (д, J=14,1 Гц, 4H, -CH2-), 3,27 (с, 2H, -CH2-), 2,21-1,96 (м, 3H). МС (FAB): 576 (М+1).
Пример 15: N,N-бис(2-гидроксиэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламин

Процедура была аналогичной описанной в примере 12, за исключением того, что бис (2-гидроксиэтил)амин использовали вместо этилового эфира глицина без гидролиза с получением N,N-бис (2-гидроксиэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензиламина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,68 (с, 1H, ArH), 8,58-8,51 (м, 1H, ArH), 7,88 (д, J=7,2 Гц, 1H, ArH), 7,65 (д, J=7,6 Гц, 1H, ArH), 7,56-7,32 (м, 9H, ArH), 7,05 (д, J=2,4 Гц, 1H, ArH), 5,29 (с, 2H, -OCH2-), 5,24 (с, 2H, -OCH2-), 4,35 (с, 2H, -OH), 3,58 (с, 2H, -CH2-), 3,41 (шир. с, 4H, -CH2-), 2,51 (м, 4H, -CH2-, с перекрыванием с пиком растворителя). МС (FAB): 598 (М+1).
Пример 16: N-(2-метансульфонаминоэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламин

Процедура была аналогичной описанной в примере 12, за исключением того, что N-(2-аминоэтил)метансульфонамид использовали вместо этилового эфира глицина без гидролиза с получением N-(2-метансульфонаминоэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,69 (с, 1H, ArH), 8,55 (д, J=4,4 Гц, 1H, ArH), 7,89 (д, J=7,6 Гц, 1H, ArH), 7,65 (д, J=8,0 Гц, 1H, ArH), 7,56-7,33 (м, 9H, ArH), 7,07 (с, 1H, ArH), 6,95 (с, 1H, -NH-), 5,30 (с, 2H, - OCH2-), 5,25 (с, 2H, -OCH2-), 3,64 (с, 2H, -CH2-), 3,01 (м, 2H, -CH2-), 2,88 (с, 3H, -CH3), 2,59 (т, J=6,4 Гц, 2H, -CH2-). МС (FAB): 631 (М).
Пример 17: N-(2-ацетиламиноэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламин

Процедура была аналогичной описанной в примере 12, за исключением того, что N-(2-аминоэтил)ацетамид использовали вместо этилового эфира глицина без гидролиза с получением N- (2-ацетиламиноэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензиламина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,69 (с, 1H, ArH), 8,55 (д, J=4,0 Гц, 1H, ArH), 7,88 (д, J=8,0 Гц, 1H, ArH), 7,80 (т, J=6,0 Гц, 1H, -NH-), 7,65 (д, J=6,0 Гц, 1H, ArH), 7,57-7,35 (м, 9H, ArH), 7,07 (с, 1H, ArH), 5,30 (с, 2H, -OCH2-), 5,25 (с, 2H, -OCH2-), 3,65 (с, 2H, -CH2-), 3,12 (кв, J=6,0 Гц, 2H, -CH2-), 2,54 (т, J=6,4 Гц, 2H, -CH2-), 1,78 (с, 3H). МС (FAB): 595 (М).
Пример 18: (Е)-3-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензиламино)бут-2-еноевая кислота
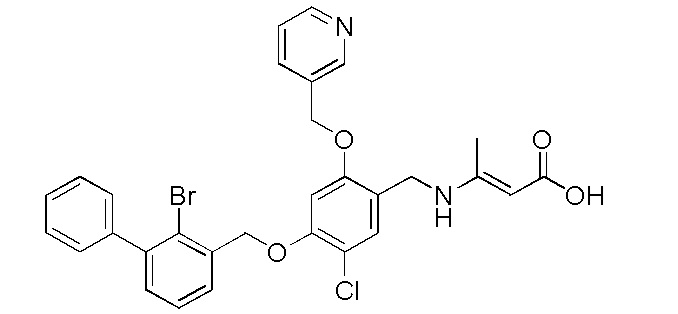
Процедура была аналогичной описанной в примере 12, за исключением того, что (E)-3-аминобут-2-еноевую кислоту использовали вместо этилового эфира глицина без гидролиза с получением (E)-3-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензиламино)бут-2-еноевой кислоты в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,74 (с, 1H, ArH), 8,55 (д, J=4,4 Гц, 1H, ArH), 7,98 (д, J=8,0 Гц, 1H, ArH), 7,65 ( дд, J1=7,6 Гц, J2=1,2 Гц, 1H, ArH), 7,55-7,34 (м, 9H, ArH), 7,13 (с, 1H, ArH), 5,33 (с, 2H, -OCH2-), 5,29 (с, 2H, -OCH2-), 3,85 (дд, J1=52,4 Гц, J2=13,2 Гц, 2H), 3,05 (с, 1H,=CH), 1,12 (д, J=6,4 Гц, 3H). МС (FAB): 594 (М+1).
Пример 19: 2-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензиламино)этансульфоновая кислота

Процедура была аналогичной описанной в примере 12, за исключением того, что 2-аминоэтансульфоновую кислоту использовали вместо этилового эфира глицина без гидролиза с получением 2-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламино)этансульфоновой кислоты в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО) δ 8,79 (с, 1H), 8,62 (д, J=4,8 Гц, 1H), 8,42 (д, J=7,2 Гц, 1H), 7,85 (т, J=4,8 Гц, 1H), 7,43 (м, 9H), 7,04 (с, 1H), 5,37 (с, 2H), 5,24 (с, 2H), 4,33 (с, 2H), 3,39 (м, 2H), 2,97 (м, 2H) 2,65 (шир.с, 1Н). МС (FAB): 618 (М+1).
Пример 20: N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)лейцин

Процедура была аналогичной описанной в примере 12, за исключением того, что этиловый эфир лейцина использовали вместо этилового эфира глицина с получением N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил) лейцина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО) δ 8,69 (с, 1H), 8,52 (д, J=4,8 Гц, 1H), 8,42 (д, J=7,2 Гц, 1H), 7,85 (т, J=4,8 Гц, 1H ), 7,43 (м, 9H), 7,04 (с, 1H), 5,37 (с, 2H), 5,24 (с, 2H), 3,79 (м, 2H), 3,18 (м, 1H), 1,86 (м, 1H) 1,41 (м, 2Н), 0,74 (м, 6Н). МС (FAB): 624 (М).
Пример 21: N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)тирозин

Процедура была аналогичной описанной в примере 12, за исключением того, что этиловый эфир тирозина использовали вместо этилового эфира глицина с получением N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил) тирозина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО) δ 8,62 (с, 1H), 8,50 (д, J=3,2 Гц, 1H), 7,81 (т, J=7,6 Гц, 1H), 7,60 (т, J=9,2 Гц, 1H ), 7,38 (м, 8H), 7,21 (с, 1H), 7,00 (с, 1H), 6,93 (д, J=8,0 Гц, 2H), 6,59 (д, J=8,0 Гц, 2H), 5,25 (с, 2H), 5,17 (с, 2H), 3,64 (м, 2H), 3,21 (т, J=6,8 Гц, 1H), 2,78 (м, 2H). МС (FAB): 674 (М).
Пример 22: N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)изолейцин

Процедура была аналогичной описанной в примере 12, за исключением того, что этиловый эфир изолейцина использовали вместо этилового эфира глицина с получением N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил) изолейцина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО) δ 8,64 (с, 1H), 8,50 (д, J=4,8 Гц, 1H), 8,38 (д, J=7,2 Гц, 1H), 7,82 (т, J=4,8 Гц, 1H), 7,43 (м, 9H), 7,00 (с, 1H), 5,25 (с, 2H), 5,18 (с, 2H), 3,63 (м, 2H), 3,48 (м, 1Н), 2,28 (м, 1Н), 1,50 (м, 2Н), 1,06 (м, 3Н), 0,73 (м, 3Н). МС (FAB): 624 (М).
Пример 23: N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)аспарагин
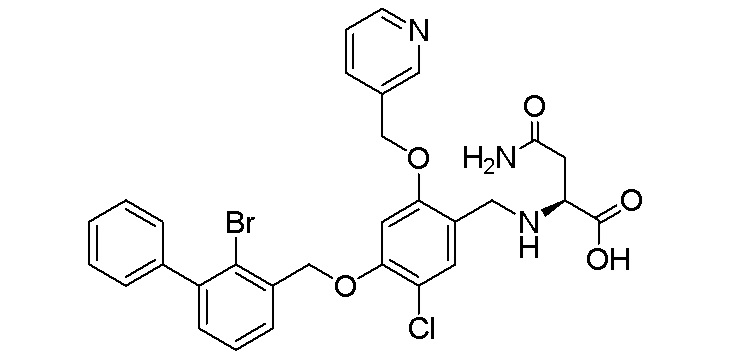
Процедура была аналогичной описанной в примере 12, за исключением того, что этиловый эфир аспарагина использовали вместо этилового эфира глицина с получением N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил) аспарагина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО) δ 11,96 (с, 1H), 8,72 (с, 1H), 8,52 (д, J=8,0 Гц, 1H) 8,16 (с, 1H), 7,68 (т, J=8,0 Гц, 1H), 7,44 (м, 10H), 7,01 (м, 2H), 5,26 (с, 2H), 5,21 (с, 2H), 3,65 (м, 2Н), 3,35 (м, 1Н), 2,65 (м, 2Н). МС (FAB): 625 (М+1).
Пример 24: N-(гидроксиэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламин

Процедура была аналогичной описанной в примере 12, за исключением того, что 2-аминоэтан-1-ол использовали вместо этилового эфира глицина без гидролиза с получением N- (гидроксиэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,70 (с, 1H, Ar-H), 8,54 (д, J=15,4 Гц, 1H, Ar-H), 7,92 (с, 1H, Ar-H), 7,72-7,25 (м, 10H), 7,11 (с, 1H, Ar-H), 5,30 (с, 2H, -CH2-) 5,28 (с, 2H, -CH2-), 3,89 (м, 2H, -CH2-), 3,54 (с, 2H, -CH2-), 2,76 (с, 2H, -CH2-). МС (FAB): 554 (М+1).
Пример 25: N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)аланин
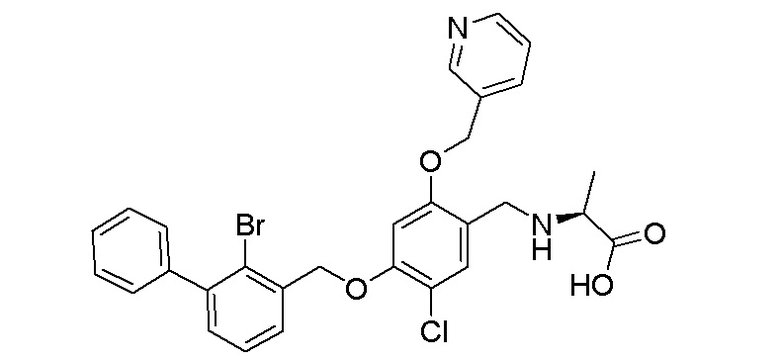
Процедура была аналогичной описанной в примере 12, за исключением того, что этиловый эфир аланина использовали вместо этилового эфира глицина с получением N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридина-3-илметиленокси)бензил) аланина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,69 (с, 1H, Ar-H), 8,53 (м, 1H, Ar-H), 7,93 (д, J=8,0 Гц, 1H, Ar-H), 7,61 (д, J=8,1 Гц, 1H, Ar-H), 7,53-7,31 (м, 9H, Ar-H), 7,08 (с, 1H, Ar-H), 5,29 (с, 2H, -CH2-), 5,27-2,23 (м, 2H, -CH2-), 3,96-3,77 (м, 2H, -CH2-), 3,12 (м, 1H, -CH-), 1,19 (д, J=7,0 Гц, 3H, -CH3). МС (FAB): 582 (М+1).
Пример 26: N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)пролин

Процедура была аналогичной описанной в примере 12, за исключением того, что этиловый эфир пролина использовали вместо этилового эфира глицина с получением N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил) пролина в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,72 (с, 1H, ArH), 8,56 (д, J=6,0 Гц, 1H, ArH), 7,95 (д, J=8,0 Гц, 1H, ArH), 7,66 (д, J=7,6 Гц, 1H, ArH), 7,5-7,34 (м, 9H, ArH), 7,12 (с, 1H, ArH), 5,35-5,27 (м, 4H, -OCH2-), 3,95 (дд, J1=51,6 Гц, J2=13,2 Гц, 2H, -CH2-), 3,12 (м, 1H, -CH-), 2,67 (м, 1H, -CH2-), 2,07 (м, 1Н, -СН2-), 1,89 (м, 1Н, -СН2-), 1,78 (м, 1Н, -СН2-), 1,68 (м, 1Н, -СН2-), 0,84 (м, 1Н, -СН2-). МС (FAB): 608 (М).
Пример 27: (S)-N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2- (пиридин-3-илметиленокси)бензил)серинат натрия

(S)-N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серин (299 мг) растворяли в 1 мл 0,5 Н водного раствора гидроксида натрия. После перемешивания в течение 30 мин при комнатной температуре к раствору добавляли абсолютный этанол до появления твердых частиц. После нагревания до растворения и охлаждения до комнатной температуры смесь помещали в холодильник для замораживания. Затем смесь фильтровали с получением продукта (300 мг) в виде белого твердого вещества. 1H ЯМР (400 МГц, метанол-d4) δ 8,65 (с, 1H, -ArH), 8,49 (д, 1H, -ArH), 8,04 (д, 1H, -ArH), 7,63 (д, J=8,0 Гц, 1H, -ArH), 7,50-7,34 (м, 8H, -ArH), 7,31 (д, J=7,5 Гц, 1H, -ArH), 6,84 (с, 1H, -ArH), 5,28 (с, 2H, - CH2-), 5,23 (с, 2H, -CH2-), 3,85-3,74 (м, 2H, -CH2-), 3,72 (д, J=4,6 Гц, 1H, -CH2-), 3,67 (м, 1H, -CH2-), 3,15 (т, J=5,6 Гц, 1H, -CH-). МС (FAB): 599 (М+1).
Пример 28: (S)-N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат кальция

(S)-N-(4-(2-Бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серинат натрия (243 мг) растворяли в 5 мл воды. Водный раствор дихлорида кальция (1%, 2,22 мл) добавляли по каплям при перемешивании при комнатной температуре. Затем смесь перемешивали в течение ночи, фильтровали, промывали водой и высушивали с получением продукта (240 мг) в виде белого твердого вещества. МС (FAB): 599 (М+1).
Пример 29: (S)-(5-метил-2-оксо-1,3-диоксол-4-ил)метил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-ил-метиленокси)бензил)серинат

(S)-N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серин (299 мг) и 4-(хлорметил)-5-метил-1,3-диоксол-2-он (74 мг) растворяли в 10 мл ДМФА. После добавления каталитического количества йодида калия смесь перемешивали при 30°С до завершения реакции. Смесь выливали в перемешиваемый, охлажденный на льду насыщенный водный раствор бикарбоната натрия, затем фильтровали, и твердое вещество промывали водой и высушивали с получением продукта (98 мг). МС (FAB): 711 (М+1).
Фармакологические эксперименты
1. Оценка активности in vitro: для метода определения уровня ферментативной активности in vitro использовали набор для анализа связывания PD-1/PD-L1 Cisbio.
Принципы и методы скрининга низкомолекулярных ингибиторов PD-1/PD-L1
1) Принцип: белок PD-1 имеет метку HIS, и лиганд PD-1, PD-L1, с меткой hFc. Eu-меченное анти-hFc-антитело и XL665-меченное анти-HIS-антитело объединяются с двумя вышеуказанными белками с метками соответственно. После лазерного возбуждения энергия может передаваться от донора Eu на рецептор XL665, позволяя XL665 светиться. После добавления ингибиторов (соединений или антител), блокирование связывания PD-1 и PD-L1 делает расстояние между Eu и XL665 большим, и энергия не может передаваться, и XL665 не светится.
2) Экспериментальный метод: специфический метод связан с набором для оценки связывания PD-1/PD-L1 Cisbio (позиция 64CUS000C-2). Реагенты следует разливать в следующем порядке. 384-луночный белый планшет для постановки ELISA: в каждую лунку добавляли 2 мкл разбавителя или целевого соединения, разведенного разбавителем, и затем добавляли 4 мкл белка PD-1 и 4 мкл белка PD-L1, инкубировали в течение 15 мин при комнатной температуре; и добавляли 10 мкл смеси антител анти-Tag1-Eu3+ и анти-Tag2-XL665 в каждую лунку и инкубировали в течение от 1 до 4 ч при комнатной температуре, и измеряли сигналы флуоресценции при 665 нм и 620 нм на планшетном анализаторе Envison. Степень HTRF=(665 нм/620 нм) × 104. Для каждого соединения анализировали 8-10 концентраций, и IC50 рассчитывали с помощью программного обеспечения Graphpad.
3) Результаты скрининга приведены в таблице 1.
Оценка ингибирующей активности соединений из примеров на молекулярном уровне на взаимодействие между PD-1 и PD-L1
Анализ HTRF Cisbio показал, что взаимодействие PD-1 и PD-L1 может достоверно ингибироваться соединением из примера 4 на молекулярном уровне с IC50 <10-13 моль/л.
2. Способность соединения из примера 4 снимать ингибирование IFNγ под действием лиганда PD-L1:
Уровень экспрессии IFNγ может отражать пролиферативную активность Т-лимфоцитов. Используя выделенные человеческие PBMC (мононуклеарные клетки периферической крови), с учетом того, что T-лимфоциты могут активироваться анти-CD3/анти-CD28-антителом, лиганд PD-L1 добавляли для ингибирования T-лимфоцитов, для оценки активности соединений из примера отменять ингибирование PD-L1.
Конкретная процедура заключалась в следующем. Раствор для разделения лимфоцитов человека DAKEWE (DKW-KLSH-0100) использовали для выделения PBMC из цельной крови человека, и PBMC высевали в 96-луночный планшет из расчета 3 × 105 клеток на лунку. Добавляли белок PD-L1 человека (конечная концентрация 5 мкг/мл), анти-CD3/анти-CD28-антитело (конечная концентрация 1 мкг/мл) и пропорциональное разведение соединения из примера 4 соответственно. Через 72 ч определяли уровень экспрессии IFNγ в супернатанте с помощью набора для анализа IFNγ Cisbio. Результаты эксперимента показали, что ингибирование PD-L1 до уровня экспрессии IFNγ может быть частично ослаблено соединением из примера 4 (YPD29B) в 10 нМ, и значение IC50 было определено на уровне 1,8 × 10-10 моль/л при тестировании различных концентраций (фиг. 1).
3. Эффективность соединения из примера 4 in vivo
Методы фармакодинамики были следующими:
Метод подкожной прививки опухолевого ксенотрансплантата был следующим. Культивированные специфические опухолевые клетки разъединяли, собирали центрифугированием и дважды промывали стерильным физиологическим раствором, и затем подсчитывали. Титр клеток доводили до 5 × 106/мл физиологическим раствором и 0,2 мл суспензии клеток инокулировали в правую подмышку мышей C57BL/6 или Bablc. На следующие сутки после инокуляции животных произвольно разделяли на две группы. В каждой группе было 6-7 мышей. После взвешивания животным проводили введение один раз в день с контролем размера опухоли. Когда размер опухолей достигал определенного значения, мышей взвешивали и отбирали образцы крови из ретробульбарного венозного сплетения мышей, и затем мышей подвергали эвтаназии дислокацией шейных позвонков. Отбирали опухолевую ткань, ткань тимуса и ткань селезенки и взвешивали соответственно. Наконец, рассчитывали степень ингибирования роста опухолей, и степень ингибирования роста опухолей использовали для оценки уровня противоопухолевого эффекта.
Метод на модели метастазирующей опухоли легкого B16F10 был следующим. Культивированные опухолевые клетки B16F10 разъединяли, центрифугировали и дважды промывали стерильным физиологическим раствором и затем подсчитывали. И титр клеток доводили до 2,5 × 106/мл физиологическим раствором. 0,2 мл клеток вводили мышам C57BL/6 в хвостовую вену, и опухолевые клетки накапливались в легких мышей. На следующие сутки после инокуляции животных произвольно разделяли на две группы. В каждой группе было 6-7 мышей. После взвешивания животным проводили введение один раз в сутки. Через 3 недели мышей взвешивали и подвергали эвтаназии, отбирали и взвешивали ткань легких и подсчитывали количество опухолей в легких после фиксации в жидкости Буэна. Наконец, рассчитывали степень ингибирования роста опухолей, и степень ингибирования роста опухолей использовали для оценки уровня противоопухолевого эффекта.
Метод на модели гидроторакса при злокачественной опухоли легкого Льюиса был следующим: подкожный ксенотрансплантат опухоли легкого Льюиса гомогенизировали и дважды промывали стерильным физиологическим раствором, и титр клеток доводили до 2,5 × 105/мл физиологическим раствором. 0,2 мл клеток вводили в грудную полость мышей C57BL/6. На следующие сутки после инокуляции животных произвольно разделяли на две группы. В каждой группе было 6-7 мышей. После взвешивания животным проводили введение один раз в сутки. Животных подвергали эвтаназии, когда масса тела животных в контрольной группе внезапно начинала снижаться. Жидкость в грудной полости извлекали шприцем и регистрировали объем жидкости.
При исследовании механизма действия соединений на вышеуказанных моделях использовали метод проточной цитометрии для определения общего относительного количества Т-клеток различных типов. Конкретные стадии были следующими. Вначале образцы обрабатывали. Кровь: образцы крови отбирали из ретробульбарного венозного сплетения. Лизирование эритроцитов использовали для удаления эритроцитов, и затем для промывки использовали буфер PBS. После промывания клетки собирали. Опухолевая ткань и селезенка: ткани измельчали с помощью гомогенизатора, и затем разбавляли буфером PBS, затем фильтровали через сито 300 меш. После подсчета количества клеток для каждого образца в пробирку EP добавляли 1×106 клеток и окрашивали антителом. После инкубации в течение 1 ч на льду каждый образец промывали 2 раза буфером PBS. Популяции клеток анализировали с помощью проточного цитометра VERSE компании BD. Общее количество клеток в опухолевой ткани составляло 1×105, и общее количество клеток в крови и селезенке составляло 1×104. Отношение Т-клеток к общему количеству клеток определяли после проточной цитометрии.
(1) Модель подкожного ксенотрансплантата высоко метастазирующей меланомы B16F10
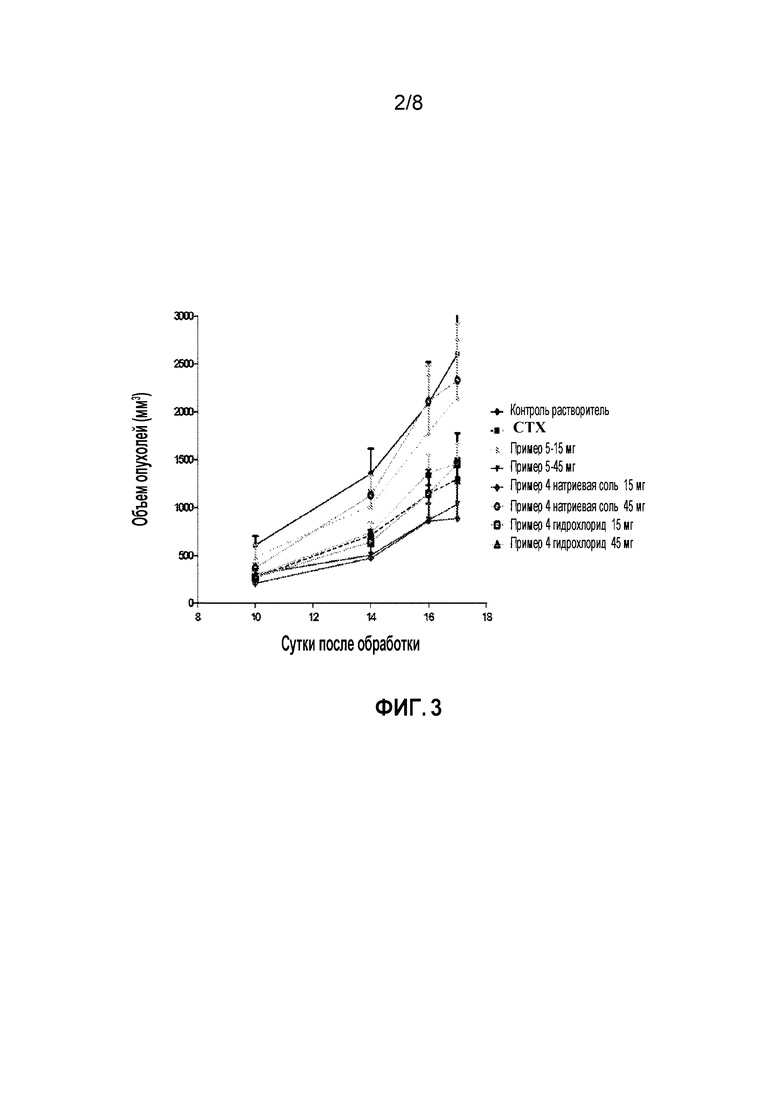
На модели высоко метастазирующей меланомы B16F10 соединения из примеров (45 мг/кг соединения из примера 5, 15 мг/кг соединения гидрохлорида из примера 4 и 15 мг/кг натриевой соли соединения из примера 4) могут достоверно ингибировать рост подкожной опухоли, основываясь на объеме или массе опухолей (фиг. 2, фиг. 3 и таблица 2) и степень ингибирования опухолевой массы может составлять 45,27%; 38,37% и 64,11% соответственно.
Ингибирование подкожных опухолевых ксенотрансплантатов B16F10 соединениями из примеров
(в начале/в конце)
TGI: степень ингибирования роста опухолей
NA: неприменимо
*P<0,05 против контроля растворителя
Из анализа механизма следует, что соединение из примера 5, натриевая соль соединения из примера 4 и соединение гидрохлорид из примера 4 могут увеличивать долю опухоль-инфильтрирующих лимфоцитов (фиг. 4, таблица 3), и натриевая соль соединения из примера 4 может увеличить долю лимфоцитов в образцах селезенки (фиг. 5, таблица 4).
Влияние примера 4 и примера 5 на опухоль-инфильтрирующие Т-лимфоциты
Влияние натриевой соли соединения из примера 4 на Т-лимфоциты в селезенке
(2) Модель метастазирования легкого высоко метастазирующей меланомы B16F10
На моделях метастатического рака легкого высокометастатической меланомы B16F10 натриевая соль соединения примера 4 может достоверно ингибировать количество метастазов в легких в дозе 15 мг/кг (фиг. 6, таблица 5).
Ингибирующее действие соединений из примеров на модели метастазирующей опухоли легкого B16F10
(в конце/в начале)
TGI: степень ингибирования роста опухолей
NA: неприменимо
*P<0,05 против контроля растворителя
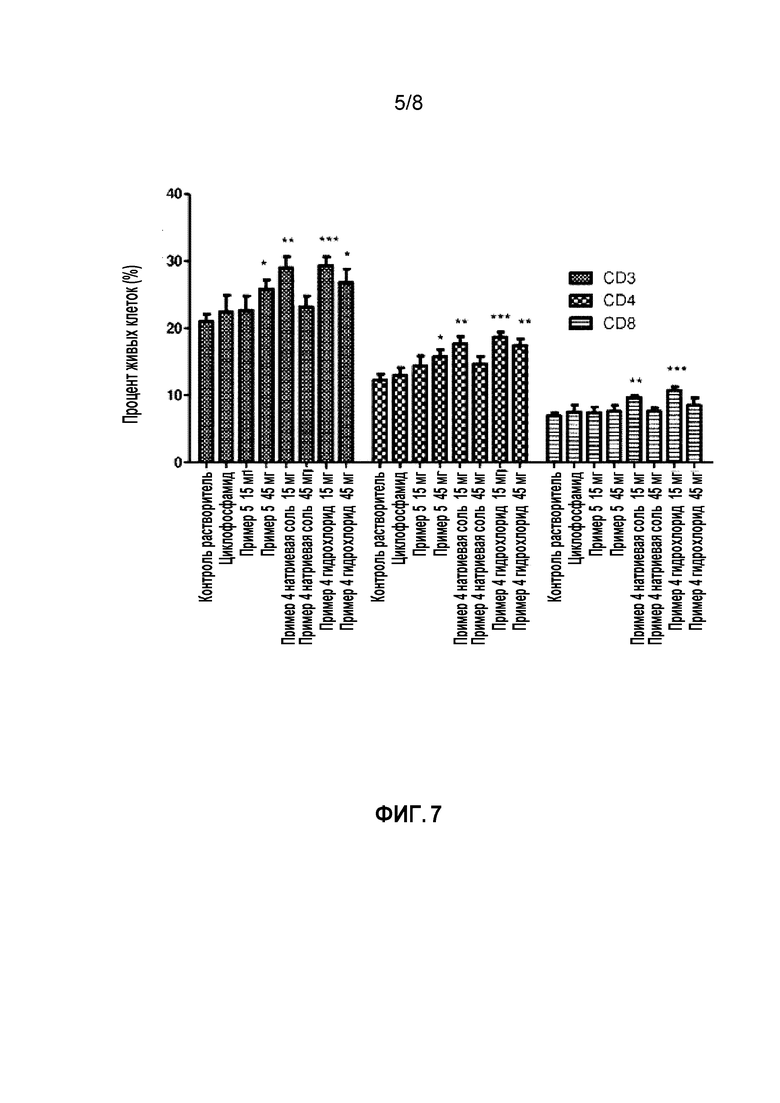
Из анализа механизма следует, что пример 4 и пример 5 могут увеличить процент лимфоцитов в крови мышей (фиг. 7, таблица 6).
Влияние соединений из примеров на процентное содержание Т-лимфоцитов в крови мышей
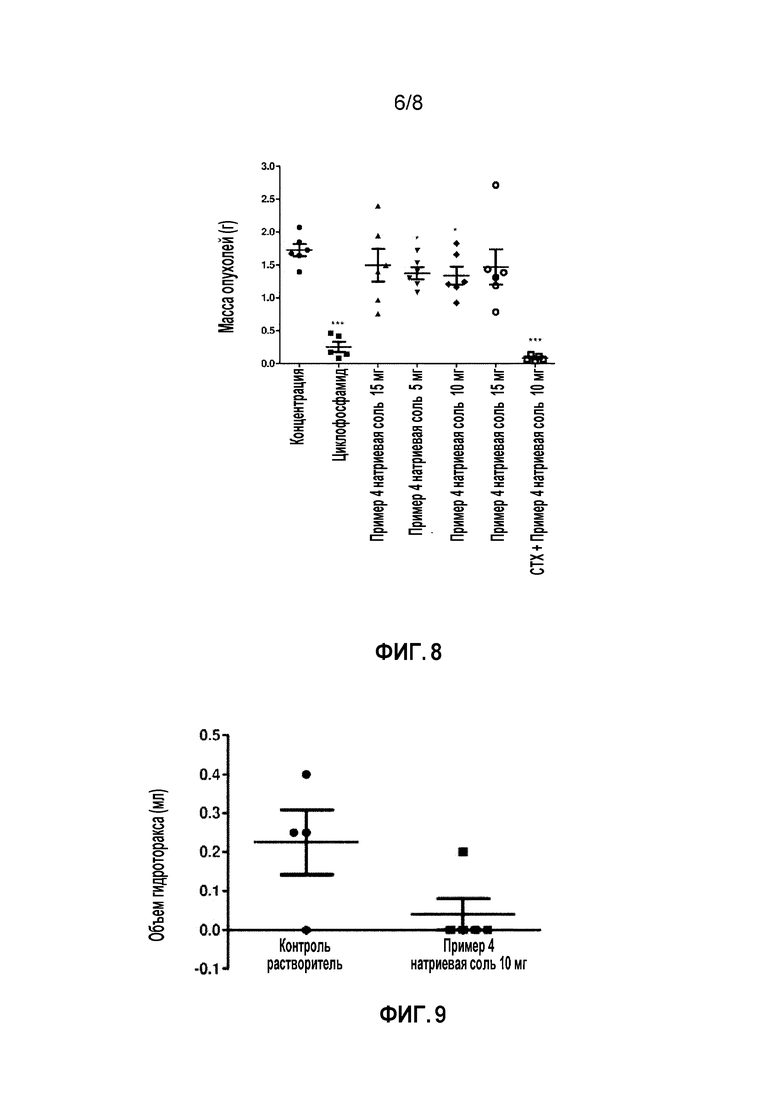
(3) Модель подкожного ксенотрансплантата мышиной злокачественной опухоли молочной железы EMT6
На модели подкожного ксенотрансплантата мышиной злокачественной опухоли молочной железы ЕМТ6 натриевая соль соединения из примера 4 оказывает некоторое ингибирующее действие на мышиную опухоль молочной железы ЕМТ6. В дозе 10 и 15 мг натриевая соль соединения из примера 4 обладает эффектом ингибирования на уровне 20% и 22% соответственно (фиг. 8, таблица 6). Кроме того, комбинация натриевой соли соединения из примера 4 и циклофосфамида может достоверно повысить степень ингибирования роста опухоли циклофосфамидом с 85% до 95% (фиг. 8, таблица 7).
Ингибирующее действие соединения из примера 4 на подкожный ксенотрансплантат мышиной опухоли EMT6
(в конце /в начале)
Среднее значение ±SD
10 мг/кг
TGI: степень ингибирования роста опухолей
NA: неприменимо
*P<0,05 против контроля растворителя
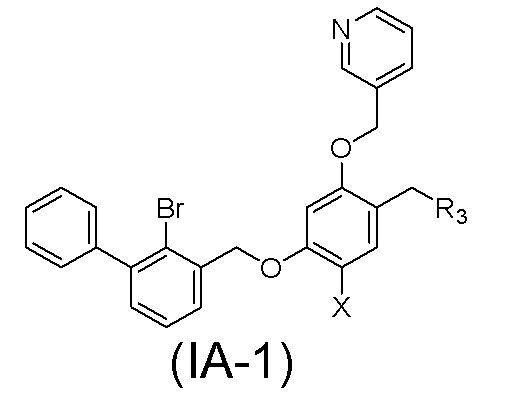
(4) Модель гидроторакса при мышиной злокачественной опухоли легких Льюиса
Натриевая соль соединения из примера 4 оказывает ингибирующее действие на модели гидроторакса при мышиной злокачественной опухоли легких Льюиса. Частота гидроторакса в контрольной группе с растворителем составляла 75%, тогда как в дозе 10 мг натриевая соль соединения из примера 4 может снижать частоту до 33% (таблица 8). Средний объем гидроторакса у мышей в контрольной группе с растворителем составлял 0,3 мл, и в группе мышей, которым вводили натриевую соль соединения из примера 4, составлял только 0,2 мл гидроторакса (фиг. 9, таблица 9). Кроме того, натриевая соль соединения из примера 4 может достоверно увеличить массовый коэффициент тимуса (фиг. 10).
Влияние примера 4 на частоту гидроторакса при злокачественной опухоли легких Льюиса
Влияние примера 4 на объем гидроторакса при злокачественной опухоли легких Льюиса
(5) Модель подкожного ксенотрансплантата мышиной злокачественной опухоли толстой кишки MC38
На модели подкожного ксенотрансплантата мышиной злокачественной опухоли толстой кишки MC38 натриевая соль соединения из примера 4 обладает достоверным ингибирующим эффектом. Кроме того, натриевая соль соединения из примера 4 оказывает синергетическое противоопухолевое действие с циклофосфамидом (CTX) на данную опухоль (фиг. 11, таблица 10).
Влияние соединения из примера на модели подкожного ксенотрансплантата мышиной злокачественной опухоли толстой кишки MC38
(в конце /в начале)
Среднее значение ±SD
+10 мг
##
##
TGI: степень ингибирования роста опухолей
NA: неприменимо
*P<0,05 против контроля растворителя; ***P<0,001 против контроля растворителя; ##p<0,01 против циклофосфамида (CTX)
4. Взаимодействие соединения из примера 4/антитела к PD-L1 с белком PD-L1 тестировали с использованием Biacore.
(1) Принцип эксперимента
Поверхностный плазмон представляет собой разновидность электромагнитной волны на поверхности металла, возникающей при взаимодействии фотона и электрона при свободных колебаниях. Поверхностный плазмонный резонанс (SPR) представляет оптическое явление, возникающее на поверхности двух видов сред, которое может быть индуцировано фотоном или электроном. Явление полного отражения света от светлой плотной среды в светорассеивающую среду формирует затухающую волну в светорассеивающей среде. Когда полная отраженная затухающая волна встречает плазмонную волну на поверхности металла, то может возникнуть резонанс, и энергия отраженного света уменьшается, и резонансный пик появляется в энергетическом спектре отраженного света. Этот резонанс называется поверхностным плазмонным резонансом. Угол падения поверхностного плазмонного резонанса называется углом SPR. Биосенсор SPR обеспечивает чувствительный метод детектирования без меток в режиме реального времени для мониторинга взаимодействия молекул. Сенсор обнаруживает изменение угла SPR, и SPR также связан с показателем преломления поверхности металла. Когда аналит связывается на поверхности чипа, то это приводит к изменению показателя преломления поверхности чипа, что приводит к изменению угла SPR. Это основной принцип детектирования межмолекулярного взаимодействия в режиме реального времени с использованием биосенсора SPR. В анализе взаимодействия изменение угла SPR записывается на карту сенсора в режиме реального времени.
(2) Экспериментальные методы
Белок PD-L1 захватывали на канале Fc4 чипа NTA методом захвата, и буферная система представляла собой PBS-P+, pH 7,4, 0,01% ДМСО. Готовили серию концентраций соединений и антител против PD-L1 и пропускали через поверхность чипа для определения взаимодействия.
(3) Экспериментальные результаты
Аффинность соединения из примера 4 и антитела против PD-L1 для PD-L1
Предварительно было определено, что связывающимся белком для примера 4 является PD-L1 (фиг. 12). Дальнейшие эксперименты на Biacore подтвердили, что комбинация примера 4 обладает высокой способностью связывать PD-L1, и значение kD аффинности составляет 2,025E-11, что даже выше, чем у антитела против PD-L1 (таблица 11, фиг.12-14).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ БЕНЗИЛФЕНИЛОВОГО ЭФИРА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2017 |
|
RU2743165C2 |
| ФЕНИЛАТНОЕ ПРОИЗВОДНОЕ, ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2017 |
|
RU2744975C2 |
| МАЛЕАТ ЭФИРНОГО ПРОИЗВОДНОГО НИКОТИНИЛОВОГО СПИРТА, ЕГО КРИСТАЛЛИЧЕСКАЯ ФОРМА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2816099C1 |
| ЛЕЧЕНИЕ ИЛИ ПРОФИЛАКТИКА ПРОЛИФЕРАТИВНЫХ СОСТОЯНИЙ | 2010 |
|
RU2705548C2 |
| ПРОИЗВОДНОЕ ИНДАНОНА, ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ ИЛИ ЭНАНТИОМЕР, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ВИРУСНОГО ЗАБОЛЕВАНИЯ | 2012 |
|
RU2574591C2 |
| ПРОИЗВОДНЫЕ 1,3-ДИОКСОИНДЕНА, ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ АНТИВИРУСНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2012 |
|
RU2566761C2 |
| ИМИДАЗОПИРИМИДИНЫ КАК ИНГИБИТОРЫ EED И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2836176C2 |
| N-(ФЕНИЛСУЛЬФОНИЛ) БЕНЗАМИДЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ BCL-2 | 2020 |
|
RU2831159C2 |
| N-(ФЕНИЛСУЛЬФОНИЛ) БЕНЗАМИДЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ BCL-2 | 2017 |
|
RU2744358C2 |
| ДЕСТРУКТОРЫ БЕЛКА MDM2 | 2017 |
|
RU2743432C2 |





Изобретение относится к простому эфирному производному никотинилового спирта формулы (IA-1), или его фармацевтически приемлемой соли или стереоизомеру;
где R3 выбран из замещенного C1-C8 насыщенного алкиламино, замещенного C2-C6 ненасыщенного алкиламино, замещенного N-содержащего C2-C6 гетероцикл-1-ила, где каждый является моно- или ди-замещенным заместителем(ми), выбранным из атома водорода, гидрокси, C1-C5 алкила, ацетиламино, циано, метансульфониламино (-NH-SO2CH3), гидроксиформила (-COOH), C1-C8 алкоксилкарбонила,  ; Х представляет собой атом хлора. А также к способу его получения, фармацевтической композиции и применению для лечения заболеваний, ассоциированных с сигнальными каналами PD-1/PD-L1, такими как рак, инфекционные заболевания и аутоиммунные заболевания. 4 н. и 6 з.п. ф-лы, 11 табл., 29 пр., 14 ил.
; Х представляет собой атом хлора. А также к способу его получения, фармацевтической композиции и применению для лечения заболеваний, ассоциированных с сигнальными каналами PD-1/PD-L1, такими как рак, инфекционные заболевания и аутоиммунные заболевания. 4 н. и 6 з.п. ф-лы, 11 табл., 29 пр., 14 ил.
1. Простое эфирное производное никотинилового спирта, представленное формулой (IA-1), или его фармацевтически приемлемая соль или стереоизомер;
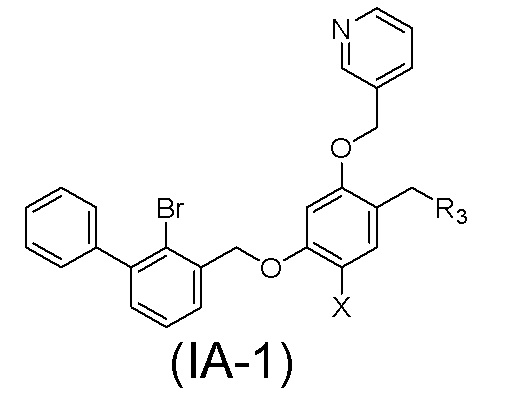
где:
R3 выбран из замещенного C1-C8 насыщенного алкиламино, замещенного C2-C6 ненасыщенного алкиламино, замещенного N-содержащего C2-C6 гетероцикл-1-ила, где каждый является моно- или ди-замещенным заместителем(ми), выбранным из атома водорода, гидрокси, C1-C5 алкила, ацетиламино, циано, метансульфониламино (-NH-SO2CH3), гидроксиформила (-COOH), C1-C8 алкоксилкарбонила,  ;
;
Х представляет собой атом хлора.
2. Простое эфирное производное никотинилового спирта по п.1, или его фармацевтически приемлемая соль или стереоизомер, где R3 выбран из:

где R выбран из этила, изопропила; и
Х представляет собой атом хлора.
3. Простое эфирное производное никотинилового спирта по п.1 или его фармацевтически приемлемая соль или стереоизомер, где соединение выбрано из:
этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината дигидрохлорида

N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серина

(S)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината

(S)-N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серина
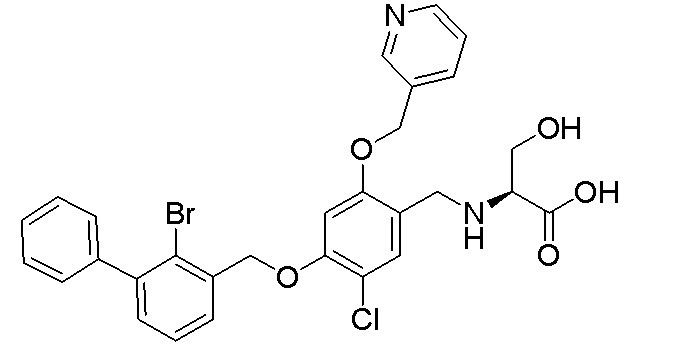
(S)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината дигидрохлорида

(S)-изопропил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината дигидрохлорида

(R)-этил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината

(R)-N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серина
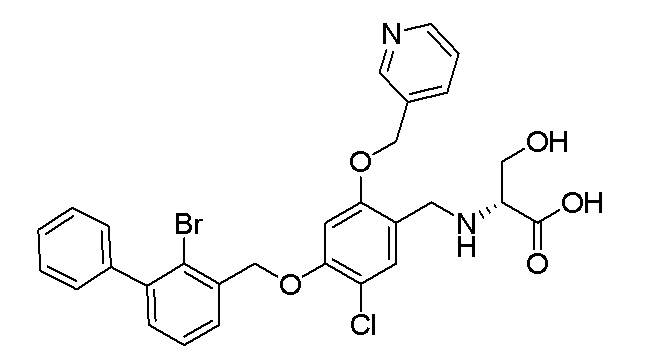
N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)глицина

N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)валина

(E)-3-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламино)бут-2-еннитрила

N,N-бис(гидроксиэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламина

N-(2-метансульфонаминоэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламина

N-(2-ацетиламиноэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламина

(E)-3-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламино)бут-2-еноевой кислоты

2-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламино)этансульфоновой кислоты

N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)лейцина
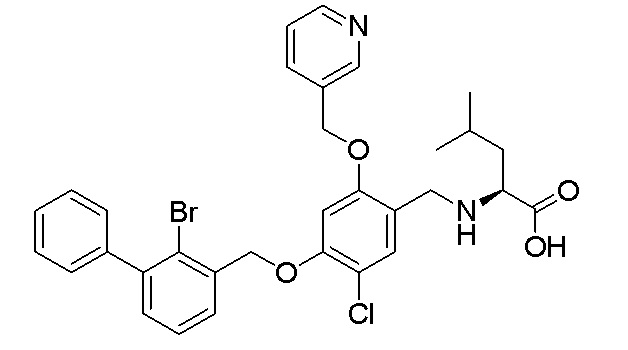
N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)тирозина

N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)изолейцина

N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)аспарагина

N-(гидроксиэтил)-4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензиламина
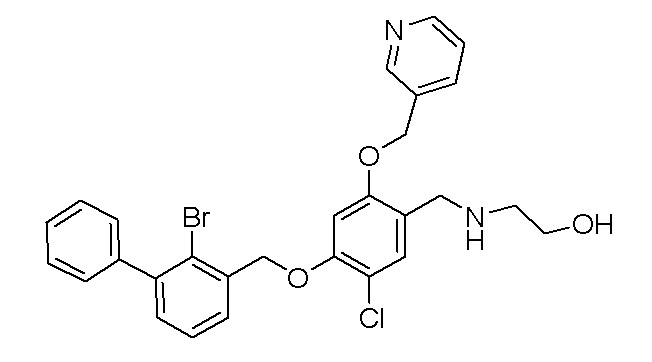
N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)аланина
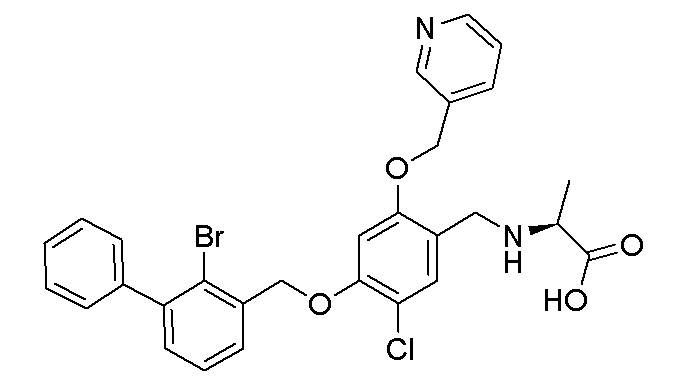
N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)пролина

(S)-N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината натрия

(S)-(N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-илметиленокси)бензил)серината кальция
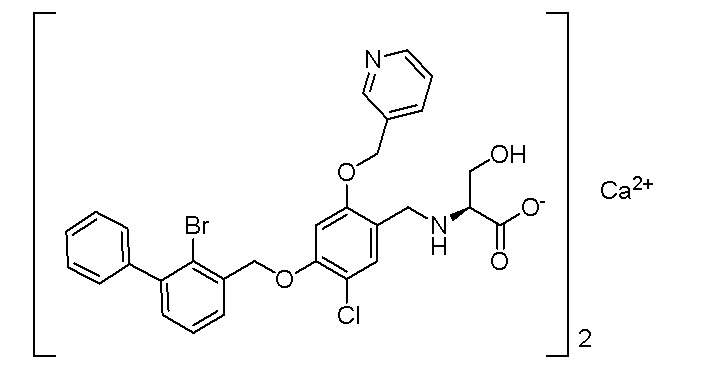
(S)-(5-метил-2-оксо-1,3-диоксол-4-ил)метил N-(4-(2-бром-3-фенилбензилокси)-5-хлор-2-(пиридин-3-ил-метиленокси)бензил)серината

4. Простое эфирное производное никотинилового спирта по п.1 или его стереоизомер и его фармацевтически приемлемая соль, где фармацевтически приемлемая соль включает соль, образованную неорганической кислотой, соль, образованную органической кислотой, соль иона щелочного металла, соль иона щелочноземельного металла или соль, образованную органическим основанием, которое обеспечивает физиологически приемлемый катион, и соль аммония.
5. Простое эфирное производное никотинилового спирта по п.4 или его стереоизомер и его фармацевтически приемлемая соль, где неорганическая кислота выбрана из хлористоводородной кислоты, бромистоводородной кислоты, фосфорной кислоты или серной кислоты; органическая кислота выбрана из метансульфоновой кислоты, п-толуолсульфоновой кислоты, трифторуксусной кислоты, лимонной кислоты, малеиновой кислоты, винной кислоты, фумаровой кислоты, лимонной кислоты или молочной кислоты; ион щелочного металла выбран из иона лития, иона натрия, иона калия; ион щелочноземельного металла выбран из иона кальция и иона магния; органическое основание, которое обеспечивает физиологически приемлемый катион, выбрано из метиламина, диметиламина, триметиламина, пиперидина, морфолина или трис(2-гидроксиэтил)амина.
6. Способ получения простого эфирного производного никотинилового спирта по любому из пп.1-5 или его стереоизомера или его фармацевтически приемлемой соли:

для получения соединений формулы (I), согласно их структуре, способ получения разделяется на две стадии:
(а) 2-гидрокси-4-(2-бром-3-R1-бензилокси)-Х-замещенный бензальдегид 1 в качестве исходного соединения подвергают взаимодействию с пиридин-3-илметиленгалогенидом в щелочных условиях с получением альдегидсодержащего промежуточного соединения 2;
(b) альдегидсодержащее промежуточное соединение 2 в качестве исходного соединения конденсируют с HR3, содержащим аминогруппу или иминогруппу, и полученный продукт восстанавливают с получением целевого соединения I;
где R1, R3 и X каждый имеет значения, определенные в любом из пп.1-5.
7. Фармацевтическая композиция для профилактики и/или лечения заболевания, ассоциированного с сигнальными каналами PD-1/PD-L1, отличающаяся тем, что она содержит эффективное количество простого эфирного производного никотинилового спирта по любому из пп.1-5, или его стереоизомер или фармацевтически приемлемую соль в качестве активного ингредиента и один или более фармацевтически приемлемых носителей или эксципиентов.
8. Применение простого эфирного производного никотинилового спирта по любому из пп.1-5 или его стереоизомера или его фармацевтически приемлемой соли в производстве лекарственного средства для профилактики и/или лечения заболевания, ассоциированного с сигнальным путем PD-1/PD-L1.
9. Применение по п.8, где заболевание, ассоциированное с сигнальным путем PD-1/PD-L1, выбрано из рака, инфекционного заболевания и аутоиммунного заболевания.
10. Применение по п.9, где рак выбран из меланомы, рака легкого, рака молочной железы и рака толстой кишки.
| WO 2015160641 A2, 22.10.2015 | |||
| CN 103787902 A, 14.05.2014 | |||
| WO 2013126428 A1, 29.08.2013 | |||
| Беликов В.Г | |||
| "Фармацевтическая химия" | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| - М.: Высшая школа, 1993, с | |||
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
Авторы
Даты
2020-11-03—Публикация
2017-05-23—Подача