Область техники, к которой относится изобретение
Настоящее изобретение относится к ингибиторам VAP-1 и их применению в качестве антифиброзных средств. Кроме того, настоящее изобретение относится к способу диагностики фиброзной болезни и набору для применения в диагностическом способе.
Уровень техники
Как правило, фиброзные болезни развиваются в результате нарушенного процесса заживления после травмы или хронического воспаления. Фиброзная патология преимущественно развивается в органах, которые постоянно подвергаются воздействию повреждающих факторов химической и биологической природы, например, печень, легкие, кожа и почки. Независимо от того, являются расстройства острыми или хроническими, они имеют общую характеристику, заключающуюся в потере органом функции, поскольку нормальная ткань замещается рубцовой тканью. Заболевание прогрессирует, часто вызывая необратимые изменения, с плохим прогнозом и выживаемостью.
Состав фиброзного рубца является практически одинаковым, независимо от причины поражения. Диагностика и установление тяжести фиброза являются очень важными с точки зрения прогноза болезни. Процесс планирования лечения в большой степени основан на оценке фиброза, его прогрессировании и начале осложнений. При фиброзе печени перкутанная биопсия является золотым стандартом для классификации и установления стадии заболевания печени. Однако это инвазивная процедура с присущим ей определенным неизбежным риском и осложнениями, которая, кроме того, ассоциируется с болью и дискомфортом. Показатели смертности в результате осложнений от этой процедуры находятся в пределах от 1:1000 до 1:10000 (Crockett et al., 2006).
Было установлено, что активность сывороточной моноаминоксидазы повышена у пациентов с циррозом, хроническим гепатитом и раком печени, которые все ассоциированы с фиброзом, но имеет нормальные показатели у пациентов с воспалительными заболеваниями соединительной ткани, такими как ревматоидный артрит или системная красная волчанка (McEwen and Castell, 1967, J. Lab. Clin. Med., 70:36-47; Ito et al., 1971, Digestion, 4:49-58; Ma Lin et al., 1976, Proc. Soc. Exp. Biol. med., 151:40-43). Однако полагалось, что повышенная активность сывороточной моноаминоксидазы является только показателем или ответом на поражение ткани, и не было известно об ее роли в патогенезе фиброза.
Обычные терапевтические подходы в основном направлены на лечение воспалительного процесса при фиброзе с использованием кортикостероидов и иммуносупрессоров. Однако, к сожалению, данные средства обладают слабой эффективностью, или она вовсе отсутствует, и существует очевидная потребность в новых лекарственных препаратах для лечения фиброзных болезней.
Сущность изобретения
Некоторые цели настоящего изобретения относятся к ингибиторам VAP-1 в качестве антифиброзных средств, применениям ингибиторов VAP-1 для производства лекарственного препарата для лечения фиброзной болезни и способам профилактики, лечения или ослабления фиброзной болезни у человека, нуждающегося в этом, где указанный способ включает введение указанному пациенту эффективного количества ингибитора VAP-1.
Дополнительная цель настоящего изобретения относится к способу диагностики фиброзной болезни у субъекта. Способ включает (а) получение пробы жидкости организма от указанного субъекта; (b) анализ количества растворимого VAP-1 (sVAP-1) или активности SSAO в указанной пробе; (с) диагностику фиброза на основе указанного количества sVAP-1 или активности SSAO. Если желательно, то количество sVAP-1 или активность SSAO можно сравнить с количеством sVAP-1 или активностью SSAO в референс-жидкости организма.
Еще одна цель настоящего изобретения относится к набору для применения в способе диагностики фиброзной болезни.
В некоторых вариантах осуществления вышеуказанных целей ингибитор VAP-1 представляет анти-VAP-1-антитело, такое как полностью человеческое анти-VAP-1-антитело, содержащее одну-три консенсусных CDR-последовательности, выбранных из группы, состоящей из последовательностей SEQ ID NO:1-3, и/или полипептид легкой цепи, содержащий одну-три консенсусных CDR- последовательности, выбранных из группы, состоящей из последовательностей SEQ ID NO:24-26. В еще одних вариантах осуществления указанное анти-VAP-1-антитело содержит полипептид тяжелой цепи, содержащий первую CDR-последовательность, выбранную из последовательностей SEQ ID NO:4-8, вторую CDR-последовательность, выбранную из последовательностей SEQ ID NO:9-13, и третью CDR-последовательность, выбранную из последовательностей SEQ ID NO:14-18, и/или полипептид легкой цепи, содержащий первую CDR-последовательность, выбранную из последовательностей SEQ ID NO:27-31, вторую CDR-последовательность, выбранную из последовательностей SEQ ID NO:32-36, и третью CDR-последовательность, выбранную из последовательностей SEQ ID NO:37-41.
В некоторых дополнительных вариантах осуществления указанное анти-VAP-1-антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:19-23, и соответствующую вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:42-46. В еще одних дополнительных вариантах осуществления указанное антитело представляет полностью человеческое рекомбинантное антитело, содержащее полипептид тяжелой цепи, представленный в SEQ ID NO:47, и полипептид легкой цепи, представленный в SEQ ID NO:48.
В еще одних вариантах осуществления вышеуказанных целей ингибитор VAP-1 представляет ингибитор SSAO, такой как соединение, выбранное из группы, состоящей из производных гидразина, пропениламинов и пропаргиламинов, 4-замещенных-2-бутиниламинов, галогеналлиламинов, производных пирролина, пропаргилдиаминов, аллиламинов, диаминов, производных 4,5,6,7-тетрагидроимидазо[4,5-с]пиридина, тиокарбамоильных производных, карбоксамидов, сульфонамидов, производных тиазола и/или гуанидина, оксимных производных, дигидразина, арилалкиламинов, оксазолидинонов, галогеналкиламинов, производных бенфотиамина и имидазопиридина.
В некоторых дополнительных вариантах осуществления вышеуказанных целей фиброзная болезнь выбрана из группы, состоящей из фиброза печени и воспалительных заболеваний, предрасполагающих к нему, т.е. острого и хронического гепатита, заболевания желчного пузыря и желчных путей, и токсического поражения печени, пульмонарного фиброза, фиброза почек, включая возникший в результате диабетической нефропатии, миелофиброза, фиброза поджелудочной железы, склеродермы, соединительнотканных заболеваний, рубцевания, фиброза кожи, фиброза сердца, трансплантата органа, стеноза сосудов, рестеноза, фиброза артерий, артрофиброза, фиброза молочной железы, фиброза мышц, ретроперитонеального фиброза, фиброза щитовидной железы, фиброза лимфатических узлов, фиброза мочевого пузыря, плеврального фиброза и COPD, заболевания при котором стенки дыхательных путей становятся фиброзными по мере накопления миофибробластов и коллагена, и включаются все подобные фиброзные ткани.
Другие конкретные варианты осуществления изобретения приводятся в зависимых пунктах формулы изобретения.
Другие цели, детали и преимущества настоящего изобретения станут понятными из последующих фигур, подробного описания изобретения и примеров.
Краткое описание фигур
Ниже изобретение будет описано подробнее посредством предпочтительных вариантов осуществления при обращении к прилагаемым фигурам, где:
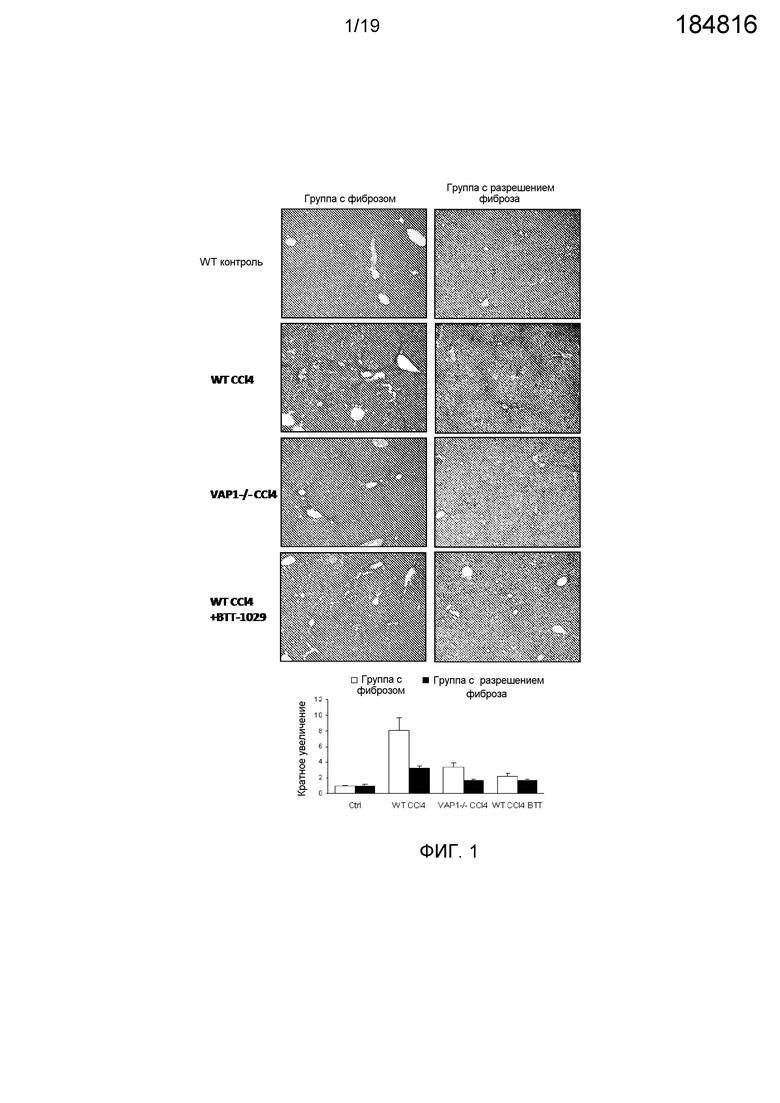
На фигуре 1 показано, что введение анти-VAP-1-антитела BTT-1029 приводит к практически полной защите от индуцированного CCl4 фиброза печени. Окрашивание сириусом красным печени от мышей WT и с нокаутом VAP-1, которым вводили минеральное масло (МО, контрольная группа), CCl4 или CCl4 вместе с антителом против VAP-1. Количественное определение фиброзного рубца проводили с использованием пороговой обработки изображений J. Приведено среднее значение±стандартная ошибка среднего. Увеличение ×10.
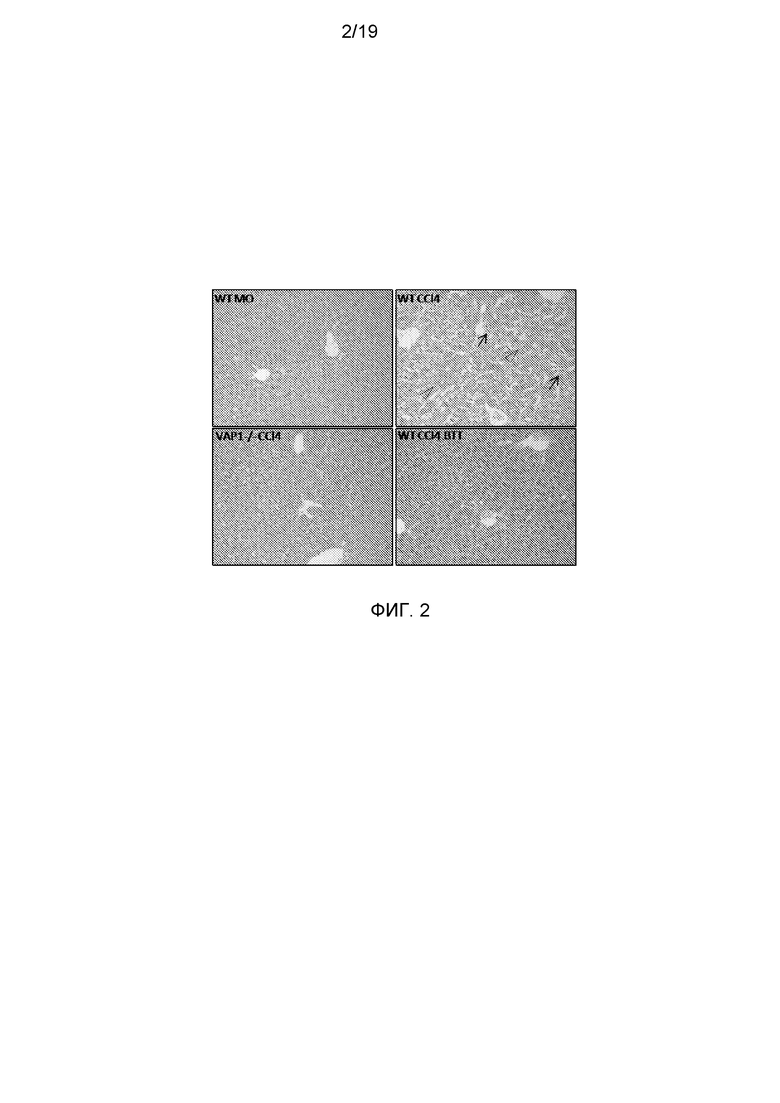
На фигуре 2 показано, что в печени мышей, обработанных антителом против VAP-1, и в печени мышей с нокаутом VAP-1 практически отсутствовал гепатит и некротические участки, несмотря на индукцию под действием CCl4 фиброза. Показаны окрашенные гематоксилин-эозином при увеличении ×20 некротические гепатоциты (острие стрелок) и текущий гепатит (стрелки).
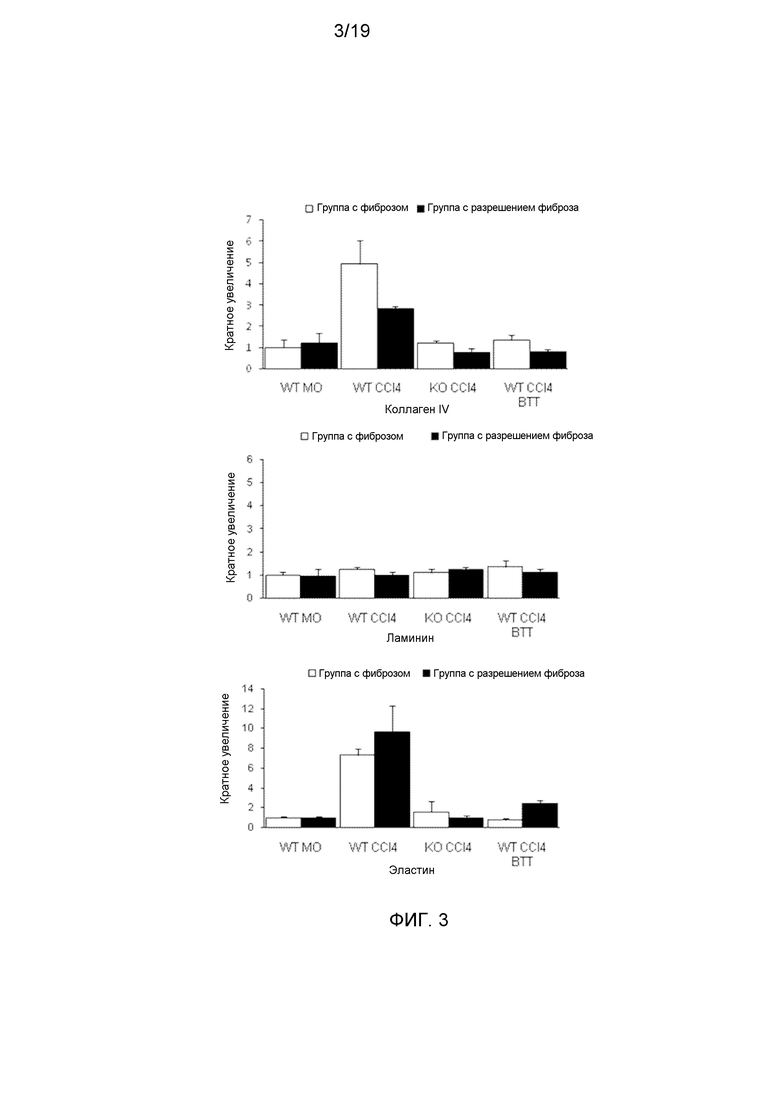
На фигуре 3 показано, что повышение экспрессии коллагена IV и эластина в фиброзных тканях предупреждается антителом против VAP-1. Проводили количественное определение коллагена IV, эластина и ламинина с использованием пороговой обработки изображений J. Приведено среднее значение±стандартная ошибка среднего.
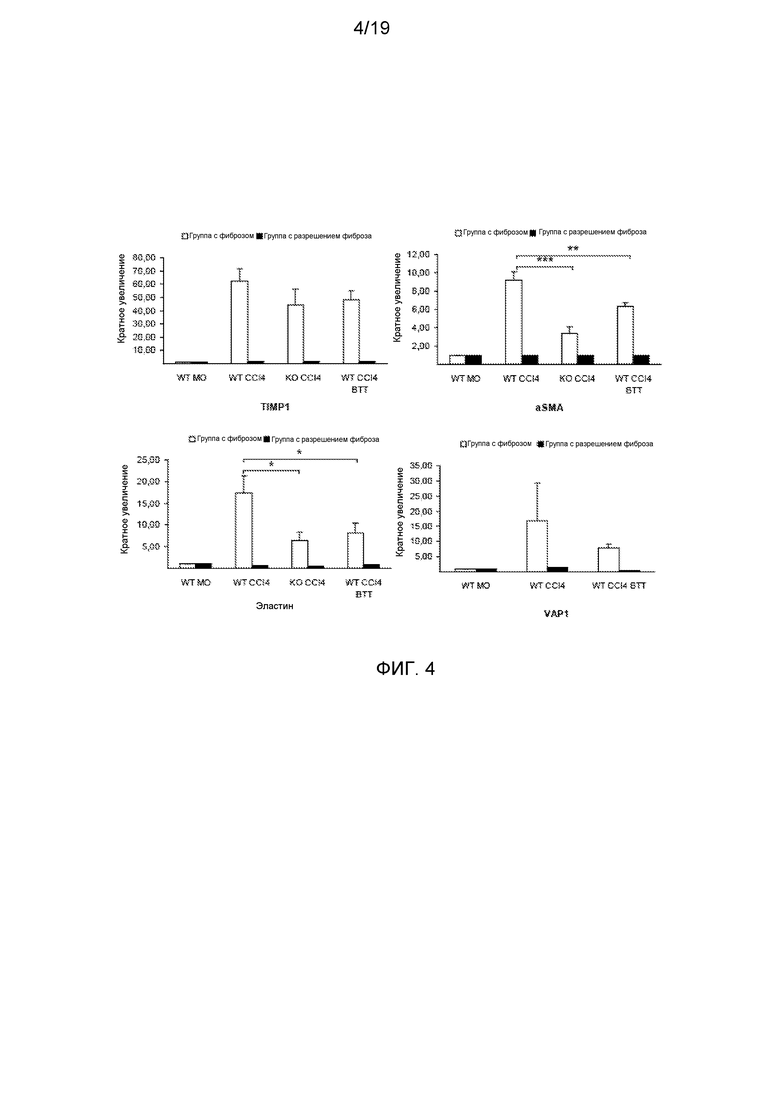
На фигуре 4 показано, что уровни мРНК указывают на регуляторное влияние VAP-1 на звездчатые клетки и фибробласты печени. Показан анализ эластина, aSMA, VAP-1 и TIMP1 количественной ОТ-ПЦР. Данные представлены в виде среднего значения±стандартная ошибка среднего по трем мышам при анализе в трех параллелях. *р<0,05; **р<0,01; ***р<0,001 (ANOVA).
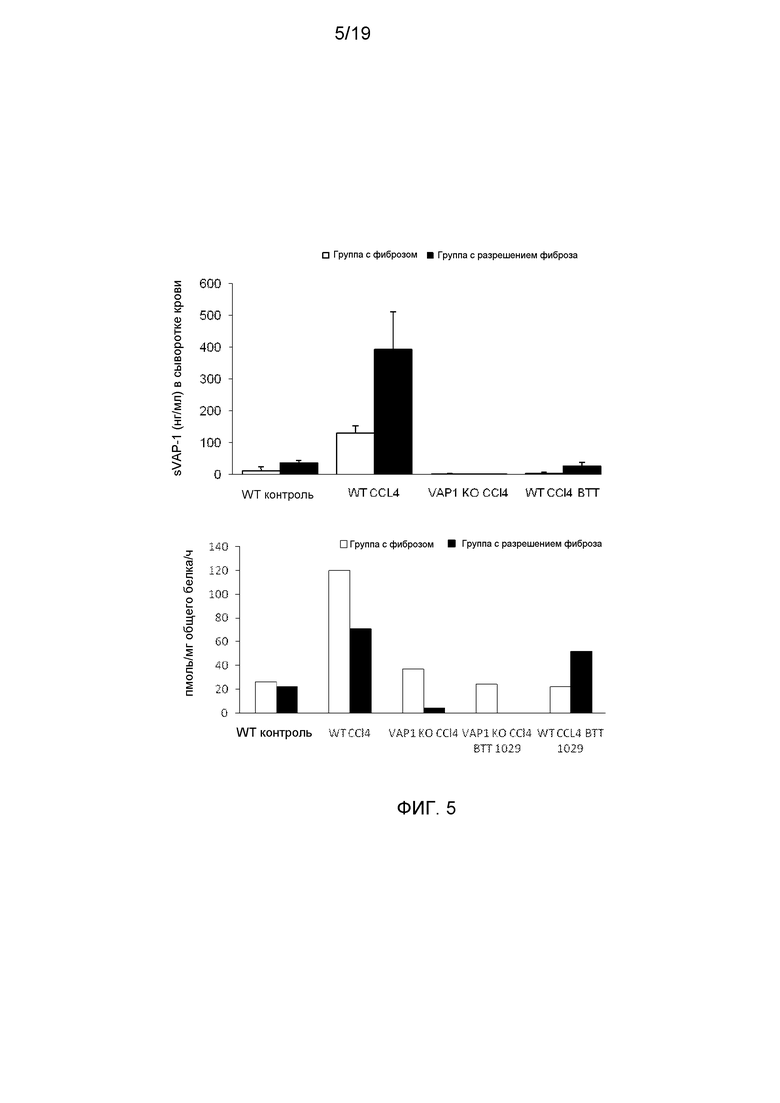
На фигуре 5 показано, что содержание растворимого VAP-1 и SSAO активность в сыворотке крови повышается в ответ на индуцированный CCl4 фиброз печени. На фигуре 5А показано влияние индуцированного CCl4 фиброза печени на содержание растворимого VAP-1 в сыворотке крови по данным разделенного во времени флуорометрического анализа с набором реагентов DELFIA. На фигуре 5В показано, что повышенная активность SSAO обнаружена в сыворотке крови мышей WT с индуцированным CCl4 фиброзом печени по данным радиохимического анализа.
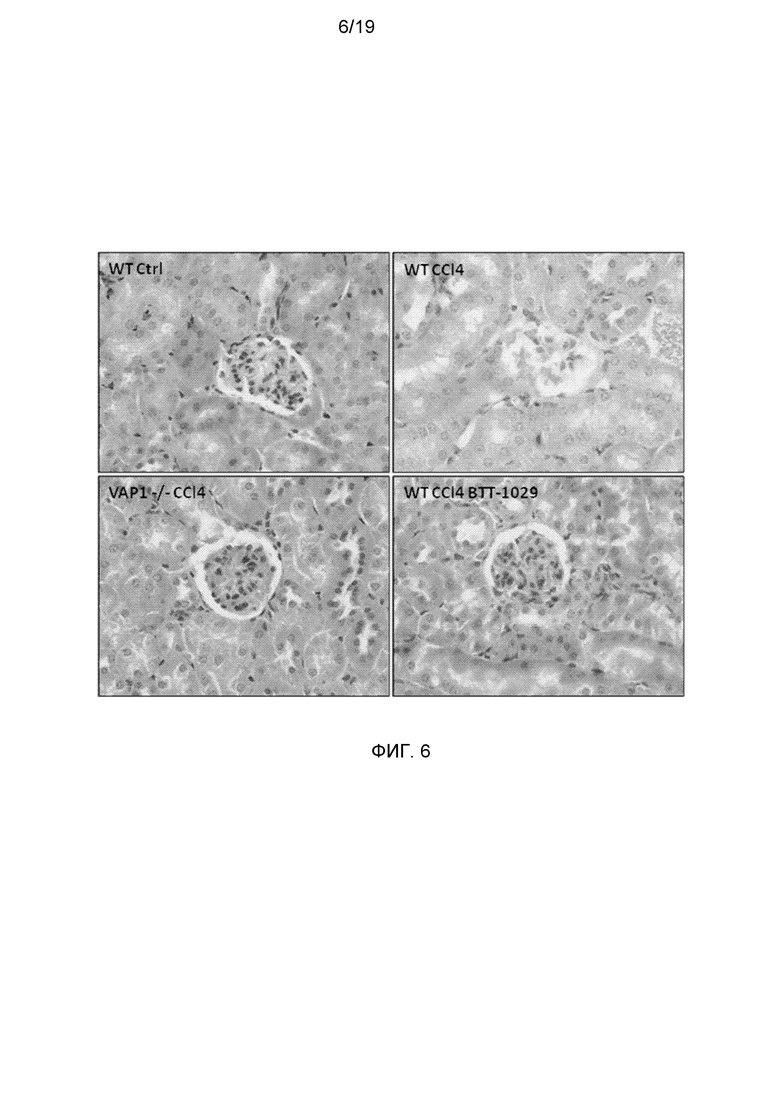
На фигуре 6 показано, что участки поражения клубочков, индуцированные CCl4, отсутствуют у мышей с нокаутом VAP-1 и у мышей C57BL/6, обработанных антителами против VAP-1. Показано окрашивание гематоксилин-эозином при увеличении ×40, выделяющее клубочки.
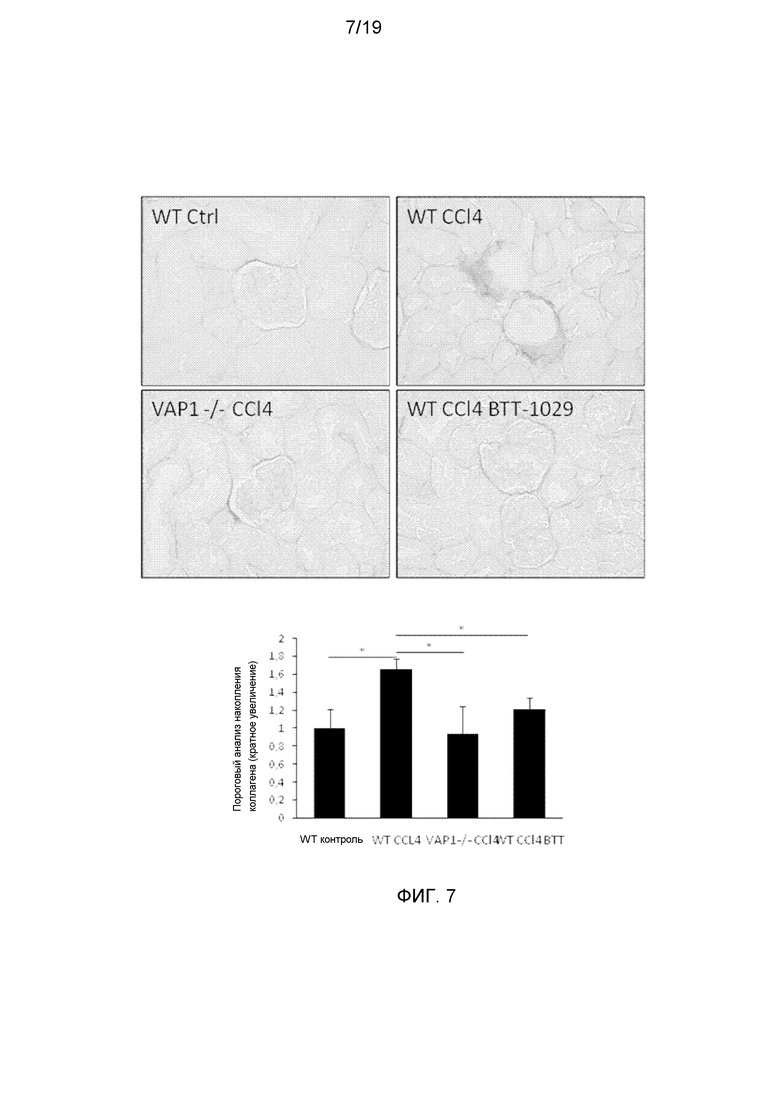
На фигуре 7 показано, что накопление коллагена, в результате индуцированного CCl4 фиброза клубочков, достоверно снижается у мышей с нокаутом VAP-1 и у мышей, обработанных антителами против VAP-1. Окрашивание сириусом красным печени от мышей WT и с нокаутом VAP-1, которым вводили минеральное масло (МО, контрольная группа), CCl4 или CCl4 вместе с антителом против VAP-1. Количественное определение фиброзного рубца проводили с использованием пороговой обработки изображений J. Приведено среднее значение ± стандартная ошибка среднего. Увеличение ×40.
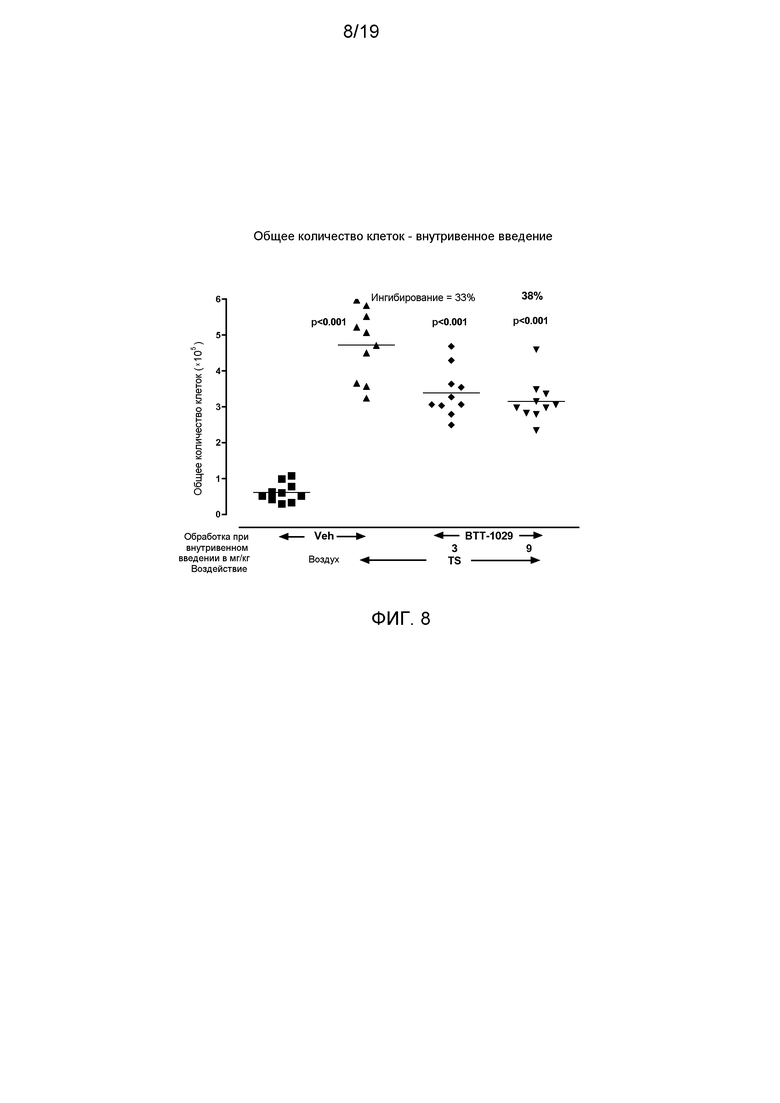
На фигуре 8 показано снижение общего числа клеток в жидкости бронхоальвеолярного лаважа от мышей, подвергшихся воздействию табачного дыма и обработанных антителом к VAP-1 (BTT-1029), по сравнению с мышами, обработанными растворителем.
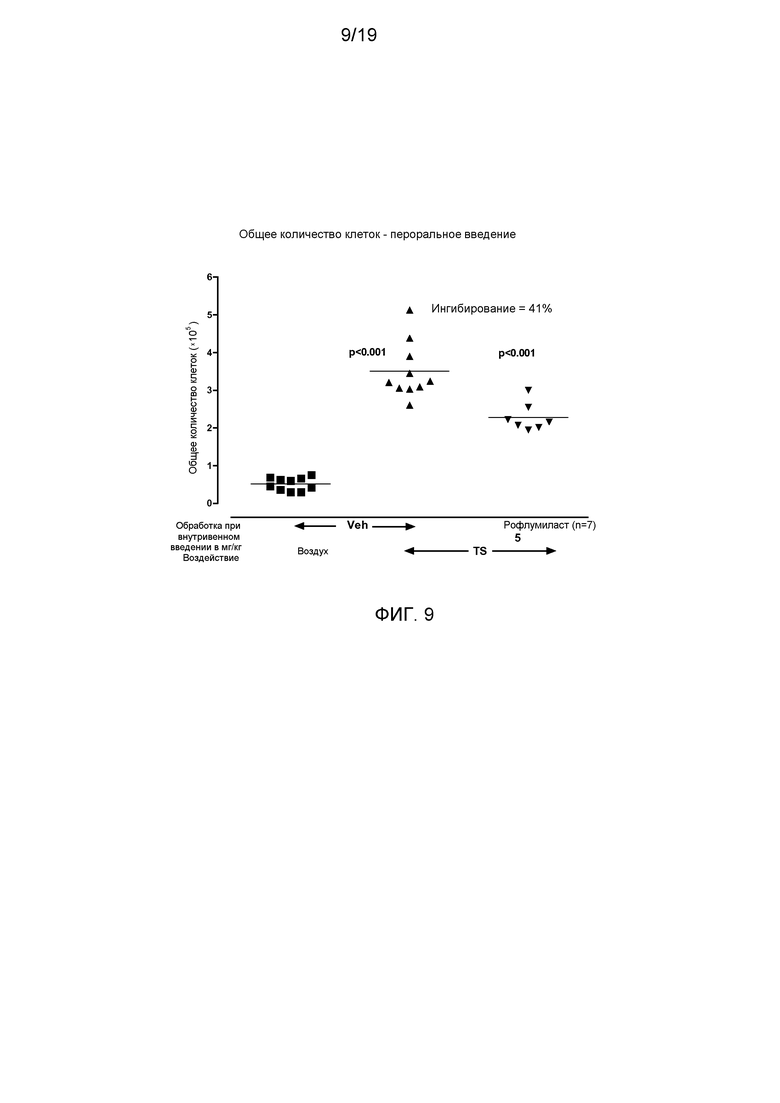
На фигуре 9 показано снижение общего числа клеток в жидкости бронхоальвеолярного лаважа от мышей, подвергшихся воздействию табачного дыма и обработанных рофлумиластом, по сравнению с мышами, обработанными растворителем.
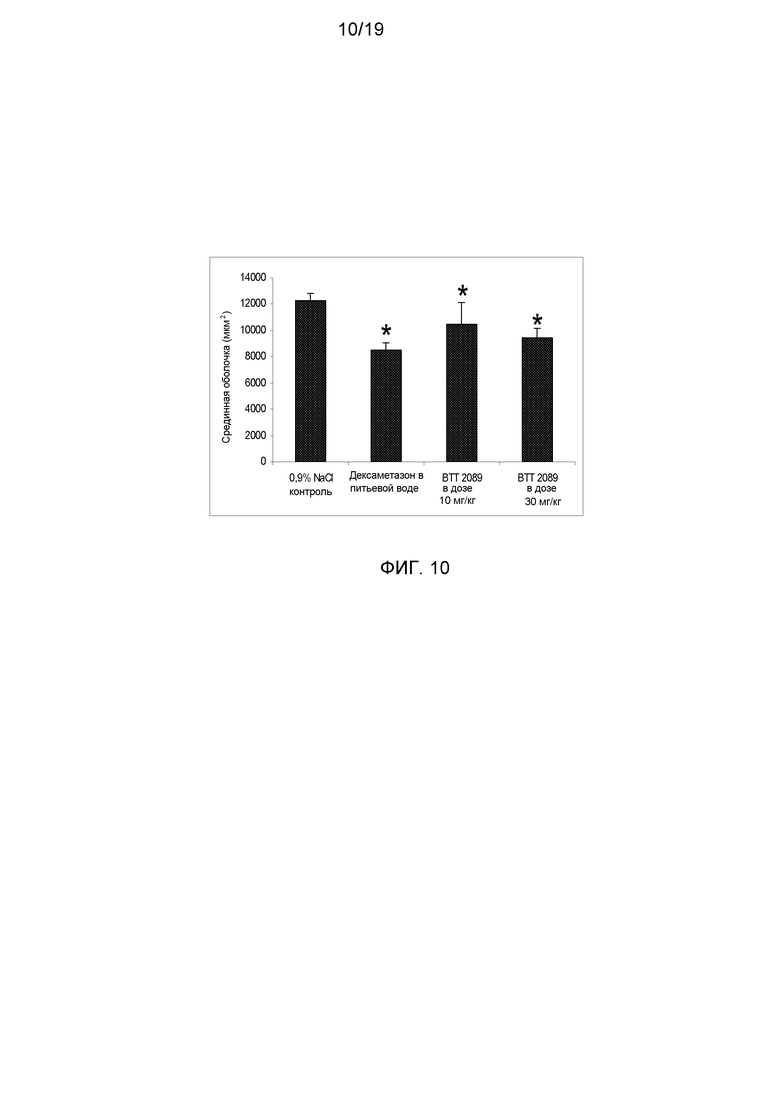
На фигуре 10 показано достоверное снижение в утолщении срединной оболочки в группе мышей, обработанных дексаметазоном, и в обеих группах, обработанных ингибитором SSAO (BTT-2089), по сравнению с мышами контрольной группы, обработанными 0,9% NaCl.
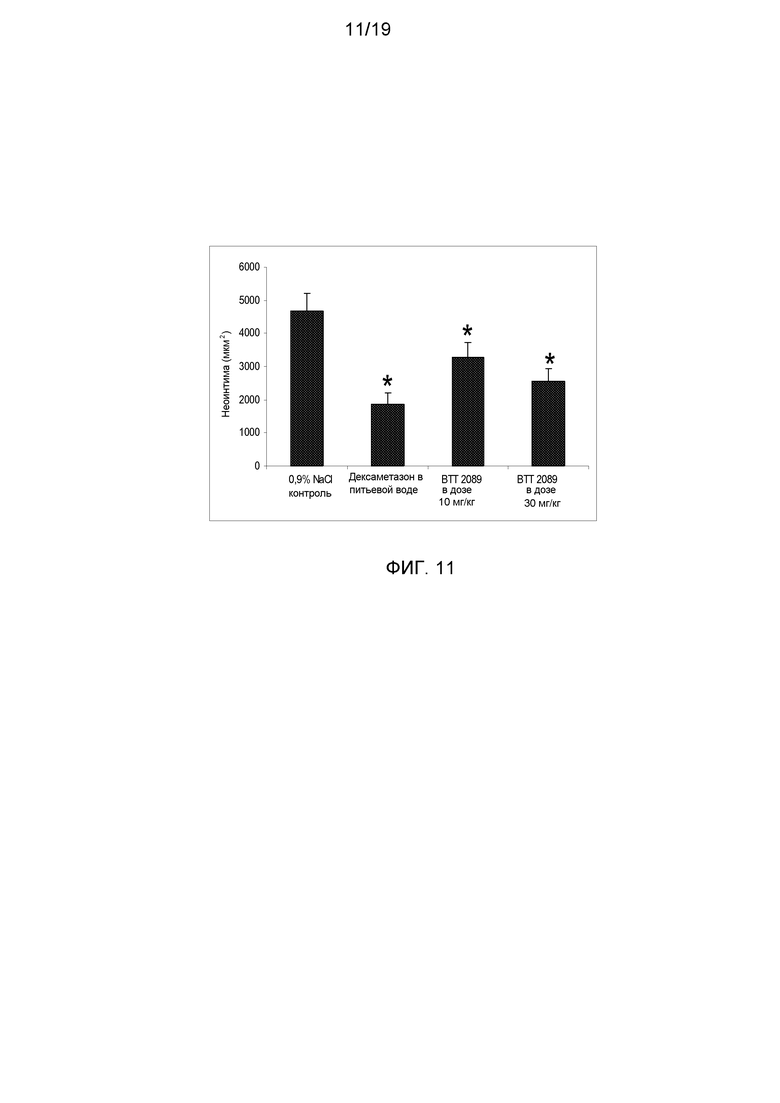
На фигуре 11 показано достоверное снижение утолщения неоинтимы в группе мышей, обработанных дексаметазоном, и в обеих группах, обработанных ингибитором SSAO (BTT-2089), по сравнению с мышами контрольной группы, обработанными 0,9% NaCl.
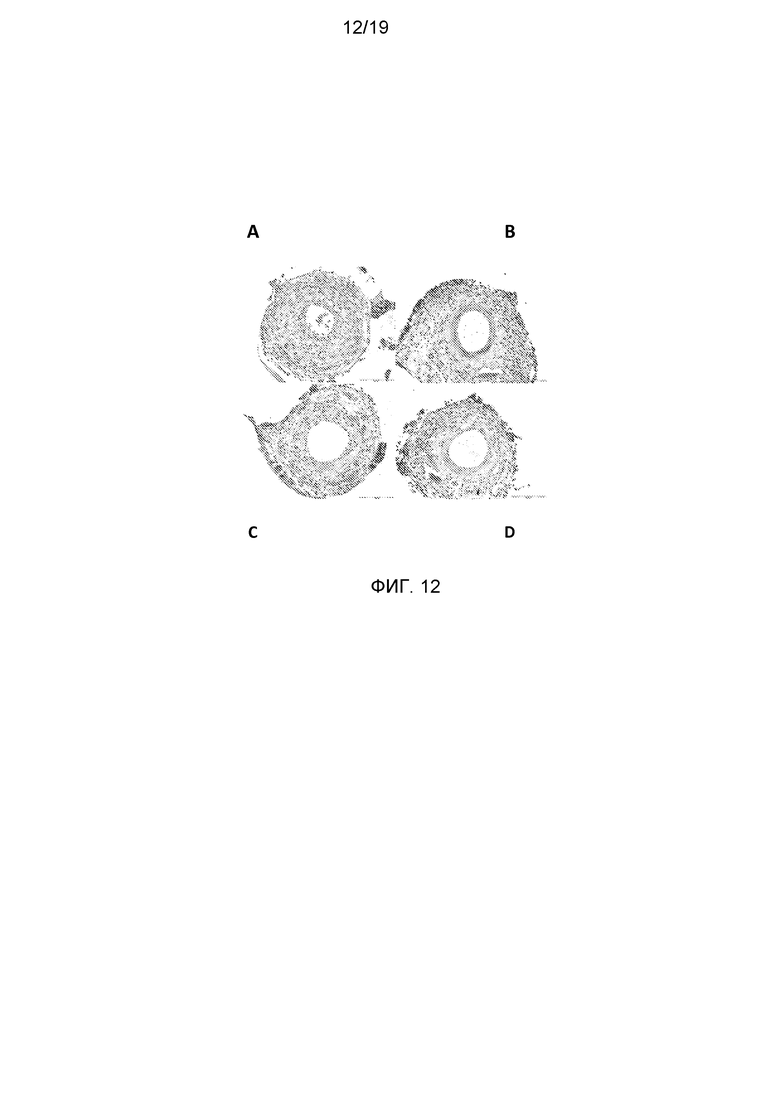
На фигуре 12 показаны примеры окрашивания сегментов сосудов гематоксилином-флоксином саффроном (HPS). Размер просвета был больше в группах С и D, обработанных ингибитором SSAO, по сравнению с контрольной группой А. А - группа с 0,9% NaCl; В - дексаметазон; С - BTT-2089 в дозе 10 мг/кг; D - BTT-2089 в дозе 30 мг/кг.
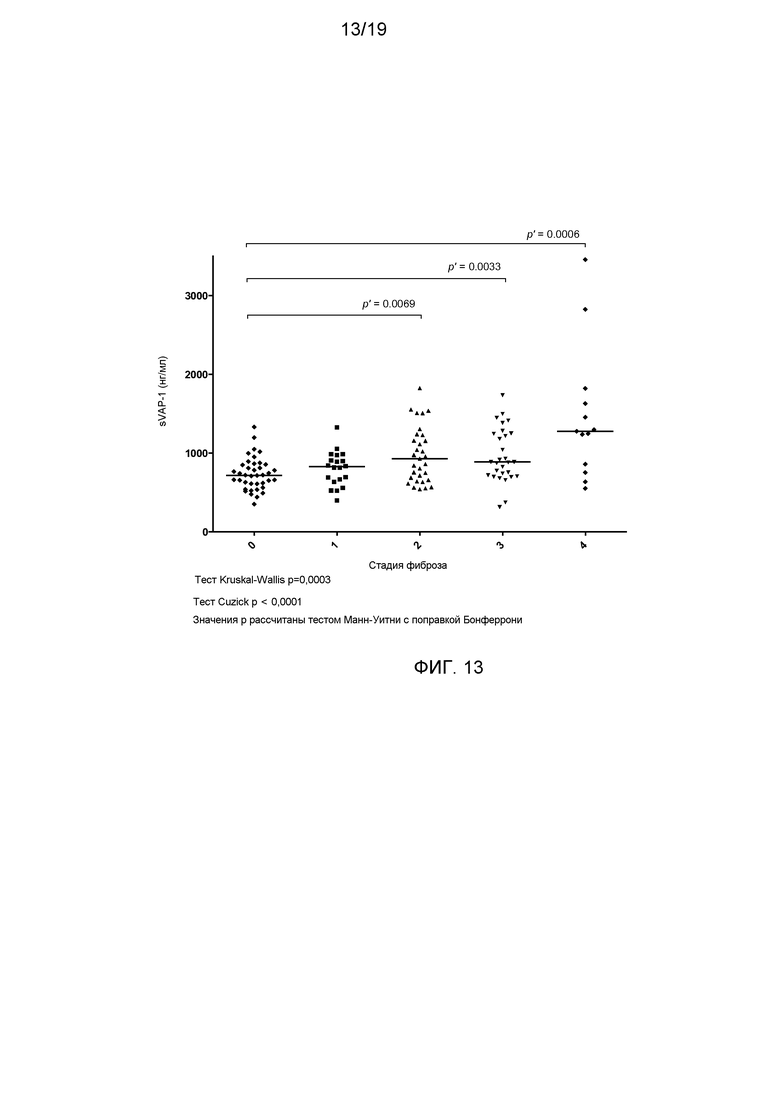
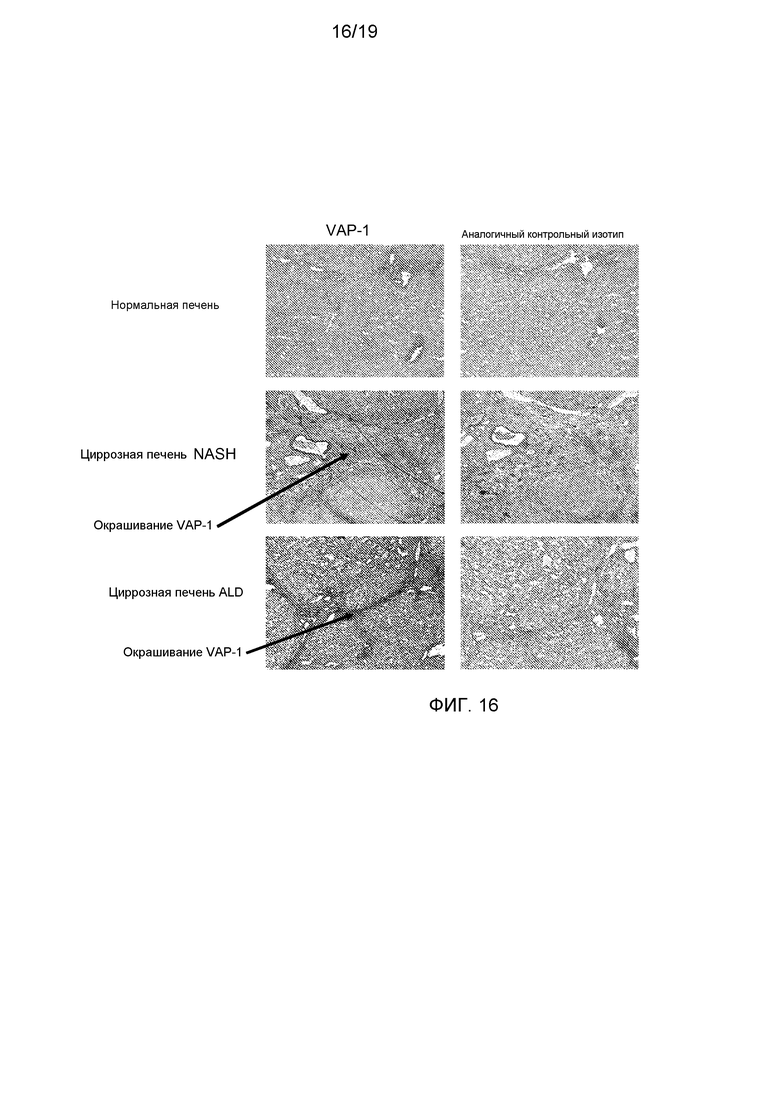
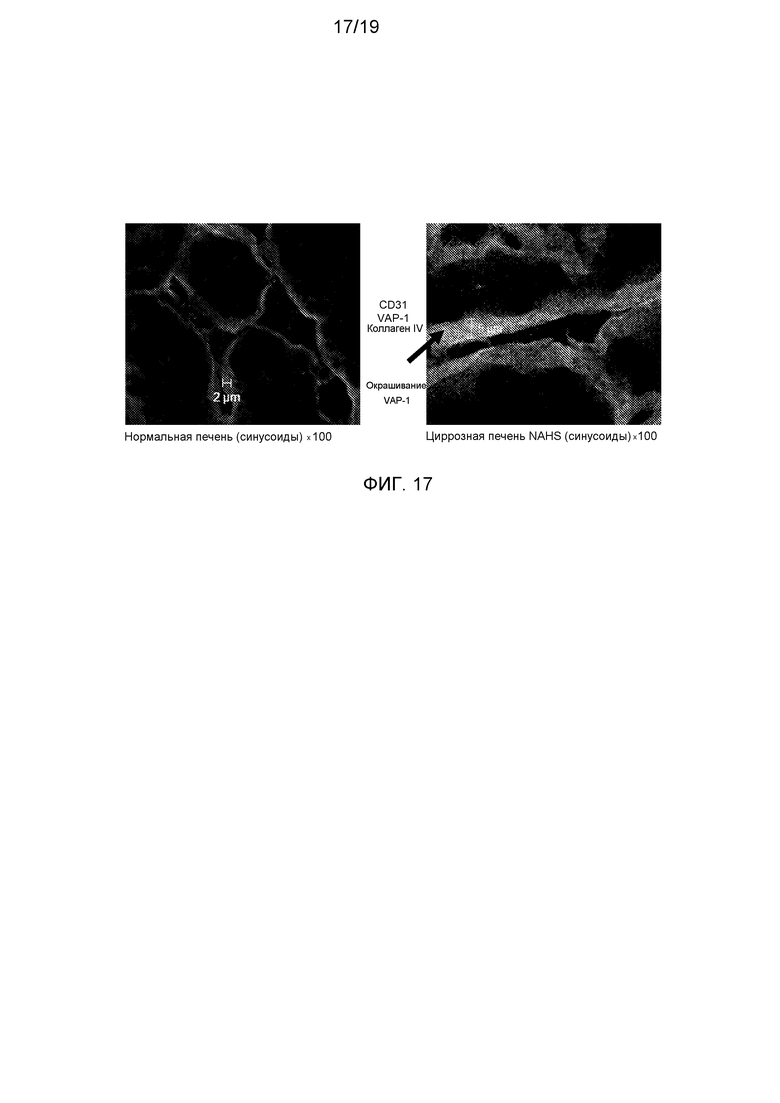
На фигуре 13 показана ткань нормальной печени, циррозной печени NASH и циррозной печени ALD, окрашенных анти-VAP-1-антителом или аналогичным по изотипу контрольным антителом. Окрашивание VAP-1 более темное в циррозной печени NASH и циррозной печени ALD по сравнению с нормальной печенью или при окрашивании антителом контрольного изотипа, и отражает повышение экспрессии VAP-1 в участках фиброза.
На фигуре 14 показана ткань нормальной печени и циррозной печени NASH, окрашенных анти-VAP-1-антителом, анти-CD31-антителом и анти-коллаген IV-антителом. Окрашивание VAP-1 указано стрелками и преобладает в основном в циррозной печени NASH и отражает повышение экспрессии VAP-1 в участках фиброза.
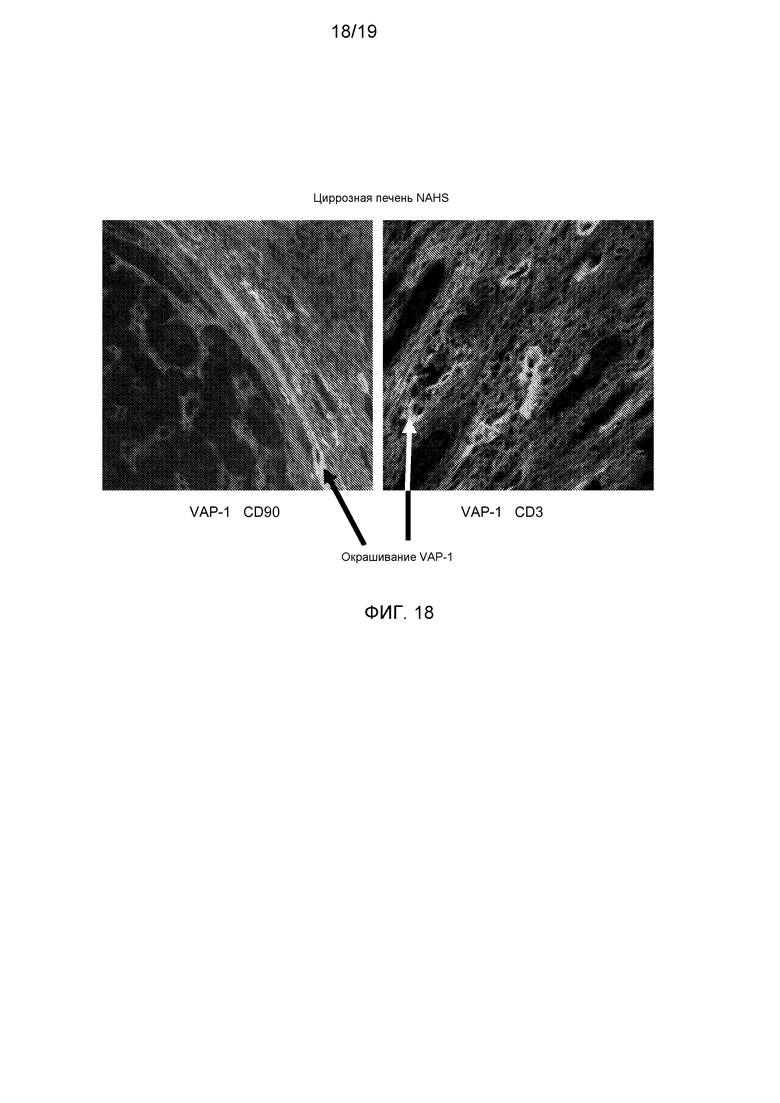
На фигуре 15 показана ткань нормальной печени и циррозной печени NASH, окрашенных анти-VAP-1-антителом, анти-CD90-антителом и анти-CD3-антителом. Окрашивание VAP-1 указано стрелками и преобладает в основном в циррозной печени NASH и отражает повышение экспрессии VAP-1 в участках фиброза.
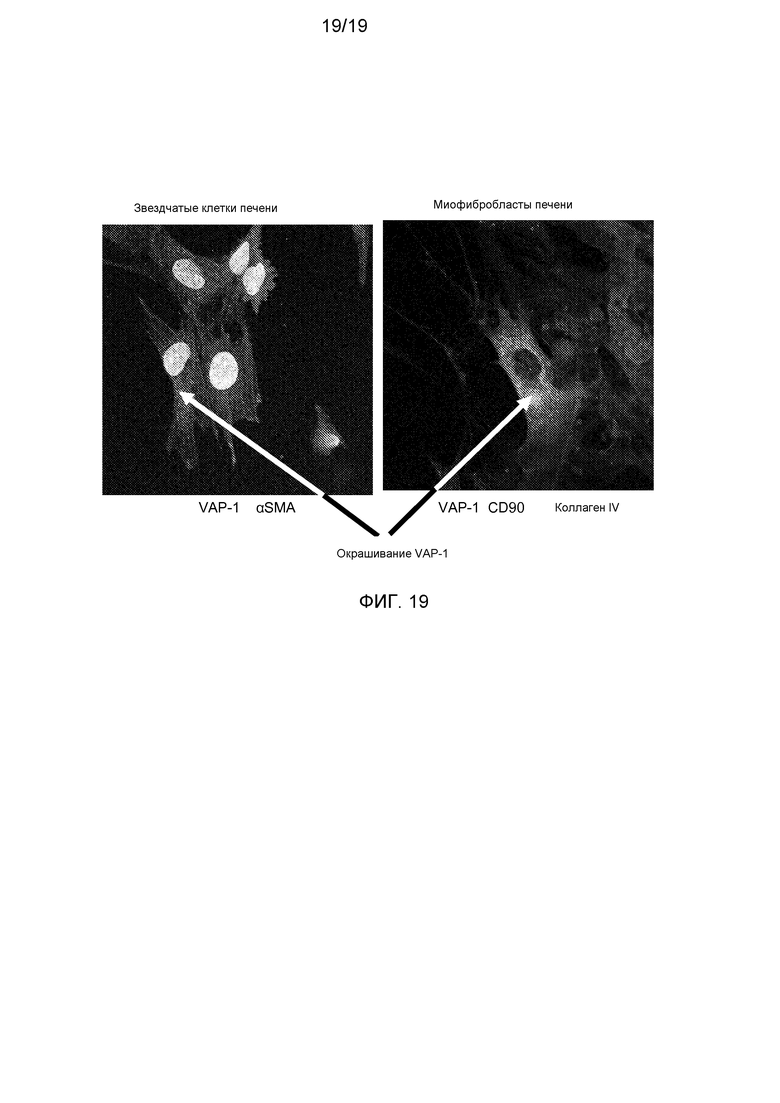
На фигуре 16 показаны звездчатые клетки печени, окрашенные анти-VAP-1-антителом и антителом против актина гладкой мускулатуры, и миофибробласты печени, окрашенные анти-VAP-1-антителом, анти-CD90-антителом и анти-коллаген IV-антителом. Окрашивание VAP-1 указано стрелками и преобладает в основном в звездчатых клетках и миофибробластах печени.
На фигуре 17 приведена диаграмма рассеивания содержания sVAP-1 и соответствующей стадии фиброза. Линии указывают медианные значения.
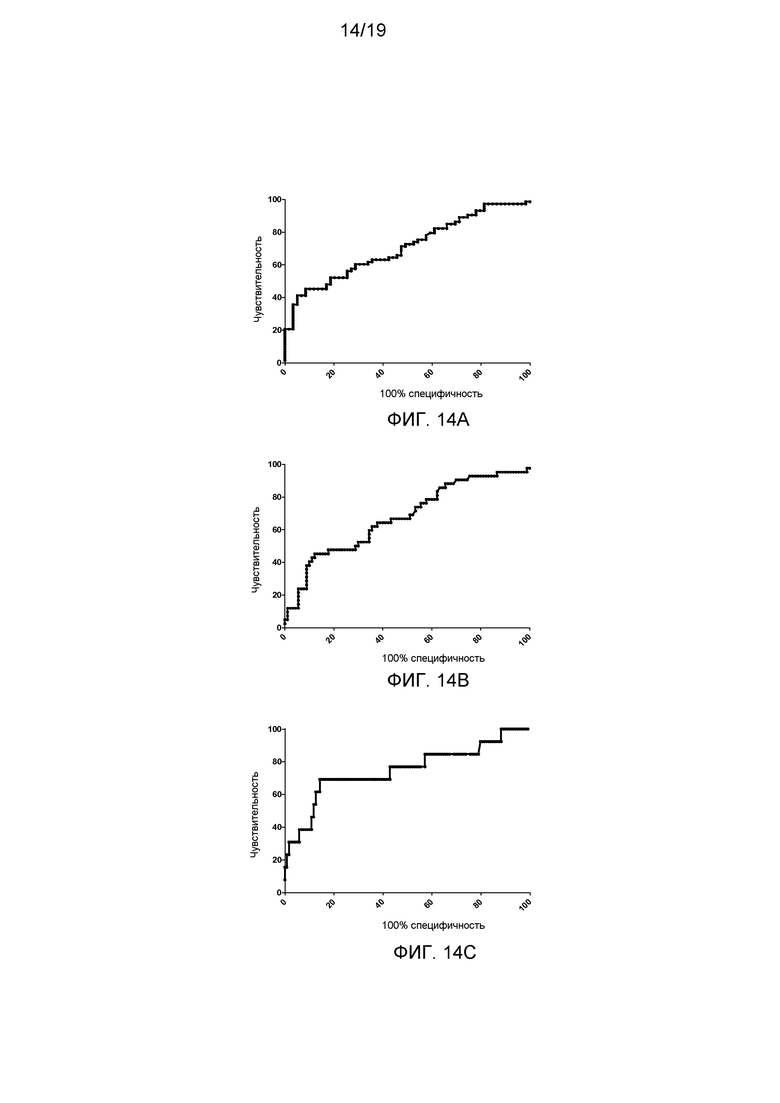
На фигуре 18 показана характеристическая кривая обнаружения (ROC) для sVAP-1, использованного в качестве единственного биологического маркера для прогноза значимого фиброза печени (стадии F2-4) (фигура 18А), выраженного фиброза печени (стадии F3-4) (фигура 18В) и цирроза (стадия F4) (фигура 18С).
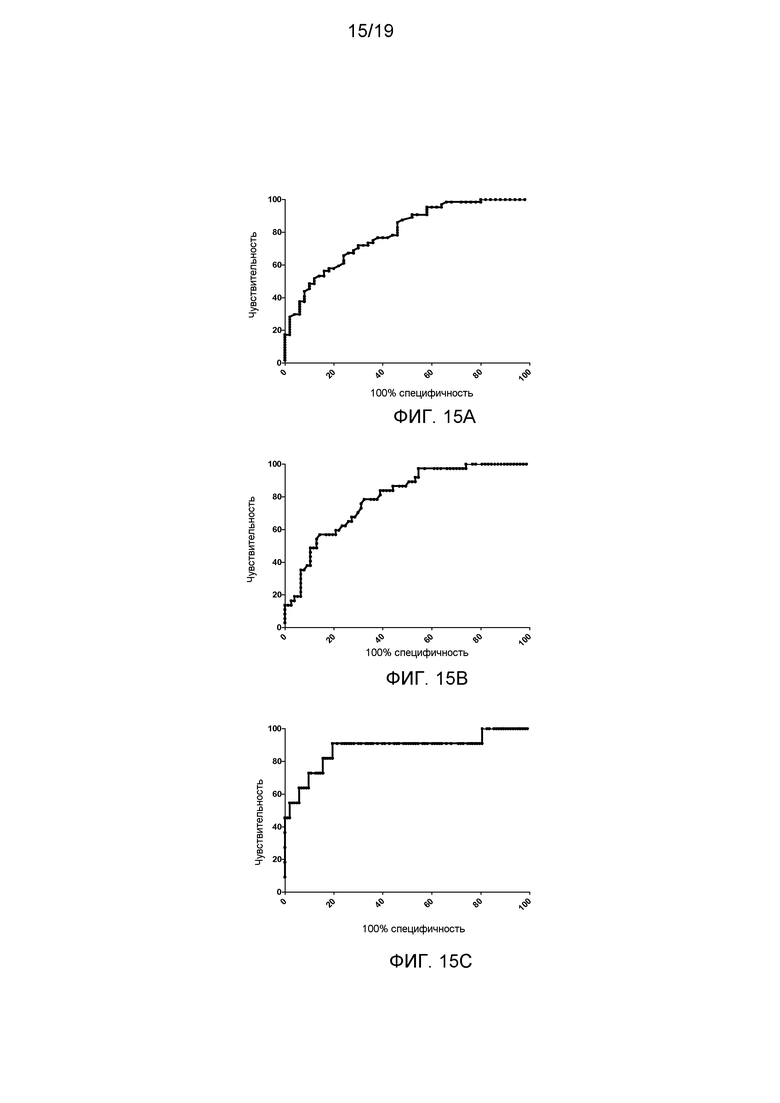
На фигуре 19 показана характеристические кривые обнаружения (ROC) для баллов оценки фиброза по уровню sVAP-1, диабетическому статусу и соотношению АСТ/АЛТ (0,837+sVAP-1 (нг/мл)×0,001 + диабет (да=1, нет=0)×0,591+log АСТ/АЛТ×0,8) для прогноза значимого фиброза печени (стадии F2-4) (фигура 19А), выраженного фиброза печени (стадии F3-4) (фигура 19В) и цирроза (стадия F4) (фигура 19С).
Подробное описание изобретения
Настоящее изобретение основано на удивительном обнаружении того, что белок 1 сосудистой адгезии (VAP-1), также известный как семикарбазид-чувствительная аминоксидаза (SSAO) и определяемый геном человека AOC3, играет непосредственную роль в образовании фиброзной ткани. К настоящему времени известно, что VAP-1 принимает участие в развитии целого ряда воспалительных заболеваний, опосредуя миграцию лейкоцитов в ткань, но не было показано, что он непосредственно вовлечен в патогенез самого фиброза.
Термин «фиброз» относится к образованию или наличию избыточной соединительной ткани в органе или ткани. Этот процесс может иметь место для восстановления или замещения в ответ на стимул, такой как поражение ткани или воспаление.
Одной из целей, лежащих в основе настоящего изобретения, было исследование роли ингибиторов VAP-1 в защите различных органов от фиброзного поражения. Были получены превосходные результаты, например, при хроническом фиброзном поражении печени, вызванном четыреххлористым углеродом на мышах на модели обструктивной болезни легких (COPD), индуцированной табачным дымом, на мышах и на мышиной модели васкулярного ремоделирования, васкулярного стеноза и утолщения неоинтимы (фиброза). Таким образом, ингибиторы VAP-1 реально могут рассматриваться в качестве антифиброзных средств.
Таким образом, в одном аспекте варианты осуществления настоящего изобретения относятся к способу подавления или лечения фиброза в условиях in vivo в организме человека введением пациенту, нуждающемуся в этом, эффективного количества ингибитора VAP-1. Термин «лечение» или «процесс лечения» включает введение ингибиторов VAP-1 субъекту в целях, которые могут включать профилактику, ослабление, предупреждение или излечение расстройств, включающих фиброз, такой как фиброз печени и воспалительные заболевания, предрасполагающие к нему, т.е. острый и хронический гепатит, заболевание желчного пузыря и желчных путей, и токсическое поражение печени, пульмонарный фиброз, фиброз почек, включая возникший в результате диабетической нефропатии, миелофиброз, фиброз поджелудочной железы, склеродерма, соединительнотканные заболевания, рубцевание, фиброз кожи, фиброз сердца, трансплантат органа, стеноз сосудов, рестеноз, фиброз артерий, артрофиброз, фиброз молочной железы, фиброз мышц, ретроперитонеальный фиброз, фиброз щитовидной железы, фиброз лимфатических узлов, фиброз мочевого пузыря, плевральный фиброз и COPD, заболевание при котором стенки дыхательных путей становятся фиброзными по мере накопления миофибробластов и коллагена, и включаются все подобные фиброзные ткани.
Термин «эффективное количество» ингибитора VAP-1 означает количество, при котором, как минимум, ослабляются все патологические эффекты фиброза. Специалисты в клинической области лечения расстройств, связанных с фиброзом, могут легко определить количества и схемы введения ингибиторов VAP-1. Предпочтительно ингибиторы VAP-1, которые являются моноклональными анти-VAP-1-антителами, вводятся интраваскулярно с интервалами в пределах от одного раза в неделю до одного раза в три месяца в дозах в пределах от 0,01 до 20 мг/кг, более предпочтительно от 0,1 до 15 мг/кг, наиболее предпочтительно от 1,0 до 10 мг/кг. Альтернативно ингибиторы VAP-1 вводят подкожно с интервалами в пределах от одного раза в неделю до одного раза в три месяца в дозах в пределах от 0,1 до 20 мг/кг, более предпочтительно от 0,2 до 10 мг/кг, наиболее предпочтительно от 0,5 до 5 мг/кг.
Соединения по настоящему изобретению, которые являются ингибиторами SSAO, можно вводить в эффективном количестве в пределах дозировок примерно от 0,1 мкг/кг до примерно 300 мкг/кг, предпочтительно примерно от 1,0 мкг/кг до 10 мг/кг. Соединения по настоящему изобретению можно вводить в одной суточной дозе или в пересчете на кг массы тела, или суммарную суточную дозу можно вводить в разделенных дозах, например, два, три или четыре раза в сутки.
Вышеуказанный аспект можно формулировать альтернативным путем, т.е. так, что некоторые варианты осуществления настоящего изобретения обеспечивают ингибиторы VAP-1 в виде антифиброзных средств для профилактики, лечения и/или ослабления фиброзной болезни, такой как фиброз печени и воспалительные заболевания, предрасполагающие к нему, т.е. острый и хронический гепатит, заболевание желчного пузыря и желчных путей, и токсическое поражение печени, пульмонарный фиброз, фиброз почек, включая возникший в результате диабетической нефропатии, миелофиброз, фиброз поджелудочной железы, склеродерма, соединительнотканные заболевания, рубцевание, фиброз кожи, фиброз сердца, трансплантат органа, стеноз сосудов, рестеноз, фиброз артерий, артрофиброз, фиброз молочной железы, фиброз мышц, ретроперитонеальный фиброз, фиброз щитовидной железы, фиброз лимфатических узлов, фиброз мочевого пузыря, плевральный фиброз и COPD, заболевание при котором стенки дыхательных путей становятся фиброзными по мере накопления миофибробластов и коллагена, и включаются все подобные фиброзные ткани. Следовательно, ингибиторы VAP-1 можно использовать для производства лекарственного препарата для лечения указанных фиброзных болезней.
Термин «ингибитор VAP-1» относится к любому соединению, обладающему способностью блокировать функцию VAP-1 или его SSAO активность. Ингибиторы VAP-1 можно разделить на две основные группы, блокирующие антитела и ингибиторы SSAO.
В том смысле, в котором в данном документе используется термин «анти-VAP-1-антитело» (Ab) или «моноклональное анти-VAP-1-антитело» (MAb), он включает интактные антитела, а также фрагменты антител, такие как Fab- и F(ab')2-фрагменты, способные специфически связываться с белком VAP-1.
Подходящие анти-VAP-1-антитела для применения в различных аспектах настоящего изобретения имеются в данной области и дополнительные антитела можно получить способами, известными специалистам в данной области. Например, в патенте США № 5580780 описано моноклональное антитело (MAb), 1В2, которое распознает человеческий VAP-1 и которое может блокировать связывание лимфоцитов с HEV в миндалинах в тесте замороженного среза. MAb 1В2 представляет собой мышиное IgM-антитело, и оно является специфическим для человеческого VAP-1. В публикации международной заявки WO 03/093319 раскрывается химерное моноклональное антитело BTT-1002, обладающее пониженной иммуногенностью по сравнению с соответствующими мышиными антителами. Однако, будучи химерным антителом, его применимость для лечения людей несет определенный риск за счет иммуногенности и возникающей продукции антител против него.
В публикации международной заявки WO 2008/129124, включенной в данный документ для сведения, раскрывается полностью человеческие анти-VAP-1-антитела с пониженной иммуногенностью и высвобождением цитокинов. Примеры предпочтительных полностью человеческих моноклональных анти-VAP-1-антител включают антитела, содержащие полипептид тяжелой цепи, содержащий одну-три консенсусных CDR-последовательностей, выбранных из группы, состоящей из последовательностей SEQ ID NO:1-3, и/или полипептид легкой цепи, содержащий одну-три консенсусных CDR-последовательности, выбранных из группы, состоящей из последовательностей SEQ ID NO:24-26. Другие предпочтительные анти-VAP-1-антитела включают антитела, содержащие полипептид тяжелой цепи, содержащий первую CDR-последовательность, выбранную из последовательностей SEQ ID NO:4-8, вторую CDR-последовательность, выбранную из последовательностей SEQ ID NO:9-13, и третью CDR-последовательность, выбранную из последовательностей SEQ ID NO:14-18, и/или полипептид легкой цепи, содержащий первую CDR-последовательность, выбранную из последовательностей SEQ ID NO:27-31, вторую CDR-последовательность, выбранную из последовательностей SEQ ID NO:32-36, и третью CDR-последовательность, выбранную из последовательностей SEQ ID NO:37-41.
В еще одних вариантах осуществления настоящего изобретения полностью человеческое анти-VAP-1-антитело представляет антитело, обозначенное как 8С10, и содержащее вариабельную область тяжелой цепи, представленную в SEQ ID NO:19, и вариабельную область легкой цепи, представленную в SEQ ID NO:42. В еще одних вариантах осуществления анти-VAP-1-антитело представляет антитело, обозначенное как 8А4, и содержащее вариабельную область тяжелой цепи, представленную в SEQ ID NO:20, и вариабельную область легкой цепи, представленную в SEQ ID NO:43. В еще одних вариантах осуществления анти-VAP-1-антитело представляет антитело, обозначенное как 3F10, и содержащее вариабельную область тяжелой цепи, представленную в SEQ ID NO:21, и вариабельную область легкой цепи, представленную в SEQ ID NO:44. В еще одних вариантах осуществления анти-VAP-1-антитело представляет антитело, обозначенное как 5F12, и содержащее вариабельную область тяжелой цепи, представленную в SEQ ID NO:22, и вариабельную область легкой цепи, представленную в SEQ ID NO:45. В еще одних вариантах осуществления анти-VAP-1-антитело представляет антитело, обозначенное как 4В3, и содержащее вариабельную область тяжелой цепи, представленную в SEQ ID NO:23, и вариабельную область легкой цепи, представленную в SEQ ID NO:46. Данные антитела также можно обеспечить в виде рекомбинантных антител, таких как рекомбинантное антитело r8C10 (BTT-1023), содержащее полипептид тяжелой цепи, представленный в SEQ ID NO:47, и полипептид легкой цепи, представленный в SEQ ID NO:48.
Примеры подходящих ингибиторов SSAO для применения в настоящем изобретении включают, не ограничиваясь этим, производные гидразина, такие как алилгидразины, в частности, фенилаллилгидразины; и производные гидроксиламина (т.е. аминокси)производные. Более конкретные примеры фенилаллилгидразинов включают, не ограничиваясь этим, 2-(фенилаллил)гидразин, N-[2-(4'-фторфенил)аллил]гидразин и (Е)-1-фтор-2-фенил-3-гидразинопропен, где более конкретные примеры производные гидроксиламина включают, не ограничиваясь этим, 2-аминоокси-1-фенилэтанол и 2-аминоокси-1-(3',4'-диметоксифенил)этанол. Такие ингибиторы SSAO описаны в международных заявках WO2006/094201 и WO2005/014530, которые включены в данный документ для сведения. Другие подходящие производные гидразина включают ацетогидразиды, такие как, не ограничиваясь этим, 2-(4-{2-[5-(4-ацетилпиперазин-1-ил)пиридин-2-ил]этил}фенил)ацетоксигидразид, описанные в международной заявке WO2009/145360, включенной в данный документ для сведения; и гидразиновые спирты, такие как, не ограничиваясь этим, (1R,2S)-2-(1-метилгидразино)-1-фенил-1-пропанол, (1R,2S)-2-(1-метилгидразино)-1,2-дифенилэтанол, 1-(1'-метилгидразино)-3-(м-метоксифенокси)-2-пропанол и (1R,2S)-2-(1-метилгидразино)-1,2-дифенилэтанол (BTT-2079), описанные в международной заявке WO02/02090, включенной в данный документ для сведения; и гидразиновые инданы, такие как, не ограничиваясь этим, (1S,2S)-2-(1-метилгидразино)-1-инданол, описанный в международных заявках WO03/006003 и WO2005/080319, включенные в данный документ для сведения.
Дополнительные примеры подходящих ингибиторов SSAO для применения в настоящих вариантах осуществления включают, не ограничиваясь этим, пропениламины и пропаргиламины, 4-замещенные-2-бутиниламины, галогеналлиламины (в частности, 2- и 3-галогенамины), производные пирролина, пропаргилдиамины, аллиламины и диамины. Более конкретные примеры вышеуказанных ингибиторов SSAO включают, не ограничиваясь этим, 5-феноксипента-2,3-диениламин, 4-(4-метоксифенил)бут-3-иниламин, 4-фенилбут-3-иниламин, 2-фенил-3-фтораллиламин, S-(Е)-4-(4-амино-2-фторбут-2-енилокси)-N-(1-фенилэтил)бензамид, (Е)-3-фтор-4-(4-метилсульфонил)фенокси)бут-2-ен-1-амин, (Е)-3-фтор-4-(4-метилбензо[d]тиазол-5-илокси)бут-2-ен-1-амин, (Е)-4-(4-амино-2-фторбут-2-енилокси)-N-(1-фенилэтил)бензолсульфонамид и (Е)-2-(4-фторфенэтил)-3-фтораллиламин (BTT-2089, мофегелин). Такие соединения описаны в международных заявках WO 2007/005737, WO 2005/082343, WO 2009/066152, WO 2009/055002, WO 2007/005737 и Palfreyman et al., J. Neural. Transm., 1994, 41, 407-414), которые все включены в данный документ для сведения.
Еще одни примеры ингибиторов SSAO, подходящих для применения в настоящем изобретении, включают, не ограничиваясь этим, производные 4,5,6,7-тетрагидроимидазо[4,5-с]пиридина (описанные в международной заявке WO 02/38153, включенной в данный документ для сведения), карбоксамиды, такие как N-гидрокси-2-(2-(2-метил-1Н-индол-3-ил)ацетамидо)ацетамид и 5-амино-2-гидрокси-N-(2-гидроксибензил)бензамид, и сульфонамиды, такие как N2-{[4-(1,1-диметилпропил)фенил]сульфонил}-N1-гидроксисеринамид, описанный в международной заявке WO 2006/013209 и заявке на патент США 2007/066646, которые включены в данный документ для сведения.
Кроме того, производные тиазола и/или гуанидина, в частности, производные 2-ациламинотриазола, подходят для применения в различных вариантах осуществления настоящего изобретения. Более конкретные примеры таких ингибиторов SSAO включают, не ограничиваясь этим, N-{4-[2-(4-{[амино(имино)метил]амино}фенил)этил]-1,3-тиазол-2-ил}ацетамид, N-{4-[2-(4-{[амино(имино)метил]амино}фенил)этил]-5-[4-(метилсульфонил)бензил]-1,3-тиазол-2-ил}ацетамид, N-{4-[2-(4-{[2-амино-1Н-имидазол-4-ил)метил]фенил}этил)тиазол-2-ил]ацетамид, 2-(4-{2-[2-(ацетиламино)-1,3-тиазол-4-ил]этил}фенил)-N-[амино(имино)метил]ацетамид. Такие соединения описаны в международных заявках WO 2004/087138, WO 2004/067521, WO 2006/028269, WO 2006/011631 и WO 2005/089755, которые все включены в данный документ для сведения.
Кроме того, различные оксимные производные представляют собой ингибиторы SSAO и, таким образом, могут использоваться в различных вариантах осуществления настоящего изобретения. Такие оксимные производные включают, не ограничиваясь этим, 5-бром-1,3-бензодиоксол-4-карбальдегида оксим, 6-этокси-1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-карбальдегида оксим, 1,3-диметил-6-(метилтио)-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-карбальдегида оксим, описанные в международной заявке WO 2010/029379, включенной в данный документ для сведения.
Также дигидразин, арилалкиламины, оксазолидиноны, галогеналкиламины и бенфотиамин (витамин В1), раскрытые в международных заявках WO 2010/015870, WO 2005/072738, Lyles G.A., Int. J. Biochemical. Cell Biol. Vol. 28, pp. 259-276 (1996) и McDonald et al., Annual Reports in Med. Chem., Vol. 42, pp 229-243 (2007)), которые все включены в данный документ для сведения, можно использовать в качестве ингибиторов SSAO в различны вариантах осуществления настоящего изобретения.
Дополнительные ингибиторы SSAO, подходящие для применения в различных аспектах и вариантах осуществления настоящего изобретения, включают производные имидазопиридина, описанные в международной заявке WO 2010/064020, включенной в данный документ для сведения.
Кроме того, подходящие ингибиторы SSAO для применения в различных вариантах осуществления настоящего изобретения включают любой стереоизомер, смесь стереоизомеров, E- или Z-формы, смесь E- или Z-форм, пролекарство, метаболит, кристаллическую форму, некристаллическую форму, гидрат, сольват или их соль, обладающие способностью ингибировать или блокировать SSAO активность VAP-1.
Другие подходящие ингибиторы SSAO можно подвергнуть скринингу с использованием тестов оценки активности SSAO, известных в данной области. Такие тесты могут включать тест оценки SSAO активности VAP-1 с использованием сопряженного колориметрического метода, в частности, описанного для моноаминоксидазы и близких ферментов (Holt A. et al., Anal. Biochem., 244:384-392 (1997)). SSAO активность в эндотелиальных клетках также можно независимо определить с использованием реагента «Amplex Red» (10-ацетил-3,7-дигидроксифеноксазин), представляющего собой высокочувствительный и стабильный зонд для Н2О2 (Zhou M., Panchuk-Voloshina N., Anal. Biochem., 253(2):169-174 (1997)). Кроме того, активность аминоксидазы можно определить радиохимическим способом с использованием [7-14C]бензиламина гидрохлорида в качестве субстрата (Jaakkola et al., Am. J. Pathol., 155(6):1953-1965 (1999)). В качестве источника фермента VAP-1 SSAO можно использовать рекомбинантный VAP-1, экспрессированный в клеточных линиях, таких как клетки яичника китайского хомячка (СНО) (Smith D.J. et al., J. Exp. Med., 188:17-27 (1998)). Другими подходящими источниками фермента VAP-1 SSAO могут быть сыворотка крови и ткани от различных видов, таких как приматы и грызуны.
Для применения по настоящему ингибиторы VAP-1 могут быть обеспечены в виде фармацевтической композиции, содержащей фармацевтически приемлемый носитель или разбавитель, и в качестве активного ингредиента ингибитор VAP-1. Композиция содержит ингибитор VAP-1 в количестве, достаточном для отмены (полной или частичной) SSAO активности у пациента или связывания природного VAP-1 с биологическими лигандами VAP-1 у пациентов, нуждающихся в такой отмене.
Количества и схемы введения ингибиторов VAP-1 могут легко определить специалисты в клинической области лечения расстройств, связанных с фиброзом. Как правило, дозы для лечения ингибитором VAP-1 будут зависеть от таких факторов, как возраст, пол и общее состояние здоровья пациента, который подвергается лечению; вида сопутствующего лечения, если таковое имеется; кратности лечения и природы требуемого эффекта; степени поражения ткани; продолжительности проявления симптомов и других переменных факторов для корректировки врачом. Требуемую дозу можно вводить один или более раз для получения желаемых результатов. Фармацевтические композиции для настоящих вариантов осуществления могут находиться в виде разовых лекарственных форм.
Фармацевтические композиции можно вводить в любом подходящем фармацевтическом носителе, используемом для введения препаратов. Их можно вводить в любой форме, которая оказывает профилактический, паллиативный, предупреждающий или лечебный эффект в отношении фиброзных болезней человека и животных.
Фармацевтические композиции для парентерального и местного введения включают стерильные водные или неводные растворители, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, рыбий жир и органические сложные эфиры для инъекционного введения. Водные носители включают воду, водно-спиртовые смеси, включая солевые растворы и забуференные растворители для парентерального введения, включающие раствор хлорид натрия, раствор декстрозы Рингера, раствор декстрозы плюс хлорид натрия, раствор Рингера, содержащий лактозу или нелетучие жирные масла. Растворители для внутривенного введения включают жидкость и заменители питательных веществ, заместители электролитов, такие как на основе раствора декстрозы Рингера. Водные композиции по вариантам осуществления могут содержать буферы, такие как натрий- или калий-фосфатный, цитратный, ацетатный, карбонатный или глициновый буферы в зависимости от требуемых пределов рН. Также пригодно применение хлорида натрия в качестве регулятора изотоничности. Композиции могут содержать другие наполнители, такие как стабилизаторы или консерванты. Подходящие стабилизаторы включают поверхностно-активные вещества (полисорбат 20 и 80, полоксамер 407), полимеры (полиэтиленгликоли, повидоны), углеводы (сахарозу, маннит, глюкозу, лактозу), спирты (сорбит, глицерин-пропиленгликоль, этиленгликоль), подходящие белки (альбумин), подходящие аминокислоты (глицин, глутаминовую кислоту), жирные кислоты (этаноламин), антиоксиданты (аскорбиновую кислоту, цистеин и т.д.), хелатообразующие агенты (соли ЭДТА, гистидин, аспарагиновую кислоту) или ионы металлов (Ca, Ni, Mg, Mn). В подходящие консерванты входят бензиловый спирт, хлорбутанол, бензалкония хлорид и возможно парабены.
Фармацевтическая композиция может находиться в концентрированной форме или в форме порошка для восстановления, когда это потребуется. В таких случаях можно использовать порошковые композиции для растворения в наполнителях для инъекции/инфузии. В случае лиофилизации предпочтительными являются некоторые криопротекторы, включающие полимеры (повидоны, полиэтиленгликоль, декстран), сахара (сахароза, глюкоза, лактоза), аминокислоты (глицин, аргинин, глутаминовая кислота) и альбумин. В том случае, если раствор для восстановления помещают в упаковку, то он может представлять чистую воду для инъекций или раствор хлорида натрия или декстрозы, или растворы глюкозы.
Терапевтически пригодные анти-VAP-1-антитела можно конъюгировать с использованием химического метода или генной инженерии с другими агентами, которые обеспечивают направленную доставку антител к требуемому месту действия. Альтернативно с антителами можно конъюгировать другие соединения с использованием химического метода или генной инженерии для повышения или обеспечения антителам дополнительных свойств, в частности, свойств, которые повышают способность антител ослаблять патологические эффекты, опосредованные связыванием VAP-1.
В анти-VAP-1-антитела можно ввести метку с использованием химического метода или генной инженерии с получением детектируемых антител. Такие меченые антитела представляют пригодные инструменты для визуализации фиброзных участков у людей, в частности, для иммуносцинтиграфической визуализации фиброзных участков. В целях визуализации применение фрагментов антител может быть предпочтительным по сравнению с использованием целых антител для антифиброзной терапии, и фрагменты, полученные из полностью человеческих антител, будут безопаснее по сравнению с их химерными или мышиными эквивалентными вариантами.
Некоторые аспекты настоящего изобретения относятся к диагностике фиброзных болезней. В связи с настоящим изобретением было установлено, что повышенные концентрации растворимого VAP-1 (sVAP-1) в жидкостях организма (таких как сыворотка или плазма крови) и, следовательно, повышенная активность SSAO коррелируют со степенью развития фиброза. Таким образом, некоторые варианты осуществления настоящего изобретения обеспечивают средства и способы диагностики фиброзных болезней, таких как фиброз печени и воспалительные заболевания, предрасполагающие к нему, т.е. острый и хронический гепатит, заболевание желчного пузыря и желчных путей, и токсическое поражение печени, пульмонарный фиброз, фиброз почек, включая возникший в результате диабетической нефропатии, миелофиброз, фиброз поджелудочной железы, склеродерма, соединительнотканные заболевания, рубцевание, фиброз кожи, фиброз сердца, трансплантат органа, стеноз сосудов, рестеноз, фиброз артерий, артрофиброз, фиброз молочной железы, фиброз мышц, ретроперитонеальный фиброз, фиброз щитовидной железы, фиброз лимфатических узлов, фиброз мочевого пузыря, плевральный фиброз и COPD, заболевание при котором стенки дыхательных путей становятся фиброзными по мере накопления миофибробластов и коллагена, и включаются все подобные фиброзные ткани.
В некоторых вариантах осуществления диагностику фиброзных болезней, основанную на повышенных концентрациях sVAP-1 и/или активности SSAO в жидкостях организма, можно объединить с анализом существующих панелей прогностических биологических маркеров фиброзных болезней. Это может повысить диагностическую способность существующих биологических маркеров. Другими словами концентрации sVAP-1 и/или активность SSAO можно использовать одни или в комбинации с другими клиническими или биохимическими маркерами в качестве нового неинвазивного теста для прогноза наличия фиброза.
Содержание sVAP-1 в образце жидкости организма, такой как сыворотка крови, можно определить с использованием следующего способа. В разделенном во времени флуорометрическом анализе (TR-IFMA) с набором реагентов (DELFIA) для количественного определения растворимого VAP-1 используется конъюгированное с биотином мышиное антитело против человеческого VAP-1 TK8-14 (Biotide Therapies Corp.) в качестве фиксатора на покрытом стрептавидином микротитрационном планшете. Детектирование связанного растворимого VAP-1 проводят с использованием конъюгированного с ионами европия мышиного антитела против человеческого VAP-1 TK8-14 (Biotide Therapies Corp.) в качестве индикатора. Метка детектируется при определении разделенным во времени флуорометрическим анализом (счетчик Victor3 multilabel) при длине волны 615 нм. Единицы флуоресценции непосредственно коррелируют с количеством растворимого VAP-1, который находится в образце. Затем данные по образцам анализируют при сравнении со стандартной кривой для стандарта.
В некоторых вариантах осуществления настоящего изобретения фиброз диагностируют на основе активности SSAO в жидкости организма, полученной от субъекта, нуждающегося в такой диагностике и/или с подозрением на фиброз. Один подходящий способ для данной цели раскрыт Li et al. в J. Chromatogr. B., 810 (2004), 277-282. В данной области известны другие средства и способы определения активности SSAO.
Кроме того, некоторые аспекты настоящего изобретения относятся к набору для применения в диагностике фиброза. В некоторых вариантах изобретения набор содержит один или более реагентов для оценки количества sVAP-1, такой как специфическое анти-VAP-1-антитело, например, одно из анти-VAP-1-антител, указанных выше. В других вариантах осуществления набор содержит один или более реагентов для оценки активности SSAO в жидкости организма, такой как сыворотка или плазма крови. Например, набор может содержать субстрат для VAP-1 SSAO, такой как бензиламин, метиламин, аминоцетон или другие алифатические или ароматические моноамины, вместе с буфером, подходящим для анализа активности фермента SSAO, и набором реагентов, и способом детектирования SSAO активности. Активность SSAO можно детектировать с использованием сопряженного анализа, в котором определяют образование пероксида водорода в результате проявления активности SSAO на моноаминах-субстратах, или можно определить непосредственно мониторингом превращения водорастворимого амина в растворимый в органическом растворителе альдегид с использованием 14С-меченного амина-субстрата, такого как бензиламин.
Специалистам в данной области, очевидно, понятно, что технологические усовершенствования, концепцию изобретения можно осуществить различными путями. Изобретение и его варианты осуществления не сводятся к примерам, описанным ниже, а могут варьировать в объеме формулы изобретения.
ПРИМЕР 1
Эффекты ингибиторов VAP-1 на модели фиброза печени на мышах
Целью исследования была оценка влияния ингибиторов VAP-1 на фиброзное поражение печени на мышах.
Всех мышей содержали и размещали в обычных условиях в отделе Биологомедицинской службы Университета Бирмингема согласно правилам Министерства внутренних дел. В каждой клетке находилось по четыре мыши, и животных адаптировали к условиям содержания в течение одной недели перед постановкой эксперимента. Использовали мышей-самок C57BL/6 и мышей VAP-1-/- (мыши c нокаутом гена АОС3 с отсутствием VAP-1) в возрасте 8-10 недель перед использованием в опыте. Мышей C57BL/6 получали из питомника отдела Биологомедицинской службы Университета Бирмингема, в то время как мышей VAP-1-/- (мыши c нокаутом гена АОС3) получали из питомника Taconic, Дания по договору.
Модель хронического фиброза печени на мышах воспроизводили внутрибрюшинным введением четыреххлористого углерода (CCl4; Aldrich Chemical) в дозе 1 мл/кг, растворенного в минеральном масле дважды в неделю в течение 8 недель, в то время как контрольная группа получала только минеральное масло. Мышам, которых обрабатывали мышиным антителом против мышиного VAP-1 BTT-1029, антитело вводили внутривенно раз в неделю за две недели до и во время введения CCl4. Обработку животных прекращали через 96 ч после введения последней дозы CCl4. Отбирали пробы крови с помощью сердечной пункции под анестезией изофлураном, после чего мышей убивали дислокацией шейных позвонков. Извлекали печень и разрезали на 4 кусочка для различной обработки.
Проводили статистический анализ ANOVA с использованием SPSS Windows версия 11.0. Использовали односторонний анализ ANOVA с последующим poc hoc тестом Фишера для наименьшей статистической разницы для определения достоверности между образцами в более, чем одной вариабельной группах.
Образцы печени фиксировали в 4% параформальдегиде, заливали в парафин и делали срезы толщиной 4 мкм. Срезы для гистологического анализа окрашивали сириусом красным или гематоксилин-эозином согласно стандартным методам. Для иммунофлуоресцентного окрашивания фиксированные образцы печени мышей обрабатывали криопротектором погружением в 30% раствор сахарозы, быстро замораживали и готовили срезы на криостате с толщиной 7 мкм. Вкратце, срезы отмывали забуференным фосфатом физиологическим раствором, содержащим 0,1% тритона Х-100 (PBST) в течение 10 мин и инкубировали в течение 1 ч при комнатной температуре с 10% козьей сывороткой в 0,1% PBST. После инкубации с первичными антителами к эластину, коллагену IV и ламинину (Abcam), разбавленными в растворе сыворотка-PBST, стекла отмывали три раза в PBST и инкубировали с вторичными антителами (Invitrogen) в течение 1 ч при комнатной температуре.
Как и предполагалось, CCl4 индуцировал развитие тяжелого фиброзного поражения у мышей C57BL/6. К 8 неделе у беспородных мышей масса печени увеличилась в 8 раз по результатам окраски фибрилл сириусом красным с некрозом гепатоцитов и текущим гепатитом. Интересно отметить, что у мышей с отсутствием VAP-1 и обработанных BTT-1029 имело место достоверное снижение фиброзного процесса. У этих мышей были только более низкие количества фибрилл при окраске сириусом красным, и гистология печени была практически нормальной с полным отсутствием некротических участков и только незначительно выраженным гепатитом (фигуры 1 и 2). Кроме того, имело место достоверно более низкое число зрелых макрофагов, что еще раз указывает на существенно менее тяжелое поражение печени по сравнению с мышами дикого типа (данные не приводятся).
Уровни мРНК генов, связанных с активацией звездчатых клеток печени, оценивали количественной ОТ-ПЦР. В конце опыта общую фракцию РНК экстрагировали из печени мышей с использованием набора Qiagen RNAeasy Mini (#74104). РНК обратно транскрибировали в матрицы кДНК с использованием произвольных праймеров (Promega) и обратной транскриптазы Superscript III производства Invitrogen. Количественную ОТ-ПЦР проводили в следующих условиях: денатурация при 95°С в течение 10 мин, амплификация при 95° в течение 10 сек, 55°С в течение 30 сек, 72°С в течение 1 сек, 55 циклов. Количественную ОТ-ПЦР проводили в термоциклере Roche LightCycler480 с использованием референс-гена GAPDH и зондов производства Roche. Уровни экспрессии количественно определяли с использованием «Е-метода» (Roche).
Данные указывают на роль VAP-1 в развитии фиброза печени через регуляцию звездчатых клеток печени (HSC). Полагается, что активированные HSC являются основным источником синтеза компонентов ECM в фиброзной печени, включая эластин. CCl4, введенный мышам дикого типа, приводил к существенному повышению αSMA и мРНК эластина в печени, указывая на накопление HSC, экспрессирующих αSMA, и отложение эластина (фигура 4). Содержание мРНК обоих αSMA и эластина в печени мышей дикого типа, обработанных BTT-1029, и мышей VAP-1-/- было достоверно ниже по сравнению с печенью мышей дикого типа. Различия в экспрессии эластина и коллагена VI также подтверждались конфокальной микроскопией, в то время как уровень ламинина оставался без изменений.
В заключение, обработка BTT-1029 индуцировала почти полную защиту от развития выраженного фиброза печени посредством снижения активности звездчатых клеток печени, тем самым ограничивая развитие фибробластов в фиброзных участках. Аналогичный эффект установили у мышей VAP-1-/-, т.е. почти полное предупреждение индуцированного CCl4 поражения печени. Полученные результаты указывают на то, что VAP-1 играет ключевую роль в развитии фиброза печени через регуляцию печеночных звездчатых клеток. VAP-1 SSAO представляет собой медьсодержащую аминоксидазу, аналогичную лизилоксидазе, еще одному медьсодержащему ферменту аминоксидазе, ответственной за поперечное сшивание белка ECM, такого как эластин и коллаген. Остается возможным, что SSAO активность VAP-1 также оказывает прямое влияние на образование поперечных сшивок в белках ECM.
Кроме того, активности SSAO сыворотки крови и ткани печени анализировали с использованием радиохимического метода с [7-14C]бензиламином гидрохлоридом (удельная активность 57 мкюри/моль) в качестве субстрата (фигура 5). Сыворотку крови (40 мг/мл) или тканевые препараты (2 мг/мл белка) предварительно инкубировали с 5 мкМ хлоргилина и паргилина, и в пробирках с неспецифическим связыванием с 1 мМ семикарбазида при 37°С в течение 30 мин. Тест проводили при 37°С в течение 1 ч в конечном объеме 200 мкл 0,2 мМ Na-фосфатного буфера (рН 7,4), содержащего [7-14C]бензиламин в качестве субстрата. Реакции по оценке каталитической ферментативной активности останавливали, и реакционные смеси обрабатывали, как описано ранее Jaakkola et al., 1999 (American Journal of Pathology, 155, 6). Содержание белка определяли по методу Брэдфорда с соавторами (Bradford M.M., 1976, Anal. Biochem., 72, 248) c использованием бычьего сывороточного альбумина в качестве стандарта.
Результаты показывали, что в дополнении к предупреждению индуцированного CCl4 фиброза печени обработка BTT-1029 заметно снижала активность SSAO в указанных образцах печени.
ПРИМЕР 2
Нефропротективные эффекты ингибиторов VAP-1 на модели поражения почек на мышах
Продолжительное воздействие четыреххлористого углерода вызывает поражение печени и почек. Следовательно, отбирали почки от обработанных CCl4 животных, описанных в примере 1, и анализировали в отношении влияния ингибиторов VAP-1 на нефропатию.
Почки фиксировали в 4% параформальдегиде, заливали в парафин и резали на срезы толщиной 4 мкм. Гистопатологический анализ проводили на срезах, окрашенных сириусом красным и гематоксилин-эозином. Окрашивание проводили согласно стандартным методам. Подсчитывали количество фибрилл, окрашенных сириусом красным, пороговым анализом с использованием программного обеспечения для визуализации J.
Проводили статистический анализ ANOVA с использованием SPSS Windows версия 11.0. Использовали односторонний анализ ANOVA с последующим poc hoc тестом Tukey HSD для наименьшей статистической разницы для определения достоверности между образцами в более чем одной вариабельной группах.
У мышей, которым вводили CCl4, имели место фокальные изменения клубочков с сегментными и общими изменениями. Окрашивание гематоксилин-эозином показывало наличие различных участков поражения, например, мезангиальной гиперклеточности, адгезии и склероза верхушечной области. Однако наиболее часто наблюдали общую атрофию клубочкового пучка только с оставшимися фрагментами клубочков (данные не приводятся). Интересно отметить, что у мышей с нокаутом VAP-1 и обработанных BTT-1029 полностью отсутствовали участки поражения клубочков (фигура 6).
Накопление коллагена вокруг клубочков, как показатель фиброза, оценивали окрашиванием сириусом красным. Введение CCl4 мышам C57BL/6 индуцировало почти двукратное повышение накопления коллагена вокруг клубочковой верхушки. Интересно отметить, что у мышей с отсутствием VAP-1 или которым вводили ингибитор VAP-1, имело место достоверное снижение отложений коллагена, аналогичное контролю (фигура 7). Результаты четко указывают на защитную роль VAP-1 в индуцированной CCl4 нефропатии.
ПРИМЕР 3
Эффекты ингибиторов VAP-1 на модели COPD на мышах
Использовали модель COPD, индуцированную табачным дымом, для оценки влияния ингибиторов VAP-1 на лечение COPD.
Мышей C57BL/6J подвергали ежедневному воздействию табачного дыма (TS) в течение 11 суток, приводя к развитию воспаления легких через 24 ч после последнего воздействия TS. Через 11 суток ответ выражался в достоверном повышении макрофагов, эпителиальных клеток, эозинофилов, нейтрофилов и лимфоцитов.
Мышей произвольно разделяли на опытные группы (n=10) и обрабатывали растворителем (PBS рН 7,4 в дозе 5 мл/кг + 0,1% полисорбата 80) или мышиным моноклональным анти-VAP-1-антителом (BTT-1029 в дозе 3 или 9 мг/кг в растворителе) внутривенно на 1, 3, 6 и 9 сутки через 4 ч после воздействия TS. Другая группа мышей (n=10) получала растворитель внутривенно и подвергалась воздействию воздуха в течение такого же периода времени. Две дополнительные группы мышей получали другой растворитель (0,5% натриевую соль карбоксиметилцеллюлозы (CMC) в стерильной воде) или стандартного препарата (рофлумиласт в дозе 5 мг/кг в 0,5% CMC) один раз в сутки в течение 11 суток за 1 ч до воздействия TS. Последняя группа (n=10) получала растворитель перорально (0,5% CMC) и подвергалась воздействию воздуха в течение такого же периода времени.
Все результаты представляли собой индивидуальные точки для каждого животного и рассчитывали среднее значение по каждой группе. В том случае, когда данные имели нормальное распределение, то первоначально их подвергали вариационному анализу (ANOVA) с последующей поправкой Бонферрони для множественных сравнений для оценки достоверных различий между опытными группами. Достоверные различия определяли при значении р≤0,05.
Все данные также подвергали обработке тестом Бартлетса для равных вариаций и множество опытных вариаций в основном были равными, однако, как это имело место в данном опыте, иногда давали положительный результат. Следовательно, использовали непараметрический анализ. Поскольку все данные имели нормальное распределение, то их оценку проводили параметрическим анализом (ANOVA).
Процентное ингибирование рассчитывали автоматически в Excel для данных по клеткам с использованием формулы, приведенной ниже:

При внутривенном введении BTT-1029 в дозах 9 или 3 мг/кг через 4 ч после воздействия TS на 1, 3, 6 и 9 сутки опыта, в BAL имело место достоверное снижение числа индуцированных клеток (ингибирование соответственно 38 и 33%, для двух доз р<0,001) (фигура 8). Это выражалось в заметном снижении макрофагов (ингибирование соответственно 29 и 22%, р<0,001 и р<0,05), нейтрофилов (ингибирование 66 и 59%, для двух доз р<0,001), лимфоцитов (ингибирование 69 и 54%, для двух доз р<0,001) и эозинофилов (ингибирование соответственно 93 и 65%, р<0,001 и р<0,01).
При введении стандартного препарата рофлумиласта перорально один раз в день за 1 ч до воздействия TS также имело место статистически достоверное снижение общего числа клеток (41%, р<0,001) (фигура 9). Это выражалось в снижении числа нейтрофилов (63%, р<0,001), эпителиальных клеток (51%, р<0,01) и лимфоцитов (65%, р<0,001). В этом опыте рофлумиласт не привел к достоверному снижению числа макрофагов и эозинофилов в BAL.
ПРИМЕР 4
Эффекты ингибиторов VAP-1 на фиброз неоинтимы и срединной оболочки стенки сосудов
Утолщение неоинтимы и срединной оболочки является ранней и важной стадией в развитии атеросклеротических бляшек и важным компонентом рестеноза. Оно сопровождается фиброзными изменениями в неоинтиме и срединной оболочке сосудистой стенки. В данном опыте исследовали роль блокирования SSAO при фиброзной болезни по оценке влияния системного введения (ежедневно при внутрибрюшинном введении) низкомолекулярного ингибитора SSAO (мофегилина, BTT-2089) на индуцированное сдавливающей манжеткой утолщение неоинтимы (индуцированный сдавливающей манжеткой стеноз) в бедренной артерии мышей ApoE3 Leiden, которые получали умеренный рацион западного типа.
Методы: 40 мышам-самцам ApoE3 Leiden (в возрасте 12 недель) скармливали средний гиперхолестеринемический рацион в течение 3 недель перед хирургическим установлением манжеты. Обработку проводили ежедневно внутрибрюшинным введением 1) растворителя; 2) дексаметазона с питьевой водой в концентрации 9 мг/л; 3) BTT-2089 ежедневно внутрибрюшинно в дозе 10 мг/кг; 3) BTT-2089 ежедневно внутрибрюшинно в дозе 30 мг/кг, все препараты вводили за день до хирургической операции и продолжали вводить во время опытного периода. На 0 сутки проводили хирургическую операцию, т.е. неконструктивную манжету (длиной 2-3 мм) помещали вокруг бедренных артерий мыши. По 10 мышей из каждой группы подвергали эвтаназии через 2 недели для проведения гистоморфометрического анализа для количественной оценки ингибирования индуцированных атеросклеротических бляшек и утолщения неоинтимы. Наблюдали достоверное снижение в утолщении срединной оболочки и неоинтимы в группе мышей, получавших дексаметазон и служивших в качестве позитивного контроля, и в группах, обработанных BTT-2089, по сравнению с контрольной группой, обработанной 0,9% NaCl (фигуры 10 и 11). Это выражалось в увеличенном размере просвета на окрашенных HPS сосудистых сегментах в группах, обработанных ингибитором SSAO, по сравнению с контрольной группой (фигура 12).
Второй опыт на той же модели проводили с ингибитором SSAO из другого химического класса, отличающегося от BTT-2089. Этот ингибитор на основе гидразина (BTT-2079) вводили в дозе 10 мг/кг ежедневно внутрибрюшинно и сравнивали с BTT-2089 в дозе 30 мг/кг. Во всех других отношениях опыт проводили аналогично, за исключением того, что контрольная группа с дексаметазоном отсутствовала. Ингибирование SSAO мофегилином (BTT-2089) в дозе 30 мг/кг внутрибрюшинно ежедневно вновь оказывало положительный эффект, и наблюдали достоверное снижение утолщения неоинтимы и процентного стеноза просвета после ингибирования SSAO. В группе мышей, обработанных ингибитором SSAO BTT-2079 в дозе 10 мг/кг внутрибрюшинно ежедневно, также отмечали достоверное снижение утолщения неоинтимы. Отсутствовали статистически достоверные различия между всеми группами в диаметре стенки сосудов, площади срединной оболочки и просвета. Соотношение интимы и срединной оболочки у мышей, обработанных BTT-2079 в дозе 10 мг/кг, и BTT-2089 в дозе 30 мг/кг, было достоверно ниже по сравнению с контрольной группой, но процентный стеноз полости был достоверно ниже только в группе с введением BTT-2089 в дозе 30 мг/кг по сравнению с контрольной группой. Отсутствовал эффект на целостность сосудов.
Данные результаты показывают, что системное введение ингибиторов SSAO приводило к меньшему утолщению неоинтимы (фиброзу неоинтимы) на модели сдавливающей манжеты на мышах по сравнению с контрольной обработанной группой.
ПРИМЕР 5
Эффекты ингибиторов VAP-1 на модели фиброза легких на мышах
Индуцированный блеомицином фиброз является установленной и воспроизводимой моделью на мышах для изучения фиброза легких.
Мышам-самцам C57BL/6J в возрасте 8 недель системно вводили блеомицин (в дозе 100 мг/кг) в течение 7 суток с помощью осмотических мининасосов Alzet для индукции поражения легких. Наблюдали не связанную с легкими токсичность в течение 7-21 суток после имплантации насоса. К 21 суткам у 12-15% мышей имел место фиброз легких, о котором свидетельствовали увеличенная частота дыхания и интенсивная потеря массы тела, и в конечном итоге гибель большей части животных в течение 42 суток (если это не происходило раньше).
Мышей произвольно разделяли на опытные группы и обрабатывали растворителем, ингибитором VAP-1 или стандартным препаратом при внутривенном введении каждые 3 суток с 0 по 28 сутки. Половину мышей в каждой опытной группе подвергали эвтаназии на 21 сутки, в то время как вторую половину - на 28 сутки.
После вскрытия легкие фиксировали (в 10% забуференном формалине) и подвергали гистопатологической обработке для оценки фиброзных участков. Тканевые срезы окрашивали гематоксилин-эозином и трихромовым красителем по Массону для идентификации фиброза. Для каждой мыши количественно определяли соотношение площади фиброзной области в легких к общей площади легких с помощью компьютерной визуализации.
Однофакторный анализ ANOVA с последующим анализом подходящим post hoc тестом использовали для оценки достоверности для образцов с более чем одной вариабельной группой.
Было показано снижение фиброза легких по достоверному снижению оценочных баллов по сравнению с контролем.
ПРИМЕР 6
Нефропротективные эффекты ингибиторов VAP-1 на модели диабетического заболевания почек на мышах
Диабет может вызвать диабетическую нефропатию (DN), ассоциированную с прогрессирующим фиброзом почек, в конечном итоге, приводящую к снижению функционирующей массы почек. Для оценки эффекта анти-VAP-1-антител и ингибиторов SSAO на фиброз почек использовали хорошо адаптированную модель диабета на мышах Db/db для диабетического заболевания почек.
Все аспекты данных опытов (содержание, проведение экспериментов и выведение животных из опыта) проводили, следуя «Руководству по содержанию и использованию лабораторных животных» (National Academy Press, Washington, D.C., 1996).
Испытуемый препарат ингибитор SSAO BTT-2079 оценивали на возможное нефропротективное действие на модели диабетической неффропатии на мышах. Испытуемое соединение и растворитель вводили внутрибрюшинно (в/б) один раз в день в течение 42 суток мышам db/db (BKS Cg-Lepr db/Lepr db) в возрасте 15 недель, когда уже полностью развился диабет. Мыши db/m служили в качестве нормального контроля с низкой массой тела. В плазме крови мышей db/db были повышенные уровни креатинина, что указывало на нарушении функции почек, а также гипергликемия и дислипидемия (LDL, общий холестерин и триглицериды) в сравнении с мышами db/db. У мышей с диабетом имело место ожирение, полиурия, альбуминурия и повышенное содержание Na+ в неабсорбируемой фракции мочи (FENa), что указывает на нарушенную реабсорбцию Na+ в клубочках. Клиренс эндогенного креатинина (CCr), показатель клубочковой фильтрации, имел тенденцию к снижению у мышей с диабетом по сравнению с мышами db/m.
Мышей db/db с неинсулинзависимым сахарным диабетом распределяли на опытные группы, как показано ниже:
Обобщение дизайна опыта
(мг/кг)
(самцы)
db/db: мыши BKS Cg-Lepr db/Lepr db; неинсулинзависимый сахарный диабет
Растворители и испытуемое вещество вводили внутрибрюшинно.
После окончания прижизненной фазы опыта проводили вскрытие мышей с отбором и консервацией тканей. Правую почку от всех 32 животных фиксировали в 10% нейтральном забуференном формалине. Выполняли продольные срезы и готовили парафиновые блоки, делали срезы толщиной 3 мкм и окрашивали периодной кислотой Шиффа (PAS) для исследования световой микроскопией. Увеличение объема мезангиального матрикса оценивали в баллах в 50 клубочках на почку по полуколичественной оценочной шкале, как описано в протоколе ниже.
50 клубочков из каждой почки оценивали на увеличение объема мезангиального матрикса по следующей системе.
Средний балл увеличения объема мезангиального матрикса по каждой группе рассчитывали сложением баллов по мезангиальному матриксу для всех животных в каждой группе и делением суммы на общее число животных в группе. Средние баллы по увеличению мезангиального матрикса приведены в следующей таблице.
Средние баллы по группе по оценке увеличения
мезангиального матрикса
У нормальных животных в клубочках можно найти небольшое количество мезангиального матрикса, но увеличение объема мезангиального матрикса характерно для различных заболеваний, таких как сахарный диабет. Мезангиальный матрикс включает базальную мембрану и связанные полианионные протеогликаны и другие молекулы, которые окрашиваются в красный-пурпурный цвет периодной кислотой Шиффа (PAS). Таким образом, количество позитивного на PAS вещества в клубочках является показателем количества присутствующего мезангиального матрикса.
50 клубочков от каждого животного исследовали под увеличением 200× и оценивали на увеличенный объем мезангиального матрикса с использованием оценочной шкалы, описанной выше. Средние баллы по группе по увеличению мезангиального матрикса рассчитывали сложением баллов для каждого анализированного клубочка для каждого животного. Затем баллы по увеличению мезангиального матрикса для всех животных в группе суммировали и делили на число животных в группе с получением среднего балла в группе по оценке увеличения мезангиального матрикса. Основываясь на этих данных, можно было заключить, что обработка BTT-2079 в дозах 5 и 15 мг/кг приводила к снижению балла увеличения мезангиального матрикса в зависимости от дозы по сравнению со средним баллом по группе по увеличению мезангиального матрикса у мышей db/db с неинсулинзависимым сахарным диабетом (группа 2).
Для оценки влияния анти-VAP-1-антител и ингибиторов SSAO фиброз почек использовали другие хорошо адаптированные модели диабетического заболевания почек: 1) модель индуцированного стрептозоцином диабета на мышах и 2) односторонняя обструкция мочеточника, модель фиброза почек.
1) Модель индуцированного стрептозоцином диабета на мышах. Мышей-самцов в возрасте 6-7 недель (с массой тела 20-25 г) выдерживали голодными в течение 6 ч до введения стрептозотоцина (STZ). Для индукции диабета свежеприготовленный раствор STZ (7 мг/мл в натрий-цитратном буфере) вводили внутрибрюшинно каждой мыши в дозе 55 мг/кг на голодный желудок. Для полной индукции заболевания данную процедуру повторяли таким образом, что каждой мыши STZ вводили в течение 5 дней. Через одну неделю после последней инъекции STZ мышей с содержанием глюкозы в крови ниже 280 мг/дл (не натощак) исключали из опыта, поскольку у таких мышей обычно диабет не развивается в достаточной степени для того, чтобы вызвать значительное поражение почек.
Всем мышам вводили растворитель или испытуемое вещество внутрибрюшинно через день в течение 3 недель в соответствующем объеме. Все животные получали обычный лабораторный гранулированный корм и воду вволю.
Биохимические показатели сыворотки крови определяли ферментативным методом (Мутаротаза-GOD), полученной из проб крови. Поражение почек оценивали по биохимическим показателям, выделению альбумина с мочой и клиренсу креатинина, и затем гистологически при окрашивании трихромовым красителем по Массону и периодной кислотой Шиффа.
2) Односторонняя обструкция мочеточника - модель фиброза почек. Всем мышам вводили растворитель или испытуемое вещество внутрибрюшинно в течение 5 суток до операции и 7 суток после операции. Ингибитор и растворитель вводили через день в соответствующем объеме для ингибирования SSAO. Все животные получали обычный лабораторный гранулированный корм и воду вволю.
Мышей-самцов в возрасте 6-7 недель (с массой тела 20-25 г) анестезировали ингаляцией изофлурана (2-хлор-2-(дифторметокси)- 1,1,1-трифторэтан) и вводили подкожно 0,05-0,1 мг/кг бупренорфина перед операцией. Мышам проводили одностороннюю обструкцию мочеточника (UUO) или имитацию операции. У подвергшихся UUO мышей левый мочеточник лигировали швом из шелка 4-0 в двух точках и перерезали между лигатурами для предупреждения ретроградного переноса инфекции в мочевые пути.
Поражение почек оценивали по биохимическим показателям, выделению альбумина с мочой и клиренсу креатинина, и затем гистологически при окрашивании трихромовым красителем по Массону и периодной кислотой Шиффа.
Во всех исследованиях использовали односторонний анализ ANOVA и тест Даннета для определения статистически достоверных различий между опытными и контрольными животными. Достоверные различия определяли при значении р<0,05.
Было показано снижение развития фиброза почек по данным достоверного уменьшения оценочных баллов в опыте по сравнению с контролем.
ПРИМЕР 7
Антифиброзная терапия при диабетической нефропатии
Диабетическая нефропатия является распространенной причиной конечной стадии болезни почек и фиброза, в частности, интерстициального фиброза, и представляет ключевой патологический признак состояния почек при диабете. С помощью клинического испытания можно определить, насколько ингибиторы VAP-1 могут снижать нефропатию у пациентов с диабетом, для пролонгации функционирования почек.
В испытание включаются взрослые пациенты с диабетом типа 1 или 2 со скоростью клубочковой фильтрации (GFR) 20-75 мл/мин/1,73 м2, протеинурией выше 300 мг/сутки и кровяным давлением ниже или равным 140/90 на ингибиторе ангиотензин-конвертирующего фермента (ACE) или антагонисте рецептора ангиотензина (ARA). Пациенты получают ингибитор VAP-1 в эффективной дозе или плацебо в течение 1 года по подходящей схеме введения, которая может представлять один раз в день или реже. Пациентов произвольно распределяют на группы с введением плацебо или ингибитора VAP-1. Во время испытаний проводят регулярное наблюдение за пациентами в отношении таких параметров, как содержание глюкозы в крови натощак и в моче, кровяное давление и биохимические показатели. Можно поставить другие пробы для определения уровня сывороточной SSAO VAP-1, которая может быть повышена при диабете и связана с прогрессированием заболевания. Кроме того, можно определить содержание метиламина в сыворотке крови. Повышенное содержание метиламина является биологическим маркером ингибирования активности SSAO VAP-1. Пациентов просят регулярно проверять кровяное давление и уровень глюкозы дома и записывать детектированные показатели для мониторинга диабетического статуса. Посредством введения инсулина в соответствующих количествах можно достичь хорошего контроля диабетического статуса у пациентов.
Пациенты находятся на современном поддерживающем лечении по поводу диабетической нефропатии, которое может включать лечение ингибитором АСЕ и/или ARA, антигипертензивную терапию с целью сохранения цифр 130/80, и надежный контроль гликемии соответствующим набором для HbA1C.
Функцию почек оценивают GFR, и первичной конечной точкой испытаний может быть изменение в функции почек по сравнению с исходным периодом испытаний. Вторичные точки могут включать процентное изменение в выделении альбумина с мочой в течение периода испытаний.
ПРИМЕР 8
VAP-1 в качестве диагностического маркера фиброзных болезней
В данном документе показано с помощью иммуногистохимии, что экспрессия VAP-1 повышается при циррозе с очень высокими уровнями в фиброзной перегородке (фигуры 13-15). С помощью многоцветной конфокальной микроскопии оценивали экспрессию VAP-1 в звездчатых клетках и миофибробластах печени (фигура 16). Культивированные человеческие звездчатые клетки печени (HSC) использовали для подтверждения экспрессии и секреции sVAP-1 HSC в условиях in vitro. На основании этих результатов можно было предположить о потенциальной роли VAP-1 в фиброгенезе.
Определяли концентрацию sVAP-1 в сыворотке крови в хорошо охарактеризованной когорте из 138 пациентов с неалкогольной жировой болезнью печени (NAFLD) с совпадающей и классифицированной гистологией почек (классификация Клейнера). Содержание sVAP-1 оценивали по отношению к гистологии печени (стеатоз, воспаление и фиброз), метаболическим параметрам и серологическим маркерам поражения печени (таблица 3).
Обобщение демографических данных и параметров, определенных у 138 пациентов с гистологически классифицированной и стадированной NAFLD
норма/избыточная
масса тела/ожирение
4(3%)/11(8%)/123(89%)
Содержание sVAP-1 было достоверно выше в группе с NAFLD (среднее значение±стандартное отклонение; 945,9±457,6 нг/мл) по сравнению со здоровыми пациентами (300-500 нг/мл). Наиболее высокие уровни имели место у пациентов со значимым фиброзом печени (стадии F2-4) и была четкая линейная зависимость между sVAP-1 и стадией фиброза (фигура 17).
Результаты одномерного корреляционного анализа подтверждали наличие достоверной корреляции между содержанием sVAP-1 и гистологической стадией фиброза (r=0,43; p=0,0000003) (таблица 4) и по данным множественной логистической регрессии с обратной элиминацией стадия фиброза была наиболее достоверным независимым фактором, оказывающим влияние на содержание sVAP-1 (таблица 5).
Факторы, которые достоверно коррелируют с уровнем sVAP-1 по данным одномерного анализа
Факторы, которые независимо связаны с уровнем sVAP-1 по данным множественной регрессии с обратной элиминацией
Результаты одномерного и многомерного анализа факторов, ассоциированных со значимым фиброзом печени (стадии F2-4), предполагают, что уровни sVAP-1 являются более значимыми по сравнению с обычными биохимическими маркерами поражения печени, такими как ферменты печени и соотношение АСТ/АЛТ (таблицы 6 и 7).
Факторы, которые ассоциированы со значимым фиброзом
(стадии F2-4) по данным одномерного анализа
Факторы, которые независимо связаны с фиброзом по данным множественной регрессии с обратной элиминацией
В том случае, когда в когорте больных содержание sVAP-1 использовали в качестве единственного биологического маркера для прогноза значимого фиброза печени (стадии F2-4), то уровень ≥ 1000 нг/мл имел положительное прогностическое значение, составляющее 88,9%. Площадь под характеристической кривой обнаружения (AUROC) для прогноза значимого фиброза (стадии F2-4), выраженного фиброза (стадии F3-4) и цирроза (стадия F4) составляла 0,71 (0,62-0,80), 0,68 (95% доверительный интервал 0,58-0,78) и 0,75 (95% доверительный интервал 0,58-0,92) соответственно (фигура 18).
Кроме того, на основании результатов можно предположить, что имеется возможность улучшить чувствительность и специфичность sVAP-1 для прогноза фиброза печени при его объединении с другими клиническими и биохимическими показателями. Балл оценки фиброза (рассчитанный по уравнению регрессии) факторов, независимо ассоциированных с фиброзом печени с использованием мультимерного анализа (sVAP-1, диабетический статус и соотношение АСТ/АЛТ), имел AUROC для прогноза значимого фиброза (стадии F2-4), фиброза на поздних стадиях (стадии F3-4) и цирроза (стадия F4) на уровне 0,79 (95% доверительный интервал 0,71-0,87), 0,80 (95% доверительный интервал 0,71-0,88) и 0,89 (95% доверительный интервал 0,74-1,02) (фигура 19).
Белок VAP-1 обладает активностью фермента монооксидазы, называемой SSAO (семикарбазид-чувствительной аминоксидазой). Поскольку активность фермента SSAO является составляющей частью белка VAP-1, то следует, что содержание sVAP-1 в жидкостях организма также можно определить по активности SSAO в жидкости организма (такой как сыворотка или плазма крови). SSAO является источником основной моноаминоксидазной активности сыворотки и плазмы крови человека, функционируя на субстратах SSAO, таких как бензиламин или метиламин. Таким образом, активность SSAO можно использовать в качестве эквивалентного маркера фиброза печени.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ ИНГИБИТОРОВ VAP-1 ДЛЯ ЛЕЧЕНИЯ ФИБРОЗНЫХ БОЛЕЗНЕЙ | 2010 |
|
RU2667963C1 |
| СПОСОБ ЛЕЧЕНИЯ НЕФРОПАТИИ | 2014 |
|
RU2718054C2 |
| НОВЫЕ ПОЛНОСТЬЮ ЧЕЛОВЕЧЕСКИЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ VAP-1 | 2008 |
|
RU2459832C2 |
| АНТИТЕЛА, НЕЙТРАЛИЗУЮЩИЕ ИНТЕГРИН ανβ8 | 2011 |
|
RU2565539C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ФИБРОЗНЫХ ЗАБОЛЕВАНИЙ ЛЕГКИХ | 2010 |
|
RU2561672C2 |
| ГУМАНИЗИРОВАННАЯ МОДЕЛЬ НАРУШЕНИЙ СО СТОРОНЫ ПОЧЕК И ПЕЧЕНИ | 2018 |
|
RU2772583C2 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТ ИНТЕГРИН АЛЬФА-V БЕТА-8 | 2012 |
|
RU2614252C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИ-ТФР-БЕТА-АНТИТЕЛА | 2005 |
|
RU2386638C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ФИБРОЗА ПОЧЕК | 2011 |
|
RU2711531C2 |
| ЛЕЧЕНИЕ ИНФАРКТА МИОКАРДА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ TGF-БЕТА | 2011 |
|
RU2637088C2 |



















Настоящее изобретение относится к способу лечения фиброзных болезней у человека, включающему введение указанному пациенту эффективного количества ингибитора VAP-1, в котором указанный ингибитор VAP-1 выбран из группы, состоящей из анти-VAP-1-антител и ингибиторов SSAO, где указанный ингибитор SSAO выбран из производных гидразина, производных 4,5,6,7-тетрагидроимидазо[4,5-с]пиридина, тиокарбамоильных производных, карбоксамидов, сульфонамидов, тиазолов, включающих производные гуанидина, оксимных производных, дигидразина, арилалкиламинов, оксазолидинонов, галогеналкиламинов, производных бенфотиамина и производных имидазопиридина. Заявленное изобретение эффективно в лечении фиброзных болезней. 4 з.п. ф-лы, 19 ил., 7 табл., 8 пр.
1. Способ лечения фиброзной болезни у человека, нуждающегося в этом, где указанный способ включает введение указанному пациенту эффективного количества ингибитора VAP-1, в котором указанный ингибитор VAP-1 выбран из группы, состоящей из анти-VAP-1-антител и ингибиторов SSAO, где указанный ингибитор SSAO выбран из производных гидразина, производных 4,5,6,7-тетрагидроимидазо[4,5-с]пиридина, тиокарбамоильных производных, карбоксамидов, сульфонамидов, тиазолов, включающих производные гуанидина, оксимных производных, дигидразина, арилалкиламинов, оксазолидинонов, галогеналкиламинов, производных бенфотиамина и производных имидазопиридина, в котором указанная фиброзная болезнь выбрана из группы, состоящей из пульмонарного фиброза, фиброза почек, включая возникший в результате диабетической нефропатии, миелофиброза, фиброза поджелудочной железы, фиброза кожи, фиброза сердца, фиброза артерий, артрофиброза, фиброза молочной железы, фиброза мышц, ретроперитонеального фиброза, фиброза щитовидной железы, фиброза лимфатических узлов, фиброза мочевого пузыря и плеврального фиброза.
2. Способ по п. 1, в котором указанное антитело представляет полностью человеческое анти-VAP-1-антитело, содержащее одну-три консенсусных CDR-последовательности, выбранных из группы, состоящей из последовательностей SEQ ID NO: 1-3, и/или полипептида легкой цепи, содержащего одну-три консенсусных CDR-последовательности, выбранных из группы, состоящей из последовательностей SEQ ID NO: 24-26.
3. Способ по п. 1, в котором указанное антитело содержит полипептид тяжелой цепи, содержащий первую CDR- последовательность, выбранную из последовательностей SEQ ID NO: 4-8, вторую CDR-последовательность, выбранную из последовательностей SEQ ID NO: 9-13, и третью CDR-последовательность, выбранную из последовательностей SEQ ID NO: 14-18, и/или полипептид легкой цепи, содержащий первую CDR-последовательность, выбранную из последовательностей SEQ ID NO: 27-31, вторую CDR-последовательность, выбранную из последовательностей SEQ ID NO: 32-36, и третью CDR-последовательность, выбранную из последовательностей SEQ ID NO: 37-41.
4. Способ по п. 1, в котором указанное антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 19-23, и соответствующую вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 42-46.
5. Способ по п. 1, в котором указанное антитело представляет полностью человеческое рекомбинантное антитело, содержащее полипептид тяжелой цепи, представленный в SEQ ID NO: 47, и полипептид легкой цепи, представленный в SEQ ID NO: 48.
| WO2009096609 A1, 06.08.2009 | |||
| WO2007005737 A2, 11.01.2007 | |||
| WO2009096609 A1, 06.08.2009 | |||
| WO2007005737 A2, 11.01.2007 | |||
| WO2008129124 A1, 30.10.2010 | |||
| WO2006094201 A2, 08.09.2006 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИИМИДОВ | 0 |
|
SU238153A1 |
| WO2006013209 A2, 09.02.2006 | |||
| WO2004087138 A1, 14.10.2004 | |||
| WO2005072738 A1, 11.08.2005. | |||
Авторы
Даты
2016-04-10—Публикация
2010-09-07—Подача