Область техники, к которой относится изобретение
Настоящее изобретение относится к способам снижения неблагоприятных последствий инфаркта миокарда.
Уровень техники
Проблемы и последствия со здоровьем в результате болезни сердца еще очень далеки от разрешения. В США болезнь сердца является основной причиной смерти как женщин, так и мужчин (Kung H.C., Hoyert D.L., Xu J., Murphy S.L. Deaths: final data for 2005. National Vital Statistics Reports, 2008; 56(10)). Каждые 34 секунды от болезни сердца в США умирает человек. Более чем 2500 американцев умирают от болезни сердца каждый день. В 2005 652091 человек умерло в результате болезни сердца (50,5% из них женщины). Это составляет 27,1% всех летальных случаев в США. Болезнь сердца является ведущей причиной смерти коренного населения Америки и жителей Аляски, чернокожих людей, латиноамериканцев и белокожих людей. Для азиатов и австралийцев основной причиной смерти является рак (ответственен за 27,5% всех летальных случаев), болезнь сердца находится на втором месте (25,0%) (CDC. Deaths: leading causes for 2004. National Vital Statistics Reports. 2007; 56(5)). Причинной госпитализаций почти 6 млн. человек каждый год (в США) является сердечно-сосудистое заболевание.
В 2009 г. затраты в результате болезней сердца составили более чем 304,6 биллионов долларов, включая службы системы здравоохранения, стоимость препаратов и потерю трудоспособности (American Heart Association. Heart Disease and Stroke Statistics-2009 Update. Dallas; AHA: 2009. Statistics Committee and Stroke Statistics Subcommitte. Circulation. 2008. Dec. 15). Во всем мире ишемическая болезнь сердца стала причиной смерти 7,6 млн. людей в 2005 году (World Health Organization. The Global Burden of Disease: 2004 Update. Geneva; WHO: 2008). Сообщалось, что в 2003 г. примерно у 37% взрослых людей имело место два или более из шести факторов риска для развития болезни сердца и инсульта (высокое кровяное давление, высокий уровень холестерина, диабет, текущее курение, отсутствие физической активности и ожирение) (Hayes D.K. et al., Disparities in multiple risk factors for heart disease and stroke, 2003, MMW, 2005; 54:113-116).
Инфаркт миокарда (MI) является гибелью сердечной ткани, вызванной ишемией. «Ишемия» относится к локальной недостаточности притока крови, как правило, в результате сужения сосудов или локальных препятствий для кровяного потока. Восстановление кровяного потока к ранее ишемической ткани или органу, такому как сердце, относится к «реперфузии».
Острый инфаркт миокарда (AMI) или «сердечный приступ» имеет место, когда локализованная ишемия миокарда приводит к повреждению ткани в определенном участке. Наиболее частой причиной AMI является разрыв атеросклеротической бляшки в коронарной артерии. Это приводит к образованию тромба, который закупоривает артерию, прекращая доставку через нее крови в область сердца, которая снабжается кровью ею.
Тяжелая и продолжительная ишемия приводит к появлению очага некроза, охватывающего стенку миокарда по всей толщине. Такой трансмуральный инфаркт обычно вызывает подъем сегмента ST. Менее тяжелая и продолжительная ишемия может иметь место в тех случаях, когда окклюзия коронарной артерии сменяется спонтанной реперфузией; связанная с инфарктом артерия полностью не перекрывается; окклюзия полная, но имеющийся коллатеральный приток крови предупреждает ишемию; или потребность в кислороде в пораженной зоне миокарда является более низкой. В таких условиях некротическая зона может быть в основном ограничена субэндокардом, что обычно не вызывает подъема сегмента ST при MI.
Инфарктные и непораженные зоны миокарда подвергаются постепенным изменениям в течение часов, дней или недель после ишемического события. Данный процесс постинфарктной эволюции миокарда приводит к появлению характерных изменений в предсказуемые сроки после первоначального события. Острая ишемия вызывает немедленную потерю сократимости в пораженном миокарде, состояние, названное гипокинезом. Некроз начинает развиваться в субэндокарде примерно через 15-30 мин после начала острой ишемии. В последующие 3-6 ч некротический участок выходит наружу к эпикарду, в конечном итоге захватывая всю стенку желудочка. По краям зоны инфаркта миокард может быть нарушен (обратимо поврежден) и в конечном итоге восстановится, если восстановится кровяной поток. Сократимость в оставшемся живым миокарде повышается, этот процесс называется гиперкинезом.
При инфаркте имеет место прогрессирующее развитие клеточных, гистологических и макроскопических изменений. Изменения в макроскопической картине инфарктной ткани не видны в течение, по меньшей мере, 6 ч после начала гибели клеток. Однако аномалии в биохимии и ультраструктуре клеток начинают проявляться уже через 20 мин. Повреждение клеток прогрессирует, приобретая все более необратимый характер, в течение примерно 12 ч.
В период между 4 и 12 ч после начала гибели клеток, зона инфаркта миокарда подвергается коагуляционному некрозу, процессу, который характеризуется набуханием клеток, разрушением органелл и денатурацией белка. Через 18 ч нейтрофилы (фагоцитирующие лимфоциты) поступают в зону инфаркта. Их число достигает пика примерно через 5 суток и затем падает. Спустя 3-4 суток появляется грануляционная ткань по краям инфарктной зоны. Она состоит из макрофагов, фибробластов (которые образуют рубцовую ткань) и новых капилляров. Миокард в зоне инфаркта является особенно мягким в период между 4 и 7 сутками и, следовательно, максимально склонен к разрыву. По мере того, как грануляционная ткань мигрирует внутрь к центру инфарктной зоны в течение нескольких недель, некротическая ткань поглощается и расщепляется макрофагами. Затем грануляционная ткань постепенно созревает с увеличением соединительной (рубцовой) ткани и потерей капилляров. Через 2-3 месяца инфаркт заживает, оставляя несократимую область в стенке желудочка, которая становится тонкой, твердой и имеет бледно-серый цвет.
В течение времени развиваются следующие микроскопические морфологические изменения: появляются волнистые волокна миокарда через 1-3 ч после начала ишемии. Дефект, который окрашивается тетразолием или основным фуксином, появляется через 2-3 ч после начала ишемии. Коагуляционный некроз с потерей поперечной полосатости, сократительные полосы, отек, кровоизлияние и ранний нейтрофильный инфильтрат появляются через 4-12 ч после начала ишемии. Заметны продолжающийся коагуляционный некроз, пикноз ядер и маргинальные полосы сокращения спустя 18-24 ч после начала ишемии. Через 24-72 ч после начала ишемии появляются потеря ядер и поперечной полосатости наряду с массивным нейтрофильным инфильтратом. Инфильтрация макрофагами и мононуклеарными клетками и фиброваскулярная реакция начинаются на 3-7 сутки после начала ишемии. Фиброваскулярная реакция с выраженной грануляционной тканью становится видной через 10-21 сутки после начала ишемии. Фиброз заметно виден через 7 недель или раньше после ишемического события.
Осложнения могут включать: аритмии и нарушения проводимости, увеличение области инфаркта или повторный инфаркт, застойную сердечную недостаточность, кардиогенный шок, перикардит, образование муральных тромбов с возможной эмболизацией, разрыв стенки миокарда с возможной тампонадой, разрыв папиллярной мышцы с возможной недостаточностью предсердий и образование вентрикулярной аневризмы.
Сущность изобретения
Изобретение относится к способу снижения неблагоприятных последствий инфаркта миокарда у пациента, включающему введение антагониста TGF-β пациенту во время острой стадии инфаркта миокарда. В некоторых вариантах осуществления инфаркт миокарда является острым инфарктом миокарда. Введение антагониста TGF-β можно начать в течение 120 ч после начала острой ишемии миокарда. В некоторых вариантах осуществления введение антагониста TGF-β начинают в течение примерно 72 ч, в течение примерно 48 ч, в течение примерно 24 ч или в течение примерно 12 ч после начала острой ишемии миокарда. Введение антагониста TGF-β можно начать до проявления массовой инфильтрации макрофагами и мононуклеарными клетками ткани, пораженной инфарктом миокарда. В некоторых вариантах осуществления введение антагониста TGF-β начинают во время периода, характеризующегося нейтрофильной инфильтрацией ткани, пораженной инфарктом миокарда. В других вариантах осуществления введение антагониста TGF-β начинают во время периода, характеризующегося некрозом ткани, пораженной инфарктом миокарда. В общем, пациент может представлять человека или млекопитающее, отличное от человека.
В некоторых вариантах осуществления антагонист TGF-β может быть выбран из группы, состоящей из: (i) антитела или фрагмента антитела, которое специфически связывается с одной или более изоформами TGF-β; (ii) рецептора TGF-β или его растворимого фрагмента; (iii) антитела или фрагмента антитела, которое специфически связывается с одним или более рецепторами TGF-β; и (iv) антисмыслового олигонуклеотида или интерферирующей РНК.
В некоторых вариантах осуществления способ дополнительно включает введение соединения, которое способно избирательно восстанавливать требуемую функцию TGF-β у пациента. Например, соединение, способное избирательно восстанавливать требуемую функцию TGF-β, может представлять собой противовоспалительный препарат или антагонист TGF-α. В некоторых вариантах осуществления способ может включать введение пациенту ингибитора АСЕ. Ингибитор АСЕ может быть выбран из группы, состоящей из беназеприла, каптоприла, фозиноприла, моэксиприла, периндоприла, квинаприла, трансдолаприла, лизиноприла, эналаприла и рампарила. В еще одних вариантах осуществления способ может дополнительно включать введение пациенту антагониста ангиотензина II. Антагонист ангиотензина II может быть выбран из группы, состоящей из эпросартана, телмисартана, лозартана, ирбесартана, олмесартана, кандесартана и валсартана.
Антагонист TGF-β может представлять собой антитело или фрагмент антитела, которое специфически связывается с одной или более изоформами TGF-β и может нейтрализовать один или более человеческий TGF-β1, TGF-β2 и TGF-β3. В некоторых вариантах осуществления антитело или фрагмент антитела может содержать VH-домен PET1073G12 (SEQ ID NO:2) с не более 5 мутациями или его антигенсвязывающий участок. В некоторых вариантах осуществления антитело или фрагмент антитела содержит VH-домен PET1074B9 (SEQ ID NO:12) с не более 5 мутациями или его антигенсвязывающий участок. В некоторых вариантах осуществления антитело или фрагмент антитела содержит VH-домен PET1287A10 (SEQ ID NO:22) с не более 5 мутациями или его антигенсвязывающий участок. В некоторых вариантах осуществления антитело или фрагмент антитела содержит VL-домен PET1073G12 (SEQ ID NO:7) с не более 5 мутациями или его антигенсвязывающий участок. В некоторых вариантах осуществления антитело или фрагмент антитела содержит VL-домен PET1074B9 (SEQ ID NO:17) с не более 5 мутациями или его антигенсвязывающий участок. В некоторых вариантах осуществления антитело или фрагмент антитела содержит VL-домен PET1287A10 (SEQ ID NO:27) с не более 5 мутациями или его антигенсвязывающий участок. В некоторых вариантах осуществления антитело или фрагмент антитела содержит VH-домен PET1073G12 (SEQ ID NO:2) и VL-домен PET1073G12 (SEQ ID NO:7). В некоторых вариантах осуществления антитело или фрагмент антитела содержит VH-домен PET1074B9 (SEQ ID NO:12) и VL-домен PET1074B9 (SEQ ID NO:17). В некоторых вариантах осуществления антитело или фрагмент антитела содержит VH-домен PET1287A10 (SEQ ID NO:22) и VL-домен PET1287A10 (SEQ ID NO:27). В некоторых вариантах осуществления антитело или фрагмент антитела содержит набор CDR (HCDR1, HCDR2 и HCDR3), где указанный HCDR3 имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:5, SEQ ID NO:15 и SEQ ID NO:25. В некоторых вариантах осуществления HCDR1, HCDR2 и HCDR3 VH-домена находятся в каркасной области тяжелой цепи зародышевой линии. В некоторых вариантах осуществления HCDR1, HCDR2 и HCDR3 VH-домена находятся в каркасной области, которая содержит до 12 мутаций из аминокислотной последовательности зародышевой линии. В некоторых вариантах осуществления антитело или фрагмент антитела содержит набор CDR (LCDR1, LCDR2 и LCDR3), где указанный LCDR3 имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:10, SEQ ID NO:20 и SEQ ID NO:30. В некоторых вариантах осуществления LCDR1, LCDR2 и LCDR3 находятся в каркасной области тяжелой цепи зародышевой линии. В некоторых вариантах осуществления LCDR1, LCDR2 и LCDR3 находятся в каркасной области, которая содержит до 5 мутаций из аминокислотной последовательности зародышевой линии.
Краткое описание фигур
На фигуре 1 показано снижение развития фиброза после введения 1D11-D3 и 1D11D-5, и 13С4.
На фигуре 2 показано утолщение передней стенки и утолщение задней стенки при анализе эхокардиограммы.
На фигуре 3 приведены результаты оценки в баллах региональной подвижности стенки при анализе эхокардиограммы.
На фигуре 4 показано снижение развития фиброза после введения 1D11 и 13С4.
На фигуре 5 показано утолщение передней стенки и утолщение задней стенки при анализе эхокардиограммы в группах животных, обработанных 13C4-D0, 1D11-D0, 13C4-D1, 1D11-D1, 13C4-D5 и 1D11-D5.
На фигуре 6 приведены результаты оценки в баллах региональной подвижности стенки при анализе эхокардиограммы в группах животных, обработанных растворителем, 13C4-D0, 1D11-D0, 13C4-D1, 1D11-D1, 13C4-D5 и 1D11-D5.
На фигуре 7 показан размер рубца в левом желудочке по сравнению с группами, обработанными растворителем.
На фигуре 8 показано число TUNEL-позитивных клеток в области, соседней с рубцом.
На фигуре 9 показана фракция выброса левого желудочка (LVEF) через 4 недели после окклюзии коронарной артерии/реперфузии коронарной артерии (CAO/CAR).
На фигуре 10 показана фракция выброса левого желудочка через 2-4 недели после CAO/CAR.
На фигуре 11 показано время изоволюметрической релаксации левого желудочка.
На фигуре 12 показано региональное утолщение стенки по сравнению с введением растворителя.
На фигуре 13 показаны наклоны отношения конечного диастолического давления левого желудочка к его конечному диастолическому объему.
На фигуре 14 показано уменьшение развития фиброзной ткани в левом желудочке при введении 1D11 в дозах 1 и 5 мг/кг в двух различных композициях.
На фигуре 15 показано уменьшение развития фиброзной ткани в области риска при введении 1D11 в дозах 1 и 5 мг/кг в двух различных композициях.
На фигуре 16 показано увеличение миокарда в области риска при введении 1D11 в дозах 1 и 5 мг/кг в двух различных композициях.
На фигуре 17 приведены результаты оценки в баллах региональной подвижности стенки при анализе эхокардиограммы после введения растворителя, 13C4 и 1D11 в дозах 1 и 5 мг/кг в обеих композициях.
На фигуре 18 показаны дозозависимые уровни 1D11 в сыворотке крови после внутривенного введения антитела.
На фигуре 19 показано снижение уровня остеопонтина в сыворотке крови при введении 1D11 после I/R.
На фигуре 20 показана индукция TGF-β1 после I/R и дозозависимое, опосредованное 1D11 снижение TGF-β1 после I/R.
На фигуре 21 показана индукция TGF-β2 после I/R и дозозависимое, опосредованное 1D11 снижение TGF-β2 после I/R.
На фигуре 22 показана индукция TGF-β3 после I/R и дозозависимое, опосредованное 1D11 снижение TGF-β3 после I/R.
На фигуре 23 показана индукция коллагена 3 после I/R и дозозависимое, опосредованное 1D11 снижение коллагена 3 после I/R.
На фигуре 24 показана индукция эндотелина-1 после I/R и дозозависимое, опосредованное 1D11 снижение эндотелина-1 после I/R.
На фигуре 25 показана индукция ингибитора-1 активатора плазминогена после I/R и дозозависимое, опосредованное 1D11 снижение ингибитора-1 активатора плазминогена после I/R.
На фигуре 26 показана индукция Snail1 после I/R и дозозависимое, опосредованное 1D11 снижение Snail1 после I/R.
На фигуре 27 показана индукция Snail2 после I/R и дозозависимое, опосредованное 1D11 снижение Snail2 после I/R.
На фигуре 28 показана индукция α-актина гладкой мускулатуры после I/R и дозозависимое, опосредованное 1D11 снижение α-актина гладкой мускулатуры после I/R.
На фигуре 29 показана индукция фибронектина после I/R и дозозависимое, опосредованное 1D11 снижение фибронектина после I/R.
На фигуре 30 показано влияние введения 1D11 в дозе 5 мг/кг на экспрессию Bax.
Подробное описание изобретения
После инфаркта миокарда или сердечного приступа сердце начинает само себя восстанавливать. Данный процесс восстановления сердца можно разделить на перекрывающиеся между собой фазы. Первая фаза известна как воспалительная фаза. После воспалительной фазы следует пролиферативная фаза. В конечном счете, фаза созревания является последней фазой восстановления сердца (Bujak M. and Frangogiannis N. G., Cardiovasc. Res., 74:184-195, 2007).
Сразу же после сердечного приступа воспалительная фаза характеризуется гибелью кардиомиоцитов, индукцией синтеза цитокинов и хемокинов, и притоком воспалительных клеток для очистки от мертвой ткани. Во время пролиферативной фазы имеет место супрессия медиаторов воспаления, а также приток в инфарктную зону клеток, которые принимают участие в образовании волокон соединительной ткани, фибробластов и эндотелиальных клеток. Фибробласты секретируют внеклеточный матрикс. Эндотелиальные клетки вносят свой вклад в образование микроваскулярной сети в развивающейся рыхлой фиброзной соединительной ткани или грануляционной ткани. Затем инфильтрированные воспалительные клетки начинают подвергаться гибели или процессу, известному, как апоптоз. Наконец, во время фазы созревания грануляционная ткань из пролиферативной фазы организуется и созревает с образованием плотного фиброзного соединительнотканного рубца. Такое ремоделирование фиброзной реакции в миокарде может быть продолжительным. В общем, воспалительная фаза продолжается со времени инфаркта до 1-7 суток после инфаркта. Пролиферативная фаза имеет место примерно через 5-14 суток после инфаркта миокарда. Наконец, фаза созревания начинается примерно с 10-14 суток после инфаркта миокарда и продолжается, пока происходит ремоделирование.
TGF-β индуцируется в зоне инфаркта миокарда и принимает участие во всех фазах восстановления после инфаркта миокарда, что осложняет попытки определить роль данного цитокина в процессе восстановления сердца. Таким образом, точная роль TGF-β в восстановлении сердца после инфаркта миокарда еще хорошо не понятна. TGF-β является полифункциональным цитокином, первоначально получившим название за счет его способности трансформировать нормальные фибробласты в клетки, способные к «якорь-независимому» росту. Существует, по меньшей мере, пять форм TGF-β, идентифицированных в настоящее время: TGF-β1, TGF-β2, TGF-β3, TGF-β4 и TGF-β5. Семейство TGF-β можно выделить из организма животных различных видов, включая людей, мышей, зеленых мартышек, свиней, коров, цыплят и лягушек. Также возможно выделить это семейство TGF-β из различных органов в организме животных, включая кость, тромбоциты или плаценту, для получения его в культуре рекомбинантных клеток и для определения его активности.
Известно, что у людей имеется три изоформы TGF-β1, TGF-β2 и TGF-β3 (инвентарные номера в базе данных Swiss Prot Р001137, Р008112 и Р00600 (соответственно)). В их биологически активном состоянии эти три изоформы представляют гомодимеры с молекулярной массой 25 кДа, содержащие два мономера из 112 аминокислот, соединенных внутрицепочечным дисульфидным мостиком. TGF-β1 отличается от TGF-β2 по 27 аминокислотам и от TGF-β3 по 22 аминокислотам. Различия в основном касаются консервативных аминокислотных замен. Трехмерная структура TGF-β определена рентгеновской кристаллографией, и установлены области связывания с рецептором. Человеческие TGF-β и мышиные TGF-β являются аналогичными. Человеческий TGF-β1 имеет одно аминокислотное отличие от мышиного TGF-β1. Человеческий TGF-β2 отличается от мышиного TGF-β2 только по трем аминокислотам, и человеческий и мышиный TGF-β3 являются идентичными.
Термин «TGF-β» или «трансформирующий ростовый фактор-бета» относится к семейству описанных молекул, которые имеют полную длину, нативную аминокислотную последовательность любой из человеческих изоформ TGF-β. Они включают латентные формы («латентный TGF-β») и ассоциированный или неассоциированный комплекс предшественников и зрелый TGF-β. При обращении к TGF-β следует понимать, что обращение относится к любой из идентифицированных в настоящее время изоформ, включающих TGF-β1, TGF-β2, TGF-β3, TGF-β4 и TGF-β5 и их латентным вариантам, а также к видам TGF-β человека, которые будут идентифицированы в будущем, включая полипептиды, полученные из последовательности любого известного TGF-β и, по меньшей мере, примерно на 75%, предпочтительно, по меньшей мере, примерно на 80%, более предпочтительно, по меньшей мере, примерно на 85%, еще более предпочтительно, по меньшей мере, примерно на 90% и еще более предпочтительно, по меньшей мере, примерно на 95% гомологичного по последовательности. Конкретные термины «TGF-β1», «TGF-β2» и «TGF-β3», а также «TGF-β4» и «TGF-β5» относятся к TGF-β, имеют значения, определенные в литературе (например, Derynck et al., Nature, выше, Seyedin et al., J. Biol. Chem., 262, выше и deMartin et al., выше). Термин «TGF-β» относится к гену, кодирующему человеческий TGF-β.
Члены семейства TGF-β являются белками, которые содержат девять остатков цистеина в зрелом фрагменте молекулы, и обладают, по меньшей мере, 65% гомологией с последовательностями других TGF-β в зрелой области, и они могут конкурировать за один и тот же рецептор. Кроме того, оказалось, что все они кодируются в виде крупного предшественника, который имеет область высокой гомологии около N-конца и демонстрирует консерватизм трех цистеиновых остатков во фрагменте предшественника, который затем удаляется во время процессинга. Также оказалось, что члены семейства TGF-β содержат сайт процессинга из четырех или пяти аминокислот.
Повышение уровня активности TGF-β имеет место при самых различных патологических состояниях, включая следующие, не ограничиваясь этим: (i) фиброз, образование рубца и адгезия во время заживления раны; (ii) фиброзные заболевания сердца, легких, печени и почек; (iii) атеросклероз и артериосклероз; (iv) некоторые типы рака, включая рак предстательной железы, нейроэндокринные опухоли пищеварительной системы, рак шейки матки, глиобластомы и рак желудка; (v) ангиопатия, васкулопатия, нефропатия; (vi) системный склероз; (vii) вирусное заболевание, такое как гепатит С или ВИЧ и (viii) иммунологические и воспалительные расстройства и недостаточности, такие как ревматоидный артрит.
Результаты первоначальных исследований по выяснению роли TGF-β в повреждении сердца указывают, что защитная роль имеет место в первой или в воспалительной фазе процесса восстановления сердца после инфаркта миокарда. В данных первоначальных опытах TGF-β вводили на моделях ишемического повреждения миокарда в течение нескольких часов после ишемического повреждения. Lefer показал на изолированном сердце крыс, что введение TGF-β до или сразу же после ишемического повреждения сердца приводило к снижению уровня супероксидных анионов в коронарном кровообращении, поддерживало эндотелий-зависимую релаксацию коронарных сосудов, снижало степень повреждения, опосредованного экзогенным фактором некроза опухолей (TNF), и предупреждало тяжелое повреждение сердца (Lefer et al., Science, 249:61, 1990). Lefer и коллеги провели исследования в поисках доказательства того, что TGF-β сохранял функцию эндотелия, в частности, поддержанием формирования эндотелий-опосредованного фактора релаксации (EDRF, в настоящее время известного как оксид азота или NO) в эндотелии (Lefer A.M., Biochem. Pharmacol., 42:1323-1327, 1991). В других исследованиях с выделенными кардиомиоцитами или изолированными препаратами сердца был далее выяснен механизм опосредованной TGF-β защиты сердца.
Keller et al. (Journal of Cardiovascular Pharmacology, 30:197-204, 1997) показали на модели I/R сердца собаки, что когда TGF-β вводили за 30 мин до ишемии/перфузии, то имело место 50% снижение индекса утечки белков (PLI) в зоне инфаркта сразу же после реперфузии по сравнению с необработанными контролями. Однако через 48 ч после реперфузии не наблюдали улучшения показателя PLI. Кроме того, TGF-β не приводил к повышению эндотелий-зависимой релаксации в течение 1 ч или 48 ч после реперфузии у собак. На основании этих результатов можно предположить, что TGF-β может предупреждать повышенную проницаемость коронарных сосудов на ранней стадии реперфузии, но не способен предупреждать повреждение коронарных сосудов на более поздней стадии (Keller et al., J. Cardiovasc. Pharmacol., 30:197-204, 1997).
Позднее исследовалась роль TGF-β в восстановлении после инфаркта миокарда с использованием антагонистов рецептора TGF-β для нарушения сигнального пути с участием TGF-β. В одном исследовании Ikeuchi et al. (Cardiovascular Research, 64:526-35, 2004) блокировали сигнальный путь TGF-β во время инфаркта миокарда внутримышечной инъекцией плазмиды, кодирующей внеклеточный домен рецептора TGF-β типа II (TβIIR), у мышей за 7 суток до инфаркта миокарда. Авторы наблюдали повышенную гибель в течение 24 ч после инфаркта миокарда, сильное воспаление, повышенное расширение левого желудочка (LV) и нарушение сократимости, несмотря на отсутствие увеличения зоны инфаркта по сравнению с необработанными мышами. Для блокирования TGF-β на более поздней стадии после инфаркта миокарда мышам вводили внутримышечно TβIIR на 0 сутки или на 7 сутки после инфаркта миокарда. Через четыре недели после инфаркта миокарда обработка TβIIR предупреждала расширение левого желудочка, сократительную дисфункцию, гипертрофию кардиомиоцитов и интерстициальный фиброз в неинфарктных зонах миокарда. TGF-β был эффективен в ранней фазе, но эффект пропадал с непрерывной экспрессией, приводя к ремоделированию левого желудочка и недостаточности.
В другом опыте Okada et al. (Circulation, 11:2430-37, 2005) вводили мышам внутримышечно аденовирус, кодирующий растворимый рецептор TGF-β типа II (Ad.CAGsTβRII) через 3 суток после инфаркта миокарда. У обработанных мышей после инфаркта миокарда выживаемость была достоверно выше. Это сопровождалось достоверным уменьшением расширения желудочков и улучшением сердечной функции через 4 недели после инфаркта миокарда. Размер зоны инфаркта миокарда не отличался от контроля, но толщина и объем инфаркта миокарда были меньше у обработанных животных. Апоптоз миофибробластов в инфарктной зоне был менее выраженным у обработанных животных. Введение Ad.CAGsTβRII на 4 неделе после инфаркта миокарда было неэффективным. Okada et al. полагали, что решающий промежуток времени для ингибирования TGF-β имел место через трое суток и до четырех недель. Инъекцию в данном опыте преднамеренно проводили на время, когда полагалось, что обработка не будет оказывать влияния на гибель кардиомиоцитов в результате острой ишемии. Okada et al. рассматривали ингибирование TGF-β во время острой стадии инфаркта миокарда как вредное явление.
После проведения этих экспериментов исследовалось антагонистическое действие по отношению TGF-β с использованием антитела-антагониста, эффективного против TGF-β1, 2 или 3, при восстановлении после инфаркта миокарда. Frantz et al. (Basic Research in Cardiology, 103:485-502, 2008) вводили антитело-антагонист к TGF-β или отрицательное контрольное антитело мышам, начиная с 7 суток до или через 5 суток после индукции инфаркта миокарда наложением лигатуры на коронарную артерию. Антитела вводили через день в течение 8 недель опыта. Смертность была достоверно выше в группах, получавших анти-TGF-β-антитело. Кроме того, у мышей в группах с обработкой анти-TGF-β-антителом имело место повышенное расширение левого желудочка. Эти авторы сделали заключение о том, что обработка анти-TGF-β-антителом до и после лигирования коронарной артерии повышает смертность и ухудшает ремоделирование левого желудочка. Авторы предполагают, что различия в продолжительности антагонистического действия по отношению к TGF-β и концентрации антагонистов TGF-β могут быть ответственными за различия в результатах их опыта и опыта Ikeuchi et al. (2004) и Okada et al. (2005).
Раскрытое в данном документе представляет способ лечения пациента, страдающего инфарктом миокарда, в частности, острым инфарктом миокарда, или снижения неблагоприятных последствий инфаркта миокарда у пациента, где способ включает введение антагониста TGF-β пациенту во время острой стадии инфаркта миокарда. Установление того факта, что введение антагониста TGF-β можно преимущественно начинать на время менее 120 ч после начала острой ишемии миокарда, является удивительным. В некоторых случаях способы, описанные в данном документе, предусматривают, что введение антагониста TGF-β можно начинать примерно в течение 72 ч, в течение примерно 48 ч, примерно в течение 24 ч или в течение примерно 12 ч после начала острой ишемии миокарда. В общем, в способах, описанных в данном документе, антагонист TGF-β вводят во время острой фазы инфаркта миокарда. Введение антагониста TGF-β можно начинать до сильной инфильтрации макрофагами и мононуклеарными клетками ткани, пораженной инфарктом миокарда. В некоторых вариантах осуществления введение антагониста TGF-β начинают во время периода, характеризующегося нейтрофильной инфильтрацией ткани, пораженной инфарктом миокарда. В еще одних вариантах осуществления введение антагониста TGF-β начинают во время периода, характеризующегося некрозом ткани, пораженной инфарктом миокарда.
Термин «лечение» относится к терапевтическому лечению или профилактическим или превентивным мерам. Субъекты, которые нуждаются в лечении, включают тех, у кого имеет место поддающееся лечению расстройство, а также тех, у которых расстройство следует профилактировать. Лечение может включать или может не включать полное излечение или восстановление нормальной функции. Также лечение может включать ослабление нежелательных симптомов и/или снижение неблагоприятных последствий расстройства. Термин «млекопитающее» может представлять собой любое животное, классифицированное как млекопитающее, включая людей, домашних и сельскохозяйственных животных, а также зоопарковых, спортивных или комнатных животных, таких как собаки, лошади, кошки, коровы и т.д. Предпочтительно млекопитающее является приматом, таким, например, как обезьяна, человекообразная обезьяна или человек. Термин «эффективное количество» относится к количеству лекарственного препарата, эффективному для лечения заболевания или расстройства у млекопитающего.
Несмотря на то что некоторые функции TGF-β могут быть желательными в ранней фазе после инфаркта миокарда, антагонистическое действие по отношению к TGF во время острого периода и позже, может приводить к улучшенному ремодулированию и восстановлению функции сердца. Однако в том случае, когда желательно восстановить одну или более выбранных функций TGF-β, то может потребоваться вводить совместно с антагонистом TGF-β другое соединение, которое способно селективно восстанавливать требуемую функцию TGF-β. Например, соединение, способное избирательно восстановить требуемую функцию TGF-β, может представлять противовоспалительный препарат или антагонист TGF-α. Также может быть желательным вводить совместно другой препарат, например, способ может включать введение пациенту ингибитора АСЕ. Ингибитор АСЕ можно выбрать из группы, состоящей из беназеприла, каптоприла, фозиноприла, моэксиприла, периндоприла, квинаприла, трансдолаприла, лизиноприла, эналаприла и рампарила. В еще одних вариантах осуществления способ может дополнительно включать введение пациенту антагониста рецептора ангиотензина II. Антагонист рецептора ангиотензина II можно выбрать из группы, состоящей из эпросартана, телмисартана, лозартана, ирбесартана, олмесарана, кандесартана и валсартана.
В качестве антагонистов TGF-β можно использовать нейтрализующие антитела. Термин «антитело» представляет собой иммуноглобулин, независимо от того является ли он природным или частично, или полностью синтетическим. Термин также включает любой полипептид или белок, содержащий антигенсвязывающий участок антитела. Фрагменты антитела, которые содержат антигенсвязывающий участок, представляют молекулы, такие как Fab, scFv, Fv, dAb, Fd и димерные антитела. Термин «антитело» используется в самом широком смысле и, в частности, включает интактные моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), образованные, по меньшей мере, двумя интактными антителами, и фрагменты антител, при условии, что они проявляют требуемую специфическую активность. Моноклональные антитела являются высокоспецифическими, направленными против одного антигенного сайта. Кроме того, в противоположность препаратам поликлональных антител, которые включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Помимо их специфичности моноклональные антитела являются преимущественными в том отношении, что они могут синтезироваться, не будучи «загрязненными» другими антителами. Прилагательное «моноклональное» указывает на природу антитела, как полученного по существу из гомогенной популяции антител, и это не следует рассматривать как обязательное получение антитела каким-либо конкретным методом. Например, моноклональные антитела для применения по настоящему изобретению можно получить гибридомным методом (с использованием мышиной или человеческой гибридомы), впервые описанным Kohler et al., Nature, 256:495 (1975), или можно получить методами рекомбинантной ДНК (смотри, например, патент США № 4816567). «Моноклональные антитела» также можно выделить из фаговых библиотек антител с использованием методов, описанных, например, Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991).
«Фрагменты антитела» включают фрагмент интактного антитела, предпочтительно содержащий его антигенсвязывающий участок или вариабельную область. Примеры фрагментов антител включают Fab-, Fab’-, F(ab’)2- и Fv-фрагменты; димерные антитела; линейные антитела; одноцепочечные молекулы антител и полиспецифические антитела, образованные фрагментами антител. Термины «Fc-рецептор» или «FcR» используются для описания рецептора, который связывается с Fc-областью антитела. Предпочтительный FcR представляет человеческий FcR с природной последовательностью.
Термин «вариабельные» по отношению к антителу или фрагменту антитела относится к тому факту, что некоторые участки вариабельных областей существенно различаются по последовательности среди антител и используются в связывании и определении специфичности каждого конкретного антитела для его конкретного антигена. Однако вариабельность неравномерно распределена в вариабельных областях антител. Она сконцентрирована в трех сегментах, называемых гипервариабельными участками в вариабельных областях легкой цепи и тяжелой цепи. Более консервативные участки вариабельных областей называются каркасными участками (FR). Каждая из вариабельных областей нативных тяжелой и легкой цепей содержит четыре FR, в основном принимающих конфигурацию бета-складок, соединенных тремя гипервариабельными участками, которые образуют петли, соединяющие, и в некоторых случаях образующие, часть бета-складчатой структуры. Термин «гипервариабельная область» относится к аминокислотным остаткам антитела, которые ответственны за связывание антигена. Как правило, гипервариабельная область содержит аминокислотные остатки из «определяющей комплементарность области» или «CDR». Остатки «каркасной области» или «FR» представляют остатки вариабельного домена иные, чем остатки гипервариабельной области, как здесь описано.
«Fv-фрагмент» представляет собой минимальный фрагмент антитела, который содержит полный сайт узнавания антигена и антигенсвязывающий участок. Данный фрагмент состоит из димера вариабельной области одной тяжелой цепи и одной легкой цепи, находящихся в тесной, нековалентной связи. Это означает, что в данной конфигурации три гипервариабельных участка каждой вариабельной области взаимодействуют с ограничением антигенсвязывающего сайта на поверхности димера VH-VL. В совокупности шесть гипервариабельных областей придают специфичность антителу в отношении связывания с антигеном. Однако даже одна вариабельная область (или половина Fv-фрагмента, содержащая только три гипервариабельных области, специфичных для антигена) обладает способностью узнавать и связываться с антигеном, хотя, и с более низкой аффинностью по сравнению с целым связывающим сайтом.
Fab-фрагмент содержит константную область легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab’-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбоксиконце домена СН1 тяжелой цепи, включающих один или более цистеинов из шарнирной области антитела. Fab’-SH обозначает в данном документе Fab’-фрагмент, в котором остаток(и) цистеина константных областей содержит одну свободную тиоловую группу. F(ab’)2-фрагменты антитела первоначально получают в виде пары Fab’-фрагментов, которые имеют цистеины шарнирной области между ними. Также известны другие химические связи между фрагментами антитела.
«Легкие цепи» антител (иммуноглобулинов) от одного вида позвоночных можно отнести к одному из двух четко различающихся типов, называемых каппа (κ) и лямбда (λ), основываясь на аминокислотных последовательностях их константных областей. «Одноцепочечные Fv-фрагменты» или «scFv» содержат VH- и VL-домены антитела, в которых данные домены находятся в одной полипептидной цепи.
«Гуманизированные» формы антител, отличных от человеческих (например, мышиные), представляют химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина, отличного от человеческого иммуноглобулина. В большинстве случаев гуманизированные антитела представляют человеческие иммуноглобулины (реципиентное антитело), в котором остатки гипервариабельной области реципиента заменены на остатки из гипервариабельной области от вида, отличного от человека (донорное антитело), такого как мышь, крыса, кролик или примат, обладающие требуемой специфичностью, аффинностью и/или эффективностью. В некоторых случаях остатки каркасной области (FR) человеческого иммуноглобулина замещены на соответствующие остатки, отличные от человеческих остатков. Кроме того, гуманизированные антитела могут содержать остатки, которые отсутствуют в реципиентном антителе или донорном антителе. Данные модификации проводят для дополнительного повышения эффективности антитела. В общем гуманизированное антитело будет содержать по существу все, по меньшей мере, один и, как правило, два вариабельных домена, в которых все или по существу все гипервариабельные петли соответствуют петлям в иммуноглобулине, отличном от человеческого иммуноглобулина, и все или по существу все FR представляют FR из последовательности человеческого иммуноглобулина. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), как правило, человеческого иммуноглобулина (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-329 (1988) и Presta, Curr. Op. Struct. Biol., 2:593-596 (1992)).
Термин «анти-TGF-β-антитело» относится к антителу, которое связывается с любой из изоформ TGF-β, предпочтительно связывается с TGF-β1, TGF-β2 или TGF-β3, или с любой их комбинацией, более предпочтительно, по меньшей мере, с TGF-β1, или, по меньшей мере, с TGF-β2, и наиболее предпочтительно с TGF-β1, или с TGF-β1 вместе с TGF-β2. Необязательно антитело может связываться, по меньшей мере, с TGF-β3.
Одно нейтрализующее мышиное моноклональное антитело, которое связывается с изоформами TGF-β1, TGF-β2 и TGF-β3, известно как 1D11 и оно является промышленно доступным от R&D Systems (каталог № MAB-1835) АТСС (инвентарный номер № НВ 9849). Также доступно от R&D Systems мышиное моноклональное антитело, направленное против человеческого TGF-β1. Также были получены мышиные нейтрализующие моноклональные антитела от мышей, иммунизированных человеческими пептидами TGF-β1, содержащими аминокислотные положения 48-60 (антитело, реагирующее с TGF-β1, TGF-β2 и TGF-β3) и аминокислотные положения 86-101 (антитело, специфическое для TGF-β1) (Hoefer and Anderer, Cancer Immunol. Immunother., 41: 302-308, 1995). GC1008 представляет гуманизированное моноклональное IgG4 антитело, которое нейтрализует изоформы TGF-β и подходит для терапевтического применения у людей.
1D11 является мышиным полиспецифическим анти-TGF-β-антителом, которое нейтрализует мышиные TGF-β1, TGF-β2 и TGF-β3 и человеческие TGF-β1 или TGF-β2 в широком ряду тестов in vitro (патент США № 5571714; листок продукта R&D Systems для MAB1835). Антитело 1D11 доказало свою эффективность на животных моделях фиброза. Однако 1D11 является мышиным моноклональным антителом и не подходит для терапевтического применения у людей. Таким образом, в некоторых вариантах осуществления может быть желательным человеческое антитело или модифицированное антитело, содержащее элементы человеческой последовательности.
В некоторых вариантах осуществления способы лечения инфаркта миокарда включают введение антител против TGF-β для лечения острого фиброза, который ассоциирован со сверхпродукцией TGF-β при ассоциированных с TGF-β заболеваниях. Организм отвечает на повреждение или болезнь регенерацией разрушенных тканей. В том случае, если повреждение является продолжительным или сильным, то разрушенная ткань может замещаться специализированной фиброзной соединительной тканью. Отложение такой фиброзной ткани может приводить к повреждению пораженной ткани или нарушению функции органа у пациента. Введение эффективного количества анти-TGF-β-антитела во время острой фазы может замедлять последующее развитие фиброза. Кроме того, эффективное количество анти-TGF-β-антитела также можно вводить во время периода восстановления после инфаркта миокарда, который, как правило, характеризуется фиброзом, для нейтрализации биологической активности TGF-β, тем самым снижая развитие фиброзной ткани.
В некоторых вариантах осуществления антагонист TGF-β может быть выбран из группы, состоящей из: (i) антитела или фрагмента антитела, которое специфически связывается с TGF-β; (ii) рецептора TGF-β или его растворимого фрагмента; (iii) антитела или фрагмента антитела, которое специфически связывается с одним или более рецепторами TGF-β; и (iv) антисмыслового олигонуклеотида или интерферирующей РНК. Анти-TGF-β-антитела, которые специфически связываются и нейтрализуют молекулу TGF-β, являются особенно подходящими в качестве антагонистов TGF-β. Примеры таких антител описаны в публикации заявки на патент США 2006/0251658. Анти-TGF-β-антитела включают специфические антитела к TGF-β, в частности, к человеческому TGF-β, включая специфические антитела, которые направлены на TGF-β1, TGF-β2 и TGF-β3.
Поскольку антитела можно модифицировать целым рядом способов, то термин «молекула антитела» можно рассматривать, как включающий любое антитело или вещество, содержащее антигенсвязывающий участок антитела с требуемой специфичностью. Таким образом, данный термин включает фрагменты и производные антитела, включая любой полипептид, содержащий антигенсвязывающий участок, независимо от того, является ли он природным или частично синтетическим. Следовательно, включаются химерные молекулы, содержащие антигенсвязывающий участок антитела, или эквивалентный вариант, слитый с другим полипептидом. Клонирование и экспрессия химерных антител описаны в EP-A-0120694 и EP-A-0125023, и в большой части последующей литературы. Именно поэтому, если он конкретно не ограничивается, то термин анти-TGF-β-антитело используется в широком смысле с включением целых антител (например, IgG, таких как IgG1 или IgG4), фрагментов антител (например, scFv, Fab, dAb) или молекул, содержащих антигенсвязывающий участок анти-TGF-β-антитела, полученный из анти-TGF-β-антитела или его компонентов.
Антагонисты TGF-β включают гуманизированные моноклональные анти-TGF-β-антитела, имеющие один или более аминокислотных остатков, введенные из источника, который отличен от человека. Получение гуманизированных антител можно проводить, следуя методу Winter и соавторов (Jones et al., Nature, 321:522-525, 1986; Riechmann et al., Nature, 332:323-329, 1988; Verhoeyen et al., Science, 239:1534-1536, 1988) замещением последовательностей гипервариабельного участка соответствующими последовательностями человеческого антитела. Следовательно, такие «гуманизированные» антитела могут представлять химерные антитела (например, описанные в патенте США № 4816567), в которых существенно меньше, чем интактный человеческий вариабельный домен замещен соответствующей последовательностью от вида, отличного от человека. В действительности гуманизированные антитела, как правило, представляют человеческие антитела, в которых некоторые остатки гипервариабельной области и возможно некоторые остатки FR замещены остатками из аналогичных сайтов в антителах грызунов.
Согласно так называемому методу «наилучшего соответствия» последовательность вариабельного домена антитела грызуна подвергают скринингу против полной библиотеки известных последовательностей вариабельного домена человека. Затем человеческую последовательность, которая является самой близкой к последовательности грызунов, принимают за человеческую каркасную область (FR) для гуманизированного антитела (Sims et al., J. Immunol., 151: 2296, 1993; Chothia et al., J. Mol. Biol., 196: 901, 1987). В другом методе используется конкретная каркасная область, полученная из консенсусной последовательности всех человеческих антител конкретной подгруппы легкой или тяжелой цепей. Один и тот же каркас можно использовать для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89: 4285 (1992); Presta et al., J. Immunol., 151: 2623 (1993)).
Предпочтительно, чтобы гуманизированные антитела сохраняли высокую аффинность для антигена и другие ценные биологические свойства. Для достижения данной цели гуманизированные антитела можно приготовить способом, включающим анализ исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются общедоступными и известными специалистам в данной области. Имеются компьютерные программы, которые иллюстрируют и изображают трехмерные конформационные структуры выбранных иммуноглобулиновых последовательностей-кандидатов. Исследование данных дисплеев позволяет оценить вероятную роль остатков в функционировании иммуноглобулиновой последовательности-кандидата, т.е. провести анализ остатков, оказывающих влияние на способность иммуноглобулина-кандидата связываться со своим антигеном. Таким путем можно выбрать и объединить остатки FR из реципиентных и импортируемых последовательностей, чтобы достичь требуемой характеристики антитела, такой как повышенная аффинность для антигена-мишени (антигенов-мишеней). Обычно остатки гипервариабельного участка оказывают непосредственное и наиболее существенное влияние на связывание антигена.
Как правило, анти-TGF-β-антитела включают VH- и VL-домены антитела. В VH- и VL-доменах находятся определяющие комплементарность области, CDR, которые могут располагаться внутри различных каркасных областей, FR, с образованием VH- и VL-доменов, как это может быть. Антигенсвязывающий сайт может состоять из VH-домена и/или VL-домена антитела, или их антигенсвязывающих участков.
Анти-TGF-β-антитело может включать набор HCDR, набор LCDR или оба набора, или VH-домен, VL-домен или оба домена.
Набор HCDR1, HCDR2 и HCDR3 может содержать последовательности, выбранные из следующих наборов:
HCDR1 SEQ ID NO:3, HCDR2 SEQ ID NO:4, HCDR3 SEQ ID NO:5 (далее по тексту «набор HCDR PET1073G12»);
HCDR1 SEQ ID NO:13, HCDR2 SEQ ID NO:14, HCDR3 SEQ ID NO:15 (далее по тексту «набор HCDR PET1074B9»);
HCDR1 SEQ ID NO:23, HCDR2 SEQ ID NO:24, HCDR3 SEQ ID NO:25 (далее по тексту «набор HCDR PET1287A10»).
Набор LCDR1, LCDR2 и LCDR3 может содержать последовательности, выбранные из следующих наборов:
LCDR1 SEQ ID NO:8, LCDR2 SEQ ID NO:9, LCDR3 SEQ ID NO:10 (далее по тексту «набор LCDR PET1073G12»);
LCDR1 SEQ ID NO:18, LCDR2 SEQ ID NO:19, LCDR3 SEQ ID NO:20 (далее по тексту «набор LCDR PET1074B9»);
LCDR1 SEQ ID NO:28, LCDR2 SEQ ID NO:29, LCDR3 SEQ ID NO:30 (далее по тексту «набор LCDR PET1287A10»).
Набор PET1073G12 HCDR вместе с набором PET1073G12 LCDR в данном документе относится к CDR PET1073G12. Набор PET1074B9 HCDR вместе с PET1074B9 LCDR в данном документе относится к CDR PET1074B12. Набор PET1287A10 HCDR вместе с PET1287A10 LCDR в данном документе относится к CDR PET1287A10. VH-домен, содержащий набор HCDR, раскрытый в данном документе, отдельно содержит VL-домен, содержащий набор LCDR, раскрытый в данном документе. Предпочтительно VH-домен спарен с таким доменом VL, и наиболее предпочтительно пары VH- и VL-доменов являются такими же, как в клонах, как показано в данном документе.
VH-домен анти-TGF-β-антитела может содержать набор HCDR - HCDR1, HCDR2 и HCDR3, где набор HCDR соответствует PET1073G12, PET1074B9 и PET1287A10 с одной или двумя аминокислотными заменами.
Анти-TGF-β-антитело может содержать VL-домен, содержащий набор LCDR - LCDR1, LCDR2 и LCDR3, где набор CDR соответствует PET1073G12, PET1074B9 и PET1287A10 с одной или двумя аминокислотными заменами.
Следуя указаниям вычислительной химии при применении анализа мультивариантных данных по отношению к взаимосвязи структура/свойство-активность (Wold et al., Multivariate analysis in chemistry. Chemometrics - Mathematics and Statistics in Chemistry (Ed.: B. Kowalski), D. Reidel Publishing Company, Dordrecht, Holland, 1984 (ISBN 90-277-1846-6)), количественную связь активность-свойство антител можно получить с использованием хорошо известных математических методов, таких как статистическая регрессия, паттерн узнавания и классификация (Norman et al., Applied Regression Analysis. Wiley-Interscience; 3rd edition (April 1998) ISBN: 0471170828; Abraham Kandel, Eric Baker. Computer-Assisted Reasoning in Cluster Analysis. Prentice Hall PTR (May 11, 1995), ISBN: 0133418847; Wojtec Krzanowski. Principles of Multivariate Analysis: A User’s Perspective (Oxford Statistical Science Series, No 22 (Paper)). Oxford University Press (December 2000), ISBN: 0198507089; Ian H. Witten, Eribe Frank. Data Mining: Practical Machine Learning Tools and Techniques with Java Implementations. Morgan Kaufmann (October 11, 1999), ISBN: 1558605525; David G. T. Denison (Editor), Christopher C. Holmes, Bani K. Mallick, Adrian F. M. Smith. Bayesian Methods for Nonlinear Classification and Regression (Wiley Series in Probability and Statistics). John Wiley & Sons (July 2002), ISBN: 0471490369; Arup K. Ghose, VellarkadN. Viswanadhan. Combinatorial Library Design and Evaluation Principles, Software, Tools, Application in Drug Discovery. ISBN: 0-8247-0487-8). Свойства антител можно определить по эмпирическим и теоретическим моделям последовательности антител, функциональным и трехмерным структурам (например, анализ вероятных контактных остатков и рассчитанных физико-химических свойств), и эти свойства можно рассматривать по отдельности или в комбинации.
С помощью анализа антител известной атомной структуры можно выяснить взаимосвязь между последовательностью и трехмерной структурой антигенсвязывающих сайтов (Chorthia C. et al., Journal Molecular Biology, 227, 799-817, 1999; Al-Lazikani et al., Journal Molecular Biology, 273(4), 927-948, 1997). На основании результатов исследования данных взаимодействий можно предположить, что за исключением третьей области (петли) в VH-доменах, петли сайта связывания имеют одну из небольшого числа основных конформаций цепей: канонические структуры. Было показано, что каноническая структура, образованная в конкретной петле, определяется ее размером и наличием некоторых остатков в ключевых сайтах в петле и каркасных областях (Chorthia C. et al. и Al-Lazikani et al., выше).
Взаимосвязь последовательность-структура можно использовать для прогноза таких остатков в антителе с известной последовательностью, но с неизвестной трехмерной структурой, которые являются важными в поддержании трехмерной структуры его петлей CDR и, следовательно, в сохранении специфичности связывания. Данный прогноз можно подтвердить сравнением прогноза с результатами экспериментов по оптимизации. В структурном подходе можно создать теоретическую модель молекулы антитела (Chorthia C. et al., Science, 223, 755-758, 1986) с использованием любого доступного или промышленно доступного пакета, такого как WAM (Whitelegg N.R. and Rees A.R., Prot. Eng., 12, 815-824, 2000). Затем можно использовать визуализацию белка и аналитическое программное обеспечение, такое как Insight II (Aceelerys, Inc.) или Deep View (Guex N. and Peitsch M., Electrophoresis, 18, 2714-2723, 1997) для оценки возможных замен в каждом положении в CDR и FR. Затем данную информацию можно использовать для получения вероятных замен, которые оказывают минимальное или положительное влияние на активность. В данной области имеются методы, необходимые для получения замен в аминокислотных последовательностях CDR, VH- или VL-доменах и специфических антителах, обычно имеющихся в данной области. Можно получить вариантные последовательности с заменами, которые можно или нельзя прогнозировать для оказания минимального или положительного влияния на активность.
Таким образом, анти-TGF-β-антитело может содержать определенный набор CDR, в частности, набор CDR PET1073G12, PET1074B9 и PET1287A10, и наборы CDR PET1073G12, PET1074B9 и PET1287A10 с одной или двумя заменами в наборе CDR. Соответствующий набор CDR обеспечивается в каркасных областях антител или других белковых каркасах, например, фибронектине или цитохроме В. Предпочтительно используются каркасные области антитела.
В тяжелой цепи анти-TGF-β-антитела может использоваться семейство VH1-генов человека. В различных вариантах осуществления аминокислотная последовательность каркасной области тяжелой цепи имеет 1-12, предпочтительно 3-12 и более предпочтительно 3-8 аминокислотных различий по сравнению с аминокислотной последовательностью зародышевой линии семейства VH1-генов человека. В некоторых вариантах осуществления каркасная последовательность тяжелой цепи является последовательностью зародышевой линии. В особо предпочтительных вариантах осуществления каркасная область антитела для тяжелой цепи может быть человеческой областью DP-10 (VH 1-69) или человеческой областью DP-88 (VH 1-е) из семейства VH1-генов. В таких вариантах осуществления при использовании гена DP-10 человека имеется аминокислота, отличная от аминокислоты зародышевой линии, в остатках 27, 78 и 94. В некоторых вариантах осуществления остаток 27 является тирозином, остаток 78 представляет треонин, и остаток 94 является серином или лейцином. В некоторых вариантах осуществления в легкой цепи используется ген семейства Vκ3 человека с 1-5, 1-4, более предпочтительно 1-3 аминокислотными различиями по сравнению с аминокислотой последовательностью зародышевой линии. В некоторых вариантах осуществления последовательность каркасной области легкой цепи является последовательностью гена семейства Vκ3 человека. В особенно предпочтительных вариантах осуществления каркасная область для легкой цепи может представлять область DPK-22 (А27) человека. В таких вариантах осуществления остаток 2 не является аминокислотой зародышевой линии. В некоторых вариантах осуществления остаток 2 является треонином.
В наиболее предпочтительном варианте осуществления обеспечивается VH-домен с аминокислотной последовательностью SEQ ID NO:2, называемый «VH-доменом PET1073G12», или с SEQ ID NO:12, называемый «VH-доменом PET1074B9», или с SEQ ID NO:22, называемый «VH-доменом PET1287A10».
В некоторых вариантах осуществления VL-домен содержит аминокислотную последовательность SEQ ID NO:7, и называется «VL-доменом PET1073G12», или SEQ ID NO:17, и называется «VL-доменом PET1074B9», или SEQ ID NO:27, и называется «VL-доменом PET1287A10». В одном примере анти-TGF-β-антитело состоит из VH-домена PET1073G12, SEQ ID NO:2, и VL-домена PET1073G12, SEQ ID NO:7. Другой пример антитела состоит из VH-домена PET1074B9, SEQ ID NO:12, и VL-домена PET1074B9, SEQ ID NO:17. Еще один пример антитела состоит из VH-домена PET1287A10, SEQ ID NO:22, и VL-домена PET1287A10, SEQ ID NO:27. Такие или любые другие сайты связывания TGF-β могут находиться в любом требуемом формате молекулы антитела, например, scFv, Fab, IgG1, IgG4, dAb и т.д., как здесь обсуждается ниже. Другим примером является молекула IgG4 антитела, содержащая VH-домен PET1073G12, PET1074B9 и PET1287A10, предпочтительно также содержащая VL-домен PET1073G12, PET1074B9 или PET1287A10.
Другие молекулы IgG4 антитела или другого антитела, содержащие VH-домен PET1073G12, PET1074B9 или PET1287A10, и/или VL-домен PET1073G12, PET1074B9 или PET1287A10, являются дополнительными примерами других молекул антител, содержащих набор HCDR PET1073G12, PET1074B9 или PET1287A10 в VH-домене антитела, и/или набор LCDR PET1073G12, PET1074B9 или PET1287A10 в VL-домене антитела.
Анти-TGF-β-антитело может представлять любое антитело, которое связывается со всеми тремя изоформами человеческого TGF-β. Такое анти-TGF-β-антитело может содержать VH-домен и/или VL-домен PET1073G12, PET1074B9 или PET1287A10, или антигенсвязывающие участки этих доменов. В некоторых вариантах осуществления VH-домен из одного вышеуказанного антитела спаривается с VL-доменом из другого вышеуказанного антитела с получением антигенсвязывающего участка. Например, VH-домен PET1073G12 (SEQ ID NO:2) может спариться с VL-доменом PET1073G12 (SEQ ID NO:7), таким образом, что образуется антигенсвязывающий участок, содержащий оба VH- и VL-домена PET1073G12. В еще одном варианте осуществления VH-домен PET1074B9 (SEQ ID NO:12) спаривается с VL-доменом PET1074B9 (SEQ ID NO:17), таким образом, что образуется антигенсвязывающий участок, содержащий VH- и VL-домены PET1074B9. В еще одном варианте осуществления VH-домен PET1287A10 (SEQ ID NO:22) спаривается с VL-доменом PET1287A10 (SEQ ID NO:27), таким образом, что образуется антигенсвязывающий участок, содержащий оба VH- и VL-домена PET1287A10. В еще одних вариантах осуществления VH-домен PET1073G12, PET1074B9 или PET1287A10 спаривается с VL-доменом, иным, чем соответствующий VL-домен PET1073G12, PET1074B9 или PET1287A10.
Аналогично любой набор HCDR, раскрытый в данном документе, можно обеспечить в VH-домене, который используется в качестве специфического антитела, один или в комбинации с VL-доменом. VH-домен можно обеспечить с набором HCDR, раскрытым в данном документе, и, если VH-домен спаривается с VL-доменом, то тогда можно обеспечить VL-домен с набором LCDR, раскрытым в данном документе. Спаривание набора HCDR и набора LCDR может иметь место, как раскрыто в данном документе, для антител PET1073G12, PET1074B9 или PET1287A10. Каркасные области VH- и/или VL-доменов могут представлять каркасные области зародышевой линии. Каркасные области домена тяжелой цепи можно выбрать из семейства VH-1, и предпочтительная каркасная область VH-1 является каркасной областью DP-10 или DP-88. Каркасные области легкой цепи могут быть выбраны из семейства Vκ3, и такой предпочтительной областью является область DPK-22.
Один или более CDR могут быть взяты из VH- или VL-домена с последовательностью, которая раскрывается в данном документе, и они включаются в подходящую каркасную область. Это обсуждается дополнительно в данном документе. Это же касается других CDR и наборов CDR антител, которые были получены с использованием способов, раскрытых в данном документе.
VH-домен антитела, VL-домен антитела, набор HCDR, набор LCDR, набор CDR, один или более HCDR, например, HCDR3 и/или один или более LCR, например, LCDR3, можно использовать в антагонисте TGF-β.
Варианты VH- и VL-доменов и CDR, включая те, аминокислотные последовательности которых приведены в данном документе, и которые можно использовать в конкретных антителах для TGF-β, можно получить с использованием способов изменения и мутации последовательностей, или скринингом.
Варианты аминокислотной последовательности вариабельных доменов любого из VH- и VL-доменов, чьи последовательности конкретно раскрыты в данном документе, можно использовать в способах, описанных в данном документе. Конкретные варианты могут включать одно или более изменений последовательности (добавление, делеция, замена и/или инсерция аминокислотного остатка), может быть не более чем примерно 20 изменений, не более чем примерно 15 изменений, не более чем примерно 10 изменений или не более чем примерно 5, 4, 3, 2 или 1 изменение. Изменения могут быть сделаны в одной или более каркасной области и/или в одном или более CDR.
В способах, раскрытых в данном документе, можно использовать человеческое, гуманизированное, химерное или специфическое антитело, которое конкурирует или перекрестно конкурирует за связывание антигена с любым специфическим антителом, которое связывается с антигеном и содержит специфический антигенсвязывающий участок антитела, VH- и VL-домены, раскрытые в данном документе, набор CDR или HCDR3, раскрытый в данном документе, или вариант любого из них. Конкуренцию между антителами можно легко определить в условиях in vitro, например, с использованием ELISA и/или введением специфической репортерной молекулы в одно антитело, которую можно детектировать в присутствии другого немеченого антитела(антител), для идентификации специфических антител, которые связываются с тем же эпитопом или с перекрывающимся эпитопом. Перекрестную конкуренцию между антителами можно легко детектировать проведением обратного анализа, например, реверсированием меченых и немеченых антител для идентификации пар, которые блокируют связыванием в обоих направлениях.
Антитело, содержащее антигенсвязывающий участок антитела, которое конкурирует или перекрестно конкурирует с молекулой антитела PET1073G12, PET1074B9 или PET1287A10, в частности, scFv и/или IgG4 PET1073G12, PET1074B9 или PET1287A10, можно использовать в качестве антагонистов TGF-β. В различных вариантах осуществления антитело является человеческим, гуманизированным, химерным или синтетическим антителом. В дополнительных аспектах можно использовать антитело, содержащее антигенсвязывающий участок человеческого, гуманизированного, химерного или синтетического антитела, которое конкурирует или перекрестно конкурирует с антигенсвязывающим участком, описанным в данном документе, за связывание с TGF-β, где антигенсвязывающий участок человеческого, гуманизированного, химерного или синтетического антитела состоит из VH-домена и VL-домена, и где домены VH и VL содержат набор CDR, раскрытых в данном документе.
С учетом информации, приведенной здесь, в данной области имеются различные способы получения человеческого, гуманизированного, химерного или синтетического антител к TGF-β, и которые могут конкурировать или перекрестно конкурировать с молекулой антитела PET1073G12, PET1074B9 или PET1287A10, с молекулой антитела с набором CDR PET1073G12, PET1074B9 или PET1287A10, с молекулой антитела с набором HCDR PET1073G12, PET1074B9 или PET1287A10 или с молекулой антитела с набором LCDR PET1073G12, PET1074B9 или PET1287A10, для применения в качестве антагониста TGF-β.
Одно или более специфических антител, способных связываться с TGF-β1, TGF-β2 и TGF-β3, можно получить способом, включающим приведение в контакт библиотеки антител и TGF-β, и отбор одного или более специфических антител из библиотеки, способных связываться со всеми указанными TGF-β. Библиотека может экспонироваться на поверхности бактериофаговых частиц, где каждая частица содержит нуклеиновую кислоту, кодирующую вариабельный VH-домен, представленный на ее поверхности, и необязательно также представляется VL-домен, если он присутствует. После отбора специфических антител, способных связываться с антигеном и экспонироваться на бактериофаговых частицах, можно отобрать нуклеиновую кислоту из бактериофаговых частиц, на которых экспонировано указанное выбранное специфическое антитело. Такую нуклеиновую кислоту можно использовать для последующего получения специфического антитела или вариабельного VH-домена антитела (и необязательно вариабельного VL-домена) экспрессией нуклеиновой кислоты с нуклеиновокислотной последовательностью, взятой с бактериофаговой частицы, на которой экспонировано указанное выбранное специфическое антитело.
VH-домен антитела с аминокислотной последовательностью VH-домена указанного выбранного специфического антитела можно получить в выделенной форме в виде специфического антитела, содержащего такой VH-домен. Затем можно тестировать способность связываться с тремя изоформами TGF-β, а также способность конкурировать или перекрестно конкурировать с PET1073G12, PET1074B9 или PET1287A10 (например, в формате scFv и/или формате IgG, например, IgG4) за связывание со всеми тремя изоформами TGF-β человека.
Антитело для применения в качестве антагониста TGF-β может связываться с TGF-β1, TGF-β2 и/или TGF-β3 с аффинностью молекулы антитела PET1073G12, PET1074B9 или PET1287A10, например, scFv, или предпочтительно IgG4, или с аффинностью, которая выше, чем аффинность одной из вышеуказанных молекул. Подходящее антитело может нейтрализовать TGF-β1, TGF-β2 и/или TGF-β3 с активностью молекулы антитела PET1073G12, PET1074B9 или PET1287A10, например, scFv, или предпочтительно IgG4 PET1073G12, PET1074B9 или PET1287A10, или с активностью, которая выше, чем активность одной из вышеуказанных молекул.
Антитело для применения в качестве антагониста TGF-β может нейтрализовать встречающийся в природе TGF-β с активностью молекулы антитела PET1073G12, PET1074B9 или PET1287A10, например, scFv, или предпочтительно IgG4, или с активностью, которая выше активности одной из вышеуказанных молекул. Аффинность связывания и активность нейтрализации различных специфических антител можно сравнить в соответствующих условиях.
Антитело для применения в качестве антагониста TGF-β включает человеческие, гуманизированные, химерные или синтетические антитела, которые могут нейтрализовать встречающийся в природе TGF-β с активностью, которая равна или выше, чем активность антигенсвязывающего участка для TGF-β, образованного VH-доменом PET1073G12, PET1074B9 или PET1287A10 и соответствующим VL-доменом PET1073G12, PET1074B9 или PET1287A10.
В дополнении к последовательностям антител, антитела, предназначенные для применения в качестве антагониста TGF-β, могут содержать другие аминокислоты, например, образующие пептид или полипептид, такой как свернутый домен, или для придания молекуле другого функционального свойства в дополнении к способности связываться с антигеном. Специфические антитела могут содержать детектируемую метку или могут быть конъюгированы с токсином или нацеливающей группой, или ферментом (например, через пептидную связь или линкер).
Антигенсвязывающее антитело содержит антигенсвязывающий участок. Антигенсвязывающий участок также может быть получен размещения CDR на белковых каркасах, которые не являются антителами, таких как фибронектин или цитохром В и т.д. (Koide et al., Journal of Molecular Biology, 284:1141-1151, 1998; Nygen et al., Current Opinion in Structural Biology, Vol. 7:463-469, 1997). Имеются подробные обзоры по каркасам для конструирования новых связывающих сайтов в белках Nygen et al., выше. Белковые каркасы для миметиков антител раскрыты в международной заявке WO 00/34784, в которой описаны белки (миметики антител), включающие домен фибронектина типа II, содержащий, по меньшей мере, одну рандомизированную петлю. Подходящий каркас, в который можно встроить один или более CDR, например, набор HCDR, можно обеспечить с использованием любого доменного члена из суперсемейства генов иммуноглобулинов. Каркас может представлять человеческий или нечеловеческий белок.
Преимущество белкового каркаса, не являющегося антителом, заключается в том, что он может обеспечить антигенсвязывающий участок в консервативной каркасной области, которая меньше и/или ее легче получить, чем, по меньшей мере, некоторые молекулы антитела. Небольшой размер антитела может придавать полезные физиологические свойства, такие как способность проникать в клетки, проникать глубоко в ткани или достигать мишеней в других структурах, или связываться с белковыми углублениями антигена-мишени.
Типичными являются белки, имеющие стабильный остов и одну или более вариабельных петель, в которых аминокислотная последовательность петли или петель специфически или произвольно мутированы для получения антигенсвязывающего участка, обладающего специфичностью для связывания с антигеном-мишенью. Такие белки включают IgG-связывающие домены белка А из S. aureus, трансферрина, тетранектина, фибронектина (например, 10 домен фибронектина типа III) и липокалинов. Другие подходы включают синтетические «Microbodies» (Selecore GmbH), которые основаны на циклотидах - небольших белках, содержащих внутримолекулярные дисульфидные связи.
В дополнении к последовательностям антитела и/или антигенсвязывающему участку антитело может содержать другие аминокислоты, например, образующие пептид или полипептид, такой как свернутый домен, или придающие молекуле другое функциональное свойство в дополнении к способности связываться с антигеном. Антитела могут нести детектируемую метку или могут быть конъюгированы с токсином или направляющей группой (через пептидную связь или линкер). Например, антитело может содержать каталитический сайт (например, в домене фермента), а также антигенсвязывающий сайт, где антигенсвязывающий участок связывается с антигеном и, таким образом, нацеливает каталитический сайт на антиген. Каталитический сайт может ингибировать биологическую функцию антигена, например, расщеплением.
Несмотря на то, как было отмечено, каркасы, такие как фибронектин или цитохром В, могут нести CDR (Haan & Maggos, BioCentury, 12(5):F1-F6, 2004; Koide et al., выше; Nygren et al., выше), структурой, несущей CDR или набор CDR, как правило, будет последовательность тяжелой или легкой цепи или ее существенный фрагмент, в которой CDR или набор CDR размещаются в положении, соответствующем CDR или набору CDR встречающихся в природе вариабельных VH- и VL-доменов антитела, кодированных реарранжированными иммуноглобулиновыми генами. Структуры и положения вариабельных доменов иммуноглобулина можно определить при обращении к Kabat et al., 1987 и более современными изданиями этого источника, в настоящее время доступными в интернете (URL: immuno.bme.nwu.edu или найти «Kabat» с использованием любого средства поиска).
Для получения других антител или химерных молекул, которые сохраняют специфичность исходного антитела, можно взять моноклональные или другие антитела, и использовать методы технологии рекомбинантной ДНК. Такие способы могут включать связывание ДНК, кодирующей вариабельную область, с константной областью иммуноглобулина, или введение гипервариабельных участков (CDR) антитела в константную область плюс каркасные области другого иммуноглобулина. Смотри, например, EP-A-184187, GB 218863A или EP-A-239400, и значительное количество последующей литературы. Гибридомные или другие клетки, продуцирующие антитело, могут подвергнуться генетической мутации или другим изменениям, которые могут менять или могут не менять специфичность связывания продуцированных антител.
Другие способы, доступные в области биотехнологии антител, сделали возможным выделить человеческие и гуманизированные антитела. Например, можно получить гибридомы, как описано Kontermann et al. (Kontermann R. and Dubel Stefan; Antibody Engineering, Springer-Verlag New York, LLC; 2001, ISBN: 3540413545). Фаговый дисплей, другой признанный способ получения антител, подробно описан во многих публикациях, таких как Kontermann et al., выше и WO 92/01047 (обсуждаются ниже). Можно использовать трансгенных мышей, у которых мышиные гены антител инактивированы и функционально замещены человеческими генами антител, в то же время оставляя интактными другие компоненты мышиной иммунной системы, для выделения человеческих антител к антигенам человека (Mendez et al., 1997). Человеческие антитела, моноклональные или поликлональные, также можно получить в других трансгенных животных, таких как коровы, овцы, кролики и т.д.
Синтетические молекулы антител, созданные путем экспрессии генов, полученных синтезом олигонуклеотидов и их сборки в подходящих экспрессирующих векторах, например, как описано Knappik et al., выше или Krebs et al., Journal of Immunological Methods, 254:67-84, 2001, можно использовать в качестве антагонистов TGF-β.
Фрагменты целого антитела могут осуществлять функцию связывания антигенов. Примерами связывающих фрагментов являются (i) Fab-фрагмент, состоящий из доменов VL, CL, VH и СН1; (ii) Fd-фрагмент, состоящий из доменов VH и СН1; (iii) Fv-фрагмент, состоящий из доменов VH и VL одного антитела; (iv) фрагмент dAb (Ward E. S. et al., Nature, 341, 544-546, 1989; McCafferty et al., Nature, 348, 552-554, 1990), который состоит из VH-домена; (v) изолированные области CDR; (vi) F(ab’)2 фрагмент, бивалентный фрагмент, содержащий два связанных Fab-фрагмента; (vii) одноцепочечные молекулы Fv (scFv), в которых VH-домен и VL-домен связаны пептидным линкером, которые позволяет двум доменам ассоциироваться с образованием антигенсвязывающего сайта (Bird et al., Science, 242, 423-426, 1988; Huston et al., Proc. Natl. Acad. Sci. USA, 85, 5879-5883, 1998; (viii) биспецифические димеры одноцепочечных Fv (PCT/US92/09665) и (ix) «димерные антитела», поливалентные или полиспецифические фрагменты, сконструированные слиянием генов (WO/13804); F. Hollinger et al., Proc. Natl. Acad. Sci. USA, 90, 6444-6448, 1993). Молекулы Fv, scFv или димерные антитела можно стабилизировать включением дисульфидных мостиков, связывающих VH- и VL-домены (Y. Reiter et al., Nature Biotech., 14, 1239-1245, 1996). Также можно получить минитела, содержащие scFv, соединенный с доменом CH3 (S. Hu et al., Cancer Res., 56, 3055-3061, 1996).
Dab (доменное антитело) представляет собой небольшой мономерный антигенсвязывающий фрагмент антитела, а именно вариабельную область тяжелой или легкой цепи антитела (Holt et al., 2003). VH dabs встречаются в природе у верблюжьих (например, верблюда, ламы), и их можно получить иммунизацией верблюжьих антигеном-мишенью, выделением антиген-специфических В-клеток и непосредственным клонированием генов dAb из отдельных В-клеток. Также dAb можно получить в культуре клеток. Их небольшой размер, хорошая растворимость и стабильность при температурных воздействиях делает их особенно физиологически пригодными и подходящими для отбора и аффинного созревания. Антитело может представлять dAb, содержащее домены VH и VL по существу, как описанные в данном документе, или VH- и VL-домен, содержащий набор CDR, по существу как описано в данном документе.
В тех случаях, когда следует использовать биспецифические антитела, то они могут представлять обычные биспецифические антитела, которые можно получить различными путями (Holliger P. and Winter G. Current Opinion Biotechnol., 4, 446-449, 1993), например, полученные химическим способом или из гибридных гибридом, или они могут представлять любой из биспецифических фрагментов антител, упомянутых выше. Примеры биспецифических антител включают антитела, полученные технологией BiTETM, в которой можно использовать связывающие домены двух антител с различной специфичностью и непосредственно связать через короткие гибкие пептиды. При этом два антитела объединяются в одну короткую полипептидную цепь. Можно сконструировать димерные антитела и scFv без Fc-области с использованием только вариабельных доменов, потенциально уменьшая эффекты антиидиотипической реакции.
Биспецифические димерные антитела, в противоположность биспецифическим целым антителам, также могут оказаться особенно полезными, поскольку их можно легко конструировать и экспрессировать в E. coli. Димерные антитела (и многие другие полипептиды, такие как фрагменты антител) с соответствующей связывающей специфичностью можно легко отобрать с использованием фагового дисплея (WO 94/13804) из библиотек. Если одно плечо димерного антитела сохраняется постоянным, например, со специфичностью, направленной против TGF-β, то тогда можно получить библиотеку, где другое плечо отличается, и отбирают антитело с соответствующей специфичностью. Биспецифические целые антитела можно получить конструированием по принципу «гребень-в-паз» (C. E. B. Ridgeway et al., Protein Eng., 9, 616-621, 1996).
Антитела могут быть гликозилированными, естественным образом или с помощью систем различных эукариотических клеток (например, СНО или NS0 клеток (ECACC 85110503)), или они могут быть негликозилированными (например, в том случае, если они продуцируются экспрессией в прокариотической клетке). Также гликозилирование может быть намеренно изменено, например, ингибированием фукозилирования, повышением активности ADCC полученного антитела. Следовательно, антитела могут быть экспрессированы таким образом, чтобы свести до минимума или элиминировать фукозилирование.
В некоторых вариантах осуществления CDR или VH- и VL-домены будут идентичными или в большой степени аналогичными по определенным областям, последовательности которых приведены в данном документе. Предусматривается, что может быть сделано 1-5, предпочтительно 1-4 или 1-2, или 3, или 4 аминокислотные замены в CDR и/или VH- и VL-доменах. VH- и VL-домены и CDR, и наборы CDR, которые в высокой степени аналогичны таковым, для которых приведены последовательности в данном документе, включаются в аспекты, как с последовательностями, которые в основном приведены в данном документе.
Структура, которая несет CDR или набор CDR, как правило, будет представлять последовательность тяжелой или легкой цепи антитела или значительный ее фрагмент, где CDR или набор CDR размещается в положении, соответствующем CDR или набору CDR встречающихся в природе вариабельных VH- и VL-доменов антитела, кодированных реарранжированными иммуноглобулиновыми генами. Структуры и положения вариабельных доменов иммуноглобулина можно определить при обращении к Kabat et al., 1987 и более современными изданиям этого источника, в настоящее время доступными в интернете (URL: immuno.bme.nwu.edu или найти «Kabat» с использованием любого средства поиска). CDR определяются по системе Kabat et al. CDR также могут находиться в других каркасах, таких как фибронектин или цитохром В.
Предпочтительно аминокислотную последовательность CDR, в основном представленную в данном документе, несет человеческий вариабельный домен или его значительный фрагмент в виде CDR. Последовательности HCDR3, в основном приведенные в данном документе, представляют предпочтительные варианты осуществления, и предпочтительно, чтобы каждая из них находилась в виде HCDR3 в вариабельном домене тяжелой цепи человека или его значительном фрагменте.
Используемые вариабельные домены можно получить или они происходят из любого человеческого вариабельного домена зародышей линии или реарранжированного человеческого вариабельного домена, или они могут представлять синтетический вариабельный домен, основанный на консенсусных или фактических последовательностях известных человеческих вариабельных доменов. Последовательность CDR (например, CDR3) может быть введена в репертуар вариабельных доменов без CDR (например, CDR3) с использованием технологии рекомбинантной ДНК. Предпочтительные каркасные области зародышевой линии уже были указаны в данном документе.
Marks et al. (Bio/Technology, 1992, 10:779-783) описывают способы получения репертуаров вариабельных доменов антител, в которых консенсусные праймеры, направленные к или являющиеся соседними к 5’-концу вариабельного домена, используются в комбинации с консенсусными праймерами к третьей каркасной области человеческих VH-генов для получения репертуара вариабельных доменов Vκ без CDR2. Также Marks et al. дополнительно описывают, как такой репертуар можно объединить с CDR2 конкретного антитела. С использованием аналогичных методов полученные из CDR3 последовательности можно переставить с репертуаром VH- или VL-доменов без CDR3, и переставленные полные VH- или VL-домены объединить с родственными VH- и VL-доменами с получением антител. Затем репертуар можно разместить в подходящей системе-хозяине, такой как система фагового дисплея, описанная в WO92/01047, или в большой части последующей литературы, включая Kay B. K., Winter J. and McCafferty J., Phage Display of Peptides and Proteins: A Laboratory Manual, San Diego: Academic Press, 1996, таким образом, чтобы можно было отобрать подходящие антитела. Репертуар может состоять из более 104 отдельных членов и больше, например, от 106 до 108 или 1010 членов. Другие подходящие системы-хозяева включают дрожжевой дисплей, бактериальный дисплей, дисплей Т7, рибосомный дисплей, ковалентный дисплей и так далее.
Аналогичная перестановка или комбинаторные методы также раскрыты Stemmer (Nature, 1994, 370:389-391), который описывает методы применительно к гену β-лактамазы, но данный подход может использоваться для получения антител.
Дополнительной альтернативой является получение новых VH- или VL-областей, несущих CDR, которые получены с использованием случайного мутагенеза одного или более выбранных генов VH и VL, с получением мутаций внутри полного вариабельного домена. Такой способ описан Gram et al., Proc. Natl. Acad. Sci. USA, 89:3576-3580), которые использовали ПЦР пониженной точности. В предпочтительных вариантах осуществления делают одну или две аминокислотных замены внутри набора HCDR и/или LCDR. Еще одним способом, который можно использовать, является направленный мутагенез CDR-областей генов VH и VL. Такие методы раскрыты Barbas et al. (Proc. Natl. Acad. Sci. USA, 91:3809-3813, 1994) и Schier et al. (J. Mol. Biol., 263:551-567). С учетом раскрытия, приведенного в данном документе, специалисты в данной области смогут применить такие методы для получения дополнительных антител с использованием обычной методологии в данной области. VH-домен PET1073G12, PET1074B9 или PET1287A10 можно подвергнуть мутации с получением одного или более вариантов аминокислотной последовательности VH-домена, которые можно объединить с одним или более VL-доменами.
VH-домен также может иметь последовательность зародышевой линии, и в предпочтительным вариантах осуществления он представляют DP-10 и DP-88. Последовательность VL-домена может представлять последовательность зародышевой линии, и в предпочтительном варианте осуществления он представляет DPK-22. Можно использовать один или более HCDR1, HCDR2 и HCDR3 PET1073G12, PET1074B9 или PET1287A10, или набор HCDR PET1073G12, PET1074B9 или PET1287A10, или один или более LCDR1, LCDR2 и LCDR3 PET1073G12, PET1074B9 или PET1287A10, или набор LCDR PET1073G12, PET1074B9 или PET1287A10.
Значительный фрагмент вариабельного домена иммуноглобулина будет содержать, по меньшей мере, три области CDR вместе с их промежуточными каркасными областями. Предпочтительно фрагмент будет также содержать, по меньшей мере, 50% одной или обеих первой и четвертой каркасных областей, где 50% является С-концевыми 50% первой каркасной области и N-концевыми 50% четвертой каркасной области. Дополнительные остатки в N-конце или С-конце значительного фрагмента вариабельного домена могут представлять остатки, которые обычно не ассоциируются с встречающимися в природе областями вариабельных доменов. Например, конструирование антител, полученных методами рекомбинантной ДНК, может приводить к введению N-концевых или С-концевых остатков, кодированных линкерами, введенными для облегчения клонирования или других манипуляционных стадий. Другие манипуляционные стадии включают введение линкеров для связывания вариабельных доменов с дополнительными белковыми последовательностями, включая тяжелые цепи иммуноглобулинов, другие вариабельные домены (например, при получении димерных антител) или белковые метки.
Антитела, содержащие пару VH- и VL-доменов, являются предпочтительными, также можно использовать единичные связывающие домены, основанные на любой из последовательностей VH- и VL-доменов. Известно, что единичные иммуноглобулиновые домены, в частности, VH-домены, способны связываться с антигенами-мишенями специфическим образом. В случае единичных связывающих доменов эти домены можно использовать для скрининга комплементарных доменов, способных образовать двудоменное антитело, которое может связываться с тремя изоформами TGF-β.
Этого можно достичь скринингом фаговым дисплеем с использованием так называемого иерархического двойного комбинаторного подхода, описанного в WO92/01047, в котором отдельные колонии, содержащие клон с Н- или L-цепью, используют для инфицирования полной библиотеки клонов, кодирующих другую цепь (L или Н), и полученное двухцепочечное антитело отбирают согласно методам фагового дисплея, таким как описаны в данном источнике.
Анти-TGF-β-антитела могут дополнительно содержать константные области антитела или ее фрагменты. Например, VL-домен может быть присоединен по его С-концу к константным доменам легкой цепи антитела, включая человеческие Cκ или Сλ цепи, предпочтительно Cκ цепи. Аналогичным образом антитело, основанное на VH-домене, можно присоединить по его С-концу ко всей или части (например, домен СН1) тяжелой цепи иммуноглобулина, полученной из антитела любого изотипа, например, IgG, IgA, IgE и IgM, и любого подкласса изотипа, в частности, IgG1 и IgG4. IgG4 является предпочтительным. IgG4 является предпочтительным для некоторых применений, поскольку он не связывается с комплементом, что приводит к подавлению эффекторных функций. В том случае, когда требуется эффекторная функция, то IgG1 является предпочтительным. Также эффекторную функцию можно повысить манипулированием состояния гликозилирования антитела, например, снижением содержания фукозы способами, известными в данной области. Тяжелая цепь может содержать или может не содержать С-концевой остаток лизина. Также в некоторых вариантах осуществления можно использовать любой синтетический или другой вариант константной области, который обладает этими свойствами и стабилизирует вариабельные области.
Могут быть полезными гетерогенные препараты антител или их антигенсвязывающие фрагменты. Например, такие препараты могут представлять смеси антител с полноразмерными тяжелыми цепями и антител с тяжелыми цепями без С-концевого лизина с различными степенями гликозилирования, с дериватизированными аминокислотами, полученными, например, циклизацией N-концевой глутаминовой кислоты с образованием остатка пироглутаминовой кислоты и/или с деамидированными формами тяжелой и/или легкой цепи.
Композиции, содержащие антитела к TGF-β, можно вводить субъектам, нуждающимся в этом, предпочтительно в «терапевтически эффективном количестве», которое достаточно для проявления лечебного эффекта у пациента. Такой лечебный эффект может представлять, по меньшей мере, ослабление одного симптома конкретного заболевания или расстройства. Фактическое вводимое количество, а также кратность и продолжительность введения будут зависеть от природы и тяжести заболевания, которое подвергается лечению. Назначение лечения, например, решение по поводу дозы и т.д. можно осуществить, основываясь на результатах доклинических и клинических исследований, дизайн которых хорошо известен специалистам в данной области.
Антитела можно вводить инъекцией (например, подкожно, внутривенно, в полость (например, после резекции опухоли), непосредственно в очаг поражения, внутрибрюшинно или внутримышечно), ингаляцией или местно (например, внутриокулярно, интраназально, ректально, аппликацией в раны, на кожу) или перорально. Путь введения можно определить с учетом физико-химических свойств продукта, особых соображений относительно заболевания, дозы или интервала между дозами, или необходимости оптимизировать эффективность или свести к минимуму побочные эффекты.
Предусматривается, что лечение анти-TGF-β-антителами не должно ограничиваться введением медицинскими работниками. Следовательно, может быть подходящей подкожная инъекция, особенно с использованием безыгольного устройства.
Точная дозировка будет зависеть от ряда факторов, включая состояние здоровья и историю болезни пациента, точную природу антитела (т.е. целое антитело, фрагмент или димерное антитело) и природу любой детектируемой метки или другой молекулы, присоединенной к антителу. Типичная доза антитела будет находиться в пределах от 100 мкг до 1 г для системных применений, и от 1 мкг до 1 мг для местных применений. Как правило, антитело будет представлять целое антитело, предпочтительно изотипа IgG4. Эта доза является терапевтической дозой для однократного введения взрослому пациенту, которую можно пропорционально скорректировать для детей и новорожденных, и также скорректировать для других форматов антител соответственно молекулярной массе и активности. Введение можно повторять ежедневно, два раза в неделю, раз в неделю, раз в месяц или с другими интервалами, по усмотрению врача.
Как правило, антитела вводятся в виде фармацевтической композиции, которая может содержать, по меньшей мере, один компонент в дополнении к антителу. Фармацевтические композиции для применения в способах лечения острого инфаркта миокарда могут включать, в дополнении к активному ингредиенту, фармацевтически приемлемый наполнитель, носитель, буфер, стабилизатор или другие вещества, хорошо известные специалистам в данной области. Такие вещества должны быть нетоксичными и не должны оказывать отрицательного влияния на эффективность активного ингредиента. Данные вещества могут включать, например, любой растворитель или все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие абсорбцию агенты и другие, которые являются физиологически совместимыми. Примерами фармацевтически приемлемых носителей являются вода, солевой раствор, забуференный фосфатом солевой раствор, декстроза, глицерин, этанол и т.п., а также их комбинации. Во многих случаях будет предпочтительным включить в композицию изотонические агенты, например сахара, многоатомные спирты, такие как маннит, сорбит, или хлорид натрия. Дополнительными примерами фармацевтически приемлемых веществ являются увлажняющие вещества или минорные количества добавочных субстанций, таких как увлажняющие агенты или эмульгаторы, консерванты или буферы, которые увеличивают срок хранения или эффективность антитела. Точная природа носителя или другого вещества будет зависеть от пути введения, который может быть пероральным, местным, или с помощью ингаляции или инъекции, например, внутривенной. В предпочтительном варианте осуществления антитело вводится внутривенной инфузией или инъекцией. В еще одном варианте осуществления антитело вводят внутримышечной или подкожной инъекцией.
Фармацевтические композиции для перорального введения могут находиться в виде таблетки, капсулы, порошка или жидкой формы, например, с инертным разбавителем или деградируемым пищевым носителем. Таблетка может содержать твердый носитель, такой как желатин или адъювант. Как правило, жидкие фармацевтические композиции содержат жидкий носитель, такой как вода, вазелин, масла животного или растительного происхождения, минеральное или синтетическое масло. В композиции можно включить физиологический раствор, декстрозу или растворы других сахаридов или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль. Антитело (и другие ингредиенты, если требуется) также могут находиться в твердой или жидкой желатиновой капсуле, спрессованной в таблетки, или непосредственно включаться в рацион субъекта. Для перорального введения активный ингредиент может быть включен с наполнителями и использоваться в виде деградируемых таблеток, буккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и тому подобное. Для введения соединения другим путем, чем парентеральный путь введения, может быть необходимым покрыть соединение, или вводить его совместно с веществом для предупреждения его инактивации.
Для внутривенной инъекции или инъекции в очаг поражения активный ингредиент будет находиться в виде водного раствора, приемлемого для парентерального введения, который является непирогенным и имеет подходящее значение pK, изотоничность и стабильность. Специалисты в данной области смогут легко приготовить подходящие растворы с использованием, например, изотонических растворителей, таких как хлорид натрия для инъекций, раствор Рингера для инъекций и/или лактированный раствор Рингера для инъекций. Консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки могут быть включены, при необходимости.
Композицию можно вводить одну или в комбинации с другими препаратами, одновременно или последовательно в зависимости от расстройства, которое подвергается лечению.
Антитела можно формулировать в жидких, полутвердых или твердых формах, таких как жидкие растворы (например, инъекционные и инфузионные растворы), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Предпочтительная форма зависит от предназначенного способа введения, терапевтического применения, физико-химических свойств молекулы и пути введения. Композиции могут включать наполнители или комбинации наполнителей, например: сахара, аминокислоты и поверхностно-активные вещества. Жидкие композиции могут иметь широкий ряд концентраций антитела и рН. Твердые композиции можно получить, например, лиофилизацией, сушкой распылением или высушиванием на основе технологии сверхкритической жидкости.
Как правило, терапевтические композиции должны быть стерильными и стабильными в условиях производства и хранения. Композицию можно формулировать в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для обеспечения высокой концентрации препарата. Стерильный инъекционный раствор можно приготовить включением антитела в необходимом количестве в подходящий растворитель с одним или комбинацией ингредиентов, перечисленных выше, как это требуется, с последующей стерилизующей фильтрацией. Обычно дисперсии готовят включением активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие требуемые ингредиенты из приведенного выше списка. В случае стерильных порошков для приготовления стерильных инъекционных растворов предпочтительными способами приготовления являются вакуумная сушка и лиофилизация, которые дают порошок активного ингредиента плюс любой другой требуемый ингредиент из предварительно стерилизованного фильтрацией раствора. Надлежащую текучесть раствора можно поддерживать, например, применением оболочки, такой как лецитин, сохранением необходимого размера частиц в случае дисперсии и применением поверхностно-активных веществ. Пролонгированное всасывание инъекционных композиций может быть достигнуто включением в композицию агента, который задерживает всасывание, например, солей моностеарата и желатина.
В некоторых вариантах осуществления активное соединение композиций антитела можно приготовить с носителем, который будет защищать антитело от быстрого высвобождения, таких как композиция с контролируемым высвобождением, включающая импланты, трансдермальные пластыри и микроинкапсулированные системы доставки. Можно использовать биодеградируемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие способы приготовления таких препаратов запатентованы и в основном известны специалистам. Смотри, например, Sustained and Controlled Release Drug Delivery Systems (J.R. Robinson ed., Marcel Dekker, Inc., New York, 1978).
В различных вариантах осуществления другие терапевтические схемы можно объединить с введением анти-TGF-β-антитела. Комбинированное введение включает совместное введение с использованием отдельных композиций или одной фармацевтической композиции, и последовательное введение в любом порядке, где предпочтительно имеется период времени, когда оба (или все) активные агенты одновременно проявляют их биологические активности.
Для предупреждения или лечения последствий инфаркта миокарда соответствующая доза антагониста TGF-β будет зависеть от состояния пациента, тяжести и течения инфаркта, от того, вводится антитело для профилактических или лечебных целей, предшествующей терапии, истории болезни пациента и ответа на антитело, и решения лечащего врача. Антагонист может вводиться один раз или серией введений, начиная с 0 суток (например, в течение 8, 12 или 24 ч), 1 суток, 2 суток, 3 суток, 4 суток или 5 суток после ишемического события, предпочтительно на 0 сутки, 3 сутки или 5 сутки. То есть, в некоторых вариантах осуществления введение антагониста TGF-β начинают примерно в течение примерно 120 ч, примерно 96 ч, примерно 72 ч, примерно 48 ч, примерно 24 ч, примерно 12 ч или даже примерно в течение 8 или меньше часов после начала острой ишемии после инфаркта. В зависимости от типа и тяжести состояния доза примерно 5 мг/кг антитела является первоначальной дозой-кандидатом для введения пациенту, например, одним или более отдельными введениями, или продолжительной инфузией после инфаркта миокарда. Типичной суточной дозой может быть доза, равная 5 мг/кг или ниже, в зависимости от факторов, упомянутых выше. Для повторных введений в течение нескольких суток или дольше, в зависимости от состояния, лечение продолжают до наступления требуемого подавления симптомов заболевания. Предпочтительной дозой антитела будет доза 5 мг/кг или ниже, введенная внутривенно. Таким образом, одну или более доз, составляющих примерно 5 мг/кг или ниже (или любую их комбинацию) можно вводить пациенту. Однако могут быть пригодными другие схемы введения. За ходом и результатами лечения можно легко следить с использованием обычных методов и тестов.
Анти-TGF-β-антитела являются пригодными для лечения острого инфаркта миокарда в комбинации с антагонистами ренин-ангиотензин-альдостероновой системы, включая, не ограничиваясь этим, ингибиторы ренина, ингибиторы ангиотензин-конвертирующего фермента (АСЕ), антагонисты рецептора Ang II (также известные, как «блокаторы рецептора Ang II») и антагонисты альдостерона. Анти-TGF-β-антитела также являются пригодными для лечения острого инфаркта миокарда в комбинации с бета-адренергическими антагонистами, включая, не ограничиваясь этим, группу, состоящую из алпренолола, буциндолола, картеолола, карведиола, лабеталола, надолола, окспренолола, пенбутолола, пиндолола, пропранолола, соталола, тимолола, атенолола, бетаксолола, бизопролола, целипролола, эсмолола, метопролола и небиволола. Кроме того, анти-TGF-β-антитела являются пригодными для лечения острого инфаркта миокарда в комбинации с агентами по поддержанию низкого уровня липидов, включая, не ограничиваясь этим, группу статинов, состоящую из ловастатина, правастатина, симвастатина, флувастатина, аторвастатина, церивастатина, резувастатина, группу секвестрантов желчных кислот, состоящую из холестирамина, целестипола, колезевалама, группу фибриновых кислот, состоящую из гемфиброзила, фенофибрата, клофибрата, группы, включающей никотиновую кислоту и ниаспан, группу, включающую агент, снижающий уровень холестерина, такой как эзетимиб и комбинация эзетемиба и симвастатина. В еще одном аспекте анти-TGF-β-антитела являются пригодными для лечения острого инфаркта с антитромбоцитарными агентами/антикоагулянтами, включая без ограничения аспирин, группу ингибиторов рецептора ADP, состоящую из клопидогреля, празугреля, тикагрелора, тиклопилина и антикоагулянта варфарина.
Терапевтические композиции антител, используемые в лечении, могут быть обеспечены в контейнере, доступном для внутривенного введения. Также можно приготовить композиции для хранения смешением антитела, имеющего требуемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами, включая без ограничения приведенные в Remington’s Pharmaceutical Sciences, 16th edition, Oslo, A., Ed., (1980), и в виде лиофилизированных композиций или водных растворов, пригодных для хранения. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов в используемых дозировках и включают буферы, такие как буферы на основе фосфата, цитрата и других органических кислот; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония, хлорид гексаметония, хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол, и м-крезол); низкомолекулярные (содержащие менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глютамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов и/или неионогенные поверхностно-активные вещества.
Композиция может также содержать более чем одно активное соединение, как это необходимо для конкретного показания, которое лечится. Предпочтительно соединения, обладающие комплементарной активностью, не оказывают неблагоприятного эффекта друг на друга. Альтернативно или дополнительно композиция может также содержать цитокин, ингибирующий рост агент, антигормональный агент, нацеленный на TGF-β агент, антиангиогенный агент и/или кардиопротектор. Такие молекулы соответственно находятся в комбинации в количествах, которые являются эффективными для предназначенной цели.
Термин «цитокин» является общим термином для белков, высвобождаемых одной клеточной популяцией, которые воздействуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и обычные полипептидные гормоны. Цитокины включают гормон роста, такой как гормон роста человека, N-метионильный гормон роста человека и гормон роста крупного рогатого скота; гормон паращитовидной железы; тироксин; инсулин, проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тироид-стимулирующий (TSH) и лютениизирующий гормон (LH); фактор роста гепатоцитов; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор-α и фактор-β некроза опухолей; мюллериан-ингибирующее вещество; мышиный гонадотропин-ассоциированный пептид; ингибин; активин; фактор роста эндотелия сосудов (VEGF); интегрин; тромбопоэтин (ТРО), факторы роста нервных клеток, такие как NGF-β; фактор роста тромбоцитов; инсулиноподобные фактор-I и фактор-II роста; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β и -γ; колониестимулирующие факторы (CSF), такие как CSF макрофагов (M-CSF), CSF гранулоцитов-макрофагов (GM-CSF) и CSF гранулоцитов (G-CSF); интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, факторы некроза опухоли, такие как TNF-α или TNF-β; и другие полипептидные факторы, включая LIF и лиганд kit (KL). В том смысле, в котором в данном документе используется термин «цитокин», он включает белки из природных источников или рекомбинантной клеточной культуры, и биологически активные эквивалентные варианты цитокинов с нативной последовательностью.
«Кардиопротектор» представляет соединение или композицию, которая предупреждает или снижает дисфункцию миокарда (т.е. кардиомиопатию и/или застойную сердечную недостаточность), ассоциированную с введением лекарственного препарата, такого как анти-TGF-β-антитело, пациенту. Кардиопротектор может, например, блокировать или снижать кардиотоксический эффект, опосредуемый свободными радикалами, и/или предупреждать или снижать повреждение за счет окислительного стресса.
Активные ингредиенты также могут быть заключены в микрокапсулы, полученные, например, способами коацервации или межфазной полимеризацией, например, микрокапсулы из гидроксиметилцеллюлозы или желатина и микрокапсулы из поли(метилметакрилата) соответственно, в коллоидных системах доставки лекарственных средств (например, липосомах, микросферах из альбумина, микроэмульсиях и нанокапсулах) или в макроэмульсиях. Такие способы раскрыты в Remington’s Pharmaceutical Sciences, 16th edition, Osol A., Ed. (1980).
Можно приготовить препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением могут включать полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих антитело, где матрицы находятся в виде фигурных предметов, например, пленок, или микрокапсул. Примеры матриц с замедленным высвобождением включают без ограничения полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый) спирт), полиактиды, сополимеры L-глутаминовой кислоты и γ-этил-L-глутамат, недеградируемый этилен-винилацетат, деградируемые сополимеры молочной кислоты-гликолевой кислоты и поли-D-(-)-3-гидроксимасляную кислоту. Композиции, предназначенные для введения in vivo, должны быть стерильными. Это легко осуществить фильтрацией через мембранные фильтры для стерилизующей фильтрации.
Может быть обеспечено изделие производства, содержащее вещества, пригодные для лечения инфаркта миокарда, как описано выше, обычно включающее контейнер и этикетку или вкладыш в упаковку на или связанный с контейнером. «Вкладыш в упаковку» включает инструкции по применению, обычно включаемые в промышленно доступные упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировках, введении, противопоказаниях и/или предостережения, касающиеся применения данных терапевтических продуктов.
Подходящие контейнеры включают, не ограничиваясь этим, бутыли, ампулы, шприцы и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая является эффективной для ингибирования сигнального пути TGF-β, и может иметь стерильное отверстие для доступа (например, контейнер может представлять собой мешок или ампулу для внутривенного введения, имеющие запирающее устройство с инъекционной иглой для подкожного введения). По меньшей мере, одно активное вещество в композиции представляет анти-TGF-β-антитело. На этикетке или вкладыше в упаковку указывается, что композиция используется для лечения инфаркта миокарда, острого инфаркта миокарда или снижения последствий инфаркта миокарда. В одном варианте осуществления на этикетке или вкладыше в упаковку указывается, что композицию, содержащую антитело, можно вводить во время острой фазы инфаркта миокарда.
Кроме того, изделие производства может содержать контейнер с композицией, находящейся в нем, где композиция содержит анти-TGF-β-антитело, и терапевтическое средство иное, чем антитело. Изделие производства может дополнительно включать вкладыш в упаковку, на котором указано, что первую и вторую композиции можно использовать в комбинации для лечения инфаркта миокарда. Такое терапевтическое средство может быть любым из дополнительных препаратов, описанных в предыдущем разделе (например, антиангиогенный препарат, антигормональный препарат, кардиопротектор и/или регулятор иммунной функции у млекопитающего, включая цитокин). Альтернативно или дополнительно изделие производства может также содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Он может дополнительно включать другие материалы, желательные с коммерческой и потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Для удобства анти-TGF-β-антитела можно обеспечить в наборе, т.е. упакованной комбинации реагентов в заранее определенных количествах с инструкциями. Кроме того, можно включить другие добавки, такие как стабилизаторы, буферы (например, буфер для блокирования или буфер для лизиса). В частности, антитела могут находиться в виде сухих порошков, обычно лиофилизированных, включая наполнители, которые при растворении будут обеспечивать раствор с соответствующей концентрацией.
В дополнении к способам, описанным в разделе «Сущность изобретения» и «Подробное описание изобретения» выше, также предусматриваются следующие варианты осуществления. Способ лечения пациента, страдающего инфарктом миокарда, острым инфарктом миокарда, или снижения неблагоприятных последствий острого инфаркта миокарда у пациента может включать введение антагониста TGF-β пациенту во время острой стадии инфаркта миокарда. Антагонист TGF-β можно выбрать из группы, состоящей из антитела или белка, содержащего фрагмент антитела, направленного против одной или более изоформ TGF-β; рецептора TGF-β; антитела или белка, содержащего фрагмент антитела, направленного против одного или более рецепторов TGF-β; ассоциированного с латентностью пептида; крупного латентного TGF-β; ингибирующего TGF-β протеогликана; соматостатина; манноза-6-фосфата; манноза-1-фосфата; пролактина; инсулиноподобного фактора роста II; IP-10; пептида, содержащего arg-gly-asp; экстракта растительного, грибкового или бактериального происхождения; антисмыслового олигонуклеотида или интерферирующей РНК; и белка, принимающего участие в сигнальном пути TGF-β.
В предпочтительных вариантах осуществления антагонист TGF-β является гуманизированным анти-TGF-β-антителом или фрагментом, или антигенсвязывающим участком анти-TGF-β-антитела. Антагонист TGF-β может представлять антитело или фрагмент антитела, способное связываться и нейтрализовать более чем одну изоформу TGF-β. Антитело может быть химерным моноклональным антителом, содержащим TGF-β-связывающий участок и остальной фрагмент, где указанный TGF-β-связывающий участок содержит антигенсвязывающий участок моноклонального антитела 1D11.16, и остальной фрагмент получен из одного или более человеческих антител. Антитело, которое направлено против более чем одной изоформы TGF-β, может представлять человеческую или гуманизированную форму моноклонального антитела 1D11.16. Антагонист TGF-β может представлять антитело или фрагмент антитела, которое нейтрализует человеческий TGF-β1, TGF-β2 и TGF-β3.
Введение антагониста TGF-β можно начать в течение примерно 120 ч, примерно 80 ч, примерно 72 ч, примерно 48 ч или примерно 24 ч после начала острой ишемии миокарда. В некоторых случаях введение антагониста TGF-β начинают в течение 12 ч после начала острой ишемии миокарда. Введение антагониста TGF-β можно начать до выраженной инфильтрации макрофагами и мононуклеарными клетками ткани, пораженной инфарктом миокарда. В других случаях введение антагониста TGF-β начинают во время периода, характеризующегося нейтрофильной инфильтрацией ткани, пораженной инфарктом миокарда. Кроме того, в некоторых случаях введение антагониста TGF-β начинают во время периода, характеризующегося некрозом ткани, пораженной инфарктом миокарда.
Способ также включает введение соединения, способного избирательно восстанавливать требуемую функцию TGF-β у пациента с диагнозом острого инфаркта миокарда во время острой стадии инфаркта миокарда, например, противовоспалительного препарата и/или антагониста TGF-α. Способ можно использовать в гуманной и ветеринарной медицине так, что пациент может быть человеком или млекопитающим, отличным от человека.
В отношении антагониста TGF-β, то в некоторых вариантах осуществления антагонист представляет антитело, которое нейтрализует человеческий TGF-β1, TGF-β2 и TGF-β3, и содержит антигенсвязывающий участок антитела, где указанный антигенсвязывающий участок содержит набор CDR HCDR1, HCDR2 и HCDR3, и где в указанном антигенсвязывающем участке используется ген семейства VH1 человека, и где HCDR3 имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:5, SEQ ID NO:15 и SEQ ID NO:25. Ген семейства VH1 человека может представлять собой ген VH1-2 человека, который в некоторых случаях является геном DP-10 или DP-88. Антигенсвязывающий участок может дополнительно содержать набор CDR LCDR1, LCDR2 и LCDR3, и где в указанном антигенсвязывающем участке используется ген семейства Vκ3 человека, и где указанный LCDR3 имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:10, SEQ ID NO:20 и SEQ ID NO:30. HCDR3 и LCDR3 могут быть выбраны из группы, состоящей из: (а) SEQ ID NO:5 и SEQ ID NO:10 соответственно; (b) SEQ ID NO:15 и SEQ ID NO:20 соответственно; и (с) SEQ ID NO:25 и SEQ ID NO:30 соответственно.
В некоторых вариантах осуществления ген семейства Vκ3 человека может представлять ген VK человека DPK22. HCDR1, HCDR2 и HCDR3 VH-домена могут входить в каркасную область тяжелой цепи зародышевой линии, или HCDR1, HCDR2 и HCDR3 VH-домена находятся в каркасной области, которая содержит до 12 мутаций из аминокислотной последовательности зародышевой линии. LCDR1, LCDR2 и LCDR3 домена Vκ могут находиться в каркасной области тяжелой цепи зародышевой линии. В некоторых случаях LCDR1, LCDR2 и LCDR3 домена Vκ могут находиться в каркасной области, которая содержит до 5 мутаций из аминокислотной последовательности Vκ зародышевой линии.
Антагонист TGF-β может представлять антитело, которое нейтрализует человеческие TGF-β1, TGF-β2 и TGF-β3, и содержит антигенсвязывающий участок антитела, где в указанном антигенсвязывающем участке используется ген VH человека DP-10 или ген VH человека DP-88, и содержится аминокислотная последовательность FR4, содержащая аминокислотную последовательность SEQ ID NO:31. В антигенсвязывающем участке может использоваться ген VH человека DP-10 или ген VH человека DP-88, и он содержит набор CDR HCDR1, HCDR2 и HCDR3, где указанный HCDR3 имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:5, SEQ ID NO:15 и SEQ ID NO:25, и дополнительно содержит аминокислотную последовательность FR4, содержащую аминокислотную последовательность SEQ ID NO:31. В антигенсвязывающем участке может дополнительно использоваться ген семейства Vκ3 человека и ген Jκ5 человека. При использовании в антигенсвязывающем участке гена семейства Vκ3 человека и гена Jκ5 человека, он может содержать CDR LCDR1, LCDR2 и LCDR3, где LCDR3 имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:10, SEQ ID NO:20 и SEQ ID NO:30.
В некоторых вариантах осуществления антагонист TGF-β нейтрализует человеческий TGF-β1, TGF-β2 и TGF-β3 и содержит антигенсвязывающий участок, где указанный антигенсвязывающий участок включает: (а) HCDR1 аминокислотной последовательности SEQ ID NO:3, HCDR2 аминокислотной последовательности SEQ ID NO:4, HCDR3 аминокислотной последовательности SEQ ID NO:5; (b) HCDR1 аминокислотной последовательности SEQ ID NO:13, HCDR2 аминокислотной последовательности SEQ ID NO:14, HCDR3 аминокислотной последовательности SEQ ID NO:15; или (с) HCDR1 аминокислотной последовательности SEQ ID NO:23, HCDR2 аминокислотной последовательности SEQ ID NO:24, HCDR3 аминокислотной последовательности SEQ ID NO:25. Антигенсвязывающий участок может дополнительно содержать VL-домен антитела. Антигенсвязывающий участок может содержать LCDR, выбранные из группы, состоящей из: (а) LCDR1 аминокислотной последовательности SEQ ID NO:8, LCDR2 аминокислотной последовательности SEQ ID NO:9, LCDR3 аминокислотной последовательности SEQ ID NO:10; (b) LCDR1 аминокислотной последовательности SEQ ID NO:18, LCDR2 аминокислотной последовательности SEQ ID NO:19, LCDR3 аминокислотной последовательности SEQ ID NO:20 и (с) LCDR1 аминокислотной последовательности SEQ ID NO:28, LCDR2 аминокислотной последовательности SEQ ID NO:29, LCDR3 аминокислотной последовательности SEQ ID NO:30. В некоторых случаях HCDR1, HCDR2 и HCDR3 VH-домена могут находиться в каркасной области тяжелой цепи зародышевой линии, например, каркасной области семейства VH1 человека. HCDR1, HCDR2 и HCDR3 VH-домена могут находиться в человеческой каркасной области тяжелой цепи VH1 DP-10 или DP-88 зародышевой линии. LCDR1, LCDR2 и LCDR3 домена VL могут находиться в каркасной области легкой цепи зародышевой линии. Каркасная область легкой цепи зародышевой линии может представлять каркасную область семейства Vκ3. Антигенсвязывающий участок может дополнительно содержать ген Jκ5 человека. Ген семейства Vκ3 человека может представлять собой ген Vκ DPK22.
В некоторых вариантах антагонист TGF-β может представлять антитело, содержащее VH-домен PET1073G12 (SEQ ID NO:2) с не более 5 мутациями, или его антигенсвязывающий участок. Антагонист TGF-β может представлять антитело, содержащее VH-домен PET1074B9 (SEQ ID NO:12) с не более 5 мутациями, или его антигенсвязывающий участок. Антагонист TGF-β может представлять антитело, содержащее VH-домен PET1287A10 (SEQ ID NO:22) с не более 5 мутациями, или его антигенсвязывающий участок. Антагонист TGF-β может представлять антитело, содержащее VL-домен PET1073G12 (SEQ ID NO:7) с не более 5 мутациями, или его антигенсвязывающий участок. Антагонист TGF-β может представлять антитело, содержащее VL-домен PET1074B9 (SEQ ID NO:17) с не более 5 мутациями, или его антигенсвязывающий участок. Антагонист TGF-β может представлять антитело, содержащее VL-домен PET1287A10 (SEQ ID NO:27) с не более 5 мутациями, или его антигенсвязывающий участок. Антагонист TGF-β может представлять антитело, содержащее VH-домен PET1073G12 (SEQ ID NO:2) и VL-домен PET1073G12 (SEQ ID NO:7). Антагонист TGF-β может представлять антитело, содержащее VH-домен PET1074B9 (SEQ ID NO:12) и VL-домен PET1074B9 (SEQ ID NO:17). Альтернативно антагонист TGF-β может представлять антитело, содержащее VH-домен PET1287A10 (SEQ ID NO:22) и VL-домен PET1287A10 (SEQ ID NO:27). Также предусматриваются дополнительные варианты, описанные в данном документе.
Обозначение SEQ ID NO относится к последовательностям, находящимся в приведенном списке последовательностей, которые оставляют часть данного раскрытия. Несмотря на то, что способы подробно описаны при обращении к некоторым вариантам их осуществления, специалистам в данной области, очевидно, понятно, что можно сделать различные изменения, и использовать эквивалентные варианты, не отступая от объема данного раскрытия или формулы изобретения, которая приводится ниже. Кроме того, последующие примеры приводятся в качестве иллюстрации аспектов способов, и их не следует рассматривать в качестве ограничивающих.
Пример 1 - Выделение антител
Моноклональные антитела 1D11 и GC 1008 выделяли из культурального супернатанта или асцитной жидкости хроматографией на протеине А-сефарозе (Goding, J. Immunol. Meth., 42; 17, 1976) (Pharmacia Fien Chemicals, Uppsala, Швеция). Связывание моноклональных антител подкласса гамма (γ)1 и подкласса гамма (γ)4, 1D11 и GC 1008, с протеином А усиливали добавлением промышленно доступного связывающего буфера (BioRad, Richmond, Калифорния). Антитела элюировали с протеина А-сефарозы 0,05 М буфером глицин-HCl плюс 0,15 М NaCl (рН 2,3), диализовали в течение ночи против буфера PBS и NaCl (рН 2,3), диализовали в течение ночи против PBS и хранили при -20°С. Антитела подкласса гамма (γ)1 и гамма (γ)4, выделенные из супернатанта, концентрировали и частично очищали осаждением аммонием сульфатом (50% насыщение) до хроматографии на протеине А.
Пример 2 - Эффект ингибитора TGF-β на крысиной модели ишемии-реперфузии сердца
Крыс самок Lewis в возрасте 12-14 недель распределяли на 5 опытных групп. На сутки 0 (D0) всех животных подвергали ишемии сердца с последующей реперфузией (I/R). Ишемию сердца воспроизводили временным наложением лигатуры на левую переднюю нисходящую коронарную артерию в левом желудочке сердца в течение 60 мин. Затем лигатуру удаляли, обеспечивая реперфузию ишемического участка сердца. Начиная с 3 или 5 суток после I/R, животным вводили внутривенно (в/в) 1D11 в дозе 5 мг/кг или контрольное антитело (антитело 13С4, представляющее собой отрицательный контроль, или растворитель) и затем вводили повторно каждые 3 суток до 28 суток.
Для анализа зоны риска (AAR) микросферы диаметром 15 мкм метили желтым флуорохромом и вводили в левый желудочек сердца непосредственно перед удалением временной лигатуры с левой ниспадающей коронарной артерии (D0). Микросферы равномерно распределялись в крови и оседали в капиллярах сердца и других органов и тканей. AAR в сердце определяли в виде зоны ткани миокарда, которая не получала каких-либо микросфер (т.е. отсутствовал приток крови), во время периода лигирования. На 28 сутки животным проводили поверхностную анестезию изофлураном и частоту сердечных сокращений поддерживали на значении 350±50 ударов в минуту. Затем проводили эхокардиографию по длинной оси для оценки региональной и глобальной сердечной функции. После проведения эхокардиографии животных подвергали эвтаназии введением высокой дозы пентобарбитала натрия. Затем иссекали сердце для гистологического анализа.
Исследовали AAR и затем давали количественную оценку в баллах. Животных с небольшой AAR (< примерно 20% от левого желудочка) или без AAR исключали из анализа. Фиброз сердечной ткани в левом желудочке исследовали гистологически, и при использовании массы сердца выражали в виде процента массы фиброзной ткани/общей массе левого желудочка. Затем региональную сердечную функцию оценивали по определению утолщения передней стенки (AWT) и сравнивали с утолщением задней стенки (PWT) в зоне риска. Утолщение стенки представляет разницу в толщине стенки во время систолы и толщину стенки во время диастолы. Глобальную функцию оценивали по определению фракции выброса (EF) и фракции укорочения (FS).
Во время опыта ежедневно проводили обычное клиническое наблюдение за животными. На фигуре 1 показано, что введение антитела 1D11 заметно снижало процент фиброзной ткани в левом желудочке по сравнению с введением растворителя и отрицательного контрольного антитела 13С4. Данное снижение фиброза имело место независимо от того, когда начинали вводить 1D11 на 3 сутки после I/R (D3) [1D11-D3] или на 5 сутки после I/R (D5) [1D11-D5]. В группе, в которой обработку 1D11 начинали на D5, достигалось статистически достоверное различие (Р<0,05) по сравнению с контрольной группой, обработанной 13С4.
Параметры сердечной функции оценивали эхокардиографией на 4 неделе после I/R, как показано в таблице 1. Фракция выброса и фракция укорочения являются показателями глобальной функции сердца. AWT, PWT и AWT/PWT (баллы оценки региональной подвижности стенки) характеризуют региональную сердечную функцию. У грызунов в норме AWT примерно равно, или может быть выше, PWT. Отсюда следует, что соотношение AWT/PWT, которое заявители назвали баллом региональной подвижности стенки, у животных в норме будет составлять ≥1. В таблице 1 в группе нормальных животных AWT был выше, чем PWT, и балл региональной подвижности стенки (AWT/PWT) равнялся 1,7±0,2.
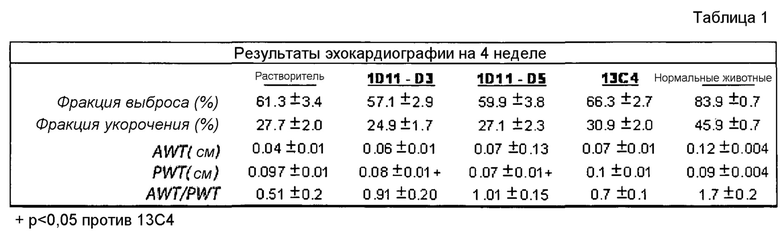
На 4 неделе после I/R сердечная функция во всех группах крыс, подвергшихся I/R, была ниже по сравнению с группой нормальных животных. AWT и PWT были аналогичными в группах 1D11-D3 и 1D11-D5 (таблица 1 и фигура 2), и баллы оценки региональной подвижности стенки составляли соответственно 0,91±0,2 и 1,01±0,15 в группах 1D11-D3 и 1D11-D5 (таблица 1 и фигура 3). Также было отмечено, что баллы оценки региональной подвижности стенки были сравнимы с минимальным нарушением региональной функции по сравнению с этим показателем у нормальных животных. В противоположность AWT был заметно ниже, чем PWT у крыс, получавших антитело 13С4, служившее в качестве отрицательного контроля, и в группах с введением растворителя (таблица 1 и фигура 2), баллы оценки региональной подвижности стенки составляли соответственно 0,7±0,1 и 0,51±0,2 в группах с введением 13С4 и растворителя, что соответствует достоверному нарушению по сравнению с группами, обработанными 1D11, и нормальными животными. Примечательно, что относительное отсутствие нарушения региональной сердечной функции в группах с обработкой 1D11 совпадало со снижением образования фиброзной ткани, наблюдаемым в этих группах, по сравнению с группами, обработанными растворителем и отрицательным контрольным антителом 13С4.
Несмотря на то что региональная функция в группах, обработанных 1D11, была лучше по сравнению с группами с введением растворителя и антитела 13С4, фракция выброса и фракция укорочения были одинаковыми у животных всех этих групп. Вероятно, это является результатом компенсации функции той части левого желудочка, в которой не было инфаркта, в группах с антителом 13С4 и растворителем. Повышение PWT, совместимое с гипертрофией, наблюдаемой в этих группах, согласуется с такой интерпретацией. Данный пример позволяет оценить, насколько инициация антагонистического действия по отношению к TGF-β на 3 сутки или 5 сутки после I/R будет приводить к подавлению фиброза при инфаркте и улучшенной сердечной функции. Имело место выраженное снижение процента фиброзной ткани в левом желудочке в обеих группах, обработанных 1D11, по сравнению с растворителем и антителом 13С4. Несмотря на то, что степень фиброза в группах 1D11-D3 и 1D11-D5 была одинаковой, в группе 1D11-D5 была достигнута статистическая достоверность по сравнению с группой отрицательного контроля 13С4 (p<0,05). На модели инфаркта миокарда было показано, что развитие фиброза после инфаркта миокарда ассоциировано с положительной регуляцией TGF-β, сигнального пути с участием TGF-β посредством пути smad и регулируемых генов TGF-β. Введение 1D11 на модели сердечной I/R на грызунах «ослабляет» положительную регуляцию TGF-β и ассоциированных с TGF-β генов после I/R, включая коллаген 3 и фибронектин, которые связаны с фиброзом. Наблюдаемое снижение развития фиброза при введении 1D11 согласуется с ингибированием под действием 1D11 опосредованного TGF-β фиброза на данной модели.
Снижение степени фиброза в группах, обработанных 1D11, соответствовало минимальным нарушениям в сердечной региональной функции, в то время как в группе с отрицательным контролем, 13С4, и в группе с растворителем имело место существенное нарушение региональной функции. AWT, PWT и баллы оценки региональной подвижности были аналогичными в обеих группах 1D11-D3 и 1D11-D5. На основании этого можно предположить, что снижение образование фиброзной ткани у обработанных 1D11 животных приводило к сберегающему действию и спасению миокарда, которое вносило свой вклад в восстановление региональной сердечной функции после инфаркта миокарда. Несмотря на то, что в обработанных 1D11 группах имела место улучшенная региональная функция по сравнению с группами с 13С4 и растворителем, значения фракции выброса и фракции укорочения были аналогичными между группами. Это согласуется с идеей о том, что сердце способно функционально компенсировать нарушение региональной функции в группах с 13С4 и растворителем. Конечной точкой в данном исследовании были 28 суток после I/R. Возможно, что компенсация в группах с введением антитела 13С4 и растворителя не будет поддерживаться в течение длительного времени на данной модели, и различия в глобальной функции между животными, обработанными 1D11, 13С4 и растворителем, станут очевидными в более отдаленный период времени.
Опосредованное 1D11 антагонистическое действие по отношению к TGF-β, начатое с 3 или 5 суток после I/R, приводило к снижению развития фиброза сердца, которое достигало статистической достоверности в группе 1D11-D5. Снижение образования фиброзной ткани соответствовало улучшенной региональной сердечной функции по сравнению с животными, получавшими антитело, служившее в качестве отрицательного контроля, 13С4, или растворитель, и на основании этого можно предположить о сберегающем действии или спасении миокарда у животных, обработанных 1D11.
Пример 3 - Влияние времени введения ингибитора TGF-β на модели ишемии-реперфузии сердца на крысах
Исследовали влияния различного времени введения 1D11, антитела-ингибитора TGF-β, на развитие фиброза миокарда на модели ишемии-реперфузии сердца на крысах (I/R). Введение 1D11 начинали на 0, 1 или 5 сутки после I/R сердца. Снижение образования фиброзной ткани в миокарде приводило к улучшенной функции сердца по данным эхокардиографии.
Крыс самок Lewis в возрасте 12-14 недель распределяли на 7 опытных групп, различающихся по характеру обработки животных. Всех животных подвергли ишемии сердца с последующей реперфузией (I/R). Ишемию сердца воспроизводили временным наложением лигатуры на левую переднюю нисходящую коронарную артерию в левом желудочке сердца в течение 60 мин. Затем лигатуру удаляли, обеспечивая реперфузию ишемического участка сердца. Начиная с 0 (2 часа после реперфузии), 1 или 5 суток после I/R животным вводили внутривенно (в/в) в дозе 5 мг/кг 1D11 или контрольное антитело (отрицательное контрольное антитело 13С4 или растворитель) и затем вводили повторно каждые 3 суток до 28 суток.
Для анализа зоны риска (AAR) микросферы диаметром 15 мкм метили желтым флуорохромом и вводили в левый желудочек сердца. Манипуляцию проводили непосредственно перед удалением временной лигатуры с левой ниспадающей коронарной артерии. Микросферы равномерно распределялись в крови и оседали в капиллярах сердца и других органов и тканей. AAR в сердце определяли в виде зоны ткани миокарда, которая не получала каких-либо микросфер (т.е. отсутствовал приток крови), во время периода лигирования.
На 28 сутки животным проводили поверхностную анестезию изофлураном и частоту сердечных сокращений поддерживали на значении 350±50 ударов в минуту. Затем проводили эхокардиографию по длинной оси для оценки региональной и глобальной сердечной функции. После проведения эхокардиографии животных подвергали эвтаназии введением высокой дозы пентобарбитала натрия. Затем иссекали сердце, взвешивали и далее обрабатывали для гистологического анализа. AAR давали количественную оценку в баллах. Животных с небольшой AAR (< примерно 20% от левого желудочка) или без AAR исключали из анализа.
Фиброз сердечной ткани в левом желудочке исследовали гистологически, и при использовании массы сердца выражали в виде процента массы фиброзной ткани/общей массе левого желудочка. Затем региональную сердечную функцию оценивали по определению утолщения передней стенки (AWT) и сравнивали с утолщением задней стенки (PWT) в зоне риска. Утолщение стенки представляет разницу в толщине стенки во время систолы и толщину стенки во время диастолы. Глобальную функцию оценивали по определению фракции выброса (EF) и фракции укорочения (FS).
Введение 1D11, начиная с 0 или 5 суток, достоверно снижало процент фиброзной ткани в левом желудочке по сравнению с группами, обработанными растворителем и отрицательным контрольным антителом, 13С4 (фигура 4). Введение 1D11, начиная с D1, показывало тенденцию к снижению фиброза по сравнению с соответствующим контролем 13С4 или растворителем.
В таблице 2 приведены параметры сердечной функции, которые оценивали эхокардиографией через 4 недели после I/R. AWT, PWT и AWT/PWT (баллы оценки региональной подвижности стенки) характеризуют региональную функцию сердца. У грызунов в норме AWT примерно равно, или может быть выше, PWT. Отсюда следует, что соотношение AWT/PWT, которое заявители назвали баллом оценки региональной подвижности стенки, у животных в норме будет составлять ≥1. В таблице 2 в группе нормальных животных AWT был выше, чем PWT, и балл региональной подвижности стенки (AWT/PWT) равнялся 1,7±0,2.
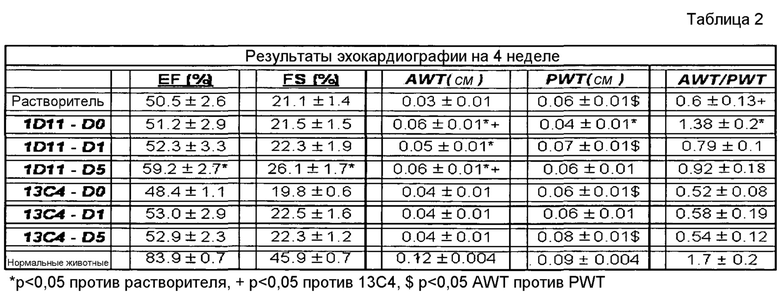
На 4 неделе после I/R сердечная функция во всех группах крыс, подвергшихся I/R, была ниже по сравнению с контрольной группой нормальных животных. Значения AWT и PWT были одинаковыми в группах 1D11-D0, 1D11-D3 и 1D11-D5 (таблица 2 и фигура 5). Баллы оценки региональной подвижности стенки составляли соответственно 1,38±0,2, 0,79±0,1 и 0,92±0,18 в группах 1D11-D0, 1D11-D3 и 1D11-D5 (таблица 2 и фигура 3). Баллы оценки региональной подвижности стенки соответствовали минимальному нарушению региональной функции по сравнению с этим показателем у нормальных животных, составляющим ≥1. В противоположность значение AWT было заметно ниже, чем PWT у крыс, получавших антитело 13С4, служившее отрицательным контролем, и в группах с введением растворителя (таблица 2 и фигура 5). Баллы оценки региональной подвижности стенки составляли соответственно 0,52±0,08, 0,58±0,19, 0,54±0,12 и 0,6±0,13 в группах 13С4-D0, 13С4-D1, 13С4-D5 и растворителя соответственно, что соответствует достоверному нарушению по сравнению с группами, обработанными 1D11, и нормальными животными. Относительное отсутствие нарушения региональной сердечной функции в группах с обработкой 1D11 совпадало со снижением развития фиброза, наблюдаемого в этой группе, по сравнению с группами, обработанными растворителем и соответствующим отрицательным контрольным антителом 13С4.
В группе 1D11-D5 также наблюдали достоверное улучшение параметров глобальной функции сердца, т.е. фракции выброса и фракции укорочения по сравнению с контрольной группой с введением растворителя (таблица 2), что согласовывалось результатами оценки образования фиброзной ткани и региональной сердечной функции. Однако в других группах, обработанных 1D11, отсутствовали изменения в глобальной функции по сравнению с группами, обработанными растворителем и соответствующим контрольным антителом 13С4. Снижение образования фиброзной ткани с относительным отсутствием нарушения региональной функции у животных, обработанных 1D11, без достоверного улучшения глобальной сердечной функции также наблюдали в предыдущем опыте и, вероятно, это является результатом компенсации функции органа той частью левого желудочка, в которой не было инфаркта в группах с антителом 13С4 и растворителем, что затрудняет детектирование изменений между группами на этой временной точке. Повышение PWT, сравнимое с гипертрофией, наблюдаемое в этих группах, совпадало с такой интерпретацией данных.
В данном примере сравнивалась биологическая активность анти-TGF-β-антитела, 1D11, введение которого начинали на различные временные точки после инфаркта миокарда на крысиной модели инфаркта миокарда, где животные подверглись ишемии сердца с последующей реперфузией. Возможно, что TGF-β играет различную роль в восстановительной ответной реакции на D0, D3 и D5, и антагонистическое действие TGF-β, начатое на эти различные временные точки, приводит к различному ответу. В группе крыс 1D11-D1 имелась тенденция к снижению образования фиброзной ткани и улучшению сердечной функции.
Опосредованное 1D11 антагонистическое действие по отношению к TGF-β, начатое с 0, 1 суток или 5 суток после I/R, приводило к снижению процессов фиброза в сердце, которое достигало статистической достоверности в группе 1D11-D0 и в группе 1D11-D5 по сравнению с группами животных, которым вводили растворитель и соответствующее контрольное антитело 13C4. В группах 1D11-D0 и 1D11-D5 снижение образования фиброзной ткани соответствовало достоверному улучшению региональной сердечной функции по сравнению с животными, получавшими антитело, представляющее собой отрицательный контроль, т.е. 13С4, или растворитель, а также достоверно улучшенной глобальной сердечной функции по сравнению с контролем растворителем в группе 1D11-D5. На основании этого можно предположить о сберегающем действии или спасении миокарда у животных, обработанных 1D11.
Пример 4 - Эффекты ингибитора TGF-β, 1D11, на модели ремоделирования миокарда после ишемии миокарда на грызунах
Введение 1D11, ингибитора TGF-β, приводило к снижению развития фиброза и, как следствие, улучшенной сердечной функции в зависимости от дозы. На 0 сутки на левую нисходящую коронарную артерию накладывали лигатуру на 60 мин (окклюзия коронарной артерии или САО) и затем снимали для обеспечения реперфузии (реперфузии коронарной артерии или CAR). На 5 сутки внутривенно вводили растворитель, 1D11 и 13С4 (контрольное антитело) и продолжали вводить каждые 3 дня до убоя на 28 сутки (4 неделя). Эхокардиографию проводили через 2 недели и 4 недели после CAR для оценки функции левого желудочка. Через 4 недели после CAR проводили конечную хирургическую процедуру для прямой оценки функции левого желудочка с использованием гемодинамики давление-объем (PV). Также ставили тест с добутаминовым стрессом. После выполнения всех вышеуказанных протоколов крыс подвергали эвтаназии, и отбирали ткани миокарда из ишемических и неишемических зон для патологического анализа. Подгруппу из девяти крыс, которую использовали для оценки размера инфарктной зоны, подвергали эвтаназии через 7 суток после CAO/CAR. Затем сердца перфузировали и окрашивали. Определяли площадь зоны риска инфарктной зоны и сравнивали между группами, получавшими растворитель и антитело 1D11 (в дозе 25 мг/кг).
Результаты данного примера показывают, что антитело 1D11 достоверно снижало размер рубца в левом желудочке при введении в дозе 5 мг/кг по сравнению с растворителем. Интересно отметить, что при введении испытуемого антитела в дозе 25 мг/кг размер рубца в левом желудочке был больше по сравнению с контролями (фигура 6). Результаты гистологического анализа показывали достоверное снижение апоптоза в зоне, соседней с рубцом, при введении 1D11 в дозе 5 мг/кг. Имел место повышенный апоптоз в группе крыс, получавших 1D11 в дозе 25 мг/кг (фигура 7). Отсутствовали различия в развитии субэпикардиального интерстициального фиброза в области, соседней с рубцом, между всеми группами (данные не приводятся).
Оценивали фракцию выброса левого желудочка (LVEF), являющуюся показателем глобальной систолической функции, на 2 и 4 неделе (фигура 8). На 4 неделе LVEF была достоверно лучше при введении 1D11 в дозе 5 мг/кг по сравнению с обработанными растворителем животными. Однако обработка 1D11 в дозе 25 мг/кг приводила к статистически достоверному снижению LVEF. Это согласуется с данными по размеру рубца, приведенными на фигуре 6. В период с 2 по 4 недели имело место достоверное улучшение в процентном изменении LVEF при введении 1D11 в дозе 5 мг/кг (фигура 9).
Время изоволюметрической релаксации левого желудочка (IVRT), являющееся показателем диастолической функции, также было достоверно лучше в группе, получавшей 1D11 в дозе 5 мг/кг, по сравнению с контрольными группами и с высокой дозой 1D11. Имела место очевидная нормализация диастолической функции по сравнению с ложнооперированными животными (фигура 10). Региональная подвижность стенки, представленная в виде процентного утолщения в передней стенке, была достоверно лучше в группе с введением 1D11 в дозе 5 мг/кг по сравнению с группой крыс, которым вводили растворитель (фигура 11).
Отношение конечного диастолического давления в левом желудочке к его конечному диастолическому объему, являющееся показателем диастолической функции, оцениваемая PV гемодинамикой, демонстрировало достоверное улучшение в группе с введением 1D11 в дозе 5 мг/кг, где данные были сравнимы с ложнооперированными животными (фигура 12). Результаты добутаминового стресса указывали на имеющуюся тенденцию к улучшению при введении 1D11 в дозе 5 мг/кг (данные не представлены).
Нижняя доза (5 мг/кг) 1D11 вызывала не четкие и достоверные положительные эффекты. Во-первых, размер рубца левого желудочка на 4 неделе был самым маленьким, указывая на то, что имело место наименьшее остаточное повреждение миокарда в результате инфаркта. Во-вторых, имел место достоверно менее выраженный апоптоз в области, соседней к рубцу, по сравнению с другими группами. В-третьих, функция левого желудочка, оцениваемая по фракции выброса левого желудочка, была достоверно выше в этой группе по сравнению с другими группами, указывая на наилучшую сохранность функции левого желудочка. Наконец, данная группа была уникальной в том отношении, что улучшение во фракции выброса левого желудочка имело место в период между 2 и 4 неделями. Наклон отношения конечного диастолического давления в левом желудочке к его конечному диастолическому объему на 4 неделе был наименьшим в данной группе, что указывает на пониженную ригидность левого желудочка и улучшенную диастолическую функцию. Это подтверждало результаты IVRT, эхокардиографический показатель диастолической функции, который показывал, что животные данной группы были единственными, которые сохраняли диастолическую функцию на 4 неделе опыта. Результаты теста добутаминового стресса указывали на наличие тенденции к улучшению сердечной функции, несмотря на присущие проблемы, связанные с анестезией и катетеризацией, которые вносили свой вклад в вариабельность и более низкую надежность этих данных в противоположность результатам эхокардиографии. Результаты опытов с контрольным антителом достоверно не отличались от данных, полученных на обработанных растворителем крысах.
С другой стороны, антитело 1D11 в высокой дозе проявляло побочные эффекты. Рубец на 4 неделе был крупнее по сравнению с другими группами, включая группу, обработанную растворителем. В соседней области апоптоз был более выраженным. Когда функцию левого желудочка оценивали по фракции выброса левого желудочка, то она была ниже, чем во всех других группах на 4 неделе. Следовательно, антагонистическое действие по отношению TGF-β при введении 1D11 в дозе 5 мг/кг было более эффективным в предупреждении неблагоприятных последствий ремоделирования после инфаркта миокарда у крыс. Достоверное уменьшение размера рубца левого желудочка и апоптоза согласовывалось с улучшением сердечной систолитической и диастолической функции на данной модели. Однако высокая доза лекарственного препарата, напротив, проявляла отрицательные эффекты в конечных точках, оцениваемых гистологически и функционально.
Пример 5 - Влияние ингибитора TGF-β, ID11, на сохранение миокарда на модели ишемии миокарда с последующей реперфузией на грызунах
Введение 1D11, ингибитора TGF-β, приводило к снижению развития фиброза, сохраняло миокард и улучшало сердечную функцию в 2 различных дозах. На 0 сутки, на левую нисходящую коронарную артерию накладывали лигатуру на 60 мин и затем снимали для обеспечения реперфузии (I/R). На 5 сутки внутривенно вводили две различные дозы (1 или 5 мг/кг) в одной из двух различных композиций 1D11 (первая и вторая композиции), растворитель и 13С4 (антитело, представляющее собой отрицательный контроль) и продолжали каждые 3 суток до 28 суток.
Для анализа зоны риска микросферы диаметром 15 мкм метили желтым флуорохромом и вводили в левый желудочек сердца. Процедуру проводили непосредственно перед удалением временной лигатуры левой ниспадающей коронарной артерии. Микросферы равномерно распределялись в крови и оседали в капиллярах сердца и других органов и тканей. AAR в сердце определяли в виде зоны ткани миокарда, которая не получала каких-либо микросфер (т.е. отсутствовал приток крови), во время периода лигирования.
На 28 сутки животным проводили поверхностную анестезию изофлураном и частоту сердечных сокращений поддерживали на значении 350±50 ударов в минуту. Затем проводили эхокардиографию по длинной оси для оценки региональной сердечной функции. После проведения эхокардиографии животных подвергали эвтаназии введением высокой дозы пентобарбитала натрия. Затем иссекали сердце, взвешивали и готовили для гистологического анализа. AAR оценивали морфометрически на срезах сердца и, используя массу сердца, выражали в виде процента массы AAR/общей массе левого желудочка. Животных с небольшой AAR (< примерно 20% от левого желудочка) или без AAR исключали из анализа.
Фиброз сердечной ткани в левом желудочке исследовали гистологически и, используя массу сердца, выражали в виде процента массы фиброзной ткани/общей массы левого желудочка. Затем региональную сердечную функцию оценивали по определению утолщения передней стенки (AWT) и сравнивали с утолщением задней стенки (PWT) в зоне риска. Утолщение стенки представляет разницу в толщине стенки во время систолы и толщине стенки во время диастолы.
Результаты данного примера показывали, что на 4 неделе после I/R введение антитела 1D11 в дозах 1 и 5 мг/кг в двух различных композициях достоверно снижало процент развития фиброза в левом желудочке по сравнению с контролями, антителом 13С4 и растворителем (фигура 14). Кроме того, антитело 1D11 в обеих дозах в обеих композициях приводило к достоверному уменьшению процента фиброза в AAR по сравнению с контролями, антителом 13С4 и растворителем (фигура 15). Важно отметить, что 1D11 в обеих дозах в обеих композициях достоверно повышало процент миокарда в AAR по сравнению с контролями (фигура 16). Этот результат указывает на то, что обработка 1D11 после I/R не только снижала развитие фиброзной ткани, но также сохраняла миокард в AAR.
На 4 неделе после I/R сердечная функция, выраженная в виде баллов оценки региональной подвижности стенки (AWT/PWT), была нарушена в меньшей степени во всех группах, обработанных 1D11 (дозы 1 и 5 мг/кг для обеих композиций), по сравнению с контролями, антителом 13С4 и растворителем (фигура 17).
В данном примере оценивали биологическую активность антитела-антагониста TGF-β, 1D11, в двух дозах (1 и 5 мг/кг) и в двух различных композициях, начиная с 5 суток после ишемии миокарда с последующей реперфузией. Антитело 1D11 в обеих дозах 1 и 5 мг/кг в обеих композициях достоверно снижало развитие фиброза, и что еще важнее, сохраняло миокард в AAR по сравнению с отрицательными контролями. Согласуясь с этими улучшениями, также улучшалась региональная сердечная функция по сравнению с отрицательными контролями.
Пример 6 - Влияние ингибитора TGF-β, ID11, на экспрессию в сердце TGF-β и связанных генов на модели ишемии миокарда с последующей реперфузией на грызунах
Введение антитела 1D11, ингибитора TGF-β, приводило к снижению экспрессии в сердце TGF-β и связанных генов, что согласуется с его эффектами на ремоделирование миокарда, сохранение миокарда и функцию миокарда по данным приведенных выше примеров. На 0 сутки, на левую нисходящую коронарную артерию накладывали лигатуру на 60 мин и затем снимали для обеспечения реперфузии (I/R). На 3 сутки внутривенно вводили 1D11 в двух различных дозах (5 или 50 мг/кг), и введение продолжали каждые 3 суток до 7 суток или 12 суток животным, которые получали 1D11 в дозе 5 мг/кг, или до 12 суток животным, которые получали 1D11 в дозе 50 мг/кг. Другая группа животных, которая подвергалась I/R, не получала никакого лечения.
В зависимости от опытной группы, на 7 или 12 сутки животных подвергали эвтаназии введением высокой дозой пентобарбитала натрия. Кровь собирали в специальную пробирку для отделения сыворотки, и сыворотку собирали для анализа концентрации 1D11 и остеопонтина (потенциальный сывороточный биомаркер эффектов 1D11 в отношении снижения развития фиброза) с использованием вариантов ELISA соответственно для 1D11 или остеопонтина. Затем иссекали сердце, удаляли предсердие и правый желудочек, и левый желудочек разрезали по длине через центр зоны риска (зона сердца, в которую не поступала кровь во время наложения лигатуры на левую нисходящую коронарную артерию). Одну половину желудочка быстро замораживали для анализа экспрессии TGF-β и связанных генов полимеразной цепной реакцией с обратной транскрипцией (ОТ-ПЦР). Для анализа ОТ-ПЦР данный участок желудочка дополнительно разделяли на апикальный участок, который включал зону риска, и базальный участок, который не подвергался ишемии. Другую половину желудочка фиксировали в формалине для дальнейшего анализа. Группу нормальных крыс подвергали эвтаназии введением высокой дозы пентобарбитала натрия, и отбирали кровь для приготовления сыворотки и сердце, как описано выше.
У животных, которые получали 1D11, в сыворотке крови детектировались антитела 1D11, в то время как у крыс в группе с I/R, но которым не вводили 1D11, детектируемые 1D11 в сыворотке крови отсутствовали (фигура 18). У животных, которым вводили 1D11 в дозе 5 мг/кг, после убоя на 7 сутки уровень 1D11 был выше по сравнению с животными, которых подвергали эвтаназии на 12 сутки. Это вполне можно было предвидеть, поскольку у животных, подвергшихся эвтаназии на 7 сутки, образцы сыворотки собирали через сутки после последнего введения 1D11, в то время как у животных, которых убивали на 12 сутки, сыворотку отбирали на 3 сутки после последней дозы 1D11. Содержание 1D11 в сыворотке крови у животных, которым вводили 1D11 в дозе 50 мг/кг и убивали на 12 сутки, было примерно в 1,5 раза выше по сравнению с крысами, получавшими 1D11 в меньшей дозе 5 мг/кг и которые были убиты в этот же день. Отсутствие четкой линейной зависимости между концентрациями 1D11 в сыворотке крови от дозы можно отнести за счет более быстрого клиренса 1D11 у крыс, которые получали высокую дозу 1D11 (50 мг/кг). Эти данные указывают на то, что внутривенное введение 1D11 приводит к дозозависимым уровням 1D11 в кровотоке и предположительно его воздействию на сердце.
Остеопонтин является потенциальным сывороточным маркером 1D11-опосредованной модуляции развития фиброза при I/R сердца. Концентрации остеопонтина в сыворотке крови были одинаковыми у нормальных животных, животных, подвергшихся I/R, но которые не получали какой-либо обработки и были убиты на 12 сутки, и у животных, которые подверглись I/R, но получали две дозы 1D11 по 5 мг/кг и были подвергнуты эвтаназии на 7 сутки (фигура 19). Имела место тенденция к снижению уровня остеопонтина у крыс после I/R, которым вводили три дозы 1D11 по 5 мг/кг и были подвергнуты эвтаназии на 12 сутки, или три дозы 1D11 по 50 мг/кг и были убиты на 12 сутки.
Экспрессию TGF-β и связанных генов анализировали ОТ-ПЦР в апикальном участке левого желудочка, который включал зону риска, и базальном участке левого желудочка, который не подвергался ишемии. В базальном участке левого желудочка уровни экспрессии всех анализированных генов были аналогичны показателям, наблюдаемым у нормальных животных. Остальной анализ экспрессии генов в сердце касается изменений, наблюдаемых в апикальной части желудочка.
Экспрессия всех изоформ TGF-β в сердце, TGF-β1, TGF-β2 и TGF-β3 была повышена у животных с I/R, которые не получали какой-либо обработки и были убиты на 12 сутки. По сравнению с нормальными животными экспрессия TGF-β1, TGF-β2 и TGF-β3 была выше примерно в 2,3; 5 и 6 раз соответственно (фигуры 20-22). Введение 1D11 в дозе 5 мг/кг снижало экспрессию TGF-β1, TGF-β2 и TGF-β3 (фигуры 20-22). У животных, которые получали 1D11 в дозе 5 мг/кг и были подвергнуты эвтаназии на 12 сутки, отмечали более выраженное снижение экспрессии TGF-β1 и TGF-β2 по сравнению с животными, получившими 2 дозы антитела и подвергнутыми эвтаназии на 7 сутки (фигуры 20, 21). Имело место одинаковое снижение экспрессии TGF-β3 у животных, которые получали две или три дозы антитела 1D11 по 5 мг/кг (фигура 22). У животных, которым вводили три дозы 1D11 50 мг/кг и подвергали эвтаназии на 12 сутки, имело место снижение экспрессии всех трех форм TGF-β. Однако снижение экспрессии TGF-β1 и TGF-β2 было до некоторой степени менее выраженным, чем наблюдаемое у животных, которым вводили две дозы 5 мг/кг и были убиты на 7 сутки (фигуры 19-21). Данные результаты свидетельствуют о дозозависимом ингибировании экспрессии всех изоформ TGF-β под действием 1D11. Интересно отметить, что более высокая доза 1D11 (50 мг/кг) приводила к меньшему подавлению экспрессии TGF-β по сравнению с дозой 5 мг/кг.
Коллаген является известным компонентом фиброза, и известно, что его экспрессия регулируется TGF-β. Экспрессия коллагена 3 в сердце была повышена примерно в 14 раз у животных с I/R, которые не получали какой-либо обработки по сравнению с нормальными животными. Введение 1D11 в дозе 5 мг/кг приводило к снижению экспрессии коллагена 3, при том, что у животных, которые получали 3 дозы 1D11, отмечали более выраженное снижение экспрессии коллагена 3 по сравнению с животными, получавшими 2 дозы 1D11 (фигура 23). У животных, которым антитело 1D11 вводили в дозе 50 мг/кг, также было снижение экспрессии коллагена 3, которое было сравнимым с наблюдаемым у крыс, получившим две дозы 1D11 5 мг/кг. Согласуясь с опосредованным 1D11 снижением развития фиброза в сердце после I/R, имело место опосредованное дозозависимое снижение экспрессии коллагена 3 в сердечной ткани. Как и в случае с опосредованным 1D11 подавлением экспрессии TGF-β, более высокая доза 1D11 (50 мг/кг) приводила к менее выраженному ингибированию продукции коллагена 3 по сравнению с дозой 5 мг/кг.
Эндотелин-1 (ЕТ-1) обладает сильным сосудосуживающим действием, экспрессия которого регулируется TGF-β. Экспрессия ЕТ-1 в сердце была повышена примерно в 5,5 раз у животных с I/R, которые оставались без какой-либо обработки по сравнению с нормальными животными. Введение 1D11 в дозе 5 мг/кг снижало экспрессию ЕТ-1, при том, что животные, получившие 3 дозы 1D11, имели более выраженное снижение экспрессии по сравнению с животными, которым вводили 2 дозы 1D11 (фигура 24). Три дозы 1D11 по 5 мг/кг практически нормализовали экспрессию ЕТ-1. У животных, которым 1D11 вводили в дозе 50 мг/кг, также имело место уменьшении экспрессии ET-1, которая была сравнима с экспрессией, наблюдаемой у животных, которые получали две дозы 1D11 5 мг/кг. Опосредованное 1D11 подавление экспрессии ЕТ-1 после I/R может вносить свой вклад в улучшенную перфузию в поврежденном миокарде и в сохранение миокарда, а также снижение ремоделирования после I/R. Интересно отметить, что антитело 1D11 в дозе 50 мг/кг приводило к менее выраженной супрессии экспрессии ЕТ-1 по сравнению с вариантом опыта с дозой 5 мг/кг.
Ингибитор-1 активатора плазминогена (PAI-1) является основным ингибитором тканевого активатора плазминогена, и он регулируется TGF-β. Повышенные уровни PAI-1 ассоциированы с усиленными атеротромботическими событиями и заболеванием сосудов. Экспрессия PAI-1 в сердце была повышена примерно в 6 раз у животных с I/R, которые не получали какой-либо обработки по сравнению с нормальными животными. Введение 1D11 в дозе 5 мг/кг снижало экспрессию PAI-1, при том, что когда животные получали 3 дозы 1D11, то имело место более выраженное снижение экспрессии PAI-1 по сравнению с животными, получившими 2 дозы 1D11 (фигура 25). У животных, которым вводили 1D11 в дозе 50 мг/кг, наблюдали пограничное снижение экспрессии PAI-1. Вероятно, опосредованное 1D11 снижение экспрессии PAI-1 после I/R вносило свой вклад в улучшение ремоделирования и сохранения миокарда. Оказалось, что 1D11 в дозе 50 мг/кг имеет гораздо менее выраженный эффект на снижение экспрессии PAI-1 по сравнению с дозой 5 мг/кг.
Недавно было установлено, что эндотелиально-мезенхимальный переход может вносить свой вклад в развитие фиброза сердца. Транскрипционные факторы Snail1 и Snail2 (Slug) принимают участие в эндотелиально-мезенхимальном переходе, и данные транскрипционные факторы индуцируются TGF-β. Экспрессия Snail1 и Snail2 в сердце повышалась примерно в 4 раза и 3 раза соответственно у животных с I/R, которых ничем не обрабатывали, по сравнению с нормальными животными. Введение 1D11 в дозе 5 мг/кг снижало экспрессию обоих Snail1 и Snail2, причем, у животных, которые получали 3 дозы 1D11, имело место более резкое снижение экспрессии Snail1 и Snail2 по сравнению с животными, получившими 2 дозы 1D11 (фигуры 26 и 27). Три дозы по 5 мг/кг, вероятно, нормализовали экспрессию Snail2. У животных, которым вводили антитело 1D11 в дозе 50 мг/кг, также имело место снижение экспрессии Snail1 и Snail2, которое было сравнимо с наблюдаемым у животных, получившим две дозы 1D11 5 мг/кг. Повышенная экспрессия Snail1 и Snail2 после I/R дает веское основание предположить, что эндотелиально-мезенхимальный переход вносит свой вклад в развитие фиброза сердца при восстановлении в ответ на I/R. Опосредованное 1D11 снижение экспрессии Snail1 и Snail2 после I/R, вероятно, является содействующим механизмом в наблюдаемом снижении развития фиброза и улучшении ремоделирования. Интересно отметить, что доза 1D11, составляющая 50 мг/кг, оказалась менее эффективной в отношении снижения экспрессии Snail1 и Snail2 по сравнению с дозой 5 мг/кг.
Маркером мезенхимальной ткани, который обнаруживают при эндотелиально-мезенхимальном переходе, является α-актин гладкой мускулатуры (α-SMA). Экспрессия α-SMA в сердце была повышена примерно в 4 раза у животных после I/R, которых не обрабатывали, по сравнению с нормальными животными. Введение 1D11 в дозе 5 мг/кг снижало экспрессию α-SMA, притом, что у животных, которым вводили 3 дозы 1D11, имело значительно более выраженное снижение экспрессии α-SMA по сравнению с животными, получившими 2 дозы 1D11 (фигура 28). У животных, которым вводили 1D11 в дозе 50 мг/кг, также отмечали снижение экспрессии α-SMA, которое было сопоставимо с наблюдаемым у крыс, получившим 1D11 две дозы по 5 мг/кг. Согласуясь с опосредованным 1D11 снижением экспрессии Snail1 и Snail2 после I/R, антитело 1D11 приводило к снижению экспрессии α-SMA. Оказалось, что введение 1D11 в дозе 50 мг/кг имело менее выраженный эффект в отношение снижения экспрессии α-SMA по сравнению с дозой 5 мг/кг.
Фибронектин считается маркером эпителиально-мезенхимального перехода и, вероятно, является маркером эндотелиально-мезенхимального перехода. Экспрессия фибронектина в сердце повышалась примерно в 16 раз у животных с I/R, которые не получали какой-либо обработки, по сравнению с нормальными животными. Введение 1D11 в дозе 5 мг/кг снижало экспрессию фибронектина, при том, что у животных, которые получили 3 дозы 1D11, имело место более сильное снижение экспрессии фибронектина по сравнению с животными, которые получили 2 дозы 1D11 (фигура 29). У животных, которым вводили 1D11 в дозе 50 мг/кг, также отмечали снижение экспрессии фибронектина, которое было сопоставимо с наблюдаемым у животных, получавшим антитело 1D11 в двух дозах по 5 мг/кг. Опосредованное 1D11 снижение фибронектина было сравнимым с опосредованным 1D11 снижением маркеров эндотелиально-мезенхимального перехода Snail1, Snail2 и α-SMA. Оказалось, что доза 1D11 50 мг/кг обладает меньшим эффектом в отношении снижения экспрессии фибронектина по сравнению с введением в дозе 5 мг/кг.
Апоптоз вносит свой вклад в потерю сердечных миоцитов во время ремоделирования сердца. Bax представляет хорошо известный проапоптотический ген, и экспрессия Bax в сердце была повышена примерно в 1,8 раз у крыс после I/R, которые не получали какой-либо обработки, по сравнению с нормальными животными. Введение 1D11 в дозе 5 мг/кг снижало экспрессию Bax, притом, что у животных, получивших 3 дозы 1D11, было более выраженное снижение экспрессии Bax по сравнению с животными, получившими 2 дозы 1D11 (фигура 30). За счет ограниченного количества образцов сердца от животных, которые получали 1D11 в дозе 50 мг/кг, их не анализировали на экспрессию Bax. Опосредованное 1D11 снижение экспрессии Bax согласуется с наблюдениями, приведенными в предшествующих примерах, когда имело место снижение апоптоза в сердце у животных с I/R, которые получали 1D11 в дозе 5 мг/кг, и отмечалось повышенное сохранение миокарда у животных после I/R, которые получали 1D11 в дозе 1 и 5 мг/кг.
Результаты, приведенные в данном примере, показывают, что внутривенное введение антагониста TGF-β (например, анти-TGF-β-антитела) приводит к дозозависимому присутствию 1D11 в крови и предпочтительно воздействию на сердце. Уровень остеопонтина в сыворотке крови может служить показателем опосредованного 1D11 снижения развития фиброзной ткани в сердце. TGF-β и связанные гены индуцируются при I/R и являются регуляторами фиброза и ремоделирования сердца, которые имеют место после I/R. Введение антитела-антагониста TGF-β, 1D11, после I/R опосредует снижение экспрессии данных генов, что обеспечивает механизм уменьшения степени фиброза, сохранения миокарда, улучшения ремоделирования и улучшения сердечной функции, что наблюдали при обработке 1D11. Результаты также показали, что гены, принимающие участие в эндотелиально-мезенхимальном переходе, индуцировались после I/R и что эндотелиально-мезенхимальный переход может вносить свой вклад в развитие фиброза сердца после I/R. По сравнению с предшествующим уровнем знаний это является новым фактом. Обработка 1D11 после I/R отрицательно регулировала эти гены и отрицательно модулировала любое участие эндотелиально-мезенхимального перехода в фиброз сердца после I/R. Интересно отметить, что доза 1D11 5 мг/кг приводила к более выраженному снижению экспрессии TGF-β и близких генов после I/R по сравнению с дозой 1D11 50 мг/кг.
| название | год | авторы | номер документа |
|---|---|---|---|
| СКОНСТРУИРОВАННЫЕ АНТИ-TGF-БЕТА АНТИТЕЛА И АНТИГЕН-СВЯЗЫВАЮЩИЕ ФРАГМЕНТЫ | 2014 |
|
RU2681502C2 |
| НЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА ПРОТИВ GDF-8 И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2360925C2 |
| ЛЕЧЕНИЕ ОСТЕОАРТРИТА И БОЛИ | 2012 |
|
RU2563830C2 |
| МОЛЕКУЛЫ АНТИТЕЛ ЧЕЛОВЕКА К IL-13 | 2004 |
|
RU2387667C2 |
| ИНТЕРЛЕЙКИН-13-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2016 |
|
RU2650767C2 |
| ИНТЕРЛЕЙКИН-13-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2012 |
|
RU2605327C2 |
| Выделенный гуманизированный белок, связывающийся с гликопротеином VI человека, выделенное антитело, связывающееся с гликопротеином VI человека | 2018 |
|
RU2778884C2 |
| АНТИТЕЛА К ФАКТОРУ XI И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2739946C2 |
| Белок, связанный с гликопротеином человека, композиция, фармацевтическая композиция, вектор экспрессии | 2016 |
|
RU2773819C2 |
| ИНТЕРЛЕЙКИН-13-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2007 |
|
RU2472807C2 |













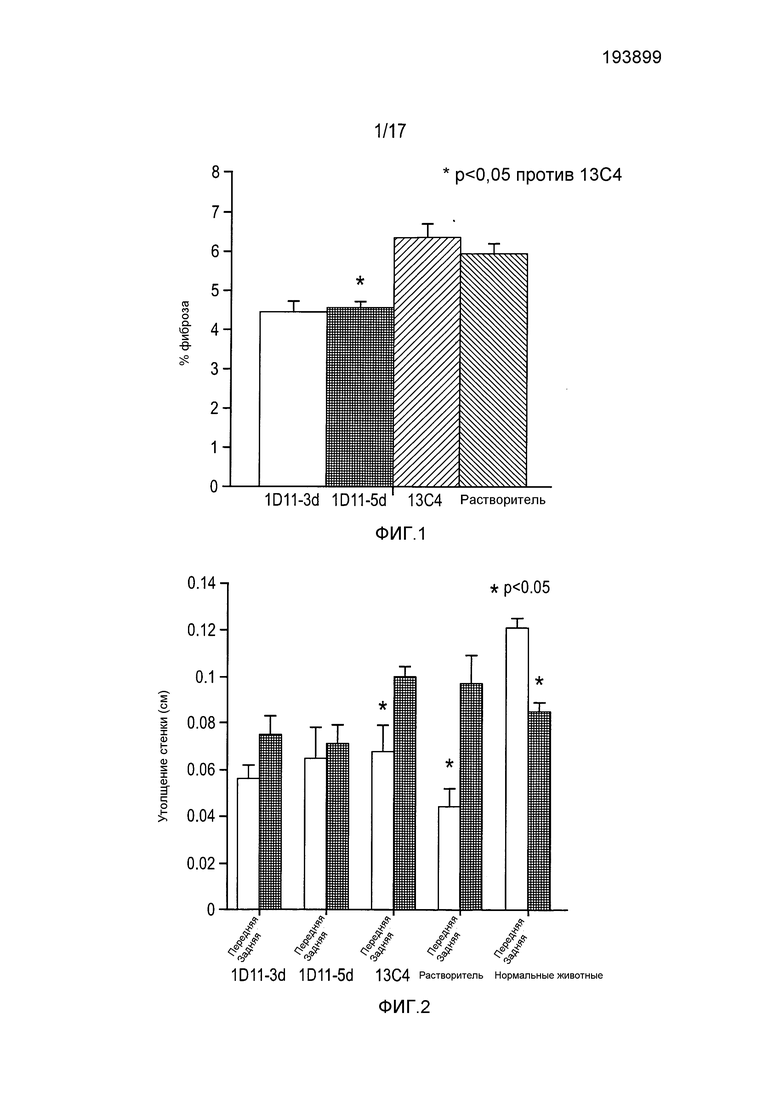
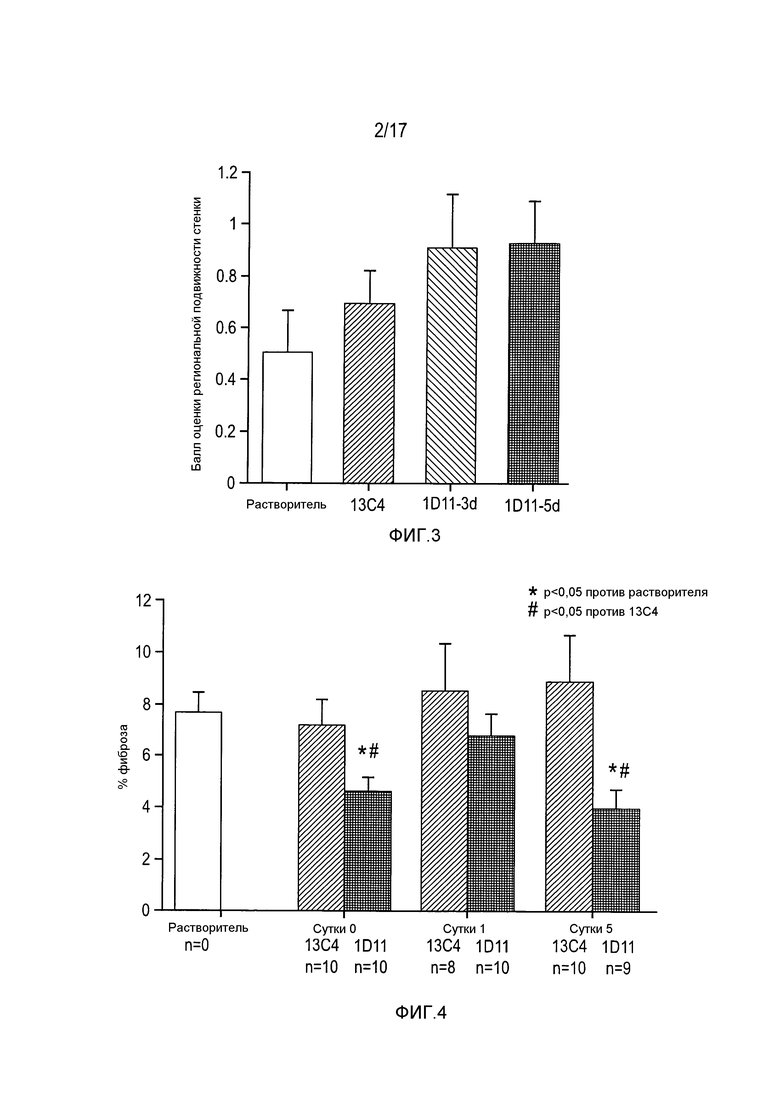
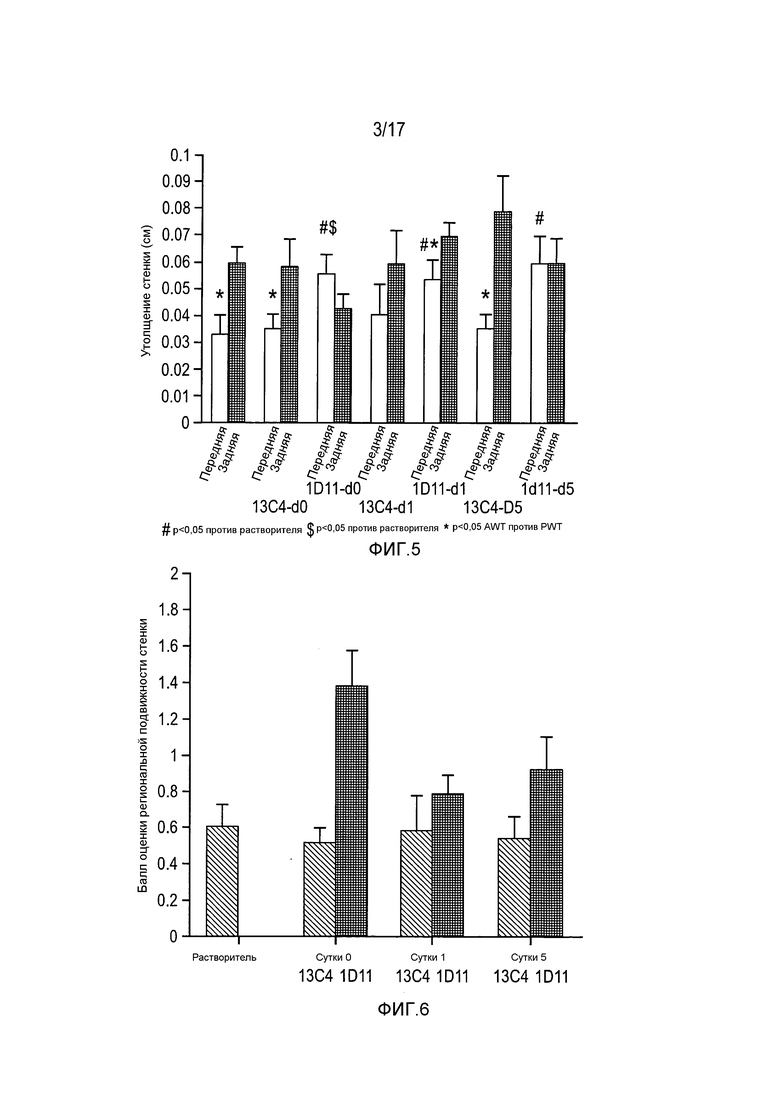
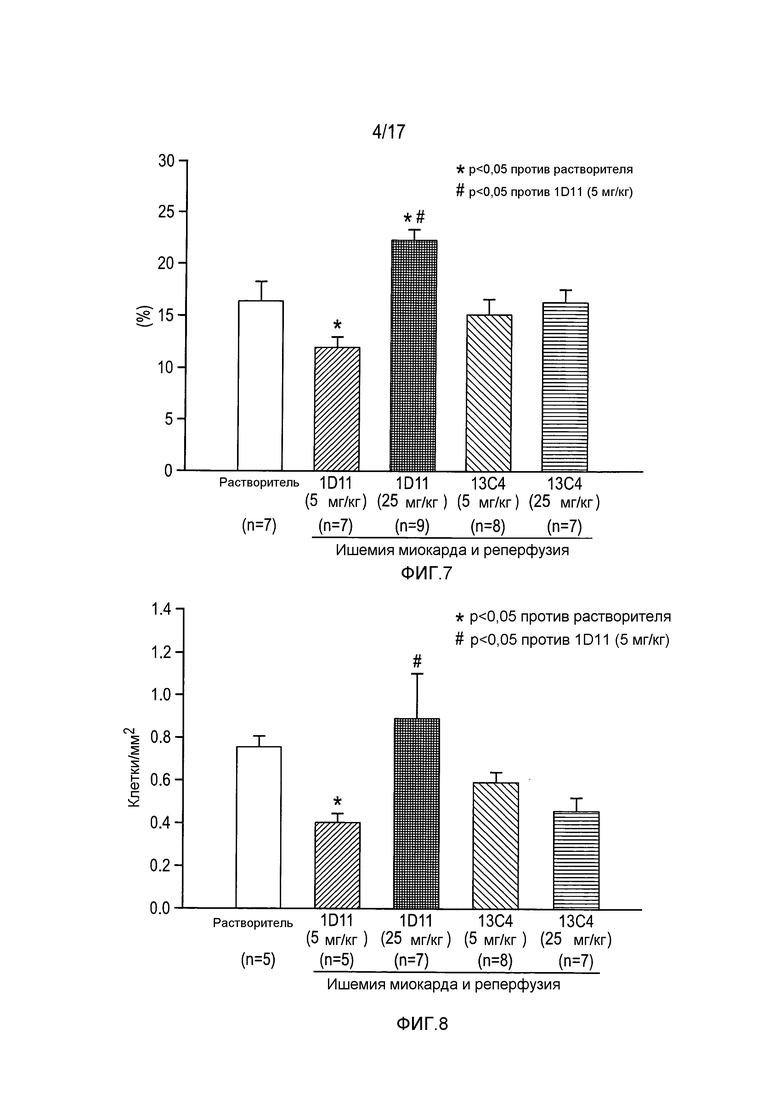
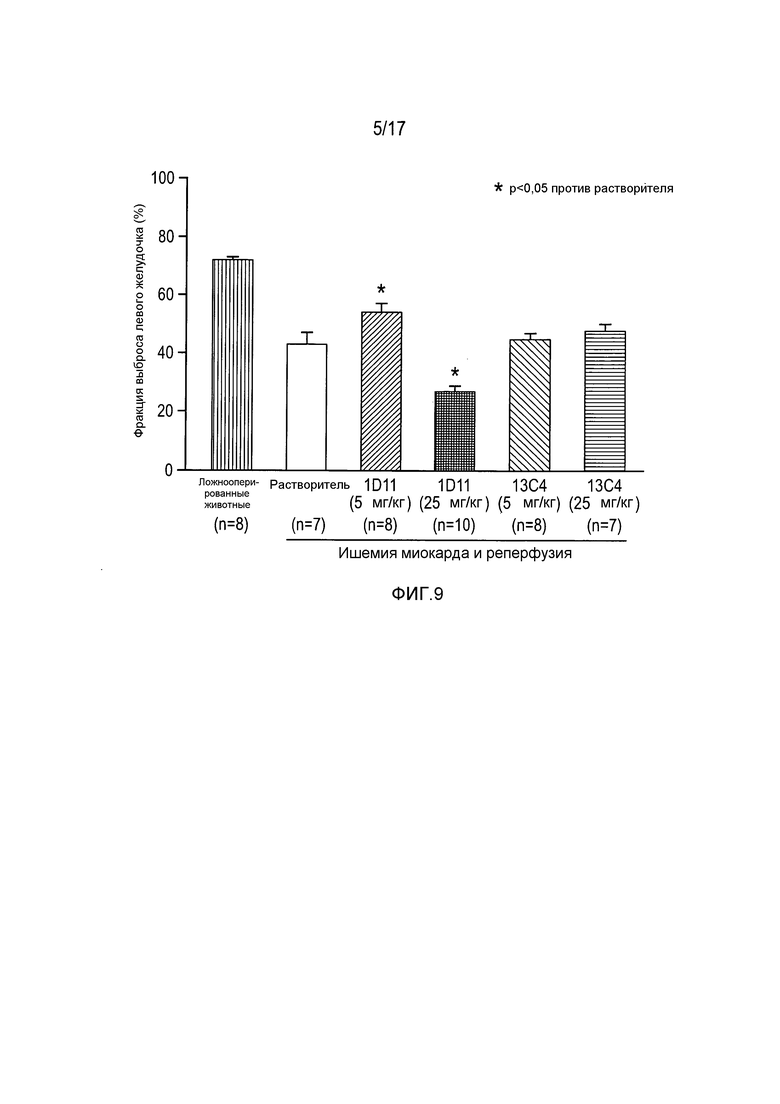
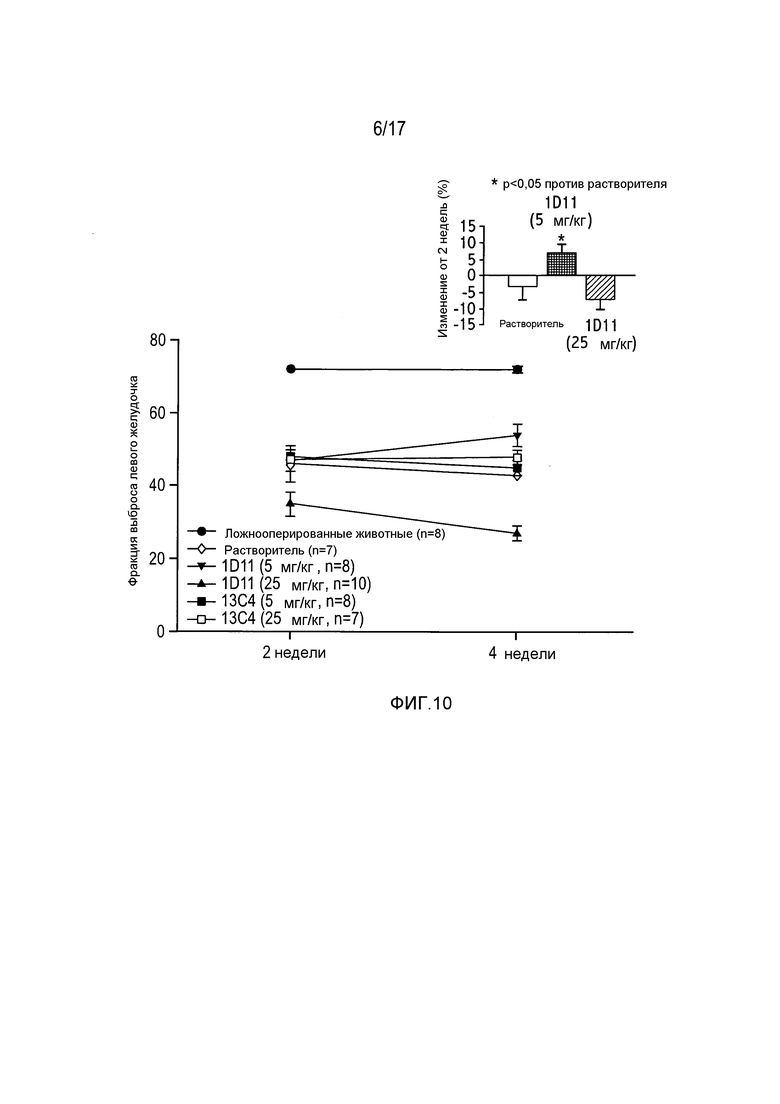

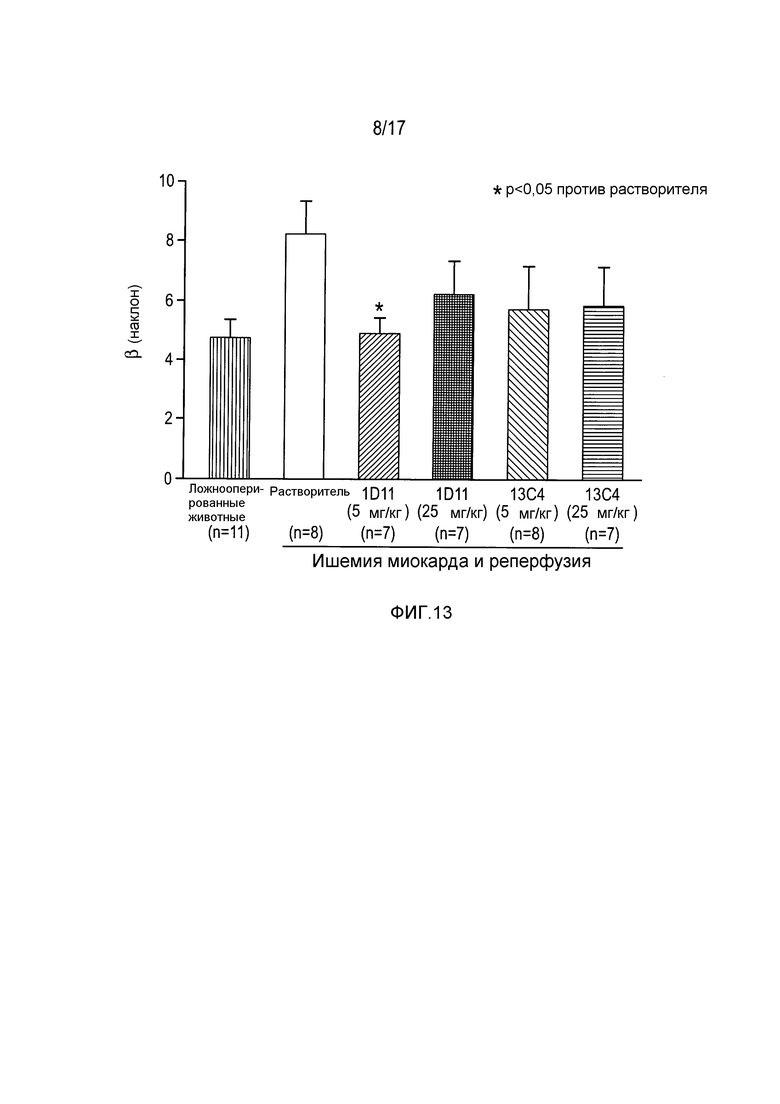
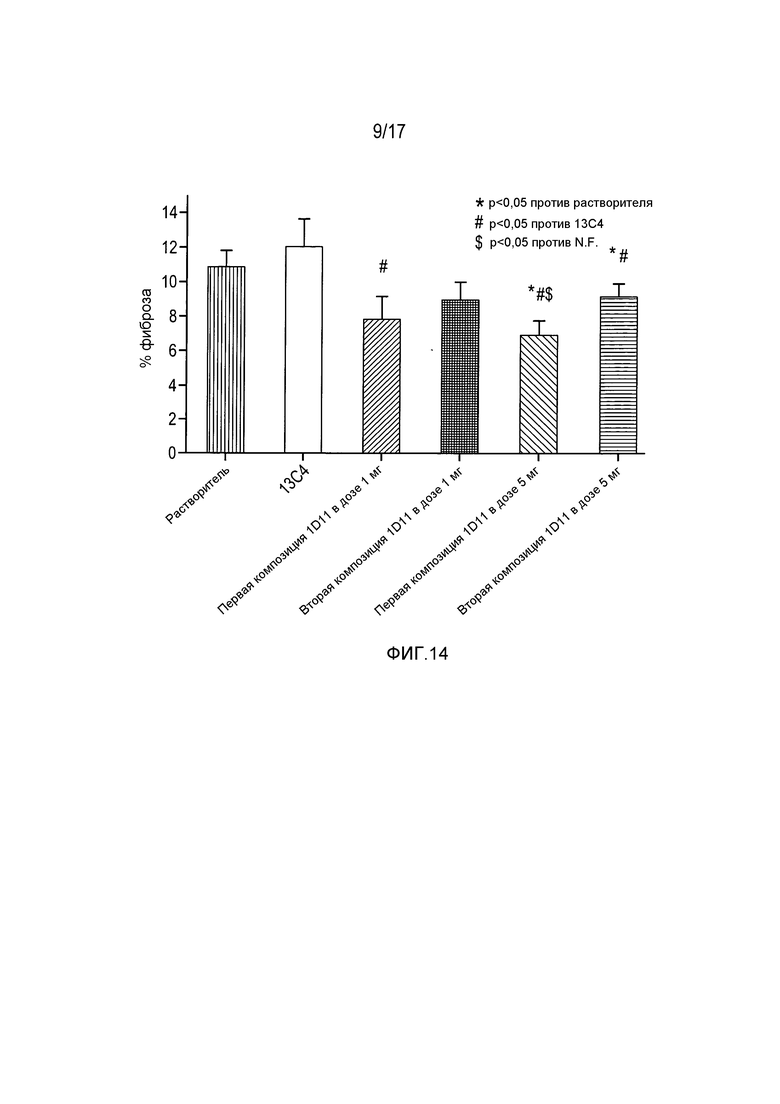
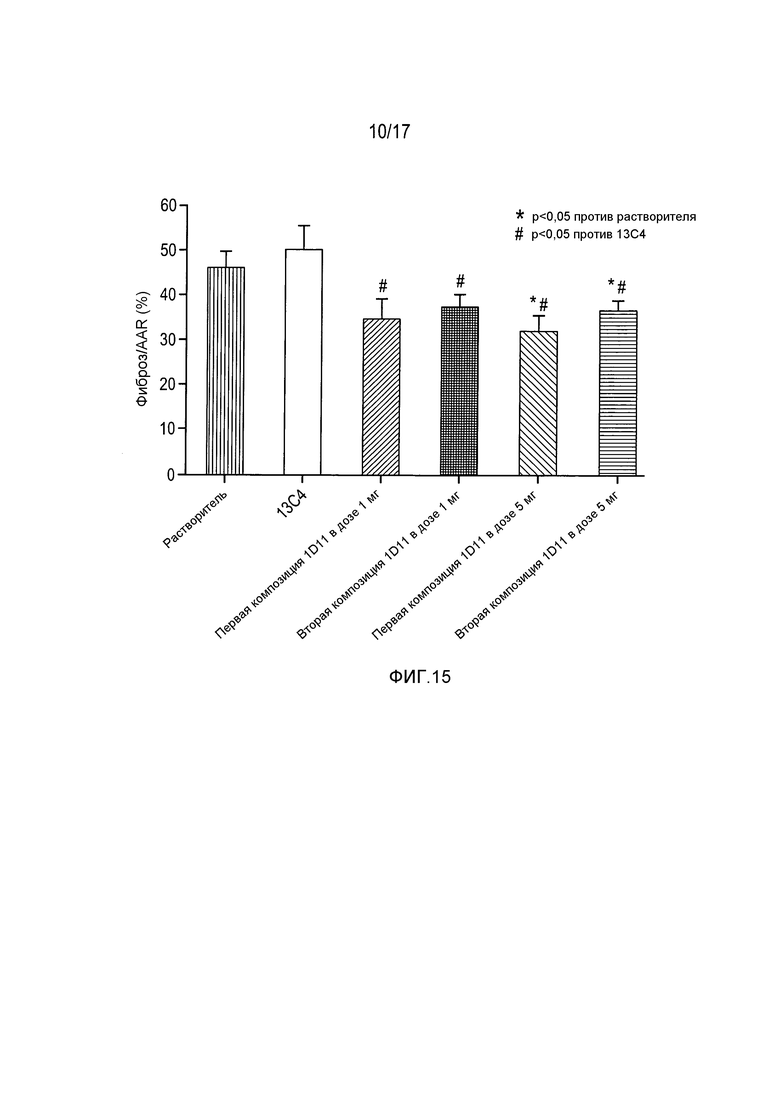
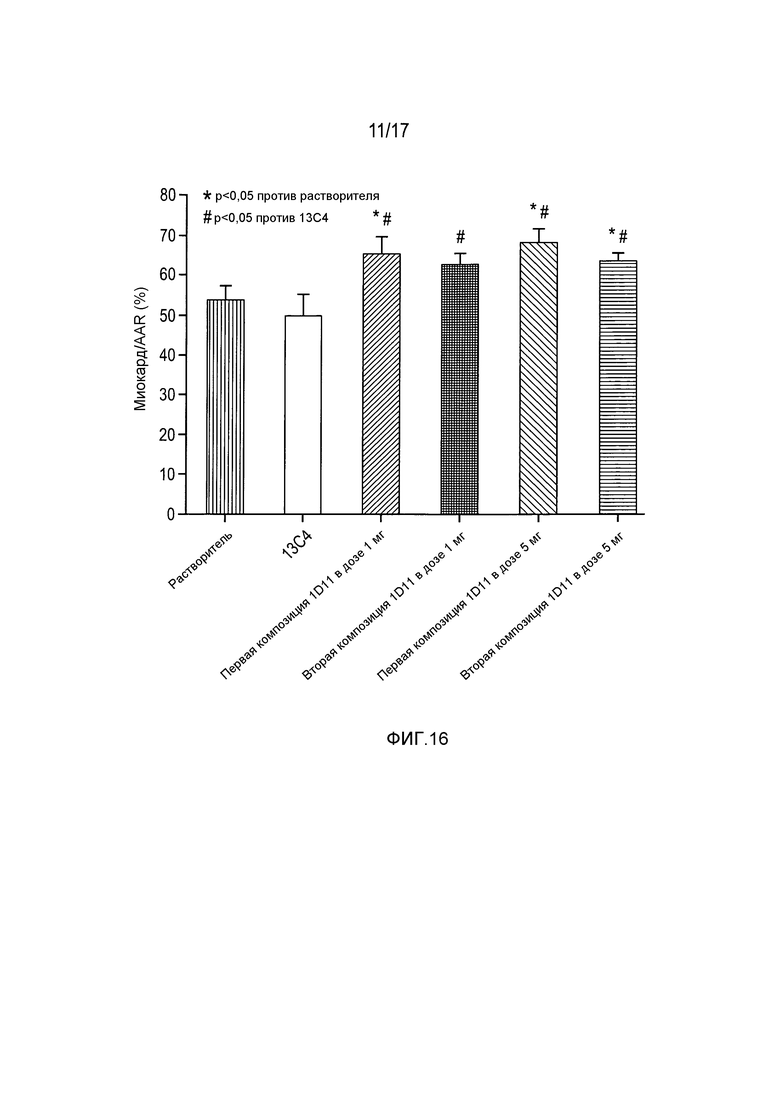
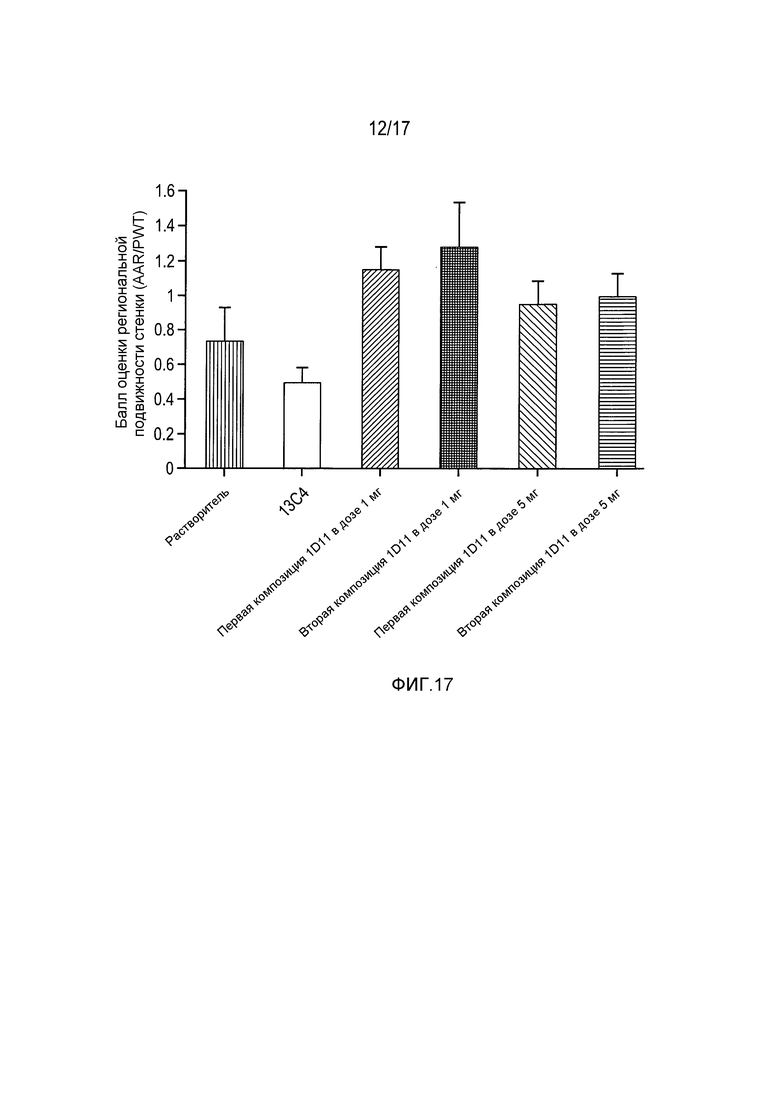
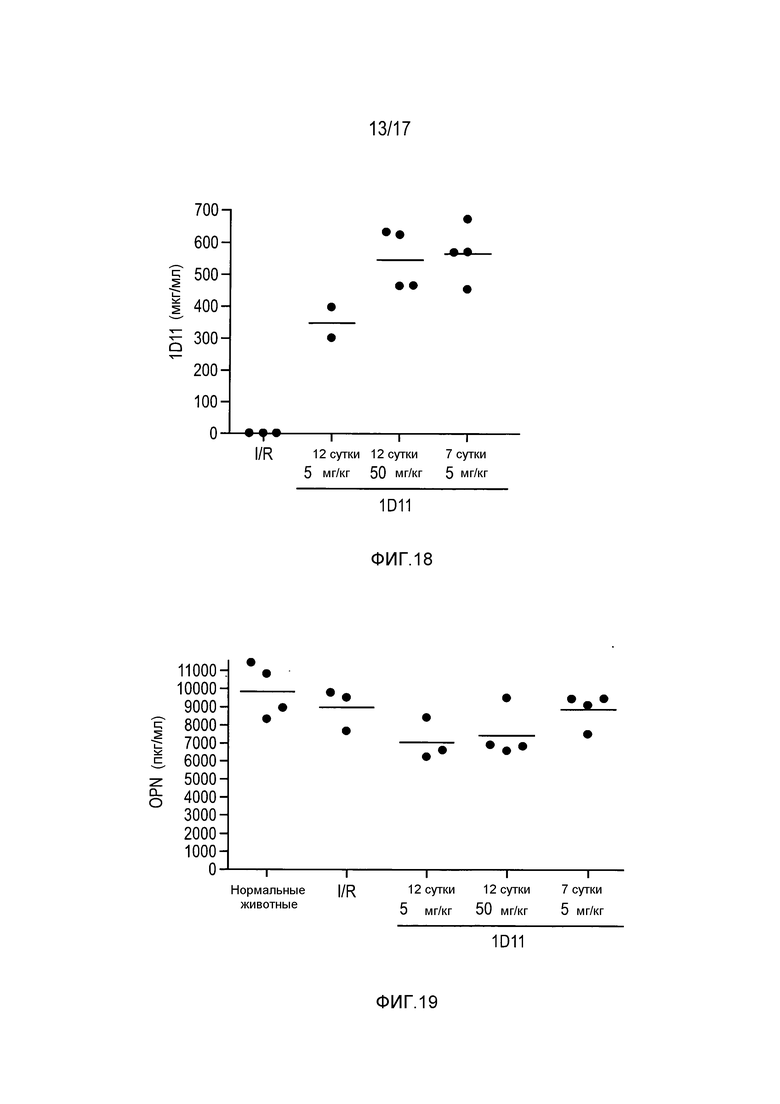
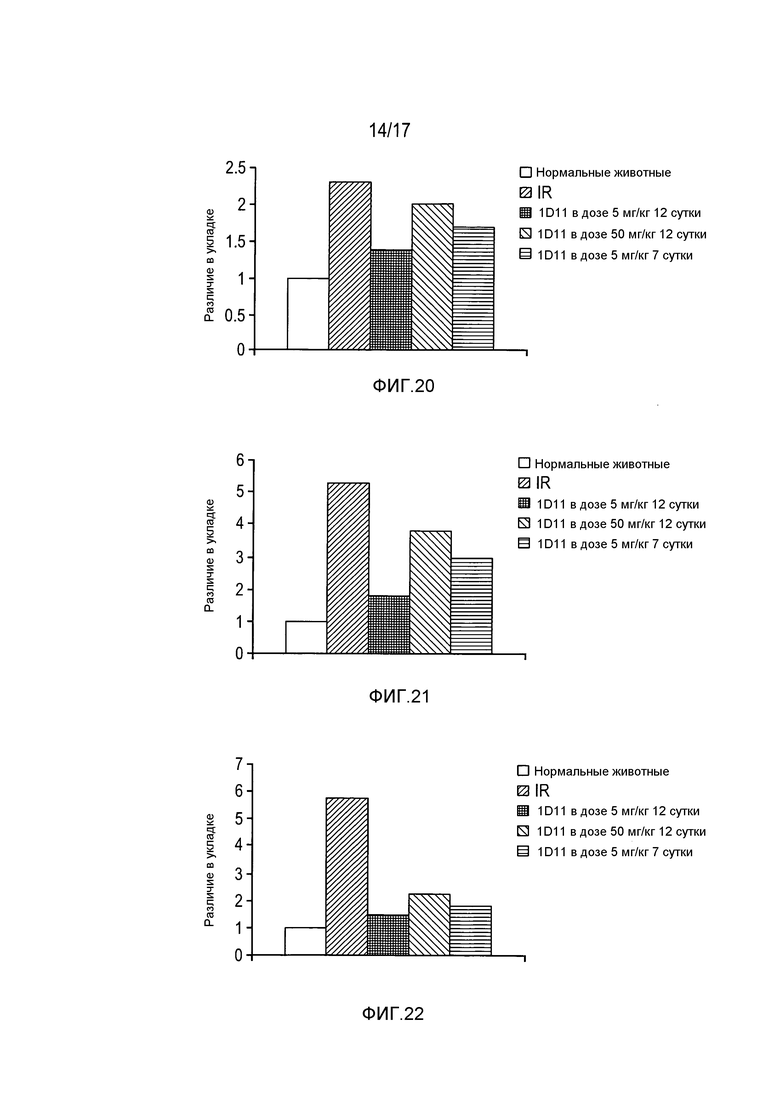
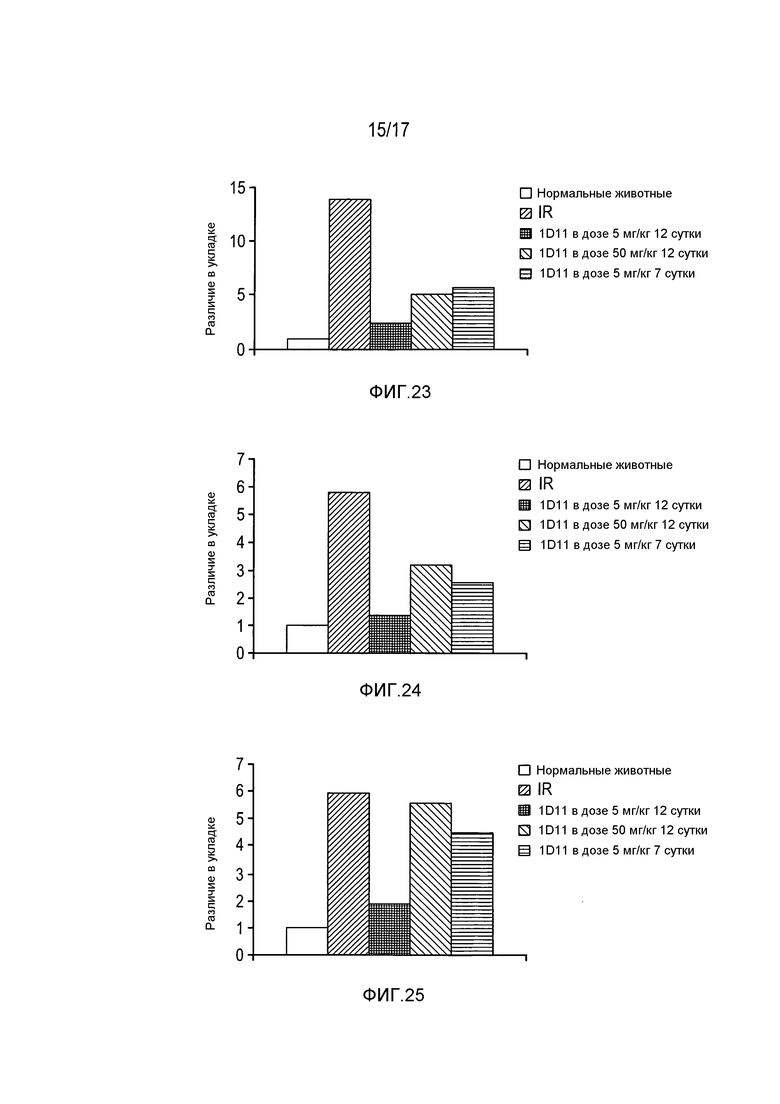
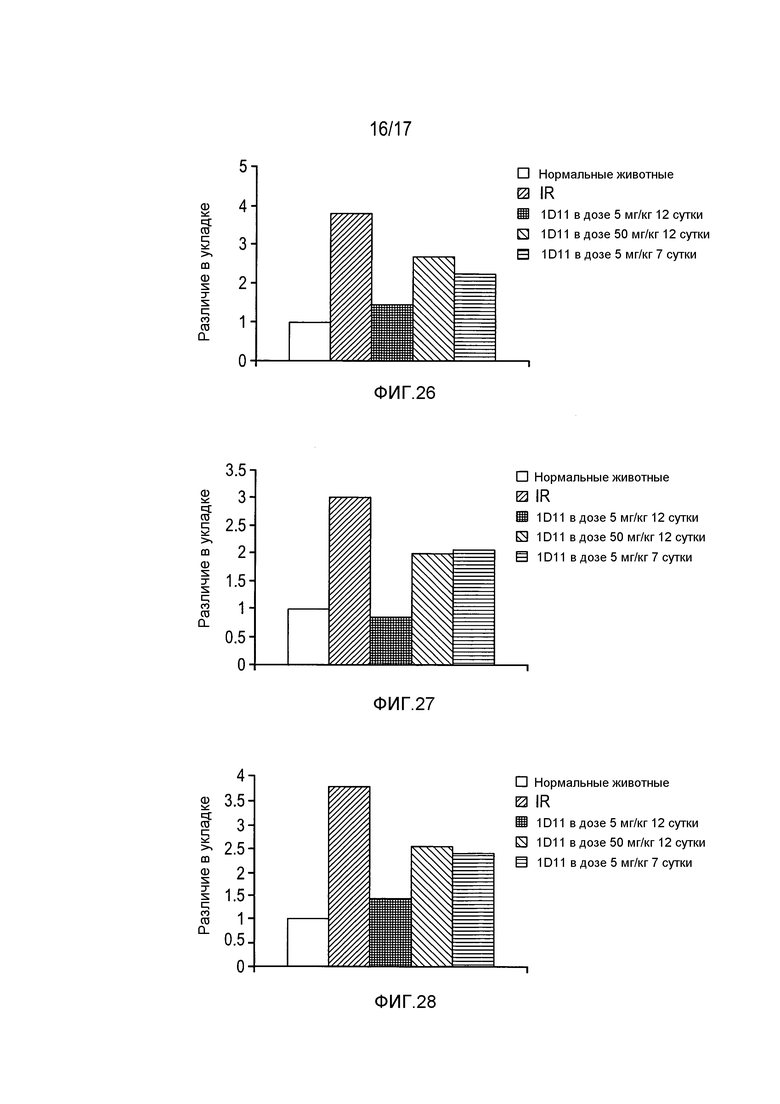
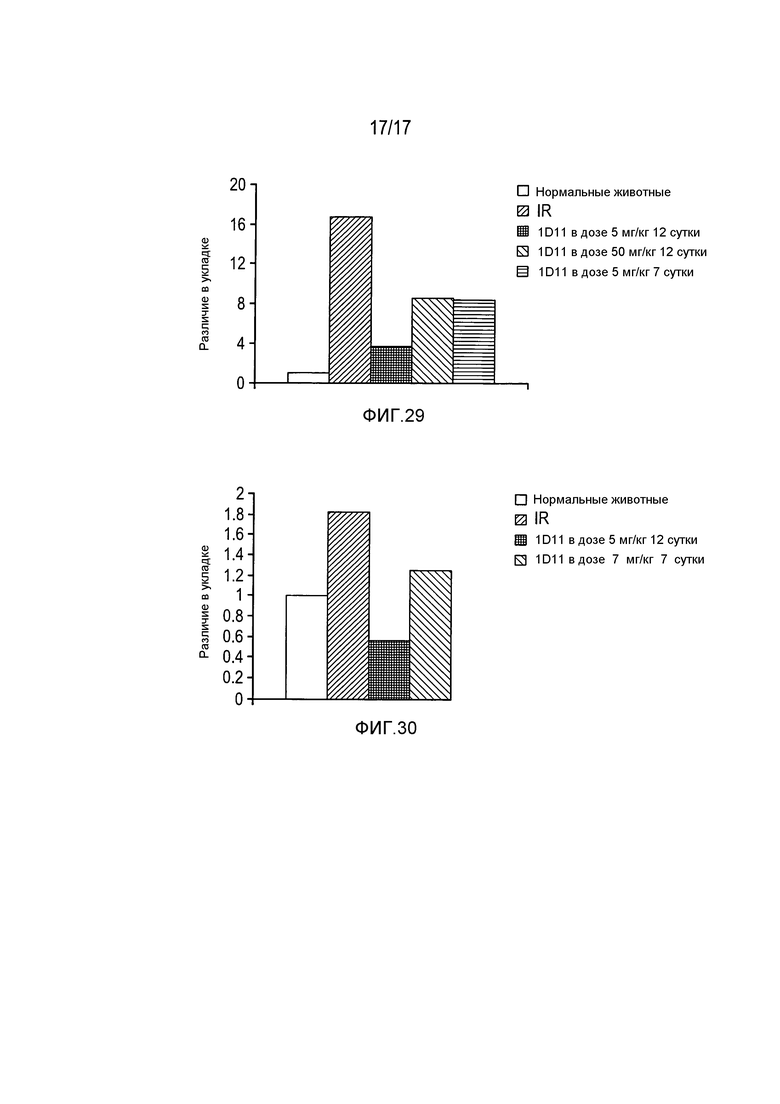
Настоящее изобретение относится к медицине, а именно к кардиологии, и касается лечения инфаркта миокарда. Для этого вводят антагонист TGF-β, представляющий собой антитело, которое содержит VH-домен PET1073G12 (SEQ ID NO:2) и VL-домен PET1073G12 (SEQ ID NO:7). Введение осуществляют в течение 72 часов с начала ишемии миокарда. Это обеспечивает уменьшение фиброза, улучшение ремоделирования и функции миокарда. 19 з.п. ф-лы, 2 табл., 30 ил., 6 пр.
1. Способ лечения инфаркта миокарда у пациента, включающий введение антагониста TGF-β пациенту в течение 72 часов после начала ишемии миокарда, где антагонист TGF-β представляет собой антитело или фрагмент антитела, которое специфически связывается с одной или более изоформами TGF-β, и где антитело или фрагмент антитела содержит VH-домен PET1073G12 (SEQ ID NO: 2) и VL-домен PET1073G12 (SEQ ID NO: 7).
2. Способ по п. 1, где пациент представляет человека или млекопитающее, отличное от человека.
3. Способ по п. 1 или 2, где способ приводит к сохранению миокарда.
4. Способ по п. 1, где антитело или фрагмент антитела нейтрализует человеческий TGF-β1, TGF-β2 и TGF-β3.
5. Способ по п. 4, где антагонист TGF-β вводят в дозе, составляющей примерно 1 мг на кг массы тела пациента.
6. Способ по п. 4, где антагонист TGF-β вводят в дозе, составляющей примерно 5 мг на кг массы тела пациента.
7. Способ по п. 1, где введение антагониста TGF-β начинают в течение примерно 48 ч после начала ишемии миокарда.
8. Способ по п. 1, где введение антагониста TGF-β начинают в течение примерно 24 ч после начала ишемии миокарда.
9. Способ по п. 1, где введение антагониста TGF-β начинают в течение примерно 12 ч после начала ишемии миокарда.
10. Способ по п. 1, где введение антагониста TGF-β начинают до выраженной инфильтрации макрофагами и мононуклеарными клетками ткани, пораженной инфарктом миокарда.
11. Способ по п. 1, где введение антагониста TGF-β начинают во время периода, характеризующегося нейтрофильной инфильтрацией ткани, пораженной инфарктом миокарда.
12. Способ по п. 1, где введение антагониста TGF-β начинают во время периода, характеризующегося некрозом ткани, пораженной инфарктом миокарда.
13. Способ по п. 1, где способ дополнительно включает введение противовоспалительного препарата.
14. Способ по п. 1, где способ дополнительно включает введение антагониста TGF-α.
15. Способ по п. 1, где способ дополнительно включает введение пациенту ингибитора АСЕ.
16. Способ по п. 15, где ингибитор АСЕ выбран из группы, состоящей из беназеприла, каптоприла, фозиноприла, моэксиприла, периндоприла, квинаприла, трансдолаприла, лизиноприла, эналаприла и рампарила.
17. Способ по п. 1, где способ дополнительно включает введение пациенту антагониста рецепторов ангиотензина II.
18. Способ по п. 17, где антагонист рецепторов ангиотензина II выбран из группы, состоящей из эпросартана, телмисартана, лозартана, ирбесартана, олмесартана, кандесартана и валсартана.
19. Способ по п. 1, где способ дополнительно включает введение бета-адренергического антагониста пациенту.
20. Способ по п. 19, где бета-адренергической антагонист выбран из группы, состоящей из алпренолола, буциндолола, картеолола, карведиола, лабеталола, надолола, окспренолола, пенбутолола, пиндолола, пропранолола, соталола, тимолола, атенолола, бетаксолола, бизопролола, целипролола, эсмолола, метопролола и небиволола.
| ГУМАНИЗИРОВАННЫЕ АНТИ-ТФР-БЕТА-АНТИТЕЛА | 2005 |
|
RU2386638C2 |
| WO 2006086469 A2, 17.08.2006 | |||
| ELLMERS L.J | |||
| et al | |||
| "Transforming growth factor-beta blockade down-regulates the renin-angiotensin system and modifies cardiac remodeling after meocardial infarction" | |||
| Endocrinology, 2008, Nov; 149(11):5828-34, найдено из Интернет: http://press.endocrine.org/doi/10.1210/en.2008-0165?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dpubmed; | |||
| OKADA H | |||
| et al | |||
| "Postinfarction gene therapy against transforming growth factor-β signal modulates infarct tissue dynamics and attenuates left ventricular remodeling and heart failute" | |||
| Circulation, 2005; 111:2430-2437, найдено 04.08.2015, найдено из Интернет: http://ajpheart.physiology.org/content/297/4/H1504.long.FRANTZ S | |||
| et al | |||
| "Transforming growth factor beta inhibition increases mortality and left ventricular dilatation after myocardial infarction" | |||
| Basic | |||
| Res | |||
| Cardiol | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2017-11-29—Публикация
2011-09-01—Подача