Перекрестная ссылка
Данная заявка заявляет приоритет предварительной заявки на патент США № 60/558290, поданной 31 марта 2004, данная заявка заявляет приоритет этой предварительной заявки согласно 35 U.S.C. § 119, содержание которой включено сюда в виде ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к гуманизированным анти-ТФР-бета-антителам и способам их получения и их применению в способах для лечения связанных ТФР-бета нарушений. Антитела являются пригодными, например, для иммуноаффинных очисток, иммуноанализов, визуализации в условиях in vivo, радиорецепторного анализа и лечений, где желательно получить антагонистическое действие в отношении активности ТФР-бета, в частности активности ТФР-бета1.
Уровень техники
Трансформирующий фактор-бета роста (ТФР-бета) представляет собой полифункциональный цитокин, первоначально названный за его способность трансформировать нормальные фибробласты в клетки, способные к «якорь»-независимому росту. ТФР-бета, в основном продуцируемый гематопоэтическими и опухолевыми клетками, может регулировать, т.е. стимулировать или ингибировать рост и дифференциацию клеток из различных нормальных тканей и новообразований (Sporn et al., Science, 233: 532 (1986)) и стимулировать образование и развитие различных стромальных элементов. Общий обзор по ТФР-бета и его функциям смотри у Sporn et al., J. Cell Biol., 105: 1039-1045 (1987) и Sporn and Roberts, Nature, 332: 217-219 (1988).
Известно, что они принимают участие во многих пролиферативных и не относящихся к пролиферации клеточных процессах, таких как пролиферация и дифференциация клеток, эмбриональное развитие, образование внеклеточного матрикса, развитие костей, заживление ран, гематопоэз и иммунные и воспалительные реакции. Pircher et al., Biochem Biophys. Res. Commun., 136: 30-37 (1986); Wakefield et al., Growth Factors, 1: 203-218 (1989); Roberts and Sporn, pp 419-472 in Handbook of Experimental Pharmacology eds M.B.Sporn & A.B.Roberts (Springer, Heidelberg, 1990); Massague et al., Annual Rev. Cell Biol., 6: 597-646 (1990); Singer and Clark, New Eng. J. Med., 341: 738-745 (1999). Также ТФР-бета применяется для лечения и профилактики заболеваний слизистой кишечника. WO 2001/24813.
Особый интерес с точки зрения иммунологии представляет высокая иммуносупрессивная активность ТФР-бета, которая включает ингибирование лимфокин-активированных клеток-киллеров (LAK) и цитотоксических Т-лимфоцитов (CTL) (Ranges et al., J. Exp. Med., 166: 991 (1987); Espevik et al., J. Immunol., 140: 2312 (1988); Grimm et al., Cancer Immunol. Immunother., 27: 53 (1988); Kasid et al., J. Immunol., 141: 690 (1988); Mule et al., Cancer Immunol. Immunother., 26: 95 (1988)), ингибирование лимфопоэза В-клеток и экспрессии легкой цепи каппа (Lee et al., J. Exp. Med., 166: 1290 (1987)), отрицательную регуляцию гематопоэза (Hino et al., Br. J. Haematol., 70: 143 (1988); Sing et al., Blood, 72: 1504 (1988)), понижающую регуляцию экспрессии HLA-DR на опухолевых клетках (Czarniecki et al., J. Immunol., 140: 4217 (1988); Zuber et al., Eur. J. Immunol., 18: 1623 (1988)) и ингибирование пролиферации антиген-активированных В-лимфоцитов в ответ на фактор роста В-клеток (Petit-Koskas et al., Eur. J. Immunol., 18: 111 (1988)). На основании наблюдения о том, что многие опухоли человека (deMartin et al., EMBO J., 6: 3673 (1987); Kuppner et al., Int. J. Cancer, 42: 562 (1988)) и многие линии опухолевых клеток (Derynck et al., Cancer Res., 47: 707 (1987); Roberts et al., Br. J. Cancer, 57: 594 (1988)) продуцируют ТФР-бета, можно предположить о возможном механизме для данных опухолей ускользать от нормального иммунологического контроля. На основании данной отрицательной иммуномодуляции в сочетании с наблюдением о том, что некоторые трансформированные клеточные линии теряют способность к ответной реакции на ТФР-бета аутокринным образом (Wakefield et al., J. Cell Biol., 105: 965 (1987); McMahon et al., Cancer Res., 46: 4665 (1986)), и что ТФР-бета стимулирует образование стромы и снижает иммунный контроль над опухолью, можно предположить о привлекательных моделях отмены контроля и пролиферации новообразований (Roberts et al., Br. J. Cancer, выше).
Кроме того, в патентах США № 5824297 и 5262319 раскрывается способ ингибирующего цитотоксического отравления нормальных клеток введением в них ТФР-бета, такого как ТФР-бета3.
В настоящее время идентифицировано, по меньшей мере, пять форм ТФР-бета, ТФР-бета1, ТФР-бета2, ТФР-бета3, ТФР-бета4 и ТФР-бета5. Известны подходящие способы для очистки данного семейства ТФР-бета от различных видов, таких как человек, мышь, зеленая мартышка, свинья, крупный рогатый скот, курица и лягушка, и из различных источников организма, таких как кость, тромбоциты или плацента, для получения его в рекомбинантной клеточной культуре и для определения его активности. Смотри, например, Derynck et al., Nature, 316: 701-705 (1985); публикации Европейского патента № 200341, опубликованная 10 декабря 1986, 169016, опубликованная 22 января 1986, 268561, опубликованная 25 мая 1988, и 267463, опубликованная 18 мая 1988; патент США № 4774322; Cheifetz et al., 48: 409-415 (1987); Jakowlew et al., Molecular Endocrin., 2: 747-755 (1988); Dijke et al., Proc. Natl. Acad. Sci. (U.S.A.), 85: 4715-4719 (1988); Derynck et al., J. Biol. Chem., 261: 4377-4379 (1986); Sharples et al., DNA, 6: 239-244 (1987); Derynck et al., Nucl. Acids Res., 15: 3188-3189 (1987); Derynck et al., Nucl. Acids Res., 15: 3187 (1987); Derynck et al., EMBO J., 7: 3737-3743 (1988)); Seyedin et al., J. Biol. Chem., 261: 5693-5695 (1986); Madisen et al., DNA, 7: 1-8 (1988) и Hanks et al., Proc. Natl. Acad. Sci. (U.S.A.), 85: 79-82 (1988), полное содержание которых включено здесь в краткой форме для сведения.
Активированная форма ТФР-бета представляет гомодимер, образованный при димеризации С-концевых 112 аминокислот 390-аминокислотного предшественника (Derynck et al., Nature, выше). ТФР-бета2 имеет предшественник из 414 аминокислот и он также процессируется в гомодимер из С-концевых 112 аминокислот, который обладает примерно 70% гомологией с активной формой ТФР-бета1 (Marquardt et al., J. Biol. Chem., 262: 12127 (1987)). ТФР-бета2 выделили из свиных тромбоцитов (Seyedin et al., J. Biol. Chem., 262: 1946-1949 (1987)) и клеток человеческой глиобластомы (Wrann et al., EMBO J., 6: 1633 (1987)) и был клонирован рекомбинантный человеческий ТФР-бета2 (deMartin et al., выше). Клонировали рекомбинантный ТФР-бета1 (Derynck et al., Nature, выше) и экспрессировали в клетках яичника китайских хомяков (Gentry et al., Mol. Cell Biol., 7: 3418-3427 (1987)). Смотри патенты США № 4774322; 4843063 и 4848063, касающиеся CIF-A и CIF-B, в настоящее время названные соответственно ТФР-бета1 и 2. Ellingsworth et al., J. Biol. Chem., 261: 12362-12367 (1986). Несмотря на наличие 14 аминокислотных различий в первых 36 аминокислотных остатках двух форм (ТФР-бета1 и ТФР-бета2) их биологическая активность является сходной. Cheifetz et al., Cell, 48: 409-415 (1987); Seyedin et al., J. Biol. Chem., 262, выше.
ТФР-бета3, ТФР-бета4 и ТФР-бета5, которые являются наиболее поздними открытыми формами ТФР-бета, были идентифицированы при скрининге библиотек кДНК. Ни один из данных трех предполагаемых белков не был выделен из природных источников, хотя, в нозерн-блоттинге была показана экспрессия соответствующих мРНК. Были клонированы человеческий и свиной ТФР-бета3, и они были описаны как гомодимеры и их экспрессировали в клетках яичника китайских хомяков (Derynck et al., EMBO J., 7: 3737-3743 (1988); ten Dijke et al., Proc. Natl. Acad. Sci. USA, 85: 4715 (1988); патент США № 4886747). Также смотри WO 1992/00318, касающуюся белков ТФР-бета3 и антител к ним. ТФР-бета1 отличается от ТФР-бета2 в основном 27 консервативными заменами и от ТФР-бета3 в основном 22 консервативными заменами. Данные различия относятся к 3-D структуре. Schlunegger and Grutter, Nature, 358: 430-434 (1992).
ТФР-бета4 и ТФР-бета5 клонировали соответственно из библиотеки кДНК куриных хондроцитов (Jakowlew et al., Molec. Endocrinol., 2: 1186-1195 (1988)) и из библиотеки кДНК ооцитов лягушки. Библиотеку кДНК ооцитов лягушки можно подвергнуть скринингу с использованием зонда, полученного из одной или более последовательностей другого типа ТФР-бета. мРНК ТФР-бета4 детектируется в куриных хондроцитах эмбрионов, но в меньшем количестве по сравнению с мРНК ТФР-бета3 в развивающихся эмбрионах или в фибробластах куриных эмбрионов. мРНК ТФР-бета5 экспрессировали в эмбрионах лягушки на стадии, предшествующей нейруле, и в клетках головастика Xenopus (ХТС).
Рекомбинантная продукция ТФР-бета1, ТФР-бета2 и ТФР-бета3 описана в патентах США № 5061786, 5268455 и 5801231. Смотри также патент США № 5120535 по ТФР-бета2, использованному для лечения гормонально зависимой карциномы и для продукции антител. Был идентифицирован гетеродимер ТФР-бета1 и ТФР-бета2, названный ТФР-бета1.2 и были показаны его применения, как раскрыто в патентах США № 4931548 и 5304541, в последнем также раскрывается антитело к нему. В WO 1990/00900, поданной 20 июля 1989, раскрывается лечение воспалительных нарушений гомодимерами ТФР-бета1 и -бета2 и гетеродимером ТФР-бета1.2. В патенте США № 5462925 раскрывается гетеродимер ТФР-бета2 и ТФР-бета3. В патенте США № 5780436 раскрываются небольшие пептидные миметики ТФР-бета.
Повышенная активность ТФР-бета принимает участие в развитии большого количества патологических состояний, включая, но не ограничиваясь этим: i) фиброз, рубцевание и адгезию во время заживления ран; ii) фиброзные заболевания легких, печени и почек; iii) атеросклероз и артериосклероз; iv) некоторые типы злокачественных опухолей, включая злокачественные опухоли простаты, нейроэндокринные опухоли пищеварительной системы, опухоль шейки матки, глиобластому и опухоль желудка; v) ангиопатию, васкулопатию, нефропатию; vi) рассеянный склероз; vii) вирусную инфекцию, такую как гепатит С и ВИЧ; и viii) иммунологические и воспалительные нарушения и недостаточности, такие как ревматоидный артрит. Модуляция иммунной и воспалительной реакций под действием ТФР-бета включает: i) ингибирование пролиферации всех подгрупп Т-клеток; ii) ингибирующие эффекты в отношении пролиферации и функции В-лимфоцитов; iii) понижающую регуляцию активности природных клеток-киллеров и ответной реакции Т-клеток; iv) регуляцию продукции цитокинов иммунными клетками; v) регуляцию функции макрофагов и vi) рекрутинг и активацию лейкоцитов.
Конкретно в отношении злокачественных опухолей известно, что члены семейства ТФР-бета обладают рядом биологических активностей, имеющих отношение к онкогенности (включая ангиогенез) и метастазирование. ТФР-бета ингибирует пролиферацию многих клеточных типов, включая эндотелиальные клетки капилляров и клетки гладкой мускулатуры. ТФР-бета снижает экспрессию интегрина (альфа1бета1, альфа2бета1 и альфаvбета3, принимающих участие в миграции эндотелиальных клеток). Интегрины участвуют в миграции всех клеток, включая относящиеся к метастазам. ТФР-бета снижает экспрессию матричной металлопротеиназы, необходимой и для ангиогенеза, и для метастазирования. ТФР-бета индуцирует ингибитор активатора плазминогена, который ингибирует каскад протеиназы, необходимый для ангиогенеза и метастазирования. ТФР-бета индуцирует нормальные клетки для подавления трансформированных клеток. Смотри, например, Yingling et al., Nature Reviews, 3 (12): 1011-1022 (2004), где раскрывается, что отмена регулирования ТФР-бета участвует в патогенезе различных заболеваний, включая злокачественную опухоль и фиброз, и представляет обоснование для рассмотрения ингибиторов сигнальных путей с участием ТФР-бета в качестве препаратов для лечения злокачественных опухолей, биомаркеров/диагностических средств, разрабатываются небольшие молекулы ингибиторов, и для их разработки применяется целенаправленная модель для открытия лекарственных препаратов. Очень важна ранняя диагностика злокачественной опухоли (Ruth et al., Nature Reviews Cancer, 3: 243-252 (2003)), и исследуется патогенез метастазирования опухолей. Fidler, Nature Reviews Cancer, 3: 453-458 (2003).
ТФР-бета проявил себя основным модулятором ангиогенеза при регуляции пролиферации, миграции эндотелиальных клеток, метаболизма внеклеточного матрикса (ECM) и экспрессии молекул адгезии. Он представляет эффективный ингибитор роста нормальных эпителиальных клеток молочной железы и ряда линий опухолевых клеток молочной железы. Оказалось, что ТФР-бета проявляет плейотропное действие в онкогенезе опухолей молочной железы контекстуальным образом, т.е. он подавляет онкогенез на ранней стадии посредством непосредственного ингибирования ангиогенеза и роста опухолевых клеток. Однако гиперпродукция ТФР-бета развившейся опухолью может усиливать прогрессирование заболевания посредством опосредованной стимуляции ангиогенеза и иммунной супрессии. Антиген мембраны клеток CD 105 (эндоглин) связывается с ТФР-бета1 и ТФР-бета3 и предпочтительно экспрессируется в ангиогенных васкулярных эндотелиальных клетках. Снижение уровня CD 105 в HUVEC приводит к подавлению ангиогенеза в условиях in vitro и высокой гибели клеток в присутствии ТФР-бета1. Мыши с отсутствием CD 105 погибают в утробе при нарушении сосудистой сети, указывая на важную роль CD 105 в развитии сосудов. Li et al., Microsc. Res. Tech., 52: 437-449 (2001). Аномальный ангиогенез, но не нарушенный гематопоэз наблюдали у мышей с дефицитом рецептора ТФР-бета типа I. Larsson et al., EMBO J., 20(7): 1663-1673 (2001). Кроме того, дефицит рецептора ТФР-бета типа II приводит к дефектам гематопоэза и васкулогенеза желточного мешка. Oshima et al., Developmental Biology, 179 (1): 297-302 (1996). Кроме того, аномалии сердца и печени и пониженную чувствительность к трансформирующему фактору-бета 2 роста наблюдали в эмбрионах с дефицитом рецептора ТФР-бета типа III. Stenvers et al., Mol. Cell Biol., 23(12): 4371-4385 (2003). Кроме того, направленный разрыв мышиного гена ТФР-бета1 приводит к развитию многоочагового воспалительного заболевания Shull et al., Nature, 359 (6397): 693-699 (1992). Было показано, что многоочаговое воспаление с ранним началом у мышей с отсутствием ТФР-бета является опосредованным лимфоцитами. Diebold et al., Proc Natl. Acad. Sci. (USA), 92 (26): 12215-12219 (1995).
Наиболее важной, не относящейся к пролиферации функцией ТФР-бета, является увеличение образования внеклеточного матрикса. Хотя, в основном это достигается посредством увеличенной транскрипции коллагена и фибронектина, ингибирование протеаз из деградирующего матрикса также вносит свой вклад в его стабильность. Деградация внеклеточного матрикса подавляется при снижении секреции самих протеаз и одновременном повышении концентрации ингибиторов протеаз.
В WO 1984/001106 описывается ТФР-бета1 и его применение для стимуляции клеточной пролиферации и восстановления тканей, заживления ран и лечения травм. В патенте США № 4806523 раскрываются ТФР-бета1 и ТФР-бета2, оба обладающие противовоспалительной активностью, и они представляют собой ингибиторы стимулированной митогеном пролиферации Т-клеток и активации В-клеток. Также сообщается, что ТФР-бета локализуется в центрах гематопоэза и лимфопоэза, и что ТФР-бета может, следовательно, быть пригодным для лечения показаний, связанных с нарушением функции или дисфункции гематопоэза и лимфопоэза.
Было показано, что ТФР-бета2 является преобладающей изоформой ТФР-бета в невральной сетчатке, пигментной сосудистой оболочке глаза и стекловидном теле человеческого глаза (Pfeffer et al., Exp. Eye Res., 59: 323-333 (1994)), и он был обнаружен в глазной жидкости человека в образцах из глаз после удаления катаракты с имплантацией внутриглазных линз. Jampel et al., Current Eye Research, 9: 963-969 (1990). Нетрансформированные пигментные эпителиальные клетки сетчатки человека преимущественно секретируют ТФР-бета2. Kvanta, Ophtalmic Res., 26: 361-367 (1994).
Другие заболевания, которые потенциально могут поддаваться лечению антителами против ТФР-бета, включают респираторный дистресс-синдром взрослых, цирроз печени, состояние после инфаркта миокарда, рестеноза после ангиопластики, келоидные рубцы и склеродерму. Повышенная экспрессия ТФР-бета2 при остеопорозе (Erlenbacher et al., J. Cell Biol., 132: 195-210 (1996)) означает, что это заболевание потенциально можно лечить антителами против ТФР-бета2.
В результате участия ТФР-бета в развитии большого количества патологических состояний существует большой интерес к разработке ингибиторов ТФР-бета. Многие предположения для ингибиторов ТФР-бета основаны на антителах.
Это насущная задача выделить фрагмент антитела, специфичный для ТФР-бета одинаковых видов. У животных в норме не продуцируются антитела к собственным антигенам, это явление было названо толерантностью (Nossal, Science, 245: 147-153 (1989). В основном вакцинация собственным антигеном не приводит к продукции циркулирующих антител. Следовательно, трудно индуцировать образование антител у человека к собственным антигенам человека. Кроме того, также существуют этические проблемы при вакцинации людей. При индукции образования антител, не относящихся к человеческим, специфичным к ТФР-бета, имеется ряд проблем. ТФР-бета представляет собой иммуносупрессивную молекулу и дополнительно имеется высокая консервативность последовательности между человеческой и мышиной молекулами ТФР-бета. Мышиный и человеческий ТФР-бета1 различаются только по одному аминокислотному остатку, замена аланина (человеческий) на серин (мышиный) в глубоком остатке. Derynck et al., J. Biol. Chem., 261: 4377-4379 (1986). Мышиный и человеческий ТФР-бета2 различаются только по трем аминокислотным остаткам; остаток 59 (Т мышиный, S человеческий); остаток 60 (К мышиный, R человеческий) и остаток 94 (N мышиный, К человеческий). Это затрудняет индукцию антител у мышей против человеческого ТФР-бета. Кроме того, любые индуцированные антитела могут быть направлены только против ограниченной группы эпитопов.
Были получены моноклональные антитела против ТФР-бета при иммунизации цыплят и иммортализации В-клеток, использованные, например, для диагностики и пассивного лечения заболевания, как описано в патенте США № 6143559.
Были индуцированы поликлональные антитела, связывающиеся с человеческим ТФР-бета1 и человеческим ТФР-бета2, против обоих нейтрализующих и не-нейтрализующих эпитопов у кроликов (Danielpour et al., Growth Factors, 2: 61-71 (1989); Roberts et al., Growth Factors, 3: 277-286 (1990)), кур (R&D Systems, Minneapolis) и индеек (Danielpour et al., J. Cell Physiol., 138: 79-86 (1989); Danielpour and Sporn, J. Cell Biochem., 13B: 84 (1989)).
Пептиды, представляющие частичные или полные последовательности ТФР-бета, также использовали в качестве иммуногенов для получения нейтрализующей поликлональной антисыворотки у кроликов. Ellingsworth et al., J. Biol. Chem., 261: 12362 (1986); Ellingsworth et al., Cell Immunol., 114: 41 (1988); Border et al., Nature, 346: 371-374 (1990); Flanders, Biochemistry 27: 739-746 (1988); Flanders et al., Growth Factors, 3: 45-52 (1990); Flanders et al., Development, 113: 183-191 (1991). Кроме того, имеются ограниченные сообщения о выделении мышиных моноклональных антител против ТФР-бета. После иммунизации бычьим ТФР-бета2 (идентичным человеческому ТФР-бета2) выделяли три не-нейтрализующих моноклональных антитела, которые были специфичными для ТФР-бета2 и одно нейтрализующее антитело, специфичное для ТФР-бета1 и ТФР-бета2. Dasch et al., J. Immunol., 142: 1536-1541 (1989). В другом сообщении после иммунизации человеческим ТФР-бета1 выделяли нейтрализующие антитела, специфичные либо для ТФР-бета1, либо перекрестно реагирующие с ТФР-бета1, ТФР-бета2 и ТФР-бета3. Lucas et al., J. Immunol., 145: 1415-1422 (1990). Было показано, что поликлональная антисыворотка к человеческому и свиному ТФР-бета (Keski-Oja et al., Cancer Res., 47: 6451-6458 (1987)) и к свиному ТФР-бета2 (Rosa et al., Science, 239: 783-785 (1988)) нейтрализует биологическую активность соответственно ТФР-бета1 и ТФР-бета2. Кроличья анти-ТФР-бета сыворотка описана Roberts et al., Proc. Natl. Acad. Sci. USA, 83: 4167-4171 (1986). Кроме того, были получены RIA против ТФР-бета1 с использованием кроличьей антисыворотки для количественного определения высвобожденного белка во время агрегации тромбоцитов. Assoian and Sporn, J. Cell Biol., 102: 12178-1223 (1986).
Промышленно доступным является нейтрализующее мышиное моноклональное антитело, которое связывается с изоформами ТФР-бета2 и ТФР-бета3, производства Genzyme Diagnostics. Промышленно доступно мышиное моноклональное антитело против человеческого ТФР-бета1 производства R&D Systems. Данное антитело только в слабой степени нейтрализует ТФР-бета1 в тесте нейтрализации. Также были получены нейтрализующие мышиные моноклональные антитела от мышей, иммунизированных человеческими пептидами ТФР-бета1, имеющими аминокислотные положения 48-60 (антитело реагировало с ТФР-бета1, ТФР-бета2 и ТФР-бета3) и аминокислотные положения 86-101 (антитело, специфичное для ТФР-бета1). Hoefer and Anderer, Cancer Immunol. Immunother., 41: 302-308 (1995).
С помощью фаговой технологии антител (WO 1992/01047; WO 1993/19172; WO 1992/20791; WO 1993/06213 и WO 1993/11236) была предложена возможность непосредственно выделять человеческие антитела против человеческого ТФР-бета. Описано выделение аутоантител из спектра сегментов антител, расположенных в фаге. Griffiths et al., EMBO J., 12: 725-734 (1993); Nissim et al., EMBO J., 13: 692-698 (1994); Griffiths et al., 13: 3245-3260 (1994); Barbas et al., Proc. Natl. Acad. Sci. USA, 90: 10003-10007 (1993) и WO 1993/11236. Кроме того, Tempest et al., Immunotechnology, 2: 306 (1996) описывает человеческие антитела, специфичные для человеческого ТФР-бета, полученного из библиотек фагового дисплея.
В WO 1997/13844 раскрывается выделение человеческих антител, специфичных к человеческому ТФР-бета1, и человеческих антител, специфичных к человеческому ТФР-бета2. В ней описываются антитела с доменом VH 31G9 и варианты домена, конкретнее, антитело CS37, которое включает домен VH 31G9 вместе с VL CS37 и варианты данного домена, включая антитела, которые: i) конкурируют с CS37 в ELISA за связывание с ТФР-бета1; ii) предпочтительно связываются с ТФР-бета1 по сравнению с ТФР-бета3 и iii) нейтрализуют ТФР-бета1.
Патент США № 6492497 основан на идентификации антител, которые относятся к CS37, но которые неожиданно обладают преимущественными свойствами в отношении связывания и нейтрализации ТФР-бета1. Они не связываются или не нейтрализуют ТФР-бета2 или ТФР-бета3. Эпитоп для данных антител находится в С-концевой области ТФР-бета1 (остатки 83-112) и включает петлю, состоящую из остатков 92-98 ТФР-бета1, также известную как «фингер» («палец») 2, область, которая была идентифицирована как взаимодействующая с рецептором ТФР-бета.
Моноклональное антитело против человеческого ТФР-бета1, которое является высоко специфичным, и его можно использовать для диагностики опухолей и аффинной хроматографии, раскрыто в заявке на патент Японии 95068278 В2, опубликованной 26 июля 1995 г.
Применение ТФР-бета и его антагонистов для модуляции кровяного давления и для лечения соответственно гипертензии и гипотензии раскрыто в WO 1991/19513.
В WO 1991/15223 раскрывается очищенный фактор супрессии респираторного приступа, который можно инкубировать с индюшачьим анти-ТФР-бета-антителом, которое специфически связывается с ТФР-бета1. Антитело полностью нейтрализовало активность ТФР-бета1 на активированных макрофагах, но не оказывало влияния на фактор супрессии респираторного приступа на макрофаге.
Подавление активности ТФР-бета и накопления внеклеточного матрикса при диагностике и лечении фиброзных заболеваний, таких как гломерулонефрит, контактированием с супрессором активности продукции ECM, таким как анти-ТФР-бета-антитело, раскрыто в WO 1991/04748 и WO 1993/10808. Также раскрываются антитела против линейных пептидов из ТФР-бета, и клетки, продуцирующие антитела.
В патенте США № 5888705 раскрывается способ индукции пролиферации клеток поджелудочной железы взрослого человека или их дифференциации контактированием первичных культур таких клеток с одним фактором роста гепатоцитов или в комбинации с анти-ТФР-бета-антителами.
В WO 2001/66140 раскрывается применение антагонистов ТФР-бета, таких как антитела, для лечения или профилактики потери функции почек.
В WO 2000/40227 раскрываются способы лечения состояний, связанных с накоплением избытка внеклеточного матрикса с использованием средств, которые ингибируют ТФР-бета, таких как антитела.
Антитела к ТФР-бета раскрываются в качестве средств, ослабляющих апоптоз почечных канальцев при односторонней закупорке мочеточника, Miyajima et al., Kidney International., 58: 2301-2313 (2000).
Продолжительная профилактика почечной недостаточности, избыточной экспрессии гена матрикса и увеличения гломерулярного мезангиального матрикса при обработке моноклональным анти-ТФР-бета-антителом у мышей db/db с диабетом раскрывается Ziyadeh et al., Proc. Natl. Acad. Sci. USA, 97(14): 8015-8020 (2000).
Описан хороший результат лечения нейтрализующими анти-ТФР-бета-антителами при экспериментальном заболевании почек при диабете, Han and Ziyadeh, Peritoneal dialysis international, 19 Suppl 2: S234-237 (1999). Было установлено, что ТФР-бета является ключевым медиатором в развитии гипергликемии и заболевания почек при диабете. Sharma and Ziyadeh, Diabetes, 44 (10) p 1139-46 (1995). Применение ТФР-бета при диабетической нефропатии раскрыто Border et al., Diabetes Metab. Rev., 12/4: 309-339 (1996).
В патенте США № 5662904 описывается композиция для применения в лечении ран для подавления образования рубцевой ткани. Примером такой композиции является антитело, нейтрализующее фактор роста, такое как антитела против ТФР-бета1, ТФР-бета2 и PDGF.
В патенте США № 5972335 раскрываются композиции, содержащие, по меньшей мере, два антитела, для применения в стимуляции заживления ран при фиброзных заболеваниях, где первое антитело является специфичным для одного эпитопа в ТФР-бета1 и второе антитело специфично для одного эпитопа в ТФР-бета2.
В патенте США № 5958411 раскрываются способы лечения патологии ЦНС введением нейтрализующих анти-ТФР-бета-антител.
В патенте США № 5616561 раскрывается способ лечения повреждения тканей, вызванного облучением, с использованием антагонистов ТФР-бета, таких как антитела.
В патенте США № 6500920 раскрывается пептид из 10-25 аминокислот, содержащий аминокислоты 49-58 ТФР-бета2, где пептид способен ингибировать специфическое связывание ТФР-бета с рецептором ТФР-бета на клетке.
В заявке на патент США № 2002/0176858 и патентах США № 5693607; 6419928; 6090383; 5783185; 5772998 и 5571714, а также ЕР 489062; 557418 и 669833, а также WO 1992/08480; 1994/09815 и 1994/18991 раскрываются моноклональные антитела против ТФР-бета, включая таковые, которые нейтрализуют активность ТФР-бета1 и ТФР-бета2, и их применение в терапевтических целях для лечения показаний, при которых имеется гиперпродукция ТФР-бета (например, при остром поражении печени, интерстициальном фиброзе легких, циррозе печени, хроническом фиброзе печени и фиброзных кожных заболеваниях, таких как склеродерма) и для диагностики или лечения злокачественных образований (например, сарком и меланом) и метастатических опухолей.
Новые антитела для лечения нарушений, связанных с ТФР-бета3, например, остеопороза, СПИДа, злокачественной опухоли и т.д., раскрыты в WO 1992/00330 и патенте США № 5262319. Такие антитела связываются с человеческим ТФР-бета3 и не проявляют перекрестной реактивности с ТФР-бета1 и ТФР-бета2.
В патенте США № 6509318 раскрывается семейство небольших пептидов с ингибирующей в отношении ТФР-бета активностью для применений, таких как подавление образования рубцевой ткани во время заживления раны.
Применение соединения (например, антитела), которое может ингибировать биологическую активность ТФР-бета на предварительно поврежденных нейронах для лечения церебральных нарушений, например ишемии мозга, раскрыто в WO 2000/13705.
Моноклональное антитело, распознающее все три изоформы ТФР-бета, которое может ингибировать биологическую активность ТФР-бета на предварительно поврежденных нейронах для лечения церебральных нарушений, раскрывается в WO 2000/54804. Такое антитело применяли для нейтрализации эндогенного ТФР-бета во время основного периода онтогенетической гибели клеток ресничного узла (CG) и спинномозговых узлов (DRG), а также моторных нейронов спинного мозга в куриных эмбрионах.
Диагностирование или прогнозирование вероятности развития чувствительной к тамоксифену или резистентной к тамоксифену опухоли молочной железы с использованием антитела, специфичного к ангиогенным факторам или рецепторам, такого как антитело, специфичное к ТФР-бета3, раскрыто в WO 2000/34788.
В ЕР 945464 В1 раскрываются члены со специфическим связыванием с человеческим ТФР-бета, т.е. члены со специфическим связыванием, содержащие человеческие домены связывания антитела-антигена, специфичные для человеческого ТФР-бета, которые предпочтительно специфически связываются с изоформами ТФР-бета2 и ТФР-бета1, или обоими, по сравнению с ТФР-бета3. Члены со специфическим связыванием можно выделить и применять для лечения заболевания, в частности, фиброзного заболевания, и также иммунного/воспалительного заболеваний.
Было показано, что антитела против ТФР-бета являются эффективными в лечении гломерулонефрита (Border et al., Diabetes Metab. Rev., выше); нейронального рубцевания (Logan et al., Eur. J. Neurosci., 6: 355-363 (1994); WO 1993/19783); рубцевания кожи (Shah et al., Lancet, 339: 213-214 (1992); Shah et al., J. Cell Science, 107: 1137-1157 (1994); Shah et al., J. Cell Science, 985-1002 (1995); WO 1992/17206; фиброза легких (Giri et al., Thorax, 48: 959-966 (1993)); повреждения артерий (Wolf et al., J. Clin. Invest., 93: 1172-1178 (1994)); и ревматоидного артрита (Wahl et al., J. Exp. Medicine, 177: 225-230 (1993)). Было высказано предположение, что ТФР-бета3 действует антагонистически по отношению к ТФР-бета1 и ТФР-бета2 при рубцевании кожи (Shah et al., 1995, выше).
Arteaga et al., J. Clin. Invest., 92: 2569-2576 (1993) раскрывают, что анти-ТФР-бета-антитела ингибируют онкогенность опухолевых клеток молочной железы и повышают активность мышиных природных киллерных клеток селезенки.
Антифиброзные средства для заживления ран и лечения фиброзных нарушений, включая анти-ТФР-бета-антитела, описаны в WO 1993/19769.
Специфические последовательности анти-ТФР-бета2-антител описаны в ЕР 853661 В1.
Другие применения, где антитела против ТФР-бета показали обнадеживающую терапевтическую эффективность, включают применение антител против ТФР-бета для лечения глазных заболеваний, включая фиброз глаз, в том числе пролиферативную ретинопатию (Pena et al., Invest. Ophthalmology Vis. Sci., 35: 2804-2808 (1994)), профилактику катаракты (WO 1995/13827), отслоение сетчатки и уренирование после операции по поводу глаукомы (Khaw et al., Eye, 8: 188-196 (1994)). Connor et al., J. Clin Invest., 83: 1661-1666 (1989) показали, что значительно более высокие концентрации ТФР-бета2 имелись в аспиратах стекловидного тела от пациентов с внутриглазным фиброзом, связанным с пролиферативной ретинопатией, по сравнению пациентами с неосложненным отслоением сетчатки без фиброза глаз и что биологическую активность данного ТФР-бета2 можно нейтрализовать антителами против ТФР-бета2.
Применение антител против ТФР-бета для лечения заболеваний было предметом заявок на патент для фиброзного заболевания (WO 1991/04748); заболеваний с недостаточностью макрофагов (WO 1993/14782); макрофагальных патогенных инфекций (WO 1993/17708; патент США № 5730976); и сосудистых заболеваний (WO 1993/21945).
Обработанная ТФР-бета-антителом композиция стволовых клеток, способная выживать в течение 14 суток в условиях in vitro или ex vivo, и быстрая репопуляция гематопоэтической системы в условиях in vivo, описаны в WO 2000/43499.
Scrip 2580 p 14, 4 октября 2000 сообщил, что Cambridge Antibody Technology (CAT) и Genzyme сотрудничали с целью разработки человеческих моноклональных антител против ТФР-бета. У САТ имеется два полных человеческих ТФР-бета-антитела, САТ-152 и САТ-192, у Genzyme - 1D11, мышиное полиспецифическое моноклональное антитело, которое нейтрализует ТФР-бета1, ТФР-бета2 и ТФР-бета3, и его признали в качестве потенциального эффективного препарата для лечения диффузной склеродермы. САТ разработал человеческий аналог 1D11 с использованием технологии фагового дисплея. Несколько других клинических показаний для лечения анти-ТФР-бета-антителами, включая офтальмические показания, рубцевание после хирургических вмешательств, фиброз основных органов, таких как легкие, почки и печень и некоторые злокачественные опухоли, также будут рассмотрены наряду с лечением злокачественных опухолей мозга ингибированием роста с помощью ТФР-бета2. САТ-152 (анти-ТФР-бета2) находится в фазе II клинических испытаний для профилактики постоперационного рубцевания у пациентов, подвергшихся операции по поводу глаукомы, и для САТ-192 (анти-ТФР-бета1) завершилась фаза I клинических испытаний. Смотри также «Trends in Antibody Research: The Monoclonal Elite», Tim Searle, Bioventure-View 1510, p. 14, 1 октября 2000 г.
Метод количественного определения ТФР-бета с использованием анти-ТФР-бета-антитела раскрыт в WO 1995/19987. Новый тест для определения активного ТФР-бета в пробе с использованием эукариотических клеток, которые содержат ТФР-бета-реакционный экспрессирующий вектор, описан в WO 2000/00641. Данный тест включает определение концентраций изоформ ТФР-бета в пробе, где замороженные срезы предварительно инкубируют с нейтрализующими антителами изоформы анти-TGF-бета. Иммуноанализы на основе ТФР-бета с использованием ТФР-бета-антител описаны, например, в патенте Японии 2126157 и заявке на патент Японии 92041307 В, опубликованной 7 июля 1992 г.
Darland и D'Amore, J. Clin. Invest., 103: 157-158 (1999) раскрывают, что развитие сосудов протекает от стадии зависимости от фактора роста, когда потеря фактора выживаемости приводит к апоптозу. Стабилизация сосудов отмечается при покрытии муральными клетками, местной активации ТФР-бета и продукции базальной мембраны. Возникает несколько вопросов, касающихся роли факторов роста для сформировавшихся сосудов, включая VEGF и ТФР-бета. Benjamin et al., J. Clin. Invest., 103: 159-165 (1999) раскрыли избирательное исчезновение неразвившихся кровеносных сосудов в развитых опухолях человека после удаления VEGF.
Способы получения химерных и гуманизированных антител описаны в и других источниках в данной области, включая, например, патент США № 6235883 по полным моноклональным антителам против рецептора человеческого эпидермального фактора роста; ЕР 184187 по мышиному-человеческому химерному антителу; ЕР 844306 по способу получения рекомбинантных антител с использованием фаговой технологии; патент США № 5859205 по получению CDR-трансплантированных антител, предпочтительно гуманизированных антител, содержащих не относящийся к человеческому донорный и человеческий акцепторные или каркасные участки, ЕР 120694; ЕР 125023; ЕР 171496; ЕР 173494; ЕР 239400; WO 1989/07452; WO 1990/07861 и WO 1986/01533 по способам получения гуманизированных антител; заявка на патент США № 2003/0039649 по супергуманизированным антителам; заявка на патент США № 2003/0039645 по гуманизированным антителам со специфичностью к человеческому TNF-альфа; ЕР 239400 по рекомбинантным антителам и их получению; WO 1991/09967 по гуманизированным антителам; WO 1992/01047 по получению антител; WO 1992/22653 по способам получения гуманизированных антител; WO 1993/11161 по поливалентным антигенсвязывающим белкам; WO 1994/13804 по поливалентным антигенсвязывающим белкам; WO 2000/66631 по членам со специфическим связыванием для ТФР-бета; и Henry «Special Delivery: Alternative methods for delivering drugs improve performance, convenience and patient compliance». C&EN, p. 49-65 (2000). Смотри также патенты США № 6140471 и 5969108, и 5872215, и 5871907, и 5858657, и 5837242, и 5733743; ЕР 1024191; ЕР 774511; WO 1997/13844; ЕР 656941 и 605522, и WO 1994/13804; ЕР 589877; ЕР 585287; WO 1993/19172; ЕР 540586; WO 1993/06213; WO 1992/20791; WO 1992/01787 и WO 1992/01047. Кроме того, в WO 2004/065417 раскрываются различные изменения в антителах и антигенсвязывающих фрагментах для повышения выхода. Также смотри патент США 20050049403.
Существует потребность регуляции молекул ТФР-бета для предупреждения их отрицательного эффекта при развитии заболеваний, таких как представленные выше. Также имеется необходимость в обеспечении моноклональных антител с высокой аффинностью, которые специфически связываются с ТФР-бета и нейтрализуют активность ТФР-бета таким образом, что они действуют в качестве антагонистов ТФР-бета. Очевидное отсутствие регуляции ТФР-бета в клетках новообразований в сочетании с супрессией иммунной функции и индуцируемого ТФР-бета образования стромы делает потенциальное воздействие антагонистов ТФР-бета привлекательной возможностью для лечения злокачественных опухолей. Кроме того, ТФР-бета-антитела являются пригодными для постановки диагностических тестов и иммуноаффинной очистки.
Сущность изобретения
В первом аспекте настоящее изобретение относится к гуманизированному антителу, которое связывается с ТФР-бета, содержащему вариабельный домен тяжелой цепи (VH), который включает остатки нечеловеческой гипервариабельной области, включенные в человеческий домен (VH), где указанный вариабельный домен содержит замену каркасной области (FR) в последовательности SEQ ID NO: 6 в положении, выбранном из группы, состоящей из 48, 49, 67, 69, 71, 73 и 78 при использовании системы нумерации, представленной Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes, Bethesda, MD (1991). Антитело включает интактное IgG1 антитело или фрагмент антитела, такой как Fab.
Предпочтительно гуманизированное антитело включает замены FR в положениях 49, 67 и 71, где более предпочтительно в положении 49 аланин заменен на глицин, в положении 67 фенилаланин заменен на аланин и в положении 71 аргинин заменен на аланин.
В еще одном предпочтительном варианте осуществления гуманизированное антитело включает замены FR в положениях 48, 49 и 71, где более предпочтительно в положении 48 валин заменен на изолейцин, в положении 49 аланин заменен на глицин и в положении 71 аргинин заменен на аланин.
Также предпочтительно, гуманизированное антитело включает замены FR в положениях 49, 69 и 71, где более предпочтительно в положении 49 аланин заменен на глицин, в положении 69 изолейцин заменен на лейцин и в положении 71 аргинин заменен на аланин. В еще одном аспекте дополнительная замена FR находится в положении 73, более предпочтительно в положении 73 аргинин заменен на лизин.
В еще одном предпочтительном варианте осуществления гуманизированное антитело включает замены FR в положениях 49, 71 и 73, где более предпочтительно в положении 49 аланин заменен на глицин, в положении 71 аргинин заменен на аланин и в положении 73 аспарагин заменен на лизин.
В еще одном предпочтительном варианте осуществления гуманизированное антитело включает замены FR в положениях 49, 71 и 78, где более предпочтительно в положении 49 аланин заменен на глицин, в положении 71 аргинин заменен на аланин и в положении 78 лейцин заменен на аланин.
В еще одном предпочтительном варианте осуществления любое из антител, описанных выше, содержит остатки определяющего комплементарность участка (CDR) вариабельного домена легкой цепи (VL) RASQSVLYSSNQKNYLA (последовательность SEQ ID NO: 36); WASTRES (последовательность SEQ ID NO: 38) и HQYLSSDT (последовательность SEQ ID NO: 40) или содержит остатки CDR домена VL, где первый CDR (CDR L1) ревертирован в последовательность локуса каппа человеческой зародышевой линии L8/L9: RASQGISSYLA (последовательность SEQ ID NO: 37) и/или второй CDR (CDR L2) ревертирован в последовательность локуса каппа человеческой зародышевой линии L8/L9/L14/L15: YASSLQS (последовательность SEQ ID NO: 39). В еще одном предпочтительном варианте осуществления любое из антител, описанных выше, содержит остатки определяющего комплементарность участка вариабельного домена тяжелой цепи (VH) GYAFTNYLIE (последовательность SEQ ID NO: 41); VNNPGSGGSNYNEKFKG (последовательность SEQ ID NO: 42), или VINPGSGGSNYNEKFKG (последовательность SEQ ID NO: 43) и SGGFYFDY (последовательность SEQ ID NO: 44).
Также изобретение относится к любому из антител, описанных выше, конъюгированному с цитотоксическим средством или не конъюгированному таким образом. Кроме того, изобретение относится к композиции, содержащей такие антитела и носитель.
В дополнительном варианте осуществления изобретение относится к выделенной нуклеиновой кислоте, кодирующей гуманизированное антитело, вектору, включающему указанную нуклеиновую кислоту и клетке-хозяину, содержащей такую нуклеиновую кислоту.
Дополнительно изобретение относится к способу получения гуманизированного антитела, предусматривающему культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, так, что нуклеиновая кислота экспрессируется и продуцируется антитело, и предпочтительно выделяется из культуры клеток-хозяев, более предпочтительно из культуральной среды клеток-хозяев. Также клетку-хозяин можно котрансфицировать с вектором, содержащим нуклеиновую кислоту, кодирующую вариабельный домен тяжелой цепи, и с вектором, содержащим нуклеиновую кислоту, кодирующую вариабельный домен легкой цепи.
В еще одном варианте осуществления изобретение относится к способу лечения нарушения, связанного с ТФР-бета, у млекопитающего, предпочтительно примата, и более предпочтительно человека, предусматривающему введение млекопитающему эффективного количества гуманизированного антитела. Способ может дополнительно предусматривать введение млекопитающему эффективного количества терапевтического средства иного, чем гуманизированное антитело, такого как химиотерапевтическое, антиангиогенное или цитотоксическое средство, или цитокин.
В еще одном варианте осуществления изобретение относится к способу детектирования ТФР-бета в пробе из организма, который предусматривает контактирование гуманизированного антитела с пробой из организма и определение того, связывается ли антитело с ТФР-бета.
Изобретение также относится к изделию, содержащему контейнер, содержащий гуманизированное антитело и инструкции для пользователя с указаниями по лечению нарушения, связанного с ТФР-бета, у млекопитающего, предпочтительно человека, антителом. Данное изделие может также включать контейнер, содержащий терапевтическое средство иное, чем гуманизированное антитело, где имеются инструкции для пользователя с указанием по лечению нарушения антителом в комбинации со средством.
В еще одном варианте осуществления данное изобретение относится к способу лечения злокачественной опухоли у млекопитающего, предусматривающему введение млекопитающему эффективного количества антитела против ТФР-бета и антитела, которое связывается с васкулярным эндотелиальным фактором роста. Предпочтительно млекопитающее является человеком. В другом варианте осуществления антитело против ТФР-бета связывается с одним или более из следующего: ТФР-бета1, ТФР-бета2 и ТФР-бета3. В дополнительном варианте осуществления антитело связывается с ТФР-бета1 или как с ТФР-бета1, так и с ТФР-бета2.
Краткое описание фигур
На фиг.1А и 1В представлено сравнение аминокислотных последовательностей вариабельного домена легкой цепи (VL) (фиг.1А) и вариабельного домена тяжелой цепи (Vн) (фиг.1В) мышиного моноклонального антитела 2G7 (соответственно последовательности SEQ ID NO: 1 и 2); доменов VL и Vн гуманизированного варианта huxТФРВ (V5H.V5L) (соответственно последовательности SEQ ID NO: 3 и 4) и человеческих VL и Vн консенсусных каркасных участков (hum κ1, подгруппа I легкой цепи каппа; humIII, подгруппа III тяжелой цепи) (соответственно последовательности SEQ ID NO: 5 и 6). Звездочки указывают на различия между гуманизированным huxТФРВ и мышиным моноклональным антителом 2G7 или между гуманизированным huxТФРВ и человеческими консенсусными каркасными участками. Подчеркнуты области, определяющие комплементарность (CDR), и CDR фактической последовательности человеческой зародышевой линии находятся ниже консенсусных каркасных участков для сравнения (последовательности SEQ ID NO: 7-11).
На фиг.2 представлены последовательности ДНК (последовательность SEQ ID NO: 12-17), кодирующие различные области CDR (последовательности SEQ ID NO: 18-23).
На фиг.3 представлены аминокислотные последовательности 709.landH.IgG1 (последовательность SEQ ID NO: 24); H2NI.V5L (последовательность SEQ ID NO: 25); V11H.V11L (последовательность SEQ ID NO: 26); V5H.V5L (последовательность SEQ ID NO: 27); chimL.chim.H (последовательность SEQ ID NO: 28) и V5H.g1L2 (последовательность SEQ ID NO: 29).
На фиг.4 представлены нуклеиновокислотные последовательности без и с сигнальными последовательностями, кодирующие последовательности, приведенные на фиг.3 (последовательности SEQ ID NO: 30-35).
На фиг.5 представлены кривые связывания варианта IgG гуманизированных антител 2G7 с ТФР-бета.
На фиг.6 представлена последовательность плазмиды pDR1 (последовательность SEQ ID NO: 45, 5391 п.н.) для экспрессии иммуноглобулиновых легких цепей, как описано в примере 2. Плазмида pDR1 содержит последовательности, кодирующие иррелевантное антитело, т.е. легкую цепь гуманизированного анти-CD3-антитела (Shalaby et al., J. Exp. Med., 175: 217-225 (1992)), старт- и стоп-кодоны, которые указаны в рамке и подчеркнуты.
На фиг.7 представлена последовательность плазмиды pDR2 (последовательность SEQ ID NO: 46, 6135 п.н.) для экспрессии иммуноглобулиновых тяжелых цепей, как описано в примере 2. Плазмида pDR2 содержит последовательности, кодирующие иррелевантное антитело, т.е. тяжелую цепь гуманизированного анти-CD3-антитела (Shalaby et al., выше), старт- и стоп-кодоны, которые отмечены жирным шрифтом и подчеркнуты.
На фиг.8 представлены кривые связывания гуманизированных антител ревертантной зародышевой линии 2G7 с ТФР-бета.
На фиг.9 представлены результаты блокирования в тесте пролиферации мышиных мезангиальных клеток с помощью антител 2G7 против ТФР-бета1 и нескольких вариантов гуманизированных антител против ТФР-бета.
На фиг.10А-10С показана нейтрализация ТФР-бета3 в трех различных концентрациях соответственно в тесте пролиферации фибробластов 3Т3 тремя гуманизированными антителами против ТФР-бета (H2NI.V5L, H2NI.g1L2 и V5H.g1L2) и мышиным антителом 2G7.
На фиг.11А-11С показана нейтрализация ТФР-бета2 в трех различных концентрациях соответственно в тесте пролиферации фибробластов 3Т3 четырьмя антителами, представленными на фиг.10.
На фиг.12А-12С показана нейтрализация ТФР-бета1 в трех различных концентрациях соответственно в тесте пролиферации фибробластов 3Т3 четырьмя антителами, представленными на фиг.10.
На фиг.13А-13С показана нейтрализация ТФР-бета1, -бета2 и -бета3 в концентрации 2 нг/мл соответственно в тесте пролиферации фибробластов 3Т3 четырьмя антителами, представленными на фиг.10.
На фиг.14А-14D показана нейтрализация трех изоформ ТФР-бета в тесте пролиферации фибробластов 3Т3 гуманизированным антителом H2NI.V5L (фиг.14А), гуманизированным антителом H2NI.g1L2 (фиг.14В), мышиным антителом 2G7 (фиг.14C) и гуманизированным антителом V5H.g1L2 (фиг.14D).
На фиг.15А и 15В представлены результаты ELISA по продукции и ингибированию ТФР-бета нормальными и опухолевыми эпителиальными клетками. На фиг.15А показана продукция ТФР-бета1 в условиях in vitro нормальными эпителиальными клетками (ЕрС) (С57) и опухолевыми клетками ЕрС (модель 4Т1). На фиг.15В показано влияние анти-ТФР-бета-антитела 2G7 в условиях in vivo на уровень ТФР-бета1 в сыворотке крови в опухолевых клетках ЕрС в сравнении с контрольным IgG антителом (изотип IgG, которое представляет антипыльцовое антитело) в нормальных и опухолевых клетках ЕрС. Тот же контрольный IgG использовали для остальных фигур, и на фиг.28 использовали контрольный IgG, который может быть или может не быть таким же.
На фиг.16А и 16В показано действие анти-ТФР-бета-антитела 2G7 на вторичные опухоли легких в сравнении с контрольным IgG. На фиг.16А представлена оценка в баллах гистологических исследований с градацией и числом пораженных долей для контрольного IgG антитела и анти-ТФР-бета-антитела 2G7, и на фиг.16В представлены массы ткани в граммах и процентах от массы тела для того же контрольного и анти-ТФР-бета-антитела 2G7.
На фиг.17 представлено действие анти-ТФР-бета-антитела 2G7 на количественное определение опухолей легких uCT в сравнении с контрольным IgG по объему опухолей и числу опухолей.
На фиг.18А и 18В представлено действие анти-ТФР-бета-антитела 2G7 и химиотерапии на модели опухоли молочной железы 4Т1 в сравнении с контрольным IgG. На фиг.18А показан объем опухоли как функция времени после введения контрольного IgG с физиологическим раствором, контроля IgG и доцетакселя (TAXOTERE®) и анти-ТФР-бета-антитела 2G7 и доцетакселя (TAXOTERE®). На фиг.18В представлена масса ткани мозга, легких, селезенки и опухолей для двух контролей (IgG с и без доцетакселя (TAXOTERE®)) и анти-ТФР-бета-антитела с доцетакселем (TAXOTERE®).
На фиг.19 представлены концентрации VEGF (пкг/мл) в плазме у мышей без опухолей (норма) или у мышей с опухолями молочной железы 4Т1, обработанных контрольными IgG антителами (контроль) или анти-ТФР-бета-антителами (2G7).
На фиг.20А и 20В представлено действие ТФР-бета-антитела 2G7 на другой модели опухоли молочной железы PymT. На фиг.20А показан объем опухоли как функция роста опухоли в сутках для ТФР-бета-антитела и контрольного IgG антитела, и на фиг.20В представлена масса ткани для анти-ТФР-бета-антитела и контрольного IgG антитела.
На фиг.21А и 21В представлена модель мышиной меланомы В16 и действие ТФР-бета-антитела 2G7 и контрольного IgG антитела. На фиг.21А представлен процент мышей с опухолями легких в отношении поверхности и патологии для контрольного и ТФР-бета-антитела, и на фиг.21В представлено количество опухолей к освобожденной поверхности и СТ для контрольного и ТФР-бета-антитела.
На фиг.22 представлено действие ТФР-бета-антитела 2G7 на рост опухоли В16 (объем) в течение 14 суток после прививки по сравнению с контрольным IgG.
На фиг.23 представлено действие ТФР-бета-антитела 2G7 на число видимых метастазов легкого В16 (Е6) по сравнению с контрольным IgG.
На фиг.24 представлено действие ТФР-бета-антитела 2G7 на рост опухоли В16 (объем) в течение 17 суток после прививки по сравнению с контрольным IgG.
На фиг.25 представлено действие ТФР-бета-антитела 2G7 на массу первичной опухоли В16 в сравнении с контрольным IgG.
На фиг.26 представлено действие ТФР-бета-антитела 2G7 на число видимых метастазов В16 (Е7) по сравнению с контрольным IgG.
На фиг.27 представлено действие ТФР-бета-антитела 2G7, мышиного моноклонального анти-VEGF-антитела А461 и комбинации двух антител на объем опухоли в трансплантате человеческих клеток опухоли легких Calu-6 у мышей в сравнении с контрольным IgG в течение периода времени до 42 суток. Обработку различными средствами начинали на 2 сутки.
На фиг.28 представлены массы опухолей для опыта с Calu-6, показанного на фиг.27, для трех типов обработок антителами и контрольным IgG.
Подробное описание предпочтительных вариантов осуществления
I. Определения
Термины «ТФР-бета» и «трансформирующий фактор роста-бета» используются здесь взаимозаменяемо, и они относятся к семейству молекул, описанных выше, которые содержат полноразмерную, природную аминокислотную последовательность любого из факторов ТФР-бета от человека, включая латентные формы и связанный или не связанный комплекс предшественника и зрелого ТФР-бета («латентный ТФР-бета»). При обращении здесь к такому ТФР-бета следует понимать, что это представляет обращение к любой из идентифицированных в настоящее время форм, включая ТФР-бета1, ТФР-бета2, ТФР-бета3, ТФР-бета4 и ТФР-бета5 и их латентным вариантам, а также человеческим видам ТФР-бета, которые будут определены в будущем, включая полипептиды, полученные из последовательности любого известного ТФР-бета и которые, по меньшей мере, примерно на 75%, предпочтительно, по меньшей мере, примерно на 80%, более предпочтительно, по меньшей мере, примерно на 85%, более предпочтительно, по меньшей мере, примерно на 90% и даже более предпочтительно, по меньшей мере, примерно на 95% гомологичны с последовательностью. Конкретные термины «ТФР-бета1», «ТФР-бета2» и «ТФР-бета3», а также «ТФР-бета4» и «ТФР-бета5» относятся к факторам ТФР-бета, которые определены в литературе, например, Derynck et al., Nature, выше, Seyedin et al., J. Biol. Chem., 262, выше и deMartin et al., выше. Термин «ТФР-бета» относится к гену, кодирующему человеческий ТФР-бета. Предпочтительный фактор ТФР-бета представляет природную, человеческую последовательность ТФР-бета.
Члены семейства ТФР-бета определяются как таковые, имеющие девять остатков цистеина в зрелой части молекулы, разделяющие, по меньшей мере, 65% гомологию с другими известными последовательностями ТФР-бета в зрелой области, и которые могут конкурировать за один и тот же рецептор. Кроме того, оказалось, что все они кодируются в виде более крупного предшественника, который имеет область с высокой гомологией около N-конца и консервативен в отношении трех остатков цистеина в области предшественника, которая удаляется позже во время процессинга. Кроме того, оказалось, что ТФР-бета имеет сайт процессинга из четырех или пяти аминокислот.
Полипептид с «природной последовательностью» представляет таковой, который имеет ту же аминокислотную последовательность в виде полипептида (например, ТФР-бета1), что и в природе. Такие полипептиды с «природной последовательностью» можно выделить из природного источника или можно получить рекомбинантным или синтетическим путем. Так, полипептид с «природной последовательностью» может иметь аминокислотную последовательность природного человеческого полипептида, мышиного полипептида или полипептида от любого другого вида млекопитающих.
Термин «вариант аминокислотной последовательности» относится к полипептидам, имеющим аминокислотные последовательности, которые в некоторой степени отличаются от полипептида с природной последовательностью. Как правило, варианты аминокислотной последовательности будут обладать, по меньшей мере, 70% гомологией с полипептидом с природной последовательностью или его областью, которую сравнивают с вариантом, и предпочтительно они будут, по меньшей мере, примерно на 80%, более предпочтительно, по меньшей мере, примерно на 90%, и еще более предпочтительно, по меньшей мере, примерно на 95% гомологичными с таким полипептидом с природной последовательностью или его областью. Варианты аминокислотной последовательности содержат замены, делеции и/или вставки в определенных положениях в природной аминокислотной последовательности.
«Гомология» определяется, как процент остатков в варианте аминокислотной последовательности, которые идентичны после выравнивания последовательностей и введения пробелов, если это необходимо, для достижения максимальной процентной гомологии. Методы и компьютерные программы для выравнивания хорошо известны в данной области. Одна такая компьютерная программа представляет собой «Align 2», принадлежащая Genentech, Inc., которая была подана с документацией для пользователя в United States Copyright office, Washington, DC 20559, 10 декабря 1991 г.
Термин «антитело» здесь используется в самом широком смысле и конкретно включает интактные моноклональные антитела, поликлональные антитела, мультивалентные антитела (например, бивалентные антитела), полученные, по меньшей мере, из двух интактных антител, и фрагменты антител, при условии, что они проявляют желаемую биологическую активность.
Термин «моноклональное антитело», в том смысле, в котором он здесь используется, относится к антителу, полученному из популяции в основном гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных природных мутаций, которые могут находиться в минорных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигенного сайта. Кроме того, в противоположность препаратам из поликлональных антител, которые включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты в антигене. Помимо их специфичности моноклональные антитела обладают преимуществом, заключающимся в том, что их можно синтезировать без примесей других антител. Определение «моноклональное» указывает на характер антитела, что оно получено в основном из гомогенной популяции антител, и не сводится к необходимой продукции антитела любым конкретным методом. Например, моноклональные антитела для применения по настоящему изобретению можно получить гибридомным методом, впервые описанным Kohler et al., Nature, 256: 495 (1975), или их можно получить методами рекомбинантной ДНК (смотри, например, патент США № 4816567). «Моноклональные антитела» также можно выделить из фаговых библиотек антител с использованием, например, методов, описанных Clackson et al., Nature, 352: 624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991).
Моноклональные антитела здесь конкретно включают «химерные» антитела, в которых участок тяжелой и/или легкой цепи является идентичным или гомологичным соответствующим последовательностям в антителах, полученным из определенных видов или принадлежащим к определенному классу или подклассу антител, в то время как оставшаяся часть цепи(ей) является идентичной или гомологичной соответствующим последовательностям в антителах, полученным из других видов или принадлежащим другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют желаемую биологическую активность (патент США № 4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). Интересующие химерные антитела здесь включают «приматизированные» антитела, содержащие антигенсвязывающие последовательности вариабельного домена, полученные от примата, не относящегося к человеку (например, низшие узконосые обезьяны, высшие обезьяны и т.д.), и последовательности человеческой константной области.
«Фрагменты антитела» включают участок интактного антитела, предпочтительно содержащий их антигенсвязывающую или вариабельную область. Примеры фрагментов антитела включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела; молекулы одноцепочечных антител и мультивалентные антитела, полученные из фрагмента(ов) антитела.
«Интактное» антитело представляет таковое, содержащее антигенсвязывающую вариабельную область, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи CH1, CH2 и CH3. Константные домены могут представлять константные домены с природной последовательностью (например, человеческие константные домены с природной последовательностью) или их варианты аминокислотной последовательности. Предпочтительно, интактное антитело имеет одну и более эффекторных функций.
«Эффекторные функции» антитела относятся к таким биологическим активностям, которые присущи области Fc (область Fc природной последовательности или вариантной области Fc аминокислотной последовательности) антитела. Примеры эффекторных функций антитела включают связывание C1q; комплементзависимую цитотоксичность; связывание рецептора Fc; антителозависимую опосредуемую клетками цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию клеточных поверхностных рецепторов (например, рецептора В-клеток; BCR) и т.д.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей интактные антитела можно подразделить на различные «классы». Существуют пять основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно дополнительно разделить на «подклассы» (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Костантные домены тяжелой цепи, которые соответствуют различным классам антител, обозначают соответственно α, δ, ε, γ и µ. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
«Антителозависимая клеточно опосредуемая цитотоксичность» и «ADCC» относятся к опосредуемой клетками реакции, при которой неспецифические цитотоксические клетки, которые экспрессируют рецепторы Fc (FcR) (например, природные клетки-киллеры (NK), нейтрофилы и макрофаги) узнают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. Основные клетки для опосредования ADCC, клетки NK, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках в обобщенном виде представлена в таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol., 9: 457-92 (1991). Для оценки активности ADCC для интересующей молекулы можно поставить тест ADCC в условиях in vitro, такой как описан в патенте США № 5500362 или 5821337. Пригодные эффекторные клетки для постановки таких тестов включают мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно активность ADCC интересующих молекул можно оценить в условиях in vivo, например, на модели на животных, такой как раскрыта Clynes et al., Proc. Natl. Acad. Sci. (USA), 95: 652-656 (1998).
«Человеческие эффекторные клетки» представляют лейкоциты, которые экспрессируют один или более FcR и осуществляют эффекторные функции. Предпочтительно клетки экспрессируют, по меньшей мере, FcγRIII и осуществляют эффекторную функцию ADCC. Примеры человеческих лейкоцитов, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), природные клетки-киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы, при том, что PBMC и NK-клетки являются предпочтительными. Эффекторные клетки можно выделить из их природного источника, например, из крови или PBMC, как здесь описано.
Термин «рецептор Fc» или «FcR» используется для обозначения рецептора, который связывается с областью Fc антитела. Предпочтительный FcR представляет человеческий FcR с природной последовательностью. Кроме того, предпочтительный FcR представляет таковой, который связывается с IgG антителом (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы данных рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, которые в основном различаются по их цитоплазматическим доменам. Активирующий рецептор FcγRIIA содержит мотив активации на основе тирозина иммунорецептора (ITAM) в его цитоплазматическом домене. Ингибирующий рецептор FcγRIIB содержит мотив ингибирования на основе тирозина иммунорецептора (ITIM) в его цитоплазматическом домене (смотри обзор Daëron, Annu. Rev. Immunol., 15: 203-234 (1997)). Обзор по FcR смотри у Ravetch and Kinet, Annu. Rev. Immunol., 9: 457-492 (1991); Capel et al., Immunomethods, 4: 25-34 (1994) и de Haas et al., J. Clin. Med., 126: 330-41 (1995). Другие FcR, включая таковые, которые будут открыты в будущем, объединяются здесь термином «FcR». Термин также включает неонатальный рецептор, FcRn, который ответственен за перенос материнских IgG плоду. Guyer et al., J. Immunol., 117: 587 (1976) и Kim et al., J. Immunol., 24: 249 (1994).
«Комплемент-зависимая цитотоксичность» или «CDC» относится к способности молекулы лизировать мишень в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента комплементной системы (C1q) с молекулой (например, антителом), образующей комплекс с родственным антигеном. Для оценки активации комплемента можно провести тест CDC, например, описанный Gazzano-Santoro et al., J. Immunol. Methods, 202: 163 (1996).
«Природные антитела» обычно представляют гетеротетрамерные гликопротеины массой примерно 150000 дальтон, состоящие из двух идентичных легких цепей (L) и двух идентичных тяжелых цепей (Н). Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, в то время как число дисульфидных связей варьирует среди тяжелых цепей различных изотипов иммуноглобулинов. Каждая тяжелая и легкая цепь также имеет регулярно расположенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует несколько константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце. Константный домен легкой цепи выстроен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи выстроен с вариабельным доменом тяжелой цепи. Полагают, что определенные аминокислотные остатки образуют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи.
Термин «вариабельный» относится к факту, что определенные участки вариабельных доменов значительно различаются по последовательности среди антител и используются при связывании и специфичности каждого конкретного антитела для его конкретного антигена. Однако вариабельность неравномерно распределена в вариабельных доменах антител. Она концентрируется в трех сегментах, названных гипервариабельными областями в вариабельных доменах легкой цепи и тяжелой цепи. Более высоко консервативные участки вариабельных доменов называются каркасными участками (FR). Каждый вариабельный домен природной тяжелой и легкой цепей включает четыре FR, в основном принимающих конфигурацию β-складки, соединенных тремя гипервариабельными областями, которые при объединении образуют петли, и в некоторых случаях образуют часть структуры β-складки. Гипервариабельные области в каждой цепи находятся вместе в тесной близости к FR и с гипервариабельными областями другой цепи, внося свой вклад в образование антигенсвязывающего сайта антител (смотри Kabat et al., выше). Константные домены непосредственно не участвуют в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в проявлении антителозависимой клеточной цитотоксичности (ADCC).
Термин «гипервариабельная область», в том смысле, в котором он здесь используется, относится к аминокислотным остаткам антитела, которые ответственны за связывание с антигеном. Как правило, гипервариабельная область содержит аминокислотные остатки из «определяющего комплементарность участка» или «CDR» (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (Н1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи; Kabat et al., выше) и/или остатки из «гипервариабельной петли» (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) в вариабельном домене тяжелой цепи; Chothia and Lesk, J. Mol. Biol., 196: 901-917 (1987)). Остатки «каркасного участка» или «FR» представляют остатки вариабельного домена иные, чем остатки гипервариабельной области, как здесь определено.
Расщепление антител папаином приводит к образованию двух одинаковых антигенсвязывающих фрагментов, называемых фрагментами «Fab», каждый с одним антигенсвязывающим сайтом, и остаточного фрагмента «Fc», чье название отражает его способность к легкой кристаллизации. Обработка пепсином дает фрагмент F(ab')2, который содержит два антигенсвязывающих сайта и он по-прежнему способен к перекрестному связыванию антигена.
«Fv» представляет минимальный фрагмент антитела, который содержит полный антигенраспознающий и антигенсвязывающий сайт. Данная область состоит из димера вариабельного домена одной тяжелой цепи и одной легкой цепи в тесной нековалентной связи. Она имеет такую конфигурацию, что три гипервариабельных области каждого вариабельного домена взаимодействуют с образованием антигенсвязывающего сайта на поверхности димера VH-VL. Вместе шесть гипервариабельных области придают антителу антигенсвязывающую специфичность. Однако даже один вариабельный домен (или половина Fv, состоящая только из трех гипервариабельных областей, специфичных для антигена) обладает способностью распознавать и связываться с антигеном, хотя и с низкой аффинностью по сравнению с целым связывающим сайтом.
Фрагмент Fab также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab добавлением нескольких остатков в карбоксильном конце домена CH1 тяжелой цепи, включая один или более остатков цистеина из шарнирной области антитела. Fab'-SH обозначает здесь Fab', в котором остаток(и) цистеина константных доменов имеет, по меньшей мере, одну свободную тиольную группу. Фрагменты антитела F(ab')2 первоначально были получены в виде пар фрагментов Fab', которые имеют шарнирные цистеины между ними. Также известны другие химические сочетания фрагментов антител.
«Легкие цепи» антител от любого вида позвоночных можно подразделить на два четко различающихся типа, называемых каппа (κ) и лямбда (λ), основываясь на аминокислотных последовательностях их константных доменов.
Фрагменты антител «одноцепочечные Fv» или «scFv» содержат домены VH и VL антитела, где данные домены находятся в одной полипептидной цепи. Предпочтительно полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовывать желаемую структуру для связывания антигена. Обзор по scFv смотри у Pluckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenberg and Moore eds., Springer-Verlag, New-York, p. 269-315 (1994). Описаны фрагменты scFv анти-ТФР-бета-антитела в WO 1993/16185; патенте США № 5571894 и патенте США № 5587458.
Термин «диатела» относится к небольшим фрагментам антитела с двумя антигенсвязывающими сайтами, где данные фрагменты включают вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в той же полипептидной цепи (VH-VL). При использовании линкера, который является слишком коротким для соединения двух доменов в одной цепи, домены вынуждены соединяться с комплементарными доменами другой цепи и образуют два антигенсвязывающих сайта. Диатела более подробно описаны, например, в EP 404097; WO 1993/11161 и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993).
«Гуманизированные» формы не относящихся к человеческим антител (например, грызунов) являются химерными антителами, которые содержат минимальную последовательность, полученную из не-человеческого иммуноглобулина. В основном гуманизированные антитела представляют человеческие иммуноглобулины (реципиентное антитело), в котором остатки гипервариабельной области реципиента заменены на остатки из гипервариабельной области видов, не относящихся к человеку (донорное антитело), таких как мышь, крыса, кролик или примат, не относящийся к человеку, обладающие желаемой специфичностью, аффинностью и эффективностью. В некоторых случаях остатки области каркасного участка (FR) человеческого иммуноглобулина заменяют на соответствующие не-человеческие остатки. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаруживают в реципиентном антителе или в донорном антителе. Данные модификации проводят для дополнительного повышения эффективности антитела. Как правило, гуманизированное антитело будет содержать в основном, по меньшей мере, один, и, как правило, два вариабельных домена, в которых все или в основном все гипервариабельные петли соответствуют таковым в не-человеческом иммуноглобулине или все или в основном все FR, которые входят в человеческую последовательность иммуноглобулина. Гуманизированное антитело также необязательно будет содержать, по меньшей мере, участок константной области иммуноглобулина (Fc), как правило, человеческого иммуноглобулина. Дополнительные детали смотри у Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332: 323-329 (1988); и Presta, Curr. Op. Struct. Biol., 2: 593-596 (1992).
«Выделенное» антитело представляет таковое, которое было идентифицировано и/или отделено от компонента его природного окружения. Загрязняющие компоненты его природного окружения представляют вещества, которые будут мешать диагностическому или терапевтическому применениям антитела, и они могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления антитело будет очищено 1) до более чем примерно 95% по массе антитела по данным метода Лоури, и наиболее предпочтительно более чем примерно 99% по массе, 2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности при применении спинингового чашечного секвенатора или 3) до гомогенности при постановке SDS-PAGE в восстанавливающих или невосстанавливающих условиях с использованием Кумасси синего или предпочтительно при окрашивании серебром. Выделенное антитело включает антитело in situ в рекомбинантных клетках, поскольку, по меньшей мере, один компонент из природной среды антитела будет отсутствовать. Как правило, однако, выделенное антитело будет приготовлено, по меньшей мере, одной стадией очистки.
Антитело, «которое связывается» с интересующим антигеном, т.е. антигеном ТФР-бета, представляет таковое, способное связываться с антигеном с достаточной аффинностью, так, чтобы антитело было пригодно в качестве терапевтического средства для целенаправленного воздействия на клетку, экспрессирующую антиген. В тех случаях, когда антитело представляет таковое, которое связывается с ТФР-бета, то, как правило, оно будет предпочтительно связываться с ТФР-бета в противоположность другим членам надсемейства ТФР-бета, и может представлять таковое, которое в значительной степени не подвергается перекрестному взаимодействию с другими белками данного семейства, такими как ВМР, активин и т.д. В таких вариантах осуществления степень связывания антитела с данными, не относящимися к ТФР-бета белками, будет составлять менее 10% по данным анализа клеточного сортинга с возбуждением флуоресценции (FACS) или радиоиммунопреципитации (RIA).
Антитело, обладающее «биологическим свойством» обозначенного антитела, такого как моноклональное антитело, обозначенное 2G7, представляет таковое, которое обладает одним или более биологическим свойством данного антитела, которое отличает его от других антител, которые связываются с тем же антигеном (например, ТФР-бета). Например, антитело с биологическим свойством 2G7 может блокировать активацию ТФР-бета и/или связываться с тем же эпитопом во внеклеточном домене ТФР-бета, который связывается с 2G7.
Если не указано иначе, то экспрессия «моноклонального антитела 2G7» относится к антителу, которое имеет антигенсвязывающие остатки, или выделенные из мышиного антитела 2G7 из примеров, представленных ниже. Например, моноклональное антитело 2G7 может представлять мышиное моноклональное антитело 2G7 или его вариант, такой как гуманизированное антитело 2G7, обладающее антигенсвязывающими аминокислотными остатками мышиного моноклонального антитела 2G7. Пример гуманизированных антител 2G7 приведены в примере 2 ниже. Если не указано иначе, то экспрессия «rhuMAb 2G7», в том смысле, в котором данный термин здесь используется, относится к антителу, включающему вариабельную последовательность легкой цепи (VL) и вариабельную последовательность тяжелой цепи (VH) соответственно последовательности SEQ ID NOS: 1 и 2, слитые с последовательностями константной области легкой и тяжелой цепи человеческого иммуноглобулина (не-А аллотипа), необязательно экспрессированные в клетках яичника китайского хомяка (СНО).
«Ингибирующее рост средство», в том смысле, в котором данный термин здесь используется, относится к соединению или композиции, которая ингибирует рост клетки, особенно экспрессирующей ТФР-бета опухолевой клетки в условиях in vitro или in vivo. Так, ингибирующее рост средство может представлять таковое, которое существенно снижает процент экспрессирующих ТФР-бета клеток в S-фазе. Примеры ингибирующих рост средств включают средства, которые блокируют протекание клеточного цикла (в ином месте, чем S-фаза), такие средства, которые индуцируют задержку в G1-фазе и задержку в М-фазе. Классические блокаторы М-фазы включают винкас (винкристин и винбластин), таксаны и ингибиторы топо II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Такие средства, которые задерживают G1-фазу, также вызывают задержку в S-фазе, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, меклоретамин, цисплатин, метотрексат, 5-фторурацил и ара-С. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, под названием «Cell cycle regulation, oncogenes and antineoplastic drugs», Murakami et al. (WB Saunders: Philadelphia, 1995), особенно стр. 13.
Примерами «ингибирующих рост» антител являются таковые, которые связываются с ТФР-бета и ингибируют рост опухолевых клеток с сверхэкспрессией ТФР-бета. Предпочтительные ингибирующие рост анти-ТФР-бета-антитела ингибируют рост опухолевых клеток молочной железы SK-BR-3 в культуре клеток более чем на 20%, и предпочтительно более чем на 50% (например, в пределах примерно от 50% до примерно 100%) при концентрации антител примерно от 0,5 до 30 мкг/мл, когда ингибирование роста определяют через шесть суток после воздействия антител на клетки SK-BR-3 (смотри патент США № 5677171 от 14 октября 1997 г.). Тест ингибирования роста клеток SK-BR-3 более подробно описан в данном патенте.
Антитело, которое «индуцирует гибель клеток», представляет таковое, которое вынуждает жизнеспособную клетку становиться нежизнеспособной. Как правило, клетка представляет таковую, которая экспрессирует рецептор ТФР-бета, особенно, когда клетка сверхэкспрессирует рецептор ТФР-бета. Предпочтительно клетка представляет опухолевую клетку, например, клетку опухоли молочной железы, яичников, желудка, эндометрия, слюнной железы, легких, почек, ободочной кишки, щитовидной железы, поджелудочной железы или мочевого пузыря. В условиях in vitro клетка может быть клеткой SK-BR-3, ВТ474, Calu 3, MDA-MB-453, MDA-MB-361 или SKOV3. Гибель клеток в условиях in vitro можно определить при отсутствии комплемента и иммунных эффекторных клеток для того, чтобы различить гибель клеток, индуцированную антителозависимой клеточноопосредованной цитотоксичностью (ADCC) или комплементзависимой цитотоксичностью (CDC). Так, тест определения гибели клеток можно провести с использованием инактивированной тепловой обработкой сывороткой крови (т.е. при отсутствии комплемента) и при отсутствии иммунных эффекторных клеток. Для определения того, насколько антитело способно индуцировать гибель клеток, можно оценить потерю целостности мембраны по поглощению иодида пропидия (PI), трипанового синего (смотри Moore et al., Cytotechnology, 17: 1-11 (1995)) или 7AAD по сравнению с необработанными клетками. Предпочтительные индуцирующие гибель клеток антитела представляют таковые, которые индуцируют поглощение PI в тесте оценки поглощения PI, на клетках ВТ474 (см. ниже).
Антитело, которое «индуцирует апоптоз» представляет таковое, которое индуцирует запрограммированную гибель клеток, что определяют по связыванию аннексина V, фрагментации ДНК, сморщиванию клеток, расширению эндоплазматического ретикулюма, фрагментации клеток и/или образованию мембранных везикул (называемых апоптозными телами). Как правило, клетка представляет таковую, которая сверхэкспрессирует рецептор ТФР-бета. Предпочтительно клетка является опухолевой клеткой, например, клеткой опухоли молочной железы, яичников, желудка, эндометрия, слюнной железы, легких, почек, ободочной кишки, щитовидной железы, поджелудочной железы или мочевого пузыря. В условиях in vitro клетка может быть клеткой SK-BR-3, ВТ474, Calu 3, MDA-MB-453, MDA-MB-361 или SKOV3. Имеются различные методы оценки клеточных событий, связанных с апоптозом. Например, можно определить транслокацию фосфатидилсерина (PS) при связывании аннексина; фрагментацию ДНК можно оценить по ступенчатости ДНК; и конденсацию ядра/хроматина наряду с фрагментацией ДНК можно оценить по увеличению количества гиподиплоидных клеток. Предпочтительно антителом, которое индуцирует апоптоз, является таковое, которое примерно в 2-50 раз, предпочтительно примерно в 5-50 раз и наиболее предпочтительно примерно в 10-50 раз больше индуцирует связывание аннексина по сравнению с необработанными клетками в тесте определения связывания аннексина при использовании клеток ВТ474 (смотри ниже). В некоторых случаях проапоптозное антитело будет представлять таковое, которое дополнительно блокирует связывание ТФР-бета (например, антитело 2G7); т.е. антитело разделяет биологические свойства с антителом против ТФР-бета. В других случаях антитело представляет таковое, которое в значительной степени не блокирует ТФР-бета. Кроме того, антитело может быть таким, которое, индуцируя апоптоз, не индуцирует значительного снижения процента клеток, находящихся в S-фазе (например, таковое, которое только вызывает примерно 0-10% снижение процента таких клеток по сравнению с контролем).
«Эпитоп 2G7» представляет область во внеклеточном домене ТФР-бета, с которой связывается антитело 2G7 (АТСС НВ 10240). Для скрининга антител, которые связываются с эпитопом 2G7, можно поставить обычный тест перекрестного блокирования, такой как описан в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988).
«Антитело против ТФР-бета» относится к антителу, которое связывается с любой изоформой ТФР-бета, предпочтительно связывается с ТФР-бета1, ТФР-бета2 или ТФР-бета3, или любой их комбинацией, более предпочтительно, по меньшей мере с ТФР-бета1, или, по меньшей мере, с ТФР-бета2 и наиболее предпочтительно с ТФР-бета1 или ТФР-бета1 вместе с ТФР-бета2. Необязательно антитело может связываться, по меньшей мере, с ТФР-бета3.
«Лечение» относится к терапевтическим и профилактическим мероприятиям. Те, кто нуждается в лечении, включают таковых, у которых уже имеются нарушения, а также таковых, у которых нарушение следует предотвратить. Следовательно, млекопитающее, которое подвергается лечению, можно определить как имеющее нарушение, или которое расположено или чувствительно к нарушению.
«Млекопитающее» для целей лечения относится к животному, которое классифицируется как млекопитающее, включая людей, домашних и сельскохозяйственных животных, а также зоопарковых, спортивных или комнатных животных, таких как собаки, лошади, кошки, коровы и т.д. Предпочтительно млекопитающее является приматом, таким как обезьяна, высшая обезьяна или человек, например, наиболее предпочтительно человеком.
«Нарушения, связанные с ТФР-бета» или «связанные с ТФР-бета нарушения» относятся к нарушению, заболеванию или состоянию, на которое будет оказывать положительное влияние лечение антителом против ТФР-бета. Они включают хронические и острые нарушения, или заболевания, включая такие патологические состояния, которые предрасполагают млекопитающее к данному нарушению. Нарушения для настоящего лечения включают заболевания, для которых характерно накопление внеклеточного матрикса, заболевания, вызванные циркулирующим ТФР-бета или активированного ТФР-бета в локальном месте, состояния, вызванные подавлением иммунной системы за счет эндогенной продукции ТФР-бета, острого иммунодефицита в результате тяжелых травм, ожогов и заболеваний, таких как вирусные или бактериальные заболевания, заболевания многих систем органов в результате продукции или очень высокой продукции ТФР-бета, и продуцирующих ТФР-бета опухолей. Неограничивающие примеры включают нейрональные, глиальные, астроцитальные, гипоталамусные и другие железистые, макрофагальные, эпителиальные, стромальные и бластокоельные нарушения, фиброз, рубцы, повреждение тканей, вызванное облучением, и адгезию во время заживления ран, фиброзные кожные нарушения, такие как склеродерма, тканевые рубцы за счет патологии ЦНС, кожные рубцы, келоидные рубцы, невральные рубцы, фиброзные заболевания брюшной полости, легких, печени и почек, такие как хронический фиброз печени, острое повреждение печени, интерстициальный фиброз легких и почек, и цирроз печени, кистозный фиброз, сосудистые нарушения, например, кардиальный фиброз, повреждение артерий, такое как атеросклероз и артериосклероз, доброкачественные и злокачественные опухоли, некоторые виды лейкемии, не подавляемые ТФР-бета и злокачественные новообразования (например, саркомы, карциномы и меланомы), включая злокачественные опухоли простаты, яичников, злокачественную меланому, молочной железы, легких, ободочной кишки, прямой кишки, ободочной и прямой кишки или шейки матки, и метастазы опухолей, а также нейроэндокринные опухоли органов пищеварительного тракта и глибластомы, ангиопатию, васкулопатию, нефропатию, рассеянный склероз, инфекции, такие как макрофагальные патогенные инфекции и вирусные инфекции, такие как гепатит С и СПИД, иммунологические, ангиогенные и воспалительные нарушения и дефицитные состояния, такие как ревматоидный артрит, глазные нарушения, особенно связанные с фиброзом глаз, включая пролиферативную ретинопатию, отслоение сетчатки и дренирование после операции по поводу глаукомы, такой как невральная сатчатка, пигментная сосудистая оболочка сетчатки и стекловидное тело человеческого глаза, и катаракты, остеопороз, респираторный дистресс-синдром взрослых, состояние после инфаркта миокарда, рестеноз после ангиопластики, гломерулонефрит, связанное с диабетом состояние, такое как гипергликемия, диабет, заболевание почек при диабете, нефропатия при диабете, нейропатия при диабете или ретинопатия, и заболевания, связанные с недостаточностью макрофагов.
Предпочтительно нарушение представляет фиброз, повреждение артерий, инфекцию, ревматоидный артрит, диабет или диабетическое состояние или злокачественную опухоль, такую как экспрессирующую ТФР-бета, более предпочтительно, когда опухоль характеризуется повышенной активацией ТФР-бета. Такая опухоль может экспрессировать в высоких количествах ТФР-бета, или альтернативно для нее не характерна сверхэкспрессия ТФР-бета.
Термин «эффективное количество» относится к количеству лекарственного препарата, эффективному для лечения заболевания или нарушение у млекопитающего. В случае злокачественной опухоли терапевтически эффективное количество лекарственного препарата может снизить количество опухолевых клеток; уменьшить размеры опухоли; подавлять (т.е. замедлять до некоторой степени и предпочтительно останавливать) инфильтрацию опухолевых клеток в периферические органы; подавлять (т.е., замедлять до некоторой степени и предпочтительно останавливать) метастазирование опухолей; ингибировать до некоторой степени рост опухолей; и/или ослаблять до некоторой степени один или более симптомов, связанных с опухолью. До некоторой степени лекарственный препарат может предупреждать рост и/или приводить к гибели имеющихся опухолевых клеток, он может быть цитостатическим и/или цитотоксическим. При лечении злокачественных опухолей эффективность можно, например, определить при оценке времени до прогрессирования заболевания (ТТР) и/или определении скорости ответной реакции (RR).
Термины «злокачественное заболевание» и «злокачественный» относятся или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется неконтролируемым ростом клеток. Примеры злокачественного заболевания включают, но не ограничиваются этим, карциному, лимфому, бластому, саркому и лейкемию или лимфоидные злокачественные образования. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточную злокачественную опухоль (например, эпителиальную плоскоклеточную опухоль), злокачественную опухоль легких, включая мелкоклеточную опухоль легких, немелкоклеточную злокачественную опухоль легких, аденокарциному легких и плоскоклеточную карциному легких, опухоль брюшины, гепатоцеллюлярную опухоль, злокачественную опухоль желудка, включая опухоли органов желудочно-кишечного тракта, злокачественную опухоль поджелудочной железы, глиобластому, опухоль шейки матки, опухоль яичников, опухоль печени, злокачественную опухоль мочевого пузыря, гепатому, злокачественную опухоль молочной железы, опухоль ободочной кишки, опухоль прямой кишки, опухоль ободочной и прямой кишки, карциному эндометрия или матки, карциному слюнных желез, злокачественную опухоль почек, опухоль простаты, опухоль вульвы, опухоль щитовидной железы, опухоль печени, карциному ануса, опухоль полового члена, а также опухоль головы и шеи.
«Экспрессирующая ТФР-бета опухоль» представляет таковую, которая продуцирует достаточные количества ТФР-бета на поверхности ее клеток так, что анти-ТФР-бета-антитело может связываться с ней и оказывать терапевтическое действие в отношении опухоли.
Опухоль, «характеризующаяся повышенной активацией», рецептора ТФР-бета представляет таковую, в которой степень активации рецептора ТФР-бета в опухолевой клетке значительно превышает уровень активации данного рецептора в неопухолевой клетке того же типа ткани. Такая повышенная активация может возникнуть в результате сверхэкспрессии рецептора ТФР-бета и/или выше по сравнению с нормальными концентрациями лиганда ТФР-бета, доступного для активирования рецептора ТФР-бета в опухолевых клетках. Такая избыточная активация может вызвать и/или может быть вызвана злокачественным состоянием опухолевой клетки. В некоторых вариантах осуществления злокачественную опухоль подвергнут диагностическому или прогностическому тесту для определения того, насколько имеет место амплификация и/или сверхэкспрессия рецептора ТФР-бета, которая приводит к такой повышенной активации рецептора ТФР-бета. Альтернативно или дополнительно опухоль можно подвергнуть диагностическому или прогностическому тесту для определения того, насколько имеет место амплификация и/или сверхэкспрессия рецептора ТФР-бета в опухоли, которая связана с избыточной активацией рецептора. В подгруппе таких опухолей избыточная активакция рецептора может возникнуть в результате аутокринного-стимулирующего пути.
На «аутокринном» стимулирующем пути происходит аутостимуляция за счет того, что опухолевая клетка продуцирует лиганд ТФР-бета и его родственный рецептор ТФР-бета. Например, опухоль может экспрессировать или сверхэкспрессировать рецептор ТФР-бета и также экспрессировать или сверхэкспрессировать лиганд ТФР-бета (например, ТФР-бета1).
Опухоль, которая «сверхэкспрессирует» рецептор ТФР-бета, представляет таковую, которая имеет значительно более высокие концентрации рецептора ТФР-бета на поверхности клеток по сравнению с незлокачественной клеткой того же типа ткани. Такая сверхэкспрессия может быть вызвана амплификацией гена или повышенной транскрипцией или трансляцией. Сверхэкспрессию рецептора ТФР-бета можно определить диагностическим или прогностическим тестом при оценке повышенных концентраций белка ТФР-бета на поверхности клетки (например, иммуногистохимическим методом; IHC). Альтернативно или дополнительно можно определить уровни кодирующей ТФР-бета нуклеиновой кислоты в клетке, например, флуоресцентной гибридизацией in situ (FISH; смотри WO 1998/45479, опубликованной в октябре 1998), саузерн-блоттингом или полимеразной цепной реакцией (ПЦР), такой как количественная ПЦР в режиме реального времени (RT-ПЦР). Можно также изучить сверхэкспрессию рецептора ТФР-бета при определении «слущивающегося» антигена (например, внеклеточный домен ТФР-бета) в биологической жидкости, такой как сыворотка крови (например, смотри патент США № 4933294 от 12 июня 1990 г.; WO 1991/05264, опубликованную 18 апреля 1991 г.; патент США № 5401638 от 28 марта 1995 г.; и Sias et al., J. Immunol. Methods, 132: 73-80 (1990)). Помимо указанных выше тестов специалистам в данной области известны различные тесты in vivo. Например, можно подвергнуть клетки в организме пациента воздействию антитела, которое необязательно помечено детектируемой меткой, например, радиоактивным изотопом, и можно оценить связывание антитела с клетками у пациента, например, внешним сканированием радиоактивности или анализом биопсийного материала, отобранного у пациента перед воздействием антитела.
В противоположность опухоль, которая «не характеризуется сверхэкспрессией рецептора ТФР-бета», представляет таковую, которая в диагностическом тесте не экспрессирует более высокие, чем в норме концентрации рецептора ТФР-бета по сравнению с незлокачественной клеткой такого же типа ткани.
Опухоль, которая «сверхэкспрессирует» лиганд ТФР-бета, представляет таковую, которая продуцирует значительно более высокие концентрации данного лиганда по сравнению с незлокачественной клеткой того типа ткани. Такая сверхэкспрессия может быть вызвана амплификацией гена или повышенной транскрипцией или трансляцией. Сверхэкспрессию лиганда ТФР-бета можно определить диагностически при оценке концентраций лиганда (или нуклеиновой кислоты, кодирующей его) у пациента, например, в биопсийном материале из опухоли или различными диагностическими тестами, такими как IHC, FISH, саузерн-блоттинг, ПЦР или тестами в условиях in vivo, описанными выше.
«Гормон-независимая» опухоль представляет таковую, в которой ее пролиферация не зависит от присутствия гормона, который связывается с рецептором, экспрессируемым клетками, в опухоли. Такие опухоли не претерпевают клинической регрессии при введении фармакологических веществ или оперативных вмешательств, которые приводят к снижению концентрации гормона в или около опухоли. Примеры гормон-независимых опухолей включают андроген-независимую опухоль простаты, эстроген-независимую опухоль молочной железы, опухоль эндометрия и опухоль яичников. Такие опухоли могут начать развиваться как гормон-зависимые опухоли и прогрессировать от гормон-чувствительной стадии до гормон-устойчивой опухоли после проведения антигормональной терапии.
Термин «цитотоксическое средство», в том смысле, в котором он здесь используется, относится к соединению, которое ингибирует или предупреждает функцию клеток и/или вызывает разрушение клеток. Термин предполагает включение радиоактивных изотопов (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu) и токсинов, таких как токсины с небольшой молекулой или энзиматически активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты.
«Химиотерапевтическое средство» представляет химическое соединение, пригодное для лечения опухолей. Примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXANTM); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, меклоретамин, окисный гидрохлорид меклоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитрозмочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофенольная кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квуламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; препараты антагонисты гормонов надпочечников, такие как аминоглутетимид, митотан, трилостан; восполнитель фолиевой кислоты, такой как фролиниковая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновая кислота; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демекольцин; диазиквон; элфорнитин; ацетат эллиптиния; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиниковая кислота; 2-этилгидразид; прокарбазин; PSK®крестин; разоксан; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2''-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-С»); циклофосфамид; тиотепа; таксаны (или таксоиды), например, паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Princeton, NY) и доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноевая кислота; эсперамицины; капецитабин и фармацевтически приемлемые соли, кислоты и производные любого из вышеуказанного.
Также в данное определение включаются антигормональные средства, которые функционируют для регуляции или ингибирования действия гормонов на опухоли, такие как антиэстрогены и избирательные модуляторы эстрогенных рецепторов (SERM), включая, например, тамоксифен (в том числе тамоксифен NOLVADEX®), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON®; ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующую продукцию эстрогенов в надпочечниках, например, такие как 4(5)-имидазолы, аминоглутетимид, мегестрол ацетат MEGASE®, экземестан AROMASIN®, форместан, фадрозол, ворозол RIVTSOR®, летрозол FEMARA® и анастрозол ARIMIDEX®; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также троксацитабин (аналог 1,3-диоксоланнуклеозида цитозина); антисмысловые олигонуклеотиды, в частности, ингибирующие экспрессию генов в сигнальных путях, принимающих участие в пролиферации клеток, такие как, например, РКС-альфа, Ralf и H-Ras; вакцины, такие как вакцины на основе генной терапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®, PROLEUKIN® rIL-2; ингибитор топоизомеразы 1 LURTOTECAN®; ABARELIX® rmRH; и фармацевтически приемлемые соли, кислоты и производные любого из вышеуказанного.
В том смысле, в котором он здесь используется, «лекарственный препарат, направленный на EGFR» относится к терапевтическому средству, которое связывается с EGFR и, необязательно ингибирует активацию EGFR. Примеры таких средств включают антитела и небольшие молекулы, которые связываются с EGFR. Примеры антител, которые связываются с EGFR, включают MAb 579 (ATCC CRL HB 8506), MAb 455 (ATCC CRL HB 8507), MAb 225 (ATCC CRL 8508), MAb 528 (ATCC CRL 8509) (смотри патент США № 4943533, Mendelsohn et al.) и их варианты, такие как химеризированное антитело 225 (С225) и реконструированное человеческое антитело 225 (Н225) (смотри WO 1996/40210, Imclone Systems Inc.); антитела, которые связываются с мутантным EGFR типа II (патент США № 5212290); гуманизированные и химерные антитела, которые связываются с EGFR, как описано в патенте США № 5891996; и человеческие антитела, которые связываются с EGFR (смотри WO 1998/50433, Abgenix). Анти-EGFR-антитело можно конъюгировать с цитотоксическим препаратом, получая, таким образом, иммуноконъюгат (например, смотри ЕР 659439, Merck Patent GmbH). Примеры небольших молекул, которые связываются с EGFR, включают ZD 1839 (Astra Zeneca), CP-358774 (OSI/Pfizer) и AG1478.
«Терапевтическое средство иное чем гуманизированное антитело» относится к любому средству, которое является эффективным при лечении нарушения, связанного с ТФР-бета, иное чем настоящие антитела, и включают типы, перечисленные ниже.
«Антиангиогенное средство» относится к соединению, которое блокирует или до некоторой степени оказывает отрицательное влияние на развитие кровеносных сосудов. Антиангиогенный фактор может представлять собой, например, небольшую молекулу или антитело, которые связываются с фактором роста или рецептором фактора роста, участвующими в ангиогенезе. Примеры включают антагонисты васкулярного эндотелиального фактора роста (VEGF), такие как антитела, которые специфически связываются с VEGF, например, AVASTIN®. «Антитела, которые связываются с VEGF», включают химерные, человеческие и гуманизированные антитела, а также фрагменты, и также включают антитела, которые блокируют или нейтрализуют VEGF или блокируют связывание VEGF с одним или более рецептором VEGF, предпочтительно обоими рецепторами.
Выражение «регуляторы иммунной функции у млекопитающего» относятся к цитокинам и факторам роста, которые регулируют иммунную функцию млекопитающего, включая интерлейкины, фактор некроза опухолей, лимфотоксин, эпидермальный фактор роста, тромбоцитарный фактор роста, ТФР-α, фактор, ингибирующий миграцию макрофагов, фактор активации макрофагов, фактор роста фибробластов, макрофагальные активирующие факторы, интерфероны и колониестимулирующие факторы. Данные регуляторы можно получить из природных источников, продуцировать с использованием лейкоцитов, синтезировать химическими методами, если это является подходящим, или получить рекомбинантными методами. Предпочтительными являются IL-1, IL-2, IL-6 и IFN-β.
Термин «цитокин» представляет общий термин для белков, выделяемых одной популяцией клеток, которые воздействуют на другие клетки в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и обычные полипептиные гормоны. В цитокины включены гормон роста, такой как человеческий гормон роста, N-метионил человеческий гормон роста и бычий гормон роста; гормон паращитовидной железы; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тироидстимулирующий гормон (TSH) и лютеинизирующий гормон (LH); печеночный фактор роста; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор-α и -β некроза опухолей; муллериан-ингибирующее вещество; мышиный связанный с гонадотропином пептид; инхибин; активин; васкулярный эндотелиальный фактор роста; интегрин; тромбопоэтин (ТРО); факторы роста нервов, такие как NGF-β; тромбоцитарный фактор роста; инсулиноподобный фактор-I и -II роста; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β и -γ; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (М-CSF); гранулоцитарный-макрофагальный-CSF(GM-CSF); и гранулоцитарный CSF(G-CSF); интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; фактор некроза опухолей, такой как TNF-α или TNF-β; и другие полипептидные факторы, включая LIF и набор-лиганд (KL). В том смысле, в котором он здесь используется, термин цитокин включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквивалентные варианты цитокинов с природной последовательностью.
Термин «пролекарство», в том смысле, в котором он используется в данной заявке, относится к предшественнику или производному фармацевтически активного соединения, которое обладает меньшей цитотоксичностью по сравнению с исходным препаратом и способно ферментативно активироваться или превращаться в более активную исходную форму. Смотри, например, Wilman, «Prodrugs in Cancer Chemotherapy» Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al., «Prodrugs: A Chemical Approach to Targeted Drug Delivery», Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). Пролекарства по данному изобретению включают, но не ограничиваются этим, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, D-аминокислотой-модифицированные пролекарства, гликозилированные пролекарства, β-лактамсодержащие пролекарства, необязательно замещенные феноксиацетамид-содержащие пролекарства или необязательно замещенные фенилацетамид-содержащие пролекарства, 5-фторцитозин и другие пролекарства на основе 5-фторуридина, которые могут превращаться в более активный цитотоксический свободный препарат. Примеры цитотоксических лекарственных препаратов, которые можно превратить в пролекарство для применения в данном изобретении, включают, но не ограничиваются этим, химиотерапевтические средства, описанные выше.
«Липосома» представляет небольшую везикулу, состоящую из различных типов липидов, фосфолипидов и/или поверхностно-активных веществ, пригодную для доставки препарата (такого как анти-ТФР-бета-антитела, раскрытые здесь и необязательно химиотерапевтическое средство) млекопитающему. Компоненты липосом обычно выстраиваются в бислой, аналогичный расположению липидов в биологической мембране.
Термин «вкладыш в упаковке» используется в отношении инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применениях, дозировке, введении, противопоказаниях и/или предупреждениях, касающихся применения данных терапевтических продуктов.
«Кардиопротектор» представляет соединение или композицию, которые предотвращают или уменьшают дисфункцию миокарда (т.е. кардиомиопатию и/или застойную сердечную недостаточность), связанную с введением лекарственного препарата, такого как антибиотик антрациклинового ряда и/или анти-ТФР-бета-антитело, пациенту. Например, кардиопротектор может блокировать или уменьшать опосредуемый свободными радикалами кардиотоксический эффект и/или предотвращать или уменьшать повреждение в результате окислительного стресса. Примеры кардиопротекторов, включенных в настоящее определение, включают декстразоксан, хелатное соединение с железом (ICRF-187) (Seifert et al., The Annals of Pharmacotherapy, 28: 1063-1072) (1994)); средство, снижающее уровень липидов и/или антиоксидант, такой как пробукол (Singal et al., J. Mol. Cell Cardiol., 27: 1055-1063 (1995)); амифостин (аминотиол 2-[(3-аминопропил)амино]этантиол кислый фосфатный эфир, также называемый WR-2721, и его дефосфорилированная форма для поглощения клетками, называемая WR-1065) и S-3-(3-метиламинопропиламино)пропилфосфоротиоевая кислота (WR-151327), смотри Green et al., Cancer Research, 54: 738-741 (1994); дигоксин (Bristow, M.R. In: Bristow M.R. ed. Drug-Induced Heart Disease (New York: Elsevier 191-215 (1980)); бета-блокаторы, такие как метопролол (Hjalmarson et al., Drugs, 47: Suppl 4: 31-9 (1994); и Shaddy et al., Am. Heart J., 129: 197-199 (1995)); витамин Е; аскорбиновая кислота (витамин С); гасители свободных радикалов, такие как олеанолевая кислота, урсоловая кислота и N-ацетилцистеин (NAC); спин-захватывающие соединения, такие как альфа-фенил-трет-бутилнитрон (PBN) (Paracchini et al., Anticancer Res., 13: 1607-1612 (1993)); селеноорганические соединения, такие как Р251 (Elbesen) и тому подобное.
«Выделенная» молекула нуклеиновой кислоты представляет молекулу нуклеиновой кислоты, которая идентифицирована и отделена, по меньшей мере, от одной загрязняющей молекулы нуклеиновой кислоты, с которой она обычно связана в природном источнике нуклеиновой кислоты, кодирующей антитело. Выделенная молекула нуклеиновой кислоты представляет иную, чем в форме или окружении, в которых она обнаружена в природе. Следовательно, выделенные молекулы нуклеиновой кислоты отличаются от молекулы нуклеиновой кислоты в том виде, в котором она находится в естественных клетках. Однако выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, находящуюся в клетках, которые обычно экспрессируют антитело, где, например, молекула нуклеиновой кислоты находится в положении хромосомы, отличающемся от естественных клеток.
Экспрессия «регулирующих последовательностей» относится к последовательностям ДНК, необходимым для экспрессии, функционально связанной кодирующей последовательности в конкретном организме-хозяине. Регулирующие последовательности, которые подходят для прокариотов, например, включают промотор, необязательно операторную последовательность и сайт связывания с рибосомами. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота «функционально связана», когда ее помещают в функциональную связь с другой нуклеиновокислотной последовательностью. Например, ДНК для препоследовательности или секреторного лидера функционально связана с ДНК для полипептида, если он экспрессируется в виде препротеина, который принимает участие в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он оказывает влияние на транскрипцию последовательности; сайт связывания с рибосомами функционально связан с кодирующей последовательностью, если он расположен таким образом, чтобы облегчить трансляцию. Как правило, «функционально связанный» означает, что связанные последовательности ДНК являются смежными и в случае секреторного лидера являются смежными и находятся в фазе считывания. Однако энхансеры необязательно являются смежными. Связывание происходит лигированием в соответствующих сайтах рестрикции. Если такие сайты отсутствуют, то применяют синтетические адапторы или линкеры согласно обычной практике.
В том смысле, в котором здесь используются данные выражения, «клетка», «клеточная линия» и «клеточная культура» применяются взаимозаменяемо, и все такие определения включают потомство. Так, слова «трансформанты» и «трансформированные клетки» включают первичные данные клетки, полученные из них культуры без учета количества трансфекций. Также следует понимать, что все такое потомство может не быть точно идентично по содержанию ДНК за счет преднамеренных или случайных мутаций. Мутантное потомство, которое обладает той же функцией или биологической активностью в скрининге, характерных для исходных трансформированных клеток, также включается. В тех случаях, когда имеются определенные обозначения, то это будет понятно из контекста.
В том смысле, в котором здесь используется данный термин, «проба из организма» относится к жидкости или биологической пробе, которая содержит или может содержать ТФР-бета для определения. Проба включает жидкости, такие как жидкости организма человека или животных, например, кровь, сыворотку крови, мочу, амниотическая жидкость, экстракты тканей, спинно-мозговая жидкость и тому подобное. Для проб может потребоваться специальная обработка, такая как экстракция перед анализом в зависимости от способности содержащихся в ней компонентов к разложению, агрегации или абсорбции в контейнере для хранения.
II. Получение гуманизированных анти-ТФР-бета-антител
В данной области описаны способы получения гуманизированных антител, не относящихся к человеческим антителам. Предпочтительно гуманизированное антитело содержит один или более аминокислотных остатков, вставленных в него из источника, который не относится к человеческому. Данные не-человеческие аминокислотные остатки часто относят к «импортируемым» остаткам, которые, как правило, взяты из «импортируемого» вариабельного домена. Гуманизацию можно в основном проводить согласно методу Winter и соавторов (Jones et al., Nature, 321: 522-525 (1986); Reichmann et al., Nature, 332: 323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988)) заменой последовательностей гипервариабельной области на соответствующие последовательности человеческого антитела. Следовательно, такие «гуманизированные» антитела являются химерными антителами (патент США № 4816567), в которых в основном меньший, чем интактный человеческий вариабельный домен замещен на соответствующую последовательность от видов, не относящихся к человеку. На практике, как правило, гуманизированные антитела являются человеческими антителами, в которых некоторые остатки гипервариабельной области и возможно некоторые остатки FR замещены на остатки из аналогичных сайтов в антителах грызунов.
Другой метод получения гуманизированных антител описан в публикации патента США 2003/0017534, опубликованной 23 января 2003, в который гуманизированные антитела и препараты антител получают от трансгенных животных, не относящихся к человеку. Животных, не относящихся к человеку, получают генной инженерией для включения одного или более локусов гуманизирванного иммуноглобулина, которые способны претерпевать перегруппировку генов и превращение генов у трансгенных животных, не относящихся к человеку, с получением различных гуманизированных иммуноглобулинов.
Выбор человеческих вариабельных доменов как легкой, так и тяжелой цепей для использования при получении гуманизированных антител является очень важным для снижения антигенности. Согласно так называемому методу «наилучшей подгонки» последовательность вариабельного домена антитела грызунов подвергают скринингу против целой библиотеки известных последовательностей человеческих вариабельных доменов. Человеческую последовательность, которая является самой близкой к таковой у грызунов, принимают на человеческий каркасный участок (FR) для гуманизированного антитела (Sims et al., J. Immunol., 151: 2296 (1993); Chorthia et al., J. Mol. Biol., 196: 901 (1987)). В другом методе используется определенный каркасный участок, полученный из консенсусной последовательности всех человеческих антител определенной подгруппы легкой или тяжелой цепей. Тот же каркасный участок можно использовать для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89: 4285 (1992); Presta et al., J. Immunol., 151: 2623 (1993)).
Также важно, чтобы антитела были гуманизированы с сохранением высокой аффинности к антигену и других полезных биологических свойств. Для достижения этой цели согласно предпочтительному способу гуманизированные антитела получают способом анализа исходных последовательностей и различных умозрительных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных антител. Обычно имеются трехмерные модели иммуноглобулинов, и они известны специалистам в данной области. Имеются компьютерные программы для иллюстрации и расположения возможных трехмерных конформационных структур выбранных последовательностей иммуноглобулинов-кандидатов. Исследование данных дисплеев позволяет анализировать возможную роль остатков в функционировании последовательностей иммуноглобулинов-кандидатов, т.е. анализировать остатки, которые оказывают влияние на способность иммуноглобулина-кадидата связываться с антигеном. Таким образом, остатки FR можно выбрать и объединить от реципиента и вставить последовательности так, чтобы достичь желаемого свойства антитела, такого как повышенная аффинность в отношении антигена-мишени. В основном остатки гипервариабельной области непосредственно и главным образом влияют на связывание с антигеном.
В примере 2 ниже описана продукция примерных гуманизированных анти-ТФР-бета-антител, которые связываются с ТФР-бета. Гуманизированное антитело содержит остатки нечеловеческой гипервариабельной области, включенной в человеческий вариабельный домен тяжелой цепи и дополнительно содержит замену каркасного участка (FR) в положении, выбранном из группы, состоящей из 48, 49, 67, 69, 71, 73 и 78 с использованием системы нумерации вариабельных доменов, представленной Kabat et al., выше. В одном варианте осуществления гуманизированное антитело содержит замены FR в двух или более положениях 48, 49, 67, 69, 71, 73 и 78; и в других вариантах осуществления в трех или более таких положениях. В предпочтительных вариантах осуществления антитело содержит замены FR в положениях 49, 67 и 71, или положениях 48, 49 и 71, или положениях 49, 69 и 71, или положениях 49, 69, 71 и 73, или положениях 49, 71 и 73, или положениях 49, 71 и 78. Предпочтительно, чтобы имелось как можно меньше замен каркасного участка для сведения к минимуму иммуногенности, но также большое значение следует придавать эффективности. Фактически замещенными аминокислотами являются таковые, которые предпочтительно представляют консервативные, так чтобы не привести к изменению иммуногенности или эффективности. В положении 48 предпочтительной является замена валина на изолейцин, в положении 49 предпочтительной является замена аланина на глицин, в положении 67 предпочтительной является замена фенилаланина на аланин, в положении 69 предпочтительной является замена фенилаланина на аланин, в положении 71 предпочтительной является замена аргинина на аланин, в положении 73 предпочтительной является замена аспарагина на лизин и в положении 78 предпочтительной является замена лейцина на аланин.
Примерное гуманизированное интересующее антитело содержит определяющие комплементарность остатки вариабельного домена тяжелой цепи GYAFTNYLIE (последовательность SEQ ID NO: 41), VNNPGSGGSNYNEKFKG (последовательность SEQ ID NO: 42) или VINPGSGGSNYNEKFKG (последовательность SEQ ID NO: 43); и/или SGGFYFDY (последовательность SEQ ID NO: 44), необязательно включающие аминокислотные модификации данных остатков CDR, например, где модификации в основном сохраняют или повышают аффинность антитела. Например, интересующий вариант антитела может содержать примерно от одной до примерно семи или примерно пяти замен аминокислот в вышеприведенных вариабельных последовательностях тяжелой цепи CDR. Такие варианты антител можно получить созреванием аффинности, например, как описано ниже. Предпочтительно остатками являются две или более из GYAFTNYLIE (последовательность SEQ ID NO: 41), VNNPGSGGSNYNEKFKG (последовательность SEQ ID NO: 42) или VINPGSGGSNYNEKFKG (последовательность SEQ ID NO: 43); наиболее предпочтительно все три; и/или SGGFYFDY (последовательность SEQ ID NO: 44). Наиболее предпочтительное гуманизированное антитело содержит аминокислотную последовательность вариабельного домена тяжелой цепи в последовательности SEQ ID NO: 4 или одну с GYAFTNYLIE (последовательность SEQ ID NO: 41), VINPGSGGSNYNEKFKG (последовательность SEQ ID NO: 43); и SGGFYFDY (последовательность SEQ ID NO: 44).
Гуманизированное антитело может содержать определяющие комплементарность остатки вариабельного домена легкой цепи RASQSVLYSSNQKNYLA (последовательность SEQ ID NO: 36) или RASQGISSYLA (последовательность SEQ ID NO: 37); WASTRES (последовательность SEQ ID NO: 38) или YASSLQS (последовательность SEQ ID NO: 39); и/или HQYLSSDT (последовательность SEQ ID NO: 40), например, в дополнении к остаткам CDR вариабельного домена тяжелой цепи, представленным в предшествующем абзаце. Такие гуманизированные антитела, необязательно содержат аминокислотные модификации вышеуказанных остатков CDR, например, где модификации в основном сохраняют или повышают аффинность антитела. Например, интересующий вариант антитела может содержать примерно от одной до примерно семи или примерно пяти замен аминокислот в вышеприведенных вариабельных последовательностях легкой цепи CDR. Такие варианты антител можно получить созреванием аффинности, например, как описано ниже. Предпочтительно остатками являются две или более из RASQSVLYSSNQKNYLA (последовательность SEQ ID NO: 36); WASTRES (последовательность SEQ ID NO: 38); и/или HQYLSSDT (последовательность SEQ ID NO: 40), наиболее предпочтительно все три. Наиболее предпочтительное гуманизированное антитело содержит аминокислотную последовательность вариабельного домена легкой цепи в последовательности SEQ ID NO: 3.
Настоящая заявка также включает антитела со зрелой аффиностью, которые связываются с ТФР-бета. Исходное антитело может представлять собой человеческое антитело или гуманизированное антитело, например, содержащее вариабельные последовательности легкой и/или тяжелой цепей соответственно SEQ ID NO: 3 и 4 (т.е. вариант 5). Антитело со зрелой аффиностью предпочтительно связывается с ТФР-бета с аффиностью, превышающей таковую для мышиного антитела 2G7 или варианта 5 (например, с повышенной примерно от 2 или примерно 4 раз до примерно 100 или примерно 1000 раз аффиностью, например, при оценке ТФР-бета-внеклеточного домена (ECD) с помощью ELISA).
Предполагаются различные формы гуманизированного антитела или антитела со зрелой аффиностью. Например, гуманизированное антитело или антитело со зрелой аффиностью может представлять фрагмент антитела, такой как Fab, который необязательно конъюгирован с одним или более цитотоксическим средством(и) для получения иммуноконъюгата. Альтернативно гуманизированное антитело или антитело со зрелой аффиностью может представлять интактное антитело, такое как интактное IgG1 антитело.
Были разработаны различные методики для получения фрагментов антител гуманизированных антител. Традиционно данные фрагменты получали протеолитическим перевариванием интактных антител (смотри, например, Morimoto et al., Journal of Biochemical and Biophysical Methods, 24: 107-117 (1992); и Brennan et al., Science, 229: 81 (1985)). Однако в настоящее время данные фрагменты можно получить непосредственно с использованием рекомбинантных клеток-хозяев. Например, фрагменты антител можно выделить из фаговых библиотек антител, обсужденных выше. Альтернативно фрагменты Fab'-SH можно непосредственно получить из E. coli и связать химически с образованием фрагментов F(ab')2 (Carter et al., Bio/Technology, 10: 163-167 (1992)). Согласно другому подходу фрагменты F(ab')2 можно непосредственно выделить из культуры рекомбинантных клеток-хозяев. Специалистам в данной области известны другие методы получения фрагментов антител. В других вариантах осуществления антителом выбора является одноцепочечный фрагмент Fv (scFv). Смотри WO 1993/16185; патент США № 5571894 и патент США № 5587458. Фрагмент антитела может также представлять «линейное антитело», например, описанное в патенте США № 5641870. Такие фрагменты линейного антитела могут быть моноспецифическими или биспецифическими.
Биспецифические антитела представляют антитела, которые обладают специфичностью связывания, по меньшей мере, с двумя различными эпитопами. Примерные биспецифические антитела могут связываться с двумя различными эпитопами белка ТФР-бета. Другие такие антитела могут сочетать сайт связывания с ТФР-бета со связывающим сайтом(и) для HER-2, EGFR, ErbB, ErbB3 и/или ErbB4. Альтернативно анти-ТФР-бета-плечо можно объединить с плечом, которое связывается с запускающей молекулой на лейкоците, такой как молекула рецептора Т-клетки (например, CD2 или CD3) или рецепторами Fc для IgG (FcγR), такими как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16), таким образом, чтобы сфокусировать защитные клеточные механизмы на экспрессирующей ТФР-бета клетке. Биспецифические антитела также можно использовать для расположения цитотоксических средств в клетках, которые экспрессируют ТФР-бета. Данные антитела обладают связывающим ТФР-бета плечом и плечом, которое связывается с цитотоксическим средством (например, сапорином, анти-интерфероном-α, винка-алкалоидом, цепью рицина А, метотрексатом или гаптеном радиоактивного изотопа). Биспецифические антитела можно получить в виде полноразмерных антител или фрагментов антител (например, биспецифических антител F(ab')2).
В WO 1996/16673 описывается биспецифическое анти-ТФР-бета/анти-FcγRIII-антитело и в патенте США № 5837234 описывается биспецифическое анти-ТФР-бета/анти-FcγRI-антитело. Биспецифическое анти-ТФР-бета/анти-Fcα-антитело описано в WO 1998/02463. В патенте США № 5821337 описано биспецифическое анти-ТФР-бета/анти-CD3-антитело.
Способы получения биспецифических антител известны в данной области. Традиционное получение полноразмерных биспецифических антител основано на коэкспрессии двух пар тяжелой цепи-легкой цепи иммуноглобулина, где две цепи обладают различной специфичностью (Millstein et al., Nature, 305: 537-539 (1983)). В результате произвольного выбора иммуноглобулиновых тяжелой и легкой цепей данные гибридомы (квадромы) продуцируют потенциальную смесь 10 различных молекул антител, из которых только одна имеет правильную биспецифическую структуру. Очистка правильной молекулы, которую обычно проводят стадиями аффинной хроматографии, является довольно громоздкой и выход продукта низкий. Аналогичные методики раскрыты в WO 1993/08829 и Traunecker et al., EMBO J., 10: 3655-3659 (1991).
Согласно другому подходу вариабельные домены антитела с желаемой специфичностью связывания (сайты объединения антитело-антиген) гибридизуют с последовательностями константного домена иммуноглобулина. Гибридизованный продукт предпочтительно представляет константный домен тяжелой цепи иммуноглобулина, включающий, по меньшей мере, шарнирные области, СН2 и СН3. Предпочтительно иметь первую константную область тяжелой цепи (СН1) с сайтом, необходимым для связывания с легкой цепью, присутствующей, по меньшей мере одном, гибридизованном продукте. ДНК, кодирующие слитые тяжелые цепи иммуноглобулина и, если желательно, легкую цепь иммуноглобулина, вставляют в отдельные экспрессирующие векторы и котрансфицируют в подходящий организм-хозяин. Это обеспечивает высокую пластичность при подгонке взаимных участков трех полипептидных фрагментов в вариантах осуществления, когда используются неравные соотношения трех полипептидных цепей в конструкции с обеспечением оптимального выхода. Однако возможно вставить кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор, когда экспрессия, по меньшей мере, двух полипептидных цепей в равных соотношениях приводит к высокому выходу или когда соотношения не имеют особого значения.
В предпочтительном варианте осуществления данного подхода биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече и гибридной парой тяжелая цепь-легкая цепь иммуноглобулина (с обеспечением второй специфичности связывания) в другом плече. Было установлено, что данная асимметричная структура облегчает отделение желаемого биспецифического соединения от нежелательных комбинаций иммуноглобулиновых цепей, поскольку присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает легкий путь отделения. Данный подход раскрыт в WO 1994/04690. Например, дополнительные детали получения биспецифических антител смотри у Suresh et al., Methods in Enzymology, 121: 210 (1986).
Согласно другому подходу, описанному в патенте США № 5731168, поверхность раздела между парой молекул антител можно сконструировать для получения максимального процента гетеродимеров, которые выделяют из культуры рекомбинантных клеток. Предпочтительная поверхность раздела содержит, по меньшей мере, часть домена СН3 константного домена антитела. В данном методе одну или более небольших боковых аминокислотных цепей из поверхности раздела первой молекулы антитела заменяют на более крупные боковые цепи (например, тирозин или триптофан). Создают компенсаторные «полости» идентичного или одинакового размера с крупной боковой цепью(и) на поверхности раздела второй молекулы антитела при замещении крупных аминокислотных боковых цепей на более мелкие (например, аланин или треонин). Это обеспечивает механизм повышения выхода гетеродимера по сравнению с нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела включают поперечно-сшитые или «гетероконъюгированные» антитела. Например, одно из антител в гетероконъюгате можно сочетать с авидином, другое - с биотином. Такие антитела, например, были предложены для целенаправленного воздействия на иммунные клетки в отличие от нежелательных клеток (патент США № 4676980) и для лечения ВИЧ-инфекции (WO 1991/00360, WO 1992/200373 и ЕР 03089). Гетероконъюгированные антитела можно получить любыми методами поперечного сшивания. Подходящие агенты для поперечного сшивания хорошо известны в данной области и они описаны, например, в патенте США № 4676980, наряду с рядом методов поперечного сшивания.
В литературе также описаны методы получения биспецифических антител из фрагментов антител. Например, биспецифические антитела можно получить с использованием химической связи. Brennan et al., Science, 229: 81 (1985) описывают методику, в которой интактные антитела протеолитически расщепляют с получением фрагментов F(ab')2. Данные фрагменты восстанавливают в присутствии дитиол-комплексобразующего агента арсенита натрия для стабилизации соседних дитиолов и предупреждения образования межмолекулярных дисульфидных связей. Затем полученные фрагменты Fab' превращают в производные тионитробензоата (TNB). Затем одно из производных Fab'-TNB вновь превращают в Fab'-тиол восстановлением меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB с образованием биспецифического антитела. Полученные биспецифические антитела можно использовать в качестве средств для селективной иммобилизации ферментов.
Недавние достижения способствуют непосредственному выделению фрагментов Fab'-SH из E. coli, которые можно объединить химическим путем с образованием биспецифических антител. Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описывают получение молекулы полностью гуманизированного биспецифического антитела F(ab')2. Каждый фрагмент Fab' отдельно секретируется E. coli и подвергается прямому химическому сочетанию с образованием биспецифического антитела в условиях in vitro. Полученное таким образом биспецифическое антитело способно связываться с клетками, сверхэкспрессирующими рецептор ТФР-бета, и нормальными человеческими Т-клетками, а также «запускать» литическую активность человеческих цитотоксических лимфоцитов для человеческих клеток-мишеней опухоли молочной железы.
Также описаны различные методики получения и выделения фрагментов биспецифического антитела непосредственно из культуры рекомбинантных клеток. Например, были получены биспецифические антитела с использованием лейциновых «застежек-молний». Kostelny et al., J. Immunol., 148 (5): 1547-1553 (1992). Пептиды лейциновой «застежки-молнии» из белков Fos и Jun связаны с участками Fab' двух различных антител слиянием генов. Гомодимеры антител восстанавливали в шарнирной области с образованием мономеров и затем вновь окисляли с образованием гетеродимеров антител. Данный метод также можно использовать для продукции гомодимеров антител. Технология получения «диател», описанная Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993), обеспечивает альтернативный механизм получения фрагментов биспецифических антител. Фрагменты включают вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) с помощью линкера, который является слишком коротким, чтобы происходило соединение двух доменов в одной цепи. Следовательно, домены VH и VL одного фрагмента вынуждены соединяться с комплементарыми доменами VH и VL другого фрагмента, образуя таким образом два антигенсвязывающих сайта. Имеются сообщения о другой стратегии получения фрагментов биспецифических антител при использовании димеров одноцепочечных Fv (sFv). Смотри Gruber et al., J. Immunol., 152: 5368 (1994).
Предусматриваются антитела с более чем двумя валентностями. Например, можно получить триспецифические антитела. Tutt et al., J. Immunol., 147: 60 (1991).
Можно оценить ингибирующее рост действие антитела при определении, например, его способности нейтрализовать, оказывать антагонистическое действие или ингибировать активность ТФР-бета, например, существенно предупреждать, по меньшей мере, одну из нежелательной ингибирующей рост, иммуносупрессивной, образующей строму (т.е. элементы стромы, включая воспалительные клетки, эндотелиальные клетки и фибробласты) или «якорь»-независимой стимулирующей рост активностей зрелого ТФР-бета, как это определено в литературе. Таким образом, антитело способно блокировать активность всех эндогенных ТФР-бета, продуцированных опухолью и супрессорными лимфоидными клетками (Т-клетками). Одним способом определения такой нейтрализации является оценка ингибирования поглощения 3Н-тимидина клеточной линией легочных фибробластов норки, например, Mv-3D9, когда увеличивается концентрация антитела, то активность ТФР-бета постоянно уменьшается, линейно или нелинейно. Линия легочных клеток норки является очень чувствительной к ингибирующему рост действию ТФР-бета, и данный тест является относительно простым для постановки. В основном тест проводят при инкубации клеток со смесью ТФР-бета и антитела в минимальной эссенциальной среде, содержащей 2 мМ глутамина и 5% фетальной бычьей сыворотки в течение 18-24 ч при 37°С в атмосфере 5% СО2 и затем введении 1 мккюри 3Н-тимидина в 20 мкл и сборе через 4 ч при 37°С. Предпочтительно антитело будет способно ингибировать пролиферацию клеток под действием ТФР-бета в большей степени по сравнению с моноклональным антителом 2G7. Другим методом оценки ингибирующего рост действия антитела является определение того, насколько оно ингибирует ТФР-бета в тесте пролиферации мезангиальных клеток, представленном в примерах ниже. Антитела также являются пригодными для постановки теста связывания рецептора или радиорецепторного анализа обычным образом при инкубировании смеси меченного радиоизотопом ТФР-бета (например, меченного радиоактивным иодом rhTФP-бета1) и антитела с клетками, содержащими рецептор ТФР-бета (например, легочными фибробластами норки, такими как клеточная линия Mv1Lu, которая доступна из АТСС под номером АТСС № CCL-64) и определении, насколько антитело блокирует связывание меченого ТФР-бета с рецептором.
Для выбора антител, индуцирующих гибель клеток, потерю целостности мембраны, на что указывают данные, например, по поглощению PI, трипанового синего или 7AAD, можно оценить по сравнению с контролем. Предпочтительным тестом является тест определения поглощения PI при использовании клеток ВТ474. Согласно данному методу клетки ВТ474 (которые можно получить из Американской коллекции типовых культур (Manassas, VA)) культивируют в среде Игла, модифицированной по способу Дульбекко (D-MEM): Ham's F-12 (50:50) с добавлением 10% инактивированной тепловой обработкой FBS (Hyclone) и 2 мМ L-глутамина. (Таким образом, тест проводят при отсутствии комплемента и иммунных эффекторных клеток). Клетки ВТ474 высевают с плотностью 3×106 на чашку в чашках размером 100×20 мм и культивируют в течение ночи. Затем среду удаляют и заменяют одной свежей средой или средой, содержащей 10 мкг/мл соответствующего моноклонального антитела. Клетки инкубируют в течение 3 суток. После каждой обработки монослои промывают забуференным фосфатом физиологическим раствором (PBS) и разделяют обработкой трипсином. Затем клетки центрифугируют при 1200 об/мин в течение 5 мин при 4°С и осадок после центрифугирования ресуспендируют в 3 мл охлажденного на льду Са2+-буфера для связывания (10 мМ Hepes, рН 7,4, 140 мМ NaCl, 2,5 мМ CaCl2) и аликвотные порции переносят в пробирки размером 12×75 с 35 мм ситом-крышкой (1 мл на пробирку, 3 пробирки на обработку) для удаления клеточных комочков. Затем в пробирки вносят PI (10 мкг/мл). Пробы можно анализировать с использованием проточного цитометра FACSCANTM и программного обеспечения FACSCONVERTTM CellQuest (Becton Dickinson). Те антитела, которые индуцируют статистически значимый уровень гибели клеток по данным поглощения PI, можно отобрать в качестве индуцирующих гибель клеток антител.
Для отбора антител, индуцирующих апоптоз, имеется тест связывания аннексина с использованием клеток ВТ474. Клетки ВТ474 культивируют и высевают на чашки, как уже указывалось в предшествующем абзаце выше. Затем среду удаляют и заменяют одной свежей средой или средой, содержащей 10 мкг/мл моноклонального антитела. После инкубации в течение 3 суток монослои промывают PBS и клетки разделяют обработкой трипсином. Затем клетки центрифугируют, ресуспендируют в Са2+-буфере для связывания и аликвотные порции переносят в пробирки, как описано выше для постановки теста определения гибели клеток. Затем в пробирки вносят меченый аннексин (например, аннексин V-FTIC) (1 мкг/мл). Пробы можно анализировать с использованием проточного цитометра FACSCANTM и программного обеспечения FACSCONVERTTM CellQuest (Becton Dickinson). Те антитела, которые индуцируют статистически значимый уровень связывания аннексина по сравнению с контролем, можно отобрать в качестве индуцирующих апоптоз клеток антител.
В дополнении к аннексинсвязывающему тесту имеется тест окрашивания ДНК с использованием клеток ВТ474. Для постановки данного теста клетки ВТ474, обработанные интересующим антителом, как описано в двух параграфах выше, инкубируют с 9 мкг/мл флуоресцентного зонда HOECHST 33342TM в течение 2 ч при 37°С, затем анализируют на проточном цитометре EPICS ELITETM (Counter Corporation) с использованием программного обеспечения MODFIT LTTM (Verity Software House). Антитела, которые индуцируют изменение процента апоптозных клеток в 2 раза и выше (и предпочтительно в 3 раза и выше) по сравнению с необработанными клетками (до 100% апоптозных клеток), можно отобрать в качестве вызывающих апоптоз антител с использованием данного теста.
Для скрининга антител, которые связываются с эпитопом в ТФР-бета, связанным с интересующим антителом, можно провести обычный перекрестно-блокирующий тест, такой как описан в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Альтернативно или дополнительно можно провести картирование эпитопа способами, известными в данной области.
Изобретение также относится к иммуноконъюгатам, содержащим антитело, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, токсин (например, токсин с небольшой молекулой или энзиматически активный токсин бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты) или радиоактивный изотоп (т.е. радиоконъюгат).
Химиотерапевтические средства, пригодные для получения таких иммуноконъюгатов, описаны выше. Конъюгаты антитела и одного или более токсинов с небольшой молекулой, таких как калихеамицин, маитанзин (патент США № 5208020), трихотен и противоопухолевое средство СС1065, также включаются здесь.
В одном предпочтительном варианте осуществления изобретения антитело конъюгировано с одной или более молекулами маитанзина (например, примерно от 1 до примерно 10 молекул маитанзина на молекулу антитела). Например, маитанзин можно превратить в May-SS-Me, который можно восстановить в May-SH3 и подвергнуть взаимодействию с модифицированным антителом (Chari et al., Cancer Research, 52: 127-131 (1992)) с получением иммунокоъюгата маитансиноид-антитело.
Другой интересующий иммуноконъюгат включает анти-ТФР-бета-антитело, конъюгированное с одной или более молекулами калихеамицина. Семейство антибиотиков калихеамицинов способно приводить к разрывам двухцепочечной ДНК в субпикомолярных концентрациях. Структурные аналоги калихеамицина, которые можно использовать, включают, но не ограничиваются этим, γ1I, α2I, α3I, N-ацетил-γ1I, PSAG и θI1 (Hinman et al., Cancer Research, 53: 3336-3342 (1993) и Lode et al., Cancer Research, 58: 2925-2928 (1998)). Смотри также патенты США № 5714586; 5712374; 5264586 и 5773001, включенные здесь для сведения.
Энзиматически активные токсины и их фрагменты, которые можно использовать, включают цепь А токсина возбудителя дифтерии, несвязывающие активные фрагменты токсина возбудителя дифтерии, цепь эндотоксина А (из Pseudomonas aeruginosa), цепь рицина А, цепь абрина А, цепь модеццина А, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор момордика карантия, курцин, кротин, ингибитор сапаонарии официналис, гелонин, метогеллин, рестриктоцин, феномицин, эномицин и трикотецены. Например, смотри WO 1993/21232, опубликованную 28 октября 1993.
Настоящее изобретение дополнительно включает иммуноконъюгат, образованный антителом и соединением с нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Для получения радиоконъюгатов анти-ТФР-бета-антител имеются различные радиоактивные изотопы. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu.
Конъюгаты антитела и цитотоксического средства можно получить с использованием различных бифункциональных агентов для соединения белков, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глютаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол 2,6-диизоцианат) и производные бис-активного фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, можно получить иммунотоксин рицин, как описано Vitetta et al., Science, 238: 1098 (1987). Меченная углеродом14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет пример хелатирующего агента для конъюгации радионуклеотида с антителом. Смотри WO 1994/11026. Линкер может быть «отщепляемым линкером», облегчающим высвобождение цитотоксического препарата в клетке. Например, можно использовать лабильный под действием кислоты линкер, чувствительный к пептидазе линкер, диметиловый линкер или дисульфид-содержащий линкер (Chari et al., Cancer Research, 52: 127-131 (1992)).
Альтернативно можно получить гибридный белок, включающий анти-ТФР-бета-антитело и цитотоксическое средство, например, рекомбинантными методами или пептидным синтезом.
В еще одном варианте осуществления антитело можно конъюгировать с «рецептором» (таким как стрептавидин) для направления к опухоли, где конъюгат антитело-рецептор вводят пациенту с последующим удалением несвязанного конъюгата из крови с использованием очищающего агента и затем введением «лиганда» (например, авидина), который конъюгирован с цитотоксическим средством (например, радионуклеотидом).
Антитела по настоящему изобретению можно также использовать в ADEPT при конъюгации антитела с активирующим пролекарство фермента, который превращает пролекарство (например, пептидиловое химиотерапевтическое средство, смотри WO 1981/01145) в активный противоопухолевый препарат. Смотри, например, WO 1988/07378 и патент США № 4975278.
Ферментный компонент иммуноконъюгата, пригодный для ADEPT, включает любой фермент, способный воздействовать на пролекарство таким образом, чтобы превратить его в более активную цитотоксическую форму.
Ферменты, которые пригодны для применения в способе по изобретению, включают, но не ограничиваются этим, щелочную фосфатазу, пригодную для превращения фосфат-содержащих пролекарств в свободные препараты; арилсульфатазу, пригодную для превращения сульфат-содержащих пролекарств в свободные препараты; цитозиндеаминазу, пригодную для превращения не токсичного 5-фторцитозина в противоопухолевый препарат, 5-фторурацил; протеазы, такие как серратиа-протеаза, термолизин, субтилизин, карбоксипептидазы и катепсины (такие как катепсины В и L), которые пригодны для превращения пептид-содержащих пролекарств в свободные препараты; D-аланилкарбоксипептидазы, пригодные для превращения пролекарств, содержащих заместители D-аминокислоты; углевод-расщепляющие ферменты, такие как β-галактозидаза и нейраминидаза, пригодные для превращения гликозилированных пролекарств в свободные препараты; β-лактамазу, пригодную для превращения препаратов, дериватизированных β-лактамами, в свободные препараты; и пенициллинамидазы, такие как пенициллин-V-амидаза или пенициллин-G-амидаза, пригодные для превращения препаратов, дериватизированных соответственно по азоту их аминогруппы феноксиацетильной или фенилацетильной группами, в свободные препараты. Альтернативно антитела с ферментативной активностью, также известные в данной области, как «абзимы», можно использовать для превращения пролекарств по изобретению в свободные активные препараты (смотри, например, Massey, Nature, 328: 457-458 (1987)). Конъюгаты антитело-абзим можно получить, как здесь описано, для доставки абзима в популяцию опухолевых клеток.
Ферменты, пригодные для данного изобретения, можно ковалентно связать с анти-ТФР-бета-антителами с использованием методик, хорошо известных в данной области, таких как применение гетеробифункциональных поперечно-сшивающих реагентов, указанных выше. Альтернативно гибридные белки, содержащие, по меньшей мере, антигенсвязывающую область антитела по изобретению, связанную, по меньшей мере, с функционально активным участком подходящего фермента, можно сконструировать с использованием методов рекомбинантной ДНК, хорошо известных в данной области (смотри, например, Neuberger et al., Nature, 312: 604-608 (1984)).
Предусматриваются другие модификации антитела. Например, антитело можно связать с одним из различных небелковых полимеров, например, полиэтиленгликолем, полипропиленгликолем, полиоксиалкиленами или сополимерами полиэтиленгликоля и полипропиленгликоля. Антитело также может быть включено в приготовленные микрокапсулы, например, методами коацервации или междуфазной полимеризацией (например, соответственно микрокапсулы из гидроксиметилцеллюлозы или желатина и микрокапсулы из поли(метилметакрилата)) и в коллоидные системы для доставки лекарственных препаратов (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или макроэмульсии. Такие методы раскрыты в Remington's Pharmaceutical Sciences, 16th edition, Oslo, A., Ed., (1980).
Анти-ТФР-бета-антитела, раскрытые здесь, можно также формулировать в виде иммунолипосом. Липосомы, содержащие антитело, готовят способами, известными в данной области, такими как описаны Epstein et al., Proc. Natl. Acad. Sci. USA, 82: 3688 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA, 77: 4030 (1980); патент США № 4485045 и 4544545; и WO 1997/38731, опубликованной 23 октября 1997 г. В патенте США № 5013556 раскрыты липосомы с повышенным временем циркуляции.
Особенно пригодные липосомы можно получить обратнофазовым выпариванием с липидной композицией, содержащей фосфатидилхолин, холестерин и ПЭГ-дериватизированный фосфатидилэтаноламин (ПЭГ-РЕ). Липосомы пропускают через фильтры с определенным размером пор с получением липосом с желаемым диаметром. Фрагменты Fab' антитела по настоящему изобретению можно конъюгировать с липосомами, как описано Martin et al., J. Biol. Chem., 257: 286-288 (1982) посредством реакции взаимообмена дисульфида. Химиотерапевтическое средство необязательно находится внутри липосомы. Смотри Gabizon et al., J. National. Cancer Inst., 81(19): 1484 (1989).
III. Векторы, клетки-хозяева и рекомбинантные способы
Изобретение также обеспечивает выделенную нуклеиновую кислоту, кодирующую гуманизированное анти-ТФР-бета-антитело, векторы и клетки-хозяева, содержащие нуклеиновую кислоту, и рекомбинантные способы получения антитела.
Для рекомбинантного получения антитела нуклеиновую кислоту, кодирующую его, выделяют и вставляют в реплицируемый вектор для последующего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующая моноклональное антитело, легко выделяется и секвенируется с использованием обычных методик (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи антител). Доступны многие векторы. Компоненты векторов, как правило, включают, но не ограничиваются этим, одно или более из следующего: сигнальную последовательность, точку начала репликации, один или более маркерных генов, энхансер, промотор и последовательность терминации-транскрипции.
i) Компонент сигнальная последовательность
Анти-ТФР-бета-антитело по данному изобретению можно получить рекомбинантным путем не только непосредственно, но также в виде гибридного полипептида с гетерологичным полипептидом, который предпочтительно является сигнальной последовательностью или другим полипептидом, обладающим специфическим сайтом расщепления на N-конце зрелого белка или полипептида. Выбранная гетерологичная сигнальная последовательность предпочтительно представляет таковую, которая распознается и процессируется (т.е. расщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не распознается и процессируют природную сигнальную последовательность анти-ТФР-бета-антитела, сигнальную последовательность заменяют прокариотической сигнальной последовательностью, выбранной, например, из группы щелочной фосфатазы, пенициллиназы, lpp или лидеров устойчивого к нагреванию энтеротоксина II. Для секреции у дрожжей природную сигнальную последовательность можно заменить, например, на лидер дрожжевой инвертазы, лидер α-фактора (включая лидеры α-фактора Saccharomyces и Kluyveromyces), лидер кислой фосфатазы, лидер глюкоамилазы C. albicans или сигнальную последовательность, описанную в WO 1990/13646. При экспрессии в клетках млекопитающих имеются сигнальные последовательности млекопитающих, а также вирусные секреторные лидеры, например, сигнал gD вируса герпеса простого.
ДНК для области такого предшественника лигируют в рамку считывания ДНК, кодирующей анти-ТФР-бета-антитело.
ii) Компонент точка начала репликации
Экспрессирующий и клонирующий векторы содержат нуклеиновокислотную последовательность, которая способствует вектору реплицироваться в одной или более клетках-хозяевах. Как правило, в клонирующих векторах данная последовательность представляет таковую, которая способствует вектору реплицироваться независимо от хромосомной ДНК хозяина, и включает точки начала репликации или автономно реплицирующиеся последовательности. Такие последовательности хорошо известны для различных бактерий, дрожжей и вирусов. Точка начала репликации из плазмиды pBR322 является подходящей для большинства грамотрицательных бактерий, плазмидная точка начала репликации 2 мк пригодна для дрожжей и различные вирусные точки начала репликации (SV40, полиома, аденовирус, VSV или BPV) пригодны для клонирующих векторов в клетках млекопитающих. Обычно компонент точка начала репликации не является необходимым для экспрессирующих векторов млекопитающих (можно использовать точку начала репликации SV40 только потому, что она включает ранний промотор).
iii) Компонент ген отбора
Экспрессирующий и клонирующий векторы могут содержать ген отбора, также называемый селектируемым маркером. Обычные гены отбора кодируют белки, которые а) придают резистентность к антибиотикам или другим токсинам, например, ампициллину, неомицину, метотрексату или тетрациклину, b) дополняют ауксотрофную недостаточность или с) поставляют важные питательные вещества, отсутствующие в сложной среде, например, ген, кодирующий рацемазу D-аланина для Bacilli.
В одном примере схемы селекции используется препарат для остановки роста клетки-хозяина. Данные клетки, которые с успехом трансформируются гетерологичным геном, продуцируют белок, придающий резистентность к препарату и, таким образом, выживают в режиме селекции. В примерах такой доминантной селекции используются препараты неомицин, микофеноликовая кислота и гигромицин.
Другим примером подходящих селектируемых маркеров для клеток млекопитающих являются таковые, которые способствуют идентификации клеток, компетентных для приема нуклеиновой кислоты, кодирующей анти-ТФР-бета-антитело, такие как DHFR, тимидинкиназа, металлотионеин-I и -II, предпочтительно гены металлотионеина приматов, аденозиндеаминаза, орнитиндекарбоксилаза и т.д.
Например, клетки, трансформированные геном отбора DHFR, вначале идентифицируют при культивировании всех трансформантов в культуральной среде, содержащей метотрексат (Mtx), конкурентный антагонист DHFR. Подходящей клеткой-хозяином, в которой применяется DHFR дикого типа, является линия клеток яичника китайского хомяка (СНО) с недостатком активности DHFR.
Альтернативно можно отобрать клетки-хозяева (в частности, хозяева дикого типа, которые содержат эндогенный DHFR), трансформированные или котрансформированные ДНК-последовательностями, кодирующими анти-ТФР-бета-антитело, белком DHFR дикого типа и другим селектируемым маркером, таким как аминогликозид-3'-фосфотрансфераза (АРН), культивированием клеток в среде, содержащей селектирующий агент для селектируемого маркера, такого как антибиотик аминогликозидного ряда, например, канамицин, неомицин или G418. Смотри патент США № 4965199.
Подходящим геном отбора для применения в дрожжах является ген trp1, присутствующий в дрожжевой плазмиде YRp7 (Stichcomb et al., Nature, 282: 39 (1979)). Ген trp1 обеспечивает селекционный маркер для мутантного штамма дрожжей с отсутствием способности расти в среде при наличии триптофана, например, АТСС № 44076 или РЕР4-1. Jones, Genetics, 85: 12 (1977). Присутствие участка trp1 в геноме дрожжевой клетки-хозяина затем обеспечивает эффективную среду для детектирования трансформации при культивировании в отсутствии триптофана. Аналогично штаммы дрожжей c недостатком Leu2 (АТСС 20622 или 38626) дополняются известными плазмидами, имеющими ген Leu2.
Кроме того, векторы, полученные из 1,6 мкм круговых плазмид pKD1, можно использовать для трансформации дрожжей Kluyveromyces. Альтернативно имелись сообщения об экспрессирующей системе для крупномасштабного получения рекомбинантного бычьего химозина для K. lactis. Van den Berg, Bio/Technology, 8: 135 (1990). Также раскрыты стабильные мультикопийные экспрессирующие векторы для секреции зрелого человеческого сывороточного альбумина промышленными штаммами Kluyveromyces. Fleer et al., Bio/Technology, 9: 968-975 (1991).
iv) Компонент промотор
Экспрессирующие и клонирующие векторы, как правило, содержат промотор, который распознается организмом-хозяином и функционально связан с нуклеиновой кислотой, кодирующей анти-ТФР-бета-антитело. Подходящие промоторы для применения с прокариотическими хозяевами включают промотор phoA, промоторные системы β-лактамазы и лактозы, щелочную фосфатазу, триптофановую (trp) промоторную систему и гибридные промоторы, такие как tac-промотор. Однако подходящими являются другие известные бактериальные промоторы. Промоторы для применения в бактериальных системах будут содержать последовательность Шин-Дальгарно (S.D.), функционально связанную с ДНК, кодирующей анти-ТФР-бета-антитело.
Известны промоторные последовательности для эукариотов. Фактически все гены эукариотов содержат богатую АТ область, расположенную примерно на 25-30 оснований выше сайта, где начинается транскрипция. Другой последовательностью, обнаруженной на 70-90 оснований выше начала транскрипции многих генов, является область CNCAAT (SEQ ID NO: 47), где N может быть любым нуклеотидом. В 3'-конце большинства эукариотических генов находится последовательность AATAAA (SEQ ID NO: 48), которая может быть сигнальной для дополнения поли-А-хвоста к 3'-концу кодирующей последовательности. Все данные последовательности соответственно вставляют в эукариотические экспрессирующие векторы.
Примеры подходящих промоторных последовательностей для применения с хозяевами-дрожжами включают промоторы для 3-фосфоглицераткиназы или других гликолитических ферментов, таких как энолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозефосфатизомераза, фосфоглюкозоизомераза и глюкокиназа.
Другие дрожжевые промоторы, которые представляют индукторные промоторы, обладающие дополнительным преимуществом транскрипции, контролируемой условиями роста, представляют промоторные области для алкогольдегидрогеназы 2, изоцитохрома С, кислой фосфатазы, подвергающихся деградации ферментов, связанных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, ответственных за утилизацию мальтозы и галактозы. Подходящие векторы и промоторы для применения в экспрессии дрожжей дополнительно описаны в EP 73657. Дрожжевые энхансеры также преимущественно используются с дрожжевыми промоторами.
Транскрипция анти-ТФР-бета-антитела из векторов в клетках-хозяевах млекопитающих контролируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус птичьей оспы, аденовирус (такой как аденовирус 2), вирус папилломы крупного рогатого скота, вирус птичьей саркомы, цитомегаловирус, ретровирус, вирус гепатита-В и наиболее предпочтительно обезьяний вирус 40 (SV40), гетерологичными промоторами млекопитающих, например, промотором актина или промотором иммуноглобулина, и промотором теплового шока, при условии, что такие промоторы совместимы с системой клетки-хозяина.
Ранние и поздние промоторы вируса SV40 соответственно получают в виде фрагмента рестрикции SV40, который также содержит точку начала репликации вируса SV40. Немедленный ранний промотор человеческого цитомегаловируса соответственно получают из фрагмента рестрикции HindIII E. Система для экспрессии ДНК в хозяевах-млекопитающих с использованием вируса папилломы крупного рогатого скота в качестве вектора раскрывается в патенте США № 4419446. Модификация данной системы раскрыта в патенте США № 4601978. Смотри также Reyes et al., Nature, 297: 598-601 (1982) по экспрессии кДНК человеческого β-интерферона в мышиных клетках под контролем промотора тимидинкиназы из вируса герпеса простого. Альтернативно длинный концевой повтор вируса саркомы Рауса можно использовать в качестве промотора.
v) Компонент энхансерный элемент
Транскрипцию ДНК, кодирующей анти-ТФР-бета-антитело по данному изобретению, у высших эукариотов часто усиливают вставкой энхансерной последовательности в вектор. В настоящее время известно много энхансерных последовательностей из генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина). Как правило, однако, используют энхансер из вируса эукариотических клеток. Примеры включают энхансер SV40 в поздней стороне точки начала репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер полиомы на поздней стороне точки начала репликации и энхансеры аденовируса. Смотри также Yaniv, Nature, 297: 17-18 (1982) по энхансерным элементам для активации промоторов эукариотов. Энхансер может быть сплайсирован в вектор в положении 5' или 3' по отношению к кодирующей последовательности анти-ТФР-бета-антитела, но предпочтительно он располагается в 5'-сайте от промотора.
vi) Компонент терминации транскрипции
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (например, дрожжах, грибах, насекомых, растений, животных, человека или ядерных клетках от других многоклеточных организмов), будут также включать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Обычно такие последовательности находятся от 5'-конца, в некоторых случаях 3'-конца, нетранслируемых областей эукариотических или вирусных ДНК, или кДНК. Данные области содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемом участке мРНК, кодирующей анти-ТФР-бета-антитело. Одним пригодным компонентом терминации трансляции является область полиаденилирования бычьего гормона роста. Смотри WO 1994/11026 и экспрессирующие векторы, раскрытые там.
vii) Селекция и трансформация клеток-хозяев
Подходящими клетками-хозяевами для клонирования или экспрессии ДНК в векторах являются прокариотические, дрожжевые или высшие эукариотические клетки, описанные здесь. Подходящие прокариоты для данной цели включают эубактерии, такие как грамотрицательные или грамположительные микроорганизмы, например, Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41Р, раскрытые в DD 266710, опубликованной 12 апреля 1989), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Одним предпочтительным хозяином из E. coli для клонирования является E. coli 294 (ATCC 31 446), хотя подходящими являются другие штаммы, такие как E. coli B, E. coli X1776 (ATCC 31537) и E. coli W3110 (ATCC 27325). Данные примеры в большей степени являются иллюстративными, чем ограничивающими.
В дополнении к прокариотам эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, являются подходящими в качестве хозяев для клонирования или экспрессии для кодирующих анти-ТФР-бета-антитело векторов. Saccharomyces cerevisiae или обычные пекарские дрожжи представляют наиболее часто используемые среди низших эукариотических микроорганизмов-хозяев. Однако имеется и является пригодным ряд других родов, видов и штаммов, таких как Schizosaccharomyces pombe; Kluyveromyces, такие как K. lactis, K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis, и нитчатые грибы, такие как, например, Neurospora, Penicillium, Tolypocladium и Aspergillus, такие как A. nidulans и A. niger.
Подходящие клетки-хозяева для экспрессии гликозилированного анти-ТФР-бета-антитела получены из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы и соответствующие возможные клетки-хозяева из насекомых, таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (комары), Aedes albopictus (комары), Drosophila melanogaster (дрозофила) и Bombyx mori. Широко известны различные вирусные штаммы для трансфекции, например, вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы можно использовать здесь в качестве вируса по настоящему изобретению, особенно для трансфекции клеток Spodoptera frugiperda.
Также можно использовать культуры растительных клеток хлопчатника, кукурузы, картофеля, сои, петуньи, томатов и табака в качестве хозяев.
Однако наибольший интерес вызывали клетки позвоночных и размножение клеток позвоночных в культуре (культура ткани) стало обычной процедурой. Примерами пригодных линий клеток-хозяев млекопитающих являются линия клеток почек обезьяны SV1, трансформированная SV40 (COS-7, ATCC CRL 1651); линия человеческих эмбриональных почечных клеток (293 или клетки 293, субклонированные для культивирования в культуральной суспензии, Graham et al., J. Gen. Virol., 36: 59 (1977)); клетки почек молодых хомячков (ВНК, АТСС CCL 10); клетки яичников китайских хомяков/DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA, 77: 4216 (1980), включая DG44 (Urlaub et al., Som. Cell and Mol Gen., 12: 555-566 (1986)) и клеточные линии DP12); мышиные клетки сертоли (TM4, Mather, Biol Reprod., 23: 243-251 (1980)); клетки почек обезьян (CV1 ATCC CCL 70); клетки почек африканской зеленой мартышки (VERO-76, ATCC CRL-1587); человеческие клетки карциномы шейки матки (HELA, ANCC CCL2); клетки почек собаки MDCK, ATCC CCL 34); клетки печени крысы (BRL 3A, ATCC CRL 1442); клетки легких человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мышей (ММТ 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci., 383: 44-68 (1982)); клетки MRC 5; клетки FS4 и линия клеток человеческой гепатомы (Нер G2).
Клетки-хозяева трансформируют с использованием вышеописанных экспрессирующих или клонирующих векторов для продукции анти-ТФР-бета антитела и культивируют в обычной питательной среде, модифицированной соответствующим образом для индуцирования промоторов, выбора трансформантов или амплификации генов, кодирующих желаемые последовательности.
viii) Культивирование клеток-хозяев
Клетки-хозяева, используемые для продуцирования анти-ТФР-бета антитела по данному изобретению, можно культивировать в различных средах. Подходящими для культивирования клеток-хозяев являются различные промышленно доступные среды, такие как среда Ham's F10 (Sigma), минимальная эссенциальная среда (МЕМ) (Sigma), RPMI-1640 (Sigma) и среда Игла, модифицированная по способу Дульбекко (DMEM) (Sigma). Кроме того, можно использовать любую среду, описанную, например, Ham et al., Meth. Enz. 58: 44 (1979); Barnes et al., Anal. Biochem., 102: 255 (1980); в патентах США № 4767704; 4657866; 4927762; 4560655 или 5122469; WO 1990/03430; WO 1987/00195 или в патенте США Re. 30985, в качестве культуральной среды для клеток-хозяев. В любую из данных сред можно добавить, как это необходимо, гормоны и/или другие факторы роста (такие как инсулин, трансферрин или эпидермальный фактор роста), соли (такие как хлорид натрия, кальций, магний и фосфат), буферы (такие как HEPES), нуклеотиды (такие как аденозин или тимидин), антибиотики (такие как GENTAMYCINTM), микроэлементы (обычно определяемые как неорганические соединения, присутствующие в конечных концентрациях на микромолярном уровне) и глюкозу или равноценный источник энергии. Можно также включить любые другие необходимые добавки в подходящих концентрациях, которые известны специалистам в данной области. Условия культивирования, такие как температура, рН и тому подобное, представляют таковые, которые ранее использовались для клеток-хозяев, выбранных для экспрессии, и они будут очевидными специалистам в данной области.
ix) Очистка анти-ТФР-бета антитела
При использовании рекомбинантных методик антитело можно продуцировать внутриклеточно или в периплазматическое пространство, или непосредственно секретировать в среду. Если антитело продуцируется внутри клетки, в качестве первой стадии, дебриз из частичек, либо клетки-хозяин, либо лизированные фрагменты, удаляют, например, центрифугировагием или ультрафильтрованием. Carter et al., Bio/Technology, 10: 163-167 (1992) описывают методику выделения антител, которые секретируются в периплазматическое пространство E. coli. Кратко, клеточную массу размораживают в присутствии ацетата натрия (рН 3,5), ЭДТА и фенилметилсульфонилфторида (PMSF) в течение 30 мин. Клеточный дебриз можно удалить центрифугированием. Когда антитело секретируется в среду, то супернатанты из таких экспрессирующих систем обычно вначале концентрируют с использованием промышленно доступного фильтра для концентрирования белка, например, блок для ультрафильтрования AMICONTM или MILLIPORE PELLICONTM. Можно включить ингибитор протеазы, такой как фенилметилсульфонилфторид (PMSF), на любой из описанных выше стадий для ингибирования протеолиза и можно добавить антибиотики для предупреждения роста случайных загрязнителей.
Композицию антитела, полученную из клеток, можно очистить с использованием, например, хроматографии на гидроксилапатите, гель-электрофореза, диализа и аффинной хроматографии, при том, что аффинная хроматография является предпочтительным методом очистки. Применимость протеина-А в качестве лиганда аффинности зависит от вида и изотипа любого домена Fc иммуноглобулина, который присутствует в антителе. Протеин-А можно использовать для очистки антител на основе человеческих тяжелых цепей γ1, γ2 или γ4 (Lindmark et al., J. Immunol. Meth., 62: 1-13 (1983)). Протеин-G рекомендуется использовать для всех мышиных изотипов и для человеческого γ3 (Guss et al., EMBO J., 5: 1567-1575 (1986)). Матрикс, с которым связан лиганд аффинности, наиболее часто представляет собой агарозу, но имеются другие матриксы. Можно использовать механически стабильные матриксы, такие как стекло с контролируемыми порами или поли(стирендивинил)бензол для обеспечения более быстрой скорости потока и уменьшения времени обработки по сравнению с агарозой. В тех случаях, когда антитело содержит домен СН3, то пригодной для очистки является смола BAKERBOND ABXTM (J.T. Baker, Phillisburg, NY). Также имеются другие методики для очистки белка, такие как фракционирование на колонке с ионообменной смолой, осаждение этанолом, обратнофазовая ВЭЖХ, хроматография на силикагеле, хроматография на гепарин SEPHAROSETM, хроматография на анион- или катионобменной смоле (такая как на колонке с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония в зависимости от антитела, которое выделяют.
После любой предварительной стадии(й) очистки смесь, содержащую интересующее антитело и примеси, можно подвергнуть гидрофобной хроматографии в условиях с низким рН с использованием буфера для элюирования при значении рН в пределах примерно 2,5-4,5, предварительно проведенной при низких концентрациях солей (например, примерно 0-0,25М соли).
IV. Фармацевтические композиции
Терапевтические композиции антител, используемых по настоящему изобретению, готовят для хранения смешением антитела, обладающего желаемой степенью чистоты, с необязательными, фармацевтически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)) в виде лиофилизованных композиций или водных растворов. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмоний хлорид; гексаметоний хлорид; бензалконий хлорид; бензетоний хлорид; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; протеины, такие как сывороточный альбумин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-протеин); и/или неионогенные поверхностно-активные вещества, такие как TWEENTM, PLURONICSTM или полиэтиленгликоль (ПЭГ). Предпочтительные лиофилизованные композиции анти-ТФР-бета-антитела описаны в WO 1997/04801, включенной здесь для сведения.
Композиция также может содержать более чем одно активное соединение, как это необходимо для конкретного показания, которое подвергается лечению, предпочтительно таковые с дополнительной активностью, которые не оказывают отрицательного влияния друг на друга. Например, может быть желательным дополнительно обеспечить антитела, которые связываются с HER-2, EGFR, ТФР-бета (например, антитело, которое связывается с другим эпитопом на ТФР-бета), ErbB3, ErbB4 или антигенами васкулярного эндотелиального фактора роста (VEGF) в одной композиции. Альтернативно или дополнительно композиция может дополнительно содержать химиотерапевтическое средство, цитотоксический агент, цитокин, ингибирующее рост средство, антигормональный препарат, препарат с целенаправленным действием на ТФР-бета, антиангиогенный препарат и/или кардиопротектор. Такие молекулы соответственно находятся в комбинации в количествах, эффективных для предназначенной цели.
Активные ингредиенты можно включить в микрокапсулы, приготовленные, например, методами коацервации или межфазной полимеризации, например, микрокапсулы из гидроксиметилцеллюлозы или желатина и микрокапсулы из поли(метилметакрилата), соответственно, в коллоидные системы для доставки препаратов (например, липосомы, альбуминовые микрогранулы, микроэмульсии, наночастицы и нанокапсулы) или макроэмульсии. Такие методики раскрыты в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Можно приготовить препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих антитело, где такие матрицы находятся в виде имеющих форму предметов, например, это пленки или микрокапсулы. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт), полиактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, не подвергающийся деградации этиленвинилацетат, деградируемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRONDEPOTTM (инъекционные микрогранулы, состоящие из сополимера молочной кислоты-гликолевой кислоты), и поли-D-(-)-3-гидроксимасляную кислоту.
Композиции для использования для введения in vivo должны быть стерильными. Это легко осуществить фильтрованием через мембраны для стерильного фильтрования.
V. Лечение анти-ТФР-бета-антителами
Предусматривается, что по настоящему изобретению анти-ТФР-бета-антитела можно использовать для лечения различных заболеваний или нарушений. Примеры состояний или нарушений включают доброкачественные или злокачественные опухоли; лейкемии и лимфоидные злокачественные образования; и другие нарушения, такие как нейрональные, глиальные, астроцитальные, гипоталамусные, железистые, макрофагальные, эпителиальные, стромальные, бластокоельные, воспалительные, ангиогенные и иммунологические нарушения.
В основном нарушение, предназначенное для лечения, представляет нарушение, связанное с ТФР-бета, наиболее предпочтительно злокачественное заболевание. Примеры злокачественных опухолей для лечения включают, но не ограничиваются этим, карциному, бластому и саркому, и некоторые виды лейкемии или лимфоидные злокачественные образования. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточную злокачественную опухоль (например, эпителиальную плоскоклеточную опухоль), злокачественную опухоль легких, включая мелкоклеточную опухоль легких, немелкоклеточную злокачественную опухоль легких, аденокарциному легких и плоскоклеточную карциному легких, опухоль брюшины, гепатоцеллюлярную опухоль, злокачественную опухоль желудка, включая опухоли органов желудочно-кишечного тракта, злокачественную опухоль поджелудочной железы, глиобластому, опухоль шейки матки, опухоль яичников, опухоль печени, злокачественную опухоль мочевого пузыря, гепатому, злокачественную опухоль молочной железы, опухоль ободочной кишки, опухоль прямой кишки, опухоль ободочной и прямой кишки, карциному эндометрия или матки, карциному слюннных желез, злокачественную опухоль почки, опухоль простаты, опухоль вульвы, опухоль щитовидной железы, опухоль печени, карциному ануса, карциному полового члена, а также опухоль головы и шеи.
В одном варианте осуществления злокачественная опухоль будет представлять таковую, которая экспрессирует (и может сверхэкспрессировать) рецептор ТФР-бета. Примеры опухолей, которые могут экспрессировать/сверхэкспрессировать рецептор(ы) ТФР-бета, включают плоскоклеточную опухоль (например, эпителиальную плоскоклеточную опухоль), злокачественную опухоль легких, включая мелкоклеточную опухоль легких, немелкоклеточную опухоль легких, аденокарциному легких и плоскоклеточную опухоль легких, опухоль брюшины, гепатоцеллюлярную опухоль, злокачественную опухоль желудка, включая опухоли органов желудочно-кишечного тракта, опухоль поджелудочной железы, глиобластому, опухоль шейки матки, опухоль яичников, опухоль печени, опухоль мочевого пузыря, гепатому, злокачественную опухоль молочной железы, опухоль ободочной кишки, опухоль прямой кишки, опухоль ободочной и прямой кишки, карциному эндометрия или матки, карциному слюнных желез, опухоль почки, опухоль простаты, опухоль вульвы, опухоль щитовидной железы, опухоль печени, карциному ануса, карциному полового члена, а также опухоль головы и шеи. Однако опухоль для лечения антителом может представлять любую опухоль, не только те, которые просто экспрессируют/сверхэкспрессируют рецептор ТФР-бета.
Если опухоль для лечения может представлять таковую, для которой характерна интенсивная активация рецептора ТФР-бета, то такая интенсивная активация может быть результатом сверхэкспрессии или повышенной продукции рецептора ТФР-бета. В одном варианте осуществления будет проводиться диагностический или прогностический тест для определения того, насколько для опухоли у пациента характерна повышенная активация рецептора ТФР-бета. Например, можно определить амплификацию и/или сверхэкспрессию рецептора ТФР-бета в опухоли. В данной области имеются различные тесты определения такой амплификации и/или сверхэкспрессии, например, методами иммуногистохимии (IHC); FISH, саузерн-блоттингом или ПЦР.
Кроме того, сверхэкспрессию или амплификацию рецептора ТФР-бета можно оценить с использованием диагностического теста в условиях in vivo, например, введением молекулы (такой как антитело), которое связано с молекулой для детектирования и меченной детектируемой меткой (например, радиоактивным изотопом) и внешним сканированием пациента для определения локализации метки.
Тесты для определения того, повышает ли гуманизированное антитело активность ТФР-бета в подавлении опухоли в условиях in vivo и in vitro, описаны ниже.
А. Цитотоксический тест
Система L-929 является удобным тестом в условиях in vitro, который позволяет быстро определить активность антитела, необязательно в сочетании с подходящим регулятором иммунной функции. Степень его корреляции с тестом некроза опухоли в условиях in vivo, Carswell et al., Proc. Natl. Acad. Sci. USA, 72: 3666 (1975) в настоящее время остается неизвестной; однако, поскольку в нем специально используются мышиные опухолевые клетки, то корреляция должна быть высокой. В данном тесте определяется активность фактора некроза опухолей (TNF-α) и лимфотоксина (TNF-бета). По своему принципу тест аналогичен раскрытому в патенте США № 4457916, в котором используются мышиные L-M клетки и окрашивание метиленовым синим. Однако было показано, что тест L-929 коррелирует (для TNF-α, полученного из клеток HL-60) с цитотоксичностью для линии человеческих опухолевых клеток.
В системе теста L-929 клетки L-929 получают в течение ночи в виде монослоев в микротитрационных планшетах. Лучшие пробы разбавляют в два раза по планшету, облучают УФ-светом и затем вносят на полученные клеточные монослои. Затем в культуральную среду в лунках вносят до 1 мкг/мл актиномицина D. Планшеты инкубируют в течение 18 ч при 37°С и планшеты оценивают визуально по балльной шкале под микроскопом. Каждой лунке дают 25, 50, 75 или 100%, выражающих степень гибели клеток в лунке. Одну единицу активности TNF определяют как разведение, при котором имеет место гибель 50% клеток.
В. Тесты в условиях in vivo
Препараты можно также тестировать на активность с использованием способности анти-ТФР-бета-антитела приводить к гибели или подавлять рост опухолей и защищать животное с опухолью от смерти. Мышам Balb/с прививают подкожно различные типы опухолевых клеток для развития локализованной опухоли. Линии опухолевых клеток включают мышиную фибросаркому MethA, полученную в виде клеточной суспензии из асцитной жидкости, и MCF-7, карциному молочной железы, которую вводят в виде 1 мм3 сгустка клеток.
Для постановки теста мышам-самкам Balb/с (19-22 г) прививают подкожно с помощью иглы номера 26 суспензию, содержащую 5×105 клеток фибросаркомы в 0,1 мл среды или клетки MCF-7. (Суспензию клеток фибросаркомы готовят из 8-суточной асцитной жидкости при подсчете количества клеток и разведении средой, не содержащей сыворотку). Через 9-10 суток, когда опухоли становятся пальпируемыми, вводят внутривенно 1 мкг TNF-α на мышь, и введение TNF-α повторяют, если желательно, в последующие дни. Результаты учитывают при определении объема опухоли и по выживаемости животных. Тест повторяют с использованием отдельных последовательных инъекций 1 мкг TNF-α на мышь и 10 мг/кг антитела 4А11 на мышь. Тест на активность антитела сравнивают с данными для данных агентов.
В тех случаях, когда опухоль для лечения является гормон-независимой опухолью, то можно определить экспрессию гормона (например, андрогена) и/или его родственного рецептора в опухоли с использованием любого из различных имеющихся тестов, например, описанных выше. Альтернативно или дополнительно пациента можно диагносцировать как имеющего гормон-независимую опухоль, в том отношении, что пациент не реагирует на антиандрогенную терапию.
В некоторых вариантах осуществления пациенту вводят иммуноконъюгат, содержащий анти-ТФР-бета-антитело, конъюгированное с цитотоксическим средством. Предпочтительно иммуноконъюгат и/или белок ТФР-бета, с которым он связан, интернализуется клеткой, приводя к повышенной терапевтической эффективности иммуноконъюгата в отношении гибели опухолевых клеток, с которыми он связывается. В предпочтительном варианте осуществления цитотоксическое средство действует целенаправленно или оказывает отрицательное влияние на нуклеиновую кислоту в опухолевой клетке. Примеры таких цитотоксических средств включают маитанзиноиды, калихеамицины, рибонуклеазы и эндонуклеазы ДНК.
Анти-ТФР-бета-антитела или иммуноконъюгаты вводят пациенту-человеку известными способами, такими как внутривенное введение, например, в виде болюса или продолжительной инфузии в течение периода времени, внутримышечным, внутрибрюшинным, интрацереброспинальным, подкожным, внутрисуставным, интрасиновиальным, интратекальным, пероральным, местным или ингаляционными путями. Внутривенное, внутрибрюшинное или подкожное введение антитела является предпочтительным, при том, что подкожный или внутрибрюшинный пути являются особенно предпочтительными. Предпочтительной схемой введения является введение 2-3 раза в неделю в зависимости от конкретного млекопитающего, которое подвергается лечению, типа антитела и других факторов, хорошо известных специалистам. Однако «работают» другие схемы введения.
Другие терапевтические схемы можно объединить с введением анти-ТФР-бета-антитела. Комбинированное введение включает совместное введение, с использованием отдельных композиций или одной фармацевтической композиции, и последовательное введение в любом порядке, где предпочтительно имеется период времени, когда оба (или все) активные средства одновременно проявляют их биологическую активность.
В одном предпочтительном варианте осуществления пациента лечат двумя различными анти-ТФР-бета-антителами.
Также может быть желательным комбинировать введение анти-ТФР-бета-антитела или антител с введением антитела, направленного против другого связанного с опухолью антигена. В данном случае другое антитело может, например, связываться с антигеном, таким как HER-2, EGFR, ErbB3, ErbB4, васкулярный эндотелиальный фактор роста (VEGF) или В-клеточный поверхностный маркер или антиген (антиген, экспрессируемый на поверхности В-клеток, который может быть направлен вместе с антагонистом, связанным с ним), такие как, например, лейкоцитарные поверхностные маркеры CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD40, CD53, CD72, CD73, CD74, CDw75, CDw76, CD77, CDw78, CD79a, CD79b, CD80, CD81, CD82, CD83, CDw84, CD85 и CD86 (описание смотри в The Leukocyte Antigen Facts Book, 2nd Edition 1997, ed. Barclay et al., Academic Press, Harcourt Brace & Co., New York). Другие В-клеточные поверхностные маркеры включают RP105, FcRH2, В-клеточный CR2, CCR6, P2X5, HLA-DOB, CXCR5, FCER2, BR3, Btig, NAG14, SLGC16270, FcRH1, IRTA2, ATWD578, FcRH3, IRTA1, FcRH6, BCMA и 239287. Особенно интересный В-клеточный поверхностный маркер предпочтительно экспрессируется на В-клетках по сравнению с другими не В-клеточными тканями млекопитающего и может экспрессироваться на предшественниках В-клеток и зрелых В-клетках. Предпочтительными В-клеточными поверхностными маркерами являются CD20 и CD22. В еще одном аспекте ТФР-бета-антитело можно объединить с антиангиогенным средством, которое ингибирует ангиогенез. Примером является агонист VEGF, такой как антитело, например, AVASTINTM.
В одном варианте осуществления лечение по настоящему изобретению включает комбинированное введение анти-TGF-бета-антитела (или антител) и одного или более регуляторов иммунной функции у млекопитающего, такого как цитокины, а также химиотерапевтических средств или ингибирующих рост средств, включая совместное введение смесей различных химиотерапевтических средств. Предпочтительные химиотерапевтические средства включают таксафены (такие как паклитаксел и доцетаксел) и/или антибиотики антрациклинового ряда. В отношение приготовления и схем введения таких химиотерапевтических средств, то их можно использовать согласно инструкциям производителей, или как эмпирически определит специалист в данной области. Приготовление и схемы введения для такой химиотерапии описаны в Chemotherapy Service, Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992).
Антитело можно комбинировать с антигормональным препаратом, например, антиэстрогенным веществом, таким как тамоксифен, или ингибитором ароматазы, таким как анастрозол; антипрогестероном, таким как онапристон (смотри ЕР 616812), или антиандрогенным веществом, таким как флутамид, в дозах, известных для таких молекул. В тех случаях, когда лечению подвергается гормон-независимая опухоль, то предварительно пациенту можно провести антигормональную терапию, после чего опухоль становится независимой от гормонов, затем можно вводить анти-TGF-бета-антитело (и необязательно другие средства, описанные здесь).
В некоторых случаях может быть полезным совместное введение пациенту кардиопротектора (для предупреждения или уменьшения дисфункции миокарда, связанной с терапией) или одного или более цитокинов. Также можно совместно вводить цитотоксический препарат. В дополнении к вышеуказанным терапевтическим схемам пациента можно подвергнуть хирургическому удалению опухолевых клеток и/или терапии облучением.
Настоящие анти-TGF-бета-антитела можно комбинировать с препаратом, действие которого направлено против EGFR, такие как обсуждались выше в разделе определений с получением дополнительного и потенциально синергического терапевтического действия.
Подходящие дозы для любого из вышеуказанных совместно вводимых средств представляют таковые, которые применяют в настоящее время и их можно снизить за счет комбинированного (синергитического) действия средства и анти-TGF-бета-антитела.
Для профилактики или лечения заболевания соответствующие дозы антитела будут зависеть от типа заболевания, которое лечат, как определялось выше, тяжести и течения заболевания, от того, вводят антитело в профилактических или терапевтических целях, предшествующей терапии, клинического анамнеза пациента и ответной реакции на введение антитела, и решения лечащего врача. Антитело соответственно вводят пациенту один раз или курсом лечения. В зависимости от типа и тяжести заболевания доза примерно от 1 мкг/кг до 15 мг/кг (например, 0,1-20 мг/кг) антитела является первоначальной возможной дозой для введения пациенту, например, при одном или более отдельных введениях, или непрерывной инфузией. Типичная суточная доза может находиться в пределах примерно от 1 мкг/кг до 100 мг/кг или выше в зависимости от факторов, упомянутых выше. Для повторных введений в течение нескольких дней или более, в зависимости от состояния, лечение продолжают до желаемого подавления имеющихся симптомов заболевания.
Предпочтительная доза антитела будет находиться в пределах примерно от 0,05 мг/кг до примерно 10 мг/кг. Так, пациенту можно вводить одну или более доз, равных примерно 0,5 мг/мг, 2,0 мг/мг, 4,0 мг/мг или 10 мг/кг (или любую их комбинацию). Такие дозы можно вводить с перерывом, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал примерно от двух до примерно двадцати, например, шесть доз анти-TGF-бета-антитела). Можно ввести первоначальную более высокую дозу с последующим введением одной или нескольких более низких доз. Примерная схема дозирования включает введение первоначальной нагрузочной дозы, равной примерно 4 мг/кг, с последующим введением недельной поддерживающей дозы, составляющей примерно 2 мг/кг анти-TGF-бета-антитела. Однако можно использовать другие схемы дозирования. Результативность данной терапии легко проследить с использованием обычных методов и тестов.
Альтернативно антитело соответственно вводят серийно или в комбинации с радиологическим лечением-облучением или введением радиоактивных веществ, таких как указаны в UICC (Ed.), Klinische Oncologie, Springer-Verlag (1982).
Помимо введения пациенту белка антитела настоящая заявка включает введение антитела генной терапией. Такое введение нуклеиновой кислоты, кодирующей антитело, входят в выражение «введение терапевтически эффективного количества антитела». Смотри, например, WO 1996/07321, опубликованной 14 марта 1996, касающейся применения генной терапии для генерации внутриклеточных антител.
Существуют два основных подхода к введению нуклеиновой кислоты (необязательно находящейся в векторе) в клетки пациента в условиях in vivo и ex vivo. В условиях доставки in vivo нуклеиновую кислоту вводят инъекционно непосредственно пациенту, обычно в место, где необходимо антитело. Для лечения ex vivo клетки пациента удаляют, нуклеиновую кислоту вводят в данные выделенные клетки и модифицированные клетки вводят пациенту непосредственно или, например, инкапсулированные в пористых мембранах, которые имплантируют пациенту (смотри, например, патент США № 4892538 и 5283187). Имеются различные доступные методы введения нуклеиновых кислот в живые клетки. Методы варьируют в зависимости от того, переносится нуклеиновая кислота в культивируемые клетки in vitro или переносится в клетки предназначаемого хозяина in vivo. Методики, подходящие для переноса нуклеиновой кислоты в клетки млекопитающих в условиях in vitro, включают применение липосом, электропорацию, микроинъекцию, слияние клеток, DEAE-декстран, преципитацию фосфатом кальция и т.д. Обычно используемым вектором для доставки гена ex vivo является ретровирус.
Предпочтительные в настоящее время методы переноса нуклеиновой кислоты in vivo включают трансфекцию вирусными векторами (такими как аденовирус, вирус герпеса простого I или аденосвязанный вирус) и системы на основе липидов (пригодными липидами для опосредуемого липидами переноса гена являются, например, DOTMA, DOPE и DC-Chol). В некоторых ситуациях желательно обеспечить источник нуклеиновой кислоты агентом, который направлен на клетки-мишени, таким как специфические антитела в отношении клеточного поверхностного мембранного белка или клетки-мишени, лиганд для рецептора на клетке-мишени и т.д. Когда применяются липосомы, то белки, связанные с клеточным поверхностным мембранным белком, связанным с эндоцитозом, можно использовать для целенаправленного и/или облегчения поглощения, например, капсидные белки или их фрагменты, обладающие тропностью для конкретного типа клеток, антитела к белкам, которые подвергаются интернализации в крови, и белки, которые направлены на внутриклеточную локализацию и повышение периода полураспада. Методика опосредованного рецептором эндоцитоза описана, например, Wu et al., J. Biol. Chem., 262: 4429-4432 (1987) и Wagner et al., Proc. Natl. Acad. Sci. USA, 87: 3410-3414 (1990). Обзор имеющихся протоколов маркировки известных генов и генной терапии смотри у Anderson et al., Science, 256: 808-813 (1992). Также смотри WO 1993/25673 и цитированные там источники.
В одном конкретном варианте осуществления опухоль, такую как злокачественная опухоль легких, меланома, злокачественная опухоль молочной железы, злокачественная опухоль почки, опухоль ободочной и прямой кишки, опухоль поджелудочной железы, лечат у млекопитающего, предпочтительно человека, введением млекопитающему эффективного количества TGF-бета-антитела и антитела, которое связывается с VEGF, необязательно вместе с любым другим подходящим средством, представленным здесь. Предпочтительно TGF-бета-антитело представляет моноклональное антитело, более предпочтительно, которое связывается с любым одним или более из следующего: TGF-бета1, TGF-бета2 и TGF-бета3, и еще более предпочтительно связывается, по меньшей мере, с TGF-бета1 или обоими TGF-бета1 и TGF-бета2, и наиболее предпочтительно представляет гуманизированное антитело, представленное здесь. В другом варианте осуществления антитело, которое связывается с VEGF, представляет моноклональное антитело и более предпочтительно оно блокирует или нейтрализует VEGF и/или блокирует связывание VEGF с одним или более его рецепторами.
VI. Изделия
В другом варианте осуществления изобретения обеспечивается изделие, содержащее вещества, пригодные для лечения нарушений, описанных выше. Изделие включает контейнер и этикетку или вкладыш в упаковку на или связанный с контейнером. Подходящие контейнеры включают, например, бутыли, ампулы, шприцы и т.д. Контейнер может быть изготовлен из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая является эффективной для лечения состояния и может иметь стерильное отверстие для доступа (например, контейнер может представлять собой мешок или ампулу для внутривенного введения, имеющие запирающее устройство с инъекционной иглой для подкожного введения). По меньшей мере, одно активное вещество в композиции представляет гуманизированное анти-ТФР-бета-антитело. На этикетке или вкладыше в упаковку указывается, что композиция используется для лечения состояния выбора, такого как злокачественная опухоль. В одном варианте осуществления на этикетке или вкладыше в упаковку указывается, что композицию, содержащую антитело, можно использовать для лечения нарушения, опосредованного ТФР-бета, например, для лечения злокачественной опухоли, которая экспрессирует рецептор ТФР-бета. Кроме того, на этикетке или вкладыше в упаковку может быть указано, что пациентом, который подвергается лечению, является таковой, имеющий опухоль, для которой характерно повышенная активация рецептора ТФР-бета. На этикетке или вкладыше в упаковку может также быть указано, что композицию можно использовать для лечения опухоли, для которой не характерна сверхэкспрессия рецептора ТФР-бета. В других вариантах осуществления на вкладыше в упаковку может быть указано, что антитело или композицию можно использовать для лечения злокачественной опухоли молочной железы (например, опухоли молочной железы с метастазами); гормон-независимой опухоли; злокачественной опухоли простаты (например, андроген-независимой опухоли простаты); злокачественной опухоли легких (например, немелкоклеточной опухоли легких); злокачественной опухоли ободочной, прямой кишки или ободочной и прямой кишки; или любых других заболеваний или нарушений, раскрытых здесь.
Кроме того, изделие может содержать а) первый контейнер с композицией, находящейся в нем, где композиция содержит гуманизированное антитело, и b) второй контейнер с композицией, находящейся в нем, где композиция содержит терапевтическое средство иное, чем гуманизированное антитело. Изделие производства в данном варианте осуществления изобретения может дополнительно включать вкладыш в упаковку, на котором указано, что первую и вторую композиции можно использовать в комбинации для лечения опосредованных ТФР-бета нарушений, таких как злокачественная опухоль. Такое терапевтическое средство может быть любым из дополнительных препаратов, описанных в предыдущем разделе (например, химиотерапевтическое средство, антиангиогенный препарат, антигормональный препарат, кардиопротектор и/или регулятор иммунной функции у млекопитающего, включая цитокин). Альтернативно или дополнительно изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Он может дополнительно включать другие материалы, желательные с коммерческой и потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
VII. Нетерапевтические применения анти-ТФР-бета-антитела
Антитела (например, гуманизированные анти-ТФР-бета-антитела) по изобретению имеют дополнительные нетерапевтические применения.
Например, антитела можно использовать в качестве агентов для аффинной очистки. В данном способе антитела иммобилизуют на твердой фазе, такой как смола SEPHADEXTM или фильтровальная бумага, с использованием методов, хорошо известных в данной области. Иммобилизованное антитело подвергают взаимодействию с пробой, содержащей белок ТФР-бета (или его фрагмент) для очистки, и затем подложку промывают подходящим растворителем, который будет удалять в основном все вещества в пробе, за исключением белка ТФР-бета, который связан с иммобилизованным антителом. Наконец, подложку промывают другим растворителем, таким как глициновый буфер, рН 5,0, который будет отделять белок ТФР-бета от антитела.
Анти-ТФР-бета-антитела также могут быть пригодными при постановке диагностических тестов для белка ТФР-бета, например, при определении его экспрессии в определенных клетках, тканях или сыворотке крови.
Для диагностических применений антитело, как правило, будет помечено с помощью детектируемой группы. Имеются многочисленные метки, которые в общем можно объединить в следующие группы:
а) радиоизотопы, такие как 35S, 14C, 125I, 3H и 131I. Антитело можно пометить радиоизотопом с использованием методов, описанных в Current Protocols in Immunology, Volumes 1 and 2, Coligen et al., Wiley-Interscience, New York, Pubs. (1991), например, и радиоактивность можно определить с использованием сцинтилляционного счетчика;
b) имеются флуоресцентные метки, такие как хелаты редких щелочно-земельных металлов (хелаты эвропия) или флуоресцеин и его производные, родамин и его производные, дансил, лиссамин, фикоэритрин и техасный красный. Флуоресцентные метки можно конъюгировать с антителом с использованием методов, например, раскрытых в Current Protocols in Immunology, выше. Флуоресценцию можно определить с использованием флуориметра;
с) имеются различные метки на основе энзим-субстратов, и в патенте США № 4275149 приводится обзор по некоторым из них. Фермент, как правило, катализирует химическое изменение хромогенного субстрата, которое можно определить с использованием различных методик. Например, фермент может катализировать изменение цвета субстрата, которое можно определить спектрофотометрически. Альтернативно фермент может изменить флуоресценцию или хемилюминесценцию субстрата. Методики для количественного определения флуоресценции описаны выше. Хемилюминесцентный субстрат становится электронно-возбужденным в результате химической реакции и затем может испускать свет, который можно определить (например, с использованием хемилюминометра), или передавать энергию акцептору флуоресценции. Примеры энзимных меток включают люциферазы (например, люциферазу светлячков и бактериальную люциферазу; патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидаза из хрена (HRPO), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы (например, глюкозооксидаза, галактозооксидаза и глюкоза-6-фосфатдегидрогеназа), гетероциклические оксидазы (такие как уриказа и ксантиноксидаза), лактопероксидазу, микропероксидазу и тому подобное. Методы конъюгирования энзимов с антителами описаны O'Sullivan et al., «Methods for Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay», in Methods in Enzym. (Ed., J. Langone & H. Van Vunakis), Academic Press, New York, 73: 147-166 (1981).
Примеры комбинаций энзим-субстрат, например, включают:
i) пероксидазу из хрена (HRPO) с перекисью водорода в качестве субстрата, где пероксидаза водорода окисляет предшественник краски (например, ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидин гидрохлорид (ТМВ));
ii) щелочную фосфатазу (АР) с пара-нитрофенилфосфатом в качестве хромогенного субстрата; и
iii) β-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, п-нитрофенил-β-D-галактозидаза) или флурогенным субстратом 4-метиллюмбеллиферил-β-D-галактозидаза.
Специалистам в данной области известны многочисленные другие комбинации энзим-субстрат. Общий обзор по ним смотри в патентах США № 4275149 и 4318980.
В некоторых случаях метку конъюгируют с антителом опосредованно. Специалистам в данной области известны различные методы для осуществления этого. Например, антитело можно конъюгировать с биотином и любую из меток, относящихся к трем группам, представленным выше, можно конъюгировать с авидином или тому подобное. Биотин избирательно связывается с авидином и, таким образом, метку можно конъюгировать с антителом данным опосредованным образом. Альтернативно для достижения опосредованного конъюгирования метки с антителом, антитело конъюгируют с небольшим гаптеном (например, дигоксином) и одну из различных типов меток, указанных выше, конъюгируют с анти-гаптен-антителом (например, анти-дигоксин-антителом). Таким образом, можно провести опосредованное конъюгирование метки с антителом.
В другом варианте осуществления изобретения не требуется введение метки в анти-ТФР-бета-антитело и его присутствие можно детектировать с использованием меченого антитела, которое связывается с анти-ТФР-бета-антителом.
Антитела по настоящему изобретению можно использовать в любом известном тесте, таком как тесты конкурентного связывания, прямом и непрямом сэндвич-тестах и тестах иммунопреципитации. Zola, Monoclonal Antibodies: A Manual of Techniques, p. 147-158 (CRC Press, Inc 1987).
Для иммуногистохимии образец опухоли может быть только что отобранным или замороженным, или может находиться в парафине и зафиксирован консервантом, таким как, например, формалин.
Антитела также можно использовать для диагностических тестов in vivo. Как правило, антитело метят радионуклидом (таким как 111In, 99Tc, 14C, 131I, 125I, 3H, 32P или 35S) так, чтобы, например, опухоль можно было локализовать с использованием иммуносцинтиографии.
Для удобства антитела по настоящему изобретению можно обеспечить в наборе, т.е. упакованной комбинации реагентов в заранее определенных количествах с инструкциями для постановки диагностического теста. Когда антитело является меченным энзимом, то набор будет включать субстраты и кофакторы, необходимые для энзима (например, предшественник субстрата, который обеспечивает детектируемый хромофор или флуорофор). Кроме того, можно включить другие добавки, такие как стабилизаторы, буферы (например, буфер для блокирования или буфер для лизиса) и тому подобное. Относительные количества различных реагентов могут варьировать в широких пределах для обеспечения концентраций в растворе реагентов, которые существенно оптимизируют чувствительность теста. В частности, реагенты могут быть обеспечены в виде сухих порошков, обычно лиофилизованных, включая наполнители, которые при растворении будут обеспечивать раствор реагента с соответствующей концентрацией.
Настоящее антитело также будет пригодным для получения изображения in vivo, когда меченое антитело вводят хозяину, предпочтительно в кровяное русло, и определяют присутствие и нахождение меченого антитела у хозяина. Данная методика визуализации соответственно применяется при постановке диагноза и лечении новообразований. Антитело соответственно метят любой группой, которая является детектируемой у хозяина, включая детектируемые нерадиоактивные индикаторы, например, ядерно-магнитный резонанс или другие методы, известные в данной области. Однако предпочтительно, чтобы метка была радиоактивной меткой, включая иод, например, 125I и 131I, селен, бифункциональные хелаты, медь, например, 67Cu, технеций, например, 99mTc и рений, например, 186Re и 188Re. Радиоактивный изотоп конъюгируют с белком любыми способами, включая металл-хелатирующие соединения или лактопероксидазу, или методами на основе иодогена для иодирования.
Мышиное моноклональное антитело 2G7 было депозировано в Американской коллекции типовых культур, 10801, University Boulevard, Manassas, VA 20110-2209, USA (ATCC) как HB10240 в 9/28/89; и мышиное моноклональное антитело 4А11 было депозировано как ATCC HB10241 в 9/28/89.
Дополнительные детали изобретения представлены последующими неограничивающими примерами. Раскрытие всех цитат в описании в сжатой форме включено здесь для сведения.
Пример 1
Получение и характеристика моноклональных антител 2G7 и 4А11
А. Протоколы тестов
I. Определение ELISA
96-луночные планшеты из полистирола покрывали очищенным ТФР-бета с концентрацией 1 мкг/мл из расчета 100 мкл/лунку в карбонатном буфере с рН 9,6 в течение 18 ч при 4°С. Покрытые планшеты блокировали 0,5% бычьим сывороточным альбумином (BSA) в PBS (названным BPBS) в течение 1 ч при 22°С, промывали поверхностно-активным веществом 0,05% твином 20ТМ в PBS (названным PBST) и инкубировали с 100 мкл супернатанта гибридомы в течение 1 ч при 22°С. Планшеты промывали PBST и связанные антитела детектировали с козьим антимышиным IgG, конъюгированным с пероксидазой (Tago, Burlingame, CA). Планшеты промывали PBST и вносили субстрат о-фенилендиамин гидрохлорид из расчета 100 мкл/лунку. Реакцию останавливали через 15 мин и определяли оптическую плотность при 492 нм на ридере для планшетов UVMAXTM (Molecular Devices, Palo Alto, CA).
II. Иодирование rTФP-бета1
Очищенный ТФР-бета1 иодировали модифицированным методом с использованием натриевой соли п-хлор-пара-толуолсульфонамида CHLORAMINE TTM (Greenwood et al., Biochem. J., 89: 114 (1963)). Вкратце, 10 мкг очищенного rTФP-бета1 метили 1 мкюри Na125 на льду при трехкратных последовательных добавлениях 20 мкл 0,1 мг/мл натриевой соли п-хлор-пара-толуолсульфонамида CHLORAMINE TTM, разделенными инкубацией в течение 2 мин. Реакцию останавливали последовательными добавлениями 20 мкл 50 мМ N-ацетилтирозина, 1М иодида калия с последующим добавлением 200 мкл 8М мочевины. Иодированный rTФP-бета1 отделяли от свободного Na125I ВЭЖХ с использованием колонки С18 и градиента трифторуксусная кислота/ацетонитрил и фракции, содержащие основной пик, объединяли и хранили при -70°С (удельная активность 112 мккюри/мкг).
III. Радиоиммуноанализ с захватом антигена
Микротитрационные полоски IMMULONTM 2 «REMOVAWELL»TM (Dynatech, Chantily, VA) покрывали козьим антимышиным IgG с концентрацией 5 мкг/мл (Boehringer Mannheim) в карбонатном буфере с рН 9,6 в течение 18 ч при 4°С. Лунки промывали PBST, блокировали PBS, содержащим 0,1% желатина (названном PBSG), промывали PBST и инкубировали с супернатантом гибридомы в течение 4 ч при 22°С. Лунки промывали PBST и вносили 75000 импульсов в мин/лунку 125I-rTФP-бета1 в 100 мкл 0,1% желатина в PBST и инкубировали в течение 2 ч при 22°С. Планшеты промывали PBST и количественно определяли связанный 125I-rTФP-бета1 на счетчике GAMMAMASTERTM (LKB, Швеция).
IV. Иммунопреципитация 1 25I-rTФP-бета
Специфичность моноклональных анти-ТФР-бета-антител также оценивали по их способности иммунопреципитировать 125I-rTФP-бета1 или свиной тромбоцитарный 125I-rTФP-бета2 (R & D Systems, Minneapolis, MN; удельная активность 103,4 мккюри/мкг). Два мкг очищенного моноклонального антитела инкубировали с 5×104 импульсов в мин 125I-rTФP-бета1 или 125I-rTФP-бета2 в течение 2 ч при 22°С. Иммунокомплексы осаждали протеин-А агарозой A-SEPHAROSETM (Repligen, Cambridge, MA), покрытой кроличьим антимышиным IgG (Boehringer Mannheim Biochemicals, Indianapolis, IN), и затем промывали 3 ч с PBST. Комплексы диссоциировали из протеин-А агарозы A-SEPHAROSETM восстанавливающим буфером, подвергали электрофорезу в 12% SDS-полиакриламидном геле (SDS-PAGE) и авторадиографировали.
V. Определение аффинности моноклональных анти-ТФР-бета-антител
Твердофазный радиоиммуноанализ, описанный Mariani et al., J. Immunol. Methods, 71: 43 (1984), использовали для определения аффинности моноклональных специфических ТФР-бета антител. Вкратце, очищенные моноклональные анти-ТФР-бета-антитела наносили на микротитрационные полоски IMMULONTM 2 «REMOVAWELL»TM в карбонатном буфере с рН 9,6 в течение 18 ч при 4°С. Лунки промывали и блокировали, как описано выше. 40000 импульсов в мин/лунку 125I-rTФP-бета1 или свиного 125I-rTФP-бета2 (R & D Systems) в 50 мкл PBSG в 2-кратных серийных разведениях немеченых rTФP-бета1 или свиного rTФP-бета2 из расчета от 2500 до 9,7 нг/лунку в 50 мкл PBSG. Полученную смесь инкубировали в течение 18 ч при 4°С. Лунки промывали и определяли радиоактивность, как описано выше, и рассчитывали константы аффинности методом Scatchard (Munson and Pollard, Anal. Biochem., 107: 220 (1980)), который дает такие же результаты как анализ нелинейной регрессии Antoni and Mariani, J. Immunol. Meth., 83: 61 (1985).
VI. Выделение моноклональных антител из асцитной жидкости
Исходные гибридомные культуры, секретирующие антитело, которое было положительным в вышеуказанных тестах, клонировали ограничивающим разведением и культивировали в асцитной жидкости мышей Balb/с (Potter et al., JNCI, 49: 305 (1972)), примированных праймером PRISTANETM. Моноклональные антитела выделяли из асцитной жидкости с помощью протеин-А агарозы A-SEPHAROSETM и элюировали 0,1М уксусной кислотой, 0,5М NaCl, рН 2,4, с использованием принятых методик (Goding, J. Immunol. Methods, 20: 241 (1978) и хранили стерильными в PBS при 4°С.
VII. Нейтрализация моноклональными антителами in vitro специфической активности ТФР-бета
Использовали тест с ТФР-бета в условиях in vitro на линии клеток легочных фибробластов норки, Mv-3D9 (субклонированных из Mv1Lu, полученных из Американской коллекции типовых культур, Manassas, VA, под номером ATCC No CCL-64). Вкратце, очищенные моноклональные анти-ТФР-бета-антитела и контрольные инкубировали с rTФP-бета1, природным свиным ТФР-бета2 (R & D Systems) или rTФP-бета3 (Derynck et al., Nature, выше) при конечной концентрации 1000-2000 пкг/мл в течение 18 ч при 4°С. 50 мкл данных смесей вносили в 96-луночные микротитрационные планшеты с последующим добавлением 1×104 клеток Mv-3D9 в 50 мкл минимальной эссенциальной среды, содержащей 2 мМ глутамина и 5% фетальной бычьей сыворотки и инкубировали в течение 18-24 ч при 37°С в атмосфере 5% СО2. В лунки вносили 1 мккюри 3Н-тимидина в 20 мкл и собирали через 4 ч при 37°С и определяли радиоактивность на сцинтилляционном счетчике. Процент ингибирования поглощения 3Н-тимидина для каждого разведения стандарта ТФР-бета использовали для расчета активности ТФР-бета в пкг/мл в пробах, обработанных отрицательным контрольным моноклональным антителом и специфическим к ТФР-бета моноклональным антителом.
VIII. Изотипирование моноклональных антител
Изотипирование ТФР-бета1-реактивных моноклональных антител проводили с использованием устройства для технологии флуоресцентного скрининга PANDEXTM. Полистироловые гранулы, покрытые крысиной антимышиной-IgG-антисывороткой, использовали для связывания моноклонального антитела из культурального супернатанта, разлитого в 96-луночные планшеты PANDEXTM. Планшеты промывали и вносили конъюгированные с FITC крысиные моноклональные к антимышиному изотипу специфические реагенты (Becton Dickinson Monoclonal Center). Количественно определяли связанную флуоресценцию на устройстве для технологии флуоресцентного скрининга PANDEXTM.
IX. Анализ эпитопа
Очищенные моноклональные анти-rTФP-бета1-антитела конъюгировали с пероксидазой из хрена (HRP) по способу Nakane и Kawaoi, J. Histochem. Cytochem., 22: 1084 (1974). Покрытые rTФP-бета1 планшеты инкубировали с 50 мкг/мл очищенных анти-rTФP-бета1-антител или отрицательным контролем в PBS в течение 2 ч при 22°С. Затем заранее определенное разведение конъюгата моноклонального анти-rTФP-бета-антитела-HRP вносили в планшеты и инкубировали в течение 1 ч при 22°С. Планшеты промывали и добавляли субстрат и количественно определяли реактивность, как описано выше. Процент блокирования гетерологичных моноклональных анти-rTФP-бета1-антител сравнивали с аутореактивным, положительным контролем.
X. Анализ иммуноблоттингом
1 мкг/полосу rTФP-бета1 подвергали электрофорезу в 12% SDS-PAGE с использованием невосстанавливающего буфера для определения реактивности различных моноклональных антител с димерными формами rTФP-бета1. Пептиды трансблоттировали на нитроцеллюлозную бумагу и гибридизовали с соответствующим моноклональным антителом, конъюгированным с HRP. Связанное антитело визуализировали с использованием нерастворимого субстрата 4-хлор-1-нафтола (Kirkegaard and Perry, Gathersburg, MD). Реакцию останавливали через 15 мин тщательным промыванием дистиллированной водой и иммуноблоты высушивали и фотографировали.
В. Продукция анти-ТФР-бета1- и анти-ТФР-бета2-специфических моноклональных антител
В первоначальных протоколах иммунизации мышей Balb/с иммунизировали rTФP-бета1 (получали и очищали, как описано Derynck et al., Nature, выше) при подкожном и внутрибрюшинном введении с использованием различных иммуногенных препаратов, доз и схем и с использованием полного и неполного адъюванта Фрейнда. Иммунизацию проводили до 11 недель. У нескольких мышей ответная реакция выражалась в определяемом, но низком титре анти-rTФP-бета1-антител, и двух из этих мышей умерщвляли и селезенки использовали для гибридизации. Из 1152 исходных культур только 84 супернатанта были положительными на анти-ТФР-бета. 10 из данных гибридом клонировали и получали моноклональные антитела с низкой аффинностью, которые невозможно было использовать для разработки теста или очистки.
В качестве альтернативной стратегии группе из 10 мышей-самок Balb/с (Charles River Breeding Laboratories, Wilmington, MA) вводили 5 мкг/дозу очищенного ТФР-бета1 в 100 мкл адъюванта DETOXTM (RIBI ImmunoChem Res. Inc., Hamilton MT) в подушечки задних конечностей на 0, 3, 7, 10 и 14 сутки. На 17 сутки животных умерщвляли, удаляли паховой и подколенный лимфатические узлы и лимфоциты отделяли от стромы узлов с использованием сетки из нержавеющей стали. Суспензии лимфоцитов от всех 10 мышей объединяли и гибридизировали с мышиной миеломой линии Х63-Ag8.653 (Kearney et al., J. Immunol., 123: 1548 (1979)) с использованием 50% полиэтиленгликоля 4000 принятой методикой (Oi and Herzenberg, in Selected Methods in Cellular Immunology, B. Mishel and S. Schiigi, eds. (W. J. Freeman Co., San Francisco, CA, 1980), р. 351. Гибридные клетки высевали в целом на 1334 96-луночных планшетах с титром 2×105 клеток/лунку с последующим отбором НАТ (Littlefield, J. W., Science, 145: 709 (1964)) на 1 сутки после гибридизации.
1190 лунок были реактивными с иммобилизованным рекомбинантным ТФР-бета1 при анализе ELISA. 18 из этих культур оставались стабильными при размножении и клеточные линии замораживали. Данные исходные культуры изотипировали и анализировали на их способность захватывать 125I-rTФP-бета1 и нейтрализовать в условиях in vitro активность ТФР-бета1. Из 18 исходных культур, которые анализировали на нейтрализацию rTФP-бета1 и затем изотипировали, две представляли собой изотип IgG1 каппа; остальные представляли изотип IgG2b каппа. Было установлено, что только моноклональные антитела, относящиеся к подклассу IgG1, проявляли ингибирующую (нейтрализующую) активность в отношении rTФP-бета1 в условиях in vitro. Отбирали три стабильных гибридомы, которые секретировали высокоаффинные моноклональные антитела против ТФР-бета. Характеристика данных антител подробно представлена ниже.
С. Иммунопреципитация меченного радиоактивным иодом ТФР-бета
Опыты по иммунопреципитации проводили для определения способности трех моноклональных антител распознавать и преципитировать ТФР-бета1 в растворе. Авторадиография показывала, что монолональные антитела против ТФР-бета 2G7, 4A11 и 12Н5 иммунопреципитировали эквивалентные количества 125I-rTФP-бета1, в то время как контрольное моноклональное антитело 6G12 давало отрицательный результат. Иммунопреципитированные полосы имели кажущуюся молекулярную массу примерно 14,5 кД. Тест конкурентного ингибирования использовали для определения аффинности взаимодействия между ТФР-бета1 и каждым из моноклональных антител. Моноклональные антитела 2G7 и 4A11 обладали примерно равной, более высокой аффинностью, которая составляла 1,2×108 л/моль.
Также опыты по иммунопреципитации проводили для определения способности отобранных моноклональных антител распознавать и преципитировать ТФР-бета2 в растворе. Авторадиография показывала, что в противоположность rTФP-бета1 только антитело 2G7 иммунопреципитировало 125I-ТФР-бета2 до определяемой степени. При сравнении антител 4A11 и 12Н5 с отрицательными контрольными антителами была выявлена незначительная специфическая преципитация. Данные результаты вызывали удивление в том отношении, что при перекрестном блокировании было показано, что антитела 4A11 и 2G7 были способны ингибировать связывание друг с другом человеческим rTФP-бета1. Смотри таблицу 1.
Блокирование моноклонального антитела
В совокупности данные указывают, что эпитопы, распознаваемые двумя этими моноклональными антителами, являются различными, но либо находятся в тесной близости, либо каким-то другим образом оказывают влияние на связывание другого на расстоянии. По данным иммунопреципитации или перекрестного блокирования оказалось, что 12Н5 является другим эпитопом, несмотря на наблюдаемое некоторое блокирование. Данный вывод также подтверждается данными по нейтрализации, представленными ниже.
D. Анализ иммуноблоттингом с rTФP-бета1
Поскольку активной формой ТФР-бета является гомодимер, то проводили иммуноблоттинг для определения того, насколько моноклональные антитела распознают данную форму. Все антитела 2G7, 4A11 и 12Н5 подвергали взаимодействию в опосредованном иммуноблоттинге с димерной формой ТФР-бета1 (невосстановленной). Антитело 2G7 давало более сильную полосу по сравнению с 4A11 или 12Н5. Как и в опыте по иммунопреципитации контрольное антитело 6G12 давало отрицательный результат. Данный тип реактивности также наблюдали в прямом вестерн-блоттинге с HRP-конъюгатами данных моноклональных антител.
В заключение проводили протокол с использованием иммунизации в подушечку конечностей со слиянием лимфоузлов после многих неудачных попыток по устранению толерантности к rTФP-бета1 с использованием различных схем иммунизации и дозирования на мышах Balb/с и С3Н с полным и неполным адъювантом Фрейнда. В основном данная процедура была признана пригодной для получения быстрой ответной реакции с очень высокой аффинностью к данным слабым антигенам в противоположность к результатам опыта Dasch et al., выше, которые получали нейтрализующие ТФР-бета1 и ТФР-бета2 моноклональные антитела с использованием очищенного бычьего, полученного из кости ТФР-бета2 в адъюванте Фрейнда в качестве иммуногена на мышах Balb/с.
Все три моноклональных антитела связывались с rTФP-бета1 в иммуноблоттинге, ELISA, перекрестном блокировании и иммунопреципитации. Два из анти-rTФP-бета1-антител нейтрализовали активность rTФP-бета1 в условиях in vitro, в то время как только одно из двух антител нейтрализовало активность ТФР-бета2 и ТФР-бета3 в клеточном тесте с легочными фибробластами норки. Нейтрализующие ТФР-бета1 антитела также блокировали связывание меченного радиоактивным иодом rTФP-бета1 в радиорецепторном тесте, указывая на то, что нейтрализация активности rTФP-бета1 в условиях in vitro может быть за счет блокирования рецептора.
Пример 2
Гуманизированные антитела 2G7
Вариабельные домены мышиного моноклонального антитела 2G7 вначале клонировали в вектор, позволяющий продуцировать химерный мышиный/человеческий фрагмент Fab. Выделяли общую фракцию РНК из гибридомных клеток с использованием набора для экстракции РНК STRAGENETM, следуя протоколам производителя. Вариабельные домены амплифицировали RT-ПЦР, очищали в геле и вставляли в производное плазмиды pUCl19, содержащей человеческий константный домен каппа и человеческий домен Сн1, как описано ранее (Carter et al., Proc. Natl. Acad. Sci. (USA), 89: 4285 (1992) и патент США № 5821337). Полученную плазмиду трансформировали в штамм 16С9 E. coli для экспрессии фрагмента Fab. Культивирование культур, индукцию экспрессии белка и очистку фрагмента Fab проводили, как описано ранее (Werther et al., J. Immunol., 157: 4986-4995 (1996); Presta et al., Cancer Research, 57: 4593-4599 (1997)).
Секвенирование ДНК химерного клона позволило идентифицировать остатки CDR (Kabat et al., выше). При использовании олигонуклеотидного сайт-направленного мутагенеза все шесть данных областей CDR вставляли в полный человеческий каркасный усчасток (VL каппа подгруппа I и VH подгруппа III), находящийся в плазмиде VX4, как описано ранее (Presta et al., Cancer Research, 57: 4593-4599 (1997)). Белок из полученного «CDR-обмена» экспрессировали и очищали, как описано выше. Проводили опыты по связыванию для сравнения двух вариантов. Вкратце, планшет NUNC MAXISORPTM покрывали 1 мкг на мл внеклеточного домена ТФР-бета (ECD; полученного, как описано в WO 1990/14357) в 50 мМ карбонатном буфере, рН 9,6, в течение ночи при 4°С и затем блокировали разбавителем для ELISA (0,5% BSA, 0,05% неионогенного поверхностно-активного вещества POLYSORBATETM, PBS) при комнатной температуре в течение 1 ч. Серийные разведения проб в разбавителе для ELISA инкубировали в планшетах в течение 2 ч. После промывания детектировали связанный фрагмент Fab с биотинилированным мышиным античеловеческим каппа антителом (ICN 634771), затем со стрептавидином, конъюгированным с пероксидазой из хрена (Sigma) и с использованием 3,3',5,5'-тетраметилбензидина (Kirkegaard & Perry Laboratories, MD) в качестве субстрата. Определяли поглощение при 450 нм. Связывание «CDR-обмена» Fab было достоверно ниже по сравнению со связыванием химерного фрагмента Fab.
Для восстановления связывания гуманизированного Fab конструировали мутанты с использованием ДНК из «CDR-обмена» в качестве матрицы. С использованием созданной компьютерной программы было установлено, что данные мутации приводят к изменению остатков человеческого каркасного участка на их мышиные противоположности в положениях, где изменение могло повлиять на конформацию CDR и поверхность раздела антитело-антиген. Мутанты представлены в таблице 2 (в качестве примечания: нумерация аминокислот выражена как у Kabat et al., выше). Последовательности смотри на фиг.1-4.
Варианты 3 и 4 использовали в качестве промежуточных для получения гуманизированных вариантов Fab, имеющих более высокие номера. Вариант 5, с изменениями AlaH49Gly, PheH67Ala и ArgH71Ala, имели восстановленное связывание до такового у исходного химерного фрагмента Fab антитела 2G7, как и варианты 709 и 11 (фиг.5). Полагают, что варианты 710 и 712 обладают аналогичным связыванием с химерным фрагментом, но вариант 712 имеет дополнительную мутацию каркасного участка, которая может быть нежелательной ввиду повышения иммуногенности. Дополнительные остатки FR или CDR, такие как L3, L24, L54 и/или Н35, можно модифицировать (например, заменить следующим образом: GlnL3Met, ArgL24Lys, ArgL54Leu, GluH35Ser). Замены, которые могли бы быть желательными для повышения стабильности, представляют замену лейцина или изолейцина на метионин для снижения окисления, или замену аспарагина в CDR на другие остатки для снижения возможности деамидирования. Альтернативно или дополнительно гуманизированное антитело может обладать зрелой аффинностью (смотри выше) для дополнительного повышения или улучшения его афффинности и/или билогической активности.
Плазмиды для экспрессии подноразмерных IgG конструировали субклонированием доменов VL и VH химерного фрагмента антитела 2G7, а также гуманизированных вариантов Fab 5, 709 и 11 в ранее описанные векторы pRK для экспрессии в клетках млекопитающих (Gorman et al., DNA Prot. Eng. Tech., 2: 3-10 (1990)). Вкратце, каждую конструкцию Fab расщепляли EcoRV и BlpI для вырезания фрагмента VL, который клонировали в сайты EcoRV/BlpI плазмиды pDR1 (смотри фиг.6) для экспрессии полной легкой цепи (домены VL-CL). Дополнительно каждую конструкцию Fab расщепляли PvuII и ApaI для вырезания фрагмента VH, который клонировали в сайты PvuII/ApaI плазмиды pDR2 (смотри фиг.7) для экспрессии полной тяжелой цепи (домены VH-CH1-CH2-CH3).
Для каждого варианта IgG проводили временные трансфекции котрансфицированием экспрессирующей легкую цепь плазмиды и экспрессирующей тяжелую цепь плазмиды в линию человеческих эмбриональных почечных клеток, трансформированных аденовирусом, 293 (Graham et al., J. Gen. Virol., 36: 59-74 (1977)). Вкратце, клетки 293 расщепляли за сутки до трансфекции и высевали в среду, содержащую сыворотку. На следующие сутки готовили преципитат с использованием фосфата кальция из двухцепочечной ДНК легкой и тяжелой цепей вместе с ДНК вектора pADV ANTAGETM (Promega, Madison, WI) и добавляли по каплям в планшеты. Клетки инкубировали в течение ночи при 37°С, затем промывали PBS и культивировали в среде без сыворотки в течение 4 суток, когда собирали кондиционированную среду. Антитела выделяли из культурального супернатанта с использованием протеин-А агарозы A-SEPHAROSE CL-4BTM, затем заменяли буфер на 10 мМ сукцинат натрия, 140 мМ NaCl, рН 6,0, и концентрировали с использованием микроконцентратора CENTRICON-10TM (Amicon). Концентрацию белка определяли анализом поглощения при 280 нм или количественным анализом аминокислот.
Дополнительные модификации варианта 5 IgG hu2G7 проводили для выяснения того, какой CDR вносит свой вклад в связывание, какой CDR можно ревертировать в последовательность локусов каппа человеческой зародышевой линии без потери активности или для стабилизации антитела. Они приведены в таблице 3 и представлены аминокислотные различия между вариантом 5 и данными вариантами.
Названием для последовательности зародышевой линии, используемой для CDR L1, является L8/L9, как представлено на фиг.4 у Cox et al., Eur. J. Immunol., 24: 827-836 (1994) и на фиг.2е у Schable and Zachau, Biol. Chem. Hoppe-Seyler, 374: 1001-1002 (1993). Для CDRL2 последовательность зародышевой линии названа L8/L9/L14/L15 (смотри Cox et al., выше и Schable and Zachau, выше).
Проводили реверсии в последовательности локуса каппа человеческой зародышевой линии (gl) во всех CDR, но только ревертанты зародышевой линии, представленные выше, показывали связывание (смотри фиг.8). Из данных, представленных на данной фигуре, следует, что V5H.g1L2 с CDR L2, ревертированный в последовательность локуса каппа человеческой зародышевой линии, по прежнему связывается с ТФР-бета, как и V5H.V5L. Два варианта V5H.g1L1g1L2 и H2NI.g1L1g1L2, а также H2NI.V5L не связывались как химерное антитело.
Тест пролиферации мышиных мезангиальных клеток использовали для тестирования контрольного антитела и нескольких гуманизированных антител (V5H.V5L, V5H.g1L2, H2NI.V5L, V5H.g1L1g1L2 и H2NI.g1L1g1L2). Протокол исследований представляет следующее:
на 1 сутки: мышиные мезангиальные клетки высевали в 96-луночный планшет в среде (смесь среды Игла в модификации Дульбекко и среды Хэмса F12 с 95% фетальной бычьей сыворотки с добавлением 5% 14 мМ буфера HEPES) и культивировали в течение ночи;
на 2 сутки: ТФР-бета в трех различных концентрациях (100 нг, 10 нг и 1 нг) и пять различных типов гуманизированных ТФР-антител (20 мкг/мл) разводили средой без сыворотки и добавляли к клеткам. Мышиное ТФР-антитело использовали в качестве контроля (2G7);
на 4 сутки: через 48 ч инкубации 20 мкл буфера для реакции (CELLTITER 96 AQUEOUS ONE SOLUTION REAGENTTM (PROMEGA INC. номер по каталогу G3580)) вносили в каждую лунку планшета и инкубировали в течение 2 ч. Поглощение (OD) определяли при 490 нм.
H2NI.V5L (20 мкг/мл) полностью блокировали ингибирование клеток, индуцированное ТФР-бета в концентрации 1 нг/мл, что является тем же результатом, полученным с использованием химерного мышиного контрольного антитела (смотри фиг.9). Вариант 5 V5H.V5L также блокировал ингибирование клеток аналогично контролю.
Различные гуманизированные антитела тестировали на их активность нейтрализовать различные ТФР-бета по сравнению с антителом 2G7 с использованием линии клеток 3Т3 из фибробластов разрушенных эмбрионов мышей Swiss, стимулированных одним из трех ТФР-бета в условиях in vitro, и затем определяли в качестве активности их пролиферацию. Результаты представлены на фиг.10-14. Данные этих фигур указывают, что гуманизированное антитело H2NI.V5L превосходило по своей блокирующей активности контрольное антитело 2G7. Другие гуманизированные тестированные антитела H2NI.g1L2 (CDR L2, ревертированный в последовательность локуса каппа человеческой зародышевой линии) и V5H.g1L2 (CDR L2, ревертированный в последовательность локуса каппа человеческой зародышевой линии) показывали сравнимую ингибирующую активность, при том, что V5H.g1L2 были наименее эффективными для всех ТФР-бета1-3.
В заключении гуманизированные антитела V5H.V5L, V5H.g1L2, H2NI.V5L, H2NI.g1L2 и варианты 709, 710 и 711 являются наиболее предпочтительными гуманизированными вариантами, поскольку они в сравнимой степени связываются с ТФР-бета, как и химерное антитело (chimH.chimL; фрагмент Fab 2G7) и/или нейтрализуют ТФР-бета или блокируют ингибирование клеток, индуцированное ТФР-бета в условиях in vitro, и обладают минимальными изменениями каркасного участка всех тестированных гуманизированных антител, что будет сводить до минимума риск проявления иммунной ответной реакции у пациентов. Кроме того, H2NI.V5L является особенно предпочтительным антителом, поскольку оно проявляет более высокую нейтрализующую активность для всех трех изоформ ТФР-бета (ТФР-бета 1, 2, 3) и может обладать повышенной стабильностью за счет изменений в CDR H2. Кроме того, можно ожидать, что данные гуманизированные антитела, которые проявляют повышенную способность блокировать активность всех трех лигандов ТФР-бета в условиях in vitro по сравнению с мышиным моноклональным антителом 2G7, будут функционировать лучше по сравнению с 2G7 в различных показаниях, представленных ниже, за счет их более высокой способности ингибировать все индуцированные ТФР-бета эффекты, что показано в тесте пролиферации фибробластов, индуцированной ТФР-бета (фиг.10-14).
Пример 3
Терапия рецидивной или резистентной злокачественной опухоли простаты
Настоящее антитело представляет полноразмерное, гуманизированное моноклональное антитело (продуцированное клетками СНО) против ТФР-бета. Оно показано в качестве единственного средства для лечения гормон-резистентной (андроген-независимой) злокачественной опухоли простаты у пациентов. Первичные конечные точки для оценки эффективности включают выживаемость в целом по сравнению с лучшими препаратами (митоксантрон/преднизон), когда применяются в качестве одного средства, и переносимость. Вторичные конечные точки эффективности включают время до прогрессирования заболевания, скорость ответной реакции, качество жизни, боль и/или продолжительность ответной реакции. Антитело вводят внутривенно (в/в) еженедельно или каждые три недели в дозе 2 или 4 мг/кг соответственно до прогрессирования заболевания. Антитело поставляют в виде жидкой композиции, содержащей много доз (20 мл резервуар с концентрацией 20 мг/мл или с более высокой концентрацией).
Антитело также показано в комбинации с химиотерапией для лечения гормон-резистентной (андроген-независимой) опухоли простаты у пациентов. Первичные конечные точки для оценки эффективности включают выживаемость в целом по сравнению с химиотерапией и переносимость. Вторичные конечные точки эффективности включают время до прогрессирования заболевания, скорость ответной реакции, качество жизни, боль и/или продолжительность ответной реакции. Антитело вводят внутривенно (в/в) еженедельно или каждые три недели в дозе 2 или 4 мг/кг соответственно до прогрессирования заболевания. Антитело поставляют в виде жидкой композиции, содержащей много доз (20 мл резервуар с концентрацией 20 мг/мл или с более высокой концентрацией).
Примеры препаратов, которые можно комбинировать с гуманизированным анти-ТФР-бета-антителом для лечения опухоли простаты (например, андроген-независимой опухоли простаты), включают ингибитор фарнезилтрансферазы; антиангиогенный препарат (например, анти-VEGF-антитело); препарат с целенаправленным действием против EGFR (например, С225 или ZD1839); анти-HER-2-антитело HERCEPTIN® или анти-ErbB-антитело, которое индуцирует апоптоз, такое как 7C2 или 7F3, включая его гуманизированные варианты или варианты со зрелой аффинностью; 2С4 или гуманизированное антитело 2С4; другое анти-ТФР-бета-антитело (например, моноклональное ТФР-бета-антитело); цитокин (например, IL-2, IL-12, G-CSF или GM-CSF); антиандроген (такой как флутамид или ципротерон ацетат); лейпролид; сурамин; химиотерапевтическое средство, такое как винбластин, эстрамустин, митоксантрон, лиарозол (средство, блокирующее обмен ретиноевой кислоты), циклофосфамид, антибиотики антрациклинового ряда, такие как доксорубицин, таксан (например, паклитаксел или доцетаксел) или метотрексат или любые комбинации вышеуказанных препаратов, так как винбластин/эстрамустин или циклофосфамид/доксорубицин/метотрексат; преднизон; гидрокортизон или их комбинации. Можно вводить стандартные дозы для данных различных препаратов, например, 40 мг/м2/неделю для доцетакселя (TAXOTERETM®); 6 (AUC)карбоплатина и 200 мг/м2 для паклитакселя (TAXOL®).
Поскольку ТФР-бета также принимает участие в развитии опухоли простаты (Shah et al., Cancer Research, 62: 7135-7138 (2002)), то антитело можно тестировать на моделях опухоли простаты (например, на трансгенных мышах TRAMP, а также трансплантированных клетках РС-3) с прогнозом результативности лечения.
Пример 4
Терапия злокачественной опухоли молочной железы
Настоящее антитело показано в качестве единственного средства для лечения пациенток со злокачественной опухолью молочной железы, в частности, но не ограничиваясь пациентками с метастазами. Первичные конечные точки оценки эффективности включают скорость ответной реакции и переносимость. Вторичные конечные точки эффективности включают выживаемость в целом, время до прогрессирования заболевания, качество жизни, и/или продолжительность ответной реакции. Антитело вводят внутривенно (в/в) еженедельно или каждые три недели в дозе 2 или 4 мг/кг соответственно до прогрессирования заболевания. Антитело поставляют в виде жидкой композиции, содержащей много доз (20 мл резервуар с концентрацией 20 мг/мл или с более высокой концентрацией).
Настоящее гуманизированное антитело также показано в комбинации с химиотерапией для лечения пациенток с опухолью молочной железы. Первичные конечные точки оценки эффективности включают выживаемость в целом по сравнению с одной химиотерапией и переносимость. Вторичные конечные точки эффективности включают время до прогрессирования заболевания, скорость ответной реакции, качество жизни и/или продолжительность ответной реакции. Гуманизированное антитело вводят внутривенно (в/в) еженедельно или каждые три недели в дозе 2 или 4 мг/кг соответственно до прогрессирования заболевания. Антитело поставляют в виде жидкой композиции, содержащей много доз (20 мл резервуар с концентрацией 20 мг/мл или с более высокой концентрацией).
Примеры препаратов, которые можно комбинировать с гуманизированным анти-ТФР-бета-антителом для лечения опухоли молочной железы (например, опухоли молочной железы с метастазами, для которой не характерна сверхэкспрессия ТФР-бета), включают химиотерапевтические средства, такие как антибиотики антрациклинового ряда (например, доксорубицин), циклофосфамид, таксан (например, паклитаксел или доцетаксел), навельбин, кселода, митомицин С, соединения платины, оксалиплатин, гемцитабин или комбинации двух или более данных препаратов, такие как доксорубицин/циклофосфамид; анти-HER-2-антитело HERCEPTIN® или анти-ErbB-антитело, которое индуцирует апоптоз, такое как 7C2 или 7F3, включая его гуманизированные варианты или варианты со зрелой аффинностью; 2С4 или гуманизированное антитело 2С4; другое анти-ТФР-бета-антитело (например, моноклональное ТФР-бета-антитело); антиэстроген (например, тамоксифен); ингибитор ароматазы (например, анастрозол); игибитор фарнезилтрансферазы, антиангиогенный препарат (например, анти-VEGF-антитело); препарат с целенаправленным действием против EGFR (например, С225 или ZD1839); цитокин (например, IL-2, IL-12, G-CSF или GM-CSF) или комбинации вышеуказанных препаратов. Можно использовать стандартные дозы для таких дополнительных препаратов.
Настоящее гуманизированное антитело дополнительно показано в комбинации с анти-HER-2-антителом HERCEPTIN® или rhuMAb 2C4 для лечения пациенток с опухолью молочной железы, особенно с метастазами. Первичные конечные точки для оценки эффективности включают скорость ответной реакции и переносимость. Вторичные конечные точки эффективности включают время до прогрессирования заболевания, выживаемость в целом по сравнению с одними анти-HER-2-антителом HERCEPTIN® или rhuMAb 2C4, качество жизни и/или продолжительность ответной реакции. RhuMAb 2C4 вводят внутривенно (в/в) еженедельно или каждые три недели в дозе 2 или 4 мг/кг соответственно до прогрессирования заболевания. Антитело rhuMAb 2C4 поставляют в виде жидкой композиции, содержащей много доз (20 мл резервуар с концентрацией 20 мг/мл или с более высокой концентрацией). Анти-HER-2-антитело HERCEPTIN® вводят в/в с начальной нагрузочной дозой, равной 4 мг/кг, с последующим введением еженедельной поддерживающей дозы 2 мг/кг. Анти-HER-2-антитело HERCEPTIN® поставляют в виде лиофилизованного порошка. Каждая ампула анти-HER-2-антитела HERCEPTIN® содержит 440 мг анти-HER-2-антитела HERCEPTIN®, 9,9 мг L-гистидина HCl, 6,4 мг L-гистидина, 400 мг α-α-трегалозы дигидрата и 1,8 мг поверхностно-активного вещества POLYSORBATE 20TM. Восстановление 20 мл бактериостатической воды для инъекций (BWFI), содержащей 1,1% бензилового спирта в качестве консерванта, дает 21 мл раствора, содержащего много доз, содержащего 21 мг/мл анти-HER-2-антитела HERCEPTIN® с рН примерно 6,0.
С использованием мышиного антитела 2G7 в эпителиальных клетках 4Т1 из спонтанной мышиной опухоли молочной железы клетки (1,5х105) прививали в жир молочной железы мыши (0 сутки). На данной модели пальпируемые первичные опухоли появляются через 1 неделю; вторичные метастазы появляются в легких через 2 недели, в печени через 3 недели и в костях через 4-5 недель. Ткани отбирали на 5 неделе. Антитело 2G7 и два контрольных IgG антитела вводили внутрибрюшинно мышам в дозе 25 мг/кг 3х/неделю и определяли в сыворотке крови продукцию ТФР-бета клетками 4Т1 в вреде культуры ткани (или в крови в опытах in vivo) с помощью промышленно доступного набора для постановки ELISA производства R&D systems.
На фиг.15А показана продукция ТФР-бета клетками 4Т1 и нормальными мышиными эпителиальными клетками С57 в качестве контроля с помощью ELISA в условиях in vitro. На фиг.15В представлено влияния антитела 2G7 на продукцию ТФР-бета клетками 4Т1 в условиях in vivo у мышей с опухолями (+анти-ТФР-бета) по сравнению с мышами без опухолей (-контроль), обработанных (контрольными) антителами (изотип IgG, который представляет антипыльцовое антитело) и по сравнению с мышами с опухолями (+контрольные), обработанными контрольными антителами. Данные результаты показывают, что эпителиальные опухолевые клетки 4Т1 продуцировали больше ТФР-бета по сравнению с контрольными эпителиальными клетками С57 в условиях in vitro (фиг.15А) и что антитело 2G7 снижало количество свободного ТФР-бета в крови по сравнению с мышами, обработанными контрольными антителами (фиг.15В).
Значения концентраций свободного ТФР-бета у мышей, обработанных анти-ТФР-бета-антителом 2G7, совпадают с ранее полученными результатами, свидетельствующими о том, что анти-ТФР-бета-антитела могут изменять доступность ТФР-бета в условиях in vivo (Wojtowicz-Praga et al., Immunother. Emphasis Tumor Immunol., 19(3): 169-75 (1996). Erratum in: J. Immunother. Emphasis Tumor Immunol., 19(5): 386 (1996), Verma UM (исправлено на Verma UN)). Кроме того, используемое здесь антитело (2G7) не мешает проведению ELISA, поскольку добавление 2G7 в контрольную плазму не влияло на показания ELISA при разведении 1:10, 1:100 и 1:1000 по сравнению с растворителем. Ziyadeh et al., Proc. Natl. Acad. Sci. USA, 97: 8015-20 (2000).
На фиг.16А представлены результаты гистологических исследований в баллах, и на фиг.16В представлены значения массы ткани для вторичных опухолей легких, полученных на модели опухолевых клеток, использованных на фиг.15, с контрольным антипыльцовым IgG и анти-ТФР-бета 2G7, введенным мышам, как описано для фиг.15, указывая, что анти-ТФР-бета-антитела приводят к снижению степени, числа пораженных долей, массы ткани в г и массы легких в виде процента от массы тела по сравнению с контролем. Вторичные опухоли легких обнаруживали компьютерной томографией ex vivo.
На фиг.17 представлены данные по количественному определению опухолей легких на вышеуказанной модели на мышах с использованием uCT, с указанием объема и количества опухолей, при том, что анти-ТФР-бета 2G7 уменьшали объем опухолей по сравнению с контрольным IgG, при введении как 2G7, так и контроля мышам, как описано для фиг.15 (т.е. 25 мг/кг 3×/неделю внутрибрюшинно).
На фиг.18А представлены данные по объему опухолей на вышеуказанной модели на мышах как функцию времени в сутках после введения клеток с использованием схемы 25 мг/кг 3×/неделю внутрибрюшинно контрольного IgG с физиологическим раствором или таксолом и 25 мг/кг 3×/неделю внутрибрюшинно анти-ТФР-бета 2G7 с таксолом, указывая, что последняя схема была наиболее эффективной в уменьшении объема опухолей. На фиг.18В показано, что анти-ТФР-бета 2G7 в комбинации с химиотерапией уменьшали массу тканей - легких, селезенки и опухолей - по сравнению с контролем IgG/физиологический раствор и IgG/химиотерапия.
Кроме того, антитело 2G7 уменьшало концентрации в крови васкулярного эндотелиального фактора роста (VEGF) по сравнению с контрольным IgG на данной модели на мышах. На фиг.19 представлены уровни VEGF в плазме крови (пкг/мл) у мышей без опухолей (нормальные) или у мышей с опухолями молочной железы 4Т1, обработанных контрольным IgG (контроль) или анти-ТФР-бета 2G7 (а ТФР-бета) (25 мг/кг 3×/неделю внутрибрюшинно для контроля и анти-ТФР-бета). Каждая точка представляет отдельную мышь. Горизонтальная линия указывает среднее значение для группы.
В заключение на модели опухоли молочной железы из эпителиальных клеток, полученных из спонтанных опухолей молочной железы у мышей Balb/с (4Т1), которым вводили в жировые подушечки молочной железы сингенных мышей, было установлено, что антитело 2G7 приводит к снижению уровня свободного ТФР-бета в крови и концентрации VEGF в крови, и для них характерно незначительная, но достоверная временная способность снижать первичный рост опухолей по сравнению с контролем. Обработка антителом 2G7 на ранней стадии уменьшала вторичные опухоли легких.
Кроме того, ранняя обработка антителами 2G7 в значительной степени ослабляла индуцируемую опухолью молочной железы деструкцию костей, имеющую место на данной модели, что установили с использованием того же сканирования, что и для легких. Смотри таблицу 4. В данной таблице трабекулярное число относится к числу трабекул (небольшие спикулы костей, которые проходят в костный мозг) и трабекулярная толщина относится к средней толщине данных трабекул. Оба указанных параметра указывают на количество костной ткани и их определяют микрокомпьютерной томографией и алгоритмом для количественного определения различных костных параметров.
Следует отметить, что проценты относятся к:
1) по отношению к нормальным мышам (т.е. без опухолей) для образцов «2G7 без первичной опухоли» и «с первичной опухолью»;
2) по отношению к мышам с опухолями, обработанными контрольными IgG антителами для образца «2G7 с первичной опухолью».
Также антитело 2G7 тестировали на модели опухоли молочной железы (PymT), описанной Maglione et al., Transgenic Polyoma middle-T mice model premalignant mammary disease, Cancer Res., 61(22): 8298-305 (2001) и Lin et al., Progression to malignancy in polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases, Am. J. Pathol., 163(5): 2113-26 (2003). Оба антитела (контрольный IgG (антипыльцовое антитело) и анти-ТФР-бета 2G7) вводили по одинаковой схеме: 25 мг/кг 3×/неделю внутрибрюшинно. На фиг.20А показано действие анти-ТФР-бета 2G7 по сравнению с контрольным IgG на объем опухоли как функцию роста опухолей в сутках на модели PymT, указывая, что антитело 2G7 приводит к снижению объема опухоли во времени по сравнению с контрольным IgG. На фиг.20В показано, что масса опухоли также уменьшалась под действием ТФР-бета-антитела 2G7 по сравнению с контрольным IgG. Также было установлено, что концентрация VEGF уменьшалась в опухолях PymT по сравнению с опухолями Her2.
С учетом этих данных можно предположить, что гуманизированные варианты антител 2G7 будут функционировать аналогично 2G7 в плане влияния на рост и метастазирование опухолей.
В отличие от эпителиальных клеток 4Т1 эпителиальные клетки Her+ не синтезировали ТФР-бета в высоких концентрациях в условиях in vitro, их рост ингибировался под действием ТФР-бета в условиях in vitro (Siegel et al., Transforming growth factor beta signaling impairs Neu-induced mammary tumorigenesis while promoting pulmonary metastasis. Proc. Natl. acad. Sci. USA, 100(14): 8430-5 (2003)), и их рост не подавлялся при обработке ТФР-бета в условиях in vivo. Кроме того, концентрация VEGF возрастала на данной модели при введении анти-ТФР-бета-антитела 2G7 по сравнению с контрольным IgG.
Окрашивание трех моделей опухоли молочной железы (4Т1, PymT и Her2) на базальную мембрану (коллаген IV), эндотелиальные клетки (CD31) или поддерживающие сосуды клетки, называемые перицитами (SMA или NG2), выявило различия в данных моделях в отношении указанных трех компонентов. Данные компоненты, не ограничиваясь какой-либо теорией, могут служить для прогнозирования чувствительности опухолей к лечению анти-ТФР-бета-антителами.
С учетом предполагаемой бифункциональной природы роли ТФР-бета в развитии опухолей применение диагностикума для определения того, как/если пациент будет реагировать, может быть пригодным в применении ТФР-бета-ингибирующей стратегии для лечения опухолей. Например, может быть важным определение того, будут или не будут опухолевые клетки у данного пациента сохранять чувствительность к ингибирующему рост действию ТФР-бета.
Не ограничиваясь какой-либо одной теорией, ниже представлен список потенциальных диагностических маркеров для отбора пациентов/опухолей, наиболее реагирующих на лечение ТФР-бета, где данный перечень не является ограничивающим:
1) экспрессия одной или более из трех изоформ ТФР-бета, ТФР-бета1, -2 и/или -3, особенно при более высоких концентрациях, при особом внимании к ТФР-бета1:
а) это будет включать ряд различных типов опухолей, включая, но не ограничиваясь злокачественными опухолями молочной железы, поджелудочной железы, простаты, почек, легких и кожи (меланомой). Было установлено, что имеется достоверная сверхэкспрессия ТФР-бета1 в данных типах опухолей по сравнению с нормальными тканями того же типа;
b) Her2-отрицательные опухоли молочной железы в противоположность Her2-положительным опухолям молочной железы, поскольку первые могут лучше реагировать на лечение антителами, на что указывает более высокая экспрессия ТФР-бета1. В данном отношении было установлено, что в данных типах опухолей имела место достоверная сверхэкспрессия ТФР-бета1 по сравнению с нормальными тканями того же типа;
2) в подтверждении #1 продукция опухолевых клеток, независимо от ТФР-бета1, также происходит в строме/среде;
3) мутация в и снижение экспрессии одного или более рецепторов ТФР-бета, особенно, но не ограничиваясь, ТФР-бета1 RI или ТФР-бетаRII (тип-IIR);
4) мутации или изменения в концентрации или локализации молекул в ТФР-бета сигнальном пути, включая, но не ограничиваясь: SMAD/фосфоSMAD, c-myc, CDC25A, p15INK4B, p21WAFl/CiP1 и p27K1P1;
5) изменения в других сигнальных путях, о которых известно, что они оказывают влияние на активность ТФР-бета, включая, но не ограничиваясь: FoxG1, Jagged/Notch, CDK2 и CDK4, и особенно Her2/neu, концентрации рецептора эстрогена, активность Ras, активность фосфатидилинозит-3-киназы (PI3K), АКТ и МАРК, а также состояние р53. Кроме того, вышеуказанные диагностические маркеры для определения того, какие опухоли можно лечить, можно использовать несколько маркеров для оценки (в опухоли и/или по периферии) биологической активности анти-ТФР-бета-антител у пациентов до и после лечения, включая, но не ограничиваясь этим:
1) концентрации ТФР-бета в опухоли и в крови (как представлено на фиг.15В, а также данные иммуногистохимии (IHC), показывающие экспрессию белка ТФР-бета1 в окрашенных срезах ткани опухолевых ксенотрансплантатов Colo205 и опухолей Calu6, опухолях HPAC и человеческой опухоли аденокарциномы протока молочной железы);
2) концентрации VEGF в опухоли или в крови (как представлено на фиг.19, а также данные, показывающие, что уровни VEGF повышаются на Her2-положительной модели, когда обеспечено антитело 2G7 по сравнению с контролем);
3) концентрации молекул, таких как SMAD/фосфоSMAD в ТФР-бета сигнальном пути в опухоли и/или в периферических клетках, таких как мононуклеарные клетки (BMC);
4) индикаторы функции иммунных клеток, особенно активность NK, Т-клеток и макрофагов.
Пример 5
Терапия злокачественной опухоли легких
Настоящее гуманизированное антитело показано в качестве единственного средства для лечения стадии IIIb или IV немелкоклеточной опухоли легких (NSCLC). Первичные конечные точки оценки эффективности включают скорость ответной реакции и переносимость. Вторичные конечные точки эффективности включают выживаемость в целом, время до прогрессирования заболевания, качество жизни и/или продолжительность ответной реакции. Гуманизированное антитело вводят внутривенно (в/в) еженедельно или каждые три недели в дозе 2 или 4 мг/кг соответственно до прогрессирования заболевания. Антитело поставляют в виде жидкой композиции, содержащей много доз (20 мл резервуар с концентрацией 20 мг/мл или с более высокой концентрацией).
Гуманизированное антитело также показано в комбинации с химиотерапией для лечения пациентов с немелкоклеточной опухолью легких с метастазами. Первичные конечные точки оценки эффективности включают выживаемость в целом по сравнению с обычной терапией и переносимость. Вторичные конечные точки эффективности включают время до прогрессирования заболевания, скорость ответной реакции, качество жизни и/или продолжительность ответной реакции. Антитело вводят внутривенно (в/в) еженедельно или каждые три недели в дозе 2 или 4 мг/кг соответственно до прогрессирования заболевания. Антитело поставляют в виде жидкой композиции, содержащей много доз (20 мл резервуар с концентрацией 20 мг/мл или с более высокой концентрацией).
Примеры дополнительных препаратов, которые можно комбинировать с настоящим антителом для лечения опухоли легких, включают химиотерапевтические средства, такие как карбоплатин, таксан (например, паклитаксел или доцетаксел), гемцитабин, навелбин, цисплатин, оксалиплатин или комбинации любых из данных препаратов, такие как карбоплатин/доцетаксел; анти-Her-2-антитело HERCEPTIN® или анти-ErbB-антитело, которое индуцирует апоптоз, такое как 7С2 или 7F3, включая гуманизированные антитела или их варианты со зрелой аффинностью; 2С4 или гуманизированное антитело 2С4; другие анти-ТФР-бета-антитела (например, моноклональное ТФР-бета-антитело); ингибитор фарнезилтрансферазы; антиангиогенный препарат (например, анти-VEGF-антитело); препарат с целенаправленным действием против EGFR (например, C225 или ZD1839); цитокин (например, IL-2, IL-12, G-CSF или GM-CSF) или комбинации вышеуказанных препаратов.
Пример 6
Терапия злокачественной опухоли ободочной и прямой кишки
Настоящее гуманизированное антитело показано в качестве единственного средства для лечения злокачественной опухоли ободочной и прямой кишки с метастазами. Первичные конечные точки оценки эффективности включают скорость ответной реакции и переносимость. Вторичные конечные точки эффективности включают выживаемость в целом, время до прогрессирования заболевания, качество жизни и/или продолжительность ответной реакции. Гуманизированное антитело вводят внутривенно (в/в) еженедельно или каждые три недели в дозе 2 или 4 мг/кг соответственно до прогрессирования заболевания. Антитело поставляют в виде жидкой композиции, содержащей много доз (20 мл резервуар с концентрацией 20 мг/мл или с более высокой концентрацией).
Гуманизированное антитело также показано в комбинации с химиотерапией для лечения пациентов с опухолью ободочной и прямой кишки с метастазами. Первичные конечные точки оценки эффективности включают выживаемость в целом по сравнению с обычной терапией и переносимость. Вторичные конечные точки эффективности включают время до прогрессирования заболевания, скорость ответной реакции, качество жизни и/или продолжительность ответной реакции. Гуманизированное антитело вводят внутривенно (в/в) еженедельно или каждые три недели в дозе 2 или 4 мг/кг соответственно до прогрессирования заболевания. Антитело поставляют в виде жидкой композиции, содержащей много доз (20 мл резервуар с концентрацией 20 мг/мл или с более высокой концентрацией).
Примеры химиотерапевтических средств, использованных для лечения опухоли ободочной и прямой кишки, которые можно комбинировать с гуманизированным антителом, которое связывается с ТФР-бета, включают 5-фторурацил (5-FU), лейковорин (LV), СРТ-11, левамизол или комбинации любых двух или более из них, например, 5-FU/LV/СРТ-11. Можно вводить стандартные дозы для таких химиотерапевтических средств. Другие препараты, которые можно комбинировать с анти-ТФР-бета-антителом для лечения опухоли ободочной и прямой кишки, включают ингибитор фарнезилтрансферазы; антиангиогенный препарат (анти-VEGF-антитело); препарат с целенаправленным действием против EGFR (например, C225 или ZD1839); цитокин (например, IL-2, IL-12, G-CSF или GM-CSF); анти-HER-2-антитело HERCEPTIN® или анти-ErbB-антитело, которое индуцирует апоптоз, такое как 7С2 или 7F3, включая гуманизированные антитела или их варианты со зрелой аффинностью; 2С4 или гуманизированное антитело 2С4; другие анти-ТФР-бета-антитела (например, моноклональное ТФР-бета-антитело) или комбинации вышеуказанных препаратов.
С учетом возможной роли ТФР-бета в развитии злокачественной опухоли ободочной кишки антитело можно тестировать на моделях опухоли ободочной кишки (например, НТ29 и НСТ116) и предполагается, что они «работают».
Пример 7
Терапия меланомы
На основании результатов по моноклональному антителу 2G7 в данном примере можно предположить, что гуманизированные антитела будут пригодными для лечения злокачественной меланомы. Мышиное анти-ТФР-бета-антитело 2G7 тестировали на моделях меланомы на животных. Конкретно, у сингенных мышей С57черных6, которым подкожно прививали клетки мышиной меланомы (B16F10 или В16В16), обработка анти-ТФР-бета-антителами (2G7) по схеме 25 мг/кг 3×/неделю внутрибрюшинно приводила к снижению размера первичной опухоли по сравнению с обработкой IgG контрольного изотипа (антипыльцовое антитело) (25 мг/кг 3×/неделю внутрибрюшинно) (фиг.22, 24 и 25). На данной модели В16 обработка анти-ТФР-бета-антителом 2G7 также уменьшала процент мышей с опухолями легких (т.е. частоту развития опухолей легких) (фиг.21А) и количество опухолей легких (фиг.21В) по сравнению с контролем, при использовании каждого метода количественного определения опухолей, т.е. определения поверхности («поверхность»), гистологических исследований («патология»), количественного определения всех видимых опухолей после осветления тканей («осветленные») или данных микрокомпьютерной томографии («СТ»). Также смотри фиг.23, 26.
Было установлено, что опухолевые клетки Calu-6 (человеческая немелкоклеточная карцинома легких) (Американская коллекция типовых культур (АТСС), Manassas, VA) продуцируют ТФР-бета в условиях in vitro. Клетки Calu-6 индуцировали экспрессию VEGF и SMA в фибробластах в условиях in vitro, где данное действие ингибировалось обработкой мышиным анти-ТФР-бета-антителом 2G7. На основании этих данных можно предположить, не ограничиваясь какой-либо одной теорией, что ТФР-бета может принимать участие в активации стромальных клеток в окружении опухоли. Проводили ксенотрансплантацию данных клеток “голым” мышам (смотри, например, Gourdeau et al., Mol. Cancer Ther., 3: 1375-1384 (2004)) и определяли объем опухолей после обработки контрольным IgG2b антителом, использованным в опыте на В16, описанном выше, (25 мг/кг 3×/неделю внутрибрюшинно) наряду с анти-VEGF-антителом (А461) (5 мг/кг 3×/неделю внутрибрюшинно), мышиным анти-ТФР-бета-антителом 2G7 (25 мг/кг 3×/неделю внутрибрюшинно) и комбинацией 2G7 и А461 (дозы представлены выше). Результаты определения объема опухолей и массы опухолей представлены соответственно на фиг.27 и 28, и они указывают, что комбинация антитела 2G7 и анти-VEGF-антитела была наиболее эффективным лечением, затем следовало антитело 2G7. Результаты показывают, что два антитела (анти-ТФР-бета и анти-VEGF) являются аддитивными и/или синергитическими друг для друга.
Основываясь на этих данных, можно предположить, что настоящие гуманизированные антитела будут также уменьшать первичные и вторичные опухоли, имеющиеся при злокачественной меланоме. Конкретно, гуманизированное антитело H2NI.V5L можно тестировать на двух моделях, на которых была показана эффективность мышиного антитела 2G7:
1) клетки мышиной меланомы (В16) у сингенных мышей и
2) опухолевые клетки Calu-6 (человеческие NSCLC) в виде ксенотрансплантатов у “голых” мышей.
На модели В16 клетки имплантировали мышам подкожно. На обеих моделях обработку анти-ТФР-бета-антителами, включая H2NI.V5L (25 мг/кг 3×/неделю) или контрольные антитела (25 мг/кг 3×/неделю) начинают, когда имеется пальпируемая опухоль. Опухоли определяют 2-3 раза в неделю.
Перед тестированием любых антител оценивают способность H2NI.V5L ингибировать индуцируемый ТФР-бета рост фибробластов (NIH3T3).
Если фрагмент Fc H2NI.V5L не является необходимым для проявления активности у мышей, то тогда можно предположить, что H2NI.V5L будут обладать такой же активностью, или более высокой активностью, чем исходные мышиные антитела 2G7 у мышей. Если фрагмент Fc является необходимым для проявления активности у мышей, то тогда можно предположить, что H2NI.V5L не будут обладать такой же активностью, чем исходные мышиные антитела 2G7 у мышей. Однако можно предположить, что H2NI.V5L (и другие гуманизированные антитела, заявленные здесь) сохранят эффективность у людей, поскольку человеческий Fc будет в них активен.
Пример 8
Фармакокинетика антитела 2G7 у нормальных мышей и мышей с опухолями
Целью исследований было определение фармакокинетических параметоров (РК) мышиного анти-ТФР-бета-антитела 2G7 у нормальных мышей и мышей с опухолями.
Схема опыта:
Модельными животными были мыши Balb/с с индуцированными клетками 4Т1 опухолями молочной железы. Четырем группам вводили одну дозу 43 мг/кг:
- группа 1: мыши без опухолей в/в
- группа 2: мыши с опухолями в/в
- группа 3: мыши с опухолями в/б
- группа 4: мыши с опухолями п/к
N=3 мыши в группе на временную точку. У каждой мыши кровь отбирали 3 раза.
Готовили сыворотку крови для определения ТФР-бета с помощью ELISA через 5, 15, 30, 60 мин; 3, 6, 24 ч; 3, 7, 10, 14, 21 сутки.
Результаты
Результаты показывают, что скорость элиминации мышиного анти-ТФР-бета-антитела выше у мышей с опухолями по сравнению с нормальными мышами. Кроме того, имеется более высокая 95% биодоступность антитела при в/б и п/к путях введения. Период полувыведения у мышей с опухолями составил 2-3 суток.
Таким образом, фармакокинетический профиль антитела 2G7 является приемлемым. У нормальных мышей период полувыведения антитела составил 4 суток, который находится в пределах, наблюдаемых для других антител и гибридных белков у нормальных мышей. У мышей с опухолями клиренс антитела был примерно в 2 раза выше, который не является вероятным фактором в данной дозе. Биодоступность была выше 95%, указывая на то, что в/б и п/к пути введения являются подходящими путями для введения лекарственных препаратов. Наличие периода полувыведения, составляющего 2-3 суток, обосновывает схему введения 2-3 раза в неделю.








































| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННЫЕ АНТИ-CD40-АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2407544C2 |
| ТЕРАПИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ, РЕЗИСТЕНТНОЙ К ПРЕПАРАТАМ НА ОСНОВЕ ПЛАТИНЫ | 2005 |
|
RU2403065C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ УМЕНЬШЕНИЯ АГРЕГАЦИИ МАКРОМОЛЕКУЛ ПРИ ФИЗИОЛОГИЧЕСКИХ УСЛОВИЯХ | 2009 |
|
RU2563823C2 |
| АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕ РЕЦЕПТОР 1 ТИПА ФАКТОРА РОСТА ФИБРОБЛАСТОВ, ПРИМЕНЕНИЕ АНТИТЕЛ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ, СПОСОБ ПОЛУЧЕНИЯ АНТИТЕЛ | 2015 |
|
RU2638457C2 |
| АНТИТЕЛА К БЕЛКУ ПРОГРАММИРУЕМОЙ КЛЕТОЧНОЙ СМЕРТИ 1 | 2018 |
|
RU2812915C2 |
| НОВЫЕ АНТИТЕЛА | 2008 |
|
RU2490277C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CXCR4 ДЛЯ ЛЕЧЕНИЯ РАКА | 2011 |
|
RU2595394C2 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ ПРОСТАГЛАНДИН Е2, И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2559525C2 |
| ВАРИАНТЫ ИММУНОГЛОБУЛИНА И ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2536937C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ГУМАНИЗИРОВАННОГО АНТИ-CD19 ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА | 2014 |
|
RU2711975C2 |

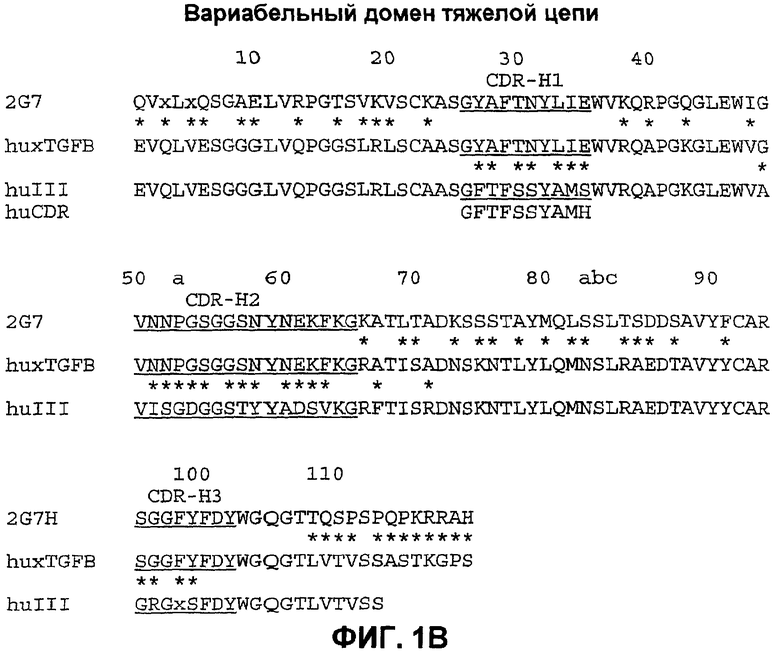












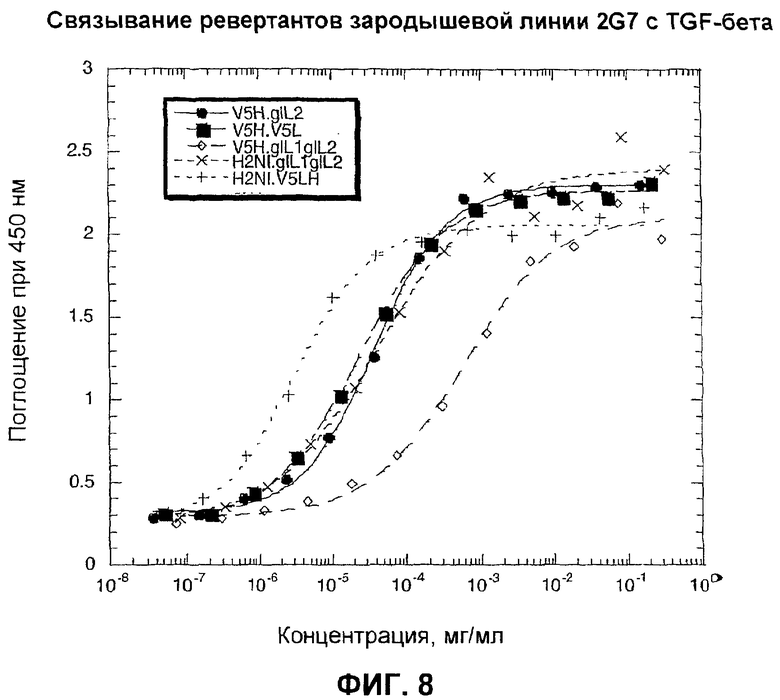

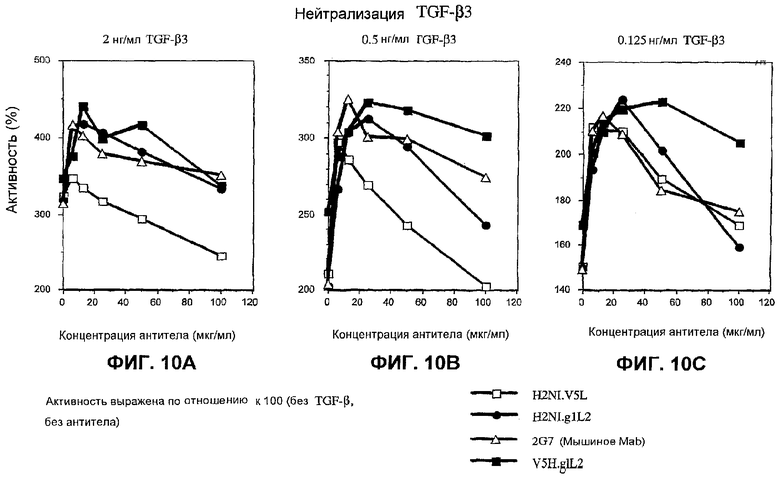

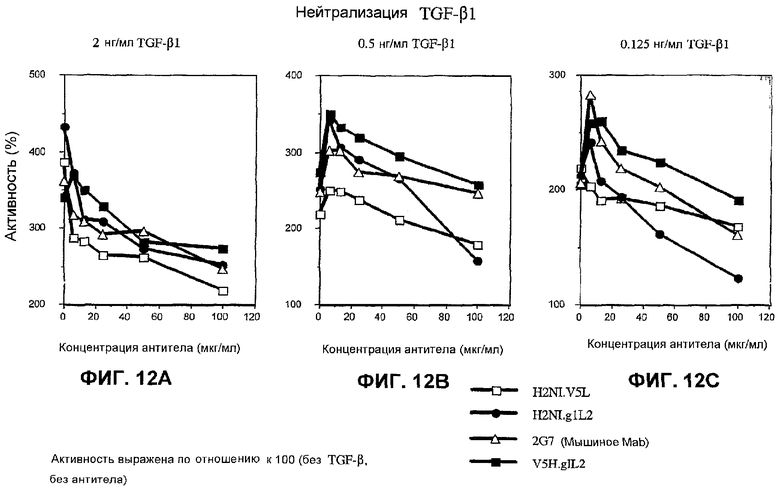

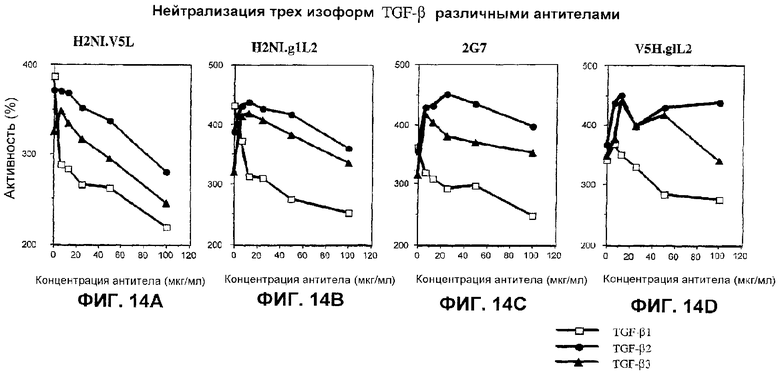


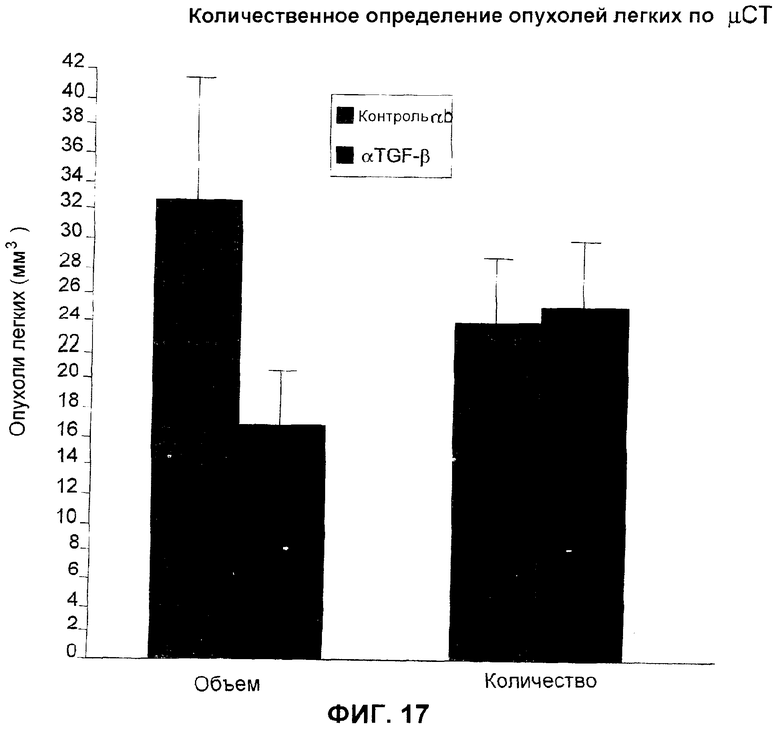
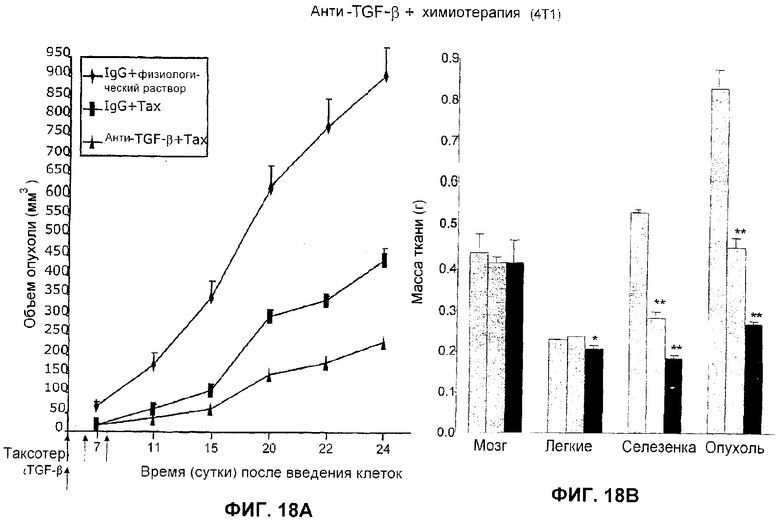

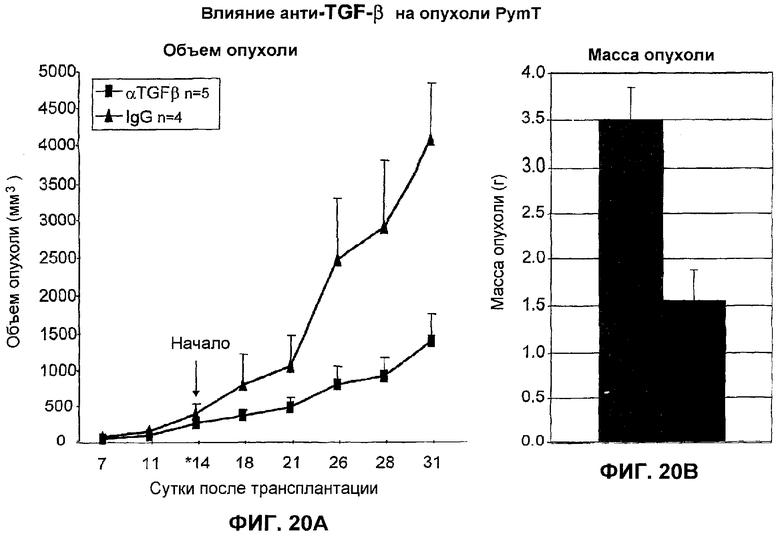

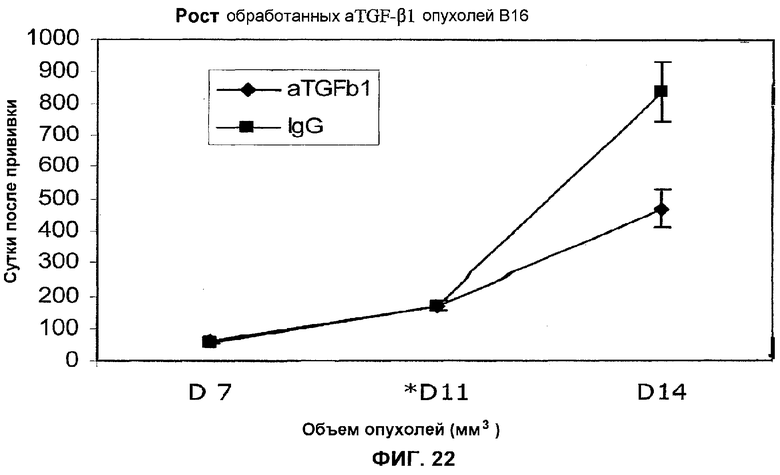



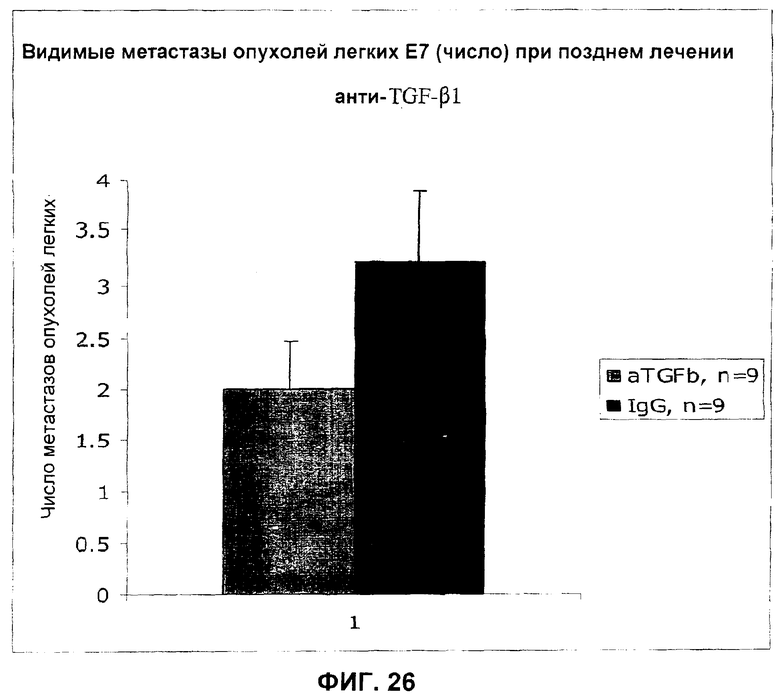
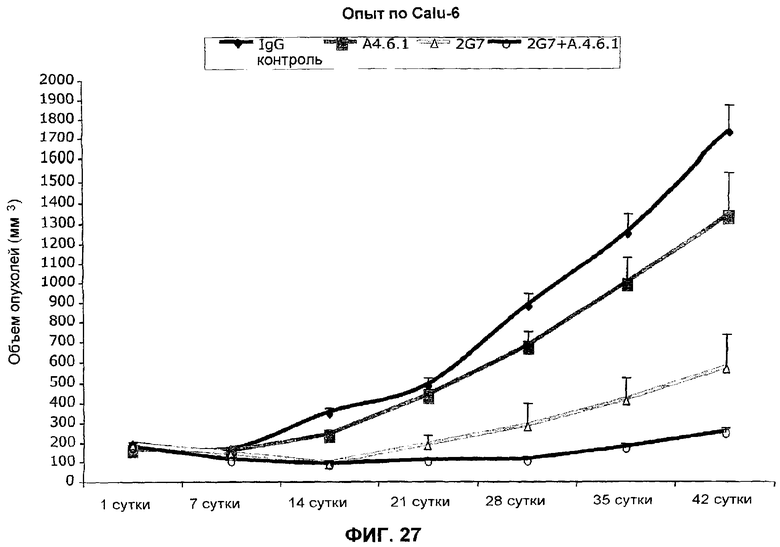
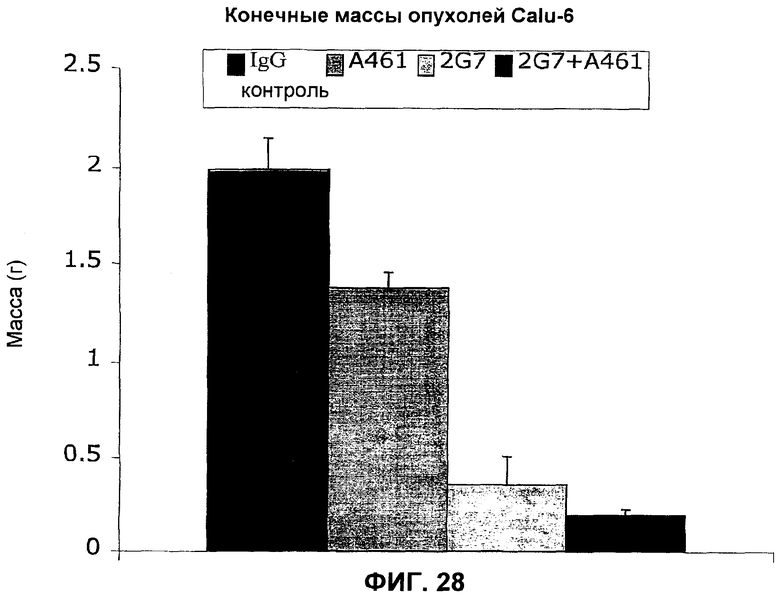
Изобретение касается гуманизированного анти-TGF-бета-антитела, которое связывается с TGF-бета. Гуманизированное антитело имеет вариабельный домен Vн, который содержит остатки гипервариабельной области (не человека), включенные в человеческий домен Vн, включающий модифицированный каркасный участок (FR) (аминокислотные и нуклеотидные последовательности приведены в перечне последовательностей). Гуманизированное антитело может содержать остатки определяющего комплементарность участка (CDR) вариабельного домена легкой цепи VL. Изобретение касается также композиции для лечения опосредованных TGF-бета нарушений, например злокачественной опухоли, нуклеиновой кислоты, кодирующей моноклональное антитело, и способа получения последнего с использованием клетки-хозяина. Изобретение охватывает способы лечения и выявления TGF-бета в пробе из организма с использованием антитела по изобретению, а также изделие, включающее гуманизированное антитело и инструкцию с указанием для лечения опосредованного TGF-бета нарушения. Использование изобретения позволяет регулировать молекулы TGF-бета, что может предупредить возможные изменения в антителах, позволяет создать гуманизированные антитела с высокой аффинностью, действующие как антагонисты TGF-бета. 10 н. и 47 з.п. ф-лы, 28 ил., 4 табл.
1. Гуманизированное антитело, которое связывается с TGF-бета, содержащее вариабельный домен тяжелой цепи (Vн), который содержит не относящиеся к человеческим остатки гипервариабельной области GYAFTNYLIE (SEQ ID NO: 21), VINPGSGGSNYNEKFKG (SEQ ID NO: 43) или VNNPGSGGSNYNEKFKG (SEQ ID NO: 22) и SGGFYFDY (SEQ ID NO: 23), включенные в человеческий домен Vн, где указанный вариабельный домен включает каркасный участок (FR), содержащий остатки каркасной области SEQ ID NO: 6 и содержащий одну или несколько замен в SEQ ID NO: 6 в положении, выбранном из группы, состоящей из 48, 49, 68, 70, 72, 74 и 79.
2. Гуманизированное антитело по п.1, содержащее замены FR в положениях 49, 68 и 72.
3. Гуманизированное антитело по п.2, в котором в положении 49 аланин заменен на глицин, в положении 68 фенилаланин заменен на аланин и в положении 72 аргинин заменен на аланин.
4. Гуманизированное антитело по п.1, содержащее замены FR в положениях 48, 49 и 72.
5. Гуманизированное антитело по п.4, в котором в положении 48 валин заменен на изолейцин, в положении 49 аланин заменен на глицин и в положении 72 аргинин заменен на аланин.
6. Гуманизированное антитело по п.1, содержащее замены FR в положениях 49, 70 и 72.
7. Гуманизированное антитело по п.6, в котором в положении 49 аланин заменен на глицин, в положении 70 изолейцин заменен на лейцин и в положении 72 аргинин заменен на аланин.
8. Гуманизированное антитело по п.6, в котором дополнительная замена FR находится в положении 74.
9. Гуманизированное антитело по п.8, в котором в положении 74 аспарагин заменен на лизин.
10. Гуманизированное антитело по п.1, содержащее замены FR в положениях 49, 72 и 74.
11. Гуманизированное антитело по п.10, в котором в положении 49 аланин заменен на глицин, в положении 72 аргинин заменен на аланин и в положении 74 аспарагин заменен на лизин.
12. Гуманизированное антитело по п.1, содержащее замены FR в положениях 49, 72 и 79.
13. Гуманизированное антитело по п.12, в котором в положении 49 аланин заменен на глицин, в положении 72 аргинин заменен на аланин и в положении 79 лейцин заменен на аланин.
14. Гуманизированное антитело по любому из пп.1-13, содержащее остатки определяющего комплементарность участка (CDR) вариабельного домена легкой цепи (VL) RASQSVLYSSNQKNYLA (SEQ ID NO: 18) или RASQGISSYLA (SEQ ID NO: 7); WASTRES (SEQ ID NO: 19) или YASSLQS (SEQ ID NO: 8) и HQYLSSDT (SEQ ID NO: 20).
15. Гуманизированное антитело по любому из пп.1-13, содержащее остатки определяющего комплементарность участка (CDR) вариабельного домена легкой цепи (VL) RASQSVLYSSNQKNYLA (SEQ ID NO: 18); WASTRES (SEQ ID NO: 19) и HQYLSSDT (SEQ ID NO: 20).
16. Гуманизированное антитело по любому из пп.1-13, содержащее аминокислотную последовательность домена VL в SEQ ID NO: 3.
17. Гуманизированное антитело по любому из пп.1-13, содержащее остатки определяющего комплементарность участка (CDR) домена Vн GYAFTNYLIE (SEQ ID NO: 21); VNNPGSGGSNYNEKFKG (SEQ ID NO: 22) и SGGFYFDY (SEQ ID NO: 23).
18. Гуманизированное антитело по любому из пп.1-13, содержащее остатки определяющего комплементарность участка (CDR) домена Vн GYAFTNYLIE (SEQ ID NO: 21); VINPGSGGSNYNEKFKG (SEQ ID NO: 43) и SGGFYFDY (SEQ ID NO: 23).
19. Гуманизированное антитело по любому из пп.1-3, содержащее аминокислотную последовательность домена Vн, представленную в SEQ ID NO: 4.
20. Гуманизированное антитело по любому из пп.1-13, которое представляет собой интактное IgG1 антитело.
21. Гуманизированное антитело по любому из пп.1-13, которое представляет собой фрагмент антитела.
22. Гуманизированное антитело по п.21, которое представляет собой фрагмент Fab.
23. Гуманизированное антитело по любому из пп.1-13, которое не конъюгировано с цитотоксическим средством.
24. Гуманизированное антитело по любому из пп.1-23, которое конъюгировано с цитотоксическим средством.
25. Композиция для лечения нарушения, опосредованного TGF-бета, содержащая гуманизированное антитело по любому из пп.1-24 и носитель.
26. Выделенная нуклеиновая кислота, кодирующая гуманизированное антитело по любому из пп.1-24.
27. Вектор, содержащий нуклеиновую кислоту по п.26.
28. Клетка-хозяин, содержащая нуклеиновую кислоту по п.26.
29. Способ получения гуманизированного антитела, предусматривающий культивирование клетки-хозяина по п.28 таким образом, что экспрессируется нуклеиновая кислота и продуцируется антитело.
30. Способ по п.29, дополнительно предусматривающий выделение антитела из культуры клетки-хозяина.
31. Способ по п.30, в котором антитело выделяют из культуральной среды клетки-хозяина.
32. Способ по любому из пп.29-31, в котором перед культивированием клетку-хозяина котрансфицируют с вектором, содержащим нуклеиновую кислоту, кодирующую вариабельный домен тяжелой цепи, и с вектором, содержащим нуклеиновую кислоту, кодирующую вариабельный домен легкой цепи.
33. Способ лечения нарушения, опосредованного TGF-бета, у млекопитающего, предусматривающий введение млекопитающему эффективного количества гуманизированного антитела по любому из пп.1-24.
34. Способ по п.33, в котором млекопитающее является приматом.
35. Способ по п.33 или 34, в котором млекопитающее является человеком.
36. Способ по любому из пп.33 и 34, в котором нарушение представляет фиброз, повреждение артерий, инфекцию, ревматоидный артрит или злокачественную опухоль.
37. Способ по п.36, в котором злокачественная опухоль представляет злокачественную опухоль ободочной кишки, злокачественную опухоль ободочной и прямой кишки, злокачественную опухоль прямой кишки, злокачественную опухоль легких, злокачественную опухоль молочной железы, злокачественную опухоль яичников или злокачественную меланому.
38. Способ по любому из пп.33-34, дополнительно предусматривающий введение млекопитающему эффективного количества терапевтического средства, иного чем гуманизированное антитело.
39. Способ по п.38, в котором терапевтическое средство представляет химиотерапевтическое средство, цитотоксический препарат, цитокин, средство, ингибирующее рост, антиангиогенный препарат или антитело.
40. Способ по п.39, в котором терапевтическое средство представляет антиангиогенный препарат.
41. Способ по п.38, в котором терапевтическое средство представляет антитело.
42. Способ по п.41, в котором антитело связывается с васкулярным эндотелиальным фактором роста.
43. Способ по п.41, в котором антитело связывается с антигеном Her-2.
44. Способ по любому из пп.41-43, в котором антитело представляет собой интактное антитело.
45. Способ по любому из пп.41-43, в котором антитело представляет собой фрагмент антитела.
46. Способ по п.45, в котором фрагмент антитела представляет собой фрагмент Fab.
47. Способ по любому из пп.41-43, в котором антитело конъюгировано с цитотоксическим средством.
48. Способ по любому из пп.41-43, в котором антитело не конъюгировано с цитотоксическим средством.
49. Способ детектирования TGF-бета в пробе из организма, который предусматривает контактирование гуманизированного антитела по любому из пп.1-24 с пробой из организма и определение того, происходит ли связывание антитела с TGF-бета.
50. Изделие, содержащее контейнер, включающий гуманизированное антитело по любому из пп.1-24 и инструкции для потребителя с указанием для лечения опосредованного TGF-бета нарушения у млекопитающего антителом в эффективном количестве.
51. Изделие по п.50, дополнительно содержащее контейнер, включающий терапевтическое средство иное, чем гуманизированное антитело, где инструкции указывают потребителю, как лечить нарушение антителом в комбинации со средством в эффективных количествах.
52. Изделие по п.50 или 51, где млекопитающее является человеком.
53. Способ лечения злокачественной опухоли у млекопитающего, предусматривающий введение млекопитающему эффективного количества антитела против TGF-бета и антитела по любому из пп.1-24, которое связывается с васкулярным эндотелиальным фактором роста.
54. Способ по п.53, в котором млекопитающее является человеком.
55. Способ по п.53 или 54, в котором антитело против TGF-бета связывается с любым одним или несколькими из следующих: TGF-бета1, TGF-бета2 и TGF-бета3.
56. Способ по любому из пп.53 и 54, в котором антитело связывается с TGF-бета1.
57. Способ по любому из пп.53 и 54, в котором антитело связывается с TGF-бета1 и ТGF-бета2.
| US 5821337 А, 13.10.1998 | |||
| US 2002176858 A1, 28.11.2002 | |||
| US 2002051785 A1, 02.05.2002 | |||
| САМОУСИЛИВАЮЩИЕСЯ ФАРМАКОЛОГИЧЕСКИ КОНТРОЛИРУЕМЫЕ ЭКСПРЕССИОННЫЕ СИСТЕМЫ | 1997 |
|
RU2197993C2 |
Авторы
Даты
2010-04-20—Публикация
2005-03-31—Подача