Изобретение относится к молекулярной биологии, биохимии и биотехнологии, конкретно к соединениям, представляющим собой производные (8-(трифторметил)бензо[f][1,2,3,4,5]пентатиепин-6-ил)амидов общей формулы I:
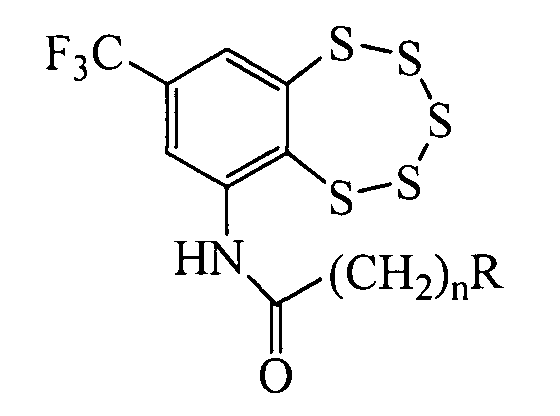
где n≥1, R - третичная аминогруппа, в том числе и входящая в состав гетероцикла, у которых выявлена биологическая активность, заключающаяся в способности ингибировать действие фермента тирозил-ДНК-фосфодиэстеразы 1 человека (Tdp1).
В последние годы ведутся активные поиски ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 (Tdp1), который рассматривается как перспективная фермент-мишень для создания лекарственных препаратов для лечения онкологических и нейродегенеративных заболеваний [1].
Tdp1 относится к классу фосфодиэстераз - ферментов, расщепляющих фосфодиэфирные связи [2]. Природный мутант этого фермента SCAN1 вызывает тяжелое нейродегенеративное заболевание - синдром спиноцеребеллярной атаксии и нейропатии [3].
Tdp1 играет важную роль в удалении повреждений ДНК, создаваемых топоизомеразой 1 (Top1), ее ингибитором камптотецином и антираковыми препаратами. Нормальный ферментативный цикл топоизомеразы 1 включает обратимую реакцию трансэтерификации. Остаток тирозина-723 активного центра фермента образует переходный ковалентный комплекс с 3′-фосфатом основания ДНК. При этом образуется одноцепочечный разрыв, который позволяет «разрезанной» цепи вращаться вокруг интактной, снимая локальное напряжение в спирали. Затем целостность ДНК восстанавливается за счет обратной реакции [4]. В нормальных условиях скорость реакции лигирования значительно выше, чем скорость расщепления, но в ряде случаев переходные комплексы оказываются стабильными. В частности, ингибиторы Top1, такие как камптотецин и его производные, применяющиеся в клинике, существенно замедляют скорость обратной реакции [4]. Невозможность восстановить структуру ДНК приводит к образованию одноцепочечных разрывов, которые могут превратиться в более токсичные двухцепочечные. Помимо ингибиторов, ряд повреждений ДНК вблизи от места присоединения Top1 также могут блокировать реакцию лигирования.
Tdp1 расщепляет 3′-диэфирную связь между остатком тирозина и 3′-концом ДНК, а также удаляет другие повреждения с 3′-конца ДНК [5, 6]. При этом на 3′-конце ДНК остается фосфат, на 5′-конце - гидроксильный остаток. Такая структура является субстратом для фермента полинуклеотидкиназа-3′-фосфатаза (PNKP), которая восстанавливает традиционную для эксцизионной репарации (ЭРО) конфигурацию 3′-ОН, 5′-фосфат [7]. В результате, Tdp1 противостоит ингибиторам Top1, которые являются достаточно эффективными антираковыми препаратами (см. обзоры [8, 9]). Предполагается, что именно Tdp1 ответственна за лекарственную устойчивость некоторых видов рака [4, 10]. Эта гипотеза подтверждается рядом исследований: мыши, нокаутные по Tdp1, и человеческие клеточные линии, имеющие мутацию SCAN1, гиперчувствительны к камптотецину [11-14]. И, наоборот, в клетках с повышенным уровнем экспрессии Tdp1 камптотецин и этопозид вызывают меньше повреждений ДНК [15, 16]. Таким образом, сочетание препаратов, воздействующих на Top1 и Tdp1, может существенно повысить эффективность химиотерапии.
В литературе описано немного ингибиторов Tdp1, и они обладают мягким ингибирующим действием (в диапазоне 100-10 мкМ) [4, 17, 18].
Показано также, что подавление активности Tdp1 делает опухолевые клетки гиперчувствтительными к противораковому препарату темозоломиду (метилирование пуринов) [19], метилметансульфонату (образование апуриновых/апиримидиновых сайтов), блеомицину (одноцепочечные/двухцепочечные разрывы с 3′-фосфогликолятами), перекиси водорода и ионизирующему излучению (разрывы и др. виды повреждений) [20]. Это предполагает участие Tdp1 в различных путях репарации ДНК.
Таким образом, ингибиторы Tdp1 могут увеличить цитотоксичность камптотецинов. Терапевтическим эффектом таких веществ может быть селективное увеличение активности ингибиторов Top1 в опухолях с нарушениями в процессах репарации ДНК и контроля клеточного цикла.
Наиболее близким к заявляемому средству - прототипом, является фурамидин, представляющий собой гетероциклический диамидин [17] общей формулы II:
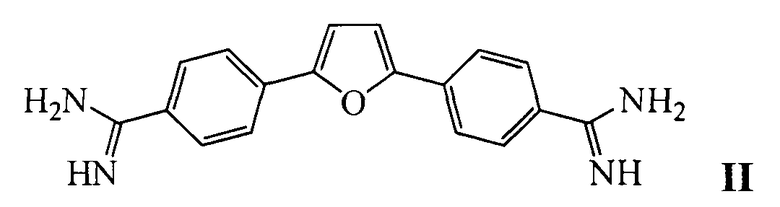
Недостатком известного средства являются неудовлетворительные ингибиторные характеристики (IC50 для одноцепочечной ДНК составляет порядка 100 мкМ).
Задачей изобретения является создание более эффективного ингибитора Tdp1.
Поставленная задача решается применением соединений, представляющих собой производные (8-(трифторметил)-бензо[f][1,2,3,4,5]пентатиепин-6-ил)амидов общей формулы I, в качестве ингибиторов действия фермента Tdp1.
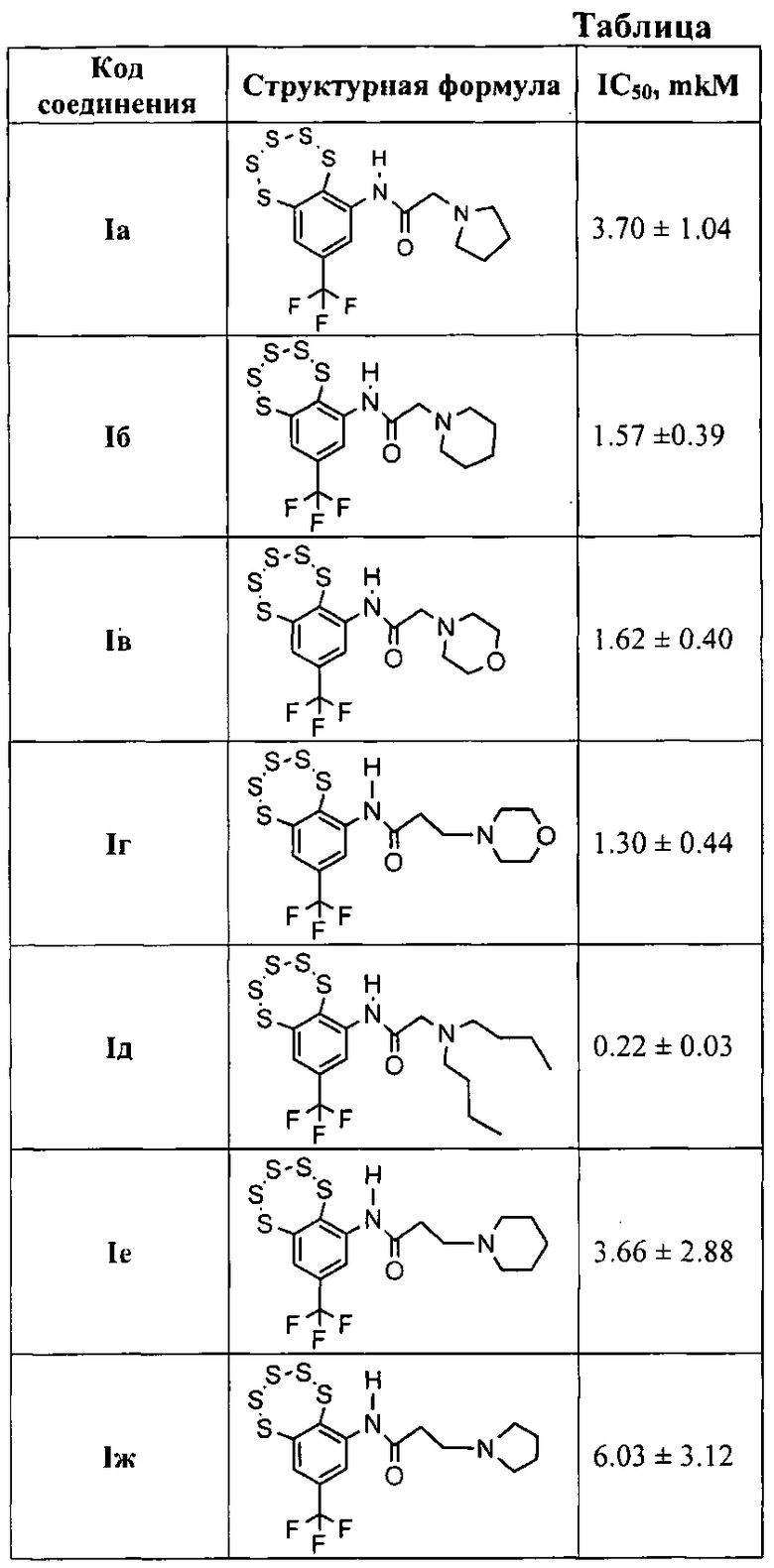
Соединения Ia (n=1, R=пирролидин-1-ил) и Iб (n=1, R=пиперидин-1-ил) впервые были описаны в работе [21], они обладают ингибирующей активностью по отношению к некоторым ферментам репарации ДНК в миллимолярных концентрациях.
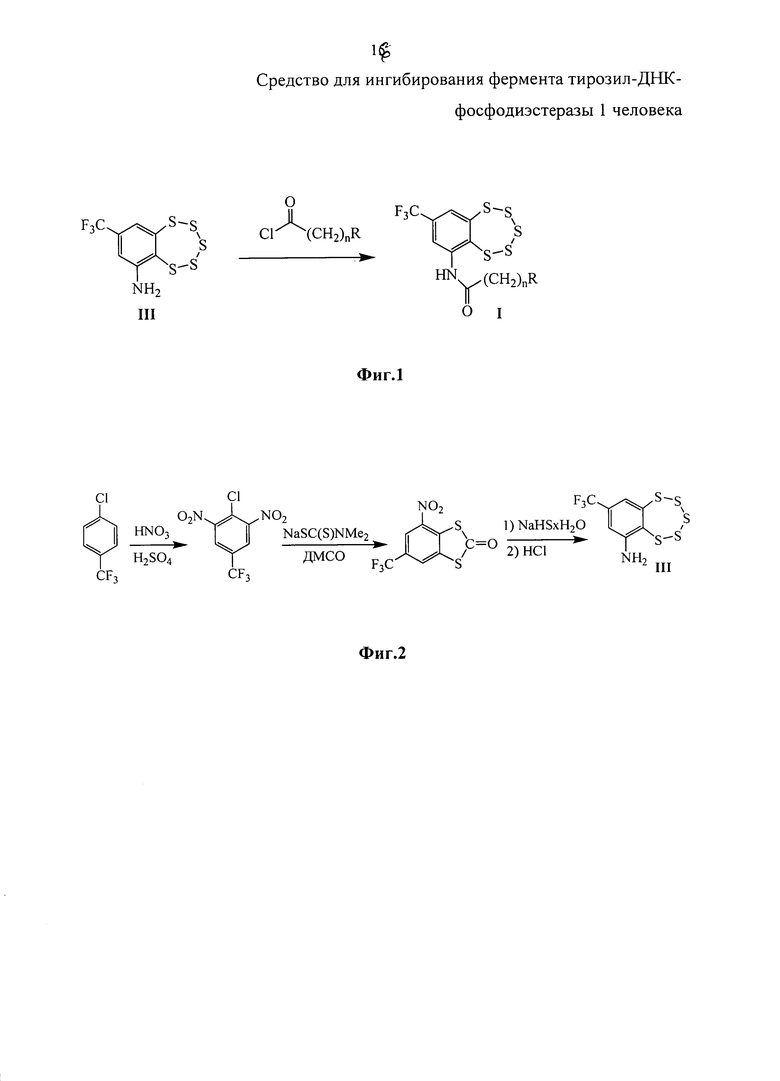
Эти соединения могут быть синтезированы взаимодействием 8-(трифторметил)бензо[f][1,2,3,4,5]пентатиепин-6-амина III с 2-(пирролидин-1-ил)ацетил хлоридом или 2-(пиперидин-1-ил)ацетил хлоридом в соответствии со схемой, приведенной на фиг. 1. Соединение III, в свою очередь, может быть синтезировано из 1-хлор-4-(трифторметил)бензола с использованием коммерчески доступных реагентов в соответствии со схемой, описанной в [22] и приведенной на фиг. 2.
Другие соединения общей формулы I могут быть синтезированы взаимодействием амина III с хлорангидридами соответствующих кислот (фиг. 1). Например, соединения Iв (n=1, R=морфолин), Iг (n=2, R=морфолин), Iд (n=1, R=дибутиламин), Iе (п=2, R=пиперидин) и Iж (n=2, R=пирролидин), могут быть синтезированы взаимодействием соединения III с 2-морфолинацетил хлоридом, 3-морфолинопропаноил хлоридом, 2-(дибутиламино)ацетил хлоридом, 3-(пиперидин-1-ил)пропаноил хлоридом или 3-(пирролидин-1-ил)пропаноил хлоридом, соответственно.
Структура и чистота полученных соединений подтверждена данными ЯМР-спектроскопии, масс-спектрометрии и ВЭЖХ.
Технический результат: получен класс эффективных ингибиторов Tdp1 с повышенными ингибирующими характеристиками (IC50 для одноцепочечной ДНК 0.2÷6.0 мкМ).
Соединения общей формулы I после проведения углубленных фармакологических исследований,могут использоваться для дальнейшей разработки новых низкотоксичных высокоэффективных противораковых средств.
Ниже приводятся конкретные примеры реализации заявляемого технического решения.
Пример 1. Синтез 2-(пирролидин-1-ил)-N-(8-(трифторметил)-бензо[f][1,2,3,4,5]пентатиепин-6-ил)ацетамида (Iа).
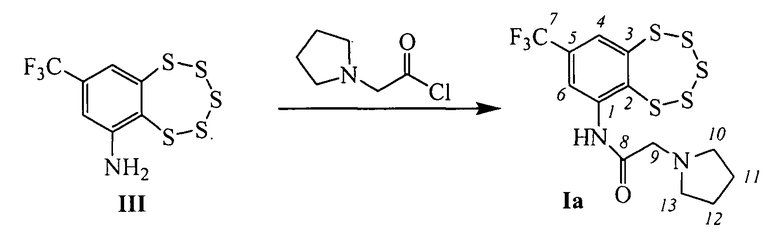
К раствору 0.095 г (0.30 ммоль) амина III в 2 мл сухого метиленхлорида (СН2Сl2) прибавили 0.044 г (0.30 ммоль) 2-(пирролидин-1-ил)ацетил хлорида. Реакционную смесь перемешивали 3 часа при комнатной температуре. Затем добавили 3 мл Н2O, 2 мл СН2Сl2, экстрагировали СН2Сl2, сушили Na2SO4. Растворитель отогнали, получили 0.082 г смеси, которую делили колоночной хроматографией на SiO2 (Macherey-Nagel, 60-200 µ), с использованием в качестве элюента смеси гексана и бензола (1:1), диэтиловый эфир. Выделили 0.042 г исходного амина III (конверсия 56%) и 0.029 г (41% в расчете на прореагировавший амин III) соединения Iа.
ЯМР 1H (CDCl3): 1.83-1.92 (м, 2Н-С(11), 2Н-С(12)), 2.68-2.80 (ш.м, 2Н-С(10), 2Н-С(13)), 3.30 (д, 2J=17.0) и 3.43 (д, 2J=17.0) 2Н-С(9), система АВ, 7.73 (д, J(4,6)=1.7, Н-С(4)), 8.92 (ш.с, Н-С(6)), 10.85 (ш.с, NH). ЯМР 13С (CDCl3): 134.00 (ш.с, С(1)), 142.23 (с, С(2)), 146.19 (с, С(3)), 126.09 (д, 3J(C,F)=3.5, С(4)), 133.01 (с, 2J(C,F)=33.2, С(5)), 118.53 (уш.д, С(6)), 122.54 (1J(C,F)=273.8, С(7)), 169.68 (ш.с, С(8)), 59.06 (т, С(9)), 54.26 (т, С(10), С(13)), 24.11 (т, С(11), С(12)). Найдено: m/z 430.964 [М+Н]+ C13H13N2F3OS5. Вычислено: [М+Н]+=430.966.
Пример 2. Синтез 2-(пиперидин-1-ил)-N-(8-(трифторметил)-бензо[f][1,2,3,4,5]пентатиепин-6-ил)ацетамида (Iб).
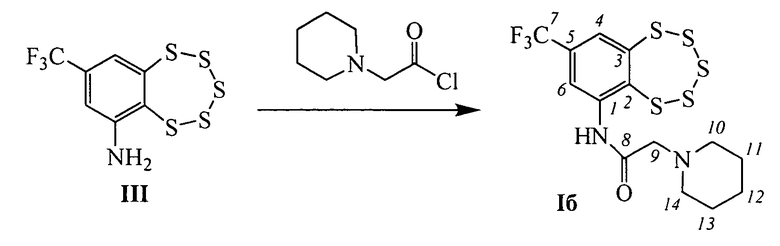
К раствору 0.090 г (0.028 ммоль) амина III в 2 мл сухого СН2Сl2 прибавили 0.045 г (0.28 ммоль) 2-(пиперидин-1-ил)ацетил хлорида. Реакционную смесь перемешивали 3 часа при комнатной температуре. Затем добавили 3 мл Н2O, 2 мл СН2Сl2, экстрагировали СН2Сl2, сушили Na2SO4. Растворитель отогнали, получили 0.093 г смеси, которую делили колоночной хроматографией на SiO2 (Macherey-Nagel, 60-200 µ), элюент: смесь гексана и бензола (1:1), диэтиловый эфир. Выделили 0.050 г (конверсия 44%) исходного амина III и 0.022 г (40% в расчете на прореагировавший амин III) соединения 1б.
ЯМР 1H (CDCl3): 1.45-1.52 (м, 2Н-С(12)), 1.61-1.73 (м, 2Н-С(11), 2Н-С(13)), 2.51-2.61 (м, 2Н-С(10), 2Н-С(14)), 3.11 (д, 2J=17.0) и 3.14 (д, 2J=17.0) 2Н-С(9), система АВ, 7.74 (д, J(4,6)=1.8, Н-С(4)), 8.96 (уш.д, J(6,4)=1.8, Н-С(6)), 10.91 (ш.с, NH). ЯМР 13С (CDCl3): 133.85 (уш.с, С(1)), 142.36 (с, С(2)), 146.18 (с, С(3)), 126.08 (д, 3J(C,F)=4.0, С(4)), 133.04 (с, 2J(C,F)=32.2, С(5)), 118.48 (д, 3J(C,F)=4.0, С(6)), 122.54 (1J(C,F)=273.8, С(7)), 169.90 (с, С(8)), 62.85 (т, С(9)), 54.90 (т, С(10), С(14)), 26.38 (т, С(11), С(13)), 23.46 (т, С(12)). Найдено: 444.990 [М+Н]+ C14H15N2F3OS5. Вычислено: [М+Н]+=444.982.
Пример 3. Синтез 2-морфолино-N-(8-(трифторметил)-бензо[f][1,2,3,4,5]пентатиепин-6-ил)ацетамида (Iв).
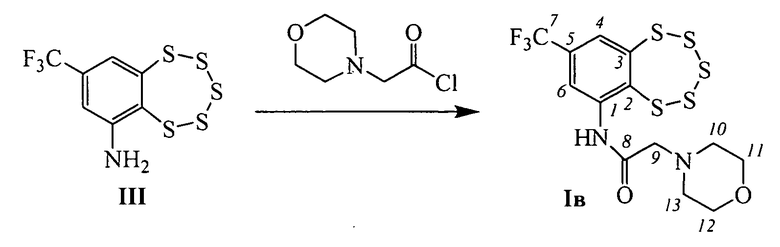
К раствору 0.095 г амина III (0.3 ммоль) в 2 мл сухого СН2Сl2 прибавили 0.049 г (0.3 ммоль) 2-морфолинацетил хлорида. Реакционную смесь перемешивали 3 часа при комнатной температуре. Затем добавили 3 мл Н2O, 2 мл СН2Сl2, экстрагировали СН2Сl2, сушили Na2SO4. Растворитель отогнали, получили 0.101 г смеси, которую делили колоночной хроматографией на SiO2 (Macherey-Nagel, 60-200 µ), элюент: смесь гексана и бензола (1:1), диэтиловый эфир. Выделили 0.049 г (конверсия 48%) амина III и 0.029 г (45% в расчете на прореагировавший амин III) соединения Iв.
ЯМР 1H (CDCl3): 2.53-2.85 (м, 2Н-С(10), 2Н-С(13)), 3.25 (ш.с, 2Н-С(9)), 3.62-3.97 (м, 2Н-С(11) 2Н-С(12)), 7.76 (ш.д, J(4,6)=1.8, Н-С(4)), 8.90 (ш.с, Н-С(6)), 10.73 (ш.с, NH). ЯМР 13С (CDCl3): 141.94 (с, С(1)), 134.04 (с, С(2)), 146.32 (с, С(3)), 126.43 (д, С(4)), 133.11 (2J(C,F)=33.4, С(5)), 118.66 (д, С(6)), 122.50 (1J(C,F)=273.65, С(7)), 168.64 (с, С(8)), 62.25 (т, С(9)), 53.57 (т, С(10), С(13)), 66.89 (т, С(11), С(12)). Найдено: 446.953 [М+Н]+ C13H13N2O2S5. Вычислено: [М+Н]+=446.960.
Пример 4. Синтез 3-морфолино-N-(8-(трифторметил)-бензо[f][1,2,3,4,5]пентатиепин-6-ил)пропанамида (Iг).
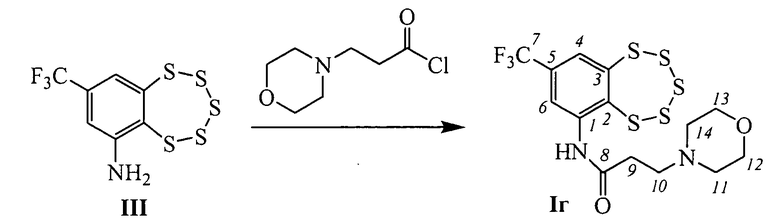
К раствору 0.120 г амина III (0.38 ммоль) в 3 мл сухого СН2Сl2 прибавили 0.175 г (0.59 ммоль) 3-морфолинопропаноил хлорида. Реакционную смесь перемешивали 20 часов при комнатной температуре. Затем добавили 4 мл Н2O, 3 мл СН2Сl2, экстрагировали СН2Сl2, сушили Na2SO4. Растворитель отогнали, получили 0.134 г смеси, которую делили колоночной хроматографией на SiO2 (Macherey-Nagel, 60-200 µ), элюент смесь гексана и бензола (1:1), диэтиловый эфир. Выделили 0.046 г (конверсия 62%) амина III и 0.056 г (45% в расчете на прореагировавший амин III) соединения Iг.
ЯМР 1H (CDCl3): 2.55-2.62 (м, 2Н-С(11), 2Н-С(14)), 2.64-2.69 (м, 2Н-С(9)), 2.71-2.77 (м, 2Н-С(10)), 3.77-3.87 (м, 2Н-С(12) 2Н-С(13)), 7.77 (д.к, J(4,6)=2.0, 4J(C,F)=0.7, Н-С(4)), 8.77 (д, J(6,4)=2.0, Н-С(6)), 10.68 (ш.с, NH). ЯМР 13С (CDCl3): 142.74 (с, С(1)), 135.12 (с, С(2)), 145.80 (с, С(3)), 126.83 (д, 3J(C,F)=3.6, С(4)), 132.63 (2J(C,F)=33.3, С(5)), 120.99 (д, 3J(C,F)=3.9, С(6)), 122.56 (1J(C,F)=273.4, С(7)), 170.96 (с, С(8)), 32.80 (т, С(9)), 54.17 (т, С(10)), 53.29 (т, С(11), С(14)), 66.28 (т, С(12), С(13)). Найдено: 460.979 [М+Н]+ C14H15N2F3O2S5. Вычислено: [М+Н]+=460.98.
Пример 5. Синтез 2-(дибутиламино)-N-(8-(трифторметил)-бензо[f][1,2,3,4,5]пентатиепин-6-ил)ацетамида (Iд).
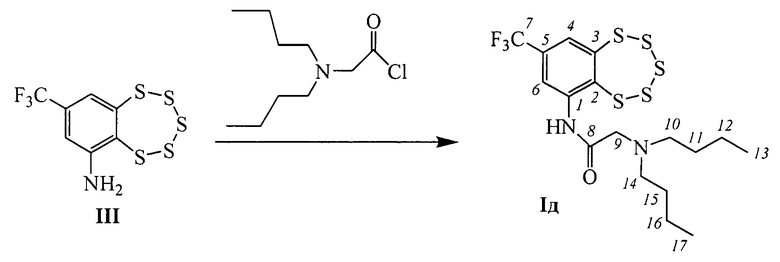
К раствору 0.095 г (0.30 ммоль) амина III в 3 мл сухого СН2Сl2 прибавили 0.070 г (0.34 ммоль) 2-(дибутиламино)ацетил хлорида. Реакционную смесь перемешивали 4 часа при комнатной температуре. Затем добавили 3 мл Н2O, 2 мл СН2Сl2, экстрагировали СН2Сl2, сушили Na2SO4. Растворитель отогнали, получили 0.099 г смеси, которую делили колоночной хроматографией на SiO2 (Macherey-Nagel, 60-200 µ), элюент: смесь гексана и бензола (1:1), диэтиловый эфир. Выделили 0.047 г (конверсия 51%) амина III и 0.029 г (39% в расчете на прореагировавший амин III) соединения Iд.
ЯМР 1H (CDCl3): 0.91 (т, J(13,12)=J(17,16)=7.5, 3H-C(13), 3H-C(17)), 1.28-1.37 (м, 2Н-С(12), 2Н-С(16)), 1.43-1.51 (м, 2Н-С(11), 2Н-С(15)), 2.54 (д.д, J=9.0, J=7.5, 2Н-С(10), 2Н-С(14)), 3.20 (с, 2Н-С(9)), 7.74 (ш.с, Н-С(4)), 9.00 (ш.с, Н-С(6)), 10.85 (ш.с, NH). ЯМР 13С (CDCl3): 142.30 (с, С(1)), 133.98 (с, С(2)), 146.07 (с, С(3)), 126.17 (д, 3J(C,F)=3.5, С(4)), 133.02 (2J(C,F)=33.2, С(5)), 118.55 (д, 3J(C,F)=4.0, С(6)), 122.58 (1J(C,F)=273.3, С(7)), 171.12 (с, С(8)), 59.57 (т, С(9)), 55.49 (т, С(10), С(14)), 29.77 (т, С(11), С(15)), 20.52 (т, С(12), С(16)), 13.93 (к, С(13), С(17)). Найдено: 489.060 [М+Н]+. C17H23N2F3OS5. Вычислено: [М+Н]+=489.04.
Пример 6. Синтез 3-(пиперидин-1-ил)-N-(8-(трифторметил)-бензо[f][1,2,3,4,5]пентатиепин-6-ил)пропанамида (Iе).
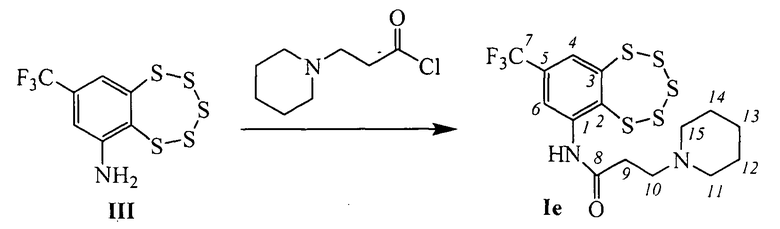
К раствору 0.105 г (0.33 ммоль) амина III в 3 мл сухого СН2Сl2 прибавили 0.088 г (0.50 ммоль) 3-(пиперидин-1-ил)пропаноил хлорида. Реакционную смесь перемешивали 20 часов при комнатной температуре. Затем добавили 4 мл Н2O, 3 мл СН2Сl2, экстрагировали СН2Сl2, сушили Na2SO4. Растворитель отогнали, получили 0.143 г смеси, которую делили колоночной хроматографией на SiO2 (Macherey-Nagel, 60-200 µ), элюент: смесь гексана и бензола (1:1), диэтиловый эфир, метанол. Выделили 0.018 г (конверсия 83%) амина III и 0.061 г (49% в расчете на прореагировавший амин III) соединения Iе.
ЯМР 1H (CDCl3): 1.47-1.55 (м, 2Н-С(13)), 1.65-1.74 (м, 2Н-С(12), 2Н-С(14)), 2.48-2.57 (м, 2Н-С(10), 2Н-С(11) или 2Н-С(15)), 2.62-2.72 (м, 2Н-С(9), 2Н-С(15) или 2Н-С(11)), 7.76 (д, J(4,6)=1.9, Н-С(4)), 8.70 (д, J(6,4)=1.9, Н-С(6)), 11.07 (ш.с, NH). ЯМР 13С (CDCl3): 142.88 (с, С(1)), 135.86 (с, С(2)), 145.69 (с, С(3)), 126.84 (д, 3J(C,F)=3.5, С(4)), 132.41 (2J(C,F)=33.2, С(5)), 121.47 (д, 3J(C,F)=3.8, С(6)), 124.78 (1J(C,F)=273.8, С(7)), 171.49 (с, С(8)), 33.03 (т, С(9)), 54.06 (т, С(10), С(11), С(15)), 25.18 (т, С(12), С(14)), 23.97 (т, С(13)). Найдено: 459.002 [М+Н]+. C15H17N2F3OS5. Вычислено: [М+Н]+=459.00.
Пример 7. Синтез 3-(пирролидин-1-ил)-N-(8-(трифторметил)-бензо[f][1,2,3,4,5]пентатиепин-6-ил)пропанамида (Iж).
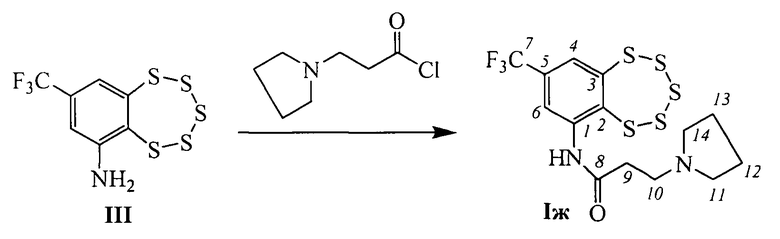
К раствору 0.080 г (0.33 ммоль) амина III в 3 мл сухого СН2Сl2 прибавили 0.080 г (0.50 ммоль) 3-(пирролидин-1-ил)пропаноил хлорида. Реакционную смесь перемешивали 2 часа при комнатной температуре. Затем добавили 3 мл Н2O, 2 мл СН2Сl2, экстрагировали СН2Сl2, сушили Na2SO4. Растворитель отогнали, получили 0.083 г смеси, которую делили колоночной хроматографией на SiO2 (Macherey-Nagel, 60-200 µ), элюент смесь гексана и бензола (1:1), диэтиловый эфир, метанол. Получили 0.022 г (20%) соединения Iж.
ЯМР 1H (CDCl3): 1.87-1.95 (м, 2Н-С(12), 2Н-С(13)), 2.64 (ш.т, J(9,10)=6.0, 2Н-С(9)), 2.66-2.73 (м, 2Н-С(11), 2Н-С(14)), 2.84 (ш.т, J(10,9)=6.0, 2Н-С(10)), 7.73 (д.к, J(4,6)=2.0, 4J(H,F)=0.7, Н-С(4)), 8.85 (д.к, J(6,4)=2.0, 4J(H,F)=0.6, H-C(6)), 11.70 (ш.с, NH). ЯМР 13C (CDCl3): 143.52 (c, C(1)), 134.76 (c, C(2)), 145.88 (c, C(3)), 126.33 (д, 3J(C,F)=3.4, C(4)), 132.57 (2J(C,F)=33.2, C(5)), 120.68 (д, 3J(C,F)=3.9, C(6)), 122.64 (1J(C,F)=273.5, C(7)), 171.62 (c, C(8)), 35.23 (т, C(9)), 51.34 (т, C(10)), 53.59 (т, C(11), C(14)), 23.65 (т, C(12), C(13)). Найдено: 444.981 [M+H]+. C14H15N2F3OS5. Вычислено: [M+H]+=444.98.
Пример 8. Исследование влияния предлагаемых соединений на активность Tdp1.
Рекомбинантная тирозил-ДНК-фосфодиэстераза 1 человека (КФ 3.1.4.) была экспрессирована в системе Escherichia coli (плазмида рЕТ 16B-Tdp1 предоставлена доктором Кальдекотт К.У., Университет Сассекса, Великобритания) и выделена, как описано [2, 23].
В качестве тест-системы для определения ингибирующих свойств предлагаемых соединений использована реакция удаления тушителя флуоресценции Black Hole Quencher 1 (BHQ1) с 3′-конца олигонуклеотида, катализируемая Tdp1. На 5′-конце олигонуклеотида находится (5,6)-FAM - флуорофор, интенсивность флуоресценции которого возрастает при удалении тушителя. Для измерения флуоресценции использовался флуориметр POLARstar OPTIMA производства BMG LABTECH.
Реакционные смеси объемом 200 мкл содержали буфер (50 мМ Tris-НСl, pH 8,0; 50 мМ NaCl; 7 мМ меркаптоэтанол), 50 нМ олигонуклеотид и различные концентрации ингибиторов. Реакция запускалась добавлением Tdp1 до конечной концентрации 1,3 нМ. Измерения проводились в линейном диапазоне зависимости скорости реакции от времени (до 8 минут) через каждые 55 секунд. Влияние предлагаемых соединений оценивали по величине IС50 (концентрация ингибитора, при которой активность фермента снижена наполовину). Обсчет значений IC50 проводился с помощью программы MARS Data Analisys 2.0 (BMG LABTECH).
Влияние предлагаемых соединений на активность Tdp1 представлено в таблице. Из таблицы видно, что величины IС50 для предлагаемых соединений составляют 0,22-6,03, что в 50-15 раз ниже, чем у соединения-прототипа.
Предлагаемые соединения оказывают специфическое ингибирующее действие на фермент тирозил-ДНК-фосфодиэстераза 1 человека (Tdp1) и, являясь эффективными соединениями, расширяют арсенал ингибиторов данного фермента и могут быть использованы для разработки лекарственных препаратов, применимых в клинической медицине.
Источники информации
1. Cortes Ledesma F, et al., Nature, 2009, 461, 674-678.
2. Interthal H, et al., Proc. Natl. Acad. Sci. U.S.A. 2001, 98, 12009-12014.
3. Rass U, et al., Cell., 2007, 130, 991-1004.
4. Dexheimer TS, et al., Anticancer Agents Med Chem. 2008, 8, 381-389.
5. Ben Hassine S, et al., The EMBO Journal, 2009, 28, 632-640.
6. Povirk LF. ISRN Mol. Biol., 2012, 1-16.
7. Vance JR, Wilson ТЕ. J. Biol. Chem., 2001, 276, 15073-15081.
8. Pommier Y. Nat. Rev. Cancer, 2006, 6, 789-802.
9. Pommier Y, et al. Chem Biol., 2010, 17, 421-433.
10. Beretta GL, et al., Curr. Med. Chem. 2010, 17, 1500-1508.
11. El-Khamisy SF, et al., DNA Repair (Amst)., 2009, 8 760-766.
12. Das BB, et al., The EMBO Journal., 2009, 28, 3667-3680.
13. Katyal S, et al., EMBO J., 2007, 26, 4720-4731.
14. Hirano R, et al., EMBO J., 2007, 26, 4732-4743.
15. Barthelmes HU, et al., J Biol Chem. 2004, 279, 55618-25565.
16. Nivens MC, et al., Cancer Chemother Pharmacol., 2004, 53, 107-115.
17. Antony, S et al., Nucleic Acids Res. 2007, 35, 4474-4484.
18. Nguyen TX, et al., J. Med. Chem., 2012, 55, 4457-4478.
19. Alagoz M, et al., Nucleic Acids Res., 2013, [Epub ahead of print].
20. Murai J, et al., J Biol Chem. 2012, 287, 12848-12857.
21. Kutuzov MM, et al., Biopolym. and Cell, 2012, 28, 239-241.
22. Khomenko TM, et al., Letters in Drug Design & Discovery, 2009, 6, 464-467.
23. Lebedeva NA, et al., FEBS Lett., 2011, 585, 683-686.
| название | год | авторы | номер документа |
|---|---|---|---|
| Адамантилсодержащие производные 1,2,4-триазола и 1,3,4-тиадиазола, имеющие монотерпеноидные фрагменты, используемые в качестве ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 | 2020 |
|
RU2761880C1 |
| Гидразинотиазоловые производные усниновой кислоты, проявляющие ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека | 2015 |
|
RU2612256C1 |
| СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ ФЕРМЕНТА ТИРОЗИЛ-ДНК-ФОСФОДИЭСТЕРАЗЫ 1 ЧЕЛОВЕКА | 2015 |
|
RU2612875C1 |
| Средство для ингибирования фермента тирозил-ДНК-фосфодиэстеразы 1 человека на основе фенилкумаринов, сенсибилизирующее опухоли к действию противоопухолевых агентов | 2019 |
|
RU2724878C1 |
| Средства для ингибирования фермента тирозил-ДНК-фосфодиэстеразы 1 на основе желчных кислот | 2018 |
|
RU2689335C1 |
| 2-Ацетил-6-(2-(2-(4-бромбензилиден)гидразинил) тиазол-4-ил)-3, 7, 9-тригидрокси-8, 9b-диметилдибензо[b, d]фуран-1(9bH)-он, проявляющий ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека | 2016 |
|
RU2627764C1 |
| СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ ФЕРМЕНТА ТИРОЗИЛ-ДНК-ФОСФОДИЭСТЕРАЗЫ 1 ЧЕЛОВЕКА | 2015 |
|
RU2605329C1 |
| Средство для ингибирования фермента тирозил-ДНК-фосфодиэстеразы 1 человека на основе производных пентафуранозилнуклеозидов | 2019 |
|
RU2748103C1 |
| 1,1'-(Гексан-1,6-диил)бис(3-(((1R,4aS,10aR)-7-изопропил-1,4а-диметил-1,2,3,4,4а,9,10,10а-октагидрофенантрен-1-ил)метил)мочевина, проявляющая ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека и увеличивающая активность темозоломида в отношении клеток глиобластомы | 2019 |
|
RU2724882C1 |
| 1-Адамантил-3-(((1R,4aS,10aR)-7-изопропил-1,4а-диметил-1,2,3,4,4а,9,10,10а-октагидрофенантрен-1-ил)метил)мочевина, проявляющая ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека и увеличивающая активность темозоломида в отношении клеток глиобластомы | 2019 |
|
RU2697409C1 |
Изобретение относится к молекулярной биологии, биохимии и биотехнологии, конкретно к известным соединениям, представляющим собой производные (8-(трифторметил)бензо[f][1,2,3,4,5]пентатиепин-6-ил)амидов общей формулы I, проявляющим способность ингибировать действие фермента тирозил-ДНК-фосфодиэстеразы 1 человека. Технический результат: повышение ингибирующего действия на фермент тирозил-ДНК-фосфодиэстеразы 1 человека (Tdp1) и расширение арсенала ингибиторов данного фермента. 2 ил., 1 табл., 8 пр.
Средство, представляющее собой одно из производных (8-(трифторметил)бензо[f][1,2,3,4,5]пентатиепин-6-ил)амидов общей формулы I:
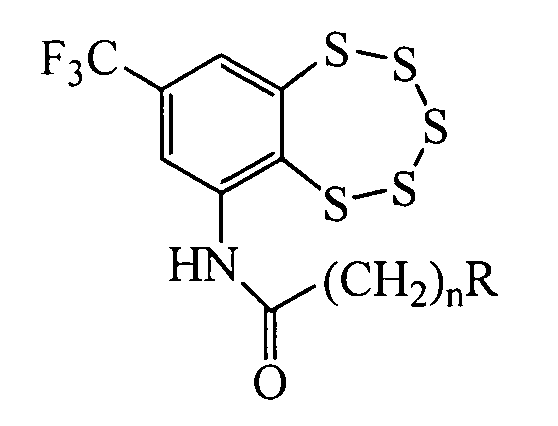
где n=1, 2, a R - третичная аминогруппа, в том числе входящая в состав шестичленного гетероцикла, содержащего атом кислорода, проявляющее ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека.
| Kutuzov, M | |||
| M.; Zakharenko, A | |||
| L.; Sukhanova, M | |||
| V.; Khodyvera, S | |||
| N.; Khomenko, T | |||
| M.; Volcho, K | |||
| P.; Salakhutdinov, N | |||
| F.; Lavrik, O | |||
| I.,"Polysulfide compounds as inhibitors of the key base excision repair enzymes.", Biopolymers and Cell, 28(3), 239-241, 2012 | |||
| WO 1984004921, A1,20.12.1984 | |||
| ПРОИЗВОДНОЕ БЕНЗОПЕНТАТИЕПИНА, ОБЛАДАЮЩЕЕ ПРОТИВОСУДОРОЖНОЙ И ПРОТИВОТРЕВОЖНОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2341521C1 |
| Вибрационный питатель | 1985 |
|
SU1305090A1 |
Авторы
Даты
2016-04-10—Публикация
2014-09-30—Подача