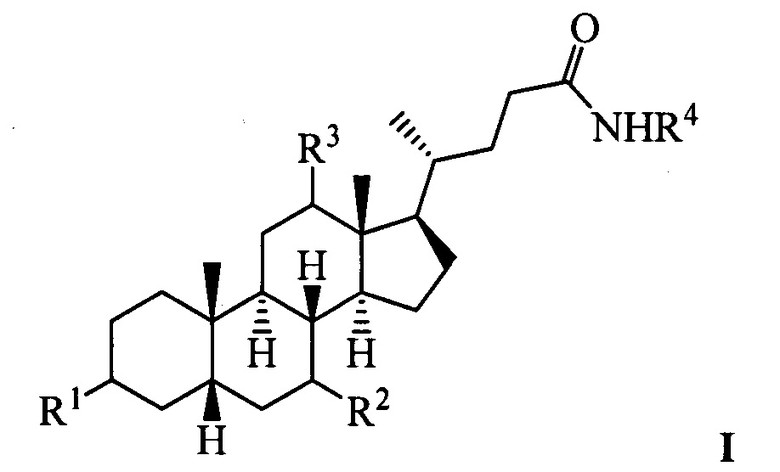
Изобретение относится к молекулярной биологии, биохимии и медицине, конкретно к применению соединений, представляющим собой производные желчных кислот общей формулы I, включая пространственные изомеры, в том числе оптически-активные формы:
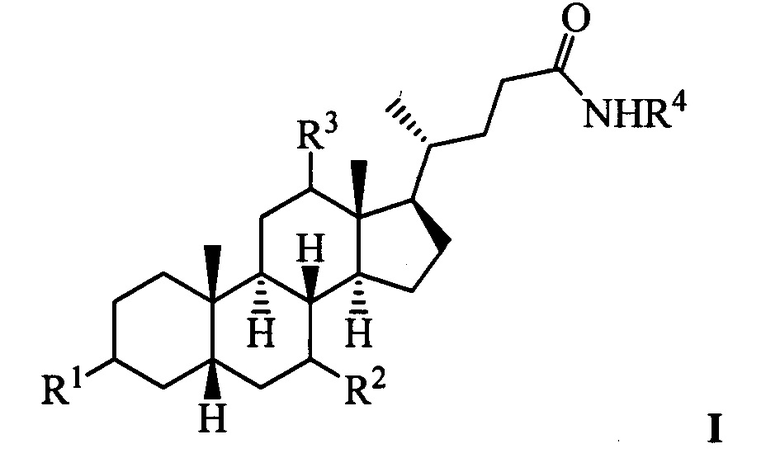
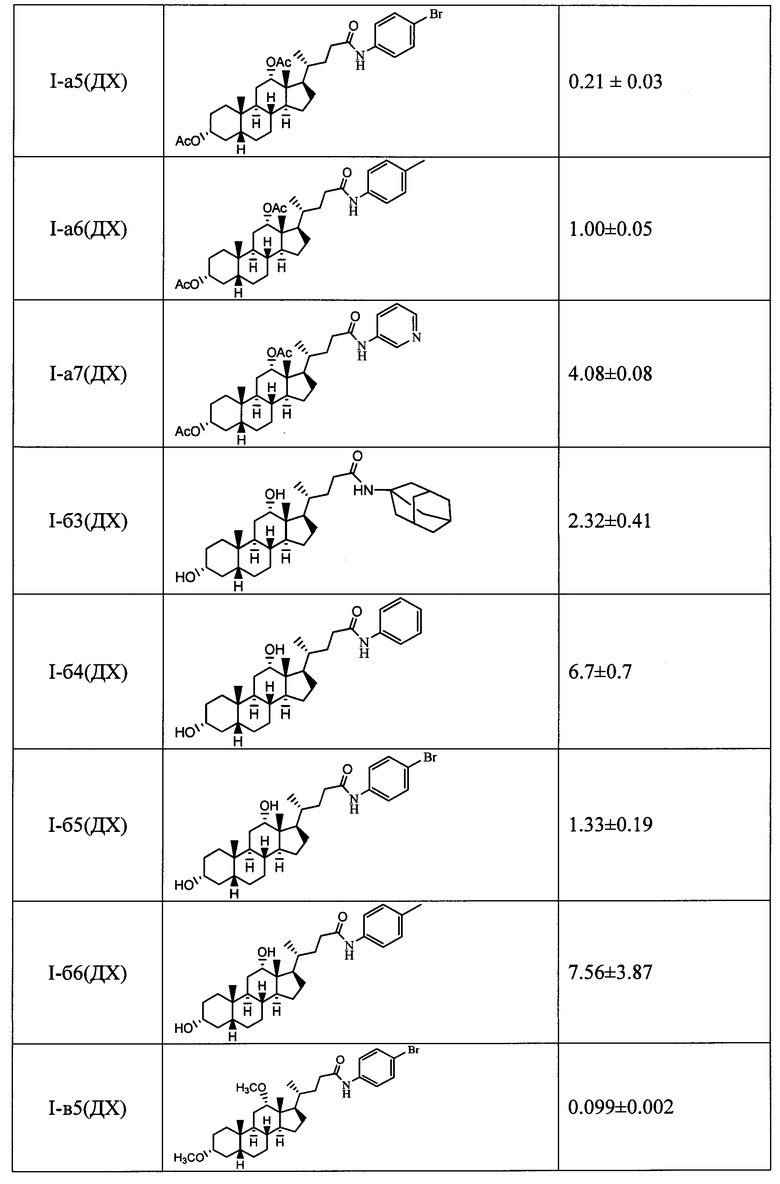
где, R1=-ОН, -ОАс, O-СН3; R2=-Н, -ОН, -ОАс; R3=-Н, -ОН, -ОАс, -O-СН3;
R4 = адамантил; -фенил, не обязательно замещенный бромом, -метилом; -пиридинил, -(CH2)2-R5, где R5 = фенил, замещенный двумя трет-бутильными группами, или индол, в качестве ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 человека (Tdp1).
Системы репарации ДНК, ответственные за исправления повреждений и разрывов в молекулах ДНК, играют важнейшую роль в поддержании целостности генома. Однако, повышенная активность подобных систем создает значительные проблемы при лечении целого ряда иммунных, нейродегенеративных и, особенно, опухолевых заболеваний [Lu JYD, et all., 2017, Dexheimer TS, et al., 2008., Laev S, el al., 2016]. Цитотоксические эффекты химио- и радиотерапии, которые используются в клинической практике при лечении злокачественных опухолевых заболеваний, основаны на способности данных методов генерировать повреждения ДНК. Способность опухолевых клеток опознавать повреждения ДНК и запускать механизм репарации может приводить к возникновению резистентности к тем или иным препаратам противораковой терапии. Ингибирование ферментов системы репарации ДНК может повысить эффективность использования уже применяющихся в практике противоопухолевых препаратов [Al Abo М, et al., 2017.] Поэтому поиск ингибиторов ферментов системы репарации ДНК является одним из востребованных направлений исследований в медицинской химии. [Huang Shar-yin N. et al. 2011, Beretta GL, et al., 2010, Geenen JJJ., et al. 2017]
В последние годы [Beretta GL, et al., 2010, Jun J.H. et al. 2018] ведутся активные поиски ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 (Tdp1, фермент класса фосфодиэстераз, расщепляющих фосфодиэфирные связи [Interthal, 2001]), который рассматривается как перспективный фермент-мишень при создании лекарственных препаратов для лечения онкологических и нейродегенеративных заболеваний [Cortes Ledesma, 2009, Dexheimer TS, et al., 2008].
Tdp1, в частности, играет важную роль в удалении повреждений ДНК, создаваемых топоизомеразой 1 (Top1) в присутствии ингибиторов Top1 (например, камптотецина и его производных, используемых в клинике), и некоторыми другими противоопухолевыми препаратами [см. обзоры Laev, 2016; Pommier, 2010; Pommier, 2006].
Нормальный ферментативный цикл Top1 включает в себя реакции «разрезания» и «сшивки» одной из цепей ДНК. Первоначально, остаток тирозина-723 активного центра фермента Top1 образует переходный ковалентный комплекс с 3'-фосфатом основания ДНК, который приводит к образованию одноцепочечного разрыва и снятию локального напряжения в спирали благодаря вращению «разрезанной» цепи вокруг интактной. Затем целостность ДНК восстанавливается за счет обратной реакции. В нормальных условиях скорость реакции «сшивки» значительно выше, чем скорость расщепления ДНК, однако ингибиторы Top1, такие как камптотецин и его производные, существенно замедляют скорость обратной реакции. Невозможность восстановить структуру ДНК приводит к образованию одноцепочечных разрывов, которые могут превратиться в более токсичные двухцепочечные. [Nguyen ТХ, et al., 2012, Dexheimer TS, et al., 2008].
Tdp1 катализирует гидролиз аддуктов ДНК, ковалентно связанных с 3'-фосфатом ДНК, включая пептиды Top1, комплексы Top1-ингибитор, а также 3'-фосфогликоляты и другие. Кроме того, Tdp1 способна отщеплять 5'-аддукты ДНК [Borda, 2015]. В результате, Tdp1 противостоит не только препаратам, направленным на ингибирование Top1 (камптотецины, инденоизохинолины), но также блеомицину, ингибиторам топоизомеразы II (Тор2) (этопозид, доксорубицин) и ДНК-алкилирующими агентами. Предполагается, что именно Tdp1 ответственна за лекарственную устойчивость некоторых видов рака [Dexheimer, 2008; Beretta, 2010]. Эта гипотеза подтверждается рядом исследований, например, известно, что мыши, нокаутные по Tdp1, гиперчувствительны к камптотецину [El-Khamisy, 2009; Das, 2009; Katyal, 2007; Hirano, 2007]. И, наоборот, в клетках с повышенным уровнем экспрессии Tdp1 камптотецин и этопозид вызывают меньше повреждений ДНК [Barthelmes, 2004; Nivens, 2004]. Также показано, что подавление активности Tdp1 делает опухолевые клетки гиперчувствительными к противораковым препаратам с другими механизмами действия: темозоломиду (метилирование пуринов) [Alagoz, 2014], метилметансульфонату (образование апуриновых/апиримидиновых сайтов), блеомицину (одноцепочечные/двухцепочечные разрывы с 3'-фосфогликолятами), перекиси водорода и ионизирующему излучению (разрывы и др. виды повреждений) [Murai, 2012].
В литературе описано немного ингибиторов Tdp1, большинство из них обладает умеренным ингибирующим действием [Antony, 2007; Nguyen, 2012; Dexheimer, 2008; Zakharenko, 2015, Zakharenko, 2016; Jun J.H. et al., 2018].
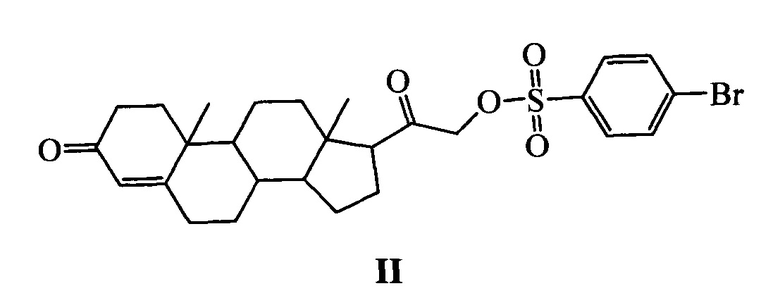
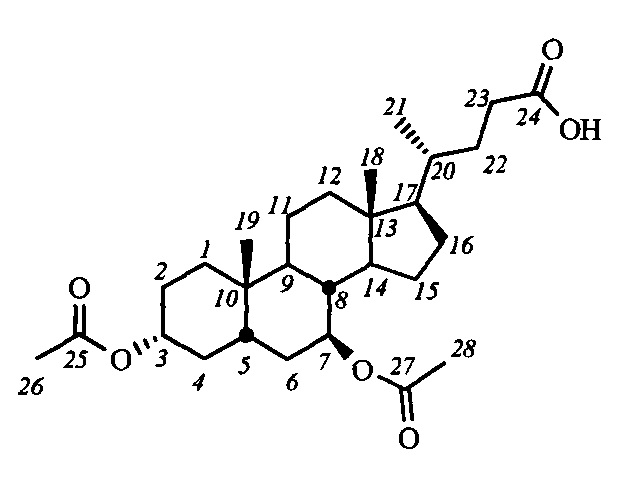
Наиболее близким к заявляемому средству - прототипом - является соединение II (NSC 88915), конъюгат дезоксикортикостерона и 4-бромбензолсульфокислоты [Dexheimer T.S. et al., 2009; Nguyen T.X et al. 2012], с достаточно высокими ингибирующими характеристиками в отношении Tdp1 (IC50 7.7 мкМ). Изучение зависимости «структура-активность» показало, что оба структурных фрагмента соединения II являются важными элементами, обуславливающими высокую ингибирующую активность указанного соединения [Dexheimer T.S. et al., 2009]. Однако, в результате исследований был выявлен ряд существенных недостатков соединения II, таких как низкая биодоступность, высокая цитотоксичность и воздействие на нежелательные мишени, связанные, по всей видимости, с гормональной природой стероидного фрагмента.
Задачей изобретения является создание более эффективного ингибитора Tdp1 нового структурного типа.
Поставленная техническая задача решается применением соединений, представляющих амиды желчных кислот, в том числе с дополнительной модификацией функциональных групп стероидного остова, общей формулы I, у которых выявлена биологическая активность, заключающаяся в подавлении активности Tdp1.
Для получения соединений общей формулы I в качестве исходных соединений использовались доступные желчные кислоты: дезоксихолевая кислота (III-(ДХ)) (R2=H, R3=αOH), хенодезоксихолевая кислота (III-(ХДХ)) (R2=αOH, R3=H), и урсодезоксихолевая кислота (III-(УДХ)) (R2=βOH, R3=H).
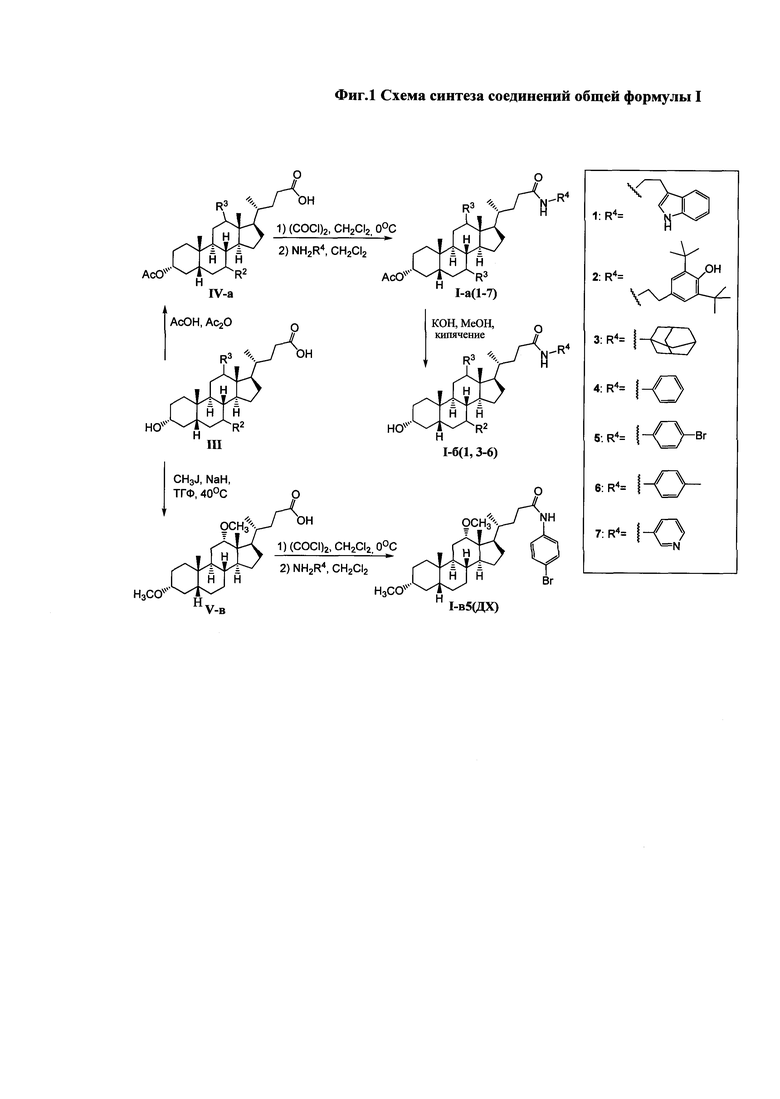
Схема синтеза соединения общей формулы I приведена на Фиг. 1.
На первом этапе может осуществляться модификация гидроксильных групп стероидного остова: взаимодействие с уксусным ангидридом в уксусной кислоте приводит к образованию диацетоксипроизводных общей формулы IV, а с йодистым метилом с присутствии гидрида натрия - диметоксипроизводного (соединение V-в). Формирование амидной группы может быть осуществлено через промежуточное образование хлорангидрида, взаимодействием карбоксильной группы с хлористым оксалилом, и последующим взаимодействием с соответствующим амином, например, триптамином (соединения с индексом 1), 4-(2-аминоэтил)-2,6-ди-t-бутилфенолом (индекс 2), 1-аминоадамантаном (индекс 3), анилином (индекс 4), n-броманилином (индекс 5), n-метиланилином (индекс 6) и м-аминопиридином (индекс 7). Получение амидных производных желчных кислот (соединения с индексом б), содержащих в стероидном остове гидроксильные группы, осуществляли взаимодействием диацетоксиамидов (соединения с индексом а) с гидроксидом калия в метаноле.
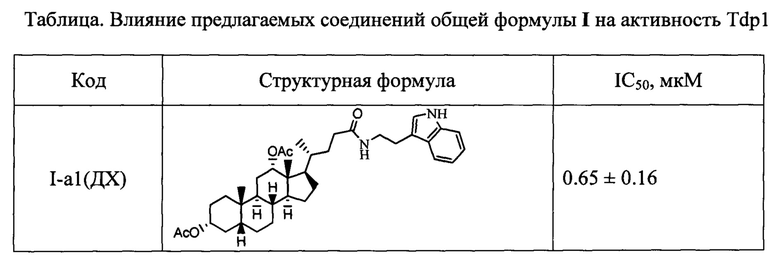
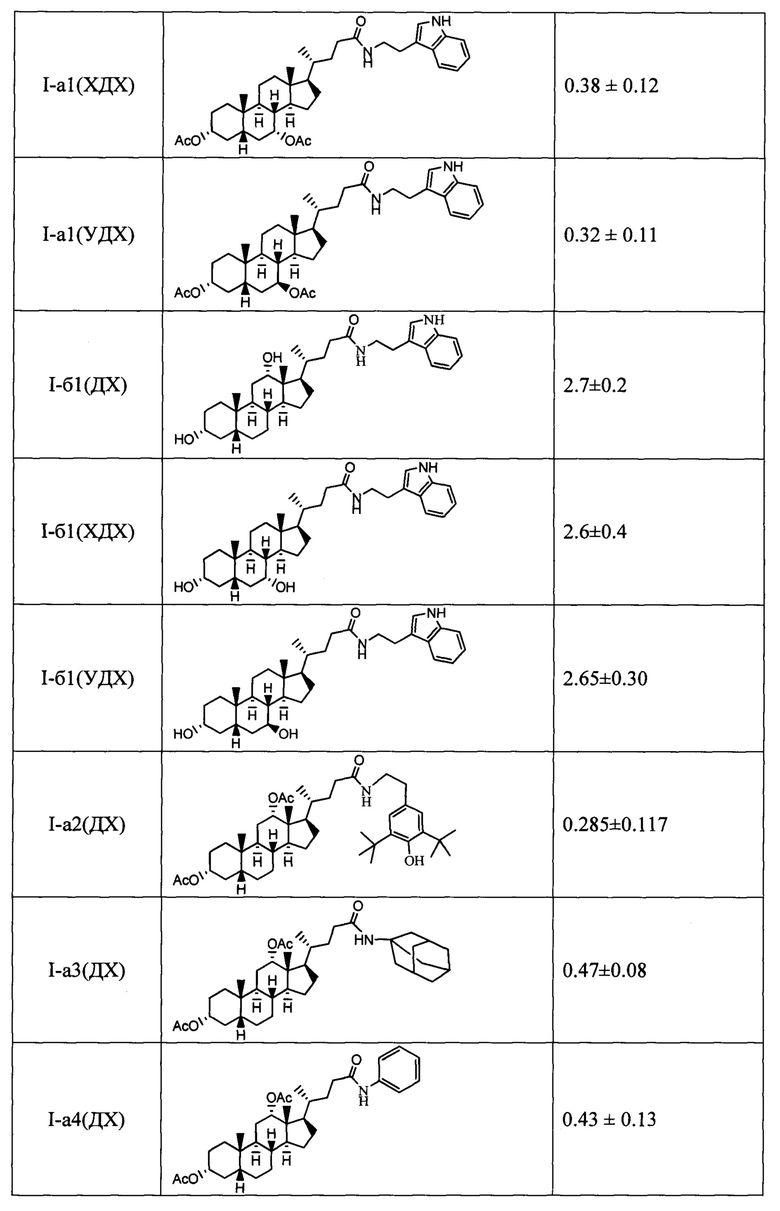
Результаты тестирования соединений формулы I на способность ингибировать фермент Tdp1 приведены в таблице.
Показано, что амидные производные, имеющие дополнительную модификацию гидроксильных групп стероидного остова (ацетоксигруппы (соединения с индексом а) и метоксигруппы (соединения с индексом в)), проявляют более выраженную активность в отношении ингибирования фермента Tdp1 по сравнению с их аналогами, имеющими не замещенную гидроксигруппу (соединения с индексом б).
Технический результат: найден новый класс эффективных ингибиторов Tdp1 с хорошими ингибирующими характеристиками (IC50 для одноцепочечной ДНК от 0.1 до 7 мкМ).
Соединения общей формулы I, после проведения углубленных фармакологических исследований, могут использоваться для дальнейшей разработки новых высокоэффективных противораковых средств.
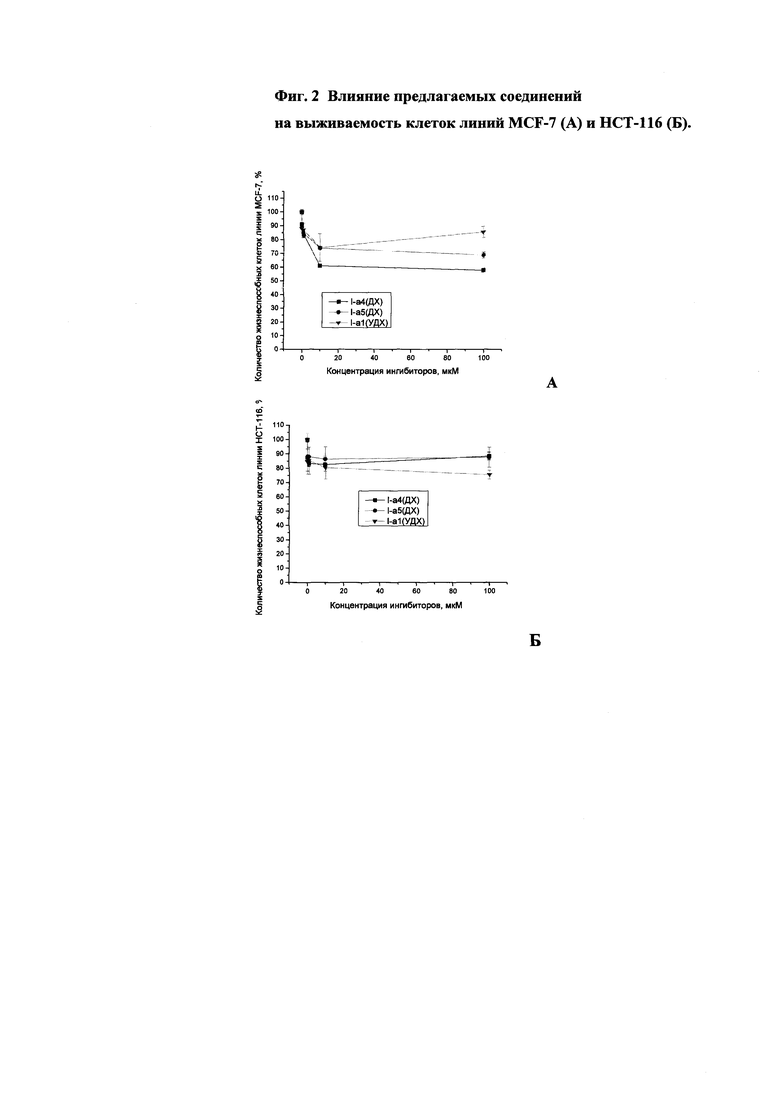
Поскольку ингибиторы ферментов репарации ДНК используются в "коктейлях" с известными противоопухолевыми препаратами, обладающими очень высокой цитотоксичностью, важно, чтобы применение новых соединений в лекарственных формах не приводило бы к дополнительной токсической нагрузке на организм. Анализ цитотоксичности предлагаемых соединений проводили на линиях клеток аденокарциномы молочной железы человека MCF-7 и карциномы прямой кишки человека НСТ-116. Индуцированную соединениями клеточную гибель оценивали с помощью стандартного МТТ-теста [Mosmann, 1983]. В качестве контроля использовали клетки, которые выращивали в присутствии 1% DMSO.
Токсичность испытанных соединений (I-а1(УДХ), I-а4(ДХ), I-а5(ДХ)) отсутствовала или была незначительна во всем диапазоне изученных концентраций (до 100 мкМ) (см. рисунок). Во всех случаях не была достигнута концентрация, соответствующая гибели 50% клеток.
Влияние предлагаемых соединений на выживаемость клеток линий MCF-7 (А) и НСТ-116 (Б), приведено на фиг. 2.
Таким образом, предлагаемые соединения, являющиеся низкотоксичными эффективными ингибиторами тирозил-ДНК-фосфодиэстеразы 1, можно рассматривать как перспективные агенты для комбинированной химиотерапии онкологических заболеваний.
Ниже приводятся конкретные примеры реализации заявляемого технического решения.
Пример 1. Синтез 3α,12α-диацетокси-5β-холан-24-овой кислоты (IV-а(ДХ))
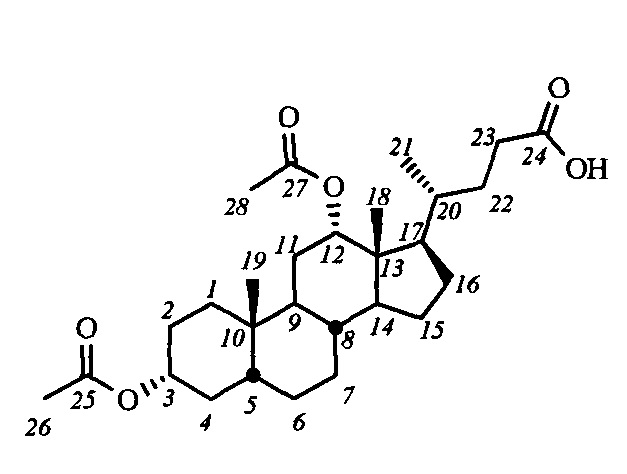
Дезоксихолевую кислоту (III-(ДХ)) (25.0 г, 63.8 ммоль) кипятили в АсОН (200 мл) несколько дней (до полной этерификации 3-ОН-группы и 90% этерификации 12-ОН-группы; ход реакции контролировали 1Н ЯМР). Добавили в реакционную смесь бензол (80 мл) и отогнали азеотроп бензол-вода с использованием насадки Дина-Старка. Затем в добавили в реакционную смесь Ac2O (4 мл) и перемешивали при комнатной температуре до полной конверсии. Реакционную смесь разбавили водой (70 мл) и выдержали 8 часов при 50°С (для разложения смешанного ангидрида уксусной и дезоксихолевой кислот), охладили до комнатной температуры и вылили в воду, далее экстрагировали смесью CH2Cl2 - t-BuOMe. Органическую фазу промыли насыщенными водными растворами NaHCO3 и NaCl (нас), сушили над безводным MgSO4. Удалили растворитель на роторном испарителе, получили сырой продукт в виде желтой аморфной массы (33.3 г). Сырой продукт очистили колоночной хроматографией (SiO2, CHCl3), получили IV-а(ДХ) (28.7 г, выход 95%) в виде белого твердого аморфного вещества. Т. пл 71.1°C (разложение; лит. 92-93°C [ Cano L.P., et al., Steroids, 2013, 78, 982-986]).
Cano L.P., et al., Steroids, 2013, 78, 982-986]).
1H ЯМР (CDCl3, 300 МГц): δ=11.18 (ш.с, 1H, ОН), 5.04 (с, 1Н, Н-12), 4.66 (м, 1Н, Н-3), 2.35 (м, 1H, Н-23), 2.20 (м, 1H, Н-23'), 2.07 (с, 3H, CH3-28), 1.99 (с, 3H, CH3-26), 0.87 (с, 3H, CH3-19), 0.78 (д, 3H, J=6.2, CH3-21), 0.69 (с, 3H, CH3-18). 13С ЯМР (CDCl3, 75 МГц): δ=179.98 (с, С-24), 170.54 (с, С-25), 170.41 (с, С-27), 75.76 (д, С-12), 74.09 (д, С-3), 49.27 (д, С-14), 47.40 (д, С-17), 44.85 (с, С-13), 41.65 (д, С-5), 35.50 (д, С-8), 34.54 (т, С-1), 34.48 (д, С-20), 34.23 (д, С-9). 33.87 (с, С-10), 32.08 (т, С-4), 30.80 (т, С-23), 30.42 (т, С-22), 27.17 (т, С-16), 26.72 (т, С-6), 26.46 (т, С-2), 25.70 (т, С-7), 25.48 (т, С-11), 23.26 (т, С-15), 22.92 (к, С-19), 21.33 (к, С-26), 21.24 (к, С-28), 17.33 (к, С-21), 12.26 (к, С-18).
Пример 2. Синтез 3α,7α-диацетокси-5β-холан-24-овой кислоты (IV-а(ХДХ))
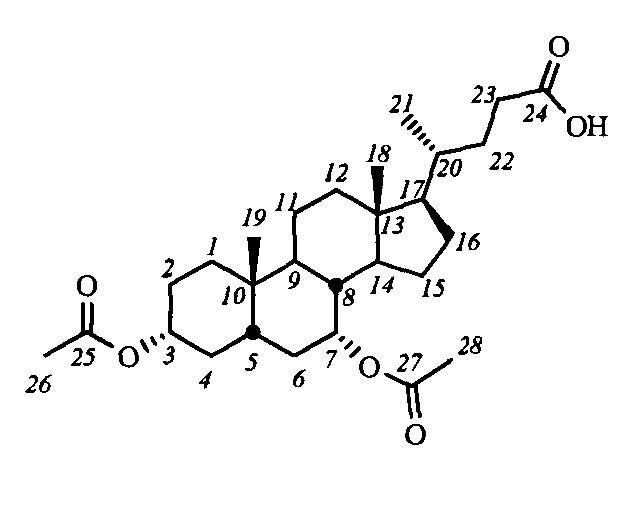
К раствору хенодезоксихолевой кислоты (III-(ХДХ)) (1 г, 2.55 ммоль) и DMAP (0.03 г, 0.255 ммоль) в CH2Cl2 (15 мл) по каплям прибавили смесь Ac2O (0.6 мл, 6.4 ммоль) и NEt3 (0.9 мл, 6.4 ммоль) при комнатной температуре и перемешивании. Ход реакции контролировали ТСХ и ЯМР 1Н. По окончании реакции в реакционную смесь добавили Et2O и промыли последовательно водой, 5%-ным водным раствором HCl, насыщенными растворами NaHCO3 и NaCl. Органическую фазу сушили над безводным MgSO4 и удалили растворитель на роторном испарителе. Получили сырой продукт IV-а(ХДХ) - стеклообразное (аморфное) желтоватое вещество, который использовали в следующих превращениях без дополнительной очистки. Выход количественный (1.27 г).
1Н ЯМР (CDCl3, 400 МГц): δ=4.81 (м, 1Н, Н-7), 4.51 (м, 1Н, Н-3), 2.42 (м, 1H, Н-23), 2.30 (м, 1H, Н-23'), 2.15 (с, 3H, CH3-28), 1.98 (с, 3H, CH3-26), 0.86 (с, 3H, CH3-19), 0.58 (с, 3H, CH3-18). 13С ЯМР (CDCl3,100 МГц): δ=178.17 (с, С-24), 170.41 (с, С-25), 170.19 (с, С-27), 73.90 (д, С-3), 70.95 (д, С-7), 55.41 (д, С-17), 50.12 (д, С-14), 42.45 (с, С-13), 40.67 (д, С-5), 39.20 (т, С-12), 37.61 (д, С-8), 34.81, 34.62, 34.52, 34.34, 33.78, 31.92, 31.03, 29.87, 27.76, 26.51, 23.26, 22.42, 21.33 (к, С-19), 21.22 (к, С-26), 20.37 (к, С-28), 18.00 (к, С-21), 11.44 (к, С-18).
Пример 3. Синтез 3α,7β-диацетокси-5β-холан-24-овая кислота (IV-а(УДХ))
Аналогично примеру 2 из урсодезоксихолевой кислоты (III-(УДХ)) (1 г, 2.55 ммоль), DMAP (0.03 г, 0.255 ммоль) и Ac2O (0.6 мл, 6.4 ммоль) и NEt3 (0.9 мл, 6.4 ммоль) в CH2Cl2
(15 мл) получили IV-a (УДХ) с количественным выходом (1.43 г), который использовали в следующих превращениях без дополнительной очистки.
1Н ЯМР (CDCl3, 400 МГц): δ=4.70 (м, 1H, Н-7), 4.60 (м, 1Н, Н-3), 1.96 (с, 3H, CH3-28), 1.92 (с, 3H, CH3-26), 0.91 (с, 3H, CH3-19), 0.87 (д, 3H, J=6.3, CH3-21), 0.62 (с, 3H, CH3-18). 13С ЯМР (CDCl3, 100 МГц): δ=179.24 (с, С-24), 170.42 (с, С-25), 170.42 (с, С-27), 73.35 (д, С-7), 73.35 (д, С-3), 54.97, 54.76, 43.36, 41.79, 39.71, 39.66, 39.12, 34.96, 34.75, 34.26, 33.74, 32.62, 30.74, 30.51, 28.19, 26.14, 25.36, 23.00 (к, С-19), 21.60 (к, С-26), 21.17 (к, С-28), 20.97 (т, С-11), 18.13 (к, С-21), 11.86 (к, С-18).
Пример 4. Синтез N-(2'-(1H-индол-2-ил)-этил)-3α,12α-диацетокси-5β-холан-24-амида (I-а1(ДХ))
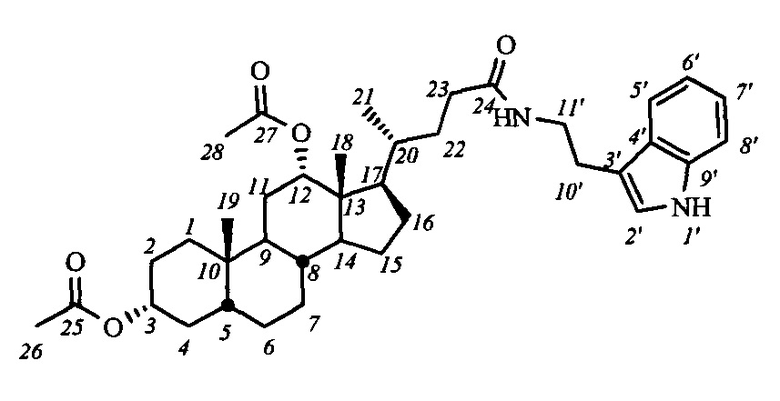
а) Раствор IV-а(ДХ) (0.45 г, 0.95 ммоль) в сухом CH2Cl2 (10 мл) охладили в бане со льдом до 0-5°C, добавили к нему оксалилхлорид (0.49 мл, 5.7 ммоль) и 3 капли ДМФА. Перемешивали 3 часа при охлаждении. В реакционную смесь добавили бензол (5 мл×2 раза) и концентрировали на ротационном испарителе для удаления растворителя и избытка хлористого оксалила. К реакционной смеси добавили CH2Cl2 (10 мл),
б) Полученный раствор хлорангидрида по каплям при интенсивном перемешивании добавили к раствору триптамина (0.3 г, 1.9 ммоль) и NEt3 (0.39 мл, 2.8 ммоль) в CH2Cl3 (10 мл). Реакционную смесь перемешивали 18 часов при комнатной температуре, ход реакции контролировали ТСХ. Растворитель удалили, добавили 50 мл AcOEt и воду, органическую фазу отделили, водную фазу экстрагировали AcOEt (2×30 мл). Объединенную органическую фазу промыли 5%-ным раствором HCl, затем раствором NaHCO3 и раствором NaCl (нас.), сушили над безводным MgSO4. Масса сырого продукта - 0.58 г, выход количественный. Сырой продукт очистили колоночной хроматографией (SiO2, CH2Cl2 с градиентом AcOEt (0-10%)), получили 2 фракции различной чистоты массами 0.29 г (97% чистоты по ВЭЖХ) и 0.23 г (94% чистоты) в виде белого твердого аморфного вещества. Выход 90%. Тпл 99.2°C [разложение]. Эл. анал. вычислено для C38H54N2O5: С, 73.75; Н, 8.80; N, 4.53; О, 12.93; найдено С, 73.37; Н, 8.68; N, 4.18. 1Н ЯМР (CDCl3, 300 МГц): δ=8.63 (шс, 1Н, NH-1'), 7.55 (д, 1Н, J5',6'=7.8, Н-5'), 7.33 (д, 1H, J8',7'=8.0, Н-8'), 7.15 (дд, 1H, J7',6'=7.2, Н-7'), 7.06 (дд, 1H, J6',5'=7.4, Н-6'), 6.97 (с, 1Н, Н-2'), 5.60 (м, 1H, C(O)NH), 5.05 (с, 1H, Н-12(β)), 4.67 (м, 1H, Н-3(β)), 3.54 (м, 2Н, CH2-11'), 2.92 (м, 2Н, CH2-10'), 2.06 (с, 3H, CH3-26), 2.01 (с, 3H, CH3-28), 0.88 (с, 3H, CH3-18), 0.71 (д, 3H, J21,20=6.4, CH3-21), 0.67 (с, 3H, CH3-19). 13С ЯМР (CDCl3, 125 МГц): δ=173.30 (с, С-24), 170.44 (с, С-25), 170.37 (с, С-27), 136.32 (с, С-9'), 127.25 (с, С-4'), 122.03 (д, С-2'), 121.90 (д, С-7'), 119.32 (д, С-5'), 118.55 (д, С-6'), 112.86 (с, С-3'), 111.16 (д, С-8'), 75.80 (д, С-12), 74.08 (д, С-3), 49.28, 47.64, 44.89, 41.70, 39.67 (т, С-11'), 35.54, 34.67, 34.59, 34.28, 33.90, 33.55, 32.14, 31.47, 27.18, 26.75, 26.50, 25.73, 25.52, 25.19 (т, С-10'), 23.28, 22.92 (к, CH3-С(O)O), 21.32 (к, С-19), 21.25 (к, CH3-С(O)O), 17.49 (к, С-21), 12.29 (к, С-18).
Пример 5. Синтез N-(2'-(1H-индол-2-ил)-этил)-3α,7α-диацетокси-5β-холан-24-амида (I-а1(ХДХ))
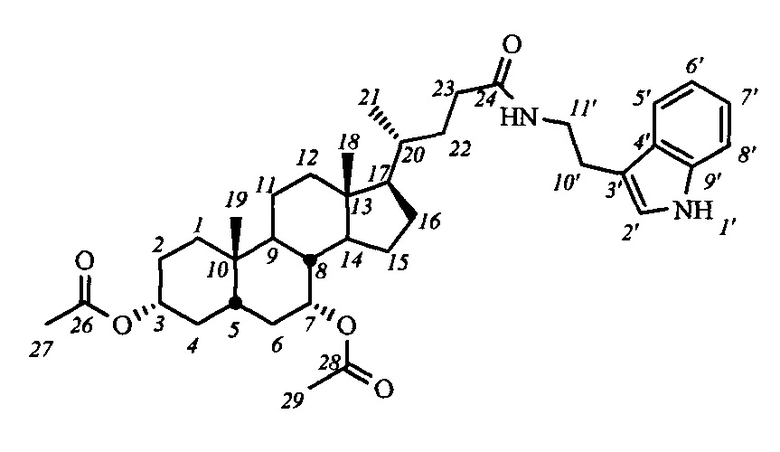
Аналогично примеру 4 (пункт а) из IV-а(ХДХ) (1.2 г, 2.5 ммоль), оксалилхлорида (1.3 мл, 15 ммоль) получили раствор хлорангидрида в CH2Cl2 (10 мл). Аналогично примеру 4 (пункт б) провели реакцию с триптамином (0.8 г, 5.0 ммоль) и NEt3 (7.5 ммоль) в CH2Cl2 (10 мл). Масса сырого продукта 1.4 г, выход 89%. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3 с градиентом МеОН (0-1%)), получили I-а1(ХДХ) 1.1 г (60% чистоты по ВЭЖХ) в виде белого твердого аморфного вещества. Выход 70%. Тпл 98.7°C [разложение]. Эл. анал. вычислено для C38H54N2O5: С, 73.75; Н, 8.80; N, 4.53; О, 12.93; найдено С, 73.54; Н, 8.63; N, 4.55. 1H ЯМР (CDCl3, 500 МГц): δ=8.47 (шс, 1Н, NH-1'), 7.56 (д, 1Н, J5',6'=7.8, Н-5'), 7.34 (д, 1H, J8',7'=8.1, Н-8'), 7.17 (дд, 1Н, J7',6'=7.6, Н-7'), 7.09 (дд, 1Н, J6',5'=7.4, Н-6'), 6.99 (с, 1H, Н-2'), 5.67 (с, 1Н, C(O)NH), 4.84 (с, 1Н, Н-7(β)), 4.55 (м, 1H, Н-3(β)), 3.56 (д, 2Н, J=5.8, CH2-11'), 2.94 (м, 2Н, CH2-10'), 2.02 (с, 3H, CH3-26), 2.01 (с, 3H, CH3-28), 0.89 (с, 3H, CH3-18), 0.86 (д, 3H, J21,20=6.0, CH3-21), 0.59 (с, 3H, CH3-19). 13С ЯМР (CDCl3, 125 МГц): δ=173.49 (с, С-24), 170.54 (с, С-25), 170.37 (с, С-27), 136.25 (с, С-9'), 127.16 (с, С-4'), 121.94 (д, С-2'), 121.89 (д, С-7'), 119.19 (д, С-5'), 118.47 (д, С-6'), 112.66 (с, С-3'), 111.16 (д, С-8'), 74.02 (д, С-3), 71.09 (д, С-7), 55.54 (д, С-17), 50.16 (д, С-14), 42.47 (с, С-13), 40.72 (д, С-5), 39.63, 39.26, 37.66 (д, С-8), 35.22, 34.68, 34.58, 34.41, 33.83, 33.40, 31.56, 31.12, 27.86, 26.58, 25.13 (т, С-10'), 23.35, 22.49, 21.46, 21.33, 20.43, 18.17 (к, С-21), 11.51 (к, С-18).
Пример 6. Синтез N-(2'-(1H-индол-2-ил)-этил)-3α,7β-диацетокси-5β-холан-24-амид (I-а1(УДХ))
Аналогично примеру 4 (пункт а) из IV-а(УДХ) (1.2 г, 2.5 ммоль), оксалилхлорида (1.3 мл, 15 ммоль) получили раствор хлорангидрида в CH2Cl2 (10 мл). Аналогично примеру 4 (пункт б) провели реакцию с триптамином (0.8 г, 5.0 ммоль) и NEt3 (7.5 ммоль) в CH2Cl2 (10 мл). Масса сырого продукта 1.52 г, выход
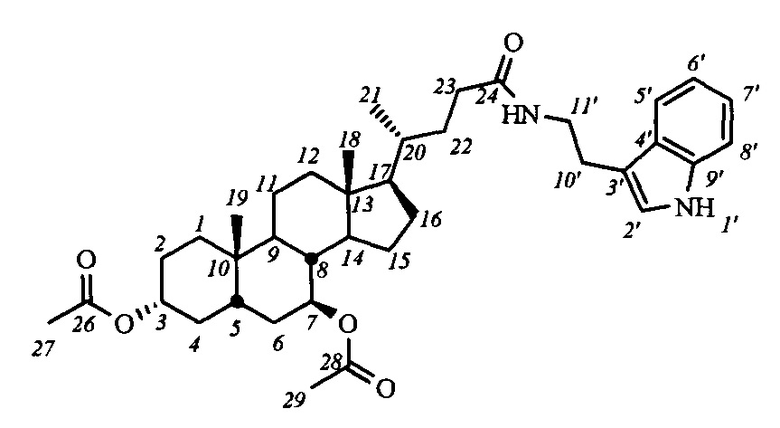
97%. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3 с градиентом МеОН (0-1%)), получили 2 фракции I-а1(УДХ) различной чистоты массами 0.2 г (>99% чистоты по ВЭЖХ) и 1.05 г (97.5% чистоты по ВЭЖХ) в виде белого твердого аморфного вещества. Выход 80%. Тпл 107.6°C [разложение]. Эл. ан. вычислено для C38H54N2O5: С, 73.75; Н, 8.80; N, 4.53; О, 12.93; найдено С, 73.68; Н, 8.76; N, 4.31. 1Н ЯМР (CDCl3, 500 МГц): δ=8.36 (шс, 1H, NH-1'), 7.57 (д, 1Н, J5',6'=7.7, Н-5'), 7.35 (д, 1H, J8',7'=8.0, Н-8'), 7.18 (дд, 1H, J7',6'=7.4, Н-7'), 7.09 (дд, 1H, J6',5'=7.4, Н-6'), 7.00 (шс, 1Н, Н-2'), 5.65 (м, 1H, C(O)NH), 4.73 (с, 1H, Н-7(α)), 4.63 (м, 1Н, Н-3(β)), 3.57 (м, 2Н, CH2-11'), 2.95 (м, 2Н, CH2-10'), 2.00 (с, 3H, CH3-26), 1.96 (с, 3H, CH3-28), 0.93 (с, 3H, CH3-18), 0.85 (д, 3H, J21,20=6.2, CH3-21), 0.62 (с, 3H, CH3-19). 13С ЯМР (CDCl3, 125 МГц): δ=173.46 (с, С-24), 170.52 (с, С-25), 170.44 (с, С-27), 136.25 (с, С-9'), 127.15 (с, С-4'), 121.93 (д, С-2'), 121.93 (д, С-7'), 119.12 (д, С-5'), 118.44 (д, С-6'), 112.60 (с, С-3'), 111.16 (д, С-8'), 73.40 (д, С-7), 73.40 (д, С-3), 54.95, 54.75, 43.32, 41.79, 39.70, 39.66, 39.61, 39.12, 35.10, 34.26, 33.74, 33.39, 32.65, 32.65, 31.54, 28.22, 26.15, 25.38, 25.15 (т, С-10'), 23.00, 21.66, 21.21, 20.96, 18.25 (к, С-21), 11.86 (к, С-18).
Пример 7. Синтез N-(2''-(3',5'-ди-трет-бутил-4'-гидроксифенил)этил)-3α,12α-диацетокси-5β-холан-24-амида (I-а2(ДХ))
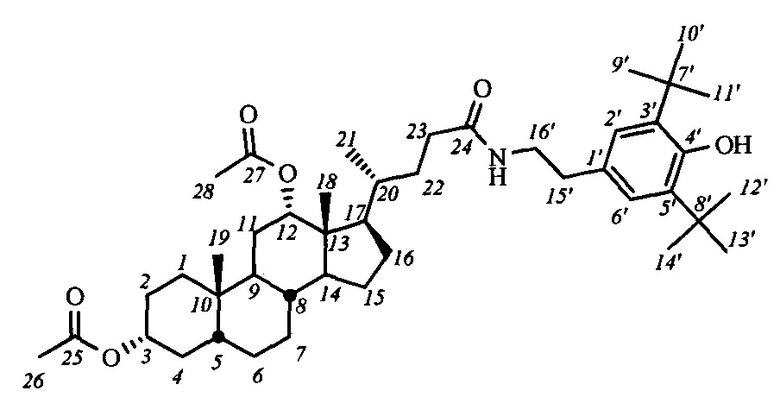
Аналогично примеру 4 (пункт а) из IV-а(ДХ) (0.20 г, 0.42 ммоль), оксалилхлорида (0.22 мл, 2.5 ммоль) получили раствор хлорангидрида в CH2Cl2 (10 мл). Аналогично примеру 4 (пункт б) провели реакцию с 4-(2-аминоэтил)-2,6-ди-трет-бутилфенолом (0.11 г, 0.44 ммоль) и NEt3 (0.66 ммоль) в CH2Cl2 (5 мл). Масса сырого продукта 0.29 г. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3 с градиентом МеОН (0-2%)), получили 0.85 г I-а2(ДХ) в виде белого твердого аморфного вещества. Выход 28%. Тпл 98.7°C [разложение]. Эл. ан. вычислено для C44H69NO6: С, 74.64; Н, 9.82; N, 1.98; О, 13.56; найдено С, 74.38; Н, 9.86; N, 2.11. 1Н ЯМР (CDCl3, 300 МГц): δ=6.94 (с, 2Н, Н-2', Н-6'), 5.48 (м, 1H, NH), 5.09 (с, 1Н, ОН), 5.04 (с, 1Н, Н-12(β)), 4.67 (м, 1Н, Н-3(β)), 3.43 (м, 2Н, CH2-16'), 2.69 (м, 2Н, CH2-15'), 2.06 (с, 3H, CH3-26), 2.00 (с, 3H, CH3-28), 0.87 (с, 3H, CH3-19), 0.77 (д, 3H, J21,20=6.1, CH3-21), 0.69 (с, 3H, CH3-18). 13С ЯМР (CDCl3, 75 МГц): δ=173.03 (с, С-24), 170.40 (с, С-25), 170.30 (с, С-27), 152.21 (с, С-4'), 135.94 (с, С-3'), 135.94 (с, С-5'), 129.31 (с, С-1'), 125.18 (д, С-2'), 125.18 (д, С-6'), 75.77 (д, С-12), 74.04 (д, С-3), 49.26, 47.58, 44.86, 41.67, 40.79, 35.52, 35.49, 34.74, 34.57, 34.24, 34.14, 33.88, 33.59, 32.11, 31.53, 30.17 (к, C(CH3)3), 27.25, 26.73, 26.48, 25.70, 25.49, 23.26, 22.92 (к, С-19), 21.31 (к, CH3-С(O)O), 21.23 (к, CH3-С(О)О), 17.49 (к, С-21), 12.28 (к, С-18).
Пример 8. Синтез N-(1'-адамантил)-3α,12α-диацетокси-5β-холан-24-амида (I-а3(ДХ))
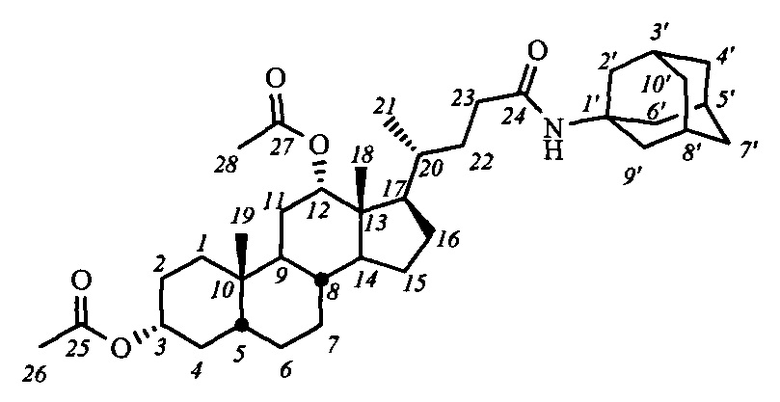
Аналогично примеру 4 (пункт а) из IV-а(ДХ) (0.6 г, 1.3 ммоль), оксалилхлорида (0.6 мл, 7.6 ммоль) получили раствор хлорангидрида в CH2Cl2 (15 мл). Аналогично примеру 4 (пункт б) провели реакцию с адамантиламином (0.26 г, 1.4 ммоль) и NEt3 (2.1 ммоль) в CH2Cl2 (10 мл). Масса сырого продукта 0.73 г. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3), получили 0.36 г I-а3(ДХ) в виде белого аморфного твердого вещества. Выход 47%. Тпл 120.7°C [разложение]. Эл. ан. вычислено для C38H59NO5: С, 74.84; Н, 9.75; N, 2.30; О, 13.12; найдено С, 74.76; Н, 9.83; N, 2.41. 1Н ЯМР (CDCl3, 600 МГц): δ=5.07 (с, 1H, Н-12(β)), 5.03 (дд, 1Н, J=5.0, NH), 4.66 (м, 1H, Н-3(β)), 2.05 (с, 3H, CH3-26), 2.02 (шс, 3H, Н-3', Н-5', Н-8'), 1.99 (с, 3H, CH3-28), 1.94 (с, 6Н, CH2-2', CH2-6', CH2-9'), 1.63 (м, 6Н, CH2-4', CH2-7', CH2-10'), 0.86 (с, 3H, CH3-19), 0.76 (д, 3H, J21,20=6.5, CH3-21), 0.68 (с, 3H, CH3-18). 13С ЯМР (CDCl3, 150 МГц): δ=172.31 (с, С-24), 170.39 (с, С-25), 170.31 (с, С-27), 75.80 (д, С-12), 74.04 (д, С-3), 51.56, 49.27, 47.67, 44.87, 41.68, 41.55 (т, С-2', С-6', С-9'), 36.22 (т, С-4', С-7', С-10'), 35.53, 34.64, 34.57, 34.53, 34.25, 33.88, 32.11, 31.49, 29.29 (д, С-3', С-5', С-8'), 27.22, 26.74, 26.47, 25.71, 25.49, 23.28, 22.91 (к, С-19), 21.30 (к, CH3-С(O)O), 21.23 (к, CH3-С(O)O), 17.53 (к, С-21), 12.29 (к, С-18).
Пример 9. Синтез N-фенил-3α,12α-диацетокси-5β-холан-24-амида (I-а4(ДХ))
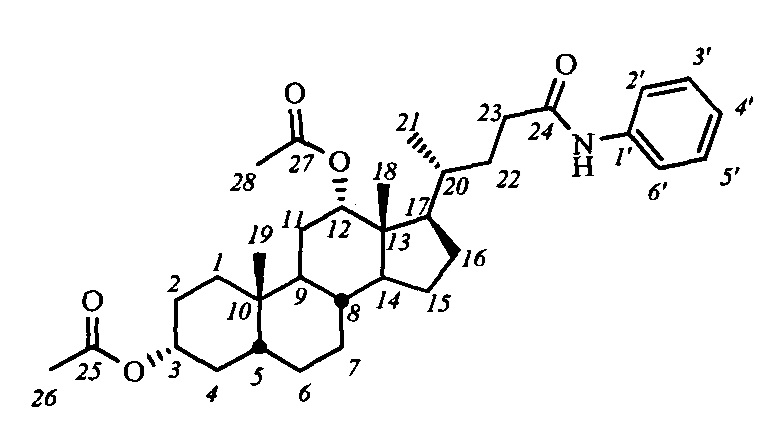
Аналогично примеру 4 (пункт а) из IV-а(ДХ) (2.0 г, 4.2 ммоль), оксалилхлорида (2.1 мл, 25.2 ммоль) получили раствор хлорангидрида в CH2Cl2 (40 мл). Аналогично примеру 4 (пункт б) провели реакцию с анилином (0.86 г, 9.2 ммоль) и NEt3 (14 ммоль) в CH2Cl2 (20 мл). Масса сырого продукта 2.0 г, выход 87%. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3), получили 3 фракции I-а4(ДХ) различной чистоты массами 0.07 г (98.3% чистоты по ВЭЖХ), 1.4 г (98.9% чистоты по ВЭЖХ) и 0.26 г (97.7% чистоты по ВЭЖХ) в виде белого твердого аморфного вещества. Выход 75%. Тпл 97.5°C [разложение]. Эл. ан. вычислено для C34H49NO5: С, 74.01; Н, 8.95; N, 2.54; О, 14.50; найдено С, 73.91; Н, 8.88; N, 2.78. 1Н ЯМР (CDCl3, 300 МГц): δ=7.48 (д, 2Н, J=7.9, Н-2', Н-6'), 7.38 (с, 1H, NH), 7.27 (дд, 2Н, J=J=7.9, Н-3', Н-5'), 7.06 (дд, 1H, J=7.4, Н-4'), 5.06 (с, 1H, Н-12(β)), 4.67 (м, 1H, Н-3(β)), 2.38 (м, 1H, Н-23), 2.19 (м, 1Н, Н-23'), 2.08 (с, 3H, CH3-26), 2.00 (с, 3H, CH3-28), 0.87 (с, 3H, CH3-19), 0.81 (д, 3H, J21,20=6.3, CH3-21), 0.69 (с, 3H, CH3-18). 13С ЯМР (CDCl3, 150 МГц): δ=171.50 (с, С-24), 170.48 (с, С-25), 170.42 (с, С-27), 137.89 (с, С-1'), 128.82 (д, С-3'), 128.82 (д, С-5'), 123.97 (д, С-4'), 119.59 (д, С-2'), 119.59 (д, С-6'), 75.83 (д, С-12), 74.08 (д, С-3), 49.27, 47.71, 44.89, 41.66, 35.51, 34.74, 34.56, 34.24, 33.88, 32.10, 31.33, 27.26, 26.73, 26.48, 25.71, 25.51, 23.29, 22.92 (к, С-19), 21.34 (к, CH3-С(O)O), 21.28 (к, CH3-С(О)О), 17.52 (к, С-21), 12.33(к, С-18).
Пример 10. Синтез N-(4'-бромфенил)-3α,12α-диацетокси-5β-холан-24-амид (I-а5(ДХ))
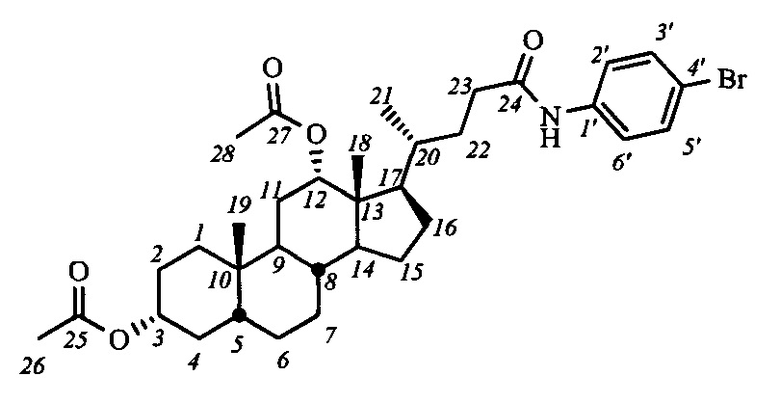
Аналогично примеру 4 (пункт а) из IV-а(ДХ) (2.0 г, 4.2 ммоль), оксалилхлорида (2.1 мл, 25.2 ммоль) получили раствор хлорангидрида в CH2Cl2 (20 мл). Аналогично примеру 4 (пункт б) провели реакцию с n-броманилином (1.6 г, 9.3 ммоль) и NEt3 (14 ммоль) в CH2Cl2 (20 мл). Масса сырого продукта 2.45 г, выход 92%. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3 с градиентом AcOEt (0-3%)), получили 2 фракции I-а5(ДХ) различной чистоты массами 0.63 г (98.6% чистоты по ВЭЖХ) и 1.41 г (98.2% чистоты по ВЭЖХ) в виде белого твердого аморфного вещества. Выход 77%. Тпл 109:3°C [разложение]. Эл. ан. вычислено для C34H48BrNO5: С, 64.75; Н, 7.67; Br, 12.67; N, 2.22; О, 12.68; найдено С, 65.10; Н, 7.75; Br, 13.00; N, 2.35. 1Н ЯМР (CDCl3, 600 МГц): δ=7.43 (с, 1H, NH), 7.38 (м, 4Н, Н-2', Н-3', Н-5', Н-6'), 5.03 (с, 1H, Н-12(β)), 4.67 (м, 1Н, Н-3(β)), 2.37 (м, 1Н, Н-23), 2.18 (м, 1Н, Н-23'), 2.07 (с, 3H, CH3-26), 2.01 (с, 3H, CH3-28), 0.87 (с, 3H, CH3-19), 0.80 (д, 3H, J21,20=6.4, CH3-21), 0.69 (с, 3H, CH3-18). 13С ЯМР (CDCl3, 150 МГц): δ=171.55 (с, С-24), 170.51 (с, С-25), 170.44 (с, С-27), 136.96 (с, С-1'), 131.76 (д, С-3'), 131.76 (д, С-5'), 121.15 (д, С-2'), 121.15 (д, С-6'), 116.49 (с, С-4'), 75.82 (д, С-12), 74.08 (д, С-3), 49.27, 47.70, 44.90, 41.65, 35.50, 34.72, 34.56, 34.53, 34.24, 33.88, 32.10, 31.23, 27.25, 26.72, 26.48, 25.70, 25.52, 23.28, 22.93 (к, С-19), 21.36 (к, CH3-С(О)О), 21.30 (к, CH3-С(О)О), 17.53 (к, С-21), 12.33 (к, С-18).
Пример 11. Синтез N-(n-толил)-3α,12α-диацетокси-5β-холан-24-амида (I-а6(ДХ)) Аналогично примеру 4 (пункт а) из IV-а(ДХ) (1.0 г, 2.1 ммоль), оксалилхлорида (1.1 мл, 12.6 ммоль) получили раствор хлорангидрида в CH2Cl2 (20 мл). Аналогично примеру 4 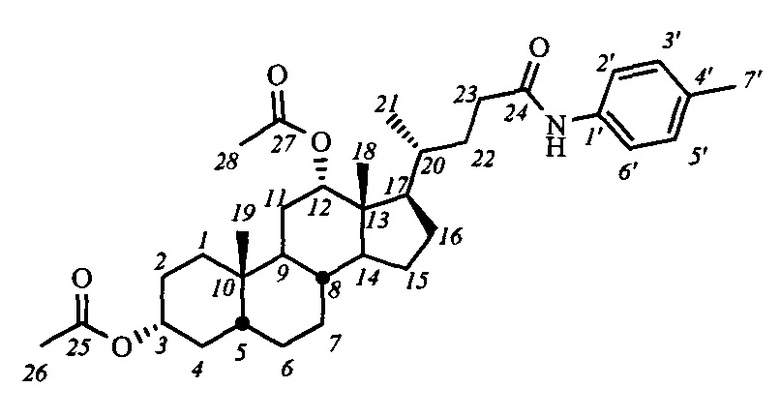
(пункт б) провели реакцию с n-толуидином (0.25 г, 2.3 ммоль) и NEt3 (3.5 ммоль) в CH2Cl2 (10 мл). Масса сырого продукта 1.2 г, выход количественный. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3), получили 1.0 г I-а6(ДХ) в виде белого твердого аморфного вещества. Выход 84%. Тпл 94.8°C [разложение]. Эл. ан. вычислено для C35H51NO5: С, 74.30; Н, 9.09; N, 2.48; О, 14.14; найдено С, 74.00; Н, 8.72; N, 2.50. 1Н ЯМР (CDCl3, 600 МГц): δ=7.65 (с, 1H, NH), 7.35 (д, 2Н, J=8.4, Н-2', Н-6'), 7.05 (д, 2Н, J=8.3, Н-3', Н-5'), 5.04 (с, 1H, Н-12(β)), 4.65 (м, 1H, Н-3(β)), 2.34 (м, 1Н, Н-23), 2.25 (с, 3H, CH3-7'), 2.15 (м, 1Н, Н-23'), 2.05 (с, 3H, CH3-26), 1.99 (с, 3H, CH3-28), 0.85 (с, 3H, CH3-19), 0.78 (д, 3H, J21,20=6.3, CH3-21), 0.67 (с, 3H, CH3-18). 13С ЯМР (CDCl3, 150 МГц): δ=171.49 (с, С-24), 170.43 (с, С-25), 170.36 (с, С-27), 135.39 (с, С-1'), 133.40 (с, С-4'), 129.18 (д, С-3'), 129.18 (д, С-5'), 119.70 (д, С-2'), 119.70 (д, С-6'), 75.79 (д, С-12), 74.02 (д, С-3), 49.21, 47.67, 44.81, 41.59, 35.44, 34.69, 34.49, 34.38, 34.17, 33.81, 32.04, 31.33, 27.18, 26.66, 26.42, 25.64, 25.44, 23.22, 22.86 (к, С-19), 21.27 (к, CH3-С(О)О), 21.21 (к, CH3-С(О)О), 20.64 (к, CH3-7'), 17.45 (к, С-21), 12.25 (к, С-18).
Пример 12. Синтез N-(пиридин-3'-ил)-3α,12α-диацетокси-5β-холан-24-амида (I-а7(ДХ))
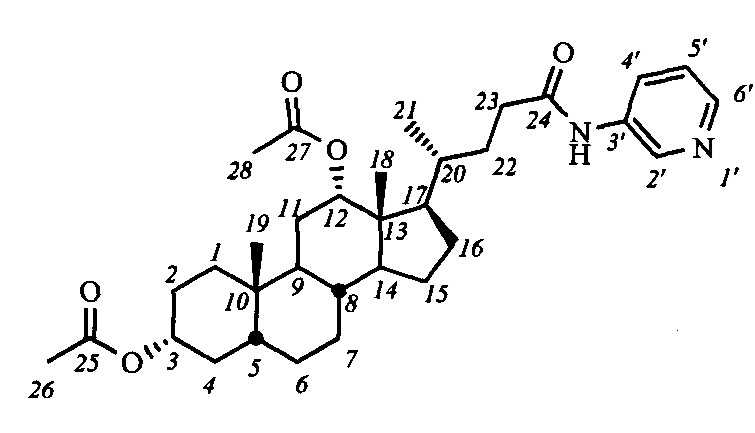
Аналогично примеру 4 (пункт а) из IV-а(ДХ) (1.0 г, 2.1 ммоль), оксалилхлорида (1.1 мл, 12.6 ммоль) получили раствор хлорангидрида в CH2Cl2 (20 мл). Аналогично примеру 4 (пункт б) провели реакцию с пиридин-3-амином (0.22 г, 2.3 ммоль) и NEt3 (3.5 ммоль) в CH2Cl2 (10 мл). Масса сырого продукта 1.34 г, выход количественный. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3 с градиентом МеОН (0-5%)), получили 0.72 г I-а7(ДХ) в виде белого твердого аморфного вещества. Выход 62%. Тпл 161.2-161.7°C. Эл. ан. вычислено для C33H48N2O5: С, 71.71; Н, 8.75; N, 5.07; О, 14.47; найдено С, 71.47; Н, 8.52; N, 5.16. 1Н ЯМР (CDCl3, 600 МГц): δ=8.54 (д, 1H, J=2.3, Н-2'), 8.30 (д, 1Н, J=4.6, Н-4'), 8.23 (с, 1H, NH), 8.20 (д, 1Н, J=8.6, Н-6'), 7.26 (дд, 1Н, J=J=4.1, H-5'), 5.07 (с, 1H, H-12(β)), 4.68 (м, 1H, H-3(β)), 2.44 (м, 1H, H-23), 2.25 (м, 1H, H-23'), 2.09 (с, 3H, CH3-26), 2.02 (с, 3H, CH3-28), 0.89 (с, 3H, CH3-19), 0.80 (д, 3H, J21,20=5.8, CH3-21), 0.70 (с, 3H, CH3-18). 13С ЯМР (CDCl3, 150 МГц): δ=172.30 (с, С-24), 170.53 (с, С-25), 170.50 (с, С-27), 144.68 (д, С-4'), 140.71 (д, С-6'), 135.07 (с, С-3'), 127.06 (д, С-2'), 123.64 (д, С-5'), 75.80 (д, С-12), 74.07 (д, С-3), 49.22, 47.65, 44.86, 41.60, 35.45, 34.71, 34.28, 34.20, 33.85, 32.06, 31.16, 29.53, 27.23, 26.68, 26.45, 25.67, 25.50, 23.26, 22.91 (к, С-19), 21.36 (к, CH3-С(O)O), 21.30 (к, CH3-С(O)O), 17.49 (к, С-21), 12.30 (к, С-18).
Пример 13. Синтез N-(2-(1Н-индол-2-ил)этил)-3α,12α-дигидрокси-5β-холан-24-амида I-б1(ДХ)
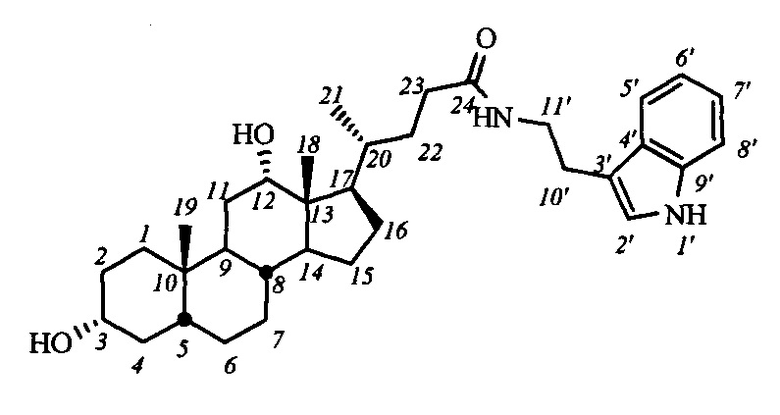
К раствору I-а1(ДХ) (0.52 мг, 0.84 ммоль) в МеОН (10 мл) по каплям прибавили раствор KOH (0.6 г, 10.7 ммоль) в МеОН (8 мл), кипятили 20 часов, ход реакции контролировали ТСХ. Реакционную смесь концентрировали под вакуумом, добавили AcOEt. Промыли органический слой 5%-ным раствором HCl, затем насыщенными водными растворами NaHCO3 и NaCl, сушили над безводным MgSO4. Масса сырого продукта 0.35 г (выход 77%). Продукт очистили колоночной хроматографией (SiO2, CH2Cl2 с градиентом МеОН (0-8%)), получили 2 фракции I-б1 (ДХ) массой 0.07 г (>98% чистоты по ВЭЖХ), и 0.13 г (<98% чистоты по ВЭЖХ). Суммарный выход составил 44%.
1H ЯМР (CDCl3, 300 МГЦ): δ=8.63 (шс, 1H, NH-1'), 7.56 (д, 1H, J5',6'=7.8, Н-5'), 7.36 (д, 1H, J8',7'=8.2, Н-8'), 7.17 (м, 1Н, Н-7'), 7.08 (м 1H, Н-6'), 7.00 (шс, 1Н, Н-2'), 5.81 (шс, 1H, C(O)NH), 3.90 (с, 1H, Н-12(β)), 3.55 (м, 3Н: Н-3(β), CH2-11'), 2.93 (м, 2Н, CH2-10'), 0.89 (д, 3H, J21,20=6.0, CH3-21), 0.87 (с, 3H, CH3-18), 0.61 (с, 3H, CH3-19). 13С ЯМР (CDCl3, 75 МГц): δ=173.70 (с, С-24), 136.32 (с, С-9'), 127.23 (с, С-4'), 122.11 (д, С-2'), 121.93 (д, С-7'), 119.23 (д, С-5'), 118.54 (д, С-6'), 112.74 (с, С-3'), 111.27 (д, С-8'), 73.03 (д, С-12), 71.59 (д, С-3), 48.10, 46.91, 46.32, 41.91, 39.60 (т, С-11'), 36.21, 35.83, 35.08, 33.96, 33.50, 33.33, 31.54, 30.26, 28.47, 27.34, 26.98, 25.98, 25.17 (т, С-10'), 23.51, 22.99 (к, С-19), 17.27 (к, С-21), 12.61 (к, С-18).
Пример 14. Синтез N-(2-(1Н-индол-2-ил)этил)-3α,7α-дигидрокси-5β-холан-24-амида I-б1 (ХДХ)
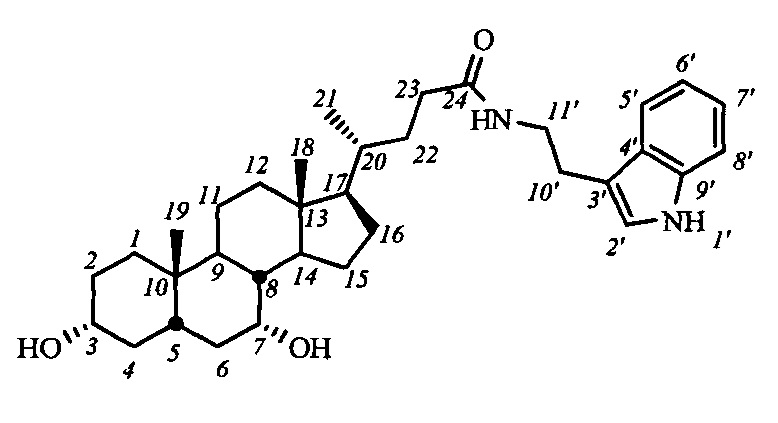
Аналогично примеру 13 из I-а1(ХДХ) (0.69 г, 1.1 ммоль) и KOH (0.38 г, 6.8 ммоль) в МеОН (25 мл) получили 0.55 г сырого продукта (выход 92%). Продукт очистили колоночной хроматографией (SiO2, CH2Cl2 с градиентом МеОН (0-5%)), получили I-б1 (ХДХ) массой 0.22 г (95% чистоты по ВЭЖХ), суммарный выход составил 37%.
1Н ЯМР (CDCl3, 500 МГц): δ=8.73 (шс, 1Н, NH-1'), 7.55 (д, 1Н, J5',6'=7.8, Н-5'), 7.35 (д, 1Н, J8',7'=7.8, Н-8'), 7.16 (дд, 1H, J7',6'=7.0, J7',8'=7.8, Н-7'), 7.08 (дд, 1H, J6',5'=7.8, Н-6'), 7.00 (шс, 1Н, Н-2'), 5.80 (шс, 1H, C(O)NH), 3.80 (шс, 1Н, Н-7(β)), 3.56 (м, 2Н, CH2-11'), 3.43 (м, 1H, Н-3(β)), 2.93 (м, 2Н, CH2-10'), 0.86 (с, 3H, CH3-18), 0.59 (д, 3H, CH3-21), 0.59 (с, 3H, CH3-19). 13С ЯМР (CDCl3, 125 МГц): δ=173.82 (с, С-24), 136.32 (с, С-9'), 127.17 (с, С-4'), 122.12 (д, С-2'), 121.85 (д, С-7'), 119.15 (д, С-5'), 118.48 (д, С-6'), 112.55 (с, С-3'), 111.27 (д, С-8'), 71.79 (д, С-3), 68.33 (д, С-7), 55.50 (д, С-17), 50.20 (д, С-14), 42.44 (с, С-13), 41.29, 39.56, 39.49, 39.43, 39.18, 35.27, 35.15, 34.85, 33.31, 32.65, 31.65, 30.86, 30.39, 28.03, 25.14, 23.49, 22.64 (к, С-19), 20.41, 18.22 (к, С-21), 11.60 (к, С-18).
Пример 15. Синтез N-(2-(1H-индол-2-ил)этил)-3α,7β-дигидрокси-5β-холан-24-амида I-б1(УДХ)
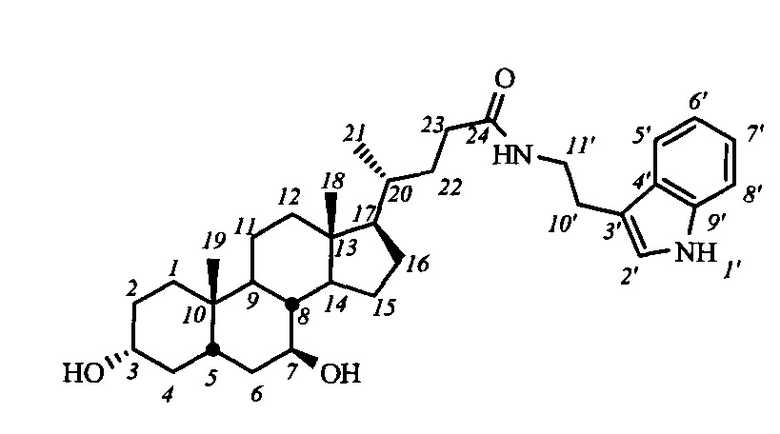
Аналогично примеру 13 из I-a1 (УДХ) (0.69 г, 1.1 ммоль) и KOH (0.38 г, 6.8 ммоль) в МеОН (25 мл) получили 0.55 г сырого продукта (выход 92%). Продукт очистили колоночной хроматографией (SiO2, CH2Cl2 с градиентом МеОН (0-5%)), получили I-б1 (УДХ) массой 0.22 г (95% чистоты по ВЭЖХ), суммарный выход составил 37%. Тпл 114.9°C [разложение]. Эл. ан. вычислено для C34H50N2O3: С, 76.36; Н, 9.42; N, 5.24; О, 8.98; найдено С, 76.43; Н, 9.64; N, 4.89. 1Н ЯМР (CDCl3, 500 МГц): δ=8.96 (шс, 1H, NH-1'), 7.53 (д, 1H, J5',6'=7.5, Н-5'), 7.33 (д, 1H, J8',7'=8.1, Н-8'), 7.13 (м, 1H, Н-7'), 7.05 (м, 1H, Н-6'), 6.97 (шс, 1Н, Н-2'), 5.97 (м, 1Н, C(O)NH), 3.49 (м, 4Н: Н-3(β), Н-7(α), CH2-11'), 2.91 (м, 2Н, CH2-10'), 0.87 (с, 3H, CH3-18), 0.82 (д, 3H, J21,20=6.0, CH3-21), 0.58 (с, 3H, CH3-19). 13С ЯМР (CDCl3, CD3OD, 125 МГц): δ=174.00 (с, С-24), 136.17 (с, С-9'), 127.06 (с, С-4'), 121.98 (д, С-2'), 121.73 (д, С-7'), 119.00 (д, С-5'), 118.35 (д, С-6'), 112.25 (с, С-3'), 111.17 (д, С-8'), 71.00 (д, С-3), 70.95 (д, С-7), 55.49, 54.60, 43.46, 43.33, 42.20, 39.88, 39.49, 39.00, 36.85, 36.65, 35.17, 34.69, 33.82, 33.32, 31.68, 29.85, 28.40, 25.01, 23.17 (к, С-19), 20.94, 18.21 (к, С-21), 11.87 (к, С-18).
Пример 16. Синтез N-(1`-адамантил)-3α,12α-дигидрокси-5β-холан-24-амида (I-б3(ДХ)
Аналогично примеру 13 из I-а3(ДХ) (0.2 г, 0.3 ммоль) и KOH (0.2 г, 3.6 ммоль) в МеОН (5 мл) получили 0.17 г сырого продукта. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3 с градиентом МеОН (0-5%)), получили 0.12 г I-б3(ДХ) в виде белого твердого аморфного вещества. Выход 71%. Тпл 300.8°C [разложение]. Эл. ан. вычислено для C34H55NO3: С, 77.66; Н, 10.54; N, 2.66; О, 9.13; найдено С, 77.92; Н, 10.29; N, 2.79. 1Н ЯМР (CDCl3, CD3OD, 400 МГц): δ=3.79
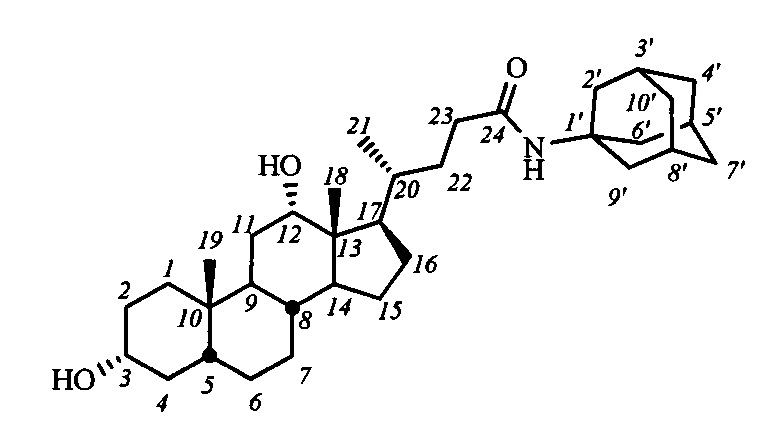
(с, 1H, Н-12(β)), 3.38 (м, 1Н, Н3(β)), 1.90 (шс, 3H, Н-3', Н-5', Н-8'), 1.82 (с, 6Н, CH2-2', CH2-6', CH2-9'), 1.51 (с, 6Н, CH2-4', CH2-7', CH2-10'), 0.81 (д, 3H, J21,20=6.3, CH3-21), 0.74 (с, 3H, CH3-19), 0.51 (с, 3H, CH3-18). 13С ЯМР (CDCl3, CD3OD, 100 МГц): δ=173.90 (с, С-24), 72.67 (д, С-12), 71.00 (д, С-3), 51.41, 47.64, 46.39, 46.01, 41.72, 40.95 (т, С-2', С-6', С-9'), 35.91 (т, С-4', С-7', С-10'), 35.57, 35.54, 34.97, 34.89, 34.74, 33.12, 31.45, 29.38, 29.01 (д, С-3', С-5', С-8'), 28.09, 27.19, 26.74, 25.80, 23.34, 22.64 (к, С-19), 16.66 (к, С-21), 12.23 (к, С-18).
Пример 17. Синтез N-фенил-3α,12α-дигидрокси-5β-холан-24-амида (I-б4(ДХ))
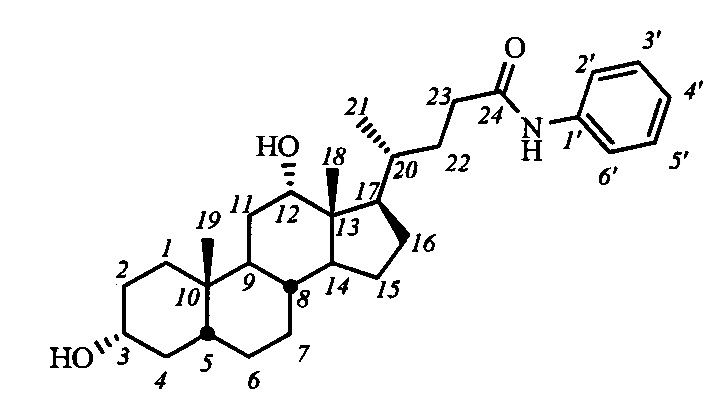
Аналогично примеру 14 из I-а4 (ДХ) (0.4 г, 0.7 ммоль) и NaOMe (0.2 г, 3.7 ммоль) в МеОН (10 мл) получили 0.43 г сырого продукта. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3 с градиентом МеОН (0-2%)), получили 0.23 г I-б4(ДХ) в виде белого твердого аморфного вещества. Выход 68%. Тпл 214.2-216.3°C. Эл. ан. вычислено для C30H45NO3: С, 77.04; Н, 9.70; N, 2.99; О, 10.26; найдено С, 77.32; Н, 9.39; N, 3.12. 1Н ЯМР (CDCl3, 400 МГц): δ=8.00 (с, 1H, NH), 7.53 (д, 2Н, J=7.7, Н-2', Н-6'), 7.25 (дд, 2Н, J=J=7.8, Н-3', Н-5'), 7.04 (дд, 1Н, J=7.3, Н-4'), 3.97 (с, 1H, Н-12(β)), 3.56 (м, 1Н, Н-3(β)), 2.38 (м, 1Н, Н-23), 2.22 (м, 1H, Н-23'), 0.95 (д, 3H, J21,20=6.0, CH3-21), 0.87 (с, 3H, CH3-19), 0.64 (с, 3H, CH3-18). 13С ЯМР (CDCl3, 100 МГц): δ=172.38 (с, С-24), 138.21 (с, С-1'), 128.74 (д, С-3'), 128.74 (д, С-5'), 123.75 (д, С-4'), 119.55 (д, С-2'), 119.55 (д, С-6'), 73.10 (д, С-12), 71.67 (д, С-3), 47.66, 46.41, 46.20, 42.00, 36.19, 35.91, 35.21, 35.03, 34.09, 33.62, 33.45, 30.97, 30.67, 28.15, 27.50, 27.19, 26.09, 23.65, 23.02 (к, С-19), 17.34 (к, С-21), 12.48 (к, С-18).
Пример 18. Синтез N-(4'-бромфенил)-3α,12α-дигидрокси-5β-холан-24-амида (I-б5 (ДХ))
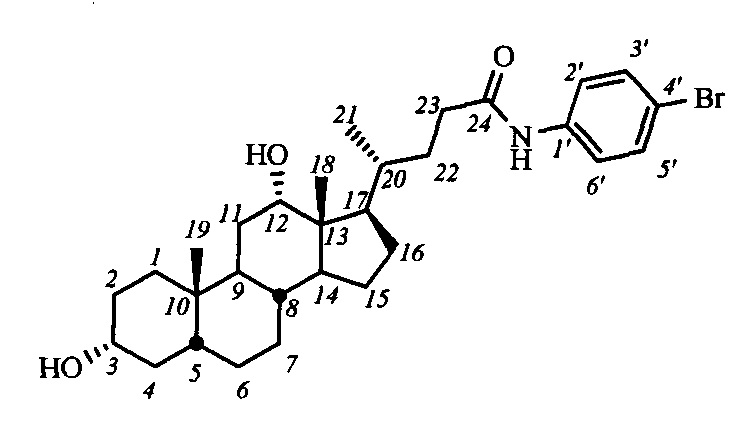
Аналогично примеру 14 из I-а5 (ДХ) (0.39 г, 0.62 ммоль) и NaOMe (0.20 г, 3.7 ммоль) в МеОН (10 мл) получили 0.7 г сырого продукта. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3 с градиентом МеОН (0-2%)), получили 0.25 г I-б5 (ДХ) в виде белого твердого аморфного вещества. Выход 74%. Тпл 229.4°C [разложение]. Эл. ан. вычислено для C30H44BrNO3: С, 65.92; Н, 8.11; Br, 14.62; N, 2.56; О, 8.78; найдено С, 65.57; Н, 7.90; Br, 14.62; N, 2.63. 1Н ЯМР (CDCl3, CD3OD, 400 МГц): δ=9.00 (с, 1Н, NH), 7.38 (д, 2Н, J=7.8, Н-2', Н-6'), 7.29 (д, 2Н, J=7.8, Н-3', Н-5'), 3.86 (с, 1H, Н-12(β)), 3.47 (м, 1Н, Н-3(β)), 2.29 (м, 1H, Н-23), 2.15 (м, 1Н, Н-23'), 0.90 (д, 3H, J21,20=5.7, CH3-21), 0.81 (с, 3H, CH3-19), 0.57 (с, 3H, CH3-18). 13С ЯМР (CDCl3, CD3OD, 100 МГц): δ=173.09 (с, С-24), 137.37 (с, С-1'), 131.42 (д, С-3'), 131.42 (д, С-5'), 121.14 (д, С-2'), 121.14 (д, С-6'), 115.99 (с, С-4'), 72.88 (д, С-12), 71.19 (д, С-3), 47.77, 46.23, 46.11, 41.77, 35.78, 35.65, 35.00, 34.97, 33.85, 33.29, 33.25, 31.10, 29.60, 28.20, 37.25, 26.85, 25.91, 23.45, 22.79 (к, С-19), 16.88 (к, С-21), 12.37 (к, С-18).
Пример 19. Синтез N-(4'-метилбензил)-3α,12α-дигидрокси-5β-холан-24-амида (I-б6(ДХ))
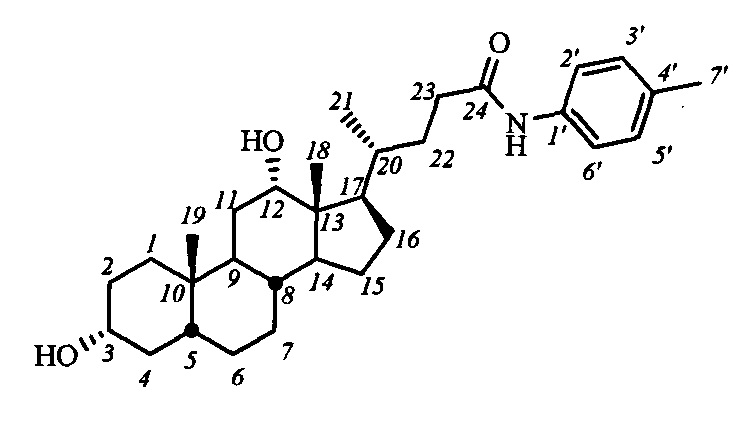
Аналогично примеру 14 из I-а6(ДХ) (0.23 г, 0.4 ммоль) и KOH (0.35 г, 6.2 ммоль) в МеОН (10 мл) получили 0.19 г сырого продукта. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3), получили 0.12 г I-б6 (ДХ) в виде белого твердого аморфного вещества. Выход 63%. Тпл 117.5°C [разложение]. Эл. ан. вычислено для C31H47NO3: С, 77.29; Н, 9.83; N, 2.91; О, 9.96; найдено С, 77.60; Н, 9.74; N, 2.99. 1Н ЯМР (CDCl3, 300 МГц): δ=7.89 (с, 1Н, NH), 7.40 (д, 2Н, J=8.2, Н-2', Н-6'), 7.05 (д, 2Н, J=8.1, Н-3', Н-5'), 3.96 (с, 1Н, Н-12(β)), 3.57 (м, 1H, Н-3(β)), 2.90 (шс, 2Н, ОН), 2.26 (с, 3H, CH3-7'), 0.96 (д, 3H, J21,20=6.3, CH3-21), 0.87 (с, 3H, CH3-19), 0.64 (с, 3H, CH3-18). 13С ЯМР (CDCl3, 75 МГц): δ=172.18 (с, С-24), 135.61 (с, С-1'), 133.34 (д, С-4'), 129.23 (д, С-3'), 129.23 (д, С-5'), 119.70 (д, С-2'), 119.70 (д, С-6'), 73.13 (д, С-12), 71.65 (д, С-3), 47.80, 46.40, 46.37, 41.96, 36.19, 35.89, 35.18, 35.02, 34.05, 33.67, 33.43, 31.11, 30.43, 28.25, 27.46, 27.11, 26.07, 23.63, 22.99 (к, С-19), 20.71 (к, CH3-7'), 17.34 (к, С-21), 12.53 (к, С-18).
Пример 20. Синтез N-(пиридин-3'-ил)-3α,12α-дигидрокси-5β-холан-24-амида (1-б7(ДХ))
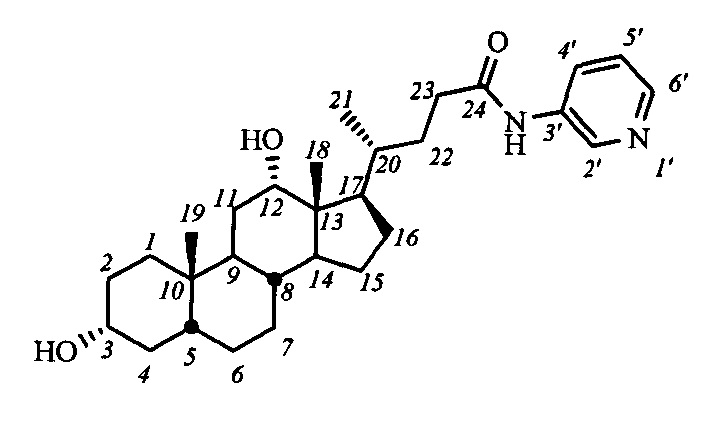
Аналогично примеру 14 из I-а7 (ДХ) (0.59 г, 1.1 ммоль) и KOH (0.48 г, 8.6 ммоль) в МеОН (20 мл) получили 0.44 г сырого продукта. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3 с градиентом МеОН (0-5%)), получили 0.22 г I-б7(ДХ) в виде белого твердого аморфного вещества. Выход 44%. Тпл 114.6°C [разложение]. Эл. ан. вычислено для C29H44N2O3: С, 74.32; Н, 9.46; N, 5.98; О, 10.24; найдено С, 73.98; Н, 9.44; N, 5.70. 1Н ЯМР (CDCl3, МеОН, 400 МГц): δ=9.53 (с, 1H, NH), 8.45 (с, 1Н, Н-2'), 8.24 (д, 1H, J=7.9, Н-4'), 8.14 (д, 1H, J=4.2, Н-6'), 7.23 (м, 1H, Н-5'), 3.88 (с, 1H, Н-12(β)), 3.48 (м, 1H, Н-3(β)), 2.36 (м, 1Н, Н-23), 2.22 (м, 1Н, Н-23'), 0.93 (д, 3H, J21,20=5.8, CH3-21), 0.82 (с, 3H, CH3-19), 0.59 (с, 3H, CH3-18). 13С ЯМР (CDCl3, МеОН, 100 МГц): δ=173.77 (с, С-24), 143.07 (д, С-4'), 139.74 (д, С-6'), 135.97 (с, С-3'), 127.69 (д, С-2'), 123.87 (д, С-5'), 72.91 (д, С-12), 71.19 (д, С-3), 47.84, 46.20, 46.14, 41.79, 35.77, 35.68, 35.00, 34.98, 33.88, 33.27, 33.10, 31.04, 29.62, 28.24, 27.28, 26.85, 25.93, 23.48, 22.82 (к, С-19), 16.89 (к, С-21), 12.41 (к, С-18).
Пример 21. Синтез 3α,12α-диметокси-5β-холан-24-овой кислоты (V-в (ДХ))
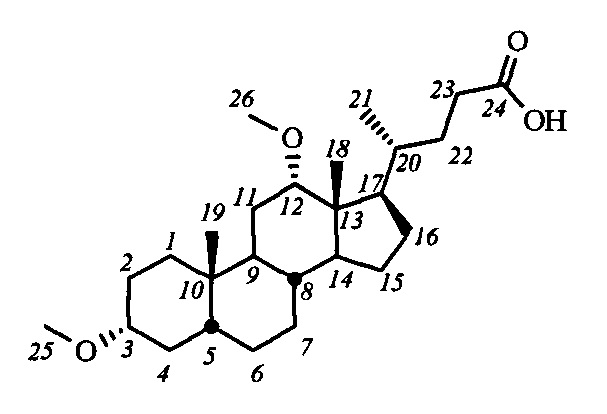
К раствору ДХК (0.5 г, 1.3 ммоль) в сухом ТГФ (15 мл) прибавили NaH (0.75 г, 31.2 ммоль (57-63% в масле)) перемешивали 10 минут при комнатной температуре, затем к смеси прибавили MeI (0.6 мл, 9.6 ммоль). Реакционную смесь выдержали сутки при 40°C. В реакционную смесь добавили МеОН (5 мл) и 5%-ный раствор HCl, затем экстрагировали смесью CH2Cl2-t-BuOMe. Органическую фазу промыли насыщенными водными растворами Na2S2O3 и NaCl, сушили над безводным MgSO4. Растворитель удалили на роторном испарителе, сырой продукт получили в виде аморфной массы. Сырой продукт очистили колоночной хроматографией (SiO2, CHCl3 с градиентом МеОН (0-2%)), получили 0.41 г V-в (ДХ) (выход 76%) в виде белого твердого вещества. Тпл 180.6-182.2°C. Эл. ан. вычислено для C31H47NO3: С, 74.24; Н, 10.54; О, 15.21; найдено С, 74.42; Н, 10.27, О, 15.21. 1Н ЯМР (CDCl3, 400 МГц): δ=3.34 (с, 1Н, Н-12), 3.31 (с, 3H, CH3-26), 3.21 (с, 3H, CH3-25), 3.12 (м, 1Н, Н-3), 2.37 (м, 1H, Н-23), 2.23 (м, 1H, Н-23'), 0.87 (с, 6Н, CH3-21, CH3-19), 0.62 (с, 3H, CH3-18). 13С ЯМР (CDCl3, 100 МГц): δ=180.19 (с, С-24), 82.07 (д, С-12), 80.38 (д, С-3), 55.48 (к, CH3-26), 55.30 (к, CH3-25), 48.66, 46.26, 46.17, 41.91, 35.85, 35.14, 34.88, 34.31, 33.35, 32.35, 30.89, 30.55, 27.22, 27.16, 26.16, 26.58, 25.94, 23.51, 23.13 (к, С-19), 21.78, 17.18 (к, С-21), 12.57 (к, С-18).
Пример 22. Синтез N-(4'-бромфенил)-3α,12α-диметокси-5β-холан-24-амида (V-в5(ДХ))
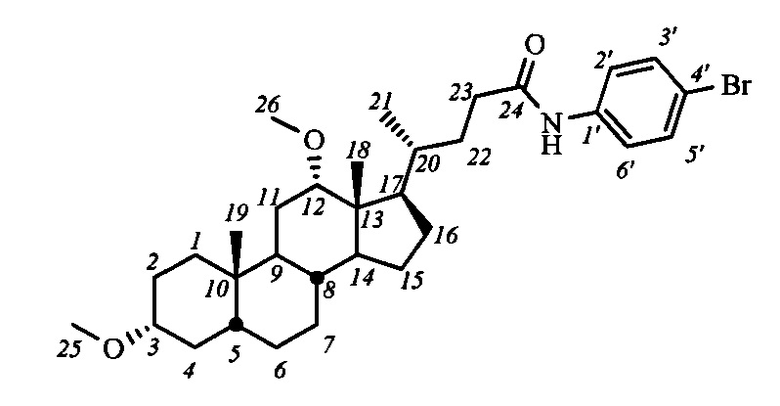
Аналогично примеру 4 (пункт а) из V-в(ДХ) (0.5 г, 1.2 ммоль), оксалилхлорида (0.5 мл, 5.9 ммоль) получили раствор хлорангидрида в CH2Cl2 (15 мл). Аналогично примеру 4 (пункт б) провели реакцию с n-броманилином (0.23 г, 1.3 ммоль) и NEt3 (2.1 ммоль) в CH2Cl2 (5 мл). Масса сырого продукта 0.67 г. Полученный продукт очистили колоночной хроматографией (SiO2, CHCl3 с градиентом МеОН (0-1%), затем SiO2, н-гексан - AcOEt (2:15, об./об.), получили 0.54 г V-в5(ДХ) в виде белого твердого вещества. Выход 79%. Тпл 168.9-170.4°C. Эл. ан. вычислено для C32H48BrNO3: С, 66.88; Н, 8.42; Br, 13.91; N, 2.44; О, 8.35; найдено С, 67.25; Н, 8.38; Br, 14.28; N, 2.52. 1Н ЯМР (CDCl3, 600 МГц): δ=7.41 (м, 1H, NH), 7.39 (м, 4Н, Н-2', Н-3', Н-5', Н-6'), 3.35 (с, 1Н, Н-12(β)), 3.32 (с, 3H, CH3-26), 3.21 (с, 3H, CH3-25), 3.13 (м, 1H, Н-3(β)), 2.38 (м, 1H, Н-23), 2.22 (м, 1Н, Н-23'), 0.90 (д, 3H, J21,20=6.2, CH3-21), 0.88 (с, 3H, CH3-19), 0.63 (с, 3H, CH3-18). 13С ЯМР (CDCl3, 150 МГц): δ=171.92 (с, С-24), 137.03 (с, С-1'), 131.75 (д, С-3'), 131.75 (д, С-5'), 121.18 (д, С-2'), 121.18 (д, С-6'), 116.41 (с, С-4'), 82.07 (д, С-12), 80.36 (д, С-3), 55.47 (к, CH3-25), 55.41 (к, CH3-26), 48.74, 46.19, 46.12, 41.90, 35.84, 35.15, 34.88, 34.32, 34.13, 33.38, 32.44, 31.27, 27.32, 27.15, 26.68, 25.94, 23.50, 23.14 (к, С-19), 21.77, 17.37 (к, С-21), 12.59 (к, С-18).
Пример 23. Исследование влияния предлагаемых соединений на способность ингибировать Tdp1.
Рекомбинантная тирозил-ДНК-фосфодиэстераза 1 человека (КФ 3.1.4.-) была экспрессирована в системе Escherichia coli (плазмида рЕТ 16B-Tdp1 любезно предоставлена доктором Кальдекотт К.У., Университет Сассекса, Великобритания) и выделена как описано [Interthal, 2001].
В качестве тест-системы для определения ингибирующих свойств предлагаемых соединений использована реакция удаления тушителя флуоресценции Black Hole Quencher 1 (BHQ1) с 3'-конца олигонуклеотида, катализируемая Tdp1. На 5'-конце олигонуклеотида находится (5,6)-FAM - флуорофор, интенсивность флуоресценции которого возрастает при удалении тушителя. Для измерения флуоресценции использовался флуориметр POLARstar OPTIMA производства BMG LABTECH.
Реакционные смеси объемом 200 мкл содержали буфер (50 мМ Tris-HCl, рН 8.0; 50 мМ NaCl; 7 мМ меркаптоэтанол), 50 нМ олигонуклеотид и различные концентрации ингибиторов. Реакция запускалась добавлением Tdp1 до конечной концентрации 1.3 нМ. Измерения проводились в линейном диапазоне зависимости скорости реакции от времени (до 8 минут) через каждые 55 секунд. Влияние предлагаемых соединений оценивали по величине IC50 (концентрация ингибитора, при которой активность фермента снижена наполовину). Обсчет значений IC50 проводился с помощью программы MARS Data Analisys 2.0 (BMG LABTECH).
Величины IC50 для изученных соединений приведены в таблице.
Пример 24. Цитотоксичность предлагаемых соединений.
Анализ цитотоксичности предлагаемых соединений проводили на линиях клеток аденокарциномы молочной железы человека MCF-7 и карциномы прямой кишки человека НСТ-116. Индуцированную соединениями клеточную гибель оценивали с помощью стандартного МТТ-теста [Mosmann, 1983] путем колориметрического измерения количества формазана, конвертированного из 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолия бромида (МТТ) клетками, подвергшимися воздействию соединений. Клетки выращивали в среде IMDM, с 40 мкг/мл гентамицина, 100 ед/мл пенициллина, 0,1 мг/мл стрептомицина и 0,25 мкг/мл амфотерицина и в присутствии 10% эмбриональной бычьей сыворотки производства фирмы "Биолот" в атмосфере с 5% CO2. После формирования 50% монослоя в культуральную среду добавляли исследуемые препараты (объем добавляемых реагентов составляет 1/100 общего объема культуральной среды, объем DMSO 1% от конечного объема) и следили за ростом клеточной культуры в течение 3 сут. В качестве контроля использовали клетки, которые выращивали в присутствии 1% DMSO.
Токсичность соединений отсутствовала или была незначительна во всем диапазоне изученных концентраций (до 100 мкМ).
Использованная литература:
- Al Abo М, et al., Mol. Cancer Ter.2017 doi:10.1158/1535-7163.MCT-17-0110
- Alagoz M, et al., Nucleic Acids Res., 2014, 42(5):3089-103. doi: 10.1093/nar/gkt1260
- Antony, S et al., Nucleic Acids Res. 2007, 35, 4474-4484.
- Barthelmes HU, et al., J Biol Chem. 2004, 279, 55618-25565.
- Beretta GL, et al., Curr. Med. Chem. 2010, 17, 1500-1508.
- Borda MA et al., Mutat Res. 2015, 781, 37-48.
- Cortes Ledesma F, et al., Nature, 2009, 461, 674-678.
- Das BB, et al., The EMBO Journal., 2009, 28, 3667-3680.
- Dexheimer TS, et al., Anticancer Agents Med Chem. 2008, 8, 381-389.
- Dexheimer T.S. et al., J. Med. Chem. 2009, 52, 7122-7131
- El-Khamisy SF, et al., DNA Repair (Amst)., 2009, 8 760-766.
- Geenen JJJ, Clin Pharmacokinet. 2017 Oct 23. doi: 10.1007/s40262-017-0587-4. [Epub ahead of print] Review.
- Jun J.H. et al. European Journal of Pharmaceutical Sciences 2018 (111) 337-348
- Hirano R, et al., EMBO J., 2007, 26, 4732-1743.
- Huang Shar-yin N. et al., Expert Opin Ther Pat. 2011 Sep; 21(9): 1285-1292.
- Interthal H, et al., Proc. Natl. Acad. Sci. U.S.A. 2001, 98, 12009-12014.
- Katyal S, et al., EMBO J., 2007, 26, 4720-1731.
- Laev S, et al., Bioorg. Med. Chem., 2016, 24, 5017-5027.
- Lu JYD, et al., PeerJ. 2017, 5:e3933. doi: 10.7717/peerj.3933
- Murai J, et al., J Biol Chem. 2012, 287, 12848-12857.
- Nguyen TX, et al., J. Med. Chem., 2012, 55, 4457-4478.
- Nivens MC, et al., Cancer Chemother Pharmacol., 2004, 53, 107-115.
-  Cano L.P., et al., Steroids, 2013, 78, 982-986.
Cano L.P., et al., Steroids, 2013, 78, 982-986.
- Pommier Y. Nat. Rev. Cancer, 2006, 6, 789-802.
- Pommier Y, et al. Chem Biol., 2010, 17, 421-433.
- Zakharenko A, et al., Bioorg. Med. Chem., 2015, 23, 2044-2052.
- Zakharenko A, et al., J. Nat. Prod, 2016, 79, 2961-2967.
| название | год | авторы | номер документа |
|---|---|---|---|
| 1,2,4-Оксадиазольные производные дезоксихолевой кислоты, обладающие простатопротекторным действием, гипохолестеринемической и противовоспалительной активностями | 2020 |
|
RU2750488C1 |
| Малотоксичные 1,3,4-оксадиазольные производные дезоксихолевой кислоты с простатопротекторным и противовоспалительным действием | 2023 |
|
RU2819604C1 |
| Средство для ингибирования фермента тирозил-ДНК-фосфодиэстеразы 1 человека на основе производных пентафуранозилнуклеозидов | 2019 |
|
RU2748103C1 |
| СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ ФЕРМЕНТА ТИРОЗИЛ-ДНК-ФОСФОДИЭСТЕРАЗЫ 1 ЧЕЛОВЕКА | 2015 |
|
RU2612875C1 |
| Гидразинотиазоловые производные усниновой кислоты, проявляющие ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека | 2015 |
|
RU2612256C1 |
| Адамантилсодержащие производные 1,2,4-триазола и 1,3,4-тиадиазола, имеющие монотерпеноидные фрагменты, используемые в качестве ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 | 2020 |
|
RU2761880C1 |
| Средство для ингибирования фермента тирозил-ДНК-фосфодиэстеразы 1 человека на основе фенилкумаринов, сенсибилизирующее опухоли к действию противоопухолевых агентов | 2019 |
|
RU2724878C1 |
| Ингибитор основной протеазы коронавируса SARS-CoV-2 | 2023 |
|
RU2840908C2 |
| 2-Ацетил-6-(2-(2-(4-бромбензилиден)гидразинил) тиазол-4-ил)-3, 7, 9-тригидрокси-8, 9b-диметилдибензо[b, d]фуран-1(9bH)-он, проявляющий ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека | 2016 |
|
RU2627764C1 |
| Хиральные монотерпеновые сульфинамиды | 2017 |
|
RU2646959C1 |
Изобретение относится к применению соединения, представляющего собой производные желчных кислот общей формулы I, в которой R1 представляет -ОН, -ОАс, O-СН3; R2 представляет -Н, -ОН, -ОАс; R3=-Н, -ОН, -ОАс, -O-СН3; R4 представляет адамантил, -фенил, необязательно замещенный бромом, -метилом; -пиридинил, -(CH2)2-R5, где R5=фенил, замещенный двумя трет-бутильными группами, или индол, в качестве ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 человека (Tdp1). Технический результат: предложено применение соединений формулы I в качестве эффективного ингибитора фермента тирозил-ДНК-фосфодиэстеразы 1 человека, которые можно использовать для разработки новых эффективных противораковых средств. 2 ил., 1 табл., 24 пр.
Применение соединения, представляющего собой производные желчных кислот общей формулы I
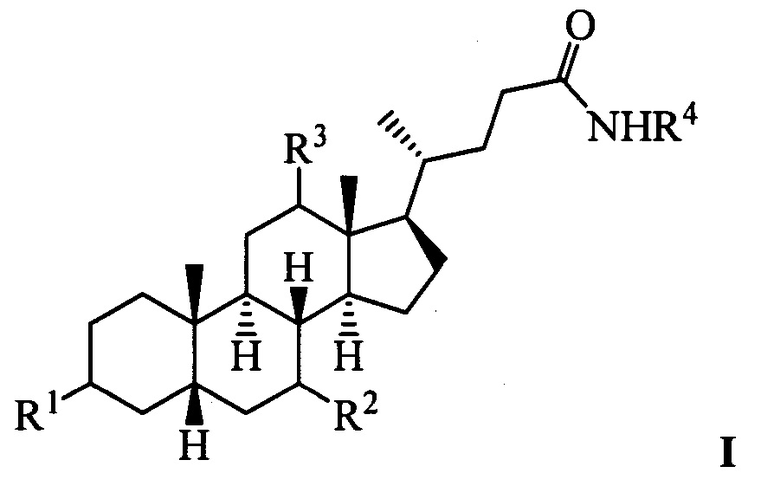
где R1=-ОН, -ОАс, O-СН3; R2=-Н, -ОН, -ОАс; R3 = -Н, -ОН, -ОАс, -O-СН3; R4=адамантил, -фенил, необязательно замещенный бромом, -метилом; -пиридинил, -(CH2)2-R5, где R5=фенил, замещенный двумя трет-бутильными группами, или индол, в качестве ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 человека (Tdp1).
| He, Xiao-Long et al | |||
| "The synthesis and antitumor activity of lithocholic acid and its derivatives" STEROIDS, 125, 2017, 54-6 | |||
| J.P | |||
| Schaefer et al | |||
| "The Structure of Desoxycholic Acid p-Bromoanilide" Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry | |||
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
| R | |||
| Joachimiak et al | |||
| "Synthesis of novel amide-linked dimers of lithocholic acid" Journal of Chemical Research, 5, 2008, 260-265 | |||
| K | |||
| Sasaki et al | |||
| "Facile Amide Bond Formation from Carboxylic Acids and Isocyanates" Organic Letters, vol.13, N9, 2011, 2256-2259 | |||
| R | |||
| Sharma et al | |||
| "Ursodeoxycholic Acid Amides As Novel Glucocorticoid Receptor Modulators" Journal of Medicinal Chemistry, 54, 2011, 122-130 | |||
| В.I | |||
| Гусаров и др | |||
| "Синтез та фiзико-хiiчнi властивостi амiдiв холевоi кислоти" Журнал органiчноi та фармацевтичноiхiмii, т.10, вип.4(40), 2012, 54-58 | |||
| K.V | |||
| Ahonen et al | |||
| "Microwave assisted synthesis and solid-state characterization of lithocholyl amides of isomeric aminopyridines" STEROIDS, 76, 2011, 261-268 | |||
| K.V | |||
| Ahonen et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| RU 2009105179 A, 27.08.2010. | |||
Авторы
Даты
2019-05-27—Публикация
2018-02-16—Подача