Изобретение относится к области медицины и химико-фармацевтической промышленности, а именно к трансдермальным препаратам для профилактики и лечения болезней суставов и мягких тканей, использующих в качестве активных компонентов хондропротекторы и нестероидные противовоспалительные средства.
Остеоартроз (артроз, остеоартрит, деформирующий остеоартроз) (далее - OA) - хроническое прогрессирующее заболевание синовиальных суставов, этиология которого неизвестна. Остеоартрозы относят к тяжелым недугам человечества, а проблема их лечения является одной из ключевых в терапии, ортопедии, ревматологии и клинической фармации. Они широко распространены среди людей пожилого и зрелого возраста, характеризуются дегенерацией суставного хряща, структурными изменениями субхондральной кости, умеренно или выражено протекающими синовитами, хроническим течением и тенденцией к прогрессированию. Все это обуславливает снижение трудоспособности (в среднем в 60% случаев) и приводит в 11,5% случаев к инвалидности больных наиболее трудоспособного возраста.
Особую значимость приобретает данная проблема в связи с ростом продолжительности жизни человека. Согласно проведенным эпидемиологическим исследованиям, дистрофические изменения в суставах обнаруживаются в 50% случаев у людей старше 40 лет, а в возрасте 70 лет это заболевание отмечено у 90% населения. В целом, удельный вес OA в общей структуре заболеваемости населения составляет 12% и занимает первое место среди патологий суставов.
При OA нарушения определяются во всех структурных компонентах сустава, но наиболее выраженные изменения прослеживаются в суставном хряще, в соответствии с чем выделяют 4 стадии OA. Имеются разные точки зрения на гистохимические и метаболические нарушения в суставном хряще при OA, в частности, снижение содержания глюкозаминогликанов (ГАГ), связанное с угасанием биохимических процессов в хондроцитах. С другой стороны, отмечается понижение способности хряща удерживать вновь синтезированные хондроцитами макромолекулы ГАГ в матриксе за счет превращения их в форму, не способную вступать в связь с гиалуроновой кислотой. С развитием дистрофических и деструктивных нарушений в суставном хряще снижается плотность хондроцитов за счет их гибели.
Разрушение суставного хряща возможно из-за воздействия ферментов, которые возникают при воспалении. Существенным звеном в патогенезе заболевания может быть повышение биосинтеза простагландинов и накопление их в синовиальной жидкости, что способствует повреждению хрящевой ткани и индукции синовита (воспаления синовиальной оболочки). Воспалительный процесс в условиях OA приводит к деструкции суставного хряща.
OA сопровождается болью, которая усиливается при прогрессировании заболевания.
Медикаментозная терапия больных OA должна проводиться комплексно, повторяющимися курсами с учетом особенностей протекания заболевания (стадии и фазы процесса), соматического и психоэмоционального состояния больного. К числу основных задач проводимого лечения OA можно отнести:
- уменьшение выраженности болевого синдрома;
- улучшение функции пораженного сустава и снижение нетрудоспособности;
- предотвращение или замедление прогрессирования заболевания и его осложнений.
OA требует всестороннего лечения, включающего симптоматическую терапию, связанную с подавлением воспаления и уменьшением боли, и базисную терапию, предполагающую применение хондропротекторов. Для фармакологической коррекции внутрисуставных нарушений при OA наиболее часто используют три группы препаратов:
- стероидные противовоспалительные препараты (СПВП);
- нестероидные противовоспалительные средства (НПВС);
- хондропротекторы.
Кроме того, широко назначают медикаментозные препараты, подавляющие активность лизосомальных ферментов, улучшающие внутрикостное и регионарное кровообращение, нормализующие тонус околосуставных мышц, стимулирующие метаболические процессы в организме.
СПВП, как правило, применяют для внутрисуставных инъекций для купирования воспалительного процесса. В целом, действие глюкокортикостероидов (ГКС) на суставной хрящ и синовиальную мембрану носит ингибирующий характер и может вызывать дегенеративные изменения в суставе.
НПВС используют для системного и местного лечения остеоартроза при острой и хронической боли. Основной механизм действия НПВС - угнетение биосинтеза простагландинов, образующихся из арахидоновой кислоты путем ингибирования циклооксигеназы. Продукты метаболизма арахидоновой кислоты (простагландины и лейкотриены) являются медиаторами воспаления. Основные виды действия НПВС: противовоспалительное, анальгезирующее, жаропонижающее.
Выбор НПВС базируется не только на эффективности основных видов действия, но и на отсутствии или степени выраженности присущих им побочных эффектов, например, ульцерогенного действия. В случае остеоартроза очень важным становится действие НПВС на метаболизм суставного хряща. Так, известно, что при системном воздействии ацетилсалициловая кислота, индометацин, ибупрофен, фенопрофен, фенилбутазон ингибируют синтез ГАГ; мелоксикам, пироксикам, диклофенак, сулиндак, целекоксиб не оказывают влияния на биосинтез ГАГ, а беноксапрофен, тиапрофеновая кислота, парацетамол и рофекоксиб стимулируют синтез ГАГ. Хондропротекторное действие на суставной хрящ оказывает нифлуминовая кислота. Кетопрофен не оказывает катаболического действия на хрящевую ткань, а в концентрациях 10-4 моль/л способен стимулировать синтез протеогликана в клетках незрелого хряща человека.
При острой боли для терапии остеоартроза назначают препараты, устраняющие симптоматические нарушения, обусловленные венозной недостаточностью, в частности, для местного применения назначают Троксевазин гель.
При хронической боли и стадии ремиссии для терапии остеоартроза назначают препараты с хондромодулирующим (хондропротекторным) действием на суставной хрящ. В настоящее время широко используются препараты, содержащие низкомолекулярные сахара (глюкозамин) и полисахариды (хондроитин сульфат натрия), а также их комбинации. В основном эти препараты предназначены для системного воздействия после орального применения в форме твердых капсул. Однако в последнее время на рынке государств СНГ появились мягкие лекарственные средства, содержащие хондроитин сульфат натрия: Хондроксид мазь 5% (ОАО «Нижфарм), Хондроксид гель 5% (ОАО «Нижфарм) и Хондроитин-Фитофарм эмульгель 5% (ОАО «Фитофарм»). ОАО «Нижфарм» запатентованы составы мягких лекарственных средств, содержащих хондроитин, глюкозамин и диметилсульфоксид, который выступает в роли пенетратора и противовоспалительного вещества [патент РФ №2271812 и патент ЕА №007809]. На рынке РФ находится препарат Терафлекс М крем (Сагмел Инк., США), содержащий комбинацию 0,8% хондроитин сульфата натрия и 0,3% глюкозамина гидрохлорида, а также 3,2% камфоры и 0,9% масла мяты перечной (около 0,5% ментола). В РФ зарегистрированы также препараты: Кондронова мазь для наружного применения, в состав которой входит 5% хондроитин сульфата натрия и 2,5% глюкозамин сульфата натрия, и Фармаскин ТГК крем для наружного применения 8%, содержащий 8% глюкозамина сульфата калия хлорида и 1% диметилсульфоксида.
Чтобы эти препараты оказали на хрящ терапевтическое действие, должно быть обеспечено трансдермальное всасывание действующих веществ. Однако каждый из этих препаратов имеет определенные недостатки. Так, препараты Хондроксид мазь 5% и Кондронова мазь для наружного применения приготовлены на гидрофобных основах, которые не позволяют всасываться действующим веществам и оказывать эффективное хондропротекторное действие. Препараты Хондроксид гель и Хондроитин-Фитофарм эмульгель 5% являются монопрепаратами и не содержат глюкозамина - действующего вещества, служащего субстратом для биосинтеза ГАГ. Кроме того, не доказано, может ли хондроитин сульфат натрия, который является высокомолекулярным соединением, высвобождаться из основ и пенетрировать через кожу с оказанием терапевтического действия. Терафлекс М крем содержит очень низкие концентрации хондроитина и глюкозамина, кроме того, он не содержит пенетратора, необходимого для трансдермального проникновения хондропротекторов, однако он содержит камфору и ментол, которые оказывают противовоспалительное и анальгезирующее действие. Фармаскин ТГК крем содержит большую концентрацию глюкозамина, однако содержание диметилсульфоксида явно недостаточно для оказания противовоспалительного действия и усиления пенетрации.
Для создания номенклатуры мягких лекарственных средств (МЛС) для лечения остеоартроза, находящихся на новом уровне техники, необходимы новые научные подходы, поскольку доказательно не установлено (ни экспериментально, ни клинически), оказывают ли препараты для накожного применения хондропротекторное действие.
Учитывая вышеизложенное, представляет интерес фармацевтическая разработка нового эффективного отечественного препарата для местного лечения OA, который бы оказывал хондропротекторное, противовоспалительное и анальгезирующее действие.
Задачей, на решение которой направлено изобретение, является расширение арсенала используемых средств и получение трансдермального средства для лечения и профилактики болезней суставов и мягких тканей, обладающего высокой стабильностью, обеспечивающего высокую степень трансдермального проникновения активного компонента и обладающего минимальными побочными эффектами.
Поставленная задача решается за счет того, что трансдермальное средство для лечения и профилактики болезней суставов и мягких тканей содержащее фармацевтически необходимое количество хондропротектора, нестероидного противовоспалительного средства и фармацевтически приемлемой основы, согласно изобретению в качестве хондропротектора используется глюкозамин или его фармацевтически приемлемая соль, в качестве нестероидного противовоспалительного средства используется кетопрофен, а фармацевтически приемлемая основа содержит смесь гелеобразователя-растворителя, антиоксидантов для хондропротектора и эмульгаторов, при этом pH препарата находится в пределах от 2,0 до 3,0.
При этом трансдермальное средство в качестве гелеобразователя-растворителя содержит смесь N-метилпирролидона, пропиленгликоля и воды, в качестве антиоксидантов для хондропротектора используется смесь лидокаина, бутилгидроксианизола и кислоты лимонной, а в качестве эмульгатора используется смесь цетостеарилового спирта и макрогола цетостеарилового эфира. Причем массовое соотношение цетостеарилового спирта и макрогола цетостеарилового эфира равно 5:1. Также препарат дополнительно содержит гелеобразователь - поли(метилвиниловый эфир малеинового ангидрида) декадиена кроссполимер (Stabilese QM).
Основа дополнительно содержит изопропилмиристат и полидиметилсилоксан, а глюкозамин, кетопрофен, N-метилпирролидон, пропиленгликоль, лидокаин и кислота лимонная находятся в виде истинного раствора.
Трансдермального средства может быть получено путем предварительного растворения в воде глюкозамина или его фармацевтически приемлемой соли, кислоты лимонной и лидокаина; растворения кетопрофена и бутилгидроксианизола в смеси изопропилмиристата и N-метилпирролидона; приготовления основы путем плавления макрогола цетостеарилового эфира и цетостеарилового спирта при нагревании в дисперсии поли(метилвинилового эфира малеинового ангидрида) декадиена кроссполимера; а затем осуществления последовательного смешивания основы с растворами.
При приготовлении основы поли(метилвиниловый эфир малеинового ангидрида) декадиен кроссполимер предварительно может быть суспендирован в пропиленгликоле.
При приготовлении основы также осуществляется эмульгирование полидиметилсилоксана и расплавленного цетостеарилового спирта с помощью растворенного макрогола цетостеарилового эфира.
При последовательном смешивание основы с растворами может быть осуществлено эмульгирование в основе раствора бутилгидроксианизола в изопропилмиристате до получения эмульсии с мелким размером частиц дисперсной фазы.
Поставленная задача решается также за счет того, что в комбинированном трансдермальном препарате для лечения и профилактики болезней суставов и мягких тканей, содержащем хондропротектор, нестероидное противовоспалительное средство и фармацевтически приемлемые вспомогательные компоненты, согласно изобретению в качестве хондропротектора используется глюкозамин или его фармацевтически приемлемая соль, в качестве нестероидного противовоспалительного средства используется кетопрофен, а в качестве вспомогательных компонентов используются лидокаин или его фармацевтически приемлемая соль, бутил гидрокси анизол, N-метилпирролидон, пропиленгликоль, макрогола цетостеариловый эфир, цетостеариловый спирт, поли(метилвиниловый эфир малеинового ангидрида) декадиен кроссполимер, кислота лимонная и вода.
При этом вспомогательные компоненты могут дополнительно содержать изопропилмиристат и/или полидиметилсилоксан.
Комбинированный трансдермальный препарат может иметь следующий состав, масс.%:
Далее по тексту предложенный комбинированный трансдермальный препарат будет условно называться «Фламакс Плюс гель».
При исследовании водных растворов глюкозамина, в частности в виде гидрохлорида, было установлено, что глюкозамин подвержен окислению, вследствие чего его растворы приобретают желтую окраску, интенсивность которой увеличивается в процессе хранения и с ростом температуры, переходя в дальнейшем в коричневую окраску. Поэтому были проведены скрининговые исследования по влиянию на окраску растворов величины pH, которую создавали трометамолом и лимонной кислотой, а также антиоксиданта лидокаина гидрохлорида.
Было установлено, что без дополнительного введения стабилизаторов глюкозамина гидрохлорид в водном растворе не стабилен.
Если в раствор глюкозамина гидрохлорида дополнительно ввести лидокаина гидрохлорид, то pH уменьшается незначительно с 4,20 до 4,13, однако после 6 месяцев хранения при температуре 30°C содержание суммы примесей уменьшается в 8,6 раза до 0,255%, а степень окрашивания раствора практически не изменяется. Таким образом, лидокаина гидрохлорид является антиоксидантом по отношению к глюкозамина гидрохлориду. Однако раствор, содержащий лидокаина гидрохлорид, остается нестабильным и его pH понижается при хранении в течение 6 месяцев на 1,5 ед. pH.
Эффективная стабилизация растворов глюкозамина гидрохлорида наблюдается, если в них наряду с лидокаина гидрохлоридом дополнительно ввести кислоты лимонной (моногидрат), смещающей pH в кислую область. При этом суммарное содержание примесей в пределах pH от 3,00 до 2,00 снижается в 10,5-12,1 раз, а pH растворов уменьшается при хранении всего на 0,1-0,3 ед. pH. Таким образом, комбинация лидокаина гидрохлорида и лимонной кислоты является эффективным антиоксидантом глюкозамина гидрохлорида, а для его стабилизации необходима кислая среда, pH которой находится в пределах от 2,0 до 3,0.
Кетопрофен вносит свой вклад в кислую среду препарата; без лимонной кислоты в присутствии 2,0% кетопрофена pH разных образцов находился в пределах от 2,54 до 2,61. Несмотря на то, что pH находится в оптимальных пределах, присутствие кислоты лимонной моногидрата является необходимым условием по следующим причинам. Без кислоты лимонной накопление примесей в процессе хранения препарата в течение 1 года при температуре 25°C не превышает установленные в ФСП пределы, а при экстраполяции также не выходит за верхние пределы содержания. Однако после выдавливания препарата из тубы при воздействии света и воздуха без лимонной кислоты крем-гель быстро желтеет и через 24 часа приобретает темно-желтый цвет. В присутствии кислоты лимонной препарат на воздухе остается белым. Кроме того, в течение около месяца после первого вскрытия упаковки в случае отсутствия в составе препарата лимонной кислоты после нарушения целости мембраны желтеет та часть крем-геля, которая контактирует с воздухом. В присутствии кислоты лимонной пожелтения не происходит.
Было обнаружено, что для создания pH крем-гелей в пределах от 2,5 до 2,3 необходимо от 0,2% до 0,7% кислоты лимонной моногидрата. Кислоты лимонной моногидрат был включен в состав препарата в концентрации ~0,5%, что обеспечивает pH препарата около 2,5. Изменение содержания кислоты лимонной моногидрата за пределы от 0,2 г до 0,7 г на 100 г в данном препарате недопустимо, поскольку кислота лимонная при анализе препарата методом жидкостной хроматографии по разделу ФСП «Посторонние примеси» дает на хроматограмме пик плацебо, учитывающийся при анализе.
В экспериментах на животных (кроликах, морских свинках и крысах) было установлено, что крем-гель с такой величиной pH не оказывал местнораздражающего действия на кожу при однократном и многократном применении.
У препарата-аналога Фармаскин ТГК крем pH водного извлечения установлен в пределах от 2,8 до 5,3, а у препарата Терафлекс М крем - в пределах от 3,0 до 5,0. Оба эти препарата при хранении приобретают коричневый цвет, который в препарате Фармаскин ТГК крем пытаются замаскировать желтым красителем куркумином, а в препарате Терафлекс М крем - зеленым экстрактом алоэ.
Дополнительно было проведено исследование по влиянию на содержание в крем-гелях, имеющих pH (2,5±0,1), продуктов разложения глюкозамина гидрохлорида в зависимости от состава антиоксидантов: лидокаина гидрохлорида и бутилгидроксианизола. Образцы крем-гелей хранили при температуре (30±1)°C в течение 3 месяцев, после чего количественно определяли посторонние примеси.
Как показали исследования, при отсутствии лидокаина гидрохлорида и бутилгидроксианизола содержание посторонних примесей максимально. Включение в состав крем-геля 0,5% лидокаина гидрохлорида уменьшает образование 5-гидроксиметилфурфурола (5-ГМФ) в 5,9 раза, а неидентифицированных примесей (НИП) - в 6,4 раза. С увеличением концентрации лидокаина гидрохлорида в 2 раза до 1,0% образование 5-ГМФ уменьшается в 7,6 раза, а НИП - в 9,4 раза. Дальнейшее увеличение концентрации лидокаина гидрохлорида оказывается мало эффективно.
Что касается бутилгидроксианизола, то он также способствует уменьшению образования примесей, но менее эффективно, чем лидокаин. Комбинация лидокаина гидрохлорида и бутилгидроксианизола имеет определенный синергизм антиоксидантного действия и уменьшает образование 5-ГМФ в 8,2 раза, а НИП - в 11,1 раза.
Таким образом, было выявлена необходимость включить в состав препарата для стабилизации глюкозамина гидрохлорида лимонную кислоту моногидрат в концентрации ~0,5% (от 0,2% до 0,7%) (в пересчете на 100% безводное вещество), лидокаина гидрохлорид в концентрации ~1,0% (от 0,5% до 2,0%) и бутилгидроксианизол в концентрации ~0,2% (от 0,1% до 0,4%)
Для трансдермальных препаратов рациональной лекарственной формой является гель на гидрофильной основе. Гели легко впитываются в кожу, а в их составы можно включать большие концентрации гидрофильных растворителей, которые выполняют роль усилителей проникновения. С другой стороны, препараты, содержащие гидрофильные растворители в высоких концентрациях и имеющие экстремальные значения pH, при длительном применении потенциально могут оказывать пересушивающее, обезжиривающее и местнораздражающее действие на кожу, что требует включения в состав таких препаратов эмольентов - гидрофобных неводных растворителей, оказывающих смягчающее действие на кожу. Поскольку гидрофобные растворители не смешиваются с дисперсионной средой геля, речь может идти о крем-геле, то есть эмульсии 1 рода, в которой дисперсионная среда имеет гелеобразную консистенцию. Наличие липофильной дисперсной фазы позволяет включать в составы крем-гелей гидрофобные вещества, которые не растворимы в водной дисперсионной среде. В случае предлагаемого препарата таким веществом является антиоксидант бутилгидроксианизол.
Мазеобразная консистенция крем-гелей может быть достигнута за счет сочетания двух факторов: во-первых, наличия гелеобразователя и, во-вторых, включения в их состав двух эмульгаторов 1 и 2 рода; при этом эмульгатор 2 рода обычно должен быть высшим жирным спиртом.
Были испытаны карбомеры и производные целлюлозы, в частности, гидроксипропилметилцеллюлоза (ГПМЦ). Однако положительных результатов не было получено; с ГПМЦ не образовывались однородные гели в концентрациях, при которых происходило гелеобразование.
Карбомеры неприемлемы в этом препарате из-за химической несовместимости с глюкозамина гидрохлоридом. Кроме того, гелеобразование в растворах карбомеров происходит при pH выше 4, а препарат должен иметь pH ~2,5 (от 2,0 до 3,0).
Рационально было выбрать гелеобразователь, который мог образовывать гели в кислой среде. В качестве вспомогательного гелеобразователя было предложено использовать поли(метилвиниловый эфир малеинового ангидрида) декадиена кроссполимер, (например, выпускаемый под торговым наименованием «Stabilese QM» / Poly (methyl vinyl ether/maleic anhydride) decadiene crosspolymer), компанией «Ashland» (США)).
Co Stabilese QM образуются гели, имеющие кислую реакцию среды. С увеличением концентрации Stabilese QM pH гелей понижается
Были приготовлены гели, содержащие разные концентрации Stabilese QM; дисперсионная среда гелей была представлена смешанным растворителем, содержащим 15% масс. N-метилпирролидона, 10% масс, пропиленгликоля и 75% масс, воды очищенной.
Как выяснилось, тип течения геля, содержащего 0,5% Stabilese QM, близок к ньтоновскому. С увеличением концентрации Stabilese QM реологические параметры (пределы текучести, структурная вязкость) гелей увеличиваются. Гели приобретают пластический тип течения и очевидные тиксотропные свойства при концентрации Stabilese QM 4%. Структурная вязкость гелей значимо возрастает, начиная с концентрации Stabilese QM 1,5%.
Результаты реологических исследований свидетельствуют, что поли(метилвиниловый эфир малеинового ангидрида) декадиена кроссполимер (Stabilese QM) может быть использован в качестве вспомогательного гелеобразователя (фактора консистенции) в кислых средах.
Далее необходимо было выбрать состав эмульгаторов 1 и 2 рода. Анионные ПАВ (например, натрия лаурилсульфат) химически несовместимы с глюкозамина гидрохлоридом. Катионные ПАВ мало приемлемы для использования в качестве эмульгаторов 1 рода, поскольку в больших концентрациях могут оказывать на кожу местнораздражающее действие. Поэтому для исследований выбрали неионогенное ПАВ - макрогола цетостеариловый эфир (в частности - «макрогола 20 цетостеариловый эфир», который, в частности, производится фирмой BASF под торговым названием «Kolliphor CS 20». В качестве эмульгатора 2 рода и второго фактора консистенции использовали цетостеариловый спирт, который в частности, производится фирмой BASF под торговым названием «Kolliwax CSA 50».
Макрогола цетостеариловый эфир является простым эфиром, который химически совместим с действующими веществами, а также устойчив к гидролизу в щелочных и кислых средах.
Известно, что при использовании в определенных соотношениях эмульгатора 1 рода (в частности, макрогола 20 цетостеарилового эфира) и цетостеарилового спирта при достаточной суммарной концентрации обоих эмульгаторов образуются вязко-пластичные консистентные эмульсии. В связи с этим были проведены соответствующие реологические исследования для выбора оптимального состава эмульгаторов 1 и 2 рода и гелеобразователя.
Для выбора концентрации эмульгаторов был приготовлен ряд крем-гелей, в которых варьировали соотношение между эмульгаторами 1 и 2 рода, то есть между Kolliphor CS 20 и Kolliwax CSA 50. Гелеобразователь Stabilese QM вводили в составы крем-гелей в концентрации 2,0%, при которой этот гелеобразователь оказывает маленькое влияние на структурную вязкость водных дисперсий.
Как было обнаружено, выбранные эмульгаторы при определенных соотношениях совместно с гелеобразователем обеспечивают консистенцию крем-гелей, для которых характерны высокий нижний предел текучести, тиксотропные свойства и достаточно большие значения структурной вязкости при низких градиентах скорости сдвига.
Также было обнаружено, что структурная вязкость образцов крем-гелей зависит от массового соотношения между цетостеариловым спиртом и неионогенным эмульгатором 1 рода и проходит через максимум при массовом соотношении между Kolliwax CSA 50 и Kolliphor CS 20 5,0:1,0.
С увеличением концентрации Stabileze QM от 0,5% до 3,0% (в присутствии эмульгаторов 1 и 2 рода) структурная вязкость и другие реопараметры крем-гелей увеличиваются. При концентрациях Stabileze QM 3,0-5,0% образуются, видимо, вторичные коагуляционные структуры, вследствие чего резко увеличивается площадь петли гистерезиса, а при высоких градиентах скоростей сдвига происходит интенсивное разрушение коагуляционной структуры с уменьшением структурной вязкости при увеличении концентрации гелеобразователя. Эти концентрации следует считать избыточными. Исходя из результатов исследований, была выбрана концентрация поли(метилвинилового эфира малеинового ангидрида) декадиена кроссполимера (Stabileze QM) от 0,5% до 3,0% (оптимально 2,0%).
Как видно из данных, представленных в таблице 0.2, с увеличением концентрации комплексного эмульгатора от 1% до 5% структурная вязкость и другие реопараметры крем-гелей увеличиваются. При концентрациях комплексного эмульгатора 7-8% структурная вязкость крем-гелей существенно увеличивается. Оптимальной является концентрация эмульгаторов 6% (от 1% до 7%).
Было установлено, что сочетание гелеобразователя Stabilese QM и эмульгаторов (Kolliwax CSA 50 и Kolliphor CS 20) позволяет добиться синергизма структурной вязкости крем-гелей, что наглядно демонстрируют данные, представленные в табл.0.3.
Как видно из представленных в таблице 0.3 данных, сумма структурных вязкостей (при разных градиентах скорости сдвига) крем-геля без эмульгаторов и крем-геля без Stabilese QM оказывается в 16-31 раз меньше, чем структурная вязкость крем-геля, содержащего одновременно и эмульгаторы и Stabilese QM. Сочетание этих вспомогательных веществ в относительно небольших концентрациях, при которых в отдельности они не могут обеспечить надлежащую консистенцию крем-геля, и наличия двух факторов консистенции позволило добиться синергизма относительно реопараметров.
На основании результатов реологических исследований в состав препарата были включены Stabilese QM в концентрации от 0,5% до 3,0% (оптимально 2,0%), а также эмульгаторы Kolliphor CS 20 и Kolliwax CSA 50 в концентрациях соответственно от 0,5% до 3,0% (оптимально 1,0%) и от 2,0% до 7,0% (оптимально 5,0%).
Выбор состава дисперсной фазы и дисперсионной среды.
Дисперсная масляная фаза в препарате Фламакс Плюс гель необходима по двум причинам:
во-первых, необходим гидрофобный растворитель для растворения 0,2% бутилгидроксианизола, в качестве которого был выбран изопропилмиристат в концентрации 5%;
во-вторых, в составе препарата необходим эмольент для смягчения кожи, поскольку препарат Фламакс Плюс гель предполагается применять длительное время.
Существуют 2 клинически доказанных способа борьбы с сухой кожей:
- применение в составе мягких лекарственных средств (МЛС) веществ, которые при впитывании в кожу связывают и удерживают в ней влагу; к таким веществам относятся гликоли, например, пропиленгликоль;
- смягчение и увлажнение кожи за счет гидрофобных растворителей (эмольентов), создающих на коже окклюзионную пленку и препятствующих испарению влаги. Эмольенты придают крем-гелям также другие важные функциональные характеристики, связанные с распределяемостью, скольжением, сенсорными ощущениями на коже и т.д.
Такие природные эмольенты, как жирные масла и триглицериды при хранении в составе препарата могут прогоркать и обычно требуют применению антиоксидантов, а также стандартизации перекисного и кислотного чисел. Поэтому был использован гидрофобный растворитель - изопропилмиристат, имеющий аналогичное функциональное назначение. Изопропилмиристат - химически стабильное вещество, устойчивое к окислению. Изопропилмиристат - эмольент с быстрой степенью растекания 1200 мм2/10 мин, что будет способствовать легкому нанесению препарата на кожу. Кроме того, изопропилмиристат - безвредное вещество, не оказывающее на кожу раздражающего действия.
Дополнительно в состав препарата Фламакс Плюс гель, как компонент масляной фазы, был включен полидиметилсилоксан (диметикон 100) в концентрации от 0,5% до 3,0% (оптимально 1,0%), который также является гидрофобным неводным растворителем и выполняет функцию эмольента. Кроме того, полидиметилсилоксан способствует легкой впитываемости крем-геля при втирании в кожу и отсутствию белесых следов и жирного блеска после аппликации препарата.
Фламакс Плюс гель должен оказывать также увлажняющее действие на кожу. Это реализуется за счет неводного растворителя пропиленгликоля, который был включен в состав препарата. Кроме того, пропиленгликоль используется как сорастворитель кетопрофена.
Действующие вещества препарата Фламакс Плюс крем-гель должны пенетрировать через кожу, для чего они должны находиться в препарате в растворенном состоянии. Для этого также следует использовать вспомогательные вещества, которые являются усилителями проникновения. В качестве пенетратора часто используют диметилсульфоксид (ДМСО), который вызывает неприятный вкус во рту после нанесения на кожу. Стратегии для химического усиления или модификации высвобождения in vivo заключаются в нарушении структуры рогового слоя кожи (влияние на диффузию), в изменении растворимости действующего вещества в роговом слое кожи (влияние на распределение) или в воздействии на осмотическую активность препарата - движущую силу для процесса пассивной диффузии действующего вещества - в составе (основе-носителе). Химические усилители проникновения могут изменять барьерную функцию.
Известны различные виды веществ, которые могут усиливать проникновение через кожу и широко используются в трансдермальных препаратах. Хотя механизмы действия, с помощью которых они изменяют роговой слой кожи в некоторой степени, различаются (например, удаление липидов из липидного бислоя, внедрение в бислой и нарушение его порядка или разжижение липидной структуры), такие вещества обладают в общем одним свойством: они повышают способность действующего вещества проникать через кожу.
Группами веществ, полученных химическим синтезом, для которых известна их способность действовать как усилители проникновения или солюбилизаторы в трансдермальных препаратах, являются, например, (данный перечень не является исчерпывающим) поверхностно-активные вещества (ПАВ), жирные кислоты и их соли, эфиры жирных кислот, алкиламины, спирты, подобные азолу молекулы, пирролидоны, сульфоксиды и терпены.
В препарате Фламакс Плюс гель для усиления пенетрации действующих веществ через кожу дополнительно использован гидрофильный неводный растворитель N-метилпирролидон, который хорошо зарекомендовал себя в качестве усилителя проникновения при экспериментальном исследовании хондропротекторного действия. Включение ~18% N-метилпирролидона в состав крем-геля, содержащего 5% глюкозамина гидрохлорида и 2% кетопрофена, обеспечило эффективное хондропротекторное, противовоспалительное и анальгезирующее действие.
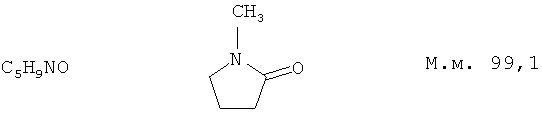
N-Метилпирролидон стандартизован в Европейской фармакопее и производится фирмой «Ashland Speciality Ingredients* (США) под торговым названием Pharmasolve® (CAS №872-50-4). Структурная и эмпирическая формулы NMP, а также его молекулярная масса представлены ниже.
В документе «Safety data Sheet Pharmasolve®» фирмы ISP это вспомогательное вещество декларируется как безопасное вещество при накожном применении, не оказывающее сенсибилизирующего, мутагенного и канцерогенного действия, а также раздражающего действия на кожу человека, не влияющее на эмбриотоксичность и гонадотоксичность. В фармацевтической и ветеринарной практике применяется в качестве растворителя, пенетратора в препаратах для местного применения.
Степень проникновения через кожу с помощью усилителя проникновения зависит от его концентрации, в связи с чем пенетраторы рационально использовать в достаточно высоких концентрациях. Примером может служить препарат Долобене гель, в котором ДМСО используется в концентрации 15%. Безопасность N-метилпирролидона при накожном применении позволяет использовать его в достаточно высоких концентрациях. Так, например, в препарате Найз гель для наружного применения, для растворения 1% нимесулида использован N-метилпирролидон в концентрации 25% совместно с 10% пропиленгликоля, 31,55% полиэтиленоксида 400 и 10% изопропилового спирта.
Представляет интерес исследование смешанного растворителя пропиленгликоль - N-метилпирролидон, а также тройного растворителя пропиленгликоль - N-метилпирролидон - вода, чтобы выявить составы и структурные области, которые позволят эффективно растворять кетопрофен. С этой целью было проведено политермическое определение плотности и кинематической вязкости указанных смешанных растворителей в широкой области составов.
Избыточная плотность при температурах 15-40°C уменьшается с ростом концентрации N-метилпирролидона примерно до 29-34% мол., что соответствует 35-40% масс.
Избыточная кинематическая вязкость также уменьшается с ростом концентрации N-метилпирролидона до 30% мол., что соответствует 35% масс. В связи с этим был приготовлен неводный растворитель, содержащий 35% масс. N-метилпирролидона и 65% масс, пропиленгликоля.
Был приготовлен неводный растворитель, содержащий 65% масс, пропиленгликоля и 35% масс. N-метилпирролидона. Проведено политермическое определение плотности и кинематической вязкости смесей полученного неводного растворителя и воды в широкой области составов.
Значения избыточных плотностей и избыточных кинематических вязкостей смешанных растворителей во всей области составов положительны. Максимум избыточных плотностей приходится на 25-30% мол. неводного растворителя, что соответствует примерно 50-60% масс. Можно прогнозировать в данной области высокую растворимость кетопрофена, которая будет резко увеличиваться с ростом концентрации смешанного неводного растворителя.
Максимум избыточных вязкостей приходится на 55% мол. неводного растворителя, что соответствует 85% масс, смешанного неводного растворителя. При более высоких его концентрациях будут превалировать смешанные структуры с преобладанием структуры неводного растворителя, что может привести к местнораздражающему действию на кожу. В области концентраций до 8,5% мол. (30% масс), видимо, преобладает структура воды, вследствие чего растворимость кетопрофена будет незначительной. В области концентраций около 12-35% мол. (40-70% масс), видимо, имеют место смешанные структуры, которые должны сочетать достаточную растворяющую способность при отсутствии местнораздражающего действия.
Для обоснования состава дисперсионной среды крем-геля была изучена растворимость кетопрофена в смешанных растворителях вода - неводный растворитель, содержащий смесь N-метилпирролидона и пропиленгликоля (35:65).
Растворимость кетопрофена изучали изотермическим методом, а концентрацию насыщенного раствора определяли методом абсорбционной спектрофотометрии в ультрафиолетовой и видимой областях по разработанной методике.
Пропиленгликоль - не достаточно эффективный сорастворитель кетопрофена, поскольку при его концентрации 60% растворяется всего 1% кетопрофена. Как и прогнозировалось по результатам исследования плотности, эффективность сорастворения резко увеличивается при сочетании пропиленгликоля с N-метилпирролидоном
Кетопрофена растворяется при концентрации смешанного неводного растворителя 40%; при содержании неводного растворителя 50% растворяется 3,1% кетопрофена, а при 60% - 16,3% кетопрофена.
В препарате Фламакс Плюс гель кетопрофен должен находиться в виде истинного раствора, что необходимо для его трансдермального проникновения. Необходимо также, чтобы кетопрофен из 2%-ного раствора не выпадал в осадок при пониженной температуре 2-8°C (возможные условия хранения). Было установлено, что 2% кетопрофена не выпадают в осадок при температуре 2-8°C в трехкомпонентном смешанном растворителе, содержащем 18 г N-метилпирролидона, 32 г пропиленгликоля и 27,3 г воды очищенной. В этих количествах указанные растворители и были включены в состав препарата.
Пропиленгликоль, входящий в состав препарата, обладает определенной антимикробной активностью, однако, эта активность недостаточна для эффективного антимикробного консервирующего действия.
При этом было установлено, что в препарате Фламакс Плюс гель для наружного применения антимикробное консервирующее действие оказывает N-метилпирролидон. Это действие, видимо, потенцируется пропиленгликолем.
Поэтому применение дополнительного антимикробного консерванта нецелесообразно.
В качестве примера может быть приведен следующий состав препарата:
Физико-химические свойства препарата:
Плотность препарата Фламакс Плюс гель составляет: при 15°C - 1,0043 г/см3, при 20°C - 1,0017 г/см3, при 25°C - 0,9983 г/см3, при 30°C - 0,9951 г/см3.
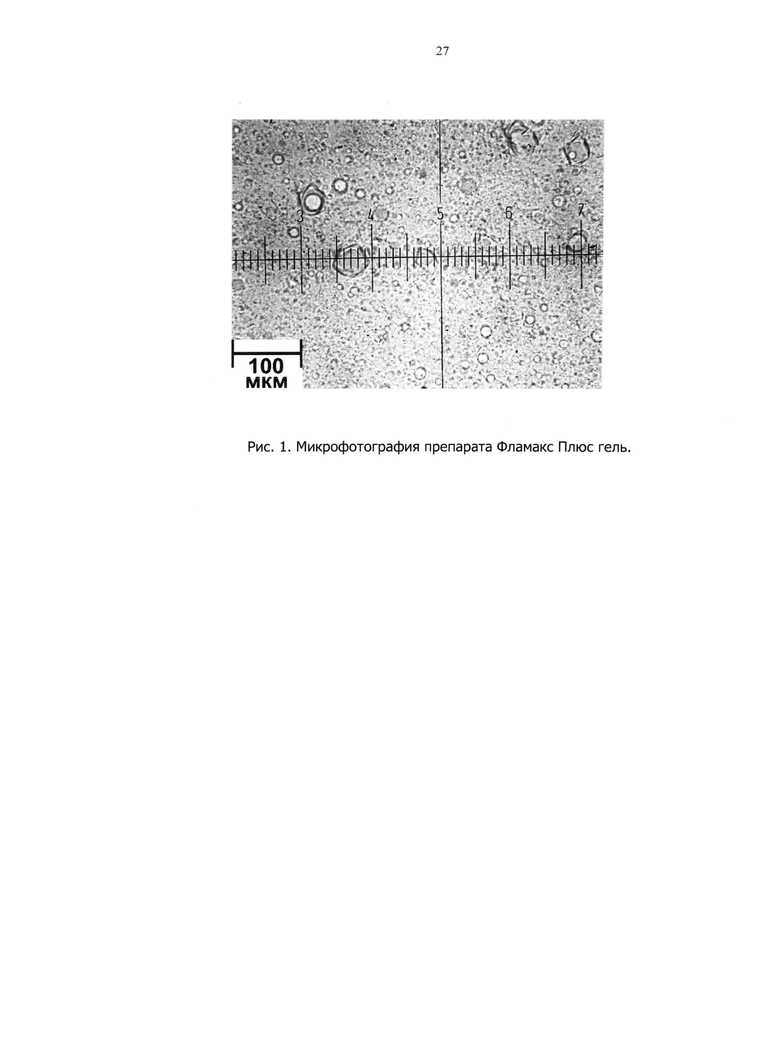
На рис.1 представлена микрофотография препарата Фламакс Плюс гель, изготовленного в реакторе-гомогенизаторе. Препарат представляет собой эмульсию 1 рода (типа масло/вода). На микрофотографии видны частицы масляной фазы и кольцевые структуры с ободками, которые являются частицами набухшего полимера Stabilese QM. При хранении препарата размеры частиц не изменяются.
Препарат представляет собой эмульсию с мелким размером частиц дисперсной фазы (размер отдельных частиц не более 50 мкм)
Технология препарата разработана с учетом свойств компонентов, входящих в его состав, и свойств крем-геля, как дисперсной системы. При выборе способа приготовления и параметров технологического процесса основывались также на данных о влиянии температуры и условий перемешивания на реологические свойства лекарственной формы.
Пример способа приготовления включает следующие технологические процессы:
- растворение в воде очищенной глюкозамина гидрохлорида, кислоты лимонной моногидрата, лидокаина гидрохлорида. При растворении глюкозамина гидрохлорида одновременно с ним должны быть растворены кислота лимонная моногидрат для создания кислой среды (рН в пределах от 2,0 до 3,0) и лидокаина гидрохлорид;
- растворение кетопрофена и бутилгидроксианизола в смеси изопропилмиристата и N-метилпирролидона; растворение необходимо осуществлять при перемешивании и, при необходимости, нагревании до температуры 25-35°C, чтобы сократить время растворения;
- суспендирование поли(метилвинилового эфира малеинового ангидрида) декадиена кроссполимера (Stabilese QM) в пропиленгликоле;
- плавление макрогола цетостеарилового эфира и цетостеарилового спирта при нагревании в дисперсии Stabilese QM с последующим эмульгированием расплавленного цетостеарилового спирта и полидиметилсилоксана (диметикона DM 100) {приготовление основы);
- последовательное смешивание основы с растворами и эмульгирование в основе раствора бутилгидроксианизола в изопропилмиристате. При этом получается эмульсия с мелким размером частиц (не более 50 мкм.) дисперсной фазы (см. выше микрофотографию на рис.0.1), что в целом свидетельствует о склонности дисперсной системы к самоэмульгированию;
- раствор глюкозамина гидрохлорида следует вводить при достаточно низкой температуре 35-37°C, чтобы предотвратить его разложение;
- охлаждение коллоидной дисперсии эмульгаторов, основы и препарата до комнатной температуры при перемешивании (в процессе охлаждения крем-геля происходит гелеобразование).
Перемешивать крем-гель при температурах ниже 35°C рационально при низких частотах в течение ограниченных отрезков времени, так как коагуляционная структура крем-гелевой основы разрушается при перемешивании.
На этапе доклинических исследований было исследовано специфическое хондропротекторное, противовоспалительное и анальгетическое действие препарата Фламакс Плюс гель, а также проведено исследование общетоксического и местнораздражающего действия.
Специфическая хондропротекторная активность препарата Фламакс Плюс гель установлена на модели системного стероидного артроза у крыс. В ходе исследования была проведена оценка уровня хондропротекторной активности данного препарата на основании клинических наблюдений, динамики биохимических показателей сыворотки крови и тканей суставного хряща, а также состояния морфо- и ультраструктуры суставных тканей крыс с системным стероидным артрозом.
Результаты клинических наблюдений и биохимических исследований свидетельствуют, что препарат Фламакс Плюс гель не только способствует нормализации клинико-биохимических показателей крыс на фоне развития экспериментального артроза, а и оказывает позитивное влияние на морфоструктуру тканей суставов лабораторных животных, с формированием слабо выраженных нарушений в структурах хряща и капсуле сустава. Кроме того, при изучении влияния данного препарата на состояние ультраструктуры суставного хряща было обнаружено, что Фламакс Плюс гель способствует усилению метаболической активности хондроцитов и сохранению структуры хрящевого матрикса.
Результаты исследования свидетельствуют, что препарат Фламакс Плюс гель проявляет высокую хондропротекторную активность, по степени которой не уступает препарату сравнения Глюкозамин крем-гель, содержащему 5% глюкозамина гидрохлорида, и превосходит препарат Фастум гель, содержащий 2,5% кетопрофена. Кроме того, результаты этого исследования подтверждают целесообразность включения в состав препарата Фламакс Плюс гель 5% глюкозамина гидрохлорида, 2,0% кетопрофена, поскольку препарат предотвращает развитие вторичных воспалительно-пролиферативных процессов мягких тканей суставов на фоне экспериментального артроза, что выгодно отличает его от обоих монопрепаратов сравнения.
Изучена специфическая фармакологическая (противовоспалительная и анальгетическая) активность препарата Фламакс Плюс гель для наружного применения, действующими веществами которого являются нестероидное противовоспалительное средство кетопрофен (2,0%) и хондропротектор глюкозамина гидрохлорид (5,0%). В качестве препарата сравнения использовали препарат Фастум гель для наружного применения 2,5% («А. Менарини Индустриэ Фармачеутикэ Риунитэ С.р.Л.», Италия), содержащий 2,5% кетопрофена.
Двукратное накожное нанесение сравниваемых препаратов в суммарной дозе 5 мг кетопрофена/стопу крысам с каррагениновым воспалением стопы достоверно ингибирует прирост экссудативного отека. Противовоспалительный эффект препарата Фламакс Плюс гель составил к 1 часу - 26,0%, 3 часу - 51,0%, 5 часу - 48,4%.
Противовоспалительный эффект препарата Фастум гель недостоверно уступал активности разработанного препарата, составив: к 1 часу - 16,3%, 3 часу - 44,4%, к 5 часу - 35,5%. Суммарный противовоспалительный эффект препарата Фламакс Плюс гель (189,4) в 1,3 раза превосходит эффект препарата Фастум гель (148,8).
Сравниваемые препараты при 8-дневном нанесении крысам с травматическим воспалением стопы в дозе 5 мг кетопрофена/стопу/сутки оказывают противовоспалительное действие, достоверно снижая прирост отека стопы уже на 2 сутки лечения. Противовоспалительные эффекты препарата Фламакс Плюс гель и препарата Фастум гель на 2 сутки составили соответственно 29,1% и 23,9%, 3 сутки - 45,9% и 36,8%, 4 сутки - 61,2% и 51,6%, 5 сутки - 70,8% и 67,1%, 7 сутки - 81,1% и 69,2%, 8 сутки - 84,1% и 62,3%. Суммарный противовоспалительный эффект препарата Фламакс Плюс гель (416,0) в 1,15 раза превышает эффект препарата Фастум гель (360,2). У тех же крыс сравниваемые препараты оказывают анальгетический эффект, составляющий, соответственно: на 1 сутки - 30,0% и 31,7%, 3 сутки - 46,6% и 45,2%, 5 сутки - 68,2% и 64,8%. Суммарный анальгетический эффект препарата Фламакс Плюс гель (206,4) полностью соответствует эффекту препарата Фастум гель (202,8).
Полученные результаты свидетельствуют, что противовоспалительная и анальгетическая активность препарата Фламакс Плюс гель для наружного применения в целом соответствует активности препарата Фастум гель для наружного применения 2,5% при тенденции к более выраженной противовоспалительной активности разработанного препарата.
Исследованы фармакокинетические свойства, включая биодоступность, препарата Фламакс Плюс гель для наружного применения при накожном нанесении. В качестве препарата сравнения исследовали препарат Фастум гель для наружного применения 2,5% («А. Менарини Индустриэ Фармачеутикэ Риунитэ С.р.Л., Италия). Фармакокинетические исследования проведены в экспериментах на кроликах при однократном накожном нанесении сравниваемых препаратов в равной дозе - 15 мг/кг в расчете по кетопрофену.
Для определения кетопрофена в плазме крови кроликов использовали метод высокоэффективной жидкостной хроматографии с предварительной твердофазной экстракцией кетопрофена из плазмы животных и концентрированием пробы под вакуумом. Показано, что по валидационным параметрам «селективность», «нижний предел количественного определения», «прецизионность», «правильность», «линейность» и «степень экстракции» использованный метод соответствует установленным критериям.
Рассчитаны основные фармакокинетические константы кетопрофена при однократном накожном нанесении кроликам.
Установлено, что при накожном нанесении кроликам препарата Фламакс Плюс гель кетопрофен характеризуется полным трансдермальным всасыванием, продолжительной циркуляцией в крови и постепенной элиминацией. Основные фармакокинетические константы кетопрофена для препаратов Глюкокет и Фастум составляют, соответственно: Cmax - 8319,23 и 3138,95 нг/мл, Tmax - 4 ч и 5 ч, MRT - 8,68 ч и 14,19 ч, Т1/2 - 5,73 ч и 8,9 ч, Kel - 0,1209 ч-1 и 0,0779 ч-1.
Относительная биодоступность кетопрофена при накожном нанесении кроликам препарата Фламакс Плюс гель относительно Фастум геля в равной по кетопрофену дозе составляет 168,91%.
Результаты сравнительного исследования фармакокинетики препаратов Фламакс Плюс гель для наружного применения и Фастум гель для наружного применения 2,5% свидетельствуют о целесообразности снижения концентрации кетопрофена в разрабатываемом комбинированном препарате до 2,0%. Это может способствовать уменьшению побочных эффектов кетопрофена с одновременным сохранением фармакологической активности фиксированной комбинации кетопрофена с глюкозамином.
На основании результатов изучения острой токсичности на крысах была установлена ЛД50, которая составляет для препарата Фламакс Плюс гель (по лекарственной форме) 2,50 (2,18÷2,82) г/кг при накожном нанесении. Согласно общепринятой классификации препарат относится к малотоксичным веществам.
При изучении острой токсичности установлено, что препарат Фламакс Плюс гель при накожном нанесении мышам в дозе 3,0 г/кг (по лекарственной форме), морским свинкам в дозе 2,5 г/кг (по лекарственной форме) и при внутрижелудочном введении мышам в дозе 5,0 г/кг (по лекарственной форме) не вызывает гибели и не влияет на общее состояние и поведение экспериментальных животных.
Препарат Фламакс Плюс гель при длительном ежедневном накожном нанесении крысам в течение 1 месяца в дозах 0,1 г/кг и 0,3 г/кг (по лекарственной форме) не влияет на общее состояние и поведение животных, потребление пищи и воды, динамику массы тела, функциональное состояние ЦНС и электрофизиологическую активность миокарда, на биохимические показатели и на показатели, характеризующие периферическую кровь.
Патоморфологически установлено, что препарат при субхроническом воздействии не изменяет относительную массу внутренних органов животных. После воздействия препарата отсутствуют макроскопические и морфологические признаки кардиотоксического и нефротоксического действия на организм животных. Препарат не вызывает видимых сдвигов в морфофункциональном состоянии центрального (тимус) и периферического (селезенка) звена иммуногенеза. Препарат Фламакс Плюс гель не вызывает перестройки в различных участках коры надпочечников и связанных с этим изменений характера минералокортикоидного синтеза. После воздействия препарата в дозе 0,3 г/кг у трети животных отмечена мелкокапельная жировая дистрофия гепатоцитов. Процесс не носит распространенного характера. Выявлены изменения слизистой фундальной части желудка у животных после применения препарата в обеих дозах: гибель покровного эпителия, образование эрозий. Указанные изменения носят дозозависимый характер.
Препарат Фламакс Плюс гель при однократном накожном нанесении кроликам в дозе 0,5 г на животное не обладает местнораздражающим эффектом. Препарат Фламакс Плюс гель при многократном накожном нанесении крысам в дозах 0,1 г/кг и 0,3 г/кг не обладает местнораздражающим эффектом.
Препарат не проявляет сенсибилизирующей активности, не обладает аллергизирующим действием.
Таким образом, полученные результаты позволяют сделать заключение о перспективности применения препарата Фламакс Плюс гель в качестве хондропротекторного средства у больных с дегенеративно-дистрофическими заболеваниями суставов и целесообразности его дальнейшего клинического изучения.
Препарат представляет собой сложную дисперсную систему, являющуюся одновременно эмульсией 1 рода (по отношению к раствору бутилгидроксианизола в изопропилмиристате и диметикону 100), истинным раствором по отношению к глюкозамина гидрохлориду, кетопрофену, N-метилпирролидону, пропиленгликолю, лидокаина гидрохлориду и кислоте лимонной, коллоидным раствором по отношению к ассоциатам эмульгаторов 1 и 2 рода, представляющим собой лиотропные жидкие кристаллы, дисперсией полимера по отношению к Stabilese QM. Кроме того, бутилгидроксианизол растворен в изопропилмиристате.
| название | год | авторы | номер документа |
|---|---|---|---|
| Трансдермальный препарат для лечения и профилактики болезней суставов и мягких тканей | 2018 |
|
RU2685436C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОСТЕОАРТРОЗОВ (ВАРИАНТЫ) | 2013 |
|
RU2538218C2 |
| НАРУЖНОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНЕЙ СУСТАВОВ И МЯГКИХ ТКАНЕЙ | 2013 |
|
RU2574008C2 |
| НАРУЖНОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ СУСТАВОВ И МЯГКИХ ТКАНЕЙ | 2007 |
|
RU2377974C2 |
| Комбинированная мягкая лекарственная форма для лечения геморроидальных заболеваний | 2018 |
|
RU2705794C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ КОЖИ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2011 |
|
RU2489144C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ В ГИНЕКОЛОГИИ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2479305C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ВИДЕ ПЕННОГО АЭРОЗОЛЯ, ОБЛАДАЮЩАЯ ПРОТИВОВОСПАЛИТЕЛЬНЫМ, РЕГЕНЕРАЦИОННЫМ И АНТИМИКРОБНЫМ ДЕЙСТВИЕМ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2013 |
|
RU2542448C1 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ С ПРОТИВОВОСПАЛИТЕЛЬНЫМ И ОБЕЗБОЛИВАЮЩИМ ДЕЙСТВИЕМ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2309738C1 |
| ПРОТИВОУГРЕВАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2530644C2 |
Изобретение относится к медицине и заключается в трансдермальном средстве для лечения и профилактики болезней суставов и мягких тканей. Средство содержит хондропротектор глюкозамин; нестероидное противовоспалительное средство кетопрофен; фармацевтически приемлемую основу, включающую смесь растворителя N-метилпирролидона и пропиленгликоля; антиоксидант для хондропротектора, а именно лидокаин и лимонную кислоту; гелеобразователь, способный образовывать гели в кислой среде, и эмульгатор в виде неионогенного ПАВ. Кислотность находится в пределах от 2,9 до 2,2 рН. Изобретение относится также к способу получения трансдермального средства. Технический результат заключается в расширении арсенала средств, высокой стабильности, высокой степени трансдермального проникновения активного компонента и в минимальных побочных эффектах. 3 н. и 9 з.п. ф-лы, 1 ил., 6 табл.
1. Трансдермальное средство для лечения и профилактики болезней суставов и мягких тканей, содержащее фармацевтически необходимое количество хондропротектора, нестероидного противовоспалительного средства и фармацевтически приемлемой основы, отличающееся тем, что в качестве хондропротектора оно содержит глюкозамин или его фармацевтически приемлемую соль, в качестве нестероидного противовоспалительного средства - кетопрофен, а фармацевтически приемлемая основа содержит смесь растворителя, включающего N-метилпирролидон и пропиленгликоль, антиоксиданта для хондропротектора, включающего лидокаин и лимонную кислоту, а также гелеобразователя, способного образовывать гели в кислой среде, и эмульгатора в виде неионогенного ПАВ, при этом кислотность находится в пределах от 2,9 до 2,2 рН.
2. Трансдермальное средство по п. 1, отличающееся тем, что в качестве растворителя оно содержит смесь N-метилпирролидона, пропиленгликоля и воды.
3. Трансдермальное средство по п. 1, отличающееся тем, что в качестве антиоксиданта для хондропротектора оно содержит смесь лидокаина, бутилгидроксианизола и кислоты лимонной.
4. Трансдермальное средство по пп. 1-3, отличающееся тем, что в качестве эмульгатора в виде неионогенного ПАВ оно содержит смесь цетостеарилового спирта и макрогола цетостеарилового эфира.
5. Трансдермальное средство по п. 4, отличающееся тем, что массовое соотношение цетостеарилового спирта и макрогола цетостеарилового эфира равно 5:1.
6. Трансдермальное средство по пп. 1-4, отличающееся тем, что в качестве гелеобразователя, способного образовывать гели в кислой среде, оно содержит поли(метилвиниловый эфир малеинового ангидрида) декадиена кроссполимер.
7. Трансдермальное средство по п. 1, отличающееся тем, что фармацевтически приемлемая основа дополнительно содержит эмольент в виде изопропилмиристата и полидиметилсилоксана или в виде жирного масла.
8. Трансдермальное средство по пп. 1-7, отличающееся тем, что глюкозамин, и/или кетопрофен, и/или N-метилпирролидон, и/или пропиленгликоль, и/или лидокаин, и/или кислота лимонная находятся в виде истинного раствора.
9. Трансдермальное средство для лечения и профилактики болезней суставов и мягких тканей, содержащее хондропротектор, нестероидное противовоспалительное средство и фармацевтически приемлемую основу, отличающееся тем, что в качестве хондропротектора оно содержит глюкозамин или его фармацевтически приемлемую соль, в качестве нестероидного противовоспалительного средства - кетопрофен, а в качестве фармацевтически приемлемой основы оно содержит смесь веществ, включающую лидокаин или его фармацевтически приемлемую соль, бутилгидроксианизол, N-метилпирролидон, пропиленгликоль, макрогола цетостеариловый эфир, цетостеариловый спирт, кислоту лимонную и воду, при этом кислотность находится в пределах от 2,9 до 2,2 рН.
10. Трансдермальное средство по п. 9, отличающееся тем, что фармацевтически приемлемая основа дополнительно содержит поли(метилвиниловый эфир малеинового ангидрида) декадиена кроссполимер, изопропилмиристат, полидиметилсилоксан.
11. Трансдермальное средство по п. 10 следующего состава, масс. %:
глюкозамин или его фармацевтически приемлемая соль 2,0 - 7,0
кетопрофен 0,5 - 4,0
лидокаин или его фармацевтически приемлемая соль 0,5 - 2,0
бутилгидроксианизол 0,1 - 0,4
N-метилпирролидон 10,0 - 25,0
пропиленгликоль 25,0 - 40,0
макрогола цетостеариловый эфир 0,5 - 3,0
цетостеариловый спирт 2,0 - 7,0
поли(метилвиниловый эфир малеинового ангидрида)
декадиена кроссполимер 0,5 - 3,0
изопропилмиристат 2,0 - 7,0
полидиметилсилоксан 0,5 - 3,0
кислота лимонная 0,2 - 0,7
вода до 100,0
12. Способ получения трансдермального средства по пп. 10, 11 заключающийся в том, что предварительно осуществляют растворение в воде глюкозамина или его фармацевтически приемлемой соли, кислоты лимонной и лидокаина, а затем проводят последовательно следующие этапы: растворение кетопрофена и бутилгидроксианизола в смеси изопропилмиристата и N-метилпирролидона; суспендирование поли(метилвинилового эфира малеинового ангидрида) декадиента кроссполимера в пропиленгликоле; приготовление основы путем плавления макрогола цетостеарилового эфира и цетостеарилового спирта при нагревании в дисперсии поли(метилвиниловый эфир малеинового ангидрида) декадиена кроссполимера с последующим эмульгированием расплавленного цетостеарилового спирта и полидиметилсилоксана; последовательное смешивание основы с растворами и эмульгирование в основе раствора бутилгидроксианизола в изопропилмиристате; охлаждение коллоидной дисперсии эмульгаторов, основы и препарата до комнатной температуры при перемешивании.
| US 20050232980 A1, 20.10.2005 | |||
| WO 2007117605 A2, 18.10.2007 | |||
| US 20030207897 A1, 06.11.2003 | |||
| US 20070248677 A1, 25.10.2007 | |||
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ФИБРОЗНЫХ ЗАБОЛЕВАНИЙ ЛЕГКИХ | 2010 |
|
RU2561672C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С АНТИАЛЛЕРГИЧЕСКИМ И ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ | 2004 |
|
RU2281102C2 |
| ТЕЛЕСКОПИЧЕСКИЙ ЗАЩИТНЫЙ КОЖУХ НАПРАВЛЯЮЩИХ МЕТАЛЛОРЕЖУЩИХ СТАНКОВ | 0 |
|
SU371026A1 |
Авторы
Даты
2016-04-20—Публикация
2013-04-25—Подача