ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к лекарственной дозированной форме для предпочтительно орального введения два раза в сутки, один раз в сутки или менее часто, которая содержит фармакологически активный агент в соответствии с общей формулой (I)
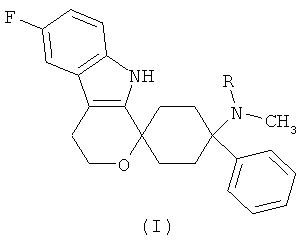 ,
,
где R представляет собой -H или -CH3 или его физиологически приемлемую соль.
Фармакологически активные агенты в соответствии с общей формулой (I) также могут обозначаться как 6′-Фтор-(N-метил- или N,N-диметил-)-4-фенил-4′,9′-дигидро-3′Н-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин. Если специально не указано иначе, этот термин также включает физиологически приемлемые соли.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Фармакологически активные агенты в соответствии с изобретением известны из уровня техники и могут вводиться орально, перорально, парентерально, внутривенно, внутрибрюшинно, внутрикожно, внутримышечно, интраназально, буккально, ректально или местно, например, на кожу, слизистые оболочки или в глаза. Соединения проявляют анальгезирующие свойства и чрезвычайно пригодны для лечения острой, висцеральной, невропатической или хронической боли (ср., например, WO 2004/043967 и WO 2008/040481).
Общепринятые болеутоляющие средства обычно доступны в виде препаратов, обеспечивающих немедленное высвобождение или в виде препаратов, обеспечивающих пролонгированное высвобождение.
С одной стороны, препараты, обеспечивающие немедленное высвобождение при оральном введении, обладают тем преимуществом, что они приводят к быстрому высвобождению обезболивающего средства в желудочно-кишечный тракт. В результате этого, сравнительно высокая доза обезболивающего средства быстро абсорбируется, что приводит к высоким уровням в плазме в течение короткого периода времени и обеспечивает быстрое начало облегчения боли, то есть обезболивающее действие начинается вскоре после введения. Это чрезвычайно желательно при острой боли.
Тем не менее, наряду с этим, обычно наблюдается быстрое уменьшение обезболивающего действия, поскольку метаболизирование и/или экскреция обезболивающего средства вызывает снижение его уровней в плазме крови. По этой причине, препараты, обеспечивающие немедленное высвобождение болеутоляющих средств, обычно необходимо вводить часто, например, восемь раз в сутки. Это не только неблагоприятно по отношению к соблюдению больным режима и схемы лечения, но также может вызывать относительно высокие пики концентрации лекарственного средства в плазме крови и высокие флуктуации между пиком и минимумом концентрации лекарственного средства в плазме крови, что, в свою очередь, может ухудшать переносимость.
С другой стороны, препараты, обеспечивающие пролонгированное высвобождение при оральном введении, обладают тем преимуществом, что их необходимо вводить менее часто, обычно один раз в сутки или два раза в сутки. Это улучшает соблюдение больным режима и схемы лечения и также может уменьшать пик концентрации лекарственного средства в плазме крови и флуктуации между пиком и минимумом концентрации лекарственного средства в плазме крови, что, в свою очередь, может улучшать переносимость.
Тем не менее, наряду с этим, высвобождение обезболивающего средства в желудочно-кишечном тракте пролонгируется. В результате этого, относительно низкая доза обезболивающего средства быстро абсорбируется, что приводит к низким уровням в плазме и обуславливает замедленное начало облегчения боли, то есть обезболивающее действие начинается довольно долго после первого введения.
Кроме того, поскольку препараты, обеспечивающие пролонгированное высвобождение обычно содержат более высокие дозы болеутоляющих средств, по сравнению с препаратами, обеспечивающими немедленное высвобождение, они могут быть связаны с более высоким риском неправильного использования. Пожилые пациенты особенно часто имеют трудности с приемом твердых лекарственных дозированных форм. Для решения этой проблемы, были разработаны различные устройства, с помощью которых твердые лекарственные дозированные формы можно измельчить или пульвелизировать ("дробилки таблеток"). Такие устройства используются, например, обслуживающим персоналом в домах престарелых. Лекарственные дозированные формы после этого вводятся людям, нуждающимся в лечении, уже не в виде таблеток и т.д., но предпочтительно в виде порошка, например, для устранения сложностей, связанных с проглатыванием таблеток. Тем не менее, измельчение лекарственных дозированных форм с помощью таких устройств является проблемным, если лекарственные дозированные формы представляют собой препараты с пролонгированным высвобождением. Как правило, измельчение впоследствии приводит к разрушению внутренней структуры лекарственной дозированной формы, которая отвечает за пролонгированное высвобождение, таким образом аннулируя действие с пролонгированным высвобождением. Следовательно, после введения, зачастую все физиологически активное вещества, которое исходно присутствует в лекарственной дозированной форме, высвобождается в течение относительно короткого периода времени, тем самым относительно очень высокая концентрация в плазме вещества неожиданно достигается в течение относительно короткого периода (дозовая разгрузка). Таким образом, препараты с исходным пролонгированным высвобождением становятся препаратами с быстрым высвобождением. Однако в зависимости от физиологического действия вещества, это может вызывать значительные побочные действия и в чрезвычайных случаях может даже приводить к смерти пациента (ср., например, J.Е. Mitchell, Oral Pharmaceutical dosage forms That Should Not Be Crushed: 2000 Update, Hospital Pharmacy, 2000; H. Miller и др., То Crush or Not to Crush, Nursing 2000; R. Griffith и др., Tablet Crushing and the law: the implications for nursing; Prof. Nurse 2003). Преднамеренное жевание препаратов с пролонгированным высвобождением также может приводить к передозировке вещества, которое в них содержится. Иногда пациенты жуют лекарственные дозированные формы умышленно, хотя часто не зная тип и назначение препарата с пролонгированным высвобождением, поскольку они надеются получить более быстрый эффект.
Также известны препараты, обеспечивающие двойной режим высвобождения, то есть комбинацию немедленного высвобождения с пролонгированным высвобождением (ср., например, С.М. Lopez и др., Compressed Matrix Core Tablet as a Quick/Slow Dual-Component Delivery System Containing Ibuprofen, AAPS PharmSciTech 2007; 8(3), E1-E8). Тем не менее, эти препараты обычно рассчитаны на единицы с быстрым высвобождением и единицы с пролонгированным высвобождением, которые местно разделены друг от друга и, следовательно, такие лекарственные дозированные формы могут быть приготовлены с помощью специфических и дорогостоящих методов.
Задачей настоящего изобретения является обеспечение лекарственных дозированных форм, содержащих 6′-Фтор-(N-метил- или N,N-диметил-)-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин, которые обладают преимуществами по сравнению с лекарственными дозированными формами, известными из уровня техники. В особенности, лекарственные дозированные формы будут обеспечивать хорошую биодоступность и быстрое облегчение боли уже после первого введения, то также будут иметь высокую переносимость, хорошее соблюдение пациентами инструкций по приему препарата и безопасность.
Эта задача решается с помощью объектов формулы изобретения.
Неожиданно было обнаружено, что 6′-Фтор-(N-метил- или N,N-диметил-)-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин имеет относительно плохую растворимость в воде. Кроме того, неожиданно было обнаружено, что несмотря на указанную плохую растворимость в воде, могут быть приготовлены лекарственные дозированные формы, которые обеспечивают немедленное высвобождение 6′-Фтор-(N-метил- или N,N-диметил-)-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амина и обеспечивают хорошую биодоступность. Более того, неожиданно было обнаружено, что 6′-Фтор-(N-метил- или N,N-диметил-)-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин имеет относительно большой фармакокинетический период полувыведения (t1/2) и следовательно, обеспечивает фармакологическую активность в течение сравнительно продолжительного периода времени после введения.
Таким образом, неожиданно было обнаружено, что при предпочтительно оральном введении лекарственной дозированной формы, содержащей фармакологически активный агент в соответствии с изобретением, может быть достигнуто быстрое начало облегчения боли с последующим пролонгированным обезболивающим эффектом, несмотря на то или даже если лекарственная дозированная форма обеспечивает немедленное высвобождение. Следовательно, лекарственная дозированная форма в соответствии с изобретением объединяет благоприятные свойства общепринятых препаратов, обеспечивающих немедленное высвобождение - быстрое облегчение боли благодаря достаточно высокой концентрации активного компонента сразу после введения фармацевтической композиции - с благоприятными свойствами общепринятых препаратов, обеспечивающих пролонгированное высвобождение - продолжительное обезболивающее действие благодаря достаточно высокому уровню активного компонента в течение пролонгированного времени, и в то же время даже преодолевая недостатки указанных общепринятых препаратов. Принимая фармакологически активный агент в препарате в соответствии с изобретением, пациент может эффективно бороться со своей болью остро и, в то же время, лечить, если эффективно в течение пролонгированного периода без дополнительных измерений и только путем регулярного введения через 12 (или например, 24) часовые интервалы.
Является чрезвычайно неожиданным, что лекарственная дозированная форма в соответствии с изобретением не только предоставляет возможность фармакологически активному агенту начинать поступать быстро в плазму при первом введении лекарственной дозированной формы, что приводит к быстрому началу облегчения боли у пациента благодаря немедленному высвобождению, но в то же время обеспечивает продолжительную терапевтическую эффективность в течение относительно длительного периода (по меньшей мере 12 часов). Следовательно, боль, от которой страдает пациент, может быть быстро облегчена при введении лекарственной дозированной формы в соответствии с изобретением без быстрого повторного снижения обезболивающего действия.
Лекарственная дозированная форма в соответствии с изобретением обеспечивает хорошее соблюдение больным режима и схемы лечения и безопасность. Даже если лекарственная дозированная форма в соответствии с изобретением изменяется, например, с помощью дробилки таблеток, дозовая разгрузка не может произойти - измельчение лекарственной дозированной формы дополнительно не усиливает кривую немедленного высвобождения.
На фигуре 1 показана кривая высвобождения фармакологически активного агента в соответствии с общей формулой (I′b) из чистой твердой формы отдельно (А), из твердых препаратов, содержащих активный компонент и полимер (Коллидон 90; В) и из твердых растворов, содержащих активный компонент, полимер (Коллидон 90 или Коллидон VA 64) и поверхностно-активное вещество (Плюроник F68 или Твин 80; С-Е) в соляной кислоте (0,1 н.). На оси Х указано время в минутах и ось Y относится к количеству растворенного активного вещества в процентах относительно общего количества активного вещества, которое исходно присутствует в дозированной форме.
На фигуре 2 показана кривая высвобождения фармакологически активного агента в соответствии с общей формулой (ГЬ) из чистой твердой формы отдельно (А), из твердого препарата, содержащего активный компонент и полимер (Коллидон VA64; В) и из твердых растворов, содержащих активный компонент, полимер (Коллидон VA 64) и поверхностно-активное вещество (Твин 80; С) в соляной кислоте (0,1 н.). На оси X указано время в минутах и ось Y относится к количеству растворенного активного вещества в процентах относительно общего количества активного вещества, которое исходно присутствует в дозированной форме.
На фигуре 3 показана рентгеновская порошковая дифрактограмма твердого раствора, содержащего фармакологически активный агент в соответствии с общей формулой (I′b), полимер Коллидон VA64 и поверхностно-активное вещество Твин 80 перед проведением теста устойчивости при хранении.
На фигуре 4 показана рентгеновская порошковая дифрактограмма твердого раствора, содержащего фармакологически активный агент в соответствии с общей формулой (I′b), полимер Коллидон VA64 и поверхностно-активное вещество Твин 80 после хранения в течение 4 недель при 25°C и относительной влажности 60%.
На фигуре 5 показана рентгеновская порошковая дифрактограмма твердого раствора, содержащего фармакологически активный агент в соответствии с общей формулой (I′b), полимер Коллидон VA64 и поверхностно-активное вещество Твин 80 после хранения в течение 4 недель при 30°C и относительной влажности 65%.
На фигуре 6 показаны средние значения цифровой рейтинговой шкалы, измеренные в течение 24-х часового периода после введения различных одноразовых доз соединения в соответствии с формулой (I′b) (200, 400, 600 мкг) по сравнению с морфином и плацебо у пациентов с острой послеоперационной болью после ортопедической хирургии (бурсэктомия).
Изобретение относится к лекарственной дозированной форме, содержащей фармакологически активный агент в соответствии с общей формулой (I)
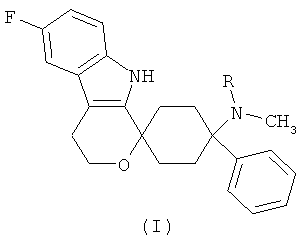 ,
,
где R представляет собой -H или -CH3
или его физиологически приемлемую соль;
указанная лекарственная дозированная форма предназначена для введения два раза в сутки, один раз в сутки или менее часто.
Фармакологически активный агент в соответствии с общей формулой (I) также может обозначаться как "6′-фтор-N-метил-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин", где R представляет собой -H и "6′-фтор-N,N-диметил-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин", где R представляет собой -CH3; для целей настоящей заявки, фармакологически активный агент в соответствии с общей формулой (I) также может обозначаться как "6′-фтор-(N-метил- или N,N-диметил-)-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин".
В предпочтительном варианте осуществления, фармакологически активный агент в соответствии с общей формулой (I) имеет стереохимию в соответствии с общей формулой (I′)
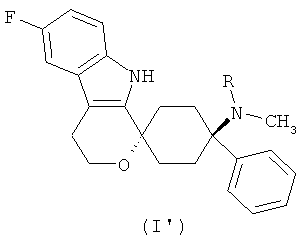 ,
,
где R представляет собой -H или -CH3 или его физиологически приемлемую соль.
В другом варианте осуществления лекарственной дозированной формы в соответствии с изобретением, соединение формулы (I) выбирают из 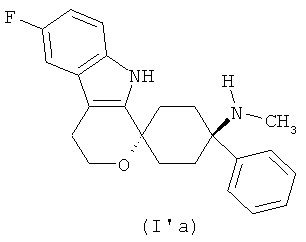
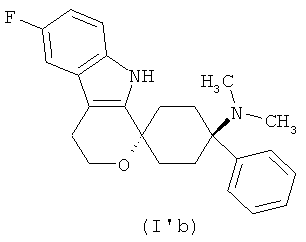
в форме свободного основания или его физиологически приемлемой соли.
Свободное основание в соответствии с общей формулой (I′a) может быть систематически обозначено как "1,1-(3-метиламино-3-фенилпентаметилен)-6-фтор-1,3,4,9-тетрагидропирано[3,4-b]индол (транс)" или как "(1r,4r)-6′-фтор-N-метил-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин", соответственно.
Свободное основание в соответствии с общей формулой (I′b) может быть систематически обозначено как "1,1-(3-диметиламино-3-фенилпентаметилен)-6-фтор-1,3,4,9-тетрагидропирано[3,4-b]индол (транс)" или как "(1r,4r)-6′-фтор-N,N-диметил-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин", соответственно.
Определение фармакологически активного агента в соответствии с общей формулой (I), как используется в настоящей заявке, включает 6′-фтор-(N-метил-или N,N-диметил-)-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин, его производные и его стереоизомеры в любой возможной форме, таким образом предпочтительно включая сольваты и полиморфы, соли, в частности соли присоединения кислот и соответствующие сольваты и полиморфы.
В предпочтительном варианте осуществления, фармакологически активный агент в соответствии с общей формулой (I) представлен в виде отдельного диастереомера в соответствии с общей формулой (I′).
В другом предпочтительном варианте осуществления фармакологически активный агент в соответствии с общей формулой (I) представлен в виде смеси диастереомеров. Такая смесь может содержать диастереомеры в любом соотношении. Диастереомерная смесь может, например, содержать диастереомеры в соотношении 60±5:40±5, 70±5:30±5, 80±5:20±5 или 90±5:10±5. Предпочтительно, лекарственная дозированная форма в соответствии с изобретением содержит диастереомер в соответствии с общей формулой (I′) в диастереомерном избытке (de) по меньшей мере 50%de, более предпочтительно по меньшей мере 60%de, еще более предпочтительно по меньшей мере 70%de, также более предпочтительно по меньшей мере 80%de, даже более предпочтительно по меньшей мере 90%de, наиболее предпочтительно по меньшей мере 95%de и в особенности по меньшей мере 98%de, по отношению к другому диастереомеру (то есть транс отн. цис и анти отн. син, соответственно).
6′-Фтор-(N-метил- или N,N-диметил-)-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин может присутствовать в лекарственной дозированной форме в соответствии с изобретением в форме свободного основания или в форме соли присоединения кислоты, таким образом можно использовать любую подходящую кислоту, способную образовывать такую соль присоединения.
Превращение 6′-Фтор-(N-метил- или N,N-диметил-)-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амина в соответствующую соль присоединения, например, путем реакции с подходящей кислотой можно осуществлять с помощью способа, хорошо известному специалисту в данной области техники. Подходящие кислоты включают, но не ограничиваясь только ими, соляную кислоту, бромистоводородную кислоту, серную кислоту, метансульфоновую кислоту, муравьиную кислоту, уксусную кислоту, щавелевую кислоту, янтарную кислоту, винную кислоту, миндальную кислоту, фумаровую кислоту, молочную кислоту, лимонную кислоту, глутаминовую кислоту и/или аспарагиновую кислоту. Образование соли предпочтительно осуществляют в растворителе, например, диэтиловом эфире, диизопропиловом эфире, алкил ацетатах, ацетоне и/или 2-бутаноне. Кроме того, триметилхлорсилан в водном растворе также пригоден для приготовления гидрохлоридов.
Фармакологически активный агент в соответствии с общей формулой (I) содержится в лекарственной дозированной форме в терапевтически эффективном количестве. Количество, которое составляет терапевтически эффективное количество, изменяется в зависимости от соединения, состояния, подвергаемого лечению, тяжести указанного состояния, пациента, подвергаемого лечению, и от того, создана ли лекарственная дозированная форма для немедленного или ретардированного высвобождения.
В предпочтительном варианте осуществления, содержание фармакологически активного агента в соответствии с общей формулой (I) в лекарственной дозированной форме в соответствии с изобретением составляет самое большее 95 мас.%, более предпочтительно самое большее 50 мас.%, также более предпочтительно самое большее 25 мас.%, еще более предпочтительно самое большее 10 мас.%, даже более предпочтительно самое большее 5 мас.%, наиболее предпочтительно самое большее 1,0 мас.% и в особенности самое большее 0,5 мас.%.
В другом предпочтительном варианте осуществления, содержание фармакологически активного агента в соответствии с общей формулой (I) в лекарственной дозированной форме в соответствии с изобретением составляет по меньшей мере 0,001 мас.%, более предпочтительно по меньшей мере 0,005 мас.%, также более предпочтительно по меньшей мере 0,01 мас.%, еще более предпочтительно по меньшей мере 0,05 мас.%, даже более предпочтительно по меньшей мере 0,1 мас.%, наиболее предпочтительно по меньшей мере 0,5 мас.% и в особенности по меньшей мере 1,0 мас.%.
Если четко не указано иначе, в контексте настоящего изобретения указание "мас.%" будет обозначать вес соответствующего ингредиента на общий вес лекарственной дозированной формы. В случае, если лекарственная дозированная форма имеет пленочную оболочку или инкапсулирована с помощью инкапсулирующей среды, которая не содержит какого-либо количества фармакологически активного агента в соответствии с общей формулой (I) и окружена ядром, которое, в свою очередь, содержит общее количество фармакологически активного агента в соответствии с общей формулой (I), указание "мас.%" будет обозначать вес соответствующего ингредиента на общий вес композиции, образующей указанное ядро.
Если лекарственная дозированная форма инкапсулирована или имеет пленочную оболочку, то фармакологически активный агент в соответствии с общей формулой (I) предпочтительно гомогенно распределен в ядре лекарственной дозированной формы. Предпочтительно, инкапсулирующая среда или пленочная оболочка не содержит какого-либо фармакологически активного агента в соответствии с общей формулой (I).
Доза фармакологически активного агента в соответствии с общей формулой (I) предпочтительно находится в пределах от 0,1 мкг до 5000 мкг, более предпочтительно в пределах от 0,1 мкг до 1000 мкг и наиболее предпочтительно в пределах от 1,0 мкг до 100 мкг или в пределах от 30 мкг до 600 мкг.
В предпочтительном варианте осуществления, содержание фармакологически активного агента в соответствии с общей формулой (I) в лекарственной дозированной форме находится в диапазоне 25±20 мкг, более предпочтительно 25±15 мкг, еще более предпочтительно 25±10 мкг и наиболее предпочтительно 25±5 мкг.
В другом предпочтительном варианте осуществления, содержание фармакологически активного агента в соответствии с общей формулой (I) в лекарственной дозированной форме находится в диапазоне 40±35 мкг, более предпочтительно 40±30 мкг, еще более предпочтительно 40±25 мкг, также более предпочтительно 40±20 мкг, даже более предпочтительно 40±15 мкг, наиболее предпочтительно 40±10 мкг и в особенности 40±5 мкг.
В еще другом предпочтительном варианте осуществления, содержание фармакологически активного агента в соответствии с общей формулой (I) в лекарственной дозированной форме находится в диапазоне 50±35 мкг, более предпочтительно 50±30 мкг, еще более предпочтительно 50±25 мкг, также более предпочтительно 50±20 мкг, даже более предпочтительно 50±15 мкг, наиболее предпочтительно 50±10 мкг и в особенности 50±5 мкг.
В другом также предпочтительном варианте осуществления, содержание фармакологически активного агента в соответствии с общей формулой (I) в лекарственной дозированной форме находится в диапазоне 60±35 мкг, более предпочтительно 60±30 мкг, еще более предпочтительно 60±25 мкг, также более предпочтительно 60±20 мкг, даже более предпочтительно 60±15 мкг, наиболее предпочтительно 60±10 мкг и в особенности 60±5 мкг.
В другом предпочтительном варианте осуществления, содержание фармакологически активного агента в соответствии с общей формулой (I) в лекарственной дозированной форме находится в диапазоне 100±90 мкг, более предпочтительно 100±80 мкг, еще более предпочтительно 100±60 мкг, также более предпочтительно 100±40 мкг, даже более предпочтительно 100±20 мкг, наиболее предпочтительно 100±10 мкг и в особенности 100±5 мкг.
В еще другом предпочтительном варианте осуществления, содержание фармакологически активного агента в соответствии с общей формулой (I) в лекарственной дозированной форме находится в диапазоне 200±175 мкг, более предпочтительно 200±150 мкг, еще более предпочтительно 200±125 мкг, также более предпочтительно 200±100 мкг, даже более предпочтительно 200±75 мкг, наиболее предпочтительно 200±50 мкг и в особенности 200±25 мкг.
В другом также предпочтительном варианте осуществления, содержание фармакологически активного агента в соответствии с общей формулой (I) в лекарственной дозированной форме находится в диапазоне 400±350 мкг, более предпочтительно 400±300 мкг, еще более предпочтительно 400±250 мкг, также более предпочтительно 400±200 мкг, даже более предпочтительно 400±150 мкг, наиболее предпочтительно 400±100 мкг и в особенности 400±50 мкг.
В предпочтительном варианте осуществления лекарственная дозированная форма предназначена для применения для лечения острой боли, где доза фармакологически активного агента в соответствии с общей формулой (I) предпочтительно находится в пределах от 50 мкг до 3000 мкг, более предпочтительно в пределах от 100 мкг до 1000 мкг, даже более предпочтительно в пределах от 300 мкг до 500 мкг и наиболее предпочтительно в пределах от 350 мкг до 450 мкг.
В другом предпочтительном варианте осуществления, лекарственная дозированная форма предназначена для применения для лечения острой боли, где доза фармакологически активного агента в соответствии с общей формулой (I) предпочтительно находится в пределах от 200 мкг до 400 мкг и в особенности в пределах от 250 мкг до 350 мкг.
Для целей настоящей заявки, выражение "предназначена для применения для лечения боли" эквивалентно выражению "адаптирована для применения для лечения боли".
В предпочтительном варианте осуществления, лекарственная дозированная форма предназначена для применения для лечения острой боли, где доза фармакологически активного агента в соответствии с общей формулой (I) предпочтительно находится в пределах от 200 мкг до 400 мкг и в особенности в пределах от 250 мкг до 350 мкг.
В предпочтительном варианте осуществления, лекарственная дозированная форма предназначена для применения для лечения острой боли, где доза фармакологически активного агента в соответствии с общей формулой (I) предпочтительно находится в пределах от 250 мкг до 450 мкг и в особенности в пределах от 300 мкг до 400 мкг.
В другом предпочтительном варианте осуществления, лекарственная дозированная форма предназначена для применения для лечения острой боли, где доза фармакологически активного агента в соответствии с общей формулой (I) предпочтительно находится в пределах от 300 мкг до 500 мкг и в особенности в пределах от 350 мкг до 450 мкг.
В другом также предпочтительном варианте осуществления, лекарственная дозированная форма предназначена для применения для лечения острой боли, где доза фармакологически активного агента в соответствии с общей формулой (I) предпочтительно находится в пределах от 350 мкг до 550 мкг и в особенности в пределах от 400 мкг до 500 мкг.
В также другом предпочтительном варианте осуществления, лекарственная дозированная форма предназначена для применения для лечения острой боли, где доза фармакологически активного агента в соответствии с общей формулой (I) предпочтительно находится в пределах от 400 мкг до 600 мкг и в особенности в пределах от 450 мкг до 550 мкг.
В другом предпочтительном варианте осуществления лекарственная дозированная форма предназначена для применения для лечения хронической боли, где доза фармакологически активного агента в соответствии с общей формулой (I) предпочтительно находится в пределах от 0,1 мкг до 500 мкг, более предпочтительно в пределах от 1 мкг до 250 мкг, даже более предпочтительно в пределах от 5 мкг до 100 мкг и наиболее предпочтительно в пределах от 10 мкг до 50 мкг.
В предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением предназначена для орального введения, то есть лекарственная дозированная форма адаптирована для орального введения. Подходящие альтернативные пути введения лекарственной дозированной формы в соответствии с изобретением включают, но не ограничиваясь только ими, вагинальное и ректальное введение.
Лекарственная дозированная форма в соответствии с изобретением предназначена для введения два раза в сутки, один раз в сутки или менее часто, то есть лекарственная дозированная форма адаптирована для введения два раза в сутки, один раз в сутки или менее часто.
В предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением предназначена для введения два раза в сутки.
Для целей настоящей заявки, "введение два раза в сутки" (bid) предпочтительно обозначает, что лекарственная дозированная форма адаптирована для введения в соответствии со схемой, включающей введение первой лекарственной дозированной формы в соответствии с изобретением и последующее введение второй лекарственной дозированной формы в соответствии с изобретением, где обе, первая и вторая лекарственные дозированные формы вводятся в течение промежутка времени приблизительно 24 часа, но где вторая лекарственная дозированная форма вводится не раньше, чем через 6 часов, предпочтительно не раньше, чем через 8 часов, более предпочтительно не раньше, чем через 10 часов и в особенности, приблизительно через 12 часов после введения первой лекарственной дозированной формы.
В другом предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением предназначена для введения один раз в сутки.
Для целей настоящей заявки, "введение один раз в сутки" (sid) предпочтительно обозначает, что лекарственная дозированная форма адаптирована для введения в соответствии со схемой, включающей введение первой лекарственной дозированной формы в соответствии с изобретением и последующее введение второй лекарственной дозированной формы в соответствии с изобретением, где обе, первая и вторая лекарственные дозированные формы вводятся в течение промежутка времени приблизительно 48 часов, но где вторая лекарственная дозированная форма вводится не раньше, чем через 18 часов, предпочтительно не раньше, чем через 20 часов, более предпочтительно не раньше, чем через 22 часов и в особенности, приблизительно через 24 часа после введения первой лекарственной дозированной формы.
В другом предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением предназначена для введения один раз в сутки или менее часто.
В другом предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением предназначена для введения менее часто чем один раз в сутки, предпочтительно три раза в течение четырех дней (3/4), два раза в течение трех дней (2/3), три раза в течение пяти дней (3/5), один раз в течение двух дней (1/2), три раза в неделю (3/7), два раза в течение пяти дней (2/5), один раз в течение трех дней (1/3), два раза в неделю (2/7), один раз в течение четырех дней (1/4), один раз в течение пяти дней (1/5), один раз в течение шести дней (1/6) или один раз в неделю (1/7). В соответствии с этим вариантом осуществления, введение один раз в течение двух дней (1/2) является особенно предпочтительным.
Для специалиста в данной области техники совершенно очевидно, что схемы введения "два раза в сутки, один раз в сутки или менее часто" могут быть реализованы путем введения одной лекарственной дозированной формы, содержащей суммарное количество фармакологически активного агента в соответствии с общей формулой (I) для введения в конкретный момент времени или, альтернативно, введения множества дозированных единиц, то есть двух, трех или большего количества дозированных единиц, сумма такого множества дозированных единиц содержит суммарное количество фармакологически активного агента в соответствии с общей формулой (I) для введения в указанный конкретный момент времени, где индивидуальные дозированные единицы предназначены для одновременного введения или введения в течение короткого периода времени, например, в пределах 5, 10 или 15 минут.
Предпочтительно, лекарственная дозированная форма в соответствии с изобретением обеспечивает немедленное высвобождение фармакологически активного агента в соответствии с общей формулой (I). Предпочтительно, лекарственная дозированная форма специфически создана для обеспечения немедленного высвобождения фармакологически активного агента в соответствии с общей формулой (I) in vitro в соответствии с Европейской фармакопеей Если лекарственная дозированная форма покрыта, например, оболочкой, которая растворима в желудочном соке, то за кинетикой высвобождения предпочтительно наблюдают после растворения такого покрытия.
В соответствии с описанием, термин "немедленное высвобождение" относится к любой кривой высвобождения, которая соответствует по меньшей мере одному, предпочтительно обоим, следующим требованиям. Во-первых, лекарственная дозированная форма распадается в течение 10 минут или меньше после воздействия дезинтегрирующей среды. Способы определения времени распадаемости известны специалисту в данной области техники. Например, они могут быть определены в соответствии с USP XXIV теста на распадаемость, используя, например, Erweka ZT-71 прибор для определения распадаемости. Во-вторых, лекарственная дозированная форма высвобождает по меньшей мере 70 мас.% лекарственного средства в течение 15 минут после воздействия среды растворения. Предпочтительно, in vitro свойства высвобождения лекарственной дозированной формы в соответствии с изобретением определяют в соответствии со способом с использованием лопастной мешалки с синкером при 50, 75 или 100 об/мин, предпочтительно в условиях in vitro при 37±0,5°C в 900 мл искусственного желудочного сока при pH 1,2 или в идентичных условиях в неискусственном желудочном соке.
В предпочтительном варианте осуществления, лекарственная дозированная форма высвобождает в условиях in vitro в 900 мл искусственного желудочного сока при pH 1,2 и 37±0,5°C через 30 минут в соответствии со способом с использованием лопастной мешалки с синкером при 100 об/мин по меньшей мере 50 мас.%, более предпочтительно по меньшей мере 60 мас.%, еще более предпочтительно по меньшей мере 70 мас.%, также более предпочтительно по меньшей мере 80 мас.%, наиболее предпочтительно по меньшей мере 90 мас.% и в особенности по меньшей мере 95 мас.% фармакологически активного агента в соответствии с общей формулой (I), исходя из общего количества фармакологически активного агента в соответствии с общей формулой (I), которое исходно присутствует в лекарственной дозированной форме.
Лекарственная дозированная форма в соответствии с изобретением проявляет чрезвычайно хорошие срок годности при хранении и стабильность при хранении, то есть ни химический состав, ни физические характеристики, ни профиль растворимости лекарственной дозированной формы существенно не изменяются при хранении.
В предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением обеспечивает достаточно стабильна по отношению к фармакологически активному агенту в соответствии с общей формулой (I), которое в них содержится, таким образом, что после хранения лекарственной дозированной формы при 40±2°C при 75% OB ±5% в течение минимально периода времени 6 недель, предпочтительно 3 месяца, концентрации нежелательных продуктов разложения и примесей, соответственно, предпочтительно вследствие распада или разложения фармакологически активного агента в соответствии с общей формулой (I) фактически, составляет самое большее 1,0 мас.%, более предпочтительно самое большее 0,8 мас.%, еще более предпочтительно самое большее 0,6 мас.%, также более предпочтительно самое большее 0,4 мас.%, даже более предпочтительно самое большее 0,2 мас.%, наиболее предпочтительно самое большее 0,1 мас.% и в особенности самое большее 0,05 мас.%, относительно первоначального содержания фармакологически активного агента в соответствии с общей формулой (I) в лекарственной дозированной форме, то есть его содержания перед хранением лекарственной дозированной формы.
Было обнаружено, что фармакологически активный агент в соответствии с общей формулой (I) может разлагаться путем удаления группы -NRCH3, таким образом получая 6′-фтор-4-фенил-4′,9′-дигидро-3′H-спиро[циклогекс-3-ен-1,1′-пирано[3,4-b]индол], который, предположительно, является фармакологически неактивным. Предпочтительно, после хранения лекарственной дозированной формы при 40±2°C и 75% OB ±5% или при 25±2°C и 60% OB ±5%, в течение минимально периода времени 6 недель, предпочтительно 3 месяца, концентрация 6′-фтор-4-фенил-4′,9′-дигидро-3′H-спиро[циклогекс-3-ен-1,1′-пирано[3,4-b]индол]а составляет самое большее 1,0 мас.%, более предпочтительно самое большее 0,8 мас.%, еще более предпочтительно самое большее 0,6 мас.%, также более предпочтительно самое большее 0,4 мас.%, даже более предпочтительно самое большее 0,2 мас.%, наиболее предпочтительно самое большее 0,1 мас.% и в особенности самое большее 0,05 мас.%, относительно первоначального содержания фармакологически активного агента в соответствии с общей формулой (I) в лекарственной дозированной форме, то есть его содержания перед хранением лекарственной дозированной формы.
Общепринятое ускоренное испытание для определения стабильности лекарственного средства в соответствии с ICH и FDA руководствами относится к хранению фармацевтического препарата, содержащего лекарственное средство (например, в его контейнере и упаковке). В соответствии с ICH руководствами, так называемое определение ускоренного хранения может быть осуществлено для фармацевтических препаратов при 40±2°C при 75% OB ±5% в течение минимально периода времени 6 месяцев. Дополнительно, так называемое исследование долговременного хранения может быть осуществлено для фармацевтических препаратов при 25±2°C при не менее чем 60% OB ±5% в течение минимально периода времени 12 месяцев. В случае, если все критерии удовлетворяются для условий определения ускоренного хранения и исследования долговременного хранения в течение периода 6 месяцев, исследование долговременного хранения может быть сокращено до 6 месяцев и соответствующие данные удвоены для получения предполагаемых данных для периода 12 месяцев.
При хранении, образцы фармацевтического препарата отбирают в указанные промежутки времени и анализируют относительно их содержания лекарственного средства, присутствия примесей, их кривых высвобождения и, в случае необходимости, других параметров. В соответствии с ICH руководствами, во всех образцах чистота лекарственного средства должна составлять ≥98%, содержание лекарственного средства должно составлять 95-105% (FDA руководство: 90-110%). Кроме того, фармацевтический препарат должен высвобождать >80% лекарственного средства в течение 30 минут.
В случае таблеток и капсул, которые содержат менее 50 мг лекарственного средства, дополнительно необходимо провести исследование однородности состава для 10 случайно выбранных дозированных форм. Фармацевтический препарат соответствует, если ни одно из содержимого индивидуальных единиц не выходит за пределы от 85% до 115% среднего содержимого. В случае, если содержимое индивидуальной единицы выходит за эти пределы, анализируют другие 30 капсул. Препарат не проходит тест, если более, чем 3 содержимого индивидуальных единиц выходят за пределы от 85 до 115% среднего содержимого или, если одно или больше содержимого индивидуальных единиц выходят за пределы от 75% до 125% среднего содержимого.
В предпочтительном варианте осуществления, после хранения лекарственной дозированной формы в течение 6 месяцев в условиях долговременного хранения (25°C и 60% относительная влажность) в запечатанном стеклянном контейнере, деградация фармакологически активного агента в соответствии с общей формулой (I) не превышает 2,0%, более предпочтительно 1,5%, еще более предпочтительно 1,0% и наиболее предпочтительно 0,5%.
В другом предпочтительном варианте осуществления, после хранения лекарственной дозированной формы в течение 6 месяцев в условиях ускоренного хранения (40°C и 75% относительная влажность) в запечатанном стеклянном контейнере, деградация фармакологически активного агента в соответствии с общей формулой (I) не превышает 4%, более предпочтительно 3%, еще более предпочтительно 2%, также более предпочтительно 1% и наиболее предпочтительно 0,5%.
Предпочтительно, после хранения лекарственной дозированной формы в течение 6 месяцев в условиях долговременного хранения (25°C и 60% относительная влажность), лекарственная дозированная форма высвобождает в условиях in vitro в 900 мл искусственного желудочного сока при pH 1,2 и 37±0,5°C через 30 минут в соответствии со способом с использованием лопастной мешалки с синкером при 100 об/мин по меньшей мере 50 мас.%, более предпочтительно по меньшей мере 60 мас.%, еще более предпочтительно по меньшей мере 70 мас.% и наиболее предпочтительно по меньшей мере 80 мас.% фармакологически активного агента в соответствии с общей формулой (I), исходя из общего количества фармакологически активного агента в соответствии с общей формулой (I), которое исходно присутствует в лекарственной дозированной форме.
Предпочтительно, после хранения лекарственной дозированной формы в течение 6 месяцев в условиях ускоренного хранения (40°C и 75% относительная влажность), лекарственная дозированная форма высвобождает в условиях in vitro в 900 мл искусственного желудочного сока при pH 1,2 и 37±0,5°C через 30 минут в соответствии со способом с использованием лопастной мешалки с синкером при 100 об/мин по меньшей мере 50 мас.%, более предпочтительно по меньшей мере 60 мас.%, еще более предпочтительно по меньшей мере 70 мас.% и наиболее предпочтительно по меньшей мере 80 мас.% фармакологически активного агента в соответствии с общей формулой (I), исходя из общего количества фармакологически активного агента в соответствии с общей формулой (I), которое исходно присутствует в лекарственной дозированной форме.
Абсорбционные свойства фармакологически активного агента, вводимого с помощью лекарственной дозированной формы, могут быть описаны с помощью фармакокинетических параметров Cmax, tmax и AUC0-t. Определение Cmax и tmax, a также рассчет AUC хорошо известны специалисту в данной области техники и описаны, например, в Bauer, Frömming, Führer, "Lehrbuch der Pharmazeutischen Technologie," 6ое издание (1999) и в Shargel, Wu-Pong, Yu, "Applied Biopharmaceuticals & Pharmacokinetics," 5oe издание (2005).
Существуют экспериментально полученные данные, указывающие на то, что AUC0-t и Cmax фармакологически активного агента в соответствии с общей формулой (I) пропорциональны дозе.
Для целей настоящей заявки, Cmax представляет собой наибольшую концентрацию в плазме фармакологически активного агента, достигаемую после однократного введения лекарственной дозированной формы.
Для целей настоящей заявки, tmax представляет собой время, необходимое для достижения Cmax.
Для целей настоящей заявки, AUC0-t представляет собой площадь под кривой после однократного введения до времени t последнего образца, которые содержит аналитически определяемую концентрацию фармакологически активного агента.
Для целей настоящей заявки, AUC0-72h представляет собой площадь под исходной кривой после однократного введения до 72 часов после этого.
Предпочтительно, соотношение Cmax / дозу находится в диапазоне от 0,01 до 3,00 м-3, также более предпочтительно в диапазоне от 0,02 до 2,50 м-3, более предпочтительно в диапазоне от 0,04 до 2,00 м-3 и наиболее предпочтительно в диапазоне от 0,06 до 1,69 м-3. В предпочтительном варианте осуществления, соотношение Cmax / дозу находится в диапазоне 0,40±0,35 м-3, более предпочтительно 0,40±0,30 м-3, еще более предпочтительно 0,40±0,25 м-3, также более предпочтительно 0,40±0,20 м-3, даже более предпочтительно 0,40±0,15 м-3, наиболее предпочтительно 0,40±0,10 м-3 и в особенности 0,40±0,05 м-3. В другом предпочтительном варианте осуществления, соотношение Cmax / дозу находится в диапазоне 0,80±0,70 м-3, более предпочтительно 0,80±0,60 м-3, еще более предпочтительно 0,80±0,50 м-3, также более предпочтительно 0,80±0,40 м-3, даже более предпочтительно 0,80±0,30 м-3, наиболее предпочтительно 0,80±0,20 м"3 и в особенности 0,80±0,10 м-3. В еще другом предпочтительном варианте осуществления, соотношение Cmax / дозу находится в диапазоне 1,20±1,05 м-3, более предпочтительно 1,20±0,90 м-3, еще более предпочтительно 1,20±0,75 м-3, также более предпочтительно 1,20±0,60 м-3, даже более предпочтительно 1,20±0,45 м-3, наиболее предпочтительно 1,20±0,30 м-3 и в особенности 1,20±0,15 м-3.
Предпочтительно, tmax находится в диапазоне от 15 минут до 24 ч, еще более предпочтительно в диапазоне от 20 минут до 20 ч, также более предпочтительно в диапазоне от 0,5 до 16 ч, наиболее предпочтительно в диапазоне от 1 до 12 ч и в особенности в диапазоне от 2 до 10 ч. В предпочтительном варианте осуществления, tmax находится в диапазоне 4±3,5 ч, более предпочтительно 4±3 ч, еще более предпочтительно 4±2,5 ч, также более предпочтительно 4±2 ч, даже более предпочтительно 4±1,5 ч, наиболее предпочтительно 4±1 ч и в особенности 4±0,5 ч. В другом предпочтительном варианте осуществления, tmax находится в диапазоне 8±7 ч, более предпочтительно 8±6 ч, еще более предпочтительно 8±5 ч, также более предпочтительно 8±4 ч, даже более предпочтительно 8±3 ч, наиболее предпочтительно 8±2 ч и в особенности 8±1 ч. В еще другом предпочтительном варианте осуществления, tmax находится в диапазоне 12±11 ч, более предпочтительно 12±9 ч, еще более предпочтительно 12±7 ч, также более предпочтительно 12±5 ч, даже более предпочтительно 12±3 ч, наиболее предпочтительно 12±2 ч и в особенности 12±1 ч.
Предпочтительно, соотношение AUC0-t / дозу находится в диапазоне от 0,3 до 20 ч/м3, более предпочтительно в диапазоне от 0,4 до 18 ч/м3, еще более предпочтительно в диапазоне от 0,5 до 16,5 ч/м3 и наиболее предпочтительно в диапазоне от 0,55 до 12,5 ч/м3. В предпочтительном варианте осуществления, соотношение AUC0-t / дозу находится в диапазоне 3±2,5 ч/м3, более предпочтительно 3±2 ч/м3, еще более предпочтительно 3±1,5 ч/м3, также более предпочтительно 3±1 ч/м3, даже более предпочтительно 3±0,75 ч/м3, наиболее предпочтительно 3±0,5 ч/м3 и в особенности 3±0,25 ч/м3. В другом предпочтительном варианте осуществления, соотношение AUC0-t / дозу находится в диапазоне 6±5 ч/м3, более предпочтительно 6±4 ч/м3, еще более предпочтительно 6±3 ч/м3, также более предпочтительно 6±2 ч/м3, даже более предпочтительно 6±1,5 ч/м3, наиболее предпочтительно 6±1 ч/м3 и в особенности 6±0,5 ч/м3. В еще другом предпочтительном варианте осуществления, соотношение AUC0-t / дозу находится в диапазоне 9±8 ч/м3, более предпочтительно 9±7 ч/м3, еще более предпочтительно 9±5 ч/м3, также более предпочтительно 9±4 ч/м3, даже более предпочтительно 9±3 ч/м3, наиболее предпочтительно 9±2 ч/м3 и в особенности 9±1 ч/м3.
В предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением является монолитной.
В другом предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением содержит ядро, которое окружено оболочкой или инкапсулирующим материалом. В предпочтительном варианте осуществления, ядро представляет собой жидкость и фармакологически активный агент в соответствии с общей формулой (I) диспергирован, предпочтительно растворен в жидкости.
Предпочтительно, лекарственная дозированная форма в соответствии с изобретением обеспечивает фармакологически активный агент в соответствии с общей формулой (I) в форме само-(микро) эмульгирующих систем доставки лекарственных средств, твердых растворов, наночастиц, циклодекстриновых комплексов, липосом, мицелл, микронизированных и/или аморфных структур.
В общих чертах, варианты для приготовления препарата плохо растворимых в воде лекарственных средств включают кристаллические твердые, аморфные и липидные препараты.
Скорость растворения фармакологически активного агента из кристаллических препаратов может быть повышена путем уменьшения размера частиц, таким образом повышая площадь поверхности для растворения, например, с помощью общепринятой микронизации фармакологически активного агента до размера частиц приблизительно 2-5 мкм. В некоторых случаях, этого недостаточно и применяют технологию нанокристаллов. Нанокристаллы имеют размер частиц 100-250 нм, который может быть получен с помощью измельчения в шаровой мельнице или с помощью технологии плотного газа или сверхкритической жидкости.
Твердые растворы обеспечивают и поддерживают фармакологически активный агент в аморфном или полу-аморфном состоянии, иммобилизированном на полимере. Аморфные раствор могут содержать поверхностно-активные вещества и полимеры, таким образом обеспечивая поверхностную активность в процессе дисперсии при контактировании с водой. Твердые растворы могут быть образованы с использованием различных технологий, таких как распылительная сушка и экструзия расплава.
Липидные препараты, проявляющие различные характеристики, можно использовать для диспергирования и образования мицеллярных растворов, включая простые растворы и само-эмульгирующие системы доставки лекарственных средств (SEDDS). В зависимости наполнителей, для одних требуется переваривание (например, простые маслянистые жидкости), другие легко могут быть абсорбированы без переваривания. Липидные препараты могут быть классифицированы в соответствии с системой классификации липидных препаратов (LFCS) следующим образом:
Другим вариантом является образование циклодекстриновых комплексов, в которых фармакологически активный агент расположен в полости циклодекстрина и поэтому присутствует в более растворимой форме в присутствии водной среды. Успех подгонки существенным образом зависит от качества циклодекстринов, а также от физико-химических свойств и размера фармакологически активного агента.
В предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением может рассматриваться как самоэмульгирующаяся система доставки лекарственного средства (SEDDS).
С этой целью, фармакологически активный агент в соответствии с общей формулой (I) предпочтительно заделан в самоэмульгирующийся препарат. Так называемая самоэмульгирующаяся система доставки лекарственного средства (SEDDS) представляет собой систему доставки лекарственного средства, в которой используется эмульсия, получаемая химическими, а не механическими, методами. Другими словами с помощью присущих свойств лекарственного препарата, а не путем специфического смешивания и обработки. Указанный препарат разводят в водной среде и получают эмульсию. В случае, если средний размер капелек меньше или равен до 50 нм, самоэмульгирующаяся система доставки лекарственного средства (SEDDS) обозначается как само-микро эмульгирующаяся = система доставки лекарственного средства (SMEDDS). В соответствии с системой классификации липидных препаратов, эти препараты обычно относятся к группе препаратов III типа.
Предпочтительной подгруппой SEDDS являются самоэмульгирующиеся масляные препараты (SEOF). SEOF обычно содержат природное или синтетическое масло, поверхностно-активное вещество и гидрофильный растворитель и иногда сорастворители. Основной характеристикой SEOF является их способность образовывать тонкие эмульсии масло-в-воде или микро эмульсии при слабом перемешивании вслед за разбавлением водными фазами. Эти препараты можно диспергировать в просвет желудочно-кишечного тракта с образованием микро эмульсий или тонкодисперсных эмульсий, при разведении желудочно-кишечными жидкостями.
В другом предпочтительном варианте осуществления, лекарственная дозированная форма содержит фармакологически активный агент в соответствии с общей формулой (I) в форме твердого раствора, то есть молекулярно диспергирован в твердом матриксе, таким образом, что предпочтительно лекарственная дозированная форма фактически имеет аморфную или полуаморфную природу. Твердый раствор предпочтительно содержит фармакологически активный агент в соответствии с общей формулой (I) в молекулярно диспергированой форме и аморфный полимерный матрикс, имеющий сравнительно большую удельную поверхность. Фармакологически активный агент в соответствии с общей формулой (I) предпочтительно представлен в молекулярно диспергированой форме, то есть соединение действительно растворено и равномерно распределено в отвержденном растворе. Размер частиц соединения не является ни кристаллическим, ни мелкокристаллическим. Типичный размер частиц предпочтительно составляет 0,1-1 мкм.
В еще другом предпочтительном варианте осуществления, фармакологически активный агент в соответствии с общей формулой (I) обеспечен с помощью нанотехнологического препарата со средним размером наночастиц предпочтительно меньше, чем 1 мкм. В предпочтительном варианте осуществления, фармакологически активный агент в соответствии с общей формулой (I) обеспечен в наноразмерной форме. В другом предпочтительном варианте осуществления, фармакологически активный агент в соответствии с общей формулой (I) смешан с наночастицами, предпочтительно выбранными из органических наночастиц и неорганических наночастиц, и таким образом абсорбирован на поверхности указанных частиц.
Органические наночастицы предпочтительно содержат небольшие белки, которые присутствуют в виде кластера или агломерата небольших белков, олигопептидов или липидов.
Неорганические наночастицы предпочтительно содержат кристаллические силикаты. Эти силикаты имеют минеральное происхождение или искусственные силикаты, такие как металлосиликаты (например, цеолиты). В предпочтительном варианте осуществления, наночастицы модифицированы таким образом, что они несут электростатический заряд. Наночастицы предпочтительно представляют собой ультра тонкоизмельченные силикаты и фармакологически активный агент в соответствии с общей формулой (I) предпочтительно связан с микропористой поверхностью наночастиц.
Образование наночастиц известно специалисту в данной области техники. Одним методом является получение коллоидных наночастиц в качестве носителей для орального высвобождения лекарственного средства путем распыления фармакологически активного агента в соответствии с общей формулой (I) под давлением при определенной температуре, совместно с подходящим материалом носителя, таким как протамин, через джеты, которые оборудованы фильтровальными плитами, в сильно охлажденные колонны. Результатом быстрого охлаждения является аморфная фаза, состоящая из наночастиц. Другим методом является измельчение фармакологически активного агента в соответствии с общей формулой (I) с подходящими макромолекулами в растворе. При добавлении гидрофобных соединений, молекулы растворителя удаляются из раствора и происходит десольватация. В связи с этим происходит образование очень маленьких частиц, в которые интегрирован фармакологически активный агент в соответствии с общей формулой (I). Для отвердения образованных наночастиц в раствор может быть добавлен сшиватель.
Для получения, например, твердой липидной наночастицы можно использовать метод гомогенизации под высоким давлением и последующего охлаждения распылением. Предпочтительно, фармакологически активный агент в соответствии с общей формулой (I) растворен в подходящем растворителе или в форме суб-микро частиц. При необходимости, в раствор можно добавлять липидный носитель и поверхностно-активное вещество. В завершение тонкоизмельченные пористые заполнители в качестве внешней фазы, а также глиданты и дополнительные поверхностно-активные вещества могут быть добавлены для заполнения полученного препарата, например, в капсулы, такие как твердые желатиновые капсулы.
В другом также предпочтительном варианте осуществления, фармакологически активный агент в соответствии с общей формулой (I) обеспечиваются в виде циклодекстриновых (включение) комплексов.
Циклодекстрины состоят из молекул Сахаров, образующих кольцо, и обычно содержат 5 или больше α-D-гликопиранозидных единиц, которые связаны посредством положения 1-4. Типичное количество связанных мономеров Сахаров находится в диапазоне от 6 до 8 единиц. Шестичленная кольцевая молекула сахара называется α-циклодекстрин. Семичленная кольцевая молекула сахара называется β-циклодекстрин и восьмичленная кольцевая молекула сахара называется γ-циклодекстрин. Форма этих соединений представляет собой тороид с большим и меньшим отверстиями, подверженными воздействию растворителя. Вследствие этого образования внутренняя часть тороида не является гидрофобной, но значительно менее гидрофильна по сравнению с водной окружающей средой и, следовательно, способна принимать гидрофобные молекулы. Наружная часть тороида достаточно гидрофильна для придания циклодекстринам растворимости в воде.
Включение фармакологически активного ингредиента в соответствии с общей формулой (I) в циклодекстрины чрезвычайно модифицирует физические и химические свойства. В большинстве случаев механизм контролированного разложения таких комплексов и получающегося в результате этого высвобождения лекарственного средства основа на изменении pH водных растворов, что приводит к отщеплению водорода или ионных связей между циклодекстринами и включенными молекулами. Альтернативными способами разрушения комплексов является нагревание или воздействие ферментов, способных расщеплять α-1-4 связи между α-D-гликопиранозидами.
В другом предпочтительном варианте осуществления, фармакологически активный агент в соответствии с общей формулой (I) обеспечивается в форме липосом. Липосома предпочтительно состоит из фосфолипидов и предпочтительно имеет сферическую форму. Оболочка этой формы предпочтительно представляет собой ламеллярную или бислойную структуру. Другим типом расположения фосфолипидов является монослой.
Фосфолипиды содержат молекулы с амфифильным свойством, то есть молекулы имеют гидрофобную (липофильную) и гидрофильную (липофобную) часть. В присутствии воды, гидрофильная часть притягивается водой и образует поверхность, обращенную к воде, в то время как гидрофобная часть отталкивается водой и образует поверхность вдали от воды. Поэтому амфифильные молекулы сами по себе упорядочиваются в одном из вышеуказанных типов.
Двухслойные структуры предпочтительно располагаются в сферической конфигурации, где внутренняя часть заполнена водным раствором. Этот тип называется "липосома". Гидрофобные части молекул обращены друг с другу в середине слоя и гидрофильные части молекул обращены к молекулам воды снаружи липосомы. Водный раствор внутри липосомы является таким же, как и снаружи липосомы. Ингредиенты, растворенные в этом водном растворе, например, фармакологически активные агенты в соответствии с общей формулой (I), таким образом находятся внутри липосомы. Типичный диаметр липосом находится в диапазоне от 25 нм до 1 мкм. Более мелкие липосомы (25 нм - 200 нм) состоят из одного единственного бислоя, тогда как более крупные липосомы (200 нм - 1 мкм) содержат несколько двухслойных оболочек на верхушке друг друга.
Монослойные структуры также упорядочиваются в сферические конфигурации. Вследствие амфифильного характера молекул и сферической конфигурации монослойных структур, внутренняя часть сферических структур заполнена /образована гидрофобными частями молекул. Эти типы называются мицеллами. Внутри структуры отсутствует растворитель. В предпочтительном варианте осуществления, внутренние части мицелл содержат фармакологически активные агенты в соответствии с общей формулой (I).
В другом предпочтительном варианте осуществления фармакологически активный агент в соответствии с общей формулой (I) обеспечивается в микронизированном состоянии. С помощью техники микронизации могут быть получены частицы фармакологически активного агента в соответствии с общей формулой (I) с диаметром в наномерном диапазоне. Такие частицы имеют большое отношение поверхности к объему.
Перемалывание и дробление является пригодным методом для получения частиц в наномерном диапазоне. Сложные техники для микронизации включают RESS (быстрое расширение сверхкритических растворов), SAS (сверхкритический антирастворитель) и PGSS (образование частиц в насыщенных газом растворах).
В RESS методе используют сверхкритическую жидкость, где фармакологически активный агент в соответствии с общей формулой (I) растворен при высоком давлении и температуре, таким образом получая гомогенную сверхкритическую фазу. После распространения раствора через форсунку, образуются небольшие частицы. Вследствие распространения в конце форсунки растворенный фармакологически активный агент в соответствии с общей формулой (I) осаждается в виде кристаллов и включает небольшое количество растворителя. Растворитель изменяет со сверхкритического жидкостного состояния в нормальное состояние, предпочтительно газовую фазу, и кристаллы распадаются изнутри наружу. Таким образом и вследствие того факта, что кристаллы сталкиваются друг с другом, образуются частицы с диаметром в наномерном диапазоне.
В SAS методе фармакологически активный агент в соответствии с общей формулой (I) растворен в предпочтительно органическом растворителе. Сверхкритическую жидкость добавляют в раствор под давлением и таким образом вынуждают также растворяться в растворителе. Вследствие этого, объем полной системы повышается и растворимость фармакологически активного агента в соответствии с общей формулой (I) снижается. Вследствие снижения его растворимости, соединение в соответствии с общей формулой (I) осаждается и образует частицы, имеющие небольшой диаметр.
PGSS метод похож на SAS метод. В этом случае, фармакологически активный агент в соответствии с общей формулой (I) расплавлен и сверхкритическая жидкость растворена в расплаве. Вследствие распространения через форсунку, фармакологически активный агент в соответствии с общей формулой (I) осаждается и образует частицы в наномерном диапазоне.
В предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением содержит
- неионное поверхностно-активное вещество (например, Cremophor® EL, Cremophor® OB 40, Cremophor® OB 60, d-альфа-токоферол полиэтилен гликоль 1000 сукцинат, полисорбат 20, полисорбат 80, Солютол® HS 15, сорбитан моноолеат, полоксамер 407, Labrafil® M-1944CS, Labrafil® M-2125CS, Labrasol®, Gelucire® 44/14, Softigen® 767 и моно- и ди-эфиры жирных кислот PEG 300, 400 или 1750); и/или
- анионное поверхностно-активное вещество (например, Konakion® MM, Cernevit® лаурилсульфат натрия (додецилсульфат натрия, например, Texapon® K12), цетилсульфат натрия (например, Lanette Е®), цетилстеарил сульфат натрия, стеарил сульфат натрия, диоктилсульфосукцинат натрия (докузат натрия); и/или
- нерастворимый в воде липид (например, касторовое масло, кукурузное масло хлопковое масло, оливковое масло, арахисовое масло, масло перечной мяты, сафлоровое масло, кунжутное масло, соевое масло, гидрогенизированные растительные масла, гидрогенизированное соевое масло и среднецепочечные триглицериды кокосового масла и пальмового растительного масла); и/или
- органическая жидкость/полутвердое вещество (например, пчелиный воск, d-альфа-токоферол, олеиновая кислота, среднецепочечные моно- и диглицериды); и/или
- циклодекстрин (например, альфа-циклодекстрин, бета-циклодекстрин, гидроксипропил-бета-циклодекстрин и сульфобутилэфир-бета-циклодекстрин); и/или
- фосфолипид (например, гидрогенизированные соевый фосфатидилхолин, дистеароилфосфатидилглицерин, L-альфа-димиристоилфосфатидилхолин и L-альфа-димиристоилфосфатидилглицерин).
Предпочтительно, фармакологически активный агент в соответствии с общей формулой (I) молекулярно диспергирован в матриксе.
В предпочтительном варианте осуществления, фармакологически активный агент в соответствии с общей формулой (I) молекулярно диспергирован в некристаллическом матриксе.
В другом предпочтительном варианте осуществления, фармакологически активный агент в соответствии с общей формулой (I) молекулярно диспергирован в неаморфном матриксе.
Предпочтительно, фармакологически активный агент в соответствии с общей формулой (I) гомогенно распределен в лекарственной дозированной форме в соответствии с изобретением. Содержание фармакологически активного агента в соответствии с общей формулой (I) двух сегментов лекарственной дозированной формы, имеющих объем 1,0 мм3 каждый, отличается друга от друга предпочтительно не более, чем ±10%, более предпочтительно не более, чем ±7,5%, еще более предпочтительно не более, чем ±5,0%, наиболее предпочтительно не более, чем ±2,5%, и в особенности не более, чем ±1,0%. Если лекарственная дозированная форма инкапсулирована или покрыта оболочкой, то указанные два сегмента лекарственной дозированной формы, имеющих объем 1,0 мм3 каждый, предпочтительно представляют собой сегменты ядра, то есть не содержат какой-либо инкапсулирующей среды или пленочной оболочки, соответственно.
Предпочтительно, лекарственная дозированная форма в соответствии с изобретением характеризуются сравнительно гомогенным распределением плотности. Предпочтительно, плотности двух сегментов лекарственной дозированной формы, имеющих объем 1,0 мм3 каждый, отличаются друга от друга не более, чем ±10%, более предпочтительно не более, чем ±7,5%, еще более предпочтительно не более, чем ±5,0%, наиболее предпочтительно не более, чем ±2,5%, и в особенности не более, чем ±1,0%. Если лекарственная дозированная форма инкапсулирована, то указанные два сегмента лекарственной дозированной формы, имеющих объем 1,0 мм3 каждый, предпочтительно представляют собой сегменты ядра, то есть не содержат какой-либо инкапсулирующей среды или пленочной оболочки.
В предпочтительном варианте осуществления, лекарственная дозированная форма дополнительно содержит поверхностно-активное вещество.
Для целей настоящей заявки, термин "поверхностно-активное вещество" относится к любому соединению, которое содержит по меньшей мере одну гидрофобную группу и по меньшей мере одну гидрофильную группу. Предпочтительно, поверхностно-активное вещество содержит по меньшей мере одну концевую гидрофобную группу (хвост) и по меньшей мере одну концевую гидрофильную группу (голова).
Гидрофобную группу предпочтительно выбирают из группы, включающей углеводород, алкиловый эфир, фторуглерод и силоксановые группы.
В предпочтительном варианте осуществления, поверхностно-активное вещество содержит по меньшей мере одну алифатическую группу, содержащую по меньшей мере 3 атома углерода, более предпочтительно по меньшей мере 4 атома углерода, еще более предпочтительно по меньшей мере 6 атомов углерода, также более предпочтительно 6 до 30 атомов углерода и наиболее предпочтительно 8 до 24 атома углерода. Алифатическая группа может быть насыщенной или ненасыщенной, разветвленной или неразветвленной (линейной), концевой или внутренней алифатической группой.
Предпочтительно, поверхностно-активное вещество содержит по меньшей мере одну группу, получаемую из насыщенной или ненасыщенной жирной кислоты или из насыщенного или ненасыщенного жирного спирта, где группа предпочтительно представляет собой простой эфир, сложный эфир карбоновой кислоты или сложноэфирную группу серной кислоты. Предпочтительно, насыщенная или ненасыщенная жирная кислота или жирный спирт содержит по меньшей мере 6 атомов углерода, также более предпочтительно 6 до 30 атомов углерода и наиболее предпочтительно 8 до 24 атома углерода.
В предпочтительном варианте осуществления, поверхностно-активное вещество содержит по меньшей мере одну группу, получаемую из насыщенной или ненасыщенной жирной кислоты, предпочтительно C6-C30 жирных кислот, более предпочтительно C8-C24 жирных кислот и наиболее предпочтительно C12-C22 жирных кислот. Примерами подходящих жирных кислот являются лауриновая кислота, миристиновая кислота, пальмитиновая кислота, стеариновая кислота, арахидиновая кислота, бегеновая кислота, лигноцериновая кислота, 12-гидроксистеариновая кислота, олеиновая кислота и рицинолеиновая кислота.
В другом предпочтительном варианте осуществления, поверхностно-активное вещество содержит по меньшей мере одну группу, получаемую насыщенного или ненасыщенного жирного спирта, предпочтительно C6-C30 жирного спирта, более предпочтительно C8-C24 жирного спирта и наиболее предпочтительно C12-C22 жирного спирта. Примерами подходящих жирных спиртов являются цетиловый спирт, стеариловый спирт, 2-октилдодекан-1-ол и 2-гексилдекан-1-ол.
Предпочтительно, поверхностно-активное вещество имеет молекулярный вес самое большее 20,000 г/моль, более предпочтительно самое большее 15,000 г/моль, еще более предпочтительно самое большее 10,000 г/моль, также более предпочтительно самое большее 5,000 г/моль, даже более предпочтительно самое большее 4,000 г/моль, наиболее предпочтительно самое большее 3,000 г/моль и в особенности в диапазоне от 100 г/моль до 2,500 г/моль.
Предпочтительно, поверхностно-активное вещество содержится в матриксе, в котором диспергирован фармакологически активный агент в соответствии с общей формулой (I), предпочтительно молекулярно.
В предпочтительном варианте осуществления, фармакологически активный агент в соответствии с общей формулой (I) и поверхностно-активное вещество равномерно гомогенно распределено в матриксе таким образом, что матрикс не содержит любых сегментов, где либо фармакологически активный агент в соответствии с общей формулой (I) присутствует при отсутствии поверхностно-активного вещества или где поверхностно-активное вещество присутствует при отсутствии фармакологически активного агента в соответствии с общей формулой (I).
В предпочтительном варианте осуществления, лекарственная дозированная форма содержит поверхностно-активное вещество. В другом предпочтительном варианте осуществления, лекарственная дозированная форма содержит смесь двух или более поверхностно-активных веществ.
В предпочтительном варианте осуществления, поверхностно-активное вещество действует в качестве эмульгатора типа масло-вода. В другом предпочтительном варианте осуществления, поверхностно-активное вещество действует в качестве эмульгатора типа вода-масло.
Предпочтительно, лекарственная дозированная форма содержит поверхностно-активное вещество, имеющее гидрофильно-липофильный баланс (HLB) по меньшей мере 10 или по меньшей мере 11. Более предпочтительно, гидрофильно-липофильный баланс (HLB) составляет по меньшей мере 12 или по меньшей мере 13. Наиболее предпочтительно, гидрофильно-липофильный баланс (HLB) находится в диапазоне от 14 до 16.
В другом предпочтительном варианте осуществления, гидрофильно-липофильный баланс (HLB) поверхностно-активного вещества составляет по меньшей мере 27, более предпочтительно по меньшей мере 29, еще более предпочтительно по меньшей мере 31, также более предпочтительно по меньшей мере 33, даже более предпочтительно по меньшей мере 35, наиболее предпочтительно по меньшей мере 37 и в особенности по меньшей мере 39.
Предпочтительно, гидрофильно-липофильный баланс (HLB) поверхностно-активного вещества составляет самое большее 30, более предпочтительно самое большее 28, еще более предпочтительно самое большее 26, также более предпочтительно самое большее 24, даже более предпочтительно самое большее 22, наиболее предпочтительно самое большее 20 и в особенности самое большее 18.
В предпочтительном варианте осуществления, HLB значение поверхностно-активного вещества находится в диапазоне 10±3,5, более предпочтительно 10±3, еще более предпочтительно 10±2,5, также более предпочтительно 10±2, даже более предпочтительно 10±1,5, наиболее предпочтительно 10±1 и в особенности 10±0,5. В другом предпочтительном варианте осуществления, HLB значение поверхностно-активного вещества находится в диапазоне 12±3,5, более предпочтительно 12±3, еще более предпочтительно 12±2,5, также более предпочтительно 12±2, даже более предпочтительно 12±1,5, наиболее предпочтительно 12±1 и в особенности 12±0,5. В еще другом предпочтительном варианте осуществления, HLB значение поверхностно-активного вещества находится в диапазоне 14±3,5, более предпочтительно 14±3, еще более предпочтительно 14±2,5, также более предпочтительно 14±2, даже более предпочтительно 14±1,5, наиболее предпочтительно 14±1 и в особенности 14±0,5. В другом предпочтительном варианте осуществления, HLB значение поверхностно-активного вещества находится в диапазоне 15±3,5, более предпочтительно 15±3, еще более предпочтительно 15±2,5, также более предпочтительно 15±2, даже более предпочтительно 15±1,5, наиболее предпочтительно 15±1 и в особенности 15±0,5. В другом также предпочтительном варианте осуществления, HLB значение поверхностно-активного вещества находится в диапазоне 16±3,5, более предпочтительно 16±3, еще более предпочтительно 16±2,5, также более предпочтительно 16±2, даже более предпочтительно 16±1,5, наиболее предпочтительно 16±1 и в особенности 16±0,5. В другом предпочтительном варианте осуществления, HLB значение поверхностно-активного вещества находится в диапазоне 18±3,5, более предпочтительно 18±3, еще более предпочтительно 18±2,5, также более предпочтительно 18±2, даже более предпочтительно 18±1,5, наиболее предпочтительно 18±1 и в особенности 18±0,5.
Поверхностно-активное вещество может быть ионным, амфотерным или неионным.
В предпочтительном варианте осуществления, лекарственная дозированная форма содержит ионное поверхностно-активное вещество, в особенности анионное поверхностно-активное вещество.
Подходящие анионные поверхностно-активные вещества включают, но не ограничиваясь только ими, сложные эфиры серной кислоты, такие как лаурилсульфат натрия (додецилсульфат натрия, например, Texapon® K12), цетилсульфат натрия (например, Lanette E®), цетилстеарил сульфат натрия, стеарил сульфат натрия, диоктилсульфосукцинат натрия (докузат натрия); и их соответствующие калиевые или кальциевые соли.
Предпочтительно, анионное поверхностно-активное вещество имеет общую формулу (II-а)
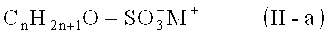
где n представляет собой целое число от 8 до 30, предпочтительно 10 до 24, более предпочтительно 12 до 18; и М выбирают из Li+, Na+, K+, 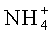
Другие подходящие анионные поверхностно-активные вещества включают соли холевой кислоты, включая гликохолат натрия (например, Konakion® MM, Cernevit®), таурохолат натрия и соответствующие калиевые или аммониевые соли.
В другом предпочтительном варианте осуществления, лекарственная дозированная форма содержит неионное поверхностно-активное вещество. Подходящие неионные поверхностно-активные вещества включают, но не ограничиваясь только ими
- жирные спирты, которые могут быть линейными или разветвленными, такие как цетиловый спирт, стеариловый спирт, цетилстеариловый спирт, 2-октилдодекан-1-ол и 2-гексилдекан-1-ол;
- стеролы, такие как холестерин;
- неполные сложные эфиры жирных кислот и сорбитана, такие как сорбитанмонолаурат, сорбитанмонопальмитат, сорбитанмоностеарат, сорбитантристеарат, сорбитанмоноолеат, сорбитанполутораолеат и сорбитантриолеат;
- неполные сложные эфиры полиоксиэтилен сорбитана и жирной кислоты (сложные эфиры полиоксиэтилен-сорбитана и жирной кислоты), предпочтительно моноэфир полиоксиэтилен сорбитана и жирной кислоты, диэфир полиоксиэтилен сорбитана и жирной кислоты или триэфир полиоксиэтилен сорбитана и жирной кислоты; например, моно- и три- лаурил, пальмитил, стеарил и олеил сложные эфиры, такие как тип, известен под названием "полисорбат" и коммерчески доступен под торговым названием "Твин", включая Твин® 20 [полиоксиэтилен(20)сорбитан монолаурат], Твин® 21 [полиоксиэтилен(4)сорбитан монолаурат], Твин® 40 [полиоксиэтилен(20)сорбитан монопальмитат], Твин® 60 [полиоксиэтилен(20)сорбитан моностеарат], Твин® 65 [полиоксиэтилен(20)сорбитан тристеарат], Твин® 80 [полиоксиэтилен(20)сорбитан моноолеат], Твин 81 [полиоксиэтилен(5)сорбитан моноолеат] и Твин® 85 [полиоксиэтилен(20)сорбитан триолеат]; предпочтительно моноэфир полиоксиэтиленсорбитана и жирной кислоты в соответствии с общей формулой (II-b)
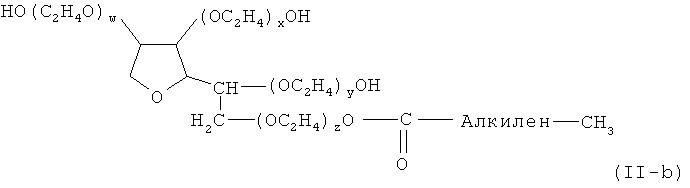
где (w+x+y+z) находится в диапазоне от 15 до 100, предпочтительно от 16 до 80, более предпочтительно 17 до 60, еще более предпочтительно от 18 до 40 и наиболее предпочтительно 19 до 21;
и алкилен представляет собой необязательно насыщенную алкиленовую группу, содержащую 6 до 30 атомов углерода, более предпочтительно 8 до 24 атома углерода и наиболее предпочтительно 10 до 16 атомов углерода;
- сложные эфиры полиоксиэтиленглицерина и жирных кислот, такие как смеси моно-, ди- и триэфиров глицерина и ди- и моноэфиров макроголей, имеющих молекулярный вес в диапазоне от 200 до 4000 г/моль, например, макроголглицеринкаприлокапрат, макроголглицеринлаурат, макроголглицеринококоат, макроголглицеринлинолеат, макрогол-20-глицеринмоностеарат, макрогол-6-глицеринкаприлокапрат, макроголглицеринолеат; макроголглицеринстеарат, макроголглицерингидроксистеарат (например, Cremophor® OB 40) и макроголглицеринрицинолеат (например, Cremophor® EL);
- полиоксиэтиленовые эфиры жирных кислот, жирная кислота предпочтительно имеет от приблизительно 8 до приблизительно 18 атомов углерода, например, макрогололеат, макроголстеарат, макрогол-15-гидроксистеарат, полиоксиэтиленовые сложные эфиры 12-гидроксистеариновой кислоты, такие как тип, известен и коммерчески доступен под торговым названием "Солютол HS 15"; предпочтительно в соответствии с общей формулой (II-c)
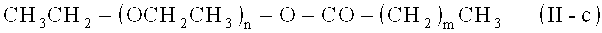
где n представляет собой целое число от 6 до 500, предпочтительно 7 до 250, более предпочтительно 8 до 100, еще более предпочтительно от 9 то 75, также более предпочтительно 10 до 50, даже более предпочтительно 11 до 30, наиболее предпочтительно 12 до 25, ив особенности 13 до 20; и где m представляет собой целое число от 6 до 28; более предпочтительно 6 до 26, еще более предпочтительно 8 до 24, также более предпочтительно 10 до 22, даже более предпочтительно 12 до 20, наиболее предпочтительно 14 до 18 и в особенности 16;
- полиоксиэтиленовые эфиры жирного спирта, например, макроголцетилстеариловый эфир, макроголариловый эфир, макрогололеиловый эфир, макроголстеариловый эфир;
- полиоксипропилен-полиоксиэтилен блок-сополимеры (полоксамеры);
- сложные эфиры жирных кислот и сахарозы; например, дистеарат сахарозы, диолеат сахарозы, дипальмитат сахарозы, моностеарат сахарозы, моноолеат сахарозы, монопальмитат сахарозы, мономиристат сахарозы и монолаурат сахарозы;
- сложные эфиры полиглицерина и жирной кислоты, например, полиглицеринолеат;
- полиоксиэтиленовые сложные эфиры альфа-токоферил сукцината, например, D-альфа-токоферил-PEG-1000-сукцинат (TPGS);
- полигликолизированные глицериды, такие как тиры, известные и коммерчески доступные под торговыми названиями "Gelucire 44/14", "Gelucire 50/13 и "Labrasol";
- продукты реакции природного или гидрогенизированного касторового масла и этилен оксида, такие как различные жидкие поверхностно-активные вещества, известные и коммерчески доступные под торговым названием "Cremophor"; и
- неполные сложные эфиры многофункциональных спиртов и жирных кислот, такие как сложные эфира глицерина и жирной кислоты, например, моно- и три-лауриловые, пальмитиловые, стеариловые и олеиловые сложные эфиры, например, глицерин моностеарат, глицерин моноолеат, например, глицерил моноолеат 40, известный и коммерчески доступный под торговым названием "Peceol"; глицерил дибегенат, глицерин дистеарат, глицерин монолинолеат; этиленгликоль моностеарат, этиленгликоль монопальмитостеарат, пентаэритритол моностеарат.
Особенно предпочтительные поверхностно-активные вещества этого класса, которые содержатся в лекарственной дозированной форме в соответствии с изобретением, представляют собой неионные поверхностно-активные вещества, имеющие гидрофильно-липофильный баланс (HLB) по меньшей мере 10, в особенности неионные поверхностно-активные вещества, имеющие HLB значение по меньшей мере 12, более предпочтительно неионные поверхностно-активные вещества, имеющие HLB значение в пределах от 14 до 16. Примерами поверхностно-активных веществ этого типа являются вышеперечисленные поверхностно-активные вещества "полисорбат 80" (Твин® 80) и "Солютол® HS 15".
Солютол® HS-15 представляет собой смесь полиэтиленгликоля 660 12-гидроксистеарата и полиэтилен гликоля. Он представляет собой белую пасту при комнатной температуре, которая становится жидкой приблизительно при 30°C и имеет HLB приблизительно 15.
Твин® 80 [полиоксиэтилен(20)сорбитан моноолеат] представляет собой жидкость при комнатной температуре, имеет вязкость 375-480 мПа. с и имеет HLB приблизительно 15.
В предпочтительном варианте осуществления, содержание поверхностно-активного вещества составляет по меньшей мере 0,001 мас.% или по меньшей мере 0,005 мас.%, более предпочтительно по меньшей мере 0,01 мас.% или по меньшей мере 0,05 мас.%, еще более предпочтительно по меньшей мере 0,1 мас.%, по меньшей мере 0,2 мас.% или по меньшей мере 0,3 мас.%, также более предпочтительно по меньшей мере 0,4 мас.%, по меньшей мере 0,5 мас.% или по меньшей мере 0,6 мас.% и в особенности по меньшей мере 0,7 мас.%, по меньшей мере 0,8 мас.%, по меньшей мере 0,9 мас.% или по меньшей мере 1,0 мас.%, исходя из общего веса лекарственной дозированной формы.
В другом предпочтительном варианте осуществления, в особенности если лекарственная дозированная форма содержит инкапсулированное ядро, содержание поверхностно-активного вещества составляет по меньшей мере 10 мас.%, более предпочтительно по меньшей мере 15 мас.%, еще более предпочтительно по меньшей мере 20 мас.%, также более предпочтительно по меньшей мере 25 мас.% и в особенности по меньшей мере 30 мас.%, исходя из общего веса композиции, образующей ядро. В предпочтительном варианте осуществления, содержание поверхностно-активного вещества находится в интервале предпочтительно от 0,1 мас.% до 95 мас.%, более предпочтительно от 1 мас.% до 95 мас.%, еще более предпочтительно от 5 мас.% до 90 мас.%, также более предпочтительно от 10 мас.% до 80 мас.%, наиболее предпочтительно от 20 мас.% до 70 мас.% и в особенности от 30 мас.% до 75 мас.%, исходя из общего веса композиции, образующей ядро.
В особенно предпочтительно варианте осуществления,
- лекарственная дозированная форма содержит поверхностно-активное вещество, имеющее HLB значение по меньшей мере 10 в количестве по меньшей мере 0,001 мас.%, исходя из общего веса лекарственной дозированной формы; и/или
- лекарственная дозированная форма содержит от 0,01% до 95% фармакологически активного агента (А); и/или
- лекарственная дозированная форма имеет вес в диапазоне от 0,1 мг до 2,000 мг; и/или
- лекарственная дозированная форма содержит полимер с молекулярным весом в диапазоне от 1,000 г/моль до 15 миллион г/моль; и/или
- лекарственная дозированная форма предназначена для орального введения; и/или
- лекарственная дозированная форма содержит фармакологически активный агент в соответствии с общей формулой (I) в дозе от 10 мкг до 50 мкг или от 300 мкг до 500 мкг; и/или
- лекарственная дозированная форма обеспечивает немедленное высвобождение фармакологически активного агента в соответствии с общей формулой (I) in vitro в соответствии с Европейской фармакопеей;
и/или
- tmax находится в диапазоне от 0,5 до 16 ч; и/или
- соотношение AUC0-t/ дозу находится в диапазоне от 0,5 до 16,5 ч/м3; и/или
- соотношение Cmax / дозу находится в диапазоне от 0,06 до 1,69 м-3.
В предпочтительном варианте осуществления лекарственная дозированная форма в соответствии с изобретением, в особенности, если она содержит фармакологически активный агент в соответствии с общей формулой (I) в форме твердого раствора, то есть молекулярно диспергирован в твердом матриксе, дополнительно может содержать по меньшей мере один матриксный материал. Предпочтительно, указанный матриксный материал содержит полимер, выбранный из группы, включающей поливинилпирролидон, винилпирролидон-поливинилацетат сополимеры, производные целлюлозы, предпочтительно сложные эфиры целлюлозы или простые эфиры целлюлозы, такие как, например, гидроксипропил метилцеллюлоза, гидроксипропил метилцеллюлоза ацетат сукцинат, гидроксипропил метилцеллюлоза фталат, этилцеллюлоза, полиметакрилаты, полиэтилен оксиды, полиэтилен гликоли и любые их комбинации. Предпочтительные примеры поливинилпирролидона серийно выпускаются в виде Коллидон® 90 и примеры сополимера винилпирролидон-поливинил ацетат серийно выпускаются в виде Коллидон® VA64.
Для целей настоящей заявки, "молекулярно диспергирована в твердом матриксе", например, в полимере, обозначает, что существенная часть общего содержания фармакологически активного агента в соответствии с общей формулой (I) представлена в некристаллической форме, то есть не обеспечивает отражения рентгеновских лучей. Предпочтительно, содержание некристаллического фармакологически активного агента в соответствии с общей формулой (I) составляет по меньшей мере 60 мас.%, более предпочтительно по меньшей мере 65 мас.%, еще более предпочтительно по меньшей мере 70 мас.%, также более предпочтительно по меньшей мере 75 мас.%, даже более предпочтительно по меньшей мере 80 мас.%, наиболее предпочтительно по меньшей мере 85 мас.% и в особенности по меньшей мере 90 мас.%, исходя из общего содержания фармакологически активного агента в соответствии с общей формулой (I).
В предпочтительном варианте осуществления лекарственная дозированная форма в соответствии с изобретением содержит полимер с усредненной молекулярной массой предпочтительно по меньшей мере 50,000 г/моль, более предпочтительно по меньшей мере 100,000 г/моль, также более предпочтительно по меньшей мере 250,000 г/моль, еще более предпочтительно по меньшей мере 500,000 г/моль, наиболее предпочтительно по меньшей мере 750,000 г/моль и в особенности по меньшей мере 800,000 г/моль.
В другом предпочтительном варианте осуществления лекарственная дозированная форма в соответствии с изобретением содержит полимер с усредненной молекулярной массой предпочтительно по меньшей мере 5000 г/моль, более предпочтительно по меньшей мере 10,000 г/моль, также более предпочтительно по меньшей мере 20,000 г/моль, еще более предпочтительно по меньшей мере 30,000 г/моль, даже более предпочтительно по меньшей мере 40,000 г/моль, наиболее предпочтительно по меньшей мере 50,000 г/моль и в особенности в диапазоне от 50,000 г/моль до 250,000 г/моль.
В предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением содержит фармакологически активный агент в соответствии с общей формулой (I) в форме твердого раствора, то есть молекулярно диспергирован в твердом матриксе, где матрикс содержит один или несколько полимеров и где содержание полимера(ов) находится в диапазоне 25±22,5 мас.%, более предпочтительно 25±20 мас.%, еще более предпочтительно 25±17,5 мас.%, также более предпочтительно 25±15 мас.%, даже более предпочтительно 25±12,5 мас.%, наиболее предпочтительно 25±10 мас.% и в особенности 25±7,5 мас.%, исходя из общего веса лекарственной дозированной формы.
В другом предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением содержит фармакологически активный агент в соответствии с общей формулой (I) в форме твердого раствора, то есть молекулярно диспергирован в твердом матриксе, где матрикс содержит один или несколько полимеров и где содержание полимера(ов) находится в диапазоне 50±22,5 мас.%, более предпочтительно 50±20 мас.%, еще более предпочтительно 50±17,5 мас.%, также более предпочтительно 50±15 мас.%, даже более предпочтительно 50±12,5 мас.%, наиболее предпочтительно 50±10 мас.% и в особенности 50±7,5 мас.%, исходя из общего веса лекарственной дозированной формы.
В еще другом предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением содержит фармакологически активный агент в соответствии с общей формулой (I) в форме твердого раствора, то есть молекулярно диспергирован в твердом матриксе, где матрикс содержит один или несколько полимеров и где содержание полимера(ов) находится в диапазоне 75±22,5 мас.%, более предпочтительно 75±20 мас.%, еще более предпочтительно 75±17,5 мас.%, также более предпочтительно 75±15 мас.%, даже более предпочтительно 75±12,5 мас.%, наиболее предпочтительно 75±10 мас.% и в особенности 75±7,5 мас.%, исходя из общего веса лекарственной дозированной формы.
В предпочтительном варианте осуществления, лекарственная дозированная форма в соответствии с изобретением содержит полимер, который содержит повторяющиеся звенья, имеющие происхождение из винилпирролидонов. В другом предпочтительном варианте осуществления полимер содержит мономерные звенья, имеющие происхождение из винил ацетатов. Предпочтительно, полимер представляет собой сополимер, содержащий повторяющиеся звенья, имеющие происхождение из винилпирролидонов и повторяющиеся звенья, имеющие происхождение из винил ацетатов, где весовое соотношение повторяющихся звеньев, имеющих происхождение из винилпирролидонов: повторяющимся звеньям, имеющим происхождение из винил ацетатов, составляет предпочтительно самое большее 10:1, более предпочтительно самое большее 4,5:1, еще более предпочтительно самое большее 4:1, наиболее предпочтительно самое большее 2:1 и в особенности самое большее 1,5:1.
В предпочтительном варианте осуществления, относительное весовое соотношение полимера по отношению к фармакологически активному агенту в соответствии с общей формулой (I) в лекарственной дозированной форме в соответствии с изобретением находится в интервале от 1:1 до 70:1, более предпочтительно от 2:1 до 50:1, еще более предпочтительно от 3:1 до 40:1, наиболее предпочтительно от 3,5:1 до 30:1 и в особенности от 4:1 до 19:1. Предпочтительно, относительное весовое соотношение полимера по отношению к фармакологически активному агенту в соответствии с общей формулой (I) в лекарственной дозированной форме в соответствии с изобретением составляет по меньшей мере 3:1 или по меньшей мере 4:1, более предпочтительно по меньшей мере 5:1 или по меньшей мере 6:1, еще более предпочтительно по меньшей мере 7:1 или по меньшей мере 8:1, также более предпочтительно по меньшей мере 9:1 или по меньшей мере 10:1, даже более предпочтительно по меньшей мере 11:1 или по меньшей мере 12:1, наиболее предпочтительно по меньшей мере 13:1 или по меньшей мере 14:1 и в особенности по меньшей мере 15:1 или по меньшей мере 16:1.
В предпочтительном варианте осуществления относительное весовое соотношение полимера, в особенности поливинилпирролидона, по отношению к фармакологически активному агенту в соответствии с общей формулой (I) в лекарственной дозированной форме в соответствии с изобретением находится в интервале от 1:1 до 70:1, более предпочтительно от 2:1 до 45:1, еще более предпочтительно от 3:1 до 20:1, наиболее предпочтительно от 3,5:1 до 10:1 ив особенности от 4:1 до 5:1.
В другом предпочтительном варианте осуществления относительное весовое соотношение полимера, в особенности сополимера винилпирролидон-винил ацетат, по отношению к фармакологически активному агенту в соответствии с общей формулой (I) в лекарственной дозированной форме в соответствии с изобретением находится в интервале от 1:1 до 70:1, более предпочтительно от 2:1 до 55:1, еще более предпочтительно от 4:1 до 40:1, наиболее предпочтительно от 10:1 до 25:1 ив особенности от 15:1 до 25:1.
В предпочтительном варианте осуществления лекарственная дозированная форма в соответствии с изобретением, в особенности, если она содержит фармакологически активный агент в соответствии с общей формулой (I) в форме твердого раствора, то есть молекулярно диспергирован в твердом матриксе, дополнительно может содержать по меньшей мере одно поверхностно-активное вещество, выбранное из группы, включающей неполные сложные эфиры полиоксиэтилен сорбитана и жирной кислоты (сложные эфиры полиоксиэтилен-сорбитана и жирной кислоты), предпочтительно моноэфир полиоксиэтилен сорбитана и жирной кислоты, диэфир полиоксиэтилен сорбитана и жирной кислоты или триэфир полиоксиэтилен сорбитана и жирной кислоты; сложные эфиры серной кислоты или их соли со щелочными или щелочно-земельными металлами; и полоксамеры.
В предпочтительном варианте осуществления лекарственная дозированная форма в соответствии с изобретением содержит поверхностно-активное вещество с усредненной молекулярной массой предпочтительно по меньшей мере 500 г/моль, более предпочтительно по меньшей мере 1,000 г/моль, также более предпочтительно по меньшей мере 2,500 г/моль, еще более предпочтительно по меньшей мере 5,000 г/моль, наиболее предпочтительно по меньшей мере 7,000 г/моль и в особенности по меньшей мере 8,000 г/моль.
В другом предпочтительном варианте осуществления лекарственная дозированная форма в соответствии с изобретением содержит поверхностно-активное вещество с усредненной молекулярной массой предпочтительно по меньшей мере 100 г/моль, более предпочтительно по меньшей мере 250 г/моль, также более предпочтительно по меньшей мере 500 г/моль, еще более предпочтительно по меньшей мере 750 г/моль, наиболее предпочтительно по меньшей мере 1,000 г/моль и в особенности по меньшей мере 1,250 г/моль.
В другом предпочтительном варианте осуществления дозированная форма в соответствии с изобретением содержит поверхностно-активное вещество, предпочтительно [полиоксиэтилен(20)сорбитан моноолеат] или полиоксиэтилен-полиоксипропилен блок со-полимер, в количестве предпочтительно от 0,5 мас.% до 80 мас.%, более предпочтительно от 1,5 мас.% до 60 мас.%, еще более предпочтительно от 2,5 мас.% до 50 мас.%, также более предпочтительно от 3,0 мас.% до 40 мас.%, наиболее предпочтительно от 3,5 мас.% до 20 мас.% и в особенности от 4 мас.% до 10 мас.%, исходя из общего веса лекарственной дозированной формы.
Предпочтительные варианты осуществления А1-А20 лекарственной дозированной формы в соответствии с изобретением обобщены в таблице, представленной ниже в данной заявке:
где
природа относится к химической природе ингредиента;
соотношение относится к относительному весовому соотношению ингредиента по отношению к двум другим ингредиентам;
X1 обозначает фармакологически активный агент в соответствии с общей формулой (I) или его физиологически приемлемую соль;
X2 обозначает фармакологически активный агент в соответствии с общей формулой (I′) или его физиологически приемлемую соль;
X3 обозначает (1r,4r)-6′-фтор-N,N-диметил-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин или (1r,4r)-6′-фтор-N-метил-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин или его физиологически приемлемую соль;
Y1 обозначает полимер, выбранный из группы, включающей поливинилпирролидон, винилпирролидон-винилацетат сополимеры, производные целлюлозы, предпочтительно сложные эфиры целлюлозы или простые эфиры целлюлозы, полиметакрилаты, полиэтилен оксиды, полиэтилен гликоли и любые их комбинации;
Y2 обозначает винилпирролидон-винилацетат сополимер;
Y3 обозначает винилпирролидон-винилацетат сополимеры, имеющие усредненную молекулярную массу в диапазоне от 40,000 до 250,000 г/моль;
Z1 обозначает неионное поверхностно-активное вещество со значением HLB 10-20;
Z2 обозначает поверхностно-активное вещество, выбранное из группы неполных сложных эфиров полиоксиэтилен сорбитана и жирной кислоты;
Z3 обозначает поверхностно-активное вещество в соответствии с общей формулой (II-b).
Например, в соответствии с таблицей, представленной выше, вариант осуществления А9 относится к фармакологически активному агенту в соответствии с общей формулой (I′) или его физиологически приемлемой соли, винилпирролидон-поливинилацетатному сополимеру и поверхностно-активному веществу, выбранному из группы полисорбитанов, где весовое соотношение составляет 2:38:5.
Дальнейший аспект изобретения относится к лекарственной дозированной форме в соответствии с изобретением, как описано выше, для применения для лечения боли.
Дальнейший аспект изобретения относится к способу лечения боли, который включает два раза в сутки, один раз в сутки или менее часто, предпочтительно оральное введение лекарственной дозированной формы в соответствии с изобретением субъекту, который в этом нуждается.
Предпочтительно, боль выбирают из острой, висцеральной, невропатической или хронической боли.
ПРИМЕРЫ
Последующие примеры дополнительно иллюстрируют изобретение, но не должны рассматриваться как ограничивающие его объем.
Общая процедура приготовления твердого раствора в соответствии с изобретением
Активный фармацевтический ингредиент (API), то есть фармакологически активный агент в соответствии с общей формулой (I), и полимер диспергировали в дихлорметане в колбе. В некоторых случаях, добавляли поверхностно-активное вещество. Колбу нагревали и подвергали воздействию ультразвука для основательного растворения ингредиентов. В соответствующих случаях, раствор фильтровали через фильтр из пористого стекла для удаления следов нерастворенного материала. Растворитель упаривали с помощью роторного испарителя при температуре 60°C.Твердый остаток в дальнейшем высушивали при высоком вакууме в течение ночи. Высушенный материал переносили в запечатанный стеклянный сосуд для анализа относительно аморфного содержания с использованием XRPD и DSC. Режим растворения анализировали в 0,1 н. HCl.
Пример 1
С помощью общей процедуры, получали твердые растворы, имеющие следующие составы.
На фигуре 1 показана кривая высвобождения API. На оси Х указано время в минутах и ось Y относится к количеству растворенного API в процентах относительно общего количества API, которое исходно присутствует в дозированной форме.
Из фигуры 1 становится очевидным, что твердый раствор, содержащий Коллидон VA64/Твин 80 в соотношении 1:19 API и полимер (пример 1-E), проявляет существенно более высокую скорость растворения по сравнению с любым другим из препаратов (примеры 1-A до 1-D). Почти 90% API растворяется в течение первых 30 минут.Плюроник F68 к препарату с Коллидоном 90 (1:4) приводит к существенному снижению скорости растворения. Плюроник F68 представляет собой дисфункциональный блок сополимер поверхностно-активное вещество, оканчивающееся на первичных гидроксильных группах и имеющее HLB значение >24.
Пример 2
С помощью общей процедуры и аналогично примеру 1, получали твердые растворы, имеющие следующие составы.
На фигуре 2 показана кривая высвобождения API. На оси Х указано время в минутах и ось Y относится к количеству растворенного API в процентах относительно общего количества API, которое исходно присутствует в дозированной форме.
Из фигуры 2 становится очевидным, что препарат, содержащий Твин 80 обеспечивает более быстрое высвобождение с большой степенью растворения, тогда как при отсутствии поверхностно-активного вещества скорость растворения уменьшена; при отсутствии поверхностно-активного вещества (пример 2-B), суммарная величина растворения составляет только 55% по сравнению с препаратом, содержащим Твин 80 (пример 2-C).
Пример 3
Стабильность при хранении твердого раствора тестировали в различных условиях и анализировали с помощью XRPD. Твердый раствор приготавливали в соответствии с примерами 1 и 2 и он имеет следующий состав.
Единичные дозы смешанного препарата заполняли в твердые желатиновые капсулы размера 0. Инкапсулированные препараты хранили при 25°C и относительной влажности 60% (0 В) при 30°C и относительной влажности 65%, соответственно. Через заранее установленные периоды времени 1, 2 и 4 недель, капсулы удаляли из хранения и анализировали.
Обнаружено, что твердый раствор API, в особенности препарат с API:V64 в соотношении 1:19, является физически стабильным в течение периода времени 4 недели при 25°C и 30°C, что продемонстрировано с помощью XRPD.
На фигуре 3 показан XRPD результат API твердого раствора во время ноль.
На фигурах 4 и 5 показан результат после хранения в течение 4 недель при 25°C и относительной влажности 60% и при 30°C и относительной влажности 65%, соответственно.
Из фигур 3-5 становится очевидным, что лекарственный продукт имеет аморфную или по меньшей мере полу-аморфную природу.
Пример 4
Клинические исследования проводили для определения анальгезирующей эффективности и переносимости однократных доз соединения в соответствии с формулой (I′b) (200 мкг, 400 мкг и 600 мкг, исходя из количества свободного основания; гемицитрат пероральный раствор соединения (I′b) в Макроголе 400) по сравнению с таковой у морфина (60 мг, форма с контролируемым высвобождением) и плацебо у пациентов с острой послеоперационной болью после ортопедической хирургии (бурсэктомия).
Для этого, 258 пациентов любого пола включали в рандомизированное, плацебо-контролируемое, двойное слепое клиническое исследование в параллельных группах. Леченные группы были хорошо сбалансированы относительно демографических и исходных характеристик с незначительным дисбалансом относительно исходной боли и этнической принадлежности.
После хирургии, всех пациентов изначально лечили с помощью местной послеоперационной анестезии через подколенный блок. Вследствие различных кинетик соединения в соответствии с формулой (I′b) и морфина, пациентов затем лечили с помощью одного из двух лекарственных средств или с помощью плацебо в незначительно отличающееся время:
За один час до прекращения подколенного блока, пациентов рандомизировали и часть из них затем получала однократную дозу соединения в соответствии с формулой (I′b) (200 мкг, 400 мкг или 600 мкг) или плацебо, тогда как другие получали морфин или плацебо 2 часов после прекращения подколенного блока.
Конечной точкой оценки первичной эффективности была абсолютная интенсивность боли в течение 24 часового периода. Интенсивность боли измеряли с использованием 11-бальной количественной шкалы оценки (NRS). В каждый момент времени, пациентов инструктировали для оценки их текущей интенсивности боли относительно 11-бальной количественной шкалы оценки. Оценка ноль соответствовала отсутствию боли и оценка 10 соответствовала наихудшей возможной боли. Пропущенную запланированную оценку боли для пациентов условно начисляли с помощью метода переноса данных последнего наблюдения вперед (LOCF). Полученные средние NRS значения в течение 24 часового периода представлены на фигуре 6.
Сумма отличий интенсивности боли в течение различных периодов времени анализировали с использованием модели ковариационного анализа (ANCOVA) с факторами для оценки лечения и сайта и исходной интенсивности боли (используя оценку интенсивности боли NPRS). Включали только субъектов с непропущенной исходной интенсивностью боли. Обобщенные данные анализа для 2х - 10ти часового периода представлены в таблице ниже.
Полученные Р-значения обобщены в следующей таблице:
Таким образом, согласно первичному параметру, статистически достоверное различие наблюдали между группами, которые получали дозу 400 мкг или 600 мкг соединения (I′b) и плацебо группами, в то время так не наблюдали статистически достоверного различия для групп, которые получали дозу 200 мкг соединения (I′b).
В последующих двух таблицах обобщены вызванные лечением нежелательные явления (TEAEQ, которые наблюдали в пяти леченных группах.
ТЕАЕ: вызванное лечением нежелательное явление; SAE: тяжелое нежелательное явление
Из таблиц, представленных выше, становится очевидным, что все четыре активных лечения хорошо переносились при таких обстоятельствах и нежелательные явления, которые проявлялись наиболее часто, соответствовала тем, которые можно наблюдать для агонистов µ-опиодного рецептора. Для группы пациентов, которая получала лечение с помощью соединения (I′b), распространенность нежелательных явлений повышалась с дозой, и при дозе 600 мкг распространенность нежелательных явлений была сопоставима с таковой для группы пациентов, получавших морфин.
Примеры возможного использования
Примеры возможного использования лекарственных дозированных форм в соответствии с изобретением представлены ниже. Эти композиции являются типичными и следует понимать, что ингредиенты, их количество и процедура получения дозированной формы может изменяться.
Аналогично примерам 1, 2 и 3, следующие композиции (твердые растворы) могут быть приготовлены в соответствии с общей процедурой:
Пример возможного использования 1
Пример возможного использования 2
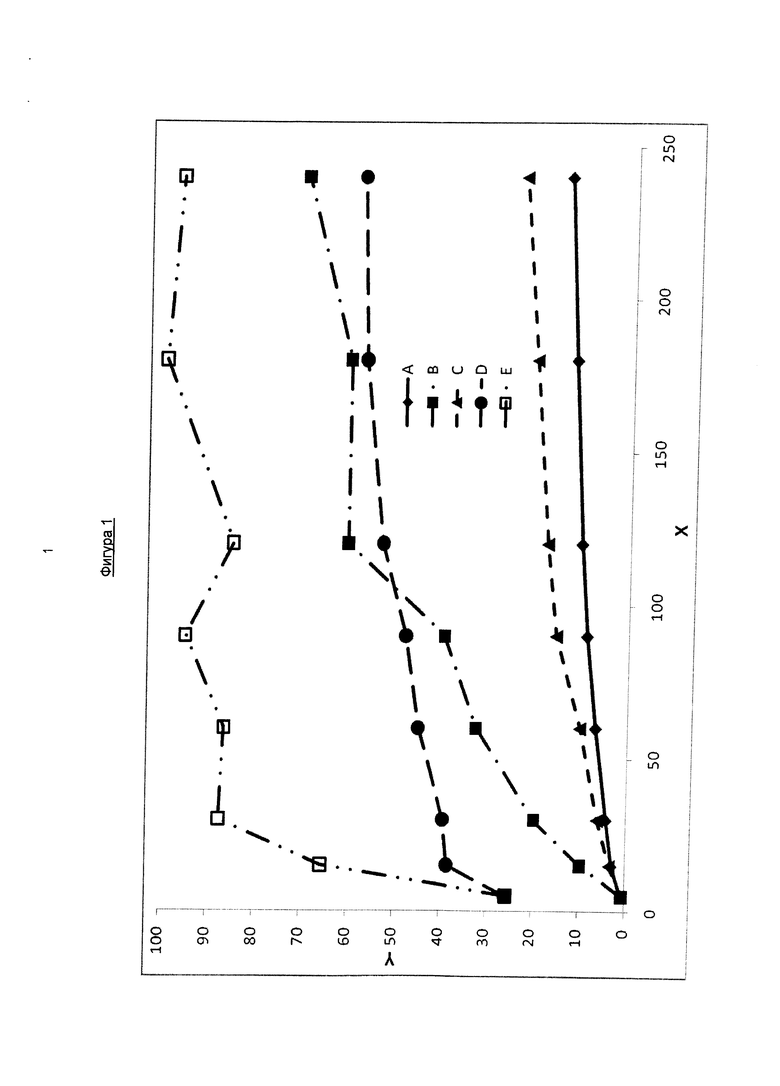
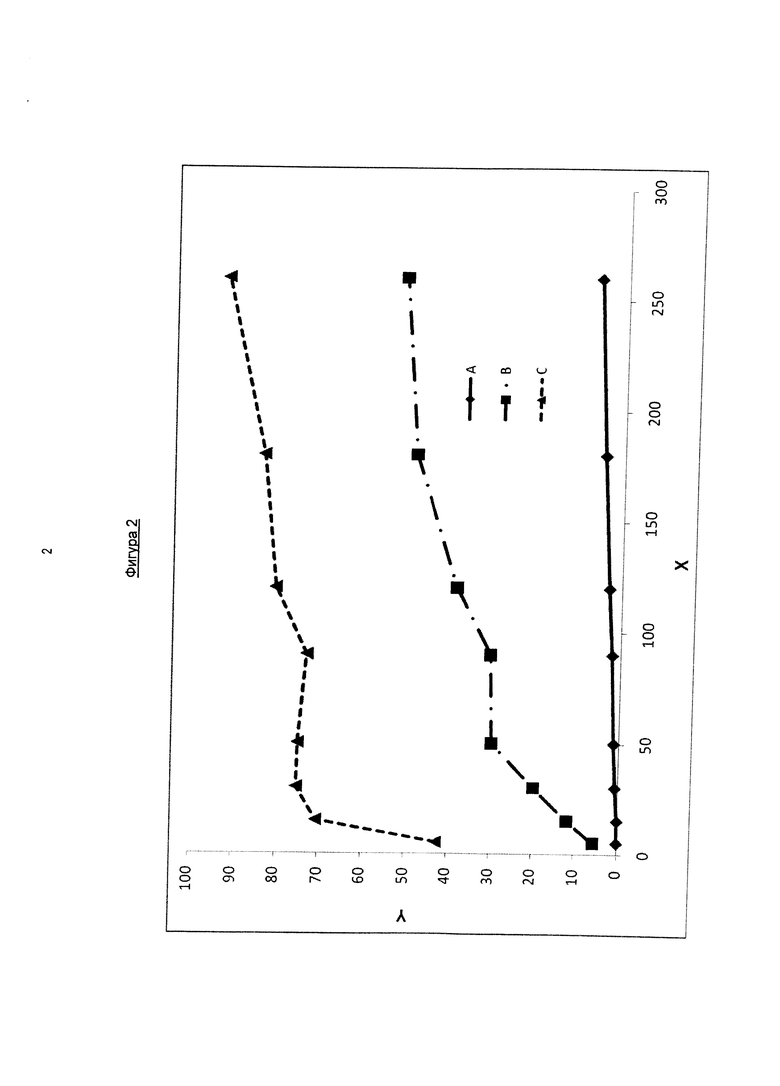
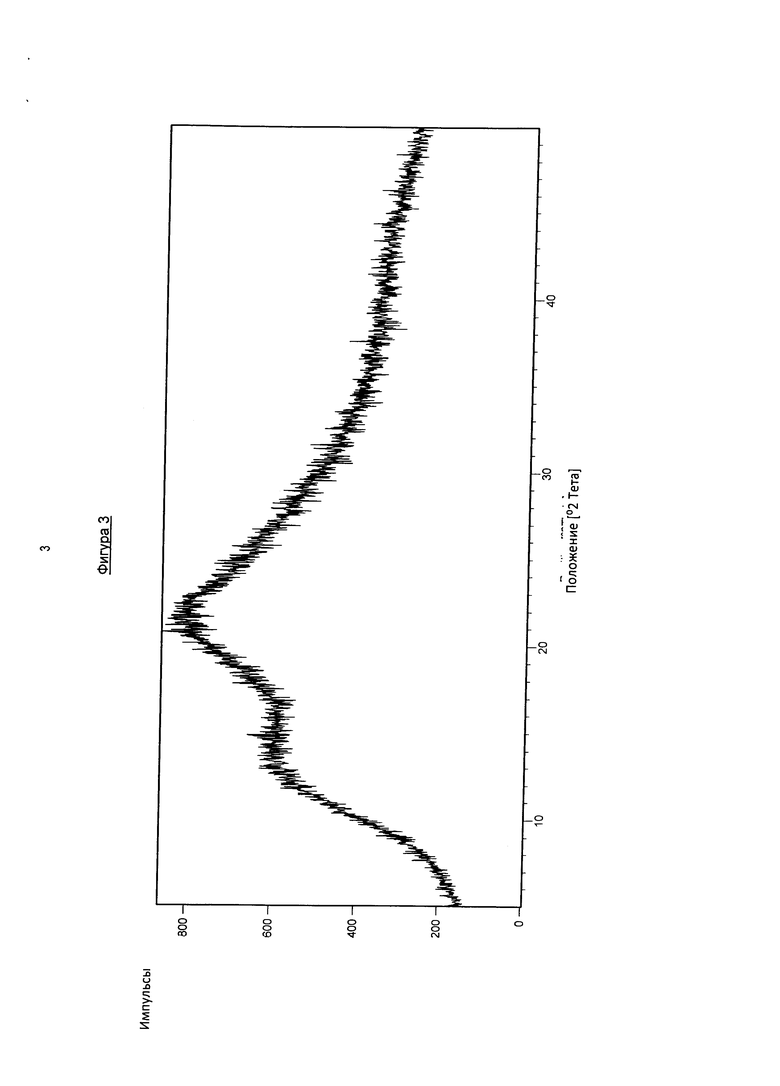
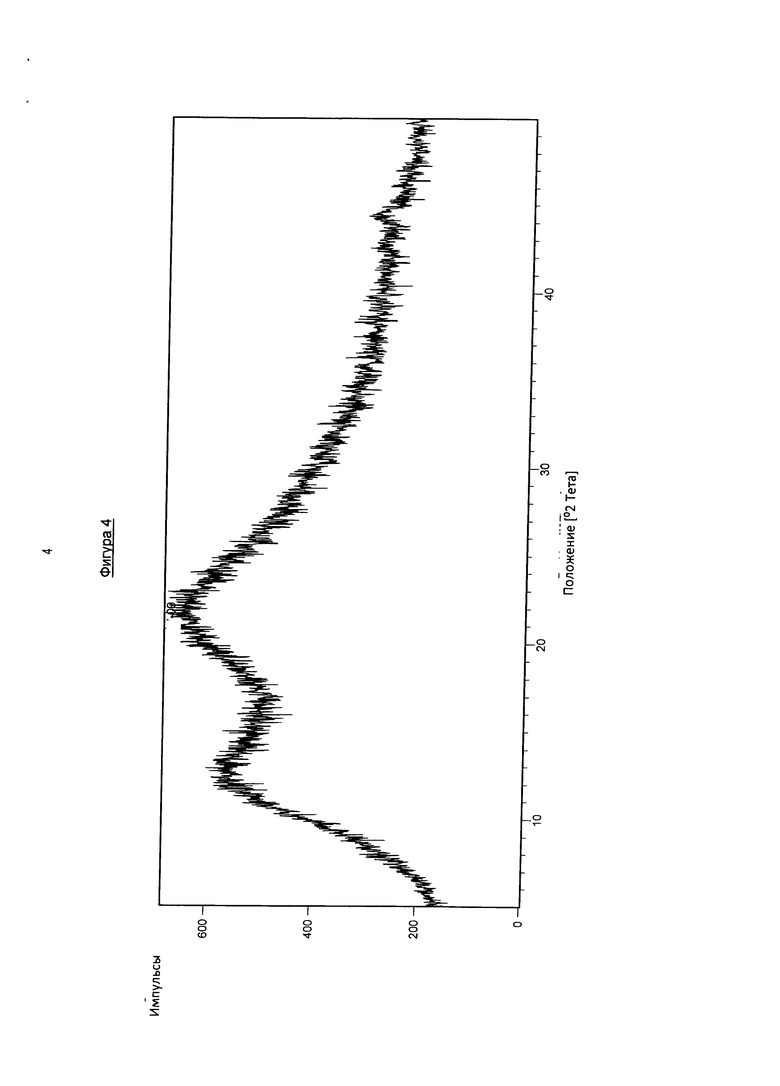
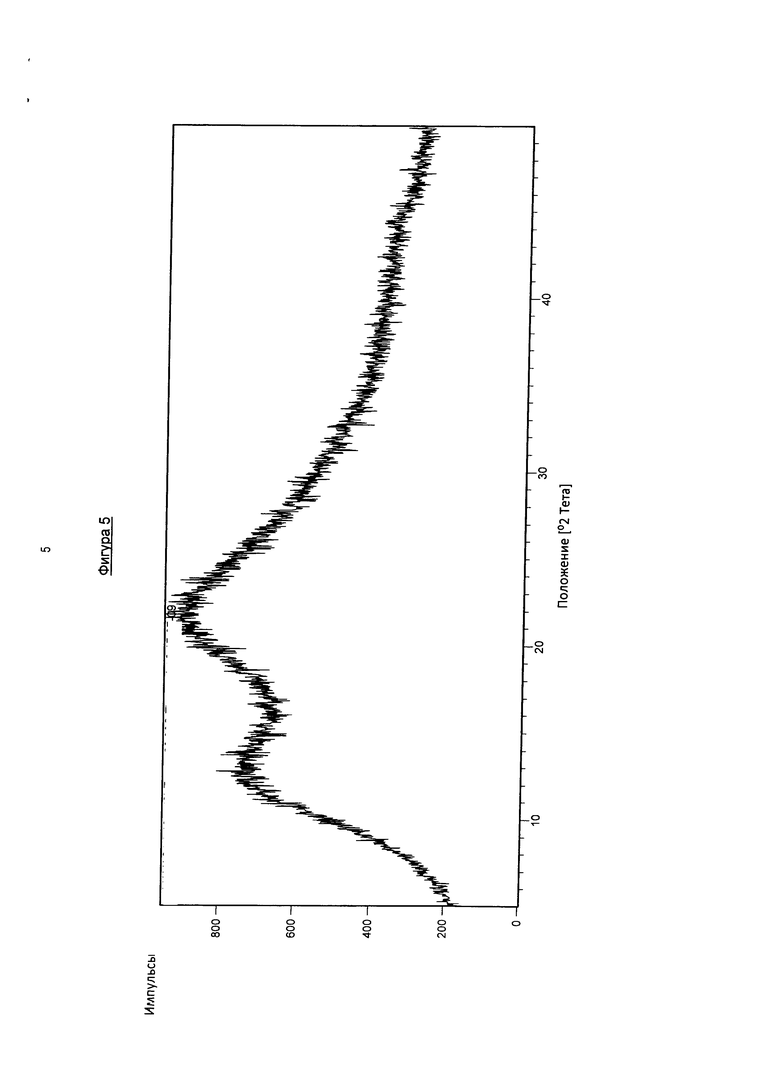
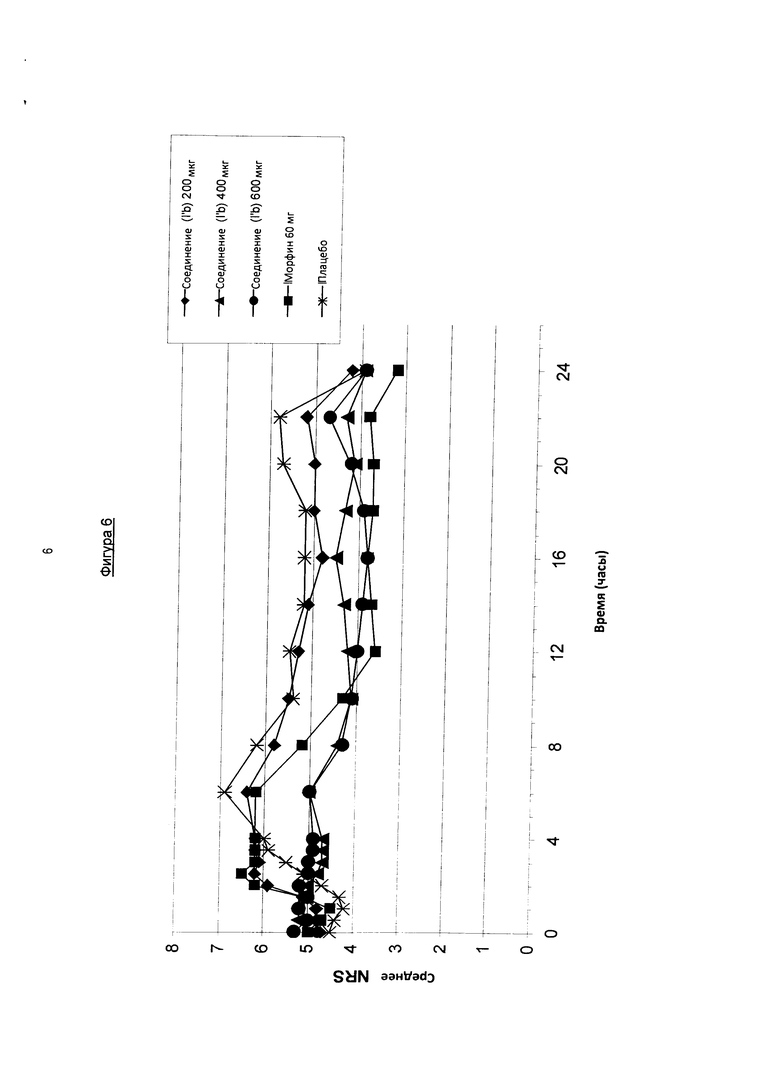
Изобретение относится к лекарственной дозированной форме для введения два раза в сутки, один раз в сутки или менее часто, которая содержит 6′-фтор-(N-метил- или N,N-диметил)-4-фенил-4′,9′-дигидро-3′H-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин или его физиологически приемлемую соль и которая высвобождает в соответствии с Европейской фармакопеей в условиях in vitro в 900 мл искусственного желудочного сока при pH 1,2 и 37±0,5°C через 30 минут в соответствии со способом с использованием лопастной мешалки с синкером при 100 об/мин по меньшей мере 50 мас. % фармакологически активного агента; твердый полимерный матриксный материал, выбранный из группы, включающей поливинилпирролидон, винилпирролидон-поливинилацетат сополимеры и любые их комбинации, в котором диспергирован фармакологически активный агент в соответствии с общей формулой (I) и поверхностно-активное вещество, имеющее HLB показатель самое большее 24, причем относительное весовое соотношение полимера по отношению к фармакологически активному агенту находится в интервале от 10:1 до 25:1. Изобретение обеспечивает создание лекарственной формы с хорошей биодоступностью и стабильностью при хранении, которая также позволяет фармацевтически активному агенту при старте быстро поступать в плазму и быстро облегчить боль у пациента из-за быстрого высвобождения, и в то же время добиться долговременной терапевтической эффективности в течение относительно долгого периода (по меньшей мере 12 часов). 9 з.п. ф-лы, 4 пр., 6 ил.
1. Лекарственная дозированная форма для введения два раза в сутки, один раз в сутки или менее часто, которая содержит фармакологически активный агент в соответствии с общей формулой (I)
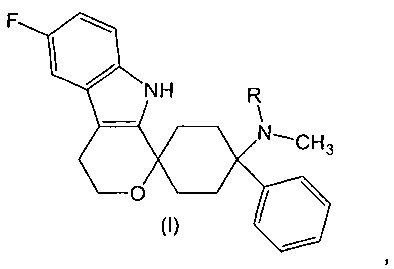
где R представляет собой -Н или -СН3,
или его физиологически приемлемую соль; и которая высвобождает в соответствии с Европейской фармакопеей в условиях in vitro в 900 мл искусственного желудочного сока при pH 1,2 и 37±0,5°C через 30 минут в соответствии со способом с использованием лопастной мешалки с синкером при 100 об/мин по меньшей мере 50 мас. % фармакологически активного агента, исходя из общего количества фармакологически активного агента, которое исходно присутствует в лекарственной дозированной форме; твердый полимерный матриксный материал, выбранный из группы, включающей поливинилпирролидон, винилпирролидон-поливинилацетат сополимеры и любые их комбинации, в котором диспергирован фармакологически активный агент в соответствии с общей формулой (I) и поверхностно-активное вещество, имеющее HLB показатель самое большее 24, причем относительное весовое соотношение полимера по отношению к фармакологически активному агенту находится в интервале от 10:1 до 25:1.
2. Лекарственная дозированная форма в соответствии с п. 1, где
- поверхностно-активное вещество имеет HLB показатель по меньшей мере 10; и/или
- содержание поверхностно-активного вещества составляет по меньшей мере 0,001 мас. %, исходя из общего веса лекарственной дозированной формы.
3. Лекарственная дозированная форма в соответствии с п. 1, где поверхностно-активное вещество выбирают из группы, включающей полиоксиэтиленовые эфиры жирных кислот, неполные сложные эфиры жирных кислот полиоксиэтиленсорбитана и сложные эфиры серной кислоты.
4. Лекарственная дозированная форма в соответствии с п. 1 или 2, где фармакологически активный агент в соответствии с общей формулой (I) имеет стереохимию в соответствии с общей формулой (I′)
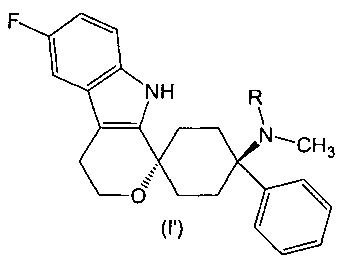 ,
,
где R имеет значения, как указано в п. 1.
5. Лекарственная дозированная форма в соответствии с п. 1 или 2, где фармакологически активный агент в соответствии с общей формулой (I) представляет собой (1r,4r)-6′-фтор-N,N-диметил-4-фенил-4′,9′-дигидро-3′Н-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин, (1r,4r)-6′-фтор-N-метил-4-фенил-4′,9′-дигидро-3′Н-спиро[циклогексан-1,1′-пирано[3,4,b]индол]-4-амин или его физиологически приемлемую соль.
6. Лекарственная дозированная форма в соответствии с п. 1 или 2, которая высвобождает в условиях in vitro в 900 мл искусственного желудочного сока при pH 1,2 через 30 минут по меньшей мере 80 мас. % фармакологически активного агента в соответствии с общей формулой (I), исходя из общего количества фармакологически активного агента в соответствии с общей формулой (I), которое исходно присутствует в дозированной форме.
7. Лекарственная дозированная форма в соответствии с п. 1 или 2, которая содержит фармакологически активный агент в соответствии с общей формулой (I) в дозе от 10 мкг до 50 мкг или от 300 мкг до 500 мкг.
8. Лекарственная дозированная форма в соответствии с п. 1 или 2, где
- фармакокинетический параметр tmax находится в диапазоне от 0,5 до 16 ч; и/или
- соотношение фармакокинетического параметра AUC0-t/дозу находится в диапазоне от 0,3 до 20 ч/м3; и/или
- соотношение фармакокинетического параметра Cmax/дозу находится в диапазоне от 0,04 до 2,00 м-3.
9. Лекарственная дозированная форма в соответствии с п. 1 или 2 для применения для лечения боли.
10. Лекарственная дозированная форма в соответствии с п. 9, где боль выбирают из острой, висцеральной, невропатической или хронической боли.
| СПИРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАНА | 2003 |
|
RU2354656C2 |
| US 20060193914 A1, 31.08.2006 | |||
| Rose-Marie Dannenfelser et al | |||
| Капельная масленка с постоянным уровнем масла | 0 |
|
SU80A1 |
| US 20080125475 A1, 29.05.2008. | |||
Авторы
Даты
2016-04-27—Публикация
2011-08-04—Подача