Настоящее изобретение относится к кодирующей нуклеотидной последовательности, прежде всего матричной РНК (мРНК), которая содержит или кодирует гистоновую структуру типа «стебель-петля» и поли(A)-последовательность или сигнал полиаденилирования, и к ее применению для повышения экспрессии кодируемого белка. В изобретении предложено также ее применение для приготовления фармацевтической композиции, прежде всего вакцины предназначенной, например, для применения при лечении опухолей и раковых заболеваний, сердечно-сосудистых заболеваний, инфекционных болезней, аутоиммунных заболеваний или генетических заболеваний, или, например, в генной терапии. Настоящее изобретение относится также к способу транскрипции in vitro, способам in vitro повышения уровня экспрессии белка с помощью нуклеиновой кислоты, которая содержит или кодирует гистоновую структуру типа «стебель-петля» и поли(A)-последовательность или сигнал полиаденилирования, и способу ex vivo и in vivo.
Помимо сердечно-сосудистых заболеваний и инфекционных болезней, опухоли и раковые заболевания представляют собой одну из наиболее часто встречающихся причин смерти в современном обществе, и в большинстве случаев их лечение и последующие меры реабилитации являются весьма дорогостоящими. Лечение опухолей и раковых заболеваний в значительной степени зависит, например, от типа имеющейся опухоли, возраста, распределения раковых клеток в организме пациента, подлежащего лечению, и т.д. Противораковую терапию в настоящее время, как правило, осуществляют с применением лучевой терапии или химиотерапии в дополнение к инвазивным операциям. Однако указанные традиционные терапии, как правило, оказывают экстраординарное стрессовое воздействие на иммунную систему, и в некоторых случаях их можно применять лишь в ограниченной степени. Кроме того, большинство этих традиционных терапий предусматривают длинные интервалы между отдельными обработками для того, чтобы дать возможность восстановиться иммунной системе.
Поэтому в последние годы было проведено изучение стратегий применения вспомогательного лечения в дополнение к указанным «традиционным методам лечения» для того, чтобы избегать или по меньшей мере снижать воздействие таких терапий на иммунную систему. Один из таких путей вспомогательного лечения включает, в частности, подходы на основе генной терапии или генетическую вакцинацию, что, как уже установлено, представляет собой весьма перспективный путь лечения или подкрепления указанных традиционных терапий.
Генная терапия и генетическая вакцинация представляют собой методы молекулярной медицины, которые уже разрешены для лечения и предупреждения заболеваний и которые, как правило, оказывают выраженное воздействие при применении в повседневной медицинской практике, в частности, при лечении упомянутых выше заболеваний. Генную терапию можно применять также в других областях медицины, например, при генетических заболеваниях, к которым относятся (наследственные) заболевания, обусловленные дефектом определенного гена, и они наследуются согласно законам Менделя. Наиболее хорошо известными примерами указанных генетических заболеваний являются среди прочего муковисцидоз (фиброзно-кистозная дегенерация) и серповидноклеточная анемия. Оба метода, т.е. генная терапия и генетическая вакцинация, основаны на интродукции нуклеиновых кислот в клетки или ткани пациента и последующем процессинге информации, кодируемой нуклеиновой кислотой, которая интродуцирована в клетки или ткани, что приводит к (белковой) экспрессии требуемых полипептидов.
Для осуществления геннотерапевтических подходов, как правило, применяют ДНК, хотя из современных разработок известно также применение РНК. Важно отметить, что во всех указанных геннотерапевтических подходах мРНК функционирует как мессенджер информации о последовательности кодируемого белка вне зависимости от того, применяют ли ДНК, вирусную РНК или мРНК.
В целом, РНК считается нестабильной молекулой: РНКазы распространены повсеместно и, как известно, их трудно инактивировать. Кроме того, РНК также являются химически более лабильными, чем ДНК. Таким образом, представляется неожиданным, что находящаяся в «нефункциональном состоянии» мРНК в эукариотической клетке отличается относительной стабильностью, и требуются специфические сигналы для усиления расщепления индивидуальных мРНК. Основной причиной этого явления, вероятно, может быть то, что расщепление мРНК в клетках катализируется практически исключительно экзонуклеазами. Однако концы эукариотической мРНК защищены от действия этих ферментов специфическими концевыми структурами и ассоциированными с ними белками: кэпом m7GpppN на 5′-конце и, как правило, poly(A)-последовательностью на 3′-конце. Таким образом, удаление указанных двух концевых модификаций оказывает влияние на ограничение скорости расщепления мРНК. Хотя стабилизирующий элемент охарактеризован в 3′ UTR мРНК альфа-глобина, последовательности РНК, влияющие на метаболизм эукариотической мРНК, как правило, действуют в качестве усилителя расщепления, как правило, посредством усиления деаденилирования (см. обзор у Meyer S., C. Temme и др., Crit Rev Biochem Mol Biol 39(4), 2004, cc.197-216.).
Как указано выше, 5′-концы эукариотических мРНК, как правило, пост-транскрипционно модифицированы таким образом, что они несут метилированную кэп-структуру, например, m7GpppN. Помимо ее участия с сплайсинге, стабилизации и транспорте РНК, кэп-структура в значительной степени усиливает рекрутмент рибосомальной 40S-субъединицы к 5′-концу мРНК в процессе инициации трансляции. Для последней функции требуется распознавание кэп-структуры эукариотическим комплексом фактора инициации eIF4F. Поли(A)-последовательность дополнительно стимулирует трансляцию путем повышенного рекрутмента 40S-субъединицы к мРНК, явление, для которого требуется вмешательство поли(A)-связывающего белка (РАВР). РАВР, в свою очередь, как установлено в последние годы, взаимодействует физически с eIF4G, являясь частью связанного с кэпом комплекса eIF4F. Это представляет собой предполагаемую модель замкнутой петли инициации трансляции на кэпированных полиаденилированных мРНК (Michel Y.M., D. Poncet и др., J Biol Chem 275(41), 2001, cc.32268-32276.).
Практически все эукариотические с мРНК несут на своем конце поли(A)-последовательность, добавление которой к их 3′-концу осуществляется с помощью повсеместно действующего механизма расщепления/полиаденилирования. Присутствие последовательности поли(A) на 3′-конце является одной из наиболее характерных особенностей эукариотических мРНК. После расщепления большинство пре-мРНК, за исключением зависящих от репликации транскриптов гистонов, приобретает полиаденилированный «хвост». В этом контексте процессинг 3′-конца представляет собой процесс ядерной котранскрипции, который усиливает транспорт мРНК из ядра в цитоплазму и влияет на стабильность и трансляцию мРНК. Образование указанного 3′-конца происходит в результате двухстадийной реакции, связанной с механизмом расщепления/полиаденилирования, и зависит от присутствия последовательностей двух элементов в мРНК-предшественниках (пре-мРНК); а именно высококонсервативного гексануклеотида AAUAAA (сигнал полиаденилирования) и расположенной в прямом направлении от него богатой G/U последовательности. На первой стадии происходит расщепление пре-мРНК между двумя указанными элементами. На второй стадии, тесно связанной с первой стадией, вновь образовавшийся 3′-конец удлиняется путем добавления поли(A)-последовательности, состоящей из 200-250 аденилатов, которые оказывают последующее влияние на все аспекты метаболизма мРНК, включая экспорт, стабильность и трансляцию мРНК (Dominski Z. и W.F. Marzluff. Gene 396(2), 2007, cc.373-390).
Единственным известным исключением из этого правила являются зависимые от репликации гистоновые мРНК, на конце которых присутствует характерная для гистонов структура типа «стебель-петля» вместо поли(A)-последовательности. Примеры последовательностей гистоновых структур типа «стебель-петля» описаны у Lopez с соавторами. (Davila Lopez М. и Samuelsson Т., RNA, изд-во New York, N.Y., 14(1), 2008, cc.1-10, doi: 10.1261/rna.782308).
За структурами типа «стебель-петля» в гистоновых пре-мРНК, как правило, располагается богатая пуринами последовательность, известная как расположенный в прямом направлении гистоновый элемент (HDE). Указанные пре-мРНК процессируются в ядре путем одного эндонуклеолитического расщепления примерно на расстоянии 5 нуклеотидов в прямом направлении относительно структуры «стебель-петля», катализируемого мяРНП (малые ядерные нуклеопротеины) U7, посредством спаривания оснований мяРНК U7 с HDE.
В результате необходимости упаковки вновь синтезированной ДНК в хроматин, синтез гистонов регулируется в зависимости от клеточного цикла. Повышенный синтез белков гистонов в процессе S-фазы достигается путем активации транскрипции генов гистонов, а также пост-транскрипционным регулированием уровней гистоновой мРНК. Можно продемонстрировать, что гистоновая структура типа «стебель-петля» важна для всех пост-транскрипционных стадий регуляции экспрессии гистонов. Для эффективного процессинга необходим экспорт мРНК в цитоплазму, включение в полирибосомы и регуляция стабильности мРНК.
В указанном выше контексте был идентифицирован белок с молекулярной массой 32 кДа, ассоциированный с гистоновой структурой типа «стебель-петля» на 3-конце гистоновых транскриптов как в ядре, так и в цитоплазме. Уровень экспрессии указанного связывающего структуру типа «стебель-петля» белка (SLBP) регулируется клеточным циклом и является наиболее высоким во время S-фазы, когда уровни гистоновой мРНК повышены. SLBP необходим для эффективного 3′-концевого процессинга гистоновой пре-мРНК с помощью мяРНП U7. После завершения процессинга SLBP остается ассоциированным со структурой типа «стебель-петля» на конце зрелых гистоновных мРНК и стимулирует их трансляцию в гистоновые белки в цитоплазме (Dominski Z. и W.F. Marzluff, Gene 396(2), 2007, cc.373-390). Важно отметить, что РНК-связывающий домен SLBP является консервативным у многоклеточных и простейших организмов (Davila Lopez M. и Samuelsson Т., RNA, изд-во New York, N.Y., 14(1), 2008, cc.1-10. doi: 10.1261/rna.782308), и удалось продемонстрировать, что его связывание с последовательностью гистоновой структуры типа «стебель-петля» зависит от структуры типа «стебель-петля» и что минимальный сайт связывания включает по меньшей мере 3 нуклеотида, расположенных в 5′-направлении, и 2 нуклеотида, расположенных в 3′-направлении относительно структуры типа «стебель-петля» (Pandey N.В. и др., Molecular and Cellular Biology, 14(3), 1994, cc.1709-1720 и Williams A.S. и Marzluff W.F., Nucleic Acids Research, 23(4), 1995, cc.654-662.).
Хотя гистоновые гены классифицируют либо как «зависимые от репликации», которые обеспечивают получение мРНК, несущей на конце гистоновую структуру типа «стебель-петля», либо как «замещенного типа», которые обеспечивают получение мРНК, несущей вместо этого поли(A)-«хвост», в некоторых очень редких случаях в естественных условиях встречаются мРНК, которые содержат и гистоновую структуру типа «стебель-петля», и поли(A)- или олиго(A)-последовательность на их 3′-конце. Sanchez с соавторами оценили воздействие встречающихся в естественных условиях олиго(A)-«хвостов», присоединенных к 3′-концу гистоновой структуры типа «стебель-петля» гистоновой мРНК, в процессе оогенеза Xenopus с использованием люциферазы в качестве репортерного белка и установили, что олиго(A)-«хвост» представляет собой активный компонент механизма репрессии трансляции, приводящий к «молчанию» гистоновой мРНК в процессе оогенеза, и что его удаление является компонентом механизма, который активирует трансляцию гистоновых мРНК (Sanchez R. и W.F. Marzluff, Mol Cell Biol 24(6), 2004, cc.2513-2525).
Кроме того, было проведено изучение требований к регуляции зависимых от репликации гистонов на уровне процессинга пре-мРНК и стабильности мРНК с использованием искусственных конструкций, кодирующих маркерный белок альфа-глобин, с учетом преимущества, которое дает факт, что ген глобина содержит интроны в отличие от не содержащих интроны генов гистонов. Для этой цели создавали конструкции, в которых за кодирующей последовательностью альфа-глобина находился сигнал гистоновой структуры типа «стебель-петля» (за гистоновой конструкцией типа «стебель-петля» по ходу транскрипции находился элемент гистона) и сигнал полиаденилирования (Whitelaw Е. и др., Nucleic Acids Research, 14(17), 1986, cc.7059-7070; Pandey N.В. и Marzluff W.F., Molecular and Cellular Biology, 7(12), 1987, cc.4557-4559; Pandey N.В. и др., Nucleic Acids Research, 18(11), 1990, cc.3161-3170).
С использованием другого подхода Lüscher с соавторами изучали зависящую от клеточного цикла регуляцию рекомбинантного гена гистона H4. Создавали конструкции, в которых за кодирующей последовательностью H4 находился сигнал гистоновой структуры типа «стебель-петля» и сигнал полиаденилирования, два участвующих в процессинге сигнала, случайным образом разделенные кодирующей последовательностью галактокиназы (Lüscher B. и др., Proc. Natl. Acad. Sci. USA, 82(13), 1985, cc.4389-4393).
Кроме того, Stauber с соавторами идентифицировали минимальную последовательность, требуемую для обеспечения зависящей от клеточного цикла регуляции уровней мРНК гистона H4. Для этих исследований использовали конструкции, содержащие кодирующую последовательность маркера для селекции, представлявшего собой ксантин: гуанинфосфорибозилтрансферазу (GPT), расположенную перед сигналом гистоновой структуры типа «стебель-петля», за которым находился сигнал полиаденилирования (Stauber C. и др., ЕМВО J, 5(12), 1986, cc.3297-3303).
Изучение процессинга гистоновой пре-мРНК позволило Wagner с соавторами идентифицировать факторы, необходимые для расщепления гистоновой пре-мРНК, с использованием репортерной конструкции, помещая EGFP между сигналом гистоновой конструкции типа «стебель-петля» и сигналом полиаденилирования, в результате чего экспрессия EGFP имела место только в случае нарушения процессинга гистоновой пре-мРНК (Wagner Е.J. и др., Mol Cell 28(4), 2007, cc.692-699).
Следует отметить, что для трансляции полиаденилированной мРНК, как правило, требуется, чтобы 3′-поли(A)-последовательность находилась в непосредственной близости от 5′-концевого кэпа. Это опосредуется белок-белковым взаимодействием между поли(A)-связывающим белком и эукариотическим фактором инициации eIF4G. Касательно зависимых от репликации гистоновых мРНК обнаружен аналогичный механизм. В этом контексте Gallie с соавторами продемонстрировали, что гистоновая конструкция типа «стебель-петля» функционально сходна с последовательностью поли(A) в том плане, что она повышает эффективность трансляции и дополнительно зависит от 5′-кэпа для обеспечения эффективного уровня трансляции. Эти авторы продемонстрировали, что гистоновая конструкция типа «стебель-петля» является достаточным и необходимым фактором повышения трансляции репортерной мРНК в трансфектированных клетках яичника китайского хомячка, но для оптимальной функциональной активности должна находиться на 3′-конце. Таким образом, аналогично поли(A)-«хвосту» других мРНК 3′-конец указанных гистоновых мРНК, вероятно, имеет решающее значение для трансляции in vivo и является функциональным аналогом поли(A)-«хвоста» (Gallic D.R., Lewis N.J. и Marzluff W.F., Nucleic Acids Research, 24(10), 1996, cc.1954-1962).
Кроме того, можно продемонстрировать, что SLBP связывается с цитоплазматической гистоновой мРНК и требуется для ее трансляции. Даже с учетом того, что SLBP не взаимодействует непосредственно с eIF4G, домен, необходимый для трансляции гистоновой мРНК, взаимодействует с недавно идентифицированным белком SLIP1. На следующей стадии SLIP1 взаимодействует с eIF4G и обеспечивает циркуляризацию гистоновой мРНК и поддерживает эффективную трансляцию гистоновой мРНК с помощью механизма, сходного с трансляцией полиаденилированных мРНК.
Как указано выше, в подходах генной терапии, как правило, используют ДНК для переноса кодирующей информации в клетку, в которой она затем транскрибируется в мРНК, которая несет встречающиеся в естественных условиях мРНК, прежде всего структуру 5′-кэпа и 3′-поли(A)-последовательность, для гарантии экспрессии кодируемого терапевтического белка.
Однако во многих случаях системы экспрессии, основанные на интродукции указанных нуклеиновых кислот в клетки или ткань пациента, и последующей экспрессии требуемых полипептидов, кодируемых этими нуклеиновыми кислотам, не обеспечивают желаемый или даже необходимый уровень экспрессии, позволяющи эффективную терапию, вне зависимости от того, применяют ли ДНК или РНК.
Как известно из существующего уровня техники, предпринимались различные попытки повысить выход экспрессии кодируемого белка, в частности, путем применения улучшенных систем экспрессии in vitro и/или in vivo. Методы повышения уровня экспрессии, которые описаны в целом и известны из существующего уровня техники, как правило, основаны на применении экспрессионных векторов или кассет, содержащих специфические промоторы и соответствующие регуляторные элементы. Поскольку указанные экспрессионные векторы или кассеты, как правило, ограничены конкретными клеточными системами, эти экспрессионные системы требуется адаптировать для применения в других клеточных системах. Затем указанными адаптированными экспрессионными векторами или кассетами, как правило, трансфектируют клетки и, как правило, обрабатывают в зависимости от конкретной клеточной линии. Таким образом, предпочтение отдается прежде всего тем молекулам нуклеиновых кислот, которые могут обеспечивать экспрессию кодируемых белков в клетке-мишени системами, присущими клетке, вне зависимости от промоторов и регуляторных элементов, которые являются специфичными для конкретных типов клеток. В этом контексте можно различать элементы, стабилизирующие мРНК, и элементы, которые повышают эффективность трансляции мРНК.
мРНК, имеющие оптимизированную кодирующую последовательность, и пригодные в целом для указанной цели, описаны в заявке WO 02/098443 (фирма CureVac GmbH). Например, в WO 02/098443 описаны мРНК, стабилизированные в обычной форме и оптимизированные для трансляции их кодирующих областей. В WO 02/098443 описан также метод выявления модификаций последовательности. В WO 02/098443 описаны также возможности замены нуклеотидов аденина и урацила в последовательностях мРНК с целью повышения содержания гуанина/цитозина (G/C) в последовательностях. Согласно WO 02/098443 указанные замены и адаптации, направленные на повышение содержания G/C, можно применять в генной терапии, а также в генетических вакцинах при лечение рака или инфекционных болезней. В этом контексте в WO 02/098443 в целом предложены последовательности, представляющие собой базовые последовательности для таких модификаций, при этом модифицированная мРНК кодирует по меньшей мере один биологически активный пептид или полипептид, который, например, не транслируется вообще в организме пациента, подлежащего лечению, либо транслируется несоответствующим образом, либо с дефектами. Альтернативно этому, в WO 02/098443 предложены мРНК, кодирующие антигены, например, опухолевые антигены или вирусные антигены, в качестве базовой последовательности для указанных модификаций.
В качестве другого подхода к повышению уровня экспрессии кодируемого белка в заявке WO 2007/036366 описано положительное влияние длинных поли(A)-последовательностей (прежде всего, превышающих по длине 120 пар оснований) и комбинации по меньшей мере двух 3′-нетранслируемых областей гена бета-глобина на стабильность и трансляционную активность мРНК.
Однако даже с учетом того, во всех последних приведенных в качестве прототипов документах уже предпринята попытка создать обладающие высокой эффективностью инструменты для геннотерапевтических подходов и дополнительно повысить стабильность и трансляционную активность мРНК, все еще сохраняется проблема, связанная с более низкой, как правило, стабильностью вариантов, основанных на использовании РНК, по сравнению с вакцинами на основе ДНК и геннотерапевтическими подходами на основе ДНК. Таким образом, в данной области все еще сохраняется потребность в улучшенных инструментах, применяемых для генной терапии и генетической вакцинации или в качестве вспомогательной терапии при осуществлении общепринятых методов лечения, указанных выше, которые позволяют улучшить обеспечение кодируемыми белками in vivo, например, посредством дополнительного повышения стабильности и/или трансляционной активности мРНК, предпочтительно для генной терапии.
Таким образом, в основу настоящего изобретения была положена задача разработать дополнительные и/или альтернативные способы повышения уровня экспрессии кодируемого белка, предпочтительно посредством стабилизации мРНК и/или повышения трансляционной эффективности указанной мРНК в отношении таких нуклеиновых кислот, для которых из существующего уровня техники известна возможность применения в терапии (например, генной терапии и генетической вакцинации).
Указанная задача решается с помощью объекта изобретения, представленного в прилагаемой формуле изобретения. В частности, задача, положенная в основу настоящего изобретения, решается с помощью предлагаемой в изобретении нуклеотидной последовательности, представляющей собой первый вариант осуществления изобретения, которая содержит или кодирует
а) кодирующую область, которая предпочтительно кодирует пептид или белок;
б) по меньшей мере одну гистоновую структуру типа «стебель-петля» и
в) необязательно поли(A)-последовательность или сигнал полиаденилирования,
которая предпочтительно предназначена для повышения уровня экспрессии кодируемого белка, где кодируемый белок предпочтительно не представляет собой ни гистоновый белок, ни репортерный белок (например, люциферазу, GFP, EGFP, β-галактозидазу, прежде всего EGFP) и ни маркерный белок или белок для селекции (например, альфа-глобин, галактокиназу и ксантин: гуанинфосфорибозилтрансферазу (GPT)).
В этом контексте согласно первому варианту осуществления настоящего изобретения предлагаемую в изобретении нуклеиновую кислоту получают по меньшей мере частично путем синтеза ДНК или РНК, или она представляет собой выделенную нуклеиновую кислоту.
В основу настоящего изобретения положен неожиданно установленный при создании изобретения факт, что комбинация поли(A)-последовательности или сигнала полиаденилирования и по меньшей мере одной гистоновой структуры типа «стебель-петля», даже хотя они представляют собой различные по своей природе механизмы, обладает синергетическим действием, поскольку указанная комбинация приводит к повышению уровня экспрессии белка до уровня, многократно превышающего тот, который достигается при индивидуальном применении любого из указанных элементов. Установлено, что синергетическое действие комбинации поли(A) и по меньшей мере одной гистоновой структуры типа «стебель-петля» не зависит от порядка расположения поли(A) и гистоновой структуры типа «стебель-петля» и не зависит от длины поли(A)-последовательности.
Таким образом, наиболее предпочтительной является предлагаемая в изобретении молекула нуклеиновой кислоты, которая содержит или кодирует а) кодирующую область, которая предпочтительно кодирует пептид или белок; б) по меньшей мере одну гистоновую структуру типа «стебель-петля» и в) последовательность поли(A) или последовательность полиаденилирования; предпочтительно предназначенная для повышения уровня экспрессии кодируемого белка, где кодируемый белок предпочтительно не представляет собой ни гистоновый белок, ни репортерный белок (например, люциферазу, GFP, EGFP, β-галактозидазу, прежде всего EGFP) и/или ни маркерный белок или белок для селекции (например, альфа-глобин, галактокиназу и ксантин: гуанинфосфорибозилтрансферазу (GPT)))
Согласно дополнительному альтернативному аспекту первого варианта осуществления настоящего изобретения предлагаемая в изобретении нуклеиновая кислота не содержит расположенный в прямом направлении гистоновый элемент (HDE).
В этом контексте наиболее предпочтительной является предлагаемая в изобретении нуклеиновая кислота, которая содержит или кодирует в направлении 5′→3′:
а) кодирующую область, предпочтительно кодирующую пептид или белок,
б) по меньшей мере одну гистоновую структуру типа «стебель-петля», необязательно без расположенного в прямом направлении гистонового элемента в 3′-области относительно гистоновой структуры типа «стебель-петля»,
в) поли(A)-последовательность или сигнал полиаденилирования.
Понятие «расположенный в прямом направлении гистоновый элемент (HDE)» относится к богатому пуринами состоящему примерно из 15-20 нуклеотидов полинуклеотидному сегменту, расположенному в 3′-направлении относительно встречающихся в естественных условиях структур типа «стебель-петля», который представляет собой сайт связывания для мяРНК U7, участвующей в процессинге гистоновой пре-мРНК в зрелую гистоновую мРНК. Например, у морских ежей HDE представляет собой CAAGAAAGA (Dominski Z. и W.F. Marzluff, Gene 396(2), 2007, cc.373-390).
Кроме того, согласно первому варианту осуществления настоящего изобретения предлагаемая в изобретении нуклеиновая кислота предпочтительно не содержит интрон.
Согласно другому наиболее предпочтительному варианту осуществления настоящего изобретения предлагаемая в изобретении нуклеотидная последовательность, представляющая собой первый вариант осуществления настоящего изобретения, содержит или кодирует в направлении 5′→3′:
а) кодирующую область, предпочтительно кодирующую пептид или белок;
б) поли(A)-последовательность; и
в) по меньшей мере одну гистоновую структуру типа «стебель-петля».
Предлагаемая в изобретении нуклеотидная последовательность, представляющая собой первый вариант осуществления настоящего изобретения, содержит любую приемлемую нуклеиновую кислоту, выбранную например, из любой (одноцепочечной или двухцепочечной) ДНК, включая предпочтительно (но, не ограничиваясь только ими), например, геномную ДНК, одноцепочечные молекулы ДНК, двухцепочечные молекулы ДНК, или ее можно выбирать, например, из любой из ПНК (пептидная нуклеиновая кислота), или ее можно выбирать, например, из любой (одноцепочечной или двухцепочечной) РНК, предпочтительно матричной РНК (мРНК) и т.д. Предлагаемая в изобретении молекула нуклеиновой кислоты может содержать также вирусную РНК (вРНК). Однако предлагаемая в изобретении нуклеотидная последовательность может не представлять собой вирусную РНК или может не содержать вирусную РНК. Более конкретно, предлагаемая в изобретении нуклеотидная последовательность может не содержать элементы вирусной последовательности, например, вирусные энхансеры или вирусные промоторы (например, не содержит инактивированные элементы вирусного промотора или вирусной последовательности, более конкретно, не инактивированные с помощью основанных на замене стратегий), или другие элементы вирусной последовательности или вирусные или ретровирусные нуклеотидные последовательности. Более конкретно, предлагаемая в изобретении нуклеотидная последовательность может не представлять собой ретровирусный или вирусный вектор или модифицированный ретровирусный или вирусный вектор.
В любом случае предлагаемая в изобретении нуклеотидная последовательность может содержать энхансерную и/или промоторную последовательность, которая может быть модифицирована или не модифицирована или которая может быть активирована или не активирована, или может не содержать указанные последовательности. Энхансер и/или промотор могут экспрессироваться или не экспрессироваться в растениях и/или могут экспрессироваться или не экспрессироваться в эукариотических организмах, и/или могут экспрессироваться или не экспрессироваться в прокариотических организмах. Предлагаемая в изобретении молекула нуклеиновой кислоты может содержать последовательность, кодирующую (обладающий способностью к автономному сплайсингу) рибозим, или не содержать указанную последовательность.
Предпочтительно предлагаемая в изобретении молекула нуклеиновой кислоты представляет собой РНК.
Согласно конкретным аспектам первого варианта осуществления настоящего изобретения предлагаемая в изобретении нуклеиновая кислота представляет собой нуклеотидную последовательность, которая входит в состав нуклеиновой кислоты, пригодной для транскрипции in vitro, прежде всего в соответствующем векторе для транскрипции in vitro (например, в плазмиде или линейной нуклеотидной последовательности, которая содержит специфические промоторы для транскрипции in vitro, такие как промоторы T3, T7 или Sp6).
Согласно другим наиболее предпочтительным аспектам первого варианта осуществления настоящего изобретения предлагаемая в изобретении нуклеиновая кислота входит в состав нуклеиновой кислоты, пригодной для транскрипции и/или трансляции в экспрессионной системе (например, в экспрессионном векторе или плазмиде), прежде всего в прокариотической (например, бактериальной типа Е. coli) или эукариотической (например, в клетках млекопитающего, таких как CHO-клетки, клетках дрожжей или клетках насекомых или в целых организмах, таких как растения или животные) экспрессионной системе.
Понятие «экспрессионная система» относится к системе (клеточная культура или целые организмы), которая пригодна для производства пептидов, белков или РНК, прежде всего мРНК.
Предлагаемая в изобретении нуклеотидная последовательность, представляющая собой первый вариант осуществления настоящего изобретения, содержит или кодирует по меньшей мере одну гистоновую структуру типа «стебель-петля». В контексте настоящего изобретения указанную гистоновую структуру типа «стебель-петля», как правило, выводят из генов гистонов, и она содержит внутримолекулярные спаривающиеся основания двух соседних полностью или частично обратно комплементарных последовательностей, которые образуют таким образом конструкцию типа «стебель-петля». Конструкция типа «стебель-петля» может находиться в одноцепочечной ДНК или, что является наиболее распространенным, в РНК. Эту структуру называют также «шпилькой» или «шпилечной петлей», и она, как правило, состоит из стебля и (концевой) петли в непрерывной последовательности, при этом «стебель» образован двумя соседними полностью или частично обратно комплементарными последовательностями, которые разделены короткой последовательностью типа спейсера, образуя петлю структуры типа «стебель-петля». Две соседние полностью или частично обратно комплементарные последовательности можно обозначать, например, как элементы stem1 и stem2 структуры типа «стебель-петля». Структура типа «стебель-петля»» образуется в том случае, когда эти две соседние полностью или частично обратно комплементарные последовательности, например, элементы stem1 и stem2 структуры типа «стебель-петля», образуют пары оснований друг с другом, что приводит к созданию двухцепочечной нуклеотидной последовательности, содержащей неспаренную петлю в концевой области, которая состоит из короткой последовательности, локализованной между элементами stem1 и stem2 структуры типа «стебель-петля» на непрерывной последовательности. Таким образом, неспаренная петля, как правило, представляет собой область нуклеиновой кислоты, которая не обладает способностью к спариванию оснований с любым из указанных элементов структуры типа «стебель-петля». Образовавшаяся имеющая форму «леденца на палочке» структура представляет собой основной конструктивный элемент многих вторичных структур РНК. Таким образом, образование структуры типа «стебель-петля» зависит от стабильности образовавшихся областей «стебля» и «петли», при этом первой предпосылкой является, как правило, присутствие последовательности, которая может обладать способностью к обратной укладке на самой себе с формированием спаренной двойной цепи. Стабильность спаренных элементов структуры типа «стебель-петля» определяется длиной, количеством мисмэтчей или выпуклостей, которые она содержит (небольшое количество мисмэтчей, как правило, является допустимым, прежде всего в случае длинной двойной цепи) и составом оснований спаренной области. В контексте настоящего изобретения оптимальная длина петли составляет 3-10 оснований, более предпочтительно 3-8, 3-7, 3-6 или еще более предпочтительно 4-5 оснований и наиболее предпочтительно 4 основания.
Согласно настоящему изобретению последовательность гистоновой структуры типа «стебель-петля», которая представляет собой компонент (б) по п.1 формулы изобретения, можно получать не из мышинного гистонового белка. Более конкретно, последовательность гистоновой структуры типа «стебель-петля» можно получать не из мышиного гена гистона H2A614. Кроме того, нуклеиновая кислота, предлагаемая в изобретении, может не содержать ни мышиной последовательности гистоновой структуры типа «стебель-петля», ни мышиного гена гистона H2A614. Кроме того, предлагаемая в изобретении нуклеотидная последовательность может не содержать сигнал процессинга структуры типа «стебель-петля», более конкретно сигнал процессинга мышиного гистона и наиболее конкретно может не содержать сигнал процессинга структуры типа «стебель-петля» H2kA614. Кроме того, предлагаемая в изобретении молекула нуклеиновой кислоты может содержать по меньшей мере один ген гистона млекопитающих. Однако по меньшей мере один ген гистона млекопитающих может не иметь последовательность, представленную в SEQ ID NO: 7 в WO 01/12824.
Согласно одному из предпочтительных аспектов первого варианта осуществления изобретения предлагаемая в изобретении нуклеотидная последовательность содержит или кодирует по меньшей мере одну последовательность гистоновой структуры типа «стебель-петля», предпочтительно соответствующую по меньшей мере одной из следующих формул (I) или (II):
формула (I) (последовательность структуры типа «стебель-петля» без пограничных элементов «стебля»):
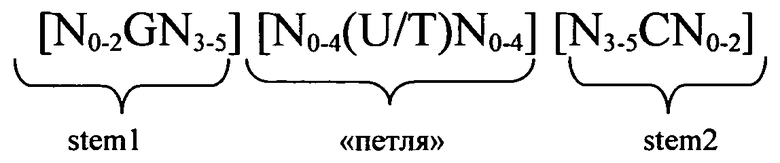
формула (II) (последовательность структуры типа «стебель-петля» с пограничными элементами):
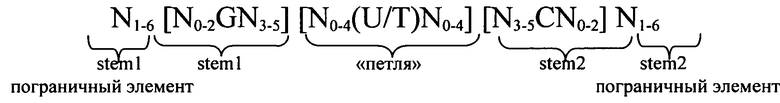
в которых:
пограничные элементы stem1 или stem2 N1-6 обозначают непрерывную последовательность, состоящую из 1 -6, предпочтительно 2-6, более предпочтительно 2-5, еще более предпочтительно 3-5, наиболее предпочтительно 4-5 или 5 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, Т, G и C или их нуклеотидного аналога;
stem1 [N0-2GN3-5] обозначает последовательность, обратно комплементарную или частично обратно комплементарную элементу stem2, и представляет собой непрерывную последовательность, состоящую из 5-7 нуклеотидов;
в которой N0-2 обозначает непрерывную последовательность, состоящую из 0-2, предпочтительно 0-1, более предпочтительно 1 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, T, G и C или его нуклеотидного аналога;
в которой N3-5 обозначает непрерывную последовательность, состоящую из 3-5, предпочтительно 4-5, более предпочтительно 4 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, T, G и C или его нуклеотидного аналога, и в которой G обозначает гуанозин или его аналог и необязательно может быть заменен на цитидин или его аналог при условии, что комплементарный ему нуклеотид цитидин в stem2 заменен на гуанозин;
последовательность «петли» [N0-4(U/T)N0-4] локализована между элементами stem1 и stem2 и обозначает непрерывную последовательность, состоящую из 3-5 нуклеотидов, более предпочтительно 4 нуклеотидов;
в которой N0-4 каждый независимо друг от друга обозначает непрерывную последовательность, состоящую из 0-4, предпочтительно 1-3, более предпочтительно 1-2 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, T, G и C или его нуклеотидного аналога; и
в которой U/T обозначает уридин или необязательно тимидин;
stem2 [N3-5CN0-2] обозначает последовательность, обратно комплементарную или частично обратно комплементарную элементу stem1, и представляет собой непрерывную последовательность, состоящую из 5-7 нуклеотидов;
в которой N3-5 обозначает непрерывную последовательность, состоящую из 3-5, предпочтительно 4-5, более предпочтительно 4 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, T, G и C или его нуклеотидного аналога;
в которой N0-2 обозначает непрерывную последовательность, состоящую из 0-2, предпочтительно 0-1, более предпочтительно 1 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, T, G или C или его нуклеотидного аналога;
и в которой С обозначает цитидин или его аналог и необязательно может быть заменен на гуанозин или его аналог при условии, что комплементарный ему нуклеотид гуанозин в stem1 заменен на цитидин;
где
у элементов stem1 и stem2 может происходить спаривание оснований друг с другом с образованием обратно комплементарной последовательности, где спаривание оснований может иметь место между stem1 и stem2, например, посредством спаривания оснований по Уотсону-Крику нуклеотидов A и U/T или G и C, или посредством спаривания оснований не по Уотсону-Крику, например, посредством спаривания «качающихся» оснований («качающегося» спаривания оснований), обратного спариванию оснований по Уотсону-Крику, посредством хугстиновского спаривания оснований, посредством обратного хугстиновскому спаривания оснований, или у них может происходить спаривание оснований друг с другом с образованием частично обратно комплементарной последовательности, при этом неполное спаривание оснований может иметь место между stem1 и stem2, вследствие того, что для одного или нескольких оснований в одном стебле не имеется комплементарного основания в обратно комплементарной последовательности другого стебля.
В указанном выше контексте спаривание «качающихся» оснований, как правило, представляет собой спаривание оснований не по Уотсону-Крику между двумя нуклеотидами. В контексте настоящего описания четыре основные пары «качающихся» оснований, которые можно применять, представляют собой гуанозин-уридин, инозин-уридин, инозин-аденозин, инозин-цитидин (G-U/T, I-U/T, I-A и I-C) и аденозин-цитидин (A-C).
Таким образом, в контексте настоящего изобретения «качающееся» основание представляет собой основание, которое формирует «качающуюся» пару оснований с другим основанием, как указано выше. Таким образом, спаривание оснований не по Уотсону-Крику, например, «качающееся» спаривание оснований, может иметь место в «стебле» гистоновой структуры типа «стебель-петля», предлагаемой в настоящем изобретении.
В указанном выше контексте частично обратно комплементарная последовательность содержит максимум 2, предпочтительно только одно ошибочное спаривание в структуре «стебля» последовательности структуры «стебель-петля», образованные(образованное) в результате спаривания оснований stem1 и stem2. Другими словами, stem1 и stem2 предпочтительно обладают способностью к (полному) спариванию оснований друг с другом на всем протяжении полной последовательности stem1 и stem2 (100% от возможных спариваний оснований по Уотсону-Крику или не по Уотсону-Крику), формируя тем самым обратно комплементарную последовательность, где каждое основание имеет правильное соответствующее ему парное по Уотсону-Крику или не по Уотсону-Крику основание в качестве комплементарно связывающего партнера. В альтернативном варианте stem1 и stem2 предпочтительно обладают способностью к спариванию оснований друг с другом на протяжении полной последовательности stem1 и stem2, где по меньшей мере примерно 70%, 75%, 80%, 85%, 90% или 95% из 100% от возможных правильных спариваний оснований по Уотсону-Крику или не по Уотсону-Крику, соответствуют правильным спариваниям оснований по Уотсону-Крику или не по Уотсону-Крику и максимум примерно 30%, 25%, 20%, 15%, 10% или 5% оставшихся оснований остаются неспаренными.
Согласно предпочтительному аспекту первого варианта осуществления изобретения по меньшей мере одна последовательность гистоновой структуры типа «стебель-петля» (с пограничными элементами «стебля») предлагаемой в изобретении нуклеотидной последовательности, представленной в настоящем описании, содержит от примерно 15 до примерно 45 нуклеотидов, предпочтительно от примерно 15 до примерно 40 нуклеотидов, предпочтительно от примерно 15 до примерно 35 нуклеотидов, предпочтительно от примерно 15 до примерно 30 нуклеотидов и еще более предпочтительно от примерно 20 до примерно 30 и наиболее предпочтительно от примерно 24 до примерно 28 нуклеотидов.
Согласно другому предпочтительному аспекту первого варианта осуществления изобретения по меньшей мере одна последовательность гистоновой структуры типа «стебель-петля» (без пограничных элементов «стебля») предлагаемой в изобретении нуклеотидной последовательности, представленной в настоящем описании, содержит от примерно 10 до примерно 30 нуклеотидов, предпочтительно от примерно 10 до примерно 20 нуклеотидов, предпочтительно от примерно 12 до примерно 20 нуклеотидов, предпочтительно от примерно 14 до примерно 20 нуклеотидов и еще более предпочтительно от примерно 15 до примерно 17 и наиболее предпочтительно примерно 16 нуклеотидов.
Согласно другому предпочтительному аспекту первого варианта осуществления изобретения предлагаемая в изобретении нуклеотидная последовательность, представляющая собой первый вариант осуществления изобретения, может содержать или кодировать по меньшей мере одну последовательность гистоновой структуры типа «стебель-петля», соответствующую по меньшей мере одной из следующих конкретных формул (Ia) или (IIa):
формула (Ia) (последовательность структуры типа «стебель-петля» без пограничных элементов «стебля»):
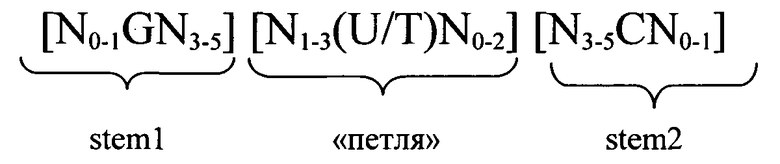 ,
,
формула (IIa) (последовательность структуры типа «стебель-петля» с пограничными элементами «стебля»):
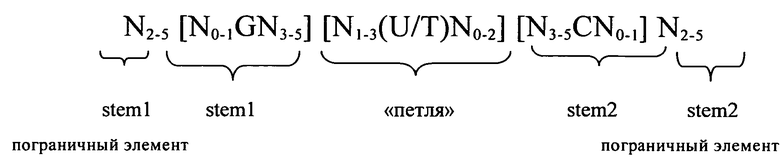 ,
,
в которой:
N, C, G, T и U) имеют указанные выше значения.
Согласно другому более предпочтительному аспекту первого варианта осуществления изобретения предлагаемая в изобретении нуклеотидная последовательность может содержать или кодировать по меньшей мере одну последовательность гистоновой структуры типа «стебель-петля», соответствующую по меньшей мере одной из следующих конкретных формул (Ib) или (IIb):
формула (Ib) (последовательность структуры типа «стебель-петля» без пограничных элементов стебля):
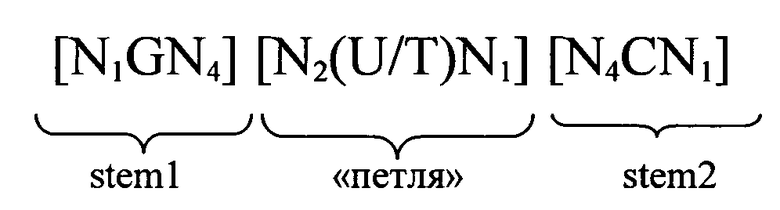
формула (IIb) (последовательность структуры типа «стебель-петля» с пограничными элементами «стебля»):

в которой:
N, C, G, T и U имеют указанные выше значения.
Согласно еще более предпочтительному аспекту первого варианта осуществления изобретения предлагаемая в изобретении нуклеотидная последовательность, представляющая собой первый вариант осуществления настоящего изобретения, может содержать или кодировать по меньшей мере одну последовательность гистоновой структуры типа «стебель-петля», соответствующую по меньшей мере одной из следующих конкретных формул (Ic)-(Ih) или (IIc)-(IIh), которые являются альтернативными по структуре типа «стебель-петля», и имеют линейную последовательность, соответствующую последовательностям гистоновой структуры типа «стебель-петля», полученную согласно методу, описанному в примере 1:
формула (Ic): (консенсусная последовательность гистоновой структуры типа «стебель-петля» без пограничных элементов «стебля», выведенная из многоклеточных и простейших организмов):
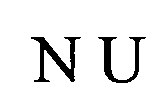

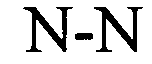
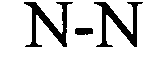
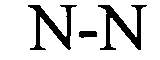
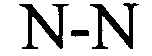
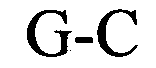
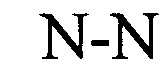 (структура типа «стебель-петля»)
(структура типа «стебель-петля»)
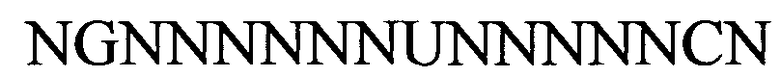
(линейная последовательность) (SEQ ID NO: 1)
формула (IIc): (консенсусная последовательность гистоновой структуры типа «стебель-петля» с пограничными элементами «стебля», выведенная из многоклеточных и простейших организмов):
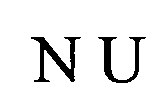

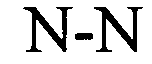
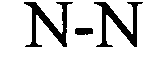
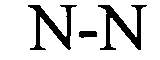
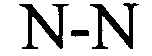
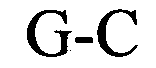
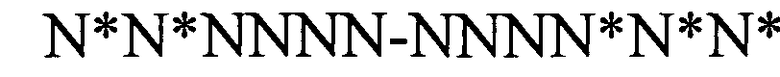 (структура типа «стебель-петля»)
(структура типа «стебель-петля»)
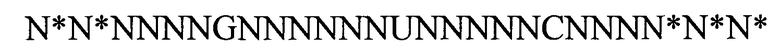
(линейная последовательность) (SEQ ID NO: 2),
формула (Id): (без пограничных элементов «стебля»)
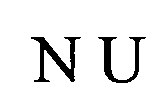

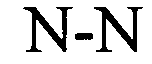
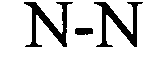
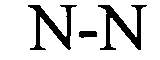
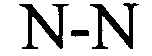
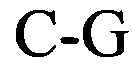
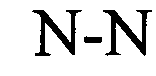 (структура типа «стебель-петля»)
(структура типа «стебель-петля»)
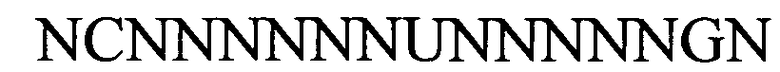
(линейная последовательность) (SEQ ID NO: 3),
формула (IId): (с пограничными элементами «стебля»)
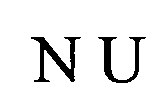

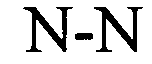
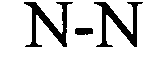
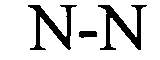
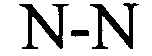
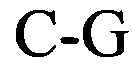
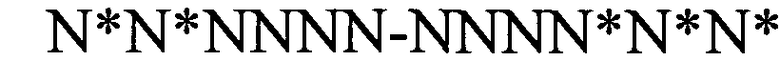 (структура типа «стебель-петля»)
(структура типа «стебель-петля»)
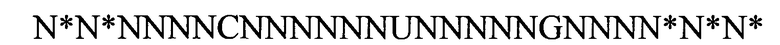
(линейная последовательность) (SEQ ID NO: 4),
формула (Ie): (консенсусная последовательность гистоновой структуры типа «стебель-петля» без пограничных элементов «стебля», выведенная из простейших организмов):
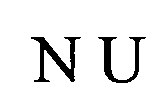

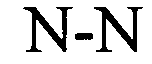
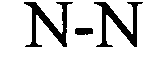
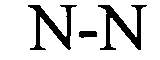
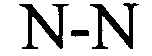
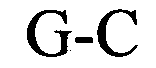
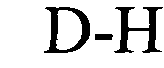 (структура типа «стебель-петля»)
(структура типа «стебель-петля»)
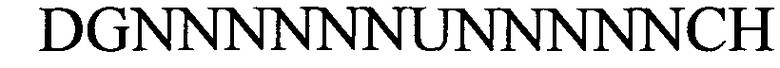
(линейная последовательность) (SEQ ID NO: 5),
формула (IIe): (консенсусная последовательность гистоновой структуры типа «стебель-петля» с пограничными элементами «стебля», выведенная из простейших организмов):
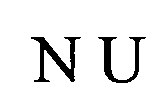

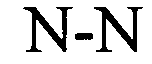
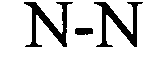
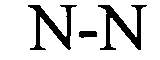
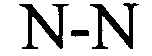
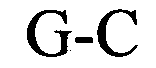
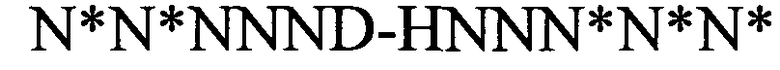 (структура типа «стебель-петля»)
(структура типа «стебель-петля»)

(линейная последовательность) (SEQ ID NO: 6),
формула (If): (консенсусная последовательность гистоновой структуры типа «стебель-петля» без пограничных элементов «стебля», выведенная из многоклеточных организмов):
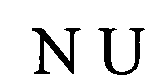

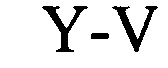
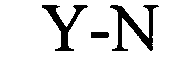
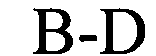
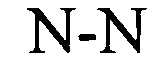
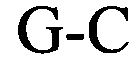
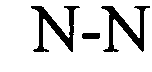 (структура типа «стебель-петля»)
(структура типа «стебель-петля»)
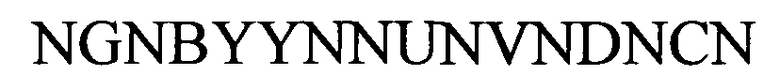
(линейная последовательность) (SEQ ID NO: 7),
формула (IIf): (консенсусная последовательность гистоновой структуры типа «стебель-петля» с пограничными элементами «стебля», выведенная из многоклеточных организмов):
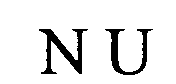
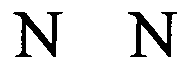

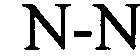
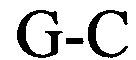
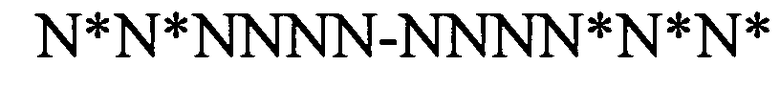 (структура типа «стебель-петля»)
(структура типа «стебель-петля»)

(линейная последовательность) (SEQ ID NO: 8),
формула (Ig): (консенсусная последовательность гистоновой структуры типа «стебель-петля» без пограничных элементов «стебля», выведенная из позвоночных животных):
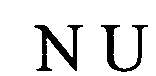

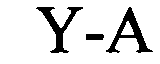
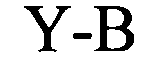
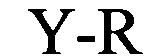
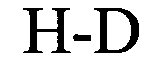
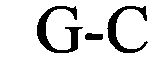
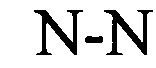 (структура типа «стебель-петля»)
(структура типа «стебель-петля»)
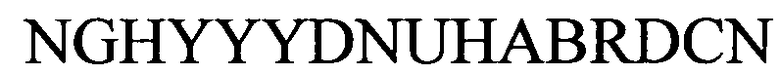
(линейная последовательность) (SEQ ID NO: 9),
формула (IIg): (консенсусная последовательность гистоновой структуры типа «стебель-петля» с пограничными элементами «стебля», выведенная из позвоночных животных):
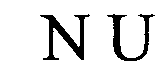

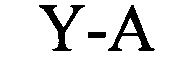
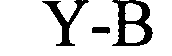
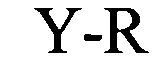
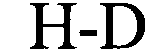

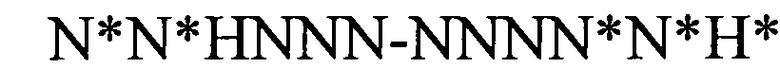 (структура типа «стебель-петля»)
(структура типа «стебель-петля»)
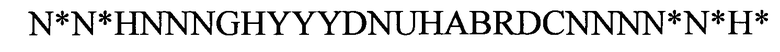
(линейная последовательность) (SEQ ID NO: 10),
формула (Ih): (человеческая {Homo sapiens) консенсусная последовательность гистоновой структуры типа «стебель-петля» без пограничных элементов «стебля»):
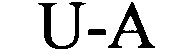
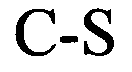
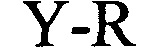
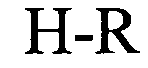

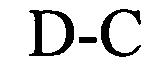 (структура типа «стебель-петля»)
(структура типа «стебель-петля»)
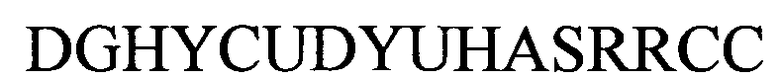
(линейная последовательность) (SEQ ID NO: 11),
формула (IIh): (человеческая {Homo sapiens) консенсусная последовательность структуры типа «стебель-петля» с пограничными элементами «стебля»):
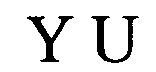
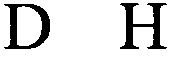
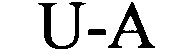
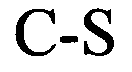
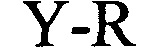
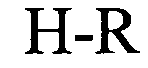

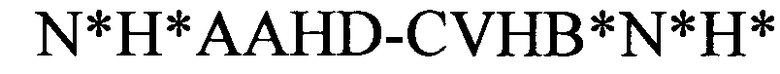 (структура типа «стебель-петля»)
(структура типа «стебель-петля»)

(линейная последовательность) (SEQ ID NO: 12),
где в каждой из формул (Ic)-(Ih) или (IIc)-(IIh):
N, C, G, A, T и U имеют указанные выше значения;
каждый U можно заменять на T;
каждый (высоко) консервативный G или C в элементах 1 и 2 «стебля» можно заменять на комплементарное ему нуклеотидное основание C или G при условии, что указанный комплементарный нуклеотид в соответствующем «стебле» параллельно заменяют на комплементарный ему нуклеотид; и/или
G, A, T, U, C, R, Y, M, K, S, W, H, B, V, D и N представляют собой нуклеотидные основания, указанные ниже в таблице:
В этом контексте наиболее предпочтительной последовательностью гистоновой структуры типа «стебель-петля», которая соответствует по меньшей мере одной из формул (I) или (Ia)-(Ih), или (II), или (IIa)-(IIh), предлагаемых в настоящем изобретении, является последовательность, выбранная из встречающейся в естественных условиях последовательности гистоновой структуры типа «стебель-петля», более предпочтительно из последовательностей гистоновой структуры типа «стебель-петля» из простейших или многоклеточных организмов и еще более предпочтительно из последовательностей гистоновой структуры типа «стебель-петля» из позвоночных животных и наиболее предпочтительно из последовательностей гистоновой структуры типа «стебель-петля» из млекопитающих, наиболее предпочтительно из человеческих последовательностей гистоновой структуры типа «стебель-петля».
Согласно наиболее предпочтительному аспекту первого варианта осуществления изобретения последовательность гистоновой структуры типа «стебель-петля», которая соответствует по меньшей мере одной из конкретных формул (I) или (Ia)-(Ih), или (II), или (IIa)-(IIh), предлагаемых в настоящем изобретении, представляет собой последовательность гистоновой структуры типа «стебель-петля», которая содержит в каждом нуклеотидном положении наиболее часто встречающийся нуклеотид, или либо наиболее часто встречающийся, либо второй по частоте встречаемости в естественных условиях нуклеотид в последовательностях гистоновой структуры типа «стебель-петля» у многоклеточных и простейших организмов (фиг.1), простейших организмов (фиг.2), многоклеточных организмов (фиг.3), позвоночных животных (фиг.4) и людей (фиг.5), которые представлены на фиг.1-5. В этом контексте наиболее предпочтительно по меньшей мере 80%, предпочтительно по меньшей мере 85% или наиболее предпочтительно по меньшей мере 90% всех нуклеотидов соответствуют нуклеотидам, наиболее часто встречающимся в естественных условиях в последовательностях гистоновой структуры типа «стебель-петля».
Согласно другому предпочтительному аспекту первого варианта осуществления изобретения последовательность гистоновой структуры типа «стебель-петля», которая соответствует по меньшей мере одной из конкретных формул (I) или (Ia)-(Ih), предлагаемых в настоящем изобретении, выбирают из представленных ниже последовательностей гистоновой структуры типа «стебель-петля» (без пограничных элементов «стебля»), которые представляют собой последовательности гистоновой структуры типа «стебель-петля», полученные согласно методу, описанному в примере 1:
 (SEQ ID NO: 13, соответствует формуле (Ic)),
(SEQ ID NO: 13, соответствует формуле (Ic)),
 (SEQ ID NO: 14, соответствует формуле (Ic)),
(SEQ ID NO: 14, соответствует формуле (Ic)),
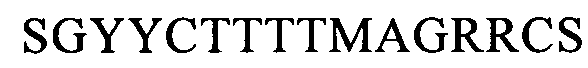 (SEQ ID NO: 15, соответствует формуле (Ic)),
(SEQ ID NO: 15, соответствует формуле (Ic)),
 (SEQ ID NO: 16, соответствует формуле (Ie)),
(SEQ ID NO: 16, соответствует формуле (Ie)),
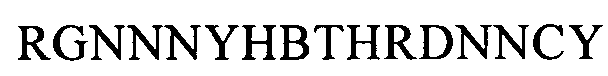 (SEQ ID NO: 17, соответствует формуле (Ie)),
(SEQ ID NO: 17, соответствует формуле (Ie)),
 (SEQ ID NO: 18, соответствует формуле (Ie)),
(SEQ ID NO: 18, соответствует формуле (Ie)),
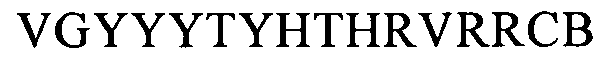 (SEQ ID NO: 19, соответствует формуле (If)),
(SEQ ID NO: 19, соответствует формуле (If)),
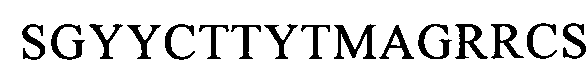 (SEQ ID NO: 20, соответствует формуле (If)),
(SEQ ID NO: 20, соответствует формуле (If)),
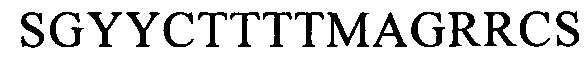 (SEQ ID NO: 21, соответствует формуле (If)),
(SEQ ID NO: 21, соответствует формуле (If)),
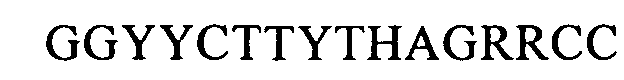 (SEQ ID NO: 22, соответствует формуле (Ig)),
(SEQ ID NO: 22, соответствует формуле (Ig)),
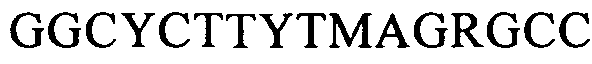 (SEQ ID NO: 23, соответствует формуле (Ig)),
(SEQ ID NO: 23, соответствует формуле (Ig)),
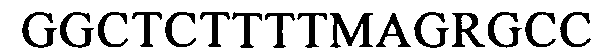 (SEQ ID NO: 24, соответствует формуле (Ig))
(SEQ ID NO: 24, соответствует формуле (Ig))
 (SEQ ID NO: 25, соответствует формуле (Ih)),
(SEQ ID NO: 25, соответствует формуле (Ih)),
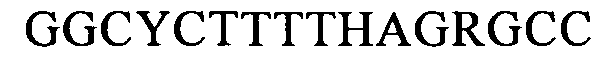 (SEQ ID NO: 26, соответствует формуле (Ih)),
(SEQ ID NO: 26, соответствует формуле (Ih)),
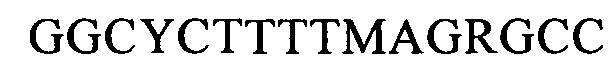 (SEQ ID NO: 27, соответствует формуле (Ih)).
(SEQ ID NO: 27, соответствует формуле (Ih)).
Кроме того, в этом контексте наиболее предпочтительными являются следующие последовательности гистоновой структуры типа «стебель-петля» (с пограничными элементами «стебля»), которые получают согласно методу, описанному в примере 1, соответствующие одной из конкретных формул (II) или (IIa)-(IIh):
 (SEQ ID NO: 28, соответствует формуле (IIc)),
(SEQ ID NO: 28, соответствует формуле (IIc)),
 (SEQ ID NO: 29, соответствует формуле (IIc))
(SEQ ID NO: 29, соответствует формуле (IIc))
 (SEQ ID NO: 30, соответствует формуле (IIc)),
(SEQ ID NO: 30, соответствует формуле (IIc)),
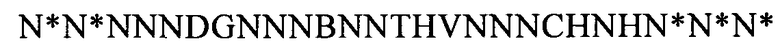 (SEQ ID NO: 31, соответствует формуле (IIe)),
(SEQ ID NO: 31, соответствует формуле (IIe)),
 (SEQ ID NO: 32, соответствует формуле (IIe)),
(SEQ ID NO: 32, соответствует формуле (IIe)),
 (SEQ ID NO: 33, соответствует формуле (IIe)),
(SEQ ID NO: 33, соответствует формуле (IIe)),
 (SEQ ID NO: 34, соответствует формуле (IIf)),
(SEQ ID NO: 34, соответствует формуле (IIf)),
 (SEQ ID NO: 35, соответствует формуле (IIf)),
(SEQ ID NO: 35, соответствует формуле (IIf)),
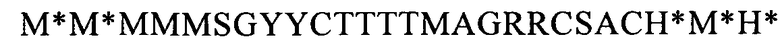 (SEQ ID NO: 36, соответствует формуле (IIf)),
(SEQ ID NO: 36, соответствует формуле (IIf)),
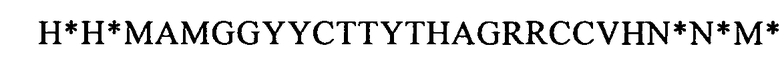 (SEQ ID NO: 37, соответствует формуле (IIg)),
(SEQ ID NO: 37, соответствует формуле (IIg)),
 (SEQ ID NO: 38, соответствует формуле (IIg)),
(SEQ ID NO: 38, соответствует формуле (IIg)),
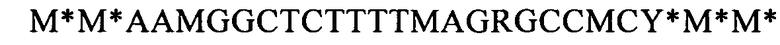 (SEQ ID NO: 39, соответствует формуле (IIg)),
(SEQ ID NO: 39, соответствует формуле (IIg)),
 (SEQ ID NO: 40, соответствует формуле (IIh)),
(SEQ ID NO: 40, соответствует формуле (IIh)),
 (SEQ ID NO: 41, соответствует формуле (IIh)),
(SEQ ID NO: 41, соответствует формуле (IIh)),
 (SEQ ID NO: 42, соответствует формуле (IIh)).
(SEQ ID NO: 42, соответствует формуле (IIh)).
Согласно следующему предпочтительному аспекту первого варианта осуществления изобретения предлагаемая в изобретении последовательность содержит или кодирует по меньшей мере одну последовательность гистоновой структуры типа «стебель-петля», последовательность которой идентична по меньшей мере примерно на 80%, предпочтительно по меньшей мере примерно w 85%, более предпочтительно по меньшей мере примерно на 90% или даже более предпочтительно по меньшей мере примерно на 95% последовательности, содержащей не более 100% консервативных нуклеотидов в последовательностях гистоновой структуры типа «стебель-петля», соответствующих по меньшей мере одной из конкретных формул (I) или (Ia)-(Ih), или (II), или (IIa)-(IIh), или встречающейся в естественных условиях последовательности гистоновой структуры типа «стебель-петля».
Предлагаемая в изобретении нуклеотидная последовательность согласно первому варианту осуществления настоящего изобретения может необязательно содержать или кодировать поли(A)-последовательность. Если она присутствует, то указанная поли(A)-последовательность включает последовательность, которая содержит от примерно 25 до примерно 400 аденозиновых нуклеотидов, предпочтительно последовательность, которая содержит от примерно 50 до примерно 400 аденозиновых нуклеотидов, более предпочтительно последовательность, которая содержит от примерно 50 до примерно 300 аденозиновых нуклеотидов, еще более предпочтительно последовательность, которая содержит от примерно 50 до примерно 250 аденозиновых нуклеотидов, наиболее предпочтительно последовательность, которая содержит от примерно 60 до примерно 250 аденозиновых нуклеотидов. В этом контексте понятие «примерно» относится к отклонению, составляющему ±10% от величины(н), к которой(ым) оно относится.
Предпочтительно нуклеиновая кислота, предлагаемая в настоящем изобретении, не содержит один или два, или по меньшей мере один или все кроме одного, или все компоненты, выбранные из группы, включающей: последовательность, которая кодирует рибозим (предпочтительно обладающий способностью к автономному сплайсингу рибозим), вирусную нуклеотидную последовательность, сигнал процессинга гистоновой структуры типа «стебель-петля», в частности, сигнал процессинга гистоновой структуры типа «стебель-петля», выведенный из гена мышиного гистона H2A614, ген Neo, инактивированную промоторную последовательность и инактивированную энхансерную последовательность. Еще более предпочтительно нуклеиновая кислота, предлагаемая в изобретении, не содержит рибозим, предпочтительно обладающий способностью к автономному сплайсингу рибозим, и один или несколько компонентов, выбранных из группы, включающей: ген Neo, инактивированную промоторную последовательность и инактивированную энхансерную последовательность, сигнал процессинга гистоновой структуры типа «стебель-петля», в частности, сигнал процессинга гистоновой структуры типа «стебель-петля», выведенный из гена мышиного гистона H2A614. Таким образом, нуклеиновая кислота в предпочтительном варианте не содержит ни рибозим, предпочтительно обладающий способностью к автономному сплайсингу рибозим, ни ген Neo, или в альтернативном варианте ни рибозим, предпочтительно обладающий способностью к автономному сплайсингу рибозим, ни один из генов, обусловливающих устойчивость (например, применяемых для селекции). В другом предпочтительном варианте нуклеиновая кислота, предлагаемая в изобретении, может не содержать ни рабозим, предпочтительно обладающий способностью к автономному сплайсингу рибозим, ни сигнал процессинга гистоновой структуры типа «стебель-петля», в частности, сигнал процессинга гистоновой структуры типа «стебель-петля», выведенный из гена мышиного гистона H2A614.
Альтернативно этому, согласно первому варианту осуществления настоящего изобретения предлагаемая в изобретении нуклеотидная последовательность необязательно содержит сигнал полиаденилирования, указанный в настоящем описании, представляющий собой сигнал, который обеспечивает полиаденилирование (транскрибируемой) мРНК посредством специфических белковых факторов (такой, например, как специфический фактор расщепления и полиаденилирования (CPSF), стимулирующий расщепления фактор (CstF), факторы расщепления I и II (CF I и CF II), поли(A)-полимераза (РАР)). В этом контексте консенсусный сигнал полиаденилирования предпочтительно содержит консенсусную последовательность NNUANA. В наиболее предпочтительном объекте изобретения сигнал полиаденилирования содержит одну из следующих последовательностей: AAUAAA или AUUAAA.
Предлагаемая в изобретении нуклеотидная последовательность согласно первому варианту осуществления настоящего изобретения кодирует также белок или пептид, который можно выбирать (но, не ограничиваясь только ими), например, из терапевтически активных белков или пептидов, включая адъювантные белки, из антигенов, например, опухолевых антигенов, патогенных антигенов (например, выбранных из антигенов из животных, из вирусных антигенов, из антигенов простейших, из бактериальных антигенов), аллергенных антигенов, аутоиммунных антигенов или других антигенов, из аллергенов, из антител, из иммуностимулирующих белков или пептидов или из антигенспецифических T-клеточных рецепторов или из любого другого белка или пептида, который можно применять для конкретного (терапевтического) введения, при этом предлагаемую в изобретении нуклеиновую кислоту можно транспортировать в клетку (например, в предназначенную для экспрессии клетку-хозяина или соматическую клетку), ткань или организм и после этого белок можно экспрессировать в этой клетке, ткани или организме.
Кодирующая область предлагаемой в изобретении нуклеиновой кислоты согласно первому варианту осуществления настоящего изобретения может находиться в виде моно- ди- или даже мультицистронной нуклеиновой кислоты, т.е. нуклеиновой кислоты, которая несет кодирующие последовательности одного, двух или даже большего количества белков или пептидов. Такие кодирующие последовательности в ди- или даже мультицистронных нуклеиновых кислотах могут быть разделены по меньшей мере одной последовательностью внутреннего сайта связывания (посадки) рибосом (IRES), например, указанной в настоящем описании, или сигнальными пептидами, которые индуцируют расщепление образовавшегося полипептида, который содержит несколько белков или пептидов.
В наиболее предпочтительных аспектах первого варианта осуществления настоящего изобретения кодируемые пептиды или белки выбирают из человеческих, вирусных, бактериальных, протозойных белков или пептидов.
В контексте настоящего изобретения терапевтически активные белки, кодируемые предлагаемой в изобретении молекулой нуклеиновой кислоты, можно выбрать (но, не ограничиваясь только ими) из белков, которые оказывают действие на заживление, обладают способностью оказывать профилактическое или терапевтическое действие на заболевание, предпочтительно указанное в настоящем описании, или представляют собой белки, в которых нуждается индивидуум. Указанные белки можно выбирать из любых встречающихся в естественных условиях или созданных путем синтеза рекомбинантных или выделенных белков, известных специалисту в данной области. Терапевтически активные белки могут представлять собой (но, не ограничиваясь только ими) белки, которые могут стимулировать или ингибировать трансдукцию сигнала в клетке, например, цитокины, лимфокины, монокины, факторы роста, рецепторы, молекулы трансдукции сигнала, факторы транскрипции; антикоагулянты;
антитромбины; противоаллергенные белки; проапоптозные факторы или связанные с апоптозом белки, терапевтически активные ферменты и любой белок, связанный с любым приобретенным заболеванием или любым врожденным заболеванием.
Предпочтительно терапевтически активный белок, который может кодироваться предлагаемой в изобретении молекулой нуклеиновой кислоты, может представлять собой также адъювантный белок. В этом контексте под адъювантым белком предпочтительно подразумевают любой белок, который обладает способностью вызывать врожденный иммунный ответ, указанный в настоящем описании. Предпочтительно указанный врожденный иммунный ответ включает активацию паттернраспознающего рецептора, такого, например, как рецептор, выбранный из семейства Толл-подобных рецепторов (TLR), включая, например, Толл-подобный рецептор, выбранный из человеческих TLR I-TLR 10 или из мышиных Толл-подобных рецепторов TLR1-TLR13. Более предпочтительно адъювантный белок выбирают из человеческих адъювантых белков или из патогенных адъювантных белков, выбранных из группы, включающей (но, не ограничиваясь только ими) бактериальные белки, протозойные белки, вирусные белки или грибные белки, белки животных, прежде всего из бактериальных адъювантных белков. Кроме того, можно применять также нуклеиновые кислоты, кодирующие белки, участвующие в проявлении адъювантного действия (например, лиганды паттернраспознающих рецепторов, паттернраспознающие рецепторы, белки путей трансдукции сигнала, факторы транскрипции или цитокины).
В альтернативном варианте предлагаемая в изобретении молекула нуклеиновой кислоты может кодировать антиген. Согласно настоящему изобретению понятие «антиген» относится к субстанции, которая распознается иммунной системой и обладает способностью запускать антигенспецифический иммунный ответ, например, путем образования антител или антигенспецифических T-клеток в качестве части адаптивного иммунного ответа. В этом контексте антигенный эпитоп, фрагмент или пептид белка означает конкретные B-клеточные и T-клеточные эпитопы, которые могут распознаваться В-клетками, антителами или T-клетками соответственно.
В контексте настоящего изобретения антигены, которые могут кодироваться предлагаемой в изобретении молекулой нуклеиновой кислоты, как правило, представляют собой любой антиген, антигенный эпитоп, антигенный фрагмент или антигенный пептид, подпадающий под вышеуказанное определение, более предпочтительно белковые и пептидные антигены, например, опухолевые антигены, аллергенные антигены или аллергены, аутоиммунные аутоантигены, патогенные антигены и т.д.
Конкретные антигены, кодируемые предлагаемой в изобретении молекулой нуклеиновой кислоты, могут представлять собой антигены, образующиеся вне клетки, более конкретно антигены, которые не образуются сами в организме-хозяине (например, в организме человека) (т.е. не аутоантигены), но чаще они представляют собой антигены, образовавшиеся из клеток-хозяев вне организма-хозяина, например, вирусные антигены, бактериальные антигены, грибные антигены, антигены простейших, антигены животных, аллергенные антигены и т.д. Аллергенные антигены (вызывающие аллергию антигены или аллергены) являются типичными антигенами, которые вызывают аллергию у человека или могут иметь происхождение из организма человека или других источников. Кроме того, антигены, кодируемые предлагаемой в изобретении молекулой нуклеиновой кислоты, могут представлять собой также антигены, образовавшиеся внутри клетки, ткани или в организме. Указанные антигены включают антигены, образовавшиеся в организме-хозяине (например, в организме человека), например, опухолевые антигены, аутоантигены или аутологичные антигены, такие как аутоиммунные аутоантигены и т.д., но также (неауто-)антигены, указанные в настоящем описании, которые исходно образованы из клеток-хозяев вне организма-хозяина, но которые фрагментированы или расщеплены внутри организма, ткани или клетки, например путем (протеазного) расщепления, метаболизма и т.д.
Один класс антигенов, кодируемых предлагаемой в изобретении молекулой нуклеиновой кислоты, содержит опухолевые антигены. «Опухолевые антигены» предпочтительно локализованы на поверхности (опухолевой) клетки. Опухолевые антигены можно выбирать также из белков, для которых характерна сверхэкспрессия на опухолевых клетках по сравнению со здоровыми клетками. Кроме того, опухолевые антигены включают также антигены, экспрессирующиеся в клетках, которые сами не являются (не были) (или исходно не сами) перерожденными, но ассоциированы с предполагаемой опухолью. Антигены, связанные с сосудами, которые поставляют кровь в опухоль, или с их (ре)формированием, в частности антигены, которые ассоциированы с неоваскуляризацией, например, факторы роста, такие как VEGF, bFGF и т.д. подпадают также под объем настоящего изобретения. К антигенам, связанным с опухолью, относятся также антигены из клеток или тканей, как правило, окружающих опухоль. Кроме того, некоторые субстанции (как правило, белки или пептиды) экспрессируются у пациентов, страдающих (установленным или неустановленным) раковым заболеванием, и они присутствуют в повышенных концентрациях в общей воде организма у таких пациентов. Эти субстанции подпадают также под понятие «опухолевые антигены», однако в строгом смысле они не являются антигенами, т.е. индуцирующими иммунный ответ субстанциями. Класс опухолевых антигенов можно подразделять также на специфические для опухоли антигены (TSA) и ассоциированные с опухолью антигены (ТАА). TSA могут презентоваться только опухолевыми клетками и никогда нормальными «здоровыми» клетками. Они, как правило, образуются в результате специфической для опухоли мутации. ТАА, которые являются более общими, как правило, презентуются как опухолевыми, так и здоровыми клетками. Эти антигены распознаются, в результате чего антигенпрезентирующая клетка может разрушаться цитотоксическими Т-клетками. Кроме того, опухолевые антигены могут присутствовать также на поверхности опухоли в форме, например, мутантного рецептора. В этом случае они могут распознаваться антителами.
Согласно другому варианту осуществления изобретения один дополнительный класс антигенов, которые могут кодироваться предлагаемой в изобретении молекулой нуклеиновой кислоты, представляет собой аллергенные антигены. Указанные аллергенные антигены можно выбирать из антигенов, происходящих из различных источников, например, из животных, растений, грибов, бактерий и т.д. В этом контексте аллергены включают, например, травы, пыльцу, плесени, лекарственные средства или многочисленные связанные с окружающей средой провоцирующие агенты. Аллергенные антигены, как правило, принадлежат к различным классам соединений, таким как нуклеиновые кислоты и их фрагменты, белки или пептиды и их фрагменты, углеводы, полисахариды, сахара, липиды, фосфолипиды и т.д. Наиболее важными в контексте настоящего изобретения являются антигены, которые могут кодироваться предлагаемой в изобретении молекулой нуклеиновой кислоты, т.е. белковые или пептидные антигены и их фрагменты или эпитопы, или нуклеиновые кислоты и их фрагменты, прежде всего нуклеиновые кислоты и их фрагменты, которые кодируют указанные белковые или пептидные антигены и их фрагменты или эпитопы.
Согласно другому варианту осуществления изобретения предлагаемая в изобретении молекула нуклеиновой кислоты может кодировать антитело или фрагмент антитела. Согласно настоящему изобретению указанное антитело можно выбирать из любого антитела, например, любых полученных рекомбинантно или встречающихся в естественных условиях антител, известных в данной области, в частности антител, пригодных для терапевтических, диагностических или научных целей, или антител, которые были идентифицированы в связи с конкретными раковыми заболеваниями. В контексте настоящего описания понятие «антитело» используется в его наиболее широком смысле и относится, в частности, к моноклональным и поликлональным антителам (включая агонистические, антагонистические и блокирующие или нейтрализующие антитела) и видам антител с полиэпитопной специфичностью. Согласно изобретению «антитело», как правило, включает любые антитела, известные в данной области (например, антитела типа IgM, IgD, IgG, IgA и IgE), в том числе встречающиеся в естественных условиях антитела, антитела, полученные иммунизацией организма-хозяина, антитела, которые выделены и идентифицированы из встречающегося в естественных условиях источника, или антитела, полученные иммунизацией организма-хозяина и полученные рекомбинантным путем с помощью методов молекулярной биологии, известных в данной области, а также химерные антитела, человеческие антитела, гуманизированные антитела, биспецифические антитела, антитела к внутреннему фактору, т.е. антитела, экспрессирующиеся в клетках и необязательно локализованные в специфических клеточных компартментах, и фрагменты и варианты указанных выше антител. Как правило, антитело состоит из легкой цепи и тяжелой цепи, которые обе имеют вариабельные и константные области. Легкая цепь состоит из N-концевой вариабельной области, VL, и C-концевой константной области, CL. В отличие от этого, тяжелая цепь антитела типа IgG, например, состоит из N-концевой вариабельной области, VH, и трех константных областей, CH1, CH2 и CH3.
В контексте настоящего изобретения антитела, кодируемые предлагаемой в изобретении молекулой нуклеиновой кислоты, могут предпочтительно представлять собой полноразмерные антитела, т.е. антитела, состоящие из полных тяжелых и полных легких цепей, описанных выше. Однако производные антител, такие как фрагменты, варианты или аддукты, могут также кодироваться предлагаемой в изобретении молекулой нуклеиновой кислоты. Фрагменты антитела предпочтительно выбирают из Fab-, Fab′-, P(ab′)2-, Fc-, Facb-, pFc′-, Fd- и Fv-фрагментов вышеуказанных (полноразмерных) антител. В целом, фрагменты антител известны в данной области. Например, Fab-фрагмент («антигенсвязывающий фрагмент» (fragment, antigen binding) состоит из одной константной и одной вариабельной области каждой тяжелой и легкой цепи. Два вариабельных домена связываются с эпитопом на специфических антигенах. Две цепи связаны через дисульфидный мостик. Например, scFv-фрагмент (одноцепочечный фрагмент вариабельной области (single chain variable fragment)), как правило, состоит из вариабельных областей легкой и тяжелой цепей. Домены связаны искусственной связью, как правило, полипептидной связью, такой как пептид, состоящий из 15-25 остатков глицина, пролина и/или серина.
В контексте настоящего изобретения является предпочтительным, когда различные цепи антитела или фрагмента антитела кодируются молекулой мультицистронной нуклеиновой кислоты. В альтернативном варианте различные линии антител или фрагментов антител кодируются несколькими моноцистронными нуклеиновыми кислотами (последовательностями).
Согласно первому варианту осуществления настоящего изобретения предлагаемая в изобретении нуклеотидная последовательность содержит кодирующую область, предпочтительно кодирующую пептид или белок. Предпочтительно кодируемый белок не представляет собой гистоновый белок. В контексте настоящего изобретения указанный гистоновый белок, как правило, представляет собой сильно щелочной белок, обнаруженный в ядрах эукариотических клеток, который осуществляет упаковку или упорядочивание ДНК в виде структурных единиц, называемых нуклеосомами. Гистоновые белки представляют собой основные белковые компоненты хроматина, они действуют в качестве катушек, вокруг которых накручиваются ДНК, и играют роль в генной регуляции. Без гистонов нескрученная ДНК в хромосомах была бы слишком длинной (соотношение длины и ширины для любой человеческой ДНК превышает 10 миллионов). Например, каждая человеческая клетка содержит ДНК длиной примерно 1,8 м, но после накручивания на гистоны она входит в состав хроматина длиной примерно 90 мм, который после дупликации и конденсации в процессе митоза приводит к образованию хромосом длиной примерно 12 мкм. Более предпочтительно в контексте настоящего изобретения указанный гистоновый белок, как правило, определяют как высококонсервативный белок, выбранный из одного из следующих пяти основных классов гистонов: H1/H5, H2A, H2B, H3 и H4, предпочтительно выбранный из гистона млекопитающего, более предпочтительно из человеческих гистонов или гистоновых белков. Указанные гистоны или гистоновые белки, как правило, образуют два надкласса, обозначенных как коровые гистоны, к которым относятся гистоны H2A, H2B, H3 и H4, и линкерные гистоны, к которым относятся гистоны H1 и H5.
В этом контексте линкерные гистоны, которые предпочтительно исключены из объема охраны рассматриваемого изобретения, предпочтительно представляют собой линкерные гистоны млекопитающих, более предпочтительно человеческие линкерные гистоны, которые, как правило, выбраны из H1, включая H1F, более конкретно включая H1F0, H1FNT, H1FOO, H1FX и H1H1, предпочтительно включая HIST1H1A, HIST1H1B, HIST1H1C, HIST1H1D, HIST1H1E, HIST1H1T, и т.д.
Кроме того, коровые гистоны, которые предпочтительно исключены из объема охраны рассматриваемого изобретения, предпочтительно представляют собой коровые гистоны млекопитающих, более предпочтительно человеческие коровые гистоны, которые, как правило, выбраны из H2A, включая H2AF, более конкретно включая H2AFB1, H2AFB2, H2AFB3, H2AFJ, H2AFV, H2AFX, H2AFY, H2AFY2, H2AFZ и H2A1, предпочтительно включая HIST1H2AA, HIST1H2AB, HIST1H2AC, HIST1H2AD, HIST1H2AE, HIST1H2AG, HIST1H2AI, HIST1H2AJ, HIST1H2AK, HIST1H2AL, HIST1H2AM и H2A2, предпочтительно включая HIST2H2AA3, HIST2H2AC; H2B, включая H2BF, более конкретно включая H2BFM, H2BFO, H2BFS, H2BFWT H2B1, предпочтительно включая HIST1H2BA, HIST1H2BB, HIST1H2BC, HIST1H2BD, HIST1H2BE, HIST1H2BF, HIST1H2BG, HIST1H2BH, HIST1H2BI, HIST1H2BJ, HIST1H2BK, HIST1H2BL, HIST1H2BM, HIST1H2BN, HIST1H2BO и H2B2, предпочтительно включая HIST2H2BE; H3, включая H3A1, предпочтительно включая HIST1H3A, HIST1H3B, HIST1H3C, HIST1H3D, HIST1H3E, HIST1H3F, HIST1H3G, HIST1H3H, HIST1H3I, HIST1H3J и H3A2, предпочтительно включая HIST2H3C, и H3A3, предпочтительно включая HIST3H3; H4, включая H41, предпочтительно включая HIST1H4A, HIST1H4B, HIST1H4C, HIST1H4D, HIST1H4E, HIST1H4F, HIST1H4G, HIST1H4H, HIST1H4I, HIST1H4J, HIST1H4K, HIST1H4L, и H44, предпочтительно включая HIST4H4, и H5.
Согласно первому варианту осуществления настоящего изобретения предлагаемая в изобретении нуклеотидная последовательность содержит кодирующую область, предпочтительно кодирующую пептид или белок. Предпочтительно кодируемый белок не представляет собой репортерный белок (например, люциферазу, зеленый флуоресцентный белок (GFP), «усиленный» зеленый флуоресцентный белок (EGFP), β-галактозидазу) и не представляет собой маркерный или применяемый для селекции белок (например, альфа-глобин, галактокиназу и ксантин: гуанинфосфорибозилтрансферазу (GPT)). Предпочтительно нуклеотидная последовательность, предлагаемая в изобретении, не содержит последовательность (бактериального) гена Neo (ген, обусловливающий устойчивость к неомицину).
Указанная выше предлагаемая в изобретении нуклеиновая кислота содержит или кодирует а) кодирующую область, предпочтительно кодирующую пептид или белок; б) по меньшей мере одну гистоновую структуру типа «стебель-петля» и в) необязательно поли(A)-последовательность или сигнал полиаденилирования; предпочтительно для повышения уровня экспрессии кодируемого белка, где кодируемый белок предпочтительно не представляет собой гистоновый белок, не представляет собой репортерный белок и/или маркерный или применяемый для селекции белок, которые указаны выше. Элементы б)-в) предлагаемой в изобретении нуклеиновой кислоты могут располагаться в предлагаемой в изобретении нуклеиновой кислоте в любом порядке, т.е. элементы а), б) и в) могут располагаться следующим образом а), б) и в) или а), в) и б), в направлении 5′→3′ в предлагаемой в изобретении нуклеотидной последовательности, при этом в нее могут входить указанные в настоящем описании дополнительные элементы, такие как 5′-кэповая структура, поли(C)-последовательность, стабилизирующие последовательности, последовательности IRES и т.д. Каждый из элементов а)-в) предлагаемой в изобретении нуклеиновой кислоты, прежде всего а) в ди- или мультицистронных конструкциях, и/или каждый из элементов б) и в), более предпочтительно элемент б), может также повторяться в предлагаемой в изобретении нуклеиновой кислоте по меньшей мере один раз, предпочтительно два или большее количество раз. Например, предлагаемая в изобретении нуклеиновая кислота может иметь, например, следующую последовательность элементов а), б) и необязательно в):
5′-кодирующая область-гистоновая структура типа «стебель-петля»-3′; или
5′-кодирующая область-кодирующая область-гистоновая структура типа «стебель-петля»-3′; или
5′-кодирующая область-IRES-кодирующая область-гистоновая структура типа «стебель-петля»-3′; или
5′-кодирующая область-гистоновая структура типа «стебель-петля» - поли(A)-последовательность-3′; или
5′-кодирующая область-гистоновая структура типа «стебель-петля» - сигнал полиаденилирования-3′; или
5′-кодирующая область-кодирующая область-гистоновая структура типа «стебель-петля»-сигнал полиаденилирования-3′; или
5′-кодирующая область-гистоновая структура типа «стебель-петля»-гистоновая структура типа «стебель-петля»-3′; или
5′-кодирующая область-гистоновая структура типа «стебель-петля»-гистоновая структура типа «стебель-петля»-поли(A)-последовательность-3′; или
5′-кодирующая область-гистоновая структура типа «стебель-петля»-гистоновая структура типа «стебель-петля»-сигнал полиаденилирования-3′; или
5′-кодирующая область-гистоновая структура типа «стебель-петля»-поли(A)-последовательность-гистоновая структура типа «стебель-петля»-3′; или
5′-кодирующая область-поли(A)-последовательность-гистоновая структура типа «стебель-петля»-3′; или
5′-кодирующая область-поли(A)-последовательность-гистоновая структура типа «стебель-петля»-гистоновая структура типа «стебель-петля»-3′; и т.д.
В этом контексте наиболее предпочтительной является предлагаемая в изобретении молекула нуклеиновой кислоты, которая содержит или кодирует а) кодирующую область, предпочтительно кодирующую пептид или белок; б) по меньшей мере одну гистоновую структуру типа «стебель-петля» и в) поли(A)-последовательность или сигнал полиаденилирования; предпочтительно для повышения уровня экспрессии кодируемого белка, где кодируемый белок предпочтительно не представляет собой гистоновый белок, не представляет собой репортерный белок (например, люциферазу, GFP, EGFP, β-галактозидазу, прежде всего EGFP) и/или не представляет собой маркерный или применяемый для селекции белок (например, альфа-глобин, галактокиназу и ксантин: гуанинфосфорибозилтрансферазу (GPT)).
В дополнительном предпочтительном аспекте первого варианта осуществления изобретения предлагаемая в изобретении молекула нуклеиновой кислоты, указанная в настоящем описании, может находиться также в форме модифицированной нуклеиновой кислоты.
Согласно одному из аспектов первого варианта осуществления изобретения молекулу нуклеиновой кислоты, указанную в настоящем описании, можно получать в виде «стабилизированной нуклеиновой кислоты», предпочтительно в виде стабилизированной РНК, более предпочтительно в виде РНК, практически устойчивой к расщеплению in vivo (например, экзо- или эндонуклеазой).
В этом контексте молекула нуклеиновой кислоты, указанная в настоящем описании, может содержать нуклеотидные аналоги/модификации, например, модификации каркаса, модификации сахара или модификации оснований. Модификация каркаса согласно настоящему изобретению представляет собой модификацию, при которой фосфаты каркаса нуклеотидов, входящие в предлагаемую в изобретении молекулу нуклеиновой кислоты, которая указана в настоящем описании, модифицируют химически. Модификация сахара согласно настоящему изобретению представляет собой химическую модификацию сахара нуклеотидов предлагаемой в изобретении молекулы нуклеиновой кислоты, указанной в настоящем описании. Кроме того, модификация оснований согласно настоящему изобретению представляет собой химическую модификацию основного фрагмента нуклеотидов предлагаемой в изобретении молекулы нуклеиновой кислоты. В этом контексте нуклеотидные аналоги или модификации предпочтительно выбирают из нуклеотидных аналогов, пригодных для транскрипции и/или трансляции.
В наиболее предпочтительном аспекте первого варианта осуществления настоящего изобретения указанные в настоящем описании нуклеотидные аналоги/модификации выбирают из модификаций оснований, которые дополнительно повышают уровень экспрессии кодируемого белка, и их предпочтительно выбирают из группы, включающей 2-амино-6-хлорпуринрибозид-5′-трифосфат, 2-аминоаденозин-5′-трифосфат, 2-тиоцитидин-5′-трифосфат, 2-тиоуридин-5′-трифосфат, 4-тиоуридин-5′-трифосфат, 5-аминоаллилцитидин-5′-трифосфат, 5-аминоаллилуридин-5′-трифосфат, 5-бромцитидин-5′-трифосфат, 5-бромуридин-5′-трифосфат, 5-йодцитидин-5′-трифосфат, 5-йодуридин-5′-трифосфат, 5-метилцитидин-5′-трифосфат, 5-метилуридин-5′-трифосфат, 6-азацитидин-5′-трифосфат, 6-азауридин-5′-трифосфат, 6-хлорпуринрибозид-5′-трифосфат, 7-деазааденозин-5′-трифосфат, 7-деазагуанозин-5′-трифосфат, 8-азааденозин-5′-трифосфат, 8-азидоаденозин-5′-трифосфат, бензимидазолрибозид-5′-трифосфат, N1-метиладенозин-5′-трифосфат, N1-метилгуанозин-5′-трифосфат, N6-метиладенозин-5′-трифосфат, O6-метилгуанозин-5′-трифосфат, псевдоуридин-5′-трифосфат или пуромицин-5′-трифосфат, ксантозин-5′-трифосфат. Наиболее предпочтительные нуклеотиды для модификаций оснований выбирают из группы нуклеотидов с модифицированными основаниями, включающей 5-метилцитидин-5′-трифосфат, 7-деазагуанозин-5′-трифосфат, 5-бромцитидин-5′-трифосфат и псевдоуридин-5′-трифосфат.
Согласно другому объекту изобретения предлагаемая в изобретении молекула нуклеиновой кислоты, указанная в настоящем описании, может нести липидную модификацию. Указанная модифицированная липидом нуклеиновая кислота, как правило, представляет собой нуклеиновую кислоту, указанную в настоящем описании. Указанная модифицированная липидом молекула нуклеиновой кислоты, которая представляет собой предлагаемую в изобретении молекулу нуклеиновой кислоты, указанную в настоящем описании, как правило, содержит также по меньшей мере один линкер, ковалентно связанный с молекулой нуклеиновой кислоты, и по меньшей мере один липид, ковалентно связанный с соответствующим линкером. В альтернативном варианте модифицированная липидом молекула нуклеиновой кислоты содержит по меньшей мере одну из молекул нуклеиновых кислот, указанных в настоящем описании, и по меньшей мере один (бифункциональный) липид, ковалентно связанный (без линкера) с указанной молекулой нуклеиновой кислоты. Согласно третьему альтернативному варианту модифицированная липидом молекула нуклеиновой кислоты содержит молекулу нуклеиновой кислоты, указанную в настоящем описании, по меньшей мере один линкер, ковалентно связанный с указанной молекулой нуклеиновой кислоты, и по меньшей мере один липид, ковалентно связанный с соответствующим линкером, а также по меньшей мере один (бифункциональный) липид, ковалентно связанный (без линкера) с молекулой нуклеиновой кислоты. В этом контексте наиболее предпочтительная липидная модификация присутствует на концах линейной предлагаемой в изобретении нуклеотидной последовательности.
Согласно другому предпочтительному аспекту первого варианта осуществления изобретения предлагаемую в изобретении молекулу нуклеиновой кислоты, указанную в настоящем описании, прежде всего, если она находится в виде (м)РНК, можно стабилизировать, защищая от расщепления РНКазами, путем добавления так называемой структуры «5′-кэпа».
Согласно другому предпочтительному аспекту первого варианта осуществления изобретения предлагаемую в изобретении молекулу нуклеиновой кислоты, указанную в настоящем описании, можно модифицировать с помощью последовательности, содержащей по меньшей мере 10 цитидинов, предпочтительно по меньшей мере 20 цитидинов, наиболее предпочтительно по меньшей мере 30 цитидинов (так называемая «поли(C)-последовательность»). В частности, предлагаемая в изобретении молекула нуклеиновой кислоты может содержать или кодировать поли(C)-последовательность, состоящую, как правило, примерно из 10-200 цитидиновых нуклеотидов, предпочтительно примерно 10-100 цитидиновых нуклеотидов, более предпочтительно примерно 10-70 цитидиновых нуклеотидов или еще более предпочтительно примерно 20-50 или даже 20-30 цитидиновых нуклеотидов. Указанная поли(C)-последовательность предпочтительно локализована в 3′-направлении относительно кодирующей области, которая входит в предлагаемую в изобретении молекулу нуклеиновой кислоты, согласно первому варианту осуществления настоящего изобретения.
Согласно другому предпочтительному аспекту первого варианта осуществления изобретения предлагаемая в изобретении молекула нуклеиновой кислоты, указанная в настоящем описании, предпочтительно содержит по меньшей мере одну стабилизирующую последовательность на 5′- и/или 3′-конце. Эти стабилизирующие последовательности в 5′- и/или 3′-нетранслируемых областях оказывают действие на удлинение времени полужизни нуклеиновой кислоты в цитозоле. Последовательность указанных стабилизирующих последовательностей может быть на 100% идентична последовательностям, встречающимся в естественных условиях в вирусах, бактериях и эукариотах, но также может быть частично или полностью синтетической. Нетранслируемые последовательности (UTR) гена (альфа-)глобина, например. Homo sapiens или Xenopus laevis, можно упомянуть в качестве примера стабилизирующих последовательностей, которые можно применять в настоящем изобретении для стабилизации нуклеиновой кислоты. Другая приведенная в качестве примера стабилизирующая последовательность имеет общую формулу (C/U)CCANxCCC(U/A)PyxUC(C/U)CC (SEQ ID NO: 55), которая содержится в 3′-UTR обладающей очень большой стабильностью мРНК, кодирующей (альфа)-глобин, коллаген типа (I), 15-липоксигеназу или тирозингидроксилазу (см. Holcik и др., Proc. Natl. Acad. Sci. USA, 94, 1997, cc.2410-2414). Естественно, такие стабилизирующие последовательности можно применять индивидуально или в сочетании друг с другом или также в сочетании с другими стабилизирующими последовательностями, известными специалисту в данной области. В этом контексте наиболее предпочтительной является 3′ UTR-последовательность гена альфа-глобина, расположенная в 3′-направлении относительно кодирующей последовательности, которая содержится в предлагаемой в изобретении молекуле нуклеиновой кислоты согласно первому варианту осуществления настоящего изобретения.
Предпочтительно осуществляют замену, добавление или элиминацию оснований в предлагаемой в изобретении молекуле нуклеиновой кислоты, указанной в настоящем описании, с использованием ДНК-матрицы для получения молекулы нуклеиновой кислоты с помощью хорошо известных методов, таких как сайтнаправленный мутагенез, или на основе стратегии олигонуклеотидного лигирования (см., например, Maniatis и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 3-е изд., изд-во Cold Spring Harbor, NY, 2001). При осуществлении указанного процесса для получения предлагаемой в изобретении молекулы нуклеиновой кислоты, указанной в настоящем описании, прежде всего, в том случае, когда нуклеиновая кислота находится в форме мРНК, соответствующую молекулу ДНК можно транскрибировать in vitro. Эта ДНК-матрица предпочтительно содержит приемлемый промотор, например, промотор T7 или SP6, для транскрипции in vitro, за которым расположена требуемая нуклеотидная последовательность молекулы нуклеиновой кислоты, например, мРНК, которую надо получить, и сигнал терминации для транскрипции in vitro. Молекулу ДНК, образующую матрицу по меньшей мере для одной представляющей интерес РНК, можно получать путем ферментативной пролиферации и последующего выделения в виде части плазмиды, которая может реплицироваться в бактериях. Плазмиды, которые можно рассматривать в качестве приемлемых для осуществления настоящего изобретения, представляют собой, например, плазмиды pT7T (GenBank, регистрационный номер U26404; Lai и др., Development, 121, 1995, cc.2349-2360), серии pGEM®, например, pGEM®-1 (GenBank, регистрационный номер X65300; фирма Promega) и pSP64 (GenBank, регистрационный номер X65327); ср. также Mezei и Storts, Purification of PCR Products в: PCR Technology: Current Innovation, под ред. Griffin и Griffin, изд-во CRC Press, Boca Raton, FL, 2001.
Молекулы нуклеиновых кислот, указанные в настоящем описании, которые можно применять согласно настоящему изобретению, можно получать с помощью любого метода, известного в данной области, включая методы синтеза, такие, например, как твердофазный синтез, а также методы in vitro, например, реакции транскрипции in vitro или методы in vivo, такие как размножение in vivo плазмидных ДНК в бактериях.
Любым из вышеуказанных модификаций можно подвергать предлагаемую в изобретении молекулу нуклеиновой кислоты, указанную в настоящем описании, а также любую нуклеиновую кислоту, применяемую в контексте настоящего изобретения, и модификации можно, если это желательно или необходимо, объединять двух с другом в любой комбинации, при условии, что такие комбинации модификаций не интерферируют друг с другом в соответствующей нуклеиновой кислоте. Специалист в данной области может осуществлять их соответствующий выбор.
Предлагаемая в изобретении молекула нуклеиновой кислоты, указанная в настоящем описании, а также белки или пептиды, кодируемые этой молекулой нуклеиновой кислоты, могут содержать фрагменты или варианты этих последовательностей. Указанные фрагменты или варианты могут, как правило, содержать последовательность, идентичную одной из вышеуказанных нуклеиновых кислот, или любому(ой) из белков или пептидов или последовательностей, если они кодируются по меньшей мере одной молекулой нуклеиновой кислоты, идентичной по меньшей мере на 5%, 10%, 20%, 30%, 40%, 50%, 60%, предпочтительно по меньшей мере на 70%, более предпочтительно по меньшей мере на 80%, более предпочтительно также по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90% и наиболее предпочтительно по меньшей мере на 95% или даже на 97%, 98% или 99%, полной последовательности дикого типа либо на нуклеотидном, либо на аминокислотном уровне.
Согласно другому предпочтительному аспекту первого варианта осуществления настоящего изобретения нуклеотидную последовательность, предлагаемую в изобретении, ассоциируют с носителем, агентом для трансфекции или комплекообразования с целью повышения эффективности трансфекции предлагаемой в изобретении нуклеотидной последовательности. В этом контексте наиболее предпочтительными агентами для повышения эффективности трансфекции являются катионные или поликатионные соединения, такие как протамин, нуклеолин, спермин или спермидин, или другие катионные пептиды или белки, такие как поли-L-лизин (PLL), полиаргинин, основные полипептиды, обладающие способностью проникать в клетку пептиды (CPP), такие как ВИЧ-связывающие пептиды. Tat БИЧ-1 (ВИЧ), выведенные из Tat пептиды, пенетратин, полученные из VP22 пептиды или аналоги, VP22 HSV (вирус герпеса простого), MAP, KALA или домены трансдукции белков (PTD), PpT620, богатые пролином пептиды, богатые аргинином пептиды, богатые лизином пептиды, MPG-пептид(ы), Pep-1, L-олигомеры, пептид(ы) кальцитонина, выведенные из Antennapedia пептиды (прежде всего, выведенные из Drosophila antennapedia), pAntp, pIs1, FGF, лактоферрин, транспортан, буфорин-2, Bac715-24, SynB, SynB(1), pVEC, выведенные из hCT пептиды, SAP или гистоны. Кроме того, предпочтительные катионные или поликатионные белки или пептиды можно выбирать из следующих белков или пептидов, которые имеют следующую общую формулу: (Arg)l;(Lys)m;(His)n;(Orn)o;(Xaa)x, в которой l+m+n+o+x обозначают 8-15 и l, m, n или o каждый независимо друг от друга могут представлять собой любые числа, выбранные из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Orn составляет по меньшей мере 50% от общего содержания аминокислот в олигопептиде; а Хаа может обозначать любую аминокислоту, выбранную из нативных (т.е. встречающихся в естественных условиях) или не встречающихся в естественных условиях аминокислот за исключением Arg, Lys, His или Orn; и x может обозначать любое число, выбранное из 0, 1, 2, 3 или 4, при условии, что общее содержание Хаа не превышает 50% от общего содержания аминокислот в олигопептиде. В этом контексте наиболее предпочтительными катионными пептидами являются, например, Arg7, Arg8, Arg9, H3R9, R9H3, H3R9H3, YSSR9SSY, (RKH)4, Y(RKH)2R и т.д. Другие предпочтительные катионные или поликатионные соединения, которые можно применять в качестве агентов для трансфекции, могут представлять собой катионные полисахариды, например, хитозан, полибрен, катионные полимеры, например, полиэтиленимин (PEI), катионные липиды, например, DOTMA: хлорид [1-(2,3-сиолеилокси)пропил)]-N,N,N-триметиламмония, DMRIE, ди-C14-амидин, DOTIM, SAINT, DC-Chol, BGTC, CTAP, DOPC, DODAP, DOPE: диолеилфосфатидилэтаноламин, DOSPA, DODAB, DOIC, DMEPC, DOGS: диоктадециламидоглицилспермин, DIMRI: бромид димиристооксипропилдиметилгидроксиэтиламмония, DOTAP: диолеоилокси-3-(триметиламмонио)пропан, DC-6-14: хлорид O,O-дитетрадеканоил-N-(α-триметиламмониоацетил)диэтаноламина, CLIP1: хлорид рац-[(2,3-диоктадецилоксипропил)(2-гидроксиэтил)]диметиламмония, CLIP6: рац-[2(2,3-дигексадецилоксипропилоксиметилокси)этил]триметиламмоний, CLIP9: рац-[2(2,3-дигексадецилоксипропилоксисукцинилокси)этил]триметиламмоний, олигофектамин, или катионные или поликатионные полимеры, например, модифицированные полиаминокислоты, такие как полимеры β-аминокислот, или обратимые полиамиды и т.д., модифицированные полиэтилены, такие как PVP (бромид поли(N-этил-4-винилпиридиния)) и т.д. модифицированные акрилаты, такие как pDMAEMA (поли(диметиламиноэтилметилакрилат)) и т.д., модифицированные амидоамины, такие как рАМАМ (поли(амидоамин)) и т.д., модифицированный сложный полибетааминоэфир (PBAE), например, с модифицированным диаминовым концом сополимеры 1,4-бутандиолдиакрилата и 5-амино-1-пентанола, и т.д. дендримеры, например, дендримеры полипропиламина или дендримеры на основе рАМАМ, и т.д. полиимин(ы), например, PEI: поли(этиленимин), поли(пропиленимин) и т.д., полиаллиламин, полимеры на основе сахарного каркаса, такие как полимеры на основе циклодекстрина, полимеры на основе декстрана, хитозан и т.д. полимеры на основе силанового каркаса, например, сополимеры PMOXA-PDMS и т.д., блок-сополимеры, состоящие из комбинации одного или несколько катионных блоков (например, выбранных из катионного полимера, указанного выше) и одного или нескольких гидрофильных или гидрофобных блоков (например, полиэтиленгликоль); и т.д.
Предпочтительно, чтобы нуклеотидная последовательность, предлагаемая в изобретении, находилась либо в оголенной форме, либо в форме комплекса, например, с поликатионными соединениями любой химической структуры, предпочтительно поликатионными (полипептидами) или синтетическими поликатионными соединениями. Предпочтительно нуклеотидную последовательность не применяют вместе с упаковывающей клеткой.
Следующим вариантом осуществления настоящего изобретения является также способ повышения уровня экспрессии кодируемого белка/пептида, заключающийся в том, что осуществляют стадии, на которых а) получают предлагаемую в изобретении нуклеиновую кислоту, указанную в настоящем описании, б) применяют или вносят предлагаемую в изобретении нуклеиновую кислоту, кодирующую белок или пептид, указанный в настоящем описании, в экспрессионную систему, например, бесклеточную экспрессионную систему, в клетку (например, предназначенную для экспрессии клетку-хозяина или соматическую клетку), ткань или организм. Способ можно осуществлять в лабораторных условиях, использовать для исследовательских, диагностических целей, для получения в промышленном масштабе пептидов или белков и/или для терапевтических целей. В этом контексте, как правило, после получения предлагаемой в изобретении нуклеиновой кислоты, указанной в настоящем описании, ее, как правило, применяют или вносят в бесклеточную экспрессионную систему, в клетку (например, клетку-хозяина для экспрессии или соматическую клетку), ткань или организм, предпочтительно в оголенной форме или в виде фармацевтической композиции или вакцины, указанной в настоящем описании, предпочтительно путем трансфекции или с помощью любого из путей введения, указанных в настоящем описании. Способ можно осуществлять in vitro, in vivo или ex vivo. Способ можно осуществлять также для лечения конкретного заболевания, предпочтительно указанного в настоящем описании.
В этом контексте способ in vitro предусматривает встраивание посредством трансфекции или трансдукции предлагаемой в изобретении нуклеиновой кислоты в клетки, находящиеся в культуре вне организма; способ in vivo предусматривает встраивание посредством трансфекции или трансдукции предлагаемой в изобретении нуклеиновой кислоты в клетки, что осуществляют путем введения предлагаемой в изобретении нуклеиновой кислоты в целый организм или в индивидуума, а способ ex vivo предусматривает встраивание посредством трансфекции или трансдукции предлагаемой в изобретении нуклеиновой кислоты в клетки, находящиеся вне организма или индивидуума, и последующее введение трансфектированных клеток в организм или в индивидуума.
Таким образом, другим вариантом осуществления настоящего изобретения является также применение предлагаемой в изобретении нуклеиновой кислоты, указанной в настоящем описании, предпочтительно для диагностических или терапевтических целей, для повышения уровня экспрессии кодируемого белка/пептида, например, путем применения или введения предлагаемой в изобретении нуклеиновой кислоты, которая кодирует белок или пептид, указанный в настоящем описании, например, в бесклеточную экспрессионную систему, в клетку (например, клетку-хозяина для экспрессии или соматическую клетку), ткань или организм. Применение можно осуществлять в лабораторных условиях, использовать для исследовательских, диагностических целей, для получения в промышленном масштабе пептидов или белков и/или для терапевтических целей. В этом контексте, как правило, после получения предлагаемой в изобретении нуклеиновой кислоты, указанной в настоящем описании, ее, как правило, вводят или вносят в бесклеточную экспрессионную систему, в клетку (например, клетку-хозяина для экспрессии или соматическую клетку), ткань или организм, предпочтительно в оголенной форме или в форме комплекса или в виде фармацевтической композиции или вакцины, указанной в настоящем описании, предпочтительно путем трансфекции, или с помощью любого из путей введения, указанных в настоящем описании. Применение можно осуществлять in vitro, in vivo или ex vivo. Применение можно осуществлять также в контексте лечения конкретного заболевания, предпочтительно указанного в настоящем описании.
Следующим вариантом осуществления настоящего изобретения является предлагаемая в изобретении экспрессионная система, которая содержит предлагаемую в изобретении нуклеиновую кислоту или экспрессионный вектор или плазмиду согласно первому варианту осуществления настоящего изобретения. В этом контексте экспрессионная система может представлять собой бесклеточную экспрессионную систему (например, систему для транскрипции/трансляции in vitro), клеточную экспрессионную систему (например, на основе клеток млекопитающих, таких как CHO-клетки, клетки насекомых, клетки дрожжей, клетки бактерий типа Е. coli) или организмы, применяемые для экспрессии пептидов или белков (например, растения или животные, такие как коровы).
Кроме того, другим вариантом осуществления настоящего изобретения является также применение предлагаемой в изобретении молекулы нуклеиновой кислоты, указанной в настоящем описании, для приготовления фармацевтической композиции, предназначенной для повышения уровня экспрессии кодируемого белка/пептида, например, для лечения заболевания, указанного в настоящем описании, например, путем внесения или введения предлагаемой в изобретении нуклеиновой кислоты, указанной в настоящем описании, например, в бесклеточную экспрессионную систему, в клетку (например, клетку-хозяина для экспрессии или соматическую клетку), ткань или организм, предпочтительно в оголенной форме или в форме комплекса или в виде фармацевтической композиции или вакцины, указанной в настоящем описании, более предпочтительно с помощью любого из путей введения, указанных в настоящем описании.
Таким образом, конкретным предпочтительным вариантом осуществления настоящего изобретения является фармацевтическая композиция, которая содержит предлагаемую в изобретении нуклеиновую кислоту, указанную в настоящем описании, и необязательно фармацевтически приемлемый носитель и/или наполнитель.
В качестве первого ингредиента предлагаемая в изобретении фармацевтическая композиция содержит предлагаемую в изобретении нуклеиновую кислоту, указанную в настоящем описании.
В качестве второго ингредиента предлагаемая в изобретении фармацевтическая композиция может содержать по меньшей мере один дополнительный фармацевтически активный компонент. Фармацевтически активный компонент в этом контексте представляет собой соединение, терапевтическое действие которого приводит к исцелению, облегчению или предупреждению конкретного показания или заболевания, указанного в настоящем описании, предпочтительно раковых заболеваний, аутоиммунного заболевания, аллергических или инфекционных болезней, сердечно-сосудистых заболеваний, болезней дыхательной системы, болезней пищеварительной системы, заболеваний кожи, скелетно-мышечных нарушений, нарушений соединительной ткани, неоплазм, иммунодефицита, эндокринных, трофических и метаболических заболеваний, заболеваний нервной системы, глазных болезней, ушных болезней и наследственных заболеваний. Указанные соединения включают (но, не ограничиваясь только ими) пептиды или белки, предпочтительно указанные в настоящем описании, нуклеиновые кислоты, предпочтительно указанные в настоящем описании, (терапевтически активные) низкомолекулярные органические или неорганические соединения (с молекулярной массой менее 5000, предпочтительно менее 1000), сахара, антигены или антитела, предпочтительно указанные в настоящем описании, терапевтические средства, известные из существующего уровня техники, антигенные клетки, антигенные клеточные фрагменты, клеточные фракции; компоненты клеточной оболочки (например, полисахариды), модифицированные, ослабленные или дезактивированные (например, химическим путем или путем облучения) патогены (вирусы, бактерии и т.д.), адъюванты, предпочтительно указанные в настоящем описании, и т.д.
Кроме того, предлагаемая в изобретении фармацевтическая композиция может содержать фармацевтически приемлемый носитель и/или наполнитель. В контексте настоящего изобретения фармацевтически приемлемый носитель, как правило, включает жидкую или нежидкую основу предлагаемой в изобретении фармацевтической композиции. Если предлагаемая в изобретении фармацевтическая композиция находится в жидкой форме, но носитель, как правило, может представлять собой свободную от пирогенов воду; изотонический соляной раствор или забуференные (водные) растворы, например, растворы, забуференные фосфатом, цитратом и т.д. Предназначенный для инъекции буфер может быть гипертоническим, изотоническим или гипотоническим относительно конкретной референс-среды, т.е. содержание в буфере солей может быть выше, идентичным или ниже их содержания в конкретной референс-среде, при этом предпочтительно можно применять такие концентрации вышеуказанных солей, которые не приводят к повреждению клеток в результате осмоса или других связанных с концентрацией воздействий. Референс-среды могут представлять собой, например, жидкости, применяемые в методах «in vivo», такие как кровь, лимфа, цитозольные жидкости или другие жидкости организма, или, например, жидкости, которые можно использовать в качестве референс-сред в методах «in vitro», такие как обычные буферы или жидкости. Указанные обычные буферы или жидкости известны специалисту в данной области. Наиболее предпочтительной жидкой основой является лактированный раствор Рингера.
Однако в предлагаемой в изобретении фармацевтической композиции можно использовать также один или несколько совместимых твердых или жидких наполнителей или разбавителей или капсулирующих соединений, которые можно применять для введения пациенту, подлежащему лечению. Понятие «совместимые» в контексте настоящего описания означает, что указанные компоненты предлагаемой в изобретении фармацевтической композиции можно смешивать с предлагаемой в изобретении нуклеиновой кислотой, указанной в настоящем описании, таким образом, чтобы не происходило взаимодействия, которое могло бы существенно снижать фармацевтическую эффективность предлагаемой в изобретении фармацевтической композиции в обычных условиях применения.
Согласно конкретному объекту изобретения предлагаемая в изобретении фармацевтическая композиция может содержать адъювант. В этом контексте под адъювантом можно подразумевать любое соединение, которое пригодно для инициации или повышения иммунного ответа врожденной иммунной системы, т.е. неспецифического иммунного ответа. Другими словами, предлагаемая в изобретении фармацевтическая композиция после ее введения предпочтительно вызывает врожденный иммунный ответ, если в ее состав необязательно входит адъювант. Предпочтительно указанный адъювант можно выбирать из адъювантов, известных специалисту в данной области, и пригодных для конкретного случая, т.е. для поддержания индукции врожденного иммунного ответа у млекопитающего, например, он может представлять собой адъювантный белок, описанный выше, или адъювант, указанный ниже.
Наиболее предпочтительными в качестве адъювантов, которые можно применять для создания депо или для введения являются катионные или поликатионные соединения, указанные выше для предлагаемой в изобретении нуклеотидной последовательности в качестве носителя, агента для трансфекции и для комплексообразования.
Предлагаемая в изобретении фармацевтическая композиция может дополнительно содержать одну или несколько вспомогательных субстанций, предназначенных для повышения при необходимости иммуногенности или иммуностимулирующего действия. При этом предпочтительно достигается синергетическое действие предлагаемой в изобретении нуклеиновой кислоты, указанной в настоящем описании, и вспомогательной субстанции, которая необязательно может входить в состав предлагаемой в изобретении фармацевтической композиции. В зависимости от различных типов вспомогательных субстанций в этом контексте можно рассматривать также различные механизмы. Например, соединения, которые обеспечивают созревание дендритных клеток (DC), например, липополисахариды, TNF-альфа или лиганд CD40, образуют первый класс приемлемых вспомогательных субстанций. В целом, в качестве вспомогательной субстанции можно использовать любой агент, которые оказывает воздействие на иммунную систему в виде «сигнала опасности» (LPS, GP96 и т.д.), или цитокины, такие как GM-CFS, которые приводят к повышению иммунного ответа или оказывают направленное воздействие на иммунный ответ. Особенно предпочтительными вспомогательными субстанциями являются цитокины, такие как монокины, лимфокины, интерлейкины или хемокины, которые также усиливают врожденный иммунный ответ, такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, INF-альфа, INF-бета, INF-гамма, GM-CSF, G-CSF, M-CSF, LT-бета или TNF-альфа, факторы роста, такие как hGH.
Другими добавками, которые можно включать в предлагаемую в изобретении фармацевтическую композицию, являются эмульгаторы, такие, например, как Tween®; смачивающие вещества, такие, например, как лаурилсульфат натрия; красители; улучшающие вкус вещества, фармацевтические носители; формирующие таблетки агенты; стабилизаторы; антиоксиданты; консерванты.
Предлагаемая в изобретении фармацевтическая композиция может содержать также любое дополнительное соединение, для которого известно, что оно стимулирует иммунную систему благодаря его аффинности к связыванию (в качестве лигандов) с человеческими Толл-подобными рецепторами TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, или в результате его аффинности к связыванию (в качестве лигандов) с мышиными Толл-подобными рецепторами TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13.
Предлагаемую в изобретении фармацевтическую композицию можно вводить орально, парентерально, с помощью спрея для ингаляции, местно, ректально, назально, трансбуккально, вагинально или с помощью имплантируемого резервуара. Понятие «парентеральный» в контексте настоящего описания включает подкожную, внутривенную, внутримышечную, внутрисуставную, интрасиновиальную, надчревную, внутриоболочечную, внутрипеченочную, в пораженный участок, внутричерепную, трансдермальную, внутрикожную, внутрилегочную, внутрибрюшинную, внутрисердечную, внутриартериальную и подъязычную инъекцию или инфузию.
Предпочтительно предлагаемую в изобретении фармацевтическую композицию можно вводить путем парентеральной инъекции, более предпочтительно с помощью подкожной, внутривенной, внутримышечной, внутрисуставной, интрасиновиальной, надчревной, внутриоболочечной, внутрипеченочной, в пораженный участок, внутричерепной, трансдермальной, внутрикожной, внутрилегочной, внутрибрюшинной, внутрисердечной, внутриартериальной и подъязычной инъекции или инфузии. Наиболее предпочтительной является внутрикожная и внутримышечная инъекция. Стерильные инъецируемые формы предлагаемых в изобретении фармацевтических композиций могут представлять собой водные или маслянистые суспензии. Эти суспензии можно приготавливать согласно методам, известным в данной области, с использованием пригодных диспергирующих или смачивающих агентов и суспендирующих агентов.
Предлагаемую в изобретении фармацевтическую композицию, указанную в настоящем описании, можно вводить также орально в любой приемлемой для орального введения форме лекарственного средства, включая (но, не ограничиваясь ими) капсулы, таблетки, водные суспензии или растворы.
Предлагаемую в изобретении фармацевтическую композицию можно применять также местно, особенно в том случае, когда мишень для лечения представляет собой области или органы, легко доступные для местной обработки, включая лечение заболеваний кожи или любых других доступных эпителиальных тканей. Для каждой из этих областей или органов можно легко приготавливать пригодные препаративные формы для местного применения. Для местных применений можно приготавливать предлагаемую в изобретении фармацевтическую композицию в виде пригодной мази, включающей предлагаемую в изобретении нуклеиновую кислоту, суспендированную или растворенную в одном или нескольких носителях.
Предлагаемая в изобретении фармацевтическая композиция, как правило, содержит в «безопасном и эффективном количестве» компоненты предлагаемой в изобретении фармацевтической композиции, прежде всего предлагаемую в изобретении нуклеиновую кислоту, указанную в настоящем описании. В контексте настоящего описания под «безопасным и эффективным количеством» подразумевается количество предлагаемой в изобретении нуклеиновой кислоты, указанной в настоящем описании, которое является достаточным для значительной индукции положительного изменения заболевания или нарушения, представленного в настоящем описании. Однако в то же время «безопасное и эффективное количество» является достаточно небольшим, чтобы избегать серьезных побочных действий, другими словами, обеспечивать разумное соотношение между преимуществом и риском. Определение этих пределов, как правило, регулируется соответствующими медицинскими правилами.
Предлагаемую в изобретении фармацевтическую композицию можно применять для лечения человека, а также для медицинских целей в области ветеринарии, предпочтительно для медицинских целей при лечении человека, в качестве фармацевтической композиции в целом или в качестве вакцины.
Согласно другому наиболее предпочтительному варианту осуществления изобретения предлагаемую в изобретении фармацевтическую композицию (или предлагаемую в изобретении нуклеиновую кислоту, указанную в настоящем описании) можно получать или применять в качестве вакцины. Как правило, такая вакцина соответствует указанным выше фармацевтическим композициям. Кроме того, указанная вакцина, как правило, содержит предлагаемую в изобретении нуклеиновую кислоту, указанную в настоящем описании, которая предпочтительно кодирует указанный выше антиген. В альтернативном варианте указанная вакцина может содержать предлагаемую в изобретении нуклеиновую кислоту, указанную в настоящем описании, и дополнительный антиген, предпочтительно в виде белка или пептида или в виде нуклеиновой кислоты, кодирующей антиген, например, указанный в настоящем описании, или в любом антигенном формате, или все возможные их комбинации.
Предлагаемая в изобретении вакцина может содержать также фармацевтически приемлемый носитель, адъювант и/или наполнитель, указанные в настоящем описании для фармацевтической композиции, предлагаемой в изобретении. Касательно предлагаемой в изобретении вакцины выбор фармацевтически приемлемого носителя определяется, в принципе, путем введения предлагаемой в изобретении вакцины. Предлагаемую в изобретении вакцину можно применять, например, системно или местно. В целом, пути введения могут представлять собой, например, трансдермальный, оральный, парентеральный пути, включая подкожные, внутривенные, внутримышечные, внутриартериальные, внутрикожные и внутрибрюшинные инъекции и/или интраназальные пути введения. Пути для местного применения, в целом, представляют собой, например, местные пути применения, но также внутрикожные, трансдермальные, подкожные или внутримышечные инъекции или инъекции внутрь пораженного участка, внутричерепные, внутрилегочные, внутрисердечные и подъязычные инъекции. Более предпочтительно вакцины можно вводить внутрикожным, подкожным или внутримышечным путем. Таким образом, предлагаемые в изобретении вакцины предпочтительно приготавливают в жидкой (или иногда в твердой) форме.
Предлагаемая в изобретении вакцина может содержать также одну или несколько вспомогательных субстанций для повышения при необходимости иммуногенности или иммуностимулирующего действия. Наиболее предпочтительными в качестве вспомогательных субстанций или добавок к фармацевтической композиции, указанной в настоящем описании, являются адъюванты.
Настоящее изобретение относится также к некоторым путям и вариантам применения предлагаемой в изобретении нуклеиновой кислоты, указанной в настоящем описании, предлагаемой в изобретении фармацевтической композиции, предлагаемой в изобретении вакцины, которые содержат предлагаемую в изобретении нуклеиновую кислоту, указанную в настоящем описании, или к включающим их наборам.
Согласно одному из конкретных вариантов осуществления изобретения настоящее изобретение относится к первому медицинскому применению предлагаемой в изобретении нуклеиновой кислоты, указанной в настоящем описании, в качестве лекарственного средства, предпочтительно в качестве иммуностимулирующего агента, адъюванта или вакцины или в области генной терапии.
Согласно другому варианту осуществления изобретения настоящее изобретение относится ко второму медицинскому применению нуклеиновой кислоты, указанной в настоящем описании, для лечения заболеваний, указанных в настоящем описании, предпочтительно к применению предлагаемой в изобретении нуклеиновой кислоты, указанной в настоящем описании, фармацевтической композиции или вакцины, содержащей их, или содержащих их наборов для приготовления лекарственного средства, предназначенного для профилактики, лечения и/или уменьшения интенсивности любых заболеваний, указанных в настоящем описании. Предпочтительно для этих целей фармацевтическую композицию или вакцину применяют или вводят пациенту, который нуждается в этом.
Предпочтительно указанные в настоящем описании заболевания выбирают из раковых или опухолевых заболеваний, инфекционных болезней, предпочтительно (вирусных, бактериальных или протозойных) инфекционных болезней, аутоиммунных заболеваний, аллергий или аллергических заболеваний, моногенных заболеваний, т.е. (наследственных) заболеваний или генетических заболеваний в целом, заболеваний, которые имеют генетически наследуемую основу и которые, как правило, вызываются дефектом одного гена и наследуются согласно законам Менделя, сердечно-сосудистых заболеваний, заболеваний нервной системы, болезней дыхательной системы, болезней пищеварительной системы, заболеваний кожи, скелетно-мышечных нарушений, нарушений соединительной ткани, неоплазм, иммунодефицита, эндокринных, трофических и метаболических заболеваний, глазных болезней, ушных болезней или любых заболеваний, на которые можно оказывать воздействие с помощью настоящего изобретения.
Раковые или опухолевые заболевания, указанные выше, предпочтительно включают, например, карциномы ободочной кишки, меланомы, карциномы почки, лимфомы, острый миелолейкоз (AML), острый лимфолейкоз (ALL), хронический миелолейкоз (CML), хронический лимфолейкоз (CLL), опухоли желудочно-кишечного тракта, карциномы легкого, глиомы, опухоли щитовидной железы, карциномы молочной железы, опухоли предстательной железы, гепатомы, различные индуцируемые вирусами опухоли, такие, например, как карцинома, вызываемая вирусом папилломы (например, карцинома шейки матки), аденокарциномы, опухоли, вызываемые вирусом герпеса (например, лимфома Беркитта, B-клеточная лимфома, индуцируемая вирусом Эпштейна-Барра (EBV) лимфома), опухоли, индуцируемые вирусом гепатита В (печеночно-клеточная карцинома), лимфомы, вызываемые HTLV-1 и HTLV-2, неврому/невриному слухового нерва, рак шейки матки, рак легкого, рак глотки, анальную карциному, глиобластомы, лимфомы, ректальные карциномы, астроцитомы, опухоли головного мозга, рак желудка, ретинобластомы, базалиомы, метастазы в головной мозг, медуллобластомы, вагинальный рак, рак поджелудочной железы, рак яичек, меланомы, карциномы щитовидной железы, рак мочевого пузыря, синдром Ходжкина, менингиомы, болезнь Шнеебергера, бронхиальные карциномы, опухоль гипофиза, грибовидный микоз, рак пищевода, рак молочной железы, карциноиды, невриномы, спиналиомы, лимфомы Беркитта, рак гортани, ренальный рак, тимомы, карциномы тела матки, рак кости, не-ходжкинские лимфомы, рак мочеиспускательного канала, CUP-синдром (синдром рака с невыявленным первичным очагом), опухоли головы/шеи, олигодендроглиомы, рак вульвы, рак кишечника, карциномы ободочной кишки, эзофагеальные карциномы, связанные с бородавками состояния, опухоли тонкого кишечника, краниофарингеомы, карциномы яичника, опухоли/саркомы мягких тканей, рак яичника, рак печени, карциномы поджелудочной железы, карциномы шейки матки, карциномы эндометрия, метастазы в печень, рак полового члена, рак языка, рак желчного пузыря, лейкозы, плазмоцитомы, рак матки, опухоль века, рак предстательной железы и т.д.
Кроме того, в контексте настоящего описания инфекционные заболевания предпочтительно выбирают из группы, включающей грипп, малярию, SARS (тяжелый острый респираторный синдром), желтую лихорадку, СПИД, боррелиоз Лайма, лейшманиоз, сибирскую язву, менингит, такие вирусные инфекционные заболевания, как СПИД, заболевание, вызываемое Condyloma acuminata, пустотелые бородавки, лихорадка Денге, трехдневная лихорадка, болезнь, вызываемая вирусом Эбола, простуда, весенне-летний менингоэнцефалит (FSME), лихорадка, опоясывающий герпес, гепатит, заболевание, вызываемое вирусом герпеса простого типа I, вирусом герпеса простого типа II, опоясывающий лишай, грипп, японский энцефалит, лихорадка Лаоса, болезнь, вызываемая вирусом Марбург, корь, ящур, мононуклеоз, эпидемический паротит, инфекция, вызываемая вирусом Норвалк, железистая лихорадка Пфейффера, натуральная оспа, полиомиелит (детская хромота), ложный круп, инфекционная эритема (пятая болезнь), бешенство, бородавки, лихорадка Западного Нила, ветряная оспа, болезнь, вызываемая цитомегаловирусом (CMV), из числа заболеваний, вызываемых бактериальными инфекциями, таких как выкидыш (воспаление предстательной железы), сибирская язва, аппендицит, боррелиоз, ботулизм, заболевание, вызываемое микроорганизмами Camphylobacter, хламидийная трахома (воспаление уретры, конъюнктивит), холера, дифтерия, донованоз, эпиглоттит, сыпной тиф, газовая гангрена, гонорея, туляремия, заболевание, вызываемое Heliobacter pylori, коклюш, венерическая лимфогранулема (паховый лимфогранулематоз), остеомиелит, болезнь легионеров, проказа, листериоз, пневмония, менингит, бактериальный менингит, сибирская язва, средний отит, заболевание, вызываемое Mycoplasma hominis, сепсис новорожденных (хориоамнионит), нома, паратиф, чума, синдром Рейтера, пятнистая лихорадка Скалистых гор, паратиф, вызываемый Salmonella, тиф, вызываемый Salmonella, скарлатина, сифилис, столбняк, триппер, японская речная лихорадка, туберкулез, тиф, вагинит (кольпит), мягкий шанкр, и инфекционные болезни, вызываемые паразитами, простейшими или грибами, такие как амебиаз, шистамоз, болезнь Шагаса, эпидермофия стопы, пятнистость, вызываемая дрожжевыми грибками, чесотка, малярия, онхоцеркоз (речная слепота) или болезни, вызываемые грибами, токсоплазмоз, трихомониаз, трипаносомоз (сонная болезнь), индийский висцеральный лейшманиоз, «подгузниковый»/«пеленочный» дерматит, шистоматоз, пищевое отравление рыбами (сигуатера), кандидоз, кожный лейшманиоз, лямблиоз (протозойная инвазия, вызываемая Lamblia intestinalis) или сонная болезнь или из инфекционных заболеваний, вызываемых Echinococcus, рыбьим солитером, лисьим цепнем, собачьим цепнем, вшами, бычьим цепнем, свиным цепнем, карликовым цепнем.
Кроме того, в контексте настоящего описания аллергии, как правило, приводят к местному или системному воспалительному ответу на указанные антигены или аллергены и вызывают иммунную реакцию в организме на указанные антигены. В данном контексте к аллергенам относятся, например, травы, пыльца, плесени, лекарственные средства или многочисленные обладающие провоцирующим действием факторы окружающей среды. Не ограничиваясь какой-либо конкретной теорией, можно считать, что в развитии аллергий участвуют несколько различных вызывающих заболевание механизмов. Согласно схеме классификации, предложенной P. Gell и R. Coombs, понятие «аллергия» было ограничено различными видами гиперчувствительности типа I, которые вызываются классическим механизмом с участием IgE. Гиперчувствительность типа I характеризуется избыточной активацией тучных клеток и базофилов с помощью IgE, что вызывает системный воспалительный ответ, который может приводить как к таким доброкачественным симптомам, как ринорея, так и к опасному для жизни анафилактическому шоку и смерти. К широко известным типам аллергий относятся (но, не ограничиваясь только ими) аллергическая астма (вызывающая опухание слизистой оболочки носа), аллергический конъюнктивит (вызывающий покраснение и зуд конъюнктивы), аллергический ринит («сенная лихорадка»), анафилаксия, ангиодема, атопический дерматит (экзема), крапивница (сыпь), эозинофилия, аллергии на укусы насекомых, кожные аллергии (вызывающие и включающие различные сыпи, такие как экзема, сыпи (крапивницу) и (контактный) дерматит), аллергии на пищу, аллергии на лекарственные средства и т.д. В настоящем изобретении предложены, например, предлагаемая в изобретении нуклеиновая кислота, предлагаемая в изобретении, фармацевтическая композиция или вакцина, которая кодирует или содержит аллерген (например, кошачий аллерген, аллерген пыльцы, клещевой аллерген, растительный аллерген (например, аллерген березовой пыльцы) в форме белка, нуклеиновой кислоты, кодирующей указанный белковый аллерген, в комбинации с предлагаемой в изобретении нуклеиновой кислотой, указанной выше, либо в форме предлагаемой в изобретении нуклеиновой кислоты. Фармацевтическая композиция, предлагаемая в настоящем изобретении, может сдвигать (избыточный) иммунный ответ в сторону более сильного TH1-ответа, подавляя или ослабляя тем самым нежелательный IgE-ответ.
Кроме того, аутоиммунные заболевания в целом можно подразделять на системные и органоспецифические или локализованные аутоиммунные нарушения в зависимости от основных клинико-патологических симптомов каждого заболевания. Аутоиммунные заболевания можно подразделять на категории системных синдромов, включающих такие заболевания, как системная красная волчанка (SLE), синдром Шегрена, склеродерма, ревматоидный артрит и полимиозит, или локальных синдромов, которые могут относиться к эндокринологическому типу (сахарный диабет типа I (DM типа 1), тиреоидит Хашимото, болезнь Аддисона и т.д.), дерматологическому типу (пузырчатка обыкновенная), гематологическому типу (аутоиммунная гемолитическая анемия), невральному типу (рассеянный склероз), или они могут затрагивать фактически любую указанную часть ткани организма. Подлежащие лечению аутоиммунные заболевания можно выбирать из группы, включающей аутоиммунные заболевания типа I или аутоиммунные заболевания типа II, или аутоиммунные заболевания типа III, или аутоиммунные заболевания типа IV, такие, например, как рассеянный склероз (MS), ревматоидный артрит, диабет, диабет типа I (сахарный диабет), хронический полиартрит, базедова болезнь, аутоиммунные формы хронического гепатита, неспецифический язвенный колит, аллергические болезни типа I, аллергические болезни типа II, аллергические болезни типа III, аллергические болезни типа IV, фибромиалгию, потерю волос, болезнь Бехтерева, болезнь Крона, тяжелую перемежающуюся хромоту, нейродермит, ревматическую полимиалгию, прогрессирующий системный склероз (PSS), псориаз, синдром Рейтера, ревматоидный артрит, васкулит и т.д., или диабет типа II. Хотя до настоящего времени остается невыясненным точный механизм, посредством которого иммунная система индуцирует иммунную реакцию на аутоантигены, известен ряд данных, касающихся их этиологии. Так, аутореакция может являться результатом отсутствия необходимости в T-клетках. В здоровой иммунной системе требуется активация B-клеток T-клетками перед тем как первые приобретают способность продуцировать антитела в больших количествах. Указанная необходимость в T-клетках может отсутствовать в редких случаях, таких как заражение организмами, продуцирующими суперантигены, которые могут инициировать поликлональную активацию B-клеток или даже T-клеток, путем непосредственного неспецифического связывания с β-субъединицей T-клеточных рецепторов. Другим возможным объяснением механизма аутоиммунных заболеваний является молекулярная мимикрия. Экзогенный антиген может обладать структурными сходствами с определенными антигенами хозяина; в результате чего любое антитело, вырабатываемое к этому антигену (который имитирует аутоантигены), может теоретически связываться также с антигенами хозяина и усиливать иммунный ответ. Наиболее сильная форма молекулярной мимикрии обнаружена в группе A бета-гемолитических стрептококков, антигены которых соответствуют человеческому миокарду и которые ответственны за воздействие на сердце ревматической атаки. Настоящее изобретение относится также к получению нуклеиновой кислоты или фармацевтической композиции или вакцины, указанной в настоящем описании, кодирующей или содержащей, например, аутоантигены (в виде белка, мРНК или ДНК, которые кодируют аутоантигенный белок), что, как правило, приводит к десенсибилизации иммунной системы.
Дополнительный вариант осуществления настоящего изобретения относится ко второму медицинскому применению предлагаемой в изобретении нуклеиновой кислоты, указанной в настоящем описании, для лечения указанных в настоящем описании заболеваний с помощью методов генной терапии.
Согласно другому предпочтительному варианту осуществления изобретения предлагаемую в изобретении нуклеиновую кислоту можно применять для приготовления фармацевтической композиции или вакцины, прежде всего для указанных в настоящем описании целей.
Предлагаемую в изобретении фармацевтическую композицию или вакцину можно применять также для лечения заболевания или нарушения, указанного в настоящем описании.
И, наконец, последним объектом настоящего изобретения являются также наборы, в частности, состоящие из частей наборы. Указанные наборы, в частности, состоящие из частей наборы, как правило, содержат в качестве компонентов, индивидуально или в сочетании с дополнительными ингредиентами, указанными в настоящем описании, по меньшей мере одну предлагаемую в изобретении нуклеиновую кислоту, указанную в настоящем описании, предлагаемую в изобретении фармацевтическую композицию или вакцину, содержащую предлагаемую в изобретении нуклеиновую кислоту. По меньшей мере одна предлагаемая в изобретении нуклеиновая кислота, указанная в настоящем описании, необязательно в сочетании с дополнительными компонентами, указанными в настоящем описании, предлагаемая в изобретении фармацевтическая композиция и/или предлагаемая в изобретении вакцина могут входить в одну часть или в различные части набора. Например, по меньшей мере одна часть набора может содержать по меньшей мере одну предлагаемую в изобретении нуклеиновую кислоту, указанную в настоящем описании, и по меньшей мере одна другая часть набора может содержать по меньшей мере один другой компонент, указанный в настоящем описании, например, по меньшей мере одна часть набора может содержать по меньшей мере одну фармацевтическую композицию или вакцину или ее компонент, например, по меньшей мере одна часть набора может содержать предлагаемую в изобретении нуклеиновую кислоту, указанную в настоящем описании, по меньшей мере одна другая часть набора может содержать по меньшей мере один другой компонент, указанный в настоящем описании, по меньшей мере одна другая часть набора может содержать по меньшей мере один компонент предлагаемой в изобретении композиции или вакцины или всю предлагаемую в изобретении фармацевтическую композицию или вакцину, а по меньшей мере одна другая часть набора может содержать по меньшей мере один антиген, по меньшей мере один фармацевтический носитель или наполнитель и т.д. Набор или состоящий из частей набор может необязательно дополнительно включать технические инструкции с информацией об особенностях введения и дозах предлагаемой в изобретении нуклеиновой кислоты, предлагаемой в изобретении фармацевтической композиции или предлагаемой в изобретении вакцины или любого из их компонентов или частей, например, если набор приготавливают в виде состоящего из частей набора.
В настоящем изобретении, если не указано иное, то, если это возможно, различные особенности альтернатив и вариантов осуществления изобретения можно объединять друг с другом. Кроме того, понятие «содержащий» не должно ограничиваться значением «состоящий из», если специально не указано иное. Однако в контексте настоящего изобретения понятие «содержащий», если это возможно, можно заменять на понятие «состоящий из».
Чертежи:
Приведенные ниже чертежи предназначены для дополнительной иллюстрации изобретения и не должны рассматриваться как ограничивающие каким-либо образом настоящее изобретение
На чертежах показано:
На фиг.1 - консенсусная последовательность гистоновой структуры типа «стебель-петля», полученная из последовательностей структур типа «стебель-петля» из многоклеточных и простейших организмов (по данным Davila Lopez М. и Samuelsson Т., RNA, изд-во New York, N.Y., 14(1), 2008, cc.1-10, doi: 10.1261/rna.782308). Выравнивали 4001 последовательность гистоновой структуры типа «стебель-петля» из многоклеточных и простейших организмов и определяли количество нуклеотидов, встречающихся в каждом положении в последовательности структуры типа «стебель-петля». В созданной консенсусной последовательности представлены все нуклеотиды, присутствующие в проанализированных последовательностях, которые обозначены с помощью однобуквенного кода. Помимо консенсусной последовательности представлены последовательности, которые содержат по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
На фиг.2 - консенсусная последовательность гистоновой структуры типа «стебель-петля», полученная из последовательностей структур типа «стебель-петля» из простейших организмов (по данным Davila Lopez M. и Samuelsson Т., RNA, изд-во New York, N.Y., 14(1), 2008, cc.1-10, doi: 10.1261/rna.782308). Выравнивали 131 последовательность гистоновой структуры типа «стебель-петля» из простейших организмов и определяли количество нуклеотидов, встречающихся в каждом положении в последовательности структуры типа «стебель-петля». В созданной консенсусной последовательности представлены все нуклеотиды, присутствующие в проанализированных последовательностях, которые обозначены с помощью однобуквенного кода. Помимо консенсусной последовательности представлены последовательности, которые содержат по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
На фиг.3 - консенсусная последовательность гистоновой структуры типа «стебель-петля», полученная из последовательностей структур типа «стебель-петля» из многоклеточных организмов (по данным Davila Lopez M. и Samuelsson Т., RNA, изд-во New York, N.Y., 14(1), 2008, cc.1-10, doi: 10.1261/rna.782308). Выравнивали 3870 последовательностей гистоновой структуры типа «стебель-петля» из многоклеточных организмов и определяли количество нуклеотидов, встречающихся в каждом положении в последовательности структуры типа «стебель-петля». В созданной консенсусной последовательности представлены все нуклеотиды, присутствующие в проанализированных последовательностях, которые обозначены с помощью однобуквенного кода. Помимо консенсусной последовательности представлены последовательности, которые содержат по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
На фиг.4 - консенсусная последовательность гистоновой структуры типа «стебель-петля», полученная из последовательностей структур типа «стебель-петля» из позвоночных животных (по данным Davila Lopez M. и Samuelsson Т., RNA, изд-во New York, N.Y., 14(1), 2008, cc.1-10, doi: 10.1261/rna.782308). Выравнивали 1333 последовательности гистоновой структуры типа «стебель-петля» из позвоночных животных и определяли количество нуклеотидов, встречающихся в каждом положении в последовательности структуры типа «стебель-петля». В созданной консенсусной последовательности представлены все нуклеотиды, присутствующие в проанализированных последовательностях, которые обозначены с помощью однобуквенного кода. Помимо консенсусной последовательности представлены последовательности, которые содержат по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
На фиг.5 - консенсусная последовательность гистоновой структуры типа «стебель-петля», полученная из человеческих (Homo sapiens) последовательностей структур типа «стебель-петля» (по данным Davila Lopez M. и Samuelsson Т., RNA, изд-во New York, N.Y., 14(1), 2008, cc.1-10, doi: 10.1261/rna.782308). Выравнивали 84 человеческие последовательности гистоновой структуры типа «стебель-петля» и определяли количество нуклеотидов, встречающихся в каждом положении в последовательности структуры типа «стебель-петля». В созданной консенсусной последовательности представлены все нуклеотиды, присутствующие в проанализированных последовательностях, которые обозначены с помощью однобуквенного кода. Помимо консенсусной последовательности представлены последовательности, которые содержат по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
На фиг.6-17: - мРНК, полученные путем транскрипции in vitro.
Представлены обозначения и последовательности мРНК, полученных путем транскрипции in vitro. Применяли следующие сокращения:
ppLuc(GC): богатая GC последовательность мРНК, кодирующая люциферазу Photinus pyralis,
ag: 3′-нетранслируемая область (UTR) гена альфа-глобина,
A64: поли(A)-последовательность, включающая 64 аденилата,
A120: поли(A)-последовательность, включающая 120 аденилатов,
histoneSL: гистоновая структура типа «стебель-петля»,
aCPSL: структура типа «стебель-петля», выбранная из библиотеки на основе специфического связывания с белком αCP-2KL,
PolioCL: 5′-область геномной РНК типа «клеверный лист» из полиовируса,
G30: поли(G)-последовательность, включающая 30 гуанилатов,
U30: поли(U)-последовательность, включающая 30 уридилатов,
SL: неспецифическая/искусственная структура типа «стебель-петля»,
N32: неспецифическая состоящая из 32 нуклеотидов последовательность.
В последовательностях выделены следующие элементы: OPC ppLuc(GC) (заглавные буквы), ag (жирный шрифт), структура типа histoneSL (подчеркнута), дополнительные отличающиеся протестированные последовательности (курсив).
На фиг.6 - последовательность мРНК ppLuc(GC)-ag (SEQ ID NO: 43).
Путем линеаризации исходного вектора в сайте рестрикции непосредственно за 3′-UTR альфа-глобина (ag) получали мРНК без поли(A)-последовательности.
На фиг.7 - последовательность мРНК ppLuc(GC)-ag-A64 (SEO ID NO: 44).
Путем линеаризации исходного вектора в сайте рестрикции непосредственно за поли(A)-последовательностью A64 получали мРНК, заканчивающуюся поли(A)-последовательностью A64.
На фиг.8 - последовательность мРНК ppLuc(GC)-ag-histoneSL (SEQ ID NO: 45).
Поли(A)-последовательность A64 заменяли на структуру типа histoneSL. Применяемую в примерах последовательность гистоновой структуры типа «стебель-петля» получали согласно Cakmakci и др., Molecular and Cellular Biology, 28(3), 2008, cc.1182-1194.
На фиг.9 - последовательность мРНК ppLuc(GC)-ag-A64-histoneSL (SEQ ID NO: 46).
Структуру типа histoneSL присоединяли к 3′-концу поли(A) A64.
На фиг.10 - последовательность мРНК ppLuc(GC)-ag-A120 (SEQ ID NO: 47).
Поли-(A)-последовательность A64 заменяли на поли(A)-последовательность A120.
На фиг.11 - последовательность мРНК ppLuc(GC)-ag-A64-ag (SEQ ID NO: 48).
Вторую 3′-UTR альфа-глобина присоединяли к 3′-концу поли(A) A64.
На фиг.12 - последовательность мРНК ppLuc(GC)-ag-A64-aCPSL (SEQ ID NO: 49).
Структуру типа «стебель-петля» присоединяли к 3′-концу поли(A) A64. Структуру типа «стебель-петля» выбирали из библиотеки на основе ее специфического связывания с белком αCP-2KL (Thisted и др., The Journal of Biological Chemistry, 276(20), 2001, cc.17484-17496). αCP-2KL представляет собой изоформу αСР-2 с наиболее высоким уровнем экспрессии белка αCP (белок, связывающий поли(C)-последовательность мРНК альфа-глобина) (Makeyev и др., Genomics, 67(3), 2000, cc.301-316), представителя группы РНК-связывающих белков, которые связываются с 3′-UTR альфа-глобина (Chkheidze и др., Molecular and Cellular Biology, 19(7), 1999, cc.4572-4581).
На фиг.13 - последовательность мРНК ppLuc(GC)-ag-A64-PolioCL (SEQ ID NO: 50).
5′-область геномной РНК типа «клеверный лист» из полиовируса присоединяли к 3′-концу поли(A) A64.
На фиг.14 - последовательность мРНК ppLuc(GC)-ag-A64-G30 (SEQ IDNO: 51)
Сегмент, состоящий из 30 гуанилатов, присоединяли к 3′-концу поли(A) A64.
На фиг.15 - последовательность мРНК ppLuc(GC)-ag-A64-U30 (SEQ ID NO: 52)
Сегмент, состоящий из 30 уридилатов, присоединяли к 3′-концу поли(A) A64.
На фиг.16 - последовательность мРНК ppLuc(GC)-ag-A64-SL (SEQ ID NO: 53)
Структуру типа «стебель-петля» присоединяли к 3′-концу поли(A) A64. Верхнюю часть «стебля» и «петли» получали согласно Babendure и др., RNA (New York, N.Y.), 12(5), 2006, cc.851-861). Структура типа «стебель-петля» содержит состоящий из 17 пар оснований богатый CG «стебель» и состоящую из 6 пар оснований «петлю».
На фиг.17 - ppLuc(GC)-ag-A64-N32 (SEO ID NO: 54)
Путем линеаризации исходного вектора в альтернативном сайте рестрикции получали мРНК с 32 дополнительными нуклеотидами, расположенными за поли(A).
На фиг.18 - данные, демонстрирующие, что комбинация поли(A) и структуры типа histoneSL синергетически повышает уровень экспрессии белка с мРНК.
Оценивали влияние поли(A)-последовательности, структуры типа histoneSL и комбинации поли(A) и структуры типа histoneSL на экспрессию люциферазы с мРНК. Для этого различные мРНК встраивали путем электропорации в клетки HeLa. Уровни люциферазы оценивали через 6, 24 и 48 ч после трансфекции. Обнаружен невысокий уровень экспрессии люциферазы при использовании мРНК, не несущей ни поли(A)-последовательность, ни структуру типа histoneSL. Добавление либо поли(A)-последовательности, либо структуры типа histoneSL приводило к повышению уровня люциферазы. Однако неожиданно было установлено, что добавление комбинации поли(A) и структуры типа histoneSL дополнительно значительно повышало уровень люциферазы, многократно превышая уровень, обнаруженный при применении любого из указанных индивидуальных компонентов, что свидетельствует об их синергетическом действии. Данные представлены графически в виде среднего значения RLU±SD (относительные световые единицы ± стандартное отклонение), полученного при трансфекции в трех повторностях. Конкретные значения RLU обобщены в примере 11.2.
На фиг.19 - данные, демонстрирующие, что комбинация поли(A) и структуры типа histoneSL повышает уровень экспрессии белка с мРНК вне зависимости от порядка их расположения.
Оценивали влияние поли(A)-последовательности, структуры типа histoneSL и комбинации поли(A) и структуры типа histoneSL, а также порядка их расположения, на экспрессию люциферазы с мРНК. Для этого различные мРНК встраивали путем липофекции в клетки HeLa. Уровни люциферазы оценивали через 6, 24 и 48 ч после начала трансфекции. При применении либо поли(A)-последовательности A64, либо структуры типа histoneSL обнаружены сопоставимые уровни люциферазы. Повышение длины поли(А)-последовательности с A64 до A120 или до A300 приводило лишь к умеренному повышению уровня люциферазы. В противоположность этому, применение комбинации поли(A) и структуры типа histoneSL существенно в большей степени приводило к повышению уровня люциферазы, чем удлинение поли(A)-последовательности. Комбинация поли(A) и структуры типа histoneSL обладала синергетическим действием, поскольку уровень люциферазы многократно превышал уровень, обнаруженный при применении любого из указанных индивидуальных компонентов. Синергетическое действие комбинации поли(A) и структуры типа histoneSL обнаружено вне зависимости от порядка расположения поли(A) и структуры типа histoneSL и вне зависимости от длины мРНК, содержащей поли(A)A64-histoneSL или histoneSL-A250. Данные представлены графически в виде среднего значения RLU±SD, полученного при трансфекции в трех повторностях. Конкретные значения RLU обобщены в примере 11.3.
На фиг.20 - данные, демонстрирующие, что повышение уровня экспрессии белка при применении комбинации поли(A) и структуры типа histoneSL является специфическим.
Оценивали влияние комбинации поли(A) и структуры типа histoneSL или поли(A) и альтернативных последовательностей на уровень экспрессии люциферазы с мРНК. Для этого различные мРНК встраивали путем электропорации в клетки HeLa. Уровни люциферазы оценивали через 6, 24 и 48 ч после трансфекции. При применении либо поли(A)-последовательности A64, либо структуры типа histoneSL обнаружены сопоставимые уровни люциферазы. Добавление комбинации поли(A) и структуры типа histoneSL значительно повышало уровень люциферазы, многократно превышая уровень, обнаруженный при применении любого из указанных индивидуальных компонентов, что свидетельствует об их синергетическом действии. В противоположность этому, комбинация поли(A) с любой из других изученных последовательностей не оказывала влияния на уровень люциферазы по сравнению с мРНК, содержащей только поли(A)-последовательность. Таким образом, комбинация поли(A) и структуры типа histoneSL действует специфически и синергетически. Данные представлены графически в виде среднего значения RLU±SD, полученного при трансфекции в трех повторностях. Конкретные значения RLU обобщены в примере 11.4.
На фиг.21 - данные, демонстрирующие, что комбинация поли(A) и структуры типа histoneSL синергетически повышает уровень экспрессии белка с мРНК in vivo.
Оценивали влияние поли(A)-последовательности, структуры типа histoneSL и комбинации поли(A) и структуры типа histoneSL на экспрессию люциферазы с мРНК in vivo. Для этого различные мРНК инъецировали внутрикожно мышам. Мышей умерщвляли через 16 ч после инъекции и оценивали уровни люциферазы в области инъекции. Люцифераза экспрессировалась с мРНК, несущей либо структуру типа histoneSL, либо поли(A)-последовательность. Однако неожиданно было обнаружено, что комбинации поли(A) и структуры типа histoneSL значительно повышала уровень люциферазы, многократно превышая уровень, обнаруженный при применении любого из указанных индивидуальных компонентов, что свидетельствует об их синергетическом действии. Данные представлены графически в виде среднего значения RLU±SD (относительные световые единицы ± стандартное отклонение). Конкретные значения RLU обобщены в примере 11.5.
На фиг. 22 - данные, демонстрирующие, что комбинация поли(A)-последовательности и структуры типа histoneSL повышает уровень экспрессии белка NY-ESO-1 с мРНК.
Оценивали влияние поли(A)-последовательности и комбинации поли(A) и структуры типа histoneSL на экспрессию NY-ESO-1 с мРНК. Для этого различные мРНК встраивали путем электропорации в клетки HeLa. Уровни NY-ESO-1 оценивали через 24 ч после трансфекции с помощью проточной цитометрии. Обнаружена экспрессия NY-ESO-1 с мРНК, несущей только поли(A)-последовательность. Однако неожиданно было установлено, что применение комбинации поли(A) и структуры типа histoneSL значительно повышало уровень NY-ESO-1, многократно превышая уровень, обнаруженный при применении только поли(A)-последовательности. Данные представлены графически в виде уровня интенсивности флуоресценции. Данные о медианных уровнях интенсивности флуоресценции (MFI) обобщены в примере 11.6.
На фиг. 23 - данные, демонстрирующие, что комбинация поли(A)-последовательности и структуры типа histoneSL повышает титр антител, образовавшихся в ответ на вакцинацию мРНК.
Оценивали влияние поли(A)-последовательности и комбинации поли(А) и структуры типа histoneSL на индукцию антител к NY-ESO-1, образовавшихся в ответ на вакцинацию мРНК. Для этого мышей линии C57BL/6 вакцинировали внутрикожно различными мРНК в комплексе с протамином. Титр специфических в отношении NY-ESO-1 антител у вакцинированных и контрольных мышей анализировали с помощью ELISA с использованием серийных разведении сыворотки. Образование антител к NY-ESO-1 в виде IgG2a[b] индуцировалось мРНК, имеющей только поли(A)-последовательность. Однако неожиданно было установлено, что применение комбинации поли(A) и структуры типа histoneSL значительно повышало титр антител к NY-ESO-1 в виде IgG2a[b], многократно превышая уровень, обнаруженный при применении только поли(A)-последовательности. Данные представлены графически в виде средних конечных титров. Данные о средних конечных титрах обобщены в примере 11.7.
Примеры
Приведенные ниже примеры предназначены для дополнительной иллюстрации изобретения и не направлены на ограничение объема изобретения.
1. Создание консенсусных последовательностей гистоновой структуры типа «стебель-петля»
Перед началом экспериментов определяли консенсусные последовательности гистоновой структуры типа «стебель-петля» на основе изучения последовательностей гистоновых структур типа «стебель-петля» многоклеточных и простейших организмов. Последовательности брали из приложения, представленного Lopez с соавторами (Davila Lopez М. и Samuelsson Т., RNA, New York, N.Y., 14(1), 2008, cc.1-10, doi: 10.1261/rna.782308), которые идентифицировали большое количество встречающихся в естественных условиях гистоновых структур типа «стебель-петля» путем исследования геномных последовательностей и маркеров экспрессируемых последовательностей. Прежде всего группировали и выравнивали все последовательности из многоклеточных и простейших организмов (4001 последовательность), или все последовательности из простейших (131 последовательность) или в альтернативном варианте из многоклеточных (3870 последовательностей), или из позвоночных животных (1333 последовательности), или из организма человека (84 последовательности). Затем определяли в каждом положении количество встречающихся нуклеотидов. На основе полученных таким образом таблиц создавали консенсусные последовательности для 5 различных групп последовательностей, соответствующих всем нуклеотидам, присутствующим в анализируемых последовательностях. Кроме того, получали также более ограниченные консенсусные последовательности, придавая особое значение консервативным нуклеотидам.
2. Получение ДНК-матриц
Конструировали вектор для транскрипции in vitro, содержащий промотор T7, за которым находилась богатая GC последовательность, кодирующая люциферазу Photinus pyralis (ppLuc(GC)), центральная часть 3′-нетранслируемой области (UTR) альфа-глобина (ag) и поли(A)-последовательность. Непосредственно за поли(A)-последовательностью находился сайт рестрикции, применяемый для линеаризации вектора перед осуществлением транскрипции in vitro для получения мРНК, кодирующей поли(A)-последовательность A64. Полученную из этого вектора путем транскрипции in vitro мРНК обозначали как «ppLuc(GC)-ag-A64».
Линеаризация указанного вектора в альтернативных сайтах рестрикции перед осуществлением транскрипции позволяла получать либо мРНК, удлиненную посредством введения дополнительных нуклеотидов, расположенных в 3′-направлении относительно A64, либо мРНК, не несущую A64. Кроме того, исходный вектор модифицировали для включения альтернативных последовательностей. В целом, из этих векторов получали путем транскрипции in vitro следующие мРНК (последовательности мРНК представлены на фиг.6-17):
3. Транскрипция in vitro
ДНК-матрицу, указанную в примере 2, линеаризовали и транскрибировали in vitro с помощью T7-полимеразы. Затем ДНК-матрицу расщепляли, осуществляя обработку ДНКазой. Все мРНК-транскрипты содержали структуру 5′-кэпа, полученную путем добавления в избыточном количестве N7-метилгуанозин-5′-трифосфат-5′-гуанозина в реакционную смесь для транскрипции. Полученную таким образом мРНК очищали и ресуспендировали в воде.
4. Ферментативное аденилирование мРНК
Ферментативно аденилировали две мРНК:
ppLuc(GC)-ag-A64 и ppLuc(GC)-ag-histoneSL.
Для этой цели РНК инкубировали с поли(A)-полимеразой Е. coli и АТФ (набор Poly(A) Polymerase Tailing Kit, фирма Epicentre, Мэдисон, США) согласно инструкциям производителя. мРНК, удлиненную с помощью поли(A)-последовательности, очищали и ресуспендировали в воде. Длину поли(A)-последовательности определяли путем электрофореза в агарозном геле. Исходные мРНК удлиняли с использованием примерно 250 аденилатов, полученные мРНК обозначали как
ppLuc(GC)-ag-A300 и ppLuc(GC)-ag-histoneSL-A250 соответственно.
5. Экспрессия люциферазы после встраивания мРНК путем электропорации
Клетки линии HeLa обрабатывали трипсином и промывали в среде opti-MEM. По 1×105 клеток в 200 мкл среды opti-MEM применяли для трансфекции путем электропорации с использованием 0,5 мкг каждой кодирующей ppLuc мРНК. В качестве контроля отдельно осуществляли электропорацию с использованием мРНК, не кодирующей ppLuc. После электропорации клетки высевали в 24-луночные планшеты в 1 мл среды RPMI 1640. Через 6, 24 или 48 ч после трансфекции среду удаляли путем аспирации и клетки лизировали с использованием 200 мкл лизирующего буфера (25 мМ Трис, pH 7,5 (HCl), 2 мМ ЭДТК, 10% глицерина, 1% Тритон X-100, 2 мМ ДТТ, 1 мМ PMSF). Лизаты хранили при -20°C вплоть до оценки активности ppLuc.
6. Экспрессия люциферазы после встраивания мРНК путем липофекции
Клетки линии HeLa высевали в 96-луночный планшет с плотностью 2×104 клеток на лунку. На следующий день клетки отмывали в среде opti-MEM и затем трансфектировали с использованием 0,25 мкг кодирующей ppLuc мРНК в комплексе с липофектином в 150 мкл среды opti-MEM. В качестве контроля отдельно осуществляли липофекцию с использованием мРНК, не кодирующей ppLuc. Из некоторых лунок среду opti-MEM удаляли путем аспирации и клетки лизировали в 200 мкл лизирующего буфера через 6 ч после начала трансфекции. В остальных лунках в этот время среду opti-MEM заменяли на среду RPMI 1640. Из этих лунок среду удаляли путем аспирации и клетки лизировлаи в 200 мкл лизирующего буфера через 24 или 48 ч после начала трансфекции. Лизаты хранили при -20°C вплоть до оценки активности ppLuc.
7. Оценка люциферазы
Активность ppLuc количественно оценивали в относительных световых единицах (RLU) с помощью планшет-ридера типа BioTek SynergyHT, осуществляя измерение в течение 5 с с использованием 50 мкл лизата и 200 мкл буфера для люциферина (25 мМ глицинглицин, pH 7,8 (NaOH), 15 мМ MgSO4, 2 мМ АТФ, 75 мкМ люциферин). Относительные величины RLU рассчитывали путем вычитания RLU, измеренных для контрольной РНК, из общих величин RLU.
8. Экспрессия люциферазы после внутрикожной инъекции мРНК (экспрессия люциферазы in vivo)
Мышей анестезировали смесью ромпуна и кетавета. Каждую кодирующую ppLuc мРНК инъецировали внутрикожно (0,5 мкг мРНК в 50 мкл на инъекцию). В качестве контроля отдельно инъецировали мРНК, не кодирующую ppLuc. Через 16 ч после инъекции мышей умерщвляли и изымали образцы тканей. Образцы тканей быстро замораживали в жидком азоте и лизировали в устройстве для лизиса тканей (фирма Qiagen) в 800 мкл лизирующего буфера (25 мМ Трис, pH 75 (HCl). 2 мМ ЭДТК, 10% глицерина, 1% Тритон X-100, 2 мМ ДТТ, 1 мМ PMSF). Затем образцы центрифугировали при 13500 об/мин при 4°C в течение 10 мин. Лизаты хранили при -80°C вплоть до анализа активности ppLuc (см. раздел 7 «Оценка люциферазы»).
9. Экспрессия NY-ESO-1 после встраивания мРНК путем электропорации
Клетки линии HeLa обрабатывали трипсином и отмывали в среде opti-МЕМ. 2×105 клеток в 200 мкл среды opti-MEM применяли для трансфекции путем электропорации с использованием 10 мкг кодирующей NY-ESO-1 мРНК. Клетки, полученные после трех электропорации, объединяли и высевали в 6-луночный планшет в 2 мл среды RPMI 1640. Через 24 ч после трансфекции клетки собирали и переносили в 96-луночный планшет с V-образным дном (по 2 лунки на одну мРНК). Клетки отмывали забуференным фосфатом физиологическим раствором (ЗФР) и повышали их проницаемость, используя по 200 мкл/лунку смеси цитофикс/цитоперм (Cytofix/Cytoperm) (фирма Becton Dickinson (BD)). Через 15 мин клетки отмывали с помощью Perm Wash (фирма BD). Затем клетки инкубировали в течение 1 ч при комнатной температуре либо с мышиным антителом к NY-ESO-1 в виде IgG1, либо с антителом, применяемым в качестве контроля изотипа (20 мкг/мл). Клетки вновь отмывали дважды Perm Wash. Затем клетки инкубировали в течение 1 ч при 4°C с разведенным в соотношении 1:500 сшитым с Alexa-647 козьим антимышиным антителом в виде IgG. И, наконец, клетки отмывали дважды с помощью Perm Wash. Клетки ресуспендировали в 200 мкл буфера (ЗФР, 2% FCS, 2 мМ ЭДТК, 0,01% азида натрия). Экспрессию NY-ESO-1 оценивали количественно с помощью проточной цитометрии и выражали в виде медианной интенсивности флуоресценции (MFI).
10. Индукция антител к NY-ESO-1 посредством вакцинации с использованием мРНК
Мышей линии C57BL/6 вакцинировали с помощью внутрикожной инъекции кодирующей NY-ESO-1 мРНК в комплексе с протамином (5 раз в течение 14 дней). Контрольных мышей обрабатывали буфером. Через 8 дней после последней вакцинации анализировали титр NY-ESO-1-специфических антител в вакцинированных и контрольных мышах с помощью ELISA: 96-луночные планшеты для ELISA (фирма Nunc) сенсибилизировали, используя по 100 мкл на лунку рекомбинантного белка NY-ESO-1 (10 мкг/мл), в течение 16 ч при 4°C. Планшеты отмывали дважды буфером для отмывки (ЗФР, 0,05% Твин-20). Затем для блокады неспецифического связывания планшеты инкубировали в течение 2 ч при 37°C в блокирующим буфером (ЗФР, 0,05% Твин-20, 1% БСА). После блокады добавляли по 100 мкл на лунку серийно разведенной мышиной сыворотки и инкубировали в течение 4 ч при комнатной температуре. Затем планшеты отмывали трижды буфером для отмывки. После этого добавляли 100 мкл на лунку биотинилированного крысиного антимышиного IgG2a[b] в качестве идентифицирующего антитела (фирма BD Biosciences), разведенного в соотношении 1:600 в блокирующем буфере, и давали происходить связыванию в течение 1 ч при комнатной температуре. Планшеты вновь отмывали трижды буфером для отмывки, после чего инкубировали в течение 30 мин при комнатной температуре с конъюгированным с пероксидазой из хрена стрептавидином, который добавляли из расчета 100 мкл на лунку. После четырех отмывок буфером для отмывки добавляли по 100 мкл на лунку 3,3′,5,5′-тетраметилбензидина (фирма Thermo Scientific). После того, как происходило изменение цвета, добавляли по 100 мкл на лунку 20%-ного раствора серной кислоты. Абсорбцию измеряли при длине волны 405 нм.
11. Результаты
11.1 Последовательности гистоновой структуры типы «стебель-петля»:
Для характеризации последовательностей гистоновых структур типа «стебель-петля» группировали и выравнивали последовательности из многоклеточных и простейших организмов (4001 последовательность), или из простейших (131 последовательность) или в альтернативном варианте из многоклеточных (3870 последовательностей), или из позвоночных животных (1333 последовательности), или из организма человека (84 последовательности). Затем определяли в каждом положении количество встречающихся нуклеотидов. На основе полученных таким образом таблиц создавали консенсусные последовательности для 5 различных групп последовательностей, соответствующих всем нуклеотидам, присутствующим в анализируемых последовательностях. В объединенной консенсусной последовательности многоклеточных и простейших организмов консервативными являлись 3 нуклеотида, а именно: T/U в петле и G и C в «стебле», которые образовывали пару оснований. Как правило, образовывалась структура, в которую входил состоящий из 6 пар оснований «стебель» и состоящая из 4 нуклеотидов «петля». Однако были выявлены следующие общие отклонения от указанной структуры: из 84 человеческих гистоновых структур типа «стебель-петля» две имели «стебель», который состоял только из 5 нуклеотидов, включая 4 пары оснований и один мисмэтч. Другая человеческая гистоновая структура типа «стебель-петля» состояла только из 5 пар оснований. Еще большее количество, а именно четыре, человеческих гистоновых структур типа «стебель-петля» содержали «стебель», состоящий из 6 нуклеотидов, но включали один мисмэтч в трех различных положениях соответственно. Кроме того, еще четыре человеческие гистоновые структуры типа «стебель-петля» содержали одну «качающуюся" пару оснований в двух различных положениях соответственно. Что касается «петли», то ее длина, соответствующая 4 нуклеотидом, вероятно, не является строго необходимой, поскольку у амеб D. discoideum идентифицирована «петля», состоящая из 5 нуклеотидов.
Помимо консенсусных последовательностей, включающих все нуклеотиды, которые присутствовали во всех анализируемых последовательностях, получали также более ограниченные консенсусные последовательности, прежде всего рассматривая консервативные нуклеотиды. В целом, получали следующие последовательности:
(Cons): включает все присутствующие нуклеотиды,
(99%): включает по меньшей мере 99% из всех присутствующих нуклеотидов,
(95%): включает по меньшей мере 95% из всех присутствующих нуклеотидов,
(90%): включает по меньшей мере 90% из всех присутствующих нуклеотидов.
Результаты анализа последовательностей гистоновых структур типа «стебель-петля» обобщены в следующих таблицах 1-5 (см. также фиг.1-5):
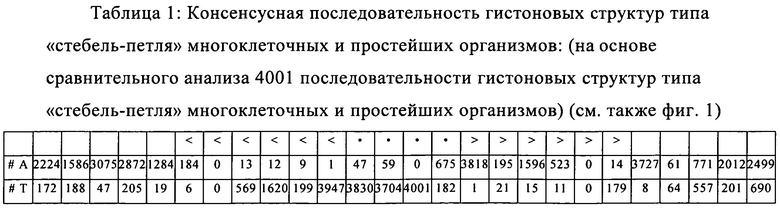
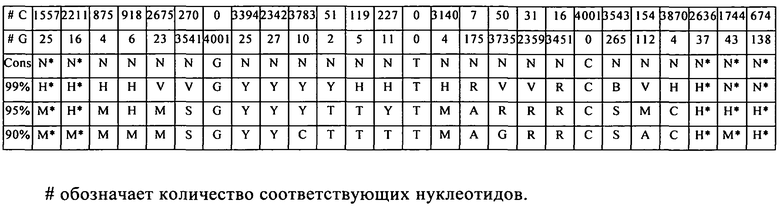
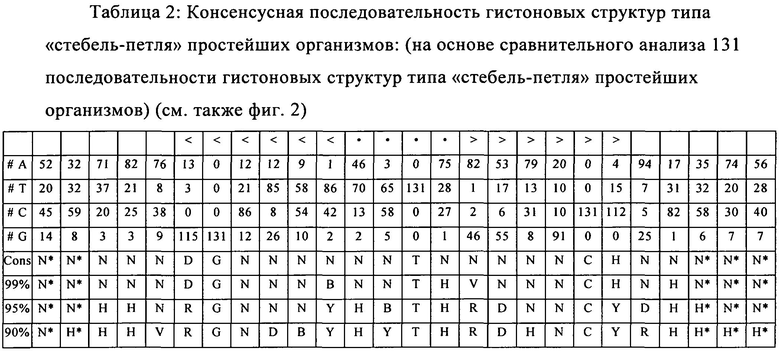

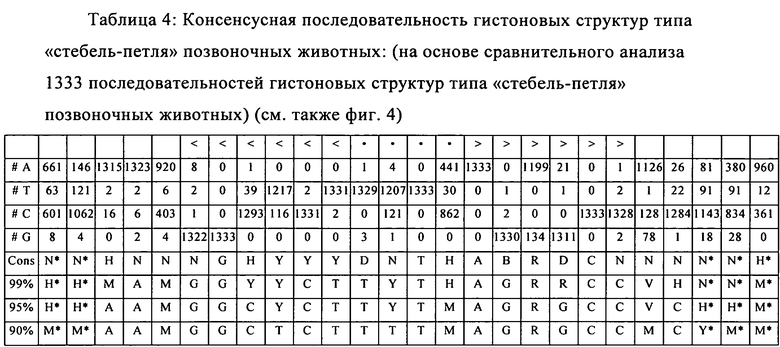

Применяемые сокращения имеют следующие значения:
11.2 Комбинация поли(A)-последовательности и структуры типа histoneSL синергетически повышает уровень экспрессии белка с мРНК
Для изучения влияния комбинации поли(A) и структуры типа histoneSL на экспрессию белка с мРНК синтезировали мРНК с различными последовательности, расположенными в 3′-направлении относительно 3′-UTR альфа-глобина: мРНК либо заканчивались в 3′-направлении сразу после 3′-UTR, т.е. у них отсутствовали и поли(A)-последовательность, и структура типа histoneSL, либо они содержали поли(A)-последовательность A64 или вместо нее структуру типа histoneSL, или и поли(A) A64 и структуру типа histoneSL, располагающиеся в 3′-направлении относительно 3′-UTR. Кодирующие люциферазу мРНК или контрольную мРНК встраивали путем электропорации в клетки линии HeLa. Уровни люциферазы оценивали через 6, 24 и 48 ч после трансфекции (см. таблицу 6 и фиг.18).
Невысокий уровень люциферазы экспрессировался с мРНК, не содержащей ни поли(A)-последовательность, ни структуру типа histoneSL. Присутствие поли(A)-последовательности или структуры типа histoneSL в одинаковой степени повышало уровень люциферазы. Любая из мРНК обеспечивала повышение уровня люциферазы в существенно большей степени, чем мРНК, у которой отсутствовали и поли(A)-последовательность, и структура типа histoneSL. Однако неожиданно было установлено, что комбинация поли(А)-последовательности и структуры типа histoneSL дополнительно значительно повышала уровень люциферазы до уровня, многократно превышающего тот, который был обнаружен при применении любого из указанных компонентов индивидуально. Степень повышения уровня люциферазы при применении комбинации поли(A)-последовательности и структуры типа histoneSL в одной и той же мРНК демонстрирует, что она обладает синергетическим действием.
Синергизм между поли(A)-последовательностью и структурой типа histoneSL количественно определяли путем деления сигнала, полученного при применении мРНК, содержащей поли(A)-histoneSL (+/+), на сумму сигналов, соответствующих мРНК, содержащей histoneS (-/+), плюс мРНК, содержащей поли(A) (+/-) (см. ниже таблицу 7).
Рассчитанный таким образом коэффициент демонстрирует, насколько выше уровень люциферазы, полученный с мРНК, которая содержит комбинацию поли(A)-последовательности и структуры типа histoneSL, по сравнению с ожидаемым для полностью аддитивного действия поли(A)-последовательности и структуры типа histoneSL. Уровень люциферазы, полученный с мРНК, которая содержит комбинацию поли(A)-последовательности и структуры типа histoneSL, оказался вплоть до 16,6 раз выше по сравнению с ожидаемым для их полностью аддитивного действия. Этот результат подтверждает, что действие комбинации поли(A)-последовательности и структуры типа histoneSL является выражено синергетическим, приводя к значительному повышению уровня экспрессии белка.
11.3 Комбинация поли(A)-последовательности и структуры типа histoneSL повышает уровень экспрессии белка с мРНК вне зависимости от их расположения
Влияние комбинации поли(A)-последовательности и структуры типа histoneSL может зависеть от длины поли(A)-последовательности и порядка расположения поли(A)-последовательности и структуры типа histoneSL. Для решения этого вопроса синтезировали мРНК с более длинной поли(A)-последовательностью и мРНК, содержащую поли(A)-последовательность и структуру типа histoneSL, в обратном порядка: т.е. две мРНК, которые содержали в 3′-направлении относительно 3′-UTR либо поли(A)-последовательность A120, либо A300. Еще в одной мРНК в 3′-направлении относительно 3′-UTR сначала располагалась структура типа histoneSL, за которой следовала поли(A)-последовательность A250. Кодирующие люциферазу мРНК или контрольную мРНК встраивали путем липофекции в клетки линии HeLa. Уровни люциферазы измеряли через 6, 24 и 48 ч после начала трансфекции (см. ниже таблицу 8 и фиг.19).
И поли(A)-последовательность A64, и структура типа histoneSL обеспечивали сопоставимые уровни люциферазы. Аналогично установленному в описанном выше эксперименте, применение комбинации A64 и структуры типа histoneSL приводило к значительному повышению уровня люциферазы, многократно превышающему уровень, обнаруженный при применении любого из указанных компонентов индивидуально. Степень повышения уровня люциферазы при применении комбинации поли(A)-последовательности и структуры типа histoneSL в одной и той же мРНК демонстрирует, что они обладают синергетическим действием. Синергизм между A64-последовательностью и структурой типа histoneSL рассчитывали согласно описанному выше методу, на основе уровней люциферазы, обнаруженных при применении A64-histoneSL-мРНК, A64-мРНК и histoneSL-мРНК (см. ниже таблицу 9). Уровень люциферазы при применении мРНК, содержащей комбинацию A64 и структуры типа histoneSL, оказался вплоть до 61,7 раза выше по сравнению с ожидаемым для полностью аддитивного действия поли(A)-последовательности и структуры типа histoneSL.
В противоположность этому, увеличение длины поли(A)-последовательности с A64 до A120 или до A300 приводило лишь к умеренному повышению уровня люциферазы (см. таблицу 8 и фиг.19). Также осуществляли сравнение мРНК, содержащей наиболее длинную поли(A)-последовательность, A300, с мРНК, в которой поли(A)-последовательность сходной длины объединяли со структурой типа histoneSL, т.е. histoneSL-A250. В этой мРНК помимо присутствия длинной поли(A)-последовательности порядок расположения структуры типа histoneSL и поли(A)-последовательности был обратным относительно мРНК A64-histoneSL. Применение комбинации A250 и структуры типы histoneSL значительно повышало уровень люциферазы до уровня, многократно превышающего тот, который был обнаружен при применении либо структуры типа histoneSL, либо A300. И в этом случае синергизм между A250 и структурой типа histoneSL рассчитывали согласно описанному выше методу, сравнивая уровень RLU при применении histoneSL-A250 и уровень RLU при применении мРНК A300 плюс мРНК histoneSL (см. ниже таблицу 10). Уровень люциферазы, обнаруженный при применении мРНК, содержащей комбинацию A250 и структуру типы histoneSL, оказался вплоть до 17,0 раз выше по сравнению с ожидаемым для полностью аддитивного действия поли(A)-последовательности и структуры типа histoneSL.
В целом, высокое синергетическое действие комбинации структуры типа histoneSL и поли(A)-последовательности на экспрессию белка с мРНК продемонстрирован для имеющих в значительной степени различную длину поли(A)-последовательностей и вне зависимости от порядка расположения поли(A)-последовательности и структуры типа histoneSL.
11.4 Повышение уровня экспрессии белка при применении комбинации поли(A)-последовательности и структуры типа histoneSL является специфическим
Для решения вопроса о том, является ли действие на экспрессию белка с мРНК комбинации поли(A)-последовательности и структуры типа histoneSL специфическим, синтезировали мРНК с альтернативными последовательностями в сочетании с поли(A)-последовательностью: эти мРНК содержали в 3′-направлении относительно A64 одну из семи различных последовательностей соответственно. Кодирующие люциферазу мРНК или контрольную мРНК встраивали путем электропорации в клетки линии HeLa. Уровни люциферазы оценивали через 6, 24 и 48 ч после трансфекции (см. ниже таблицу 11 и фиг.20).
Применение поли(A)-последовательности или структуры типа histoneSL приводило к получению сопоставимых уровней люциферазы. И в этом случае применение комбинации поли(A)-последовательности и структуры типа histoneSL значительно повышало уровень люциферазы до уровня, многократно превышающего тот, который был обнаружен при применении любого из элементов индивидуально, что свидетельствует о наличии синергизма. В противоположность этому, комбинация поли(A)-последовательности с любой из альтернативных последовательностей не оказывала воздействия на уровень люциферазы по сравнению с мРНК, содержащей только поли(A)-последовательность. Таким образом, применение комбинации поли(A)-последовательности и структуры типа histoneSL приводит к синергетическому повышению уровня экспрессии белка с мРНК, и это действие является специфическим.
11.5 Комбинация поли(A)-последовательности и структуры типа histoneSL синергетически повышает уровень экспрессии белка с мРНК in vivo
Для изучения влияния комбинации поли(A)-последовательности и структуры типа histoneSL на уровень экспрессии белка с мРНК in vivo, мышам инъецировали внутрикожно кодирующие люциферазу мРНК с различными последовательностями, расположенными в 3'-направлении относительно 3′-UTR альфа-глобина, или контрольную мРНК: мРНК содержали либо поли(A)-последовательность A64 или вместо нее структуру типа histoneSL, либо и поли(A)-последовательность A64, и структуру типа histoneSL в 3′-направлении относительно 3′-UTR. Уровни люциферазы оценивали через 16 ч после инъекции (см. ниже таблицу 12 и фиг.21).
Экспрессия люциферазы с мРНК имела место при применении мРНК, несущей либо структуру типа histoneSL, либо поли(A)-последовательность. Однако неожиданно было установлено, что комбинация поли(A)-последовательности и структуры типа histoneSL дополнительно значительно повышала уровень люциферазы до уровня, многократно превышающего тот, который был обнаружен при применении любого из указанных элементов индивидуально. Степень повышения уровня люциферазы при применении комбинации поли(A)-последовательности и структуры типа histoneSL в одной и той же мРНК демонстрирует, что они обладают синергетическим действием.
Синергизм между поли(A)-последовательностью и структурой типа histoneSL количественно определяли путем деления сигнала, полученного при применении мРНК, содержащей поли(A)-histoneSL (+/+), на сумму сигналов, соответствующих мРНК, содержащей histoneS (-/+), плюс мРНК, содержащей поли(A) (+/-) (см. ниже таблицу 13).
Рассчитанный таким образом коэффициент демонстрирует, насколько выше уровень люциферазы, полученный с мРНК, которая содержит комбинацию поли(A)-последовательности и структуры типа histoneSL, по сравнению с ожидаемым в случае полностью аддитивного действия поли(A)-последовательности и структуры типа histoneSL. Уровень люциферазы, полученный с мРНК, которая содержит комбинацию поли(A) и структуры типа histoneSL, оказался в 8 раз выше по сравнению с ожидаемым в случае их полностью аддитивного действия. Этот результат подтверждает, что действие комбинации поли(A)-последовательности и структуры типа histoneSL является выражено синергетическим, приводя к значительному повышению уровня экспрессии белка in vivo.
11.6 Комбинация поли(A)-последовательности и структуры типа histoneSL повышает уровень экспрессии белка NY-ESO-1 с мРНК
Для изучения влияния комбинации поли(А)-последовательности и структуры типа histoneSL на уровень экспрессии белка с мРНК синтезировали кодирующие NY-ESO-1 мРНК с различными последовательностями, расположенными в 3′-направлении от 3′-UTR альфа-глобина: мРНК содержали либо поли(A)-последовательность A64, либо и поли(A) A64, и структуру типа histoneSL в 3′-направлении относительно 3′-UTR. Кодирующие NY-ESO-1 мРНК встраивали путем электропорации в клетки линии HeLa. Уровни NY-ESO-1 оценивали через 24 ч после трансфекции с помощью проточной цитометрии (см. ниже таблицу 14 и фиг.22).
Экспрессия NY-ESO-1 с мРНк имела место при применении мРНК, содержащей только поли(A)-последовательность. Однако неожиданно было установлено, что комбинация поли(A)-последовательности и структуры типа histoneSL значительно повышала уровень NY-ESO-1 до уровня, многократно превышающего тот, который был обнаружен при применении только поли(A)-последовательности.
11.7. Комбинация поли(A)-последовательности и структуры типа histoneSL повышает титр антител, образовавшихся в ответ на вакцинацию мРНК
Для изучения влияния комбинации поли(A)-последовательности и структуры типа histoneSL на индукцию антител, образовавшихся в ответ на вакцинацию мРНК, мышей линии C57BL/6 вакцинировали, вводя путем внутрикожной инъекции кодирующие NY-ESO-1 мРНК в комплексе с протамином, которые имели различные последовательности в 3′-направлении относительно 3′-UTR альфа-глобина. мРНК содержали либо поли(A)-последовательность A64, либо и поли(A)-последовательность A64, и структуру типа histoneSL в 3′-направлении относительно 3′-UTR. Титр специфических в отношении NY-ESO-1 антител у вакцинированных и контрольных мышей анализировали с помощью ELISA с использованием серийных разведении сыворотки (см. ниже таблицу 15 и фиг.23).
Образование антител к NY-ESO-1 в виде IgG2a[b] индуцировалось мРНК, имеющей только поли(A)-последовательность. Однако неожиданно было установлено, что комбинация поли(A)-последовательности и структуры типа histoneSL значительно повышала титр антител к NY-ESO-1 в виде IgG2a[b] до уровня, многократно превышающего титр, обнаруженный при применении только поли(A)-последовательности.
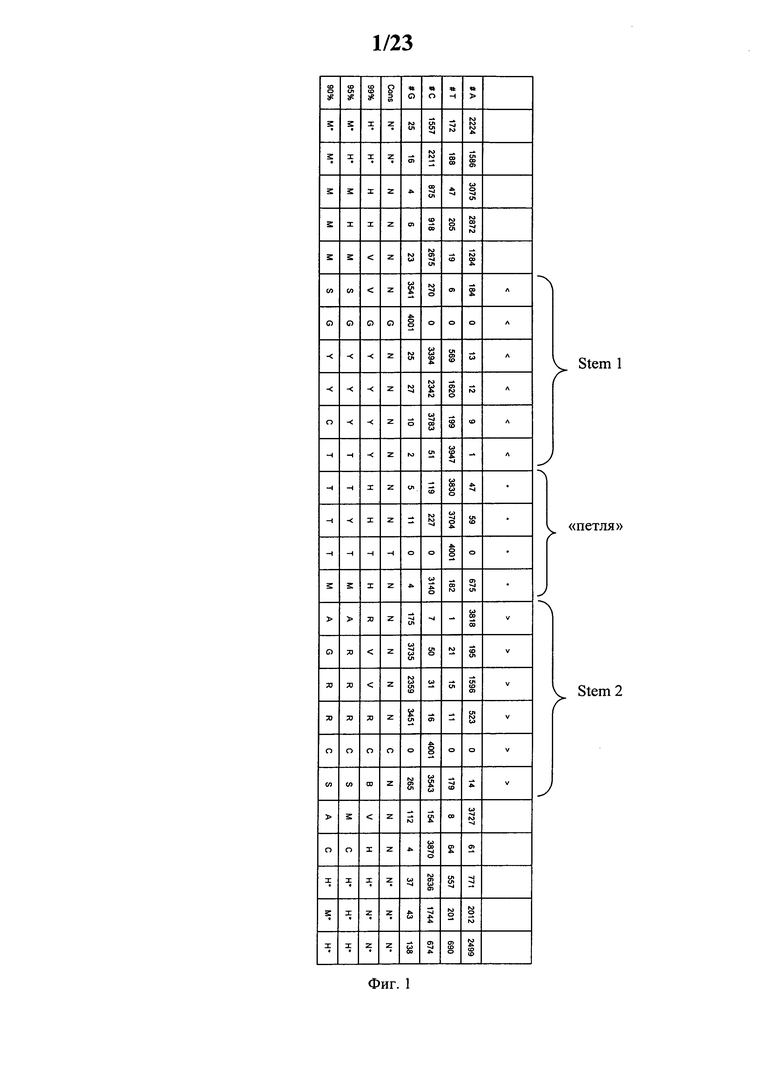
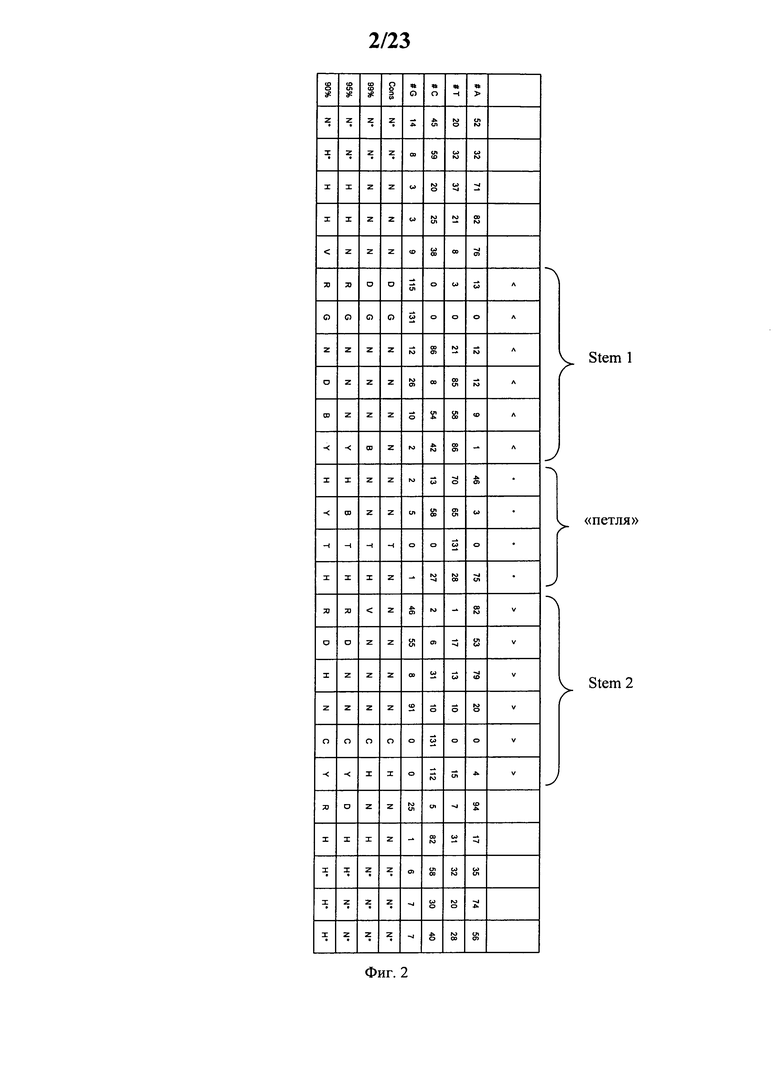
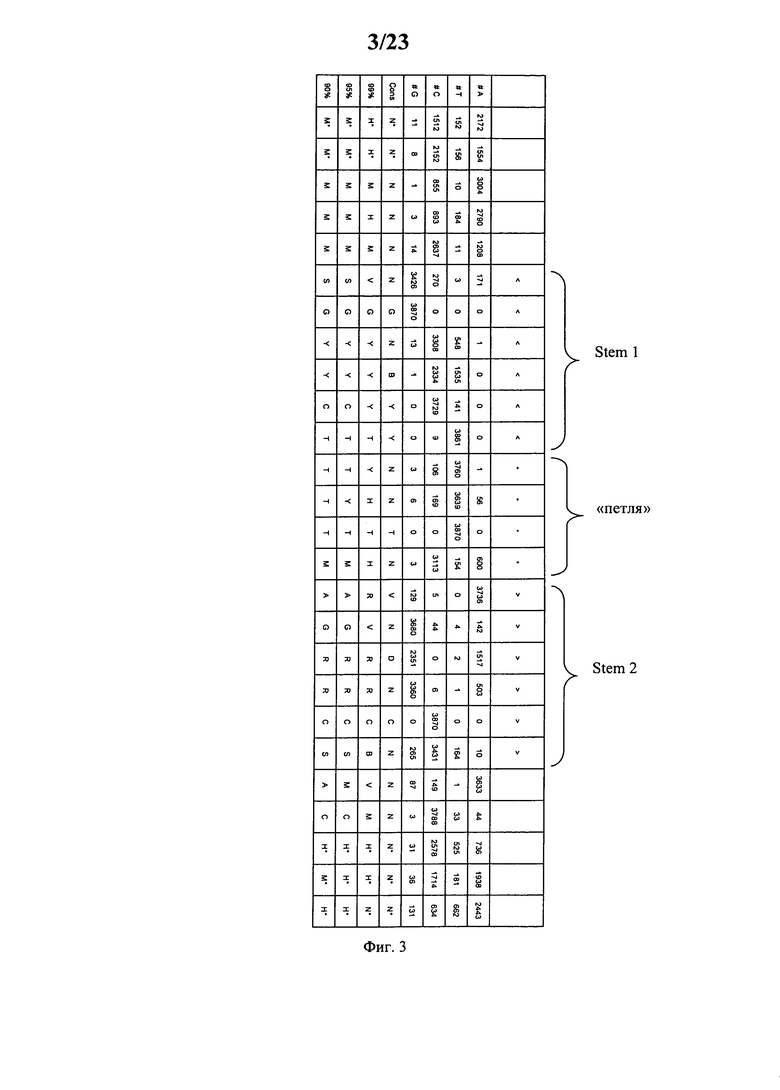
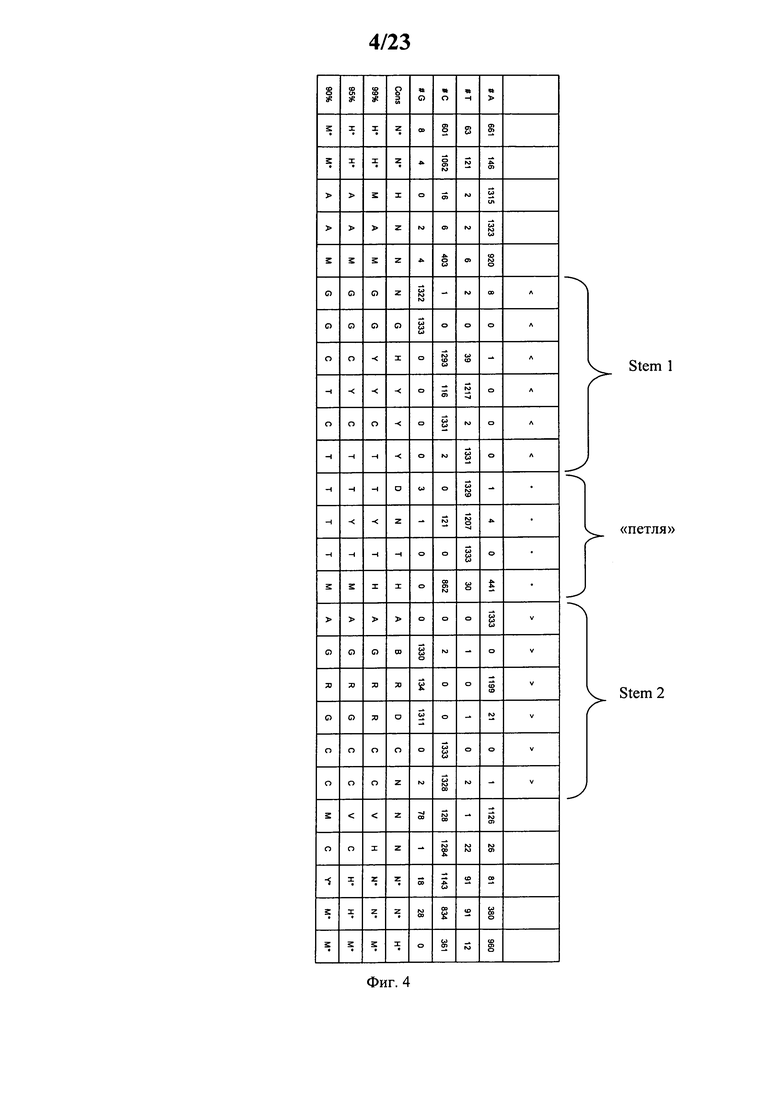
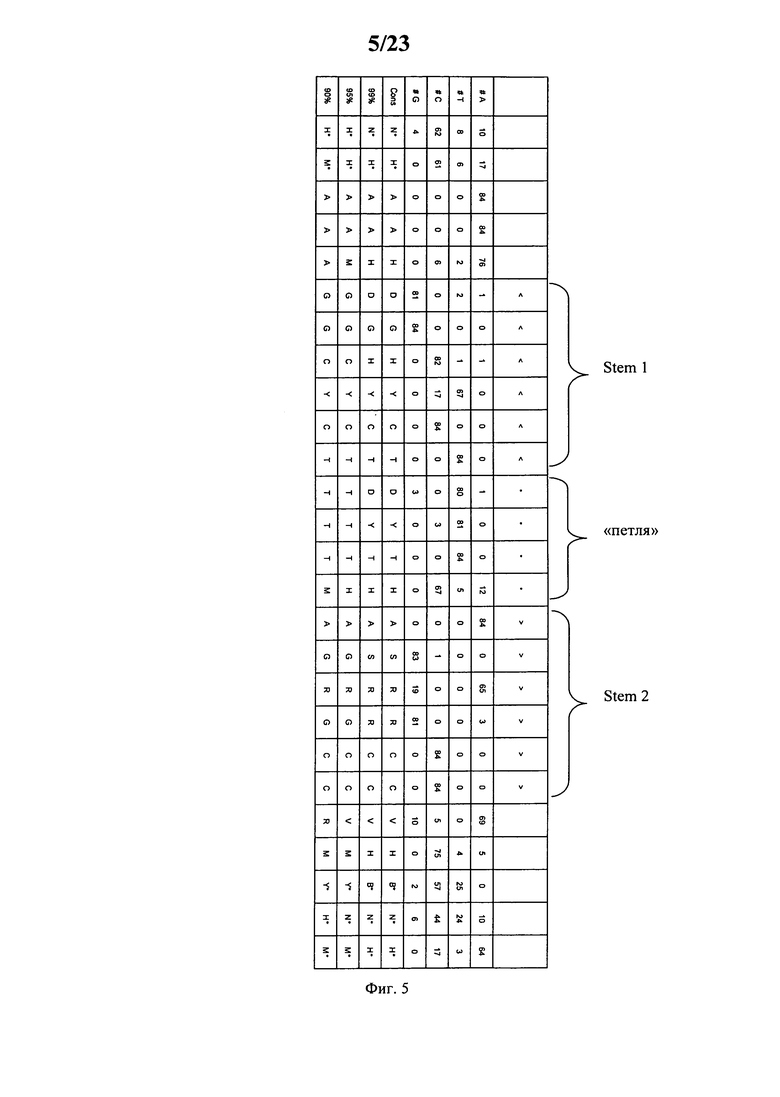












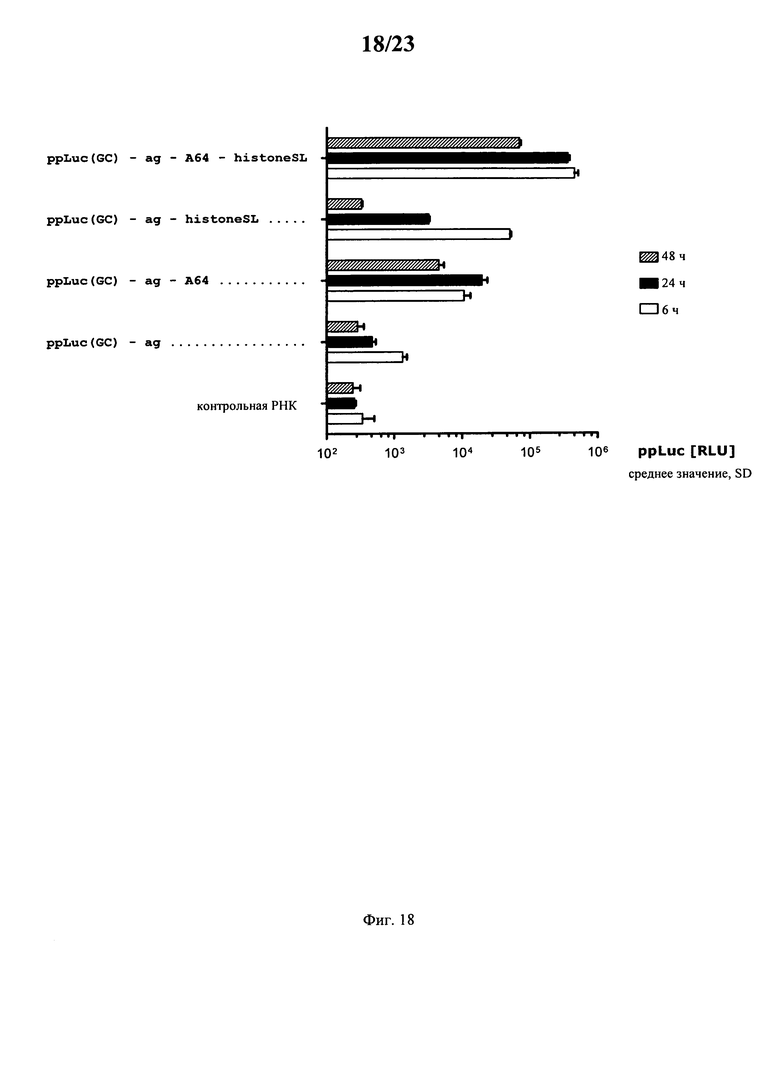
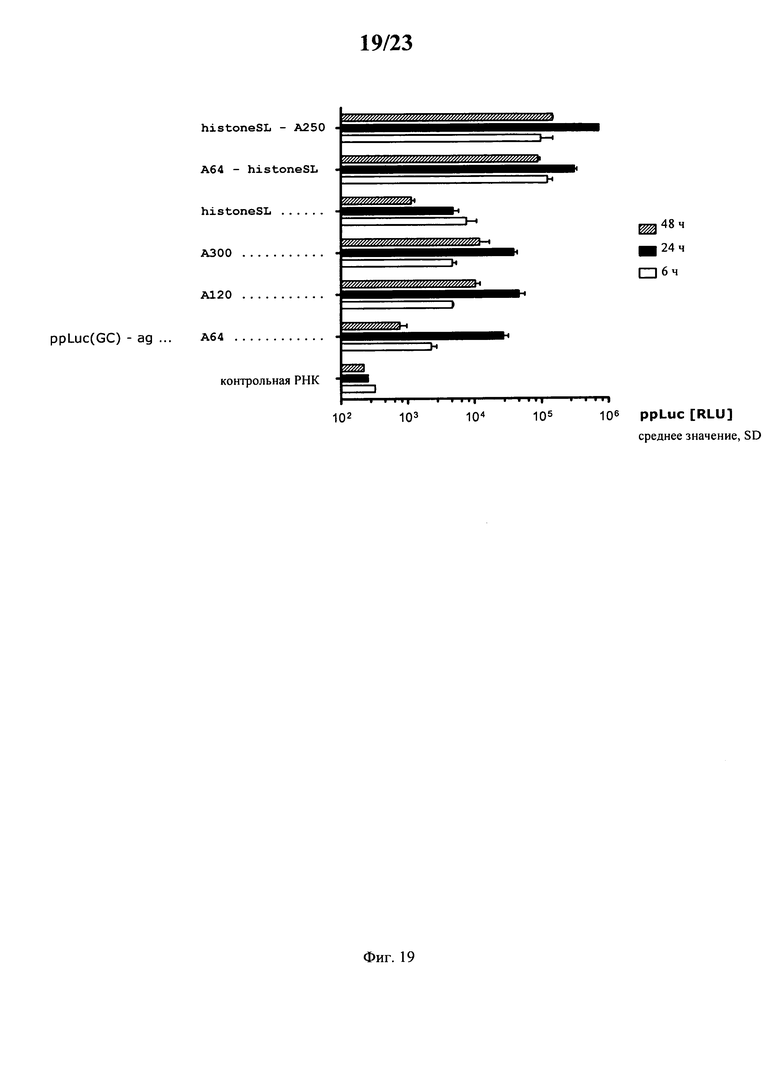
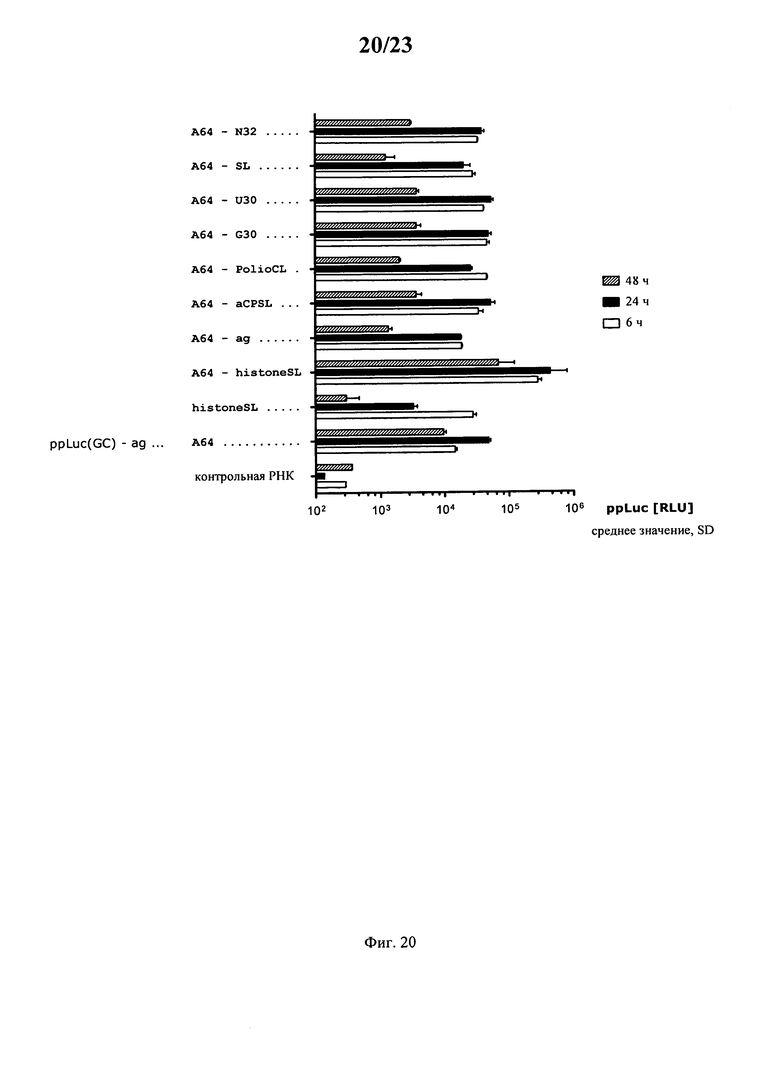
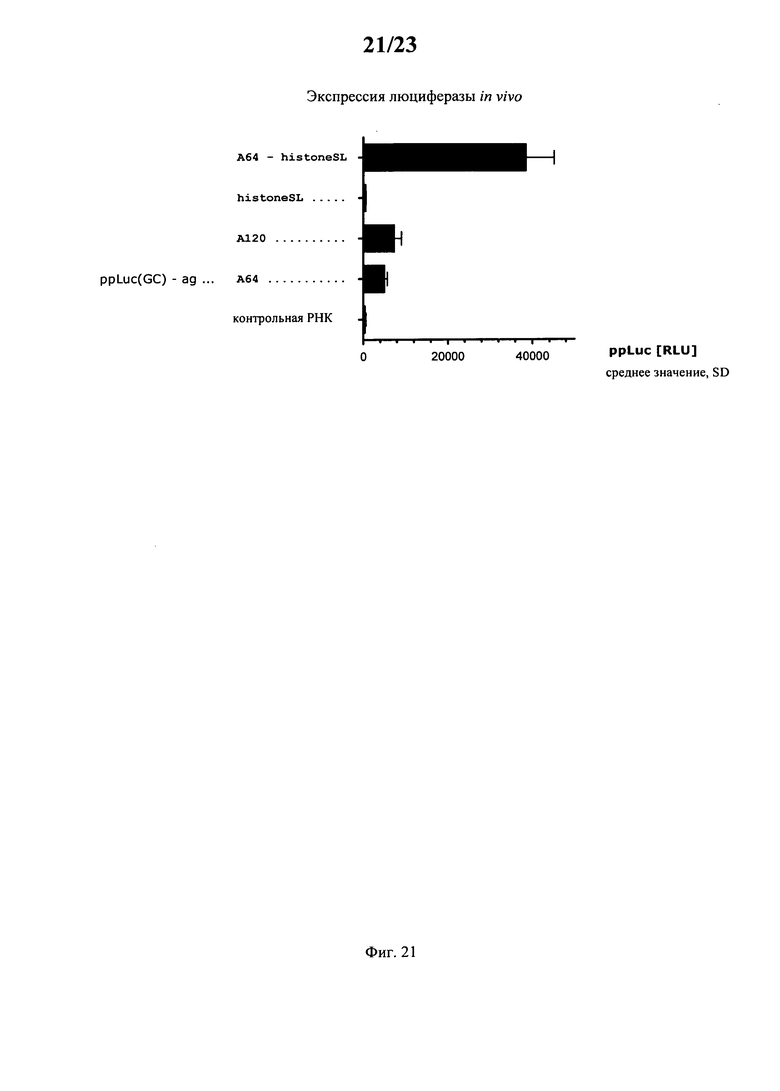
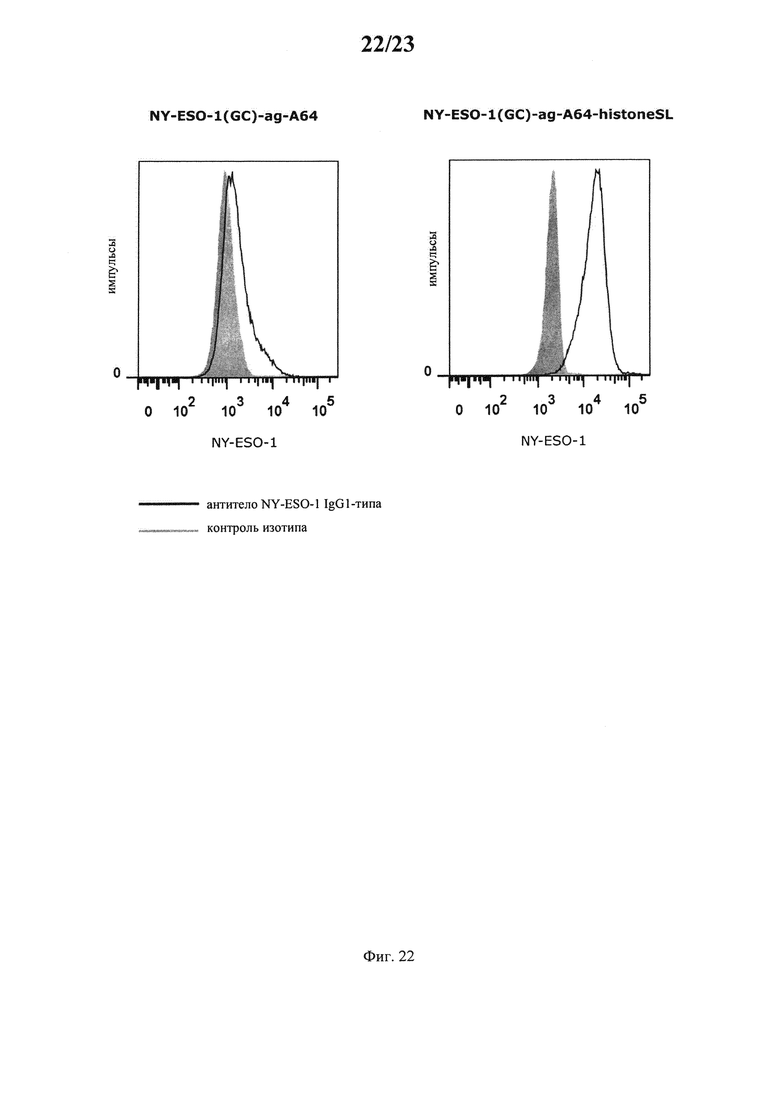
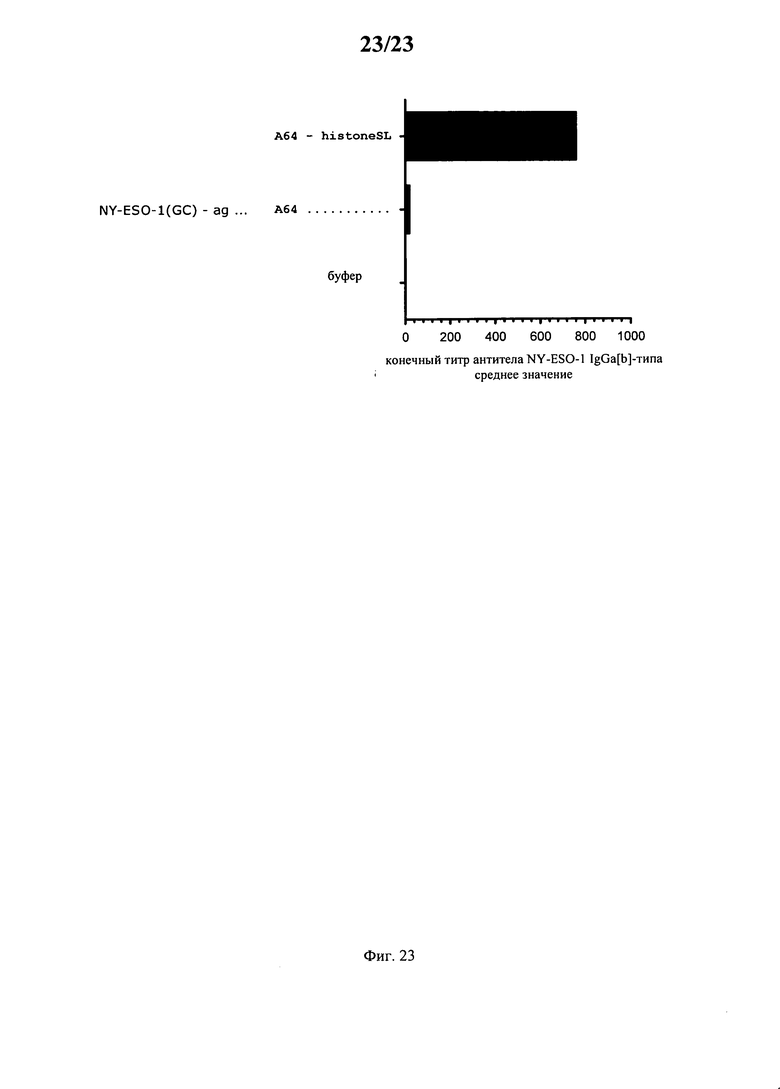




























































Изобретение относится к области биотехнологии. Описана кодирующая нуклеотидная последовательность, прежде всего матричная РНК (мРНК), которая содержит или кодирует гистоновую структуру типа «стебель-петля» и поли(A)-последовательность или сигнал полиаденилирования. Последовательность применяется для повышения уровня экспрессии кодируемого белка. Также описано ее применение для приготовления фармацевтической композиции, прежде всего вакцины, предназначенной для применения при лечении опухолевых и раковых заболеваний, сердечно-сосудистых заболеваний, инфекционных болезней, аутоиммунных или генетических заболеваний или в генной терапии. Дополнительно описан способ транскрипции in vitro, способы in vitro для повышения уровня экспрессии белка с использованием нуклеиновой кислоты, которая содержит или кодирует гистоновую структуру типа «стебель-петля» и поли(A)-последовательность или сигнал полиаденилирования, и способ ex vivo и in vivo. 3 н. и 11 з.п.ф-лы, 23 ил., 15 табл., 11 пр.
1. Применение нуклеиновой кислоты, которая содержит
а) кодирующую область, которая кодирует терапевтически активный пептид или белок, адъювантный белок, антиген, опухолевый антиген, патогенный антиген, антиген из животных, вирусный антиген, антиген простейших, бактериальный антиген, аллергенный антиген, аутоиммунный антиген, аллерген, антитело, иммуностимулирующий белок или пептид, или антигенспецифический Т-клеточный рецептор; при условии, что кодирующая область не кодирует гистоновые белки, репортерные белки, выбранные из EGFP и люциферазы, и маркерные или применяемые для селекции белки, выбранные из альфа-глобина, галактокиназы и ксантин-гуанинфосфорибозилтрансферазы (GPT),
б) по меньшей мере одну гистоновую структуру типа «стебель-петля» и
в) поли(А)-последовательность или сигнал полиаденилирования,
для увеличения экспрессии указанных белков, кодируемых кодирующей областью, как определено в (а), при лечении или профилактике раковых заболеваний, инфекционных болезней, аутоиммунных заболеваний, аллергий или аллергических заболеваний, моногенных заболеваний, генетических заболеваний, сердечно-сосудистых заболеваний, заболеваний нервной системы, болезней дыхательной системы, болезней пищеварительной системы, заболеваний кожи, скелетно-мышечных нарушений, нарушений соединительной ткани, иммунодефицита, эндокринных, трофических и метаболических заболеваний, глазных болезней или ушных болезней.
2. Применение по п. 1, при лечении вирусных, бактериальных или протозойных инфекционных болезней
3. Применение по п. 1 или 2, где нуклеиновая кислота представляет собой РНК, предпочтительно мРНК.
4. Применение по п. 1 или 2, в которой по меньшей мере одна гистоновая структура типа «стебель-петля» выбрана из структур, имеющих следующие формулы (I) или (II):
формула (I) (последовательность структуры типа «стебель-петля» без пограничных элементов «стебля»):
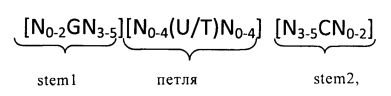
формула (II) (последовательность структуры типа «стебель-петля» с пограничными элементами «стебля»):
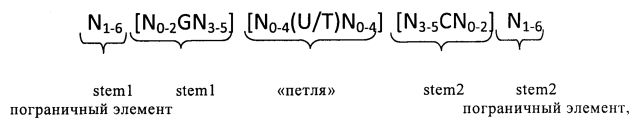
в которых:
где
stem1 и stem2 способны к спариванию оснований друг с другом
с образованием обратно комплементарной последовательности, где спаривание оснований может иметь место между stem1 и stem2, или
с образованием частично обратно комплементарной последовательности, если может происходить неполное спаривание оснований между stem1 и stem2.
5. Применение по п. 4, в которой по меньшей мере одна гистоновая структура типа «стебель-петля» выбрана из структур, имеющих следующие формулы (Ia) или (IIa):
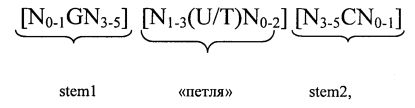
формула (Ia) (последовательность структуры типа «стебель-петля» без пограничных элементов «стебля»),
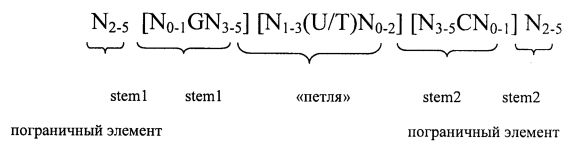
формула (IIa) (последовательность структуры типа «стебель-петля» с пограничными элементами «стебля»).
6. Применение по пп. 1, 2 или 5, в которой поли(А)-последовательность включает последовательность, которая содержит от примерно 25 до примерно 400 аденозиновых нуклеотидов, предпочтительно последовательность, которая содержит от примерно 50 до примерно 400 аденозиновых нуклеотидов, более предпочтительно последовательность, которая содержит от примерно 50 до примерно 300 аденозиновых нуклеотидов, еще более предпочтительно последовательность, которая содержит от примерно 50 до примерно 250 аденозиновых нуклеотидов, наиболее предпочтительно последовательность, которая содержит от примерно 60 до примерно 250 аденозиновых нуклеотидов.
7. Применение по пп. 1, 2 или 5, в которой сигнал полиаденилирования содержит консенсусную последовательность NNUANA, предпочтительно AAUAAA или AUUAAA.
8. Применение по пп. 1, 2 или 5, где нуклеиновая кислота представляет собой моноцистронную, бицистронную или мультицистронную нуклеиновую кислоту.
9. Применение фармацевтической композиции, содержащей нуклеиновую кислоту, как определено в любом из пп. 1-8, для увеличения экспрессии белков, кодируемых кодирующей областью указанной нуклеиновой кислоты, при лечении или профилактике раковых заболеваний, инфекционных болезней, аутоиммунных заболеваний, аллергий или аллергических заболеваний, моногенных заболеваний, генетических заболеваний, сердечно-сосудистых заболеваний, заболеваний нервной системы, болезней дыхательной системы, болезней пищеварительной системы, заболеваний кожи, скелетно-мышечных нарушений, нарушений соединительной ткани, иммунодефицита, эндокринных, трофических и метаболических заболеваний, глазных болезней или ушных болезней.
10. Применение по п. 9, где фармацевтическая композиция дополнительно включает фармацевтически приемлемый носитель.
11. Применение по п. 10, при лечении вирусной, бактериальной или протозойных инфекционных болезней
12. Применение вакцины, содержащей нуклеиновую кислоту, как определено в любом из пп. 1-8, которая кодирует протеиновый антиген, для увеличения экспрессии указанного протеинового антигена при лечении или профилактике раковых заболеваний, инфекционных болезней, аллергий или аллергических болезней или аутоиммунных болезней.
13. Применение по п. 12, при лечении вирусной, бактериальной или протозойных инфекционных болезней.
14. Применение по п. 12 или 13, в котором антиген выбран из опухолевых антигенов, аллергенных антигенов, аутоиммунных аутоантигенов, патогенных антигенов, вирусных антигенов, бактериальных антигенов, грибных антигенов, антигенов простейших, антигенов животных или аллергенных антигенов.
Авторы
Даты
2016-05-10—Публикация
2011-08-12—Подача