ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу получения сахарной жидкости из содержащей целлюлозу биомассы.
УРОВЕНЬ ТЕХНИКИ
Процесс ферментационной выработки химических продуктов с использованием сахаров в качестве исходных материалов используется для получения различных промышленных материалов. В настоящее время при использовании сахара в качестве ферментационного сырья в промышленных масштабах используется сахар, полученный из пищевых материалов, таких как сахарный тростник, крахмал и сахарная свекла. Однако, принимая во внимание тот факт, что ожидается рост цен на пищевые материалы вследствие роста населения мира, или рассматривая с этической точки зрения тот факт, что сахара в качестве промышленных материалов могут конкурировать с сахарами для еды, в будущем необходимо создание процесса эффективного получения сахарной жидкости из возобновляемого непищевого источника, то есть, содержащей целлюлозу биомассы, или процесса использования полученной сахарной жидкости в качестве ферментационного сырья для эффективного преобразования в промышленный материал.
В предшествующем уровне техники для получения сахара из биомассы общеизвестны способы, в которых концентрированная серная кислота применяется для гидролиза целлюлозы и гемицеллюлозы, содержащихся в биомассе, в моносахариды, в виде глюкозы и ксилозы (патентные документы 1 и 2), и способы, в которых осуществляется предварительная обработка для увеличения реакционной способности биомассы, за чем следует гидролиз биомассы посредством ферментативной реакции (патентные документы 3 и 4).
Однако при гидролизе содержащей целлюлозу биомассы происходит разложение компонентов целлюлозы и гемицеллюлозы и им подобных, при том происходит реакция разложения вырабатываемых сахаров, таких как глюкоза и ксилоза, с выработкой побочных продуктов, таких как фурановые соединения, включая фурфурол и гидроксиметилфурфурол, и органические кислоты, включая муравьиную кислоту и уксусную кислоту, что является проблематичным. Такие соединения проявляют ингибирующие действия во время этапа ферментации с использованием микроорганизма и вызывают ингибирование роста микроорганизма, что приводит к сниженному выходу ферментационного продукта. Вследствие этого, такие соединения называются ингибиторами ферментации и представляют серьезную проблему, когда содержащая целлюлозу сахарная жидкость из биомассы использовалась в качестве ферментационного сырья.
В качестве способа удаления таких ингибиторов ферментации во время процесса выработки сахарной жидкости был раскрыт способ, называемый передерживание (непатентный документ 1). В этом способе во время этапа нейтрализации обработанная кислотой целлюлоза или осахаренная добавлением извести жидкая смесь выдерживается в течение некоторого промежутка времени с нагреванием до приблизительно 60°C для удаления ингибиторов ферментации, таких как фурфурол и ГМФ вместе с гипсовым компонентом. Однако избыточная обработка известью оказывает лишь небольшое влияние на удаление органических кислот, таких как муравьиная кислота, уксусная кислота и левулиновая кислота, что является проблематичным.
Также в качестве другого способа удаления ингибиторов ферментации был раскрыт способ, в котором сахарную жидкость обдувают водяным паром, приготовленным из содержащей целлюлозу биомассы, для удаления ингибиторов ферментации выпариванием (патентный документ 5). Однако так как такой способ испарительных удалений зависит от точек кипения ингибиторов ферментации, эффективности удаления для ингибиторов ферментации, таких как органические кислоты, имеющие высокие точки кипения, являются исключительно низкими, такими, что требуется большое количество энергии для достижения достаточных эффективностей удаления, что является проблематичным.
Также существует способ, в котором ингибиторы ферментации удаляются при помощи ионного обмена (патентный документ 6), но это является проблематичным с точки зрения цены. Также существует способ, в котором осуществляется адсорбционное удаление с использованием карбида на древесной основе, то есть, активированного угля или чего-либо подобного, но удаляемые объекты ограничены гидрофобными соединениями, что является проблематичным (патентный документ 7).
Также существует способ, в котором ингибиторы ферментации удаляются с помощью мембраны (патентный документ 8), но количество ингибиторов ферментации, которые могут быть удалены на сторону пермеата, ограничено, что является проблематичным.
ДОКУМЕНТЫ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
[Патентные документы]
Патентный документ 1: Японская переведенная патентная заявка согласно PCT, опубликованная под No. 11-506934.
Патентный документ 2: JP 2005-229821 A.
Патентный документ 3: JP 2001-95597 A.
Патентный документ 4: JP 3041380 B.
Патентный документ 5: JP 2004-187650 A.
Патентный документ 6: Японская переведенная патентная заявка согласно PCT, опубликованная под No. 2001-511418.
Патентный документ 7: JP 2005-270056 A.
Патентный документ 8: WO 2010/067785.
[Непатентный документ]
Непатентный документ 1: M Alfred el al. "Влияние pH, времени и температуры избыточной обработки известью на детоксификацию разбавленных кислотами гидролизатов для ферментации Saccaromyces Cerevisiae" Process Biochemistry, 38, 515-512 (2002).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Задачи, решаемые изобретением
Таким образом, настоящее изобретение предоставляет способы решения вышеупомянутых задач, то есть, способ, в котором ингибиторы ферментации, вырабатываемые в процессе получения сахара из содержащей целлюлозу биомассы, удаляются на этапе получения сахарной жидкости, и способ получения очищенной сахарной жидкости, содержащей только небольшую массу ингибиторов ферментации.
Средства для решения задач
В результате интенсивного изучения вышеуказанных задач авторы настоящего открытия обнаружили то, что в процессе получения сахарной жидкости из содержащей целлюлозу биомассы может быть получен больший эффект удаления ингибиторов ферментации из сахарной жидкости процедурой добавления анионного полимера к водному раствору сахаров, полученному из содержащей целлюлозу биомассы (в дальнейшем в этом документе называемому водный полученный из целлюлозы сахарный раствор), с последующим пропусканием полученного в результате водного сахарного раствора через нанофильтрационную мембрану и/или обратноосмотическую мембрану для удаления ингибиторов ферментации из сахарной жидкости, предназначенной для использования в качестве ферментационного сырья, по сравнению с процедурой удаления ингибиторов ферментации из сахарной жидкости, предназначенной для использования в качестве ферментационного сырья, только пропусканием водного полученного из целлюлозы сахарного раствора через нанофильтрационную мембрану и/или обратноосмотическую мембрану. Таким образом, настоящее изобретение имеет следующие варианты воплощения.
Способ получения сахарной жидкости, включающий концентрирование водного полученного из целлюлозы сахарного раствора с помощью нанофильтрационной мембраны и/или обратноосмотической мембраны, в котором концентрация осуществляется после добавления водорастворимого анионного полимера к водному полученному из целлюлозы сахарному раствору, для удаления ингибитора(ов) ферментации на сторону пермеата нанофильтрационной мембраны и/или обратноосмотической мембраны.
Способ получения химического продукта, включающий ферментационное культивирование микроорганизма, имеющего способность вырабатывать химический продукт с использованием в качестве ферментационного сырья сахарной жидкости, полученной вышеописанным способом получения.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Посредством настоящего изобретения органические кислоты, такие как уксусная кислота, муравьиная кислота, кумаровая кислота и феруловая кислота, которые являются ингибиторами ферментации, могут быть удалены из водного полученного из целлюлозы сахарного раствора, при этом сахара, такие как глюкоза и ксилоза, могут быть выработаны с высокой чистотой и высоким выходом. В результате посредством использования очищенной сахарной жидкости, полученной по настоящему изобретению, в качестве ферментационного сырья, эффективности ферментационной выработки различных химических продуктов могут быть повышены.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой возможный пример способа добавления анионного полимера в выработке сахарной жидкости.
Фиг. 2 представляет собой возможный пример способа добавления анионного полимера в выработке сахарной жидкости.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение описано более конкретно.
Водный полученный из целлюлозы сахарный раствор по настоящему изобретению означает водный раствор, содержащий моносахариды, такие как глюкоза и ксилоза, и олигосахариды, растворенные в воде, раствор приготовлен предварительной обработкой содержащей целлюлозу биомассы или выполнением ферментативной обработки после предварительной обработки для гидролиза целлюлозного или гемицеллюлозного компонента в содержащей целлюлозу биомассе.
Содержащая целлюлозу биомасса по настоящему изобретению означает источник, который получен из организма и содержит не менее 5% по массе целлюлозы. Конкретные примеры содержащей целлюлозу биомассы содержат виды травянистой биомассы, такие как багасса, просо прутьевидное, слоновая трава, Erianthus, кукурузная солома, стебли риса и стебли пшеницы; и виды древесной биомассы, такие как деревья и ненужные строительные материалы. Так как такие содержащие целлюлозу виды биомассы содержат лигнин в качестве ароматических макромолекул в дополнение к целлюлозе/гемицеллюлозе, она также называется лигноцеллюлоза. Гидролизованием целлюлозы и гемицеллюлозы, которые являются полисахаридными компонентами, содержащимися в содержащей целлюлозу биомассе, может быть получена сахарная жидкость, содержащая моносахариды, которая может быть использована в качестве ферментационного сырья.
В предварительной обработке настоящего изобретения содержащая целлюлозу биомасса подвергается физической или химической обработке. Более конкретные примеры предварительной обработки включают, но не ограничены ими, кислотную обработку, в которой обработка осуществляется с разбавленной серной кислотой, сульфитом или им подобным при высокой температуре и высоком давлении; щелочную обработку, в которой обработка осуществляется с водным раствором основания, такого как гидроксид кальция или гидроксид натрия; аммиачную обработку, в которой обработка осуществляется жидким аммиаком, аммиачным газом или водным раствором аммиака; гидротермическую обработку, в которой обработка осуществляется горячей водой под давлением; пульверизационную обработку, в которой волокна механически нарезают с использованием режущей мельницы, молотковой мельницы, дробилки или чего-либо подобного; и обработку паровой обдувкой, в которой содержащая целлюлозу биомасса обдувается водяным паром в течение короткого промежутка времени, и затем давление мгновенно снижается, приводя к пульверизации из-за объемного расширения.
Среди видов предварительной обработки кислотная обработка представляет собой способ обработки, в котором содержащая целлюлозу биомасса подвергается обработке водным кислотным раствором серной кислоты, сульфита или им подобным при условиях высокой температуры и высокого давления для получения предварительно обработанного продукта. Обычно в кислотной обработке лигнин растворен, и гемицеллюлозный компонент, который имеет низкую кристалличность, гидролизуется первым, за этим следует деградация целлюлозного компонента, который имеет высокую кристалличность. Вследствие этого может быть получена жидкость, содержащая большее количество ксилозы, полученной из гемицеллюлозы. Дополнительно, установлением множества этапов условия гидролиза, пригодные для каждой из гемицеллюлозы и целлюлозы, могут быть установлены такими, что эффективность деградации и выход сахара могут быть увеличены.
Кислота, которая будет использована в кислотной обработке, не ограничена, при условии, что она вызывает гидролиз, и с экономической точки зрения предпочтительной является серная кислота. Концентрация кислоты составляет предпочтительно от 0,1 до 15% по массе, более предпочтительно от 0,5 до 5% по массе. Температура реакции может быть установлена в диапазоне от 100 до 300°C. Продолжительность реакции может быть установлена в диапазоне от 1 секунды до 60 минут. Количество раз обработки не ограничено, и обработка может быть осуществлена один или более раз. Деградация с помощью осахаривающего фермента после кислотной обработки может быть осуществлена для каждого твердого вещества и жидкого компонента, выделенных из предварительно обработанного продукта, полученного после кислотной обработки, или может быть осуществлена непосредственно со смесью твердого вещества и жидкого компонента. Так как твердый материал и жидкий компонент, полученные с помощью кислотной обработки, содержат примененную кислоту, нейтрализация выполняется перед реакцией гидролиза осахаривающим ферментом. Также возможно использовать жидкий компонент, полученный после кислотной обработки. Даже без добавления осахаривающего фермента жидкий компонент содержит большое количество моносахаридов и их олигосахаридов, главным образом состоящих из полученного из гемицеллюлозы компонента, полученного гидролизом с применением кислоты. Этот жидкий компонент также может быть использован в качестве жидкости, которая будет нанесена на нанофильтрационную мембрану и/или обратноосмотическую мембрану без добавления осахаривающего фермента.
Среди видов предварительной обработки гидротермическая обработка является способом, в котором обработка осуществляется горячей водой под давлением при температуре от 100 до 400°C в течение от 1 секунды до 60 минут. Обработка обычно осуществляется так, что содержащая целлюлозу биомасса после обработки, которая нерастворима в воде при нормальной температуре 25°C, содержится в концентрации от 0,1 до 50% по массе по отношению к общей массе содержащей целлюлозу биомассы и воды. Давление не ограничено, так как оно зависит от температуры переработки, и составляет предпочтительно от 0,01 до 10 МПа.
В гидротермической обработке, которая является одним из видов предварительной обработки, компоненты, элюированные в горячую воду, варьируются в зависимости от температуры горячей воды под давлением. В целом, по мере того как температура горячей воды под давлением возрастает, сначала происходит элюирование танина и лигнина в качестве первой группы из содержащей целлюлозу биомассы, и затем происходит элюирование гемицеллюлозы в качестве второй группы при температуре не менее, чем от 140 до 150°C, за которым дополнительно следует элюирование целлюлозы в качестве третьей группы при температуре выше 230°C. Дополнительно, в то же время, что и элюирование, может происходить гидролиз гемицеллюлозы и целлюлозы. Различие в элюированных компонентах в зависимости от температуры горячей воды под давлением может быть использовано для увеличения реакционной эффективности осахаривающего фермента по отношению к целлюлозе и гемицеллюлозе, выполнением многостадийной обработки при различных температурах. В этом документе, среди фракций, полученных гидротермической обработкой, водорастворимый материал, содержащий компоненты, элюированные в горячую воду под давлением, называется растворимый в горячей воде материал, и компоненты за исключением растворимого в горячей воде материала называются нерастворимый в горячей воде материал.
Нерастворимый в горячей воде материал является твердым материалом, полученным в результате элюирования больших количеств лигнинового и гемицеллюлозного компонента, и главным образом содержит ди- и высшие сахариды, в качестве целлюлозного (C6) компонента. В дополнение к целлюлозе в качестве главного компонента нерастворимый в горячей воде материал может содержать гемицеллюлозный компонент и лигниновый компонент. Соотношения содержания таких компонентов может варьироваться в зависимости от температуры горячей воды под давлением во время гидротермической обработки и типа обрабатываемой биомассы. Содержание воды в нерастворимом в горячей воде материале составляет от 10% до 90%, более предпочтительно от 20% до 80%.
Растворимый в горячей воде материал представляет собой водорастворимый материал в жидком состоянии или состоянии суспензии, содержащий гемицеллюлозу, лигнин, танин и часть целлюлозного компонента, элюированные в горячую воду под давлением в жидком состоянии или состоянии суспензии. Соотношение содержимого элюированных компонентов в растворимом в горячей воде материале обычно составляет от 0,1% по массе до 10% по массе. В данном документе, соотношение содержимого элюированных компонентов в растворимом в горячей воде материале может быть измерено с использованием средства для измерения содержания воды (например, инфракрасный влагомер FD720, изготовляемый Kelt Electric Laboratory). Более конкретно, соотношение может являться значением, рассчитанным вычитанием содержания воды в растворимом в горячей воде материале, полученном с использованием средства для измерения содержания воды, от 100%. Элюированные компоненты содержат не только водорастворимые компоненты, такие как моносахариды и олигосахариды, но также все другие компоненты, содержащиеся в воде, такие как осадки, образующиеся после предоставления растворимому в горячей воде материалу возможности отстоятся, и коллоидные компоненты, в большей степени диспергированные, чем осажденные в воде.
Так как растворимый в горячей воде материал содержит чрезвычайно большое количество ингибиторов ферментации, то есть органические кислоты, включая муравьиную кислоту и уксусную кислоту, и фуран/ароматические соединения, включая ГМФ и фурфурол, то обычно выполнение ферментационной выработки химического продукта напрямую с использованием сахарного раствора, приготовленного переработкой растворимого в горячей воде материала осахаривающим ферментом, является сложным. Также компоненты в растворимом в горячей воде материале содержат большое количество коллоидных компонентов и дисперсных компонентов, и это может вызвать засорение мембраны во время фильтрации с использованием мембраны. Жидкий компонент, полученный в виде растворимого в горячей воде материала, содержит большое количество сахаров, вырабатываемых гидролизом, вызванным горячей водой, в которых не только моносахариды, но также их олигосахариды содержатся в большом количестве. Дополнительно гидролиз может быть осуществлен добавлением фермента, или жидкий компонент может быть использован в качестве жидкости, которая будет нанесена на нанофильтрационную мембрану и/или обратноосмотическую мембрану без добавления фермента.
Среди видов предварительной обработки щелочная обработка представляет собой способ обработки, в котором содержащей целлюлозу биомассе предоставляется возможность прореагировать в водном щелочном растворе, который обычно является водным раствором основной соли (за исключением гидроксида аммония). Посредством щелочной обработки, лигнин, который ингибирует реакцию целлюлозы/гемицеллюлозы с осахаривающим ферментом, может быть удален. В качестве основной соли предпочтительно используются гидроксид натрия или гидроксид кальция. Концентрация основания в водном растворе предпочтительно лежит в диапазоне от 0,1 до 60% по массе. Этот раствор добавляется к содержащей целлюлозу биомассе, и обработка осуществляется обычно при температуре в диапазоне от 100 до 200°C, предпочтительно в диапазоне от 110 до 180°C. Количество раз обработки не ограничено, и обработка может быть осуществлена один или более раз. В случаях, когда обработка осуществляется 2 или более раз, условия для множества раз обработки могут быть отличными друг от друга. Так как предварительно обработанный продукт, полученный щелочной обработкой, содержит основание, предварительно обработанный продукт нейтрализуется перед гидролизом с помощью осахаривающего фермента.
Среди видов предварительной обработки аммиачная обработка представляет собой способ обработки, в котором водный раствор аммиака или чистый аммиак (в состоянии или жидкости, или газа) реагирует с полученной из целлюлозы биомассой. Примеры способа, который может быть использован, содержат способы, описанные в JP 2008-161125 A и JP 2008-535664 A. В них описано, что при аммиачной обработке, аммиак реагирует с целлюлозным компонентом для разрушения кристалличности целлюлозы, что приводит к существенному увеличению эффективности реакции посредством осахаривающего фермента. Аммиак обычно добавляется к содержащей целлюлозу биомассе так, что концентрация аммиака лежит в диапазоне от 0,1 до 15% по массе по отношению к содержащей целлюлозу биомассе, и обработка осуществляется при от 4°C до 200°C, предпочтительно от 60°C до 150°C. Количество раз обработки не ограничено, и обработка может быть осуществлена один или более раз. Предварительно обработанный продукт, полученный аммиачной обработкой, подвергается нейтрализации аммиака или удалению аммиака перед осуществлением реакции гидролиза с помощью осахаривающего фермента. Кислотный реагент, который будет использован для нейтрализации, не ограничен. Примеры реагента, который может быть использован для нейтрализации, содержат хлористоводородную кислоту, азотную кислоту и серную кислоту, и, с точки зрения предотвращения от действия реагента в качестве фактора, вызывающего коррозию технологических труб, или в качестве фактора, ингибирующего ферментацию, предпочтительной является серная кислота. Удаление аммиака может быть осуществлено выдерживанием обработанного аммиаком продукта при пониженном давлении для выпаривания аммиака.
Также водный полученный из целлюлозы сахарный раствор может являться водным сахарным раствором, полученным выполнением вышеописанной предварительной обработки и затем ферментативной обработки для предоставления возможности реакции гидролиза.
В настоящем изобретении осахаривающий фермент означает компонент фермента, который имеет деградирующую целлюлозу или гемицеллюлозу активность или способствующую деградации целлюлозы или гемицеллюлозы активность. Конкретные примеры компонента фермента содержат целлобиогидролазу, эндоглюканазу, экзоглюканазу, β-глюкозидазу, ксиланазу и ксилозидазу и способствующие набуханию биомассы ферменты. Дополнительно, осахаривающий фермент предпочтительно является ферментной смесью, содержащей множество типов таких компонентов. Например, так как гидролиз целлюлозы и гемицеллюлозы может быть эффективно осуществлен посредством согласованного эффекта или дополняющего эффекта такого множества ферментных компонентов, то ферментная смесь предпочтительно применяется в настоящем изобретении.
В настоящем изобретении осахаривающий фермент, вырабатываемый микроорганизмом, может быть предпочтительно применен. Например, осахаривающий фермент может содержать множество ферментных компонентов, вырабатываемых одним типом микроорганизма, или может являться смесью ферментных компонентов, вырабатываемых множеством типов микроорганизмов.
Микроорганизм, который вырабатывает осахаривающий фермент, представляет собой микроорганизм, который внутриклеточно или внеклеточно вырабатывает осахаривающий фермент, предпочтительно микроорганизм, который внеклеточно вырабатывает осахаривающий фермент. Причина этого заключается в том, что осахаривающий фермент может быть более легко отделен от микроорганизма, если микроорганизм внеклеточно вырабатывает осахаривающий фермент.
Микроорганизм, который вырабатывает осахаривающий фермент, не ограничен, при условии, что микроорганизм вырабатывает вышеописанный ферментный компонент, и микроорганизм предпочтительно представляет собой нитчатый гриб. Нитчатый гриб, относимый к Trichoderma (в дальнейшем в этом документе также называемый гриб Trichoderma), может быть особенно предпочтительно использован в качестве микроорганизма, который вырабатывает осахаривающий фермент, так как он внеклеточно секретирует большое количество различных осахаривающих ферментов.
Осахаривающий фермент, используемый в настоящем изобретении, предпочтительно представляет собой осахаривающий фермент, полученный из гриба Trichoderma, более предпочтительно осахаривающий фермент, полученный из гриба Trichoderma, такого как Trichoderma reesei QM9414, Trichoderma reesei QM9123, Trichoderma reesei Rut C-30, Trichoderma reesei PC3-7, Trichoderma reesei CL-847, Trichoderma reesei MCG77, Trichoderma reesei MCG80, Trichoderma viride QM9123 или Trichoderma longibrachiatum (CBS614.94). Дополнительно, осахаривающий фермент также может быть получен из мутантного штамма, приготовленного из нитчатого гриба Trichoderma при помощи мутагенеза с использованием мутагена, УФ-облучения или им подобного для увеличения продуктивности осахаривающего фермента. Например, осахаривающий фермент может являться осахаривающим ферментом, имеющим модифицированное соотношение композиции, полученным из мутантного штамма, который был приготовлен изменением гриба Trichoderma так, что экспрессия части ферментного компонента увеличена.
Коммерчески доступный осахаривающий фермент, полученный из гриба Trichoderma, также может быть использован. Примеры коммерчески доступного осахаривающего фермента содержат "Cellic CTec" и "Cellic CTec2", изготавливаемые Novozymes; "Accellerase 1000", "Accellerase 1500" и "Accellerase DUET", изготавливаемые Genencor Kyowa; "Целлюлазу из Trichoderma reesei ATCC 2691", "Целлюлазу из Trichoderma viride" и "Целлюлазу из Trichoderma longibrachiatum", изготавливаемые Sigma Aldrich.
Осахаривающий фермент, происходящий из гриба Trichoderma, может быть получен культивированием гриба Trichoderma в течение произвольно выбранного периода в среде, приготовленной так, что возможна выработка ферментного компонента. Компонент среды, который будет использован, не ограничен, и среда, дополненная целлюлозой, может быть предпочтительно применена для того, чтобы стимулировать выработку осахаривающего фермента. Также культуральная жидкость сама по себе, или культуральный супернатант, полученный удалением клеток Trichoderma, могут быть предпочтительно применены. Также среда может быть дополнена добавкой(ами), такой(ими) как ингибитор протеазы, диспергирующий агент, сжижающий агент и/или стабилизирующий агент.
Типы ферментных компонентов и соотношения компонентов в происходящем из гриба Trichoderma осахаривающем ферменте не ограничены. Например, культуральная жидкость, полученная из Trichoderma reesei, содержит целлобиогидролазу, β-глюкозидазу и им подобные. В случаях гриба Trichoderma высокоактивная целлобиогидролаза продуцируется в культуральную жидкость, но так как β-глюкозидаза удерживается в клетке или в поверхностном слое клетки, β-глюкозидазная активность в культуральной жидкости является низкой. Таким образом, в таких случаях β-глюкозидаза, полученная из различных видов или одинаковых видов, может быть дополнительно добавлена к культуральному супернатанту. Если в таких случаях будет добавлена β-глюкозидаза, полученная из различных видов, то предпочтительно применяется β-глюкозидаза, полученная из Aspergillus. Примеры β-глюкозидазы, полученной из Aspergillus, содержат "Novozyme 188", которая коммерчески доступна у Novozymes.
Анионный полимер по настоящему изобретению означает полимер, имеющий остов или группу боковой цепи, заряженную отрицательным ионом(ами) (анион(ы)). Анионный полимер может быть в форме одиночного анионного мономера, полимера из множества анионных мономеров, или сополимера, содержащего анионные мономеры. Форма сополимера также не ограничена, и может являться любой из статистического сополимера, блок-сополимера, графт-сополимера и чередующегося сополимера. Дополнительно анионный полимер также может являться смесью из 2 или более полимеров, в которой по меньшей мере один из полимеров является анионным соединением. Причиной этого является то, что использование 2 или более типов полимеров может увеличить эффект. Также анионный полимер ограничен растворимыми в воде полимерами. Термин "растворимый в воде" означает, что растворимость анионного полимера в воде при 25°C составляет не менее 1 г/л. Растворимость более предпочтительно составляет не менее 10 г/л. Причиной этого является то, что в случаях, когда анионный полимер является нерастворимым в воде, происходит засорение мембраны, и, следовательно, эффект настоящего изобретения не может быть воплощен. Средняя молекулярная масса анионного полимера составляет от 100 до 20000, более предпочтительно от 200 до 10000, исходя из значений, измеренных способом ГФХ. Еще более предпочтительно, чтобы средняя молекулярная масса составляла от 300 до 1000 в случаях фосфатного полимера, и от 2000 до 8000 в случаях карбоксилатного полимера. В случаях, когда растворимость является низкой или молекулярная масса является высокой, вязкость жидкости является высокой, и, в некоторых случаях, имеет место высокая вероятность возникновения загрязнения нанофильтрационной мембраны и/или обратноосмотической мембраны из-за агрегирования молекул. Также количество повторений базовых элементов молекулярной структуры предпочтительно лежит в диапазоне от 2 до 200. В случаях, когда количество повторений составляет не менее 2, эффективность удаления органических кислот является высокой, что является предпочтительным, и в случаях, когда количество повторений составляет не более 200, растворимость в воде является превосходной и, следовательно, вероятность возникновения агрегирования из-за взаимодействия между молекулами полимера является низкой, что является предпочтительным.
Анионный полимер по настоящему изобретению предпочтительно является полимером(ами), выбранным(ыми) из группы, состоящей из солей фосфатных полимеров, фосфатных полимеров, солей поликарбоксилатных полимеров, поликарбоксилатных полимеров и полисульфоновых полимеров. Полимер более предпочтительно является полимером(ами), выбранным(ами) из группы, состоящей из солей фосфатных полимеров, фосфатных полимеров, солей поликарбоксилатных полимеров и поликарбоксилатных полимеров. В частности, поликарбоксилатные полимеры и их соли, и неорганические фосфатные полимеры и их соли являются предпочтительными. Полимер еще более предпочтительно является неорганическим полифосфатом. По мере возрастания соответствия, возрастает эффект улучшения эффективности удаления органических кислот, как описано в примерах. Причина, по которой в настоящем изобретении может быть достигнута эффективность удаления органических кислот не является очевидной, но предполагается, что причиной является то, что соответствующий положительный ион (катион), удерживающий ионизированную органическую кислоту, такую как формиат ион или ацетат ион, например, ион натрия, ион калия, ион кальция, ион кремния, ион магния, ион аммония или ион железа, вероятно, содержащийся в сахарной жидкости, удерживается анионным полимером, и она проникает через мембрану в виде молекулы свободной органической кислоты. Вследствие этого, анионный полимер более предпочтительно является полимером, имеющим свойство хелатирования катионов.
Поликарбоксилатный полимер означает полимер, содержащий карбоксилат в остове или в группе боковой цепи. Конкретные примеры поликарбоксилатного полимера содержат полиакриловую кислоту, полиметакриловую кислоту, полималеиновую кислоту, полифумаровую кислоту, полиитаконовую кислоту, полистиролкарбоновую кислоту, поли 1-карбокси-1-метилтетраметилен, поли{1-[(2-карбоксифенил)иминометил]-2-фенилэтилен, поли[(E,E)-6-аминогекса-2,4-диеновую кислоту, поли(22,24-пентакозадииновую кислоту), поли(10,12-пентакозадииновую кислоту), поли{(1,3-диоксоиндолин-5.2 диил)[бис(трифторметил)метилен](1,3-диоксоиндолин-5.2 диил)(5-карбокси-1,3-фенилен)}, поли(3-карбоксифенилмалеимид), поли(3-метилпиррол-4-карбоновую кислоту), поли(2-аминобензойную кислоту)поли[дихлор(3-цианопропил)метилсилан], поли(2-гидрокси-3-метилбензоуксусную кислоту) и поли[1-(карбоксиоктил)этилен]. Поликарбоксилатный полимер может являться сополимером мономеров, приведенных в качестве примера выше. Полимер может быть в форме соли вышеописанного полимера. Еще более предпочтительно, полимер является полиакриловой кислотой или полималеиновой кислотой, или их сополимером, или их солью. В случаях соли, примеры соли содержат натриевую соль, калиевую соль, кальцевую соль и магниевую соль каждого полимера. С экономической точки зрения соль более предпочтительно является натриевой солью. Поликарбоксилатный полимер также может являться сополимером с мономерами за исключением мономеров, содержащих карбоксилат. Примеры полимера содержат винилсульфоновую кислоту, стиролсульфоновую кислоту, акрилонитрилэтиленгликольдиолефин гидроксиаллилоксипропансульфоновую кислоту, акриламидметилпропансульфоновую кислоту, олефин, изоолефин, простой виниловый эфир, виниловый спирт, гидроксиэтилметакрилат, акриламид и сложный виниловый эфир. Мономеры, которые будут сополимеризованы, отличающиеся от мономеров, содержащих карбоксилат, предпочтительно являются мономерами, содержащими группу сульфоновой кислоты, такую как винилсульфоновая кислота, стиролсульфоновая кислота, акрилонитрил этиленгликоль диолефин гидроксиаллилоксипропансульфоновая кислота и/или акриламидметилпропансульфоновая кислота. Средняя молекулярная масса поликарбоксилатного полимера составляет предпочтительно от 300 до 10000. Дополнительно, количество повторений базовых элементов молекулярной структуры поликарбоксилатного полимера составляет предпочтительно от 4 до 100. В случаях, когда поликарбоксилатный полимер имеет среднюю молекулярную массу не менее 300 и количество повторений базовых элементов молекулярной структуры не менее 4, эффективность удаления органических кислот является высокой, что является предпочтительным. Дополнительно, в случаях, когда поликарбоксилатный полимер имеет среднюю молекулярную массу не более чем 10000 и количество повторений базовых элементов молекулярной структуры не более чем 100, растворимость в воде является превосходной, и полимер хорошо диспергируется, так что мембранная эффективность не ухудшается, что является предпочтительным.
Фосфатный полимер означает полимер, имеющий группу PO3, которая является фосфатом. Группа PO3 может являться или функциональной или нефункциональной группой. Конкретные примеры содержащего фосфат полимера содержат неорганические фосфатные полимеры, такие как пирофосфорная кислота, гидропирофосфат, триполифосфорная кислота, тетраполифосфорная кислота, изополифосфорная кислота, метафосфорная кислота, триметафосфорная кислота, тетраметафосфорная кислота, гексаметафосфорная кислота, гидрогексаметафосфорная кислота, изометафосфорная кислота и ультрафосфорная кислота, и различные соли натрия и соли калия, а также соль Грэма, соль Мадрелла и соль Курроля. Дополнительные примеры полимера содержат фосфоновую кислоту и фосфиновую кислоту, и их соли, включая 2-фосфонобутан трикарбоновой кислоты-1,2,4-фосфонобутан трикарбоновой кислоты-1,2,4-1 натриевую соль, 2-фосфонобутан трикарбоновой кислоты-1,2,4-1 калиевую соль, 2-фосфонобутан трикарбоновой кислоты-1,2,4-2 натриевую соль, 2-фосфонобутан трикарбоновой кислоты-1,2,4-2 калиевую соль, 2-фосфонобутан трикарбоновой кислоты-1,2,4-3 натриевую соль, 2-фосфонобутан трикарбоновой кислоты-1,2,4-3 калиевую соль, 2-фосфонобутан трикарбоновой кислоты-1,2,4-4 натриевую соль и 2-фосфонобутан трикарбоновой кислоты-1,2,4-4 калиевую соль; 1-гидроксиэтилиден-1,1-дифосфоновую кислоту, 1-гидроксиэтилиден-1,1-дифосфоновой кислоты-1 натриевую соль, 1-гидроксиэтилиден-1,1-дифосфоновой кислоты-1 калиевую соль, 1-гидроксиэтилиден-1,1-дифосфоновой кислоты-2 натриевую соль, 1-гидроксиэтилиден-1,1-дифосфоновой кислоты-1,2 калиевую соль, 1-гидроксиэтилиден-1,1-дифосфоновой кислоты-1,3 натриевую соль и 1-гидроксиэтилиден-1,1-дифосфоновой кислоты-1,3 калиевую соль; аминотри(метиленфосфоновую кислоту), аминотри(метиленфосфоновой кислоты)-1 натриевую соль, аминотри(метиленфосфоновой кислоты)-1 калиевую соль, аминотри(метиленфосфоновой кислоты)-1,2 натриевую соль, аминотри(метиленфосфоновой кислоты)-1,2 калиевую соль, аминотри(метиленфосфоновой кислоты)-1,3 натриевую соль, аминотри(метиленфосфоновой кислоты)-1,3 калиевую соль, аминотри(метиленфосфоновой кислоты)-1,4 натриевую соль, аминотри(метиленфосфоновой кислоты)-1,4 калиевую соль, аминотри(метиленфосфоновой кислоты)-1,5 натриевую соль и аминотри(метиленфосфоновой кислоты)-1,5 калиевую соль; этилендиаминтетра(метиленфосфоновую кислоту), этилендиаминтетра(метиленфосфоновой кислоты)-1 натриевую соль, этилендиаминтетра(метиленфосфоновой кислоты)-1 калиевую соль, этилендиаминтетра(метиленфосфоновой кислоты)-1,2 натриевую соль, этилендиаминтетра(метиленфосфоновой кислоты)-1,2 калиевую соль, этилендиаминтетра(метиленфосфоновой кислоты)-1,3 натриевую соль, этилендиаминтетра(метиленфосфоновой кислоты)-1,3 калиевую соль, этилендиаминтетра(метиленфосфоновой кислоты)-1,4 натриевую соль, этилендиаминтетра(метиленфосфоновой кислоты)-1,4 калиевую соль, этилендиаминтетра(метиленфосфоновой кислоты)-1,5 натриевую соль, этилендиаминтетра(метиленфосфоновой кислоты)-1,5 калиевую соль, этилендиаминтетра(метиленфосфоновой кислоты)-1,6 натриевую соль и этилендиаминтетра(метиленфосфоновой кислоты)-1,6 калиевую соль; бис(поли-2-карбоксиэтил)фосфиновую кислоту, натрий бис(поли-2-карбоксиэтил)фосфиновую кислоту, калий бис(поли-2-карбоксиэтил)фосфиновую кислоту и тому подобное; фитиновую кислоту; и фосфатные эфиры спиртов. Фосфатный полимер более предпочтительно является неорганическим полифосфатом. Фосфатный полимер предпочтительно имеет среднюю молекулярную массу от 160 до 3000. Фосфатный полимер предпочтительно имеет количество повторений базовых элементов молекулярной структуры от 2 до 20. В случаях, когда фосфатный полимер имеет среднюю молекулярную массу не менее 160 и количество повторений базовых элементов молекулярной структуры не менее 2, эффективность удаления органических кислот является высокой, что является предпочтительным. Дополнительно, в случаях, когда фосфатный полимер имеет среднюю молекулярную массу не более 3000 и количество повторений базовых элементов молекулярной структуры не более 20, растворимость в воде является превосходной, и полимер диспергируется хорошо, так что мембранная эффективность не ухудшается, что является предпочтительным.
Полимер с группой сульфоновой кислоты означает полимер, содержащий группу сульфоновой кислоты, и конкретные примеры полимера содержат полистиролсульфоновую кислоту, акрилонитрилэтиленгликольдиолефин гидроксиаллилоксипропансульфоновую кислоту, акриламидометилпропансульфоновую кислоту, 2-акриламино-2-метилпропансульфоновую кислоту, алкилнафталинсульфоновую кислоту, метанитробензолсульфоновую кислоту, 2-гидрокси-3-аллилокси-1-пропансульфоновую кислоту, изопренсульфоновую кислоту и 2-акриламидо-2-метилпропансульфоновую кислоту. Полимер с группой сульфоновой кислоты предпочтительно имеет среднюю молекулярную массу от 600 до 10000. Полимер с группой сульфоновой кислоты предпочтительно имеет количество повторений базовых элементов молекулярной структуры от 4 до 75. В случаях, когда полимер с группой сульфоновой кислоты имеет среднюю молекулярную массу не менее 600 и количество повторений базовых элементов молекулярной структуры не менее 4, эффективность удаления органических кислот является высокой, что является предпочтительным. Также в случаях, когда полимер с группой сульфоновой кислоты имеет среднюю молекулярную массу не более чем 10000 и количество повторений базовых элементов молекулярной структуры не более чем 75, растворимость в воде является превосходной и полимер хорошо диспергируется, так что мембранная эффективность не ухудшается, что является предпочтительным.
Количество анионного полимера, которое будет добавлено, не ограничено, и количество составляет предпочтительно от 0,005 мг/л до 5000 мг/л, более предпочтительно от 0,05 мг/л до 500 мг/л по отношению к объему водного полученного из целлюлозы сахарного раствора, который будет нанесен на нанофильтрационную мембрану и/или обратноосмотическую мембрану. Количество анионного полимера, которое будет добавлено, еще более предпочтительно составляет от 0,5 мг/л до 50 мг/л. Причиной этого является то, что добавление меньшего количества полимера имеет лишь низкий эффект, тогда как добавление слишком большого количества полимера не приводит к существенному улучшению эффекта. Анионный полимер играет роль в хелатировании анионов, особенно неорганических анионов. Причина, по которой такой анионный полимер, имеющий хелатирующую способность, является предпочтительным, является такой, как описано выше.
В настоящем изобретении кислота или щелочь может быть добавлена вместе с анионным полимером. Причиной этого является то, что для некоторых анионных полимеров по настоящему изобретению способность удалять ингибиторы ферментации увеличена при оптимальных для них значениях pH. Значение pH водного полученного из целлюлозы сахарного раствора при добавлении водорастворимого анионного полимера предпочтительно лежит между pH анионного полимера и 12. Значение pH более предпочтительно составляет от 4 до 9. Причиной этого является то, что оптимальное значение pH для эффективности анионного полимера лежит в этом диапазоне, и, следовательно, эффективность удаления органических кислот как ингибиторов ферментации может быть увеличена без понижения pH до менее 4 добавлением анионного полимера. Примеры кислоты в настоящем изобретении содержат хлористоводородную кислоту, серную кислоту, фосфорную кислоту, азотную кислоту и органические кислоты, и кислота предпочтительно является хлористоводородной кислотой, серной кислотой или фосфорной кислотой с экономической точки зрения и учитывая влияние на этап ферментации. Примеры щелочей по настоящему изобретению содержат гидроксиды, такие как гидроксид натрия и гидроксид кальция; и амины, такие как аммиак. Более предпочтительной щелочью является гидроксид натрия, гидроксид кальция или аммиак с экономической точки зрения и учитывая влияние на этап ферментации. Регулирование pH предпочтительно осуществляется перед добавлением анионного полимера. Причиной этого является то, что часть анионного полимера в сахарной жидкости может быть инактивирована под влиянием кислоты или щелочи, использованных для регулирования pH.
В настоящем изобретении добавление анионного полимера к водному полученному из целлюлозы сахарному раствору может быть осуществлено на любой стадии перед концентрацией водного полученного из целлюлозы сахарного раствора с использованием нанофильтрационной мембраны и/или обратноосмотической мембраны (описано далее). То есть, добавление может быть осуществлено при гидролизе посредством ферментативного осахаривания; при разделении твердая фаза-жидкость (описано далее); или при обработке с помощью микрофильтрационной мембраны и/или ультрафильтрационной мембраны (описано далее), то есть осуществлено в виде предварительной обработки для концентрации водного полученного из целлюлозы сахарного раствора с помощью нанофильтрационной мембраны и/или обратноосмотической мембраны. Обработка более предпочтительно осуществляется при предконцентрационной обработке посредством обработки с помощью микрофильтрационной мембраны и/или ультрафильтрационной мембраны, или на стадии концентрации с помощью нанофильтрационной мембраны и/или обратноосмотической мембраны. Причиной этого является то, что потеря полимера может происходить из-за разделения твердая фаза-жидкость или ему подобного посредством адгезии полимера к твердому материалу. Еще более предпочтительно, как показано на фиг. 2, анионный полимер добавляется после обработки с помощью микрофильтрационной мембраны и/или ультрафильтрационной мембраны, но перед обработкой с помощью нанофильтрационной мембраны и/или обратноосмотической мембраны. Причиной этого является то, что, если добавление анионного полимера происходит перед обработкой с помощью микрофильтрационной мембраны и/или ультрафильтрационной мембраны, потеря анионного полимера может происходить из-за концентрационной поляризации мембраны или адгезии полимера к поверхности мембраны, хотя анионный полимер не индуцирует агрегирование.
В настоящем изобретении ингибирование ферментации означает явление, в котором, когда химический продукт вырабатывается с использованием в качестве ферментационного сырья сахарной жидкости, которая была приготовлена с использованием содержащей целлюлозу биомассы в качестве исходного материала, количество химического продукта, вырабатываемого или накапливаемого, или уровень выработки химического продукта снижается из-за ингибиторов ферментации по сравнению со случаем, когда реактивный моносахарид используется в качестве ферментационного сырья. Степень такого ингибирования ферментации варьируется в зависимости от типов и количеств ингибиторов ферментации, представленных в сахарной жидкости, и также варьируется в зависимости от видов применяемого микроорганизма и типа химического продукта, вырабатываемого им. Водный полученный из целлюлозы сахарный раствор по настоящему изобретению содержит ингибиторы ферментации в любом случае, хотя их компоненты и содержания варьируются в зависимости от условий предварительной обработки и реакции осахаривания, типа содержащей целлюлозу биомассы, и тому подобного. Вследствие этого подверганием водного полученного из целлюлозы сахарного раствора обработке с помощью нанофильтрационной мембраны и/или обратноосмотической мембраны после добавления анионного полимера, ингибиторы ферментации могут быть эффективно удалены.
Ингибиторы ферментации представляют собой вещества, вырабатываемые на этапе предварительной обработки содержащей целлюлозу биомассы и этапе гидролиза осахаривающим ферментом, эти вещества ингибируют, как описано выше, ферментацию на этапе ферментации с использованием в качестве исходного материала сахарной жидкости, полученной способом получения настоящего изобретения. Ингибиторы ферментации грубо подразделяются на органические кислоты, фурановые соединения и фенольные соединения.
Конкретные примеры органических кислот содержат уксусную кислоту, муравьиную кислоту и яблочную кислоту. Конкретные примеры фурановых соединений содержат фурфурол и гидроксиметилфурфурол (ГМФ). Такие органические кислоты и фурановые соединения представляют собой продукты, вырабатываемые разложением глюкозы или ксилозы, которые являются моносахаридами. Конкретные примеры фенольных соединений содержат ванилин, ацетованилин, кумаровую кислоту, феруловую кислоту, ванилиновую кислоту, сиреневую кислоту, галлиевую кислоту, конифериловый альдегид, дигидроконифериловый спирт, гидрохинон, катехол, ацетогуаикон, гомованилиновую кислоту, 4-гидроксибензойную кислоту и производные 4-гидрокси-3-метоксифенила (кетоны Хибберта). Эти фенольные соединения получены из лигнина или предшественников лигнина.
В случаях, когда ненужный строительный материал, фанера или ей подобные, используется в качестве содержащей целлюлозу биомассы, компоненты, такие как связующие вещества и краски, используемые в процессе лесозаготовки, могут содержаться в качестве ингибиторов ферментации. Примеры связующих веществ содержат карбамидные смолы, меламиновые смолы, феноловые смолы, и сополимеры карбамид/меламин. Примеры ингибиторов ферментации, полученных из таких связующих веществ, содержат уксусную кислоту, муравьиную кислоту и формальдегид.
В частности, как описано в примерах ниже, добавление анионного полимера повышает проницаемость нанофильтрационной мембраны и/или обратноосмотической мембраны для органических кислот, фурановых соединений, содержащих карбоксильную группу, и фенольных соединений, содержащих карбоксильную группу. Таким образом, удаление органических кислот из водного полученного из целлюлозы сахарного раствора может быть эффективно осуществлено. Примеры фурановых соединений, содержащих карбоксильную группу, содержат фуранкарбоновую кислоту и бензофуран-2-карбоновую кислоту. Примеры фенольных соединений, содержащих карбоксильную группу, содержат кумаровую кислоту, феруловую кислоту, ванилиновую кислоту, сиреневую кислоту, галлиевую кислоту, гомованилиновую кислоту и 4-гидроксибензойную кислоту.
Водный полученный из целлюлозы сахарный раствор содержит по меньшей мере одно из веществ в качестве ингибитора(ов) ферментации, и раствор обычно содержит множество веществ. Такие ингибиторы ферментации могут быть детектированы и количественно измерены общепринятым аналитическим способом, таким как тонкослойная хроматография, газовая хроматография или высокоэффективная жидкостная хроматография.
Нанофильтрационная мембрана, используемая в настоящем изобретении, также называется нанофильтр (нанофильтрационная мембрана, НФ мембрана), и обычно определяется как "мембрана, которая позволяет проникновение моновалентных ионов, но блокирует бивалентные ионы". Считается, что мембрана имеет мелкие полости, размером приблизительно несколько нанометров, и главным образом используется для блокирования мелких частиц, молекул, ионов и солей в воде.
Обратноосмотическая мембрана, используемая в настоящем изобретении, также называется ОО мембрана, и обычно определяется как "мембрана, имеющая функцию обессоливания, которая также может удалять моновалентные ионы". Считается, что мембрана имеет ультрамелкие полости, имеющие размеры, варьирующиеся от приблизительно нескольких ангстрем до нескольких нанометров, и главным образом используется для удаления ионных компонентов, как, например, обессоливание морской воды и производство воды высшей степени очистки.
Водный полученный из целлюлозы сахарный раствор фильтруется через одну или обе мембраны из нанофильтрационной мембраны и обратноосмотической мембраны, для получения очищенной сахарной жидкости в виде мембранной фракции непермеата. Сахара, растворенные в водном полученном из целлюлозы сахарном растворе, особенно моносахариды, такие как глюкоза и ксилоза, могут быть блокированы или выделены на загрузочной стороне, тогда как ингибиторы ферментации могут быть удалены предоставлением им возможности отфильтровываться в виде фракции мембранного пермеата (фильтрат).
Эффективность нанофильтрационной мембраны или обратноосмотической мембраны, используемой в настоящем изобретении, может быть определена расчетом степени пермеации (%) подвергаемого воздействию соединения (ингибитор ферментации, моносахарид или им подобное), содержащимся в сахарном растворе. Способ расчета степени пермеации (%) показан в уравнении 1.
Степень пермеации (%) = (концентрация подвергаемого воздействию соединения на пермеатной стороне/концентрация подвергаемого воздействию соединения на загрузочной стороне)×100 (уравнение 1)
Способ измерения концентрации подвергаемого воздействию соединения в уравнении 1 не ограничен, при условии, что способ позволяет точное и воспроизводимое измерение, и примеры способа, который может быть предпочтительно применен, содержат высокоэффективную жидкостную хроматографию и газовую хроматографию. Как в нанофильтрационной мембране, так и в обратноосмотической мембране, используемым в настоящем изобретении, степени пермеации моносахаридов предпочтительно являются низкими, и степени пермеации ингибиторов ферментации предпочтительно являются высокими.
Нанофильтрационная мембрана обычно имеет больший размер пор, чем обратноосмотическая мембрана. Вследствие этого, считается, что, в случаях, когда используется нанофильтрационная мембрана, количество ингибиторов ферментации, удаленных пермеацией через мембрану, является относительно большим, при этом количество моносахаридов в качестве целевых продуктов, потерянных на стороне пермеата, также является относительно большим, по сравнению со случаями, когда используется обратноосмотическая мембрана. В частности, в случаях, когда концентрация сахара является высокой, эта тенденция однозначно проявляется. И наоборот, в случаях, когда используется обратноосмотическая мембрана, считается, что количество удаленных высокомолекулярных ингибиторов ферментации будет меньше, так как обратноосмотическая мембрана имеет меньший размер пор, чем нанофильтрационная мембрана. Вследствие этого, предпочтительно выбирать подходящую(ие) мембрану(ы) среди нанофильтрационных мембран и обратноосмотических мембран, принимая во внимание содержания и молекулярные массы главных ингибиторов ферментации в водном, полученном из целлюлозы сахарном растворе. Множество типов мембран могут быть выбраны среди нанофильтрационных мембран и обратноосмотических мембран в зависимости от композиции сахарного раствора и могут быть использованы в комбинации.
Когда используется нанофильтрационная мембрана, по мере того как концентрация моносахаридов, собранных на загрузочной стороне (концентрационная сторона) нанофильтрационной мембраны возрастает, степень потери моносахаридов на сторону пермеата (фильтратная сторона) в некоторых случаях резко возрастает. С другой стороны, когда используется обратноосмотическая мембрана, потери моносахаридов почти не происходит даже при увеличенной концентрации моносахарида на стороне непермеата мембраны. Однако, с точки зрения удаления ингибиторов ферментации, нанофильтрационная мембрана имеет более высокую эффективность, чем обратноосмотическая мембрана. Вследствие этого, в случаях, когда нанофильтрационная мембрана и обратноосмотическая мембрана применяются в комбинации, предпочтительно удалять ингибиторы ферментации с использованием нанофильтрационной мембраны до концентрации, при которой потеря сахаров на сторону пермеата мембраны может считаться невысокой, за чем следует применение обратноосмотической мембраны, которая позволяет концентрацию моносахаридов без потери.
Примеры нанофильтрационной мембраны, которая может быть использована в настоящем изобретении содержат мембраны, состоящие из макромолекулярных материалов, таких как полимеры ацетат целлюлозы; полиамид; полиэфир; полиимид; виниловые полимеры, включая поливиниловый спирт; полисульфон; сульфированный полисульфон; полиэфирсульфон и сульфированный полиэфирсульфон. Мембрана также может являться мембраной, содержащей множество таких материалов. С точки зрения структуры мембраны, мембрана может являться или асимметричной мембраной, которая имеет плотный слой на по меньшей мере одной стороне и микропоры, имеющей размер пор, который постепенно увеличивается в направлении от плотного слоя к внутренней части мембраны или другой стороне мембраны, или композиционной мембраной, которая имеет очень тонкий функциональный слой, образованный другим материалом на плотном слое асимметричной мембраны. Примеры композиционной мембраны, которые могут быть использованы, содержат композиционную мембрану, описанную в JP 62-201606 A, которая имеет фильтр, состоящий из полиамидного функционального слоя на мембране-подложке, содержащей полисульфон в качестве мембранного материала.
Среди таких нанофильтрационных мембран композиционная мембрана, имеющая функциональный слой, состоящий из полиамида, является предпочтительной, так как она имеет устойчивость к высокому давлению, высокую проницаемость и высокую эффективность удаления растворенных веществ, что делает мембрану чрезвычайно производительной. Для поддержания стойкости против действующего давления, и высокой проницаемости и высокой блокирующей эффективности мембрана предпочтительно имеет структуру, в которой полиамид используется в качестве функционального слоя и слой удерживается подложкой, состоящей из пористой мембраны или нетканого материала. Дополнительно в качестве полиамидной полупроницаемой мембраны пригодна композиция полупроницаемой мембраны, имеющая на подложке функциональный слой поперечно сшитого полиамида, полученного реакцией поликонденсации между полифункциональным амином и полифункциональным кислотным галогенидом.
В нанофильтрационной мембране, имеющей полиамидный функциональный слой, предпочтительные примеры карбоновой кислоты в качестве компонента мономеров, составляющих полиамид, содержат ароматические карбоновые кислоты, такие как тримезиновая кислота, бензофенонтетракарбоновая кислота, тримеллитовая кислота, пиромеллитовая кислота, изофталевая кислота, терефталевая кислота, нафталиндикарбоновая кислота, дифенилкарбоновая кислота и пиридинкарбоновая кислота. С точки зрения растворимости в пленкообразующих растворителях, тримезиновая кислота, изофталевая кислота и терефталевая кислота и их смеси являются более предпочтительными.
Предпочтительные примеры амина в качестве компонента мономеров, составляющих полиамид, содержат первичные диамины, имеющие ароматическое кольцо, такие как м-фенилендиамин, п-фенилендиамин, бензидин, метиленбисдианилин, 4,4'-диаминодифениловый эфир, дианизидин, 3,3',4-триаминобифениловый эфир, 3,3',4,4'-тетрааминобифениловый эфир, 3,3'-диоксибензидин, 1,8-нафталиндиамин, м(п)-монометилфенилендиамин, 3,3'-монометиламино-4,4'-диаминобифениловый эфир, 4,N,N'-(4-аминобензоил)-п(м)-фенилендиамин-2,2'-бис(4-аминофенилбензимидазол), 2,2'-бис(4-аминофенилбензооксазол) и 2,2'-бис(4-аминофенилбензотиазол); и вторичные диамины, такие как пиперазин, пиперидин и их производные. Нанофильтрационная мембрана, имеющая функциональный слой, состоящий из поперечно сшитого полиамида, содержащего, среди этого, пиперазин или пиперидин в качестве мономеров, предпочтительно применяется, так как она обладает тепловой устойчивостью и химической устойчивостью в дополнение к устойчивости к давлению и долговечности.
Полиамид более предпочтительно содержит в качестве главного компонента поперечно сшитый пиперазинполиамид или поперечно сшитый пиперидин полиамид и дополнительно содержит составляющий компонент, изображаемый химической формулой (1). Полиамид еще более предпочтительно содержит поперечно сшитый пиперазинполиамид в качестве главного компонента и дополнительно составляющий компонент, изображаемый химической формулой (1). Также особенно предпочтительно, в химической формуле 1, n=3. Примеры нанофильтрационной мембраны, имеющей функциональный слой, состоящий из полиамида, содержащего поперечно сшитый пиперазинполиамид в качестве главного компонента и дополнительно содержащего составляющий компонент, изображаемый химической формулой (1), включают мембрану, описанную в JP 62-201606 A, и конкретные примеры мембраны содержат UTC60, изготавливаемую Toray Industries, Inc., которая представляет собой поперечно сшитую пиперазинполиамидную нанофильтрационную мембрану, имеющую функциональный слой, состоящий из полиамида, содержащего поперечно сшитый пиперазинполиамид в качестве главного компонента и дополнительно содержащего составляющий компонент, представленный химической формулой (1), в которой n=3.
[Химическая формула 1]
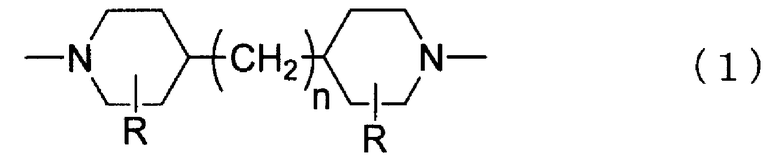
В химической формуле 1, R представляет собой -H или -CH3, и n является целым числом от 0 до 3.
Нанофильтрационная мембрана обычно используется в виде спирально-навитого мембранного элемента, и нанофильтрационная мембрана, используемая в настоящем изобретении, также предпочтительно используется в виде спирально-навитого мембранного элемента. Конкретные предпочтительные примеры нанофильтрационного мембранного модуля содержат GEsepa DK series, HL series и DL series, которые являются ацетатцеллюлозными нанофильтрационными мембранами, изготавливаемыми GE Osmonics; NTR-7410 и NTR-7450, которые имеют функциональные мембраны из сульфированного полисульфона; NTR-725HF, NTR-7250, NTR-729HF, NTR-769SR и NTR-759HR, изготавливаемые Nitto Denko Corporation, имеющие функциональную мембрану, состоящую из поливинилового спирта, изготавливаемые Nitto Denko Corporation; NF99, NF99HF и NF97, которые являются нанофильтрационными мембранами, изготавливаемыми Alfa-Laval, имеющими полиамидный функциональный слой; NF-45, NF-90, NF-200, NF-270 и NF-400, которые являются нанофильтрационными мембранами, имеющими функциональный слой, состоящий из поперечно сшитого пиперазинполиамида, изготавливаемые Filmtec Corporation; и SU-210, SU-220, SU-600 и SU-610, которые являются нанофильтрационными мембранными модулями, изготавливаемыми Toray Industries, Inc., имеющими функциональный слой, состоящий из полиамида, содержащего поперечно сшитый пиперазинполиамид в качестве главного компонента. Нанофильтрационный мембранный элемент более предпочтительно является NF99 или NF99HF, которые являются нанофильтрационными мембранами, имеющими функциональный слой, состоящий из полиамида, изготавливаемыми Alfa-Laval; NF-45, NF-90, NF-200 или NF-400, которые являются нанофильтрационными мембранами, имеющими функциональный слой, состоящий из поперечно сшитого пиперазинполиамида, изготавливаемыми Filmtec Corporation; или SU-210, SU-220, SU-610 или SU-620, которые являются нанофильтрационными мембранными модулями, изготавливаемыми Toray Industries, Inc., имеющими функциональный слой, состоящий из полиамида, содержащего поперечно сшитый пиперазинполиамид в качестве главного компонента. Нанофильтрационный мембранный элемент еще более предпочтительно является SU-210, SU-220, SU-610 или SU-620, которые являются нанофильтрационными мембранными модулями, изготавливаемыми Toray Industries, Inc., имеющими функциональный слой, состоящий из полиамида, содержащего поперечно сшитый пиперазинполиамид в качестве главного компонента.
В фильтрации через нанофильтрационную мембрану водный полученный из целлюлозы сахарный раствор предпочтительно загружается на нанофильтрационную мембрану при давлении в диапазоне от 0,1 МПа до 8 МПа, хотя предпочтительное давление варьируется в зависимости от концентрации раствора. В случаях, когда давление составляет менее 0,1 МПа, степень пермеации мембраны может быть низкой, тогда как в случаях, когда давление составляет более чем 8 МПа, мембрана может быть повреждена. В случаях, когда давление составляет от 0,5 МПа до 6 МПа, поток мембранной пермеации является высоким, таким что сахарному раствору может быть позволено эффективно отфильтровываться, что является особенно предпочтительным.
С точки зрения материала обратноосмотической мембраны, используемой в настоящем изобретении, примеры мембраны содержат композиционную мембрану, имеющую функциональный слой, состоящий из ацетатцеллюлозного полимера (в дальнейшем в этом документе также называется ацетатцеллюлозная обратноосмотическая мембрана), и композиционную мембрану, имеющую функциональный слой, состоящий из полиамида (в дальнейшем в этом документе также называется полиамидная обратноосмотическая мембрана). В данном документе, примеры ацетатцеллюлозного полимера содержат полимеры, приготовленные со сложными эфирами целлюлозы с органической кислотой, такие как ацетатцеллюлозы, диацетат целлюлозы, триацетат целлюлозы, пропионат целлюлозы и бутират целлюлозы, которые могут быть использованы по отдельности, в виде смеси, или в виде смешанного эфира. Примеры полиамида содержат линейные полимеры и поперечно сшитые полимеры, содержащие алифатические и/или ароматические диаминовые мономеры.
Конкретные примеры обратноосмотической мембраны, используемой в настоящем изобретении, содержат полиамидные обратноосмотические мембранные модули, изготавливаемые Toray Industries, Inc., такие как типы модулей сверхнизкого давления SUL-G10 и SUL-G20, типы модулей низкого давления SU-710, SU-720, SU-720F, SU-710L, SU-720L, SU-720LF, SU-720R, SU-710P, SU-720P, TMG10, TMG20-370 и TMG20-400, а также типы модулей высокого давления SU-810, SU-820, SU-820L и SU-820FA; ацетатцеллюлозные обратноосмотические мембраны, изготавливаемые тем же производителем SC-L100R, SC-L200R, SC-1100, SC-1200, SC-2100, SC-2200, SC-3100, SC-3200, SC-8100 и SC-8200; NTR-759HR, NTR-729HF, NTR-70SWC, ES10-D, ES20-D, ES20-U, ES15-D, ES15-U и LF10-D, изготавливаемые Nitto Denko Corporation; RO98pHt, R099, HR98PP и CE4040C-30D, изготавливаемые Alfa-Laval; GE Sepa AG series и AK series, изготавливаемые GE; BW30-4040, TW30-4040, XLE-4040, LP-4040, LE-4040, SW30-4040 и SW30HRLE-4040, изготавливаемые FilmTec Corporation; TFC-HR и TFC-ULP, изготавливаемые KOCH; и ACM-1, ACM-2 и ACM-4, изготавливаемые TRISEP.
В настоящем изобретении предпочтительно применяется обратноосмотическая мембрана, содержащая полиамидный материал. Причиной этого является то, что в случаях, когда ацетатцеллюлозная мембрана применяется в течение длительного промежутка времени, ферменты, используемые на этапе предварительной обработки, особенно часть целлюлазного компонента, могут проникать через мембрану, вызывая деградацию целлюлозы в качестве мембранного материала.
Примеры формы обратноосмотической мембраны, подходящим образом используемой в настоящем изобретении, содержат плоскую мембрану, спирально-навитую мембрану и половолоконную мембрану.
В обратноосмотической мембране, имеющей полиамидный функциональный слой, предпочтительные примеры компонента карбоновой кислоты и аминового компонента мономеров, составляющих полиамид, являются такими же, как компоненты для нанофильтрационной мембраны, описанной выше, имеющей полиамидный функциональный слой.
В фильтрации через обратноосмотическую мембрану водный полученный из целлюлозы сахарный раствор предпочтительно нагружается на обратноосмотическую мембрану при давлении в диапазоне от 0,5 МПа до 8 МПа, хотя предпочтительное давление варьируется в зависимости от концентрации раствора. В случаях, когда давление составляет менее 0,5 МПа, степень пермеации мембраны может быть низкой, тогда как в случаях, когда давление составляет более чем 8 МПа, мембрана может быть повреждена. В случаях, когда давление фильтрации составляет от 1 МПа до 7 МПа, поток мембранной пермеации является высоким, таким что сахарному раствору может быть позволено эффективно отфильтроваться и вероятность повреждения мембраны является низкой, что является более предпочтительным.
В настоящем изобретении ингибиторы ферментации удаляются из сахарного раствора добавлением водорастворимой анионной макромолекулы в раствор и последующей пермеацией ингибиторов ферментации через нанофильтрационную мембрану и/или обратноосмотическую мембрану. Среди ингибиторов ферментации органическим кислотам, фурановым соединениям, содержащим карбоксильную группу, и фенольным соединениям, содержащим карбоксильную группу, может быть предпочтительно позволено отфильтроваться, и они могут быть удалены. С другой стороны, сахара, содержащиеся в сахарном растворе, являются блокированными или отделенными на загрузочной стороне нанофильтрационной мембраны и/или обратноосмотической мембраны.
Водный полученный из целлюлозы сахарный раствор в настоящем изобретении предпочтительно фильтруется через микрофильтрационную мембрану и/или ультрафильтрационную мембрану перед обработкой с помощью нанофильтрационной мембраны и/или обратноосмотической мембраны. Причиной этого является то, что посредством фильтрации через микрофильтрационную мембрану и/или ультрафильтрационную мембрану, может быть предотвращено загрязнение нанофильтрационной мембраны и/или обратноосмотической мембраны.
Микрофильтрационная мембрана в настоящем изобретении представляет собой мембрану, функциональная поверхность которой имеет средний размер пор не более чем 1 мкм. Микрофильтрационная мембрана более предпочтительно имеет пористую функциональную поверхность. Пористая микрофильтрационная мембрана означает мембрану, функциональная поверхность которой имеет структуру пространственной сети, в которой полости образованы так, чтобы они сообщались друг с другом. Мембрана более предпочтительно является пористой микрофильтрационной мембраной, имеющей средний размер пор не более чем 0,25 мкм.
В качестве среднего размера пор микрофильтрационной мембраны номинальный размер пор, представленный каждым производителем разделительных мембран, может быть применен, или средний размер пор может быть непосредственно измерен. В качестве способа измерения размера пор микрофильтрационной мембраны, может быть применен способ прямого наблюдения. В способе прямого наблюдения сканирующая электронная микроскопия (SEM) применяется для наблюдения поверхностных пор, представленных внутри площади 10 мкм × 9 мкм, и измеряются диаметры пор. Расчетом их среднего значения может быть определен средний размер пор. Дополнительно, в случаях мембран, размер пор которых не может быть определен способом непосредственного наблюдения, таких как нетканый материал или тканый материал, осуществляется определение точки пузырька для определения размера пор. В способе определения точки пузырька, давление воздуха применяется со вторичной стороны мембраны, и измеряется минимальное давление, при котором наблюдается образование пузырька воздуха на мембранной поверхности. В соответствии с выражением отношения между поверхностным натяжением применяемой жидкости и давлением может быть рассчитан средний размер пор. Более конкретно, измерение может быть осуществлено в соответствии с ASTM F316-03 (способ определения точки пузырька) с использованием, например, анализатора распределения по размерам проникающих пор/газовая проницаемость, изготавливаемого Bel Japan, Inc.
Примеры материала микрофильтрационной мембраны, используемой в настоящем изобретении, содержат ряд целлюлоз, ароматический полиамид, поливиниловый спирт, полисульфон, полиэфирсульфон, поливинилиденфторид, полиэтилен, полиакрилонитрил, полипропилен, поликарбонат, политетрафторэтилен, керамику и металлы. Предпочтительными среди этого являются ароматический полиамид, поливиниловый спирт, полисульфон, поливинилиденфторид, полиэтилен, полиакрилонитрил, полипропилен, поликарбонат и политетрафторэтилен, так как на них не воздействуют осахаривающие ферменты, содержащиеся в осахаренной ферментативным путем жидкости, и они обладают превосходной способностью удалять нерастворимый твердый материал.
Ультрафильтрационная мембрана в настоящем изобретении представляет собой мембрану, обычно имеющую ограничение по молекулярной массе от 1000 до 100000, и называется ультрафильтрационная, УФ мембрана или подобным образом для краткости. Так как размер пор ультрафильтрационной мембраны является слишком маленьким, то затруднительно измерить размер пор ее мембранной поверхности под электронным микроскопом. Вследствие этого, значение, называемое ограничение по молекулярной массе, используется в качестве показателя размера пор вместо среднего размера пор. Как описано, например, что "кривая, полученная нанесением молекулярной массы растворенного вещества на ось абсцисс и уровня блокирования на ось ординат, называется кривой ограничения по молекулярной массе. Молекулярная масса, при которой уровень блокирования достигает 90%, называется ограничение по молекулярной массе мембраны." (The Membrane Society of Japan ed., "Membrane Experiment Series, Vol. HI, Artificial Membrane, editorial committee members: Shoji Kimura, Shin-ichi Nakao, Haruhiko Ohya и Tsutomu Nakagawa (1993, Kyoritsu Shuppan Co., Ltd.), p. 92), ограничение по молекулярной массе хорошо известно специалистам в данной области как показатель, отражающий мембранную эффективность ультрафильтрационной мембраны.
В способе получения сахарной жидкости по настоящему изобретению, ультрафильтрационная мембрана, имеющая ограничение по молекулярной массе в диапазоне от 500 до 40000, более предпочтительно используется, так как она позволяет эффективную регенерацию осахаривающего фермента, применяемого для ферментативного осахаривания. Причиной этого является то, что осахаривающий фермент представляет собой смесь множества типов компонентов, и среди осахаривающих ферментов в смеси, ферменты, имеющие меньшие молекулярные массы, имеют молекулярные массы приблизительно 40000. Форма ультрафильтрационной мембраны, которая будет использована, не ограничена, и мембрана может представлять собой любую из спирально-навитой мембраны, половолоконной мембраны, трубчатой мембраны и плоской мембраны. Повторным использованием регенерированного осахаривающего фермента в реакции гидролиза, количество используемого фермента может быть снижено.
Примеры материала ультрафильтрационной мембраны включают, но не ограничены ими, органические материалы, такие как целлюлоза, эфир целлюлозы, полисульфон, сульфированный полисульфон, полиэфирсульфон, сульфированный полиэфирсульфон, хлорированный полиэтилен, полипропилен, полиолефин, поливиниловый спирт, полиметилметакрилат, поливинилиденфторид и политетрафторэтилен; металлы, такие как нержавеющая сталь; и неорганические материалы, такие как керамика. Материал ультрафильтрационной мембраны может быть соответствующим образом выбран с точки зрения свойств гидролизата и производственных затрат, и предпочтительно представляет собой органический материал, более предпочтительно хлорированный полиэтилен, полипропилен, поливинилиденфторид, полисульфон или полиэфирсульфон. Конкретные примеры материала содержат Type G-5, Type G-10, Type G-20, Type G-50, Type PW и Type HWS UF, изготавливаемые DESAL; HFM-180, HFM-183, HFM-251, HFM-300, HFM-116, HFM-183, HFM-300, HFK-131, HFK-328, MPT-U20, MPS-U20P и MPS-U20S, изготавливаемые KOCH; SPE1, SPE3, SPE5, SPE10, SPE30, SPV5, SPV50 и SOW30, изготавливаемые Synder; продукты Microza (зарегистрированная торговая марка) UF series, изготавливаемые Asahi Kasei Corporation, имеющие ограничение молекулярной массы от 3000 до 100000; и NTR7410, изготавливаемый Nitto Denko Corporation.
Фильтрация через микрофильтрационную мембрану и/или ультрафильтрационную мембрану в настоящем изобретении может являться поперечноточной фильтрацией или тупиковой фильтрацией. С точки зрения потребления энергии насосом тупиковая фильтрация является предпочтительной. Однако жидкость с плохой фильтруемостью предпочтительно подвергается поперечноточной фильтрации. Дополнительно, процесс, такой как обратная промывка или аэрирование, предпочтительно осуществляется во время фильтрации. Причиной этого является то, что посредством этого снижается загрязнение мембраны. После фильтрации через микрофильтрационную мембрану полученный пермеат пропускается через ультрафильтрационную мембрану для удаления осахаривающего фермента в виде фракции непермеата, и фракция пермеата подвергается процессу фильтрации через нанофильтрационную мембрану и/или обратноосмотическую мембрану. В данном документе с экономической точки зрения удаленный осахаривающий фермент может быть повторно использован в процессе ферментативного осахаривания.
Перед фильтрацией через микрофильтрационную мембрану и/или ультрафильтрационную мембрану может быть осуществлена обработка для разделения твердая фаза-жидкость в качестве предварительной обработки для уменьшения загрязнения вещества. Способ разделения твердая фаза-жидкость не ограничен. В соответствии с "Food Engineering Basic Course, Solid-liquid Separation" (Korin Publishing Co., Ltd.), конкретные примеры способа разделения твердая фаза-жидкость содержат способ центрифугирования, способ компрессионного разделения, способ фильтрации, способ флотационного разделения и способ разделения осаждением. Примеры способа центрифугирования содержат способы с использованием горизонтальной центрифуги непрерывного действия (обработка шнековым декантатором), дисковой центрифуги (обработка De Laval), фильтрующей центрифуги или ультрацентрифуги Sharpies; примеры способа фильтрации содержат способы с использованием ленточного фильтра, ленточного пресса, винтового пресса, намывного фильтра или фильтр-пресса; примеры способа флотационного разделения содержат способы с использованием аппарата для непрерывного флотационного разделения; и примеры способа разделения осаждением содержат способы с использованием аппарата для агрегированного осаждения или аппарата для быстрого осаждения; но способ не ограничен любым из этого. Однако любое из этого, или комбинация двух или более из этого, допускает сокращение загрузки на мембрану во время обработки с помощью микрофильтрационной мембраны и/или ультрафильтрационной мембраны.
После удаления ингибиторов ферментации вышеописанным способом и концентрации с использованием нанофильтрационной мембраны и/или обратноосмотической мембраны сахарная жидкость предпочтительно дополнительно фильтруется через ультрафильтрационную мембрану, имеющую ограничение по молекулярной массе от 500 до 2000. В случаях, когда анионный полимер по настоящему изобретению представляет собой вещество, которое ухудшает осуществление ферментации, ультрафильтрационная мембрана может быть использована для получения сахарной жидкости в виде фильтрата, в котором был удален или снижено содержание анионного полимера. Это может увеличивать эффективность ферментации на более позднем этапе. Дополнительно, анионный полимер, регенерированный из загрузочной стороны ультрафильтрационной мембраны, может быть повторно использован для снижения количества с использованного анионного полимера.
Выполнением ферментационного культивирования микроорганизма, имеющего способность вырабатывать химический продукт с использованием в качестве ферментационного сырья очищенной сахарной жидкости, полученной посредством настоящего изобретения, может быть выработан химический продукт. Очищенная сахарная жидкость полученная по настоящему изобретению содержит, в качестве главного(ых) компонента(ов), глюкозу и/или ксилозу, которые являются источниками углерода для роста микроорганизмов или культивируемых клеток. С другой стороны, содержания ингибиторов ферментации, таких как фурановые соединения, органические кислоты и ароматические соединения, являются очень низкими. Вследствие этого, очищенная сахарная жидкость может быть эффективно использована в качестве ферментационного сырья, особенно в качестве источника углерода.
В настоящем изобретении примеры микроорганизма или культивируемых клеток, применяемых в способе получения химического продукта, содержат дрожжи, такие как пекарские дрожжи; бактерии, такие как E. coli и коринеформные бактерии; нитчатые грибы; актиномицеты; клетки животных и клетки насекомых; которые широко используются в ферментационной отрасли промышленности. Микроорганизм или культивируемые клетки, которые будут использованы, могут быть выделены из естественной среды, или могут быть приготовлены частичной модификацией свойств микроорганизма или клеток мутацией или рекомбинацией генов. В частности, так как сахарная жидкость, полученная из содержащей целлюлозу биомассы, содержит пентозы, такие как ксилоза, может быть предпочтительно применен микроорганизм, имеющий улучшенные метаболические пути превращения пентозы.
В настоящем изобретении среда, применяемая в способе получения химического продукта, предпочтительно является жидкой средой, содержащей в дополнение к очищенной сахарной жидкости, источники азота, неорганические соли, и, если требуется, органические микронутриенты, такие как аминокислоты и витамины. Очищенная сахарная жидкость по настоящему изобретению содержит в качестве источников углерода моносахариды, которые могут быть использованы микроорганизмами, такие как глюкоза и ксилоза, а, в некоторых случаях, сахара, такие как глюкоза, сахароза, фруктоза, галактоза и лактоза; осахаренные крахмальные жидкости, содержащие такие сахара; меласса из сладкого картофеля; меласса из сахарной свеклы; высокосахаристая меласса; органические кислоты, такие как уксусная кислота; спирты, такие как этанол; глицерин; и им подобное могут быть дополнительно добавлены к ним в качестве источников углерода, для обеспечения ферментационного сырья. Примеры источников азота, которые могут быть использованы, содержат аммиачный газ, водный аммиак, соли аммония, мочевину и соли азотной кислоты; и другие органические источники азота, используемые дополнительно, такие как жмых, соевые гидролизованные жидкости, казеиновые перевары, другие аминокислоты, витамины, жидкие кукурузные экстракты, дрожжи или дрожжевые экстракты, мясные экстракты, пептиды, такие как пептоны, и клетки различных ферментационных микроорганизмов и их гидролизаты. Примеры неорганических солей, которые могут быть добавлены подходящим образом, содержат соли ортофосфорной кислоты, соли магния, соли кальция, соли железа и соли марганца.
В случаях, когда для микроорганизма, используемого в настоящем изобретении, требуется особый нутриент для его роста, нутриент может быть добавлен в виде состава или в виде натурального продукта, содержащего его. Также может быть добавлен, если требуется, агент против формирования.
Микроорганизм обычно культивируется при pH в диапазоне от 4 до 8, при температуре в диапазоне от 20 до 40°C. pH культуральной среды доведено предварительно неорганической или органической кислотой, основным веществом, мочевиной, карбонатом кальция, аммиачным газом или им подобным до заранее определенного pH в диапазоне, обычно, от 4 до 8. В случаях, когда необходимо, чтобы интенсивность питания кислородом была увеличена, это может быть достигнуто применением, например, способа, в котором концентрация кислорода поддерживается при не менее 21% добавлением кислорода в воздух, способа, в котором культивирование осуществляется под давлением, способа, в котором скорость перемешивания увеличена, или способа, в котором объем вентиляции увеличен.
В качестве способа получения химического продукта с использованием в качестве ферментационного сырья очищенной сахарной жидкости, полученной способом по настоящему изобретению, для получения сахарной жидкости, могут быть применены способы ферментационного культивирования, известные специалистам в данной области, и, с точки зрения продуктивности предпочтительно применяется способ непрерывного культивирования, раскрытый в WO2007/097260.
В настоящем изобретении химический продукт, вырабатываемый способом получения химического продукта, не ограничен, при условии, что он представляет собой вещество, вырабатываемое в культуральной жидкости вышеуказанным микроорганизмом или клетками. Конкретные примеры химического продукта, вырабатываемого в настоящем изобретении, содержат спирты, органические кислоты, аминокислоты и нуклеиновые кислоты, которые являются веществами массового получения ферментационной промышленности. Примеры спиртов содержат этанол, 1,3-пропандиол, 1,4-пропандиол и глицерин; примеры органических кислот содержат уксусную кислоту, молочную кислоту, пировиноградную кислоту, янтарную кислоту, яблочную кислоту, итаконовую кислоту и лимонную кислоту; примеры нуклеиновых кислот содержат нуклеозиды, такие как инозин и гуанозин, и нуклеотиды, такие как инозиновая кислота и гуаниловая кислота; и соединения диамина, такие как кадаверин. Дополнительно, настоящее изобретение также может быть применено для выработки веществ, таких как ферменты, антибиотики и рекомбинантные белки. Фиг. 1 и 2 представляют собой схематические изображения главных вариантов способа получения сахарной жидкости по настоящему изобретению. Такие варианты содержат: емкость для ферментативного осахаривания для гидролиза предварительно обработанного продукта содержащей целлюлозу биомассы осахаривающим ферментом для получения ферментативным путем осахаренной жидкости; секцию для разделения твердая фаза-жидкость для удаления недеградированных остатков; секцию для добавления анионного полимера; секцию для удаления загрязняющих веществ из сахарной жидкости, в которой загрязняющие вещества и ферменты удаляются фильтрацией через микрофильтрационную мембрану и/или ультрафильтрационную мембрану; и секцию очистки сахарной жидкости, в которой сахарная жидкость фильтруется через нанофильтрационную мембрану и/или обратноосмотическую мембрану для концентрации/очистки сахарной жидкости, для получения очищенной сахарной жидкости в виде фракции мембранного непермеата.
ПРИМЕРЫ
Способ по настоящему изобретению для получения сахарной жидкости описан ниже более подробно посредством примеров. Однако настоящее изобретение не ограничено такими примерами.
(1) Способ измерения средних молекулярных масс анионного полимера, поликарбоновой кислоты и полисульфоновой кислоты
Посредством гель-фильтрацинной хроматографии (ГФХ) молекулярную массу измеряли в следующих условиях. Каждый образец готовили так, чтобы его концентрация составляла 0,1% по массе, и пропускали через 0,45-мкм фильтр перед измерением.
Колонка: Asahipak GF-7M (изготавливаемая Shodex)
Подвижная фаза: 50 мМ гидрофосфат натрия (скорость потока: 0,6 мл/мин.)
Реакционная жидкость: Нет
Способ обнаружения: RI (показатель дифференциальной рефракции)
Температура: 40°C
(2) Способ измерения средних молекулярных масс анионного полимера и полифосфатного полимера
Посредством гель-фильтрационной хроматографии (ГФХ), молекулярную массу измеряли в следующих условиях. Каждый образец готовили так, чтобы его концентрация составляла 0,1% по массе, и пропускали через 0,45-мкм фильтр перед измерением.
Колонка: Asahipak GS-220HQ (изготавливаемая Shodex); две колонки располагали линейно
Подвижная фаза: 50 мМ хлорид натрия (скорость потока: 0,6 мл/мин.)
Реакционная жидкость: нет
Способ обнаружения: RI (показатель дифференциальной рефракции)
Температура: 60°C
(3) Способ измерения pH
С использованием портативного pH-метра "D-50" изготавливаемого Horiba, Ltd. измеряли pH водного полученного из целлюлозы сахарного раствора. После перемешивания для измерения, 500-мл аликвоты собирали в мензурки, и осуществляли измерение 3 раза. Среднее измеренных значений использовалось в качестве значения pH.
(Справочный пример 1) Способ измерения концентраций моносахарида
Концентрации моносахаридов (концентрация глюкозы и концентрация ксилозы), содержащихся в сахарной жидкости, полученной в каждом из примеров и сравнительных примеров, анализировали посредством ВЭЖХ при следующих условиях, и определяли их количество на основании сравнения со стандартными образцами.
Колонка: Luna NH2 (изготавливаемая Phenomenex, Inc.)
Подвижная фаза: вода высшей степени очистки:ацетонитрил = 25:75 (скорость потока, 0,6 мл/мин.)
Реакционная жидкость: Нет
Способ обнаружения: RI (показатель дифференциальной рефракции)
Температура: 30°C
(Справочный пример 2) Способ измерения концентраций ингибиторов ферментации
Ингибиторы ферментации на основе фурана (ГМФ и фурфурол) и ингибиторы ферментации на основе фенола (ванилин, ацетованилин, сиреневая кислота, левулиновая кислота и 4-гидроксибензойная кислота), содержащиеся в сахарной жидкости, анализировали с помощью ВЭЖХ при следующих условиях, и определяли их количество на основании сравнения со стандартными образцами.
Колонка: Synergi HidroRP 4,6 мм*250 м (изготавливаемая Phenomenex, Inc.)
Подвижная фаза: ацетонитрил - 0,1 мас.% H3PO4 (скорость потока, 1,0 мл/мин.)
Способ обнаружения: УФ (283 нм)
Температура: 40°C
Среди ингибиторов ферментации, содержащихся в сахарной жидкости, органические кислоты (уксусная кислота и муравьиная кислота) анализировали ВЭЖХ при следующих условиях, и выражали количественно на основании сравнения со стандартными образцами.
Колонка: Shim-Pack SPR-H и Shim-Pack SCR101H (изготавливаемые Shimadzu Corporation), которые располагали линейно
Подвижная фаза: 5 мМ п-толуолсульфоновая кислота (скорость потока, 0,8 мл/мин.)
Реакционная жидкость: 5 мМ п-толуолсульфоновая кислота, 20 мМ Бис-трис, 0,1 мМ ЭДТА-2Na (скорость потока, 0,8 мл/мин.)
Способ обнаружения: Электрическая проводимость
Температура: 45°C
(Справочный пример 3) Этап гидролиза содержащей целлюлозу биомассы обработкой разбавленной серной кислотой/ферментом
Процесс гидролиза содержащей целлюлозу биомассы на этапе (1) описан ниже посредством примера, в котором от 0,1 до 15% по массе разбавленной серной кислоты и фермента использовали для гидролиза содержащей целлюлозу биомассы. В качестве содержащей целлюлозу биомассы использовали стебли риса, которые размельчали на куски по 2 мм. Содержащую целлюлозу биомассу вымачивали в 1% водном растворе серной кислоты, и подвергали обработке с использованием автоклава (изготавливаемого Nine Koatsu Co., Ltd.) при 150°C в течение 30 минут. После этого, осуществляли разделение твердая фаза-жидкость для отделения обработанной серной кислотой целлюлозы от водного раствора серной кислоты. Затем, обработанную серной кислотой целлюлозу смешивали с жидкостью для обработки разбавленной серной кислотой с перемешиванием так, чтобы концентрация твердого материала составляла 10% по массе, и pH доводили до приблизительно 5 гидроксидом натрия. К этой смеси, добавляли Accellerase 1500 и XY (Genencor Kyowa), для выполнения реакции гидролиза с перемешиванием при 50°C в течение 1 дня. После этого, осуществляли разделение твердая фаза-жидкость с использованием фильтр-пресса (изготавливаемого Yabuta Industries Co., Ltd., MO-4) для отделения и удаления недеградированной целлюлозы или лигнина, для получения водного раствора, содержащего сахара, (в дальнейшем в этом документе называемого обработанная разбавленной серной кислотой осахаренная жидкость). Мутность обработанной разбавленной серной кислотой осахаренной ферментативным путем жидкости составляла 70 NTU. Композиции ингибиторов ферментации и моносахаридов, содержащихся в разбавленной обработанной серной кислотой осахаренной ферментативным путем жидкости, были такими, как показано в таблицах 1-3.
(Справочный пример 4) Этап гидролиза содержащей целлюлозу биомассы посредством гидротермической обработки и обработки ферментом
Процесс гидролиза содержащей целлюлозу биомассы на этапе (1) описан ниже посредством примера, в котором докритическую воду и фермент использовали для гидролиза содержащей целлюлозу биомассы. В качестве содержащей целлюлозу биомассы, использовали стебли риса, которые размельчали на куски по 2-мм. Содержащую целлюлозу биомассу размачивали в воде, и подвергали обработке с использованием автоклава (изготавливаемого Nitto Koatsu Co., Ltd.) при 180°C в течение 5 минут с перемешиванием. Давление в это время составляло 10 МПа. После этого, осуществляли разделение твердая фаза-жидкость обработанного компонента биомассы центрифугированием (3000 G). К полученному в результате компоненту раствора добавляли Accellerase DUET (Genencor Kyowa), и реакции позволяли протекать при 50°C в течение 24 часов, для получения сахарной жидкости, полученной из компонента раствора (в дальнейшем в этом документе называемой гидротермически обработанная жидкость). После этого измеряли содержание воды в обработанном компоненте биомассы, и RO воду добавляли к сахарной жидкости так, чтобы концентрация твердого материала составляла 10% по массе, исходя из полного высушивания обработанной биомассы, за этим следовало добавление туда Accellerase 1500 и XY (Genencor Kyowa) в качестве целлюлаз для осуществления реакции гидролиза с перемешиванием при 50°C в течение 1 дня. После этого, полученную в результате жидкость обрабатывали с использованием фильтр-пресса (изготавливаемого Yabuta Industries Co., Ltd., MO-4) для отделения и удаления недеградированной целлюлозы или лигнина, для получения сахарной жидкости, полученной из обработанной биомассы (в дальнейшем в этом документе называемой гидротермически обработанная осахаренная жидкость). Мутность гидротермически обработанной осахаренной жидкости составляла 10 NTU. Мутность гидротермически обработанной жидкости составляла 800 NTU. Композиции ингибиторов ферментации и моносахаридов, содержащихся в гидротермически обработанной жидкости и гидротермически обработанной осахаренной ферментативным путем жидкости, были такими, как показано в таблицах 4-6.
осахаренная
жидкость
осахаренная
жидкость
жидкость
(Справочный пример 5) Этап аммиачной обработки содержащей целлюлозу биомассы с последующим ферментативным гидролизом
Процесс гидролиза содержащей целлюлозу биомассы на этапе (1) описан ниже посредством примера, в котором от 5,0 до 100% по массе водного аммиака и фермента использовали для гидролиза содержащей целлюлозу биомассы. В качестве содержащей целлюлозу биомассы использовали стебли риса, которые размельчали на 2-мм куски. Содержащую целлюлозу биомассу вводили в компактный реактор (изготавливаемый Taiatsu Techno Corporation, TVS-N2 30 мл), и охлаждали жидким азотом. В этот реактор впускали аммиачный газ, и образец полностью вымачивали в жидком аммиаке. Крышку реактора закрывали, и реактор оставляли при комнатной температуре в течение приблизительно 15 минут. Затем, реактор обрабатывали в масляной бане при 150°C в течение 30 минут. После этого, реактор удаляли из масляной бани, и аммиачный газ вытекал в вытяжном шкафу, за чем следовало вакуумирование внутри реактора до 10 Па вакуумным насосом, тем самым высушивая содержащую целлюлозу биомассу. Обработанную содержащую целлюлозу биомассу смешивали с чистой водой с перемешиванием так, чтобы концентрация твердого материала составляла 15% по массе, и pH доводили до приблизительно 5 серной кислотой. К этой смеси добавляли Accellerase 1500 и XY (Genencor Kyowa), для выполнения реакции гидролиза с перемешиванием при 50°C в течение 1 дня. После этого, осуществляли обработку фильтр-прессом для отделения и удаления недеградированной целлюлозы и лигнина, для получения водного раствора, содержащего сахара (в дальнейшем в этом документе называемого обработанная аммиаком осахаренная жидкость). Мутность обработанной аммиаком сахарной жидкости составляла 25 NTU. Композиции ингибиторов ферментации и моносахариды, содержащиеся в обработанной аммиаком осахаренной ферментативным путем жидкости, были такими, как показано в таблицах 7-9.
(Пример 1) Добавление анионного полимера
Обработанную разбавленной серной кислотой осахаренную жидкость, полученную в справочном примере 3, фильтровали через микрофильтрационную мембрану (Stericup, изготавливаемую Millipore, размер пор 0,22 мкм). Полученный фильтрат разделяли аликвоты на 500-мл, и добавляли к ним в качестве анионного полимера 5 мг/л триполифосфата натрия (средняя молекулярная масса: 368, изготавливаемый Kanto Chemical Co., Ltd.), который является неорганическим полифосфатом, или полиакрилата натрия (средняя молекулярная масса: 2000 по ГФХ, изготавливаемый Sigma Aldrich), который является поликарбоксилатом. Каждую жидкость, полученную добавлением полимера, подвергали исследованию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics), который может быть использован в качестве компактного детектора фильтрации для спирально-навитого модуля. В качестве мембраны использовали нанофильтрационную мембрану GE SEPA-DK series (изготавливаемую GE Osmonics) или ОО мембрану сверхнизкого давления UTC70U. Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационного потока 0,2 м/D. Результаты показаны в таблице 10 (для случаев, когда использована нанофильтрационная мембрана) и таблице 11 (для случаев, когда использована ОО мембрана для сверхнизкого давления). В этих таблицах степени пермеации (%) глюкозы, муравьиной кислоты, уксусной кислоты, фурфурола и феруловой кислоты являются значениями, рассчитанными непосредственным измерением их концентраций на стороне пермеата и делением измеренных значений на концентрации, показанные в вышеприведенных справочных примерах, с последующим умножением полученных значений на 100. Измерение осуществляли при постоянной температуре 25°C после подтверждения того, что изменение pH из-за добавления полимера составляло менее 0,05. В результате обнаружили, что добавление триполифосфата натрия или полиакрилата натрия в качестве водного анионного полимерного раствора повышает степени пермеации муравьиной кислоты, уксусной кислоты и феруловой кислоты, по сравнению с далее описанными в сравнительном примере 1, в котором не добавляли такие полимеры.
(Сравнительный Пример 1) Отсутствие добавления полимера или добавление катионного полимера
Фильтрат, полученный посредством обработки с помощью микрофильтрационной мембраны в примере 1, разделяли на 500-мл аликвоты, и не добавляли к ним полимер, или добавляли к ним 5 мг/л полиэтиленимина (средняя молекулярная масса приблизительно 600; изготавливаемый Wako Pure Chemical Industries, Ltd.) в качестве катионного полимера. Каждую жидкость, полученную добавлением или без добавления полимера, подвергали испытанию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics), который может быть использован в качестве компактного детектора фильтрации для спирально-навитого модуля. В качестве мембраны использовали нанофильтрационную мембрану GE SEPA-DK series (изготавливаемую GE Osmonics) или ОО мембрану сверхнизкого давления UTC70U (изготавливаемую Toray Industries, Inc.). Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационном потоке 0,5 м/D. Результаты показаны в таблице 12 и таблице 13. В этих таблицах степени пермеации (%) глюкозы, муравьиной кислоты, уксусной кислоты, фурфурола и кумаровой кислоты являются значениями, рассчитанными непосредственным измерением их концентраций на стороне пермеата и делением измеренных значений на концентрации, показанные в вышеприведенных справочных примерах, с последующим умножением полученных значений на 100. Измерение осуществляли при постоянной температуре 25°C после подтверждения того, что изменение pH из-за добавления полимера составляло менее 0,05. В результате обнаружили, что в случаях без добавления полимера были продемонстрированы более низкие степени пермеации муравьиной кислоты, уксусной кислоты и феруловой кислоты, чем в случаях примера 1, в котором добавляли анионный полимер, и что в случаях, в которых добавляли катионный полимер полиэтиленимин, были продемонстрированы даже более низкие степени пермеации муравьиной кислоты, уксусной кислоты и феруловой кислоты, чем в случаях без добавления полимера.
(Пример 2)
Каждую из гидротермически обработанных жидкостей и гидротермически обработанную осахаренную жидкость, полученную в справочном примере 4, фильтровали через микрофильтрационную мембрану (Stericup, изготавливаемую Millipore, размер пор 0,22 мкм). Так как переработка гидротермически обработанной жидкости микрофильтрационной мембраной в большом масштабе являлась затруднительной, то ее фильтрационную обработку осуществляли с промывкой поверхности мембраны после фильтрации каждых 100 мл. Полученный фильтрат разделяли на 500-мл аликвоты, и, подобно примеру 1 добавляли к ним 5 мг/л триполифосфата натрия или полиакрилата натрия. Подобно примеру 1, каждую жидкость, полученную добавлением полимера, подвергали испытанию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics). В качестве мембраны использовали нанофильтрационную мембрану GE SEPA-DK series (изготавливаемую GE Osmonics). Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационном потоке 0,2 м/D. Результаты показаны в таблице 14 (для результатов фильтрации гидротермически обработанной жидкости) и таблице 15 (для результатов фильтрации гидротермически обработанной осахаренной жидкости). В этих таблицах степень пермеации (%) глюкозы составляет значение, рассчитанное непосредственным измерением ее концентрации на стороне пермеата и делением измеренного значения на концентрацию, показанную в вышеприведенных справочных примерах, с последующим умножением полученного значения на 100. Измерение осуществляли при постоянной температуре 25°C после подтверждения того, что изменение pH из-за добавления полимера составляло менее 0,05. В результате обнаружили, что добавление исключительно триполифосфата натрия в качестве водного анионного полимерного раствора к сахарной жидкости перед обработкой с помощью нанофильтрационной мембраны повышает степени пермеации муравьиной кислоты, уксусной кислоты и феруловой кислоты по сравнению со сравнительным примером 2, в котором полимер не добавляли. Дополнительно, полиакрилат натрия также являлся эффективным для улучшения таких степеней пермеации, хотя эффект был меньше, чем у триполифосфата натрия.
(Сравнительный пример 2)
Каждый фильтрат, полученный обработкой с помощью микрофильтрационной мембраны в примере 2, разделяли на 500-мл аликвоты, и не добавляли к ним полимер, или добавляли к ним 5 мг/л полиэтиленимина в качестве катионного полимера. Каждую жидкость, полученную добавлением или без добавления полимера, подвергали испытанию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics), который может быть использован в качестве компактного детектора фильтрации для спирально-навитого модуля. В качестве мембраны использовали нанофильтрационную мембрану GE SEPA-DK series (изготавливаемую GE Osmonics) или ОО мембрану сверхнизкого давления UTC70U (изготавливаемую Toray Industries, Inc.). Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационного потока 0,5 м/D. Результаты показаны в таблице 16 и таблице 17. В этих таблицах степени пермеации (%) глюкозы, муравьиной кислоты, уксусной кислоты, фурфурола и кумаровой кислоты являются значениями, рассчитанными непосредственным измерением их концентраций на стороне пермеата и делением измеренных значений на концентрации, показанные в вышеприведенных справочных примерах, с последующим умножением полученных значений на 100. Измерение осуществляли при постоянной температуре 25°C после подтверждения того, что изменение pH из-за добавления полимера составляло менее 0,05. В результате обнаружили, что степени пермеации муравьиной кислоты, уксусной кислоты и феруловой кислоты были хуже, чем в примере 2, в котором анионный полимер добавляли перед фильтрацией с помощью нанофильтрационной мембраны. Дополнительно, обнаружили, что добавление катионного полимера полиэтиленимина не является эффективным или приводит к низкой степени пермеации любых веществ.
5 мг/л
(Пример 3)
Каждую обработанную аммиаком осахаренную жидкость, полученную в справочном примере 5, фильтровали через микрофильтрационную мембрану (Stericup, изготавливаемую Millipore; размер пор 0,22 мкм). Полученный фильтрат разделяли на 500-мл аликвоты, и добавляли к ним в качестве анионного полимера 5 мг/л или 50 мг/л триполифосфата натрия, который является неорганическим фосфатным полимером, или полиакрилата натрия, который является поликарбоксилатным полимером. Каждую жидкость, полученную добавлением полимера, подвергали испытанию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics), который может быть использован в качестве компактного детектора фильтрации для спирально-навитого модуля. В качестве мембраны использовали ОО мембрану сверхнизкого давления UTC70U. Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационного потока 0,2 м/D. Результаты показаны в таблице 18. В этой таблице степени пермеации (%) глюкозы, муравьиной кислоты, уксусной кислоты, фурфурола и феруловой кислоты являются значениями, рассчитанными непосредственным измерением их концентраций на стороне пермеата и делением измеренных значений на концентрации, показанные в вышеприведенных справочных примерах, с последующим умножением полученных значений на 100. Измерение осуществляли при постоянной температуре 25°C после подтверждения того, что изменение pH из-за добавления полимера составляло менее 0,05. В результате обнаружили, что добавление триполифосфата натрия или полиакрилата натрия в качестве водного анионного полимерного раствора к сахарной жидкости перед обработкой с помощью обратноосмотической мембраны повышает степени пермеации муравьиной кислоты, уксусной кислоты и феруловой кислоты по сравнению со сравнительным примером 3, в котором такие полимеры не добавляли.
5 мг/л
5 мг/л
50 мг/л
(Сравнительный Пример 3)
Фильтрат, полученный обработкой с помощью микрофильтрационной мембраны в примере 3, разделяли на 500-мл аликвоты, и не добавляли к ним полимер или добавляли к ним 5 мг/л или не более 50 мг/л полиэтиленимина в качестве катионного полимера. Каждую жидкость, полученную добавлением или без добавления полимера, подвергали испытанию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics), который может быть использован в качестве компактного детектора фильтрации для спирально-навитого модуля. В качестве мембраны использовали нанофильтрационную мембрану GE SEPA-DK series (изготавливаемую GE Osmonics) или ОО мембрану сверхнизкого давления UTC70U (изготавливаемую Toray Industries, Inc.). Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационного потока 0,5 м/D. Результаты показаны в таблице 19. В этой таблице, степени пермеации (%) глюкозы, муравьиной кислоты, уксусной кислоты, фурфурола и кумаровой кислоты являются значениями, рассчитанными непосредственным измерением их концентраций на стороне пермеата и делением измеренных значений на концентрации, показанные в вышеприведенных справочных примерах, с последующим умножением полученных значений на 100. Измерение осуществляли при постоянной температуре 25°C после подтверждения того, что изменение pH из-за добавления полимера составляло менее 0,05. В результате обнаружили, что степени пермеации муравьиной кислоты, уксусной кислоты и феруловой кислоты были хуже, чем в примере 3, в котором анионный полимер добавляли перед фильтрацией с помощью нанофильтрационной мембраны. Дополнительно, обнаружили, что добавление катионного полимера полиэтиленимина не является эффективным или приводит к низкой степени пермеации любого из веществ.
5 мг/л
50 мг/л
(Пример 4)
Обработанную аммиаком осахаренную жидкость, полученную в справочном примере 5, фильтровали через микрофильтрационную мембрану (Stericup, изготавливаемую Millipore; размер пор 0,22 мкм). Полученный фильтрат разделяли на 500-мл аликвоты, и, подобно примеру 1, добавляли к ним 0,05 г/л или 500 мг/л триполифосфата натрия или полиакрилата натрия в качестве анионного полимера. Каждую жидкость, полученную добавлением полимера, подвергали испытанию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics), который может быть использован в качестве компактного детектора фильтрации для спирально-навитого модуля. В качестве мембраны использовали ОО мембрану сверхнизкого давления UTC70U. Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационного потока 0,2 м/D. Результаты показаны в таблице 18. В этой таблице степени пермеации (%) глюкозы, муравьиной кислоты, уксусной кислоты, фурфурола и феруловой кислоты являются значениями, рассчитанными непосредственным измерением их концентраций на стороне пермеата и делением измеренных значений на концентрации, показанные в вышеприведенных справочных примерах, с последующим умножением полученных значений на 100. Измерение осуществляли при постоянной температуре 25°C после подтверждения того, что изменение pH из-за добавления полимера составляло менее 0,05. В результате обнаружили, что добавление 0,05 мг/л или 500 мг/л триполифосфата натрия или полиакрилата натрия в качестве водного анионного полимерного раствора к сахарной жидкости перед обработкой с помощью обратноосмотической мембраны повышает степени пермеации муравьиной кислоты, уксусной кислоты и феруловой кислоты по сравнению со сравнительным примером 3, в котором такие полимеры не добавляли, хотя эффекты были меньше, чем в примере 3, в котором концентрация составляла от 0,05 мг/л или 500 мг/л.
500 мг/л
(Пример 5)
Обработанную аммиаком осахаренную жидкость, полученную в справочном примере 5, фильтровали через микрофильтрационную мембрану (Stericup, изготавливаемую Millipore; размер пор 0,22 мкм). Полученный фильтрат разделяли на 500-мл аликвоты, и, подобно примеру 1, добавляли к ним 0,005 мг/л или 5 г/л триполифосфата натрия или полиакрилата натрия в качестве анионного полимера. Каждую жидкость, полученную добавлением полимера, подвергали испытанию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics), который может быть использован в качестве компактного детектора фильтрации для спирально-навитого модуля. В качестве мембраны использовали ОО мембрану сверхнизкого давления UTC70U. Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационного потока 0,2 м/D. Результаты показаны в таблице 18. В этой таблице степени пермеации (%) глюкозы, муравьиной кислоты, уксусной кислоты, фурфурола и феруловой кислоты являются значениями, рассчитанными непосредственным измерением их концентраций на стороне пермеата и делением измеренных значений на концентрации, показанные в вышеприведенных справочных примерах с последующим умножением полученных значений на 100. Измерение осуществляли при постоянной температуре 25°C после подтверждения того, что изменение pH из-за добавления полимера составляло менее 0,05. В результате добавление 0,005 г/л триполифосфата натрия или полиакрилата натрия в качестве водного анионного полимерного раствора к сахарной жидкости перед обработкой с помощью обратноосмотической мембраны являлось эффективным для проницаемости в той же степени, хотя эффект был меньше, чем в примере 3. С другой стороны, их добавление в концентрации 5 г/л являлось эффективным, но не наблюдалось улучшения эффекта по сравнению с добавлением 500 мг/л или менее в примере 4.
5 г/л
5 г/л
(Пример 6)
Таким же образом, как в примере 2, каждую из гидротермически обработанных жидкостей и гидротермически обработанную осахаренную жидкость, полученную в справочном примере 4, фильтровали через микрофильтрационную мембрану (Stericup, изготавливаемую Millipore, размер пор 0,22 мкм). Полученный фильтрат разделяли на 500-мл аликвоты, и добавляли к ним 5 мг/л гексаметафосфата натрия (средняя молекулярная масса, 612; изготавливаемого Sigma Aldrich), полисополимера акриловой кислоты и малеиновой кислоты (средняя молекулярная масса, 3000; изготавливаемого Sigma Aldrich) или полиакрилата натрия (средняя молекулярная масса, 8000, изготавливаемого Sigma Aldrich) в качестве фосфатного полимера. Каждую жидкость, полученную добавлением полимера, подвергали испытанию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics) таким же образом, как в примере 1. В качестве мембраны использовали нанофильтрационную мембрану GE SEPA-DK series (изготавливаемую GE Osmonics). Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационного потока 0,2 м/D. Результаты показаны в таблице 22 (результаты фильтрации гидротермически обработанной жидкости) и таблице 23 (результаты фильтрации гидротермически обработанной осахаренной жидкости). В этих таблицах степень пермеации (%) глюкозы представляет собой значение, рассчитанное непосредственным измерением ее концентрации на стороне пермеата и делением измеренного значения на концентрацию, показанную в вышеприведенных справочных примерах, с последующим умножением полученных значений на 100. Измерение осуществляли при постоянной температуре 25°C после подтверждения того, что изменение pH из-за добавления полимера составляло менее 0,05. В результате обнаружили, что добавление гексаметафосфата натрия, полисополимера акриловой кислоты и малеиновой кислоты или полиакрилата натрия в качестве водного анионного полимерного раствора к сахарной жидкости перед обработкой с помощью нанофильтрационной мембраны повышает степени пермеации муравьиной кислоты, уксусной кислоты и кумаровой кислоты по сравнению со сравнительным примером 2, в котором обработку с помощью нанофильтрационной мембраны осуществляли без добавления какого-либо полимера.
(средняя молекулярная масса 8000)
(средняя молекулярная масса 8000)
(Пример 7) Добавление одновременно полиакрилата и полифосфата натрия
Гидротермически обработанную жидкость, полученную в справочном примере 4, фильтровали через микрофильтрационную мембрану (Stericup, изготавливаемую Millipore, размер пор 0,22 мкм), при этом поверхность мембраны промывали после фильтрации каждых 100 мл, для выполнения фильтрационной обработки. К полученному фильтрату добавляли триполифосфат натрия (средняя молекулярная масса 368) (изготавливаемый Rin Kagaku Kogyo Co., Ltd.) и полиакрилат натрия (средняя молекулярная масса 2000) (изготавливаемый Wako Pure Chemical Industries, Ltd.) так, чтобы содержалось 5 мг/л каждого из них. Жидкость, полученную добавлением полимеров, подвергали испытанию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics) таким же образом, как в примере 1. В качестве мембраны использовали нанофильтрационную мембрану GE SEPA-DK series (изготавливаемую GE Osmonics). Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационного потока 0,2 м/D. Результаты показаны в таблице 24. В этой таблице степень пермеации (%) глюкозы представляет собой значение, рассчитанное непосредственным измерением ее концентрации на стороне пермеата и делением измеренного значения на концентрацию, показанную в вышеприведенных справочных примерах, с последующим умножением полученных значений на 100. Измерение осуществляли при постоянной температуре 25°C после подтверждения того, что изменение pH из-за добавления полимера составляло менее 0,05. В результате обнаружили, что добавление одновременно триполифосфата натрия и полиакрилата натрия в виде водных растворов анионного полимера к сахарной жидкости перед обработкой с помощью нанофильтрационной мембраны повышает степени пермеации муравьиной кислоты, уксусной кислоты и феруловой кислоты, которые являются органическими кислотами, по сравнению со сравнительным примером 2 (таблица 16), в котором полимер не добавляли.
(Сравнительный пример 4) добавление нерастворимого в воде анионного полимера
Гидротермически обработанную жидкость, полученную в справочном примере 4, фильтровали через микрофильтрационную мембрану (Stericup, изготавливаемую Millipore, размер пор 0,22 мкм), при этом поверхность мембраны промывали после фильтрации каждых 100 мл, для выполнения фильтрационной обработки. К полученному фильтрату добавляли 5 мг DIAION SKI 10 (изготавливаемого Mitsubishi Chemical Corporation), который используется в качестве ионообменной смолы, в качестве нерастворимого в воде анионного полимера, и подтверждали, что полимер не растворялся. Жидкость, полученную после добавления, подвергали испытанию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics) таким же образом, как в примере 1. В качестве мембраны использовали нанофильтрационную мембрану GE SEPA-DK series (изготавливаемую GE Osmonics). Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационного потока 0,2 м/D. Однако, так как действующее давление увеличивалось непосредственно после начала фильтрации, фильтрация прекращалась. Когда плоский мембранный блок открывали и осматривали поверхность мембраны, обнаруживали присоединение SK110 к поверхности мембраны и спейсерной петле, таким образом, установили, что нерастворимый в воде анионный полимер не может быть использован.
(Пример 8) Изменение pH
Гидротермически обработанную осахаренную жидкость, полученную в справочном примере 4, фильтровали через микрофильтрационную мембрану (Stericup, изготавливаемую Millipore, размер пор 0,22 мкм). Полученный фильтрат разделяли на 500-мл аликвоты, и добавляли к ним 5 мг/л триполифосфата натрия или полиакрилата натрия. После этого, серную кислоту или гидроксид натрия добавляли к полученной в результате смеси для доведения pH до 3, 4, 5, 9 или 11, и каждую полученную в результате жидкость подвергали испытанию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics) таким же образом, как в примере 1. В качестве мембраны использовали нанофильтрационную мембрану GE SEPA-DK series (изготавливаемую GE Osmonics). Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационного потока 0,2 м/D. Результаты показаны в таблице 25. Действующее давление в испытании также показано в таблице. В этой таблице степень пермеации (%) глюкозы представляет собой значение, рассчитанное непосредственным измерением ее концентрации на стороне пермеата и делением измеренного значения на концентрацию, показанную в вышеприведенных справочных примерах, с последующим умножением полученных значений на 100. Измерение осуществляли при постоянной температуре 25°C после подтверждения того, что изменение pH из-за добавления полимера составляло менее 0,05.
(Сравнительный Пример 5) Изменение pH (без добавления анионного полимера)
Гидротермически обработанную осахаренную жидкость, полученную в справочном примере 4, фильтровали через микрофильтрационную мембрану (Stericup, изготавливаемую Millipore, размер пор 0,22 мкм). Полученный фильтрат разделяли на 500-мл аликвоты. Серную кислоту или гидроксид натрия добавляли к каждой аликвоте для доведения pH до 3, 4, 5, 9 или 11, и полученную в результате жидкость подвергали испытанию мембранной пермеации с использованием плоского мембранного блока SEPA CF-II (изготавливаемого GE Osmonics) таким же образом, как в примере 1. В качестве мембраны использовали нанофильтрационную мембрану GE SEPA-DK series (изготавливаемую GE Osmonics). Испытание проницаемости осуществляли при условиях поверхностной линейной скорости 20 см/с и фильтрационного потока 0,2 м/D. Результаты показаны в таблице 26. Действующее давление в испытании также приведено в таблице. В этой таблице степень пермеации (%) глюкозы представляет собой значение, рассчитанное непосредственным измерением ее концентрации на стороне пермеата и делением измеренного значения на концентрацию, показанную в вышеприведенных справочных примерах, с последующим умножением полученных значений на 100. Измерение осуществляли при постоянной температуре 25°C после подтверждения того, что изменение pH из-за добавления полимера составляло менее 0,05.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Посредством настоящего изобретения, ингибиторы ферментации могут быть эффективно удалены из водного сахарного раствора, полученного из содержащей целлюлозу биомассы, и, с другой стороны, очищенная сахарная жидкость, содержащая моносахариды, такие как глюкоза и ксилоза, может быть выработана с высокой чистотой и высоким выходом, такими что использование очищенной сахарной жидкости в качестве ферментационного сырья предоставляет возможность увеличения эффективности ферментативной выработки различных химических продуктов.
ОПИСАНИЕ ОБОЗНАЧЕНИЙ
1 Ферментативное осахаривание
2 Разделение твердая фаза-жидкость
3 Анионный полимер
4 Микрофильтрационная мембрана и/или ультрафильтрационная мембрана
5 Нанофильтрационная мембрана и/или обратноосмотическая мембрана
6 Сахарная жидкость
7 Ингибитор ферментации
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОИЗВОДСТВА РАСТВОРА САХАРА | 2012 |
|
RU2597199C2 |
| СПОСОБ ПОЛУЧЕНИЯ САХАРНОГО РАСТВОРА | 2009 |
|
RU2516792C2 |
| СПОСОБ ПРОИЗВОДСТВА САХАРНОГО РАСТВОРА | 2012 |
|
RU2577901C2 |
| СПОСОБ ПОЛУЧЕНИЯ САХАРНОГО РАСТВОРА | 2012 |
|
RU2582649C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ИЗГОТОВЛЕНИЯ САХАРНОГО РАСТВОРА | 2011 |
|
RU2560443C2 |
| СПОСОБ ПОЛУЧЕНИЯ БУТАНОЛА | 2011 |
|
RU2560167C2 |
| СПОСОБ ПРОИЗВОДСТВА РАСТВОРА САХАРА И УСТРОЙСТВО ДЛЯ ЕГО ПРОИЗВОДСТВА | 2011 |
|
RU2564571C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТВОРА САХАРА | 2016 |
|
RU2739007C2 |
| СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ, СПОСОБ ПОЛУЧЕНИЯ ЛАКТИДА И СПОСОБЫ ПОЛУЧЕНИЯ ПОЛИМОЛОЧНОЙ КИСЛОТЫ | 2009 |
|
RU2574783C2 |
| КОМПОЗИЦИЯ МОЛОЧНОЙ КИСЛОТЫ И ЕЕ ПРИМЕНЕНИЕ | 2009 |
|
RU2650802C1 |
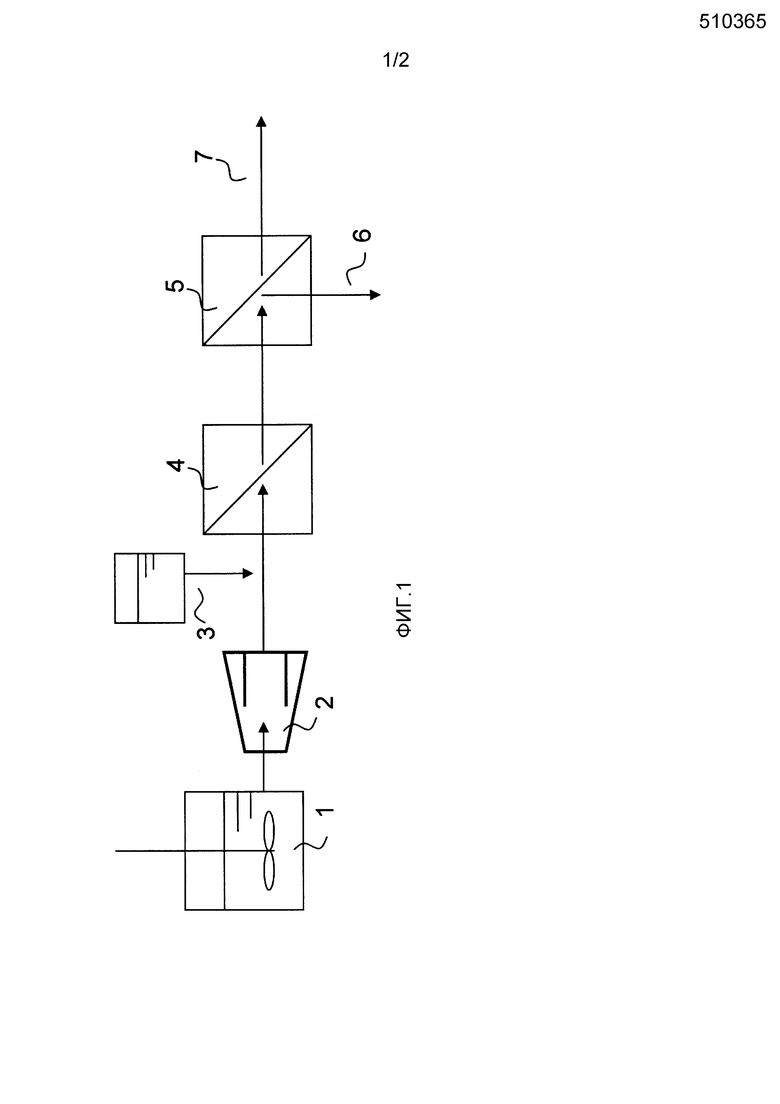
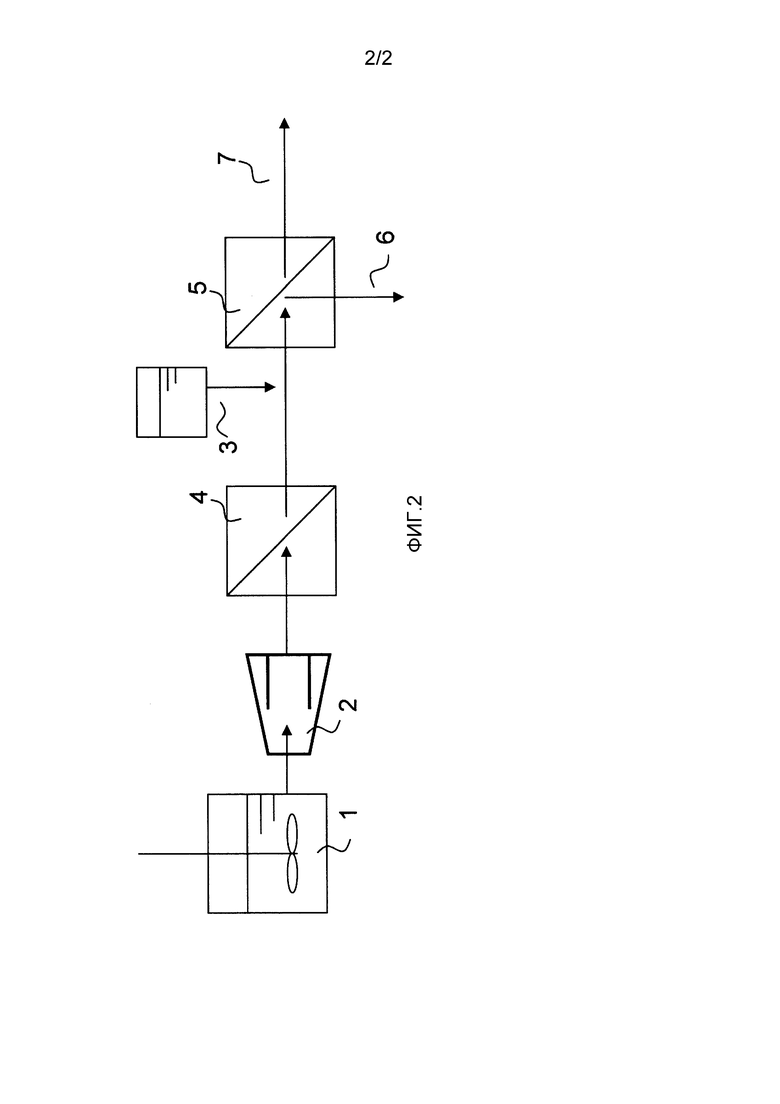
Изобретение относится к пищевой промышленности. Способ включает концентрирование водного полученного из целлюлозы сахарного раствора с помощью нанофильтрационной мембраны и/или обратноосмотической мембраны, в котором указанная концентрация осуществляется после добавления водорастворимого анионного полимера к указанному водному полученному из целлюлозы сахарному раствору, для удаления ингибиторов ферментации на стороне пермеата указанной нанофильтрационной мембраны и/или обратноосмотической мембраны. Водорастворимый анионный полимер включает полимер, выбранный из группы, состоящей из соли фосфатного полимера, фосфатного полимера, соли поликарбоксилатного полимера и поликарбоксилатного полимера. Водорастворимый анионный полимер добавляется к указанному водному полученному из целлюлозы сахарному раствору в концентрации от 0,5 мг/л до 500 мг/л. Средняя молекулярная масса указанного водорастворимого анионного полимера составляет от 200 до 10000. Изобретение обеспечивает производство сахарной жидкости с малой вероятностью содержания ингибиторов ферментации. 3 н. и 5 з.п. ф-лы, 2 ил., 26 табл., 8 пр.
1. Способ получения сахарной жидкости, включающий концентрирование водного полученного из целлюлозы сахарного раствора с помощью нанофильтрационной мембраны и/или обратноосмотической мембраны, в котором указанная концентрация осуществляется после добавления водорастворимого анионного полимера к указанному водному полученному из целлюлозы сахарному раствору, для удаления ингибитора(ов) ферментации на стороне пермеата указанной нанофильтрационной мембраны и/или обратноосмотической мембраны,
где указанный водорастворимый анионный полимер включает полимер, выбранный из группы, состоящей из соли фосфатного полимера; фосфатного полимера; соли поликарбоксилатного полимера и поликарбоксилатного полимера,
где указанный водорастворимый анионный полимер добавляется к указанному водному полученному из целлюлозы сахарному раствору в концентрации от 0,5 мг/л до 500 мг/л, и
где средняя молекулярная масса указанного водорастворимого анионного полимера составляет от 200 до 10000.
2. Способ получения сахарной жидкости по п. 1, в котором указанный водный полученный из целлюлозы сахарный раствор, концентрируемый с помощью указанной нанофильтрационной мембраны и/или обратноосмотической мембраны, является пермеатом микрофильтрационной мембраны и/или ультрафильтрационной мембраны.
3. Способ получения сахарной жидкости по п. 1, в котором указанный водорастворимый анионный полимер является неорганическим полифосфатом.
4. Способ получения сахарной жидкости по любому из пп. 1-3, в котором pH указанного водного полученного из целлюлозы сахарного раствора после добавления указанного водорастворимого анионного полимера составляет от 4 до 9.
5. Способ получения сахарной жидкости по п. 1, в котором указанный(ые) ингибитор(ы) ферментации является/являются одним или более из органических кислот, фурановых соединений, имеющих карбоксильную(ые) группу(ы), и фенольных соединений, имеющих карбоксильную(ые) группу(ы).
6. Способ получения сахарной жидкости по п. 5, в котором указанный(ые) ингибитор(ы) ферментации содержит(ат) по меньшей мере уксусную кислоту или муравьиную кислоту.
7. Способ получения сахарной жидкости, включающий фильтрование сахарной жидкости, полученной способом по любому из пп. 1-6, дополнительно через ультафильтрационную мембрану, имеющую ограничение по молекулярной массе от 500 до 2000.
8. Способ получения химического продукта, включающий ферментационное культивирование микроорганизма, имеющего способность вырабатывать химический продукт с использованием в качестве ферментационного сырья сахарной жидкости, полученной способом по любому из пп. 1-7.
| WO 2010067785 A1, 17.06.2010 | |||
| US 20100186737 A1, 29.07.2010 | |||
| СПОСОБ ОЧИСТКИ СЫРОЙ ВОДЫ, СОДЕРЖАЩЕЙ ТРУДНОРАЗЛАГАЕМОЕ ВЕЩЕСТВО | 2005 |
|
RU2375312C2 |
Авторы
Даты
2016-05-10—Публикация
2012-03-28—Подача