Изобретение относится к медицине и может быть использовано для прогнозирования риска развития инфекционных осложнений у больных злокачественными лимфопролиферативными заболеваниями (ЗЛПЗ), получающих программную полихимиотерапию (ПХТ) и комбинированную антибактериальную терапию.
Опухоли лимфатической системы с быстропрогрессирующим течением патологического процесса представляют собой гетерогенную группу новообразований, различающуюся по морфологическим, молекулярно-биологическим, иммуногистохимическим, иммунофенотипическим и клиническим характеристикам [1].
В настоящее время внедрены протоколы лечения опухолей высокой степени злокачественности, а также разработаны основы профилактики и терапии осложнений инфекционно-воспалительного генеза, возникающих в процессе ПХТ вследствие развития цитостатического агранулоцитоза [2]. Несмотря на это, довольно часто встречаются случаи активизации инфекций даже на фоне адекватной их антимикробной профилактики, что, несомненно, отражается на тяжести течения и прогнозе заболевания.
К числу наиболее часто встречающихся ЗЛПЗ относятся: диффузная В-крупноклеточная лимфома (ДВККЛ), на долю которой приходится до 30% от всех случаев неходжкинских лимфом, лимфома из клеток мантийной зоны (МКЛ - 6%) и множественная миелома (ММ: 10-15% от всех гемобластозов человека) [3].
Известно, что толл-подобные рецепторы (Toll-like receptors - TLRs) относятся к эволюционно консервативным структурам врожденного иммунитета и играют важную роль в В-клеточной активации, созревании и образовании клеток-памяти, поэтому могут быть вовлечены в патогенез ЛПЗ. В соответствии с имеющимися современными данными, TLRs при данных опухолях причастны к злокачественной трансформации, опухолевой прогрессии и к процессу ускользания опухоли от иммунного надзора [4]. TLRs также играют важную роль в распознавании и внедрении микроорганизмов, участвуя в патофизиологии инфекционных и воспалительных заболеваний [5]. Большинство TLRs относятся к I типу трансмембранных протеинов, то есть внутриклеточно располагается терминальный участок С, внеклеточно-терминальный участок N с единственным трансмембранным доменом (TLR1, TLR2, TLR4, TLR5, TLR6). Однако существует несколько исключений - это TLR3, TLR7, TLR8 и TLR9, которые локализованы во внутриклеточных структурах, таких как эндосомы и эндоплазматический ретикулум. Среди них, TLR9 - способен распознавать специфические нуклеиновые кислоты бактерий, вирусов и грибов. Кроме того, TLR9 совместно с В-клеточным рецептором (BCR) может также отвечать на аутоантигены [6].
Описано, что у некоторых индивидуумов повышена чувствительность к инфекционно-воспалительным заболеваниям из-за нарушения процессов адекватного реагирования TLRs вследствие однонуклеотидных точечных мутаций (single-nucleotide polymorphisms - SNPs) в их генах [5]. Данные генетические полиморфизмы могут приводить к аминокислотным заменам с последующим изменением функции рецептора, а также сигнальной трансдукции в клеточных элементах врожденного иммунитета, влияя на распознавание инфекционных агентов, а также на чувствительность и/или устойчивость к различным инфекциям [7, 8].
Ген TLR9 картирован в 3 хромосоме (3р21.3). Один из выявляемых функциональных полиморфизмов гена заключается в нуклеотидной замене тимина на цитозин в позиции 1237, что приводит к изменению экспрессии TLR9 в клетках и к нарушению распознавания инфекционных агентов и, следовательно, к повышению частоты инфекционных осложнений [10].
Существует несколько способов прогнозирования развития инфекций у лиц, получающих химиотерапию. Так, существует метод, при котором авторы предлагали определять абсолютное количество лимфоцитов и CD34-лимфоцитов в периферической крови и вычисление процентного соотношения CD34-клеток к количеству лимфоцитов для определения вероятности развития или отсутствия инфекционного осложнения химиотерапии у 40 детей с гемобластозами, получающими данный вид лечения [11]. Исследователи предлагают экстраполировать полученные данные на всех больных, получающих химиотерапию независимо от возраста и нозологической принадлежности гемобластоза, что вызывает сомнения, так как схемы и дозы применяемых лекарственных препаратов могут весьма сильно различаться и оказывать влияние на содержание исследуемых клеточных элементов и, следовательно, не могут точно отражать функциональные возможности иммунной системы в отношении формирования резистентности к инфекциям.
Известен также способ прогнозирования инфекционных осложнений после химиотерапии у больных острыми лейкозами, где авторами исследовалась активность ферментов лимфоцитов периферической крови (глюкозо-6-фосфатдегидрогеназы и НАДФ-зависимой декарбоксилирующей малатдегидрогеназы) больных острым лейкозом до проведения химиотерапии. О возможности возникновения инфекционных осложнений судили по сочетанию величин активности этих дегидрогеназ, как показателей метаболического и функционального состояния клеток, участвующего в прогнозе инфекционных осложнений [12]. Однако не во всех лабораториях возможно использование биолюминометра и, кроме того, на метаболическое состояние клеток, могут оказывать влияние и сопутствующие заболевания. Учитывая, что данный метод был апробирован у больных острыми лейкозами, представляется невозможным использовать предлагаемый способ у больных ЗЛПЗ.
Существует также способ прогноза развития инфекции и тяжелых инфекционных осложнений у больных гемобластозами, получающих программную полихимиотерапию, который включает исследование комплекса клинико-иммунологических показателей, среди которых оценивались: абсолютное количество лимфоцитов, относительное содержание CD3+T-лимфоцитов, CD16+-клеток в крови; концентрация IgM в сыворотке крови; фагоцитарная активность гранулоцитов и моноцитов; митоген-индуцированная пролиферация мононуклеарных клеток. Для прогноза развития тяжелых инфекционных осложнений использовали комплекс иммунологических показателей, включавший: абсолютное количество лимфоцитов в крови; фагоцитарную активность гранулоцитов и моноцитов; относительное содержание HLA-DR+-моноцитов; спонтанную пролиферацию мононуклеарных клеток [13]. Среди недостатков данного метода следует отметить, что он апробирован лишь у 10 больных гемобластозами после окончания курса полихимиотерапии до развития цитостатической нейтропении. Кроме того, большой перечень маркеров, предлагаемых авторами для оценки, ведет к весьма продолжительному времени обследования, включает трудоемкие и дорогостоящие способы исследования и включает показатели иммунной системы, обладающие весьма широкими референсными интервалами в зависимости от возраста, наличия сопутствующих заболеваний, нозологической формы гемобластоза, проводимого предшествующего лечения.
Анализ литературы показал, что предлагаемый способ прогнозирования развития инфекций у больных ЗЛПЗ на основании анализа SNP TLRs не имеет прототипа, соответственно обладает критерием «новизна» и по совокупности отличительных действий от аналогов присутствует критерий «существенные отличия».
Таким образом, выявление генетических мутаций в образ-распознающих рецепторах иммунной системы у больных ЗЛПЗ может оказаться дополнительным прогностическим критерием риска развития инфекционно-воспалительных осложнений на фоне ПХТ и сопутствующей антимикробной терапии.
Цель изобретения - разработка способа прогнозирования риска развития инфекционных осложнений у больных злокачественными лимфопролиферативными заболеваниями, получающими программную химиотерапию и комбинированную антибактериальную терапию.
Поставленная цель достигается с помощью анализа полиморфизма гена TLR9 Т-1237С до назначения ПХТ или в ранние сроки лечения у пациентов со ЗЛПЗ, получающих программную химиотерапию и комбинированную антибактериальную терапию с или без клинических проявлений инфекционно-воспалительных процессов до периода развития цитостатического агранулоцитоза.
Способ применяли следующим образом. Верификацию диагноза ЗЛПЗ осуществляли на основании клинической картины заболевания, общеклинического, биохимического анализа крови, морфологического исследования пунктатов и трепанобиоптатов костного мозга, гистологического и иммуногистохимического исследования лимфатических узлов, а также иммунофенотипического профиля опухолевых клеток. В первые пять суток стационарного наблюдения, после подтверждения диагноза и до появления миелотоксических осложнений у больных проводили забор венозной крови в объеме 1000 мкл в полистироловую пробирку типа «Эпппендорф» с замком объемом 1,5 мл, содержащую 200 мкл 4% раствора цитрата натрия.
Дальнейшее исследование осуществляли согласно методике в три этапа с использованием комплекта реагентов «SNP-экспресс» для выявления полиморфного локуса гена TLR9 методом полимеразной цепной реакции с аллель-специфичными праймерами (производства НПФ «Литех», г. Москва), на амплификаторе «Терцик» (ООО «ДНК технология», г. Москва) и электрофоретической детекцией продуктов реакции в агарозном геле.
На первом этапе (выделение ДНК из биопроб) в чистую пробирку типа «Эппендорф» с замком вносили 1000 мкл цельной крови. В случае ее расслоения в процессе хранения кровь перемешивали до однородного состояния. Пробирку закрывали и центрифугировали со скоростью 3000 об/мин при комнатной температуре +22°С на микроцентрифуге-вортексе «Эппендорф» (Германия) в течение 5 мин. После центрифугирования крови и разделения ее на плазму и форменные элементы аккуратно пипеткой-дозатором переменного объема удаляли плазму, оставляя ее тонкий слой, не захватывая лейкоциты. Пробирку закрывали и выдерживали при -20°С в морозильной камере в течение 1 часа до полного замораживания форменных элементов. Затем пробирку доставали и размораживали ее содержимое при комнатной температуре +22°С. Следующим шагом было внесение в пробирку 500 мкл реактива «ДНК-экспресс-кровь», что равно 500 мкл суммарного объема оставшихся в пробирке форменных элементов и плазмы. Пробирку закрывали, защелкивали замочек, после чего содержимое в течение 10 с тщательно перемешивали на вортексе Elmi Sky Line (Литва). В предварительно прогретый до температуры +98°С твердотельный термостат устанавливали анализируемую пробирку и выдерживали в течение 15 мин. На следующем этапе пробирку замком в сторону оси помещали в высокоскоростную микроцентрифугу и центрифугировали со скоростью 1200 об/мин при комнатной температуре +22°С в течение 10 мин. Полученный супернатант использовали в качестве исследуемого образца ДНК непосредственно после его приготовления или замораживали после перенесения образца в отдельную пробирку типа «Эппендорф» в морозильной камере при -20°С на срок не более 6 месяцев. Замороженные образцы перед использованием полностью размораживали при комнатной температуре +22°С.
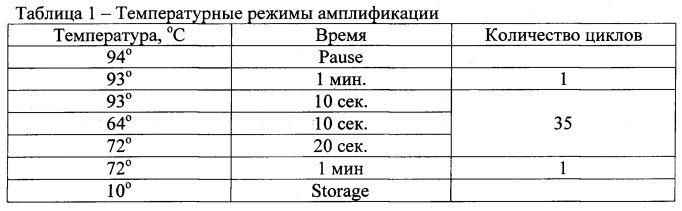
На втором этапе (проведение полимеразной цепной реакции) использовали комплект реагентов для амплификации «SNP-экспресс». Вначале приготавливали и маркировали пробирки для проведения амплификации вместимостью 0,5 мл из расчета 2 штуки на одну пробу («норма» - N и «патология» - Р) плюс 1 пробирка для отрицательного контроля. За 20 минут до приготовления рабочей амплификационной смеси комплект реагентов для ПЦР извлекали из морозильной камеры и полностью размораживали при комнатной температуре +22°С. Пробирки с реакционной смесью и раствором разбавителя тщательно перемешивали (путем вортексирования и переворачивания пробирки, соответственно). Из компонентов комплекта готовили рабочие смеси реагентов для амплификации из расчета на 1 пробу: одна пробирка с реакционной смесью «Норма»: 17,5 мкл разбавителя; 2,5 мкл реакционной смеси «Норма»; 0,2 мкл Taq-полимеразы. Вторая пробирка с реакционной смесью «Патология»: 17,5 мкл разбавителя; 2,5 мкл реакционной смеси «Патология»; 0,2 мкл Taq-полимеразы. После приготовления рабочих смесей для амплификации их тщательно перемешивали пипетированием. В соответствующие пробирки, подготовленные для амплификации, добавляли по 20 мкл соответствующей рабочей амплификационной смеси. Во все пробирки вносили по 1 капле минерального масла и по 5 мкл образца под слой масла из обработанной анализируемой пробы в пробирку с рабочей амплификационной смесью «Норма» и в пробирку с рабочей амплификационной смесью «Патология». В качестве отрицательного контрольного образца добавляли разбавитель в объеме 5 мкл в оба типа реакционной смеси. Пробирки закрывали и центрифугировали в течение 3 с при 3000 об/мин при комнатной температуре +22°С на микроцентрфуге-вортексе. Затем перемещали пробирки в прогретый до +94°С (температура, установившаяся в режиме «Пауза») программируемый твердотельный термостат (амплификатор) и проводили амплификацию по следующей программе (Таблица 1):
На третьем этапе - детекции, для разделения продуктов амплификации методом горизонтального электрофореза, в аппарат для электрофореза «Biometra Standart Power Pack Р25» (Германия) заливали ТАЕ буфер, приготовленный на дистиллированной воде с разбавлением 50хТАЕ в 50 раз (рН=8,3). К 3 г агарозы добавляли 2 мл 50хТАЕ буфера и 100 мл дистиллированной воды. Данную смесь расплавляли в СВЧ-печи и добавляли к 100 г расплавленной агарозы 10 мкл 1% раствора бромистого этидия, перемешивали. Расплавленную агарозу охлаждали до температуры 60°С и заливали в планшет. Для получения в агарозном геле карманов для нанесения образцов устанавливали на планшет гребенку, используя зажим типа «бульдог». После застывания агарозы осторожно вынимали гребенку из геля и переносили планшет с гелем в камеру для проведения электрофореза. В карманы геля наносили по 15 мкл амплификата в последовательности соответствующей нумерации проб. Подключали электрофоретическую камеру к источнику питания и задавали напряжение, соответствующее напряженности электрического поля 15 В/см геля. Проводили электрофоретическое разделение продуктов амплификации в направлении от катода (-) к аноду (+). Контроль за электрофоретическим разделением осуществляли визуально по движению полосы красителя в течение 15 мин. Затем вынимали гель из формы и переносили на стекло УФ-трансиллюминатора Vilber Lourmat (Франция). Включали трансиллюминатор и анализировали результаты анализа: фрагменты анализируемой ДНК проявлялись в виде светящихся оранжево-красных полос (таблица 2).

Пример интерпретации результатов анализа представлен на рисунке,
где К - отрицательный контрольный образец,
1 - нормальная гомозигота,
2 - гетерозигота,
3 - патологическая (мутантная) гомозигота.
4 - контаминация или затекание из соседнего кармана геля в тесте на патологическую (мутантную) аллель,
5 - реакция не прошла (ошибка при проведении анализа или некорректная работа амплификатора).
Распределение генотипов по исследуемому полиморфному локусу проверяли на соответствие равновесию Харди-Вайнберга с помощью точного теста Фишера. Для сравнения частот аллелей между различными группами использовали критерий χ2 Пирсона с поправкой Йэйтса на непрерывность. Дополнительно оценивали показатель отношения шансов - odds ratio (OR) с вычислением границ 95%-го доверительного интервала (95%CI). Значение OR=1 свидетельствовало об отсутствии ассоциации риска развития инфекций с наблюдаемым генотипом. При значении OR<1 говорили об отрицательной ассоциации (фактор пониженного риска развития инфекционных осложнений), a OR>1 рассматривали как положительную ассоциацию инфекций с признаком (фактор повышенного риска). Для расчета результатов использовали пакеты программ MS Office Excel 2003 STATISTICA V.12, а также «Калькулятор для расчета статистики в исследованиях «случай-контроль» (http:gen-exp.ru/calculator_or.php). Статистически значимыми считали различия при р<0,05.
Разработанный способ прогноза развития инфекционных осложнений у больных ЗЛПЗ, получающих ПХТ и комбинированную антибактериальную терапию, был оценен у 41 пациента (20 мужчин - 48,8% и 21 женщина - 51,2%, медиана (Me) возраста 59 лет). Среди них, 28 человек с ММ, 9 - с ДВККЛ и 4 - с МКЛ. В зависимости от развития клинических проявлений инфекционно-воспалительных процессов больные были разделены на 2 группы, сопоставимые по возрастным и тендерным характеристикам. В первую группу вошли 27 (65,9%) больных с отсутствием инфекций, во вторую - 14 (34,1%) обследованных с клиническими проявлениями инфекционных заболеваний. Спектр инфекционных осложнений представлен обострениями бактериальных инфекций (хронический бронхит, фарингит, энтероколит), рецидивами герпесвирусной инфекции (орофасциальный герпес), развитием грибковых инфекций (стоматит, эзофагит) и эпизодов фебрильной лихорадки.
Проведенные статистические расчеты позволили выявить взаимосвязь полиморфизма гена TLR9 (Т-1237С) у больных ЗЛПЗ и развитием инфекционных осложнений, несмотря на проводимую сопроводительную антимикробную терапию. А именно, при оценке мутационного статуса гена TLR9 (Т-1237С) установлено, что наличие мутантного аллеля С и содержащих его генотипов ТС+СС встречается достоверно реже среди лиц, не имевших инфекционных осложнений на фоне ПХТ (5,6% vs. 25,0%, χ2=6,51, р=0,01, OR=0,18, 95%CI: 0,04-0,75 и 11,1% vs. 42,9%, χ2=5,42, р=0,02, OR=0.17, 95%CI: 0,03-0,83, соответственно) (таблица 3).

Таким образом, полученные результаты свидетельствуют о взаимосвязи полиморфизма гена TLR9 (Т-1237С) с манифестацией инфекционных осложнений на фоне программной и антибактериальной терапии у больных ЗЛПЗ. Выделен фактор, повышающий риск возникновения данных осложнений - мутантный аллель С гена TLR9 (Т-1237С) в гомозиготном состоянии. Определение данного маркера позволяет прогнозировать и профилактировать развитие инфекционных осложнений на фоне ПХТ и антибактериальной терапии у больных ЗЛПЗ до наступления цитостатического агранулоцитоза, оптимизировать индивидуальную противомикробную тактику ведения данных больных.
Пример 1. Больной С., 1956 года рождения. Диагноз ММ был установлен в мае 2007 г., подтвержден присутствием в миелограмме 35% плазмоцитов, гиперпротеинемией (общий белок 138 г/л) и наличием М-градиента в протеинограмме. Проведено 8 курсов терапии с использованием ингибиторов протеосом (бортезомиб) и 2 курса химиотерапии, включающий иммуномодулирующий препарат (леналидомид). При молекулярно-генетическом тестировании у больного на 2-е сутки госпитализации был взят 1 мл венозной крови и проведено исследование полиморфного участка гена TLR9 (Т-1237С). Выявлена нормальная гомозигота ТТ гена TLR9 (Т-1237С). На 21-е сутки лечения отмечался агранулоцитоз 0,6×109/л, клинические проявления каких-либо инфекционных процессов отсутствовали.
Пример 2. Больная А., 1948 года рождения. Диагноз ММ установлен в ноябре 2011 г. подтвержден данным биопсии экстрамедуллярного очага в области грудины, протеинурией 1,4 г/л, повышением сывороточного уровня IgG до 42,1 г/л. Проведено 2 курса терапии с бортезомиб-содержащими препаратами, 1 курс лучевой терапии на экстрамедуллярный очаг поражения и 5 курсов ПХТ с применением иммуномодулирующих средств (леналидомид). Молекулярно-генетическое тестирование проводили на 4-е сутки XT. Обнаружили мутантную гомозиготу СС гена TLR9 (Т-1237С). На 14-е сутки ПХТ отмечался агранулоцитоз 0,4×109/л. Несмотря на проводимую антибактериальную (цефтазидим) и противогрибковую терапию (флуконазол), на 4-й день после окончания курса ПХТ появились жалобы на кашель, одышку, повышение температуры тела до фебрильных цифр. В гемограмме число лейкоцитов составляло 0,28×109/л. Объективно: состояние тяжелое; в легких дыхание жесткое, единичные сухие хрипы; ЧДД=22-24/мин. При рентгенографии органов грудной клетки - признаки бронхита. Проведена коррекция антимикробной терапии с добавлением амикацина, ванкомицина, метронидазола и противогрибковой терапии (ирунин) соответственно чувствительности микрофлоры. В результате на 25-е сутки самочувствие больной нормализовалось.
Источники информации
1. Гершанович М.Л. Основные принципы лечения неходжкинских лимфом. Практическая онкология. 2004. Т. 5. №3. С. 185-193.
2. Программное лечение заболеваний системы крови: Сборник алгоритмов диагностики и протоколов лечения заболеваний системы крови / Под ред. В.Г. Савченко. - М.: Практика, 2012. - 1056 с.
3. Основы клинической гематологии: учебное пособие / С.А. Волкова, Н.Н. Боровков. - Н. Новгород: Издательство Нижегородской гос. медицинской академии, 2013. - 400 с.
4. Toll-like receptors in the pathogenesis of human В cell malignancies / Isaza-Corerea J.M., Liang Z., van der Berg A., Diepstra A., Visser L. // Journal of Hematology and Oncology. 2014. Vol. 7. №1. URL: http://www.jhoonline.org/content/7/1/57 (дата обращения 14.08.2014).
5. Trejo-de la О A., Hernandez-Sancen P., Maldonado-Bernal C. Relevance of single-nucleotide polymorphisms in human TLR genes to infectious and inflammatory diseases and cancer // Genes and Immunity. 2014. Vol. 15. №6. P. 199-209.
6. The role of Toll-like receptors in chronic В cell malignancies / Muzio M., Bertilaccio M.T.S., Simonetti G., Frenquelli M., Caligaris-Cappio F. // Leukemia and Lymphoma. 2009. Vol. 50. №10. P. 1573-1580.
7. Генетический полиморфизм иммуногенной сигнальной системы / Цыган В.Н., Иванов A.M., Камилова Т.А., Кожухова Е.А., Мурашкин Н.Н., Цыган Н.В. // Журнал инфектологии. 2011. Т. 3. №2. С. 21-27.
8. Kutikhin A.G., Yuzhalin А.Е. Inherited variation in pattern recognition receptors and cancer; dangerous liaisons? // Cancer Management and research. 2012. №4. P. 31-38.
9. Evaluation of the toll-like receptor 6 Ser249Pro polymorphism in patients with asthma, atopic dermatitis and chronic obstructive pulmonary disease // Hoffjan S., Stemmler S., Parwez Q., Petrasch-Parwez E., Arinir U., Rohde G., Reinitz-Rademacher K., Schultze-Werninghaus G., Bufe A., Epplen J.T. // BMC medical Genetics. 2005. Vol. 34. №6. URL: http://www.biomedcentral.com/1471-2350/6/34 (дата обращения 18.08.2014).
10. Polymorphisms in Toll-like receptor genes and susceptibility to pulmonary aspergillosis / Carvalho A., Pasqualotto A.C., Pitzurra L., Romani L., Denning D.W, Rodrigues F. // The Journal of Infectious Diseases. 2008. Vol. 197. №4. P. 618-621.
11. Способ прогнозирования развития инфекционных осложнений химиотерапии»: пат. 2294540 Рос. Федерация. №2005118188/14; заявл. 14.06.05; опубл. 27.02.07. Бюл. №6.
12. Способ прогнозирования инфекционных осложнений после химиотерапии у больных острыми лейкозами: пат. 2315305 Рос. Федерация. №2005134594/15; заявл. 08.11.2005; опубл. 20.01.08. Бюл. №2.
13. Способ прогноза развития инфекции и тяжелых инфекционных осложнений у больных гемобластозами на программной полихимиотерапии: пат. 2199115 Рос. Федерация. №2000118298/14; заявл. 10.07.00; опубл. 20.02.03.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования риска развития COVID-19 у больных гемобластозами | 2022 |
|
RU2783422C1 |
| СПОСОБ ПРОГНОЗА РАЗВИТИЯ ИНФЕКЦИИ И ТЯЖЕЛЫХ ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ ГЕМОБЛАСТОЗАМИ НА ПРОГРАММНОЙ ПОЛИХИМИОТЕРАПИИ | 2000 |
|
RU2199115C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ СЕПСИСА ИЛИ ПНЕВМОНИИ У БОЛЬНЫХ ОСТРЫМ МИЕЛОИДНЫМ ЛЕЙКОЗОМ | 2024 |
|
RU2832525C1 |
| Способ прогнозирования прогресса папилломавирусной инфекции у пациенток с хроническим рецидивирующим ВПЧ - ассоциированным цервицитом | 2017 |
|
RU2646785C1 |
| Способ прогнозирования антрациклин-индуцированной кардиотоксичности у женщин с раком молочной железы | 2019 |
|
RU2714683C1 |
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЭНТЕРОПАТИЙ, РАЗВИВАЮЩИХСЯ НА ФОНЕ ПОЛИХИМИОТЕРАПИИ | 2009 |
|
RU2405546C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ ТОКСИЧЕСКОГО ГЕПАТИТА ПРИ ХИМИОТЕРАПИИ МНОЖЕСТВЕННОЙ МИЕЛОМЫ | 2005 |
|
RU2283494C1 |
| СПОСОБ СОПРОВОДИТЕЛЬНОГО ЛЕЧЕНИЯ ОСТРОГО ЛИМФОБЛАСТНОГО ЛЕЙКОЗА | 2006 |
|
RU2320367C1 |
| Способ выявления первично-рефрактерной формы множественной миеломы в дебюте заболевания | 2020 |
|
RU2749612C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ ПОСЛЕ ХИМИОТЕРАПИИ У БОЛЬНЫХ ОСТРЫМИ ЛЕЙКОЗАМИ | 2005 |
|
RU2315305C2 |

Изобретение относится к области медицины и предназначено для прогнозирования риска развития инфекционных осложнений у больных злокачественными лимфопролиферативными заболеваниями, получающих программную химиотерапию. Из клеток периферической венозной крови выделяют ДНК и до наступления цитопенических осложнений программной химиотерапии и манифестации инфекций проводят анализ распределения генотипов полиморфизма Т-1237С гена TLR9. В случае выявления гомозиготы СС Т-1237С TLR9 прогнозируют повышение риска развития инфекций. Изобретение обеспечивает получение новых критериев прогноза развития инфекционных осложнений в ранние сроки полихимиотерапии. 1 ил., 3 табл., 2 пр.
Способ прогнозирования риска развития инфекционных осложнений у больных злокачественными лимфопролиферативными заболеваниями, получающих программную химиотерапию, включающий выделение ДНК из клеток периферической венозной крови, характеризующийся тем, что проводится анализ распределения генотипов полиморфизма Т-1237С гена TLR9 до наступления цитопенических осложнений программной химиотерапии и манифестации инфекций и в случае выявления мутантной гомозиготы СС Т-1237С гена TLR9 прогнозируют повышение риска развития инфекций.
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОТВЕТА НА ХИМИОТЕРАПИЮ ПРИ ХРОНИЧЕСКОМ ЛИМФОЛЕЙКОЗЕ | 2012 |
|
RU2495427C1 |
| ELMAAGACLI A.H | |||
| et al | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Bone Marrow Transplant | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Приспособление для плетения проволочного каркаса для железобетонных пустотелых камней | 1920 |
|
SU44A1 |
| ЛЕМЯКИНА | |||
Авторы
Даты
2016-06-20—Публикация
2014-12-17—Подача