ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет предварительных заявок на патенты США №№61/413016 и 61/413018, поданных 12 ноября 2011 года и которые включены во всей своей полноте в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Воспалительные заболевания и расстройства являются состояниями, при которых аномальный или иным способом нерегулируемый воспалительный ответ вносит вклад в этиологию или тяжесть заболевания. Примеры включают аутоиммунные заболевания, такие как ревматоидный артрит, рассеянный склероз и диабет, инфекционные заболевания, такие как туберкулез и различные формы менингита и энцефалита, включая вирусный энцефалит Западного Нила и другие расстройства, включая атеросклероз и ишемическую реперфузию.
[0003] Многие из данных заболеваний характеризуются инфильтрацией мононуклеарных клеток в месте повреждения ткани или другой травмы. Примеры мононуклеарных клеток, которые были обнаружены в данных инфильтратах, включают лимфоциты, особенно Т-лимфоциты, и клетки системы мононуклеарных фагоцитов (СМФ-клетки), такие как моноциты, макрофаги, дендритные клетки, микроглиальные клетки и другие.
[0004] Предполагается, что многие из клеток, найденных в инфильтратах мононуклеарных клеток, играют роль в данных аномальных воспалительных ответах. Например, при таких заболеваниях, как рассеянный склероз, CD4+Т-клетки, как известно, играют центральную роль в патологическом аутоиммунном ответе. Дендритные клетки и другие СМФ-клетки могут быть ответственны за активацию CD4+Т-клеток в ранний момент Т-клеточной активации. СМФ-клетки могут также способствовать воспалению путем фагоцитоза, хотя, по меньшей мере, при некоторых воспалительных заболеваниях неясно, способны ли такие клетки на это в отсутствие CD4+Т-клеток.
[0005] Моноциты периферической крови могут быть классифицированы на две группы в соответствии с экспрессией или отсутствием определенных молекул клеточной поверхности. В частности, человеческие "резидентные моноциты" или "зрелые моноциты" рассматриваются как имеющие фенотип CD14loCD16+(мышиным аналогом является CX3CR1hiCCR2-Gr1-). Другая группа клеток - "воспалительные моноциты" или "незрелые моноциты" - рассматриваются как имеющие фенотип CD14+CD16- (мышиным аналогом является CX3CR1loCCR2+Gr1+). (Geissmann F. et al. 2003 Immunity 19: 71-82)
[0006] Важно отметить, что в то время как последние понимаются как "воспалительные" в том смысле, что они мигрируют в воспаленную ткань от клеток периферической крови, сформированных из костного мозга, не было показано, что эти клетки вызывают воспаление либо непосредственно, либо через действие других клеток. Кроме того, не было показано, чтобы различные СМФ-клетки, которые могут быть сформированы при дифференциации этих клеток, вызывали воспаление.
[0007] Традиционные клинические стратегии для неспецифической долгосрочной иммуносупрессии при расстройствах, связанных с нежелательным иммунным ответом, основаны на длительном применении иммунодепрессантов широкого действия, например блокаторов сигнала 1, таких как циклоспорин A (CsA), FK506 (такролимус) и кортикостероиды. Длительное применение высоких доз данных лекарственных средств может иметь токсические побочные эффекты. Более того, даже у тех пациентов, которые способны переносить данные лекарственные средства, необходимость пожизненной иммуносупрессивной лекарственной терапии несет значительный риск серьезных побочных эффектов, в том числе опухолей, тяжелых инфекций, нефротоксичности и метаболических расстройств.
[0008] Были разработаны способы индукции антигенспецифической толерантности, в том числе связывание клеткой антигена или пептида. Например, в одном из способов, пептид индуцировал клеточную толерантность, опосредованную связыванием, включавший сбор, разделение и обработку клеток периферической крови антигенами, специфичными для заболевания, и связывающим реагентом этиленкарбодиимидом (ECDI) в стерильных условиях с последующим повторным введением донору/пациенту. Данный процесс является дорогостоящим и должен осуществляться под строгим контролем условий квалифицированными специалистами, и ограничен количеством центров, которые могут проводить процедуру. Использование эритроцитов в качестве типа клетки-донора расширяет потенциальный источник, учитывая аллогенные доноры, тем самым значительно увеличивая запас клеток-источников и потенциально расширяя предоставление данной терапии любым оборудованием, сертифицированным для переливания крови. Эти способы имеют существенные ограничения, связанные с запасом клеток-источников и необходимостью совпадения типов тканей для минимизации иммунного ответа на клетки-доноры. В дополнение к этому местная обработка клеток EDCI для связывания аутоантигенов представляет собой существенную проблему для проведения контроля качества. Кроме того, эти подходы также требуют, по меньшей мере, некоторых знаний о патологическом антигене, к которому требуется иммунная толерантность.
[0009] В последнее время были описаны пептид-связанные частицы, что устраняет потребность в запасе клеток-источников и обходит требование тканевого типирования предварительных способов, см. WO 2010/085509, включенная в настоящий документ в полном объеме посредством ссылки. Однако эти подходы все же основаны на антигенспецифической иммунной толерантности.
[0010] Как правило, антигенспецифическая толерантность не является идеальной, поскольку, как правило, специфические антигены/эпитопы заболеваний человека не известны. Кроме того, антигены могут варьировать от субъекта к субъекту, поэтому для того, чтобы антигенспецифический подход был эффективным, необходимо определить, какие антигены будет узнавать каждый конкретный пациент, или необходимым будет связывание библиотеки возможных пептидов с частицами перед введением. Синтез и индивидуальное связывание данных пептидов является и трудоемким, и дорогим. Таким образом, существует потребность в способе лечения, решающем обе эти проблемы, тем самым устраняя потребность в источнике клеток подходящей ткани и в то же время устраняя необходимость синтеза и связывания больших панелей пептидов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0011] Настоящее изобретение описывает удивительное открытие того факта, что модифицированные частицы сами по себе, то есть без пептида, связанного с ними, являются эффективными в устранении воспалительного иммунного ответа у пациентов, нуждающихся в этом. Удивительно, но все, что необходимо для ослабления воспалительного иммунного ответа и также для лечения воспалительного заболевания, - это введение карбоксилированных частиц без необходимости присоединения к ним пептида(ов).
[0012] В одном варианте воплощения изобретения настоящее изобретение предлагает фармацевтическую композицию, содержащую карбоксилированные частицы. В дополнительном варианте воплощения настоящего изобретения карбоксилированные частицы не содержат прикрепленный пептид или антигенные фрагменты. В некоторых вариантах воплощения настоящего изобретения карбоксилированные частицы являются полистироловыми частицами. В других вариантах воплощения настоящего изобретения карбоксилированные частицы являются алмазными частицами. В других вариантах воплощения настоящего изобретения карбоксилированные частицы являются частицами поли(молочной-со-гликолевой кислоты) (PLGA).
[0013] В одном варианте воплощения настоящего изобретения фармацевтическая композиция, содержащая карбоксилированные частицы, индуцирует иммунную толерантность при введении субъекту, нуждающемуся в этом. В дополнительном варианте воплощения настоящего изобретения фармацевтическая композиция, содержащая карбоксилированные частицы, устраняет воспалительный иммунный ответ при введении субъекту, нуждающемуся в этом.
[0014] В одном варианте воплощения настоящего изобретения карбоксилированные частицы, содержащие фармацевтическую композицию согласно настоящему изобретению, имеют диаметр от примерно 0,1 мкм до примерно 10 мкм. В дополнительном варианте воплощения настоящего изобретения карбоксилированные частицы имеют диаметр от примерно 0,3 мкм до примерно 5 мкм. В еще одном дополнительном варианте воплощения настоящего изобретения карбоксилированные частицы имеют диаметр от примерно 0,5 мкм до примерно 3 мкм. В еще одном дополнительном варианте воплощения настоящего изобретения карбоксилированные частицы имеют диаметр примерно 0,5 мкм.
[0015] В одном варианте воплощения изобретения настоящее изобретение предлагает способ снижения продолжительности или тяжести воспалительного иммунного ответа у субъекта, включающий введение субъекту фармацевтической композиции, содержащей карбоксилированные частицы. В дополнительном варианте воплощения настоящего изобретения карбоксилированные частицы свободны от связанных пептидов или антигенных фрагментов. В некоторых вариантах воплощения настоящего изобретения карбоксилированные частицы являются полистироловыми частицами. В других вариантах воплощения настоящего изобретения карбоксилированные частицы являются алмазными частицами. В других вариантах воплощения настоящего изобретения карбоксилированные частицы являются частицами поли(молочной-со-гликолевой кислоты) (PLGA).
[0016] В одном варианте воплощения настоящего изобретения способ согласно настоящему изобретению индуцирует иммунную толерантность при введении субъекту, нуждающемуся в этом. В дополнительном варианте воплощения настоящего изобретения способ устраняет воспалительный иммунный ответ при введении субъекту, нуждающемуся в этом.
[0017] В одном варианте воплощения настоящего изобретения способ согласно настоящему изобретению использует карбоксилированные частицы, имеющие диаметр от примерно 0,1 мкм до примерно 10 мкм. В дополнительном варианте воплощения настоящего изобретения карбоксилированные частицы имеют диаметр от примерно 0,3 мкм до примерно 5 мкм. В еще одном дополнительном варианте воплощения настоящего изобретения карбоксилированные частицы имеют диаметр от примерно 0,5 мкм до примерно 3 мкм. В еще одном дополнительном варианте воплощения настоящего изобретения карбоксилированные частицы имеют диаметр примерно 0,5 мкм.
[0018] В одном варианте воплощения настоящего изобретения субъект имеет аутоиммунное расстройство. В дополнительном варианте воплощения настоящего изобретения аутоиммунным расстройством является рассеянный склероз, склеродермия, диабет I типа, ревматоидный артрит, тиреоидит, системная красная волчанка, синдром Рейно, синдром Шегрена, аутоиммунный увеит, аутоиммунный миокардит или болезнь Крона. В конкретном варианте воплощения настоящего изобретения аутоиммунным расстройством является рассеянный склероз.
[0019] В другом варианте воплощения настоящего изобретения субъект имеет аллергическое расстройство. В дополнительном варианте воплощения настоящего изобретения аллергическим расстройством является экзема, астма, аллергический ринит или гиперчувствительность кожи.
[0020] В другом варианте воплощения настоящего изобретения субъект является реципиентом трансплантата. В еще одном варианте воплощения настоящего изобретения субъект перенес инфаркт миокарда. В еще одном варианте воплощения настоящего изобретения пациент имеет ишемическую реперфузию. В еще одном варианте воплощения настоящего изобретения пациент имеет атеросклероз.
[0021] В одном варианте воплощения настоящего изобретения способ включает введение карбоксилированных частиц при помощи любых подходящих средств. В одном варианте воплощения настоящего изобретения композиция вводится перорально, назально, внутривенно, внутримышечно, в глаза, чрескожно или подкожно. В конкретном варианте воплощения настоящего изобретения карбоксилированные частицы вводятся назально. В еще одном варианте воплощения настоящего изобретения частицы вводят внутривенно.
[0022] В одном варианте воплощения изобретения настоящее изобретение предлагает способ лечения бактериальной или вирусной инфекции у субъекта, включающий введение субъекту фармацевтической композиции, содержащей карбоксилированные частицы. В дополнительном варианте воплощения настоящего изобретения карбоксилированные частицы свободны от связанного пептида или антигенных фрагментов. В некоторых вариантах воплощения настоящего изобретения карбоксилированные частицы являются полистироловыми частицами. В других вариантах воплощения настоящего изобретения карбоксилированные частицы являются алмазными частицами. В других вариантах воплощения настоящего изобретения карбоксилированные частицы являются частицами поли(молочной-со-гликолевой кислоты) (PLGA).
[0023] В одном варианте воплощения настоящего изобретения способ согласно настоящему изобретению индуцирует иммунную толерантность при введении субъекту с бактериальной или вирусной инфекцией. В дополнительном варианте воплощения настоящего изобретения способ устраняет или ослабляет воспалительный иммунный ответ при введении пациенту с бактериальной или вирусной инфекцией.
[0024] В одном варианте воплощения настоящего изобретения способы лечения бактериальной или вирусной инфекции согласно настоящему изобретению используют карбоксилированные частицы, имеющие диаметр от примерно 0,1 мкм до примерно 10 мкм. В дополнительном варианте воплощения настоящего изобретения карбоксилированные частицы имеют диаметр от примерно 0,3 мкм до примерно 5 мкм. В еще одном дополнительном варианте воплощения настоящего изобретения карбоксилированные частицы имеют диаметр от примерно 0,5 мкм до примерно 3 мкм. В еще одном дополнительном варианте воплощения настоящего изобретения карбоксилированные частицы имеют диаметр примерно 0,5 мкм.
[0025] В одном варианте воплощения настоящего изобретения субъект имеет вирусную инфекцию. В дополнительном варианте воплощения настоящего изобретения вирусная инфекция является герпевирусной инфекцией, инфекцией вируса гепатита, инфекцией вируса Западного Нила, флавивирусной инфекцией, гриппозной инфекцией, риновирусной инфекцией, папилломавирусной инфекцией или инфекцией вируса парагриппа. В дополнительном варианте воплощения настоящего изобретения вирусная инфекция поражает центральную нервную систему указанного субъекта. В еще одном дополнительном варианте воплощения настоящего изобретения вирусная инфекция вызывает вирусный энцефалит или вирусный менингит.
[0026] В одном варианте воплощения настоящего изобретения субъект имеет бактериальную инфекцию. В дополнительном варианте воплощения настоящего изобретения бактериальная инфекция поражает центральную нервную систему указанного субъекта. В еще одном дополнительном варианте воплощения настоящего изобретения бактериальная инфекция вызывает септический бактериальный энцефалит или бактериальный менингит.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0027] Фигура 1 описывает (А) процент выживаемости мышей после инфицирования высокой дозой или низкой дозой ВЗН; (B) потерю массы, связанную с инфицированием мышей высокой дозой ВЗН; (C) титры вируса в мозге мышей, погибших от инфекции; (D) потерю массы у мышей, инфицированных высокой и низкой дозой ВЗН через 0-7 дней после инфицирования; (Е) титры вируса в головном мозге мышей, инфицированных высокой и низкой дозой ВЗН на 7 день после инфицирования и корреляцию между процентом потери массы на 7 день и титром вируса, (F) корреляцию между процентом потери массы и наличием CD45+лейкоцитов в головном мозге мышей через 7 дней после инфицирования высокой и низкой дозой ВЗН; (G) корреляцию между титром вируса в головном мозге и присутствием CD45+лейкоцитов в головном мозге мышей через 7 дней после инфицирования высокой и низкой дозой ВЗН; (H) корреляцию между процентом потери массы и наличием CD45hi макрофагов в головном мозге мышей через 7 дней после инфицирования высокой и низкой дозой ВЗН.
[0028] Фигура 2 описывает корреляцию между процентом потери массы и наличием (A) CD45intCD11b+иммигрировавшей микроглии; (C) CD3+Т-клеток, (D) CD11bhi Ly6G+нейтрофилов и (Е) NK1.1+CD11blo/- естественных клеток киллеров, в то время как количество CD45lo резидентной микроглии (B) оставалось неизменным через 7 дней после инфицирования высокой или низкой дозой ВЗН; (F) описывает корреляцию между потерей массы и титром вируса в головном мозге ко времени умерщвления мышей, инфицированных низкой дозой ВЗН; (G) описывает корреляцию инфильтрации лейкоцитов и процента потери массы у мышей, инфицированных низкой дозой ВЗН и (Н) демонстрирует отсутствие корреляции между титром вируса и инфильтрацией лейкоцитов после инфицирования низкой дозой ВЗН.
[0029] Фигура 3 (А) описывает долгосрочную выживаемость мышей, получавших карбоксилированные полистироловые гранулы в PBS на 6 день после инфицирования высокой дозой ВЗН; (B) демонстрирует, что лечение мышей, инфицированных низкими дозами ВЗН, карбоксилированными полистироловыми гранулами, начиная с 6 дня после инфицирования, является неэффективным в продлении выживаемости мышей; (C) демонстрирует, что лечение мышей, инфицированных низкими дозами ВЗН, карбоксилированными полистироловыми гранулами, начиная с 6 дня после инфицирования, является неэффективным в предотвращении потери массы у мышей по сравнению с мышами контрольной группы, (D) демонстрирует, что лечение мышей, инфицированных низкими ВЗН, является эффективным в продлении выживаемости мышей, когда гранулы вводятся при потери массы у мышей. (E-G) описывает потерю массы, зарегистрированную для данных мышей до 20 дня после инфицирования.
[0030] Фигура 4 (A-D) является примерами лечения мышей, инфицированных низкими дозами ВЗН, карбоксилированными полистироловыми гранулами при потере массы мышами, мыши в (A-B) требуют лечения гранулами только в течение 5 дней, и масса остается стабильной, и они выживают без дальнейшего лечения гранулами, в то время как мыши в (C-D) начинают терять массу снова после прекращения лечения гранулами через 5 дней, поэтому лечение продолжается, пока масса не стабилизируется, (E) описывает инфильтрацию CD45+CD11b+макрофагов в головной мозг мышей, инфицированных низкими дозами ВЗН, на 9 дней после инфицирования, которые либо потеряли массу, либо не потеряли массу и получали либо PBS, либо карбоксилированные гранулы на 8 день после инфицирования; (F) является графической демонстрацией типов клеток, инфильтрирующих головной мозг мышей, инфицированных ВЗН, на 9 дней после инфицирования, которые либо потеряли массе, либо не потеряли массу и получали либо PBS, либо карбоксилированные гранулы на 8 день после инфицирования.
[0031] Фигура 5 описывает (А) разницу в выживаемости мышей, получавших карбоксилированные полистироловые гранулы, голые полистироловые гранулы или PBS после инфицирования низкой дозой ВЗН; (B) описывает разницу в проценте потери массы у мышей, получавших карбоксилированные полистироловые гранулы, голые полистироловые гранулы или PBS после инфицирования низкой дозой ВЗН; (С, D) описывает разницу в проценте потери массы между лечением мышей карбоксилированными гранулами и голыми гранулами после инфицирования низкой дозой ВЗН; (E,O) описывает локализацию FITC-конъюгированных карбоксилированных гранул или голых гранул на 7 день у мышей, инфицированных высокой дозой ВЗН в 0 день и FITC- карбоксилированных гранул, FITC-конъюгированных голых гранул или PBS на 6 день. (E-G) представляют собой кровь 3 отдельных мышей, получавших PBS, (H-J) представляют собой кровь 3 отдельных мышей, получавших голые полистироловые гранулы, и (L-N) представляют собой кровь 3 отдельных мышей, получавших карбоксилированные полистироловые гранулы, демонстрируя, что в крови остается больше простых гранул, чем карбоксилированных гранул.
[0032] Фигура 6 демонстрирует (A-C) отсутствие инфильтрации FITC-конъюгированными полистироловыми гранулами в головном мозге инфицированных и подвергнутых лечению мышей, как показано на Фигуре Е-О; (D-E) описывает снижение инфильтрации различных лейкоцитов, макрофагов и микроглии в головном мозге мышей, инфицированных ВЗН, получавших карбоксилированные полистироловые гранулы или голые полистироловые гранулы, как показано на Фигуре 5 (E-O).
[0033] Фигура 7 описывает (А) ассоциацию FITC-конъюгированных полистироловых карбоксилированных гранул и FITC-конъюгированных голых полистироловых гранул в селезенке с CD45+лейкоцитами (A, B, F) в CD11b+(С, G), CD11c+(D,H) Ly6 с+(E, I) клетках; (J-R) описывает типы клеток, которые захватывают FITC-конъюгированные карбоксилированные гранулы и FITC-конъюгированные голые гранулы.
[0034] Фигура 8 описывает способность к захвату FITC-конъюгированных полистироловых карбоксилированных гранул или FITC-конъюгированных голых полистироловых гранул и увеличение количеств CD11b+CD11c- моноцитов (А) и CD11b+CD11c+(В) или CD11b- CD11c+(С) дендритных клеток в селезенке после инфицирования высокой дозой ВЗН.
[0035] Фигура 9 описывает (A-D) способность к захвату FITC-конъюгированных полистироловых карбоксилированных гранул или FITC-конъюгированных голых полистироловых гранул и увеличение количества субпопуляций CD19+В-клеток и CD3+Т-клеток в селезенке после инфицирования высокой дозой ВЗН.
[0036] Фигура 10 описывает (A-L) способность к захвату FITC-конъюгированных полистироловых карбоксилированных гранул или FITC-конъюгированных голых полистироловых гранул CD11b+(C,G), CD11c+(D, Н), и Ly6 с+(E, I) клетками, в частности, CD11b+CD11c- моноцитами (J) и CD11b+CD11c+(K) или CD11b- CD11c+(L) дендритными клетками в печени после инфицирования высокой дозой ВЗН.
[0037] Фигура 11 описывает (A-G) способность к захвату FITC-конъюгированных полистироловых карбоксилированных гранул или FITC-конъюгированных голых полистироловых гранул CD11b+, (C,F), CD11c+и Ly6C+(D, G) клетками в костном мозге после инфицирования высокой дозой ВЗН.
[0038] Фигура 12 описывает (А) процент выживаемости мышей, инфицированных низкой дозой ВЗН, получавших высокую или низкую дозу карбоксилированных полистироловых гранул различных размеров; (B) описывает процент выживаемости мышей, инфицированных низкой дозой ВЗН, получавших FITC-конъюгированные карбоксилированные гранулы, голые FITC-конъюгированные гранулы, карбоксилированные PLGA сферы или голые PLGA сферы; (C) описывает инфильтрацию/активацию различных популяций моноцитов в головном мозге мышей, инфицированных низкой дозой ВЗН и получавших карбоксилированные FITC-гранулы, карбоксилированные-FITC PLGA сферы или карбоксилированные наноалмазы.
[0039] Фигура 13 описывает (А) процент выживаемости и (B) потерю массы у мышей дикого типа и мышей с Т-клеточной недостаточностью, инфицированных высокой или низкой дозой ВЗН; (C) корреляцию между потерей массы и титрами вируса в головном мозге мышей дикого типа и мышей с Т-клеточной недостаточностью, инфицированных высокой или низкой дозой ВЗН; (D) потерю массы (E) и инфильтрацию иммунными клетками головного мозга мышей дикого типа и мышей с Т-клеточной недостаточностью, инфицированных высокой дозой ВЗН на 8 день после инфицирования; (F) процент выживаемости (G) и потерю массы мышей дикого типа и мышей с Т-клеточной недостаточностью, инфицированных высокой или низкой дозой ВЗН, и получавших карбоксилированные гранулы или PBS при значительной потере массы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0040] Авторы настоящего изобретения неожиданно обнаружили, что когда карбоксилированные частицы, такие как карбоксилированные полистироловые, PLGA или алмазные частицы, определенного размера вводятся субъектам, устраняются воспалительные иммунные ответы. Дополнительно авторы настоящего изобретения также неожиданно обнаружили, что те же самые карбоксилированные частицы при введении пациентам с активной вирусной или бактериальной инфекцией, особенно инфекциями, длительно поражающими центральную нервную систему, приводят к значительному снижению симптомов этих инфекций и увеличенной выживаемости. Следовательно, эти частицы могут быть полезны в лечении любого заболевания или состояния, характеризующегося чрезмерным воспалительным иммунным ответом, например, аутоиммунных заболеваний, а также в лечении бактериальных и вирусных инфекций.
[0041] "Частица" в данном контексте относится к любой нетканевой мельчайшей композиции вещества, она может быть сферой, сфероподобной или гранулой. Термин "частица" и термин "гранула" могут быть использованы взаимозаменяемо. Дополнительно термин "частица" может быть использован для охватывания гранул и сфер.
[0042] "Карбоксилированные частицы" или "карбоксилированные гранулы" или "карбоксилированные сферы" включает любую частицу, которая была модифицирована и содержит на ее поверхности карбоксильную группу. В некоторых вариантах воплощения настоящего изобретения добавление карбоксильной группы усиливает фагоцитарный/моноцитарный захват частиц из кровотока, например, путем взаимодействия с фагоцитарными рецепторами, например, MARCO.
[0043] "Антигенный фрагмент" в данном контексте относится к любому фрагменту, например пептиду, который распознается иммунной системой хозяина. Примеры антигенных фрагментов включают, но не ограничиваются, аутоантигены и/или бактериальные или вирусные белки, пептиды или компоненты. Не будучи связанными какой-либо теорией, в то время как карбоксилированные гранулы сами по себе могут быть распознаны иммунной системой, карбоксилированные гранулы без какой-либо прикрепленной частицы не считаются "антигенным фрагментом" для целей настоящего изобретения.
[0044] "Голые гранулы", или "голые частицы", или "голые сферы" в данном контексте относится к гранулам, частицам или сферам, которые не были карбоксилированы.
[0045] Частица может иметь любую форму частицы или конформацию. Однако в некоторых вариантах воплощения настоящего изобретения предпочтительно использовать частицы, которые будут агллютинироваться in vivo с наименьшей вероятностью. Примерами частиц в данных вариантах воплощения настоящего изобретения являются те, которые имеют сферическую форму.
[0046] Необязательно, чтобы каждая частица была однородной по размеру, хотя, в целом, частицы должны иметь достаточный размер для запуска фагоцитоза антигенпрезентирующей клеткой или другой СМФ-клеткой. Предпочтительно частицы имеют микроскопический или наноскопический размер с целью увеличения растворимости, во избежание возможных осложнений, вызванных агрегацией in vivo, и облегчения пиноцитоза. Размер частиц может быть фактором захвата из интерстициального пространства в области созревания лимфоцитов. Частица, имеющая диаметр от примерно 0,1 мкм до примерно 10 мкм, способна к запуску фагоцитоза. Таким образом, в одном варианте воплощения настоящего изобретения частица имеет диаметр в этих пределах. В другом варианте воплощения настоящего изобретения частица имеет диаметр от примерно 0,3 мкм до примерно 5 мкм. В еще одном варианте воплощения настоящего изобретения частица имеет диаметр от примерно 0,5 мкм до примерно 3 мкм. В предпочтительном варианте воплощения настоящего изобретения частица имеет размер примерно 0,5 мкм. Частицы в композиции не должны быть однородными по диаметру. Например, фармацевтическая композиция может содержать множество частиц, некоторые из которых имеют диаметр примерно 0,5 мкм, тогда как другие имеют диаметр примерно 1,0 мкм. Любая смесь размеров частиц в этих заданных диапазонах будет полезной.
[0047] В некоторых вариантах воплощения настоящего изобретения частица является неметаллической. В этих вариантах воплощения настоящего изобретения частица может быть изготовлена из полимера. В предпочтительном варианте воплощения настоящего изобретения частица биоразлагаема в индивидууме. В этом варианте воплощения настоящего изобретения частицы могут быть введены индивидууму через многократные дозы без накопления частиц в индивидууме. Примеры подходящих частиц включают полистироловые частицы, PLGA частицы и алмазные частицы.
[0048] Предпочтительно поверхность частицы состоит из материала, который минимизирует неспецифические или нежелательные биологические взаимодействия. Взаимодействия между поверхностью частиц и интерстицием могут быть фактором, играющим важную роль в лимфатическом захвате. Поверхность частицы может быть покрыта материалом для предотвращения или уменьшения неспецифических взаимодействий. Стерическая стабилизация путем покрытия частиц гидрофильными слоями, такими как полиэтиленгликоль (ПЭГ) и его сополимеры, такие как PLURONICS (включая сополимеры поли(этиленгликоль)-bl-поли(пропиленгликоль)-bl-поли(этиленгликоль)), может уменьшить неспецифические взаимодействия с белками интерстиция, что было продемонстрировано улучшенным лимфатическим захватом после подкожного введения. Все эти факты указывают на важность физических свойств частиц для лимфатического захвата. Биоразлагаемые полимеры могут быть использованы для изготовления всех или некоторых полимеров и/или частиц и/или слоев. Биоразлагаемые полимеры могут подвергаться деградации, например, в результате реакции функциональных групп с водой в растворе. Термин "деградация" в данном контексте относится приобретению свойства растворимости, либо путем уменьшения молекулярной массы, либо путем конверсии гидрофобных групп в гидрофильные группы. Полимеры с эфирными группами, в целом, подвержены спонтанному гидролизу, например, полилактиды и полигликолиды.
[0049] Частицы согласно настоящему изобретению могут также содержать дополнительные компоненты. Например, носители могут иметь визуализирующие агенты, включенные или конъюгированные с носителем. Примером наносферы-носителя, которая имеет визуализирующий агент и которая в настоящее является коммерчески доступной, являются наносферы Kodak X-sight. Было обнаружено, что неорганические квантово-размерные люминесцентные нанокристаллы, известные как квантовые точки (КТ), являются идеальными донорами в способах FRET: их высокий квантовый выход и модифицируемые, зависимые от размера стоксовы сдвиги позволяют различным размерам испускать излучение от синего до инфракрасного при возбуждении при одной длине волны ультрафиолетового спектра (Bruchez, et al., Science, 1998, 281, 2013; Niemeyer, C. M Angew. Chem. Int. Ed. 2003, 42, 5796; Waggoner, A. Methods Enzymol. 1995, 246, 362; Brus, L. E. J. Chem. Phys. 1993, 79, 5566). Квантовые точки, например гибридные органические/неорганические квантовые точки на основе класса полимеров, известного как дендримеры, могут использоваться в биологической маркировке, обработке изображений и оптических системах биодатчиков (Lemon, et al., J. Am. Chem. Soc. 2000, 122, 12886). В отличие от традиционного синтеза неорганических квантовых точек, синтез данных гибридных наночастиц квантовых точек не требует высоких температур или высокой токсичности, нестабильных реагентов (Etienne, et al., Appl. Phys. Lett. 87, 181913, 2005).
[0050] Частицы могут быть изготовлены из широкого спектра материалов. Предпочтительно частица состоит из материала, подходящего для биологического использования. Например, частицы могут состоять из стекла, кремнезема, полиэфиров гидроксикарбоновых кислот, полиангидридов дикарбоновых кислот или сополимеров гидроксикарбоновых кислот и дикарбоновых кислот. В общем, частицы-носители могут состоять из сложных полиэфиров с прямой или разветвленной цепью, замещенных или незамещенных, насыщенных или ненасыщенных, линейных или сшитых, алканил, галогеналкил, тиоалкил, аминоалкил, арил, аралкил, алкенил, аралкенил, гетероарил или алкоксигидрокси кислот или полиангидридов с прямой или разветвленной цепью, замещенных или незамещенных, насыщенных или ненасыщенных, линейных или сшитых, алканил, галогеналкил, тиоалкил, аминоалкил, арил, аралкил, алкенил, аралкенил, гетероарил или алкоксидикарбоновых кислот. Дополнительно частицы-носители могут быть квантовыми точками или состоять из квантовых точек, таких как полистироловые частицы квантовых точек (Joumaa et al. (2006) Langmuir 22: 1810-6). Частицы-носители, включая смеси сложноэфирных и ангидридных связей (например, сополимеры гликолевой и себациновой кислоты), также могут быть использованы. Например, частицы-носители могут содержать материалы, включающие полимеры полигликолевой кислоты (PGA), полимеры полимолочной кислоты (PLA), полимеры полисебациновой кислоты (PSA), сополимеры полимолочной-со-гликолевой кислоты (PLGA), сополимеры молочной-со-себациновой кислоты (PLSA), сополимеры полигликолевой-со-себациновой кислоты (PGSA) и т.д. Другие биосовместимые, биоразлагаемые полимеры, используемые в настоящем изобретении, включают полимеры или сополимеры капролактонов, карбонатов, амидов, аминокислот, ортоэфиров, ацеталей, цианоакрилатов и разлагаемых уретанов, а также их сополимеры с прямой или разветвленной цепью, замещенные или незамещенные, алканил, галогеналкил, тиоалкил, аминоалкил, алкенил или ароматические гидрокси или дикарбоновые кислоты. Дополнительно биологически важные аминокислоты с реакционноспособными группами боковых цепей, такие как лизин, аргинин, аспарагиновая кислота, глутаминовая кислота, серин, треонин, тирозин и цистеин или их энантиомеры, могут быть включены в сополимеры с любым из вышеупомянутых материалов для предоставления реакционных групп для конъюгации с антигенными пептидами и белками или конъюгирующими фрагментами. Биоразлагаемые материалы, пригодные для настоящего изобретения, включают алмаз, полимеры PLA, PGA и PLGA. Биосовместимые, но не биоразлагаемые, материалы также могут быть использованы в частицах-носителях в соответствии с настоящим изобретением. Например, могут быть использованы небиоразлагаемые полимеры акрилатов, этиленвинилацетата, ацилзамещенных ацетатов целлюлозы, неразлагаемых уретанов, стиролов, винилхлоридов, винилфторидов, винилимидазолов, хлорсульфированных олефинов, этиленоксида, виниловых спиртов, TEFLON ® (DuPont, Уилмингтон, Делавэр) и нейлон.
[0051] Подходящие гранулы, которые в настоящее время коммерчески доступны, включают гранулы полистирола, такие как FluoSpheres (Molecular Probes, Юджин, Орегон).
[0052] Физические свойства также связаны с полезностью наночастиц после захвата и удержания в местах, имеющих незрелые лимфоциты. Они включают механические свойства, такие как жесткость или эластичность. Некоторые варианты воплощения настоящего изобретения основаны на эластичном ядре, например полипропиленсульфидном (PPS) ядре с верхним слоем, например гидрофильным верхним слоем, таким как в ПЭГ, как в ППС-ПЭГ системе, недавно разработанной и описанной для системной (но не направленной или иммунной) доставки. Эластичное ядро является противопоставлением по существу жесткому ядру как в системе полистироловых или металлических наночастиц. Термин «эластичный» относится к некоторым упругим материалам, кроме природных или синтетических каучуков, «эластичный» является термином, известным в области полимеров. Например, сшитый PPS может быть использован для изготовления гидрофобного эластичного ядра. PPS является полимером, распадающимся в окислительных условиях до полисульфоксида и, наконец, полисульфона, переходя из гидрофобной резины в гидрофильный водорастворимый полимер. Другие сульфидные полимеры могут быть адаптированы для использования с термином «сульфидный полимер», относящемуся к полимеру с серой в основе мономерного звена. Другими эластичными полимерами, которые могут быть использованы, являются сложные полиэфиры с температурой стеклования при гидратированных условиях, которая меньше, чем примерно 37°С. Гидрофобное ядро предпочтительно может быть использовано с гидрофильным верхним слоем, так как ядро и верхний слой не будут смешиваться, в результате этого верхний слой будет иметь тенденцию к стерическому расширению от ядра. Ядро относится к частице, имеющей верхний слой. Слой относится к материалу, покрывающему, по меньшей мере, часть ядра. Слой может быть адсорбирован или ковалентно связан. Частица или ядро могут быть твердыми или полыми. Эластичные гидрофобные ядра имеют преимущества перед жесткими гидрофобными ядрами, такими как кристаллические или стеклообразные (как в случае полистирола) ядра, в которых большие дозировки гидрофобных лекарственных средств могут быть перенесены частицами с эластичными гидрофобными ядрами.
[0053] Еще одним физическим свойством является гидрофильность поверхности. Гидрофильный материал может иметь растворимость в воде, по меньшей мере, 1 грамм на литр, когда он не имеет перекрестных связей. Стерическая стабилизация частиц гидрофильными полимерами может улучшить захват из интерстиция путем снижения неспецифических взаимодействий; однако увеличенный характер малозаметности частиц может также уменьшить интернализацию фагоцитарными клетками в областях, имеющих незрелые лимфоциты. Балансировка этих конкурирующих характеристик оказалась проблематичной, однако, что задокументировано в данной заявке, были созданы наночастицы для эффективной лимфатической доставки в ДК и другие АПК в лимфатических узлах. Некоторые варианты воплощения настоящего изобретения включают гидрофильный компонент, например слой из гидрофильного материала. Примерами подходящих гидрофильных материалов являются один или более из полиалкиленоксидов, полиэтиленоксидов, полисахаридов, полиакриловых кислот и простых полиэфиров. Молекулярная масса полимеров в слое может регулироваться для обеспечения нужной степени стерического несоответствия in vivo, например, от примерно 1000 до примерно 100000 или даже более; специалистам в данной области сразу понятно, что рассматриваются все диапазоны и значения в указанных четким образом диапазонах, например, между 10000 и 50000.
[0054] Наночастицы могут включать функциональные группы для дальнейшей реакции. Функциональные группы для дальнейшей реакции включают электрофилы или нуклеофилы; они являются подходящими для взаимодействия с другими молекулами. Примерами нуклеофилов являются первичные амины, тиолы и гидроксилы. Примерами электрофилов являются сукцинимидильные сложные эфиры, альдегиды, изоцианаты и малеинимиды.
[0055] Частицы согласно настоящему изобретению можно вводить в любой дозе, эффективной для снижения воспалительного иммунного ответа у нуждающегося в этом субъекта, или для лечения бактериальной или вирусной инфекции у нуждающегося в этом субъекта. В некоторых вариантах воплощения настоящего изобретения от примерно 102 до примерно 1020 частиц вводятся индивидууму. В еще одном варианте воплощения настоящего изобретения вводится между примерно 103 до примерно 1015 частиц. В еще одном варианте воплощения настоящего изобретения вводится от примерно 106 до примерно 1012 частиц. В еще одном варианте вводится между примерно 108 до примерно 1010 частиц. В одном варианте воплощения настоящего изобретения предпочтительная доза составляет 0,1% твердых частиц/мл. Таким образом, для гранул 0,5 мкм предпочтительная доза составляет примерно 4х109 гранул, для гранул 0,05 мкм предпочтительная доза составляет примерно 4х1012 гранул, для гранул 3 мкм предпочтительная доза составляет 2х107 гранул. Тем не менее, любая эффективная доза в лечении конкретного состояния, требующего лечения, охватывается настоящим изобретением.
[0056] Настоящее изобретение является полезным для лечения иммунных расстройств, таких как аутоиммунное заболевание, отторжение трансплантата и аллергические реакции. Замена синтетической биосовместимой системы частиц для индуцирования иммунной толерантности может привести к упрощению производства, широкой доступности терапевтических агентов, увеличению однородности между образцами, увеличению количества потенциальных сайтов лечения и значительному снижению возможности аллергических ответов на клетку-носитель.
[0057] В данном контексте термин "иммунный ответ" включает Т-клеточно и/или В клеточно-опосредованные иммунные ответы. Примеры иммунных ответов включают Т-клеточные ответы, например продукцию цитокинов и клеточную цитотоксичность. В дополнение к этому термин иммунный ответ включает иммунные ответы, которые косвенно опосредованы Т-клеточной активацией, например продукция антител (гуморальный ответ) и активация чувствительных к цитокинам клеток, например, макрофагов. Иммунные клетки, вовлеченные в иммунный ответ, включают лимфоциты, такие как В-клетки и Т-клетки (CD4+, CD8+, Th1 и Th2 клетки); антигенпредставляющие клетки (например, профессиональные антигенпредставляющие клетки, такие как дендритные клетки, макрофаги, В-лимфоциты, клетки Лангерганса и непрофессиональные антигенпредставляющие клетки, таких как кератиноциты, эндотелиальные клетки, астроциты, фибробласты, олигодендроциты); естественные клетки-киллеры, миелоидные клетки, такие как макрофаги, эозинофилы, тучные клетки, базофилы и гранулоциты. В некоторых вариантах воплощения настоящего изобретения модифицированные частицы согласно настоящему изобретению являются эффективными для снижения миграции клеток воспаления в участок воспаления.
[0058] В данном контексте термины "анергия", "толерантность" или "антигенспецифическая толерантность" относятся к нечувствительности Т-клеток к стимуляции через Т-клеточный рецептор. Такая нечувствительность, как правило, является антигенспецифической и сохраняется после прекращения воздействия антигенным пептидом. Например, анергия Т-клеток характеризуется недостатком продукции цитокинов, например ИЛ-2. Анергия Т-клеток происходит при воздействии антигенов Т-клеткам и получения ими первого сигнала (Т-клеточный рецептор или CD-3 опосредованный сигнал) при отсутствии второго сигнала (ко-стимулирующий сигнал). В данных условиях повторное воздействие на клетки того же антигена (даже если повторное воздействие происходит в присутствии ко-стимулирующей молекулы) приводит к неспособности продуцировать цитокины и впоследствии неспособности к пролиферации. Таким образом, неспособность продуцировать цитокины препятствует пролиферации. Анергичные Т-клетки, однако, пролиферируют при культивировании с цитокинами (например, ИЛ-2). Например, Т-клеточная анергия также может наблюдаться при недостаточности продукции ИЛ-2 Т-лимфоцитами, определенной способом ИФА или анализом пролиферации, с использование индикаторной клеточной линии. Альтернативно может быть использована конструкция гена-репортера. Например, анергичные Т-клетки не могут инициировать транскрипцию гена DL-2, индуцированную гетерологичным промотором под контролем энхансера гена 5'-IL-2 или мультимера API последовательности, которую возможно обнаружить в энхансере (Kang et al. 1992 Science. 257:1134).
[0059] В данном контексте термин "иммунологическая толерантность" относится к способам, воплощаемым на части субъектов, получавших лечение, по сравнению с субъектами, не получавшими лечения, где: а) снижен уровень специфического иммунологического ответа (считается опосредованным, по меньшей мере, частично антигенспецифическими эффекторными Т-лимфоцитами, В-лимфоцитами, антителом или их эквивалентами), b) задержка начала или прогрессирования конкретного иммунного ответа, или с) снижен риск начала или развития конкретного иммунного ответа. "Специфическая" иммунологическая толерантность возникает, когда иммунологическая толерантность преимущественно обращена против определенных антигенов в сравнении с другими. "Неспецифическая" иммунологическая толерантность возникает, когда иммунологическая толерантность неизбирательно направлена против антигенов, приводящих к воспалительному иммунному ответу. "Квазиспецифическая" иммунологическая толерантность возникает, когда иммунологическая толерантность направлена полуизбирательно против антигенов, приводящих к патогенному иммунному ответу, но не против других, приводящих к защитному иммунному ответу.
[0060] Передача толерогенной активности является способностью частицы стимулировать продукцию соответствующего цитокина в требуемом месте. Иммунорегуляторным цитокином, продуцируемым Т-супрессорными клетками в сайте-мишени, как полагают, является ТФР-β (Miller et al., Proc. Natl. Acad. Sci. USA 89:421, 1992). Другими факторами, которые могут продуцироваться при толерантности, являются цитокины ИЛ-4 и ИЛ-10 и медиатор PGE. Наоборот, лимфоциты в тканях, подвергающихся активному иммунному разрушению, секретируют цитокины, такие как ИЛ-1, ИЛ-2, ИЛ-6 и ИФНγ. Следовательно, эффективность модифицированной частицы может быть оценена путем измерения ее способности стимулировать соответствующий тип цитокинов.
[0061] С учетом этого может быть проведен быстрый скрининговый тест модифицированных частиц, эффективных слизистых связующих компонентов, эффективных комбинаций или эффективных режимов и графиков мукозального введения с использованием систем животных моделей. Животным на поверхность слизистой оболочки наносится испытуемая композиция частиц, и через некоторое время им вводят болезнетворный антиген или инфекционный агент. Выделяются клетки селезенки и культивируются in vitro в присутствии болезнетворного антигена или антигена, полученного из инфекционного агента, в концентрации примерно 50 мкг/мл. Секреция цитокинов в среду может количественно оценена стандартным иммуноанализом.
[0062] Способность частиц подавлять активность клеток может быть определена с использованием клеток, выделенных из животных, иммунизированных модифицированными частицами, или путем создания линии клеток, реагирующей на болезнетворный антиген или вирусный антиген к мишени (Ben-Nun et al., Eur. J. Immunol. 11:195, 1981). В одном из вариантов этого эксперимента популяция клеток супрессоров слабо облучена (примерно от 1000 до 1250 рад) для предотвращения пролиферации, супрессоры культивируются совместно с иммунореактивными клетками, а затем используется меченный тритием тимидин (или МТТ) для количественной оценки пролиферативной активности иммунореактивных клеток. В другом варианте популяция клеток супрессоров и популяция иммунореактивных клеток культивируются на верхних и нижних уровнях двухкамерной культуральной системы Трансвелл (Costar, Cambridge Mass.), что позволяет совместное инкубировать популяции в пределах 1 мм друг от друга, разделяемых поликарбонатной мембраной (WO 93/16724). В данном способе облучение популяции клеток супрессоров не является необходимым, так как пролиферативную активность иммунореактивных клеток возможно измерить отдельно.
[0063] Эффективность композиций и способов введения для лечения конкретного заболевания также может быть достигнута на соответствующей животной модели заболевания. Способность лечения ослаблять или отсрочивать симптоматику заболевания контролируется на уровне циркулирующих биохимических и иммунологических признаков заболевания, иммуногистологического исследования пораженной ткани и суммарных клинических признаков в зависимости от используемой модели. Неограничивающие примеры животных моделей, которые возможно использовать для тестирования, включены в следующий раздел.
[0064] Изобретение рассматривает моделирование толерантности путем моделирования TH1 ответа, TH2 ответа, TH17 ответа или сочетание этих ответов. Моделирование TH1 ответа охватывает изменение экспрессии, например, интерферона гамма. Моделирование ответа TH2 охватывает изменение экспрессии, например, любой комбинации ИЛ-4, ИЛ-5, ИЛ-10 и ИЛ-13. Как правило, увеличение (уменьшение) TH2 ответа будет включать в себя увеличение (уменьшение) экспрессии, по меньшей мере, одного из ИЛ-4, ИЛ-5, ИЛ-10 или ИЛ-13; более типично увеличение (уменьшение) TH2 ответа будет включать в себя увеличение экспрессии, по меньшей мере, двух из ИЛ-4, ИЛ-5, ИЛ-10 или ИЛ-13; наиболее типично увеличение (уменьшение) TH2 ответа будет включать в себя увеличение, по меньшей мере, трех ИЛ-4, ИЛ-5, ИЛ-10 или ИЛ-13, а в идеале увеличение (уменьшение) TH2 ответа будет включать в себя увеличение (уменьшение) экспрессии всех ИЛ-4, ИЛ-5, ИЛ-10 и ИЛ-13. Моделирование TH17 включает в себя изменение экспрессии, например, ТФР-бета, ИЛ-6, ИЛ-21 и ИЛ-23 и влияние на уровни ИЛ-17, ИЛ-21 и ИЛ-22.
[0065] Толерантность к аутоантигенам и аутоиммунному заболеванию достигается при помощи различных механизмов, в том числе негативной селекции самореактивных Т-клеток в тимусе и механизмов периферической толерантности для тех аутореактивных Т-клеток, которые избегают тимусную делецию и могут быть обнаружены на периферии. Примеры механизмов, которые обеспечивают периферическую Т-клеточную толерантность, включают "игнорирование" собственных антигенов, анергию или отсутствие ответа на аутоантиген, цитокиновую иммунную девиацию и индуцированную активацией гибель самореактивных Т-клеток. Кроме того, было показано, что регуляторные Т-клетки участвуют в обеспечении периферической толерантности. См., например, Walker et al. (2002) Nat. Rev. Immunol. 2: 11-19; Shevach et al. (2001) Immunol. Rev. 182:58-67. В некоторых ситуациях теряется (или нарушается) периферическая толерантность к аутоантигену и следует аутоиммунный ответ. Например, на животной модели EAE было показано, что активация антигенпредставляющих клеток (АРК) через TLR врожденные иммунные рецепторы нарушает аутотолерантность и приводит к индукции ЕАЕ (Waldner et al. (2004) J. Clin. Invest. 113:990-997).
[0066] В этой связи в некоторых вариантах воплощения настоящее изобретение описывает способы увеличения презентации антигена при одновременном подавлении или снижении TLR7/8, TLR9 и/или TLR 7/8/9 зависимой клеточной стимуляции. Как описано в настоящем документе, введение конкретных модифицированных частиц приводит к презентации антигена ДК или АПК при одновременной супрессии TLR 7/8, TLR9 и/или \TLR7/8/9-зависимых клеточных ответов, связанных с иммуностимулирующими полинуклеотидами. Такая супрессия может включать снижение уровней одного или более TLR-ассоциированных цитокинов.
[0067] Как описано выше, настоящее изобретение предлагает новые соединения, которые обладают биологическими свойствами, полезными при лечении расстройств, опосредованных Mac-1 и LFA-1.
[0068] В этой связи в другом аспекте настоящего изобретения предлагаются фармацевтические композиции, содержащие карбоксилированные частицы и, необязательно, содержащие фармацевтически приемлемый носитель. В некоторых вариантах воплощения настоящего изобретения эти композиции необязательно содержат один или более дополнительных терапевтических агентов. Альтернативно, модифицированные частицы согласно настоящему изобретению можно вводить пациенту, нуждающемуся в этом, в сочетании с введением одного или нескольких других терапевтических агентов. Например, дополнительные терапевтические агенты для совместного введения или включения в фармацевтическую композицию с соединением согласно настоящему изобретению, могут быть утвержденным противовоспалительным агентом или могут быть любым из числа агентов, проходящих утверждение в Food and Drug Administration, которые в конечном итоге получат разрешение для лечения любого расстройства, характеризующегося неконтролируемым воспалительным иммунным ответом или бактериальной или вирусной инфекцией. Следует также принять во внимание, что некоторые модифицированные частицы согласно настоящему изобретению могут существовать в свободной форме для лечения или, при необходимости, в качестве их фармацевтически приемлемого производного.
[0069] Фармацевтические композиции согласно настоящему изобретению дополнительно содержат фармацевтически приемлемый носитель, который, в данном контексте, включает любой и все растворители, разбавители или другой жидкий носитель, диспергирующие или суспендирующие вещества, поверхностно-активные вещества, изотонические вещества, загустители или эмульгаторы, консерванты, твердые связующие вещества, смазывающие вещества и тому подобное, подходящие для конкретной желаемой лекарственной формы. Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) описывает различные носители, используемые при разработке фармацевтических композиций, и известные способы их получения. За исключением тех случаев, когда стандартная несущая среда является несовместимой с соединениями согласно настоящему изобретению, например, создавая любой нежелательный биологический эффект или взаимодействуя другим пагубным образом с любым другим компонентом(ами) фармацевтической композиции, ее использование предусматривается в рамках настоящего изобретения. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не ограничиваются, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; вспомогательные вещества, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло; сафлоровое масло, кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли; такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат, агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатно-буферные растворы, а также другие нетоксичные совместимые смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, антиадгезивы, покровные вещества, подсластители, вкусовые агенты и ароматизаторы, консерванты и антиоксиданты, которые также могут присутствовать в композиции в соответствии с решением разработчика рецептуры.
[0070] Жидкие лекарственные формы для перорального введения включают в виде неограничивающих примеров фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие лекарственные формы могут содержать инертные разбавители, общепринятые в данной области, такие как, например, вода или другие растворители, солюбилизираторы и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, зародышевое, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и эфиры жирных кислот сорбитана и их смеси. Помимо инертных разбавителей, пероральные композиции могут также включать адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие вещества, подсластители, вкусовые агенты и ароматизаторы.
[0071] Инъекционные формы, например стерильные инъекционные водные или масляные суспензии, могут быть разработаны в соответствии с известным уровнем техники с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих веществ. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор, суспензию или эмульсию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые могут быть использованы, находятся вода, раствор Рингера (согласно Фармакопее США) и изотонический раствор хлорида натрия. В дополнение к этому в качестве растворителя или суспендирующей среды традиционно используют стерильные нелетучие масла. Для этой цели может быть использовано любое мягкое нелетучее масло, в том числе синтетические моно- или диглицериды. В дополнение к этому для получения инъекционных форм используются жирные кислоты, такие как олеиновая кислота.
[0072] Инъекционные лекарственные формы могут быть простерилизованы, например, фильтрованием через фильтр, удерживающий бактерии, или введением стерилизующих веществ в форму стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной инъекционной среде перед использованием.
[0073] Для продления эффекта лекарственного средства часто желательным будет замедлить абсорбцию лекарственного средства при подкожном или внутримышечном введении. Это может быть достигнуто путем использования жидкой суспензии или кристаллического или аморфного материала с плохой растворимостью в воде. Тогда скорость абсорбции лекарственного средства зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, замедленное всасывание парентерально вводимой лекарственной формы достигается путем растворения или суспендирования лекарственного средства в масляном носителе. Инъекционные депо-формы получают путем формирования микрокапсульных матриц лекарственного средства в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения лекарственного средства и полимера и природы конкретного используемого полимера возможно контролировать скорость высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают полиортоэфиры и полиангидриды. Инъекционные лекарственные депо-формы также получают путем включения лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями организма.
[0074] Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах модифицированные частицы смешивают, по меньшей мере, с одним инертным фармацевтически приемлемым вспомогательным веществом или носителем, таким как цитрат натрия или дикальций фосфат и/или а) наполнителями или разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, с) увлажнителями, такими как глицерин, d) дезинтегрирующими веществами, такими как агар-агар, карбонат кальция, картофельный крахмал или маниоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, е) агентами, замедляющими растворение, такими как парафин, f) ускорителями абсорбции, такими как четвертичные аммониевые соединения, g) смачивающими веществами, такими как, например, цетиловый спирт и моностеарат глицерина, h) абсорбентами, такими как каолин и бентонитовая глина и і) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль лекарственные формы могут также содержать буферные вещества.
[0075] Твердые лекарственные формы подобного типа могут также применяться в качестве наполнителей в желатиновых капсулах, заполняемых в мягком и твердом состоянии, с использованием таких вспомогательных веществ, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и тому подобное. Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области фармацевтической разработки. Они могут необязательно содержать затемнители и могут также быть композицией, высвобождающей активный ингредиент(ы) только или предпочтительно в определенной части кишечного тракта, необязательно замедленным образом. Примеры погружаемых композиций, которые могут быть использованы, включают полимерные вещества и воски. Твердые композиции подобного типа могут также применяться в качестве наполнителей в желатиновых капсулах, заполняемых в мягком и твердом состоянии, с использованием таких вспомогательных веществ, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и тому подобное.
[0076] Модифицированные частицы также могут быть в микрокапсулированной форме с одним или несколькими вспомогательными веществами, как уже отмечалось. Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия, контролирующими высвобождение покрытиями и другими покрытиями, хорошо известными в области фармацевтической разработки. В таких твердых лекарственных формах активное соединение может быть смешано, по меньшей мере, с одним инертным разбавителем, таким как сахароза, лактоза и крахмал. Такие лекарственные формы могут также содержать, как в обычной практике, дополнительные вещества, отличные от инертных разбавителей, например, таблетированные смазывающие вещества и другие вспомогательные вещества для таблетирования, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль лекарственные формы могут также содержать буферные вещества. Они могут необязательно содержать рентгенконтрастные вещества и также могут быть композицией, высвобождающей модифицированные частицы только или предпочтительно в определенной части кишечного тракта, необязательно замедленным образом. Примеры погружаемых композиций, которые могут быть использованы, включают полимерные вещества и воски.
[0077] Настоящее изобретение охватывает фармацевтически приемлемые лекарственные формы для наружного применения модифицированных частиц согласно настоящему изобретению. Термин "фармацевтически приемлемая лекарственная форма для наружного применения" в данном контексте означает любую лекарственную форму, которая является фармацевтически приемлемой для внутрикожного введения модифицированных микрочастиц согласно настоящему изобретению путем нанесения лекарственной формы на эпидермис. В некоторых вариантах воплощения настоящего изобретения фармацевтически приемлемая лекарственная форма для наружного применения содержит систему-носитель. Фармацевтически эффективные носители включают в качестве неограничивающих примеров растворители (например, спирты, полиспирты, вода), крема, лосьоны, мази, масла, пластыри, липосомы, порошки, эмульсии, микроэмульсии и забуференные растворы (например, гипотонический или забуференный физиологический раствор) или любой другой носитель, известный в области лекарственных препаратов для наружного применения. Более полный перечень известных в данной области носителей приведен в текстах ссылок, которые являются стандартными в данной области, например, в Remington's Pharmaceutical Sciences, 16th Edition, 1980 и 17th Edition, 1985, оба опубликованы Mack Publishing Company, Easton, Pа., содержание которых включено во всей полноте в настоящий документ посредством ссылки. В некоторых других вариантах воплощения настоящего изобретения лекарственные формы для наружного применения согласно настоящему изобретению могут содержать вспомогательные вещества. Любое фармацевтически приемлемое вспомогательное вещество, известное в данной области, может быть использовано для получения фармацевтически приемлемых лекарственных форм для наружного применения согласно настоящему изобретению. Примеры вспомогательных веществ, которые могут быть включены в лекарственные формы для наружного применения согласно настоящему изобретению включают в качестве неограничивающих примеров консерванты, антиоксиданты, увлажнители, смягчающие вещества, буферные вещества, солюбилизаторы, другие агенты для проникновения, вещества, защищающие кожу, поверхностно-активные вещества и пропелленты и/или дополнительные терапевтические агенты, используемые в сочетании с модифицированными частицами. Подходящие консерванты включают в качестве неограничивающих примеров спирты, четвертичные амины, органические кислоты, парабены и фенолы. Подходящие антиоксиданты включают в качестве неограничивающих примеров аскорбиновую кислоту и ее сложные эфиры, бисульфит натрия, бутилированный гидрокситолуол, бутилированный гидроксианизол, токоферолы и хелатные агенты, такие как ЭДТА и лимонная кислота. Подходящие увлажнители включают в качестве неограничивающих примеров глицерин, сорбит, полиэтиленгликоли, мочевину и пропиленгликоль. Подходящие буферные агенты для использования согласно настоящему изобретению включают в качестве неограничивающих примеров лимоннокислый, солянокислый и молочнокислый буферы. Подходящие солюбилизаторы включают в качестве неограничивающих примеров хлориды четвертичного аммония, циклодекстрины, бензилбензоат, лецитин, полисорбаты. Подходящие вещества, защищающие кожу, которые могут быть использованы в лекарственных формах для наружного применения согласно настоящему изобретению, включают в качестве неограничивающих примеров масляный раствор витамина Е, аллатоин, диметикон, глицерин, вазелин и оксид цинка.
[0078] В некоторых вариантах воплощения настоящего изобретения фармацевтически приемлемые лекарственные формы для наружного применения согласно настоящему изобретению, по меньшей мере, содержат модифицированные частицы согласно настоящему изобретению и агент, усиливающий проникновение. Выбор лекарственной формы для наружного применения будет зависеть от нескольких факторов, включая состояние, подлежащее лечению, физико-химические характеристики соединения согласно настоящему изобретению и других присутствующих вспомогательных веществ, их стабильность в лекарственной форме, доступное производственное оборудование и ограничения на издержки. В данном контексте термин "агент, усиливающий проникновение" означает агент, способный транспортировать фармакологически активное соединение через роговой слой и в эпидермис и дерму, предпочтительно практически с малой или без системной абсорбции. Широкий круг соединений был оценен в отношении их эффективности в повышении скорости проникновения лекарственных средств через кожу. См., например, Percutaneous Penetration Enhancers, Maibach H. I.и Smith H. E. (eds.), CRC Press, Inc., Boca Raton, Fla. (1995), в котором приведен обзор использования и тестирования различных усилителей проникновения через кожу, и Buyuktimkin et al., Chemical Means of Transdermal Drug Permeation Enhancement in Transdermal и Topical Drug Delivery Systems, Gosh T. K., Pfister W. R., Yum S. I. (Eds.), Interpharm Press Inc., Buffalo Grove, Ill. (1997). В некоторых примерных вариантах воплощения настоящего изобретения агенты, усиливающие проникновение для использования в настоящем изобретении, включают в качестве неограничивающих примеров триглицериды (например, соевое масло), композиции с алоэ (например, гель алоэ вера), этиловый спирт, изопропиловый спирт, октолифенилполиэтиленгликоль, олеиновую кислоту, полиэтиленгликоль 400, пропиленгликоль, N-децилметилсульфоксид, сложные эфиры жирных кислот (например, изопропилмиристат, метиллаурат, глицерин моноолеат и пропиленгликоль моноолеат) и N-метилпирролидон.
[0079] В некоторых вариантах воплощения настоящего изобретения композиции могут быть в виде мазей, паст, кремов, лосьонов, гелей, порошков, растворов, спреев, ингаляторов или пластырей. В некоторых примерных вариантах воплощения настоящего изобретения лекарственные формы композиций согласно настоящему изобретению являются кремами, которые могут дополнительно содержать насыщенные или ненасыщенные жирные кислоты, такие как стеариновая кислота, пальмитиновая кислота, олеиновая кислота, пальмитоолеиновая кислота, цетиловый или олеиловый спирты, при этом стеариновая кислота является особенно предпочтительной. Крема согласно настоящему изобретению могут также содержать неионогенное поверхностно-активное вещество, например, полиокси-40-стеарат. В некоторых вариантах воплощения настоящего изобретения активный компонент при необходимости смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами. Офтальмологическая лекарственная форма, ушные капли и глазные капли также предусматриваются как входящие в объем настоящего изобретения. Кроме того, настоящее изобретение предусматривает применение чрескожных пластырей, которые имеют дополнительное преимущество в обеспечении контролируемой доставки соединения в тело. Такие лекарственные формы получают путем растворения или диспергирования соединения в соответствующей среде. Как отмечалось выше, агенты, усиливающие проникновение, также могут быть использованы для увеличения потока соединения через кожу. Скорость может контролироваться либо при помощи мембраны, регулирующей скорость, либо диспергированием соединения в полимерной матрице или геле.
[0080] Модифицированные частицы могут быть введены в виде аэрозоля. Это достигается путем приготовления водного аэрозоля, липосомного лекарственного препарата или твердых частиц, содержащих модифицированные частицы. Может быть использована неводная суспензия (например, фторуглеродный пропеллент).
[0081] Как правило, водный аэрозоль получен путем объединения водного раствора или суспензии агента вместе с традиционными фармацевтически приемлемыми носителями и стабилизаторами. Носители и стабилизаторы варьируют в зависимости от требований конкретного соединения, однако обычно включают неионогенные поверхностно-активные вещества (Tweens, Pluronics или полиэтиленгликоль), нетоксичные белки, такие как сывороточный альбумин, сложные эфиры сорбитана, олеиновую кислоту, лецитин, аминокислоты, такие как глицин, буферы, соли, сахара или сахароспирты. Аэрозоли обычно изготавливают из изотонических растворов.
[0082] Следует принимать во внимание, что модифицированные частицы и фармацевтические композиции согласно настоящему изобретению могут быть разработаны и использованы в комбинированных способах лечения, то есть соединения и фармацевтические композиции могут быть разработаны с или одновременно введены с, до или после, одного или более желаемых терапевтических средств или медицинскими процедурами. Конкретное сочетание способов лечения (терапевтических средств или процедур) для использования в комбинированном режиме будет принимать во внимание совместимость желаемых терапевтических средств и/или процедур и желаемого терапевтического эффекта, который необходимо достичь. Следует принимать во внимание, что используемые способы лечения могут достичь желаемого эффекта для того же расстройства (например, соединение согласно настоящему изобретению может вводиться одновременно с другим противовоспалительным агентом), или они могут достичь различных эффектов (например, контроль любых побочных действий).
[0083] В некоторых вариантах воплощения настоящего изобретения фармацевтические композиции, содержащие модифицированные частицы согласно настоящему изобретению, дополнительно содержат один или несколько дополнительных терапевтически активных ингредиентов (например, противовоспалительный и/или паллиативный). Для целей настоящего изобретения термин "паллиативный" относится к лечению, которое сфокусировано на облегчении симптомов заболевания и/или побочных эффектов терапевтического режима, но не является лечебным. Например, паллиативное лечение включает обезболивающие препараты, противорвотные препараты и препараты против укачивания.
[0084] Изобретение предлагает способы регулирования иммунного ответа у индивидуума, предпочтительно у млекопитающего, более предпочтительно у человека, включающие введение указанному индивидууму модифицированных частиц, описанных в настоящем документе. Способы иммунорегуляции, предлагаемые настоящим изобретением, включают способы, подавляющие и/или ингибирующие врожденный иммунный ответ или адаптивный иммунный ответ, включая в качестве неограничивающих примеров иммунный ответ, активированный иммуностимулирующими полипептидами или вирусными или бактериальными компонентами.
[0085] Модифицированные частицы вводят в количестве, достаточном для регуляции иммунного ответа. Как описано в настоящем документе, регуляция иммунного ответа может быть гуморальной и/или клеточной и измеряется с использованием стандартных способов в данной области и как это описано в настоящем документе.
[0086] В некоторых вариантах воплощения настоящего изобретения индивидуум страдает от расстройства, связанного с нежелательной иммунной активацией, такого как аллергическое заболевание или состояние, аллергия и астма. Индивидуум, имеющий аллергическое заболевание или астму, является индивидуумом с узнаваемым симптомом существующего аллергического заболевания или астмы.
[0087] В некоторых вариантах воплощения настоящего изобретения индивидуум страдает от расстройства, связанного с нежелательной иммунной активацией, такого как атеросклероз, ишемическое реперфузионное повреждение и инфаркт миокарда.
[0088] В некоторых вариантах воплощения настоящего изобретения индивидуум страдает от расстройства, связанного с нежелательной иммунной активацией, такого как аутоиммунное заболевание и воспалительное заболевание. Индивидуум, имеющий аутоиммунное заболевание или воспалительное заболевание, является индивидуумом с узнаваемым симптомом существующего аллергического заболевания или воспалительного заболевания.
[0089] Аутоиммунные заболевания возможно разделить на две большие категории: органо-специфические и системные. Аутоиммунные заболевания включают, без ограничения, ревматоидный артрит (РA), системную красную волчанку (СКВ), сахарный диабет I типа, сахарный диабет типа II, рассеянный склероз (РС), иммунное бесплодие, такое как преждевременное угасание функции яичников, склеродермия, болезнь Шегрена, витилиго, алопецию (облысение), полигландулярную недостаточность, болезнь Грейвса, гипотиреоз, полимиозит, обыкновенную пузырчатку, эксфолиативную пузырчатку, воспалительное заболевание кишечника, включая болезнь Крона и язвенный колит, аутоиммунный гепатит, включая ассоциированный с вирусом гепатита В (HBV) и вирусом гепатита С (HCV), гипопитуитаризм, реакция трансплантат-против-хозяина (РТПХ), миокардит, болезнь Аддисона, аутоиммунные заболевания кожи, увеит, пернициозную анемию и гипопаратиреоз.
[0090] Аутоиммунные заболевания могут в том числе включать, без ограничения, тиреоидит Хашимото, аутоиммунные полигландулярные синдромы I типа и II типа, паранеопластическую пузырчатку, буллезный пемфигоид, герпетиформный дерматит, IgA зависимый линейный дерматоз, приобретенный буллезный эпидермолиз, узелковую эритему, гестационный пемфигоид, рубцовый пемфигоид, эссенциальную смешанную криоглобулинемию, хроническое буллезное заболевание детей, гемолитическую анемию, тромбоцитопеническую пурпуру, синдром Гудпасчера, аутоиммунную нейтропению, миастению гравис, миастенический синдром Итона-Ламберта, синдром скованного человека, острый рассеянный энцефаломиелит, синдром Гийена-Барре, хроническую воспалительную демиелинизирующую полирадикулонейропатию, мультифокальную моторную нейропатию с блоком проводимости, хроническую нейропатию с моноклональной гаммапатией, опсоклонус-миоклонус синдром, мозжечковую дегенерацию, энцефаломиелит, ретинопатию, первичный билиарный склероз, склерозирующий холангит, глютен-чувствительную энтеропатию, анкилозирующий спондилит, реактивные артриты, полимиозит/дерматомиозит, смешанное заболевание соединительной ткани, синдром Бехчета, псориаз, узелковый полиартериит, аллергический васкулит и гранулематоз (болезнь Черга-Страусс), поливаскулит с синдромом перекрывания, аллергический васкулит, гранулематоз Вегенера, темпоральный артериит, артериит Такаясу, болезнь Кавасаки, изолированный васкулит центральной нервной системы, облитерирующий тромбоваскулит, саркоидоз, гломерулонефрит и криопатии. Эти условия хорошо известны в области медицины и описаны, например, в Harrison's Principles of Internal Medicine, 14th ed., Fauci A S et al., eds., New York: McGraw-Hill, 1998.
[0091] Животные модели для исследования аутоиммунных заболеваний известны в данной области. Например, животные модели, которые являются наиболее похожими на аутоиммунное заболевание человека, включают животных штаммы, у которых спонтанно развивается отдельное заболевание с высокой частотой возникновения. Примерами таких моделей в качестве неограничивающих примеров являются не страдающая ожирением диабетическая (NOD) мышь, у которой развивается заболевание, сходное с диабетом I типа, и животные, склонные к волчаночному заболеванию, такие как New Zealand гибрид, MRL-Faslpr и BXSB мыши. Животные модели, в которых было индуцировано аутоиммунное заболевание, включают в качестве неограничивающих примеров экспериментальный аутоиммунный энцефаломиелит (ЕАЕ), который является моделью рассеянного склероза, коллаген-индуцированный артрит (CIA), который является моделью ревматоидного артрита, а также экспериментальный аутоиммунный увеит (EAU), который является моделью для увеита. Животные модели для аутоиммунных заболеваний также были созданы путем генетической манипуляции и включают, например, ИЛ-2/ИЛ-10-нокаутных мышей для воспалительного заболевания кишечника, нокаутных мышей, дефицитных по Fas- или Fas-лиганду для СКВ, и нокаутных мышей, дефицитных по антагонисту рецептора ИЛ-1 для ревматоидного артрита.
[0092] В некоторых вариантах воплощения настоящего изобретения индивидуум страдает от бактериальной или вирусной инфекции. Индивидуум, имеющий бактериальную или вирусную инфекцию, является индивидуумом с узнаваемым симптомом существующей бактериальной или вирусной инфекции.
[0093] Неограничивающий перечень вирусных инфекций, поддающихся лечению модифицированными частицами согласно настоящему изобретению, включает герпевирусные инфекции, инфекции вируса гепатита, инфекции вируса Западного Нила, инфекции флавивируса, виды гриппа, риновирусные инфекции, папилломавирусные инфекции, инфекции паромиксовируса, инфекции вируса парагриппа и ретровирусные инфекции. Предпочтительными вирусами являются те вирусы, которые инфицируют центральную нервную систему субъекта. Наиболее предпочтительными вирусами являются те, которые вызывают энцефалит или менингит.
[0094] Неограничивающий перечень бактериальных инфекций, поддающихся лечению модифицированными частицами согласно настоящему изобретению, включает стафилококковые инфекции, стрептококковые инфекции, микобактериальные инфекции, палочковые инфекции, инфекции Salmonella, инфекции Vibrio, спирохетовые инфекции и инфекции Neisseria. Предпочтительными являются бактерии, которые инфицируют центральную нервную систему субъекта. Наиболее предпочтительными являются бактерии, вызывающие энцефалит или менингит.
[0095] В некоторых вариантах воплощения настоящее изобретение относится к использованию композиций согласно настоящему изобретению до начала заболевания. В других вариантах воплощения настоящее изобретение относится к использованию композиций согласно настоящему изобретению для ингибирования текущего заболевания. В некоторых вариантах воплощения настоящее изобретение относится к устранению заболевания у субъекта. Под устранением заболевания у субъекта подразумевается лечение, профилактика или подавления болезни у субъекта.
[0096] В некоторых вариантах воплощения настоящее изобретение относится к предотвращению рецидива заболевания. Например, нежелательный иммунный ответ может возникнуть в определенной области пептида (такой как антигенная детерминанта). Рецидив заболевания, связанный с нежелательным иммунным ответом, может происходить при атаке иммунным ответом различных областей пептида. Поскольку карбоксилированные частицы согласно настоящему изобретению свободны от прикрепленных пептидов или антигенных фрагментов, частицы будут эффективны против нескольких эпитопов. Т-клеточные ответы при некоторых нарушениях иммунного ответа, в том числе РС и другие TH1/17-опосредованные аутоиммунные заболевания, могут быть динамическими и развиваться в течение рецидивирующе-ремиттирующего и/или хронического прогрессирующего заболевания. Динамическая природа Т-клеточного репертуара имеет значение для лечения некоторых заболеваний, так как цель может измениться по мере прогрессирования заболевания. Ранее уже существующее знание схем ответов было необходимо для предсказания прогрессирования заболевания. Настоящее изобретение предлагает композиции, которые могут предотвратить эффект динамически изменяющегося заболевания, функцию "рассеяния эпитопа". Известной моделью рецидива является иммунная реакция на протеолипидный белок (ПЛП) в качестве модели рассеянного склероза (РС). Начальный иммунный ответ может происходить в ответ на PLP139-151. Последующее начало заболевания может произойти путем рецидивирующего иммунного ответа на PLP151-171.
[0097] Некоторые варианты воплощения настоящего изобретения относятся к лечению патологических состояний, связанных с нежелательной гиперчувствительностью. Гиперчувствительность может иметь любой из типов I, II, III и IV. Гиперчувствительность немедленного типа (тип I). Частота введения, как правило, будет соответствовать времени воздействия аллергена. Подходящие животные модели известны в данной области (например, Gundel et al., Am. Rev. Respir. Dis. 146:369, 1992, Wada et al., J. Med. Chem. 39, 2055, 1996; и WO 96/35418).
[0098] Другие варианты воплощения настоящего изобретения относятся к трансплантации. Речь идет о пересадке образца ткани или трансплантата от донора к реципиенту и часто выполняется для людей, нуждающихся в ткани с целью восстановления физиологических функций, обеспечиваемых тканью. Трансплантируемые ткани включают (в качестве неограничивающих примеров) целые органы, такие как почка, печень, сердце, легкие, части органов, такие как трансплантаты кожи и роговица глаза; и суспензии клеток, таких как клетки костного мозга и культуры клеток, отобранные и культивированные из костного мозга или периферической крови, и переливания цельной крови.
[0099] Серьезное потенциальное осложнение любой трансплантации вытекает из антигенных различий между реципиентом и трансплантируемой тканью. В зависимости от характера и степени различия, может присутствовать риск иммунологической атаки на трансплантат хозяином или трансплантатом на хозяина, или оба случая могут иметь место. Степень риска определяется путем отслеживания образца ответа в популяции субъектов, получавших одно лечение и имеющих одинаковый фенотип, с корреляцией различных возможных факторов в соответствии с общепринятыми клиническими процедурами. Иммунологическая атака может быть результатом существующего иммунного ответа (например, предварительно образованное антитело) или ответа, инициированного трансплантацией (например, генерация TH-клеток). Антитело, Т-хелперные (TH) клетки или цитотоксические Т (Tc)-клетки могут быть вовлечены в любой комбинации друг с другом и с различными эффекторными молекулами и клетками. Однако антигены, вовлеченные в иммунный ответ, как правило, неизвестны, тем самым создавая трудности в разработке антигенспецифических способов лечения или индукции антигенспецифической толерантности. Модифицированные частицы согласно настоящему изобретению особенно полезны в профилактике отторжения органов, поскольку не нужно конъюгировать прикрепленные пептиды или антигены с модифицированными частицами для того, чтобы частицы были эффективными в индукции толерантности или устранении воспалительного иммунного ответа.
[00100] Некоторые варианты воплощения настоящего изобретения относятся к снижению риска реакции трансплантат-против-хозяина, приводящей к отторжению тканевого трансплантата реципиентом. Лечение может быть проведено для предотвращения или снижения влияния гиперострого, острого или хронического отторжения. Лечение преимущественно инициируется достаточно заблаговременно до трансплантации, так что к моменту введения трансплантата уже будет сформирована толерантность; но там, где это невозможно, лечение может быть начато одновременно с или после трансплантации. Независимо от времени начала, лечение обычно продолжают с регулярными интервалами, по меньшей мере, первый месяц после трансплантации. Последующих доз может не потребоваться при наличии удовлетворительного приспособления трансплантата, но их введение может быть возобновлено, если есть какие-либо доказательства отторжения или воспаления трансплантата. Конечно, процедуры толеризации согласно настоящему изобретению могут быть объединены с другими формами иммуносупрессии для достижения еще более низкого уровня риска.
ПРИМЕРЫ
[00101] Следующие примеры предназначены для дальнейшей иллюстрации преимуществ и характеристик настоящего изобретения, но не ограничивают объем настоящего изобретения.
Материалы и способы
Культивирование вируса
[00102] Как описано ранее (Getts et al., J Neurochem. 103:1019, 2007) вирус Западного Нила (штамм Sarafend) был получен из мозга новорожденных мышей и использован для заражения монослоев конфлюэнтных клеток Vero, с множественностью инфицирования 5 бляшкообразующих единиц (БОЕ) на клетку. Клетки инкубировали с вирусом в течение 40 часов при 37°С, после чего они были заморожены. Колбы затем оттаивали, и супернатант, насыщенный вирусом, осветляли центрифугированием, после чего аликвоты хранили при -70°С до использования.
Мыши и инфекция
[00103] C57BL/6 (CD45.2) самки в возрасте от 8 до 12 недель и конгенные B6.SJL-PtprcaPep3b/BoyJ (CD45.1) мыши были получены из Animal Resources Center, Западная Австралия. C57BL/6-7.2fms-EGFP трансгенные (CD45.2) мыши были получены из Transgenic Animal Resources Center Queensland, Австралия. Все процедуры были выполнены с разрешения University of Sydney Animal Ethics Committee. Все животные содержались в условиях биологической опасности II класса в клетках с hepa-фильтром, расположенным вверху клетки. Пища и вода были предоставлены ad libitum.
[00104] Было проведено интраназальное инфицирование высокими дозами, как описано ранее, 6x104 БОЕ ВЗН в стерильном забуференном фосфатом физиологическом растворе (PBS; Gibco BRL, Калифорния, США). Для инфицирования низкой дозой мышей инокулировали 6x103 БОЕ ВЗН. Ложное инфицирование проведено путем инокуляции мышей только стерильным PBS. (Getts et al., J Neurochem. 103:1019, 2007, Wacher et al., J Virol. 81: 860, 2007)
[00105] После инфицирования мышей взвешивали дважды в день. Мышей умерщвляли под наркозом путем кардиальной перфузии с использованием 40 мл ледяного PBS. Для гистологического исследования мыши дополнительно были перфузированны 20 мл 4% параформальдегида (Sigma Aldrich, Сент-Луис, США) в PBS.
Анализ бляшкообразования для определения титра вируса
[00106] Для определения титров живого вируса в образцах тканей был проведен анализ бляшкообразования с использованием вирусовосприимчивых клеток ВНК (любезно предоставлены Guna Kapuriah, John Curtin Medical School, Канберра, Австралия). Как описано ранее (Getts et al., J Neurochem. 103: 1019, 2007), у животных были иссечены образцы ткани и разделены электронным гомогенизатором (Tissue Tearor, Biospec, Bartles, Оклахома, США). Краткое описание: пятикратные разведения осветленных гомогенатов были подготовлены в среде Roswell Park Memorial Institute 1640 (RPMI; CSL Biosciences) и использованы для инфицирования конфлюэнтных ВНК клеток в 6-луночных планшетах (1х106 клеток, высеянных в течение ночи в 2 мл среды RPMI).
[00107] Клетки инкубировали в течение 1 часа при 37°С, после чего инокуляты удаляли аспирацией. Лунки покрывали 3 мл 1,5% (о/в) легкоплавкой Agarose II (Amresco, Солон, Огайо, США) в 2X минимальной поддерживающей среде (MEM; GibcoBRL, Grand Island, Нью-Йорк, США). Клетки инкубировали в течение еще 3 дней при 37°С, после чего они были фиксированы 3 мл 10%-ного формалина (Со.) в течение 2 ч перед удалением агарозной пробки. 3%-ный раствор кристаллического фиолетового (Hopkins and Williams, Эссекс, Англия) в 20% метаноле (Fronine, Riverstone, Новый Южный Уэльс, Австралия) был использован для окрашивания фиксированных клеток. Бляшки были подсчитаны при помощи счетчика колоний (IUL S.A., Барселона, Испания), а окончательный БОЕ на грамм (ткань) был определен путем факторизации количества бляшек, объема инокулята и разведения образцов.
Получение химерных мышей
[00108] Как описано ранее (Getts et al., J Neurochem. 103: 1019, 2007), мыши B6.SJL-PtprcaPep3b/BoyJ (CD45.1) в возрасте от 6 до 8 недель были облучены одной дозой в 950 рад. Через двенадцать часов мышей восстанавливали 107 клетками костного мозга от C57BL/6-7.2fms-EGFP доноров. Мышам вводили сульфаметоксазол (Sigma Aldrich) и триметоприм (Sigma Aldrich) в питьевой воде в течение 10 дней после облучения. Через шесть недель после облучения мышей инфицировали ВЗН, как описано выше. Химеризация была проверена при помощи проточной цитометрии и устойчиво имела 96-99% донорского происхождения, как это было продемонстрировано ранее (Getts et al., J Neurochem. 103: 1019, 2007).
Внутривенное введение гранул
[00109] 0,5; 0,05 и 3 мкл FITC или голые Bright Blue (BB) Flouresbrite и карбоксилированные полистироловые гранулы были получены от PolyScience, Нью-Йорк, США. Голые гранулы полимолочной-со-гликолевой кислоты (PLGA) и карбоксилированные гранулы были получены от Phosphorex, Массачусетс, США.
[00110] Гранулы разводили в стерильном PBS, и 300 мкл вводили внутривенно в хвостовую вену инфицированных или ложно инфицированных мышей. Для исследования выживаемости при инфицировании высокой дозой (6x104 БОЕ ВЗН интраназально) мышам вводили одну дозу гранул каждый день, начиная с 6 дня после инфицирования. При необходимости мышам в дальнейшем инъекции делали каждый день, пока масса не рестабилизировалась. Для исследования выживаемости при инфицировании низкой дозой (6x103 БОЕ ВЗН интраназально) мышам вводили либо гранулы с 6 дня после инфицирования, либо в случае регистрировании значительной потери массы (4-6% от общей массы тела). Мышам вводили 300 мкл гранул один раз в день в течение 5 дней или до тех пор, пока масса не рестабилизировалась. Для отбора ткани мышам, инфицированным дозой 6x104 или 6x103, вводили 300 мкл гранул либо на 6 день после инфицирования, либо в случае регистрировании значительной потери массы, с последующей сортировкой при необходимости. Органы отбирали для иммуногистохимического анализа, проточной цитометрии, анализа бляшкообразования и анализа цитокинов, как описано ниже.
Иммуногистология
[00111] Флуоресцентную иммуногистохимию (IHC) проводили для мозга, селезенки, печени, легких и почек, отобранных у C57BL/6 и CFMS-EGFP (в B6.SJL-PtprcaPep3b/BoyJ) химер. После перфузии органы фиксировали в 4%-ном параформальдегиде при 4°С в течение 4 часов и затем погружали в 30%-ную сахарозу в течение ночи перед замораживанием в Optimum Cutting Temperature Compound (OCT; Tissue-Tek,Токио, Япония). Срезы тканей толщиной восемь микрон были получены на криостатном микротоме и высушены на воздухе. Флуоресцентная IHC была проведена, как описано ранее (Getts et al, J Exp Med. 29: 2319, 2007), с добавлением амплификационной системы на тирамиде (комплект TSA; Perkin Elmer, Бельгия), используемый в соответствии с инструкциями производителя. Срезы тканей перед визуализацией были контр-окрашены DAPI (Vector).
Микроскоп и получение изображений
[0100] Изображения были получены на микроскопе Olympus BX-51 (Olympus, Япония) с использованием DP-70 камеры и программного обеспечения DP manager 2.2.1 (Olympus).
Выделение лейкоцитов из головного мозга и печени
[0101] Лейкоциты были получены, как это описано ранее (Getts et al, J Exp Med. 29: 2319, 2007), из головного мозга мышей, перфузированных PBS, путем расщепления материала головного мозга в течение 60 минут при 37°С в PBS с дезоксирибонуклеазой (0,005 г/мл, Sigma Aldrich) и коллагеназой IV (0,05 г/мл, Sigma Aldrich). Расщепление останавливали добавлением 10% FCS, и гомогенат пропускали через нейлоновое сито с диаметром отверстий 70 мкм (Becton Dickinson, Нью-Джерси, США). Осадок, полученный после 10 минут, центрифугировали при 340xg, был ресуспендирован в 30% Percoll (Amersham, Норвегия) и наслоен на 80% Percoll. Лейкоциты были отобраны из 30%/80% пограничного слоя после центрифугирования при 1140xg в течение 25 минут при комнатной температуре. Тот же протокол также используется для получения лейкоцитов из печени, при этом ткань перед обработкой взвешивают.
Выделение лейкоцитов из селезенки, крови и костного мозга
[0102] Для анализа способом проточной цитометрии была иссечена правая бедренная кость, и клетки костного мозга промывали заполненными PBS шприцами. Для выделения предшественников костного мозга были использованы бедра и голени, по меньшей мере, 4 мышей. Клеточная суспензия, полученная после промывки, была профильтрована через клеточный фильтр с размером пор 70 мкм и центрифугирована в течение 5 минут при 340xg. Эритроциты в полученном осадке лизировали в буфере для лизиса эритроцитов на основе NH4Cl (BD Pharm LyseTM; BD Pharmingen), а затем центрифугировали в течение 5 минут при 340xg. В случае периферической крови кровь отбирали кардиальной пункцией и немедленно переносили в цитратный буфер (ммоль, Sigma Alrich). Полученная суспензия была наслоена на 70% Percoll и центрифугирована при 1140xg в течение 20 минут при комнатной температуре с растормаживанием. Пограничный слой был отобран, и клетки промывали один раз в PBS, центрифугировали при 340xg. Для выделения лейкоцитов селезенки, селезенки пропускали через клеточное сито с диаметром пор 7070 мкм и центрифугировали в течение 5 минут при 340xg. Эритроциты в полученном осадке лизировали в буфере для лизиса эритроцитов на основе NH4Cl (BD Pharm LyseTM; BD Pharmingen), а затем центрифугировали в течение 5 минут при 340xg.
Проточная цитометрия
[0103] Клетки, отобранные (как описано выше) из головного мозга, печени, крови и костного мозга, промывали в PBS и блокировали антителом к CD16/CD32 (BioLegend). Жизнеспособные клетки подсчитывали с использованием способа исключения трипанового синего, который постоянно показывал >95% жизнеспособности клеток.
[0104] Была измерена экспрессия молекулы на поверхности клетки, и распределение клеток было проведено на FACS ARIA (Becton Dickinson), оснащенном аргоновым ионным и гелий-неоновым лазером. Жизнеспособные популяции были стробированы прямым и угловым рассеянием, и после этого идентифицированные флуоресцентные популяции определяли по прогнозному стробированию. Сортировку проводили с использованием специфичных флуоресцентных параметров и параметров рассеяния, определяя популяции, представляющие интерес. Точность сортировки была установлена для достижения чистоты популяций костного мозга >98%.
[0105] Приобретенные файлы данных FACS были проанализированы с использованием программы проточной цитометрии Flow Jo (FlowJo, Ashland, Орегон, США). Количественное определение клеточных популяций, представляющих интерес, было проведено на основе процентов проточной цитометрии в ходе анализы и абсолютного количества клеток каждого органа.
Адоптивный перенос
[0106] Как популяции Ly6Chi/cFMS-EGFP+/CD11b+, так и популяции Ly6Clo/Cfms-EGFP+/CD11b+были отобраны от мышей, интраназально инфицированных ВЗН на 6 день. Ly6Chi BM был помечен 10 ммоль клеточного трекера оранжевого (CMTMR [5- (и -6)-(((4-хлорметил)бензоил)амино)тетраметилродамин)-смешанные изомеры; Invitrogen). Отсортированные клетки были центрифугированы и выращены в 1 мл PBS, содержащем 10 мкмоль CMTMR. Клетки окрашивали в течение 10 мин, после чего реакцию останавливали добавлением 10% FCS. Клетки промывали в 50 мл PBS, по меньшей мере, три раза. Помеченные CMTMR Ly6Chi ВМ клетки смешивали в соотношении 1:1 с клетками Ly6Clo, что, за исключением добавления CMTMR, было аналогично проведено для Ly6Chi популяций. В общей сложности 2×106 ВМ клеток были внутривенно введены либо мышам, инфицированным ВЗН на 6,5 день, или ложно-инфицированным Ly5.1-C57BL /6 конгенным мышам. За этим сразу же следовала внутривенная инъекция 300 мкл BB полистироловых гранул. Через 12 ч головной мозг, селезенки и печени отбирали способом, описанным выше. Наличие донорских клеток исследовали с использованием проточной цитометрии, с использованием как CFMS-EGFP, так и CMTMR-клеточного трекера оранжевого.
Мультиплексный ИФА
[0107] Мультиплексные ИФА на пластинках были выполнены в соответствии с инструкциями производителя (Quansys Biosciences, Logan, Юта, США). Краткое описание: головной мозг, селезенку, печень и ткани гомогенизировали в PBS, осветляли центрифугированием при 1000xg и хранили при -20 °С до проведения анализа. Образцы сыворотки также были использованы. Размороженные образцы и стандарты разводили в предоставленном буфере, и 30 мкл каждого вносили в каждый планшет, содержащий 16 лунок, каждая из которых содержит иммобилизованное антитело для конкретного растворимого белка. Затем планшеты инкубировали в течение 1 часа на орбитальном шейкере при 120 об/мин. Планшеты промывали трехкратно, и 30 мкл обнаруживаемых антител добавляли в каждую лунку и инкубировали в течение еще одного часа. После трехкратной промывки был добавлен стрептавидин-HRP и инкубирован еще в течение 15 минут. Планшеты затем промывали 6 раз, и добавляли смесь субстрата. С планшетов сразу же были сняты показания на ПЗС-датчике (Kodak, Rochester Нью-Йорк, США). Изображения пластин были проанализированы с использованием программного обеспечения Quansys Q-View (Quansys Biosciences).
Индукция и оценка экспериментального аутоиммунного энцефалита (ЕАЕ)
[0108] C57BL /6 мышам подкожно вводили эмульсию, содержащую 0,1 мг MOG пептида (MEVGWYRSPFSRVVHLYRNGK; Auspep, Парквилл, Виктория, Австралия;>95% очищенных ВЭЖХ) и полный адъювант Фрейнда, содержащий 2 мг/мл микобактерий туберкулеза (Sigma Aldrich). Через два дня мышам интраперитонеально вводили 500 мкл коклюшевого токсина (Sigma Aldrich). Мыши были проконтролированы на предмет прогрессирования заболевания и оценены по следующей шкале: 1, вялый хвост и/или слабость в одной задней конечности; 2, слабость более чем в одной конечности, нарушение походки; 3, паралич одной конечности; 4, паралич более, чем одной конечности, недержание мочи; 5, умирающие.
Индукция тиогликолят-индуцированного перитонита
[0109] Индукцию перитонита проводили путем инъекции 1 мл тиогликолевой кислоты (4% (о/в); Alrich Sigma), растворенной в PBS. Внутрибрюшинное промывание проводили на мышах, умерщвленных путем смещения шейных позвонков. Краткое описание: 5 мл буфера для перитонеального промывания (PLB; PBS, содержащего 0,5 мМ ЭДТА (Fronine) с гепарином (Sigma Aldrich) 9,9 ед/мл) вводили в брюшину. Брюшину осторожно массировали до введения PLB в шприц на 10 мл. Этот процесс был повторен дважды. Затем объем лаважа был повышен до 50 мл в PLB, и лаваж был центрифугирован при 340xg в течение 5 минут. Клетки были подготовлены для проточной цитометрии, как описано выше.
Статистика
[0110] Были построены графики, и был проведен компьютеризированный статистический анализ в GraphPad Prism и InStat, соответственно (обе программы программного обеспечения GraphPad, Сан-Диего, Калифорния, США). В зависимости от данных был применен непарный, двусторонний критерий Стьюдента или однофакторный дисперсионный анализ с последующим тестом Тьюки-Крамера с Р<0,05, которое считалось статистически значимым.
Для анализа корреляции между такими параметрами, как потеря массы, инфильтрация и титр вируса, была использована нелинейная регрессия (кривая fit) с полиномом второго порядка (Y=A+B*X+C*X^2).
Пример 1
Характеристика моделей энцефалита, индуцированного высокими и низкими дозами вируса Западного Нила
[0111] Интраназальное инфицирование C57BL/6 мышей высокими дозами ВЗН, равными 6x104 БОЕ ВЗН, привело к 100%-ной смертности на 7 день после инфицирования (Фигура 1А). Макрофаги и иммигрировавшая микроглия, которые мы ранее показали, образуются из циркулирующих предшественников - моноцитов Ly6chi (Getts et al, J Exp Med. 29: 2319, 2007), инфильтрируют головной мозг, инфицированный ВЗН на 5 день после инфицирования. Т-клетки, NK-клетки и нейтрофилы также попадают в ЦНС в этой временной точке, с пиком инфильтрации на 7 день после инфицирования (Фигура 1F-Н, Фигура 2А-D) Титр вируса в головном мозге также экспоненциально возрастает с 5 дня после инфицирования, достигая высоких уровней на 7 день после инфицирования (Фигура 1С), и масса тела инфицированных мышей значительно уменьшается с 5 дня после инфицирования до смерти (Фигура 1 В).
[0112] Инокуляция мышей в 10 раз меньшей дозой вируса, т.е. 6x103 БОЕ интраназально, дает сублетальные результаты. Возникает некоторая вариативность в смертности при сравнении независимых экспериментов, которая колеблется в пределах 40-60% (Фигура 1А), однако последовательно продемонстрированы сильная корреляция между процентом потери массы и титром вируса/инфильтрацией (Фигура 1 В-Н, Фигура 2A-E). Ежедневный мониторинг массы мыши оказался надежным способом предсказания исхода инфекции у людей и свидетельствует о том, что мыши требуют вмешательства для того, чтобы выжить после инфекции (Фигура 1 В).
[0113] Мыши, которые не теряют массы после инокуляции дозой ВЗН, равной 6x103, не погибают от инфекции и имеют иммунитет к последующему реинфицированию дозой, равной 6x104 (Фигура 1А-B). Эти мыши не демонстрируют никаких симптомов заболевания при первоначальном инфицировании или реинфицировании высокими дозами, в том числе потерю массы. Наоборот, мыши, теряющие значительное количество массы по сравнению с нормальными колебаниями ложно-инфицированных контрольных групп (обычно >4% массы тела в 24-часовой период времени), продолжают терять массу, обычно в течение 2-3 дней прежде, чем наступает смерть. В данной модели энцефалита большинство мышей, погибающих от инфекции, начинают терять массу между 6 днем и 11 днем после инфицирования, и смерть наступает до 16 дня после инфицирования. У этих мышей наблюдаются высокие титры вируса в головном мозге при TOD, что сопоставимо с мышами, инфицированными дозой, равной 6x104 на 7 день после инфицирования (Фигура 1С).
[0114] Сравнение проточной цитометрией инфильтрации лейкоцитов в головном мозге мышей, инфицированных дозой, равной 6x104 и 6x103, показало, что процент потери массы на 7 день после инфицирования сильно коррелирует с общей инфильтрацией лейкоцитов (Фигура 1F), макрофагов (Фигура 1H), иммигрировавшей микроглии (Фигура 2А), Т-клеток (Фигура 2C) и NK клеток (Фигура 2Е) с некоторой корреляцией, наблюдающейся между потерей массы и иммиграцией нейтрофилов (2D). Неудивительно, что количество CD45lo микроглии оставалось относительно неизменным у всех мышей, так как эта популяция в основном содержит резидентную микроглию головного мозга (Фигура 2 В).
[0115] Для дальнейшего исследования модели инфицирования низкой дозой, мышей, инфицированных дозой, равной 6x103, ежедневно взвешивали и умерщвляли на день 0-14 с отбором головного мозга для проточной цитометрии и анализа бляшкообразования. Некоторая корреляция наблюдалась между процентом потери массы ко времени умерщвления и титром вируса (Фигура 2F) или инфильтрацией лейкоцитов (Фигура 2G). Однако сравнение между титром вируса и инфильтрацией лейкоцитов показало, что некоторые мыши имели высокие титры вируса без существенной инфильтрации (Фигура 2H), и в то время как некоторые из этих мышей также теряли значительное количество массы, у других этого не отмечалось (Фигура 2F). Поскольку мышей необходимо было умертвить для определения титра вируса в головном мозге, неясно, имели ли эти мыши вирус в головном мозге без значительной потери массы или инфильтрация лейкоцитов нейтрализовала вирус без демонстрации потери массы или инфильтрации, или высокий титр вируса предшествует инфильтрации головного мозга/потере массы.
Пример 2
Лечение карбоксилированными гранулами по существу улучшает выживаемость в моделях энцефалита, индуцированного высокими и низкими дозами ВЗН
[0116] Флуоресцентные гранулы часто использованы в литературе для прослеживания миграции субпопуляций моноцитов в различных моделях заболевания in vivo. Однако эти исследования не учитывают потенциальное влияние этих теоретически "инертных" гранул с возможной функцией моноцитов на исход заболевания.
[0117] В попытке отследить моноциты при инфицировании ВЗН мы использовали как голые, так и карбоксилированные полистироловые гранулы и обнаружили неожиданные изменения в ходе болезни. Следующие данные показывают, что как голые, так и карбоксилированные полистироловые гранулы значительно уменьшали инфильтрацию головного мозга клетками иммунной системы, а также содействовали долгосрочной выживаемости инфицированных мышей.
[0118] Введение мышам, инфицированным дозой 6х104 ВЗН, 4,41x109 карбоксилированных полистироловых гранул диаметром 0,5 мкм в 300 мкл PBS, на 6 день после внутривенного инфицирования давало 10% долгосрочной выживаемости мышей в данной летальной модели заболевания (Фигура 3А). Чтобы убедиться, что результаты выживаемости могут быть улучшены, мы вводили ту же концентрацию гранул мышам, инфицированных низкой дозой, равной 6x103, на 6 день после инфицирования. Однако эта стратегия уменьшила выживаемость мышей по сравнению с контрольными группами, получавшими PBS (Фигура 3 В). Эти результаты подчеркивают, что гранулы должны вводится терапевтически, т.е. когда мыши первично демонстрируют значительную потерю массы, которая, как мы показали, говорит о высоком титре вируса и инфильтрации головного мозга популяциями лейкоцитов (см. Фигуры 1, 2).
[0119] Поэтому мы установили терапевтический подход к введению частиц в модели инфицирования низкой дозой. Мышей взвешивали ежедневно (Фигура 3E-G), и 4,41x109 карбоксилированных полистироловых гранул вводили в случае значительной потери массы, обнаруженной в 24-часовой период (обычно >4% общей массы тела по сравнению с нормальным колебаниями ложно-инфицированных контрольных групп). Используя данную стратегию, мы смогли увеличить выживаемость мышей, которые обычно продолжают терять массу и умирают без вмешательства на 60% (40-80% в независимых экспериментах) (Фигура 3D). Как и ожидалось, все мыши, потерявшие массу и получавшие PBS, продолжали терять массу и умирали на 2-4 дня позже (Фигура 3E, G). Мыши, которые не потеряли значительного количества массы, в любое время демонстрировали аналогичную стабильность в массе, как и контрольные группы, которым был введен PBS (Фигура 3E-F).
[0120] Мыши получали карбоксилированные гранулы в течение 5 дней с момента первичного обнаружения значительной потери массы. Для некоторых мышей достаточным было 5-дневное лечение гранулам, и масса оставалась стабилизированной после прекращения введения гранул, и эти мыши переживали инфекцию без дальнейшего вмешательства (Фигура 4A-B). Однако некоторые мыши начинали терять массу снова после прекращения лечения на 5 день, поэтому лечение было возобновлено, пока масса не рестабилизировалась, и эти мыши также демонстрировали долгосрочную выживаемость (Фигура 4C-D).
[0121] На 9 день после инфицирования была проведена проточная цитометрия головного мозга мышей, инфицированных дозой ВЗН, равной 6х103, которые получали либо карбоксилированные полистироловые гранулы, либо PBS. Мыши, которые не потеряли массу, также получали гранулы или PBS на 8 день в качестве контрольных групп для эксперимента. Как показано на Фигуре 4D-L, мыши, которые не потеряли массы на 8 день после инфицирования, но получали гранулы (Фигура 4H-I) или PBS (Фигура 4D-E), продемонстрировали отсутствие инфильтрации головного мозга макрофагами или иммигрировавшей микроглией, сформированных из моноцитов, Т-клеток, NK-клеток или нейтрофилов, при этом основной изолированной популяцией была CD45lo/intCD11b+резидентная микроглия. У мышей, которые потеряли массу на 8 день после инфицирования и получали PBS, была очевидна массивная инфильтрация головного мозга на 9 день после инфицирования (Фигура 4F-G), и основной популяцией были CD45hi воспалительные макрофаги, сформированные из моноцитов (Фигура 4L). Однако у мышей, потерявших массу и получавших гранулы на 8 день после инфицирования, все же оставалась значительная инфильтрация, но была значительно снижена по сравнению с мышами, получавшими PBS (Фигура 4J-L). Необходимо повторить проточную цитометрию для мышей, инфицированных 103-дозой, получавших гранулы или PBS при потери массы для демонстрации того, что снижение инфильтрации происходит при получении мышами гранул через 6-14 дней после инфицирования.
Пример 3
Карбоксилирование гранул имеет решающее значение для улучшения выживаемости по существу и изменений в популяциях лейкоцитов у мышей, инфицированных ВЗН
[0122] На данном этапе исследования было неясно, имело ли карбоксилирование гранул решающее значение в улучшениях, отмеченных для выживаемости и снижения лейкоцитов, мигрирующих в головной мозг. Мышам, инфицированным дозой ВЗН, равной 6х103, внутривенно вводили 4,41x109 голых или карбоксилированных гранул диаметром 0,5 мкм в 300 мкл PBS или только PBS при регистрации значительной потери массы. Мыши, которым вводили карбоксилированные гранулы, продемонстрировали значительное улучшение выживаемости, равное 60%, в то время как мыши, получавшие голые гранулы, продемонстрировали гораздо меньшее улучшение, равное 25% (Фигура 5А). Мышей, которые не потеряли массу, не лечили, и такие мыши выжили после инфекции без вмешательства, в то время как все мыши, которые потеряли массу и получали PBS, умерли на 14 день после инфицирования (Фигура 5B-D). Потеря массы контролировалась у этих мышей до 20 дня после инфицирования; мыши, которые не потеряли значительное количество массы, продемонстрировали картину стабильности, аналогичную контрольным группам, которым вводили PBS (данные не представлены), в то время как мыши, которые получали либо карбоксилированные, либо голые гранулы (Фигура 5B-C) в итоге стабилизировались и выжили, или продолжали терять массу и умерли через 2-4 дня. Все мыши, которые потеряли массу и получали PBS (B, D), продолжали терять массу и умерли через 2-5 дней.
[0123] Для исследования изменений в популяциях лейкоцитов и определения клеток, которые могут быть обнаружены в ассоциации либо с карбоксилированными, либо с голыми гранулами, была проведена проточная цитометрия для мышей, инфицированных дозой, равной 6x104 БОЕ ВЗН. Мышам внутривенного вводили 4,41x109 карбоксилированных FITC-гранул или голых FITC-гранул диаметром 0,5 мкм в 300 мкл PBS или только PBS на 6 день после инфицирования. Мышей умерщвляли на 7 день после инфицирования, и кровь, головной мозг, костный мозг, печень и селезенка были отобраны для проточной цитометрии.
[0124] "Свободные" гранулы, а также гранулы в ассоциации с CD45+лейкоцитами, могли быть обнаружены при помощи проточной цитометрии (Ex/Em Макс 441/486 нм). Как и ожидалось, гранулы не могли быть обнаружены в крови контрольных групп, которым вводили PBS (Фигура 5E-G), но могли быть обнаружены у мышей, получавших голые (Фигура 5H-J) и карбоксилированные (Фигура L-M) гранулы. Гранулы были очищены более эффективно, если они были карбоксилированы, а из оставшихся в кровотоке гранул многие были в ассоциации с CD45+лейкоцитами (Фигура 5O) по сравнению с голыми гранулами (Фигура 5K), которые были изначально "свободными". Эти данные предполагают, что карбоксилирование каким-то образом способствует захвату гранул лейкоцитами из кровотока по сравнению с голыми гранулами, некоторые из которых все еще остаются "свободными" в кровотоке через 24 ч после введения.
[0125] Проточная цитометрия головного мозга выявила некоторые существенные различия в снижении популяции лейкоцитов в головном мозге мышей, получавших либо карбоксилированные, либо голые гранулы. Карбоксилированные или голые гранулы не могут быть обнаружены в головном мозге на 7 день после инфицирования, на 1 день после лечения (Фигура 6А-C), что позволяет предположить, что клетки, захватывающие гранулы, не проникают в инфицированную ЦНС. Общее количество лейкоцитов как в головном мозге мышей, подвергнутых лечению голыми гранулами, так и в головном мозге мышей, подвергнутых лечению карбоксилированными гранулами, было по существу снижено по сравнению с PBS-контрольными группами, а также общим количеством популяций макрофагов и микроглии (Фигура 6D). Однако только карбоксилированные гранулы снижали количество Т-клеток и NK-клеток в головном мозге этих мышей. Как Ly6chi, так и Ly6clo/int популяции макрофагов были значительно снижены обработками гранул обоих типов, без заметных изменений в небольшой популяции Ly6 с--клеток. Что касается CD45int активированной микроглии, снижения в субпопуляции Ly6chi были установлены только для лечения карбоксилированными гранулами, но снижения Ly6clo/int и Ly6 с- субпопуляций были установлены для обработки гранулами обоих типов. Не были отмечены никакие изменения в небольшой субпопуляции Ly6chi CD45lo оставшейся микроглии, однако лечение гранулами обоих типов значительно уменьшило Ly6clo/int и Ly6 с- субпопуляции.
[0126] Проточная цитометрия селезенки продемонстрировала, что многие гранулы были захвачены лейкоцитами в этом органе с некоторыми интересными различиями в популяциях между лечением. Как показано на Фигуре 7А-I, гранулы+клетки были в основном CD11b+, CD11c++и Ly6 с+.
[0127] Дальнейший анализ показал, что три основных субпопуляции, представляющие интерес, захватывали гранулы в селезенке - CD11b+, CD11c- моноциты (Фигура 7J, M, P), CD11b+, CD11c+"миелоидные" дендритные клетки, в первую очередь Ly6clo/- (Фигура 7K, N, Q), и CD11b-, CD11c+дендритные клетки, в первую очередь Ly6clo/- (Фигура 7L, O, R).
[0128] Увеличения в этих трех популяциях клеток были также очевидны в селезенке мышей, получавших карбоксилированные гранулы. Увеличения общих количеств CD11b+, CD11c- моноцитов, а также общего количества Ly6cint/hi, гранулы+Ly6cint/hi и гранулы- Ly6cint/hi субпопуляций были выявлены у мышей, получавших карбоксилированные гранулы (Фигура 8А). Также было установлено увеличение общего количества Ly6c-/lo, гранулы+Ly6c-/lo и гранулы- Ly6c-/lo при лечении карбоксилированными гранулами. Эти данные предполагают, что моноциты могут мигрировать в селезенку в результате лечения карбоксилированными гранулами, но привлекаются не только гранулы+, но и гранулы- клетки.
[0129] Среди CD11b+, CD11c+дендритных клеток в селезенке, было установлено, что популяция Ly6c-/lo захватывала оба типа гранул (Фигура 8В). Однако только карбоксилированные гранулы увеличивали в селезенке общее количество CD11b+, CD11c+дендритных клеток, и из них популяции Ly6c-/lo. Поскольку не наблюдалось увеличение гранулы- Ly6c-/lo дендритных клеток, очевидно, что только гранулы+Ly6c-/lo дендритные клетки мигрируют в селезенку после захвата карбоксилированных гранул. Вполне возможно, что эти клетки формируются из Ly6chi воспалительных моноцитов, которые захватывают гранулы из кровотока, направляются в селезенку, вместо миграции в головной мозг, где они подавляют экспрессию Ly6 с и активируют экспрессию CD11c после их дифференциации в дендритные клетки.
[0130] Из популяций дендритных клеток CD11b-, CD11c+в селезенке, Ly6c-/lo клетки захватывали оба типа гранул (Фигура 8С). При лечении карбоксилированными гранулами наблюдалось увеличение в общем количестве CD11b- CD11c+популяций дендритных клеток, в частности Ly6c-/lo клеток. Увеличения наблюдались как в гранулы+, и гранулы- клетках этой популяции, предполагая, что не только гранулы+, но и гранулы- клетки увеличиваются в селезенке. Эта популяция может содержать резидентные ДК селезенки, немиелоидные ДК селезенки, привлеченные из периферии, или могут также потенциально состоять из воспалительных моноцитов, которые захватили гранулы, подавленной CD11b и Ly6 с и активированной CD11c экспрессии.
[0131] Гранулы также были обнаружены в ассоциации с небольшим процентом В-клеток в селезенке, однако только карбоксилированные гранулы значительно увеличивали число В-клеток в селезенке (Фигура 9A-D). Единственным другим существенным увеличением, обнаруженным для селезенки, было увеличение CD8+Т-клеток, в то время как количество CD4+Т-клеток, NK-клеток и нейтрофилов оставалось неизменным.
[0132] Гранулы также могли быть обнаружены в печени, прежде всего в ассоциации с CD11b, CD11c и Ly6c-экспрессирующими клетками (Фигура 10А-I). Что касается селезенки, было обнаружено, что CD11b+CD11c- моноциты (Фигура 10J), CD11b+CD11c+(Фигура 10K) и CD11b- CD11c+(Фигура 10L) дендритные клетки захватывают гранулы в печени. Однако не было никакого значительного увеличения или уменьшения в любой популяции лейкоцитов печени. Небольшое количество гранул было также обнаружено в костном мозге, в небольшой популяции CD11b+, CD11c+Ly6 с+лейкоцитов (Фигура 11A-G). Однако не было установлено не значительного увеличения или уменьшения в любых популяциях лейкоцитов костного мозга.
Пример 4
[0133] Мышам, инфицированным дозой ВЗН, равной 6х103, внутривенно вводили низкую дозу 0,1% или высокую дозу 0,5% карбоксилированных полистироловых гранул диаметром 0,5; 0,05 или 3 мкм в 300 мкл PBS или только PBS при регистрации значительной потери массы. Мыши, получавшие низкую дозу гранул диаметром 0,5; 0,05 или 3 мкл, продемонстрировали аналогичные улучшения в выживаемости, примерно 40-50% (Фигура 12А). Однако лечение мышей высокими дозами оказалось пагубным для выживаемости, с гораздо меньшим улучшением на 20%. У значительного числа мышей, получавших высокие дозы гранул, проявились атипичные симптомы заболевания, и было предположено, что присутствие такой высокой дозы гранул в жизненно важных органах в течение нескольких дней было пагубным для мыши. Этот курс будет повторен с потенциальным включением других более низких доз гранул. Проточная цитометрия также будет проведена для мышей, инфицированных дозой ВЗН, равной 6x104, подвергнутых лечению на 6 день после инфицирования гранулами различных размеров.
[0134] Эти данные подчеркивают тот факт, что карбоксилированные полистироловые гранулы могут не разрушаться in vivo, и, следовательно, могут иметь ограниченное терапевтическое применение. Поэтому мы получили биоразлагаемые полимолочной-со-гликолевой кислоты (PLGA) сферы диаметром 0,5 мкм, которые были либо карбоксилированными, либо голыми (однако голые сферы также содержат небольшое количество карбоксильных групп). Мышам, инфицированным дозой ВЗН, равной 6х103, вводили 4,41x109 голых или карбоксилированных полистироловых гранул или PLGA сфер диаметром 0,5 мкм при определении значительной потери массы. Как видно на Фигуре 12В, к настоящему времени PLGA голые и карбоксилированные сферы продемонстрировали аналогичные какрбоксилированным полистироловым гранулам улучшения выживаемости.
[0135] Чтобы проверить, снизили ли карбоксилированные PLGA сферы, введенные на 6 день после инфицирования, инфильтрацию головного мозга на 7 день у мышей, инфицированных дозой ВЗН, равной 6x104, мы сравнили лечение мышей PBS, карбоксилированными гранулами диаметром 0,5 мкм, карбоксилированными PLGA сферами диаметром 0,5 мкм и 0,5 мкм карбоксилированными алмазными частицами в дозе 4,41x109, введенной внутривенно. Головной мозг, кровь, селезенка и печень были обработаны для проточной цитометрии. Анализ этого эксперимента продолжается, однако предварительный анализ головного мозга этих мышей показал, что все три частицы успешно снижают инфильтрацию головного мозга иммунными клетками (Фигура 12С). Также наблюдались увеличения общего числа лейкоцитов в селезенке, в соответствии с результатами, которые мы видели у мышей, получавших карбоксилированные гранулы.
Пример 5
Лечение гранулами мышей с Т-клеточной недостаточностью
[0136] Мышей дикого типа C57BL/6 (ДТ) и RAG (Т-клеточная недостаточность) инфицировали дозой, равной 6x104 или 6x103 БОЕ ВЗН. ДТ мыши, инфицированные высокой дозой, равной 6x104, продемонстрировали 100% смертность на 7 день после инфицирования, в то время как RAG мыши, инфицированные той же дозой, начали умирать на 8 день после инфицирования, с некоторыми мышами, жившими до 13 дня после инфицирования. ДТ мыши, инфицированные низкой дозой, равной 6x103, продемонстрировали 60% смертность на 8 день после инфицирования, но с 40% долгосрочной выживаемостью после этого момента времени. RAG мыши, инфицированные этой же дозой, не умирали до 14 дня после инфицирования, однако к 16 дню все RAG мыши были мертвы (Фигура 13A-B). Эти данные предполагают либо прямую, либо косвенную роль Т-клеток в иммунопатологии энцефалита, индуцированного ВЗН, поскольку мыши с Т-клеточной недостаточностью выживают дольше, чем RAG мыши. Однако это также подчеркивает, что Т-клетки имеют решающее значение для контроля вирусной инфекции, так как все RAG мыши, инфицированные низкой дозой, погибли от инфекции, в то время как 40% ДТ мышей выживают с иммунитетом.
[0137] Потеря массы этих мышей регистрировалась ежедневно, и было показано, что потеря массы предшествует смерти как RAG мышей, так и ДТ мышей (Фигура 13В). Однако было установлено, что ДТ мыши живут только в течение максимум 2-3 дней после первичной потери массы, в то время RAG мыши могли жить до 5 дней после начала потери массы. Анализ бляшкообразования для головного мозга, отобранного от RAG мышей и ДТ мышей, инфицированных дозой, равной либо 6x104, либо 6x103 показал, что процент потери массы сильно коррелирует с титром вируса (Фигура 12С). В общем, RAG мыши продемонстрировали большую потерю массы на момент смерти и более высокие титры вируса, чем ДТ мыши. По-видимому, это возможно объяснить тем, что они были способны выжить после первичной потери массы в течение более длительного периода, чем ДТ мыши и, таким образом, вирус продолжал возрастать в головном мозге и мыши продолжали терять массу до момента смерти, в противоположность непосредственному результатом неспособности контролировать вирус без Т-клеток. Эта гипотеза поддерживается проточной цитометрией головного мозга (Фигура 13D-E), в которой был сравнен головной мозг на 7 день ДТ мышей и RAG мышей на 7 день/8 день. RAG мыши демонстрируют значительное снижение инфильтрации головного мозга макрофагами микроглии, Т-клетками (поскольку по ним наблюдается недостаточность) и нейтрофилами, которая не увеличивается между 7 днем и 8 днем после инфицирования. Это может объяснить причину того, почему эти животные живут дольше после первичной потери массы, чем ДТ мыши, если иммунопатология является основной причиной гибели этих животных.
[0138] RAG и ДТ мыши были также инфицированы дозой, равной 6x103 БОЕ ВЗН, и их ежедневно взвешивали для проверки эффективности карбоксилированных гранул в отсутствие Т-клеток. При значительной потере массы (>4% в течение 24 часов) мышам внутривенно вводили 4,41x109 карбоксилированных гранул или PBS, доставленных в объеме 300 мкл. Не было никакого существенного улучшения выживаемости RAG мышей после введения гранул (Фигура 12F). RAG мыши продолжали терять массу после введения гранул или PBS и умерли через 2-5 дней (Фигура 12G). Этот эксперимент необходимо повторить еще раз для подтверждения результатов.
Пример 6
Лечение гранулами при EAE
[0139] C57BL/6 мыши будут примированы MOG и CFA адъювантом. Ко времени развития симптома заболевания, что будет определено изменениями походки, позы и других свойств, карбоксилированные частицы будут вводить внутривенно либо каждые 8 часов, каждые 16 часов, каждый день или каждые 48 часов. Тяжесть заболевания будет определятся изменениями в показателях по шкале заболевания. Введение частиц позволит предотвратить миграцию моноцитов в головной мозг и последующее примирование T-клетками, приводящее к значительному снижению показателей по шкале заболевания.
Пример 7
Лечение гранулами атеросклероза и неоинтимальной пролиферации клеток гладкой мускулатуры
[0140] Мыши с недостаточностью APO/E будут получать диету, богатую жирами. С 4-недельного возраста внутривенно будут вводиться карбоксилированные частицы каждые 8 часов, каждые 16 часов, каждые 24 часа, каждые 48 часов, каждые 72 часа, один раз в неделю или один раз в месяц. Тяжесть заболевания будет определяться изменениями в артериальной гистологии. Введение частиц предотвратит миграцию моноцитов в стенки артерии и предотвратит последующие иммунные осложнения, имеющие решающее значение в запуске пролиферации гладких мышц и образовании бляшек в интиме.
[0141] В то время как конкретные варианты воплощения настоящего изобретения были описаны и проиллюстрированы, такие варианты воплощения настоящего изобретения должны рассматриваться как иллюстрирующие настоящее изобретение и не ограничивающие настоящее изобретение, что истолковывается в соответствии с прилагаемой формулой изобретения.
[00112] Все патенты, заявки и другие ссылки, приведенные в настоящем документе, включены во всей своей полноте посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ ИНГИБИТОРОВ СОХ-2 ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИММУНОДЕФИЦИТА | 2001 |
|
RU2303452C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ РАКА МОЗГА | 2012 |
|
RU2705244C2 |
| ПРИМЕНЕНИЕ ВИРУСА МИКСОМЫ ДЛЯ ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ РАКА И ХРОНИЧЕСКОЙ ВИРУСНОЙ ИНФЕКЦИИ | 2004 |
|
RU2362584C2 |
| ЧАСТИЦЫ, КОНЪЮГИРОВАННЫЕ С ПЕПТИДАМИ | 2013 |
|
RU2669346C2 |
| ВИРУСОПОДОБНЫЕ ЧАСТИЦЫ (VLP) ИЗ ГЛИКОПРОТЕИНА ВИРУСА БЕШЕНСТВА | 2011 |
|
RU2575800C2 |
| ВЕКТОР ПАРАПОКСВИРУСА, СОДЕРЖАЩИЙ АНТИГЕН ВИРУСА БЕШЕНСТВА | 2011 |
|
RU2545694C2 |
| ВВЕДЕНИЕ ЭРИТОРАНА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ ДЛЯ ЛЕЧЕНИЯ ОРТОМИКСОВИРУСНЫХ ИНФЕКЦИЙ | 2013 |
|
RU2636622C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ ЦИТОМЕГАЛОВИРУСА | 2012 |
|
RU2737530C1 |
| ИММУНОГЕННЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ КОМПОЗИЦИИ | 2011 |
|
RU2722357C2 |
| ИММУНОГЕННЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ КОМПОЗИЦИИ | 2011 |
|
RU2581922C2 |

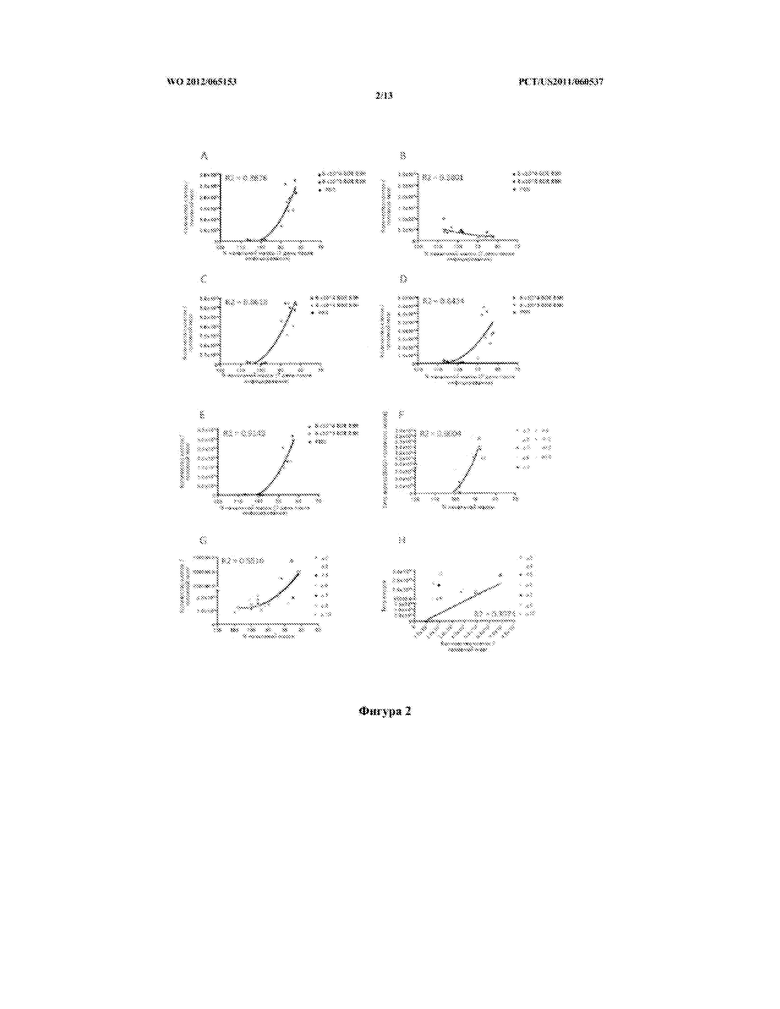
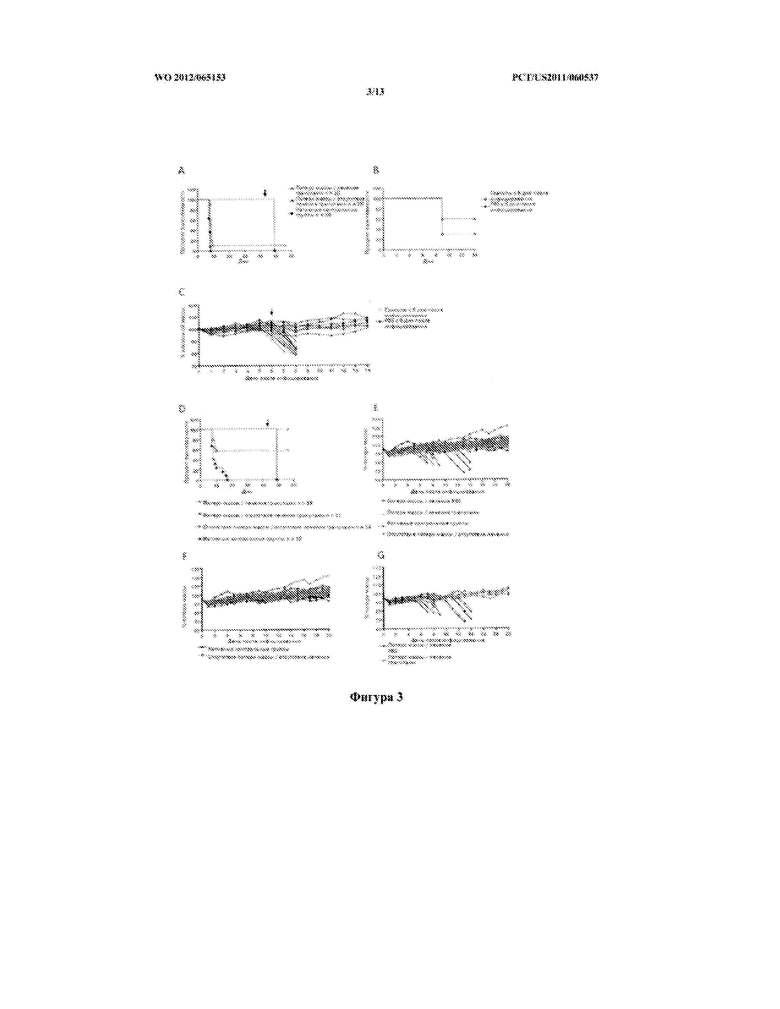

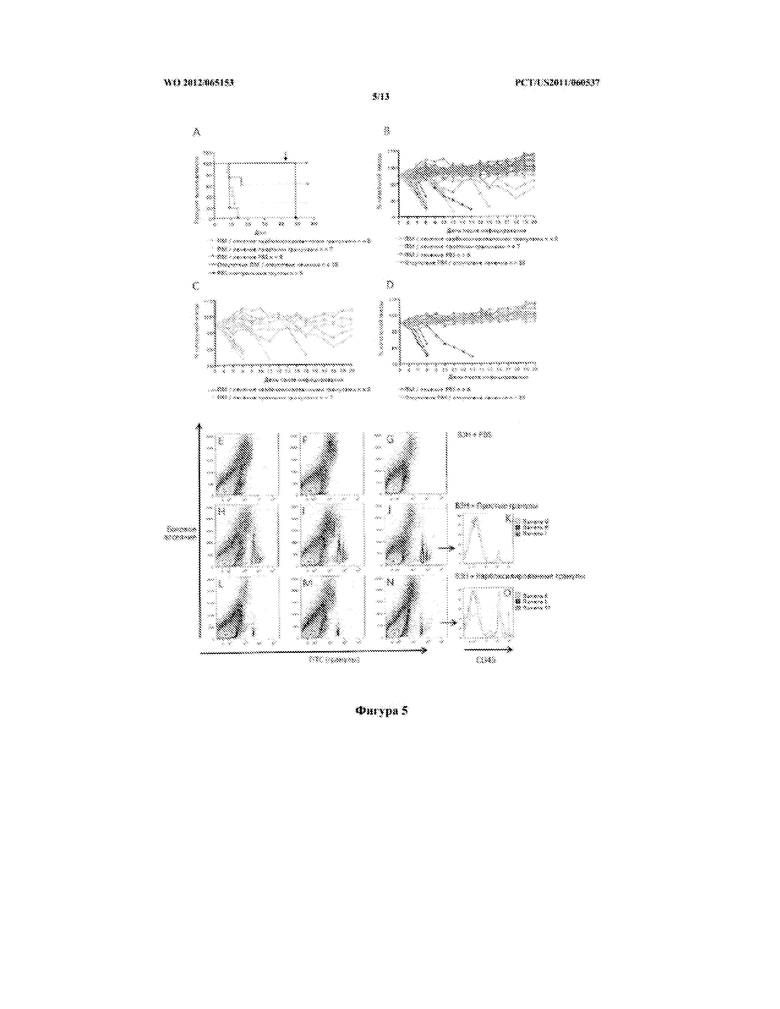
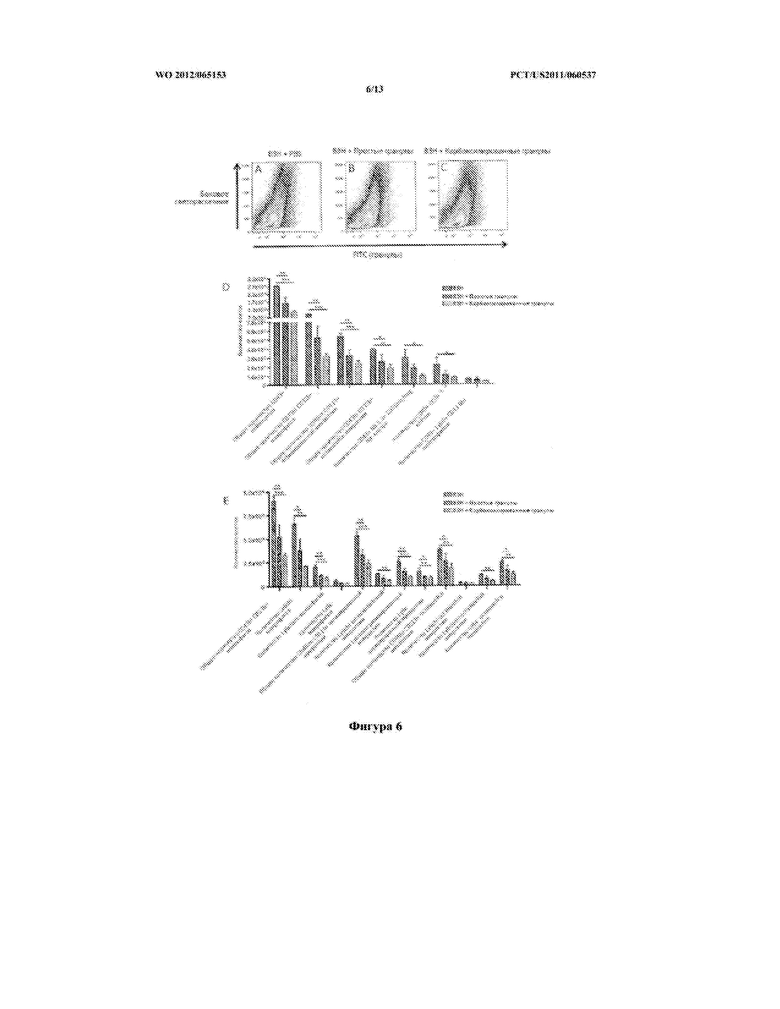

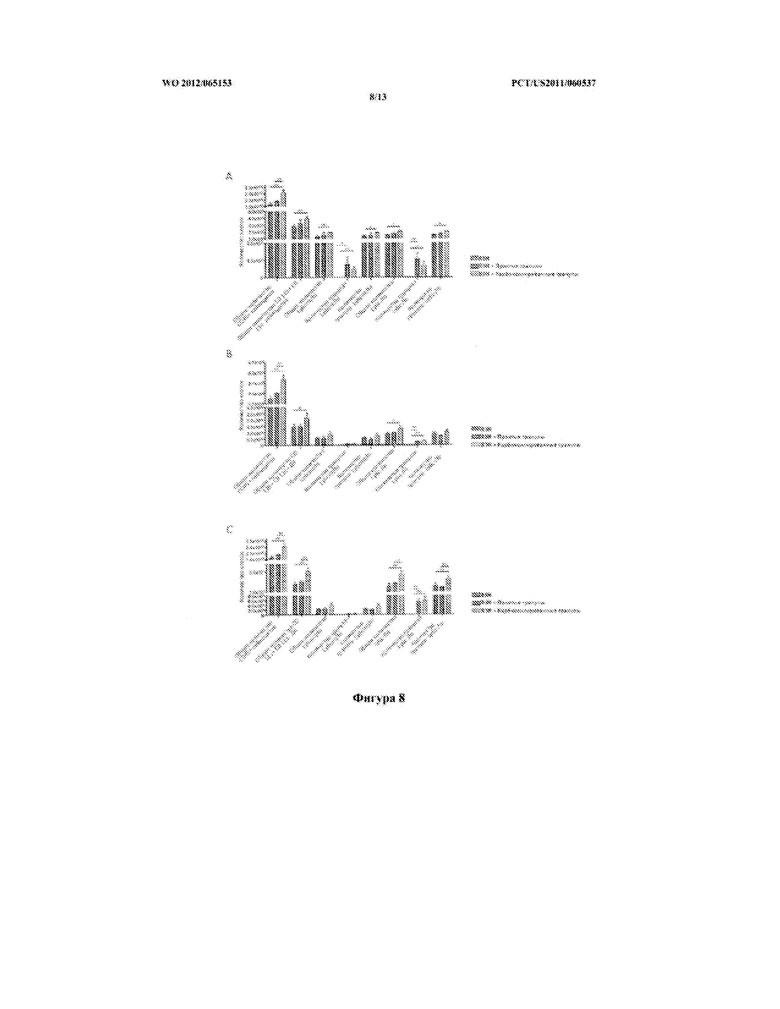





Группа изобретений относится к медицине, фармакологии и касается способов снижения продолжительности или тяжести воспалительного иммунного ответа у субъекта, а также фармацевтической композиции, содержащей как таковые карбоксилированные частицы. Причем прикрепленные биологически активные вещества или прикрепленные антигенные молекулы в указанных частицах отсутствуют. Частицы являются частицами полимолочной-со-гликолевой кислоты (PLGA), полистироловыми частицами или алмазными частицами. Диаметр указанных частиц составляет между примерно 0,1 мкм до примерно 10 мкм. Субъект может иметь аутоиммунное расстройство, такое как рассеянный склероз, склеродермия, диабет I типа, ревматоидный артрит, тиреоидит, системная красная волчанка, синдром Рейно, синдром Шегрена, аутоиммунный увеит, аутоиммунный миокардит или болезнь Крона, имеет ишемическое реперфузионное повреждение, атеросклероз, страдал от инфаркта миокарда, является реципиентом трансплантата, имеет псориаз или дерматит, или страдает от аллергического расстройства, такого как экзема, астма, аллергический ринит или гиперчувствительность кожи. Субъект может иметь вирусную или бактериальную инфекцию, которые могут вызывать у субъекта развитие энцефалита или менингита. Группа изобретений обеспечивает ослабление или устранение воспалительного, иммунного ответа у субъекта без необходимости прикрепления к частицам каких-либо биологически активных веществ, антигенов. 3 н. и 9 з.п. ф-лы, 13 ил., 7 пр.
1. Способ снижения продолжительности или тяжести воспалительного иммунного ответа у субъекта, включающий введение указанному субъекту фармацевтической композиции, содержащей карбоксилированные частицы, при этом прикрепленные биологически активные вещества или прикрепленные антигенные молекулы в указанных частицах отсутствуют, при этом указанные частицы являются частицами полимолочной-со-гликолевой кислоты (PLGA), полистироловыми частицами или алмазными частицами, и при этом диаметр указанных частиц составляет между примерно 0,1 мкм до примерно 10 мкм.
2. Способ по п. 1, отличающийся тем, что диаметр указанных карбоксилированных частиц составляет между примерно 0,3 мкм до примерно 5 мкм, между примерно 0,5 мкм до примерно 3 мкм, между примерно 0,5 мкм до примерно 1 мкм или примерно 0,5 мкм.
3. Способ по п. 1, отличающийся тем, что субъект имеет аутоиммунное расстройство, такое как рассеянный склероз, склеродермия, диабет I типа, ревматоидный артрит, тиреоидит, системная красная волчанка, синдром Рейно, синдром Шегрена, аутоиммунный увеит, аутоиммунный миокардит или болезнь Крона, имеет ишемическое реперфузионное повреждение, атеросклероз, страдал от инфаркта миокарда, является реципиентом трансплантата, имеет псориаз или дерматит, или страдает от аллергического расстройства, такого как экзема, астма, аллергический ринит или гиперчувствительность кожи.
4. Способ по п. 1, отличающийся тем, что указанную композицию вводят перорально, назально, внутривенно, внутримышечно, через глаз, чрескожно или подкожно.
5. Способ лечения вирусной или бактериальной инфекции у субъекта, включающий введение указанному субъекту фармацевтической композиции, содержащей карбоксилированные частицы, при этом прикрепленные биологически активные вещества или прикрепленные антигенные молекулы в указанных частицах отсутствуют, и при этом указанные частицы являются частицами полимолочной-со-гликолевой кислоты (PLGA), полистироловыми частицами или алмазными частицами, и при этом диаметр указанных частиц составляет между примерно 0,1 мкм до примерно 10 мкм.
6. Способ по п. 5, отличающийся тем, что диаметр указанных карбоксилированных частиц составляет между примерно 0,3 мкм до примерно 5 мкм, между примерно 0,5 мкм до примерно 3 мкм, между примерно 0,5 мкм до примерно 1 мкм или примерно 0,5 мкм.
7. Способ по п. 5, отличающийся тем, что вирусная инфекция избрана из группы, состоящей из инфекции вируса Западного Нила, инфекции вируса герпеса, инфекции вируса гепатита, флавивируса, инфекции гриппа, риновирусной инфекции, ретровирусной инфекции, инфекции вируса папилломы, парамиксовирусной инфекции и инфекции вируса парагриппа.
8. Способ по п. 5, отличающийся тем, что вирусная инфекция инфицирует центральную нервную систему указанного субъекта или вызывает вирусный энцефалит или вирусный менингит.
9. Способ по п. 5, отличающийся тем, что бактериальная инфекция инфицирует центральную нервную систему указанного субъекта или вызывает бактериальный энцефалит или бактериальный менингит.
10. Способ по п. 5, отличающийся тем, что указанную композицию вводят перорально, назально, внутривенно, внутримышечно, через глаз, чрескожно или подкожно.
11. Фармацевтическая композиция для применения в устранении воспалительного иммунного ответа у пациентов, нуждающихся в этом, содержащая карбоксилированные частицы, при этом прикрепленные биологически активные вещества или прикрепленные антигенные молекулы в указанных частицах отсутствуют, при этом указанные частицы являются частицами полимолочной-со-гликолевой кислоты (PLGA), полистироловыми частицами или алмазными частицами, и при этом диаметр указанных частиц составляет между примерно 0,1 мкм до примерно 10 мкм.
12. Композиция по п. 11, отличающаяся тем, что диаметр указанных карбоксилированных частиц составляет между примерно 0,3 мкм до примерно 5 мкм, между примерно 0,5 мкм до примерно 3 мкм, между примерно 0,5 мкм до примерно 1 мкм или примерно 0,5 мкм.
| US 2009214474 A1, 27.08.2009, реф | |||
| DWPI | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Устройство для совершенствования навыков стрельбы биатлонистов | 2020 |
|
RU2740960C1 |
| Нанотехнологии, найдено [30.09.2015] из Интернет http://nano-info.ru/nanotechnologies, дата размещ | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
Авторы
Даты
2016-06-27—Публикация
2011-11-14—Подача