Изобретение относится к имплантату, содержащему по меньшей мере два слоя, изготовленных из волокон, и по меньшей мере один слой из биоактивного материала, расположенный между указанными по меньшей мере двумя слоями.
Уже известно использование армированных композитов, изготовленных из отдельных наполнителей или армирующих волокон. Армированные волокном композиты современного уровня техники демонстрируют свойства высокой прочности, и за счет выбора для композита многофазной смолистой матрицы можно значительно улучшить характеристики обращения с композитом.
С другой стороны, имеется множество разработок с биоактивными материалами, которые представляют собой биоактивную керамику и стекло и обработанный по золь-гель-технологии кремний. Данные материалы могут использоваться для достижения соединения, например, кости с поверхностью биоматериала после введения материала в контакт с тканью. Дополнительным преимуществом биоактивного стекла является его противомикробное воздействие на микробы, имеющиеся, например, в инфицированных пазухах кости. Документ WO 2004/049904 раскрывает биоактивные рассасываемые каркасы для тканевой инженерии. Каркасы изготавливают из биоактивных стеклянных сеток, которые содержат переплетенные биоактивные стеклянные волокна и могут содержать инкубируемые клетки, такие как фибробласты и хондробласты.
С хирургической точки зрения отдельное замещение кости, хряща и мягких тканей является недостаточным в опухолевой, травматологической и тканевой восстановительной хирургии, несмотря на увеличивающееся продвижение в исследовании биоматериалов и способов их клинического применения и тканевой инженерии. Необходимость и показания для разработки новых типов материалов обусловлены недостатками использования аллотрансплантатов. С аллотрансплантацией связаны риски переносимых заболеваний (ВИЧ, болезнь Крейтцфельдта-Якоба и т. д.). Металлы не являются биоактивными или остеокондуктивными, и их использование приводит к явлениям экранирования напряжений и костной атрофии соседней кости. Металлические имплантаты являются причиной также сложных проблем при магнитно-резонансной томографии (MRI) при диагностике заболеваний пациентов. Данные основные недостатки хорошо задокументированы в больших клинических сериях испытаний.
Таким образом, все еще существует потребность в альтернативных имплантатах для медицинских вариантов применения.
Целью представленного изобретения является предоставление биологически совместимого материала, который не имеет перечисленных выше недостатков, или такие недостатки по меньшей мере минимизированы. Конкретно целью представленного изобретения является предоставление материала, подходящего для медицинских, стоматологических и хирургических вариантов применения, например для костной трансплантации при восстановлении костных дефектов и фиксации треснувших частей кости.
Фиг. 1 схематично показывает имплантат согласно первому варианту осуществления.
Фиг. 2 схематично показывает имплантат согласно второму варианту осуществления.
Фиг. 3 схематично показывает имплантат согласно второму варианту осуществления с другим углом.
Фиг. 4 схематично показывает имплантат согласно третьему варианту осуществления.
Фиг. 5 схематично показывает имплантат согласно четвертому варианту осуществления.
Фиг. 6 схематично показывает имплантат согласно четвертому варианту осуществления с другим углом.
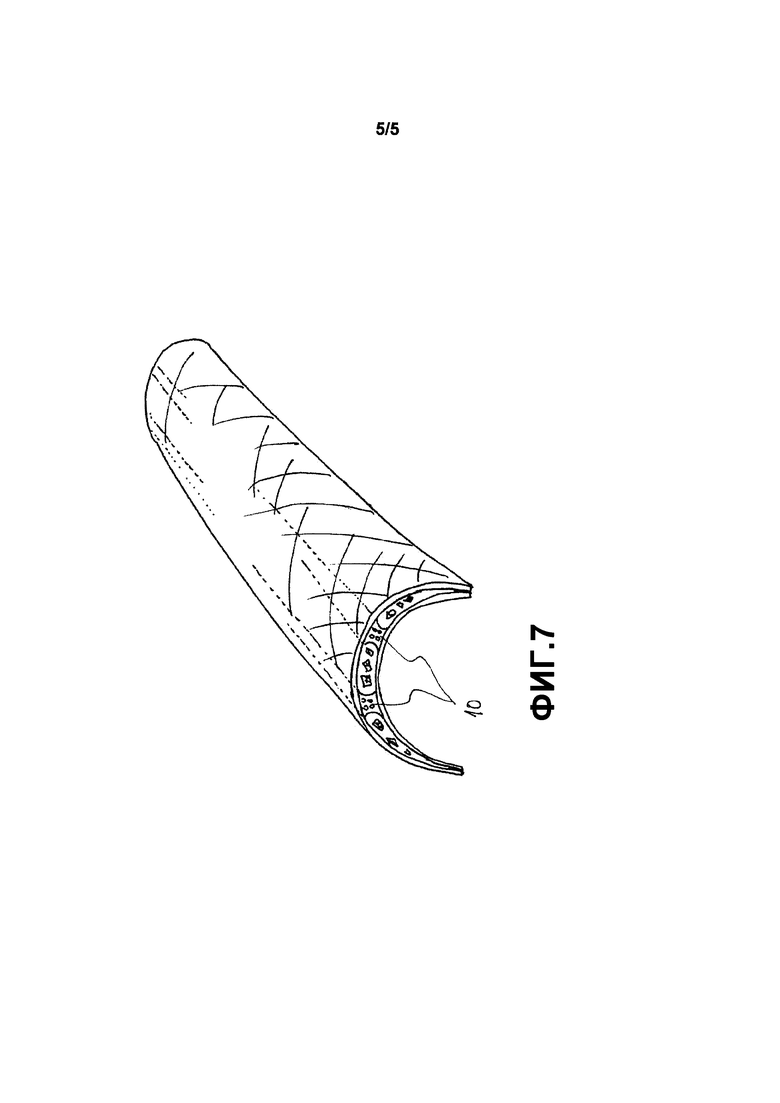
Фиг. 7 схематично показывает имплантат согласно пятому варианту осуществления.
Изобретение относится к имплантату, содержащему по меньшей мере два слоя, изготовленных из волокон, и по меньшей мере один слой из биоактивного материала, расположенного между указанными по меньшей мере двумя слоями.
Типичный имплантат согласно данному изобретению содержит по меньшей мере два слоя, изготовленных из волокон, и биоактивный материал, расположенный между указанными по меньшей мере двумя слоями по меньшей мере один из слоев образован по меньшей мере в основном из сетки, изготовленной из стекловолокон, имеющих диаметр, составляющий 3-100 мкм, и размер сетки выбирают таким образом, чтобы биоактивный материал оставался внутри имплантата. Кроме того, слои заделаны в матрицу, изготовленную из смолы, выбранной из группы, состоящей из сложных полиэфиров, эпоксидных смол, акрилатов и их смесей, при этом слои прикреплены друг к другу вдоль контура имплантата. Кроме того, биоактивный материал выбирают из группы, состоящей из биоактивного стекла, гидроксиапатита, трикальцийфосфата и их смесей.
Таким образом, имплантат согласно данному изобретению получает преимущество капиллярного эффекта, так как по меньшей мере одна из поверхностей образована по меньшей мере в основном из сетки. В самом деле, структура имплантата благодаря использованию по меньшей мере одной сетки и биоактивного материала такова, что капиллярный эффект усиливается, приводя таким образом к улучшенному срастанию кости, так как текучие среды могут проникать внутрь имплантата лучше, чем если бы обе поверхности были изготовлены из плотного тканевого материала или пленки. В дополнение отверстия сетки допускают, чтобы проникновение текучих сред организма происходило со стороны различных направлений имплантата, что означает, что проникновение текучих сред нечувствительно к направлению кровотока из артерий.
Имплантат может иметь обе свои наружные поверхности, изготовленные из сетки, или одна из поверхностей может быть изготовлена из пленки или плотного тканевого материала. Когда другая поверхность изготовлена не из сетки, это, как правило, поверхность, которая будет находиться снаружи, когда имплантат находится на своем месте. Имплантат также может содержать более чем два слоя, например три, четыре или пять слоев. Согласно варианту осуществления толщина слоя составляет приблизительно 500-700 мкм. Толщина имплантата зависит, например, от толщины кости, которую он предположительно должен заменить. Наиболее часто максимальная толщина, равная 10 мм, достигается при пяти слоях. Когда используют несколько слоев, промежуточные (т. е. внутренние слои, расположенные напротив самых крайних слоев) предпочтительно изготовлены из сетки. Согласно предпочтительному варианту осуществления все слои импрегнированы смолой, т. е. внедрены в матрицу. Выбранная смола может быть одинаковой или разной для каждого слоя. Кроме того, когда используют несколько слоев, только два самых крайних могут быть прикреплены друг к другу вдоль контура имплантата, или все или некоторые из других слоев (промежуточных слоев) могут быть прикреплены друг к другу аналогичным образом.
В данном описании под «отверждением» подразумевают полимеризацию и/или поперечное сшивание. Под матрицей понимают непрерывную фазу композиции, а под неотвержденной матрицей подразумевают матрицу, которая находится в деформируемом состоянии, но которая может затвердевать, т. е. отверждаться по существу в недеформируемое состояние. Неотвержденная матрица может уже содержать некоторые длинные цепи, но по существу она еще не является полимеризованной и/или поперечно-сшитой. Под «препрегом» подразумевают полуизготовленный продукт, то есть продукт, который не полимеризован или только частично полимеризован, но все еще является деформируемым. Отверждение смолы ведет к композитному материалу, в котором отвержденная смола образует матрицу.
Слои имплантата по меньшей мере в основном образованы из сетки, что означает, что по меньшей мере 55% поверхности слоя изготовлено из сетки. Предпочтительно по меньшей мере 60, 65, 70, 75, 80, 85, 90 или 95% поверхности изготовлено из сетки. Как будет объяснено позже, слои также могут содержать зоны, где слой находится в иной форме, чем сетка, такой как плотно сплетенная ткань или непрерывные волокна. Как правило, данные зоны используются для отрезания или сгибания имплантата. Наиболее предпочтительно слои изготавливают из сетки за исключением данных зон. Иногда контур слоев может быть изготовлен из непрерывных волокон. Они могут использоваться, например, в имплантате, где они прикреплены к кости в области, где кость (и таким образом соединение) находится под значительным напряжением. Вследствие этого непрерывные волокна усиливают контур, где происходит соединение с костью.
Согласно одному варианту осуществления изобретения волокна выбирают из группы, состоящей из инертных стекловолокон и биоактивных стекловолокон. Согласно еще одному варианту осуществления стекловолокна изготавливают из стеклянной композиции из E-стекла, S-стекла, R-стекла, C-стекла или биоактивных стекол.
Согласно еще одному варианту осуществления диаметр волокон составляет 4-25 мкм. Диаметр волокон может составлять, например, от 3, 5, 6, 10, 15, 20, 25, 30, 40, 45, 50, 60, 70 или 80 мкм до 5, 6, 10, 15, 20, 25, 30, 40, 45, 50, 60, 70, 80, 90 или 100 мкм. Также можно использовать волокна в нанометровом масштабе, т. е. с диаметром поперечного сечения, варьирующим между 200-1000 нм.
Биоактивный материал может быть в любой форме, подходящей для вставки между двумя слоями, состоящими в основном из сетки. Он может быть, например, в монолитном виде или в форме частиц. Под «частицами» подразумевают объекты, в которых наибольший размер не более чем в пять раз больше, чем наименьший размер, таким образом он также может быть в виде измельченных, коротких волокон. Когда используют частицы, их размер меньше, чем размер сетки слоев, для того, чтобы слой имел возможность удерживать их внутри имплантата. Биоактивный материал также может быть в монолитном виде или только двух, трех или четырех больших частиц. Некоторые возможные размеры частиц составляют 10-1000 мкм. Размер частиц может составлять, например, от 10, 20, 50, 100, 150, 200, 250, 300, 400, 500, 650, 700 или 800 мкм до 20, 50, 100, 150, 200, 250, 300, 400, 500, 650, 700, 800, 900 или 1000 мкм.
Биоактивный материал также может быть в виде текучей среды, имеющей такую вязкость, чтобы слои сетки были непроницаемы для текучей среды, то есть имплантат может содержать подобный биоактивный материал в дополнение к материалам, перечисленным в независимом пункте формулы изобретения. Текучей средой может быть сильно вязкая текучая среда или коллоид в жидкой форме. Под коллоидом подразумевают вещество, равномерно микроскопически диспергированное в другом веществе. Естественно, биоактивный материал также может быть в некоторых из данных форм, например комбинация частиц в текучей среде. Предпочтительно биоактивным материалом является биоактивное стекло.
Согласно варианту осуществления размер сетки оптимизируют посредством способа плетения сетки и вязкости и количества импрегнированной смолы сетки. Согласно варианту осуществления размер сетки предпочтительно на 1-5 микрометров меньше, чем наименьший диаметр частиц. Размер сетки может составлять, например, 9-999 мкм. Таким образом размер сетки может составлять, например, от 1, 2, 3, 5, 7, 9, 10, 15, 20, 50, 100, 150, 200, 250, 300, 400, 500, 650, 700, 800 или 900 мкм до 2, 3, 5, 7, 9, 10, 15, 20, 50, 100, 150, 200, 250, 300, 400, 500, 650, 700, 800, 900, 950 или 1000 мкм.
Согласно дополнительному варианту осуществления два слоя сетки прикреплены друг к другу также вдоль по меньшей мере одной линии отреза. Линия отреза может быть образована, например, из однонаправленных непрерывных волокон.
Зона соединения, т. е. часть имплантата, где слои скреплены вместе, может варьировать по ширине. Преимущество большой зоны соединения состоит в том, что имплантат можно меньше резать, подгоняя к предназначенному применению, а также он остается функциональным, так как биоактивный материал удерживается внутри имплантата.
Положение зоны соединения также является важным и может варьировать в зависимости от предназначенного применения. Например, имплантат может быть изготовлен таким образом, чтобы он имел более чем одну часть (например, две, три, четыре, пять или шесть частей), при этом каждая часть отделена от других частей зоной соединения, т. е. линией отреза. Зоны соединения между частями могут использоваться, например, для более легкого сгибания имплантата или для отрезания от имплантата одной или более частей. Таким образом может быть изготовлен легко приспосабливаемый имплантат, когда пользователь должен будет решать, какой размер необходим только непосредственно перед тем, как имплантировать имплантат. Это особенно важно для неотложных операций, а также можно полагать, что это уменьшит расходы, так как больше не будет необходимости содержать запас имплантатов различных размеров. Есть основания полагать, что срок годности данных имплантатов будет приблизительно один год, естественно, в зависимости от используемых компонентов.
Контур имплантата, т. е. зона соединения вдоль контура, также может содержать отверстия, которые проходят через оба слоя сетки для облегчения прикрепления имплантата на свое место, например, винтами для костей. При необходимости аналогичные отверстия также могут быть предоставлены в линии отреза. Кроме того, когда используют большую зону соединения вдоль контура имплантата, он может быть снабжен серией отверстий на различных расстояниях от краев, так чтобы имплантат можно было прикреплять также легко даже при разрезании на более маленький размер.
Имплантат может быть однородным по своей структуре и материалам, или он может состоять из различных материалов и/или свойств в разных местах, например возможно изменять одно или более из следующего: размера сетки, матричного материала, величины матрицы, материала волокна, диаметра волокна или биоактивного материала. Это может приводить, например, к различной прочности в различных местах имплантата.
Предпочтительным матричным материалом является акрилат полимер. Матрица образуется, когда смола отверждается. Согласно варианту осуществления смолу матрицы выбирают из группы, состоящей из замещенных и незамещенных диметакрилатов и метакрилатов. Некоторыми особенно предпочтительными материалами матрицы (мономерами) являются метилакрилат, метилметакрилат, метакрилат, функционализированный дендримерами глицидилдиметакрилат (бис-GMA), триэтиленгликоль диметакрилат (TEGDMA) и уретандиметакрилат (UDMA). Материалы могут использоваться в виде смесей, и они могут образовывать взаимопроникающие полимерные сети (IPNs). Они также могут быть функционализированы биоактивными молекулами, которые предусматривают лекарствоподобный контактный эффект. Также для использования подходят комбинации мономеров и полимеров, включая модификации смолистых систем за счет противомикробных боковых групп, содержащих йодин, который обеспечивает дополнительную пользу при повышении радионепроницаемости смолистых систем.
Вязкость смолы такая, чтобы она не мешала структуре сетки. Некоторые примеры вязкости смолы и размера сетки приведены ниже.
Имплантат может дополнительно содержать модифицирующие частицы. Данные модифицирующие частицы могут, например, быть биоактивными и, например, улучшать остеокондуктивность имплантата. Частицы могут быть в виде гранулированных наполнителей или волокон. Массовая доля данных модифицирующих частиц в имплантате может составлять, например, 10-60% масс., например от 5, 10, 15, 20, 35 или 50% масс. до 10, 15, 20, 35, 50, 55, 60 или 75% масс.
Согласно одному варианту осуществления модифицирующие частицы выбирают из группы, состоящей из биоактивной керамики, биоактивного стекла, кремниевого геля, титанового геля, кремниевого ксерогеля, кремниевого аэрогеля, натриевого кремниевого стекла, титановых гелей, иономера биоактивного стекла, гидроксиапатита, Ca/P-легированного кремниевого геля и их смесей. Естественно, также можно использовать любую комбинацию указанных материалов. Когда необходима быстрая минерализация, предпочтительно иметь биоактивное стекло с золь-гель обработанными кремниевыми частицами.
Имплантат согласно представленному изобретению, кроме того, может содержать дополнительный гранулированный материал-наполнитель, такой как оксиды металлов, керамика, полимеры и их смеси. Оксиды металлов можно, например, использовать в качестве материалов, радио- или рентгенонепроницаемых или в качестве окрашивающих материалов.
Имплантат также может содержать терапевтически активные агенты или клетки, такие как стволовые клетки, белки, такие как факторы роста и/или сигнальные молекулы. Некоторые типы клеток, включая гемопоэтические костномозговые клетки, фибробласты, остеобласты, регенеративные клетки, эмбрионоподобные стволовые клетки, мезенхимные стволовые клетки или жировые стволовые клетки, могут быть введены в имплантат. Эмбриональные стволовые клетки могут иметь или могут не иметь человеческое происхождение. Стволовые клетки, посеянные в имплантат, можно культивировать в биореакторах ex vivo, в других частях тела перед вставкой образованной ткани на свое окончательное место, или непосредственно на месте, где необходимо регенеративное и восстановительное лечение. Имплантат также может содержать добавки, усиливающие возможности его обработки, такие как инициаторы полимеризации. Материалы имплантата могут быть либо биорассасывающимися, биоразрушающимися, биостабильными или их смесью.
Имплантат также может содержать между слоями взаимосвязанные части, которые являются жесткими и по существу несжимаемыми. Данные взаимосвязанные части таким образом обеспечивают, что, когда материал изгибается, слои не входят в контакт друг с другом, так как они должны остаться разделенными промежутком. Тогда это обеспечивает, что свойства имплантата остаются по существу неизменными в отношении капиллярного эффекта и срастания кости.
Размер и форму имплантата выбирают согласно предназначенному применению. Диаметр имплантата может составлять, например, от 10 до 350 мм. Формой может быть любая подходящая форма, например круглая, эллиптическая, квадратная и т. д. Имплантат также может иметь поперечное сечение, которое является по существу симметричным относительно двух слоев, т. е. они разделены одинаковыми промежутками по существу по всей ширине имплантата. Имплантат также может иметь различные формы, как будет объяснено более подробно в связи с чертежом. Таким образом, имплантат может иметь по существу плоскую верхнюю (или нижнюю) поверхность и протяжение на другой поверхности. Подобные формы особенно подходят для краниальных вариантов применения для наполнения в окончатые дефекты после хирургии.
Имплантат может использоваться для восстановления костей после травмы, дефекта или хирургического лечения заболеваний. Реконструкцию с помощью имплантата поврежденных или недостающих частей скелета выполняют посредством обеспечения немедленного восстановления анатомической формы и адекватной механической опоры оставшихся частей кости с одновременным проникновением в имплантат кроветворных и костеобразующих клеток из соседних тканей. Как правило, существует необходимость в восстановлении дефектов костей свода черепа после нейрохирургических операций и травм, при реконструкции костей дна глазной ямки и костей челюсти, но имплантат может быть использован также в ортопедической хирургии и хирургии позвоночника, а также при фиксации фрагментированных частей кости. В присутствии длинных костей, ослабленных заболеваниями, или когда потеряны части кортикальной кости, имплантат может быть использован для усиления длинных костей и покрытия отверстий, где потеряна кортикальная кость. В вариантах тканевой инженерии в имплантат, изготовленный с требующейся формой, могут быть загружены стволовые клетки и ткань, полученная в биореакторе или в соседних тканях пациента перед внесением имплантата в итоговое место.
Имплантат предпочтительно получают следующим образом. Из прозрачного материала для отливочной формы получают состоящую из двух частей отливочную форму для придания формы обеим сторонам имплантата. Как правило, наружную поверхность имплантата делают толще и не сетчатой, тогда как внутреннюю поверхность, которую собираются вводить в контакт с кровотоком поврежденных тканей, делают сетчатой. В случаях, когда предпочтительной является более хорошая проницаемость имплантата для текучих сред и/или ткани, наружную поверхность также делают из сетчатого материала. Волокнистую ткань для наружной поверхности, как правило, полностью импрегнируют системой из мономерной смолы, и волокнистую ткань помещают в отливочную форму. Частицы биоактивного стекла наливают на внутреннюю поверхность образованного таким образом слоя наружной поверхности. Для получения сетчатой внутренней поверхности для имплантата сетчатую волокнистую ткань импрегнируют мономерной смолой, варьируя количество мономерной смолы и ее вязкость в волокнистой ткани, можно варьировать размеры отверстий во внутреннем многослойном материале. Далее следуют некоторые примеры подходящей вязкости. Вязкость мономерной смолы глицидилдиметакрилат и триэтиленгликольдиметакрилат может варьировать от 550 Пуассон в сек у чистого глицидилдиметакрилата до 50 Пуассон в сек у трехэтиленгликольдиметакрилата. Смесь 50%:50% глицидилдиметакрилата и триэтилгликольдиметакрилата может иметь вязкость, составляющую 180 Пуассон в сек, а смола может быть использована для импрегнирования волокнистой сетки, имеющей размер отверстий, составляющий 300 микрометров. За счет увеличения доли глицидилдиметакрилата вязкость смеси повышается, а чтобы иметь размер итоговой сетки (отверстий), составляющий 300 микрометров, могут быть использованы более крупные отверстия волокнистой сетки. Вязкость приведена для температуры, составляющей 25°C.
Сетчатую ткань помещают поверх многослойного материала наружного слоя имплантата и биоактивных частиц с последующим закрытием отливочной системы. Через прозрачный материал отливочной формы, с помощью света инициируют первоначальную полимеризацию мономерной смолистой системы. Первоначально в мономерной смоле имплантата будут полемиризоваться светочувствительный инициатор и активирующая система. Отливочную форму открывают и первоначально полемиризованный имплантат высвобождают из отливочной формы, а отверждение завершают при разрежении и при повышенной температуре перед завершающей обработкой имплантата (закругление контуров и т. д.).
Некоторые варианты осуществления изобретения более подробно объяснены на приложенных чертежах, которые не следует истолковывать как ограничение формулы изобретения. Ссылочные обозначения также не следует истолковывать как ограничение формулы изобретения.
Далее одни и те же ссылочные обозначения используются для одних и тех же или аналогичных компонентов в различных вариантах осуществления и/или фигурах.
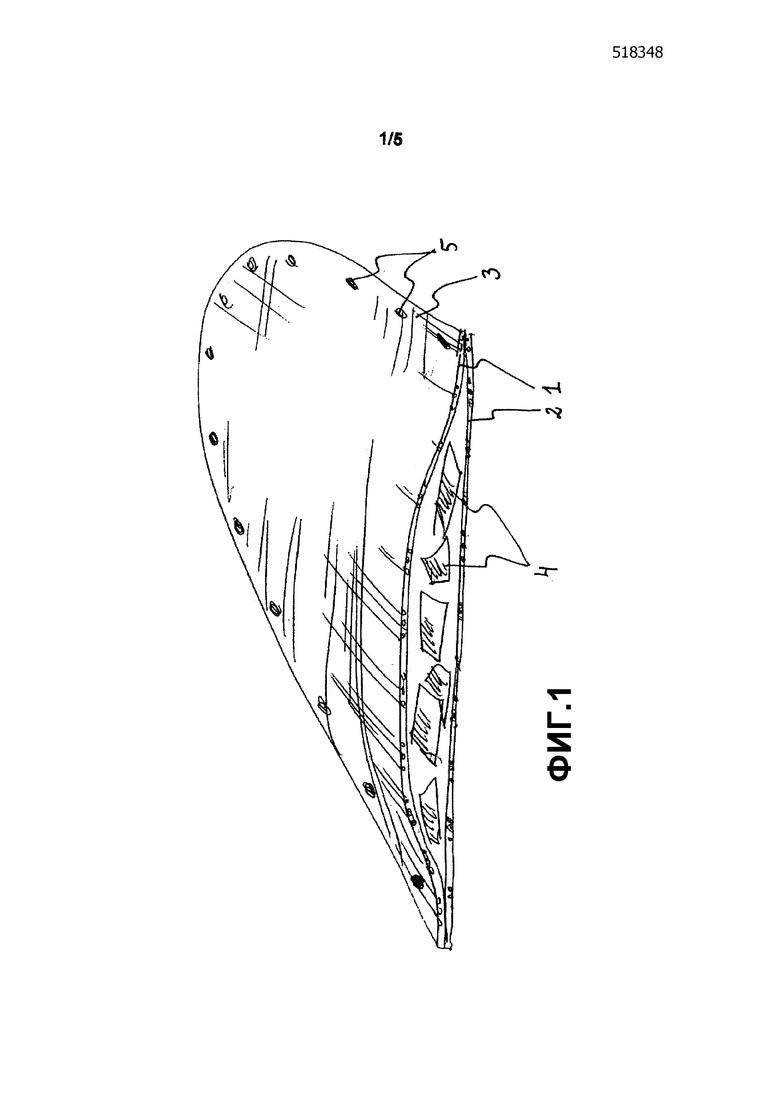
Фиг. 1 схематично показывает имплантат согласно первому варианту осуществления. В данном варианте осуществления имплантат состоит из двух слоев, первого верхнего слоя 1 и второго нижнего слоя 2, изготовленных из волокнистой сетки. Слои прикреплены друг к другу вдоль контура 3 имплантата, а между слоями расположены биоактивные частицы 4. Контур 3 также содержит отверстия 5, которые проходят через оба слоя 1 и 2 для облегчения прикрепления имплантата на свое место, например, с помощью костных винтов.
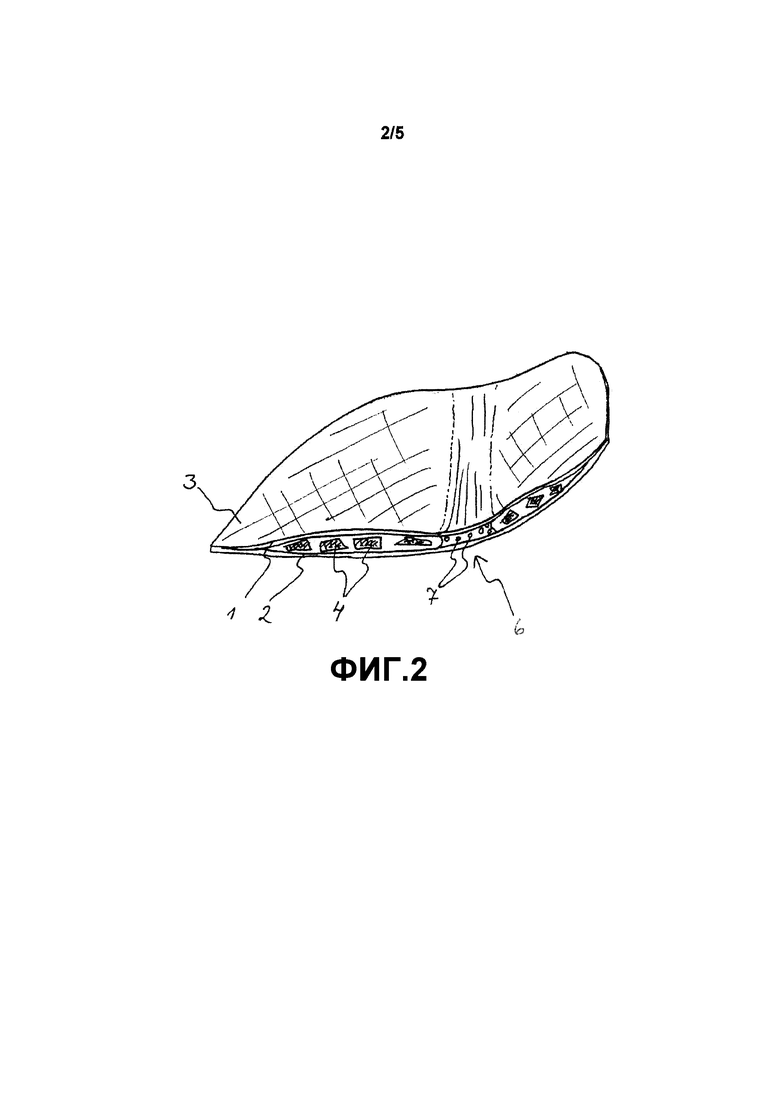
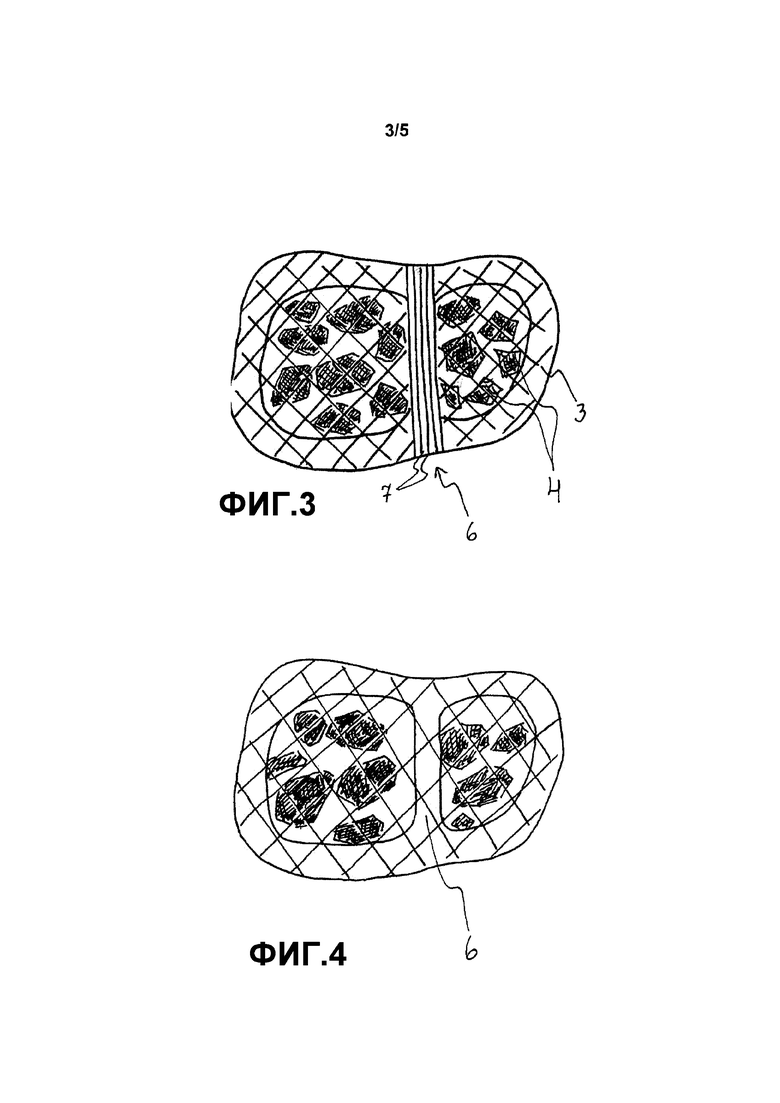
Фиг. 2 схематично показывает имплантат согласно второму варианту осуществления. В данном варианте осуществления имплантатом является глазничная пластинка, состоящая из двух слоев, первого верхнего слоя 1 и второго нижнего слоя 2, сделанного в основном из плетеного волокна со сквозными отверстиями, армированного композитной сеткой. Слои также имеют линию 6 отреза, сделанную из ненаправленных длинных волокон 7. Слои прикреплены друг к другу вдоль контура 3 имплантата, а также вдоль линии 6 отреза, между слоями расположены биоактивные частицы 4. Фиг. 3 схематично показывает имплантат согласно второму варианту осуществления с другим углом, т. е. перпендикулярно слоям. На данной фигуре можно видеть, что линия 6 отреза состоит из непрерывных ненаправленных волокон 7, проходящих от одного конца имплантата к другому. Данная фигура также показывает, насколько размер сетки слоев меньше, чем размер частицы 4. Фигура также показывает ширину зоны соединения вдоль контура 3.
Фиг. 4 схематично показывает имплантат согласно третьему варианту осуществления. В данном варианте осуществления линия 6 отреза изготовлена из такого же материала, как остальные слои, и образована за счет простого прикрепления слоев друг к другу.
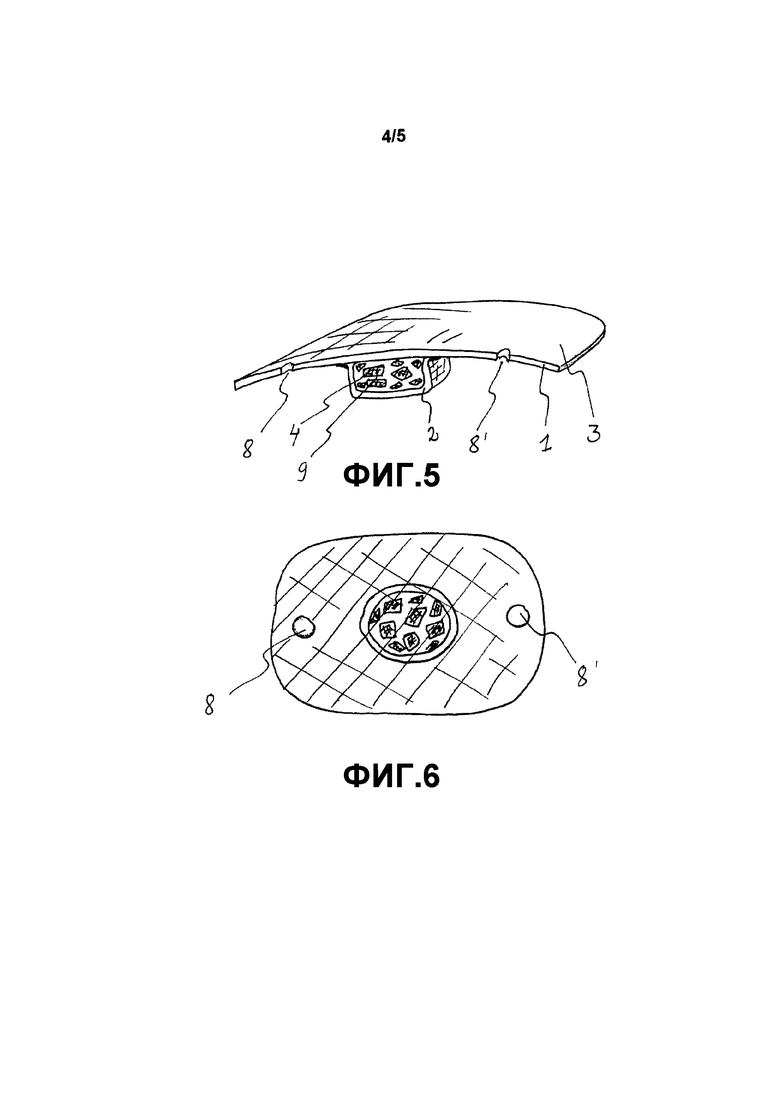
Фиг. 5 схематично показывает имплантат согласно четвертому варианту осуществления. В данном варианте осуществления имплантат представляет собой фиксирующую заглушку для костных трансплантатов после краниотомии. В данном варианте осуществления зона 3 соединения является достаточно большой для того, чтобы обеспечить хорошее прилипание имплантата к кости. Зона 3 соединения также имеет два отверстия 8, 8' для фиксации винтов, показанные на этой фигуре в виде половинных отверстий. Первый, верхний, слой 1 в данном варианте осуществления является по существу плоским, а второй, нижний, слой 2 образует протяжение 9 под первым слоем 1. Размер и форма протяжения 9 по существу идентичны окончатому дефекту в кости свода черепа. Данные протяжения также содержат биоактивные частицы 4 для улучшения срастания костей.
Фиг. 6 схематично показывает имплантат согласно четвертому варианту осуществления с другим углом, и можно ясно видеть два отверстия 8, 8′ для фиксации винтов.
Фиг. 7 схематично показывает имплантат согласно пятому варианту осуществления. В данном варианте осуществления имплантатом является покрывающая пластина для костных дефектов длинных костей. Имплантат содержит также взаимосвязанные части 10, обеспечивая, что, когда материал изгибается, слои не входят в контакт друг с другом в областях, где они должны оставаться разделенными промежутком для того, чтобы обеспечивать возможность хорошего срастания костей.
Изобретение относится к области медицины, а именно к имплантату для применения при замещении кости, содержащему, по меньшей мере, два слоя, изготовленных из волокон, и биоактивный материал, который выбирают из биоактивного стекла, гидроксиапатита, трикальцийфосфата и их смесей в виде частиц, расположенный между указанными, по меньшей мере, двумя слоями, в котором, по меньшей мере, один из слоев в основном образован из сетки, изготовленной из стекловолокон, имеющих диаметр 3-100 мкм, и размер сетки выбирают таким образом, чтобы биоактивный материал оставался внутри имплантата, при этом слои заделаны в матрицу, изготовленную из смолы, выбранной из замещенных и незамещенных диметакрилатов и метакрилатов, и слои прикреплены друг к другу вдоль контура имплантата. Изобретение обеспечивает улучшенное срастание кости. 7 з.п. ф-лы, 7 ил.
1. Имплантат для применения при замещении кости, содержащий по меньшей мере два слоя, изготовленных из волокон, и биоактивный материал, расположенный между указанными по меньшей мере двумя слоями, в котором
- по меньшей мере один из слоев по меньшей мере в основном образован из сетки, изготовленной из стекловолокон, имеющих диаметр, составляющий 3-100 мкм, и при этом
- размер сетки выбирают таким образом, чтобы биоактивный материал оставался внутри имплантата,
- слои заделаны в матрицу, изготовленную из смолы, выбранной из группы, состоящей из замещенных и незамещенных диметакрилатов и метакрилатов,
- слои прикреплены друг к другу вдоль контура имплантата, при этом биоактивный материал выбирают из группы, состоящей из биоактивного стекла, гидроксиапатита, трикальцийфосфата и их смесей в виде частиц.
2. Имплантат по п. 1, в котором стекловолокна изготавливают из стеклянной композиции из S-стекла, Е-стекла или биоактивного стекла.
3. Имплантат по п. 1 или 2, в котором диаметр волокон составляет 4-25 мкм.
4. Имплантат по п. 1, в котором размер частиц биоактивного материала составляет 10-1000 мкм.
5. Имплантат по п. 1, в котором он содержит биоактивный материал в виде текучей среды, имеющей такую вязкость, что слои сетки непроницаемы для текучей среды.
6. Имплантат по п. 1, в котором размер сетки составляет 9-990 мкм.
7. Имплантат по п. 1, в котором два слоя сетки дополнительно прикреплены друг к другу вдоль, по меньшей мере, одной линии отреза.
8. Имплантат по п. 7, в котором линия отреза образована из однонаправленных непрерывных волокон.
| WO 2004049904 A2, 17.06.2004 | |||
| US 7997901 B2, 16.08.2011. |
Авторы
Даты
2016-07-10—Публикация
2013-05-28—Подача