Изобретение относится к области микробиологии и гибридомной биотехнологии и может быть использовано при создании иммунодиагностических тест-систем на основе моноклональных антител (МКА) для определения токсигенных штаммов Vibrio cholerae по продукции холерного токсина (XT).
Холера - тяжелая острая инфекционная болезнь, вызываемая токсигенными штаммами холерного вибриона. В условиях продолжающейся седьмой пандемии холеры активные миграционные процессы и существование современных высокоскоростных транспортных средств создают постоянную угрозу заноса инфекции в любую точку земного шара в кратчайшие сроки.
В настоящее время иммунологические методы диагностики холеры используются как в рамках бактериологического исследования (ускоренные методы обнаружения возбудителя и идентификация культур), так и самостоятельно - для индикации холерного вибриона в материале, зараженном этим возбудителем [Лабораторная диагностика холеры: МУК 4.2.2218-07 М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора; 2007. 87 с; Kaper J.B., Morris J.G., Levine М.М. Cholera. Clin. Microbiol. Rev. 1995; Р. 48-86].
Наиболее перспективным подходом в данном направлении является определение продукции XT V. cholerae с помощью иммуноферментного анализа с применением МКА. Поскольку концентрация энтеротоксина, вызывающая заболевание незначительная [Scarlatos A., Welt В., Cooper В., et al. // J.Food. Sci. 2005. V. 70 (8). P. 121-124], важно разработать иммуноферментную тест-систему с высокой чувствительностью.
Известен штамм гибридных культивируемых клеток животных Mus musculus L-продуцент моноклональных антител класса М к холерному энтеротоксину, которые могут быть использованы для конструирования иммунобиологических препаратов, выявляющих холерный токсин в количестве 1,0 нг/мл (патент RU 1835848).
Известны также клоны гибридных клеток CT-B1/F8, СТ-Е6/Е10, CT-F5/H3 животных Mus Musculus L-продуценты моноклональных антител к холерному токсину, применение которых в иммуноферментном анализе позволяет определить 0,2 нг/мл XT (патент RU 2401299, RU 2401300, RU 2401301).
Задачей изобретения является получение штамма гибридомы-продуцента высокоспецифичных МКА, предназначенных для использования в качестве иммунореагентов при конструировании иммуноферментных диагностических тест-систем с целью определения продукции холерного токсина у штаммов V. cholerae, превосходящих по чувствительности имеющиеся аналоги.
Поставленная задача решается получением штамма гибридных клеток животных Mus musculus XT 3E5 - продуцента моноклональных антител изотипа G 2а к В-субъединице холерного токсина.
Заявляемый штамм гибридных клеток животных Mus musculus XT 3E5 получают путем гибридизации спленоцитов иммунной мыши линии BALB/c с клетками мышиной миеломы Sp 2/0 в присутствии сливающего агента - полиэтиленгликоля (ПЭГ), последующего рассева взвеси клеток в лунки 96-луночных культуральных планшетов, выращивания в селективных средах с постепенным переходом на полную среду культивирования гибридных клеток, отбора первичного клона по показателю продукции специфических антител, его клонирования и реклонирования методом лимитирующих разведений.
Штамм гибридных клеток животных Mus musculus XT 3E5 характеризуется следующими признаками:
Маркерные признаки и методы их оценки.
Штамм секретирует мышиные иммуноглобулины, специфически взаимодействующие с холерным токсином. Анализ мышиных иммуноглобулинов проводят методом иммуноферментного анализа, используя в качестве антигена холерного токсина, и антитела против иммуноглобулинов мыши, меченые пероксидазой хрена.
Контаминация бактериями и грибами не обнаружена.
Морфологические признаки.
Культура состоит из крупных округлых клеток, сходных по морфологии и размерам с исходной родительской миеломой Sp 2/0.
Культуральные свойства.
Соматические клетки инкубируют при 37°C в атмосфере с 5% CO2 в пластиковых 96-луночных планшетах. Культивирование миеломных линий проводят в ростовой среде следующего состава: гибридомная среда Hybridomia Express Plus (with HEPES, without L - Glutamine), дополненная антибиотиками (стрептомицин, гентамицин, пенициллин, амфотерицин), 3% лошадиной сывороткой («РАА», Австрия) или 10% эмбриональной сывороткой плодов коровы («РАА», Австрия) для гибридом соответственно.
На всех этапах гибридизации иммунных спленоцитов с клетками мышиной плазмацитомы применяют бессывороточную среду Hybridomia Express Plus с вышеуказанными ингредиентами. Эта среда использовалась для приготовления раствора сливающего агента - полиэтиленгликоля. Для этого 1 г ПЭГ автоклавировали при 110°C 30 мин и растворяли в 1 мл среды непосредственно перед фузией.
Селективная среда состоит из среды для культивирования гибридом, дополненной 50-кратным раствором гипоксантин-аминоптерин-тимидин (HAT) или гипоксантин-тимидин (НТ). Для растворения HAT или НТ использовали деионизованную воду, которую стерилизовали, используя мембранные фильтры с диаметром пор 0,22 мкм. После неоднократного скрининга для накопления препаративного количества гибридных клеток, синтезирующих моноклональные антитела, дальнейшее культивирование продолжали на гибридомной среде.
Штамм является монослойно-суспензионной культурой, в которой до 15% клеток находится в суспензии, не прикрепляясь к поверхности посуды для культивирования. Посевная доза - 105 кл/мл. Частота пассирования 2-3 суток.
Культивирование штамма гибридных клеток 3E5 в организме животного.
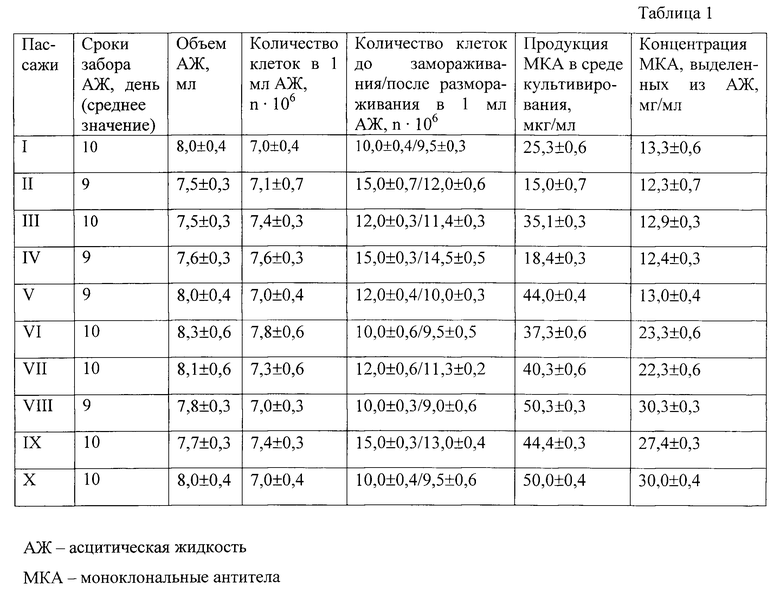
8-12 недельным мышам весом 20 г инбредной линии BALB/c, сингенных по отношению к линиям плазмацитомы Sp.2/0-Ag.8 предварительно праймированных 0,5 мл пристана, вводят внутрибрюшинно 2×106 гибридных клеток. Формирование асцитных опухолей регистрируют у 100% биопродуцентов в одни и те же сроки (на 9-10 день). В среднем объем иммуноасцитической жидкости от одной мыши составил 7,5-8,0 мл при концентрации клеток 7-7,5×106 м.к. в 1 мл.
Антителопродуцирующая активность, которая определялась непрямым иммуноферментным анализом, в течение 1 года сохранялась на постоянном уровне и хорошо воспроизводилась и в культуре клеток, что свидетельствовало о стабильности основных свойств штамма 3E5 как in vivo, так и in vitro.
Характеристика полезного продукта. Штамм гибридных клеток XT 3E5 продуцирует специфические моноклональные антитела к холерному токсину, титр которых составляет в культуральной жидкости 1:20000, в иммуноасцитической жидкости - 1:2000000. Иммуноглобулиновую фракцию выделяли двукратным осаждением насыщенным до 45-50% раствором сульфата аммония. Концентрацию иммуноглобулинов определяли электрофоретически при длине волны 280 нм.
Продуктивность штамма. Продукция МКА в среде культивирования варьировала от 15 мкг/мл до 50 мкг/мл, в асцитической жидкости - 10-30 мг/мл. Стабильная продукция МКА сохраняется на протяжении не менее 10 пассажей in vitro и 10 пассажей in vivo (срок наблюдения).
Криоконсервация. Линии плазмоцитом и позитивные клоны гибридных клеток вне периода экспериментов по накоплению препаративных количеств МКА 3E5 клетки гибридомы сохраняли в пробирках для криоконсервирования с фетальной сывороткой и добавлением в качестве криопротектора 10% диметилсульфоксида при температуре минус 196°C в сосудах Дьюара с жидким азотом. Размораживание производили при 37°C на водяной бане в течение 2-3 минут. Жизнеспособность клеток после размораживания составляет не менее 80%.
Свойства полезного продукта. Изотипирование полученного МКА проводили с помощью набора «Mouse Monoclonal Antibody Isotyping Reagents» (Sigma, США) по прилагаемой инструкции изготовителя. Гибридома XT 3E5 продуцирует МКА, относящиеся к иммуноглобулинам класса G субкласса 2а. Константу аффинности определяли по методу J.D. Beatty. - 1,8±0,10 109 М-1 [Beatty J.D., Beatty B.G., Vlahos W.G. Measurement of monoclonal antibody affinity by non-competitive enzyme immunoassay // J. Immunol. Methods. - 1987. - 100. - P. 173-179.].
Штамм гибридных клеток XT 3E5 - продуцент МКА изотипа G 2а к В - субъединице холерного токсина получен в Российском научно-исследовательском противочумном институте «Микроб» Роспотребнадзора и депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» под номером Н-43.
Изобретение иллюстрируют примеры.
Пример 1. Получение штамма гибридных клеток животных Mus musculus XT 3E5.
Штамм получают гибридизацией спленоцитов гипериммунных мышей BALB/c с миеломными клетками Sp.2/0-Ag.8, дефектными по синтезу фермента гипоксантин-гуанин-фосфорибозилтрансферазы. Для иммунизации мышей линии BALB/c оптимальной оказалась схема, предусматривающая 5-кратное внутрибрюшинное введение препарата XT в дозе 2 мкг с 3-дневным интервалом.
После полного цикла иммунизации титры специфических антител в сыворотках животных определяют непрямым твердофазным иммуноферментным анализом.
Гибридизация. За два дня до слияния осуществляют бустерную прививку, а также подготавливают 96-луночные планшеты с фидерным слоем клеток. Гибридизацию иммуноспленоцитов мыши и клеток миеломы проводят в соотношении 1:5 в присутствии 1 мл полиэтиленгликоля 4000 в течение 1 минуты.
Селекция. После отмывки полиэтиленгликоля клетки высевают на 96-луночные планшеты с фидером. На первом этапе после гибридизации используют селективную среду с HAT. Через 5-7 дней в инвертированном микроскопе наблюдали клоны гибридных клеток. Начиная с 14 дня после слияния, культивирование гибридом осуществляли на среде с НТ, через 5-7 дней переводили на ростовую среду без селективных компонентов.
Скрининг гибридных клонов. Для отбора гибридом-продуцентов МКА к типоспецифическим эпитопам на 14-й день после проведения гибридизации культуральную жидкость лунок с пролиферирующими клонами тестируют на наличие антителопродуцирующих гибридом в непрямом иммуноферментном анализе. Лунки полистироловых планшетов для ИФА сенсибилизируют XT и его В-субъединицей в концентрации 20 мкг/мл и 5 мкг/мл, соответственно. Планшеты инкубируют при температуре 37°C в течение 2 часов или при температуре 4°C в течение 16-18 часов.
По истечении времени инкубации в лунки планшета вносят 0,5% раствор сухого обезжиренного молока в фосфатно-солевомом буфере (ФСБ). Инкубируют при температуре 37°C в течение 30 мин. После удаления блокирующего раствора, трижды промывают лунки ФСБ, далее вносят культуральную жидкость из тех лунок, где 1/3 дна лунки покрыта клеток. Планшеты инкубируют при температуре 37°C в течение 1 часа. Затем лунки планшетов трижды промывают ФСБ и вносят раствор антивидового конъюгата "Антитела диагностические против Ig G (Н+L)" белой мыши, меченых пероксидазой хрена в рабочем разведении. В качестве разводящей жидкости используют 0,5% раствор твина-20 в ФСБ и 0,5% раствор лактальбумина в соотношении 1:9. Планшеты инкубируют при температуре 37°C в течение 1 часа. Удаляют встряхиванием жидкость из лунок и отмывают 6-кратно. Затем в каждую лунку планшетов вносят по 100 мкл субстрат-индикаторной смеси. Планшет помещают на шейкер и выдерживают 30 мин при легком встряхивании. Учет результатов проводят спектрофотометрически, определяя оптическое поглощение при длине волны 405 нм.
Клонирование. Гибридомы, с максимальными и стабильно регистрируемыми значениями оптической плотности были отобраны для проведения клонирования методом лимитирующих разведений в 96-луночных планшетах с фидерным слоем клеток. Скрининг клонов осуществляли непрямым иммуноферментным анализом, как описано выше.
Криоконсервация. Линии плазмоцитом и позитивные клоны гибридных клеток сохраняют в пробирках для криоконсервирования с фетальной сывороткой и добавлением в качестве криопротектора 10% диметилсульфоксида при температуре минус 196°C в сосудах Дьюара с жидким азотом.
Пример 2. Культивирование штамма гибридных клеток XT 3E5, секретирующего МКА к холерному токсину, in vivo.
Мышам весом 18-20 г инбредной линии BALB/c после пристанизации через 14 дней вводят внутрибрюшинно гибридные клетки в дозе 2-106 на одну мышь. Формирование асцитных опухолей отмечалось у 100% биопродуцентов в одни и те же сроки (на 9-10 день). В среднем объем иммуноасцитической жидкости от одной мыши составил 7,5-8,0 мл при концентрации клеток 7-7,5·106 м.к. в 1 мл. Оба показателя характеризовались приблизительно одинаковыми значениями во всех пассажах. Клетки из асцитической жидкости могут использоваться для дальнейшего перевивания либо храниться в криоконсервированном состоянии, а в надосадочной жидкости определяют титр антител с помощью иммуноферментного анализа, как описано выше. Характеристика штамма гибридных культивируемых клеток животных Mus musculus XT 3E5 представлена в таблице 1.
Пример 3. Определение продуктивности клона в культуральной и иммуноасцитической жидкостях.
Лунки полистиролового планшета для ИФА сорбируют XT в концентрации 20 мкг/мл. Планшет инкубируют при температуре 37°C в течение 2 часов или при температуре 4°C в течение 16-18 часов.
По истечении времени инкубации лунки блокируют 0,5% раствором сухого обезжиренного молока в ФСБ. Инкубируют при температуре 37°C в течение 30 мин. После удаления блокирующего раствора, трижды промывают лунки ФСБ. Испытуемые культуральную и иммуноасцитическую жидкости титруют начиная с разведения 1/5000 и 1/2000, соответственно, до 12-й лунки, последовательно перенося по 100 мкл жидкости из каждой предыдущей лунки в последующую. Планшет инкубируют при температуре 37°C в течение 1 часа. Затем лунки планшета трижды промывают ФСБ и вносят раствор антивидового конъюгата "Антитела диагностические против Ig G (Н+L)" белой мыши, меченых пероксидазой хрена, в рабочем разведении. В качестве разводящей жидкости используют 0,5% раствор твина-20 в ФСБ и 0,5% раствор лактальбулина в соотношении 1:9. Планшет инкубируют при температуре 37°C в течение 1 часа. Удаляют встряхиванием жидкость из лунок и отмывают 6-кратно. Затем в каждую лунку планшета вносят по 100 мкл субстрат-индикаторной смеси. Планшет помещают на шейкер и выдерживают 30 мин при легком встряхивании.
В лунках планшета, где прошла реакция, появляется окрашивание от насыщенно-зеленого до светло-зеленого. Интенсивность окрашивания снижается по мере снижения концентрации внесенных специфических антител. В лунках, не содержащих специфических антител, субстрат бесцветный или слабоокрашенный. По результатам видно, что продуктивность клона в культуральной и иммуноасцитической жидкостях составила 1:20000 и 1:2000000, соответственно.
Пример 4. Выделение очищенных моноклональных антител, продуцируемых штаммом гибридных клеток XT 3E5.
Выделение иммуноглобулиновой фракции осуществляют двукратным осаждением насыщенным раствором сульфата аммония до 45-50% насыщения. Для этого отцентрифугированную асцитическую жидкость разводят в 2 раза дистиллированной водой и проводят первое насыщение насыщенным раствором сульфата аммония до 45%, оставляют на ночь при 4°C. На следующий день после центрифугирования проводят второе насыщение насыщенным раствором сульфата аммония до 50%, также оставляют на ночь при 4°C. Освобождение иммуноглобулиновой фракции от сернокислого аммония проводят с помощью диализа против физиологического раствора.
Пример 5. Определение специфического взаимодействия и чувствительности иммуноглобулиновой фракции штамма гибридных клеток XT 3E5 с холерным токсином в иммуноферментном анализе.
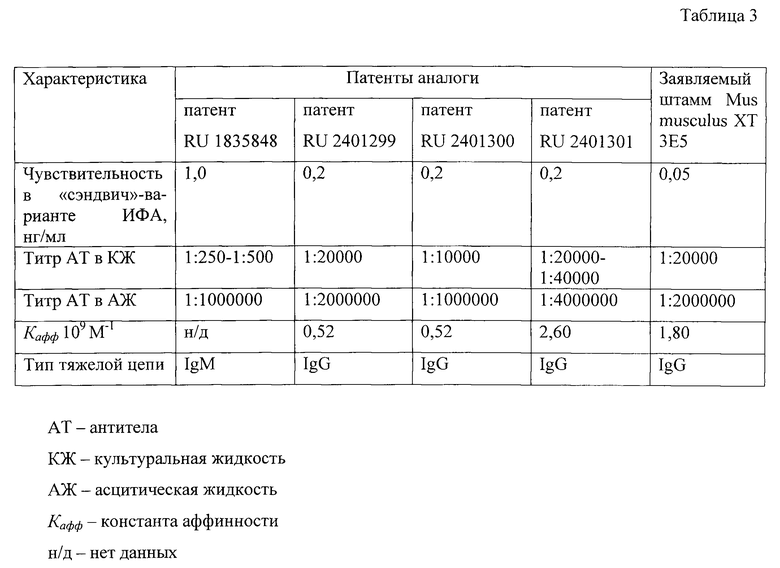
Для проведения неспецифической сорбции в лунки полистиролового планшета вносят МКА в концентрации 10 мкг/мл. Планшеты инкубируют при температуре 37°C в течение 2 часов или при температуре 4°C в течение 16-18 ч. По истечении времени инкубации раствор МКА удаляют и блокируют 0,5% раствором лактальбумина, выдерживая планшет в термостате при температуре 37°C в течение 30 мин. В первую лунку титрационного ряда вносят 200 мкл, а в остальные - по 100 мкл. Затем в первую лунку вносят XT в количестве 100 нг/мл и последовательно переносят, предварительно перемешивая, 100 мкл содержимого лунки. Планшет выдерживают в термостате при температуре 37°C в течение 1 часа. Далее лунки планшета трижды промывают ФСБ и вносят раствор конъюгата пероксидазного иммуноглобулинового моноклонального в рабочем разведении. После инкубации при температуре 37°C в течение 1 часа лунки планшета 6-кратно промывают ФСБ и вносят субстратную смесь. Реакцию учитывают фотометрически при длине волны 405 нм по изменению окраски в лунках. Для этого рассчитывают среднее арифметическое значение в лунках с отрицательным контрольным образцом - ОПср(К-). Результат анализа считали положительным, если ОПобр≥ОПср(К-)×2. Результат анализа считали отрицательным, если ОПобр<ОПср(К-)×2, где ОПобр - оптическая плотность в лунке с анализируемым образцом.
По результатам анализа специфическая чувствительность взаимодействия моноклональных антител штамма гибридных культивируемых клеток животных Mus musculus XT 3E5 с холерным токсином составляет 0,05 нг/мл, что превосходит известные аналоги. Результаты специфической чувствительности со значениями оптической плотности представлены в таблице 2. Сравнительная характеристика штаммов аналогов и заявляемого представлена в таблице 3.
Таким образом, заявляемый штамм гибридных культивированных клеток животных Mus musculus XT 3E5 обеспечивает получение иммуноглобулинов, специфичных к В-субъединице холерного токсина, относящихся к иммуноглобулинам класса G субкласса 2а. Очищенные моноклональные антитела специфично взаимодействовали с препаратом холерного токсина в иммуноферментном анализе, чувствительность которого составляет 0,05 нг/мл.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРОВАННЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS ХТ 2Е5 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ИЗОТИПА G 1 К В-СУБЪЕДИНИЦЕ ХОЛЕРНОГО ТОКСИНА | 2015 |
|
RU2583306C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРОВАННЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS FRANCISELLA TULARENSIS 1D6 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ЛИПОПОЛИСАХАРИДУ ТУЛЯРЕМИЙНОГО МИКРОБА | 2016 |
|
RU2621379C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 3F11 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К БОТУЛИНИЧЕСКОМУ ТОКСИНУ ТИПА B | 2014 |
|
RU2566553C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 1G7 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К БОТУЛИНИЧЕСКОМУ ТОКСИНУ ТИПА В | 2014 |
|
RU2571208C1 |
| Штамм культивируемых гибридных клеток животных Mus. musculus - продуцент моноклональных антител к мембранному белку, общему для типичных и атипичных холерных вибрионов 01 серогруппы | 2022 |
|
RU2785463C1 |
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS L. - продуцент моноклональных антител к холерному энтеротоксину биотипа эльтор | 1990 |
|
SU1742325A1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS 10G4 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К КАПСУЛЬНОМУ FL АНТИГЕНУ YERSINIA PESTIS | 2011 |
|
RU2460787C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS-ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА К МЕМБРАННОМУ БЕЛКУ, ОБЩЕМУ ДЛЯ ТСР+ ШТАММОВ ХОЛЕРНЫХ ВИБРИОНОВ О1 И О139 СЕРОГРУПП | 2017 |
|
RU2663003C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ХОЛЕРНОМУ ТОКСИНУ | 2009 |
|
RU2401300C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ХОЛЕРНОМУ ТОКСИНУ | 2009 |
|
RU2401301C1 |
Изобретение относится к области биохимии. Заявлен штамм культивируемых гибридных клеток животных Mus musculus XT 3Е5 - продуцент моноклональных антител изотипа G 2a к В-субъединице холерного токсина. Штамм депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» под номером Н-43. Изобретение позволяет получить высокоспецифичные моноклональные антитела, которые могут использоваться для конструирования иммуноферментных диагностических тест-систем с целью определения продукции холерного токсина у штаммов V.cholerae. 3 табл., 5 пр.
Штамм гибридных культивируемых клеток животных Mus musculus XT 3E5 - продуцент моноклональных антител изотипа G 2a к B-субъединице холерного токсина, депонированный в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» под номером H-43.
| КЛОН ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ХОЛЕРНОМУ ТОКСИНУ | 2009 |
|
RU2401299C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ХОЛЕРНОМУ ТОКСИНУ | 2009 |
|
RU2401300C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ХОЛЕРНОМУ ТОКСИНУ | 2009 |
|
RU2401301C1 |
| APTER F.M | |||
| et al., Analysis of the roles of antilipopolysaccharide and anti-cholera toxin immunoglobulin A (IgA) antibodies in protection against Vibrio cholerae and cholera toxin by use of monoclonal IgA antibodies in vivo, Infect | |||
| Immun., December 1993, vol.61, no.12, pp.5279-5285. | |||
Авторы
Даты
2016-07-10—Публикация
2015-03-11—Подача