Предлагаемое изобретение относится к биотехнологии, в частности гибридомной биотехнологии и может быть применено при создании иммуноферментных препаратов и тест-систем для лабораторной диагностики холеры.
Проблема изменчивости штаммов V. cholerae, выделенных от людей и из объектов окружающей среды, продолжает оставаться актуальной на современном этапе развития седьмой пандемии холеры.
За период 1988-2019 гг. на территории бывшего СССР и субъектов Российской Федерации из объектов окружающей среды выделено 168 штаммов холерных вибрионов, атипичных по признаку агглютинабельности (частота их встречаемости составляла 1,1-28,0%), а также частично (34,5%) не содержащих ген rfb (wbe), ответственный за синтез О-антигена. Важным и своевременным при мониторинговых исследованиях на холеру является анализ результатов изучения атипичных по признаку агглютинабельности выделяемых штаммов V. cholerae, в том числе в связи с возможным затруднением их идентификации в случае снижения или отсутствия агглютинации с холерной диагностической сывороткой O1 при отрицательном результате детекции гена rfb (wbe), кодирующего О-антиген.
В настоящее время в лабораторной диагностике холеры актуальной задачей по-прежнему остается разработка новых диагностических средств, позволяющих своевременно обнаружить антигены Vibrio cholerae O1 серогруппы для характеристики поверхностных антигенов типичных и атипичных по агглютинабельности штаммов V. cholerae O1.
Разработан штамм культивируемых гибридных клеток Mus. Musculus L. ГХ-A5D8/Omp, депонированный под номером Н-60. Данный штамм является продуцентом моноклональных антител, специфичных к эпигону мембранного белка холерных вибрионов O1 серогруппы, в связи с чем может быть использован для характеристики типичных и атипичных по агглютинабельности штаммов V. cholerae O1.
Известен штамм культивируемых гибридных клеток животных Mus. musculus L- продуцент моноклональных антител, специфичных к О-антигену холерных вибрионов O1 серогруппы [1], заключающийся в том, что в результате клонирования получен продуктивный штамм, стабильно продуцирующий моноклональные иммуноглобулины изотипа JgG, специфичные к О-антигену холерных вибрионов O1 серогруппы.
Однако МКА выявляют О-антиген холерных вибрионов сероваров Огава и Инаба, не давая перекрестной активности с вибрионами не O1 группы, O139 серогруппы и представителями близкородственых семейств. Продукт штамма использовали в реакции слайд-агглютинации, иммнофлуоресценции, иммуноферментном анализе для идентификации только типичных штаммов V. cholerae O1, агглютинирующихся видовой О-холерной и сероваро спецфическими сыворотками.
Известна иммуноферментная тест-система на основе кроличьих антител к белкам наружной мембраны V. cholerae O1 Огава, O1 Инаба и V cholerae O139 [2]. Антисыворотку получали путем иммунизации кроликов препаратами белков наружных мембран (ОМР). ОМР-атисыворотки отличаются специфичностью (не имеют перекрестной реактивности с другими бактериями кишечной группы) и позволяют выявлять холерные вибрионы O1 и O139 серогрупп в реакциях дот-ИФА (106 м.кл) и ТИФА на пластике (10 м.кл) при исследовании проб от людей. Тест система не предназначена для обнаружения атипичных по агглютинабельности штаммов холерных вибрионов.
Известен тест в формате «сэндвич»-ИФА на нитроцеллюлозной мембране [3], где в качестве реагентов используются кроличьи антитела к мембранному белку OmpW, а также два МКА, направленных к рекомбинантному мембранному белку r-OmpW и холерному токсину r-CtxB. Диагностикум предназначен для обнаружения В-субъединицы холерного токсина (не менее 60 пг CtxB/мл-1) и типичных холерных вибрионов (104 КОЕ/мл-1).
Наиболее близким решением поставленной задачи является штамм гибридных культивируемых клеток животного Mus Musculus ВСКК (П) 614 D - продуцент моноклональных антител к R-формам Vibrio cholerae O1 [4]. Штамм продуцирует моноклональные антитела к антигенной детерминанте R-ЛПС холерного вибриона 01.
Штамм использовался для серологической идентификации R-вариантов Vibrio cholerae O1. МКА этого штамма взаимодействует с антигенами R-вариантов V. cholerae O1, не давая перекрестных реакций с типичными вибрионами O1 и не O1 групп. Антитела применялись в реакциях непрямой иммунофлуоресценции, иммуноферментном методе, реакции агглютинации и иммунодиффузии с использованием в качестве антигенного препарата холерных вибрионов в R-форме. Продукт штамма не испытывали для идентификации S-R вибрионов, т.е. группы штаммов, которые агглютинируются всеми холерными сыворотками, в том числе и RO.
Технической задачей предлагаемого изобретения является изыскание штамма гибридных культивируемых клеток животных Mus musculus L., продуцирующего моноклональные антитела к эпитопам мембранного белка холерных вибрионов O1 серогруппы.
Поставленная задача достигается получением штамма культивируемых гибридных клеток животных Mus. musculus L. ГХ-А5Б8/Оmр - продуцент моноклональных антител, специфичных к мембранному белку холерных вибрионов 01 серогруппы, депонированный под номером Н-60 в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск».
Способ получения штамма включает несколько этапов:
I - получение иммунных спленоцитов. Мышей линии BALB/c, иммунизируют взвесью цельных клеток штамма Vibrio cholerae El Tor 13020 (из коллекции Музея живых культур Ростовского-на-дону противочумного института), убитых нагреванием (100°С, 15 мин, проверка на специфическую стерильность). Иммунизацию мышей проводят трехкратно с интервалом 2 недели, вводят внутрибрюшинно 0,2 мл инактивированной взвеси холерных вибрионов (109 кл/мл) в смеси с полным адъювантом Фрейнда (ПАФ, Calbiochem) 1:1, затем с неполным адъювантом Фрейнда (НАФ, Calbiochem) 1:1, для бустерной иньекции вводят микробную взвесь с физиологическим раствором 1:1. В стерильных условиях извлекают селезенку мышей через 3 дня после заключительной инъекции антигена, растирают в гомогенизаторе и готовят суспензию спленоцитов в бессывороточной среде RPMI-1640 (Gibco, Invitrogen).
II - проведение гибридизации. Получение гибридных клеток проводили в соответствии с методикой Fazekas de St. et al. [5]. Клетки перевиваемой миеломы P3-X63/Ag8.653 (получена из Коллекции культур клеток позвоночных ФГБУН Институт цитологии РАН, Санкт-Петербург) гибридизуют с иммунными клетками селезенки в соотношении 5:1 в 50% растворе полиэтиленгликоля (Mr 1500, Fluka) на среде RPMI 1640 в течение 1 мин совместной инкубации. Взвесь клеток центрифугируют 10 мин при 1 000 об/мин, после этого супернатант декантируют, осадок клеток осторожно ресуспендируют в селективной среде состава: RPMI 1640, 20% сыворотки плода коровы (HyClone, Thermo Scientific), 4 mM 1-глютамина (Amimed), компоненты ГАТ (0,0131 мг/мл гипоксантина, 0,000191 мг/мл аминоптерина, 0,00385 мг/мл тимидина, Gibco).
III - культивирование гибридом. Суспензию слившихся клеток в ГАТ-среде разливают по 0,1 мл в четыре 96-луночных плоскодонных культуральных планшета (Cellstar, Greiner bio-one) на фидерный слой предварительно высеянных (за сутки) перитонеальных макрофагов белых мышей в дозе 10000 клеток на лунку, и культивируют при 37°С в CO2-инкубаторе (Nuaire). Видимые колонии гибридных клеток мышей появляются на 7-10 день. Гибридому культивируют 14 дней на среде ГАТ, затем 7-10 дней на среде ГТ. После чего переводят на ростовую среду без селективных компонентов.
IV - скрининг гибридом. Культуральные жидкости гибридом периодически отбирают из лунок для тестирования в ИФА.
V - клонирование. Гибридому дважды клонируют методом предельных разведений на фидере из перитонеальных макрофагов белых мышей. В результате клонирования получают продуктивный штамм гибридных культивируемых клеток мыши, стабильно продуцирующих МКА заданной специфичности.
Штамм ГXA5D8/Omp депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур («ГКПМ-Оболенск») ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии» Роспотребнадзора под номером 179 (от 12.12.2016).
Заявляемый штамм гибридом обладает следующими характеристиками:
Морфологические признаки. Гибридные клетки представляют собой крупные округлые клетки с узким ободком базофильной цитоплазмы. Ядра гиперхромные, неправильно-овальной формы, крупные, с грубой структурой ядерного хроматина. В значительной части клеток цитоплазма имеет выросты.
Культуральные признаки типичны для перевиваемых клеток мышиных плазмоцитом. Клетки культивируют в виде стационарной суспензии при 37°С в пластиковой или стеклянной посуде при посевной дозе 100-150 тыс/мл в течение 3-4 дней до плотности насыщения 800-900 тыс.кл./мл. Клетки пассируют один раз в 3-4 дня, контролируя микроскопически интенсивность роста. Кратность рассева 1:4-1:5. Среда для культивирования - среда RPMI-1640 с добавлением 15% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 100 мкг/мл гентамицина. Клетки культивируют при 37°С в атмосфере 5%-ного CO2 при 70-80%-ной влажности. Гибридный клон не теряет способности синтеза антител при 10 пассажах in vitro (срок наблюдения).
Культивирование штамма в организме экспериментальных животных. Индукцию асцитных опухолей у белых мышей, внутрибрюшинно праймированных приставом в дозе 0,5 мл/мышь за 14 дней до введения гибридомы, осуществляют путем инокулирования 5-10 млн гибридных клеток на одно животное. Иммунную асцитическую жидкость собирают по мере формирования асцитных опухолей через 20-30 дней в объеме 2-5 мл. Культуру клеток поддерживали в течение двух пассажей асцитной опухоли на мышах (срок наблюдения).
Кариологические признаки. Модальное число хромосом 87, С-маркеры родительской миеломной линии P3-X63/Ag 8.653. Кариотип клеток штамма ГХ-A5D8/Omp по видовой принадлежности - мышиный.
Биотехнологическая характеристика полезного продукта. МКА относятся к изотипу IgG. Методом иммуноблоттинга установлено, что гибридома ГХ-A5D8/Omp продуцирует специфичные моноклональные антитела к термостабильному белковому антигену холерных вибрионов O1 серогруппы. Титр специфических иммуноглобулинов в ИФА составляет: в культуральной жидкости (КЖ) 1:800-1:1000, в асцитической жидкости (АЖ) - 1:200000. МКА выявляют эпитоп мембранного белка (м.м. 40 кДа) у штаммов холерных вибрионов O1 серогруппы, не давая перекрестных реакций с представителями близкородственных и гетерологичных микроорганизмов.
Контаминация. Бактерии и грибы в культуре клеток не обнаруживаются. Заражение микоплазмой не выявлено.
Криоконсервация. Среда замораживания содержит эмбриональной телячьей сыворотки - 90% и криопротектора диметилсульфоксида - 10%. Режим криоконсервации и отогрева: гибридные клетки вносят в криопробирки, помещают в контейнер из пенопласта и оставляют на 16-24 часа в кельвинаторе при температуре -70°С и затем опускают в жидкий азот. Размораживание проводят быстро на водяной бане при температуре 37°С. Ампулы содержат 1,0 мл криозащитной среды с концентрацией гибридных клеток 1*106. Жизнеспособность восстанавливаемых гибридом после криоконсервации составляет 75-85%.
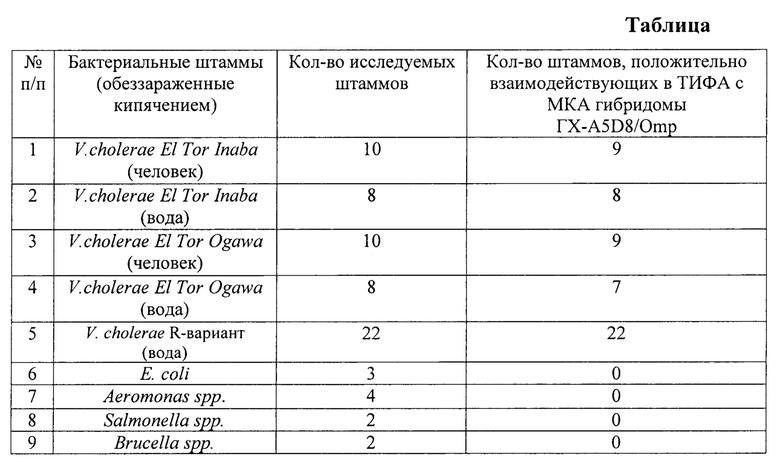
Исследование специфичности МКА. Моноклональные антитела из КЖ выделяют преципитацией сульфатом аммония [6]. Для определения специфичности МКА, продуцируемых гибридомой, используют набор штаммов холерных вибрионов O1 серогруппы, представителей рода Aeromonas, Salmonella spp., штаммы V.cholerae не O1/не O139, Е. coli. В качестве антигенов в исследуемых серологических реакциях используют убитые кипячением бактериальные клетки.
Пример 1. Полученение МКА из штамма ГХ-A5D8/Omp. Гибридому выращивают in vitro до конечной концентрации 1⋅106-5⋅103 кл./мл среды. Клетки осаждают центрифугированием при 1000-1500 об/мин в течение 10 мин, надосадочную жидкость с содержащимися в ней МКА собирают, клетки используют для последующего пассажа in vitro. Бесклеточный супернатант используют в виде МКА для подтверждения специфической активности на штаммах холерных вибрионов, а также для выделения моноклональных антител путем осаждения насыщенным раствором сульфата аммония, которые можно длительно хранить в условиях низкотемпературного холодильника без потери специфической активности.
Пример 2. Подтверждение специфической активности МКА гибридомы ГХ-A5D8/Omp в отношении типичных штаммов V.cholerae O1 и атипичных по агглютинабельности штаммов холеры R-вариант в непрямом твердофазном иммуноферментном анализе (ТИФА). МКА гибридомы ГХ-A5D8/Omp специфически взаимодействуют со штаммами V.cholerae El Tor, что подтверждается при проведении непрямого ТИФА. Постановку реакции осуществляют следующим образом: в лунки 96-луночного полистиролового планшета для иммуноферментного анализа (Greiner bio-one) вносят по 108 микробных клеток, убитых кипячением, в карбонат-бикарбонатном буфере рН 9.0, и выдерживают при температуре 37°С в течение 2 часов или при +4°С в течение 18 часов. Три раза отмывают фосфатно-солевым буфером рН 7.4, содержащим 0,5% твин-20 (ФСБ-Т). Далее вносят в лунки супернатант культуральной жидкости гибридомы ГХ-A5D8/Omp (полученный в Примере 1) в объеме 100 мкл и инкубируют при температуре 37°С в течение 1 часа.
После этого лунки планшета трижды отмывают раствором ФСБ-Т и добавляют в ативидовой пероксидазный конъюгат (IgG белой мыши, меченные пероксидазой хрена, (BioRad) в рабочем разведении. Планшет инкубируют при температуре 37°С в течение 40 минут, затем 2 раза отмывают лунки раствором ФСБ-Т и один раз дистиллированной водой. После этого в лунки вносят по 100 мкл субстрат-индикаторного раствора на основе тетраметилбензидина (Applichem). Положительную реакцию оценивают по появлению сине-голубого окрашивания. Реакцию останавливают добавлением в лунки по 100 мкл 1М серной кислоты. Учет результатов проводят на спектрофотометре (BioTek, США) для ИФА при длине волны 450 нм (референс-волна 630 нм).
Результаты реакции представлены в таблице. Из данных таблицы видно МКА гибридомы ГХ-A5D8/Omp взаимодействуют с большей частью штаммов V.cholerae El Tor (положительная реакция), выделенных от людей и из объектов окружающей среды, и со всеми взятыми в исследование штаммами V.cholerae R-вариант. Специфичность МКА в отношении холерных вибрионов O1 серогрупп подтверждается отрицательной реакцией в ИФА с представителями близкородственных и гетерологичных микроорганизмов.
Пример 3. Определение эпитопной направленности МКА гибридомы ГХ-A5D8/Omp методом иммуноблоттинга.
Определение эпитопной направленности МКА, продуцируемых гибридомой, проводят с использованием в качестве антигена взвесей клеток холерных вибрионов, обеззараженных кипячением. Электрофорез образцов по Laemmli U.K. [6] в пластинах 12,5% полиакриламидного геля размером 70×100×0,7 мм проводят в денатурирующих условиях (SDS-PAGE) при постоянном напряжении на приборе Mini-Protean Tetra System («Bio-Rad Laboratories, inc.» (США). Полусухой перенос образцов из геля на нитроцеллулозную мембрану (НЦМ) с диаметром пор 0,45 μм осуществляют на приборе Trans-Blot Turbo Transfer System («Bio-Rad Laboratories, inc.», США) с использованием буфера для переноса (25 мМ Трис, 192 мМ глицин и 20% этанол, рН 8,3), после чего мембраны высушивают. Постановку иммуноблоттинга проводят, как описано Н. Towbin et al. [7]. Свободные сайты НЦМ блокируют 1% раствором БСА (Albumin bovine, Amresco) при 37°С в течение 30 мин. После 3-кратной отмывки ФСБ - Т НЦМ инкубируют 1 час с препаратом МКА в рабочем разведении при комнатной температуре на ротационном встряхивателе. Затем мембрану отмывают и проявляют конъюгатом кроличьих антимышиных иммуноглобулинов с пероксидазой хрена (Invitrogen) - инкубация 40 минут при комн. температуре на ротационном встряхивателе. НЦМ 3-кратно отмывают в ФСБ-Т, затем помещают в хромогенную смесь на основе 3,3-диаминобензидин-4-гидрохлорида (ДАБ) («Serva»). После проявления специфических полос на мембране реакцию останавливают промыванием блота в дистиллированной воде. При проведении электрофореза используют белковые маркеры молекулярных весов от 10 до 250 кДа (BioRad).
Результаты иммуноблоттинга представлены на фото 1.
Вывод: МКА ГХ-A5D8/Omp у типичных штаммамов V. cholerae O1 выявляет специфический эпитоп в виде интенсивной полосы, локализованной на уровне 38-42 кДа, что соответствует, по данным литературы, белкам наружных мембран OmpT и OmpU (мол. масса 40 и 38 кДа).
Пример 4. Определение специфической активности МКА ГХ-A5D8/Omp в отношении атипичных по агглютинабельности штаммов V. cholerae R-вариант методом иммуноблоттинга. Электрофорез и иммуноблоттинг проводят так же, как описано в Примере 3.
Результаты представлены на фото2.
На фото видно, что МКА гибридомы ГХ-A5D8/Omp выявляют у атипичных штаммов V. cholerae O1 белковую полосу на уровне 38-42 кДа, аналогичные эпитопам типичных штаммов.
Таким образом, МКА, секретируемые штаммом гибридных культивируемых клеток ГХ-A5D8/Omp, могут быть применены в иммунологических реакциях для характеристики и установления идентичных поверхностных антигенов у типичных и атипичных по агглютинабельности штаммов V. cholerae. Штамм можно использовать при создании новых иммуноферментных диагностических тест-систем для идентификации эпидемически значимых холерных вибрионов в целях лабораторной диагностики в здравоохранении и для проведения научных исследований.
Источники информации:
1. Алексеева Л.П., Евдокимова В.В., Фатеева О.Ф. ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus. musculus L. - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К О-АНТИГЕНУ ХОЛЕРНЫХ ВИБРИОНОВ O1 СЕРОГРУППЫ., пат. №2425874 от 13.04.2010 г., кл. C12N 5/18.
2. Martinez-Govea A., Ambrosio J., Gutierrez-Cogco L., Flisser A. Identification and strain differentiation of Vibrio cholerae by using polyclonal antibodies against outer membrane proteins. Clin Diagn Lab Immunol. 2001 Jul;8(4):768-71. doi: 10.1128/CDLI.8.4.768-771.2001.
3. Tuteja U., Kumar S., Shukla J., Kingston J., Batra H.V. Simultaneous direct detection of toxigenic and non-toxigenic Vibrio cholerae from rectal swabs and environmental samples by sandwich ELISA. J. Med. Microbiol. 2007; 56(Pt 10): 1340-5.
4. Бурлакова О.С., Алексеева Л.П., Черепахина И.Я., Балахнова В.В. Штамм гибридных культивируемых клеток мыши Mus Musculus ВСКК(П) 614 D- прдуцент моноклональных антител к R-формам Vibrio cholerae O1., Заяка №94023932/13, 24.06.1994 г.
5. Fazekas, De St., Groth S.F., Scheidegger D. Production of monoclonal antibodies: strategy and tactics. J. Immunol. Methods. 1980; 35(1-2): 1-21. DOI: 10.1016/0022-1759(80)90146-5
6. Laemmli U.K. Cleavage of structural proteins during assembly of the head of bacteriophage T4. Nature. 1970; 227, №5259: 680-685.
7. Towbin H., Gordon J. Immunoblotting and dot immunobinding - Current status and outlook. J. Immunol. Methods. 1984; 72: 313-340.

Предлагаемое изобретение относится к биотехнологии, в частности гибридомной биотехнологии, и может быть применено при создании иммуноферментных диагностических тест-систем для идентификации штаммов V cholerae 01 в лабораторной практике. Сущность изобренения заключается в том, что получают штамм культивируемых гибридных клеток животных Mus. musculus L. ГX-A5D8/Omp - продуцент моноклональных антител, специфичных к мембранному белку, общему для типичных и атипичных холерных вибрионов 01 серогруппы, депонированный под номером Н-60 в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск». 2 ил., 1 табл., 4 пр.
Штамм культивируемых гибридных клеток животных Mus. musculus L. ГX-A5D8/Omp - продуцент моноклональных антител, специфичных к мембранному белку, общему для типичных и атипичных холерных вибрионов 01 серогруппы, депонированный под номером Н-60 в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск».
| Экономайзер | 0 |
|
SU94A1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS-ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА К МЕМБРАННОМУ БЕЛКУ, ОБЩЕМУ ДЛЯ ТСР+ ШТАММОВ ХОЛЕРНЫХ ВИБРИОНОВ О1 И О139 СЕРОГРУПП | 2017 |
|
RU2663003C1 |
| FAZEKAS, DE ST., et al., Production of monoclonal antibodies: strategy and tactics | |||
| J | |||
| Immunol | |||
| Methods | |||
| Способ получения фтористых солей | 1914 |
|
SU1980A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2022-12-08—Публикация
2022-04-13—Подача