ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к применению адъювантов и композициям вакцин, содержащим адъюванты в соответствии с изобретением, с предотвращением явления паралича Белла с частотой выше естественной встречаемости.
УРОВЕНЬ ТЕХНИКИ
Паралич Белла является дисфункцией черепного нерва VII (лицевой нерв), которая приводит к неспособности контролировать лицевые мышцы на пораженной стороне. Некоторые заболевания могут вызвать паралич лицевого нерва, например, опухоль головного мозга, инсульт и болезнь Лайма. Однако, если конкретная причина не может быть определена, то состояние называют паралич Белла. Названный в честь Чарлза Белла, шотландского физиолога XIX века, который впервые описал его, паралич Белла является наиболее распространенной резкой мононевропатией (заболевание, затрагивающее только один нерв) и является наиболее распространенной причиной резкого паралича лицевого нерва.
Паралич Белла определяется как идиопатический односторонний паралич лицевого нерва, обычно самоизлечивающийся и встречается с частотой около 30-35/100000 в год. Характерными особенностями являются быстрое возникновение частичного или полного паралича, обычно за один день. Он может происходить на двух сторонах, приводя к полному параличу лицевого нерва в приблизительно 1% случаев. Например, в Европе ежегодная заболеваемость параличом Белла составляет приблизительно 32 случая в расчете на 100000 человек. Правая сторона бывает поражена в 63% случаев. Для людей с диабетом риск быть пораженным параличом Белла на 25-29% выше, чем для людей без диабета. При этом измерение уровней глюкозы в крови во время диагностики паралича Белла может выявить недиагностированный диабет. На международном уровне наибольшая заболеваемость была обнаружена в исследовании в Секкори, Япония, в 1986 и наименьшая заболеваемость была обнаружена в Швеции в 1971. Большинство популяционных исследований обычно демонстрируют ежегодную заболеваемость 30-35 случаев в расчете на 100000 человек в год с возрастной зависимостью заболеваемости, при этом заболеваемость для старших выше (вплоть до 60 случаев в расчете на 100000) и для младших ниже.
Считается, что воспалительное заболевание приводит к набуханию лицевого нерва. Нерв перемещается по черепу в узкий костный канал под ухом. Считается, что набухание и сжатие нерва в узком костном канале приводят ингибированию, повреждению или гибели нерва.
Паралич Белла характеризуется парезом лицевого нерва в пораженной половине, из-за нарушения функции лицевого нерва (VII черепной нерв), который контролирует мышцы лица. Лицевой паралич характеризуется неспособностью контролировать движение лицевых мышц. Паралич относится к инфра-ядерному/нижнему мотонейронному типу.
Лицевые нервы контролируют ряд функций, такие как моргание и закрывание глаз, улыбка, нахмуривание бровей, слезоотделение и слюноотделение. Они также иннервируют стремянные (стремя) мышцы среднего уха и переносят вкусовые ощущения с передних двух третей языка.
Из-за анатомической особенности, лобные мышцы получают иннервацию от обеих частей мозга. Вследствие этого лоб может быть наморщен пациентом, чей лицевой паралич вызван нарушением в одном из полушарий мозга (центральный лицевой паралич). Если нарушение относится к самому лицевому нерву (периферический паралич), то теряются все нервные сигналы на ипсилатеральной (той же стороне, что и повреждение) половине стороны лица, включая лоб (контралатеральные лобные неподвижные морщины).
Единственным заболеванием, которое может быть сложно исключить из дифференциального диагноза является вовлечение лицевого нерва в процесс инфекций вирусом опоясывающего герпеса. Основными отличиями этого заболевания являются наличие маленьких волдырей или пузырьков на наружном ухе и слуховые нарушения, но иногда эти признаки могут отсутствовать (абортивный опоясывающий лишай).
Болезнь Лайма может привести к характерному параличу и может быть легко диагностирована поиском специфических для Лайма антител в крови. В эндемических областях болезнь Лайма может являться наиболее распространенной причиной лицевого паралича.
Степень повреждения нерва может быть оценена с использованием шкалы Хауса-Бракмана.
Хотя паралич Белла определяется как мононеврит (задействующий только один нерв), пациенты с диагнозом паралич Белла могут иметь "несметное число неврологических симптомов", включая "покалывание лица, умеренную или сильную головную боль/боль в шее, нарушения памяти, нарушения равновесия, ипсилатеральную парестезию конечностей, ипсилатеральную ослабленность конечностей и чувство неповоротливости", которые "не объясняются дисфункцией лицевого нерва". Это все еще является загадочным аспектом этого заболевания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Во время клинических испытаний композиций вакцин имели место случаи заболеваемости параличом Белла с повышенной частотой (Plos One (2009), vol 4 (9), e6999). Несмотря на то, что паралич Белла обычно является временным состоянием, которое допускает полное восстановление активности лицевых нервов, он считается крайне нежелательным побочным эффектом, при котором, как следствие, клинические испытания останавливаются, и вакцина никогда не попадает на рынок. Предполагается, что при использовании адъюванта в соответствии с изобретением нежелательный побочный эффект, наблюдаемый в виде паралича Белла, предотвращается в том смысле, что заболеваемость или частота паралича Белла является такой же, как естественная заболеваемость (15-30 случаев в расчете на 100000 человек в год).
Адъювант в соответствии с изобретением может содержать
i) одну или более карбоновых кислот или один или более аминов
и необязательно
ii) один или более моноглицеридов.
Адъювант в соответствии с изобретением может также представлять собой адъювант, содержащий один амин или смесь двух аминов.
Адъювант в соответствии с изобретением может также представлять собой адъювант, содержащий один амин или смесь двух аминов и дополнительно содержащий дополнительные адъюванты, например, сквален или соевое масло. Адъювант в соответствии с изобретением может также представлять собой адъювант, содержащий
i) одну или более карбоновых кислот и необязательно
ii) один или более моноглицеридов.
Адъювант в соответствии с изобретением может также представлять собой адъювант, содержащий
i) одну или более карбоновых кислот и необязательно
ii) один или более моноглицеридов
и дополнительно содержащий дополнительные адъюванты, например, сквален или соевое масло.
Адъювант в соответствии с изобретением может также представлять собой адъювант, содержащий
i) одну карбоновую кислоту или смесь двух карбоновых кислот и необязательно
ii) один или более моноглицеридов
и дополнительно содержащий дополнительные адъюванты например, сквален или соевое масло.
Изобретение также относится к применению адъюванта в вакцине, при этом адъювант содержит
i) одну или более карбоновых кислот и/или один или более аминов и
b) необязательно один или более моноглицеридов
и посредством этого снижает риск паралича Белла у пациента до приблизительно естественной заболеваемости.
Вне связи с какой-либо теорией, предполагается, что из-за подобной эндогенной природы карбоновых кислот (также как и их соответствующих аминов) и моноглицеридов в соответствии с изобретением достигается минимальное системное отклонение, что может в свою очередь привести к низкой встречаемости наблюдаемых случаев паралича Белла, т.е. встречаемости с приблизительно такой же частотой, как естественно встречающиеся случаи паралича Белла.
Кроме того, было предположено, что одной возможной причиной паралича Белла являются морфологические изменения обонятельного нерва, что наблюдалось, когда, например, в качестве адъюванта в вакцине был использован холерный токсин.
Амины, используемые в настоящем изобретении, включают разветвленные или неразветвленные, циклические или ациклические, замещенные или незамещенные алкил-, алкенил- и алкиниламины, необязательно имеющие многократную ненасыщенность (двойная или тройная связь), которые могут дополнительно по желанию могут быть различного вида, от 4 до 30 атомов углерода, например, от 6 до 24 атомов углерода, от 8 до 20 атомов углерода или от 12 до 20 атомов углерода. Также необходимо понимать, что также подразумевается, что определение охватывает различные типы изомеров, например, диастереоизомеры (цис-транс изомеры), которые могут быть в любой комбинации.
Карбоновые кислоты, используемые в настоящем изобретении, содержат длинноцепочные (C4-C30) алкил-, алкенил- или алкинилкарбоновые кислоты, которые могут необязательно быть разветвленными или неразветвленными, циклическими или ациклическими, необязательно имеющими многократную ненасыщенность (двойная или тройная связь), которые дополнительно по желанию могут быть различного типа.
Моноглицериды, используемые в настоящем изобретении, могут являться сложными эфирами карбоновой кислоты и глицерина, где карбоновые кислоты могут являться длинноцепочными (C4-C30) алкил-, алкенил- или алкинилкарбоновыми кислотами, которые могут необязательно быть разветвленными или неразветвленными, необязательно имеющими многократную ненасыщенность (двойная или тройная связь), которые могут дополнительно по желанию могут быть различного типа.
Определения
По всему тексту, включая формулу изобретения, следующие термины должны определяться, как указано ниже.
Термин "амин" охватывает разветвленные или неразветвленные, циклические или ациклические, замещенные или незамещенные алкил-, алкенил- и алкиниламины, необязательно имеющие многократную ненасыщенность (двойная или тройная связь), которые дополнительно по желанию могут быть различного типа из от 4 до 30 атомов углерода, например, от 6 до 24 атомов углерода, от 8 до 20 атомов углерода или от 12 до 20 атомов углерода. Также необходимо понимать, что подразумевается, что определение охватывает различные типы диастереоизомеров (цис-транс изомеры), которые могут быть в любой комбинации.
Примерами являются, но не ограничиваясь ими, лауриламин (C12), миристиламин (C14), цетиламин (C16), пальмитолеиламин (C16:1), олеиламин (C18:1), линолеиламин (C18:2) и стераиламин (C18). Другими примерами являются гексиламин, октиламин, дециламин, ундециламин, додециламин
Термин "карбоновая кислота" охватывает разветвленные или неразветвленные, циклические или ациклические, замещенные или незамещенные алкил-, алкенил- и алкинилкарбоновые кислоты, необязательно имеющие многократную ненасыщенность (двойная или тройная связь), которые дополнительно по желанию могут быть различного типа (двойные и тройные связи в любом сочетании или комбинации), из от 4 до 30 атомов углерода, например, от 6 до 24 атомов углерода, от 8 до 20 атомов углерода, от 12 до 20 атомов углерода. Также необходимо понимать, что подразумевается, что определение охватывает разные типы диастереоизомеров (цис-транс изомеры), которые могут также быть в комбинации.
Примерами являются, но не ограничиваясь ими; лауриновая кислота (C12), миристиновая кислота (C14), пальмитиновая кислота (C16), пальмитолеиновая кислота (C16:1), олеиновая кислота (C18:1), линолевая кислота (C18:2) и стеариновая кислота. Другими примерами являются капроновая кислота, каприловая кислота, декановая кислота (каприновая кислота), арахидиновая кислота, бегеновая кислота, лигноцериновая кислота, альфа-линоленовая кислота, стеаридоновая кислота, эйкозапентаеновая кислота, докозогексаеновая кислота, гамма-линоленовая кислота, дигомолиноленовая кислота, арахидоновая кислота, эруковая кислота и нервоновая кислота.
Термин "моноглицерид" охватывает моноэфиры глицерина (пропан-1,2,3-триол) и карбоновых кислот, где карбоновые кислоты могут быть разветвленными или неразветвленными, циклическими или ациклическими, замещенными или незамещенными алкил-, алкенил- и алкинилкарбоновыми кислотами, необязательно имеющим многократную ненасыщенность (двойная или тройная связь), которые дополнительно по желанию могут быть различного типа, состоящими из от 4 до 30 атомов углерода, например, от 6 до 24 атомов углерода, от 8 до 20 атомов углерода или от 12 до 20 атомов углерода. Также необходимо понимать, что подразумевается, что определение также охватывает различные типы диастереоизомеров (цис-транс изомеры), которые могут быть в любой комбинации. Примерами кислот, используемых для стерификации глицерина являются, но не ограничиваясь ими, являются лауриновая кислота (C12), миристиновая кислота (C14), пальмитиновая кислота (C16), пальмитолеиновая кислота (C16:1), олеиновая кислота (C18:1), линолевая кислота (C18:2) и стеариновая кислота. Другими примерами являются капроновая кислота, каприловая кислота, декановая кислота (каприновая кислота), арахидиновая кислота, бегеновая кислота, лигноцериновая кислота, альфа-линоленовая кислота, стеаридоновая кислота, эйкозапентаеновая кислота, докозогексаеновая кислота, гамма-линоленовая кислота, дигомо-гамма-линоленовая кислота, арахидоновая кислота, эруковая кислота и нервоновая кислота.
Термин "антиген" определяется как что-либо, что может служить в качестве мишени для иммунного ответа. Иммунный ответ может быть как клеточным, так и гуморальным, и может быть обнаружен в соматических и/или слизистых компартментах.
Термин "вакцина" в рамках изобретения определяется как суспензия или раствор антигенных групп, обычно состоящий из инфекционных агентов или какой-либо части инфекционных агентов, которые вводятся в животный или человеческий организм для выработки активного иммунитета.
Термины "адъювант" или "адъювантная смесь" в рамках изобретения используются взаимозаменяемо и в используемом в рамках изобретения значении являются любым веществом, примесь которого при введении с иммуногеном повышает или иным образом модифицирует иммунный ответ при введении в животный или человеческий организм.
Подразумевается, что термин "среда" в используемом в рамках изобретения значении означает физиологически приемлемую среду, такую как, например, водная среда, которая может содержать буферы, соли, регуляторы pH, консерванты и т.д.
Подразумевается, что термин "снижение", как это используется в выражении снижение заболеваемости заболеванием, таком как, например, снижение заболеваемости параличом Белла, означает уменьшение заболеваемости до уровня приблизительно равного естественной заболеваемости заболеванием. В случае паралича Белла естественная заболеваемость составляет 30-35 человек, пораженных параличом Белла, в расчете на 100000 человек в год.
Подразумевается, что термин "предотвращение" заболеваемости заболеванием означает, что риск возникновения заболевания у пациента, такого как, например, паралич Белла, приблизительно равен естественно встречающейся частоте заболевания. Применительно к параличу Белла, пациент будет подвержен риску получения паралича Белла около 30-35 случаев в расчете на 100000 человек в год, и, следовательно, в настоящем изобретении предотвращение заболевания параличом Белла у пациента означает, что пациент будет подвержен приблизительно такому же риску получения паралича Белла, как естественная заболеваемость 30-35 случаев в расчете на 100000 человек в год.
Амин или амины в адъювантной смеси, используемой в соответствии с изобретением, могут быть разветвленными или неразветвленными, циклическими или ациклическими, замещенными или незамещенными алкил-, алкенил- и алкиниламинами, необязательно имеющими многократную ненасыщенность (двойная или тройная связь), которые дополнительно по желанию могут быть различного типа, состоящими из от 4 до 30 атомов углерода, например, от 6 до 24 атомов углерода, от 8 до 20 атомов углерода или от 12 до 20 атомов углерода. Амины могут также представлять собой различные диастереоизомеры, цис или транс, которые дополнительно могут быть (в случае многократной ненасыщенности) различного типа в одной молекуле. Диастереомер может также быть представлен в любом сочетании, таком, например, 50% цис и 50% транс, или 40% цис и 60% транс, или 30% цис и 70% транс, или 20% цис и 80% транс, или 10% цис и 90% транс, или 5% цис и 95% транс, или 1% цис и 99% транс, или 40% транс и 60% цис, или 30% транс и 70% цис, или 20% транс и 80% цис, или 10% транс и 90% цис, или 5% транс и 95% цис, или 1% транс и 99% цис, или 100% цис и 0% транс, или 0% цис и 100% транс.
Примерами являются, но не ограничиваясь ими, лауриламин (C12), миристиламин (C14), цетиламин (C16), пальмитолеиламин (C16:1), олеиламин (C18:1), линолеиламин (C18:2) и стераиламин (C18). Другими примерами являются гексиламин, октиламин, дециламин, ундециламин, додециламин.
Адъювант, содержащий два амина в соответствии с изобретением, может быть таким, что отношение масс./масс. между двумя аминами составляет от приблизительно 0,1 до приблизительно 10, такое как, например, от приблизительно 0,25 до приблизительно 9, от приблизительно 0,5 до приблизительно 8, от приблизительно 0,75 до приблизительно 7, от приблизительно 1 до приблизительно 6, от приблизительно 1 до приблизительно 5, от приблизительно 1 до приблизительно 4, от приблизительно 1 до приблизительно 3, от приблизительно 1 до приблизительно 2 или от приблизительно 1 до приблизительно 1. Альтернативно, общее количество одного или более аминов в адъюванте может варьироваться, например, от приблизительно 100% или менее, приблизительно 95% или менее, приблизительно 90% или менее, приблизительно 85% или менее, приблизительно 80% или менее, приблизительно 75% или менее, приблизительно 70% или менее, приблизительно 65% или менее, приблизительно 60% или менее, приблизительно 55% или менее, приблизительно 50% или менее, приблизительно 45% или менее, приблизительно 40% или менее, приблизительно 35% или менее, приблизительно 30% или менее, приблизительно 25% или менее, приблизительно 20% или менее, приблизительно 15% или менее, приблизительно 10% или менее, приблизительно 9% или менее, приблизительно 8% или менее, приблизительно 7% или менее, приблизительно 6% или менее, приблизительно 5% или менее, приблизительно 4% или менее, приблизительно 3% или менее, приблизительно 2% или менее, приблизительно 1% или менее, приблизительно 0,5% или менее, приблизительно 0,25% или менее, приблизительно 0,1% или менее, приблизительно 0,05% или менее от объема адъюванта.
Адъювант, содержащий два амина в соответствии с изобретением, может являться смесью олеиламина и лауриламина. Отношение массы олеиламина к массе лауриламина может составлять от приблизительно 0,1 до приблизительно 10, такое как, например, от приблизительно 0,25 до приблизительно 9, от приблизительно 0,5 до приблизительно 8, от приблизительно 0,75 до приблизительно 7, от приблизительно 1 до приблизительно 6, от приблизительно 1 до приблизительно 5, от приблизительно 1 до приблизительно 4, от приблизительно 1 до приблизительно 3, от приблизительно 1 до приблизительно 2 и от приблизительно 1 до приблизительно 1.
Карбоновые кислоты, используемые в адъювантной смеси, могут быть разветвленными или неразветвленными, циклическими или ациклическими, замещенными или незамещенными алкил-, алкенил- и алкинилкарбоновыми кислотами, необязательно имеющими многократную ненасыщенность (двойная или тройная связь), которые дополнительно по желанию могут быть различного типа (двойные и тройные связи в любом сочетании или комбинации), состоящими из от 4 до 30 атомов углерода, например, от 6 до 24 атомов углерода, от 8 до 20 атомов углерода или от 12 до 20 атомов углерода. Карбоновые кислоты могут также представлять собой различные диастереоизомеры, цис или транс, которые могут дополнительно быть (в случае многократной ненасыщенности) различного типа в одной молекуле. Диастереомер может также быть представлен в любом сочетании, таком как, например, 50% цис и 50% транс, или 40% цис и 60% транс, или 30% цис и 70% транс, или 20% цис и 80% транс, или 10% цис и 90% транс, или 5% цис и 95% транс или 1% цис и 99% транс, или 40% транс и 60% цис, или 30% транс и 70% цис, или 20% транс и 80% цис, или 10% транс и 90% цис, или 5% транс и 95% цис, или 1% транс и 99% цис, или 100% цис и 0% транс, или 0% цис и 100% транс.
Примерами являются, но не ограничиваясь ими, лауриновая кислота (C12), миристиновая кислота (C14), пальмитиновая кислота (C16), пальмитолеиновая кислота (C16:1), олеиновая кислота (C18:1), линолевая кислота (C18:2) и стеариновая кислота. Другими примерами являются капроновая кислота, каприловая кислота, декановая кислота (каприновая кислота), арахидиновая кислота, бегеновая кислота, лигноцериновая кислота, альфа-линоленовая кислота, стеаридоновая кислота, эйкозапентаеновая кислота, докозогексаеновая кислота, гамма-линоленовая кислота, дигомо-гамма-линоленовая кислота, арахидоновая кислота, эруковая кислота и нервоновая кислота.
Моноглицериды в соответствии с изобретением имеют формулу:
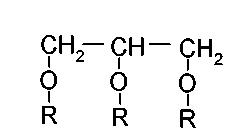
где R выбран из H и ацильного радикала, содержащего от 4 до 30 атомов углерода при условии, что две из R групп представляют собой H. В моноглицериде ацильные цепи обычно расположены у атома углерода 1 или 3 глицеринового остова, но часто будет иметь место ацильная миграция между атомами углерода 1 и 3 и центральным атомом углерода 2, приводящая к тому, что приблизительно 90% ацильных цепей будут расположены у атома углерода 1 или 3 и приблизительно 10% будут расположены у центрального атома углерода. Ацильный радикал может являться, но не ограничиваясь этим, выбором из соответствующих карбоновых кислот, используемых при эстерификации глицерина, и может являться разветвленными или неразветвленными, циклическими или циклическими, замещенными или незамещенными алкил-, алкенил- и алкинилкарбоновыми кислотами, необязательно имеющими многократную ненасыщенность (двойная или тройная связь), которые дополнительно необязательно могут быть различного типа, состоящими из от 4 до 30 атомов углерода, например, от 6 до 24 атомов углерода, от 8 до 20 атомов углерода или от 12 до 20 атомов углерода. Карбоновые кислоты, используемые при эстерификации глицерина, могут также представлять собой различные диастереоизомеры, цис или транс, которые дополнительно могут быть (в случае многократной ненасыщенности) различного типа в одной молекуле. Диастереомеры также могут быть представлены в любом сочетании, таком как, например, 50% цис и 50% транс, или 40% цис и 60% транс, или 30% цис и 70% транс, или 20% цис и 80% транс, или 10% цис и 90% транс, или 5% цис и 95% транс, или 1% цис и 99% транс, или 40% транс и 60% цис, или 30% транс и 70% цис, или 20% транс и 80% цис, или 10% транс и 90% цис, или 5% транс и 95% цис, или 1% транс и 99% цис, или 100% цис и 0% транс, или 0% цис и 100% транс.
Примерами карбоновых кислот, используемых при моноэтерификации глицерина, являются, но не ограничиваясь ими, лауриновая кислота (C12), миристиновая кислота (C14), пальмитиновая кислота (C16), пальмитолеиновая кислота (C16:1), олеиновая кислота (C18:1), линолевая кислота (C18:2) и стеариновая кислота. Другими примерами являются капроновая кислота, каприловая кислота, декановая кислота (каприновая кислота), арахидиновая кислота, бегеновая кислота, лигноцериновая кислота, альфа-линоленовая кислота, стеаридоновая кислота, эйкозапентаеновая кислота, докозогексаеновая кислота, гамма-линоленовая кислота, дигомо-гамма-линоленовая кислота, арахидоновая кислота, эруковая кислота и нервоновая кислота.
В настоящем изобретении используется дистиллированный 1-моноглицерид с чистотой по меньшей мере 80% по массе, например, по меньшей мере 90% по массе или по меньшей мере 95% по массе.
Концентрация моноглицерида может быть в пределах, например, от приблизительно 0,1 г до приблизительно 50 г в расчете на 100 мл адъювантной смеси, предпочтительно в пределах, например, от приблизительно 1 г до приблизительно 20 г в расчете на 100 мл, или от приблизительно 0,5 г до приблизительно 40 г, например, от 0,5 г до приблизительно 30 г, как приблизительно, например, от 0,5 г до приблизительно 25 г, например, от 1 г до приблизительно 20 г, как от приблизительно 2 г до приблизительно 15 г, например, от 5 г до приблизительно 10 г в расчете на 100 мл адъювантной смеси.
Концентрация карбоновой кислоты может быть в пределах, например, приблизительно 0,1-50 г в расчете на 100 мл адъювантной смеси, предпочтительно в пределах 1-20 г в расчете на 100 мл адъювантной смеси или от приблизительно 0,5 г до приблизительно 40 г, например, от 0,5 г до приблизительно 30 г, как приблизительно, например, от 0,5 г до приблизительно 25 г, например, от 1 г до приблизительно 20 г, как от приблизительно 2 г до приблизительно 15 г, например, от 5 г до приблизительно 10 г в расчете на 100 мл адъювантной смеси.
В адъювантной смеси между одним или более моноглицеридов и одной или более карбоновых кислот процентное содержание моноглицерида в карбоновой кислоте может варьировать от 1 до 99%, предпочтительно 10-90%, или, например, общее количество одного или более моноглицеридов в адъюванте может варьироваться, например, от приблизительно 100% или менее, приблизительно 95% или менее, приблизительно 90% или менее, приблизительно 85% или менее, приблизительно 80% или менее, приблизительно 75% или менее, приблизительно 70% или менее, приблизительно 65% или менее, приблизительно 60% или менее, приблизительно 55% или менее, приблизительно 50% или менее, приблизительно 45% или менее, приблизительно 40% или менее, приблизительно 35% или менее, приблизительно 30% или менее, приблизительно 25% или менее, приблизительно 20% или менее, приблизительно 15% или менее, приблизительно 10% или менее, приблизительно 9% или менее, приблизительно 8% или менее, приблизительно 7% или менее, приблизительно 6% или менее, приблизительно 5% или менее, приблизительно 4% или менее, приблизительно 3% или менее, приблизительно 2% или менее, приблизительно 1% или менее, приблизительно 0,5% или менее, приблизительно 0,25% или менее, приблизительно 0,1% или менее, приблизительно 0,05% или менее.
Соответственно, общее количество одной или более карбоновых кислот в адъюванте может варьировать, например, от приблизительно 100% или менее, приблизительно 95% или менее, приблизительно 90% или менее, приблизительно 85% или менее, приблизительно 80% или менее, приблизительно 75% или менее, приблизительно 70% или менее, приблизительно 65% или менее, приблизительно 60% или менее, приблизительно 55% или менее, приблизительно 50% или менее, приблизительно 45% или менее, приблизительно 40% или менее, приблизительно 35% или менее, приблизительно 30% или менее, приблизительно 25% или менее, приблизительно 20% или менее, приблизительно 15% или менее, приблизительно 10% или менее, приблизительно 9% или менее, приблизительно 8% или менее, приблизительно 7% или менее, приблизительно 6% или менее, приблизительно 5% или менее, приблизительно 4% или менее, приблизительно 3% или менее, приблизительно 2% или менее, приблизительно 1% или менее, приблизительно 0,5% или менее, приблизительно 0,25% или менее, приблизительно 0,1% или менее, приблизительно 0,05% или менее от объема адъюванта.
Адъювантная смесь в соответствии с изобретением содержит адъювантные компоненты, т.е. одну или более карбоновых кислот отдельно или в смеси с одним или более моноглицеридов в концентрации, которая вызывает иммунный ответ у человека или животного на антиген, вводимый человеку или животному, когда добавлен антиген. Авторы настоящего изобретения обнаружили, что адъюванты в соответствии с настоящим изобретением особенно эффективны, когда вакцинация осуществляется через назальный путь, например, введение в слизистую оболочку носовой полости. Авторы изобретения неожиданно обнаружили, что использование адъювантов в соответствии с настоящим изобретением при вакцинации через назальный путь усиливает иммунный ответ при вакцинации.
Как упомянуто выше, адъювантная смесь может содержать одну или более карбоновых кислот и один или более моноглицеридов. Общая концентрация карбоновой кислоты вместе с одним или более моноглицеридов в адъювантной смеси составляет самое большее 75% мас./об., или самое большее 50% мас./об., или самое большее 25% мас./об., или самое большее 20% мас./об., или самое большее 15% мас./об., или самое большее 10% мас./об., или самое большее 5% мас./об., или самое большее 4% мас./об., или самое большее 3% мас./об., или самое большее 2% мас./об., или самое большее 1% мас./об., или самое большее 0,5% мас./об., или самое большее 0,1% мас./об. от полного объема адъюванта.
Кроме того, адъювантная смесь, содержащая один или более моноглицеридов вместе с одной или более карбоновых кислот, может иметь общее количество одного или более моноглицеридов вместе с одной или более карбоновых кислот в адъювантной смеси в пределах от приблизительно 0,1% мас./об. до приблизительно 10% мас./об., например, от приблизительно 0,25% мас./об. до приблизительно 9% мас./об., от приблизительно 0,5% мас./об. до приблизительно 8% мас./об., от приблизительно 1% мас./об. до приблизительно 7% мас./об., от приблизительно 1% мас./об. до приблизительно 6% мас./об., от приблизительно 1% мас./об. до приблизительно 5% мас./об., от приблизительно 1% мас./об. до приблизительно 4% мас./об., от приблизительно 1% мас./об. до приблизительно 3% мас./об., от приблизительно 1% мас./об. до приблизительно 2% мас./об. или от приблизительно 0,5% мас./об. до приблизительно 4% мас./об. от общего объема адъювантной смеси.
Адъювант в соответствии с изобретением может дополнительно содержать среду, такую, например, поверхностно-активные агенты, которые могут быть гидрофильными и инертными и биосовместимыми, такими как, например, полоксамеры, например, плюроник F68 или плюроник-127.
Среда может дополнительно содержать одну или более физиологически приемлемых добавок или фармацевтические вспомогательные вещества, например, буферные вещества, такие как, например, Трис, стабилизирующие вещества, осмотически активные вещества, консерванты и регулирующие уровень pH вещества.
pH среды должен находится в физиологически приемлемых пределах, например, от pH 4 до приблизительно pH 9, например, от приблизительно pH 5 до приблизительно pH 7, например, от приблизительно pH 7 до приблизительно pH 9, например, от приблизительно 7,5 до приблизительно pH 8,5 или например, от приблизительно pH 5,5 до приблизительно pH 6,5, или например, приблизительно pH 6, или приблизительно pH 5, или приблизительно pH 8.
Адъювант в соответствии с изобретением может также дополнительно содержать дополнительные адъюванты. Дополнительными адъювантами могут быть например, сквален, соль алюминия например, гидроксид алюминия, ортофосфат алюминия, сульфат гидроксифосфата алюминия, сульфат алюминия-калия, соевое масло или любая их комбинация. Количество дополнительного адъюванта может быть в пределах, например, приблизительно 0,1-50 г в расчете на 100 мл адъювантной смеси, предпочтительно в пределах 1-20 г в расчете на 100 мл адъювантной смеси или от приблизительно 0,5 г до приблизительно 40 г, например, от 0,5 г до приблизительно 30 г, как приблизительно, например, от 0,5 г до приблизительно 25 г, например, от 1 г до приблизительно 20 г, например, от приблизительно 2 г до приблизительно 15 г, например, от 5 г до приблизительно 10 г в расчете на 100 мл адъювантной смеси.
Конечная концентрация одной или более карбоновых кислот по желанию вместе с одним или более моноглицеридов может составлять вплоть до приблизительно 10% от конечной композиции адъюванта или вакцины, например, вплоть до приблизительно 8%, например, вплоть до приблизительно 7%, например, вплоть до приблизительно 5%, например, вплоть до приблизительно 3%, например, вплоть до приблизительно 1%, например, вплоть до приблизительно 0,1% от конечной композиции адъюванта или вакцины.
Конечная концентрация одного или более аминов может составлять вплоть до приблизительно 10% от конечной композиции адъюванта или вакцины, например, вплоть до приблизительно 8%, например, вплоть до приблизительно 7%, например, вплоть до приблизительно 5%, например, вплоть до приблизительно 3%, например, вплоть до приблизительно 1%, например, вплоть до приблизительно 0,1% от конечной композиции адъюванта или вакцины.
Вакцины
Адъювантная смесь в соответствии с настоящим изобретением предназначена для использования для получения вакцины. Такая вакцина содержит адъювант вместе с иммуногенным количеством антигенного компонента и по желанию диспергирована в среде, такой как водная среда.
Следовательно, композиция вакцины в соответствии с изобретением может содержать
одну или более карбоновых кислот или один или более аминов
и необязательно
ii) один или более моноглицеридов,
ii) один или более антигенов.
Например, композиция вакцины по изобретению может содержать
i) от приблизительно 0,1 г до приблизительно 90 г или одной, или двух карбоновых кислот,
ii) от приблизительно 0,01 г до приблизительно 90 г антигена
в расчете на 100 г конечной композиции вакцины.
Более конкретно композиция вакцины по изобретению может содержать
i) от приблизительно 0,1 г до приблизительно 90 г карбоновой кислоты или в виде единственной карбоновой кислоты, или смесь двух кислот,
ii) от приблизительно 0,1 г до приблизительно 90 г моноглицерида,
iii) от приблизительно 0,001 г до приблизительно 90 г антигена
в расчете на 100 г конечной композиции вакцины.
Необходимо отчетливо понимать, что вышеуказанные композиции вакцины могут дополнительно содержать один или более дополнительных адъювантов, например, сквален или/и масло, такое например, соевое масло.
Таким образом, композиция вакцины по изобретению может содержать
i) от приблизительно 0,1 г до приблизительно 90 г карбоновой кислоты или в виде единственной карбоновой кислоты, или смесь двух кислот,
ii) от приблизительно 0,1 г до приблизительно 90 г моноглицерида,
iii) от приблизительно 0,1 г до приблизительно 90 г дополнительного адъюванта, такого как, например, сквален или соевое масло,
iv) от приблизительно 0,001 г до приблизительно 90 г антигена
в расчете на 100 г конечной композиции вакцины.
Более конкретно композиция вакцины по изобретению может содержать
i) от приблизительно 0,1 г до приблизительно 90 г карбоновой кислоты,
ii) от приблизительно 0,1 г до приблизительно 90 г моноглицерида,
iii) от приблизительно 0,01 г до приблизительно 90 г антигена
в расчете на 100 г конечной композиции вакцины.
Кроме того, композиция вакцины может содержать, например,
i) от приблизительно 0,1 г до приблизительно 90 г одного или двух или более аминов,
ii) от приблизительно 0,01 г до приблизительно 90 г антигена
в расчете на 100 г конечной композиции вакцины.
Композиция вакцины может дополнительно содержать дополнительные адъюванты, такие как сквален или масло, например, соевое масло.
Антигены могут представлять собой, например, полностью инактивированные антигены, например, полностью инактивированные вирусы. Антиген может также представлять собой часть патогена, например, часть инактивированного вируса. Антигенными компонентами, которые могут быть использованы, являются, но не ограничиваясь ими, например, вирусные, бактериальные, микобактериальные или паразитарные антигены. Вирусными патогенами являются, например, вирусы гепатита A, B, C, D и E3, HIV, вирусы герпеса 1, 2, 6 и 7, цитомегаловирус, вирус ветряной оспы, папилломавирус, Вирус Эпштейна-Барра, вирусы гриппа, вирусы парагриппа, аденовирусы, буниавирусы (например, хантавирус), вирусы коксаки, пикорнавирусы, ротавирусы, респираторно-синцитиальные вирусы, поксвирусы, риновирусы, вирус краснухи, паповавирус, вирус свинки и вирус кори.
Бактериальными патогенами могут являться, например, микобактерии, вызывающие туберкулез и проказу, пневмококки, аэробные грамотрицательные или грамположительные бациллы, микоплазма, стафилококковые инфекции, стрептококковые инфекции, Хеликобактер пилори, сальмонеллы и хламидии.
Количество одного или более антигенов может быть в пределах, например, от приблизительно 300 мкг или менее, приблизительно 200 мкг или менее, приблизительно 100 мкг или менее, приблизительно 95 мкг или менее, приблизительно 90 мкг или менее, приблизительно 85 мкг или менее, приблизительно 80 мкг или менее, приблизительно 75 мкг или менее, приблизительно 70 мкг или менее, приблизительно 65 мкг или менее, приблизительно 60 мкг или менее, приблизительно 55 мкг или менее, приблизительно 50 мкг или менее, приблизительно 45 мкг или менее, приблизительно 40 мкг или менее, приблизительно 35 мкг или менее, приблизительно 30 мкг или менее, приблизительно 25 мкг или менее, приблизительно 20 мкг или менее, приблизительно 15 мкг или менее, приблизительно 10 мкг или менее, приблизительно 9 мкг или менее, приблизительно 8 мкг или менее, приблизительно 7 мкг или менее, приблизительно 6 мкг или менее, приблизительно 5 мкг или менее, приблизительно 4 мкг или менее, приблизительно 3 мкг или менее, приблизительно 2 мкг или менее, приблизительно 1 мкг или менее, приблизительно 0,5 мкг или менее, приблизительно 0,25 мкг или менее, приблизительно 0,1 мкг или менее, или приблизительно 0,05 мкг или менее. Антиген может также быть представлен в любом количестве достаточном для вызывания иммунного ответа у субъекта.
Состав вакцины в соответствии с настоящим изобретением может быть использован для защиты или лечения животных или людей от множества болезненных состояний, таких как, например, вирусные, бактериальные или паразитарные инфекции, рак, аллергии и аутоиммунные нарушения. Некоторыми конкретными примерами нарушений или болезненных состояний, от которых можно защититься или которые можно вылечить с использованием способов или композиций в соотвествии с данным изобретением, являются вирусные инфекции, вызванные вирусами гепатита A, B, C, D и E3, HIV, вирусом герпеса 1, 2, 6 и 7, цитомегаловирусом, вирусом ветряной оспы, вирусом папилломы, вирусом Эпштейна-Барра, вирусами гриппа, вирусами парагриппа, аденовирусами, буниавирусами (например, хантавирусом), вирусами коксаки, пикорнавирусами, ротавирусами, респираторно-синцитиальными вирусами, рохвирусами, риновирусами, вирусом краснухи, паповавирусом, вирусом свинки и вирусом кори.
Заболевания могут также являться бактериальными инфекциями, такими как инфекции, вызванные микобактериями, вызывающими туберкулез и проказу, пневмококками, аэробными грамотрицательными бациллами, микоплазмой, стафилококковыми инфекциями, стрептококковыми инфекциями, Хеликобактером пилори, сальмонеллами, дифтерией и хламидиями.
Заболевания могут также представлять собой паразитарную малярию, лейшманиоз, трипанозомоз, токсоплазмоз, шистосомиаз, филяриоз или различные типы рака, такие как, например, рак груди, рак желудка, рак толстой кишки, рак прямой кишки, рак головы и шеи, рак почки, злокачественная меланома, рак гортани, рак яичников, рак шейки матки, рак предстательной железы.
Заболевания могут также представлять собой аллергии на клеща домашней пыли, пыльцу и другие аллергены окружающей среды и аутоиммунные заболевания такие как, например, системная красная волчанка.
Антиген в композиции вакцины может представлять собой полностью инактивированные антигены, например, полностью инактивированные вирусы. Технологии инактивации хорошо известны в данной области, такие как, тепловая инактивация, инактивация облучением УФ-излучением или инактивация формалином или обработка бета-пропиолактоном.
Композиция вакцины в соответствии с изобретением может дополнительно содержать фармацевтический приемлемые вспомогательные вещества, такие как, например, среда, которая может являться водной средой, дополнительно содержащей поверхностно-активный агент, который может быть гидрофильным и инертным и биосовместимым, например, полоксамеры например, плюроник F68 или плюроник 127.
Вакцина в соответствии с настоящим изобретением, таким образом, может дополнительно содержать дополнительные адъюванты, антибактериальные агенты, антиоксиданты, инактиваторы вирусов, консерванты, красители, стабилизаторы, противовспенивающие агенты, сурфактанты (неионные, анионные или катионные) или любую их комбинацию.
pH смеси вакцины должен быть физиологически приемлемом диапазоне, таком например, от приблизительно pH 4 до приблизительно pH 9, таком как от, например, приблизительно pH 5 до приблизительно pH 7, например, от приблизительно pH 7 до приблизительно pH 9, например, от приблизительно 7,5 до приблизительно pH 8,5 или таком как от, например, приблизительно pH 5,5 до приблизительно pH 6,5 или, например, приблизительно pH 6, или приблизительно pH 5, или приблизительно pH 8. Предусмотрено, что pH адъюванта или композиции вакцины в случае, когда используются амины, будет иметь значение в диапазоне, например, от приблизительно pH 5 до приблизительно pH 7, такое как приблизительно pH 5,5. В случае, когда адъюванты или композиции вакцины основаны на карбоновых кислотах, диапазон pH может составлять, например, от приблизительно pH 7,5 до приблизительно pH 8,5.
Дополнительный адъювант может быть, например, масла, такие как сквален или соевое масло или соль алюминия, например, алюминия гидроксид, алюминия ортофосфат, сульфат гидроксифосфата алюминия, сульфат алюминия-калия или любой их комбинацией.
Антибактериальные агенты могут представлять собой, например, амфотерицин или любое его производное, хлортетрациклин, формальдегид или формалин, гентамицин, неомицин, полимиксин В или любое его производное, стрептомицин или любую их комбинацию.
Аантиоксиданты могут представлять собой, например, аскорбиновую кислоту или токоферол или любую их комбинацию.
Иинактиваторы вирусов могут представлять собой, например, формалин, бета-пропиолактон, УФ-излучение, нагревание или любую их комбинацию.
Консерванты могут представлять собой, например, хлорид бензетония, ЭДТА, фенол, 2-феноксиэтанол или тимеросал или любую их комбинацию.
Красители могут представлять собой, например, любые индикаторы (например, феноловый красный) или бриллиантовый зеленый или любую их комбинацию.
Противовспенивающие агенты могут представлять собой, например, полидиметилсилозон.
Сурфактанты могут быть, например, анионными, катионными или неионными или цвиттер-ионными, такими, например полиоксиэтилен и его производные, полисорбаты (например, полисорбат 20 или полисорбат 80), твин 80, полоксамеры (такие как, например, плюроник F68) или любой их комбинацией.
Изобретение также относится к профилактике и/или лечению любых инфекционных заболеваний, как раскрыто в настоящем описании.
Обычно вакцины могут быть введены любым подходящим способом, таким как посредством парентерального введения или мукозного введения, таким как, например, назальное, пероральное, ректальное, вагинальное, легочное, ушное или топическое введение или посредством внутривенного, внутримышечного, подкожного, внутрикожного введения или топических путей посредством трансдермального применения посредством кремов, мазей или трансдермальных пластырей и любых их комбинаций.
Нос является наиболее привлекательным путем для иммунизации при введении через слизистую из-за того обстоятельства, то он легко доступен, является высоко васкуляризированным и содержит большую абсорбирующую поверхность. Мукозный, гуморальный и клеточный иммунные ответы могут быть индуцированы, и иммунный ответ может быть индуцирован в отдаленных участках мукозной системы, таких как влагалище и прямая кишка. Кроме того, большие популяции могут быть легко иммунизированы с меньшим риском инфекции.
В случае если мишенью для введения является нос, способом введения может быть, например, распыление вакцины в носовую полость или введение вакцины закапыванием вакцины с помощью пипетки в носовую полость или на слизистую стенки носа.
Предполагается, что парентеральное введение является внутривенной, внутриартериальной, внутримышечной, внутрицеребральной, интрацеребровентрикулярной, внутрисердечной, подкожной, внутрикостной, внутрикожной, интратекальной, внутрибрюшинной, внутрипузырной или интракавернозной инъекцией.
Изобретение, таким образом, относится к способу усиления иммунного ответа у человека или животного к антигену, введенному человеку или животному, при этом способ включает введение эффективного для усиления иммунного ответа количества вакцины, содержащей адъювант в соответствии с настоящим изобретением человеку или животному. Способ может дополнительно включать введение пациенту композиции вакцины в соответствии с изобретением посредством назального, внутривенного, подкожного или внутримышечного введения.
Подписи к фигурам
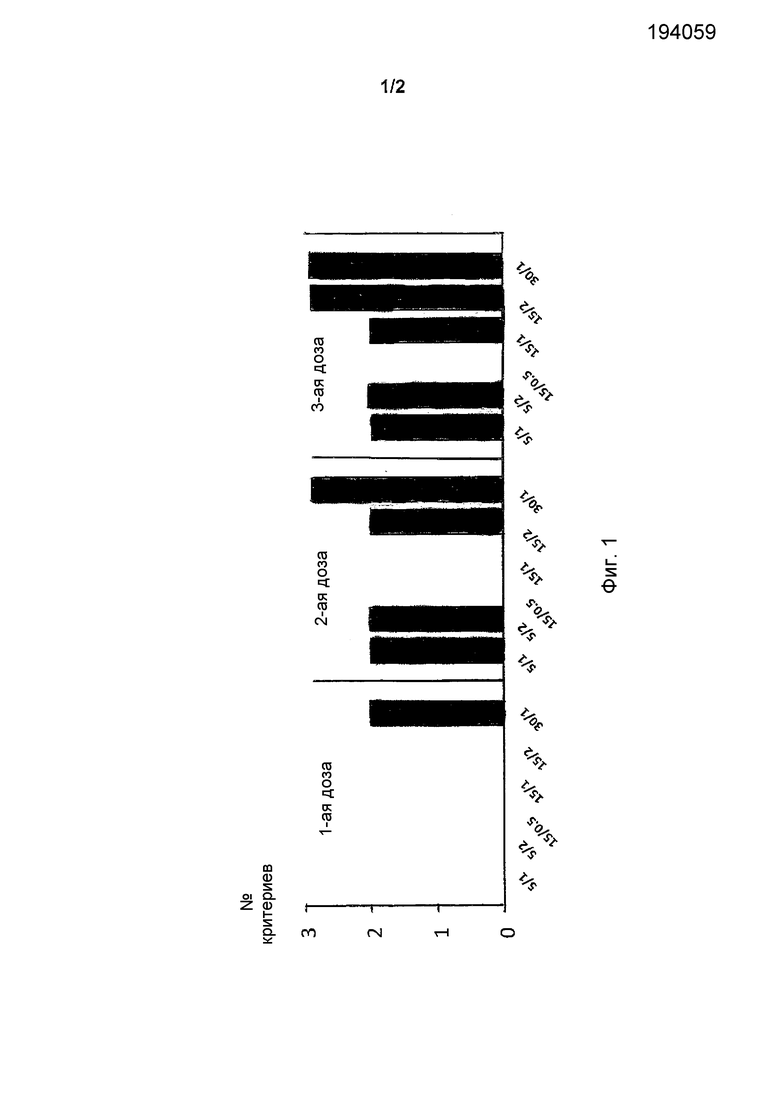
Фиг.1 иллюстрирует несколько исследуемых групп, которые достигают индивидуальные критерии EMA (Европейское медицинское агенство) HAI (подавление гемагглютинации) после каждой дозы.
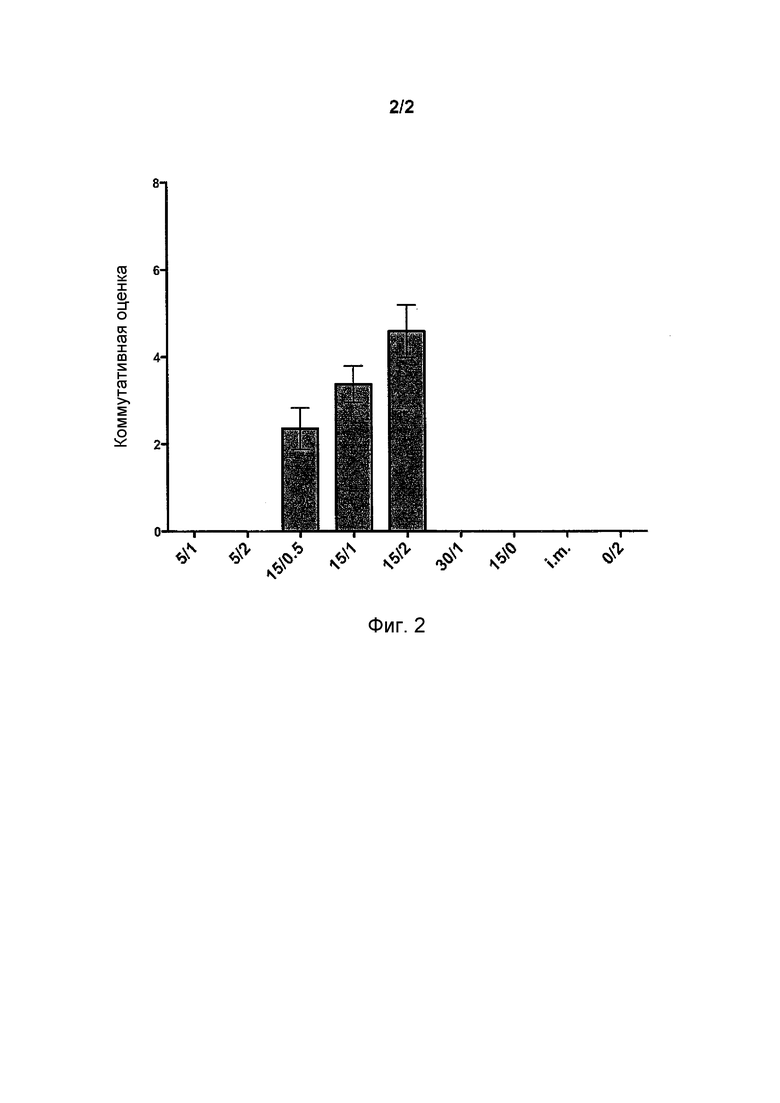
Фиг.2 иллюстрирует комбинацию дозозависимой оценки отрицательно заряженного состава адъюванта (HAI, N-IgA H1/Bri/Cal, H3/Bris/Cal, S-IgG, S-lgA и INF-γ).
Следующие примеры предусмотрены для иллюстрации изобретения без ограничения каким бы то ни было образом.
ПРИМЕРЫ
Пример 1
Получение адъюванта
Получение положительно заряженного адъюванта осуществляли смешиванием олеиламина и лауриламина в соотношении 1:1 (по массе). Полученную в результате смесь впоследствии эмульгировали в 50 мМ ацетатном буфере при pH 6,5 так, что конечная концентрация олеиламин/лауриламин составляла 2% мас./об.
Альтернативно, получение положительно заряженного адъюванта осуществляли смешиванием олеиламина, лауриламина и сквалена в соотношении 1:1:1 (по массе). Полученную в результате смесь впоследствии эмульгировали в 50 мМ ацетатном буфере при pH 6,5 так, что конечная концентрация олеиламин/лауриламин/сквален составляла 2% мас./об.
Альтернативно олеиламин эмульгировали в 50 мМ ацетатном буфере при pH 6,5 так, что конечная концентрация олеиламина составляла 2% мас./об.
Альтернативно, масло, такое как сквален, могло быть добавлено к олеиламину в соотношении 1:1 (по массе), таким образом обеспечивая конечную концентрацию олеиламина и сквалена в эмульсии 2%.
Учитывая использование ацетата в качестве буфера, pH конечного состава для положительно заряженных составов может лежать в интервале pH 5-7,5.
Вышеупомянутые положительно заряженные эмульсии получали или гомогенизацией под высоким давлением, или обработкой проб ультразвуком. Полученные в результате стоковые растворы по желанию разбавляли в разведениях 2, 4, 8, 16 и 32 водой или раствором ацетатного буфера.
Отрицательно заряженную эмульсию получали смешиванием олеиновой кислоты и моноолеина в соотношении 1:1, после чего смесь эмульгировали в 0,1 M Трис-буфере, имеющем pH 8,0.
Альтернативно, отрицательно заряженную эмульсию получали смешиванием олеиновой кислоты и лауриновой кислоты в соотношении 1:1, после чего смесь эмульгировали в 0,1 M Трис-буфере, имеющем pH 8,0.
Конечная концентрация карбоновых кислот по желанию вместе с моноглицеридами может быть вплоть до 10% от конечной композиции адъюванта или вакцины. Вышеупомянутые отрицательно заряженные эмульсии получали или гомогенизацией под высоким давлением, или обработкой проб ультразвуком. Полученные в результате стоковые растворы необязательно разбавляли в разведениях 2, 4, 8, 16 и 32 водой или раствором Трис-буфера.
Отрицательно заряженный адъювант получали смешиванием олеиновой кислоты (0,46 г) и лауриновой кислоты (0,34 г), его впоследствии обрабатывали ультразвуком с 9,2 мл 0,1 M Трис-буфера (pH 8,0). pH конечного раствора доводили до pH 8,0 5M NaOH. Конечная концентрация составляла 8% липидного состава. Композиция в дальнейшем сокращенно обозначена адъювант A.
Кроме того, дополнительно отрицательно заряженный адъювант получали смешиванием моноолеина (0,45 г) и олеиновой кислоты (0,35 г) и последующей обработкой ультразвуком с 9,2 мл 0,1 M Трис-буфера (pH 8,0). Доводили pH конечного состава до pH 8 5M NaOH. Конечная концентрация составляла 8% липидного состава. Композиция в дальнейшем сокращенно обозначена адъювант B.
Еще один дополнительный адъювант получали смешиванием моноолеина (0,15 г), олеиновой кислоты (0,12 г) и соевого масла (0,53 г). Смесь впоследствии обрабатывали ультразвуком с 0,2 мл 0,1 M Трис-буфера (pH 8,0). Доводили pH конечного состава до pH 8 5M NaOH. Конечная концентрация составляла 8% липидного состава. Композиция в дальнейшем сокращенно обозначена адъювант С.
Составы вакцин адъювантов готовили смешиванием пригодного антигена и 8% состава липидного адъюванта в соотношении 1:1, для того чтобы получить конечную концентрацию липида 4% в каждом составе.
Составы адъюванта с липидным содержанием 8%, конечно, могут быть разбавлены до 1%, 2%, 4% или 6% растворов, когда требуется, добавлением дополнительного буферного раствора.
Пример 1.1
Положительно заряженный состав с олеиламином, имеющим концентрацию 2%, смешивали в соотношении 1+1 (об./об.) с суспензией частиц инактивированного вируса гриппа (штамм H1N1/California). Смесь впоследствии вводили интраназально мышам объемом 5 мкл в каждое носовое отверстие. Доза частиц вируса гриппа была эквивалентна 1,5 мкг гемагглютинина (HA). Мышей иммунизировали по три раза, с перерывами по три недели. Через три недели после последней иммунизации мышей умерщвляли, и образцы крови анализировали на наличие иммунного ответа. Результаты продемонстрировали, что титр HAI у мышей, получивших антиген без адъюванта, возрастал до титра HAI 47 (среднее геометрическое, N=8), тогда как положительно заряженный состав приводил к возрастанию до титра HAI 1140 (среднее геометрическое, N=8). Таким образом, было получено 24-кратное возрастание титра HAI.
Выполнение анализа Т-клеточного ответа в виде пг/мл INF-γ после NP стимуляции, выявило то, что положительно заряженный адъювант увеличивал ответ в 28 раз по сравнению с составом без адъюванта.
Конечная концентрация аминов может составлять вплоть до 10% от конечной композиции адъюванта или вакцины
Пример 1.2
Положительно заряженный состав с олеиламином и скваленом, имеющими концентрацию 2%, смешивали в соотношении 1+1 (об./об.) с суспензией инактивированных частиц вируса гриппа (штамм H1N1/California). Смесь впоследствии вводили интраназально мышам объемом 5 мкл в каждое носовое отверстие. Доза инактивированных частиц вируса гриппа была эквивалентна 1,5 мкг гемагглютинина (HA). Мышей иммунизировали по три раза, с перерывами по три недели. Через три недели после последней иммунизации мышей умерщвляли, и анализировали образцы крови на Т-клеточный иммунный ответ.
Выполнение анализа Т-клеточного ответа в виде пг/мл INF-γ после NP стимуляции, выявило то, что положительно заряженный адъювант увеличивал ответ в 60 раз по сравнению с составом без адъюванта.
Пример 2
Отрицательно заряженный состав с олеиновой кислотой и моноолеином, имеющих концентрацию 4%, смешивали в соотношении 1+1 (об./об.) с суспензией частиц инактивированного вируса гриппа (штамм H1N1/California). Смесь впоследствии вводили интраназально мышам объемом 5 мкл в каждое носовое отверстие. Доза частиц вируса гриппа была эквивалентна 1,5 мкг гемагглютинина (HA). Мышей иммунизировали по три раза, с перерывами по три недели. Через три недели после последней иммунизации мышей умерщвляли, и анализировали образцы крови на иммунный ответ.
Результаты продемонстрировали, что титр HAI у мышей, получивших антиген без адъюванта, возрастал до титра HAI 47 (среднее геометрическое, N=8), тогда как отрицательно заряженный состав привел возрастанию титра HAI 147 (среднее геометрическое, N=8). Таким образом, было получено 4-кратное повышение титра HAI.
Выполнение анализа Т-клеточного ответа в виде пг/мл INF-γ после NP стимуляции, выявило то, что положительно заряженный адъювант увеличивал ответ в 7 раз по сравнению с составом без адъюванта.
Пример 3
Отрицательно заряженный состав с олеиновой кислотой и моноолеином, имеющими концентрацию 4%, смешивали в соотношении 1+1 (об./об.) с суспензией инактивированных частиц вируса гриппа (штамм H1N1/Brisbane). Смесь впоследствии вводили интраназально людям объемом 150 мкл в виде капель в каждое носовое отверстие. Дозу частиц вируса гриппа, эквивалентную 5, 15 или 30 мкг гемагглютинина (HA), комбинировали с концентрацией 0,5, 1 или 2% состава отрицательно заряженного адъюванта в различных комбинациях в разных группах. В общем 104 подверженных испытанию людей иммунизировали по три раза с перерывами по три недели составами, содержащими как антиген, так и адъювант. В общем 120 субъектов получали адъювантные составы интраназально, включая контрольный состав, содержащий только адъювант и не содержащий антиген. Через три недели после последней иммунизации анализировали образцы крови на иммунные ответы. Результаты выявили то, что:
не было обнаружено никаких серьезных нежелательных явлений, связанных с вакциной, ни у кого из подверженных испытанию людей. Не было сообщений о параличе Белла среди всех пациентов, получавших адъювант. Нежелательные явления, о которых было сообщено, включали небольшой временный дискомфорт в носу, который исчезал за два часа после введения составов. В таблице 1 нежелательные явления, НЯ, о которых было сообщено, представлены для группы, получавшей 15 мкг антигена и 2% отрицательно заряженного адъюванта.
(3 дозы дозы, n=18)
Для того чтобы получить разрешение на использование вакцины против сезонного гриппа, по меньшей мере один из следующих критериев должен быть выполнен (как определено Европейским медицинским агенством, EMA). Эти критерии включают:
Сероконверсия: часть субъектов, достигших значительного повышения HAI, т.е. по меньшей мере 4-кратное повышение титра (необходимое условие > 40%).
GMT: среднее геометрическое количество раз повышения титров HAI (необходимое условие > 2,5).
Серопротекция: часть субъектов, достигших титр HAI ≥ 40 (необходимое условие > 70%).
Как видно из фиг.1, эти критерии выполнены для одной группы субъектов после одного введения, для 5 групп после 2 введений и для всех групп после 3 введений.
Для того чтобы оценить общую иммуногенность составов, испытываемых на людях, рассчитывали комбинированную оценку. Например, когда субъект получал по меньшей мере 4-кратное увеличение титра, ему присваивали оценку 1 (один). Оценки определяли для следующих анализов: HAI, назальный IgA против H1N1/Brisbane, назальный IgA против H1N1/California, назальный IgA против H3N2/Brisbane, назальный IgA против H1N1/California и IFN-γ. Субъект, таким образом, мог получить максимум 8 баллов. Как можно увидеть на фиг.2, был получен дозозависимый эффект относительно концентрации отрицательно заряженного адъюванта.
Пример 4
Исследования нежелательных явлений при использовании адъювантов в соответствии с изобретением и дифтеритного токсоида (ДТ)
Исследование было рандомизированным, двойным слепым, в параллельных группах. Всего 40 здоровых добровольцев задействовали и рандомизировали в 1 из 4 групп лечения. Первая группа получала 1% адъюванта B/ДТ (дифтеритного токсоида), который вводили стандартным аппликатором. После того, как была установлена безопасность первой группы, следующие две группы обрабатывали или 4% адъюванта B/ДТ, или ДТ отдельно в качестве контроля, вводимых стандартным аппликатором. В четвертой группе, 4% адъюванта B/ДТ вводили назальным аппликатором. Соответствующих установленным критериям субъектов иммунизировали через назальную слизистую оболочку на день 1. Через четырнадцать дней оценивали противодифтерийный иммунный ответ к вакцине. Определяли нежелательные явления во время всего периода исследования.
Адъювант B/ДТ вакцина: 1% или 4% адъюванта В и 75 Lf/мл ДТ, 2×100 мкл вводили посредством стандартного или назального аэрозольного спрея.
Тридцать восемь (38) из 40 субъектов сообщили в целом о 107 нежелательных явлениях (AE). Наиболее распространенным типом нежелательных явлений были совсем слабые и связанные с местным раздражением слизистой оболочки носа, проявляемые чувством жжения в носу, ринореей, чиханием, заложенностью носа, эпистаксисом и болезненностью в носовой полости. За время исследования не было сообщений о смертях, серьезных нежелательных явлениях или прекращениях применения исследуемого продукта из-за нежелательных явлений.
4.1 Выявление и анализ нежелательных явлений
В целом 38 из 40 включенных субъектов сообщили о 107 явлениях. О двух из этих явлений, артроскопия у субъекта № 117 и мигрень у субъекта № 106, было сообщено как о серьезных, о 12 было сообщено как об умеренных и о 93 как о слабых. Количество явлений, о которых было сообщено в расчете на субъект, варьировалось от 1 до 8, со средним значением 2,8 явления. Большая часть НЯ, о которых было сообщено (63 из 107), имели причинно-следственную связь с лечением; например, возможную, предположительную или определенную связь. Двух субъектов, которые не сообщили ни о каких НЯ, включали в контрольную группу лечения и в группу лечения 1% адъювант B/ДТ. Все НЯ суммированы по связи с лечением в таблице 6.
Девять из 107 явлений привели к введению сопутствующей лекарственной терапии, и все субъекты выздоровели без осложнений. Наиболее распространенными НЯ были чувство жжения в носу (26 случаев) и головная боль (15 случаев). Таблицы 2-5 демонстрируют набор НЯ с лечением с лечение после введения ДТ отдельно, 1% Адъювант B/ДТ, 4% Адъювант B/ДТ стандартным аппликатором и после введения 4% адъюванта B/ДТ назальным аппликатором, соответственно.
Во время исследования не произошло смертей, других серьезных нежелательных явлений или прекращений из-за нежелательных явлений, произошедших во время исследования. Кроме того, не наблюдали паралич Белла или его симптомы.
Пример 5
Испытываемые средства имели различные концентрации (0,5 и 2%) адъюванта В и 2% адъюванта В с концентрацией антигена 0,1 мкг/мкл. В качестве контрольного препарата использовали наполнитель, 0,1 M ТРИС буфер. Исследование выполняли на 60 крысах SD обоих родов (30 самцов и 30 самок). Животных поделили на пять групп (6 самок и 6 самцов на группу). Всех животных обрабатывали посредством назального введения носителя, адъюванта или адъювант + вирусный антиген, в объеме 50 мкл (приблизительно 25 мкл в каждое носовое отверстие) с помощью катетера. После введения животных держали анестезированными в течение 5 минут для того, чтобы предоставить возможность абсорбции жидкости и для минимизации риска вытекания раствора из носовой полости. Введения выполняли 4 раза в течение через 9-10 дней.
Животных обрабатывали следующим образом:
Группа 1: Наполнитель; группа 2: низкая доза (0,5%) адъюванта; группа 3: высокая доза (2%) адъюванат; Группа 4: высокая доза (2%) адъюванта + антиген вируса серотипа H1N1 (5 мкг); группа 5: высокая доза (2%) адъюванта + антиген вируса серотипа H1N1 (5 мкг), восстановление. Масса животных была записана по прибытию, после адаптации, затем 3 раза раз в неделю и в заключение в конце исследования. Не было обнаружено никаких статистически важных различий в массах между группами лечения. Животных проверяли ежедневно на изменение в потреблении пищи, активность и т.д., в качестве признаков изменения общего состояния здоровья. Не было зарегистрировано нарушений состояния здоровья. Через один день после последнего введения первых трех животных в группах 1, 2, 3 и 4 и через два дня после последнего введения оставшихся животных в группах 1, 2, 3 и 4 анестезировали и получали кровь и сыворотку для гематологии, клинической биохимии и иммунологических анализов. Через одну неделю после последнего лечения животных в группе подвергали отбору образцов крови как указано выше. Не имели место статистически значимые различия между группами относительно проверяемых гематологических параметров. Клиническая биохимия не выявила статистически значимых различий между группами самок. Среди самцов LDH для животных, обработанных наполнителем, было статистически значимо выше, чем у животных обработанных высокой дозой адъюванта + антиген вируса. Это наблюдение, возможно, не имело практического значения, так как наблюдаемое LDH для обработанных наполнителем самцов выше, чем обычно наблюдаемое для крыс Спраг-Доули.
Иммунологические анализы сыворотки продемонстрировали, что животные во всех группах, а также животные в группах, которые не были целенаправленно обработаны вирусным антигеном, имели антитела против Гриппа A (H1N1/PR8). Однако, 12/12 животных в группе 5 и 9/12 животных в группе 4 являлись серопозитивными, что демонстрирует, что антиген был эффективен комбинации с 2% адъюванта для стимуляции образования антител против гриппа A. Присутствие антител в группе животных, не обрабатываемых целенаправленно гриппом A, указывает на то, что эти животные до некоторой степени были подвержены гриппу A, что не является необычным наблюдением для животных, которые не были выращены в условиях клетки-изолятора. Через один день после последнего введения первых трех животных в группах 1, 2, 3 и 4 и через два дня после последнего введения оставшихся животных в группах 1, 2, 3 и 4 усыпляли и вырезали легкие, сердце, печень, селезенку, поджелудочную железу, почки, гонады, подвздошную кишку, брыжеечные лимфатические узлы, подмышечные лимфатические узлы, подчелюстные лимфатические узлы, тимус, костный мозг и череп. Через неделю после последней обработки всех животных в группе 5 подвергали отбору органов как указано выше. После фиксации и заливки в парафин ткани разделяли и затем анализировали гистопатологические изменения. Гистопатология демонстрировала повреждения только в назальной слизистой оболочке, все другие вырезанные органы были в норме. Так как адъювант и антиген вируса вводили в носовую полость, и они вызвали иммунный ответ, можно было ожидать обнаружение признаков воспалительной реакции в назальной слизистой оболочке. Повреждения, однако, были также обнаружены у обработанных наполнителем животных, что делает истолкование гистопатологических результатов затруднительным, так как носитель не должен вызывать такие эффекты. То обстоятельство, что животные, используемые в данном исследовании, по-видимому, подвергались гриппу A, может быть одной из причин наблюдаемых повреждений, но и другие инфекционные агенты не могут быть исключены. Маловероятно, что адъювант сам по себе вызвал повреждения, так как 0/6 самцов имели повреждения в группе животных, обрабатываемых высокой дозой адъюванта. Таким образом, встречаемость повреждений, наблюдаемых в группе животных-самцов, обрабатываемых низкой дозой адъюванта, может представлять высокую нормальную частоту назальных повреждений в этой группе животных. Вследствие этого, может быть сделан вывод, что частота повреждений в группе животных, обрабатываемых адъювантом и вирусным антигеном, не была выше, чем в других группах животных. В действительности, хи-квадрат анализ не продемонстрировал статистически значимого различия в частоте повреждений в пределах групп лечения. Был сделан вывод, что антиген H1N1, используемый в этом исследовании, вызывал иммунный ответ, который стимулировал образование антител против вируса H1N1. Тяжесть и частота повреждений у животных, обрабатываемых адъювантом или адъювант + вирусный антиген, была схожей с частотой повреждений, обнаруженной у животных обработанных наполнителем. Это указывает на то, что адъювант или адъювант + антиген вируса не продуцировали повреждения слизистой. Записи в медицинской карте анализов гематологии, клинической биохимии и гистопатологии указывают на то, что вакцина, после повторного введения, не вызывала общих токсических реакций у крысы.
Обобщение гистопатологических обнаружения относительно повреждений в назальной слизистой оболочке
В таблице 7 приведено обобщение повреждений, наблюдаемых в назальной слизистой оболочке в виде четырех разделенных уровней (L1-L4). Уровень L4b представляет уровень, в котором также была представлена обонятельная луковица (OB). X указывает на то, что повреждение было обнаружено, W/OAR (With Out Any Remarks (Без каких-либо примечаний)) указывает на то, что не было зафиксировано никаких примечаний о состоянии органа. Повреждения были в виде крови в носовой полости, эрозий эпителия в назальной слизистой оболочке, эдемы или воспаления. Колонку, обозначенную "Повреждение", использовали для статистического анализа частоты повреждений между группами.
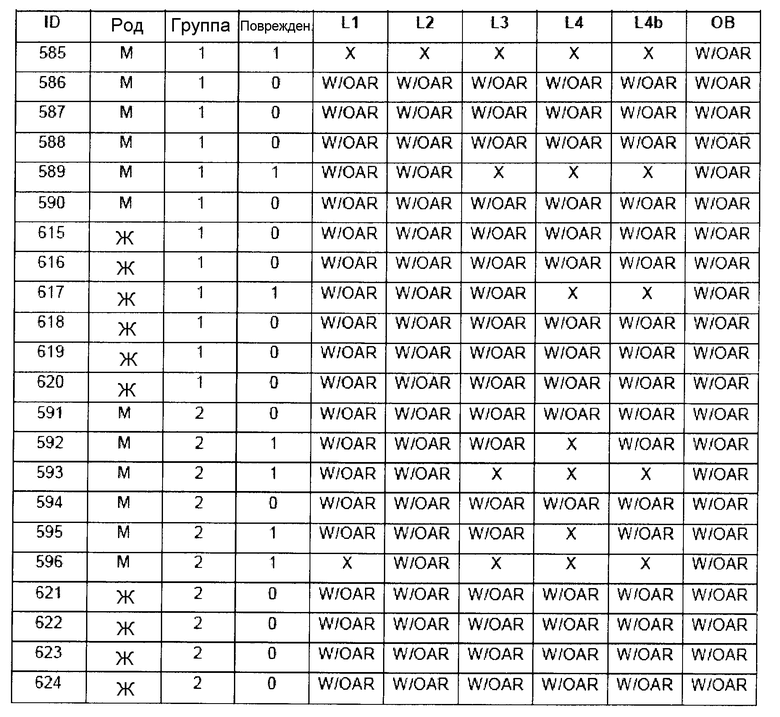
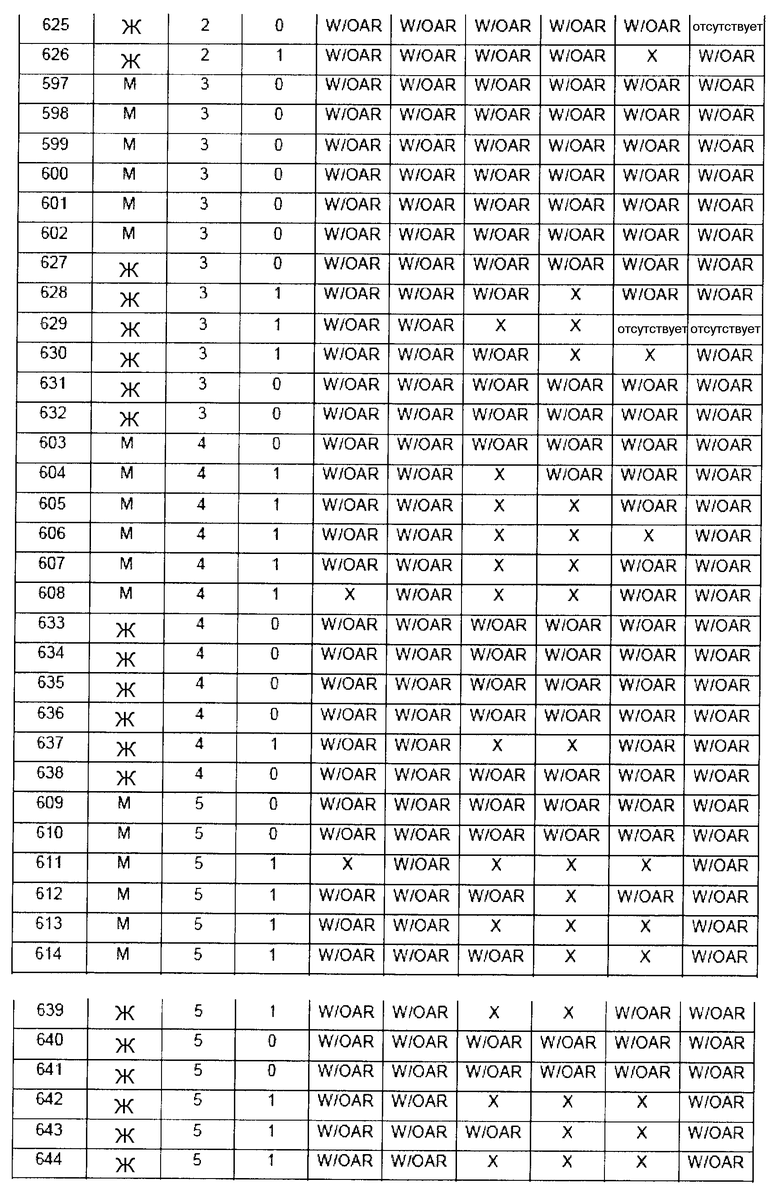
5.1 Частота наличия повреждений между группами лечения
Таблицы 8a-c демонстрируют количество животных в каждой группе лечения, у которых имелись повреждения в назальной слизистой оболочке (повреждение = 1), и животных без повреждений (повреждение = 0).
адъюв. + вирусный антиген
адъюв. + вирусный антиген, восстановление recovery
адъюв. + вирусный антиген
адъюв. + вирусный антиген, восстановление
Пример 6
Испытываемые средства будут иметь различные концентрации (0,5 и 2%) адъюванта B, антигена (5 мкг) и 0,5 или 2% адъюванта с концентрацией антигена 0,1 мкг/мкл. Так как испытываемые средства будут введены в общем объеме 50 мкл каждой крысе, то содержащее H1N1 испытываемое средство будет обозначено 0,5 или 2% адъюванта + 5 мкг антигена.
(Набор №:95002-
0810-6)
№: 95002-0810-17)
5 мкг антигена (Набор №: 95002-0810-19)
Контрольное средство
Наполнитель, 0,1 M ТРИС буфер
Материалы и способы
Животные:
Исследование будет выполнено с использованием 84 крыс SD обоих родов (42 самца и 42 самки), весящих приблизительно 200 г по прибытии, (самцы от ID 2244-8 до 2285-8 и самки от ID 2287-8 до 2328-8). Животные будут получены у Scanbur BK, Соллентуна, Швеция. Животные будут содержаться в клетках M4 (3 в каждой). Они будут обеспечены свободным доступом к воде и имеющемуся на рынке корму R34 от Lactamin AB, Швеция. Все животные будут акклиматизированы в течении минимум 7 дней перед началом эксперимента. Эксперимент утвержден местным комитетом по этике отношений к экспериментальным животным в Уппсала (C25/7). Крысы выбраны потому, что с ними легко обращаться в таком типе исследований.
Введение тестового и контрольного средств:
Животные будут разделены на семь групп (6 крыс-самок и 6 крыс-самцов в группе). Все животные будут обработаны посредством назального введения (при слабой изофлурановой анестезии) наполнителем, адъювантом, антигеном или адъювант + вирус антиген, в объеме 50 мкл (приблизительно 25 мкл в каждое носовое отверстие) с помощью пипетки. После введения животные будут поддерживаться под анестезией в течение нескольких минут, для того чтобы предоставить возможность абсорбции и для минимизации риска вытекания раствора из носовой полости. Введения будут выполнены 4 раза с промежутком 14 дней. Животные будут обрабатываться следующим образом:
Группа 1: Наполнитель
Группа 2: Низкая доза (0,5%) адъюванта
Группа 3: Высокая доза (2%) адъюванта
Группа 4: Антиген вируса (отдельно) серотипа H1N1 (5 мкг)
Группа 5: Низкая доза адъюванта 0,5% + антиген вируса (5 мкг)
Группа 6: Высокая доза адъюванта 2% + антиген вируса (5 мкг)
Группа 7: Высокая доза адъюванта 2% + антиген вируса (5 мкг)
Технические примечания
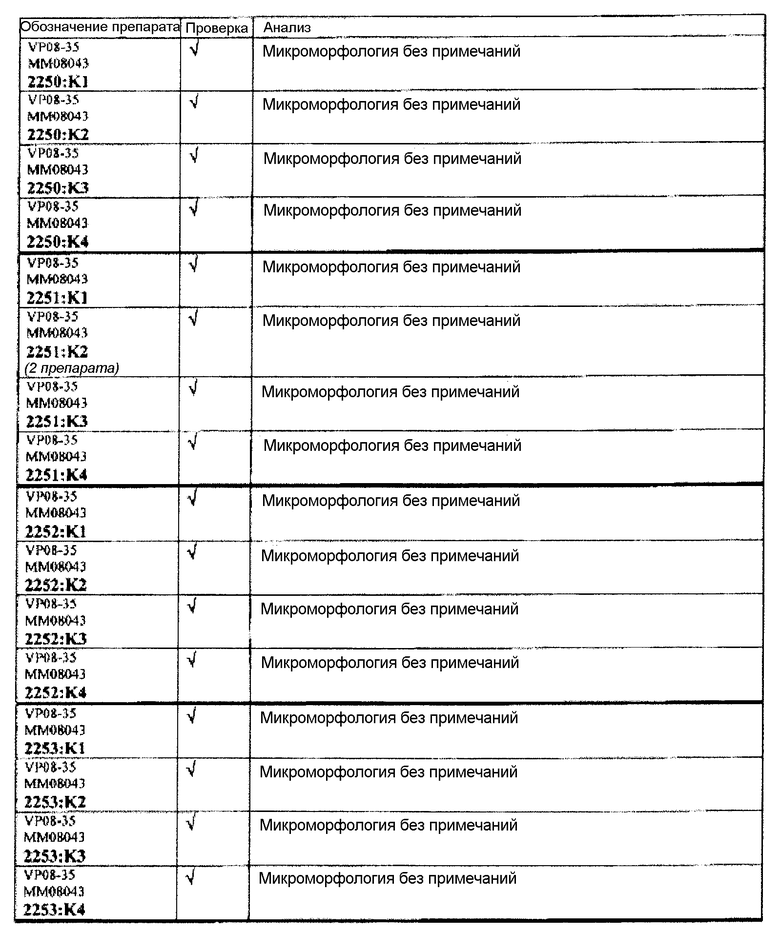
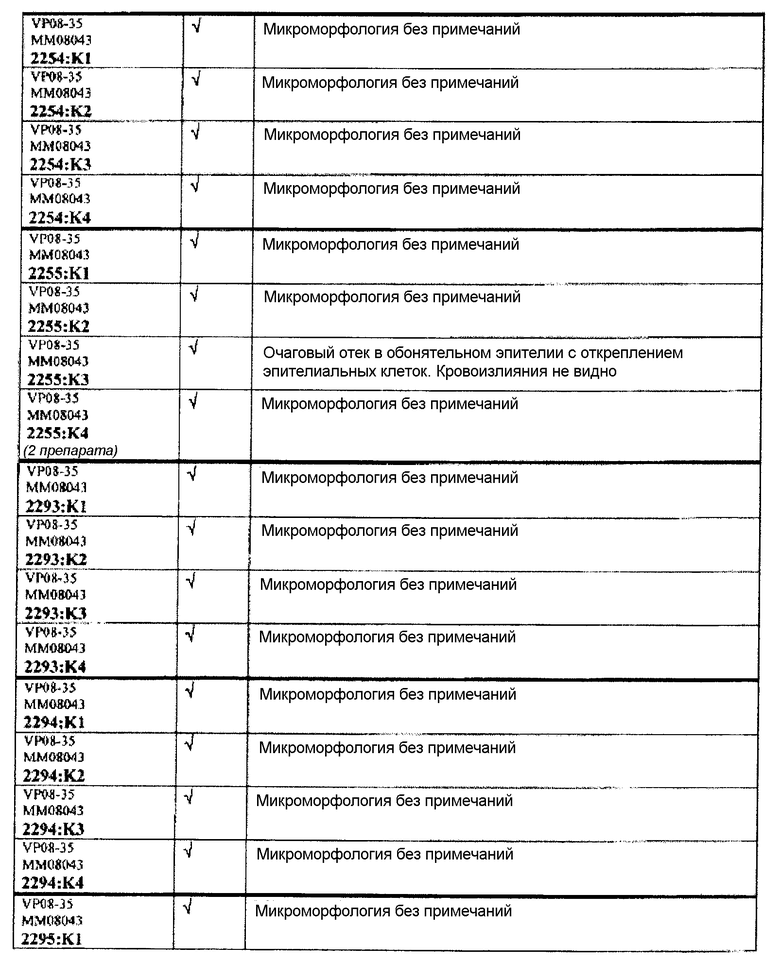
Ткани подразделяли на ряд кассет, обозначенных следующим образом:
K1: череп, уровень 1
K2: череп, уровень 2
КЗ: череп, уровень 3
K4: череп, уровень 4.
Если не указано иное в таблице, то представлен один препарат на один тканевой блок. Препараты с новыми сечениями (т.е. тканевые блоки, подверженные повторному сечению) обозначены n.s. (“new section” (новое сечение)). Препараты, обозначенные "niv8..." (уровень) отображают то, что сечения брали больше, чем с одного уровня.
Группа 1:

Группа 1 (продолжение):
Группа 1 (продолжение):
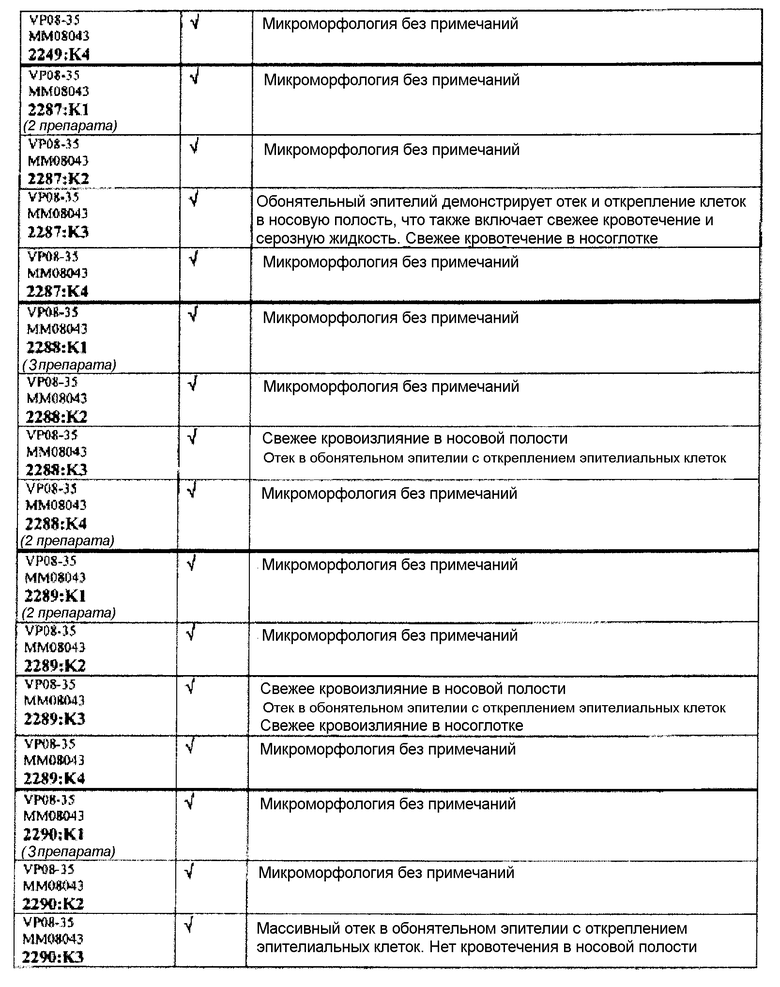
Группа 1 (продолжение):
Группа 2:
Группа 2 (продолжение):
Группа 2 (продолжение):

Группа 3:

Группа 3 (продолжение):
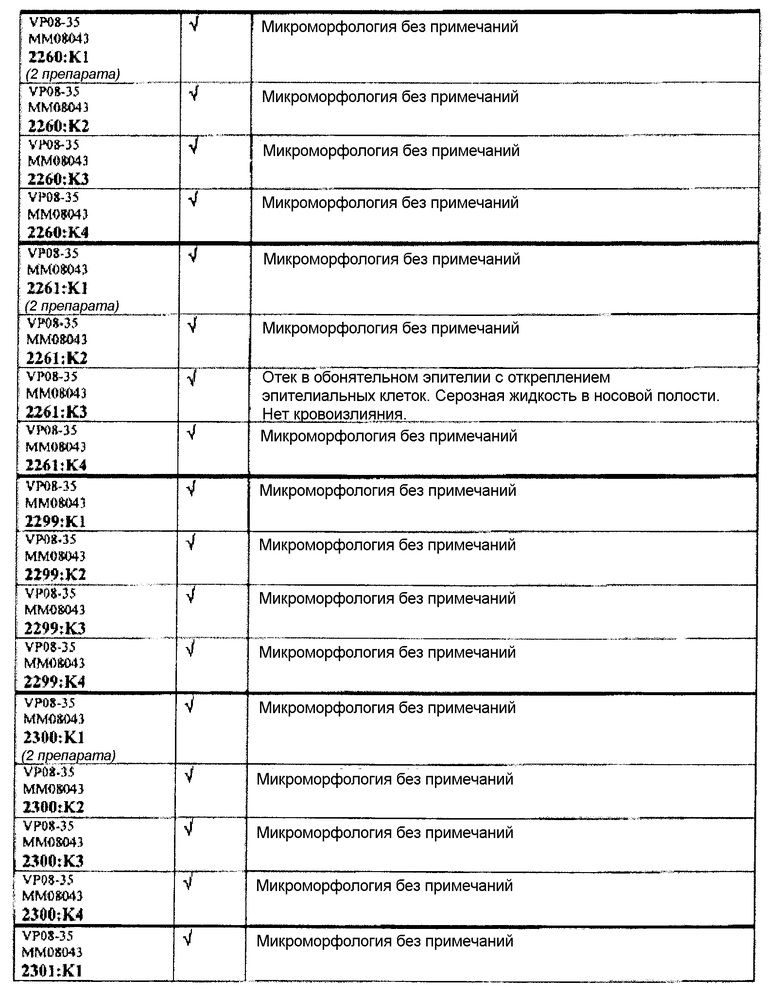
Группа 3 (продолжение):
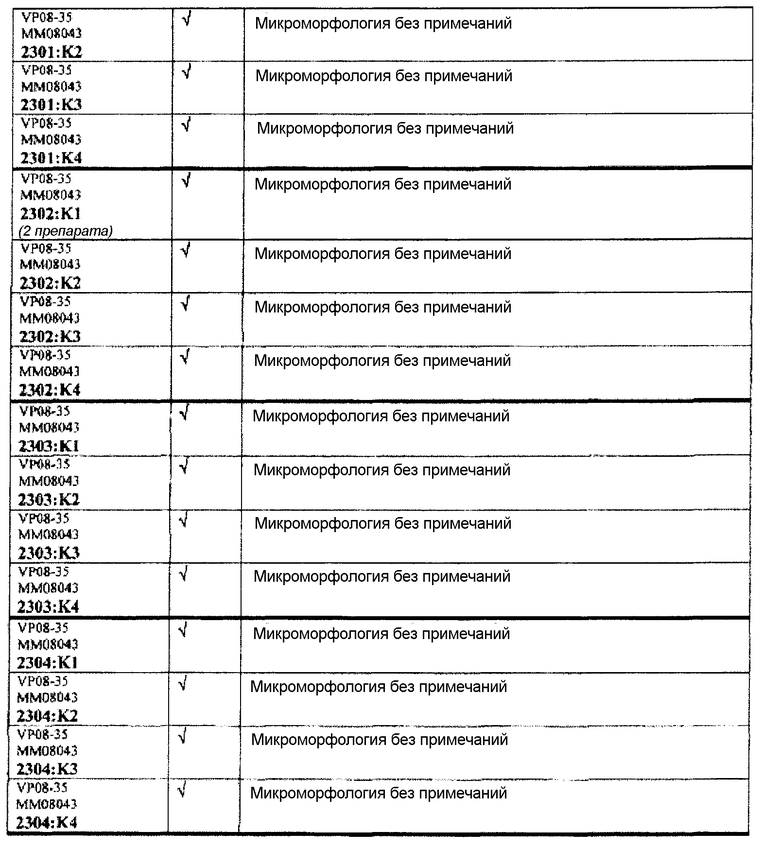
Группа 4:
Группа 4 (продолжение):

Группа 4 (продолжение):
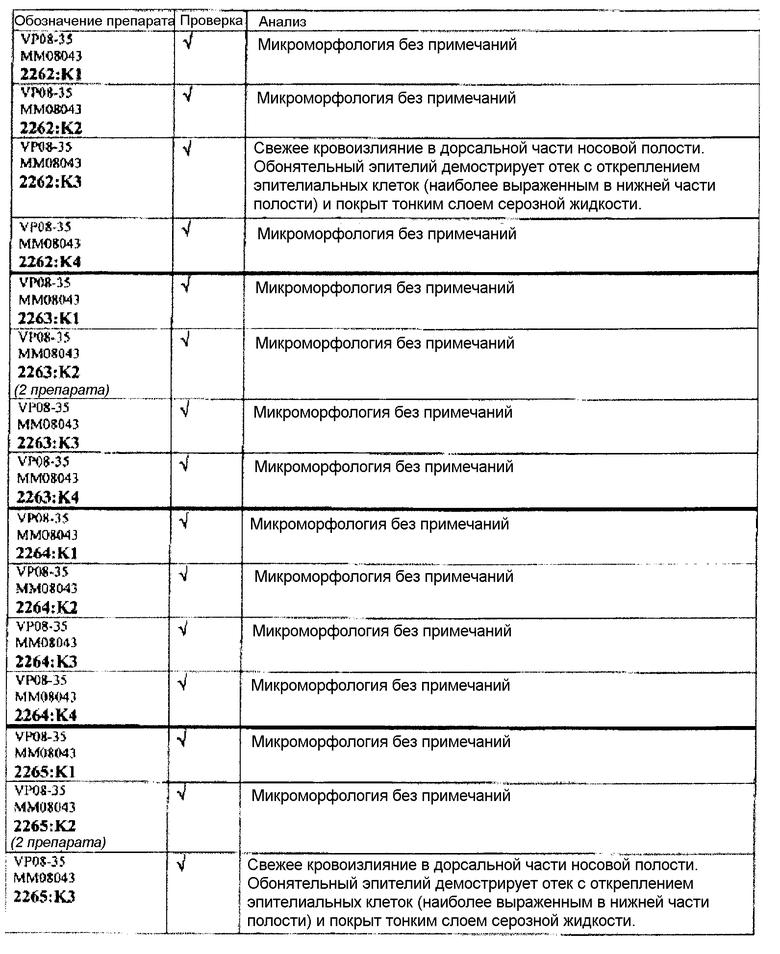
Группа 5:
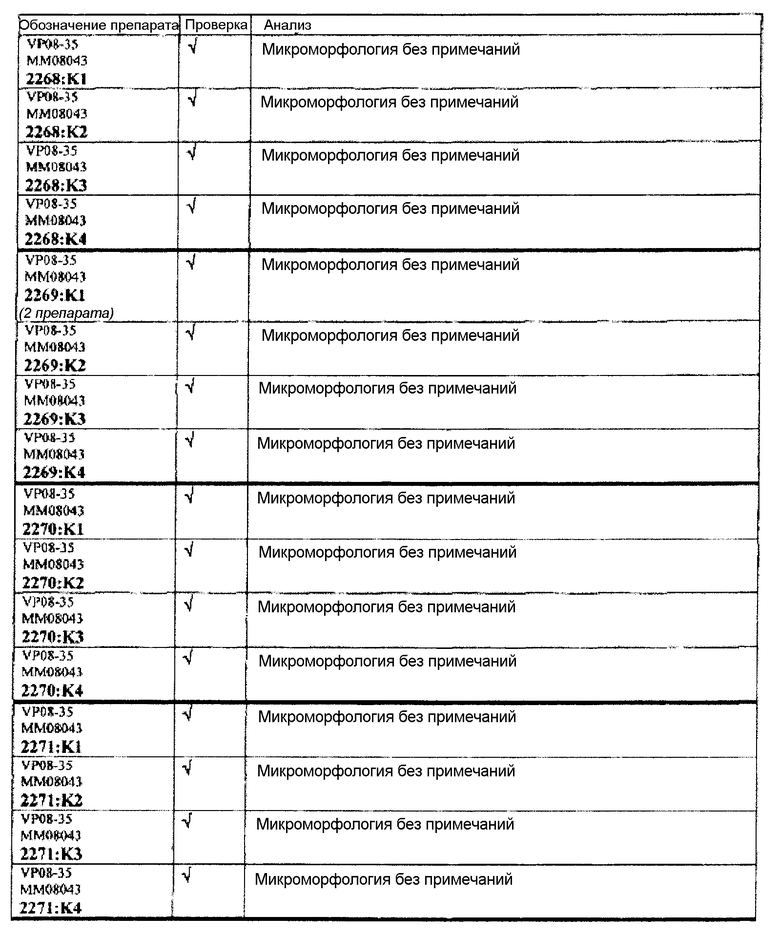
Группа 5 (продолжение):

Группа 5 (продолжение):

Группа 6:
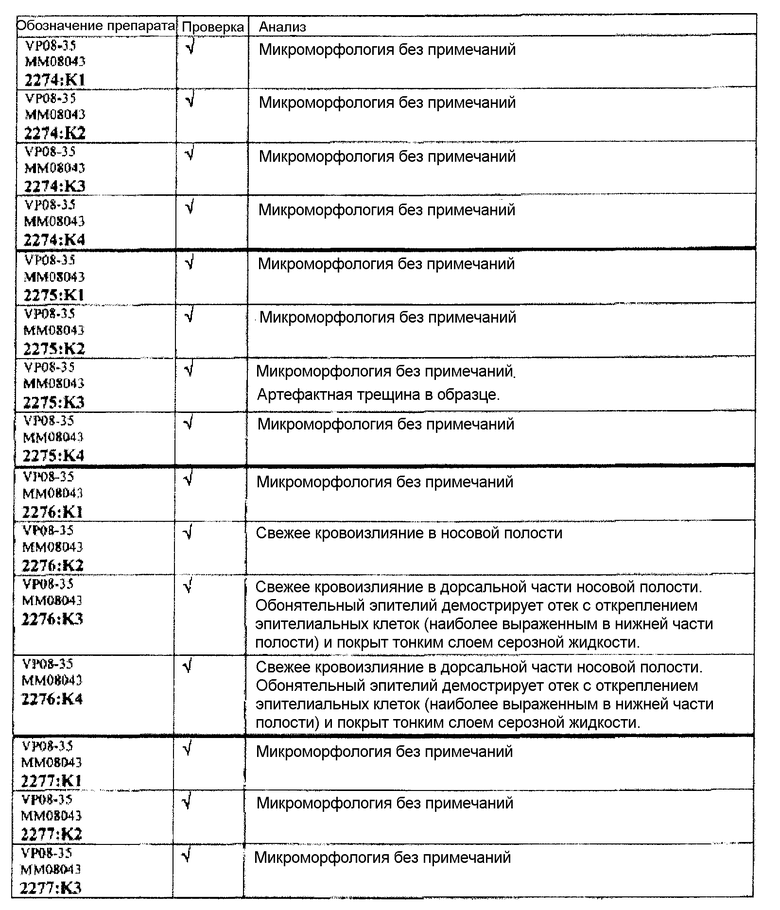
Группа 6 (продолжение):
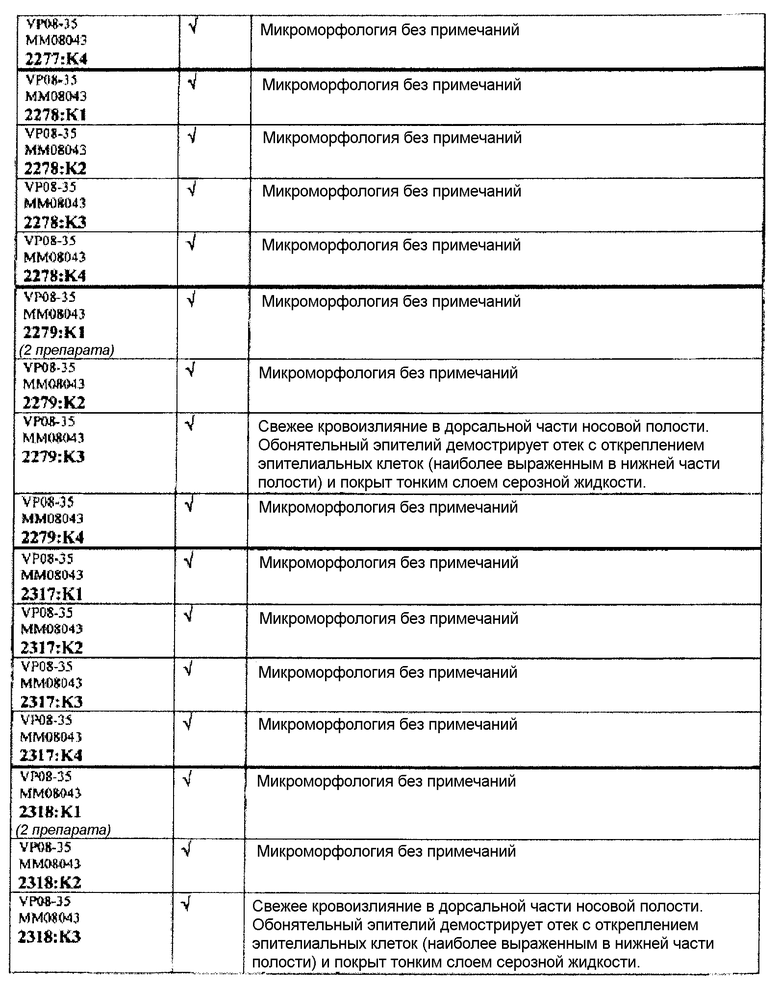
Группа 6 (продолжение):
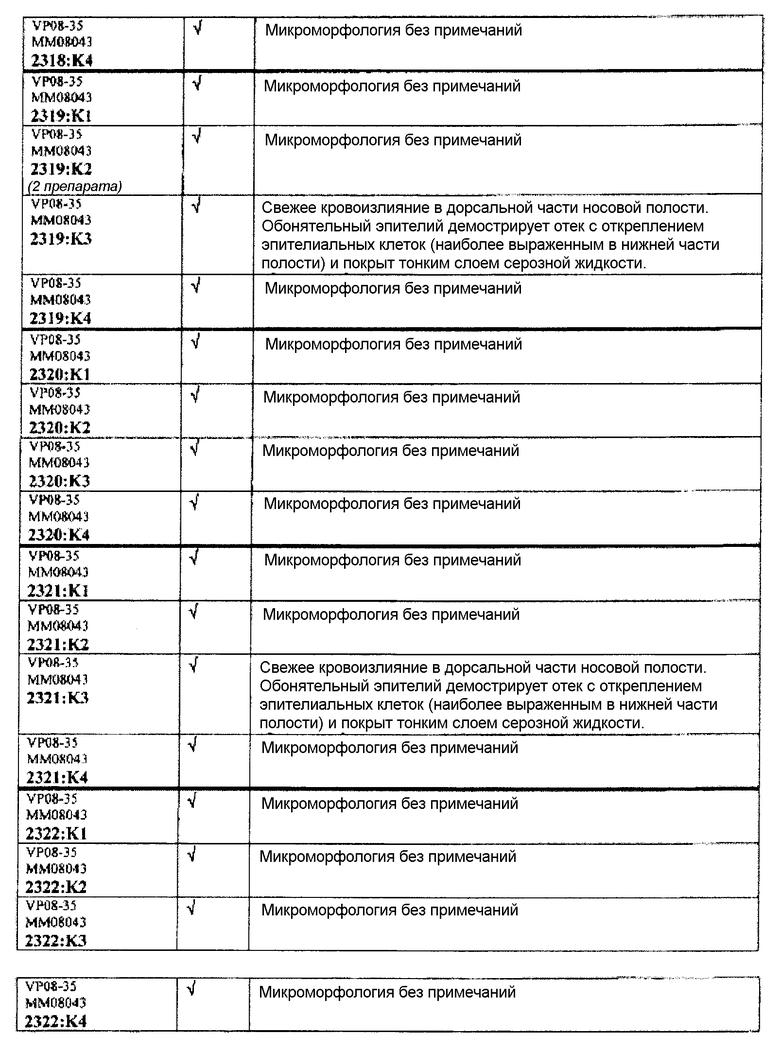
Группа 7:

Группа 7 (продолжение):
Группа 7 (продолжение):
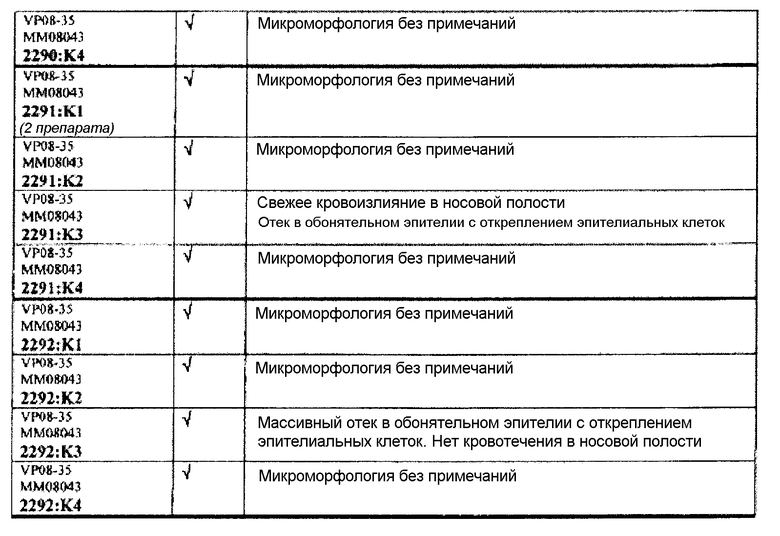
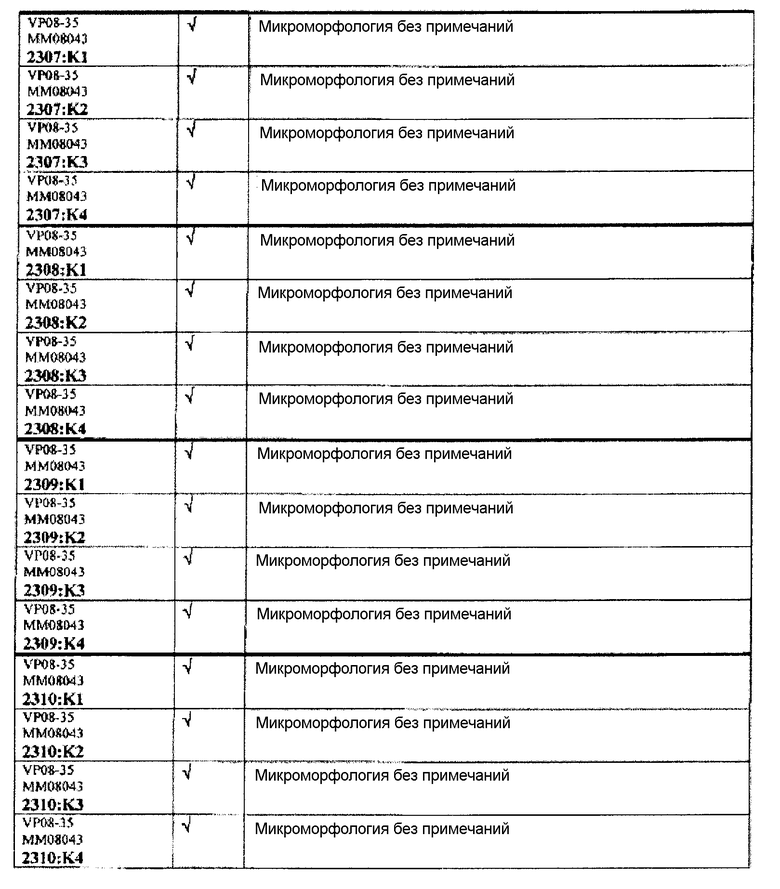
Следовательно, встречаемость микроморфологических изменений является очень низкой во всех группах, как видно из таблицы выше. Так как имеет место характерная связь между такими морфологическими изменениями в носовой полости или обонятельной луковице и встречаемостью паралича Белла, то такие результаты однозначно демонстрируют, что при использовании адъювантов в соответствии с изобретением можно ожидать, что встречаемость паралича Белла будет с такой же частотой, как обычно наблюдаемая (т.е. приблизительно 30-40 человек в расчете на 100000).
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ НЕИММУНИЗИРОВАННЫХ ИНДИВИДУУМОВ | 2013 |
|
RU2661407C2 |
| НОВЫЕ АДЪЮВАНТНЫЕ КОМПОЗИЦИИ | 2009 |
|
RU2510280C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ ПРИМЕНЕНИЯ В ПОПУЛЯЦИЯХ СУБЪЕКТОВ С ОСЛАБЛЕННЫМ ИММУНИТЕТОМ | 2013 |
|
RU2661408C2 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ КОМПЛЕКСА РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ СОБАК | 2012 |
|
RU2553222C2 |
| АДЪЮВАНТНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ НАНОЧАСТИЦЫ ПОЛИ-ГАММА-ГЛУТАМИНОВОЙ КИСЛОТЫ-ХИТОЗАН | 2010 |
|
RU2558794C2 |
| ОСНОВНЫЕ ЭФИРЫ ЖИРНЫХ КИСЛОТ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ ИЛИ ИММУНОМОДУЛИРУЮЩИХ СРЕДСТВ | 2003 |
|
RU2337093C2 |
| ФУНКЦИОНАЛЬНО РЕКОНСТРУИРОВАННЫЕ ВИРУСНЫЕ МЕМБРАНЫ, СОДЕРЖАЩИЕ АДЪЮВАНТ | 2004 |
|
RU2348428C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ Bordetella bronchiseptica | 2012 |
|
RU2554480C2 |
| АДЪЮВАНТНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АЛЮМИНИЙ, И СОДЕРЖАЩАЯ ЕЕ ВАКЦИННАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2721417C2 |
| Противоящурная вакцина | 2016 |
|
RU2698305C2 |
Изобретение относится к медицине, а именно к вакцинопрофилактике. Предложена композиция вакцины, содержащая один или более антигенов, и адъювант, содержащий олеиновую кислоту и моноолеин для применения в интраназальной вакцинации пациента. Использование изобретения позволяет предотвратить развитие побочного эффекта указанной композиции вакцины - паралича Белла. 19 з.п. ф-лы, 15 табл., 2 ил.
1. Композиция вакцины, содержащая i) один или более антигенов, и ii) адъювант, содержащий a) олеиновую кислоту и b) моноолеин для применения в интраназальной вакцинации пациента, представляющего собой человека, для предотвращения побочных эффектов указанной композиции вакцины - паралича Белла, наблюдаемых с частотой выше, чем естественно встречающаяся заболеваемость.
2. Композиция вакцины для применения по п. 1, где адъювант дополнительно включает водную среду.
3. Композиция вакцины для применения по п. 1, где концентрация моноолеина лежит в пределах от приблизительно 0,1 г до приблизительно 50 г в расчете на 100 мл адъювантной смеси, или в пределах, например, от приблизительно 1 г до приблизительно 20 г в расчете на 100 мл, или, например, от приблизительно 0,5 г до приблизительно 40 г, например, от 0,5 г до приблизительно 30 г, как приблизительно, например, от 0,5 г до приблизительно 25 г, например, от 1 г до приблизительно 20 г, как от приблизительно 2 г до приблизительно 15 г, например, от 5 г до приблизительно 10 г в расчете на 100 мл адъювантной смеси.
4. Композиция вакцины для применения по п. 1, где концентрация олеиновой кислоты может быть в пределах, например, приблизительно от 0,1 г до приблизительно 50 г в расчете на 100 мл адъювантной смеси, или в пределах от приблизительно 1 г до приблизительно 20 г в расчете на 100 мл адъювантной смеси, или от приблизительно 0,5 г до приблизительно 40 г, например, от 0,5 г до приблизительно 30 г, как приблизительно, например, от 0,5 г до приблизительно 25 г, например, от 1 г до приблизительно 20 г, как от приблизительно 2 г до приблизительно 15 г, например, от 5 г до приблизительно 10 г в расчете на 100 мл адъювантной смеси.
5. Композиция вакцины для применения по п. 1, где моноолеин вместе с олеиновой кислотой в адъювантной смеси составляют самое большее 75% мас./об., или самое большее 50% мас./об., или самое большее 25% мас./об., или самое большее 20% мас./об., или самое большее 15% мас./об., или самое большее 10% мас./об., или самое большее 5% мас./об., или самое большее 4% мас./об., или самое большее 3% мас./об., или самое большее 2% мас./об., или самое большее 1% мас./об., или самое большее 0,5% мас./об., или самое большее 0,1% мас./об.
6. Композиция вакцины для применения по п. 2, где водная среда имеет pH в физиологически приемлемых пределах, например, от приблизительно pH 4 до приблизительно pH 9, например, от приблизительно pH 5 до приблизительно pH 7, например, от приблизительно pH 5,5 до приблизительно pH 6,5, или например, приблизительно pH 6, или приблизительно pH 5, или от приблизительно pH 8, или от приблизительно pH 7 до приблизительно pH 9, например, от приблизительно pH 7,5 до приблизительно pH 8,5.
7. Композиция вакцины для применения по п. 2, где водная среда дополнительно содержит поверхностно-активный агент.
8. Композиция вакцины для применения по п. 7, где поверхностно-активный агент является гидрофильным и инертным и биосовместимым, например, плюроник F68 или плюроник-127.
9. Композиция вакцины для применения по п. 1, где адъювант дополнительно содержит дополнительные адъюванты, например сквален, соевое масло или соль алюминия, например гидроксид алюминия, ортофосфат алюминия, сульфат гидроксифосфата алюминия, сульфат алюминия-калия или любую их комбинацию.
10. Композиция вакцины для применения по п. 2, где водная среда дополнительно содержит одну или более физиологически приемлемых добавок или фармацевтических наполнителей, например буферные вещества, стабилизирующие вещества, осмотически активные вещества, консерванты и регулирующие уровень pH вещества или любых их комбинации.
11. Композиция вакцины для применения по п. 1, где антиген выбран из, например, бактерий, вирусов, паразитов, аллергенов, раковых антигенов или их комбинаций.
12. Композиция вакцины для применения по п. 1, где антиген выбран из одного или более вирусных, или бактериальных, или паразитарных антигенов, таких, например, как вирусы гепатита А, В, С, D и Е3, HIV, вирусы герпеса 1, 2, 8 и 7, цитомегаловирус, вирус ветряной оспы, вирус папилломы, вирус Эпштейна-Бара, вирусы гриппа, вирусы парагриппа, аденовирусы, буниавирусы (хантавирус), вирусы Коксаки, пикорнавирусы, ротавирусы, респираторно-синцитиальные вирусы, поксвирусы, риновирусы, вирус краснухи, паповавирус, вирус свинки и вирус кори, микобактерии, вызывающие туберкулез и проказу, пневмококки, аэробные грамотрицательные бациллы, микоплазма, стафилококковые инфекции, стрептококковые инфекции, сальмонеллы и хламидии, Helicobacter pylori, малярия, лейшманиоз, трипанозомоз, токсоплазмоз, шистосомиаз, филяриоз.
13. Композиция вакцины для применения по п. 1, где антиген выбран из одного или более антигенов, вызывающих инфекции, таких, например, как микобактерии, вызывающие туберкулез и проказу, пневмококки, аэробные грамотрицательные бациллы, микоплазма, стафилококковые инфекции, стрептококковые инфекции, сальмонелла и хламидии.
14. Композиция вакцины для применения по п. 1, где антиген выбран из одного или более антигенов, вызывающих паразитарную малярию, лейшманиоз, трипаносомоз, токсоплазмоз, шистосомиаз, филяриоз.
15. Композиция вакцины для применения по п. 1, где антиген выбран из одного или более антигенов, вызывающих различные типы рака, такие как, например, рак груди, рак желудка, рак толстой кишки, рак прямой кишки, рак головы и шеи, рак почки, злокачественная меланома, рак гортани, рак яичников, рак шейки матки, рак предстательной железы.
16. Композиция вакцины для применения по п. 1, где антиген выбран из одного или более антигенов, вызывающих аллергии на клеща домашней пыли, пыльцу или другие аллергены окружающей среды и аутоиммунные заболевания такие как, например, системная эритематозная волчанка.
17. Композиция вакцины для применения по п. 1, содержащая адъювант и антиген в количестве, достаточном для вызывания иммунного ответа.
18. Композиция вакцины для применения по п. 1, где вакцина вводится в слизистую оболочку носовой полости.
19. Композиция вакцины для применения по п. 18, где вакцина вводится в слизистую оболочку носовой полости распылением вакцины в носовую полость или введением вакцины посредством закапывания вакцины с помощью пипетки на слизистую оболочку носовой полости.
20. Композиция вакцины для применения по п. 1, где композиция вакцины содержит i) от приблизительно 0,1 г до приблизительно 90 г олеиновой кислоты, ii) от приблизительно 0,1 г до приблизительно 90 г моноолеина, iii) от приблизительно 0,001 до приблизительно 0,01 г до приблизительно 90 г антигена в расчете на 100 г конечной композиции вакцины.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| LEWIS D | |||
| et al | |||
| Transient facial nerve paralysis (Bell's palsy) | |||
Авторы
Даты
2016-07-20—Публикация
2011-09-30—Подача