Изобретение относится к области медицины, а именно к (диагностике) исследованию физических и химических свойств биологических материалов, и может быть использовано в клинической практике для дифференциальной диагностики злокачественных новообразованиях эпителиальных тканей и патологиях не онкологического генеза.
По данным Всемирной организации здравоохранения, на сегодняшний день ежегодно рак диагностируется у 14 миллионов человек, а количество смертей от этого заболевания составляет 8,2 миллиона в год (Global battle against cancer won′t be won with treatment alone. Effective prevention measures urgently needed to prevent cancer crisis // The International Agency for Research on Cancer Organization, World Health, Press release N 224, Lyon/London. 2014. p.630). Предполагается, что заболеваемость раком значительно возрастет: к 2025 году эта цифра достигнет 19 миллиона в год, а к 2035 году - 24 миллиона случаев. Эффективность лечения онкологических заболеваний существенно возрастает при их выявлении на ранней стадии заболевания: так, при раке молочной железы на первой стадии излечиваются примерно 90% пациентов, на третьей стадии - 55-65%, на четвертой - менее 10%. Таким образом, раннее выявление злокачественных новообразований - важный фактор снижения смертности от данного заболевания. Однако скрининговые программы для разных типов онкологических заболеваний существенно отличаются. Разработка методики, позволяющей выявить любое злокачественное заболевание на ранней стадии, существенно бы повысила эффективность лечения и привела к снижению смертности от этого грозного заболевания.
Известен способ дифференциальной диагностики злокачественных новообразований и соматических незлокачественных заболеваний (РФ патент №2232391, МПК G01N 33/48, G01N 33/49, опубл. 10.04.2004).
Известный способ включает взятие в качестве биологического материала для исследования венозной сыворотки крови, подготовку образца путем ее высушивания, размельчения и приготовления суспензии в вазелиновом масле, выполняют инфракрасный (ИК) спектрометрический анализ материала образца в области 1200- 1000 см-1 и регистрируют частотные характеристики взаимодействия материала образца с электромагнитным полем. Способ может быть использован для диагностики и дифференциальной диагностики злокачественных новообразований легких, злокачественных новообразований желудка, злокачественных новообразований кроветворной системы, злокачественных новообразований толстого кишечника, злокачественных новообразований кожи, злокачественных новообразований мужской мочеполовой системы, злокачественных новообразований женской мочеполовой системы, злокачественных новообразований молочной железы, злокачественных новообразований поджелудочной железы и соматических незлокачественных заболеваний по данным инфракрасных спектров поглощения сыворотки крови.
Технический результат известного способа заключается в обеспечении возможности определения локализации патологии в пределах органа или системы органов по результатам анализа одного образца венозной сыворотки крови и назначить своевременное адекватное лечение и контролировать состояние больного в процессе лечения.
За прототип предлагаемого изобретения выбран известный способ дифференциальной диагностики злокачественных новообразований и соматических незлокачественных заболеваний, включающий исследование биологического материала с помощью инструментальных методов исследования и постановку диагноза (РФ патент №2335768, МПК G01N 33/50, опубл. 10.10.2008).
Известный способ осуществляют следующим образом.
В качестве биологического материала для исследования берут венозную сыворотку крови. Осуществляют подготовку образца путем его высушивания и размельчения. Готовят водно-метанольный экстракт материала образца и выполняют высокоэффективную жидкостную хроматографию водно-метанольного экстракта материала образца в области от 200 до 300 нм, определяют высоты хроматографических пиков поглощения с объемами удерживания от 300 до 3400 мкл с шагом в 1 мкл. Определяют наличие характеристических комплексов хроматографических пиков поглощения, при этом диагноз злокачественного новообразования легких выставляется пациенту при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 580, 620, 700, 840, 1010, 1150, 2070, 2490, 2900 мкл, диагноз злокачественного новообразования желудка выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 840, 1090, 1220, 2330, 2435, 2635, 2889, 3165, 3310 мкл, диагноз злокачественного новообразования лимфоидной ткани выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 580, 1090, 1220, 2330, 2445, 2635, 3310 мкл, диагноз злокачественного новообразования толстого кишечника выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 1090, 1145, 1360, 1845, 2075, 2340, 2630 мкл, диагноз злокачественного новообразования кожи выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 1500, 1760, 1845, 2070, 2375, 2450, 2590, 2885 мкл, диагноз злокачественного новообразования мужской половой системы выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 795, 1135, 1505, 1975, 2390, 2960 мкл, диагноз злокачественного новообразования женской половой системы выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 1815, 1970, 2250, 2340, 2500, 3000 мкл, диагноз злокачественного новообразования молочной железы выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 720, 750, 800, 1885, 2500, 2960 мкл, диагноз злокачественного новообразования поджелудочной железы выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 1340, 1775, 1815, 1890, 2975 мкл, диагноз злокачественного новообразования почек выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 1130, 1975, 2380, 2410, 2440, 2735 мкл, диагноз злокачественного новообразования мочевого пузыря выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 630, 1130, 1505, 2250, 2410, 2735, 3285 мкл, диагноз соматического незлокачественного заболевания легких выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 620, 700, 2070, 2910, 2950, 3020, 3230 мкл, диагноз соматического незлокачественного заболевания желудка выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 840, 2500, 2740, 2850, 3165, 3280, 3340 мкл, диагноз соматического незлокачественного заболевания лимфоидной ткани выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 620, 850, 1080, 2505, 2850, 3300 мкл, диагноз соматического незлокачественного заболевания толстого кишечника выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 630, 720, 1150, 2500, 2630, 3165 мкл, диагноз соматического незлокачественного заболевания женской половой системы выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 790, 1970, 2455, 2500, 3165, 3300 мкл, диагноз соматического незлокачественного заболевания мужской половой системы выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 625, 1130, 2330, 2390, 2850, 3315 мкл, диагноз соматического незлокачественного заболевания молочной железы выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания 800, 1815, 2490, 2850, 2950, 3305, 3320 мкл, диагноз соматического незлокачественного заболевания поджелудочной железы выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания - 580, 620, 1150, 1890, 2070, 2590, 3180 мкл, диагноз соматического незлокачественного заболевания почек выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания - 740, 1130, 1778, 1890, 2440, 2850, 3180 мкл, диагноз соматического незлокачественного заболевания мочевого пузыря выставляется при наличии следующего характеристического комплекса хроматографических пиков поглощения с объемами удерживания - 620, 695, 790, 2740, 2850, 3000, 3140 мкл.
Предлагаемый способ позволяет расширить список диагностических позиций для выявления органной локализации очагов злокачественных новообразований, в том числе, отдельно в половой системе, почках, мочевом пузыре, а также лимфоидной ткани и органной локализации соматических незлокачественных заболеваний, сокращение времени анализа и увеличения пропускной способности диагностической лаборатории.
К недостаткам способа можно отнести его сложность и трудоемкость выполнения, поэтому не может быть использован в качестве скрининг диагностики. Кроме того, способ ограничен в применении из-за отсутствия в больницах практического здравоохранения технического оснащения для его выполнения.
Техническим результатом предлагаемого изобретения является обеспечение возможности проведения скрининг диагностики, сокращение времени исследования и упрощение способа, не снижая его точности, специфичности и объективности.
Технический результат достигается тем, что в известном способе дифференциальной диагностики заболеваний онкологического и не онкологического генеза, включающем исследование биологического материала инструментальными методами исследования и постановку диагноза, исследуют электрофоретическую подвижность эритроцитов и при снижении электрофоретической подвижности эритроцитов менее чем на 49% от физиологической нормы диагностируют заболевание не онкологического генеза, при снижении электрофоретической подвижности эритроцитов более чем на 50% от физиологической нормы диагностируют заболевание онкологического генеза, при физиологической норме, равной 1,75±0,04 мкм·см/В·с.
Предлагаемое изобретение отвечает критерию новизна, так как при проведении патентно информационных исследований не выявлены источники научно-технической и патентной литературы, которые бы порочили новизну изобретения.
Новизна предлагаемого способа заключается в том, что исследуют электрофоретическую подвижность эритроцитов и при снижении электрофоретической подвижности эритроцитов менее чем на 49% от физиологической нормы диагностируют заболевание не онкологического генеза, при снижении электрофоретической подвижности эритроцитов более чем на 50% от физиологической нормы диагностируют заболевание онкологического генеза, при физиологической норме, равной 1,75±0,04 мкм·см/В·с.
Известно, что Электрофоретическая подвижность эритроцитов (ЭФПЭ) является интегральным показателем, комплексно характеризующим гомеостаз организма, поскольку любая патология или стресс, реализуется в условиях целостного организма опосредованно - через мембранные системы клеток. Состояние мембраны во многом определяет протекание физиологических и биохимических процессов и тем самым является исходным звеном в сложной цепи приспособительных модификаций на всех уровнях. ЭФПЭ как интегральный показатель морфофункционального состояния мембран служит индикатором состояния системы крови и организма в целом (Крылов В.Н., Дерюгина А.В. Изменение электрофоретической подвижности изолированных эритроцитов при действии стресс-факторов. Гематология и трансфузиология 2011; 5: 18-21).
На сегодняшний день выявлены изменения ЭФПЭ крови у больных при самых разных заболеваниях (Бирюкова Л.С., Пурло Н.В., Козинец Г.И. Морфофункциональные свойства эритроцитов у больных в терминальной стадии хронической почечной недостаточности, получающих заместительное лечение программным гемодиализом и эритропоэтином. Нефрология и диализ 2003; 5(1): 43-49., Козинец Г.И., Попова О.В., Будник М.И., Шмаров Д.А., Погорелов В.Μ., Проценко Д.Д. Электрический заряд клеток крови. М.: Практическая медицина; 2007; 208 с.).
Однако в литературе нет сведений о возможности дифференциальной диагностики заболеваний онкологического и неонкологического генеза с помощью показателей ЭФПЭ, что позволяет сделать вывод о соответствии предлагаемого изобретения критерию «изобретательский уровень».
Предлагаемое изобретение обеспечивает при использовании следующий технический эффект:
- обеспечивает возможность проведения скрининг диагностики;
- высокая точность диагностического исследования;
- значительное снижение времени для осуществления диагностического исследования;
- увеличение экологической безопасности проводимого анализа, поскольку в способе, взятом за прототип, используется водно-метанольный экстракт биологических материалов, работа с которым является потенциально опасной для здоровья персонала медицинской лаборатории;
- снижение трудоемкости проводимого диагностического исследования;
- снижение экономических затрат на осуществление дифференциальной диагностики, так как для осуществления ее методом прототипа требуется наличие жидкостного хроматографа, хроматографической колонки для высокоэффективной жидкостной хроматографии, цены на которые превышают 500000 руб.
Технический результат подтвержден проведенными клинико-лабораторными испытаниями
Предлагаемый способ поясняется графическим материалом.
На фиг. 1 изображена диаграмма уровня электрофоретической подвижности эритроцитов у пациентов с  - сердечно-сосудистыми,
- сердечно-сосудистыми,  - пульмонологическими,
- пульмонологическими, гинекологическими,
гинекологическими,  - гастроэнтерологическими и
- гастроэнтерологическими и  - онкологическими заболеваниями по сравнению со здоровыми людьми -
- онкологическими заболеваниями по сравнению со здоровыми людьми -  ,
,
* - различия с показателями контрольной группы достоверны (р<0,05),
 - различия с показателями между группами достоверны (р<0,05).
- различия с показателями между группами достоверны (р<0,05).
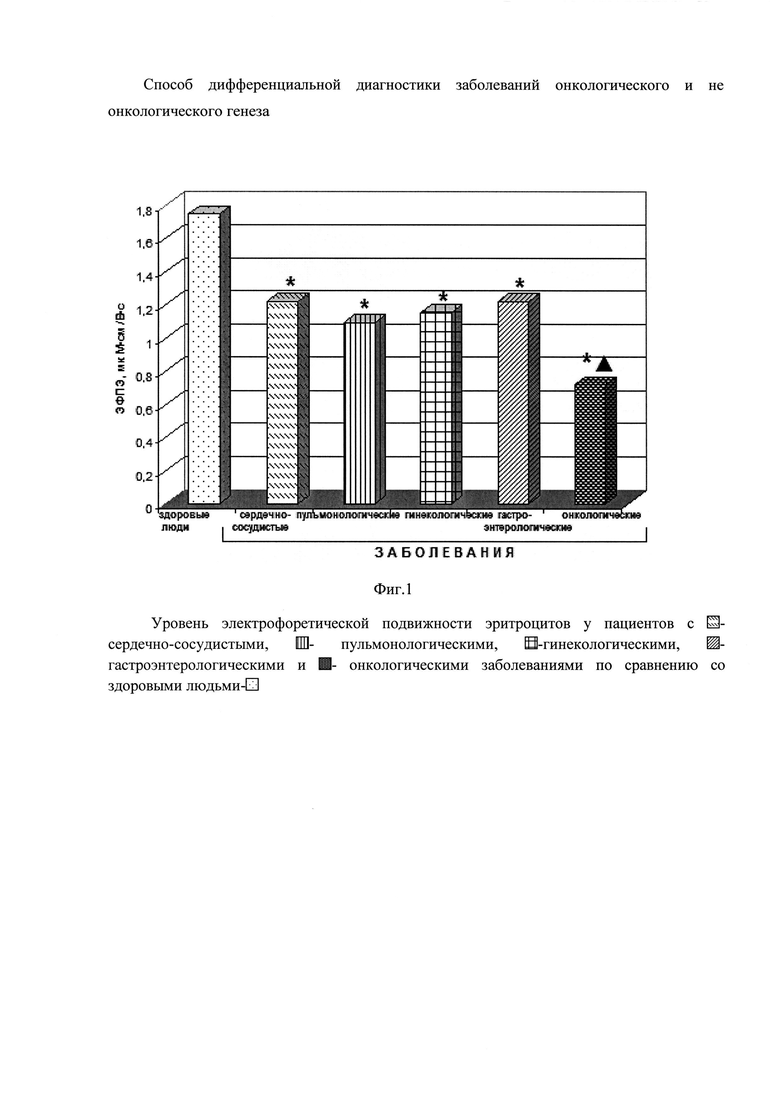
На фиг. 2 изображена диаграмма уровня электрофоретической подвижности эритроцитов у пациентов при различных стадиях злокачественных новообразований эпителиальных тканей: - I стадия,
- I стадия,  - II стадия,
- II стадия,  - III стадия,
- III стадия,  - IV стадия с онкологическими заболеваниями по сравнению со здоровыми людьми -
- IV стадия с онкологическими заболеваниями по сравнению со здоровыми людьми - 
В работе был проведен анализ электрофоретической подвижности эритроцитов крови 20 больных злокачественными новообразованиями эпителиальных тканей, ранее не подвергавшихся противоопухолевому лечению, и больных с сердечно-сосудистыми (острый инфаркт миокарда, артериальная гипертония, стенокардия, миокардит, сердечная недостаточность), бронхо-легочными (хроническая обструктивная болезнь легких, острый бронхит, острая внебольничная пневмония), гинекологическими (угроза выкидыша, обострение хронического эндомерита, диструктиментальное маточное кровотечение), гастроэнтерологическими заболеваниями (язвенная болезнь желудка, холецестит, острый гастрит, острый панкреатит) не онкологического генеза (по 15 в каждой группе) (табл.1).
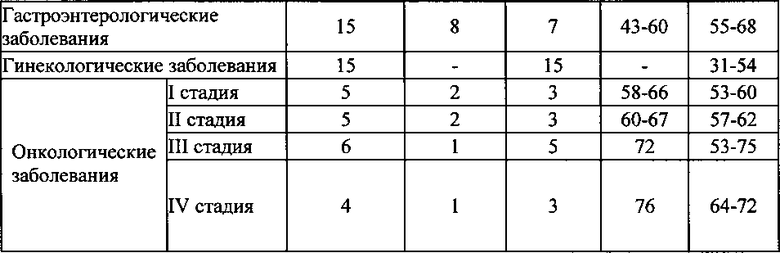
При патологиях не онкологического генеза ЭФПЭ была снижена относительно уровня физиологической нормы (1,75±0,04 мкм·см/В·с): при сердечно-сосудистых заболеваниях на 30% (1,22±0,07); при пульмонологических заболеваниях на 38% (1,09±0,09); при гинекологических заболеваниях на 34% (1,15±0,06); при гастроэнтерологических заболеваниях на 30% (1,22±0,02), то есть не более 40% Диаграмма распределения уровня ЭФПЭ представлена на фиг. 1.
Анализ ЭФПЭ в зависимости от стадии онкологического заболевания (фиг. 2) выявил резкое снижение данного показателя на начальном этапе: при I (0,62±0,024) и II (0,69±0,044) стадиях и менее значительном, но достоверном отличии от уровня у здоровых людей при терминальных стадиях: III (0,86±0,29) и особенно IV (1,11±0,37). Интересно, что обнаружено статистически значимое различие уровня ЭФПЭ при I и стадиях IV злокачественных новообразованиях эпителиальных тканей.
По мнению авторов изобретения, снижение ЭФПЭ наиболее выражено в острый период заболевания, что сочетается с усилением активности симпатоадреналовой системы. При этом степень изменения ЭФПЭ зависит от степени дизадаптации организма. Результаты свидетельствуют, что заболевания не онкологического генеза (в период обострения) вызывают снижение ЭФПЭ не превышающие 50% от средних значений физиологической нормы, тогда как дизадаптация, развивающаяся на фоне злокачественных новообразований, приводит к более значительному снижению ЭФПЭ (снижение более 50%). При этом в процессе хронического стресса, в частности, при развитии онкологии, возможно вовлечение гипофизарно-надпочечникового звена стресс-реализующих систем организма, что и приводит к частичному увеличению ЭФПЭ.
Развитие злокачественных новообразований различных локализаций сопровождается значительно более выраженным снижением ЭФПЭ (более чем на 50% от средних значений физиологической нормы), в отличие от заболеваний неонкологического генеза (менее чем на 50%). Наиболее значительное изменение электрокинетических свойств эритроцитов наблюдается на начальных стадиях канцерогенеза. Таким образом, анализ ЭФПЭ может быть использован для ранней диагностики злокачественных новообразований эпителиальных тканей.
Анализ распределения онкологических больных диагнозам показал, что рак кишечника диагностирован у 7 человек (35%), рак почки - у 5 (25%), рак мочевого пузыря - у 2 (10%), рак простаты - у 4 (20%), рак шейки матки - у 2 (10%). Контрольную группу составили 15 практически здоровых лиц: 6 мужчин (34-65 лет) и 9 женщин (35-65 лет). После оперативного вмешательства у онкологических больных, было проведено гистологическое исследование опухолевого материала по результатам которого была установлена стадия заболевания. Статистическая обработка материала проводилась в программе Excel и BIOSTAT с применением методов дисперсионного анализа. Различия считали достоверными при уровне значимости p<0,05.
При патологиях не онкологического генеза ЭФПЭ была снижена относительно уровня физиологической нормы (1,75±0,04 мкм·см/В·с): при сердечно-сосудистых заболеваниях на 24% (1,33±0,07); при пульмонологических заболеваниях на 32% (1,19±0,09); при гинекологических заболеваниях на 28% (1,26±0,06); при гастроэнтерологических заболеваниях на 24% (1,33±0,02). Значительно более сильное снижение данного параметра наблюдалось у пациентов с онкологическими заболеваниями - более чем в 2 раза (на 59%) (0,72±0,12).
Анализ электрофоретической подвижности эритроцитов в зависимости от стадии онкологического заболевания выявил резкое снижение данного показателя на начальном этапе: при I (0,62±0,024) и II (0,69±0,044) стадиях и менее значительном, но достоверном отличии от уровня у здоровых людей при терминальных стадиях: III (0,86±0,29) и особенно IV (1,11±0,37). Интересно, что обнаружено статистически значимое различие уровня ЭФПЭ при I и стадиях IV злокачественных новообразованиях эпителиальных тканей.
Результаты свидетельствуют, что заболевания не онкологического генеза вызывают снижение ЭФПЭ не более чем на 49% от уровня физиологической нормы, тогда как дизадаптация, развивающаяся на фоне злокачественных новообразований, приводит к более значительному снижению ЭФПЭ 0 более 50%.
Предлагаемый способ осуществляют следующим образом.
Исследование ЭФПЭ и клинический анализ крови проводят при поступлении пациентов в стационар до начала терапевтических мероприятий. Забор крови у больных и практически здоровых людей проводят из локтевой вены натощак. Измерение ЭФПЭ производят методом микроэлектрофореза (Харамоненко С.С., Ракитянская А.А. Электрофорез клеток крови в норме и при патологии. Минск: Беларусь: 1974; 144 с.). В день определения ЭФПЭ готовят взвесь эритроцитов и используют ее для измерения ЭФП отмытых эритроцитов. Отмытые эритроциты получают трехкратным центрифугированием при 1500 об/мин в течении 10 минут с 0,9% раствором хлористого натрия. Суспензию клеток разводят в 10 мМ трис HCl буфере (рН 7,4) и измеряют ЭФПЭ метод микроэлектрофореза в горизонтальной микрокамере при силе тока 15 мА. При снижении ЭФПЭ менее чем на 49% от физиологической нормы диагностируют заболевание не онкологического генеза, при снижении ЭФПЭ более чем на 50% от физиологической нормы диагностируют заболевание онкологического генеза (при физиологической норме равной 1,75±0,04 мкм·см/В·с).
Примеры конкретного исполнения даны в виде выписок из истории болезни
Пример 1
Пациент Α., 29 лет. Поступил в клинику с диагнозом желудочно-кишечное кровотечение неуточненное, в тяжелом состоянии. При поступлении жалобы на слабость, головокружение, кал черного цвета. Из анамнеза: 5 лет назад боли в эпигастральной области, диагноз язвенная болезнь желудка.
Предварительный диагноз. Язвенная болезнь желудка, осложненная кровотечением.
Объективно при поступлении: сознание 15 баллов ШКГ. Кожные покровы бледные. Гемодинамика АД 110/70 мм рт.ст., ЧСС 112 в мин.
Пищеварительная система: Язык обложен серым налетом, влажный. Живот обычной формы не вздут, мягкий. Перистальтические шумы выслушиваются, вялые.
Лабораторные показатели: гемоглобин 90 г/л, гематокрит 35%, тромбоциты 250·109 л. СОЭ 24 мм/ч, глюкоза крови 7,3 ммоль/л, К+ 4,7 ммоль/л, Na+ 135 ммоль/л, PvCO2=40,7 PvO2=68,4 ВЕ=-2,7 РФМК++. Протромбиновый индекс 40%. Тромбиновое время 26 сек.
ФГДС: Пищевод свободно проходим, слизистая желудка бледная с наличием примеси типа «кофейной гущи». По малой кривизне, ближе к антральному отделу желудка язвенный дефект диаметром 1,5 см под тромбом темно-красного цвета с подтеканием крови из-под него. Выполнена остановка кровотечения обкалыванием раствором с адреналином 0,1%. Привратник проходим, Луковица ДПК без деформации.
Заключение: Язва желудка под тромбом. Желудочное кровотечения F1-b.
При поступлении в стационар до начала терапевтических мероприятий методом микроэлектрофореза определена элктрофоретическая подвижность эритроцитов, которая у пациента А. составила 1,08 мкм·см/В·с. Таким образом, наблюдаемое снижение ЭФПЭ пациента А. равно 38%, что менее 49%, что свидетельствует об отсутствии у него злокачественной опухоли.
Пример 2
Пациентка Б., 33 года. При поступлении в стационар до начала терапевтических мероприятий методом микроэлектрофореза определена элктрофоретическая подвижность эритроцитов, которая у пациентки Б. составила 1,25 мкм·см/В·с. Таким образом, снижение ЭФПЭ пациентки Б. составило 29%, от физиологической нормы (меньше 49%), что свидетельствует об отсутствии злокачественной опухоли.
При дальнейшем исследовании диагностирована прогрессирующая правосторонняя трубная беременность. Назначена операция: Лапароскопия. Тубэктомия справа.
Проведена операция. Постоперационный период протекал без осложнений. Проводилась противовоспалительная, инфузионная терапия: Ampicillini sulbactami 1,5 гр в/венно, Cerucali 2 мл в /м, Ketonali 2 мл в/м.
Пример 3
Пациент В., 57 лет. На момент обследования при поступлении отмечает небольшой дискомфорт и слабо выраженный болевой синдром в левом боку, других жалоб не предъявляет. Сопутствующие заболевания: кисты левой почки, гипертоническая болезнь II ст., в течение жизни отмечает простудные заболевания.
Методом микроэлектрофореза определена элктрофоретическая подвижность эритроцитов, которая у пациента В. составила 0,62 мкм·см/В·с. Таким образом, снижение ЭФПЭ пациента В. по сравнению с физиологической нормой равно 65%-соответственно более 50%, что свидетельствует о наличии у него злокачественной опухоли.
Общий анализ крови: гемоглобин = 152 г/л, эритроциты = 4,88·1012/л, тромбоциты = 238·109/л, лейкоциты = 6,4·109/л, СОЭ = 36 мм/ч. Опухолевые маркеры: СА 19-9=13,80 Ед./мл (норма - от 0.00 до 37.00), раково-эмбриональный антиген = 0,76 нг/мл (норма - от 0,00 до 5,00), α-фетопротеин = 3,30 МЕд./мл (норма - от 0,00 до 5,50), простатспецифический антиген = 16,98 нг/мл (норма - от 0,00 до 4,50).
Общий анализ мочи: цвет - желтый, прозрачность - неполная, относительная плотность - 1043, рН=5,0, белок = 0,150 г/л, глюкоза - отриц., билирубин - отриц., лейкоциты - 10-20 в п/зр., эритроциты - 5-10 в п/зр.
Диагноз: рак левой почки T1вΝοΜο, почечно-клеточная карцинома, светлоклеточный вариант G2, стадия 1 (стадия заболевания установлена в соответствии с международной классификацией ΤΝΜ на основе иммуногистохимического анализа операционного опухолевого материала).
Пример 4
Пациентка С., 58 лет. Проходила полное обследование в ходе диспансеризации. При обследовании - жалоб на состояние здоровья не предъявляет. Общий анализ крови: гемоглобин = 144 г/л, эритроциты = 4,88·1012/л, тромбоциты = 192·109/л, лейкоциты = 4,5·109/л, СОЭ = 6 мм/ч. Опухолевые маркеры: СА 19-9=5,00 Ед./мл (норма - от 0.00 до 37.00), СА 125=5,59 Ед./мл (норма от 0,00 до 35,00) раково-эмбриональный антиген = 2,60 нг/мл (норма - от 0,00 до 5,00), α-фетопротеин = 1,30 МЕд./мл (норма - от 0,00 до 5,50).
При обследовании методом микроэлектрофореза определена элктрофоретическая подвижность эритроцитов, которая у пациентки С. составила 1,53 мкм·см/В·с. Таким образом, при анализе ЭФПЭ пациентки С. выявлено незначительное снижение данного показателя - около 12% - менее 49%, что свидетельствует об отсутствии у нее злокачественной опухоли.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ И СОМАТИЧЕСКИХ НЕЗЛОКАЧЕСТВЕННЫХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2335768C2 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ И СОМАТИЧЕСКИХ НЕЗЛОКАЧЕСТВЕННЫХ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2232391C2 |
| Способ прогнозирования течения острого панкреатита | 2016 |
|
RU2637637C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ДОБРОКАЧЕСТВЕННЫХ И ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ВНУТРЕННИХ ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ | 2006 |
|
RU2323439C1 |
| СПОСОБ СКРИНИНГА ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ У ЧЕЛОВЕКА | 2017 |
|
RU2665965C1 |
| Способ дифференциальной диагностики рака яичников, кистозных образований яичника и рака тела матки | 2024 |
|
RU2836527C1 |
| СПОСОБ ВЫЯВЛЕНИЯ "ГРУППЫ ОПУХОЛЕВОГО РИСКА" И СКРИНИНГА РАННИХ СТАДИЙ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ | 1997 |
|
RU2137420C1 |
| Малоинвазивный способ диагностики рака легкого на основании изменения копийности локуса мтДНК HV2 | 2018 |
|
RU2678227C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2011 |
|
RU2469333C1 |
| СПОСОБ ДИАГНОСТИКИ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ У КОШЕК И СОБАК | 2010 |
|
RU2480748C2 |
Изобретение относится к области медицины, а именно к способу дифференциальной диагностики заболеваний онкологического и не онкологического генеза. Сущность способа состоит в том, что исследуют электрофоретическую подвижность эритроцитов и при снижении электрофоретической подвижности эритроцитов менее чем на 49% от физиологической нормы диагностируют заболевание не онкологического генеза. При снижении электрофоретической подвижности эритроцитов более чем на 50% от физиологической нормы диагностируют заболевание онкологического генеза, при физиологической норме, равной 1,75±0,04 мкм·см/В·с. Использование заявленного изобретения позволяет повысить эффективность дифференциальной диагностики заболеваний онкологического и не онкологического генеза. 2 ил., 1 табл., 4 пр.
Способ дифференциальной диагностики заболеваний онкологического и не онкологического генеза, включающий исследование биологического материала инструментальными методами исследования и постановку диагноза, отличающийся тем, что исследуют электрофоретическую подвижность эритроцитов и при снижении электрофоретической подвижности эритроцитов менее чем на 49% от физиологической нормы диагностируют заболевание не онкологического генеза, при снижении электрофоретической подвижности эритроцитов более чем на 50% от физиологической нормы диагностируют заболевание онкологического генеза, при физиологической норме, равной 1,75±0,04 мкм·см/В·с.
Авторы
Даты
2016-07-27—Публикация
2015-06-10—Подача