Изобретение относится к медицине, а именно к молекулярной биологии, онкологии, и может быть использовано для малоинвазивной диагностики рака легкого.
В мире ежегодно регистрируется более 1 млн. 800 тыс. новых случаев заболевания раком легкого и более 1 млн. 500 тыс. смертей от данной патологии (см. World Cancer Report 2014. Chapter 1.1. World Health Organization. 2014. ISBN 9283204298).
Столь высокий показатель смертности отчасти связан с тем, что в настоящее время проблема ранней диагностики рака легкого остается не решенной, а изученные молекулярные маркеры не показывают достоверной специфичности.
Прогностическое значение многих из них спорно и, главным образом, отражает различия в методологии исследований, группах пациентов и интерпретациях.
Прогностической ценностью обладают сигнатуры экспрессии определенных генов (например, DUSP6, MMD, STAT1, ERBB3 и LCK) хотя эти данные чрезвычайно гетерогенны (см. Кутилин Д.С., Енин Я.С., Петрусенко Н.А., Водолажский Д.И. Изменение копийности генетических локусов при малигнизации тканей легкого // Современные проблемы науки и образования. - 2016. - №6.; URL: https://www.science-education.ru/ru/article/view?id=25994).
Трансформация нормальных клеток в раковые связана с накоплением изменений в геноме, обеспечивающих приобретение трансформированными клетками неограниченного потенциала к пролиферации; резистентности к сигналам апоптоза; способности поддерживать ангиогенез; способности к инвазии и метастазированию.
Молекулярные изменения, ответственные за приобретение вышеуказанных свойств, могут использоваться в качестве онкомаркеров (см. Zhu C.Q., Shih W., Ling C.H., Tsao M.S. Immunohistochemical markers of prognosis in non-small cell lung cancer: a review and proposal for a multiphase approach to marker evaluation // J. Clin. Pathol. - 2006. - V. 59 (8). - P. 790-800; см. Владимирова Л.Ю., Кит О.И., Шолохова Е.А. Роль гистологического и молекулярного анализа в выборе метода лечения немелкоклеточного рака легкого поздних стадий // Фарматека. 2012. №8 (241). С. 9-22.).
К подобным молекулярным онкомаркерам можно отнести специфические изменения числа копий генов (см. Кит О.И., Водолажский Д.И., Кутилин Д.С., Гудуева Е.Н. Изменение копийности генетических локусов при раке желудка // Молекулярная биология. - 2015. - Т. 49, №4. - С. 658-666.).
Изменение числа копий гена (copy number variation, CNV) является одним из основных механизмов изменения степени экспрессии потенциальных онкогенов и генов-супрессоров опухолей раковыми клетками. CNV - вид генетического полиморфизма, возникающий в результате несбалансированных хромосомных перестроек, приводящих к делециям и дупликациям фрагментов ДНК размером, больше, чем 50 (пар оснований) (см. Zarrei М., MacDonald J.R., Merico D., Scherer S.W. A copy number variation map of the human genome // Nature Reviews Genetics. - 2015. - V. 16 (3). - P. 172-83).
Результатом подобных несбалансированных хромосомных перестроек также может явиться снижение или повышение числа копий определенного гена и, следовательно, пониженная или повышенная экспрессия продукта гена - белка или некодирующей РНК (см. Chen Z., Xu W.R., Qian Н., Zhu W., Bu X.F., Wang S., Yan Y.M., Mao F., Gu H.B., Cao H.L., Xu X.J. Oct4, a novel marker for human gastric cancer // J. Surg. Oncol. - 2009. - V. 99 (7). - P. 414-9.).
CNV являются следующим уровнем в полном понимании молекулярного контекста развития опухолевого процесса. Так была изучена роль CNV в качестве фактора малигнизации тканей желудка и легкого (см.  Schneider-Stock R
Schneider-Stock R Kasper H.U., Pross М., Hackelsberger A., Lippert Н., Roessner A. Mdm2 gene amplification in gastric cancer correlation with expression of Mdm2 protein and p53 alterations. A Mod Pathol. - 2000 - V. 13 (6) - P. 621-626; см. Кутилин Д.С., Енин Я.С., Петрусенко H.A., Водолажский Д.И. Изменение копийности генетических локусов при малигнизации тканей легкого // Современные проблемы науки и образования. - 2016. - №6.; URL: https://www.science-education.ru/ru/article/view?id=25994).
Kasper H.U., Pross М., Hackelsberger A., Lippert Н., Roessner A. Mdm2 gene amplification in gastric cancer correlation with expression of Mdm2 protein and p53 alterations. A Mod Pathol. - 2000 - V. 13 (6) - P. 621-626; см. Кутилин Д.С., Енин Я.С., Петрусенко H.A., Водолажский Д.И. Изменение копийности генетических локусов при малигнизации тканей легкого // Современные проблемы науки и образования. - 2016. - №6.; URL: https://www.science-education.ru/ru/article/view?id=25994).
Было проведено исследование относительной копийности генетических локусов, ответственных за регуляцию апоптоза (ВАХ, BCL2, C-FLAR, Р53, MDM2), пролиферацию (SOX2, ОСТ4, NANOG, PIK3 и МK167), окислительное фосфорилирование (HV2) и ответ на гипоксию (HIF1A1) в образцах, содержащих опухолевые и нормальные клетки тканей легкого и выявлены генетические локусы, которые имеют высокий потенциал в качестве молекулярных маркеров для прогнозирования рака легкого (HV2, HIF1A1, Р53, MDM2). Однако этот потенциал ограничен высоким уровнем инвазивности при получении биоматериала.
Возможное решение этой проблемы находится в переходе на исследование копийности генов во внеклеточной ДНК плазмы крови.
К внеклеточной ДНК в организме следует относить: клеточную и митохондриальную ДНК из соматических и из опухолевых клеток, подвергающихся процессам апоптоза и некроза; ДНК из эритробластов, ядра которых энуклеируются в процессе дифференцировки в эритроциты, ДНК из лимфоцитов в процессе их апоптотической гибели после стимуляции, ДНК эмбрионов в крови матери, бактериальную и вирусную ДНК.
При многих видах опухолей определяется повышенный уровень внеклеточной ДНК (внДНК) в периферической крови. При этом прогресс заболевания часто связан с постепенным повышением уровня внДНК. Более того, довольно часто уровень внДНК возрастает при метастазировании опухоли, по сравнению со значениями в отсутствие последних (см. Козлов В.А. Свободная внеклеточная ДНК в норме и при патологии. Медицинская иммунология. 2013, Т. 15, №5, с. 399-412).
Изменение числа копий митохондриальной ДНК определяемое по копийности локуса HV2 (гипервариабельный участок с 33 по 160 нуклеотид D-петли мтДНК), отражает состояние окислительного фосфорилирования малигнизированных клеток (см. Scatena R. Mitochondria and cancer: a growing role in apoptosis, cancer cell metabolism and dedifferentiation. // Adv Exp Med Biol. - 2012. - V. 942. - P. 287-308).
В широкомасштабном исследовании, включавшем в себя группы пациентов с раком желудка на различных стадиях и условно здоровых доноров, была показана достоверная корреляция копийности мтДНК и прогрессии заболевания (см. Liao L.M. et al. Mitochondrial DNA Copy Number and Risk of Gastric Cancer: a Report from the Shanghai Women's Health Study // Cancer Epidemiol Biomarkers Prev; 2011, 20 (9); 1944-9).
Результаты другого исследования показали, что во внДНК у 95% пациентов с аденокарциномой легкого обнаружено достоверное снижение количества копий HV2 по сравнению с внДНК условно здоровых доноров (см. Кутилин Д.С., Айрапетова Т.Г., Анистратов П.А., Пыльцин С.П., Лейман И.А., Чубарян А.В., Туркин И.Н., Водолажский Д.И., Николаева Н.В., Лысенко И.Б. Изменение относительной копийности генетических локусов во внеклеточной ДНК у пациентов с аденокарциномой легкого. Известия вузов. Северо-Кавказский регион. Естественные науки, 2017. №3. С. 74-83).
Поэтому, в качестве маркера для прогнозирования рака легкого допустимо использование показателя относительной копийности HV2 мтДНК.
Из патентных источников известны следующее изобретения, наиболее близкие нашему.
1. «Способ комбинированной эндоскопической диагностики рентгенонегативных синхронных центральных раков легких» (см. патент RU 2628649 С1, опубликован: 21.08.2017, Бюл. №24) Способ заключается в комбинированной эндоскопической диагностике рентгенонегативных синхронных центральных раков легкого с помощью видеобронхоскопии в узкоспектральном режиме - сине-зеленой части спектра и в аутофлюоресцентном режим
При выявлении с помощью аутофлюоресценции патологических участков, включая и минимальные очаги слизистой оболочки бронхиального дерева, за злокачественную трансформацию принимают участки с выраженным сиреневым свечением на фоне зеленого свечения нормальной окружающей слизистой оболочки.
2. «Способ диагностики рака легкого» (см. патент RU 2633693 С1, опубликован: 16.10.2017, Бюл. №29) Способ предназначен для малоинвазивной диагностики рака легкого путем выявления аберрантно-метилированных маркерных генов в составе внеклеточной ДНК (внДНК) плазмы крови.
Проводят метил-специфичную-ПЦР с использованием специально подобранных праймеров и зондов для контрольного гена FDPS и аберрантно-метилированных маркерных генов RARbeta2, RASSF1A и TCF21. Далее проводят сравнительный анализ результатов ПЦР с учетом полученного Сл для выявляемых генов. Если значение Ct≤35,1 для гена FDPS и Ct≤41 для генов RARbeta2 и/или RASSF1A и/или Ct≤42,5 для гена TCF 21, то делают заключение о наличии рака легкого у пациента.
3. «Способ дифференциальной диагностики злокачественных новообразований и соматических незлокачественных заболеваний» (см. патент RU 2232391 С2, опубликован: 10.07.2004, Бюл. №19).
Способ заключается в дифференциальной диагностике злокачественных новообразований легких, злокачественных новообразований желудка, злокачественных новообразований кроветворной системы, злокачественных новообразований толстого кишечника, злокачественных новообразований кожи, злокачественных новообразований мужской мочеполовой системы, злокачественных новообразований женской мочеполовой системы, злокачественных новообразований молочной железы, злокачественных новообразований поджелудочной железы и соматических незлокачественных заболеваний по данным инфракрасных спектров поглощения сыворотки крови.
4. «Аптамер, специфичный к опухолевым тканям легкого человека» (см. патент RU 2528870 С2, опубликовано: 20.09.2014, Бюл. №26) Способ направлен на выявление рака легкого с помощью аптамеров, и может быть использован в диагностике.
Аптамеры получают в результате селекции, включающей чередование раундов позитивной селекции аптамеров к измельченным опухолевым тканям легкого человека, забиравшимся после операции у онкологических больных, и негативной селекции к здоровым тканям легкого и цельной крови здоровых людей, с выявлением пула аптамеров с наибольшей аффинностью, его клонирования, секвенирования, проверки на специфичность связывания с опухолевыми клетками легкого.
Полученные аптамеры обладают высокой чувствительностью к продуктам распада опухоли и циркулирующим раковым клеткам в периферической крови больных раком легкого, что позволяет повысить эффективность диагностики рака легкого человека.
Однако, описанные выше способы принципиально отличаются от нашего, обладают меньшей чувствительностью или специфичностью, чем предлагаемый нами. При этом данные способы более сложны для клинической реализации, либо имеют меньшую точность из-за особенности интерпретации данных.
Анализ патентных источников (www.fips.ru) также показал отсутствие действующих патентов и заявок на «Малоинвазивный способ диагностики рака легкого на основании изменения копийности локуса мтДНК HV2».
Техническим результатом заявляемого изобретения является создание нового, простого в исполнении, не дорогостоящего и точного способа с уникальными высокоспецифичными последовательностями синтетических олигонуклеотидов (праймеров) для диагностики развития рака легкого.
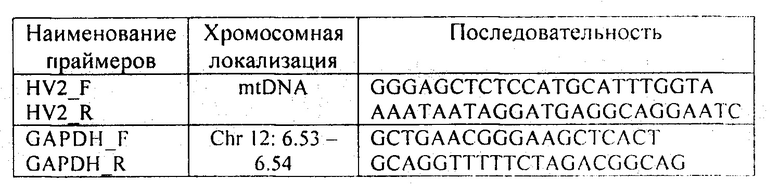
Технический результат достигается тем, что проводят определение копийности генетического локуса HV2 относительно референсного гена GAPDH методом ПЦР-РВ в присутствии красителя EVA-Green и высокспецифичных праймеров: для HV2 F - GGGAGCTCTCCATGCATTTGGTA, R - AAATAATAGGATGAGGCAGGAATC; для GAPDH F - GCTGAACGGGAAGCTCACT, R - GCAGGTTTTTCTAGACGGCAG на матрице выделенной внДНК, рассчитывают относительную копийности гена (rC) по формуле rC=2-ΔCt, где Ct - медиана сигналов флюоресценции, ΔCt=Ct(HV2) - Ct(GAPDH), и сравнивают полученные значения rC с прогностическим интервалом копийности, и при значениях rCHV2>16169±3423 диагностируют отсутствие злокачественных опухолей легкого, при значениях rCHV2<1756±496 у пациента диагностируют рак легкого, а при значениях rCHV2 между указанными интервалами считают полученный результат неопределенным.
Сущность способа заключается в том, что образцы крови (10 мл крови и 3 мл 10 мМ фосфатного буфера, рН 7,5, с 0,15 М NaCl и 50 мМ ЭДТА) разделяют на плазму и фракцию клеток центрифугированием в течение 20 минут при 400 g при 15°С. Из плазмы крови выделяют внДНК фенол-хлороформным методом и проводят амплификацию с высокоспецифичными праймерами для локуса HV2 и гена GAPDH, анализируют первичные данные и вычисляют относительную копийность (rC) по формуле 2-ΔCt где ΔCt=Ct(HV2) - Ct(GAPDH). Затем сравнивают полученные значения rC с прогностическими значениями копийности, и при значениях в интервале rCHV2>16169±3423 у пациента диагностируют отсутствие злокачественных новообразований легкого (чувствительность 96%, специфичность 95%), а при значениях в интервале rCHV2<1756±496 у пациента диагностируют рак легкого (чувствительность 96%, специфичность 92%). При значениях rCHV2 между указанными интервалами считают полученный результат неопределенным.
Заявленный анализ основан на определении количества копий мтДНК относительно референсного гена GAPDH во внДНК плазмы крови пациентов с риском развития рака легкого, и последующем сравнении полученных значений с интервалом копийности rCHV2 характерным для рака легкого или его отсутствия.
Заявленный способ включает следующие приемы:
- выделение внеклеточной ДНК из плазмы крови с помощью метода фенол-хлороформной экстракции;
- определение относительной копийности генетического локуса HV2 методом ПЦР-РВ в присутствии красителя EVA-Green и специфичных праймеров на матрице выделенной внДНК;
- анализ первичных данных с помощью программного продукта амплификатора;
- расчет относительной копийности гена (rC) на основании соотношения сигналов, продуцируемых амплификатами изучаемой и референсной последовательностей,
- сравнением rC пробы с прогностическими значениями копийности rCстандарт, определенными для больных раком легкого и условно здоровых доноров (без онкологических заболеваний).
Для осуществления способа были разработаны специфичные олигонуклеотидные прямые и обратные праймеры для локусов HV2 и GAPDH. Дизайн специфичных олигонуклеотидных праймеров (таблица 1) осуществлялся с использованием референсных последовательностей NCBI GenBank.

Заявленный способ осуществляется следующим образом:
На первом этапе образцы крови (10 мл крови и 3 мл 10 мМ фосфатного буфера, рН 7,5, с 0,15 М NaCl и 50 мМ ЭДТА) разделяют на плазму и фракцию клеток центрифугированием в течение 20 минут при 400 g при 15°С.
Из плазмы крови ДНК выделяют фенол-хлороформным методом в нашей модификации. К плазме крови добавляют равный объем лизирующего буфера (2% SDS и 1% меркаптоэтанол) и 20 мкл протеиназы К, инкубируют в термостате при 58°С 1 час.
К полученному лизату добавляют равный объем щелочного фенола и хлороформа (соотношение 1:1), центрифугируют 20 минут 3000 об/мин.
После разделения фаз отбирают водную фазу в отдельную стерильную пробирку. К водной фазе добавляют равный объем 96% изопропилового спирта и раствор 5 М NaCl до концентрации 100 mM, пробирку помещают в холодильник на -20°С на 60 минут.
Далее центрифугируют 15 минут при 12700 об/мин, при -10°С, декантируют супернатант, а осадок промывают 80% этиловым спиртом, центрифугированием удаляют остатки этанола, высушивают осадок в твердотельном термостате и растворяют в 10 мМ ТЕ буфере.
Концентрация полученных препаратов ДНК измеряется на флюориметре. Для проведения ПЦР-РВ концентрацию ДНК в каждом образце нормализуют до 0,5 нг/мкл.
Амплификацию проводят в 20 мкл ПЦР-смеси, содержащей 3 нг внДНК, 0,20 мМ dNTPs, 2,5 мМ MgCl2, 1х ПЦР-буфер, 1х краситель EvaGreen, и 0,1 е.а./мкл реакционной смеси ДНК-полимеразы Thermus aquaticus, и по 600 нМ прямого и обратного праймеров для референсного гена или гена-мишени.
Количественную ПЦР-РВ амплификацию проводят на термоциклере по следующей программе: t=95°C в течение 4 мин. 40 циклов: t=95°C в течение 10 с, t=58°C (чтение сигнала) в течение 30 с, t=72°C в течение 30 с.
Относительная копийность локуса HV2 вычисляется следующим образом: рассчитывается Сt для целевого локуса HV2 и референсного GAPDH, далее рассчитывается величина ΔCt=Ct(HV2) - Ct(GAPDH); копийность генетического локуса относительно референсного гена (rC) рассчитывается по формуле 2-ΔCt.
Сравниваются полученные значения rC с интервалом прогностического коэффициента копийности:
- при значениях rCHV2>16169±3423 диагностируют отсутствие злокачественных опухолей легкого (чувствительность 96%, специфичность 95%),
- при значениях rCHV2<1756±496 у пациента диагностируют рак легкого (чувствительность 96%, специфичность 92%),
- при значениях rCHV2 между указанными интервалами считают полученный результат неопределенным.
Предлагаемым способом было осуществлено обследование 50 пациентов, у которых был диагностирован рак легких, и 30 условно здоровых доноров (без онкологических заболеваний). Для доказательства прогностической ценности предлагаемого способа приводятся следующие примеры.
1. Группу из 30 условно-здоровых доноров в возрасте от 27 до 57 лет обследовали заявляемым способом на копийность локуса HV2 относительно GAPDH. Работа проводилась с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан» (указ Президента РФ от 24.12.1993 №2288) и с разрешения этического комитета ФГБУ «РНИОИ» Минздрава России. У всех условно-здоровых доноров-добровольцев взяли кровь при помощи вакутейнера с антикоагулянтом. Из полученной после центрифугирования плазмы выделили внДИК, и провели анализ заявленным способом.
Значения rCHV2 находились в интервале от 12746 до 19592 (у 29 доноров), что соответствует показателю rCHV2 характерному для отсутствия злокачественных опухолей легкого. У 1 донора (в возрасте 50 лет) полученный результат был неопределенным (промежуточный интервал) rCHV2=3917,19. Было проведено обследование всех доноров (первичный осмотр ЧДД: 16-18 в мин; одышки нет, грудная клетка пальпаторно: безболезненна, дыхание везикулярное, хрипы отсутствуют, СКТ ОГК без патологии).
2. Группу из 50 человек, первично обратившихся по поводу заболевания раком легкого, обследовали заявляемым способом на копийность локуса HV2 относительно GAPDH. Средний возраст исследуемых составил 60,1±7,3 лет, на момент выполнения исследования 48 пациентов имели верифицированный диагноз рак легкого на стадиях от T1N0M0 до T3N2M1, и 2 пациента диагноз рак легкого на стадиях T4N2M1 и T4N3M1. У всех больных взяли кровь (до хирургического вмешательства) при помощи вакутейнера и получили плазму при помощи центрифугирования, из полученной плазмы выделили внДНК (как описано в способе).
Значения rCHV2 находились в интервале от 1260 до 2252 (у 48 пациентов), что соответствует показателю rCHV2 характерному для рака легкого. У 1 из двух пациентов (T4N3M1) полученный результат был неопределенным (меньше прогностического минимума характерного для рака легкого) rCHV2=686,24, у 2 из двух пациентов (T4N2M1) полученный результат также был неопределенным (меньше прогностического минимума характерного для рака легкого) rCHV2=180,21.
Заявляемый способ, включает разработанные нами праймеры и является экономически оправданным для диагностики рака легкого, осуществляется в условиях стандартной лаборатории молекулярной биологии (ПЦР), без использования специального дорогостоящего оборудования; обладает высокой чувствительностью и специфичностью, осуществление анализа возможно с плазмой крови, занимает не более 5 часов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ дифференциальной диагностики плоскоклеточного рака языка и доброкачественного новообразования языка | 2024 |
|
RU2841122C1 |
| МАЛОИНВАЗИВНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ ОПУХОЛИ ПРЯМОЙ КИШКИ К ЛУЧЕВОЙ ТЕРАПИИ НА ОСНОВАНИИ ИЗМЕНЕНИЯ КОПИЙНОСТИ ГЕНОВ Н2АХ И RBBP8 | 2019 |
|
RU2740576C1 |
| Малоинвазивный способ диагностики серозной аденокарциномы яичников высокой степени злокачественности на основании показателя копийности генов SULT1E1, CYP1B1 и ESR1 | 2021 |
|
RU2750472C1 |
| Малоинвазивный способ диагностики метастатического поражения регионарных лимфатических узлов у больных раком шейки матки на основании показателя копийности генов CCND1 и PPARGC1A | 2021 |
|
RU2766774C1 |
| Малоинвазивный способ дифференциальной ранней диагностики гепатоцеллюлярной карциномы и жирового гепатоза | 2023 |
|
RU2822224C1 |
| МАЛОИНВАЗИВНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ ОПУХОЛЕЙ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ К ЛУЧЕВОЙ ТЕРАПИИ НА ОСНОВАНИИ ИЗМЕНЕНИЯ КОПИЙНОСТИ ГЕНОВ BRCA2 И RAD50 | 2019 |
|
RU2728428C1 |
| Способ прогнозирования развития метастазов у больных раком желудка | 2016 |
|
RU2624505C1 |
| Тест-система для прогнозирования развития метастазов у больных раком желудка на основании определения числа копий HV2 мтДНК | 2017 |
|
RU2683571C1 |
| Способ прогнозирования развития метастазов в регионарные лимфоузлы у пациентов с аденокарциномой желудка | 2017 |
|
RU2661600C1 |
| Способ дифференциальной диагностики рака желудка различных гистологических типов | 2015 |
|
RU2613139C1 |
Изобретение относится к биотехнологии. Определение копийности генетического локуса HV2 относительно референсного гена GAPDH проводят методом ПЦР-РВ в присутствии красителя EVA-Green. Используют высокоспецифичные праймеры: для HV2 F - GGGAGCTCTCCATGCATTTGGTA, R - AAATAATAGGATGAGGCAGGAATC; для GAPDH F - GCTGAACGGGAAGCTCACT, R - GCAGGTTTTTCTAGACGGCAG на матрице выделенной внДНК. Рассчитывают относительную копийность гена (rC) по формуле rC=-2-ΔCt, где Ct - медиана сигналов флюоресценции, ΔCt=Ct(HV2) - Ct(GAPDH), и сравнивают полученные значения rC с прогностическим интервалом копийности. При значениях rCHV2>16169±3423 диагностируют отсутствие злокачественных опухолей легкого, при значениях rCHV2<1756±496 у пациента диагностируют рак легкого, а при значениях rCHV2 между указанными интервалами считают полученный результат неопределенным. Способ обладает высокой чувствительностью и специфичностью, его использование осуществляется с плазмой крови; регистрацию результатов производят однократно в конце исследования, занимающего не более 5 часов. Способ позволяет сделать процедуру первичной диагностики рака легкого более простой, точной и комфортной для пациента, а также повысить уровень раннего обнаружения заболевания. 1 табл., 2 пр.
Малоинвазивный способ диагностики рака легкого на основании изменения копийности локуса мтДНК HV2, включающий выделение внеклеточной ДНК из плазмы крови, отличающийся тем, что проводят определение копийности генетического локуса HV2 относительно референсного гена GAPDH методом ПЦР-РВ в присутствии красителя EVA-Green и высокоспецифичных праймеров: для HV2 F - GGGA GCTCTCCATGCATTTGGTA, R - AAATAATAGGATGAGGCAGGAATC; для GAPDH F - GCTGAACGGGAAGCTCACT, R - GCAGGTTTTTCTAGA CGGCAG на матрице выделенной внДНК, рассчитывают относительную копийность гена (rC) по формуле rC=2-ΔCt, где Ct - медиана сигналов флюоресценции, ΔCt=Ct(HV2)-Ct(GAPDH), и сравнивают полученные значения rC с прогностическим интервалом копийности, и при значениях rCHV2>16169±3423 диагностируют отсутствие злокачественных опухолей легкого, при значениях rCHV2<1756±496 у пациента диагностируют рак легкого, а при значениях rCHV2 между указанными интервалами считают полученный результат неопределенным.
| Кутилин Д.С., Енин Я.С., Петрусенко Н.А., Водолажский Д.И., ИЗМЕНЕНИЕ КОПИЙНОСТИ ГЕНЕТИЧЕСКИХ ЛОКУСОВ ПРИ МАЛИГНИЗАЦИИ ТКАНЕЙ ЛЕГКОГО, Современные проблемы науки и образования, 2016 г., номер 6, стр | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| William C | |||
| Copeland, Mitochondrial DNA Alterations in Cancer, Cancer Investigation, 2002, Vol | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Weizhu Zhu, Mitochondrial DNA mutations in breast cancer tissue and in matched nipple aspirate fluid, Carcinogenesis, Volume 26, Issue 1, 1.01.2005, Pages 145-152. | |||
Авторы
Даты
2019-01-24—Публикация
2018-02-26—Подача