Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям и комопозиции для ингибирования никотинамидфосфорибозилтрансферазы ("NAMPT"), их синтезу, применениям и антидоту.
Предпосылки создания изобретения
Никотинамидадениндинуклеотид (NAD) играет фундаментальную роль как в клеточном энергетическом метаболизме, так и в клеточной сигнальной активности. В энергетическом метаболизме химия пиридинового кольца позволяет NAD легко принимать и отдавать электроны в реакциях гидридного переноса, катализируемых различными дегидрогеназами.
Получение класса соединений, включающего несколько подклассов, которые действуют в качестве ингибиторов образования никотинамидаденилнуклеотида, и их применение в качестве противоопухолевых средств уже было описано в патентных заявках WO 00/50399, WO 97/48695, WO 97/48696, WO 97/48397, WO 99/31063, WO 99/31060, WO 99/31087, WO 99/31064, WO 00/50399 и WO 03/80054.
Один из этих ингибиторов, (E)-N-[4-(1-бензоилпиперидин-4-ил)бутил]-3-(пиридин-3-ил)акриламид, также известный как APO866, FK866, WK175 или WK22.175 и указанный далее в настоящем описании как FK866 [международное непатентованное название], в основном описан в литературе в качестве противоракового средства. FK866 можно использовать для лечения заболеваний, включающих нарушенную регуляцию апоптоза, таких как рак. В предшествующем уровне техники было продемонстрировано, что FK866 препятствует биосинтезу никотинамидаденилдинуклеотида (также известного и указанного далее в настоящем описании как NAD) и индуцирует апоптическую клеточную гибель без каких-либо эффектов повреждения ДНК.
Кроме того, FK866 ((E)-N-[4-(1-бензоилпиперидин-4-ил)бутил]-3-(пиридин-3-ил)акриламид) индуцирует апоптоз в HepG2 клетках, не имея при этом первичных воздействий на клеточный энергетический метаболизм. (Hasmann M, Schemainda I. FK866, a Highly Specific Noncompetitive Inhibitor of Nicotinamide Phosphoribosyltransferase, Represents a Novel Mechanism for Induction of Tumor Cell Apoptosis. Cancer Res 2003; 63:7436-7442. [PubMed: 14612543]). Вместо немедленного эффекта цитотоксичности, он ингибирует NAMPT и истощает содержание NAD в клетках, и это дает основание предположить, что FK866 может быть перспективным средством против раковых клеток, которые зависят от никотинамида для синтеза NAD. Кристаллическая структура NAMPT-FK866 комплекса показывает, что соединение связывается на никотинамид-связывающем сайте NAMPT для ингибирования его активности. FK866 был испытан на мышиной модели ренальноклеточной карциномы и проявил противоопухолевую активность, антиметастатическую и анти-ангиогенную активности (Drevs J, et al. Antiangiogenic potency of FK866/K22.175, a new inhibitor of intractllular NAD biosynthesis, in murine renal cell carcinoma. Anticancer Res 2003; 23:4853-4858. [PubMed: 14981935]).
На мышиной модели карциномы молочной железы FK866 также индуцирует задержку роста опухоли и усиление чувствительности опухоли к облучению, сопровождаемому дозо-зависимым снижением уровней NAD, pH и энергетического статуса. Хемосенсибилизирующий эффект FK866 также наблюдали на примере клеточной гибели, индуцированной противоопухолевым 1-метил-3-нитро-1-нитрозогуанидинием (MNNG), в THP-1 и K562 лейкозных клеточных линиях (Pogrebniak A, et al. Chemopotentiating effects of a novel NAD biosyntjesis inhibitor, FK866, in combination with antineoplastic agents. Eur J Med Res 2006; 11:313-321. [PubMed: 17052966]).
Эффективность GMX1777 оценивали на моделях ксенотрансплантата, и фармакокинетический профиль GMX1778 и его эффект на клеточные уровни никотинамидадениндинуклеотида измеряли методом жидкостной хроматографии/масс-спектрометрии. (Beauparlant P., et al. Preclinical development of nicotinamide phosphoribosyl transferase inhibitor prodrug GMX1777. Anticancer Drugs. 2009 Jun; 20(5):346-54).
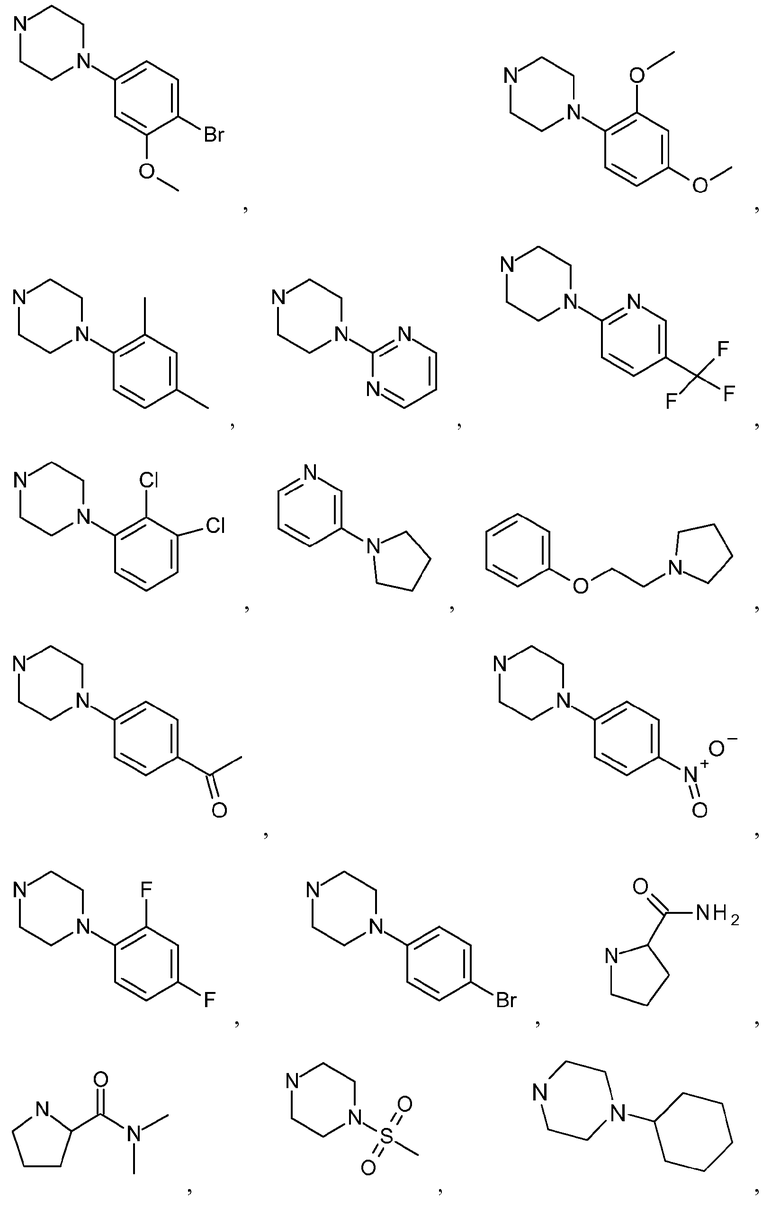
GMX1777 представляет собой водорастворимое вводимое внутривенно пролекарство GMX1778, которое предоставлено по лицензии Gemin X от LEO Pharma (номера LEO: EB1627 и CHS828, соответственно). Эти соединения и другие замещенные гуаногуанидины имеют структуру, показанную в таблице 1.
Таблица 1
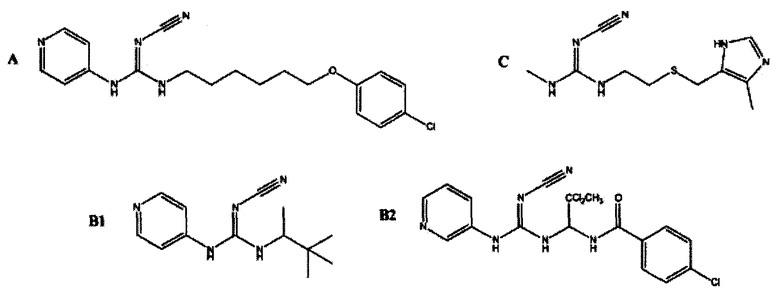
Замещенные гуаногуанидины с определенными фармакологическими эффектами:
A цитотоксичный CHS 828;
B Агенты открытия калиевых каналов пинацидил (B1) и 12 г соединения, описанного в Perez-Medrano et al (B2); и
c Антагонист гистаминового-II рецептора циметидин (от Lovborg et al. BMC Research Notes 2009 2:114 doi:10,1186/1756-0500-2-114)
Позднее CHS-828 был идентифицирован как ингибитор NAMPT (Olesen U.H, et al. Anticancer agent CHS-828 inhibits cellular synthesis of NAD. Biochem Biophys Res Commun 2008; 367:799-804. [PubMed: 18201551]). Было показано, что CHS-828 сильно ингибирует клеточный рост во многих различных опухолевых клеточных линиях, хотя подробный механизм этого ингибирующего эффекта CHS-828 остается неустановленным (Ravaud A, et al. Phase I study and guanidine kinetics of CHS-828, a guanidine-containing compound, administered orally as a single dose every 3 weeks in solid tumors: an ECSG/EORTC study. Eur J Cancer 2005; 41:702-707. [PubMed: 15763645]). Как FK866, так и CHS-828 в настоящее время проходят клинические испытания при лечении рака.
Существуют различные применения для лекарственных средств, которые ингибируют NAMPT.
Недостаток экспрессии NAMPT сильно влияет на развитие как T, так и B лимфоцитов. Используя мутантные формы этого белка, а также хорошо охарактеризованный фармакологический ингибитор (FK866), авторы настоящего изобретения продемонстрировали, что для способности NAMPT регулировать жизнеспособность клеток при генотоксическом стрессе требуется его ферментативная активность. Все вместе, эти данные демонстрируют, что NAMPT участвует в клеточной резистентности к генотоксическому/окислительному стрессу и он может сообщать клеткам иммунной системы способность к выживанию в стрессовых ситуациях, таких как воспаление. (Rongvaux, A., et al. The Journal of Immunology, 2008, 181:4685-4695).
NAMPT также имеет воздействие на эндотелий (EC) в связи с высокими уровнями глюкозы, окислительный стресс и на старение. Также считают, что NAMPT может обеспечить резистентность пролиферирующих человеческих EC к окислительному стрессу, связанному со старением и высокими уровнями глюкозы, и продуктивное использование избытка глюкозы для поддержки репликативной долговечности и ангиогенной активности.
Краткое описание изобретения
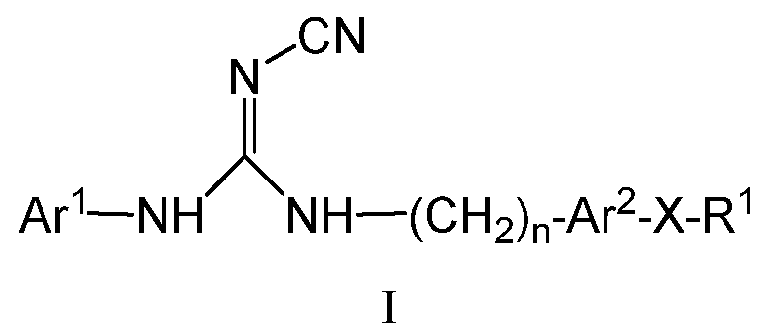
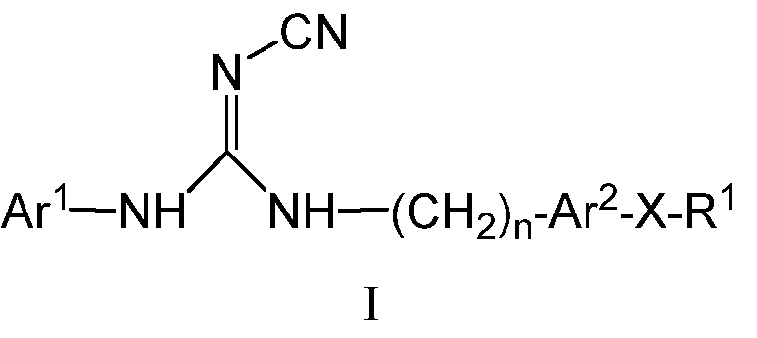
Одним из аспектов данного изобретения является обеспечение соединений, композиций, наборов и антидотов для метаболического пути NAMPT у млекопитающих, содержащих соединение формулы I:
где
Ar1 представляет собой арил, гетероарил, арилалкил или гетероарилалкил, где число гетероатомов каждого из указанного гетероарила и гетероарила независимо составляет 1, 2 или 3, и они независимо выбраны из N, S или O, кроме того, где каждый из указанного арила, гетероарила, арилалкила и гетероарилалкила необязательно может быть либо замещенным, либо конденсированным с арилом или гетероарилом, более того, где любой из указанного арила, гетероарила, арилалкила и гетероарилалкила является либо незамещенным, либо необязательно независимо замещен одним или более заместителями, которые могут быть одинаковыми или различными и независимо выбраны из группы, состоящей из дейтерия, галогена, циано, амино, аминоалкила-, (амино)алкокси-, -CONH2, -C(О)NH(алкила), -C(О)N(алкил)2, -C(О)NH(арила), -C(О)N(арил)2, -CHZF3-Z, -OCHzF3-z, алкила, алкенила, алкинила, алкокси-, -арилокси-, (алкоксиалкил)окси-, (алкоксиалкил)амино-, -циклоалкила, -гетероциклоалкила, -арила, -C(О)-алкила, -C(О)-арила, -S(О)-арила, -NH-C(О)-алкила, -NH-C(О)-арила и гетероарила, при условии, что два смежных гетероатома в кольце не могут оба представлять собой S или оба представлять собой O;
n равен 0, 1, 2, 3 или 4;
Ar2 представляет собой арил или гетероарил, каждый из указанного арила и гетероарила является либо незамещенным, либо необязательно независимо замещен 1, 2, 3 или 4 заместителями, которые могут быть одинаковыми или различными и независимо выбраны из группы, состоящей из дейтерия, галогена, циано, амино, аминоалкила-, (амино)алкокси-, -CONH2, -C(О)NH(алкила), -C(О)N(алкил)2, -C(О)NH(арила), -C(О)N(арил)2, -CHZF3-Z, -OCHzF3-z, алкила, алкенила, алкинила, алкокси-, -арилокси-, (алкоксиалкил)окси-, (алкоксиалкил)амино-, -циклоалкила, -гетероциклоалкила, -арила, -C(О)-алкила, -C(О)-арила, -S(О)-арила, -NH-C(О)-алкила, -NH-C(О)-арила и гетероарила, при условии, что два смежных гетероатома в кольце не могут оба представлять собой S или оба представлять собой O;
Х представляет собой S, S(O), S(О)2, O или C(O);
R1 представляет собой циклоалкил, -CHZF3-Z, арил, гетероциклоалкил, гетероарил, алкил, алкенил, алкинил, (арил)алкил-, (гетероарил)алкил- или (гетероциклоалкил)алкил-, (i) где каждый из указанного циклоалкила, арила, гетероциклоалкила, гетероарила и алкила является либо незамещенным, либо необязательно независимо замещен 1, 2, 3, 4 или 5 заместителями, которые могут быть одинаковыми или различными и независимо выбраны из группы, состоящей из дейтерия, галогена циано, амино, аминоалкила-, (амино)алкокси-, -CONH2, -C(О)NH(алкила), -C(О)N(алкил)2, -C(О)NH(арила), -C(О)N(арил)2, -CHZF3-Z, OCHzF3-z, алкила, алкенила, алкинила, алкокси-, арилокси-, (алкоксиалкил)амино-, -циклоалкила, -гетероциклоалкила, -арила, -S(О)2-алкила, -S(О)2-арила, -S(О)2-CF3, -C(О)N(алкил)2, -C(О)алкила, -NH-C(О)-алкила, -NH-C(О)-арила, метилендиокси, гетероарила, арилалкила-, (гетероарил)алкила- и (гетероциклоалкил)алкила-, (ii) кроме того, где каждый из указанного циклоалкила, арила, гетероциклоалкила и гетероарила дополнительно может быть конденсирован с независимо выбранным арилом, гетероарилом, гетероциклоалкилом или циклоалкилом; и z равен 0, 1 или 2;
и его фармацевтически приемлемые соли, сольваты, сложные эфиры, пролекарства или изомеры.
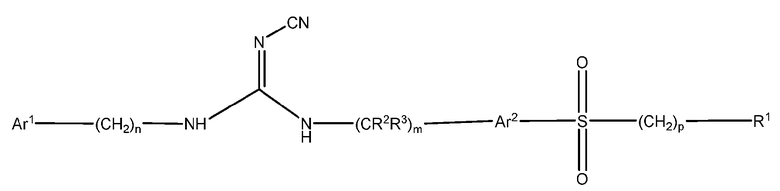
Другой аспект настоящего изобретения включает соединения формулы I, где X означает SO2, и формула соответствует формуле II:
II
где
Ar1 представляет собой арил или гетероарил, где указанный арил или гетероарил является незамещенным или замещен одним или более заместителями, независимо выбранными из группы, состоящей из:
дейтерия, галогена, циано, алкила, гидроксиалкила, цианоалкила, галогеналкила, алкенила, алкинила, алкокси, галогеналкокси, арилокси, -NRaRb, -C(О)N(RaRb), -C(О)-алкила, -C(О)-арила, -S(О)-арила, -NH-C(О)-алкила, -NH-C(О)-арила, -(алкоксиалкил)окси-, циклоалкила, гетероциклоалкила, арила и гетероарила;
Ar2 представляет собой незамещенный арил или гетероарил;
R1 представляет собой циклоалкил, арил, гетероциклоалкил или гетероарил,
(i) где каждый из указанного циклоалкила, арила, гетероциклоалкила и гетероарила является либо незамещенным, либо необязательно независимо замещен 1, 2, 3, 4 или 5 заместителями, которые могут быть одинаковыми или различными и независимо выбраны из группы, состоящей из:
дейтерия, галогена, циано, алкила, цианоалкила, галогеналкила, алкенила, алкинила, алкокси, алкилалкокси, галогеналкокси, арилокси, -NRaRb, -CONRaRb, -S(О)2-алкила, -S(О)2-арила, -S(О)2N(алкил)2, -S(О)2-CF3, -C(О)алкила, -NH-C(О)алкила, -NH-C(О)арила, метилендиокси, -(CH2)qциклоалкила, -(CH2)qарила, -(CH2)qгетероарила и -(CH2)qгетероциклоалкила,
(ii) где каждый из указанного циклоалкила, арила, гетероциклоалкила и гетероарила дополнительно может быть незамещенным или замещен одним или более заместителями, такими как галоген, циано, алкил или алкокси, или может быть конденсирован с независимо выбранным арилом, гетероарилом, гетероциклоалкилом или циклоалкилом;
Ra и Rb независимо представляют собой H, алкил, алкокси, арил, алкоксиалкил, -S(О)2алкил и циклоалкил, или Ra и Rb могут образовывать 5 или 6-членную гетероциклоалкильную группу вместе с атомом азота, к которому они присоединены, где указанная гетероциклоалкильная группа может содержать один или более дополнительных гетероатомов, выбранных из N, S или O;
R2 и R3 представляют собой H или дейтерий;
m, n, p и q независимо равны 0, 1 или 2.
Другой аспект настоящего изобретения включает обеспечение способов лечения заболевания путем ингибирования NAMPT у нуждающегося в этом субъекта (например, человека) путем введения субъекту эффективного количества соединения или фармацевтической композиции по настоящему изобретению.
Еще один аспект настоящего изобретения включает обеспечение способа лечения, профилактики, ингибирования или устранения заболевания или состояния у пациента путем ингибирования NAMPT у указанного пациента путем введения терапевтически эффективного количества, по меньшей мере, одного соединения, раскрытого в настоящем изобретении, где указанное заболевание или состояние выбрано из группы, состоящей из рака, рака яичника, рака молочной железы, рака матки, рака толстой кишки, цервикального рака, рака легкого, рака предстательной железы, рака кожи, рака мочевого пузыря, рака поджелудочной железы, лейкоза, лимфомы, болезни Ходжкина, вирусных инфекций, вируса иммунодефицита человека, вируса гепатита, вируса герпеса, простого герпеса, воспалительных расстройств, синдрома раздраженной толстой кишки, воспалительного заболевания кишечника, ревматоидного артрита, астмы, хронического обструктивного заболевания легких, остеоартрита, остеопороза, дерматита, атопического дерматита, псориаза, системной красной волчанки, рассеянного склероза, псориатического артрита, анкилозирующего спондилита, болезни «трансплантат против хозяина», болезни Альцгеймера, сердечно-сосудистого осложнения, атеросклероза, диабета, гломерулонефрита, метаболического синдрома, немелкоклеточного рака легкого, мелкоклеточного рака легкого, множественной миеломы, лейкоза, лимфом, сквамозноклеточных типов рака, рака почки, рака уретры и мочевого пузыря, рака головы и шеи, раковых заболеваний головного мозга и центральной нервной системы.
Другой предпочтительный вариант осуществления включает фармацевтическую композицию, содержащую фармацевтически приемлемое количество соединения по настоящему изобретению, которое обеспечивает, при введении человеку, снижение опухолевой нагрузки и/или метастазов. Фармацевтическую композицию можно вводить перорально или другим подходящим путем.
Еще один вариант осуществления включает способ лечения рака яичника у субъекта (например, человека), нуждающегося в этом, путем введения субъекту эффективного количества соединения или фармацевтической композиции по настоящему изобретению.
Еще один вариант осуществления включает способ лечения рака толстой кишки у субъекта (например, человека), нуждающегося в этом, путем введения субъекту эффективного количества соединения или фармацевтической композиции по настоящему изобретению.
Еще один вариант осуществления включает способ лечения рака молочной железы у субъекта (например, человека), нуждающегося в этом, путем введения субъекту эффективного количества соединения или фармацевтической композиции по настоящему изобретению.
Еще один вариант осуществления включает способ лечения лейкоза у субъекта (например, человека), нуждающегося в этом, путем введения субъекту эффективного количества соединения или фармацевтической композиции по настоящему изобретению.
Еще один вариант осуществления включает способ лечения рака толстой кишки, до или после хирургической резекции и/или лучевой терапии, у субъекта (например, человека), нуждающегося в этом, путем введения субъекту эффективного количества соединения или фармацевтической композиции по настоящему изобретению.
Еще один вариант осуществления включает способ лечения рака, до или после хирургической резекции и/или лучевой терапии, у субъекта (например, человека), нуждающегося в этом, путем введения субъекту эффективного количества соединения или фармацевтической композиции по настоящему изобретению, включая дополнительные лечебные мероприятия для лечения тошноты, с или без дексаметазона.
Еще один вариант осуществления включает способ лечения рака, до или после хирургической резекции и или лучевой терапии, у субъекта (например, человека), нуждающегося в этом, путем введения субъекту эффективного количества соединения или фармацевтической композиции по настоящему изобретению, включая дополнительные лечебные мероприятия с использованием одного или более дополнительных терапевтических средств, или их фармацевтически приемлемых солей. Неограничивающие примеры таких дополнительных терапевтических средств включают цитотоксические средства (такие как, например, но, не ограничиваясь ими, ДНК-взаимодействующие средства (такие как цисплатин или доксорубицин)); таксаны (например, таксотере, таксол); ингибиторы топоизомеразы II (такие как этопозид); ингибиторы топоизомеразы I (такие как иринотекан (или CPT-11), камптостар или топотекан); тубулин-взаимодействующие средства (такие как паклитаксел, доцетаксел или эпотилоны); гормональные средства (такие как тамоксифен); ингибиторы тимидилатсинтазы (такие как 5-фторурацил или 5-FU); антиметаболиты (такие как метокстрексат); алкилирующие средства (такие как темозоломид, циклофосфамид); ингибиторы фарнезилпротеинтрансферазы (такие как, SARASAR™. (4-[2-[4-[(11R)-3,10-дибром-8-хлор-6,11-дигидро-5H-бензо[5,6]циклогепта[1,2-b]пиридин-11-ил]-1-пиперидинил]-2-оксоэтил]-1-пиперидинкарбоксамид или SCH 66336), типифарниб (Zarnestra® или R115777 от Janssen Pharmaceuticals), L778,123 (ингибитор фарнезилпротеинтрансферазы от Merck & Company, Whitehouse Station, N.J.), BMS 214662 (ингибитор фарнезилпротеинтрансферазы от Bristol-Myers Squibb Pharmaceuticals, Princeton, N.J.); ингибиторы сигнальной трансдукции (такие как, Iressa® (от Astra Zeneca Pharmaceuticals, England), Tarceva® (ингибиторы EGFR киназы), антитела к EGFR (например, C225), GLEEVEC® (ингибитор C-abl киназы от Novartis Pharmaceuticals, East Hanover, N.J.); интерфероны, такие как, например, интрон® (от Merck & Company), ПЭГ-интрон® (от Merck & Company); комбинации гормональной терапии; комбинации ароматазы; ara-C, адриамицин, цитоксан и гемцитабин.
Другие противораковые (также известные как противоопухолевые) средства включают, но не ограничиваются ими, урацил иприт, хлорметин, ифосфамид, мелфалан, хлорамбуцил, пипоброман, триэтиленмеламин, триэтилентиофосфорамин, бусульфан, кармустин, ломустин, стрептозоцин, дакарбазин, флоксуридин, цитарабин, 6-меркаптопурин, 6-тиогуанин, флударабин фосфат, оксалиплатин, лейковирин, оксалиплатин (ELOXATIN® от Sanofi-Synthelabo Pharmaceuticals, France), пентостатин, винбластин, винкристин, виндезин, блеомицин, дактиномицин, даунорубицин, доксорубицин, эпирубицин, идарубицин, митрамицин, дезоксикоформицин, митомицин-C, L-аспарагиназу, тенипозид 17α-этинилэстрадиол, диэтилстилбестрол, тестостерон, преднизон, флуоксиместерон, дромостанолон пропионат, тестолактон, мегестролацетат, метилпреднизолон, метилтестостерон, преднизолон, триамцинолон, хлортрианисен, гидроксипрогестерон, аминоглутетимид, эстрамустин, медроксипрогестеронацетат, лейпролид, флутамид, торемифен, госерелин, цисплатин, карбоплатин, гидроксимочевина, амсакрин, прокарбазин, митотан, митоксантрон, левамизол, навелбен, анастразол, летразол, капецитабин, релоксафин, дролоксафин, гексаметилмеламин, авастин, герцептин, бексар, велкаде®, зевалин, трисенокс, кселода, винорелбин, порфимер, эрбитукс, липосомал, тиотепа, алтретамин, мелфалан, трастузумаб, лерозол, фулвестрант, эксеместан, ифосфомид, ритуксимаб, C225 и кампат, 5-фторурацил и лейковорин, с или без ингибитора 5-HT3 рецептора (например, долансетрона, гранисетрона, ондасетрона), с или без дексаметазона.
При формулировании в виде фиксированной дозы в таких комбинированных продуктах используют соединения по настоящему изобретению с дозами в пределах, описанных в настоящем описании (или известных специалистам в данной области), и другие фармацевтически активные средства или лечения в пределах определенных для них доз. Например, было обнаружено, что ингибитор CDC2 оломуцин действует синергически с известными цитотоксическими средствами в индукции апоптоза (J. Cell Sci., (1995) 108, 2897). Соединения по настоящему изобретению также можно вводить последовательно с известными противораковыми или цитотоксическими средствами, когда комбинированная композиция является неподходящей. В любом комбинированном лечении настоящее изобретение не ограничивается последовательностью введения; соединения формулы (I) можно вводить либо до, либо после введения известного противоракового или цитотоксического средства. Например, на цитотоксическую активность ингибитора циклин-зависимой киназы флавопиридола влияет последовательность введения при его использовании с противораковыми средствами. Cancer Research, (1997) 57, 3375. Такие способы известны специалистам в данной области, а также лечащим врачам.
Любой из указанных выше способов можно дополнить введением жидкостей (таких как вода), сильных диуретиков, ингибирующих резорбцию воды и натрия из петли Генле, одного или нескольких химиотерапевтических или противоопухолевых средств, таких как лейковорин и фторурацил, и дополнительного химиотерапевтического средства (такого как филграстим и эритропоэтин), или любой комбинации вышеперечисленных средств.
Еще один вариант осуществления включает способ введения соединения по настоящему изобретению субъекту (например, человеку), нуждающегося в этом, путем введения субъекту фармацевтической композиции по настоящему изобретению.
Еще один вариант осуществления включает способ получения фармацевтической композиции по настоящему изобретению путем смешивания, по меньшей мере, одного фармацевтически приемлемого соединения по настоящему изобретению и необязательно одной или нескольких фармацевтически приемлемых добавок или эксципиентов.
Для получения фармацевтических композиций из соединений, описанных в настоящем изобретении, инертные фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Твердые формы препаратов включают порошки, таблетки, диспергируемые гранулы, капсулы, саше и суппозитории. Порошки и таблетки могут включать от около 5 до около 95 процентов активного ингредиента. Подходящие твердые носители известны в данной области, например, карбонат магния, стеарат магния, тальк, сахар или лактоза. Таблетки, порошки, саше и капсулы можно использовать в виде твердых дозированных форм, подходящих для перорального введения. Примеры фармацевтически приемлемых носителей и способов получения различных композиций можно найти в A. Gennaro (ed.), Remington's Pharmaceutical Sciences, 18th Edition, (1990), Mack Publishing Co., Easton, Pa.
Жидкие формы препаратов включают растворы, суспензии и эмульсии. В качестве примера можно указать воду или пропиленгликолевые водные растворы для парентеральной инъекции или добавление подсластителей и веществ, делающих композицию непрозрачной, для пероральных растворов, суспензий и эмульсий. Жидкие формы препаратов также могут включать растворы для интраназального введения.
Аэрозольные препараты, подходящие для ингаляции, могут включать растворы и твердые вещества в порошкообразной форме, которые могут быть в комбинации с фармацевтически приемлемым носителем, таким как инертный находящийся под давлением газ, например, азот.
Также включены твердые формы препаратов, которые предназначены для преобразования, непосредственно перед применением, в жидкие препараты либо для перорального, либо парентерального введения. Такие жидкие формы включают растворы, суспензии и эмульсии.
Соединения по настоящему изобретению также могут быть в форме препаратов для чрескожной доставки. Чрескожные композиции могут быть в форме кремов, лосьонов, аэрозолей и/или эмульсий и могут быть включены в чрескожный пластырь матричного или резервуарного типа, традиционно используемый в данной области для этих целей.
Соединения по настоящему изобретению также можно вводить подкожно.
Предпочтительно, соединение вводят перорально или внутривенно.
Предпочтительно, фармацевтический препарат представляет собой единичную дозированную форму. В такой форме препарат разделен на единичные дозы подходящего размера, содержащие подходящие количества активного компонента, например, количество, эффективное для достижения желаемой цели.
Количество активного соединения в единичной дозе препарата может варьировать или может регулироваться от около 1 мг до около 1000 мг, предпочтительно, от около 1 мг до около 500 мг, более предпочтительно, от около 1 мг до около 250 мг, еще более предпочтительно, от около 1 мг до около 25 мг, в соответствии с конкретным применением.
Реально используемая доза может варьировать в зависимости от требований пациента и тяжести состояния, подлежащего лечению. Определение подходящей схемы введения для конкретной ситуации находится в пределах компетентности специалиста в данной области. Для удобства, общую суточную дозу можно разделить и вводить частями в течение суток, как это необходимо.
Количество и частоту введения соединений по настоящему изобретению и/или их фармацевтически приемлемых солей можно регулировать в соответствии с мнением лечащего врача, принимая во внимание такие факторы, как возраст, состояние и размер пациента, а также тяжесть симптомов, подлежащих лечению. Обычная рекомендуемая суточная доза для перорального введения может находиться в пределах от около 1 мг/день до около 500 мг/день, предпочтительно, от 1 мг/день до 200 мг/день, в виде двух-четырех разделенных доз.
Другой аспект настоящего изобретения включает фармацевтическую композицию, содержащую соединение согласно настоящему изобретению и спасающее клетки средство, которое может быть выбрано из группы, состоящей из никотинамида, никотиновой кислоты и никотинамидмононуклеотида (NMN).
Определения
Если определение отсутствует, действует общеизвестное определение, известное специалистам в данной области.
"Пациент" включает как человека, так и животных.
"Млекопитающее" означает человека и других млекопитающих животных.
Термин “ингибитор” относится к молекуле, такой как соединение, лекарственное средство, активатор фермента или гормон, которая блокирует или иным образом вмешивается в конкретную биологическую активность.
Термины “эффективное количество” или “терапевтически эффективное количество” относятся к количеству средства, достаточному для обеспечения желаемого биологического результата. Такой результат может представлять собой уменьшение и/или облегчение признаков, симптомов или причин заболевания или любое другое желаемое изменение биологической системы. Например, “эффективное количество” для терапевтического применения представляет собой количество композиции, содержащей соединение, раскрытое в настоящем описании, необходимое для обеспечения клинически значимого уменьшения тяжести заболевания. Подходящее “эффективное” количество в любом индивидуальном случае сможет определить специалист в данной области с использованием рутинного экспериментирования. Таким образом, выражение “эффективное количество”, как правило, относится к количеству, при котором активное вещество имеет терапевтический эффект. В данном случае, активное вещество представляет собой ингибитор образования никотинамидфосфорибозилтрансферазы (NAMPT).
Как используется в настоящем описании, термины “лечить” или “лечение” являются синонимами термину “препятствовать” и указывают отсрочку развития заболеваний, профилактику развития заболеваний и/или уменьшение тяжести таких симптомов, которые будут развиваться или развитие которых ожидается. Таким образом, эти термины включают ослабление существующих симптомов заболевания, профилактику дополнительных симптомов, уменьшение или профилактику лежащих в основе метаболических причин симптомов, ингибирование расстройства или заболевания, например, остановку развития расстройства или заболевания, облегчение расстройства или заболевания, индукцию регрессии расстройства или заболевания, облегчение состояния, вызванного заболеванием или расстройством, или остановку развития симптомов заболевания или расстройства.
Под “фармацевтически приемлемым” или “фармакологически приемлемым” подразумевается вещество, которое не является биологически или иным образом существенно нежелательным, т.е. такое вещество можно вводить субъекту, не вызывая при этом каких-либо существенных нежелательных биологических эффектов или нежелательного взаимодействия с какими-либо другими компонентами композиции, в которой оно содержится. Примеры солей включают, но не ограничиваются ими, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат "мезилат", этансульфонат, бензолсульфонат, паратолуолсульфонат и памоат (то есть 1,1'-метилен-бис(2-гидрокси-3-нафтоат)). Фармацевтически приемлемые соли могут содержать включение другой молекулы, такой как ацетатный ион, сукцинатный ион или другой противоион. Противоион может быть любой органической или неорганической группой, которая стабилизирует заряд на исходном соединении. Кроме того, фармацевтически приемлемая соль может иметь более чем один заряженный атом в своей структуре. Случаи, когда несколько заряженных атомов являются частью фармацевтически приемлемой соли, могут включать несколько противоионов. Таким образом, фармацевтически приемлемая соль может иметь один или несколько заряженных атомов и/или один или несколько противоионов.
“Вещества-носители” или вещества, также указываемые как “эксципиенты”, включают любые традиционно используемые в фармацевтике эксципиенты, и их следует выбирать с учетом свойств совместимости и профиля высвобождения желаемой дозированной формы. Примеры веществ-носителей включают, например, связующие, суспендирующие вещества, дезинтегранты, наполнители, поверхностно-активные вещества, солюбилизаторы, стабилизаторы, лубриканты, смачивающие вещества, разбавители и подобные. “Фармацевтически совместимые вещества-носители” могут включать, например, аравийскую камедь, желатин, коллоидный диоксид кремния, глицерофосфат кальция, лактат кальция, мальтодекстрин, глицерин, силикат магния, казеинат натрия, соевый лецитин, хлорид натрия, трикальцийфосфат, дикалийфосфат, стеароиллактилат натрия, карраген, моноглицерид, диглицерид, предварительно желатинизированный крахмал и подобные. См., например, Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa. 1975.
Как используется в настоящем описании, термин “субъект” охватывает млекопитающих и не являющихся млекопитающими животных. Примеры млекопитающих включают, но не ограничиваются ими, всех членов класса млекопитающих: человека, отличных от человека приматов, таких как шимпанзе и другие человекообразные обезьяны и виды обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы, свиньи; домашних животных, таких как кролики, собаки и кошки; лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки, и т.п. Примеры не являющихся млекопитающими животных включают, но не ограничиваются ими, птиц, рыб и т.п. В одном варианте осуществления настоящего изобретения, млекопитающим является человек.
Как используется в настоящем описании, "алкил" означает прямую цепь или разветвленную насыщенную цепь, содержащую от 1 до 10 атомов углерода. Репрезентативные насыщенные алкильные группы включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, 2-метил-1-пропил, 2-метил-2-пропил, 2-метил-1-бутил, 3-метил-1-бутил, 2-метил-3-бутил, 2,2-диметил-1-пропил, 2-метил-1-пентил, 3-метил-1-пентил, 4-метил-1-пентил, 2-метил-2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 2,2-диметил-1-бутил, 3,3-диметил-1-бутил, 2-этил-1-бутил, бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил и подобные, и более длинные алкильные группы, такие как гептил и октил, и подобные. Алкильная группа может быть незамещенной или замещенной. Алкильные группы, содержащие три или более атомов углерода могут быть прямыми, разветвленными или циклизованными. Как используется в настоящем описании, "низший алкил" означает алкил, содержащий от 1 до 6 атомов углерода.
Как используется в настоящем описании, "алкенильная группа" включает неразветвленную или разветвленную углеводородную цепь, имеющую одну или более двойных связей. Двойная связь алкенильной группы может быть несопряженной или сопряженной с другой ненасыщенной группой. Иллюстративные алкенильные группы включают, но не ограничиваются ими, (C2-C8)алкенильные группы, такие как этиленил, винил, аллил, бутенил, пентенил, гексенил, бутадиенил, пентадиенил, гексадиенил, 2-этилгексенил, 2-пропил-2-бутенил, 4-(2-метил-3-бутен)пентенил и подобные. Алкенильная группа может быть незамещенной или замещенной.
Термин "гидроксиалкил" означает алкильную группу, как определено выше, где, по меньшей мере, один из атомов водорода из алкильной группы заменен гидроксигруппой.
Примеры гидроксиалкила включают, но не ограничиваются ими, метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил или н-гексил, где один или более атомов водорода заменены группой OH, а также такие гидроксиалкильные группы, которые конкретно проиллюстрированы ниже при помощи примеров настоящего описания.
Термин "цианоалкил" означает алкильную группу, как указано выше, где, по меньшей мере, один из атомов водорода заменен цианогруппой (-CN).
Как используется в настоящем описании, "алкинильная группа" включает неразветвленную или разветвленную углеводородную цепь с одной или более тройными связями. Тройная связь алкинильной группы может быть несопряженной или сопряженной с другой ненасыщенной группой. Подходящие алкинильные группы включают, но не ограничиваются ими, (C2-C6)алкинильные группы, такие как этинил, пропинил, бутинил, пентинил, гексинил, метилпропинил, 4-метил-1-бутинил, 4-пропил-2-пентинил, 4-бутил-2-гексинил и подобные. Алкинильная группа может быть незамещенной или замещенной.
Термин "галогеналкил" означает алкильную группу, как указано выше, где, по меньшей мере, один из атомов водорода алкильной группы заменен атомом галогена, предпочтительно фтором или хлором, наиболее предпочтительно фтором. Примеры галогеналкила включают, но не ограничиваются ими, метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил или н-гексил, где один или более атомов водорода заменены атомом(ами) Cl, F, Br или I, а также такие галогеналкильные группы, которые подробно проиллюстрированы ниже при помощи примеров настоящего описания. Из предпочтительных галогеналкильных групп можно указать монофтор-, дифтор- или трифторметил, -этил или -пропил, например, 3,3,3-трифторпропил, 2-фторэтил, 2,2,2-трифторэтил, фторметил, трифторметил.
Термины "трифторметил", "сульфонил" и "карбоксил" включают CF3, SO2 и CO2H, соответственно.
Термин "гидрокси" означает группу OH.
Термин "алкокси", как используется в настоящем описании, включает -O-(алкил), где алкил определен выше.
Термин "аминоалкил", как используется в настоящем описании, означает группу, содержащую один или более атомов азота и одну или более алкильных групп, как указано выше, связанных с азотом.
"Аралкил" или "арилалкил" означает арилалкильную группу, в которой арил и алкил имеют значения, определенные в настоящем описании. Предпочтительные аралкилы включают низшую алкильную группу. Неограничивающие примеры подходящих аралкильных групп включают бензил, 2-фенетил и нафталенилметил. Связь с исходной группой через алкил.
"Гетероарилалкил" означает гетероарильную группу, как определено в настоящем описании, связанную через алкильную группу (определена выше) с исходным ядром. Неограничивающие примеры подходящих гетероарилов включают 2-пиридинилметил, хинолинилметил и подобные.
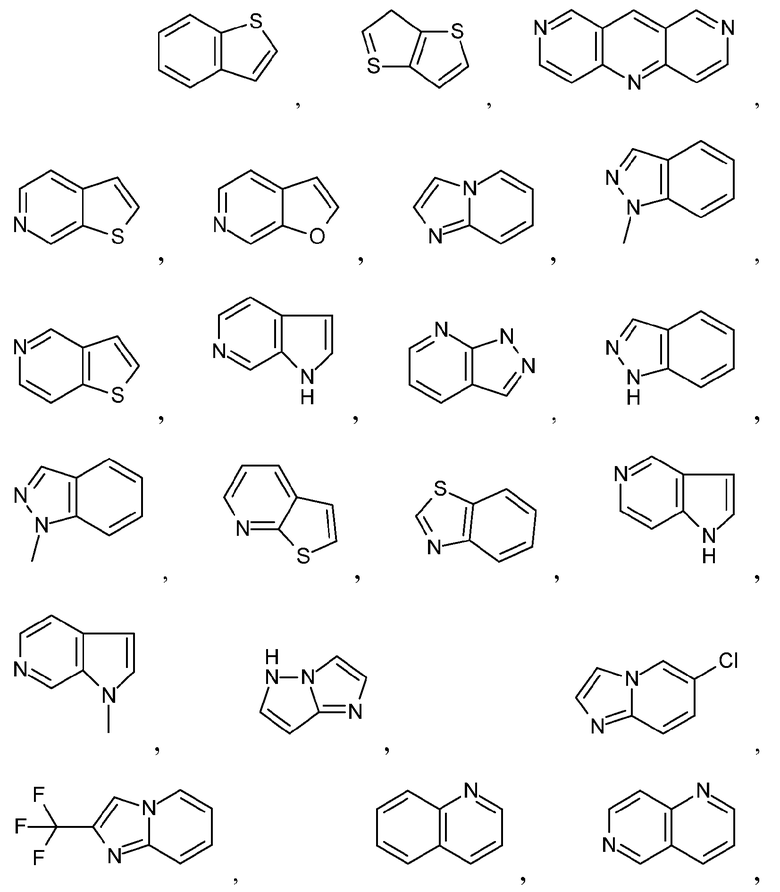
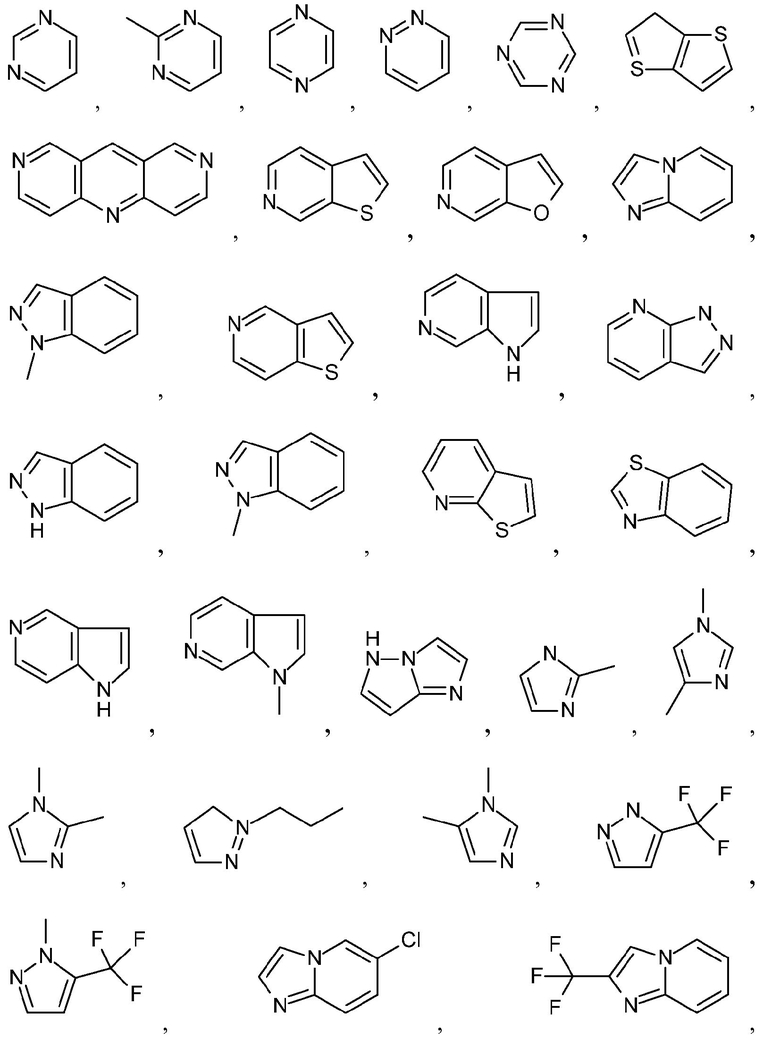
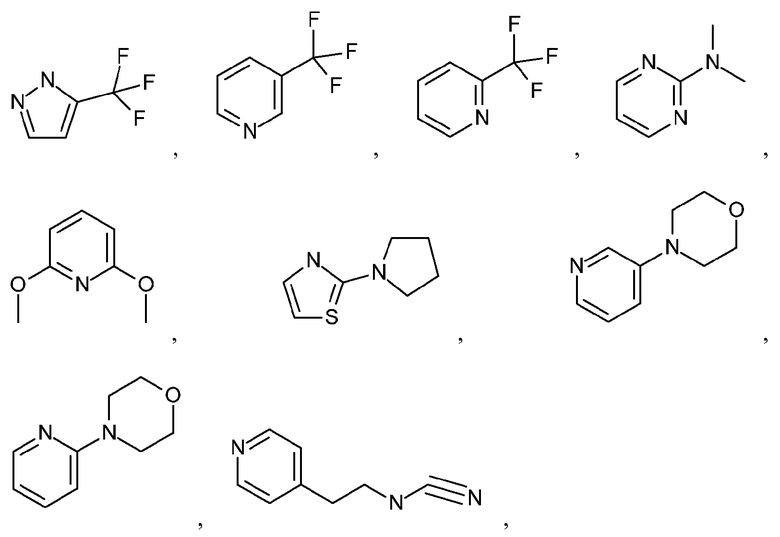
Термин "бициклический гетероарил" означает структуру, содержащую атомы, сгруппированные в два кольца, конденсированные вместе, при этом, по меньшей мере, два атома являются общими для этих колец, и, по меньшей мере, одно из колец является гетероарильным кольцом. Неограничивающие примеры бициклического гетероарила включают бициклические гетероарильные группы, содержащие 1, 2, 3 или 4 гетероатома, независимо выбранные из N, S или O. Иллюстративные примеры бициклических гетероарилов включают, но не ограничиваются ими:

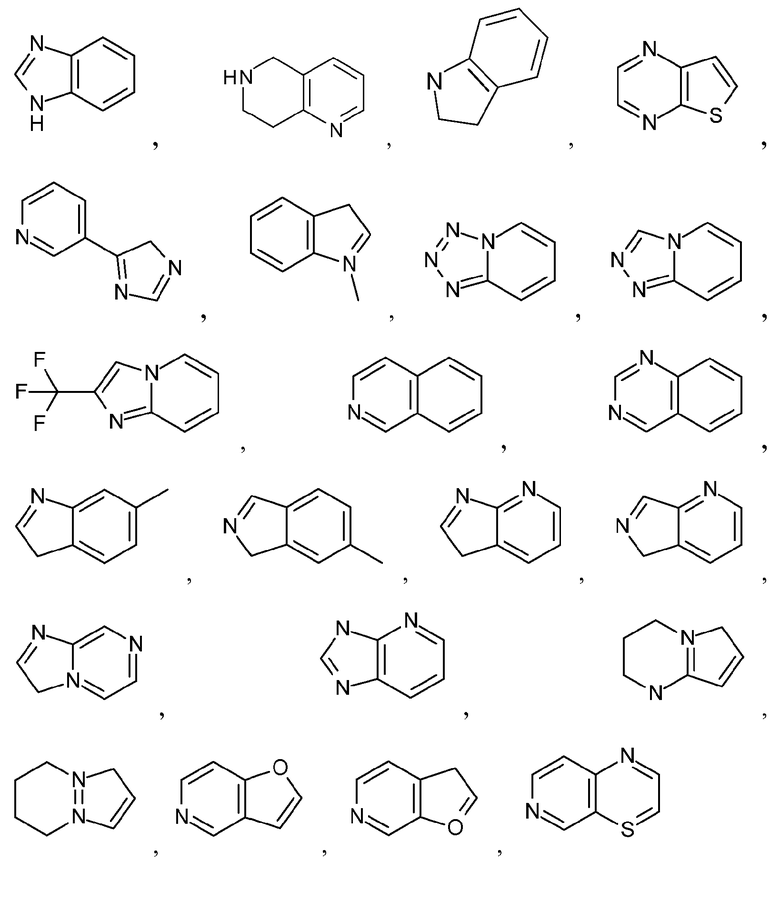
и подобные.
Дополнительные примеры бициклических гетероарилов включают, но не ограничиваются ими:
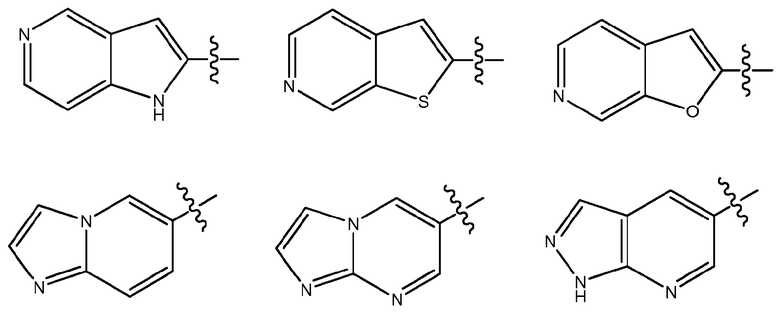
Эти бициклические гетероарильные группы могут быть замещенными, как определено для Ar1 в настоящем описании.
"Гетероциклилалкил" означает гетероциклильную группу, как определено в настоящем описании, связанную через алкильную группу (определена выше) с исходным ядром. Неограничивающие примеры подходящих гетероциклилалкилов включают пиперидинилметил, пиперазинилметил и подобные.
Следует также отметить, что предполагается, что любой атом углерода, а также гетероатом с ненасыщенными валентностями в тексте, схемах, примерах и таблицах настоящего описания содержит достаточное количество атомов водорода для насыщения валентностей.
Когда любая переменная (например, арил, гетероцикл, R и т.д.) встречается более чем один раз в любом составляющем элементе или в формулах, ее определение в каждом случае не зависит от ее определения в любом другом случае.
Как используется в настоящем описании, термин "композиция" предназначен для определения продукта, содержащего указанные ингредиенты в указанных количествах, а также любого продукта, который является результатом, прямым или косвенным, комбинации конкретных ингредиентов в указанных количествах.
Термин "дейтерий", как используется в настоящем описании, означает стабильный изотоп водорода, имеющий нечетные количества протонов и нейтронов.
Термин "галоген", как используется в настоящем описании, означает заместитель, содержащий, по меньшей мере, один галоген, выбранный из фтора, хлора, брома и йода.
Термин "циано", как используется в настоящем описании, означает заместитель, содержащий атом углерода, связанный с атомом азота при помощи тройной связи.
Термин "амино", как используется в настоящем описании, означает заместитель, содержащий, по меньшей мере, один атом азота.
Термин "(амино)алкокси", как используется в настоящем описании, означает заместитель, содержащий, по меньшей мере, одну аминогруппу и, по меньшей мере, одну алкоксигруппу.
Термин "арилокси", как используется в настоящем описании, означает заместитель формы Ar-O-, где Ar представляет собой арильную группу, как определено в настоящем описании.
Термин "метилендиокси", как используется в настоящем описании, означает группу со структурной формулой -О-CH2-О-, которая соединена с молекулой при помощи двух химических связей через атомы кислорода.
Как используется в настоящем описании, "алкоксиалкил" означает -(алкил)-O-(алкил), где каждый "алкил" независимо представляет собой алкильную группу, определенную выше.
Термин "(алкоксиалкил)амино", как используется в настоящем описании, означает заместитель, содержащий, по меньшей мере, одну алкоксиалкильную группу, определенную выше, и, по меньшей мере, одну аминогруппу, определенную выше.
"Арил" означает одновалентный ароматический углеводородный радикал с 6-20 атомами углерода (С6-С20), образованный путем удаления одного атома водорода от одного атома углерода исходной ароматической кольцевой системы. Некоторые арильные группы представлены в проиллюстрированных структурах как "Ar". Арил включает бициклические радикалы, включающие ароматическое кольцо, конденсированное с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим кольцом. Конкретные арильные группы включают, но не ограничиваются ими, радикалы, образованные из бензола (фенил), замещенные бензолы, нафталин, антрацен, бифенил, инденил, инданил, 1,2-дигидронафталин, 1,2,3,4-тетрагидронафтил и подобные. Арильные группы необязательно замещены независимо одним или более заместителями, описанными в настоящем описании. Иллюстративные примеры арильных групп включают, но не ограничиваются ими, фенил, нафталин и следующие группы:
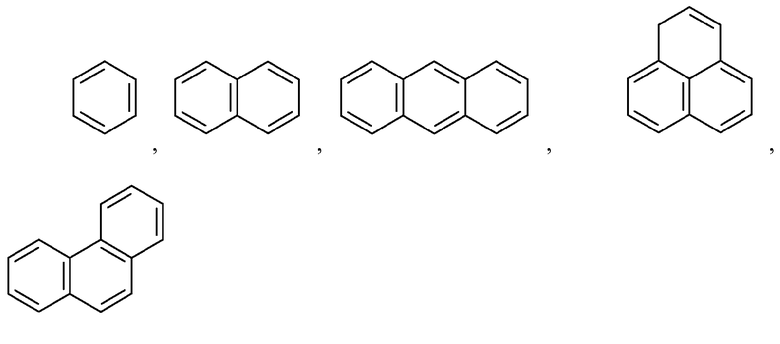
и подобные.
Иллюстративные и неограничивающие примеры замещенных арильных групп включают:
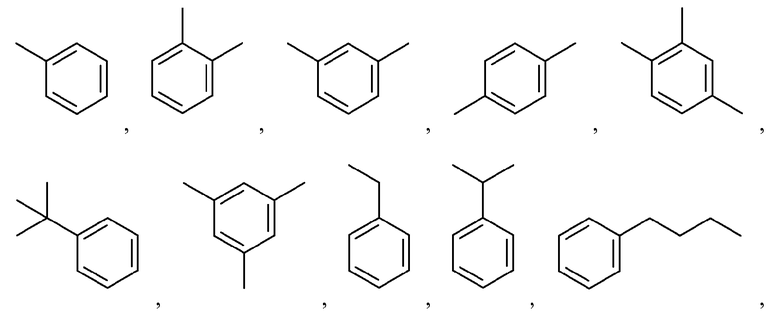
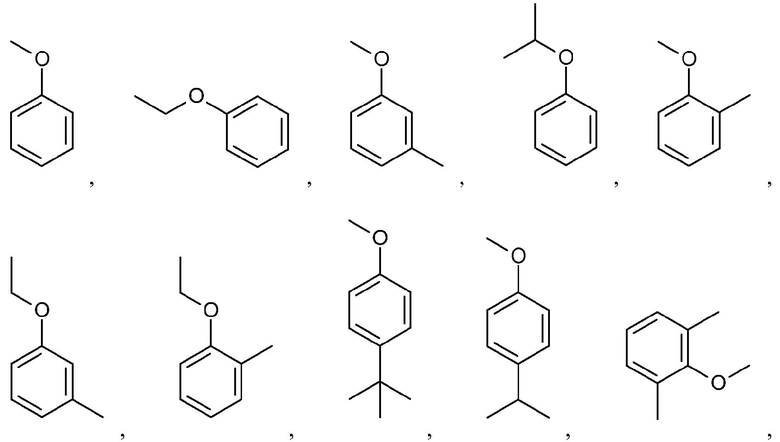
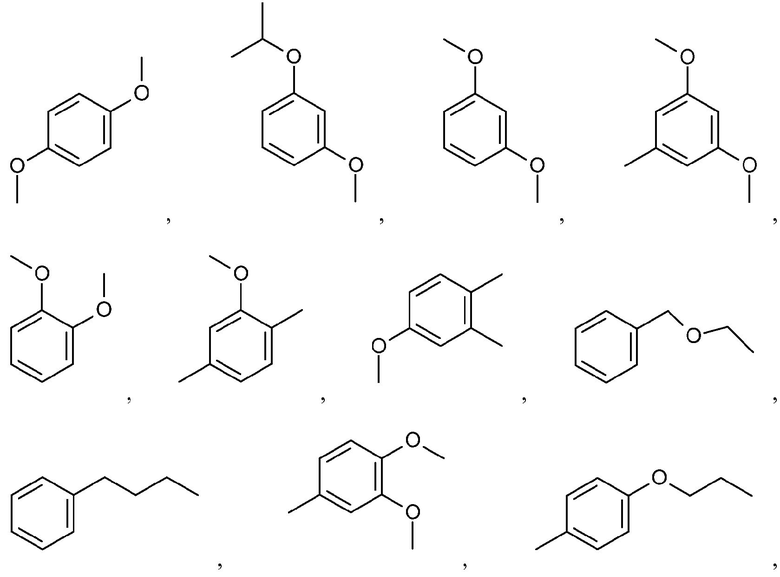
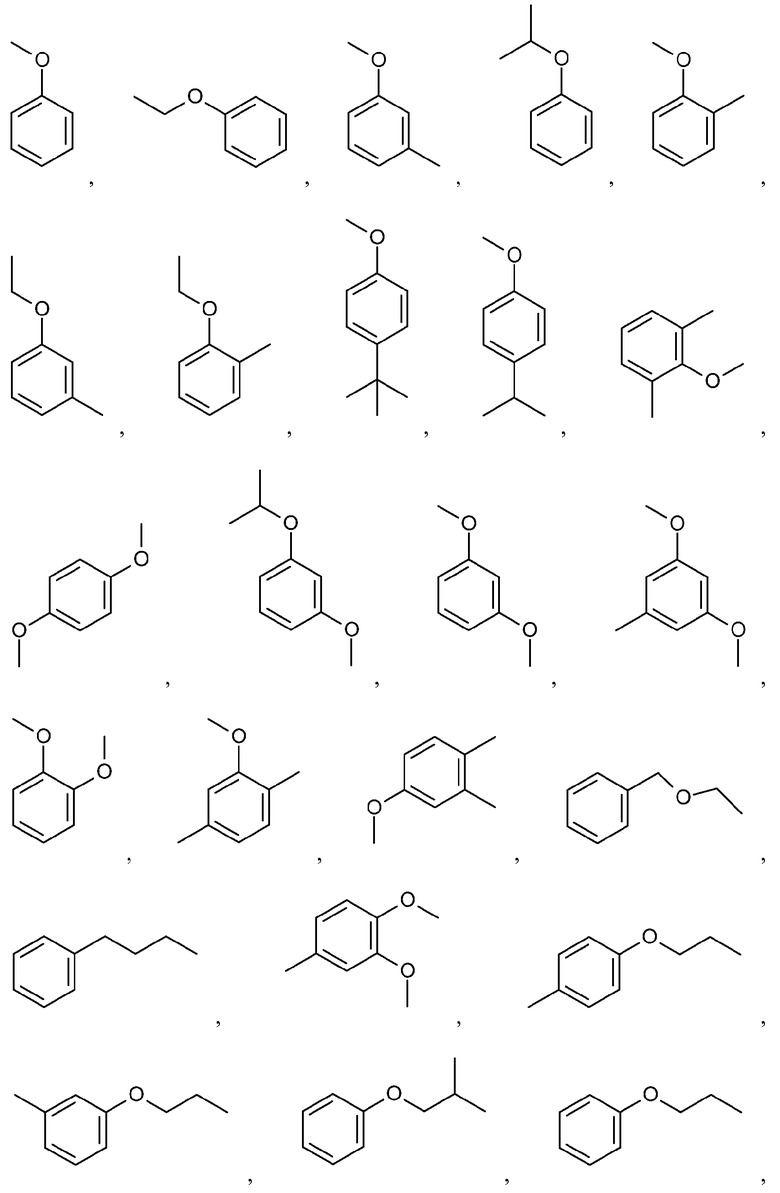
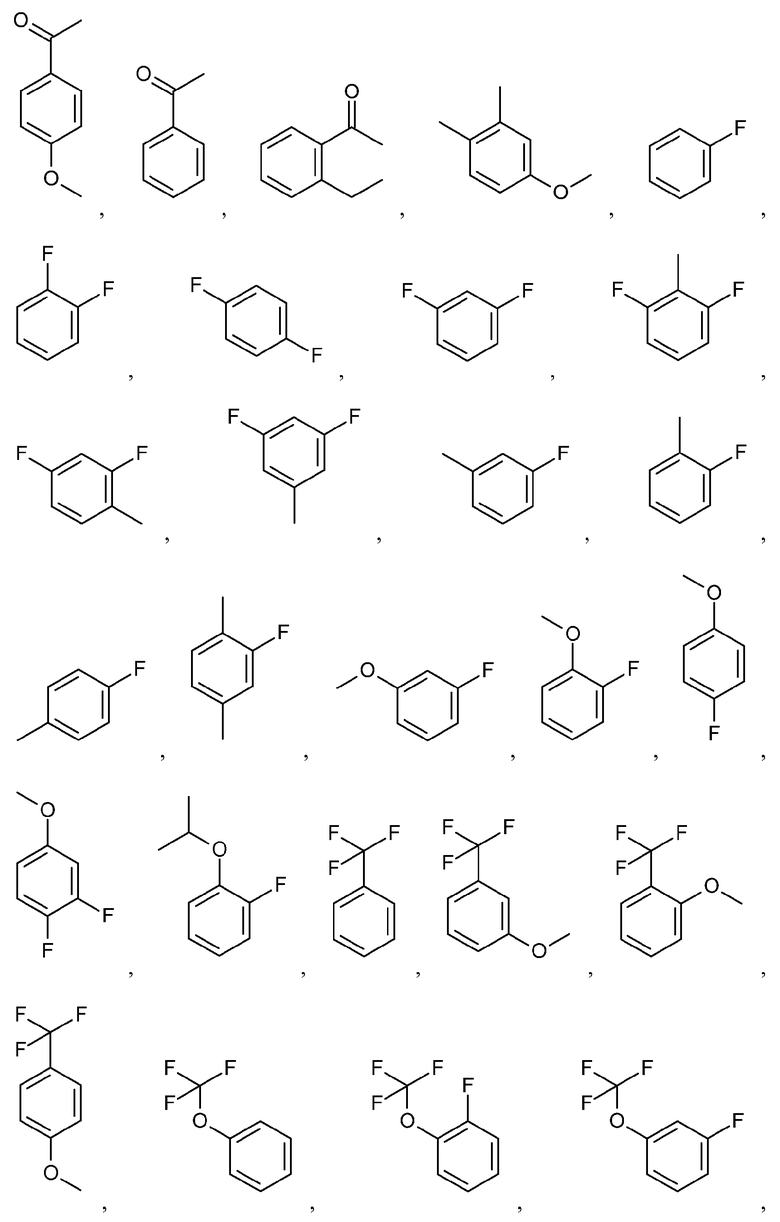
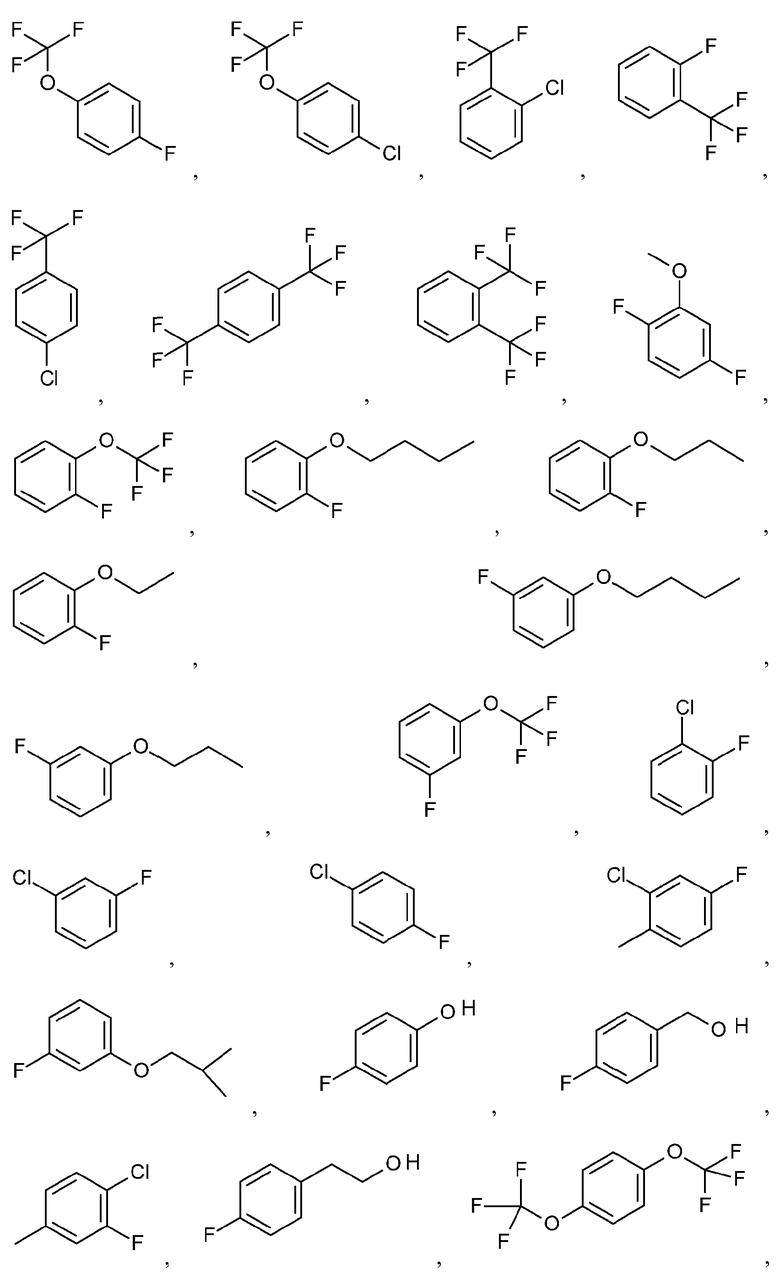
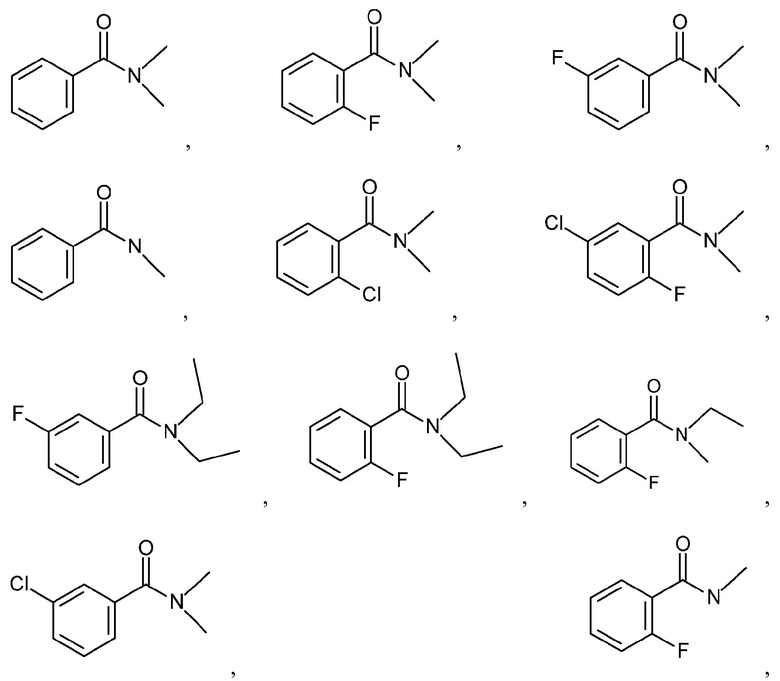
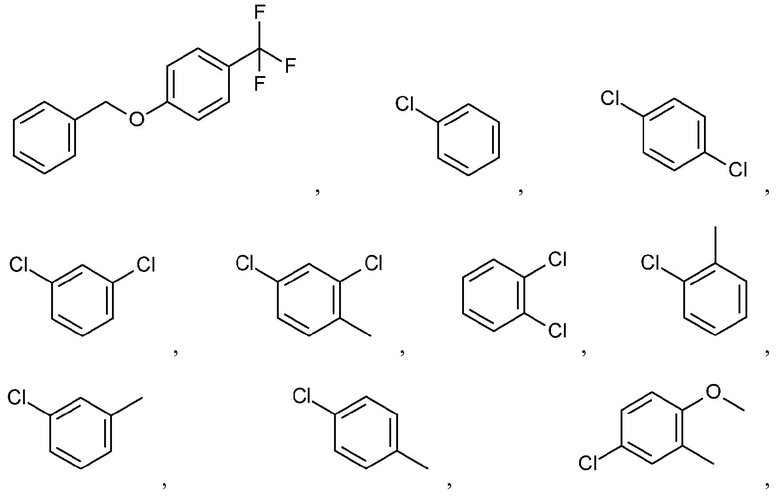
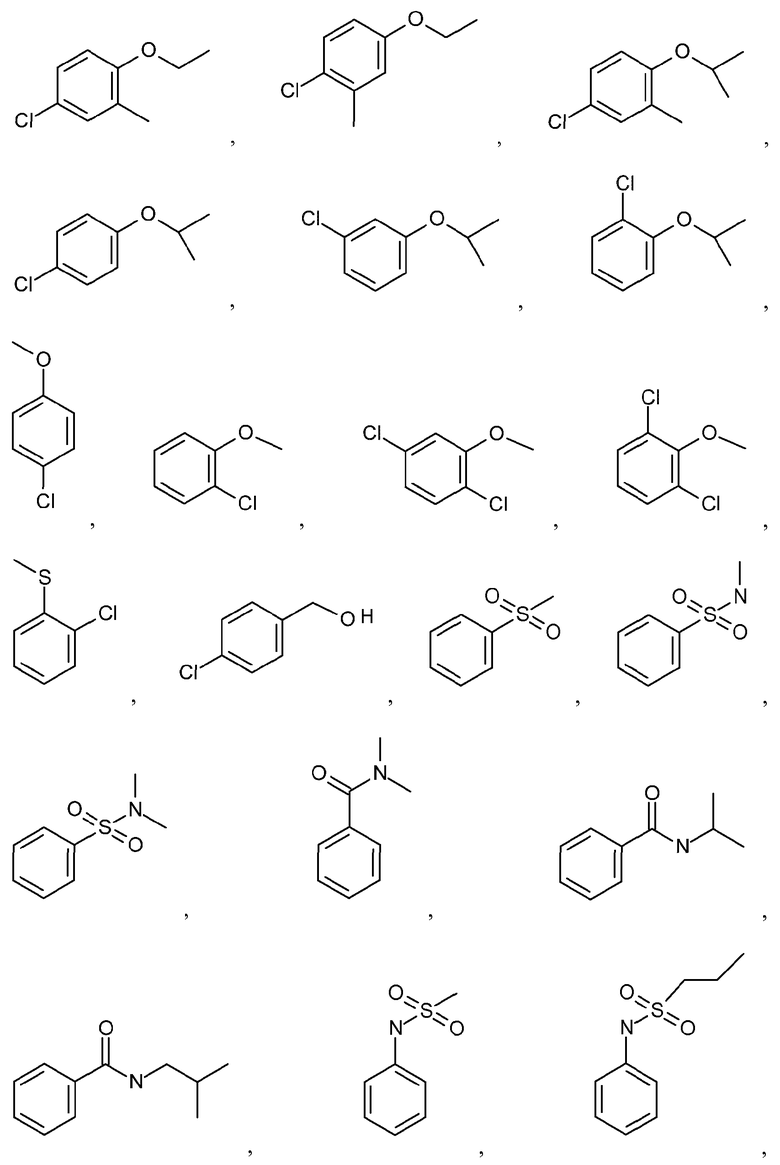
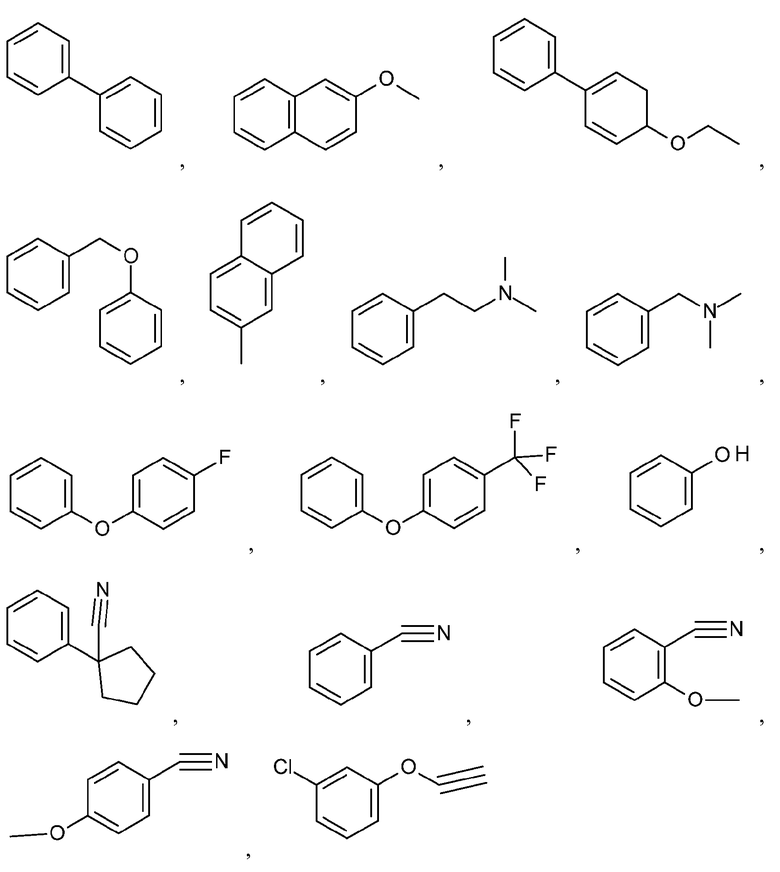
и подобные.
Как используется в настоящем описании, термин "гетероарил" относится к моноциклическому или конденсированному полициклическому ароматическому гетероциклу (кольцевой структуре, содержащей атомы в кольце, выбранные из атомов углерода, а также гетероатомов азота, кислорода и серы), содержащему от 3 до 24 атомов в кольце. Иллюстративные примеры гетероарильных и замещенных гетероарильных групп включают, но не ограничиваются ими, следующие группы:
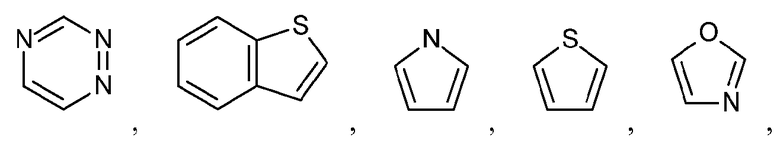
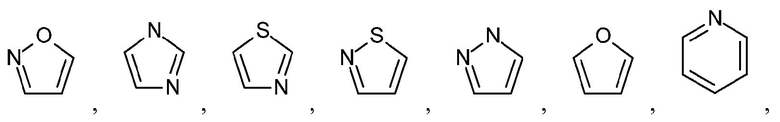
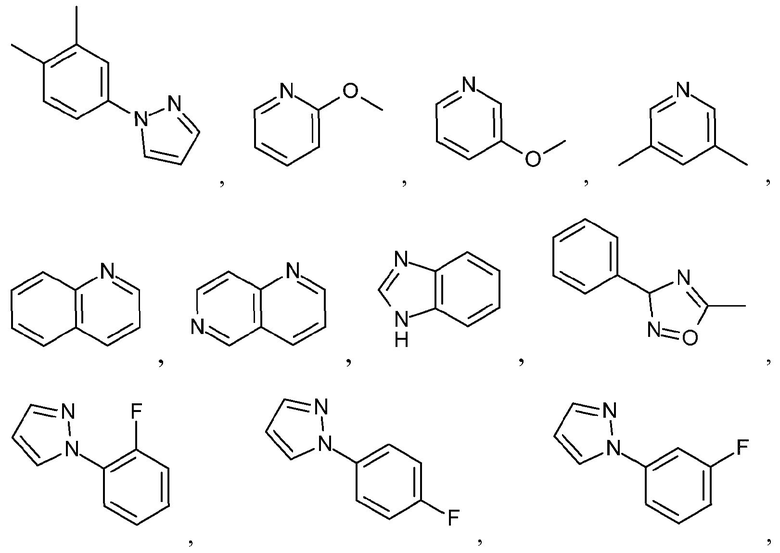
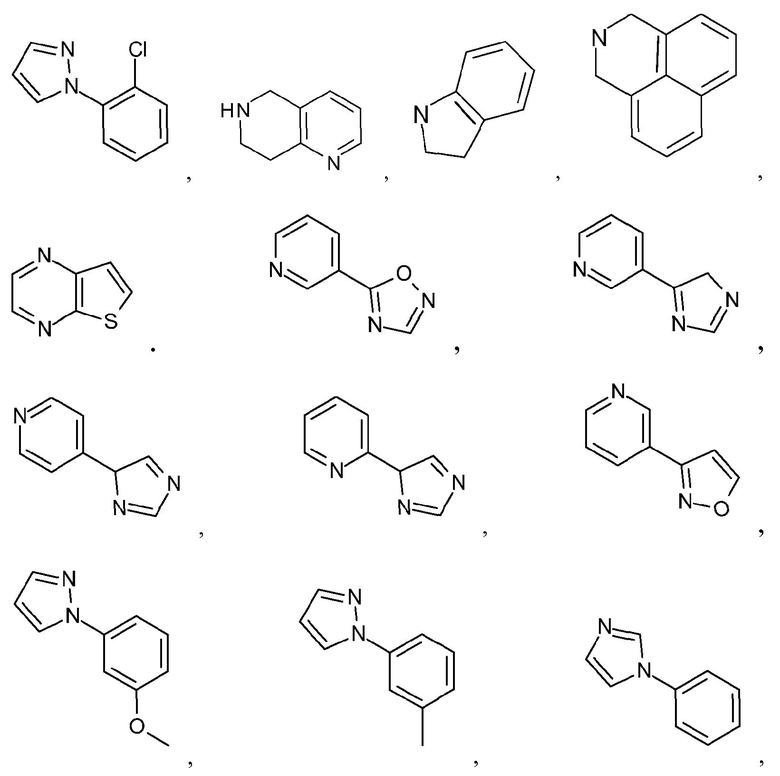
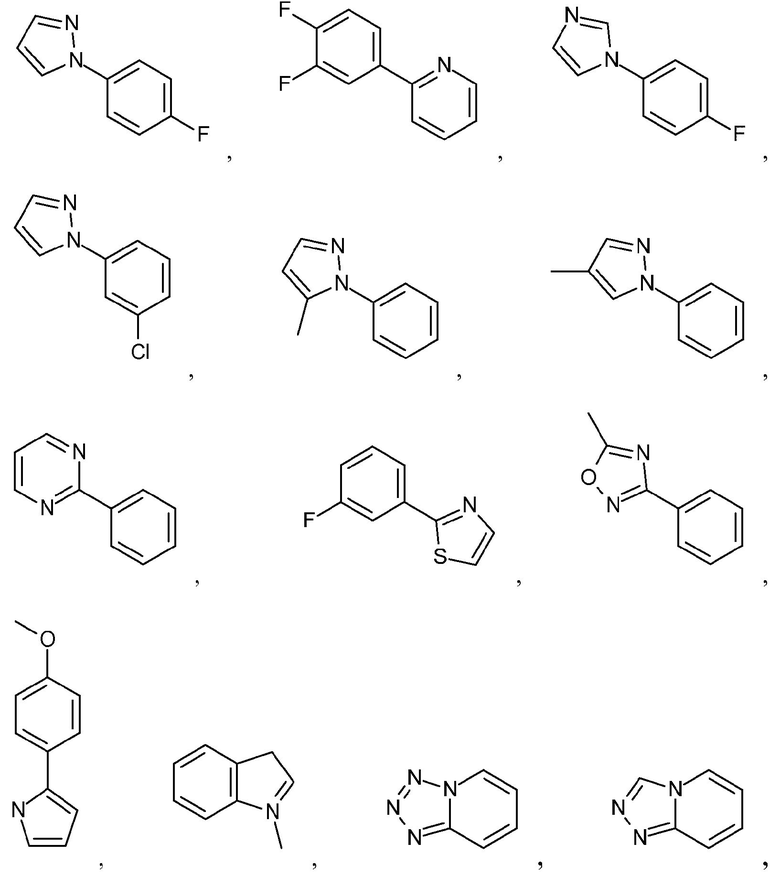
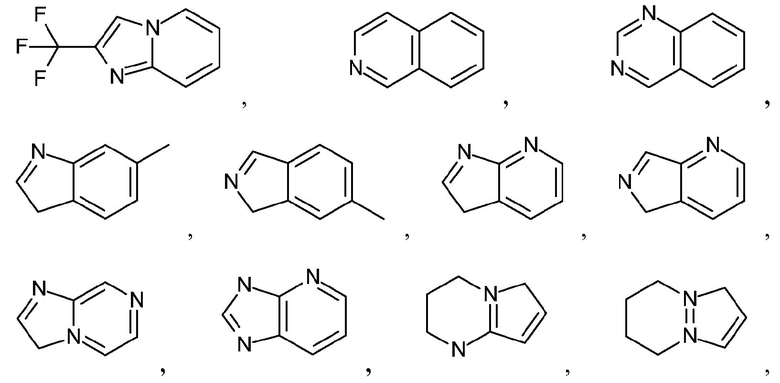
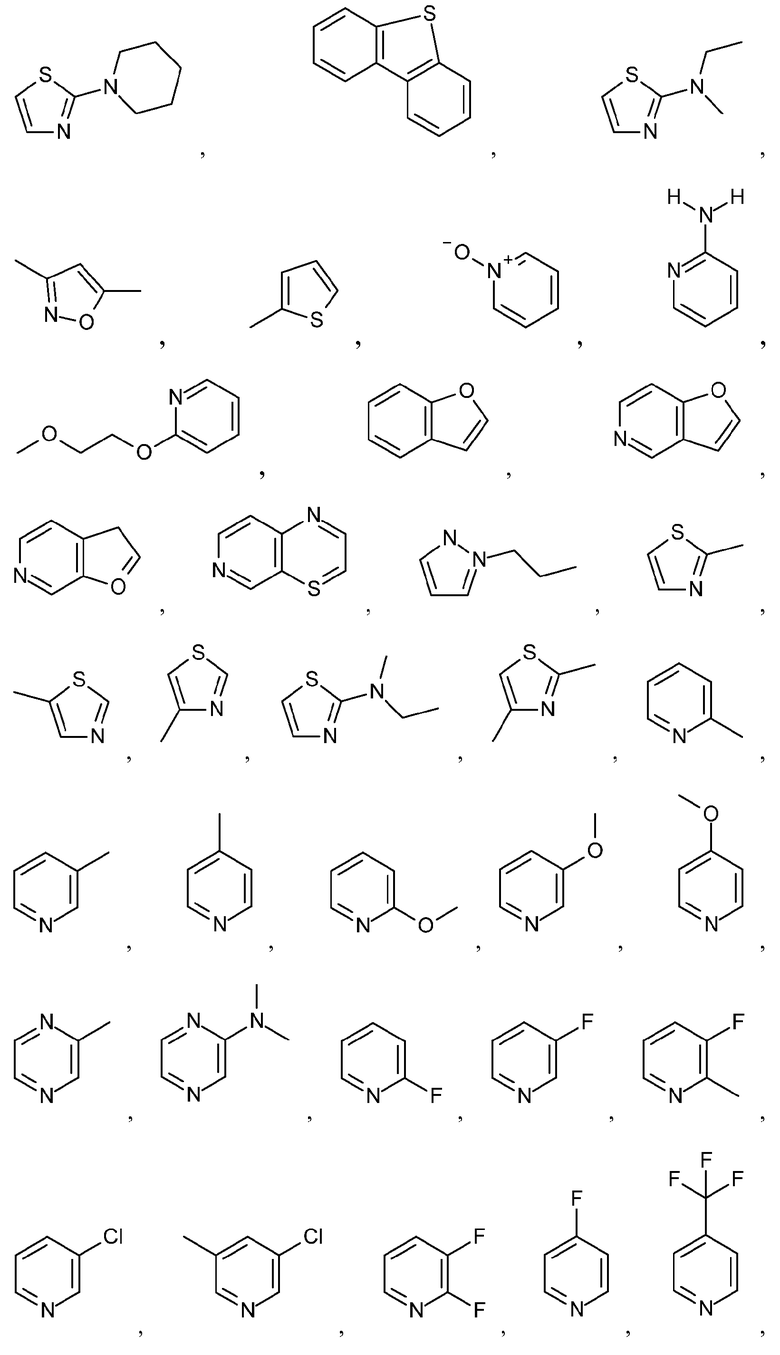
и подобные.
Как используется в настоящем описании, термин "циклоалкил" относится к насыщенному или частично насыщенному, моноциклическому или конденсированному, или спирополициклическому карбоциклу, содержащему от 3 до 24 или от 3 до 6 атомов углерода в кольце: например, (C3-C6)циклоалкил. Иллюстративные примеры циклоалкильных групп включают, но не ограничиваются ими, следующие группы:
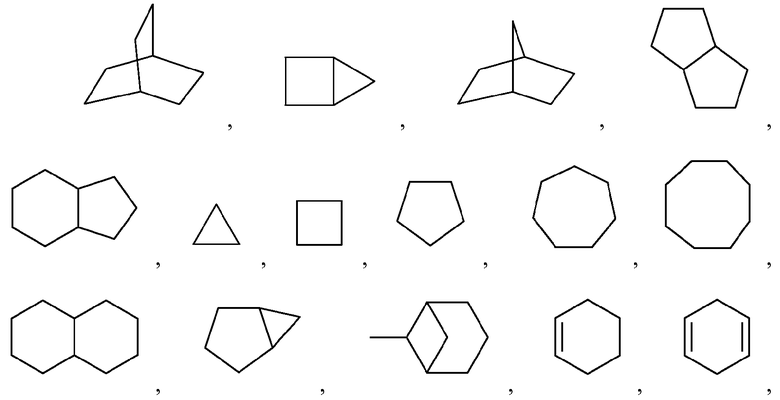
и подобные.
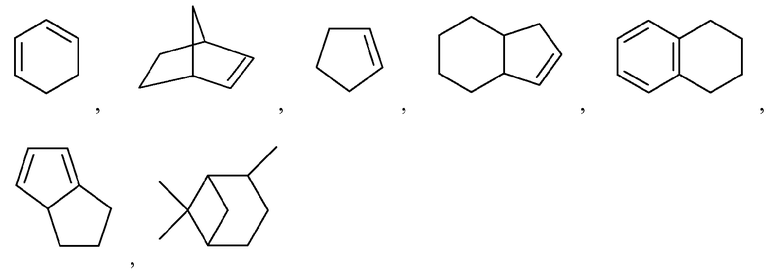
Как используется в настоящем описании, термин "гетероциклил" или "гетероциклоалкил" относится к моноциклической или конденсированной или спирополициклической кольцевой структуре, которая является насыщенной или частично насыщенной и содержит от 3 до 24 или 5-6 атомов в кольце, выбранных из атомов C и гетероатомов N, O и S. Иллюстративные примеры гетероциклоалкильных и замещенных гетероциклоалкильных групп включают, но не ограничиваются ими:
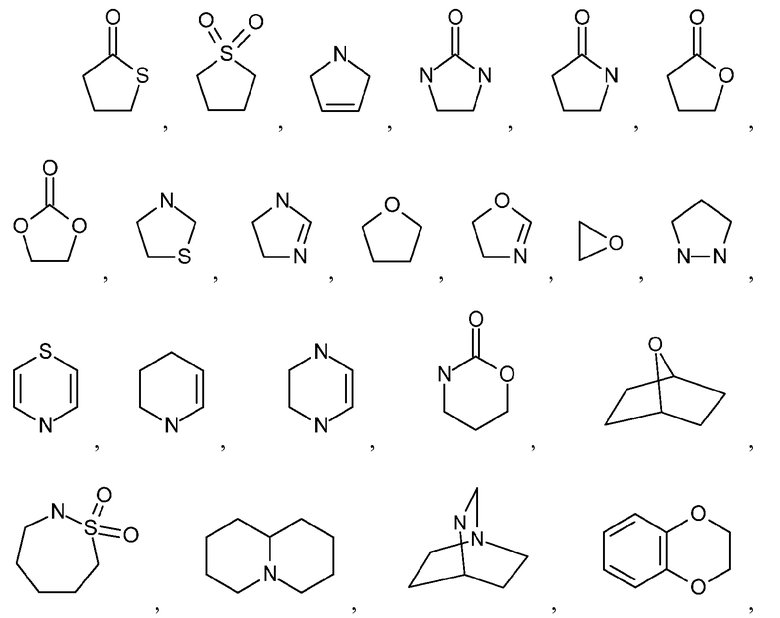
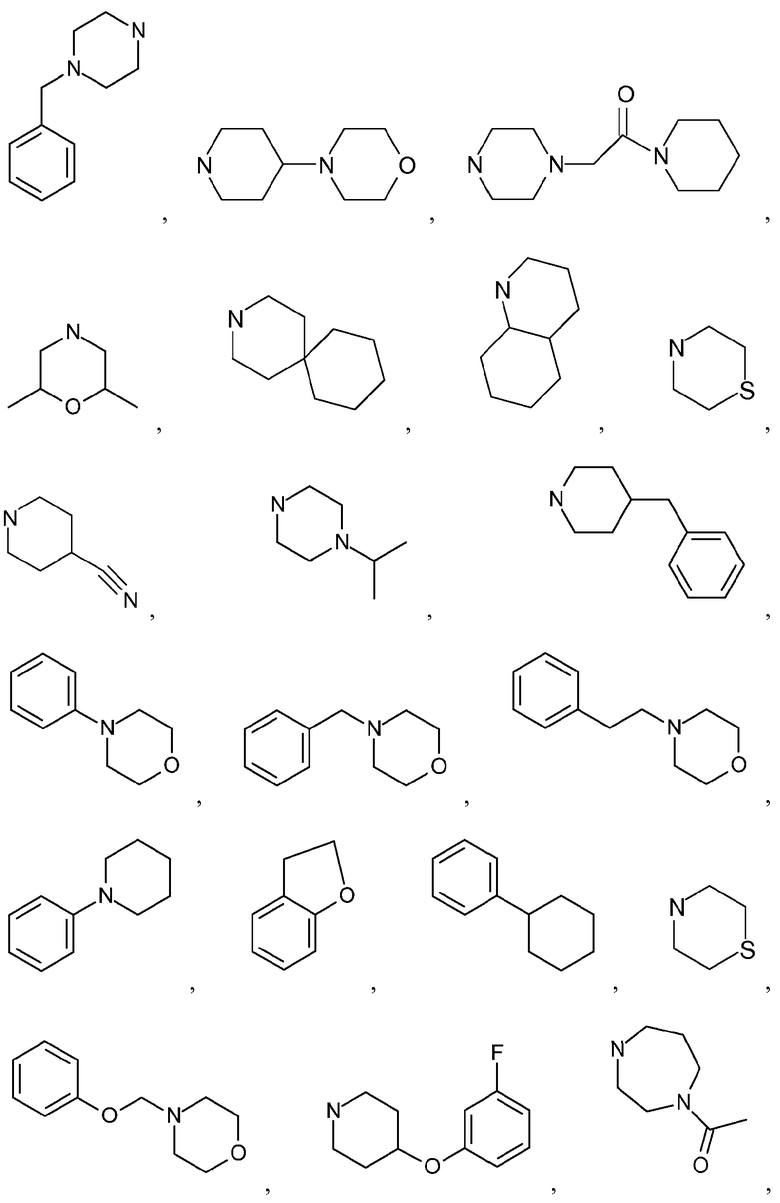
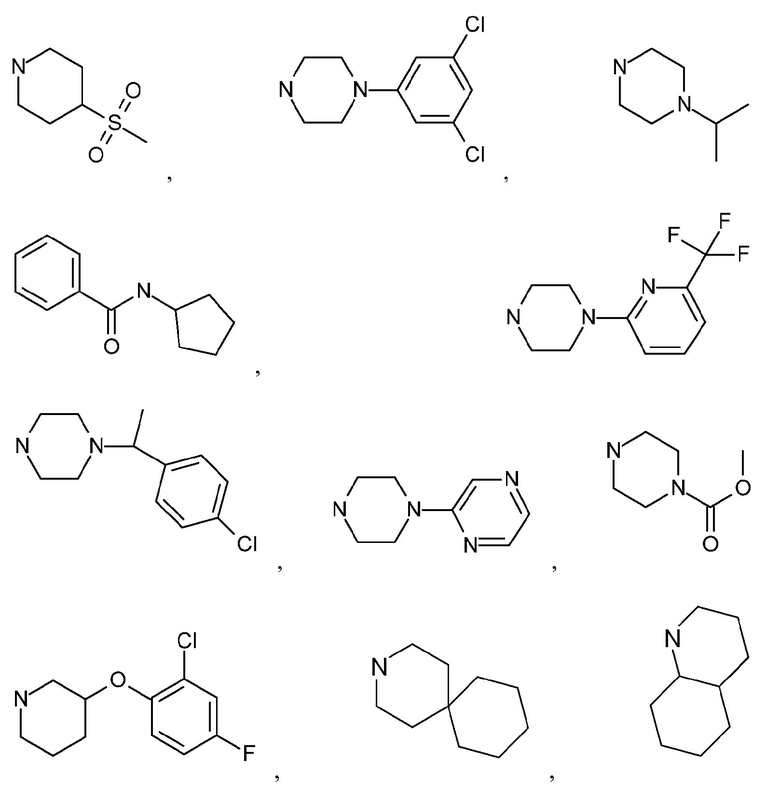
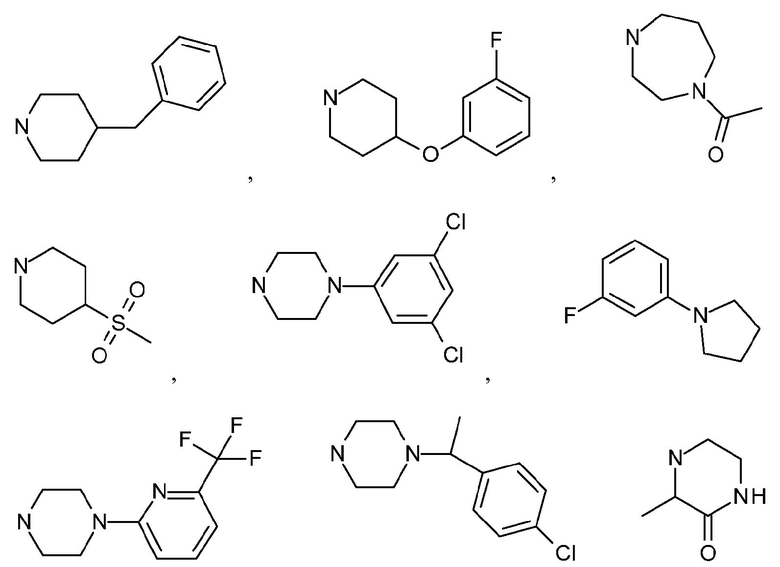
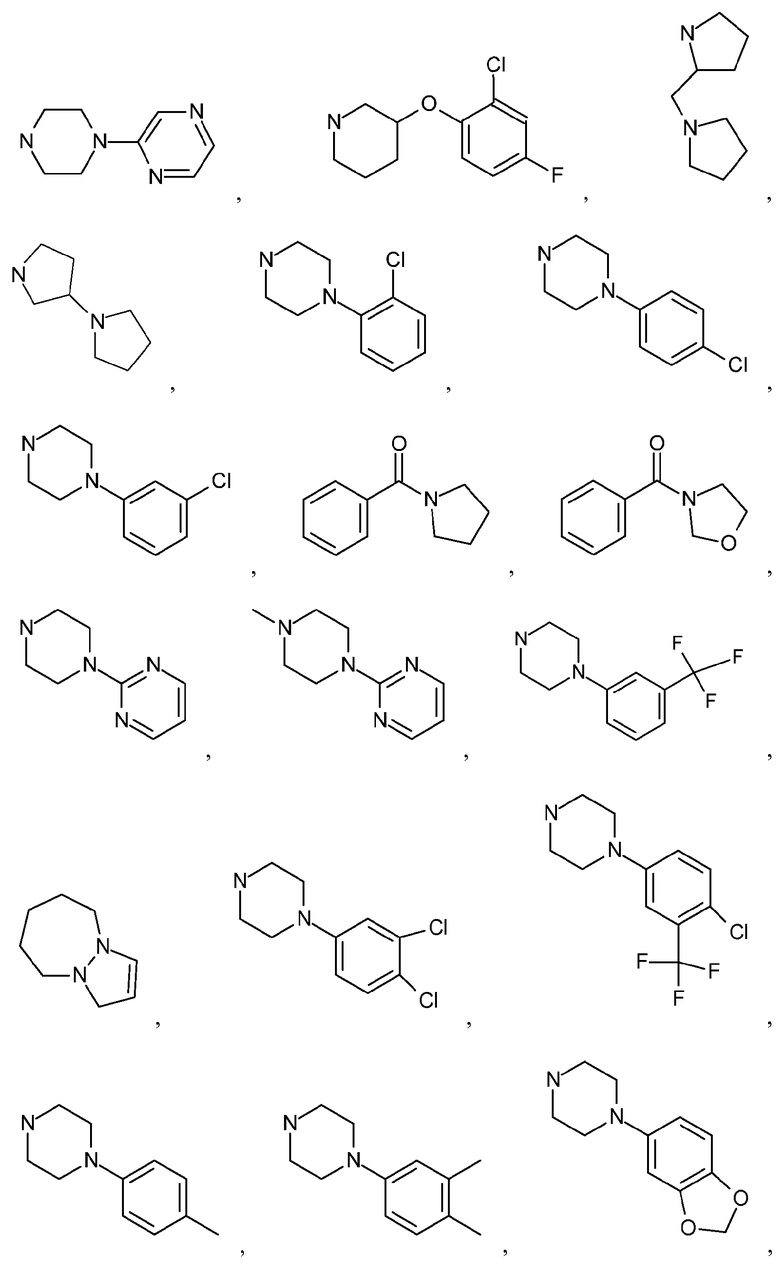
и подобные.
Области числовых значений, как используется в настоящем описании, включают последовательные целые числа. Например, область в пределах “от 0 до 4” включает 0, 1, 2, 3 и 4.
Как используется в настоящем описании, термин “замещенный” означает, что указанная группа или фрагмент содержит один или более подходящих заместителей.
Как используется в настоящем описании, термин “незамещенный” означает, что указанная группа не содержит каких-либо заместителей.
Как используется в настоящем описании, термин “необязательно замещенный” означает, что указанная группа является незамещенной или замещена одним или более заместителями.
Когда показана многофункциональная группа, точка присоединения к ядру молекулы указана штрихом. Например, (циклоалкилокси)алкил- относится к алкилу, являющемуся точкой присоединения к ядру, тогда как циклоалкил приоединен к алкилу через оксигруппу.
Выражение “дополнительное химиотерапевтическое средство”, как правило, относится к средствам, которые лечат, ослабляют, облегчают или уменьшают тяжесть побочных эффектов химиотерапевтических средств. Такие средства включают средства, которые модифицируют рост и созревание клеток крови. Примеры дополнительных химиотерапевтических средств включают, но не ограничиваются ими, филграстим и эритропоэтин. Другие такие дополнительные химиотерапевтические средства включают средства, которые ингибируют тошноту, связанную с введением химиотерапевтических средств, например, ингибитор рецептора 5-HT3 (например, долансетрон, гранисетрон или ондасетрон), с или без дексаметазона.
Термины “химиотерапевтическое средство” и “противоопухолевое средство”, как правило, относятся к средствам, которые лечат, предотвращают, вылечивают, исцеляют, облегчают, ослабляют, изменяют, исправляют состояние, уменьшают тяжесть, улучшают состояние или влияют на опухоли и их метастазы. Примеры таких средств (также известных как “противоопухолевые средства”) включают, но не ограничиваются ими, преднизон, фторурацил (например, 5-фторурацил (5-FU)), анастрозол, бикалутамид, карбоплатин, цисплатин, хлорамбуцил, цисплатин, карбоплатин, доцетаксел, доксорубицин, флутамид, интерферон-альфа, летрозол, лейпролид, мегестрол, митомицин, оксалиплатин, паклитаксел, пликамицин (Mithracin™), тамоксифен, тиотепа, топотекан, валрубицин, винвластин, винкристин и любую комбинацию любых из вышеперечисленных средств. Дополнительные такие средства описаны ниже.
“Никотинамидфосфорибозилтрансфераза”, также имеющая название NAMPT, NMPRT, NMPRTaза или NAmPRTaза, (Международная номенклатура: E.C. 2.4.2.12), является ключевым ферментом в биосинтезе никотинамидаденилдинуклеотида (NAD) из природного предшественника никотинамида.
Следует отметить, что, как используется в описании и прилагаемой формуле изобретения, формы единственного числа включают также формы множественного числа, если в контексте явно не указано иное.
При использовании в качестве терапевтического средства, ингибиторы образования никотинамидфосфорибозилтрансферазы (NAMPT), описанные в настоящем описании, можно вводить с одним или более физиологически приемлемыми эксципиентами. Физиологически приемлемый носитель или эксципиент представляет собой состав, к которому соединение может быть добавлено для его растворения или иным образом облегчения его введения.
Дозированные формы по настоящему изобретению могут содержать смесь одного или более соединений по настоящему изобретению и могут включать дополнительные вещества, известные специалистам в данной области как фармацевтические эксципиенты. Такие фармацевтические эксципиенты включают, например, следующие: стабилизирующие добавки могут быть включены в раствор агента доставки. Для некоторых лекарственных средств присутствие таких добавок способствует стабильности и диспергируемости средства в растворе. Стабилизирующие добавки можно использовать в концентрации, находящейся в пределах примерно от 0,1 до 5% (масс./об.), предпочтительно около 0,5% (масс./об.). Подходящие, но не ограничивающие, примеры стабилизирующих добавок включают аравийскую камедь, желатин, метилцеллюлозу, полиэтиленгликоль, карбоновые кислоты и их соли и полилизин. Предпочтительными стабилизирующиими добавками являются аравийская камедь, желатин и метилцеллюлоза.
Подкислители (уксусная кислота, ледяная уксусная кислота, лимонная кислота, фумаровая кислота, хлористоводородная кислота, разбавленная хлористоводородная кислота, яблочная кислота, азотная кислота, фосфорная кислота, разбавленная фосфорная кислота, серная кислота, винная кислота); пропелленты для аэрозолей (бутан, дихлордифторметан, дихлортетрафторэтан, изобутан, пропан, трихлормонофторметан); вытеснители воздуха (диоксид угдерода, азот); средства для денатурирования спирта (денатонийбензоат, метилизобутилкетон, октацетат сахарозы); подщелачивающие средства (концентрированный раствор аммиака, карбонат аммония, диэтаноламин, диизопропаноламин, гидроксид калия, бикарбонат натрия, борат натрия, карбонат натрия, гидроксид натрия, троламин); средства, предотвращающие слеживание (см. глиданты); противовспенивающие средства (диметикон, симетикон); противомикробные консерванты (бензалконийхлорид, раствор бензалконийхлорида, бензелтонийхлорид, бензойная кислота, бензиловый спирт, бутилпарабен, цетилпиридинийхлорид, хлорбутанол, хлоркрезол, крезол, дегидроуксусная кислота, этилпарабен, метилпарабен, натрийметилпарабен, фенол, фенилэтиловый спирт, ацетат фенилртути, нитрат фенилртути, бензоат калия, сорбат калия, пропилпарабен, натрийпропилпарабен, бензоат натрия, дегидроацетат натрия, пропионат натрия, сорбиновая кислота, тимеросал, тимол); антиоксиданты (аскорбиновая кислота, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, гипофосфористая кислота, монотиоглицерин, пропилгаллат, натрийформальдегидсульфоксилат, метабисульфит натрия, тиосульфат натрия, диоксид серы, токоферол, токоферолы в качестве эксципиента); буферные вещества (уксусная кислота, карбонат аммония, фосфат аммония, борная кислота, лимонная кислота, молочная кислота, фосфорная кислота, цитрат калия, метафосфат калия, монокалийфосфат, ацетат натрия, цитрат натрия, раствор лактата натрия, вторичный кислый фосфат натрия, первичный кислый фосфат натрия); лубриканты для капсул (см. лубриканты для таблеток и капсул); хелатообразующие вещества (динатрийэдетат, этилендиаминтетрауксусная кислота и ее соли, эдетиновая кислота); вещества покрытий (натриевая соль карбоксиметилцеллюлозы, ацетат целлюлозы, ацетатфталат целлюлозы, этилцеллюлоза, желатин, фармацевтическая глазурь, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы, сополимер метакриловой кислоты, метилцеллюлоза, полиэтиленгликоль, поливинилацетатфталат, шеллак, сахароза, диоксид титана, карнаубский воск, микрокристаллический воск, зеин); красители (цвета жженого сахара, красный, желтый, черный или смеси, оксид железа); комплексобразующие вещества (этилендиаминтетрауксусная кислота и соли (EDTA), эдетиновая кислота, гентизиновая кислота этаноламид, оксихинолинсульфат); влагопоглотители (хлорид кальция, сульфат кальция, диоксид кремния); эмульгирующие и/или солюбилизирующие вещества (аравийская камедь, холестерин, диэтаноламин (вспомогательное вещество), глицерилмоностеарат, ланолиновые спирты, лецитин, моно- и диглицериды, моноэтаноламин (вспомогательное вещество), олеиновая кислота (вспомогательное вещество), олеиловый спирт (стабилизатор), полоксамер, полиоксиэтилен 50 стеарат, полиоксил 35 касторовое масло, полиоксил 40 гидрированное касторовое масло, полиоксил 10 олеиловый эфир, полиоксил 20 цетостеариловый эфир, полиоксил 40 стеарат, полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 80, пропиленгликоль диацетат, пропиленгликоль моностеарат, лаурилсульфат натрия, стеарат натрия, сорбитан монолаурат, сорбитан моноолеат, сорбитанмонопальмитат, сорбитанмоностеарат, стеариновая кислота, троламин, эмульгирующий воск); вспомогательные вещества для фильтрования (порошкообразная целлюлоза, очищенный кремнезем); отдушки и ароматизаторы (анетол, бензальдегид, этилванилин, ментол, метилсалицилат, мононатрийглутамат, масло из цветков апельсинового дерева, перечная мята, масло мяты перечной, спирт из мяты перечной, розовое масло, концентрированная розовая вода, тимол, толуанский бальзам в виде настойки, ваниль, ванильная настойка, ванилин); глиданты и/или предотвращающие слеживание вещества (силикат кальция, магния силикат, коллоидный диоксид кремния, тальк); увлажнители (глицерин, гексиленгликоль, пропиленгликоль, сорбит); пластификаторы (касторовое масло, диацетилированные моноглицериды, диэтилфталат, глицерин, моно- и диацетилированные моноглицериды, полиэтиленгликоль, пропиленгликоль, триацетин, триэтилцитрат); полимеры (например, ацетат целлюлозы, алкилцеллюлозы, гидроксиалкилцеллюлозы, акриловые полимеры и сополимеры); растворители (ацетон, спирт, разбавленный спирт, амиленгидрат, бензилбензоат, бутиловый спирт, тетрахлорид углерода, хлороформ, кукурузное масло, масло семян хлопчатника, этилацетат, глицерин, гексиленгликоль, изопропиловый спирт, метиловый спирт, метиленхлорид, метилизобутилкетон, минеральное масло, арахисовое масло, полиэтиленгликоль, пропиленкарбонат, пропиленгликоль, кунжутное масло, вода для инъекций, стерильная вода для инъекций, стерильная вода для промывания, дистиллированная вода); сорбенты (порошкообразная целлюлоза, древесный уголь, очищенный кремнезем); сорбенты на основе диоксида угдерода (барийгидроксидная известь, натровая известь); загустители (гидрированное касторовое масло, цетостеариловый спирт, цетиловый спирт, воскообразные сложные цетиловые эфиры, твердый жир, парафин, полиэтиленовый эксципиент, стеариловый спирт, эмульгирующий воск, белый воск, желтый воск); суспендирующие и/или повышающие вязкость вещества (аравийская камедь, агар, альгиновая кислота, моностеарат алюминия, бентонит, очищенный бентонит, густая суспензия бентонита, карбомер 934p, кальцийкарбоксиметилцеллюлоза, натрийкарбоксиметилцеллюлоза, натрийкарбоксиметилцеллюлоза 12, карраген, микрокристаллическая целлюлоза и натрийкарбоксиметилцеллюлоза, декстрин, желатин, гуаровая камедь, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, магнийалюминиевый силикат, метилцеллюлоза, пектин, полиэтиленоксид, поливиниловый спирт, повидон, пропиленгликоль альгинат, диоксид кремния, коллоидный диоксид кремния, альгинат натрия, трагакант, ксантановая камедь); подсластители (аспартам, декстраты, декстроза, декстроза в качестве эксципиента, фруктоза, маннит, сахарин, кальцийсахарин, натрийсахарин, сорбит, раствор сорбита, сахароза, прессуемый сахар, кондитерский сахар, сироп); связующие для таблеток (аравийская камедь, альгиновая кислота, натрийкарбоксиметилцеллюлоза, микрокристаллическая целлюлоза, декстрин, этилцеллюлоза, желатин, жидкая глюкоза, гуаровая камедь, гидроксипропилметилцеллюлоза, метилцеллюлоза, полиэтиленоксид, повидон, предварительно желатинизированный крахмал, сироп); разбавители для таблеток и/или капсул (карбонат кальция, двухосновной фосфат кальция, трехосновной фосфат кальция, сульфат кальция, микрокристаллическая целлюлоза, порошкообразная целлюлоза, декстраты, декстрин, декстроза в качестве эксципиента, фруктоза, каолин, лактоза, маннит, сорбит, крахмал, предварительно желатинизированный крахмал, сахароза, прессуемый сахар, кондитерский сахар); дезинтегранты для таблеток (альгиновая кислота, микрокристаллическая целлюлоза, натрийкроскармелоза, кросповидон, калийполакрилин, натрийкрахмалгликолят, крахмал, предварительно желатинизированный крахмал); лубриканты для таблеток и/или капсул (стеарат кальция, глицерилбегенат, стеарат магния, светлое минеральное масло, полиэтиленгликоль, стеарилфумарат натрия, стеариновая кислота, очищенная стеариновая кислота, тальк, гидрированное растительное масло, стеарат цинка); агент тоничности (декстроза, глицерин, маннит, хлорид калия, хлорид натрия); носитель: ароматизированный и/или подслащенный (ароматический эликсир, эликсир на основе бензальдегидных соединений, изоспиртовой эликсир, перечномятная вода, раствор сорбита, сироп, толуанский бальзам в виде сиропа); носитель: масляный (миндальное масло, кукурузное масло, масло семян хлопчатника, этилолеат, изопропилмиристат, изопропилпальмитат, минеральное масло, светлое минеральное масло, миристиловый спирт, октилдодеканол, оливковое масло, арахисовое масло, персиковое масло, кунжутное масло, соевое масло, сквален); носитель: твердый носитель (сахарные сфероидальные частицы); носитель: стерильный (бактериостатическая вода для инъекций, бактериостатический хлорид натрия для инъекций); повышающее вязкость вещество (см. суспендирующее средство); водоотталкивающее средство (циклометикон, диметикон, симетикон); и смачивающее и/или солюбилизирующее средство (бензалконийхлорид, бензетонийхлорид, цетилпиридинийхлорид, докузатнатрий, ноноксинол 9, ноноксинол 10, октоксинол 9, полоксамер, полиоксил 35 касторовое масло, полиоксил 40, гидрированное касторовое масло, полиоксил 50 стеарат, полиоксил 10 олеиловый эфир, полиоксил 20, цетостеариловый эфир, полиоксил 40 стеарат, полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 80, лаурилсульфат натрия, сорбитанмонолаурат, сорбитанмоноолеат, сорбитанмонопальмитат, сорбитанмоностеарат, тилоксапол). Этот перечень не является исчерпывающим, но только репрезентативным для класса эксципиентов и конкретных эксципиентов, которые можно использовать в дозированных формах по настоящему изобретению.
Соединения по настоящему изобретению могут образовывать соли, которые также охватываются объемом настоящего изобретения. Ссылку на соединение формулы в настоящем описании следует рассматривать как включающую ссылку на соли такого соединения, если не указано иное. Термин "соль(и)", как он используется в настоящем описании, означает кислотные соли, образованные с неорганическими и/или органическими кислотами, а также основные соли, образованные с неорганическими и/или органическими основания. Кроме того, когда соединение указанных формул содержит как основную группу, такую как, но, не ограничиваясь ими, пиридин или имидазол, и кислотную группу, такую как, но, не ограничиваясь ими, карбоновую кислоту, могут быть образованы цвиттерионы ("внутренние соли"), и они охватываются термином "соль(и)", как он используется в настоящем описании. Фармацевтически приемлемые (т.е. нетоксичные физиологически приемлемые) соли являются предпочтительными, хотя другие соли также являются полезными. Соли соединений представленной формулы могут быть образованы, например, путем взаимодействия соединения указанной формулы с количеством кислоты или основания, таким как эквивалентное количество, в среде, такой как среда, в которой соль осаждается, или в водной среде, с последующей лиофилизацией.
Примеры кислотно-аддитивных солей включают ацетаты, аскорбаты, бензоаты, бензолсульфонаты, бисульфаты, бораты, бутираты, цитраты, камфораты, камфорсульфонаты, фумараты, гидрохлориды, гидробромиды, гидроиодиды, лактаты, малеаты, метансульфонаты, нафталинсульфонаты, нитраты, оксалаты, фосфаты, пропионаты, салицилаты, сукцинаты, сульфаты, тартраты, тиоцианаты, толуолсульфонаты (также известные как тозилаты) и подобные. Кроме того, кислоты, которые в основном считаются подходящими для образования фармацевтически полезных солей из основных фармацевтических соединений, обсуждаются, например, в P. Stahl et al, Camille G. (eds.) Handbook of Pharmaceutical Salts. Properties, Selection and Use. (2002) Zurich: Wiley-VCH; S. Berge et al, Journal of Pharmaceutical Sciences (1977) 66(1) 1-19; P. Gould, International J. of Pharmaceutics (1986) 33 201-217; Anderson et al, The Practice of Medicinal Chemistry (1996), Academic Press, New York; и в The Orange Book (Food & Drug Administration, Washington, D.C. на их веб-сайте). Эти описания включены в настоящее описание посредством ссылки.
Примеры основных солей включают соли аммония, соли щелочных металлов, такие как натриевые, литиевые и калиевые соли, соли щелочноземельных металлов, такие как кальциевые и магниевые соли, соли с органическими основаниями (например, органическими аминами), такими как дициклогексиламины, трет-бутиламины, и соли с аминокислотами, такими как аргинин, лизин и подобные. Основные азотсодержащие группы могут быть кватернизированы при помощи веществ, таких как низшие алкилгалогениды (например, метил-, этил- и бутилхлориды, -бромиды и -иодиды), диалкилсульфаты (например, диметил-, диэтил- и дибутилсульфаты), длинноцепочечные галогениды (например, децил-, лаурил- и стеарилхлориды, -бромиды и -иодиды), аралкилгалогениды (например, бензил- и фенетилбромиды) и др.
Предполагается, что все такие кислотные соли и основные соли являются фармацевтически приемлемыми солями, охватываемыми объемом настоящего изобретения, и все кислотные и основные соли считаются эквивалентными свободным формам соответствующих соединений для целей настоящего изобретения.
Соединения по настоящему изобретению и их соли, сольваты, сложные эфиры и пролекарства могут существовать в их таутомерной форме (например, в виде амида или иминоэфира). Все такие таутомерные формы предусматриваются в настоящем описании как часть настоящего изобретения.
Соединения по настоящему изобретению могут содержать асимметрические или хиральные центры и поэтому могут существовать в различных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений приведенных формул, а также их смеси, включая рацемические смеси, составляют часть настоящего изобретения. Кроме того, настоящее изобретение охватывает все геометрические изомеры и изомеры положения. Например, если соединение приведенной формулы включает двойную связь или конденсированное кольцо, как цис-, так и транс-формы, а также смеси охватываются объемом настоящего изобретения.
Диастереомерные смеси можно разделить на их индивидуальные диастереомеры на основании их физико-химических отличий способами, хорошо известными специалистам в данной области, такими как, например, хроматография и/или фракционированная кристаллизация. Энантиомеры можно разделить путем преобразования энантиомерной смеси в диастереомерную смесь путем взаимодействия с подходящим оптически активным соединением (например, хиральным вспомогательным веществом, таким как хиральный спирт или хлорангидрид кислоты Мошера), разделения диастереомеров и преобразования (например, гидролиз) индивидуальных диастереомеров в соответствующие чистые энантиомеры. Также, некоторые соединения различных формул могут представлять собой атропизомеры (например, замещенные биарилы), и они считаются частью настоящего изобретения. Энантиомеры также можно разделить при использовании хиральной ВЭЖХ колонки.
Также соединения различных формул могут существовать в различных таутомерных формах, и все такие формы охватываются объемом настоящего изобретения. Также, например, все кето-енольные и имин-енаминовые формы соединений включены в настоящее изобретение.
Все стереоизомеры (например, геометрические изомеры, оптические изомеры и подобные) соединений по настоящему изобретению (включая соли, сольваты, сложные эфиры и пролекарства соединений, а также соли, сольваты и сложные эфиры пролекарств), такие как стереоизомеры, которые могут существовать благодаря асимметрическим атомам углерода на различных заместителях, включая энантиомерные формы (которые могут существовать даже в отсутствие асимметрических атомов угдерода), ротамерные формы, атропизомеры и диастереомерные формы, охватываются объемом настоящего изобретения, как и изомеры положения (такие как, например, 4-пиридил и 3-пиридил). (Например, если соединение по настоящему изобретению включает двойную связь или конденсированное кольцо, как цис-, так и транс-формы, а также их смеси охватываются объемом настоящего изобретения. Также, например, все кето-енольные и имин-енаминовые формы соединений включены в настоящее изобретение.) Индивидуальные стереоизомеры соединений по настоящему изобретению могут быть, например, по существу свободными от других изомеров или могут быть смешаны, например, в виде рацематов или со всеми другими, или другими выбранными, стереоизомерами. Хиральные центры по настоящему изобретению могут иметь S или R конфигурацию, как определено рекомендациями IUPAC 1974. Предполагается, что используемые термины "соль", "сольват", "сложный эфир", "пролекарство" и подобные в равной степени относятся к соли, сольвату, сложному эфиру и пролекарству энантиомеров, стереоизомеров, ротамеров, таутомеров, изомеров положения, рацематов или пролекарств соединений по настоящему изобретению.
Настоящее изобретение также охватывает изотопно-меченные соединения по настоящему изобретению, которые идентичны соединениям, описанным в настоящем описании, но в которых один или несколько атомов заменены атомом, имеющим атомную массу или массовое число отличные от атомной массы или массового числа, обычно присутствующих в природе. Примеры изотопов, которые могут быть включены в соединения по настоящему изобретению, включают изотопы водорода, угдерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl, соответственно.
Некоторые изотопно-меченные соединения по настоящему изобретению (например, соединения, меченные 3H и 14C) являются полезными в анализах распределения соединения и/или тканей субстрата. Меченные тритием (т.е. 3H) и угдеродом-14 (т.е. 14C) изотопы являются особенно предпочтительными из-за простоты их получения и детекции. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т.е. 2H), может дать некоторые терапевтические преимущества, являющиеся результатом лучшей метаболической стабильности (например, больший период полужизни in vivo или более низкие необходимые дозы) и, следовательно, могут быть предпочтительными в некоторых обстоятельствах. Изотопно-меченные соединения приведенных формул, как правило, могут быть получены с использованием методик, аналогично описанным в настоящем описании ниже на схемах и/или в примерах, путем замены не меченного изотопом реагента подходящим изотопно-меченным реагентом.
Полиморфные формы соединений по настоящему изобретению и солей, сольватов, сложных эфиров и пролекарств соединений по настоящему изобретению включены в настоящее изобретение.
Преимущества настоящего изобретения включают пероральное введение оптимального количества ингибитора биосинтеза никотинамидфосфорибозилтрансферазы.
Преимущества настоящего изобретения включают внутривенное введение оптимального количества ингибитора биосинтеза никотинамидфосфорибозилтрансферазы.
Преимущества настоящего изобретения включают интраперитонеальное введение оптимального количества ингибитора биосинтеза никотинамидфосфорибозилтрансферазы.
Преимущества настоящего изобретения включают интрамуральное введение оптимального количества ингибитора биосинтеза никотинамидфосфорибозилтрансферазы.
Преимущества настоящего изобретения включают внутримышечное введение оптимального количества ингибитора биосинтеза никотинамидфосфорибозилтрансферазы.
Преимущества настоящего изобретения включают подкожное введение оптимального количества ингибитора биосинтеза никотинамидфосфорибозилтрансферазы.
Преимущества настоящего изобретения включают внутриопухолевое введение оптимального количества ингибитора биосинтеза никотинамидфосфорибозилтрансферазы.
Преимущества настоящего изобретения включают интратекальное введение оптимального количества ингибитора биосинтеза никотинамидфосфорибозилтрансферазы.
Преимущества настоящего изобретения включают субдуральное введение оптимального количества ингибитора биосинтеза никотинамидфосфорибозилтрансферазы.
Преимущества настоящего изобретения включают периорбитальное введение оптимального количества ингибитора биосинтеза никотинамидфосфорибозилтрансферазы.
На основании этих результатов, настоящее изобретение имеет важное значение для разработки новых стратегий лечения пациентов с раком, включая лейкозы и солидные опухоли, воспалительными заболеваниями, остеопорозом, атеросклерозом; синдромом раздраженной толстой кишки и другими состояниями, которые раскрыты в настоящем описании или которые известны специалистам в данной области.
Описание некоторых вариантов осуществления
Один аспект настоящего изобретения относится к соединениям, раскрытым в настоящем описании.
Один аспект настоящего изобретения относится к соединениям, которые являются или могут быть ингибиторами образования никотинамидфосфорибозилтрансферазы.
Один аспект настоящего изобретения относится к применению ингибитора образования никотинамидфосфорибозилтрансферазы для получения лекарственного средства, используемого при лечении, профилактике, ингибировании или устранении опухолей.
Один аспект настоящего изобретения относится к применению ингибитора образования никотинамидфосфорибозилтрансферазы для получения лекарственного средства, используемого при лечении, профилактике, ингибировании или устранении рака.
Один аспект настоящего изобретения относится к применению ингибитора образования никотинамидфосфорибозилтрансферазы для получения лекарственного средства, используемого при лечении, профилактике, ингибировании или устранении рака, где рак выбран из лейкоза, лимфомы, рака яичника, рака молочной железы, рака матки, рака толстой кишки, цервикального рака, рака легкого, рака предстательной железы, рака кожи, рака ЦНС, рака мочевого пузыря, рака поджелудочной железы и болезни Ходжкина.
В настоящем изобретении также описан один или более способов синтеза соединений по настоящему изобретению.
В настоящем изобретении также описано одно или более применений соединений по настоящему изобретению.
В настоящем изобретении также описано одно или более применений соединений по настоящему изобретению с дополнительным средством, как использование с TNF, GCSF или другими химиотерапевтическими средствами.
В настоящем изобретении также описано одно или более применений фармацевтических композиций по настоящему изобретению.
Один аспект настоящего изобретения относится к применению в качестве ингибитора образования никотинамидфосфорибозилтрансферазы для получения лекарственного средства, используемого при лечении воспалительных заболеваний.
Один аспект настоящего изобретения относится к применению в качестве ингибитора образования никотинамидфосфорибозилтрансферазы для получения лекарственного средства, используемого при лечении воспалительных заболеваний, таких как синдром раздраженной толстой кишки или воспалительное заболевание кишечника.
Один аспект настоящего изобретения относится к применению в качестве ингибитора образования никотинамидфосфорибозилтрансферазы для получения лекарственного средства, используемого при лечении заболевания кости, такого как остеопороз.
Один аспект настоящего изобретения относится к применению в качестве ингибитора образования никотинамидфосфорибозилтрансферазы для получения лекарственного средства, используемого при лечении заболевания сердечно-сосудистой системы, такого как атеросклероз.
Один аспект настоящего изобретения относится к применению в качестве ингибитора образования никотинамидфосфорибозилтрансферазы для получения лекарственного средства, используемого при лечении заболевания или состояния, вызванного повышенным уровнем NAMPT.
Такое заболевание или состояние представляет собой одно или более, выбранных из группы, состоящей из рака, рака яичника, рака молочной железы, рака матки, рака толстой кишки, цервикального рака, рака легкого, рака предстательной железы, рака кожи, рака мочевого пузыря, рака поджелудочной железы, лейкоза, лимфомы, болезни Ходжкина, вирусной инфекции, вируса иммунодефицита человека, вируса гепатита, вируса герпеса, простого герпеса, воспалительного расстройства, синдрома раздраженной толстой кишки, воспалительного заболевания кишечника, ревматоидного артрита, астмы, хронического обструктивного заболевания легких, остеоартрита, остеопороза, дерматита, атопического дерматита, псориаза, системной красной волчанки, рассеянного склероза, псориатического артрита, анкилозирующего спондилита, болезни «трансплантат против хозяина», болезни Альцгеймера, сердечно-сосудистого осложнения, атеросклероза, диабета, гломерулонефрита, метаболического синдрома, немелкоклеточного рака легкого, мелкоклеточного рака легкого, множественной миеломы, лейкозов, лимфом, сквамозноклеточных типов раковых заболеваний, рака почки, рака уретры и мочевого пузыря, рака головы и шеи, раковых заболеваний головного мозга и центральной нервной системы (ЦНС).
Соединения по настоящему изобретению могут быть полезными в терапии пролиферативных заболеваний, таких как рак, аутоиммунных заболеваний, вирусных заболеваний, грибковых заболеваний, неврологических/нейродегенеративных расстройств, артрита, воспаления, анти-пролиферативного (например, глазной ретинопатии), нервного, алопеции и сердечно-сосудистого заболевания.
Более конкретно, соединения могут быть полезными при лечении различных раковых заболеваний, включающих (но, не ограничиваясь ими) следующие: карциному, включая карциному мочевого пузыря, молочной железы, толстой кишки, почки, печени, легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, головы и шеи, пищевода, желчного пузыря, яичника, поджелудочной железы, желудка, цервикальную, щитовидной железы, предстательной железы и кожи, включая сквамозноклеточные типы карциномы; гематопоэтические опухоли лимфоидного происхождения, включая лейкоз, острый лимфоцитарный лейкоз, острый лимфобластный лейкоз, B-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, не-ходжкинскую лимфому, волосистоклеточную лимфому, серповидноклеточную лимфому, миелому и лимфому Беркетта; гематопоэтические опухоли миелоидного происхождения, включая острый и хронические миелогенный лейкоз, миелодиспластический синдром и промиелоцитарный лейкоз;
опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркому;
опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и шванномы; и другие опухоли, включая меланому, семиному, тератокарциному, остеосаркому, пигментную ксенодерому, кератоктантому, тиреоидный фолликулярный рак и саркому Капоши.
Соединения по настоящему изобретению могут индуцировать или ингибировать апоптоз.
Соединения по настоящему изобретению также могут быть полезными в хемопрофилактике рака. Хемопрофилактику определяют как ингибирование развития инвазивного рака либо путем блокирования инициирующего мутагенного события, либо путем блокирования прогрессирования пред-злокачественных клеток, которые уже были поражены, или ингибирования рецидива опухоли.
Следующий аспект настоящего изобретения включает способ ингибирования NAMPT пути у животного, причем указанный способ включает введение указанному животному, нуждающемуся в этом, фармацевтически приемлемого количества соединения по настоящему изобретению.
Следующий аспект настоящего изобретения включает фармацевтическую композицию, содержащую соединение по настоящему изобретению.
Еще один вариант осуществления настоящего изобретения включает фармацевтическую композицию по настоящему изобретению, где фармацевтическая композиция при введении человеку обеспечивает снижение опухолевой нагрузки.
Еще один вариант осуществления настоящего изобретения включает фармацевтическую композицию, дополнительно содержащую одно или более противоопухолевых средств, химиотерапевтических средств или дополнительных химиотерапевтических средств.
Фармацевтические композиции по настоящему изобретению могут дополнительно содержать терапевтически эффективное количество дополнительного химиотерапевтического средства.
Дополнительное химиотерапевтическое средство может представлять собой средство, которое модифицирует рост и созревание клеток крови. Неограничивающие примеры дополнительного химиотерапевтического средства включают филграстим, пэгфилграстим и эритропоэтин.
Настоящее изобретение также направлено на способ лечения или профилактики расстройства, связанного с чрезмерной скоростью роста клеток у млекопитающего, включающий введение млекопитающему эффективного количества фармацевтической композиции по настоящему изобретению. Неограничивающие примеры расстройства включают рак или метастазы злокачественных опухолей.
Другой аспект настоящего изобретения включает способ ингибирования роста и скорости деления опухолевых клеток у млекопитающего, страдающего раком или другим расстройством, связанным с аномальным делением клеток, включающий введение млекопитающему эффективного количества фармацевтической композиции по настоящему изобретению.
Другой вариант осуществления настоящего изобретения включает способ лечения костной боли из-за чрезмерного роста опухоли или метастазов в кости у млекопитающего, нуждающегося в этом, включающий введение млекопитающему эффективного количества фармацевтической композиции по настоящему изобретению.
Еще один вариант осуществления настоящего изобретения включает способ введения NAMPT-ингибитор-содержащего соединения млекопитающему, нуждающемуся в этом, включающий введение млекопитающему фармацевтической композиции по настоящему изобретению. В одном варианте осуществления млекопитающим является человек.
Следующий вариант осуществления настоящего изобретения включает способ получения фармацевтической композиции, включающий смешивание, по меньшей мере, одного фармацевтически приемлемого соединения по настоящему изобретению и необязательно одного или более фармацевтически приемлемых эксципиентов или добавок.
Один аспект настоящего изобретения относится к фармацевтическим композициям, содержащим соединение по настоящему изобретению и спасающее клетки средство.
Еще один аспект настоящего изобретения относится к фармацевтическим композициям, содержащим соединение по настоящему изобретению и спасающее клетки средство, выбранное из группы, состоящей из никотинамида, никотиновой кислоты и никотинамидмононуклеотида (NMN).
Настоящее изобретение также направлено на способы синтеза соединений по настоящему изобретению.
Соединения по настоящему изобретению
Изобретение направлено на соединения, описанные в настоящем описании, и их фармацевтически приемлемые соли, сольваты, сложные эфиры, пролекарства или изомеры и фармацевтические комопозиции, содержащие одно или более соединений, описанных в настоящем описании. Изобретение, кроме того, относится к молекулам, которые полезны для ингибирования фермента никотинамидфосфорибозилтрансферазы (NAMPT), и их фармацевтически приемлемым солям или изомерам.
Один аспект настоящего изобретения включает обеспечение соединений, композиций, наборов и антидотов для метаболического пути NAMPT у млекопитающих, имеющих формулу I:
где
Ar1 представляет собой арил, гетероарил, арилалкил или гетероарилалкил, где число гетероатомов каждого из указанного гетероарила и гетероарила независимо составляет 1, 2 или 3, и они независимо выбраны из N, S или O, кроме того, где каждый из указанного арила, гетероарила, арилалкила и гетероарилалкила необязательно может быть либо замещен, либо конденсирован с арилом или гетероарилом, более того, где любой из указанного арила, гетероарила, арилалкила и гетероарилалкила является либо незамещенным, либо необязательно независимо замещен одним или более заместителями, которые могут быть одинаковыми или различными и независимо выбраны из группы, состоящей из дейтерия, галогена циано, амино, аминоалкила-, (амино)алкокси-, -CONH2, -C(О)NH(алкил), -C(О)N(алкил)2, -C(О)NH(арил), -C(О)N(арил)2, -CHZF3-Z, -OCHzF3-z, алкила, алкенила, алкинила, алкокси-, -арилокси-, (алкоксиалкил)окси-, (алкоксиалкил)амино-, -циклоалкила, -гетероциклоалкила, -арила, -C(О)-алкила, -C(О)-арила, -S(О)-арила, -NH-C(О)-алкила, -NH-C(О)-арила и гетероарила, при условии, что два смежных гетероатома в кольце не могут оба представлять собой S или оба представлять собой O;
n равен 0, 1, 2, 3 или 4;
Ar2 представляет собой арил или гетероарил, где каждый из указанного арила и гетероарила является либо незамещенным, либо необязательно независимо замещен 1, 2, 3 или 4 заместителями, которые могут быть одинаковыми или различными и независимо выбраны из группы, состоящей из дейтерия, галогена циано, амино, аминоалкила-, (амино)алкокси-, -CONH2, -C(О)NH(алкил), -C(О)N(алкил)2, -C(О)NH(арил), -C(О)N(арил)2, -CHZF3-Z, -OCHzF3-z, алкила, алкенила, алкинила, алкокси-, -арилокси-, (алкоксиалкил)окси-, (алкоксиалкил)амино-, -циклоалкила, -гетероциклоалкила, -арила, -C(О)-алкила, -C(О)-арила, -S(О)-арила, -NH-C(О)-алкила, -NH-C(О)-арила и гетероарила, при условии, что два смежных гетероатома в кольце не могут оба представлять собой S или оба представлять собой O;
X представляет собой S, S(O), S(О)2, O или C(O);
R1 представляет собой циклоалкил, -CHZF3-Z, арил, гетероциклоалкил, гетероарил, алкил, алкенил, алкинил, (арил)алкил-, (гетероарил)алкил- или (гетероциклоалкил)алкил-, (i) где каждый из указанного циклоалкила, арила, гетероциклоалкила, гетероарила и алкила является либо незамещенным, либо необязательно независимо замещен 1, 2, 3, 4 или 5 заместителями, которые могут быть одинаковыми или различными и независимо выбраны из группы, состоящей из дейтерия, галогена, циано, амино, аминоалкила-, (амино)алкокси-, -CONH2, -C(О)NH(алкил), -C(О)N(алкил)2, -C(О)NH(арил), -C(О)N(арил)2, -CHZF3-Z, -OCHzF3-z, алкила, алкенила, алкинила, алкокси-, арилокси-, (алкоксиалкил)амино-, -циклоалкила, -гетероциклоалкила, -арила, -S(О)2-алкила, -S(О)2-арила, -S(О)2-CF3, -C(О)N(алкил)2, -C(О)алкила, -NH-C(О)-алкила, -NH-C(О)-арила, метилендиокси, гетероарила, арилалкила-, (гетероарил)алкила- и (гетероциклоалкил)алкила-, (ii) кроме того, где каждый из указанного циклоалкила, арила, гетероциклоалкила и гетероарила дополнительно может быть конденсирован с независимо выбранным арилом, гетероарилом, гетероциклоалкилом или циклоалкилом; и z равен 0, 1 или 2;
и его фармацевтически приемлемых солей, сольватов, сложных эфиров, пролекарств или изомеров.
Следующие варианты осуществления направлены на формулу I, как это является подходящим. Для любых групп, которые конкретно не определены, подходят предыдущие определения. Кроме того, арильная, гетероарильная и гетероциклоалкильная группы в этих вариантах осуществления могут быть независимо незамещенными или необязательно замещенными, или необязательно конденсированными, как описано выше. Любой один или более описанных ниже вариантов осуществления, относящихся к формуле I, может быть объединен с одним или более другими вариантами осуществления для формулы I.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой арил, и n, z, X, Ar и R1 являются такими, как определено выше.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой гетероарил, и n, z, X, Ar2 и R1 являются такими, как определено выше.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой (гетероарил)алкил-, и n, z, X, Ar2 и R1 являются такими, как определено выше.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы Id, где различные группы являются независимо выбранными, Ar1 представляет собой арилалкил-, и n, z, X, Ar2 и R1 являются такими, как определено выше.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения, где различные группы являются независимо выбранными, Ar1, n, z, Ar2 и R1 являются такими, как определено выше, и X представляет собой S.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, Ar2 и R1 являются такими, как определено выше, и X представляет собой S(O).
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, Ar2 и R1 являются такими, как определено выше, и X представляет собой S(О2).
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, Ar2 и R1 являются такими, как определено выше, и X представляет собой O.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, Ar2 и R1 являются такими, как определено выше, и X представляет собой C(O).
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, Ar2 и R1 являются такими, как определено выше, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, Ar2 и R1 являются такими, как определено выше, и n равен 2.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой арил, и n, X, Ar2 и R1 являются такими, как определено выше, и z равен 0.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой арил, и n, X, Ar2 и R1 являются такими, как определено выше, и z равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой арил, и n, X, Ar2 и R1 являются такими, как определено выше, и z равен 2.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, X и R1 являются такими, как определено выше, и Ar2 представляет собой арил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, X и R1 являются такими, как определено выше, и Ar2 представляет собой гетероарил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, X и Ar2 являются такими, как определено выше, и R1 представляет собой арил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, X и Ar2 являются такими, как определено выше, и R1 представляет собой гетероарил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, X и Ar2 являются такими, как определено выше, и R1 представляет собой арилалкил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, X и Ar2 являются такими, как определено выше, и R1 представляет собой (гетероарил)алкил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, X и Ar2 являются такими, как определено выше, и R1 представляет собой гетероциклоалкил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1, n, z, X и Ar2 являются такими, как определено выше, и R1 представляет собой (гетероциклоалкил)алкил-.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой фенил, и n, z, X, Ar2 и R1 являются такими, как определено выше.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, и n, z, X, Ar2 и R1 являются такими, как определено выше.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридилметил-, и n, z, X, Ar2 и R1 являются такими, как определено выше.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой имидазопиридил-, и n, z, X, Ar2 и R1 являются такими, как определено выше.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой (имидазопиридил)метил-, и n, z, X, Ar2 и R1 являются такими, как определено выше.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, n, z, Ar2 и R1 являются такими, как определено выше, и X представляет собой S(О2).
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой имидазопиридил, n, z, Ar2 и R1 являются такими, как определено выше, и X представляет собой S(О2).
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридилметил, n, z, Ar2 и R1 являются такими, как определено выше, и X представляет собой S(О2).
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой (имидазопиридил)метил, n, z, Ar2 и R1 являются такими, как определено выше, и X представляет собой S(О2).
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z, X, Ar2 и R1 являются такими, как определено выше, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой имидазопиридил, z, X, Ar2 и R1 являются такими, как определено выше, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридилметил, z, X, Ar2 и R1 являются такими, как определено выше, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой (имидазопиридил)метил-, z, X, Ar2 и R1 являются такими, как определено выше, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z, X и R1 являются такими, как определено выше, Ar2 представляет собой арил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой имидазопиридил, z, X и R1 являются такими, как определено выше, Ar2 представляет собой арил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридилметил, z, X и R1 являются такими, как определено выше, Ar2 представляет собой арил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой (имидазопиридил)метил, z, X и R1 являются такими, как определено выше, Ar2 представляет собой арил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой арил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой гетероарил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой арилалкил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой гетероарилалкил-, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой гетероциклоалкил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой (гетероциклоалкил)алкил-, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой фенил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой пиридил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой нафталенил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой хинолил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой изохинолил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой морфолинил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой морфолинилалкил, и n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формулы I, где различные группы являются независимо выбранными, Ar1 представляет собой пиридил, z и X являются такими, как определено выше, Ar2 представляет собой арил, R1 представляет собой оксаазабициклооктанил, и n равен 1.
Изобретение, представленное в настоящем описании, включает любые комбинации различных вариантов осуществления соединений формулы I, описанных выше.
Другой вариант осуществления настоящего изобретения представляет собой соединения формулы II, которая образована из формулы I, где X представляет собой SO2:
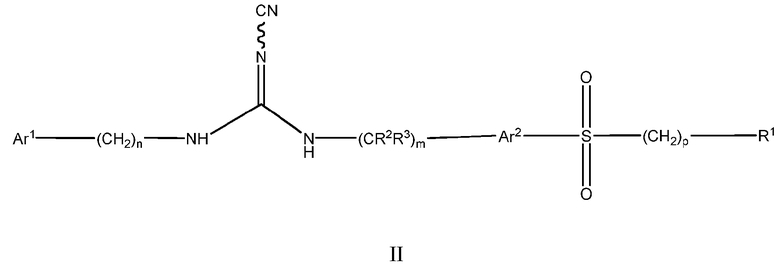
где
Ar1 представляет собой арил или гетероарил, где указанный арил или гетероарил является незамещенным или замещен одним или более заместителями, независимо выбранными из группы, состоящей из:
дейтерия, галогена, циано, алкила, цианоалкила, галогеналкила, алкенила, алкинила, алкокси, галогеналкокси, арилокси, -NRaRb, -C(О)N(RaRb), -C(О)-алкила, -C(О)-арила, -S(О)-арила, -NH-C(О)-алкила, -NH-C(О)-арила, -(алкоксиалкил)окси-, циклоалкила, гетероциклоалкила, арила и гетероарила;
Ar2 представляет собой незамещенный арил или гетероарил;
R1 представляет собой циклоалкил, арил, гетероциклоалкил или гетероарил,
(i) где каждый из указанного циклоалкила, арила, гетероциклоалкила и гетероарила является либо незамещенным, либо необязательно независимо замещен 1, 2, 3, 4 или 5 заместителями, которые могут быть одинаковыми или различными и независимо выбраны из группы, состоящей из:
дейтерия, галогена, циано, алкила, гидроксиалкила, цианоалкила, галогеналкила, алкенила, алкинила, алкокси, алкилалкокси, галогеналкокси, арилокси, -NRaRb, -CONRaRb, -S(О)2-алкила, -S(О)2-арила, -S(О)2N(алкил)2, -S(О)2-CF3, -C(О)алкила, -NH-C(О)алкила, -NH-C(О)арила, метилендиокси, -(CH2)qциклоалкила, -(CH2)qарила, -(CH2)qгетероарила и -(CH2)qгетероциклоалкила,
(ii) где каждый из указанного циклоалкила, арила, гетероциклоалкила и гетероарила дополнительно может быть незамещенным или замещен одним или более заместителями, такими как галоген, циано, алкил или алкокси, или может быть конденсирован с независимо выбранным арилом, гетероарилом, гетероциклоалкилом или циклоалкилом;
Ra и Rb независимо представляют собой H, алкил, алкокси, арил, алкоксиалкил, -S(О)2алкил и циклоалкил, или Ra и Rb могут образовывать 5- или 6-членную гетероциклоалкильную группу вместе с атомом азота, к которому они присоединены, где указанная гетероциклоалкильная группа может содержать один или более дополнительных гетероатомов, выбранных из N, S или O;
R2 и R3 представляют собой H или дейтерий;
m, n, p и q независимо равны 0, 1 или 2;
или их фармацевтически приемлемые соли.
Другой вариант осуществления настоящего изобретения представляет собой соединения формулы IIA:
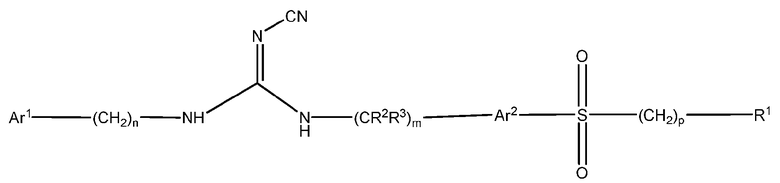
IIA
где различные группы являются такими, как определено выше.
Еще один вариант осуществления настоящего изобретения представляет собой соединения формулы IIB:
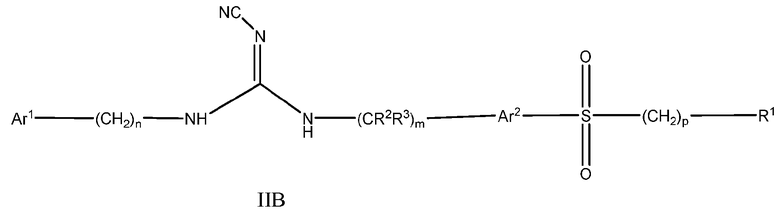
где различные группы являются такими, как определено выше.
В соединениях формул II, IIA и IIB различные группы являются независимо выбранными.
Следующие варианты осуществления направлены на формулы II, IIA и IIB, как это является подходящим. Для любых групп, которые конкретно не определены, действительны предыдущие определения. Кроме того, арильная, гетероарильная и гетероциклоалкильная группы в этих вариантах осуществления независимо могут быть незамещенными или необязательно замещены, или необязательно конденсированы, как описано выше. Любой один или более описанных ниже вариантов осуществления, относящихся к формулам II, IIA и IIB, могут быть объединены с любым одним или более другими вариантами осуществления формул II, IIA и IIB.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и Ar1 представляет собой арил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и Ar1 представляет собой гетероарил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и Ar1 представляет собой незамещенный гетероарил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и Ar1 представляет собой незамещенный пиридин.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и Ar1 представляет собой замещенный пиридин.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и Ar1 представляет собой пиридин, замещенный алкилом.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и Ar1 представляет собой 9- или 10-членный бициклический гетероарил, содержащий 1, 2 или 3 гетероатома, выбранные из N, S или O, при условии, что два смежных гетероатома в кольце не могут оба представлять собой S или оба представлять собой O.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, Ar2 представляет собой фенил, и Ar1 представляет собой имидазопиридин.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и Ar1 представляет собой арил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIBG, где различные группы являются независимо выбранными, и Ar2 представляет собой арил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и Ar2 представляет собой фенил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и Ar2 представляет собой гетероарил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, Ar2 представляет собой фенил, и Ar1 представляет собой имидазопиридин.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и R1 представляет собой арил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и R1 представляет собой незамещенный фенил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и R1 представляет собой фенил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, циано, алкила, алкокси, галогеналкила, гидроксиалкила, цианоалкила, галогеналкокси, алкилсульфонила, гетероциклоалкила, -NHсульфонилалкила, -C(О)алкила, -C(О)гетероциклоалкила, -C(О)NHалкила, -C(О)N(алкил)2, -CO(О)NHциклоалкила, -C(О)NHгетероциклоалкила, арила, гетероарила и гетероарила, необязательно замещенного алкилом.
Один вариант осуществления настоящего изобретения представляет собой соединение формул II, IIA или IIB, где различные группы являются независимо выбранными, и R1 представляет собой незамещенный или замещенный фенил, Ar2 представляет собой незамещенный арил, и Ar1 представляет собой пиридин.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и R1 представляет собой незамещенный гетероарил.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и R1 представляет собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, алкила, алкокси, гетероциклоалкила и -N(RaRb), где RaRb являются такими, как определено выше.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и R1 представляет собой гетероарил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, алкила, алкокси, гетероциклоалкила и -N(RaRb), и Ar2 представляет собой незамещенный арил, и Ar1 представляет собой пиридин.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и R1 представляет собой 9- или 10-членный бициклический гетероарил, содержащий 1, 2 или 3 гетероатома, выбранные из N, S или O, при условии, что два смежных гетероатома в кольце не могут оба представлять собой S или оба представлять собой O.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и R1 представляет собой 9- или 10-членный бициклический гетероарил, где гетероарил выбран из группы, состоящей из пиридина, хинолина, бензодиозола, индазола и 8-окса-3-азабицикло[3.2.1]октана.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где различные группы являются независимо выбранными, и R1 представляет собой 9- или 10-членный бициклический гетероарил, содержащий 1, 2 или 3 гетероатома, выбранные из N, S или O, при условии, что два смежных гетероатома в кольце не могут оба представлять собой S или оба представлять собой O, и Ar2 представляет собой незамещенный арил, и Ar1 представляет собой пиридин.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где q равен 0.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где m равен 0.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где n равен 1.
Один вариант осуществления настоящего изобретения представляет собой обеспечение соединения формул II, IIA или IIB, где p равен 0.
Изобретение, представленное в настоящем раскрытии, включает любые комбинации различных вариантов осуществления соединений формул II, IIA и IIB, описанных выше.
В другом варианте осуществления, изобретение дополнительно проиллюстрировано соединениями, приведенными в таблице 2.
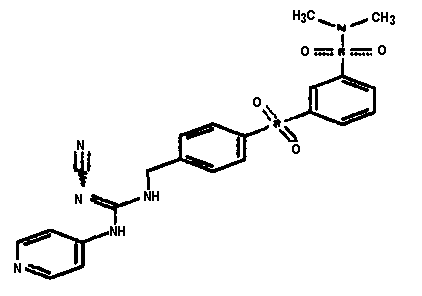
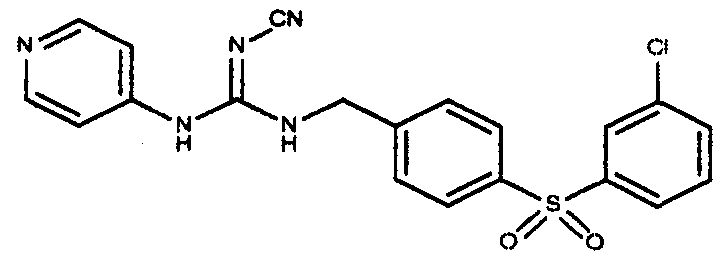
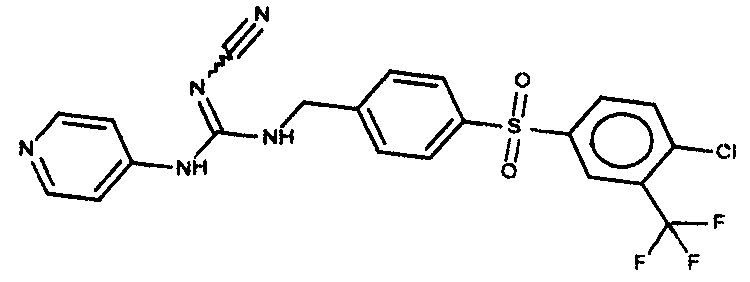
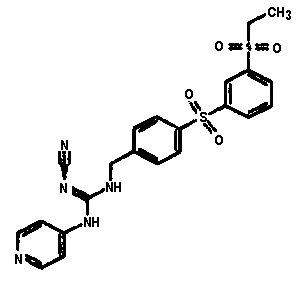
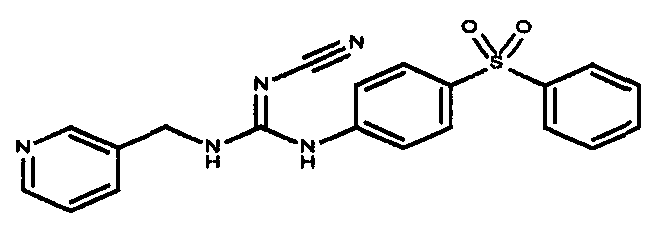
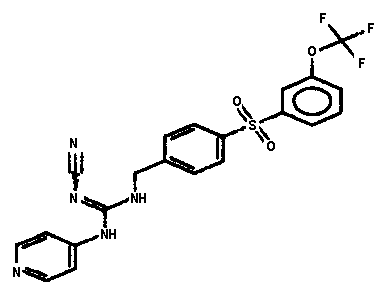
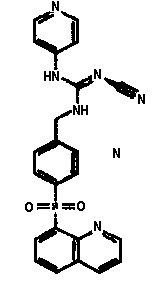
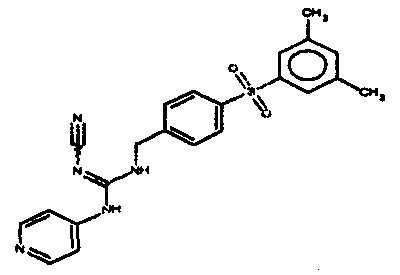
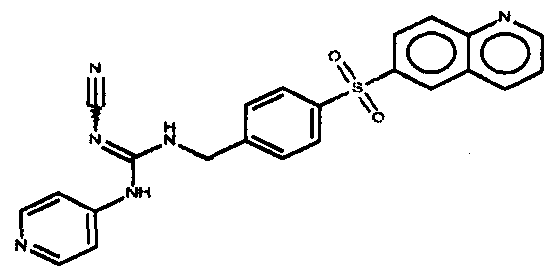
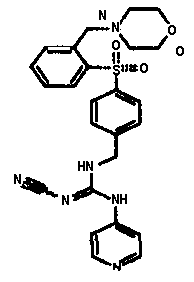
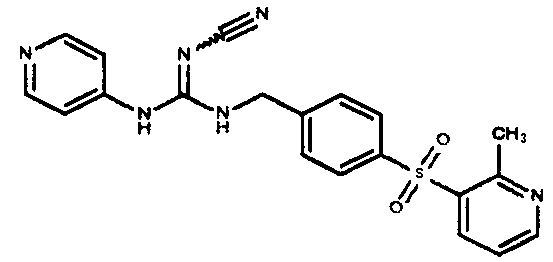
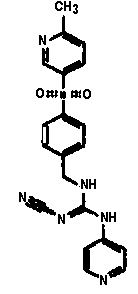
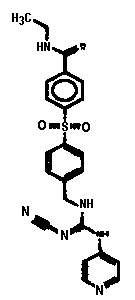
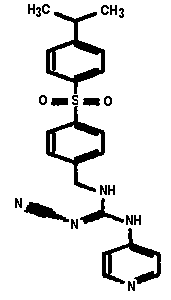
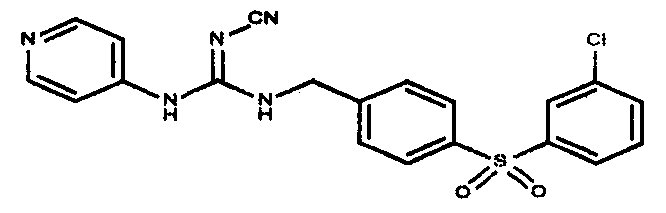
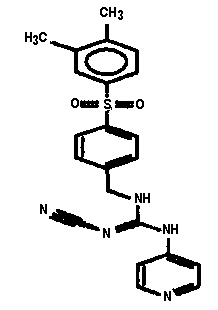
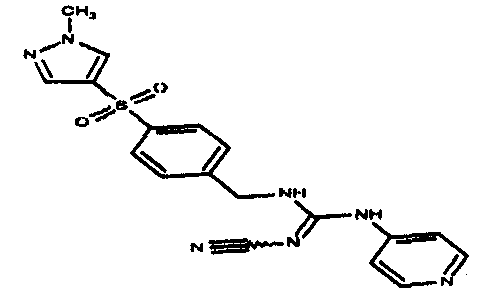
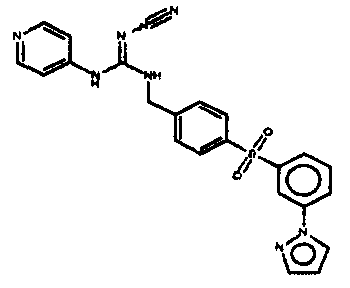
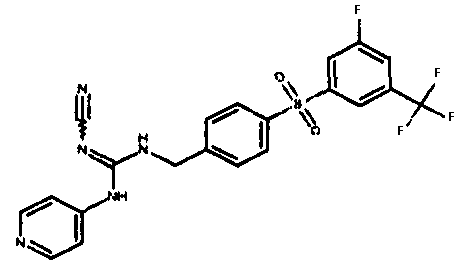
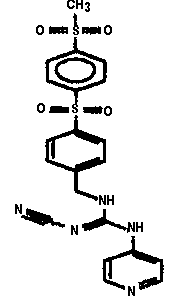
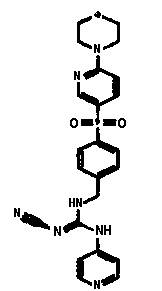
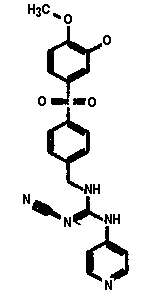
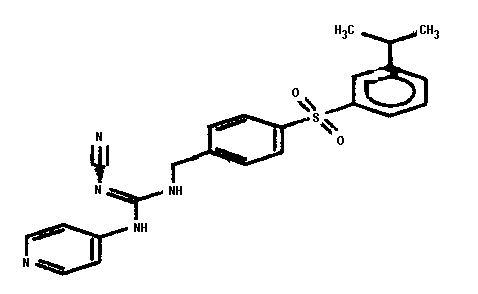
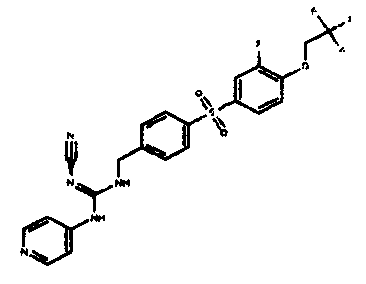
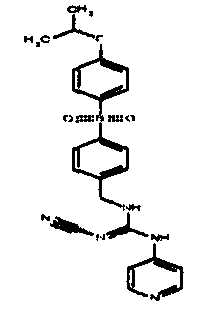
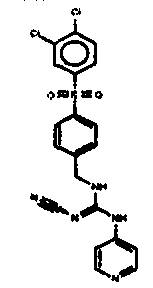
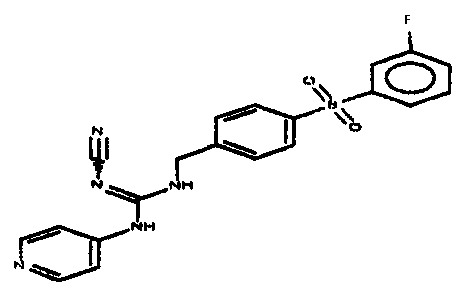
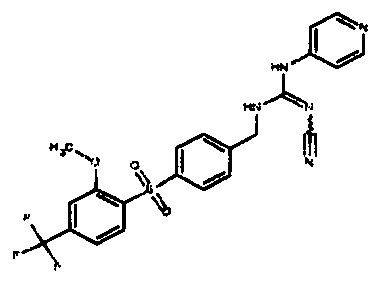
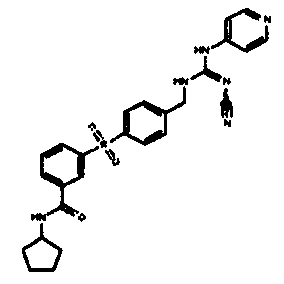
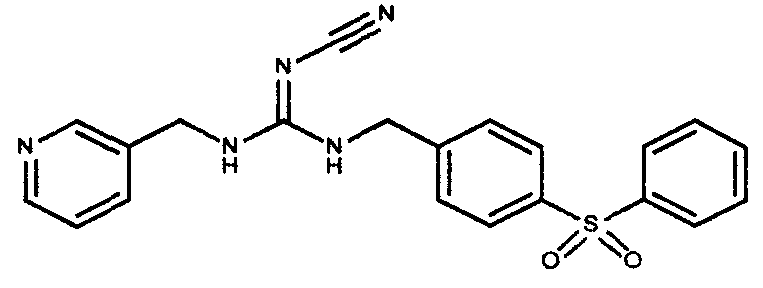
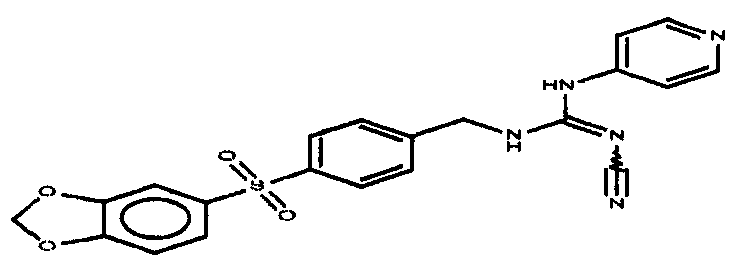
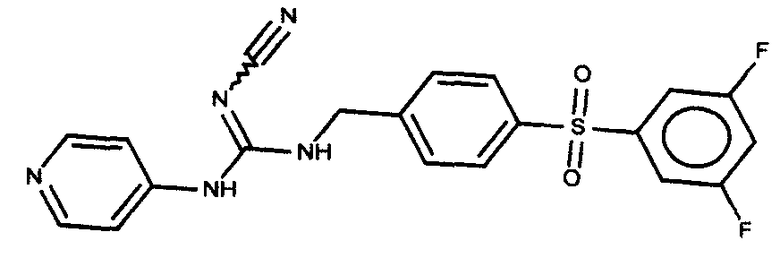
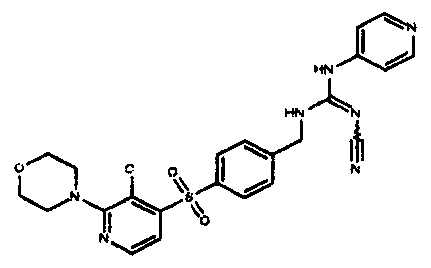
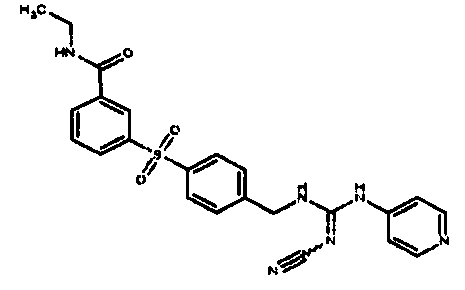
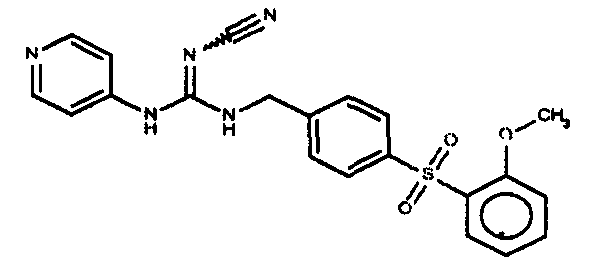
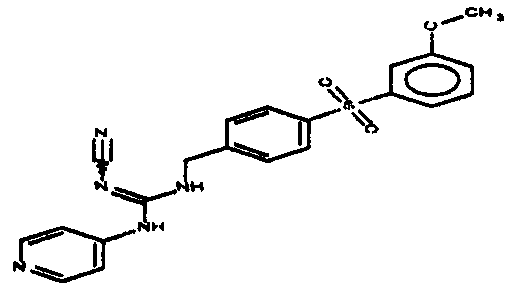
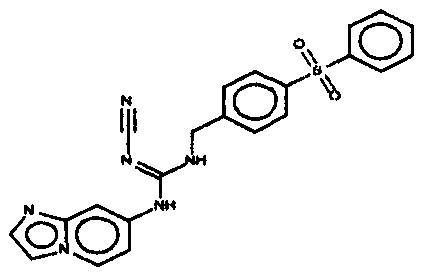
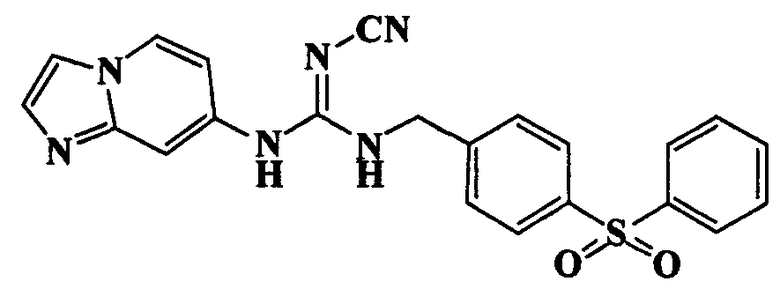
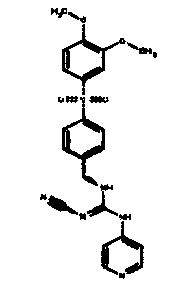
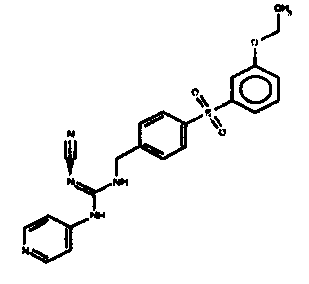
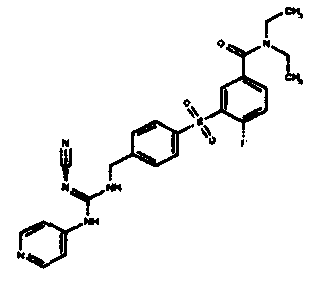
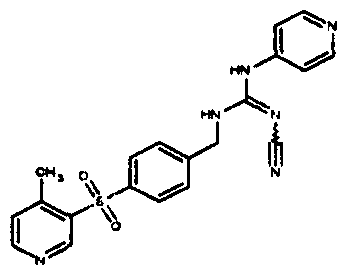
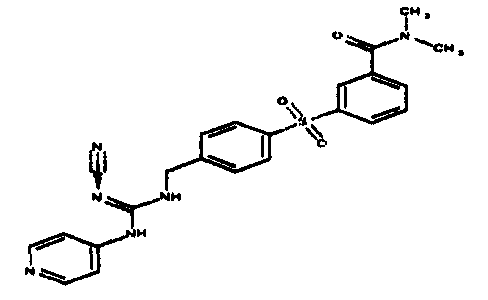
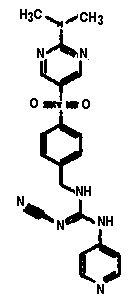
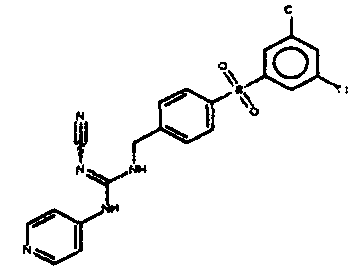
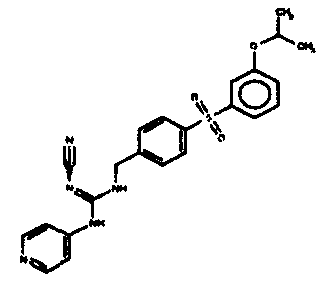
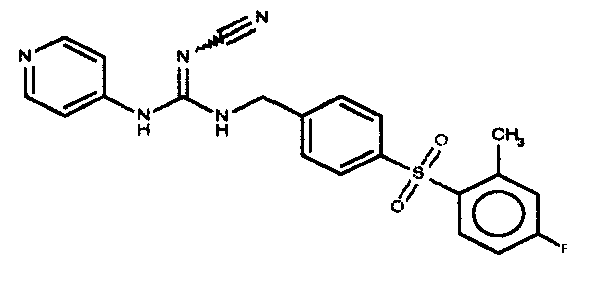
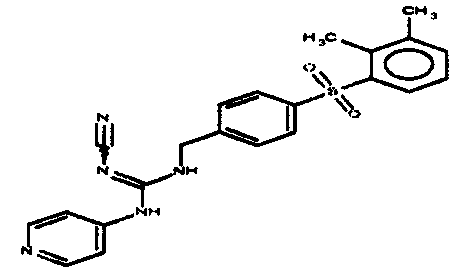
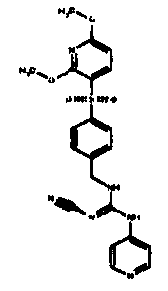
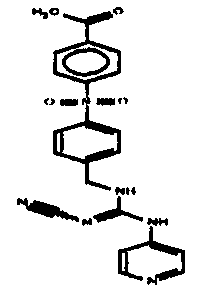
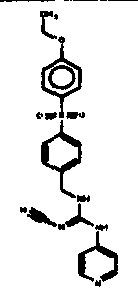
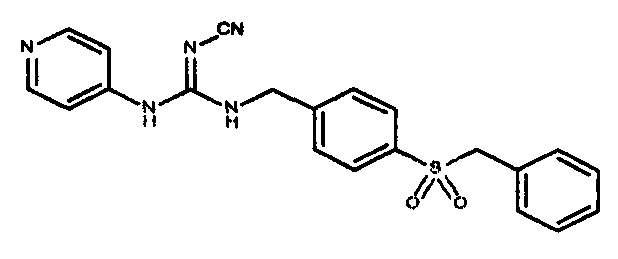
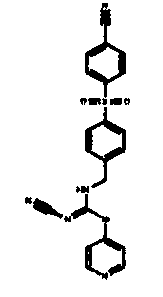
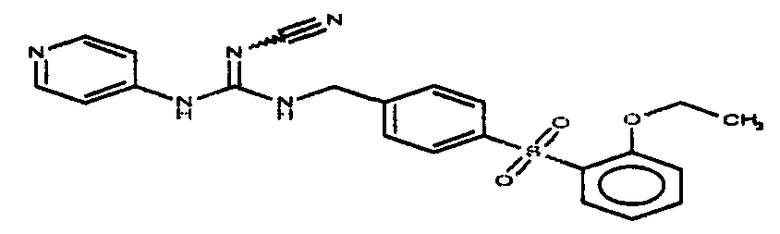
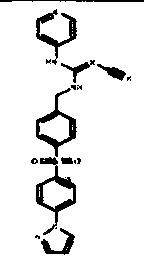
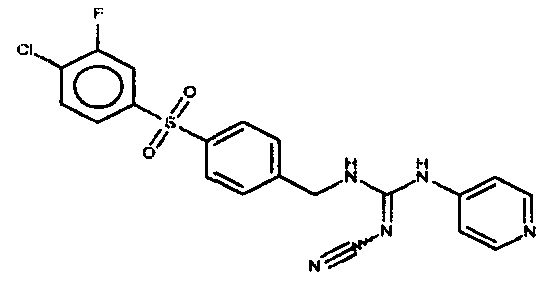
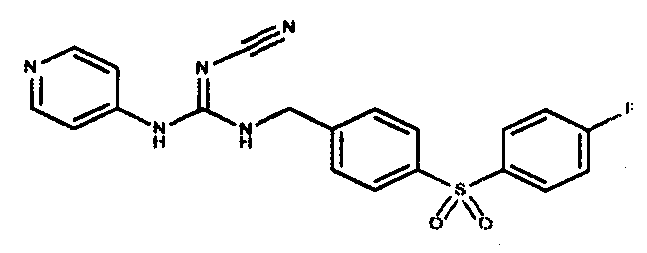
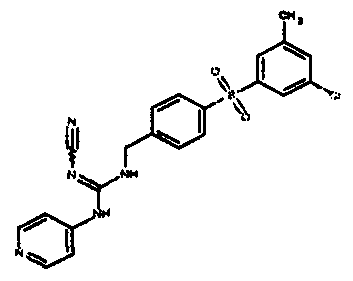
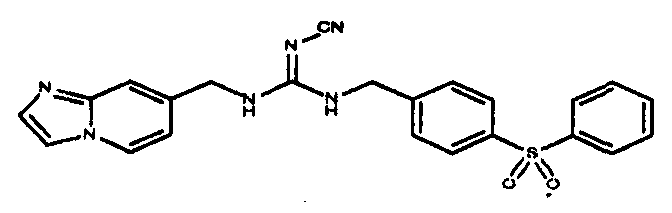
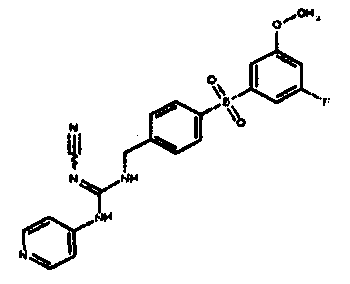
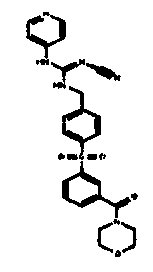
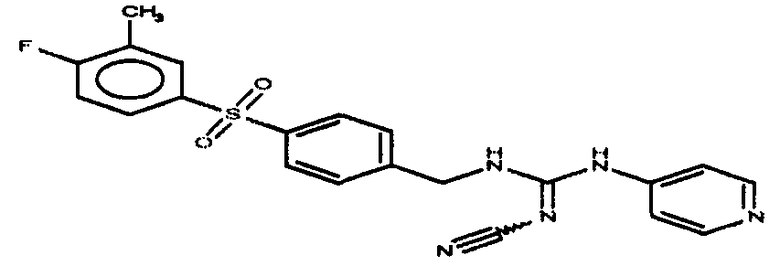
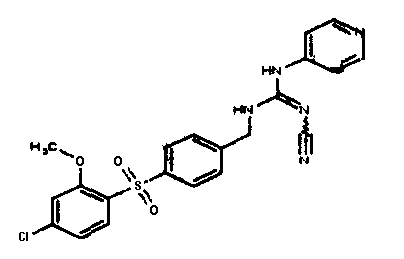
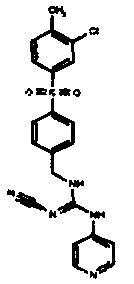
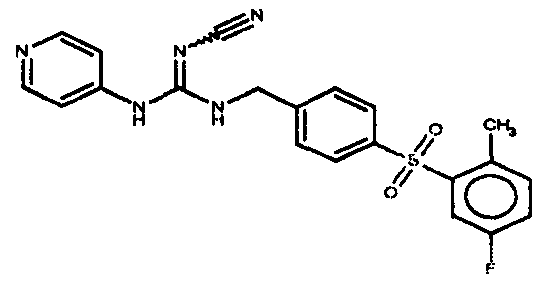
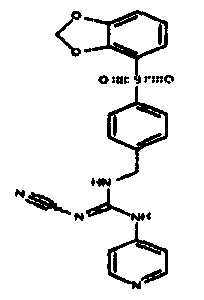
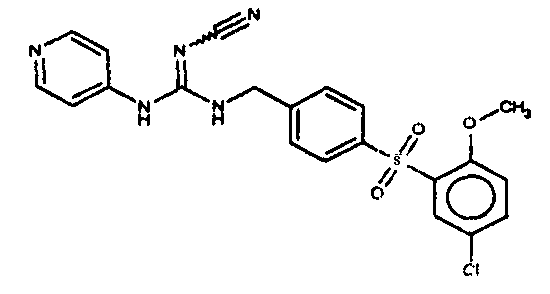
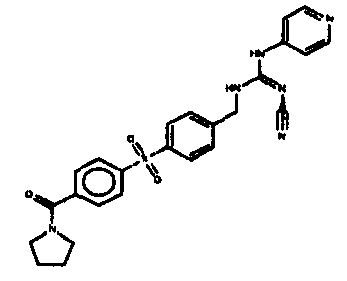
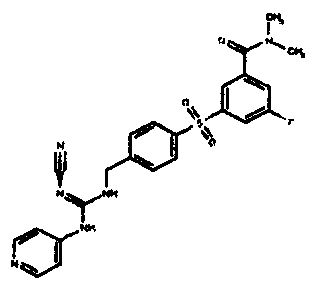
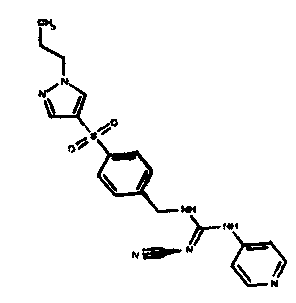
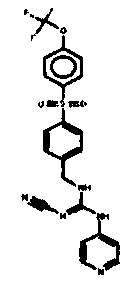
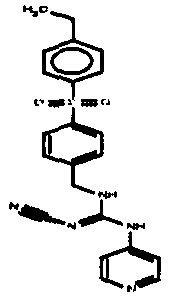
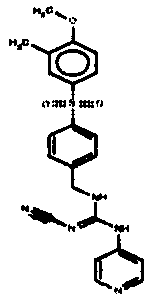
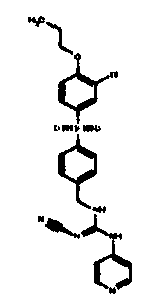
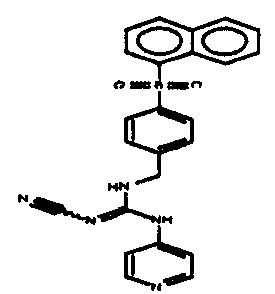
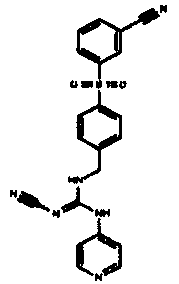
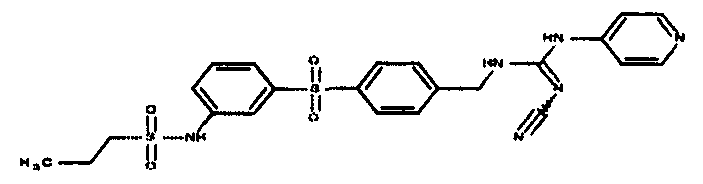
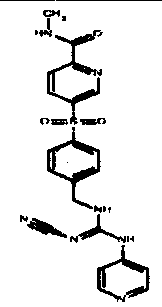
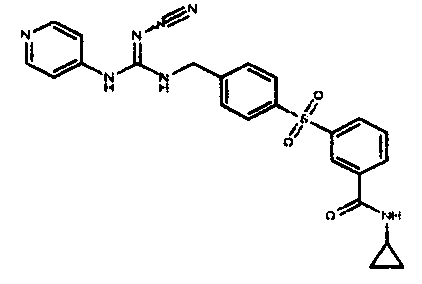
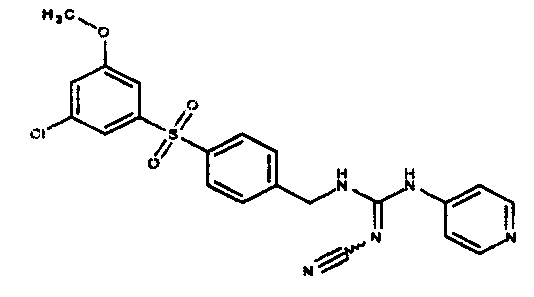
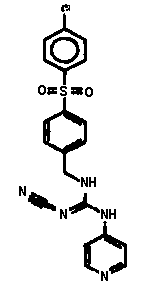
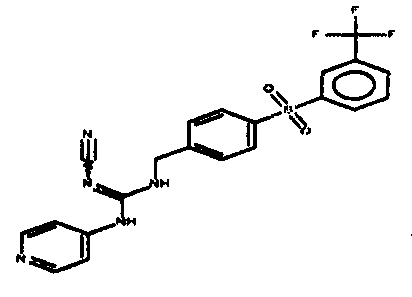
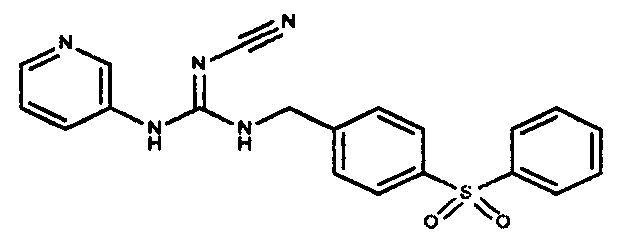
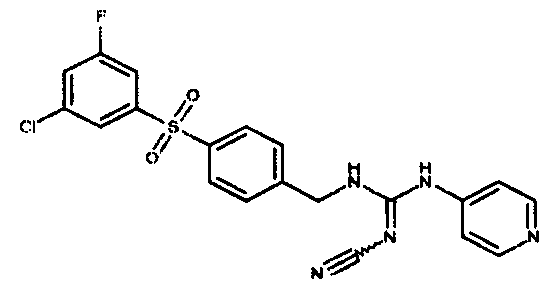
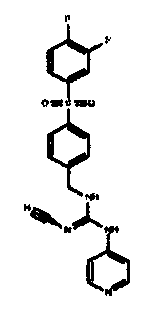
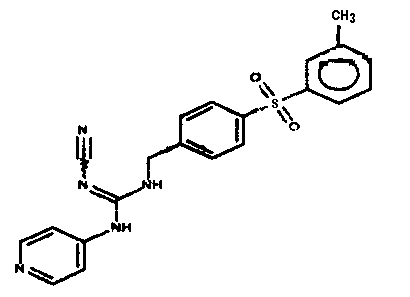
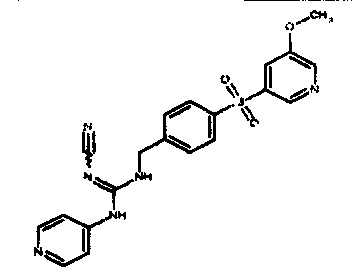
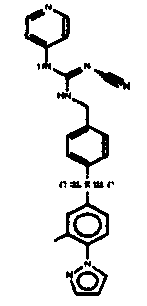
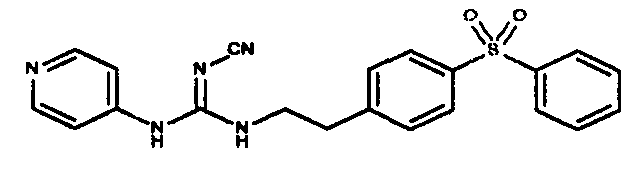
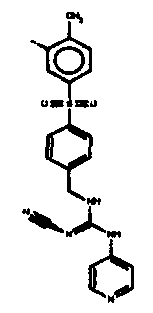
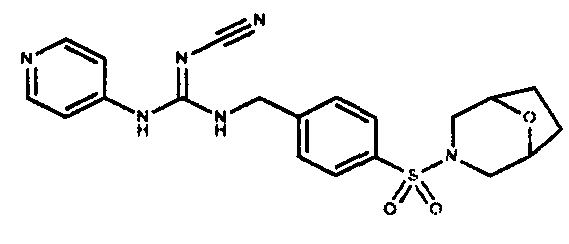
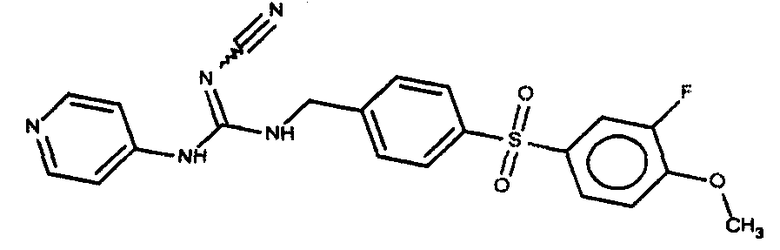
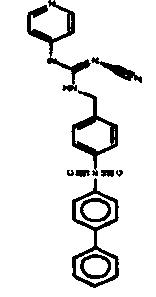
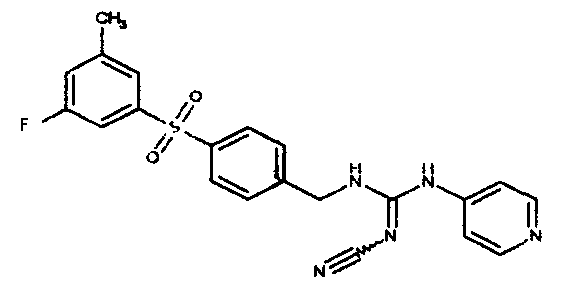
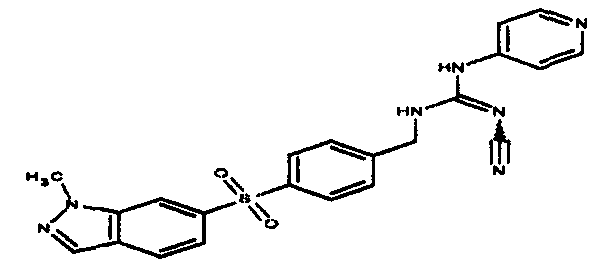
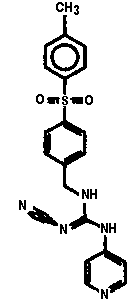
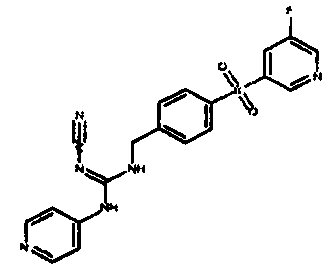
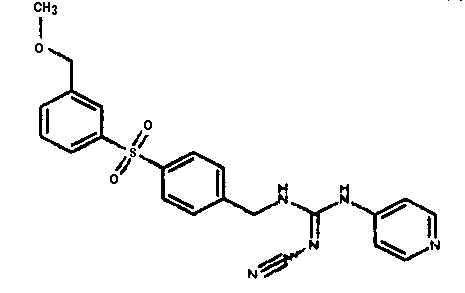
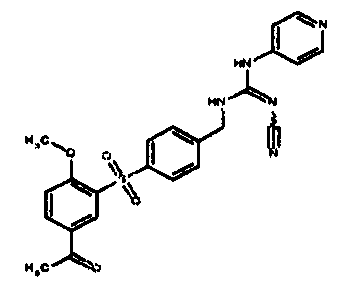
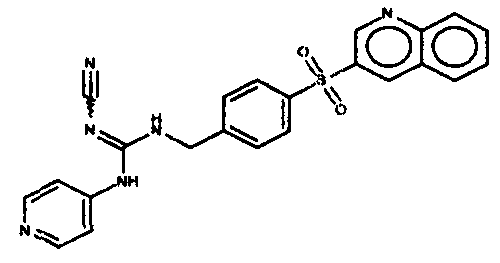
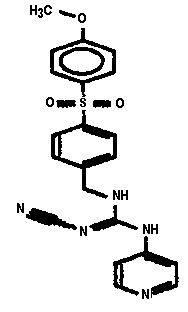
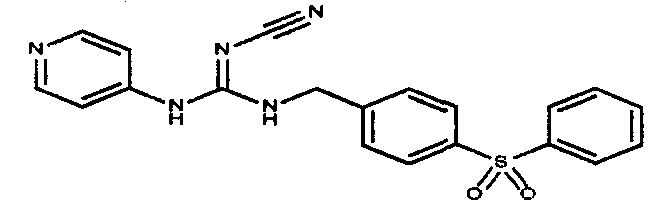
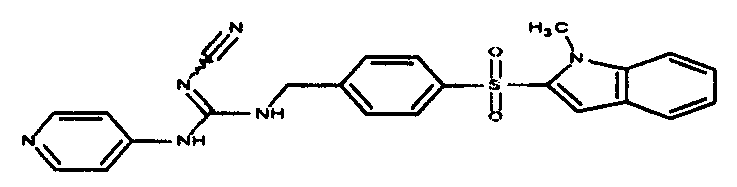
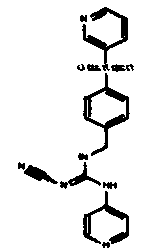
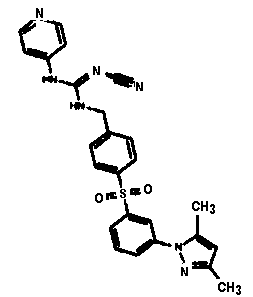
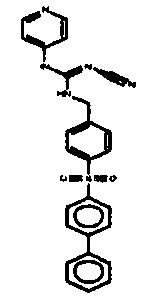
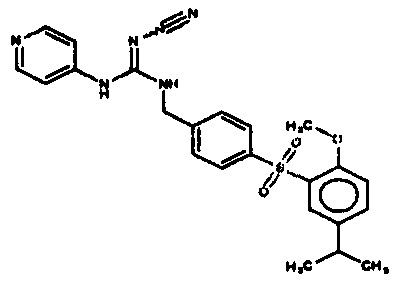
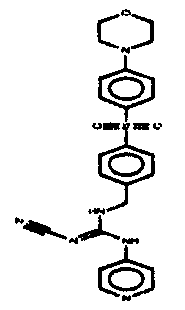
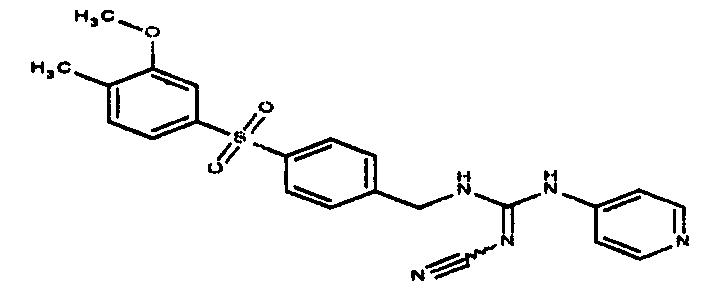
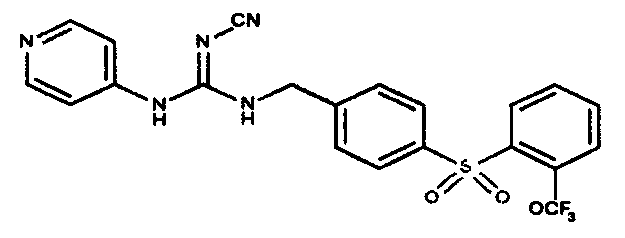
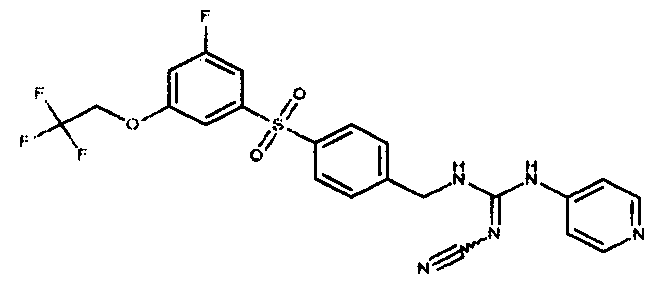
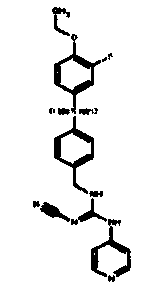
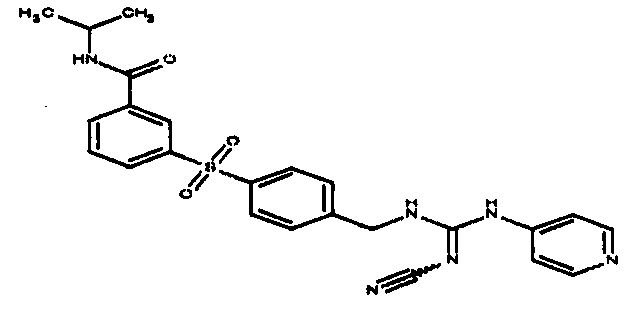
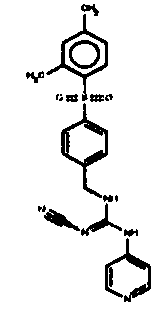
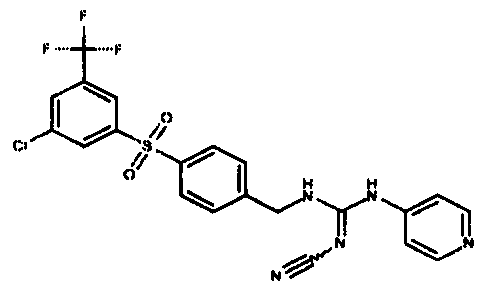
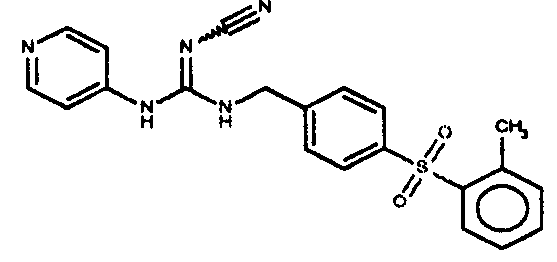
Примеры
Далее представлены иллюстративные, но не ограничивающие, примеры конкретных вариантов осуществления настоящего изобретения.
Определения, используемые в следующих схемах и других разделах в настоящем описании, представляют собой следующие:
Примеры
Изобретение далее проиллюстрировано следующими примерами, которые не должны быть истолкованы как ограничивающие объем или сущность настоящего изобретения описанными в них конкретными методиками. Специалистам в данной области техники будет понятно, что исходные вещества могут варьировать, и можно использовать дополнительные стадии для получения соединений, охватываемых настоящим изобретением, как продемонстрировано при помощи следующих примеров. В некоторых случаях защита определенных реакционноспособных функциональных групп может быть необходима для достижения некоторых указанных выше преобразований. Как правило, такая необходимость защиты групп, а также условия, необходимые для присоединения и удаления таких групп, будут очевидны специалистам в области органического синтеза.
Получение соединений
Соединения по настоящему изобретению могут быть получены разными способами, хорошо известными специалистам в области органического синтеза. В качестве примера, соединения по настоящему изобретению могут быть синтезированы с использованием способов, описанных ниже, вместе со способами синтеза, известными в области синтетической органической химии, или их вариантами, как понятно специалистам в данной области. Предпочтительные способы включают, но не ограничиваются ими, способы, описанные ниже. Соединение по настоящему изобретению цианогуанидин (VI) может быть синтезировано путем осуществления следующих стадий, описанных на схеме 1.
Схема 1
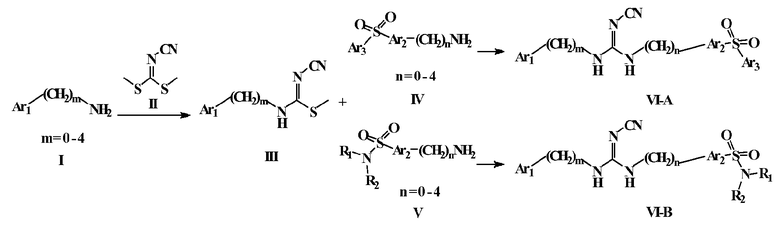
Промежуточное соединение III можно получить путем обработки соединения I соединением II в присутствии основания, такого как DMAP, DBU, в растворителе, таком как ДМФА, DMA, в диапазоне температур от -78°C до 200°C. Соединение по настоящему изобретению VI можно получить путем обработки соединения III либо соединением IV, либо соединением V в присутствии основания, такого как DMAP, в органическом растворителе, таком как пиридин, в диапазоне температур от -78°C до 200°C.
Специалистам в данной области техники будет понятно, что исходные вещества могут варьировать и можно использовать дополнительные стадии для получения соединений, охватываемых настоящим изобретением, как продемонстрировано при помощи следующих примеров. Если не указано иное, все реагенты и растворитель являются стандартными коммерческими веществами и используются без дополнительной очистки.
Эти примеры иллюстрируют получение репрезентативных замещенных цианогуанидиновых аналогов.
Примеры
Получение репрезентативных цианогуанидин-сульфоновых аналогов
Эти примеры иллюстрируют получение репрезентативных замещенных мочевина-сульфонамидных аналогов.
Пример 1
2-циано-1-(4-(фенилсульфонил)бензил)-3-(пиридин-3-ил)гуанидин
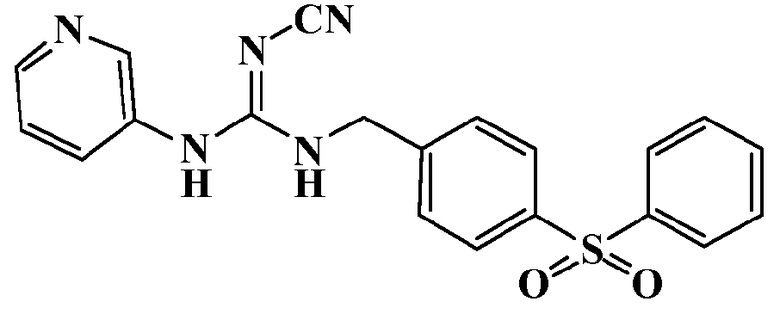
A: 4-(фенилсульфонил)бензонитрил:
Смесь 4-фторбензонитрила (5 г, 41,3 ммоль) и бензолсульфината натрия (7,45 г, 45,4 ммоль) в ДМСО (30 мл) нагревали при 130°C в течение 16 часов. Смесь охлаждали до комнатной температуры и выливали на 300 г льда. Осадок собирали, промывали водой и сушили, с получением указанного в заголовке соединения.
1Н ЯМР (CDCl3) δ: 8,03-8,07 (м, 2H), 7,93-7,97 (м, 2H), 7,78-7,82 (м, 2H), 7,60-7,65 (м, 1H), 7,26-7,58 (м, 2H).
B: (4-[фенилсульфонил]фенил)метанамин:
Смесь 4-(фенилсульфонил)бензонитрила (9,4 г, 38,64 ммоль) и Ni Ренея (500 мг) в 2н растворе NH3-MeOH (150 мл) гидрировали в течение 16 часов при 3,515 кг/см2 (50 ф/дюйм2). Газообразный азот барботировали через смесь, которую затем фильтровали через тонкий слой целита и промывали метанолом. Фильтрат концентрировали и растирали с простым эфиром, с получением указанного в заголовке соединения.
1Н ЯМР (300 МГц, ДМСО-d6): δ 7,85-7,95 (м, 4H), 7,53-7,68 (м, 5H), 3,74 (c, 2H), 1,83 (ушир.c, 2H).
C: метил N'-циано-N-(пиридин-3-ил)карбамидотиоат:
3-аминопиридин (2,0 г, 21,28 ммоль) и диметилцианокарбонимидодитиоат (4,15 г, 25,2 ммоль) растворяли в ДМФА (8 мл) и добавляли DMAP (0,269 г, 2,13 ммоль). Полученный желтый раствор охлаждали до 0°C на ледяной бане, затем порциями добавляли гидрид натрия (0,88 г, 36,6 ммоль) в течение 20 минут при 0°C. Смесь гасили водой (10 мл) и экстрагировали смесью 20% MeOH/DCM (5×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении, с получением желтого остатка. Неочищенное вещество очищали хроматографией на силикагеле (от 2% до 5% MeOH/DCM), с получением указанного в заголовке соединения.
1Н ЯМР (300 МГц, ДМСО-d6): δ 10,27 (c, 1H), 8,61 (д, 1H), 8,47 (т, 1H), 7,90 (м, 1H), 7,45 (м, 1H), 2,73 (c, 3H);
ЖХ-МС(ESI): 191,0 (М-1).
D: 2-циано-1-(4-(фенилсульфонил)бензил)-3-(пиридин-3-ил)гуанидин:
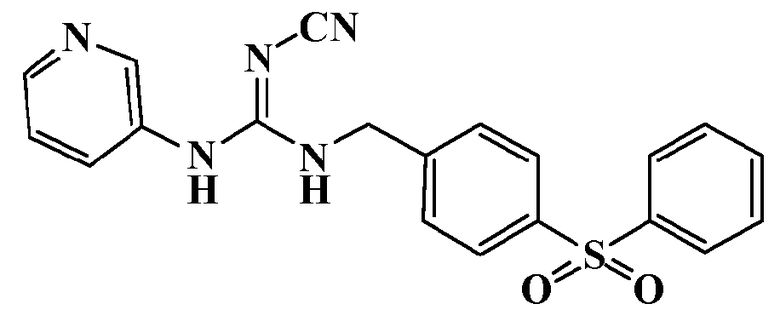
К раствору метил N'-циано-N-(пиридин-3-ил)карбамидотиоата (50 мг, 0,26 ммоль) и (4-[фенилсульфонил]фенил)метанамина (81 мг, 0266 ммоль) в пиридине (3 мл) добавляли TEA (73 мкл, 0,520 ммоль) и DMAP (3,18 мг, 0,026 ммоль). Полученную смесь перемешивали в течение ночи при 60°C. Реакционную смесь охлаждали и концентрировали в вакууме, с получением не совсем белого твердого вещества. Неочищенное вещество очищали хроматографией на силикагеле (2% MeOH/DCM до 6% MeOH/DCM), с получением указанного в заголовке соединения.
1Н ЯМР (300 МГц, ДМСО-d6): δ 8,45 (c, 1H), 8,37 (д, 1H), 7,90 (м, 5H), 7,63 (м, 5H), 7,52 (д, 2H), 7,36 (м, 1H), 4,45 (д, 2H);
ЖХ-МС(ESI): 389,9 (М-1).
Пример 2
2-циано-1-(имидазо[1,2-a]пиридин-7-ил)-3-(4-(фенилсульфонил)бензил)гуанидин
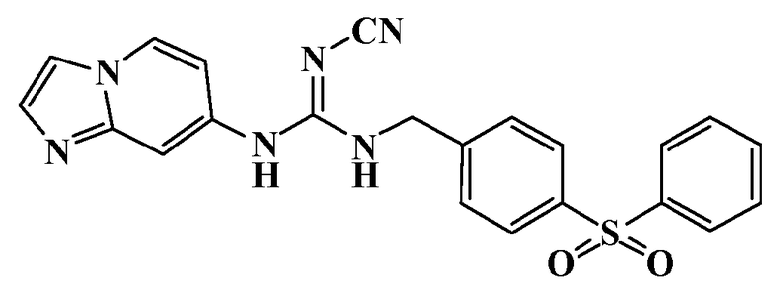
A: метил N'-циано-N-(имидазо[1,2-a]пиридин-7-ил)карбамидотиоат:
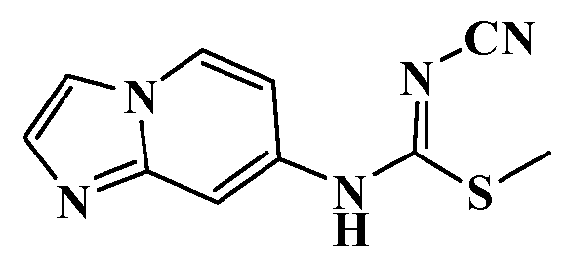
В круглодонную колбу объемом 100 мл добавляли имидазо[1,2-a]пиридин-7-амин (1 г, 7,51 ммоль), диметилцианокарбонимидодитиоат (1,318 г, 9,01 ммоль) и DMAP (0,092 г, 0,751 ммоль) в ДМФА (объем: 10 мл), с получением желтого раствора. Реакционную смесь охлаждали до 0°C и порциями добавляли гидрид натрия (0,323 г, 12,77 ммоль). Реакционную смесь перемешивали при 0°C в течение 4 часов и затем давали нагреться до комнатной температуры в течение ночи. Реакционную смесь затем концентрировали при пониженном давлении, затем разбавляли метиленхлоридом и промывали насыщенным водным раствором NH4Cl. В делительной воронке образовывалось большое количество твердого вещества, поэтому фильтровали всю смесь. Выделяли 2,25 г желтого порошка, который показал продукт, согласно данным ЯМР, наряду с примесью. Очищали твердое вещество на системе Biotage, с получением указанного в заголовке соединения.
1Н ЯМР (300 МГц, ДМСО-d6): δ 11,25 (ушир.c, 1H), 8,49 (д, 1H), 7,93 (c, 1H), 7,52 (д, 1H), 7,64 (c, 1H), 7,03 (дд, 1H), 2,82 (c, 3H);
ЖХ-МС(ESI): 232,09 (М+1).
B: 2-циано-1-(имидазо[1,2-a]пиридин-7-ил)-3-(4-(фенилсульфонил)бензил)гуанидин:
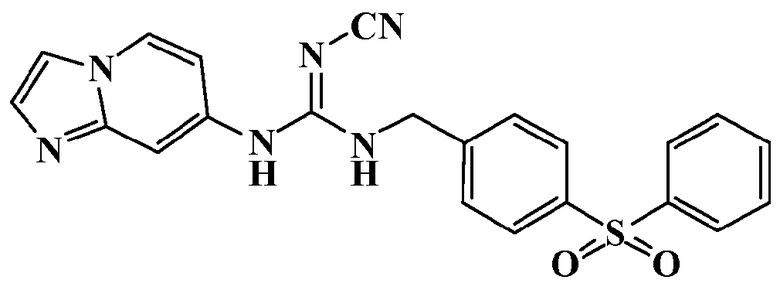
В круглодонную колбу объемом 50 мл добавляли (Z)-метил N'-циано-N-(имидазо[1,2-a]пиридин-7-ил)карбамидотиоат (200 мг, 0,865 ммоль), (4-(фенилсульфонил)фенил)метанамин (214 мг, 0,865 ммоль), DMAP (10,56 мг, 0,086 ммоль) и TEA (0,241 мл, 1,730 ммоль) в пиридине (объем: 10 мл) с последующим нагреванием смеси в течение ночи до 70°C. Реакцию контролировали ЖХМС, затем концентрировали при пониженном давлении и очищали непосредственно на Biotage, с получением 281 мг продукта плюс исходный амин (NMR FT00239-29-A). Полученные вещества очищали снова на Biotage, с получением указанного в заголовке соединения.
1Н ЯМР (ДМСО-d6): δ 9,39 (ушир.c, 1H), 8,46 (д, 1H), 7,86-8,00 (м, 6H), 7,56-7,68 (м, 3H), 7,50 (м, 3H), 7,33 (д, 1H), 6,80 (дд, 1H), 4,44 (д, 2H);
ЖХ-МС(ESI): 445,15 (М+1).
Пример 3
2-циано-1-(имидазо[1,2-a]пиридин-7-илметил)-3-(4-(фенилсульфонил)бензил)гуанидин
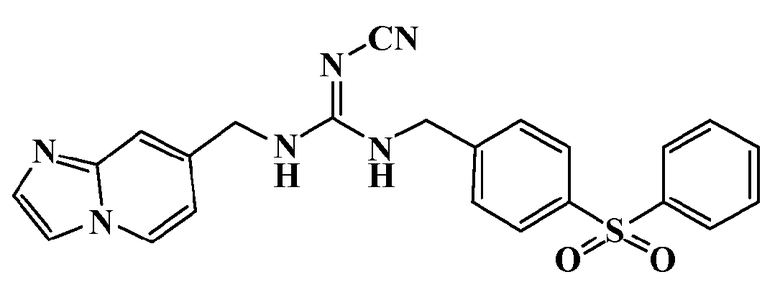
A: метил N'-циано-N-(имидазо[1,2-a]пиридин-7-илметил)карбамидотиоат:
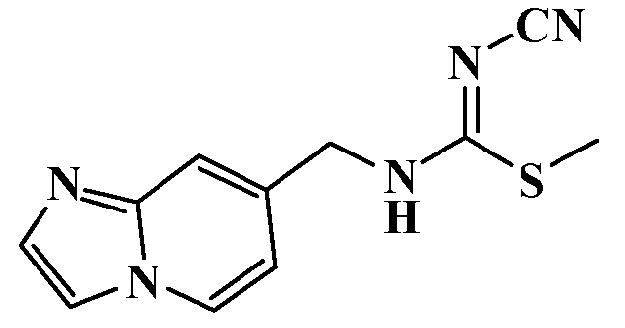
В круглодонную колбу объемом 50 мл добавляли имидазо[1,2-a]пиридин-7-илметанамин (500 мг, 3,40 ммоль), диметилцианокарбонимидодитиоат (621 мг, 4,25 ммоль), DMAP (41,5 мг, 0,340 ммоль) и DIEA (1,187 мл, 6,79 ммоль) в пиридине (объем: 20 мл) с последующим нагреванием смеси до 60°C. Реакционную смесь перемешивали в течение ночи и затем охлаждали до комнатной температуры. Затем к суспензии добавляли метиленхлорид, и смесь фильтровали и промывали метиленхлоридом, с получением указанного в заголовке соединения.
1Н ЯМР (300 МГц, ДМСО-d6): 8,86 (ушир.с, 1H), 8,47 (c, 1H), 9,97 (c, 1H), 7,54 (м, 2H), 7,19 (дд, 1H), 4,41 (c, 2H), 2,61 (3H);
ЖХ-МС(ESI): 246,10 (М+1).
B: 2-циано-1-(имидазо[1,2-a]пиридин-7-илметил)-3-(4-(фенилсульфонил)бензил)гуанидин:
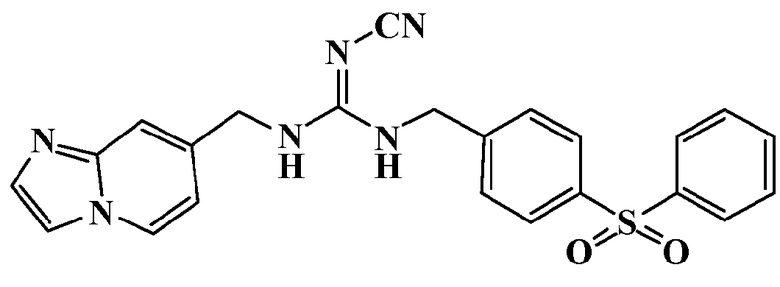
В круглодонную колбу объемом 50 мл добавляли (Z)-метил N'-циано-N-(имидазо[1,2-a]пиридин-7-илметил)карбамидотиоат (400 мг, 1,631 ммоль), (4-(фенилсульфонил)фенил)метанамин (403 мг, 1,631 ммоль), DMAP (19,92 мг, 0,163 ммоль) и триэтиламин (0,500 мл, 3,59 ммоль) в пиридине (объем: 10 мл) с последующим нагреванием реакционной смеси до 100°C в течение ночи. Реакционную смесь затем охлаждали, разбавляли метиленхлоридом и фильтровали. Твердое вещество промывали метиленхлоридом и затем сушили в вакууме, с получением 319,5 мг исходного цианоимидата. ЖХМС анализ маточного раствора показывал только следовые количества продукта. Брали извлеченное вещество и добавляли 1 эквивалент бензиламина, 2 эквивалента триэтиламина и каталитическое количество DMAP в пиридине и нагревали при кипячении с обратным холодильником в течение ночи. ЖХМС анализ показал приблизительно 50% завершение, поэтому нагревание продолжали в течение уикэнда до окончательного завершения. Реакционную смесь концентрировали при пониженном давлении и очищали на системе Biotage, с получением 262 мг продукта с незначительной примесью. Полученное вещество растирали с метиленхлоридом и фильтровали, с получением указанного в заголовке соединения.
1Н ЯМР (ДМСО-d6): δ 8,30 (c, 1H), 7,84-7,93 (м, 5H), 7,74 (т, 1H), 7,54-7,68 (м, 5H), 7,47 (д, 1H), 7,38 (д, 2H), 7,05 (д, 1H), 4,39 (д, 2H), 4,30 (д, 2H);
ЖХ-МС(ESI): 445,15 (М+1).
Пример 4
3-({4-[(3-хлорбензол)сульфонил]фенил}метил)-2-циано-1-(пиридин-4-ил)гуанидин
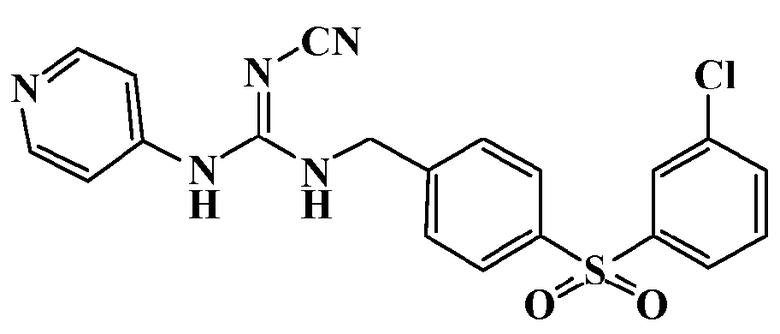
A: 4-(ацетамидометил)бензолсульфинат натрия:
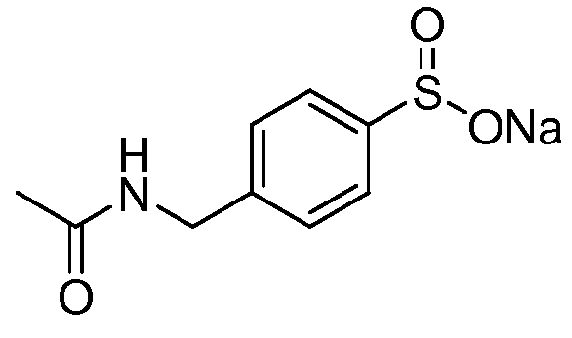
4-(Ацетамидометил)бензол-1-сульфонилхлорид (1,24 г, 5 ммоль) добавляли к охлажденному водой раствору Na2SO3 (1,89 г, 15 ммоль) в воде (3,75 мл), затем несколькими небольшими порциями добавляли твердый NaHCO3 (850 мг, 10 ммоль) для поддержания слабощелочного рН. Смесь перемешивали при температуре окружающей среды в течение 2 часов, с получением густой белой суспензии. Добавляли насыщенный солевой раствор (2 мл) и смесь перемешивали при температуре окружающей среды в течение 15 минут. Осадок собирали фильтрованием и сушили в течение ночи в вакууме. Твердое вещество измельчали и перемешивали с 125 мл MeOH в течение 30 минут, затем твердое вещество отфильтровывали, промывали MeOH (20 мл). Фильтрат концентрировали, с получением указанного в заголовке соединения в виде белого твердого вещества.
1Н ЯМР (400 МГц, CD3OD): δ 7,61 (д, J=8,4 Гц, 2H), 7,34 (д, J=8,4 Гц, 2H), 4,38 (c, 2H), 1,98 (c, 3H).
B: (4-(3-хлорфенилсульфонил)фенил)метанамин:
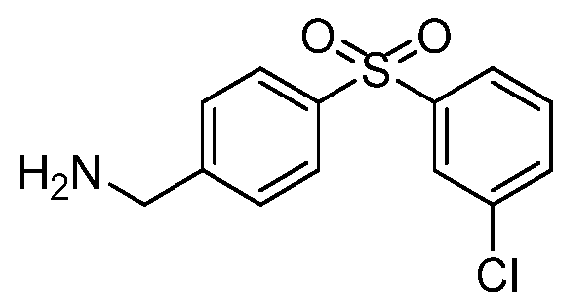
Смесь 4-(ацетамидометил)бензолсульфината натрия (23,5 мг, 0,1 ммоль), 3-хлорбензолбороновой кислоты (19,5 мг, 0,125 ммоль), ацетата меди(II) (22,7 мг, 0,125 ммоль) и TEA (0,063 мл, 0,45 ммоль) в ДМСО (1,5 мл) нагревали при 60°C в течение 16 часов. Смесь охлаждали до комнатной температуры и распределяли между EtOAc и насыщенным солевым раствором. Органический слой отделяли и концентрировали в вакууме. Неочищенное вещество очищали ПТСХ (100% EtOAc), с получением указанного в заголовке соединения в виде белого твердого вещества, которое смешивали с 3н HCl (0,36 мл, 1,08 ммоль) в 70% изо-PrOH (0,2 мл) и нагревали при 100°C в течение 5 часов. Смесь концентрировали досуха, с получением указанного в заголовке соединения.
1Н ЯМР (300 МГц, ДМСО-d6): 8,04-8,10 (м, 2H), 8,01 (т, 1H), 7,91-7,94 (м, 1H), 7,74-7,78 (м, 1H), 7,61-7,69 (м, 3H), 4,11 (ушир, 2H).
C: 3-({4-[(3-хлорбензол)сульфонил]фенил}метил)-2-циано-1-(пиридин-4-ил)гуанидин:
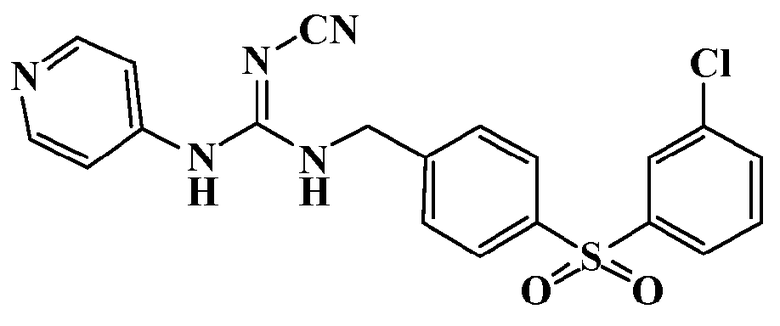
В колбу объемом 100 ил добавляли метил N'-циано-N-(пиридин-4-ил)карбамидотиоат (1 г, 5,2 ммоль) и (4-(3-хлорфенилсульфонил)фенил)метанаминтрифторуксусную кислоту (2,66 г, 6,76 ммоль) в 50 мл пиридина с последующим добавлением триэтиламина (2,17 мл, 15,6 ммоль) и N,N-диметилпиридин-4-амина (32 мг). Смесь нагревали до 60°C в течение 16 часов. Смесь концентрировали и очищали непосредственно на системе biotage, с получением 1,224 г продукта.
1Н ЯМР (300 МГц, ДМСО-d6): 9,63 (ушир.c, 1H), 8,37 (м, 3H), 7,96-8,03 (м, 3H), 7,89-7,98 (м, 1H), 7,73-7,76 (м, 1H), 7,60-7,65 (м, 1H), 7,54-7,55 (д, 2H), 7,17 (c, 2H), 4,52 (д, 2H);
ЖХ-МС: 426,18 (М+1).
Пример 5
(E)-1-(4-(бензилсульфонил)бензил)-2-циано-3-(пиридин-4-ил)гуанидин
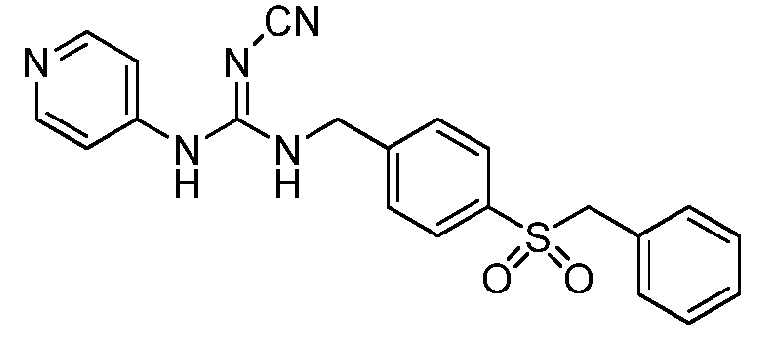
A: N-(4-(бензилсульфонил)бензил)ацетамид:
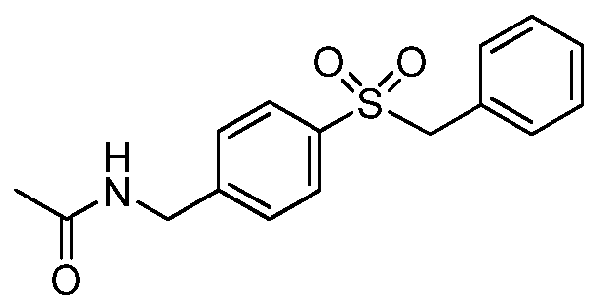
К раствору 4-(ацетамидометил)бензолсульфината натрия (1 г, 4,25 ммоль) в воде (12 мл) добавляли тетрабутиламмониййодид (TBAI) (0,157 г, 0,425 ммоль) и (бромметил)бензол (0,742 г, 4,34 ммоль) в токе N2. Реакционную смесь нагревали до 70°C в течение 2 часов. Выделяли белые твердые вещества. ЖХ-МС анализ показал, что реакция завершена. Белые твердые вещества отфильтровывали и промывали водой и диэтиловым эфиром, затем сушили при пониженном давлении, с получением 696 мг целевого продукта с чистотой 90%, определенной ВЭЖХ. Неочищенный продукт был готов для следующей стадии без дополнительной очистки.
1Н ЯМР (300 МГц, CDCl3) δ 7,54 (д, 2H), 7,33-7,24 (д, 5H), 7,08 (д, 2H), 5,94 (ушир.c, 1H), 4,50 (д, 2H), 4,29 (c, 2H), 2,07 (c, 3H);
ЖХ-МС: М+Н=304,12.
B: (4-(бензилсульфонил)фенил)метанамин:
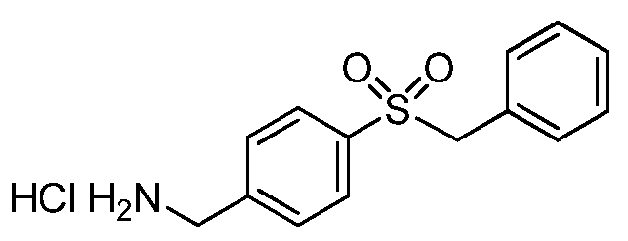
Смесь N-(4-(бензилсульфонил)бензил)ацетамида (300 мг, 0,989 ммоль) и 3н HCl (11,87 мл, 35,6 ммоль) в изо-ΡrΟΗ (12 мл) нагревали до 100°C. Мутная смесь становилась прозрачным раствором при повышении температуры. Реакционную смесь перемешивали в течение 16 часов при 100°C. Белые твердые вещества осаждались после охлаждения смеси до комнатной температуры. Твердые вещества отфильтровывали и промывали небольшим количеством холодной воды и эфира, затем фильтровали и сушили при пониженном давлении, с получением указанного в заголовке соединения в виде гидрохлоридной соли.
1Н ЯМР (300 МГц, ДМСО-d6) δ 8,44 (ушир.c, 3H), 7,75 (д, 2H), 7,66 (д, 2H), 7,29 (м, 3H), 7,15 (м, 2H), 4,69 (c, 2H), 4,12 (c, 2H);
ЖХ-МС: М+Н=262,11.
C: (E)-1-(4-(бензилсульфонил)бензил)-2-циано-3-(пиридин-4-ил)гуанидин:
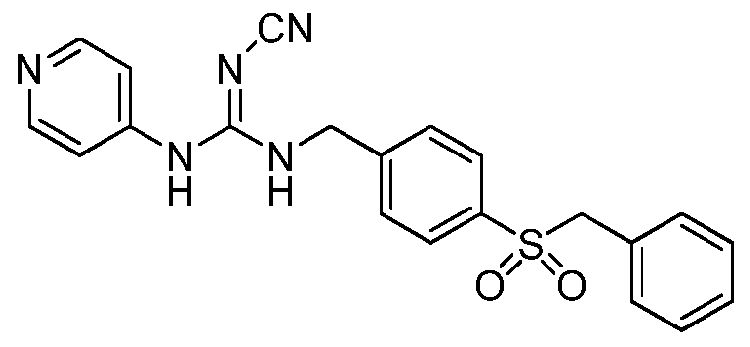
В круглодонную колбу объемом 50 мл добавляли (Z)-метил N'-циано-N-(пиридин-4-ил)карбамидотиоат (47,6 мг, 0,248 ммоль), (4-(бензилсульфонил)фенил)метанамин (65 мг, 0,249 ммоль), DMAP (3,02 мг, 0,025 ммоль) и TEA (0,069 мл, 0,495 ммоль) в пиридине (10 мл) с последующим нагреванием смеси в течение ночи при 80°C. Реакцию отслеживали ЖХ-МС и затем концентрировали при пониженном давлении. Остаток растворяли в дихлорметане и очищали на системе Biotage, с получением указанного в заголовке соединения (31,6 мг, 32% выход).
1Н ЯМР (ДМСО-d6): δ 9,62 (c, 1H), 8,41(c, 3H), 7,68 (д, 2H), 7,48 (д, 2H), 7,26-7,21 (м, 5H), 7,11 (д, 2H), 4,64 (c, 2H), 4,54 (д, 2H);
ЖХМС (ESI): М+H=406,22.
ИСПЫТАНИЯ
Пример испытания 1
Биохимический анализ ингибирования
Очистка белка NAMPT
Рекомбинантный His-меченный NAMPT продуцировали в клетках E.coli, очищали на Ni колонке и затем очищали на разделительной колонке по размеру частиц XTAL Biostructures.
Ферментативная реакция NAMPT
Ферментативные реакции NAMPT осуществляли в буфере A (50 мМ Hepes pH 7,5, 50 мМ NaCl, 5 мМ MgCl2 и 1 мМ THP) в 96-луночных планшетах с V-образным дном. Титрование соединений осуществляли в отдельном планшете для разведений, осуществляя серийные разведения соединений в ДМСО, с получением 100X исходного раствора. Буфер A (89 мкл), содержащий 33 нМ NAMPT белка, добавляли к 1 мкл 100X соединения в планшет, содержащий контроли (например, ДМСО или пустой). Смесь соединения и фермента инкубировали в течение 15 минут при комнатной температуре, затем 10 мкл 10X субстрата и кофакторы в буфере A добавляли в лунки для анализа с получением конечной концентрации 1 мкМ NAM, 100 мкМ 5-Фосфо-D-рибоза 1-дифосфата (PRPP) и 2,5 мМ аденозин 5′-трифосфата (ATP). Реакции давали осуществиться в течение 30 минут при комнатной температуре, затем гасили путем добавления 11 мкл раствора муравьиной кислоты и L-цистатионина, с получением конечной концентрации 1% муравьиной кислоты и 10 мкМ L-цистатионина. Уровень фона и сигнала определяли путем добавления (или не добавления) серийного разведения HMN к предварительно гашеной смеси фермента и кофакторов.
Количественное определение HMN
Анализ на основе масс-спектрометрии использовали для измерения NAMPT реакционного продукта (HMN) и внутреннего контроля (L-цистатионина). Для детекции HMN и L-цистатионина использовали предоставляемые услуги компании Biocius Lifesciences с использованием системы RapidFire. Кратко, HMN и L-цистатионин связывали с графитовым угдеродным картриджем в 0,1% растворе муравьиной кислоты, элюировали в 30% ацетонитрильном буфере и вводили в Sciex 4000 масс-спектрометр. Компоненты образца ионизировали при помощи ионизации электрораспылением и осуществляли детекцию положительных ионов. Массы Q1 (родительский ион) и Q3 (фрагментный ион) HMN составляли 334,2 и 123,2, соответственно. Q1 и Q3 для L-цистатионина составляли 223,1 и 134,1, соответственно. Фрагменты подсчитывали и анализировали следующим способом.
% ингибирования определяли с использованием данного способа.
Сначала HMN сигнал нормализовали к сигналу L-цистатионина путем деления HMN сигнала на сигнал L-цистатионина для каждой лунки. Сигнал от фоновых лунок усредняли и вычитали из испытуемых планшетов. Обработанные соединением клетки затем анализировали для определения % ингибирования с использованием формулы:
% ингибирования=100-100*x/y,
где x означает средний сигнал обработанных соединением лунок, и y означает средний сигнал обработанных ДМСО лунок.
Значения IC50 определяли с использованием Excel и формулы:
IC50=10^(LOG10(X)+(((50-% ингибирования при концентрации 1 соединения)/(XX-YY)*(LOG10(X)-LOG10(Y)))),
где X означает концентрацию 1 соединения, Y означает концентрацию 2 соединения, XX означает % ингибирования при концентрации 1 соединения (X), и YY означает % ингибирования при концентрации 2 соединения (Y).
Соединения по настоящему изобретению, являющиеся ингибиторами NAMPT, имеют значения IC50 ниже 10 мкМ, предпочтительно ниже 1 мкМ, более предпочтительно ниже 0,1 мкМ, и наиболее предпочтительно ниже 0,01 мкМ. Результаты для репрезентативных соединений представлены в таблице 3 ниже.
Пример испытания 2
In-Vitro анализ клеточной пролиферации
A2780 клетки высевали в 96-луночные планшеты при плотности 1×103 клеток/лунка в 180 мкл культуральной среды (10% FBS, 1% пенициллина/стрептомицина амфотерицин B, RPMI-1640), с и без добавления либо β-никотинамидмононуклеотида (HMN), либо никотинамида (NAM). После инкубации в течение ночи при 37°C и 5% CO2 осуществляли титрование соединений в отдельном планшете для разведений, осуществляя серийные разведения соединений в ДМСО, с получением 100X исходного раствора. Соединения затем снова разбавляли до 10X конечной концентрации в культуральной среде, затем 20 мкл каждого разведения добавляли к клеткам в планшете с контролями (например, ДМСО и пустой) до получения конечного объема 200 мкл. Конечная концентрация ДМСО в каждой лунке была 0,1%. Планшеты затем инкубировали в течение 72 часов при 37°C в 5% CO2 инкубаторе. Затем определяли количество жизнеспособных клеток при помощи анализа с использованием сульфородамина B (SRB). Клетки фиксировали при 4°C в течение 1 часа с добавлением 50 мкл 30% раствора трихлоруксусной кислоты (TCA) до получения конечной концентрации 6% TCA. Планшеты промывали четыре раза H2O и давали высохнуть, по меньшей мере, в течение 1 часа, затем в каждую лунку добавляли 100 мкл раствора 4% SRB в 1% уксусной кислоте и инкубировали при комнатной температуре, по меньшей мере, в течение 30 минут. Планшеты затем промывали три раза 1% раствором уксусной кислоты, сушили и обрабатывали 100 мкл раствора 10 мМ Tris-Base. Планшеты затем считывали на микропланшет-ридере при спектральной поглощательной способности 570 нм. Уровень фона устанавливали на отдельном планшете с использованием только среды.
Способ определения % ингибирования
Сначала сигналы от фоновых лунок усредняли, затем значение фона вычитали из испытуемых планшетов. Обработанные соединением клетки затем анализировали для определения % ингибирования с использованием формулы:
% ингибирования = 100-100*x/y,
где x означает средний сигнал обработанных соединением клеток, и y означает средний сигнал обработанных ДМСО клеток.
Формула для определения значений IC50:
IC50=10^(LOG10(X)+(((50-% ингибирования при концентрации 1 соединения)/(XX-YY)*(LOG10(X)-LOG10(Y)))),
где X означает концентрацию 1 соединения, Y означает концентрацию 2 соединения, XX означает % ингибирования при концентрации 1 соединения (X), и YY означает % ингибирования при концентрации 2 соединения (Y).
Специфичность цитотоксичности
Ингибирование NAMPT можно изменить путем добавления NAM или HMN. Специфичность соединений определяли при помощи анализа жизнеспособности клеток в присутствии соединения и либо NAM, либо HMN. Процент ингибирования определяли с использованием способа, описанного выше.
Соединения по настоящему изобретению, являющиеся ингибиторами NAMPT, имеют значения IC50 ниже 1 мкМ, более предпочтительно ниже 0,1 мкМ, и наиболее предпочтительно ниже 0,01 мкМ. Результаты для соединений представлены в таблице 3 ниже.
Исследования ксенотрансплантата in vivo
C.B-17-Igh-1b-Prkdc scid мышам (самки) при помощи подкожной инъекции вводили 5×106 A2780 клетки (NCI) в левый бок. Через 10-12 дней, когда опухоли достигали размера 100-200 мм3, мышей рандомизировали на группы обработки, по 8 мышей на группу, включая контрольную группу введения носителя и группу введения ссылочного стандарта. Соединения формулировали в 60:30:10 PEG-400:D5W:этанол и вводили перорально при дозе объемом 10 мл/кг BID в течение 5 или 10 дней. Дозу, используемую для эффективности, выбирали из MTD (максимально переносимая доза) испытания. Мышей взвешивали и постоянно через день измеряли опухоли с использованием штангенциркулей. Объем опухоли рассчитывали в соответствии с формулой (длина × ширина2)/2. Все работы с животными были одобрены Institutional Animal Care and Use Committee of Biological Resource Centre, Singapore.
Результаты
Следующие соединения обеспечивали регрессию опухоли:
3149471 3-({4-[(3-хлорбензол)сульфонил]фенил}метил)-2-циано-1-(пиридин-4-ил)гуанидин;
3154027 2-циано-3-(пиридин-4-ил)-1-[(4-{[3-(трифторметил)бензол]сульфонил}фенил)метил]гуанидин и
3154028 2-циано-3-(пиридин-4-ил)-1-[(4-{[3-(трифторметокси)бензол]сульфонил}фенил)метил]гуанидин.
Следующее соединение замедляло рост опухоли.
3143046 2-циано-1-({4-[(2-этоксибензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидин.
Хотя настоящее изобретение было описано в связи с конкретными вариантами осуществления, изложенными выше, многие альтернативы, модификации и другие варианты осуществления будут очевидны для специалистов в данной области. Предполагается, что все такие альтернативы, модификации и варианты охватываются существом и объемом настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617424C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2616612C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617643C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617988C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ FASN | 2014 |
|
RU2686323C2 |
| СОЕДИНЕНИЯ N-ПИРРОЛИДИНИЛМОЧЕВИНЫ, N'-ПИРАЗОЛИЛМОЧЕВИНЫ, ТИОМОЧЕВИНЫ, ГУАНИДИНА И ЦИАНОГУАНИДИНА КАК ИНГИБИТОРЫ КИНАЗЫ TRKA | 2013 |
|
RU2677667C2 |
| МОНОМЕРНЫЕ ПРОИЗВОДНЫЕ ГЛИКОПЕПТИДНОГО АНТИБИОТИКА | 2005 |
|
RU2424248C2 |
| СПОСОБ СИНТЕЗА ПРОИЗВОДНЫХ ИМИДАЗОЛАМИНОКИСЛОТ И РОДСТВЕННЫХ СОЕДИНЕНИЙ | 2005 |
|
RU2444516C2 |
| ИНГИБИТОРЫ IAP | 2006 |
|
RU2451025C2 |
| ПРОИЗВОДНЫЕ ДИАЗАГОМОАДАМАНТАНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2549551C2 |
Изобретение относится к соединению формулы II:
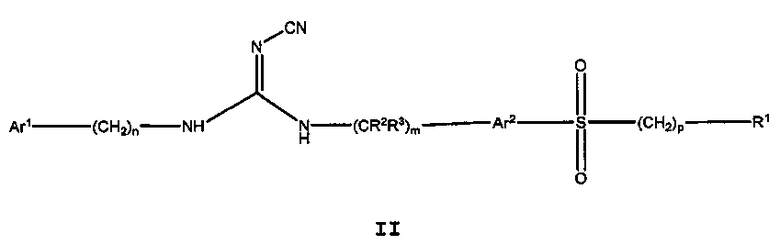
где Ar1 представляет собой 6-10-членный гетероарил, где гетероарил относится к моноциклическому или бициклическому гетероарилу, содержащему 1, 2 или 3 гетероатома, выбранных из N, S или О, при условии, что два смежных гетероатома в кольце не могут оба представлять собой S или оба представлять собой О; Ar2 представляет собой фенил; R1 представляет собой фенил, 5-12-членный гетероциклоалкил или 5-12-членный гетероарил, (i) где каждый из указанного фенила, гетероциклоалкила и гетероарила является либо незамещенным, либо необязательно независимо замещен 1, 2, 3, 4 или 5 заместителями, которые могут быть одинаковыми или различными и независимо выбраны из группы, состоящей из: галогена, циано, алкила, галогеналкила, алкокси, галогеналкокси, -NRaRb, -CONRaRb, -S(О)2-алкила, -S(О)2N(алкил)2, -(СН2)qарила, -(СН2)qгетероарила и -(СН2)qгетероциклоалкила, (ii) где каждый из указанного фенила дополнительно может быть незамещенным или замещен одним или более заместителями, такими как галоген, циано, алкил или алкокси, или может быть конденсирован с независимо выбранным ариломгетероарилом или гетероциклоалкилом; Ra и Rb независимо представляют собой Н, алкил, -S(O)2алкил и циклоалкил, или Ra и Rb могут образовывать 5- или 6-членную гетероциклоалкильную группу вместе с атомом азота, к которому они присоединены, где указанная гетероциклоалкильная группа может содержать один или более дополнительных гетероатомов, выбранных из N, S или О; (iii) указанный 5-12-членный гетероциклоалкил содержит 1, 2 или 3 гетероатома, выбранных из N, S или О; (iv) указанный 5-12- членный гетероарил содержит 1, 2 или 3 гетероатома, выбранных из N, S или О; R2 и R3 представляют собой Н; m, n, р и q независимо равны 0, 1 или 2; и их фармацевтически приемлемые соли. Соединения могут быть использованы для ингибирования NAMPT. 7 н. и 22 з.п. ф-лы,3 табл., 5 пр.
1. Соединения формулы II:

где Ar1 представляет собой 6-10-членный гетероарил, где гетероарил относится к моноциклическому или бициклическому гетероарилу, содержащему 1, 2 или 3 гетероатома, выбранных из N, S или О, при условии, что два смежных гетероатома в кольце не могут оба представлять собой S или оба представлять собой О;
Ar2 представляет собой фенил;
R1 представляет собой фенил, 5-12-членный гетероциклоалкил или 5-12-членный гетероарил,
(i) где каждый из указанного фенила, гетероциклоалкила и гетероарила является либо незамещенным, либо необязательно независимо замещен 1, 2, 3, 4 или 5 заместителями, которые могут быть одинаковыми или различными и независимо выбраны из группы, состоящей из:
галогена, циано, алкила, галогеналкила, алкокси, галогеналкокси, -NRaRb, -CONRaRb, -S(О)2-алкила, -S(О)2N(алкил)2, -(СН2)qарила, -(СН2)qгетероарила и -(СН2)qгетероциклоалкила,
(ii) где каждый из указанного фенила дополнительно может быть незамещенным или замещен одним или более заместителями, такими как галоген, циано, алкил или алкокси, или может быть конденсирован с независимо выбранным ариломгетероарилом или гетероциклоалкилом;
Ra и Rb независимо представляют собой Н, алкил, -S(O)2алкил и циклоалкил, или Ra и Rb могут образовывать 5- или 6-членную гетероциклоалкильную группу вместе с атомом азота, к которому они присоединены, где указанная гетероциклоалкильная группа может содержать один или более дополнительных гетероатомов, выбранных из N, S или О;
(iii) указанный 5-12-членный гетероциклоалкил содержит 1, 2 или 3 гетероатома, выбранных из N, S или О;
(iv) указанный 5-12-членный гетероарил содержит 1, 2 или 3 гетероатома, выбранных из N, S или О;
R2 и R3 представляют собой Н;
m, n, р и q независимо равны 0, 1 или 2;
и их фармацевтически приемлемые соли.
2. Соединения по п. 1, имеющие следующую формулу IIA:
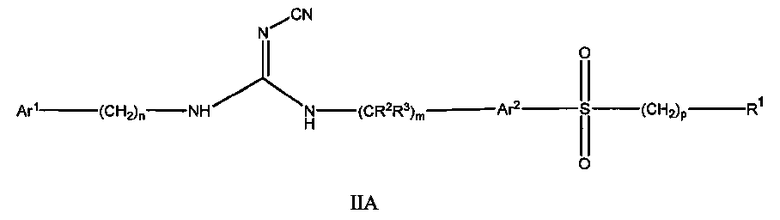
3. Соединения по п. 1, имеющие следующую формулу IIB:
4. Соединения по п. 1, где Ar1 представляет собой незамещенный пиридин.
5. Соединения по п. 1, где Ar1 представляет собой пиридин, замещенный алкилом.
6. Соединения по п. 1, где Ar1 представляет собой 9- или 10-членный бициклический гетероарил, включающий 1, 2 или 3 гетероатома, выбранные из N, S или О, при условии, что два смежных гетероатома в кольце не могут оба представлять собой S или оба представлять собой О.
7. Соединения по п. 6, где Ar1 представляет собой имидазопиридин.
8. Соединения по п. 1, где R1 представляет собой фенил, который является незамещенным или замещен одним или более заместителями, выбранными из группы, состоящей из галогена, циано, алкила, алкокси, галогеналкила, галогеналкокси, алкилсульфонила и гетероарила, необязательно замещенного алкилом.
9. Соединения по п. 1, где R1 представляет собой гетероарил, который является незамещенным или замещен одним или более заместителями, выбранными из галогена, алкила, алкокси, гетероциклоалкила, -N(RaRb), где Ra и Rb являются такими, как определено в п. 1.
10. Соединения по п. 9, где гетероарил представляет собой 5-12-членный моноциклический или бициклический гетероарил, включающий 1, 2 или 3 гетероатома, выбранные из N, S или О, при условии, что два смежных гетероатома в кольце не могут оба представлять собой S или оба представлять собой О.
11. Соединения по п. 10, где гетероарил выбран из группы, состоящей из пиридина, хинолина, бензодиазола, индазола и 8-окса-3-азабицикло[3.2.1]октана.
12. Соединения по п. 1, где q равен 0.
13. Соединения по п. 1, где m равен 0.
14. Соединения по п. 1, где n равен 1.
15. Соединения по п. 1, где р равен 0.
16. Соединение, выбранное из группы, состоящей из:
2-циано-1-[(4-{[3-(диметилсульфамоил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
(Е)-3-({4-[(3-хлорбензол)сульфонил]фенил}метил)-2-циано-1-(пиридин-4-ил)гуанидина;
1-[(4-{[4-хлор-3-(трифторметил)бензол]сульфонил}фенил)метил]-2-циано-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[3-(этансульфонил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
1-[4-(бензолсульфонил)фенил]-2-циано-3-(пиридин-3-илметил)гуанидина;
2-циано-3-(пиридин-4-ил)-1-[(4-{[3-(трифторметокси)бензол]сульфонил}фенил)метил]гуанидина;
2-циано-3-(пиридин-4-ил)-1-{[4-(хинолин-8-сульфонил)фенил]метил}гуанидина;
2-циано-1-({4-[(3,5-диметилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-3-(пиридин-4-ил)-1-{[4-(хинолин-6-сульфонил)фенил]метил}гуанидина;
2-циано-1-[(4-{[2-(морфолин-4-илметил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
2-циано-1-{[4-(2-метилпиридин-3-сульфонил)фенил]метил}-3-(пиридин-4-ил)гуанидина;
2-циано-1-{[4-(6-метилпиридин-3-сульфонил)фенил]метил}-3-(пиридин-4-ил)гуанидина;
4-[(4-{[2-циано-3-(пиридин-4-ил)карбамидамидо]метил}бензол)сульфонил]-N-этилбензамида;
2-циано-1-[(4-{[4-(пропан-2-ил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
3-({4-[(3-хлорбензол)сульфонил]фенил}метил)-2-циано-1-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3,4-диметилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-{[4-(1-метил-1Н-пиразол-4-сульфонил)фенил]метил}-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[3-(1Н-пиразол-1-ил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[3-фтор-5-(трифторметил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(4-метансульфонилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[6-(морфолин-4-ил)пиридин-3-сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
1-({4-[(3-хлор-4-метоксибензол)сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[3-(пропан-2-ил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[3-фтор-4-(2,2,2-трифторэтокси)бензол]сульфонил)фенил)метил]-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[4-(пропан-2-илокси)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3,4-дихлорбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3-фторбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[2-метокси-4-(трифторметил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
3-[(4-{[2-циано-3-(пиридин-4-ил)карбамидамидо]метил}бензол)сульфонил]-N-циклопентилбензамида;
(Е)-3-{[4-(бензолсульфонил)фенил]метил}-2-циано-1-(пиридин-3-илметил)гуанидина;
1-{[4-(2Н-1,3-бензодиоксол-5-сульфонил)фенил]метил}-2-циано-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3,5-дифторбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
1-({4-[3-хлор-2-(морфолин-4-ил)пиридин-4-сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
3-[(4-{[2-циано-3-(пиридин-4-ил)карбамидамидо]метил}бензол)сульфонил]-N-этилбензамида;
2-циано-1-({4-[(2-метоксибензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3-метоксибензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-(имидазо[1,2-а]пиридин-7-илметил)-3-(4-(фенилсульфонил)бензил)гуанидина;
3-{[4-(бензолсульфонил)фенил]метил}-2-циано-1-{имидазо[1,2-а]пиридин-7-ил}гуанидина;
2-циано-1-({4-[(3,4-диметоксибензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3-этоксибензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
3-[(4-{[2-циано-3-(пиридин-4-ил)карбамидамидо]метил}бензол)сульфонил]-N,N-диэтил-4-фторбензамида;
2-циано-1-{[4-(4-метилпиридин-3-сульфонил)фенил]метил}-3-(пиридин-4-ил)гуанидина;
3-[(4-{[2-циано-3-(пиридин-4-ил)карбамидамидо]метил}бензол)сульфонил]-N,N-диметилбензамида;
2-циано-1-({4-[2-(диметиламино)пиримидин-5-сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3,5-дихлорбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[3-(пропан-2-илокси)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(4-фтор-2-метилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(2,3-диметилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-{[4-(2,6-диметоксипиридин-3-сульфонил)фенил]метил}-3-(пиридин-4-ил)гуанидина;
1-({4-[(4-ацетилбензол)сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(4-этоксибензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-3-{[4-(фенилметан)сульфонилфенил]метил}-1-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(4-цианобензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(2-этоксибензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[4-(1Н-пиразол-1-ил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
1-({4-[(4-хлор-3-фторбензол)сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
2-циано-3-({4-[(4-фторбензол)сульфонил]фенил}метил)-1-(пиридин-4-ил)гуанидина;
1-({4-[(3-хлор-5-метилбензол)сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
3-{[4-(бензолсульфонил)фенил]метил}-2-циано-1-{имидазо[1,2-а]пиридин-7-илметил}гуанидина;
2-циано-1-({4-[(3-фтор-5-метоксибензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-{[4-({3-[(морфолин-4-ил)карбонил]бензол}сульфонил)фенил]метил}-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(4-фтор-3-метилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
1-({4-[(4-хлор-2-метоксибензол)сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
1-({4-[(3-хлор-4-метилбензол)сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(5-фтор-2-метилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
1-{[4-(2Н-1,3-бензодиоксол-4-сульфонил)фенил]метил}-2-циано-3-(пиридин-4-ил)гуанидина;
1-({4-[(5-хлор-2-метоксибензол)сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
2-циано-3-(пиридин-4-ил)-1-{[4-({4-[(пирролидин-1-ил)карбонил]бензол}сульфонил)фенил]метил}гуанидина;
2-циано-3-(пиридин-4-ил)-1-[(4-{[4-(трифторметил)бензол]сульфонил}фенил)метил]гуанидина;
3-[(4-{[2-циано-3-(пиридин-4-ил)карбамидамидо]метил}бензол)сульфонил]-5-фтор-N,N-диметилбензамида;
2-циано-1-{[4-(1-пропил-1Н-пиразол-4-сульфонил)фенил]метил}-3-(пиридин-4-ил)гуанидина;
2-циано-3-(пиридин-4-ил)-1-[(4-{[4-(трифторметокси)бензол]сульфонил}фенил)метил]гуанидина;
2-циано-1-({4-[(4-этилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(4-метокси-3-метилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
1-({4-[(3-хлор-4-пропоксибензол)сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
2-циано-1-{[4-(нафталин-1-сульфонил)фенил]метил}-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3-цианобензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[3-(пропан-1-сульфонамидо)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
5-[(4-{[2-циано-3-(пиридин-4-ил)карбамидамидо]метил}бензол)сульфонил]-N-метилпиридин-2-карбоксамида;
3-[(4-{[2-циано-3-(пиридин-4-ил)карбамидамидо]метил}бензол)сульфонил]-N-циклопропилбензамида;
1-({4-[(3-хлор-5-метоксибензол)сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
1-({4-[(4-хлорбензол)сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
2-циано-3-(пиридин-4-ил)-1-[(4-{[3-(трифторметил)бензол]сульфонил}фенил)метил]гуанидина;
3-{[4-(бензолсульфонил)фенил]метил}-2-циано-1-(пиридин-3-ил)гуанидина;
1-({4-[(3-хлор-5-фторбензол)сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3,4-дифторбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3-метилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-{[4-(5-метоксипиридин-3-сульфонил)фенил]метил}-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[3-фтор-4-(1Н-пиразол-1-ил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
1-{2-[4-(бензолсульфонил)фенил]этил}-2-циано-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3-фтор-4-метилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-3-[(4-{8-окса-3-азабицикло[3.2.1]октан-3-сульфонил}фенил)метил]-1-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3-фтор-4-метоксибензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(4-фенилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3-фтор-5-метилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-{[4-(1-метил-1Н-индазол-6-сульфонил)фенил]метил}-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(4-метилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-{[4-(5-фторпиридин-3-сульфонил)фенил]метил}-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[3-(метоксиметил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
1-({4-[(5-ацетил-2-метоксибензол)сульфонил]фенил}метил)-2-циано-3-(пиридин-4-ил)гуанидина;
2-циано-3-(пиридин-4-ил)-1-{[4-(хинолин-3-сульфонил)фенил]метил}гуанидина;
2-циано-1-({4-[(4-метоксибензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
3-{[4-(бензолсульфонил)фенил]метил}-2-циано-1-(пиридин-4-ил)гуанидина;
2-циано-1-{[4-(1-метил-1Н-индол-2-сульфонил)фенил]метил}-3-(пиридин-4-ил)гуанидина;
2-циано-3-(пиридин-4-ил)-1-{[4-(пиридин-3-сульфонил)фенил]метил}гуанидина;
2-циано-1-[(4-{[3-(3,5-диметил-1Н-пиразол-1-ил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
3-хлор-5-[(4-{[2-циано-3-(пиридин-4-ил)карбамидамидо]метил}бензол)сульфонил]-N,N-диэтилбензамида;
2-циано-1-[(4-{[2-метокси-5-(пропан-2-ил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
2-циано-1-[(4-{[4-(морфолин-4-ил)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(3-метокси-4-метилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
2-циано-1-(пиридин-4-ил)-3-[(4-{[2-(трифторметокси)бензол]сульфонил}фенил)метил]гуанидина;
2-циано-1-[(4-{[3-фтор-5-(2,2,2-трифторэтокси)бензол]сульфонил}фенил)метил]-3-(пиридин-4-ил)гуанидина;
2-циано-1-({4-[(4-этокси-3-фторбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
3-[(4-{[2-циано-3-(пиридин-4-ил)карбамидамидо]метил}бензол)сульфонил]-N-(пропан-2-ил)бензамида;
2-циано-1-({4-[(2,4-диметилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
1-[(4-{[3-хлор-5-(трифторметил)бензол]сульфонил}фенил)метил]-2-циано-3-(пиридин-4-ил)гуанидина и
2-циано-1-({4-[(2-метилбензол)сульфонил]фенил}метил)-3-(пиридин-4-ил)гуанидина;
или их фармацевтически приемлемой соли.
17. Фармацевтическая композиция для ингибирования никотинамидфосфорибозилтрансферазы, содержащая соединение по любому из пп. 1-16 и фармацевтически приемлемый носитель.
18. Соединение по любому из пп. 1-16 для применения в способе ингибирования аномального клеточного роста или лечения гиперпролиферативного расстройства у млекопитающего.
19. Способ ингибирования никотинамидфосфорибозилтрансферазы (NAMPT) у пациента путем введения терапевтически эффективного количества по меньшей мере одного соединения по любому из пп. 1-16.
20. Способ лечения, профилактики, ингибирования или устранения заболевания или состояния у пациента путем ингибирования NAMPT у указанного пациента путем введения терапевтически эффективного количества по меньшей мере одного соединения по любому из пп. 1-16, где указанное заболевание или состояние выбрано из группы, состоящей из рака, рака яичников, рака молочной железы, рака матки, рака толстой кишки, цервикального рака, рака легкого, рака предстательной железы, рака кожи, рака мочевого пузыря, рака поджелудочной железы, лейкоза, лимфомы, болезни Ходжкина, вирусных инфекций, вируса иммунодефицита человека, вирусного гепатита, вируса герпеса, простого герпеса, воспалительных заболеваний, синдрома раздраженной толстой кишки, воспалительных заболеваний кишечника, ревматоидного артрита, астмы, хронического обструктивного заболевания легких, остеоартрита, остеопороза, дерматита, атопического дерматита, псориаза, системной красной волчанки, рассеянного склероза, псориатического артрита, анкилозирующего спондилоартрита, заболевания «трансплантат против хозяина», болезни Альцгеймера, нарушения мозгового кровообращения, атеросклероза, диабета, гломерулонефрита, метаболического синдрома, немелкоклеточного рака легкого, мелкоклеточного рака легкого, множественной миеломы, лейкозов, лимфом, сквамозно-клеточных типов рака, рака почки, рака мочеиспускательного канала и мочевого пузыря, рака головы и шеи, рака головного мозга и центральной нервной системы.
21. Способ по п. 20, где указанное заболевание представляет собой рак.
22. Способ по п. 21, где указанный рак выбран из группы, состоящей из лейкоза, лимфомы, рака яичников, рака молочной железы, рака матки, рака толстой кишки, цервикального рака, рака легкого, рака предстательной железы, рака кожи, рака ЦНС, рака мочевого пузыря, рака поджелудочной железы и болезни Ходжкина.
23. Применение соединения по любому из пп. 1-16 или фармацевтической композиции по п. 17 для лечения гиперпролиферативного расстройства у млекопитающего.
24. Применение по п. 23 для лечения рака.
25. Применение соединения по любому из пп. 1-16 или фармацевтической композиции по п. 17 для получения лекарственного средства для лечения рака.
26. Применение по п. 25, где указанный рак выбран из группы, состоящей из лейкоза, лимфомы, рака яичников, рака молочной железы, рака матки, рака толстой кишки, цервикального рака, рака легкого, рака предстательной железы, рака кожи, рака ЦНС, рака мочевого пузыря, рака поджелудочной железы и болезни Ходжкина.
27. Соединения по любому из пп. 1-16, где m равен 1.
28. Соединения по любому из пп. 1-16, где m равен 2.
29. Соединения по любому из пп. 1-16, где n равен 0.
| Способ изготовления вырубных ножевых штампов с фасонным ножом | 1940 |
|
SU61561A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| WO 2005113534,A2, 01.12.2005 | |||
| WO 2003088908,A2, 30.10.2003 | |||
| RU 95105437,A1, 27.10.1996 | |||
| ПРОИЗВОДНЫЕ ПИРИДИЛЦИАНОГУАНИДИНОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2002 |
|
RU2292344C2 |
| ПАТЕНТ КЗ--^^TEK;i!'4LL..A>&1 БйБЛ',;3'1 i':'.A | 0 |
|
SU172960A1 |
Авторы
Даты
2016-08-10—Публикация
2011-09-02—Подача