По настоящей заявке испрашивается приоритет согласно предварительной патентной заявке США № 60/751801, поданной 19 декабря 2005 года, которая приобщена к настоящей заявке ссылкой во всей ее полноте.
Область изобретения
Настоящее изобретение относится к органическим соединениям, применимым для лечения и/или профилактики млекопитающих, и в особенности к ингибиторам белков IAP, применимым для лечения рака.
Уровень техники
Апоптоз или запрограммированная гибель клеток является генетически и биохимически регулируемым механизмом, который играет важную роль в развитии и гомеостазе у беспозвоночных, а также у позвоночных. Отклонения от нормы в апоптозе, которые ведут к преждевременной гибели клеток, связаны с разнообразными нарушениями развития. Недостаточности в апоптозе, которые имеют результатом недостаточное отмирание клеток, связаны с раком и хроническими вирусными инфекциями (Thompson et al., (1995) Science 267, 1456-1462).
Одними из ключевых эффекторных молекул в апоптозе являются каспазы (цистеинсодержащие аспартатспецифические протеазы). Каспазы являются сильными протеазами, расщепляющими после остатков аспарагиновой кислоты, и, будучи активированными, переваривают белки живых клеток из содержимого клетки. Так как каспазы являются столь сильными протеазами, строгий контроль этого семейства белков необходим для предотвращения преждевременной гибели клеток. Как правило, каспазы синтезируются как почти совсем неактивные зимогены, которые требуют протеолитического процессинга, чтобы стать активными. Этот протеолитический процессинг является только одним из путей, которыми каспазы регулируются. Второй механизм осуществляется через семейство белков, которые связывают и ингибируют каспазы.
Семейство молекул, которые ингибируют каспазы, образуют ингибиторы апоптоза (IAP) (Deveraux et al., J Clin Immunol (1999), 19:388-398). IAP первоначально были обнаружены в бакуловирусе по их функциональной способности замещать белок Р35, антиапоптозный ген (Crook et al., (1993) J Virology 67, 2168-2174). IAP описаны в организмах в диапазоне от Drosophila до человека. Независимо от их происхождения структурно IAP содержат от одного до трех повторяющихся (BIR) доменов бакуловирусного IAP, и большинство из них также обладает фингер-мотивом RING с концевым карбоксилом. Домен BIR сам по себе является связывающим цинк доменом из приблизительно 70 остатков, содержащим 4 альфа-спирали и 3 бета-нити с остатками цистеина и гистидина, которые координируют ион цинка (Hinds et al., (1999) Nat. Struct. Biol. 6, 648-651). Это и есть домен BIR, который, по-видимому, вызывает антиапоптозный эффект путем ингибирования каспаз и тем самым подавления апоптоза. Как, например, IAP, связанный с Х-хромосомой человека (XIAP), ингибирует каспазу 3, каспазу 7 и опосредуемую Apaf-1-цитохромом С активацию каспазы 9 (Deveraux et al., (1998) EMBO J. 17 2215-2223). Каспазы 3 и 7 ингибируются BIR2 доменом XIAP, тогда как BIR3 домен XIAP является ответственным за ингибирование активности каспазы 9. XIAP экспрессирован повсеместно в большинстве зрелых и эмбриональных тканей (Liston et al., Natura, 1996, 379(6563):349) и сверхэкспрессирован в некоторых линиях опухолевых клеток панели клеточных линий NCI 60 (Fong et al. Genomics, 2000, 70:113; Tamm et al., Clin. Cancer Res. 2000, 6(5):1796). Сверхэкспрессия XIAP в опухолевых клетках служит доказательством создания защиты против разнообразных про-апоптозных стимулов и промотирует резистентность к химиотерапии (LaCasse et al., Oncogene, 1998, 17(25):3247). В соответствии с этим сильная корреляция между уровнями белка XIAP и выживанием продемонстрирована для пациентов с острым миелогенным лейкозом (Tamm et al., указано выше). Понижающая регуляция экспрессии XIAP антисмысловыми олигонуклеотидами, как было показано, сенсибилизирует опухолевые клетки к гибели, вызываемой широким диапазоном про-апоптозных агентов, как in vitro, так и in vivo (Sassaki et al., Cancer Res., 2000, 60(20):5659; Lin et al., Biochem. J., 2001, 353:299; Hu et al., Clin. Cancer Res., 2003, 9(7):2826). Smac/DIABLO-производные пептиды, как было также продемонстрировано, сенсибилизируют некоторые линии различных опухолевых клеток к апоптозу, вызываемому разнообразными про-апатозными лекарственными средствами (Arnt et al., J. Biol. Chem., 2002, 277(46): 44236; Fulda et al., Natura Med., 2002, 8(8): 808; Guo et al., Blood, 2002, 99(9): 3419; Vucic et al., J. Biol. Chem., 2002, 277(14): 12275; Yang et al., Cancer Res., 2003, 63(4): 831).
IAP меланомы (ML-IAP) является IAP, не обнаруживаемый в большинстве нормальных зрелых тканей, но является повышающе регулируемым в меланоме (Vucic et al., (2000) Current Bio 10:1359-1366). Определение структуры белка показало значительную гомологию фингерных доменов ML-IAP BIR и RING по отношению к соответствующим доменам, присутствующим в организме человека, XIAP, C-IAP1 и C-IAP2. BIR домен ML-IAP, по-видимому, имеет большинство подобий BIR2 и BIR3 доменов XIAP, C-IAP1 и C-IAP2 и, очевидно, является ответственным за ингибирование апоптоза, как определено делеционным анализом. Более того, Vucic et al. продемонстрировано, что ML-IAP может ингибировать апоптоз, вызываемый химиотерапевтическим агентом. Агенты, такие как адриамицин и 4-трет-бутилфенол (4-ТВР), были испытаны в системе клеточных культур меланом, сверхэкспрессирующих ML-IAP, и химиотерапевтические агенты были значительно менее эффективны в уничтожении клеток по сравнению с нормальным меланоцитарным контролем. Механизм, посредством которого ML-IAP проявляет антиапоптозную активность, осуществляется частично через ингибирование каспазы 3 и 9. ML-IAP не ингибирует эффективно каспазы 1, 2, 6 или 8.
Так как апоптоз является точно регулируемым путем с многочисленными взаимодействующими факторами, открытие того, что IAP сами по себе регулируются, не является необычным. У плодовой мушки Drosophila белки Reaper (rpr), Head Involution Defective (hid) и GRIM физически взаимодействуют с IAP семейства Drosophila и ингибируют их антиапоптозную активность. У млекопитающих белки SMAC/DIABLO действуют так, что блокируют IAP и дают возможность происходить апоптозу. Показано, что во время нормального апоптоза, SMAC переходит в активную форму и высвобождается из митохондрии в цитоплазму, где физически связывается с IAP и препятствует связыванию IAP с каспазой. Это ингибирование IAP дает возможность каспазе оставаться активной и, следовательно, возобновлять апоптоз. Интересно, что гомологичность последовательности между ингибиторами IAP показывает, что существует четыре аминокислотных мотива на N-конце преобразованных активных белков. Этот тетрапептид, по-видимому, связывается с образованием гидрофобного кармана в BIR домене и нарушает связывание BIR домена с каспазами (Chai et al., (2000) Natura 406:855-862, Liu et al., (2000) Natura 408:1004-1008, Wu et al., (2000) Natura 408:1008-1012).
Сущность изобретения
В одном аспекте настоящего изобретения предложены новые ингибиторы белков IAP, имеющие общую формулу (I):
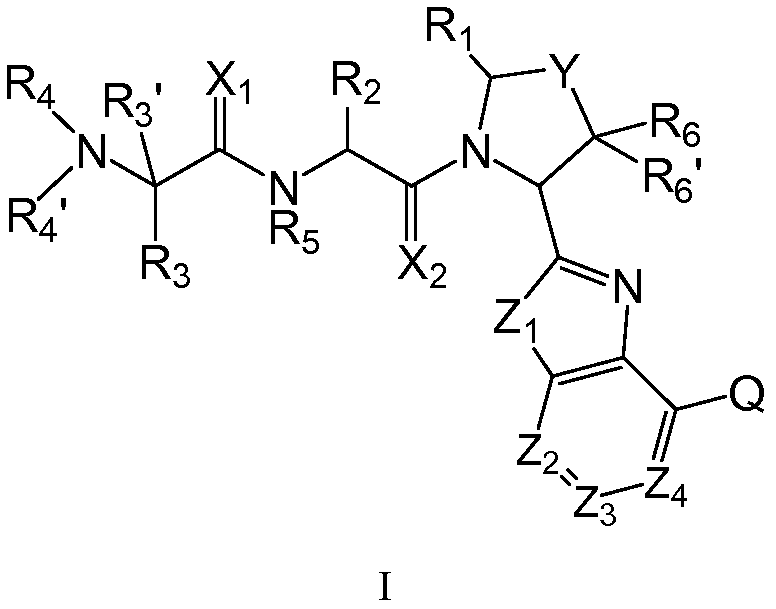
где
Х1 и Х2, каждый независимо, означают О или S;
Y означает связь, (СR7R7)n, О или S;
Z1 означает NR8, O, S, SO или SO2;
Z2, Z3 и Z4 независимо означают CQ или N;
Q означает Н, галоген, гидроксил, карбоксил, амино, нитро, циано, алкил, карбоцикл, гетероцикл; где одна или несколько групп СH2 или СН алкила необязательно заменены на -O-, -S-, -S(О)-, S(О)2, -N(R8)-, -C(О)-, -C(О)-NR8-, -NR8-C(O)-, -SO2-NR8-, -NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-; и алкил, карбоцикл и гетероцикл необязательно замещены одной или несколькими группами, такими как гидроксил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, замещенный галогеном алкил, амино, циано, нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл;
R1 означает Н, OH или алкил; или R1 и R2 вместе образуют 5-8-членный гетероцикл;
R2 означает алкил, карбоцикл, карбоциклилалкил, гетероцикл или гетероциклилалкил, каждый из которых необязательно замещен группой, такой как галоген, гидроксил, оксо, тион, меркапто, карбоксил, алкил, галогеналкил, ацил, алкокси, алкилтио, сульфонил, амино и нитро, где указанные алкил, ацил, алкокси, алкилтио и сульфонил необязательно замещены группами, такими как гидрокси, меркапто, галоген, амино, алкокси, гидроксиалкокси и алкоксиалкокси;
R3 означает H или алкил, необязательно замещенный галогеном или гидроксилом, или R3 и R4 вместе образуют 3-6 гетероцикл;
R3' означает Н, или R3 и R3' вместе образуют 3-6 карбоцикл;
R4 и R4' независимо означают H, гидроксил, амино, алкил, карбоцикл, карбоциклоалкил, карбоциклоалкилокси, карбоциклоалкилоксикарбонил, гетероцикл, гетероциклоалкил, гетероциклоалкилокси или гетероциклоалкилоксикарбонил; где каждый алкил, карбоциклоалкил, карбоциклоалкилокси, карбоциклоалкилоксикарбонил, гетероцикл, гетероциклоалкил, гетероциклоалкилокси и гетероциклоалкилоксикарбонил необязательно замещены группами, такими как галоген, гидроксил, меркапто, карбоксил, алкил, алкокси, амино, имино и нитро; или R4 и R4' вместе образуют гетероцикл;
R5 означает Н или алкил;
R6 и R6', каждый независимо, означают H, алкил, арил или аралкил;
R7 означает Н, циано, гидроксил, меркапто, галоген, нитро, карбоксил, амидино, гуанидино, алкил, карбоцикл, гетероцикл или -U-V; где U означает -O-, -S-, -S(O)-, S(O)2, -N(R8)-, -C(O)-, -C(О)-NR8-, -NR8-C(O)-, -SО2-NR8-, -NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)- и V означает алкил, карбоцикл или гетероцикл; и где одна или несколько групп СH2 или СН алкила необязательно заменены на -O-, -S-, -S(O)-, S(О)2, -N(R8)-, -C(О)-, -C(O)-NR8-, -NR8-C(O)-, -SO2-NR8-, -NR8-SO2-, -NR8-C(O)-NR8-, -C(O)-O- или -O-C(O)-; и алкил, карбоцикл и гетероцикл необязательно замещены такими группами, как гидроксил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, замещенный галогеном алкил, амино, циано, нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл;
R8 означает Н, алкил, карбоцикл или гетероцикл, где одна или несколько групп СH2 или СН указанного алкила необязательно заменены на -O-, -S-, -S(O)-, S(O)2, -N(R8) или -C(O)-; и указанные алкил, карбоцикл и гетероцикл необязательно замещены такими группами, как гидроксил, алкокси, ацил, галоген, меркапто, оксо (=O), карбоксил, ацил, замещенный галогеном алкил, амино, циано нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл; и
n имеет значения от 0 до 4.
В другом аспекте изобретения предложены композиции, содержащие соединения формулы I и носитель, разбавитель или эксципиент.
В другом аспекте изобретения предложен способ индуцирования апоптоза в клетке, включающий введение в указанную клетку соединения формулы I.
В другом аспекте изобретения предложен способ сенсибилизации клетки к апоптозному сигналу, включающий введение в указанную клетку соединения формулы I.
В другом аспекте изобретения предложен способ ингибирования связывания белка IAP с белком каспазы, включающий контактирование указанного белка IAP с соединением формулы I.
В другом аспекте изобретения предложен способ лечения заболевания или состояния, связанного со сверхэкспрессией белка IAP, у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения формулы I.
Подробное описание предпочтительных вариантов осуществления изобретения
"Ацил" означает карбонил, содержащий заместитель, представленный формулой -C(O)-R, в которой R означает H, алкил, карбоцикл, гетероцикл, замещенный карбоциклом алкил или замещенный гетероциклом алкил, где алкил, алкокси, карбоцикл и гетероцикл имеют указанные в настоящем описании значения. Ацильные группы включают алканоил (например, ацетил), ароил (например, бензоил) и гетероароил.
"Алкил" означает разветвленную или неразветвленную, насыщенную или ненасыщенную (например, алкенил, алкинил) алифатическую углеводородную группу, имеющую вплоть до 12 атомов углерода, если не уточнено иначе. При использовании в качестве части другого термина, например, "алкиламино", алкильная часть может быть насыщенной углеводородной цепью, однако также включает ненасыщенные углеводородные цепи, такие как "алкениламино" и "алкиниламино". Примерами предпочтительных алкильных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, 2-метилбутил, 2,2-диметилпропил, н-гексил, 2-метилпентил, 2,2-диметилбутил, н-гептил, 3-гептил, 2-метилгексил и тому подобное. Термины "низший алкил", "C1-C4 алкил" и "алкил из 1-4 атомов углерода" являются синонимами и используются взаимозаменяемо для обозначения метила, этила, 1-пропила, изопропила, циклопропила, 1-бутила, втор-бутила или трет-бутила. Если не определено иначе, замещенные алкильные группы могут содержать один, например, два, три или четыре заместителя, которые могут быть одинаковыми или различными. Примерами заместителей являются, если не определено иначе, галоген, амино, гидроксил, защищенный гидроксил, меркапто, карбокси, алкокси, нитро, циано, амидино, гуанидино, мочевина, сульфонил, сульфинил, аминосульфонил, алкилсульфониламино, арилсульфониламино, аминокарбонил, ациламино, алкокси, ацил, ацилокси, карбоцикл, гетероцикл. Примеры указанных замещенных алкильных групп включают, но не ограничиваются перечисленными, цианометил, нитрометил, гидроксиметил, тритилоксиметил, пропионилоксиметил, аминометил, карбоксиметил, карбоксиэтил, карбоксипропил, алкилоксикарбонилметил, аллилоксикарбониламинометил, карбамоилоксиметил, метоксиметил, этоксиметил, трет-бутоксиметил, ацетоксиметил, хлорметил, бромметил, иодметил, трифторметил, 6-гидроксигексил, 2,4-дихлор(н-бутил), 2-амино(изопропил), 2-карбамоилоксиэтил и тому подобное. Алкильная группа также может быть замещенной карбоциклической группой. Примеры включают группы циклопропилметил, циклобутилметил, циклопентилметил и циклогексилметил, а также соответствующие -этильные, -пропильные, -бутильные, -пентильные, -гексильные группы и т.д. Замещенные алкилы включают замещенные метилы, например метильную группу, замещенную такими же заместителями, как "замещенная Cn-Cm алкильная" группа. Примеры замещенной метильной группы включают группы, такие как гидроксиметил, защищенный гидроксиметил (например, тетрагидропиранилоксиметил), ацетоксиметил, карбамоилоксиметил, трифторметил, хлорметил, карбоксиметил, бромметил и иодметил.
"Амидин" означает группу -C(NH)-NHR, в которой R означает H, алкил, карбоцикл, гетероцикл, замещенный карбоциклом алкил или замещенный гетероциклом алкил, где алкил, алкокси, карбоцикл и гетероцикл имеют указанные в настоящем описании значения. Предпочтительный амидин представляет собой группу -NH-C(NH)-NH2.
"Амино" означает первичный (т.е. -NH2), вторичный (т.e. -NRH) и третичный (т.e. -NRR) амины, в которых R означает Н, алкил, карбоцикл, гетероцикл, замещенный карбоциклом алкил или замещенный гетероциклом алкил, где алкил, алкокси, карбоцикл и гетероцикл имеют указанные в настоящем описании значения.
Предпочтительными вторичными и третичными аминами являются алкиламин, диалкиламин, ариламин, диариламин, аралкиламин и диаралкиламин, где алкил имеет указанные в настоящем описании значения и является необязательно замещенным. Предпочтительными вторичными и третичными аминами являются метиламин, этиламин, пропиламин, изопропиламин, фениламин, бензиламин, диметиламин, диэтиламин, дипропиламин и диизопропиламин.
Используемый в настоящем описании термин "аминозащитная группа" относится к производному групп, обычно используемых для блокирования и защиты аминогруппы, пока реакции проводят на других функциональных группах соединения. Примеры таких защитных групп включают карбаматы, амиды, алкильные и арильные группы, имины, а также многие производные N-гетероатома, которые могут быть удалены, чтобы регенерировать желаемую аминогруппу. Предпочтительными аминозащитными группами являются Boc, Fmoc и Cbz. Дополнительные примеры таких групп находятся в T. W. Greene & P. G. M. Wuts, "Protective Groups in Organic Synthesis", 2nd ed., John Wiley & Sons, Inc., New York, NY, 1991, chapter 7; E. Haslam, "Protective Groups in Organic Chemistry", J. G. W. McOmie, Ed., Plenum Press, New York, NY, 1973, Chapter 5, и T. W. Greene, "Protective Groups in Organic Synthesis", John Wiley & Sons, New York, NY, 1981. Термин "защищенная амино" относится к аминогруппе, замещенной одной из указанных аминозащитных групп.
"Арил", когда используется один или как часть другого термина, означает карбоциклическую ароматическую группу, конденсированную или нет, имеющую указанное число атомов углерода или, если число не указано, вплоть до 14 атомов углерода. Предпочтительными арильными группами являются фенил, нафтил, бифенил, фенантренил, нафтаценил и тому подобное (смотрите, например, Lang's Handbook of Chemistry (Dean, J. A., ed) 13th ed. Table 7-2 [1985]). Предпочтительным арилом является фенил. Замещенный фенил или замещенный арил означает фенильную группу или арильную группу, замещенную одним, двумя, тремя, четырьмя или пятью, например, 1-2, 1-3 или 1-4, заместителями, выбранными, если не указано иначе, из таких как галоген (F, Cl, Br, I), гидрокси, защищенная гидрокси, циано, нитро, алкил (например, C1-C6 алкил), алкокси (например, C1-C6 алкокси), бензилокси, карбокси, защищенная карбокси, карбоксиметил, защищенный карбоксиметил, гидроксиметил, защищенный гидроксиметил, аминометил, защищенный аминометил, трифторметил, алкилсульфониламино, алкилсульфониламиноалкил, арилсульфониламино, арилсульфониламиноалкил, гетероциклилсульфониламино, гетероциклилсульфониламиноалкил, гетероциклил, арил или другие точно определенные группы. Одна или несколько метиновых (CH) и/или метиленовых (CH2) групп в указанных заместителях, в свою очередь, могут быть замещенными группой, подобной указанным выше. Примеры термина "замещенный фенил" включают, но не ограничиваются перечисленными, моно- или ди(галоген)фенильную группу, такую как 2-хлорфенил, 2-бромфенил, 4-хлорфенил, 2,6-дихлорфенил, 2,5-дихлорфенил, 3,4-дихлорфенил, 3-хлорфенил, 3-бромфенил, 4-бромфенил, 3,4-дибромфенил, 3-хлор-4-фторфенил, 2-фторфенил и тому подобное; моно- или ди(гидрокси)фенильную группу, такую как 4-гидроксифенил, 3-гидроксифенил, 2,4-дигидроксифенил, их защищенные гидроксипроизводные и тому подобное; нитрофенильную группу, такую как 3- или 4-нитрофенил; цианофенильную группу, например 4-цианофенил; моно- или ди(низший алкил)фенильную группу, такую как 4-метилфенил, 2,4-диметилфенил, 2-метилфенил, 4-(изопропил)фенил, 4-этилфенил, 3-(н-пропил)фенил и тому подобное; моно- или ди(алкокси)фенильную группу, например 3,4-диметоксифенил, 3-метокси-4-бензилоксифенил, 3-метокси-4-(1-хлорметил)бензилоксифенил, 3-этоксифенил, 4-(изопропокси)фенил, 4-(трет-бутокси)фенил, 3-этокси-4-метоксифенил и тому подобное; 3- или 4-трифторметилфенил; моно- или дикарбоксифенил или (защищенную карбокси)фенильную группу, такую как 4-карбоксифенил, моно- или ди(гидроксиметил)фенил или (защищенный гидроксиметил)фенил, такой как 3-(защищенный гидроксиметил)фенил или 3,4-ди(гидроксиметил)фенил; моно- или ди(аминометил)фенил или (защищенный аминометил)фенил, такой как 2-(аминометил)фенил или 2,4-(защищенный аминометил)фенил; или моно- или ди(N-(метилсульфониламино))фенил, такой как 3-(N-метилсульфониламино)фенил. Также термин "замещенный фенил" представляет дизамещенные фенильные группы, заместители которых различны, например 3-метил-4-гидроксифенил, 3-хлор-4-гидроксифенил, 2-метокси-4-бромфенил, 4-этил-2-гидроксифенил, 3-гидрокси-4-нитрофенил, 2-гидрокси-4-хлорфенил и тому подобное, а также тризамещенные фенильные группы, где заместители являются различными, например 3-метокси-4-бензилокси-6-метилсульфониламино, 3-метокси-4-бензилокси-6-фенилсульфониламино, и тетразамещенные фенильные группы, где заместители являются различными, такие как 3-метокси-4-бензилокси-5-метил-6-фенилсульфониламино. Предпочтительные замещенные фенильные группы включают 2-хлорфенил, 2-аминофенил, 2-бромфенил, 3-метоксифенил, 3-этоксифенил, 4-бензилоксифенил, 4-метоксифенил, 3-этокси-4-бензилоксифенил, 3,4-диэтоксифенил, 3-метокси-4-бензилоксифенил, 3-метокси-4-(1-хлорметил)бензилоксифенил, 3-метокси-4-(1-хлорметил)бензилокси-6-метилсульфониламинофенильные группы. Конденсированные кольца арилов также могут быть замещенными какими-либо, например 1, 2 или 3, заместителями, указанными в настоящем описании, таким же образом, как замещенные алкильные группы.
"Карбоциклил", "карбоциклический", "карбоцикл" и "карбоцикло" отдельно и при использовании как части составной группы, такой как карбоциклоалкильная группа, относятся к моно-, би- или трициклическому алифатическому кольцу, имеющему от 3 до 14 атомов углерода, например от 3 до 7 атомов углерода, которое может быть насыщенным или ненасыщенным, ароматическим или неароматическим. Предпочтительными насыщенными карбоциклическими группами являются циклопропил, циклобутил, циклопентил и циклогексил. Предпочтительным насыщенным карбоциклом является циклопропил. Другим предпочтительным насыщенным карбоциклом является циклогексил. Предпочтительными ненасыщенными карбоциклами являются ароматические, например арильные группы, которые указаны выше, например фенил. Термины "замещенный карбоциклил", "карбоцикл" и "карбоцикло" означают такие группы, замещенные такими же заместителями, как "замещенный алкил".
"Карбоксизащитная группа", используемая в настоящем описании, относится к одному из сложноэфирных производных группы карбоновой кислоты, обычно используемых для блокирования и защиты группы карбоновой кислоты, когда реакции проводят на других функциональных группах соединения. Примеры таких групп, защищающих карбоновую кислоту, включают 4-нитробензил, 4-метоксибензил, 3,4-диметоксибензил, 2,4-диметоксибензил, 2,4,6-триметоксибензил, 2,4,6-триметилбензил, пентаметилбензил, 3,4-метилендиоксибензил, бензгидрил, 4,4'-диметоксибензгидрил, 2,2',4,4'-тетраметоксибензгидрил, алкил, такой как трет-бутил или трет-амил, тритил, 4-метокситритил, 4,4'-диметокситритил, 4,4',4"-триметокситритил, 2-фенилпроп-2-ил, триметилсилил, трет-бутилдиметилсилил, фенацил, 2,2,2-трихлорэтил, бета-(триметилсилил)этил, бета-(ди(н-бутил)метилсилил)этил, п-толуолсульфонилэтил, 4-нитробензилсульфонилэтил, аллил, циннамил, 1-(триметилсилилметил)проп-1-eн-3-ил и подобные группы. Разновидность используемой карбоксизащитной группы не является критической при условии, что дериватизированная карбоновая кислота является устойчивой в условиях последующей реакции (реакций) на других положениях молекулы и защитная группа может быть удалена при соответствующих условиях без разрушения остальной части молекулы. В частности, важно не подвергать карбоксизащищенную молекулу воздействию сильных нуклеофильных оснований, таких как гидроксид лития или NaOH, или восстановительных условий с использованием высокоактивных гидридов металлов, таких как LiAlH4. (Таких жестких условий удаления следует также избегать при удалении аминозащитных групп и гидроксизащитных групп, обсуждаемых ниже.) Предпочтительными защитными группами для карбоновой кислоты являются алкил (например, метил, этил, трет-бутил), аллил, бензил и п-нитробензил. Подобные карбоксизащитные группы, используемые в технологии цефалоспорина, пенициллина и пептидов, также могут быть использованы для защиты заместителей карбоксигрупп. Дополнительные примеры таких групп находятся в T. W. Greene and P. G. M. Wuts, "Protective Groups in Organic Synthesis", 2nd ed., John Wiley & Sons, Inc., New York, N.Y., 1991, chapter 5; E. Haslam, "Protective Groups in Organic Chemistry", J. G. W. McOmie, Ed., Plenum Press, New York, N.Y., 1973, Chapter 5, и T.W. Greene, "Protective Groups in Organic Synthesis", John Wiley and Sons, New York, NY, 1981, Chapter 5. Термин "защищенная карбокси" относится к карбоксигруппе, замещенной одной из указанных карбоксизащитных групп.
"Гуанидин" означает группу -NH-C(NH)-NHR, в которой R означает Н, алкил, карбоцикл, гетероцикл, замещенный карбоциклом алкил или замещенный гетероциклом алкил, где алкил, алкокси, карбоцикл и гетероцикл имеют указанные в настоящем описании значения. Предпочтительным гуанидином является группа -NH-C(NH)-NH2.
"Гидроксизащитная группа", используемая в настоящем описании, относится к производному гидроксигруппы, обычно используемому для блокирования или защиты гидроксигруппы, пока реакции проводят на других функциональных группах соединения. Примеры таких защитных групп включают тетрагидропиранилокси, бензоил, ацетокси, карбамоилокси, бензил и группы простых силилэфиров (например, TBS, TBDPS). Дополнительные примеры таких групп находятся в T. W. Greene and P. G. M. Wuts, "Protective Groups in Organic Synthesis", 2nd ed., John Wiley & Sons, Inc., New York, NY, 1991, chapters 2-3; E. Haslam, "Protective Groups in Organic Chemistry", J. G. W. McOmie, Ed., Plenum Press, New York, NY, 1973, Chapter 5, и T.W. Greene, "Protective Groups in Organic Synthesis", John Wiley and Sons, New York, NY, 1981. Термин "защищенная гидрокси" относится к гидроксигруппе, замещенной одной из указанных выше гидроксизащитных групп.
"Гетероциклическая группа", "гетероциклический", "гетероцикл", "гетероциклил" или "гетероцикло" отдельно и при использовании как часть в составной группе, такой как гетероциклоалкильная группа, используются взаимозаменяемо и относятся к какому-либо моно-, би- или трициклическому, насыщенному или ненасыщенному, ароматическому (гетероарил) или неароматическому кольцу, имеющему обозначенное число атомов, обычно от 5 до приблизительно 14 атомов кольца, где атомами кольца являются атомы углерода и по меньшей мере один гетероатом (азот, сера или кислород), например от 1 до 4 гетероатомов. Обычно 5-членное кольцо имеет от 0 до 2 двойных связей, и 6- или 7-членное кольцо имеет от 0 до 3 двойных связей, и гетероатомы азота или серы необязательно могут быть окисленными (например, SO, SO2), и какой-либо гетероатом азота необязательно может быть кватернизованным. Предпочтительными неароматическими гетероциклами являются морфолинил (морфолинo), пирролидинил, оксиранил, оксетанил, тетрагидрофуранил, 2,3-дигидрофуранил, 2H-пиранил, тетрагидропиранил, трииранил, тиэтанил, тетрагидротиэтанил, азиридинил, азетидинил, 1-метил-2-пирролил, пиперазинил и пиперидинил. "Гетероциклоалкильной" группой является гетероциклическая группа, определение которой дано выше, ковалентно связанная с алкильной группой, определение которой дано выше. Предпочтительными 5-членными гетероциклами, содержащими атом серы или кислорода и от одного до трех атомов азота, являются тиазолил, в частности тиазол-2-ил и тиазол-2-ил-N-оксид, тиадиазолил, в частности 1,3,4-тиадиазол-5-ил и 1,2,4-тиадиазол-5-ил, оксазолил, например оксазол-2-ил, и оксадиазолил, такой как 1,3,4-оксадиазол-5-ил и 1,2,4-оксадиазол-5-ил. Предпочтительные гетероциклы с 5-членными кольцами, содержащие от 2 до 4 атомов азота, включают имидазолил, такой как имидазол-2-ил; триазолил, такой как 1,3,4-триазол-5-ил; 1,2,3-триазол-5-ил, 1,2,4-триазол-5-ил, и тетразолил, такой как 1H-тетразол-5-ил. Предпочтительными бензоконденсированными 5-членными гетероциклами являются бензоксазол-2-ил, бензтиазол-2-ил и бензимидазол-2-ил. Предпочтительные 6-членные гетероциклы содержат от одного до трех атомов азота и необязательно атом серы или кислорода, например пиридил, такой как пирид-2-ил, пирид-3-ил и пирид-4-ил; пиримидил, такой как пиримид-2-ил и пиримид-4-ил; триазинил, такой как 1,3,4-триазин-2-ил и 1,3,5-триазин-4-ил; пиридазинил, в частности пиридазин-3-ил, и пиразинил. Пиридин-N-оксиды и пиридазин-N-оксиды и группы пиридил, пиримид-2-ил, пиримид-4-ил, пиридазинил и 1,3,4-триазин-2-ил являются предпочтительными группами. Заместители для "необязательно замещенных гетероциклов" и дополнительные примеры 5- и 6-членных кольцевых систем, обсуждавшихся выше, могут быть найдены в патенте США № 4278793, W. Druckheimer et al. В предпочтительном варианте осуществления такие необязательно замещенные гетероциклические группы замещены такими группами, как гидроксил, алкил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, замещенный галогеном алкил, амино, циано, нитро, амидино и гуанидино.
"Гетероарил", один или когда используется как часть сложной группы, такой как гетероаралкильная группа, относится к какой-либо моно-, би- или трициклической ароматической кольцевой системе, имеющей указанное число атомов, где по меньшей мере одно кольцо представляет 5-, 6- или 7-членное кольцо, содержащее от одного до четырех гетероатомов, выбранных из группы азота, кислорода и серы, и в предпочтительном варианте осуществления по меньшей мере один гетероатом является атомом азота (Lang's Handbook of Chemistry, указано выше). Включены в определение любые бициклические группы, где какие-либо из указанных гетероарильных колец конденсированы с бензольным кольцом. Предпочтительные гетероарилы включают гетероатом азота или кислорода. Следующие кольцевые системы являются примерами гетероарильных (замещенных или незамещенных) групп, обозначенных термином "гетероарил": тиенил, фурил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тиадиазолил, оксадиазолил, тетразолил, тиатриазолил, оксатриазолил, пиридил, пиримидил, пиразинил, пиридазинил, тиазинил, оксазинил, триазинил, тиадиазинил, оксадиазинил, дитиазинил, диоксазинил, оксатиазинил, тетразинил, тиатриазинил, оксатриазинил, дитиадиазинил, имидазолинил, дигидропиримидил, тетрагидропиримидил, тетразолo[1,5-b]пиридазинил и пуринил, а также бензоконденсированные производные, например бензоксазолил, бензофурил, бензотиазолил, бензотиадиазолил, бензотриазолил, бензоимидазолил и индолил. Предпочтительными "гетероарилами" являются: 1,3-тиазол-2-ил, 4-(карбоксиметил)-5-метил-1,3-тиазол-2-ил, 4-(карбоксиметил)-5-метил-1,3-тиазол-2-илнатриевая соль, 1,2,4-тиадиазол-5-ил, 3-метил-1,2,4-тиадиазол-5-ил, 1,3,4-триазол-5-ил, 2-метил-1,3,4-триазол-5-ил, 2-гидрокси-1,3,4-триазол-5-ил, 2-карбокси-4-метил-1,3,4-триазол-5-илнатриевая соль, 2-карбокси-4-метил-1,3,4-триазол-5-ил, 1,3-оксазол-2-ил, 1,3,4-оксадиазол-5-ил, 2-метил-1,3,4-оксадиазол-5-ил, 2-(гидроксиметил)-1,3,4-оксадиазол-5-ил, 1,2,4-оксадиазол-5-ил, 1,3,4-тиадиазол-5-ил, 2-тиол-1,3,4-тиадиазол-5-ил, 2-(метилтио)-1,3,4-тиадиазол-5-ил, 2-амино-1,3,4-тиадиазол-5-ил, 1H-тетразол-5-ил, 1-метил-1H-тетразол-5-ил, 1-(1-(диметиламино)эт-2-ил)-1H-тетразол-5-ил, 1-(карбоксиметил)-1H-тетразол-5-ил, 1-(карбоксиметил)-1H-тетразол-5-илнатриевая соль, 1-(метилсульфоновая кислота)-1H-тетразол-5-ил, 1-(метилсульфоновая кислота)-1H-тетразол-5-илнатриевая соль, 2-метил-1H-тетразол-5-ил, 1,2,3-триазол-5-ил, 1-метил-1,2,3-триазол-5-ил, 2-метил-1,2,3-триазол-5-ил, 4-метил-1,2,3-триазол-5-ил, пирид-2-ил-N-оксид, 6-метокси-2-(N-оксид)пиридaз-3-ил, 6-гидроксипиридaз-3-ил, 1-метилпирид-2-ил, 1-метилпирид-4-ил, 2-гидроксипиримид-4-ил, 1,4,5,6-тетрагидро-5,6-диоксо-4-метил-as-триазин-3-ил, 1,4,5,6-тетрагидро-4-(формилметил)-5,6-диоксо-as-триазин-3-ил, 2,5-дигидро-5-оксо-6-гидрокси-as-триазин-3-ил, 2,5-дигидро-5-оксо-6-гидрокси-as-триазин-3-илнатриевая соль, 2,5-дигидро-5-оксо-6-гидрокси-2-метил-as-триазин-3-илнатриевая соль, 2,5-дигидро-5-оксо-6-гидрокси-2-метил-as-триазин-3-ил, 2,5-дигидро-5-оксо-6-метокси-2-метил-as-триазин-3-ил, 2,5-дигидро-5-оксо-as-триазин-3-ил, 2,5-дигидро-5-оксо-2-метил-as-триазин-3-ил, 2,5-дигидро-5-оксо-2,6-диметил-as-триазин-3-ил, тетразолo[1,5-b]пиридазин-6-ил и 8-аминотетразолo[1,5-b]пиридазин-6-ил. Альтернативная группа "гетероарила" включает: 4-(карбоксиметил)-5-метил-1,3-тиазол-2-ил, 4-(карбоксиметил)-5-метил-1,3-тиазол-2-илнатриевую соль, 1,3,4-триазол-5-ил, 2-метил-1,3,4-триазол-5-ил, 1H-тетразол-5-ил, 1-метил-1H-тетразол-5-ил, 1-(1-(диметиламино)эт-2-ил)-1H-тетразол-5-ил, 1-(карбоксиметил)-1H-тетразол-5-ил, 1-(карбоксиметил)-1H-тетразол-5-илнатриевую соль, 1-(метилсульфоновая кислота)-1H-тетразол-5-ил, 1-(метилсульфоновая кислота)-1H-тетразол-5-илнатриевую соль, 1,2,3-триазол-5-ил, 1,4,5,6-тетрагидро-5,6-диоксо-4-метил-as-триазин-3-ил, 1,4,5,6-тетрагидро-4-(2-формилметил)-5,6-диоксо-as-триазин-3-ил, 2,5-дигидро-5-оксо-6-гидрокси-2-метил-as-триазин-3-илнатриевую соль, 2,5-дигидро-5-оксо-6-гидрокси-2-метил-as-триазин-3-ил, тетразолo[1,5-b]пиридазин-6-ил и 8-аминотетразолo[1,5-b]пиридазин-6-ил. Гетероарильные группы являются необязательно замещенными, как описано для гетероциклов.
"Ингибитор" означает соединение, которое уменьшает или предотвращает связывание белков IAP с белками каспазы, или которое уменьшает или предотвращает ингибирование апоптоза белком IAP. Альтернативно, "ингибитор" означает соединение, которое предотвращает связывающее взаимодействие X-IAP с каспазами или связывающее взаимодействие ML-IAP с SMAC.
"Необязательно замещенный", если не указано иначе, означает, что группа может быть незамещенной или замещенной одним или несколькими (например, 0, 1, 2, 3 или 4) заместителями, перечисленными для такой группы, в которой указанные заместители могут быть одинаковыми или различными. В варианте осуществления необязательно замещенная группа имеет 1 заместитель. В другом варианте осуществления необязательно замещенная группа имеет 2 заместителя. В другом варианте осуществления необязательно замещенная группа имеет 3 заместителя.
"Фармацевтически приемлемые соли" включают аддитивные соли как с кислотами, так и с основаниями. "Фармацевтически приемлемая аддитивная соль с кислотой" относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных оснований и которые не являются биологически или иным образом нежелательными, образованным с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота и тому подобное, и с органическими кислотами, которые могут быть выбраны из алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоновых и сульфоновых органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, глюконовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, аспарагиновая кислота, аскорбиновая кислота, глутаминовая кислота, антраниловая кислота, бензойная кислота, коричная кислота, миндальная кислота, эмбоновая кислота, фенилуксусная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и тому подобное.
"Фармацевтически приемлемые аддитивные соли с основаниями" включают соли, полученные из неорганических оснований, такие как соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и тому подобное. Предпочтительными аддитивными солями с основаниями являются соли аммония, калия, натрия, кальция и магния. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и ионообменные смолы основного характера, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диэтиламиноэтанол, триметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминосмолы и тому подобное. Предпочтительными органическими нетоксичными основаниями являются: изопропиламин, диэтиламин, этаноламин, триметамин, дициклогексиламин, холин и кофеин.
"Сульфонил" означает группу -SO2-R, в которой R означает Н, алкил, карбоцикл, гетероцикл, замещенный карбоциклом алкил или замещенный гетероциклом алкил, где алкил, алкокси, карбоцикл и гетероцикл имеют указанные в настоящем описании значения. Предпочтительными сульфонильными группами являются алкилсульфонил (т.е. -SO2-алкил), например метилсульфонил; арилсульфонил, например фенилсульфонил; аралкилсульфонил, например бензилсульфонил.
Используемое в настоящем описании выражение "и их соли и сольваты" означает, что соединения по изобретению могут существовать в одной форме или в форме смеси солей и сольватных форм. Например, соединение по изобретению может быть по существу чистым в одной предпочтительной солевой или сольватной форме или еще может быть смесями двух или более солей или сольватных форм.
Настоящее изобретение относится к новым соединениям, имеющим общую формулу I:

где Q, X1, X2, Y, Z1, Z2, Z3, Z4, R1, R2, R3, R3', R4, R4', R5, R6, R6' и n имеют указанные выше значения. Соединения по изобретению включают их соли, сольваты и полиморфы, если не указано иначе.
X1 и X2, каждый независимо, означают O или S. В предпочтительном варианте осуществления X1 и X2, оба, означают O. В другом предпочтительном варианте осуществления X1 и X2, оба, означают S. В другом предпочтительном варианте осуществления X1 означает S, тогда как X2 означает O. В другом предпочтительном варианте осуществления X1 означает O, тогда как X2 означает S.
Y означает связь, (CR7R7)n, O или S. В варианте осуществления Y означает связь, (CR7R7)n, O или S; где n означает 1 или 2 и R7 имеет указанные в настоящем описании значения или означает Н, галоген, алкил, арил, аралкил, амино, ариламино, алкиламино, аралкиламино, алкокси, арилокси или аралкилокси. В предпочтительном варианте осуществления Y означает (CHR7)n, O или S; где n означает 1 или 2 и R7 означает Н, галоген, алкил, арил, аралкил, амино, ариламино, алкиламино, аралкиламино, алкокси, арилокси или аралкилокси. В предпочтительном варианте осуществления Y означает CH2. В предпочтительном варианте осуществления n равно 1. В предпочтительном варианте осуществления Y означает связь. В предпочтительном варианте осуществления n равно 1 и Y означает CHR7, где R7 означает аралкилокси, например бензилокси. В предпочтительном варианте осуществления n равно 1 и Y означает CHR7, где R7 означает F. В предпочтительном варианте осуществления n равно 1 и Y означает CHR7, где R7 означает аралкиламино, например бензиламино. В другом предпочтительном варианте осуществления Y означает O. В другом предпочтительном варианте осуществления Y означает S.
Z1 означает NR8, O, S, SO или SO2; где R8 имеет указанные в настоящем описании значения. В варианте осуществления Z1 означает NR8, O или S. В варианте осуществления Z1 означает NR8, где R8 означает Н, алкил, арил или аралкил. В предпочтительном варианте осуществления Z1 означает NR8, где R8 означает бензил. В предпочтительном варианте осуществления Z1 означает NR8, где R8 означает Me. В предпочтительном варианте осуществления Z1 означает NR8, где R8 означает Н. В предпочтительном варианте осуществления Z1 означает O. В предпочтительном варианте осуществления Z1 означает S.
Z2, Z3 и Z4 независимо представляют CQ или N. В предпочтительном варианте осуществления Z2 означает N. В предпочтительном варианте осуществления Z3 означает N. В предпочтительном варианте осуществления Z4 означает N. В варианте осуществления Z2, Z3 и Z4 представляют CQ. В варианте осуществления Z2 означает N, Z3 означает CQ и Z4 означает CQ. В варианте осуществления Z2 означает CQ, Z3 означает N и Z4 означает CQ. В варианте осуществления Z2 означает CQ, Z3 означает CQ и Z4 означает N. В варианте осуществления Z2 означает N, Z3 означает CQ и Z4 означает N.
Q означает Н, галоген, гидроксил, карбоксил, амино, нитро, циано, алкил, карбоцикл, гетероцикл; где одна или несколько групп СH2 или СН алкила необязательно заменены на -O-, -S-, -S(O)-, S(О)2, -N(R8)-, -C(О)-, -C(О)-NR8-, -NR8-C(O)-, -SO2-NR8-, -NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-; и где любой из предшествующих алкила, карбоцикла и гетероцикла необязательно замещен одним или несколькими заместителями, такими как гидроксил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, замещенный галогеном алкил, амино, циано, нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл. Заместители "необязательно замещенного карбоцикла" и "необязательно замещенного гетероцикла" имеют указанные в настоящем описании значения. В предпочтительном варианте осуществления такие карбоциклические и гетероциклические группы замещены такими группами, как гидроксил, алкил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, замещенный галогеном алкил, амино, циано, нитро, амидино и гуанидино. В предпочтительном варианте осуществления Q означает карбоцикл или гетероцикл, необязательно замещенные галогеном, амино, оксо, алкилом, карбоциклом или гетероциклом; где одна или несколько групп СH2 или СН алкила необязательно заменены на -O-, -S-, -S(О)-, S(О)2, -N(R8)-, -C(О)-, -C(О)-NR8-, -NR8-C(O)-, -SO2-NR8-, -NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-; и где указанный алкил, карбоцикл или гетероцикл необязательно замещены такими заместителями, как галоген, амино, гидроксил, меркапто, карбоксил, алкокси, алкоксиалкокси, гидроксиалкокси, алкилтио, ацилокси, ацилоксиалкокси, алкилсульфонил, алкилсульфонилалкил, алкилсульфинил и алкилсульфинилалкил. В предпочтительном варианте осуществления по меньшей мере в одном случае Q означает карбоцикл или гетероцикл, который имеет указанные в настоящем описании значения и который является необязательно замещенным, как описано в настоящем описании, тогда как другие Q независимо выбраны из группы, состоящей из H, галогена, карбоксила, амино, нитро и циано. В предпочтительном варианте осуществления один из Q означает арил или гетероарил, тогда как другие Q независимо выбраны из группы, состоящей из H, галогена, карбоксила, амино, нитро и циано. В предпочтительном варианте осуществления такие другие Q представляют H. В другом предпочтительном варианте осуществления такие другие Q представляют H, галоген или алкил.
В предпочтительном варианте осуществления Q означает карбоцикл или гетероцикл, выбранный из группы, состоящей из III-1 - III-16:


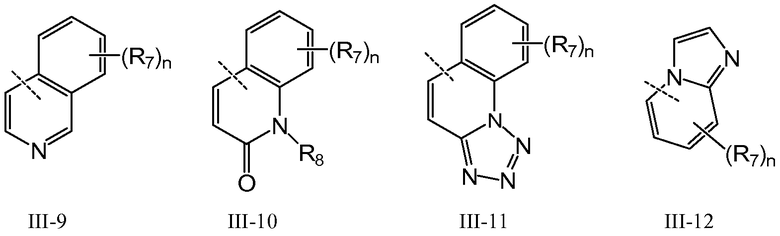

где n означает 1-4, например 1-3, например 1-2, например 1; T означает O, S, NR8 или CR7R7; W означает O, NR8 или CR7R7; и R7 и R8 имеют указанные в настоящем описании значения. В варианте осуществления соединения по изобретению содержат одну группу Q, имеющую общую формулу от III-1 до III-16. В другом варианте осуществления соединения по изобретению имеют одну группу Q, имеющую общую формулу от III-1 до III-16, тогда как другие значения Q независимо выбраны из группы, состоящей из H, галогена, карбоксила, амино, нитро и циано. В предпочтительном варианте осуществления такие другие значения Q представлены H. В другом предпочтительном варианте осуществления такие другие значения Q представлены H, галогеном или алкилом.
В предпочтительном варианте осуществления Q означает карбоцикл или гетероцикл, выбранный из группы, состоящей из IIIa-IIIs:





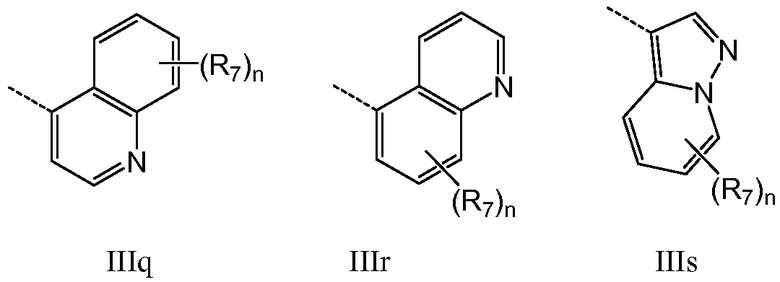
где n означает 1-4, например 1-3, например 1-2, например 1; T означает O, S, NR8 или CR7R7; W означает O, NR8 или CR7R7; и R7 и R8 имеют указанные в настоящем описании значения. В предпочтительном варианте осуществления Q представляет одну из формул IIIa-IIIi, где R8 означает Н и R7 выбран из группы, состоящей из H, F, Cl, Me, метокси, гидроксиэтокси, метоксиэтокси, ацетоксиэтокси, метилсульфонила, метилсульфонилметила, фенила и морфолин-4-ила. В другом предпочтительном варианте осуществления Q означает IIId. В предпочтительном варианте осуществления Q означает группу IIId, которая замещена R7 в положении 4. В другом предпочтительном варианте осуществления Q означает IIId, которая замещена R7 в положении 5. В предпочтительном варианте осуществления Q представляет F, Me, изо-Pr, фенил, фенил, замещенный следующим образом: 2-Cl, 3-Cl, 4-Cl, 2-F, 3-F или 4-F замещенный, бензил, пирид-3-ил или пирид-4-ил. В варианте осуществления соединения по изобретению содержат одну группу Q, имеющую общую формулу от IIIa до IIIs. В другом варианте осуществления соединения по изобретению имеют одну группу Q, имеющую общую формулу от IIIa до IIIs, тогда как другие значения Q независимо выбраны из группы, состоящей из H, галогена, карбоксила, амино, нитро и циано. В предпочтительном варианте осуществления такие другие значения Q представляют H. В другом предпочтительном варианте осуществления такие другие значения Q представляют H, галоген или алкил.
R1 означает Н, OH или алкил; или R1 и R2 вместе образуют 5-8-членный гетероцикл. В предпочтительном варианте осуществления R1 означает Н. В предпочтительном варианте осуществления R1 и R2 вместе образуют 6-членное кольцо. В предпочтительном варианте осуществления R1 и R2 вместе образуют 7-членное кольцо. В другом предпочтительном варианте осуществления R1 и R2 вместе образуют 8-членное кольцо. В другом предпочтительном варианте осуществления R1 и R2 вместе образуют 7-членное кольцо, тогда как Y означает S. В другом предпочтительном варианте осуществления R1 означает Н, тогда как Y означает CH2. В другом предпочтительном варианте осуществления R1 означает Н, тогда как Y означает S. В другом предпочтительном варианте осуществления R1 означает Н, тогда как Y означает O.
R2 означает алкил, карбоцикл, карбоциклилалкил, гетероцикл или гетероциклилалкил, каждый из которых необязательно замещен группой, такой как галоген, гидроксил, оксо, тион, меркапто, карбоксил, алкил, галогеналкил, ацил, алкокси, алкилтио, сульфонил, амино и нитро, где указанные алкил, ацил, алкокси, алкилтио и сульфонил необязательно замещены гидрокси, меркапто, галогеном, амино, алкокси, гидроксиалкокси и алкоксиалкокси. В варианте осуществления R2 означает алкил, карбоцикл, карбоциклилалкил, гетероцикл или гетероциклилалкил, каждый из которых необязательно замещен группой, такой как галоген, гидроксил, оксо, тион, меркапто, карбоксил, алкил, галогеналкил, алкокси, алкилтио, сульфонил, амино и нитро. В предпочтительном варианте осуществления R2 означает алкил, карбоцикл, карбоциклилалкил, гетероцикл или гетероциклилалкил, каждый из которых необязательно замещен группой, такой как галоген, гидроксил, оксо, меркапто, тион, карбоксил, алкил, галогеналкил, алкокси, ацил, алкилтио, ацил, гидроксиацил, метоксиацил, сульфонил, амино и нитро. В варианте осуществления R2 означает алкил, карбоцикл, карбоциклилалкил, гетероцикл или гетероциклилалкил, каждый из которых необязательно замещен группой, такой как галоген, гидроксил, меркапто, карбоксил, алкил, алкокси, ацил, амино и нитро. В предпочтительном варианте осуществления R2 означает алкил, циклоалкил, циклоалкилалкил, арил, аралкил, гетероцикл или гетероциклилалкил. В предпочтительном варианте осуществления R2 означает алкил, циклоалкил или гетероцикл. В предпочтительном варианте осуществления R2 выбран из группы, состоящей из таких соединений, как трет-бутил, изопропил, циклогексил, тетрагидропиран-4-ил, N-метилсульфонилпиперидин-4-ил, тетрагидротиопиран-4-ил, тетрагидротиопиран-4-ил (в которых S находится в окисленной форме SO или SO2), циклогексан-4-он, 4-гидроксициклогексан, 4-гидрокси-4-метилциклогексан, 1-метил-тетрагидропиран-4-ил, 2-гидроксипроп-2-ил, бут-2-ил, тиофен-3-ил, пиперидин-4-ил, N-ацетилпиперидин-4-ил, N-гидроксиэтилпиперидин-4-ил, N-(2-гидроксиацетил)пиперидин-4-ил, N-(2-метоксиацетил)пиперидин-4-ил, пиридин-3-ил, фенил, тетрагидрофуран-2-илкарбонил, метоксиэтанон, 2-метоксиэтоксиэтанон и 1-гидроксиэт-1-ил. В варианте осуществления изобретения R2 означает трет-бутил, изопропил, циклогексил, циклопентил, фенил или тетрагидропиран-4-ил. В предпочтительном варианте осуществления R2 означает фенил. В предпочтительном варианте осуществления R2 означает циклогексил. В другом варианте осуществления R2 означает тетрагидропиран-4-ил. В другом предпочтительном варианте осуществления R2 означает изопропил (т.е. боковую цепь аминокислоты валина). В другом предпочтительном варианте осуществления R2 означает трет-бутил. В предпочтительном варианте осуществления R2 ориентирован так, что аминокислота или аналог аминокислоты, который он содержит, находится в L-конфигурации.
R3 означает Н или алкил, необязательно замещенный галогеном или гидроксилом; или R3 и R4 вместе образуют 3-6 гетероцикл. В варианте осуществления R3 означает Н или алкил; или R3 и R4 вместе образуют 3-6 гетероцикл. В варианте осуществления R3 означает Н или метил, этил, пропил или изопропил. В особенно предпочтительном варианте осуществления R3 означает Н или метил. В другом предпочтительном варианте осуществления R3 означает метил. В другом предпочтительном варианте осуществления R3 означает фторметил. В другом предпочтительном варианте осуществления R3 означает этил. В другом предпочтительном варианте осуществления R3 означает гидроксиэтил. В предпочтительном варианте осуществления R3 означает фторметил. В предпочтительном варианте осуществления R3 означает гидроксиэтил. В другом варианте осуществления R3 ориентирован так, что аминокислота или аналог аминокислоты, который он содержит, находится в L-конфигурации. В предпочтительном варианте осуществления R3 и R4 вместе с атомами, от которых они зависят, образуют 3-6 гетероцикл. В предпочтительном варианте осуществления R3 и R4 вместе образуют кольцо азетидина. В предпочтительном варианте осуществления R3 и R4 вместе образуют пирролидин.
R3' означает Н, или R3 и R3' вместе образуют 3-6 карбоцикл. В варианте осуществления R3' означает Н. В другом варианте осуществления R3 и R3' вместе образуют 3-6 карбоцикл, например кольцо циклопропила. В предпочтительном варианте осуществления R3 и R3', оба, представляют метил.
R4 и R4' независимо означают H, гидроксил, амино, алкил, карбоцикл, карбоциклоалкил, карбоциклоалкилокси, карбоциклоалкилоксикарбонил, гетероцикл, гетероциклоалкил, гетероциклоалкилокси или гетероциклоалкилоксикарбонил; где каждый алкил, карбоциклоалкил, карбоциклоалкилокси, карбоциклоалкилоксикарбонил, гетероцикл, гетероциклоалкил, гетероциклоалкилокси и гетероциклоалкилоксикарбонил необязательно замещены галогеном, гидроксилом, меркапто, карбоксилом, алкилом, алкокси, амино, имино и нитро; или R4 и R4' вместе образуют гетероцикл. В варианте осуществления R4 и R4' независимо представляют H, гидроксил, амино, алкил, арил, аралкил, циклоалкил, циклоалкилалкил, гетероарил или гетероарилалкил, где каждый алкил, арил, аралкил, циклоалкил, циклоалкилалкил, гетероарил и гетероарилалкил необязательно замещены галогеном, гидроксилом, меркапто, карбоксилом, алкилом, алкокси, амино и нитро; или R4 и R4' вместе образуют гетероцикл. В предпочтительном варианте осуществления R4 и R4' вместе образуют гетероцикл, например кольцо азетидина или кольцо пирролидина. В предпочтительном варианте осуществления R4 и R4', оба, представляют H. В другом предпочтительном варианте осуществления R4 означает метил и R4' означает Н. В предпочтительном варианте осуществления один из R4 и R4' представляет гидроксил (OH), тогда как другой означает Н. В другом варианте осуществления один из R4 и R4' представляет аминогруппу, такую как NH2, NHMe и NHEt, тогда как другой означает Н. В предпочтительном варианте осуществления R4' означает Н и R4 означает Н, алкил, арил, аралкил, циклоалкил, циклоалкилалкил, гетероарил или гетероарилалкил. В предпочтительном варианте осуществления R4 представляет группу, выбранную из группы, состоящей из:






R5 означает Н или алкил. В предпочтительном варианте осуществления R5 означает Н или метил. В предпочтительном варианте осуществления R5 означает Н. В другом предпочтительном варианте осуществления R5 означает метил.
R6 и R6', каждый независимо, представляют H, алкил, арил или аралкил. В предпочтительном варианте осуществления R6 означает алкил, например метил. В другом предпочтительном варианте осуществления R6 означает арил, например фенил. В другом предпочтительном варианте осуществления R6 означает аралкил, например бензил. В предпочтительном варианте осуществления R6 и R6' являются одинаковыми, например оба алкил, например оба метил. В другом предпочтительном варианте осуществления R6 представляет метил и R6' означает Н.
R7 в каждом случае независимо представляет H, циано, гидроксил, меркапто, галоген, нитро, карбоксил, амидино, гуанидино, алкил, карбоцикл, гетероцикл или -U-V; где U означает -O-, -S-, -S(O)-, S(О)2, -N(R8)-, -C(О)-, -C(О)-NR8-, -NR8-C(O)-, -SO2-NR8-, -NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)- и V означает алкил, карбоцикл или гетероцикл; и где одна или несколько групп СH2 или СН алкила необязательно заменены на -O-, -S-, -S(O)-, S(О)2, -N(R8)-, -C(О)-, -C(О)-NR8-, -NR8-C(O)-, -SO2-NR8-, -NR8-SO2-, -NR8-C(O)-NR8-, -NR8-C(NH)-NR8-, -NR8-C(NH)-, -C(O)-O- или -O-C(O)-; и алкил, карбоцикл и гетероцикл необязательно замещены такими группами, как гидроксил, алкокси, ацил, галоген, меркапто, оксо, карбоксил, ацил, замещенный галогеном алкил, амино, циано, нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл. Заместители "необязательно замещенного карбоцикла" и "необязательно замещенного гетероцикла" имеют указанные в настоящем описании значения. В предпочтительном варианте осуществления такие карбоциклические и гетероциклические группы замещены гидроксилом, алкилом, алкокси, ацилом, галогеном, меркапто, оксо, карбоксилом, ацилом, замещенным галогеном алкилом, амино, циано, нитро, амидино и гуанидино. В варианте осуществления R7 означает Н, галоген, алкил, арил, аралкил, амино, ариламино, алкиламино, аралкиламино, алкокси, арилокси или аралкилокси.
R8 означает Н, алкил, карбоцикл или гетероцикл, где одна или несколько групп СH2 или СН указанного алкила необязательно заменены на -O-, -S-, -S(O)-, S(O)2, -N(R8) или -C(O)-; и указанные алкил, карбоцикл и гетероцикл необязательно замещены такими группами, как гидроксил, алкокси, ацил, галоген, меркапто, оксо (=O), карбоксил, ацил, замещенный галогеном алкил, амино, циано, нитро, амидино, гуанидино, необязательно замещенный карбоцикл или необязательно замещенный гетероцикл. Заместители "необязательно замещенного карбоцикла" и "необязательно замещенного гетероцикла" имеют указанные в настоящем описании значения. В предпочтительном варианте осуществления такие карбоциклические и гетероциклические группы замещены гидроксилом, алкилом, алкокси, ацилом, галогеном, меркапто, оксо, карбоксилом, ацилом, замещенным галогеном алкилом, амино, циано, нитро, амидино и гуанидино. В предпочтительном варианте осуществления R8 означает Н, алкил или ацил. В варианте осуществления R8 означает метил. В другом варианте осуществления R8 означает ацетил. В предпочтительном варианте осуществления R8 означает Н. В варианте осуществления R7 означает Н, галоген, амино, гидроксил, карбоксил, алкил, галогеналкил или аралкил. В предпочтительном варианте осуществления R7 означает галоген, например Cl или F. В предпочтительном варианте осуществления R7 означает Н. Понятно, что замещения, определенные для R7 и R8, а также для других переменных групп в настоящем описании, подчинены допустимой валентности.
n имеет значения от 0 до 4. В варианте осуществления n равно 0. В варианте осуществления n равно 1. В варианте осуществления n равно 2. В варианте осуществления n равно 3. В варианте осуществления n равно 4.
Соединения по изобретению содержат один или несколько асимметричных атомов углерода. Соответственно, соединения могут существовать как диастереомеры, энантиомеры или их смеси. В синтезе соединений могут быть использованы рацематы, диастереомеры или энантиомеры в качестве исходных материалов или в качестве промежуточных соединений. Диастереомерные соединения могут быть разделены методами хроматографии и кристаллизации. Подобным образом, энантиомерные смеси могут быть разделены с использованием тех же технологий или других известных в технике. Каждый из асимметричных атомов углерода может быть в R- или S-конфигурации, и обе эти конфигурации входят в объем изобретения. В предпочтительном варианте осуществления соединения по изобретению имеют следующую стереохимическую конфигурацию формулы I'

где X1, X2, Y, Z1, Z2, Z3, Q, R1, R2, R3, R4, R4', R5, R6 и R6' имеют указанные в настоящем описании значения.
В предпочтительных вариантах осуществления соединения по изобретению имеют общую формулу IIa-IIe

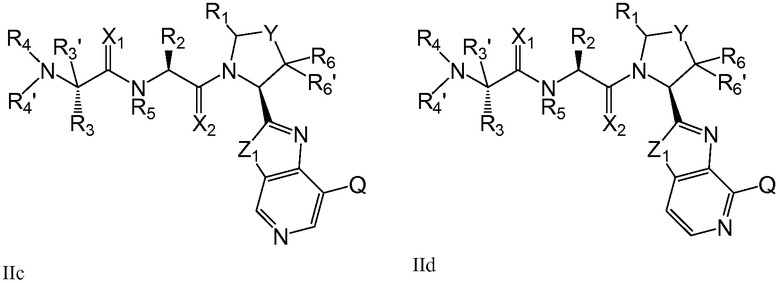

где X1, X2, Y, Z1, Q, R1, R2, R3, R4, R4', R5, R6 и R6' имеют указанные в настоящем описании значения.
Изобретение также охватывает пролекарства соединений, описанных выше. Подходящие пролекарства, где они применимы, включают известные аминозащитные и карбоксизащитные группы, которые высвобождаются, например гидролизуются, давая исходное соединение в физиологических условиях. Предпочтительным классом пролекарств являются соединения, в которых атом азота в группах амино, амидино, аминоалкиленамино, иминоалкиленамино или гуанидино замещен гидроксигруппой (OH), алкилкарбонильной (-CO-R) группой, алкоксикарбонильной (-CO-OR), ацилоксиалкилалкоксикарбонильной (-CO-O-R-O-CO-R) группой, где R означает одновалентную или двухвалентную группу и имеет значения, указанные выше, или группу, имеющую формулу -C(O)-O-CP1P2-галогеналкил, где P1 и P2 одинаковые или разные и представляют H, низший алкил, низшую алкокси, циано, галоген-низший алкил или арил. В предпочтительном варианте осуществления атом азота является одним из атомов азота амидиногруппы соединения по изобретению. Такие пролекарства получают при взаимодействии соединения по изобретению, описанного выше, с активированным ацильным соединением, чтобы связать атом азота в соединении по изобретению с карбонилом активированного ацильного соединения. Подходящие активированные карбонильные соединения содержат соответствующую уходящую группу, связанную с карбонильным углеродом, и включают ацилгалогениды, ациламины, ацилпиридиниевые соли, ацилалкоксиды, в частности ацилфеноксиды, такие как п-нитрофеноксиацил, динитрофеноксиацил, фторфеноксиацил и дифторфеноксиацил. Реакции обычно бывают экзотермическими, и их проводят в инертных растворителях при пониженных температурах, таких как от -78 до приблизительно 5°С. Реакции обычно также проводят в присутствии неорганического основания, такого как карбонат калия или бикарбонат натрия, или органического основания, такого как амин, включая пиридин, триэтиламин и т.д. Один способ получения пролекарств описан в публикации USSN 08/843369, поданной 15 апреля 1997 года (соответствующей публикации PCT WO9846576), содержание которых приобщено к настоящей заявке ссылкой во всей его полноте.
Предпочтительные соединения формулы I включают следующие:





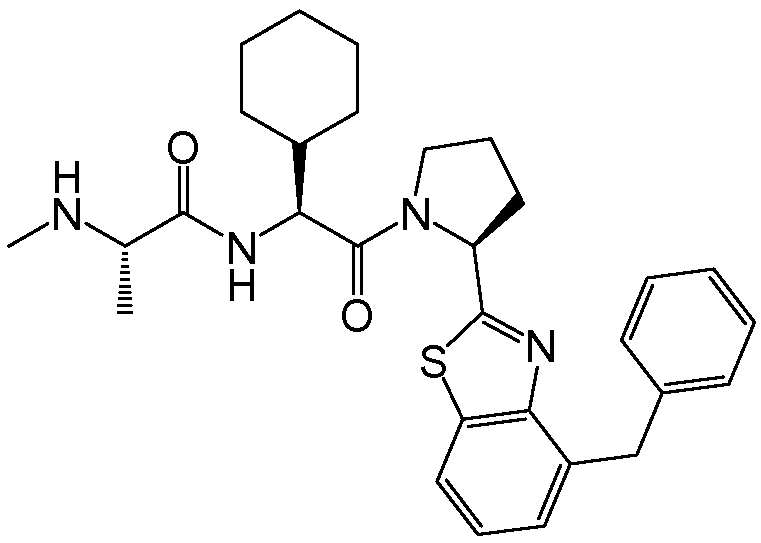



















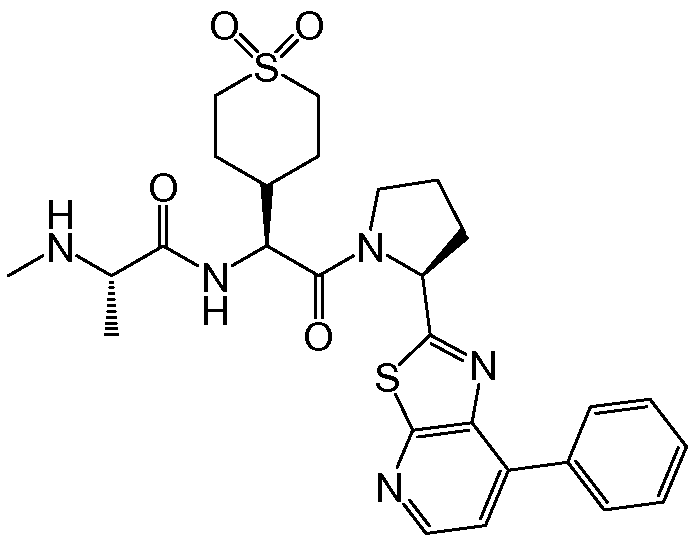

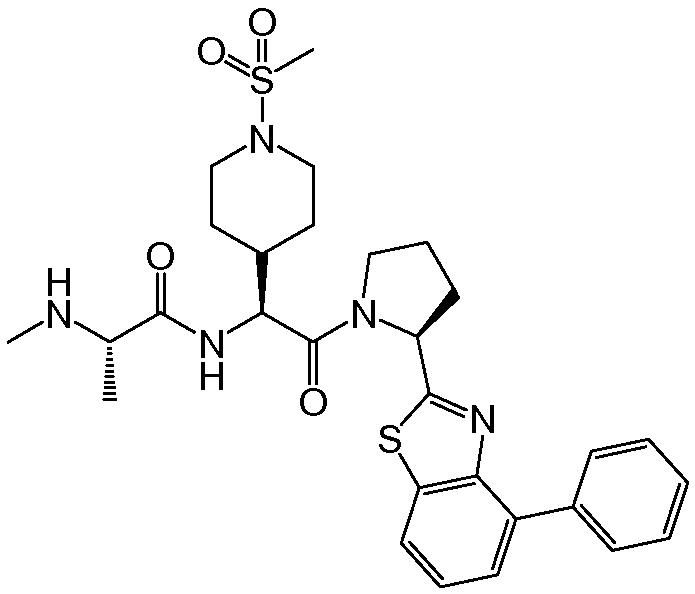










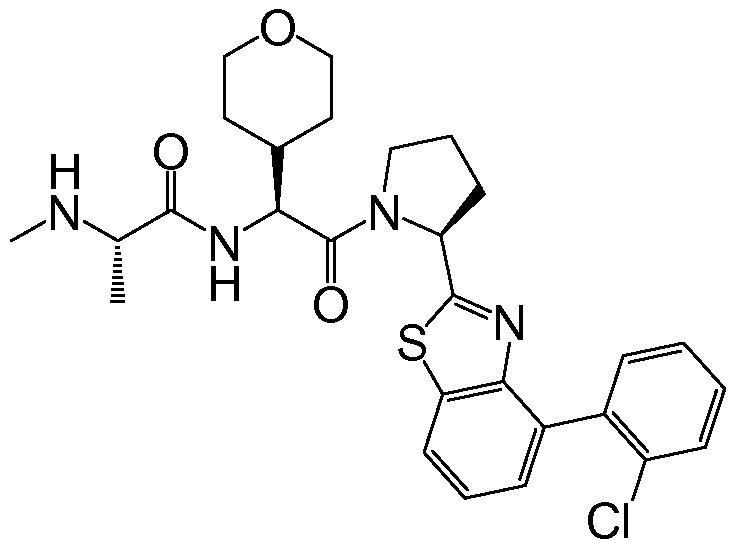










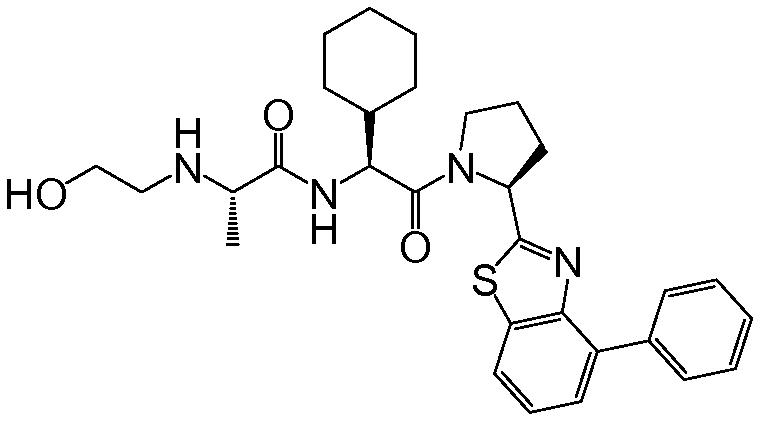


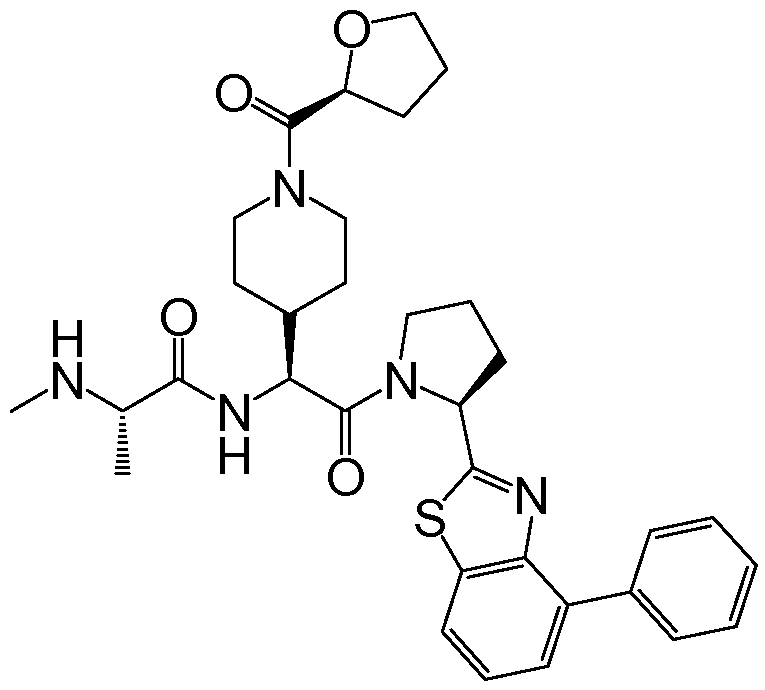


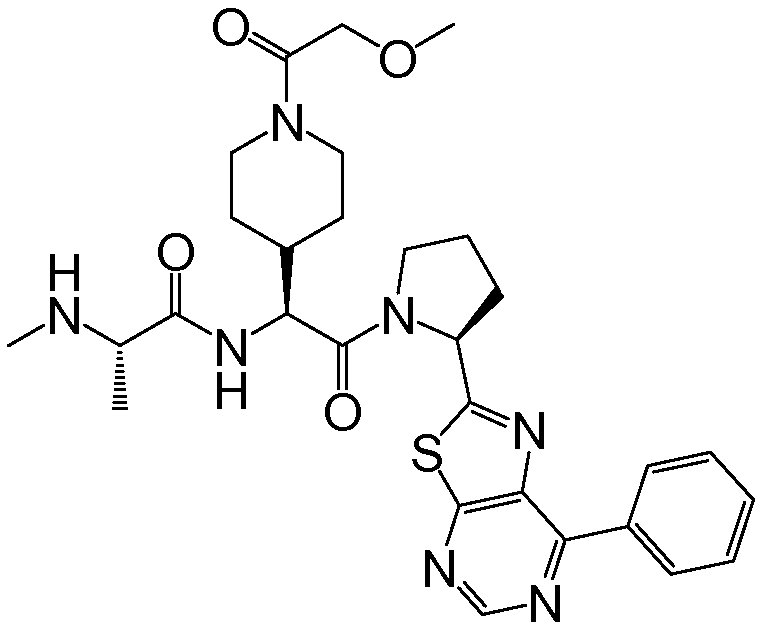
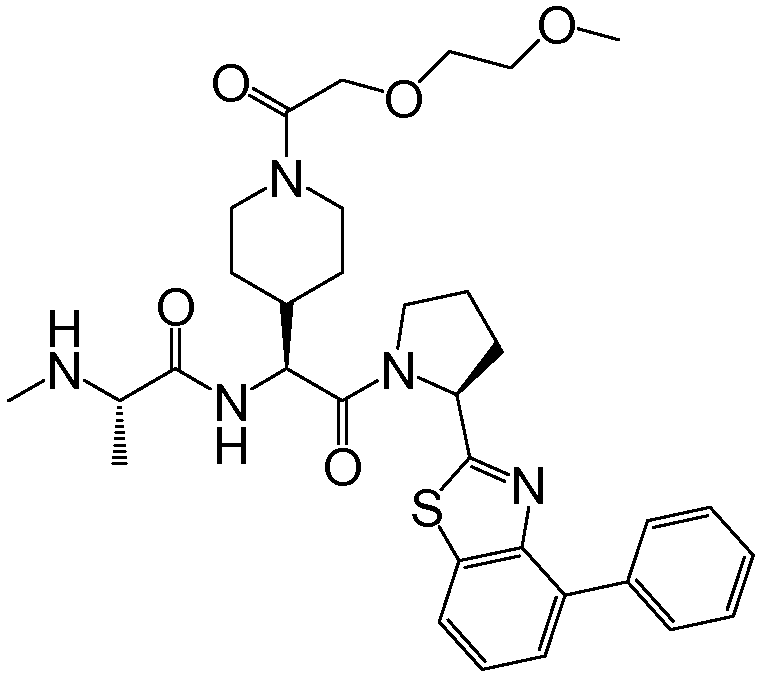






Соединения по изобретению могут существовать в различных резонансных формах, и все такие резонансные формы входят в объем настоящего изобретения.
Синтез
Соединения по изобретению получают, используя стандартные технологии органического синтеза, из коммерчески доступных исходных материалов и реагентов. Следует учитывать, что процедуры синтеза, используемые при получении соединений по изобретению, будут зависеть от конкретных заместителей, присутствующих в соединении, и что стадии введения и удаления различных защитных групп, которые являются стандартными в органическом синтезе, могут быть необходимы, но они могут быть не показаны на следующих общих схемах. По предпочтительной общей схеме синтеза соединения по изобретению могут быть получены сочетанием аналогов аминокислотных остатков с использованием типичных процедур амидного сочетания. На схеме 1, где Q, Y, Z1, Z2, Z3, Z4, R1, R6 и R6' имеют указанные выше определения и Pr означает соответствующую защитную группу, аналоги аминокислотных остатков с защищенными аминогруппами сочетают и затем удаляют защитные группы, чтобы получить конечные соединения.
Схема 1
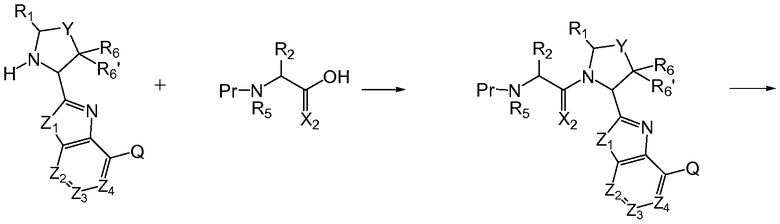
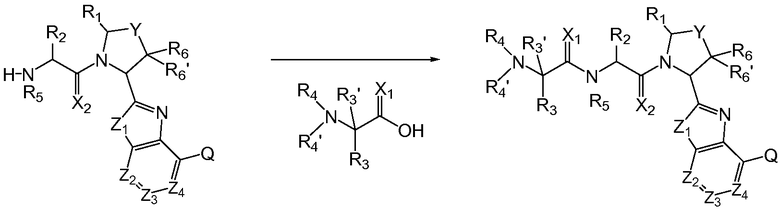
Следует принимать во внимание, что аналоги аминокислотных остатков могут быть сочтены в любом порядке и могут быть получены с использованием твердофазного носителя, который является обычным в технике. Например, схема 2 поясняет альтернативный путь сочетания аналогов аминокислотных остатков, в котором R4 или R4' является аминозащитной группой или другой группой, как определено в настоящем описании, которая делает амин не способным к взаимодействию с карбоксильными группами.
Схема 2


Промежуточные соединения тиазола для получения соединений по изобретению, в которых Z1 означает S, могут быть получены согласно схеме 3, где Q, Y, Z1, Z2, Z3, Z4, R1, R6, и R6' имеют указанные выше определения и Pr означает соответствующую защитную группу.
Схема 3

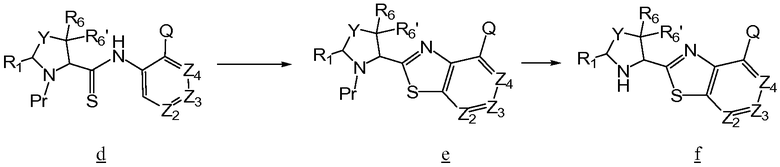
Амин а сочетают с b, используя стандартные процедуры, до образования амида с, который превращают в соответствующий тиоамид d путем взаимодействия с реагентом Лавессона. Тиоамид d подвергают циклизации, например, с K3Fe(CN)6 в EtOH с образованием е, из которого удаляют защитную группу, чтобы получить желаемый тиазол f для использования при получении соединений по изобретению.
Альтернативно, промежуточные соединения тиазола для получения соединений по изобретению, в которых Z1 означает S, могут быть получены согласно схеме 4.
Схема 4


Хлорзамещенный амин а сочетают с хлорангидридом кислоты b, чтобы получить амид с, который подвергают взаимодействию с реагентом Лавессона и нагревают, чтобы получить циклизованное соединение d. Из соединения d затем удаляют защитную группу, чтобы получить желаемое промежуточное соединение тиазола е для использования при получении соединений по изобретению.
Промежуточные соединения оксазола для получения соединений по изобретению, в которых Z1 означает О, могут быть получены согласно процедурам, описанным Wang et al. (Bioorganic & Medicinal Chemistry (2004), 12(1):17-21, как показано на схеме 5.
Схема 5

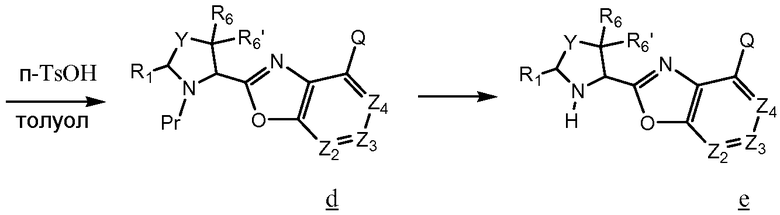
Подобно схемам 3 и 4, хлорангидрид кислоты b сочетают с амином а, чтобы получить амид с. Однако амид с нагревают при кипении с обратным холодильником в растворе п-толуолсульфоновой кислоты в толуоле, чтобы получить d, и удаляют защитную группу Pr, чтобы получить желаемый оксазол е для использования при получении соединений по изобретению.
Альтернативно, промежуточные соединения оксазола для получения соединений по изобретению, в которых Z1 означает О, могут быть получены согласно процедурам, описанным Kauffman et al. (Journal of Heterocyclic Chemistry (2002), 39(5), 981-988), поясняемым на схеме 6.
Схема 6

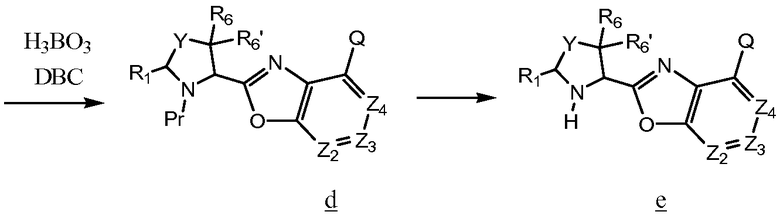
Кислоту а с диоксаном, тионилхлоридом и N-метилпирролидиноном нагревают при кипении с обратным холодильником в атмосфере инертного газа, и полученный хлорангидрид кислоты сочетают с гидрокси/амином b, чтобы получить амид с. Затем нагревают с борной кислотой в дибутилкарбитоле, чтобы получить е, и удаляют защитную группу Pr, чтобы получить желаемое промежуточное соединение оксазола е, которое может быть использовано для получения соединений по изобретению.
Промежуточные соединения имидазола для получения соединений по изобретению, в которых Z1 означает NH, могут быть получены согласно процедурам, описанным Kumar et al.(Bioorganic & Medicinal Chemistry (2002), 10(12), 3997-4004), как показано на схеме 7.
Схема 7


Хлорангидрид кислоты а сочетают с нитро/амином b, чтобы получить амид с. Нитрогруппу амида с восстанавливают до соответствующего амина, например, железом, и затем подвергают циклизации нагреванием с уксусной кислотой, чтобы получить d. Защитную группу Pr соединения d удаляют, чтобы получить желаемое промежуточное соединение имидазола е, которое может быть использовано для получения соединений по изобретению.
Соединения по изобретению, в которых R4 и R4' являются иными, чем Н, могут быть получены согласно стандартным технологиям органической химии, например гидроаминированием, в процессе которого исходный аналог аминокислотного остатка, например NH2-CH(R3)-C(O)-OH, подвергают взаимодействию с соответствующим альдегидом или кетоном, чтобы получить желаемые заместители R4 и R4'. Смотрите схему 8. Полученное замещенное R4/R4' аминокислотное промежуточное соединение может быть затем сопряжено со следующим аминокислотным промежуточным соединением или остальной частью соединения с использованием стандартных процедур сочетания пептидов.
Схема 8

В предпочтительном варианте осуществления аланин подвергают взаимодействию с 1-метилиндол-2-карбоксальдегидом и восстанавливают цианоборгидридом натрия, растворенным в 1% HOAc/ДМФА, чтобы получить N-замещенный остаток аланина, который может быть использован при получении соединений по изобретению. Смотрите схему 9.
Схема 9

Альтернативно, процедура гидроаминирования для введения заместителей R4/R4' является конечной стадией при получении соединения.
Когда соединения по изобретению включают R4 или R4', иные, чем Н, они также могут быть получены замещением соответствующего кислотного промежуточного соединения, которое включает уходящую группу, желаемым амином. Например, Br-CH(R3)-C(O)-OH замещают амином R4-NH2 или R4-NH-R4' согласно схеме 10.
Схема 10

Альтернативно, реакция замещения, вводящая заместители R4 или R4', может быть осуществлена как конечная стадия при получении соединения, как показано на схеме 11.
Схема 11

В предпочтительном варианте осуществления 2-бромпропионовую кислоту подвергают взаимодействию со следующими аминами, растворенными в ДМФА, и барботируют до тех пор, пока замещение не завершится с образованием N-замещенных остатков аланина:




Соединения по изобретению, в которых или Х1, или Х2 означает серу, например соединение включает тиоамид, могут быть получены согласно установленным технологиям органической химии. Например, соединения, в которых Х2 представляет серу, могут быть получены согласно схеме 12 исходя из защищенного Fmoc аналога аминокислотного остатка NH2-CH(R2)-COOH, который растворяют в ТГФ и охлаждают до -25°С, с добавлением DIPEA, сопровождаемым добавлением изобутилхлорформиата. Через 10 минут добавляют диамин, 4-нитробензол-1,2-диамин, и реакционную смесь непрерывно перемешивают при -25°С в течение 2 часов, затем при комнатной температуре в течение ночи. ТГФ удаляют в вакууме и смесь затем подвергают флэш-хроматографии с использованием 50% EtOAc/гексана, чтобы получить продукт. Производное Fmoc-аланина, пентасульфид фосфора и карбонат натрия смешивают в ТГФ и перемешивают в течение ночи. Раствор концентрируют, и непосредственная хроматография с использованием 80% EtOAc/гексана дает активированный тиоаланин. Активированный тиоаланин и нитрит натрия затем смешивают в уксусной кислоте и разбавляют Н2О. Полученный осадок фильтруют и сушат, чтобы получить продукт. Тиоаланин сочетают с замещенным А-кольцом пролиновым аналогом аминокислотного остатка путем растворения обоих в ДМФА. Тиоамидный продукт затем освобождают от защитных групп обработкой 20% PIP/DMA в течение 15 минут и используют для присоединения к R4/R4'-N-С(R3)(R3')-COOH. Альтернативно, Fmoc-защищенный тиоамид вначале сочетают с замещенным А-кольцом пролиновым аналогом аминокислотного остатка, затем удаляют защитную группу Fmoc и потом присоединяют к аналогу аминокислотного остатка R4/R4'-R4/R4'-N-С(R3)(R3')-COOH.
Схема 12



Полезность
Соединения по изобретению ингибируют связывание белков IAP с каспазами, особенно связывающее взаимодействие X-IAP с каспазами 3 и 7. Соединения также ингибируют связывание ML-IAP с белком Smac. Соответственно, соединения по изобретению применимы для индуцирования апоптоза в клетках или сигналов, сенсибилизирующих клетки к апоптозу, в частности раковые клетки. Соединения по изобретению применимы для индуцирования апоптоза в клетках, которые сверхэкспрессируют белки IAP.
Альтернативно, соединения по изобретению применимы для индуцирования апоптоза в клетках, в которых митохондриальный путь апоптоза нарушается таким образом, что высвобождение Smac из белков ML-IAP ингибируется, например, повышающей регуляцией Bcl-2 или понижающей регуляцией Bax/Bak. Более широко, соединения могут быть использованы для лечения всех типов рака, которые недостаточно подвергаются апоптозу. Примеры таких типов рака включают такие, как нейробластома, кишечная карцинома, такая как ректальная карцинома, карцинома толстой кишки, обычная аденоматозная полипозная карцинома и наследственный неполипозный колоректальный рак, эзофагеальная карцинома, лабиальная карцинома, карцинома гортани, карцинома гортаноглотки, карцинома языка, карцинома слюнной железы, желудочная карцинома, аденокарцинома, медуллярная тиреоидная карцинома, папиллярная тиреоидная карцинома, почечная карцинома, почечная паренхиматозная карцинома, карцинома яичника, карцинома шейки матки, карцинома матки, карцинома эндометрия, карцинома хориона, панкреатическая карцинома, карцинома простаты, карцинома яичка, карцинома молочной железы, карцинома мочевых путей, меланома, опухоли головного мозга, такие как глиобластома, астроцитома, менингиома, медуллобластома и периферические нейроэктодермальные опухоли, лимфома Ходжкина, неходжкинская лимфома, лимфома Беркитта, острый лимфолейкоз (ALL), хронический лимфолейкоз (CLL), острый миелоидный лейкоз (AML), хронический миелоидный лейкоз (CML), Т-клеточная лейкемия-лимфома, гепатоцеллюлярная карцинома, карцинома желчного пузыря, бронхиальная карцинома, мелкоклеточный рак легких, немелкоклеточный рак легких, множественная миелома, базалиома, тератома, ретинобластома, хороидальная меланома, семинома, рабдомиосаркома, краниофарингеома, остеосаркома, хондросаркома, миосаркома, липосаркома, фибросаркома, саркома Эвинга и плазмоцитома.
Соединения по изобретению применимы для сенсибилизации клеток к апоптозным сигналам. Соответственно, возможно введение соединений предварительно, одновременно или после применения лучевой терапии или цитостатической или противоопухолевой химиотерапии. Соответствующие соединения для цитостатической химиотерапии включают, но без ограничения указанными, (i) антиметаболиты, такие как цитарабин, флударабин, 5-фтор-2'-дезоксиуридин, гемцитабин, гидроксимочевину или метотрексат; (ii) ДНК-фрагментирующие агенты, такие как блеомицин, (iii) ДНК-сшивающие агенты, такие как хлорамбуцил, цисплатин, циклофосфамид или азотистый иприт; (iv) вставочные агенты, такие как адриамицин (доксорубицин) или митоксантрон; (v) ингибиторы синтеза белка, такие как L-аспарагиназа, циклогексимид, пуромицин или токсин дифтерии; (vi) яды топоизомеразы I, такие как камптотецин или топотекан; (vii) яды топоизомеразы II, такие как этопозид (VP-16) или тенипозид; (viii) направленные на микроканальцы агенты, такие как колцемид, колхицин, паклитаксел, винбластин или винкристин; (ix) ингибиторы киназы, такие как флавопиридол, стауроспорин, STI571 (CPG 57148B) или UCN-01 (7-гидроксистауроспорин); (х) разнообразные исследовательские агенты, такие как тиоплатин, PS-341, фенилбутират, ET-18-OCH3 или ингибиторы фарнезилтрансферазы (L-739749, L-744832); полифенолы, такие как кверцетин, ресвератрол, пицеатаннол, галлат эпигаллокатехина, теафлавины, флаванолы, процианидины, бетулиновая кислота и их производные; (xi) гормоны, такие как глюкокортикоиды или фенретинид; (xii) антагонисты гормонов, такие как тамоксифен, финастерид или антагонисты LHRH. В предпочтительном варианте осуществления соединения по настоящему изобретению вводят совместно с цитостатическим соединением, выбранным из группы, состоящей из таких соединений, как цисплатин, доксорубицин, таксол, таксотер и митомицин С. В предпочтительном варианте осуществления цитостатическим соединением является доксорубицин.
Другой класс активных соединений, которые могут быть использованы по настоящему изобретению, образуют соединения, которые способны сенсибилизировать к апоптозу или индуцировать апоптоз путем связывания с гибельными рецепторами ("агонисты гибельных рецепторов"). Такие агонисты гибельных рецепторов включают лиганды гибельных рецепторов, такие как фактор α некроза опухоли (TNF-α), фактор β некроза опухоли (TNF-β, лимфотоксин-α), LT-β (лимфотоксин-β), TRAIL (Apo2L, лиганд DR4), лиганд CD95 (Fas, APO-1), лиганд TRAMP (DR3, Apo-3), лиганд DR6, а также фрагменты и производные любого из указанных лигандов. В варианте осуществления лигандом гибельного рецептора является TNF-α. В предпочтительном варианте осуществления лигандом гибельного рецептора является Apo2L/TRAIL. Кроме того, агонисты гибельных рецепторов содержат агонистические антитела к гибельным рецепторам, такие как антитело анти-CD95, антитело анти-TRAIL-R1 (DR4), антитело анти-TRAIL-R2 (DR5), антитело анти-TRAIL-R3, антитело анти-TRAIL-R4, антитело анти-DR6, антитело анти-TNF-R1 и антитело анти-TRAMP (DR3), а также фрагменты и производные любого из указанных антител.
С целью сенсибилизации клеток к апоптозу, соединения по настоящему изобретению могут быть также использованы в комбинации с лучевой терапией. Выражение "лучевая терапия" относится к применению электромагнитного или предпочтительного излучения в лечении новообразований. Лучевая терапия основана на принципе, что высокая доза облучения целевой области будет приводить к гибели репродуцирующих клеток как в опухоли, так и в нормальных тканях. Режим дозирования облучения обычно определяют в показателях дозы поглощенного излучения (рад), времени и фракционирования, и он должен быть тщательно определен онкологом. Количество облучения, которое получает пациент, будет зависеть от различных соображений, но двумя наиболее важными соображениями являются местоположение опухоли по отношению к другим критическим структурам или органам тела и пространство, до которого опухоль распространилась. Примеры радиотерапевтических агентов представлены, но без ограничения, в лучевой терапии и известны в литературе (Hellman, Principles of Radiation Therapy, Cancer, in Principles I and Practice of oncology, 24875 (Devita et al., 4th ed., vol 1, 1993). Последние достижения в лучевой терапии включают облучение трехмерным конформным поверхностным пучком, лучевую терапию модулированной интенсивности (IMRT), стереотактическую радиохирургию и брахитерапию (внутритканевую лучевую терапию), последнее помещение источника излучения непосредственно в опухоль в виде имплантированных "капсул". Эти новейшие возможности лечения позволяют доставить более высокие дозы излучения к опухоли, которые приводят к повышенной эффективности по сравнению со стандартной лучевой терапией поверхностным пучком.
Ионизирующее излучение бета-излучающими радионуклидами считается наиболее пригодным для радиотерапевтических назначений по причине умеренного линейного энергетического переноса (LET) ионизирующей частицы (электрона) и его промежуточного диапазона (обычно несколько миллиметров в ткани). Гамма-лучи доставляют дозу при более низких уровнях на значительно бóльшие расстояния. Альфа-частицы представляют другую противоположность, они доставляют более высокую дозу LET, но имеют чрезвычайно ограниченный диапазон и, следовательно, должны быть в близком контакте с клетками ткани, которая должна быть обработана. В дополнение, альфа-эмиттерами обычно являются тяжелые металлы, которые ограничивают возможную химию и представляют чрезмерную опасность из-за утечки радионуклида из области, которая должна быть обработана. В зависимости от опухоли, которую нужно лечить, все виды потенциальных эмиттеров входят в объем настоящего изобретения.
Более того, настоящее изобретение охватывает типы неионизирующего излучения, такие как, например, ультрафиолетовое (UV) излучение, высокоэнергетический видимый свет, микроволновое излучение (гипертермическая терапия), инфракрасное (IR) излучение и лазеры. В предпочтительном варианте осуществления настоящего изобретения применяют UV-излучение.
Изобретение также включает фармацевтические композиции или лекарственные средства, содержащие соединения по изобретению и терапевтически инертный носитель, разбавитель или эксципиент, а также способы применения соединений по изобретению для получения таких композиций и лекарственных средств. Обычно соединения формулы I, используемые в способах по изобретению, составляют в композиции путем смешивания при температуре окружающей среды при соответствующем pH и при желательной степени чистоты с физиологически приемлемыми носителями, т.е. носителями, которые нетоксичны для пациентов при дозировках и концентрациях, используемых в галеновой форме для введения. pH композиции зависит, главным образом, от конкретного применения и концентрации соединения, но может находиться в пределах от приблизительно 3 до приблизительно 8. Композиция в ацетатном буфере при pH 5 является подходящим вариантом осуществления. В варианте осуществления ингибирующее соединение для использования в настоящем описании является стерильным. Соединение обычно следует хранить в виде твердой композиции, хотя лиофилизованные препараты или водные растворы являются приемлемыми.
Композицию по изобретению будут составлять, дозировать и вводить в соответствии с принятой хорошей медицинской практикой. Принимаемые во внимание факторы в этом контексте включают конкретное расстройство, требующее лечения, конкретное млекопитающее, подвергаемое лечению, клиническое состояние отдельного пациента, причину расстройства, место доставки агента, способ введения, режим введения и другие факторы, известные медицинским работникам. "Эффективное количество" соединения, которое должно быть введено, будет обусловлено указанными соображениями и является минимальным количеством, необходимым для того, чтобы ингибировать взаимодействие IAP с каспазами, индуцировать апоптоз или сенсибилизировать злокачественную клетку к апоптозному сигналу. Такое количество может быть ниже количества, которое является токсичным для нормальных клеток или для млекопитающего в целом.
Как правило, первоначальное фармацевтически эффективное количество вводимого парентерально соединения по изобретению на дозу будет в пределах приблизительно 0,01-100 мг/кг, например приблизительно 0,1-20 мг/кг массы тела пациента в сутки, при типичном первоначальном диапазоне используемого соединения от 0,3 до 15 мг/кг/сутки. Единичные дозированные формы для орального введения, такие как таблетки и капсулы, могут содержать от приблизительно 25 до приблизительно 1000 мг соединения по изобретению.
Соединение по изобретению может быть введено любыми подходящими способами, включая оральное, местное, трансдермальное, парентеральное, подкожное, интраперитонеальное, внутрилегочное и интраназальное введение и, если желательно для местного лечения, введение непосредственно в очаг поражения. Парентеральные вливания включают внутримышечное, внутривенное, внутриартериальное, интраперитонеальное или подкожное введение. Например, подходящей дозированной формой для орального введения является таблетка, содержащая приблизительно 25 мг, 50 мг, 100 мг, 250 мг или 500 мг соединения по изобретению, смешанного с приблизительно 90-30 мг безводной лактозы, приблизительно 5-40 мг натриевой соли кроскармеллозы, приблизительно 5-30 мг поливинилпирролидона (PVP) К30 и приблизительно 1-10 мг стеарата магния. Порошкообразные ингредиенты вначале смешивают вместе и затем смешивают с раствором PVP. Полученная композиция может быть высушена, гранулирована, смешана со стеаратом магния и спрессована в форме таблетки с помощью обычного оборудования. Аэрозольный препарат может быть получен растворением соединения, например, 5-400 мг, по изобретению в подходящем буферном растворе, например в фосфатном буфере, добавлением агента для изотоничности раствора, например соли, такой как хлорид натрия, если желательно. Раствор обычно фильтруют, например используя фильтр 0,2 микрона, чтобы удалить примеси и загрязнения.
ПРИМЕРЫ
Изобретение станет более понятным при обращении к следующим примерам. Они, однако, не должны рассматриваться как ограничивающие объем изобретения. Реагенты и растворители получали из коммерческих источников и использовали такими, как получены. Если не указано иначе, хроматографические очистки проводили, используя предварительно набитые силикагелем колонки по системе CombiFlash Copanion от Teledyne-Isco, Inc. Lincoln, Nebraska. Идентичность и чистоту соединений проверяли анализом ЖХМС и 1Н-ЯМР.
Сокращения, используемые в настоящем описании:
AcOH: уксусная кислота;
ACN: ацетонитрил;
Chg: циклогексилглицин;
DCM: дихлорметан;
DIPEA: диизопропилэтиламин;
DMAP: 4-диметиламинопиридин;
DME: 1,2-диметоксиэтан;
ДМФА: диметилформамид;
ДМСО: диметилсульфоксид
EDC: 1-этил-3-(3-диметиламинопропил)карбодиимид;
EEDQ: 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин;
EtOAc: этилацетат;
EtOH: этанол;
ЖХМС: масс-спектрометрия жидкостной хроматографии;
HATU: гексафторфосфат O-(7-азобензотриазол-1-ил)-1,1,3,3-тетраметилурония;
HOBt: N-гидроксибензотриазол;
HBTU: гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония;
ВЭЖХ: высокоэффективная жидкостная хроматография;
MeOH: метанол;
NBS: N-бромсукцинамид;
TASF: дифтортриметилсиликат трис(диметиламино)сульфония;
TEA: триэтиламин;
TFA: трифторуксусная кислота;
ТГФ: тетрагидрофуран.
Пример 1
2-[трет-бутоксикарбонил-(1H-пиррол-2-илметил)амино]пропионовая кислота


Этиловый сложный эфир аланина b (5 г, 32,5 ммоль), пиррол-2-карбоксальдегид a (3,1 г, 32,5 ммоль), цианоборгидрид натрия (2,04 г, 32,5 ммоль) и AcOH (1%) смешивают в ДМФА и перемешивают в течение ночи. Реакцию гасят H2O и ДМФА выпаривают. Смесь разбавляют EtOAc, промывают 0,1 н. NaOH, сушат и концентрируют, получая продукт c 2,5 г. Полученный сложный эфир c (2,5 г, 12,8 ммоль), ди-трет-бутилдикарбонат (3,06 г, 14 ммоль) смешивают в ТГФ, H2O с NaHCO3 и перемешивают в течение ночи. ТГФ выпаривают и смесь разбавляют EtOAc, промывают 1 н. NaOH, насыщ. NH4Cl и насыщенным раствором соли. После сушки смесь концентрируют, получая Boc-защищенный сложный эфир d 3,3 г. Boc-защищенный сложный эфир d (1,67 г, 5,6 моль), моногидрат гидроксида лития (284 мг, 6,77 ммоль) смешивают в ТГФ и H2O при 0°C. ТГФ удаляют в вакууме и раствор подкисляют разбавленной H2SO4, экстрагируют EtOAc дважды. Органические слои объединяют, сушат и выпаривают, получая продукт 2-[трет-бутоксикарбонил-(1H-пиррол-2-илметил)амино]пропионовую кислоту e.
Пример 2
Тетрагидропиранилглицин

Тетрагидропиранилглицин покупают у NovaBiochem или синтезируют согласно литературе: Ghosh, A. K.; Thompson, W. J.; Holloway, M. K.; McKee, S. P.; Duong, T. T.; Lee, H. Y.; Munson, P. M.; Smith, A. M.; Wai, J. M; Darke, P. L.; Zugay, J. A.; Emini, E. A.; Schleife, W. A.; Huff, J. R.; Anderson, P. S. J. Med. Chem, 1993, 36, 2300-2310.
Пример 3
Пиперидинилглицин

Пиперидинилглицин синтезируют согласно процедурам, описанным Shieh et al. (Tetrahedron: Asymmetry, 2001, 12, 2421-2425).
Пример 4
4,4-дифторциклогексилглицин

4,4-дифторциклогексилглицин получают согласно процедурам, описанным в патентной заявке США 20030216325.
Пример 5
Boc-(S)-2-амино-2-(4-гидроксициклогексил)уксусная кислота

Следуя процедуре, описанной Sheih et al. (Tetrahedron: Asymmetry, 2001, 12, 2421-2425), раствор кетона a (8,4 г) и EtOAc (30 мл) добавляют к раствору метилового сложного эфира N-Cbz-фосфоноглицина b, TMG (4,5 мл) и EtOAc (30 мл). Раствор поддерживают при комнатной температуре в течение 48 ч, затем промывают 1 н. HCl (3×50 мл), насыщенным раствором соли (1×50 мл), сушат (Na2SO4), фильтруют и концентрируют. Остаток адсорбируют на целите и очищают хроматографией, затем дополнительно очищают перекристаллизацией из смеси EtOAc/гексан, получая 5,2 г продукта c.

Следуя процедуре, описанной Sheih (Tetrahedron: Asymmetry, 2001, 12, 2421-2425), раствор енамида c (5,0 г), (S,S)-Me-BPE-Rh(I) (1,5 г, Strem Chemicals, Newburyport, MA) и MeOH (100 мл) энергично встряхивают под давлением H2 70 фунтов на кв. дюйм в течение 48 ч. Растворитель удаляют при пониженном давлении. Остаток забирают в EtOAc и фильтруют через SiO2 с дополнительным EtOAc. Растворитель удаляют при пониженном давлении, получая 4,0 г продукта d в виде бесцветного твердого вещества.

Смесь Cbz-карбамата d (4,0 г), Boc2O (2,9 г), 20% Pd(OH)2·C (1,0 г) и MeOH (30 мл) поддерживают в атмосфере H2 в течение 6 ч. Смесь фильтруют через целит с MeOH. Растворитель удаляют при пониженном давлении, получая 4,5 г остатка e, который собирают непосредственно.

Полученный выше остаток e растворяют в H2O (10 мл), AcOH (30 мл), ТГФ (5 мл) и дихлоруксусной кислоте (3 мл) и поддерживают при комнатной температуре в течение ночи. Воду (5 мл) добавляют и раствор выдерживают, пока не завершится гидролиз, который отслеживают посредством ВЭЖХ-МС. Твердый Na2CO3 добавляют осторожно, пока не прекратится газовыделение, смесь разбавляют водн. NaHCO3 и экстрагируют 10% EtOAc/DCM. Объединенные органические фазы промывают один раз насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают хроматографией, получая 2,9 г продукта f.

Смесь кетона f (1,5 г), MeOH (50 мл) обрабатывают NaBH4 (290 мг) при 0°С в течение 20 мин. Смесь подкисляют до ~pH 1 10% водн. лимонной кислотой и MeOH удаляют при пониженном давлении. Остаток разбавляют водой и экстрагируют 20% EtOAc/DCM. Объединенные органические фазы промывают один раз насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают хроматографией, получая 1,17 г продукта g и 0,23 г продукта h.

Смесь сложного эфира g (1,17 г), LiOH·H2O (160 мг), ТГФ (3 мл) и воды (4,5 мл) перемешивают энергично при комнатной температуре в течение ночи. Смесь разбавляют насыщенным раствором соли и основательно экстрагируют EtOAc. Объединенные органические фазы промывают один раз насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют, получая кислоту i (525 мг).
Пример 6
N-Boc-N-циклопропилметил-1-аланин


Гидрохлорид метилового сложного эфира L-аланина a (5 г, 35,8 ммоль) и циклопропанкарбоксальдегид b (2,67 мл, 35,8 ммоль) суспендируют в 50 мл ТГФ w/1% AcOH. Добавление 5 мл CH3OH делает мутный раствор прозрачным. NaCNBH4 (2,25 г, 35,8 ммоль) добавляют и реакционную смесь перемешивают в течение ночи. Реакцию гасят добавлением 1 н. водн. NaOH, экстрагируют EtOAc дважды, органические слои сушат над Na2SO4 и концентрируют досуха. Сырой материал очищают хроматографией, используя смесь 30% EtOAc/гексан (подкрашенную нингидрином), получая соединение c (1 г, 18%). Соединение c (1 г, 6,37 ммоль) и ди-трет-Вoc-дикарбонат (2,1 г, 9,55 ммоль) разбавляют в ТГФ (20 мл) и H2O (20 мл), NaHCO3 (1,3 г, 15,9 ммоль) добавляют. Реакционную смесь перемешивают в течение ночи для завершения реакции. ТГФ удаляют при пониженном давлении и водный слой экстрагируют EtOAc 3 раза. Объединенные органические слои промывают 1 н. NaOH, насыщ. NH4Cl, а затем насыщенным раствором соли и концентрируют досуха. Boc-защищенное соединение d (1,39 г, 5,40 ммоль) перемешивают с LiOH·H2O (1,14 г, 27 ммоль) в ТГФ (20 мл) и H2O (20 мл) в течение ночи при комнатной температуре. ТГФ отпаривают и водный слой доводят до pH 4 добавлением 10% лимонной кислоты, затем экстрагируют EtOAc 3 раза. Объединенные органические слои промывают насыщенным раствором соли и концентрируют. Сырое вещество очищают на колонке C-18 с обращенной фазой, элюируя смесью 0-50% ацетонитрил/H2O, получая чистое соединение e в виде белого твердого вещества (794 мг).
Пример 7
N-Boc-N-метил-L-аланин-L-циклогексилглицин

Раствор Fmoc-L-циклогексилглицина (3,6 г, 9,6 ммоль), растворенного в DCM (50 мл) и DIPEA (5,6 мл, 32 ммоль), добавляют к 2-хлортритилхлоридной смоле (5 г, 8 ммоль) и осторожно перемешивают в течение 3 часов при комнатной температуре. Смолу промывают DCM 4 раза, DCM/MeOH/DIPEA (17:2:1) 3 раза, DCM 3 раза и 2 раза диметилацетамидом (DMA). Fmoc группу удаляют обработкой смолы смесью 20% пиперидин/DMA (50 мл) в течение 15 минут. Смолу промывают DMA 6 раз. Раствор Boc-N-метилаланина (3,3 г, 16 ммоль), HBTU (6,1 г, 16 ммоль) и DIPEA (5,6 мл, 32 ммоль) и DMA/DCM (1:1, 50 мл) добавляют к смоле и осторожно перемешивают в течение 2 часов при комнатной температуре. Смолу промывают DMA 5 раз, DCM 2 раза и сушат при пониженном давлении. Дипептид отщепляют от смолы путем осторожного взбалтывания с HOAc/TFE/DCM (1:1:3, 100 мл) в течение 2 часов при комнатной температуре. Смолу удаляют фильтрованием и раствор концентрируют. Остаточный AcOH удаляют азеотропной обработкой гексаном (15-кратный объем). Твердый остаток очищают ВЭЖХ с обращенной фазой (С18, MeCН-H2O, 0,1% TFA) и растворители удаляют лиофилизацией, получая 1,2 г (43%) дипептида N-Boc-N-метил-L-аланин-L-циклогексилглицина в виде белого порошка.
Пример 8
N-Boc-N-метил-L-аланин-L-дегидропиранилглицин
Смесь метилового сложного эфира N-Cbz-дегидропиранилглицина a (Burk, M. J.; Gross, M. F.; Martinez, J. P. J. Am Chem. Soc. 1995, 777, 9375, и имеющиеся там ссылки) (5,2 г, 17 ммоль), 5% Pd·C (500 мг), MeOH (75 мл) и ТГФ (25 мл) сохраняют в атмосфере H2 в течение 24 ч. Смесь фильтруют через целит и целит промывают MeOH и концентрируют при пониженном давлении, получая количественный выход амина b в виде бесцветного масла, которое непосредственно перерабатывают далее.

Полученный амин b объединяют с CH2Cl2 (40 мл), насыщенным водным NaHCO3 (40 мл) и охлаждают до 0°С. Бензилоксикарбонил хлорид (3,0 мл) затем добавляют по каплям и смесь перемешивают энергично в течение ночи. Фазы разделяют и водную фазу экстрагируют CH2Cl2 (3×20 мл). Объединенные органические фазы промывают насыщенным раствором соли (1×50 мл), сушат (Na2SO4), фильтруют, адсорбируют на целите и подвергают хроматографии (ISCO, колонка со 120 г диоксида кремния, градиентное элюирование 5-55% EtOAc-гексан), получая 4,15 г (80%) рацемического метилового сложного эфира Cbz-пиранилглицина. Энантиомеры разделяют на колонке Chiracel OD, элюируя 10% EtOH-гексан. Желаемый S-энантиомер c элюируется первым в этих условиях.
Смесь метилового сложного эфира (S)-N-Cbz-пиранилглицина c (2,4 г, 7,82 ммоль), 10% Pd·C (700 мг), MeOH (80 мл) выдерживают в атмосфере H2 под давлением 1 атм. в течение 24 ч. Смесь фильтруют через целит с MeOH и концентрируют при пониженном давлении, получая 1,35 г (100%) амина d в виде бесцветного масла. Альтернативно, пиранилглицин может быть синтезирован в энантиочистой форме, следуя процедуре Ghosh (Ghosh, A. K.; Thompson, W. J.; Holloway, M. K.; McKee, S. P.; Duong, T. T.; Lee, H. Y.; Munson, P. M.; Smith, A. M.; Wai, J. M.; Darke, P. L.; Zugay, J. A.; Imini, E. A.; Schleif, W. A.; Huff, J. R.; Anderson, P. S. J. Med. Chem., 1993, 36, 2300).
Смесь амина d (1,35 г, 7,8 ммоль), N-Boc-N-метилаланина e (1,74 г, 8,6 ммоль), EDC (1,65 г, 8,8 ммоль) и MeCN (50 мл) поддерживают при комнатной температуре в течение ночи. MeCN удаляют при пониженном давлении и остаток разбавляют EtOAc, промывают 0,5 н. HCl (3×10 мл), 0,5 н. NaOH (3×10 мл), сушат (MgSO4), фильтруют и концентрируют, получая 2,1 г (75%) защищенного дипептида f в виде светлого масла.

К раствору сложного эфира f (2,10 г, 5,86 ммоль) и ТГФ (50 мл) при 0°С добавляют LiOH·H2O (1,23 г, 29,3 ммоль) и воду (2 мл). Смесь поддерживают при 0°С в течение 2 ч, затем охлаждающую баню удаляют и смесь перемешивают в течение ночи. Бóльшую часть ТГФ затем удаляют при пониженном давлении и остаток разбавляют CH2Cl2, промывают 0,5 н. HCl, сушат (MgSO4), фильтруют и концентрируют, получая 1,53 г (78%) дипептида N-Boc-N-метил-L-аланин-L-дегидропиранилглицина g в виде бесцветного твердого вещества.
Пример 9
(S)-трет-бутил-2-(4-фенилбензо[d]тиазол-2-ил)пирролидин-1-карбоксилат
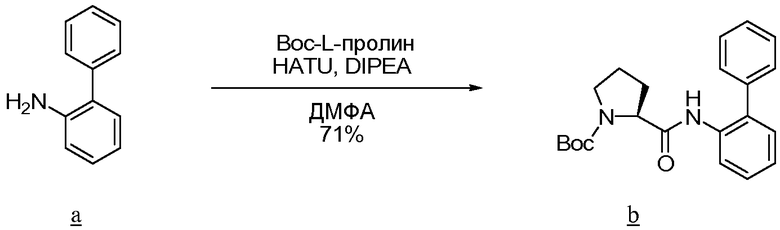
К перемешиваемому раствору Boc-L-пролина (1,0 г, 4,6 ммоль) в 50 мл сухого ДМФА добавляют DIPEA (2,4 мл, 13,8 ммоль), а затем HATU (1,75 г, 4,6 ммоль). Полученный раствор перемешивают в течение 5 минут при комнатной температуре. 2-аминобифенил a (0,89 г, 5,3 ммоль) затем добавляют одной порцией и перемешивание продолжают при комнатной температуре в течение 2 ч. Раствор затем нагревают до 45°С в течение 5 ч и охлаждают до комнатной температуры в течение 16 ч. Реакционную смесь затем выливают в 250 мл воды, к которой добавляют 50 мл насыщенного раствора соли. Водную фазу экстрагируют 3 раза 50 мл EtOAc и органические фазы объединяют. Органические фазы затем промывают 100 мл 1 M HCl и 100 мл насыщенного раствора соли, затем сушат MgSO4, фильтруют и концентрируют до масла. Это масло адсорбируют на силикагеле и очищают флэш-хроматографией (40 г SiO2, 0-40% EtOAc в гексане), получая желаемый амид b в виде светлого масла (1,2 г, 3,3 ммоль, 71%).

К перемешиваемому раствору b (1,06 г, 2,9 ммоль) в 30 мл толуола добавляют реагент Лавессона (0,69 г, 1,7 ммоль) одной порцией. Реакционную смесь нагревают до 80°С на масляной бане в течение 3 ч, затем охлаждают до комнатной температуры в течение 16 ч. Раствор адсорбируют на силикагеле и очищают флэш-хроматографией (40 г SiO2, 0-40% EtOAc в гексане), получая желаемый тиоамид c в виде светлого масла (0,63 г, 1,6 ммоль, 57%).

К перемешиваемому раствору K3Fe(CN)6 (1,51 г, 4,6 ммоль) в 4 мл воды при 85°С медленно добавляют суспензию c, полученную первоначально смачиванием c (0,42 г, 1,1 ммоль) несколькими каплями EtOH, затем добавлением 30% раствора NaOH (1,2 мл, 9,0 ммоль) и энергичным пипетированием в течение нескольких минут. После завершения добавления реакционную смесь перемешивают в течение 2 1/2 часа при 85°С, после чего реакционную смесь разбавляют 25 мл воды и фильтруют. Фильтрат растворяют в дихлорметане и адсорбируют на силикагеле и очищают флэш-хроматографией (12 г SiO2, 0-25% EtOAc в гексане), получая (S)-трет-бутил-2-(4-фенилбензо[d]тиазол-2-ил)пирролидин-1-карбоксилат d (0,22 г, 0,58 ммоль, 52%).
Пример 10
(S)-трет-бутил-2-(4-метилбензо[d]тиазол-2-ил)пирролидин-1-карбоксилат

Соединение c получают согласно процедурам примера 9 выше. Орто-толуидин (0,72 мл, 6,7 ммоль) превращают в соединение a (1,49 г, 4,9 ммоль, 87%). Соединение a (1,14 г, 3,7 ммоль) затем превращают в соединение b (0,27 г, 0,84 ммоль, 23%). Соединение b (0,27 г, 0,84 ммоль) превращают в соединение c.
Пример 11
(S)-трет-бутил-2-(4-изопропилбензо[d]тиазол-2-ил)пирролидин-1-карбоксилат

Соединение c получают согласно процедурам примера 9. 2-изопропиланилин (0,9 мл, 5,2 ммоль) превращают в соединение a (1,53 г, 4,9 ммоль, 87%). Соединение a (1,53 г, 4,9 ммоль) затем превращают в соединение b (1,14 г, 3,3 ммоль, 67%). Соединение b (1,14 г, 3,3 ммоль) превращают в (S)-трет-бутил-2-(4-изопропилбензо[d]тиазол-2-ил)пирролидин-1-карбоксилат c (0,35 г, 1,0 ммоль, 31%).
Пример 12
(S)-трет-бутил-2-(4-бензилбензо[d]тиазол-2-ил)пирролидин-1-карбоксилат
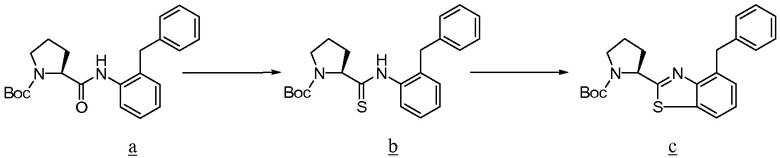
Соединение c получают согласно процедурам примера 9. 2-бензиланилин (1,18 г, 6,4 ммоль) превращают в соединение a (1,43 г, 3,8 ммоль, 59%). Соединение a (1,18 г, 3,1 ммоль) затем превращают в соединение b (0,85 г, 2,1 ммоль, 69%). Соединение b (0,85 г, 2,1 ммоль) превращают в (S)-трет-бутил-2-(4-бензилбензо[d]тиазол-2-ил)пирролидин-1-карбоксилат c (0,18 г, 0,46 ммоль, 22%).
Пример 14
7-фенил-2-(пирролидин-2-ил)тиазоло[5,4-b]пиридин
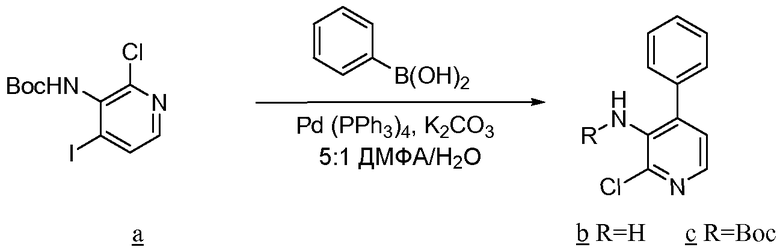
Трет-бутиловый сложный эфир (2-хлор-4-иодпиридин-3-ил)карбаминовой кислоты a (4,20 г, 11,8 ммоль), фенилбороновую кислоту (1,90 г, 15,6 ммоль), карбонат калия (2,42 г, 17,5 ммоль) и тетракистрифенилфосфин палладий(0) (0,68 г, 0,59 ммоль) взвешивают в сосуд емкостью 20 мл для микроволновой обработки. Из сосуда откачивают воздух, затем его продувают азотом 3 раза. Добавляют 16,7 мл сухого ДМФА, затем 3,3 мл воды, которую дегазируют барботированием через нее азота в течение ночи. Затем сосуд закрывают крышкой и подвергают микроволновой обработке при 130°С в течение 40 минут. Полученный раствор выливают в 250 мл воды и экстрагируют EtOAc (3×50 мл). Объединенные органические фазы сушат MgSO4, фильтруют и концентрируют. Полученное масло адсорбируют на силикагеле и очищают флэш-хроматографией (150 г SiO2, 0-40% EtOAc в гексане), получая 2-хлор-3-амино-4-фенилпиридин b (0,84 г, 4,1 ммоль, 35%) и Boc-защищенный 2-хлор-3-амино-4-фенилпиридин c (1,74 г, 5,7 ммоль, 48%) в виде желтого и белого твердых веществ, соответственно.

Соединение c (1,74 г, 5,7 ммоль) растворяют в 50 мл смеси 4:1 метиленхлорид/TFA и добавляют 1 мл толуола. Полученный раствор нагревают до 40°С в течение 2 ч, после чего реакционную смесь концентрируют до желтоватого твердого вещества. Это твердое вещество растворяют в 50 мл метиленхлорида и промывают 100 мл водного 1 н. NaOH. Потом слои разделяют, водную фазу экстрагируют дополнительно два раза 50 мл метиленхлорида. Органические экстракты объединяют, сушат MgSO4, фильтруют и концентрируют до желтого твердого вещества, которое используют далее без дополнительной очистки.
К перемешиваемому раствору 2-хлор-3-амино-4-фенилпиридина в сухом метиленхлориде добавляют пиридин (2,5 мл, 30,9 ммоль) и затем (S)-бензил-2-(хлоркарбонил)пирролидин-1-карбоксилат (1,83 г, 6,8 ммоль), полученный в примере 15, по каплям. Реакционную смесь перемешивают 16 ч в атмосфере азота, затем выливают в 200 мл 1 н. HCl. Слои разделяют и водную фазу экстрагируют метиленхлоридом (3×50 мл). Объединенные органические фазы сушат MgSO4, фильтруют и концентрируют. Полученное масло адсорбируют на силикагеле и очищают флэш-хроматографией (40 г SiO2, 0-60% EtOAc в гексане), получая желаемый амид d в виде пены (2,51 г, 5,8 ммоль, 100%).

Соединение d (1,78 г, 4,08 ммоль) и реагент Лавессона (1,05 г, 2,60 ммоль) растворяют в 10 мл сухого диметоксиэтана и нагревают до 40°С в течение 24 часов. Вторую порцию реагента Лавессона (0,56 г, 1,38 ммоль) добавляют и нагревание продолжают в течение 48 часов. Реакцию гасят добавлением 1 мл диметилформамида и перемешивание продолжают в течение 1 ч при 40°С. Раствор охлаждают, затем разбавляют 100 мл EtOAc. Это промывают 1% раствором NaClO (3×50 мл), сушат MgSO4, фильтруют и адсорбируют на силикагеле и очищают флэш-хроматографией (40 г SiO2, 0-60% EtOAc в гексане), получая желаемый 7-азабензотиазол e в виде белой пены (1,06 г, 2,55 ммоль, 62%).
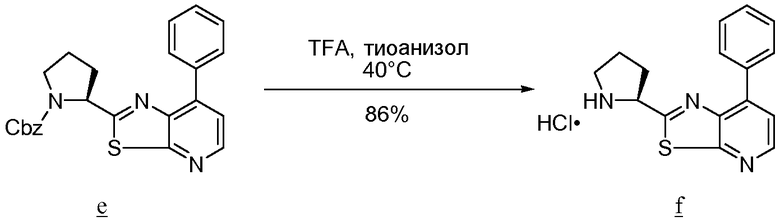
Соединение e (1,30 г, 3,1 ммоль) растворяют в 30 мл TFA. Тиоанизол (2,9 мл, 24,7 ммоль) добавляют и раствор нагревают до 40°С в течение 16 часов. Летучие вещества затем удаляют в вакууме и полученное масло растворяют в диэтиловом простом эфире (50 мл). Раствор выливают в 1 н. NaOH (200 мл) и слои разделяют. Водную фазу экстрагируют диэтиловым простым эфиром (2×50 мл) и органические фазы объединяют. Органические фазы сушат MgSO4 и фильтруют. Добавляют 4 н. HCl в диоксане (0,8 мл, 3,2 ммоль), и осаждается белое твердое вещество. Материал охлаждают до 4°С в течение 4 часов, затем фильтруют, промывают холодным диэтиловым простым эфиром (3×50 мл), получая гидрохлорид 7-фенил-2-(пирролидин-2-ил)тиазолo[5,4-b]пиридина f (0,852 г, 2,7 ммоль, 86%) в виде тонких белых кристаллов. Продукт содержит 10-20% нежелательного стереоизомера пролина, который удаляют на этой стадии путем очистки с применением хиральной SFC. Аликвотные пробы впрыскивают в систему Mettler-Toledo SFC Semi-Prep, снабженную колонкой Chiralpak OD (21,2×250 мм), и элюируют изократически, используя 20% MeOH в надкритическом CO2.
Пример 15
(S)-бензил-2-(хлоркарбонил)пирролидин-1-карбоксилат

Cbz-Pro-OH a (2,0 г, 8,0 ммоль) растворяют в DCM (10 мл) и добавляют оксалилхлорид (6 мл 2 M раствора, 12,0 ммоль). Добавляют ДМФА (2 капли) и смесь перемешивают при комнатной температуре в течение 30 мин. Раствор концентрируют, получая 2,1 г (100%) (S)-бензил-2-(хлоркарбонил)пирролидин-1-карбоксилата b в виде бледно-желтого масла.
Пример 16
7-фенил-2-((S)-пирролидин-2-ил)тиазолo[5,4-c]пиридин

4-амино-3,5-дихлорпиридин a (2,0 г, 12,3 ммоль), тетракис(тифенилфосфин)палладий (696 мг, 0,6 ммоль), фенилбороновую кислоту (1,9 г, 15,9 ммоль) и карбонат калия (2,2 г, 15,9 ммоль) смешивают в сосуде емкостью 10 мл для микроволновой обработки в атмосфере N2. ДМФА (6 мл) и дезоксигенированную H2O (1,2 мл) добавляют. N2 барботируют через смесь в течение 5 мин и смесь нагревают в течение 20 мин при 140°С в микроволновом диапазоне. Смесь разбавляют водой (30 мл) и экстрагируют EtOAc (3×20 мл). Объединенные органические фазы промывают водой (50 мл) и насыщенным раствором соли (50 мл), сушат MgSO4, фильтруют и концентрируют. Полученное бурое масло адсорбируют на силикагеле и очищают флэш-хроматографией (SiO2, 0-70% этилацетат/гексан), получая 970 мг (37%) b в виде бесцветного масла. МС: m/z 205 (M+H).

4-амино-3-хлор-5-фенилпиридин b (650 мг, 3,16 ммоль) растворяют в DCM (10 мл). Добавляют Cbz-Pro-Cl (1,6 г, 6,3 ммоль), растворенный в DCM (5 мл), а затем пиридин (467 мг, 6,3 ммоль) и смесь перемешивают в течение ночи при комнатной температуре. Реакцию гасят 0,5 н. HCl, фазы разделяют и водную фазу экстрагируют DCM (2×20 мл). Объединенные органические фазы сушат MgSO4, фильтруют и концентрируют. Полученное масло адсорбируют на силикагеле и очищают флэш-хроматографией (SiO2, 0-100% EtOAc/гексан), получая 1,12 г (80%) c в виде бесцветного масла. МС: m/z 436 (M+H).

Следуя общей процедуре Charette (Charette, A.B. et al, J. Orг. Chem., 2003, 68, 5792-5794), соединение d (1,7 г, 3,9 ммоль) и пиридин (0,89 мл, 4,7 ммоль) смешивают вместе в DCM (20 мл) при 0°С и раствор перемешивают в течение 5 мин. Трифторметансульфоновый ангидрид (1,3 г, 4,7 ммоль) медленно добавляют. Раствор перемешивают в течение 3 ч и дают возможность нагреться до комнатной температуры. Реакцию гасят быстрым добавлением 20% водного раствора сульфида аммония (2,0 мл, 5,8 ммоль) и перемешивают в течение ночи при комнатной температуре. Смесь фильтруют через слой силикагеля и промывают DCM (50 мл). Фильтрат концентрируют и полученное масло адсорбируют на силикагеле и очищают флэш-хроматографией (SiO2, 0-70% этилацетат/гексан), получая 500 мг (28%) e в виде желтого твердого вещества. МС: m/z 452 (M+H).
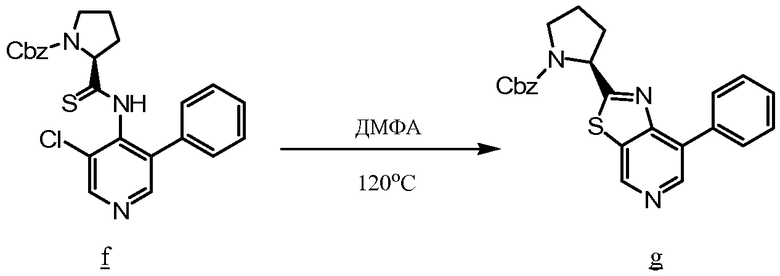
Соединение f растворяют в ДМФА (5 мл) и раствор перемешивают при 120°С в течение 3 дней. Смесь охлаждают до комнатной температуры, разбавляют 20 мл H2O и экстрагируют EtOAc (3×25 мл). Объединенные органические фазы промывают водой (50 мл) и насыщенным раствором соли (50 мл), сушат MgSO4, фильтруют и концентрируют. Полученное масло адсорбируют на силикагеле и очищают флэш-хроматографией (SiO2, гексан в этилацетате), получая 423 мг (98%) g в виде желтого масла. МС: m/z 415 (M+H).

Соединение g (423 мг, 1,0 ммоль) и тиоанизол (993 мг, 8,0 ммоль) растворяют в TFA (40 мл). Смесь перемешивают при 40°С в течение ночи. Смесь охлаждают до комнатной температуры и концентрируют. Остаточное масло растворяют в простом эфире (20 мл) и промывают 1 н. NaOH (30 мл). Водную фазу экстрагируют простым эфиром (2×20 мл). Объединенные органические фазы сушат MgSO4 и фильтруют. 4 н. HCl в диоксане добавляют, пока не произойдет осаждение твердого вещества. Твердое вещество собирают фильтрованием, промывают простым эфиром и сушат на воздухе, получая 240 мг (76%) 7-фенил-2-((S)-пирролидин-2-ил)тиазолo[5,4-c]пиридина h в виде бледно-желтого твердого вещества. МС: m/z 282 (M+H).
Пример 17
7-фенил-2-((S)-пирролидин-2-ил)тиазолo[5,4-d]пиримидин
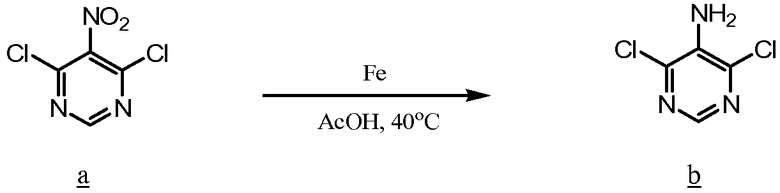
Порошок железа (12,5 г, 112 ммоль) добавляют к суспензии 4,6-дихлор-5-нитропиримидина a (7,0 г, 36,1 ммоль) в уксусной кислоте (70 мл). Смесь перемешивают при 40°С в течение 45 мин. Смесь выливают на лед и нейтрализуют добавлением твердого бикарбоната натрия. Водную фазу экстрагируют EtOAc (3×200 мл). Объединенные органические фазы сушат MgSO4, фильтруют и концентрируют, получая бледно-желтое твердое вещество. Перекристаллизация в горячем этилацетате дает 3,6 г (61%) соединения b в виде не совсем белых игольчатых кристаллов. МС: m/z 165 (M+H).

Соединение c получают из соединения b (1,0 г, 6,1 ммоль), используя общую процедуру получения соединения b примера 16. Процедура дает 410 мг (28%) c в виде желтого твердого вещества. МС: m/z 206 (M+H). Соединение d получают из соединения c (270 мг, 1,3 ммоль), используя общую процедуру получения соединения c примера 16. Процедура дает 565 мг (99%) d в виде бесцветного масла. МС: m/z 437 (M+H).

Смесь соединения d (550 мг, 1,26 ммоль) и реагента Лавессона (341 мг, 0,84 ммоль) в толуоле (10 мл) нагревают при 80°С в течение ночи. Раствор концентрируют, адсорбируют на силикагеле и очищают флэш-хроматографией (SiO2, 0-60% этилацетат/гексан), получая 514 мг (98%) e в виде бледно-желтого твердого вещества. МС: m/z 417 (M+H).

Соединение f получают из соединения e (510 мг, 1,2 ммоль), используя процедуру получения соединения h примера 16. Процедура дает 378 мг (98%) 7-фенил-2-((S)-пирролидин-2-ил)тиазолo[5,4-d]пиримидина f в виде не совсем белого твердого вещества. МС: m/z 283 (M+H).
Пример 18
2,3-диаминобифенил

2-аминобифенил a (21,9289 г, 130 ммоль) растворяют в Ac2O (30 мл, 318 ммоль) и перемешивают 10 минут. Дополнительную порцию Ac2O (10 мл, 106 ммоль) добавляют, затем перемешивают в течение не менее 10 минут. Образец выливают на лед. Полученное твердое вещество подвергают вакуумному фильтрованию и промывают H2O, получая N-ацетил-2-аминобифенил b (26,955 г, 128 ммоль, 98%).

Следуя общей процедуре Stepan (Stepan, A. H., et al, J. Am. Chem. Soc., 1949, 71, 2438), N-ацетил-2-аминобифенил b (7,198 г, 34,1 ммоль), HOAc (6 мл) и Ac2O (5 мл) смешивают и нагревают при 120°С в течение нескольких минут до растворения N-ацетил-2-аминобифенила b. Образец охлаждают до комнатной температуры. HOAc (1,5 мл) добавляют медленно к 2,3 мл дымящей HNO3 (2,3 мл, 54,5 ммоль) на бане со льдом. Поддерживая температуру менее 26,5°С, 1,5 мл смеси HNO3 добавляют быстро, затем остальную смесь HNO3 добавляют по каплям к N-ацетил-2-аминобифенилу b. Образец перемешивают при комнатной температуре в течение 4 часов, затем хранят при 4°С в течение ночи. Реакционную смесь выливают в лед и экстрагируют один раз бензолом. Слой бензола хранят при 4°С в течение 1 часа. Полученное твердое вещество подвергают вакуумному фильтрованию и промывают холодным бензолом, получая N-ацетил-2-амино-3-нитробифенил c (2,346 г, 9,15 ммоль, 27%).
N-ацетил-2-амино-3-нитробифенил c (1,008 г, 3,93 ммоль), EtOH (19 мл, 325 ммоль) и концентрированную HCl (5 мл, 50 ммоль) смешивают и нагревают при кипении с обратным холодильником при 120°С в течение ночи. Образец адсорбируют на силикагеле и очищают флэш-хроматографией (12 г SiO2, 0-33% EtOAc в гексане), получая 2-амино-3-нитробифенил d (0,720 г, 3,36 ммоль, 85%)

2-амино-3-нитробифенил d (0,613 г, 2,86 ммоль) продувают азотом в течение 30 минут, затем добавляют HOAc (5 мл) с последующим добавлением порошка железа (0,4895 г, 8,76 ммоль). Образец нагревают при 60°С в течение 30 минут, затем добавляют HOAc (5 мл). Образец перемешивают при 60°С в течение 1 часа, затем выливают в лед. Образец экстрагируют EtOAc (3×100 мл). Экстракты EtOAc промывают насыщенным раствором NaHCO3 (3×100 мл). Слой EtOAc сушат над MgSO4, фильтруют и концентрируют, получая 2,3-диаминобифенил e (0,439 г, 2,38 ммоль, 83%).
Пример 19
2(S)-[[(2-иодфенил)амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота

Boc-Pro-OH a (5,0030 г, 23,2 ммоль) растворяют в сухом CH2Cl2 (50 мл), затем охлаждают до 0°С. Добавляют сухой пиридин (3,8 мл, 46,4 ммоль). Цианурфторид (2,2 мл, 25,5 ммоль) добавляют по каплям. Образец нагревают до комнатной температуры и перемешивают в течение 30 минут. H2O (5 мл) добавляют, чтобы погасить реакцию. Реакционную смесь разбавляют H2O и экстрагируют три раза CH2Cl2. Экстракты CH2Cl2 промывают насыщенным раствором NaCl. Слой CH2Cl2 сушат над MgSO4, фильтруют и концентрируют, получая фторид кислоты b, который используют без дополнительной очистки. Фторид кислоты b растворяют в сухом CH2Cl2 (50 мл). 2-иоданилин (4,9932 г, 22,8 ммоль) добавляют и образец перемешивают в течение ночи. Реакционную смесь адсорбируют на силикагеле и очищают флэш-хроматографией (80 г SiO2, 0-50% EtOAc в гексане), получая 2(S)-[[(2-иодфенил)амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновую кислоту c (3,845 г, 9,24 ммоль, 40%).
Пример 20
2(S)-[[(2-(4-пиридил)фенил)амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота

2(S)-[[(2-иодфенил)амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновую кислоту a (0,4810 г, 1,16 ммоль), 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин (0,3240 г, 1,58 ммоль), K2CO3 (0,2190 г, 1,58 ммоль) и Pd(PPh3)4 (0,0702 г, 0,0607 ммоль) объединяют в сосуде емкостью 5 мл для микроволновой обработки. Из образца отсасывают воздух и продувают образец азотом три раза. Добавляют сухой ДМФА (2 мл) и дезоксигенированную H2O (0,4 мл). Образец подвергают микроволновой обработке при 130°С в течение 10 минут. Реакционную смесь разбавляют H2O и экстрагируют три раза EtOAc. Экстракты EtOAc сушат над MgSO4 и фильтруют. Сырой материал адсорбируют на силикагеле и очищают флэш-хроматографией (4 г SiO2, 0-100% EtOAc в гексане), получая 2(S)-[[(2-(4-пиридил)фенил)амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновую кислоту b (0,404 г, 1,10 ммоль, 95%).
Пример 21
2(S)-[[2-(3'-хлор-(1,1'-бифенил))амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота

Согласно процедуре примера 20 2(S)-[[(2-иодфенил)амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота a (0,4576 г, 1,10 ммоль), 3-хлорфенилбороновая кислота (0,2520 г, 1,61 ммоль), K2CO3 (0,2431 г, 1,76 ммоль) и Pd(PPh3)4 (0,0725 г, 0,0627 ммоль) дают 2(S)-[[2-(3'-хлор-(1,1'-бифенил))амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновую кислоту b (0,399 г, 0,995 ммоль, 90%).
Пример 22
2(S)-[[2-(2'-хлор-(1,1'-бифенил))амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота

Согласно процедуре примера 20 2(S)-[[(2-иодфенил)амино]карбонил]-1'-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота a (0,4554 г, 1,09 ммоль), 2-хлорфенилбороновая кислота (0,2518 г, 1,59 ммоль), K2CO3 (0,2592 г, 1,88 ммоль) и Pd(PPh3)4 (0,0752 г, 0,0651 ммоль) дают 2(S)-[[2-(2'-хлор-(1,1'-бифенил))амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновую кислоту b (0,414 г, 1,03 ммоль, 94%).
Пример 23
2(S)-[[2-(4'-хлор-(1,1'-бифенил))амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота

Согласно процедуре примера 20 2(S)-[[(2-иодфенил)амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота a (0,4494 г, 1,08 ммоль), 4-хлорфенилбороновая кислота (0,2561 г, 1,62 ммоль), K2CO3 (0,2639 г, 1,91 ммоль) и Pd(PPh3)4 (0,0732 г, 0,0633 ммоль) дают 2(S)-[[2-(4'-хлор-(1,1'-бифенил))амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновую кислоту b (0,411 г, 1,08 ммоль, 100%).
Пример 24
2(S)-[[2-(3'-фтор-(1,1'-бифенил))амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота

Согласно процедуре примера 20 2(S)-[[(2-иодфенил)амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота a (0,4507 г, 1,08 ммоль), 3-фторфенилбороновая кислота (0,2158 г, 1,54 ммоль), K2CO3 (0,2343 г, 1,69 ммоль) и Pd(PPh3)4 (0,0756 г, 0,0654 ммоль) дают 2(S)-[[2-(3'-фтор-(1,1'-бифенил))амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновую кислоту b (0,387 г, 1,01 ммоль, 89%).
Пример 25
2(S)-[[2-(2'-фтор-(1,1'-бифенил))амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота

Согласно процедуре примера 20 2(S)-[[(2-иодфенил)амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота a (0,4487 г, 1,08 ммоль), 2-фторфенилбороновая кислота (0,2154 г, 1,54 ммоль), K2CO3 (0,2305 г, 1,67 ммоль) и Pd(PPh3)4 (0,0663 г, 0,0574 ммоль) дают 2(S)-[[2-(2'-фтор-(1,1'-бифенил))амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновую кислоту b (0,410 г, 1,07 ммоль, 99%).
Пример 26
2(S)-[[2-(4'-фтор-(1,1'-бифенил))амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота

Согласно процедуре примера 20 2(S)-[[(2-иодфенил)амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновая кислота a (0,4467 г, 1,07 ммоль), 4-фторфенилбороновая кислота (0,2230 г, 1,59 ммоль), K2CO3 (0,2434 г, 1,76 ммоль) и Pd(PPh3)4 (0,0686 г, 0,0594 ммоль) дают 2(S)-[[2-(4'-фтор-(1,1'-бифенил))амино]карбонил]-1-(1,1-диметилэтиловый сложный эфир)-1-пирролидинкарбоновую кислоту b (0,382 г, 0,994 ммоль, 92%).
Пример 27
3-амино-4-хлор-2-фенилпиридин

Следуя общей процедуре Norman (Norman, M. H., et al, J. Med. Chem., 2000, 43, 4288), 2,4-дигидроксипиридин (4,931 г, 44,4 ммоль) и H2SO4 (20 мл) объединяют и охлаждают до 0°С. HNO3 (20 мл, 444 ммоль) добавляют по каплям. Образец перемешивают в течение 30 минут, затем выливают на лед. Полученное твердое вещество выдерживают при 4°С в течение 1 часа, затем подвергают вакуумному фильтрованию, получая 2,4-дигидрокси-3-нитропиридин (5,143 г, 32,9 ммоль, 74%).
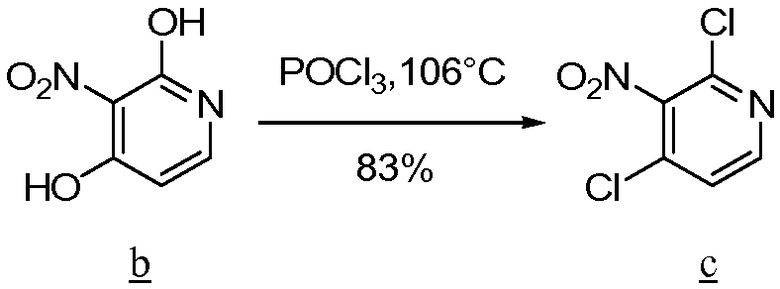
Следуя общей процедуре Norman (Norman, M. H., et al, J. Med. Chem., 2000, 43, 4288), 2,4-дигидрокси-3-нитропиридин b (2,0013 г, 12,9 ммоль) и POCl3 (25 мл, 268 ммоль) объединяют в атмосфере азота. Смесь нагревают до 106°С и перемешивают в течение ночи. Образец концентрируют и выливают на лед. Реакционную смесь экстрагируют EtOAc (3×100 мл). Экстракты EtOAc промывают насыщенным раствором NaCl (1×100 мл). Слой EtOAc сушат над MgSO4 и фильтруют. Сырой материал адсорбируют на силикагеле, фильтруют через слой силикагеля (50% EtOAc в гексане) и концентрируют, получая 2,4-дихлор-3-нитропиридин c (2,058 г, 10,7 ммоль, 83%).

2,4-дихлор-3-нитропиридин c (2,058 г, 10,7 ммоль) растворяют в HOAc (10 мл) в атмосфере азота. Добавляют порошок железа (1,9191 г, 34,4 ммоль). Образец нагревают при 40°С в течение двух часов. Реакционную смесь выливают на лед и затем добавляют NaHCO3, чтобы получить нейтральный раствор. Образец экстрагируют EtOAc (3×100 мл). Экстракты EtOAc промывают насыщенным раствором NaHCO3 (1×100 мл). Объединенные водные слои снова экстрагируют один раз 100 мл EtOAc. Объединенные экстракты EtOAc сушат над MgSO4, фильтруют и концентрируют, получая 3-амино-2,4-дихлорпиридин d (1,510 г, 9,26 ммоль, 87%).

3-амино-2,4-дихлорпиридин d (0,7047 г, 4,32 ммоль), фенилбороновую кислоту (0,5177 г, 4,24 ммоль), K2CO3 (0,8023 г, 5,80 ммоль) и Pd(PPh3)4 (0,0702 г, 0,0607 ммоль) объединяют. Из образца откачивают воздух и продувают азотом три раза. Сухой ДМФА (2 мл) и дезоксигенированную H2O (0,4 мл) добавляют. Образец подвергают микроволновой обработке при 130°С в течение 40 минут. Реакционную смесь разбавляют H2O (50 мл) и экстрагируют EtOAc (3×50 мл). Экстракты EtOAc сушат над MgSO4 и фильтруют. Сырой материал адсорбируют на силикагеле и очищают флэш-хроматографией (40 г SiO2, 0-30% EtOAc в гексане), получая 3-амино-4-хлор-2-фенилпиридин e (0,435 г, 2,12 ммоль, 49%).
Пример 28
2(S)-[4-фенил-2-тиазолo[4,5-c]пиридинил]-1-(9H-флуорен-9-илметил)сложный эфир-1-пирролидинкарбоновая кислота

3-амино-4-хлор-2-фенилпиридин a (0,435 г, 2,12 ммоль) растворяют в сухом CH2Cl2 (10 мл). Добавляют сухой пиридин (0,86 мл, 10,6 ммоль). Cbz-Pro-Cl (1,0804 г, 4,04 ммоль), полученный согласно примеру 15, в CH2Cl2 (5 мл) добавляют по каплям. Образец перемешивают в течение одного часа. Реакционную смесь адсорбируют на силикагеле и очищают флэш-хроматографией (40 г SiO2, 0-100% EtOAc в гексане), получая 2(S)-[[(4-хлор-2-фенил-3-пиридинил)амино]карбонил]-1-(9H-флуорен-9-илметил)сложный эфир-1-пирролидинкарбоновую кислоту b (0,986 г, 2,12 ммоль, 100%).

2(S)-[[(4-хлор-2-фенил-3-пиридинил)амино]карбонил]-1-(9H-флуорен-9-илметил)сложный эфир-1-пирролидинкарбоновую кислоту b (9,564 г, 21,9 ммоль) растворяют в сухом диметоксиэтане (240 мл). Реагент Лавессона (5,83 г, 14,3 ммоль) добавляют. Образец нагревают до 40°С и перемешивают в течение ночи. Реакционную смесь адсорбируют на силикагеле и очищают флэш-хроматографией (330 г SiO2, градиент гексан до 10% MeOH в дихлорметане), получая 2(S)-[4-фенил-2-тиазолo[4,5-c]пиридинил]-1-(9H-флуорен-9-илметил)сложный эфир-1-пирролидинкарбоновую кислоту c (11,88 г, 28,6 ммоль, >100%). Группу Cbz затем удаляют в условиях, идентичных условиям примера 14.
Пример 29
N-Boc-защищенная циклическая сульфониламинокислота

Сульфид a (810 мг, 2,5 ммоль), синтезированный согласно общей процедуре Shieh [Shieh, W-C.; Xue, S.; Reel, N.; Wu, R.; Fitt, J.; Repic, O. Tetrahedron: Asymmetry, 2001, 72, 2421-2425], растворяют в метаноле (25 мл). Оксон (4,5 г) растворяют в деионизированной воде (25 мл). Метанольный раствор субстрата охлаждают до -10°С и водный раствор оксона медленно добавляют к реакционной смеси. Реакционную смесь держат на льду и позволяют постепенно нагреваться до комнатной температуры, перемешивая в течение ночи. Деионизированную воду используют для разбавления реакционной смеси до приблизительно 150 мл, затем смесь выливают в 90% этилацетат-гексан для экстракции. Органическую фазу сушат (Na2SO4), адсорбируют на целите и очищают хроматографией на 40 г колонке ISCO CombiFlash, 5-90% этилацетат-гексан в течение 30 мин, получая 804 мг (2,27 ммоль, 91%) продукта, сульфона b.
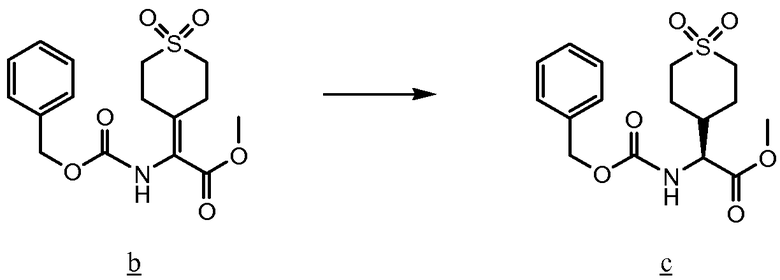
Следуя общей процедуре Burk [Burk, M. J.; Gross, M. F.; Martinez, J. P. J. Am. Chem. Soc. 1995, 117, 9375-9376.], алкен b (774 мг, 2,19 ммоль), сухой метанол (40 мл) и [(S,S)-Me-BPE-Rh(COD)]+OTf- (500 мг, 0,8 ммоль) смешивают в колбе шейкера Парра, продутой азотом. Из колбы Парра откачивают газ и затем заполняют до 60 фунтов на кв. дюйм газообразным водородом и энергично встряхивают в течение ночи. Метанол удаляют при пониженном давлении и сырой продукт фильтруют через небольшой слой силикагеля с применением этилацетата. Выпаривание растворителя дает 730 мг (2,0 ммоль, 94%) продукта c выходом >98%.

Z-защищенный сложный аминоэфир c (804 мг, 2,27 ммоль) растворяют в метаноле (16 мл). К этому раствору добавляют BOC-ангидрид (1,5 г, 6,8 ммоль), затем 20% Pd(OH)2·C (250 мг). Весь воздух удаляют из реакционной колбы вакуумированием и смесь перемешивают энергично в течение 5 мин. Колбу затем заполняют газообразным водородом и продолжают энергичное перемешивание при комнатной температуре в течение 6 ч. После откачивания атмосферы водорода смесь фильтруют через целит с использованием метанола и сырой продукт d получают выпариванием растворителя (508 мг, 1,56 ммоль, выход 70%).

Сложный эфир d (508 мг, 1,56 ммоль) растворяют в 8 мл ТГФ. Добавляют деионизированную воду (4 мл), затем LiOH·H2O (120 мг, 2,8 ммоль). Смесь перемешивают при комнатной температуре в течение ночи, подкисляют, используя водный 1 н. HCl, и экстрагируют в этилацетат (3×25 мл). Органические экстракты сушат дополнительно Na2SO4, фильтруют и концентрируют, получая 372 мг (1,21 ммоль, выход 78%) N-Boc-защищенной циклической сульфониламинокислоты e, которую используют в дальнейшем без очистки.
Пример 30
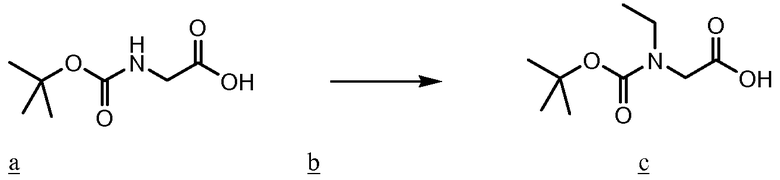
Следуя общей процедуре Grigg [Blaney, P.; Grigg, R.; Rankovic, Z.; Thornton-Pett, M.; Xu, J. Tetrahedron, 2002, 58, 1719-1737], в круглодонную колбу загружают гидрид натрия (480 мг, 60% дисперсия в масле, 12,0 ммоль, 4,0 экв.) и продувают азотом в течение 15 мин. ТГФ (6,0 мл) добавляют в колбу и суспензию охлаждают до 0°С, используя водяную баню со льдом. В отдельную колбу загружают BOC-глицин a (525 мг, 3,0 ммоль), сухой ТГФ (6,0 мл) и этилиодид (1,0 мл, 12 ммоль, 4 экв.). Полученную смесь добавляют по каплям к суспензии NaH в ТГФ с энергичным перемешиванием при 0°С. После перемешивания в течение 1 ч, реакционную смесь нагревают до комнатной температуры и продолжают перемешивание в течение ночи. Реакционную смесь снова охлаждают до 0°С и метанол (4 мл) добавляют очень медленно, чтобы погасить избыточный гидрид. Деионизированную воду добавляют, чтобы разбавить смесь, и метанол удаляют при пониженном давлении. Примеси экстрагируют в 90% этилацетат-гексан, водный слой затем подкисляют добавлением твердой лимонной кислоты, пока pH не достигнет 2-3. Продукт экстрагируют в 90% этилацетат-гексан. Полученный органический слой сушат (Na2SO4) и фильтруют. Удаление растворителей при пониженном давлении дает количественный выход продукта b.
Пример 32
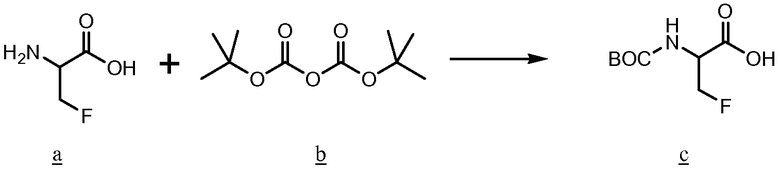
Смесь незащищенной аминокислоты a (775 мг, 7,24 ммоль) и карбоната натрия (1,69 г, 16,0 ммоль) растворяют в 1:1 растворе деионизированной воды и ТГФ (по 15 мл каждого). К этой смеси добавляют BOC-ангидрид b (1,73 г, 7,96 ммоль). Смесь перемешивают при комнатной температуре в течение ночи и ТГФ удаляют при пониженном давлении. Смесь затем подкисляют до pH 2-3 насыщенным водным раствором лимонной кислоты и продукт экстрагируют в 10% этилацетат-дихлорметан. Органический слой сушат (Na2SO4), фильтруют и концентрируют при пониженном давлении, получая светлую BOC-защищенную аминокислоту c (1,40 г, 6,7 ммоль, 93%), которая может быть использована без дополнительной очистки.
Пример 33
Испытания ингибирования IAP
В следующих экспериментах использовали химерный BIR домен, упоминаемый как МLXBIR3SG, в котором 11 из 110 остатков соответствуют остаткам, обнаруженным в XIAP-BIR3, тогда как остальное соответствует ML-IAP-BIR. Было показано, что химерный белок МLXBIR3SG связывает и ингибирует каспазу-9 значительно лучше, чем какой-либо из нативных BIR доменов, за исключением связанных пептидов на основе Smac и сформировавшихся Smac с аффинностями, подобными таковым нативного ML-IAP-BIR. Усовершенствованное каспазой-9 ингибирование химерного BIR домена МLXBIR3SG коррелирует с усиленным ингибированием индуцируемого доксорубицином апоптоза при трансфекции в клетки MCF7.
Последовательность МLXBIR3SG:



Испытание связывания пептида TR-FRET
Конкурентные эксперименты по флуоресцентному резонансному энергетическому переносу с разрешением во времени проводили на ридере Wallac Victor2 Multilabeled Counter Reader (Perkin Elmer Life and Analytical Sciences, Inc.), согласно процедурам по Kolb et al (Journal of Biomolecular Screening, 1996, 1(4): 203). Коктейль реагентов, содержащий 300 нM his-меченный MLXBLR3SG; 200 нM биотинилированного пептида SMAC (AVPI); 5 мкг/мл анти-his аллофикоцианина (XL665) (CISBio International) и 200 нг/мл стрептавидин-европия (Perkin Elmer) получали в буфере реагентов (50 мM Tris [pH 7,2], 120 мM NaCl, 0,1% бычьих глобулинов, 5 мM DTT и 0,05% октилглюкозида). (В качестве варианта этот коктейль может быть приготовлен с использованием меченного европием анти-His (Perkin Elmer) и стрептавидин-аллофикоцианина (Perkin Elmer) при концентрациях 6,5 нM и 25 нM, соответственно). Коктейль реагентов инкубировали при комнатной температуре в течение 30 минут. После инкубирования коктейль добавляли к последовательным разбавлениям 1:3 соединения-антагониста (исходя из концентрации 50 мкM) в 384-луночных черных планшетах FIA (Greiner Bio-One, Inc.). После 90-минутного инкубирования при комнатной температуре флуоресценцию считывали с фильтров для активизации европия (340 нм) и длинами волн эмиссии европия (615 нм) и аллофикоцианина (665 нм). Данные антагониста рассчитывали как отношение эмиссионного сигнала аллофикоцианина при 665 нм к сигналу эмиссии европия при 615 нм (эти отношения умножали на коэффициент 10000 для облегчения обращения с данными). Полученные величины наносили на график как функцию концентрации антагониста и подставляли в 4-параметрическое уравнение, используя компьютерные программы Kaleidograph (Synergy Software, Reading, PA). Показатели силы антагониста определяли из величин IC50.
Флуоресцентное поляризационное испытание связывания пептида
Поляризационные эксперименты проводили на приборе Analyst HT 96-384 (Molecular Devices Corp.) согласно процедуре Keating, S.M., Marsters, J, Beresini, M., Ladner, C., Zioncheck, K., Clark, K., Arellano, F., and Bodary., S. (2000), Proceedings of SPIE: In Vitro Diagnostic Instrumentation (Cohn, Г.E., Ed.) pp.128-137, Bellingham, WA. Образцы для флуоресцентных поляризационных измерений аффинности готовили добавлением 1:2 последовательных разбавлений при конечной концентрации 5 мкM МLXBIR3SG в буфере для поляризации (50 мM Tris [pH 7,2], 120 мM NaCl, 1% бычьих глобулинов 5 мM DTT и 0,05% октилглюкозида) к 5-карбоксифлуоресцеин-конъюгированному AVPdi-Phe-NH2 (AVР-diPhe-FAM) при конечной концентрации 5 нM.
зонд AVР-diPhe-FAM
Реакции регистрировали после времени инкубирования 10 минут при комнатной температуре со стандартными отсекающими фильтрами для флуоресцеинового флуорофора (λex=485 нм; λem=530 нм) в 96-луночных черных планшетах HE96 (Моlecular Devices Corp.). Величины флуоресценции наносили на график как функцию концентрации белка, и величины IC50 получали подстановкой данных в 4-параметрическое уравнение, используя компьютерные программы Kaleidograph (Synergy software, Reading, PA). Конкурентные эксперименты проводили путем добавления МLXBIR3SG при 30 нM в лунки, содержащие 5 нM зонда AVР-diPhe-FAM, а также последовательных разбавлений 1:3 соединения-антагониста, исходя из концентрации 300 мкM в буфере для поляризации. Образцы регистрировали после 10-минутного инкубирования. Величины флуоресцентной поляризации наносили на график как функцию концентрации антагониста, и величины IC50 получали подстановкой данных в 4-параметрическое уравнение, используя компьютерные программы Kaleidograph (Synergy software, Reading, PA). Константы ингибирования (Ki) для антагонистов определяли из величин IC50. Соединения по изобретению, которые были проверены в этом испытании, показали Ki 100 мкM или менее. Например, соединение 48 имело Ki 7,87, соединение 54 имело Ki 0,0556, соединение 56 имело Ki 0,0338 и соединение 60 имело Ki 0,1454.
N/A - не определено
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ IAP | 2008 |
|
RU2491276C2 |
| ИМИДАЗОПИРИДИНОВЫЕ ИНГИБИТОРЫ IAP | 2007 |
|
RU2466131C2 |
| ИНГИБИТОРЫ IAP | 2005 |
|
RU2401840C2 |
| ЗАМЕЩЕННЫЕ ПИРИДОПИРАЗИНЫ КАК НОВЫЕ ИНГИБИТОРЫ Syk | 2012 |
|
RU2569635C9 |
| N-ФЕНИЛ-ДИОКСО-ГИДРОПИРИМИДИНЫ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРА ВИРУСА ГЕПАТИТА С (HCV) | 2008 |
|
RU2542099C2 |
| ИНГИБИТОРЫ БЕТА-ЛАКТАМАЗ | 2013 |
|
RU2654692C2 |
| АНТИВИРУСНЫЕ СОЕДИНЕНИЯ | 2009 |
|
RU2505540C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ | 2015 |
|
RU2733405C2 |
| ПРОИЗВОДНЫЕ БОРОНОВОЙ КИСЛОТЫ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2017 |
|
RU2773346C2 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2808166C2 |

Изобретение относится к новым ингибиторам IAP общей формулы I, где Q, X1, X2, Y, Z1, Z2, Z3, Z4, R1, R2, R3, R3', R4, R4', R5, R6, R6' и n имеют указанные в настоящем описании значения. Соединения применимы в качестве терапевтических агентов для лечения злокачественных новообразований 6 н. и 9 з.п. ф-лы, 33 пр.

1. Соединение формулы (I):

где X1 и Х2, оба означают O;
Y означает (CR7R7)n, где R7 означает Н;
Z1 означает NH или S;
Z2, Z3 и Z4 независимо означают CQ или N;
Q означает Н, галоген, низший алкил (который необязательно замещен фенилом), фенил (который необязательно замещен галогеном) или пиридинил;
R1 означает Н;
R2 выбирают из группы, состоящей из таких групп, как трет-бутил, изопропил, циклогексил, тетрагидропиран-4-ил, N-метилсульфонилпиперидин-4-ил, тетрагидротиопиран-4-ил, тетрагидротиопиран-4-ил (в котором S находится в окисленной форме SO или SO2), циклогексан-4-он, 4-гидроксициклогексан, 4-гидрокси-4-метилциклогексан, 1-метилтетрагидропиран-4-ил, 2-гидроксипроп-2-ил, бут-2-ил, тиофен-3-ил, пиперидин-4-ил, N-ацетилпиперидин-4-ил, N-гидроксиэтилпиперидин-4-ил, N-(2-гидроксиацетил)пиперидин-4-ил, N-(2-метоксиацетил)пиперидин-4-ил, пиридин-3-ил, фенил, тетрагидрофуран-2-илкарбонил и 1-гидроксиэт-1-ил;
R3 означает метил;
R3' означает Н;
R4 и R4' независимо означают Н или низший алкил, необязательно замещенный гидроксилом;
R5 означает Н;
R6 и R6' означают Н; и
n имеет значения от 0 до 4.
2. Соединение по п.1, где Z1 означает S, и Z2, Z3 и Z4 означают CQ или N.
3. Соединение по п.1, где Z1 означает S, и Z2, Z3 и Z4 означают СН.
4. Соединение по п.1, где Q означает фенил, который необязательно замещен галогеном, или пиридинил.
5. Соединение по п.1, где Q означает фенил, который необязательно замещен галогеном.
6. Соединение по п.1, где R2 означает трет-бутил, изопропил, циклогексил, тетрагидропиран-4-ил, тетрагидротиопиран-4-ил, тиофен-3-ил, пиперидин-4-ил или пиридин-3-ил.
7. Соединение по п.1, где R4 означает Н или метил, и R4' означает Н.
8. Соединение по п.2, где R2 означает изопропил, трет-бутил или циклогексил; R4 означает метил, R4' означает Н.
9. Способ индуцирования апоптоза в клетке, включающий введение в указанную клетку соединения по п.1.
10. Способ сенсибилизации клетки к апоптозному сигналу, включающий введение в указанную клетку соединения по п.1.
11. Способ по п.10, где указанный апоптозный сигнал индуцируют контактированием указанной клетки с соединением, выбранным из группы, состоящей из таких соединений, как цитарабин, флударабин, 5-фтор-2'-дезоксиуридин, гемцитабин, метотрексат, блеомицин, цисплатин, циклофосфорамид, адриамицин (доксорубицин), митоксантрон, камптотецин, топотекан, колцемид, колхицин, паклитаксел, винбластин, винкристин, тамоксифен, финастерид, таксотер и митомицин С, или облучением.
12. Способ по п.10, где указанный апоптозный сигнал индуцируют контактированием указанной клетки с Apo2L/TRAIL.
13. Способ ингибирования связывания белка IAP с белком каспазы, включающий контактирование указанного белка IAP с соединением по п.1.
14. Способ лечения заболевания или состояния, связанного со сверхэкспрессией IAP, у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения по п.1.
15. Способ лечения рака, включающий введение указанному млекопитающему эффективного количества соединения по п.1.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2012-05-20—Публикация
2006-12-19—Подача