Область техники
Настоящее изобретение относится к композиции, содержащей очищенный экстракт, выделенный из Pseudolysimachion rotundum var. subintegrum, содержащий большое количество активного компонента, или соединения, выделенные из него, в качестве активного компонента, для профилактики или лечения хронической обструктивной болезни легких (ХОБЛ) и ее применению.
Уровень техники
Как правило, хроническая обструктивная болезнь легких (ХОБЛ) представляет собой одну из болезней легких, вызванную атипичным воспалительным заболеванием легких, приводящим к обструкции дыхательных путей. ХОБЛ приводит к одышке, возникающей в результате затруднения прохождения потока выдыхаемого воздуха, и характеризуется различными симптомами, например, слабо обратимым ограничением прохождения воздуха в дыхательных путях или обструкцией дыхательных путей, прогрессирующим развитием в соответствии со временем от начала заболевания и т.д., отличными от общих симптомов, характерных для астмы, и может быть классифицирована как легочная эмфизема и хронический обструктивный бронхит (Barnes P.J. 20014, Mediators of chronic obstructive pulmonary disease, Pharmacol. Rev. 56:515-548).
Сообщалось, что ХОБЛ может быть одним из факторов риска сердечнососудистой заболеваемости и смертности, и что ХОБЛ была пятой по значимости причиной смерти в мире в 2001 году. Распространенность хронической обструктивной болезни легких по данным Глобальной инициативы по хронической обструктивной болезни легких (GOLD) (отношение ОФВ1 к ФВС менее 0,7) составила 17,2% (у мужчин 25,8%; у женщин 9,6%) среди корейцев старше 45 лет (Dong Soon Kim, Young Sam Kim, Ki-Suck Jung, Jung Hyun Chang, Chae-Man Lim, Jae Ho Lee, Soo-Taek Uh, Jae Jeong Shim и Woo Jin Lew, on behalf of the Kopean Academy of Tuberculosis and Respiratory Diseases, Am J Respir Crit Care Med Vol 172. pp 842-847, 2005; Don D. Sin and S.F. Paul Man, Chronic Obstructive Pulmonary Disease as a Risk Factor for Cardiovascular Morbidity and Mortality, Proc Am Thorac Soc Vol 2. pp 8-11, 2005; A Sonia Buist, Mary Ann McBurnie, William M Vollmer, Suzanne Gillespie, Peter Burney, David M Mannino, Ana M В Menezes, Sean D Sullivan, Todd A Lee, Kevin В Weiss, Robert L Jensen, Guy В Marks, Amund Gulsvik, Ewa Nizankowska-Mogilnicka, International variation in the prevalence of COPD (The BOLD Study): a population-based prevalence study, Lancet, Vol 370; 741-750, September 1, 2007).
У большинства пациентов с ХОБЛ наблюдаются все три патологических механизма (хронический обструктивный бронхит, эмфизема и закупорка слизью), которые вызваны курением, но они могут различаться соотношением между эмфиземой и обструктивным бронхитом. В развитых странах курение сигарет является на сегодняшний день наиболее распространенной причиной ХОБЛ, но есть и другие факторы риска, включая загрязнение воздуха (в частности, загрязнение воздуха внутри помещений в результате сжигания топлива), плохое питание и профессиональное воздействие. ХОБЛ характеризуется увеличением темпов естественного снижения легочной функции с возрастом. Медленно прогрессирующее ограничение скорости воздушного потока приводит к дееспособности и преждевременной смерти, и довольно сильно отличается от переменной обструкции дыхательных путей и симптомов при астме, для которых редко наблюдается прогрессирование степени тяжести.
Сообщалось, что патофизиологическое действие и комплекс симптомов ХОБЛ принципиально отличаются от таковых при астме. Хотя и при ХОБЛ и при астме наблюдается воспаление в дыхательных путях, существуют заметные различия в характере воспалительного процесса - различия в воспалительных клетках, медиаторах, ответе на воспаление, анатомическом распространении и ответе на противовоспалительную терапию, например, (a) касательно воспалительных клеток, тучных клеток, эозинофилов, D4 + клеток (Th2), макрофагов и т.д., они главным образом влияют на возникновение астмы, в то время как на возникновение ХОБЛ главным образом влияют нейтрофилы, CD8+ (Tc) и т.д.; (b) касательно медиаторов воспаления, лейкотриенов B, гистамина, ИЛ-4, ИЛ-5, ИЛ-13, эотаксина, RENTES, окислительного стресса и т.д., они главным образом участвуют в возникновении астмы, в то время как в возникновении ХОБЛ главным образом участвуют ФНО-альфа, ИЛ-8, GRO-альфа и т.д.; (c) касательно воспалительного комплекса симптомов, астма показывает воспалительный комплекс симптомов путем воздействия на весь легочный тракт в раннем возрасте, например, AHR (гиперреактивность дыхательных путей), эпителиальный шеддинг, фиброз, непаренхимальное вовлечение, секреция слизи, относительно обратимая обструкция дыхательных путей, кашель, чихание, одышка и т.д., в отличие от ХОБЛ, которая возникает в результате воздействия на периферические дыхательные пути у взрослых и характеризуется различными симптомами, такими как эпителиальная метаплазия, разрушение паренхимы, относительно необратимая обструкция дыхательных путей, хронический бронхит, эмфизема и т.д. (Barnes PJ (2000b) Mechanisms in COPD: differences from asthma. Chest 117 (Suppl): 10S-14S.; Saetta M, Turato G, Maestrelli P, Mapp CE, and Fabbri LM (2001) Cellular and structural bases of chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 163:1304-1309).
Гистопатологические исследования ХОБЛ показывают преобладающее участие периферических дыхательных путей (бронхиол) и легочной паренхимы, в то время как астма включает воспаление во всех дыхательных путях, но без вовлечения легочной паренхимы. Присутствует обструкция бронхиол с фиброзом и инфильтрацией макрофагами и Т-лимфоцитами. Присутствует разрушение паренхимы легких, а так же увеличение числа макрофагов и CD8 (цитотоксических) Т-лимфоцитов (Saetta М, Di Stefano A, Turato G, Facchini FM, Corbino L, Mapp CE, Maestrelli P, Ciaccia A, and Fabbri LM (1998) CD8T-lymphocytes in peripheral airways of smokers with chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 157:822-826.). Бронхиальная биопсия показывает, что у больных с тяжелой ХОБЛ наблюдаются аналогичные изменения с инфильтрацией макрофагами и CD8 клетками и увеличенное число нейтрофилов (Di Stefano A, Capelli A, Lusuardi М, BALBo Р, Vecchio С, Maestrelli Р, Mapp CE, Fabbri LM, Donner CF, and Saetta M (1998) Severity of airflow limitation is associated with severity of airway inflammation in smokers. Am. J. Respir. Crit. Care Med. 158:1277-1285.).
В отличие от астмы, эозинофилы не повышены, исключая период обострения или когда у пациента имеется сопутствующая астма (Fabbri L, Beghe В, Caramori G, Papi A, and Saetta M (1998) Similarities and discrepancies between exacerbations of asthma and chronic obstructive pulmonary disease. Thorax 53:803-808; Fabbri LM, Romagnoli M, Corbetta L, Casoni G, Busljetic K, Turato G, Ligabue G, Ciaccia A, Saetta M, and Papi A (2003) Differences in airway inflammation in patients with fixed airflow obstruction due to asthma or chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 167:418-424.).
Соответственно, терапевтический подход к лечению хронической обструктивной болезни легких (ХОБЛ) должен отличаться от подхода к лечению астмы, однако существующая в настоящее время терапия направлена на неспецифическое лечение обоих заболеваний. Таким образом, не существует противовоспалительной терапии, специально одобренной для ХОБЛ, и имеющиеся противовоспалительные методы терапии были первоначально разработаны для лечения астмы. Задачи, стоящие перед исследованиями ХОБЛ, разноплановы; необходимо раскрыть механизмы, лежащие в основе сложной и гетерогенной патологии этого заболевания; необходимо подтвердить роль воспаления в прогрессировании заболевания (Hele Dj, Belvisi MG, 2003. Novel therapies for the treatment of inflammatory airway disease, Expert. Opino. Invest. Drug, 12:5-18; J Craig Fox and Mary F Fitzgerald; The role of animal models in the pharmacological evaluation of emerging anti-inflammatory agents for the treatment of COPD, Current Opinion in Pharmacology 2009, 9:231-242).
Постоянно разрабатываются улучшенные методы терапии, используемые для лечения астмы, с применением более длительно действующих агонистов, более безопасных стероидов и комбинаций терапий, и антихолинергические средства обеспечивают облегчение симптомов для ХОБЛ. Стероиды используют для лечения обострений, но до сих пор ни для одного метода лечения не было показано, что он может в значительной степени влиять на прогрессирующее снижение функции легких при ХОБЛ или развитие астмы.
Соответственно, до настоящего времени было проведено много исследований, направленных на разработку новых лекарственных средств, способных обеспечивать эффективное и специфическое лечение ХОБЛ.
Особое внимание авторы настоящего изобретения уделяли разработке активного безопасного и эффективного лекарственного средства, полученного из природных источников, таких как растения, животные и т.д., обладающего сильной ингибирующей активностью на образование воспалительных клеток и, наконец, было обнаружено, что экстракт Pseudolysimachion longifolium проявляет высокую противовоспалительную, противоаллергическую и противоастматическую активность (патент Кореи №10-860080), и различные соединения, выделенные из него, такие как верпрозид (6-O-3,4-дигидроксибензоилкаталпол), пикрозид II (6-O-4-гидрокси-3-метоксибензоилкаталпол), верминозид (6-O-3,4-дигидроксициннамоилкаталпол), 6-O-вератроилкаталпол (6-O-3,4-диметоксибензоилкаталпол), минекозид (6-O-3-гидрокси-4-метоксициннамоилкаталпол), каталпол и т.п., также показали высокую противовоспалительную, противоаллергическую и противоастматическую активность (публикация патента Кореи №10-2006-125499).
Pseudolysimachion rotundum var subintegrum представляет собой многолетнее травянистое растение, распространенное в Корее, Китае, Японии, на острове Сахалин и в России.
На основании предыдущих исследований по противовоспалительной, противоаллергической и противоастматической активности экстракта Pseudolysimachion longifolium, описанного в патенте Кореи №10-860080, авторы настоящего изобретения пытались разработать более эффективный способ получения более активных компонентов и в более высоких количествах, выделенных из экстракта Pseudolysimachion rotundum var subintegrum и проявляющих противовоспалительную, противоаллергическую и противоастматическую активность.
Тем не менее, не сообщалось и не был раскрыт эффективный способ получения более активных компонентов и в более высоких количествах, выделенных из экстракта Pseudolysimachion rotundum var subintegrum, проявляющих более высокую и специфическую активность против ХОБЛ, чем описанные в цитируемой выше литературе, раскрытие которых включено в данное описание с помощью ссылок.
Соответственно, авторы настоящего изобретения разработали новый промышленный способ получения очищенного экстракта, содержащего более высокие количества активных компонентов, таких как производные каталпола, из экстракта Pseudolysimachion rotundum var subintegrum, и очищенный экстракт или соединения, выделенные из него, показали высокую активность против ХОБЛ без агонистического эффекта на бета-2-рецепторы в различных исследованиях in vivo с использованием самцов мышей BALB/c, например, в исследовании ингибирования пролиферации и активности воспалительных иммуноцитов и рекрутинга нейтрофилов в легкие, вызванных заболеванием ХОБЛ; исследовании ингибирования воспроизводства хемокинов, вовлеченных в разрушение пневмоцитов, таких как МИП-2/CXCL-2, ФНО-альфа, KC/CXCL-1 (хемокины Gro-альфа), CXCL-8 и т.д.; эффект снижения высвобождения ИЛ-1 бета, ИЛ-6, ФНО-альфа и экспрессии ММП-9 за счет уменьшения активации NF-каппаВ в исследованиях на животных с применением СПФ (свободных от специфической патогенной микрофлоры) крыс линии Спрег-Доули, а также в исследовании in vitro, например, в исследовании ингибирования экспрессии гена MUC5AC (олигомерного слизь/гель-образующего), индуцирующий эффект на экспрессию ИЛ-4 Th2 клетками в исследовании анализа изменений молекулярной экспрессии и т.д.
Раскрытие изобретения
Техническая задача
Согласно настоящему изобретению предложена фармацевтическая композиция и полезный для здоровья пищевой продукт, содержащие новый очищенный экстракт, содержащий активные компоненты, такие как производные каталпола, из Pseudolysimachion rotundum var subintegrum, или по меньшей мере одно соединение, выбранное из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, для лечения и профилактики хронической обструктивной болезни легких (ХОБЛ).
Согласно настоящему изобретению также предложено применение нового очищенного экстракта, содержащего активные компоненты, такие как производные каталпола, из Pseudolysimachion rotundum var subintegrum, или по меньшей мере одно соединение, выбранное из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, для лечения и профилактики хронической обструктивной болезни легких (ХОБЛ).
Согласно настоящему изобретению также предложен способ лечения или профилактики хронической обструктивной болезни легких (ХОБЛ) у млекопитающего, включающий введение указанному млекопитающему эффективного количества нового очищенного экстракта, содержащего активные компоненты, такие как производные каталпола, из Pseudolysimachion rotundum var subintegrum, или по меньшей мере одно соединение, выбранное из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, совместно с их фармацевтически приемлемым носителем.
Решение задачи
Соответственно, задачей настоящего изобретения является обеспечение фармацевтической композиции или полезного для здоровья функционального пищевого продукта, содержащего новый очищенный экстракт, содержащий активные компоненты, такие как производные каталпола, из Pseudolysimachion rotundum var subintegrum, или по меньшей мере одно соединение, выбранное из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
В настоящем описании термин "производные каталпола" включает верпрозид, каталпозид, пикрозид II, изованиллоил каталпол и 6-O-вератроил каталпол и т.д.
В настоящем описании термин "Pseudolysimachion rotundum var subintegrum" включает культивированное или выросшее в естественных условиях растение и коммерчески доступное растение, но не ограничивается перечисленным в настоящем документе.
В настоящем описании термин "новый очищенный экстракт" включает (a) очищенный экстракт, фракционированный с помощью бутанола (обозначенный как "ATC1" в дальнейшем) и (b) экстракт, очищенный с помощью вторичного фракционирования (обозначенный как "ATC2" в дальнейшем).
Конкретно, термин "очищенный экстракт, фракционированный с помощью бутанола (ATC1)" характеризуется содержанием 15-50% (масс./масс.) верпрозида, 0,3-10% (масс./масс.) вератровой кислоты, 0,5-10% (масс./масс.) каталпозида, 0,3-10% (масс./масс.) пикрозида II, 0,3-10% (масс./масс.) изованиллоил каталпола и 0,3-10% (масс./масс.) 6-O-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var subintegrum; предпочтительно 20-25% (масс./масс.) верпрозида, 0,5-5% (масс./масс.) вератровой кислоты, 1-5% (масс./масс.) каталпозида, 0,5-5% (масс./масс.) пикрозида II, 0,5-5% (масс./масс.) изованиллоил каталпола и 1-5% (масс./масс.) 6-O-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var subintegrum;
и/или характеризуется содержанием 12,3-47% (масс./масс.) производных каталпола в общем экстракте (100%) Pseudolysimachion rotundum var subintegrum, при этом массовое соотношение (масс./масс.) производных каталпола в экстракте является следующим: 15,0-18,0 частей (масс./масс.) верпрозида, 2,10-2,60 частей (масс./масс.) каталпозида, 1 часть (масс./масс.) пикрозида II, 1,00-1,30 частей (масс./масс.) изованиллоил каталпола и 2,00-2,30 частей (масс./масс.) 6-O-вератроил каталпола; предпочтительно 16,0-17,0 частей (масс./масс.) верпрозида, 2,20-2,50 частей (масс./масс.) каталпозида, 1 часть (масс./масс.) пикрозида II, 1,10-1,20 частей (масс./масс.) изованиллоил каталпола и 2,10-2,20 частей (масс./масс.) 6-O-вератроил каталпола; более предпочтительно 16,20-16,99 частей (масс./масс.) верпрозида, 2,40-2,45 частей (масс./масс.) каталпозида, 1 часть (масс./масс.) пикрозида II, 1,10-1,19 частей (масс./масс.) изованиллоил каталпола и 2,10-2,19 частей (масс./масс.) 6-O-вератроил каталпола.
Более конкретно, термин "очищенный экстракт, фракционированный с помощью бутанола (ATC1)" приготовлен по способу, включающему: добавление на первой стадии по меньшей мере одного экстрагирующего растворителя, выбранного из воды, низшего C1-C4 спирта, такого как метанол, этанол, бутанол и т.д. или их смесей, предпочтительно смеси воды и этанола, более предпочтительно 30-80% (масс./масс.) этанола в воде, для высушивания Pseudolysimachion rotundum var subintegrum; осуществление на второй стадии по меньшей мере одного способа экстракции, выбранного из экстракции горячей водой в колбе с обратным холодильником, экстракции холодной водой, ультразвуковой или обычной экстракции, предпочтительно экстракции холодной водой, с последующей экстракцией в колбе с обратным холодильником при температуре в диапазоне от 10 до 100°C, предпочтительно от 20 до 90°C, в течение периода времени от 30 минут до 72 часов, предпочтительно от 6 до 48 часов, более предпочтительно экстракции холодной водой при температуре в диапазоне от 10 до 60°C, предпочтительно от 20 до 50°C, в течение периода времени от 30 минут до 72 часов, предпочтительно от 6 до 48 часов, и затем экстракции в колбе с обратным холодильником при температуре в диапазоне от 40 до 120°C, предпочтительно от 60 до 90°C, в течение периода времени от 30 минут до 72 часов, предпочтительно от 6 до 48 часов, многократно, с получением первичного экстракта; суспендирование на 3 стадии первичного экстракта в примерно 0,5-10 кратном объеме (об./об.), предпочтительно примерно 1-5 кратном объеме (об./об.) воды с получением суспендированного экстракта; и добавление примерно 0,5-20 кратного объема (об./об.), предпочтительно примерно 1-10 кратного объема (об./об.) бутанола, разделение на водный слой и слой бутанола, и отбор слоя бутанола с получением фракционированного с помощью бутанола очищенного экстракта (ATC1), содержащего 15-50% (масс./масс.) верпрозида, 0,3-10% (масс./масс.) вератровой кислоты, 0,5-10% (масс./масс.) каталпозида, 0,3-10% (масс./масс.) пикрозида II, 0,3-10% (масс./масс.) изованиллоил каталпола и 0,3-10% (масс./масс.) 6-O-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var subintegrum, для лечения и профилактики хронической обструктивной болезни легких (ХОБЛ).
Соответственно, согласно другому варианту реализации настоящего изобретения предложен способ получения очищенного экстракта, фракционированного с помощью бутанола (ATC1), выделенного из Pseudolysimachion rotundum var subintegrum, который включает следующие стадии: добавление на первой стадии по меньшей мере одного экстрагирующего растворителя, выбранного из воды, низшего C1-C4 спирта, такого как метанол, этанол, бутанол и т.д. или их смесей, предпочтительно смеси воды и этанола, более предпочтительно 30-80% (масс./масс.) этанола в воде, для высушивания Pseudolysimachion rotundum var subintegrum; осуществление на второй стадии по меньшей мере одного способа экстракции, выбранного из экстракции горячей водой в колбе с обратным холодильником, экстракции холодной водой, ультразвуковой или обычной экстракции, предпочтительно экстракции холодной водой, с последующей экстракцией в колбе с обратным холодильником при температуре в диапазоне от 10 до 100°C, предпочтительно от 20 до 90°C, в течение периода времени от 30 минут до 72 часов, предпочтительно от 6 до 48 часов, более предпочтительно экстракции холодной водой при температуре в диапазоне от 10 до 60°C, предпочтительно от 20 до 50°C, в течение периода времени от 30 минут до 72 часов, предпочтительно от 6 до 48 часов и затем экстракции в колбе с обратным холодильником при температуре в диапазоне от 40 до 120°C, предпочтительно от 60 до 90°C, в течение периода времени от 30 минут до 72 часов, предпочтительно от 6 до 48 часов, многократно, с получением первичного экстракта; суспендирование на 3 стадии первичного экстракта в примерно 0,5-10 кратном объеме (об./об.), предпочтительно примерно 1-5 кратном объеме (об./об.) воды с получением суспендированного экстракта; и добавление примерно 0,5-20 кратного объема (об./об.) бутанола, предпочтительно примерно 1-10 кратного объема (об./об.) бутанола, разделение на водный слой и слой бутанола, и отбор слоя бутанола с получением фракционированного с помощью бутанола очищенного экстракта (ATC1), содержащего 15-50% (масс./масс.) верпрозида, 0,3-10% (масс./масс.) вератровой кислоты, 0,5-10% (масс./масс.) каталпозида, 0,3-10% (масс./масс.) пикрозида II, 0,3-10% (масс./масс.) изованиллоил каталпола и 0,3-10% (масс./масс.) 6-O-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var subintegrum, для лечения и профилактики хронической обструктивной болезни легких (ХОБЛ).
Конкретно, термин "экстракт, очищенный с помощью вторичного фракционирования (ATC2)" содержит 30-60% (масс./масс.) верпрозида, 0,5-10% (масс./масс.) вератровой кислоты, 2-20% (масс./масс.) каталпозида, 1-10% (масс./масс.) пикрозида II, 1-10% (масс./масс.) изованиллоил каталпола и 2-20% (масс./масс.) 6-O-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var subintegrum; предпочтительно 40-50% (масс./масс.) верпрозида, 1-5% (масс./масс.) вератровой кислоты, 3-10% (масс./масс.) каталпозида, 2-5% (масс./масс.) пикрозида II, 2-8% (масс./масс.) изованиллоил каталпола и 3-8% (масс./масс.) 6-O-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var subintegrum;
и/или содержит 36,5-91% (масс./масс.) производных каталпола в общем экстракте (100%) Pseudolysimachion rotundum var subintegrum, при этом массовое соотношение (масс./масс.) производных каталпола в экстракте является следующим: 13,0-16,0 частей (масс./масс.) верпрозида, 2,20-2,50 частей (масс./масс.) каталпозида, 1 часть (масс./масс.) пикрозида II, 1,10-1,40 частей (масс./масс.) изованиллоил каталпола и 2,00-2,20 частей (масс./масс.) 6-O-вератроил каталпола; предпочтительно 14,0-15,0 частей (масс./масс.) верпрозида, 2,30-2,45 частей (масс./масс.) каталпозида, 1 часть (масс./масс.) пикрозида II, 1,20-1,35 частей (масс./масс.) изованиллоил каталпола и 2,00-2,10 частей (масс./масс.) 6-O-вератроил каталпола; более предпочтительно 14,0-14,99 частей (масс./масс.) верпрозида, 2,35-2,43 частей (масс./масс.) каталпозида, 1 часть (масс./масс.) пикрозида II, 1,25-1,34 частей (масс./масс.) изованиллоил каталпола и 2,01-2,09 частей (масс./масс.) 6-O-вератроил каталпола.
Более конкретно, термин "экстракт, очищенный с помощью вторичного фракционирования (ATC2)" приготовлен по способу, включающему: добавление на первой стадии по меньшей мере одного экстрагирующего растворителя, выбранного из воды, низшего C1-C4 спирта, такого как метанол, этанол, бутанол и т.д. или их смесей, предпочтительно смеси воды и этанола, более предпочтительно 30-80% (масс./масс.) этанола в воде, для высушивания Pseudolysimachion rotundum var subintegrum; осуществление на второй стадии по меньшей мере одного способа экстракции, выбранного из экстракции горячей водой в колбе с обратным холодильником, экстракции холодной водой, ультразвуковой или обычной экстракции, предпочтительно экстракции холодной водой с последующей экстракцией в колбе с обратным холодильником при температуре в диапазоне от 10 до 100°C, предпочтительно от 20 до 90°C, в течение периода времени от 30 минут до 72 часов, предпочтительно от 6 до 48 часов, более предпочтительно экстракции холодной водой при температуре в диапазоне от 10 до 60°C, предпочтительно от 20 до 50°C, в течение периода времени от 30 минут до 72 часов, предпочтительно от 6 до 48 часов, и затем экстракции в колбе с обратным холодильником при температуре в диапазоне от 40 до 120°C, предпочтительно от 60 до 90°C, в течение периода времени от 30 минут до 72 часов, предпочтительно от 6 до 48 часов, многократно, с получением первичного экстракта; суспендирование на 3 стадии первичного экстракта в примерно 0,5-10 кратном объеме (об./об.) воды, предпочтительно примерно 1-5 кратном объеме (об./об.) воды, с получением суспендированного экстракта; добавление примерно 0,5-20 кратного объема (об./об.), предпочтительно примерно 1-10 кратного объема (об./об.) бутанола, разделение на водный слой и слой бутанола, и отбор слоя бутанола с получением фракционированного с помощью бутанола (ATC1) очищенного экстракта; и осуществление по меньшей мере одного способа очистки очищенного экстракта, фракционированного с помощью бутанола (ATC1), при этом способ очистки выбран из группы, состоящей из обращенно-фазовой распределительной хроматографии, нормально-фазовой распределительной хроматографии, ионообменной хроматографии и гель-хроматографии, с получением экстракта, очищенного с помощью вторичного фракционирования (ATC2), содержащего 30-60% (масс./масс.) верпрозида, 0,5-10% (масс./масс.) вератровой кислоты, 2-20% (масс./масс.) каталпозида, 1-10% (масс./масс.) пикрозида II, 1-10% (масс./масс.) изованиллоил каталпола и 2-20% (масс./масс.) 6-O-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var subintegrum, для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
Соответственно, согласно другому варианту реализации настоящего изобретения предложен способ получения нового экстракта, очищенного с помощью вторичного фракционирования (ATC2), выделенного из Pseudolysimachion rotundum var subintegrum, который включает следующие стадии: добавление на первой стадии по меньшей мере одного экстрагирующего растворителя выбранного из воды, низшего C1-C4 спирта, такого как метанол, этанол, бутанол и т.д. или их смесей, предпочтительно смеси воды и этанола, более предпочтительно 30-80% (масс./масс.) этанола в воде, для высушивания Pseudolysimachion rotundum var subintegrum; осуществление на второй стадии по меньшей мере одного способа экстракции, выбранного из экстракции горячей водой в колбе с обратным холодильником, экстракции холодной водой, ультразвуковой или обычной экстракции, предпочтительно экстракции холодной водой с последующей экстракцией в колбе с обратным холодильником при температуре в диапазоне от 10 до 100°C, предпочтительно от 20 до 90°C, в течение периода времени от 30 минут до 72 часов, предпочтительно от 6 до 48 часов, более предпочтительно экстракции холодной водой при температуре в диапазоне от 10 до 60°C, предпочтительно от 20 до 50°C, в течение периода времени от 30 минут до 72 часов, предпочтительно от 6 до 48 часов, и затем экстракции в колбе с обратным холодильником при температуре в диапазоне от 40 до 120°C, предпочтительно от 60 до 90°C, в течение периода времени от 30 минут до 72 часов, предпочтительно от 6 до 48 часов, многократно, с получением первичного экстракта; суспендирование на 3 стадии первичного экстракта в примерно 0,5-10 кратном объеме (об./об.), предпочтительно примерно 1-5 кратном объеме (об./об.) воды с получением суспендированного экстракта; добавление примерно 0,5-20 кратного объема (об./об.), предпочтительно примерно 1-10 кратного объема (об./об.) бутанола, разделение на водный слой и слой бутанола, отбор слоя бутанола с получением фракционированного с помощью бутанола (ATC1) очищенного экстракта; и осуществление по меньшей мере одного дополнительного способа очистки очищенного экстракта, фракционированного с помощью бутанола (ATC1), при этом способ очистки выбран из группы, состоящей из обращенно-фазовой распределительной хроматографии, нормально-фазовой распределительной хроматографии, ионообменной хроматографии и гель-хроматографии, с получением экстракта, очищенного с помощью вторичного фракционирования (ATC2), содержащего 30-60% (масс./масс.) верпрозида, 0,5-10% (масс./масс.) вератровой кислоты, 2-20% (масс./масс.) каталпозида, 1-10% (масс./масс.) пикрозида II, 1-10% (масс./масс.) изованиллоил каталпола и 2-20% (масс./масс.) 6-O-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var subintegrum, для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
Конкретно, термин "дополнительный способ очистки" выбран из (i) обращенно-фазовой распределительной хроматографии, (ii) нормально-фазовой распределительной хроматографии, (iii) ионообменной хроматографии или (iv) гель-хроматографии, предпочтительно обращенно-фазовой распределительной хроматографии, или любого вида хроматографии с применением любой смолы в качестве неподвижной фазы, которая может удерживать неполярное вещество с элюированием полярного вещества, например, смола сефадекс, такая как сефадекс, сефадекс LH20, сефадекс G-25, сефадекс G-10, сефароза, супердекс, смола метилкрилата, карбоксиметилцеллюлоза, сульфопропилцеллюлоза, карбоксиметил сефадекс, сульфопропил сефадекс, карбоксиметил сефароза, сульфопропил сефароза и т.п.; полимерная смола с обращенной фазой, полученная с применением сополимера стирола-дивинилбензола, такого как полимер X, HP20, PRP-h1 полимер и т.п., или метакрилатная смола-носитель и т.д.; силикагель с нормальной фазой, такой как продукт BPC (хроматография на неподвижной фазе), продукт силикагеля, производимый YMC Co. Ltd, продукт силикагеля, производимый DAISO Co. Ltd, продукт силикагеля, производимый ASAHI Co. Ltd, продукт силикагеля, производимый COSMOSYL Co. Ltd и т.п., продукт ОДС, служащий наполнителем для ВЭЖХ, такой как продукт ОДС, производимый YMC Co. Ltd, продукт ОДС, производимый DAISO Co. Ltd, продукт ОДС, производимый ASAHI Co. Ltd, продукт ОДС, производимый CHEMCO Co. Ltd, продукт ОДС, производимый Merck Co. Ltd, продукт ОДС, производимый COSMOSYL Co. Ltd, продукт ОДС, производимый FUJI Co. Ltd и т.п.
В предпочтительном варианте реализации, в котором применяют (i) обращенно-фазовую распределительную хроматографию в качестве дополнительного способа очистки согласно настоящему изобретению, "неподвижной фазой в вышеописанной обращенно-фазовой распределительной хроматографии" может быть любая неподвижная фаза, такая как вещество с обращенной фазой, которое способно удержать неполярное вещество и при этом элюироваться полярное вещество, предпочтительно неподвижная фаза на основе силикагеля, неподвижная фаза на основе полимера, такого как полистирол и т.д. и т.п., более предпочтительно производные силикагеля C2, C4, C6, C8, C10, C12, 14, C16, C18 и т.п.; или неподвижная фаза на основе полимера, такая как PS-2, Oasis HLB и т.п., и наиболее предпочтительно продукт на основе силикагеля с обращенной фазой (C18(IV)-D), ODS-A/ODS-AQ, производимый YMC Co. Ltd., продукт SP-C-ODS, производимый CHEMCO Co. Ltd., продукт SP-ODS-RPS, производимый DAISO Co. Ltd., продукт 5C18, производимый COSMOSYL Co. Ltd, продукт Хроматорекс (Chromatorex), производимый FUJI Co. Ltd и т.п.
В предпочтительном варианте реализации, в котором в качестве дополнительного способа очистки согласно настоящему изобретению применяют (i) обращенно-фазовую распределительную хроматографию, "подвижной фазой в вышеописанной (i) обращенно-фазовой распределительной хроматографии" может быть по меньшей мере один растворитель, выбранный из воды, ацетонитрила, низшего спирта, такого как метанол, этанол, бутанол и т.д., тетрагидрофуран (ТГФ) или их смесь, предпочтительно вода, низший спирт, такой как метанол, этанол, бутанол и т.д. или их смесь, более предпочтительно смесь растворителя из воды и метанола, наиболее предпочтительно смесь растворителя из воды и метанола с градиентом от 90:10 (об./об.) до 60:40 (об./об.), для элюирования полярного вещества.
В предпочтительном варианте реализации, в котором в качестве дополнительного способа очистки согласно настоящему изобретению применяют (ii) нормально-фазовую распределительную хроматографию, "неподвижной фазой в вышеописанной нормально-фазовой распределительной хроматографии" может быть любая неподвижная фаза, такая как вещество с нормальной фазой, которое может удержать полярное вещество и при этом элюироваться неполярное вещество, предпочтительно силикагель, флюоросил или неподвижная фаза на основе окиси алюминия, неподвижная фаза на основе полимера с функциональной группой CN, диол или NH2 и т.п., более предпочтительно силикагель, флюоросил или неподвижная фаза на основе окиси алюминия и т.д.
В предпочтительном варианте реализации, в котором в качестве дополнительного способа очистки согласно настоящему изобретению применяют (ii) нормально-фазовую распределительную хроматографию, "подвижной фазой в вышеописанной (ii) нормально-фазовой распределительной хроматографии" может быть по меньшей мере один растворитель, выбранный из гексана, гептана, этилацетата, этанола, диэтилового эфира, 2-пропанола или их смеси, предпочтительно гексан, гептан, этилацетат или их смесь, для элюирования неполярного вещества.
В предпочтительном варианте реализации, в котором в качестве дополнительного способа очистки согласно настоящему изобретению применяют (iii) ионообменную хроматографию, "неподвижной фазой в вышеописанной (iii) ионообменной хроматографии" может быть любая высокомолекулярная неподвижная фаза, такая как неподвижная фаза, которая имеет заряженный мостиковый фрагмент, предпочтительно катионообменная смола, анионообменная смола или синтетический адсорбент и т.п., более предпочтительно сильнокислая катионообменная смола, такая как AG 50W-x8, Amberlite IR-120, Dowex 60W-x8, SKIB и т.д., слабокислая катионообменная смола, такая как Amberlite IRA-67, Dowex 3-х4А и т.д., сильно основная катионообменная смола, такая как DIAION SKIB, DIAION PK216, DIAION CR20, DIAION UBK555 (Mitsubishi Chemical Co.), TRILITE SPC 160H, TRILITE SPC 180H, TRILITE SPC 400JH (Samyang Co. Ltd.), AMBERLITE 200C Na, AMBERLITE CG50, AMBERLITE CR1310 Na, AMBERJET 200H, AMBERLYST 131 WET, ALBERLYST 232 WET (ROHM and HAAS Co. Ltd.), Lewatit VP OC 1800, Lewatit VP OC 1812, Lewatit MDS1368 Na, Lewaitit K1221 (Bayer Co. Ltd.), PUROLITE PCR833CA, PUROLITE С145 (Purolite Co. Ltd.), MFG210, MFG 250 (Finex Co. Ltd.) и т.д.; сильно основная анионообменная смола, такая как SA11A, SA20A, SA21A т.д.; или CaptoQ (GE Healthcare Co. Ltd.), или смола, имеющая аналогичное свойство указанной, такая как Toyopearl QEA (Tosoh Co. Ltd.), Q сефароза FF (GE Healthcare Co. Ltd.), Fractogel EMD, Fractogel TMAE, Fractogel HICAP (Merck KGaA Co. Ltd or Darmstadt Co. Ltd.); наиболее предпочтительно, SA21A; адсорбент, такой как SP207, HP20SS, HP20 и т.д., более предпочтительно HP 20.
В предпочтительном варианте реализации, в котором в качестве дополнительного способа очистки согласно настоящему изобретению применяют (iv) гель-хроматографию, "неподвижной фазой в вышеописанной (iv) гель-хроматографии" может быть любая гелевая неподвижная фаза, такая как неподвижная фаза, которая может разделять молекулы образца по размеру, предпочтительно, гель на основе декстрана, такой как сефадекс (например, сефадекс G-25), гель на основе полиакриламида, такой как сефакрил (например, сефакрил S400), гель на основе агарозы, такой как супероза или сефароза (например, сефароза CL-4B) или их комбинации, такие как комбинация супердекса 200 с декстраном (например, Сефадекс™) или сшитый агарозный гель (Супероза™) и т.п., однако, не ограничивается перечисленными. "Подвижной фазой в вышеописанной (iv) гель-хроматографии" может быть буферный раствор, выбранный из группы, состоящей из натрий-ацетатного буфера, натрий-фосфатного буфера, аммоний-ацетатного буфера, MES (2-(N-морфолино)этансульфоновая кислота, Бис-Трис[2-Бис(2-гидроксиэтил)амино-2-(гидроксиметил)-1,3-пропандиол], ADA [N-(2-ацетамидо)иминодиацетат)], PIPES [пиперазин-N,N′-Бис(2-этансульфоновая кислота)], BES [N,N′-Бис(2-гидроксиэтил)-2-аминоэтансульфоновая кислота), MOPS [3-(N-морфолино)пропансульфоновая кислота)], TES (N-Трис(гидроксиметил)метил-2-аминоэтансульфоновая кислота], HEPES [N-2-гидроксиэтил-пиперазин-N′-2-этансульфоновая кислота)], и т.п.; предпочтительно натрий-ацетатный буфер, натрий-фосфатный буфер или аммоний-ацетатный буфер.
В предпочтительном варианте реализации настоящего изобретения может также применяться (v) гель-проникающая хроматография или гель-фильтрационная хроматография в дополнении к (i) обращенно-фазовой распределительной хроматографии, (ii) нормально-фазовой распределительной хроматографии, (iii) ионообменной хроматографии, (iv) гель-хроматографии или их комбинации, в качестве дополнительного способа очистки согласно настоящему описанию.
Согласно настоящему изобретению предложен новый очищенный экстракт, такой как (a) очищенный экстракт, фракционированный с помощью бутанола (обозначенный как "ATC1" в дальнейшем) или (b) экстракт, очищенный с помощью вторичного фракционирования (обозначенный как "ATC2" в дальнейшем), полученный вышеописанными способами получения.
Согласно настоящему изобретению также предложен новый очищенный экстракт, фракционированный с помощью бутанола (ATC1), из экстракта Pseudolysimachion rotundum var subintegrum, полученный вышеописанными способами получения, который содержит 12,3-47% (масс./масс.) производных каталпола в общем экстракте (100%) Pseudolysimachion rotundum var subintegrum, при этом указанные производные каталпозида состоят из 15-50% (масс./масс.) верпрозида, 0,3-10% (масс./масс.) вератровой кислоты, 0,5-10% (масс./масс.) каталпозида, 0,3-10% (масс./масс.) пикрозида II, 0,3-10% (масс./масс.) изованиллоил каталпола и 0,3-10% (масс./масс.) 6-O-вератроил каталпола, предпочтительно 20-25% (масс./масс.) верпрозида, 0,5-5% (масс./масс.) вератровой кислоты, 1-5% (масс./масс.) каталпозида, 0,5-5% (масс./масс.) пикрозида II, 0,5-5% (масс./масс.) изованиллоил каталпола и 1-5% (масс./масс.) 6-O-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var subintegrum.
Согласно настоящему изобретению также предложен новый очищенный экстракт, фракционированный с помощью бутанола (ATC1), из экстракта Pseudolysimachion rotundum var subintegrum, полученный вышеописанными способами получения, при этом массовое соотношение (масс./масс.) производных каталпозида в экстракте является следующим: 15,0-18,0 частей (масс./масс.) верпрозида, 2,10-2,60 частей (масс./масс.) каталпозида, 1 часть (масс./масс.) пикрозида II, 1,00-1,30 частей (масс./масс.) изованиллоил каталпола и 2,00-2,30 частей (масс./масс.) 6-O-вератроил каталпола, предпочтительно 16,0-17,0 частей (масс./масс.) верпрозида, 2,20-2,50 частей (масс./масс.) каталпозида, 1 часть (масс./масс.) пикрозида II, 1,10-1,20 частей (масс./масс.) изованиллоил каталпола и 2,10-2,20 частей (масс./масс.) 6-O-вератроил каталпола, более предпочтительно 16,20-16,99 частей (масс./масс.) верпрозида, 2,40-2,45 частей (масс./масс.) каталпозида, 1 часть (масс./масс.) пикрозида II, 1,10-1,19 частей (масс./масс.) изованиллоил каталпола и 2,10-2,19 частей (масс./масс.) 6-O-вератроил каталпола.
Согласно настоящему изобретению также предложен новый экстракт, очищенный с помощью вторичного фракционирования (ATC2), из экстракта Pseudolysimachion rotundum var subintegrum, полученный вышеописанными способами получения, который содержит 36,5-91% (масс./масс.) производных каталпола в общем экстракте (100%) Pseudolysimachion rotundum var subintegrum, при этом указанные производные каталпола состоят из 30-60% (масс./масс.) верпрозида, 0,5-10% (масс./масс.) вератровой кислоты, 2-20% (масс./масс.) каталпозида, 1-10% (масс./масс.) пикрозида II, 1-10% (масс./масс.) изованиллоил каталпола и 2-20% (масс./масс.) 6-O-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var subintegrum, предпочтительно 40-50% (масс./масс.) верпрозида, 1-5% (масс./масс.) вератровой кислоты, 3-10% (масс./масс.) каталпозида, 2-5% (масс./масс.) пикрозида II, 2-8% (масс./масс.) изованиллоил каталпола и 3-8% (масс./масс.) 6-O-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var subintegrum.
Согласно настоящему изобретению также предложен новый экстракт, очищенный с помощью вторичного фракционирования (ATC2), из экстракта Pseudolysimachion rotundum var subintegrum, полученный вышеописанными способами получения, при этом массовое соотношение (масс./масс.) производных каталпола в экстракте является следующим: 13,0-16,0 частей (масс./масс.) верпрозида, 2,20-2,50 частей (масс./масс.) каталпозида, 1 часть (масс./масс.) пикрозида II, 1,10-1,40 частей (масс./масс.) изованиллоил каталпола и 2,00-2,20 частей (масс./масс.) 6-O-вератроил каталпола, предпочтительно 14,0-15,0 частей (масс./масс.) верпрозида, 2,30-2,45 частей (масс./масс.) каталпозида, 1 часть (масс./масс.) пикрозида II, 1,20-1,35 частей (масс./масс.) изованиллоил каталпола и 2,00-2,10 частей (масс./масс.) 6-O-вератроил каталпола, более предпочтительно 14,50-14,99 частей (масс./масс.) верпрозида, 2,35-2,43 частей (масс./масс.) каталпозида, 1 часть (масс./масс.) пикрозида II, 1,15-1,24 частей (масс./масс.) изованиллоил каталпола и 2,01-2,09 частей (масс./масс.) 6-O-вератроил каталпола.
Термин "очищенный экстракт", раскрытый в настоящем описании, может быть использован в сухой форме, полученной способом испарения в вакууме, способом сублимационной сушки или способом сушки горячим воздухом и т.д.
Термин "профилактика", раскрытый в настоящем описании, включает любое воздействие, направленное на ингибирование или замедление возникновения определенного заболевания или расстройства, раскрытого здесь, с помощью введения композиции настоящего изобретения, термин "лечение", раскрытый в настоящем описании, включает любое воздействие, направленное на облегчение или благоприятное изменение симптомов, связанных с определенным заболеванием или расстройством, раскрытым в настоящем описании, путем введения композиции настоящего изобретения.
Авторы настоящего изобретения обнаружили, что новый промышленный способ получения очищенного экстракта может обеспечить активные компоненты в большем количестве, т.е. от 36,5% до 91,0% (масс./масс.), таких как производные каталпола, из экстракта Pseudolysimachion rotundum var subintegrum, по сравнению с неочищенным экстрактом, полученным обычным способом, раскрытым в известном уровне техники, где содержание производных каталпола составляет только 8,49% (масс./масс.) по данным различных ВЭЖХ анализов; например, очищенный экстракт настоящего изобретения (ATC1) содержит 17,6% (масс./масс.) верпрозида, 0,72% (масс./масс.) вератровой кислоты, 2,62% (масс./масс.) каталпозида, 1,08% (масс./масс.) пикрозида II, 1,26% (масс./масс.) изованиллоил каталпола и 2,36% (масс./масс.) 6-O-вератроил каталпола (см. Пример 2), и очищенный экстракт настоящего изобретения (ATC2) содержит 43,83% (масс./масс.) верпрозида, 1,80% (масс./масс.) вератровой кислоты, 7,07% (масс./масс.) каталпозида, 2,93% (масс./масс.) пикрозида II, 3,85% (масс./масс.) изованиллоил каталпола и 6,15% (масс./масс.) 6-O-вератроил каталпола, в то время как неочищенный экстракт (CX), полученный обычным способом, раскрытым в известном уровне техники, содержит только 5,9% (масс./масс.) верпрозида, 0,21% (масс./масс.) вератровой кислоты, 0,82% (масс./масс.) каталпозида, 0,40% (масс./масс.) пикрозида II, 0,42% (масс./масс.) изованиллоил каталпола и 0,74% (масс./масс.) 6-O-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var subintegrum; неочищенный экстракт, так же как и очищенный экстракт или выделенные из него соединения показали высокую активность против ХОБЛ без агонистического эффекта на бета-2-рецепторы в различных исследованиях in vivo с использованием самцов BALB/c мышей, например, исследовании ингибирования пролиферации и активности воспалительных иммуноцитов и рекрутинга нейтрофилов в легкие, вызванных заболеванием ХОБЛ; исследовании ингибирования воспроизводства хемокинов, вовлеченных в разрушение пневмоцитов, таких как МИП-2/CXCL-2, ФНО-альфа, KC/CXCL-1 (хемокины Gro-альфа), и CXCL-8 и т.д.; эффект снижения высвобождения ИЛ-1 бета, ИЛ-6, ФНО-альфа и ММП-9 экспрессии с помощью уменьшения активации NF-каппаВ в исследованиях на животных с применением СПФ (свободный от специфической патогенной микрофлоры) крыс линии Спрег-Доули, а также исследовании in vitro, например, исследовании ингибирования экспрессии гена MUC5AC (олигомерного слизь/гель-образующего), индуцирующий эффект на экспрессию ИЛ-4 Th2 клетками в исследовании анализа изменений молекулярной экспрессии и т.д.
Авторы настоящего изобретения обнаружили максимальное массовое отношение между вератровой кислотой, верпрозидом, каталпозидом, пикрозидом II, изованиллоил каталполом и 6-O-вератроил каталполом для лечения и профилактики хронической обструктивной болезни легких (ХОБЛ), т.е. верпрозид (ATC1-68,6%; ATC2-66,8%; расчитанный диапазон содержания на основании общей массы соединений: 45-90% (масс./масс.)), вератровая кислота (ATC1-2,8%; ATC2-2,7%; расчитанный диапазон содержания на основании общей массы соединений: 1,5-4,0% (масс./масс.)), каталпозид (ATC1-10,2%; ATC2-10,8%; расчитанный диапазон содержания на основании общей массе соединений: 7,0-14,0% (масс./масс.)), пикрозид II (ATC1-4,2%; ATC2-4,5%; расчитанный диапазон содержания на основании общей массы соединений: 3,0-6,0% (масс./масс.)), изованиллоил каталпол (ATC1-4,9%; ATC2-5,8%; расчитанный диапазон содержания на основании общей массы соединений: 3,0-8,0% (масс./масс.)) и 6-O-вератроил каталпол (ATC1-9,2%; ATC2-9,4%; рассчитанный диапазон содержания на основании общей массы соединений: 6,0-12,0% (масс./масс.)).
В соответствии с другим аспектом настоящего изобретения, согласно настоящему изобретению предложена фармацевтическая композиция или функциональный полезный для здоровья пищевой продукт, содержащие комбинации соединений в следующем массовом соотношении: 40-93% верпрозида, 1,0-10% вератровой кислоты, 2,0-25% каталпозида, 1,0-15% пикрозида II, 1,0-15% изованиллоил каталпола и 2,0-25% 6-O-вератроил каталпола, предпочтительно 45-90% верпрозида, 1,0-1,0% вератровой кислоты, 3,0-15% каталпозида, 2,0-10% пикрозида II, 2,0-10% изованиллоил каталпола и 2,0-15% 6-O-вератроил каталпола, для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
Согласно настоящему изобретению предложена фармацевтическая композиция или функциональный полезный для здоровья пищевой продукт, содержащие комбинации соединений в следующем массовом соотношении: 40-93% верпрозида, 1,0-10% вератровой кислоты, 2,0-25% каталпозида, 1,0-15% пикрозида II, 1,0-15% изованиллоил каталпола и 2,0-25% 6-O-вератроил каталпола, предпочтительно 45-90% верпрозида, 1,0-7,0% вератровой кислоты, 3,0-15% каталпозида, 2,0-10% пикрозида II, 2,0-10% изованиллоил каталпола и 2,0-15% 6-O-вератроил каталпола, и фармацевтически приемлемые носители или вспомогательные вещества, для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
В соответствии с другим аспектом настоящего изобретения, согласно настоящему изобретению предложена фармацевтическая композиция или функциональный полезный для здоровья пищевой продукт, содержащие новый очищенный экстракт, содержащий активные компоненты, полученные вышеописанными способами, или по меньшей мере одно соединение, выбранное из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
Согласно настоящему изобретению предложена фармацевтическая композиция, содержащая новый очищенный экстракт, содержащий активные компоненты, полученные вышеописанными способами, или по меньшей мере одно соединение, выбранное из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, и фармацевтически приемлемые носители или вспомогательные вещества, для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
В соответствии с другим аспектом настоящего изобретения, согласно настоящему изобретению предложено также применение нового очищенного экстракта, полученного вышеописанными способами, или по меньшей мере одного соединения, выбранного из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, для производства лекарственных средств для применения для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
Термин "фармацевтически приемлемые носители или вспомогательные вещества", определенный здесь, включает «фармацевтические добавки, неактивные компоненты, применяемые в составе лекарственных средств. Они включают красители, ароматизаторы, связующие вещества, смягчающие вещества, наполнители, смазывающие вещества, консерванты и вещества многих других классов. Обычные вспомогательные вещества включают кукурузный крахмал, лактозу, тальк, стеарат магния, сахарозу, желатин, стеарат кальция, диоксид кремния, шеллак и лак, которые хорошо известны в данной области (см., домашнюю страницу «Food and Drug Administration»: www.fda.gov или информацию о лекарственных средствах онлайн: www.drugs.com) или ранее вышедших публикациях (например, Rowe, Raymond С et al., Handbook of Pharmaceutical Excipients, Pharmaceutical Press, 7th Edition, 2012).
В соответствии с другим аспектом настоящего изобретения, согласно настоящему изобретению также предложен способ лечения или профилактики хронической обструктивной болезни легких (ХОБЛ) у млекопитающих, причем этот способ включает введение терапевтически эффективного количества нового очищенного экстракта, полученного вышеописанными способами, или по меньшей мере одного соединения, выбранного из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-О-вератроил каталпола, млекопитающему, страдающему хронической обструктивной болезнью легких (ХОБЛ).
В соответствии с другим аспектом настоящего изобретения, согласно настоящему изобретению также предложен способ лечения или профилактики хронической обструктивной болезни легких (ХОБЛ) у млекопитающих, причем этот способ включает введение композиции, содержащей терапевтически эффективное количество нового очищенного экстракта, полученного вышеописанными способами, или по меньшей мере одного соединения, выбранного из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, и фармацевтически приемлемые носители или вспомогательные вещества, млекопитающему, страдающему хронической обструктивной болезнью легких (ХОБЛ).
В соответствии с другим аспектом настоящего изобретения, согласно настоящему изобретению также предложен способ лечения или профилактики хронической обструктивной болезни легких (ХОБЛ) у млекопитающих, причем этот способ включает введение терапевтически эффективного количества комбинации соединений в следующем массовом соотношении: 40-93% верпрозида, 1,0-10% вератровой кислоты, 2,0-25% каталпозида, 1,0-15% пикрозида II, 1,0-15% изованиллоил каталпола и 2,0-25% 6-O-вератроил каталпола, предпочтительно 45-90% верпрозида, 1,0-7,0% вератровой кислоты, 3,0-15% каталпозида, 2,0-10% пикрозида II, 2,0-10% изованиллоил каталпола и 2,0-15% 6-O-вератроил каталпола, млекопитающему, страдающему хронической обструктивной болезнью легких (ХОБЛ).
В соответствии с другим аспектом настоящего изобретения, согласно настоящему изобретению также предложен способ лечения или профилактики хронической обструктивной болезни легких (ХОБЛ) у млекопитающих, причем этот способ включает введение композиции, содержащей терапевтически эффективное количество комбинации соединений в следующем массовом соотношении: 40-93% верпрозида, 1,0-10% вератровой кислоты, 2,0-25% каталпозида, 1,0-15% пикрозида II, 1,0-15% изованиллоил каталпола и 2,0-25% 6-O-вератроил каталпола, предпочтительно 45-90% верпрозида, 1,0-7,0% вератровой кислоты, 3,0-15% каталпозида, 2,0-10% пикрозида II, 2,0-10% изованиллоил каталпола и 2,0-15% 6-O-вератроил каталпола, и фармацевтически приемлемые носители или вспомогательные вещества, млекопитающему, страдающему хронической обструктивной болезнью легких (ХОБЛ).
В соответствии с другим аспектом настоящего изобретения, также предложено применение композиции, содержащей новый очищенный экстракт, полученный вышеописанными способами, или по меньшей мере одно соединение, выбранное из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, и фармацевтически приемлемые носители или вспомогательные вещества, для производства лекарственных средств, применяемых для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
В соответствии с другим аспектом настоящего изобретения, также предложено применение композиции, содержащей комбинации соединений в следующем массовом соотношении: 40-93% верпрозида, 1,0-10% вератровой кислоты, 2,0-25% каталпозида, 1,0-15% пикрозида II, 1,0-15% изованиллоил каталпола и 2,0-25% 6-O-вератроил каталпола, предпочтительно 45-90% верпрозида, 1,0-7,0% вератровой кислоты, 3,0-15% каталпозида, 2,0-10% пикрозида II, 2,0-10% изованиллоил каталпола и 2,0-15% 6-O-вератроил каталпола, и фармацевтически приемлемые носители или вспомогательные вещества, для производства лекарственных средств, применяемых для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
Композиция настоящего изобретения для лечения и профилактики хронической обструктивной болезни легких (ХОБЛ) может содержать вышеуказанные экстракты или соединения в количестве 0,1~99%, предпочтительно 0,1~50% в расчете на общую массу композиции.
Композиция согласно настоящему изобретению может быть приготовлена в виде фармацевтической композиции, содержащей фармацевтически приемлемые носители, вспомогательные вещества или разбавители, например, лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмалы, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральное масло. Составы могут дополнительно включать наполнители, агенты, препятствующие агглютинации, смазывающие агенты, смачивающие агенты, ароматизаторы, эмульгаторы, консерванты и т.п. Композиции изобретения могут быть изготовлены так, чтобы обеспечить быстрое, длительное или замедленное высвобождение активного компонента после их введения пациенту с применением любого способа, хорошо известного в данной области.
Например, композиции настоящего изобретения могут быть растворимы в маслах, пропиленгликоле или других растворителях, которые обычно применяют для приготовления инъекционных форм. Подходящие примеры носителей включают физиологический солевой раствор, полиэтиленгликоль, этанол, растительные масла, изопропилмиристат и т.п., но не ограничиваются ими. Для местного применения, экстракт настоящего изобретения можно изготавливать в виде мазей и кремов.
Фармацевтические составы, включающие композицию настоящего изобретения, могут быть приготовлены в любой форме, такой как лекарственная форма для перорального применения (порошок, таблетка, капсула, мягкая капсула, лекарственное средство на водной основе, сироп, эликсиры, пилюли, порошок, саше, гранулы), или препарат для местного применения (крем, мазь, лосьон, гель, бальзам, пластырь, паста, раствор для распрыскивания, аэрозоль и т.п.) или препарат для инъекций (раствор, суспензия, эмульсия).
Композицию настоящего изобретения в фармацевтических лекарственных формах можно применять в виде их фармацевтически приемлемых солей и также можно применять по отдельности или в соответствующей комбинации, а также в комбинации с другими фармацевтически активными соединениями.
Требуемая доза экстракта или соединения настоящего изобретения изменяется в зависимости от состояния и массы субъекта, тяжести состояния, формы лекарственного средства, способа и периода введения, и может быть выбрана специалистом в данной области. Тем не менее, для получения требуемых эффектов, обычно рекомендуют введение количества экстракта настоящего изобретения в интервале от 0,0001 до 1000 мг/кг, предпочтительно от 0,001 до 100 мг/кг массы/день. Дозу можно вводить однократно или разделить на несколько приемов в день.
Фармацевтическую композицию настоящего изобретения можно вводить субъекту, представляющему собой животное, такое как млекопитающие (крыса, мышь, домашние животные или человек) различными путями. Рассматриваются все способы введения, например, можно вводить перорально, ректально или с помощью внутривенной, внутримышечной, подкожной, внутрикожной, интратекальной, эпидуральной или интрацеребровентрикулярной инъекции.
Экстракт настоящего изобретения можно использовать в качестве основного компонента или дополнительного и вспомогательного агента для приготовления различных функциональных полезных для здоровья пищевых продуктов и пищевых продуктов для оздоровления организма.
Соответственно, другой задачей настоящего изобретения является обеспечение функционального полезного для здоровья пищевого продукта, содержащего терапевтически эффективное количество нового очищенного экстракта, содержащего активные компоненты, полученные вышеописанными способами, или по меньшей мере одно соединение, выбранное из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, для профилактики или облегчения хронической обструктивной болезни легких (ХОБЛ).
Соответственно, другой задачей настоящего изобретения является обеспечение функционального полезного для здоровья пищевого продукта, содержащего комбинацию соединений в следующем массовом соотношении: 40-93% верпрозида, 1,0-10% вератровой кислоты, 2,0-25% каталпозида, 1,0-15% пикрозида II, 1,0-15% изованиллоил каталпола и 2,0-25% 6-O-вератроил каталпола, предпочтительно 45-90% верпрозида, 1,0-7,0% вератровой кислоты, 3,0-15% каталпозида, 2,0-10% пикрозида II, 2,0-10% изованиллоил каталпола и 2,0-15% 6-O-вератроил каталпола, для профилактики или облегчения хронической обструктивной болезни легких (ХОБЛ).
Термин "функциональный полезный для здоровья пищевой продукт" определен здесь как функциональный пищевой продукт, обладающий повышенной функциональностью, такой как физическая функциональность или физиологическая функциональность за счет добавления экстракта настоящего изобретения в обычное питание, предназначенного для профилактики или улучшения целевого заболевания у человека или млекопитающего.
Другой задачей настоящего изобретения является обеспечение пищевого продукта для оздоровления организма, содержащего терапевтически эффективное количество нового очищенного экстракта, содержащего активные компоненты в достаточном количестве, полученные вышеописанными способами, или по меньшей мере одно соединение, выбранное из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, для профилактики или облегчения хронической обструктивной болезни легких (ХОБЛ).
Термин "пищевой продукт для оздоровления организма" определен здесь как пищевой продукт, содержащий экстракт или соединение(я) настоящего изобретения, оказывающий не какой-то специфический желаемый эффект, а общий желаемый эффект в виде добавки в небольшом количестве или в форме порошка, гранулы, капсулы, пилюли, таблетки и т.д. в целом.
Термин "ситологически приемлемая добавка", определенный здесь, включает "любое вещество, предполагаемое применение которого приводит или можно обоснованно ожидать, что приведет, прямо или косвенно, к тому, что добавка будет представлять собой компонент или оказывать иного рода влияние на характеристики любой пищи", и могут быть классифицированы на три группы согласно их происхождению, т.е. (1) химически синтетические добавки, такие как кетоны, глицин, цитрат калия, никотиновая кислота и т.д.; (2) природные добавки, такие как краситель хурмы, экстракт солодки, кристаллическая целлюлоза, гуа дум и т.д.; (3) смешанная добавка, такая как L-глутамат натрия, консерванты, смоляной краситель и т.д., или различные категории согласно их функции в пищевом продукте, например, средство для загущения, средство для ускорения созревания, отбеливающее средство, секвестрант, увлажнитель, средство против слеживания, осветляющее средство, отверждающее средство, эмульгатор, стабилизатор, загуститель, основания и кислоты, пенообразующие вещества, питательные вещества, красящее вещество, вкусовая добавка, подсластитель, консервирующее средство, антиоксидант и т.д., которые хорошо известны в данной области и литературе уровня техники (см., "Codex General Standard for Food Additives" (GSFA, Codex STAN 192-1995) на домашней странице GSFA Online: www.codexalimentarius.net/gsfaonline/index.html).
Если вещество добавляется в пищевой продукт для определенной цели в этом пищевом продукте, то оно упоминается как непосредственно пищевая добавка, а косвенные пищевые добавки представляют собой такие, которые стали частью пищевого продукта в следовых количествах при его упаковке, хранении или других операциях.
Термины "пищевой продукт для оздоровления или функциональный полезный для здоровья пищевой продукт", раскрытые здесь, могут быть включены в пищевые продукты, полезные для здоровья напитки, диетические добавки и т.д., и могут быть подготовлены в виде фармацевтически дозированной формы, такой как порошок, гранула, таблетка, суспензия, эмульсия, сироп, жевательная таблетка, капсула, напиток и т.д; или формы пищевого продукта, например, хлеб, рисовые лепешки, сухие фрукты, конфеты, шоколад, жевательная резинка, мороженое, молоко, например, молоко с низким содержанием жира, лактозо-гидролизованное молоко, козье молоко, обработанное молоко, молочный продукт, такой как кисломолочный продукт, масло сливочное, концентрированное молоко, молочные сливки, топленое масло, натуральный сыр, плавленый сыр, сухое молоко, молочная сыворотка и т.д., обработанный мясной продукт, такой как гамбургер, ветчина, колбаса, бекон и т.д., обработанный яичный продукт, рыбный продукт, такой как рыбный пирог и т.д., макаронные изделия, такие как лапша быстрого приготовления, высушенная лапша, влажная лапша, жареная лапша, не жареная лапша, желатинизированная сухая лапша, приготовленная лапша, замороженная лапша, паста и т.д., чайный продукт, такой как чай в пакетиках, выщелоченный чай и т.д., полезные для здоровья напитки, такие как фруктовые напитки, овощные напитки, газированные безалкогольные напитки, напитки на основе соевого молока, молочные напитки, смешанные напитки и т.д., заправка для пищи, такая как соевый соус, паста из соевых бобов, паста из красного перца, chunjang (своего рода ферментированный соевый продукт, окрашенный карамелью), cheonggukjang (натуральный ферментированный соевый продукт, полученный путем добавления сенной палочки), смешанная паста, уксус, соус, кетчуп, карри, заправка и т.д., маргарин, шортенинг, пицца и т.д., но не ограничиваются ими, для профилактики или облегчения целевого заболевания.
Кроме того, вышеописанный экстракт может быть добавлен к пище или напитку для профилактики и облегчения целевого расстройства. Количество вышеописанного экстракта или соединения(ий) в пищевом продукте или напитке в качестве функционального полезного для здоровья пищевого продукта или пищевого продукта для оздоровления, как правило, может изменяться от примерно 0,01 до 100% (масс./масс.) от общей массы пищевого продукта для композиции функционального полезного для здоровья пищевого продукта. В частности, несмотря на предпочтительное количество экстракта настоящего изобретения в функциональном полезном для здоровья пищевом продукте, пищевом продукте для оздоровления или специальном питательном пищевом продукте может варьироваться в соответствии с предполагаемой целью каждого пищевого продукта, предпочтительно применение экстракта или соединения настоящего изобретения, как правило, в качестве добавки в количестве в диапазоне от примерно 0,01 до 5% в пищевом продукте, таком как лапша или т.п., от 40 до 100% в пищевом продукте для оздоровления в расчете на 100% пищевой композиции.
При условии, что композиция полезного для здоровья напитка настоящего изобретения содержит вышеописанный экстракт или соединение(ия) в качестве основного компонента в указанном соотношении, нет особого ограничения в отношении другого жидкого компонента, при этом другой компонент может быть представлен различной отдушкой или природным углеводом и т.д., таким как в обычном напитке. Примерами вышеупомянутого природного углевода являются моносахарид, такой как глюкоза, фруктоза и т.д.; дисахарид, такой как мальтоза, сахароза и т.д.; обычный сахар, такой как декстрин, циклодекстрин; и сахарный спирт, такой как ксилит, эритрит и т.д. В качестве отдушки, помимо вышеуказанной, можно с пользой применять природную отдушку, такую как тауматин, экстракт стевии, такой как леваудиозид A, глицирризин и др., а также синтетическую отдушку, такую как сахарин, аспартам и др. Количество вышеописанного природного углевода обычно находится в интервале от примерно 1 до 20 г, предпочтительно от 5 до 12 г в расчете на 100 мл композиции полезного для здоровья напитка.
Компоненты, помимо вышеуказанной композиции, представляют собой различные питательные вещества, витамин, минерал или электролит, синтетическую вкусовую добавку, окрашивающую добавку и улучшитель в случае сыра, шоколада и др., пектиновую кислоту и ее соль, альгиновую кислоту и ее соль, органическую кислоту, защитное коллоидное адгезивное вещество, вещество, регулирующее pH, стабилизатор, консервант, глицерин, спирт, вещество, способствующее карбонизации, применяемое в газированном напитке, и др. Компонентами, помимо вышеуказанных компонентов, может быть фруктовый сок для получения природного фруктового сока, напиток с фруктовым соком и овощной напиток, в котором компонент можно применять независимо или в комбинации. Отношение компонентов не является таким важным, но обычно оно находится в интервале примерно от 0 до 20% масс./масс. на 100% масс./масс. композиции настоящего изобретения. Примеры пищевого продукта, пригодного для введения добавки, содержащей вышеуказанный экстракт или соединение, представляют собой различные пищевые продукты, напиток, жевательный продукт, витаминный комплекс, полезный для здоровья пищевой продукт и тому подобное.
Экстракт или соединение(ия) настоящего изобретения нетоксичны и, следовательно, не имеют отрицательного воздействия; они безопасны при применении.
Для специалиста в данной области будет понятно, что различные модификации и варианты могут быть сделаны в композициях, применении и препаратах настоящего изобретения без отступления от сущности или объема изобретения.
Настоящее изобретение более конкретно объясняется следующими примерами. Тем не менее, следует понимать, что эти примеры не ограничивают настоящее изобретение никоим образом.
Полезные эффекты изобретения
Как описано в настоящем изобретении, очищенный экстракт изобретения, содержащий большое количество активных компонентов, таких как производных каталпола из экстракта Pseudolysimachion rotundum var subintegrum, или по меньшей мере одно соединение, выбранное из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, показали сильную активность против ХОБЛ без агонистического эффекта на бета-2-рецепторы в различных исследованиям in vivo с использованием самцов BALB/c мышей, например, в исследовании ингибирования пролиферации и активности воспалительных иммуноцитов и рекрутинга нейтрофилов в легкие, вызванных заболеванием ХОБЛ; исследовании ингибирования воспроизводства хемокинов, вовлеченных в разрушение пневмоцитов, таких как МИП-2/CXCL-2, ФНО-альфа, KC/CXCL-1 (хемокины Gro-альфа), CXCL-8 и т.д.; показали эффект снижения высвобождения ИЛ-1 бета, ИЛ-6, ФНО-альфа и ММП-9 экспрессии с помощью уменьшения активации NF-каппаВ в исследованиях на животных с применением СПФ (свободных от патогенной специфической микрофлоры) крыс линии Спрег-Доули, а также в исследовании in vitro, например, в исследовании ингибирования экспрессии гена MUC5AC (олигомерного слизь/гель-образующего), индуцирующий эффект на экспрессию ИЛ-4 Th2 клетками в исследовании анализа изменений молекулярной экспрессии и т.д. Таким образом, он может применяться в качестве терапевтического или функционального полезного для здоровья пищевого продукта для лечения и профилактики хронической обструктивной болезни легких (ХОБЛ).
Описание чертежей
Вышеуказанные и другие задачи, отличительные признаки и другие преимущества настоящего изобретения будут, несомненно, более понятны из следующего подробного описания в сочетании с прилагаемыми чертежами, на которых:
на Фиг. 1 показан результат ВЭЖХ-анализа неочищенного экстракта из Pseudolysimachion rotundum var subintegrum, полученного в сравнительном Примере 1;
на Фиг. 2 показан результат ВЭЖХ-анализа очищенного экстракта (ATC1) настоящего изобретения из Pseudolysimachion rotundum var subintegrum, полученного в Примере 1;
на Фиг. 3 показан результат ВЭЖХ-анализа очищенного экстракта (ATC2) настоящего изобретения из Pseudolysimachion rotundum var subintegrum, полученного в Примере 2;
на Фиг. 4 показан схематический способ создания модели ADRB2 GPCR-экспрессирующей клеточной линии;
на Фиг. 5 показано образование ореола в U2OS клетке, получавшей уже известный ADRB агонист;
на Фиг. 6 показано образование ореола в U2OS клетке, получавшей очищенный экстракт и соединения настоящего изобретения;
на Фиг. 7 показан детализированный результат экспрессии MUC5AC с применением ГСК;
на Фиг. 8 показано изменение экспрессии MUC5AC в А549 клетке, получавшей TGFb1;
на Фиг. 9 показано изменение экспрессии MUC5AC в А549 клетке, которая предварительно получала очищенный экстракт или соединения настоящего изобретения, а затем получала ФНО-альфа;
на Фиг. 10 показано изменение экспрессии MUC5AC в А549 клетке, получавшей акролеин, очищенный экстракт или соединения настоящего изобретения;
на Фиг. 11 показано влияние очищенного экстракта или соединений настоящего изобретения на индукцию дифференцировки Th2 из нативных CD4+ T клеток (CD4+CD62L+);
на Фиг. 12 показано влияние очищенного экстракта или соединений настоящего изобретения на дифференцировку Th2 мыши;
на Фиг. 13 показано влияние очищенного экстракта или соединений настоящего изобретения на экспрессию ИЛ-4, маркера дифференцировки мышиной Th2 клетки;
на Фиг. 14 показано влияние очищенного экстракта или соединений настоящего изобретения на общее количество иммуноцитов, нейтрофилов и уровень T лимфоцитов после ЛПС ингаляции для мыши линии BALB/c и воздействия сигаретного дыма;
на Фиг. 15 показано влияние очищенного экстракта или соединений настоящего изобретения на число CD4+ и CD8+ T клеток в ЖБАЛ (A: общее количество клеток (x105)/ЖБАЛ (мл); B: число нейтрофилов (x104)/ЖБАЛ (мл); C: абсолютное число CD4+ и CD8+ T клеток (x104)/ЖБАЛ (мл), данные, показанные как среднее число клеток ± СЭМ (P<0,05, P<0,01, P<0,001 в сравнении с ЛПС+CS; n=10);
на Фиг. 16 показано влияние очищенного экстракта или соединений настоящего изобретения на уровень CXCL-1, ФНО-альфа, и МИП-2 после ЛПС ингаляции для мыши линии BALB/c и воздействия сигаретного дыма;
на Фиг. 17 показано влияние очищенного экстракта или соединений настоящего изобретения на количество воспалительных клеток;
на Фиг. 18 показано влияние очищенного экстракта или соединений настоящего изобретения на общее количество клеток в ЖБАЛ;
на Фиг. 19 показано влияние очищенного экстракта или соединений настоящего изобретения на ММП-9 активность в легочной ткани;
на Фиг. 20 показано влияние очищенного экстракта или соединений настоящего изобретения на экспрессию провоспалительных белков в легочной ткани;
на Фиг. 21 показано ингибирующее влияние очищенного экстракта настоящего изобретения на воспалительный ответ в клетках легочной ткани с применением гистологического исследования бронхоальвеолярного выделения;
Наилучший вариант осуществления изобретения
Для специалиста в данной области будет понятно, что различные модификации и варианты могут быть сделаны в композициях, применении и препаратах настоящего изобретения без отступления от сущности или объема изобретения.
Настоящее изобретение более конкретно объясняется следующими примерами. Тем не менее, следует понимать, что эти примеры не ограничивают настоящее изобретение никоим образом.
Примеры
Следующие справочные примеры, примеры и экспериментальные примеры предназначены для дополнительной иллюстрации настоящего изобретения, но никак не ограничивают его объем.
Сравнительный пример 1. Получение неочищенного экстракта Pseudolysimachion rotundum var subintegrum
1-1. Получение неочищенного экстракта (ATE)
1 кг сухого Psendolysimachion rotundum var subintegrum (культивировали при 244, Soi-myeon Eumseong-gun Chungcheongbuk-do в Корее согласно GAP) нарезали небольшими кусочками и смешивали с 10 л 40% этанола. Смесь перемешивали при комнатной температуре в течение 24 часов и подвергали экстракции в колбе с обратным холодильником при 78°C в течение 12 часов, и трижды собирали фильтрат. Экстракт фильтровали через фильтровальную бумагу для удаления твердых частиц. Собранный фильтрат концентрировали с помощью роторного испарителя (EYELA, N-2100, Япония) при 55~65°C при пониженном давлении и сушили способом сублимационной сушки с получением 202 г сухого неочищенного экстракта (обозначенного как "ACE" в дальнейшем) для применения в качестве сравнительного примера.
1-2. Анализ компонентов
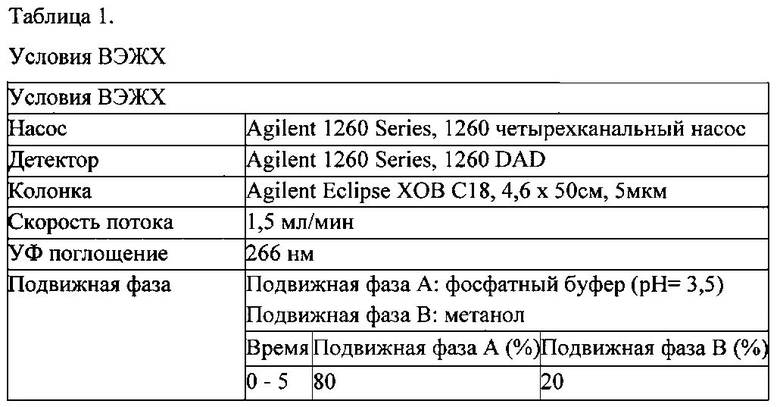
Анализ компонентов проводили с применением ВЭЖХ (Agilent 1260 model, США) согласно условиям в таблице 1, и результаты показаны на фиг. 1.
Как показано на фиг. 1, было подтверждено, что компоненты имеют следующие времена удерживания: при 9,548 мин (верпрозид), 10,817 мин (вератровая кислота), 16,728 мин (каталпозид), 20,346 мин (пикрозид II), 21,853 мин (изованиллоил каталпол) и 30,462 мин (6-0-вератроил каталпол), соответственно.
Содержание каждого компонента (%) в образце рассчитывали на основе данных ВЭЖХ (время удерживания) согласно математической формуле 1.
Математическая формула 1
содержание каждого компонента = концентрация стандарта (мг/мл) / концентрация исследуемого образца (мг/мл) × At/As × чистота стандарта (%),
где "At" обозначает площадь компонента исследуемого образца, и "As" обозначает площадь компонента в стандарте, при условии, что отобранный объем исследуемого образца и стандарта идентичны друг другу.
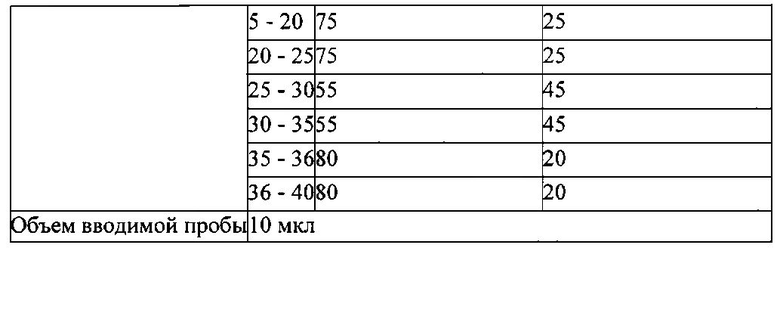
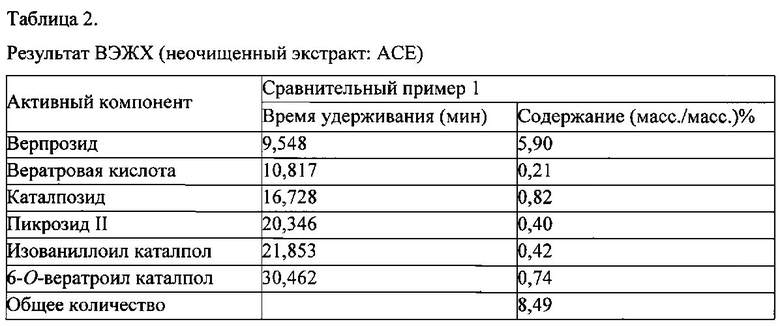
В результате, подтвердили, что неочищенный экстракт из Pseudolysimachion rotundum var subintegrum содержит только 8,49% (масс./масс.) производных каталпозида, т.е., 5,9% (масс./масс.) верпрозида, 0,21% (масс./масс.) вератровой кислоты, 0,82% (масс./масс.) каталпозида, 0,40% (масс./масс.) пикрозида II, 0,42% (масс./масс.) изованиллоил каталпола и 0,74% (масс./масс.) 6-O-вератроил каталпола, соответственно, как можно видеть в таблице 2.
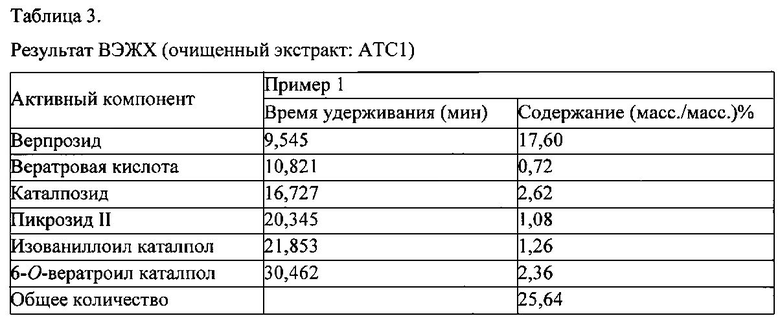
Пример 1. Получение очищенного экстракта (ACT1) из Pseudolysimachion rotundum var subintegrum
Неочищенный экстракт (ACE) из Pseudolysimachion rotundum var subintegrum получали обычным способом в соответствии со сравнительным примером 1, суспендировали в 2 л дистиллированной воды и к суспензии добавляли 2 л бутанола для разделения на бутанол-растворимую фракцию и водо-растворимую фракцию. Бутанол-растворимую фракцию собирали, концентрировали при пониженном давлении и сушили с получением 82 г очищенного экстракта настоящего изобретения, фракционированного с помощью бутанола (ATC1), применяемого в качестве исследуемого примера.
Анализ компонентов проводили с применением ВЭЖХ (Agilent 1260 model, США) согласно условиям в таблице 1, результаты показаны на фиг. 2.
Как показано на фиг. 2, было подтверждено, что компоненты были обнаружены при следующих значениях: 9,545 мин (верпрозид), 10,821 мин (вератровая кислота), 16,727 мин (каталпозид), 20,345 мин (пикрозид II), 21,853 мин (изованиллоил каталпол) и 30,462 мин (6-O-вератроил каталпол), соответственно.
Содержание каждого компонента (%) в образце рассчитывали на основе данных ВЭЖХ (время удерживания) согласно математической формуле 1.
В результате, было подтверждено, что очищенный экстракт настоящего изобретения, фракционированный с помощью бутанола (ATC1), из Pseudolysimachion rotundum var subintegrum содержит 25,64% (масс./масс.) производных каталпозида, т.е., 17,60% (масс./масс.) верпрозида, 0,72% (масс./масс.) вератровой кислоты, 2,62% (масс./масс.) каталпозида, 1,08% (масс./масс.) пикрозида II, 1,26% (масс./масс.) изованиллоил каталпола и 2,36% (масс./масс.) 6-O-вератроил каталпола, соответственно, как можно видеть в таблице 3.
Пример 2. Получение очищенного экстракта (ACT2) из Pseudolysimachion rotundum var subintegrum
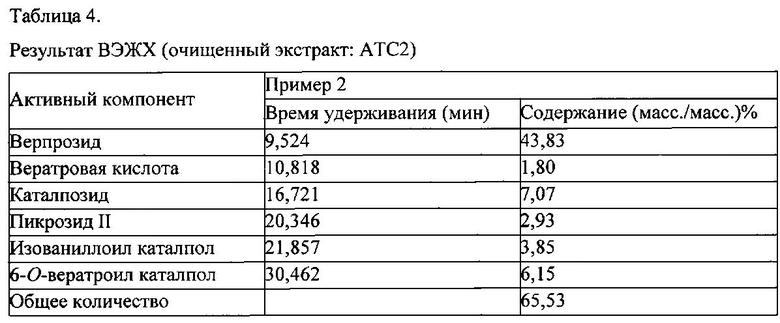
Очищенный экстракт настоящего изобретения, фракционированный с помощью бутанола (ATC1) из Pseudolysimachion rotundum var subintegrum согласно примеру 1, растворяли в 75 мл смешанного растворителя (дистиллированная вода : метанол = 1:0,003) и 75 г раствора наносили на колонку обращенно-фазовой хроматографии (C18(IV)-D-75-120 нм, AGC Si-Tech Co. Ltd., Япония, 450 г), элюировали суспензию с помощью растворителя для элюирования (дистиллированная вода : метанол = 90:10→60:40). 8,4 л элюированного раствора, полученного в исходной элюирующей системе растворителей (дистиллированная вода : метанол = 90:10), собирали и концентрировали при пониженном давлении. 5,6 л элюированного раствора, полученного в конечной элюирующей системе растворителей (дистиллированная вода : метанол = 60:40), собирали, концентрировали при пониженном давлении и сушили с получением 33 г экстракта настоящего изобретения, очищенного с помощью вторичного фракционирования (ATC2), применяемого в качестве исследуемого примера.
Анализ компонентов проводили с применением ВЭЖХ (Agilent 1260 model, США) согласно условиям в таблице 1, результаты показаны на фиг. 3.
Как показано на фиг. 3, было подтверждено, что каждый компонент был обнаружен при следующих значениях: 9,525 мин (верпрозид), 10,818 мин (вератровая кислота), 16,721 мин (каталпозид), 20,346 мин (пикрозид II), 21,857 мин (изованиллоил каталпол) и 30,462 мин (6-O-вератроил каталпол), соответственно.
Содержание каждого компонента (%) в образце рассчитывали на основе данных ВЭЖХ (время удерживания) согласно математической формуле 1.
В результате, было подтверждено, что экстракт настоящего изобретения, очищенный с помощью вторичного фракционирования (ATC2), из Pseudolysimachion rotundum var subintegrum содержит 65,63% (масс./масс.) производных каталпола, т.е., 43,83% (масс./масс.) верпрозида, 1,80% (масс./масс.) вератровой кислоты, 7,07% (масс./масс.) каталпозида, 2,93% (масс./масс.) пикрозида II, 3,85% (масс./масс.) изованиллоил каталпола и 6,15% (масс./масс.) 6-O-вератроил каталпола, соответственно, как можно видеть в таблице 4.
Пример 3. Получение соединений настоящего изобретения из Pseudolysimachion rotundum var subintegrum
Соединения настоящего изобретения, т.е. верпрозид, вератровая кислота, каталпозид, пикрозид II, изованиллоил каталпол и 6-O-вератроил каталпол, имеющие следующие физико-химические свойства, были очищены из экстракта Pseudolysimachion rotundum var subintegrum согласно способу выделения, раскрытому в публикации корейского патента No. 10-2006-125499, и физико-химические свойства каждого соединения были сравнены с данными в уже опубликованной литературе для идентификации каждой химической структуры.
1. Верпрозид (=6-O-(3,4-дигидроксибензоил)каталпол)
1H ЯМР (400 МГц, DMSO-d6) δ: 2.47 (1H, dd, J=8.0, 9.2 Гц, H-9), 2.59 (1H, dddd, J=1.6, 4.0, 8.0, 8.0, H-5), 3.00 (1H, m, H-G4), 3.05 (1H, m, H-G2), 3.14 (1H, m, H-G5), 3.18 (1H, m, H-G3), 3.42, 3.71 (2H, m, H-G6). 3.67 (1H, s, H-7), 3.71, 3.91 (2H, d, J=13.2 Гц, each, H-10), 4.61 (1H, d, J=7.6 Гц, H-G1), 4.94 (1H, dd, J=4.0, 6.0 Гц, H-4), 5.03 (1H, d, J=8.0 Гц, H-6), 5.09 (1H, d, J=9.2 Гц, H-1), 6.41 (1H, dd, J=1.6. 6.0 Гц, H-3), 6.82 (1H, d, J=8.0 Гц, H-5′), 7.35 (1H, dd, J=2.0, 8.0 Гц, H-6′), 7.39 (1H, d, J=2.0 Гц, H-2′).
13C-ЯМР (100 МГц, DMSO-d6) δ: 93.0 (C-1), 141.1 (C-3), 101.8 (C-4), 35.2 (C-5), 79.5 (C-6), 58.2 (C-7), 65.8 (C-8), 41.8 (C-9), 120.0 (C-1′), 116.4 (C-2′), 145.1 (C-3′), 150.8 (C-4′), 115.4 (C-5′), 122.6 (C-6′), 165.6 (C-7′), 97.9 (C-G1), 73.4 (C-G2), 76.4 (C-G3), 70.3 (C-G4), 77.5 (C-G5), 61.4 (C-G6).
2. Пикрозид II (=6-O-(4-гидрокси-3-метоксибензоил)каталпол)
1H-ЯМР (400 МГц, DMSO-d6) δ: 2.47 (1H, dd, J=8.0, 9.6 Гц, H-9), 2.58 (1H, dddd, J=1.2, 6.0, 8.0, 8.4 Гц, H-5), 3.00 (1H, m, H-G4), 3.05 (1H, m, H-G2), 3.14 (1H, m, H-G5), 3.18 (1H, m, H-G3), 3.42, 3.71 (2H, m, H-G6), 3.67 (1H, br s, H-7), 3.72, 3.92 (2H, d, J=13.2, each, H-10), 4.62 (1H, d, J=7.6 Гц, H-G1), 4.99 (1H, dd, J=4.4, 6.0 Гц, H-4), 5.06 (1H, d, J=8.4 Гц, H-6), 5.11 (1H, d, J=9.6 Гц, H-1), 6.42 (1H, dd, J=1.2. 6.0 Гц, H-3), 6.89 (1H, d, J=8.4 Гц, H-5′), 7.46 (1H, d, J=2.0 Гц, H-2′), 7.52 (1H, dd, J=2.0, 8.4 Гц, H-6′), 3.83 (3H, s, 3′-O-CH3).
13C-ЯМР (100 МГц, DMSO-d6) δ: 93.0 (C-1), 141.1 (C-3), 101.8 (C-4), 35.2 (C-5), 79.7 (C-6), 58.2 (C-7), 65.8 (C-8), 41.8 (C-9), 58.5 (C-10), 120.0 (C-1′), 112.7 (C-2′), 147.5 (C-3′), 152.0 (C-4′), 115.3 (C-5′), 123.8 (C-6′), 165.6 (C-7′), 97.9 (C-G1), 73.4 (C-G2), 76.4 (C-G3), 70.3 (C-G4), 77.5 (C-G5), 61.4 (C-G6), 55.7 (3′-OCH3).
3. Каталпозид (=6-O-(4-гидроксибензоил)каталпол)
1H-ЯМР (400 МГц, DMSO-d6) δ: 2.47 (1H, dd, J=8.0, 9.6 Гц, H-9), 2.56 (1H, dddd, J=1.2, 4.0, 8.0, 8.0 Гц, H-5), 3.00 (1H, m, H-G4), 3.05 (1H, m, H-G2), 3.14 (1H, m, H-G5), 3.18 (1H, m, H-G3), 3.43, 3.72 (2H, m, H-G6), 3.69 (1H, br s, H-7), 3.72, 3.92 (2H, d, J=13.2 Гц, each, H-10), 4.62 (1H, d, J=8.0 Гц, H-G1), 4.96 (1H, dd, J=4.0, 6.0 Гц, H-4), 5.05 (1H, dd, J=1,2, 8.0 Гц, H-6), 5.11 (1H, d, J=9.6 Гц, H-1), 6.42 (1H, dd, J=1.2. 6.0 Гц, H-3), 6.86 (2H, d, J=8.0 Гц, H-3′, -5′), 7.85 (2H, d, J=2.0 Гц, H-2′, -6′).
13C-ЯМР (100 МГц, DMSO-d6) δ: 92.9 (C-1), 141.1 (C-3), 101.8 (C-4), 35.1 (C-5), 79.6 (C-6), 58.2 (C-7), 65.8 (C-8), 41.8 (C-9), 119.6 (C-1′), 131.7 (C-2′, 6′), 115.5 (C-3′, 5′), 162.6 (C-4′), 165.5 (C-7′), 97.8 (C-G1), 73.4 (C-G2), 76.4 (C-G3), 70.3 (C-G4), 77.5 (C-G5), 61.4 (C-G6).
4. Изованиллоил каталпол (=6-O-(3-гидрокси-4-метоксибензоил)каталпол)
1H-ЯМР (400 МГц, DMSO-d6) δ: 2.47 (1H, m, H-9), 2.55 (1H, m H-5), 3.00 (1H, m, H-G4), 3.05 (1H, m, H-G2), 3.14 (1H, m, H-G5), 3.18 (1H, m, H-G3), 3.43, 3.70 (2H, m, H-G6), 3.70 (1H, br s, H-7), 3.72, 3.92 (2H, d, J=13.2, each, H-10), 4.62 (1H, d, J=8.0 Гц, H-G1), 4.95 (1H, dd, J=4.4, 6.0 Гц, H-4), 5.06 (1H, d, J=8.0 Гц, H-6), 5.11 (1H, d, J=9.2 Гц, H-1), 6.42 (1H, d, J=6.0 Гц, H-3), 7.04 (1H, d, J=8.4 Гц, H-5′), 7.42 (1H, br s, H-2′), 7.48 (1H, d, J=8.4 Гц, H-6′), 3.84 (3H, s, 4′-O-CH3).
13C-ЯМР (100 МГц, DMSO-d6) δ: 93.0 (C-1), 141.0 (C-3), 101.6 (C-4), 35.2 (C-5), 79.7 (C-6), 58.2 (C-7), 65.8 (C-8), 41.8 (C-9), 58.4 (C-10), 121.7 (C-1′), 115.7 (C-2′), 146.3 (C-3′), 152.1 (C-4′), 111.4 (C-5′), 121.3 (C-6′), 165.3 (C-7′), 97.8 (C-G1), 73.4 (C-G2), 76.4 (C-G3), 70.3 (C-G4), 77.4 (C-G5), 61.4 (C-G6), 55.7 (4′-OCH3).
5. 6-O-вератроил каталпол (=6-O-(3,4-диметоксибензоил)каталпол)
1H-ЯМР (400 МГц, DMSO-d6) δ: 2.47 (1H, dd, J=8.0, 9.6 Гц, H-9), 2.59 (1H, dddd, J=1.6, 4.8, 8.0, 8.0 Гц, H-5), 3.00 (1H, m, H-G4), 3.05 (1H, m, H-G2), 3.14 (1H, m, H-G5), 3.18 (1H, m, H-G3), 3.42, 3.71 (2H, m, H-G6), 3.70 (1H, br s, H-7), 3.72, 3.90 (2H, d, J=13.2 Гц, each, H-10), 4.61 (1H, d, J=7.6 Гц, H-G1), 4.97 (1H, dd, J=4.8, 6.0 Гц, H-4), 5.08 (1H, d, J=8.8 Гц, H-6), 5.10 (1H, d, J=9.6 Гц, H-1), 6.42 (1H, dd, J=1.6. 6.0 Гц, H-3), 7.09 (1H, d, J=8.4 Гц, H-5′), 7.46 (1H, d, J=2.0 Гц, H-2′), 7.64 (1H, dd, J=2.0, 8.4 Гц, H-6′), 3.81, 3.84 (6H, s each, 3′, 4′-OCH3).
13C-ЯМР (100 МГц, DMSO-d6) δ: 92.9 (C-1), 141.1 (C-3), 101.8 (C-4), 35.2 (C-5), 79.9 (C-6), 58.2 (C-7), 65.9 (C-8), 41.8 (C-9), 58.4 (C-10), 121.3 (C-1′), 111.8 (C-2′), 148.5 (C-3′), 153.2 (C-4′), 111.2 (C-5′), 123.5 (C-6′), 165.5 (C-7′), 97.8 (C-G1), 73.4 (C-G2), 76.4 (C-G3), 70.3 (C-G4), 77.5 (C-G5), 61.4 (C-G6), 55.6, 55.7 (3′, 4′-OCH3).
Экспериментальный пример 1. Создание системы клеточного анализа ADBR2 GPCR-таргетирования.
В целях разработки системы клеточного анализа ADBR2 GPCR-таргетирования было выполнено следующее исследование.
1-1. Разработка экспрессирующей клеточной линии ADBR2 GPCR.
ADBR2 (бета-2 адренергический рецептор) GPCR (рецептор, сопряженный с G-белком, Sinco Biological Inc., HF10378-M) клонировали в pIRESpuro вектор (Clontech, Mountain View, CA), трансформировали в U2OS (ATCC, HTB-96, клеточная линия остеосаркомы человека) и поместили в питательную среду, дополненную DEME (HyClone), 10% ФБС (HyClone, SH30071.03) и 1% антибиотиком (Gibco, 15140), для отбора отдельной колонии.
Выбранные стабильные колонии инокулировали в 96-луночные плашки, и исследуемые образцы, т.е. индакатерол (положительный контроль, Zhiyu biotechnology, Китай), через 24 часа после инокуляции обрабатывали ATC2 экстрактом, полученным в примере. Лунку фиксировали раствором формалина в течение 5 мин, промывали стерилизованной водой и подтверждали образование пятна (ореола) с помощью программного обеспечения детектора пятен (ThermoFisher, U.S.A), как показано на фиг. 4.
1-2. Оценка эффективности положительного контроля
Выбранные U2OS клетки, стабильно экспрессирующие ADBR2 GPCR, обрабатывали 10 мкмоль хорошо известных ADBR2 агонистов, т.е. изопретеренол, сальметерол, формотерол, сальбутамол и индакатерол (Zhiyu biotechnology, Китай), и образование пятен после обработки определяли с помощью программного обеспечения детектора пятен на аппарате Cellomics (ThermoFisher, U.S.A).
Как показано на фиг. 5, было подтверждено, что все группы, обработанные хорошо известными ADBR2 агонистами (изопретеренол, сальметерол, формотерол, сальбутамол и индакатерол), особенно индакатеролом, показали явное образование пятен, и бета-2-агонист, такой как индакатерол, образует явное пятно, выступая в качестве ADRB2 агониста (бета-2-рецептора), тогда как ATC2 при 40 мг/мл не образует пятна.
1-3. Оценка эффективности исследуемых образцов
Выбранные U2OS клетки, стабильно экспрессирующие ADBR2 GPCR, обрабатывали 40 мкг/мл ATC2, а также соединениями настоящего изобретения, т.е., 20 мкмоль верпрозида, вератровой кислоты, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератровой кислоты, соответственно, и образование пятен после обработки определяли с помощью программного обеспечения детектора пятен на аппарате Cellomics (ThermoFisher, U.S.A).
Как показано на фиг. 6, было подтверждено, что все группы, обработанные ATC2, а также соединениями настоящего изобретения, т.е., 20 мкмоль верпрозида, вератровой кислоты, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, не показывали образование пятен, что означает наличие ADRB2-GFP на рецепторе. Согласно полученному результату, было подтверждено, что АТС экстракт и соединения настоящего изобретения не действуют в качестве ADBR2 агониста.
Соответственно, также было подтверждено, что экстракт и соединения настоящего изобретения, направленные непосредственно на MUC5AC, основную терапевтическую мишень, и предотвращающие экспрессию MUC5AC, могут решить существующие проблемы традиционного способа лечения, такого как лечение бета-2 агонистами, например, адренергические реакции на бета-2 рецептор, такие как гипокалиемия, судороги, тревога, тахикардия, желудочковая экстрасистолия и т.д., и побочные реакции в случае перорального введения, такие как аритмия, эпилепсия и т.д., вызванные нерегулярным изменением концентрации препарата в крови.
Экспериментальный пример 2. Создание системы клеточного анализа муцин 5AC-таргетирования.
Сообщалось, что Mucin5A/C представляет собой важную мишень для разработки средства лечения ХОБЛ (Busse PJ, Zhang TF, Srivastava K, Schofield B, Li XM. 2007. Effect of ageing on pulmonary inflammation, airway hyperresponsiveness and T and B cell responses in antigen-sensitized and -challenged mice. Clinical & Experimental Allergy. 37(9):1392-403., Smirnova MG, Birchall JP, Pearson JP. 2000. TNF-alpha in the regulation of MUC5AC secretion: some aspects of cytokine-induced mucin hypersecretion on the in vitro model. Cytokine, 12:1732-6).
Соответственно, авторы настоящего изобретения разработали новый высокопроизводительный скрининг-тест с помощью введения многопараметрической скриниговой системы, которая может количественно определить экспрессию целевого белка на клеточном уровне у животных, и с целью скрининга средства, ингибирующего экспрессию муцина 5A/C, следующее исследование выполняли путем модификации способа целевого активатора, опубликованного на Cellomics BioApplication.
2-1. Преобразование в цифровую форму экспрессии Mucin 5A/C с помощью ГСК
Клеточную линию А549 (ATCC, CCL-185), эпителиальную клеточную линию, выделенную из пораженной раком ткани легкого человека, высеивали на 96-луночную плашку (5000 клеток/лунка) и через 24 часа после посева обрабатывали 20 нг/мл оФРФ, 100 нг/мл ЭФР, 20 мкмоль ИФР, 5 нг/мл ТФР-бета1, 30 наномоль акролеина, 5 наномоль РМА, 1 мкг/мл ЛПС и 20 нг/мл ИЛ-1-бета. Экспрессию муцина 5A/C преобразовывали в цифровую форму программой целевого активатора на аппарате Cellomics.
Как показано на фиг. 7, исследованиями было подтверждено, что все исследованные вещества, кроме ТФР-бета1, повышали экспрессию муцина 5A/C.
2-2. Преобразование в цифровую форму ингибирующего эффекта ТФР-бета1 на экспрессию муцина 5A/C
Клеточную линию А549 (ATCC, CCL-185) обрабатывали различными концентрациями ТФР-бета1 (PeproTech, #100-21), т.е., 1, 5 и 10 нг/мл ТФР-бета1, и экспрессию муцина 5A/C преобразовывали в цифровую форму программой целевого активатора на аппарате Cellomics.
Как показано на фиг. 8, было подтверждено, что ТФР-бета1 сильнее ингибирует экспрессию муцина 5A/C, чем контрольная среда (GM, DMEM, 10% ФБС, 1% антибиотики).
2-3. Преобразование в цифровую форму ингибирующего эффекта ФНО-альфа на экспрессию муцина 5A/C
Клеточную линию А549 обрабатывали различными концентрациями экстракта ATC2 в течение 2 часов, затем ее обрабатывали в течение 24 часов 20 г/мл ФНО-альфа. Экспрессию муцина 5A/C преобразовывали в цифровую форму программой целевого активатора на аппарате Cellomics.
Как показано на фиг. 9, было подтверждено, что экспрессия муцина 5А/С эффективно ингибируется обработкой ФНО-альфа, что в случае предварительной обработки ATC2 повышает экспрессию MUC5AC дозозависимым образом.
2-4. Эффект ингибирования исследуемых образцов настоящего изобретения на экспрессию муцина 5A/C
Разбавленную DMEM средой, дополненной 5% красным фенолом и ФБС (фетальной бычьей сывороткой), клеточную линию А549 (ATCC, CCL-185) засеивали в 6-луночные плашки (4×105 клеток/лунка) для прилипания к ним в течение ночи, и клеточную линию А549 в течение 1 часа обрабатывали 20 и 40 мкг/мл экстракта ATC2. Клетки обрабатывали 30 нМ акролеина для индукции экспрессии муцина 5A/C. С клеток удаляли среду, промывали раствором ФСБ и гомогенизировали в течение 5 мин с помощью Trizol (Invitrogen, CA, США) для выделения рибонуклеиновых кислот из клеток. Клетки собирали, переносили в центробежный сепаратор, полностью смешивали с хлороформом в течение 15 секунд, оставляли в покое на 3 минуты и центрифугировали в течение 15 минут со скоростью 14000 об/мин Супернатант, содержащий рибонуклеиновую кислоту, перемещали в новую пробирку и перемешивали с изопропиловым спиртом в течение 10 минут. Раствор центрифугировали для удаления супернатанта и добавляли 75% этанол для получения осадка. Осадок центрифугировали в течение 5 минут со скоростью 10000 об/мин и удаляли супернатант. Осажденную рибонуклеиновую кислоту высушивали при комнатной температуре в течение 20 минут. Высушенную рибонуклеиновую кислоту суспендировали в дистиллированной воде, обработанной DEPC (диэтилпилокарбонат, W2004, www.biosesang.com, Корея). После количественной оценки рибонуклеиновой кислоты, комплементарную ДНК синтезировали с применением 1 мкг РНК и набора RT-kit (OmniScript RT-kit, Qiagen, США), а синтетическую кДНК применяли в качестве матрицы. Праймер муцина 5A/C (прямой: 5-CGACAACTACTTCTGCGGTGC-3, обратный: 5-GCACTCATCCTTCCTGTCGTT-3) смешивали с ней, денатурировали в течение 5 минут при 94°C с применением ПЦР смеси (DreamTaq™ PCR Master Mix, Fermentas, США), подвергали взаимодействию в течение 40 циклов, т.е. 30 секунд при 94°C, 30 секунд при 58°C, 45 секунд при 72°C и выполняли ПЦР в течение 5 минут при 72°C для инактивации фермента. GAPDH (глицеральдегид-3-фосфатдегидрогеназа, Bioneer Corporation, www.bioneer.co.kr, Корея) применяли в качестве внутреннего стандарта.
Как показано на фиг. 10, было подтверждено, что экспрессия MUC5A/C была увеличена при помощи обработки акролеином, в то время как экспрессия ингибировалась обработкой экстрактом (ATC2) настоящего изобретения или соединениями настоящего изобретения, такими как верпрозид или 6-O-вератроил каталпол, дозозависимым образом.
Экспериментальный пример 3. Ингибирование дифференциации Th2 клеток у мыши
3-1. Создание дифференцировки Th2 клеток у мыши
aCD4+T-клетки (CD4+CD62L+) выделяли из лимфатических узлов и селезенки C57BL6 мышей с помощью MACS (Miltenyi Biotec, кат. №130-090-976) и собранные CD4+ Т-клетки культивировали на плашках с покрытием анти-CD3 (1 мкг/мл, BD Pharmingen) и анти-CD28 (0,5 мкг/мл, BD Pharmingen).
Дифференцировку Th2 клеток индуцировали RPMI средой, дополненной анти-IFN-гамма и rm ИЛ-4 (Hyclone) и степень дифференцированности была определена с помощью FACS (проточная цитометрия, Becton-Dickinson, FACSCalibur).
Как показано на фиг. 11, было подтверждено, что использовали установленные условия исследования, поскольку степень дифференцировки при данных условиях была определена как 29,6%, аналогично обычно доступным условиям с применением коммерческой среды для индукции дифференцировки Th2 клеток (38%, Merck Milipore, FCIM025162), и дифференцировку Th2 клеток индуцировали на 3 день, после индукции дифференциации с помощью повторного подтверждения индукции маркера экспрессии через RT-ПЦР (S1000 термоциклер, Bio-Rad) эксперимент с применением маркеров дифференциации Th2 (ИЛ-4 и GATA3) для определения экспрессии ими мРНК.
3-2. Влияние на дифференцировку Th2 клеток у мыши
Нативные клетки CD4+ T cells (CD4+CD62L+Miltenyi Biotec, 130-093-227) выделяли из лимфатических узлов и селезенки C57BL6 мыши с помощью MACS (Miltenyi Biotec, кат. №130-090-976) и обрабатывали 5, 10, 20 и 40 мкг/мл ATC2, когда индуцировали дифференцировку клетки в ТЫ клетку. Степень Th2 дифференциации определяли по экспрессии маркера дифференцировки ИЛ-4.
Как показано на фиг. 12, было подтверждено, что степень дифференцировки Th2 в исследуемой группе, обработанной различными концентрациями ATC2, уменьшалась в зависимости от дозы, на 19,2% в случае 5 мгк/мл ATC2, в то время как в контрольной группе на 29,6%. Однако общее количество клеток в исследуемой группе, обработанной 20 и 40 мкг/мл ATC2, было снижено и, следовательно, действительно подтвердили, что менее 10 мкг/мл ATC2 демонстрирует эффективную ингибирующую концентрацию на дифференциацию Th2 без влияния на общее число клеток.
Соответственно, было подтверждено, что менее 10 мкг/мл ATC2 представляет собой подходящую концентрацию для исследования.
3-3. Влияние на спектральные изменения в молекулярной экспрессии, участвующей в дифференцировке Th2 клеток
Нативные CD4+ T клетки (CD4+CD62L+Miltenyi Biotec, 130-093-227) выделяли из лимфатических узлов и селезенки C57BL6 мыши с помощью MACS (Miltenyi Biotec, кат. №130-090-976) и обрабатывали 2,5, 5 и 10 мкг/мл ATC2 в тот момент, когда клетка была индуцирована дифференцироваться в Th2 клетку. Степень Th2 дифференцировки определяли по экспрессии маркера дифференцировки ИЛ-4.
Как показано на фиг. 13, было подтверждено, что только в Th2 клетках индуцируется ИЛ-4 экспрессия по сравнению с нативной клеткой, и экспрессия маркера дифференцировки ИЛ-4 резко снизилась до примерно 60% в группе, получавшей 2,5 мкг/мл ATC2, примерно на 30% в группе, получавшей 5 мкг/мл ATC2, и примерно 5% в группе, получавшей 10 мкг/мл ATC2.
Окислительный стресс, вызванный курением или загрязнением воздуха, приводит к разрушению альвеолярной защиты, увеличению апоптоза и воспалительной реакции, вызывая дисбаланс протеазы/антипротеазы, и усиливая воспаление через механизмы старения и аутоиммунной реакции, что проводит к возникновению заболевания ХОБЛ по прошествии 30-50 лет. ХОБЛ показывает конкретные симптомы, например, обструкция дыхательных каналов и эмфизема или специфическое воспаление в легких, такое как повышенный уровень макрофагов, нейтрофилов, Т-лимфоцитов, CD 8 клеток, хемокинов и т.д.
Настоящее исследование позволило определить эффективную концентрацию исследуемых образцов (ATC2, верпрозид, рофлумиласт) у мышей с индуцированной ХОБЛ с помощью интратрахеального вливания ЛПС и CS.
В результате было подтверждено, что более 15 мг/кг ATC2, 15 мг/кг верпрозида и 15 мг/кг рофлумиласта показали сходную ингибирующую активность на общее количество иммуноцитов, нейтрофилов и Т-лимфоцитов и т.д. в ЖБАЛ. Более 15 мг/кг ATC2, 15 мг/кг верпрозида и 15 мг/кг рофлумиласта, показали сходную ингибирующую активность на воспроизведенный уровень ФНО-альфа, KC/CXCL-1, и МИП-2, медиатор уничтожения легочных альвеол.
Благодаря этим результатам, было подтверждено, что более 15 мг/кг ATC2, 15 мг/кг верпрозида и 15 мг/кг рофлумиласта показали высокую активность против ХОБЛ путем ингибирования пролиферации и активации рекрутинга нейтрофилов в легкие, вызванных возникновением ХОБЛ.
Экспериментальный пример 4. Модель исследования на животном (мышь)
Для определения эффекта против ХОБЛ экстракта или соединений настоящего изобретения на общее число иммуноцитов, нейтрофилов и Т-лимфоцитов и т.д. в ЖБАЛ, и воспроизведенный уровень ФНО-альфа, KC/CXCL-1, и МИП-2, выполняли следующее исследование с применением мышей с индуцированной ХОБЛ.
4-1. Опыт на животном
Свободные от патогенной микрофлоры BALB/c мыши-самцы (примерно 18-20 г), в возрасте 8 недель, которые были серологически отобраны обычным способом для соответствующих возбудителей респираторных заболеваний, были приобретены у ORIENT Co. (www.orient.co.kr, Сеул, Корея) и разводились в условиях свободного доступа к корму и воде в камере для разведения с регулируемой температурой 22±2°C и влажностью 55±15% с 12 часовым циклом чередования света и темноты и акклиматизировались в экспериментальных условиях в течение 1 недели.
4-2. Лекарственное средство и введение
(1) исследуемый образец
4 вида образцов, а именно ATC2 (30 мг/кг), верпрозид (30 мг/кг), индакатерол (30 мг/кг) рофлумиласт (30 мг/кг) растворяли в 0,5% КМЦ (натрий-карбоксиметилцеллюлоза) и применяли в качестве исследуемых образцов.
(2) введение
30 мг/кг каждого ATC2, верпрозида, индакатерола и рофлумиласта смешивали с 100 мкл смеси ЛПС+CS {ЛПС(100 мкг/мл) + стандартный экстракт сигарет (курение сигарет (CS), 4 мг/мл) = 1:1} и вводили перорально мышам, за час до предварительного интратрахеального вливания.
(3) приготовление стандартного экстракта сигарет (курение сигарет; CS)
- тестовый материал: 60 штук стандартных сигарет CM7 (Coresta Monitering Cigarette 7, Heinr Borgwaldt, Германия) и изопропанол, этанол (Merck, Германия), н-гептадекан (Sigma-Aldrich, США) применяли в качестве тестовых материалов, и в эксперименте применяли автоматическую курительную машину (ISO 3308 стандартизированный продукт, автоматическая курительная машина, модель No.: RM20, Heinr Borgwaldt).
4-3. сбор потока дыма, вдыхаемого курильщиком
(1) сбор потока дыма, вдыхаемого курильщиком
Поток дыма стандартных сигарет CM7, вдыхаемого курильщиком (Coresta Monitering Cigarette 7, Heinr Borgwaldt, Германия), собирали согласно способу, раскрытому в KS Н ISO (Международная организация стандартизации) 3402 стандарт (Табак и табачные изделия - Воздух для кондиционирования и испытаний) и корейском руководстве (Determination guideline for the harmful component in Cigarette type smoking desire suppressor, October, 2012, KFDA) и проводили в курительной комнате (температура: 22±2°C, относительная влажность: 60±5%).
Сигареты сжигали согласно способу курения ISO стандарта, т.е. объем дыма (35,0±0,3 мл), интервал курения (60±0,5 сек), время курения (2,00±0,02 сек) и длина окурков (мундштучная бумага + 3 мм, обертка + 3 мм) с применением автоматической курительной машины (ISO 3308 стандартизированный продукт, автоматическая курительная машина, модель No.: RM20/CS, Heinr Borgwaldt, Германия) в соответствии со стандартом ISO3308 (Обычная аналитическая сигарета - Курительная машина - Определения и стандартные условия) и ТРМ (общее количество твердых частиц) собирали из сигарет с применением 92 мм кембриджского фильтра (ISO3308 стандартизированный продукт, RM20, Heinr Borgwaldt, Германия) в соответствии с ISO3308 стандартом (KS Н ISO 3308, 2000).
(2) масса общего количества твердых частиц (TPM)
Массу мундштука, содержащего предварительно сожженный кембриджский фильтр, определяли в соответствии с ISO 3308 стандартом, и затем массу мундштука (RM20/CS, Heinr Borgwaldt, Германия), содержащего собранный кембриджским фильтром сигаретный дым (RM20, Heinr Borgwaldt, Германия) после сгорания, применяли для расчета содержания ТРМ (KS Н ISO 4387, 2000; Сигареты - Определение общего числа твердых частиц и не содержащих никотина с применением обычной аналитической курительной машины) и согласно корейскому руководству (Determination guideline for the harmful component in Cigarette type smoking desire suppressor, October, 2012, KFDA).
В результате, было подтверждено, что содержание TPM в случае, когда стандартная сигарета была сожжена трижды, было определено как 16,0621 мг (19 штук), 15,9135 мг (20 штук), 15,5380 мг/сиг (20 штук), соответственно. Исследуемое общее количество стандартных сигарет было 59 штук, и TPM составило 47,5136 мг.
(3) экстракция TPM сигарет
Кембриджский фильтр, содержащий RPM, выделяли из мундштука и помещали в 100 мл коническую колбу Эрленмейера. К нему добавляли 50 мл изопропанола, тщательно перемешивали, оставляли в покое при комнатной температуре в течение более 8 часов для экстракции. После экстракции раствор фильтровали, концентрировали под вакуумом и переносили в сцинтилляционный флакон (WHEATON, 03-340-25N, США) для концентрирования под азотом.
Содержание TPM сигарет в потоке дыма, вдыхаемого курильщиком, рассчитывали в соответствии со следующей эмпирической формулой 1.
Эмпирическая формула 1
<расчет содержания ТРМ>
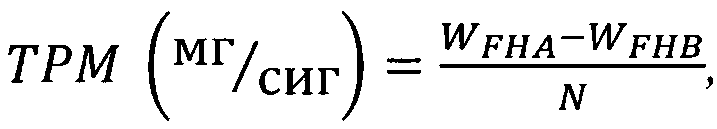
где TPM обозначает общее количество твердых частиц;
WFHA обозначает массу мундштука после курения;
WFHB обозначает массу мундштука перед курением;
N обозначает количество выкуренных сигарет (vig.)/Trap.
4-4. тестовая процедура
(1) модель ХОБЛ животных
BALB/c мышей-самцов, в возрасте 8 недель, анестезировали 7% раствором хлоральгидрата, и мышам ингалировали 100 мкл смеси ЛПС+CS {ЛПС(100 мкг/мл) + стандартный экстракт сигарет (курение сигарет (CS), 4 мг/мл) = 1:1} в течение трех недель раз в неделю для подготовки модели ХОБЛ животного. Кратко, 100 мкл смеси ЛПС+CS равномерно ингалировали в нос и рот связанным мышам. Исследуемые группы были разделены на шесть групп, т.е., (i) нормальная группа без обработки (интактная), (ii) контрольная группа, получавшая смесь ЛПС+CS (ХОБЛ-контроль), (iii) исследуемая группа, получавшая ATC2 (30 мг/кг, перорально) за 1 час до получения ЛПС+CS (ХОБЛ-ATC2), (iv) исследуемая группа, получавшая верпрозид (30 мг/кг, перорально) за 1 час до получения ЛПС+CS (ХОБЛ-верпрозид), (v) исследуемая группа, получавшая индакатерол (30 мг/кг, перорально) за 1 час до получения ЛПС+CS (ХОБЛ-индакатерол) и (vi) исследуемая группа, получавшая рофлумиласт (30 мг/кг, перорально) за 1 час до получения ЛПС+CS (ХОБЛ-рофлумиласт). После окончания эксперимента, кровь, ЖБАЛ и пневмоноциты каждой мыши выделяли и собирали для исследования.
(2) выделение МКПК из крови и определение количества клеток
После окончания эксперимента, собирали 800~1000 мкл крови из мышей, которым вводили 40 мкл 30 I.U гепарина (APU8AF, JW Pharmaceutical, Корея) и затем анестезировали диэтиловым эфиром согласно сердечной пункции. 500 мкл собранной крови добавляли к 9,5 мл раствора ACK (A1049201. Invitrogen, США) и оставляли в покое на 5 минут для растворения эритроцитов. Кровь центрифугировали в течение 5 минут со скоростью 1200 об/мин для выделения МКПК (мононуклеарные клетки периферической крови) и окрашивали 0,04% трипановым синим (15250061, Invitrogen, США) для подсчета общего количества клеток число/мл.
(3) выделение ЖБАЛ (БАЛ жидкость) и определение общего количества клеток
После сбора крови, 1 мл свободной от ФБС/DMEM среды, содержащейся в шприце, вводили во трахею умерщвленных мышей, мышей фиксировали жгутом для обеспечения циркуляции крови трижды и выделяли клетки из ЖБАЛ. Кровь выделяли, обрабатывали раствором AK при 37°C в течение 5 минут для растворения эритроцитов, промывали свободной от ФБС/DMEM средой и окрашивали 0,04% трипановым синим для подсчета общего количества клеток.
(4) выделение клеток легких (пневмоцитов) и определение общего количества клеток
Легкие отбирали у мышей, у которых не была выделена ЖБАЛ, и легочную ткань нарезали тонкими слоями. К слоям добавляли 3 мл DMEM среды (LM001-05, Welgene, КОРЕЯ) без фетальной бычьей сыворотки (ФБС), при этом к среде был добавлен 1 мг/мл коллагеназы IV (С5138, Sigma-Aldrich, США). Среду инкубировали во встряхивателе-инкубаторе (KMC480S, VISION SCI, Корея) при 37°C в течение 30 минут, ткань перерабатывали более 4 раз для выделения пневмоцитов. Выделенные пневмоциты промывали средой и пропускали через сито для клеток (352350, FALCON, США) для удаления непереработанных тканей, отличных от клеток, или примесей. Клетки обрабатывали раствором ACK при 37°C в течение 5 минут для растворения эритроцитов, снова промывали средой и окрашивали 0,04% трипановым синим (15250061, Invitrogen, США) для подсчета общего количества клеток.
(5) FACS-анализ
Выделенные МКПК, БАЛ (бронхоальвеолярный лаваж) и пневмоциты доводили до 5×105 клеток и проводили иммунофлуоресцентное окрашивание при 4°C. К ним добавляли PE-анти-CD3e (553064, BD Pharmingen, США), FITC-анти-CD8 (553031, BD Pharmingen, США), PE-анти-CD4 (553047, BD Pharmingen, США), PE-анти-Gr-1 (553128, BD Pharmingen, США), и FITC-анти-нейтрофил (ab55453, Abcam, UK), соответственно, и проводили реакцию во льду в течение 30 минут. После реакции клетки промывали забуференным фосфатом физиологическим солевым раствором более трех раз, и частоту клеток (%) CD3+CD4+ и CD3+CD8+ и Gr-1+нейтрофилов+ определяли с помощью программы Cell Quest (643274, BD Biosciences, США) проточного цитометра (FACSCalibur, Becton, Dickinson, США), и абсолютное общее количество в каждой ткани рассчитывали на основании общего количества клеток.
(6) ИФА
Уровни ИЛ-1β, ИЛ-6, ФНО-альфа, ИЛ-17, МХП-1 и GRO-альфа (BioSource, США) в ЖБАЛ, выделенной из мышей, определяли с помощью иммуноферментного анализа. Соответствующие антитела против ИЛ-1β, ИЛ-6, ФНО-альфа, ИЛ-17, МХП-1 и GRO-альфа разводили буфером для иммобилизации (291195, R&D System, США), наносили на микролунку и оставляли в покое на ночь при 4°C. Каждую лунку трижды промывали отмывочным буферным раствором и добавляли 100 мкл 10-кратно разбавленной сыворотки. Раствор оставляли в покое на 1 час при комнатной температуре, дважды промывали отмывочным буфером (Tween-20, Sigma-Aldrich, США), добавляли 100 мкл конъюгированных Avidin-HRP антител (DY998, R&D System, США), оставляли в покое на 1 час при комнатной температуре и снова промывали. К смеси добавляли 100 мкл субстрата ТМБ (555214, BD, США). Раствор оставляли в покое на 30 минут в тени и добавляли 50 мкл стоп-реагента (DY994, R&D system, США) для определения спектральной поглощательной способности с помощью ELISA при 450 нм (340PC384, Molecular Devices, США).
(7) Определение генной экспрессии мРНК в легочной ткани
(7-1) выделение РНК из легочной ткани
Выделяли легочную ткань мышей и измельчали на куски, добавляли 500 мл RNAzolB (CS-105B, Tel-Test, США) для растворения. К 50 мл хлороформа (CHCl3) добавляли смешанный раствор высокой плотности и снова перемешивали в течение 15 секунд. Раствор оставляли в покое во льду в течение 15 минут, центрифугировали при 13000 об/мин для отделения примерно 200 мл супернатанта, добавляли 200 мл 2-пропанола к равному объему супернатанта. Смесь оставляли в покое во льду в течение 15 минут, снова центрифугировали при 13000 об/мин, промывали 80% EtOH и сушили с помощью вакуумного насоса (ULVAC, США) в течение 3 минут для экстракции РНК. Экстрагированную РНК растворяли в 20 мл дистиллированной воды, обработанной диэтилпирокарбонатом (ДЭПК, IBS-BW1004, Intron, Корея), и инактивировали с помощью нагревательного блока (2050, Lab-Line, Индия) при 75°C для применения в синтезе первой цепи кДНК.
(7-2) полимеразная цепная реакция с обратной транскрипцией
Реакцию обратной транскрипции проводили в соответствии с процедурой, как указано далее: 2 мкг полученной общей РНК подвергали реакции в нагревательном блоке при 37°C в течение 30 минут путем добавления ДНКазы I (10 ед/мл), 2 ед/туба, денатурировали при 75°C в течение 10 минут, добавляли 2,5 мл 10 мМ смеси dNTP (4026, 4027, 4028, 4029, TaKaRA, Япония), 1 мл случайной последовательности гексануклеотидов (25 пмоль/25 мл (11034731001, Roche, Германия), 1 мл ингибитора РНКазы (2313A, TaKaRa, Япония, 20 U/mL) в качестве ингибитора РНК, 1 мл 100 мМ DTT (Р1171, Progmega, США), 4,5 мл 5×RT буфера (М531А, Promega, США) и 250 мМ Трис-HCl (pH 8,3, 375 мМ KCl, 15 мМ MgCl2), снова добавляли 1 мл M-MLV RT (200 ед/мл, M1705, Promega, США) и конечный объем раствора доводили до 20 мл путем добавления дистиллированной воды, обработанной ДЭПК (диэтилпирокарбонат). 20 мл реакционной смеси тщательно перемешивали, центрифугировали при 2000 об/мин в течение 5 секунд, подвергали реакции в нагревательном блоке при 37°C в течение 60 минут для синтеза первой цепи кДНК, оставляли в покое на 5 минут при 95°C для инактивации M-MLV RT и применяли синтезированную кДНК в полимеразной цепной реакции (ПЦР).
(7-3) количественная ОТ-ПЦР в режиме реального времени
Синтезированную кДНК применяли в количественной ПЦР в режиме реального времени (Galli SJ. Allergy, Curr. Biol., 10:R93-95, 2006) с применением системы ПЦР в режиме реального времени Applied Biosystems 7500 (Applied Biosystems, США). CATGTTCCAGTATGACTCCACTCACG (VIC, продукт от Applied Biosystems Co. Ltd.) применяли в качестве зонда для ТФР-β1, MUC5AC, и мышиную глицеральдегид-3-фосфатдегидрогеназу (G3PDH), и Sper-Taqman ПЦР мастер-микс (4369016, ABI) применяли в эксперименте для достижения конечной концентрации в реакции 200 нМ. Количественную ПЦР в режиме реального времени проводили, как указано далее: преденатурация: при 50°C в течение 2 минут, при 94°C в течение 10 минут, и 40 циклов при 95°C в течение 0,15 минут, при 60°C в течение 1 минуты. G3PDH (4351309, ABI, США) применяли в качестве внутреннего стандарта в RME обработанной группе и контрольной группе и RQ (относительное количество) рассчитывали согласно следующей эмпирической формуле 2 (см. Таблицу 5).
[Эмпирическая формула 2]
ЦЕЛЕВАЯ ГРУППА КОЛИЧЕСТВЕННОЙ ПЦР y=x(1+e)n
x - начальное количество, y - выход вещества, n - количество циклов, e - эффективность

(8) Гистопатологическое исследование
Выделенные легкие быстро фиксировали 10% раствором формальдегида (F0161, SAMCHUN, Корея) и нарезали тонкими слоями. Слои промывали проточной водой в течение 8 часов, покрывали эпоксидной смолой, нарезали слоями с помощью микротома (SM2000R, LEICA, Германия), окрашивали гематоксилином и эозином, окрашивали трихромом по Массону для выявления отложений коллагена. Для наблюдений бокаловидных клеток, клетки окрашивали PAS (Шифф-йодной кислотой) и наблюдали с помощью 400x оптического микроскопа (333246, NIKON, Япония).
4-5. статистика
Все результаты, полученные из различных экспериментов, были зафиксированы как среднее ± стандартная ошибка, и проверку значимости определяли по t-критерию Стьюдента. Приведенные выше данные были проанализированы согласно однофакторному дисперсионному анализу для определения статистически значимого отклонения между соответствующей группой для каждой определенной конечной точки, и статистическую значимость между каждой группой определяли согласно непараметрическому критерию Манна-Уитни и критерию множественного сравнения Даннета (IBM SPSS statistics version 19.0 statistic software, Inc, IBM, США). Различия между каждым контролем (ХОБЛ-контроль) были очевидны, и поэтому не показаны на фигурах и таблицах. Результаты (представлены как среднее ± стандартная ошибка среднего) были выражены в виде значений P: <0,05 (∗), <0,01 (∗∗) или <0,001 (∗∗∗) как статистически значимые.
4-6. результат исследования
(1) влияние на общее количество иммуноцитов, нейтрофилов и Т-лимфоцитов в ЖБАЛ
Общее количество иммуноцитов, общее количество клеток нейтрофилов+Gr-1+, и общее число клеток CD4+ и CD8+ T клеток в контрольной группе (ХОБЛ-контроль) было резко увеличено по сравнению с количеством в нормальной группе (нормальная группа линии BALB/c). Общее количество иммуноцитов в исследуемой группе, получавшей более 15 мг/кг ATC2 (5, 10, 15, 30 мг/кг), уменьшилось по сравнению с контрольной группой, и в исследуемой группе, получавшей верпрозид (15 мг/кг) и рофлумиласт (15 мг/кг) (p<0,05) количество иммуноцитов резко снижено по сравнению с контрольной группой (Фиг. 14). Общее количество клеток нейтрофилов+Gr-1 (общее абсолютное количество) в исследуемой группе, получавшей более 15 мг/кг (p<0,001) и 30 мг/кг (p<0,001) ATC2 (5, 10, 15, 30 мг/кг), уменьшилось более чем на 73,2% и 81,9%, соответственно, по сравнению с контрольной группой, и количество клеток в исследуемой группе, получавшей верпрозид (15 мг/кг) (p<0,001) и рофлумиласт (15 мг/кг) (p<0,001) снизилось более чем на 93,9% и 97,5%, соответственно, по сравнению с контрольной группой (Фиг. 14). Общее количество клеток CD4+ T клеток (общее абсолютное количество) в исследуемой группе, получавшей 15 мг/кг (p<0,001) и 30 мг/кг (p<0,001) ATC2 (5, 10, 15, 30 мг/кг), уменьшилось более чем на 47,7% и 19,7%, соответственно, по сравнению с контрольной группой, и в исследуемой группе, получавшей верпрозид (15 мг/кг) (p<0,001) и рофлумиласт (15 мг/кг) (p<0,001), количество клеток было снижено более чем на 32,9% и 73,2%, соответственно, по сравнению с контрольной группой (Фиг. 14c). Общее количество клеток CD8+ T клеток (общее абсолютное количество) в исследуемой группе, получавшей ATC2 (5, 10, 15, 30 мг/кг) и верпрозид (15 мг/кг) существенно не отличались от такового в контрольной группе, в то время как в исследуемой группе, получавшей рофлумиласт (15 мг/кг) (p<0,001), количество клеток было снижено более чем на 67,2% по сравнению с таковым в контрольной группе (Фиг. 14).
В результате, было подтверждено, что группы, получавшие более 15 мг/кг ATC2 (5, 10, 15, 30 мг/кг), верпрозид (15 мг/кг), и рофлумиласт (15 мг/кг), показали более сильное ингибирующее действие на пролиферацию и активацию воспалительных иммуноцитов и нейтрофилов, рекрутируемых в легкие, что проявляется в высокой активности противо ХОБЛ.
(2) Влияние на количество нейтрофилов в ЖБАЛ
Число нейтрофилов, окрашенных по Дифф-Квик в контрольной группе (ХОБЛ-контроль) с применением цитоцентрифуги, в ЖБАЛ мышей резко увеличено примерно в 184 раза по сравнению с таковым в нормальной группе (BALB/c нормальная группа) (Фиг. 15). Как показано на Фиг. 15, число нейтрофилов в группе, получавшей 15 мг/кг (p<0,001) и 30 мг/кг (p<0,001) ATC2 (5, 10, 15, 30 мг/кг) сократилось более чем на 89,1% и 72,4%, соответственно, по сравнению с контрольной группой, и в группах, получавших верпрозид (15 мг/кг) (p<0,001) и рофлумиласт (15 мг/кг) (p<0,001) число клеток сократилось более чем на 94,2% и 99,0%, соответственно, по сравнению с контрольной группой.
В результате, было подтверждено, что группы, получавшие более 15 мг/кг ATC2 (5, 10, 15, 30 мг/кг), верпрозид (15 мг/кг) и рофлумиласт (15 мг/кг), показали сильное ингибирующее действие на пролиферацию нейтрофилов, рекрутируемых в легкие, что проявляется в высокой активности против ХОБЛ.
(3) Влияние на воспроизводство CXCL-1, ФНО-альфа и МИП-2 в ЖБАЛ
Различные хемокины МИП-2/CXCL-2, ФНО-альфа и протеаза и т.д. высвобождаются при вызванном воспалительными макрофагами в легких разрушении альвеолярного слоя, и KC/CXCL-1 (хемокины Gro-α) и CXCL-8 стимулируют нейтрофилы, высвобождают протеазу и таким образом снова разрушают альвеолы, приводя к ХОБЛ (Blidberg K, Palmberg L, Dahlen B, Lantz AS, Larsson K. 2012. Chemokine release by neutrophils in chronic obstructive pulmonary disease. Innate Immun. 18: 503-510).
На Фиг. 16A показано воспроизводство хемокина KC/CXCL-1 (хемокины Gro-α) в ЖБАЛ мышей, определенное способом ИФА, при этом воспроизводство хемокина KC/CXCL-1 (хемокины Gro-α) в контрольной группе было резко увеличено примерно в 5,9 раз по сравнению с таковым в контрольной группе (нормальная группа BALB/c). Воспроизводство хемокина KC/CXCL-1 (хемокины Gro-α) в группе, получавшей 15 мг/кг (p<0,001) и 30 мг/кг (p<0,001) ATC2 (5, 10, 15, 30 мг/кг) сократилось более чем на 46,8% и 83,9%, соответственно, по сравнению с контрольной группой, и в группах, получавших верпрозид (15 мг/кг) (p<0,05) и рофлумиласт (15 мг/кг) (p<0,01) воспроизводство хемокина сократилось более чем на 57,4% и 82,7%, соответственно, по сравнению с контрольной группой. На Фиг. 16B показано воспроизводство ФНО-альфа в ЖБАЛ мышей, определенное способом ИФА, при этом воспроизводство ФНО-альфа в контрольной группе было резко увеличено примерно в 2,8 раза по сравнению с таковым в контрольной группе (нормальная группа BALB/c). Воспроизводство ФНО-альфа в группе, получавшей 15 мг/кг (p<0,05) и 30 мг/кг (p<0,01) ATC2 (5, 10, 15, 30 мг/кг) сократилось более чем на 45,5% и 63,4%, соответственно, по сравнению с контрольной группой, и в группах, получавших верпрозид (15 мг/кг) (p<0,05) и рофлумиласт (15 мг/кг) (p<0,01) сократилось более чем на 42,2% и 65,0%, соответственно, по сравнению с контрольной группой. На Фиг. 16C показано воспроизводство хемокинов МИП-2/CXCL-2 в ЖБАЛ мышей, определенное способом ИФА, при этом воспроизводство хемокинов МИП-2/CXCE-2 в контрольной группе было резко увеличено примерно в 5,2 раза по сравнению с таковым в контрольной группе (нормальная группа BALB/c). Воспроизводство хемокинов МИП-2/CXCL-2 в группе, получавшей 15 мг/кг (p<0,05) и 30 мг/кг (p<0,001) ATC2 (5, 10, 15, 30 мг/кг) сократилось более чем на 48,4% и 86,4%, соответственно, по сравнению с контрольной группой, и в группах, получавших верпрозид (15 мг/кг) (p<0,01) и рофлумиласт (15 мг/кг) (p<0,001), сократилось более чем на 63,0% и 81,9%, соответственно, по сравнению с контрольной группой.
В результате, было подтверждено, что группы, получавшие более 15 мг/кг ATC2 (5, 10, 15, 30 мг/кг), верпрозид (15 мг/кг), рофлумиласт (15 мг/кг), показали более сильное ингибирующее действие на воспроизводство хемокинов МИП-2/CXCL-2, ФНО-альфа, KC/CXCL-1 (хемокины Gro-α) и CXCL-8 и т.д., участвующих в разрушении клеток легких, что проявляется в высокой активности против ХОБЛ.
Экспериментальный пример 5. Модель исследования на животном (крыса)
Для определения эффекта против ХОБЛ экстракта или соединений настоящего изобретения на общее число иммуноцитов, нейтрофилов и т.д. в ЖБАЛ, воспроизведенный уровень цитокинов, таких как ИЛ-1бета, ИЛ-6, ФНО-альфа, активацию ММП-9, экспрессию провоспалительных белков, таких как ММП-9, NF-каппаВ, и воспалительный ответ в легочной ткани, выполняли следующее исследование с применением мышей с индуцированной ХОБЛ.
5-1. Опыт на животном
Свободные от патогенной микрофлоры мыши-самцы Спрег-Доули (примерно 180-200 г), в возрасте 6 недель, которые были обычным образом серологически отобраны для соответствующих возбудителей респираторных заболеваний, были приобретены у ORIENT Co. (www.orient.co.kr, Seoul, Корея) и разводились в условиях свободного доступа к корму (без антибиотиков, Samyang Oil & Feed Corp., Корея) и воде в камере для разведения с регулируемой температурой 22±2°C и влажностью 55±15% с 12 часовым циклом чередования света и темноты и акклиматизировались в экспериментальных условиях в течение 1 недели.
5-2. Лекарственное средство и введение
(1) исследуемый образец
3 вида образцов, а именно ATC2 (30 мг/кг), верпрозид (30 мг/кг), даксас (основной компонент: рофлумиласт, 1 мг/кг) растворяли в ФСБ и применяли в качестве исследуемых образцов.
(2) введение
ATC2, верпрозид, индакатерол, даксас вводили мышам перорально в дозе 4 мг/кг, за час до предварительного интратрахеального вливания.
5-3. Подготовка крысиной ХОБЛ-модели
(1) стандарт сигарет
Эталон сигарет Кентукки 3R4F (Университет Калифорнии, США) применяли в качестве стандарта сигарет для генерирования сигаретного дыма. Сигареты, содержащие 9,4 мг смолы, 11 мг TPM (общее количество твердых частиц) и 12 мг монооксида углерода в одной сигарете, применяли после уравновешивания при температуре 22±2°C и относительной влажности 60±2%, после открытия в течение 48~72 часов.
(2) Процедура
Воздействие сигаретным дымом проводили с применением генератора сигаретного дыма (CH Technology Corp. США). В деталях, через 1 час после перорального введения исследуемых образцов с применением воздействия только на одну часть "голова/нос" (TSE System, Германия) в соответствии со способом "только-нос", сигаретный дым ингалировали каждый час в течение 3 дней. В эксперименте выполняли 8 затяжек (объем 35 мл, продолжительность 2 секунды, интервал 1 раз/мин) на единицу стандартной сигареты. Исследуемые группы были разделены на пять групп, т.е., (i) нормальная группа без обработки (нормальный контроль, NC), (ii) контрольная группа, подвергаемая воздействию сигаретным дымом (ХОБЛ), (iii) исследуемая группа, получавшая даксас (1 мг/кг, перорально) за 1 час до воздействия сигаретного дыма (DA), (iv) исследуемая группа, получавшая ATC2 (30 мг/кг, перорально) за 1 час до воздействия сигаретного дыма (YPL), и (v) исследуемая группа, получавшая верпрозид (30 мг/кг, перорально) за 1 час до воздействия сигаретного дыма (Ver). После окончания эксперимента, кровь, ЖБАЛ и пневмоноциты каждой крысы выделяли и собирали для исследования.
5-4. Выделение ЖБАЛ и определение числа иммуноцитов
После окончания эксперимента крыс анестезировали Zoletil50 (3VX9, Virbac, France, p.o) и выделяли кровь через хвостовые вены. Для выделения ЖБАЛ из легких, бронх правого легкого лигировали наложением шва, а затем проводили трахеотомию. Внутривенный катетер (16 GA, 3S-Cath, Dukwoo, Корея) вводили в бронх, бронх и катетер (16 GA, 3S-Cath, Dukwoo, Корея) фиксировали наложением шва. Устройство для инъекций, содержащее 5 мл ФСБД (фосфатно-солевой буфер Дюльбекко, 14190-250, Invitrogen, США) присоединяли к ним и ФСБД искусственно циркулировали три раза для выделения ЖБАЛ. Правое легкое, лигированное наложением шва, выделяли, фиксировали 10%-ным нейтральным раствором формалина, и остальную легочную ткань сохранили в холодильнике при -70°C. Выделенную ЖБАЛ центрифугировали в течение 15 минут при 1500 об/мин для осаждения клеток и супернатант сохранили в холодильнике при -70°C для анализа цитокинов. Клеточный сгусток суспендировали в ФСБД, и клетки прикрепляли к предметному стеклу с помощью цитоцентрифуги (CS03270047, Hanil, Корея). Выполняли окрашивание по Дифф-Квик (ZS1003, Sysmex, Япония) и наблюдали клетки с помощью оптического микроскопа (DM 1000, Leica, Германия) для подсчета количества иммуноцитов в каждом исследуемом образце.
5-5. анализ цитокинов в ЖБАЛ
Уровни ИЛ-1β, ИЛ-6 и ФНО-альфа (R&D System, США) в ЖБАЛ, выделенной из крыс, определяли с помощью иммуноферментного анализа (ИФА). Анализ каждого цитокина проводили в соответствии с инструкцией изготовителя и определяли спектральную поглощательную способность при 450 нм с помощью ИФА (340PC384, Molecular Devices, США).
5-6. Определение экспрессии иммуноцитов
(1) желатиновая зимография
Ткани легких крыс гомогенизировали с помощью буфера для лизиса тканей (С3228, Sigma-Aldrich, США), обрабатывали ингибитором протеазы (11836153001, Roche, Германия) и гомогенизировали ткань легких центрифугированием при 12000 об/мин в течение 10 минут для выделения супернатанта. Для количественной оценки применяли реагент белкового анализа (500-0006, Bio-Rad, США). Для определения активности ММП-9, в эксперименте применяли гель-электрофорез с додецил-сульфатом натрия (SDS-ПААГ), содержащим 1% желатина (G9382, Sigma-Aldrich, США). Белок подвергали электрофорезу в дозе 60 мкг/полоска. Гель зимограммы промывали 2,5% Triton Х-100 (0694, Amresco, США) и подвергали реакции в течение 16 часов при 37°C с применением проявляющего буфера (1М Трис-HCl, pH 7.5 с CaCl2, T1503, Sigma-Aldrich, США). После завершения реакции, гель зимограммы окрашивали с помощью кумасси бриллиантовый голубой (0472, Amresco, США) и промывали обесцвечивающим буфером {500 мл метанола (M1447, Samchun, Корея) + 1400 мл дистиллированной воды + 160 мл уксусной кислоты (9151, J.T. Baker)}. Плотность ММП-9 бэнда определяли с помощью Chemidoc (170-8070, Bio-Rad, США) для определения активности ММП-9.
(2) Вестерн-блоттинг
Белок, полученный с помощью гомогенизации, наносили на электрофорез в дозе 30 мкг/полоска и переносили с применением мембраны из поливинилидендифторида (ПВДФ) (IPVH00010, Millipore, США). Мембрану (IPVH00010, Millipore, США) блокировали 5% обезжиренным молоком, а затем подвергали взаимодействию с антителами анти-ММП-9 (ab38898, Abcam, UK), анти-р65 (sc-372, Santa Cruz, США) и анти-p-p65 (sc-33039, Santa Cruz, США). После завершения реакции мембрану промывали TBST (Трис-буферизированный солевой раствор, содержащий 0,05% Tween-20, HT2008, Biosesang, Корея) и подвергали взаимодействию с подходящим вторичным антителом (sc-358914, Santa Cruz, США) при комнатной температуре в течение 1 часа. Мембрану снова промывали TBST и бэнд верифицировали с помощью набора хемилюминесценции (34095, Thermo, США).
5-7. гистопатологическое исследование
Выделенные легкие быстро фиксировали 10% раствором формальдегида (F0161, SAMCHUN, Корея) и нарезали тонкими слоями. Слои промывали проточной водой в течение 8 часов, покрывали эпоксидной смолой, нарезали слоями с помощью микротома (SM2000R, LEICA, Германия), и окрашивали гематоксилином (MHS-16, Sigma-Aldrich, США) и эозином (HT110-1-32, Sigma-Aldrich, США). Для наблюдения гистопатологических изменений в легочной ткани, клетки наблюдали с помощью 400x оптического микроскопа (DM1000, Leica, Германия).
5-8. статистика
Все результаты, полученные из различных экспериментов, были определены с помощью однофакторного дисперсионного анализа, и статистическую значимость между каждой группой определяли согласно критерию множественного сравнения Даннета для последующего сравнения результатов.
5-9. результат исследования
(1) влияние на общее количество иммуноцитов в ЖБАЛ
В ХОБЛ-индуцированной группе наблюдали характеристический повышенный уровень нейтрофилов. Контрольная группа, получавшая даксас, показала понижение уровня нейтрофилов, однако это не существенно по сравнению с ХОБЛ-индуцированной группой. В то же время группы, получавшие ATC2 и верпрозид, показали существенное понижение уровня нейтрофилов и общего числа иммуноцитов по сравнению с ХОБЛ-индуцированной группой (Фиг. 17A). Снижение наблюдалось в отношении уровня нейтрофилов к общему количеству иммуноцитов. Группа положительного контроля, получавшая даксас, показала аналогичное отношение числа нейтрофилов к числу иммуноцитов в случае подсчета 300 иммуноцитов для ХОБЛ-индуцированной группы, тогда как группы, получавшие ATC2 и верпрозид, показали существенное понижение отношения числа нейтрофилов (Фиг. 17B).
(2) влияние на высвобождение цитокинов в ЖБАЛ
Уровни ИЛ-1β, ИЛ-6 и ФНО-альфа в ЖБАЛ резко выросли у ХОБЛ-индуцированной группы. Контрольная группа, получавшая даксас, не показала значительное понижение уровня цитокинов по сравнению с ХОБЛ-индуцированной группой. В то же время, группы, получавшие ATC2 и верпрозид, показали существенное понижение уровня цитокинов по сравнению с ХОБЛ-индуцированной группой, у которой уровень резко понизился по сравнению с контрольной группой, получавшей даксас (Фиг. 18).
(3) влияние на активность ММП-9 в легочной ткани
В ХОБЛ-индуцированной группе была значительно повышена активность ММП-9, важного медиатора, участвующего в воспалении и разрушении внеклеточного матрикса. В то же время, группы, получавшие ATC2 и верпрозид, показали значительно пониженную активность ММП-9, уровень которого был схож с уровнем в контрольной группе, получавшей даксас (Фиг. 19).
(4) влияние на экспрессию провоспалительных белков в легочной ткани
В ХОБЛ-индуцированной группе активность провоспалительных белков, таких как ММП-9 и NF-каппаВ, была значительно повышена. Тем не менее, такая повышенная экспрессия провоспалительных белков у ХОБЛ-индуцированной группы значительно понизилась у групп, получавших ATC2 и верпрозид, аналогично контрольной группе, получавшей даксас (Фиг. 20).
(5) влияние на воспаление в легочной ткани
В ХОБЛ-индуцированной группе была показана инфильтрация множества воспалительных клеток в бронхи, периваскулярную ткань и интерстициальную ткань и т.д. Тем не менее, такое повышенное воспаление у ХОБЛ-индуцированной группы значительно снизилось у групп, получавших ATC2 и верпрозид, а также в контрольной группе, получавшей даксас, при этом ингибирующий эффект на воспаление в группах, получавших ATC2 и верпрозид, был более сильным, чем в контрольной группе, получавшей даксас (Фиг. 21).
В результате, было подтверждено, что ATC2 и соединения, выделенные из него, верпрозид и т.п., имеют сильное лечебное действие на ХОБЛ посредством ингибирования высвобождения ИЛ-1β, ИЛ-6 или ФНО-альфа, активации NF-каппаВ и экспрессии ММП-9, основной причины ХОБЛ. Было подтверждено, что такое лечебное действие экстракта или соединений настоящего изобретения аналогично или более сильное, чем у обычно используемого для лечения ХОБЛ вещества (даксас).
Экспериментальный пример 6. Исследование острой токсичности перорального введения у крыс.
Исследование острой токсичности проводили путем введения экстракта и соединений по изобретению крысам СПФ линии Спрег-Доули в возрасте 6 недель.
250 мг/кг, 500 мг/кг, 1000 мг/кг, 5000 мг/кг экстракта и соединений настоящего изобретения перорально вводили каждой группе, состоящей из 2 крыс, и симптомы у крыс наблюдались в течение 14 дней. После введения экстракта или соединений наблюдали все клинические изменения, т.е. смертность, клинические признаки, изменения массы тела, и были проведены исследования крови, такие как гематологическое исследование и гематологическая биохимия. После вскрытия наблюдали аномальные изменения органов брюшной полости и грудной клетки.
Не было показано каких-либо изменений в смертности, клинических признаках, изменений массы тела и обобщенных данных в любой группе или любого пола. Кроме того, была показана токсичность в исследуемой группе, получавшей 5000 мг/кг экстракта или соединений настоящего изобретения.
Соответственно, было подтверждено, что экстракт и соединения настоящего изобретения являются эффективным и безопасным веществом, показывающим LD50 (более 5000 мг/кг) при пероральном введении.
Осуществление изобретения
В дальнейшем описаны способы приготовления лекарственного средства и виды вспомогательных веществ, но настоящее изобретение не ограничивается перечисленным. Далее описаны типичные примеры препаратов.
Препарат в виде инъекции
Препарат в виде инъекции получали растворением активного компонента, установлением pH приблизительно 7,5 и затем ведением всех компонентов в 2 мл ампулу и стерилизацией способом, общепринятым для препаратов в виде инъекции.
Препарат в виде порошка
Препарат в виде порошка получали смешиванием вышеуказанных компонентов и наполнением герметичной упаковки.
Препарат в виде таблетки
Препарат в виде таблетки смешиванием вышеуказанных компонентов и формированием таблетки.
Препарат в виде капсулы
Препарат в виде таблетки, получали смешиванием вышеуказанных компонентов и наполнением желатиновой капсулы способом, общепринятым для желатинового препарата.
Препарат в виде жидкости
Препарат в виде жидкости получали растворением активного компонента и затем введением всех компонентов в 1000 мл ампулу и стерилизацией способом, общепринятым для препаратов в виде жидкости.
Препарат в виде полезного для здоровья пищевого продукта
Вышеуказанные смеси витаминов и минералов можно изменять различными способами. Такие варианты не следует рассматривать как отступление от сущности и объема настоящего изобретения.
Препарат в виде полезного для здоровья напитка
Препарат в виде полезного для здоровья напитка получали растворением активного компонента, смешиванием, перемешиванием при 85°C в течение 1 часа, фильтрованием и затем введением всех компонентов в 1000 мл ампулу и стерилизацией способом, общепринятым для препарата в виде полезного для здоровья напитка.
Из описанного таким образом изобретения будет понятно, что представленное описание можно изменять несколькими путями. Такие варианты не следует рассматривать как отступление от сущности и объема настоящего изобретения, и все такие модификации, как будет понятно для специалиста в данной области, предназначены для включения в объем следующей далее формулы изобретения.
Промышленная применимость
Как описано в настоящем изобретении, очищенный экстракт настоящего изобретения, содержащий высокие количества активных компонентов, таких как производные каталпола из экстракта Pseudolysimachion rotundum var subintegrum, или по меньшей мере одного соединения, выбранного из группы, состоящей из вератровой кислоты, верпрозида, каталпозида, пикрозида II, изованиллоил каталпола и 6-O-вератроил каталпола, показал высокую активность против ХОБЛ без агонистического эффекта на бета-2-рецепторы в различных исследованиях in vivo с использованием линии BALB/c мышей-самцов, например, исследовании ингибирования пролиферации и активности воспалительных иммуноцитов и рекрутинга нейтрофилов в легкие, вызванных заболеванием ХОБЛ; исследовании ингибирования воспроизводства хемокинов, вовлеченных в разрушение пневмоцитов, таких как МИП-2/CXCL-2, ФНО-альфа, KC/CXCL-1 (хемокины Gro-альфа), CXCL-8 и т.д.; эффект снижения высвобождения ИЛ-1 бета, ИЛ-6, ФНО-альфа и ММП-9 экспрессии путем уменьшения активации NF-каппаВ в исследованиях на животных с применением СПФ (свободный от патогенной микрофлоры) крыс линии Спрег-Доули, а также исследовании in vitro, например, исследовании ингибирования экспрессии гена MUC5AC (олигомерного слизь/гель-образующего), индуцирующий эффект на ИЛ-4 экспрессию Th2 клетками в исследовании анализа изменений молекулярной экспрессии и т.д. Таким образом, его можно использовать в качестве терапевтического средства или функционального полезного для здоровья пищевого продукта для лечения и профилактики хронической обструктивной болезни легких (ХОБЛ).
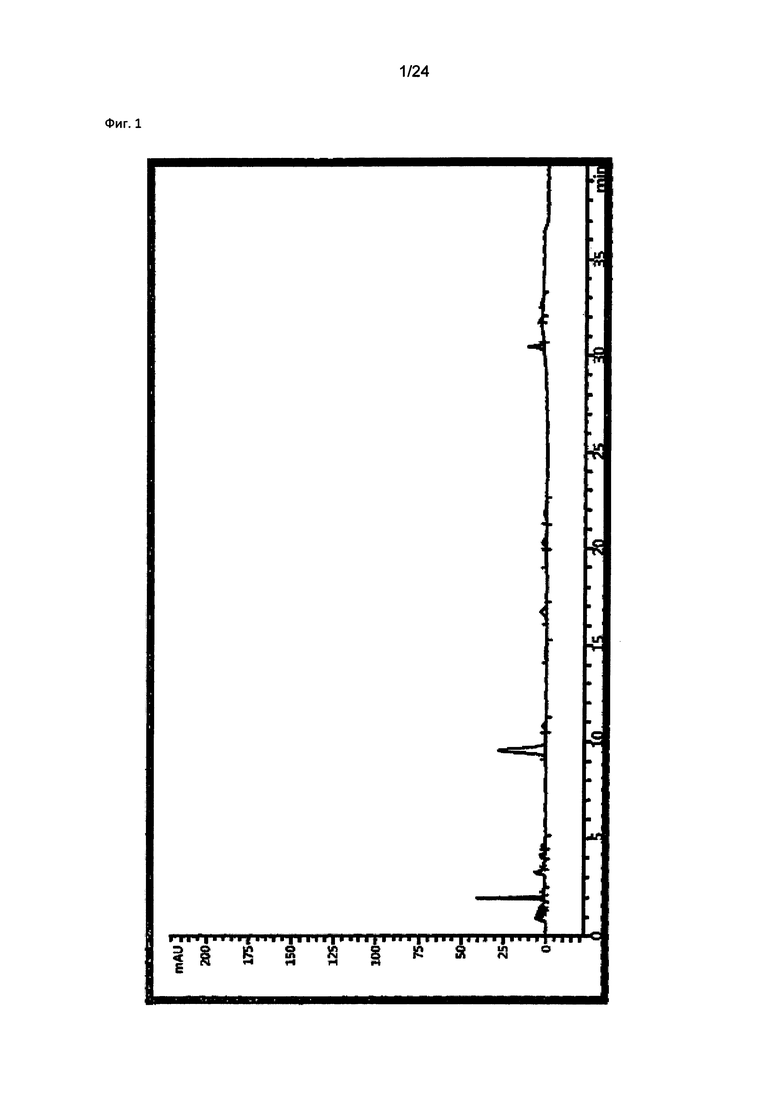
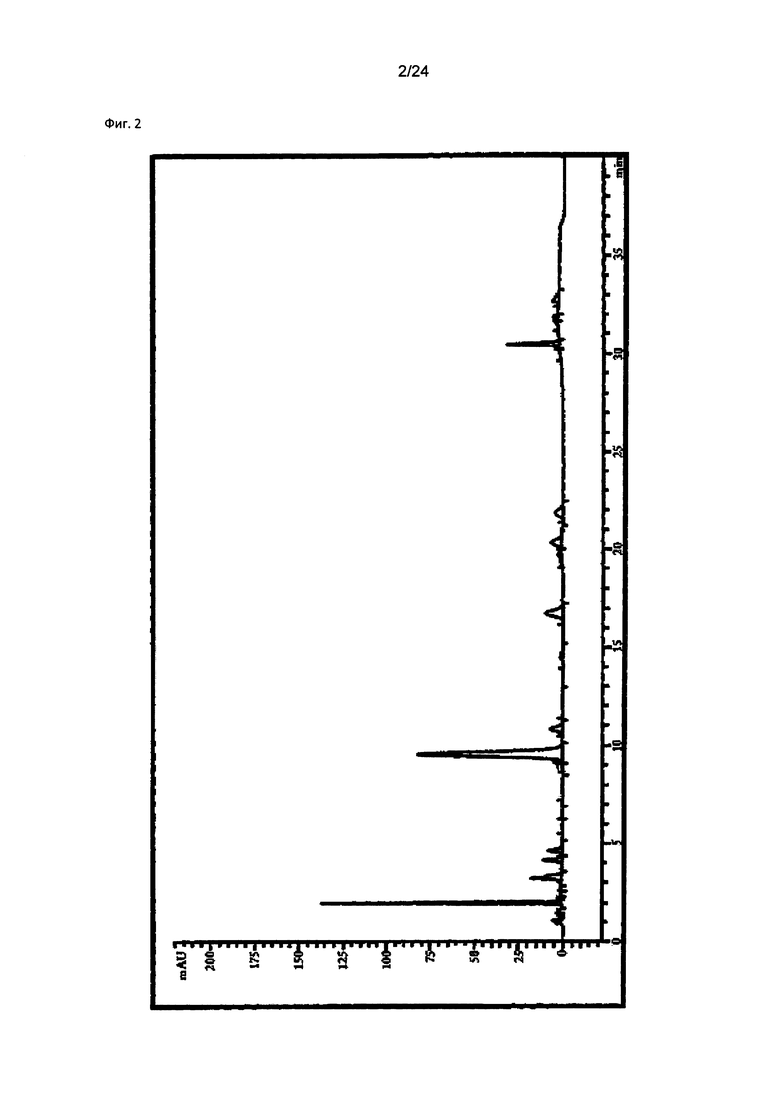
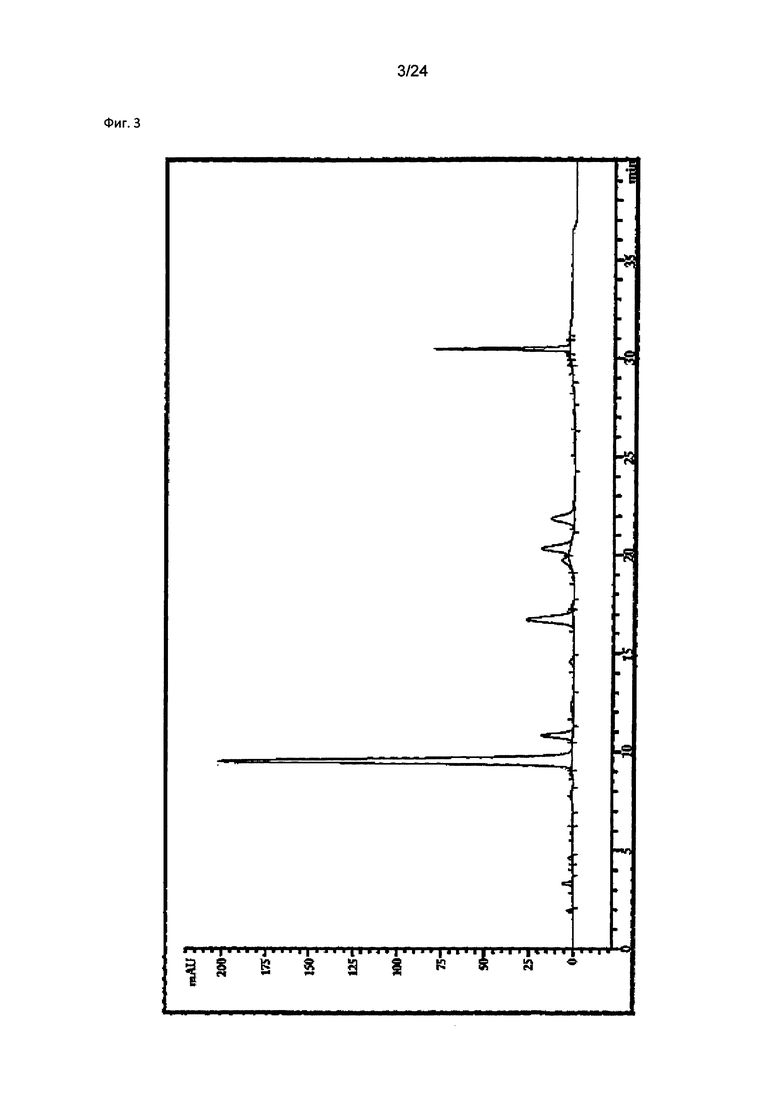
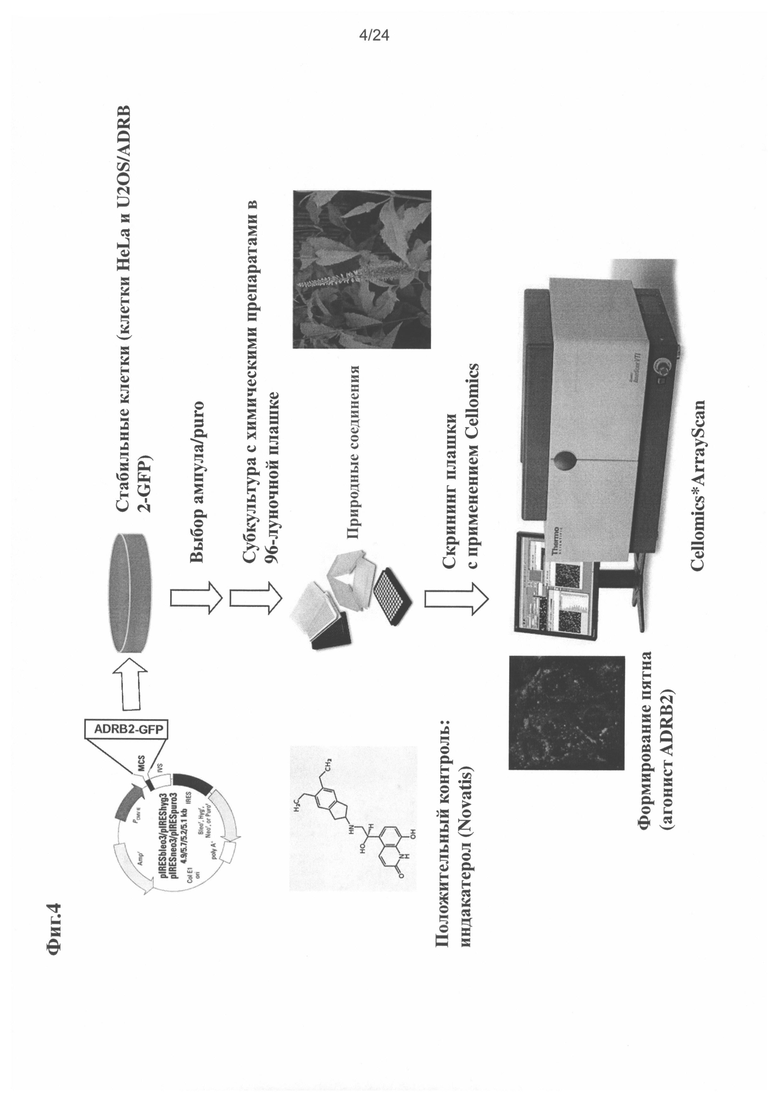
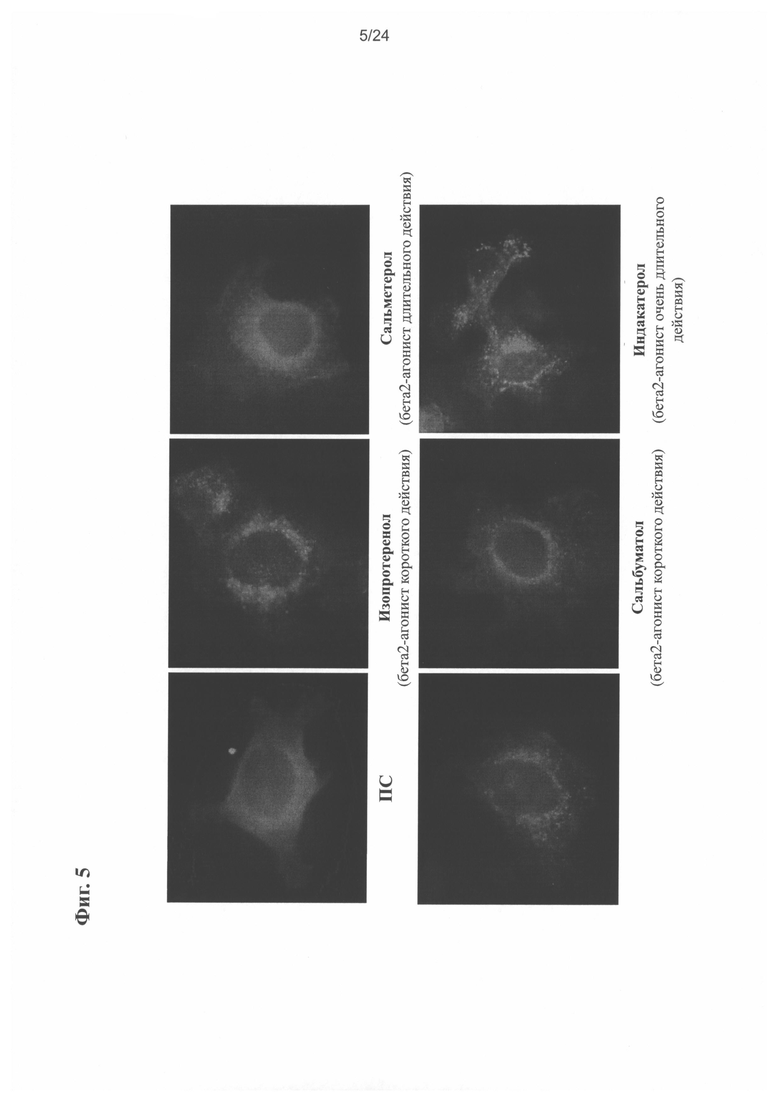
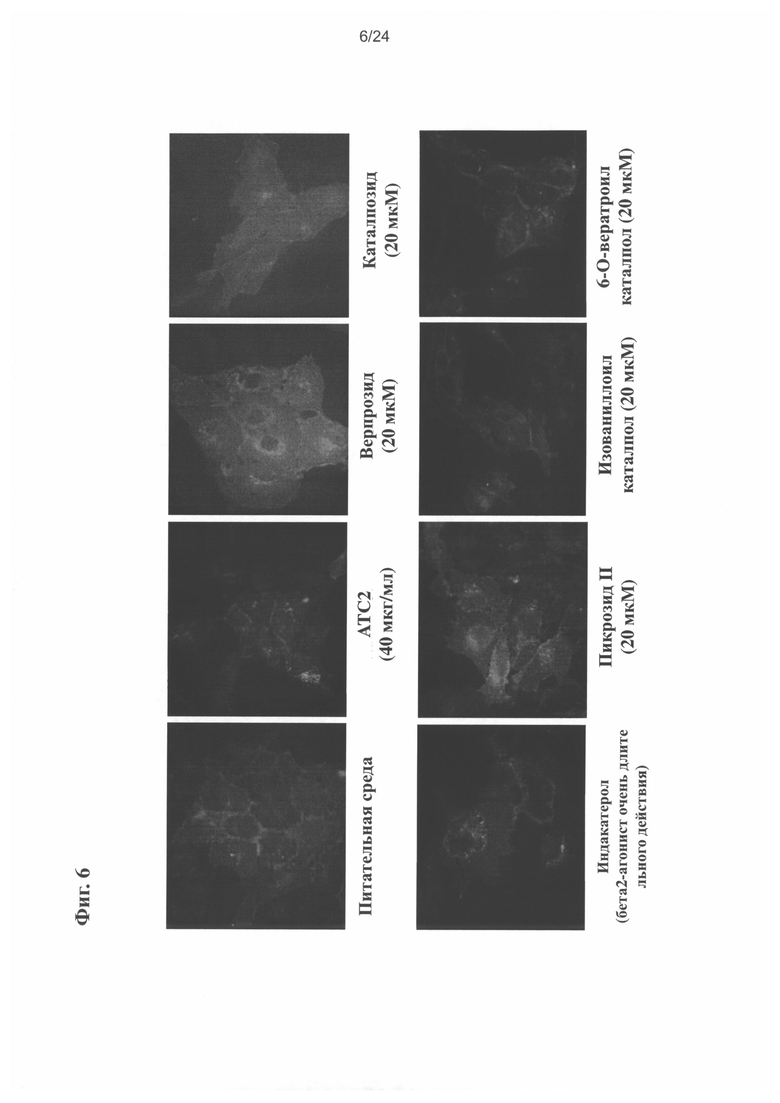
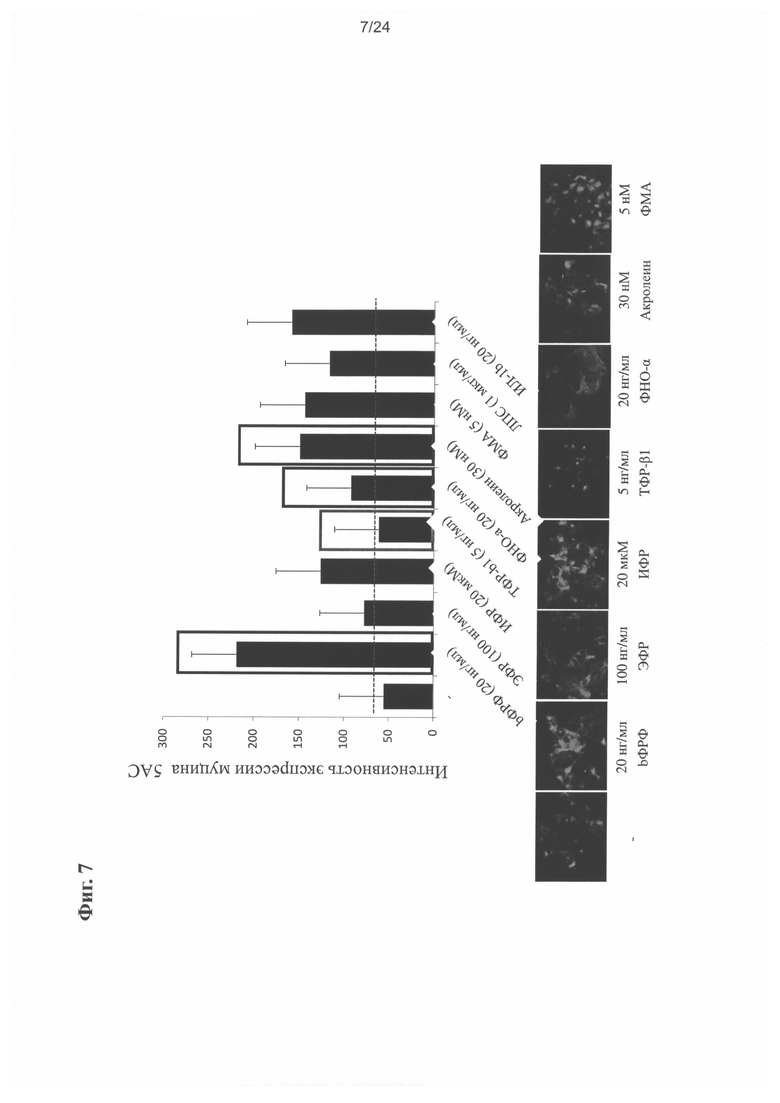
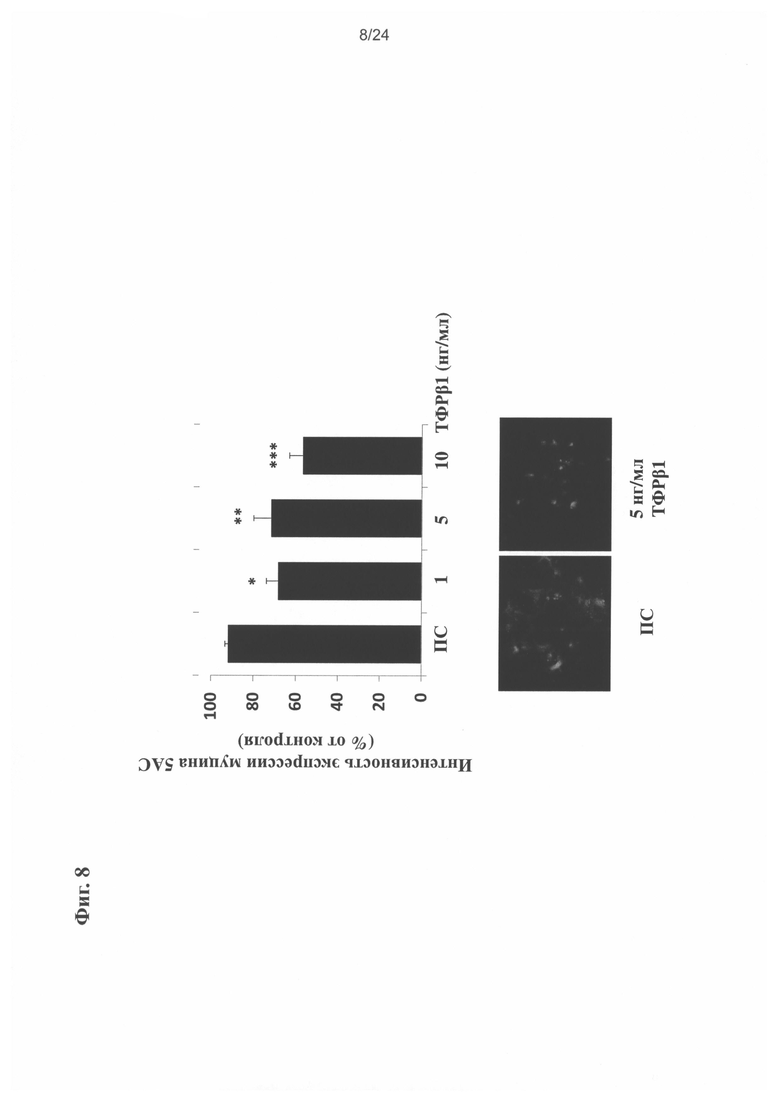
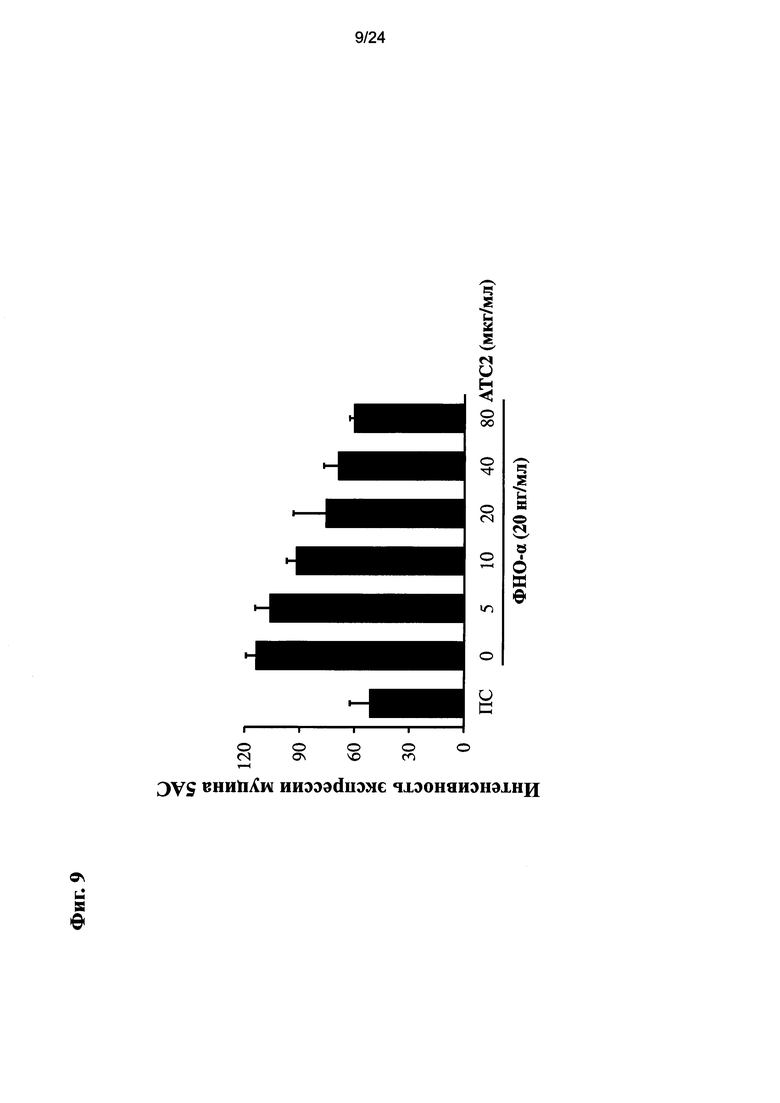
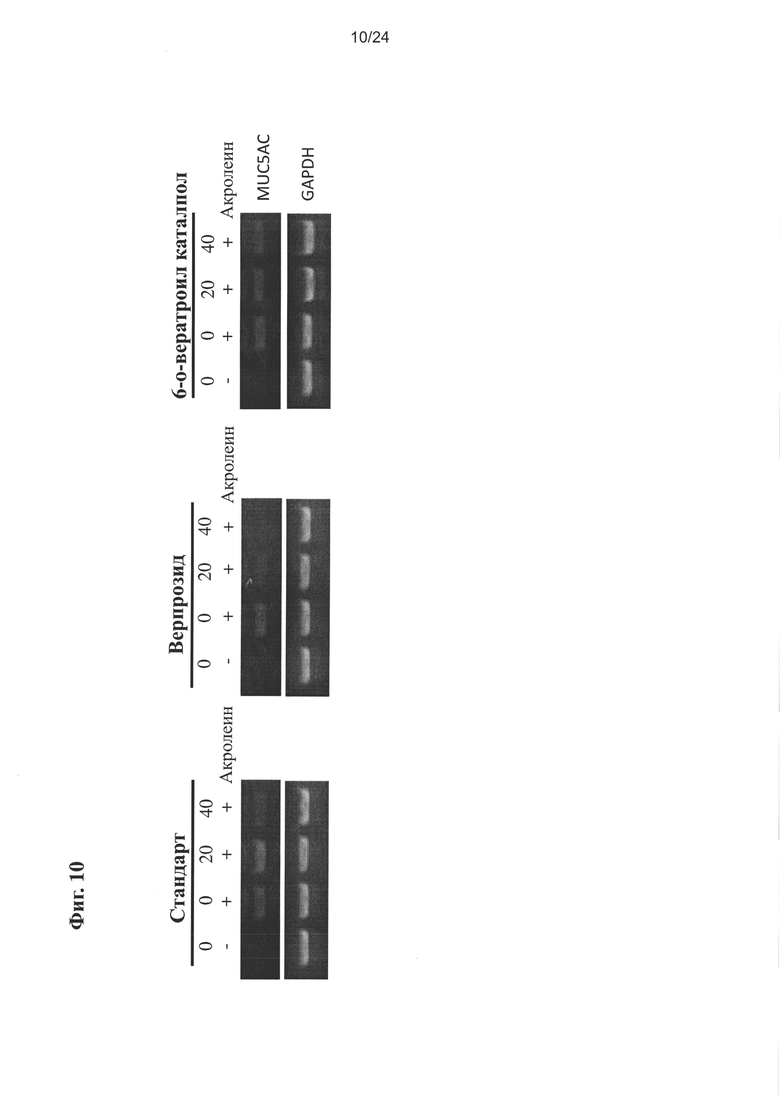
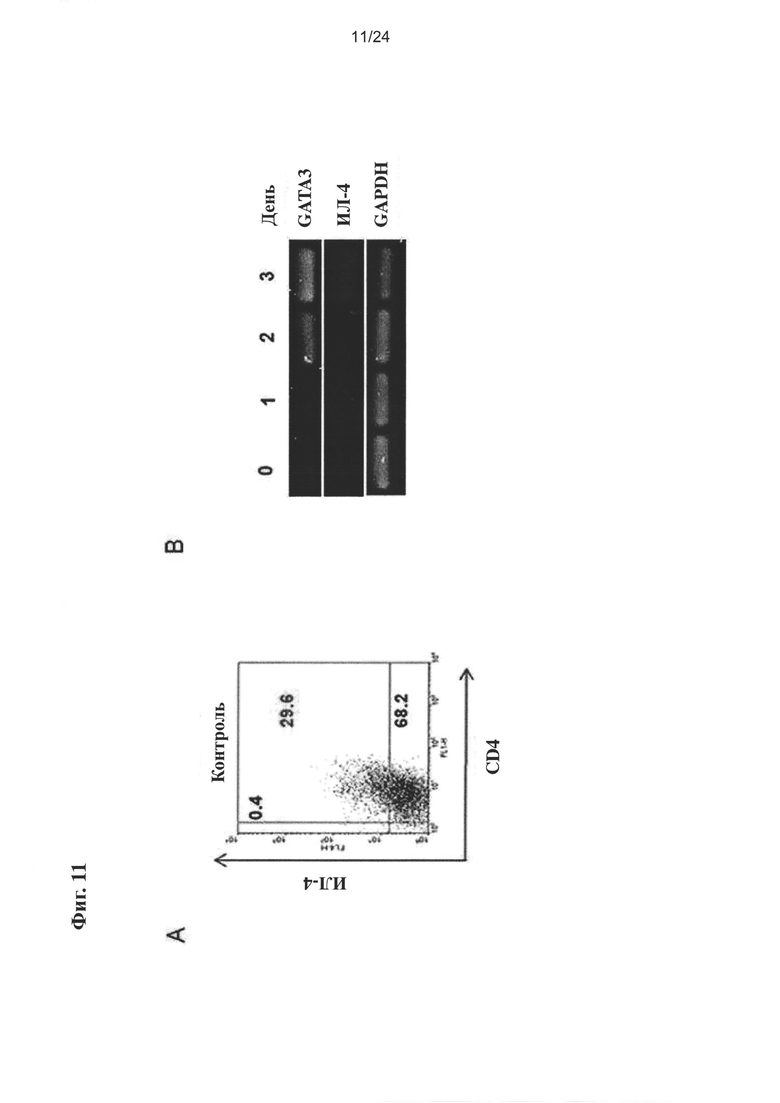
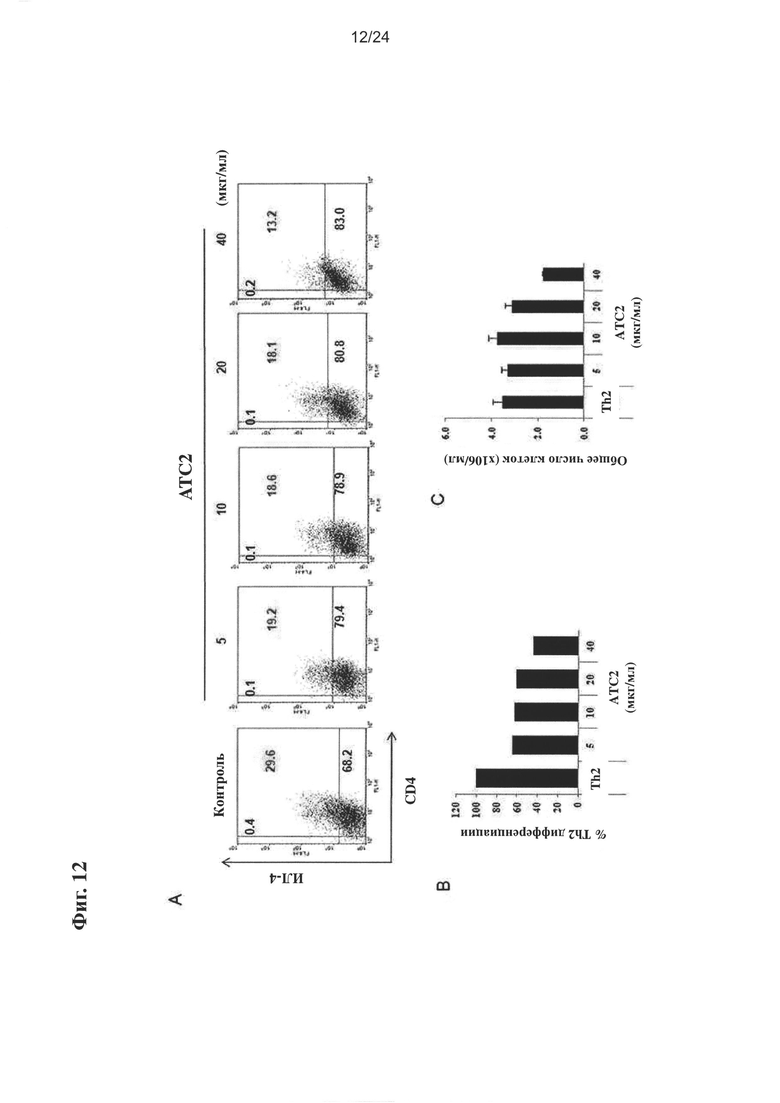
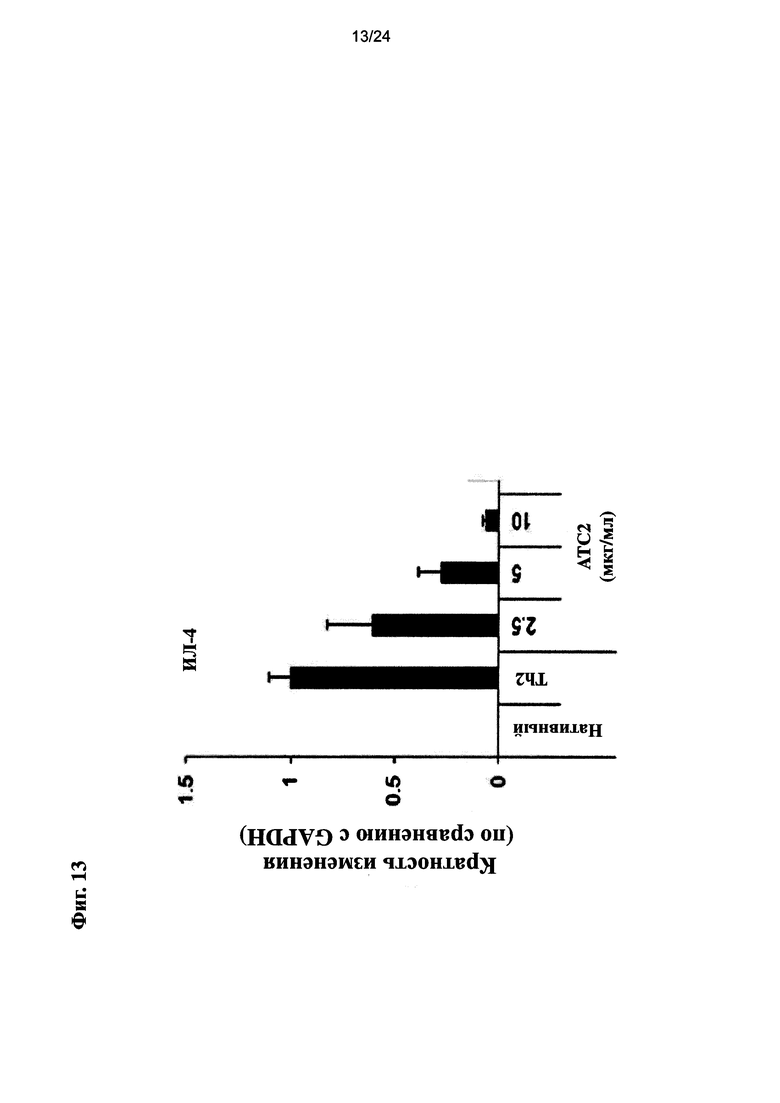
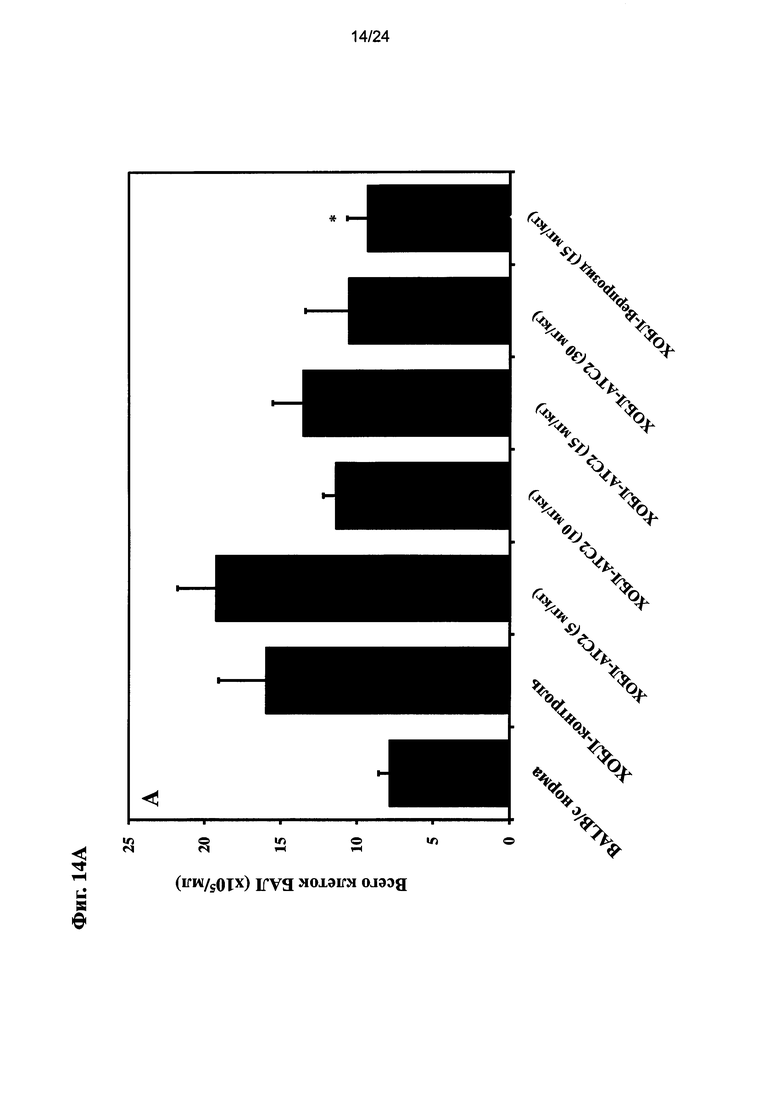
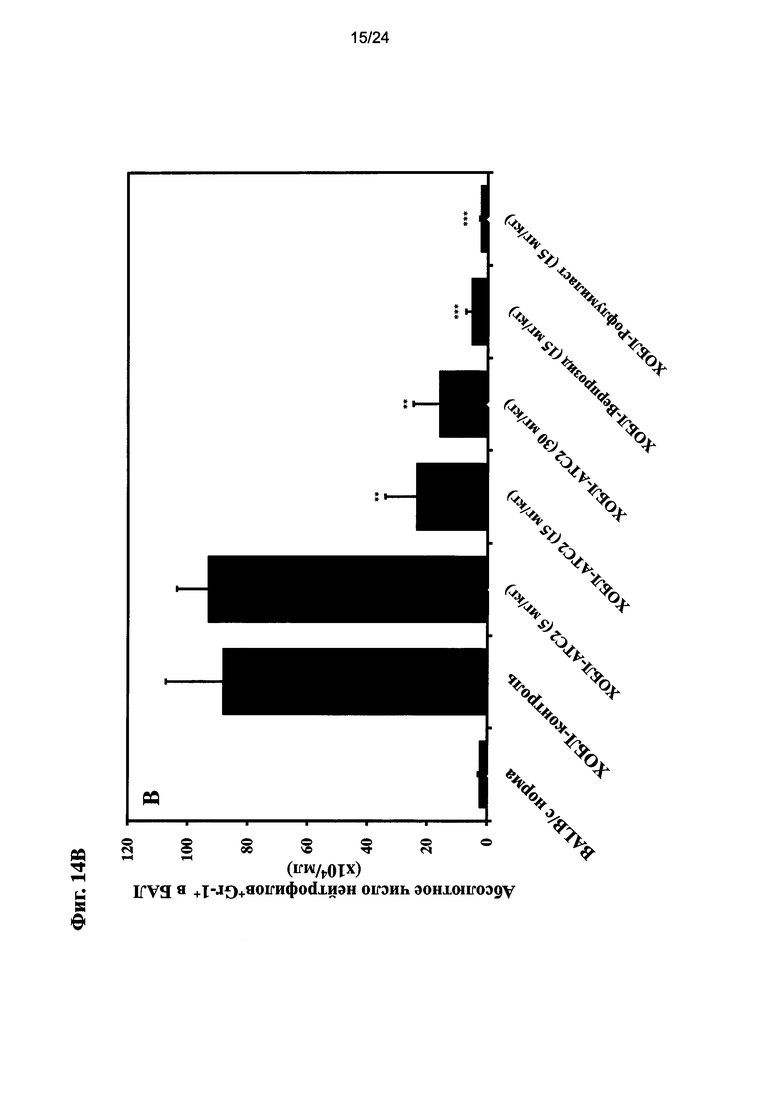
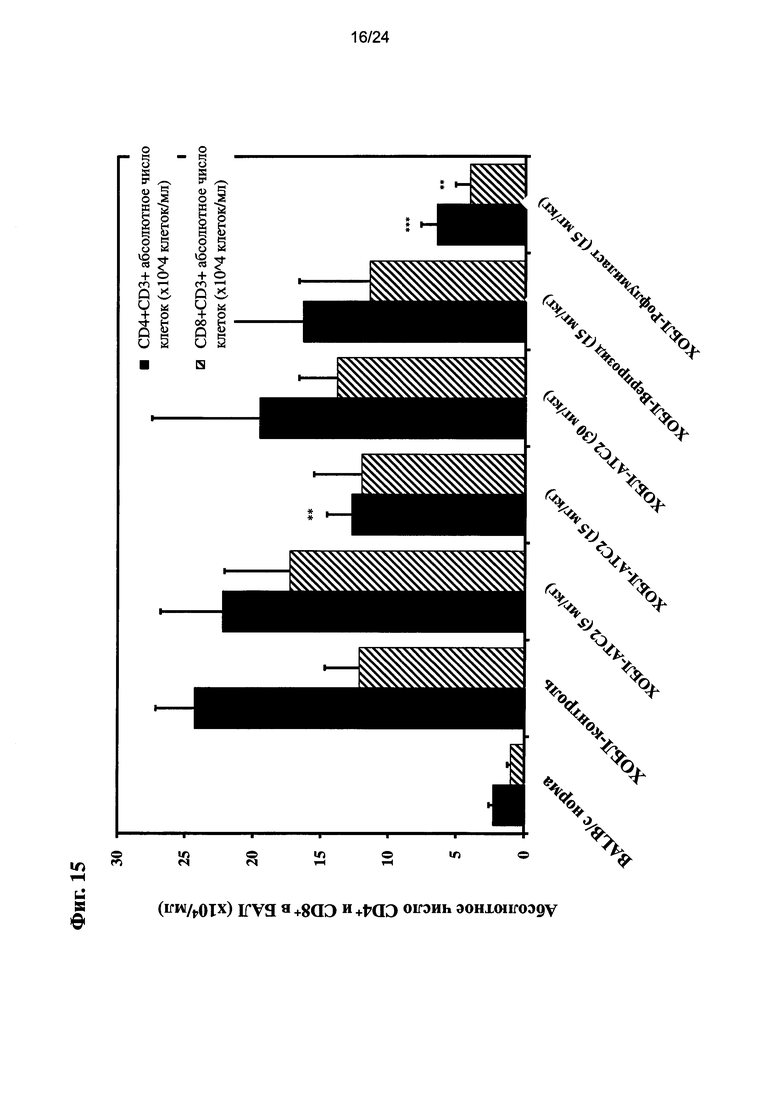
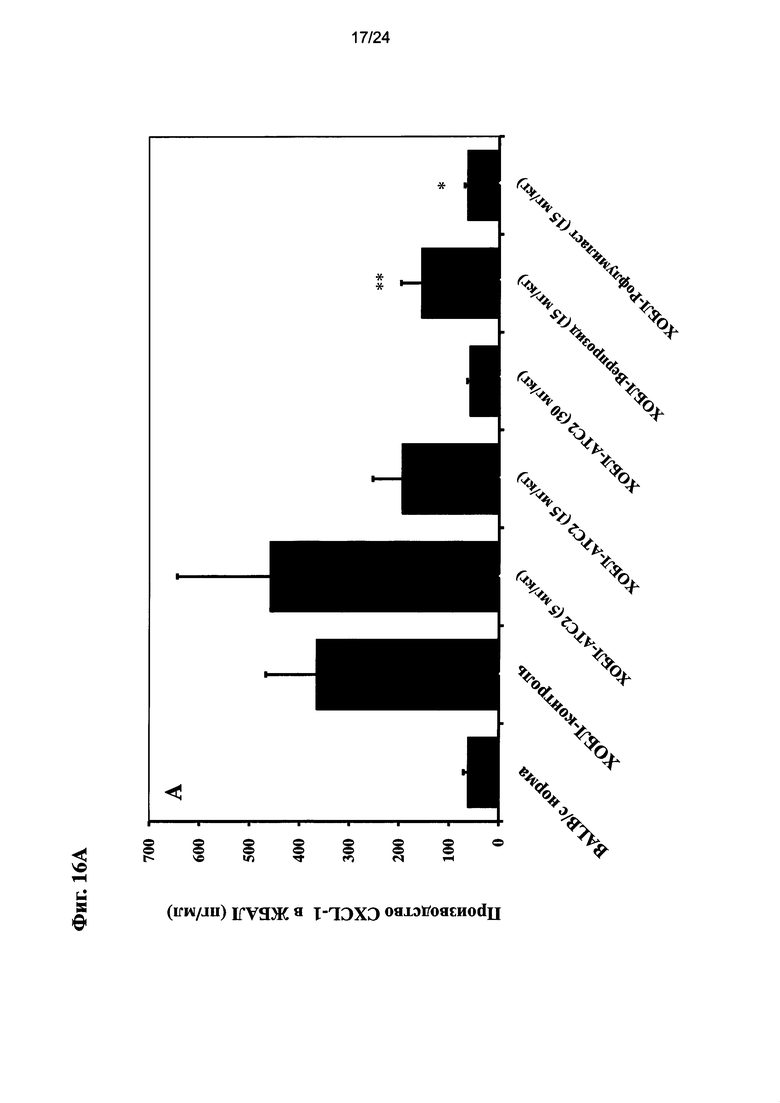
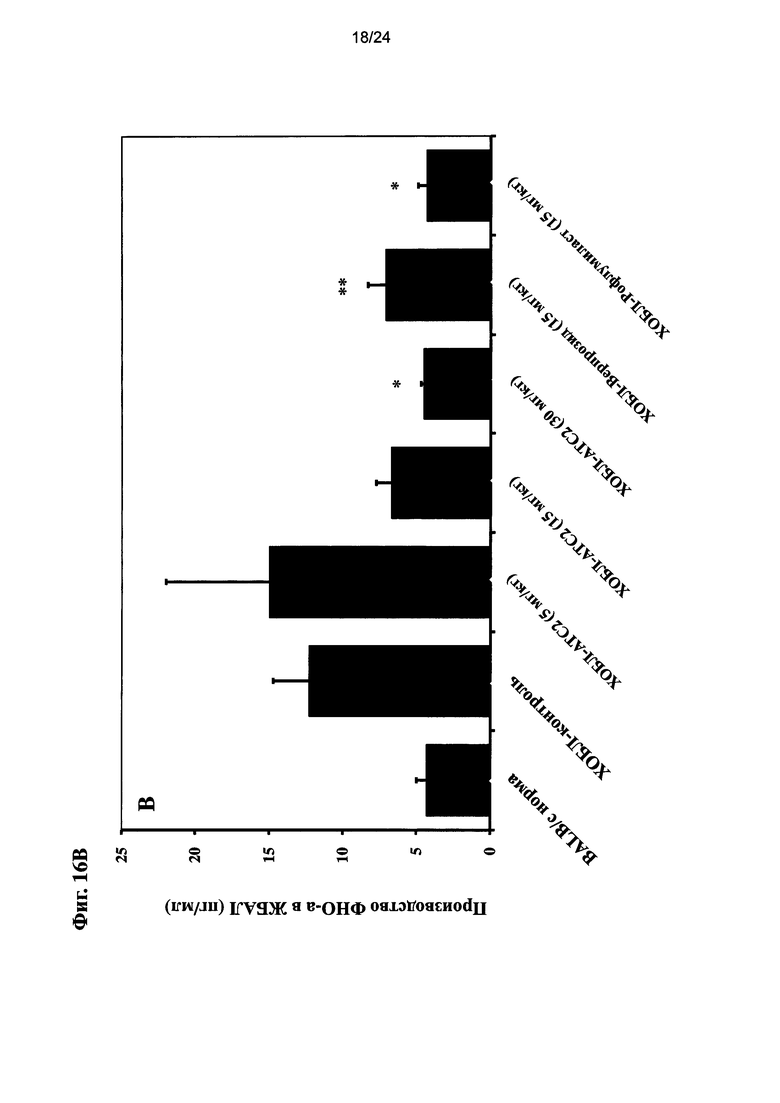
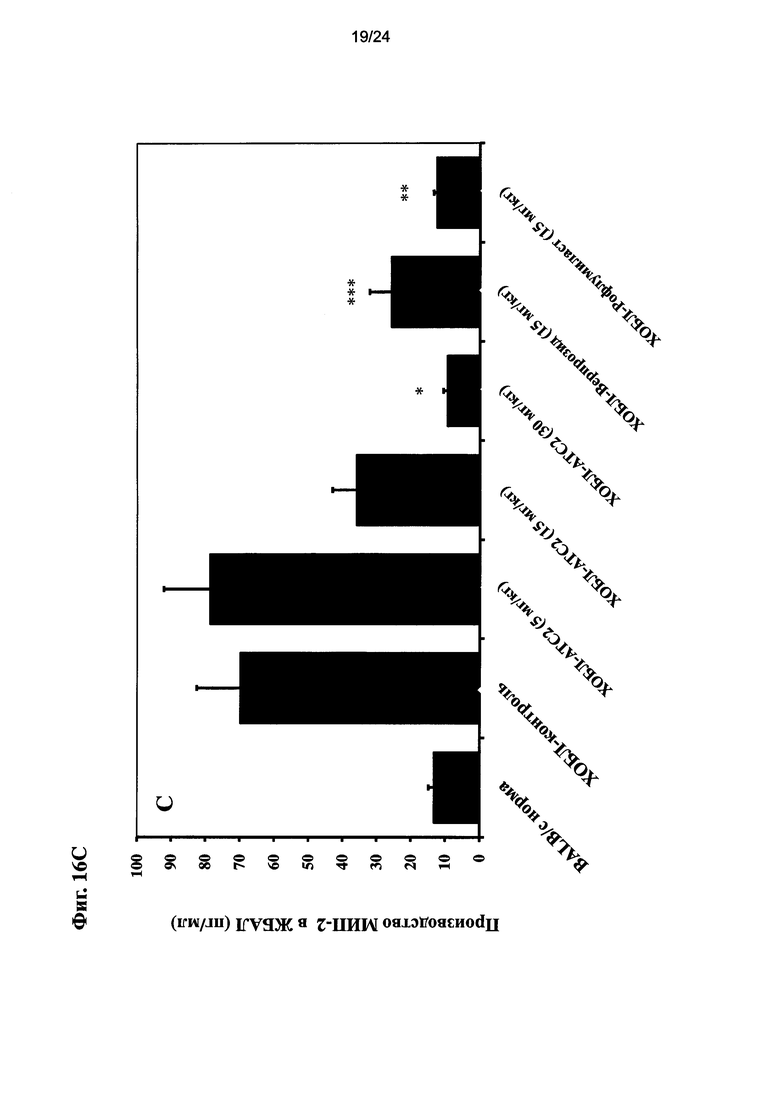
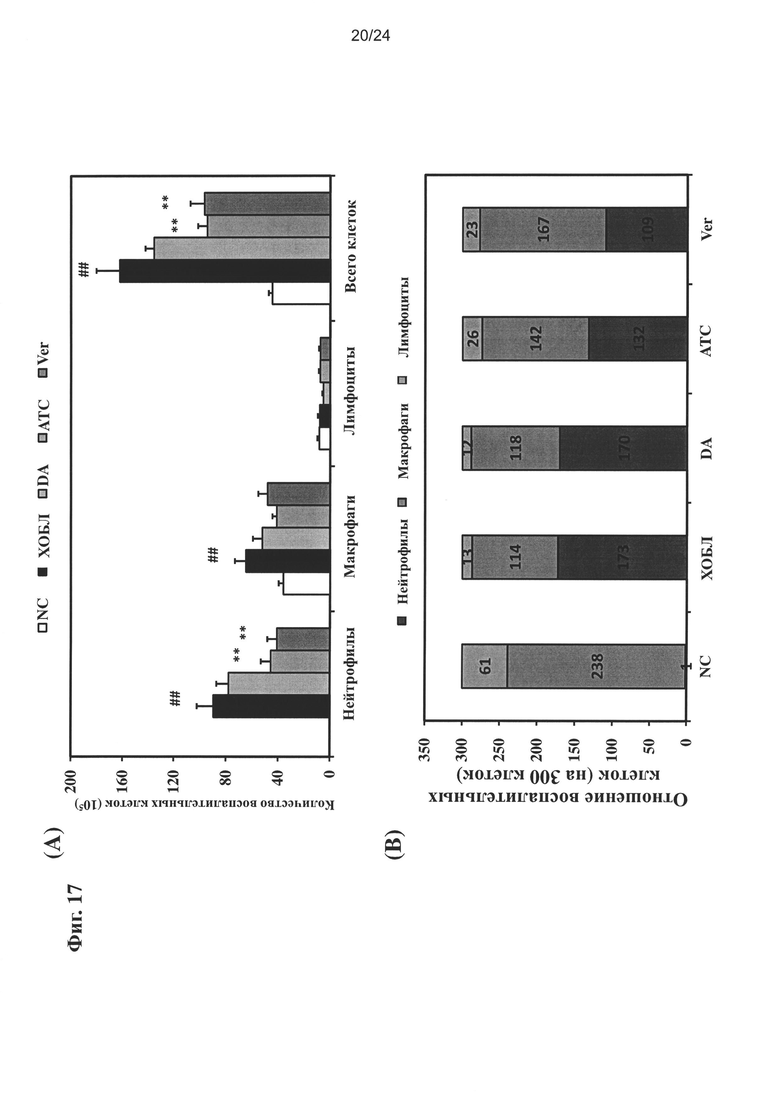
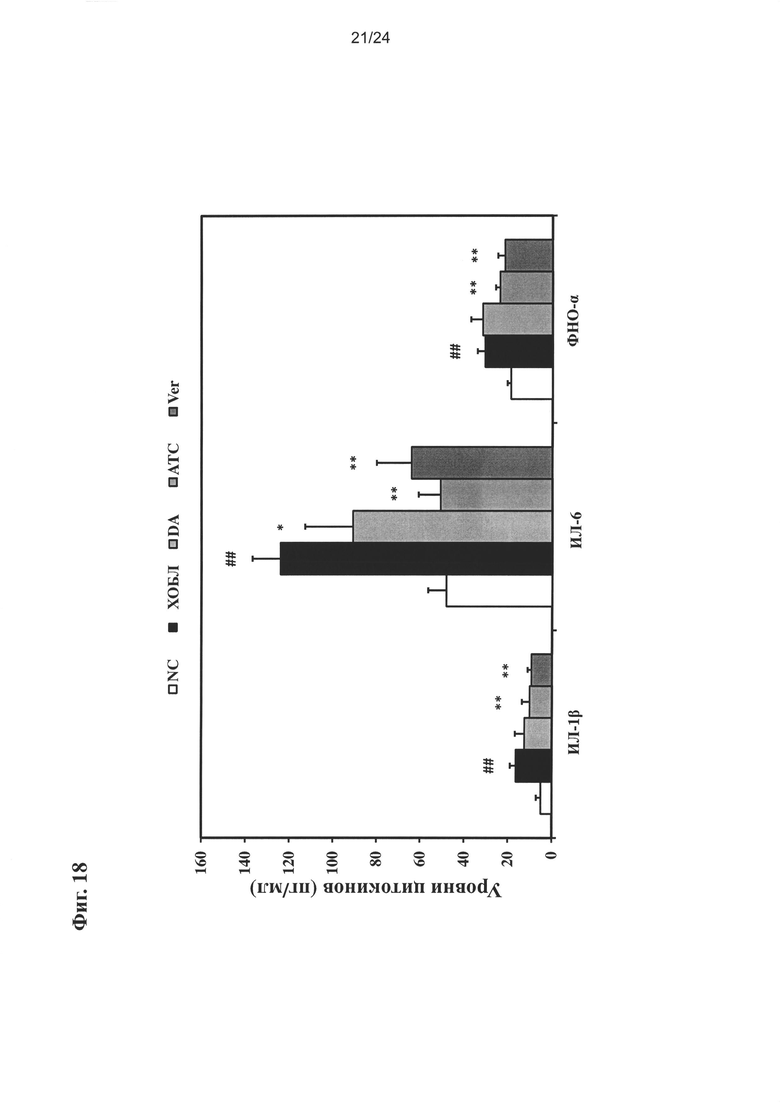
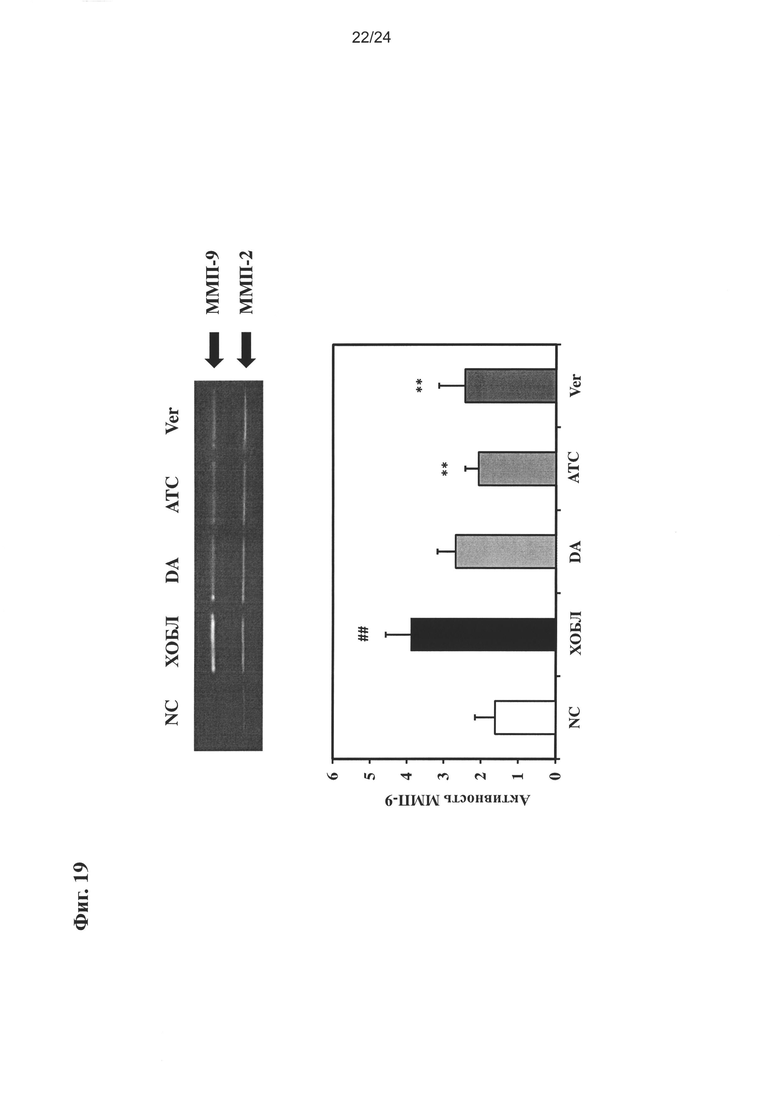
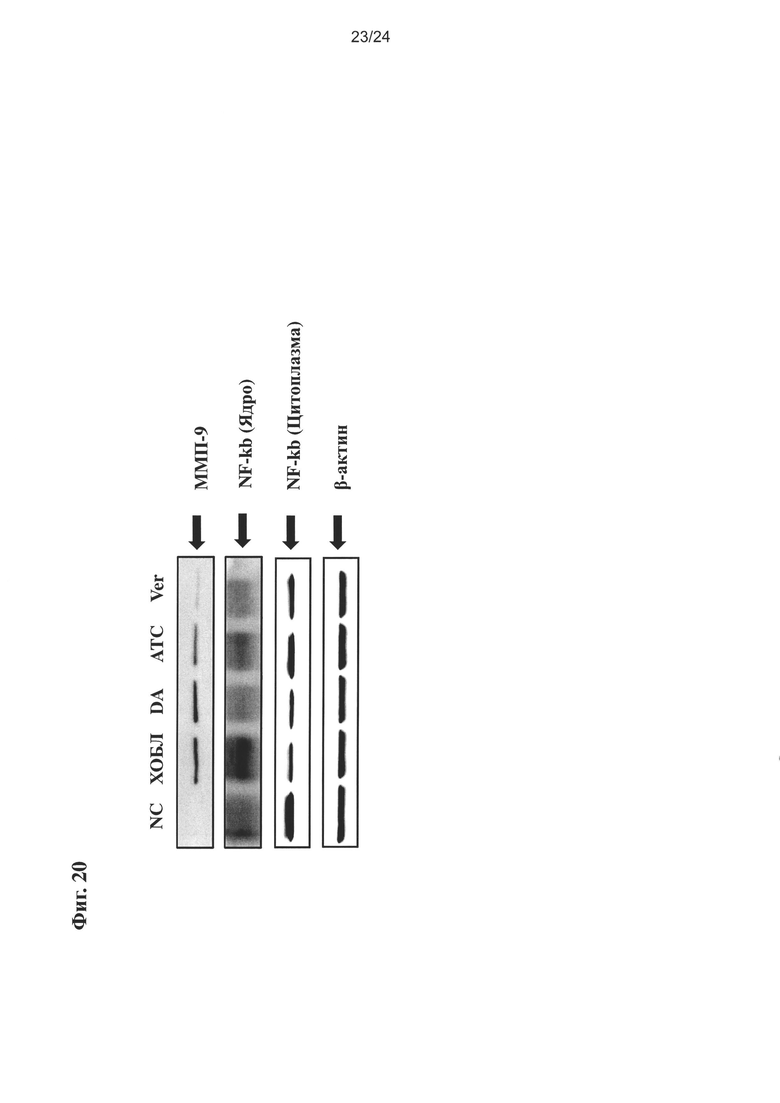
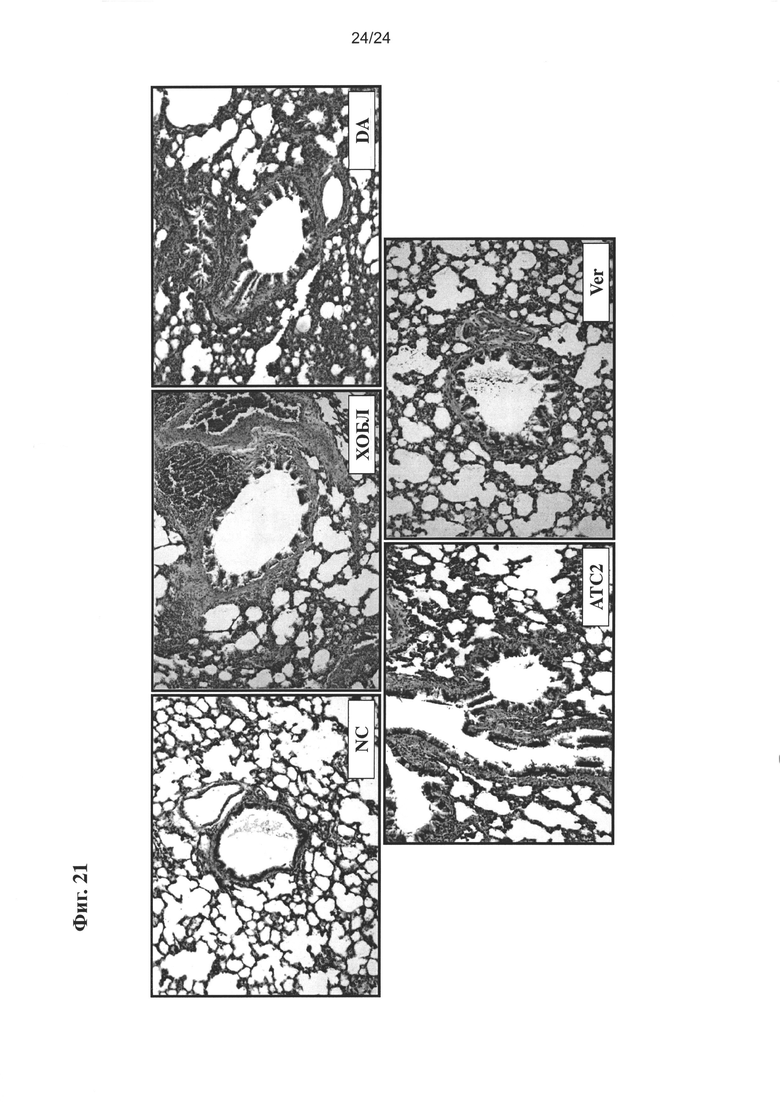
Настоящее изобретение относится к фармацевтической промышленности, а именно к композиции для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ). Фармацевтическая композиция, содержащая экстракт Pseudolysimachion rotundum var. subintegrum, очищенный с помощью вторичного фракционирования (АТС2), содержащий верпрозид, вератровую кислоту, каталпозид, пикрозид II, изованиллоил каталпол и 6-О-вератроил каталпол или верпрозид, в определенном количестве, для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ) (варианты). Фармацевтическая композиция содержит комбинацию верпрозида, вератровой кислоты, каталпозида, пикрозида II, изованиллоил каталпол, 6-О-вератроил каталпола, и фармацевтически приемлемые носители или вспомогательные вещества, для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ). Полезный для здоровья функциональный пищевой продукт содержит экстракт Pseudolysimachion rotundum var. subintegrum, очищенный с помощью вторичного фракционирования (АТС2), содержащий верпрозид, вератровую кислоту, каталпозид, пикрозид II, изованиллоил каталпол, 6-О-вератроил каталпол или верпрозид, в качестве активного ингредиента, взятые в определенном количестве, для облегчения или профилактики хронической обструктивной болезни легких (ХОБЛ). Полезный для здоровья функциональный пищевой продукт содержит комбинацию вышеуказанных соединений, в определенном соотношении, для облегчения или профилактики хронической обструктивной болезни легких (ХОБЛ). Вышеописанные средства эффективны для лечения или профилактики хронической обструктивной болезни легких 5 н. и 1 з п. ф-лы, 24 ил., 5 табл., 6 пр.
1. Фармацевтическая композиция, содержащая экстракт, очищенный с помощью вторичного фракционирования (АТС2), содержащий 30-60% (масс./масс.) верпрозида, 0,5-10% (масс./масс.) вератровой кислоты, 2-20% (масс./масс.) каталпозида, 1-10% (масс./масс.) пикрозида II, 1-10% (масс./масс.) изованиллоил каталпола и 2-20% (масс./масс.) 6-О-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var. subintegrum, или верпрозид, для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
2. Фармацевтическая композиция по п. 1, в которой указанный экстракт, очищенный с помощью вторичного фракционирования (АТС2), получен по способу, включающему: добавление на первой стадии по меньшей мере одного экстрагирующего растворителя, выбранного из воды, метанола, этанола, бутанола или их смесей, с получением сухого Pseudolysimachion rotundum var. subintegrum; осуществление на второй стадии по меньшей мере одного способа экстракции, выбранного из экстракции горячей водой в колбе с обратным холодильником, экстракции холодной водой, многократной ультразвуковой или обычной экстракции с получением первичного экстракта; суспендирование на третьей стадии первичного экстракта в примерно 0,5-10-кратном объеме (об./об.) воды с получением суспендированного экстракта; добавление на третьей стадии примерно 0,5-20-кратного объема (об./об.) бутанола, разделение на водный слой и слой бутанола и отбор слоя бутанола с получением фракционированного с помощью бутанола очищенного экстракта (АТС1); и осуществление по меньшей мере одного способа очистки очищенного экстракта, фракционированного с помощью бутанола (АТС1), при этом способ очистки выбран из группы, состоящей из обращенно-фазовой распределительной хроматографии, нормально-фазовой распределительной хроматографии, ионообменной хроматографии и гель-хроматографии или их комбинации, с получением экстракта, очищенного с помощью вторичного фракционирования (АТС2), содержащего 30-60% (масс./масс.) верпрозида, 0,5-10% (масс./масс.) вератровой кислоты, 2-20% (масс./масс.) каталпозида, 1-10% (масс./масс.) пикрозида II, 1-10% (масс./масс.) изованиллоил каталпола и 2-20% (масс./масс.) 6-О-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var. subintegrum.
3. Фармацевтическая композиция, содержащая экстракт, очищенный с помощью вторичного фракционирования (АТС2), содержащий 30-60% (масс./масс.) верпрозида, 0,5-10% (масс./масс.) вератровой кислоты, 2-20% (масс./масс.) каталпозида, 1-10% (масс./масс.) пикрозида II, 1-10% (масс/масс.) изованиллоил каталпола и 2-20% (масс./масс.) 6-О-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var. subintegrum, или верпрозид и фармацевтически приемлемые носители или вспомогательные вещества, для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
4. Фармацевтическая композиция, содержащая комбинацию соединений в следующем массовом соотношении: 40-93% верпрозида, 1,0-10% вератровой кислоты, 2,0-25% каталпозида, 1,0-15% пикрозида II, 1,0-15% изованиллоил каталпола и 2,0-25% 6-О-вератроил каталпола, и фармацевтически приемлемые носители или вспомогательные вещества, для лечения или профилактики хронической обструктивной болезни легких (ХОБЛ).
5. Полезный для здоровья функциональный пищевой продукт, содержащий экстракт, очищенный с помощью вторичного фракционирования (АТС2), содержащий 30-60% (масс./масс.) верпрозида, 0,5-10% (масс./масс.) вератровой кислоты, 2-20% (масс./масс.) каталпозида, 1-10% (масс./масс.) пикрозида II, 1-10% (масс./масс.) изованиллоил каталпола и 2-20% (масс./масс.) 6-О-вератроил каталпола в расчете на массу общего экстракта (100%) Pseudolysimachion rotundum var. subintegrum, или верпрозид в качестве активного ингредиента, для облегчения или профилактики хронической обструктивной болезни легких (ХОБЛ).
6. Полезный для здоровья функциональный пищевой продукт, содержащий комбинацию соединений в следующем массовом соотношении: 40-93% верпрозида, 1,0-10% вератровой кислоты, 2,0-25% каталпозида, 1,0-15% пикрозида II, 1,0-15% изованиллоил каталпола и 2,0-25% 6-О-вератроил каталпола, для облегчения или профилактики хронической обструктивной болезни легких (ХОБЛ).
| RAM A et all | |||
| Medicinal plants useful for treating chronic obstructive pulmonary disease (COPD): current status and future perspectives //Fitoterapia | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| EUN JEONG PARK et all | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| WO 2006129964 A1, | |||
Авторы
Даты
2016-08-10—Публикация
2014-04-09—Подача