В изобретении описано устройство для перемешивания питания, которое позволяет одновременно перемешивать два или более питательных растворов для среды культивирования, имеющих нефизиологические значение pH, в результате чего значение pH объединенных питательных растворов доводят внутри этого устройства для перемешивания питания, например, до физиологического значения pH перед его добавлением в среду для культивирования.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Чтобы увеличить выход продукта или время культивирования при культивировании клеток млекопитающих, в среду для культивирования добавляют питательные растворы для поддержания концентрации существенных компонентов среды на критическом уровне или выше критического уровня.
Подача питательных растворов, обладающих физиологическими свойствами, отличающимися от среды культивирования, влияет на физические параметры среды культивирования, таких как осмоляльность или значение pH. В связи со слабой растворимостью или необходимой стабилизацией различных компонентов значение pH питательных растворов иногда нужно изменить до нефизиологических значений.
Авторами Luan, Y.T., et al. описаны стратегии для продления продолжительности жизни гибридом в культуре и стимуляции выхода моноклональных антител (Biotechnol. Lett. 9 (1987) 691-696). Улучшенные способы ферментации клеточных линий NS0, экспрессирующих антитела человека и глутаминсинтетазу, описаны авторами Dempsey, J., et al. (Biotechnol. Prog. 19 (2003) 175-178). Авторами Bibila, T.A., et al. описан способ разработки моноклональных антител, при котором применяют концентраты среды (Biotechnol. Prog. 10 (1994) 87-96).
В документе WO 2008/013809 описаны способы культивирования клеток. Сухие порошкообразные клетки, реагенты для клеточных культур и способы их получения описаны в документе US 2006/0003448. В документе US 5081036 описан способ и аппарат для клеточной культуры. Технология концентратов сред описана в документе US 5681748. В документе US 6924124 описаны стратегии питания для клеточной культуры.
В документе WO 2009/132616 описана система питания. Способ и аппарат для получения спирта или сахара, при котором применяют биореактор коммерческого масштаба, описан в документе WO 2010/045168. В документе US 2003/0092652 описан защищенный препарат в одном флаконе для молекул нуклеиновых кислот, способ его получения путем поточного перемешивания, а также родственные продукты и способы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данном изобретении описано устройство для перемешивания питания, с помощью которого питательные компоненты можно подавать, например, в виде растворов, имеющих значение pH, при котором эти компоненты обладают высокой растворимостью и/или высокой стабильностью, причем это значение pH может отличаться/отличается от значения pH среды культивирования, то есть от физиологически приемлемого значения pH, составляющего от pH 6,5 до pH 7,5, то есть эти растворы независимо друг от друга имеют значение pH, составляющее менее pH 6,5 или более pH 7,5. Изобретение позволяет выполнять культивирование в более гибких условиях по сравнению с культивированием, при котором, например, значение pH питательного раствора ограничено небольшим диапазоном вокруг значения pH среды культивирования.
В одном аспекте настоящего изобретения описано устройство для добавления в сосуд для культивирования клеток по меньшей мере двух растворов, каждый из которых имеет нефизиологические значение рН, где устройство включает камеру для перемешивания растворов перед их добавлением в сосуд для культивирования клеток.
В одной форме осуществления отношение объема камеры для перемешивания растворов к объему среды культивирования в сосуде для культивирования составляет от 0,8 мл/л до 1,2 мл/л. В одной форме осуществления это отношение составляет от 0,9 мл/л до 1,1 мл/л. В одной форме осуществления это отношение составляет приблизительно 1 мл/л. В одной форме осуществления это отношение составляет 0,95 мл/л. В одной форме осуществления объем среды культивирования представляет собой объем жидкости в начале культивирования в сосуде для культивирования.
В одной форме осуществления по меньшей мере два раствора, каждый из которых имеет нефизиологическое значение pH, представляют собой по меньшей мере один кислый раствор и по меньшей мере один щелочной раствор. В одной форме осуществления по меньшей мере два раствора, каждый из которых имеет нефизиологическое значение pH, независимо друг от друга имеют значение pH, составляющее менее pH 6,5 или более pH 7,5. В одной форме осуществления по меньшей мере два раствора, каждый из которых имеет нефизиологическое значение pH, независимо друг от друга имеют значение pH, составляющее от pH 0 до pH 6,49 или от pH 7,51 до pH 14.
В одной форме осуществления значения pH кислого и щелочного растворов отличаются по меньшей мере на 0,5 единиц pH от значения pH среды культивирования. В одной форме осуществления кислый раствор имеет значение pH, составляющее pH 6,5 или ниже. В одной форме осуществления кислый раствор имеет значение pH, составляющее pH 4,0 или ниже. В одной форме осуществления щелочной раствор имеет значение pH, составляющее pH 8,0 или выше. В одной форме осуществления щелочной раствор имеет значение pH, составляющее 10,0 или выше.
В одной форме осуществления устройство применяют для добавления от двух до четырех отдельных растворов, имеющих нефизиологическое значение pH, по меньшей мере один из которых представляет собой кислый раствор, и по меньшей мере один представляет собой щелочной раствор.
В одной форме осуществления каждый из растворов представляет собой питательный раствор, содержащий по меньшей мере одно соединение, выбранное из следующих соединений: аминокислоты, сахара, витамина, микроэлемента, лактата и фактора роста.
В одной форме осуществления камера для перемешивания растворов отделена от сосуда для культивирования и включает выпускное устройство во внутреннюю часть сосуда для культивирования. В одной форме осуществления камера находится снаружи сосуда для культивирования или внутри сосуда для культивирования.
В одной форме осуществления камера имеет объем, составляющий от 0,1 мл до 50000 мл. В одной форме осуществления камера имеет объем, составляющий от 0,25 мл до 30000 мл. В одной форме осуществления камера имеет объем, составляющий от 0,5 мл до 1000 мл.
В одной форме осуществления камера имеет объем, составляющий приблизительно 1,15 мл, либо приблизительно 8 мл, либо приблизительно 80 мл, либо приблизительно 200 мл, либо приблизительно 400 мл, либо приблизительно 800 мл, либо приблизительно 1,6 л, либо приблизительно 4 л, либо приблизительно 8 л, либо приблизительно 16 л, либо приблизительно 40 л.
В одной форме осуществления перемешивание происходит непосредственно перед добавлением в сосуд для культивирования.
В одной форме осуществления камера для перемешивания растворов включает впускное устройство, включающее отдельные соединители для каждого из растворов.
В одной форме осуществления устройство является стерилизуемым.
В другом аспекте настоящего изобретения описано применение устройства, описанного в данной работе, при периодическом культивировании клеток в подпиткой или при непрерывном культивировании клеток.
В аспекте настоящего изобретения также описан сосуд для культивирования, включающий устройство, описанное в данной работе.
В аспекте настоящего изобретения описан способ получения полипептида, включающий следующие стадии:
- культивирование клетки, содержащей нуклеиновую кислоту, кодирующую полипептид, в периодической культуре с подпиткой или в непрерывной культуре в сосуде для культивирования, включающем устройство, описанное в данной работе, с помощью которого во время культивирования добавляют по меньшей мере один кислый питательный раствор и по меньшей мере один щелочной питательный раствор, и
- выделение полипептида из среды культивирования или из клеток, в результате чего получают полипептид.
В одной форме осуществления смешанные питательные растворы имеют значение pH, составляющее от pH 4,5 до pH 9.5 при добавлении в сосуд для культивирования. В одной форме осуществления смешанные питательные растворы имеют значение pH, составляющее от pH 6,5 до pH 7,5 при добавлении в среду культивирования.
В одной форме осуществления сосуд для культивирования имеет объем, составляющий приблизительно 2 л, либо 10 л, либо 20 л, либо 100 л, либо 250 л, либо 500 л, либо 1000 л, либо 2000 л, либо 5000 л, либо 10000 л, либо 20000 л, либо 50000 л.
В одной форме осуществления объем среды культивирования составляет приблизительно 1,2 л, либо приблизительно 8 л, либо приблизительно 16 л, либо приблизительно 80 л, либо приблизительно 200 л, либо приблизительно 400 л, либо приблизительно 800 л, либо приблизительно 1600 л, либо приблизительно 4000 л, либо приблизительно 8000 л, либо приблизительно 16000 л, либо приблизительно 40000 л.
В одной форме осуществления устройство, описанное в данной работе, работает при комнатной температуре.
В аспекте настоящего изобретения также описан способ получения сниженного количества гликоформы G (0) и/или повышенного количества гликоформы G (1) полипептида, включающий следующие стадии:
- культивирование клетки, содержащей нуклеиновую кислоту, кодирующую полипептид, в периодической культуре с подпиткой или в непрерывной культуре в сосуде для культивирования, включающем устройство, описанное в данной работе, с помощью которого во время культивирования добавляют по меньшей мере один кислый питательный раствор и по меньшей мере один щелочной питательный раствор, и
- выделение полипептида из среды культивирования или из клеток, в результате чего получают сниженное количество гликоформы G (0) и/или повышенное количество гликоформы G (1) полипептида,
где смешанные питательные растворы при добавлении в сосуд для культивирования имеют значение pH, составляющее от pH 4,0 до pH 6,0.
В одной форме осуществления полипептид представляет собой антитело или Fc-слитый полипептид.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Широко применяемым форматом для получения терапевтических полипептидов или биомассы является периодическая ферментация с подпиткой. При периодических ферментациях с подпиткой культуры клеток млекопитающих часто имеют плотности клеток, превышающие 100·105 клеток/мл, что приводит к проблемам, связанным с подачей достаточный количеств необходимых субстратов для культивирования, в связи с низкой растворимостью и/или нарушенной стабильностью некоторых веществ или классов веществ.
Таким образом, общий способ растворения или стабилизации необходимых количеств таких веществ состоит в применении питательных растворов, имеющих нефизиологические значения pH. Например, адекватная подача аминокислоты тирозина через жидкий питательный раствор из-за ее низкой растворимости с трудом достижима при значениях pH, составляющих приблизительно pH 7. Тем не менее, в данном случае растворимость повышается при высоких, нефизиологических значениях pH, что обеспечивает стратегии подпитки, соответствующей общему потреблению тирозина в периодических процессах с подпиткой питательными растворами, при нефизиологических значениях pH. В частности, для стратегий непрерывной подпитки необходимы стабильные питательные растворы. Таким образом, срок хранения питательных компонентов должен превышать по меньшей мере период подпитки.
Кроме того, добавление питательных растворов, имеющих нефизиологические значения pH, то есть щелочные или кислые значения pH, запускает ответ механизма контроля pH устройства для культивирования. Это приводит в результате к увеличенному и нежелательному добавлению кислоты или основания для компенсации изменений pH, вызванных добавлением питательных растворов, имеющих нефизиологическое значение pH.
Во избежание воздействий, создаваемых в результате применения питательных растворов, имеющих нефизиологическое значение pH, например, воздействий высоких или низких значений pH, можно применять устройство для перемешивания питания, описанное в данной работе, которое обеспечивает непрерывное перемешивание по меньшей мере двух питательных растворов непосредственно перед добавлением в сосуд для культивирования. В результате применения устройства для перемешивания питания, описанного в данной работе, питательные компоненты можно растворять при значениях pH, при которых они обладают высокой растворимостью и/или высокой стабильностью, где значение pH может явным образом отличаться от значения pH среды культивирования, то есть отличаться от физиологического значения pH. Это позволяет применять более гибкие значения pH для питательного раствора, поскольку в данном случае значение pH доводят непосредственно перед добавлением в среду культивирования и клеточную суспензию.
Устройство, описанное в данной работе, представляет собой устройство для перемешивания питания, полезное при культивировании клеток, во время которого нужно добавлять соединения, например, при периодическом культивировании с подпиткой или при непрерывном культивировании. При применении устройства для перемешивания питания, описанного в данной работе, культивирование можно выполнять по меньшей мере при одной относительной степени свободы и, следовательно, большей гибкости. Применение устройства, описанного в данной работе, дает возможность применять питательные растворы, имеющие нефизиологическое значение pH и/или высокую концентрацию соединения. Нефизиологическое значение pH может требоваться, например, для стабилизации питательных компонентов, чувствительных к pH. Перед добавлением в сосуд для культивирования и, следовательно, в среду культивирования можно доводить любое значение pH. При периодическом или непрерывном процессе подпитки это дает возможность добавлять определенные количества соединений. Например, осмоляльность можно регулировать путем добавления определенных количеств ионов, имеющих предопределенную осмоляльность.
В результате приобретенной вариабельности значения pH питательных растворов, которая возможна при применении устройства, описанного в данной работе, можно применять питательные растворы, имеющие любое значение pH, то есть щелочные, нейтральные или кислые растворы, и любую концентрацию отдельных компонентов. В добавляемой подпитке также возможно создавать градиент pH, в результате чего можно также добавлять по существу аналогичное количество веществ по сравнению с общепринятыми стратегиями подпитки без применения устройства, описанного в данной работе. Следовательно, можно даже применять питательные растворы, в которых компоненты вследствие их низкой растворимости или нарушенной стабильности приходится добавлять при крайне щелочных или кислых, то есть при нефизиологических значениях pH.
Значение pH смешанного питательного раствора, выходящего из устройства для перемешивания питания и добавляемого в среду культивирования, зависит от волюметрического отношения смешивания отдельных подпиток и от времени пребывания в камере для перемешивания и, следовательно, от объемного потока отдельных питательных растворов.
В одной форме осуществления суммарный объемный поток в сосуд для культивирования через устройство для перемешивания питания составляет от 1 до 1,5 г/ч/л. В одной форме осуществления объемный поток составляет от 1,15 г/ч/л до 1,35 г/ч/л. В одной форме осуществления объемный поток составляет приблизительно 1,25 г/ч/л. Единица г/ч/л означает следующее: масса подпитки/время культивирования/объем культивирования. В одной форме осуществления объем культивирования представляет собой объем жидкости в сосуде для культивирования в начале культивирования.
В результате применения устройства, описанного в данной работе, для перемешивания питательных растворов жизнеспособность культивируемых клеток можно поддерживать в течение длительного периода времени, превышающего предопределенный уровень, и, следовательно, дает возможность для более длительного общего времени культивирования. В то же время можно снизить концентрацию лактата и потребления глюкозы.
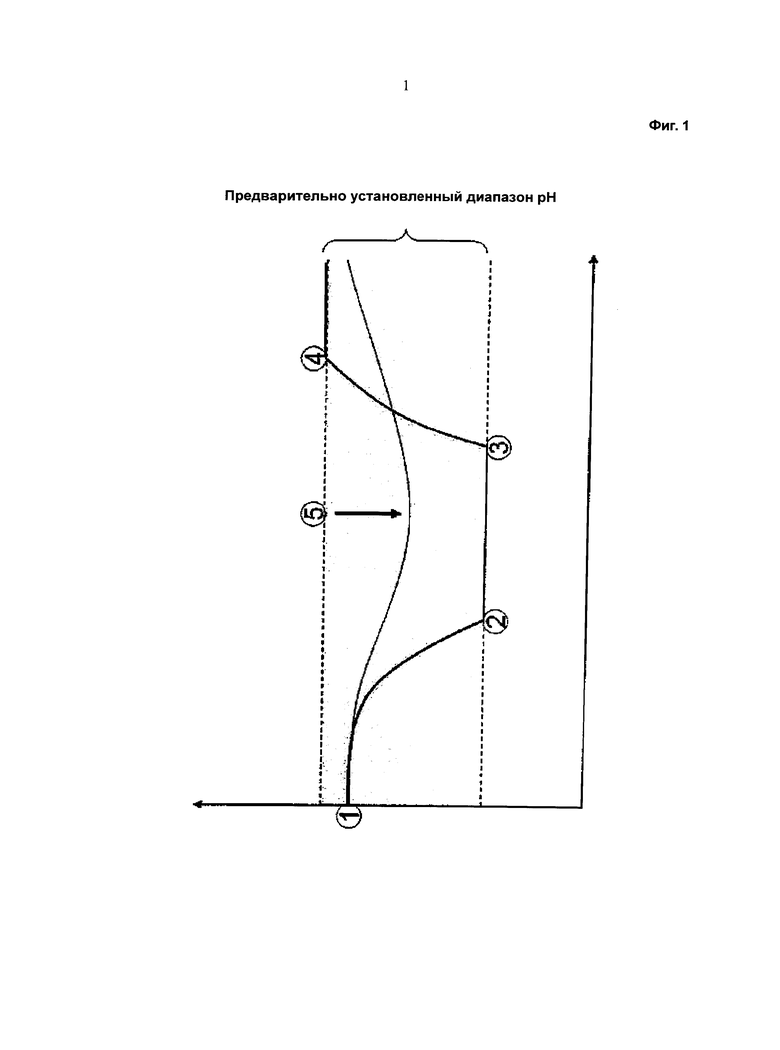
Общий ход изменения значения pH при культивировании клеток показан на Фиг.1. После инокуляции (Фиг.1, “1”) значение pH культивирования снижается и достигает нижней границы предопределенного диапазона pH (Фиг.1, “2”). Это является следствием образования лактата и накопления диоксида углерода в среде культивирования. Включенный механизм контроля pH обеспечивает поддержание значения pH на уровне нижней границы предварительно установленного диапазона pH путем добавления основания. Добавление основания продолжается до тех пор, пока клеточный метаболизм не изменится, и лактат в среде культивирования снова претерпевает метаболизм и/или происходит удаление накопленного диоксида углерода (Фиг.1, “3”). Затем значение pH возрастает и достигает верхней границы предварительно установленного диапазона pH (Фиг.1, “4”). Механизм контроля pH поддерживает значение pH при этом значении верхней границы путем добавления кислоты.
Щелочной питательный раствор может поддерживать значение pH среды культивирования, превышающее нижнюю границу предварительно установленного диапазона pH, например, без включения контроля механизма pH. Таким образом, изменению значение pH в сосуде для культивирования можно противодействовать путем изменения отношения скоростей отдельных объемных потоков двух или более питательных растворов, добавляемых в среду культивирования, при применении устройства для перемешивания питания, описанного в данной работе. Таким образом, при применении устройства, описанного в данной работе, можно, соответственно, прекратить применение механизма контроля pH или по меньшей мере сократить время его включения (а также добавляемые количества кислоты и основания).
При применении щелочного питательного раствора и кислого питательного раствора при индивидуальных скоростях подпитки и устройства для перемешивания питания, описанного в данной работе, значение pH объединенных питательных растворов можно доводить до любого целевого значения. Путем варьирования индивидуальных скоростей подпитки и/или питательных растворов в ходе культивирования значение pH объединенных питательных растворов можно изменять в ходе культивирования. Таким образом, возможна адаптация и/или контроль значения pH в зависимости от метаболизма культивируемых клеток. Переменное значение pH объединенных питательных растворов можно использовать для подкрепления или замены других средств регулирования значения pH культивирования.
При применении устройства для перемешивания питания, описанного в данной работе, можно непрерывно объединять два или более питательных растворов. Питательные растворы могут содержать любое соединение. Например, такие соединения, как витамины, можно стабилизировать при (высоких) нефизиологических значениях pH. Значение pH доводят перед добавлением в среду культивирования с помощью устройства для перемешивания питания, описанного в данной работе, до значения pH, находящегося в физиологическом диапазоне. Таким образом, сокращается время, в течение которого питательное соединение выдерживают при значении pH, снижающем его стабильность.
При применении одного или более щелочных растворов и одного или более кислых растворов возможна регуляция переменного значения pH. С помощью устройства, описанного в данной работе, значение pH в среде культивирования можно регулировать в реальном времени путем регулирования отношения и индивидуальных скоростей потоков питательных растворов (Фиг.1, “5”).
При применении питательных растворов, обладающих различными свойствами, возможно регулирование в зависимости от времени, например, следующих параметров: концентрации ионов, значения pH, осмоляльности, соотношений соединений, вязкости, поверхностного натяжения, проводимости, смачиваемости, удельного сопротивления и/или плотности.
При применении датчиков в реальном времени с помощью устройства, описанного в данной работе, возможно объединять различные питательные растворы, обладающие различными физическими и/или химическими свойствами. При этом можно изменять различные параметры в соответствии с предварительно установленным режимом.
При применении устройства, описанного в данной работе, возможно использовать в качестве питательного раствора твердые вещества, дисперсию и с трудом смешиваемые соединения/растворы. Химические и/или физические свойства питательных растворов могут быть различными.
При применении устройства для перемешивания питания, описанного в данной работе, можно создать градиент pH добавляемого смешанного питательного раствора в ходе культивирования.
Индивидуальные подпитки независимо друг от друга могут представлять собой дисперсию, эмульсию или раствор. Растворы можно переносить в устройство для перемешивания питания, используя общепринятые насосы или любой другой известный механический или технологический способ. Если подпитка не является настоящим раствором, эту подпитку можно добавлять, например, используя механический способ переноса.
Масштаб устройства для перемешивания питания может варьировать, и, таким образом, это устройство можно применять в устройстве культивирования любого типа и размера, например в сосуде для культивирования (реакторе с механическим перемешиванием), в микрожидкостной технологии или в реакторе с нагнетательным трубопроводом.
При применении устройства, описанного в данной работе, в камере для перемешивания практически не образуется осадок, хотя значение pH питательного раствора выраженно меняется перед добавлением в среду культивирования после перемешивания отдельных питательных растворов.
При применении устройства, описанного в данной работе, и, следовательно, при регулировании отдельных подпиток с получением объединенной (кислой) подпитки количество продуцируемого полипептида, имеющего гликоформу G (0), в частности продуцируемого иммуноглобулина, можно снизить по сравнению с культивированием с единственной щелочной подпиткой без применения устройства, описанного в данной работе. Аналогично при использовании устройства, описанного в данной работе, и при регулировании отдельных подпиток с получением смешанной кислой подпитки можно увеличить количество гликоформы G (1) по сравнению с культивированием с единственной щелочной подпиткой без применения устройства, описанного в данной работе.
Путем регулирования условия культивирования клеток можно изменить содержание белка клетки-хозяина в среде культивирования перед дальнейшей обработкой. Это возможно при использовании определенных питательных растворов. Таким образом, с помощью стратегии регулируемой подпитки, включающей регулирование pH питательных растворов, имеющих определенную концентрацию протонов, то есть определенное значение pH, можно добавлять идентичное или по меньшей мере подобное количество питательных компонентов и одновременно можно уменьшить количество кислоты или основания, необходимого для корректирования значения pH среды культивирования, и также можно одновременно уменьшить содержание белка клетки-хозяина в супернатанте культивирования.
Таким образом, в одной форме осуществления устройство для перемешивания питания, описанное в данной работе, применяют для снижения концентрации белка клетки-хозяина в супернатанте культивирования клеток.
Приведенные ниже примеры и графические материалы предложены, чтобы помочь понять настоящее изобретение, действительный объем которого представлен в прилагаемой формуле изобретения. Понятно, что в описанные методы можно внести модификации без отклонения от сущности изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1 - Схема общего хода изменения значения рН при культивировании клеток.
Фиг.2 - Ход изменения жизнеспособности клеток: незакрашенный символ: одна подпитка (подпитка 1); закрашенный символ: отдельные подпитки (подпитка 2 и подпитка 3); кружок: с хлоридом калия; квадрат: с хлоридом натрия.
Фиг.3 - Ход изменения жизнеспособности: незакрашенный символ: одна подпитка (подпитка 1); закрашенный символ: отдельные подпитки (подпитка 2 и подпитка 3); кружок: с хлоридом калия; квадрат: с хлоридом натрия. Видно, что жизнеспособность при применении устройства для перемешивания, описанного в данной работе, остается более длительной и составляет более 90%.
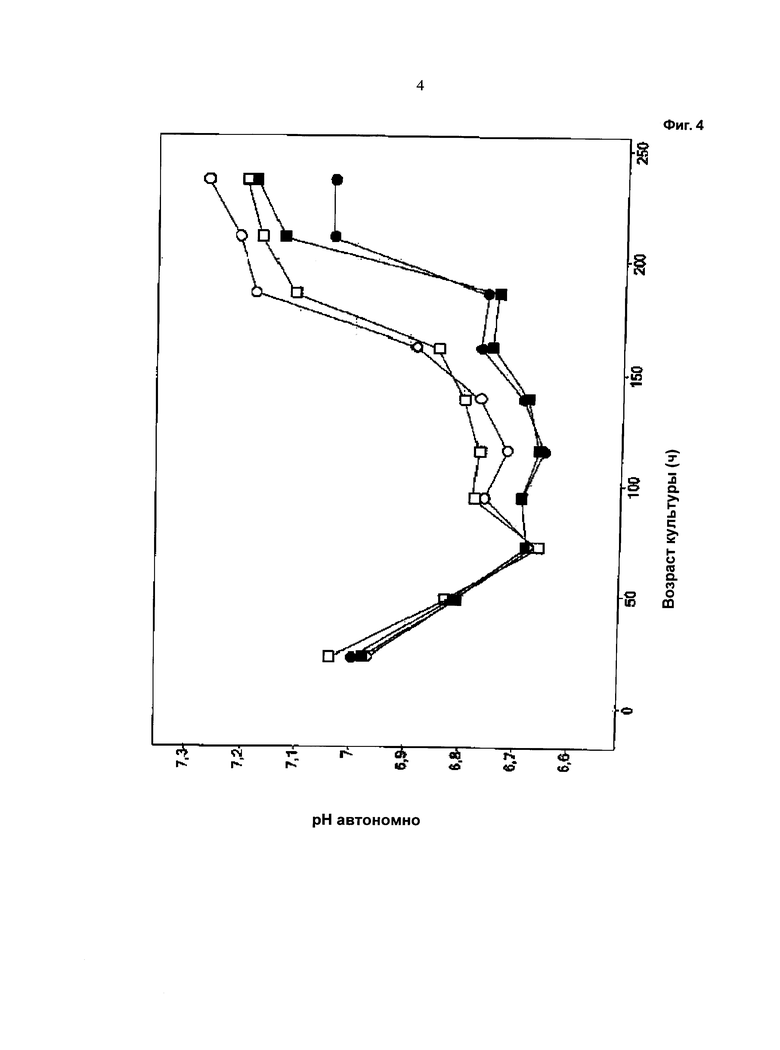
Фиг.4 - Ход изменения значения pH: незакрашенный символ: одна подпитка (подпитка 1); закрашенный символ: отдельные подпитки (подпитка 2 и подпитка 3); кружок: с хлоридом калия; квадрат: с хлоридом натрия. Ход изменения сравним с началом подпитки (после 72 часов).
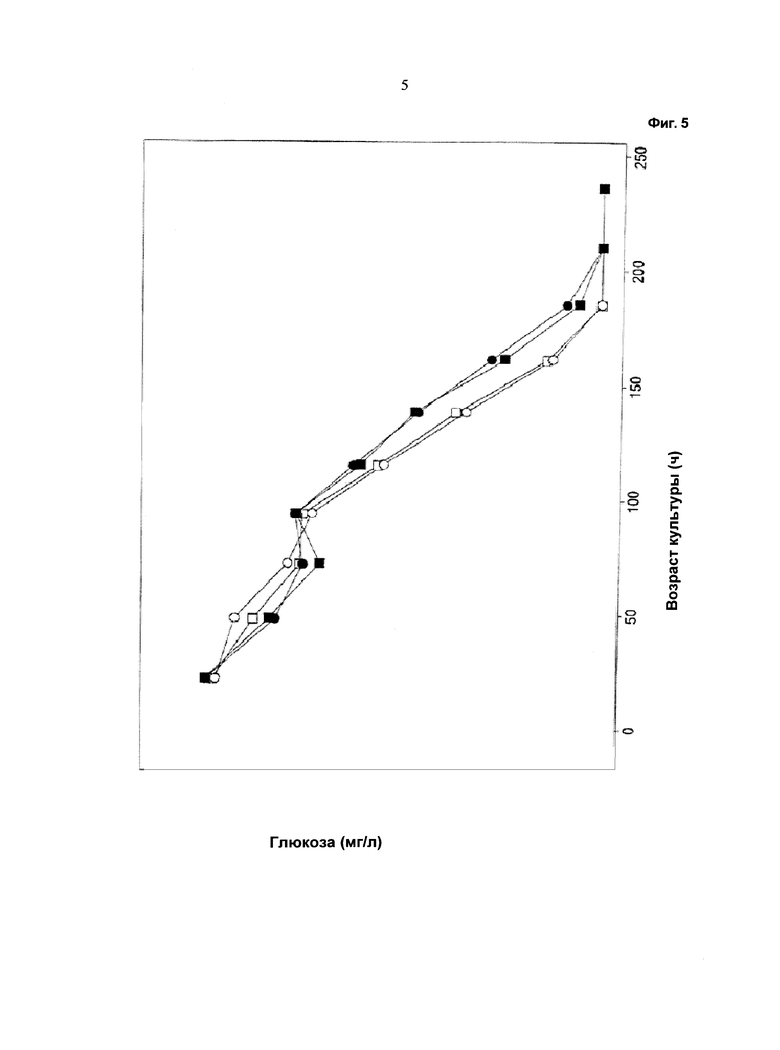
Фиг.5 - Ход изменения потребления глюкозы: незакрашенный символ: одна подпитка (подпитка 1); закрашенный символ: отдельные подпитки (подпитка 2 и подпитка 3); кружок: с хлоридом калия; квадрат: с хлоридом натрия. Потребление глюкозы снижается при применении устройства, описанного в данной работе.
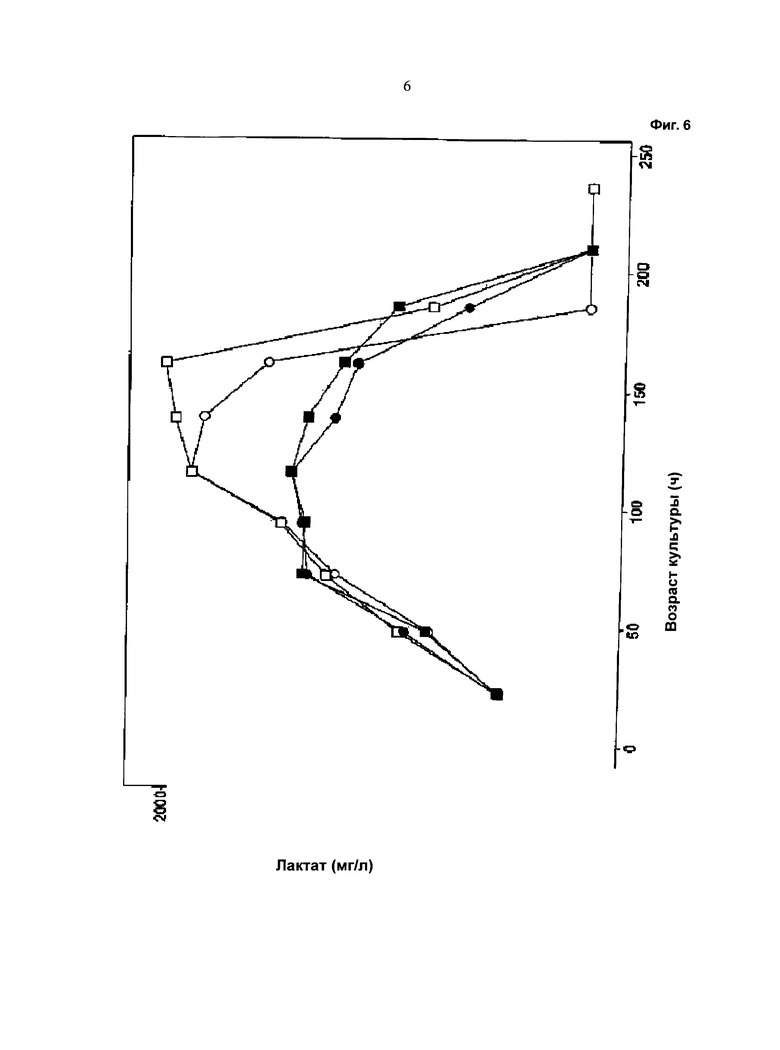
Фиг.6 - Ход изменения образования лактата: незакрашенный символ: одна подпитка (подпитка 1); закрашенный символ: отдельные подпитки (подпитка 2 и подпитка 3); кружок: с хлоридом калия; квадрат: с хлоридом натрия. Образование лактата и начало вторичного метаболизма повышается при использовании устройства для перемешивания, описанного в данной работе.
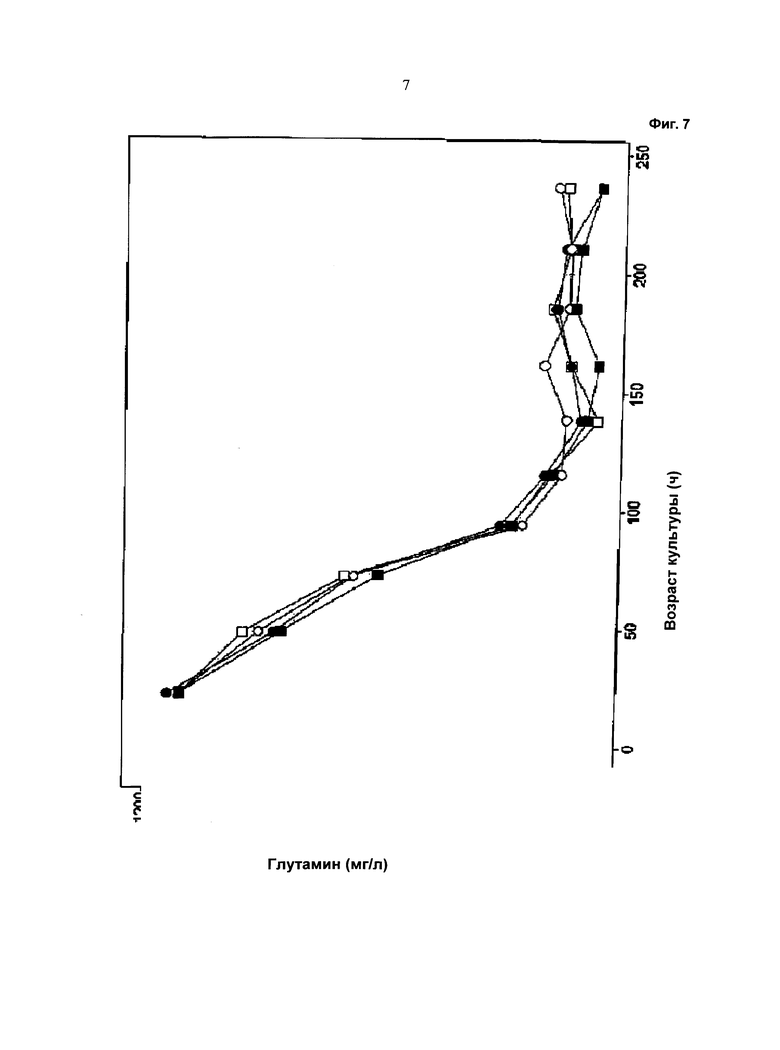
Фиг.7 - Ход изменения потребления глутамина: незакрашенный символ: одна подпитка (подпитка 1); закрашенный символ: отдельные подпитки (подпитка 2 и подпитка 3); кружок: с хлоридом калия; квадрат: с хлоридом натрия.
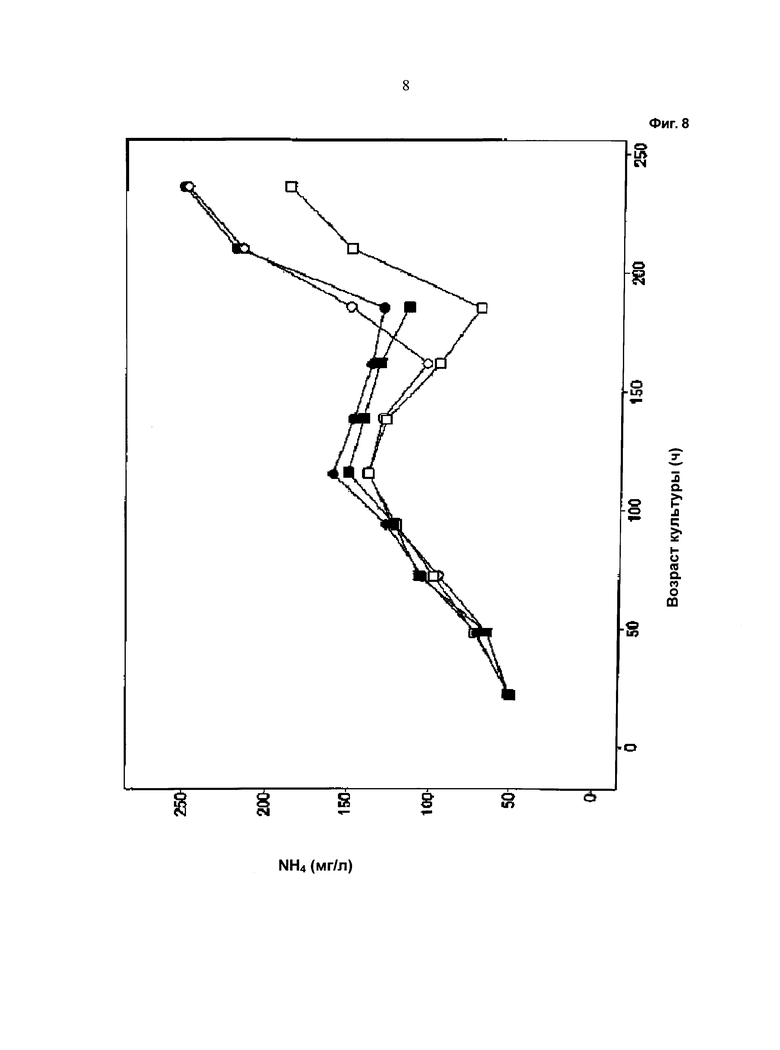
Фиг.8 - Ход изменения накопления аммиака: незакрашенный символ: одна подпитка (подпитка 1); закрашенный символ: отдельные подпитки (подпитка 2 и подпитка 3); кружок: с хлоридом калия; квадрат: с хлоридом натрия.
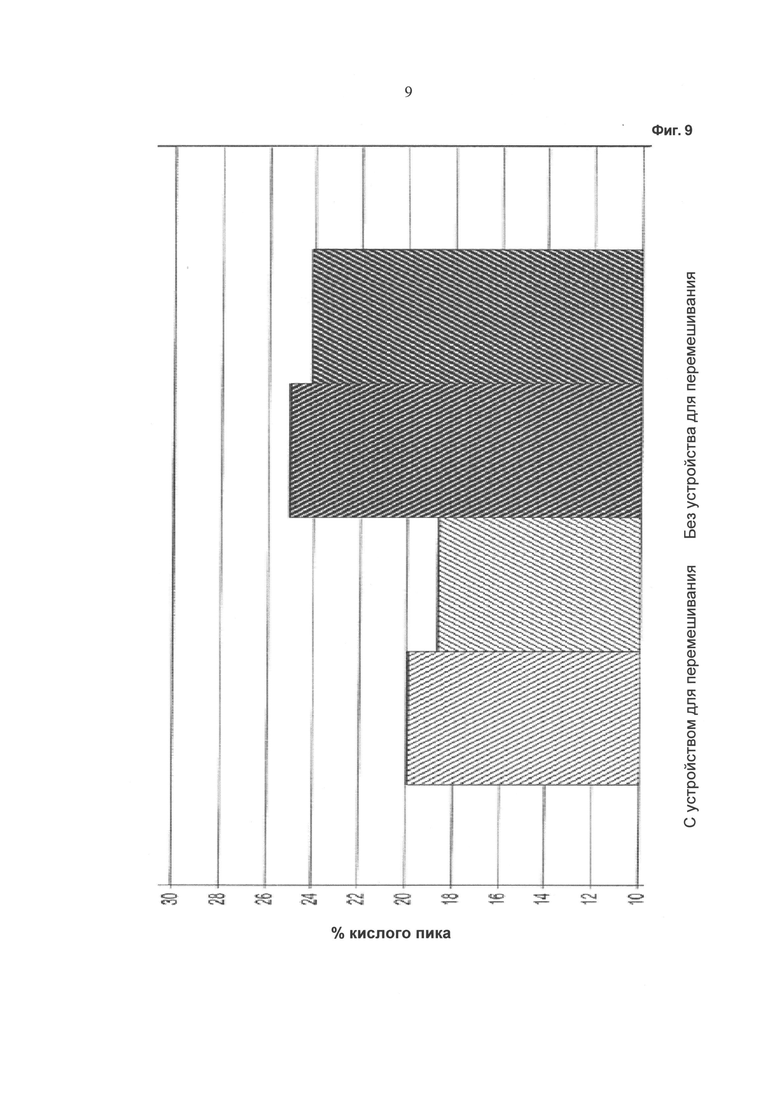
Фиг.9 - Фракция кислого пика: слева: применение устройства, описанного в данной работе; темное справа: без применения устройства, описанного в данной работе.
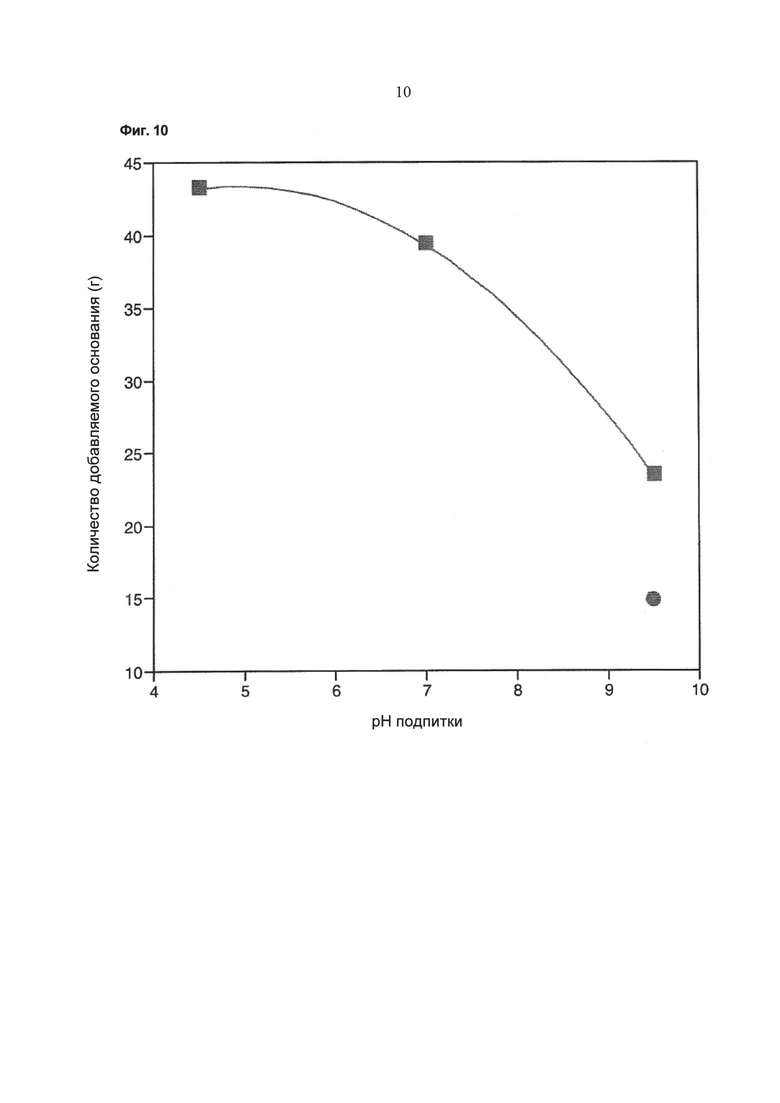
Фиг.10 - Зависимость требуемого количества добавленного основания (после 14 суток культивирования) от значения pH питательного раствора. Кружок: без применения устройства, описанного в данной работе; квадрат: при применении устройства, описанного в данной работе.
Фиг.11 - Зависимость образования лактата (после 14 суток культивирования) от значения pH питательного раствора. Кружок: без применения устройства, описанного в данной работе; квадрат: при применении устройства, описанного в данной работе.
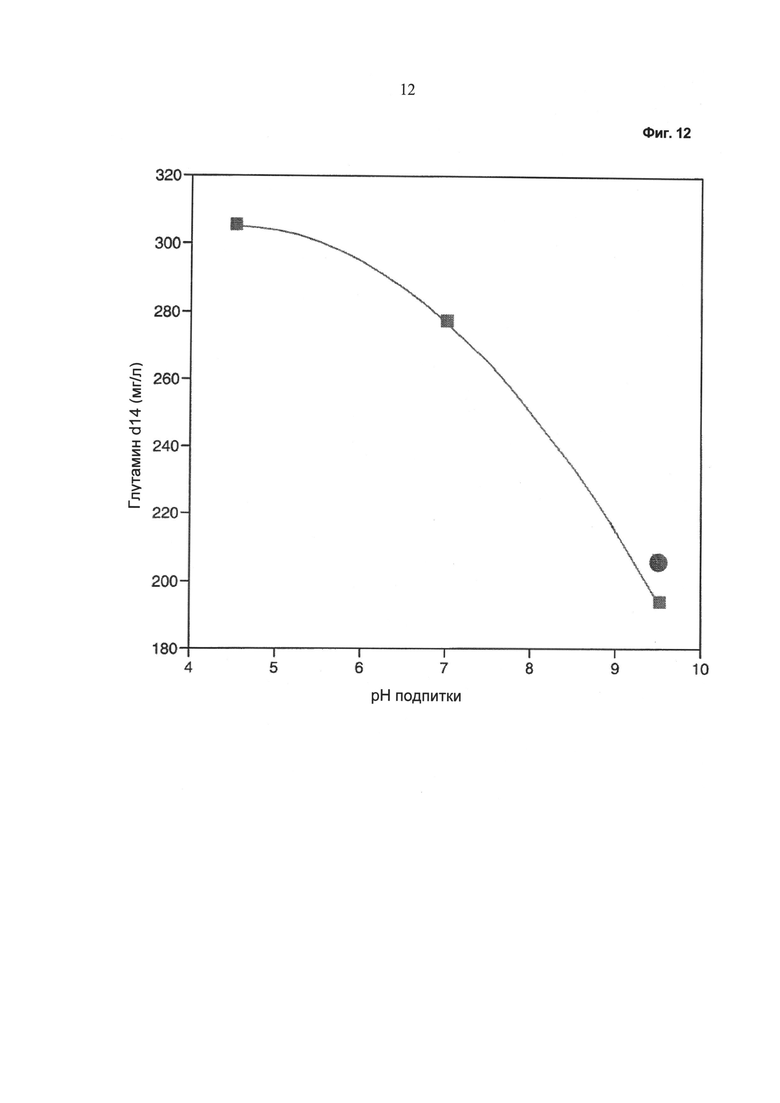
Фиг.12 - Зависимость концентрации глутамина (после 14 суток культивирования) от значения pH питательного раствора. Кружок: без применения устройства, описанного в данной работе; квадрат: при применении устройства, описанного в данной работе.
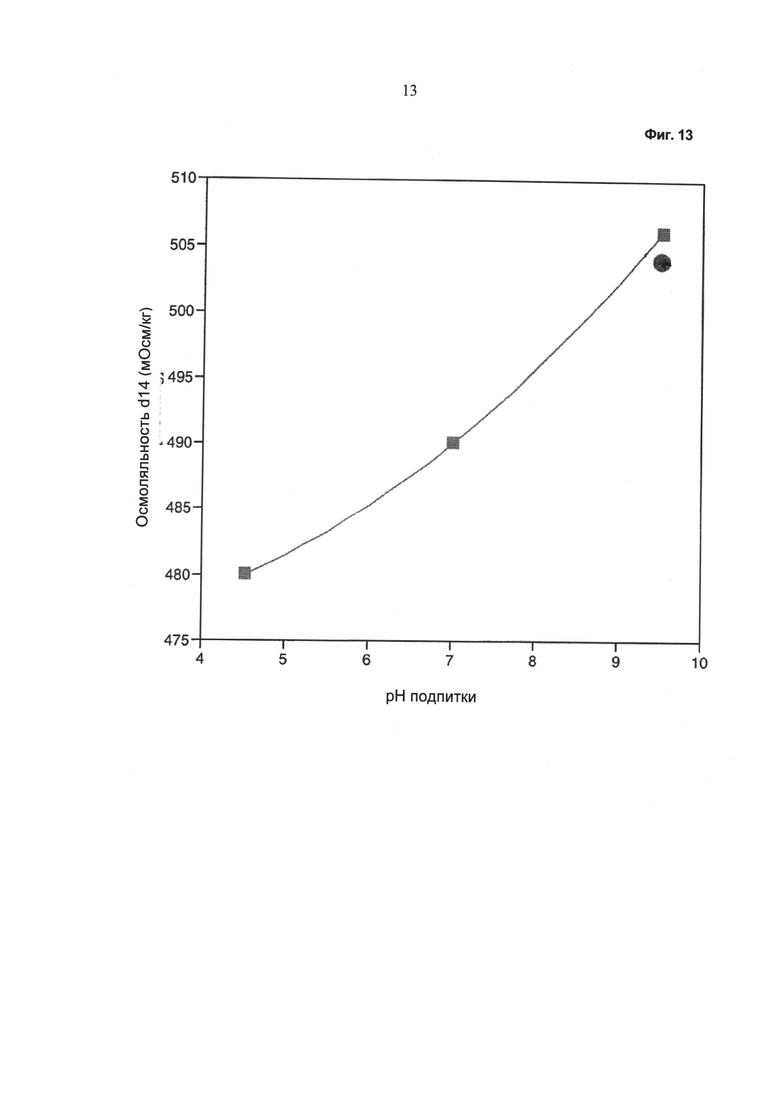
Фиг.13 - Зависимость осмоляльности в среде культивирования (после 14 суток культивирования) от значения pH питательного раствора. Кружок: без применения устройства, описанного в данной работе; квадрат: при применении устройства, описанного в данной работе.
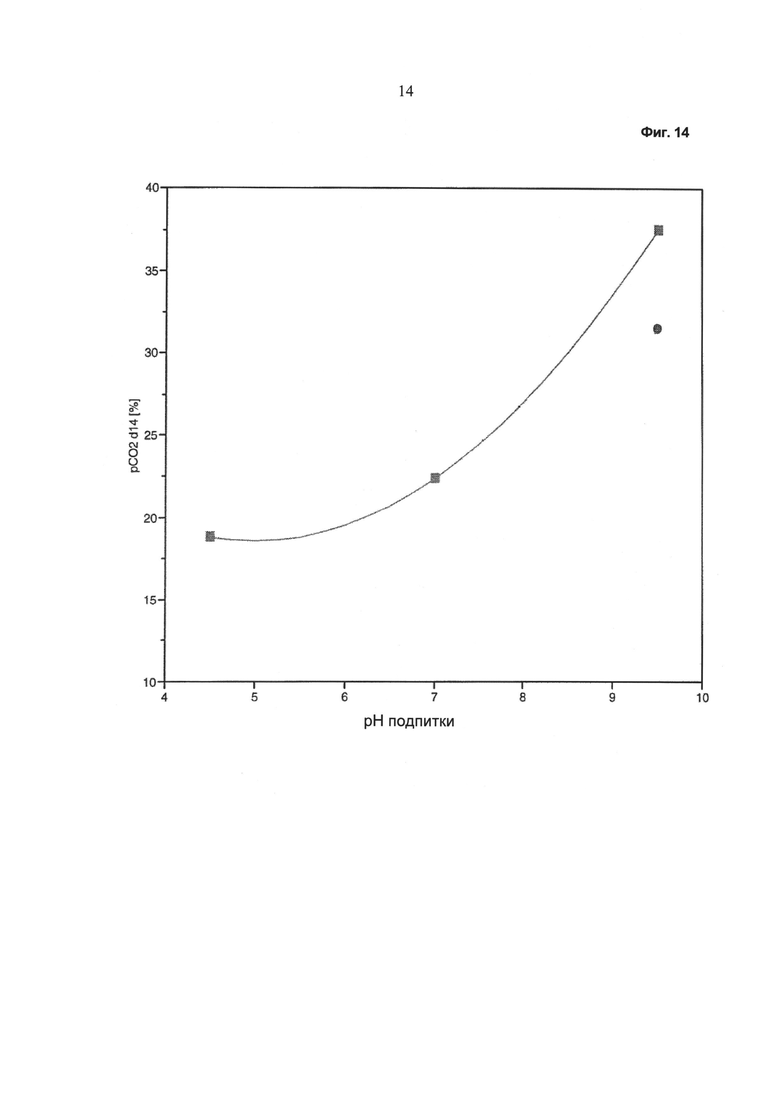
Фиг.14 - Зависимость растворенного диоксида углерода (после 14 суток культивирования) от значения pH питательного раствора. Кружок: без применения устройства, описанного в данной работе; квадрат: при применении устройства, описанного в данной работе.
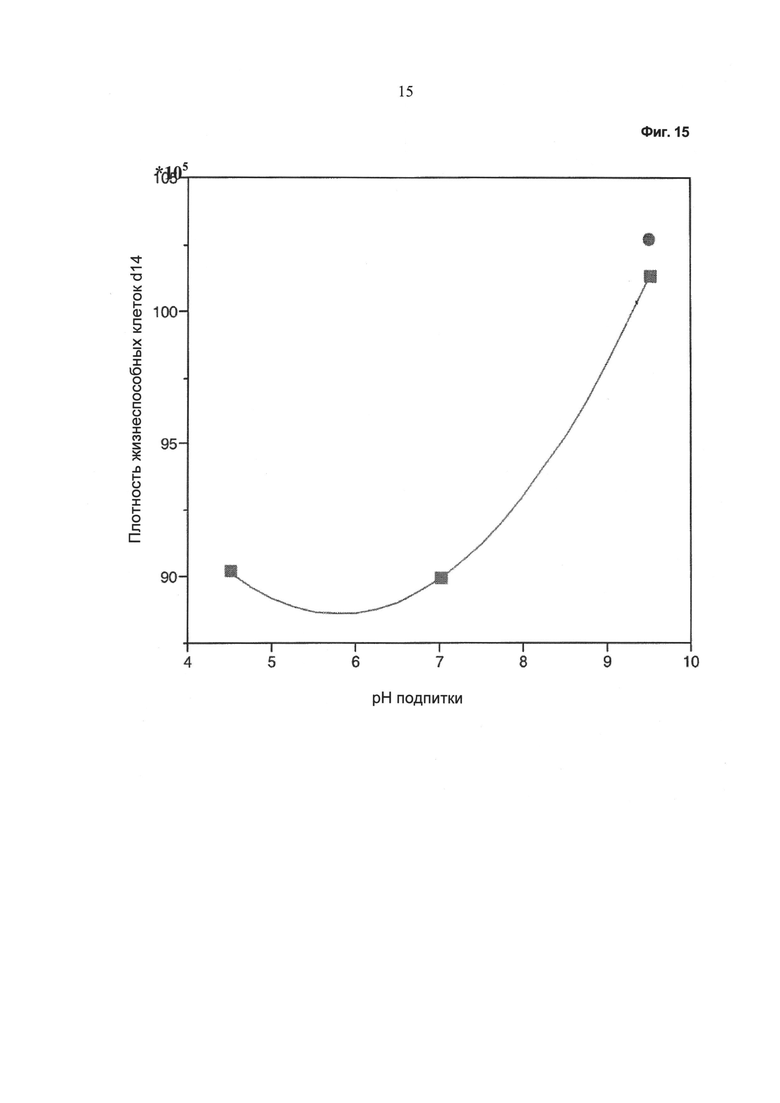
Фиг.15 - Зависимость плотности жизнеспособных клеток (после 14 суток культивирования) от значения pH питательного раствора. Кружок: без применения устройства, описанного в данной работе; квадрат: при применении устройства, описанного в данной работе.
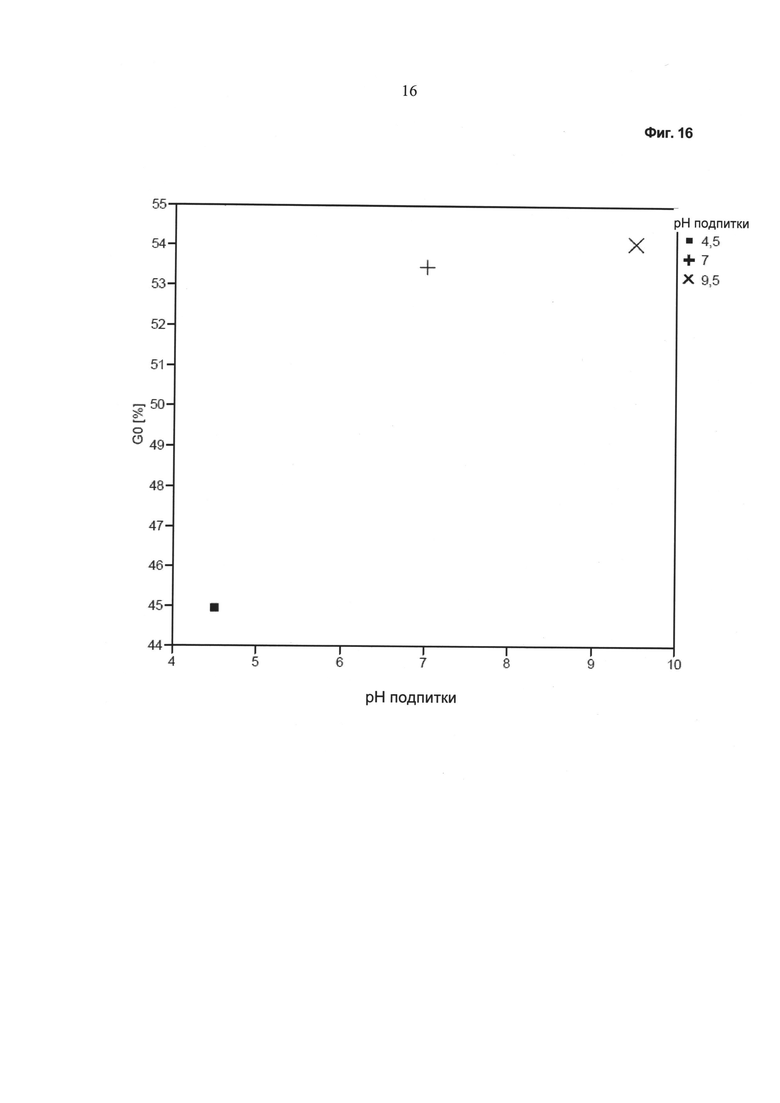
Фиг.16 - Зависимость фракции G (0) от значения pH питательного раствора.
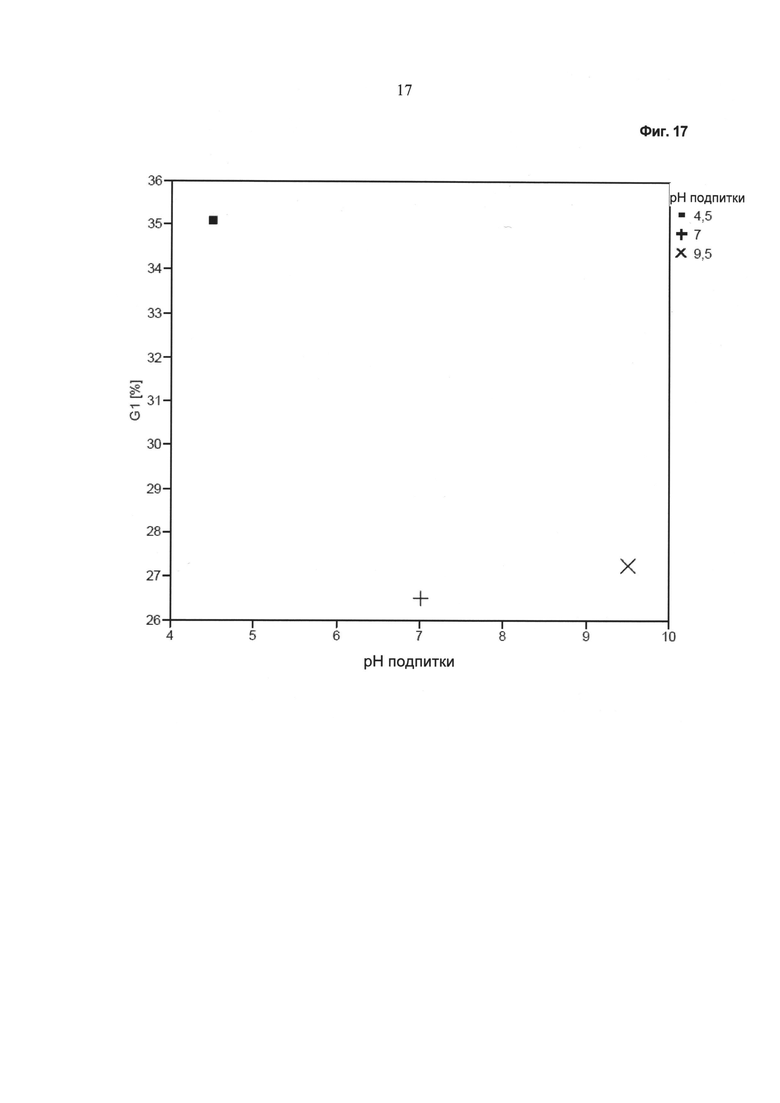
Фиг.17 - Зависимость фракции G (1) от значения pH питательного раствора.
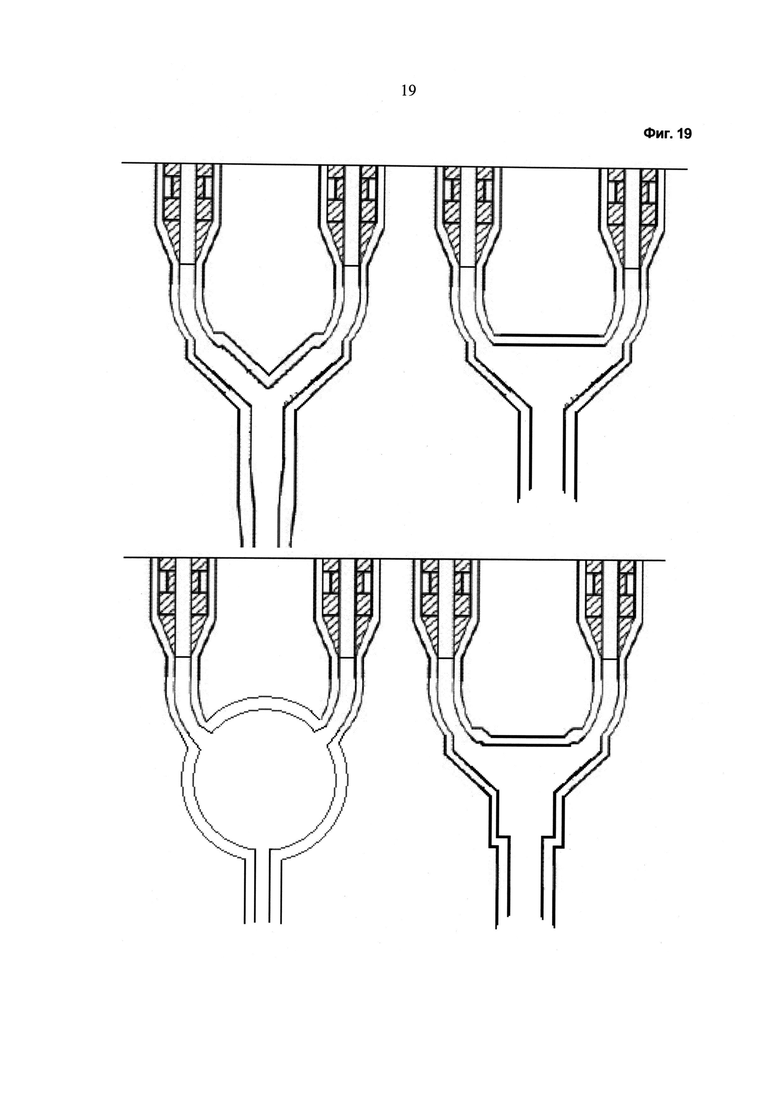
Фиг.18, 19 - Иллюстративные схемы устройства, описанного в данной работе.
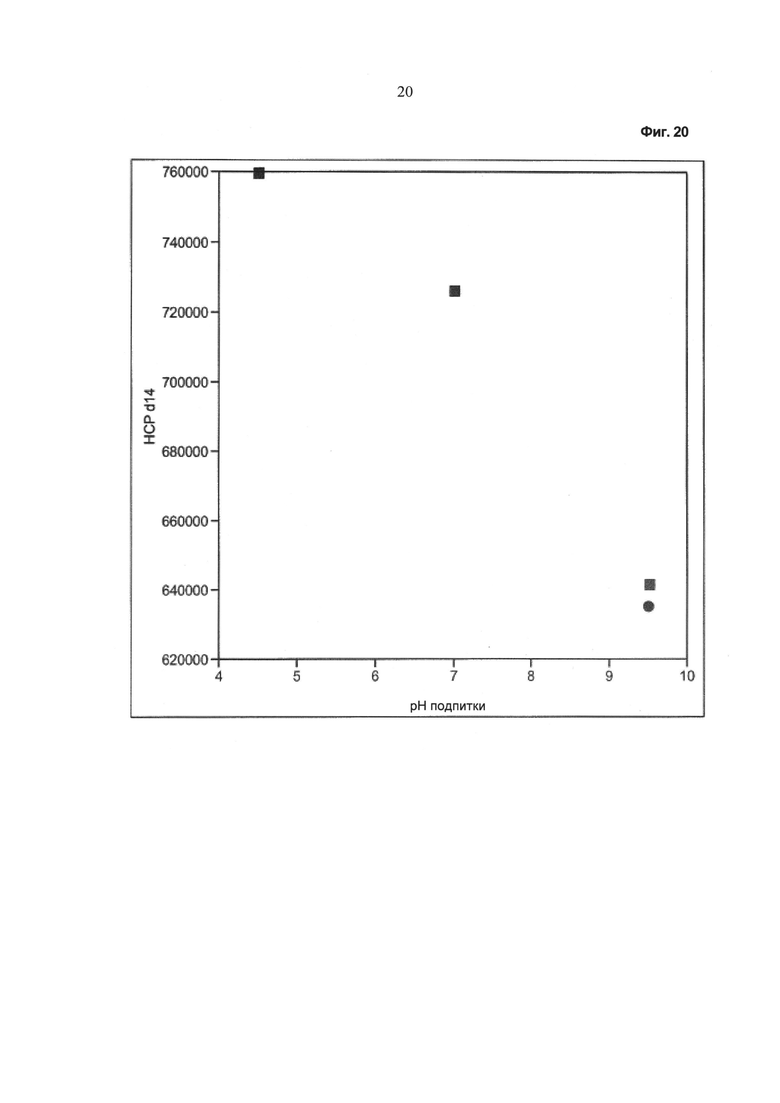
Фиг.20 - Зависимость содержания белка клетки-хозяина от значения pH питательного раствора.
ПРИМЕРЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Материалы
Антитело
Иллюстративное антитело, применяемое в способе и в примерах настоящего изобретения, представляет собой антитело против IL17, описанное в документе WO 2010/034443 (включенном в предложенное описание посредством ссылки).
Питательные растворы
Подпитка 1: Данный раствор включает все питательные компоненты (аминокислоты и пируват), имеющие значение pH, составляющее приблизительно 9,5.
Подпитка 2: Данный раствор включает компоненты, растворимые при кислом значении pH, составляющем приблизительно pH 1,5, в двойной концентрации.
Подпитка 3: Данный раствор включает компоненты, растворимые при основном значении pH, составляющем приблизительно pH 10, в двойной концентрации.
В данной системе гарантировано, что как концентрация, так и число компонентов, а также объем добавляемой подпитки 1 аналогичны тем же параметрам при объединении подпитки 2 и подпитки 3. Значение pH подпитки 1 составляет приблизительно pH 9,5, а значение pH объединенных подпиток 2 и 3 составляет приблизительно pH 7,2.
Размеры устройства для перемешивания питания
Объем камеры для перемешивания питательных растворов: 1,146 мл
Объем среды культивирования при начале культивирования в 2-литровом сосуде для культивирования: 1,2 л
Скорость тока подпитки через устройство для перемешивания питания: 36 г/сутки
Пример 1
Четыре 2-х литровых сосуда для культивирования (Sartorius Biostat B-DCU Quad, Sartorius, Goettingen, Germany) параллельно инокулировали раствором инокулума, предварительно выращенного в такой же качалочной колбе. Два сосуда для культивирования включали устройство, описанное в данной работе, тогда как два других сосуда для культивирования включали два отдельных общепринятых устройства подпитки с фиксатором Люэра, но без камеры для перемешивания.
Все культивирования выполняли при постоянной скорости аэрации, постоянной температуре и постоянной скорости перемешивания в течение всего периода культивирования. Все скорости подпитки вычислены на основании исходного рабочего объема и представлены в виде объема подпитки на исходный объем ферментации в сутки.
Подпитку в сосудах для культивирования, включающих устройство для перемешивания питания, начинали после времени культивирования, составляющего 72 часа, подпиткой 2 и подпиткой 3 в виде непрерывной подпитки при одинаковом объемном потоке. Подпитки объединяли в устройстве для перемешивания питания и добавляли в среду культивирования после перемешивания.
Подпитку в сосудах для культивирования, включающих общепринятое устройство подпитки, начинали после 72 времени культивирования, составляющего 72 часа, подпиткой 1 при объемном потоке, дважды превышающем объемный поток при соответствующих культивированиях, включающих устройство для перемешивания питания.
Таким образом, как добавляемый объем, так и добавляемое количество всех питательных компонентов идентично при всех четырех культивированиях (см. таблицы 1 и 2).
Ход изменения плотности жизнеспособных клеток в процессе культивирования показан на Фиг.2, ход изменения жизнеспособности клеток показан на Фиг.3, ход изменения значения pH в среде культивирования показан на Фиг.4, и ход изменения потребления глюкозы показан на Фиг.5. На Фиг.6 показан ход изменения концентрации лактата в процессе культивирования. Ход изменения концентрации глутамина в процессе культивирования показан на Фиг.7. На Фиг.8 показан ход изменения концентрации аммиака в процессе культивирования. Количество кислого пика продуцированного иммуноглобулина показано на Фиг.9.
Как видно из графических материалов, при применении устройства, описанного в данной работе, можно поддерживать жизнеспособность, составляющую выше 90%, в течение продолжительного периода времени. Ход изменения значения pH сравним в течение первых 72 часов, то есть до начала подпитки. Затем значение pH при культивировании с применением устройства для перемешивания питания ниже, чем при других культивированиях. При культивированиях с применением устройства, описанного в данной работе, потребление глюкозы снижено. Максимальная концентрация лактата в ходе культивирования с применением устройства для перемешивания питания ниже по сравнению с максимальной концентрацией лактата при культивировании без применения устройства для перемешивания питания.
Пример 2
В данном примере анализировали влияние только значения pH питательных растворов на различные параметры культивирования, включающие следующие параметры: потребление основания, образование лактата, кинетику роста или образование продукта. Все остальные параметры поддерживали при сравнимых значениях.
Композицию питательного раствора готовили таким образом, чтобы различалось только значение pH после перемешивания, тогда как все остальные параметры были сравнимы и включали следующие параметры: добавляемое количество компонентов подпитки, объем подпитки или осмоляльность. Таким образом, питательные растворы добавляли не при постоянной скорости подпитки, а с помощью гравиметрического контроля подпитки.
Значение pO2 доводили до значения, составляющего 35% насыщения воздухом, и определяли с помощью датчика pO2 (Mettler-Toledo InPro 6820). Датчик pO2 калибровали при условиях процесса после 72 часов насыщения газом на основании среднего значения, определенного с помощью сертифицированного анализа газов (GA4, Dasgip). Аэрацию смесью азота, воздуха, чистого кислорода и диоксида углерода во время культивирования поддерживали при постоянной скорости, составляющей 75 мл/мин. Доля диоксида углерода в суммарном потоке газа была постоянной и составляла 7 об.% от суммарного потока газа; ее изменяли исключительно в случае повышенной потребности в регулировании pH.
Значение pH среды культивирования доводили с помощью раствора карбоната натрия, концентрация которого составляла 1 моль/л, в качестве основания и диоксида углерода в качестве кислоты до установленного значения, составляющего 7,0±0,05 единиц pH. Необходимое количество диоксида углерода добавляли к общему потоку диоксида углерода, составляющему 75 мл/мин. Датчик pH (Mettler Toledo 405-DPAS-SC-K8S/200) калибровали в сравнении с буферными растворами, имеющими значения pH 7,0 и 4,01, после уравновешивания среды культивирования в течение по меньшей мере 72 часов в условиях процесса в виде среднего значения анализатора кислотно-основного баланса крови (Bioprofile, РНОх BGA).
Культивирование выполняли при постоянной скорости мешалки, составляющей приблизительно 230 об/мин. Использовали мешалку, представляющую собой тарелочный смеситель. Потребляемая мощность составляла приблизительно 80 Вт/м3. Аналогичную потребляемую мощность использовали при предварительном культивировании, чтобы гарантировать сравнимость и избежать быстрого изменения условий.
В связи с образованием пены добавляли раствор пеногасителя. Датчик пеногасителя не использовали. Количество пеногасителя, необходимое для сосуда для культивирования с самым высоким образованием пены, также добавляли в другие сосуды для культивирования. В качестве пеногасителя использовали 1% Dow для использования в медицине.
Среда культивирования представляла собой химически определенную среду. Для каждой ферментации использовали один литр среды. Объем инокуляции составлял 200 мл. Таким образом, культивирование выполняли при исходном объеме, составляющем 1200 мл.
В качестве клеточной линии использовали клетки CHO, трансфицированные нуклеиновой кислотой, кодирующей антитело против IL17. Плотность клеток в объеме инокуляции, составляющем 200 мл, доводили, чтобы обеспечить плотность клеток при культивировании, составляющую приблизительно 3,5×105 клеток/мл. Потребляемую мощность при культивировании инокулума поддерживали при таком же значении, как при последующем основном культивировании. Культивирование инокулума выполняли при следующих параметрах: приблизительно 36,5°C, 7% CO2 и относительной влажности 85%.
После переноса среды инокуляции в основное культивирование образцы отбирали на ежесуточной основе. Основное культивирование выполняли в режиме периодического культивирования с подпиткой, где подпитку начинали приблизительно через 72 часа после начала основного культивирования.
Одновременно выполняли пять различных культивирований. Параметры культивирования представлены в таблице 3.
Результаты
Применение питательного раствора оказывает прямое влияние на значение pH среды культивирования. Также, но только косвенно, влияет количество кислоты и/или основания, которое необходимо добавить в процессе культивирования с помощью механизмов контроля pH.
На Фиг.10-17 показано влияние значения pH питательного раствора на следующие параметры: количество добавляемого основания, количество добавляемой кислоты, полученное в результате pCO2 в среде культивирования после периода культивирования, составляющего 14 суток.
Как видно из Фиг.10, количество добавляемого основания зависит от значения pH питательного раствора.
Как видно из Фиг.11, количество лактата в среде культивирования после культивирования в течение 14 суток зависит от значения pH питательного раствора таким образом, что применение питательного раствора, имеющего значение pH, составляющее 9,5, приводит в результате к самому большому количеству лактата. При применении устройства, описанного в данной работе, общее количество лактата снижается приблизительно на 30% по сравнению с комбинированной подпиткой.
Как видно из Фиг.12, количество глутамина в среде культивирования после периода культивирования, составляющего 14 суток, зависит от значения pH питательного раствора.
Как видно из Фиг.13, осмоляльность в среде культивирования после периода культивирования, составляющего 14 суток, зависит от значения pH питательного раствора.
На Фиг.14 показано значение pCO2 в среде культивирования после периода культивирования, составляющего 14 суток. Видно, что pCO2 зависит от значения pH питательного раствора таким образом, что самое высокое значение pCO2 было получено при применении щелочных питательных растворов, как в виде одной подпитки, так и в виде смешанной подпитки с применением устройства, описанного в данной работе. Видно, что при использовании подпитки, имеющей более низкое значение pH, значение pCO2 после периода культивирования, составляющего 14 суток, может быть резко снижено, позволяя избежать высоких, нефизиологических значений pCO2 в среде культивирования.
На Фиг.15 показана плотность жизнеспособных клеток после периода культивирования, составляющего 14 суток. Видно, что плотность жизнеспособных клеток при культивировании находится на уровне значения, составляющего 90% или выше.
На Фиг.16 показано количество гликоформы G (0) в зависимости от значения pH питательного раствора. Видно, что при нейтральном или щелочном питательном растворе были получены сравнимые количества гликоформы G (0). При кислом питательном растворе количество гликоформы G (0) было снижено.
На Фиг.17 показано количество гликоформы G (1) в зависимости от значения pH питательного раствора. Видно, что при нейтральном или щелочном питательном растворе были получены сравнимые количества гликоформы G (1). При кислом питательном растворе количество гликоформы G (1) было повышено.
Пример 3
Поведение смешанных подпиток
Щелочной питательный раствор, имеющий значение pH, составляющее 11,3, и кислый питательный раствор, имеющий значение pH, составляющее приблизительно 1,0, объединяли с получением целевого значения pH, составляющего приблизительно pH 6,5. Перемешивание отдельных растворов выполняли при комнатной температуре и при 4°C путем объединения 10 мл каждого питательного раствора, имеющего соответствующую температуру.
После периода инкубации, составляющего 110 мин, для подпиток, перемешиваемых и инкубируемых при комнатной температуре, наблюдали образование небольшого осадка. Для подпиток, перемешиваемых и инкубируемых при 4°C, осадок образовывался уже спустя короткое время после выполнения перемешивания.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА | 2011 |
|
RU2631001C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДОВ | 2005 |
|
RU2433185C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ПОЛИПЕПТИДА | 2011 |
|
RU2577972C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ КЛЕТОК МЛЕКОПИТАЮЩИХ И ПОЛУЧЕНИЕ ПОЛИПЕПТИДОВ С ИСПОЛЬЗОВАНИЕМ КОМПОЗИЦИИ КЛЕТОЧНОЙ КУЛЬТУРЫ | 2013 |
|
RU2678142C2 |
| ПРОИЗВОДСТВО ЩЕЛОЧНЫХ ФОСФАТАЗ | 2016 |
|
RU2801121C2 |
| ПРОИЗВОДСТВО ЩЕЛОЧНЫХ ФОСФАТАЗ | 2016 |
|
RU2745528C2 |
| КОМПОЗИЦИИ КЛЕТОЧНЫХ КУЛЬТУР С АНТИОКСИДАНТАМИ И СПОСОБЫ ПОЛУЧЕНИЯ ПОЛИПЕПТИДОВ | 2014 |
|
RU2718986C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ПОЛИПЕПТИДА | 2012 |
|
RU2628310C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДОВ | 2015 |
|
RU2699715C2 |
| СПОСОБ ОЧИСТКИ ГЕТЕРОЛОГИЧНОГО ПОЛИПЕПТИДА | 2004 |
|
RU2337968C2 |




Группа изобретений относятся к области биохимии. Предложен способ получения полипептида и способ получения сниженного количества гликоформы G(0) и/или повышенного количества гликоформы G(1) полипептида. Способ получения полипептида включает культивирование клетки, содержащей кодирующую полипептид нуклеиновую кислоту, в сосуде для культивирования и выделение полипептида из среды культивирования или из клеток. Способ получения сниженного количества гликоформы G(0) и/или повышенного количества гликоформы G(1) полипептида включает культивирование клетки, содержащей кодирующую полипептид нуклеиновую кислоту, в сосуде для культивирования и выделение полипептида из среды культивирования или из клеток. Причём в среду для культивирования смешивают и добавляют кислый питательный раствор и щелочной питательный раствор. Изобретения обеспечивают поддерживание жизнеспособности культивируемых клеток в течение длительного периода времени, сокращение времени, в течение которого питательное соединение выдерживают при значении рН, снижающем его стабильность, использование в качестве питательного раствора твердых веществ, дисперсию и с трудом смешиваемые соединения/растворы, а также снижении концентрации белка клетки-хозяина в супернатанте культивирования клеток. 2 н. и 10 з.п. ф-лы, 20 ил., 3 табл., 3 пр.
1. Способ получения полипептида, включающий следующие стадии:
- культивирование клетки, содержащей нуклеиновую кислоту, кодирующую полипептид, в периодической культуре с подпиткой или в непрерывной культуре в сосуде для культивирования, включающем устройство для добавления в сосуд для культивирования клеток по меньшей мере двух питательных растворов, каждый из которых имеет нефизиологические значение рН, или аппарат для культивирования клеток, при котором по меньшей мере два питательных раствора, каждый из которых имеет нефизиологическое значение рН, смешивают и добавляют в среду для культивирования, и
- выделение полипептида из среды культивирования или из клеток, при этом
указанное устройство включает отдельные впускные устройства для питательных растворов, камеру для перемешивания питательных растворов и одно выпускное устройство для добавления смешанных питательных растворов в сосуд для культивирования клеток, где отношение объема камеры для перемешивания растворов к объему среды культивирования в сосуде для культивирования клеток составляет от 0,8 мл/л до 1,2 мл/л, и
указанный аппарат включает следующие элементы:
a) сосуд для культивирования клеток,
b) подвод газа,
c) по меньшей мере два устройства для хранения жидкостей для питательных растворов, каждый из которых имеет нефизиологическое значение рН,
d) по меньшей мере датчик для определения значения рН в сосуде для культивирования клеток, и
e) указанное устройство.
2. Способ по п. 1, отличающийся тем, что отношение объема камеры для перемешивания растворов к объему среды культивирования в сосуде для культивирования клеток составляет 1 мл/л.
3. Способ по п. 1, отличающийся тем, что устройство отделено от сосуда для культивирования и выпускное устройство находится внутри сосуда для культивирования.
4. Способ по п. 1, отличающийся тем, что камера для перемешивания питательных растворов находится снаружи сосуда для культивирования или внутри сосуда для культивирования.
5. Способ по п. 1, отличающийся тем, что камера для перемешивания питательных растворов имеет объем, составляющий от 0,5 мл до 1000 мл.
6. Способ по п. 1, отличающийся тем, что устройство изготовлено из стерилизуемого материала.
7. Способ по п. 1, отличающийся тем, что
- кислый питательный раствор имеет значение рН, составляющее рН 6,5 или ниже, и/или щелочной питательный раствор имеет значение рН, составляющее рН 8,0 или выше, и
- смешанные питательные растворы имеют значение рН, составляющее от рН 7 до рН 7,5.
8. Способ по п. 1, отличающийся тем, что перемешивание происходит непосредственно перед добавлением в сосуд для культивирования.
9. Способ по п. 1, отличающийся тем, что кислый питательный раствор имеет значение рН, составляющее рН 4,5 или ниже, и/или щелочной питательный раствор имеет значение рН, составляющее рН 10,0 или выше.
10. Способ по п. 1, отличающийся тем, что в среду для культивирования добавляют от двух до четырех отдельных питательных растворов, из которых по меньшей мере один представляет собой кислый питательный раствор, по меньшей мере один представляет собой щелочной питательный раствор.
11. Способ по любому из пп. 7-10, отличающийся тем, что каждый из щелочных или кислых питательных растворов содержит по меньшей мере соединение, выбранное из следующих соединений: аминокислоты, сахара, витамина, микроэлемента, лактата и фактора роста.
12. Способ получения сниженного количества гликоформы G(0) и/или повышенного количества гликоформы G(1) полипептида, включающий следующие стадии:
- культивирование клетки, содержащей нуклеиновую кислоту, кодирующую полипептид, в периодической культуре с подпиткой или в непрерывной культуре в сосуде для культивирования, включающем устройство, как определено в п. 1, или аппарат, как определено в п. 1, при котором по меньшей мере один кислый питательный раствор и по меньшей мере один щелочной питательный раствор смешивают и добавляют в среду для культивирования, и
- выделение полипептида из среды культивирования или из клеток,
где смешанный питательный раствор после добавления в сосуд для культивирования имеет значение рН, составляющее от рН 4,0 до рН 6,0.
| WO 2010045168 A1, 22.04.2010 | |||
| US 20030092652 A1, 15.05.2003 | |||
| EP 200702050 A1, 23.04.2008 | |||
| СПОСОБ ОБРАБОТКИ ИЛА В ОЧИСТНОМ СООРУЖЕНИИ МИЦЕЛЛЯРНЫМИ СПОСОБАМИ | 2002 |
|
RU2303572C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ ЧУМНОГО МИКРОБА | 1994 |
|
RU2102472C1 |
Авторы
Даты
2016-08-27—Публикация
2011-12-05—Подача