Основа создания изобретения
1. Область, к которой относится изобретение
Данное изобретение относится к способу очистки интересующих полипептидов из бульона после микробиологической ферментации или из гомогената. Более конкретно, в бульон или гомогенат вводят осаждающее средство, например, для осуществления удаления белка, ДНК или клеточного дебриса.
2. Описание предшествующего уровня техники
Развитие рекомбинантной технологии сейчас позволяет получать в подходящим образом трансформированных клетках высокие уровни белков. В результате существует повышенная потребность в быстрых, надежных и эффективных способах получения созданных рекомбинантным способом белков. Как правило, белки получают культивированием таких клеток, как клеточные линии млекопитающих, насекомых, грибов и бактерий, сконструированных для продукции интересующего белка посредством вставки рекомбинантной плазмиды, несущей ген данного белка. Так как используемые клеточные линии представляют собой живые организмы, им необходимо обеспечивать питание в виде комплексной среды для роста, содержащей сахара, аминокислоты и ростовые факторы, как правило, получаемые из препаратов сыворотки животных. Отделение желательного белка от смеси компонентов для питания клеток и от субпродуктов самих клеток до чистоты, достаточной для применения в качестве лекарственного средства для человека, представляет собой значительную проблему.
Процедуры очистки белков от клеточного дебриса исходно зависят от места экспрессии белка. Некоторые белки могут секретироваться напрямую из клетки в окружающую питательную среду; другие синтезируются внутриклеточно. Для белков, образующихся в клетках млекопитающих, схема очистки значительно проще, чем для полипептидов, образующихся в других типах клеток-хозяев. Клетки млекопитающих экспортируют полипептиды так, что их можно собрать из питательной среды, где они существуют в относительно чистой форме. Однако если полипептид образуется в клетках, отличных от клеток млекопитающих, например в клетках таких микроорганизмов, как грибы или E. coli, белок будет получен внутри клетки или в периплазматическом пространстве (Kipriyanov and Little, Molecular Biotechnology, 12: 173-201 (1999); Skerra and Pluckthun, Science, 240: 1038-1040 (1988)). Следовательно, необходимо высвободить белок из клеток во внеклеточную среду посредством экстракции, такой как лизис клеток. Такое разрушение превращает полное содержимое клетки в гомогенат и дополнительно образует субклеточные фрагменты, которые трудно удалить ввиду их малого размера. Их, как правило, удаляют посредством дифференциального центрифугирования или посредством фильтрации.
Лизис клеток, как правило, сопровождают применением способов механического разрушения, таких как гомогенизация или head milling. Хотя интересующий белок, как правило, выделяется эффективно, у таких способов есть несколько недостатков (Engler, Protein Purification Process Engineering, Harrison eds., 37-55 (1994)). Повышение температуры, что часто происходит в течение обработки, может приводить к взаимодействию белка. Кроме того, образующаяся в результате суспензия содержит широкий спектр загрязняющих белков, нуклеиновых кислот и полисахаридов. Нуклеиновые кислоты и полисахариды увеличивают вязкость раствора, потенциально затрудняя последующую обработку посредством центрифугирования, фильтрацию в поперечном потоке или хроматографию. Сложные ассоциации данных загрязнителей с интересующим белком могут осложнять процесс очистки и приводить к неприемлемо малым выходам.
По существу, более селективные способы высвобождения внутриклеточных белков облегчают дальнейшую дополнительную обработку. Для нарушения проницаемости клеточной мембраны и/или экстрагирования клеточных белков описаны несколько способов. Данные способы включают в себя применение растворителей, детергентов, хаотропных средств, антибиотиков, ферментов и хелатирующих средств для увеличения клеточной проницаемости и/или содействия экстракции. Описано, что добавки в течение роста культуры к среде ферментации определенных соединений, таких как глицин, также способствуют высвобождению определенных внутриклеточных ферментов. Наконец, также показано, что такие способы, как обработка способом замораживания-оттаивания или осмотическим шоком, высвобождают подклассы внутриклеточных белков.
Однако данные способы необязательно применимы ко всем внутриклеточным белкам микроорганизмов, и они все имеют ограниченное применение для крупномасштабной обработки и/или другие недостатки. Например, хотя такие растворители, как толуол или хлороформ, способствуют высвобождению внутриклеточных белков, известно, что данные вещества являются токсичными и/или канцерогенными (Windholtz et al., The Merck Index 10th Edition: 300 and 1364 (1983)). Ионные детергенты, такие как SDS, часто необратимо денатурируют выделяемые белки. Хотя неионные детергенты, как правило, не денатурируют, выделенные белки часто ассоциированы с мицеллами детергента, что может требовать дополнительной обработки для получения белка без детергента. Хаотропные средства, такие как мочевина и гуанидингидрохлорид, могут являться денатурирующими при концентрациях, необходимых для полного высвобождения, и их эффективность может зависеть от фазы роста культуры. Применение лизоцима, обеспечивающее относительно мягкое средство выделения белков, ограничено вследствие его относительно высокой стоимости и вследствие необходимости последующей очистки интересующего белка от фермента. Кроме того, хелатирующие средства, часто применяемые для увеличения эффективности других способов нарушения проницаемости мембран/выделения, таких как экстракция с применением лизоцима или толуола, страдают недостатком неспецифического выделения белков хозяина.
У других способов выделения белков также существуют недостатки. Например, для осмотического шока, при котором клетки суспендируют в среде с высоким осмотическим давлением, извлекают, а затем помещают в буфер с низким осмотическим давлением, необходимы дополнительные стадии обработки по отношению к другим альтернативам для экстракции (Moir et al., Separation Processes in Biotechnology, Asenjo eds: 67-94 (1990)) или необходимо поддерживать большие объемы жидкости при низких температурах. Это делает способ непривлекательным для широкомасштабной обработки.
Обработка замораживанием-оттаиванием также высвобождает внутриклеточные белки, однако относительно низкие выходы часто приводят к многократным циклам и дополнительным необходимым условиям для обработки. Кроме того, замораживание клеточной массы представляет собой дополнительное нетривиальное необходимое условие обработки по сравнению с другими альтернативами для экстракции.
Наконец, в течение ферментации добавляли реагенты, такие как глицин, для содействия высвобождению белков во внеклеточную среду (Aristidou et al., Biotechnology Letters15: 331-336 (1993)).Хотя сообщалось о частичном высвобождении некоторых внутриклеточных белков, данный подход требует прямого сопряжения стратегий ферментации и выделения и последующего отделения интересующего белка от потенциально сложного внеклеточного бульона.
После высвобождения интересующего полипептида из клетки-хозяина необходима его очистка от других клеточных компонентов. К сожалению, большинство способов экстракции, такие как лизис клеток, не только оставляют белок незащищенным от возможной деградации клеточными протеазами, но также делают отделение белка от других элементов полученной смеси более сложным. Например, присутствие отрицательно заряженных молекул, таких как ДНК, РНК, фосфолипиды и липополисахариды (LPS), часто требует применения анионообменной хроматографии (Sassenfeld, TIBTECH, 8: 88-93 (1990); Spears, Biotechnology, vol. 3--Bioprocessing, Rehm eds:40-51 (1993)) и/или осаждения поликатионами, такими как протаминсульфат (Kelley et al., Bioseparation,1: 333-349 (1991); Scopes, Protein Purification Principles and Practice, 2nd edition, Cantor eds., pp. 21-71 (1987)), стрептомицинсульфат (Wang et al., eds, Fermentation and Enzyme Technology: 253-256 (1979)), полиэтиленимин (PEI) (Kelley et al., выше; Sassenfeld, выше; Cumming et al., Bioseparation, 6: 17-23 (1996); Jendrisak, The use of polyethyleneimine in protein purification. Protein purification: micro to macro, ed. Alan R., Liss, Inc, 75-97 (1987); Salt et al., Enzyme and Microbial Technology, 17: 107-113 (1995)), и/или водной двухфазной экстракции в несмешивающихся полимерных системах, таких как полиэтиленгликоль (PEG)/фосфат или PEG/декстран (Kelley et al., выше, Strandberg et al., Process Biochemistry26: 225-234 (1991)).
Альтернативно интересующий белок можно отделить от небелковых полианионных загрязняющих веществ посредством добавления нейтральной соли, такой как сульфат аммония или хлорид калия (Wheelwright, Protein Purification: Design and Scale up of Downstream Processing: 87-98 (1991); Englard et al., Methods in Enzymology Volume 182, Deutscher eds.: 285-300 (1990)), и/или полимера, такого как PEG или сульфат декстрана (Wang et al.,выше; Wheelwright, выше). Когда интересующий белок заряжен положительно, он стремиться связаться с отрицательно заряженными молекулами, находящимися рядом, что делает очистку белка фактически невозможным.
Как правило, для отделения нарушающих работу полианионов от интересующего белка исследователи применяют описанные выше начальные стадии фракционирования. К сожалению, каждый из этих начальных способов разделения обладает серьезными недостатками, особенно когда их применяют в производстве фармацевтических реагентов. Например, большие количества небелковых полианионных загрязняющих веществ, находящихся в бактериальных лизатах, ведут к уменьшению связывающих способностей смол для анионообменной хроматографии. Кроме того, протоколы регенерации часто оказываются неэффективными вследствие прочного связывания полианионов со смолами (Spears, выше). В заключение, условия с низкой ионной силой, благоприятствующие белковому связыванию, неэффективны при разрушении взаимодействий полианион-белок и приводят к отсутствию разделения (Scopes, Protein Purification Principles and Practice, 3rd edition, Cantor eds., p. 171 (1994)). Препараты протаминсульфата загрязнены протеазными и вирусными загрязняющими веществами. Кроме того, при применении данного реагента может произойти нежелательное выпадение в осадок (Scopes, Protein Purification Principles and Practice, 2nd edition, Cantor eds., 21-71 (1987)).
При получении фармацевтических белков, как правило, стрептомицинсульфат не применяют вследствие общего опасения применять антибиотики в качестве реагентов для получения (Scawen et al., Handbook of Enzyme Biotechnology 2nd edition, Wiseman eds.: 15-53 (1985)). Препараты PEI часто загрязнены различными количествами мономера этиленимина, у которого подозревают наличие канцерогенных свойств (Scawen et al.,выше). PEI также приводит к необратимому связыванию со многими хроматографическими смолами, тем самым ограничивая его эфффективность и количество потенциально доступных для применения после очищения с применением PEI хроматографических смол. В общих чертах, поведение систем водной двухфазной экстракции трудно предсказать и часто для определения условий, при которых интересующих белок уходит в соответствующую водную фазу, необходим эмпирический подход (Kelley et al., выше).
Способы, которые специфически осаждают интересующий белок, часто приводят к захвату в осадок небелковых загрязняющих веществ, делая разделение неэффективным (Scopes, выше; Wheelwright, выше).
Примеры патентов, описывающих получение и очистку белка, включают в себя следующее:
В Патенте США № 5665866 описан способ получения антител в растворимой и правильно уложенной и собранной форме. Он включает в себя стадию одномоментного поднятия рабочей температуры от 34 до 60°C в процессе, выбранном для облегчения последующего выделения растворимого, правильно уложенного и собранного антитела, существенно очищенного от других связанных с антителом веществ.
В патенте США № 5760189 описан способ высвобождения подобного тиоредоксину гибридного белка вместе с отрицательно заряженным небелковым веществом из E. coli в раствор посредством добавления к раствору хелатора и осаждения отрицательно заряженного небелкового вещества из раствора посредством добавления к раствору раствора двухвалентного катиона/спирта с формированием первой растворимой фракции, содержащей белок, и первой нерастворимой фракции, содержащей нежелательные загрязняющие вещества. Необязательно температура до добавления хелатора может являться значительно холоднее, чем после добавления хелатора. Двухвалентный катион включает в себя, например, магний, марганец и кальций, отдельно или в сочетании.
В патенте США №5714583 описаны способы очистки фактора IX в растворе, включающие в себя стадии нанесения содержащего фактор IX раствора на анионообменную смолу, отмывки анионообменной смолы раствором с электрической проводимостью, меньшей, чем необходимо для элюции со смолы фактора IX, элюции анионообменной смолы первым элюантом с формированием первого элюата, нанесение элюата на гепарин или подобную гепарину смолу (например, отрицательно заряженный матрикс), элюирование гепарина или подобной гепарину смолы вторым элюантом с формированием второго элюата, нанесение второго элюата а гидроксиапатитную смолу, а затем элюирование гидроксиапатитной смолы третьим элюантов с формированием третьего элюата, содержащего очищенный фактор IX.
В патенте США №6322997 описан способ получения полипептида, включающий в себя воздействие на содержащую полипептид композицию реагента, связывающего или модифицирующего полипептид, где реагент иммобилизован на твердой фазе; а затем пропускание композиции через фильтр, несущий заряд, противоположный заряду реагента в композиции, для удаления из композиции выщелоченного реагента.
В патенте США №6214984 описана хроматография на основе гидрофобных взаимодействий при низком рН для очистки антител.
Конкретно данный патент относится к способу очистки антитела от загрязнений, включающему в себя нанесение содержащей антитела и загрязняющие вещества смеси на колонку для хроматографии на основе гидрофобных взаимодействий и элюцию антитела с колонки буфером с pH приблизительно 2,5-4,5. Как правило, pH смеси, наносимой на колонку, приблизительно такой же, как и элюирующий буфер.
Патент США № 6121428 относится к способу получения полипептида, включающему в себя воздействие на содержащую полипептид композицию связывающегося или модифицирующего полипептид реагента, где реагент иммобилизован на твердой фазе; а затем пропускание композиции через фильтр, несущий заряд, противоположный заряду реагента в композиции для удаления из композиции выщелоченного реагента.
Патент США № 5641870 относится к способу очистки антитела, где содержащую антитела и загрязняющие вещества смесь подвергают LPHIC, необязательно при низкой концентрации солей. Антитело элюируют с колонки в не связывающейся с ней фракции. На стадии экстракции осадки замороженных клеток ресуспендируют при комнатной температуре в 20 мМ буфере MES, pH 6,0, содержащем 5 мМ ЭДТА и 20 мМ 4,4'-DTP, предварительно растворенном в этаноле (3 литра буфера/кг клеточного осадка). Суспендированные клетки разрушают двукратным пропусканием через гомогенизатор Mantin Gaulin при скорости от 5500 до 6500 фунтов/дюйм2. Гомогенат доводят до 0,25% (об./об.) полиэтиленимином (PEI) и разводят равным объемом очищенной воды с температурой 2-8°C. Разведенный гомогенат затем центрифугируют. Фрагменты антитела находятся в супернатанте.
Исторически иммуноглобулин G (IgG) очищали из человеческих сыворотки и плазмы (Putnam, ed., The Plasma Proteins, vol. 1 (Academic Press, 1975)). Процесс очистки часто включал в себя одну или несколько стадий осаждения. Наиболее часто применяемая схема для получения IgG представляет собой фракционирование по Коэну (Cohn et al., J. Amer. Chem. Soc., 72: 465 (1950)). Однако сообщали о других способах осаждения (Niederauer and Glatz, Advances in Biochemical Engineering Biotechnology, v. 47 (Springer-Verlag Berlin Heidelberg, 1992); Steinberg and Hershberger, Biochim. et Biophys. Acta, 342: 195-206 (1974)). Первая работа по очистке IgG из плазмы с применением высокоароматического катионного красителя 6,9-диамино-2-этоксиакридинлактата (наименование USAN, а здесь называемого этакридинлактат и также известного под наименованиями ETHODIN™ или RIVANOL™) напечатана Horsjsi and Smetana, Acta Med. Scand., 155: 65 (1956). В последующую декаду был выпущен ряд публикаций, показывающих способность 6,9-диамино-2-этоксиакридинлактата очищать IgG и другие белки (Miller, Nature, 184: 450 (1959); Steinbuch and Niewiarowski, Nature, 186: 87 (1960); Neurath and Brunner, Experientia, 25: 668 (1969)) от биологических веществ, например плазмы и среды роста. Опубликовано применение этакридинлактата для получения антител и других белков из других источников. См. Tchernov et al., J. Biotechnol., 69: 69-73 (1999); SU 944580 опубликовано 28 июля 1982 года; Franek and Dolnikova, Biotech-Forum-Eur, 7: 468-470 (1990); EP 250288 опубликовано 23 декабря 1987 года; DE3604947 опубликовано 20 августа 1987 года; Rothwell et al., Anal. Biochem.,149: 197-201 (1985); Lutsik and Antonyuk, Biokhimiya, 47: 1710-1715 (1982); and Aizenman et al., Mikrobiol-Zh., 44: 69-72 (1982).
На первой стадии получения полипептидов из микроорганизмов наиболее часто проводят удаление твердого вещества, например клеток или клеточного дебриса. Важно осознавать необходимость в разделении желательного продукта от присутствующих в кондиционируемой среде компонентов, с которыми он специфически взаимодействует. Когда интересующий белок заряжен положительно, это приводит к связыванию любых присутствующих отрицательно заряженных молекул, тем самым делая очень трудной очистку белка традиционными способами. Дополнительное удаление в течение данной стадии загрязняющего растворимого белка из грубых микробиологических экстрактов, например гомогената E. coli, могло бы упростить дальнейшие стадии хроматографии. Такое дополнительное удаление могло бы являться особенно полезным для промышленного получения, приводя к уменьшению размера хроматографических колонок и времени получения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к очистке, как указано в формуле изобретения.
Конкретно в одном из аспектов изобретение относится к способу очистки желательного гетерологического полипептида из бульона или гомогената после микробиологической ферментации, в котором получение и растворение данного полипептида включает в себя добавление к бульону или гомогенату эффективного количества раствора 6,9-диамино-2-этоксиакридинлактата (этакридинлактата) для осаждения загрязняющих клетки-хозяева веществ в условиях, когда большая часть полипептида остается растворимой, и выделение желательного полипептида из бульона или гомогената.
В другом аспекте изобретение относится к ферментационному бульону или гомогенату микробиологических клеток, содержащему этакридинлактат и полипептид, гетерологичный для клеток.
Добавление этакридинлактата в качестве осаждающего средства неожиданно приводит к существенному удалению дебриса хозяина, включая белки хозяина. В данном процессе большинство белков хозяина вместе с клеточным дебрисом уходят в осадок, а полипептид остается в очищенном супернатанте. Увеличенная при применении этакридинлактата чистота очищенного экстракта приводит к уменьшению объема среды или смолы для хроматографии, необходимых для колонок, тем самым уменьшая размер, необходимый для последующей очистки. Это также приводит к исключению некоторой стадии(й) хроматографии, что улучшает время обработки и стоимость. Кроме того, указанный способ приводит к стабильному исходному сырью и его можно применять при нейтральном pH.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 представляет собой схематическое изображение конструкции плазмид pS1130 (один промотор) и pxCD18-7T3 (двойной промотор), кодирующих связанные лейциновой застежкой F(ab')2 к CD18.
На фигуре 2 изображена вставленная последовательность нуклеиновой кислоты (обозначенная как Anti-CD18-7T3.ДНК; SEQ ID № 1) конструкции pxCD18-7T3 с двойным промотором.
На фигурах 3A и 3B изображены аминокислотные последовательности (в совокупности обозначенные как Anti-CD18-7T3.Белок), кодируемые двумя трансляционными единицами в конструкции pxCD18-7T3 (SEQ ID №№ 2 и 3), обозначенные как STII + Anti-CD18 легкая цепь (фиг. 3A) и STII + Anti-CD18 тяжелая цепь (фиг. 3B) соответственно. N-концевые секреторные сигнальные последовательности STII подчеркнуты.
Фигура 4 представляет собой схему плазмид paTF130 (промоторы phoA/phoA) и pxTF-7T3FL (промоторы phoA/tacII), кодирующих IgG1 к тканевому фактору.
На фигуре 5 изображена вставленная последовательность нуклеиновой кислоты (обозначенная как Anti-TF-7T3FL.ДНК; SEQ ID № 4) конструкции pxTF-7T3FL с промотором phoA/tacII.
На фигурах 6A и 6B изображены аминокислотные последовательности (в совокупности обозначенные как Anti-TF-7T3FL.Белок), кодируемые двумя трансляционными единицами в конструкции pxTF-7T3FL (SEQ ID №№ 5 и 6), обозначенные как STII + Anti-TF легкая цепь (фиг. 6A) и STII + Anti-TF тяжелая цепь (фиг. 6B) соответственно. N-концевые секреторные сигнальные последовательности STII подчеркнуты.
На фигуре 7 изображена схематическая структура этакридинлактата.
На фигурах 8A-8C приведен анализ трех супернатантов после осаждения этакридинлактатом в геле способом невосстанавливающего SDS-PAGE с окраской кумасси голубым. Осаждение проводили при различных значениях pH, как указано на каждой дорожке. Дорожки, обозначенные как X, представляют собой очищенный супернатант соответствующего гомогената E. coli, т.е. F(ab')2 к CD18, F(ab')2 к TF и полноразмерные антитела к TF (фигуры 8А, 8В и 8С соответственно). Гомогенаты разводили в 4 раза 0,8% раствором этакридинлактата, т.е. до конечной концентрации этакридинлактата в каждом эксперименте 0,6%. Во всех образцах до нанесения на гель компенсировали объем. Следовательно, если достигнуто 100% получение, интенсивность полос должна являться сравнимой с экстрактом (X). Стрелки указывают на полосу продукта.
На фигурах 9А-9С приведен анализ супернатантов после осаждения этакридинлактатом в геле способом невосстанавливающего SDS-PAGE с окраской кумасси голубым. Осаждение проводили при различных концентрациях этакридинлактата, как указано на каждой дорожке. Дорожки, обозначенные как X, представляют собой очищенный супернатант соответствующего гомогената Е. coli, т.е. F(ab')2 к CD18, F(ab')2 к TF и полноразмерные антитела к TF (фигуры 9А, 9В и 9С соответственно). рН F(ab')2 к CD18, F(ab')2 к TF и полноразмерных антител к TF составлял 8,5, 7,5 и 6,0 соответственно. Удельная электропроводность в образцах составляла 3,2±0,2 мСм/см. Во всех образцах до нанесения на гель компенсировали объем. Следовательно, если достигнуто 100% получение, интенсивность полос должна являться сравнимой с экстрактом (X). Стрелки указывают на полосу продукта.
На фигурах 10А и 10В приведен анализ двух супернатантов после разведения водой или этакридинлактатом соответственно в геле способом невосстанавливающего SDS-PAGE с окраской кумасси голубым. Осаждение проводили при различных уровнях электрической проводимости. Для данного исследования применяли гомогенаты Е. coli, содержащие F(ab')2 к CD18. Гомогенат разбавляли в 4 раза или водой (фиг.10А) или 0,8% раствором этакридинлактата, т.е. до конечной концентрации этакридинлактата в каждом эксперименте 0,6% (фиг.10 В), а рН доводили до 8,3. Для изменения электрической проводимости в образцы добавляли NaCl в различных концентрациях в диапазоне 0-400 мМ (как указанно на фигурах). Стрелки указывают на полосу продукта.
На фигуре 11 приведена диаграмма растворимости этакридинлактата при увеличении концентраций хлорида натрия. Образцы перед определением концентрации растворимого этакридинлактата три часа инкубировали при комнатной температуре. Пустыми символами указан 1,2% раствор этакридинлактата, а сплошными символами - 0,6% раствор. Сплошная линия представляет собой 0,6% раствор этакридинлактата при рН 6,0, пунктирная линия представляет собой 1,2% раствор этакридинлактата при рН 6, точечная линия представляет собой 0,6% раствор этакридинлактата при рН 9, и пунктирная линия с точками представляет собой 1,2% раствор этакридинлактата при рН 9.
На фигурах 12А-12С приведен анализ трех супернатантов после осаждения этакридинлактатом в геле способом невосстанавливающего SDS-PAGE с окраской кумасси голубым. Осаждение проводили при повышенных температурах. Дорожки, обозначенные как X, представляют собой очищенный супернатант соответствующего гомогената Е. coll, т.е. F(ab')2 к CD18, F(ab')2 к TF и полноразмерные антитела к TF (фигуры 12А, 12В и 12С соответственно). Гомогенат разводили в 4 раза до конечной концентрации этакридинлактата 0,6%, а pH для F(ab')2 к CD18, F(ab')2 к TF и полноразмерных антител к TF доводили до 8,5, 7,5 и 6,0 соответственно. Температура и время инкубации указаны на фигурах. Стрелки указывают на полосу продукта.
На фигуре 13 представлена диаграмма мутности как функции времени для трех различных супернатантов. Супернатанты из гомогената с F(ab')2 к CD18, обработанные 0,6% этакридинлактатом, обозначены как заштрихованные окружности (4°C) или пустые окружности (21°C), а образцы, обработанные 0,2% PEI, представлены как заштрихованные квадраты (4°C) и пустые квадраты (21°C). Супернатант, полученный из очищенного гомогената с F(ab')2 к CD18, который перед концентрацией разводили водой, представлен как заштрихованные треугольники (4°C) и пустые треугольники (21°C). Во всех случаях гомогенат с F(ab')2 к CD18 разводили в 4 раза, а pH составлял 7,2.
ПОДРОБНОЕ ОПИСАНИЕ И ПРЕДПОЧТИТЕЛЬНЫЕ ОСУЩЕСТВЛЕНИЯ
Определения
Выражение "бульон или гомогенат после микробиологической ферментации" относится к бульону, пасте или экстракту, предпочтительно ресуспендированным, полученным из микроогранизмов, включающих в себя дрожжи, грибы и прокариоты, такие как бактерии, которые культивировали и которые потребляли питательные вещества, вне зависимости от применяемого сосуда для культивирования, например, встряхиваемой колбы или ферментера. Предпочтительно бульон или гомогенат получают из дрожжей или прокариот. Наиболее предпочтительно бульон или гомогенат получают из бактерий. Здесь предпочтителен гомогенат. В некоторых случаях, если раствор обладает очень высокой удельной электропроводностью, это может являться предпочтительным для сбора клеток и их ресуспендирования, но в других случаях предпочтительно применять гомогенат, такой как гомогенат непосредственно из ферментера. Компоненты бульона или гомогената включают в себя клеточный дебрис, белок клетки-хозяина, ДНК, РНК и т.п. Таким образом, добавление сюда лактата приводит к избирательному осаждению белков клетки-хозяина и т.д., обеспечивая лучшую степень очистки, чем без применения лактата.
Выражение "в условиях, когда большая часть полипептида остается растворимой" относится к добавлению этакридинлактата в бульон или гомогенат в количествах и при температуре и уровне электрической проводимости, которые предотвращают выпадение в осадок из бульона или гомогената большей части интересующего белка. Предпочтительно такие состояния предотвращают от выпадения в осадок приблизительно более чем 60% полипептида, более предпочтительно - приблизительно более чем 70%, еще более предпочтительно - приблизительно более чем 75%, даже более предпочтительно - приблизительно более чем 80%, даже еще более предпочтительно - приблизительно более чем 85%, даже еще более предпочтительно - приблизительно более чем 90%, а наиболее предпочтительно - приблизительно более чем 95%. Данную степень растворимости измеряют посредством соответствующего анализа, например, такого как RP-HPLC, аффинная хроматография, ELISA, RIA и сочетание SDS-PAGE и высокоэффективной аффинной хроматографии (НРАС). Выбор анализа зависит от таких факторов, как тип применяемой клетки-хозяина и получаемого пептида.
"Бактерии" для целей данного описания включают в себя эубактерии и архебактерии. Предпочтительными из них являются эубактерии, включающие в себя грамположительные и грамотрицательные бактерии. Более предпочтительными являются грамотрицательные бактерии. Одним из предпочтительных типов бактерий являются Enterobacteriaceae. Примеры бактерий, принадлежащих Enterobacteriaceae, включают в себя Escherichia, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, Serratia и Shigella. Другие типы пригодных бактерий включают в себя Azotobacter, Pseudomonas, Rhizobia, Vitreoscilla и Paracoccus. Здесь предпочтительны E. coli. Пригодные хозяева E. coli включают в себя E. coli W3110 (ATCC 27325), E. coli 294 (ATCC 31446), E. coli B и E. coli X1776 (ATCC 31537). Данные примеры являются иллюстративными, а не ограничивающими, а предпочтительным является W3110. Также можно использовать мутантные клетки любых указанных выше бактерий. Естественно, что необходимо выбрать подходящие бактерии, принимая во внимание реплицируемость репликона в таких бактериальных клетках. Например, в качестве хозяина соответствующим образом можно использовать виды E. coli, Serratia или Salmonella, когда для поддержания репликона применяют хорошо известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410. Относительно примеров пригодных бактериальных клеток-хозяев см. далее ниже.
Как применяют здесь, выражение "клетка", "клеточная линия", "штамм" и "клеточная культура" применяют попеременно и все такие обозначения включают в себя потомство. Таким образом, слова "трансформанты" и "трансформированные клетки" включают в себя исходную обрабатываемую клетку и культуры, полученные из нее, вне зависимости от количества пересадок. Также понятно, что все потомство может являться не абсолютно идентичным по содержанию ДНК вследствие намеренных или случайных мутаций. Сюда включают мутантное потомство, обладающее той же функцией или биологической активностью, как показано для исходной трансформированной клетки. Когда подразумевают особые обозначения, это будет ясно из контекста.
Как применяют здесь, "полипептид", как правило, относится к пептидам и белкам из любого клеточного источника, состоящим из более чем приблизительно десяти аминокислот. "Гетерологичные" полипептиды представляют собой полипептиды, чужеродные для применяемой клетки-хозяина, такие как человеческий белок, продуцируемый E. coli. Хотя гетерологичный полипептид может являться прокариотическим или эукариотическим, предпочтительно он является эукариотическим, более предпочтительно - млекопитающих, а наиболее предпочтительно - человека. Предпочтительно он является продуцируемым рекомбинантным способом или рекомбинантным полипептидом.
Полипептид продуцируется и растворяется в ферментационном бульоне или гомогенате, означая, что он получен в таком бульоне или гомогенате и находится или уже в растворимой фракции, получаемой в процессе продукции, или находится в нерастворимой фракции, или форме, или фазе, которые обрабатывают и приводят в контакт с растворяющим средством, таким как хаотропное средство (например, мочевина или гуанидин) или детергент (такой как додецилсульфат натрия (SDS)), с восстанавливающим средством (таким как дитиотреитол или бета-меркаптоэтанол), так чтобы растворить полипептид. "Растворимый", "растворенный", "растворение", "разбавленный" или "разбавление" в используемом здесь смысле означает, что полипептид после центрифугирования находится в супернатанте, а не в твердой фракции. Можно определить выпадение осадка или степень растворимости, например, посредством соответствующих анализов, как отмечено выше.
Примеры полипептидов млекопитающих включают в себя такие молекулы, как, например, ренин, гормон роста, включающий в себя человеческий гормон роста; бычий гормон роста; фактор, высвобождающий гормон роста; паратиреоидный гормон; тиреостимулирующий гормон; липопротеины; 1-антитрипсин; A-цепь инсулина; B-цепь инсулина; проинсулин; тромбопоэтин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы коагуляции, такие как фактор VIIIC, фактор IX, тканевой фактор и фактор фон Виллебранда; факторы, противодействующие свертыванию, такие как протеин C; атриальный натрийуретический фактор; легочный сурфактант; активатор плазминогена, такой как урокиназ или человеческая моча или тканевой активатор плазминогена (t-PA) и его варианты, такие как RETEVASE™ и TNKASE™; бомбезин; тромбин; гемопоэтический ростовой фактор; фактор некроза опухолей-альфа и -бета; антитела к домену(ам) ErbB2, такие как 2C4 (WO 01/00245; гибридома ATCC HB-12697), связывающиеся с областью во внеклеточном домене ErbB2 (например, одним или несколькими остатками в области ErbB2 приблизительно от остатка 22 до приблизительно 584 включительно), энкефалиназа; сывороточный альбумин, такой как человеческий сывороточный альбумин; ингибирующее Мюллеровы протоки вещество; A-цепь релаксина; B-цепь релаксина; прорелаксин; мышиный ассоциированный с гонадотропином пептид; микробиологический белок, такой как бета-лактамаза; ДНКаза; ингибин; активин; фактор роста эндотелия сосудов (VEGF); рецепторы для гормонов или факторов роста; интегрин; протиен A или D; ревматоидные факторы; нейротропный фактор, такой как нейротрофический фактор головного мозга (BDNF), нейротропин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или фактор роста нервов, такой как NGF; кардиотрофины (фактор гипертофии сердца), такой как кардиотрофин-1 (CT-1); тромбоцитарный фактор роста (PDGF); фактор роста фибробластов, такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); дез(1-3)-IGF-I (IGF-I головного мозга), белки, связывающие инсулиноподобный фактор роста; белки CD, такие как CD-3, CD-4, CD-8 и CD-19; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; морфогенный белок кости (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; сывороточный альбумин, такой как человеческий сывороточный альбумин (HSA) или бычий сывороточный альбумин (BSA); колониестимулирующие факторы (CSF), например M-CSF, GM-CSF, и G-CSF; интерлейкины (IL), например, начиная от IL-1 до IL-10; антитела к HER-2; лиганд Apo2; супероксиддисмутаза; рецепторы T-клеток; поверхностные мембранные белки; комплементзависимый стимулятор гемолиза; вирусный антиген, такой как, например, часть оболочки ВИЧ; транспортные белки; рецепторы "хоминга"; аддрессины; регуляторные белки; антитела; и фрагменты любого из перечисленных выше полипептидов.
Предпочтительные здесь полипептиды включают в себя человеческий сывороточный альбумин (HSA), 2C4, тканевой фактор, антитело к тканевому фактору, антитело к CD20, антитело к HER-2, херегулин, антитело к IgE, антитело к CD11a, антитело к CD18, VEGF и его рецепторы и антитела к нему, такие как rhuFab V2 и AVASTIN™, гормон роста и его варианты, такие как hGH, рецепторы гормона роста, белок, высвобождающий гормон роста (GHRP), LIV-1 (EP 1263780), TRAIL, фактор некроза опухолей (TNF) и антитела к нему, рецептор TNF и связанные антитела, рецептор TNF-IgG, ассоциированные с рецептором TNF факторы (TRAF) и их ингибиторы, фактор VIII, домен B фактора VIII, интерфероны, такие как интерферон-гамма, трансформирующие факторы роста (TGF), такие как TGF-бета, антитело к TGF, такие как антитело к TGF-бета, активин, ингибин, антитело к активину, антитело к ингибину, активаторы тканевого плазминогена и их варианты, такие как t-PA, RETEPLASE™ и TNKase, антитела к Fas, лиганду Apo-2; ингибитор лиганда Apo-2; рецептор Apo-2, Apo-3, факторы апоптоза, Ced-4, DcR3, рецептор гибели и антитела-агонисты (DR4, DR5), лимфотоксин (LT), пролактин, рецептор пролактина, белки SOB, WISP (индуцируемые wnt секретируемые белки), нейротоксин-3 (NT-3), фактор роста нервов (NGF) и антитело к NGF, ДНКаза, антиген вируса гепатита, антиген вируса простого герпеса, лептин, инсулиноподобные факторы роста (IGFs), такие как IGF-1 и IGF-2 и связывающие их белки и рецепторы, такие как IGFBP-1-IGFBP-6, инсулин, факторы роста фибробластов (FGF), такие как FGF-17, белок Toll, лиганды TIE, CD40 и антитело к CD40, иммуноадгезины, субтилизин, фактор роста гепатоцитов (HGF), тромбопоэтин (TPO), интерлейкины, такие как IL-2, IL-12, IL-17, IL-22, IL-8, IL-9, и антитела к ним, и специфический для простаты опухолевый антиген (PSCA).
Примеры антител, связывающих HER2, включают в себя 4D5, 7C2, 7F3 и 2C4, а также их гуманизированные варианты, включающие в себя huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8, как описано в таблице 3 патента США 5821337; и гуманизированные мутанты 2C4 №№ 560, 561, 562, 568, 569, 570, 571, 574 или 56869, как описано в WO01/00245. 7C2 и 7F3 и их гуманизированные варианты описаны в WO98/17797.
Примеры антител, связывающих антиген CD20, включают в себя "C2B8", названное сейчас "Rituximab" ("RITUXAN®") (патент США № 5736137); меченное иттрием-[90] мышиное антитело 2B8, обозначенное "Y2B8" (патент США № 5736137); мышиное IgG2a "B1", необязательно меченное 131I с получением антитела "131I-B1" (BEXXAR™) (патент США № 5595721); мышиное моноклональное антитело "1F5" (Press et al., Blood, 69(2): 584-591 (1987)); антитело "гибридное 2H7" (патент США № 5677180) и моноклональные антитела L27, G28-2, 93-1B3, B-C1 или NU-B2, доступные из International Leukocyte Typing Workshop (Valentine et al., In: Leukocyte Typing III (McMichael, Ed., p. 440, Oxford University Press (1987)).
Более предпочтительными полипептидами являются 2C4, антитело к тканевому фактору, антитело к CD20, антитело к HER-2, херегулин, антитело к IgE, антитело к CD11a, антитело к CD18, антитело к VEGF, такое как rhuFab V2, hGH, GHRP, LIV-1, TRAIL, антитела к TNF и рецептору TNF и родственные антитела, ингибиторы TRAF, рецептор TNF-IgG, фактор VIII, домен B фактора VIII, интерферон-гамма, TGF-бета и антитело к TGF-бета, активин, ингибин, антитело к активину, антитело к ингибину, t-PA, TNKаза, антитела к Fas, лиганд Apo-2; ингибитор лиганда Apo-2; рецептор Apo-2, Apo-3, DcR3, рецептор гибели и антитела-агонисты (DR4, DR5), лимфотоксин (LT), пролактин, рецептор пролактина, WISP, антитело к NGF, NGF, NT-3, антитело к IL-8, антитело к IL-9. IL-17, IL-22, ДНКаза, GHRP, антиген вируса гепатита, антиген вируса простого герпеса, лептин, IGF-1 и IGFBP1-6, инсулин, FGF-17, белок Toll, лиганды TIE, CD40, иммуноадгезины, субтилизин, HGF и TPO.
Еще более предпочтительными полипептидами являются 2C4, антитело к тканевому фактору, антитело к CD20, антитело к HER-2, антитело к IgE, антитело к CD11a, антитело к CD18, антитело к VEGF, такое как rhuFab V2, hGH, LIV-1, TRAIL, антитела к TNF и рецептору TNF и родственные антитела, рецептор TNF-IgG, фактор VIII, домен B фактора VIII, интерферон-гамма, TGF-бета и антитело к TGF-бета, активин, ингибин, антитело к активину, антитело к ингибину, t-PA, TNKаза, лиганд Apo-2; ингибитор лиганда Apo-2; рецептор Apo-2, Apo-3, DcR3, рецептор гибели и антитела-агонисты (DR4, DR5), WISP, ингибиторы TRAF, антитело к NGF, NGF, NT-3, антитело к IL-8, антитело к IL-9. IL-17, IL-22, антитело к TGF, ДНКаза, GHRP, антиген вируса гепатита, антиген вируса простого герпеса, лептин, IGF-1 и IGFBP1-6, инсулин, FGF-17, белок Toll, лиганды TIE, антитело к CD40, HGF и TPO.
Особенно предпочтительными полипептидами являются рекомбинантные полипептиды, более предпочтительно - антитела, включающие в себя моноклональные антитела и гуманизированные антитела. Такие антитела могут представлять собой полноразмерные антитела или фрагменты антител. Более предпочтительно данные антитела являются человеческими или гуманизированными антителами. Они включают в себя, например, особенно предпочтительные полипептиды 2C4, Fab'2 и полноразмерные антитела против тканевого фактора, антитела против CD20, антитела против HER-2, антитела против IgE, антитела против CD11a, Fab'2 и полноразмерные антитела против CD18, полноразмерные антитела и rhuFab V2 против VEGF, LIV-1, DR4, DR5 и TRAIL.
Еще более предпочтительно, чтобы антитело представляло собой антитело против IgE, антитело против CD18, антитело против VEGF, антитело против тканевого фактора, 2C4, антитело против Her-2, антитело против CD20, антитело против CD40 или антитело против CD11a. Фрагменты антител, охватываемые определением полипептида, предпочтительно содержат легкую цепь, а более предпочтительно - легкую цепь каппа. Такие предпочтительные фрагменты включают в себя, например, Fab, Fab', F(ab')2 или слитый белок связанных лейциновой застежкой (LZ) F(ab')2, а наиболее предпочтительно представляют собой F(ab')2. Наиболее предпочтительные антитела представляют собой F(ab')2 против CD18, F(ab')2 против тканевого фактора, полноразмерное антитело против тканевого фактора и антитело против VEGF.
Здесь термин "антитело" применяют в широчайшем смысле, а конкретно он относится к интактным моноклональным антителам, поликлональным антителам, антителам со множественной специфичностью (например, антителам с двойной специфичностью) формируемым по меньшей мере из двух интактных антител и фрагментов антитела, при условии, что они проявляют желаемую биологическую активность.
Здесь термин "моноклональное антитело" относится к антителу, полученному из совокупности в значительной степени гомогенных антител, т.е. составляющие совокупность отдельные антитела являются идентичными за исключением возможных природных мутаций, которые могут присутствовать в небольших количествах. Моноклональные антитела являются высокоспецифичными, направленными на один антигенный участок. Кроме того, в противоположность препаратам поликлональных антител, которые включают в себя различные антитела против различных детерминант (эпитопов), каждое моноклональное антитело направлено на одну детерминанту на антигене. В дополнение к их специфичности моноклональные антитела обладают тем преимуществом, что их можно синтезировать незагрязненными другими антителами. Добавка "моноклональное" указывает на характер антитела как полученное из в значительной степени гомогенной совокупности антител, и его не следует рассматривать как антитело, требующее получения каким-либо конкретным способом. Например, моноклональные антитела для применения согласно изобретению можно получать способом гибридом, впервые описанным Koehler et al., Nature, 256: 495 (1975), или их можно получать способами рекомбинантных ДНК (см., например, патент США № 4816567). "Моноклональные антитела" также можно выделять из фаговых библиотек антител с применением способов, описанных, например, у Clackson et al., Nature, 352: 624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991).
Моноклональные антитела здесь включают в себя, в частности, "химерные" антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, полученных из конкретных видов или принадлежащих конкретному классу или подклассу антител, тогда как остаток цепи(ей) идентичен или гомологичен соответствующим последовательностям антител, полученных из других видов или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии что они проявляют желаемую биологическую активность (патент США № 4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). Интересующие химерные антитела здесь включают в себя "приматизированные" антитела, включающие в себя антигенсвязывающие последовательности вариабельного домена, полученные от примата, не являющегося человеком (например, обезьяна Старого Света, человекообразная обезьяна и т.п.) и последовательности человеческой константной области.
"Фрагменты антител" содержат часть интактного антитела, предпочтительно включая в себя его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают в себя Fab, Fab', F(ab')2 и фрагменты Fv; ди-антитела; линейные антитела; молекулы одноцепочечных антител и антитела с множественной специфичностью, формируемые из фрагмента(ов) антител.
"Интактное" антитело представляет собой антитело, содержащее антигенсвязывающую вариабельную область, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи, CH1, CH2 и CH3. Константные домены могут представлять собой природные последовательности константных доменов (например, человеческие константные домены с природной последовательностью) или вариант их аминокислотной последовательности. Предпочтительно интактное антитело обладает одной или несколькими эффекторными функциями.
"Эффекторные функции" антител относятся к видам биологической активности, относящимся к области Fc антитела (область Fc с природной последовательностью или область Fc с изменением аминокислотной последовательности). Примеры эффекторных функций антител включают в себя связывание C1q, зависимую от комплемента цитотоксичность, связывание рецептора к Fc, зависимую от антител опосредованную клетками цитотоксичность (ADCC), фагоцитоз, понижающая регуляция рецепторов клеточной поверхности (например, B-клеточный рецептор; BCR), и т.п.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей интактные антитела можно распределить по различным "классам". Существует пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, с тяжелыми цепями, обозначенными α, δ, ε, λ и μ соответственнно. Классы λ и α дополнительно разделяют на подклассы на основе относительно незначительных различий в последовательности и функции CH, например, у людей экспрессируются следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
"Зависимая от антитела опосредованная клетками цитотоксичность" и "ADCC" относятся к опосредованной клетками реакции, в которой неспецифические токсические клетки, экспрессирующие рецепторы к Fc (FcR) (например, натуральные клетки-киллеры (NK), нейтрофилы и макрофаги) распознают связанное антитело на клетке-мишени и далее вызывают лизис клетки-мишени. Первичные клетки, опосредующие ADCC, NK-клетки, экспрессируют только FcRIII, тогда как моноциты экспрессируют FcRI, FcRII и FcRIII. Данные об экспрессии на гематопоэтических клетках FcR обобщены в таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol., 9: 457-492 (1991). Для оценки активности ADCC интересующей молекулы можно провести анализ ADCC in vitro, например, такой как описан в патентах США № 5500362 или 5821337. Пригодные для такого анализа эффекторные клетки включают в себя мононуклеарные клетки периферической крови (PBMC) и натуральные клетки-киллеры (NK). Альтернативно или дополнительно активность ADCC интересующей молекулы можно оценить in vivo, например, в модели на животных, например, так, как описано у Clynes et al.Proc. Natl. Acad. Sci. USA,95: 652-656 (1998).
"Человеческие эффекторные клетки" представляют собой лейкоциты, экспрессирующие один или несколько FcR и выполняющие эффекторные функции. Предпочтительно клетки экспрессируют по меньшей мере FcRIII и выполняют эффекторную функцию ADCC. Примеры человеческих лейкоцитов, опосредующих ADCC, включают в себя мононуклеарные клетки периферической крови (PBMC), натуральные клетки-киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы, где предпочтительными являются PBMC и NK-клетки. Эффекторные клетки можно выделять из их природных источников, например из крови или PBMC, как описано здесь.
"Природные антитела", как правило, представляют собой гетеротетрамерные гликопротеины массой приблизительно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая часть связана с тяжелой цепью одной ковалентной дисульфидной связью, тогда как количество дисульфидных связей между тяжелыми цепями в различных изотипах иммуноглобулинов варьирует. У каждой тяжелой и легкой цепи также есть регулярно расположенные межцепочечные дисульфидные мостики. У каждой тяжелой цепи на одном из концов есть вариабельный домен (VH) со следующим далее рядом константных доменов. У каждой легкой цепи на одном из концов есть вариабельный домен (VL), а на другом ее конце - константный домен. Константный домен легкой цепи выровнен с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. Полагают, что между вариабельными доменами легкой и тяжелой цепей связь формируют конкретные аминокислотные остатки.
Термин "вариабельный" относится к тому факту, что определенные части вариабельных доменов у антител значительно отличаются по последовательности и используются для связывания и узнавания каждым конкретным антителом своего конкретного антигена. Однако вариабельность распространена на протяжении вариабельных доменов антител неравномерно. Она сконцентрирована в трех сегментах, называемых гипервариабельные области, расположенных в вариабельных доменах и легких и тяжелых цепях.
Наиболее высококонсервативные области вариабельных доменов называются каркасными областями (FR). Каждый вариабельный домен природных тяжелой и легкой цепей содержит по четыре FR, преимущественно принимающих конфигурацию бета-слоя, связанных гипервариабельными областями, формирующими петли, связывающие, а в некоторых случаях формирующие, части структуры бета-слоя. Гипервариабельные области в каждой цепи удерживаются вместе в непосредственной близости посредством FRs и с гипервариабельными областями другой цепи участвуют в формировании антигенсвязывающего участка антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены в связывание антитела с антигеном непосредственно не вовлечены, но выполняют разнообразные эффекторные функции, такие как выпадение антител в осадок при опосредованной клетками цитотоксичности (ADCC).
Здесь термин "гипервариабельная область" относится к аминокислотным остаткам антитела, ответственным за связывания антигена. Гипервариабельная область, как правило, содержит аминокислотные остатки из "определяющей комплементарность области", или "CDR" (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или остатки из "гипервариабельной петли" (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk, J. Mol. Biol., 196: 901-917 (1987)). Остатки "каркасной области" или "FR" представляют собой остатки вариабельного домена, отличающиеся от остатков гипервариабельной области, как определено здесь.
Расщепление антител папаином приводит к образованию двух идентичных связывающих антиген фрагментов, называемых фрагменты "Fab", каждый с одним антигенсвязывающим участком, и остаточного фрагмента "Fc", чье название отражает его способность легко кристаллизоваться. Обработка пепсином приводит к образованию фрагмента F(ab')2 с двумя антигенсвязывающими участками и еще способного к перекрестному связыванию антигена.
"Fv" представляет собой минимальный фрагмент антитела, содержащий полный антигенраспознающий и антигенсвязывающий участок. Данная область состоит из димера одной тяжелой цепи и вариабельного домена одной легкой цепи, объединенных нековалентными связями. Именно в данной конфигурации три гипервариабельных области каждого вариабельного домена взаимодействуют для определения антигенсвязывающего участка на поверхности димера VH-VL. Вместе шесть гипервариабельных областей обеспечивают специфичность связывания антигена антителом. Однако даже один вариабельный домен (или половина Fv, содержащая только три гипервариабельных области, специфичные к антигену) обладает способностью распознавать и связывать антиген, хотя и с меньшей, чем у полного связывающего участка аффинностью.
Фрагмент Fab также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab добавлением немногих остатков на карбоксильном конце домена CH1 тяжелой цепи, включающих в себя один или несколько цистеиновых остатков из шарнирной области антитела. Fab'-SH здесь представляет собой обозначение для Fab', в котором цистеиновый остаток(ки) константных доменов несут по меньшей мере одну свободную тиольную группу. Фрагменты антител F(ab')2 исходно получали как пары фрагментов Fab' с шарнирными цистеиновыми остатками между ними. Также известны другие виды химического соединения фрагментов антител.
"Легкие цепи" антител любого вида млекопитающих на основе аминокислотных последовательностей их константных доменов можно отнести к одному из двух четко отличающихся типов, называемых каппа (6) и лямбда (8).
Фрагменты антитела "одноцепочечные Fv" или "scFv" содержат домены антитела VH и VL, где данные домены находятся в одной полипептидной цепи. Предпочтительно полипептид Fv между доменами VH и VL дополнительно содержит полипептидный линкер, дающий возможность scFv сформировать желательную для связывания антигена структуру. Для обзора scFv, см. Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds. (Springer-Verlag, New York, 1994), pp. 269-315. В WO93/16185, патенте США № 5571894 и патенте США № 5587458 описаны фрагменты scFv антитела к ErbB2.
Термин "ди-антитела" относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, где фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH - VL). Посредством применения линкера, слишком короткого, чтобы позволить образование пары между двумя доменами одной и той же цепи, домены принуждают образовывать пары с комплементарными доменами другой цепи и создавать два антигенсвязывающих участка. Ди-антитела более полно описаны, например, в EP 404097; WO 93/11161 и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993).
"Гуманизированные" формы антител, не принадлежащих человеку (например, грызунов), представляют собой антитела, содержащие минимальную последовательность полученную из антитела, не принадлежащего человеку. Как правило, гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки из гипервариабельной области реципиента заменены остатками из обладающей желаемой специфичностью, аффинностью и способностью гипервариабельной области (донорное антитело) видов, не являющегося человеком, таких как мышь, крыса, кролик или приматы, не являющиеся человеком. В некоторых случаях соответствующими остатками, не принадлежащими человеку, заменяют остатки каркасной области (FR) человеческого иммуноглобулина. Кроме того, гуманизированные антитела могут содержать остатки, не присутствующие в реципиентном или донорном антителах. Данные модификации проводят для дополнительного улучшения характеристик антитела. Как правило, гуманизированное антитело содержит по существу весь по меньшей мере один, а как правило, два вариабельных домена, в которых все или по существу все из гипервариабельных петель соответствуют петлям иммуноглобулина, полученного не от человека, а все или по существу все FR представляют собой FR последовательности человеческого иммуноглобулина. Гуманизированное антитело необязательно также содержит по меньшей мере часть константной области иммуноглобулина (Fc), как правило, Fc человеческого иммуноглобулина. Для дополнительных подробностей, см. Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332: 323-329 (1988) и Presta, Curr. Op. Struct. Biol.,2: 593-596 (1992).
"Выделенное" антитело представляет собой антитело, которое идентифицировано и отделено и/или получено из компонентов его природного окружения. Загрязняющие компоненты его природного окружения представляют собой вещества, препятствующие диагностическим или терапевтическим применениям антитела и могут включать в себя ферменты, гормоны и другие белковые и небелковые растворимые вещества. В предпочтительных осуществлениях антитело необходимо очистить (1) до более чем 95% по массе антитела, как определено способом Лоури, а более предпочтительно - более чем 99% по массе, (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности посредством применения секвенатора с вращающимися чашками или (3) до гомогенности при SDS-PAGE в восстанавливающих или невосстанавливающих условиях с применением окраски Кумаси синим или, что предпочтительно, серебром. Выделенное антитело включает в себя антитело in situ в рекомбинантных клетках, так как по меньшей мере один компонент природного окружения антитела не присутствует. Однако, как правило, выделенное антитело получают посредством по меньшей мере одной стадии очистки.
"Лейциновая застежка" представляет собой пептид (часто приблизительно из 20-40 аминокислотных остатков длиной) с несколькими повторяющимися аминокислотами, в котором каждая седьмая аминокислота представляет собой лейциновый остаток. Такие последовательности лейциновых застежек формируют амфипатические альфа-спирали с лейциновыми остатками, расположенными на гидрофобной стороне для формирования димера. Примеры лейциновых застежек здесь включают в себя лейциновую застежку Fos-Jun (O'Shea et al., Science, 245: 646 (1989)), которую можно применять для формирования гетеродимеров (например, антител с двойной специфичностью); лейциновую застежку GCN4 из дрожжей (Landschulz et al., Science, 240: 1759-1764 (1988)), которую можно применять для формирования гомодимеров (например, моноспецифических антител), и лейциновые застежки, находящиеся в других связывающих ДНК белках, таких как C/EBP и c-myc, а также любые их варианты.
Выражение "контрольные последовательности" относится к последовательностям ДНК, необходимым для экспрессии функционально связанных кодирующих последовательностей в конкретном организме-хозяине. Контрольные последовательности, пригодные для бактерий, включают в себя промотор, необязательно последовательность оператора и участок связывания рибосомы.
Нуклеиновая кислота является "функционально связанной", когда ее располагают в функциональной связи с другой последовательностью нуклеиновой кислоты. Например, ДНК предпоследовательности или секреторной лидерной последовательности функционально связана с ДНК полипептида, если она экспрессируется как пробелок, принимающий участие в секреции полипептида; промотор функционально связан с кодирующей последовательностью, если он воздействует на транскрипцию последовательности; или связывающий рибосому участок связан с кодирующей последовательностью, если он расположен так, чтобы содействовать трансляции. Как правило, "функционально связанный" означает, что связанные последовательности ДНК непрерывны и в случае секреторной лидерной последовательности непрерывны на стадии чтения. Связывание проводят, например, посредством лигирования по пригодным рестрикционным участкам. Если такие участки не существуют, применяют синтетические олигонуклеотидные адаптеры или линкеры в соответствии с обычной практикой.
Термин "получение" полипептида, как правило, означает получение полипептида, без клеток в которых он продуцируется.
"Загрязнения из клеток-хозяев" означает загрязнение белками хозяина и другими биомолекулярными загрязняющими веществами, такими как ДНК и клеточный дебрис, в ферментационном бульоне или гомогенате.
Способы осуществления изобретения
В одном из аспектов изобретение относится к способу очистки желательного гетерологического полипептида из бульона или гомогената после микробиологической ферментации, в котором он продуцируется и растворяется. Полипептид уже может быть получен в растворимой фракции или может быть нерастворимым (например, продуцироваться в нерастворимой фракции, фазе или форме) и, следовательно, его приводят в контакт или обрабатывают так, чтобы растворить полипептид. Если полипептид продуцируется в нерастворимом состоянии, его перед добавлением этакридинлактата растворяют посредством воздействия или приведения в контакт с растворяющим средством (как указано выше), например, добавляя такое средство к фракции, содержащей нерастворимый полипептид. Предпочтительно, чтобы полипептид уже находился в растворимой фракции. Данный способ включает в себя добавление к бульону или гомогенату эффективного количества раствора этакридинлактата для осаждения загрязнений из клеток-хозяев, содержащихся в бульоне или гомогенате. Такое добавление производят в условиях, в которых большинство полипептидов остается растворимыми. На следующей стадии из бульона или гомогената, содержащего клеточный дебрис, белки клеток-хозяев, ДНК, РНК и т.п., выделяют желательный полипептид.
Поскольку большинство белков хозяина, осаждаемых этакридинлактатом, несут отрицательный заряд, тогда как интересующий полипептид несет на поверхности положительный заряд, предпочтительно, чтобы интересующий полипептид обладал большей pI, чем средняя pI белков хозяина, содержащихся в загрязнениях из клетки-хозяина так, чтобы его можно было отделить в супернатанте от осажденных белков хозяина. Такую среднюю pI можно определить посредством двумерного геля белков хозяина, где, например, для диапазона полос pI приблизительно от 7,5 до 5,0, среднее составляет 6,25. Альтернативно для такого определения можно применять только изоэлектрофокусирование (представляющее собой первое измерение двухмерного геля), а также хроматофокусировку и расчеты по аминокислотному составу. Наиболее предпочтительными полипептидами являются полипептиды с pI по меньшей мере приблизительно 7, а предпочтительно - приблизительно 7-10.
Предпочтительные полипептиды для применения указаны выше.
Применяемая концентрация этакридинлактата зависит, например, от количества отрицательных зарядов в растворе, находящихся на поверхности большинства клеточных загрязнений, присутствующих в растворе. Следовательно, концентрация этакридинлактата зависит по меньшей мере от количества таких загрязнений из клеток-хозяев, как концентрация ДНК и белка хозяина в растворе. Чем больше концентрация белка хозяина и ДНК в гомогенате, тем большее количество этакридинлактата необходимо. Следовательно, чем более отрицательно заряженные компоненты доступны для образования комплекса с этакридинлактатом и осаждения таким образом, тем большее количества этакридинлактата необходимо для максимизации образования осадка. Предпочтительная концентрация этакридинлактата, как правило, составляет более чем приблизительно 0,1% мас./объем. Более предпочтительной является концентрация этакридинлактата приблизительно 0,1-5%, даже более предпочтительно - приблизительно 0,4-5%, а наиболее предпочтительно - 0,6-5% мас./объем.
Как правило, чем меньше удельная электропроводность раствора, когда проводят осаждение, тем более эффективной является очистка полипептида от клеточного дебриса и ДНК. Удельную электропроводность можно контролировать, например, количеством соли в гомогенате или бульоне или посредством разведения гомогената или бульона водой или другим пригодным растворителем. Предпочтительно, чтобы электрическая проводимость бульона или гомогената после добавления этакридинлактата составляла меньше чем приблизительно 16 миллиСименс (мСм), более предпочтительно - приблизительно 1-15 мСм, даже более предпочтительно - приблизительно 1-10 мСм, а наиболее предпочтительно - приблизительно 1-5 мСм.
Электрическая проводимость раствора в течение осаждения зависит по меньшей мере частично от типа присутствующей в нем соли. Галогениды (например, хлориды или бромиды) не являются предпочтительными анионами для солей, но если они присутствуют, они предпочтительны в концентрации менее чем приблизительно 100 мМ в растворе перед добавлением этакридинлактата и ниже приблизительно 50 мМ после добавления этакридинлактата. Некоторые иллюстративные соли для применения здесь включают в себя буферные соли, TRIS, MES, MOPS, ацетат и цитрат. Концентрация присутствующих солей не может быть больше того количества, которое может осадить этакридинлактат. Точное количество в основном зависит от типа соли и стехиометрического отношения между солью и этакридинлактатом, а предел находится на нижнем пределе стехиометрического отношения, т.е. нижний предел означает большее количество соли относительно этакридинлактата.
pH бульона или гомогената после добавления этакридинлактат зависит, например, от pI полипептида, количества отрицательных поверхностных зарядов на полипептиде, количества загрязнений из клеток-хозяев в растворе и концентрации этакридинлактата. pH предпочтительно не превышает pI полипептида. Как правило, диапазон pH составляет приблизительно 4-10; однако для эффективного осаждения загрязнений из клеток-хозяев pH бульона или гомогената после добавления этакридинлактата предпочтительно не превышает приблизительно 9, так как этакридинлактат становится менее заряженным при pH выше данного, с предпочтительным диапазоном приблизительно 4-9. Более предпочтительно pH бульона или гомогената после добавления этакридинлактата составляет приблизительно 5-9 и даже более предпочтительно - приблизительно 6-9. Чем больше поверхностных отрицательных зарядов на полипептиде, тем ниже pH в данном диапазоне с предпочтительным диапазоном pH для таких полипептидов в размере приблизительно 6-7.
Бульон или гомогенат после добавления этакридинлактата необязательно в течение некоторого периода времени инкубируют при повышенной температуре. Повышать ли температуру и на какой промежуток времени зависит от множества факторов, включающих в себя тип интересующего белка, типа, если имеет место, модификаций интересующего белка, происходящих при воздействии повышенной температуры в течение данного периода в процессе и т.п. Например, для очисток F(ab')2 к тканевому фактору предпочтительны повышенные температуры, тогда как для полноразмерного антитела предпочтительно не применять нагревание или чтобы температура не поднималась выше приблизительно 25°C. Принимая во внимание данные факторы, как правило, диапазон температуры бульона или гомогената после добавления этакридинлактата составляет приблизительно от комнатной температуры до приблизительно 70°C, более предпочтительно - приблизительно от комнатной температуры до приблизительно 65°C со временем удерживания приблизительно в течение 1-60 минут. Если температуру необходимо поднять, предпочтительный диапазон составляет приблизительно от 50 до 65°C со временем удерживания приблизительно 1-60 минут.
В другом аспекте изобретение относится к композиции вещества, представляющей собой ферментационный бульон или гомогенат от микробных клеток, содержащий этакридинлактат и гетерологичный полипептид. Предпочтительно полипептид растворен в таком бульоне или гомогенате. Клетки, полипептид, концентрация и условия для бульона или гомогената указаны выше. Степень растворения полипептида можно определить подходящим видом анализа, таким как указанные выше анализы. Параметры культивирования применяют и получение полипептида проводят обычным способом, таким как описанные ниже процедуры.
A. Отбор нуклеиновой кислоты и ее модификации
Хотя данные полипептиды, такие как антитело, можно получить из любого источника (например, пептидное расщепление интактных антител), предпочтительным является получать их рекомбинантным способом. Кодирующая интересующий полипептид нуклеиновая кислота соответственно представляет собой РНК, кДНК или геномную ДНК из любого источника, при условии что она кодирует интересующий полипептид(ы). Способы для отбора пригодной нуклеиновой кислоты для экспрессии гетерологических полипеитидов (включая их варианты) в микробных хозяевах хорошо известны. Отбор пригодной нуклеиновой кислоты для получения не являющихся антителами полипептидов в микробиологической клеточной культуре хорошо известен в данной области.
Если получают моноклональные антитела, кодирующую моноклональные антитела ДНК легко выделить и определить последовательность с применением традиционных процедур (например, с применением олигонуклеотидных зондов, способных к специфическому связыванию с генами, кодирующими тяжелые и легкие цепи мышиных антител). Для такой ДНК предпочтительным источником служат гибридомные клетки. После выделения ДНК можно поместить в экспрессирующие векторы, которые затем трансформируют в микробные клетки-хозяева, здесь для организации синтеза моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи о рекомбинантной экспрессии кодирующих антитела ДНК у бактерий включают в себя Skerra et al., Curr. Opinion in Immunol.,5: 256-262 (1993) и Pluckthun, Immunol. Revs.,130: 151-188 (1992).
В данной области описаны способы гуманизирования не принадлежащих человеку антител. Предпочтительно гуманизированное антитело несет один или несколько аминокислотных остатков, введенных в него из источника, не являющегося человеком. Эти не принадлежащие человеку аминокислотные остатки часто обозначают как "импортированные" остатки, которые, как правило, берут из вариабельного домена для "импорта". Гуманизирование по существу можно проводить по способу Winter с коллегами (Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332: 323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988)), посредством замещения последовательностей гипервариабельной области для соответствующих последовательностей человеческого антитела. Соответственно такие "гуманизированные" антитела представляет собой гибридные антитела (патент США № 4816567), где соответствующими последовательностями видов, не являющихся человеком, по существу заменен менее чем один интактный человеческий вариабельный домен. На практике гуманизированные антитела, как правило, представляет собой человеческие антитела, в которых некоторые остатки гипервариабельной области и, возможно, некоторые остатки FR заменены остатками из аналогичных участков антител грызунов.
Выбор человеческих вариабельных доменов и тяжелой, и легкой цепей для применения в создании гуманизированных антител очень важен для уменьшения антигенности. По так называемому способу "оптимального приближения" последовательность вариабельного домена антитела грызуна скринируют по отношению к полной библиотеке известных последовательностей человеческих вариабельных доменов. Затем человеческую последовательность, ближайшую к последовательности грызуна, выбирают в качестве каркасной области (FR) для гуманизированного антитела (Sims et al., J. Immunol., 151: 2296 (1993); Chothia et al., J. Mol. Biol., 196: 901 (1987)). В другом способе применяют конкретную каркасную область, выведенную из консенсусной последовательности всех человеческих антител конкретной подгруппы легких или тяжелых цепей. Один и тот же каркас можно применять для нескольких отличающихся гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89: 4285 (1992); Presta et al., J. Immunol., 151: 2623 (1993)).
Кроме того, важно, чтобы антитела гуманизировали с сохранением высокой аффинности в отношении антигена и других благоприятных биологических свойств. Для достижения данной цели по предпочтительному способу гуманизированные антитела получают в процессе анализа исходных последовательностей и различных абстрактных гуманизированных продуктов с применением трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов, как правило, доступны и известны специалистам в данной области. Доступны компьютерные программы, иллюстрирующие и демонстрирующие возможные трехмерные конформационные структуры выбранных в качестве кандидатов иммуноглобулиновых последовательностей. Исследование данных изображений позволяет анализировать возможную роль остатков в функционировании иммуноглобулиновых последовательностей-кандидатов, т.е. анализировать остатки, влияющие на способность выбранного в качестве кандидата иммуноглобулина связывать антиген. Таким образом, остатки FR из реципиента и последовательностей для импорта можно выбрать и объединить так, чтобы достичь желательных характеристик антитела, таких как увеличенная аффинность для антигена(ов)-мишени(ей). В общих чертах остатки гипервариабельной области непосредственно и наиболее существенно вовлечены во влияние на связывание антигена.
Предложены различные формы гуманизированного антитела или аффинно зрелого антитела. Например, гуманизированное антитело или аффинно зрелое антитело может представлять собой фрагмент антитела, такой как Fab, который необязательно конъюгирован с одним или несколькими направляющими средствами для получения иммуноконъюгата. Альтернативно гуманизированное антитело или аффинно зрелое антитело может представлять собой интактное антитело, такое как интактное антитело IgG1.
Фрагменты Fab'-SH можно непосредственно получать из E. coli и химически связывать с формированием фрагментов F(ab')2 (Carter et al., Bio/Technology, 10: 163-167 (1992)). По другому подходу фрагменты F(ab')2 можно выделять непосредственно из культуры рекомбинантных клеток-хозяев. Практикующим специалистам очевидны другие способы для получения фрагментов антител. В других осуществлениях выбранное антитело представляет собой одноцепочечный фрагмент Fv (scFv) (WO 93/16185; патенты США №№ 5571894 и 5587458). Фрагмент антитела может также представлять собой "линейное антитело", например, как описано в патенте США № 5641870. Такие фрагменты линейного антитела могут являться моноспецифическими или являться антителами с двойной специфичностью.
Антитела с двойной специфичностью представляют собой антитела, специфично связывающиеся по меньшей мере с двумя различными эпитопами. Иллюстративные антитела с двойной специфичностью могут связываться с двумя различными эпитопами белка Dkk-1. Антитела с двойной специфичностью можно получать как полноразмерные антитела или фрагменты антител (например, F(ab')2 антител с двойной специфичностью).
По другому подходу вариабельные домены антител с желательными специфичностями связывания (участки взаимодействия антитело-антиген) сливают с последовательностями константных доменов иммуноглобулинов. Слияние предпочтительно проводят с константным доменом тяжелой цепи иммуноглобулина, содержащим по меньшей мере часть шарнирной области областей CH2 и CH3. Предпочтительно включать в состав первую константную область тяжелой цепи (CH1), содержащую участок, необходимый для связывания легкой цепи, присутствующую по меньшей мере в одном из слияний. ДНК, кодирующие объединения тяжелых цепей иммуноглобулинов и, если желательно, легких цепей иммуноглобулинов, вставляют в раздельные экспрессирующие векторы и котрансфецируют в пригодный бактериальный организм-хозяин. Это обеспечивает большую гибкость в регуляции взаимных пропорций трех полипептидных фрагментов в осуществлениях, когда применяемые в конструкции неравные отношения трех полипептидных цепей обеспечивают оптимальные выходы. Однако когда экспрессия по меньшей мере двух полипептидных цепей в равном соотношении приводит к высоким выходам или когда отношения не имеют особого значения, в один экспрессирующий вектор можно вставлять кодирующие последовательности для двух или всех трех полипептидных цепей.
В предпочтительном осуществлении данного подхода антитела с двойной специфичностью состоят из гибридной тяжелой цепи иммуноглобулина с первым специфическим участком связывания на одной ветви и гибридной парой тяжелая цепь-легкая цепь (обеспечивающей второй специфический участок связывания) на другой ветви. Обнаружено, что данная ассиметричная структура облегчает разделение желательного соединения с двойной специфичностью от нежелательных сочетаний иммуноглобулиновых цепей, так как присутствие легкой цепи иммуноглобулина только в половине молекулы с двойной специфичностью облегчает путь выделения. Данный подход описан в WO 94/04690. Для дополнительных подробностей о получении антител с двойной специфичностью см., например, Suresh et al., Methods in Enzymology, 121: 210 (1986).
По другому подходу, описанному в патенте США № 5731168, можно так сконструировать поверхность взаимодействия между парой молекул антител, чтобы максимизировать процент гетеродимеров, выделяемых из культуры рекомбинантных клеток. Предпочтительная поверхность взаимодействие содержит по меньшей мере часть домена CH3 константного домена антитела. В данном способе боковые цепи одной или нескольких аминокислот поверхности взаимодействия молекулы первого антитела заменяют более крупными боковыми цепями (например, тирозином или триптофаном). На поверхности взаимодействия молекулы второго антитела посредством замещения больших боковых цепей аминокислот меньшими боковыми цепями (например, аланином или треонином) создают компенсаторные "углубления" идентичного или сходного с большой боковой цепью(ями) размера. Это обеспечивает механизм увеличения выхода гетеродимеров по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Антитела с двойной специфичностью включают в себя перекрестно связанные или "гетероконъюгированные" антитела. Например, одно из антител в гетероконъюгате может являться связанным с авидином, а другое - с биотином. Такие антитела, например, предлагали для направления клеток иммунной системы к нежелательным клеткам (патент США № 4676980) и для лечения инфекции ВИЧ (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгированные антитела можно получать с применением любых подходящих для перекрестного связывания способов. Пригодные перекрестно связывающие средства хорошо известны в данной области и наряду с рядом способов для перекрестного связывания описаны, например, в патенте США № 4676980.
Также в литературе описаны способы получения антител с двойной специфичностью из фрагментов антител. Например, антитела с двойной специфичностью можно получать с применением химического связывания. Brennan et al., Science, 229: 81 (1985) описывают способ, в котором интактные антитела протеолитически расщепляют с получением фрагментов F(ab')2. Данные фрагменты получают в присутствии комплексообразователя дитиолов арсенита натрия для стабилизации соседних дитиолов и предотвращения формирования межмолекулярных дисульфидных связей. Затем полученные фрагменты Fab' преобразуют в производные тионитробензоата (TNB). Одно из производных Fab'-TNB затем обратно превращают в Fab'-тиол восстановлением меркаптоэталамином и смешивают с эквимолярным количеством другого производного Fab'-TNB с формированием антитела с двойной специфичностью. Полученные антитела с двойной специфичностью можно применять как средства для селективной иммобилизации ферментов.
Кроме того, фрагменты Fab'-SH можно непосредственно получать из E. coli и химически связывать с формированием антител с двойной специфичностью (Shalaby et al., J. Exp. Med., 175: 217-225 (1992)).
Также описаны различные способы для получения и выделения антител с двойной специфичностью непосредственно из культуры рекомбинантных клеток. Например, антитела с двойной специфичностью получены с применением лейциновых застежек (Kostelny et al., J. Immunol., 148: 1547-1553 (1992)). Пептиды с лейциновыми застежками из белков Fos и Jun связывают с частями Fab' двух различных антител посредством слияния генов. Гомодимеры антител восстанавливают в шарнирной области для формирования мономеров, а затем снова окисляют с формированием гетеродимеров антител. Данный способ также можно применять для получения гомодимеров антител. Технология "ди-антител", описанная Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993), предоставляет альтернативный механизм получения фрагментов антител с двойной специфичностью. Фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) посредством линкера, являющегося слишком коротким, чтобы позволить спаривание двух доменов на одной и той же цепи. Таким образом, домены VH и VL одного фрагмента заставляют образовывать пару с комплементарными доменами VL и VH другого фрагмента, тем самым формируя два антигенсвязывающих участка. Также описана другая стратегия получения фрагментов антител с двойной специфичностью посредством применения димеров одноцепоечных Fv (sFv) (Gruber et al., J. Immunol., 152: 5368 (1994)).
Рассматривают антитела более чем с двумя валентностями. Например, можно получать триспецифические антитела (Tutt et al., J. Immunol., 147: 60 (1991)).
Молекулы нуклеиновой кислоты, кодирующие варианты полипептидов, получают различными известными в данной области способами. Данные способы включают в себя в качестве неограничивающих примеров выделение из природного источника (в случае встречающихся в природе вариантов аминокислотной последовательности) или получение опосредованным олигонуклеотидами (или сайт-специфическим) мутагенезом, ПЦР-мутагенезом или кассетным мутагенезом ранее полученного варианта или безвариантной версии полипептида.
Может являться желательным модифицировать антитело по изобретению в отношении эффекторной функции, например, так чтобы усилить связывание рецептора Fc. Этого можно достичь введением одной или нескольких аминокислотных замен в область Fc антитела. Альтернативно или дополнительно в область Fc можно вводить цистеиновый остаток(ки), тем самым обеспечивая образование межцепочечной дисульфидной связи в данной области.
Для увеличения времени полужизни антитела в антитело (особенно во фрагмент антитела) можно вводить эпитоп связывания рецептора реутилизации, как, например, описано в патенте США 5739277. Как применяют здесь, термин "эпитоп связывания рецептора реутилизации" относится к эпитопу области Fc молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), ответственному за увеличение времени полужизни молекулы IgG в сыворотке in vivo.
Здесь рассматривают другие модификации антитела. Например, антитело можно связывать с одним из множества небелковых полимеров, например полиэтиленгликолем, полипропиленгликолем, полиоксиалкиленами или сополимерами полиэтиленгликоля и полипропиленгликоля.
B. Вставка нуклеиновой кислоты в реплицируемый вектор
Гетерологичную нуклеиновую кислоту (например, кДНК или геномную ДНК) соответствующим образом вставляют в реплицируемый вектор для экспрессии в микроорганизме под контролем подходящего промотора. Для данной цели пригодно множество векторов, а выбор соответствующего вектора главным образом зависит от размера вставляемой в вектор нуклеиновой кислоты и конкретной клетки-хозяина, трансформируемой вектором. Каждый вектор содержит различные компоненты в зависимости от конкретной клетки-хозяина, с которой он совместим. В зависимости от конкретного типа хозяина компоненты вектора, как правило, включают в себя в качестве неограничивающих примеров одно или несколько из следующих: сигнальная последовательность, точку начала репликации, один или несколько маркерных генов, промотор и последовательность терминации транскрипции.
В общих чертах в связи с микробными хозяевами применяют плазмидные векторы, содержащие последовательность репликона и контрольные последовательности, полученные из видов, совместимых с клеткой-хозяином. Как правило, вектор несет участок репликации, а также маркирующие последовательности, способные обеспечить фенотипическую селекцию трансформированных клеток. Например, E. coli, как правило, трансформируют с применением pBR322 плазмиды, полученной из вида E. coli (см., например, Bolivar et al., Gene, 2: 95 (1977)). pBR322 содержит гены устойчивости к ампициллину и тетрациклину и, таким образом, обеспечивает простые средства для идентификации трансформированных клеток. Также плазмида pBR322 или другая бактериальная плазмида или фаг, как правило, содержит или модифицирована так, чтобы содержать промоторы, которые можно применять у хозяина для экспрессии селективных маркерных генов.
(i) Компонент сигнальной последовательности
ДНК, кодирующая интересующий здесь полипептид, можно экспрессировать не только непосредственно, но также и в виде гибрида с другим полипептидом, предпочтительно сигнальной последовательностью или другим полипептидом со специфическим участком расщепления на N-конце зрелого полипептида. В общих чертах сигнальная последовательность может являться компонентом вектора или она может представлять собой часть полипептидной ДНК, вставляемой в вектор. Выбираемая гетерологичная сигнальная последовательность должна представлять собой узнаваемую и процессируемую (т.е. расщепляемую сигнальной пептидазой) клеткой-хозяином последовательность.
Для прокариотических клеток-хозяев, не распознающих и не процессирующих природную сигнальную последовательность или сигнальную последовательность эукариотического полипептида, сигнальную последовательность можно заместить прокариотической сигнальной последовательностью, например, выбранной из группы, состоящей из лидирующих последовательностей lamB, ompF, щелочной фосфатазы, пенициллиназы, lpp, или термостабильного энтеротоксина II. Для секреции в дрожжах сигнальная последовательность может представлять собой, например, лидерную последовательность дрожжевой инвертазы, лидерную последовательность фактора альфа (включая лидирующие последовательности факторов Saccharomyces и Kluyveromyces, где последний описан в патенте США № 5010182), или лидерную последовательность кислой фосфатазы, лидерную последовательность глюкоамилазы C. albicans (EP 362179, опубликованная 4 апреля 1990 года) или сигнал, описанный в WO 90/13646, опубликованной 15 ноября 1990 года.
(ii) Компонент начала репликации
Экспрессирующие векторы содержат последовательность нуклеиновой кислоты, позволяющей вектору реплицироваться в одном или нескольких выбранных клетках-хозяевах. Такие последовательности хорошо известны для множества микроорганизмов. Начало репликации из плазмиды pBR322 пригодно для большинства грамотрицательных бактерий, таких как E. coli.
(iii) Компонент гена селекции
Экспрессирующие векторы, как правило, содержат ген селекции, также обозначаемый как селективный маркер. Данный ген кодирует белок, необходимый для выживания или роста трансформированной клетки-хозяина, растущей в культуре на селективной среде. Клетки-хозяева, не трансформированные вектором, содержащим селективный ген, не выживают в среде для культивирования. Данный селективный маркер отличен от генетических маркеров, и его применяют и определяют в данном изобретении. Типичные гены селекции кодируют белки, которые (a) дают устойчивость к антибиотикам или другим токсинам, например ампициллину, неомицину, метотрексату или тетрациклину, (b) дополняют ауксотрофный дефицит, отличный от дефицита, вызванного присутствием генетического маркера(ов), или (c) поставляют важные пищевые компоненты, недоступные из комплексной среды, например ген, кодирующий рацемазу D-аланина у Bacilli.
В одном из примеров схемы селекции для задержки роста клетки-хозяина применяют лекарственной средство. В данном случае те клетки, которые успешно трансформированы интересующей нуклеиновой кислотой, продуцируют полипептид, дающий устойчивость к лекарственному средству и, таким образом, выживают в режиме селекции. В примерах такой доминантной селекции применяют лекарственные средства: неомицин (Southern et al., J. Molec. Appl. Genet., 1: 327 (1982)), микофеноловую кислоту (Mulligan et al., Science, 209: 1422 (1980)) или гигромицин (Sugden et al., Mol. Cell. Biol., 5: 410-413 (1985)). В трех приведенных выше примерах применяют бактериальные гены по эукариотическим контролем для передачи устойчивости к соответствующему лекарственному средству G418, или неомицину (генетицин), xgpt (микофеноловая кислота), или гигромицину соответственно.
(iv) Компонент промотора
Экспрессирующий вектор для получения интересующего полипептида содержит подходящий промотор, который узнает организм хозяина и который функционально связан с нуклеиновой кислотой, кодирующей интересующий белок. Пригодные для применения в прокариотических хозяевах промоторы включают в себя промоторные системы бета-лактамазы и лактозы (Chang et al., Nature, 275: 615 (1978); Goeddel et al., Nature, 281: 544 (1979)), промоторную систему арабинозы (Guzman et al., J. Bacteriol., 174: 7716-7728 (1992)), промоторную систему щелочной фосфатазы, триптофана (trp) (Goeddel, Nucleic Acids Res., 8: 4057 (1980) and EP 36776) и гибридные промоторы, такие как промотор tac (deBoer et al., Proc. Natl. Acad. Sci. USA, 80: 21-25 (1983)). Однако пригодны и другие известные промоторы. Их нуклеотидные последовательности опубликованы, тем самым, позволяя специалистам лигировать их в ДНК, кодирующую интересующий полипептид (Siebenlist et al., Cell, 20: 269 (1980)), с применением линкеров или адаптеров для обеспечения любых необходимых участков рестрикции.
Также промоторы для применения в бактериальных системах, как правило, содержат последовательность Шайна-Дальгарно (S.D.), функционально связанную с ДНК, кодирующей интересующий полипептид. Промотор можно удалить из ДНК бактериального источника посредством расщепления ферментом рестрикции и вставить в вектор, содержащий желаемую ДНК.
Промоторы, пригодные для применения в дрожжах, хорошо известны в данной области. Примеры пригодных промоторных последовательностей для применения в дрожжевых хозяевах включают в себя промоторы 3-фосфоглицераткиназы (Hitzeman et al., J. Biol. Chem., 255: 2073 (1980)) или других гликолитических ферментов (Hess et al., J. Adv. Enzyme Reg., 7: 149 (1968); Holland, Biochemistry, 17: 4900 (1978)), таких как енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомираза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа.
Другие дрожжевые промоторы, представляющие собой индуцибельные промоторы с дополнительным преимуществом транскрипции, контролируемой условиями роста, представляют собой промоторные области алкогольдегидрогеназы 2, изоцитохрома C, кислой фосфатазы, деструктивных ферментов, ассоциированных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, ответственных за утилизацию мальтозы и галактозы. Пригодные векторы и промоторы для применения при экспрессии в дрожжах дополнительно описаны в EP 73657.
(v) Конструирование и анализ векторов
Конструирование пригодных векторов, содержащих один или несколько перечисленных выше компонентов, включает в себя применение стандартных способов лигирования. Выделенные плазмиды или фрагменты ДНК расщепляют, приспосабливают и снова лигируют в форме, желательной для получения необходимых плазмид.
Для анализа с целью подтверждения корректных последовательностей в сконструированных плазмидах смеси после лигирования применяют для трансформации штамма 294 E. coli K12 (ATCC 31446) или других штаммов, а клетки с успешной трансформацией отбирают по устойчивости к ампициллину или тетрациклину, когда подходит. Плазмиды для трансформантов получают, анализируют расщеплением рестрикционными эндонуклеазами и/или определяют поледовательность способом Sanger et al., Proc. Natl. Acad. Sci. USA, 74: 5463-5467 (1977) или Messing et al., Nucleic Acids Res., 9: 309 (1981) или способом Maxam et al., Methods in Enzymology, 65: 499 (1980).
C. Отбор и трансформация клеток-хозяев
Подходящие клетки-хозяева для клонирования или экспрессии ДНК в векторах согласно изобретению представляют собой любые микробные клетки, включая прокариотические клетки или клетки грибов, включая дрожжи. Пригодные для данной цели прокариоты включают в себя бактерии, как определено выше, предпочтительно эубактерии, такие как грамотрицательные или грамположительные организмы. Примеры включают в себя Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P описанные в DD 266710, опубликованной 12 апреля 1989 года), Pseudomonas, такие как P. aeruginosa и Streptomyces. Одна из предпочтительных в качестве хозяина для клонирования E. coli представляет собой E. coli 294 (ATCC 31, 446), хотя также пригодны другие штаммы, такие как E. coli B, E. coli X1776 (ATCC 31537) и E. coli W3110 (ATCC 27325). Данные примеры являются иллюстративными, а не ограничивающими. Также в качестве начальных хозяев можно применять мутантные клетки любых из указанных выше штаммов, которые затем дополнительно подвергают мутациям, чтобы содержать по меньшей мере минимальный требуемый здесь генотип.
Штамм E. coli W3110 является предпочтительным родительским хозяином E. coli, так как он является общим штаммом-хозяином для ферментации продуктов рекомбинантных ДНК. Примеры исходных хозяев E. coli для применения в качестве родительских хозяев наряду с их генотипами включены в таблицу ниже:
Также пригодны промежуточные формы при получении штамма 36F8, т.е. 27B4 (патент США № 5304472) и 35E7 (изолят спонтанных устойчивых к температуре колоний, растущий лучше, чем 27B4). Дополнительный пригодный штамм представляет собой штамм E. coli с мутантной периплазматической протеазой(ами), описанный в патенте США № 4946783, выданный 7 августа 1990 года.
Указанные выше штаммы можно получать посредством хромосомной интеграции родительского штамма или другими способами, включая те, что указаны в примерах ниже.
Полноразмерные антитела можно получать в E. coli по руководствам WO 02/061090, опубликованной 8 августа 2002 года.
В дополнение к прокариотам подходящими экспрессирующими хозяевами для кодирующих полипептиды векторов являются эукариотические микроорганизмы, такие как мицелиальные грибы или дрожжи. Часто используемым микроорганизмом, принадлежащим низшим эукариотам, является Saccharomyces cerevisiae. Другие виды включают в себя Schizosaccharomyces pombe (Beach and Nurse, Nature, 290: 140 (1981); EP 139383, опубликованный 2 мая 1985 года); хозяева Kluyveromyces (патент США № 4943529; Fleer et al., Bio/Technology, 9: 968-975 (1991)), например, такие как K. lactis (MW98-8C, CBS683, CBS4574; Louvencourt et al., J. Bacteriol., 737 (1983)), K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906; Van den Berg et al., Bio/Technology, 8: 135 (1990)), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070; Sreekrishna et al., J. Basic Microbiol., 28: 265-278 (1988)); Candida; Trichoderma reesia (EP 244234); Neurospora crassa (Case et al., Proc. Natl. Acad. Sci. USA, 76: 5259-5263 (1979)); Schwanniomyces, такие как Schwanniomyces occidentalis (EP 394538, опубликованный 31 октября 1990 года) и мицелиальные грибы, например, такие как Neurospora, Penicillium, Tolypocladium (WO 91/00357, опубликованная 10 января 1991 года) и хозяева Aspergillus, такие как A. nidulans (Ballance et al., Biochem. Biophys. Res. Commun., 112: 284-289 (1983); Tilburn et al., Gene, 26: 205-221 (1983); Yelton et al., Proc. Natl. Acad. Sci. USA, 81: 1470-1474 (1984)) и A. niger (Kelly and Hynes, EMBO J., 4: 475-479 (1985)). Здесь пригодны метилотрофные дрожжи, и они включают в себя в качестве неограничивающих примеров дрожжи, способные к росту на метаноле, выбранные из родов, включающих в себя Hansenula, Candida, Kloeckera, Pichia, Saccharomyces, Torulopsis и Rhodotorula. Список конкретных видов, являющихся примерами данного класса дрожжей, можно найти у C. Anthony, The Biochemistry of Methylotrophs, 269 (1982).
Нуклеиновую кислоту, кодирующую интересующий полипептид, вносят в клетки-хозяева. Предпочтительно это проводят, трансформируя клетки-хозяева описанными выше экспрессирующими векторами и культивируя в традиционной питательной среде, модифицируемой, как необходимо для включения различных промоторов.
В зависимости от применяемой клетки-хозяина трансформацию проводят с применением стандартных способов, пригодных для таких клеток. Для прокариотических клеток и других клеток, содержащих существенные барьеры в виде клеточной стенки, как правило, используют обработку кальцием с применением хлорида кальция, как описано в части 1,82 у Sambrook et al., Molecular Cloning: A Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989). В другом способе трансформации применяют полиэтиленгликоль/DMSO, как описано у Chung and Miller, Nucleic Acids Res., 16: 3580 (1988). Трансформацию у дрожжей, как правило, проводят по способу Van Solingen et al., J. Bact., 130:946 (1977) и Hsiao et al., Proc. Natl. Acad. Sci. (USA), 76:3829 (1979). Однако для введения ДНК в клетки также можно применять другие способы, такие как посредством микроинъекции, электропорации, слияния бактериальных протопластов с интактными клетками или поликатионов, например полибрена, полиорнитина.
D. Культивирование клеток-хозяев
Применяемые для получения полипептидов по изобретению прокариотические клетки растят в известных в данной области и подходящих для культивирования выбранных клеток-хозяев средах, включающих в себя среды, как правило, описанные у Sambrook et al., выше. Среды, пригодные для бактерий, включают в себя в качестве неограничивающих примеров среду AP5, питательный бульон, бульон Луриа-Бертани (LB), минимальную среду Нейдхардта и минимальную или полную среду C.R.A.P. с необходимыми питательными добавками. В предпочтительных осуществлениях среды также содержат средство для селекции, выбираемое на основе конструкции экспрессирующего вектора, для селективного роста прокариотических клеток, содержащих экспрессирующий вектор. Например, для роста клеток, экспрессирующих ген устойчивости к ампициллину, в среды добавляют ампициллин. Также кроме источников углерода, азота и неорганического фосфата можно включать любые необходимые добавки в соответствующих концентрациях, вводимые отдельно или в качестве смеси с другой добавкой или средой, такой как комплексный источник азота. Необязательно среда для культивирования может содержать одно или несколько восстанавливающих средств, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликолата, дитиоэритриола и дитиотреитола.
Примеры пригодных сред приведены в патентах США №№ 5304472 и 5342763. Среда C.R.A.P. с ограничением фосфата состоит из 3,57 г (NH4)2(SO4), 0,71 г цитрата Na-2H2O, 1,07 г KCl, 5,36 г дрожжевого экстракта (сертифицирован), 5,36 г HycaseSF™-Sheffield с доведением pH посредством KOH до 7,3, доведенных необходимым количеством до 872 мл H2O SQ и проавтоклавированных; охлажденных до 55°C и дополненных 110 мл 1 М MOPS pH 7,3, 11 мл 50% глюкозы, 7 мл 1 М MgSO4). Затем можно добавить карбенициллина в концентрации 50 мкг/мл для индукции культуры.
Прокариотические клетки-хозяева культивируют при подходящих температурах. Например, для роста E. coli предпочтительным диапазоном температуры является приблизительно от 20°C до приблизительно 39°C, более предпочтительно приблизительно от 25°C до приблизительно 37°C, и даже более предпочтительно приблизительно 30°C.
Когда используют промотор щелочной фосфатазы, применяемые для получения интересующего полипептида по настоящему изобретению клетки E. coli культивируют в подходящей среде, в которой можно частично или полностью индуцировать промотор щелочной фосфатазы, например, как в общих чертах описано у Sambrook et al., выше. Культивирование никогда не должно происходить в отсутствие неорганического фосфата или на уровнях нехватки фосфата. Во-первых, среда содержит неорганический фосфат в количестве, большем, чем уровень индукции синтеза белков и достаточном для роста бактерии. Так как клетки растут и утилизируют фосфат, они уменьшают уровень фосфата в среде, тем самым, вызывая индукцию синтеза полипептида.
Если промотор представляет собой индуцибельный промотор, для того, чтобы произошла индукция клетки, как правило, культивируют до достижения определенной оптической плотности, например, до A550 в размере приблизительно 200 с применением процесса с высокой клеточной плотностью, где начинают индукцию (например, добавлением индуктора, посредством уменьшения компонента среды и т.п.) для индукции экспрессии гена, кодирующего интересующий полипептид.
Также в соответствующих концентрациях можно добавлять любые необходимые добавки, известные специалистам в данной области, вводимые отдельно или в качестве смеси с другой добавкой или средой, такой как комплексный источник азота. pH среды может представлять собой любой pH приблизительно от 5 до 9, в основном в зависимости от организма хозяина. Для E. coli pH предпочтительно представляет собой приблизительно от 6,8 до приблизительно 7,4, а более предпочтительно - приблизительно 7,0.
Одна из селективных сред, которые можно применять для культивирования дрожжей, представляет собой синтетический полный агар с декстрозой с отсутствием урацила (SCD-Ura), получаемая, как описано у Kaiser et al., Methods in Yeast Genetics (Cold Spring Harbor Press, Cold Spring Harbor, NY, 1994), p. 208-210.
E. Выявление экспрессии
Генную экспрессию в образце можно измерить непосредственно, например, посредством традиционных блотинга по Саузерну, "нозерн"-блоттинга, с количественным подсчетом транскрипции мРНК (Thomas, Proc. Natl. Acad. Sci. USA, 77: 5201-5205 (1980)), дот-блоттинга (анализ ДНК), или гибридизации in situ, с применением соответствующим образом меченного зонда, основанного на последовательностях полипептида. Можно применять различные метки, наиболее часто применяют радиоизотопы, а конкретно 32P. Однако можно применять также другие способы, такие как использование модифицированных биотином нуклеотидов для введения в полинуклеотид. Затем биотин служит в качестве участка связывания авидина или антител, которые можно метить обширным множеством меток, таких как радиоизотопы, флуоресцирующие вещества, ферменты и т.п. Альтернативно можно применять анализы или гели для выявления белка.
F. Очистка полипептидов
При применении рекомбинантных способов полипептиды согласно изобретению получают внутри клетки или в периплазматическом пространстве. Если полипептид образован внутри клетки, в качестве первой стадии для получения клеточного бульона или гомогената, например, посредством центрифугирования или ультрацентрифугирования удаляют дебрис из клеток-хозяев или лизированных клеток (например, получающихся в результате гомогенизации)
Затем согласно изобретению определенные выше клеточные загрязнения удаляют из гомогената или бульона посредством осаждения с применением этакридинлактата в условиях, указанных выше, а полученную в результате смесь обрабатывают так, чтобы получить интересующий полипептид в растворимой форме.
Отделение интересующего полипептида от бульона или гомогената можно проводить любыми пригодными способами, включая способы, хорошо известные в данной области, такие как центрифугирование или фильтрация. Предпочтительно отделение проводят с применением центрифугирования или фильтрации в тангенциальном потоке, например, с применением фильтра приблизительно от 300 килодальтон до 1 микрона.
После того как полипептид отделят от бульона или гомогената, его можно очищать любыми известными способами, включая хроматографию или фильтрацию, такую как ультрафильтрацию/диафильтрацию или фильтрацию в тангенциальном потоке. Конкретно примерами пригодных способов фильтрации являются следующие способы, как отдельно так и в сочетании с конкретным способом(ами), применяемым в зависимости от типа полипептида: аффинную хроматографию с иммобилизованным металлом (IMAC); разделение в двух водных фазах (ATPS); фракционирование на иммуноаффинных или ионообменных колонках; осаждение этанолом; ВЭЖХ с обращенной фазой; хроматография на основе гидрофобных взаимодействий (HIC); хроматография на диоксиде кремния; хроматография на ионообменной смоле, такой как S-SEPHAROSE™ и DEAE; хроматофокусирование; SDS-PAGE; осаждение сульфатом аммония; ультрафильрация/диафильрация, фильтрация в тангенциальном потоке и гель-фильтрация с применением, например, SEPHADEX™ G-75.
Например, как часть общего процесса получения белка полипептид можно приводить в контакт с иммобилизованным реагентом, связывающим или модифицирующим полипептид. Таким образом, полипептид можно подвергать аффинной хроматографии, где иммобилизованный реагент, специфически связывающийся с полипептидом, таким как антитело, захватывает антитело, а загрязнения проходят через колонку аффинной хроматографии. Далее полипептид можно элюировать с колонки посредством изменения условий, так что полипептид более не связывается с иммобилизованным реагентом. Иммобилизованный реагент также может представлять собой фермент, такой как протеаза, который модифицирует полипептид (Sahni et al., Anal. Biochem.,193: 178-185 (1991) и Voyksner et al., Anal. Biochem.,188: 72-81 (1990)).
Другим типом процесса очистки является фильтрация. Фильтрацию из жидкостей примесей с малым размером частиц проводят с использованием различных пористых фильтрующих сред, через которые загрязненная композиция проходит так, что примеси остаются на фильтре. Удержание примесей может происходить в результате механического фильтрования или электрокинетического захвата и адсорбции частиц. При механическом фильтровании частица удерживается в результате физической задержки, когда она пытается пройти через пору, меньшую, чем она сама. В случае механизмов электрокинетического захвата частица сталкивается с поверхностью в пористом фильтре и задерживается на поверхности силами притяжения с малым радиусом действия. Для достижения электрокинетического захвата для изменения характеристик поверхностного заряда фильтра можно применять системы изменения заряда (см., например, WO 90/11814). Например, когда примеси для удаления являются анионами, для изменения характеристик заряда фильтра можно применять модификатор с зарядом катиона, так что примесь удерживается фильтром.
Моноклональные антитела можно соответствующим образом отделять от осадка посредством традиционных процедур очистки антител, например, таких как гель-фильтрация или электрофорез, диализ, HIC, аффинная хроматография, например SEPHAROSE™ с белком A, хроматография с белком-G, аффинность к антигену или аффинность к IgG, гомогенизация, очистка фильтрацией при центрифугировании, осаждением, например посредством обработки сульфатом аммония, полиэтиленгликолем или каприловой кислотой, ионообменная хроматография, например, с применение таких смол, как гидроксиапатит, например, смол, содержащих фосфат кальция, таких как керамический гидроксиапатит и BIOGEL HT™, и анионообменных смол, включая смолы с положительно заряженными остатками (при нейтральном pH), такие как диэтиламиноэтан (DEAE), полиэтиленимин (PEI) и четвертичный аминоэтан (QAE), например смола Q-SEPHAROSE FAST FLOW™ (Pharmacia), смола DEAE-SEPHAROSE FAST FLOW™, смола DEAE-TOYOPEARL™, смола QAE-TOYOPEARL™, смола POROS-Q™, смола FRACTOGEL-DMAE™, смола FRACTOGEL EMD-TMAE™, MATREX CELLUFINE DEAE™ и т.п. Способы выделения и очистки антител дополнительно описаны в Antibodies: A Laboratory Manual"; Harlow and Lane, eds. (Cold Spring Harbor Laboratories, New York: 1988).
В одном конкретном осуществлении стадия получения включает в себя приведение растворенного полипептида в контакт с твердой фазой, на которой иммобилизован реагент, связывающий или модифицирующий полипептид. В одном осуществлении твердая фаза помещена в колонку, а иммобилизованный реагент захватывает полипептид. В другом осуществлении реагент химически и/или физически модифицирует полипептид и мобилизует на твердой фазе, которая, например, помещена в колонку, а композиция проходит через колонку. Например, полипептид может содержать домен-предшественник, который иммобилизованный реагент удаляет в качестве части процесса получения, например, полипептид-предшественник представляет собой антитело с доменом димеризации лейциновой застежки, который удаляет иммобилизованный пепсин в процессе получения.
В данном осуществлении композиция, содержащая полипептид и выщелоченный реагент (и необязательно одну или несколько дополнительных примесей), проходит через фильтр, несущий заряд, противоположный заряду реагента при pH композиции, так чтобы удалить выщелоченный реагент из композиции. Фильтр может являться положительно заряженным для удаления примесей, заряженных при pH композиции отрицательно, таких как кислотные протеазы, белок A, белок G или другие реагенты, которые можно выщелачивать из аффинных колонок. Альтернативно фильтр может являться заряженным отрицательно для удаления примесей, заряженных при pH композиции положительно, таких как основные протеазы. Предпочтительно характеристики заряда интересующего полипептида в композиции, проходящей через фильтр, таковы, что полипептид фильтром значительно не удерживается и проходит через него. Фильтр можно поместить "на одной линии" со стоком, обработанным на предыдущей стадии (т.е. сток, непосредственно проходящий через фильтр). Этого можно достичь соединением фильтра непосредственно с выходным портом колонки, перед тем как сток собирается в сборный резервуар. Фильтр можно регенерировать с применением пригодных для используемого типа фильтров способов.
Для очистки фрагментов антител также применят HIC. См., например, Inouye et al., Protein Engineering, pp. 6, 8 and 1018-1019 (1993); Inouye et al., Animal Cell Technology: Basic & Applied Aspects, 5: 609-616 (1993); Inouye et al., Journal of Biochemical and Biophysical Methods, 26: 27-39 (1993); Morimoto et al., Journal of Biochemical and Biophysical Methods, 24: 107-117 (1992) и Rea et al., Journal of Cell. Biochem., Suppl. 0, Abstract No. X1-206 (17 Part A), p. 50 (1993). Колонки HIC, как правило, содержат основной матрикс (например, агарозу с перекрестными сшивками или синтетическое сополимерное вещество), с которым связываютися гидрофобные лиганды (например, алкильные или арильные группы). Большинство колонок для HIC доступны коммерчески. Примеры включают в себя в качестве неограничивающих примеров колонку Phenyl SEPHAROSE 6 FAST FLOW™ с низким или высоким замещением (Pharmacia LKB Biotechnology, AB, Sweden); колонку Phenyl SEPHAROSE™ High Performance (Pharmacia LKB Biotechnology, AB, Sweden); колонку Octyl SEPHAROSE™ High Performance (Pharmacia LKB Biotechnology, AB, Sweden); колонки FRACTOGEL™ EMD Propyl или FRACTOGEL™ EMD Phenyl (E. Merck, Germany); MACRO-PREP™ Methyl или MACRO-PREP™ t-Butyl Supports (Bio-Rad, California); колонку WP HI-Propyl (C 3)™ (J. T. Baker, New Jersey) и или фениловые или бутиловые колонки TOYOPEARL™ (TosoHaas, PA).
Примеры наборов матриц для гидрофобной хроматографии хорошо известны в данной области и включают в себя алкильные цепи длиной C18, связанные с поддерживающим матриксом, таким как SEPHAROSE™, агароза или оксид кремния, например бутил-, фенил-, или октил-SEPHAROSE™, или такие полимеры как целлюлоза или полистирол. В патенте США № 6214984 описано применение хроматографии на основе гидрофобных взаимодействий при низком значении рН (LPHIC) для очистки антитела и фрагмента антитела. Данный способ является особенно пригодным для очистки фрагментов антител, особенно правильно уложенных и связанных дисульфидными связями фрагментов антител (например, фрагментов Fab) от загрязняющих фрагментов антител, которые неправильно уложены и/или у которых образованы неправильные дисульфидные связи. До LPHIC полученную из клеток композицию антител предпочтительно подвергают по меньшей мере одной стадии очистки с примерами, включающими в себя хроматографию на гидроксиапатите, гель-электрофорез, диализ и аффинную хроматографию. Пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа любого домена Fc иммуноглобулина, присутствующего в антителе. Белок A можно применять для очистки антител, основанных на определенных человеческих тяжелых цепях (Lindmark et al., J. Immunol. Meth.,62: 1-13 (1983)). Белок G рекомендован для всех мышиных изотипов и для одного человеческого изотипа (Guss et al., EMBO J., 5: 1567-1575 (1986)). Матрикс, к которому прикрепляют аффинный лиганд, чаще всего представляет собой агарозу, но доступны и другие матриксы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, обеспечивают более быстрые скорости потока и более короткое время обработки, чем то, которое можно достичь при применении агарозы. Когда антитело содержит домен CH3, для очистки пригодна смола BAKERBOND ABX™ (J. T. Baker, Phillipsburg, N.J.). В зависимости от антитела для получения также доступны другие способы очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, ВЭЖХ с обращенной фазой, хроматография на оксиде кремния, хроматография на гепарин-SEPHAROSE™, хроматография на анионо- или катионообменной смоле (такой как колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония.
G. Применения полипептидов
Полученный таким образом полипептид можно формулировать в фармацевтически приемлемый носитель и применять для различных диагностических, терапевтических и других целей, известных для таких молекул. Например, описанные здесь антитела можно применять для иммунологических анализов, таких как ферментативные иммунологические анализы.
Также предусмотрены терапевтические применения очищенных с использованием описанного здесь способа полипептидов. Например, для усиления роста при необходимости можно применять ростовой фактор или гормон, а антитело можно применять для ориентированной цитотоксичности (например, для уничтожения клеток опухоли), в качестве адъювантов вакцин, для доставки тромболитических средств к тромбам, для доставки иммунотоксинов к клеткам опухоли, для преобразования активируемых ферментами пролекарственных средств в участке-мишени (например, в опухоли), для лечения инфекционных заболеваний или для направления иммунных комплексов к рецепторам клеточной поверхности.
Терапевтические препараты полипептида получают для хранения посредством смешивания полипептида с желательной степенью очистки с необязательными физиологически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences, 16th edition, Osol, A., Ed., (1980)) в форме лиофилизированного брикета или водных растворов.
Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиента в применяемых дозах и концентрациях и включают в себя буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; полипептиды с низкой молекулярной массой (приблизительно менее чем 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие глицин, глутамин, аспарагин, аргинин или лизин; моносахаридфы, дисахариды и другие углеводороды, включая глюкозу, маннозу или декстрины; хелатирующие средства, такие как ЭДТА; сахарные спирты, такие как маннит или сорбит; формирующие соли противоионы, такие как натрий и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
Полипептид также можно заключать в микрокапсулы, например, получаемые способами коацервации или посредством межфазной полимеризации (например, гидроксиметилцеллюлоза или микрокапсулы с желатином или капсулы с поли-(метилметацилатом) соответствено), в коллоидных системах доставки лекарственного средства (например, липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие способы описаны у Remington's Pharmaceutical Sciences, выше.
Полипептид для применения для введения in vivo должен быть стерильным. Этого легко достичь фильтрацией через стерильные фильтрующие мембраны до или после лиофилизации и получения. Как правило, антитело необходимо хранить в лиофилизированной форме или в растворе.
Терапевтические полипептидные композиции, как правило, помещают в контейнер со стерильным отверстием для доступа, например мешок для внутривенного раствора или флакон с ограничителем, прокалываемый иглой, для подкожных инъекций.
Маршрут введения полипептида соответствует известным способам, например инъекции или инфузии посредством внутривенного, интраперитонеального, интрацеребрального, внутримышечного, интраокулярного, внутриартериального пути или введения внутрь очага повреждения или посредством систем с замедленным высвобождением, как отмечено ниже. Полипептид вводят непрерывно посредством инфузии или посредством болюсной инъекции.
Подходящие примеры препаратов с замедленным высвобождением включают в себя полупроницаемые мембраны твердых гидрофобных полимеров, содержащие полипептид, где матрицы находятся в форме имеющих определенную форму продуктов, например пленки или микрокапсулы. Примеры матриц для замедленного высвобождения включают в себя полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат), как описано у Langer et al., J. Biomed. Mater. Res., 15: 167-277 (1981) и Langer, Chem. Tech., 12: 98-105 (1982) или поли(виниловый спирт)), полилактиды (патент США № 3773919, EP 58481), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата (Sidman et al., Biopolymers, 22: 547-556 (1983)), нераспадающийся этиленвинилацетат (Langer et al.,выше), распадающиеся сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и леупролидацетата), и поли-D-(-)-3-гидроксимасляная кислота (EP 133988).
Хотя такие полимеры, как этиленвинилацетат и молочная кислота-гликолевая кислота, позволяют высвобождение молекул в течение свыше 100 суток, определенные гидрогели высвобождают белки в течение более коротких периодов времени. Например, когда инкапсулированные антитела остаются в организме в течение длительного периода, они могут денатурировать или агрегировать в результате воздействия влаги при 37°C, приводя к потере биологической активности и возможному изменению иммуногенности. В зависимости от вовлеченных механизмов для стабилизации антител можно разрабатывать рациональные стратегии. Например, если обнаруженный механизм агрегации представляет собой формирование межмолекулярного мостика S--S посредством обмена тиодисульфидами, стабилизации можно достичь модификацией сульфгидрильных остатков, лиофилизацией из кислых раствором, контролем влагосодержания с применением соответствующих добавок и разработкой специфических матриксных композиций.
Полипептидные композиции с замедленным высвобождением также включают в себя заключенные в липосомы полипептиды. Содержащие антитела липосомы получают по существу известными способами: DE 3218121; Epstein et al., Proc. Natl. Acad. Sci. USA, 82: 3688-3692 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA, 77: 4030-4034 (1980); EP 52322; EP 36676; EP 88046; EP 143949; EP 142641; патентная заявка Японии 83-118008; патенты США №№ 4485045 и 4544545 и EP 102324. Как правило, липосомы являются малыми однослойными липосомами (приблизительно 200-800 Ангстрем), где содержание липида является бóльшим, чем приблизительно 30 мол.% холестерина, с выбранной пропорцией, регулируемой для наиболее эффективной терапии полипептидом.
Эффективное количество полипептида для терапевтического применения зависит, например, от терапевтических целей, маршрута введения и состояния пациента. Таким образом, существует необходимость в терапевте для титрования дозы и изменения маршрута введения, необходимого для получения наиболее выгодного терапевтического эффекта. Обычная дневная доза может варьировать приблизительно от 1 мкг/кг до 10 мг/кг или более в зависимости от указанных выше факторов. Как правило, врач-клиницист вводит полипептид до достижения дозы, обеспечивающей желаемый эффект. Прогресс данного лечения легко контролировать традиционными способами анализа.
Изобретение будет более понятным из следующих примеров. Однако их не следует истолковывать как ограничение области изобретения. Все литературные и патентные цитаты здесь включены в качестве ссылки.
ПРИМЕР 1
Материалы и методы
A. Плазмиды, трансформация, ферментация
1. Получение rhuFab'2 (xCD18)
a. Конструирование плазмиды
Контрольная плазмида pS1130 предназначена для двухцистронной экспрессии F(ab')2 к CD18 F(ab')2 и основана на векторе, описанном Carter et al., Bio/Technology, 10: 163-167 (1992). В данной конструкции транскрипцию генов двух легких цепей и одного фрагмента тяжелой цепи с C-терминальной лейциновой застежкой помещают под контроль одного промотора phoA. Транскрипция завершается посредством терминатора транскрипции λt0, расположенного ниже кодирующей лейциновую застежку тяжелой цепи последовательности (Scholtissek and Grosse, Nucleic Acids Res., 15(7): 3185 (1987)). Сигнальная последовательность термостабильного энтеротоксина (STII) предшествует кодирующей последовательности каждой цепи и направляет секрецию полипептида в периплазму (Lee et al, Infect. Immun., 42: 264-268 (1983); Picken et al., Infect. Immun., 42: 269-275 (1983)). Для обеспечения димеризации двух ветвей Fab' к C-концу фрагмента тяжелой цепи присоединена лейциновая застежка.
Плазмида с двумя промоторами, содержащая две отдельных единицы трансляции, pxCD18-7T3, разделяет транскрипцию легкой цепи от транскрипции тяжелой цепи по времени. Как и в pS1130, легкая цепь остается под контролем промотора phoA. Однако в pxCD18-7T3 за кодирующей последовательностью легкой цепи следует терминатор транскрипции λt0. Ниже данного терминатора для контроля транскрипции фрагмента тяжелой цепи/C-концевой лейциновой застежки добавлен промотор tacII (DeBoer et al., Proc. Natl. Acad. Sci. USA, 80: 21-25 (1983)). За данной кодирующей последовательностью следует второй терминатор транскрипции λt0. Для направления секреции обеих цепей применяли молчащие варианты кодонов сигнальной последовательности STII (Simmons and Yansura, Nature Biotechnology, 14: 629-634 (1996)).
Схематическое сравнение контрольной плазмиды с одним промотором с плазмидой с двумя промоторами приведено на фигуре 1. Последовательность экспрессионной кассеты pxCD18-7T3 представлена на фигуре 2 (SEQ ID № 1), а аминокислотные последовательности (SEQ ID №№ 2 и 3) двух трансляционных единиц показаны на фигурах 3A (легкая цепь) и 3B (тяжелая цепь) соответственно.
b. Ферментация
Штамм-хозяин, применяемый для ферментации, происходящий из E. coli W3110, обозначали 59A7. Полный генотип 59A7 представляет собой W3110 fhuA phoAE15 (argF-lac)169 deoC degP41 ilvG2096(Valr) prc sprW148R. Клетки-хозяева 59A7 трансформировали плазмидой pxCD18-7T3 и клетки с успешной трансформацией отбирали и растили в культуре. Вместе с pxCD18-7T3 совместно трансформировали дополнительную плазмиду pMS421. Данная дополнительная плазмида, pMS421, представляет собой основанную на pSC101 плазмиду, предоставляющую lacIq для усиления контроля за промотором tacII, также несущую устойчивость к спектиномицину и стрептомицину.
Для каждых 10 литров раствора ферментации в 1-литровой встряхиваемой колбе, содержащей 500 мл среды LB, дополненной 0,5 мл раствора тетрациклина (5 мг/мл) и 2,5 мл 1М раствора фосфата натрия, растворяли один флакон, содержащий 1,5 мл культуры в 10-15% DMSO. Исходную культуру растили приблизительно 16 часов при 30°C, а затем использовали для инокуляции в 10-литровый ферментер.
Сначала ферментер запускали приблизительно с 6,5 литрами среды, содержащей приблизительно 4,4 г глюкозы, 100 мл 1М сульфата магния, 10 мл раствора микроэлементов (100 мл соляной кислоты, 27 г гексагидрата хлорида железа, 8 г гептагидрата сульфата цинка, 7 г гексагидрата хлорида кобальта, 7 г дигидрата молибдата натрия, 8 г пентагидрата сульфата меди, 2 г борной кислоты, 5 г моногидрата сульфата марганца в конечном объеме 1 литр), 20 мл раствора тетрациклина (5 мг/мл в этаноле), 10 мл FERMAX Adjuvant 27™ (или какого либо эквиватентного пеногасителя), 1 пакет солей HCD (37,5 г сульфата аммония, 19,5 г двухосновного фосфата калия, 9,75 г одноосновного фосфата натрия, 7,5 г дигидрата цитрата натрия, 11,3 г одноосновного фосфата калия) и 200 г NZ Amine A (гидролизат белков). Ферментации проводили при 30°C с 10 сл/мин воздушного потока и pH держали на уровне 7,0±0,2 (хотя в некоторых случаях происходили случайные отклонения от данного диапазона). Обратное давление ферментера и скорость перемешивания варьировали для манипуляции скоростью перемещения кислорода в ферментере и, следовательно, контроля за уровнем дыхания клеток.
После инокуляции в ферментер содержащей клетки среды из встряхиваемой колбы культуру растили в ферментере с высокой плотностью клеток с применением основанного на компьютере алгоритма для введения в ферментер раствора концентрированной глюкозы. При необходимости контроля pH в ферментер вводили гидроксид аммония (58% раствор) и серную кислоту (24% раствор). Также в некоторых случаях использовали дополнительные добавки пеногасителя для контроля пенообразования. Когда культура достигала клеточной плотности приблизительно 40 OD550, в ферментер добавляли дополнительные 100 мл 1М сульфата марганца. Дополнительно в ферментер, когда культура достигала приблизительно 20 OD550, начинали при скорости 2,5 мл/мин добавлять концентрированную соль (состоящую из приблизительно 10 г сульфата аммония, 26 г двухосновного фосфата калия, 13 г дигидрата одноосновного фосфата натрия, 2 г дигидрата цитрата натрия и 15 г моноосновного фосфата калия в 1 л воды) и продолжали до добавления к раствору ферментации приблизительно 1250 мл. Ферментации, как правило, продолжали в течение 72-80 часов.
В течение ферментации, как только достигалась контрольная для ферментации точка растворенного кислорода, основываясь на сигнале проверки растворенного кислорода, для контроля концентрации растворенного кислорода в контрольной точке добавляли концентрированный раствор глюкозы. Следовательно, в данной схеме контроля манипуляции с параметрами функционирования ферментера, такими как скорость перемешивания или обратное давление, влияющее на способность перемещать кислород при ферментации, соответственно изменяли скорость захвата кислорода или уровень метаболизма клеток.
Для контроля за составом выделяющегося при ферментациях газа применяли масс спектрометр, и он позволял подсчет скоростей захвата кислорода и выделения диоксида углерода при ферментациях.
Когда культура достигала клеточной плотности приблизительно 220 OD550, перемешивание уменьшали от начальной скорости в 1000 об/мин приблизительно до 725 об/мин в течение приблизительно 12 часов. Для индукции синтеза тяжелой цепи приблизительно через 12 часов после достижения культурой клеточной плотности 220 OD550 добавляли пятьдесят мл 200 мМ изопропил-β-D-тиогалактопиранозида (IPTG).
2. Получение F(ab')2 к тканевому фактору
a. Конструирование плазмиды
Плазмиду с двумя промоторами, pxTF7T3, создавали подобно плазмиде с двумя промоторами pxCD18-7T3, и применяли для обеспечения временного разделения экспрессии легких цепей и тяжелых цепей антитела к тканевому фактору. В pxTF7T3 для создания новой плазмиды с двумя промоторами, pJVG3IL, также вставляли последовательность lacI из плазмиды pMS421.
b. Ферментация
Штамм-хозяин, применяемый для данных ферментаций, представлял собой производное E. coli W3110, обозначенное 60H4. Полный генотип 60H4 представляет собой: W3110 fhuAmanA phoAE15 (argF-lac)169 deoC2 degP41 ilvG2096(Valr) prc супрессор prc. Клетки-хозяева 60H4 трансформировали посредством pJVG3IL, а клетки с успешно прошедшей трансформацией отбирали и растили в культуре.
Ферментации проводили в условиях, сходных с условиями для F(ab')2 к CD18, как описано выше, с тем принципиальным исключением, что длительность процесса варьировала приблизительно от 72 до 114 часов, а тяжелую цепь с применением OPTG индуцировали приблизительно через промежуток времени от 4 до 12 часов после достижения культурой OD550 220.
3. Получение полноразмерных антител к TF
a. Конструирование плазмиды
Экспрессионная кассета для плазмиды pxTF-7T3FL содержит, начиная от 5' до 3': (1) промотор phoA (Kikuchi et al., Nucleic Acids Res., 9(21): 5671-5678 (1981)); (2) последовательность Шайна-Дальгарно для trp (Yanofsky et al., Nucleic Acids Res.,9: 6647-6668 (1981)); (3) молчащий вариант кодона в сигнальной последовательности STII (относительная мощность TIR приблизительно 7) (Simmons and Yansura, Nature Biotechnology, 14: 629-634 (1996)); (4) кодирующую последовательность легкой цепи антитела к тканевому фактору; (5) терминатор λt0 (Scholtissek and Grosse, Nucleic Acids Res., 15: 3185 (1987)); (6) промотор tacII ((DeBoer et. al., Proc. Natl. Acad. Sci. USA, 80: 21-25 (1983)); (7) вторую последовательность Шайна-Дальгарно для trp; (8) второй молчащий вариант кодона сигнальной моследовательности STII (относительная сила TIR приблизительно 3); (9) кодирующую последовательность полноразмерной тяжелой цепи антитела к тканевому фактору и (10) второй терминатор λt0. Данную экспрессионную кассету клонировали в каркас плазмиды E. coli pBR322 (Sutcliffe, Cold Spring Harbor Symp. Quant. Biol., 43: 77-90 (1978)).
Таким образом, векторная конструкция pxTF-7T3FL обеспечивает временное разделение экспрессии каждой цепи посредством применения двух различных, а не двух идентичных промоторов. В данной плазмиде легкая цепь находится под контролем промотора phoA. Однако для контроля транскрипции тяжелой цепи применяют промотор tacII. Как известно в данной области, промоторы phoA и tacII индуцируются в существенно разных условиях. Схематическое сравнение плазмиды с одним промотором paTF130 и pxTF-7T3FL приведено на фигуре 4. Последовательность нуклеиновой кислоты экспрессионной кассеты pxTF-7T3FL (SEQ ID № 4) представлена на фигуре 5, а кодируемые ей полипептидные последовательности (SEQ ID №№ 5 и 6) представлены на фигурах 6A (легкая цепь) и 6B (тяжелая цепь) соответственно. Клетки-хозяева ниже совместно трансформировали pxTF-7T3FL и pJJ247. pJJ247 кодирует промотор tacII, управляющий экспрессией и DsbA и DsbC, с DsbA первой в последовательности, а ее конструкция описана в WO 02/061090.
b. Ферментация
Для ограниченной экспрессии в качестве клеток-хозяев применяли штамм E. coli 61D6 с генотипом W3110 fhuA (tonA) ptr3 lacIq lacL8 ompT(nmpc-fepE) degP41. После трансформации, отобранные трансформанты инокулировали в 5 мл среды Луриа-Бертани, дополненную карбенициллином (50 мкг/мл) и канамицином (50 мкг/мл) и растили в культуральных чашках при 30°C в течение ночи. 10-литровую ферментацию проводили с применением сред, как описано в WO 02/061090, а основные условия ферментации также описаны в WO 02/061090 за исключением, что в процессе ферментации проводили следующие модификации: приблизительно через 40 часов для получения концентрации приблизительно 30 мМ добавляли 300 мл 1M NaPO4, pH 7,0. Приблизительно через 44 часа для получения концентрации приблизительно 2 мМ добавляли 100 мл 200 мМ раствора IPTG. Сбор клеток после ферментации проводили через 80 часов после инокуляции.
B. Определение белков
Проводили одномерный гель-электрофорез SDS-PAGE линейном градиенте акриламида 4-12% из Novex. Конкретно, применяемая система представляла собой NOVEX® NUPAGE™ System, состоящую из NUPAGE™ Bis-TRIS Pre-Cast Gels (для белков с малой и средней молекулярной массой).
C. Химикаты
Осаждающее средство этакридинлактат являлось 98% чистоты, и его приобретали в Sigma (St. Louis, MO, USA). Молекулярная масса этакридинлактата составляет 361,4 Да. Все другие химикаты являлись реактивами аналитической чистоты.
D. Осаждение
Содержащие антитела и F(ab')2 вещество E. coli гомогенизировали с применением микрофлуидизатора, приобретенного в Watts Fluidair Inc. (модель B12-04DJC, Kittery, MN, USA). Клетки три раза пропускали через микрофлуидизатор при давлении 4 бар. Для устранения температурного разрушения белков вещество пропускали через баню с ледяной водой при каждом проходе через микрофлуидизатор. Общая концентрация белка в гомогенатах F(ab')2 составляла 30 мг/мл. Гомогенат полноразмерных антител к TF, полученный из ресуспендированной пастообразной массы, обладал общей концентрацией белков 18 мг/мл. Пастообразную массу антител к TF ресуспендировали в 25 мМ буфере TRIS-HCl, pH 7,5.
Осаждающее средство этакридинлактит растворяли в воде до желаемой конечной концентрации (мас./об.).
1. Исследование pH:
Эксперименты по осаждению проводили при постоянной концентрации этакридинлактата в размере 0,6% (мас./об.). Получали 0,8% раствор этакридинлактата и смешивали с гомогенатом Е. coll в соотношении 3:1, например 3 мл этакридинлактата и 1 мл гомогената Е. coll. рН доводили с применением HCl или NaOH в зависимости от желаемого рН.
2. Исследование концентрации этакридинлактата:
Гомогенат разводили в 4 раза исходными растворами этакридинлактата (1:3, как и в исследовании рН), а рН поддерживали на установленном значении для каждого белка-мишени. Для антитела к CD18 рН составлял 8,5, а для антитела к TF рН составлял 7,5. Конечные концентрации этакридинлактата в осаждающих системах составляли 0,15, 0,30, 0,45, 0,60, 0,75 и 0,9% (мас./об.). В качестве сравнения проводили ряд экспериментов с концентрацией этакридинлактата в размере 0%.
3. Исследование электрической проводимости/разбавления:
К гомогенату антитела против CD18 добавляли различные концентрации NaCl для оценки воздействия электрической проводимости на осаждение белка. Исследованные концентрации NaCl составляли 0, 50, 100, 150, 200 и 400 мМ. В качестве сравнения также проводили ряд исследований без этакридинлактата для определения возможности осаждения какого-либо белка вследствие высокой концентрации соли. рН в данном исследовании пиков соли составлял 8,5, а гомогенат антитела против CD18 разводили в 4 раза. Концентрация этакридинлактата в образцах составляла 0,6% и 0% для контрольных экспериментов.
Для изменения электрической проводимости образца гомогенаты разбавляли в увеличивающихся степенях, рН поддерживали постоянным на уровне рН 8,5 и 7,5 для антител против CD18 и антител против TF соответственно. Конечная концентрация этакридинлактата во всех экспериментах составляла 0,6% (мас./об.). Гомогенаты разбавляли в 2, 3, 4, 5, 6 и 7 раз.
4. Исследование температуры:
Некоторые эксперименты проводили при повышенных температурах. Гомогенат Е. coli разбавляли в 4 раза, а конечная концентрация этакридинлактата составляла 0,6%. рН для антител против CD18 и антител против TF составлял 8,5 или 7,5 соответственно. Образцы инкубировали в термостате с водяной баней при желательной температуре, т.е. 50, 60 и 70°С. Образцы инкубировали в течение 20-120 минут при повышенных температурах. Одну долговременную инкубацию в течение 16 часов проводили при 50°С.
После смешивания осаждающего средства и гомогената Е. coli и доведения рН образцы инкубировали в условиях смешивания в течение 30-60 минут. Эксперименты по осаждению проводили в стеклянных пробирках на уровне 4 мл. Все эксперименты проводили в двух экземплярах и сообщали средние значения.
E. Анализ белков E. coli
Этакридинлактат взаимодействует с наиболее часто применяемыми анализами измерения белка, например, по Bradford, BCA и измерение поглощения при 280 нм. Таким образом, общие концентрации белков измеряли с применением общего анализа белков E. coli посредством ELISA. Образцы разводили в содержащим желатин буфере fish (0,15 М NaCl, 0,1 М NaPO4, 0,1% желатин fish, 0,05% TWEEN 20™, 0,05% PROCLIN™ 300) для уменьшения неспецифического связывания с антителами к белкам E. coli. Покрывающее антитело представляло собой козье антитело к целому ECP. Образующее конъюгат антитело представляло собой антитело к антителу к целому ECP, присоединенное к пероксидазе хрена. Затем контролировали поглощение с применением планшетного ридера из Molecular Devices модели SPECTRA MAX PLUS™ (Sunnyvale, CA, USA).
F. Анализ белка G
Для измерения полученных концентраций F(ab')2 и антитела применяли анализ аффинной хроматографией с белком G. Колонку с белком G приобретали в PerSeptive Biosystems (Framingham, MA, USA). Колонку уравновешивали фосфатно-солевым буфером (PBS) и элюировали PBS с pH, доведенным до 2,2 с применением HCl. Для минимизации воздействия этакридинлактата образцы перед анализом обрабатывали на исключающих вращающихся колонках (BIO-SPIN® 6 Tris columns (Bio-Rad Laboratories, Hercules, CA, USA)). Вращающиеся колонки применяли, как рекомендовано производителем. В способ хроматографии для минимизации любого воздействия остаточного этакридинлактата в образце ввели стадию отмывки тетраметиламмонийхлоридом (TMAC) (Fahrner et al., Biotechnology and Genetic Engineering Reviews, 18: 302-327 (2001)). Анализ проводили с применением HPLC (жидкостный хроматограф HP 1090™) из Hewlett Packard (Mountain View, CA, USA). Образцы разводили PBS. Для каждого из белков с применением очищенного белка (из Genentech, Inc.) строили стандартные кривые.
G. Анализ ДНК
Концентрацию ДНК в супернатантах после осаждения измеряли с применением набора Pico Green Kit из Molecular Probes (Eugene, OR, USA). Он представляет собой флуоресцентный анализ, где флуоресцентный реагент связывается с двухцепочечной ДНК. Реагент Pico green выходит при 502 нм, а эмиссию при 523 нм записывали. Анализ проводили с применением планшетного ридера флуоресценции SPECTRA MAX GENINI XS™, из Molecular Devices (Sunnyvale, CA, USA). Этакридинлактат взаимодействует с анализом Pico green и, таким образом, осаждающее средство удаляют из раствора до анализа. Этакридинлактат удаляют из образца с применением колонок BIO-SPIN® 6 TRIS, описанных в разделе об аффинной хроматографии с белком G.
H. SDS-PAGE
Полученные после осаждения этакридинлактатом супернатанты анализировали посредством SDS-PAGE. Для визуализации очистки и получения антител к CD18 и антител к TF применяли невосстанавливающие гели 4-12% NUPAGE™ из Novex (San Diego, CA, USA). Применяли гели заводского изготовления, а буфером для проведения являлся MOPS (предварительно изготовленный концентрат приобретали в Novex). Гели окрашивали фильтрованным раствором COOMASSIE BRILLIANT BLUE R250™. Супернатанты компенсировали по объему относительно соответствующего очищенного экстракта E. coli. Таким образом, если в супернатантах после осаждения этакридинлактатом получен 100% выход, интенсивность полос белка в экстракте E. coli и образцах должна являться идентичной. Таким образом, гели можно применять для точного определения степени очистки, полученной после осаждения.
I. Растворимость этакридинлактата:
Исследовали два раствора этакридинлактата, т.е. 0,6 и 1,2%. Каждый раствор разделяли на две аликвоты и pH доводили до 6,0 и 9,0 соответственно. Для получения незначительной буферной емкости в системе этакридинлактат растворяли в 10 мМ буфере Tris-HCl. На каждый раствор этакридинлактата воздействовали увеличивающимися количествами NaCl, т.е. 0, 50, 100, 150, 200, 300 и 600 мМ. Образцы инкубировали в течение 3 часов, затем центрифугировали в течение 20 минут при 12000 g на микроцентрифуге (SORVALL MC12V™, DuPont, Wilmington, DE, USA). Супернатанты оценивали на этакридинлактат посредством измерения поглощения при 270 нм. Применяемый спектрофотометр представлял собой HP8453 UV-VIS™ из Hewlett Packard (Wilmington, DE), сейчас Aligent Technologies (Palo Alto, CA) и известный как спектрофотометр AGILENT 8453 UV-VIS™. Из раствора с известной концентрацией этакридинлактата получали стандартную кривую.
J. Вязкость
Для измерения стабильности супернатантов как функции от времени и температуры измеряли вязкость. Применяемый измеритель вязкости приобретен в HACH (модель 2100N, Ames, Iowa, USA). Образцы измеряли при комнатной температуре и без разведения образца.
Гомогенат антитела к CD18 обрабатывали или 0,6% этакридинлактатом, 0,2% PEI или только водой. Во всех трех образцах гомогенат антитела к CD18 разводили в 4 раза, а pH составлял 7,2 + 0,2. После центрифугирования в течение одного часа при 4000 g получали супернатанты и разделяли на две аликвоты. Одну часть каждого образца инкубировали при комнатной температуре (21°C), а другую при 4°C.
Результаты и обсуждение
Действие pH
Молекулы этакридинлактата положительно заряжены на большинстве интервала pH (Miller, выше; Neurath and Brunner, выше; Franek, Methods in Enzymology, ed. Langone, J.J., Van Vunakis, H., 121: 631-638 (1986)). Однако так как изменения pH влияют на заряд полипептидов и существует корреляция между pI полипептида и pH, при котором он осаждается при воздействии на него этакридинлактата (Neurath and Brunner, выше), исследовали действие pH на степень очистки в способе по настоящему изобретению.
Гомогенаты, содержащие F(ab')2 к CD18, F(ab')2 к TF и полноразмерные антитела к TF соответственно, подвергали воздействию 0,6% раствора этакридинлактата, доведенного до покрытия диапазона pH 4-10. Фигуры 8A-8C демонстрируют очищенные фазы после обработки этакридинлактатом и центрифугирования каждого из данных белков, соответственно.
В таблице 1 антитело к TF изучали и как полноразмерное антитело, и как F(ab')2. Гомогенаты E. coli обрабатывали 0,8% (мас./об.) раствором этакридинлактата в соотношении 1:3, т.е. до конечной концентрации этакридинлактата в образце в размере 0,6%. pH доводили HCl и NaOH соответственно для получения желаемого pH. Подсчитывали выходы и коэффициенты очистки в отношении каждого из очищенных клеточных гомогенатов. Концентрация ДНК в востанновленных супернатантах также представлена в таблице.
Действие pH на очистку и выход антитела к CD18 и антитела к TF при обработке этакридинлактатом
Можно видеть, что для всех трех белков получена колоколообразная кривая по отношению к степени очистки и концентрации ДНК в диапазоне pH от 4 до 10. В середине значений pH, т.е. pH 5-9, получена приблизительно в 5 раз большая очистка. Выход F(ab')2 к CD18 и полноразмерного антитела к TF и F(ab')2 уменьшался с увеличением pH, а полноразмерное антитело к TF и F(ab')2 обладают более сильной зависимостью от pH, чем зависимость F(ab')2 к CD18. Выход F(ab')2 к CD18 уменьшен от 100 до 85%, а F(ab')2 к TF от 93 до 18% в диапазоне pH 4-10. Без ограничения какой либо одной теорией, это частично может происходить вследствие меньшей pI антитела к TF по сравнению с антителом к CD18, например, pI 7,5 и 8,9 соответственно; однако они представляют собой теоретически рассчитанные значения.
Полноразмерные белки TF обладают даже более строгой зависимостью, чем вариант F(ab')2 белка. Чистота полноразмерного антитела к TF наибольшая при pH 7,0. При pH выше 8 наблюдают значительные потери выхода (фиг. 8C). Для полноразмерного антитела к TF предпочтителен pH в размере приблизительно 7,0, т.е. в 7,1 раз большая очистка и выход 86%. Без ограничения какой-либо теорией, одним из возможных объяснений для больших потерь у антител к TF по сравнению с антителами к CD18 является то, что антитела к TF несут больше поверхностных отрицательных зарядов, чем антитела к CD18 при инкубации выше его pI. Без ограничения какой-либо теорией, аналогично этому большие полноразмерные антитела к TF могут нести больше поверхностных отрицательных зарядов, чем соответствующие F(ab')2 и, таким образом, обладать значительно большей потерей выхода, наблюдаемой при увеличении pH.
Однако от полипептида-мишени необходимо отделить компоненты, отличные от клеточного дебриса и белков хозяина. Одним из таких компонентов является ДНК. Большим недостатком наличия высокой концентрации ДНК вместе с полипептидом-мишенью является увеличение вязкости раствора. Это будет иметь негативное влияние на дальнейшую расположенную ниже обработку. Кроме того, если в качестве первой захватывающей колонки применяют анионообменную колонку, отрицательно заряженные ДНК свяжутся со смолой и, таким образом, уменьшат емкость колонки по белку.
Следовательно, после осаждения этакридинлактатом в супернатантах определили концентрацию ДНК. Результаты показывают, что концентрация ДНК в супернатантах после осаждения этакридинлактатом значительно уменьшалась в сравнении с исходной концентрацией ДНК, полученной в гомогенате E. coli. Однако концентрация ДНК в супернатанте увеличивалась при увеличении pH супернатанта, т.е. 0,1 и 0,2 мкг/мл при pH 5,0 и 4,0 соответственно. Без ограничения какой-либо теорией, это может происходить вследствие того факта, что фосфаты в ДНК становятся менее отрицательно заряженными при низком pH. При очень высоком pH, например pH 10,0, концентрация ДНК значительно возрастала (0,3 мкг/мл), а чистота очистки белка также уменьшалась. Без ограничения какой-либо теорией, это частично происходит вследствие того факта, что pH находится выше pI антитела и F(ab')2; однако это частично может происходить вследствие того факта, что этакридинлактат менее заряжен при данном pH.
Действие концентрации этакридинлактата
Гомогенаты E. coli смешивали с растворами этакридинлактата в соотношении (1:3). Концентрация этакридинлактата в образцах увеличивалась с приростом в 0,15% от 0 до 0,9% (мас./об.). Данное исследование проводили при pH 8,5, 7,5 и 6,0 для антитела к CD18, F(ab')2 к TF и полноразмерного антитела соответственно.
В таблице 2 представлено действие концентрации этакридинлактата на очистку и выход. В таблице 2 антитело к TF изучали и в качестве полноразмерного антитела и в качестве F(ab')2. Гомогенаты E. coli обрабатывали в соотношении 1:3 различными концентрациями растворов этакридинлактата; показана конечная концентрация этакридинлактата в образце. pH антитела к CD18, F(ab')2 к TF и полноразмерного антитела к TF составляла 8,5, 7,5 и 6,0 соответственно. Также в данной таблице приводят концентрацию ДНК в полученных супернатантах.
Эффект на чистоту и выход антитела к CD18 и антитела к TF при обработке увеличивающейся концентрацией этакридинлактата
(%)
Показано, что чистота антител строго коррелированна с концентрацией этакридинлактата (фигуры 9A-9C и таблица 2). При концентрациях этакридинлактата выше, чем приблизительно 0,6% эффект увеличивающейся концентрации этакридинлактата на увеличение очистки не являлся драматичным. Однако при более низких концентрациях, т.е. когда этакридинлактат находится в дефиците, даже небольшое добавление осаждающего средства приводит к существенной дополнительной очистке F(ab')2.
Добавление различных концентраций этакридинлактата не влияет на выход F(ab')2 к CD18. Стадия получения для обоих F(ab')2 составляла приблизительно 90% для всех экспериментов. Однако кажется более простым достигнуть количественного получения F(ab')2 к CD18, чем F(ab')2 к TF. Без ограничения какой-либо теорией, это может происходить потому, что на поверхности F(ab')2 к TF по сравнению с F(ab')2 к CD18 существует большее количество отрицательных зарядов при изучаемом pH. Полноразмерные антитела к TF достигали своего максимума очистки при более низкой концентрации этакридинлактата, чем соответствующий белок, 0,3% и 0,6% соответственно. Без ограничения какой-либо теорией, это, вероятно, может происходить вследствие меньшей общей концентрации белка в гомогенате с полноразмерными антителами к TF, т.е. 18 и 30 мг/мл для полноразмерного антитела к TF и F(ab')2 соответственно. Полноразмерные антитела к TF также получают из ресуспендированной пастообразной массы, а F(ab')2 получают непосредственно из бульона из ферментера. Следовательно, растворимые компоненты культуральных сред, присутствующие в бульоне E. coli, не присутствуют в материале ресуспендированного полноразмерного антитела к TF, что может частично объяснить наблюдаемые различия без ограничения какой-либо одной теорией.
Концентрация ДНК в супернатантах строго коррелирована с полученными данными для очистки белка. При добавлении 0,6% или выше этакридинлактата ДНК в супернатантах не выявляли. Также существует ясная тенденция уменьшения концентрации ДНК, т.е. от 78 до 0 мкг/мл, в супернатантах, когда концентрация этакридинлактата возрастает от 0 до 0,6%.
Эффект электрической проводимости
Так как этакридинлактат осаждает белки частично вследствие характеристик заряда молекулы (Neurath and Brunner, выше), электрическая проводимость образца может оказывать влияние на чистоту антитела и F(ab')2 после осаждения. Следовательно, если образец имеет высокую концентрацию солей, т.е. высокую электрическую проводимость, соли могут защищать белки от этакридинлактата и, таким образом, уменьшать эффект очистки.
Гомогенат антител против CD18 подвергали воздействию в двух сериях экспериментов для различения эффекта электрической проводимости от эффекта концентрации белка в образце. В обеих сериях экспериментов добавляли NaCl (0-400 мМ). В одной серии экспериментов содержание этакридинлактата составляло 0,6%, а в другой использовали воду. Содержащие воду системы применяли в качестве контроля, так, чтобы если NaCl вызывал какое-либо осаждение, это можно было бы отличить от осаждения, связанного с этакридинлактатом. В системах без этакридинлактата, т.е. водных системах в диапазоне концентраций NaCl от 0 до 400 мМ осаждения белков не наблюдали (фиг.10А). В экспериментах показано, что в присутствии этакридинлактата наблюдается четкое увеличение очистки анти-СD18-антитела при уменьшении электрической проводимости (фиг.10В).
Без ограничения какой-либо теорией одним из доводов в пользу улучшения очистки антитела против CD18 при меньшей электрической проводимости может быть меньшая экранирующая емкость заряженного этакридинлактата при низкой концентрации солей. Аналогичные экранирующие эффекты можно наблюдать, когда для очистки белков при увеличивающейся концентрации солей применяют PEI (Jendrisak, выше). Однако даже более важным фактором является низкая растворимость этакридинлактата при высоких концентрациях солей (Miller, выше; Neurath and Brunner, выше; Franek, выше). При 100 мМ NaCl наблюдали осаждение этакридинлактата в системе для экстракции, и так как концентрация солей увеличивалась, осаждалось большее количество этакридинлактата. Следовательно, в системе остается растворимым и доступным для осаждения белков и других биологических молекул меньшее количество этакридинлактата.
Когда изучали растворимость этакридинлактата как функцию от концентрации NaCl, наблюдали зависимость от рН (фиг.11). При рН 6 значительных отличий в растворимости между 0,6 и 1,2% растворами этакридинлактата не наблюдали. Оба раствора оставались растворимыми при 50 мМ NaCl, но почти полностью осаждались при 100 мМ. Для растворов с рН 9, где этакридинлактат являлся менее заряженным, между двумя концентрациями этакридинлактата наблюдали значительную разницу в растворимости. 0,6% раствор этакридинлактата осаждался при меньшей концентрации солей, чем более концентрированный раствор этакридинлактата (фиг.11). Показано, что хлориды осаждают этакридинлактат особенно эффективно (Franek, выше).
Практически электрическую проводимость в экспериментах по осаждению необходимо определять посредством коэффициента разбавления. Следовательно, проводили серию экспериментов, где изучали влияние коэффициента разбавления гомогената Е. coll. Общую концентрацию этакридинлактата поддерживали постоянной, т.е. 0,6% (мас./об.), но электрическую проводимость образца уменьшали, увеличивая разбавление. Результаты показаны в таблице 3. В таблице 3 антитела против TF изучали как в виде полноразмерного антитела, так и в виде F(ab')2. Концентрация этакридинлактата в каждом эксперименте составляла 0,6% (мас./об.). рН антитела против CD18, F(ab')2 против TF (F(ab')2) и полноразмерного антитела против TF составлял 8,5, 7,5 и 6,0 соответственно. Выходы и коэффициенты очистки рассчитывали для каждого из очищенных клеточных гомогенатов. В таблице приведена также концентрация ДНК в полученных супернатантах.
Результаты показали, что очистка F(ab')2 увеличивалась при уменьшении электрической проводимости посредством увеличения разведения. Однако при электрической проводимости 3,5 мСм или менее эффект электрической проводимости становился незначительным. Для гомогената Е. coli, используемого в данном примере, проводили 4-кратное разведение для получения электрической проводимости менее 3,5 мСм. Для полноразмерного антитела против TF можно проводить немного более низкие разведения, чем для гомогенатов с F(ab')2. Без ограничения рамками какой-либо теории, это может происходить вследствие того факта, что концентрация белка в гомогенате с полноразмерным антителом более низкая. Кроме того, так как вещество полноразмерного антитела получают из ресуспендированной пастообразной массы, некоторые компоненты сред, которые могут влиять на осаждение, удалены до осаждения этакридинлактатом.
В этих экспериментах концентрацию белка уменьшали, увеличивая разбавление (уменьшая электрическую проводимость). Таким образом, даже если добавляли 0,6% этакридинлактата, для которого в исследованиях концентрации этакридинлактата было выявлено, что он присутствует в избыточной концентрации, в менее разбавленных образцах максимальное удаление белка и ДНК хозяина не достигается. Это происходит из-за увеличенной концентрации гомогената, т.е. общего белка и ДНК в данных образцах по сравнению с образцом, представленным при исследовании концентрации этакридинлактата. Следовательно, общая концентрация белка, ДНК и других компонентов будет влиять на концентрацию этакридинлактата или, альтернативно, необходимость разведения. Выход анти-CD18-F(ab')2 и полноразмерных антител и F(ab')2 против TF увеличивается с уменьшением электрической проводимости.
Выявлено, что электрическая проводимость влияет также и на удаление ДНК. При двукратном разведении, т.е. при 5,0 мСм в супернатанте получали высокую концентрацию ДНК, составляющую 20,7 мкг/мл. Однако если делали трехкратное разведение, т.е. 4,0 мСм, концентрация уменьшалась до 0,5 мкг/мл, а при более высоком разведении ДНК уже не выявлялась. Как было указано ранее, в данном случае общее количество этакридинлактата по отношении к белку и ДНК увеличивается при увеличении разведения, т.е. при уменьшении электрической проводимости. Таким образом, наблюдаемый в данном примере эффект отражает и уменьшение электрической проводимости, и увеличение количеств этакридинлактата.
Эффект температуры
Температура представляет собой фактор,. для которого известно, что он важен при проведении экспериментов по осаждению. Таким образом, изучали некоторое увеличение температур в сочетании с этакридинлактатом. Также исследовали воздействие времени инкубации при увеличенной температуре.
Инкубация при увеличенной температуре, т.е. 50-70°С, оказывала положительное действие на очистку двух белков F(ab')2 (фигуры 12А и 12 В). Чем выше температура, тем более эффективна очистка. Инкубация при 70°С значительно увеличивала чистоту белков F(ab')2. Инкубация образца при 70°С в течение более длительного времени, т.е. в течение 40 минут по сравнению с 20 минутами не увеличивала чистоту F(ab')2 (фигуры 12А и 12В), но при этом наблюдали приблизительно 10% потерю выхода. Однако когда образец инкубировали при температуре больше 70°С, F(ab')2 не получали, что происходило вследствие температурного осаждения F(ab')2, а также других белков Е. coll.
Для исследования эффекта времени инкубации более подробно проводили эксперимент, где образцы инкубировали в течение 16 часов и 30 минут при 50°С. Результаты показали, что существенного улучшения очистки образца, инкубируемого в течение 16 часов, по сравнению с 30-минутной инкубацией при данной температуре не происходит. Это указывает на то, что температурное осаждение представляет собой стремительное явление и позволяет предположить, что быстрое нагревание до соответствующей температуры может являться более подходящим, чем длительное время инкубации.
Полноразмерные антитела против TF также изучали при повышенных температурах. 15-минутная инкубация при 50°С оказывала незначительное положительное действие на чистоту антитела, и по сравнению с инкубацией образца при комнатной температуре не наблюдали потерь в получаемом материале (фиг.12С). Однако если температуру увеличивали до 60°С, почти все антитела против TF выпадали в осадок. Эти данные указывают, что полноразмерные анти-TF-антитела обладают меньшей стабильностью при увеличенной температуре, чем белок F(ab')2 против TF.
Так как повышение температуры может приводить к модификациям полипептида-мишени, следует сначала оценить стабильность конкретного представляющего интерес полипептида при повышенной температуре.
Стабильность потока поступающих веществ
Важным является получение наиболее равномерного потока поступающих веществ из возможных. Однако другой важной характеристикой потока поступающих веществ является его стабильность с течением времени. Следовательно, сравнивали стабильность супернатантов после обработки этакридинлактатом или PEI или супернатанта после простого центрифугирования. Каждый из супернатантов инкубировали при двух температурах, т.е. при комнатной температуре (21°С) и при 4°С. Стабильность контролировали посредством изменения вязкости соответствующего образца.
На фигуре 13 показана вязкость с течением времени для трех различных супернатантов, т.е. супернатанта с этакридинлактатом, с PEI и необработанного очищенного супернатанта соответственно. Можно ясно увидеть, что полиэлектролиты, т.е. этакридинлактат и PEI, значительно уменьшают вязкость супернатанта. Непосредственно после очистки необработанный очищенный супернатант обладал вязкостью, составляющей приблизительно 700 NTU, тогда как обработанный PEI образец имел вязкость, составляющую только половину указанной вязкости, т.е. 327 NTU, a супернатант с этакридинлактатом имел вязкость, составляющую 1 NTU. Когда исследовали вязкость обработанного PEI супернатанта, большого различия с течением времени или в зависимости от температур инкубации не наблюдали. Для супернатанта, который только центрифугировали, наблюдали тенденцию к снижению вязкости в образце при комнатной температуре в течение первых 48 часов. Однако для образца при комнатной температуре через 72 часа провести измерения оказалось невозможным вследствие высокой вязкости образца. Обработанный этакридинлактатом супернатант обладал очень низкой вязкостью, которая при инкубации при 4°С значительно не увеличивалась. Когда образец инкубировали при 21°С, вязкость значительно увеличивалась, а именно, от 1 до 100 NTU за 72 часа. Однако 100 NTU - это все еще меньше, чем вязкость, получаемая для других двух супернатантов непосредственно после очистки. Следовательно, можно заключить, что супернатант, полученный поле обработки этакридинлактатом при рН 7, представляет собой стабильный поток поступающих веществ.
Вывод
Этакридинлактат можно успешно применять в качестве осаждающего средства для первичного получения гетерологичных полипептидов из культурального бульона или гомогената. Когда в качестве осаждающего средства применяют этакридинлактат, идеальный полипептид-мишень предпочтительно обладает более высоким значением pI, чем среднее арифметическое белков хозяина. Следовательно, большинство белков могут быть отрицательно заряженными и осаждаться этакридинлактатом, в то же время как белок-мишень заряжен положительно и, таким образом, остается в супернатанте.
Предпочтительная концентрация этакридинлактата для осаждения сильно зависит от концентрации белка и ДНК хозяина в бульоне или гомогенате. Чем больше концентрация белка и ДНК в бульоне или гомогенате, тем большее количество этакридинлактата необходимо. Следовательно, чем более отрицательно заряжены компоненты, доступные для этакридинлактата для образования комплекса и, таким образом, осаждения, тем выше предпочтительное количество этакридинлактата для осаждения. Чем меньше электрическая проводимость раствора при проведении осаждения, тем более эффективной является очистка полипептида. Стадия осаждения обеспечивает значительную очистку полипептида и уменьшение ДНК в то же самое время, когда удаляют клеточный дебрис.
Для эффективного осаждения белков и ДНК хозяина рН, как правило, составляет приблизительно от 4 до 10, а предпочтительно не более чем приблизительно рН 9, так как молекула становится менее заряженной при более высоких рН. Этакридинлактат при очистке полипептида более предпочтительно использовать при рН в диапазоне приблизительно 5-9. Для улучшения очистки можно проводить короткую инкубацию при повышенной температуре. Однако необходимо определить стабильность конкретного представляющего интерес полипептида при высоких температурах во избежание осаждения полипептида-мишени. Необходимо также исследовать качество получаемого полипептида-мишени, чтобы убедиться, что никаких модификаций полипептида-мишени не произошло.
| название | год | авторы | номер документа |
|---|---|---|---|
| БАКТЕРИЯ Е.coli, ПРОДУЦИРУЮЩАЯ ГЕТЕРОЛОГИЧНЫЙ ПОЛИПЕПТИД, И СПОСОБ ПРОДУЦИРОВАНИЯ ПОЛИПЕПТИДА | 2001 |
|
RU2287574C2 |
| УСОВЕРШЕНСТВОВАННЫЕ СПОСОБЫ ВЫДЕЛЕНИЯ РЕКОБИНАНТНЫХ БЕЛКОВ | 2013 |
|
RU2636353C2 |
| СПОСОБЫ И КОМПОЗИЦИЯ ДЛЯ СЕКРЕЦИИ ГЕТЕРОЛОГИЧНЫХ ПОЛИПЕПТИДОВ | 2010 |
|
RU2585488C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДОВ | 2005 |
|
RU2433185C2 |
| СПОСОБЫ ОЧИСТКИ ПОЛИПЕПТИДОВ | 2011 |
|
RU2594163C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ СЕКРЕЦИИ ГЕТЕРОЛОГИЧНЫХ ПОЛИПЕПТИДОВ | 2015 |
|
RU2748026C2 |
| НОВАЯ КОМПОЗИЦИЯ И СПОСОБЫ ЛЕЧЕНИЯ СВЯЗАННЫХ С ИММУНИТЕТОМ ЗАБОЛЕВАНИЙ | 2004 |
|
RU2375078C2 |
| АГОНИСТИЧЕСКИЕ АНТИТЕЛА ПРОТИВ NOTCH3 И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ NOTCH3-АССОЦИИРОВАННЫХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2461569C2 |
| КЛОСТРИДИАЛЬНЫЙ ТОКСИН NetB | 2008 |
|
RU2474587C2 |
| СОДЕРЖАЩИЕ ФАКТОР ФОН ВИЛЛЕБРАНДА (vWF) ПРЕПАРАТЫ И СПОСОБЫ, НАБОРЫ И ПРИМЕНЕНИЯ, СВЯЗАННЫЕ С НИМИ | 2010 |
|
RU2579977C2 |

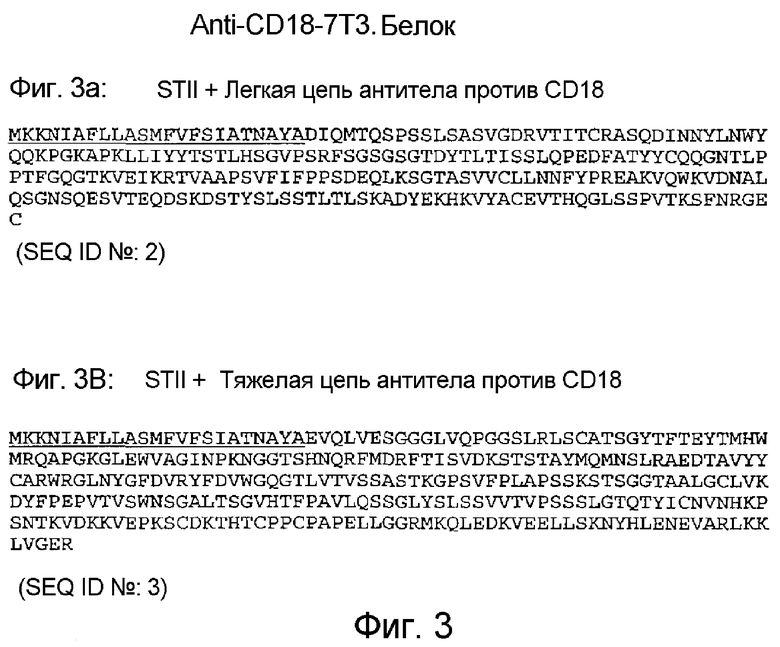
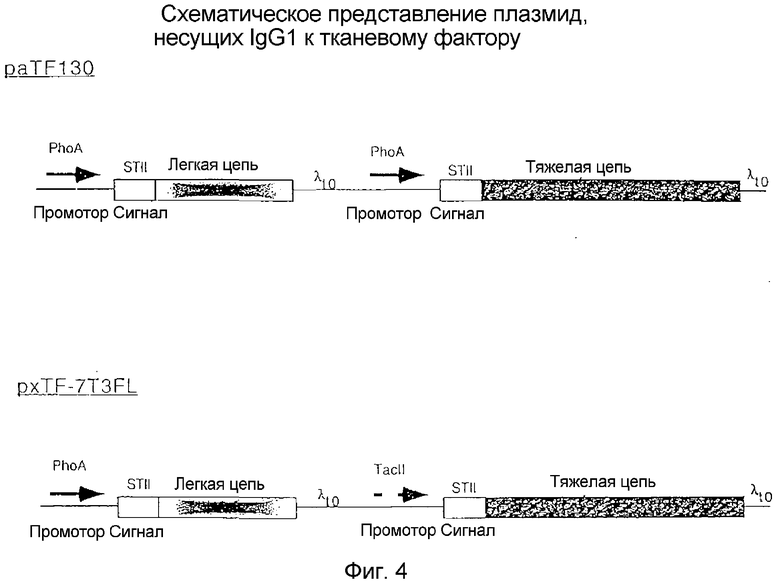


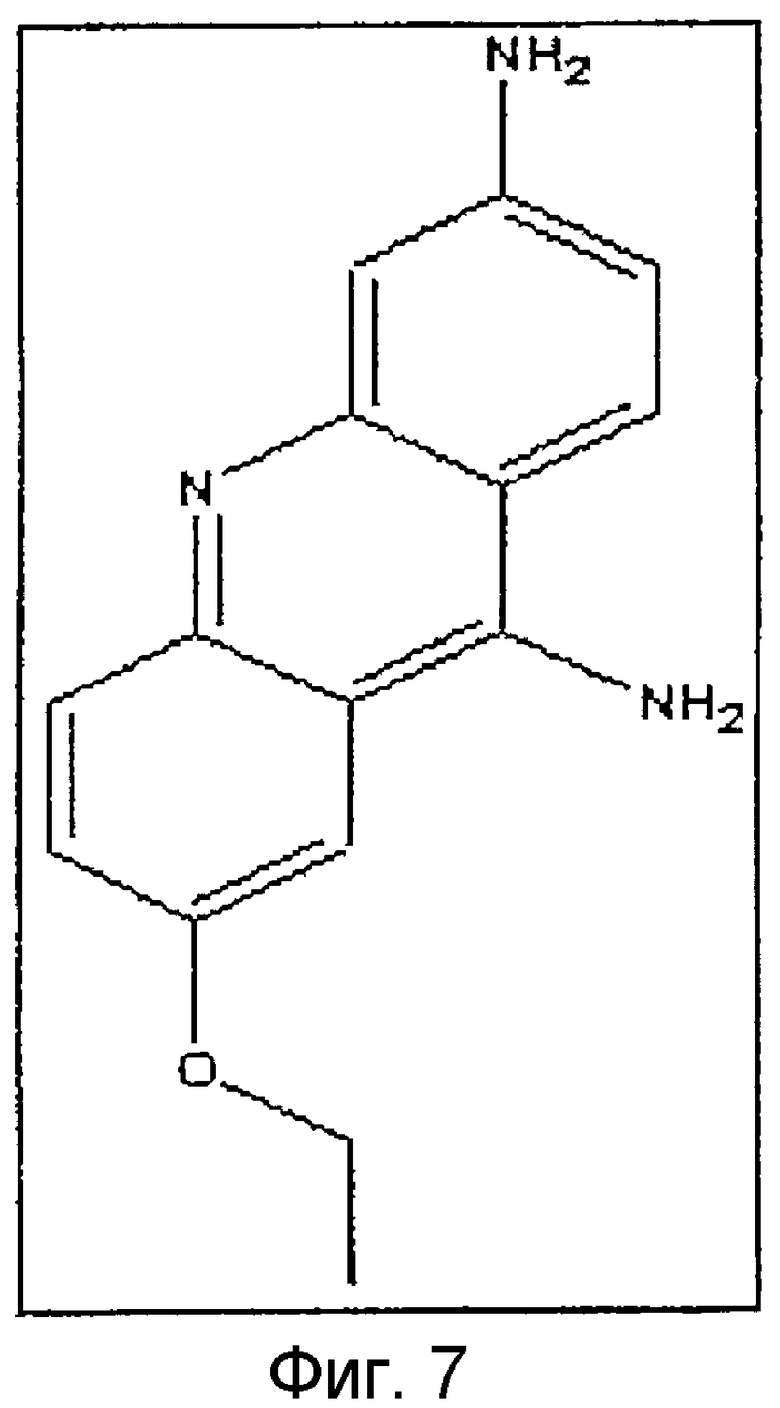
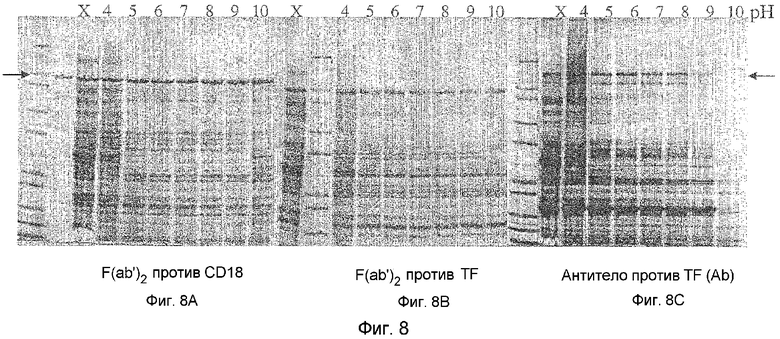
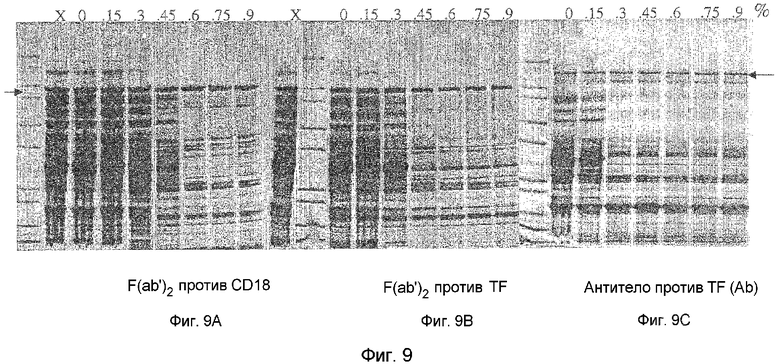
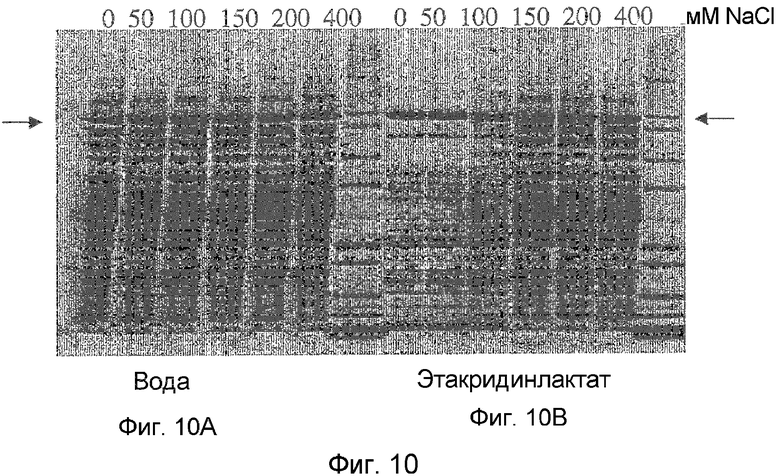
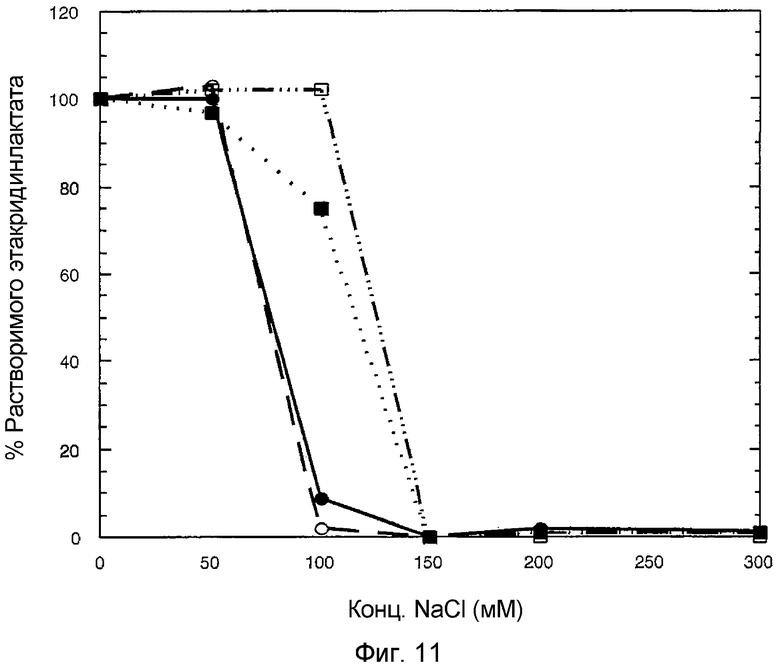
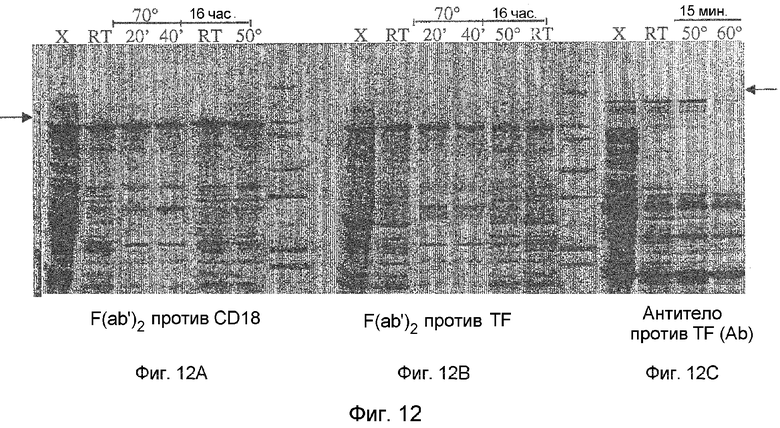
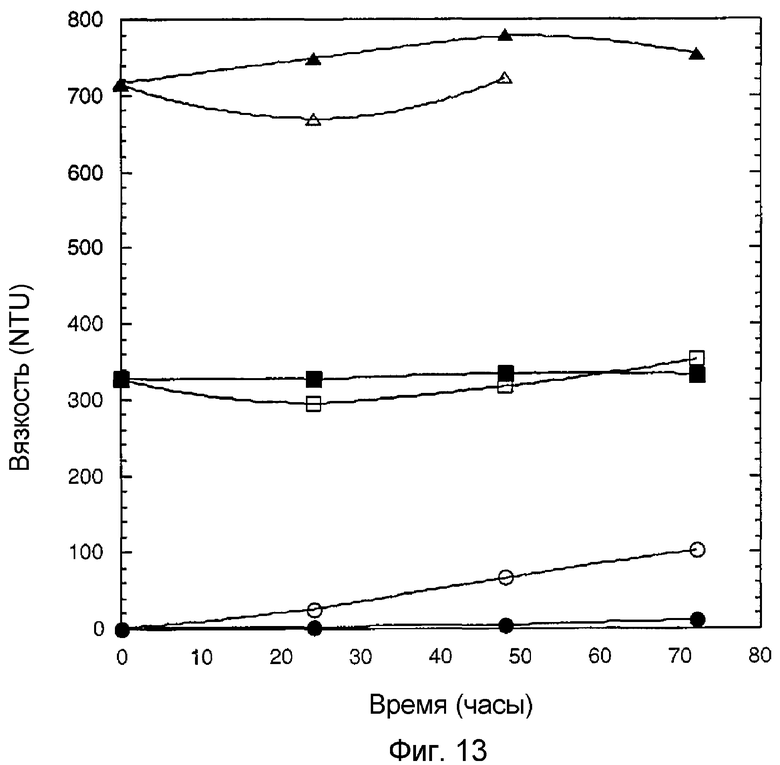
Изобретение относится к биотехнологии. Способ предусматривает добавление к ферментационному бульону или гомогенату из Е.coli эффективного количества раствора этакридинлактата для осаждения загрязнений из клеток-хозяев в условиях, когда большая часть полипептида остается растворимой, и выделение гетерологичного полипептида из бульона или гомогената. Изобретение позволяет упростить очистку целевого полипептида и получить его с высокой степенью чистоты. 22 з.п. ф-лы, 13 ил., 3 табл.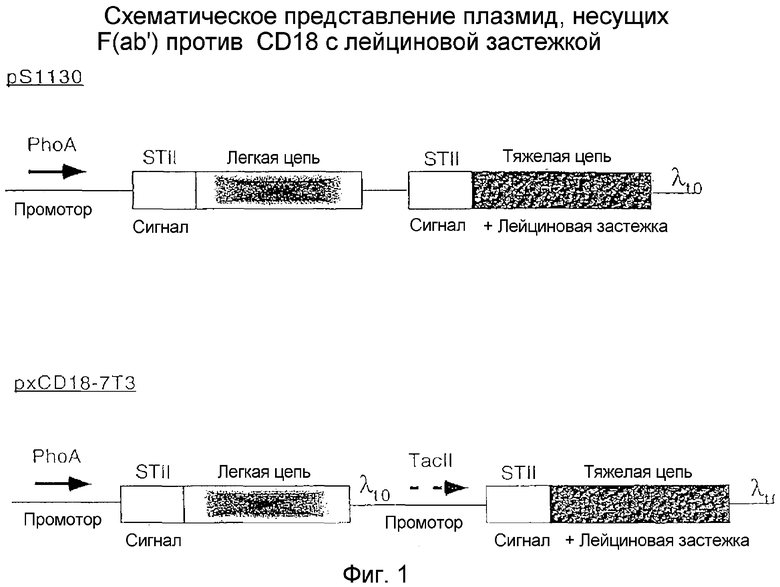
| TCHERNOV А.А | |||
| ет al | |||
| Purification of phycobiliproteins from Nostoc sp | |||
| by amynohexyl-Sepharose chromatography | |||
| J | |||
| of biotechnology | |||
| Способ приготовления пищевого продукта сливкообразной консистенции | 1917 |
|
SU69A1 |
| US 3930953 A, 06.01.1976 | |||
| АМОРТИЗАТОР | 1972 |
|
SU418647A1 |
Авторы
Даты
2008-11-10—Публикация
2004-01-08—Подача