Изобретение относится к медицине, а именно к медицинской диагностике. Предложенное техническое решение, может быть использовано для экспресс-диагностики, например, сахарного диабета, по содержанию микропримесей ацетона в выдыхаемом пациентом воздухе Использование указанного технического решения обеспечивает возможность контроля содержания глюкозы в крови больного диабетом посредством точного и чувствительного измерения концентрации паров ацетона в выдыхаемом воздухе пациента в режиме реального времени.
С медицинской точки зрения диабет является заболеванием, которое характеризуется абсолютной или относительной недостаточностью инсулина, сложным нарушением метаболизма и повышенным уровнем содержания глюкозы в крови. При дефиците инсулина глюкоза перестает быть доступным источником энергии, поэтому в качестве альтернативного источника энергии в организме больного начинается производство, так называемых, кетонов, Как хорошо известно, кетоны (например, ацетон) всегда присутствуют в крови. Заболевание диабетом является наиболее распространенной причиной патологического повышения производства ацетона организмом больного. Это происходит из-за недостаточного количества инсулина в крови. Организм больного может избавиться от ацетона через легкие, что придает дыханию больного сладковатый запах подгнивших фруктов. Большое количество ацетона, которое содержится в дыхании, означает, что клетки организма либо не имеют достаточно инсулина, либо они не могут использовать инсулин надлежащим образом. Повышенный уровень глюкозы в крови, как правило, приводит к тяжелым медицинским осложнениям, таким как: слепота, почечная недостаточность, а также к болезни сердца, к гангрене, ампутации конечностей и к преждевременной смерти.
Имеющиеся в настоящее время методы ежедневного контроля уровня глюкозы в крови для проведения инсулиновой терапии, как правило, дороги, неудобны и достаточно болезненны. Обычно это делается путем прокалывания пальца и помещением капли крови на тест-полоски с нанесенными на них химических веществ чувствительных к глюкозе. Для того, чтобы строго контролировать уровень глюкозы в крови и эффективно смягчать возможные осложнения посредством инсулиновой терапии, для больных сахарным диабетом рекомендуется производить 4-7 тестов в день. Но из-за дороговизны тест-полосок, этот тип мониторинга уровня глюкозы в крови приходится проводить с частотой не более чем два раза в день. Кроме того, физические страдания приводят к частым уклонениям больных от этой жизненно важной процедуры. Особенно проблематично частое проведение этой манипуляции у больных детей. Отметим также довольно низкую точность измерения уровня глюкозы в крови в домашних условиях, которая согласно стандарту ISO 15197 для доступных глюкометров не превышает ±20% (Freckmann G., Baumstark Α., Jendrike Ν., Zschornack Ε., Kocher S., Tshiananga J., Heister F., Haug C. System Accuracy Evaluation of 27 Blood Glucose Monitoring Systems According to DIN EN ISO 15197 // Diabetes Technology & Therapeutics. 2010. 12, Is. 3. P. 221-231).
Известны технические решения, представленные в различных неинвазивных методах для контроля уровня глюкозы в крови больных диабетом по дыханию человека. Все разработанные методы, в основном, можно разделить на две группы. К первой из них можно отнести методы, основанные на отличие отношения массы к заряду ионов детектируемых веществ или отличие их диффузионных свойств, ко второй используется отличие спектров поглощения или эмиссионных спектров различных веществ.
Первая группа методов включает в себя: Масс спектрометрию (Лебедев А.Т. Масс-спектрометрия в органической химии. БИНОМ, 2003), Газовую хроматографию (Березкин В.Г. Газо-жидко-твердофазная хроматография. М.: Химия, 1986, 112 с), Масс-спектрометрия, совмещенная с газохроматографическим разделением (Mamyrin В.А., Time-of-flight mass spectrometry (concepts, achievements, and prospects) // International Journal of Mass Spectrometry, 2001, 206(3), 251-266.).
Недостатком этих технических решений является непригодность для широкого ежедневного использования в амбулаторных или в домашних условиях в режиме реального времени. Эти технические решения требуют использования сложного и громоздкого оборудования с применением сверхвысокого вакуума, больших объемов сверхчистых газов-носителей в сменяемых баллонах высокого давления; они сложны в реализации и требуют обслуживание квалифицированных операторов. Кроме того измерения занимают много времени на сбор образцов дыхания, на их транспортировку, хранение и на подготовку к анализу. Кроме того, следовые количества ацетона, которые присутствуют в дыхании пациента в присутствии большого количества паров воды, легко могут быть потеряны во время этих сложных процедур, поскольку ацетон является летучим и химически активный материалом, и он смешивается с водой практических в любых соотношениях. Поскольку эти перечисленные методы слишком сложны и дороги - они могут быть реализованы в только специализированных лабораториях и не подходят для ежедневного применения в амбулаторных или домашних условиях.
Известны технические решения, отнесенные ко второй группе неинвазивных методах для контроля уровня глюкозы в крови больных диабетом по дыханию пациента с использованием отличий спектров поглощения или эмиссионных спектров различных веществ, например: Спектроскопия комбинационного рассеяния: (Kharintsev S.S., Hoffmann G.G., Loos J., De With G., Dorozhkin P.S., Salakhov M. Kh., Subwavelengthresolution near-field Raman spectroscopy // Journal of Experimental and Theoretical Physics, 2007, 105(5), 909-915); Фотоакустическая спектроскопия: (Zheng J., Tang Zh., He Y., Guo L. Sensitive detection of weak absorption signals in photoacoustic spectroscopy by using derivative spectroscopy and wavelet transform // Journal of Applied Physics, 2008, 103(9), 093116-(1-4)); Диодно-лазерная спектроскопия поглощения: (Yan W.-B., Trace gas analysis by diode laser cavity ring-down spectroscopy // Test and Measurement Applications of Optoelectronic Devices, Proc. SPIE, 2002, 4648, 156-164).
Недостатком этих технических решений является низкая точность и чувствительность измерений. А так же использования дорогих лазерных источников света, состоящих из лазеров накачки или перестраиваемых в широком спектральном диапазоне диодных лазеров и громоздких многопроходных ячеек поглощения. Зачастую, эти методы требуют использование криогенных температур, необходимых для функционирования источников излучения или детекторов. В случае использования спектроскопии поглощения, большое количество паров воды в дыхании пациента оказывает негативное влияние на чувствительность и точность измерений, поскольку пропускание многопроходных ячеек поглощения резко снижается вследствие конденсации паров на оптических окнах. Большое количество линий воды в регистрируемых спектрах представляют серьезную проблему для их расшифровки и интерпретации.
К настоящему времени наибольший интерес вызывает эмиссионная спектроскопия видимого светового излучения разряда переменного или постоянного токов в выдыхаемом воздухе. Преимущество эмиссионной спектроскопии по сравнению с другими выше перечисленными методами заключаются в том, что не требуется применения сверхвысокого вакуума и криогенных температур. К тому же эмиссионная спектроскопия в видимом диапазоне длин волн малочувствительна к наличию паров воды в выдыхаемом воздухе пациента в силу отсутствия сильных линий воды в этом диапазоне и имеет высокую спектральную селективность, ограниченную лишь уширением эмиссионных линий вследствие допплер-эффекта. Поскольку измерения производятся с использованием эмиссионного излучения, становится не нужным использование многопроходных ячеек поглощения. Кроме того, высокая селективность этого метода сочетается с широким спектральным диапазоном, охватывающим практически все биомаркеры, интересные для медицинских приложений. Регистрация эмиссионного спектра происходит практически на «нулевом световом фоне» в отличие от регистрации спектра поглощения, которое производится в условиях сильной засветки фотоприемника пробным излучением. Это позволяет достичь, большего соотношения сигнал/шум в случае эмиссионной спектроскопии, по сравнению со случаем спектроскопии поглощения. Появление на рынке оптических спектрографов с размерами спичечного коробка делает возможным создание компактных и простых эмиссионно-спектроскопических приборов пригодных для широкого использования.
Известно техническое решение, представляющее собой способ и устройство для определения и прецизионного измерения содержания алкоголя в дыхании человека (патент US 3830630 A «Apparatus and method for alcoholic breath and other gas analysis», МПК G01N 27/16; G01N 33/497, опубликован 20.08.1974) Точность измерения в предложенном техническом решении достигается параллельным детектированием и измерением концентрации CO2, а также нормировкой сигнала, пропорционального концентрации алкоголя, на сигнал, пропорционального концентрации CO2. Дело в том, что сигнал по алкоголю и его измеренная концентрация сильно зависит от интенсивности, с которой испытуемый дышит в прибор: более сильное дыхание может производить более сильный сигнал, в то время как реальная концентрация алкоголя при этом является константой. Поскольку сигнал от СО2 так же пропорционален интенсивности дыхания, то авторы этого патента продемонстрировали, что предложенная нормировка существенно повышает точность и воспроизводимость измерения концентрации алкоголя в дыхании человека.
Недостатком этого технического решения является необходимость в использовании дополнительного спектрального прибора для параллельного детектирования и измерения концентрации СО2, что существенно усложняет конструкцию прибора и затрудняет проведение измерений. Последнее, что очень важно, снижает чувствительность прибора и делает невозможным обнаружения сверхмалых концентраций ацетона на начальных стадиях заболевания, когда еще возможно излечение больного.
Известно техническое решение, представляющее собой способ и устройство для неинвазивного мониторинга диабета посредством измерения концентрации ацетона в выдыхаемом воздухе (Патент US 7417730 B2, «Apparatus and method for monitoring breath acetone and diabetic diagnostics», МПК G01J 3/30, G01N 21/73, опубликован 04.10.2007), выбранное в качестве прототипа. Техническое решение содержит линию отбора проб с источником несущего газа, разрядную ячейку, источник питания для инициирования и поддержания разряда, спектрограф и работает следующим образом: выдохнутый пациентом воздух в линию отбора проб смешивается с несущим газом. В качестве несущего газа используется сверхчистый аргон или гелий при атмосферном давлении. Затем смесь газов прокачивается через разрядную ячейку с расходом несущего газа порядка 1 литра в минуту. В ячейке поддерживается коронный разряд. Эмиссионный спектр разряда с помощью линзы или оптического волокна подается на спектрограф, сигнал с которого анализирует эмиссионный спектр пробы выдыхаемого воздуха пациента. Было обнаружено, что эмиссионный спектр ацетона представляет собой несколько пиков с центральным пиком около 516,5 нанометров. Этот пик был использован в качестве индикатора, по которому обнаруживался и измерялся ацетон в выдыхаемом воздухе пациента. Устройство было откалибровано с использованием смеси несущего газа и с добавлением паров ацетона, которое давало концентрацию ацетона 25 частей на миллион. Калибровку с более низкими концентрациями осуществлялась с помощью специализированных прецизионных контролеров. Была обнаружена линейная зависимость показания этого устройства от концентрации ацетона.
Недостатком известного технического решения является применение разряда при атмосферном давлении, который характеризуется крайней нестабильностью горения. Это ведет к большим флуктуациям интенсивности эмиссионного излучения, это, в свою очередь, повышает шумы в измерительном сигнале, что резко снижает точность измерения концентрации ацетона и чувствительность технического решения.
Перед авторами ставилась задача разработать способ мониторинга малых примесей ацетона в выдыхаемом воздухе пациента пригодного для неинвазивного, широкого и ежедневного использования в амбулаторных или в домашних условиях в режиме реального времени и устройство для его реализации.
Поставленная задача решается тем, что в способе мониторинга малых примесей ацетона в выдыхаемом воздухе пациента включающим использование источника питания, спектрометра, разрядной ячейки, линии отбора пробы, блока анализа и обработки, осуществление забора выдыхаемого воздуха пациента с последующей подачей его в линию отборы пробы, инициирование разряда в разрядной ячейке, регистрацию эмиссионного спектра, анализирование эмиссионного спектра пробы выдыхаемого воздуха пациента, при этом, дополнительно используют насос прокачки, выполненный для понижения давления выдыхаемого воздуха пациента в разрядной ячейке, линию отбора пробы оснащают регулируемым клапаном, кроме того, дополнительно осуществляют регулирование натекания выдыхаемого воздуха пациента через линию отбора пробы регулируемым клапаном, осуществляют понижение давления выдыхаемого воздуха пациента в разрядной ячейке насосом прокачки, а инициацию разряда в разрядной ячейке осуществляют при пониженном давлении, анализирование эмиссионного спектра пробы выдыхаемого воздуха пациента выполняют посредством нормировки интенсивности этого эмиссионного спектра на концентрацию паров воды в выдыхаемом воздухе пациента.
Способ реализуется с помощью устройства для мониторинга малых примесей ацетона в выдыхаемом воздухе пациента, содержащего источник питания, спектрометр, разрядную ячейку, линию отбора пробы, блок анализа и обработки, которое дополнительно оснащено насосом прокачки, выполненного для понижения давления выдыхаемого воздуха пациента в разрядной ячейке, при этом, линия отборы пробы выполнена оснащенной регулируемым клапаном, а блок анализа и обработки выполнен осуществляющим нормировку интенсивности эмиссионного спектра на концентрацию паров воды в выдыхаемом воздухе пациента.
Технический эффект заявляемого технического решения заключается в повышении точности и чувствительности в 15 раз в измерении концентрации малых примесей ацетона в выдыхаемом воздухе пациента, а также в упрощении конструкции и, расширении ассортимента устройств данного назначения.
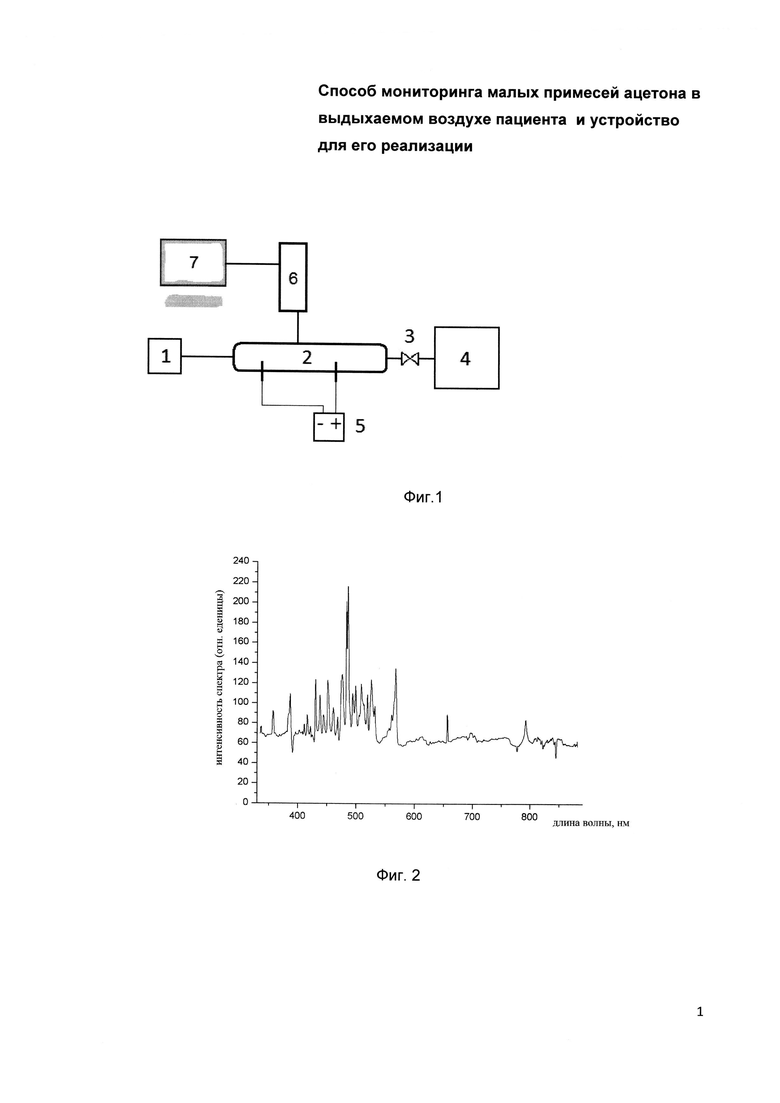
Заявляемый способ мониторинга малых примесей ацетона в выдыхаемом воздухе пациента реализуется с помощью устройства, которое поясняется блок-схемой, представленной на фиг. 1, где 1 - насос прокачки, 2 - разрядная ячейка, 3 - регулируемый клапан 4 - линия отбора пробы, 5 - источник питания, 6 - спектрометр, 7 - блок анализа и обработки.
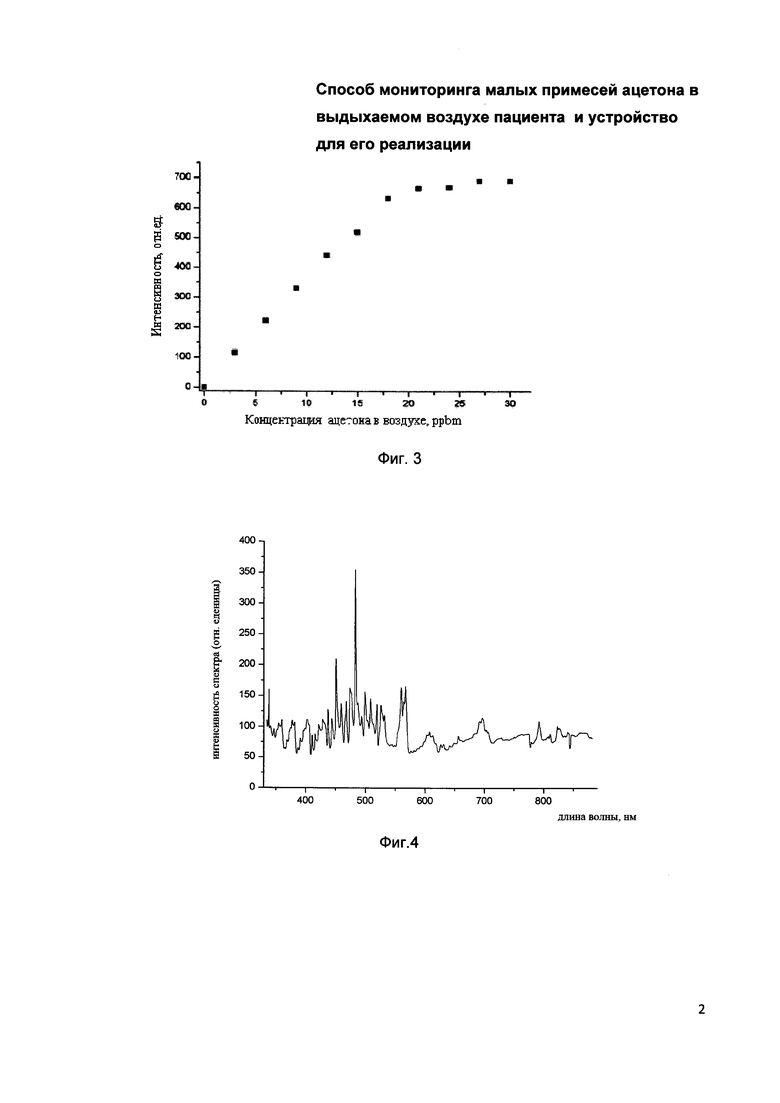
На фиг. 2 представлен пример эмиссионного спектра пробы выдыхаемого воздуха пациента с добавлением ацетон.
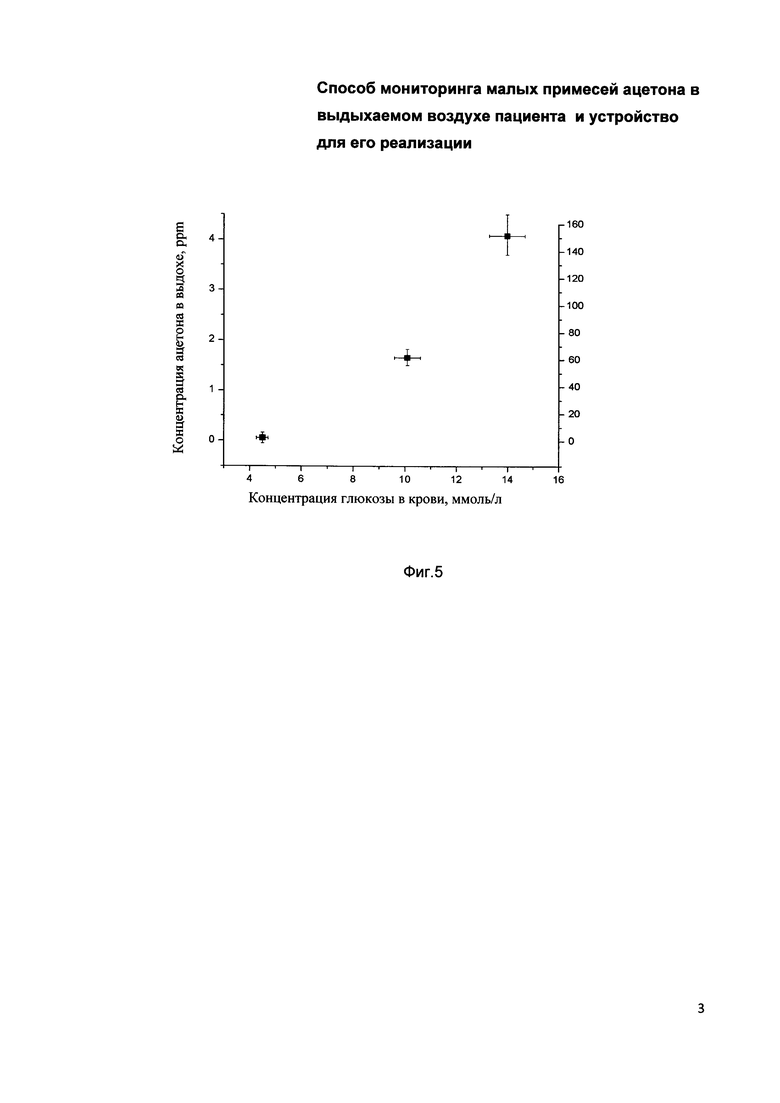
На фиг. 3 представлена зависимость интенсивности эмиссионного спектра ацетона от его концентрации.
На фиг. 4 представлен типичный эмиссионный спектр выдыхаемого воздуха пациента, больного диабетом.
На фиг. 5 представлен график зависимости концентрации глюкозы в крови от концентрации ацетона в выдыхаемом воздухе для 2-х пациентов и одного человека, не имеющего заболевание диабетом.
Заявляемый способ мониторинга малых примесей ацетона в выдыхаемом воздухе пациента основанный на использовании устройства для мониторинга малых примесей ацетона в выдыхаемом воздухе пациента, работает следующим образом. Устройство дополнительно оснащают насосом прокачки 1, который выполнен для понижения давления выдыхаемого воздуха пациента в разрядной ячейке 2, и линией отбора пробы 4, которую оснащают регулируемым клапаном 3. Первоначально, осуществляется забор выдыхаемого воздуха пациента с последующей подачей его в линию отбора пробы 4, затем с помощью регулируемого клапана 3, осуществляют регулирование натекания выдыхаемого воздуха пациента через линию отбора пробы 4. Далее, выдыхаемый воздух пациента поступает в разрядную ячейку 2, в которой во время работы поддерживается пониженное давление воздуха на уровне 10-100 Торр с помощью насоса прокачки 1 и регулируемого клапана 3. При достижении рабочего давления в разрядной ячейке 2 инициируют тлеющий разряд с постоянным током, который варьируется в диапазоне от 5 до 20 мА. Для поддержания разряда используется источник питания 5 с напряжением 1500 вольт и максимальным током до 20 мА. Далее, через оптоволоконный кабель эмиссионное излучение разряда направляется в спектрометр 6, сигнал с которого регистрируется и обрабатывается блоком анализа и обработки 7, который осуществляет нормировку интенсивности эмиссионного спектра на концентрацию паров воды в выдыхаемом воздухе пациента посредством измерения параметров разряда. Для осуществления заявляемого способа используется спектрометр, например, оптоволоконный с высокой фотометрической чувствительностью в видимом спектральном диапазоне. Входная щель спектрографа с шириной 50 мкм и дифракционная решетка с 600 штрихами на 1 мм обеспечивают спектральное разрешение равное 1,2 нм.
На Фиг. 2 представлен типичный эмиссионный спектр ацетона, полученный в тлеющем разряде лабораторного воздуха при добавлении в него ацетона. Этот эмиссионный спектр получен при концентрации ацетона равной 30 ppm. Ацетон в эмиссионном спектре представлен в виде 14 пиков различных амплитуд расположенных в интервале длин волн от 480 до 580 нанометров. Яркие линии с длинами волн 656 нм и 486 нм отвечают линиям водорода Нα и Ηβ серии Бальмера.
Главная причина, по которой в прототипе использовались только чистые благородные газы в качестве несущих газов, было опасение, что ацетон будет разлагаться в воздушном разряде, в результате окисления ацетона кислородом воздуха.
Были проведены эксперименты по регистрации эмиссионного спектра ацетона в отсутствии кислорода посредством использовании чистого азота и аргона в качестве газа носителя. Полученные эмиссионные спектры ацетона были неотличимы от эмиссионных спектров, зарегистрированных в воздушном разряде. Этот результат исключает гипотетическую возможность искажения эмиссионного спектра ацетона вследствие его окисления кислородом воздуха в тлеющем разряде.
На фиг. 3 представлена зависимость интенсивности эмиссионных спектров ацетона от его концентрации в воздухе. Для этого, в объем предварительной подготовки пробы, впрыскивались прецизионные порции жидкого ацетона, а после его испарения смесь через регулированный клапан вводилась в разрядную ячейку 2. При малых концентрациях ацетона эта зависимость с хорошей точностью является линейной, а затем при концентрации около 17,5 ppbm график выходит на насыщение. Было измерено, что пороговая чувствительность предлагаемого устройства на уровне шумов разряда, составляет величину порядка 1 ppbv. Такая большая чувствительность по сравнению пороговой чувствительностью прототипа (15 ppbv) явилась результатом применения разряда в разрядной ячейке 2 при пониженном давлении, когда шумы разряда сведены к минимуму. Достигнутая пороговая чувствительность предлагаемого устройства на уровне шумов разряда, составляет величину порядка 10 ppbv, что позволяет выявлять заболевание на ранней стадии, когда еще возможно избежать применения пожизненной инсулиновой терапии.
Для нормировки полезного сигнала использовалось уменьшение тока разряда, который снижался вследствие уменьшения температуры и подвижности электронов разряда из-за их столкновений с молекулами воды. Это уменьшение может быть экстрагирован непосредственно из-за источника питания, поэтому в предлагаемом способе нет необходимости использования дополнительных спектрографов или фотоприемников.
Клинические испытания предлагаемого технического решения проводились в НИИ физиологии и фундаментальной медицины СО РАМН. В испытаниях участвовали три пациента, двое из которых были больны диабетом около 10 лет, третий был на начальной стадии болезни с компенсированным недостатком инсулина в организме.
Перед проведением каждого измерения снимался эмиссионный спектр воздуха помещения, который брался в качестве опорного. Далее, производился анализ крови с целью установления уровня глюкозы в крови каждого больного. Анализ крови на сахар в крови производился на приборе Yellow Springs Instruments. Затем просили пациентов просто дышать в объем предварительной подготовки пробы до достижения нужного потока исследуемого воздуха в линии отборы пробы устройства. Эти тесты были проведены для всех исследуемых пациентов натощак перед завтраком. Всего были протестированы двое больных пациента и один пациент, не имеющий заболевание диабетом.
На фиг. 4 показан типичный эмиссионный спектр, полученный у одного из пациентов, болеющего диабетом в течение десяти лет. На графике хорошо видны характерные спектральные линии ацетона подобные тем, которые представлены на фиг. 2. Линия в области 337 нм соответствует молекулярному газу NO, который является биомаркером таких заболеваний, как рак органов пищеварения, астмы, гастрита и др. В области от 350 до 430 нм находятся широкие спектральные полосы, отвечающие метану, который является индикатором расстройства желудочно-кишечного тракта пациента. Отметим, полное отсутствие линий воды, не смотря на то, что водяные пары в дыхании составляют заметную долю. В эмиссионном спектре также имеется ряд неидентифицированных молекулярных полос и линий, которые требуют дальнейшего исследования. Измеренная зависимость концентрации ацетона в выдыхаемом воздухе пациента от концентрации глюкозы в крови представлена на фиг. 5. Каждая точка этой зависимости представляет собой отдельное измерение для одного пациента. Крайняя левая точка является результатом измерения условно здорового человека. Погрешность измерения концентрации ацетона достаточно мало и представляет собой статистическую ошибку устройства, а погрешность измерения уровня глюкозы в крови взята из литературы.
Преимуществом предлагаемого изобретения является то, что в качестве несущего газа используется сам выдыхаемый воздух пациента пониженного давления. Это позволило значительно упростить и удешевить устройство и избежать необходимости применения тяжелых, опасных и дорогих баллонов высокого давления. Пониженное давление воздуха в разряде позволило резко уменьшить уровень шумов разряда и тем самым существенно повысить чувствительность к определению сверхмалых концентраций ацетона. Применение нормировки сигнала с использованием параметров разряда позволяет резко увеличить точность измерения содержание ацетона в дыхании больного, что видно из приведенных результатов.
Так же представленное техническое решение может быть использовано для детектирования и мониторинга различных малых примесей в окружающем воздухе. К ним относятся примеси паров взрывчатых и наркотических веществ, ртути, диоксина, примеси метана, ксенона, окиси азота и прочее.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ контроля концентрации ацетона в воздухе, выдыхаемом человеком, и устройство для его реализации | 2018 |
|
RU2697809C1 |
| Способ мониторинга выдыхаемого пациентом воздуха для прогноза декомпенсации сахарного диабета | 2022 |
|
RU2794820C1 |
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ САХАРНОГО ДИАБЕТА | 2006 |
|
RU2368904C2 |
| УСТРОЙСТВО ДЛЯ КОМПЕНСАЦИИ ГИПЕРГЛИКЕМИИ У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ | 2015 |
|
RU2605792C2 |
| СПОСОБ АНАЛИЗА СОСТАВА ВЫДЫХАЕМОГО ВОЗДУХА МЕТОДОМ ВРАЩАТЕЛЬНОЙ СПЕКТРОМЕТРИИ | 2022 |
|
RU2822004C2 |
| СПОСОБ НЕИНВАЗИВНОГО СБОРА И АНАЛИЗА ТРАНСКУТАНТНОГО ГАЗА ИЗ ЖИВОГО ОРГАНИЗМА В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2005 |
|
RU2328213C2 |
| БЛОК ДЕТЕКТИРОВАНИЯ ЛЕТУЧИХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В СОСТАВЕ ВЫДЫХАЕМОГО ЧЕЛОВЕКОМ ВОЗДУХА | 2024 |
|
RU2831639C1 |
| МУЛЬТИПАРАМЕТРИЧЕСКОЕ УСТРОЙСТВО ДЛЯ ФУНКЦИОНАЛЬНОЙ ДИАГНОСТИКИ ДЫХАТЕЛЬНОЙ СИСТЕМЫ | 2024 |
|
RU2839640C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОСТОЯНИЯ ОРГАНИЗМА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1998 |
|
RU2174366C2 |
| ХИМИЧЕСКИЙ СЕНСОР ДЛЯ ОПРЕДЕЛЕНИЯ ПРОПАНОНА-2 В ВОЗДУХЕ, УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ ПРОПАНОНА-2 В ВЫДЫХАЕМОМ ВОЗДУХЕ И СПОСОБ ДИАГНОСТИКИ ГИПЕРКЕТОНЕМИИ | 1997 |
|
RU2094804C1 |
Изобретение относится к медицине, а именно к медицинской диагностике наличия ацетона в выдыхаемом воздухе пациента. Способ измерения концентрации ацетона в выдыхаемом воздухе основан на измерении уровня содержания ацетона по эмиссионным линиям разряда при пониженном давлении пробы выдыхаемого воздуха пациента с нормировкой на концентрацию паров воды, определенную по параметрам тлеющего разряда. Устройство для реализации способа состоит из разрядной трубки с разрядом в прокачиваемом через трубку выдыхаемого воздуха пациента в сочетании со спектрометром видимого диапазона волн и с возможностью расшифровки и интерпретации эмиссионных спектров. Использование изобретения обеспечивает возможность неинвазивного контроля содержания глюкозы в крови больного диабетом посредством измерения концентрации паров ацетона в выдыхаемом воздухе пациента в режиме реального времени. Изобретение позволяет повысить точность и чувствительность измерения концентрации примесей ацетона в выдыхаемом воздухе пациента, а также упростить конструкцию и расширить ассортимент устройств данного назначения. 2 н.п. ф-лы, 5 ил.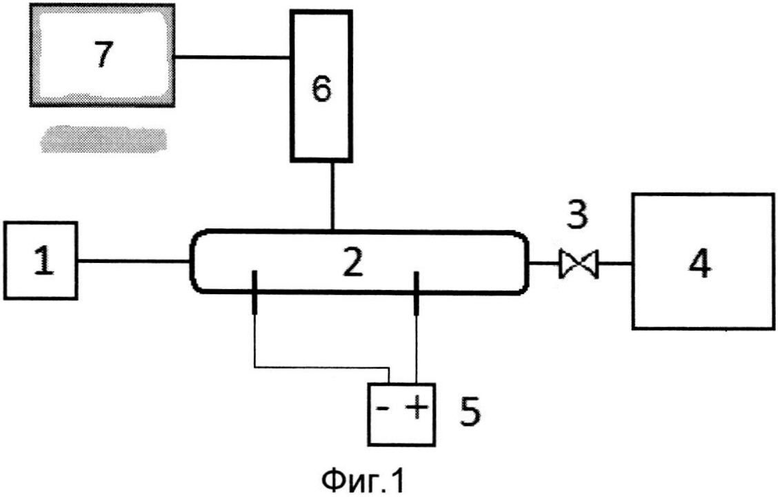
1. Способ мониторинга малых примесей ацетона в выдыхаемом воздухе пациента, включающий использование источника питания, спектрометра, разрядной ячейки, линии отбора пробы, блока анализа и обработки, осуществление забора выдыхаемого воздуха пациента с последующей подачей его в линию отборы пробы, инициирование разряда в разрядной ячейке, регистрацию эмиссионного спектра, анализирование эмиссионного спектра пробы выдыхаемого воздуха пациента, отличающийся тем, что при этом дополнительно используют насос прокачки, выполненный для понижения давления выдыхаемого воздуха пациента в разрядной ячейке, линию отбора пробы оснащают регулируемым клапаном, кроме того, дополнительно осуществляют регулирование натекания выдыхаемого воздуха пациента через линию отбора пробы регулируемым клапаном, осуществляют понижение давления выдыхаемого воздуха пациента в разрядной ячейке насосом прокачки, а инициирование разряда в разрядной ячейке осуществляют при пониженном давлении, анализирование эмиссионного спектра пробы выдыхаемого воздуха пациента выполняют посредством нормировки интенсивности этого эмиссионного спектра на концентрацию паров воды в выдыхаемом воздухе пациента.
2. Устройство для мониторинга малых примесей ацетона в выдыхаемом воздухе пациента, содержащее источник питания, спектрометр, разрядную ячейку, линию отбора пробы, блок анализа и обработки, отличающееся тем, что оно дополнительно оснащено насосом прокачки, выполненным для понижения давления выдыхаемого воздуха пациента в разрядной ячейке, при этом линия отборы пробы выполнена оснащенной регулируемым клапаном, а блок анализа и обработки выполнен осуществляющим нормировку интенсивности эмиссионного спектра на концентрацию паров воды в выдыхаемом воздухе пациента.
| US 7361514 B2, 22.04.2008 | |||
| US 7417730 B2, 26.08.2008 | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ БРОНХО-ЛЕГОЧНЫХ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2486522C2 |
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ САХАРНОГО ДИАБЕТА | 2006 |
|
RU2368904C2 |
| CA 2873417 A1, 21.11.2013 | |||
| US 4587427 A, 06.05.1986. | |||
Авторы
Даты
2016-09-20—Публикация
2015-07-15—Подача