Область техники
Настоящее изобретение относится к области биомедицины. В частности, оно относится к способу и системе для определения того, существует ли аномалия генома, а конкретнее, настоящее изобретение относится к способу определения геномной последовательности ядросодержащих эритроцитов плода, способу определения того, существует ли аномалия генома, и системе для определения того, существует ли аномалия генома.
Предпосылки создания изобретения
Пренатальная диагностика, также известная как дородовая диагностика, относится к диагностированию с высокой точностью того, страдает ли плод до рождения некоторыми генетическими заболеваниями или врожденными пороками развития, с помощью объединения результатов генетического детектирования и томографического исследования. Используемые в настоящее время способы пренатальной диагностики в основном делят на инвазивную диагностику и неинвазивную диагностику в соответствии с различиями в способах отбора образца. Инвазивная диагностика в основном включает амниоцентез (исследование амниотической жидкости), пункцию хориона, отбор образца пуповинной крови, фетоскопию, биопсию эмбриона и т.д., и в настоящее время амниоцентез и пункция хориона являются относительно часто применяемыми. В случае инвазивной диагностики, так как клетки или ткани плода могут быть отобраны непосредственно, может быть получен точный и верный результат после генетического детектирования, но из-за инвазивного способа отбора образца будет причиняться потенциальный вред беременной женщине и плоду, а в серьезном случае даже вызываются выкидыш или внутриутробная инфекция и т.д. В соответствии со статистикой амниоцентез и пункция хориона могут приводить к коэффициенту выкидыша, составляющему приблизительно 1% и 1-2% соответственно.
В настоящее время способы пренатальной диагностики все еще подлежат усовершенствованию.
Краткое изложение сущности изобретения
Настоящее изобретение направлено на решение по крайней мере одной из технических проблем, существующих в данной области техники. По этой причине настоящее изобретение представляет способ и систему, способную эффективно определить, существует ли аномалия генома.
В соответствии с аспектом настоящего изобретения настоящее изобретение представляет способ определения того, существует ли аномалия генома. В соответствии с вариантами осуществления настоящего изобретения способ определения того, существует ли аномалия генома, включает стадии: выделения ядросодержащих эритроцитов плода из образца от беременной женщины, секвенирования по крайней мере части генома указанных ядросодержащих эритроцитов, чтобы получить результат секвенирования, и, на основе указанного результата секвенирования, определения того, существует ли аномалия генома в указанных ядросодержащих эритроцитах. Авторы настоящего изобретения установили, что можно эффективно определить, существует ли аномалия генома в ядросодержащих эритроцитах плода, выделенных из образца от беременной женщины, используя способ в соответствии с вариантами осуществления настоящего изобретения. Способ может быть предназначен для немедицинской цели.
В соответствии со вторым аспектом настоящего изобретения настоящее изобретение представляет систему для определения того, существует ли аномалия генома. В соответствии с вариантами осуществления настоящего изобретения система включает устройство для отделения ядросодержащих эритроцитов, при этом указанное устройство для отделения ядросодержащих эритроцитов используется для выделения ядросодержащих эритроцитов плода из образца от беременной женщины, устройство для секвенирования, при этом указанное устройство для секвенирования используется для секвенирования по крайней мере части генома указанных ядросодержащих эритроцитов, чтобы получить результат секвенирования, и устройство для анализа результата секвенирования, при этом указанное устройство для анализа результата секвенирования соединено с устройством для секвенирования для получения указанного результата секвенирования от указанного устройства для секвенирования, и на основе указанного результата секвенирования выносится решение, существует ли аномалия генома в указанных ядросодержащих эритроцитах. Способ определения того, существует ли аномалия генома, в соответствии с вариантами осуществления настоящего изобретения можно эффективно осуществить, используя систему для определения анеуплоидии по хромосоме(ам) в ядросодержащих эритроцитах, и, таким образом, можно эффективно определить, существует ли аномалия генома в ядросодержащих эритроцитах.
В соответствии с другим аспектом настоящего изобретения настоящее изобретение представляет способ определения геномной последовательности ядросодержащих эритроцитов плода. В соответствии с вариантами осуществления настоящего изобретения он включает стадии: выделения ядросодержащих эритроцитов плода из образца от беременной женщины и секвенирования по крайней мере части генома указанных ядросодержащих эритроцитов, чтобы получить результат секвенирования. Информацию о последовательности генома ядросодержащих эритроцитов можно эффективно получить, используя этот способ, так что можно получить информацию о последовательности генома плода.
Дополнительные аспекты и преимущества настоящего изобретения будут отчасти указаны в следующем описании и отчасти станут очевидными благодаря следующему описанию, или будут понятны благодаря осуществлению на практике настоящего изобретения.
Описание чертежей
Вышеупомянутые и/или дополнительные аспекты и преимущества настоящего изобретения станут очевидными и понятными благодаря описанию вариантов осуществления в сочетании со следующими чертежами, где:
на фиг. 1 представлена блок-схема последовательности операций в способе определения того, существует ли аномалия генома в ядросодержащих клетках, в соответствии с вариантом осуществления настоящего изобретения;
На фиг. 2 представлена блок-схема последовательности операций в способе определения того, существует ли аномалия генома в ядросодержащих клетках, в соответствии с другим вариантом осуществления настоящего изобретения;
На фиг. 3 представлена блок-схема системы, используемой для определения того, существует ли аномалия генома в ядросодержащих клетках, в соответствии с вариантом осуществления настоящего изобретения;
На фиг. 4 представлена блок-схема устройства для отделения ядросодержащих эритроцитов в соответствии с вариантом осуществления настоящего изобретения;
На фиг. 5 представлена блок-схема системы, используемой для определения того, существует ли аномалия генома в ядросодержащих клетках, в соответствии с еще одним вариантом осуществления настоящего изобретения;
На фиг. 6 представлена блок-схема устройства для приготовления библиотеки для секвенирования полного генома в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 7 представлен результат детектирования сконструированной библиотеки ДНК в соответствии с вариантом осуществления настоящего изобретения с помощью анализатора Agilent® Bioanalyzer 2100. Вкратце, амплифицированный продукт полного генома позитивных клеток (ядросодержащих эритроцитов), полученных с помощью отделения, разрезали с помощью ультразвуковой волны, основанная полоса после разрезания составляла приблизительно 350 п.о., размеры фрагментов после лигирования с адаптером были увеличены на приблизительно 120 п.о., и фрагмент размером 430-450 п.о. выделяли вырезанием из геля. На фиг. 7 можно видеть, что диапазон фрагментов четырех библиотек удовлетворяет требованиям, и качество библиотеки удовлетворяет требованиям секвенирования, где GP9 представляет собой исследуемый образец, а YH6 представляет собой контрольный образец (образец от нормального человека).
На фиг. 8 представлен результат анализа данных секвенирования в соответствии с вариантом осуществления настоящего изобретения, где в (А) представлено распределение значения для содержания GC в каждом окне и числа уникально совмещаемых данных секвенирования для исследуемого образца; в (В) представлена сглаженная сплайновая кривая связи между содержанием GC и числом уникально совмещаемых данных секвенирования, в (С) представлено распределение весового коэффициента, соответствующего поправке данных для каждого окна в исследуемом образце, где окно с каждым содержанием GC соответствует одному значению UR в качестве соответствующего поправке весового коэффициента; и в (D) представлена коробчатая диаграмма, демонстрирующая данные секвенирования каждой хромосомы.
Конкретные варианты осуществления
Варианты осуществления настоящего изобретения детализированы ниже, и примеры указанных вариантов осуществления представлены на чертежах, на которых одинаковые или сходные пометы представляют собой одинаковые или сходные элементы или элементы с одинаковыми или схожими функциями от первого до последнего. Следующие варианты осуществления, описанные с учетом чертежей, являются примерными и используются лишь для объяснения настоящего изобретения, но их нельзя понимать как ограничение настоящего изобретения.
Необходимо отметить, что термины «первый» и «второй» используются лишь с целью описания, и их нельзя понимать как указание на относительную важность или неявное указание на число указанных технических признаков, или как предположение этого. Таким образом, признаки, определенные с помощью «первый» и «второй», могут явно или неявно включать один или более признаков. Кроме того, в описании настоящего изобретения, кроме особо оговоренных случаев, значением термина «множество» является два или более.
1. Способ определения того, существует ли аномалия генома
Аспект настоящего изобретения представляет способ определения того, существует ли аномалия генома. С учетом фиг. 1, в соответствии с вариантами осуществления настоящего изобретения, способ включает стадии:
S10: выделение ядросодержащих эритроцитов плода из образца от беременной женщины.
В настоящем изобретении выбор выделения ядросодержащих эритроцитов плода из образца от беременной женщины сделан на основе следующего открытия, сделанного авторами настоящего изобретения: в настоящее время исследования генетических аномалий у плода в основном основаны на выделении свободной ДНК плода из беременной женщины. Однако, поскольку помимо свободной ДНК плодного происхождения в периферической крови беременной женщины также существует большое количество ДНК материнского происхождения, и половина геномной ДНК плода происходит от матери, точная дифференциация происхождения ДНК является относительно трудной в настоящее время. Вместе с тем свободная ДНК плода в периферической крови матери существует в неполном геноме, и по этой причине большое увеличение вероятности ложноотрицательного результата обусловлено утратой матрицы в процессе детектирования конкретного сайта гена. По этой причине детектирование генетических аномалий у плода, используя свободную ДНК плода, имеет свои собственные недостатки, и вдобавок авторы настоящего изобретения дополнительно установили, что помимо свободных нуклеиновых кислот плода интактные клетки плода также существуют в периферической крови матери. Свободные клетки плода в периферической крови беременной женщины в основном включают трофобластные клетки, лейкоциты и ядросодержащие эритроциты плода. Авторы настоящего изобретения установили, что среди них трофобластные клетки являются легкоприводящими к ошибочному диагнозу вследствие существования двух форм, многоядерной формы и одноядерной формы. Лейкоциты будут существовать в крови матери постоянно после рождения плода и будут мешать детектированию при следующей беременности. Кроме того, авторы настоящего изобретения установили, что ядросодержащие эритроциты плода имеют относительно короткий жизненный цикл, будут исчезать в пределах 90 дней после рождения плода и не будут мешать детектировании при другой беременности, и вместе с тем антигены на поверхности ядросодержащих эритроцитов являются относительно стабильными, и они являются легко распознаваемыми и выделяемыми. Таким образом, аномалию генома плода можно эффективно определить, используя ядросодержащие эритроциты плода. Авторы настоящего изобретения установили, что эффект способа использования ядросодержащих эритроцитов плода в периферической крови беременной женщины для проведения неинвазивной пренатальной диагностики в сочетании с высокопроизводительным секвенированием намного превосходит используемую в настоящее время неинвазивную пренатальную диагностику с использованием плазмы беременной женщины.
В соответствии с вариантами осуществления настоящего изобретения образец от беременной женщины в качестве источника ядросодержащих эритроцитов не очень ограничивается. В соответствии с некоторыми вариантами осуществления настоящего изобретения, в соответствии с вариантом осуществления настоящего изобретения, указанным образцом от беременной женщины является предпочтительно периферическая кровь беременной женщины. Таким образом, эти образцы можно без труда получить от беременной женщины, и на основе предпосылки, что на развитие плода не оказывается влияние, ядросодержащие эритроциты плода можно получить из периферической крови беременной женщины для выполнения секвенирования полного генома, тем самым выполняя неивазивное пренатальное исследование. Кроме того, стадия беременности беременной женщины в качестве источника ядросодержащих эритроцитов плода не очень ограничивается. В соответствии с вариантами осуществления настоящего изобретения для выделения ядросодержащих эритроцитов плода можно выбрать образец от беременной женщины со сроком беременности меньше 20 недель, например, образец от беременной женщины со сроком беременности 12-20 недель может быть выбран в качестве объекта исследования. Таким образом, ядросодержащие эритроциты плода можно эффективнее выделить для выполнения исследования. Кроме того, авторы настоящего изобретения с удивлением обнаружили, что, используя способ настоящего изобретения, даже в том случае, если получен только 1 ядросодержащий эритроцит плода, исследование может быть выполнено эффективно.
В соответствии с вариантами осуществления настоящего изобретения способ выделения ядросодержащих эритроцитов из биологического образца, например, периферической крови, не очень ограничивается. В соответствии с конкретными вариантами осуществления настоящего изобретения выделение указанных ядросодержащих эритроцитов из периферической крови дополнительно включает следующие стадии.
Прежде всего, выполняют центрифугирование в градиенте плотности указанной периферической крови, используя реагент для создания градиента плотности, чтобы получить моноциты. В соответствии с вариантами осуществления настоящего изобретения тип реагента для создания градиента плотности не очень ограничивается, и в соответствии с конкретными примерами полисахароза, например, Фиколл, можно выбрать для создания градиента плотности. Предпочтительно указанное центрифугирование в градиенте плотности можно выполнять при 8000×g в течение 30 минут.
После получения моноцитов обогащение ядросодержащими эритроцитами осуществляют, исходя из полученных моноцитов, с использованием магнитных частиц, несущих антитело, причем антитело, содержащееся на магнитных частицах, специфически распознает антиген на поверхности ядросодержащих эритроцитов, затем ядросодержащие клетки будут связываться с магнитными частицами благодаря антителу, и впоследствии ядросодержащие эритроциты можно получить с помощью магнитной сортировки.
В соответствии с вариантами осуществления настоящего изобретения после получения указанных моноцитов и до осуществления обогащения указанными ядросодержащими эритроцитами с использованием магнитных частиц, несущих антитело против CD71, процесс дополнительно включает отмывку указанных моноцитов, используя буфер PBS, содержащий 1% BSA, чтобы удалить остаточный реагент для создания градиента плотности, предпочтительно указанный буфер PBS содержит первичный кислый фосфат калия и двузамещенный фосфорнокислый калий, но не содержит ионы кальция и ионы магния, и, таким образом, эффективность обогащения ядросодержащими эритроцитами может быть значительно увеличена. В соответствии с конкретными примерами настоящего изобретения отмывка указанных моноцитов, используя буфер PBS, содержащий 1% BSA дополнительно включает: смешивание указанных моноцитов и указанного буфера PBS, содержащего 1% BSA, чтобы получить суспензию, содержащую моноциты, и центрифугирование указанной суспензии, содержащей моноциты, предпочтительно ее центрифугирование при 200×g в течение 5 минут, и отбрасывание супернатанта, чтобы получить отмытые ядросодержащие эритроциты. Предпочтительно указанным антителом является антитело, специфически распознающее CD71. Авторы настоящего изобретения установили, что с помощью способа отделения ядросодержащих эритроцитов в соответствии с вариантами осуществления настоящего изобретения ядросодержащие эритроциты можно эффективно выделить из периферической крови, и, в частности, ядросодержащие эритроциты плода можно выделить. Таким образом, настоящее изобретение представляет способ выделения ядросодержащих эритроцитов плода из периферической крови, который является простым и легко выполняемым. Конечно, квалифицированным в данной области техники будет понятно, в способ отделения ядросодержащих эритроцитов могут быть также включены другие стадии. Например, в соответствии с конкретными примерами настоящего изобретения способ отделения ядросодержащих эритроцитов включает: взятие соответствующего количества крови беременной женщины, выполнение антикоагуляции с использованием антикоагулянта, разведение образца крови пропорционально 0,1М фосфатным буферным раствором (PBS), не содержащим ионы кальция и ионы магния, медленное наслаивание разведенного образца на реагент для центрифугирования в градиенте плотности и выполнение центрифугирования в градиенте плотности при комнатной температуре. После центрифугирования можно увидеть слой моноцитов, слой клеток осторожно отсасывают пипеткой, переносят в новую центрифужную пробирку, ресуспендируют с использованием 3 объемов буфера PBS, содержащего 1% BSA, и снова центрифугируют при комнатной температуре, супернатант отбрасывают, полученный клеточный осадок далее дважды отмывают с использованием того же способа для удаления остаточной жидкости градиента плотности и, наконец, клеточный осадок ресуспендируют в PBS, содержащем 0,1% BSA, и равномерно пипетируют. Затем магнитные частицы, несущие антитело, добавляют в соотношении 20 микролитров/106 клеток и центрифугируют после выдерживания при 4°С, супернатант отбрасывают, а осадок ресуспендируют в PBS, содержащем 0,1% BSA, и собирают систему для сортировки магнитных частиц. Сортировочную колонку увлажняют с помощью 500 микролитров буфера PBS, содержащего 0,1% BSA, и после спуска жидкости клетки, подвергаемые сортировке, загружают в колонку, и выходящую жидкость собирают и помечают как негативные клетки. Трубку увлажняют с использованием PBS, содержащего 0,1% BSA, и после спуска жидкости это же снова повторяют дважды, в сортировочную колонку добавляют PBS/EDTA/BSA, и после спуска жидкости это же снова повторяют один раз. Наконец, PBS, содержащий 0,1% BSA, добавляют в сортировочную колонку, магнитное поле убирают, жидкость сливают в новую центрифужную пробирку, и получают ядросодержащие эритроциты.
S20: после выделения ядросодержащих эритроцитов плода из образца от беременной женщины можно секвенировать по крайней мере часть генома ядросодержащих эритроцитов, и таким образом можно получить результат секвенирования, соответствующий объектам секвенирования.
В соответствии с вариантами осуществления настоящего изобретения после выделения ядросодержащих эритроцитов плода можно секвенировать по крайней мере часть генома ядросодержащих эритроцитов. Квалифицированные в данной области техники специалисты могут выбрать объекты секвенирования из генома ядросодержащих эритроцитов в соответствии с представляющими интерес генами и таким образом получить результат секвенирования, соответствующий этим объектам секвенирования. В соответствии с вариантами осуществления настоящего изобретения квалифицированные в данной области техники специалисты могут выбрать любой известный способ для выбора объектов секвенирования, например, могут выбрать только отдельные хромосомы в нем. Конечно, квалифицированные в данной области техники специалисты будут понимать, что можно также сразу секвенировать полный геном ядросодержащих эритроцитов, и после получения результата секвенирования данные секвенирования конкретного сайта отбирают из результата секвенирования для выполнения исследования (см. подробности ниже). Из-за удобства, нижеследующее иллюстрирует это с секвенированием полного генома ядросодержащих эритроцитов в качестве примера.
В соответствии с вариантами осуществления настоящего изобретения после получения ядросодержащих эритроцитов способ секвенирования полного генома ядросодержащих эритроцитов не очень ограничивается. В соответствии с вариантом осуществления настоящего изобретения секвенирование полного генома ядросодержащих эритроцитов дополнительно включает: прежде всего, амплификацию полного генома ядросодержащих эритроцитов для получения амплифицированного полного генома, впоследствии конструирование библиотеки для секвенирования полного генома, используя амплифицированный полный геном, и, наконец, секвенирование библиотеки для секвенирования полного генома, чтобы получить результат секвенирования, состоящий из множества данных секвенирования. Таким образом, можно эффективно получить информацию о полном геноме ядросодержащих эритроцитов, и таким образом можно дополнительно увеличить эффективность определения того, существует ли аномалия генома в ядросодержащих эритроцитах. Квалифицированные в данной области техники специалисты могут выбрать различные способы конструирования библиотеки для секвенирования полного генома в соответствии с конкретным протоколом для используемого метода секвенирования генома, и ради подробностей конструирования библиотеки для секвенирования полного генома смотрите директивные правила, предлагаемые производителем секвенатора, например, Illumina Corporation, например, смотрите Multiplexing Sample Preparation Guide (Part#1005361; Feb 2010) или Paired-End SamplePrep Guide (Part#10050631; Feb 2010), предлагаемое Illumina Corporation, которое включено сюда посредством ссылки.
Необязательно, в соответствии с вариантами осуществления настоящего изобретения, оно может дополнительно включать стадию лизиса указанных ядросодержащих эритроцитов для высвобождения полного генома указанных ядросодержащих эритроцитов. В соответствии с некоторыми примерами настоящего изобретения способ, который может использоваться для лизиса ядросодержащих эритроцитов и высвобождения полного генома, не очень ограничивается при условии, что способ может лизировать, предпочтительно полностью лизировать, ядросодержащие эритроциты. В соответствии с некоторыми примерами настоящего изобретения щелочной буфер для лизиса может использоваться для лизиса указанных ядросодержащих эритроцитов и высвобождения полного генома указанных ядросодержащих эритроцитов. Авторы настоящего изобретения установили таким образом, что ядросодержащие эритроциты можно эффективно лизировать и высвободить полный геном, и при секвенировании высвобожденного полного генома можно увеличить уровень точности, и таким образом дополнительно увеличивается эффективность определения анеуплоидии по хромосоме(ам) в ядросодержащих эритроцитах. В соответствии с вариантами осуществления настоящего изобретения способ амплификации полного генома ядросодержащих эритроцитов не очень ограничивается, и можно выбрать способ на основе ПЦР (PCR), можно выбрать, например, PEP-PCR, DOP-PCR и OmniPlex WGA, и можно также выбрать способ не на основе ПЦР, например, MDA (амплификацию с множественным вытеснением цепи). В соответствии с конкретными примерами настоящего изобретения предпочтительно выбирают способ на основе ПЦР, например, способ OmniPlex WGA. Выбираемые коммерциализированные наборы включают, но без ограничения, GenomePlex от Sigma Aldrich, PicoPlex от Rubicon Genomics, REPLI-g от Qiagen, illustra GenomiPhi от GE Healthcare и т.д. Следовательно, в соответствии с конкретными примерами настоящего изобретения, перед конструированием библиотеки для секвенирования можно выбрать OmniPlex WGA для амплификации полного генома ядросодержащих эритроцитов. Таким образом, полный геном можно эффективно амплифицировать, и таким образом дополнительно увеличивается эффективность определения анеуплоидии по хромосоме(ам) в ядросодержащих эритроцитах.
В соответствии с вариантами осуществления настоящего изобретения конструирование библиотеки для секвенирования полного генома (также называемой здесь иногда «библиотекой нуклеиновых кислот» или «библиотекой для секвенирования), используя указанный амплифицированный полный геном дополнительно включает.
Прежде всего, амплифицированный полный геном подвергают фрагментации, чтобы получить фрагменты ДНК, и в соответствии с вариантами осуществления настоящего изобретения способ фрагментации полученной ДНК не очень ограничивается, и в соответствии с некоторыми конкретными примерами фрагментацию можно выполнить с помощью по крайней мере одного способа, выбираемого из тонкого измельчения, ультразвукового способа разрезки, HydroShear и процедуры ферментативного расщепления, предпочтительно амплифицированный полный геном подвергают фрагментации, используя ультразвуковое устройство для разрезки Covaris. В соответствии с вариантами осуществления настоящего изобретения размер фрагментов ДНК, получаемых после процедуры фрагментации, составляет 200-400 п.о., предпочтительно 350 п.о. Авторы настоящего изобретения установили, что получаемые фрагменты ДНК этого размера можно эффективно использовать для конструирования библиотеки нуклеиновых кислот и последующих обработок.
После получения фрагментов ДНК можно выполнить репарацию концов полученных фрагментов ДНК, чтобы получить фрагменты ДНК с репарированными концами. В соответствии с вариантами осуществления настоящего изобретения можно выполнить репарацию концов фрагментов ДНК, используя фрагмент Кленова, ДНК-полимеразу Т4 и полинуклеотидкиназу Т4, причем фрагмент Кленова обладает 5′→3′ полимеразной активностью и 3′→5′ экзонуклеазной активностью, но не обладает 5′→3′ экзонуклеазной активностью, и таким образом можно эффективно выполнить репарацию концов фрагментов ДНК.
После выполнения репарации ДНК фрагментов ДНК основания А можно добавить к 3′-концам фрагментов ДНК с репарированными концами, чтобы получить фрагменты ДНК с «липким» концом А. В соответствии с некоторыми конкретными примерами настоящего изобретения основания А можно добавить к 3′-концам фрагментов ДНК с репарированными концами, используя фрагмент Кленова (3′→5′ exo-), т.е. фрагмент Кленова, который не обладает 3′→5′ экзонуклеазной активностью, и таким образом можно эффективно получить фрагменты ДНК с «липким» концом А.
После добавления к концу оснований А фрагменты ДНК с «липким» концом А можно лигировать с адаптером, чтобы получить продукт лигирования. В соответствии с вариантами осуществления настоящего изобретения фрагменты ДНК с «липким» концом А можно лигировать с адаптером, используя ДНК-лигазу Т4, и таким образом можно эффективно получить продукт лигирования. В соответствии с вариантами осуществления настоящего изобретения метку можно дополнительно включить в адаптер, и таким образом можно одновременно сконструировать подходящим образом библиотеки для секвенирования полного генома из множества образцов ядросодержащих эритроцитов, и библиотеки для секвенирования из множества образцов объединяют и секвенируют одновременно. Таким образом, можно в полной мере использовать платформу для высокопроизводительного секвенирования, и сберечь время, и эффективно снизить затраты на секвенирование.
После получения продукта лигирования выполняют амплификацию с использованием ПЦР указанного продукта лигирования, чтобы получить второй продукт амплификации, и указанный второй продукт амплификации очищают и выделяют, чтобы получить выделенный продукт, и указанный выделенный продукт образует указанную библиотеку для секвенирования полного генома.
После конструирования библиотеки для секвенирования полного генома, в соответствии с вариантами осуществления настоящего изобретения, указанную библиотеку для секвенирования полного генома можно секвенировать. Конечно, квалифицированным в данной области техники специалистам будет понятно, что стадию секвенирования в настоящем изобретении можно выполнить с помощью любого метода секвенирования, который включает, но без ограничения, метод обрыва цепи с использованием дидезоксинуклеотидов, предпочтительно способов высокопроизводительного секвенирования, и таким образом можно использовать характеристики высокопроизводительного и глубокого секвенирования этих устройств для секвенирования, и дополнительно увеличивается эффективность определения анеуплоидии по хромосоме(ам) в ядросодержащих эритроцитах. Указанные способы высокопроизводительного секвенирования включают, но без ограничения, метод секвенирования второго поколения или метод секвенирования одной молекулы.
Указанные платформы для секвенирования второго поколения (Metzker ML., Sequencing technologies-the next generation. Nat Rev Genet. 2010 Jan; 11(1): 31-46) включают, но без ограничения, Illumina-Solexa (GA™, HiSeq2000™ и т.д.), ABI-Solid и платформу для секвенирования (пиросеквенирования) Roche-454; а платформы (методы) для секвенирования одной молекулы включают, но без ограничения, метод секвенирования действительно одной молекулы (True Single Molecule DNA sequencing) от Helicos Corporation, секвенирование в режиме реального времени одной молекулы (SMRT™) от Pacific Biosciences Corporation и метод секвенирования с использованием мембраны с нанопорами от Oxford Nanopore Technologies Corporation и т.д. (Rusk, Nicole (2009-04-1). Cheap Third-Generation Sequencing. Nature Methods 6(4); 244-245).
Учитывая непрерывную разработку технологии секвенирования, квалифицированным в данной области техники специалистам будет понятно, что секвенирование полного генома можно также выполнить, используя другие методы секвенирования и устройства для него. В соответствии с вариантами осуществления настоящего изобретения размеры данных секвенирования, получаемых при секвенировании полного генома, не очень ограничивается. В соответствии с конкретным примером настоящего изобретения средний размер указанного множества данных секвенирования составляет приблизительно 50 п.о. Авторы настоящего изобретения установили, что, когда средний размер данных секвенирования составляет приблизительно 50 п.о., анализ данных секвенирования может быть значительно облегчен, эффективность анализа увеличивается, и вместе с тем могут быть значительно снижены затраты на анализ. Кроме того, увеличивается эффективность определения анеуплоидии по хромосоме(ам) в ядросодержащих эритроцитах, и снижаются затраты на определение анеуплоидии по хромосоме(ам) в ядросодержащих эритроцитах. Термин «средний размер», используемый здесь, относится к среднему значению численных значений размеров всех данных секвенирования.
S30: после получения результата секвенирования определяют, на основе полученного результата секвенирования, существует ли аномалия генома в ядросодержащих эритроцитах.
Используемый здесь термин «аномалия генома» следует понимать широко, и он может относиться к любому изменению в геномной последовательности, например, анеуплоидии по хромосоме(ам), структурной вариации, мутации в одном нуклеотиде и другим генетическим вариациям (http://en.wikipedia.org/wiki/Genetic_variation), и она может также быть изменением сайта модификации генома, например, уровня метилирования. В соответствии с вариантами осуществления настоящего изобретения исследуемая аномалия генома представляет собой по крайней мере одну аномалию, выбираемую из анеуплоидии по хромосоме(ам) и мутации в заранее определенной области. В вариантах осуществления настоящего изобретения мутация в заранее определенной области относится к структурной вариации (http://en.wikipedia.org/wiki/Genetic_variation) или мутации в одном нуклеотиде (SNP, http://en.wikipedia.org/wiki/Single-nucleotide_polymorphism).
В соответствии с вариантами осуществления настоящего изобретения определение мутации в заранее определенной области в геноме может дополнительно включать.
Прежде всего, на основе результата секвенирования определяют нуклеотидную последовательность заранее определенной области в указанных ядросодержащих эритроцитах. Квалифицированные в данной области техники специалисты могут выбрать любой известный способ для определения нуклеотидной последовательности заранее определенной области. Например, может быть выбран известным способ сбора данных секвенирования конкретной области в результате секвенирования, получая таким образом нуклеотидную последовательность заранее определенной последовательности.
После получения нуклеотидной последовательности заранее определенной последовательности нуклеотидную последовательность заранее определенной области в указанных ядросодержащих эритроцитах совмещают с контрольной нуклеотидной последовательностью, предпочтительно указанной контрольной нуклеотидной последовательностью является геномная последовательность нормального человека. Впоследствии, на основе результата совмещения можно определить, существует ли аномалия в заранее определенной области в ядросодержащих эритроцитах. В соответствии с вариантами осуществления настоящего изобретения мутация в заранее определенной области, которую можно детектировать с помощью этого способа, включает по крайней мере одну мутацию, выбираемую из инсерционной мутации, делеционной мутации, мутации с заменой, мутацией с инверсией, вариации числа копий, мутации с транслокацией и однонуклеотидного полиморфизма.
С учетом фиг. 2, в соответствии с вариантами осуществления настоящего изобретения, способ определения анеуплоидии по хромосоме(ам) включает стадии:
S100: прежде всего, секвенируют полный геном ядросодержащих эритроцитов, чтобы получить первый результат секвенирования. Секвенирование полного генома было детализировано выше и не повторяется.
S200: известную последовательность первой хромосомы делят на окна.
Для анализа данных секвенирования ядросодержащих эритроцитов, прежде всего, известную последовательность первой хромосомы делят на окна, и эти окна независимо имеют заранее задаваемый размер, соответственно. В соответствии с вариантами осуществления настоящего изобретения размеры этих окон могут быть одинаковыми, могут также быть различными и не очень ограничиваются. В соответствии с вариантом осуществления настоящего изобретения заранее задаваемые размеры окон в указанном множестве являются одинаковыми. Предпочтительно все заранее задаваемые размеры окон в указанном множестве составляют 60 т.п.о. Таким образом, можно увеличить эффективность определения анеуплоидии по хромосоме(ам) в ядросодержащих эритроцитах. Кроме того, квалифицированные в данной области техники специалисты могут выбрать область последовательности первой хромосомы, охватываемую этими окнами, при необходимости.
S300: определяют число данных секвенирования, относящихся к каждому окну.
После получения данных секвенирования полученные данные секвенирования совмещают с известной последовательностью первой хромосомы, и таким образом полученные данные секвенирования можно разделить на окна с заранее задаваемыми размерами, соответственно. Квалифицированным в данной области техники специалистам будет понятно, что любой известный способ или средство можно выбрать для выполнения совмещения и расчета суммарного числа этих данных секвенирования. Например, программное обеспечение, предоставляемое производителем секвенатора, можно выбрать для выполнения анализа, например, SOAP версии 2.20. В соответствии с вариантом осуществления настоящего изобретения указанными данными секвенирования, относящимися к каждому окну, являются уникально совмещаемые данные секвенирования. Таким образом, благодаря скринингу данных секвенирования можно дополнительно увеличить эффективность определения анеуплоидии по хромосоме(ам) в ядросодержащих эритроцитах. Используемый здесь термин «уникально совмещаемые данные секвенирования» относится к данным секвенирования, которые могут полностью совпадать с или быть успешно совмещены только один раз с контрольным геномом, когда данные секвенирования совмещают с известной хромосомной последовательностью, например, геном человека Hg19, и также упоминается здесь иногда как «уникальное считывание».
Используемый здесь термин «первая хромосома» следует понимать широко, он может относиться к любой целевой хромосоме, которую предполагают исследовать, ее число не ограничивается только одной хромосомой, и даже все хромосомы могут исследоваться одновременно. В соответствии с вариантами осуществления настоящего изобретения первой хромосомой может быть любая хромосома из числа хромосом человека и может быть любая хромосома, выбираемая из хромосом 1-23 человека. В соответствии с вариантами осуществления настоящего изобретения предпочтительно ей является по крайней мере одна хромосома, выбираемая из хромосомы 21, хромосомы 18, хромосомы 13, хромосомы X и хромосомы Y человека. Таким образом, можно эффективно определить широко распространенные хромосомные болезни человека, например, можно предсказать генетические заболевания плода. Следовательно, способ определения анеуплоидии по хромосоме(ам) в ядросодержащих эритроцитах в соответствии с вариантами осуществления настоящего изобретения может очень эффективно применяться в предимплантационном скрининге (PGS) и предимплантационной диагностике (PGD) в области in vitro репродукции, пренатальном исследовании ядросодержащих эритроцитов и т.д., и, таким образом, можно быстро предсказать, существует ли аномалия хромосом у плода, благодаря простому выделению ядросодержащих эритроцитов, что позволяет аннулировать случай, когда плод страдает серьезным генетическим заболеванием. Используемый здесь термин «может быть совмещен с первой хромосомой» относится к результату секвенирования, когда при совмещении данных секвенирования с известной последовательностью первой хромосомы контрольного генома он может быть совмещен с последовательностью первой хромосомы, и таким образом определяют, происходят ли эти данные секвенирования из первой хромосомы.
S400: на основе получения числа данных секвенирования, относящихся к каждому окну, определяют первый параметр.
Исходя из того, что в результате секвенирования полного генома ядросодержащих эритроцитов число данных секвенирования для некой конкретном хромосомы положительно коррелирует с содержанием хромосомы в полном геноме, поэтому посредством анализа числа данных секвенирования, происходящих из некой конкретной хромосомы, в результате секвенирования и суммарного числа при секвенировании полного генома можно эффективно определить содержание хромосомы. Следовательно, первый параметр можно определить посредством исследования числа данных секвенирования, относящихся к каждому окну первой хромосомы. Чтобы сделать первый параметр способным действительно отражать, существует ли анеуплоидия по первой хромосоме, в соответствии с вариантом осуществления настоящего изобретения, на основе получения числа данных секвенирования, относящихся к каждому окну, определение первого параметра дополнительно включает: установку заранее задаваемого весового коэффициента (также иногда здесь называемого весовым множителем) для числа данных секвенирования, относящихся к каждому окну, соответственно, и в соответствии с весовым коэффициентом выполнение средневзвешенного усреднения числа данных секвенирования, относящихся к каждому окну, для получения медианы для указанной первой хромосомы, при этом полученная медиана составляет первый параметр первой хромосомы. Авторы настоящего изобретения установили, что первый параметр, полученный таким образом, может эффективно представлять число данных секвенирования для первой хромосомы в данных секвенирования, и таким образом эффективность определения анеуплоидии по хромосоме(ам) может быть дополнительно увеличена. В соответствии с вариантами осуществления настоящего изобретения весовой коэффициент устанавливают для возможности исключения искажения данных, причиной которого являются некоторые ошибки, которые могут возникать в процессе секвенирования. В соответствии с примером настоящего изобретения заранее задаваемый весовой коэффициент получают посредством увязки числа данных секвенирования, относящихся к каждому окну, с содержанием GC в соответствующем окне, соответственно. Таким образом, результирующие ошибки вследствие ошибки метода секвенирования в области с высоким содержанием GC могут быть эффективно исключены. Например, в соответствии с вариантами осуществления настоящего изобретения весовой коэффициент может быть получен с помощью следующего метода.
Прежде всего, каждую хромосому полного генома человека делят на окна с установленным размером = 60 т.п.о., соответственно, и фиксируют начальное положение и конечное положение каждого окна, и с помощью статистики определяют среднее значение GC (фиксируемое как GCref). После получения данных секвенирования исследуемого образца последовательности в результате секвенирования совмещают с геномом, данные секвенирования, которые полностью совпадают и успешно совмещаются только один раз, т.е. уникально совмещаемые данные секвенирования, извлекают, и получают информацию о сайтах всех уникально совмещаемых данных секвенирования. Подсчитывают число уникально совмещаемых данных секвенирования (фиксируемое как URsample) в каждом окне в каждой хромосоме в геноме, соответствующее результату совмещения, исследуемого образца, полученные URsample и GCref используют для построения диаграммы, и получают фиг. 8А. На фиг. 8А можно видеть, что связанная с высоким содержанием GC ошибка, вводимая секвенатором, является причиной того, что размещено больше данных секвенирования с GC приблизительно в области [0.35, 0.55]. Дискретные точки на фиг. 8А встраивают с помощью сплайнового метода сглаживания в сглаженную кривую, которая представляет собой диаграмму, отражающую связь между содержанием GC и числом данных секвенирования, и получают фиг. 8В, в случае которой все окна делят на длину шага среднего значения GC=1%. Число уникально совмещаемых данных секвенирования, т.е. Mfit, в окне, соответствующем каждому среднему значению GC, можно получить из подвергнутых пригонке данных. В соответствии с формулой WGC=M/Mfit, получают заранее задаваемый весовой коэффициент WGC, и см. фиг. 8С ради распределения весового коэффициента, где М представляет собой число уникально совмещаемых данных секвенирования, относящихся к окнам с равным средним значением GC для исследуемого образца.
Впоследствии, после получения первого параметра, можно определить, имеют ли ядросодержащие эритроциты анеуплоидию по указанной первой хромосоме, посредством сравнения между первым параметром и заранее задаваемым контрольным параметром. Используемый здесь термин «заранее задаваемый» следует понимать широко, и он может быть определен посредством эксперимента заранее и может также быть получен с помощью выбора параллельного эксперимента, когда биологический образец исследуется. Используемый здесь термин «параллельный эксперимент» следует понимать широко, и он не только может относиться к одновременному секвенированию и анализу неизвестного образца и известного образца, но также может относиться к секвенированию и анализу, выполненных последовательно в одних и тех же условиях. Например, первый параметр для образца, полученный посредством исследования образца ядросодержащих эритроцитов, которые, как известно, имеют анеуплоидию, или ядросодержащих эритроцитов, которые, как известно, не имеют анеуплоидию, может использоваться в качестве контрольного параметра.
Кроме того, авторы настоящего изобретения установили, что можно определить, характеризуется ли первая хромосома анеуплоидией, посредством сравнения и статистического анализа чисел данных секвенирования различных хромосом при одном и том же выполнении секвенирования. Следовательно, в соответствии с вариантом осуществления настоящего изобретения, на основе указанного первого параметра, определение того, имеют ли указанные ядросодержащие эритроциты анеуплоидию по указанной первой хромосоме дополнительно включает: осуществление процедуры в отношении второй хромосомы, одинаковой с таковой в отношении первой хромосомы, чтобы получить медиану для указанной второй хромосомы, выполнение проверки по t-критерию Стьюдента медианы для первой хромосоме и медианы для второй хромосомы, чтобы получить разницу между указанной первой хромосомой и указанной второй хромосомой, и сравнение полученной разницы с заранее задаваемым первым пороговым значением и вторым пороговым значением, и, если полученная разница меньше заранее задаваемых пороговых значений, то определение, что ядросодержащие эритроциты имеют анеуплоидию по первой хромосоме, и, если полученная разница больше указанных заранее задаваемых пороговых значений, то определение, что ядросодержащие эритроциты не имеют анеуплоидию по первой хромосоме. Таким образом, разница между первой хромосомой и другой хромосомой может быть дополнительно представлена, и таким образом увеличивается эффективность определения анеуплоидии по хромосоме(ам).
Используемый здесь термин «вторая хромосома» следует понимать широко, он может относиться к любой целевой хромосоме, которую предполагают исследовать, ее число не ограничивается только одной хромосомой, и даже все хромосомы, отличные от первой хромосомы, могут исследоваться одновременно. В соответствии с вариантами осуществления настоящего изобретения второй хромосомой может быть любая хромосома из числа хромосом человека, и в случае ядросодержащих эритроцитов плода второй хромосомой является предпочтительно любая хромосома, выбираемая из хромосом 1-23 человека. В соответствии с вариантами осуществления настоящего изобретения предпочтительно второй хромосомой является любая хромосома, выбираемая из хромосом 1-12 в геноме человека. Поскольку обычно в этих хромосомах хромосомная анеуплоидия не существует, эти хромосомы могут эффективно использоваться в качестве контроля для исследования первой хромосомы, и эффективность анализа увеличивается.
В соответствии с вариантом осуществления настоящего изобретения следующую формулу используют для выполнения проверки по t-критерию Стьюдента медианы для первой хромосоме и медианы для второй хромосомы:
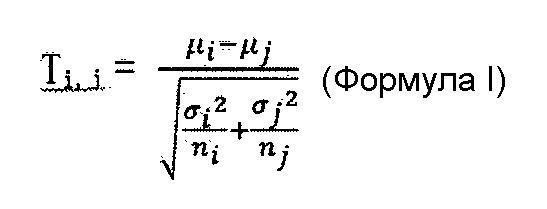
где Ti,j представляет собой разницу между указанной первой хромосомой и второй хромосомой, µi представляет собой медиану для первой хромосомы, µj представляет собой медиану для второй хромосомы, µi представляет собой среднеквадратическое отклонение распределения числа данных секвенирования в каждом окне в первой хромосоме, σj представляет собой среднеквадратическое отклонение распределения числа данных секвенирования в каждом окне во второй хромосоме, ni представляет собой число окон в первой хромосоме, и nj представляет собой число окон во второй хромосоме.
В соответствии с вариантами осуществления настоящего изобретения размер заранее задаваемых пороговых значений можно определить по опыту, или соответствующее значение t-критерия Стьюдента, полученное при исследовании заранее образца ядросодержащих эритроцитов, которые, как известно, имеют анеуплоидию, или ядросодержащих эритроцитов, которые, как известно, не имеют анеуплоидию, используют в качестве порогового значения. Предпочтительно указанное заранее задаваемое первое пороговое значение составляет -4 или меньше, а указанное второе пороговое значение составляет -3,5 или больше.
Используемый здесь термин «анеуплоидия» противоположен термину «хромосомная эуплодия», и он относится к тому, что одна или несколько хромосом отсутствуют в геноме или дополнительно добавлены в него. Обычно в нормальной клетке существуют две хромосомы каждого вида, но гаметы с анормальным числом хромосом образуются вследствие нерасхождения или слишком раннего расхождения пары гомологичных хромосом во время мейоза, и слияние таких гамет друг с другом или с нормальными гаметами будет создавать различные анеуплоидные клетки. Кроме того, анеуплоидные клетки, например, опухолевые клетки с очень высоким коэффициентом вариации и т.д., также образуются во время деления соматических клеток.
2. Система для определения того, существует ли аномалия генома в ядросодержащих эритроцитах
В соответствии с еще одним аспектом настоящего изобретения настоящее изобретение представляет систему 1000 для определения того, существует ли аномалия генома. С учетом фиг. 3, в соответствии с вариантами осуществления настоящего изобретения, система 1000 включает: устройство для отделения ядросодержащих эритроцитов 100, устройство для секвенирования 200 и устройство для анализа результата секвенирования 300. В соответствии с вариантами осуществления настоящего изобретения устройство для отделения ядросодержащих эритроцитов 100 используется для выделения ядросодержащих эритроцитов плода из образца от беременной женщины. Устройство для секвенирования 200 используется для секвенирования по крайней мере части генома ядросодержащих эритроцитов, чтобы получить результат секвенирования. Устройство для анализа результата секвенирования 300 соединено с устройством для секвенирования 200 для получения результата секвенирования от устройства для секвенирования 200, и на основе полученного результата секвенирования выносится решение, существует ли аномалия генома в выделенных ядросодержащих эритроцитах.
В соответствии с вариантами осуществления настоящего изобретения устройство для отделения ядросодержащих эритроцитов 100 может дополнительно включать, элемент для выделения моноцитов 101 и магнитный элемент для обогащения 102. Среди них, в соответствии с вариантами осуществления настоящего изобретения, элемент для выделения моноцитов 101 подходит для выполнения центрифугирования в градиенте плотности образца от беременной женщины, используя реагент для создания градиента плотности, чтобы получить моноциты, причем образцом от беременной женщины является периферическая кровь беременной женщины. Магнитный элемент для обогащения 102 соединен с элементом для выделения моноцитов 101 и подходит для отделения ядросодержащих эритроцитов от моноцитов, используя магнитные частицы, несущие антитело, причем указанное антитело специфически распознает антиген на поверхности ядросодержащих эритроцитов. Таким образом, благодаря устройству для отделения ядросодержащих эритроцитов 100 ядросодержащие эритроциты можно эффективно выделить с помощью следующего способа.
Прежде всего, выполняют центрифугирование в градиенте плотности указанной периферической крови, используя реагент для создания градиента плотности, чтобы получить моноциты. После получения моноцитов обогащение ядросодержащими эритроцитами осуществляют, исходя из полученных моноцитов, с использованием магнитных частиц, несущих антитело, причем антитело, содержащееся на магнитных частицах, специфически распознает антиген на поверхности ядросодержащих эритроцитов, и таким образом ядросодержащие эритроциты будут связываться с магнитными частицами благодаря антителу, и впоследствии ядросодержащие эритроциты можно получить с помощью магнитной сортировки. В соответствии с конкретными примерами настоящего изобретения вышеотмеченное устройство для отделения ядросодержащих эритроцитов 100 может быть подходящим для выполнения следующих операций: взятия соответствующего количества периферической крови беременной женщины, выполнения антикоагуляции с использованием антикоагулянта, разведения образца крови пропорционально 0,1М фосфатным буферным раствором (PBS), не содержащим ионы кальция и ионы магния, медленного наслаивания разведенного образца на реагент для центрифугирования в градиенте плотности и выполнения центрифугирования в градиенте плотности при комнатной температуре. После центрифугирования можно увидеть слой моноцитов, слой клеток осторожно отсасывают пипеткой, переносят в новую центрифужную пробирку, ресуспендируют с использованием 3 объемов буфера PBS, содержащего 1% BSA, и снова центрифугируют при комнатной температуре, супернатант отбрасывают, полученный клеточный осадок далее дважды отмывают с использованием того же способа для удаления остаточной жидкости градиента плотности и, наконец, клеточный осадок ресуспендируют в PBS, содержащем 0,1% BSA, и равномерно пипетируют. Затем магнитные частицы, несущие антитело, добавляют в соотношении 20 микролитров/106 клеток и центрифугируют после выдерживания при 4°С, супернатант отбрасывают, а осадок ресуспендируют в PBS, содержащем 0,1% BSA, и собирают систему для сортировки магнитных частиц. Сортировочную колонку увлажняют с помощью 500 микролитров буфера PBS, содержащего 0,1% BSA, и после спуска жидкости клетки, подвергаемые сортировке, загружают в колонку, и выходящую жидкость собирают и помечают как негативные клетки. Трубку увлажняют с использованием PBS, содержащего 0,1% BSA, и после спуска жидкости это же снова повторяют дважды, в сортировочную колонку добавляют PBS/EDTA/BSA, и после спуска жидкости это же снова повторяют один раз. Наконец, PBS, содержащий 0,1% BSA, добавляют в сортировочную колонку, магнитное поле убирают, жидкость сливают в новую центрифужную пробирку, и получают ядросодержащие эритроциты. Способ выделения ядросодержащих эритроцитов был детализирован выше и не повторяется.
Кроме того, в соответствии с вариантами осуществления настоящего изобретения, с учетом фиг. 5, система может также включать устройство для приготовления библиотеки для секвенирования полного генома 400. В соответствии с вариантами осуществления настоящего изобретения устройство для приготовления библиотеки для секвенирования полного генома 400 соединено с устройством для секвенирования 200 и обеспечивает библиотеку для секвенирования полного генома для устройства для секвенирования 200. По этой причине, с учетом фиг. 6, в соответствии с примерами настоящего изобретения, устройство для приготовления библиотеки для секвенирования полного генома 400 может дополнительно включать элемент для лизиса ядросодержащих эритроцитов 401, элемент для амплификации полного генома 402 и элемент для конструирования библиотеки для секвенирования 403. Среди них, в соответствии с вариантами осуществления настоящего изобретения, элемент для лизиса ядросодержащих эритроцитов 401 соединен с устройством для отделения ядросодержащих эритроцитов 100 и получает и лизирует выделенные ядросодержащие эритроциты для высвобождения полного генома ядросодержащих эритроцитов. Элемент для амплификации полного генома 402 соединен с элементом для лизиса ядросодержащих эритроцитов 401 и используется для амплификации полного генома ядросодержащих эритроцитов, чтобы получить амплифицированный полный геном. Элемент для конструирования библиотеки для секвенирования 403 используется для получения амплифицированного полного генома и конструирования библиотеки для секвенирования полного генома, используя амплифицированный полный геном. Устройство для приготовления библиотеки для секвенирования полного генома может эффективно конструировать библиотеку для секвенирования ядросодержащих эритроцитов. Используемый здесь термин «соединяться» следует понимать широко, он не только может относиться к прямому соединению, но также может относиться к непрямому соединению, и даже может использоваться тот же контейнер или оборудование, если может быть осуществлен функциональный контакт. Например, элемент 302 для лизиса ядросодержащих эритроцитов 302 и элемент для амплификации полного генома 303 могут находиться в одном и том оборудовании, т.е. после выполнения лизиса ядросодержащих эритроцитов процедура амплификации полного генома может быть выполнена в том же оборудовании или контейнере, и не требуется доставка высвободившегося полного генома в другое оборудование или контейнеры, если условия (в том числе условия реакции и состав реакционной системы) в оборудовании переводятся в условия, подходящие для выполнения реакции амплификации полного генома. Таким образом, осуществляют функциональный контакт элемента для лизиса ядросодержащих эритроцитов 302 и элемента для амплификации полного генома 303, который, как может также считаться, охватывается термином «соединяться». Квалифицированные в данной области техники специалисты могут выбрать различные способы и оборудование для конструирования библиотеки для секвенирования полного генома в соответствии с конкретным протоколом для используемого метода секвенирования генома, и ради подробностей конструирования библиотеки для секвенирования полного генома может быть приведена ссылка на директивные правила, предлагаемые производителем секвенатора, например, Illumina Corporation. В соответствии с вариантом осуществления настоящего изобретения элемент для амплификации полного генома 303 включает устройство, подходящее для амплификации указанного полного генома, используя способ OmniPlex WGA. Таким образом, полный геном можно эффективно амплифицировать, и таким образом дополнительно увеличивается эффективность определения аномалии генома в ядросодержащих эритроцитах.
В соответствии с вариантом осуществления настоящего изобретения устройство для секвенирования полного генома 100 включает по крайней мере одно устройство, выбираемое из Illumina-Solexa, ABI-Solid, Roche-454 и устройства для секвенирования одной молекулы. Таким образом можно использовать характеристики высокопроизводительного и глубокого секвенирования этих устройств для секвенирования, и таким образом эффективность определения анеуплоидии по хромосоме(ам) в ядросодержащих эритроцитах дополнительно увеличивается. Конечно, квалифицированные в данной области техники специалисты будут понимать, что секвенирование полного генома можно также выполнить, используя другие методы секвенирования и устройства для него, например, метод секвенирования третьего поколения и более усовершенствованные методы секвенирования, которые могут быть разработаны впоследствии. В соответствии с вариантами осуществления настоящего изобретения размеры данных секвенирования, получаемых при секвенировании полного генома, не очень ограничиваются.
Как отмечалось ранее, в соответствии с вариантами осуществления настоящего изобретения, после получения результата секвенирования генома ядросодержащих эритроцитов можно исследовать анеуплоидию по хромосоме(ам). Следовательно, в соответствии с вариантами осуществления настоящего изобретения, устройство для анализа результата секвенирования 300 может подходить для выполнения следующих операций: прежде всего, деления известной последовательности первой хромосомы на множество окон, при этом окна в этом множестве независимо имеют заранее задаваемый размер, соответственно; впоследствии, совмещения данных секвенирования в указанном результате секвенирования с известной последовательностью первой хромосомы для получения числа данных секвенирования, относящихся к каждому окну; наконец, на основе получения числа данных секвенирования, относящихся к каждому окну, определения первого параметра и, на основе указанного первого параметра, определения, имеют ли указанные ядросодержащие эритроциты анеуплоидию по указанной первой хромосоме. Можно эффективно определить, имеют ли ядросодержащие эритроциты анеуплоидию по хромосоме, используя систему 100. В соответствии с вариантом осуществления настоящего изобретения устройство для анализа результата секвенирования 300 дополнительно включает элемент для совмещения последовательностей (не представленный на фигурах). Элемент для совмещения последовательностей используется для совмещения результата секвенирования с информацией об известной геномной последовательности для получения всех данных секвенирования, которые могут быть совмещены с контрольным геномом, и для получения данных секвенирования для первой хромосомы. Таким образом, данные секвенирования для конкретной хромосомы могут быть эффективно определены, и таким образом дополнительно увеличивается эффективность определения анеуплоидии по хромосоме в ядросодержащих эритроцитах. Используемый здесь термин «первая хромосома» следует понимать широко, он может относиться к любой целевой хромосоме, которую предполагают исследовать, ее число не ограничивается только одной хромосомой, и даже все хромосомы могут исследоваться одновременно. В соответствии с вариантами осуществления настоящего изобретения первой хромосомой может быть любая хромосома из числа хромосом человека, например, может быть по крайней мере одна хромосома, выбираемая из хромосомы 21, хромосомы 18, хромосомы 13, хромосомы X и хромосомы Y человека. Таким образом, можно эффективно определить широко распространенные хромосомные болезни человека, например, можно предсказать генетические заболевания плода. Следовательно, способ определения анеуплоидии по хромосоме(ам) в ядросодержащих эритроцитах в соответствии с вариантами осуществления настоящего изобретения может очень эффективно применяться в предимплантационном скрининге (PGS) и предимплантационной диагностике (PGD) в области in vitro репродукции, и пренатальном исследовании ядросодержащих эритроцитов и т.д. Таким образом, можно быстро предсказать, существует ли аномалия хромосом у плода, благодаря простому выделению ядросодержащих эритроцитов, что позволяет аннулировать случай, когда плод страдает серьезным генетическим заболеванием.
Первый параметр и другие характеристики были детализированы выше и не повторяются здесь. Необходимо отметить следующее.
В соответствии с вариантом осуществления настоящего изобретения устройство для анализа результата секвенирования 300 может дополнительно включать элемент, который подходит для определения, на основе получения числа данных секвенирования, относящихся к каждому окну, первого параметра с помощью стадий: установки заранее задаваемого весового коэффициента для числа данных секвенирования, относящихся к каждому окну, соответственно, и в соответствии с указанным весовым коэффициентом выполнения средневзвешенного усреднения указанного числа данных секвенирования, относящихся к каждому окну, для получения медианы для указанной первой хромосомы, при этом медиана для указанной первой хромосомы составляет первый параметр указанной первой хромосомы.
В соответствии с вариантом осуществления настоящего изобретения устройство для анализа результата секвенирования 300 может дополнительно включать элемент, который подходит для определения, на основе указанного первого параметра, того, имеют ли указанные ядросодержащие эритроциты анеуплоидию по указанной первой хромосоме, с помощью следующего: осуществления процедуры в отношении второй хромосомы, одинаковой с таковой в отношении указанной первой хромосомы, чтобы получить медиану для указанной второй хромосомы, выполнения проверки по t-критерию Стьюдента медианы для указанной первой хромосомы и медианы для указанной второй хромосомы, чтобы получить разницу между указанной первой хромосомой и указанной второй хромосомой, и сравнения указанной разницы с заранее задаваемым пороговым значением, и, если указанная полученная разница меньше указанного заранее задаваемого порогового значения, то определения, что указанные ядросодержащие эритроциты имеют анеуплоидию по первой хромосоме.
В соответствии с вариантом осуществления настоящего изобретения устройство для анализа результата секвенирования 300 может дополнительно включать элемент, который подходит для использования следующей формулы для выполнения проверки по t-критерию Стьюдента медианы для указанной первой хромосоме и медианы для указанной второй хромосомы:
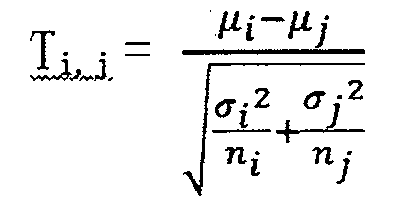
где Ti,j представляет собой разницу между указанной первой хромосомой и указанной второй хромосомой, µi представляет собой медиану для первой хромосомы, µj представляет собой медиану для второй хромосомы, σi представляет собой среднеквадратическое отклонение распределения числа данных секвенирования в каждом окне в первой хромосоме, σj представляет собой среднеквадратическое отклонение распределения числа данных секвенирования в каждом окне во второй хромосоме, ni представляет собой число окон в первой хромосоме, и nj представляет собой число окон во второй хромосоме.
Кроме того, в соответствии с вариантами осуществления настоящего изобретения, устройство для анализа результата секвенирования 300 подходит для определения того, существует ли мутация в заранее определенной области в геноме. Следовательно, в соответствии с вариантом осуществления настоящего изобретения, устройство для анализа результата секвенирования 300 может дополнительно включать: элемент для определения последовательности нуклеиновой кислоты, элемент для совмещения и элемент для определения аномалии. Среди них, элемент для определения последовательности нуклеиновой кислоты в заранее определенной области подходит для определения, на основе указанного результата секвенирования, нуклеотидной последовательности заранее определенной области в указанных ядросодержащих эритроцитах. Элемент для совмещения соединен с указанным элементом для определения последовательности нуклеиновой кислоты и подходит для совмещения нуклеотидной последовательности заранее определенной области в указанных ядросодержащих эритроцитах с контрольной нуклеотидной последовательностью, предпочтительно контрольная нуклеотидная последовательность хранится в элементе для совмещения, более предпочтительно контрольной нуклеотидной последовательностью является геномная последовательность нормального человека. Элемент для определения аномалии соединен с указанным элементом для совмещения и подходит для определения, на основе результата указанного совмещения, того, существует ли аномалия в заранее определенной области в указанных ядросодержащих эритроцитах. Способ и детали определения мутации в заранее определенной области были детализированы выше и не повторяются здесь.
Другие характеристики и преимущества, описанные в соответствующих способах выше, также подходят для системы для определения того, существует ли аномалия в ядросодержащих эритроцитах, и не повторяются здесь.
3. Способ определения геномной последовательности ядросодержащих эритроцитов плода
Тем не менее, другой аспект настоящего изобретения представляет способ определения геномной последовательности ядросодержащих эритроцитов плода, который включает следующие стадии.
Прежде всего, ядросодержащие эритроциты плода выделяют из образца от беременной женщины. После получения ядросодержащих эритроцитов плода секвенируют по крайней мере часть генома выделенных ядросодержащих эритроцитов, чтобы получить результат секвенирования. Наконец, на основе полученного результата секвенирования, определяют геномную последовательность ядросодержащих эритроцитов плода.
Используемое здесь выражение «геномная последовательность» следует понимать в общем смысле, т.е. ей может быть последовательность полного генома, а может также быть последовательность части генома. Выделение ядросодержащих эритроцитов плода из образца от беременной женщины и секвенирование по крайней мере части генома ядросодержащих эритроцитов были детализированы выше и не повторяются здесь. Необходимо отметить следующее.
В соответствии с вариантом осуществления настоящего изобретения указанным образцом от беременной женщины является периферическая кровь беременной женщины. В соответствии с вариантом осуществления настоящего изобретения срок беременности указанной женщины составляет 12-20 недель. В соответствии с вариантом осуществления настоящего изобретения выделение ядросодержащих эритроцитов плода из периферической крови указанной беременной женщины дополнительно включает: выполнение центрифугирования в градиенте плотности указанной периферической крови, используя реагент для создания градиента плотности, чтобы получить моноциты, и отделение ядросодержащих эритроцитов от указанных моноцитов, с использованием магнитных частиц, несущих антитело, причем указанное антитело специфически распознает антиген на поверхности ядросодержащих эритроцитов. В соответствии с вариантом осуществления настоящего изобретения указанным реагентом для создания градиента плотности является полисахароза, необязательно указанное центрифугирование в градиенте плотности выполняют при 8000×g в течение 30 минут. В соответствии с вариантом осуществления настоящего изобретения после получения указанных моноцитов и до отделения указанных ядросодержащих эритроцитов с использованием магнитных частиц, несущих антитело против CD71, процесс дополнительно включает отмывку указанных моноцитов, используя буфер PBS, содержащий 1% BSA, чтобы удалить остаточный реагент для создания градиента плотности, при этом предпочтительно указанный буфер PBS не содержит ионы кальция и ионы магния. В соответствии с вариантом осуществления настоящего изобретения отмывка указанных моноцитов, используя буфер PBS, содержащий 1% BSA дополнительно включает: смешивание указанных моноцитов и указанного буфера PBS, содержащего 1% BSA, чтобы получить суспензию, содержащую моноциты, и центрифугирование указанной суспензии, содержащей моноциты, предпочтительно ее центрифугирование при 200×g в течение 5 минут, и отбрасывание супернатанта, чтобы получить отмытые ядросодержащие эритроциты. В соответствии с вариантом осуществления настоящего изобретения указанным антителом является антитело, специфически распознающее CD71. В соответствии с вариантом осуществления настоящего изобретения секвенируют один ядросодержащий эритроцит. В соответствии с вариантом осуществления настоящего изобретения секвенируют полный геном указанных ядросодержащих эритроцитов. В соответствии с вариантом осуществления настоящего изобретения секвенирование полного генома указанных ядросодержащих эритроцитов дополнительно включает: амплификацию полного генома указанных ядросодержащих эритроцитов для получения амплифицированного полного генома, конструирование библиотеки для секвенирования полного генома, используя указанный амплифицированный полный геном, и секвенирование указанной библиотеки для секвенирования полного генома, чтобы получить результат секвенирования, состоящий из множества данных секвенирования. В соответствии с вариантом осуществления настоящего изобретения полный геном указанных ядросодержащих эритроцитов амплифицируют с помощью способа OmniPlex WGA. В соответствии с вариантом осуществления настоящего изобретения конструирование библиотеки для секвенирования полного генома, используя указанный амплифицированный полный геном дополнительно включает: фрагментацию указанного амплифицированного полного генома, чтобы получить фрагменты ДНК, выполнение репарации концов указанных фрагментов ДНК, что получить фрагменты ДНК с репарированными концами, добавление оснований А к 3′-концам указанных фрагментов ДНК с репарированными концами, чтобы получить фрагменты ДНК с «липким» концом А, лигирование указанных фрагментов ДНК с «липким» концом А с адаптером, чтобы получить продукт лигирования, выполнение амплификации с использованием ПЦР указанного продукта лигирования, чтобы получить второй продукт амплификации, и очистку и выделение указанного второго продукта амплификации, чтобы получить выделенный продукт, и указанный выделенный продукт образует указанную библиотеку для секвенирования полного генома. В соответствии с вариантом осуществления настоящего изобретения фрагментацию указанного амплифицированного полного генома осуществляют, используя устройство для разрезки Covaris. В соответствии с вариантом осуществления настоящего изобретения размеры указанных фрагментов ДНК составляют приблизительно 350 п.о. В соответствии с вариантом осуществления настоящего изобретения выполнение репарации концов указанных фрагментов ДНК выполняют, используя фрагмент Кленова, ДНК-полимеразу Т4 и полинуклеотидкиназу Т4, и указанный фрагмент Кленова обладает 5′→3′ полимеразной активностью и 3′→5′ экзонуклеазной активностью, но не обладает 5′→3′ экзонуклеазной активностью. В соответствии с вариантом осуществления настоящего изобретения добавление оснований А к 3′-концам указанных фрагментов ДНК с репарированными концами осуществляют, используя фрагмент Кленова (3′→5′ exo-). В соответствии с вариантом осуществления настоящего изобретения лигирование указанных фрагментов ДНК с «липким» концом А с адаптером осуществляют, используя ДНК-лигазу Т4. В соответствии с вариантом осуществления настоящего изобретения указанное секвенирование выполняют, используя по крайней мере одно устройство, выбираемое из Hiseq2000, SOLiD, 454 и устройства для секвенирования одной молекулы. Преимущества этих характеристик детализированы выше и не повторяются.
Другие характеристики и преимущества, описанные выше в способе определения того, существует ли геномная аномалия в хромосомах ядросодержащих эритроцитов, также подходят для способа определения геномной последовательности ядросодержащих эритроцитов плода и не повторяются здесь.
Настоящее изобретение описано ниже с использованием конкретных вариантов осуществления, и необходимо отметить, что эти варианты осуществления предназначены лишь для цели описания, и их нельзя толковать как ограничение настоящего изобретения каким-либо образом.
Вариант осуществления 1:
Экспериментальные материалы
Образцы периферической крови были от беременной женщины с высоким риском рождения детей с синдромом Дауна, все из которых уже имели клинический исход. Кроме особо оговоренных случаев, все другие материалы для исследования были реагентами, приготовленными с помощью традиционных в данной области техники способов, или имеющимися в продаже реагентами.
Экспериментальное выполнение
1. Выделение ядросодержащих эритроцитов
Брали 3 мл периферической крови беременной женщины, в качестве антикоагулянта был выбран EDTA, образец крови разводили 0,1М фосфатным буферным раствором (PBS), не содержащим Ca+2 и Mg+2, в соотношении 1:1, разведенный образец медленно наслаивали на 3 мл реагента Фиколла (продукт Sigma Corporation, США) с плотностью = 1,077, и выполняли центрифугирование в градиенте плотности при комнатной температуре, 800×g, 30 минут. После центрифугирования можно было увидеть слой моноцитов, слой клеток осторожно отсасывали пипеткой и переносили в новую 1,5-мл центрифужную пробирку, полученные моноциты ресуспендировали с использованием 3 объемов PBS, содержащего 1% BSA, и центрифугировали при комнатной температуре 200×g, 5 минут, супернатант отбрасывали, и клеточный осадок далее дважды отмывали с использованием того же способа для удаления остаточной жидкости градиента плотности. Наконец, клеточный осадок ресуспендировали в 300 мкл PBS, содержащего 0,1% BSA, и равномерно пипетировали. Клетки подсчитывали, и затем добавляли магнитные частицы, несущие антитело против CD71 (Miltenyi Biotec Corporation, Германия) в соотношении 20 микролитров/106 клеток и хранили при 4°С в течение 15 мин. Выполняли центрифугирование, 300×g, 10 минут, супернатант отбрасывали, и осадок ресуспендировали в 500 мкл PBS, содержащего 0,1% BSA, и собирали систему для сортировки магнитных частиц (Miltenyi Biotec Corporation, Германия). Сортировочную колонку увлажняли с помощью 500 микролитров PBS, содержащего 0,1% BSA, и после его спуска клетки, подвергаемые сортировке, загружали в колонку, и выходящую жидкость собирали и помечали как негативные клетки. Трубку увлажняли с использованием 500 мкл PBS, содержащего 0,1% BSA, и после спуска жидкости это же снова повторяли дважды, в сортировочную колонку добавляли 500 мкл PBS/EDTA/BSA, и после спуска жидкости это же снова повторяли один раз. Наконец, 1 мл PBS, содержащий 0,1% BSA, добавляли в сортировочную колонку, сортировочную колонку удаляли из магнитного поля, и ее содержимое сливали в 15-мл пробирку и помечали как позитивные клетки. Позитивные клетки центрифугировали и концентрировали, лишь приблизительно 100 микролитров самого нижнего слоя сохраняли и были готовы к использованию, и полученные ядросодержащие эритроциты помечали как GP9.
2. Конструирование библиотек для секвенирования полного генома
Амплификацию полного генома выполняли на ядросодержащих эритроцитах, набор GenomePlex Single Cell Whole Genome Amplification Kit был выбран для выполнения амплификации полного генома в этом эксперименте, и технологическая схема была выполнена в соответствии с инструкциями, предоставляемыми производителем, Sigma Corporation. Продукт амплификации разрезали, используя устройство для разрезки Covaris, в строгом соответствии с сопроводительными инструкциями для устройства для разрезки для получения разрезанного продукта, фрагментов ДНК, с основной полосой после разрезки, сосредоточенной в приблизительно 350 п.о.
Осуществляли репарацию концов разрезанного продукта, и добавляли основания А к концу, и конкретным процессом был следующий процесс:
Реакцию для репарации концов выполняли в соответствии со следующей системой:
10 Х буфер для полинуклеотидкиназы Т4 - 10 мкл
dNTP (10 мМ) - 4 мкл
ДНК-полимераза Т4 - 5 мкл
Фрагмент Кленова - 1 мкл
Полинуклеотидкиназа Т4 - 5 мкл
Разрезанный продукт - фрагменты ДНК - 30 мкл
ddH2O, добавляемая до 100 мкл.
После осуществления реакции при 20°С в течение 30 минут продукт с репарированными концами выделяли, используя набор для очистки продуктов ПЦР (QIAGEN). Наконец, полученный продукт растворяли в 34 мкл буфера ЕВ.
Реакцию для добавления оснований А к концу выполняли в соответствии со следующей системой:
10 Х буфер для фрагмента Кленова - 5 мкл
dATP (1 мМ) - 10 мкл
Фрагмент Кленова (3′→5′ exo-) - 3 мкл
ДНК - 32 мкл
После инкубации при 37°С в течение 30 минут продукт очищали с использованием набора для очистки продуктов ПЦР MinElute® (QIAGEN), и продукт растворяли в 12 мкл буфера ЕВ.
Реакция лигирования с адаптером была следующей:
2 Х буфер для быстрого лигирования ДНК - 25 мкл
Адаптерная олигоСмесь PEI A (20 мкМ) - 10 мкл
ДНК-лигаза Т4 - 5 мкл
ДНК с основаниями А, добавленными к концу, - 10 мкл
После осуществления реакции при 20°С в течение 15 минут продукт лигирования выделяли, используя набор для очистки продуктов ПЦР (QIAGEN). Наконец, полученный продукт растворяли в 32 мкл буфера ЕВ.
Реакционная система для ПЦР была приготовлена в 0,2-мл пробирке для ПЦР:
Образец - 10 мкл
Смесь для ДНК-полимеразы Phusion - 25 мкл
ПЦР-праймер* (10 пмоль/мкл) - 1 мкл
Index N праймер** (10 пмоль/мкл) - 1 мкл
Вода высшей степени очистки - 13 мкл.
*Последовательностью ПЦР-праймера была
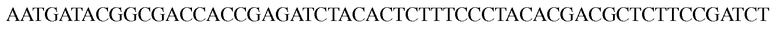
**Последовательностью Index N праймера была
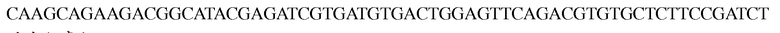
Программа для осуществления реакции была следующей:

Продукт ПЦР выделяли, используя набор для очистки продуктов ПЦР (QIAGEN). Наконец, образец растворяли в 22 мкл буфера ЕВ.
Среди них, Index N был уникальной последовательностью метки размером 8 п.о., поддерживаемой в каждой библиотеке, соответственно, сконструированные библиотеки были исследованы с помощью анализатора Agilent® Bioanalyzer 2100, и результаты представлены на фиг. 8. Как показано на фиг. 8, диапазон распределения фрагментов сконструированных библиотек удовлетворял требованиям, библиотеки были дополнительно подвергнуты количественной оценке с помощью метода количественной ПЦР, соответственно, и после количественной оценки библиотеки смешивали в одном и том же проходе в проточной ячейке для выполнения автоматического секвенирования, и для уменьшения затрат было выбрано секвенирование одного конца. В этом примере устройство для секвенирования Illumina® HiSeq2000™ и способ для него были выбраны для выполнения секвенирования, причем установка параметров и операционный метод для этого устройства были выполнены в строгом соответствии с эксплуатационным руководством, предоставляемым производителем Illumina® (имеющими на сайте: http://www.illumina.com/support/documentation.ilmn). В этом примере использовали секвенатор HiSeq2000™, и число циклов секвенирования было равно индексу РЕ91 (т.е. секвенирование с индексом 91 п.о. спаренных концов).
3. Анализ данных
Результаты секвенирования, полученные при секвенировании, представлены в таблице 1, где суммарное число данных секвенирования (считываний), полученное при секвенировании образца GP9, составляло 13407381, число тех, которые можно было совместить с контрольным геномом (HG19), составляло 9217701, коэффициент совмещения составлял 68,70%, число данных секвенирования, которые можно было единожды совместить с контрольной последовательностью, составляло 7341230, и коэффициент уникального совмещения составлял 80%.
Данные секвенирования
После предварительного анализа данных протяженность считывания при секвенировании была совмещена с контрольной последовательностью hg19, используя SOAP версии 2.20, и способ совмещения был следующим.
Весовой коэффициент был получен с помощью следующего метода.
Прежде всего, каждую хромосому полного генома человека делили на окна с установленным размером = 60 т.п.о., соответственно, и фиксировали начальное положение и конечное положение каждого окна, и с помощью статистики получали среднее значение GC (фиксируемое как GCref). После получения данных секвенирования исследуемого образца последовательности в результате секвенирования совмещали с геномом, данные секвенирования, которые полностью совпадали и успешно совмещались только один раз, т.е. уникально совмещаемые данные секвенирования, извлекали, и получали информацию о сайтах всех уникально совмещаемых данных секвенирования. Подсчитывали число уникально совмещаемых данных секвенирования (фиксируемое как URsample) в каждом окне в каждой хромосоме в геноме, соответствующее результату совмещения, исследуемого образца, полученные URsample и GCref использовали для построения диаграммы, и была получена фиг. 8А. На фиг. 8А можно видеть, что связанная с высоким содержанием GC ошибка, вводимая секвенатором, являлась причиной того, что размещено больше данных секвенирования с GC приблизительно в области [0.35, 0.55]. Дискретные точки на фиг. 8А встраивали с помощью сплайнового метода сглаживания в сглаженную кривую, которая представляет собой диаграмму, отражающую связь между содержанием GC и числом данных секвенирования, была получена фиг. 8В, в случае которой все окна делили на длину шага среднего значения GC=1%. Число уникально совмещаемых данных секвенирования, т.е. Mfit, в окне, соответствующем каждому среднему значению GC, можно было получить из подвергнутых пригонке данных. В соответствии с формулой WGC=M/Mfit, получали заранее задаваемый весовой коэффициент WGC, и смотрите фиг. 8С ради распределения весового коэффициента, где М представляет собой число уникально совмещаемых данных секвенирования, относящихся к окнам с равным средним значением GC для исследуемого образца.
В число уникально совмещаемых данных секвенирования (фиксируемое как URbin), относящихся к окнам каждой хромосомы в геноме исследуемого образца, вносили поправку, используя полученный весовой коэффициент, URfit (соответствующий каждому окну) = URbin * WGC, медиану URi (i=1, 2, … 22) для числа уникально совмещаемых данных секвенирования после внесения поправки рассчитывали для каждой хромосомы, и коробчатая диаграмма, т.е. фиг. 8D, была построена и получена. На фиг. 8D можно видеть, что число уникально совмещаемых данных секвенирования, соответствующее хромосоме 21 в образце GP9, было явно больше таковых, соответствующих другим хромосомам, и можно было определить, что в хромосоме 21 существуют анеуплоидия.
Кроме того, проверка по t-критерию Стьюдента была выполнена на хромосомах 13, 18 и 21, в которых анеуплоидия является часто встречающейся. Для этих трех относительно часто встречающихся анеуплоидий авторы настоящего изобретения выполнили проверку по t-критерию Стьюдента на объемах данных для этих трех хромосом в соответствии со следующей формулой:
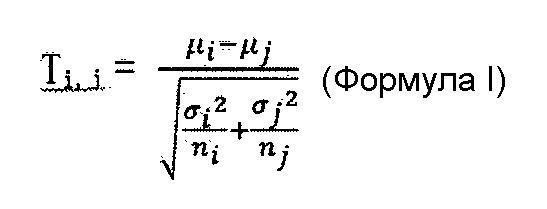
где µ представляет собой URi (i=13, 18, 21; j=1, 2, … 22) для какой-либо хромосомы исследуемого образца; i и j представляют собой хромосомы i, j, σ представляет собой среднеквадратическое отклонение распределения UR для какой-либо хромосомы, и n представляет собой число окон в какой-либо хромосоме.
Хромосому i сравнивали, как отмечено выше, с хромосомами 1-12, соответственно, и среднее значение разницы (t-критерий) получали в соответствии со следующей формулой:
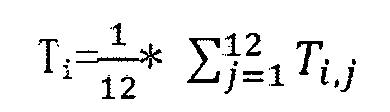
Хромосомы 1-12 были выбраны, поскольку вариация данных для хромосом 1-12 была относительно небольшой, и представляющие интерес для авторов настоящего изобретения хромосомы (включая хромосому 13, хромосому 18 и хромосому 21) были исключены насколько это возможно. Пороговыми значениями, установленными в этом способе (для аутосом), были: t-критерий ≤-4, что означает, что соответствующая хромосома подвержена высокому риску трисомии; -4<t-критерий≤-3,5, что означает, что результат детектирования является неопределенным, и необходимо снова взять образцы для внесения в устройство, или необходимо снова конструировать библиотеки для внесения в устройство для определения результата детектирования; и t-критерий >-3,5, что означает, что результатом детектирования является низкий риск. В таблице 2 можно видеть, что среди t-критериев, соответствующих хромосомам 13, 18 и 21 образца GP9, t-критерий для хромосомы 21 уже превышал критерий для высокого риска 21-трисомии.
Результаты значения t-критерия
В описании настоящего изобретения, при описании ссылочных терминов «вариант осуществления», «некоторые варианты осуществления», «примеры», «конкретный пример» или «некоторые примеры» и другие подразумевается, что конкретные признаки, структуры, материалы или характеристики, описанные в связи с вариантом осуществления или примером, содержатся в по крайней мере одном варианте осуществления или примере настоящего изобретения. В настоящем описании схематическое представление вышеотмеченных терминов необязательно относится к тому же самому варианту осуществления или примеру. Кроме того, описанные конкретные признаки, структуры, материалы или характеристики могут быть объединены в любом одном или нескольких вариантах осуществления или примерам соответствующим образом.
Хотя варианты осуществления настоящего изобретения были представлены и описаны, квалифицированным в данной области техники специалистам будет понятно, что без отступа от принципа и сущности настоящего изобретения, эти варианты осуществления могут быть подвергнуты различным изменениям, модификациям, подстановкам и вариациям, и объем настоящего изобретения ограничивается формулой настоящего изобретения и ее эквивалентами.
| название | год | авторы | номер документа |
|---|---|---|---|
| НЕИНВАЗИВНОЕ ОБНАРУЖЕНИЕ ГЕНЕТИЧЕСКОЙ АНОМАЛИИ ПЛОДА | 2011 |
|
RU2589681C2 |
| СПОСОБ И СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ В ЗАДАННОЙ ОБЛАСТИ ГЕНОМА ПЛОДА | 2012 |
|
RU2597981C2 |
| СПОСОБ НЕИНВАЗИВНОЙ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ АНЕУПЛОИДИЙ ПЛОДА | 2014 |
|
RU2583830C2 |
| Способ неинвазивного пренатального скрининга анеуплоидий плода | 2019 |
|
RU2712175C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНЕУПЛОИДИИ ПЛОДА В ОБРАЗЦЕ КРОВИ БЕРЕМЕННОЙ ЖЕНЩИНЫ | 2021 |
|
RU2777072C1 |
| СПОСОБ НЕИНВАЗИВНОЙ ДИАГНОСТИКИ АНЕУПЛОИДИЙ ПЛОДА МЕТОДОМ СЕКВЕНИРОВАНИЯ | 2014 |
|
RU2543155C1 |
| ТЕХНОЛОГИЯ ОПРЕДЕЛЕНИЯ АНЕУПЛОИДИИ МЕТОДОМ СЕКВЕНИРОВАНИЯ | 2012 |
|
RU2529784C2 |
| СПОСОБ НЕИНВАЗИВНОЙ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ АНЕУПЛОИДИЙ ПЛОДА | 2015 |
|
RU2627673C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ ФРАКЦИИ ВНЕКЛЕТОЧНЫХ НУКЛЕИНОВЫХ КИСЛОТ В БИОЛОГИЧЕСКОМ ОБРАЗЦЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2699728C2 |
| Способ определения кариотипа плода беременной женщины на основании секвенирования гибридных прочтений, состоящих из коротких фрагментов внеклеточной ДНК | 2019 |
|
RU2717023C1 |
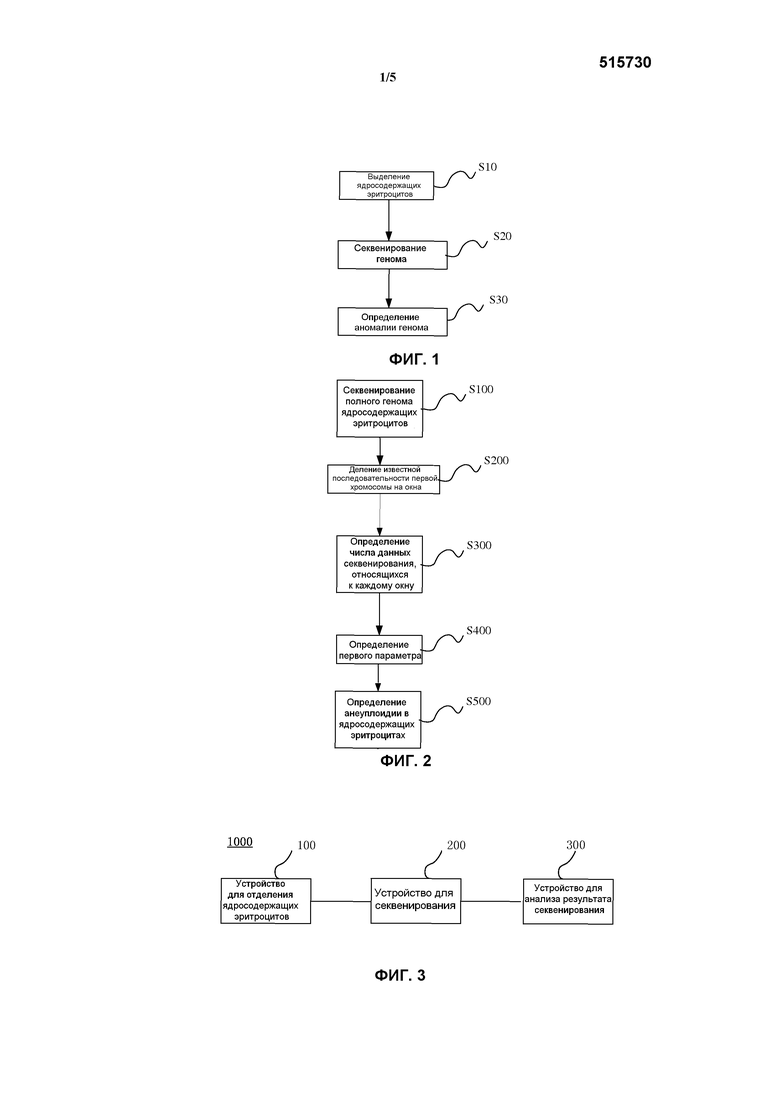
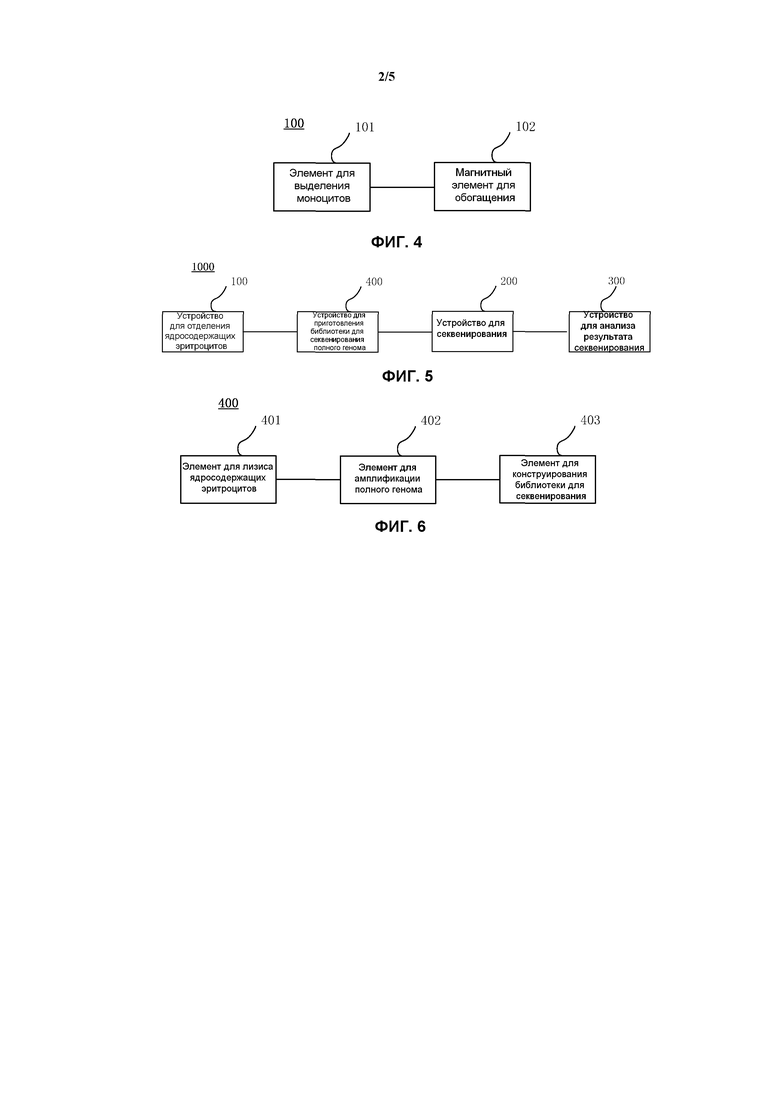
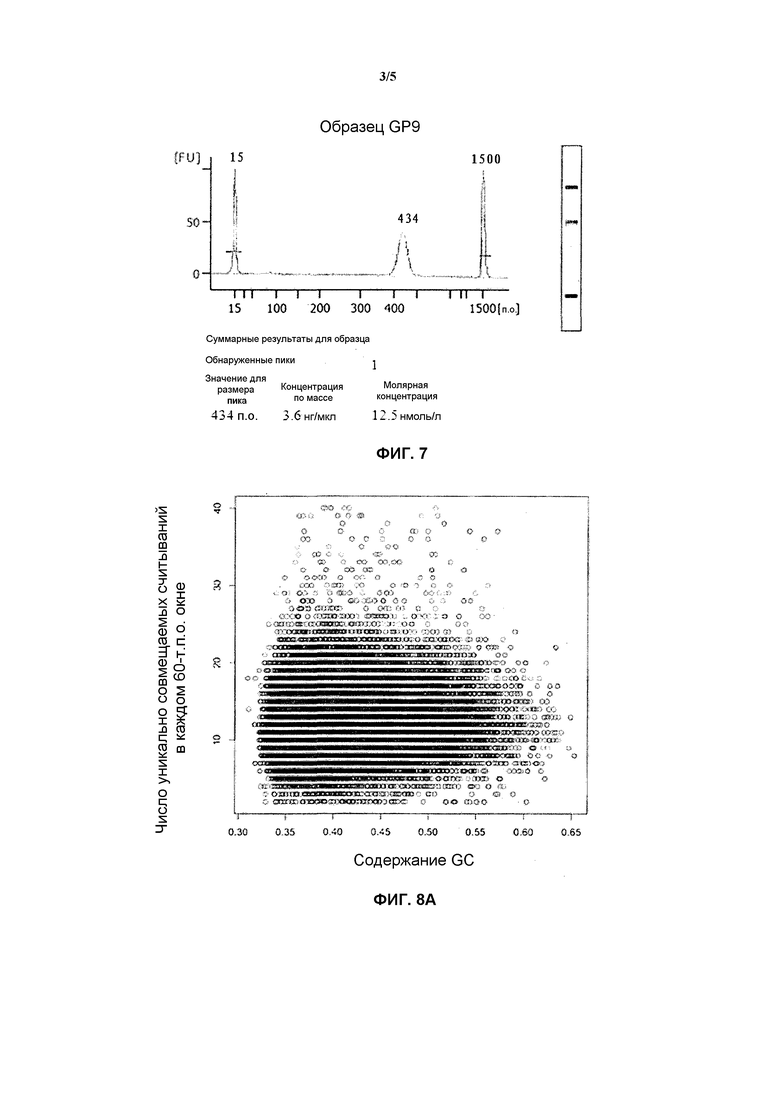
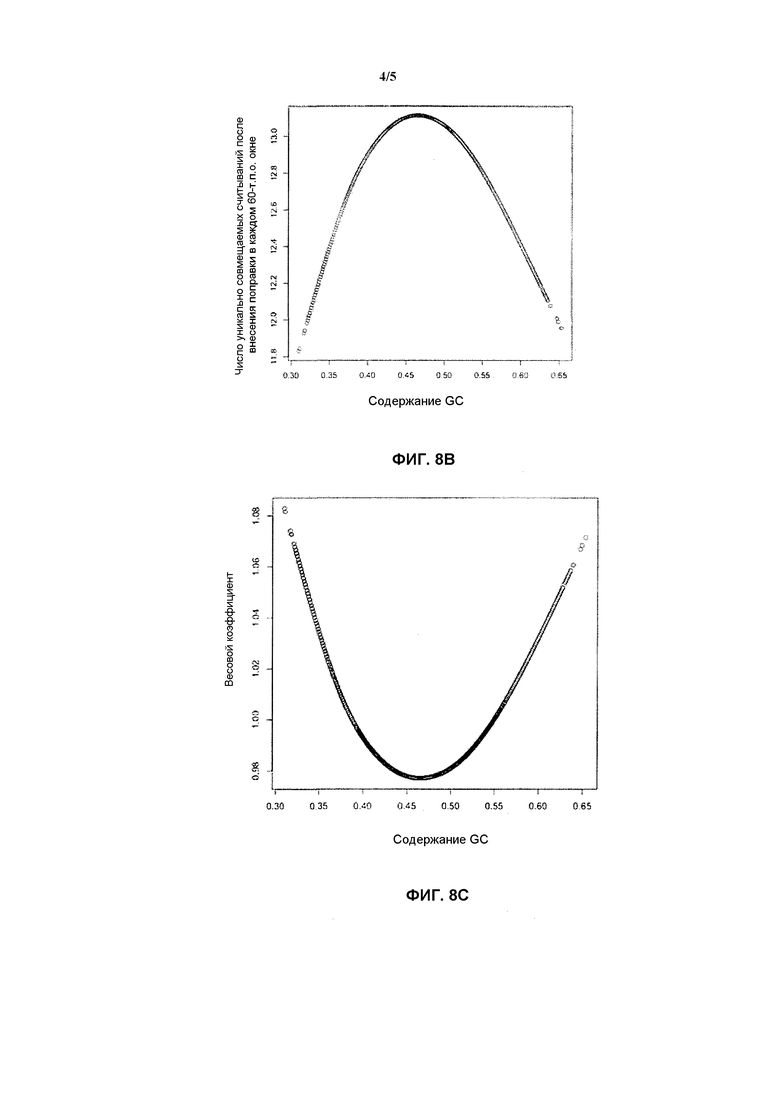
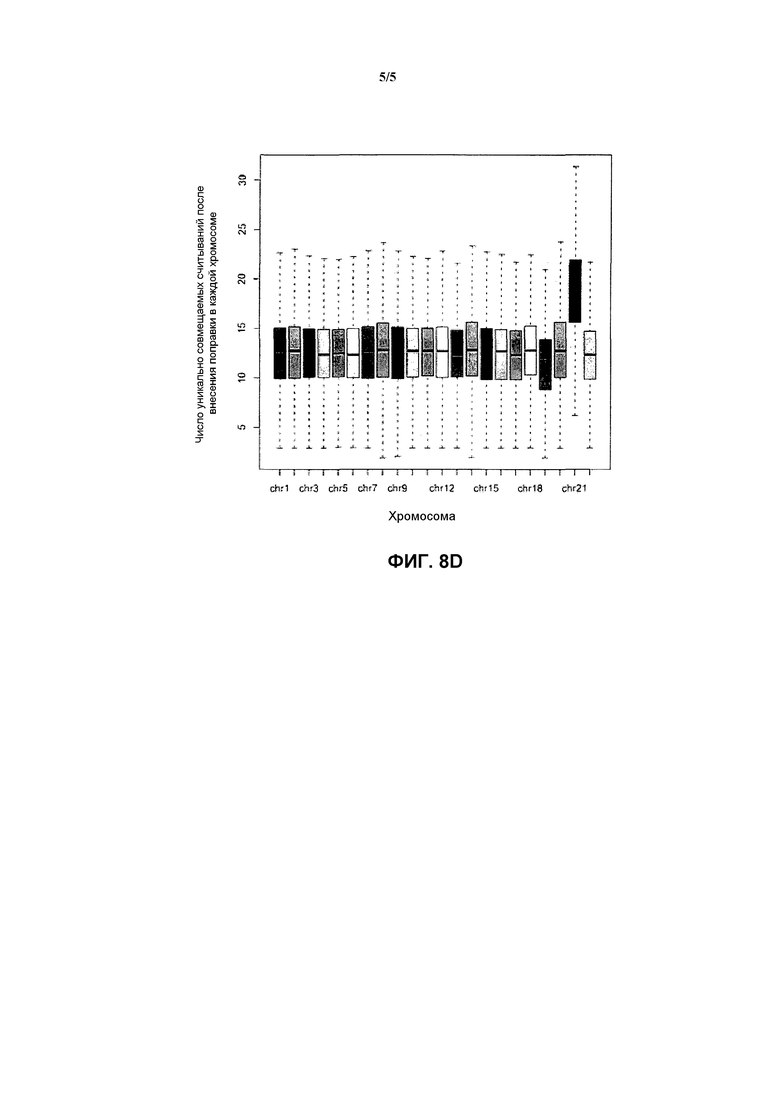
Изобретение относится к области биотехнологии. Описаны способ и система для определения того, существует ли аномалия генома. При этом аномалия генома представляет собой анеуплоидию. Способ включает стадии выделения ядросодержащих эритроцитов плода из образца от беременной женщины, секвенирования полного генома указанных ядросодержащих эритроцитов, чтобы получить результат секвенирования, и на основе указанного результате секвенирования определения того, существует ли аномалия генома в указанных ядросодержащих эритроцитах. Предложенная группа изобретений может быть использована в медицине. 2 н. и 18 з.п. ф-лы, 11 ил., 2 табл.
1. Способ определения того, существует ли аномалия генома у плода, характеризующийся тем, что включает стадии:
выделения ядросодержащих эритроцитов плода из образца от беременной женщины,
выполнение секвенирования полного генома ядросодержащих эритроцитов, чтобы получить результат секвенирования, состоящий из множества данных секвенирования; и
на основе указанного результата секвенирования, определения того, существует ли аномалия генома у указанного плода, посредством определения аномалии генома в ядросодержащих эритроцитах,
где указанная аномалия генома представляет собой анеуплоидию по хромосоме(ам), причем,
существует ли аномалия генома в указанных ядросодержащих эритроцитах, определяется способом, включающим:
деление известной последовательности первой хромосомы на множество окон, причем окна в указанном множестве независимо имеют заранее задаваемый размер соответственно;
совмещение данных секвенирования в указанном результате секвенирования с указанной известной последовательностью первой хромосомы для получения числа данных секвенирования, относящихся к каждому окну;
на основе получения числа данных секвенирования, относящихся к каждому окну, выполнение средневзвешенного усреднения указанного числа данных секвенирования для получения медианы для указанной первой хромосомы, при этом медиана для указанной первой хромосомы составляет первый параметр указанной первой хромосомы, и
осуществление процедуры в отношении второй хромосомы, одинаковой с таковой в отношении указанной первой хромосомы, чтобы получить медиану для указанной второй хромосомы,
выполнение проверки по t-критерию Стьюдента медианы для указанной первой хромосомы и медианы для указанной второй хромосомы, чтобы получить разницу между указанной первой хромосомой и указанной второй хромосомой,
сравнение полученной разницы с заранее задаваемым первым пороговым значением и вторым пороговым значением, и, если указанная разница меньше указанных заранее задаваемых пороговых значений, то определение, что указанные ядросодержащие эритроциты имеют анеуплоидию по первой хромосоме, и, если указанная разница больше указанных заранее задаваемых пороговых значений, то определение, что указанные ядросодержащие эритроциты не имеют анеуплоидию по первой хромосоме.
2. Способ по п. 1, характеризующийся тем, что указанным образцом от беременной женщины является периферическая кровь беременной женщины и срок беременности указанной беременной женщины составляет 12-20 недель.
3. Способ по п. 2, характеризующийся тем, что выделение ядросодержащих эритроцитов плода из периферической крови указанной беременной женщины дополнительно включает:
выполнение центрифугирования в градиенте плотности указанной периферической крови, используя реагент для создания градиента плотности, чтобы получить моноциты, и обогащение ядросодержащими эритроцитами, исходя из указанных моноцитов, с использованием магнитных частиц, несущих антитело, причем указанное антитело специфически распознает антиген на поверхности ядросодержащих эритроцитов.
4. Способ по п. 3, характеризующийся тем, что указанным антителом является антитело, специфически распознающее CD71.
5. Способ по п. 1, где полный геном указанных ядросодержащих эритроцитов дополнительно секвенируют способом, включающим:
амплификацию полного генома указанных ядросодержащих эритроцитов для получения амплифицированного полного генома,
конструирование библиотеки для секвенирования полного генома, используя указанный амплифицированный полный геном, и
секвенирование указанной библиотеки для секвенирования полного генома, чтобы получить результат секвенирования, состоящий из множества данных секвенирования.
6. Способ по п. 5, характеризующийся тем, что конструирование библиотеки для секвенирования полного генома, используя указанный амплифицированный полный геном, дополнительно включает:
фрагментацию указанного амплифицированного полного генома, чтобы получить фрагменты ДНК,
выполнение репарации концов указанных фрагментов ДНК, чтобы получить фрагменты ДНК с репарированными концами,
добавление оснований А к 3′-концам указанных фрагментов ДНК с репарированными концами, чтобы получить фрагменты ДНК с «липким» концом А,
лигирование указанных фрагментов ДНК с «липким» концом А с адаптером, чтобы получить продукт лигирования,
выполнение амплификации указанного продукта лигирования с использованием ПЦР, чтобы получить второй продукт амплификации, и
очистку и выделение указанного второго продукта амплификации, чтобы получить выделенный продукт, и при этом указанный выделенный продукт образует указанную библиотеку для секвенирования полного генома.
7. Способ по п. 1, характеризующийся тем, что указанной первой хромосомой является по крайней мере одна хромосома, выбираемая из хромосомы 21, хромосомы 18, хромосомы 13, хромосомы X и хромосомы Y человека.
8. Способ по п. 1, характеризующийся тем, что заранее задаваемые размеры окон в указанном множестве являются одинаковыми.
9. Способ по п. 1, характеризующийся тем, что указанными данными секвенирования, относящимися к каждому окну, являются уникально совмещаемые данные секвенирования.
10. Способ по п. 1, характеризующийся тем, что на основе получения числа данных секвенирования, относящихся к каждому окну, определение первого параметра дополнительно включает:
установку заранее задаваемого весового коэффициента для числа данных секвенирования, относящихся к каждому окну, соответственно, и
в соответствии указанным весовым коэффициентом выполнение средневзвешенного усреднения указанного числа данных секвенирования.
11. Способ по п. 10, характеризующийся тем, что указанный заранее задаваемый весовой коэффициент получают посредством увязки числа данных секвенирования, относящихся к каждому окну, с содержанием GC в соответствующем окне соответственно.
12. Способ по п. 1, характеризующийся тем, что указанной второй хромосомой является любая хромосома, выбираемая из хромосом 1-12 в геноме человека.
13. Способ по п. 1, характеризующийся использованием следующей формулы для выполнения проверки по t-критерию Стьюдента медианы для указанной первой хромосомы и медианы для указанной второй хромосомы:
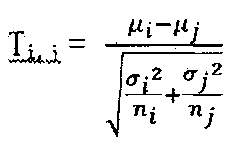
где Ti,j представляет собой разницу между указанной первой хромосомой и указанной второй хромосомой, µi представляет собой медиану для первой хромосомы, µj представляет собой медиану для второй хромосомы, σi представляет собой среднеквадратическое отклонение распределения числа данных секвенирования в каждом окне в первой хромосоме, σj представляет собой среднеквадратическое отклонение распределения числа данных секвенирования в каждом окне во второй хромосоме, ni представляет собой число окон в первой хромосоме и nj представляет собой число окон во второй хромосоме.
14. Способ по п. 10, характеризующийся тем, что указанное заранее задаваемое первое пороговое значение составляет -4 или меньше, а указанное второе пороговое значение составляет -3,5 или больше.
15. Способ по п. 1, характеризующийся тем, что указанная аномалия генома дополнительно включает мутацию в заранее определенной области, и то, существует ли указанная аномалия генома в указанных ядросодержащих клетках, определяют способом, включающим:
на основе указанного результата секвенирования, определение нуклеотидной последовательности заранее определенной области в указанных ядросодержащих эритроцитах,
совмещение нуклеотидной последовательности заранее определенной области в указанных ядросодержащих эритроцитах с контрольной нуклеотидной последовательностью, где указанной контрольной нуклеотидной последовательностью является геномная последовательность нормального человека, и
на основе результата указанного совмещения определение, существует ли аномалия в заранее определенной области в указанных ядросодержащих эритроцитах.
16. Применение совокупности устройств, включающей: устройство для отделения ядросодержащих эритроцитов, где
указанное устройство для отделения ядросодержащих эритроцитов используется для выделения ядросодержащих эритроцитов плода из образца от беременной женщины,
устройство для секвенирования, при этом указанное устройство для секвенирования используется для выполнения секвенирования полного генома ядросодержащих эритроцитов, чтобы получить результат секвенирования, состоящий из множества данных секвенирования; и
устройство для анализа результата секвенирования, при этом указанное устройство для анализа результата секвенирования соединено с устройством для секвенирования для получения указанного результата секвенирования от указанного устройства для секвенирования, и на основе указанного результата секвенирования выносится решение, существует ли аномалия генома в указанных ядросодержащих эритроцитах,
для определения того, существует ли аномалия генома, где указанная аномалия генома представляет собой анеуплоидию по хромосоме(ам), причем
существует ли аномалия генома в указанных ядросодержащих эритроцитах, определяется способом, включающим:
деление известной последовательности первой хромосомы на множество окон, причем окна в указанном множестве независимо имеют заранее задаваемый размер соответственно;
совмещение данных секвенирования в указанном результате секвенирования с указанной известной последовательностью первой хромосомы для получения числа данных секвенирования, относящихся к каждому окну;
на основе получения числа данных секвенирования, относящихся к каждому окну, выполнение средневзвешенного усреднения указанного числа данных секвенирования для получения медианы для указанной первой хромосомы, при этом медиана для указанной первой хромосомы составляет первый параметр указанной первой хромосомы, и
осуществление процедуры в отношении второй хромосомы, одинаковой с таковой в отношении указанной первой хромосомы, чтобы получить медиану для указанной второй хромосомы,
выполнение проверки по t-критерию Стьюдента медианы для указанной первой хромосомы и медианы для указанной второй хромосомы, чтобы получить разницу между указанной первой хромосомой и указанной второй хромосомой,
сравнение полученной разницы с заранее задаваемым первым пороговым значением и вторым пороговым значением, и, если указанная разница меньше указанных заранее задаваемых пороговых значений, то определение, что указанные ядросодержащие эритроциты имеют анеуплоидию по первой хромосоме, и, если указанная разница больше указанных заранее задаваемых пороговых значений, то определение, что указанные ядросодержащие эритроциты не имеют анеуплоидию по первой хромосоме.
17. Применение по п. 16, характеризующееся тем, что указанное устройство для отделения ядросодержащих эритроцитов дополнительно включает:
элемент для выделения моноцитов, при этом указанный элемент для выделения моноцитов подходит для выполнения
центрифугирования в градиенте плотности указанного образца от беременной женщины, используя реагент для создания градиента плотности, чтобы получить моноциты, причем указанным образцом от беременной женщины является предпочтительно периферическая кровь беременной женщины, и
магнитный элемент для обогащения, где указанный магнитный элемент для обогащения соединен с указанным элементом для выделения моноцитов и подходит для обогащения ядросодержащими эритроцитами, исходя из указанных моноцитов, используя магнитные частицы, несущие антитело, причем указанное антитело специфически распознает антиген на поверхности ядросодержащих эритроцитов.
18. Применение по п. 16, характеризующееся включением дополнительно устройства для приготовления библиотеки для секвенирования полного генома, где указанное устройство для приготовления библиотеки для секвенирования полного генома соединено с устройством для секвенирования и обеспечивает библиотеку для секвенирования полного генома для указанного устройства для секвенирования,
причем
указанное устройство для приготовления библиотеки для секвенирования полного генома дополнительно включает
элемент для лизиса ядросодержащих эритроцитов, где указанный элемент для лизиса ядросодержащих эритроцитов соединен с указанным устройством для отделения ядросодержащих эритроцитов и получает и лизирует ядросодержащие эритроциты для высвобождения полного генома указанных ядросодержащих эритроцитов,
элемент для амплификации полного генома, где указанный элемент для амплификации полного генома соединен с указанным элементом для лизиса ядросодержащих эритроцитов и используется для амплификации полного генома указанных ядросодержащих эритроцитов, чтобы получить амплифицированный полный геном, и
элемент для конструирования библиотеки для секвенирования, где указанный элемент для конструирования библиотеки для секвенирования используется для получения указанного амплифицированного полного генома и конструирования указанной библиотеки для секвенирования полного генома, используя указанный амплифицированный полный геном.
19. Применение по п. 16, характеризующееся тем, что указанное устройство для анализа результата секвенирования дополнительно включает:
элемент для определения последовательности нуклеиновой кислоты, при этом указанный элемент для определения последовательности нуклеиновой кислоты в заранее определенной области подходит для определения, на основе указанного результата секвенирования, нуклеотидной последовательности заранее определенной области в указанных ядросодержащих эритроцитах,
элемент для совмещения, при этом указанный элемент для совмещения соединен с указанным элементом для определения последовательности нуклеиновой кислоты и подходит для совмещения нуклеотидной последовательности заранее определенной области в указанных ядросодержащих эритроцитах с контрольной нуклеотидной последовательностью, и
элемент для определения аномалии, при этом указанный элемент для определения аномалии соединен с указанным элементом для совмещения и подходит для определения, на основе результата указанного совмещения, того, существует ли аномалия в заранее определенной области в указанных ядросодержащих эритроцитах.
20. Применение по п. 19, характеризующееся тем, что контрольная нуклеотидная последовательность хранится в указанном элементе для совмещения, предпочтительно указанной контрольной нуклеотидной последовательностью является геномная последовательность нормального человека.
| WO2007147079 A2, 21.12.2007 | |||
| CN101305087 A, 12.11.2008 | |||
| ОПРЕДЕЛЕНИЕ ХРОМОСОМНЫХ АНОМАЛИЙ В КЛЕТКАХ, ПОЛУЧЕННЫХ ИЗ ФОЛЛИКУЛЯРНОЙ ЖИДКОСТИ | 2005 |
|
RU2395584C2 |
Авторы
Даты
2016-10-10—Публикация
2011-12-17—Подача