Изобретение относится к медицине, а именно к клинической лабораторной диагностике, и может быть использовано для определения мозговой изоформы (изофермента) креатинфосфокиназы в крови человека при диагностике ишемических и других форм повреждения головного мозга.
При повреждении клеток внутриклеточные энзимы поступают в кровоток по универсальному механизму. Из современных научных источников известно о наличии в крови трех изоформ креатинфосфокиназы. Это ВВ-изоформа (мозговая), ММ-изоформа (мышечная) и МВ-изоформа (сердечная). Каждая молекула фермента состоит их двух субъединиц, обладающих сходной ферментативной активностью. У здорового человека активность и содержание ВВ-изоформы составляет менее 1% от общей активности и обычно в диагностике повреждений миокарда и скелетных мышц ею пренебрегают. Активность МВ-изоформы у пациентов или здоровых без признаков острого коронарного синдрома составляет менее 2-4% от общей активности, а активность ММ-изоформы является доминирующей и выражается в Ед/л при использовании стандартизованных лабораторных методов (норма для взрослых до 175-195 Ед/л). При повреждении сердца активность МВ-изоформы в крови повышается в течение 3-6 часов, что и послужило основанием для использования MB изофермента в качестве одного из главных диагностических тестов в кардиологических отделениях (у здоровых нормальные значения активности КФК-MB составляют до 20-24 Ед/л).
Сущность определения КФК-МВ по активности состоит в следующем. В инкубационную смесь с сывороткой крови пациента добавляют заведомо избыточное количество реактива, содержащего антитела против М-субъединиц КФК. После инкубации добавляют субстраты указанного фермента аналогично определению общей КФК и после повторной инкубации определяют скорость ферментативной реакции. Поскольку данный анализ используют в клинике для диагностики повреждения миокарда, то считается, что после добавления антител все М-субъединицы фермента блокированы, а ВВ-изоформы в крови не существует (активностью этой изоформы пренебрегают, считая ее ничтожной). Поэтому полученную активность приписывают сердечной изоформе фермента, математически результат умножают на коэффициент 2, чтобы таким образом компенсировать заблокированную активность М-субъединицы, входящей в состав каждой молекулы КФК-МВ.
Однако при инфаркте миокарда происходит серьезное разрушение клеток миокарда и значительная часть белков, в том числе и КФК, повреждается и теряет ферментативную активность. Поэтому лабораторные тесты нового поколения, внедренные в ведущих клинико-диагностических лабораториях мира, используют определение не активности изоформ КФК, а массы молекулы, то есть иммунохимический принцип. В автоматических анализаторах ведущих производителей лабораторного оборудования (Abbott, Beckman-Coulter (США), Roche (Швейцария)) анализ на КФК-МВ включает взаимодействие с данной молекулой моноклональных антител, а затем регистрацию такого взаимодействия с помощью люминесцентной реакции. Поэтому данный анализ получил название «КФК-МВ масса», а количество определяемого фермента выражается в нг/мл. Выполнение указанных анализов на КФК и изоформы КФК-МВ как по активности, так и по массе, является рутинными процедурами в клинико-диагностических лабораториях, которые занимают не более 20 минут времени от момента постановки на борт прибора образца крови пациента.
Однако подобных методов для определения ВВ-изоформы в научной литературе не описано.
Известен способ определения всех изоформ КФК с помощью электрофореза, который требует наличия специального оборудования для проведения этой аналитической процедуры, особо чистых реактивов, а также является многоступенчатым неавтоматизированным тестом, когда высококвалифицированный химик проводит процедуру ручного нанесения образца сыворотки крови на гель, подключает источник постоянного тока, затем останавливает реакцию, окрашивает белки, отмывает несвязавшуюся краску, денситометрирует гели и т.д. (более 7 последовательных этапов). Этот способ является ближайшим аналогом предлагаемого способа и принят за прототип ["Macro creatine kinase agarose electrophoresis kit and preparation method thereof CN 1880954 А].
К недостаткам электрофоретического способа относятся сложность методики, необходимость высокой квалификации персонала, неоперативность, высокая стоимость наборов реагентов, необходимость закупки специальных прекурсоров наркотических веществ в качестве компонентов буферных растворов для электрофореза. Совокупность этих факторов привела к тому, что электрофоретическое разделение изоформ КФК практически исчезло из ассортимента тестов клинико-диагностических лабораторий. Кроме того, необходимо отметить, что результаты разделения изоформ КФК с помощью электрофореза предполагают в качестве заключительного этапа методики использование денситометрии, таким образом, результаты исследования выражают в процентном отношении (например, КФК-МВ - 11%, КФК-ВВ - 2%, КФК-ММ - 87%). Чтобы перейти от таких значений к общепринятым единицам активности ферментов исследователь (или лаборант) должен определить активность общей КФК (КФК-ОБЩ) стандартным энзимологическим методом и затем рассчитать математически активность каждой изоформы. Таким образом, данный способ предполагает выполнение двух независимых методик - определения КФК-ОБЩ и электрофореза со специфическим окрашиванием изоформ.
Технический результат, достигаемый изобретением, заключается в создании нового оперативного лабораторного способа определения мозговой изоформы креатинфосфокиназы (КФК-ВВ акт), который можно внедрить в работу рутинных клинико-диагностических лабораторий.
Указанный технический результат достигается тем, что в способе определения мозговой изоформы креатинфосфокиназы в условиях клинико-диагностической лаборатории, включающем определение активности общей креатинфосфокиназы (КФК-ОБЩ акт), согласно изобретению дополнительно определяют активность креатинфосфокиназы сердечной изоформы (КФК-МВ акт) и содержание креатинфосфокиназы сердечной изоформы по массе (КФК-МВ масс), а затем определяют мозговую изоформу креатинфосфокиназы (КФК-МВ акт) по следующей формуле:
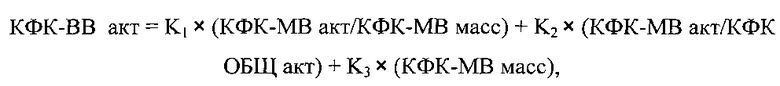
где:
КФК-ВВ акт - активность мозговой изоформы креатинфосфокиназы, Ед/л;
КФК-МВ акт - активность креатинфосфокиназы сердечной изоформы, определенная кинетическим методом, Ед/л;
КФК-МВ масс - количество креатинфосфокиназы сердечной изоформы, определенная иммунохимическим методом, нг/мл;
КФК-ОБЩ акт - активность всех форм креатинфосфокиназы, включающая мозговую, сердечную и мышечную активность креатинфосфокиназы, определенная кинетическим методом, Ед/л;
Κ1=0,64; K2=-32,30; K3=2,62 - числовые коэффициенты, полученные при использовании пуповинной крови новорожденных в качестве образца для исследования, кинетического метода для определения КФК-ОБЩ акт и КФК-МВ акт, а также иммунохимического метода для определения КФК-МВ масс.
Изобретение основано на предположении, что при повреждении мозга или без него общая активность КФК-ОБЩ в крови представлена всеми тремя изоферментами (мышечным, сердечным и мозговым). Такие ситуации особенно характерны при рождении ребенка, в том числе при осложненных родах. Здесь нередко случается и гипоксическое повреждение мозга, и повреждение сердца (миокардиты, гипоксическое повреждение), а также родовой травматизм с повреждением поперечнополосатой мускулатуры.
Для создания предлагаемого способа были проведены клинические исследования в группе из 34 новорожденных, направленные на изучение в пуповинной крови общей креатинфосфокиназной активности КФК-ОБЩ акт, а также активности и массы КФК-МВ. Все включенные в исследование пациенты родились естественным путем или после операции кесарева сечения. У всех пациентов брали пуповинную кровь путем стандартного забора крови из пуповинной вены.
Использовали следующие лабораторные методы.
1. Определение общей креатинфосфокиназной активности (КФК-ОБЩ акт) спектрофотометрическим методом.
КФК ОБЩ акт. определяли при 37°С на биохимическом анализаторе «UniCel DxC 600 Synchron» (Beckman Coulter, США) с использованием наборов «CK (IFCC)» (Thermo Fisher Scientific, Финляндия).
2. Определение активности изоформы MB креатинфосфокиназы (КФК-МВ акт) спектрофотометрическим методом.
КФК-МВ акт определяли при 37°С на биохимическом анализаторе «UniCel DxC 600 Synchron» (Beckman Coulter, США) с использованием наборов «CK-МВ» (Thermo Fisher Scientific, Финляндия).
Спектрофотометрический метод основан на иммуноингибировании активности М-мономера КФК при помощи моноклональных антител. При этом активность ММ-изоформы КФК (мышечная изоформа) полностью ингибируется, а активность КФК-МВ акт (сердечная) снижается в два раза.
3. Определение массы изоформы MB креатинфосфокиназы (КФК-МВ масс) методом хемилюминесцентного иммуноанализа на микрочастицах.
На первом этапе анализа смешиваются проба и микрочастицы, покрытые антителами к КФК-МВ. После первого инкубирования и отмывания присутствовавший в пробе изофермент КФК-МВ остается связанным с микрочастицами. На втором этапе анализа добавляются антитела к КФК-МВ, меченные хемилюминесцентным акридином. После второй инкубации и отмывания к реакционной смеси добавляются растворы пре-триггера и триггера, инициирующие хемилюминесцентную реакцию. Поскольку существует прямая взаимосвязь между количеством КФК-МВ в пробе и детектируемой в относительных единицах хемилюминесценцией, содержание КФК-МВ высчитывается при помощи калибровочной кривой.
В нашей работе мы определяли КФК-МВ масс на иммунохемилюминесцентном анализаторе «Architect i1000» (Abbott, США) с использованием наборов STAT CK-МВ (Abbott, США), результаты выражали в нг/мл (мг/л). Необходимо отметить, что метод определения КФК-МВ масс является нестандартизованным, и количественные результаты зависят от использованных производителем реактивов антител и калибровочных материалов.
4. Определение активности изоферментов креатинфосфокиназы методом электрофореза (по прототипу).
Как указывалось выше, наиболее близким к выбранному методу является электрофоретический способ отделения молекул гигантской (митохондриальной) креатинкиназы от классических изоформ этого фермента ("Macro creatine kinase agarose electrophoresis kit and preparation method thereof CN 1880954 А заявлен 16/06/2005). По прототипу проводили электрофорез белков сыворотки с использованием коммерческих реактивов «Hydragel ISO-CK» (Sebia, Франция). На полуавтоматической системе для электрофореза «Hydrasys» (Sebia, Франция) с помощью наборов «Hydragel ISO-CK» (Sebia, Франция) проводили электрофорез образцов сыворотки на агарозном геле со щелочным буфером (рН 8,4). После разделения трех изоферментов КФК осуществляли их визуализацию с использованием специфического хромогенного субстрата согласно инструкции к наборам. Все изоферменты КФК в данном методе катализируют одну и ту же реакцию, которая используется для их визуализации. Получающиеся в результате гели пригодны для визуального осмотра и денситометрии, что позволяет получить относительное количественное содержание белков в процентах, соответствующих различным зонам, а затем, исходя из определения общей активности КФК-ОБЩ (см. выше), высчитывали активность отдельных изоферементов в Ед/л.
Для осуществления предлагаемого способа разработана математическая формула. Для этого в исследовании в базу пациентов было включено 34 новорожденных. Средний вес составил 3443±65 г, средний рост 50±0,4 см, оценка по шкале Апгар от 7 до 9 баллов.
На первом этапе из базы пациентов методом генерации равномерно распределенных дискретных целочисленных значений была сформирована выборка объемом 20 пациентов. У пациентов определяли описанные выше лабораторные показатели, а именно: КФК-МВ акт, КФК-МВ масс, КФК-ОБЩ акт.
Рассчитывали частные ковариации и дисперсии всех определяемых показателей. На их основе строили предиктивные регрессионные модели. В качестве зависимой переменной выступала КФК-ВВ акт - активность мозговой изоформы КФК, выраженная в Ед/л.
Выбирали модель с коэффициентом детерминации, наиболее близким к единице. Затем проводили процедуру проверки предсказательной способности модели на выборке объемом 14 новорожденных, не вошедших в первую выборку.
Критерием для выбора модели служило значение среднеквадратичного отклонения предсказанного значения от определенного по прототипу. В итоге была выбрана модель с наименьшим отклонением оценочного значения КФК-ВВ акт от значения активности, определенного по прототипу.
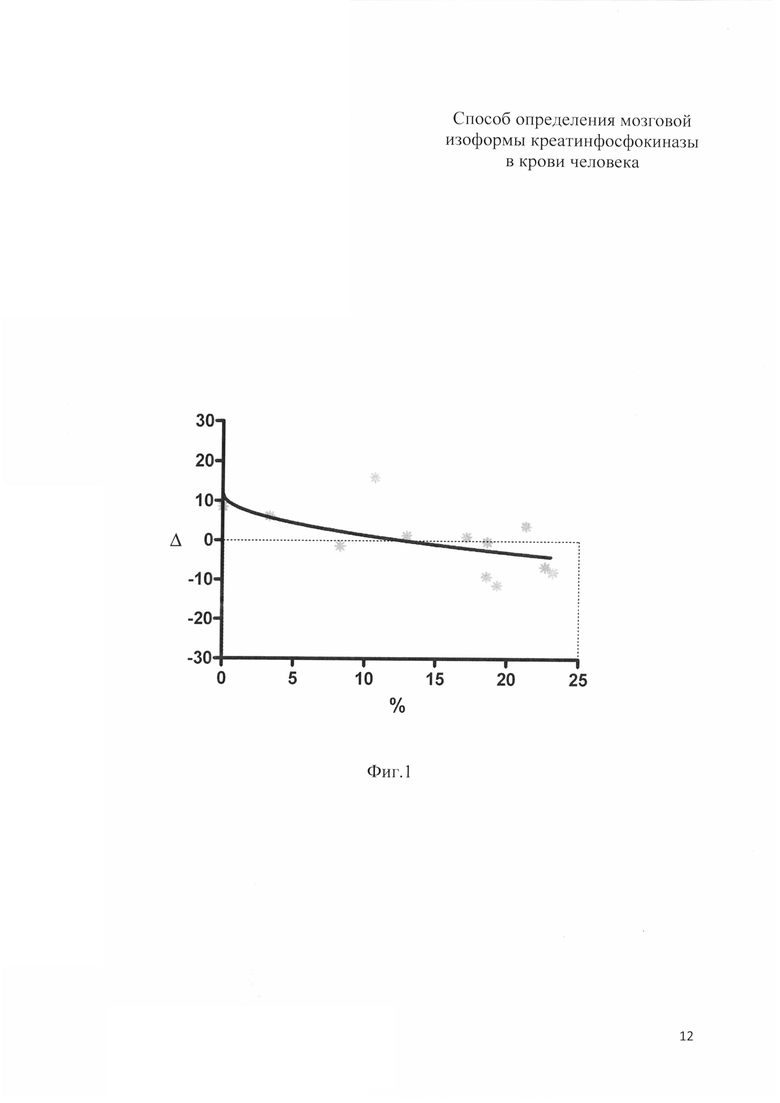
Точечная оценка отклонения предсказанного значения от активности КФК-ВВ акт по прототипу составила 0,01±2,13 Ед/л.
Можно утверждать, что при расчете по предлагаемой формуле в 99% случаев величина отклонения расчетного значения от значения, определенного по прототипу, составит от -5.08 до 5.09 Ед/л.
Способ иллюстрируется фиг. 1-3. На фиг. 1 представлены результаты проверки построенной модели. По оси абсцисс отложены процентное содержание ВВ изоформы КФК, полученное методом электрофореза. По оси ординат отклонение значения, предсказываемого формулой, от полученного по прототипу. Пунктирной линией отмечено нулевое отклонение.
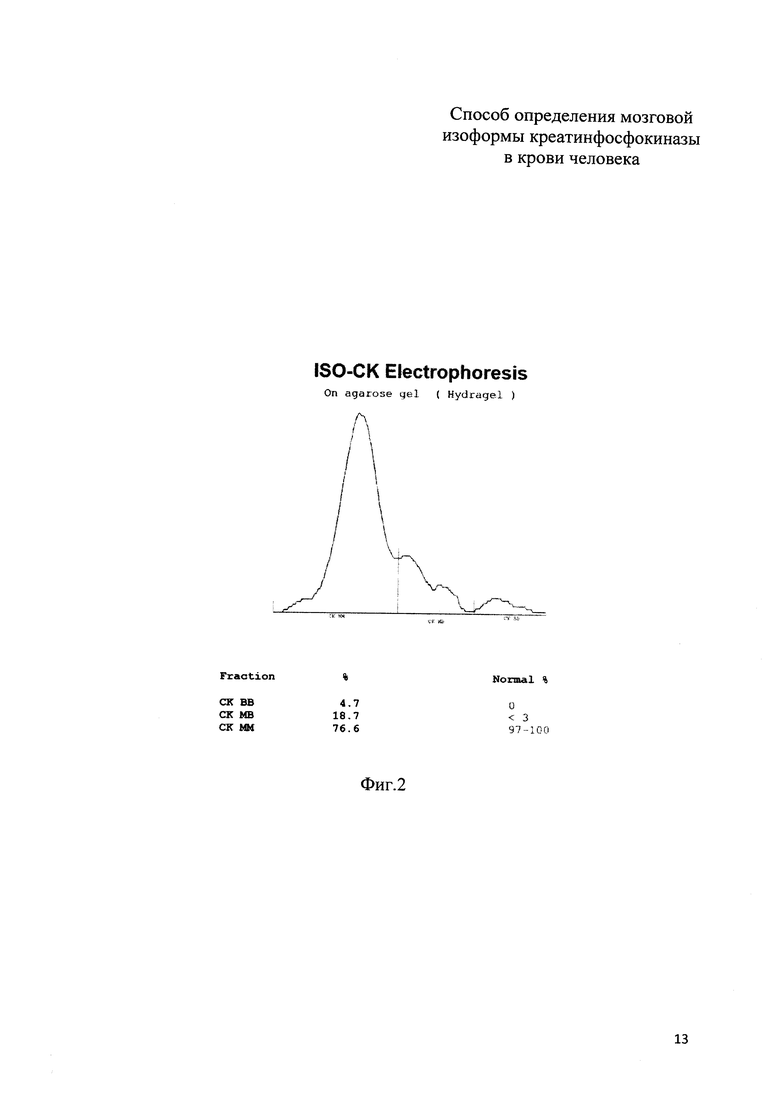
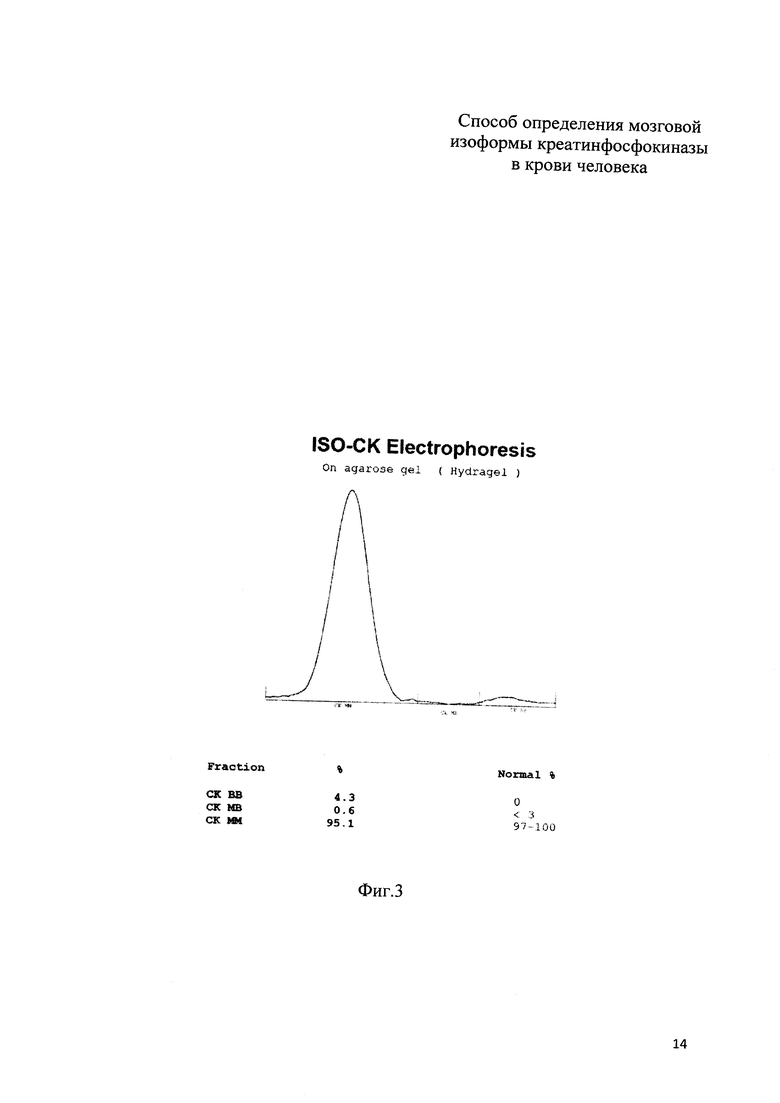
На фиг. 2 приведены результаты электрофореза (электрофореграмма) изоформ КФК по примеру 1; на фиг. 3 приведены результаты электрофореза (электрофореграмма) изоформ КФК по примеру 2.
Осуществление способа подтверждается следующими примерами.
Для использованных методов (анализаторов) были рассчитаны числовые значения коэффициентов K1, K2, K3
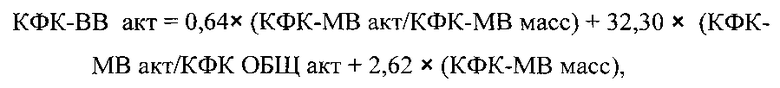
где: K1=0,64; K2=-32,30; K3=2,62
Пример 1 (фиг. 2). У новорожденного ребенка женского пола (вес 3578 г, рост 51 см, оценка по шкале Апгар при рождении и через 5 минут равна 7 баллов) измеренные значения оказались следующими: КФК общ = 275 Ед/л, КФК-МВ акт = 128 Ед/л, КФК-МВ масс = 5,7 нг/мл. По формуле:
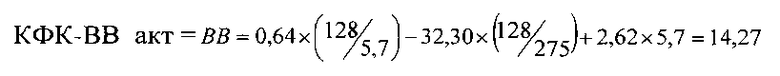
Предсказанное значение равно 14,27 Ед/л, полученное по прототипу (по данным электрофореза) = 12,94 Ед/л, разность между значениями 1,33 Ед/л, что составляет менее 10% от вычисленного значения.
Пример 2 (фиг. 3). У новорожденного ребенка женского пола (вес 3750 гр, рост 53 см, оценка по шкале Апгар 8 баллов) измеренные значения оказались следующими: КФК общ = 496 Ед/л, КФК-(МВ) акт = 72 Ед/л, КФК-(МВ) масс = 9,5 нг/мл,
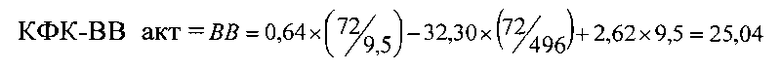
Предсказанное значение равно 25,04 Ед/л, полученное по прототипу = 21,32 Ед/л, разность составляет 3,72 Ед/л, или 12% от вычисленного значения, причем активность КФК-(ВВ) при обоих способах вычисления превышает нормальные значения.
Предлагаемый способ расширяет арсенал средств для определения мозговой изоформы креатинфосфокиназы путем создания нового оперативного лабораторного способа определения активности КФК-ВВ акт, который может стать рутинной процедурой в клинико-диагностических лабораториях.
Изобретение относится к медицине, а именно к клинической лабораторной диагностике и касается способа определения мозговой изоформы креатинфосфокиназы в крови человека. Сущность способа заключается в том, что определяют активности общей креатинфосфокиназы и сердечной изоформы креатинфосфокиназы, а также содержание креатинфосфокиназы сердечной изоформы по массе. Мозговую изоформу креатинфосфокиназы определяют по следующей формуле: КФК-ВВ акт=K1 × (КФК-МВ акт/КФК-МВ масс) + K2 × (КФК-МВ акт/КФК ОБЩ акт) + K3 × (КФК-МВ масс), где КФК-ВВ акт - активность мозговой изоформы креатинфосфокиназы, Ед/л; КФК-МВ акт - активность креатинфосфокиназы сердечной изоформы, определенная кинетическим методом, Ед/л; КФК-МВ масс - количество креатинфосфокиназы сердечной изоформы, определенная иммунохимическим методом, мг/л; КФК ОБЩ акт - активность всех форм креатинфосфокиназы, включающая мозговую, сердечную и мышечную активность креатинфосфокиназы, определенная кинетическим методом, Ед/л; K1=0,64; K2=-32,30; K3=2,62 - числовые коэффициенты, полученные при использовании пуповинной крови новорожденных в качестве образца для исследования, кинетического метода для определения КФК ОБЩ акт, КФК-MB акт и иммунохимического метода для определения КФК-МВ масс. Использование способа позволяет быстро определить мозговую изоформу креатинфосфокиназы в крови человека. 3 ил.
Способ определения мозговой изоформы креатинфосфокиназы в условиях клинико-диагностической лаборатории, включающий определение активности общей креатинфосфокиназы, отличающийся тем, что дополнительно определяют активность креатинфосфокиназы сердечной изоформы и содержание креатинфосфокиназы сердечной изоформы по массе, а затем определяют мозговую изоформу креатинфосфокиназы по следующей формуле:
КФК-ВВ акт=К1×(КФК-МВ акт/КФК-МВ масс)+К2×(КФК-МВ акт/КФК ОБЩ акт)+К3×(КФК-МВ масс),
где:
КФК-ВВ акт - активность мозговой изоформы креатинфосфокиназы, Ед/л;
КФК-МВ акт - активность креатинфосфокиназы сердечной изоформы, определенная кинетическим методом, Ед/л;
КФК-МВ масс - количество креатинфосфокиназы сердечной изоформы, определенная иммунохимическим методом, нг/мл;
КФК-ОБЩ акт - активность всех форм креатинфосфокиназы, включающая мозговую, сердечную и мышечную активность креатинфосфокиназы, определенная кинетическим методом, Ед/л;
К1=0,64; К2=-32,30; К3=2,62 - числовые коэффициенты, полученные при использовании пуповинной крови новорожденных в качестве образца для исследования, кинетического метода для определения КФК-ОБЩ акт, КФК-МВ акт и иммунохимического метода для определения КФК-МВ масс.
| CN 1880954 A1, 20.12.2006 | |||
| US 4001088 A, 04.01.1977 | |||
| В | |||
| С | |||
| БЕРЕСТОВСКАЯ и др., Методы определения креатинкиназы и ее изоферментов // Лабораторная диагностика, 2007, N1 (13) [найдено в Интернет: http://www.terra-medica.spb.ru/ld1_2007/berestovska.htm]. |
Авторы
Даты
2016-10-20—Публикация
2015-06-24—Подача