Настоящее изобретение относится к биомаркерам, которые являются прогностическими для клинической эффективности лечения эрлотиниба гидрохлоридом у больных раком.
Целый ряд злокачественных опухолей человека ассоциирован с аберрантной экспрессией или сверхэкспрессией рецептора эпидермального фактора роста (EGFR). С EGFR связываются эпидермальный фактор роста (EGF от англ. epidermal growth factor), трансформирующий фактор роста-α (TGF-α от англ. transforming growth factor-α), а также ряд других лигандов, стимулируя автофосфорилирование внутриклеточных тирозинкиназных доменов рецептора. В результате активируются различные внутриклеточные сигнальные пути, и эти последующие события приводят к пролиферации опухолевых клеток in vitro. Предполагается, что стимуляция опухолевых клеток через EGFR может быть важной как для роста опухоли, так и для выживания опухоли в in vivo.
Первые клинические данные с Тарцева®, ингибитором тирозинкиназы EGFR, показывают, что данное соединение является безопасным и хорошо переносится в дозах, обеспечивающих целевую эффективную концентрацию (как показывают доклинические данные). Исследования клинической фазы I и II у пациентов с прогрессирующим заболеванием показали, что Тарцева® обладает перспективной клинической активностью на ряде эпителиальных опухолей. Действительно, препарат Тарцева®, как было показано, способен индуцировать долговременную частичную ремиссию у получавших ранее лечение пациентов с раком головы и шеи, а также НМРЛ (немелкоклеточным раком легкого) в такой же степени, как и стандартная химиотерапия второй линии, но при этом преимущества данного препарата заключаются в лучшем профиле безопасности, по сравнению с химиотерапией, и в большем удобстве применения (таблетка вместо внутривенного [в.в.] введения). Рандомизированное двойное слепое плацебо-контролируемое исследование (BR.21) показало, что агент Тарцева® ,в отдельности значительно продлевает и улучшает выживаемость больных НМРЛ, для которых стандартная терапия для поздней стадии заболевания оказалась не эффективной.
Тарцева® (эрлотиниба гидрохлорид) представляет собой небольшое химическое вещество; этот агент представляет собой активный при пероральном введении сильнодействующий ингибитор тирозинкиназы EGFR (EGFR-TKI).
Иресса™ (гефитиниб) представляет собой небольшое химическое вещество, этот агент представляет собой активный при пероральном введении ингибитор тирозинкиназы EGFR (EGFR-TKI).
Рак легких является основной причиной онкологической смертности в Северной Америке и Европе. В Соединенных Штатах число смертей на фоне рака легких превышает число смертей, обусловленных вследствие второй (рак толстой кишки), третьей (рак груди), и четвертой (рака простата) ведущих причин смерти от рака, вместе взятых. Примерно 75%-80% всех случаев рака легких представляет собой НМРЛ, при этом примерно у 40% пациентов опухоль является местнораспространенной и/или неоперабельной. Эта группа обычно включает в себя пациентов с массивными поражениями на стадии IIIA и IIIB, за исключением злокачественных плевральных выпотов.
По грубым оценкам, заболеваемость раком легких в Европейском Союзе составляет 52,5, смертность составляет 48,7 случаев/100000/год. Среди мужчин эти показатели составляют 79,3 и 78,3, а среди женщин - 21,6 и 20,5, соответственно. На НМРЛ приходится 80% всех случаев рака легких. Около 90% смертности от рака легких среди мужчин и 80% среди женщин, связано с курением.
В США по данным Американского общества рака в 2004 году насчитывалось около 173800 новых случаев рака легкого (93100 у мужчин и 80700 женщин) и на их долю приходится около 13% всех новых случаев рака. Большинство пациентов умирают вследствие заболевания в течение двух лет после постановки диагноза. Для многих пациентов с НМРЛ, успешное лечение остается недостижимым. Прогрессирующие опухоли часто не поддаются хирургии, и они могут также быть устойчивыми к переносимым дозам лучевой терапии и химиотерапии. В рандомизированных исследованиях в настоящее время наиболее активная комбинированная химиотерапия достигает уровня ответа примерно от 30% до 40%, а однолетняя выживаемость составляет от 35% до 40%. Это действительно является прогрессом, по сравнению с 10% однолетней выживаемостью только при поддерживающей терапии (Shepherd, 1999).
До недавнего времени возможности для лечения пациентов после рецидива ограничивались лучшей поддерживающей терапией или временным облегчением. Недавнее исследование по сравнению доцетаксела (Таксотер) с лучшей поддерживающей терапией показало, что у пациентов с НМРЛ может наблюдаться благоприятный эффект от химиотерапии второй линии, после того как химиотерапия первой линии на основании цисплатина, оказалась неэффективной. Пациенты всех возрастов со статусом 0, 1 или 2 по шкале ECOG продемонстрировали улучшение выживаемости с доцетакселом, как и пациенты, трудно поддающиеся лечению с помощью препаратов платины. Пациенты, у которых не наблюдалось положительного результата на терапию, включали пациентов с потерей веса на 10%, с высоким уровнем лактатдегидрогеназы, поражением многих органов или с поражением печени. Кроме того, положительный эффект монотерапии доцетакселом не выходил за пределы режима терапии второй линии. Пациенты, получавшие доцетаксел в качестве терапии третьей или более линии, не демонстрировали увеличения срока выживаемости. Монотерапия доцетакселом стала стандартом терапии второй линии для лечения НМРЛ. В другом недавно проведенном рандомизированном испытании III фазы для препаратов для терапии НМРЛ второй линии сравнивали пеметрексед (Alimta®) и доцетаксел. Лечение с помощью пеметрекседа привело к клинически эквивалентной эффективности, но со значительно меньшим количеством побочных эффектов, по сравнению с доцетакселом.
Уже давно признано, что существует необходимость в разработке способов индивидуализации лечения рака. С развитием направленных (целевых) способов лечения рака, существует особый интерес к методологиям, которые могли бы обеспечить молекулярный профиль опухоли-мишени (то есть такой профиль, который был бы прогностическим для клинического эффекта). Принцип определения профиля экспрессии генов в опухоли уже проверен на основании молекулярной классификации типов опухолей, которая не очевидна на основании наблюдаемых результатов морфологических и иммуногистохимических тестов. С помощью определения профиля экспрессии генов можно различить две отдельные нозологические формы с различными прогнозами, которые на основании существующей классификации объединены в одну группу диффузной В-клеточной лимфомы.
Было показано, что пациенты с НМРЛ, несущие мутацию, приводящую к активации EGFR в опухоли, особенно успешно реагируют на лечение ингибиторами тирозинкиназы, такими как эрлотиниб и гефитиниб (Paz-Ares et al. 2010). В то время как гефитиниб, по-видимому, не приводит к какому-либо клинически благоприятному эффекту у неселектированной популяции пациентов (Thatcher et al. Lancet 2005), эрлотиниб проявляет такой эффект (Shepherd et al. NEJM 2005; Cappuzzo et al. 2010). Следовательно, целью настоящего изобретения является обеспечение экспрессионных маркеров, которые являются прогностическими для клинического эффекта эрлотиниба гидрохлорида в лечении онкологических больных, и не являются прогностическими факторами клинической эффективности терапии гефитинибом у больных раком.
Экстраклеточный матрикс (ЭКМ) обеспечивает структурную основу для формирования тканей и органов. ЭКМ связывается с молекулами, прилипающими к субстрату, на поверхности клетки и влияет на различные внутриклеточные сигнальные пути, которые регулируют выживание, пролиферацию, полярность и дифференцировку. Важным семейством молекул адгезии, связывающихся с ЭКМ, являются интегрины. Интегрины включают альфа- и бета-субъединицы и состоят из больших экстраклеточных доменов и относительно небольших цитоплазматических доменов. Связывание лиганда активирует сигнальные каскады, которые приводят к сборке мультибелкового комплекса, в области адгезии клеток с ЭКМ. Эти события оказывают два важных эффекта на клетки: они налаживают связь между ЭКМ и актиновым цитоскелетом, и они изменяют потоки многих внутриклеточных сигнальных путей. Тремя белками, функционирующими как важные регуляторы опосредованной интегрином передачи сигналов, являются ILK (Integrin Linked Kinase, связанная с интегрином киназа) и адаптерные белки PINCH (Particularly Interesting Cys-His-rich Protein, особенно интересный Cys-His-богатый белок) и Parv (Parvin, парвин), среди которых ILK является основным регулятором опосредованного интегрином сигналинга. Эти молекулы образуют гетеротримерный комплекс, который известен как комплекс IPP. Основной функцией ILK является соединение интегринов с цитоскелетом. ILK связывается с PINCH через свой N-концевой домен, и связывается с альфа-парвин через С-концевой домен, в результате чего образуется тройной комплекс PINCH-ILK-альфа-парвин (комплекс IPP). Комплекс IPP функционирует и как адаптер между интегринами и актиновым цитоскелетом, и как центр, регулирующий несколько сигнальных путей.
Линии НМРЛ, содержащие EGFR дикого типа, проявляют более высокую чувствительность к эрлотиниба гидрохлориду перед ЭМП (Thomson et al. (2005)). Эпителиально-мезенхимальный переход (ЭМП) представляет собой фенотипическое преобразование биологических клеток, характеризующееся потерей клеточной адгезии, репрессией Е-кадгерина и повышенной подвижностью клетки. Предполагается, что ЭМП запускают несколько онкогенных путей (например, пептидные факторы роста, интегрин и т.д.). ЭМП является характерной особенностью клеток, претерпевающих пролиферацию, и, как предполагается, он играет значительную роль в прогрессировании опухоли и метастазах. Повышенная экспрессия интегрин-связанной киназы ассоциирована с более коротким периодом выживаемости при немелкоклеточном раке легкого (Takanami et al. (2005)).
Исследование MERIT представляет собой нерандомизированное, открытое испытание, направленное на идентификацию эффективных маркеров для терапии пациентов с немелкоклеточным раком легких с помощью Тарцевы во второй линии.
Термин «биомаркер» обозначает вещество, применяемое в качестве показателя биологического состояния, т.е. биологических процессов или фармакологического ответа на терапевтическое взаимодействие. Биомаркер служит признаком изменения экспрессии или состояния белка, которое коррелирует с риском развития или прогрессированием заболевания или с восприимчивостью заболевания к конкретному лечению.
Термин «маркерный ген» обозначает ген, который применяют для проверки успешного встраивания участка ДНК в организм хозяина.
Экспрессия гена представляет собой процесс, при котором информация от гена используется для синтеза функционального продукта гена, например, белка. Термин «уровень экспрессии» обозначает уровень, на котором конкретный ген экспрессируется в клетке, в ткани или в организме. Термин «уровень экспрессии» в отношении белка отражает количество конкретного белка в клетке в определенный момент времени.
«Химическая протеомика» представляет собой подход с использованием аффинной хроматографии на основе масс-спектрометрии, в котором используются малые молекулы, иммобилизованные в качестве «приманки», для захвата и выявления взаимодействующих белковых комплексов из всего протеома. Этот подход можно применять как для ингибиторов киназ, например, для изучения их действия, так и для идентификации мишеней природных продуктов.
Термин «уровень активации» отражает способность конкретного белка быть активным в клетке в определенный момент времени. Примером являются киназы, которые фосфорилируются в определенном сайте для того, чтобы они могли модифицировать свой субстрат.
Термин «репрезентативные/типичные значения уровня экспрессии комплекса IPP в опухолях популяции пациентов, у которых лечение не произвело благоприятного клинического эффекта» относится к оценке среднего уровня экспрессии маркерного гена в опухолях популяции пациентов, у которых лечение не произвело благоприятного клинического эффекта. Благоприятный клинический эффект определяют как наличие объективного ответа или стабилизацию заболевания в течение ≥12 недель.
В конкретном варианте реализации уровень экспрессии маркерного гена определяют с помощью микрочиповой технологии или других технологий, которые позволяют оценить уровни экспрессии РНК, такой как количественная ПЦР, или любым способом, выявляющим уровень экспрессии соответствующих белков, например иммуногистохимического анализа (ИГХ). Конструирование и применение генных чипов хорошо известны в данной области техники. См. патенты США №5202231; 5445934; 5525464; 5695940; 5744305; 5795716 и 1 5800992. См. также, Johnston, М. Curr. Biol. 8: R171-174 (1998); Iyer VR et al., Science 283:83-87 (1999). Как известно, уровень экспрессии гена можно определить другими способами, которые известны специалистам в данной области, такими как, например, Нозерн-блот-анализ, ОТ-ПЦР, количественная ПЦР в реальном времени, удлинение праймера, защита от РНКазы, определения профиля экспрессии РНК.
Маркерный ген согласно настоящему изобретению может быть объединен с другими биомаркерами в набор биомаркеров, в частности с биомаркерами EGFR. Наборы биомаркеров могут быть составлены из любого сочетания прогностических биомаркеров для прогнозирования влияния терапии эрлотиниба гидрохлоридом на больных раком. Биомаркеры и наборы биомаркеров, описанные в настоящей заявке, можно применять, например, для прогнозирования реакции пациента, страдающего раком, на терапевтическое вмешательство с помощью эрлотиниба гидрохлорида.
Термин «ген», используемый в настоящей заявке, включает варианты гена. Термин «вариант» относится к нуклеотидным последовательностям, которые, по существу аналогичны нуклеотидным последовательностям, для которых даны номера доступа в базе GenBank. Термин «по существу аналогичны» хорошо понятен специалисту в данной области. В частности, вариант гена может представлять собой аллель, в которой содержатся нуклеотидные замены, по сравнению с нуклеотидной последовательностью наиболее распространенной аллели в популяции человека. Предпочтительно, такие по существу аналогичные нуклеотидные последовательности имеют сходство по последовательности с наиболее распространенной аллелью по меньшей мере 80%, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%, наиболее предпочтительно по меньшей мере 95%. Термин «варианты» также относится к сплайсированным вариантам.
Методики для обнаружения и количественной оценки экспрессии генов, описанных в настоящем изобретении, включают, но не ограничены перечисленными, Нозерн-блот-анализ, ОТ-ПЦР, количественную ПЦР в реальном времени, удлинение праймеров, защиту от РНКазы, определение профиля экспрессии РНК и связанные с ними методы. Эти методы хорошо известны специалистам в данной области, см., например, Sambrook J et al., Molecular Cloning: A Laboratory Manual, Third Edition (Cold Spring Harbor Press, Cold Spring Harbor, 2000).
Методы для выявления экспрессии белков соответствующих генов, описанных в настоящем изобретении, включают, без ограничений, иммуногистохимический анализ (ИГХ).
Биомаркеры согласно настоящему изобретению направлены на индивидуализированную терапию для пациентов с раком, в частности, для пациентов с не поддающимся лечению НМРЛ. Такая индивидуализированная терапия позволит лечащему врачу выбрать наиболее подходящий агент из существующих препаратов для лечения рака, в частности НМРЛ. Преимуществами индивидуализированной терапии для каждого будущего пациента являются: увеличение числа ответов/количества пациентов с благоприятным ответом и снижение риска побочных эффектов вследствие неэффективного лечения.
Следует понимать, что терминология, используемая в настоящем документе, предназначена для описания конкретных вариантов осуществления и не является ограничивающей. Кроме того, хотя на практике или при тестировании настоящего изобретения можно применять любые способы, устройства и материалы, подобные или эквивалентные таковым, описанным в настоящей заявке, описанные ниже способы, устройства и материалы являются предпочтительными.
В настоящем изобретении неожиданно было обнаружено, что реакцию больного раком на лечение эрлотиниба гидрохлоридом можно предсказать путем определения уровней активации белков ILK, альфа-парвина и PINCH в совокупности, по отдельности или в каждых комбинации отдельных белков в образце опухоли пациента. Кроме того, различия в клинических результатах можно отнести к различиям профилей взаимодействия белков для эрлотиниба и гефитиниба, определенные с помощью химической протеомики.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции пациента, больного раком, на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня экспрессии одного, двух или трех генов, выбранных из группы, включающей гены ILK, альфа-парвина и PINCH, в образце опухоли пациента и сравнение уровня экспрессии генов ILK, альфа-парвина и PINCH в совокупности или по отдельности со значением типичного уровня экспрессии генов ILK, альфа-парвина и PINCH в совокупности или по отдельности в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень экспрессии генов ILK, альфа-парвина и PINCH в совокупности или по отдельности в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции пациента, больного раком, на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня экспрессии генов ILK, альфа-парвина и PINCH в образце опухоли пациента и сравнение уровня экспрессии генов ILK, альфа-парвина и PINCH в совокупности со значением типичного уровня экспрессии генов ILK, альфа-парвина и PINCH в совокупности в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень экспрессии генов ILK, альфа-парвина и PINCH в совокупности в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу in vitro прогнозирования реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня экспрессии генов ILK и альфа-парвина в образце опухоли пациента и сравнение уровня экспрессии генов ILK и альфа-парвина в совокупности со значением типичного уровня экспрессии генов ILK и альфа-парвина в совокупности в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень экспрессии генов ILK и альфа-парвина в совокупности в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня экспрессии генов альфа-парвина и PINCH в образце опухоли пациента и сравнение уровня экспрессии генов альфа-парвина и PINCH в совокупности со значением типичного уровня экспрессии генов альфа-парвина и PINCH в совокупности в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень экспрессии генов альфа-парвина и PINCH в совокупности в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня экспрессии гена ILK в образце опухоли пациента и сравнение уровня экспрессии гена ILK со значением типичного уровня экспрессии гена ILK в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень экспрессии гена ILK в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня экспрессии гена PINCH в образце опухоли пациента и сравнение уровня экспрессии гена PINCH со значением типичного уровня экспрессии гена PINCH в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень экспрессии гена PINCH в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня экспрессии гена альфа-парвина в образце опухоли пациента и сравнение уровня экспрессии гена альфа-парвина со значением типичного уровня экспрессии гена альфа-парвина в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень экспрессии гена альфа-парвина в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу, как описано в настоящей заявке, в котором уровень экспрессии определяют с помощью технологии микрочипов
Один из объектов настоящего изобретения относится к способу in vitro прогнозирования реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня активации одного, двух или трех белков, выбранных из группы, включающей белки ILK, альфа-парвин и PINCH, в образце опухоли пациента и сравнение уровня активации белков ILK, альфа-парвина и PINCH в совокупности или в отдельности со значением типичного уровня активации белков ILK, альфа-парвина и PINCH в совокупности или в отдельности в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень активации белков ILK, альфа-парвина и PINCH в совокупности или в отдельности в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня активации одного, двух или трех белков, выбранных из группы, включающей белки ILK, альфа-парвин и PINCH, в образце опухоли пациента и сравнение уровня активации белков ILK, альфа-парвина и PINCH в совокупности со значением типичного уровня активации белков ILK, альфа-парвина и PINCH в совокупности в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень активации белков ILK, альфа-парвина и PINCH в совокупности в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня активации белка ILK в образце опухоли пациента и сравнение уровня активации белка ILK со значением типичного уровня активации белка ILK в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень активации белка ILK в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня активации белка PINCH в образце опухоли пациента и сравнение уровня активации белка PINCH со значением типичного уровня активации белка PINCH в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень активации белка PINCH в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня активации белков ILK и PINCH в образце опухоли пациента и сравнение уровня активации белка белков ILK и PINCH в совокупности со значением типичного уровня активации белков ILK и PINCH в совокупности в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень активации белков ILK и PINCH в совокупности в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня активации белков ILK и альфа-парвина в образце опухоли пациента и сравнение уровня активации белка белков ILK и альфа-парвина в совокупности со значением типичного уровня активации белков ILK и альфа-парвина в совокупности в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень активации ILK и альфа-парвина в совокупности в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня активации белка альфа-парвина в образце опухоли пациента и сравнение уровня активации белка альфа-парвина со значением типичного уровня активации белка альфа-парвина в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом более низкий уровень активации белка альфа-парвина в образце опухоли пациента указывает на то, что лечение приведет к благоприятному клиническому эффекту у такого пациента.
Один из объектов настоящего изобретения относится к способу прогнозирования in vitro реакции больного раком на лечение эрлотиниба гидрохлоридом, включающему:
определение уровня фосфорилирования белка ILK в образце опухоли пациента и сравнение уровня фосфорилирования белка ILK со значением типичного уровня фосфорилирования белка ILK в опухолях популяции пациентов, у которых лечение не привело к благоприятному клиническому эффекту, при этом отличающийся уровень фосфорилирования белка ILK в образце опухоли пациента указывает на то, что лечение будет оказывать благоприятный клинический эффект на пациента.
Один из объектов настоящего изобретения относится к способу выбора лечения рака у пациента, являющегося человеком, способу включающему:
I) определение уровня экспрессии одного, двух или трех генов, выбранных из группы, включающей гены ILK, альфа-парвин и PINCH, в образце опухоли пациента,
II) сравнение уровня экспрессии одного, двух или трех генов, выбранных из группы, включающей гены ILK, альфа-парвин и PINCH, со значением, характеризующим уровень экспрессии одного, двух или трех генов, выбранных из группы, включающей гены ILK, альфа-парвин и PINCH в опухолях популяции пациентов, на которых лечение не оказывает благоприятного клинического эффекта,
III) при этом более низкий уровень экспрессии одного, двух или трех генов, выбранных из группы, включающей гены ILK, альфа-парвин и PINCH, в образце опухоли пациента указывает на то, что такой пациент получит благоприятный клинический эффект от лечения эрлотиниба гидрохлоридом, и
IV) выбор лечения эрлотиниба гидрохлоридом в качестве терапии рака для пациента.
Один из объектов настоящего изобретения относится к способу лечения рака у пациента, включающий введение эффективного количества эрлотиниба гидрохлорида пациенту, при условии, что уровень экспрессии одного, двух или трех генов, выбранных из группы, включающей гены ILK, альфа-парвин и PINCH, в образце опухоли пациента ниже, чем уровень экспрессии одного, двух или трех генов, выбранных из группы, включающей гены ILK, альфа-парвин и PINCH, в опухолях популяции пациентов, не получающих благоприятного клинического эффекта от лечения эрлотинибом гидрохлорида.
Один из объектов настоящего изобретения относится к способу выбора лечения рака у пациента, являющегося человеком, способу включающему:
I) определение уровня активации одного, двух или трех белков, выбранных из группы, включающей белки ILK, альфа-парвин и PINCH, в образце опухоли пациента,
II) сравнение уровня активации одного, двух или трех белков, выбранных из группы, включающей белки ILK, альфа-парвин и PINCH, со значением, типичным для уровня активации одного, двух или трех белков, выбранных из группы, включающей белки ILK, альфа-парвин и PINCH, в опухолях популяции пациентов, на которых лечение не приводит к благоприятному клиническому эффекту,
III) при этом более низкий уровень активации одного, двух или трех белков, выбранных из группы, включающей белки ILK, альфа-парвин и PINCH, в образце опухоли пациента указывает на то, что такой пациент получит благоприятный клинический эффект от лечения эрлотиниба гидрохлоридом, и
IV) выбор лечения эрлотиниба гидрохлоридом в качестве терапии рака для пациента.
Один из объектов настоящего изобретения относится к способу лечения рака у пациента, включающий введение эффективного количества эрлотиниба гидрохлорида пациенту, при условии, что уровень активации одного, двух или трех белков, выбранных из группы, включающей белки ILK, альфа-парвин и PINCH, в образце опухоли пациента ниже, чем уровень активации одного, двух или трех белков, выбранных из группы, включающей белки ILK, альфа-парвин и PINCH, в опухолях популяции пациентов, не получающих благоприятного клинического эффекта от лечения эрлотинибом гидрохлорида.
Один из объектов настоящего изобретения относится к способу, как описано в настоящей заявке, относящегося к ILK, альфа-парвину и PINCH в совокупности.
Один из объектов настоящего изобретения относится к способу, как описано в настоящей заявке, относящегося к ILK и PINCH в совокупности.
Один из объектов настоящего изобретения относится к способу, как описано в настоящей заявке, относящемуся к альфа-парвину и PINCH в совокупности.
Один из объектов настоящего изобретения относится к способу, как описано в настоящей заявке, относящемуся к ILK и альфа-парвину в совокупности.
Один из объектов настоящего изобретения относится к способу, как описано в настоящей заявке, относящемуся к ILK.
Один из объектов настоящего изобретения относится к способу, как описано в настоящей заявке, относящемуся к альфа-парвину.
Один из объектов настоящего изобретения относится к способу, как описано в настоящей заявке, относящемуся к PINCH.
Один из объектов настоящего изобретения относится к способу, как описано в настоящей заявке, в котором рак представляет собой немелкоклеточный рак легкого (НМРЛ).
Один из объектов настоящего изобретения относится к способу, как описано в настоящей заявке, в котором рак пациент не реагирует на лечение гефитинибом.
Один из объектов настоящего изобретения относится к применению одного, двух или трех генов, выбранных из группы, включающей гены ILK, альфа-парвин и PINCH, для прогнозирования реакции пациента, больного раком, на лечение эрлотиниба гидрохлоридом.
Один из объектов настоящего изобретения относится к применению генов ILK, альфа-парвина и PINCH для прогнозирования реакции пациента, больного раком, на лечение эрлотиниба гидрохлоридом.
Один из объектов настоящего изобретения относится к применению генов альфа-парвина и PINCH для прогнозирования реакции пациента, больного раком, на лечение эрлотиниба гидрохлоридом.
Один из объектов настоящего изобретения относится к применению генов ILK и PINCH для прогнозирования реакции пациента, больного раком, на лечение эрлотиниба гидрохлоридом.
Один из объектов настоящего изобретения относится к применению генов ILK и альфа-парвина для прогнозирования реакции пациента, больного раком, на лечение эрлотиниба гидрохлоридом.
Один из объектов настоящего изобретения относится к применению эрлотиниба гидрохлорида для лечения рака, в котором
I) оценивают активацию уровня одного, двух или трех белков, выбранных из группы, включающей белки ILK, альфа-парвин и PINCH, образце опухоли пациента,
II) сравнивают уровень экспрессии генов ILK, альфа-парвина и PINCH в совокупности или в отдельности со значением, типичным для уровней экспрессии генов ILK, альфа-парвина и PINCH в совокупности или в отдельности в опухолях популяции больных, не получающих благоприятного эффекта от лечения, и
III) вводят эрлотиниба гидрохлорид пациенту, имеющему более низкий уровень экспрессии генов ILK, альфа-парвина и PINCH в совокупности или в отдельности.
Один из объектов настоящего изобретения относится к применению эрлотиниба гидрохлорида для лечения рака, которое связано с уровнем активации белков ILK, альфа-парвина и PINCH в совокупности.
Один из объектов настоящего изобретения относится к применению эрлотиниба гидрохлорида для лечения рака, которое связано с уровнем активации белка ILK.
Один из объектов настоящего изобретения относится к применению эрлотиниба гидрохлорида для лечения рака, которое связано с уровнем активации белка альфа-парвина.
Один из объектов настоящего изобретения относится к применению эрлотиниба гидрохлорида для лечения рака, которое связано с уровнем активации белка PINCH.
Один из объектов настоящего изобретения относится к применению эрлотиниба гидрохлорида для лечения рака, которое связано с уровнем активации белков ILK и альфа-парвина.
Один из объектов настоящего изобретения относится к применению эрлотиниба гидрохлорида для лечения рака, которое связано с уровнем активации белков ILK и PINCH.
Один из объектов настоящего изобретения относится к применению эрлотиниба гидрохлорида для лечения рака, которое связано с уровнем активации белков альфа-парвина и PINCH.
Один из объектов настоящего изобретения относится к применению, как описано в настоящей заявке, относящемуся к ILK.
Один из объектов настоящего изобретения относится к применению, как описано в настоящей заявке, относящемуся к альфа-парвину.
Один из объектов настоящего изобретения относится к применению, как описано в настоящей заявке, относящемуся к PINCH.
Один из объектов настоящего изобретения относится к применению, как описано в настоящей заявке, где рак представляет собой рак НМРЛ.
Один из объектов настоящего изобретения относится к применению, как описано в настоящей заявке, где рак пациент не отвечает на лечение гефитинибом.
Один из объектов настоящего изобретения относится к набору для выявления уровня экспрессии одного, двух или трех генов, выбранных из группы, включающей гены ILK, альфа-парвина и PINCH, набору, включающему I) соединение, способное специфично детектировать уровни экспрессии одного, двух или трех генов, выбранных из группы, включающей гены ILK, альфа-парвин и PINCH, и II) инструкции по применению указанного набора для прогнозирования восприимчивости пациента, страдающего от раком, к лечение эрлотиниба гидрохлорид, при этом снижение уровня экспрессии одного, двух или трех генов, выбранных из группы, включающей гены ILK, альфа-парвин и PINCH, по сравнению с эталонным образцом, указывает на то, что пациент может получить благоприятный клинический эффект от лечения с эрлотиниба гидрохлоридом.
Один из объектов настоящего изобретения относится к набору, как описано в настоящей заявке, относящемуся к ILK.
Один из объектов настоящего изобретения относится к набору, как описано в настоящей заявке, относящемуся к альфа-парвину.
Один из объектов настоящего изобретения относится к набору, как описано в настоящей заявке, относящемуся к PINCH.
Один из объектов настоящего изобретения относится к набору, как описано в настоящей заявке, где рак представляет собой рак НМРЛ.
Один из объектов настоящего изобретения относится к набору, как описано в настоящей заявке, где рак пациент не отвечает на лечение гефитинибом.
Еще один из объектов, настоящее изобретение обеспечивает терапевтический способ лечения пациента, больного раком, идентифицированного с помощью способа in vitro по настоящему изобретению. Указанный терапевтический способ включает введение эрлотиниба гидрохлорида пациенту, который был выбран для лечения на основе прогностической экспрессии и/или активации паттерна генов, имеющих указанные в приложении к заявке последовательности SEQ ID 1, 2 и 3. В частности рак, подлежащий лечению, представляет собой НМРЛ.
Описание последовательностей:
Seq. Id. No. 1 представляет собой нуклеотидную последовательность ILK человека.
Seq. Id. No. представляет собой нуклеотидную последовательность альфа-парвина человека.
Seq. Id. No. 3 представляет собой нуклеотидную последовательность PINCH человека.
Фигуры
Фигура 1: Показаны изменения в содержании белков с увеличением концентрации соединения, уровень которых значимо изменялся под воздействием эрлотиниба гидрохлорида, гефитиниба или обоих агентов. Изменения, как правило, хорошо согласуются с ожидаемыми значениями на основании р-значений (см. Фигуру 2). Однако LIMS1 (PINCH) и M3K1 были идентифицированы и, таким образом, определены количественно только в образцах, полученных при воздействии эрлотиниба гидрохлорида, тогда как ЕРНА1, K0564, KC1E, NUD12, SN1L1 были обнаружены только в образцах , полученных при воздействии гефитиниба.
Фигура 2: Показан график зависимости скорректированных р-значений для эрлотиниба гидрохлорида от скорректированных р-значений гефитиниба после log10-преобразования (линии указывают 5% вероятность ошибки). В области А показаны белки, значимо связывающиеся с эрлотиниба гидрохлоридом и гефитинибом, в области В и С показаны белки, значимо связывающиеся с эрлотиниба гидрохлоридом и гефитинибом, соответственно. Белки в области D не показывают значимого связывания ни с одним из двух агентов. На этой фигуре отображены только те белки, которые были идентифицированы при действии обоих соединений, в связи с этим белки, перечисленные выше, которые присутствуют в образцах только при действии эрлотиниба гидрохлорида или только при действии гефитиниба, здесь не приведены.
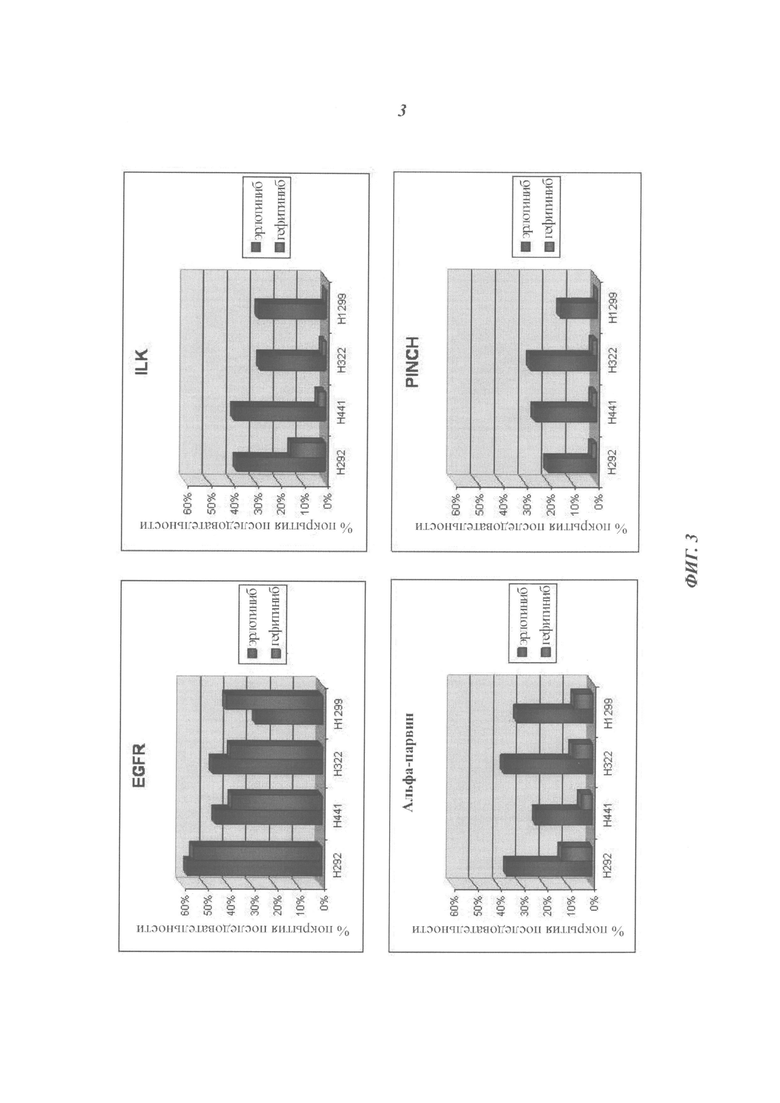
Фигура 3: Профили взаимодействия эрлотиниба гидрохлорида и гефитиниба в различных клеточных линиях НМРЛ. Поскольку относительное количество EGFR было схожим во всех клеточных линиях, на этой фигуре показано удельное обогащение для ILK, альфа-парвина и PINCH во фракциях, связанных с эрлотиниба гидрохлоридом.
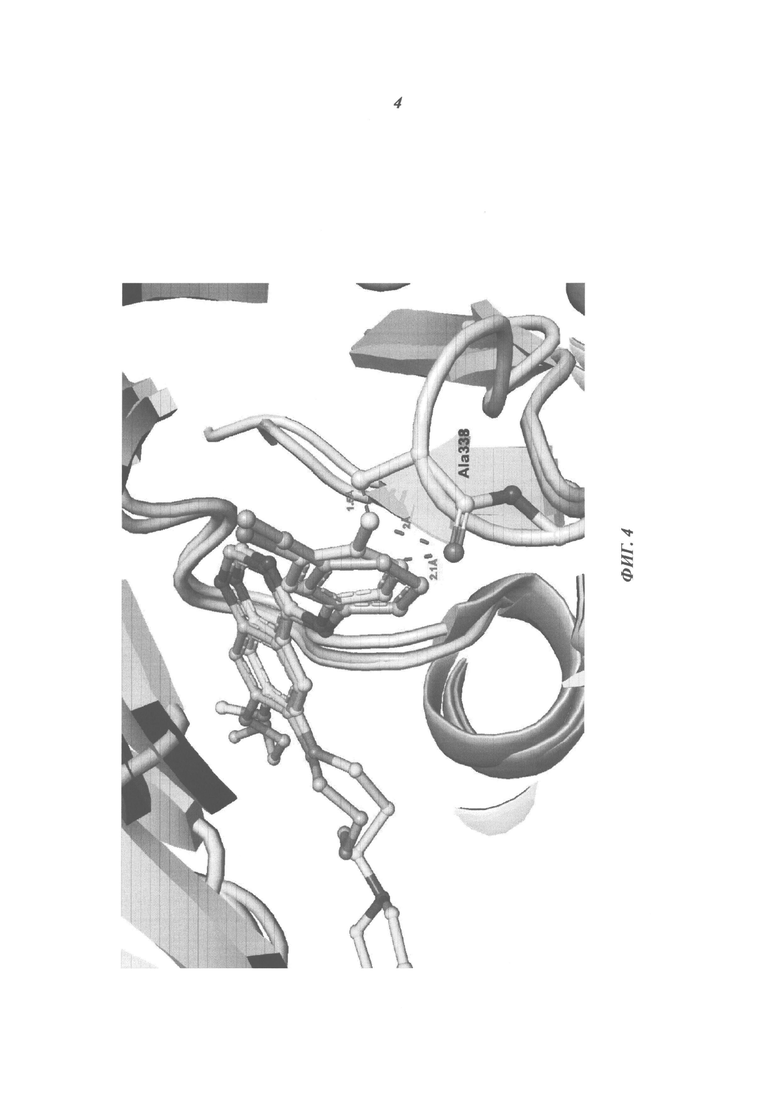
Фигура 4: АТФ-связывающий сайт связывания выровненных и наложенных друг на друга кристаллических структуры белков ILK и EGFR, где контуром показаны возможные взаимодействия эрлотиниба и гефитиниба с областью ILK DFG-петли. Атомы кислорода окрашены в красный, азот - в синий цвет, хлор - в зеленый и фтор - в светло-голубой цвета, атомы углерода комплекса эрлотиниб/EGFR (1М17) окрашены в светло-оранжевый цвет, углерод комплекса гефитиниб/EGFR (2ITY) - в желтый, и атомы углерода ILK окрашены в белый цвет. Изображение было создано с помощью с PyMOL. Заместители в анилиновых кольцах эрлотиниба и гефитиниба различны (положение 3 замещено хлором в молекуле гефитиниба, но ацетиленом в молекуле эрлотиниба, и положении 4 не замещено в молекуле эрлотиниба, но замещено фтором в молекуле гефитиниба). На основании имеющихся различий в расстояниях между атомами можно предположить, что эрлотиниб с большей вероятностью эффективно связывается с АТФ-связывающим сайтом ILK, по сравнению с гефитинибом.
Фигура 5: Эрлотиниб замедляет преобразование клеток Н358, стабилизируя Е-кадгерин. А) Вестерн-блот-анализ Е-кадгерина. Количественные сигналы, В) Е-кадгерина, С) ILK и D) PINCH, нормированные по общему содержанию белка и усредненные для двух отдельных экспериментов.
Фигура 6: Экспрессия IPP в клеточной линии НМРЛ. А) Вестерн-блот-анализ ILK, альфа-парвина, PINCH, Е-кадгерина, виментина и GAPDH на эпителиальных клеточных линиях НМРЛ Н292, Н441, Н358, Н322, и мезенхимальных клеточных линиях Н460, Н1299, Н226 и Calu6, включающих EGFR дикого типа. В) Количественные сигналы Вестерн-блот-анализа, нормированные по уровню GAPDH и усредненные для определения уровня экспрессии комплекса IPP.
Фигура 7: Сравнение уровня экспрессии Е-кадгерина (CDH1) и ILK у пациентов с благоприятным клиническим эффектом с уровнями экспрессии у пациентов без благоприятного клинического эффекта. Каждая точка представляет сигнал для конкретного гена (log2-преобразованный), измеренный в одном образце. Синие и красные точки соответствуют образцам от пациентов благоприятным клиническим эффектом и без благоприятного клинического эффекта, соответственно. (Точечные диаграммы построены с помощью программного обеспечения Partek).
Пример
Далее изобретение будет описано в приведенном ниже примере, который предназначен только для иллюстрации и не ограничивает объем настоящего изобретения.
Клеточная культура
Клетки Н292 поддерживали в среде RPMI 1640 (Gibco-31870) с добавлением 10% ЭБС и пенициллина/стрептомицина/глутамина. Осадок 1·108 клеток Н292 лизировали в 2,5 мл буфера (150 мМ NaCl (хлорид натрия), 1 мМ CaCl2 (хлорид кальция), MgC12 (дихлорид магния), 1% NP40 (нонил феноксиполиэтоксиоэтанол), полные протеазные ингибиторы, лишенные ЭДТА
(этилендиаминтетрауксусная кислота), 1 мМ ортованадат и 50 мМ Hepes). Через 10 минут инкубации на льду лизаты очищали центрифугированием в течение 15 минут при 12000×g при 4°C.
Синтез соединений и иммобилизация
Эрлотиниба гидрохлорид и гефитиниб были химически модифицированы для ковалентного связывания с эпоксиактивированными сефарозными гранулами 6В (GE Healthcare). Связывание производных с эпоксиактивированной сефарозой 6В проводили в 50%-диметилформамиде (ДМФ)/0,1 М карбонат натрия (Na2CO3), pH 11 в присутствии 10 мМ гидроксида натрия (NaOH) в течение ночи при комнатной температуре в темноте. После 3 промывок 50% диметилформамидом (ДМФ)/0,1 М карбонат натрия (Na2CO3), оставшиеся реакционноспособные группы блокировали с помощью 1 М этаноламина. Последующие стадии промывания проводили в соответствии с инструкциями производителя. Эффективность связывания оценивалась путем сравнения оптических плотностей растворов соединений до и после связывания при максимальных длинах волн поглощения 247 и 330 нм.
Анализ конкуренции и аффинная хроматография
500 мкг соответствующих белков предварительно инкубировали с возрастающими концентрациями (0, 0,0856, 0,2862, 0,957, 3,2, 10,7, 35,78, 119,6 и конечной концентрации 400 мкМ) либо эрлотиниба гидрохлорида, либо гефитиниба в течение 1 часа при 4°C при вращении. Затем образцы перемешивали с уравновешенной эпоксиактивированной сефарозой с иммобилизованными гидрохлорида эрлотинибом или гефитинибом в течение 3 часов при 4°C при вращении. Затем гранулы промывали три раза с помощью буфера для лизиса и в заключение ресуспендировали в 100 мкл буфера для нанесения с ДСН, кипятили 5 минут при 85°C и центрифугировали 5 минут при 12000×g.
ДСН-ПААГ
Элюированные образцы разделяли с помощью 4-20% Трис-Глицин ДСН-ПААГ (Invitrogen, ЕС6025ВОХ). Гели фиксировали 1 час в 40%-ном этаноле с 10% уксусной кислотой и окрашивали в течение ночи с использованием Кумасси синего (Invitrogen LC6025).
Масс-спектрометрия
Для гидролитического расщепления в геле использовали модифицированный протокол Шевченко и соавторов (Shevchenko et al., 1996). Кратко, каждую дорожку геля разрезали на 9 кусочков и наносили на 96-луночные планшеты Proxeon. Кусочки гелей последовательно промывали водой MilliQ и ацетонитрилом, восстанавливали в дитиотреитоле и алкилировали с помощью иодацетамида. После тщательной промывки, кусочки инкубировали с 50 нг трипсина (Promega, V5111) и оставляли расщепляться в течение ночи. Собирали супернатанты гидролизатов, и пептиды экстрагировали из кусочков геля с помощью одной смены 25 мМ бикарбоната аммония, с последующими двумя сменами 5% муравьиной кислоты. Все супернатанты собирали, сушили и ресуспендировали в 2% ацетонитрила, 5% муравьиной кислоты и анализировали с помощью ЖХ-МС/МС с использованием нанопоточного жидкостного хроматографа (Proxeon EASY-nLC), соединенного с масс-спектрометром с ионной ловушкой электрораспылением (Velos LTQ-Orbitrap, Thermo Scientific). Разделение пептидов осуществляли на колонке ReproSil-PUR C18-AQUA 3 мкм, соединенной с AQUA 100 мкс улавливающей колонкой при градиенте ацетонитрила в течение 60 минут.
Идентификация последовательностей
Файлы исходных данных были обработаны с использованием алгоритма поиска SEQUEST 27 (SEQUEST версии 27.0, обновление 12, Thermo Electron). Поиск проводили против базы данных последовательностей человека SwissProt Human database (версия 48, 219024 записей) с допустимой массой +/-10 м.д. родительских ионов и +/-1,0 Да для фрагментарных ионов. Метионины (восстановленные/окисленные; +159949 Да) рассматривали как различающиеся модификации, тогда как цистеин рассматривали как полностью карбамидометилированный (+580133 Да). Только полностью триптические пептиды не более чем с один негидролизованным сайтом учитывали при анализе данных. Пептиды считали идентифицированными однозначно, если их оценки XCorr превышали 2,0, 2,5 или 3,0 для одно-, двух- и триждызаряженных ионов, соответственно, и если соответствующие показатели dCn были больше, чем 0,1. В этом отчете были для дальнейшей обработке с целью количественной оценки брали только белки, для которых были определены по меньшей мере два различных пептида.
Обработка данных масс-спектрометрического анализа с помощью Genedata RefinerMS 5.2.
Для каждого соединения и каждой полосы независимо загружали соответствующие исходные файлы Thermo с помощью Genedata RefinerMS 5.2.6. Центроидные данные отбрасывали для экономии памяти. Сигналы, происходящие только в одном спектре, удаляли, все представленные данные для образцов (= хроматограммы) приведены в виде стандартной сетки 2D m/z-RT. Перед выравниванием хроматограмм, которое основывается на соответствующих параметрах поиска пика, параметры поиска оценивали визуально. Выравнивание хроматограммы корректирует сдвиги времени удерживания между хроматограммами, на основании найденных общих пиков и алгоритма тривиального дерева (Trivial Tree Algorithm). Правильность этой операции оценивали визуально. Ограничение диапазона RT (RT Range Restriction) отбрасывает сигналы и данных вне информативной области, составляющей 23-52 мин хроматографии. The Функция усреднения хроматограмм (Chromatogram Average activity) вычисляет виртуальную среднюю хроматограмму для всех вводимых хроматограмм. Уровень шума уменьшается с помощью этапа «порога интенсивности» (Intensity Threshold), устраняющего каждый сигнал ниже порогового значения в 1000 о.е.. Находили пики и их границы в направлении RT и м/Z, и визуализировали в виде окружающих пик квадратов. Квадраты проецировали на каждую хроматограмму и определяли счет извлеченных ионов (XIC, extracted Ion Counts) в пределах этих границ. Полученную развернутую таблицу с одной строкой на пике и одним столбцом на хроматограмму сохраняли как файл на следующем этапе обработки данных. Изображения МС/МС от ScanID в пределах указанных границ сигнала сохраняли таким же образом. Создавали отчет, в котором суммированы этапы процесса обработки, их параметры упорядочения, а также диагностические данные (например, степень локального хроматографического сдвиг на образец, количество найденных сигналов).
Дальнейшая обработка
Соответствующие образцы для каждого соединения и каждой полосы независимо были нормализованы с использованием квантильного подхода (Smyth 2003). Пики, обнаруженные в RefinerMS, были приписаны к информации о последовательностях через их ScanID в соответствующем измерении. Пики без идентификации или с более неоднозначной идентификацией исключали. Количественную информацию преобразовывали с помощью log2. Для контроля процессом (Process Control) количественные данные подвергали анализу методом главных компонентов: Показатели первых 4 главных компонентов коррелировали с концентрацией соединения и параметрами процесса, такими как номер дорожки в геле, ID партии ЖХ-МС или номер прогона ЖХ-МС. Значения, отклоняющиеся от расстояния Махаланобиса, определяли на основе оценки первых двух главных компонентов, образцы за пределами 95% доверительный интервал принимали за выбросы и удаляли из дальнейшего анализа.
Объединение интенсивностей пептидов с белком-суррогатом
Пептиды соотносили с их потенциальными белками-предшественниками. Каждую найденную комбинацию белков-предшественников относили в отдельную группу для количественной оценки белка, обычно только с одним белком или белком и его сплайсированными вариантами. Согласно Иризарри с соавторами (Irizarry et al. 2003), относительное содержание для каждой группы количественно определяемого белка рассчитывали из нормированных и логарифмически преобразованных счетов извлеченных ионов (XIC) согласно линейной аддитивной модели:
XICijn=µin+αjn+εijn, где αjn - эффект пептида, µi - относительное количество группы количественно определяемого белка по логарифмической шкале, и εij представляет собой независимые одинаково распределенные остаточные члены со средним значением 0. Как описано в работах Иризарри с соавторами (Irizarry et al. 2003) и Холдера с соавторами (Holder et al. 2001), используется медианный фильтр для надежной оценки параметров модели.
Обнаружение значимых зависимостей доза-ответ
Матрица контрастов Хиротсу (Hirotsu contras matrix) получена на основе числовых концентраций соединения (см. Bretz et al. 2001), первый и последний контрасты исключали. Модерируемую Т-статистику TSC получали для каждого контраста и группы количественно определяемого белка (см. Smyth et al. 2004). Для каждой группы количественно определяемого белка получали значения ТМС=max (TSC) (см. Bretz et al. 2001). Р-значения получали на основе алгоритма для понижающихся МахТ-скорректированных р-значений с 1000 перестановками согласно методике Ге с соавторами (Ge et al. 2003), взятой из работы Вестфолла и Янга (Westfall and Young, 1993). Методика модифицирована изменение с учетом односторонности статистики путем выбора не |Т|, а Т.
Визуализацию и все вычислительные операции осуществляли с использованием языка программирования R 2.10.1 (цит. «R»).
Подтверждение профилей связывания в других линиях клеток НМРЛ
Линии клеток Н292, Н441, Н460 и Н1299 клетки поддерживали в среде RPMI 1640, с добавлением 10% фетальной бычьей сывороткой и 2 ммоль/л L-глутамина. Синтез соединения, иммобилизацию и аффинную хроматографию проводили, как описано выше. Масс-спектрометрический анализ проводили на ЖХ-системе (LC-Packings), соединенной с прибором Thermo Finnigan LCQ Deca XP. Вкратце, пептидные экстракты (в 5% ацетонитриле, 0,5% уксусной кислоты, 0,012% ГФМК (гептафтормасляной кислоты) с 1% муравьиной кислоты) инъецировали в улавливающую колонку (РерМар™ С18, 5 мкм (LC-Packings), 5 мм × 300 мкм в.д..) при 20 мкл/мин. Впоследствии, пептиды переносили в растворитель A (5% ацетонитрил, 0,5% уксусная кислота, 0,012% ГФМК) на аналитическую колонку (Magic С18™ 5 мкм (Spectronex), 10 см × 75 мкм в.д.). Элюирование проводили с 3-этапным линейным градиентом от 5 до 15% растворителя В (0,5% уксусная кислота, 0,012% ГФМК в 80% (об./об.) ацетонитриле) в течение 8 мин, от 15 до 38% растворителя B в течение 65 мин и от 38 до 80% растворителя В в течение 25 мин. Элюат с колонки непосредственно введен в ESI-источник (электрораспылительный ионизатор) масс-спектрометра. Масс-спектрометр работал в режиме положительных ионов, и родительские ионы были выбраны для фрагментации в зависимом от данных режиме. Осуществляли поиск среди исходных данных по МС/МС в сравнении с базой данных SwissProt последовательностей человека с использованием SEQUEST (версия 27). Параметры допускали один пропущенный сайт расщепления и пептид, допустимая масса 1,5 Да.
Использовали Н358, модельную линию клеток, которая была описана ранее как линия, переходящая из эпителиального в мезенхимальное состояние (эпителиально-мезенхимальный переход, ЭМП) при обработке TGFbeta3 (Thomson, 2008). Было показано уменьшение уровня Е-кадгерина после 13 дней обработки TGFbeta3, что свидетельствует о том, что переход клеток в действительности произошел (Фиг 5а). Уровень Е-кадгерина в клетках Н358, обработанных TGFbeta3 и эрлотинибом, оставался неизменным, в отличие от клеток, обработанных TGFbeta3 и гефитинибом. Количественное определение сигналов Вестерн-блота показало снижение более чем на 1/3 уровня Е-кадгерина (Фиг.6, б) у клеток, обработанных в течение 13 дней с TGFbeta3, по сравнению с не обработанными клетками. Обработка эрлотинибом предотвращает это снижение, тогда как гефитиниба не может ингибировать TGFb3-опосредованное уменьшение уровня Е-кадгерина (Фиг.5б). Анализ влияния на экспрессию ILK и PINCH показал, что уровни обоих белков увеличиваются после обработки TGFb3 (Фиг.5, г). Уровни экспрессии ILK и PINCH не изменяются при обработке клеток эрлотинибом, при этом этот эффект не был настолько выраженным при обработке гефитинибом. Модель ЭМП, таким образом, показывает, что эрлотиниб снижает степень ЭМП путем ингибирования снижения уровня Е-кадгерина и свидетельствует о возможности предотвращения TGFb3-опосредованного увеличения ILK и PINCH.
Три компонента комплекса ILK, альфа-парвин и PINCH, изучали в отдельности, не рассматривая возможности того, что экспрессия всего комплекса коррелирует с ЭМП-статусом. Восемь линий клеток НМРЛ с EGFR дикого типа были выбраны на основании ЭМП-статуса (Thomson 2005; Thomson 2008), которое оценивали по экспрессии Е-кадгерина как эпителиального маркера и виментина как мезенхимальные маркера. Все белки IPP были обнаружены с различными интенсивностями во всех восьми клеточных линиях, за исключением альфа-парвина в Н358 (Фиг.6а). После количественной оценки и нормализации, общая сумма интенсивностей комплекса IPP оказалась в 1,8 раз выше в мезенхимальных клетках, в сравнении с эпителиальными клетками. Наибольший уровень экспрессии был показан для белка PINCH1 (56% и 58% от общего уровня экспрессии IPP в эпителиальных и мезенхимальных клетках, соответственно), за которым следует ILK (25% и 22%) альфа-парвин (19% и 20%) (Фиг.6b).
Экспрессия Е-кадгерина и ILK
Оценивали возможную связь между IPP и более общими генами, вовлеченными в ЭМП. В частности, различия в профилях их экспрессии у пациентов с благоприятным клиническим эффектом и без него. В общей сложности, только 16 из 21 предварительно выбранных генов были идентифицированы с помощью наборов зондов для детекции и проанализировали статистически. Среди 31 наборов зондов (соответствующих 16 уникальным генам), два выявили статистически значимую дифференциальную экспрессию в опухолевых образцах от пациентов с благоприятным клиническим эффектом и без него. Им соответствовали два гена - ILK и CDH1 (Е-кадгерина), которые подавлялись (0,93-кратно, p=0,011) и активировались (1,38-кратно, p=0,033), соответственно, у пациентов с благоприятным клиническим эффектом.
Выравнивание кристаллических структуры белков EGFR и ILK
Из базы данных по кристаллографии PDB (Berman 2000) были загружены общедоступные pdb-файлы с информацией о кристаллической структуре связанного с EGFR эрлотиниба или гефитиниба и кристаллической структуры комплекса ILK с аденозинтрифосфатом (АТФ) (коды pdb 1М17, 2ITY, 3KMW; Stamos 2002; Yun 2007; Fukuda 2009). Три структуры киназ выравнивали с использованием координат Сα-атомов из подмножества остатков, образующих АТФ-связывающий сайт (номера остатков согласно нумерации EGFR 691-693, 701-703, 719-72 (19) 1, 751, 766-772, 820-823, 831-832). Выравнивание и измерение расстояний проводили с помощью пакета визуализации PyMOL.
Анализ ЭМ-перехода на Н358 клеточной линии НМРЛ
Клетки Н358 обрабатывали рекомбинантным TFGβ3 в концентрации 10 нг/мл (Peprotech, New York, NY, USA) и 5 мкМ эрлотинибом или гефитинибом в течение 3, 6, 10 и 13 дней. Культуральную среду обновляли каждые 3 дня. Лизис клеток проводили в ФСБ, содержащем 1% NP-40 и ингибиторы протеазы. После очистки путем центрифугирования при 12000 g в течение 15 мин при 4°C белки разделяли электрофорезом в ДСН-ПААГ, и проводили Вестерн-блот-анализ. Изображения получали с помощью компактной цифровой камеры (Luminescent Image Analyzer: Fujifilm, Tokyo, Japan) и проводили количественную оценку с помощью ImageQuant TL (GE Healthcare, Waukesha, WI, USA).
Анализ данных MERIT
Профили экспрессии генов измерены в биоптатах опухоли из 102 пациентов со стадиями заболевания IIIb/IV НМРЛ, получавших лечение эрлотинибом (150 мг/день). Биоптаты опухолей анализировались с помощью определения профиля экспрессии генов с использованием микрочипа для генома человека Affymetrix GeneChip Human Genome U133A 2.0 (Affymetrix, Santa Clara, CA, USA). Все данные по экспрессии генов, описанные в настоящей заявке, (кратность изменения и р-значения) взяты из уже опубликованного статистического анализа (Tan 2010). Мы специально обратили внимание на различия между профилями экспрессии генов пациентов с благоприятным клиническим эффектом и без него. Следующие 21 белков, которые потенциально участвуют в регуляции ЭМП на уровне транскрипции или в комплексе-IPP, были сопоставлены с соответствующими генами и наборами зондов для микрочипов: Twist, Snail [Sma1], Zeb [TCF8], Lef-1, E12/E47 basic Loop helix [bHLH], Slug [Sma2], Е-кадгерин [CDH1], N-кадгерин [CDH2], Мус, виментин, катенин-бета, катенин-дельта, фибронектин, эпиморфин, integrin-linked kinase [ILK], парвин-альфа, парвин-бета, PINCH 1, PINCH 2, Metastasis associated protein 3 [МТА3] (ассоциированный с метастазами белок 3), Y box-связывающий белок 1 [YB-1].
Ссылки
Shevchenko, A.; Wilm, М.; Vorm, О.; Mann, М. Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels. Anal Chem 1996; 68, 850-58.
Smyth, G.K., and Speed, T.P. (2003). Normalization of cDNA microarray data. Methods 31, p265-273.
Smyth, G.K., Michaud, J., and Scott, H. (2005). The use of within-array replicate spots for assessing dierential expression in microarray experiments. Bioinformatics 21 (9), 2067-2075.
Irizarry RA, Hobbs B, Collin F, Beazer-Barclay YD, Antonellis KJ, Scherf U, Speed TP. (2003) Exploration, normalization, and summaries of high density oligonucleotide array probe level data. Biostatistics Apr; 4 (2): 249-64.
Holder, D, Raubertas, RF, Pikounis, VB, Svetnik, V and Soper, K (2001). Statistical analysis of high density oligonucleotide arrays: a SAFER approach. Proceedings of the ASA Annual Meeting 2001. Atlanta, GA.
Bretz F, Hothorn LA. (2001) Testing dose-response relationships with a priori unknown, possibly nonmonotone shapes. J Biopharm Stat. 11 (3): 193-207.
Smyth GK. (2004) Linear models and empirical bayes methods for assessing differential expression in microarray experiments. Stat Appl Genet Mol Biol.; 3: Article 3. Epub 2004 Feb 12.
Bretz F, Hothorn LA. (2002) Detecting dose-response using contrasts: asymptotic power and sample size determination for binomial data. Stat Med. 2002 21 (22): 3325-35.
P.H. Westfall and S.S. Young (1993). Resampling-based multiple testing: Examples and methods for p-value adjustment. John Wiley & Sons, Algorithm 4.1, p116-117.
R Development Core Team (2009). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, URL http://www.R-project.org.
Ge, Y. et al. (2003) Resampling-based multiple testing for microarray data analysis, Test, 12 (1), 1-77.
Thomson et al.; 2005; Cancer Res.; 65; 9455-9462.
Takanami, I.; 2005; BMC Cancer; 5; 1-7.
Berman, H.M., Westbrook, J., Feng, Z., Gilliland, G., Bhat, T.N., Weissig, H., Shindyalov, I.N., and Bourne, P.E. (2000) The Protein Data Bank. pp.235-242.
Stamos, J., Sliwkowski, M.X., and Eigenbrot, C. (2002) Structure of the epidermal growth factor receptor kinase domain alone and in complex with a 4-anilinoquinazoline inhibitor. J Biol Chem 277, 46265-46272.
Yun, С.H., Boggon, T.J., Li, Y., Woo, M.S., Greulich, H., Meyerson, M., and Eck, M.J. (2007) Structures of lung cancer-derived EGFR mutants and inhibitor complexes: mechanism of activation and insights into differential inhibitor sensitivity. Cancer Cell 11, 217-227.
Fukuda, K., Gupta, S., Chen, K., Wu, C, and Qin, J. (2009) The pseudoactive site of ILK is essential for its binding to alpha-Parvin and localization to focal adhesions. Mol Cell 36, 819-830.
Tan, E.H., Ramlau, R., Pluzanska, A., Kuo, H.P., Reck, M., Milanowski, J., Au, J.S., Felip, E., Yang, P.C, Damyanov, D., Orlov, S., Akimov, M., Delmar, P., Essioux, L., Hillenbach, C, Klughammer, В., McLoughlin, P., and Baselga, J. (2010) A multicentre phase II gene expression profiling study of putative relationships between tumour biomarkers and clinical response with erlotinib in non-small-cell lung cancer. Ann Oncol 21, 217-222.
Yauch, R.L., Januario, Т., Eberhard, D.A., Cavet, G., Zhu, W., Fu, L., Pham, T.Q., Soriano, R., Stinson, J., Seshagiri, S., Modrusan, Z., Lin, C.Y., O'Neill, V., and Amler, L.C. (2005) Epithelial versus mesenchymal phenotype determines in vitro sensitivity and predicts clinical activity of erlotinib in lung cancer patients. Clin Cancer Res 11, 8686-8698.
Cabodi, S., Del Pilar Camacho-Leal, M., Di Stefano, P., and Defilippi, P. (2010) Integrin signalling adaptors: not only figurants in the cancer story. Nat Rev Cancer 10, 858-870.
Thomson, S., Buck, E., Petti, F., Griffin, G., Brown, E., Ramnarine, N., Iwata, K.K., Gibson, N., and Haley, J.D. (2005) Epithelial to mesenchymal transition is a determinant of sensitivity of non-small-cell lung carcinoma cell lines and xenografts to epidermal growth factor receptor inhibition. Cancer Res 65, 9455-9462.
Thomson, S., Petti, F., Sujka-Kwok, I., Epstein, D., and Haley, J.D. (2008) Kinase switching in mesenchymal-like non-small cell lung cancer lines contributes to EGFR inhibitor resistance through pathway redundancy. Clin Exp Metastasis 25, 843-854.
Singh, A., and Settleman, J. (2010) EMT, cancer stem cells and drug resistance: an emerging axis of evil in the war on cancer. Oncogene 29, 4741-4751.
Oloumi, A., McPhee, Т., and Dedhar, S. (2004) Regulation of E-cadherin expression and beta-catenin/Tcf transcriptional activity by the integrin-linked kinase. Biochim Biophys Acta 1691, 1-15.










Предложенная группа изобретений относится к области медицины. Предложен способ прогнозирования реакции пациента, больного немелкоклеточным раком легкого (НМРЛ), на лечение эрлотиниба гидрохлоридом, включающий определение уровня экспрессии гена ILK в образце опухоли пациента и сравнение уровней экспрессии гена ILK со значением экспрессии гена ILK в опухолях популяции пациентов, на которых указанное лечение не произвело благоприятного клинического эффекта, и в образце опухоли пациента, если уровень экспрессии гена ILK в 0,93 раза меньше, то лечение будет производить благоприятный клинический эффект на такого пациента, который не реагирует на лечение гефитинибом. Предложено применение гена ILK для прогнозирования реакции пациентов, больных НМРЛ, на лечение эрлотиниба гидрохлоридом и применение эрлотиниба гидрохлорида для лечения НМРЛ. Предложенная группа изобретений обеспечивает эффективное прогнозирование реакции пациента на лечение эрлотиниба гидрохлоридом. 3 н. и 1 з.п. ф-лы, 7 ил., 1 пр.
1. Способ прогнозирования реакции пациента, больного немелкоклеточным раком легкого (НМРЛ), на лечение эрлотиниба гидрохлоридом, включающий:
определение уровня экспрессии гена ILK в образце опухоли пациента и сравнение уровней экспрессии гена ILK со значением, типичным для уровней экспрессии гена ILK в опухолях популяции пациентов, на которых указанное лечение не произвело благоприятного клинического эффекта, при этом более низкий уровень экспрессии гена ILK в 0,93 раза меньше в образце опухоли пациента указывает на то, что указанное лечение будет производить благоприятный клинический эффект на такого пациента, который не реагирует на лечение гефитинибом.
2. Способ по п. 1, в котором уровень экспрессии определяют с помощью технологии микрочипов.
3. Применение гена ILK для прогнозирования реакции пациентов, больных немелкоклеточным раком легкого, на лечение эрлотиниба гидрохлоридом, где пациенты, больные раком, не реагируют на лечение гефитинибом.
4. Применение эрлотиниба гидрохлорида для лечения немелкоклеточного рака легкого, в котором
I) оценивают уровень активации белка ILK в образце опухоли пациента,
II) сравнивают уровень экспрессии РНК гена ILK со значением, типичным для уровня экспрессии гена ILK в опухолях популяции пациентов, на которых указанное лечение не произвело благоприятного клинического эффекта, и
III) вводят эрлотиниба гидрохлорид пациенту, имеющему более низкий уровень экспрессии гена ILK в 0,93 раза меньше, и
где пациент, больной раком, не реагирует на лечение гефитинибом.
| FUCHS B.C | |||
| et al | |||
| Epithelial-to-mesenchymal transition and integrin-linked kinase mediate sensitivity to epidermal growth factor receptor inhibition in human hepatoma cells | |||
| Cancer Res | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Способ получения смеси хлоргидратов опийных алкалоидов (пантопона) из опийных вытяжек с любым содержанием морфия | 1921 |
|
SU68A1 |
| US 2006211060 A1, | |||
Авторы
Даты
2016-10-27—Публикация
2011-10-12—Подача