Область техники
Изобретение относится к способам прогнозирования развития резистентности к терапии рака на основе ингибитора EGFR. Кроме того, изобретение относится к способам выбора подходящих для пациентов схем лечения рака и к способам лечения раковых заболеваний, резистентных к конкретному лекарственному средству, а также к продуктам для применения в таких способах. В частности, изобретение относится к способам и продуктам для прогнозирования развития резистентности к терапии рака ингибиторами EGFR и к способам и продуктам для лечения такого резистентного к лекарственному средству рака с применением комбинации ингибитора EGFR и ингибитора MEK.
Предшествующий уровень техники
Рецептор эпидермального фактора роста (EGFR) был идентифицирован в качестве мишени при лечении ряда раковых заболеваний, в частности, солидных опухолей, так как он участвует в регулировании клеточных функций, важных для пролиферации и выживания раковых клеток. Повышенную экспрессию EGFR установили при раке мочевого пузыря, молочной железы, глиобластомы, головы и шеи, легких и желудка. Развитие рака можно, например, ассоциировать с активирующей мутацией в EGFR, и высокую экспрессию EGFR часто связывают с неблагоприятным прогнозом.
Активирующие рак мутации в EGFR часто представляют собой соматические мутации с приобретением функции (gain-of-function mutations) в экзонах, которые кодируют тирозинкиназный домен рецептора. Примеры таких мутаций, идентифицированных в аденокарциномах легких у пациентов с немелкоклеточным раком легких (НМРЛ), включают мультинуклеотидные делеции внутри рамки считывания в экзоне 19 (вовлекающие элиминацию четырех аминокислот, Leu-Arg-Glu-Ala) и замену одного нуклеотида в нуклеотиде 2573 (Т→G) в экзоне 21, имеющую результатом замену аргинина на лейцин в положении 858 (L858R). Обнаружено, что эти мутации повышают чувствительность к тирозинкиназным ингибиторам EGFR (TKI). Следовательно, терапии первой линии целенаправленного воздействия на EGFR часто основаны на ингибировании тирозинкиназной активности мутантного рецептора.
Известные терапии первой линии для пациентов с активирующей мутацией в EGFR включают применение TKI EGFR, таких как гефитиниб (Iressa™), эрлотиниб (Tarceva™) и афатиниб (Gilotrif™). Однако, несмотря на первоначальную восприимчивость к этим TKI EGFR, значительная доля пациентов в конце концов показывает прогрессирование заболевания вследствие приобретенной резистентности, которая, как было показано, во многих случаях ассоциируется с дополнительной мутацией в EGFR, такой как Т790М.
Приобретенная резистентность привела к разработке дополнительных TKI, таких как AZD9291, СО-1686 и WZ4002, которые ингибируют рецепторы EGFR, имеющие активирующие мутации в тирозинкиназном домене, такие как мутации экзона 19del и L858R, а также мутацию Т790М в доклинических моделях. Однако вызывает озабоченность то, что опухоли могут в конце концов также развивать резистентность к этим лекарственным средствам, ограничивая их долгосрочную эффективность у пациентов.
Таким образом, существует необходимость определить механизмы, лежащие в основе приобретенной резистентности к ингибиторам EGFR при терапии рака, и попытаться предложить новые препараты, которые могут преодолевать эти дополнительные механизмы резистентности.
Краткое изложение сущности изобретения
На основе лабораторных экспериментов с популяциями раковых клеток, авторы настоящего изобретения обнаружили, что резистентность к терапии рака ингибиторами EGFR у некоторых пациентов может быть ассоциирована с генетическими аномалиями вирусного онкогена RAS нейробластомы, гомологичного гену (NRAS), который кодирует белок-гомолог (NRAS) вирусного онкогена RAS нейробластомы, обнаруживаемыми по некоторым мутациям, имеющим результатом замену в кодоне в кодированном белке, или по росту копийности гена NRAS. Согласно одному аспекту настоящего изобретения резистентность к терапия рака ингибитором EGFR может быть ассоциирована с мутацией E63K NRAS и/или с мутацией G12V NRAS.
Белок NRAS активирует путь Ras, Raf, MAP протеинкиназа/регулируемая внеклеточными сигналами киназа-киназа (MEK), регулируемая внеклеточными сигналами киназа (ERK) (путь Ras/Raf/MEK/ERK) в клетках. Этот путь исходит от рецептора EGFR и играет центральную роль в регулировании ряда клеточных функций, зависящих от клеточного контекста, включая клеточную пролиферацию, дифференциацию, выживание, иммортализацию, инвазию и ангиогенез (рассматривается в Peyssonnaux and Eychene, Biology of the Cell, 2001, 93:3-62). Действительно, Ras-зависимый Raf-MEK-MAPK каскад является одним из ключевых сигнальных путей, отвечающих за последовательную передачу как митогенных, так и инвазивных сигналов с клеточной поверхности в ядро, имея результатом изменения экспрессии гена и судьбы клетки.
Ряд мутаций NRAS ранее был идентифицирован как имеющий место при некоторых раковых заболеваниях. Однако мутация E63K не была ранее описана, и мутации E63K/G12V по настоящему изобретению ранее не были ассоциированы с резистентностью к ингибированию EGFR при терапии рака легких.
Без ограничения какой-либо теорией, полагают, что у клеток, зависимых от пути EGFR, ингибирование этого пути также ингибирует (нисходящий) Ras/Raf/MEK/ERK путь. Однако клетки, которые длительно обрабатывали ингибитором EGFR, находят альтернативный механизм для обхода ингибирования EGFR, (например посредством активирующей мутации в NRAS), который дает возможность клеткам выживать в отсутствие сигналов EGFR, и таким образом, допускает развитие заболевания у пациента.
При обнаружении одной или более присутствующих мутаций NRAS у пациента (или, более конкретно, обнаружения значимой(ых) мутации(й) в образце подходящей ткани или крови, взятом у пациента), существует возможность идентифицировать пациентов, у которых развился или у которых прогнозируется развитие формы рака, который является резистентным к терапии ингибитором EGFR.
Авторами изобретения дополнительно было обнаружено, что клетки, у которых развилась резистентность к ингибитору EGFR на основе мутации NRAS, описанной здесь, неожиданно демонстрируют повышенную чувствительность к ингибитору MEK (который ингибирует путь Ras/Raf/MEK/ERK) по сравнению как с родительской клеточной линией (чувствительной к ингибитору EGFR и NRAS дикого типа), так и по сравнению с клеточными линиями, резистентными к ингибитору EGFR, которые представляют собой NRAS дикого типа. Неожиданно оказывается, что эта повышенная чувствительность зависит от сохранения ингибирования EGFR в комбинации с ингибированием MEK. Без ограничения какой-либо теорией, полагают, что EGFR-мутантные клетки могут возвращаться к сигналам EGFR в отсутствие длительного ингибирования ингибитором EGFR, так что клетки являются более не чувствительными к ингибированию MEK.
Раковые пациенты, резистентные к ингибитору EGFR, имеющие мутацию NRAS в раковых клетках своего заболевания, как описано здесь, могут таким образом получать пользу от лечения с применением комбинации ингибитора EGFR и ингибитора MEK. Таким образом, комбинация ингибитора EGFR и ингибитора MEK обеспечивать эффективную ступенчатую (например, вторую + линии) терапию у раковых пациентов, которые уже получили или получают терапии с ингибированием EGFR.
Комбинация ингибитора EGFR и ингибитора MEK также может обеспечивать эффективную терапию первой линии против ассоциированного с EGFR рака даже у пациентов, которых еще не лечили ингибитором EGFR. У таких пациентов комбинированное лечение может отсрочить или предупредить развитие резистентности на основе активации NRAS (и пути Ras/Raf/MEK/ERK).
Более конкретно, авторы настоящего изобретения определили, что каждая из резистентных к ингибитору EGFR клеточных популяций, содержащих мутации E63K, G12V и G12R NRAS, демонстрирует чувствительность к лечению ингибитором MEK в комбинации с ингибитором EGFR. Как понятно специалисту и более подробно объясняется ниже, вовлечение G12V и G12R предполагает, что любая однонаправленная мутация в положениях 288 или 289 в гене NRAS может в результате привести к чувствительности к ингибитору MEK в комбинации с ингибитором EGFR. Таким образом, специалисту будет понятно, что однонаправленные мутации, выявляемые в положениях 288 или 289 гена NRAS (например, из кДНК), соответствуют мутациям G12A, G12D, G12S и G12C в белке NRAS в дополнение к мутациям G12V и G12R белка NRAS, что описано посредством эксперимента в дальнейшем. Таким образом, в одном аспекте изобретения предложены способы лечения резистентного к ингибитору EGFR рака, вовлекающего присутствие/обнаружение любой из вышеупомянутых мутаций, где лечение включает лечение ингибитором MEK в комбинации с ингибитором EGFR.
Таким образом, в одном аспекте изобретения предложен способ отбора ракового пациента, подходящего для лечения комбинацией ингибитора EGFR и ингибитора MEK, включающий:
а) тестирование ракового пациента для определения наличия мутации NRAS; и
б) отбор пациента как подходящего для лечения комбинацией ингибитора EGFR и ингибитора MEK, если присутствует мутация NRAS;
где мутация NRAS выбрана из группы, состоящей из: E63K, G12V, G12R, G12A, G12D, G12S и G12C.
В одном воплощении NRAS мутация выбрана из E63K, G12V и G12R.
В одном воплощении NRAS мутация выбрана из G12V, G12R, G12A, G12D, G12S и G12C.
В одном воплощении NRAS мутация выбрана из G12R, G12A, G12D, G12S и G12C.
В одном воплощении NRAS мутация выбрана из G12V и G12R.
В одном воплощении NRAS мутация представляет собой G12R.
В одном воплощении ингибитор EGFR выбран из AZD9291 и CO1686 или фармацевтически приемлемой соли любого из них.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или CO1686, или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемая соль.
В одном аспекте изобретения предложен способ отбора ракового пациента, подходящего для лечения комбинацией ингибитора EGFR и ингибитора MEK, включающий:
а) тестирование ракового пациента для определения наличия NRAS активирующей мутации; и
б) отбор пациента как подходящего для лечения комбинацией ингибитора EGFR и ингибитора MEK, если присутствует активирующая мутация NRAS;
где активирующая мутация NRAS выбрана из группы, состоящей: мутации E63K NRAS; и мутации NRAS G12V.
В еще одном аспекте изобретения предложен способ отбора ракового пациента, подходящего для лечения комбинацией ингибитора EGFR и ингибитора MEK, включающий:
а) тестирование ракового пациента для определения наличия роста копийности NRAS; и
б) отбор пациента как подходящего для лечения комбинацией ингибитора EGFR и ингибитора MEK, если присутствует рост копийности NRAS.
В еще одном аспекте изобретения предложен способ выбора подходящей схемы лечения рака у ракового пациента, включающий:
а) определение наличия мутации NRAS у пациента; и
б) выбор схемы лечения рака у пациента, включающей предоставление комбинации ингибитора EGFR и ингибитора MEK, если присутствует мутация NRAS;
где мутация NRAS выбрана из группы, состоящей из: E63K, G12V, G12R, G12A, G12D, G12S и G12C.
В одном воплощении мутация NRAS выбрана из E63K, G12V и G12R.
В одном воплощении мутация NRAS выбрана из G12R, G12A, G12D, C12S и G12C.
В одном воплощении мутация NRAS выбрана из G12V, G12R, G12A, G12D, G12S и G12C.
В одном воплощении мутация NRAS выбрана из G12V и G12R.
В одном воплощении мутация NRAS представляет собой G12R.
В еще одном воплощении ингибитор EGFR выбран из AZD9291 и CO1686 или фармацевтически приемлемой соли любого из них.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемая соль. В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или CO1686, или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одном аспекте изобретения предложен способ выбора подходящей схемы лечения рака у ракового пациента, включающий:
а) определение наличия мутации NRAS у пациента; и
б) выбор схемы лечения рака у пациента, включающей предоставление комбинации ингибитора EGFR и ингибитора MEK, если присутствует мутация NRAS;
где активирующая мутация NRAS выбрана из группы, состоящей из: E63K, G12V, G12R, G12A, G12D, G12S и G12C.
В одном воплощении мутация NRAS выбрана из E63K, G12V и G12R.
В одном воплощении мутация NRAS выбрана из G12V, G12R, G12A, G12D, G12S и G12C.
В одном воплощении мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В одном воплощении мутация NRAS выбрана из G12V и G12R.
В одном воплощении мутация NRAS представляет собой G12R.
В еще одном воплощении ингибитор EGFR выбран из AZD9291 и CO1686 или фармацевтически приемлемой соль любого из них.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или CO1686, или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или фармацевтически приемлемую соль его, и MEK ингибитор представляет собой селуметиниб или фармацевтически приемлемую соль его.
В одном аспекте изобретения предложен способ выбора подходящей схемы лечения рака у ракового пациента, включающий:
а) определение наличия активирующей мутации NRAS у пациента; и
б) выбор схемы лечения рака у пациента, включающей предоставление комбинации ингибитора EGFR и ингибитора MEK, если присутствует активирующая мутация NRAS;
где активирующая мутация NRAS выбрана из группы, состоящей из: мутации E63K NRAS; и мутации NRAS G12V.
В еще одном аспекте изобретения предложен способ выбора подходящей схемы лечения рака у ракового пациента, включающий:
а) определение наличия роста копийности NRAS у пациента; и
б) выбор схемы лечения рака у пациента, включающей предоставление комбинации ингибитора EGFR и ингибитора MEK, если присутствует рост копийности NRAS;
В еще одном аспекте изобретения предложен способ прогнозирования развития у ракового пациента приобретенной резистентности к терапевтическому эффекту ингибитора EGFR, включающий:
а) определение наличия активирующей мутации NRAS у пациента; и
б) идентифицирование того, что раковое заболевание является или будет резистентным, если присутствует активирующая мутация NRAS;
где активирующая мутация NRAS выбрана из группы, состоящей из: мутации E63K NRAS и мутации G12V NRAS.
В еще одном аспекте изобретения предложен способ прогнозирования развития у ракового пациента приобретенной резистентности к терапевтическому эффекту ингибитора EGFR, включающий:
а) определение присутствия роста копийности NRAS у пациента; и
б) идентифицирование того, раковое заболевание является или будет резистентным, если присутствует рост копийности NRAS.
В еще одном аспекте изобретения предложен способ лечения рака у пациента, включающий:
а) определение наличия активирующей мутации NRAS у пациента; и
б) лечение пациента комбинацией ингибитора EGFR и ингибитора MEK, если присутствует активирующая мутация NRAS;
где активирующая мутация NRAS выбрана из группы, состоящей из: мутации E63K NRAS; и мутации NRAS G12V.
В еще одном аспекте изобретения предложен способ лечения рака у пациента, включающий:
а) определение наличия роста копийности NRAS у пациента; и
б) лечение пациента комбинацией ингибитора EGFR и ингибитора MEK, если присутствует рост копийности NRAS.
В конкретных воплощениях любого из аспектов изобретения пациент получал или получает лечение ингибитором EGFR. В других воплощениях определение у пациента аномалии гена NRAS/белка NRAS выполняют на подходящем биологическом образце, полученном от пациента. Этот образец может быть взят перед осуществлением способа лечения или во время него. Этот образец обычно содержит опухолевые клетки, нуклеиновую кислоту опухоли или нуклеиновую кислоту, полученную из них.
В еще одном аспекте изобретения предложен способ определения вероятности эффективности комбинированного препарата, содержащего ингибитор EGFR и ингибитор MEK, для лечения рака у пациента, страдающего раковым заболеванием, включающий: определение того, содержит ли ген NRAS, полученный из биологического образца, полученного от указанного пациента, по меньшей мере один вариант нуклеиновой кислоты, выбранный из:
а) мутации, которая имеет результатом присутствие лизина вместо глутаминовой кислоты в положении 63 NRAS;
б) мутации, которая имеет результатом присутствие валина, аргинина, аланина, аспарагиновой кислоты, серина или цистеина вместо глицина в положении 12 NRAS; или
в) повышения копийности гена NRAS;
где биологический образец представляет собой образец ткани или жидкости, выделенной из пациента, которая содержит опухолевые клетки или нуклеиновую кислоту из опухолевых клеток, и где присутствие по меньшей мере одного варианта нуклеиновой кислоты указывает на то, что комбинированный препарат, содержащий тирозинкиназный ингибитор EGFR и ингибитор MEK, вероятно, является эффективным.
Таким образом, в изобретении предложен способ определения вероятности эффективности комбинированного препарата, содержащего тирозинкиназный ингибитор EGFR и ингибитор MEK, для лечения рака у пациента, страдающего раковым заболеванием, включающий: определение того, содержит ли ген NRAS, полученный из биологического образца, полученного от указанного пациента, по меньшей мере один вариант нуклеиновой кислоты, выбранный из:
а) присутствия аденина вместо гуанина в положении, соответствующем основанию 441 в кДНК NRAS;
б) присутствия нуклеиновой кислоты, отличной от гуанина, в положении, соответствующем основанию 288 в кДНК NRAS;
в) присутствия нуклеиновой кислоты, отличной от гуанина, в положении, соответствующем основанию 289 в кДНК NRAS; или
г) повышения копийности гена NRAS;
где биологический образец представляет собой образец ткани или жидкости, выделенной из пациента, которая содержит опухолевые клетки или нуклеиновую кислоту из опухолевых клеток, и где присутствие по меньшей мере одного варианта нуклеиновой кислоты указывает на то, что комбинированный препарат, содержащий тирозинкиназный ингибитор EGFR и ингибитор MEK, вероятно, является эффективным.
В одном воплощении по меньшей мере один вариант нуклеиновой кислоты выбран из:
а) присутствия аденина вместо гуанина в положении, соответствующем основанию 441 в кДНК NRAS;
б) присутствия тимина вместо гуанина в положении, соответствующем основанию 289 в кДНК NRAS; или
в) повышения копийности гена NRAS.
В одном воплощении по меньшей мере один вариант нуклеиновой кислоты выбран из:
а) присутствия аденина вместо гуанина в положении, соответствующем основанию 441 в кДНК NRAS;
б) присутствия тимина вместо гуанина в положении, соответствующем основанию 289 в кДНК NRAS;
в) присутствия цитозина вместо гуанина в положении, соответствующем основанию 288 в кДНК NRAS; или
г) повышения копийности гена NRAS.
В еще одном воплощении ингибитор EGFR выбран из AZD9291 и CO1686, или фармацевтически приемлемой соли любого из них.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или CO1686, или его фармацевтически приемлемую соль, и MEK ингибитор представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и MEK ингибитор представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одном аспекте изобретения предложен способ определения вероятности эффективности комбинированного препарата, содержащего тирозинкиназный ингибитор EGFR и ингибитор MEK, для лечения рака у пациента, страдающего раковым заболеванием, включающий: определение того, содержит ли ген NRAS, полученный из биологического образца, полученного от указанного пациента, по меньшей мере один вариант нуклеиновой кислоты, выбранный из:
а) мутации, которая имеет результатом замену лизина на глутаминовую кислоту в положении 63 NRAS или замену валина на глицин в положении 12 NRAS; или
б) повышения копийности гена NRAS;
где биологический образец представляет собой образец ткани или жидкости, выделенной из пациента, которая содержит опухолевые клетки или нуклеиновую кислоту из опухолевых клеток, и где присутствие по меньшей мере одного варианта нуклеиновой кислоты указывает на то, что комбинированный препарат, содержащий тирозинкиназный ингибитор EGFR и ингибитор MEK, вероятно, является эффективным.
В еще одном аспекте изобретения предложен способ лечения рака у пациента, страдающего раковым заболеванием, включающий: (1) определение того, содержит ли ген NRAS, полученный из биологического образца, полученного от указанного пациента, по меньшей мере один вариант нуклеиновой кислоты, выбранный из:
а) мутации, которая имеет результатом замену лизина на глутаминовую кислоту в положении 63 NRAS или замену валина на глицин в положении 12 NRAS; или
б) повышения копийности гена NRAS;
и (2) лечение пациента комбинацией ингибитора EGFR и ингибитора MEK, если присутствует вариант нуклеиновой кислоты; где биологический образец представляет собой образец ткани или жидкости, выделенной из пациента, которая содержит опухолевые клетки или нуклеиновую кислоту из опухолевых клеток.
В еще одном аспекте изобретения предложен способ определения вероятности эффективности комбинированного препарата, содержащего тирозинкиназный ингибитор EGFR и ингибитор MEK, для лечения рака у пациента, страдающего раковым заболеванием, включающий: определение того, содержит ли ген или белок NRAS, полученный из биологического образца, полученного от указанного пациента, по меньшей мере один вариант, выбранный из:
а) мутации, которая имеет результатом замену лизина на глутаминовую кислоту в положении 63 NRAS или замену валина на глицин в положении 12 NRAS; или
б) повышения копийности гена NRAS;
где биологический образец представляет собой образец ткани или жидкости, выделенной из пациента, которая содержит опухолевые клетки или нуклеиновую кислоту из опухолевых клеток, и где присутствие по меньшей мере одного варианта нуклеиновой кислоты указывает на то, что комбинированный препарат, содержащий тирозинкиназный ингибитор EGFR и ингибитор MEK, вероятно, является эффективным.
В еще одном аспекте изобретения предложен способ лечения рака у пациента, страдающего раковым заболеванием, включающий: (1) определение того, содержит ли ген NRAS и белок NRAS, полученные из биологического образца, полученного от указанного пациента, по меньшей мере один вариант, выбранный из:
а) мутации, которая имеет результатом замену лизина на глутаминовую кислоту в положении 63 NRAS или замену валина на глицин в положении 12 NRAS; или
б) повышения копийности гена NRAS;
и (2) лечение пациента комбинацией ингибитора EGFR и ингибитора MEK, если присутствует вариант; где биологический образец представляет собой образец ткани или жидкости, выделенной из пациента, который содержит опухолевые клетки или нуклеиновую кислоту из опухолевых клеток.
В конкретном воплощении перед определением того, содержит ли образец от пациента по меньшей мере один вариант нуклеиновой кислоты или нет, пациент получал лечение ингибитором EGFR.
Описание графических материалов
Фиг.1: Время до развития резистентности - График зависимости концентрации гефитиниба от времени, выполненный для клеток РС9, выращенных в присутствии гефитиниба при этой концентрации, до достижения конфлюентности примерно 80% (концентрацию гефитиниб удваивали каждый раз до достижения этой конфлюентности).
Фиг. 2: Примерная кривая зависимости доза-эффект - Примерная кривая зависимости доза-эффект для клеток РС9 NRAS (WT), обработанных титрованиями селуметиниба.
Фиг. 3: Примерная кривая зависимости доза-эффект - Примерная кривая зависимости доза-эффект для резистентных к AZD9291 клеток РС9 NRAS (E63K), обработанных титрованиями селуметиниба.
Фиг. 4: Примерная кривая зависимости доза-эффект - Примерная кривая зависимости доза-эффект для резистентных к гефитинибу клеток РС9 E63K NRAS, обработанных титрованиями селуметиниба.
Фиг. 5: Примерная кривая зависимости доза-эффект - Примерная кривая зависимости доза-эффект для резистентных к афатинибу клеток РС9 NRAS (WT) gain, обработанных титрованиями селуметиниба.
Фиг. 6: Примерная кривая зависимости доза-эффект - Примерная зависимости кривая доза-эффект для резистентных к AZD9291 клеток РС9 NRAS (G12V), обработанных титрованиями селуметиниба.
Фиг. 7: Анализ активации Ras - Вестерн-блоттинг, показывающий уровни активного NRAS в клеточных линиях РС9 и РС9, резистентных к AZD9291, с мутациями E63K NRAS (РС9 AZDR_5 клеток) и G12V (РС9 AZDR_2 клетки) после обработки в течение 2 часов в присутствии или при отсутствии 160 нМ AZD929.
Фиг. 8: Воздействие миРНК нокдауна WT NRAS и E63K NRAS на нисходящие сигналы - Воздействия 48-часового миРНК-опосредованного нокдауна экспрессии NRAS или KRAS на: фосфорилирование, показатель активности белков: фосфорилированный EGFR (Р EGFR); фосфорилированный ERK (Р ERK), NRAS, KRAS и GAPDH (контроль для нанесения); у клеток РС9, у клеток РС9, резистентных к AZD9291 (АКА. РС9 AZDR_5), имеющих мутацию E63K NRAS; и у клеток РС9, резистентных к гефитинибу (АКА. РС9 GR_2), имеющих мутацию E63K NRAS.
Фиг. 9: Воздействие миРНК нокдауна WT NRAS и E63K NRAS на пролиферацию - Воздействия 96 -часового миРНК-опосредованного нокдауна экспрессии NRAS или KRAS на клеточный рост у клеток РС9, у клеток РС9, резистентных к AZD9291 (АКА. РС9 AZDR_5), имеющих мутацию E63K NRAS; и у клеток РС9, резистентных к гефитинибу (АКА. РС9 GR_2), имеющих мутацию E63K NRAS.
Фиг. 10: Воздействие экзогенной сверхэкспрессии E63K NRAS на резистентность к ингибированию роста клеток РС9 посредством гефитиниба или AZD9291 - Воздействия сверхэкспрессии мутанта E63K NRAS на рост клеток РС9 в отсутствие и в присутствии или 100 нМ AZD9291 или 300 нМ гефитиниба.
Описание последовательностей
В данном описании изобретения ссылаются на различные последовательности. В частности:
SEQ ID NO: 1 предлагает аминокислотную последовательность EGFR;
SEQ ID NO: 2 предлагает последовательность кДНК предлагает EGFR;
SEQ ID NO: 3 предлагает аминокислотную последовательность NRAS;
SEQ ID NO: 4 предлагает последовательность кДНК, предлагает NRAS;
SEQ ID NO: 5 предлагает аминокислотную последовательность MEK1;
SEQ ID NO: 6 предлагает последовательность кДНК, предлагает MEK1;
SEQ ID NO: 7 предлагает аминокислотную последовательность MEK2; и
SEQ ID NO: 8 предлагает последовательность кДНК, кодирующей MEK2.
Подробное описание изобретения
По всему описанию и пунктам формулы изобретения данного документа, единственное число включает множественное число, если в контексте не требуется иное. В частности, когда используют единственное число, документ следует понимать как рассматривающий множественное число, а также единственное число, если в контексте требуется иное.
Отличительные признаки, целые числа, характеристики, соединения, химические группировки или группы, описанные совместно с конкретным аспектом, воплощением или примером по изобретению, следует понимать как применимые к любому другому аспекту, воплощению или примеру, описанному в данном описании изобретения, за исключением не совместимых с этими. Таким образом, все воплощения, определения, аспекты и пункты формулы изобретения, описанные в данном описании изобретения, можно комбинировать друг с другом в любой комбинации (за исключением случаев, когда такая комбинация была бы неуместна, учитывая контекст), с целью получения еще одних воплощений, аспектов или пунктов формулы изобретения.
По всему описанию и пунктам формулы изобретения данного документа, слова "содержать" и "включает" и варианты слов, например "содержащий" и "содержат", могут означать "включающий, но без ограничения", и не исключают, в общем случае, другие группировки, дополнительные вещества, компоненты, целые числа или стадии.
Если не указано иное, технические термины используют в соответствии с общепринятым применением.
Согласно традиции, обычно записывают гены курсивом, а белки -обычным текстом. Согласно общепринятой традиции в данной области техники, в этом документе обозначения генов записывают выделенным курсивом текстом, а обозначения белков записывают обычным текстом (то есть не выделяют курсивом). Таким образом, "NRAS" используют для указания на белок NRAS, и "NRAS" используют для указания на ген. Хотя в этом документе были сделаны попытки указывать ген NRAS или белок NRAS согласно этой традиции, специалисту в данной области техники, на основе научного контекста, будет понятно, является ли какая-либо из ссылок на "NRAS" или "NRAS" неправильной.
Определения обычных терминов в молекулярной биологии можно найти в Benjamin Lewin, Genes V, опубликованной Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, опубликованной Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); and Robert A. Meyers (ed.), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, опубликованной VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
Все литературные публикации и патентные документы, упомянутые в этом документе, включены в данное описание изобретения посредством ссылки в этом документе.
Как описано здесь выше, авторы настоящего изобретения определили, что резистентность к терапии ингибитором EGFR у раковых пациентов может быть ассоциирована с одной или более мутациями NRAS, выбранными из группы, состоящей из: мутации E63K NRAS; и мутации NRAS G12V. Считается, что эти мутации представляют собой активирующие мутации NRAS. Также авторами изобретения было обнаружено, что резистентность к терапии ингибитором EGFR у раковых пациентов может быть ассоциирована с ростом копийности NRAS. Кроме того, авторами изобретения было обнаружено, что раковых пациентов, которые имеют одну или более этих активирующих мутаций NRAS или роста копийности NRAS, можно эффективно лечить комбинацией ингибитора EGFR и ингибитора MEK, даже если пациент проявляет (или способен проявлять) резистентность к терапии одним ингибитором EGFR. Кроме того, авторами изобретения было обнаружено, что раковых пациентов, которые имеют мутацию G12R NRAS, можно эффективно лечить комбинацией ингибитора EGFR и ингибитора MEK, даже если пациент проявляет (или способен проявлять) резистентность к терапии одним ингибитором EGFR. Настоящее изобретение делает возможным более эффективное целенаправленное воздействие курса лечения на раковых пациентов и, в частности, более эффективную идентификацию и лечение раковых заболеваний, у которых развилась, или разовьется, резистентность к эффектам ингибитора EGFR.
Таким образом, в одном аспекте способы по изобретению можно применять для прогнозирования развития у раковых пациентов приобретенной резистентности к терапевтический эффекту ингибитора EGFR. В таком способе пациента тестируют для определения наличия мутации NRAS или роста копийности NRAS, как описано здесь, и рак идентифицируют как развивающий приобретенную резистентность, если показано, что пациент имеет активирующую мутацию NRAS или рост копийности NRAS согласно изобретению. Такого пациента можно характеризовать как положительного в отношении активирующей мутации NRAS или роста копийности NRAS, описанных в данном описании изобретения.
В еще одном аспекте способы по изобретению можно применять для отбора раковых пациентов, подходящих для лечения комбинацией ингибитора EGFR и ингибитора MEK. В таком способе ракового пациента тестируют для установления присутствия мутации NRAS или роста копийности NRAS, как описано здесь, и выбирают в качестве подходящего для лечения, если присутствует одна или более из мутаций NRAS, описанных в данном описании изобретения, или рост копийности NRAS. В одном воплощении при тестировании для определения наличия мутации NRAS или роста копийности NRAS, раковый пациент представляет собой пациента, который получил или получает лечение ингибитором EGFR.
Способы по изобретению также можно применять для выбора подходящей схемы лечения рака для ракового пациента. В таком способе ракового пациента тестируют для установления присутствия мутации NRAS, как описано здесь, или роста копийности NRAS, и выбирают схему лечения, включающую предоставление комбинации ингибитора EGFR и ингибитора MEK, если присутствует мутация NRAS или рост копийности NRAS. В одном воплощении, когда тестируют для установления присутствия мутации NRAS, раковый пациент представляет собой пациента, который получил или получает лечение ингибитором EGFR.
Рак
Ряд раковых заболеваний ассоциируют с аномальной или сверхэкспрессией EGFR и/или сверхэкспрессией его специфических лигандов, например рецептора трансформирующего фактора роста-α (Gullick, Br Med Bull. 47:87-98, 1991; Modijtahedi and Dean, Int. J. Oncol. 4:277-296, 1994; Salomon etal., Crit Rev Oncol Hematol. 19:183-232, 1995). Сверхэкспрессия EGFR была ассоциирована с неблагоприятным прогнозом ряда раковых заболеваний у человека, включая НМРЛ.
В одном воплощении "рак" относится к ассоциированному с EGFR раку.
Способы идентификации и диагностики ассоциированных с EGFR раковых заболеваний хорошо известны специалисту в данной области техники. В качестве примера, подробности различных способов и условия, при которых их можно применять, предлагаются в Ellison, et al. J Clin Pathol 2013; 66:2 79-89.
Например, ассоциированный с EGFR рак может представлять собой рак, который реагировал или который реагирует на лечение ингибитором EGFR, таким как любой из ингибиторов EGFR, описанных в данном описании изобретения.
Ассоциированный с EGFR рак может представлять собой рак, который стал или который станет резистентным к терапевтическому эффекту одного или более ингибиторов EGFR, как описано здесь. Такая резистентность может быть ассоциирована с мутацией в EGFR, такой как Т790М.
Ассоциированный с EGFR рак может представлять собой рак (или опухоль), который является (или который являлся) зависимым, по меньшей мере частично, от сигнального пути EGFR.
Ассоциированный с EGFR рак может быть ассоциирован с одной или более мутациями в EGFR. Такая мутация EGFR может трансформировать клетку в раковое состояние.
Мутация EGFR, которую ассоциируют с раком, может представлять собой активирующую мутацию EGFR. Такая мутация обычно имеет результатом сверхэкспрессию и/или сверхактивность белка EGFR. Любая активность EGFR может быть нарушена. Мутация может, например, иметь место в нуклеотидной последовательности, например в ДНК, кодирующей EGFR, и/или в аминокислотной последовательности, например в аминокислотной последовательности белка EGFR. Мутация может иметь место в нуклеотидной последовательности, кодирующей другой белок, или в аминокислотной последовательности другого белка, где эффект мутации служит причиной сверхэкспрессии и/или сверхактивности белка EGFR. Обычно мутация представляет собой соматическую мутацию.
Мутация может, например, представлять собой соматическую мутацию, при которой белковый продукт экспрессии мутантного гена приобретает новые и патологические функции в тирозинкиназном домене EGFR. Некоторые такие мутации усиливают чувствительность рака к тирозинкиназному ингибитору EGFR. Эти мутации обычно находятся в экзонах 18-21 гена EGFR. Смотреть, например WO 2005/094397 и WO 2005/118876. Примеры этих мутаций включают мультинуклеотидные делеции внутри рамки считывания в экзоне 19, вовлекающие элиминацию четырех аминокислот, Leu-Arg-Glu-Ala, и замену одного нуклеотида в нуклеотиде 2573 (Т→G) в экзоне 21, имеющую результатом замену аргинина на лейцин в положении 858 (L858R). Эти мутации, в частности, ассоциируют с раком легких, например немелкоклеточным раком легких (НМРЛ).
L858R представляет собой одну из ряда мутаций EGFR, представляющую особый интерес в контексте настоящего изобретения, так как ее часто ассоциируют с раковыми заболеваниями, которые реагируют на тирозинкиназные ингибиторы EGFR, такие как эрлотиниб, гефитиниб, афатиниб и AZD9291 (дополнительные подробности включены в другом месте в данном описании изобретения). В одном воплощении изобретения ассоциированный с EGFR рак может представлять собой рак, который ассоциируют с мутацией EGFR, выбранной из группы, состоящей из: L858R; и мутаций делеции в экзоне 19.
Кроме того или альтернативно, ассоциированный с EGFR рак может быть ассоциирован с мутацией EGFR Т790М. Эта мутация часто представляется супрессорной мутацией в EGFR, имеющей место в дополнение к первой первичной активирующей мутации. Обычно вторичная мутация появляется во время лечения ингибитором EGFR и обусловливает механизм резистентности к ингибитору. Мутацию Т790М, в частности, ассоциируют с раком легких, например НМРЛ. AZD9291 можно применять для лечения ассоциированных с EGFR раковых заболеваний, ассоциированных с мутациями делеций в экзоне 19 и/или мутациями замены L858R и, возможно, мутацией резистентности Т790М.
Примеры ассоциированных с EGFR раковых заболеваний могут включать: несолидные опухоли, такие как лейкоз, например острый миелоидный лейкоз, множественная миелома, гематологические злокачественные заболевания (например миелодиспластический синдром или миелопролиферативный синдром) или лимфома; и солидные опухоли и их метастазы, такие как меланома, немелкоклеточный рак легких (НМРЛ), глиома, гепатоклеточная (печени) карцинома, глиобластома, карцинома щитовидной железы, желчного протока, костей, желудка, головного мозга/ЦНС, головы и шеи, печени, области желудка, предстательной железы, молочной железы, почек, яичка, яичника, кожи, шейки матки, легких, мышц, нейрональные опухоли, карцинома пищевода, мочевого пузыря, легких, матки, влагалища, эндометрия, почки, прямой/толстой кишки, поджелудочной железы, плевральных/периотонеальных мембран, слюнных желез и эпидермоидные опухоли.
В одном воплощении ассоциированный с EGFR рак представляет собой солидную опухоль.
В одном воплощении ассоциированный с EGFR рак представляет собой рак легких.
В одном воплощении ассоциированный с EGFR рак представляет собой НМРЛ.
Применение способов, медицинские применения, фармацевтические композиции и другие аспекты изобретения в контексте раковых заболеваний, выбранных из этой группы, или метастазов таких раковых заболеваний, считается подходящим воплощением.
Раковый пациент
Изобретение можно применять к любому подходящему организму. В одном аспекте пациент представляет собой животное или человека, например, млекопитающее, такое как теплокровное млекопитающее. В одном аспекте пациент представляет собой человека.
Обычно у пациента проявляется один или более клинических или доклинических симптомов ассоциированного с EGFR рака, описанного в данном описании изобретения. Пациент может быть клинически диагностирован как страдающий таким раковым заболеванием или как предрасположенный к такому заболеванию.
Пациент может получать в данный момент или получать прежде терапию рака при помощи ингибитора EGFR, такого как EGFR TKI. Пациент может представлять собой пациента, у которого уже развилась, или у которого вероятно разовьется приобретенная резистентность к терапии ингибитором EGFR, как описано здесь. Таким образом, данные способы можно применять для обеспечения терапии второй или последующей линии.
Резистентность и приобретенная резистентность
При использовании в данном описании изобретения резистентность к лечению описывает клиническую ситуацию, где раковое заболевание (или раковый пациент) является невосприимчивым к лечению, или менее восприимчивым, чем в начале лечения (часто называют приобретенной резистентностью).
Приобретенная резистентность относится к ситуации, при которой раковое заболевание (или раковый пациент) сначала поддается лечению агентом (например, ингибитором EGFR), но с течением времени становится менее восприимчивым или совсем не восприимчивым к дальнейшему лечению агентом, и рак прогрессирует. Раковое заболевание или раковый пациент могут проявлять степени резистентности (и таким образом степени восприимчивости к лечению) стечением времени.
Под восприимчивостью подразумевают, что лечение обеспечивает по меньшей мере один клинически выявляемый терапевтический эффект, как описано здесь. Пациент является невосприимчивым, если отсутствует клинически выявляемый терапевтический эффект, как описано здесь. Терапевтический эффект может представлять собой, например, противораковый эффект, как описано здесь.
Раковое заболевание, которое прогнозируется как развивающее приобретенную резистентность к ингибитору EGFR в соответствии с изобретением, представляет собой раковое заболевание, которое уже является резистентным к лечению ингибитором EGFR или станет таковым.
Лечение, терапия и терапевтический эффект
Термины лечение, терапия или терапевтический эффект при использовании в данном описании изобретения включают перечисленные ниже и их комбинации: (1) ингибирование, например замедление инициирования и/или прогрессирования, рака, например купирование, ослабление или замедление развития рака или его рецидива в случае поддерживающего лечения или вторичной профилактики, или по меньшей мере одного его клинического или субклинического симптома; (2) предупреждение или замедление появления клинических симптомов рака, развивающегося у субъекта, который может быть поражен раковым заболеванием или предрасположен к нему, но еще не ощущает или не проявляет клинические или субклинические симптомы такого заболевания; и/или (3) облегчение и/или излечение от рака (например, вызывание регресса рака или по меньшей мере одного из его клинических или субклинических симптомов, излечение пациента или введение пациента в ремиссию). Лечение или терапия при использовании в данном описании изобретения могут включать профилактику или профилактическое лечение.
Таким образом, например, терапевтический эффект в данном описании изобретения может относиться к одному или более из (1), (2) и (3), имеющих место у ракового пациента.
Терапевтический эффект в данном описании изобретения может представлять собой противораковый эффект. Противораковые эффекты включают, но без ограничения, ингибирование роста опухоли, замедление роста опухоли, регресс опухоли, уменьшение размера опухоли, увеличенный срок до возобновления роста опухоли после прекращения лечения, замедление прогрессирования заболевания.
Терапевтический эффект в терапии первой линии, на который ссылаются здесь, может относиться к замедлению или предупреждению развития приобретенной резистентности к терапии ингибитором EGFR, которая, например, может быть приобретена в результате развития мутации NRAS, описанной в данном описании изобретения.
Обычно терапевтический эффект оказывает благотворное действие, которое является клинически выявляемым. Благотворное действие для субъекта или пациента, подлежащего лечению, может быть либо статистически значимым или, по меньшей мере, заметным пациенту или терапевту, или другому специалисту. Понятно, что лекарственное средство необязательно будет оказывать клинический эффект у каждого пациента, которому его вводят; таким образом, у любого отдельного пациента или даже у конкретной популяции пациентов лечение может не иметь успеха или быть успешным только частично, и значения терминов "лечение", "профилактика" и "ингибитор" и близких терминов следует понимать соответствующим образом.
Термин "профилактика" или "профилактическое лечение" включает ссылку на курс лечения или терапии с целью сохранения здоровья или ингибирования или замедления инициирования и/или прогрессирования рака, например с целью снижения вероятности, или предупреждения появления рака. Результатом профилактики может быть, например, сохранение здоровья или замедление инициирования и/или прогрессирования рака. Следует напомнить, что у любого отдельного пациента или даже в конкретной популяции пациентов лечение может не иметь успеха, и этот абзац следует понимать соответствующим образом.
Лечение рака согласно изобретению можно оценивать посредством общепринятых показателей, таких как степень противоопухолевого эффекта, процент положительного клинического ответа, время до начала прогрессирования заболевания и/или выживаемость.
Терапия первой линии для ассоциированного с EGFR рака в данном описании изобретения относится к терапии, вводимой пациенту, которого раньше не лечили от рака с применением ингибитора EGFR.
Терапия второй линии для ассоциированного с EGFR рака в данном описании изобретения относится к терапии, вводимой пациенту, которого раньше лечили от рака с применением ингибитора EGFR, но где ассоциированный с EGFR рак прогрессировал (или иным образом стал резистентным) во время лечения ингибитором EGFR.
Терапия третьей линии для ассоциированного с EGFR рака в данном описании изобретения относится к терапии, вводимой пациенту, которого раньше лечили от рака, в частности, которого раньше лечили при помощи двух различных терапий, например разных ингибиторов EGFR.
Авторы изобретения полагают, что способы лечения и/или медицинские применения, раскрытые в данном описании изобретения, могут при необходимости применяться в контексте терапий первой, второй, третьей или дальнейших линий для ассоциированных с EGFR раковых заболеваний.
EGFR/EGFR
EGFR при использовании в данном описании изобретения относится к рецептору эпидермального фактора роста, обычно к трансмембранному гликопротеину, который является членом суперсемейства протеинкиназ.
EGFR может принадлежать любому из видов, соответствующих видам, подлежащим лечению. В одном аспекте EGFR представляет собой человеческий EGFR.
Человеческий EGFR (Ген ID: 1956) существует в различных изоформах согласно альтернативно сплайсированным транскриптам. EGFR при использовании в данном описании изобретения может относиться к любой из этих изоформ.
Последовательность человеческого гена EGFR дикого типа описана в Gene ID: 1956. Ген EGFR может иметь продукт экспрессии мРНК, соответствующий последовательности кДНК в GenBank учетный номер. Х00588.1, и продукт экспрессии белка, имеющий аминокислотную последовательность белка EGFR в UniProtKB/Swiss-Prot Р00533.2 (которая включает 24-аминокислотную сигнальную последовательность из аминокислот 1-24, которая отщепляется в зрелом белке). Ссылка в данном описании изобретения на ген, мРНК, кДНК EGFR или белок EGFR может относиться к этому человеческому гену, мРНК (или соответствующей кДНК) или белку с дополнительной мутацией, как позволяет контекст. МРНК, кДНК или белок EGFR, относящиеся к данному описанию изобретения, могут также относиться к изоформе вышеупомянутого, например к растворимой изоформе, не имеющей трансмембранного домена и внутриклеточного домена, с дополнительной мутацией, как позволяет контекст.
В некоторых случаях EGFR может относиться к варианту упомянутого выше, например, к встречающемуся в природе варианту дикого типа (например, из неопухолевой клетки).
Изложенное выше применяется с соответствующими изменениями к отличному от человеческго EGFR. Например, ссылка в данном описании изобретения на ген, мРНК EGFR или белок EGFR может относиться к виду-гомологу упомянутого выше человеческого гена, мРНК или белка с дополнительной мутацией, как позволяет контекст.
Нумерация аминокислотной последовательности для EGFR и мутаций EGFR при использовании в данном описании изобретения обычно связана со ссылкой на аминокислотную последовательность и нумерацию человеческого EGFR дикого типа, который представлен в UniProtKB/Swiss-Prot Р00533.2 (который, как указано выше, включает сигнальную последовательность из аминокислот 1-24). Таким образом, например, ссылка на мутацию Т790М относится к замене Т на М в аминокислоте 790 в 1210-аминокислотной последовательности в UniProtKB/Swiss-Prot Р00533.2. Из-за применяемой эталонной последовательности мутацию Т790М первоначально называли Т766М (Blencke et al. J. Biol. Chem. 278:15435-15440, 2003).
Подобным образом, нумерация последовательности кДНК EGFR при использовании в данном описании изобретения связана со ссылкой на последовательность кДНК EGFR дикого типа в GenBank Х00588.1 (с кодирующей белок последовательностью из оснований 187-3819).
Ссылка на мутации EGFR в данном описании изобретения может также охватывать появление мутаций в соответствующих положениях в EGFR нечеловеческих видов, имеющих одинаковый функциональный эффект.
Ингибитор
Ингибитор, как изложено в данном описании изобретения, может представлять собой, например, полипептид, нуклеиновую кислоту, углевод, липид, низкомолекулярное соединение, олигонуклеотид, олигопептид, миРНК, антисмысловое соединение, рекомбинантный белок, антитело, пептитело, или их конъюгаты или слитые белки. Для обзора миРНК см. Milhavet О, Gary DS, Mattson MP. (Pharmacol Rev. 2003 Dec; 55(4):629-48. Для обзора антисмысловых соединений см. Opalinska JB, Gewirtz AM. Sci STKE. 2003 Oct 28; 2003 (206): pe47.
Низкомолекулярное соединение может, например, относиться к соединению с молекулярной массой менее 2000 Да, 1000 Да, 700 Да или 500 Да. Конкретные ингибиторы для применения в настоящем изобретении представляют собой небольшие молекулы TKI EGFR.
Ингибитор EGFR
Ингибитор EGFR обычно снижает или предотвращает экспрессию и/или активность EGFR. Подходящий ингибитор может быть идентифицирован путем анализа ингибирующего эффекта на экспрессию и/или активность EGFR.
Обычно ингибитор снижает экспрессию или активность по меньшей мере на выявляемое в подходящем анализе количество. Ингибитор может, например, снижать экспрессию или активность по меньшей мере на 10, 20, 30, 40, 50, 60, 70, 80 или по меньшей мере на 90%.
Специалисту в данной области техники известны многие подходящие методики, посредством которых можно снижать экспрессию EGFR. Кроме того, специалисту также известно много агентов, способных снижать активность EGFR, включая, но без ограничения, примеры, предложенные в другом месте в этом документе.
Любая подходящая активность EGFR может подвергаться воздействию, например, активности тирозинкиназы. Таким образом, в одном аспекте ингибитор EGFR может содержать ингибитор тирозинкиназы (TKI). Ингибирование тирозинкиназной активности можно определять в любом подходящем анализе, таком как анализ, описанный в Ward et. al. J. Med. Chem. 2013, 56:7025-7048.
Примеры тирозинкиназных ингибиторов EGFR включают: гефитиниб, эрлотиниб, афатиниб, AZD9291, СО-1686, WZ4002, PD153035 и PF 00299804. Ингибиторы могут включать фармацевтически приемлемые соли этих соединений, как описано в другом месте в данном описании изобретения. Такие ингибиторы хорошо известны специалисту в данной области техники.
Известные TKI EGFR, такие как гефитиниб, эрлотиниб и афатиниб, можно применять в качестве первой линии терапии против рака у пациентов. Совсем недавно разработанные TKI EGFR, включающие AZD9291, СО-1686, WZ4002, можно иногда применять против ассоциированного с EGFR рака, когда развилась резистентность к одному из более известных лекарственных средств на основе TKI EGFR (например, против рака, ассоциированного и с первичной активирующей мутацией EGFR и с дополнительной мутацией EGFR, такой как Т790М).
Из TKI EGFR, представленных выше, группа, состоящая из: гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686, представляет особенно интересные в контексте настоящего изобретения примеры (когда специалисту понятно, что каждый из таких TKI EGFR можно возможно использовать в форме фармацевтически приемлемой соли). Применение TKI EGFR, выбранных из этой группы, представляет собой подходящее воплощение настоящего изобретения. Таким образом, в любом воплощении, аспекте или пункте формулы изобретения, где упоминается ингибитор EGFR, могут быть образованы дополнительные воплощения, аспекты и пункты формулы изобретения, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и CO1686, или фармацевтически приемлемой соли любого из них. Могут быть образованы еще одни воплощения, аспекты и пункты формулы изобретения, где ингибитор EGFR выбран из гефитиниба, AZD9291 и CO1686.
Гефитиниб
Ингибитор EGFR может содержать гефитиниб или его фармацевтически приемлемую соль.
Гефитиниб представляет собой лекарственное средство на основе EGFR TKI, которое одобрено для применения при НМРЛ в прогрессирующей стадии в целом ряде территорий.
Структура гефитиниба показана ниже:

Гефитиниб также может быть известен под химическим названием N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолин-4-илпропокси)хиназолин-4-амин.
Эрлотиниб
Ингибитор EGFR может содержать эрлотиниб или его фармацевтически приемлемую соль.
Эрлотиниб представляет собой лекарственное средство на основе TKI EGFR, применяемое против раковых заболеваний поджелудочной железы, легких и других раковых заболеваний, как описано здесь.
Структура эрлотиниба показана ниже:
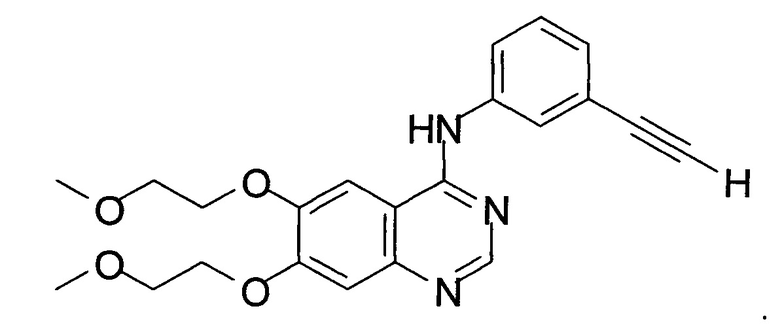
Эрлотиниб также может быть известен под химическим названием N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин.
Афатиниб
Ингибитор EGFR может содержать афатиниб или его фармацевтически приемлемую соль.
Афатиниб представляет собой лекарственное средство на основе TKI EGFR, используемое, в частности, против НМРЛ, как описано здесь. Лекарственное средство иногда можно иногда применять для лечения раковых заболеваний, которые являются или стали резистентными к лечению гефитинибом или эрлотинибом.
Структура афатиниба показана ниже:
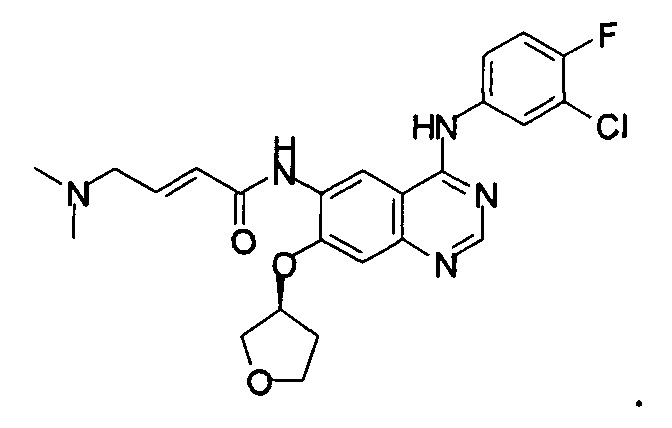
Афатиниб также может быть известен под химическим названием N-[4-[(3-хпор-4-фторфенил)амино]-7-[[(3S)-тетрагидро-3-фуранил]окси]-6-хиназолинил]-4(диметиламино)-2-бутенамид.
AZD9291
Ингибитор EGFR может содержать AZD9291 или его фармацевтически приемлемую соль. AZD9291 иногда можно применять для лечения раковых заболеваний, которые являются или стали резистентными к лечению ингибиторами EGFR, такими как гефитиниб, эрлотиниб и/или афатиниб.
AZD9291 имеет структуру:
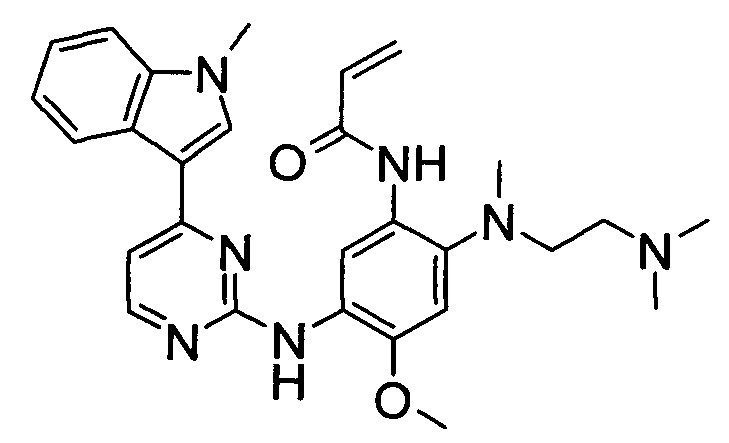
и может быть известен под химическим названием N-(2-{2-диметиламиноэтил-метиламино}-4-метокси-5-{[4-(1-метилиндол-3-ил)пиримидин-2-ил]амино}фенил)проп-2-енамид. AZD9291 и его фармацевтически приемлемые соли раскрыты в международной заявке на патент PCT/GB2012/051783 (номер публикации WO 2013/014448), содержание которой тем самым включено посредством ссылки.
Фармацевтически приемлемая соль AZD9291 может содержать любую из солей, описанных в данном описании изобретения, например мезилатную соль.
СО-1686 - также известный как "роцилетиниб"
Ингибитор EGFR может содержать СО-1686 или его фармацевтически приемлемую соль. Химическая структура СО-1686 представляет собой:
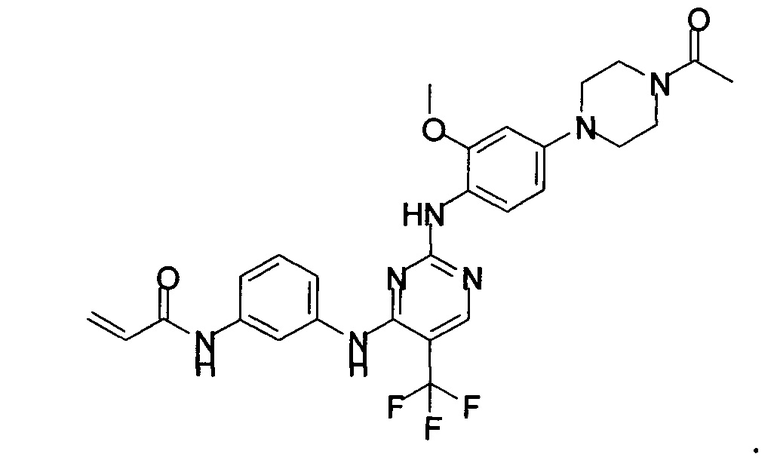
СО-1686 может быть известен под химическим названием: N-(3-{[2-{[4-(4-ацетилпиперазин-1-ил)-2-метоксифенил]амино}-5-(трифторметил)пиримидин-4-ил]амино}фенил)поп-2-енамид. Фармацевтически приемлемая соль СО-1686 может, например, содержать соль HBr.
WZ4002
Представляет собой селективный в отношении мутанта тирозинкиназный ингибитор EGFR, эффективный против EGFR Т790М. Это соединение описано в издании Zhouef al. (Nature 462, 1070-1074; 2009)
NRAS/NRAS
NRAS при использовании в данном описании изобретения относится к гомологу вирусного онкогена RAS нейробластомы и кодируется онкогеном NRAS.
NRAS является членом семейства генов Ras. Семейство генов Ras млекопитающих включает гены ras Harvey и Kirsten (HRAS и KRAS), неактивный псевдоген каждого из них (c-Hras2 и c-Kras1) и ген NRAS. Белки RAS имеют активность ГТФ-ГДФ связывания и активость ГТФазы.
NRAS может представлять собой любому из видов, соответствующим видам, подлежащим лечению. В одном аспекте NRAS представляет собой человеческий NRAS.
Человеческий ген NRAS (NRAS) (дикого типа) описан в Gene ID: 4893 и состоит из 7 экзонов (-I, 1, II, II, IV, V, VI). Человеческий ген NRAS дикого типа обычно имеет продукт экспрессии мРНК, соответствующий последовательности кДНК в GenBank, учетный номер НМ_002524, и продукт экспрессии белка, имеющий аминокислотную последовательность белка NRAS в UniProtKB/Swiss-Prot Р01111.1.
Ссылка в данном описании изобретения на ген, мРНК, кДНК NRAS или белок NRAS может относиться к этому человеческому гену, мРНК или к соответствующей последовательности кДНК, или белку с дополнительной мутацией, как позволяет контекст.
NRAS в некоторых случаях может относиться к варианту любого из упомянутых выше, например, к встречающемуся в природе варианту дикого типа.
Указанное выше применяется с соответствующими изменениями для NRAS нечеловеческих видов. Например, ссылка в данном описании изобретения на ген, мРНК, кДНК NRAS или белок NRAS может относиться к виду-гомологу указанного выше человеческого гена, мРНК или белка с дополнительной мутацией, как позволяет контекст.
Нумерация аминокислот NRAS и мутации описаны в данном описании изобретения со ссылкой на аминокислотную последовательность в UniProtKB/Swiss-Prot P01111.1. Таким образом, например, ссылка в данном описании изобретения на мутацию E63K NRAS относится к замене глутаминовой кислоты (Е) на лизин (К) в аминокислоте с номер 63 в 189-аминокислотной последовательности в UniProtKB/Swiss-Prot Р01111.1.
В последовательности кДНК NRAS в GenBank, учетный номер. НМ_002524, кодирующая белок последовательность показана на нуклеотидах 255-824. 570-нуклеотидная консенсусная кодирующая последовательность также представлена в базе данных CCDS под учетным номер. CCDS877.1. Нумерация последовательности кДНК NRAS и мутации, описанные в данном описании изобретения, связаны со ссылкой на последовательность кДНК в GenBank учетный номер НМ_002524.
Ссылка на мутации NRAS в данном описании изобретения может также охватывать появление мутаций, имеющих одинаковый функциональный эффект, в соответствующих положениях у NRAS нечеловеческих видов.
Активирующая мутация NRAS
Активирующая мутация NRAS при использовании в данном описании изобретения обычно имеет результатом сверхэкспрессию и/или сверхактивность белка NRAS. Мутация может, например, иметь место в нуклеотидной последовательности (например ДНК, кодирующей NRAS) и/или в аминокислотной последовательности (например в последовательности белка NRAS). Мутация NRAS, описанная в данном описании изобретения, обычно представляет собой соматическую мутацию.
Любая активность NRAS может быть нарушена, например, посредством активности ГТФазы.
Активирующие мутации NRAS, описанные здесь, включают: мутацию E63K NRAS; мутацию G12V NRAS. Активирующая мутация NRAS, описанная здесь, может возникать спонтанно с развитием рака, или она может быть получена при раковом заболевании (или у ракового пациента) в ответ на лечение ракового заболевания (или пациента), такое как при помощи ингибитора EGFR. Дополнительная мутация NRAS, описанная в данном описании изобретения, представляет собой мутацию G12R NRAS.
Мутация E63K NRAS
Мутация E63K NRAS относится к замене аминокислоты с глутаминовой кислоты (Е) на лизин (К) в положении аминокислоты, соответствующем Е63 в аминокислотной последовательности белка NRAS (SEQ ID NO: 3).
Замена аминокислоты обычно кодируется заменой в последовательности ДНК в гене NRAS. Обычно она представляет собой замену в кодоне 63 кодирующей последовательности (нуклеотиды 441-443 последовательности кДНК NRAS). В частности, замена может происходить в результате замены G на А в положении, соответствующем основанию 441 в последовательности кДНК NRAS, что означает замену GAG на AAG в положении, соответствующем основаниям 441-443. (Она также может возникать от двойной замены нуклеотидных оснований, такой как GAG на AAA в положении, соответствующем основаниям 441-443 последовательности кДНК NRAS).
Мутация G12VNRAS
Мутация G12V NRAS относится к замене глицина (G) на валин (V) в аминокислотной последовательности в положении аминокислоты, соответствующем G12 в аминокислотной последовательности белка NRAS (SEQ ID NO: 3).
Замена аминокислоты обычно кодируется заменой в последовательности ДНК в гене NRAS. Обычно она представляет собой замену в кодоне 12 кодирующей последовательности (нуклеотиды 288-290 последовательности кДНК NRAS). В частности, замена может происходить в результате замены G на Т в положении, соответствующем основанию 289 в последовательности кДНК NRAS, что означает замену с GGT на GTT для оснований 288-290.
Мутация G12R NRAS
Мутация G12R NRAS относится к замене глицина (G) на аргинин (R) в аминокислотной последовательности в положении аминокислоты, соответствующем G12 в аминокислотной последовательности белка NRAS (SEQ ID NO: 3). Замена аминокислоты обычно кодируется посредством замены в последовательности ДНК в гене NRAS. Обычно она представляет собой замену в кодоне 12 кодирующей последовательности (нуклеотиды 288-290 последовательности кДНК NRAS). В частности, замена может происходить в результате замены G на С в положении, соответствующем основанию 288 в последовательности кДНК NRAS, что означает замену GGT на CGT для оснований 288-290.
Рост копийности NRAS
Рост копийности NRAS (N-ras) относится к замене в ДНК, которая имеет результатом присутствие повышенного числа копий гена NRAS по сравнению с контрольными клетками. Контрольная клетка может представлять собой нормальную нераковую клетку или родственную нормальную контрольную клетку, то есть нераковую клетку/популяцию клеток, взятую от одного и того же пациента. Повышенное число копий гена NRAS также может быть измерено относительно эталонного числа копий, указывающего на нормальную ситуацию.
Например, активирующая мутация может иметь результатом повышение копийности гена NRAS по меньшей мере на 1 по сравнению с контрольными клетками, такое как по меньшей мере 2, 3, 4, 5, 6, 7 или 8 по сравнению с клетками, не имеющими роста копийности. Копийность гена может показывать кратное повышение более чем в 1, более чем в 2, более чем в 3 или более чем в 4 раза.
Обнаружение мутаций и рост копийности
Согласно одному аспекту изобретения пациентов тестируют на наличие активирующей мутации NRAS, выбранной из любой одной или более из: мутации E63K NRAS и мутации G12V NRAS.
Согласно еще одному аспекту изобретения пациентов тестируют на наличие роста копийности NRAS.
Подходящие способы, посредством которых можно обнаруживать мутации или рост копийности, включают способы, выбранные из группы, состоящей из: секвенирования нового поколения (NGS); секвенирования экзома; аллель-специфической амплификации и матричной сравнительной геномной гибридизации (aCGH).
Более конкретно, в подходящем воплощении присутствие активирующей мутации NRAS, выбранной из мутации E63K NRAS, мутации G12V NRAS и мутации G12R NRAS, может быть обнаружено посредством NGS, аллель-специфической амплификации или секвенирования экзома. В подходящем воплощении рост копийности NRAS можно определять посредством CGH.
Понятно, что пациента можно тестировать на наличие такой мутации путем анализа на наличие у пациента любого подходящего индикатора, который служит признаком мутации. Например, индикатор может представлять собой изменение в: последовательности или в количестве геномной ДНК (например в конкретном гене или регуляторном элементе экспрессии); последовательности или количестве конкретной мРНК (или соответствующем кДНК); последовательности или количестве белка; или активности белка, который служит признаком мутации. При необходимости, любое из приведенного выше может быть обнаружено путем анализа подходящего фрагмента геномной ДНК, мРНК (или соответствующей кДНК) или белка.
Регуляторный элемент экспрессии для гена относится к последовательности ДНК, которая функционально связана с геном и которая по меньшей мере частично регулирует экспрессию гена, например промотор или энхансерная последовательность.
Подходящий индикатор для определения одной или более из приведенных выше активирующих мутаций NRAS может представлять собой изменение в: последовательности гена NRAS или регуляторном элементе экспрессии для гена; в количестве (повышение) или последовательности мРНК NRAS, экспрессированной геном NRAS (или соответствующей ей кДНК); в количестве (повышение) или в последовательности белка NRAS; или активности белка NRAS (повышение). Подходящим индикатором для определения повышения копийности NRAS будет повышение числа копий присутствующего гена NRAS. При необходимости любое из приведенного выше может быть обнаружено путем анализа подходящего фрагмента геномной ДНК, мРНК (или соответствующей кДНК) NRAS или белка NRAS.
Без ограничения какой-либо теорией, полагают, что мутации NRAS у пациента имеют место в ДНК опухолевых клеток, обычно (одной из) опухолей, которые лечат у пациента. Таким образом, ДНК, мРНК или белок, которые анализируют, могут представлять собой ДНК, мРНК или белок, присутствующие или экспрессированные в такой опухолевой клетке, обычно геномную ДНК, NRAS, мРНК NRAS или белок NRAS.
Мутация может быть обнаружена при помощи любого подходящего способа. Обычно способ включает анализ образца, полученного от пациента, на наличие мутации (обычно путем анализа подходящего индикатора, как описано). Таким образом, данные способы можно выполнять in vitro. В некоторых случаях способ может включать получение подходящего образца от пациента.
Можно использовать любой подходящий образец, характерный для мутации. Например, образец может содержать клетку или ткань, которые являются, или предположительно являются, раковыми, или содержать нуклеиновую кислоту рака/опухоли. Таким образом, способы могут включать тестирование раковых ткани или клеток для определения наличия мутации. Обычно рак, на который ссылаются, представляет собой рак, по поводу которого лечат пациента. Подходящие образцы может получать при помощи биопсии или другой хирургической процедуры. Таким образом, образец может представлять собой биопсию опухоли. Раковые клетки или их ДНК могут в некоторых случаях присутствовать в циркулирующей крови и могут быть выделены из биологических жидкостей, таких как кровь, плазма, сыворотка или выпот в плевральной полости. Таким образом, способы могут включать тестирование биологических жидкостей, которые содержат либо раковые клетки, которые отслоились от опухолевой массы, либо циркулирующую свободную ДНК из таких раковых клеток, для определения присутствующей мутации.
Способы, которые вовлекают анализ на наличие изменения количества мРНК NRAS или белка NRAS (или его фрагмента), или на наличие изменения величины активности NRAS, или на наличие изменения копийности гена NRAS, обычно включают:
- определение уровня мРНК NRAS или белка NRAS (или фрагмента), или уровня активности NRAS, или копийности гена NRAS в подходящем образце;
- сравнение определенного уровня или копийности с эталонным значением; и
- определение присутствия роста копийности NRAS, если определенный уровень или копийность значительно больше эталонного значения.
Подходящее эталонное значение для уровня мРНК NRAS /белок/ активность NRAS можно получать на основании среднего уровня в контрольной популяции, соответствующей субъекту и типу образца. Специалист сможет выбрать подходящий контроль для получения требуемого эталонного значения.
Подходящее эталонное значение для копийности гена NRAS равно 2 (то есть две копии в клетке).
Определение наличия роста копийности NRAS
Любое повышение копийности NRAS может служить признаком повышенной резистентности к EGFR-опосредованной терапии рака, и такая повышенная резистентность может быть выявлена посредством определения повышения копийности гена NRAS. Копийность гена NRAS можно анализировать непосредственно, или копийность гена NRAS можно определять опосредовано путем анализа другого индикатора, который служит признаком копийности гена NRAS.
Как указывалось выше, наличие роста копийности NRAS может быть обнаружена посредством анализов aCGH. Альтернативно, рост копийности NRAS может быть обнаружен посредством секвенирования ДНК ракового пациента.
Рост копийности NRAS также можно обнаруживать путем определения повышения количества мРНК NRAS или белка NRAS, или повышения величины активности NRAS. Количество мРНК NRAS или белка NRAS можно анализировать непосредственно в подходящем образце. Альтернативно, подходящий образец может анализировать на наличие другого индикатора, который служит признаком количества мРНК NRAS или белка NRAS.
Уровни мРНК или белка можно определять посредством любого подходящего способа, известного специалисту в данной области техники.
Только в качестве примера, уровень белка (например белка NRAS) у субъекта можно определять с помощью анализа, при котором обнаруживают белок, и определять имеющийся уровень посредством связывания белка со специфическим партнером связывания. Партнер связывания может быть меченым непосредственно или опосредованно.
Антитела или фрагменты антител, которые связываются с белком, представляют собой особенно подходящие примеры таких партнеров связывания, и их используют в иммунологических анализах. Подходящие примеры иммунологических анализов этого вида, которые можно применять в способах по изобретению, включают анализы, выбранные из группы, состоящей из: иммуносорбентного анализа с ферментной меткой (ELISA), радиоиммунологического анализа (RIA) и мультиплексных иммунологических анализов (таких как анализы Luminex™, созданные в Luminex Corporation).
Антитело для специфического связывания с NRAS может представлять собой антитело, полученное из гибридомы. Способы получения гибридом хорошо известны специалисту в данной области техники. После того как желательная гибридома была выбрана и клонирована, полученное антитело продуцируют путем in vitro культивирования желательной гибридомы в подходящей среде. В качестве альтернативного способа желательную гибридому можно инъецировать непосредственно в мышей для получения концентрированных количеств антител.
Патенты, относящиеся к моноклональным антителам против опухолей человека, полученным посредством гибридомной техники, включают US 4182124 и 4196265. Характерным для данного уровня техники касательно моноклональных антител, которые имеют специфичность в отношении антигенов на клетках карциномы, является US 4350683.
Кроме того, специалисту будет понятно, что существует множество имеющихся в продаже антител, специфичных в отношении NRAS, и что их может применять без необходимости производить новые антитела.
Анализы, которые можно использовать для определения количества мРНК NRAS в образце, включают количественную ПЦР в реальном времени. Только в качестве примера, авторами изобретения было обнаружено, что этот способ можно применять на практике, используя имеющиеся в продаже праймеры Taqman и зонды от ABI Lifetechnologies.
Любую подходящую активность NRAS можно анализировать для определения повышения. В одном аспекте анализируют активность ГТФазы NRAS, чтобы оценить, проявляется ли или не проявляется повышение.
Определение присутствия мутации E63K NRAS
В нуклеиновой кислоте
Наличие мутации E63K NRAS у пациента может быть определено посредством обнаружения соответствующей мутации в кодирующей ген NRAS последовательности. Это может включать, например, обнаружение мутации в самой последовательности геномной ДНК, или в соответствующей экспрессированной мРНК (или соответствующей кДНК), или в подходящем фрагменте любого из этих полинуклеотидов, где фрагмент охватывает мутацию нуклеиновой кислоты, кодирующую мутацию E63K. Мутация также может быть обнаружена в нуклеиновой кислоте, которая была реплицирована на основе тестируемой последовательности с применением амплификации, такой как полимеразная цепная реакция. Например, праймеры обеих сторон последовательности NRAS, кодирующей кодон 63 NRAS, используют для амплификации до целевой последовательности, и наличие или отсутствие мутации можно распознать по этой реакции амплификации или по продукту этой амплификации. Сайт мутации для мутации нуклеиновой кислоты, кодирующей мутацию E63K, обычно находится в кодоне 63 последовательности, кодирующей NRAS. Это можно понимать как замену любого из оснований, соответствующих основаниям 441-443 в NRAS-кодирующей последовательности кДНК, которая имеет результатом кодированный лизин. В частности, мутация может иметь место в положении, соответствующем основанию 441 в кДНК, кодирующей NRAS.
Мутация может представлять собой замену гуанина (G) на аденин (A) (G на А, соответствующий уридину в мРНК) в кодоне 63 в последовательности, кодирующей NRAS. В частности, замена может представлять собой замену G на А в положении, соответствующем основанию 441 в NRAS, кодирующем последовательность кДНК, например, замену GAG на AAG в положении, соответствующем нуклеотидам 441-443. Замена может представлять собой двойную замену G на А в положении, соответствующем основанию 441 и 443 в последовательности кДНК, кодирующей NRAS, например, замену GAG на AAA в положении, соответствующем нуклеотидам 441-443.
Мутация нуклеиновой кислоты согласно изобретению может быть обнаружена посредством любого подходящего способа. Обычно подходящий способ включает амплификацию представляющего интерес участка нуклеиновой кислоты, то есть последовательность нуклеиновых кислот, содержащую полиморфный локус. Можно использовать любой подходящий способ амплификации, например, ПЦР-амплификацию, аллель-специфическую амплификацию, амплификацию, основанную на последовательности нуклеиновых кислот (NASBA), активированную лигированием амплификацию (LAT), лигазную цепную реакцию (LCR) с использованием системы Q-бета-репликазы, амплификацию нуклеиновых кислот на основе цепной реакции/репарации (RCR) или амплификацию нуклеиновых кислот путем активации замещения цепи (SDA). Предпочтительно используют ПЦР-амплификацию.
Праймеры для ПЦР-амплификации последовательности нуклеиновых кислот, охватывающей сайт мутации, описанный выше в данном описании изобретения, могут быть получены специалистом в данной области техники, используя, например, последовательность гена NRAS или последовательность кДНК NRAS. Такая пара праймеров для ПЦР гибридизуется в подходящих условиях ПЦР с полинуклеотидом, кодирующим полипептид NRAS или его фрагмент, так что праймеры захватывают в вилку сайт мутации.
Подходящий праймер для ПЦР обычно гибридизуется в подходящих условиях ПЦР со смысловой цепью или антисмысловой цепью полинуклеотидной последовательности в 5' каждой соответствующей цепи до сайта мутации. Праймер для ПЦР может связывать максимум примерно до 200 нуклеотидов мутации. Любой образец нуклеиновой кислоты, в очищенной или неочищенной форме, можно использовать в качестве исходной нуклеиновой(ых) кислот(ы), при условии, что она содержит или предполагается содержащей конкретную последовательность нуклеиновых кислот, содержащую полиморфный локус. Таким образом, в процессе может амплифицироваться, например, ДНК или РНК, включая информационную РНК, где ДНК или РНК может представлять собой одноцепочечную или двухцепочечную. В том случае, если РНК предназначена для применения в качестве матрицы, можно использовать ферменты и/или условия, оптимальные для обратного транскрибирование матрицы в кДНК. Кроме того, можно использовать гибрид ДНК-РНК, который содержит одну цепь каждой. Способ может, например, вовлекать извлечение нуклеиновых кислот для анализа из подходящего образца пациента. Например, мРНК может быть извлечена и соответствующая кДНК (вся или часть мРНК) получена посредством обратной транскрипции. Способы для извлечения мРНК и получения кДНК известны в данной области техники и описаны в данном описании изобретения.
Обнаружение мутации нуклеиновой кислоты, описанной в данном описании изобретения, обычно включает приведение в контакт нуклеиновых кислот со средством для селективного обнаружения мутации. Обычно такое средство отличает мутантную последовательность в сайте мутации от последовательности дикого типа в этом сайте. Средство можно иметь метку для обнаружения.
Таким образом, способ обнаружения мутации нуклеиновой кислоты, кодирующей E63K, может включать приведение подходящего образца в контакт со средством для селективного обнаружения нуклеотидной последовательности, содержащей мутант G в положении, соответствующем основанию 441 NRAS, кодирующего кДНК, и идентифицирования того, что основание в этом положении представляет собой А. Обычно средство различает, где мутант Т, а где С дикого типа в этом положении.
Средство может представлять собой, например, праймер для ПЦР, олигонуклеотидный зонд, или средство сиквенс-специфического расщепления, такие как любое из описанных в данном описании изобретения.
В некоторых случаях сам способ амплификации можно использовать для отличия мутанта от последовательности нуклеиновых кислот дикого типа, например, амплификация может быть селективной в отношении нуклеиновой кислоты, содержащей мутацию, при использовании, например, аллель-специфической амплификации или других подходящих способов, которые известны в данной области техники.
Например, ПЦР-амплификацию можно выполнять, используя праймер для ПЦР, который связывается селективно с мутантной нуклеиновой кислотой, но не с нуклеиновой кислотой дикого типа в подходящих для ПЦР условиях. Обычно такой праймер гибридизуется в подходящих для ПЦР условиях с последовательностью смысловой цепи или с последовательностью антисмысловой цепи NRAS-кодирующего полинуклеотида или его фрагмента, содержащего мутацию в сайте мутации, но гибридизуется слабо или совсем не гибридизуется со вторым полинуклеотидом NRAS, который представляет собой дикий тип в этом положении, в условиях ПЦР.
Например, селективный праймер для ПЦР может гибридизоваться в подходящих для ПЦР условиях с последовательностью смысловой цепи или с последовательностью антисмысловой цепи NRAS-кодирующего полинуклеотида или его фрагмента, который включает мутант А в положении, соответствующем основанию 441 NRAS, кодирующего кДНК, но гибридизуется слабо или совсем не гибридизуется со вторым NRAS-кодирующим полинуклеотидом, содержащим G дикого типа в этом положении, в условиях ПЦР.
ПЦР-амплификацию можно выполнять, используя этот праймер и подходящий второй праймер для получения ампликона ПЦР, содержащего мутацию (например, мутант Т) в сайте мутации. Обнаружение ампликона, таким образом, указывает на наличие мутации.
Согласно одному аспекту изобретения предлагается олигонуклеотид, способный селективно гибридизоваться с последовательностью нуклеиновых кислот, которая кодирует лизин в положении, соответствующем положению 63 белка NRAS. В одном воплощении олигонуклеотид способен гибридизоваться, в подходящих условиях, с последовательностью смысловой цепи или с последовательностью антисмысловой цепи NRAS-кодирующего полинуклеотида или его фрагмента, который включает мутант А в положении, соответствующем основанию 441 NRAS, кодирующего кДНК, но гибридизуется слабо или совсем не гибридизуется со вторым NRAS кодирующим полинуклеотидом, содержащим G дикого типа в этом положении. Олигонуклеотид может содержать или быть ассоциирован с выявляемой меткой. В одном воплощении олигонуклеотид применяется или является подходящим для применения в качестве праймера в реакции ПЦР. В другом воплощении олигонуклеотид применяется или является подходящим для применения в качестве гибридизационного зонда.
Согласно другому аспекту изобретения предложен олигонуклеотид, способный селективно гибридизоваться с последовательностью нуклеиновых кислот, которая кодирует лизин в положении, соответствующем положению 63 белка NRAS, для применения в способе определения того, имеет ли пациент нуклеиновую кислоту, которая кодирует замену E63K в белке NRAS, или нет.
Согласно другому аспекту изобретения предложен олигонуклеотид, способный селективно гибридизоваться с последовательностью нуклеиновых кислот, которая кодирует лизин в положении, соответствующем положению 63 белка NRAS, для применения в способе отбора пациента для комбинированного лечения ингибитором EGFR и ингибитором MEK, как описано здесь.
Реакция ПЦР может включать выявляемую метку в ампликон ПЦР, и способ может включать обнаружение метки.
В других случаях амплифицированные последовательности можно дополнительно анализировать, либо в растворе, либо после связывания с твердой подложкой, путем любого способа, обычно применяемого для обнаружения специфической последовательности ДНК, таким как ПЦР, олигомерная рестрикция (Saiki, et. al., Bio/Technology, 3:1008-1012, (1985)), анализ с применением аллель-специфического олигонуклеотидного (ASO) зонда (Conner, et. al., Proc. Natl. Acad. Sci. U.S.A., 80:278, (1983)), анализы лигирования олигонуклеотидов (OLAs) (Landgren, et. al., Science, 241:1007, (1988)) и подобными. Были рассмотрены молекулярные способы анализа ДНК (Landgren, et. al., Science, 242:229-237, (1988)).
В одном примере целевую нуклеиновую кислоту можно подвергать ПЦР-амплификации, используя по меньшей мере один аллель-специфический (селективный в отношении мутации) праймер для ПЦР, как описано выше.
В другом примере селективный в отношении мутации олигонуклеотидный зонд (иногда называемый аллель-специфическим зондом) может использоваться для обнаружения мутировавшей нуклеиновой кислоты. В таком способе амплифицированную нуклеиновую кислоту приводят в контакт с олигонуклеотидным зондом, который гибридизуется селективно с нуклеиновой кислотой, содержащей мутацию в сайте мутации, но гибридизуется слабо или совсем не гибридизуется с нуклеиновой кислотой дикого типа в сайте мутации в подходящих условиях гибридизации. Обнаружение связывания зонда с нуклеиновой кислотой указывает на наличие мутации.
Либо средство в виде зонда, либо нуклеиновые кислоты можно иммобилизовать перед стадией приведения в контакт. В таком способе компонент, который связывается с иммобилизованным партнером, обычно является меченым, и определение наличия мутации включает обнаружение метки.
Подходящий олигонуклеотидный зонд для применения в способе может, например, гибридизоваться с полинуклеотидом, кодирующим NRAS, или его фрагментом, где последовательность зонда включает основание, комплементарное мутанту А в положении, соответствующем основанию 441 кДНК NRAS, и где зонд гибридизуется слабо или совсем не гибридизуется с полинуклеотидом, содержащим С дикого типа в этом положении, в подходящих условиях гибридизация.
Способы разработки аллель-специфических олигонуклеотидных зондов известны в данной области техники. Обычно они представляют собой короткие одноцепочечные полинуклеотиды, сконструированные для гибридизации именно с целевой последовательностью при данной комбинации условий. Праймер или зонд для применения в данном описании изобретения обычно представляет собой короткий одноцепочечный полинуклеотид, который гибридизуется конкретно с целевой последовательностью при данной комбинации условий. Праймер или зонд обычно имеет в длину по меньшей мере 8 нуклеотидов, например, по меньшей мере 10, 12, 14, 16, 18, 20, 30 нуклеотидов вплоть до примерно 50 нуклеотидов. Зонд или праймер может быть длиной, например, не более 15, 20, 25 или 20 нуклеотидов, такой как 8-15, 10-20 или 10-30 нуклеотидов. Аллель-специфический олигонуклеотидный зонд может представлять собой, например, 14-17 пар оснований, такой как, например, примерно 17 оснований.
Способы обнаружения мутации нуклеиновых кислот в данном описании изобретения могут также включать крупномасштабные способы на основе последовательностей в чипе на матрице (large-scale chip array sequence-based techniques). Обзор различий в применении и разработке чипов на матрице рассматривается в Southern, Е.М., Trends In Genetics, 12:110-115 (March 1996) and Cheng et al., Molecular Diagnosis, 1:183-200 (September 1996). Дополнительная методика крупномасштабного анализа «ДНК-чипов» подробно описана в Hacia et al., Nature Genetics, 14:441-447 (1996).
Мутация E63K NRAS, описанная здесь, может быть обнаружена путем анализа на наличие замены глутаминовой кислоты (Е) на лизин (К) в положении аминокислоты, соответствующем аминокислоте Е63 в аминокислотной последовательности белка NRAS или его подходящего фрагмента, включающего аминокислоту 63. Он может быть выполнен любым подходящим способом.
Например, присутствие белка NRAS (или его фрагмента), имеющего мутацию E63K, можно определять путем анализа, в котором мутировавший белок NRAS или его фрагмент обнаруживают по связыванию мутировавшего белка NRAS или его фрагмента со специфическим партнером связывания. Специфический партнер связывания связывается с мутантным белком NRAS или фрагментом, имеющим мутацию E63K, а не с белком или фрагментом NRAS без мутации. Партнер связывания может быть меченым непосредственно или опосредовано.
Антитела или фрагменты антител, которые связываются с мутантным белком, представляют собой особенно подходящие примеры таких партнеров по связыванию, и они подлежат применению в иммунологических анализах. Подходящие примеры иммунологических анализов это вида, которые можно применять в способах по изобретению, включают анализы, выбранные из группы, состоящей из: иммуносорбентного анализа с ферментной меткой (ELISA); радиоиммунологического анализа (RIA); и мультиплексных иммунологических анализов (таких как анализы Luminex™, созданные в Luminex Corporation). Можно также применять вестерн-блоттинг.
Антитело для обнаружения конкретного мутанта E63K NRAS может представлять собой антитело, полученное из гибридомы. Способы получения антител из гибридом описаны в другом месте в данном описании изобретения.
Согласно одном аспекту изобретения предложено антитело, способное селективно связываться с полипептидом EGFR, который содержит лизин в положении, соответствующем положению 63 белка NRAS, где антитело предпочтительно связывается с полипептидом, имеющим лизин в положении, соответствующем положению 63 белка NRAS, а не с полипептидом, имеющим в указанном положении глутаминовую кислоту.
Согласно другому аспекту изобретения предлагается антитело, способное селективно связываться с полипептидом EGFR, который содержит лизин в положении, соответствующем положению 63 белка NRAS, для применения в способе определения того, имеет ли пациент или не имеет белок NRAS с лизином, соответствующим положению 63 белка NRAS, где антитело предпочтительно связывается с полипептидом, имеющим лизин в положении, соответствующем положению 63 белка NRAS, а не с полипептидом, имеющим в указанном положении глутаминовую кислоту. В конкретном воплощении такой способ применяют для отбора пациента для комбинированного лечения ингибитором EGFR и ингибитором MEK, как описано здесь.
Анализ может включать приведение в контакт специфического партнера по связыванию с подходящим образцом, таким как любой из образцов, описанных в данном описании изобретения. В некоторых примерах белки в целом или конкретно белок NRAS можно сначала извлекать из образца пациента, и приводить специфический партнер по связыванию в контакт с белковым экстрактом. Способы извлечения белка известны в данной области техники. Белок NRAS можно извлекать из образца пациента любым подходящим способом. Например, можно использовать антитела, связывающиеся конкретно с белком NRAS. Антитела, связывающие NRAS, можно получать с использованием гибридом, применяя способы, аналогичные описанным выше.
Извлеченные белок или белки можно рассматривать как выделенные. Термин "выделенный" при использовании в данном описании изобретения обычно обозначает биологический компонент (такой как молекула нуклеиновой кислоты или белок), который по существу был отделен или очищен от других биологических компонентов в клетке организма, в которой этот компонент находится в природе, то есть от других хромосомной и внехромосомной ДНК и РНК и белков. В одном аспекте извлеченные белки или нуклеиновые кислоты были отделены в объеме, в котором они могут взаимодействовать с реагентами в желательной реакции, например с праймером или зондом, или с антителом. Нуклеиновые кислоты и белки, которые были "выделены", включают нуклеиновые кислоты и белки, очищенные путем стандартным способов очистки. Термин также охватывает нуклеиновые кислоты и белки, полученные посредством рекомбинантной экспрессии в хозяйской клетке, а также химически синтезированные нуклеиновые кислоты, белки и пептиды.
В другом примере присутствие белка NRAS (или его фрагмента), имеющего мутацию E63K, можно определять путем анализа, в котором определяют аминокислотную последовательность белка NRAS или фрагмент с аминокислотой 63, например, посредством секвенирования аминокислот или используя средство сиквенс-специфического расщепления.
В таком анализе белок NRAS или его фрагмент, охватывающий аминокислоту 63, обычно выделяют из образца пациента, применяя способы, описанные в данном описании изобретения выше. Выделенные белок или фрагмент можно затем подвергать секвенированию по меньшей мере в части определения аминокислоты в положении 63. Подходящие способы секвенирования известны в данной области техники.
Определение присутствия мутации G12V NRAS
В нуклеиновой кислоте
Наличие мутации G12V NRAS у пациента можно определять путем обнаружения соответствующей мутации в последовательности, кодирующей ген NRAS.
Способы, описанные выше по отношению к мутации E63K, применяют, с соответствующими изменениями, к мутации G12V, за исключением положения сайта мутации.
Сайт мутации для мутации нуклеиновой кислоты, кодирующей мутацию G12V, обычно находится в кодоне 12 последовательности, кодирующей NRAS. Это можно понимать как замену любого из оснований, соответствующих основаниям 288-290 в последовательности кДНК NRAS, которая имеет результатом валин. В частности, мутация может иметь место в положении, соответствующем основанию 289 в кДНК NRAS.
Мутация может представлять собой замену G на Т в кодоне 12 в последовательности, кодирующей NRAS. В частности, замену может представлять собой замену G на Т в положении, соответствующем основанию 289 в последовательности кДНК NRAS, например, замену GGT на GTT в положении, соответствующем нуклеотидам 288-290.
Согласно одному аспекту изобретения предложен олигонуклеотид, способный селективно гибридизоваться с последовательностью нуклеиновых кислот, которая кодирует валин в положении, соответствующем положению 12 белка NRAS. В одном воплощении олигонуклеотид способен гибридизоваться в подходящих условиях с последовательностью смысловой цепи или с последовательностью антисмысловой цепи NRAS-кодирующего полинуклеотида или его фрагмента, который включает мутант Т в положении, соответствующем основанию 289 кДНК, кодирующей NRAS, но гибридизуется слабо или совсем не гибридизуется со вторым кодирующим NRAS полинуклеотидом, содержащим G дикого типа в этом положении Олигонуклеотид может содержать детектируемую метку или быть связанным с ней. В одном воплощении олигонуклеотид применяется или является подходящим для применения в качестве праймера в реакции ПЦР. В другом воплощении олигонуклеотид применяется или является подходящим для применения в качестве гибридизационного зонда.
Согласно другому аспекту изобретения предложен олигонуклеотид, способный селективно гибридизоваться с последовательностью нуклеиновых кислот, которая кодирует валин в положении, соответствующем положению 12 белка NRAS, для применения в способе определения того, имеет ли пациент нуклеиновую кислоту, которая кодирует замену G12V в белке NRAS.
Согласно другому аспекту изобретения предложен олигонуклеотид, способный селективно гибридизоваться с последовательностью нуклеиновых кислот, которая кодирует валин в положении, соответствующем положению 12 белка NRAS, для применения в способе отбора пациента для комбинированного лечения ингибитором EGFR и ингибитором MEK, как описано здесь.
В белке
Мутация G12V NRAS, описанная в данном описании изобретения, может быть обнаружена путем анализа на наличие замены глицина (G) на валин (V) в положении аминокислот, соответствующем G12 в аминокислотной последовательности белка NRAS или ее подходящем фрагменте, охватывающем аминокислоту 12. Это может быть выполнено посредством любого подходящего способа.
Способы, описанные выше по отношению к мутации E63K, применяют, с соответствующими изменениями, к мутации G12V, за исключением положения сайта мутации.
Определение наличия мутации G12V может также включать определение повышения количества белка NRAS.
Согласно одному аспекту изобретения предложено антитело, способное селективно связываться с полипептидом EGFR, который содержит валин в положении, соответствующем положению 12 белка NRAS, где антитело предпочтительно связывается с полипептидом, имеющим валин в положении, соответствующем положению 12 белка NRAS, а не с полипептидом, имеющим в указанном положении глицин.
Согласно другому аспекту изобретения предложено антитело, способное селективно связываться с полипептидом EGFR, который содержит валин в положении, соответствующем положению 12 белка NRAS, для применения в способе определения того, имеет ли пациент белок NRAS с валином в положении, соответствующем положению 12 белка NRAS, где антитело предпочтительно связывается с полипептидом, имеющим валин в положении, соответствующем положению 12 белка NRAS, а не с полипептидом, имеющим в указанном положении глицин. В конкретном воплощении такой способ применяют для отбора пациента для комбинированного лечения ингибитором EGFR и ингибитором MEK, как описано здесь.
Определение наличия мутации G12R NRAS
В нуклеиновой кислоте
Наличие мутации G12R NRAS у пациента можно определять посредством обнаружения соответствующей мутации в кодирующей ген NRAS последовательности.
Способы, описанные выше по отношению к мутации E63K, применяют с соответствующими изменениями к мутации G12V, за исключением положения сайта мутации.
Сайт мутации для мутации нуклеиновой кислоты, кодирующей мутацию G12R, обычно находится в кодоне 12 последовательности, кодирующей NRAS. Это можно понимать как замену любого из оснований, соответствующих основаниям 288-290 в последовательности кДНК NRAS, которая имеет результатом аргинин. В частности, мутация может иметь место в положении, соответствующем основанию 288 в кДНК NRAS.
Мутация может представлять собой замену G на С в кодоне 12 в кодирующей NRAS последовательности. В частности, замена может представлять собой замену G на С в положении, соответствующем основанию 288 в последовательности кДНК NRAS, например, замену GGT на CGT в положении, соответствующем нуклеотидам 288-290.
В белке
Мутацию G12R NRAS, описанную в данном описании изобретения, можно обнаруживать путем анализа на наличие замены глицина (G) на аргинин (R) в положении аминокислоты, соответствующем G12 в аминокислотной последовательности белка NRAS или его подходящего фрагмента, охватывающего аминокислоту 12. Это может быть выполнено любым подходящим способом.
Способы, описанные выше применительно к мутации E63K, применяют с соответствующими изменениями к мутации G12R, за исключением положения сайта мутации.
Определение наличия мутации G12R может также включать определение повышения количества белка NRAS.
Лечение согласно изобретению
Согласно изобретению, пациентов, имеющих ассоциированное с EGFR раковое заболевание, которые имеют активирующую мутацию NRAS или рост копийности гена NRAS согласно изобретению, можно эффективно лечить при помощи комбинации ингибитора EGFR и ингибитора MEK.
Обычно раковый пациент с мутацией NRAS или с ростом копийности гена NRAS уже получил или получает терапию с ингибитором EGFR. Пациент может демонстрировать симптомы приобретенной резистентности к лечению одним ингибитором EGFR. В этой ситуации ингибитор EGFR в комбинированном препарате может представлять собой такой же ингибитор, который применяли в лечении пациента (и к которому пациент имеет приобретенную резистентность). Однако в лечении также предусматривается, что ингибитор EGFR в комбинированном препарате представляет собой ингибитор, отличный от ингибитора, примененного в лечении. В таком случае ингибитор EGFR в комбинированном препарате обычно принадлежит к тому же поколению или к более новому поколению, чем ингибитор EGFR, применяемый в лечении пациента, и к которому была приобретена резистентность.
В другом воплощении после определения наличия мутации E63K, G12V, G12R, G12A, G12D, G12S или G12C NRAS или роста копийности гена NRAS у пациента, в изобретении также предложена терапия первой линии для ассоциированного с EGFR рака у пациента, который еще не получал лечение ингибитором EGFR. В этой терапии первой линии комбинацию EGFR ингибитора и ингибитора MEK вводят пациенту с целью замедления или предупреждения развития приобретенной резистентности к ингибитору EGFR (например, при наличии мутации NRAS, как описано здесь).
В еще одном воплощении ингибитор EGFR выбран из AZD9291 и CO1686 или фармацевтически приемлемой соли любого из них.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или CO1686, или фармацевтически приемлемую соль любого из них, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В другом воплощении после определения присутствия активирующей мутации E63K или G12V NRAS, или роста копийности гена NRAS у пациента, в изобретении также предложена терапия первой линии для ассоциированного с EGFR рака у пациента, который еще не получал лечение ингибитором EGFR. В такой терапии первой линии комбинацию ингибитора EGFR и ингибитора MEK вводят пациенту с целью замедления или предупреждения развития приобретенной резистентности к ингибитору EGFR (например, при наличии активирующей мутации NRAS, как описано здесь).
В данных способах комбинацию ингибитора EGFR и ингибитора MEK вводят пациенту в терапевтически эффективном количестве.
Понятно, что ссылка в данном описании изобретения на комбинированный препарат, содержащий ингибитор EGFR и ингибитор MEK, включает комбинацию, содержащую один или более ингибиторов EGFR и один или более ингибиторов MEK, и что комбинация ингибитора EGFR и ингибитора MEK или комбинация, содержащая их, охватывает комбинацию одного или более ингибиторов EGFR и/или одного или более ингибиторов MEK. Конкретные комбинации ингибиторов EGFR и ингибиторов MEK рассматриваются в другом месте в этом документе.
Ингибиторы MEK
Ингибитор MEK при использовании в данном описании изобретения обычно имеет активность, которая ингибирует путь Ras/Raf/MEK/ERK. Ингибитор может действовать на компонент на любой стадии пути, путем ингибирования, например, экспрессии и/или активности компонента пути.
Ингибитор MEK может представлять собой, например, низкомолекулярное соединение.
Ингибитор MEK может ингибировать экспрессию гена, например, мешая стабильности или трансляции мРНК. Ингибитор MEK можно выбирать из антисмыслового олигонуклеотида, малой интерферирующей РНК (миРНК), которая иногда известна как короткая интерферирующая РНК или РНК-сайленсинг, или короткая шпилечная РНК (кшРНК), которая иногда известна как малая шпилечная РНК. Такой ингибитор MEK может ингибировать экспрессию гена mek1 и/или mek2, например, мешая стабильности или трансляции мРНК.
Обычно ингибитор снижает экспрессию или активность по меньшей мере на выявляемую в подходящем анализе величину. Ингибитор может, например, снижать экспрессию или активность по меньшей мере на 10, 20, 30, 40, 50, 60, 70, 80 или по меньшей мере на 90%.
Подходящие примеры ингибиторов MEK рассматриваются на следующих страницах этого описания изобретения. Без ограничения, ингибиторы MEK, подходящие для применения в контексте настоящего изобретения, включают ингибиторы, выбранные из группы, состоящей из: селуметиниба; траметиниба; MEK-162 и кобиметиниба, а также фармацевтически приемлемых солей этих ингибиторов.
Селуметиниб
Химическая структура селуметиниба представляет собой:
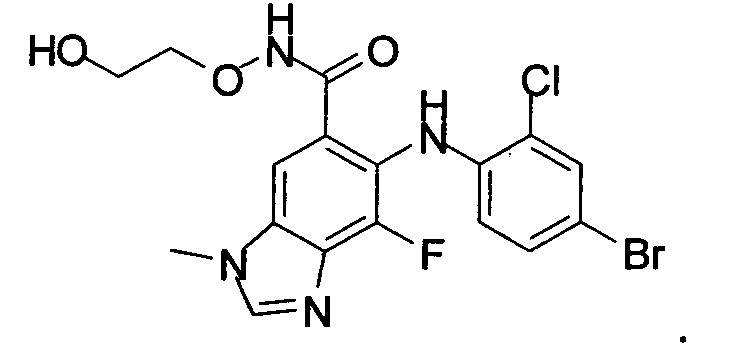
Он также может известен под химическим названием: «(6-(4-бром-2-хлор-фениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты (2-гидрокси-этокси)-амид)». Аналогичным образом, он также может быть известен под химическим названием: «5-[(4-бром-2-хлорфенил)амино]-4-фтор-N-(2-гидроксиэтокси)-1-метил-1Н-бензимидазол-6-карбоксамид».
Селуметиниб также может быть представлен в форме фармацевтически приемлемой соли, такой как гидросульфатная соль; то есть селуметиниба гидросульфат (то есть 1:1 лекарственное средство:H2SO4). В подходящем воплощении ингибитор MEK может содержать селуметиниб или его фармацевтически приемлемые соли, такие как гидросульфатная соль.
Траметиниб
Химическая структура траметиниба представляет собой:

Он также может быть известен под химическим названием: N-(3-{3-циклопропил-5-[(2-фтор-4-йодофенил)амино]-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидропиридо[4,3-d]пиримидин-1(2Н)-ил}фенил)ацетамид.
Траметиниб также может быть представлен в форме фармацевтически приемлемой соли, и, если в контексте требуется иное, ссылки на траметиниб в данном описании изобретения также должны охватывать такие фармацевтически приемлемые соли.
MEK-162
Химическая структура MEK-162 представляет собой:
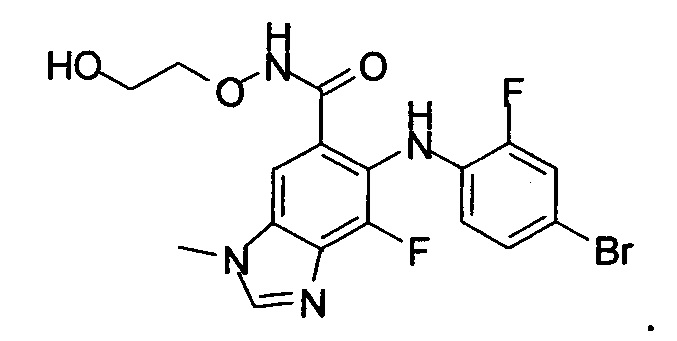
Он также может быть известен под химическим названием: 5-[(4-бром-2-фторфенил)амино]-4-фтор-N-(2-гидроксиэтокси)-1-метил-1Н-бензимидазол-6-карбоксамид. MEK-162 также может быть представлен в форме фармацевтически приемлемой соли, и, если в контексте не требуется иное, ссылки на MEK-162 в данном описании изобретения также должны охватывать такие фармацевтически приемлемые соли.
Кобиметиниб
Химическая структура кобиметиниба представляет собой:

Кобиметиниб также может быть известен под химическим названием: {3,4-дифтор-2-[(2-фтор-4-йодофенил)амино]фенил}{3-гидрокси-3-[(2S)-пиперидин-2-ил]азетидин-1-ил}метанон.
Кобиметиниб также может быть представлен в форме фармацевтически приемлемой соли, такой как фумаратная соль кобиметиниба (2:1 лекарственное средство: фумаровая кислота). Если в контексте требуется иное, ссылки на кобиметиниб в данном описании изобретения также должны охватывать такие фармацевтически приемлемые соли, такие как фумаратная соль.
В подходящем воплощении ингибитор MEK может ингибировать активность как MEK1, так и MEK2 (так называемый "ингибитор MEK1/2"). В одном аспекте ингибитор MEK может ингибировать экспрессию и/или активность белка MEK1 или MEK2.
MEK1
MEK1 при использовании в данном описании изобретения относится к митоген-активируемой протеинкиназе киназе 1.
MEK1 может принадлежать любому из видов, соответствующих видам, подлежащим лечению. В одном аспекте MEK1 представляет собой человеческий MEK1.
Человеческий ген MEK1 (дикого типа) описан в Gene ID: 5604. Человеческий ген mekl дикого типа обычно имеет продукт экспрессии мРНК с последовательностью, соответствующей последовательности кДНК MEK1 в GenBank с учетным номером НМ_002755.3, и продукт экспрессии белка, имеющий аминокислотную последовательность белка MEK1 в UniProtKB/Swiss-Prot Q02750. В последовательности кДНК MEK1, представленной в GenBank с учетным номером НМ_002755.3, последовательность, кодирующая белок, показана в нуклеотидах 476-1657. Консенсусная кодирующая последовательность также присутствует в базе данных CCDS под учетным номером CCDS10216.1
Ссылка в данном описании изобретения на мРНК, кДНК гена mek1 (гена MEK1) или на белок MEK1 может относиться к этому человеческому гену, мРНК или соответствующей последовательности кДНК, или белку.
MEK1 может в некоторых случаях также относиться к варианту любого из приведенных выше, такому как встречающийся в природе вариант.
Приведенное выше применяется с соответствующими изменениями для MEK1 нечеловеческих видов. Например, ссылка в данном описании изобретения на ген mek1, мРНК, кДНК или белок MEK1 может относиться к виду-гомологу приведенного выше человеческого гена, мРНК или белка.
MEK2
MEK2 при использовании в данном описании изобретения относится к митоген-активируемой протеинекиназе киназе 2.
MEK2 может принадлежать любому из видов, соответствующих видам, подлежащим лечению. В одном аспекте MEK2 представляет собой человеческий MEK2.
Человеческий ген MEK2 (дикого типа) описано в Gene ID: 5605. Человеческий ген mek2 дикого типа обычно имеет продукт экспрессии мРНК с последовательностью, соответствующей последовательности кДНК MEK2 в GenBank с учетным номером НМ_030662.3, и продукт экспрессии белка, имеющий аминокислотную последовательность белка MEK2 в UniProtKB/Swiss-Prot Р36507. В последовательности кДНК MEK2 в GenBank с учетным номером НМ_030662.3 последовательность, кодирующая белок, показана в нуклеотидах 255-1457. Консенсусная кодирующая последовательность также представлена в базе данных CCDS под учетным номером CCDS12120.1.
Ссылка в данном описании изобретения на ген mek2 (ген MEK2), мРНК, кДНК или белок MEK2 может относиться к этому человеческому гену, мРНК или соответствующей последовательности кДНК, или белку.
MEK2 может в некоторых случаях также относиться к варианту любого из приведенных выше, такому, как встречающийся в природе вариант.
Приведенное выше применяется с соответствующими изменениями для MEK2 отличных от человеческих видов. Например, ссылка в данном описании изобретения на ген mek2, мРНК, кДНК или белок MEK2 может относиться к виду-гомологу приведенного выше человеческого гена, мРНК или белка.
Ингибиторы MEK1 и MEK2
Ингибитор MEK может ингибировать любую подходящую активность MEK1 или MEK2, например, активность протеинкиназы. Ингибирование активности протеинкиназы может быть определено в подходящем анализе, например, как описано в Yen et al. Clin Cancer Res March 1, 2007 13; 1576.
Ингибитор MEK может быть выбран, например, из любого АТФ-конкурентного ингибитора MEK, не-АТФ конкурентного ингибитора MEK, или АТФ-неконкурентного ингибитора MEK.
Подходящие ингибиторы MEK, которые ингибируют активность MEK1 и/или MEK2, включают селуметиниб.
Специальные комбинации ингибиторов EGFR и ингибиторов MEK для применения у пациентов, чьи опухоли, как обнаружено, содержат мутации E63K, G12V, G12R, G12A, G12D, G12S или G12C NRAS или рост копийности гена NRAS.
В подходящем воплощении комбинированный препарат может содержать TKI EGFR гефитиниб (или его фармацевтически приемлемую соль) и ингибитором MEK селуметиниб (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR гефитиниб (или его фармацевтически приемлемую соль) и ингибитор MEK траметиниб (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR гефитиниб (или его фармацевтически приемлемую соль) и ингибитор MEK MEK-162 (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR гефитиниб (или его фармацевтически приемлемую соль) и ингибитор MEK кобиметиниб (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR эрлотиниб (или его фармацевтически приемлемую соль) и ингибитор MEK селуметиниб (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR эрлотиниб (или его фармацевтически приемлемую соль) и ингибитор MEK траметиниба (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR эрлотиниб (или его фармацевтически приемлемую соль) и ингибитор MEK MEK-162 (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR эрлотиниб (или его фармацевтически приемлемую соль) и ингибитор MEK кобиметиниб (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR афатиниб (или его фармацевтически приемлемую соль) и ингибитор MEK селуметиниб (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR афатиниб (или его фармацевтически приемлемую соль) и ингибитор MEK траметиниб (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR афатиниб (или его фармацевтически приемлемую соль) и ингибитор MEK MEK-162 (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR афатиниб (или его фармацевтически приемлемую соль) и ингибитор MEK кобиметиниб (или его фармацевтически приемлемую соль).
В подходящем воплощении комбинированный препарат может содержать TKI EGFR AZD9291 (или его фармацевтически приемлемую соль) и ингибитор MEK селуметиниб (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать EGFR TKI AZD9291 (или его фармацевтически приемлемую соль) и ингибитор MEK траметиниб (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR AZD9291 (или его фармацевтически приемлемую соль) и ингибитор MEK MEK-162 (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать TKI EGFR AZD9291 (или его фармацевтически приемлемую соль) и ингибитор MEK кобиметиниб (или его фармацевтически приемлемую соль).
В подходящем воплощении комбинированный препарат может содержать TKI EGFR СО-1686 (или его фармацевтически приемлемую соль) и ингибитор MEK селуметиниб (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать EGFR TKI СО-1686 (или его фармацевтически приемлемую соль) и ингибитор MEK траметиниб (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать EGFR TKI СО-1686 (или его фармацевтически приемлемую соль) и ингибитор MEK MEK-162 (или его фармацевтически приемлемую соль). В подходящем воплощении комбинированный препарат может содержать EGFR TKI СО-1686 (или его фармацевтически приемлемую соль) и ингибитор MEK кобиметиниб (или его фармацевтически приемлемую соль).
Ингибиторы NRAS
Ингибитор MEK может ингибировать активность, ассоциированную с сигналами NRAS, так как MEK1 и/или MEK2 представляют собой нисходящие компоненты сигнального пути NRAS.
Например, ингибитор MEK может ингибировать экспрессию гена NRAS, например, мешая стабильности или трансляции мРНК. Примеры миРНК, целенаправленно воздействующих на экспрессию гена NRAS, предложены в Примерах.
Другие агенты
Комбинацию ингибитора EGFR и ингибитора MEK согласно изобретению можно вводить раковому пациенту в качестве монотерапии. Альтернативно, ингибитор EGFR и ингибитор MEK можно вводить в комбинации с дополнительной хирургической или лучевой терапией, или с дополнительным химиотерапевтическим агентом или терапевтическим антителом.
Комбинированное введение
Согласно изобретению, компоненты комбинированного лечения можно вводить в комбинации или в сочетании друг с другом. Комбинированное лечение может быть в форме комбинированного препарата, например комбинированного препарата ингибитора EGFR и ингибитора MEK. Комбинация может содержать отдельные композиции одного или более из этих компонентов, например, отдельные композиции ингибитора EGFR и ингибитора MEK.
Компоненты в комбинации (например, отдельные композиции) можно вводить последовательно, по отдельности и/или одновременно, как описано здесь по отношению к способам комбинированного лечения. Таким образом, например, ингибитор EGFR можно вводить по отдельности, последовательно или одновременно с ингибитором MEK.
В одном воплощении компоненты вводят одновременно (возможно, неоднократно). В одном воплощении компоненты вводят последовательно (возможно, неоднократно). В одном воплощении компоненты вводят по отдельности (возможно, неоднократно).
Специалисту будет понятно, что когда отдельные композиции агентов в комбинации вводят последовательно или серийно, то это может представлять собой введение агентов в любом порядке. Таким образом, когда ингибитор EGFR и ингибитор MEK вводят последовательно или серийно, это может представлять собой введение ингибитора EGFR с последующим введением ингибитора MEK, или введение ингибитора MEK с последующим введением ингибитора EGFR.
В одном воплощении отдельные композиции агентов можно вводить в соответствии с альтернативными схемами дозирования.
Когда введение отдельных композиций является последовательным или по отдельности, замедление введения второй (или последующей) композиции не должно быть таким, чтобы терялся полезный терапевтический эффект комбинированного препарата.
Комбинированные продукты
Компоненты комбинированного препарата, описанного в данном описании изобретения, могут быть предложены в виде комбинированного продукта.
Комбинированный продукт обычно содержит:
а) ингибитор EGFR; и
б) ингибитор MEK; как описано здесь.
Комбинированный продукт является полезным для лечения ассоциированного с EGFR рака посредством способа, описанного в данном описании изобретения.
Комбинированный продукт может содержать
а) ингибитор EGFR; и
б) ингибитор MEK;
вместе с фармацевтически приемлемым вспомогательным лекарственным средством, разбавителем или носителем.
Комбинированный продукт, как определено в данном описании изобретения, может находиться в форме комбинированного препарата компонентов. Таким образом, комбинированный продукт может находиться в форме комбинированного препарата ингибитора EGFR и ингибитора MEK.
Комбинированный продукт, как определено в данном описании изобретения, может содержать набор, содержащий в продукте отдельные композиции каждого из агентов. Таким образом, набор может содержать отдельные композиции ингибитора EGFR и ингибитора MEK, как описано здесь.
Комбинированный продукт может содержать набор, содержащий
а) ингибитор EGFR или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым вспомогательным лекарственным средством, разбавителем или носителем;
и:
б) ингибитор MEK или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым вспомогательным лекарственным средством, разбавителем или носителем;
где компоненты предложены в форме, подходящей для последовательного, раздельного и/или одновременного введения раковому пациенту, чьи опухолевые клетки содержат E63K, G12V, G12R, G12A, G12D, G12S или G12C мутацию NRAS.
В еще одних воплощениях опухолевые клетки содержат мутацию NRAS, выбранную из E63K, G12V и G12R.
В еще одних воплощениях опухолевые клетки содержат мутацию NRAS, выбранную из G12R, G12A, G12D, G12S и G12C.
В еще одном воплощении ингибитор EGFR выбран из AZD9291 и CO1686 или их фармацевтически приемлемой соли.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитором MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В других воплощениях опухолевые клетки содержат мутацию E63K, G12V или G12R NRAS.
В одном воплощении опухолевые клетки содержат мутацию G12R NRAS. Комбинированный продукт может содержать набор, содержащий
а) ингибитор EGFR вместе с фармацевтически приемлемым вспомогательным лекарственным средством, разбавителем или носителем;
и:
б) ингибитор MEK вместе с фармацевтически приемлемым вспомогательным лекарственным средством, разбавителем или носителем;
где компоненты предложены в форме, подходящей для последовательного, раздельного и/или одновременного введения раковому пациенту, чьи опухолевые клетки содержат рост копийности гена NRAS или белок NRAS с активирующей мутацией E63K и/или G12V NRAS.
Набор может содержать:
первый контейнер, содержащий первый из компонентов комбинированного продукта вместе в фармацевтически приемлемым вспомогательным лекарственным средством, разбавителем или носителем; и
второй или последующий контейнер, содержащий второй или любой последующий из компонентов комбинированного продукта, соответственно, каждый компонент вместе с фармацевтически приемлемым вспомогательным лекарственным средством, разбавителем или носителем, и
упаковочный контейнер для содержания указанных первого и второго и любых последующих контейнеров.
Комбинированный продукт, как определено в данном описании изобретения, может содержать фармацевтическую композицию, которая содержит:
а) ингибитор EGFR; и
б) ингибитор MEK.
Фармацевтическая композиция обычно содержит фармацевтически приемлемые вспомогательное лекарственное средство, разбавитель или носитель.
Комбинированный продукт может содержать фармацевтическую композицию, содержащую:
а) ингибитор EGFR вместе с фармацевтически приемлемым вспомогательным лекарственным средством, разбавителем или носителем; и
б) ингибитор MEK вместе с фармацевтически приемлемым вспомогательным лекарственным средством, разбавителем или носителем.
Комбинированный продукт по изобретению может содержать более одного ингибитора EGFR и/или более одного ингибитора MEK. Комбинированный продукт может содержать один или более других активных агентов, выбранных из агентов, описанных в данном описании изобретения.
Набор, как описано здесь, может дополнительно содержать инструкции для введения компонентов последовательно, раздельно и/или одновременно для лечения рака.
В одном воплощении комбинированный продукт, как описано здесь, дополнительно содержит инструкции, указывающие, что продукт, как определено в данном описании изобретения, можно применять для лечения ассоциированного с EGFR рака посредством способа, описанного в данном описании изобретения. Продукт может содержать инструкции, указывающие, что продукт предназначен для применения в лечении рака, как описано здесь, у ракового пациента, как описано здесь. Например, продукт может включать инструкции, указывающие, что продукт можно применять для лечения рака у пациента, который получил или получает терапию ингибитором EGFR, и тесты которого дают положительный результат на наличие мутации NRAS или рост копийности гена NRAS согласно изобретению. В другом примере продукт может включать инструкции, указывающие, что продукт можно применять для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат рост копийности гена NRAS или белок NRAS с активирующей мутацией E63K и/или G12V NRAS, в качестве терапии первой линии. В другом примере продукт может включать инструкции, указывающие, что продукт можно применять для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию G12R NRAS. В одном воплощении продукт включает инструкции, указывающие, что продукт можно применять для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию E63K, G12V, G12R, G12A, G12D, G12S или G12C NRAS.
Медицинские способы и медицинские применения
Изобретение также относится к способу лечения ассоциированного с EGFR рака у пациента, включающему введение комбинированного продукта или фармацевтической композиции, как описано здесь, где пациент имеет активирующую мутацию NRAS, выбранную из группы, состоящей из: мутации E63K NRAS и мутации G12V NRAS, или роста копийности гена NRAS.
В одном воплощении предложен способ лечения ассоциированного с EGFR рака у пациента, включающий введение комбинированного продукта или фармацевтической композиции, как описано здесь, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS.
В одном воплощении пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
В другом воплощении пациента имеет мутацию NRAS, выбранную из E63K, G12V и G12R.
В еще одних воплощениях пациент имеет мутацию NRAS, выбранную из G12R, G12A, G12D, G12S или G12C.
В одном аспекте изобретение относится к комбинированному продукту, как определено в данном описании изобретения, содержащему
а) ингибитор EGFR; и
б) ингибитор MEK;
для применения последовательно, раздельно и/или одновременно в любом из способов, описанных в данном описании изобретения.
Кроме того, предложен комбинированный продукт, содержащий ингибитор EGFR и ингибитор MEK, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности гена NRAS; где ингибитор EGFR и ингибитор MEK каждый находится в ассоциации с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, и где ингибитор EGFR и ингибитор MEK предложены в форме, подходящей для отдельного, одновременного и/или последовательного введения.
Кроме того, предложен комбинированный продукт, содержащий ингибитор EGFR и ингибитор MEK, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R, или роста копийности гена NRAS; где ингибитор EGFR и ингибитор MEK каждый находится в ассоциации с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, и где ингибитор EGFR и ингибитор MEK предложены в форме, подходящей для раздельного, одновременного и/или последовательного введения.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686 или его фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Кроме того, предложен комбинированный продукт, содержащий ингибитор EGFR и ингибитор MEK, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет активирующую мутацию NRAS, выбранную из группы, состоящей из: мутации E63K NRAS и мутации G12V NRAS, или роста копийности гена NRAS; где ингибитор EGFR и ингибитор MEK каждый находится в ассоциации с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, и где ингибитор EGFR и ингибитор MEK предлагаются в форме, которая является подходящей для раздельного, одновременного и/или последовательного введения.
В еще одном аспекте изобретения предложена фармацевтическая композиция, содержащая ингибитор EGFR и ингибитор MEK (каждый возможно в форме фармацевтически приемлемой соли) вместе с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS.
В еще одном аспекте изобретения предложена фармацевтическая композиция, содержащая ингибитор EGFR и ингибитор MEK (каждый возможно в форме фармацевтически приемлемой соли) вместе с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R, соответствующую положению в белке NRAS, или роста копийности NRAS.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одном воплощении ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одном аспекте изобретения предложена фармацевтическая композиция, содержащая ингибитор EGFR и ингибитор MEK вместе с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет активирующую мутацию NRAS, выбранную из группы, состоящей из: E63K и G12V, соответствующим положению в белке NRAS, или роста копийности NRAS.
Изобретение также относится к применению комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS. Таким образом, изобретение относится к применению комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS.
Изобретение также относится к применению комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Таким образом, изобретение относится к применению комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C. В еще одном воплощении мутация NRAS выбрана из G12R, G12R, G12A, G12D, G12S и G12C. В еще одном воплощении рак, вызванный мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS. В еще одном воплощении рак, вызванный мутировавшим NRAS, имеет рост копийности NRAS.
Изобретение также относится к применению комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R.
Таким образом, изобретение относится к применению комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C. В еще одном воплощении рак, вызванный мутировавшим NRAS, имеет рост копийности NRAS.
Изобретение также относится к применению комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет активирующую мутацию NRAS, выбранную из группы, состоящей из: мутация E63K NRAS и мутации G12V NRAS, или роста копийности NRAS.
Изобретение также относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS.
Таким образом, изобретение относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS.
Изобретение также относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C. Таким образом, изобретение относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Изобретение также относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R; или роста копийности NRAS.
Таким образом, изобретение относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, или роста копийности NRAS.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях рак, вызванный мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Изобретение также относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет активирующую мутацию NRAS, выбранную из группы, состоящей из: мутации E63K NRAS и мутации G12V NRAS, или роста копийности NRAS.
Также предложен ингибитор EGFR для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS и где ингибитор EGFR вводят в комбинации с ингибитором MEK.
Таким образом, предложен ингибитор EGFR для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS и где ингибитор EGFR вводят в комбинации с ингибитором MEK.
Также предложен ингибитор EGFR для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C; и где ингибитор EGFR вводят в комбинации с ингибитором MEK.
Таким образом, предложен ингибитор EGFR для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, и где ингибитор EGFR вводят в комбинации с ингибитором MEK.
Также предложен ингибитор EGFR для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R, или роста копийности NRAS, и где ингибитор EGFR вводят в комбинации с ингибитором MEK.
Таким образом, предложен ингибитор EGFR для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, или роста копийности NRAS и где ингибитор EGFR вводят в комбинации с ингибитором MEK.
Также предложен ингибитор EGFR для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R; и где ингибитор EGFR вводят в комбинации с ингибитором MEK.
Таким образом, предложен ингибитор EGFR для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R и где ингибитор EGFR вводят в комбинации с ингибитором MEK.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях рак, вызванный мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Также предложен ингибитор EGFR для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет активирующую мутацию NRAS, выбранную из группы, состоящей из: мутации E63K NRAS и мутации G12V NRAS, или роста копийности NRAS, и где ингибитор EGFR вводят в комбинации с ингибитором MEK.
Также предложен ингибитор MEK для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS, и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Таким образом, предложен ингибитор MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Также предложен ингибитор MEK для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Таким образом, предложен ингибитор MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Также предложен ингибитор MEK для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R, или роста копийности NRAS, и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Таким образом, предложен ингибитор MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, или роста копийности NRAS и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Также предложен ингибитор MEK для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R, и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Таким образом, предложен ингибитор MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях рак, вызванный мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Также предложен ингибитор MEK для применения в лечении ассоциированного с EGFR рака у пациента, где пациент имеет активирующую мутацию NRAS, выбранную из группы, состоящей из: мутации E63K NRAS и мутации G12V NRAS, или роста копийности NRAS, и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Изобретение также относится к применению ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS, и где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
Таким образом, изобретение относится к применению ингибитора MEK для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS, и где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
Изобретение также относится к применению ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, и где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
Таким образом, изобретение относится к применению ингибитора MEK для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C; и где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
Изобретение также относится к применению ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R, или роста копийности NRAS, и где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
Таким образом, изобретение относится к применению ингибитора MEK для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, или роста копийности NRAS, и где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
Изобретения также относится к применению ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R, и где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
Таким образом, изобретение относится к применению ингибитора MEK для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, и где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях рак, вызванный мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Изобретение также относится к применению ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет активирующую мутацию NRAS, выбранную из группы, состоящей из: мутации E63K NRAS и мутации G12V NRAS, или роста копийности NRAS, и где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
Лекарственное средство (например, комбинированный продукт, как описано здесь) может содержать ингибитор MEK и ингибитор EGFR.
Изобретение также относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Таким образом, изобретение относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Таким образом, изобретение относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R, или роста копийности NRAS, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Таким образом, изобретение относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, или роста копийности NRAS, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Таким образом, изобретение относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях рак, вызванный мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или его фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Изобретение также относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет активирующую мутацию NRAS, выбранную из группы, состоящей из: мутации E63K NRAS и мутации G12V NRAS, или роста копийности NRAS, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Таким образом, изобретение относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности NRAS, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Таким образом, изобретение относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного в EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R, или роста копийности NRAS, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Таким образом, изобретение относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, или роста копийности NRAS, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет мутацию NRAS, выбранную из E63K, G12V и G12R, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Таким образом, изобретение относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R; и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях рак, вызванный мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Изобретение также относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, где пациент имеет активирующую мутацию NRAS, выбранную из группы, состоящей из: мутации E63K NRAS и мутации G12V NRAS, или роста копийности NRAS, и где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Лекарственное средство может представлять собой комбинированный продукт, как описано здесь.
Также предложен способ лечения ассоциированного с EGFR рака у пациента, включающий введение комбинированного продукта или фармацевтической композиции, как описано здесь.
В изобретении также предложен комбинированный продукт, содержащий ингибитор EGFR и ингибитор MEK, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, где ингибитор EGFR и ингибитор MEK каждый находится в ассоциации с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, и где ингибитор EGFR и ингибитор MEK предложены в форме, подходящей для раздельного, одновременного и/или последовательного введения пациенту, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Таким образом, в изобретении предложен комбинированный продукт, содержащий ингибитор EGFR и ингибитор MEK, как описано здесь, для применения в лечении рака, вызванного мутировавшим NRAS, где ингибитор EGFR и ингибитор MEK каждый находится в ассоциации с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, и где ингибитор EGFR и ингибитор MEK предложены в форме, подходящей для раздельного, одновременного и/или последовательного введения, и где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности гена NRAS.
В изобретении также предложен комбинированный продукт, содержащий ингибитор EGFR и ингибитор MEK, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, где ингибитор EGFR и ингибитор MEK каждый находится в ассоциации с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, и где ингибитор EGFR и ингибитор MEK предложены в форме, подходящей для раздельного, одновременного и/или последовательного введения пациенту, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Таким образом, в изобретении предложен комбинированный продукт, содержащий ингибитор EGFR и ингибитор MEK, как описано здесь, для применения в лечении рака, вызванного мутировавшим NRAS, где ингибитор EGFR и ингибитор MEK каждый находится в ассоциации с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, и где ингибитор EGFR и ингибитор MEK предложены в форме, подходящей для раздельного, одновременного и/или последовательного введения, и где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
В изобретении также предложен комбинированный продукт, содержащий ингибитор EGFR и ингибитор MEK, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, где ингибитор EGFR и ингибитор MEK каждый находится в ассоциации с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, и где ингибитор EGFR и ингибитор MEK предложены в форме, подходящей для раздельного, одновременного и/или последовательного введения пациенту, чьи опухолевые клетки содержат рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V и G12R.
Таким образом, в изобретении предложен комбинированный продукт, содержащий ингибитор EGFR и ингибитор MEK, как описано здесь, для применения в лечении рака, вызванного мутировавшим NRAS, где ингибитор EGFR и ингибитор MEK каждый находится в ассоциации с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, и где ингибитор EGFR и ингибитор MEK предложены в форме, подходящей для раздельного, одновременного и/или последовательного введения и где мутация NRAS выбрана из E63K, G12V и G12R, или роста копийности гена NRAS.
В изобретении также предложен комбинированный продукт, содержащий ингибитор EGFR и ингибитор MEK, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, где ингибитор EGFR и ингибитор MEK каждый находится в ассоциации с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, и где ингибитор EGFR и ингибитор MEK предложены в форме, подходящей для раздельного, одновременного и/или последовательного введения пациенту, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V и G12R.
Таким образом, в изобретении предложен комбинированный продукт, содержащий ингибитор EGFR и ингибитор MEK, как описано здесь, для применения в лечении рака, вызванного мутировавшим NRAS, где ингибитор EGFR и ингибитор MEK каждый находится в ассоциации с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, и где ингибитор EGFR и ингибитор MEK предложены в форме, подходящей для раздельного, одновременного и/или последовательного введения и где мутация NRAS выбрана из E63K, G12V и G12R.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях рак, вызванного мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В изобретении также предложен комбинированный продукт, содержащий ингибитор EGFR и ингибитор MEK, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, где ингибитор EGFR и ингибитор MEK каждый находится в ассоциации с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителем, и где ингибитор EGFR и ингибитор MEK предложены в форме, подходящей для раздельного, одновременного и/или последовательного введения пациенту, чьи опухолевые клетки содержат рост копийности гена NRAS или белок NRAS с активирующей мутацией E63K и/или G12V NRAS.
Изобретение также относится к фармацевтической композиции, содержащей ингибитор EGFR и ингибитор MEK вместе с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителями, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C. Таким образом, в изобретении предложена фармацевтическая композиция, содержащая ингибитор EGFR и ингибитор MEK вместе с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителями, как описано здесь, для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности гена NRAS.
Изобретение также относится к фармацевтической композиции, содержащей ингибитор EGFR и ингибитор MEK вместе с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителями, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Таким образом, в изобретении предложена фармацевтическая композиция, содержащая ингибитор EGFR и ингибитор MEK вместе с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителями, как описано здесь, для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Изобретение также относится к фармацевтической композиции, содержащей ингибитор EGFR и ингибитор MEK вместе с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителями, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V и G12R.
Таким образом, в изобретении предложена фармацевтическая композиция, содержащая ингибитор EGFR и ингибитор MEK вместе с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителями, как описано здесь, для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, или роста копийности гена NRAS.
Изобретение также относится к фармацевтической композиции, содержащей ингибитор EGFR и ингибитор MEK вместе с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителями, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V и G12R.
Таким образом, в изобретении предложена фармацевтическая композиция, содержащая ингибитор EGFR и ингибитором MEK вместе с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителями, как описано здесь, для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях рак, вызванный мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS,
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Изобретение также относится к фармацевтической композиции, содержащей ингибитор EGFR и ингибитор MEK вместе с фармацевтически приемлемым вспомогательным лекарственным средством, носителем или разбавителями, как описано здесь, для применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или белок NRAS с активирующей мутацией E63K и/или G12V NRAS.
Более того, изобретение относится к применению комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Таким образом, предложено применение комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности гена NRAS.
Более того, изобретение относится к применению комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Таким образом, предложено применение комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Более того, изобретение относится к применению комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V и G12R.
Таким образом, предложено применение комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R или роста копийности гена NRAS.
Более того, изобретение относится к применению комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V и G12R.
Таким образом, предложено применение комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях рак, вызванный мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Более того, изобретение относится к применению комбинированного продукта или фармацевтической композиции, как описано здесь, для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или белок NRAS с активирующей мутацией E63K и/или G12V NRAS.
Изобретение также относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Таким образом, изобретение относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности гена NRAS.
Изобретение также относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Таким образом, изобретение относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Изобретение также относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V и G12R.
Таким образом, изобретение относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R или роста копийности гена NRAS.
Изобретение также относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V и G12R.
Таким образом, изобретение относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях рак, вызванный мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Изобретение также относится к ингибитору EGFR и ингибитору MEK для комбинированного применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или белок NRAS с активирующей мутацией E63K и/или G12V NRAS.
Также предложен ингибитор EGFR для применения в лечении ассоциированного с EGFR рака у пациента, где ингибитор EGFR вводят в комбинации с ингибитором MEK пациенту, чьи опухолевые клетки содержат рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Таким образом предложен ингибитор EGFR для применения в лечении рака, вызванного мутировавшим NRAS, где ингибитор EGFR вводят в комбинации с ингибитором MEK и мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности гена NRAS.
Также предложен ингибитор EGFR для применения в лечении ассоциированного с EGFR рака у пациента, где ингибитор EGFR вводят в комбинации с ингибитором MEK пациенту, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Таким образом, предложен ингибитор EGFR для применения в лечении рака, вызванного мутировавшим NRAS, где ингибитор EGFR вводят в комбинации с ингибитором MEK, и мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
Также предложен ингибитор EGFR для применения в лечении ассоциированного с EGFR рака у пациента, где ингибитор EGFR вводят в комбинации с ингибитором MEK пациенту, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V и G12R.
Таким образом, предложен ингибитор EGFR для применения в лечении рака, вызванного мутировавшим NRAS, где ингибитор EGFR вводят в комбинации с ингибитором MEK, и мутация NRAS выбрана из E63K, G12V и G12R, или роста копийности гена NRAS.
Также предложен ингибитор EGFR для применения в лечении ассоциированного с EGFR рака у пациента, где ингибитор EGFR вводят в комбинации с ингибитором MEK пациенту, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V и G12R.
Таким образом, предложен ингибитор EGFR для применения в лечении рака, вызванного мутировавшим NRAS, где ингибитор EGFR вводят в комбинации с ингибитором MEK, и мутация NRAS выбрана из E63K, G12V и G12R.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях рак, вызванный мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Также предложен ингибитор EGFR для применения в лечении ассоциированного с EGFR рака у пациента, где ингибитор EGFR вводят в комбинации с ингибитором MEK пациенту, чьи опухолевые клетки содержат рост копийности гена NRAS или белок NRAS с активирующей мутацией E63K и/или G12VNRAS.
Также предложен ингибитор MEK для применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Таким образом, предложен ингибитор MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, или роста копийности гена NRAS, и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Также предложен ингибитор MEK для применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Таким образом, предложен ингибитор MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Также предложен ингибитор MEK для применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V и G12R, где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Таким образом, предложен ингибитор MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, или роста копийности гена NRAS, и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Также предложен ингибитор MEK для применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V и G12R, где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Таким образом, предложен ингибитор MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, и где ингибитор MEK вводят в комбинации с ингибитором EGFR.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях рак, вызванный мутировавшим NRAS, представляет собой рак, вызванный мутацией G12R NRAS.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Также предложен ингибитор MEK для применения в лечении ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат рост копийности гена NRAS или белок NRAS с активирующей мутацией E63K и/или G12V NRAS, где ингибитор MEK вводят в комбинации с ингибитором EGFR.
Изобретение также относится к применению ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
Изобретение также относится к применению ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
Изобретение также относится к применению ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V и G12R, где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
Изобретения также относится к применению ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V и G12R, где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях мутация NRAS представляет собой G12R.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Изобретение также относится к применению ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или белок NRAS с активирующей мутацией E63K и/или G12V NRAS, где лечение включает введение ингибитора MEK в комбинации с ингибитором EGFR.
Изобретение также относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V и G12R, где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки содержат мутацию белка NRAS, выбранную из E63K, G12V и G12R, где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях мутация NRAS представляет собой G12R.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Изобретение также относится к применению ингибитора EGFR для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или белок NRAS с активирующей мутацией E63K и/или G12V NRAS, где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V и G12R, где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Изобретение также относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или мутацию белка NRAS, выбранную из E63K, G12V и G12R, где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях мутация NRAS представляет собой G12R.
В еще одних воплощениях ингибитор EGFR выбран из AZD9291 и CO1686, или их фармацевтически приемлемой соли.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль. В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или CO1686, или их фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В еще одних воплощениях ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Изобретение также относится к применению ингибитора EGFR и ингибитора MEK для изготовления лекарственного средства для лечения ассоциированного с EGFR рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS или белок NRAS с активирующей мутацией E63K и/или G12V NRAS, где лечение включает введение ингибитора EGFR в комбинации с ингибитором MEK.
Лекарственное средство может представлять собой комбинированный продукт, как описано здесь.
Дополнительные воплощения
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R.
В еще одних воплощениях мутация NRAS представляет собой G12R.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутациями E63K и/или G12V NRAS.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией G12R NRAS.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака у пациента, чьи опухолевые клетки содержат рост копийности гена NRAS.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией E63K NRAS.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией E63K NRAS.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией G12V NRAS.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12V NRAS.
В еще одном воплощении предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12R NRAS.
В любых воплощениях, описанных в данном описании изобретения, ингибитор EGFR может быть выбран из гефитиниба, эрлотиниба, афатиниба, дакомитиниба, AZD9291 и СО-1686 (где все из вышеупомянутых могут быть в форме фармацевтически приемлемой соли, при условии, что имеется по меньшей мере функциональная группа, допускающая образование таких солей).
В любых воплощениях, описанных в данном описании изобретения, ингибитор EGFR может быть выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 (где все из вышеупомянутых могут быть в форме фармацевтически приемлемой соли, при условии, что имеется по меньшей мере функциональная группа, допускающая образование таких солей).
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK (каждый возможно в форме фармацевтически приемлемой соли) для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
В еще одних воплощениях мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C.
В еще одних воплощениях мутация NRAS представляет собой G12R.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK (каждый возможно в форме фармацевтически приемлемой соли) для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK (каждый возможно в форме фармацевтически приемлемой соли) для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
Таким образом в одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутациями E63K и/или G12V NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK (каждый возможно в форме фармацевтически приемлемой соли) для лечения рака, вызванного мутацией G12R NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
Таким образом, предлагается ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12R NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686, или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией E63K NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией E63K NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли. В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией G12V NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12V NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK (каждый, возможно, в форме фармацевтически приемлемой соли) для лечения рака, вызванного мутацией G12R NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12R NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли.
В любых воплощениях, описанных в данном описании изобретения, ингибитор MEK может быть выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба (где все из вышеупомянутых могут быть в форме фармацевтически приемлемой соли, при условии, что имеется по меньшей мере функциональная группа, допускающая образование таких солей).
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK (каждый, возможно, в форме фармацевтически приемлемой соли) для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK (каждый, возможно, в форме фармацевтически приемлемой соли) для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK (каждый, возможно, в форме фармацевтически приемлемой соли) для лечения рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
Таким образом, в одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутациями E63K и/или G12V NRAS, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK (каждый, возможно, в форме фармацевтически приемлемой соли) для лечения рака, вызванного мутацией G12R NRAS, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12R NRAS, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака у пациента, чьи опухолевые клетки содержат рост копийности гена NRAS, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией E63K NRAS, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией E63K NRAS, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией G12V NRAS, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12V NRAS, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK (каждый, возможно, в форме фармацевтически приемлемой соли) для лечения рака, вызванного мутациией G12R NRAS, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12R NRAS, где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли, и где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли, и где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли, и где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутациями E63K и/или G12V NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли, и где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутациями E63K и/или G12V NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли, и где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли. В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли, и где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
Таким образом предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли, и где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией E63K NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли, и где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией E63K NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли, и где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией G12V NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли, и где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12V NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли, и где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В одном воплощении предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12R NRAS, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО-1686 или их фармацевтически приемлемой соли, и где ингибитор MEK выбран из селуметиниба, траметиниба, MEK-162 и кобиметиниба или их фармацевтически приемлемой соли.
В любых воплощениях, описанных в данном описании изобретения, ингибитор MEK может представлять собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V, G12R, G12A, G12D, G12S и G12C, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из G12R, G12A, G12D, G12S и G12C, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутировавшим NRAS, где мутация NRAS выбрана из E63K, G12V и G12R, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутациями E63K и/или G12V NRAS, где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутациями E63K и/или G12V NRAS, где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12R NRAS, где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS, где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS, где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией E63K NRAS, где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией E63K NRAS, где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией G12V NRAS, где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12V NRAS, где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В любых воплощениях, описанных в данном описании изобретения, ингибитор EGFR может быть выбран из гефитиниба и AZD9291, и ингибитор MEK представляет собой селуметиниб (где любой из вышеупомянутых может находиться в форме фармацевтически приемлемой соли).
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией E63K и/или G12V NRAS, где ингибитор EGFR выбран из гефитиниба и AZD9291 или их фармацевтически приемлемой соли, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией E63K и/или G12V NRAS, где ингибитор EGFR выбран из гефитиниба и AZD9291 или их фармацевтически приемлемой соли, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12R NRAS, где ингибитор EGFR выбран из гефитиниба и AZD9291 или их фармацевтически приемлемой соли, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12R NRAS, где ингибитор EGFR выбран из AZD9291 и CO1686 или их фармацевтически приемлемой соли, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предлагается ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12R NRAS, где ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS, где ингибитор EGFR выбран из гефитиниба и AZD9291 или их фармацевтически приемлемой соли, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS, где ингибитор EGFR выбран из гефитиниба и AZD9291 или их фармацевтически приемлемой соли, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией E63K NRAS, где ингибитор EGFR выбран из гефитиниба и AZD9291 или их фармацевтически приемлемой соли, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией E63K NRAS, где ингибитор EGFR выбран из гефитиниба и AZD9291, или его фармацевтически приемлемой соли, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В одном воплощении предложено применение ингибитора EGFR в комбинации с ингибитором MEK для лечения рака, вызванного мутацией G12V NRAS, где ингибитор EGFR выбран из гефитиниба и AZD9291 или их фармацевтически приемлемой соли, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
Таким образом, предложен ингибитор EGFR в комбинации с ингибитором MEK для применения в лечении рака, вызванного мутацией G12V NRAS, где ингибитор EGFR выбран из гефитиниба и AZD9291 или их фармацевтически приемлемой соли, и где ингибитор MEK представляет собой селуметиниб или его фармацевтически приемлемую соль.
В любых воплощениях в данном описании изобретения, описывающих «рак, вызванный мутацией E63K NRAS», рак может представлять собой «рак легких, вызванный мутацией E63K NRAS», или «немелкоклеточный рак легких, вызванный мутацией E63K NRAS», или «рак, вызванный мутацией E63K NRAS, который ранее лечили при помощи TKI EGFR».
В любых воплощениях в данном описании изобретения, описывающих «рак, вызванный мутацией G12V NRAS», рак может представлять собой «рак легких, вызванный мутацией G12V NRAS», или «немелкоклеточный рак легких, вызванный мутацией G12V NRAS», или «рак, вызванный мутацией G12V NRAS, который ранее лечили при помощи TKI EGFR». Этот же принцип можно применять к другим мутациям белка NRAS с получением еще одних воплощений, как описано здесь.
В любых воплощениях в данном описании изобретения, описывающих «рак, вызванный мутацией NRAS», рак можно дополнительно определять как «рак легких, вызванный мутацией NRAS», или «немелкоклеточный рак легких, вызванный мутацией NRAS», или «рак, вызванный мутацией NRAS, который ранее лечили при помощи TKI EGFR».
В любых воплощениях в данном описании изобретения, описывающих «рак у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS», рак может представлять собой «немелкоклеточный рак легких у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS», или «рак у пациента, чьи опухолевые клетки имеют рост копийности гена NRAS, где рак ранее лечили при помощи TKI EGFR».
Синергизм комбинированного препарата
Ожидается, что комбинированный препарат по настоящему изобретению дает синергетический или благотворный эффект в лечении рака у субъекта. Такой эффект может быть определен, например, по одному или более из следующего: выраженности противоопухолевого эффекта, проценту положительного клинического ответа, времени до начала прогрессирования заболевания или проценту выживаемости.
В одном аспекте синергетический или благотворный эффект достигается, если эффект является терапевтически превосходящим, при измерении по отношению, например, к выраженности ответа, проценту положительного клинического ответа/степени излечения, времени до начала прогрессирования заболевания, испытанным побочным эффектам или периоду выживаемости, которые достигаются при применении одного из компонентов комбинированного препарата, например, в его обычной дозе или концентрации.
Синергетический или благотворный эффект может быть получен, если комбинированный эффект является терапевтически превосходящим сумму отдельных эффектов, достигнутых при применении одного из компонентов комбинации, и/или если эффект достигается в группе пациентов, которые не реагируют (или реагируют слабо) на один из компонентов по отдельности.
Кроме того, комбинированный препарат может быть определен как обеспечивающий синергетический или благотворный эффект, если один из компонентов применяют в его обычной дозе или концентрации, а другой(ие) компонент(ы) применяют в сниженной дозе или концентрации, а терапевтический эффект равноценен или лучше, чем эффект, достигаемый при применении обычных количеств компонентов комбинированного препарата.
В частности, может считаться, что синергизм или благотворное действие имеют место, если обычную дозу одного из компонентов комбинированного препарата можно понижать без отрицательного влияния на одно или более из: выраженность ответа, процент положительного клинического ответа, время до начала прогрессирования заболевания и данные о выживании, в частности без отрицательного влияния на продолжительность ответа, но с немногими и/или менее неприятными побочными эффектами, чем те, которые имеют место, когда используют обычные дозы или концентрации каждого компонента.
Композиции и пути доставки
Фармацевтическая композиция или комбинированный продукт для применения in vivo обычно содержит активный агент или агенты (например, ингибитор EGFR и/или ингибитор MEK, как описано здесь) в смеси с одним или более фармацевтически приемлемыми эксципиентами, носителями или разбавителями, вспомогательными лекарственными средствами, наполнителями, буферами, стабилизаторами, консервантами, смазывающими веществами или другими веществами, хорошо известными специалисту в данной области техники.
Полезные в данном описании изобретения фармацевтически приемлемые эксципиенты являются обычными. В Remington's Pharmaceutical Sciences, от Е.W. Martin, Mack Publishing Co, Easton, PA, 15th Edition (1975) описаны композиции и препараты, подходящие для фармацевтической доставки соединений, раскрытых в данном описании изобретения.
Обычно такие композиции могут дополнительно содержать фармацевтически приемлемые концентрации соли, буферизующих агентов, консервантов, антиоксидантов и/или совместимых носителей.
Композиции также могут включать антиоксиданты и/или консерванты. В качестве антиоксидантов можно отметить токоферолы, бутилированный гидроксианизол, бутилированный гидрокситолуол, соли содержащих серу кислот (например, сульфат натрия, бисульфит натрия, натрий ацетонбисульфит, метабисульфит натрия, сульфит натрия, натрий формальдегидсульфоксилат, натрия тиосульфат) и нордигидрогваяретовую кислоту. Подходящие консерванты могут, например, представлять собой фенол, хлорбутанол, бензиловый спирт, метилпарабен, пропил парабен, бензалкония хлорид и цетилпиридиния хлорид.
Композиции могут быть представлены в стандартной лекарственной форме.
Композиции и продукты, описанные в данном описании изобретения, можно доставлять в клетки-мишени (или в ткани, орган или субъекту, содержащим клетки-мишени) посредством любого подходящего способа.
Примеры путей введения и/или способа доставки для доставки субъекту включают: пероральный, парентеральный, чрескожный, внутрикожный, внутриартериальный или внутривенный, или местный. В одном примере введение может осуществляться посредством внутривенной, внутриартериальной или подкожной инъекции или инфузии, или посредством перорального введения.
Композиция или продукт могут быть предназначены для перорального введения. В одном аспекте пероральная композиция может содержать пероральную лекарственную форму, содержащую активный агент в комбинации с усилителем для улучшения биодоступности и/или абсорбции агента.
Композиции, подходящие для перорального введения (например, посредством проглатывания), могут быть представлены в виде обособленных единиц, таких как капсулы, саше или таблетки, где каждая содержит заранее определенное количество активного агента в виде порошка или гранул, в виде раствора или суспензии в водной или неводной жидкости, или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле, в виде болюса, в виде лекарственной кашки, или в виде пасты.
В одном примере композиция или продукт могут быть предназначены для парентерального введения. Парентеральные препараты можно вводить посредством одного или более путей, таких как внутривенный, подкожный, внутрикожный и инфузия; конкретный пример представляет собой внутривенный путь. Композицию, раскрытую в данном описании изобретения, можно вводить, используя шприц, инжектор, плунжер для твердых композиций, помпу или любое другое устройство, принятое в данной области техники для парентерального введения.
Композиция или продукт могут быть предназначены для местного введения, например на кожу.
Терапевтически эффективные количества/дозы
Действующие количества (например, уровни дозировок) или концентрации активного ингредиента (например, ингибитора EGFR, или ингибитора MEK, или другого активного агента) в композициях, например в фармацевтических композициях, можно варьировать, для того чтобы получать количество активного ингредиента, которое является эффективным для достижения желательного терапевтического ответа для конкретного субъекта, композиции и способа введения (называющимся в данном описании изобретения «терапевтически эффективным" количеством или дозой).
Выбранный уровень дозировки может, например, зависеть от активности конкретного активного ингредиента, тяжести состояния, подлежащего лечению, и состояния и, если необходимо, предшествующей истории болезни подлежащего лечению субъекта. Однако начинать дозирование на уровнях, ниже требуемых для достижения желательного эффекта, и постепенно повышать дозировку до достижения желательного эффекта находится в рамках компетентности специалиста в данной области техники.
Дозировка ингибитора в комбинации, описанной в данном описании изобретения для данного субъекта или пациента, может быть определена лечащим терапевтом или другим специалистом, принимая во внимание различные факторы, известные для модификации действия лекарственных средств, включая тяжесть и тип заболевания или состояния, массу тела, пол, режим питания, время и путь введения, другие лекарственные средства и другие значимые факторы, например клинические факторы. Терапевтически эффективные дозировки можно определять посредством или in vitro или in vivo способов.
Терапевтически эффективное количество для использования будет зависеть, например, от терапевтических целей, пути введения и состояния субъекта. Таким образом, предпочтительно для терапевта или другого специалиста титровать дозировку и модифицировать путь введения, как требуется для получения оптимального терапевтического эффекта. Типичная суточная дозировка может варьироваться от примерно 0,0001 мг/кг вплоть до 250 мг/кг или более в зависимости от факторов, упоминаемых выше. Обычно клиницист или другой специалист вводит ингибитор или комбинацию (например, комбинированный продукт), как описано в данном описании изобретения, до получения дозировки, которая достигает желательного эффекту. Когда вводят отдельные композиции агентов комбинации, последовательность, в которой можно вводить агенты в комбинации (то есть который из двух, и в какой момент времени имеет место последовательное, отдельное и/или одновременное введение), может быть определена терапевтом или специалистом.
Введение комбинации агентов может иметь место, как описано выше в данном описании изобретения, например, отдельные композиции агентов можно вводить последовательно, раздельно и/или одновременно.
Фармацевтически приемлемые соли
Изобретение также относится к фармацевтически приемлемым солям конкретных ингибиторов EGFR и ингибиторов MEK, указанных в данном описании изобретения. Ссылка в данном описании изобретения на "ингибитор EGFR" или "ингибитор MEK" может, таким образом, быть интерпретирована как охватывающая и конкретные названные ингибиторы, и их фармацевтически приемлемые соли.
Применения и употребления, описанные для названного ингибитора, можно рассматривать как касающиеся, с соответствующими изменениями, его фармацевтически приемлемых солей.
Термин "фармацевтически приемлемый" при использовании в данном описании изобретения относится к соединениям, веществам, композициям и/или к лекарственным формам, которые являются, в рамках здравого медицинского суждения, подходящими для применения в контакте с тканями субъекта (например, человека) без избыточной токсичности, болезненной чувствительности, аллергической реакции или другой проблемы или осложнения, в соответствии с обоснованным соотношением благотворное действие/риск.
Может быть удобно или желательно получать, очищать и/или обрабатывать соответствующую соль агента, описанного в данном описании изобретения (например ингибитор EGFR или ингибитором MEK), например, фармацевтически приемлемую соль.
Подходящая фармацевтически приемлемая соль может представлять собой, например, соль присоединения кислоты, которая является достаточно основной, например, соль присоединения кислоты с неорганической или органической кислотой. Такие соли присоединения кислоты включают, но без ограничения, фумаратные, метансульфонатные, гидрохлоридные, гидробромидные, цитратные и малеатные соли и соли, образованные фосфорной и серной кислотой. Подходящая фармацевтически приемлемая соль может представлять собой, например, соль, которая является достаточно кислой, например соль щелочного или щелочноземельного металла. Такие соли щелочных или щелочноземельных металлов включают, но без ограничения, соль щелочного металла, например натрия или калия, соль щелочноземельного металла, например кальция или магния, соль аммония, или соль органического амина, например триэтиламин, этаноламин, диэтаноламин, триэтаноламин, морфолин, N-метилпиперидин, N-этилпиперидин, дибензиламин, или аминокислоты, такие как лизин. Соль может представлять собой, например, мезилатную соль или соль HBr.
ПРИМЕРЫ
Теперь изобретение будет описано посредством конкретных Примеров и со ссылкой на прилагаемые графические материалы, которые предлагаются только для иллюстративных целей и не должны рассматриваются как ограничивающие идеи данного изобретения.
Пример 1. Образование популяции резистентных к гефитинибу клеток РС9 и популяции резистентных к AZD9291 клеток РС9
Реагенты
Среда RPMI-1640 (Sigma R7509)
Фосфатно-солевой буферный раствор по Дульбекко (PBS) (Sigma D8537)
L-глутамин 200 мМ (100 х) (Gibco, Life Technologies 25030)
Фетальная телячья сыворотка (Sigma F7524)
TrypLE Express (Gibco, Life Technologies 12605)
AZD9291 и гефитиниб (собственного производства)
Среда для выращивания
Среда RPMI-1640
10% Фетальная телячья сыворотка
2 мМ L-глутамин
Клетки
Клетки РС9 ЛНМР человека.
Все реагенты, соединения и клетки доступны из коммерческих источников.
Образование популяций клеток РС9, резистентных к гефитинибу, AZD9291 или афатинибу с применением способа эскалации дозы
Клетки РС9 высевали в количестве 5×105 клеток в свежие колбы Т75 для многократного применения в среду для выращивания и инкубировали при 37°С, 5% СО2. На следующий день среду в колбах удаляли и заменяли свежей средой для выращивания, дополненной либо 20 нМ гефитиниба, 10 нМ AZD9291 либо 0,8 нМ афтиниба (эти концентрации представляют собой концентрацию либо гефитиниба, AZD9291, либо афатиниба, требующуюся для ингибирования роста клеток РС9 на 50% (ЕС50), как определено ранее). Клетки возвращали в инкубатор, и культивирование продолжали в среде, дополненной 20 нМ гефитиниба, 10 нМ AZD9291 или 0,8 нМ афатиниба, с заменой среды каждые 2-3 суток.
Для каждой из колб с РС9 большинство клеток в культуре умерли и оторвались от колбы в начальной стадии, эти клетки удаляли по мере того как заменяли среду. Небольшое количество клеток оставались прикрепленными к колбе и начинали расти в качестве резистентных колоний. Рост этих колоний продолжали до конфлюэнтности в колбе, равной примерно 80%. На этой стадии среду удаляли из колбы и добавляли 10 мл PBS. Осторожно ополаскивали клетки PBS, который затем удаляли. Добавляли 2 мл TrypLE Express и покачивали колбу для обеспечения покрытия всех клеток раствором трипсина. Клетки инкубировали при 37°С, 5% СО2 в течение 10 минут. Затем осторожно похлопывали по колбе для сдвигания с места всех клеток, и клетки ресуспендировали в общей сложности в 10 мл среды для выращивания, дополненной гефитинибом, AZD9291 или афатинибом, как приведено выше. Клетки считали и использовали для посева в количестве 5×105 клеток в чистые колбы Т75 в среду для выращивания, дополненную либо 40 нМ гефитиниба, 20 нМ AZD9291 либо 1,6, нМ афатиниба (то есть удвоение концентрации гефитиниба, AZD9291 или афатиниба).
Для каждой из колб с РС9 продолжали культивирование и пассивирование клеток, как описано выше, с концентрациями гефитиниба, AZD9291 или афатиниба, удвоенными каждый раз, когда резистентные клетки достигали конфлюэнтности примерно 80%, до достижения максимальной концентрации 1500 нМ гефитиниба, 160 нМ AZD9291 или 1500 нМ афатиниба. Для каждой резистентной популяции время, затраченное на достижение удвоения каждой концентрации (то есть время, затраченное для клеток РС9 на достижение конфлюентности примерно 80%), регистрировали и наносили на график в зависимости от концентрации. На Фиг. 1 показаны данные примера, нанесенные на график относительно времени, затраченного на образование популяции клеток РС9, резистентных к гефитинибу. Данные указывают на то, что, после того как клетки становятся резистентными к приблизительно 320 нМ гефитиниба (приблизительно 62 суток), дальнейшее повышение концентрации ингибитора оказывает меньшее воздействие на скорость роста и выживание клеток. Это говорит о том, что эти клетки РС9 в течение первых 62 суток приобрели механизм резистентности, который может обходить ингибирование EGFR и дает возможность клеткам выживать, даже когда концентрацию гефитиниба повышают в дополнение к 1500 нМ.
Эти резистентные клетки сохраняют в качестве популяции клеток, резистентных к гефитинибу. Образовавшиеся резистентные популяции размножали и образцы клеток замораживали для дополнительного определения молекулярного профиля, чтобы идентифицировать возможные механизмы резистентности в популяции.
Образование популяций клеток РС9, резистентных к AZD9291, используя одну концентрацию AZD9291
Клетки РС9 высевали в количестве 5×105 клеток в свежую колбу Т75 в среду для выращивания и инкубировали при 37°С, 5% СО2. На следующий день среду в колбе удаляли и заменяли свежей средой для выращивания, дополненной 160 нМ AZD9291 (заранее определенной в качестве клинически значимой концентрации AZD9291). Клетки возвращали в инкубатор, и культивирование продолжали в среде, дополненной 160 нМ AZD9291, с заменами среды каждые 2-3 суток. В начальной стадии большинство клеток в культуре умерли и оторвались от колбы, эти клеток удаляли по мере того как заменяли среду. Очень небольшое количество клеток сохранялись прикрепленными к колбе и начинали расти в качестве резистентных колоний. Рост этих колоний продолжали до конфлюэнтности в колбе, равной примерно 80% (приблизительно 70 суток культивирования).
Эту популяцию клеток размножали, и образцы клеток замораживали для дополнительного анализа, чтобы идентифицировать возможные механизмы резистентности в популяции.
Пример 2. Определение генетического профиля популяций клеток РС9, резистентных к гефитинибу, AZD9291 и афатинибу, и идентификация изменений NRAS
Получение дебриса из резистентных клеток
Образцы популяций клеток РС9, резистентных к гефитинибу, клеток РС9, резистентных к AZD9291, и клеток РС9, резистентных к афатинибу, культивировали в колбах Т75 до их конфлюэнтности, равной примерно 80%. Клетки трипсинизировали, как описано ранее, и ресуспендировали в общей сложности в объеме 10 мл PBS. Клетки осаждали центрифугированием со скоростью 1000 об/мин в течение 5 минут и промывали в дополнительных 10 мл PBS. Клетки повторно осаждали и удаляли как можно больше PBS. Дебрис замораживали при -20°С в течение максимум 1 недели перед дальнейшей обработкой.
Аналогичные способы применяли для получения дебриса из других клеточных популяций, например родительских клеток РС9, при необходимости.
Получение ДНК из клеток
Образцы ДНК получали, используя универсальный набор Allprep DNA/RNA/miRNA (Qiagen) согласно инструкциям изготовителя и включая стадию РНКазы для предупреждения переноса РНК.
Образцы ДНК использовали для установления присутствия мутаций ДНК и/или изменений копийности гена, применяя по меньшей мере две платформы: секвенирование нового поколения (NGS) и матричную сравнительную геномную гибридизацию (aCGH).
Идентификация мутаций E63K, G12V и G12R NRAS
NGS выполняли для популяций клеток РС9, резистентных к гефитинибу, резистентных к AZD9291 и резистентных к афатинибу. Анализ выполняли, используя систему Qiagen GeneRead (праймеры для мультиплексной ПЦР, нацеленные на все экзоны из 20 родственных генов рака легких) для обогащения очищенной ДНК с последующим секвенированием, используя технологию Illumina. Результаты валидировали путем секвенирования субпопуляции образцов, используя секвенирование по Сэнгеру, секвенирование, предложенное Life Technologies (Ion Torrent PGM), или обогащение ment Agilent Haloplex™, с последующим секвенированием, предложенным Illumina. Секвенирование по Сэнгеру интерпретировали путем непосредственного считывания хроматограмм и способы на основе секвенирования нового поколения путем стандартных методик - контроля качества чтений секвенирования, выравнивания на референсный геном человека hg19, идентификации варианта и распознавания мутаций после визуального контроля
В целом, анализировали количество клеточных линий РС9, резистентных к гефитинибу (РС9 IR-GM, РС9 IRLR, РС9 IR-4, ПЦР IR-6), и клеточных линий РС9, резистентных к AZD9291 (РС9 9291-5, РС9 9291_6, РС9 9291-LOB_1, РС9 9291-3 и РС9 9291-2), а также родительскую клеточную линию РС9.
Новую мутацию NRAS, E63K, обнаружили в одной резистентной к гефитинибу клеточной линии (РС9 IR-LR) и также в одной резистентной к AZD9291 клеточной линии (РС9 9291-LOB_1).
Анализ с использованием Qiagen GeneRead system и система Haloplex™ (Agilent Technologies) показали, что соответствующая мутация ДНК (С на Т), которая кодирует мутацию E63K, не имеет место на значительном уровне (выше шума) в родительской клеточной линии РС9 или других тестированных клеточных линиях, резистентных к гефитинибу или резистентных к AZD9291 (смотреть Таблицы 1 и 2 ниже). Таким образом, мутация E63K не является предсуществующей, но приобретается в ответ на ингибирование EGFR.
Анализ NGS выполняли, как описано выше для мутации E63K.
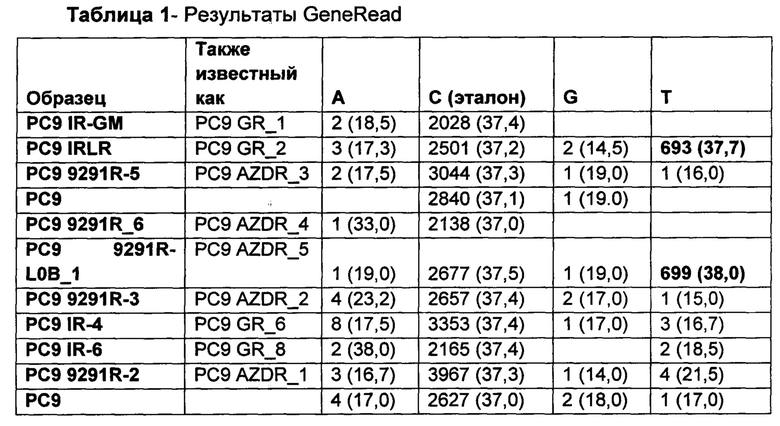
Первое приведенное число указывает на количество чтений, и число в скобках указывает на средний балл качества секвенирования (балл ниже 25 следует считать шумом). Мутацию E63K (С на Т) выделяют жирным шрифтом.
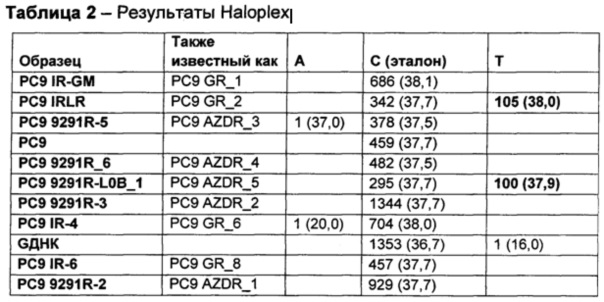
Первое приведенное число указывает на количество чтений, и число в скобках указывает на средний балл качества секвенирования. Мутацию E63K (С на Т) выделяют жирным шрифтом.
Когда клеточные линии тестировали на наличие мутации Т790М EGFR, обнаружили, что ни одна из E63K-резистентных клеточных линий не имеет эту мутацию. Мутация Т709М была обнаружена в других резистентных к гефитинибу клеточных линиях (РС9 IR-4, РС9 IR-GM и РС9 IR-6), но не присутствовала в любой из резистентных к AZD9291 клеточных линиях.
Идентификация роста копийности NRAS
Рост копийности NRAS идентифицировали, применяя aCGH с родительскими клетками РС9 и резистентными к афатинибу клетками РС9 (РС9_афатиниб_5). Рост копийности гена NRAS подробно описан ниже и относительно предполагаемой копийности (Таблица 3), так и отношении log2 копийности (Таблица 4):


Приведенные выше значения вычисляли, используя Perl Script. Полученные данные log2 потом анализировали, форматировали и визуализировали. Пороговую величину кратности изменения больше 1 и меньше -0,5 применяли к данным, чтобы визуализировать данные aCGH от всех образцов. На основании полученной визуализации ген NRAS идентифицировали как показывающий рост копийности по сравнению со средним значением в родительских клеточных линиях РС9. Применяя NGS, как описано выше, также обнаруживали рост числа копий гена NRAS в 2 популяциях РС9, резистентных к AZD9291.

Пример 4. Анализ чувствительности резистентных клеточных линий к комбинации селуметиниба (ингибитор MEK) и ингибитора EGFR
Влияние панели ингибиторов канонического пути на рост и выживание клеток измеряли, применяя клеточный анализ с использованием окрашивания Sytox Green в качестве конечной точки.
Реагенты
Среда RPMI-1640 (Sigma R7509)
Фосфатно-солевой буферный раствор по Дульбекко (PBS) (Sigma D8537)
L-глутамин 200 мМ (100 х) (Gibco, Life Technologies 25030)
Фетальная телячья сыворотка (Sigma F7524)
TrypLE Express (Gibco, Life Technologies 12605)
AZD9291 и гефитиниб (собственного производства)
Среда для выращивания
Среда RPMI-1640
10% Фетальная телячья сыворотка
2 мМ L-глутамин
Раствор Sytox Green - краситель Sytox Green, Invitrogen S7020, 5 мМ исходный раствор, разбавленный до 2 мкМ в TBS, содеражщем 5 мМ EDTA, рН 7,5
0,25% раствор сапонина в лунку (номер в каталоге Sigma-Aldrich 84510. (2,5% исходный раствор сапонина, приготовленный в TBS, содержащем 5 мМ EDTA, рН 7,5 и стерилизован фильтрованием)
Тестированные клеточные линии:
РС9 (NRAS WT)
PC9_IRGM (NRAS WT) (AKA. PC9 GR_1)
PC9_9291RLOB1 (E63K NRAS)(AKA PC9 AZDR_5)
PC9_IRLR (E63K NRAS) (АКА. PC9 GR_2)
PC9_9291R_3 (NRAS G12V) (AKA. PC9 AZDR_2)
PC9_9291R_5 (NRAS WT) (AKA. PC9 AZDR_3)
РС9_афатиниб_5 (NRAS WT рост) (AKA. PC9 AR_5)
PC9_IR4_9291R_2 (NRAS WT рост) (AKA. PC9 GR6 AZDR_2)
PC9_IR4_9291R_3 (NRAS WT рост) (AKA. PC9 GR6 AZDR_3)
Способы
Клеточные линии сеяли в 384-луночные планшеты в количестве 1000 клеток в лунку в 70 мкл в лунке среды RPMI, содержащей 10% фетальную телячью сыворотку, 2 мМ L-глутамин и инициирующий ингибитор EGFR.
Клетки оставляли прикрепляться в течение ночи при 37°С, 5% СО2. На следующий день в планшеты для анализа добавляли титры тестируемого соединения, используя Echo Liquid Handler Labcyte (California, USA) и обработанные клетки инкубировали в течение дополнительных 72 часов при 37°С, 5% СО2. Каждое соединение тестировали в виде 11 точечной зависимости доза-эффект с максимальной концентрацией 10 мкМ и разведениями 1 к 3. После 72 часов инкубации обработанных соединением планшетов добавляли по 5 мкл в лунку 2 мкМ криасителя нуклеиновых кислот SYTOX Green, Life Technologies (Paisley, UK), и планшеты инкубировали при комнатной температуре в течение одного часа. Число флуоресцирующих клеток в лунке измеряли на Acumen ТТР LabTech Ltd. (Melbourn, UK), где это число представляет собой число мертвых клеток. Добавляли в лунку по 10 мкл 0,25% сапонина Sigma (Dorset, UK) и планшеты инкубировали в течение ночи при комнатной температуре. Суммарное число флуоресцирующих клеток в лунке измеряли на Acumen. Число мертвых клеток вычитали из суммарного числа клеток и число живых клеток наносили на график для определения значений ЕС50 исходя из кривых зависимости доза-эффект.
Было замечено, что клеточные линии, которые приобрели мутацию NRAS, были более чувствительными к селуметинибу по сравнению с родительскими клетками и другими клеточными линиями, у которых мутация NRAS не была обнаружена.
В таблице ниже (Таблица 6) показаны значения ЕС50 мкМ по всем NRAS WT и тестированным мутантным клеточным линиям. Данные указывает на то, что клеточные линии, которые приобрели мутацию NRAS, являются более чувствительными к селуметинибу при обработке в комбинации с инициирующим ингибитором EGFR и по сравнению с родительской клеточной линией. Напротив, клеточные линии, в которых не обнаружили мутацию NRAS, были не чувствительными к селуметинибу при обработке в комбинации с инициирующим ингибитором EGFR.
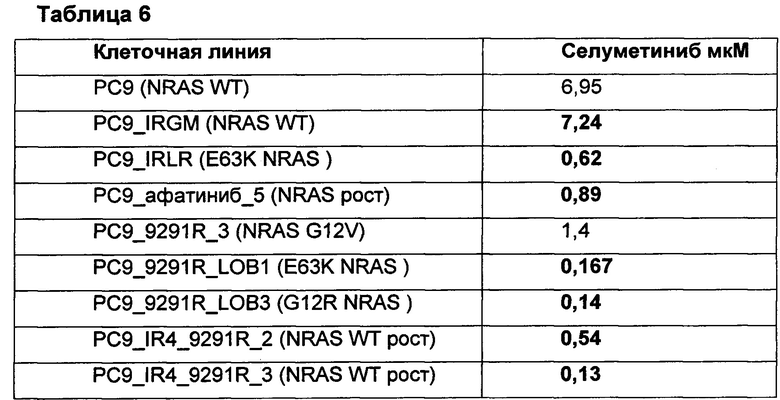
Клеточные линии обрабатывали при помощи титрований дозы селуметиниба и значения ЕС50 μМ определяли по кривым зависимости доза-эффект. Пример кривых зависимости доза-эффект показан на Фиг. 2-6.
Пример 5: Анализ функциональной роли мутации E63K NRAS в выживании резистентных к гефитинибу или AZD9291 клеточных популяций
С целью изучения, является ли новая мутация E63K NRAS активирующей мутацией, которая приводит к выживанию резистентных к гефитинибу или AZD9291 клеток, авторы изобретения использовали целый ряд способов:
а) анализы активации RAS для сравнения основных уровней активного NRAS в родительских клетках РС9 (WT NRAS) с основными уровнями активного NRAS в резистентных клетках с мутантным NRAS.
б) миРНК-нокдаун экспрессии WT и мутанта NRAS для изучения воздействия на нисходящие сигналы и клеточный рост.
в) экзогенная экспрессия NRAS WT и мутантных вариантов E63K NRAS в клетках РС9 для изучения воздействия на клеточный рост ингибирования посредством гефитиниба или AZD9291.
а). Анализ активации RAS
Способ
РС9 и РС9 AZD9291 резистентным клетки культивировали в среде, не содержащей AZD9291, в течение 4 суток. Затем клетки высевали в 6-луночные планшеты, и сыворотку истощали в течение ночи. На следующий день клетки обрабатывали в течение 2 часов средой, дополненной 160 нМ AZD9291 или без него. Получали лизаты, и активный NRAS выделяли, используя анализ с осаждением GST-RAS связывающего домена (Thermo Scientific). Осажденные лизаты анализировали посредством вестерн-блоттинга, используя антитело, специфичное к NRAS.
Результаты
Основные уровни активного NRAS были ниже в родительских клетках РС-9 по сравнению с резистентными популяциями клеток РС-9, в которых была обнаружена мутация E63K или G12V NRAS. Кроме того, обработка родительских клеток РС-9 160 нМ AZD9291 в течение 2 часов вызывала снижение фосфорилированного EGFR и активного NRAS. Напротив, в клетках мутантного NRAS снижение фосфорилированного EGFR не ассоциировали с соответствующим снижением активного NRAS, из чего можно заключить, что конститутивная активация NRAS не зависит от EGFR в этих клетках. Результаты показаны на Фиг. 7.
б) Анализ воздействия обработки миРНК NRAS и KRAS на популяции клеток РС9, резистентных к гефитинибу и резистентных к AZD9291.
Клетки РС9, резистентные к гефитинибу клетки РС9 и резистентные к AZD9291 клетки РС9 высевали в количестве 5×105 клеток в лунку в 6-луночные планшеты в 2 мл в лунке среды для выращивания, дополненной ингибитором EGFR, при необходимости (резистентные клетки выращивали в присутствие ингибитора EGFR). Клетки инкубировали в течение ночи при 37°С, 5% СО2. На следующий день клетки обрабатывали с использованием конечной концентрация 20 нМ миРНК от Dharmacon, как подробно показано в Таблице 7.
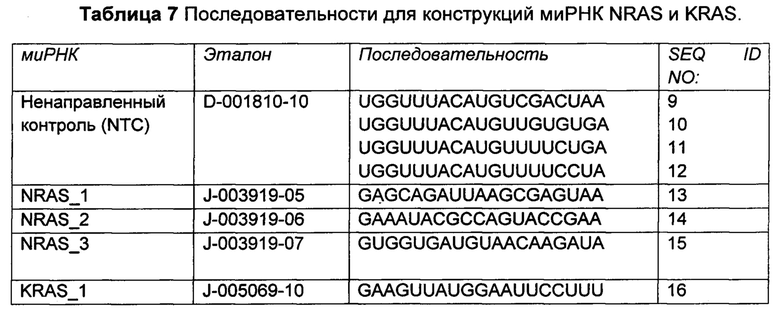
Каждую миРНК конструкцию получали в среде Optimem (Life Technologies), используя РНК iMAX (Invitrogen) в качестве реагента для трансфекции. Для каждой лунки: 2,5 мкл миРНК (20 мкл исходный раствор) смешивали с 250 мкл Optimem и 2,5 мкл РНК iMAX смешивали с 250 мкл Optimem. 2 раствора смешивали вместе пипетированием и давали отстояться в течение 5 минут при комнатной температуре. Затем 500 мкл конечного раствора пипетировали приблизительно в 2 мл среды для выращивания в 6-луночные планшеты. Планшеты осторожно вращали для перемешивания раствора и дополнительно инкубировали в течение ночи при 37°С, 5% CO2. На следующий день собирали клетки из каждой лунки и считали число клеток.
Образец клеток от каждой трансфекции затем высевали в 96-луночные планшеты в количестве 3000 клеток в лунку в 100 мкл среды для выращивания дополненной, ингибитором EGFR, при необходимости, во всем 5 параллельным лункам для каждого условия трансфекции. Оставшуюся часть клеток повторно высевали в свежие 6-луночные планшеты. Как 96-, так и 6-луночные планшеты возвращали в инкубатор для дальнейшего роста.
На следующий день получали лизаты из 6-луночных планшетов, для того чтобы можно было оценить нокдаун экспрессии белка после 48 часов обработки миРНК. Лизаты анализировали посредством вестерн-блоттинга на уровни: фосфорилированного EGFR, фосфорилированного ERK, NRAS и KRAS. Уровни GAPDH применяли в качестве контроля для нанесения во всех образцах клеток. (Фиг. 8)
Соответствующее клетки в 96-луночных планшетах оставляли расти в течение дополнительных 5 суток, после чего их фиксировали путем добавления 100 мкл 4% формальдегида в лунку в течение 30 минут при комнатной температуре. Лунки промывали PBS, и ядра окрашивали путем добавления Hoechst (разведение 1 к 5000) в течение 30 минут при комнатной температуре. Число клеток считали, используя счетчик Cellomics Arrayscan с увеличением в 10 раз 9 полей зрения на лунку. Среднее число клеток наносили на график. (Фиг. 9).
Результаты вестерн-блоттинга показали, что экспрессия NRAS подверглась нокдауну во всех клеточных линиях в результате использования всех 3 конструкций миРНК NRAS, и что не наблюдали воздействия на экспрессию NRAS посредством конструкции миРНК NTC или KRAS. С другой стороны, только конструкция KRAS_1 вызывала нокдаун экспрессии KRAS, в то время как не имела влияния на экспрессию NRAS (Фиг. 8).
Воздействие на клеточный рост посредством трансфекций миРНК показало, что в резистентных к гефитинибу и в резистентных к AZD9291 клеточных линиях, в которых была идентифицирована новая мутацию NRAS, нокдаун экспрессии NRAS значительно ингибировал клеточный рост, в то время как нокдаун экспрессии KRAS не имел влияния на клеточный рост. Напротив, ни нокдаун NRAS, ни нокдаун KRAS не имел влияния на рост родительских клеток РС9 (Фиг. 9).
Эти данные говорят о том, что мутация E63K NRAS представляет собой активирующую мутацию и что она приводит к выживанию резистентных клеток.
в) Анализ сверхэкспрессии вариантов ДНК NRAS WT и мутанта E63K NRAS в клетках РС9 для изучения воздействий на клеточный рост ингибирования посредством гефитиниба или AZD9291
Клетки РС9 трансфицировали контрольной конструкцией ДНК, рсДНК 3.1+ контроль, или конструкцией, сконструированной для экспрессии E63K мутанта NRAS, рсДНК 3.1+ / E63K NRAS, (Life Technologies Ltd.). В течение 96 часов экспрессии методику трансфекции MaxCyte применяли для электропорации клеток РС9. Клетки РС9 пересевали за сутки перед трансфекцией. В сутки трансфекции клетки собирали и ресуспендировали в количестве 9×107 клеток на 600 мкл буфера MaxCyte. 100 мкл клеточной суспензии переносили в кювету MaxCyte, и клетки электропорировали с 20 мг конструкции ДНК. После электропорации клетки для каждого условия переносили в 6-луночный планшет и инкубировали при 37°С в течение 30 минут, после чего их высевали в 6-луночный планшет в количестве 4×105 клеток в лунку. После инкубации в течение ночи клетки собирали и повторно высевали в 384-луночный планшет в количестве 1000 клеток/лунка. На следующий день клетки дозировали либо 100 нМ AZD9291, либо 300 нМ гефитиниба, и планшеты инкубировали в течение дополнительных 96 часов. Число живых клеток определяли, применяя способ с sytox green, как описано выше в данном описании изобретения. На Фиг. 10 показано, что ингибирование клеточного роста посредством AZD9291 и гефитиниба снижалось, когда клетки сверхэкспрессировали мутант E63K NRAS.
Чувствительность к ингибитору MEK (селуметиниб) клеточных популяций, содержащих мутацию G12R NRAS
Резистентную к AZD9291 клеточную линию РС9 получали, применяя стандартные способы, как иллюстрировано выше в данном описании изобретения. Ряд таких резистентных клеточных популяций ккультивировали и анализировали. Обнаружили, что одна такая клеточная популяция содержит мутацию G12R NRAS, и эта популяция также показывала более чем 5-кратное повышение чувствительности к ингибитору MEK, селуметинибу, по сравнению с родительской клеточной линией.


















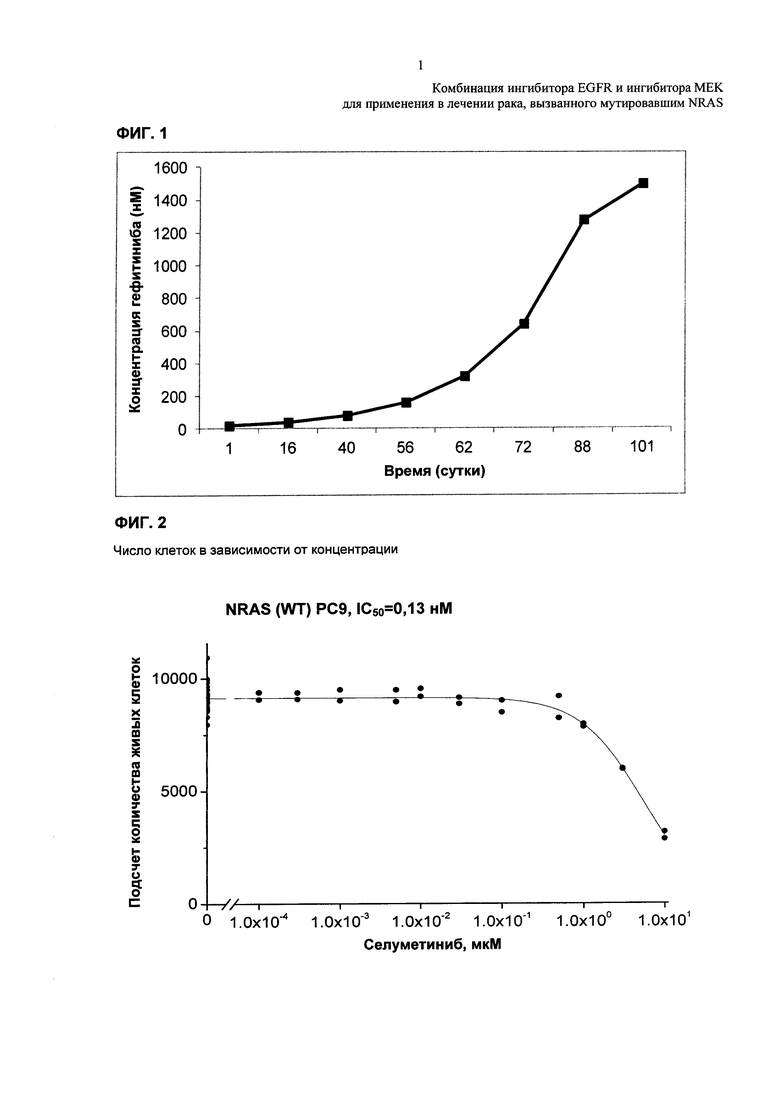
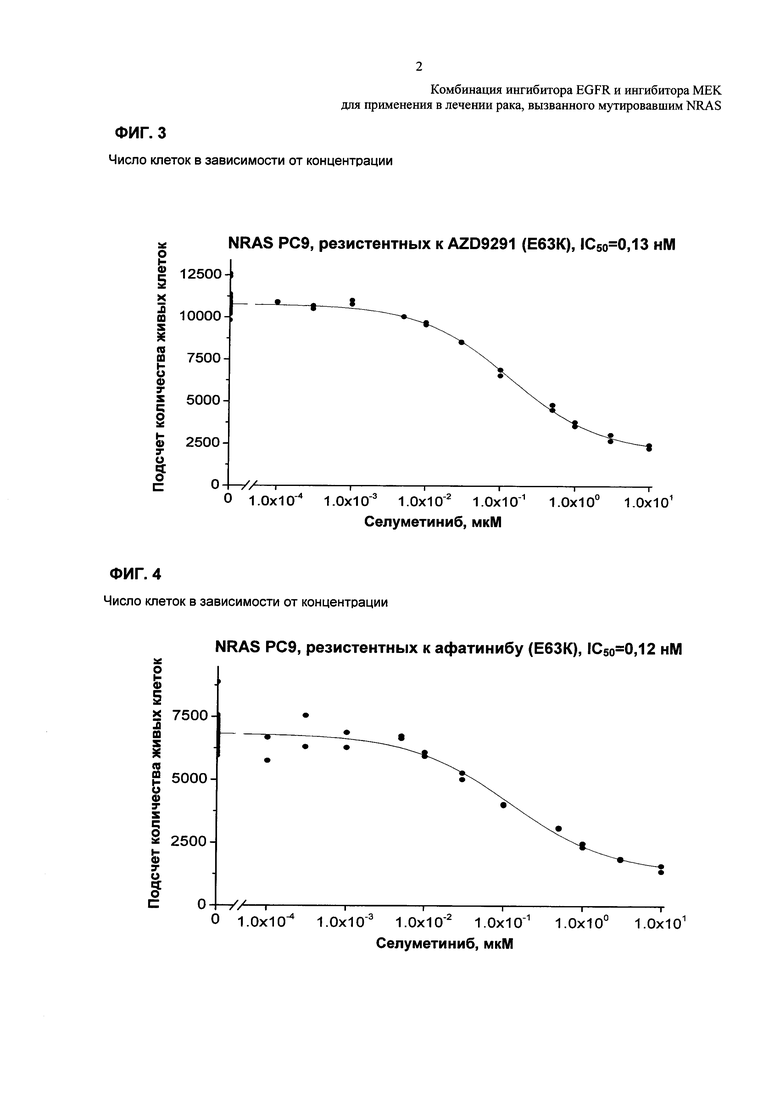
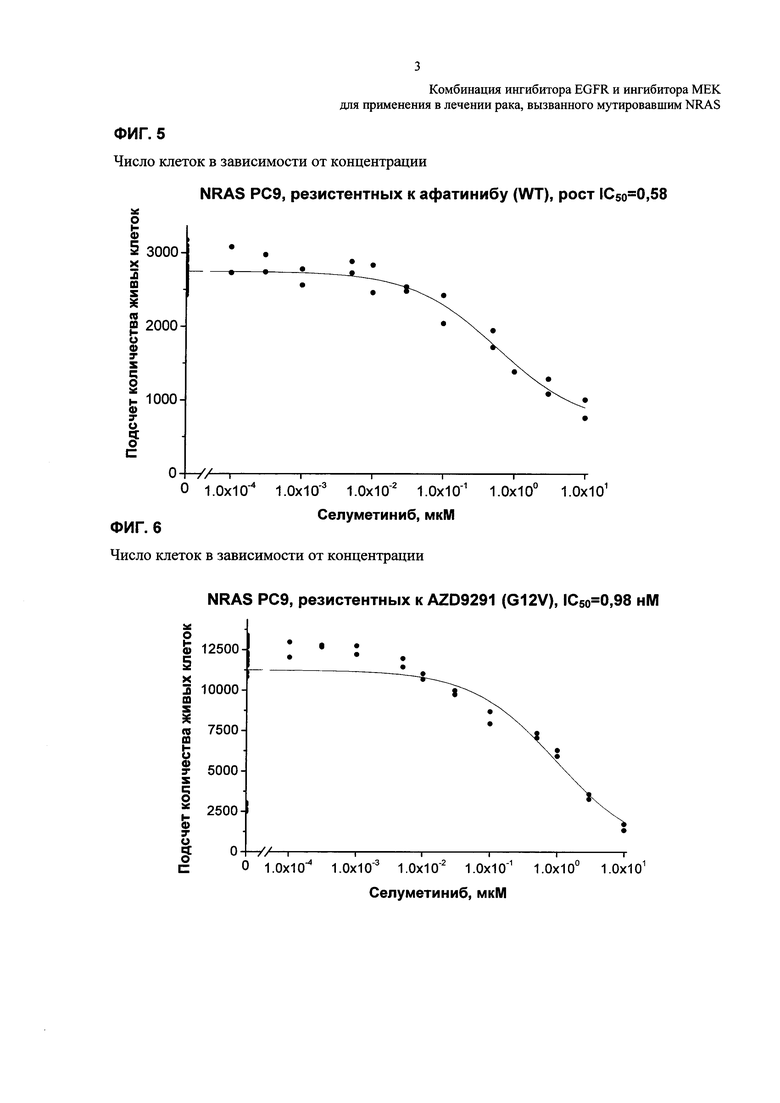
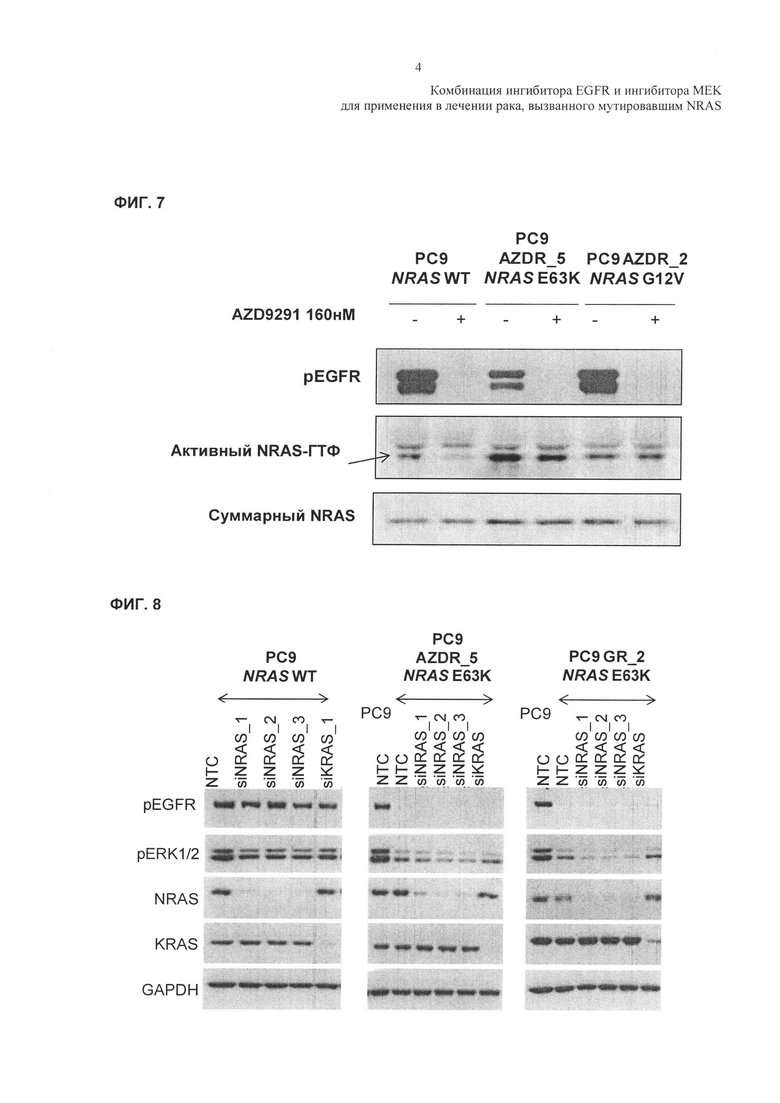

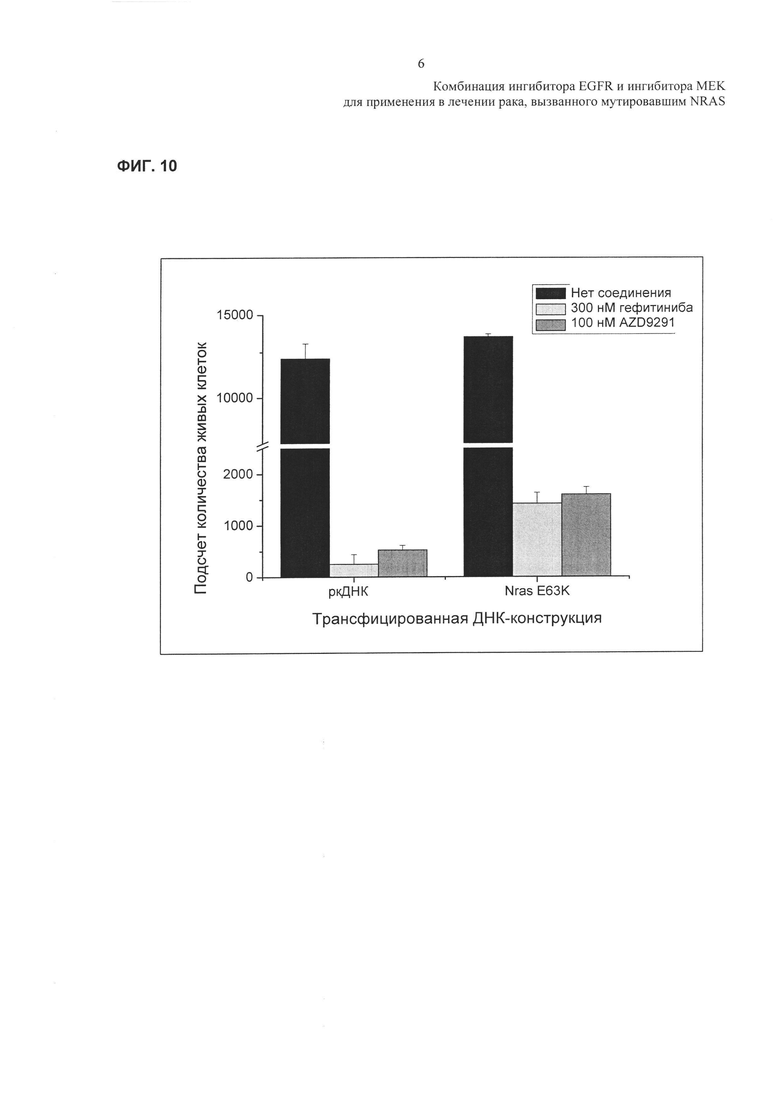
Изобретение относится к области медицины. Предложено применение ингибитора EGFR в лечении немелкоклеточного рака легкого, вызванного мутировавшим NRAS, где ингибитор EGFR вводят в комбинации с ингибитором МЕК и мутация NRAS выбрана из Е63К, G12V и G12R или роста копийности гена NRAS. Изобретение обеспечивает эффективное лечение немелкоклеточного рака легкого, вызванного мутировавшим NRAS, с помощью комбинации ингибитора EGFR с ингибитором МЕК. 5 з. п. ф-лы, 10 ил., 7 табл., 4 пр.
1. Применение ингибитора EGFR (рецептор эпидермального фактора роста) в лечении немелкоклеточного рака легкого, вызванного мутировавшим NRAS (вирусный онкоген RAS нейробластомы), где ингибитор EGFR вводят в комбинации с ингибитором МЕК (MAP (митогенактивируемая) протеинкиназа/регулируемая внеклеточными сигналами киназа-киназа) и мутация NRAS выбрана из Е63К, G12V и G12R или роста копийности гена NRAS.
2. Применение ингибитора EGFR по п. 1, где ингибитор EGFR выбран из гефитиниба, эрлотиниба, афатиниба, AZD9291 и СО 1686 или их фармацевтически приемлемой соли.
3. Применение ингибитора EGFR по п. 2, где ингибитор EGFR выбран из AZD9291 и СО 1686 или их фармацевтически приемлемой соли.
4. Применение ингибитора EGFR по п. 3, где ингибитор EGFR представляет собой AZD9291 или его фармацевтически приемлемую соль.
5. Применение ингибитора EGFR по любому из пп. 1-4, где ингибитор МЕК выбран из селуметиниба, траметиниба, МЕК-162 и кобиметиниба или их фармацевтически приемлемой соли.
6. Применение ингибитора EGFR по п. 5, где ингибитор МЕК представляет собой селуметиниб или его фармацевтически приемлемую соль.
| MISALE S | |||
| et al | |||
| Blockade of EGFR and MEK intercepts heterogeneous mechanisms of acquired resistance to anti-EGFR therapies in colorectal cancer | |||
| Sci Transl Med | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| WO 2013170066 A1, 14.11.2013 | |||
| УСТРОЙСТВО ДЛЯ СООБЩЕНИЯ ДВИЖЕНИЯ СРЕДСТВАМ ПЕРЕДВИЖЕНИЯ ПО ВОДЕ | 1929 |
|
SU18624A1 |
Авторы
Даты
2019-03-27—Публикация
2015-04-02—Подача