Перекрестные ссылки на родственные заявки
По настоящей заявке испрашивается приоритет предварительной патентной заявки США №61/646,218, поданной 11 мая 2012, включенной в настоящее описание посредством ссылки во всей полноте.
Дополнительные заявки, включенные посредством ссылки
Следующие заявки также включены в настоящее описание посредством ссылки во всей полноте:
Патентная заявка США №13/281,360, поданная 25 октября 2011;
Патентная заявка на патент США №13/281,361, поданная 25 октября 2011; и
Патентная заявка на патент США №13/281,395, поданная 25 октября 2011.
Как таковые, компоненты и характеристики вариантов осуществления, раскрытых в этих заявках, могут быть объединены с различными компонентами и характеристиками, раскрытыми в настоящей заявке.
Область техники
Настоящее изобретение относится в целом к ренальной нейромодуляции, и к связанным с ней системам и способам. В частности, некоторые варианты осуществления относятся к катетерным устройствам, содержащим группы из нескольких электродов, для радиочастотной (РЧ) абляции для внутрисосудистой ренальной нейромодуляции, и соответствующих системам и способам.
Предшествующий уровень техники
Симпатическая нервная система (СНС) является, прежде всего, вегетативной системой контроля организма, как правило, связанной с ответом на стресс. Волокна СНС, иннервирующие ткани, присутствуют почти во всех системах органов тела человека, и могут влиять на такие характеристики, как диаметр зрачков, моторика кишечника и мочевыделение. Такая регуляция может применяться с целью адаптации для поддержки гомеостаза или подготовки тела к быстрому ответу на факторы окружающей среды. Однако, хроническая активация СНС является обычным неадекватным ответом, который может приводить к прогрессированию многих патологических состояний. В частности, в экспериментах и у людей было установлено, что избыточная активация почечной СНС, возможно, вносит вклад в комплексную патофизиологию гипертензии, состояний объемной перегрузки (таких, как сердечная недостаточность) и прогрессирующей почечной недостаточности. Например, введение радиоактивных индикаторов показало повышенные уровни радиоактивного норэпинефрина («НЭ») в почках у пациентов с эссенциальной гипертензией.
Гиперактивность кардиоренальных симпатических нервов может быть особенно выражена у пациентов с сердечной недостаточностью. Например, у этих пациентов часто обнаруживается избыточное выделение НЭ из сердца и почек. Повышенная активация СНС обычно характеризует и хроническую, и терминальную почечную недостаточность. У пациентов с терминальной почечной недостаточностью было показано, что уровни НЭ в плазме выше среднего прогнозируют сердечно-сосудистые повреждения и в некоторых случаях смерть. Это также верно для пациентов, страдающих диабетической или контраст-индуцированной нефропатией. Эти данные позволяют предположить, что сенсорные афферентные сигналы, исходящие от пораженных почек, вносят основной вклад в инициацию и поддержку повышенного центрального симпатического влияния.
Симпатические нервы, иннервирующие почки, заканчиваются в кровеносных сосудах, юкстагломерулярном аппарате и почечных канальцах. Стимуляция симпатических нервов почки может вызвать повышенное высвобождение ренина, повышенную реабсорбцию натрия (Na+), и снижение почечного кровотока. Эти компоненты нервной регуляции почечной функции значительно стимулируются при патологических состояниях, характеризующихся повышенным симпатическим тонусом, и вероятно, вносят вклад в повышение кровяного давления у пациентов, страдающих гипертензией. Снижение почечного кровотока и скорости гломерулярной фильтрации, происходящее из-за симпатической эфферентной стимуляции почки, вероятно, является краеугольным камнем в снижении почечной функции при кардиоренальном синдроме (т.е. дисфункции почки как прогрессирующего осложнения хронической сердечной недостаточности). Фармакологические стратегии для противодействия последствиям эфферентной симпатической стимуляции почек включают симпатолитические препараты центрального действия, бета-блокаторы (направленные на снижение высвобождения ренина), ингибиторы ангиотензин-превращающего фермента и блокаторы рецептора (предназначенные для блокирования действия ангиотензина II и активации альдостерона вследствие высвобождения ренина), и диуретики (направленные на противодействие задержке натрия и воды, опосредованной симпатической системой почек). Однако эти фармакологические стратегии имеют существенные ограничения, включающие ограниченную эффективность, проблемы соблюдения режима лечения, побочные эффекты, и тому подобное. Недавно было показано, что внутрисосудистые устройства, снижающие симпатическую нервную активность путем приложения энергетического поля к целевому участку в кровеносном сосуде почки (например, путем РЧ-абляции), снижают кровяное давление у пациентов с гипертензией, устойчивой к лечению.
Краткое описание чертежей
Многие аспекты настоящего описания станут более понятны со ссылкой на следующие чертежи. Компоненты на чертежах не обязательно показаны в масштабе. Вместо этого делается акцент на ясной иллюстрации принципов настоящего изобретения. Далее, компоненты могут быть показаны как прозрачные на некоторых видах, только для простоты иллюстрации, и не указывают, что иллюстрированный компонент действительно является прозрачным.
Фиг. 1 является отчасти схематической диаграммой системы нейромодуляции, сконструированной в соответствии с вариантом осуществления настоящего изобретения.
Фиг. 2 иллюстрирует модуляцию нервов почки с многоэлектродным катетером, сконструированным в соответствии с вариантом осуществления настоящего изобретения.
Фиг. 3А является видом сбоку дистальной части катетера, содержащей терапевтический блок или лечебную секцию в состоянии доставки (например, низкопрофильной или сжатой конфигурации) снаружи пациента, в соответствии с вариантом осуществления настоящего изобретения.
Фиг. 3В является изображением в перспективе дистальной части катетера с Фиг. 3А в развернутом состоянии (например, расширенной конфигурации) снаружи тела пациента.
Фиг. 4 является увеличенным изображением части лечебного устройства с Фиг. 3А.
Фиг. 5 является отчасти схематическим изображением загружающего устройства в соответствии с вариантом осуществления настоящего изобретения.
Фиг. 6 является концептуальной диаграммой, иллюстрирующей симпатическую нервную систему и то, как мозг сообщается с организмом через симпатическую нервную систему.
Фиг. 7 является увеличенным анатомическим изображением, иллюстрирующим нервы, иннервирующие левую почку, с формированием почечного сплетения, окружающего левую почечную артерию.
Фиг. 8А и 8В являются анатомическим и концептуальным изображением, соответственно, иллюстрирующим организм человека, включая головной мозг и почки, и нервное эфферентное и афферентное сообщение между головным мозгом и почками.
Фиг. 9А и 9В являются анатомическими изображениями, иллюстрирующими, соответственно, артериальную и венозную сосудистую сеть человека.
Подробное описание изобретения
Настоящее изобретение направлено на устройства, системы и способы для достижения электрически и/или термически индуцированной нейромодуляции (т.е. обеспечения нейтрализации или инактивации, или иного полного или частичного снижения функции нервных волокон, иннервирующих почку) посредством чрескожного транслюминального внутрисосудистого доступа. В частности, варианты осуществления настоящего изобретения относятся к катетерам и блок катетеров, содержащим многоэлектродные матрицы, и обладающие возможностью перевода между состоянием доставки или низкопрофильным состоянием (например, в целом прямой формы) и развернутым состоянием (например, радиально расширенной, в целом спиральной формы). Электроды или элементы, доставляющие энергию, содержащие многоэлектродную матрицу, сконструированы для доставки энергии (например, электрической энергии, РЧ-энергии, импульсной электрической энергии, термической энергии) к почечной артерии после продвижения через катетер по чрескожному транслюминальному пути (например, через прокол в бедренной артерии, в подвздошную артерию и аорту, радиальную артерию, или по другому подходящему внутрисосудистому пути). Катетер или катетерный блок, несущий многоэлектродную матрицу, подобран по размеру и форме так, чтобы электроды или элементы, доставляющие энергию, контактировали с внутренней стенкой почечной артерии, когда катетер находится в развернутом (например, спиральном) состоянии в почечной артерии. Кроме того, спиральная форма развернутой части катетера, несущего матрицу, позволяет крови протекать через спираль, что, как ожидается, предотвращает окклюзию почечной артерии при активации элемента, доставляющего энергию. Далее, кровоток в матрице и вокруг нее может охлаждать связанные элементы, доставляющие энергию, обеспечивая доставку высоких уровней энергии при более низких температурах, чем те, которые могут быть достигнуты без охлаждения. Эта характеристика, как ожидается, способствует достижению более глубоких и/или обширных поражений при лечении, снижению температуры внутренней поверхности, и/или обеспечению более продолжительного времени активации при снижении риска избыточного нагревания во время лечения.
Специфические подробности некоторых вариантов осуществления изобретения описаны ниже со ссылкой на Фиг. 1-9В. Хотя многие из вариантов осуществления описаны ниже со ссылкой на устройства, системы способы для внутрисосудистой модуляции нервов с применением многоэлектродных матриц, другие приложения и другие варианты осуществления, в дополнение к тем, которые описаны в настоящей заявке, находятся в пределах объема настоящего изобретения. Кроме того, некоторые другие варианты осуществления изобретения могут иметь иные конфигурации, компоненты или процедуры, чем те, которые описаны в настоящей заявке. Таким образом, специалисту в данной области техники понятно, что изобретение может иметь другие варианты осуществления с дополнительными элементами, или изобретение может иметь другие варианты осуществления без некоторых характеристик, показанных и описанных ниже со ссылкой на Фиг. 1-9В.
Термины «дистальный» и «проксимальный», используемые в настоящей заявке, определяют положение или направление по отношению к лечащему врачу или контрольному устройству врача (например, рукоятке в сборе). «Дистальный» или «дистально» может означать положение, удаленное, или находящееся в направлении от врача или контрольного устройства врача. «Проксимальный» или «проксимально» может означать положение рядом, или положение по направлению к врачу или контрольному устройству врача.
I. Нейромодуляция почек
Нейромодуляция почек означает частичное или полное нарушение функции, или другое разрушение эффективности нервов, иннервирующих почки (например, обеспечение инертности или неактивности нервных волокон, или иное полное или частичное ослабление функции). Например, нейромодуляция почек может включать ингибирование, снижение и/или блокаду нервного сообщения по нервным волокнам (т.е. эфферентным и/или афферентным нервным волокнам), иннервирующим почки. Такое нарушение функции может быть долговременным (например, непрерывным в течение месяцев, лет или десятилетий) или кратковременным (например, в течение минут, часов, суток или недель). Предполагается, что нейромодуляция почек обеспечивает эффективное лечение некоторых патологических состояний, характеризующихся повышенной общей симпатической активностью, и в частности, состояний, связанных с центральной симпатической избыточной стимуляцией, таких как гипертензия, сердечная недостаточность, острый инфаркт миокарда, метаболический синдром, инсулиновая резистентность, диабет, гипертрофия левого желудочка, хроническая и терминальная почечная недостаточность, неадекватная задержка жидкости при сердечной недостаточности, кардио-ренальный синдром, остеопороз и внезапная смерть. Снижение афферентных нервных сигналов вносит вклад в системное снижение симпатического тонуса/стимула, а нейромодуляция почек, как ожидается, может быть полезной при лечении некоторых состояний, связанных с системной симпатической избыточной активностью или гиперактивностью. Нейромодуляция почек может быть полезной для различных органов и структур организма, иннервируемых симпатическими нервами.
Различные методики могут применяться для частичной или полной инактивации нервных путей, таких как те, которые иннервируют почку. Целенаправленное приложение энергии (например, электрической энергии, термической энергии) к ткани посредством элемента(ов), доставляющего энергию, может индуцировать один или несколько необходимых эффектов термического нагревания в локализованных участках почечной артерии и соседних участках почечного сплетения, прилегающих непосредственно или расположенных рядом с адвентициальной оболочкой почечной артерии. Целенаправленное приложение эффектов термического нагревания позволяет достичь нейромодуляции по всему почечному сплетению или его части.
Термические эффекты могут включать как термическую абляцию, так и неабляционное термическое поражение или повреждение (например, посредством непрерывного нагревания и/или стойкого нагревания). Необходимые эффекты термического нагревания, например, могут включать повышение температуры целевых нервных волокон выше порога, необходимого для достижения неабляционного термического повреждения, или выше, до более высокой температуры, для достижения абляционного термического повреждения. Например, целевая температура может быть выше температуры тела (например, около 37°C), но ниже примерно 45°C, для неабляционного термического повреждения, или целевая температура может быть около 45°C или выше, для абляционного термического повреждения.
В частности, воздействие термической энергии (нагревания), превышающей температуру тела около 37°C, но ниже температуры около 45°C, может индуцировать термическое повреждение посредством умеренного нагревания целевых нервных волокон или сосудистых структур, перфузирующих нервные волокна. В случаях, если повреждены сосудистые структуры, целевые нервные волокна могут быть лишены перфузии, что приводит к некрозу нервной ткани. Например, это может индуцировать неабляционное термическое повреждение волокон или структур. Воздействие нагревания выше температуры примерно 45°C, или выше примерно 60°C, может индуцировать термическую абляцию посредством существенного нагревания волокон или структур. Например, такие высокие температуры могут вызывать термическую абляцию целевых нервных волокон или сосудистых структур; у некоторых пациентов может быть необходимо достичь температур, вызывающих термическую абляцию целевых нервных волокон или сосудистых структур, но менее примерно 90°C, или менее примерно 85°C, или менее примерно 80°C, и/или менее примерно 75°C. Независимо от типа теплового воздействия, используемого для индукции термической нейромодуляции, ожидается снижение активности симпатических нервов в почках (АСНП).
II. Избранные варианты осуществления систем для нейромодуляции
Фиг. 1 иллюстрирует систему для ренальной нейромодуляции 10 («систему 10»), сконструированную в соответствии с вариантом осуществления настоящего изобретения. Система 10 включает внутрисосудистый катетер 12, функционально связанный с источником энергии или генератором энергии 26 (например, генератором РЧ-энергии). Катетер 12 может включать удлиненный ствол 16, имеющий проксимальную часть 18, рукоятку 34 на проксимальном участке проксимальной части 18, и дистальную часть 20. Катетер 12 может дополнительно включать терапевтический блок или лечебную секцию 21 (показанную схематически) на дистальной части 20 (например, прикрепленную к дистальной части 20, определяющую секцию дистальной части 20, и т.д.). Как подробно разъясняется ниже, терапевтический блок 21 может включать поддерживающую структуру 22 и матрицу из двух или более элементов, доставляющих энергию 24 (например, электродов), сконструированных для доставки в кровеносный сосуд почки (например, почечную артерию) в низкопрофильной конфигурации. При доставке к целевому участку лечения в кровеносном сосуде почки, терапевтический блок 21 дополнительно сконструирован для развертывания в расширенное состояние (например, в целом спиральную/винтовую конфигурацию) для доставки энергии в участок лечения и обеспечения терапевтически эффективной электрически и/или термически индуцированной ренальной нейромодуляции. Альтернативно, развернутое состояние может быть не спиральным, с тем условием, что развернутое состояние доставляет энергию к участку лечения. Терапевтический блок 21 может быть трансформирован между состоянием доставки и развернутым состоянием с применением множества подходящих механизмов или методик (например, саморасширения, удаленной активации через привод, и т.д.).
Проксимальный конец терапевтического блока 21 переносится или прикреплен к дистальной части 20 удлиненного ствола 16. Дистальный конец терапевтического блока 21 может заканчиваться катетером 12, например, с атравматическим наконечником 40. В некоторых вариантах осуществления дистальный конец терапевтического блока 21 может также быть сконструирован для сцепления с другим элементом системы 10 или катетера 12. Например, дистальный конец терапевтического блока 21 может определять проход для приема проволочного направляющего элемента (не показанного) для доставки лечебного устройства с применением методик доставки по проводнику («OTW») или быстрого обмена («RX»). Дополнительные подробности, касающиеся таких размещений, описаны ниже.
Катетер 12 может быть электрически соединен с источником энергии 26 через кабель 28, и источник энергии 26 (например, генератор РЧ-энергии) может быть сконструирован для получения избранной модальности и амплитуды энергии для доставки к участку лечения посредством элементов, доставляющих энергию 24. Как подробно описано ниже, подающие провода (не показаны) могут проходить вдоль удлиненного ствола 16 или через полость в стволе 16 к отдельным элементам, доставляющим энергию 24, и передавать лечебную энергию к элементам, доставляющим энергию 24. В некоторых вариантах осуществления каждый элемент, доставляющий энергию 24, включает собственный подающий провод. Однако в других вариантах осуществления два или более элемента, доставляющих энергию 24, могут быть электрически связаны с тем же самым подающим проводом. Контрольный механизм 32, такой как ножная педаль или переносное удаленное контрольное устройство, может быть соединен с источником энергии 26, чтобы позволить врачу начинать, заканчивать, и факультативно, регулировать различные оперативные характеристики источника энергии 26, включая доставку энергии, но не ограничиваясь ею. Устройство удаленного контроля (не показано) может располагаться в стерильной области, функционально соединяться с элементами, доставляющими энергию 24, и может быть сконструировано, чтобы позволить врачу избирательно активировать и дезактивировать элементы, доставляющие энергию 24. В других вариантах осуществления устройство удаленного контроля может быть встроено в рукоятку в сборе 34.
Источник энергии или генератор энергии 26 может быть сконструирован для доставки лечебной энергии посредством автоматизированного контрольного алгоритма 30 и/или под контролем врача. Например, источник энергии 26 может включать компьютерные устройства (например, персональные компьютеры, служебные ЭВМ, планшеты, и т.д.), имеющие обрабатывающую схему (например, микропроцессор), сконструированный для выполнения хранящихся инструкций, связанных с контрольным алгоритмом 30. Кроме того, обрабатывающая схема может быть сконструирована для выполнения одного или нескольких алгоритмов оценки/обратной связи 31, которые могут сообщаться с врачом. Например, источник энергии 26 может включать монитор или дисплей 33 и/или связанные характеристики, сконструированные для обеспечения визуальных, аудио, или иных указаний уровня мощности, показаний датчиков, и/или иной обратной связи. Источник энергии 26 может также быть сконструирован для передачи обратной связи и другой информации к другому устройству, такому как монитор в лаборатории катетеризации.
Элементы, доставляющие энергию 24, могут быть сконструированы для доставки энергии независимо (т.е. могут применяться в однополярном режиме), одновременно, избирательно, или последовательно, и/или могут доставлять энергию между любой необходимой комбинацией элементов (т.е. могут применяться в биполярном режиме). В однополярных вариантах осуществления нейтральный или дисперсионный электрод 38 может электрически соединяться с генератором энергии 26, и присоединяться к внешней области пациента (например, как показано на Фиг. 2). Далее, врач факультативно может выбрать, какой элемент(ы), доставляющий энергию 24, применять для доставки энергии с целью формирования высоко специфического поражения(ний) в почечной артерии, имеющей разнообразные формы или виды. В других вариантах осуществления система 10 может быть сконструирована для доставки других подходящих форм лечебной энергии, таких как комбинация однополярных и биполярных электрических полей.
В некоторых вариантах осуществления источник энергии 26 может включать модуль оценки радиочастотной идентификации (РЧИД) (не показан), установленный на одном или нескольких портах на источнике энергии 26 или рядом с ними, и сконструированный для беспроводного чтения и записи одного или нескольких РЧИД наконечников (не показаны) на катетере 12. В одном частном варианте осуществления, например, катетер 12 может включать РЧИД наконечник, расположенный внутри или иным образом прикрепленный к соединительной части кабеля 28, связанного с источником энергии 26. РЧИД наконечник может включать, например, антенну и РЧИД чип для обработки сигналов, отправки/приема РЧ- сигналов, и хранения данных в памяти. Подходящие РЧИД наконечники включают, например, РЧИД наконечники MB89R118, поставляемые Fujitsu Limited, Токио, Япония. Запоминающая часть РЧИД наконечника может включать множество блоков, назначенных для различных типов данных. Например, первый блок памяти может включать идентификатор валидации (например, уникальный идентификатор, связанный со специфическим типом катетера и генерируемый от уникального идентификационного номера РЧИД наконечника с применением алгоритма шифровки), а второй блок памяти может быть предназначен в качестве счетчика использования катетера, который может читаться, а затем записываться РЧИД модулем, переносимым источником энергии 26 после применения катетера. В других вариантах осуществления РЧИД наконечник может включать дополнительные блоки памяти, назначенные для дополнительных счетчиков применения катетера (например, для обеспечения применения катетера 12 специфическое ограниченное число раз) и/или другой информации, связанной с катетером 12 (например, номера серии, номера абонента, модели катетера, общих данных, и т.д.).
Модуль оценки РЧИД, переносимый источником энергии 26, может включать антенну и контур обработки, которые совместно применяются для сообщения с одной или несколькими частями источника энергии 26 и беспроводного чтения/записи одного или нескольких РЧИД наконечников поблизости от них (например, когда кабель 28, включающий РЧИД наконечник, присоединен к источнику энергии 26). Подходящие модели РЧИД оценки включают, например, TRF796QA модуль оценки, поставляемый Texas Instruments Incorporated, Даллас, Техас.
При функционировании РЧИД модуль оценки сконструирован для чтения информации от РЧИД наконечника (переносимого кабелем 28 или другой подходящей частью катетера 12), и передачи информации программному обеспечению источника энергии 26 для валидации присоединенного катетера 12 (например, оценки совместимости катетера 12 с источником энергии 26), чтения числа предыдущих применений, связанных с конкретным катетером 12, и/или записи РЧИД наконечника для индикации применения катетера. В различных вариантах осуществления источник энергии 26 может быть сконструирован для блокирования доставки энергии к катетеру 12, если предварительно заданные условия РЧИД наконечника не выполняются. Например, когда каждый катетер 12 соединяется с источником энергии 26, РЧИД модуль оценки может читать уникальный антифальсификационный номер в зашифрованном формате с РЧИД наконечника, расшифровывать номер, а затем удостоверять номер и формат данных катетера для распознанных катетеров (например, катетеров, совместимых с конкретным источником энергии 26, не фальсифицированных катетеров, и т.д.). В различных вариантах осуществления РЧИД наконечник может включать идентификаторы, которые соответствуют специфическому типу катетера, и РЧИД модуль оценки может передавать эту информацию главному контроллеру источника энергию 26, который может регулировать установки (например, контрольный алгоритм 30) источника энергии 26 до необходимых операционных параметров/характеристик (например, уровней мощности, режимов отображения, и т.д.), связанных со специфическим катетером. Далее, если РЧИД модуль оценки идентифицирует катетер 12 как фальсифицированный, или по иным причинам не может идентифицировать катетер 12, источник энергии 26 может автоматически блокировать применение катетера 12 (например, предотвращать доставку энергии).
Когда катетер 12 идентифицирован, модуль оценки РЧИД может читать адрес ячейки памяти РЧИД наконечника, чтобы определить, был ли катетер 12 раньше соединен с генератором (т.е. использовался ранее). В некоторых вариантах осуществления РЧИД наконечник может ограничивать катетер 12 до единичного применения, но в других вариантах осуществления РЧИД наконечник может быть сконструирован для обеспечения более одного применения (например, 2 применений, 5 применений, 10 применений, и т.д.). Если модуль оценки РЧИД распознает, что катетер 12 был записан (т.е. применялся) более предварительно заданного предела применения, то РЧИД модуль может передавать сообщение источнику энергии 26 для блокирования доставки энергии к катетеру 12. В некоторых вариантах осуществления модуль оценки РЧИД может быть сконструирован для интерпретации всех соединений катетера с источником энергии в течение предварительно заданного периода времени (например, 5 часов, 10 часов, 24 часов, 30 часов и т.д.) в качестве единственного соединения (т.е. единственного применения), и обеспечения использования катетера 12 множество раз в течение предварительно заданного периода времени. После обнаружения, распознавания и оценки катетера 12 в качестве «нового соединения» (например, не используемого более предварительно заданного предела), модуль оценки РЧИД может делать запись на РЧИД наконечнике (например, время и дату применения системы и/или другую информацию) для индикации применения катетера 12. В других вариантах осуществления модуль оценки РЧИД и/или РЧИД наконечник могут иметь другие характеристики и/или другие конфигурации.
Система 10 может также включать один или несколько датчиков (не показанных), расположенных поблизости или внутри элементов, доставляющих энергию 24. Например, система 10 может включать датчики температуры (например, термопары, термисторы и т.д.), датчики импеданса, датчики давления, оптические датчики, датчики потока, и/или другие подходящие датчики, соединенные с одним или несколькими подающими проводами (не показаны), передающими сигналы от датчиков и/или подающими энергию к элементам, доставляющим энергию 24. Фиг. 2 (с дополнительной ссылкой на Фиг. 1) иллюстрирует модуляцию нервов почки с вариантом осуществления системы 10. Катетер 12 обеспечивает доступ к почечному сплетению ПС через внутрисосудистый путь П, такой как от чрескожного участка доступа в бедренной (показано), плечевой, лучевой или подмышечной артерии к целевому участку лечения в соответствующей почечной артерии ПА. Как иллюстрировано, секция проксимальной части 18 ствола 16 расположена снаружи пациента. Путем манипуляции проксимальной частью 18 ствола 16 с наружной стороны внутрисосудистого пути П, врач может продвигать ствол 16 через отчасти извилистый внутрисосудистый путь П, и осуществлять удаленную манипуляцию дистальной частью 20 ствола 16. В варианте осуществления, иллюстрированном на Фиг. 2, терапевтический блок 21 доставляют интраваскулярно к участку лечения с применением проволочного направляющего элемента 66 по методике OTW. Как упоминалось ранее, дистальный конец терапевтического блока 21 может определять полость или проход для приема проволочного направляющего элемента 66 для доставки катетера 12 с применением методик OTW или RX. В участке лечения проволочный направляющий элемент 66 может быть по меньшей мере частично аксиально извлечен или удален, и терапевтический блок 21 может быть трансформирован или иным образом перемещен в развернутое состояние для доставки энергии к участку лечения. Дополнительные подробности, касающиеся таких размещений, описаны ниже со ссылкой на Фиг. 3А и 3В. Проволочный направляющий элемент 66 может включать любой подходящий медицинский проволочный направляющий элемент, подобранный по размеру для установки при скольжении внутри полости. В одном частном варианте осуществления, например, проволочный направляющий элемент 66 может иметь диаметр 0,365 мм (0,014 дюймов). В других вариантах осуществления терапевтический блок 21 может быть доставлен к участку лечения внутри направляющей капсулы (не показанной) с применением проволочного направляющего элемента 66 или без него. Когда терапевтический блок 21 находится в участке лечения, направляющая капсула может быть по меньшей мере частично извлечена или втянута, а терапевтический блок 21 может быть трансформирован в развернутое состояние. Дополнительные подробности, касающиеся этого типа конфигурации, описаны ниже. В других вариантах осуществления ствол 16 может быть управляемым, так чтобы терапевтический блок 21 можно было доставлять к участку лечения без применения проволочного направляющего элемента 66 и/или направляющей капсулы.
Управление с визуализацией, например, компьютерную томографию (КТ), флюороскопию, внутрисосудистый ультразвук (ВСУЗ), оптическую когерентную томографию (ОКТ), интракардиальную эхокардиографию (ИКЭ), или другую подходящую методику управления, или их комбинации, можно применять для расположения и манипуляции врачом терапевтического блока 21. Например, флюороскопическую систему (например, включающую плоскопанельный детектор, рентген или раму С-типа) можно вращать для точной визуализации и идентификации целевого участка лечения. В других вариантах осуществления участок лечения может быть определен с применением ВСУЗ, ОКТ и/или других подходящих методик визуализации, которые могут сопоставлять целевой участок лечения с идентифицируемой анатомической структурой (например, спинальной характеристикой) и/или радионепроницаемой линейкой (например, расположенной под пациентом или на нем) перед доставкой катетера 12. Далее, в некоторых вариантах осуществления компоненты управления с визуализацией (например, ВСУЗ, ОКТ) могут быть интегрированы с катетером 12 и/или работать параллельно с катетером 12 для обеспечения управления с визуализацией во время размещения терапевтического блока 21. Например, компоненты управления с визуализацией (например, ВСУЗ или ОКТ) могут быть соединены по меньшей мере с одним из терапевтического блока 21 (например, проксимально к терапевтическим штативам 25) для обеспечения трехмерных изображений сосудистой сети рядом с участком лечения, для облегчения размещения или развертывания многоэлектродного блока в целевом кровеносном сосуде почки.
Целенаправленное приложение энергии от элементов, доставляющих энергию 24, может затем применяться к целевой ткани для индукции одного или нескольких необходимых нейромодулирующих эффектов в локализованных участках почечной артерии и соседних участках почечного сплетения ПС, которые находятся непосредственно в адвентициальной оболочке почечной артерии А, рядом, или в тесной близости к ней. Целенаправленное приложение энергии может обеспечивать нейромодуляцию по всему почечному сплетению ПС или его части. Нейромодулирующие эффекты, как правило, являются функцией, по меньшей мере отчасти, мощности, времени, контакта между элементами, доставляющими энергию 24 (Фиг. 1) и стенкой сосуда, и кровотока через сосуд. Нейромодулирующие эффекты могут включать денервацию, термическую абляцию, и/или неабляционное термическое повреждение или нарушение (например, посредством непрерывного нагревания и/или резистивного нагревания). Необходимые эффекты термического нагревания могут включать повышение температуры целевых нервных волокон выше необходимого порога для достижения неабляционного термического повреждения, или более высокой температуры для достижения абляционного термического повреждения. Например, целевая температура может быть выше температуры тела (например, около 37°C), но менее примерно 45°C для неабляционного термического повреждения, или целевая температура может составлять примерно 45°С или выше для абляционного термического повреждения. Необходимые нетермические нейромодулирующие эффекты могут включать изменение электрических сигналов, передаваемых в нерве.
Фиг. 3А является видом сбоку дистальной части 20 катетера 12 и терапевтического блока или лечебной секции 21 в развернутом состоянии (например, низкопрофильной или сжатой конфигурации) снаружи пациента, а Фиг. 3В является изображением в перспективе терапевтического блока 21 в развернутом состоянии (например, расширенной конфигурации) снаружи пациента. Как было описано ранее, катетер 12 может быть сконструирован для OTW доставки от участка доступа, в котором проволочный направляющий элемент 66 (Фиг. 2) вначале вводят в участок лечения (например, внутри почечной артерии), а катетер 12 вставляют по проволочному направляющему элементу. Как более подробно описано ниже, проволочный направляющий элемент может быть введен или по меньшей частично извлечен из дистальной части 20 для трансформации терапевтического блока 21 между состоянием доставки (Фиг. 3А) и развернутым состоянием (Фиг. 3В). Например, как показано на Фиг. 3А, проволочный направляющий элемент (не показан), проходящий по меньшей мере через часть длины катетера 12, может быть сконструирован для распрямления спирального винтового контрольного элемента 50 с предварительно заданной формой (схематически показанного штриховыми линиями) из катетера 12 во время доставки; а проволочный направляющий элемент по меньшей мере частично извлечен или перемещен при скольжении относительно дистальной части 20, для обеспечения трансформации терапевтического блока 21 в развернутое состояние (Фиг. 3В).
Как лучше видно на Фиг. 3А, терапевтический блок 21 включает множество (например, четыре, пять, и т.д.) элементов, доставляющих энергию 24, переносимых поддерживающей структурой 22. В этом варианте осуществления поддерживающая структура 22 содержит гибкую трубку 42 и контрольный элемент 50 с предварительно заданной формой внутри трубки 42. Гибкая трубка 42 может состоять из полимерного материала, такого как полиамид, полиимид, полиэфир-блок-амидный сополимер, поставляемый под торговой маркой Пебакс, полиэтилен терефталат (ПЭТ), полипропилен; алифатический термопластический полиуретан на поликарбонатной основе, поставляемый под торговой маркой Карботан; или полиэфирэфиркетоновый (ПЭЭК) полимер, обеспечивающий необходимую гибкость. Однако в других вариантах осуществления трубка 42 может состоять из других подходящих материалов.
Как упоминалось выше, контрольный элемент 50 с предварительно заданной формой может использоваться для обеспечения спиральной/винтовой формы относительно гибкой дистальной части 20 катетера 12. Как лучше видно на Фиг. 3, например, контрольный элемент 50 является трубчатой структурой, содержащей нитиноловую мультифиламентную скрученную проволоку с полостью в ней, и поставляемую под торговой маркой HELICAL HOLLOW STRAND (HHS) от Fort Wayne Metals, Форт-Уэйн, Индиана. Трубчатый контрольный элемент 50 может быть сформирован из множества различных типов материалов, может быть расположен в одинарной или двухслойной конфигурации, и может быть произведен с выбранным направлением растяжения, сжатия, вращения и резьбы. Например, материал HHS может быть обрезан с применением лазера, электроискровой обработки (ЭИО), электрохимического шлифования (ЭХШ), или других подходящих средств для достижения необходимой итоговой длины и геометрии компонента. Например, как лучше видно на Фиг. 3В, контрольный элемент 50 в варианте настоящего изобретения имеет предварительно заданную спиральную/винтовую конфигурацию, определяющую развернутое состояние терапевтического блока 21, так чтобы элементы, доставляющие энергию 24 из терапевтического блока 21, были смещены друг от друга (например, оба смещены в угловом и продольном направлении относительно продольной оси почечной артерии), и могли располагаться в устойчивом контакте со стенкой почечной артерии (Фиг. 2) для лечения. Для простоты, предварительно заданная спиральная форма терапевтического блока 21 в развернутом состоянии может быть определена размерами (например, спиральным диаметром и шагом резьбы) самого HHS. Другими словами, мультифиламентная полая трубка, образующая контрольный элемент 50, сама имеет предварительно заданную спиральную форму.
Формирование контрольного элемента 50 нитиноловой мультифиламентной скрученной проволоки (проволок) или других подобных материалов, как ожидалось, устранит необходимость какой-либо дополнительной армированной проволоки (проволок) или структур внутри поддерживающей структуры 22 для обеспечения необходимого уровня поддержки и жесткости терапевтического блока 21. Эта характеристика, как ожидается, снижает число производственных процессов, необходимых для формирования катетера 12, и уменьшает число материалов, необходимых для устройства. Другой характеристикой терапевтического блока 12 является то, что контрольный элемент 50 и внутренняя стенка трубки 42 находятся в тесном контакте, и имеется мало, или не имеется пространства между контрольным элементом 50 и трубкой 42 (как лучше видно на Фиг. 4). В одном варианте осуществления, например, трубка 42 может быть расширена перед сборкой, так что применение горячего воздуха к трубке 42 во время производственного процесса может вызывать усадку трубки на контрольный элемент 50, как понятно знакомым с обычным применением материалов для трубок из термоусадочной пленки. Эта характеристика, как ожидается, подавляет или устраняет складки или перегибы, которые могут возникать на трубке 42, когда терапевтический блок 21 трансформируется из относительно прямого состояния доставки до развернутого, в целом спирального состояния.
В других вариантах осуществления контрольный элемент 50 и/или другие компоненты поддерживающей структуры 22 могут состоять из различных материалов и/или иметь другое размещение. Например, контрольный элемент 50 может быть сформирован из других подходящих материалов с памятью формы (например, никеля-титана (нитинола), проволоки или трубки, помимо HHS; полимеров с памятью формы, электроактивных полимеров), предварительно сформированных или с предварительно заданной формой в необходимом развернутом состоянии. Альтернативно, контрольный элемент 50 может быть сформирован из множества материалов, таких как композиция из одного или нескольких полимеров и металлов.
Матрица из элементов, доставляющих энергию 24, может включать серии из отдельных ленточных электродов, размещенных вдоль поддерживающей структуры 22 и связанных с трубкой 42 с применением адгезивного средства. Ленточные или трубчатые электроды могут применяться в некоторых вариантах осуществления, например, поскольку они, как правило, имеют более низкие энергетические потребности для абляции, по сравнению с дисковыми или плоскими электродами. Однако в других вариантах осуществления также пригодны дисковые или плоские электроды. В еще одном варианте осуществления могут применяться электроды, имеющие спиральную или винтовую форму. В некоторых вариантах осуществления элементы, доставляющие энергию 24, могут быть равномерно разделены по длине поддерживающей структуры 22. Элементы, доставляющие энергию 24, могут быть изготовлены из любого подходящего металлического материала (например, золота, платины, или сплава платины и иридия, и т.д.). Однако в других вариантах осуществления число, расположение и/или состав элементов, доставляющих энергию 24, может варьировать.
Фиг. 4 является увеличенным изображением части катетера 12 с Фиг. 3А. Что касается Фиг. 1 и 4 вместе, каждый элемент, доставляющий энергию, или электрод 24, электрически соединяется с источником энергии 26 (Фиг. 1) посредством проводника или бифилярного провода 44, проходящего через полость трубки 42. Каждый элемент, доставляющий энергию 24, может быть приварен или иным образом соединен с проводом, подающим энергию 44, а каждый провод 44 может проходить через трубку 42 и удлиненный ствол 16 (Фиг. 1) по всей длине ствола, так чтобы его проксимальный конец был связан с источником энергии 26 (Фиг. 1). Как упоминалось выше, трубка 42 сконструирована для тесной подгонки к контрольному элементу 50 и проводам 44, для минимизации расстояния между внутренней частью трубки 42 и компонентами, расположенными в ней, для предотвращения формирования складок в терапевтическом блоке 21 при развертывании. В некоторых вариантах осуществления катетер 12 может также включать изолирующий слой (например, слой ПЭТ или другого подходящего материала) поверх контрольного элемента 50 для дополнительной электрической изоляции материала (например, HHS) контрольного элемента 50 от проводов 44.
Как лучше видно на Фиг. 4, каждый элемент, доставляющий энергию 24, может включать суженные концевые части 24а (например, округления), сконструированные для обеспечения тупого угла между внешней поверхностью трубки 42 и внешней поверхностью соответствующего элемента, доставляющего энергию 24. Гладкий переход угла, обеспеченный суженными концевыми частями 24а, как ожидается, предотвращает заедание или захват направляющей капсулы или загружающего инструмента краями элементов, доставляющих энергию 24, когда направляющая капсула или загружающий элемент продвигается по длине терапевтического блока 21 (Фиг. 3А и 3В) при продвижении и извлечении. В других вариантах осуществления протяженность суженных частей 24а на элементах, доставляющих энергию 24, может варьировать. В некоторых вариантах осуществления суженные концевые части 24 содержат округления, сформированные из адгезивного материала на каждом конце соответствующих элементов, доставляющих энергию 24. В других вариантах осуществления, однако, суженные концевые части 24а могут быть выполнены из того же самого материала, что и трубка 42 (например, сформированы как единое целое с трубкой 42, или сформированы отдельно и прикреплены к любому концу элемента, доставляющего энергию 24). Далее, суженные части 24а являются факультативной характеристикой, которая может быть не включена в некоторых вариантах осуществления.
Возвращаясь к Фиг. 3А и 3В, терапевтический блок 21 включает атравматический гибкий изогнутый наконечник 40 на дистальном конце блока 21. Изогнутый наконечник 40 сконструирован для обеспечения дистального отверстия 41 для проволочного направляющего элемента 66 (Фиг. 2), который отводит проволочный направляющий элемент от стенки почечной артерии, когда терапевтический блок 21 находится в предварительно заданной развернутой конфигурации. Ожидается, что эта характеристика облегчает выравнивание спирального терапевтического блока 21 в кровеносном сосуде, когда он расширяется, а также снижает риск повреждения стенки кровеносного сосуда, когда дистальный наконечник проволочного направляющего элемента продвигают из отверстия 41. Кривизна наконечника 40 может варьировать, в зависимости от конкретного размера/конфигурации терапевтического блока 21. Как лучше видно на Фиг. 3В, например, в иллюстрированном варианте осуществления наконечник 40 является изогнутым, так что он находится вне предварительно заданной спиральной/винтовой оси, определенной контрольным элементом 50. Однако в других вариантах осуществления наконечник 40 может иметь другую кривизну. В некоторых вариантах осуществления наконечник 40 может также включать один или несколько радионепроницаемых маркеров 52 и/или один или несколько датчиков (не показаны). Наконечник 40 может быть прикреплен к дистальному концу поддерживающей структуры 22 с помощью адгезивного средства, опрессовки, многокомпонентного формования, или других подходящих методик.
Гибкий изогнутый наконечник 40 может быть изготовлен из полимерного материала (например, полиэфир-блокамидного сополимера, поставляемого под торговой маркой Пебакс), термопластического полиэфируретанового материала (поставляемого под торговыми марками Эластан или Пеллетан), или других подходящих материалов, имеющих необходимые свойства, включая выбранную твердость. Как упоминалось выше, наконечник 40 сконструирован для обеспечения отверстия для проволочного направляющего элемента 66, и необходимо, чтобы сам наконечник сохранял необходимую форму/конфигурацию при операции. Соответственно, в некоторых вариантах осуществления могут быть добавлены один или несколько материалов наконечника, чтобы способствовать улучшению сохранения формы наконечника, например, в одном варианте осуществления примерно 5-30 масс. % силоксана может быть смешано с материалом наконечника (например, термопластическим полиэфируретановым материалом), и можно применять электронный пучок или гамма-облучение для индукции поперечной сшивки материалов. В других вариантах осуществления наконечник 40 может быть сформирован из другого материала (материалов) и/или иметь другое расположение.
При операции (и со ссылкой на Фиг. 2, 3А и 3В), после размещения терапевтического блока 21 в необходимом участке в почечной артерии ПА пациента, терапевтический блок 21 может быть трансформирован из его состояния доставки в его развернутое состояние или развернутое расположение. Трансформация может быть начата с применением размещения компонентов устройства, как описано в настоящей заявке по отношению к частным вариантам осуществления и их различным режимам развертывания. В одном варианте осуществления, например, терапевтический блок 21 может быть развернут путем втягивания проволочного направляющего элемента 66, пока дистальный наконечник проволочного направляющего элемента 66 не будет в целом выровнен с наконечником 40 катетера 12. В некоторых вариантах осуществления проволочный направляющий элемент 66 может иметь различную жесткость или гибкость по своей длине, так чтобы обеспечить повышенную гибкость в дистальном направлении. Когда проволочный направляющий элемент 66 с вариабельной гибкостью частично втянут, как описано выше, предварительно установленная спиральная форма контрольного элемента 50 обеспечивает усилие, восстанавливающее форму, достаточное для преодоления распрямляющего усилия, обеспеченного наиболее дистальной частью проволочного направляющего элемента 66, так что терапевтический блок 21 может развертываться в спиральную конфигурацию. Далее, поскольку гибкая дистальная часть проволочного направляющего элемента 66 остается внутри терапевтического блока 21 в развернутом состоянии, проволочный направляющий элемент 66 может обеспечивать дополнительную структурную целостность спиральной части при лечении. Эта характеристика, как ожидается, способствует миграции или снижает проблемы, связанные с сохранением терапевтического блока на месте во время лечения (например, способствует вазоконстрикции).
В другом варианте осуществления проволочный направляющий элемент 66 может иметь профиль жесткости, позволяющий дистальной части проволочного направляющего элемента 66 оставаться выступающей из отверстия 41, при этом позволяя терапевтическому блоку 21 трансформироваться до его развернутой конфигурации. В других вариантах осуществления проволочный направляющий элемент 66 может быть полностью извлечен из терапевтического блока 21 (например, наиболее дистальная концевая часть проволочного направляющего элемента 66 является проксимальной для терапевтического блока 21) для обеспечения трансформации, в то время как самая дистальная часть проволочного направляющего элемента 66 остается внутри ствола 16. В другом варианте осуществления проволочный направляющий элемент 66 может быть полностью извлечен из ствола 16. В любом из вышеизложенных примеров врач может извлекать проволочный направляющий элемент 66 в достаточной степени для наблюдения терапевтического блока в развернутой конфигурации, и/или пока рентгеновское изображение не покажет, что дистальный наконечник проволочного направляющего элемента 66 находится в необходимом участке по отношению к терапевтическому блоку 21 (например, в целом выровнен с наконечником 40, полностью извлечен из терапевтического блока 21 и т.д.). В некоторых вариантах осуществления степень извлечения проволочного направляющего элемента может быть основана, по меньшей мере отчасти, на решении врача по отношению к выбранному проволочному направляющему элементу и степени извлечения, необходимой для достижения развертывания.
После лечения терапевтический блок 21 может быть трансформирован назад в низкопрофильную конфигурацию доставки путем аксиального продвижения проволочного направляющего элемента 66 относительно терапевтического блока 21. Например, в одном варианте осуществления проволочный направляющий элемент 66 может продвигаться до тех пор, пока дистальный наконечник проволочного направляющего элемента 66 не будет в целом выровнен с наконечником 40, и катетер 12 может затем быть вытянут назад над стационарным проволочным направляющим элементом 66. Однако в других вариантах осуществления наиболее дистальная часть проволочного направляющего элемента 66 может продвигаться к другому участку относительно терапевтического блока 21, для достижения трансформации терапевтического блока 21 назад в низкопрофильную конфигурацию.
Варианты осуществления катетерной системы, описанные выше, включают процедурный проволочный направляющий элемент для направления катетера к участку лечения, а также для ограничения терапевтического блока или лечебной секции в низкопрофильной конфигурации доставки. В других вариантах осуществления катетерные системы, сконструированные в соответствии с настоящей технологией, могут дополнительно включать внешний загружающий инструмент, который может располагаться и втягиваться поверх терапевтического блока для дополнительного содействия трансформации терапевтического блока между конфигурацией доставки и развернутой конфигурацией.
Например, Фиг. 5 является отчасти схематическим видом сбоку загружающего инструмента 190 в соответствии с вариантом осуществления настоящего изобретения. Загружающий инструмент 190 является трубчатой структурой, сконструированной для передвижения при скольжении по внешней поверхности ствола 16 и терапевтического блока 21 (с целью иллюстрации, терапевтический блок 21 и связанные характеристики показаны штриховыми линиями). Загружающий инструмент 190 имеет размер и жесткость, пригодные для сохранения терапевтического блока 21 в низкопрофильной конфигурации для обратной загрузки проволочного направляющего элемента 66 (Фиг. 2), т.е. вставки проксимального конца проволочного направляющего элемента 66 в дистальное отверстие 41. В иллюстрированном варианте осуществления загружающий инструмент 190 может включать суженную часть 192, чтобы облегчать продвижение оболочки поверх терапевтического блока 21 и связанных элементов, доставляющих энергию 24. В некоторых вариантах осуществления дистальная часть 194 загружающего инструмента 190 может также включать гладкие, округленные внутренние и внешние края 195, чтобы способствовать ослаблению внутренней стенки загружающего инструмента поверх элементов, доставляющих энергию 24, при продвижении загружающего инструмента относительно терапевтического блока 21. Загружающий элемент 190 может состоять из полиэтилена высокой плотности (ПЭВП) или других подходящих материалов, имеющих необходимую прочность и скользкость. В других вариантах осуществления загружающий инструмент 190 может состоять из двух или более различных материалов. В одном варианте осуществления, например, секция наибольшего диаметра загружающего инструмента 190 дистально от суженной части 192 может состоять из ПЭВП, в то время как секция наименьшего диаметра загружающего инструмента 190 проксимально от суженной части 192 может состоять из линейного полиэтилена низкой плотности ЛПЭНП). В других вариантах осуществления загружающий инструмент 190 может состоять из различных материалов и/или иметь иную конфигурацию.
В других вариантах осуществления загружающий инструмент 190 может быть пригоден в сочетании с катетером 12, когда катетер 12 находится вне пациента перед лечением, а затем удаляется из катетера 12 перед введением катетера 12 пациенту. В частности, как обсуждалось выше, загружающий инструмент 190 можно использовать для сохранения терапевтического блока 21 в низкопрофильной конфигурации, когда проволочный направляющий элемент загружают назад (передвигают от дистального конца к проксимальному концу катетера 12). Загружающий инструмент 190 затем может быть удален из катетера 12, а терапевтический блок 21 может быть ограничен в конфигурации доставки с поддержкой проволочного направляющего элемента; в другом варианте осуществления загружающий инструмент 190 может оставаться установленным на катетер 12 после обратной загрузки проволочного направляющего элемента, но может скользить по длине катетера 12 к проксимальной части 18 катетера 12 рядом с рукояткой 34 (Фиг. 1). таким образом, загружающий инструмент 190 остается с катетером 12, но удаляется во время лечения.
Однако в других вариантах осуществления загрузочный инструмент 190 может оставаться на дистальной части 20 (Фиг. 1) катетера 12 или рядом с ней во время лечения. Например, в одном варианте осуществления врач может удерживать загрузочный инструмент 190 на дистальной части 20 катетера 12 или рядом с ней, а затем вставлять загружающий инструмент 190 в гемостатический клапан (не показан), соединенный с направляющим катетером (не показан). В зависимости от профиля загружающего инструмента 190 и внутреннего диаметра гемостатического клапана, врач может вставить примерно 2-4 см загружающего инструмента 190 в гемостатический клапан. Одним преимуществом такого подхода является то, что терапевтический блок 21 (Фиг. 3А и 3В) дополнительно защищен, когда катетер 12 продвигают через гемостатический клапан, и врач, как ожидается, будет чувствовать меньше, или не чувствовать совсем трения между катетером 12 и гемостатическим клапаном. В других вариантах осуществления, однако, загрузочный инструмент 190 может иметь другую конфигурацию относительно гемостатического клапана и/или других компонентов системы 10 (Фиг. 1) при операции.
III. Анатомия и физиология области, к которой относится изобретение
В следующем описании подробно описаны анатомия и физиология пациента, относящаяся к настоящему изобретению. Этот раздел предназначен для дополнения и расширения предшествующего обсуждения, касающегося соответствующей анатомии и физиологии и для обеспечения дополнительного контекста, касающегося раскрытой технологии, и терапевтических эффектов, связанных с ренальной нейромодуляцией. Например, как упоминалось ранее, некоторые свойства почечных сосудов могут обеспечивать информацию для конструкции лечебных устройств и связанных с ними способов для достижения ренальной нейромодуляции, и задавать специфические требования для конструкции таких устройств. Специфические требования к конструкции могут включать обеспечение доступа к почечной артерии, мочеточнику, или структурам почечной лоханки, облегчение устойчивого контакта между терапевтическим элементом из лечебного устройства и поверхностью или стенкой полости, и/или эффективную модуляцию почечных нервов с применением терапевтического элемента.
А. Симпатическая нервная система
Симпатическая нервная система (СНС) является частью вегетативной нервной системы вместе с нервной системой кишечника и парасимпатической нервной системой. Она всегда активна на базовом уровне (называющемся симпатическим тонусом) и становится более активной во время стресса. Как и другие части нервной системы, симпатическая нервная система работает посредством ряда взаимосоединенных нейронов. Симпатические нейроны часто считаются частью периферической нервной системы (ПНС), хотя могут находиться в пределах центральной нервной системы (ЦНС). Симпатические нейроны спинного мозга (который является частью ЦНС) сообщаются с периферическими симпатическими нейронами через ряд симпатических ганглиев. Внутри ганглиев симпатические нейроны спинного мозга соединяются с периферическими симпатическими нейронами через синапсы. Таким образом, симпатические нейроны спинного мозга называются пресинаптическими (или преганглионическими) нейронами, в то время как периферические симпатические нейроны называются постсинаптическими (или постганглионическими) нейронами.
На синапсах внутри симпатических ганглиев преганглионические симпатические нейроны высвобождают ацетилхолин, химический мессенджер, который связывается с никотиновыми ацетилхолиновыми рецепторами на постганглионических нейронах и вызывает их активацию. В ответ на этот стимул постганглионические нейроны преимущественно высвобождают норадреналин (норэпинефрин). Пролонгированная активация может вызвать высвобождение адреналина из мозгового вещества надпочечников.
При высвобождении норэпинефрин и эпинефрин связываются с адренергическими рецепторами в периферических тканях. Связывание с адренергическими рецепторами вызывает нейрональный и гормональный ответ. Физические проявления включают расширение зрачков, увеличение скорости сердечных сокращений, иногда рвоту, и повышение кровяного давления. Повышенная потливость также обусловлена связыванием с холинергическими рецепторами потовых желез.
Симпатическая нервная система ответственна за повышающую и понижающую регуляцию многих гомеостатических механизмов в живых организмах. Волокна ЦНС, иннервирующие ткани почти во всех системах органов, обеспечивают по меньшей мере часть регуляции таких функций, как изменение диаметра зрачка, подвижность кишечника, и выход мочи. Этот ответ также известен как симпато-адреналовый ответ организма, поскольку преганглионические симпатические волокна, заканчивающиеся в мозговом веществе надпочечников (а также все другие симпатические волокна) секретируют ацетилхолин, который активирует секрецию адреналина (эпинефрина) и в меньшей степени норадреналина (НЭ). Таким образом, этот ответ, действующий в первую очередь на сердечно-сосудистую систему, осуществляется непосредственно через импульсы, передаваемые через симпатическую нервную систему и опосредованно через катехоламины, секретируемые мозговым веществом надпочечников.
С научной точки зрения, СНС является автоматической регуляторной системой, т.е. она работает без вмешательства сознания. Некоторые специалисты в области эволюции полагают, что симпатическая нервная система работает у ранних организмов для поддержания выживания, поскольку симпатическая нервная система ответственна за стимуляцию действия организма. Одним примером этой стимуляции является момент перед пробуждением, когда симпатический выход спонтанно увеличивается при подготовке к деятельности.
1. Симпатическая цепь
Как показано на Фиг. 6, СНС представлена сетью нервов, обеспечивающих сообщение головного мозга с организмом. Симпатические нервы исходят из внутренней части позвоночного столба, по направлению к средней части спинного мозга в латеральном промежуточном столбе (или боковом роге), начинаясь на первом грудном сегменте спинного мозга, и как полагают, проходя до второго или третьего поясничного сегмента. Поскольку эти клетки начинаются в грудных и поясничных участках спинного мозга, говорят, что СНС оказывает влияние в грудо-поясничной области. Аксоны этих нервов покидают спинной мозг через передний корешок/отросток. Они проходят рядом со спинальным (сенсорным) ганглием, где поступают в передние ветви спинальных нервов. Однако, в отличие от соматической иннервации, они быстро отделяются от соединителей белых ветвей, которые соединяются либо с паравертебральными ганглиями (которые пролегают рядом с позвоночным столбом), либо с превертебральными ганглиями (которые пролегают рядом с бифуркацией аорты), проходя вдоль позвоночного столба.
Чтобы достичь целевых органов и желез, аксоны должны пройти большие расстояния в организме, и для обеспечения этого многие аксоны посылают сигналы вторым клеткам через синаптическую передачу. Концы аксонов связываются через пространство синапса с дендритами вторых клеток. Первая клетка (пресинаптическая клетка) посылает нейротрансмиттер через синаптическую щель, где он активирует вторую клетку (постсинаптическую клетку). Затем сигнал передается окончательному адресату.
В СНС и других компонентах периферической нервной системы эти синапсы имеются в участках, называемых ганглиями. Клетка с принимающими волокнами называется преганглионической клеткой, в то время как клетка, чьи волокна покидают ганглий, называется постганглионической клеткой. Как упоминалось ранее, преганглионические клетки СНС расположены между первым грудным (Т1) сегментом и третьим позвоночным (L3) сегментом спинного мозга. Клеточные тела постганглионических клеток находятся в ганглиях, а их аксоны направляются к целевым органам или железам.
Ганглии включают не только симпатические стволы, но также и шейные ганглии (верхний, средний и нижний), которые направляют симпатические нервные волокна к сердцу и органам грудной полости, и чревные и брыжеечные ганглии (направляющие симпатические волокна к кишечнику).
2. Нервы почек
Как показано на Фиг. 7, нервная система почек включает почечное сплетение, которое тесно связано с почечной артерией. Почечное сплетение является автономным сплетением, которое окружает почечную артерию и встроено в адвентициальную оболочку почечной артерии. Почечное сплетение проходит вдоль почечной артерии и достигает ткани почек. Волокна, относящиеся к почечному сплетению, отходят от чревного ганглия, верхнего брыжеечного ганглия, аортально-почечного ганглия и аортального сплетения. Почечное сплетение, также обозначаемое как почечный нерв, преимущественно состоит из симпатических компонентов. Парасимпатической иннервации почек нет (или по меньшей мере, она является минимальной).
Клеточные тела преганглионических нейронов располагаются в латеральном промежуточном столбе спинного мозга. Преганглионические аксоны проходят через паравертебральные ганглии (без синапсов), образуя малый внутренностный нерв, низший внутренностный нерв, первый поясничный внутренностный нерв, второй поясничный внутренностный нерв, и проходят к чревному ганглию, верхнему брыжеечному ганглию, и аортально-почечному ганглию. Клеточные тела постганглионических нейронов выходят от чревного ганглия, верхнего брыжеечного ганглия и аортально-почечного ганглия к почечному сплетению и распределяются в сосудистой системе почки.
3. Активность симпатической нервной системы почки
Сигналы проходят через СНС в двух направлениях. Эфферентные сигналы могут запускать изменения в различных частях организма одновременно. Например, симпатическая нервная система может увеличивать частоту сердечных сокращений; расширять бронхи; снижать моторику (двигательную активность) толстой кишки; сужать кровеносные сосуды; повышать перистальтику пищевода; вызывать расширение зрачков, пило-эрекцию («гусиную кожу») и перспирацию (стимулировать потоотделение); и повышать кровяное давление. Афферентные сигналы проводятся от различных органов и сенсорных рецепторов и, в частности, головного мозга.
Гипертензия, сердечная недостаточность и хроническое заболевание почек являются немногими из множества заболеваний, возникающих в результате хронической активации СНС, особенно симпатической нервной системы почек. Хроническая активация СНС является не способствующим адаптации ответом, ведущим к прогрессированию этих патологических состояний. Фармакологическое воздействие на ренин-ангиотензин-альдостероновую систему (РААС) является давно существующим, но иногда неэффективным подходом к снижению избыточной активности СНС.
Как упоминалось выше, симпатическая нервная система почек вносит основной вклад в сложную патофизиологию гипертензии, состояний объемной перегрузки (такой как сердечная недостаточность), и прогрессирующего заболевания почек, как в экспериментах на животных, так и у человека. В исследованиях с применением методики радиоактивных индикаторов для измерения выделения норэпинефрина из почек в плазму было установлено повышение скорости накопления избытка почечного НЭ у пациентов с эссенциальной гипертензией, практически у таких молодых лиц с гипертензией, что вместе с повышенным накоплением НЭ из сердца, это согласуется с гемодинамическим профилем, обычно наблюдаемым при ранней гипертензии, и характеризуется повышением скорости сердечных сокращений, минутного объема сердца и почечно-сосудистого сопротивления. Известно, что эссенциальная гипертензия является в целом нейрогенной, часто сопровождаясь выраженной избыточной активностью симпатической нервной системы.
Активация сердечно-почечной симпатической нервной системы еще более выражена при сердечной недостаточности, как продемонстрировано резко увеличенным повышением накопления НЭ из сердца и почек в плазме в данной группе пациентов. С данным замечанием согласуется недавняя демонстрация сильного отрицательного прогностического значения симпатической активации почек для общей смертности при трансплантации сердца у пациентов с застойной сердечной недостаточностью, независимой от общей симпатической активности, скорости гломерулярной фильтрации и фракции выброса левого желудочка. Эти наблюдения поддерживают представление о том, что режимы лечения, разработанные для снижения симпатической стимуляции почек, могут улучшить выживание у пациентов с сердечной недостаточностью.
Как хронические заболевания почек, так и заболевания в терминальной стадии характеризуются повышенной активацией симпатической нервной системы. Было показано, что у пациентов с заболеванием почек в терминальной стадии повышение НЭ в плазме выше среднего уровня является прогностическим как для общей смертности, так и для смертности от сердечно-сосудистых заболеваний. Это также верно для пациентов, страдающих диабетической или контрастной нефропатией. Имеется неопровержимое доказательство того, что сенсорные афферентные сигналы, возникающие от больных почек, вносят основной вклад в раздражение и сохранение повышенного центрального симпатического влияния в этой группе пациентов, что ускоряет развитие хорошо известных побочных последствий хронической избыточной симпатической активности, таких как гипертензия, гипертрофия левого желудочка, желудочковая аритмия, внезапная сердечная смерть, резистентность к инсулину, сахарный диабет и метаболический синдром.
(i) Симпатическая эфферентная активность почек
Симпатические нервы, ведущие к почкам, заканчиваются на кровеносных сосудах, юкстагломерулярном аппарате и почечных канальцах. Стимуляция симпатических нервов почек вызывает повышенное высвобождение ренина, повышение реабсорбции натрия (Na+) и снижение кровотока в почках. Эти компоненты нервной регуляции почечной функции существенно стимулируются при патологических состояниях, характеризующихся повышенным тонусом симпатической системы, явно вносят вклад в подъем кровяного давления у пациентов с гипертензией. Снижение кровотока в почках и скорости гломерулярной фильтрации в результате симпатической эфферентной стимуляции почек, вероятно, является краеугольным камнем потери функции почек при кардиоренальном синдроме, проявляющемся в виде нарушения функции почек в качестве прогрессирующего осложнения хронической сердечной недостаточности, с клиническим течением, обычно изменяющимся в зависимости от клинического состояния пациента и лечения. Фармакологические стратегии с целью предотвращения последствия эфферентной симпатической стимуляции почек включают симпатолитические лекарственные средства центрального действия, бета-блокаторы (предназначенные для снижения высвобождения ренина), ингибиторы и блокаторы рецепторов ангиотензин-превращающего фермента (предназначенные для блокирования действия ангиотензина II и активации альдостерона вследствие высвобождения ренина) и диуретики (предназначенные для противодействия опосредованной симпатической системой задержке натрия и воды почками). Однако современные фармакологические стратегии имеют существенные ограничения, включая ограниченную эффективность, проблемы соблюдения режима лечения, побочные эффекты, и тому подобное,
(ii) Активность сенсорных афферентных нервов почек
Почки сообщаются с интегральными структурами в центральной нервной системе через сенсорные афферентные нервы почек. Некоторые формы «повреждения почек» могут индуцировать активацию сенсорных афферентных сигналов. Например, ишемия почек, снижение ударного объема или почечного кровотока, или избыток аденозиновых ферментов может запускать активацию афферентной нервной коммуникации. Как показано на Фиг. 8А и 8, эта афферентная коммуникация может проходить от почек к головному мозгу, или от одной почки к другой почке (через центральную нервную систему). Эти афферентные сигналы центрально интегрированы и приводят к повышению симпатического влияния. Это симпатическое влияние направлено к почкам, таким образом, активируя РААС и индуцируя повышение секреции ренина, задержку натрия, задержку объема и сужение кровеносных сосудов. Избыточная центральная симпатическая активность также влияет на другие органы и структуры организма, иннервируемые симпатическими нервами, такие как сердце и периферические сосуды, что приводит к описанным побочным эффектам симпатической активации, некоторые аспекты которой также вносят вклад в повышение кровяного давления.
Таким образом, эта физиология позволяет предположить, что (i) модуляция ткани с эфферентными симпатическими нервами позволит снизить неадекватное высвобождение ренина, задержку соли, и снижение почечного кровотока, и что (ii) модуляция ткани с афферентными сенсорными нервами позволит снизить системный вклад в гипертензию через прямое влияние на задний гипоталамус, а также другую почку. В дополнение к центральным гипотензивным эффектам афферентной денервации почек, ожидается необходимое снижение центрального симпатического влияния на различные другие органы с симпатической иннервацией, такие как сердце и сосуды.
B. Дополнительные клинические эффекты ренальной нейромодуляции
Как описано выше, ренальная нейромодуляция, вероятно, может быть полезной при лечении некоторых патологических состояний, характеризующихся повышением общей и в частности почечной симпатической активности, таких как гипертензия, метаболический синдром, резистентность к инсулину, диабет, гипертрофия левого желудочка, хроническая и терминальная почечная недостаточность, неадекватная задержка жидкости при сердечной недостаточности, кардиоренальный синдром и внезапная смерть. Поскольку снижение афферентных нервных сигналов вносит вклад в системное снижение симпатического тонуса/стимула, ренальная нейромодуляция может также быть полезной при лечении других состояний, связанных с системной симпатической гиперактивностью. Соответственно, ренальная нейромодуляция может также оказывать благоприятное действие на другие органы и структуры организма, иннервируемые симпатическими нервами, включая те, что указаны на фигуре 6.
C. Обеспечение внутрисосудистого доступа к почечной артерии
В соответствии с настоящим изобретением, нейромодуляция левого и/или правого почечного сплетения ПС, непосредственно связанного с левой и/или правой почечной артерией, может быть обеспечена посредством внутрисосудистого доступа. Как показано на Фиг. 9А, кровь, перемещаемая за счет сердечных сокращений, передается из левого желудочка сердца в аорту. Аорта спускается через грудину и разветвляется на левую и правую почечную артерию. Ниже почечных артерий, аорта разветвляется на левую и правую подвздошную артерию. Левая и правая подвздошные артерии нисходят, соответственно, в левую и правую ногу и соединяются с левой и правой бедренными артериями.
Как показано на Фиг. 9В, кровь собирается в вены и возвращается к сердцу, через бедренные вены в подвздошные вены и в нижнюю полую вену. Нижняя полая вена разветвляется на левую и правую почечные вены. Над почечными венами нижняя полая вена поднимается для передачи крови в правое предсердие сердца. Из правого предсердия кровь передается через правый желудочек в легкие, где насыщается кислородом. Из легких насыщенная кислородом кровь поступает в левое предсердие. От левого предсердия насыщенная кислородом кровь передается через левый желудочек назад в аорту.
Как подробно описывается ниже, бедренную артерию можно выделить и ввести в нее канюлю на основе бедренного треугольника, прямо над средней точкой паховой связки. Катетер можно вставить через этот участок доступа, чрескожно в бедренную артерию и провести в подвздошную артерию и аорту, в левую или правую почечную артерию. Это составляет внутрисосудистый путь и обеспечивает минимально инвазивный доступ к соответствующей почечной артерии и/или другим кровеносным сосудам почки.
Запястье и плечо являются другими участками для введения катетеров в артериальную систему. Например, катетеризация лучевой, плечевой или подмышечной артерии может применяться в избранных случаях. Катетеры, вводимые через эти участки доступа, можно пропускать через подключичную артерию на левой стороне (или через подключичную и плечеголовную артерию на правой стороне), через дугу аорты, вниз в нисходящую аорту и в почечные артерии с помощью стандартной ангиографической методики.
D. Свойства и характеристики сосудов почки
Поскольку нейромодуляция левого и/или правого почечного сплетения может быть достигнута в соответствии с настоящей технологией посредством внутрисосудистого доступа, свойства и характеристики сосудистой системы почек могут налагать ограничения и/или обеспечивать информацию для конструкции аппарата, систем и способов для достижения такой ренальной нейромодуляции. Некоторые из этих свойств и характеристик могут варьировать среди популяции пациентов и/или у некоторых пациентов со временем, а также в ответ на патологические состояния, такие как гипертензия, хроническая болезнь почек, заболевание сосудов, терминальная почечная недостаточность, резистентность к инсулину, диабет, метаболический синдром, и т.д. Эти свойства и характеристики, как разъясняется в настоящей заявке, могут оказывать влияние на эффективность процедуры и специфическую конструкцию внутрисосудистого устройства. Интересующие свойства могут включать, например, материальные/механические, пространственные, гидродинамические/гемодинамические и/или термодинамические свойства.
Как обсуждалось ранее, катетер можно продвигать чрескожно в левую или в правую артерию через минимально инвазивный внутрисосудистый путь. Однако минимально инвазивный доступ в почечную артерию может быть проблематичным, например, потому, что по сравнению с некоторыми другими артериями, в которые рутинно осуществляется доступ посредством катетеров, почечные артерии часто являются крайне извилистыми, могут иметь относительно маленький диаметр, и/или могут иметь относительно короткую длину. Далее, атеросклероз почечной артерии встречается у многих пациентов, в частности, у страдающих сердечно-сосудистым заболеванием. Анатомия почечной артерии может также существенно варьировать у разных пациентов, что дополнительно осложняет минимально инвазивный доступ. Могут наблюдаться существенные вариации среди пациентов, например, по относительной извилистости, диаметру, длине, и/или количеству атеросклеротических бляшек, а также углу ответвления почечной артерии от аорты. Аппарат, системы и способы для достижения ренальной нейромодуляции посредством внутрисосудистого доступа должны учитывать эти и другие аспекты анатомии почечной артерии и ее вариаций в популяции пациентов для минимально инвазивного доступа в почечную артерию.
В дополнение к сложному доступу к почечной артерии, специфические характеристики почечной анатомии также затрудняют осуществление устойчивого контакта между аппаратом для нейромодуляции и поверхностью полости или стенкой почечной артерии. Когда аппарат для нейромодуляции включает элемент, доставляющий энергию, такой как электрод, согласованное расположение и надлежащее контактное усилие, прилагаемое элементом, доставляющим энергию, к стенке сосуда, может быть необходимо для прогнозируемости. Однако, навигация, как правило, затрудняется узким пространством почечной артерии, а также извилистостью артерии. Далее, установка согласованного контакта может осложняться движениями, дыханием и/или циклом сердечных сокращений пациента. Эти факторы, например, могут вызывать существенное перемещение почечной артерии относительно аорты, а цикл сердечных сокращений может временно расширять почечную артерию (т.е. вызывает пульсацию стенки артерии).
После доступа в почечную артерию и облегчения устойчивого контакта между аппаратом для нейромодуляции и поверхностью полости артерии, нервы в адвентициальной оболочке артерии и вокруг нее можно безопасно модулировать с помощью аппарата для нейромодуляции. Эффективное приложение термического воздействия из внутренней части почечной артерии является не очевидным, с учетом возможных клинических осложнений, связанных с таким лечением. Например, внутренняя и средняя оболочка почечной артерии высокочувствительны к термическому повреждению. Как более подробно обсуждается ниже, толщина внутренней и средней оболочки, отделяющей полость сосуда от адвентициальной оболочки, означает, что целевые нервы почки могут быть на расстоянии нескольких миллиметров от поверхности полости артерии. Достаточная энергия может быть доставлена к целевым нервам почки для модуляции целевых нервов почки без избыточного охлаждения или нагревания стенки сосуда до степени, при которой стенка замерзает, высыхает или иным образом повреждается до нежелательной степени. Потенциальным клиническим осложнением, связанным с избыточным нагреванием, является образование тромба из коагулировавшей крови, протекающей через артерию. Соответственно, сложные гидромеханические и термодинамические условия, присутствующие в почечной артерии при лечении, в частности те, которые могут влиять на динамику теплопереноса в участке лечения, могут быть важными для приложения энергии из внутренней части почечной артерии.
Аппарат для нейромодуляции может быть сконструирован для обеспечения регулируемого расположения и перемещения элемента, доставляющего энергию, внутри почечной артерии, поскольку расположение воздействия может также оказывать влияние на клиническую эффективность. Например, может быть предпочтительно прилагать воздействие по всей окружности из внутренней части почечной артерии, с учетом того, что почечные нервы могут располагаться по окружности вокруг почечной артерии. В некоторых случаях поражение по всей окружности, вероятно, возникающее от непрерывного поражения по окружности, может приводить к стенозу почечной артерии. Таким образом, может быть необходимо формирование более сложных поражений по продольному направлению почечной артерии и/или перемещение аппарата для нейромодуляции к множеству участков лечения. Однако необходимо отметить, что польза, обеспечиваемая кольцевой абляцией, может превышать вред возможного стеноза почечной артерии, или риск может быть ослаблен с некоторыми вариантами осуществления или у некоторых пациентов, задачей может стать обеспечение кольцевой абляции. Кроме того, вариабельное размещение и перемещение аппарата для нейромодуляции может, как доказано, быть полезным в случаях, когда почечная артерия является особенно извилистой, или когда имеются проксимальные ветви сосудов, отходящие от основного сосуда почечной артерии, что затрудняет воздействие в некоторых участках.
Кровоток через почечную артерию может быть временно остановлен на короткое время с минимальными осложнениями или без осложнений. Однако можно избежать окклюзии на значительное время в некоторых случаях для снижения вероятности повреждения почки, такого как ишемия. Может быть предпочтительным вовсе избежать окклюзии, или если окклюзия благоприятна для варианта осуществления, ограничить длительность окклюзии, например, до 2-5 минут.
На основании вышеописанных проблем (1) вмешательства в почечную артерию, (2) согласованного и стабильного размещения лечебного элемента против сосудистой стенки, (3) эффективного приложения воздействия через стенку сосуда, (4) размещения и потенциального перемещения лечебного аппарата для обеспечения множества участков лечения, и (5) предотвращения или ограничения продолжительности окклюзии кровотока, различные интересующие независимые и зависимые свойства сосудов почки включают, например: (а) диаметр сосуда, длину сосуда, толщину внутренней и средней оболочки, коэффициент трения, и извилистость; (b) растяжимость, жесткость и модуль эластичности стенки сосуда; (с) пиковую систолическую, конечную диастолическую скорость кровотока, а также среднюю систолическую-диастолическую пиковую скорость кровотока, и среднюю/максимальную объемную скорость кровотока; (d) удельную теплоемкость крови и/или стенки сосуда, теплопроводность крови и/или стенки сосуда, и/или теплопроводность кровотока за участком воздействия на сосудистую стенку и/или излучательный теплоперенос; (е) движение почечной артерии относительно аорты, индуцированное дыханием, движениями пациента, и/или пульсацией кровотока; и (f) угол, под которым почечная артерия отходит от аорты. Эти свойства обсуждаются более подробно по отношению к почечным артериям. Однако, в зависимости от аппарата, систем и способов, используемых для достижения ренальной нейромодуляции, такие свойства почечных артерий также могут направлять и/или ограничивать характеристики конструкции.
Как отмечалось выше, аппарат, расположенный в почечной артерии, может соответствовать геометрии артерии. Диаметр почечной артерии, DRA, как правило, находится в диапазоне примерно 2-10 мм, при этом большинство в популяции пациентов имеет DRA примерно от 4 мм до 8 мм со средним значением около 6 мм. Длина почечной артерии LRA, от устья в соединении аорты/почечной артерии и до дистальных ветвей, обычно находится в диапазоне примерно 5-70 мм, и у значительной части популяции пациентов находится в диапазоне примерно 20-50 мм. Поскольку целевое почечное сплетение встроено в адвентициальную оболочку почечной артерии, общая толщина внутренней и средней оболочки IMT (т.е. радиальное внешнее расстояние от поверхности полости артерии до адвентициальной оболочки, содержащей целевые нервные структуры) также известна, и как правило, находится в диапазоне примерно 0,5-2,5 мм, в среднем примерно 1,5 мм. Хотя определенная глубина воздействия может быть важна для достижения целевых нервных волокон, может быть предотвращено слишком глубокое воздействие (например, >5 мм от внутренней стенки почечной артерии), чтобы избежать не-целевых тканей и таких анатомических структур, как почечная вена.
Дополнительным интересующим свойством почечной артерии может быть степень движения почки относительно аорты, индуцированного дыханием и/или пульсацией кровотока. Почка пациента, расположенная на дистальном конце почечной артерии, может двигаться на 4 дюйма в краниальном направлении с экскурсией грудной клетки. Это может вызывать значительное движение почечной артерии, соединяющей аорту и почки, таким образом, требуя от аппарата для нейромодуляции уникального баланса жесткости и гибкости для сохранения контакта между термическим лечебным элементом и стенкой сосуда во время циклов дыхания. Далее, угол между почечной артерией и аортой может существенно варьировать у разных пациентов, а также может динамически меняться у пациента, например, из-за движения почки. Этот угол, как правило, может быть в диапазоне примерно 30°-135°.
V. Дополнительные примеры
Следующие примеры являются иллюстрациями некоторых вариантов осуществления настоящего изобретения.
1. Катетерный аппарат, включающий:
- удлиненный трубчатый ствол, имеющий проксимальную часть и дистальную часть; и
- терапевтический блок, расположенный на дистальной части удлиненного ствола и приспособленный к размещению в целевом участке внутри почечной артерии пациента - человека, где терапевтический блок включает поддерживающую структуру, содержащую:
- контрольный элемент, имеющий предварительно заданную спиральную форму, где контрольный элемент является трубчатой структурой, содержащей полость, проходящую в ней, и состоящей из нитиноловой мультифиламентной витой проволоки; и
- множество элементов, доставляющих энергию, переносимых поддерживающей структурой,
- где удлиненный трубчатый ствол и терапевтический блок вместе определяют полость для проволочного направляющего элемента, сконструированную для приема при скольжении медицинского проволочного направляющего элемента; и
- где аксиальное перемещение проволочного направляющего элемента относительно терапевтического блока трансформирует поддерживающую структуру между (а) низкопрофильной конфигурацией доставки и (b) развернутой конфигурацией, приводящей к принятию предварительно заданной спиральной формы контрольного элемента.
2. Катетерный аппарат из примера 1, в котором терапевтический блок сконструирован для трансформации между низкопрофильной конфигурацией доставки и развернутой конфигурацией, в то время как по меньшей мере дистальная часть проволочного направляющего элемента остается в полости проволочного направляющего элемента терапевтического блока.
3. Катетерный аппарат из примера 2, в котором поддерживающая структура включает усилие, восстанавливающее форму, достаточное для преодоления распрямляющего усилия, обеспечиваемого дистальной частью проволочного направляющего элемента для трансформации терапевтического блока в развернутую конфигурацию, когда наиболее удаленный наконечник проволочного направляющего элемента в целом выровнен с дистальным наконечником терапевтического блока.
4. Катетерный аппарат из примера 1, в котором:
- поддерживающая структура включает восстанавливающее форму усилие, недостаточное для преодоления распрямляющего усилия, обеспечиваемого дистальным участком проволочного направляющего элемента, когда проволочный направляющий элемент находится внутри полости для проволочного направляющего элемента терапевтического блока; и
- терапевтический блок сконструирован для трансформации в развернутую конфигурацию, когда наиболее удаленную часть проволочного направляющего элемента извлекают через полость для проволочного направляющего элемента до точки, приближенной к терапевтическому блоку.
5. Катетерный аппарат из любого из примеров 1-4, в котором дистальная часть терапевтического блока дополнительно включает гибкий изогнутый наконечник, сконструированный для обеспечения отверстия для проволочного направляющего элемента, и в развернутой конфигурации, для отведения проволочного направляющего элемента от стенки почечной артерии.
6. Катетерный аппарат из примера 5, в котором гибкий изогнутый наконечник состоит из полиэфир-блок-амидного сополимера.
7. Катетерный аппарат из примера 5, в котором гибкий изогнутый наконечник состоит из термопластического полиэфируретанового материала.
8. Катетерный аппарат из примера 7, в котором гибкий изогнутый наконечник состоит из примерно 5-30 вес. % силоксана, смешанного с термопластическим полиэфируретановым материалом.
9. Катетерный аппарат из любого из примеров 1-8, в котором в развернутой конфигурации элементы, доставляющие энергию, переносимые поддерживающей структурой, отделены друг от друга по продольной оси почечной артерии и конструированы для сохранения контакта со стенкой почечной артерии.
10. Катетерный аппарат из любого из примеров 1-9, в котором элементы, доставляющие энергию, содержат серию ленточных электродов.
11. Катетерный аппарат из примера 10, в котором по меньшей мере один из ленточных электродов содержит суженные концевые части, и в котором суженные концевые части сконструированы для обеспечения тупого угла между внешней поверхностью поддерживающей структуры и внешней поверхностью по меньшей мере одного ленточного электрода.
12. Катетерный аппарат из любого из примеров 1-11 в котором терапевтический блок содержит четыре элемента, доставляющих энергию.
13. Катетерный аппарат из любого из примеров 1-12, дополнительно содержащий втяжной загружающий инструмент, окружающий и ограничивающий по меньшей мере продольную часть терапевтического блока в низкопрофильной конфигурации доставки.
14. Катетерный аппарат из примера 13, в котором загружающий инструмент содержит дистальную концевую часть, имеющую округленные углы.
15. Система ренальной нейромодуляции для лечения пациента - человека, включающая:
- удлиненный ствол, имеющий проксимальный конец и дистальный конец, где дистальный конец ствола сконструирован для внутрисосудистой доставки по процедурному проволочному направляющему элементу в почечную артерию пациента;
- трубчатую спиральную структуру с предварительно заданной формой, расположенную на дистальном конце удлиненного ствола или рядом с ним, где спиральная структура сконструирована для трансформации между нерасширенной конфигурацией и расширенной конфигурацией, имеющей тенденцию к принятию формы спиральной структуры с предварительно заданной формой, и где спиральная структура построена, по меньшей мере отчасти, из мультифиламентной нитиноловой проволоки; и
- множество электродов, связанных со спиральной структурой;
- где удлиненный ствол и спиральная структура вместе определяют полость для проволочного направляющего элемента в них, и где
- полость для проволочного направляющего элемента сконструирована для приема при скольжении процедурного проволочного направляющего элемента для размещения спиральной структуры в целевом участке лечения в кровеносном сосуде почки пациента, и удерживания спиральной структуры в нерасширенной конфигурации, и где
- проксимальное перемещение процедурного проволочного направляющего элемента через полость для проволочного направляющего элемента относительно спиральной структуры так, чтобы дистальная концевая часть проволочного направляющего элемента по меньшей мере отчасти находилась в полости для проволочного направляющего элемента, трансформирует спиральную структуру до расширенной конфигурации.
16. Система из примера 15, где процедурный проволочный направляющий элемент содержит дистальную часть, имеющую вариабельную гибкость, и кроме того, где по меньшей мере область дистальной части проволочного направляющего элемента сконструирована для сохранения внутри части полости для проволочного направляющего элемента, определенной спиральной структурой, когда спиральная структура находится в расширенной конфигурации.
17. Система из примера 15 или примера 16, дополнительно включающая гибкую трубку, покрывающую спиральную структуру и находящуюся с ней в тесном контакте.
18. Система из примера 17, где множество электродов связано с гибкой трубкой с применением адгезивного материала.
19. Система из любого из примеров 15-18, где множество электродов состоит из золота.
20. Система из любого из примеров 15-19, где множество электродов по отдельности соединяется с источником энергии вне пациента, и где источник энергии способен к индивидуальному контролю энергии, доставляемой к каждому электроду во время лечения.
21. Способ выполнения ренальной нейромодуляции, включающий:
- внутрисосудистую доставку катетера для ренальной нейромодуляции в низкопрофильной конфигурации доставки по проволочному направляющему элементу к целевому участку лечения в кровеносном сосуде почки пациента - человека, и по меньшей мере поблизости от почечного нерва пациента, где катетер для ренальной модуляции содержит:
- удлиненный ствол; и
- многоэлектродную матрицу, расположенную на дистальной части ствола, и состоящую, по меньшей мере отчасти, из трубчатой структуры, образованной из мультифиламентной нитиноловой проволоки;
- извлечение проволочного направляющего элемента в проксимальном направлении, до тех пор пока катетер не трансформируется из низкопрофильной конфигурации доставки в развернутую конфигурацию, где трубчатая структура имеет радиально расширенную, в целом спиральную форму, сконструированную для контакта со стенкой кровеносного сосуда почки и для обеспечения кровотока через сосуд; и
- избирательную доставку энергии к одному или нескольким электродам из многоэлектродной матрицы для подавления передачи нервных импульсов по почечному нерву.
22. Способ из примера 21, где избирательная доставка энергии к одному или нескольким электродам из многоэлектродной матрицы включает получение множества поражений в необходимом режиме вдоль кровеносного сосуда почки.
23. Способ из примера 21 или примера 22, где отдельные электроды из многоэлектродной матрицы достаточно удалены друг от друга, так чтобы поражения не перекрывались.
24. Способ из любого из примеров 21-23, дополнительно включающий прикрепление внешнего заземления снаружи пациента, и где избирательная доставка энергии к одному или нескольким электродам дополнительно включает доставку электрического поля в однополярном режиме между каждым из электродов и внешним заземлением.
25. Способ из любого из примеров 21-23, в котором избирательная доставка энергии включает избирательную доставку электрического поля в биполярном режиме между электродами из многоэлектродной матрицы.
26. Способ из любого из примеров 21-25, в котором извлечение проволочного направляющего элемента в проксимальном направлении, пока не трансформируется терапевтический блок, включает лишь частичное извлечение проволочного направляющего элемента из терапевтического блока, так чтобы по меньшей мере часть проволочного направляющего элемента оставалась в терапевтическом блоке после трансформации терапевтического блока в развернутую конфигурацию.
27. Способ из любого из примеров 21-25, в котором извлечение проволочного направляющего элемента в проксимальном направлении, пока не трансформируется терапевтический блок, включает полное извлечение проволочного направляющего элемента из терапевтического блока, так чтобы наиболее удаленная часть проволочного направляющего элемента была извлечена до точки, приближенной к терапевтическому блоку.
28. Способ из любого из примеров 21-27, где целевой участок лечения содержит первый целевой участок лечения, и где способ дополнительно включает:
- продвижение проволочного направляющего элемента в дистальном направлении после избирательной доставки энергии к одному или нескольким электродам из многоэлектродной матрицы, для трансформации многоэлектродной матрицы из развернутой конфигурации обратно в низкопрофильную конфигурацию доставки;
- перемещение катетера ко второму участку лечения, отличающемуся от первого участка лечения;
- извлечение проволочного направляющего элемента в проксимальном направлении для повторной трансформации терапевтического блока из конфигурации доставки в развернутую конфигурацию; и
- избирательную доставку энергии к одному или нескольким электродам из многоэлектродной матрицы, расположенной во втором целевом участке лечения.
V. Заключение
Вышеприведенное подробное описание вариантов осуществления настоящего изобретения не предназначено для исчерпывающего разъяснения или ограничения настоящего изобретения до точной формы, раскрытой выше. Хотя специфические варианты осуществления и примеры технологии описаны выше с целью иллюстрации, различные эквивалентные модификации возможны в пределах объема изобретения, как понятно специалистам в данной области техники. Например, в то время как этапы представлены в определенном порядке, в альтернативных вариантах осуществления могут применяться этапы в другом порядке. Различные варианты осуществления, описанные в настоящей заявке, также могут быть объединены для обеспечения дополнительных вариантов осуществления.
Из вышеизложенного нужно понять, что хотя специфические варианты осуществления изобретения были описаны с целью иллюстрации, но хорошо известные структуры и функции не были показаны или описаны подробно, чтобы избежать ненужной путаницы в описании вариантов осуществления изобретения. Там, где это позволяет контекст, формы единственного или множественного числа могут также включать множество или единственное число, соответственно.
Далее, если явно не указано, что термин «или» означает только один элемент, отличающийся от других элементов в ссылке на перечень из двух или более элементов, то применение элемента «или» в таком перечне должно интерпретироваться как включающее: (а) любой отдельный элемент в перечне; (b) все из элементов в перечне; или (с) любую комбинацию элементов из перечня. Кроме того, используемый термин «включающий» подразумевает включение по меньшей мере указанных характеристик(и), такой как любая большая степень той же самой характеристики и/или это не мешает дополнительным типам других характеристик. Также нужно понять, что специфические варианты осуществления описаны с целью иллюстрации, но различные модификации могут быть выполнены без отклонения от изобретения. Далее, в то время как преимущества, связанные с определенными вариантами осуществления изобретения, описаны в контексте этих вариантов осуществления, другие варианты осуществления могут также проявлять такие преимущества, и не все варианты осуществления обязательно проявляют такие преимущества, чтобы находиться в объеме настоящего изобретения. Соответственно, описание и связанная технология могут охватывать другие варианты осуществления, не описанные или определенные точно в настоящей заявке.







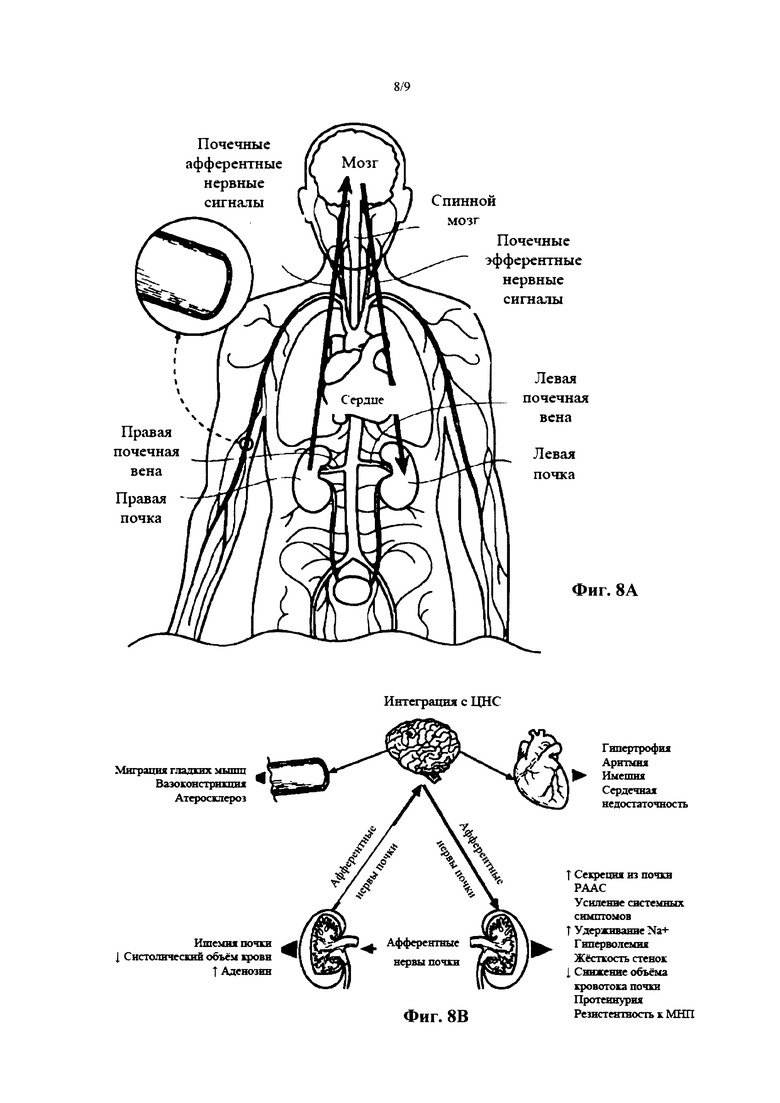

Группа изобретений относится к медицинской технике, а именно к средствам нейромодуляции. Катетерный аппарат включает удлиненный трубчатый ствол, имеющий проксимальную часть и дистальную часть, и терапевтический блок, расположенный на дистальной части удлиненного ствола и приспособленный к размещению в целевом участке внутри почечной артерии пациента, где терапевтический блок включает поддерживающую структуру, содержащую контрольный элемент, имеющий предварительно заданную спиральную форму, где контрольный элемент является трубчатой структурой, содержащей полость, проходящую в ней, и состоящей из нитиноловой мультифиламентной витой проволоки, и множество элементов, доставляющих энергию, переносимых поддерживающей структурой, где удлиненный трубчатый ствол и терапевтический блок вместе определяют полость для проволочного направляющего элемента, сконструированную для приема при скольжении медицинского проволочного направляющего элемента и где аксиальное перемещение проволочного направляющего элемента относительно терапевтического блока трансформирует поддерживающую структуру между (а) низкопрофильной конфигурацией доставки и (b) развернутой конфигурацией, приводящей к принятию предварительно заданной спиральной формы контрольного элемента. Система ренальной нейромодуляции для лечения пациента включает также множество электродов, связанных со спиральной структурой, где удлиненный ствол и спиральная структура, вместе, определяют полость для проволочного направляющего элемента в них, где полость для проволочного направляющего элемента сконструирована для приема при соскальзывании процедурного проволочного направляющего элемента для размещения спиральной структуры в целевом участке лечения в кровеносном сосуде почки пациента и удерживания спиральной структуры в нерасширенной конфигурации и где проксимальное перемещение процедурного проволочного направляющего элемента через полость для проволочного направляющего элемента относительно спиральной структуры так, чтобы дистальная концевая часть проволочного направляющего элемента по меньшей мере отчасти находилась в полости для проволочного направляющего элемента, трансформирует спиральную структуру до расширенной конфигурации. Использование изобретения позволяет снизить побочные эффекты и повысить эффективность лечения. 2 н. и 18 з.п. ф-лы, 9 ил.

1. Катетерный аппарат, включающий:
- удлиненный трубчатый ствол, имеющий проксимальную часть и дистальную часть; и
- терапевтический блок, расположенный на дистальной части удлиненного ствола и приспособленный к размещению в целевом участке внутри почечной артерии пациента - человека, где терапевтический блок включает поддерживающую структуру, содержащую:
- контрольный элемент, имеющий предварительно заданную спиральную форму, где контрольный элемент является трубчатой структурой, содержащей полость, проходящую в ней, и состоящей из нитиноловой мультифиламентной витой проволоки; и
- множество элементов, доставляющих энергию, переносимых поддерживающей структурой,
- где удлиненный трубчатый ствол и терапевтический блок, вместе, определяют полость для проволочного направляющего элемента, сконструированную для приема при скольжении медицинского проволочного направляющего элемента; и
- где аксиальное перемещение проволочного направляющего элемента относительно терапевтического блока трансформирует поддерживающую структуру между (а) низкопрофильной конфигурацией доставки и (b) развернутой конфигурацией, приводящей к принятию предварительно заданной спиральной формы контрольного элемента.
2. Катетерный аппарат по п. 1, в котором терапевтический блок сконструирован для трансформации между низкопрофильной конфигурацией доставки и развернутой конфигурацией, в то время как по меньшей мере дистальная часть проволочного направляющего элемента остается в полости проволочного направляющего элемента терапевтического блока.
3. Катетерный аппарат по п. 2, в котором поддерживающая структура включает усилие, восстанавливающее форму, достаточное для преодоления распрямляющего усилия, обеспечиваемого дистальной частью проволочного направляющего элемента для трансформации терапевтического блока в развернутую конфигурацию, когда наиболее удаленный наконечник проволочного направляющего элемента в целом выровнен с дистальным наконечником терапевтического блока.
4. Катетерный аппарат по п. 1, в котором:
- поддерживающая структура включает восстанавливающее форму усилие, недостаточное для преодоления распрямляющего усилия, обеспечиваемого дистальным участком проволочного направляющего элемента, когда проволочный направляющий элемент находится внутри полости для проволочного направляющего элемента терапевтического блока; и
- терапевтический блок сконструирован для трансформации в развернутую конфигурацию, когда наиболее дистальную часть проволочного направляющего элемента извлекают через полость для проволочного направляющего элемента до точки, приближенной к терапевтическому блоку.
5. Катетерный аппарат по п. 1, в котором дистальная часть терапевтического блока дополнительно включает гибкий изогнутый наконечник, сконструированный для обеспечения отверстия для проволочного направляющего элемента, и в развернутой конфигурации, для отведения проволочного направляющего элемента от стенки почечной артерии.
6. Катетерный аппарат по п. 5, в котором гибкий изогнутый наконечник состоит из полиэфир-блок-амидного сополимера.
7. Катетерный аппарат по п. 5, в котором гибкий изогнутый наконечник состоит из термопластического полиэфируретанового материала.
8. Катетерный аппарат по п. 7, в котором гибкий изогнутый наконечник состоит из примерно 5-30 вес. % силоксана, смешанного с термопластическим полиэфируретановым материалом.
9. Катетерный аппарат по п. 1, в котором в развернутой конфигурации элементы, доставляющие энергию, переносимые поддерживающей структурой, отделены друг от друга по продольной оси почечной артерии и конструированы для сохранения контакта со стенкой почечной артерии.
10. Катетерный аппарат по п. 1, в котором элементы, доставляющие энергию, содержат серию ленточных электродов.
11. Катетерный аппарат по п. 10, в котором по меньшей мере один из ленточных электродов содержит суженные концевые части и в котором суженные концевые части сконструированы для обеспечения тупого угла между внешней поверхностью поддерживающей структуры и внешней поверхностью по меньшей мере одного ленточного электрода.
12. Катетерный аппарат по п. 1, в котором терапевтический блок содержит четыре элемента, доставляющих энергию.
13. Катетерный аппарат по п. 1, дополнительно содержащий втяжной загружающий инструмент, окружающий и ограничивающий по меньшей мере продольную часть терапевтического блока в низкопрофильной конфигурации доставки.
14. Катетерный аппарат по п. 13, в котором загружающий инструмент содержит дистальную концевую часть, имеющую округленные углы.
15. Система ренальной нейромодуляции для лечения пациента - человека, включающая:
- удлиненный ствол, имеющий проксимальный конец и дистальный конец, где дистальный конец ствола сконструирован для внутрисосудистой доставки по процедурному проволочному направляющему элементу в почечную артерию пациента;
- трубчатую спиральную структуру с предварительно заданной формой, расположенную на дистальном конце удлиненного ствола или рядом с ним, где спиральная структура сконструирована для трансформации между нерасширенной конфигурацией и расширенной конфигурацией, имеющей тенденцию к принятию формы спиральной структуры с предварительно заданной формой, и где спиральная структура построена по меньшей мере отчасти из мультифиламентной нитиноловой проволоки; и
- множество электродов, связанных со спиральной структурой;
- где удлиненный ствол и спиральная структура вместе определяют полость для проволочного направляющего элемента в них, и где
- полость для проволочного направляющего элемента сконструирована для приема при соскальзывании процедурного проволочного направляющего элемента для размещения спиральной структуры в целевом участке лечения в кровеносном сосуде почки пациента, и удерживания спиральной структуры в нерасширенной конфигурации, и где
- проксимальное перемещение процедурного проволочного направляющего элемента через полость для проволочного направляющего элемента относительно спиральной структуры так, чтобы дистальная концевая часть проволочного направляющего элемента по меньшей мере отчасти находилась в полости для проволочного направляющего элемента, трансформирует спиральную структуру до расширенной конфигурации.
16. Система по п. 15, где процедурный проволочный направляющий элемент содержит дистальную часть, имеющую вариабельную гибкость, и, кроме того, где по меньшей мере область дистальной части проволочного направляющего элемента сконструирована для сохранения внутри части полости для проволочного направляющего элемента, определенной спиральной структурой, когда спиральная структура находится в расширенной конфигурации.
17. Система по п. 15, дополнительно включающая гибкую трубку, покрывающую спиральную структуру и находящуюся с ней в тесном контакте.
18. Система по п. 17, где множество электродов связано с гибкой трубкой с применением адгезивного материала.
19. Система по п. 15, где множество электродов состоит из золота.
20. Система по п. 15, где множество электродов по отдельности соединяется с источником энергии вне пациента и где источник энергии способен к индивидуальному контролю энергии, доставляемой к каждому электроду во время лечения.
| WO 2012061161 A1, 10.05.2012 | |||
| US 2001023365 A1, 20.09.2001 | |||
| US 6656195 A1, 12.02.2003 | |||
| WO 2006065949 A1, 22.06.2006 | |||
| СПОСОБ ДОСТИЖЕНИЯ ТРАНСМУРАЛЬНОСТИ ПОВРЕЖДЕНИЯ МИОКАРДА ПРЕДСЕРДИЙ ПРИ ЛЕЧЕНИИ НАДЖЕЛУДОЧКОВЫХ АРИТМИЙ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2394522C2 |
Авторы
Даты
2016-11-10—Публикация
2013-03-11—Подача