Изобретение относится к области химии гетероциклических соединений, а именно к способу получения производных 2-меркаптобензтеллуразола-веществ, обладающих биологически активным действием.
Производные 2-меркаптобензимидазола, -оксазола и -тиазола в щелочной среде или их Na- или K-солей с алкил- и арилгалогенидами широко используются для синтеза различных S- алкил- и арилзамещенных производных (Патент 48244645 США, 1990 г. Н. Turu, N. Eiki, S. Ryo, M. Konichi. Патент 3901909 США, 1976 г. N.Y. Lakashmi, Н.R. Dieter. Заявка. №63-208579 Япония, 1990 г. Сусуму, С. Кацу, Я. Томио, Н. Ютака, X. Масатоси. «Производные бензимидазола, их получение и противоязвенные лекарственные препараты на их основе». Патент 5091399 США, 1993 г. Osei-Gyimah, S.E. Sherba, RohmmHaas).
Известен способ получения 2-аллилмеркаптобензимидазола, -оксазола, и -тиазола добавлением к раствору этилата натрия маленькими порциями 2-меркаптобензтеллуразола, затем при 0°С свежеперегнанного бромистого аллила, перемешиванием в течение 22-24 часов при комнатной температуре. Выходы продуктов 60-68% (Takahashi T., Hayami A., Bull. Inst. Chem. Res, KyotoUniv., 51, 163(1973). O.P. Suri, R.K. Khayuria, D.B. Saxena, N.S. Rawat, C.K. Atal, J. HeterocyclChm, 20, 813(1983). Д. ГюКит, И.М. Миронова, B.B. Абдин, изв. Вузов. Химия и хим. технол., 36, 67(1994). С. Goux, P. Lhoste, D. Sinou, Tetrahedron, 50, 10321(1994). Saxena D.В, Khajuriu R.K., Suri O.P., Syntesis and Spectral Studias of 2-Mercatobenzimidazole Derivatives. I. // J. HeterocyclicChem. 1983. V. 20. №3. P. 813-814).
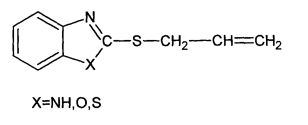
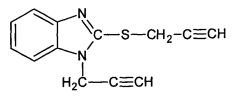
Известен также способ получения N-пропаргил-2-(пропаргилтио)бензимидазола кипячением 2-меркаптобензимидазола с избытком пропаргилбромида в ацетоне в присутствии карбоната калия (Balasubramanian K.K., Venugopalan В., «StudiesinClaisenRearrangementaNovelDepropargylativcyclisationofN-propargil-2-(propargilthio)-benzimidazol» TetrahedronLett, 1974. №31. Р. 2645-2648).
Известен способ алкилирования 2-меркаптобензтиазола и -оксазола, заключающийся во взаимодействии 3Н-бензтиа(окса)зол-2-тиона со спиртами в присутствии различных катализаторов. Этот метод предлагается авторами как эффективный, недорогой метод. Также авторы работы предлагают использовать иминоэфиры как алкилирующий реагент, как утверждают авторы, выход продуктов S-алкилирования составляет 63%-85% (YanfelYu, ZhengningLi, andLanJiang. ANovelSynthesisof 2-Alkylthiobenzothiazolesand 2-Alkylthiobenzoxazoles. Phosphorus, Sulfur, andSilicon, 2012. С. 632-640).
Известен способ получения 2-алкилтиобензокса(тиа)золов кипячением в ТГФ бензокса(тиа)зол-2-тионов с иминоэтилом, лучшие выходы были получены, при использовании в качестве катализатора кислоты или основания не менее 10%. J.М. Gardiner, С.R. Loyns. Syntesis of 1-, 1,4- and 1,7-Substituted 2-Mercapto- and 2-Methylmercapto-Benzimidazoles: Acidic Analogues of the HIV-1 RT Inhibitor, TIBO // Tetrahedron. 1995. V 51. №42. P. 11515-11530).
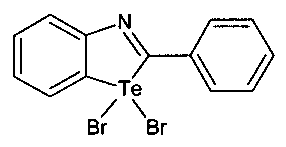
Известен способ получения 1,1-дибром-2-фенилбензотеллуразола, заключающийся в добавлении к раствору 2-фенилбензотеллуразола в 20 мл CCI4, охлажденному в бане со льдом, медленно, при энергичном перемешивании прикапывают раствор брома в CCI4. Выпавший осадок промывают CCI4 и перекристализовывают из ацетона (Садеков И.Д., Абакаров Г.М., Шнайдер А.А., Курень С.Г., Гарновсий А.Д., Минкин В.И. Реакции 2-фенилбензотеллуразола // Тез. Докл. 4 Всесоюзн. конф. по металлорганич. химии. Казань. 1988. С. 2.19. №177).
Известен способ получения карбамоильных производных меркаптобензоксазола взаимодействием бензоксазолинтионов с изоцианатами в сухом ацетоне (Н.Л. Познанская, А.В. Массальская, Н.И Швецов-Шиловский, Н.Н. Мельников, В.А. Гранжан, С.К. Лактионова, С.Н. Иванова, (Деп) «Синтез и свойства N-карбоамильных производных бензоксазолинонов и бензоксазолинтионов», РЖХим. 1974, 20, Ж299).
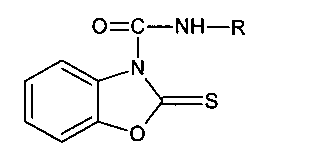
Известен способ получения 2-алкилтиобензокса(тиа)золов, который был получен кипячением в ТГФ 2-алкилтиобензокса(тиа)золов с иминоэтилом в присутствии кислот или оснований в каталитических количествах, лучшие выходы были получены при использовании количества кислоты или основания не менее 10%.
AbdullahHarizi,AnisRomdhaneandZineMighri.Synthesisandreactivityofbenzoxa(thia)zoles:TetrahedronLetters 41 (2000) 5833-5835
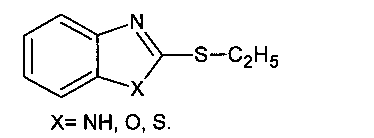
Известен способ получения ацильных производных бензимидазолин- и бензоксазолинтионов, используя ангидриды кислот и изоционаты, реакция протекает с образованием только продукта N-ацилирования (L. Spirer. «Preparationofbenzimidazolederivatives» RocznikiChem. 1954. V. 28. P. 455 С.А. 1956, V. 50. P. 311).
Известен способ получения йодид N-метил-2-фенилбензотеллуразола на кипящей водяной бане; в запаянной ампуле нагревают 2-фенилбензотеллуразол в йодистом метиле, в течение 16 часов, после охлаждения осадок отфильтровывают, промывают гексаном и сушат, выход продукта 91% (Садеков И.Д., Абакаров Г.М., Шнайдер А.А., Минкин В.И. Теллур-азотсодержащие гетероциклы 3*. Реакции 2-фенилбензотеллуразола по гетероатомам «Химия гетероциклических соединений», 1989. №7. С. 989-993; Садеков И.Д. и др. Подходы к синтезу 2-замещенных бензтеллуразолов. Химия гетероциклических соединений, 1989. №1. С. 120-125; Садеков И.Д. и др. Синтез бензтеллуразолов и их производных. Химия гетероциклических соединений, 1988. №2. С. 276-278).
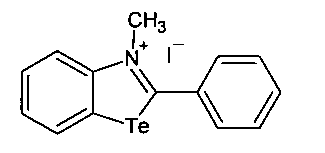
Также известен способ синтеза солей по атому азота (алкилсульфонатов) и синтез производных по SH-группе, предполагается, что вместо X могут быть следующие элементы O, S, N, Те, Se и т.д. вместо YH и SH группы, т.е. это производные нафталинбензимидазола, оксазола, теллуразола. US 5326876 А1 (KawataKen), 05.07.1994.
Однако все вышеуказанные способы для получения производных 2-меркаптобензтеллуразола могут быть использованы только в видоизмененном виде.
Известен способ синтеза 2-меркаптобензтеллуразола (RU 2546674 С2, 10.04.2015), который является наиболее близким аналогом и исходным веществом для синтеза заявленных соединений.
Задача - получение соединений, обладающих биологически активным действием, а также поиск биологически активных веществ среди азотсодержащих гетероциклических соединений теллура.
Технический результат заключается в разработке методов синтеза новых биологически активных производных класса меркаптобензтеллуразолов.
Сущность изобретения в том, что синтезируют
производные 2-меркаптобензтеллуразола, которые имеют структурную формулу:
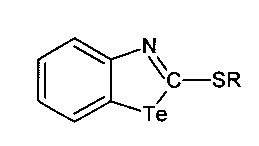
R = СН2=СН-СН2-, НС≡С-СН2-, СН3-, 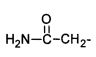 ,
,  , при этом
, при этом
способ получения производных 2-меркаптобензтеллуразола, обладающих биологической активностью, включает взаимодействие 2-меркаптобензтеллуразолята натрия с соответстветствующими галогенидами при перемешивании от 1 до 5 часов, а
2-метилмеркаптобензтеллуразол имеет структурную формулу:
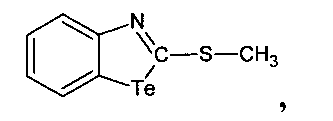
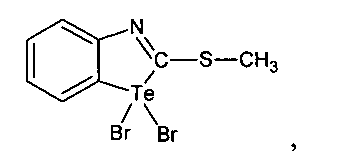
при этом способ получения соединения 1,1-дибром-2-метилмеркаптобензтеллуразола включает взаимодействие 2-метилмеркаптобензтеллуразола с бромом в четыреххлористом углероде при перемешивании в течение 30 мин
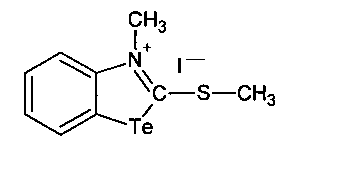
а способ получения соединения N-метил-2-метилмеркаптобензтеллуразолия иодида включает взаимодействие 2-метилмеркаптобензтеллуразола с йодистым метилом при нагревании в течение 6 часов в запаянной ампуле
Таким образом, нам удалось синтезировать 8 веществ:
1. 2-Аллилмеркаптобензтеллуразол (далее вещество 1);
2. 2-Пропаргилмеркаптобензтеллуразол (далее вещество 2);
3. 2-Метилмеркаптобензтеллуразол (далее вещество 3);
4. 1,1-Дибром-2-метилмеркаптобензтеллуразол (далее вещество 4);
5. 2-Ацетамидомеркаптобензтеллуразол (далее вещество 5);
6. 2-Этилмеркаптобензтеллуразол (вещество 6);
7. 2-Ацетилмеркаптобензтеллуразол (далее вещество 7);
8. N-Метил-2-метилмеркаптобензтеллуразолия йодид (далее вещество 8).
2-Аллилмеркаптобензтеллуразол, полученный взаимодействием 2-меркаптобензтеллуразола в этилате натрия с аллилом бромистым, имеет структурную формулу:
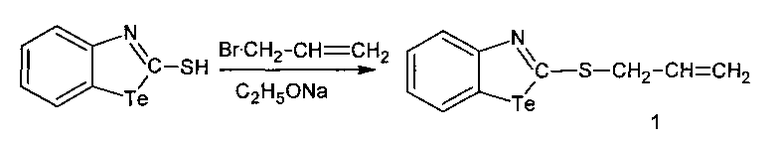
и обладает модифицирующим действием на белки крови лабораторных крыс за счет снижения содержания SH-групп, а также вызывает у крыс судороги при внутрибрюшинном введении.
Получение 2-аллилмеркаптобензтеллуразола заключается в том, что в трехгорлую колбу помещают абсолютный этиловый спирт и Na, к полученному раствору этилата натрия маленькими порциями добавляют 2-меркаптобензтеллуразол, смесь охлаждают до 0°С, затем добавляют бромистый аллил, перемешивают при 0°С в течение 1 часа, затем при комнатной температуре в течение 5 часов. Реакционную смесь отфильтровывают, осадок промывают водой, сушат и перекристализовывают.
Пример 1
В трехгорлую колбу, снабженную мешалкой, холодильником и капельной воронкой, помещали 30 мл абсолютного этилового спирта и 0.53 г (2.3 ммоль) Na. К полученному раствору этилата натрия маленькими порциями в течение 30 минут добавляли 6 г (2,3 ммоль) 2-меркаптобензтеллуразола. Смесь охлаждали до 0°С и медленно добавляли 1,8 мл (2,1 ммоль) свежеперегнанного бромистого аллила, перемешивали при 0°С в течение 1 часа, затем при комнатной температуре в течение 5 часов. Реакционную смесь отфильтровывали. Кристаллический осадок после фильтрации, содержащий вещество промывали несколько раз водой, сушили на воздухе, перекристализовывали из элюента эфир:гексан (1:9). Выход 3.7 г (1.2 моль 58%), белые игольчатые кристаллы, т. пл. 115-117°С. ИК-спектр, ν, см-1: 3100-3090 (NH), 3100-3048 (СН=), 2858-2817 (CHAr), 1645-1570 (N=C), 1600-1530, 1480-1380 (Ar). Спектр ЯМР 1Н, δ, м.д.: 8.00 д (1Н, СН7, J 8.0 Гц), 7.88 д (1H, СН4, J 8.4 Гц), 7.37 д.д (1Н, СН6, J 8.0, 7.2 Гц), 7.11 д.д (1H, СН5, J 8.4, 7.2 Гц), 6.65 д.д (2Н, =СН2, J 17.0, 11.6 Гц), 6.43-6.19 м (1Н, СН=), 3.40 д (2Н, СН2, J 7.2 Гц). Спектр ЯМР 13С, δС, м.д.: 161.46 (С2), 140.62 (С9), 133.33 (С6), 132.09 (С7), 126.80 (С5), 124.15 (С8), 123.56 (С4), 120.26 (С11), 18.50 (С12), 15.06 (С13). Масс-спектр, m/z (Iотн, %): 175 (37), 135 (100), 102 (90), 76 (92). Найдено, %: С 39.63; Н 2.95; N 4.68; S 10.55. C10H9NSTe. Вычислено, %: С 39.66; Н 2.99; N 4.63; S 10.59.
2-Пропаргилмеркаптобензтеллуразол имеет структурную формулу:
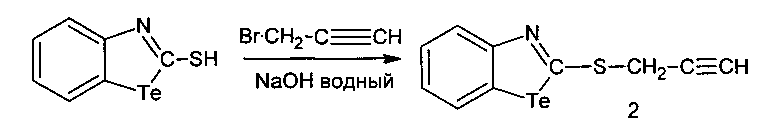
и обладает модифицирующим действием на белки крови лабораторных крыс за счет снижения содержания SH-групп, а также вызывает у крыс судороги при внутрибрюшинном введении.
Пример 2
В трехгорлую колбу, снабженную мешалкой, капельной воронкой и обратным холодильником, помещали 0.16 г (3.8 ммоль) NaOH, растворенного в 30 мл воды, и маленькими порциями добавляли 1.0 г (3.8 ммоль) 2-меркаптобензотеллуразола. К полученному раствору при комнатной температуре добавляли 0.5 мл (3.88 ммоль) свежеперегнанного бромистого пропаргила. Полученную смесь коричневого цвета перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь отфильтровывали, промывали водой до нейтральной реакции, сушили и перекристаллизовывали из элюента гексан:эфир:бензол (8:1:2). Выход 0.57 г. (1.9 ммоль, 50%), коричневые кристаллы, т. пл. 78-80°С. ИК-спектр, ν, см-1: 3080-3050 (CHAr), 2150-2050 (С≡С), 1580-1540, 1485-1430 (Ar), 1645-1590 (N=C). Спектр ЯМР 1H, δ, м.д.: 7.74 д (1H, СН7, J 8.0 Гц), 7.36 д (1Н, СН4, J 8.4 Гц), 7.30 д.д (1Н, СН6, J 7.9, 7.2 Гц), 7.10 д.д (1Н, СН5, J 8.4, 7.3 Гц), 3.49 д (2Н, СН2, J 2.6 Гц), 2.14 т (1Н, ≡СН, J 2.6 Гц). Спектр ЯМР 13С, δС, м.д.: 195.73 (С2), 146.83 (С9), 132.35 (С6), 127.31 (С7), 123.95 (С5), 120.80 (С8), 114.93 (С4), 97.50 (С11), 18.50 (С12), 15.06 (С13). Масс-спектр, m/z (Iотн, %): 173 (100), 161 (20), 134 (67), 102 (30), 76 (27). Найдено, %: С 39.90; Н 2.38; N 4.68; S 10.64. C10H7NSTe. Вычислено, %: С 39.92; Н 2.35; N 4.66; S 10.66.
2-Метилмеркаптобензтеллуразол имеет структурную формулу:
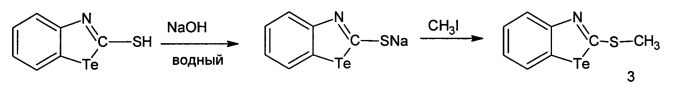
и обладает модифицирующим действием на белки крови лабораторных крыс за счет снижения содержания SH-групп, а также вызывает у крыс судороги при внутрибрюшинном введении.
Пример 3
В трехгорлую колбу, снабженную мешалкой и капельной воронкой, помещали раствор 1.0 г (3.8 ммоль) 2-меркаптобензтеллуразола в 30 мл этанола, содержащего 7.5 ммоль NaOH, добавляли 0.26 мл (4.8 ммоль) йодистого метила, полученную смесь желтого цвета перемешивали 1 ч при комнатной температуре и оставляли на 5 ч. Образовавшийся осадок отфильтровывали, промывали водой до нейтральной реакции, высушивали и перекристаллизовывали из изопропилового спирта
Выход 0.58 г (2.1 ммоль, 58%). Белое кристаллическое вещество, т. пл. 115-117°С. ИК-спектр, ν, см-1: 3067-3043 (CHAr), 2900-2811 (СН3), 1613-1574, 1549-1420. Спектр ЯМР 1Н, δ, м.д.: 2.67 с (3Н, СН3), 7.07-7.10 м (1Н, СН4), 7.34-7.37 м (1Н, СН7), 7.37-7.82 м (1Н, СН5), 7.94 с (1Н, СН6). Спектр ЯМР 13С, δС, м.д.: 17.07 (С11), 123.30 (С5), 123.59 (С7), 123.60 (С4), 126.56 (С6), 133.16 (С8), 160.29 (С9), 168.64 (С2). Спектр ЯМР, 15N: δN 173.73 м.д. Спектр ЯМР 125Те: δТе 986.05 м.д. Найдено, %: С 34.71; Н 2.55; N 5.06; S 11.58. C8H7NSTe. Вычислено, %: С 34.70; Н 2.53; N 5.06; S 11.57; Те 46.13.
1,1-Дибром-2-метилмеркаптобензтеллуразол, полученный взаимодействием 2-метилмеркаптобензтеллуразола с бромом, имеет структурную формулу:
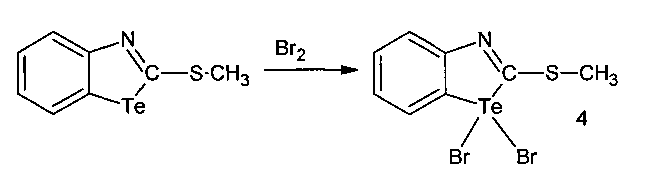
и обладает модифицирующим действием на белки крови лабораторных крыс за счет снижения содержания SH-групп, а также вызывает у крыс судороги при внутрибрюшинном введении.
Пример 4
В трехгорлую колбу помещали раствор из 0.692 г (2.5 ммоль) 2-метилмеркаптобензтеллуразола в 20 мл CCl4, к нему медленно прикапывали при перемешивании раствор 0.80 г (5 ммоль) брома в 5 мл CCl4, перемешивали в течение 30 минут. Выпавший осадок отфильтровывали, промывали эфиром и перекристализовывали из спирта. Выход 0.86 г (2 ммоль 78%), оранжево-желтые кристаллы, т. пл. 176-178°С. ИК-спектр, ν, см-1: 3100, 3050 (N=C), 2950 (СН3), 2925 (CHAr), 2850, 1755, 1730, 1722, 1697, 1653, 1630, 1583, 1540, 1520 (С-Н), 1465, 1420 (Ar), 1229, 1196, 1115, 754, 710 (N-C), 650, 609, 590, 540 (C-S), 465, 450, 400 (NTeC), (NTeBr). Спектр ЯМР 1H, δ, м.д.: 7.72 с (1H, СН6), 7.36 д.д (1H, СН5, J 7.9, 7.2 Гц), 7.30 д (1Н, СН7, J 7.6 Гц), 7.10 д (1Н, СН4, J 7.9 Гц), 2.29 с (3Н, СН3). Спектр ЯМР 13С, δС, м.д.: 160.4 (С2), 153.1 (С9), 132.0 (С8), 126.6 (С7), 123.6 (С6), 123.4 (С4), 117.7 (С5), 17.1 (С11). Масс-спектр, m/z (Iотн, %): 149 (100), 279 (32), 76 (25), 102 (16), 264 (13). Найдено, % С: 21.65; H 1.62; N 3.26; S 7.39. C8H7NSBr2Te. Вычислено, %: С 21.72; Н 1.73; N 3.21; S 7.41.
2-Ацетамидомеркаптобензтеллуразол, полученный взаимодействием 2-меркаптобензтеллуразола с -α-хлорацетамидом, имеет структурную формулу:
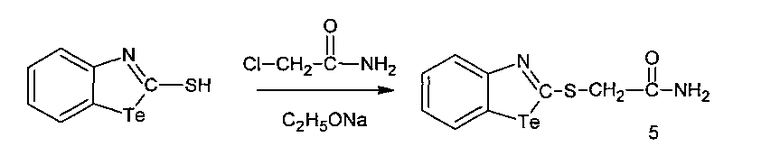
и обладает модифицирующим действием на белки крови лабораторных крыс за счет снижения содержания SH-групп, а также вызывает у крыс судороги при внутрибрюшинном введении.
Пример 5
В трехгорлую колбу помещают раствор этилата натрия, полученного из 0.08 г Na (3.8 ммоль) и 25 мл абсолютного этанола, к нему маленькими порциями при перемешивании добавляли 1 г (3.8 ммоль) 2-меркаптобензтеллуразола. К полученной смеси добавляли раствор 0.33 г (3.5 ммоль) α-хлорацетамида в 15 мл абсолютного этанола, перемешивали 2 ч при комнатной температуре, отфильтровывали, фильтрат разбавляли холодной водой, выпавший осадок сушили и перекристаллизовывали из этанола. Выход 0.93 г (3.5 ммоль, 77%). Белое кристаллическое вещество, т. пл. 188-190°С. ИК-спектр, ν, см-1: 3174 (NH), 3047-3000 (СНаром), 2950-2900 (СН3), 1659 (С=O), 1621-1576, 1452-1426 (Ar), 1370 (C=S). Спектр ЯМР 1Н, δ, м.д.: 3.95 с (2Н, СН2), 7.09 м (1Н, СН5), 7.24 с и 7.67 с (NH2), 7.35 м (1Н, СН6), 7.80 м (1Н, СН4), 7.97 м (1Н, СН7). Спектр ЯМР 13С, δС, м.д.: 37.31 (С11), 123.53 (С5), 123.66 (С4), 126.50 (С6), 131.92(С7), 133.87 (С8), 159.66 (С9), 166.50 (С12), 169.13 (С2). Спектр ЯМР 15N: δN 109.14 м.д. Спектр ЯМР 125Те: δТе 1001.50 м.д. Найдено, %: С 33.50; Н 2.52; N 8.76; S 10.02; Те 39.89. C9H8N2OSTe. Вычислено, %: С 33.80; Н 2.52; N 8.76; S 10.01; Те 39.92.
2-Этилмеркаптобензтеллуразол, полученный взаимодействием 2-меркаптобензтеллуразола в этилате натрия с йодистым этилом, имеет структурную формулу
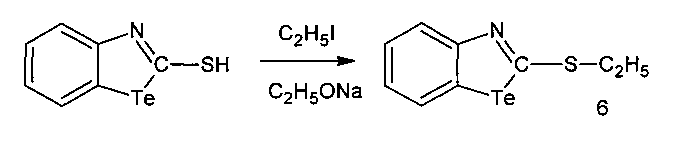
и обладает модифицирующим действием на белки крови лабораторных крыс за счет снижения содержания SH-групп, а также вызывает у крыс судороги при внутрибрюшинном введении.
Пример 6
В трехгорлую колбу, снабженную мешалкой, капельной воронкой и обратным холодильником, помещают раствор этилата натрия, полученного из 0,11 г (5 ммоль) Na и 30 мл абсолютного этанола, маленькими порциями при перемешивании добавляли 1.31 г (5 ммоль) 2-меркаптобензотеллуразола. К полученному раствору добавляли 0.44 г (5 ммоль) йодистого этила, растворенного в 20 мл абсолютного этилового спирта. Смесь при комнатной температуре перемешивали в течение 1,5 ч. Раствор отфильтровывали, фильтрат разбавляли 20 мл холодной воды. Выпавший осадок сушили перекристаллизовывали из этилового спирта. Выход (0.58 г. 2.1 ммоль) (71%). Темно-бордовые игольчатые кристаллы, т. пл. 69-71°С. ИК-спектр, ν, см-1: 3100-3055 (CHAr), 2960-2840 (СН3), 1610-1590 (N=C), 1555-1490 (Ar). Спектр ЯМР 1H, δ, м.д.: 7.98 д (1Н, СН7, J 8.0 Гц), 7.82 д (1Н, СН4, J 8.4 Гц), 7.35 д.д (1Н, СН6, J 8.0, 7.3 Гц), 7.09 д.д (1Н, СН5, J 8.5, 7.2 Гц), 1.38 т (3Н, СН3, J 7.1 Гц), 3.23 д (2Н, SCH2, J 8.1 Гц). Спектр ЯМР 13С, δС, м.д.: 167.11 (С2), 160.20 (С9), 133.23 (С6), 132.11 (С7), 126.68 (С5), 123.72 (С4), 123.60 (С8), 28.46 (С11), 14.58 (С12). Масс-спектр, m/z (Iотн, %): 163 (51), 135 (100), 102 (35), 76 (31). Найдено, %: С 37.21; Н 3.09; N 4.81; S 11.05. C9H9NSTe. Вычислено, %: С 37.17; Н 3.12; N 4.82; S 11.02.
2-Ацетилмеркаптобензтеллуразол, полученный взаимодействием 2-меркаптобензтеллуразола в этилате натрия с бромистым ацетилом, имеет структурную формулу:
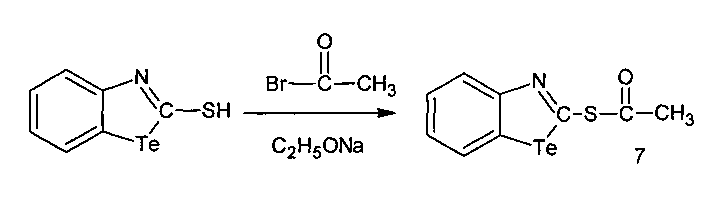
и обладает модифицирующим действием на белки крови лабораторных крыс за счет снижения содержания SH-групп, а также вызывает у крыс судороги при внутрибрюшинном введении
Пример 7
В трехгорлую колбу, снабженную мешалкой, капельной воронкой и обратным холодильником, помещали 0.16 г (3.8 ммоль) NaOH растворенного в 30 мл абсолютного спирта и маленькими порциями добавляли 1 г (3.8 ммоль) 2-меркаптобензотеллуразола. К нему добавляли 0.33 мл (3.8 ммоль) свежеперегнанного бромистого ацетила. Выпадение осадка начинается через 10 мин после добавления бромистого ацетила. Смесь перемешивали в течение 1 часа при комнатной температуре. Образовавшийся осадок отфильтровывали, промывали водой до нейтральной реакции. Продукты реакции разделяли с помощью колоночной хроматографии. В качестве элюента брали смесь бензола гексана и ацетона в соотношении 5:5:1.5. Выход 0.86 г (2.7 ммоль, 74%), красные кристаллы т. пл. 234-236°С.
ИК-спектр, ν, см-1: 3106-3034 (CHAr), 2961-2897 (СН3), 1698-1577, 1653-1600 (С=О), 1453-1425 (Ar). Спектр ЯМР 1Н, δ, м.д.: 7.72 д (1Н, СН7, J 7.9 Гц), 7.36 д (1H, СН4, J 7.9 Гц), 7.32 д.д (1Н, СН6, J 8.0, 7.2 Гц), 7.20 д.д (1Н, СН5, J 8.4, 7.2 Гц), 2.49 с (3Н, СН3). Спектр ЯМР 13С, δC, м.д.: 169.2 (С2), 166.6 (С12), 159.7 (С9), 133.9 (С8), 132.0 (С7), 126.5 (С6), 123.6 (С4), 123.6 (С5), 37.3 (С11). Масс-спектр, m/z (Iотн, %): 135 (100), 263 (61), 76 (39), 91 (13). Найдено, %: С 35.48; Н 2.33; N 4.63; S 10.47. C9H8N2OSTe. Вычислено, %: С 35.46; Н 2.31; N 4.59; S 10.52.
N-Метил-2-метилмеркаптобензтеллуразолия йодид, полученный взаимодействием 2-метилмеркаптобензтеллуразола с йодистым метилом, имеет структурную формулу:
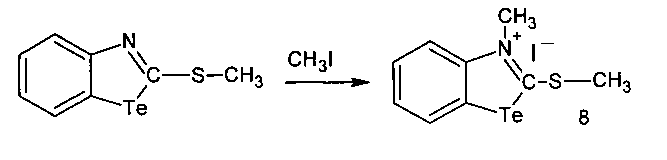
и обладает модифицирующим действием на белки крови лабораторных крыс за счет снижения содержания SH-групп, а также вызывает у крыс судороги при внутрибрюшинном введении
Пример 8
В запаянной ампуле смесь из 1.05 г (2.5 ммоль) 2-метилмеркаптобензотеллуразола с 10 мл йодистого метила нагревали в течение 6 ч на кипящей водяной бане. После охлаждения содержимое ампулы отфильтровывали, промывали эфиром, сушили. Выход 0.966 г (2.1 ммоль) 92%), желтые кристаллы, т. пл. 177-179°С. ИК-спектр, ν, см-1: 3050-3000 (CHAr), 2955-2890 (СН3), 1697-1630, 1443-1378 (Ar), 1565 (N=C). Спектр ЯМР 1Н, δ, м.д.: 8.96 д.д (1Н, СН6, J 7.9, 7.4 Гц), 8.52 д.д (1Н, СН5, J 8.6, 7.3 Гц), 8.16 д (1Н, СН7, J 8.0 Гц), 7.96 д (1Н, СН4, J 8.6 Гц), 3.79 с (3Н, NCH3), 2.94 с (3Н, СН3). Спектр ЯМР, 13С, δС, м.д.: 168.2 (С2), 148.0 (С9), 132.8 (С8), 128.6 (С7), 126.0 (С6), 122.5 (С4), 118.9 (С5), 31.5 (С12), 22.1 (С11). Масс-спектр, m/z (Iотн, %): 279 (100), 149 (55), 76 (4), 102 (4). Найдено, %: С 23.81; Н 2.53; N 3.38; S 7.64. C9H10NSITe. Вычислено, %: С 23.62; Н 2.48; N 3.35; S 7.66.
Были проведены серии испытаний на биологическую активность предлагаемых веществ (см. таблицу 1). Результаты исследований показали, что при внутрибрюшинном введении испытуемых веществ у всех животных наблюдалось развитие судорог. Так как теллурсодержащие вещества известны своей токсичностью для центральной нервной системы, то вероятно, что испытуемые вещества вызывают судороги центрального происхождения. Особенно быстро (в течение 1 мин после введения) развивались судороги при введении вещества 1, что свидетельствует о его быстром всасывании через брюшину. У этого же вещества были зафиксированы судороги самой большой продолжительности (судороги продолжались сутки).
Результаты исследования содержания сульфгидрильных групп плазмы крови лабораторных крыс при введении синтезированных производных 2-меркаптобензтеллуразола отражены в таблице 1.

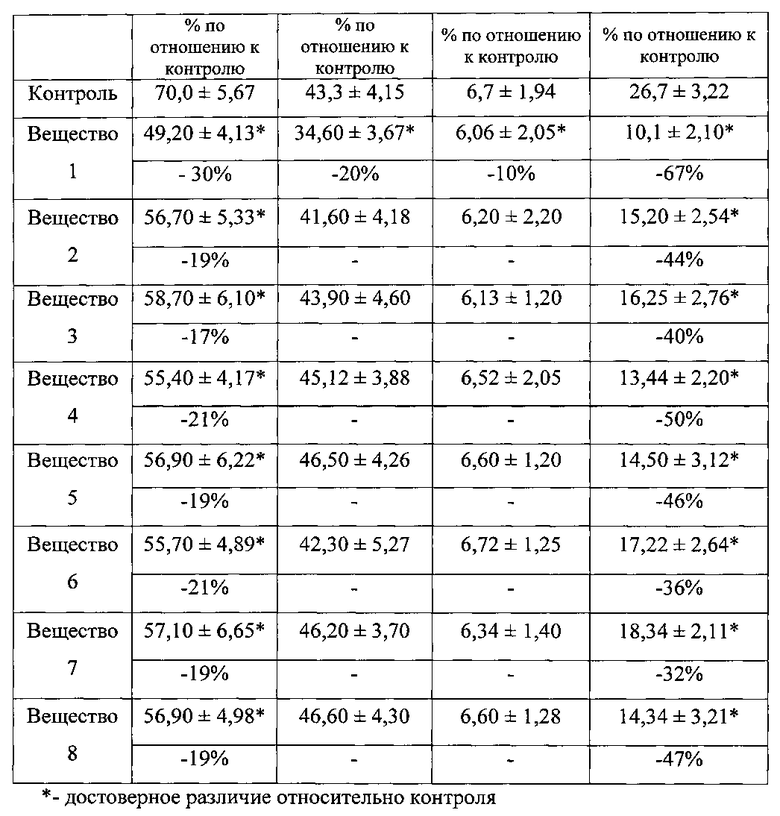
Как следует из таблицы 1, внутрибрюшинное введение испытуемых синтезированных производных 2-меркаптобензтеллуразола вызывает достоверное снижение общего содержания SH-групп и снижение скрытых SH-групп в плазме крови крыс на 62%.
Таким образом, синтезированные и испытанные производные 2-меркаптобензтеллуразола in vivo, возможно, изменяют конформацию белков за счет снижения содержания сульфгидрильных групп, а также вызывают судороги при внутрибрюшинном введении. Что касается возможности использования заявленной группы в здравоохранении, помимо проведенных испытаний, известен источник информации, подтверждающий биологическую активность соединений.
Так, в обзоре работ по токсикологии и фармакологии органических соединений теллура (Cristina W. Nogueira, GilsonZeni, and Joao B.T. Rocha Organoseleniumand Organotellurium Compounds: / Chem. Rev. 2004, 104, 6255-6285) приводятся сведения о нескольких возможных механизмах нейротоксичности теллурсодержащих органических соединений, подтверждаемых экспериментально. В частности, у теллурсодержащих органических соединений было выявлено мощное ингибиторное действие на скваленмонооксигеназу, что вызывает резкое снижение скорости биосинтеза холестерина и ведет к деградации миелина. Ингибиторное действие связано, по данным авторов, именно с воздействием изученных соединений теллура на сульфгидрильные группы фермента. Следовательно, при введении теллурсодержащих соединений может возникать временная демиелинизация периферических нервов, что приводит к параличу и дискоординации нервной системы. Такие нейропатии показаны для диметилтеллурида, диметилтеллуриядихлорида и триметилтеллура хлорида.
Также показана нейротоксичность теллурсодержащих органических соединений через нарушения в синаптическом транспорте глутаминовой кислоты, являющейся главнейшим нейромедиатором нервной системы. В частности, показана высокая ингибирующая способность дифенилдителлурида на глутаматергические синапсы у крыс, причем в данных исследованиях также выдвигается механизм, опосредованный воздействием на тиоловые группы.
Наконец, нейротоксические эффекты теллурсодержащих органических соединения вызывают ингибирование в синапсах тока Са2+, который непосредственно участвует в синаптической передаче.
Таким образом, полученные нами вещества воздействуют на нервную систему с помощью механизмов, показанных и для других соединений теллура, ингибируя сульфгидрильные группы ферментов, глутаматергические синапсы и транспорт Са2+.
По поводу применения соединений теллура можно сказать следующее.
Патентуемые теллурсодержащие органические соединения могут быть использованы потенциально как родентициды, инсектициды, фунгициды и бактерициды, так как сульфгидрильные группы, ингибируемые ими, имеются в каждом белке.
Таким образом, поставленная задача получения соединений, обладающих биологически активным действием, а также технический результат, заключающийся в разработке методов синтеза БАВ класса меркаптобензтеллуразолов, достигнуты. Лабораторные испытания подтвердили возможность промышленного применения полученных БАВ. Готовится пакет документов для внедрения технических испытаний не только в сельском хозяйстве, но и в медицине.
| название | год | авторы | номер документа |
|---|---|---|---|
| Синтез новых производных 2-меркаптобензтеллуразола, обладающих биологической активностью | 2017 |
|
RU2650516C1 |
| НОВЫЕ ЦИАНИНОВЫЕ КРАСИТЕЛИ НА ОСНОВЕ N-МЕТИЛ-2-МЕТИЛМЕРКАПТОБЕНЗТЕЛЛУРАЗОЛИЯ ИОДИДА, ОБЛАДАЮЩИЕ БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2677662C1 |
| ЦИННАМОИЛЬНЫЕ ПРОИЗВОДНЫЕ ОКСИМА ДИБЕНЗОФУРАНОНА, ОБЛАДАЮЩИЕ ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ | 2023 |
|
RU2810250C1 |
| Производные кумарина, тиокумарина и хинолинона, обладающие противосудорожной активностью | 2017 |
|
RU2720510C2 |
| Производные 4-фенилпирролидона, обладающие противосудорожной и ноотропной активностью, как средства лечения эпилепсии и пароксизмальных состояний | 2017 |
|
RU2748419C2 |
| ПРОИЗВОДНЫЕ АРИЛЦИКЛОАЛКИЛАМИНОВ, НЕЙРОПРОТЕКТОР (ВАРИАНТЫ), ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ СОЧЕТАННЫМ НЕЙРОПРОТЕКТОРНЫМ, АНАЛЬГЕТИЧЕСКИМ И АНТИДЕПРЕССИВНЫМ ДЕЙСТВИЕМ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ЕГО ОСНОВЕ | 2016 |
|
RU2637928C2 |
| 2-АРИЛ-1,3-ТИАЗОЛИДИН-4-КАРБОНОВЫЕ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2630775C2 |
| СПОСОБ ПОЛУЧЕНИЯ 4-ЗАМЕЩЕННЫХ ТИОМОРФОЛИНОВ | 2013 |
|
RU2551658C1 |
| N-ЗАМЕЩЕННЫЕ (1S,4aR,5S)-МЕТИЛ-5-[2-(2'-ОКСО-2',5'-ДИГИДРО-1Н-ПИРРОЛ-3'-ИЛ)ЭТИЛ]-1,4a-ДИМЕТИЛ-6-МЕТИЛЕНДЕКАГИДРОНАФТАЛИН-1-КАРБОКСИЛАТЫ, ОБЛАДАЮЩИЕ ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2385863C2 |
| 5-АМИНОЗАМЕЩЕННЫЕ ТИЕТАНСОДЕРЖАЩИЕ 3-БРОМ-4-НИТРОПИРАЗОЛЫ С АНТИДЕПРЕССИВНОЙ АКТИВНОСТЬЮ | 2022 |
|
RU2801039C1 |
Изобретение относится к области химии гетероциклических соединений, а именно к производным 2-меркаптобензтеллуразола, имеющим структурную формулу:
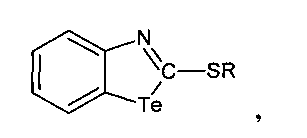
где R = СН2=СН-СН2-, HC≡С-СН2-, СН3-, 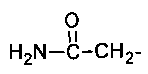 ,
, 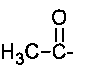 .
.
Также предложены способ получения производных 2-меркаптобензтеллуразола, способ получения 1,1-дибром-2-метилмеркаптобензтеллуразола и способ получения N-метил-2-метилмеркаптобензтеллуразолия иодида. Полученные соединения вызывают достоверное снижение общего содержания SH-групп и снижение скрытых SH-групп в плазме крови крыс на 62%, а также вызывают судороги при внутрибрюшинном введении. 5 н.п. ф-лы, 1 табл., 8 пр.
1. Производные 2-меркаптобензтеллуразола, имеющие структурную формулу:

где:
R = СН2=СН-СН2-, HC≡С-СН2-, СН3-, 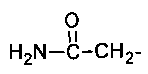 ,
, 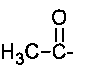 .
.
2. Способ получения производных 2-меркаптобензтеллуразола по п.1, обладающих биологической активностью, включающий взаимодействие 2-меркаптобензтеллуразолята натрия с соответствующими галогенидами при перемешивании от 1 до 5 часов.
3. 2-Метилмеркаптобензтеллуразол, имеющий структурную формулу:
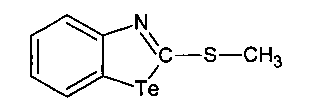 .
.
4. Способ получения соединения 1,1-дибром-2-метилмеркаптобензтеллуразола, включающий взаимодействие 2-метилмеркаптобензтеллуразола с бромом в четыреххлористом углероде при перемешивании в течение 30 мин.
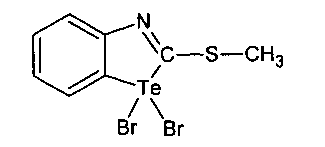
5. Способ получения соединения N-метил-2-метилмеркаптобензтеллуразолия иодида, включающий взаимодействие 2-метилмеркаптобензтеллуразола с йодистым метилом при нагревании в течение 6 часов в запаянной ампуле.
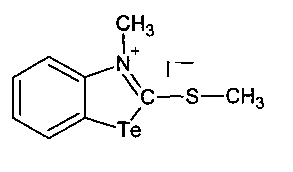
| 2-МЕРКАПТОБЕНЗТЕЛЛУРАЗОЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2546674C2 |
| САДЕКОВ И.Д | |||
| и др., Подходы к синтезу 2-замещенных бензотеллуразолов, Химия гетероциклических соединений, 1989, номер 1, с | |||
| Кровля из глиняных обожженных плит с арматурой из проволочной сетки | 1921 |
|
SU120A1 |
| САДЕКОВ И.Д | |||
| и др., Синтез бензотеллуразолов и их производных, Химия гетероциклических соединений, 1988, номер 2, с | |||
| СПОСОБ СОСТАВЛЕНИЯ ЗВУКОВОЙ ЗАПИСИ | 1921 |
|
SU276A1 |
Авторы
Даты
2016-11-20—Публикация
2015-09-02—Подача