Группа изобретений относится к медицине, в частности к кардиологии, и может быть использована для создания средства для снижения риска развития фатальной аритмии, в частности у пациентов с нестабильной стенокардией.
УРОВЕНЬ ТЕХНИКИ
В основе гибели клеток при ишемии или реперфузии лежат изменения энергетического обмена кардиомиоцитов. В частности, происходит снижение запасов аденозинтрифосфорной кислоты (АТФ), так как при ишемии происходит нарушение утилизации энергетических субстратов и снижение синтеза АТФ.
В связи с этим постоянно существует потребность в препарате, способном восстановить энергетический потенциал кардиомиоцитов при остром ишемическом или реперфузионном повреждении, однако многие исследования закончились неудачей [1].
Наиболее перспективным подходом считается попытка увеличить окисление в митохондриях клеток глюкозы, либо частично затормозить метаболизм длинноцепочечных жирных кислот (ДЦ-ЖК), которые для своего окисления требуют большие количества кислорода [2].
В частности, одним из таких подходов может быть восстановление содержания L-карнитина, содержание которого в кардиомиоцитах при ишемии резко снижается.
Следует сказать, что карнитин играет важную роль в энергетическом обмене кардиомиоцитов. Карнитин является ключевым компонентом «карнитинового челнока», ответственного за перенос ДЦ-ЖК внутрь митохондрий кардиомиоцитов. Работа карнитинового челнока сводится к следующему: под влиянием фермента карнитин-пальмитоил трансферазы-1 (КПТ-1), локализованного на наружной мембране митохондрии (MX), происходит перенос ДЦ-ацила с КоА на карнитин, в результате чего образуется эфир ДЦ-ацил-карнитин, который транспортируется специальным переносчиком - ацил-карнитин/карнитин транслоказой (АККТ) - через внутреннюю мембрану MX в обмен на карнитин, который находится в митохондриях. Стехиометрия такого обмена составляет 1:1. Внутри митохондрий ДД-ацильный остаток с помощью фермента КПТ-2 переносится с ДЦ-ацил-карнитина на КоА митохондрий. Образовавшийся ДЦ-ацил-КоА в дальнейшем подвергается β-окислению. Когда поступление ацил-КоА превосходит его использование в цикле β-окисления, ацил-КоА вновь превращается в ацилкарнитин, который удаляется из митохондрий в цитоплазму, а затем из клеток - в кровь. Этот процесс предупреждает накопление ацил-КоА в цитоплазме и тормозит развитие липотоксического эффекта. Вследствие снижения внутримитохондриального пула L-карнитина при повышенном удалении из клеток ДЦ-ацилкарнитинов может происходить ограничение активности матриксного фермента CrAT, который предпочтительно образует эфиры короткоцепочечных ЖК с L-карнитином. Особая роль CrAT в регуляции метаболизма в MX связана со снижением отношения ацетил-КоА/свободный КоА в результате переноса ацетильных остатков на карнитин и увеличением уровня свободного КоА (регенерация КоА), который используется пируватдегидрогеназой (ПДГ), а также ферментом цикла трикарбоновых кислот (цикла Кребса) - α-кетоглютаратдегидрогеназой [3, 4, 5, 6].
Следует отметить, что некоторые ферменты цикла Кребса, в частности α-кетоглютаратдегидрогеназа, используют большие количества свободного КоА, который образуется из ДЦ-ацил-КоА с участием L-карнитина. Дефицит последнего может тормозить синтез субстратов НАДН, ФАДН2, сукцината и тем самым снижать уровень образования АТФ. В то же время избыточное поступление ацетил-КоА увеличивает генерацию CO2, создавая условия для снижения внутриклеточного pHi и развития ацидоза. Перенос ацетильной группы с ацетил-КоА на карнитин приводит к образованию свободного КоА, который используется во множестве метаболических реакций, протекающих в кардиомиоцитах, включая цикл Кребса, синтез липидов и др. В связи с этим становится ясной важная роль L-карнитина в энергетическом обмене в физиологических условиях и его защитное действие при ишемии. Таким образом, очевидно, что адекватное содержание и обмен L-карнитина в организме имеет большое значение для синтеза АТФ и поддержания функциональной активности кардиомиоцитов [7, 8, 9].
Удаление избытка ацетил-КоА из MX в цитоплазму с помощью образования ацетил-карнитина приводит к увеличению синтеза физиологического ингибитора КПТ-1 - малонил-КоА, что тормозит транспорт и окисление ДЦ-ЖК в MX в условиях недостатка кислорода и частично переключает энергетический обмен на окисление метаболита глюкозы - пирувата. Помимо этого, при ишемии L-карнитин участвует в выведении ДЦ-ЖК и их недоокисленных продуктов из MX в цитоплазму, а затем - из клеток, что предупреждает эктопическое накопление липидов в сердце и развитие липоцитотоксического эффекта.
Один из подходов к улучшению энергетического обмена в кардиомиоцитах при ишемии основан на введении экзогенного L-карнитина, который ускоряет выведение из MX ацетил-КоА, способствует увеличению активности ПДГ и усиливает окисление пирувата. Кроме того, в цитоплазме из ацетил-КоА ферментативно образуется малонил-КоА, который блокирует активность КПТ-1, тормозит окисление ДЦ-ЖК и в еще большей степени усиливает окисление пирувата. Известно, что в период длительной ишемии уровень свободного и общего L-карнитина уменьшен в зоне ишемии и периишемической зоне [10, 11]. Rebuzzi AG и соавторами показано, что введение L-карнитина уменьшает распространенность инфаркта миокарда при введении в течение 8 часов после начала симптомов [12].
Доказательством того, что L-карнитин снижает объем пораженного миокарда при остром инфаркте миокарда, могут служить данные, полученные в нескольких клинических плацебо контролируемых рандомизированных двойных слепых исследованиях, где введение L-карнитина обеспечивало меньший уровень в крови маркеров повреждения миокарда. Так, в исследовании Singh R.B. и соавт. было показано, что в группе пациентов, получавших L-карнитин, в крови были достоверно более низкие уровни КФК (95,5±23,6 против 116,2±26,2 Ме/л на плацебо, р<0,01), ее MB фракции (58,6±16,6 против 73,3±21,5 Ме/л на плацебо, р<0,01), а также меньший индекс QRS на ЭКГ, определенный как сумма зубцов Q и R в отведениях V1-V6 (7,4±1,2 против 10,7±2,0, р<0,01). При этом в группе проходивших лечение L-карнитином отмечали меньшее число эпизодов ишемии (17,6% против 36,0%; ОШ составило -0,49 (0,98, 0,24)) и число пациентов с сердечной недостаточностью III/IV функционального класса по NYHA в сочетании с увеличением левого желудочка (23,4% против 36,0% пациентов; ОШ-0,56 (1,86, 0,17)) [13, 14].
В двойном слепом плацебо контролируемом исследовании CEDIM (The L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico, 472 пациента с первичным передним ИМ) L-карнитин или плацебо вводили в течение 5 дней внутривенно в суточной дозе 9 г и затем в течение 12 месяцев внутрь в суточной дозе 6 г. В группе, получавшей L-карнитин, наблюдалось достоверное снижение объемов сердца, начиная с третьего месяца терапии (конечно-систолический объем 55,0±1,63 мл против 58,9±1,75 мл, р=0,03 и конечно-диастолический - 99,3±2,06 мл против 105,4±2,37 мл, р=0,01). Значимых различий в величине ФВ к 12 месяцу лечения не наблюдалось (45,8±0,57% против 45,2±0,52%, р=0,46). В другом исследовании (160 пациентов после ИМ) показано, что прием L-карнитина в течение одного года по сравнению с плацебо приводил к большему улучшению систолического АД, функции левого желудочка и уменьшению частоты приступов стенокардии [13].
Показано, что в условиях ишемии L-карнитин предотвращает накопление эфиров жирных кислот, которое может приводить к возникновению фатальных желудочковых аритмий (ЖА). В нескольких работах проводилась оценка влияния L-карнитина у пациентов с острым инфарктом миокарда. Однако данные по снижению смертности пациентов с ИМ разноречивы, что может быть обусловлено различными протоколами введения карнитина. Так, в исследовании CEDIM различий в смертности получено не было, не было различий также в комбинированной точке - частота смертельных исходов + случаи развития сердечной недостаточности (6% против 9.6% в группе плацебо, н.д.) [14, 15]. В других исследованиях отмечено значительное уменьшение смертности (1,2 против 12,5%, р<0.005). Меньшим был комбинированный показатель «смерть по сердечным причинам+нефатальный инфаркт миокарда» (15,6% против 26% в группе плацебо). Положительный эффект возможно обусловлен протективным эффектом в отношении некроза сердца и осложнений в течение первых 28 дней [13, 16]. В рандомизированном двойном слепом плацебо контролируемом исследовании CEDIM 2 (2330 пациентов с острым передним ИМ) было получено значимое снижение ранней смертности после инфаркта миокарда - на 5 сутки острого периода снижение составило 39% (ОР=0.61, 95% ДИ 0.37-0.98, р=0.04). Отчасти снижение смертности в ранние сроки инфаркта миокарда (2-е сутки) может быть обусловлено снижением у большего числа пациентов желудочковых экстрасистол высоких градаций (IVa и IVb по Lown) при введении 5 г L-карнитина, чем у пациентов, получавших плацебо (р=0.028) [17, 18]. Близкие данные получены в параллельном двойном слепом плацебо контролируемом исследовании у 56 пациентов с ИМ, которым в течение 36 часов вводили L-карнитин в дозе 100 мг/кг каждые 12 часов в период от 5 до 12 часов от начала заболевания. В группе получавших L-карнитин эпизоды нарушений ритма уменьшались на 80% и достоверно снижалось время регистрации мультиформных или парных экстрасистол [19].
В нескольких исследованиях оценено влияние L-карнитина при операциях коронарной реваскуляризации. Так, среди пациентов, которым в течение 24 часов после проведения чрескожной транслюминальной коронарной ангиопластики (ЧТКА) по поводу инфаркта миокарда без подъема ST, вводили L-карнитин в дозе 5 г в день болюсом за 30 минут до ЧТКА и в последующие 3 дня по 10 г в день инфузионно, меньшим (Р<0,01) был максимальный уровень креатинфосфокиназы (МВ-КФК) через 12 и 24 часа после оперативного вмешательства, и тропонина I через 8 часов. Мультивариантный анализ показал, что терапия L-карнитином была независимым предиктором меньшего уровня МВ-КФК (r=0.596, Р<0.001) и тропонина-I (r=0.633, P<0.001). Внутривенное введение пропионил-L-карнитина до операций аортокоронарного шунтирования значительно улучшало раннее послеоперационное восстановление у больных сахарным диабетом, что проявлялось увеличением сердечного индекса и снижением давления в легочной артерии. При проведении экстракорпорального кровообращения во время аорто-коронарного шунтирования (АКШ) назначение L-карнитина предупреждало развитие ишемических изменений и сохраняло в пределах нормальных значений уровень лактата, пирувата, отношения сукцинат/фумарат, отражающих гликолитический клеточный метаболизм, в отличие от группы плацебо [20, 21, 22].
Весьма интересные и важные данные были получены у пациентов с кардиогенным шоком (27 человек). В открытом исследовании показано, что назначение L-карнитина в виде внутривенного болюсного введения 4 г с последующей инфузией 6 г в период шока обеспечило к 10 дню 77,8% выживаемость пациентов, что существенно превышает указываемые в литературе 25-30%. Важно, что препарат хорошо переносится, и при длительном приеме не было необходимости в его отмене из-за побочных эффектов [23].
Однако все проведенные к настоящему времени исследования касаются лечения пациентов с острым инфарктом миокарда, и нет исследований, подтверждающих успешное применение L-карнитина у пациентов с нестабильной стенокардией (НС).
В то же время ранее было показано, что другой метаболический цитопротектор - триметазидин может оказывать выраженное положительное действие у пациентов с нестабильной стенокардией. В исследовании была изучена и обоснована возможность применения триметазидина при НС. В рандомизированном плацебо-контролируемом исследовании у 50 пациентов с НС оценено влияние добавления триметазидина с модифицируемым высвобождением к стандартной терапии острого коронарного синдрома (ОКС) на динамику ангинозных приступов, суммарную депрессию сегмента ST и длительность QT. В течение 6 месяцев проводился контроль над клиническими событиями. В группе больных, лечившихся триметазидином, число приступов стенокардии в неделю было меньшим, чем в группе получавших стандартную терапию, соответственно, к 7 суткам лечения (2,7±1,06 против 7,1±0,95, р<0,05); к 30 суткам лечения (0,5±0,09 против 5,3±1,14, р<0,01); и через 6 месяцев от начала заболевания (0,7±0,12 против 2,0±0,14, р<0,01). Отмечено более быстрое достоверное уменьшение суммарной депрессии сегмента ST в грудных отведениях: через 2 часа - до 1,14±0,2 мм в группе пациентов, проходивших лечение триметазидином, и 2,60±0,3 мм в группе получавших стандартную терапию, а также на 3 сутки (1,11±0,2 мм против 2,09±0,3 мм), на 7 сутки (1,09±0,1 мм и 2,03±0,1 мм) и 30 сутки лечения (0,76±0,1 мм и до 1,95±0,1 мм, р<0,01). Длительность QT в группе пациентов, проходивших лечение триметазидином, снижалась быстрее, особенно у лиц с исходно удлиненным QT интервалом. Количество неблагоприятных сердечно-сосудистых исходов за 6 месяцев наблюдения (инфаркт миокарда, смерть, повторные госпитализации, операции реваскуляризации) также было достоверно меньшим в группе, принимавших триметазидин (8 случаев против 25 случаев, достоверность различий по методу Фишера - 0,0016). Было сделано заключение, что метаболический цитопротектор триметазидин оказывает выраженное противоишемическое действие у пациентов с нестабильной стенокардией и его включение в комплексную терапию больных целесообразно [24].
Однако существует и сложность в использовании триметазидина, обусловленная отсутствием лекарственной формы препарата для внутривенного введения, что задерживает начало действия препарата.
За ближайший аналог заявленного изобретения принят способ снижения риска развития фатальной аритмии, описанный в [24].
Как уже упоминалось выше, данный способ не обладает достаточной эффективностью, т.к. введение триметазидина по данному способу не может быть осуществлено внутривенно.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В связи с вышесказанным, целью настоящего изобретения является создание нового эффективного способа снижения риска развития фатальной аритмии, а также расширение области применения раствора L-карнитина для внутривенного и внутримышечного введения.
Техническим результатом настоящего изобретения является снижение риска развития фатальной аритмии за счет снижения оксидативного стресса в клетках MX у пациентов, страдающих острым коронарным синдромом, в частности нестабильной стенокардией или инфарктом миокарда.
Технический результат достигается за счет применения раствора L-карнитина для внутривенного и внутримышечного введения в качестве средства для снижения риска увеличения дисперсии QT у пациента.
Варианты осуществления настоящего изобретения относятся также к применению раствора L-карнитина для внутривенного и внутримышечного введения в качестве средства для снижения риска увеличения дисперсии QT у пациентов, страдающих нестабильной стенокардией, а также к способу снижения риска увеличения дисперсии QT у пациентов, в частности у пациентов, страдающих нестабильной стенокардией.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
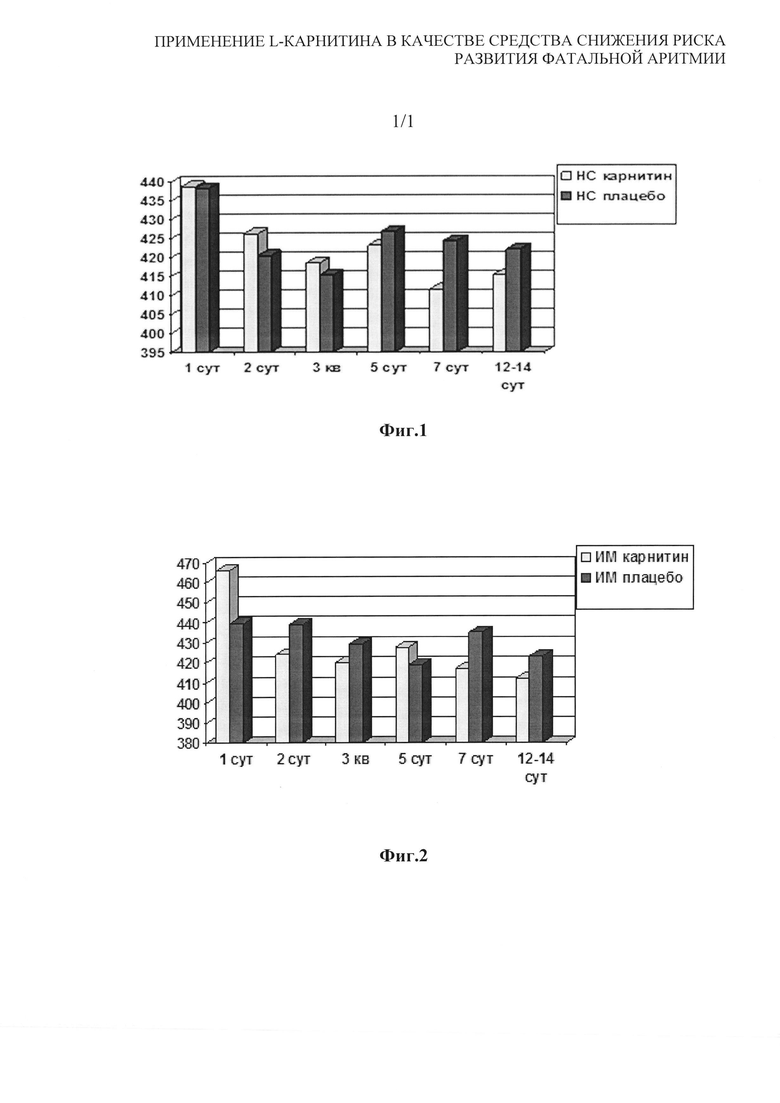
На фиг. 1 приведена диаграмма влияния L-карнитина у пациентов с нестабильной стенокардией.
На фиг. 2 приведена диаграмма влияния L-карнитина у пациентов с инфарктом миокарда.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Соответственно, основным аспектом осуществления настоящего изобретения является применение раствора L-карнитина для внутривенного и внутримышечного введения в качестве средства для снижения риска увеличения дисперсии QT у пациента.
Другим аспектом осуществления настоящего изобретения является применение раствора L-карнитина для внутривенного и внутримышечного введения в качестве средства для снижения риска увеличения дисперсии QT у пациентов, страдающих нестабильной стенокардией.
Другим аспектом настоящего изобретения является способ снижения риска увеличения дисперсии QT у пациента, заключающийся в том, что 4 ампулы раствора «Элькар» (2 г L-карнитина) для внутривенного и внутримышечного введения вводят пациенту внутривенно 2 раза в сутки в течение первых 3 суток с начала лечения, после чего дозу снижают вдвое и продолжают вводить упомянутый раствор пациенту внутривенно в течение 12 суток или до достижения благоприятного эффекта.
Другим аспектом настоящего изобретения является способ снижения риска увеличения дисперсии QT у пациента, страдающего нестабильной стенокардией, заключающийся в том, что 4 ампулы раствора «Элькар» (2 г L-карнитина) для внутривенного и внутримышечного введения вводят упомянутому пациенту 2 раза в сутки в течение первых 3 суток с начала лечения, после чего дозу снижают вдвое и продолжают вводить упомянутый раствор упомянутому пациенту внутривенно в течение 12 суток или до достижения благоприятного эффекта.
Другим аспектом настоящего изобретения является фармацевтическое средство для снижения риска увеличения дисперсии QT у пациента, содержащее L-карнитин, представляющее собой раствор для внутривенного и внутримышечного введения. Более конкретно упомянутое фармацевтическое средство предназначено для пациента, страдающего острым коронарным синдромом, в частности заболеванием, выбранным из группы: нестабильная стенокардия, острый инфаркт миокарда. Более конкретно упомянутое фармацевтическое средство представляет собой лекарственный препарат для медицинского применения «Элькар» (РУ № ЛСР-006143/10), содержащий L-карнитин в количестве 0,5 г на ампулу.
ДЕТАЛЬНОЕ РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Раствор «Элькар» для внутривенного и внутримышечного введения (далее по тексту - Элькар, карнитин) является известным из уровня техники препаратом и его состав далее, соответственно, не описывается [25].
Для проверки правильности и применимости настоящего технического решения была проведена научно-исследовательская работа, направленная на изучение новой специфической фармакологической активности L-карнитина (Элькара).
В соответствии со ст. 11 Федерального закона «Об обращении лекарственных средств», №61-Ф3, «Доклиническое исследование лекарственного средства для медицинского применения проводится путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства».
Для этих целей было проведено проспективное двойное слепое рандомизированное плацебо-контролируемое исследование в параллельных группах.
Для включения пациентов были использованы следующие критерии включения: пациенты с ОКС, не подвергавшиеся инвазивному коронарному вмешательству, старше 18 лет; наличие нестабильной стенокардии, в частности учащение или усиление типичных стенокардических болей, наличие депрессий ST, отсутствие повышения уровня тропонина; подписанное согласие пациента на проведение исследования; и не включения: боли или изменения на ЭКГ, возникшие в связи с повышением артериального давления (АД) (более 180 и 100 мм рт. ст.); кардиогенный шок; хронические заболевания печени и почек с выраженными нарушениями функции; наличие хронических интоксикаций (алкоголизм, наркомания); прием других препаратов метаболического действия.
Рандомизация пациентов на группу плацебо и группу активного лечения проводилась случайным образом с помощью таблицы простых чисел.
Элькар и плацебо назначались сразу после рандомизации пациента. Элькар назначался в следующей дозировке: в течение первых 3 суток по 2 г (по 4 ампулы) 2 раза в сутки (всего 8 ампул в сутки), с 4 суток по 15 сутки (или до достижения благоприятного эффекта, если он наступал раньше) по 2 г (по 4 ампулы) 1 раз в сутки. Продолжительность наблюдения - не менее 15 дней или до выписки из стационара.
Действие препарата оценивалось следующим образом. Анализировали параметры электрокардиограммы (ЭКГ) с помощью электрокардиографа и данных эхокардиографического исследования. ЭКГ регистрировали в покое в 12 общепринятых отведениях при скорости движения бумаги 25 мм/с в день поступления и затем на 2, 3, 5, 7 и 12-15 сутки госпитализации. Оценку противоишемического действия проводили по изменению величины суммарного отклонения ST во всех 12 отведениях ЭКГ. Степень депрессии оценивали на расстоянии 0,08 мс от точки J.
Интервал QT показывает время общей электрической активности желудочков, включая как деполяризацию, так и реполяризацию. Измерение интервала QT производили вручную от места перехода изоэлектрической линии сегмента P-Q (R) в зубец Q (R) до поздней точки зубца Т, которую определяли как окончание зубца Т в месте пересечения изоэлектрической линии Т-Р с касательной, проведенной по максимальному наклону нисходящей части волны Т. В отведениях, где присутствовала U волна, окончанием Т волны считалась низшая точка между двумя волнами U и Т. Измерение проводилось во II стандартном отведении. Интервал QT и предшествующий ему интервал RR измерялся не менее чем в трех последовательных циклах с расчетом средних значений. Для корректного измерения и клинической интерпретации интервала QT использовалась формула Базетта QTc = QT/√RR, где QTc - интервал QT корригированный, RR - время между соседними зубцами R на ЭКГ. Рассчитывали также дисперсию интервала QT (ΔQT), которую определяли как разницу между максимальной и минимальной длительностью QT интервала в каждом из 12 стандартных отведений поверхностной ЭКГ (ΔQT = QTmax - QTmin). Дисперсия интервала QT отражает региональную неоднородность реполяризации (то есть функционального восстановления) желудочков. Во многих работах показано повышение дисперсии реполяризации после острого инфаркта миокарда и обосновано важное прогностическое значение данного показателя как предиктора возникновения в постинфарктном периоде фатальных аритмий и внезапных сердечных смертей (ВСС) [26]. Повышенную дисперсию QT принято рассматривать как признак неблагоприятного прогноза у широкой категории людей (здоровых, больных с врожденными заболеваниями сердца, ишемической болезнью сердца, инфарктом миокарда и др.). Основанием для этого служат многочисленные исследования, свидетельствующие о том, что у пациентов, перенесших инфаркт миокарда, дисперсия QT выше, чем у лиц, не имевших в анамнезе инфаркта миокарда, и существенно выше у лиц, имеющих пароксизмы желудочковой тахикардии по сравнению с теми, у кого нарушений ритма сердца нет [27]. По мнению большинства исследователей дисперсия QT как маркер негомогенности реполяризации может быть использована для выявления групп высокого риска, в частности риска ВСС [28-30]. Известно, что дисперсия QT увеличивается при острой ишемии, вызванной физической нагрузкой или инфарктом миокарда [31, 32]. При этом так же известно, что дисперсия QT является чувствительным предиктором риска жизнеугрожающих аритмий у пациентов, перенесших инфаркт миокарда [33]. В крупных исследованиях, таких как The Strong Heart Study (1839 участников) и Роттердамское исследование (анализ более 5000 ЭКГ исследований у лиц старше 55 лет), подтверждена предсказательная значимость дисперсии QT в отношении смерти по любой причине и по причинам сердечно-сосудистых заболеваний. Аналогично и проведенный подгрупповой анализ исследования ValHeFT (Valsartan Heart Failure Trial) показал, что дисперсия QT более 70 мс ассоциируется со значимым повышением риска смерти [34-37]. Важно, что дисперсия QT служит предиктором не только краткосрочных, но и долгосрочных прогнозов у пациентов с инфарктом миокарда [38]. Причем дисперсия QT является истинным фактором риска, так как она не только увеличивается при ишемии миокарда, но, что особенно важно, устранение ишемии приводит к отчетливому уменьшению выраженности дисперсии QT. Это наблюдают при успешно проведенной тромболитической терапии и при хирургическом восстановлении коронарного кровотока (в частности, при стентировании) [39-42]. Важным моментом для дальнейшего прогноза является скорость уменьшения дисперсии QT при устранении ишемии. Так, если в ближайшие шесть часов уменьшение было маловыраженным, даже при восстановлении кровотока прогноз был неблагоприятным, при этом смертность была выше (14.6 vs 2.4%, р<0.001) [43].
В соответствии с критериями включения и не включения в исследование вошли 19 пациентов, клиническая характеристика которых приведена в таблице 1.
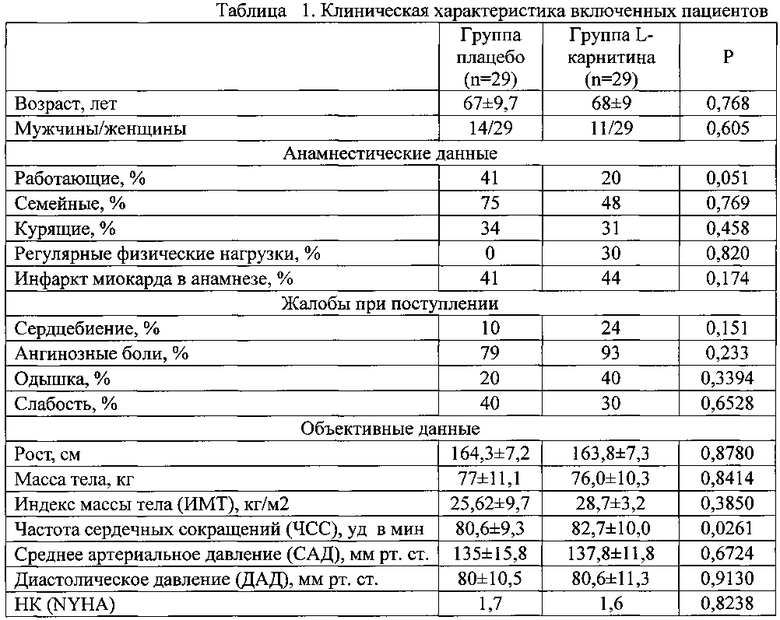
Как видно из приведенных данных, рандомизация была успешной и группы практически не отличались по своим антропометрическим, анамнестическим и клиническим характеристикам, кроме величины ЧСС.
Суммарная величина депрессий сегмента ST в день поступления была одинаково выраженной в обеих группах. Как видно из данных, представленных в таблице 1, в обеих группах больных отмечалось уменьшение значений QTc. Однако в группе получавших плацебо это снижение не было достоверным. В группе, получавших L-карнитин, уменьшение продолжительности QTc был достоверным с первого дня заболевания. При оценке выраженности уменьшения продолжительности QTc установлено, что в группе L-карнитина снижение было достоверно большим.
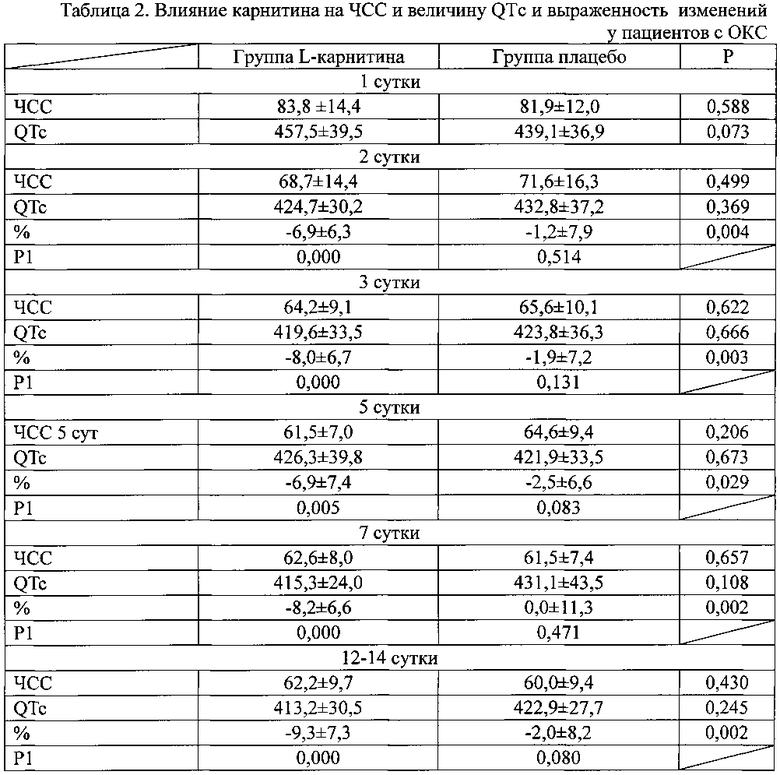
Примечание к таблице 2. Данные представлены в виде М±σ; Р - достоверность различий между группами леченных карнитином и плацебо; Р1 - достоверность различий показателей по сравнению с 1 днем заболевания.
Из проведенного анализа влияния L-карнитина на продолжительность интервала QTc в зависимости от варианта острого коронарного синдрома (таблица 3; фиг. 1, 2) видно, что продолжительность QTc снижалась и в группах с нестабильной стенокардией и в группах пациентов с инфарктом миокарда. Однако в группах с нестабильной стенокардией уменьшение QTc не носило достоверного характера. В группе пациентов с инфарктом миокарда лечение карнитином приводило к достоверному уменьшению длительности QTc начиная с первого дня заболевания и выраженность снижения достоверно отличалась от динамики QTc в группе плацебо.
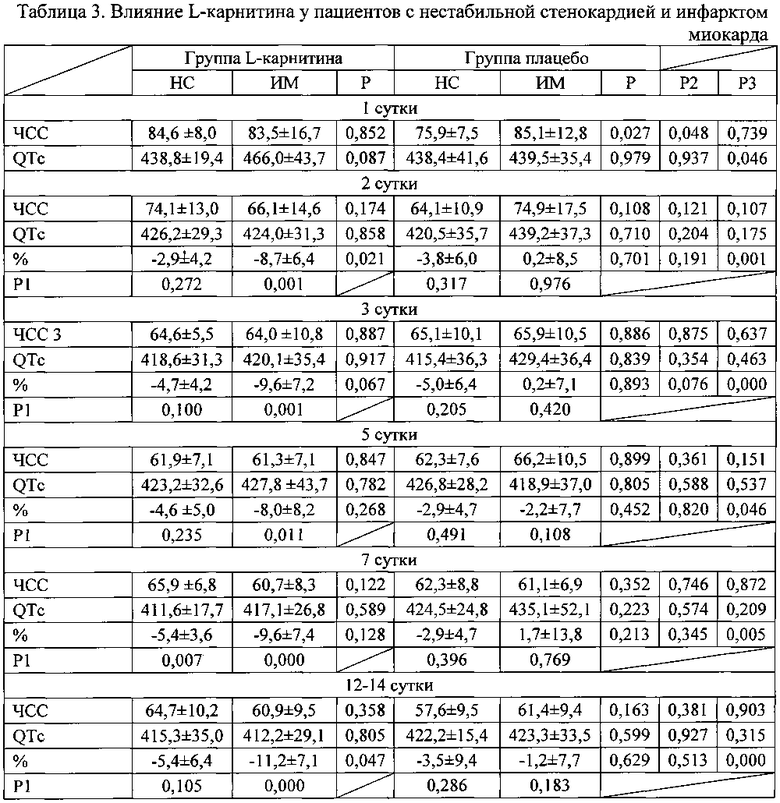
Примечание к таблице 3. Данные представлены в виде М±σ; НС - нестабильная стенокардия; ИМ - инфаркт миокарда; Р - достоверность различий между группами нестабильной стенокардии и инфарктом миокарда; Р1 - достоверность различий показателей по сравнению с 1 днем заболевания; Р2 - достоверность различий между группой пациентов с нестабильной стенокардией получавших плацебо и карнитин; Р3 - достоверность различий между группой пациентов с инфарктом миокарда.
При анализе выраженности изменений длительности интервала QTc в зависимости от его исходной величины (таблица 4) видно, что более выраженное уменьшение происходило в группах пациентов, исходно имевших длительность QTc более 440 мс. При этом в группе карнитина у лиц, имевших большую продолжительность интервала QTc, уменьшение наблюдалось с первого дня заболевания. В группе плацебо уменьшение QTc достигло достоверности лишь к 7 дню заболевания. В группе леченных L-карнитином при исходном QTc менее 440 мс также наблюдалось уменьшение его продолжительности к 7 дню заболевания. В группе плацебо у лиц с QTc менее 440 мс достоверных изменений не наблюдалось.
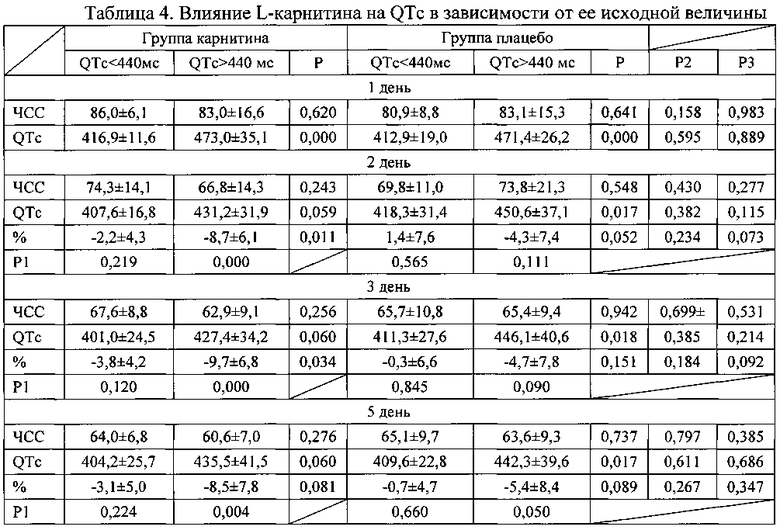
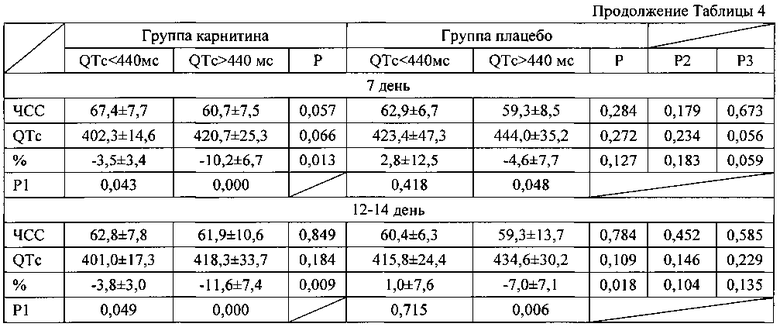
Примечание к таблице 4. Данные представлены в виде М±σ; Р - достоверность различий между группами нестабильной стенокардии и инфарктом миокарда; Р1 - достоверность различий показателей по сравнению с 1 днем заболевания; Р2 - достоверность различий между группой пациентов с нестабильной стенокардией, получавших плацебо и карнитин; Р3 - достоверность различий между группой пациентов с инфарктом миокарда.
При этом дисперсия QT снижалась в обеих группах (таблица 5). Однако в группе L-карнитина уменьшение ΔQTc отмечено с первого дня заболевания и выраженность снижения ΔQTc была более выраженной, чем в группе плацебо в течение всего периода наблюдения.
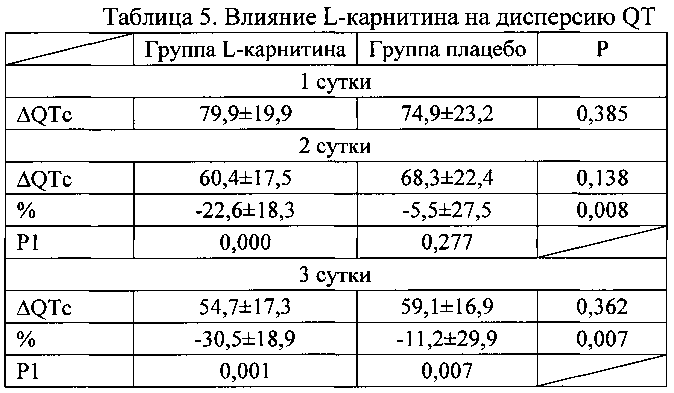
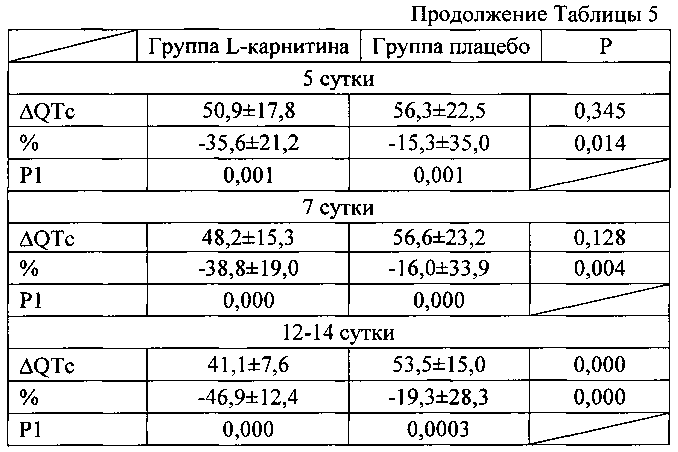
Примечание к таблице 5. Данные представлены в виде М±σ; Р - достоверность различий между группами леченных карнитином и плацебо; Р1 - достоверность различий показателей по сравнению с 1 днем заболевания.
При этом было выявлено, что дисперсия QT снижалась и в группах пациентов с нестабильной стенокардией и в группах с инфарктом миокарда (таблица 6). Более того в группе, получавших L-карнитин, при обоих вариантах острого коронарного синдрома снижение дисперсии QT носило достоверный характер с первого дня заболевания, а в группе, получавших плацебо, при нестабильной стенокардии изменения не носили достоверного характера, при инфаркте миокарда - достоверность отмечена к 7 суткам заболевания. Важно, что во всех временных точках абсолютное значение ΔQTc и степень ее снижения при инфаркте миокарда в группе, получавших L-карнитин, была достоверно более выраженной.
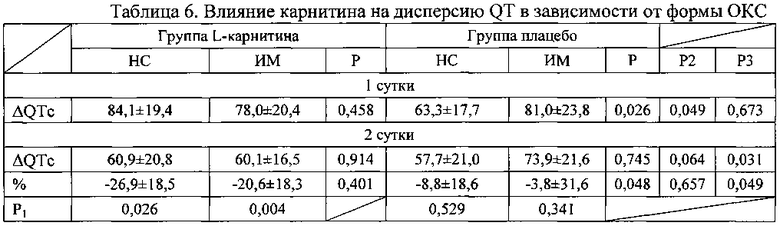
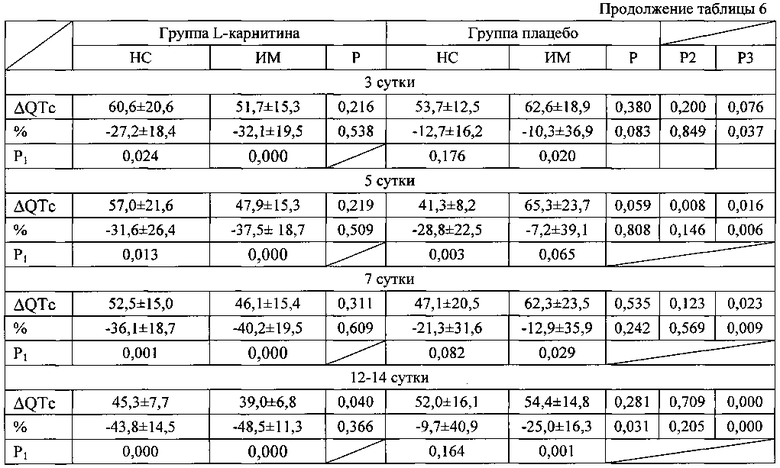
Примечание к таблице 6. Данные представлены в виде М±σ; НС - нестабильная стенокардия; ИМ - инфаркт миокарда; Р - достоверность различий между группами леченных карнитином и плацебо; Р1 - достоверность различий показателей по сравнению с 1 днем заболевания; Р2 - достоверность различий между группой пациентов с нестабильной стенокардией, получавших плацебо и карнитин; Р3 - достоверность различий между группой пациентов с инфарктом миокарда.
При анализе изменения дисперсии QT в зависимости от ее исходной величины установлено (таблица 7), что в группах пациентов с большой дисперсией QT ее снижение выражено в большей степени, чем у пациентов с дисперсией менее 80 мс. Это различие прослеживается наиболее отчетливо в группе плацебо начиная с 3 суток заболевания. В группе, получавших L-карнитин, выраженность снижения дисперсии QT в меньшей степени зависела от ее исходной величины. В группе, получавших L-карнитин, уменьшение дисперсии QT было более выраженным, чем в группе плацебо, особенно у пациентов с исходно большей дисперсией, и к 12-14 суткам наблюдения достигала значимых различий.
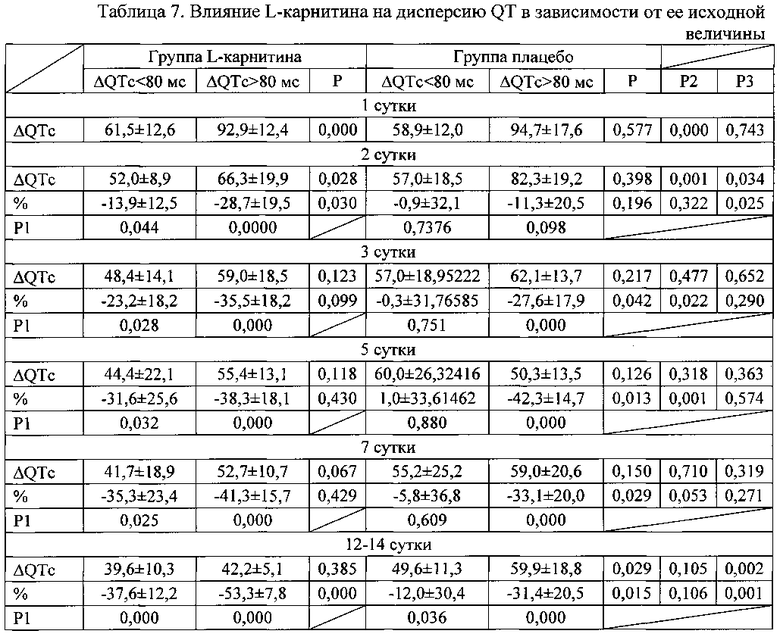
Примечание к таблице 7. Данные представлены в виде М±σ; Р - достоверность различий между группами нестабильной стенокардии и инфарктом миокарда; Р1 - достоверность различий показателей по сравнению с 1 днем заболевания; Р2 - достоверность различий между группой пациентов с нестабильной стенокардией, получавших плацебо и карнитин; Р3 - достоверность различий между группой пациентов с инфарктом миокарда.
Таким образом, лечение L-карнитином приводило к более выраженному и более раннему улучшению параметров электрической стабильности миокарда у пациентов с острым коронарным синдромом.
Наиболее выраженное влияние карнитин оказывал на больных, которых можно отнести к категории высокого риска.
Можно полагать, что положительное действие L-карнитина обусловлено его действием в качестве метаболического цитопротектора.
В основе гибели клеток при ишемии/реперфузии лежат изменения энергетического обмена кардимиоцитов. В частности, происходит снижение запасов АТФ, так как при ишемии происходит нарушение утилизации энергетических субстратов и снижение синтеза АТФ.
По результатам исследования авторами было показано, при нестабильной стенокардии в результате ишемии сердца нарушается доставка крови, энергетических субстратов (ДЦ-ЖК, глюкозы, лактата) и кислорода к кардиомиоцитам. Следствием этого является торможение синтеза АТФ, изменение взаиморегуляции потоков субстратов в митохондрии, разобщение гликолиза от окисления метаболита глюкозы - пирувата в MX, возникновение внутриклеточного ацидоза, нарушение ионного гомеостаза и сократительной активности сердца. В этих условиях в MX усиливается образование радикалов кислорода, формируется оксидативный стресс, который вместе с падением уровня АТФ, перегрузкой цитоплазмы кардиомиоцитов ионами Са2+, снижением pHi вызывает гибель кардиомиоцитов по механизму некроза или апоптоза. В кровь выделяются соединения (хемоатрактантны), по градиенту которых фагоциты (сперва нейтрофилы, затем моноциты) из крови поступают в пораженный участок, активируются и выделяют разнообразные высокоактивные агенты (катионные белки, протеолитические ферменты, провоспалительные цитокины), которые ответственны за создание условий, способствующих фагоцитозу поврежденных или разрушенных клеток. Важная роль среди таких агентов принадлежит радикалам кислорода, генерируемым в большом количестве в процессе «дыхательного взрыва», которые вместе с некоторыми соединениями (например, гипохлоритом натрия и хлораминовыми производными аминокислот) изменяют структуры белков и подавляют их ферментативную активность в миелопероксидазной реакции. Особо необходимо отметить, что радикалы кислорода, генерируемые фагоцитами крови, способны разрушать практически все виды макромолекул: белки, углеводы, РНК, ДНК, что требуется для санации пораженной области и активации процессов репарации. Однако при неадекватно большом образовании таких радикалов кислорода происходит не только разрушение погибших клеток, но и жизнеспособных клеток микроокружения, что увеличивает область поражения. Определить способность фагоцитов к адекватному или неадекватному ответу у конкретного пациента можно в опытах in vitro на образцах цельной крови при воздействии стандартных стимуляторов.
В проведенном авторами исследовании был использован такой подход для оценки силы ответной индивидуальной реакции фагоцитов пациентов с нестабильной стенокардией на воздействие стандартных агентов (определение нормы реакции) и возможности коррекции неадекватных ответов фагоцитов в образцах крови, связанных с отсутствием «транзиторности» ответа и чрезмерным образованием радикалов кислорода в условиях in vitro с помощью L-карнитина. Генерацию радикалов кислорода в образцах цельной крови определяли по хемилюминесценции люминофора - люцигенина (20 мкМ) на хемилюминометре «Биотокс-7» (Россия). В качестве стандартных стимуляторов использовали бактериальный трипептид - формил-метионил-лейцил-фенилаланин (fMLP) и форболовый эфир (форбол миристат ацетат - РМА), раствор Элькара в ампулах (Россия, ООО «ПИК-ФАРМА»). В качестве стандартных антиоксидантов использовали супероксид дисмутазу и тролакс. Периферическую кровь пациентов с нестабильной стенокардией забирали из локтевой вены, собирали в пластиковые пробирки, содержащие гепарин (30 МЕ/мл). К пробам крови (объемом 100 мкл) добавляли люцигенин (конечная концентрация 30 мкМ). Спонтанное и индуцированное стандартными стимуляторами образование радикалов кислорода регистрировали на хемилюминометре «Биотокс»-7. Измерения проводили при 25°C. Образование супероксид анионов  регистрировали в непрерывном режиме и выражали в количестве импульсов в секунду, а также оценивали по интегральным значениям хемилюминесценции (светосумма за 10 сек). В результате проведенных исследований было показано, что в крови пациентов с нестабильной стенокардией фагоциты предактивированы и L-карнитин дозозависимым образом подавлял ответ на стандартные стимуляторы. Ингибиторный эффект L-карнитина наблюдался также при неадекватном ответе фагоцитов крови на стандартные агенты. Таким образом, за счет снижения оксидативного стресса в клетках MX, L-карнитин может быть применен в качестве средства снижения риска увеличения дисперсии QT у пациента, в частности у пациента с нестабильной стенокардией.
регистрировали в непрерывном режиме и выражали в количестве импульсов в секунду, а также оценивали по интегральным значениям хемилюминесценции (светосумма за 10 сек). В результате проведенных исследований было показано, что в крови пациентов с нестабильной стенокардией фагоциты предактивированы и L-карнитин дозозависимым образом подавлял ответ на стандартные стимуляторы. Ингибиторный эффект L-карнитина наблюдался также при неадекватном ответе фагоцитов крови на стандартные агенты. Таким образом, за счет снижения оксидативного стресса в клетках MX, L-карнитин может быть применен в качестве средства снижения риска увеличения дисперсии QT у пациента, в частности у пациента с нестабильной стенокардией.
Предлагаемый способ снижения риска увеличения дисперсии QT у пациента может быть реализован, в частности, следующим образом.
При поступлении у пациента регистрируют электрокардиограмму и на фоне стандартной проводимой терапии дезагрегантами и статинами начинают терапию L-карнитином, который вводят внутривенно в течение первых 3 суток по 2 г (по 4 ампулы) 2 раза в сутки (всего 8 ампул в сутки), с 4 суток по 15 сутки (или до выписки, если она происходит раньше) - по 2 г (по 4 ампулы) 1 раз в сутки. Продолжительность терапии - не менее 15 дней или до выписки из стационара.
Список цитируемых источников
1. Dirksen М Т., Laarman G J., Simoons М L., Duncker D J.G.M. Reperfusion injury in humans: A review of clinical trials on reperfusion injury inhibitory strategies Cardiovascular Research 2007; 74 (): 343-355.
2. Кардиология и сердечно-сосудистая хирургия. Е.И. Асташкин, М.Г. Глезер, №2, том 6, 2012 год.
3. Noland R.C., Koves T.R., Seiler S.E., et al. Carnitine insufficiency caused by aging and overnutrition compromises mitochondrial performance and metabolic control. J.Biol.Chem. 2009; 284:34: 22840-22852. Sharma Sh, Black St.M. Carnitine homeostasis, mitochondrial function, and cardiovascular disease //DrugDiscov Today Dis Mech. 2009; 6:1-4: e31-e39.
4. Sharma Sh., Sud N., Wiseman D.A., et al. Altered carnitine homeostasis is associated with decreased mitochondrial function and altered nitric oxide signaling in lambs with pulmonary hypertension Am J Physiol Lung Cell MolPhysiol, 2008, 294: 1: L46-L56.
5. Indiveri C., Iacobazzi V., Tonazzi A. et al. The mitochondrial carnitine/acylcarnitine carrier: Function, structure and physiopathology. MolAspectsMed. 2011; 32 (4-6): 223-233.
6. Lee K., Kerner J., HoppelCh.L. Mitochondrial carnitine palmitoyltransferase 1a (CPT1a) is part of an outer membrane fatty acid transfer complex J Biol Chem. 2011; 286: 29: 25655-25662.
7. Dyck J.R., Lopaschuk G.D. Malonyl CoA control of fatty acid oxidation in the ischemic heart // J Mol Cell Cardiol., 2002; 34: 1099-1109.
8. Stanley W.C., Recchia F.A., Lopaschuk G.D. Myocardial subsrate metabolism in the normal and failing heart // Physiol Rev., 2005; 85: 1093-1129.
9. Folmes C.D., Lopaschuk G.D. Role of malonyl CoA in heart disease and the hypothalamic control of obesity // Cardiovasc Res., 2007; 73: 278-187.
10. Spagnoli LG, Corsi M, Villaschi S, Palmieri G, Maccari F. Myocardial carnitine deficiency in acute myocardial infarction. Lancet. 1982; 1: 8286: 1419-1420.
11. Shug Al, Thomsen Jh, Folts Jd, et al. Changes in tissue levels of carnitine and other metabolites during myocardial ischemia and anoxia. Arch BiochemBiophys l978; 187:1:25-33.
12. Rebuzzi AG, Schiavoni G, Amico CM, et al. Beneficial effect of L-carnitine in the reduction of necrotic area in acute myocardial infarction. Drugs ExpClinRes. 1984; 10: 219-223.
13. Singh RB, Niaz MA, Agarwal P, et al. A randomized, double-blind, placebo controlled trial of L-carnitine in suspected myocardial infarction. PostgradMedJ 1996; 72: 843: 45-50.
14. Chiariello M, Nrevetti G, Policicclio A, et al. L-Camitine in acute myocardial infarction. A multicentre randomized trial. In: Borum, ed. Clinical aspects of human carnitine deficiency, New York: Pergamon Press, 1986; p. 242-243.
15. Iliceto S, Scrutinio D, Bruzzi P, et al. Effect of L-carnitine administration on left ventricular remodeling after acute anterior myocardial infarction: the L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico (CEDIM) trial. J Am Coll Cardiol. 1995; 26 (2): 380-387.
16. Cave M.C., Hurt R.T., Frazier Т.Н., et al. Obesity, inflammation, and the potential application of pharmaconutrition Nutr. Clin. Pract, 2008; 23: 1: 16-34.
17. Tarantini G, Scrutinio D, Bruzzi P, et al. Metabolic treatment with L-carnitine in acute anterior ST segment elevation myocardial infarction. A randomized controlled trial. Cardiology. 2006; 106: 4: 215-223.
18. Martina B, Zuber M, Weiss P, et al. Anti-arrhythmia treatment using L-carnitine in acute myocardial infarct. Schweiz Med Wochenschr. 1992; 122: 37: 1352-1355.
19. Rizzon P, Biasco G, Di Biase M et al. High doses of L-carnitine in acute myocardial infarction: metabolic and antiarrhythmic effects. Eur Heart J. 1989; 10: 6: 502-508.
20. Xue YZ, Wang LX, Liu HZ, Qi XW, Wang XH, Ren HZ. L-carnitine as an adjunct therapy to percutaneous coronary intervention for non-ST elevation myocardial infarction. Cardiovasc Drugs Ther. 2007; 21: 6: 445-8.
21. Lango R, Smolenr ski RT, Rogowski J, et al. Propionyl-L-carnitine improves hemodynamics and metabolic markers of cardiac perfusion during coronary surgery in diabetic patients. Cardiovasc Drugs Ther. 2005; 19: 4: 267-275.
22. Corbucci GG, Menichetti A, Cogliatti A, et al. Metabolic aspects of acute tissue hypoxia during extracorporeal circulation and their modification induced by L-carnitine treatment. IntJClinPharmacolRes. 1992; 12: 3: 149-157.
23. Corbucci GG, Loche F. L-carnitine in cardiogenic shock therapy: pharmacodynamic aspects and clinical data. Int J Clin Pharmacol Res. 1993; 13: 2: 87-91.
24. Глезер М.Г., Васильев C.B. Антиангинальная и противоишемическая эффективность триметазидина с модифицируемым высвобождением у пациентов с нестабильной стенокардией. Кардиоваскулярная терапия и профилактика. 2009, том 8, №1, стр. 42-46.
25. Инструкция к препарату «Элькар» раствор для внутривенного и внутримышечного введения. ЛСР-002224/08 от 31.03.2008. Дата переоформления 18.12.2012 (ООО «ПИК-ФАРМА»).
26. Никитин Ю.П., Кузнецов А.А. Дисперсия интервала QT (обзор). - Кардиология, 1998, 5, 58-63.
27. Walter Т, Griessl G, Kluge Р, Neugebauer A. QT dispersion in surface ECG and QT dynamics in long-term ECG in patients with coronary heart disease in the chronic post-infarct stage with and without ventricular tachyarrhythmias-correlation with other risk parameters. Z Kardiol. 1997; 86 (3): 204-10.
28. Bluzaite I, Brazdzionyte J,  , Rickli H, Ammann P. QT dispersion and heart rate variability in sudden death risk stratification in patients with ischemic heart disease. Medicina (Kaunas). 2006; 42 (6): 450-4.
, Rickli H, Ammann P. QT dispersion and heart rate variability in sudden death risk stratification in patients with ischemic heart disease. Medicina (Kaunas). 2006; 42 (6): 450-4.
29. Zabel M, Klingenheben T, Franz MR, Hohnloser SH. Assessment of QT dispersion for prediction of mortality or arrhythmic events after myocardial infarction: results of a prospective, long-term follow-up study. Circulation 1998, 97: 2543-2550.
30. Day CP, McComb JM, Campbell RW. QT dispersion: an indication of arrhythmia risk in patients with long QT syndrome. Br Heart J. 1990, 63:342-344.
31. Roukema G, Singh JP, Meijs M, Carvalho C, Hart G. Effects of exercise-induced ischemia on QT interval dispersion. Am Heart J 1998; 135: 88-92.
32. Tomassoni G, Pisano E, Gardner L, Krucoff MW, Natale A. QT prolongation and dispersion in myocardial ischemia and infarction. J Electrocardiol 1998; 30S: 187-90.
33. Perkimki J, Koistinen MJ, Yli-Myry S, Huikuru H. Measurement of QT dispersion identifies patients at risk. J Am Coll Cardiol 1995; 26: 174-9.
34. Okin PM, Devereux RB, Howard BV, Fabsitz RR, Lee ET, Welty TK. Assessment of QT interval and QT dispersion for prediction of all-cause and cardiovascular mortality in American Indians. The Strong Heart Study. Circulation 2000; 101: 61-6.
35. De Bruyne MC, Hoes AW, Kors JA, Hofman A, van Bemmel JH, Grobbee DE. QTc dispersion predicts cardiac mortality in the elderly. The Rotterdam Study. Circulation 1998; 97: 467.
36. Senft MK. QT-Dispersion bei Patienten mit Herzinsuffizienz. Subgruppenanalyse der 313 deutschen Studienteilnehmer der ValHeFT-Studie. Thesis. Available form: URL: http://tumb1.biblio.tu-muenchen.de/pub/diss/me/2001/senf.pdf
37. Stierle U, Giannitsis E, Sheikhzadeh A,  ,
,  . Relation between QT dispersion and the extent of myocardial ischemia in patients with three-vessel coronary artery disease. Am J Cardiol 1998; 81: 564-8.
. Relation between QT dispersion and the extent of myocardial ischemia in patients with three-vessel coronary artery disease. Am J Cardiol 1998; 81: 564-8.
38. Spargias KS, Lindsay SJ, Kawar GI, Greenwood DC, Cowan JC, Ball SG, Hall AS. QT dispersion as a predictor of long-term mortality in patients with acute myocardial infarction and clinical evidence of heart failure. Eur Heart J. 1999; 20 (16): 1158-65.
39. Ornek E, Duran M, Ornek D,  , Murat S, Kurtul A,
, Murat S, Kurtul A,  ,
,  , Kahveci K, Doger C,
, Kahveci K, Doger C,  . The effect of thrombolytic therapy on QT dispersion in acute myocardial infarction and its role in the prediction of reperfusion arrhythmias. Niger J Clin Pract. 2014; 17(2): 183-7.
. The effect of thrombolytic therapy on QT dispersion in acute myocardial infarction and its role in the prediction of reperfusion arrhythmias. Niger J Clin Pract. 2014; 17(2): 183-7.
40. Moreno FL, Villanueva T, Karagounis LA, Anderson JL. Reduction in QT interval dispersion by successful thrombolytic therapy in acute myocardial infarction. TEAM-2 Study Investigators. Circulation. 1994; 90 (1): 94-100.
41. Ueda H, Hayashi T, Tsumura K, Kaitani K, Yoshimaru K, Nakayama Y, Yoshiyama M. QT dispersion and prognosis after coronary stent placement in acute myocardial infarction. Clin Cardiol. 2007; 30 (5):229-33.
42. Pan KL, Hsu JT, Chang ST, Chung CM, Chen MC. Prognostic value of QT dispersion change following primary percutaneous coronary intervention in acute ST elevation myocardial infarction. Int Heart J. 2011; 52 (4): 207-11.
43. Zimarino M1, Corazzini A, Tatasciore A, Marazia S, Torge G, Di Iorio C, De Caterina R. Defective recovery of QT dispersion predicts late cardiac mortality after percutaneous coronary intervention. Heart. 2011; 97 (6): 466-72.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2008 |
|
RU2391044C2 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ РЕПЕРФУЗИОНННОЙ ИШЕМИИ МИОКАРДА | 2024 |
|
RU2822815C1 |
| СПОСОБ РАННЕГО ПРОГНОЗИРОВАНИЯ ВОЗНИКНОВЕНИЯ В ПЕРИОДЕ ПОСТИНФАРКТНОГО КАРДИОСКЛЕРОЗА ЗЛОКАЧЕСТВЕННЫХ ЖЕЛУДОЧКОВЫХ НАРУШЕНИЙ РИТМА | 2004 |
|
RU2266042C2 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ТРОМБОЛИТИЧЕСКОЙ ТЕРАПИИ У ПАЦИЕНТОВ С ОСТРЫМ КОРОНАРНЫМ СИНДРОМОМ | 2007 |
|
RU2348351C1 |
| Способ выявления электрической нестабильности миокарда с использованием ЭКГ высокого разрешения с оценкой поздних потенциалов предсердий и желудочков у пациентов с минимальными клиническими проявлениями после электротравмы | 2021 |
|
RU2763669C1 |
| Средство, обладающее кардиопротекторной активностью | 2019 |
|
RU2791641C2 |
| СПОСОБ ДИАГНОСТИКИ ИШЕМИЧЕСКИХ ЖЕЛУДОЧКОВЫХ НАРУШЕНИЙ РИТМА У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА | 2004 |
|
RU2280402C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ СЕРДЕЧНО-СОСУДИСТЫХ ОСЛОЖНЕНИЙ ПОСЛЕ ПЕРЕНЕСЕННОГО ОСТРОГО ИНФАРКТА МИОКАРДА С ПОДЪЕМОМ СЕГМЕНТА ST У БОЛЬНЫХ С ТРЕВОЖНО-ДЕПРЕССИВНЫМИ РАССТРОЙСТВАМИ | 2015 |
|
RU2593791C1 |
| Лекарственное средство, фармацевтическая композиция, активный ингредиент фармацевтической композиции и способ лечения тревоги и депрессии у больных острым инфарктом миокарда | 2018 |
|
RU2702128C1 |
| Активный ингредиент фармацевтической композиции, применяемой для лечения тревоги и депрессии у больных острым инфарктом миокарда | 2019 |
|
RU2708233C1 |
Группа изобретений относится к медицине, в частности к кардиологии, и может быть использована для создания средства для снижения риска увеличения дисперсии QT у пациента. Для этого внутривенно вводят раствор L-карнитина. Группа изобретений позволяет снизить риск развития фатальной аритмии за счет снижения оксидативного стресса в клетках MX (митохондрий) у пациентов, страдающих острым коронарным синдромом, в частности нестабильной стенокардией или инфарктом миокарда. 3 н. и 7 з.п. ф-лы, 2 ил., 7 табл.
1. Применение раствора L-карнитина для внутривенного и внутримышечного введения в качестве средства для снижения риска увеличения дисперсии QT у пациента.
2. Применение по п. 1, отличающееся тем, что пациентом является пациент, страдающий острым коронарным синдромом.
3. Применение по п. 2, отличающееся тем, что пациентом является пациент, страдающий, по меньшей мере, одним заболеванием, выбранным из группы: нестабильная стенокардия, острый инфаркт миокарда.
4. Способ снижения риска увеличения дисперсии QT у пациента, заключающийся в том, что 2 г L-карнитина в виде раствора для внутривенного и внутримышечного введения вводят пациенту внутривенно 2 раза в сутки в течение первых 3 суток с начала лечения, после чего дозу снижают вдвое и продолжают вводить упомянутый раствор пациенту внутривенно в течение 12 суток или до достижения благоприятного эффекта.
5. Способ по п. 4, отличающийся тем, что пациентом является пациент, страдающий острым коронарным синдромом.
6. Способ по п. 5, отличающийся тем, что пациентом является пациент, страдающий, по меньшей мере, одним заболеванием, выбранным из группы: нестабильная стенокардия, острый инфаркт миокарда.
7. Фармацевтическое средство для снижения риска увеличения дисперсии QT у пациента, содержащее L-карнитин, представляющее собой раствор для внутривенного и внутримышечного введения.
8. Фармацевтическое средство по п. 7, отличающееся тем, что пациентом является пациент, страдающий острым коронарным синдромом.
9. Фармацевтическое средство по п. 8, отличающееся тем, что пациентом является пациент, страдающий, по меньшей мере, одним заболеванием, выбранным из группы: нестабильная стенокардия, острый инфаркт миокарда.
10. Фармацевтическое средство по любому из пп 7-9, отличающееся тем, что содержит L-карнитин в количестве 0,5 г на ампулу.
| ГЛЕЗЕР М.Г | |||
| и др | |||
| "Антиангинальная и противоишемическая эффектиность триметазидина с модифицируемым высвобождением у пациентов с нестабильной стенокардией"// Кардиоваскулярная терапия и профилактика, 2009, no 8, с.42-46 | |||
| СПОСОБ ЛЕЧЕНИЯ АРИТМИЧЕСКОГО СИНДРОМА ПРИ ПРОГРЕССИРУЮЩЕЙ СТЕНОКАРДИИ | 2004 |
|
RU2266130C1 |
| Устройство звуковой сигнализации об остановке газовой машины на сахарных заводах | 1928 |
|
SU15010A1 |
| CUBEDDU L.X | |||
| Iatrogenic QT Abnormalities and Fatal Arrhythmias: Mechanisms and Clinical Significance// Curr Cardiol Rev | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2016-11-20—Публикация
2014-11-25—Подача