Область техники, к которой относится изобретение
Изобретение относится к медицине, в частности к фармации, и касается фармацевтической композиции, содержащей в качестве действующего вещества - амид N-(6-фенилгексаноил)глицил-L-триптофана (ГБ-115) [Патент РФ 2227144 (приоритет от 15.11.2001 г.) на изобретение «Замещенные триптофан-содержащие дипептиды с холецистокининонегативной или холецистокининопозитивной активностью»], обладающий анксиолитической активностью. Технический результат изобретения заключается в повышении эффективности использования лекарственного средства ГБ-115.
Уровень техники
В ФГБНУ «НИИ фармакологии имени В.В. Закусова» на основе структуры эндогенного анксиогенного тетрапептида холецистокинина-4 (Trp-Met-Asp-Phe-NH2) с использованием топохимического принципа Шемякина-Овчинникова-Иванова сконструирован его ретропептидный аналог амид N-(6-фенилгексаноил)глицил-триптофана (ГБ-115). Амид N-(6-фенилгексаноил)глицил-L-триптофана - антагонист холецистокининовых (ХЦКО рецепторов - обладает свойствами анксиолитика с модулирующим влиянием на функциональную активность холецистокининовой системы [Гудашева Т.А., Кирьянова Е.П., Колик Л.Г., Константинопольский М.А., Середенин С.Б. // Биоорган, химия. 2007. Т. 33. №4. С. 413-420; Колик Л.Г., Жуков В.Н., Середенин С.Б. // Эксперим. и клин. фармакол. 2007. Т. 70. №4. С. 413-420; Kolik L.G., Gudasheva Т.А., Seredenin S.B. // Eur. Neuropsychopharmacol. 2011. V. 21 Suppl. 2. S 146-147].
При изучении анксиолитических свойства ГБ-115, дипептидного ретроаналога холецистокинина-4, в тестах «открытое поле» (ОП) и «приподнятый крестообразный лабиринт» (ПКЛ) на беспородных и инбредных мелких лабораторных животных с различным уровнем эмоциональности при пероральном введении показано, что анксиолитическое действие ГБ-115 проявлялось у беспородных мышей в дозах 0,1-0,5 мг/кг и у инбредных мышей линии BALB/c с «пассивным» фенотипом эмоционально-стрессовой реакции в дозах 0,1 и 5,0 мг/кг в тесте ОП. В тесте ПКЛ ГБ-115 увеличивал время заходов в открытые рукава лабиринта у беспородных крыс в интервале доз 0,5-0,7 мг/кг и у «высокотревожных» мышей BALB/c в дозе 0,1 мг/кг. Полученные результаты подтверждают зависимость эффекта ГБ-115 от фенотипа ответа на эмоциональный стресс и свидетельствуют о смещении диапазона анксиолитических доз препарата от 0,006-0,100 мг/кг при внутрибрюшинном введении до 0,100-5,000 мг/кг при пероральном использовании. [Колик Л.Г., Константинопольский М.А., Рыбина И.В. и др. // Бюллетень экспериментальной биологии и медицины. - 2013. - Т. 155, №2. - С. 163-166.]
Эффективность пептидного анксиолитика ГБ-115 в отношении патологической тревожности доказана как на генетических моделях (селективные и инбредные линии животных), так и с использованием фармакологических моделей, в частности, при моделировании тревоги, индуцированной отменой психоактивных веществ. По способности устранять анксиогенез, вызванный отменой этанола, амид N-(6-фенилгексаноил)глицил-L-триптофана не уступает диазепаму [Колик Л.Г. Автореферат диссер. д.б.н., Москва 2012]. При оценке поведения беспородных животных после отмены диазепама (4,0 мг/кг/день, в/б, 30 дней) отмечалось сокращение времени пребывания в открытых рукавах (в 3,5 раза) и уменьшения числа заходов в открытые рукава (в 3,7 раза). ГБ-115 в дозе 0,1 мг/кг через 48 ч после отмены диазепама при однократном системном введении купировал индуцированную отменой диазепама тревогу у беспородных крыс, увеличивая время пребывания в открытых рукавах (р<0,01) и число заходов (р<0,05) в открытые рукава. Моделирование повышенной тревожной реакции у крыс со сформированной бензодиазепиновой зависимостью и последующее введение ГБ-115 вызывают противоположные изменения в обмене дофамина в опытах ex vivo [Колик Л.Г., Кадников И.А., Жуков В.Н. и др. // Экспериментальная и клиническая фармакология. 2011. Т. 74, №10. С. 52-56]. Установлено, что амид N-(6-фенилгексаноил)глицил-L-триптофана не оказывает негативного влияния на показатели дыхания, деятельности сердца, кровообращение и артериальное давление. Доказано отсутствие аддиктивного потенциала в диапазоне эффективных доз [Колик Л.Г. Автореферат диссер. д.б.н., Москва 2012]. Результаты исследований при длительном введении амида N-(6-фенилгексаноил)глицил-L-триптофана показали, что анксиолитический эффект сохраняется при хроническом применении. Резкое прекращение длительного введения не приводит к развитию синдрома отмены или каким-либо изменениям поведения и состояния животных, что выгодно отличает амид N-(6-фенилгексаноил)глицил-L-триптофана от анксиолитиков бенздиазепинового ряда [Колик Л.Г., Гарибова Т.Л., Литвинова С.А. и др. // Вестник РАМН. 2011. №7. С. 37-42.]
При оценке безопасности препарата было установлено, что он относится к практически нетоксичным соединениям: LD50>6 г/кг для крыс при пероральном введении [А.В. Сорокина, С.В. Алексеева, Е.П. Немова, др, // Экспер. и клин, фармакол. 2010. Т. 73, №6. С. 29-32].
Несмотря на расширяющийся поиск альтернативного пути введения и методов лекарственной доставки оральный путь введения остается наиболее популярным. По подсчетам около 70% всех лекарственных форм (ЛФ) предназначены для перорального применения, так как данный способ введения является наиболее приемлемым и удобным для пациентов. Кроме того, это широко изученный и отработанный метод заводского производства, используемый для получения твердых ЛФ (ТЛФ) (таких как таблетки и капсулы). ТЛФ дешевы в производстве, у них оптимально соотношение цена - качество.
К преимуществам таблеток и капсул относятся: точное дозирование лекарственных веществ (ЛВ) в условиях массового производства; высокая производительность; корригирующая способность.
Наиболее распространены три технологические схемы получения таблеток: с применением влажного или сухого гранулирования и прямое прессование.
Гранулирование включает следующие технологические операции: перемешивание ЛВ с наполнителем; увлажнение смеси раствором связывающего вещества; влажное гранулирование; сушка; сухое гранулирование; перемешивание гранул с антифрикционными веществами; прессование или наполнение капсул. К технологическим операциям метода прямого прессования относятся: перемешивание ЛВ с наполнителями, антифрикционными (скользящими) веществами; прессование. Из вышесказанного следует, что прямое прессование является более экономичным процессом в сравнении с гранулированием, т.к. метод гранулирования требует осуществления дополнительных стадий, ведущих к увеличению энергозатрат.
Для обеспечения длительного срока годности предлагаемых композиций важно, чтобы гранулят, полученный влажным гранулированием, либо другим методом на водной основе, имел влажность, не превышающую 3%.
Процесс сушки осуществляется в лотковой сушилке или сушкой в псевдоожиженном слое, причем последняя предпочтительнее. Сушку обычно проводят при температуре на входе около 50°С и относительной влажности менее 50%.
Технологические процессы тесно связаны с выбором вспомогательных веществ (ВВ). Основной задачей ВВ является обеспечение определенных технологических функций при изготовлении ЛФ. В зависимости от назначения ВВ, используемые в производстве ТЛФ, подразделяются на следующие группы: наполнители, разрыхляющие вещества, связывающие вещества, антифрикционные вещества, оболочки и др.
ВВ в производстве ТЛФ предназначены для придания порошковой массе необходимых технологических свойств, обеспечивающих механическую прочность, точность дозирования, распадаемость, стабильность в процессе хранения и др. Наполнители используют для придания ТЛФ определенной массы при небольшой дозировке ЛВ. Для процесса прямого прессования наполнители должны обладать хорошей сыпучестью и прессуемостью. Для процесса гранулирования применяют связывающие вещества, обеспечивающие сцепление между частицами и прочность получаемых гранул. При неудовлетворительном показателе распадаемости ТЛФ применяют разрыхляющие вещества. Разрыхляющие вещества вводятся как до гранулирования, так и после стадии гранулирования. На заключительной стадии производства ТЛФ к смесям добавляют антифрикционное вещество, обеспечивающее текучесть порошковой смеси или гранулята и препятствующее прилипанию к пуансонам и стенкам матрицы.
Раскрытие изобретения
Фармацевтические композиции, выполненные в ТЛФ, содержат в качестве действующего вещества - амид N-(6-фенилгексаноил)глицил-L-триптофана в терапевтически эффективном количестве, а в качестве ВВ - фармацевтически приемлемые ВВ, пригодные для использования в ТЛФ.
Фармацевтические композиции, выполненные в ТЛФ, в качестве ВВ, обеспечивающего достаточную массу таблетки (наполнитель), содержат, по меньшей мере, одно вещество, выбранное из группы: целлюлоза и ее производные (микрокристаллическая целлюлоза, выпускаемая под наименованиями: Avicel (FMC, США), Tabulose (Blanver, Бразилия), Microcel (Blanver, Бразилия), Vivacel, Vivapur (JRS Pharma, Германия), Emcocel (JRS Pharma, Германия), Celocal (FMC, США), Prosolv (Penwest, США), MicroceLac (MEGGLE, Германия)); полиолы (лактоза и ее производные, выпускаемые под наименованиями: Tablettose (MEGGLE, Германия), FlowLac (MEGGLE, Германия), DuraLac (MEGGLE, Германия), Cellactose (MEGGLE, Германия), MicroceLac (MEGGLE, Германия), StarLac (Roquette, Франция), Pharmatose (DMV, Голландия), Ludipress (BASF, Германия); сахароза, выпускаемая под наименованиями CompriSugar (Sudzucker, Германия), Di-pac (American sugar, США); мальтоза, выпускаемая под наименованиями Advantose 100 (SPI Pharma, Франция); фруктоза, выпускаемая под наименованиями Advantose FS 95 (SPI Pharma, Франция); сорбит, выпускаемый под наименованиями Parteck SI (Merck Millipore, Германия); маннит, выпускаемый под наименованием Parteck М (Merck Millipore, Германия); поливинилпирролидон и его сополимеры, выпускаемые под наименованием Kollidon VA 64 (BASF, Германия); соли неорганических соединений (кальция карбонат, выпускаемый под наименованиями Formaxx (Merck Millipore, Германия); кальция фосфат, кальция дигидрофосфат, кальция гидрофосфат дигидрат, кальция сульфат дигидрат).
ВВ с сорбционной способностью: коллоидный кремний (аэросил, Syloid® (Grace, США)), алюмометасиликат магния (Neusilin®, Fuji, Япония).
В качестве связывающего вещества используется, по меньшей мере, одно, выбранное из группы: крахмальный клейстер, растворы: карбоксиметилцеллюлозы, оксиэтилцеллюлозы, оксипропилметилцеллюлозы; поливинилового спирта, поливинилпирролидона, выпускаемые под наименованиями Kollidon 25 (BASF, Германия), натрия альгината, метилцеллюлозы, гидроксипропилметилцеллюлозы.
В качестве растворителя для приготовления раствора связывающего вещества используется, по меньшей мере, одно, выбранное из группы: вода очищенная, спирт этиловый, хлороформ.
В случае необходимости добавляют разрыхляющие вещества. В качестве разрыхляющего вещества используется, по меньшей мере, одно, выбранное из группы: крахмал (пшеничный, картофельный, кукурузный); пектин, натрий карбоксиметилцеллюлоза; поливинилпирролидон, кроскармеллоза натрия, крахмал прежелатизированный (Starch 1500 (Colorcon, Великобритания), карбоксиметилированный - Explosol (Blanver, Бразилия)).
В качестве поверхностно-активного вещества (ПАВ) используется, по меньшей мере, одно, выбранное из группы: олеат натрия, лаурилсульфат натрия.
В качестве ВВ, предотвращающего налипание и обеспечивающего выталкивание из матрицы (антифрикционное вещество), используется, по меньшей мере, одно, выбранное из группы: стеариновая кислота и/или ее соли, коллоидный кремний (аэросил).
Фармацевтическая композиция выполнена в ТЛФ, в виде таблеток или капсул. Таблеточную или капсульную массу получают методом прямого прессования, влажного и сухого гранулирования, а также пеллетизацией.
Предложены следующие варианты изготовления ТЛФ на основе фармацевтической композиции амида N-(6-фенилгексаноил)глицил-L-триптофана.
Первый вариант способа изготовления ТЛФ заключается в том, что на первой стадии готовят тритурацию амида N-(6-фенилгексаноил)глицил-L-триптофана с синтетическим алюмометасиликатом магния путем смешения, затем добавляют наполнители (марки для прямого прессования). Порошковая смесь опудривается антифрикционным веществом и таблетируется, или помещается в твердую желатиновую капсулу (ТЖК).
Второй вариант способа изготовления ТЛФ заключается в том, что на первой стадии амид N-(6-фенилгексаноил)глицил-L-триптофана полностью растворяется в подходящем растворителе и далее сорбируется на твердый носитель (синтетический алюмометасиликат магния Neusilin US2 (Fuji, Япония)). Затем добавляют наполнители (марки для прямого прессования). Порошковая смесь опудривается антифрикционным веществом и таблетируется, или помещается в ТЖК.
В другом варианте осуществления способа изготовления ТЛФ на основе предлагаемой композиции, амид N-(6-фенилгексаноил)глицил-L-триптофана и ВВ (наполнители) гранулируют этанолом и/или раствором связывающего вещества (10%-ый раствор поливинилпирролидона), и полученные гранулы после этого сушат. Остальные ВВ, которые не использовали для включения в гранулы, затем смешивают с высушенными гранулами с получением в результате композиции, пригодной для капсулирования, таблетирования.
Еще один вариант способа изготовления ТЛФ заключается в том, что наполнители смешиваются, и порошковая смесь отправляется на стадию влажного гранулирования. В качестве связывающего раствора используют 10% спиртовой раствор поливинилпирролидона с растворенным в нем амидом N-(6-фенилгексаноил)глицил-L-триптофана. Гранулят сушится до практически полного удаления органического растворителя. Затем добавляется оставшаяся часть наполнителя. Последняя стадия - опудривание антифрикционным веществом и таблетирование, или помещение в ТЖК.
Последний вариант способа изготовления ТЛФ заключается в том, что смешиваются амид N-(6-фенилгексаноил)глицил-L-триптофана, наполнитель. В данном случае в качестве метода изготовления используется брикетирование (сухое гранулирование). Полученная порошковая смесь прессуется в брикеты, которые затем подвергаются размалыванию до частиц с определенным размером. Затем полученные после размола частицы опудриваются антифрикционным веществом и прессуются в таблетки или помещаются в ТЖК.
Из предлагаемых композиций изготавливаются ТЛФ известными методами с обеспечением унифицированных доз амида N-(6-фенилгексаноил)глицил-L-триптофана для перорального приема, например, 0,0005 г, 0,0010 г, 0,0050 г, 0,0100 г, 0,0150 г, 0,0200 г в виде ТЖК и таблеток.
Осуществление изобретения
Фармацевтические композиции выполнены в ТЛФ, в виде таблетки или ТЖК, содержащей 0,50-1,50 мас.% амида N-(6-фенилгексаноил)глицил-L-триптофана. Масса полученной лекарственной формы составляет приблизительно 0,1000 г.
Вариантом осуществления композиции ТЛФ является таблетка или ТЖК, содержащая амид N-(6-фенилгексаноил)глицил-L-триптофана в эффективном количестве и фармацевтически приемлемые вспомогательные вещества, пригодные для использования в твердых лекарственных формах, при следующем соотношении компонентов (мас.%):
и по меньшей мере одно вещество из следующих групп вспомогательных веществ: вещества с сорбционной способностью в количестве 1,00-10,00 мас.%, связывающие - 1,50-10,00 мас.%, поверхностно-активные вещества в количестве 0,50-1,00 мас.%, разрыхляющие - 3,00-5,00 мас.%.
Фармацевтическая композиция согласно ОФС 42-0003-04 должна высвобождать в раствор не менее 75% амида N-(6-фенилгексаноил)глицил-L-триптофана за 45 минут.
ТЛФ отвечает всем требованиям Государственной Фармакопеи РФ XII издания и СССР XI издания.
Следующие примеры иллюстрируют варианты фармацевтической композиции.
Пример 1. Предварительно отвешенные и просеянные амид N-(6-фенилгексаноил)глицил-L-триптофана (1,00 мас.%) и вещество с сорбционной способностью (алюмометасиликат магния, 10,00 мас.%) тщательно перемешивают, добавляют наполнитель (лудипресс, 75,00 мас.%), повторно перемешивают. Гранулируют раствором связывающего вещества (крахмальный клейстер, 10,00 мас.%). Гранулят высушивают при температуре 40°С до постоянной влажности, не превышающей 3%. Затем полученная порошковая смесь поступает на стадию опудривания 1,00 мас.% антифрикционным веществом (магния стеарат), разрыхляющим веществом (поливинилпирролидон, 3,00 мас.%) и таблетируется, либо смесью заполняют ТЖК. Масса таблетки составляет 0,10 г. Получают таблетки по технологии прямого прессования или ТЖК с содержанием амида N-(6-фенилгексаноил)глицил-L-триптофана 0,001 г.
Пример 2. Все ингредиенты просеиваются. Соотношения всех ингредиентов взяты из примера 1. Амид N-фенилгексаноил)глицил-L-триптофана растворяют в подходящем растворителе (спирт этиловый с предварительно растворенным в нем связывающим веществом (оксипропилметилцеллюлозой)), смешивают с веществом с сорбционной способностью (алюмометасиликат магния) до получения однородной смеси. Добавляют наполнитель (лактоза), повторно перемешивают. Затем полученная порошковая смесь поступает на стадию опудривания антифрикционным веществом (магния стеарат) и разрыхляющим веществом (поливинилпирролидон) и таблетируется, либо смесью заполняют ТЖК. Масса таблетки составляет 0,10 г. Получают таблетки по технологии прямого прессования или ТЖК с содержанием амида N-(6-фенилгексаноил)глицил-L-триптофана 0,001 г.
Пример 3. Все ингредиенты отвешивают и просеивают. Амид N-(6-фенилгексаноил)глицил-L-триптофана (1,00 мас.%), связывающее (поливинилпирролидон, 10,00 мас.%) - часть добавляют в сухом виде, оставшуюся часть вводят в виде связывающего раствора, и наполнитель (мальтоза, 85,00 мас.%) тщательно перемешивают. Полученную порошковую смесь просеивают для достижения однородности смешивания и подвергают влажному гранулированию. В качестве связывающего раствора выступает 10% спиртовой раствор поливинилпирролидона. Гранулят высушивают при температуре 40°С до постоянной влажности, не превышающей 3%. Затем гранулят поступает на стадию опудривания антифрикционным веществом (магния стеарат, 1% масс.) и разрыхляющим веществом (пектин, 3,00 мас.%) и таблетируется, либо помещается в ТЖК. Масса таблетки составляет 0,10 г.
Пример 4. Все ингредиенты отвешивают и просеивают.Соотношения всех ингредиентов взяты из примера 3. В качестве связывающего раствора используют 10% раствор карбоксиметилцеллюлозы с растворенным в нем амидом N-(6-фенилгексаноил)глицил-L-триптофана. Наполнитель (маннит) увлажняют связывающим раствором с амидом N-(6-фенилгексаноил)глицил-L-триптофана, полученную порошковую смесь подвергают влажному гранулированию. Гранулят высушивают при температуре 40°С до постоянной влажности, не превышающей 3%. Затем гранулят поступает на стадию опудривания антифрикционным веществом (стеариновая кислота), разрыхляющим веществом (кроскармеллоза натрия) и таблетируется, либо помещается в ТЖК. Масса таблетки составляет 0,10 г.
Пример 5. Все ингредиенты отвешивают и просеивают. Соотношения всех ингредиентов взяты из примера 3. В качестве связывающего раствора используют водный раствор оксипропилметилцеллюлозы. Смесь сорбита, фруктозы и микрокристаллической целлюлозы (наполнители), и амид N-(6-фенилгексаноил)глицил-L-триптофана увлажняют связывающим раствором, полученную порошковую смесь подвергают влажному гранулированию. Гранулят высушивают при температуре 40°С до постоянной влажности, не превышающей 3%. Затем гранулят поступает на стадию опудривания антифрикционным веществом (магния стеарат), разрыхляющим веществом (крахмал прежелатизированный) и таблетируется, либо помещается в ТЖК. Масса таблетки составляет 0,10 г.
Пример 6. Все ингредиенты отвешивают и просеивают. Амид N-(6-фенилгексаноил)глицил-L-триптофана (1,00 мас.%), наполнитель (кальция фосфат, 88,00 мас.%), разрыхляющее (крахмал пшеничный 3,75 мас.%) тщательно перемешивают. В качестве связывающего раствора используют водный раствор поливинилпирролидона (5,25 мас.%) и лаурилсульфата натрия (ПАВ, 1% масс.). Полученную смесь сухих компонентов увлажняют водным раствором поливинилпирролидона и лаурилсульфата натрия, полученную порошковую смесь подвергают влажному гранулированию. Гранулят высушивают при температуре 40°С до постоянной влажности, не превышающей 3%. Затем гранулят поступает на стадию опудривания антифрикционным веществом (магния стеарат, 1% масс.) и таблетируется, либо помещается в ТЖК. Масса таблетки составляет 0,10 г.
Пример 7. Все ингредиенты отвешивают и просеивают. Амид N-(6-фенилгексаноил)глицил-L-триптофана (0,5 мас.%), наполнитель (кальция карбонат 86,5 мас.%) тщательно перемешивают. В качестве связывающего раствора используют натрия альгинат (10,00 мас.%), полученную порошковую смесь подвергают влажному гранулированию. Добавляют ПАВ (олеат натрия, 1,00 мас.%), вещество с сорбционной способностью (коллоидный кремний, 1,00 мас.%). Гранулят высушивают при температуре 40°С до постоянной влажности, не превышающей 3%. Затем гранулят поступает на стадию опудривания антифрикционным веществом (стеариновая кислота, 1,00 мас.%) и таблетируется, либо помещается в ТЖК. Масса таблетки составляет 0,10 г.
Пример 8. Все ингредиенты отвешивают и просеивают. Амид N-(6-фенилгексаноил)глицил-L-триптофана (1,00 мас.%), наполнитель (смесь лактозы и микрокристаллической целлюлозы) 96,00 мас.% тщательно перемешивают. В качестве связывающего используют гидроксипропилметилцеллюлозу (1,5 мас.%), полученную порошковую смесь подвергают влажному гранулированию. Гранулят высушивают при температуре 40°С до постоянной влажности, не превышающей 3%. Затем гранулят поступает на стадию опудривания антифрикционным веществом (кальция стеарат, 1,5 мас.%) и таблетируется, либо помещается в ТЖК. Масса таблетки составляет 0,10 г.
Пример 9. Все ингредиенты отвешивают и просеивают. Амид N-(6-фенилгексаноил)глицил-L-триптофана (1,50 мас.%), наполнитель (микрокристаллическая целлюлоза, 70,50 мас.%), вещество с сорбционной способностью (коллоидный кремний, 10,00 мас.%), разрыхляющее (крахмал кукурузный, 5,00 мас.%) тщательно перемешивают. Полученную порошковую смесь подвергают влажному гранулированию раствором оксиэтилцеллюлозы (10,00 мас.%). Гранулят высушивают при температуре 40°С до постоянной влажности, не превышающей 3%. Затем гранулят поступает на стадию опудривания антифрикционным веществом (магния стеарат, 3,00 мас.%) и таблетируется, либо помещается в ТЖК. Масса таблетки составляет 0,10 г.
Пример 10. Все ингредиенты отвешивают и просеивают. Амид N-(6-фенилгексаноил)глицил-L-триптофана (1,00 мас.%), наполнитель (лактоза 73,00 мас.%), вещество с сорбционной способностью (коллоидный кремний, 10,00 мас.%), разрыхляющее (крахмал картофельный, 5,00 мас.%) тщательно перемешивают. Полученную порошковую смесь подвергают влажному гранулированию раствором метилцеллюлозы (10,00 мас.%). Гранулят высушивают при температуре 40°С до постоянной влажности, не превышающей 3%. Затем гранулят поступает на стадию опудривания антифрикционным веществом (аэросил, 1,00 мас.%) и таблетируется, либо помещается в ТЖК. Масса таблетки составляет 0,10 г.
Пример 11. Все ингредиенты просеиваются. Смешиваются: амид N-(6-фенилгексаноил)глицил-L-триптофана 1,00 мас.% и вещество с сорбционной способностью (алюмометасиликат магния, 10,00 мас.%). Порошковая смесь просеивается, проверяется однородность дозирования смеси. Следующая стадия - брикетирование (сухое гранулирование). Брикеты размалываются. На данной стадии контролируется размер частиц, их диаметр после размола 50-400 мкм, что совпадает с размером частиц лудипресса. Частицы после размола смешиваются с наполнителем (лудипресс) 88,00 мас.%, тем самым достигается максимальная однородность смешивания. Затем таблеточная масса поступает на стадию опудривания 1,00 мас.% антифрикционного вещества (стеариновая кислота) и таблетируется, либо помещается в ТЖК. Масса таблетки составляет 0,10 г.
Пример 12. Предварительно отвешенные и просеянные амид N-(6-фенилгексаноил)глицил-L-триптофана (1,00 мас.%) и вещество с сорбционной способностью (алюмометасиликат магния, 10,00 мас.%) тщательно перемешивают, добавляют наполнитель (сахароза, 75,00 мас.%), повторно перемешивают. Гранулируют раствором связывающего вещества (поливиниловый спирт, 10,00 мас.%). Гранулят высушивают при температуре 40°С до постоянной влажности, не превышающей 3%. Затем полученная порошковая смесь поступает на стадию опудривания 1,00 мас.% антифрикционным веществом (магния стеарат), разрыхляющим веществом (крахмал карбоксиметилированный, 3,00 мас.%) и таблетируется, либо смесью заполняют ТЖК. Масса таблетки составляет 0,10 г. Получают таблетки по технологии прямого прессования или ТЖК с содержанием амида N-(6-фенилгексаноил)глицил-L-триптофана 0,001 г.
Пример 13. Все ингредиенты отвешивают и просеивают. Амид N-(6-фенилгексаноил)глицил-L-триптофана (1,00 мас.%), наполнитель (кальция фосфат, 81,50 мас.%), разрыхляющее (натрий карбоксиметилцеллюлоза, 4,75 мас.%), вещество с сорбционной способностью (Neusilin US2, 6%) тщательно перемешивают. В качестве связывающего раствора используют водный раствор поливинилпирролидона (5,25 мас.%) и лаурилсульфата натрия (ПАВ, 0,5% масс.). Полученную смесь сухих компонентов увлажняют водным раствором поливинилпирролидона и лаурилсульфата натрия, полученную порошковую смесь подвергают влажному гранулированию. Гранулят высушивают при температуре 40°С до постоянной влажности, не превышающей 3%. Затем гранулят поступает на стадию опудривания антифрикционным веществом (магния стеарат, 1% масс.) и таблетируется, либо помещается в ТЖК. Масса таблетки составляет 0,10 г.
Пример 14. Все ингредиенты просеиваются. Амид N-(6-фенилгексаноил)глицил-L-триптофана 1,00 мас.% растворяют в подходящем растворителе (спирт этиловый), смешивают с веществом с сорбционной способностью (алюмометасиликатом магния (Neusilin US2)) 10,00 мас.% до получения однородной смеси. Добавляют наполнитель (лудипресс) 88,00 мас.%, повторно перемешивают. Затем полученная порошковая смесь поступает на стадию опудривания 1,00 мас.% антифрикционного вещества (магния стеарат) и таблетируется, либо смесью заполняют ТЖК. Масса таблетки составляет 0,10 г. Получают таблетки по технологии прямого прессования или ТЖК с содержанием амида N-(6-фенилгексаноил)глицил-L-триптофана 0,001 г.
Согласно Биофармацевтической классификационной системе (Biopharmaceutical Classification System, 1995 г. ), подразделяющей все лекарственные вещества в зависимости от их растворимости и проницаемости в кишечнике, ГБ-115 относится ко II классу веществ, характеризующихся низкой растворимостью и высокой степенью проницаемости. Лекарственные вещества II класса являются классическими объектами для теста "Растворение", поскольку именно для них наибольшее значение имеют такие факторы, как размер частиц субстанции, ее кристаллическое состояние, вид и свойства лекарственной формы [Великая Е.В. и др. Хим.-фарм. журнал. 2004 №5. С. 38-41.]. Корреляция испытаний invivo I invitro с наибольшей вероятностью может быть обнаружена для веществ II класса [Конюшкова А.Н. и др. Обзор требований к исследованиям биоэквивалентности дженериковых лекарственных средств. Требования FDA. Ремедиум. 2011. №5. С. 54-56]. Для всех предлагаемых вариантов выполнения фармацевтической композиции ГБ-115, раскрытых в примерах, был осуществлен тест «Растворение» (согласно ОФС 42-0003-04.), что позволяет экстраполировать значения высвобождения in vitro на эксперименты in vivo и обосновывает достаточность приводимых в описании изобретения сведений для подтверждения фармакокинетических и фармакодинамических свойств заявляемой композиции (Раменская, Г.В. In vivo in vitro корреляция (ivivc): современный инструмент для оценки поведения лекарственных форм в условиях in vivo / invitro Г.В. Раменская, Шохин И.Е., Давыдова К.С., Савченко А.Ю.// Медицинский альманах. - №1. - 2011. - С. 222-226).
В таблице 1 «Значения степени высвобождения ГБ-115 из полученных фармацевтических композиций (%)» представлены результаты теста «Растворение» вариантов фармацевтической композиции на основе амид N-(6-фенилгексаноил)глицил-L-триптофана, изготовленной согласно примерам 1-14.
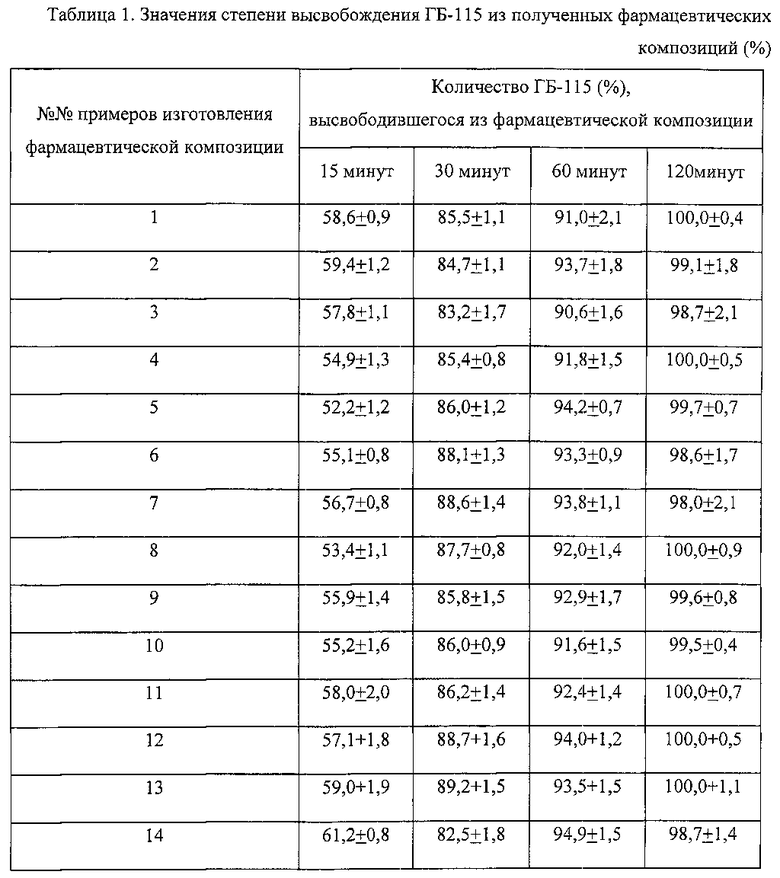
Близкие внутриинтервальные показатели высвобождения ГБ-115 из фармацевтических композиций позволяют сделать вывод о возможности установления для данного лекарственного средства корреляции in vivo-in vitro и о близости значений фармакокинетических/фармакодинамических показателей для композиций по всем приведенным примерам (Таблица 1).
Пример 15. Изучение фармакодинамических свойств субстанции амида N-(6-фенилгексаноил)глицил-L-триптофана и фармацевтической композиции амида N-(6-фенилгексаноил)глицил-L-триптофана при пероральном введении в опытах in vivo
Эксперименты были выполнены на 140 беспородных белых крысах-самцах массой 220-260 г. Животных содержали в условиях вивария ФГБНУ «НИИ фармакологии имени В.В. Закусова» (температура воздуха 21-23°С, относительная влажность воздуха 40-60%) при естественной освещенности на стандартной диете лабораторных животных в соответствии с ГОСТ Р 50258-92 (1994 г. ) с соблюдением правил лабораторной практики при проведении доклинических исследований в РФ, регламентированных ГОСТ Р 51000.3-96 и ГОСТ Р 51000.4-96 (1996 г. ), приказом Минздравсоцразвития РФ от 23.08.2010 N 708н «Об утверждении Правил лабораторной практики и с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1986 г. ).
Оценку анксиолитической активности субстанции и фармацевтической композиции амида N-(6-фенилгексаноил)глицил-L-триптофана, изготовленной по примеру 8, их влияние на выраженность тревоги у контрольных и опытных крыс проводили, используя тест «приподнятый крестообразный лабиринт» в базовой модификации [File S.E. // Behav. Brain Res. 1993. V. 58, №1-2. Р. 199-202; Pellow S., Chopin P., File S.E., Briley M. // J. Neyrosci. Methods, 1985. V. 4. №3. Р. 149-167].
Данный тест рассматривается как наиболее специфический для выявления анксиолитической активности биологически активных соединений. Процедура тестирования в «приподнятом крестообразном лабиринте» выполнялась в течение 5 минут. Регистрировали следующие показатели - число заходов в открытые рукава лабиринта и время пребывания в них.
Водные растворы исследуемой субстанции амида N-(6-фенилгексаноил)глицил-L-триптофана и ее фармацевтической композиции готовили ex tempore с добавлением твин-80. Полученные растворы вводили животным перорально (внутрижелудочно) в объеме 1 мл/1 кг массы тела. В качестве контроля вводили равные объемы растворителя для субстанции (дистиллированная вода + твин 80) или водный раствор плацебо + твин 80 при изучении фармацевтической композиции.
Данные экспериментов обрабатывали статистически, используя непараметрический критерий "Mann-Whitney-U-test" для оценки различий между независимыми группами и описательную статистику для оценки средних значений и различий внутри групп, уровни статистической значимости обозначены как * - Р<0,05 при оценке различий между данными контрольной и опытной групп; # - Р<0,05; ## - Р<0,01 при оценке различий между данными, полученными в опытных группах через 15 и 45 мин; каждый столбец диаграммы отражает усредненные данные по 10-20 животным.
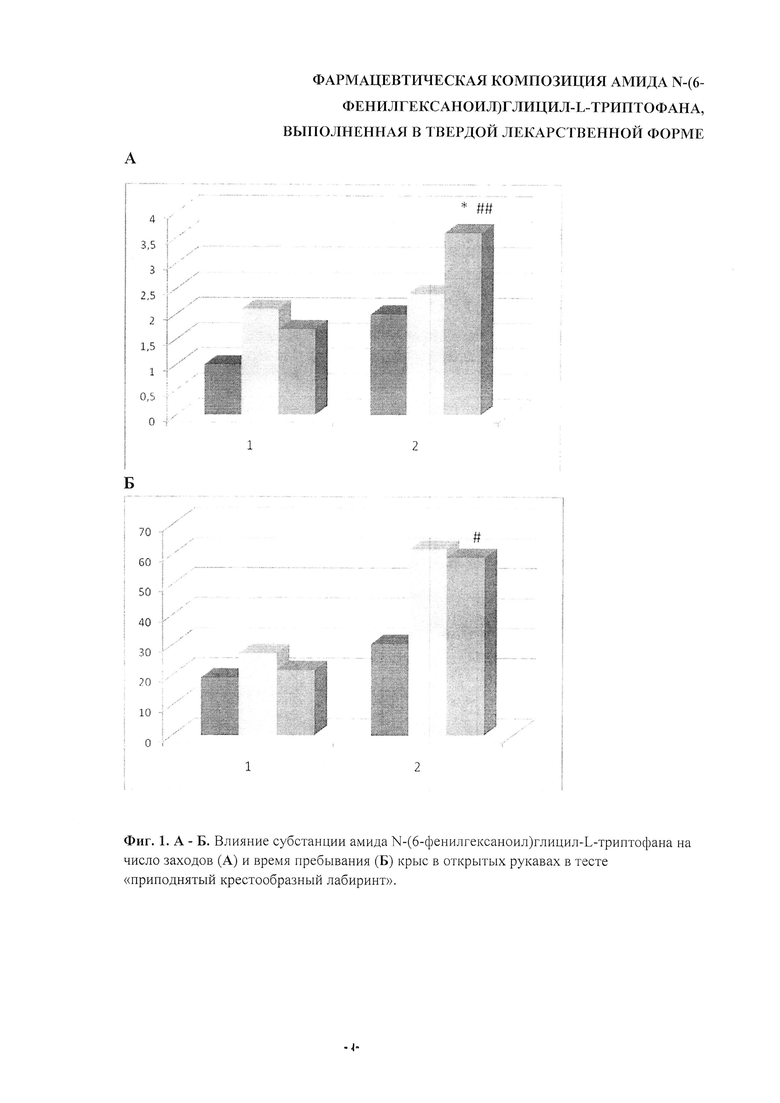
Полученные результаты представлены на фиг. 1А, Б и 2А, Б. Как следует из диаграмм, субстанция амида N-(6-фенилгексаноил)глицил-L-триптофана демонстрирует высокий уровень анксиолитической активности в дозе 0,7 мг/кг: через 45 минут после введения число заходов в открытые рукава возрастало с 2,0 в контрольной группе до 3,6 в опытной, т.е. на 80% (Р<0,05); время пребывания увеличивалось на 94% (Р=0,08) (фиг. 1А, Б). Активность субстанции статистически значимо выросла к 45 мин наблюдения в дозе 0,7 мг/кг. При этом число заходов в открытые рукава увеличилось с 1,7 (15-я мин) до 3,6 (45 мин), т.е. на 112% (Р<0,01), одновременно, время пребывания в открытых рукавах лабиринта выросло на 172,8% (Р<0,05).
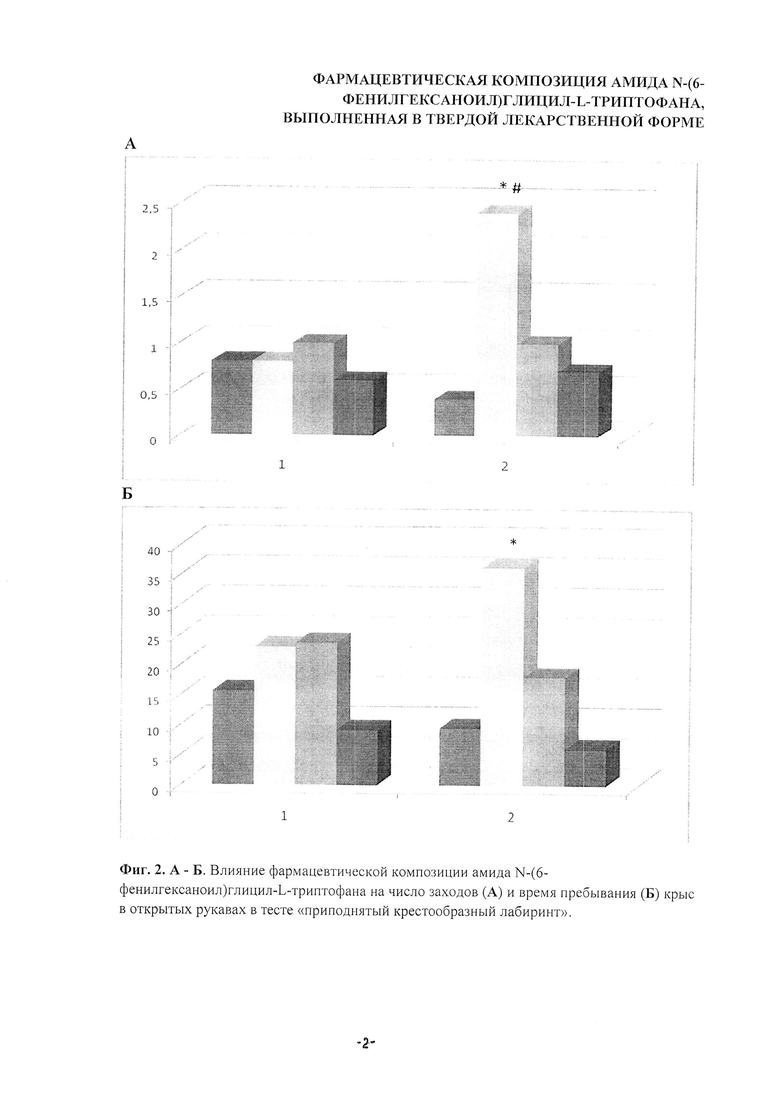
Фармацевтическая композиция амида N-(6-фенилгексаноил)глицил-L-триптофана, в меньшей дозе, 0,3 мг/кг значительно повышала показатели, соответствующие анксиолитической активности: число заходов в открытые рукава возрастало с 0,4 в контроле до 2,4 в опытной группе, т.е. на 500%; время пребывания в открытых рукавах с 9,5 сек в контроле до 36,2 сек в опытной группе, т.е. на 281%, Р<0,05 (фиг. 2А, Б). Фармацевтическая композиция показала существенное усиление активности при оценке ее фармакодинамической характеристики. Во временном интервале с 15-й по 45 мин число заходов в открытые рукава возрастало с 0,8 до 2,4, т.е. на 200% (Р<0,05, фиг. 2А).
Полученные результаты позволяют заключить, что изученная фармацевтическая композиция амида N-(6-фенилгексаноил)глицил-L-триптофана демонстрирует выраженную анксиолитическую активность по специфическим показателям - числу заходов в открытые рукава приподнятого крестообразного лабиринта и времени пребывания в них. Фармацевтическая композиция амида N-(6-фенилгексаноил)глицил-L-триптофана показала специфическую и более выраженную в сравнении с субстанцией эффективность по анксиолитическому действию. Эффект фармацевтической композиции в дозе 0,3 мг/кг был статистически значим через 45 минут после перорального введения животным. В то же время активность субстанции отмечали только в более высокой дозе 0,7 мг/кг, время пребывания в открытых рукавах лабиринта на 45-й минуте не отличалось от контрольных значений.
Таким образом, на основании выполненных фармакологических исследований в опытах in vivo, анализа зависимостей «доза-эффект» и «время-эффект» можно сделать заключение, что предлагаемая фармацевтическая композиция обеспечивает повышение биодоступности амида N-(6-фенилгексаноил)глицил-L-триптофана и эффективность его использования по сравнению с исходной субстанцией за счет снижения действующей анксиолитической дозы амида N-(6-фенилгексаноил)глицил-L-триптофана.
Пример 16. Фармакокинетический эксперимент на крысах после перорального введения фармацевтической композиции амида N-(6-фенилгексаноил)глицил-L-триптофана
Эксперименты проведены на белых беспородных крысах-самцах массой 250±30 г, полученных из питомника «Столбовая» РАН. Животных содержали по 10 особей в клетке на стандартной диете вивария вивария ФГБНУ «НИИ фармакологии имени В.В. Закусова». Фармацевтическую композицию (по примеру 14) и субстанцию вводили в водном растворе в дозе 100,00 мг/кг. Эксперименты ставились приблизительно в один и тот же промежуток светового дня. Животных декапитировали через определенные промежутки времени: 5, 10, 15, 30, 45, 60, 90 минут после введения дипептида и собирали кровь в гепаринизированные пробирки. Плазму получали центрифугированием при 8000 об/мин в течение 10 мин.
Экстракцию проводили следующим способом: к 1,00 мл плазмы крови крыс, содержащей амид N-(6-фенилгексаноил)глицил-L-триптофана, добавляли двукратный объем ацетонитрила (2,00 мл) для осаждения белков. Водно-ацетонитрильный раствор центрифугировали при температуре - 2°С со скоростью 8000 об/мин в течение 10 минут. Далее отбирали очищенную от белков плазму, добавляли 5,00 мл эфира, встряхивали в течение 15 минут, отделяли эфирный слой и высушивали в токе азота досуха, остаток растворяли в элюенте и вводили в систему высокоэффективной жидкостной хроматографии - ультрафиолетовой спектрофотометрии (ВЭЖХ-УФ). Система представляла собой жидкостной хроматограф, состоящий из изократической помпы SYSTEM COLD 127 (США), ультрафиолетового детектора и компьютера с соответствующим пакетом программ для обсчета хроматограмм "Амперсенд" (Россия). Хроматографическое разделение проводили на аналитической колонке - Luna 5u С 18 (2) 100А, 250×4,6 мм, детектирование проводили при длине волны 282 нм, что позволило избежать влияния коэкстрактивных веществ, которые бы мешали определению амида N-(6-фенилгексаноил)глицил-L-триптофана. В качестве элюента использовали систему: ацетонитрил: вода в соотношении 400:450 по объему с добавлением трифторуксусной кислоты до рН 3,2. Скорость потока подвижной фазы составляла 1,00 мл/мин.
Количественное определение проводили методом абсолютной калибровки. Калибровочный график был линеен в интервале концентраций 50,00-1000,00 нг/мл. Коэффициент корреляции составил 0,99965. Полученные результаты обработаны статистически согласно "Statistica 7". Основные фармакокинетические параметры рассчитывали модельно-независимым методом статистических моментов. Относительная биодоступность была рассчитана по формуле: AUC (площадь под кривой «концентрация-время») (per os ЛФ × доза субстанции)/AUC(per os субстанция × доза ЛФ) × 100%.
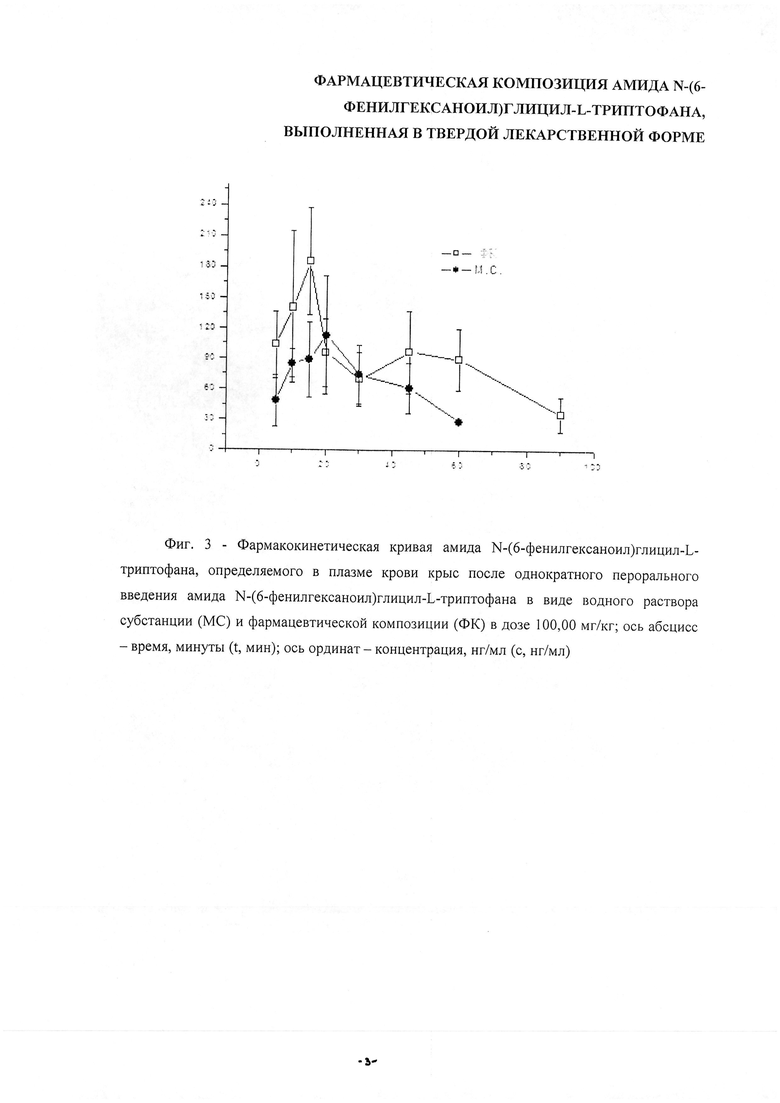
На фиг. 3 представлены фармакокинетические кривые для амида N-(6-фенилгексаноил)глицил-L-триптофана, определяемого в плазме крови крыс после однократного перорального введения амида N-(6-фенилгексаноил)глицил-L-триптофана в виде водного раствора субстанции (МС) и фармацевтической композиции в дозе 100,00 мг/кг.
Амид N-(6-фенилгексаноил)глицил-L-триптофана быстро всасывается в желудочно-кишечный тракт, поступает в системный кровоток и определяется в плазме крови крыс уже через 5 минут после введения как самой субстанции, так и фармацевтической композиции, содержащей амид N-(6-фенилгексаноил)глицил-L-триптофана. Однако на стадии абсорбции отмечаются значительные различия в динамике изменения концентраций для фармацевтической композиции и субстанции, а также в их количественном содержании.
Фармацевтическая композиция отличается резким подъемом концентрации: уже через 5 минут после введения она составляет 103,41 нг/мл и достигает максимума через 15 минут - 185,10 нг/мл. В последующие интервалы времени концентрация амида N-(6-фенилгексаноил)глицил-L-триптофана постепенно снижалась на протяжении 1,5 часа и в конечный период времени составила - 35,61 нг/мл. Значительные различия в кинетике амида N-(6-фенилгексаноил)глицил-L-триптофана для субстанции и фармацевтической композиции наблюдались и на стадии его элиминации из плазмы крови крыс.
В случае фармацевтической композиции концентрация амида N-(6-фенилгексаноил)глицил-L-триптофана в плазме крови крыс снижалась медленно и через 60 минут определялась в достаточно высоком количестве; при увеличении длительности исследования содержание амида N-(6-фенилгексаноил)глицил-L-триптофана удалось определить через 90 минут после его введения.
На основании полученных экспериментальных данных рассчитаны основные фармакокинетические параметры амида N-(6-фенилгексаноил)глицил-L-триптофана модельно-независимым методом, которые представлены в сводной таблице 2.
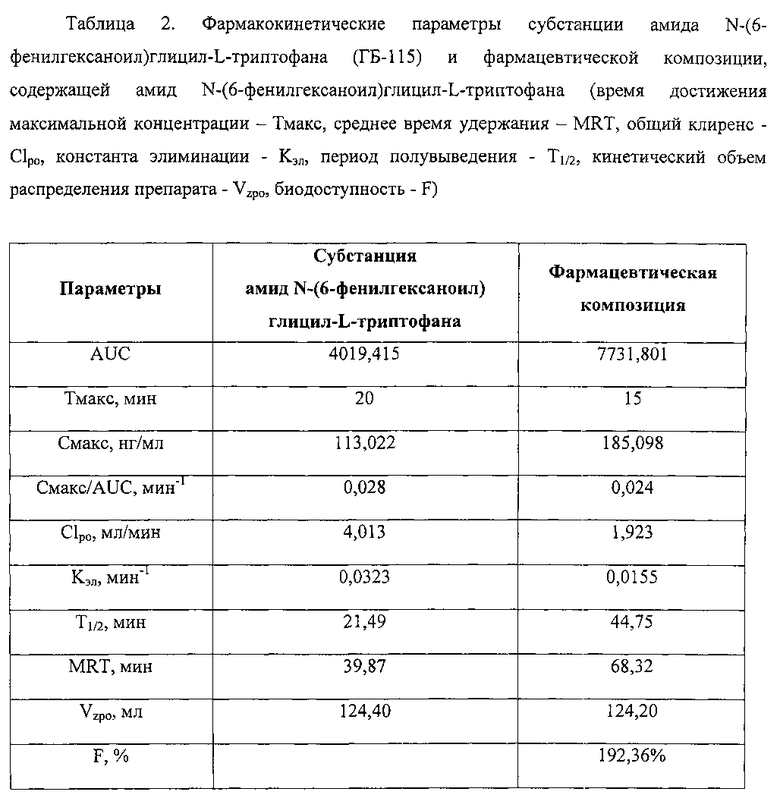
Следует отметить, что концентрации амида N-(6-фенилгексаноил)глицил-L-триптофана во все исследуемые интервалы времени были выше при введении фармацевтической композиции по сравнению с субстанцией, что может свидетельствовать о влиянии вспомогательных веществ на скорость и степень всасывания амида N-(6-фенилгексаноил)глицил-L-триптофана.
Для сравнения длительности пребывания активного вещества в неизменном виде в организме испытуемых животных после введения субстанции и фармацевтической композиции необходимо сравнить следующие параметры: Kэл, Т1/2, MRT, Смакс/AUC.
Для фармацевтической композиции регистрируется второй максимум концентраций вещества (между 40 и 60 минутами после введения), что может быть связано с эффектом энтерогепатической рециркуляции. Для заявляемой композиции характерны более медленное снижение концентрации вещества в плазме крови крыс с Кэл - 0,0155 мин-1, длительный период полувыведения - 44,75 мин и значительное среднее время удержания амида N-(6-фенилгексаноил)глицил-L-триптофана в плазме крови крыс - MRT - 68,32 мин.
Невысокое значение клиренса для фармацевтической композиции также говорит о более длительном удержании амида N-(6-фенилгексаноил)глицил-L-триптофана в организме животных после введения фармацевтической композиции в неизмененном виде. Для фармацевтической композиции, а также для субстанции характерны высокие значения гипотетического объема распределения - 124,20 и 124,40 соответственно.
Фармацевтическая композиция имеет высокую площадь под фармакокинетической кривой (табл. 2) и соответственно высокую величину относительной биодоступности, составляющую 192%.
ВЫВОД
Таким образом, заявленный технический результат изобретения достигается: предлагаемая фармацевтическая композиция в соответствии со своими физико-химическими, фармакодинамическими и фармакокинетическими характеристиками способствует увеличению биодоступности пептидного препарата ГБ-115 и существенно повышает эффективность его использования по сравнению с исходной субстанцией.
Описание чертежей
Фиг. 1 А, Б. Влияние субстанции амида N-(6-фенилгексаноил)глицил-L-триптофана на число заходов (А) и время пребывания (Б) крыс в открытых рукавах в тесте «приподнятый крестообразный лабиринт». По оси абсцисс - время после введения изучаемых соединений, 1-15 мин, 2-45 мин. По оси ординат - число заходов в открытые рукава лабиринта (А), время пребывания в открытых рукавах лабиринта (Б). Столбики слева направо: контроль, ГБ-115 в дозах 0,3 и 0,7 мг/кг.
Статистический анализ - непараметрический критерий «Mann-Whitney-U-test». * - Р<0,05, значимые различия с контрольной группой; # - Р<0,05; ## - Р<0,01, значимые различия между соответствующими группами через 15 (1) и 45 (2) мин после введения.
Фиг. 2. А, Б. Влияние фармацевтической композиции амида N-(6-фенилгексаноил)глицил-L-триптофана на число заходов (А) и время пребывания (Б) крыс в открытых рукавах в тесте «приподнятый крестообразный лабиринт». По оси абсцисс - время после введения изучаемых соединений, 1-15 мин, 2-45 мин. По оси ординат - число заходов в открытые рукава лабиринта (А), время пребывания в открытых рукавах лабиринта (Б). Столбики слева направо контроль, ГБ-115 в дозах 0,3, 0,5 и 0,7 мг/кг.
Статистический анализ - непараметрический критерий «Mann-Whitney-U-test». * - Р<0,05 - значимые различия с контрольной группой; # - Р<0,05; ## - Р<0,01 - значимые различия между соответствующими группами через 15 (1) и 45 (2) мин после введения.
Фиг. 3. Фармакокинетическая кривая амида N-(6-фенилгексаноил)глицил-L-триптофана, определяемого в плазме крови крыс после однократного перорального введения амида N-(6-фенилгексаноил)глицил-L-триптофана в виде водного раствора МС и фармацевтической композиции в дозе 100,00 мг/кг; ось абсцисс - время (t, мин), ось ординат - концентрация (с, нг/мл).
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АМИДА N-(6-ФЕНИЛГЕКСАНОИЛ)ГЛИЦИЛ-L-ТРИПТОФАНА С ПЛЕНОЧНЫМ ПОКРЫТИЕМ И СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ | 2013 |
|
RU2663691C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ С АНТИПСИХОТИЧЕСКОЙ АКТИВНОСТЬЮ И СПОСОБЫ ЕЁ ПОЛУЧЕНИЯ | 2012 |
|
RU2584653C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ НА ОСНОВЕ ГЕКСАМЕТИЛЕНДИАМИДА БИС-(N-МОНОСУКЦИНИЛ-L-СЕРИЛ-L-ЛИЗИНА) | 2021 |
|
RU2790827C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОМИКРОБНЫМ ДЕЙСТВИЕМ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2497501C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ ДЛЯ ЛЕЧЕНИЯ ЦЕРЕБРОВАСКУЛЯРНЫХ РАССТРОЙСТВ | 2014 |
|
RU2611339C2 |
| Фармацевтическая композиция пролонгированного действия на основе 5-этокси-2-[2-(морфолино)-этилтио] бензимидазола дигидрохлорида и/или основания (Афобазола) | 2017 |
|
RU2694837C2 |
| Фармацевтическая композиция на основе гексаметилендиамида бис-(N-моносукцинил-L-серил-L-лизина) (ГСБ-106) | 2018 |
|
RU2697254C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА АНТИОКСИДАНТНОГО ДЕЙСТВИЯ В ФОРМЕ ТАБЛЕТКИ | 2020 |
|
RU2749718C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СПАЗМОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2001 |
|
RU2183119C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОЯЗВЕННОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2019 |
|
RU2736184C1 |
Изобретение относится к медицине, в частности к фармации, и касается фармацевтической композиции, выполненной в твердой лекарственной форме и содержащей в качестве лекарственного вещества терапевтически эффективное количество амида N-(6-фенилгексаноил)глицил-L-триптофана, а в качестве вспомогательных веществ - связывающее вещество группы веществ, обеспечивающих достаточную массу таблетки или капсулы: целлюлозу или производные целлюлозы, такие как микрокристаллическая целлюлоза; лактозу, поливинилпирролидон, кальция карбонат, кальция фосфат; вспомогательные вещества, обладающие повышенной сорбционной способностью: коллоидный кремний, алюмометосиликат магния; группы скользящих веществ - стеариновая кислота и/или ее соли, поверхностно-активные вещества: олеат натрия, лаурилсульфат натрия; разрыхляющие вещества из группы: крахмал, пектин, поливинилпирролидон, кроскармеллоза натрия, натрия карбоксиметилцеллюлоза. Таблетки и капсулы отвечают всем требованиям Государственной фармакопеи XI и XII издания и повышенной биодоступностью указанного лекарственного пептида. 3 ил., 2 табл., 16 пр.
Фармацевтическая композиция, обладающая анксиолитическим действием, выполненная в твердой лекарственной форме, содержащая амид N-(6-фенилгексаноил)глицил-L-триптофана в эффективном количестве и фармацевтически приемлемые вспомогательные вещества, пригодные для использования в твердых лекарственных формах при следующем соотношении компонентов (мас.%):
и по меньшей мере одно вещество из следующих групп вспомогательных веществ: вещества с сорбционной способностью в количестве 1,00-10,00 мас.%, связывающие - 1,50-10,00 мас.%, поверхностно-активные вещества в количестве 0,50-1,00 мас.%, разрыхляющие - 3,00-5,00 мас.%,
в которой в качестве наполнителя содержится по меньшей мере одно вещество, выбранное из группы: микрокристаллическая целлюлоза; лактоза, сахароза; мальтоза; фруктоза; сорбит; маннит; поливинилпирролидон; кальция карбонат, кальция фосфат,
в качестве антифрикционного вещества содержится по меньшей мере одно вещество, выбранное из группы: стеариновая кислота и/или ее соли, коллоидный кремний,
в качестве веществ с сорбционной способностью может содержаться по меньшей мере одно вещество, выбранное из группы: коллоидный кремний, алюмометасиликат магния,
в качестве связывающих может содержаться по меньшей мере одно вещество, выбранное из группы: крахмальный клейстер, растворы: метилцеллюлозы, карбоксиметилцеллюлозы, оксиэтилцеллюлозы, оксипропилметилцеллюлозы; поливинилового спирта, поливинилпирролидона, натрия альгината, гидроксипропилметилцеллюлозы,
в качестве поверхностно-активных может содержаться по меньшей мере одно вещество, выбранное из группы: олеат натрия, лаурилсульфат натрия,
в качестве разрыхляющих может содержаться по меньшей мере одно вещество, выбранное из группы: крахмал картофельный, кукурузный, пшеничный, прежелатизированный, карбоксиметилированный, пектин, поливинилпирролидон, кроскармеллоза натрия, натрия карбоксиметилцеллюлоза.
| ЗАМЕЩЕННЫЕ ТРИПТОФАНСОДЕРЖАЩИЕ ДИПЕПТИДЫ С ХОЛЕЦИСТОКИНИНОНЕГАТИВНОЙ ИЛИ ХОЛЕЦИСТОКИНИНОПОЗИТИВНОЙ АКТИВНОСТЬЮ | 2001 |
|
RU2227144C2 |
| Т.А.Гудашева и др., Синтез, конформационный анализ и анксиолитическая активность ретропептидных аналогов холецистокинина-4, Химико-фармацевтический журнал, 2006, том.40, N 7, стр.21-26 | |||
| П.О.Бочков и др., Фармакокинетическое исследование трех новых оригинальных лекарственных средств и их оптимальных лекарственных форм, | |||
Авторы
Даты
2016-11-20—Публикация
2013-12-13—Подача