Настоящее изобретение относится к биотехнологии, в частности к штаммам бактерий Escherichia coli - продуцентам янтарной кислоты, способным к эффективной продукции янтарной кислоты из глюкозы, а так же к способу получения янтарной кислоты, с использованием этих штаммов, с улучшенными показателями коэффициента конверсии субстрата в целевой продукт, приближенными к максимально теоретически возможным значениям.
Янтарная кислота рассматривается как один из важнейших "строительных блоков" для получения широкого спектра химических веществ с высокой добавленной стоимостью, таких как органические растворители, пластификаторы, биодеградируемые пластики и др. (Cukalovic A., Stevens C.V., Feasibility of production methods for succinic acid derivatives: a marriage of renewable resources and chemical technology. Biofuels, Bioprod Bioref., 2008, 2(6):505-529). Потенциальный объем рынка янтарной кислоты и ее производных оценивается в 6 млн. тон/год.
Традиционно, янтарную кислоту получают нефтехимическим синтезом из малеинового ангидрида, однако, в последние годы значительный прогресс был достигнут в коммерциализации и промышленной реализации процессов микробиологического синтеза янтарной кислоты из возобновляемого сырья (Jansen M.L., van Gulik W.M. Towards large scale fermentative production of succinic acid. Curr Opin Biotechnol., 2014, 30:190-197). Основу этих процессов составляет ферментация углевод-содержащих субстратов высокоэффэктивными микробными штаммами, полученными с помощью направленной метаболической инженерии. В силу относительной дешевизны и значительных объемов производства, предпочтительным субстратом для микробиологического получения янтарной кислоты является глюкоза, наиболее распространенный углевод в составе растительной биомассы (Song Н. Lee S.Y., Production of succinic acid by bacterial fermentation. Enz. Microbial Technol., 2006, 39(3):352-361). Наилучшие показатели конверсии глюкозы в янтарную кислоту демонстрируют штаммы-продуценты, созданные на основе бактерий Escherichia coli (Cheng К.К., et al. Improved succinate production by metabolic engineering. 2013 Biomed Res Int. doi: 10.1155/2013/538790).
Факультативно анаэробная бактерия Escherichia coli способна синтезировать янтарную кислоту в ограниченном наборе биохимических реакций. К ним относятся реакции оксидативного цикла трикарбоновых кислот, реакции одной из ветвей смешаннокислотного брожения, известной как восстановительная ветвь цикла трикарбоновых кислот, и реакци глиоксилатного шунта.
Наиболее эффективным процессом микробиологического получения янтарной кислоты является анаэробное сбраживание глюкозы, с формированием целевого вещества в восстановительной ветви цикла трикарбоновых кислот. В данном процессе максимально возможный коэффициент конверсии субстрата в продукт в расчете на углерод составляет 2 моль/моль. Это обуславливается фиксацией СО2 на стадии образования из гликолитических интермидиатов оксалоацетата - предшественника в анаэробном пути сбраживания глюкозы в янтарную кислоту. Однако практической реализуемости данного процесса препятствует его окислительно-восстановительная несбалансированность. Конверсия каждой из двух молекул оксалоацетата, полученных из интермедиатов гликолитической утилизации глюкозы, в янтарную кислоту требует 2-х восстановленных эквивалентов (NADH), в то время как в ходе гликолиза формируется лишь половина необходимых эквивалентов (1 NADH на одну молекулу оксалоацетата). Этим обуславливается то, что лучшие показатели продукции янтарной кислоты специально полученными мутантными штаммами достигаются в процессах биосинтеза, представляющих сочетание двух биохимических путей - восстановительной ветви цикла трикарбоновых кислот и глиоксилатного шунта. С участием глиоксилатного шунта две молекулы янтарной кислоты могут быть синтезированы из одной молекулы оксалоацетата, двух молекул Ацетил-СоА и одного NADH. Глиоксилатный шунт, потребляющий меньшее количество NADH на каждую синтезируемую молекулу янтарной кислоты выступает в данном случае как донор "остаточных" гликолитических NADH для высокопродуктивного формирования целевого вещества в восстановительной части цикла трикарбоновых кислот. Однако, поскольку в глиоксилатный шунт, наряду с оксалоацетатом, вовлечены 2 молекулы Ацетил-СоА, формирующиеся из гликолитического предшественника с потерей СО2, вклад этого процесса в общий биосинтез янтарной кислоты приводит к снижению суммарного выхода продукта. Конечный выход целевого продукта определяется, таким образом, соотношение вкладов каждого из путей в биосинтез янтарной кислоты. В то время как ключевые реакции биосинтеза оксалоацетата из трехуглеродных гликолитических предшественников являются NADH независимыми, образование Ацетил-СоА из гликолитически сформированной пировиноградной кислоты может сопровождаться дополнительной генерацией NADH. В клетках Ε. coli окисление пирувата в Ацетил-СоА, в зависимости от условий аэрации, катализируется либо пируват дегидрогеназой, либо пируват формат лиазой. Конверсия пировиноградной кислоты в Ацетил-СоА под действием пируватформатлиазы не сопровождающаяся формированием NADH, в то время как действие пируватдегидрогеназы приводит к формированию дополнительной молекулы NADH на каждый образующийся Ацетил-СоА. В зависимости от участия конкретных ферментов в формировании Ацетил-КоА, биосинтез янтарной кислоты из глюкозы при совместном действии восстановительной ветви цикла трикарбоновых кислот и глиоксилатного шунта может осуществляться в трех окислительно-восстановительно сбалансированных режимах, характеризующихся различными значениями максимального теоретически возможного выхода продукта.
При формировании Ацетил-СоА под действием пируват формат лиазы, окислительно-восстановительно сбалансированный анаэробный биосинтез янтарной кислоты из глюкозы возможен в результате совместного действия восстановительной ветви цикла трикарбоновых кислот и глиоксилатного шунта с распределением потока углерода между двумя путями в соотношении 60:40, обуславливающим максимально возможный коэффициент конверсии субстрата в целевой продукт 1,6 моль/моль. При формировании Ацетил-СоА под действием как пируват формат лиазы, так и пируват дегидрогеназы, анаэробный биосинтез янтарной кислоты из глюкозы может быть окислительно-восстановительно сбалансирован при распределении потока углерода между восстановительной ветвью цикла трикарбоновых кислот и глиоксилатным шунтом в соотношении 50:50, обуславливающем максимально возможный коэффициент конверсии субстрата в целевой продукт 1,6(6) моль/моль. В случае формирования ацетил-СоА под действием исключительно пируват дегидрогеназы, распределение потока углерода между восстановительной ветвью цикла трикарбоновых кислот и глиоксилатным шунтом в соотношении 57,14:42,86 обеспечивает окислительно-восстановительно сбалансированный анаэробный биосинтез янтарной кислоты из глюкозы и обуславливает максимально возможный коэффициент конверсии субстрата в целевой продукт 1,71 моль/моль.
Следует отметить, что в E. coli конверсия пировиноградной кислоты в Ацетил-СоА в анаэробных условиях осуществляется под действием пируват формат лиазы, в то время как экспрессия генов пируват дегидрогеназного комплекса при анаэробиозе репрессирована (см., например, Soini J. et al., Norvaline is accumulated after a down-shift of oxygen in Escherichia coli W3110. Microb Cell Fact., 2008, 7:30, doi: 10.1186/1475-2859-7-30). Таким образом, вовлечение пируват дегидрогеназы в анаэробный биосинтез ацетил-СоА требует соответствующего усиления экспрессии генов, кодирующих компоненты указанного ферментативного комплекса.
Среди штаммов Е. coli продуцентов янтарной кислоты, полученных с помощью направленной метаболической инженерии без привлечения методов мутагенеза и селекции, репрезентативными штаммами характеризующимися максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту 1,6 моль/моль являются SBS550MG [pHL413] (Sánchez AM et al., Novel pathway engineering design of the anaerobic central metabolic pathway in Escherichia coli to increase succinate yield and productivity. Metab Eng. 2005, 7(3), 229-239; Cox S.J. et al., Development of a metabolic network design and optimization framework incorporating implementation constraints: A succinate production case study. Metab Eng., 2006, 8:46-57), SGM1.0 [pPYC] и SGM1.1 [pPYC] (RU 2528056). Штаммами Ε. coli продуцентами янтарной кислоты характеризующимися максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту 1,6(6) моль/моль являются SGM2.0 [pPYC] и SGM2.1 [pPYC] (RU 2528056). Штаммам-продуцентам характеризующимися максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту 1,71 моль/моль соответствуют NZ-041 (Zhu X. et al. Metabolic evolution of two reducing equivalent-conserving pathways for high-yield succinate production in Escherichia coli. Metab Eng., 2014, doi: 10.1016/j.ymben.2014.05.003), SGM3.0 [pPYC] и SGM3.1 [pPYC] (RU 2528056).
Штаммы Ε. coli SBS550MG [pHL413], SGM1.0 [pPYC], SGM1.1 [pPYC]; SGM2.0 [pPYC] и SGM2.1 [pPYC], а также NZ-041, SGM3.0 [pPYC] и SGM3.1 [pPYC] рассматриваем в качестве ближайших аналогов завляемых штаммов продуцентов янтарной кислоты.
Следует отметить, что направленные генетические модификации, приводящие к получению штаммов Е. coli продуцентов янтарной кислоты, способных синтезировать целевое вещество с выходами приближенными к соответствующим теоретическим значениям, могут различаться по своему набору. Рациональный выбор генов мишений, основанный только на анализе доступной информации о функционировании целевых биохимических путей, не может надежно предопределить успеха в улучшении продукции янтарной кислоты сконструированными штаммами. Более того, неочевидным является сохранение сконструированными штаммами способности к анаэробной утилизации глюкозы, при объединении в них генетических модификаций, влияющих на глобальную координацию метаболизма углерода и окислительно-восстановительного баланса клетки в условиях анаэробиоза. При этом, реально достигаемые показатели коэффициентов конверсии глюкозы в янтарную кислоту для штаммов характеризующихся различными максимально возможными значениями выходов разнятся в зависимости от набора конкретных модификаций внесенных в соответствующие штаммы.
В штамме SBS550MG [pHL413] инактивированны гены асkА, pta, ldhA, adhE, iclR, кодирующие ацетат киназу, фосфотрансацетилазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу и белок транскрипционный репрессор экспрессии генов, кодирующих ферменты глиоксилатного шунта и экспрессирован ген рус Lactococcus lactis, кодирующий пируват карбоксилазу. Вместе с тем, данный штамм содержит интактный ген рохВ, кодирующий пируват оксидазу, конкурирующую с биосинтезом янтарной кислоты за метаболит-предшественник пировиноградную кислоту. Конверсия пировиноградной кислоты в Ацетил-СоА в штамме SBS550MG [pHL413] осуществляется под действием пируват формат лиазы, что обуславливает максимально возможный коэффициент конверсии глюкозы в янтарную кислоту - 1,6 моль/моль (Сох S.J. et al., Development of a metabolic network design and optimization framework incorporating implementation constraints: a succinate production case study. Metab. Eng., 2006, 8:46-57). В богатых комплексных средах штамм SBS550MG [pHL413] синтезирует янтарную кислоту из глюкозы с коэффициентом конверсии 1,59 моль/моль (Sánchez A.M. et al., Novel pathway engineering design of the anaerobic central metabolic pathway in Escherichia coli to increase succinate yield and productivity. Metab Eng. 2005, 7(3):229-239), 1,4 моль/моль (PCT/FR 2010/050230) и 1,25 моль/моль (Martínez I. et al., Metabolic impact of the level of aeration during cell growth on anaerobic succinate production by an engineered Escherichia coli strain. Metab Eng., 2010, 12:499-509) в зависимости от условий культивирования. Данные коэффициенты конверсии достигнуты при продукции штаммом янтарной кислоты в среде LB, содержащей значительное количество аминокислот. В условиях анаэробиоза окислительное дезаминирование аминокислот, сопровождающееся генерацией NADH, способно обеспечить дополнительные к гликолитическим восстановленные эквиваленты необходимые для формирования янтарной кислоты в восстановительной ветви цикла трикарбоновых кислот. При исчерпании в среде аминокислот, штамм лишается дополнительного источника восстановленных эквивалентов для эффективного биосинтеза янтарной кислоты. Действительно, при осуществлении процесса анаэробного биосинтеза янтарной кислоты из глюкозы штаммом SBS550MG [pHL413] в минимальной солевой среде с глюкозой коэффициент конверсии субстрата в целевой продукт составляет 1,3 моль/моль (WO 2009/083756).
В штаммах SGM1.0 [pPYC] и SGM1.1 [pPYC] инактивированны гены асkА, pta, рохВ, ldhA, adhE, кодирующие ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу и экспрессирован ген русА Bacillus subtilis, кодирующий пируват карбоксилазу. В штамме SGM1.1 [pPYC] также инактивирован ген iclR, кодирующий белок транскрипционный репрессор экспрессии генов, кодирующих ферменты глиоксилатного шунта. Конверсия пировиноградной кислоты в Ацетил-СоА в штаммах SGM1.0 [pPYC] и SGM1.1 [pPYC] осуществляется под действием пируват формат лиазы, что обуславливает максимально возможный коэффициент конверсии глюкозы в янтарную кислоту - 1,6 моль/моль. В минимальной солевой среде штаммы SGM1.0 [pPYC] и SGM1.1 [pPYC] синтезируют янтарную кислоту из глюкозы с коэффициентами конверсии 1,31 моль/моль и 1,32 моль/моль, соответственно (RU 2528056).
В штаммах SGM2.0 [pPYC] и SGM2.1 [pPYC] инактивированны гены ackA, pta, poxB, ldhA, adhE, кодирующие ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу, усилена экспрессия генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, и экспрессирован ген рус А Bacillus subtilis, кодирующий пируват карбоксилазу. В штамме SGM2.1 [pPYC] также инактивирован ген iclR, кодирующий белок транскрипционный репрессор экспрессии генов, кодирующих ферменты глиоксилатного шунта. Конверсия пировиноградной кислоты в Ацетил-СоА в штаммах SGM2.0 [pPYC] и SGM2.1 [pPYC] осуществляется под действием как пируват формат лиазы, так и пируват дегидрогеназы, что обуславливает максимально возможный коэффициент конверсии глюкозы в янтарную кислоту - 1,6(6) моль/моль. В минимальной солевой среде штаммы SGM2.0 [pPYC] и SGM2.1 [pPYC] синтезируют янтарную кислоту из глюкозы с коэффициентами конверсии 1,42 моль/моль и 1,49 моль/моль, соответственно (RU 2528056).
В штамме NZ-041 инактивированны гены асkА, pta, ldhA, pflB, ptsl, кодирующие ацетат киназу, фосфотрансацетилазу, лактат дегидрогеназу, пируват формат лиазу и фермент I фосфоенолпируват зависимой системы транспорта сахаров, а также усилена экспрессия генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, гена pck, кодирующего фосфоенолпируват карбоксикиназу, и гена galP, кодирующего Н+-симпортер галактозы. Вместе с тем, данный штамм содержит интактные гены рохВ и adhE, кодирующие пируват оксидазу и альдегид/алкоголь дегидрогеназу, конкурирующие с биосинтезом янтарной кислоты за метаболиты-предшественники - пировиноградную кислоту и ацетил-СоА, соответсвенно. Конверсия пировиноградной кислоты в Ацетил-СоА в штамме NZ-041 осуществляется под действием пируват дегидрогеназы, что обуславливает максимально возможный коэффициент конверсии глюкозы в янтарную кислоту - 1,71 моль/моль. В минимальной солевой среде штамм NZ-041 синтезирует янтарную кислоту из глюкозы с коэффициентом конверсии 1,31 моль/моль (Zhu X. et al. Metabolic evolution of two reducing equivalent-conserving pathways for high-yield succinate production in Escherichia coli. Metab Eng., 2014, doi: 10.1016/j.ymben.2014.05.003).
В штаммах SGM3.0 [pPYC] и SGM3.1 [pPYC] инактивированны гены ackA, pta, poxB, ldhA, adhE, pflB, кодирующие ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу, пируват формат лиазу, усилена экспрессия генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, и экспрессирован ген русА Bacillus subtilis, кодирующий пируват карбоксилазу. В штамме SGM3.1 [pPYC] также инактивирован ген iclR, кодирующий белок транскрипционный репрессор экспрессии генов, кодирующих ферменты глиоксилатного шунта. Конверсия пировиноградной кислоты в Ацетил-СоА в штаммах SGM3.0 [pPYC] и SGM3.1 [pPYC] осуществляется под действием пируват дегидрогеназы, что обуславливает максимально возможный коэффициент конверсии глюкозы в янтарную кислоту - 1,71 моль/моль. В минимальной солевой среде штаммы SGM3.0 [pPYC] и SGM3.1 [pPYC] синтезируют янтарную кислоту из глюкозы с коэффициентами конверсии 1,46 моль/моль и 1,66 моль/моль, соответственно (RU 2528056).
Задача заявляемого изобретения состоит в расширении ассортимента штаммов бактерий Escherichia coli - продуцентов янтарной кислоты, способных синтезировать целевое вещество с повышенной эффективностью, и способов получения янтарной кислоты с использованием этих штаммов.
Задача решена путем
- констрирования штаммов Escherichia coli - продуцентов янтарной кислоты:
1. MSG1.0 [pPYC], обладающего инактивированными генами ackA, pta, poxB, ldhA, adhE, ptsG, кодирующими ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу и пермеазу глюкозы, соответственно, усиленной экспрессией генов galP и glk, кодирующих Н+-симпортер галактозы и глюкокиназу, а также активностью пируват карбоксилазы;
2. MSG1.1 [pPYC], обладающего инактивированными генами ackA, pta, poxB, ldhA, adhE, ptsG, iclR, кодирующими ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу, пермеазу глюкозы и транскрипционный репрессор генов, кодирующих ферменты глиоксилатного шунта, соответственно, усиленной экспрессией генов galP и glk, кодирующих Н+-симпортер галактозы и глюкокиназу, а также активностью пируват карбоксилазы;
3. MSG2.0 [pPYC], обладающего инактивированными генами ackA, pta, poxB, ldhA, adhE, ptsG, кодирующими ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу и пермеазу глюкозы, соответственно, усиленной экспрессией генов galP и glk, кодирующих Н+-симпортер галактозы и глюкокиназу, усиленной экспрессией генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, а также активностью пируват карбоксилазы;
4. MSG2.1 [pPYC], обладающего инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR, кодирующими ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу, пермеазу глюкозы и транскрипционный репрессор генов, кодирующих ферменты глиоксилатного шунта, соответственно, усиленной экспрессией генов galP и glk, кодирующих Н+-симпортер галактозы и глюкокиназу, усиленной экспрессией генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, а также активностью пируват карбоксилазы;
5. MSG3.0 [pPYC], обладающего инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, кодирующими ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу, пермеазу глюкозы и пируват формат лиазу, соответственно, усиленной экспрессией генов galP и glk, кодирующих Н+-симпортер галактозы и глюкокиназу, усиленной экспрессией генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, а также активностью пируват карбоксилазы;
6. MSG3.1 [pPYC], обладающего инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, iclR, кодирующими ацетат киназу, фосфотрансацетилазу, пируват оксидазу, лактат дегидрогеназу, альдегид/алкоголь дегидрогеназу, пермеазу глюкозы, пируват формат лиазу и транскрипционный репрессор генов, кодирующих ферменты глиоксилатного шунта, соответственно, усиленной экспрессией генов galP и glk, кодирующих Н+-симпортер галактозы и глюкокиназу, усиленной экспрессией генов асеЕ, aceF и lpdA, кодирующих компоненты пируват дегидрогеназы, а также активностью пируват карбоксилазы;
- разработки способа получения янтарной кислоты с использованием заявляемых штаммов.
Конверсия пировиноградной кислоты в Ацетил-СоА осуществляется в заявляемых штаммах либо под действием пируват формат лиазы, либо под действием пируват формат лиазы и пируват дегидрогеназы, либо под действием исключительно пируват дегидрогеназы что обуславливает максимально возможные коэффициенты конверсии глюкозы в янтарную кислоту - 1,6 моль/моль, 1,6(6) моль/моль, 1,71 моль/моль. Заявляемые штаммы способны анаэробно синтезировать янтарную кислоту из глюкозы с коэффициентами конверсии, приближенными к максимальным теоретически возможным значениям.
Объектом настоящего изобретения являются штаммы бактерий вида Escherichia coli, обладающие способностью к эффективной конверсии глюкозы в янтарную кислоту.
Также объектом настоящего изобретения является штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, усиленной экспрессией генов galP и glk, и обладающий активностью пируват карбоксилазы - продуцент янтарной кислоты с максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту - 1,6 моль/моль;
Также объектом настоящего изобретения является штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR, усиленной экспрессией генов galP и glk, и обладающий активностью пируват карбоксилазы - продуцент янтарной кислоты с максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту - 1,6 моль/моль;
Также объектом настоящего изобретения является штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, асе F и lpdA, и обладающий активностью пируват карбоксилазы - продуцент янтарной кислоты с максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту - 1,6(6) моль/моль;
Также объектом настоящего изобретения является штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и обладающий активностью пируват карбоксилазы - продуцент янтарной кислоты с максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту - 1,6(6) моль/моль;
Также объектом настоящего изобретения является штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и обладающий активностью пируват карбоксилазы - продуцент янтарной кислоты с максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту - 1,71 моль/моль;
Также объектом настоящего изобретения является штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, iclR, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и обладающий активностью пируват карбоксилазы - продуцент янтарной кислоты с максимально возможным коэффициентом конверсии глюкозы в янтарную кислоту - 1,71 моль/моль;
Также объектом настоящего изобретения являются штаммы бактерий Escherichia coli, описанные выше, при этом активность пируват карбоксилазы обеспечивается за счет введения в бактерию молекулы ДНК, содержащей ген, кодирующий фермент, обладающий активностью, классифицируемой как К.Ф. 6.4.1.1.
Также объектом настоящего изобретения являются штаммы бактерий Escherichia coli, описанные выше, в которых экспрессия генов galP и glk усилена за счет замены в хромосомах штаммов нуклеотидных последовательностей природных промоторов, контролирующих экспрессию генов galP и glk, на более сильные промоторы.
Также объектом настоящего изобретения являются рекомбинантные штаммы бактерий Escherichia coli, в которых экспрессия генов асеЕ, aceF и lpdA усилена за счет замены в хромосомах штаммов нуклеотидной последовательности природного промотора, контролирующего экспрессию генов aceEF-lpdA оперона, на более сильный промотор.
Также объектом настоящего изобретения является способ получения янтарной кислоты, включающий стадии культивирования штаммов, описанных выше, в питательной среде; и выделения произведенной и накопленной янтарной кислоты из культуральной жидкости.
Также объектом настоящего изобретения является, описанный выше способ, в котором процесс культивирования рекомбинантных штаммов включает в себя аэробную стадию накопления биомассы и анаэробную стадию продукции янтарной кислоты.
Штамм, согласно настоящему изобретению, - это штамм бактерий вида Escherichia coli, сконструированный в результате направленных генно-инженерных манипуляций.
Термин «штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG означает, что указанная бактерия была модифицирована таким образом, что в результате модификации такая бактерия содержит пониженное количество белков AckA, Pta, РохВ, LdhA, AdhE, PtsG по сравнению с немодифицированной бактерией, или указанная бактерия не способна синтезировать белки AckA, Pta, РохВ, LdhA, AdhE, PtsG.
Термин «штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR» означает, что указанная бактерия была модифицирована таким образом, что в результате модификации такая бактерия содержит пониженное количество белков AckA, Pta, РохВ, ldhA, AdhE, PtsG и lclR по сравнению с немодифицированной бактерией, или указанная бактерия не способна синтезировать белки AckA, Pta, РохВ, LdhA, AdhE, PtsG и IclR.
Термин «штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB» означает, что указанная бактерия была модифицирована таким образом, что в результате модификации такая бактерия содержит пониженное количество белков AckA, Pta, РохВ, LdhA, AdhE, PtsG и PflB по сравнению с немодифицированной бактерией, или указанная бактерия не способна синтезировать белки AckA, Pta, РохВ, LdhA, AdhE, PtsG и PflB.
Термин «штамм бактерий Escherichia coli с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, iclR» означает, что указанная бактерия была модифицирована таким образом, что в результате модификации такая бактерия содержит пониженное количество белков AckA, Pta, РохВ, LdhA, AdhE, PtsG, PflB и IclR по сравнению с немодифицированной бактерией, или указанная бактерия не способна синтезировать белки AckA, Pta, РохВ, LdhA, AdhE, PtsG, PflB и IclR.
Термин «инактивация генов асkА, pta, рохВ, ldhA, adhE, ptsG» означает, что естественная экспрессия модифицированных участков ДНК невозможна из-за делеций данных генов или их частей или модификации примыкающих к генам областей, которые включают последовательности, контролирующие экспрессию соответствующих генов, такие как промоторы, энхансеры, аттенуаторы, и т.д.
Термин «инактивация гена iclR» означает, что естественная экспрессия модифицированного участка ДНК невозможна из-за делеций данного гена или его части или модификации примыкающих к гену областей, которые включают последовательности, контролирующие экспрессию гена, такие как промоторы, энхансеры, аттенуаторы, и т.д.
Термин «инактивация гена pflB» означает, что естественная экспрессия модифицированного участка ДНК невозможна из-за делеций данного гена или его части или модификации примыкающих к гену областей, которые включают последовательности, контролирующие экспрессию гена, такие как промоторы, энхансеры, аттенуаторы, и т.д.
Наличие или отсутствие генов асkА, pta, рохВ, ldhA, adhE, ptsG, а также iclR и/или pflB на хромомсоме бактерии можно определить известными методами, включая ПЦР, блоттинг по Саузерну, и т.п. Кроме того, уровни экспрессии гена можно оценить определением количества транскрибируемой с гена РНК с использованием различных известных методов, включая блоттинг по Нозерну, количественную ОТ-ПЦР, и т.п. Количества или молекулярные массы кодируемых генами белков могут быть определены известными методами, включая SDS-ПААГ-электрофорез с последующим иммуноблотингом ПЦР (блоттинг по Вестерну) и т.п.
Ген асkА (синонимы: ЕСК2290, b2296) кодирует белок АсkА (синоним: В2296), проявляющий активность ацетаткиназы, классифицируемую как К.Ф. 2.7.2.1. Ген асkА (нуклеотиды с 2,411,492 по 2,412,694 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между открытой рамкой считывания yfbV и геном pta на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена ackA и аминокислотная последовательность AckA, кодируемого геном асkА, приведены в Перечне последовательностей под номерами 1 (SEQ ID NO: 1) и 2 (SEQ ID NO: 2) соответственно. Ген pta (синонимы: ЕСК2291, b2297) кодирует белок Pta (синоним: В2297), проявляющий активность фосфотрансацетилазы, классифицируемую как К.Ф. 2.3.1.8. Ген pta (нуклеотиды с 2,412,769 по 2,414,913 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между геном асkА и открытой рамкой считывания yfcC на хромосоме штамма Е. coli Κ12. Нуклеотидная последовательность гена pta и аминокислотная последовательность Pta, кодируемого геном pta, приведены в Перечне последовательностей под номерами 3 (SEQ ID NO: 3) и 4 (SEQ ID NO: 4) соответственно. Ген poxB (синонимы: ЕСК0862, b0871) кодирует белок РохВ (синоним: В0871), проявляющий активность пируватоксидазы, классифицируемую как К.Ф. 1.2.5.1. Ген рохВ (нуклеотиды комплементарные нуклеотидам с 908,554 по 910,272 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между геном ltaE и геном hcr на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена рохВ и аминокислотная последовательность РохВ, кодируемого геном рохВ, приведены в Перечне последовательностей под номерами 5 (SEQ ID NO: 5) и 6 (SEQ ID NO: 6) соответственно. Ген ldhA (синонимы: ЕСК1377, b1380) кодирует белок ldhA (синоним: В1380), проявляющий активность лактатдегидрогеназы, классифицируемую как К.Ф. 1.1.1.28. Ген ldhA (нуклеотиды комплементарные нуклеотидам с 1,439,878 по 1,440,867 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между геном hslJ и открытой рамкой считывания ydbH на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена ldhA и аминокислотная последовательность LdhA, кодируемого геном ldhA, приведены в Перечне последовательностей под номерами 7 (SEQ ID NO: 7) и 8 (SEQ ID NO: 8) соответственно. Ген adhE (синонимы: ЕСК1235, b1241) кодирует белок AdhE (синоним: В1241), проявляющий активность алкоголь дегидрогеназы и альдегид дегидрогеназы, классифицируемые как К.Ф. 1.1.1.1. и К.Ф. 1.2.1.3. Ген adhE (нуклеотиды комплементарные нуклеотидам с 1,294,669 по 1,297,344 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между открытой рамкой считывания ychG и открытой рамкой считывания ychE на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена adhE и аминокислотная последовательность AdhE, кодируемого геном adhE, приведены в Перечне последовательностей под номерами 9 (SEQ ID NO: 9) и 10 (SEQ ID NO: 10) соответственно. Ген ptsG (синонимы: ЕСК1087, b1101) кодирует белок PtsG (синоним: В1101), проявляющий активность пермеазы глюкозы фосфоенолпируват зависимой системы транспорта Сахаров. Ген ptsG (нуклеотиды с 1,157,092 по 1,158,525 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между открытой рамкой считывания ycfH и геном fhuE на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена ptsG и аминокислотная последовательность белка PtsG, кодируемого геном ptsG, приведены в Перечне последовательностей под номерами 11 (SEQ ID NO: 11) и 12 (SEQ ID NO: 12) соответственно. Ген iclR (синонимы: ЕСК4010, b4018) кодирует белок IclR (синоним: В4018) являющийся транскрипционным репрессором асеВАК оперона, кодирующего ферменты глиоксилатного шунта. Ген iclR (нуклеотиды комплементарные нуклеотидам с 4,220,827 по 4,221,651 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между геном arpA и геном metH на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена iclR и аминокислотная последовательность IclR, кодируемого геном iclR, приведены в Перечне последовательностей под номерами 13 (SEQ ID NO: 13) и 14 (SEQ ID NO: 14) соответственно. Ген pflΒ (синонимы: ЕСК0894, b0903) кодирует белок PflB (синоним: В0903), проявляющий активность пируватформатлиазы, классифицируемую как К.Ф. 2.3.1.54. Ген pflB (нуклеотиды комплементарные нуклеотидам с 950,495 по 952,777 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между геном pflA и геном focA на хромосоме штамма Е. coli К-12. Нуклеотидная последовательность гена pflB и аминокислотная последовательность PflB, кодируемого геном pfl, приведены в Перечне последовательностей под номерами 15 (SEQ ID NO: 15) и 16 (SEQ ID NO: 16) соответственно.
Поскольку у представителей различных штаммов вида Escherichia coli возможны некоторые вариации в нуклеотидных последовательностях, понятие инактивируемого гена не ограничивается генами, последовательности которых приведены в Перечне последовательностей под номерами 1 (SEQ ID NO: 1), 3 (SEQ ID NO: 3), 5 (SEQ ID NO: 5), 7 (SEQ ID NO: 7), 9 (SEQ ID NO: 9), 11 (SEQ ID NO: 11), 13 (SEQ ID NO: 13), 15 (SEQ ID NO: 15), но также может включать и гены, гомологичные SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, кодирующие варианты белков AckA, Pta, РохВ, LdhA, AdhE, PtsG, IclR и PflB. Термин «вариант белка» в значении, в котором он используется в настоящем изобретении, означает белок, имеющий изменения в аминокислотной последовательности, а именно делеции, вставки, добавления или замены аминокислот. Количество изменений в варианте белка зависит от положения аминокислотного остатка в трехмерной структуре или его типа. Количество изменений может быть от 1 до 30, предпочтительно от 1 до 15 и наиболее предпочтительно от 1 до 5 изменений в последовательностях SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14 и SEQ ID NO: 16. Данные изменения в вариантах белка являются консервативными мутациями, при которых сохраняется функция белка. Другими словами, данные изменения могут иметь место в областях белка, некритичных для его трехмерной структуры. Это становится возможным благодаря тому, что некоторые аминокислоты обладают высокой гомологией друг к другу, и поэтому третичная структура при таких заменах не нарушается. Консервативная мутация - это мутация, при которой имеют место взаимные замены среди Phe, Trp, Tyr, если сайт замены - ароматическая аминокислота; среди Leu, Ile, Val, если сайт замены - гидрофобная аминокислота; между Gln, Asn, если сайт замены - положительно заряженная аминокислота; среди Lys, Arg, His, если сайт замены - основная аминокислота; между Asp, Glu, если сайт замены - кислая аминокислота и между Ser, Thr, если это аминокислота с гидроксильной группой. Консервативные замены являются типичными консервативными мутациями. Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp, и замену Val на Met, Ile или Leu. Описанные выше замены, делеции, вставки, добавления, перестановки и т.п. одного или нескольких аминокислотных остатков включают природные мутации (мутант или вариант) в зависимости от видовых различий или индивидуальных различий микроорганизмов, содержащих гены асkА, pta, рохВ, ldhA, adhE, ptsG, iclR и pflB. Такие гены могут быть получены модифицированием нуклеотидной последовательности, показанной в SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13 и SEQ ID NO: 15 с использованием, например, сайт-специфического мутагенеза, таким образом, что сайт-специфический аминокислотный остаток в соответствующем кодируемом белке включает замены, делеции, вставки или добавления.
Следовательно, варианты белков, кодируемых генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR и pflB, могут иметь гомологию не менее 80%, предпочтительно не менее 90%, и наиболее предпочтительно не менее 95%, по отношению к полной аминокислотной последовательности, показанной в Перечне последовательностей под номерами SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14 и SEQ ID NO: 16, соответственно.
В связи с этим гены асkА, pta, рохВ, ldhA, adhE, ptsG, iclR и pflB могут быть вариантами, которые гибридизуются в жестких условиях с нуклеотидными последовательностями, приведенными в Перечне последовательностей под номерами 1 (SEQ ID NO: 1), 3 (SEQ ID NO: 3), 5 (SEQ ID NO: 5), 7 (SEQ ID NO: 7), 9 (SEQ ID NO: 9), 11 (SEQ ID NO: 11), 13 (SEQ ID NO: 13), 15 (SEQ ID NO: 15), или с зондом, который может быть синтезирован на основе указанной нуклеотидной последовательности. «Жесткие условия» включают такие условия, при которых специфические гибриды, например, гибриды с гомологией не менее 60%, предпочтительно не менее 70%, более предпочтительно не менее 80%, еще более предпочтительно не менее 90%, и наиболее предпочтительно не менее 95%, образуются, а неспецифические гибриды, например, гибриды с меньшей гомологией, чем указано выше, - не образуются. Практическим примером жестких условий является однократная отмывка, предпочтительно двух- или трехкратная, при концентрации солей 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°С. Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, такова, как рекомендовано производителем. Например, рекомендуемая продолжительность отмывки для нейлоновой мембраны Hybond™ N+(Amersham) при строгих условиях-15 минут. Предпочтительна двух- трехкратная отмывка. Длина зонда может быть выбрана в зависимости от условий гибридизации, обычно от 100 н.п. до 1000 н.п.
Гомология между последовательностями аминокислот может быть определена с использованием известных методов, например, компьютерной программы BLAST 2.0.
Экспрессия генов асkА, pta, рохВ, ldhA, adhE, ptsG, а также iclR и/или pflB может быть ослаблена введением мутации в соответствующий ген на хромосоме, при которой внутриклеточная активность белка, кодируемого геном, снижена или отсутствует по сравнению с немодифицированным штаммом. Такой мутацией гена может быть вставка гена устойчивости к антибиотику, или делеция гена или его части (Qiu, Ζ. and Goodman, M.F., J., Biol. Chem., 1997, 272:8611-8617; Kwon, D. H. et al., J. Antimicrob. Chemother., 2000, 46:793-796). Экспрессия генов асkА, pta, рохВ, ldhA, adhE, ptsG, а также iclR и/или pflB также может быть ослаблена модификацией регуляторных последовательостей, таких как промотор или последовательность Shine-Dalgarno (SD) (заявка РСТ WO 95/34672; Carrier, Т.А. and Keasling, J.D., Biotechnol Prog., 1999, 15:58-64).
Например, следующие методы могут применяться для введения мутаций путем генной рекомбинации. Конструируется мутантный ген, и бактерия для ее модификации трансформируется фрагментом ДНК, содержащим мутантный ген. Затем нативный ген на хромосоме замещается гомологичной рекомбинацией мутантным геном, отбирается полученный штамм. Такое замещение гена с использованием гомологичной рекомбинации может быть проведено методом с использованием линейной ДНК, известным как "Red-зависимая интеграция" или "интеграция посредством Red-системы" (Datsenko K.Α., Wanner B.L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12):6640-6645) или методом с использованием плазмиды, репликация которой чувствительна к температуре (патент США 6,303,383 или патентная заявка Японии JP 05-007491 А). Далее, введение сайт-специфической мутации путем замещения гена с использованием вышеупомянутой гомологичной рекомбинации может также быть осуществлено с использованием плазмиды с пониженной способностью к репликации в клетке хозяина.
Экспрессия гена также может быть ослаблена вставкой транспозона или IS фактора в кодирующую область гена (патент США 5,175,107), или традиционными методами, такими как мутагенез с использованием УФ излучения или обработка нитрозогуанидином (N-метил-N'-нитро-N-нитрозогуанидин).
Инактивация гена также может быть осуществлена традиционными методами, такими как мутагенез с использованием УФ излучения или обработка нитрозогуанидином (N-метил-N'-нитро-N-нитрозогуанидин), сайт-специфический мутагенез, разрушение гена с использованием гомологичной рекомбинации, или/и мутагенез вставкой-делецией (Yu D. et al., Proc. Natl. Acad. Sci. USA, 2000, 97:12: 5978-5983; Datsenko K.A. and Wanner B.L., Proc. Natl. Acad. Sci. USA, 2000, 97(12):6640-6645) также называемый "Red-зависимая интеграция".
Приведенное выше описание, касающееся вариантов белков, инактивации гена и других методов, может быть применимо к другим белкам, генам и конструированию бактерий, приведенным ниже.
Термин "усиление экспрессии гена" может означать, что экспрессия гена выше, чем в немодифицированном штамме, например, в штамме дикого типа. Примеры таких модификаций могут включать увеличение числа копий экспрессируемого гена в клетке, усиление экспрессии гена и т.д. Количество копий экспрессируемого гена определяют, например, путем рестрикции хромосомной ДНК с последующим блоттингом по Саузерну с использованием зонда, сконструированного на основе последовательности гена, флуоресцентной гибридизации in situ (FISH), и т.п. Уровень экспрессии гена можно определить различными известными методами, включая Нозерн-блоттинг, количественную ОТ-ПЦР, и т.п. Кроме того, штаммы, которые могут быть использованы в качестве контроля, включают, например, Escherichia coli K-12.
Ген galP (синонимы: ЕСK2938, b2943) кодирует белок GalP (синоним: В2943), проявляющий активность Н+-симпортера галактозы. Ген galP (нуклеотиды с 3,086,306 по 3,087,700 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между геном metK и открытой рамкой считывания yggI на хромосоме штамма Е. coli K-12. Нуклеотидная последовательность гена galP и аминокислотная последовательность белка GalP, кодируемого геном galP, приведены в Перечне последовательностей под номерами 17 (SEQ ID NO: 17) и 18 (SEQ ID NO: 18) соответственно. Ген glk (синонимы: ЕСK2384, b2388) кодирует белок Glk (синоним: В2388), проявляющий активность глюкокиназы, классифицируемую как К.Ф. 2.7.1.2. Ген glk (нуклеотиды комплементарные нуклеотидам с 2,506,483 по 2,507,448 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен между геном fryB и открытой рамкой считывания yfeO на хромосоме штамма Е. coli K-12. Нуклеотидная последовательность гена glk и аминокислотная последовательность белка Glk, кодируемого геном glk, приведены в Перечне последовательностей под номерами 19 (SEQ ID NO: 19) и 20 (SEQ ID NO: 20) соответственно.
Гены асеЕ, aceF и lpdA (синонимы: b0114, ЕСK0113; b0115, ЕСK0114; b0116, ЕСK0115) кодируют белки АсеЕ, AceF и LpdA - компоненты ферментативного комплекса NAD+-восстанавливающей пируват дегидрогеназы. Гены aceEF-lpdA оперона (нуклеотиды, гомологичные нуклеотидам с 123017 по 129336; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank, gi: 49175990) расположены между генами pdhR и уасН на хромосоме Е. coli K-12. Нуклеотидные последовательности генов асеЕ, aceF и lpdA и аминокислотные последовательности белков АсеЕ, AceF и LpdA, кодируемых генами асеЕ, aceF и lpdA представлены в SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25 и SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, соответственно.
Понятие "вариант белка" также применимо для белков GalP и Glk, кодирующих глюкокиназу и Н+-симпортер галактозы, и белков АсеЕ, AceF и LpdA - компонентов ферментативного комплекса NAD+-воссτанавливающей пируват дегидрогеназы. Термин "вариант белка" трактуется аналогично тому, как это описано выше.
В связи с этим гены galP, glk и гены асеЕ, aceF и lpdA также могут существовать в виде вариантов, которые гибридизуются в жестких условиях с нуклеотидными последовательностями, представленными в SEQ ID NO: 17, SEQ ID NO: 19 и в SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25, или с зондами, которые могут быть синтезированы на основе указанных нуклеотидных последовательностей, при условии, что они кодируют функциональные белки GalP, Glk и АсеЕ, AceF и LpdA. Термин "жесткие условия" трактуется аналогично тому, как это описано выше.
Методы, которые могут быть использованы для усиления экспрессии гена, включают увеличение числа копий гена. Введение гена в вектор, способный функционировать в бактерии вида Escherichia coli, может увеличивать число копий гена. Могут использоваться низкокопийные векторы. Примеры низкокопийных векторов включают, но не ограничиваются ими, pSC101, pMW118, pMW119, и т.п. Термин "низкокопийный вектор" используется для векторов, число копий которого в клетке достигает пяти.
Усиление экспрессии гена может также быть достигнуто путем введения множества копий гена в бактериальную хромосому, например, методом гомологичной рекомбинации, Mu интеграции и т.п. Например, один акт Mu интеграции позволяет ввести в бактериальную хромосому до 3 копий гена.
Число копий гена также может быть увеличено путем введения множества копий гена в хромосомную ДНК бактерии. Для введения множества копий гена в бактериальную хромосому может быть выполнена гомологичная рекомбинация с использованием в качестве целевых последовательностей, присутствующих в хромосоме во множестве копий. Последовательности с множеством копий в хромосомной ДНК, включают, но не ограничиваются ими, повторяющиеся ДНК или инвертированные повторы на концах транспонируемых элементов. Также возможно включить ген в состав транспозона и обеспечить его перенос для введения множества копий гена в хромосомную ДНК.
Усиление экспрессии гена также может быть достигнуто путем подстановки фрагмента ДНК под контроль сильного промотора. Примерами сильных промоторов являются lac промотор, trp промотор, trc промотор, PR или PL промоторы фага λ. Использование сильного промотора можно сочетать с увеличением копий гена.
С другой стороны, действие промотора может быть усилено, например, введением в промотор мутации, ведущей к увеличению уровня транскрипции локализованного за промотором гена. Кроме того, известно, что замена нескольких нуклеотидов в области между сайтом связывания рибосомы (ribosome binding site - RBS) и стартовым кодоном, особенно в последовательности непосредственно перед стартовым кодоном, существенно влияет на трансляционную способность мРНК. Например, обнаружен 20-кратный разброс в уровне экспрессии в зависимости от природы трех нуклеотидов, предшествующих стартовому кодону (Gold L. et al., Annu. Rev. Microbiol., 1981, 35:365-403; Hui A. et al., EMBO J., 1984,3:623-629).
Кроме того, возможно ввести нуклеотидную замену в область промотора гена на бактериальной хромосоме, результатом чего является усиление функции промотора. Изменение последовательности, контролирующей экспрессию, можно осуществить, например, таким же способом, что и замена гена с использованием чувствительной к температуре плазмиды, как раскрыто в международной заявке WO 00/18935 и заявке Японии JP 1-215280 А.
Штаммами бактерий Escherichia coli, согласно настоящему изобретению, также являются штаммы, описанные выше, модифицированные таким образом, что приобретают активность пируват карбоксилазы. Активность пируват карбоксилазы может обеспечиваться, в частности, присутствием в бактерии молекулы ДНК, содержащей ген, кодирующий пируват карбоксилазу.
Пируват карбоксилаза - фермент, способный катализировать реакцию карбоксилирования пировиноградной кислоты с образованием щавелеуксусной кислоты: АТФ+пируват+НСО3 -=АДФ+фосфат+оксалоацетат. Указанную активность классифицируют как К.Ф. 6.4.1.1. Наличие активности пируват карбоксилазы может быть установлено, например, с использованием метода, описанного Peters-Wendisch P.G. et al. (Pyruvate carboxylase from Corynebacterium glutamicum: characterization, expression and inactivation of the рус gene. Microbiology, 1998, 144:915-927). Примером фермента, обладающего активностью пируват карбоксилазы, может являться белок РусА из Bacillus subtilis (последовательность с инвентарным номером NP_389369.1 в базе данных GenBank, gi: 16078550), кодируемый геном русА (нуклеотиды с 1554185 по 1557631 в последовательности с инвентарным номером NC_000964.3 в базе данных GenBank, gi: 255767013). Нуклеотидная последовательность гена русА и аминокислотная последовательность кодируемого им белка РусА представлены в SEQ ID NO: 27 и SEQ ID NO: 28, соответственно.
Понятие "вариант белка" также применимо для пируват карбоксилазы. Термин "вариант белка" трактуется аналогично тому, как это описано выше.
В связи с этим ген русА также может существовать в виде вариантов, которые гибридизуются в жестких условиях с нуклеотидной последовательностью, представленной в SEQ ID NO: 27, или с зондом, который может быть синтезирован на основе указанной нуклеотидной последовательности, при условии, что они кодируют функциональный белок РусА. Термин "жесткие условия" трактуется аналогично тому, как это описано выше.
Молекула ДНК, содержащая ген, кодирующий пируват карбоксилазу может быть введена в бактерию в составе плазмидного вектора или же интегрированна в хромосому бактерии методом гомологичной рекомбинации или Mu интеграции. Ген русА может быть получен с помощью ПЦР с использованием в качестве матрицы хромосомы организма, природно содержащего данный ген, и праймеров, синтезированных в соответствии с целевой нуклеотидной последовательностью.
Штаммами бактерий Escherichia coli, согласно настоящему изобретению, являются штаммы, описанные выше, модифицированные таким образом, что приобретают активность пируват карбоксилазы за счет введения в бактерию молекулы ДНК, содержащей ген, кодирующий пируват карбоксилазу в составе плазмидного вектора.
Методы приготовления плазмидной ДНК, рестрикции и лигирования ДНК, трансформации, выбора нуклеотидов в качестве праймера и т.п. могут быть обычными методами, известными специалисту в этой области. Эти методы описаны, например, в Sambrook, J., Fritsch, E.F., and Maniatis, T., "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989).
Способ получения янтарной кислоты в общем виде.
Заявляемый способ продукции янтарной кислоты осуществляют путем культивирования заявляемого штамма бактерий Escherichia coli в питательной среде, обеспечивающей продукцию, накопление янтарной кислоты в культуральной жидкости и выделение янтарной кислоты или ее соли из культуральной жидкости.
Согласно заявляемому способу выращивание, выделение и очистку янтарной кислоты или ее соли из культуральной или подобной ей жидкости осуществляют способом, подобным традиционным способам ферментации, в которых янтарная кислота продуцируется с использованием микроорганизмов. В качестве питательной среды, используют как синтетическую, так и натуральную, при условии, что среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. К источникам углерода относят различные углеводы, такие как глюкоза и сахароза, а также различные органические полиолы, такие как глицерин. В качестве источника азота используют различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, зерновые или бобовые гидролизаты, ферментолизат микроорганизмов. В качестве минеральных добавок используют фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. При необходимости в питательную среду добавляют дополнительные источники СО2 и/или ионов НСО3 - и СО3 2- вводимые в среду за счет газообмена или же растворения соответствующих солей.
Выращивание и инкубацию осуществляют при температуре в пределах от 30°С до 37°С, предпочтительно в пределах от 35°С до 37°С. рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6,5 до 7,2. рН среды регулируют аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Обычно, культивирование в течение от 1-го до 5-ти дней приводит к накоплению янтарной кислоты в культуральной жидкости.
Заявляемый способ включает аэробную ростовую и анаэробную продуктивную стадии.
После культивирования твердые остатки, такие как клетки, удаляют из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем янтарная кислота или ее соль может быть выделена и очищена методами электродиализа, ионообменной хроматографии, обращеннофазовой хроматографии, концентрирования и/или кристаллизации.
Пример 1. Конструирование штаммов бактерий Escherichia coli.
Сконструированны и использованны следующие штаммы и плазмиды -


В качестве базового для конструирования всех рекомбинантных штаммов использован штамм дикого типа Escherichia coli K-12 MG1655 (ВКПМ В-6195). Плазмида pPYC, содержащая ген рус А, кодирующий функционально активную пируваткарбоксилазу из Bacillus subtilis, известна (RU 2466186).
1.1. Конструирование штамма MSG0.1.
Штамм MSG0.1 (Е. coli MG1655 ΔackA, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG) получен на основе штамма E.coli MG1655 в результате инактивации генов асkА, pta, рохВ, ldhA, adhE и ptsG с помощью рекомбинационной инженерии, основанной на методе, использующем λRed-зависимую гомологичную рекомбинацию. Принцип метода детально описан, например, в (Sawitzke J. et al., Recombineering: In Vivo Genetic Engineering in E.coli, S. enterica, and Beyond. Methods in Enzymology., 2007, 421:171-199), а примеры его практического применения, например, в (RU 2330883).
Первоначально все хромосомные модификации получены индивидуально с использованием в качестве реципиента штамма E.coli MG1655. На основе отобранных индивидуальных колоний штаммов, несущих маркированные целевые хромосомные модификации получены препараты соответствующих Р1-трансдуцирующих фагов. Далее серией последовательных трансдукций полученные модификации объединены в хромосоме целевого штамма. После каждого раунда трансдукций, из хромосомы полученных штаммов осуществляли удаление маркера устойчивости к антибиотику, фланкированного аттечмент сайтами фага лямбда, с использованием плазмиды pMWts-Int/Xis (WO 2007 013638; RU 2005123423), включающей гены Int/Xis зависимой системы сайт-специфической рекомбинации фага лямбда.
Сначала получены фрагменты ДНК для инактивации генов асkА, pta, рохВ, ldhA, adhE и ptsG.
Линейные фрагменты ДНК для делеций целевых генов получены при помощи ПЦР с использованием пар праймеров P1 (SEQ ID NO: 29) и Р2 (SEQ ID NO: 30), Р5 (SEQ ID NO: 31) и Р6 (SEQ ID NO: 32), P9 (SEQ ID NO: 33) и P10 (SEQ ID NO: 34), P13 (SEQ ID NO: 35) и P14 (SEQ ID NO: 36), P17 (SEQ ID NO: 37) и P18 (SEQ ID NO: 38) и плазмиды pMW118-attL-Cm-attR (Каташкина Ж.И. и др., Направленное изменение уровня экспрессии генов в бактериальной хромосоме. Мол. Биол., 2005, 39(5): 823-831) в качестве матрицы.
Праймеры P1, Р5, Р9, Р13 и Р17 содержат участки ДНК размером в 36 нуклеотидов, гомологичные участкам ДНК, расположенным на 5'-концах генов асkА, рохВ, ldhA, adhE и ptsG, и участки ДНК размером 28 нуклеотидов, комплементарные участку ДНК, расположенному на 3'-конце области attR. Праймеры Р2, Р6, P10, Р14 и Р18 содержат участки ДНК размером в 36 нуклеотидов, комплементарные участкам ДНК, расположенным на 3'-концах генов pta, рохВ, ldhA, adhE и ptsG, а также участки ДНК размером 28 нуклеотидов, гомологичные участку ДНК, расположенному на 5'-конце области attL. Температурный профиль для ПЦР: денатурация при 95°С в течение 5 мин; последующие 25 циклов: 30 сек при 95°С, 30 сек при 52°С, 1 мин при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксирибонуклеозидтрифосфаты производства Fermentas (Литва).
Полученные ПЦР-продукты длиной 1700 п.н. для инактивации генов асkА и pta, рохВ, ldhA, adhE и ptsG, индивидуально очищали электрофорезом в агарозном геле и выделяли, в соответствии с рекомендациями производителя, с помощью Qiagen QIAquick Gel Extraction Kit (Qiagen, США). Итоговые фрагменты содержат ген устойчивости к хлорамфениколу (ген cat, кодирующий хлорамфениколацетилтрансферазу), фланкированный сайтами attL и attR фага лямбда, а также 36-ти звенные области фланговой гомологии с кодирующими областями целевых генов.
Интеграцию полученных линейных фрагментов ДНК в хромосому штамма Е. coli MG1655 осуществляли с использованием системы Red-зависимой гомологичной рекомбинации фага λ.
Для этого рекомбинантные ДНК вводили электротрансформацией в индивидуальные клоны штамма Е. coli MG1655, содержащего плазмиду pKD46 с термочувствительным репликоном. Плазмида pKD46 (Datsenko K.А., Wanner B.L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12):6640-6645) содержит ДНК-фрагмент фага λ длиной 2154 п.н. (позиции с 31088 по 33241 нуклеотидной последовательности с инвентарным номером J02459 в базе данных GenBank), а также содержит гены λ Red-гомологичной системы рекомбинации (гены γ, β, ехо) под контролем промотора PаrаB, индуцируемого арабинозой. Плазмида pKD46 необходима для интеграции линейных ДНК в хромосому штамма.
Электрокомпетентные клетки штамма Е. coli MG1655, содержащего плазмиду pKD46, получали следующим образом: ночную культуру штамма Е. coli MG1655, содержащего плазмиду pKD46, выращивали при 30°С в среде LB с добавкой ампициллина (100 мг/л) и разводили в 100 раз, добавляя 10 мл среды SOB (Sambrook et al, "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989), содержащей ампициллин и L-арабинозу (10 мМ). Полученную культуру растили с перемешиванием при 30°С до достижения OD600≈0,8, после чего придавали клеткам свойства электрокомпетентности, путем концентрирования в 100 раз и трехкратного отмывания ледяной деионизированной Н2О. Электропорацию проводили с использованием 70 мкл клеток и ~300 нг индивидуального ПЦР-продукта. После электропорации клетки инкубировали в 1 мл среды SOC (Sambrook et al, "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989) при 37°C в течение 2,5 часов, после чего высевали на чашки с L-агаром, содержащим 30 мкг/мл хлорамфеникола, и выращивали при 37°С для отбора CmR-рекомбинантов. Удаление плазмиды-помощника pKD46 осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с селекцией устойчивых к хлорамфениколу и чувствительных к ампициллину CmRАрS вариантов.
Факты соответствия предполагаемых и полученных экспериментально структур хромосом отобранных CmRАрS колоний подтверждали ПЦР анализом с помощью пар локус-специфичных праймеров Р3 (SEQ ID NO: 39) и Р4 (SEQ ID NO: 40), Р7 (SEQ ID NO: 41) и P8 (SEQ ID NO: 42), P11 (SEQ ID NO: 43) и P12 (SEQ ID NO: 44), P15 (SEQ ID NO: 45) и P16 (SEQ ID NO: 46), P19 (SEQ ID NO: 47) и P20 (SEQ ID NO: 48), для оперона ackA-pta и генов рохВ, ldhA, adhE и ptsG, соответственно. Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С.
Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta, 1872 п.н. для интактного гена рохВ, 1299 п.н. для интактного гена ldhA, 2903 п.н. для интактного гена adhE и 1494 п.н. для интактного гена ptsG. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток мутантных штаммов, составляла 1920 п.н. для инактивированного оперона ackA-pta, 1852 п.н. для инактивированного гена рохВ, 2008 п.н. для инактивированного гена ldhA, 1926 п.н. для инактивированного гена adhE и 1759 п.н. для инактивированного гена ptsG.
На основе отобранных индивидуальных CmRApS колоний штаммов с замененными геном cat опероном ackA-pta и генами рохВ, ldhA, adhE и ptsG по стандартной методике (Sambrook et al, "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989) получены препараты соответствующих P1-трансдуцирующих фагов.
Штамм Ε. coli с делетированными генами асkА, pta получен переносом в хромосому штамма Е. coli MG1655 фрагмента хромосомы, с опероном ackA-pta, замененным геном cat, фланкированным аттечмент сайтами фага лямбда, с использованием препарата трансдуцирующего фага, несущего целевую маркированную генетическую модификацию. Для этого клетки штамма Е. coli MG1655 выращивали в течение ночи при 37°С в среде LB (Sambrook et al, "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989). Клетки из 500 мкл ночной культуры штамма-реципиента собирали центрифугированием, ресуспендировали в 100 мкл буфера, содержащего 0,1 M MgSO4 и 5 мМ СаСl2, добавляли препарат трансдуцирующего фага, в разведении соответствующем 109 фаговых частиц/мл, и инкубировали 20 мин при 37°С. Клетки осаждали центрифугированием, промывали 1 мл стерильной воды, высевали на чашку с L-агаром, содержащим 30 мкг/мл хлорамфеникола, и выращивали при 37°С для отбора CmR-трансдуктантов. Очистку полученных трансдуктантов от остаточных фаговых частиц осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с последующей селекцией устойчивых к хлорамфениколу CmR вариантов. В хромосомах клонов, формирующих наиболее быстрорастущие колонии правильной формы, подтверждали замену генов оперона ackA-pta геном cat, фланкированным аттечмент сайтами фага лямбда, ПЦР анализом с помощью локус-специфичных праймеров Р3 (SEQ ID NO: 39) и Р4 (SEQ ID NO: 40). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток полученных трансдуктантов, составляла 1920 п.н. для оперона ackA-pta, замененного геном cat, фланкированным аттечмент сайтами фага лямбда. С целью удаления из хромосом трансдуктантов маркера устойчивости к антибиотику, отобранные клоны трансформировали плазмидой pMWts-Int/Xis (WO 2007 013638; RU 2005123423). Селекция трансформированных клонов производилась с использованием среды LB, содержащей ампициллин (100 мкг/мл). Ген cat был удален из трансформированных клонов путем выращивания отдельных колоний штаммов на чашках с LB средой с селекцией чувствительных к хлорамфениколу и устойчивых к ампициллину CmSApR вариантов. Удаление гена cat из хромосом трансдуктантов и делецию в них генов оперона ackA-pta подтверждали ПЦР с помощью соответствующих локус-специфичных праймеров Р3 и Р4. Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток штамма с делетированным опероном ackA-pta, составляла 323 п.н.. В результате последующего излечивания клонов от плазмиды-помощника pMWts-Int/Xis, проведенного с помощью повторного рассева до отдельных колоний на чашках с LB средой и селекции CmSApS-вариантов, получен штамм Е. coli MG1655 (ΔасkА, Δpta) с делетированным генами асkА, pta.
Штамм Е. coli с делетированными генами асkА, pta и рохВ получен переносом в хромосому штамма Е. coli MG1655 (ΔackA-pta) фрагмента хромосомы, с геном рохВ, замененным геном cat, фланкированным аттечмент сайтами фага лямбда, с использованием препарата трансдуцирующего фага, несущего целевую маркированную генетическую модификацию, как описано выше. Очистку полученных трансдуктантов от остаточных фаговых частиц осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с последующей селекцией устойчивых к хлорамфениколу CmR вариантов. В хромосомах клонов, формирующих наиболее быстрорастущие колонии правильной формы, подтверждали замену гена рохВ геном cat, фланкированным аттечмент сайтами фага лямбда, ПЦР анализом с помощью локус-специфичных праймеров Р7 (SEQ ID NO: 41) и Р8 (SEQ ID NO: 42). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MG1655 (ΔасkА, Δpta), составляла 1872 п.н. для интактного гена рохВ. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток полученных трансдуктантов, составляла 1852 п.н. для гена рохВ, замененного геном cat, фланкированным аттечмент сайтами фага лямбда. С целью удаления из хромосом трансдуктантов маркера устойчивости к антибиотику, отобранные клоны трансформировали плазмидой pMWts-Int/Xis (WO 2007 013638; RU 2005123423). Селекция трансформированных клонов производилась с использованием среды LB, содержащей ампициллин (100 мкг/мл). Ген cat был удален из трансформированных клонов путем выращивания отдельных колоний штаммов на чашках с LB средой с селекцией чувствительных к хлорамфениколу и устойчивых к ампициллину CmSApR вариантов. Удаление гена cat из хромосом трансдуктантов и делецию в них генов оперона ackA-pta и гена рохВ подтверждали ПЦР с помощью соответствующих пар локус-специфичных праймеров Р3 (SEQ ID NO: 39), Р4 (SEQ ID NO: 40) и P7 (SEQ ID NO: 41), P8 (SEQ ID NO: 42). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток исходного штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta и 1872 п.н. для интактного гена рохВ. Длина соответствующих продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток штамма с делетированными опероном ackA-pta и геном рохВ, составляла 323 п.н. и 255 п.н.. В результате последующего излечивания клонов от плазмиды-помощника pMWts-Int/Xis, проведенного с помощью повторного рассева до отдельных колоний на чашках с LB средой и селекции CmSApS-вариантов, получен штамм Е. coli MG1655 (ΔасkА, Δpta, ΔрохВ) с делетированным генами ackA-pta и рохВ.
Штамм Е. coli с делетированными генами асkА, pta, рохВ и ldhA получен переносом в хромосому штамма Е. coli MG1655 (ΔасkА, Δpta, ΔрохВ) фрагмента хромосомы, с геном ldhA, замененным геном cat, фланкированным аттечмент сайтами фага лямбда, с использованием препарата трансдуцирующего фага, несущего целевую маркированную генетическую модификацию, как описано выше. Очистку полученных трансдуктантов от остаточных фаговых частиц осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с последующей селекцией устойчивых к хлорамфениколу CmR вариантов. В хромосомах клонов, формирующих наиболее быстрорастущие колонии правильной формы, подтверждали замену гена ldhA геном cat, фланкированным аттечмент сайтами фага лямбда, ПЦР анализом с помощью локус-специфичных праймеров Ρ11 (SEQ ID NO: 43) и P12 (SEQ ID NO: 44). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MG1655 (ΔackA-pta, ΔрохВ), составляла 1299 п.н. для интактного гена ldhA. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток полученных трансдуктантов, составляла 2008 п.н. для гена ldhA, замененного геном cat, фланкированным аттечмент сайтами фага лямбда. С целью удаления из хромосом трансдуктантов маркера устойчивости к антибиотику, отобранные клоны трансформировали плазмидой pMWts-Int/Xis (WO 2007 013638; RU 2005123423). Селекция трансформированных клонов производилась с использованием среды LB, содержащей ампициллин (100 мкг/мл). Ген cat был удален из трансформированных клонов путем выращивания отдельных колоний штаммов на чашках с LB средой с селекцией чувствительных к хлорамфениколу и устойчивых к ампициллину CmSApR вариантов. Удаление гена cat из хромосом трансдуктантов и делецию в них генов оперона ackA-pta, гена рохВ и гена ldhA подтверждали ПЦР с помощью соответствующих пар локус-специфичных праймеров Р3 (SEQ ID NO: 39) и Р4 (SEQ ID NO: 40), Р7 (SEQ ID NO: 41) и P8 (SEQ ID NO: 42), P11 (SEQ ID NO: 43) и P12 (SEQ ID NO: 44). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток исходного штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta, 1872 п.н. для интактного гена рохВ и 1299 п.н. для интактного гена ldhA. Длина соответствующих продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток штамма с делетированными опероном ackA-pta, геном рохВ и геном ldhA составляла 323 п.н., 255 п.н. и 411 п.н.. В результате излечивания клонов от плазмиды-помощника pMWts-Int/Xis, проведенного с помощью повторного рассева до отдельных колоний на чашках с LB средой и селекции CmSApS-вариантов, получен штамм Е. coli MG1655 (ΔасkА, Δpta, ΔрохВ, ΔldhA) с делетированным генами асkА, pta, рохВ и ldhA.
Штамм Е. coli с делетированными генами асlА, pta, рохВ, ldhA и adhE получен переносом в хромосому штамма Е. coli MG1655 (ΔасkА, Δpta, ΔрохВ, ΔldhA) фрагмента хромосомы, с геном adhE, замененным геном cat, фланкированным аттечмент сайтами фага лямбда, с использованием препарата трансдуцирующего фага, несущего целевую маркированную генетическую модификацию, как описано выше. Очистку полученных трансдуктантов от остаточных фаговых частиц осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с последующей селекцией устойчивых к хлорамфениколу CmR вариантов. В хромосомах клонов, формирующих наиболее быстрорастущие колонии правильной формы, подтверждали замену гена adhE геном cat, фланкированным аттечмент сайтами фага лямбда, ПЦР анализом с помощью локус-специфичных праймеров Р15 (SEQ ID NO: 45) и PI6 (SEQ ID NO: 46). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С.Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MG1655 (ΔackA, Δpta, ΔpoxB, ΔldhA), составляла 2903 п.н. для интактного гена adhE. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток полученных трансдуктантов, составляла 1926 п.н. для гена adhE, замененного геном cat, фланкированным аттечмент сайтами фага лямбда. С целью удаления из хромосом трансдуктантов маркера устойчивости к антибиотику, отобранные клоны трансформировали плазмидой pMWts-Int/Xis (WO 2007 013638; RU 2005123423). Селекция трансформированных клонов производилась с использованием среды LB, содержащей ампициллин (100 мкг/мл). Ген cat был удален из трансформированных клонов путем выращивания отдельных колоний штаммов на чашках с LB средой с селекцией чувствительных к хлорамфениколу и устойчивых к ампициллину CmSАрR вариантов. Удаление гена cat из хромосом трансдуктантов и делению в них генов оперона ackA-pta, гена рохВ, гена ldhA и гена adhE подтверждали ПЦР с помощью соответствующих пар локус-специфичных праймеров Р3 (SEQ ID NO: 39) и Р4 (SEQ ID NO: 40), Р7 (SEQ ID NO: 41) и P8 (SEQ ID NO: 42), P11 (SEQ ID NO: 43) и P12 (SEQ ID NO: 44), P15 (SEQ ID NO: 45) и P16 (SEQ ID NO: 46). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток исходного штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta, 1872 п.н. для интактного гена рохВ, 1299 п.н. для интактного гена ldhA и 2903 п.н. для интактного гена adhE. Длина соответствующих продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток штамма с делетированными опероном ackA-pta, геном рохВ, геном ldhA и геном adhE составляла 323 п.н., 255 п.н., 411 п.н. и 329 п.н.. В результате излечивания клонов от плазмиды-помощника pMWts-Int/Xis, проведенного с помощью повторного рассева до отдельных колоний на чашках с LB средой и селекции CmSApS-вариантов, получен штамм E.coli MG1655 (ΔackA, Δpta, ΔpoxB, ΔldhA, ΔadhE) с инактивированными генами асkА, pta, рохВ, ldhA и adhE.
Штамм Ε. coli с делегированными генами ackA-pta, рохВ, ldhA, adhE и ptsG получен переносом в хромосому штамма Е. coli MG1655 (ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE) фрагмента хромосомы, с геном ptsG, замененным геном cat, фланкированным аттечмент сайтами фага лямбда, с использованием препарата трансдуцирующего фага, несущего целевую маркированную генетическую модификацию, как описано выше. Очистку полученных трансдуктантов от остаточных фаговых частиц осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с последующей селекцией устойчивых к хлорамфениколу CmR вариантов. В хромосомах клонов, формирующих наиболее быстрорастущие колонии правильной формы, подтверждали замену гена ptsG геном cat, фланкированным аттечмент сайтами фага лямбда, ПЦР анализом с помощью локус-специфичных праймеров Р19 (SEQ ID NO: 47) и Р20 (SEQ ID NO: 48). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MG1655 (ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE), составляла 1494 п.н. для интактного гена ptsG. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток полученных трансдуктантов, составляла 1759 п.н. для гена ptsG, замененного геном cat, фланкированным аттечмент сайтами фага лямбда. С целью удаления из хромосом трансдуктантов маркера устойчивости к антибиотику, отобранные клоны трансформировали плазмидой pMWts-Int/Xis (WO 2007 013638; RU 2005123423). Селекция трансформированных клонов производилась с использованием среды LB, содержащей ампициллин (100 мкг/мл). Ген cat был удален из трансформированных клонов путем выращивания отдельных колоний штаммов на чашках с LB средой с селекцией чувствительных к хлорамфениколу и устойчивых к ампициллину CmSАрR вариантов. Удаление гена cat из хромосом трансдуктантов и делецию в них генов оперона ackA-pta, гена рохВ, гена ldhA, гена adhE и гена ptsG подтверждали ПЦР с помощью соответствующих пар локус-специфичных праймеров Р3 (SEQ ID NO: 39) и Р4 (SEQ ID NO: 40), Р7 (SEQ ID NO: 41) и P8 (SEQ ID NO: 42), P11 (SEQ ID NO: 43) и P12 (SEQ ID NO: 44), P15 (SEQ ID NO: 45) и P16 (SEQ ID NO: 46), P19 (SEQ ID NO: 47) и P20 (SEQ ID NO: 48). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток исходного штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta, 1872 п.н. для интактного гена рохВ, 1299 п.н. для интактного гена ldhA, 2903 п.н. для интактного гена adhE и 1494 п.н. для интактного гена ptsG. Длина соответствующих продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток штамма с делетированными опероном ackA-pta, геном рохВ, геном ldhA, геном adhE и геном ptsG составляла 323 п.н., 255 п.н., 411 п.н., 329 п.н. и 162 п.н.. В результате излечивания клонов от плазмиды-помощника pMWts-Int/Xis, проведенного с помощью повторного рассева до отдельных колоний на чашках с LB средой и селекции CmSАрS-вариантов, получен штамм Е. coli MG1655 (ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG) с инактивированными генами асkА, pta, рохВ, ldhA, adhE и ptsG, названный MSG0.1.
1.2. Конструирование штамма MSG0.2.
Штамм MSG0.2 (Е. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, Ptac-galP) получен на основе штамма MSG0.1 (Е. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG) в результате замены в нем нативной регуляторной области гена galP промотором Ptac.
Первоначально целевая хромосомная модификации была получена индивидуально с использованием в качестве реципиента штамма E.coli MG1655. Для усиления экспрессии гена galP укороченный вариант промотора Рtac, обеспечивающий конститутивную транскрипцию в LacI позитивных штаммах, был интегрирован в хромосому реципиентного штамма перед кодирующим участком гена galP. На основе полученного штамма, несущего маркированную целевую хромосомную модификацию получен препарат соответствующего Ρ1-трансдуцирующего фага. Далее P1-трансдукций полученная модификация была внесена в хромосому целевого штамма. После трансдукции, из хромосомы полученного штамма осуществляли удаление маркера устойчивости к антибиотику, фланкированного аттечмент сайтами фага лямбда, с использованием плазмиды pMWts-Int/Xis (WO 2007 013638; RU 2005123423), включающей гены Int/Xis зависимой системы сайт-специфической рекомбинации фага лямбда.
Сначала был получен фрагмент ДНК для замены нативной регуляторной области гена galP.
Получение вышеупомянутого искусственного фрагмента ДНК, для интеграции в соответствующий участок бактериальной хромосомы, осуществлялось в несколько стадий. На первой стадии, с помощью ПЦР получен фрагмент ДНК, содержащий в начале участок узнавания эндонуклеазы рестрикции BglII, промотор Ptас, 18 нуклеотидов комплементарных области предшествующей кодирующей части гена galP и 18 нуклеотидов комплементарных 5'-концевой области кодирующей части гена gal Р. ПЦР проводили с использованием праймеров Р21 (SEQ ID NO: 49) и Р22 (SEQ ID NO: 50) и плазмиды pDR540 (последовательность с инвентарным номером U13847 в базе данных GenBank; gi: 595699) в качестве матрицы. Праймер Р21 содержит участок узнавания BglII и область гомологичную 5'-концу промотора Рtас. Праймер Р22 содержит 18 нуклеотидов комплементарных области предшествующей кодирующей части гена galP, 18 нуклеотидов комплементарных 5'-концевой области кодирующей части гена galP и область, комплементарную 3'-концу промотора Ptac. Температурный профиль для ПЦР: денатурация при 95°С в течение 5 мин; последующие 25 циклов: 30 сек при 95°С, 30 сек при 51°С, 60 сек при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Pfu ДНК полимеразу, соответствующий буфер и дезоксирибонуклеозидтрифосфаты производства Fermentas (Литва).
Параллельно осуществляли вторую стадию конструирования фрагмента ДНК. Фрагмент ДНК, содержащий маркер CmR, кодируемый геном cat, получен при помощи ПЦР с использованием праймеров Р23 (SEQ ID NO: 51) и Р24 (SEQ ID NO: 52) и плазмиды pMW118-attL-Cm-attR (Каташкина Ж.И. и др., Направленное изменение уровня экспрессии генов в бактериальной хромосоме. Мол. Биол., 2005, 39(5):823-831) в качестве матрицы. Праймер Р23 содержит 36 нуклеотидов гомологичных участку ДНК, расположенному на 174 нуклеотида ранее кодирующей области гена galP и участок ДНК размером 28 нуклеотидов, комплементарный участку ДНК, расположенному на 3'-конце области attR. Праймер Р24 содержит участок узнавания BglII и участок ДНК размером 28 нуклеотидов, гомологичный участку ДНК, расположенному на 5'-конце области attL. Температурный профиль для ПЦР: денатурация при 95°С в течение 5 мин; последующие 25 циклов: 30 сек при 95°С, 30 сек при 52°С, 1 мин при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва).
Полученные фрагменты ДНК очищали в агарозном геле и выделяли, в соответствии с рекомендациями производителя, с помощью Qiagen QIAquick Gel Extraction Kit, с последующим осаждением этанолом.
Два полученных фрагмента ДНК были обработаны эндонуклеазой рестрикции BglII с последующим лигированием с использованием Т4 ДНК-лигазы в соответствии со стандартной процедурой (Maniatis T., Fritsch E.F., Sambrook, J.: Molecular Cloning:A Laboratory Manual. 2nd edn. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press, 1989).
Продукт лигирования амплифицировали с помощью ПЦР с использованием праймеров Р22 (SEQ ID NO: 50) и Р23 (SEQ ID NO: 51). Температурный профиль для ПЦР: денатурация при 98°С в течение 1 мин; последующие 30 циклов: 15 сек при 98°С, 15 сек при 55°С, 1 мин при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Phusion ДНК полимеразу и соответствующий буфер производства Finnzymes; дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Полученный ПЦР-продукт длиной 1756 п.н., очищали электрофорезом в агарозном геле и выделяли, в соответствии с рекомендациями производителя, с помощью Qiagen QIAquick Gel Extraction Kit (Qiagen, США). Итоговый фрагмент содержал промотор Ptac, ген устойчивости к хлорамфениколу (ген cat, кодирующий хлорамфениколацетилтрансферазу), фланкированный сайтами attL и attR фага лямбда, а также 36-ти звенные области фланговой гомологии с участком ДНК предшествующим кодирующей области гена galP и участком ДНК, включающим 5'-регион кодирующей области гена galP.
Интеграцию полученного линейного фрагмента ДНК в хромосому штамма E.coli MG1655 осуществляли с использованием системы Red-зависимой гомологичной рекомбинации фага λ.
Для этого рекомбинантную ДНК вводили электротрансформацией в клетки штамма E.coli MG1655, содержащего плазмиду pKD46 (Datsenko К.А., Wanner B.L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12):6640-6645).
Электрокомпетентные клетки штамма E.coli MG1655, содержащего плазмиду pKD46, получали как описано выше. Электропорацию проводили с использованием 70 мкл клеток и ~300 нг индивидуального ПЦР-продукта. После электропорации клетки инкубировали в 1 мл среды SOC (Sambrook et al, "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989) при 37°C в течение 2,5 часов, после чего высевали на чашки с L-агаром, содержащим 30 мкг/мл хлорамфеникола, и выращивали при 37°С для отбора CmR-рекомбинантов. Удаление плазмиды-помощника pKD46 осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с селекцией устойчивых к хлорамфениколу и чувствительных к ампициллину CmRApS вариантов.
Факт соответствия предполагаемой и полученной экспериментально структур хромосомы соответствующих CmRАрS колоний подтверждали ПЦР анализом с помощью локус-специфичных праймеров Р25 (SEQ ID NO: 53) и P26 (SEQ ID NO: 54). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MG1655 и праймеров Р25 и Р26 составляла 317 п.н. для интактной регуляторной области гена galP. Длина продукта ПЦР, полученного в результате реакции с использованием в качестве матрицы клеток мутантного штамма и праймеров Р25 и Р26, составляла 1845 п.н. для модифицированной регуляторной области гена galP. Также в хромосомах полученных клонов соответствие запланированной и экспериментально полученной нуклеотидной последовательности нового регуляторного элемента, введенного перед кодирующей областью гена galP, было подтверждено секвенированием.
На основе отобранного CmRApS варианта штамма, в котором нативная регуляторная область гена galP заменена промотором Рtac, сопряженным с геном cat, фланкированным аттечмент сайтами фага лямбда, получен препарат соответствующего Р1-трансдуцирующего фага.
Штамм Е. coli с делетированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, и усиленной экспрессией гена galP, получен переносом в хромосому штамма MSG0.1 (Е. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG) фрагмента хромосомы, в котором нативная регуляторная область гена galP заменена промотором Ptac, сопряженным с геном cat, фланкированным аттечмент сайтами фага лямбда, с использованием препарата трансдуцирующего фага, несущего целевую маркированную генетическую модификацию, как описано выше. Очистку полученных трансдуктантов от остаточных фаговых частиц осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с последующей селекцией устойчивых к хлорамфениколу CmR вариантов. В хромосомах клонов, формирующих наиболее быстрорастущие колонии правильной формы, замену нативной регуляторной области гена galP промотором Ptac, сопряженным с геном cat, фланкированным аттечмент сайтами фага лямбда, подтверждали ПЦР анализом с помощью локус-специфичных праймеров Р25 (SEQ ID NO: 53) и Р26 (SEQ ID NO: 54). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MSG0.1, составляла 317 п.н. для интактной регуляторной области гена galP. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток полученных трансдуктантов, составляла 1845 п.н. п.н. для регуляторной области гена galP, замененной промотором Ptac, сопряженным с геном cat, фланкированным аттечмент сайтами фага лямбда. С целью удаления из хромосом трансдуктантов маркера устойчивости к антибиотику, отобранные клоны трансформировали плазмидой pMWts-Int/Xis. Селекция трансформированных клонов производилась с использованием среды LB, содержащей ампициллин (100 мкг/мл). Ген cat был удален из трансформированных клонов путем выращивания отдельных колоний штаммов на чашках с LB средой с селекцией чувствительных к хлорамфениколу и устойчивых к ампициллину CmSApR вариантов. Удаление гена cat из хромосом трансдуктантов и делецию в них генов оперона ackA-pta, гена рохВ, гена ldhA, гена adhE, и гена ptsG, а также факт наличия промотора Ptac, перед геном galP, подтверждали ПЦР с помощью соответствующих пар локус-специфичньгх праймеров Р3 (SEQ ID NO: 39) и Р4 (SEQ ID NO: 40), Р7 (SEQ ID NO: 41) и P8 (SEQ ID NO: 42), P11 (SEQ ID NO: 43) и P12 (SEQ ID NO: 44), P15 (SEQ ID NO: 45) и P16 (SEQ ID NO: 46), P19 (SEQ ID NO: 47) и P20 (SEQ ID NO: 48), P25 (SEQ ID NO: 53) и P26 (SEQ ID NO: 54). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток исходного штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta, 1872 п.н. для интактного гена рохВ, 1299 п.н. для интактного гена ldhA, 2903 п.н. для интактного гена adhE, 1494 п.н. для интактного гена ptsG и 317 п.н. для интактной регуляторной области гена galP. Длина соответствующих продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток штамма с делетированными опероном ackA-pta, геном рохВ, геном ldhA, геном adhE, геном ptsG и содержащими промотор Ptac перед геном galP составляла 323 п.н., 255 п.н., 411 п.н., 329 п.н., 162 п.н. и 248 п.н.. В результате излечивания клонов от плазмиды-помощника pMWts-Int/Xis, проведенного с помощью повторного рассева до отдельных колоний на чашках с LB средой и селекции CmSApS-вариантов, получен штамм Е. coli MG1655 (ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, Ptac-galP) с инактивированными генами асkА, pta, poxΒ, ldhA, adhE и ptsG, и усиленной экспрессией гена galP, названный MSG0.2.
1.3. Конструирование штамма MSG1.0.
Штамм MSG1.0 (Е. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, Ptac-galP, PL-glk) получен на основе штамма MSG0.2 (Ε. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, Ptac-galP) в результате замены в нем нативной регуляторной области гена glk промотором PL фага лямбда.
Первоначально целевая хромосомная модификации была получена индивидуально с использованием в качестве реципиента штамма E.coli MG1655. Для усиления экспрессии гена glk промотор PL фага лямбда был интегрирован в хромосому реципиентного штамма перед кодирующим участком гена glk. На основе полученного штамма, несущего маркированную целевую хромосомную модификацию получен препарат соответствующего P1-трансдуцирующего фага. Далее Р1-трансдукций полученная модификация была внесена в хромосому целевого штамма. После трансдукции, из хромосомы полученного штамма осуществляли удаление маркера устойчивости к антибиотику, фланкированного аттечмент сайтами фага лямбда, с использованием плазмиды pMWts-Int/Xis (WO 2007 013638; RU 2005123423), включающей гены Int/Xis зависимой системы сайт-специфической рекомбинации фага лямбда.
Сначала был получен фрагмент ДНК для замены нативной регуляторной области гена glk.
Получение вышеупомянутого искусственного фрагмента ДНК, для интеграции в соответствующий участок бактериальной хромосомы, осуществлялось в несколько стадий. На первой стадии, с помощью ПЦР получен фрагмент ДНК, содержащий в начале участок узнавания эндонуклеазы рестрикции BglII, PL фага лямбда и 35 нуклеотидов комплементарных области предшествующей кодирующей части гена glk. ПЦР проводили с использованием праймеров Р27 (SEQ ID NO: 55) и Р28 (SEQ ID NO: 56) и геномной ДНК фага лямбда (последовательность с инвентарным номером NC_001416.1 в базе данных GenBank, gi: 9626243) в качестве матрицы. Праймер Р27 содержит участок узнавания BglII и область гомологичную 5'-концу промотора PL. Праймер Р28 содержит 35 нуклеотидов комплементарных области предшествующей кодирующей части гена glk и область, комплементарную 3'-концу промотора PL. Температурный профиль для ПЦР: денатурация при 95°С в течение 5 мин; последующие 25 циклов: 30 сек при 95°С, 30 сек при 51°С, 60 сек при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Pfu ДНК полимеразу, соответствующий буфер и дезоксирибонуклеозидтрифосфаты производства Fermentas (Литва).
Параллельно осуществляли вторую стадию конструирования фрагмента ДНК. Фрагмент ДНК, содержащий маркер CmR, кодируемый геном cat, получен при помощи ПЦР с использованием праймеров Р29 (SEQ ID NO: 57) и Р24 (SEQ ID NO: 52) и плазмиды pMW118-attL-Cm-attR (Каташкина Ж.И. и др., Направленное изменение уровня экспрессии генов в бактериальной хромосоме. Мол. Биол., 2005, 39(5):823-831) в качестве матрицы. Праймер Р29 содержит 36 нуклеотидов гомологичных участку ДНК, расположенному на 135 нуклеотида ранее кодирующей области гена glk и участок ДНК размером 28 нуклеотидов, комплементарный участку ДНК, расположенному на 3'-конце области attR. Праймер Р24 содержит участок узнавания BglII и участок ДНК размером 28 нуклеотидов, гомологичный участку ДНК, расположенному на 5'-конце области attL. Температурный профиль для ПЦР: денатурация при 95°С в течение 5 мин; последующие 25 циклов: 30 сек при 95°С, 30 сек при 52°С, 1 мин при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва).
Полученные фрагменты ДНК очищали в агарозном геле и выделяли, в соответствии с рекомендациями производителя, с помощью Qiagen QIAquick Gel Extraction Kit, с последующим осаждением этанолом.
Два полученных фрагмента ДНК были обработаны эндонуклеазой рестрикции BglII с последующим лигированием с использованием Т4 ДНК-лигазы в соответствии со стандартной процедурой (Maniatis T., Fritsch E.F., Sambrook, J.: Molecular Cloning:A Laboratory Manual. 2nd edn. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press, 1989).
Продукт лигирования амплифицировали с помощью ПЦР с использованием праймеров Р28 (SEQ ID NO: 56) и Р29 (SEQ ID NO: 57). Температурный профиль для ПЦР: денатурация при 98°С в течение 1 мин; последующие 30 циклов: 15 сек при 98°С, 15 сек при 55°С, 1 мин при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Phusion ДНК полимеразу и соответствующий буфер производства Finnzymes; дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Полученный ПЦР-продукт длиной 1955 п.н., очищали электрофорезом в агарозном геле и выделяли, в соответствии с рекомендациями производителя, с помощью Qiagen QIAquick Gel Extraction Kit (Qiagen, США). Итоговый фрагмент содержал промотор PL фага лямбда, ген устойчивости к хлорамфениколу (ген cat, кодирующий хлорамфениколацетилтрансферазу), фланкированный сайтами attL и attR фага лямбда, а также области фланговой гомологии с участком ДНК предшествующим кодирующей области гена glk на 135 нуклеотидов и участком ДНК непосредственно предшествующим кодирующей области гена glk.
Интеграцию полученного линейного фрагмента ДНК в хромосому штамма Е. coli MG1655 осуществляли с использованием системы Red-зависимой гомологичной рекомбинации фага λ.
Для этого рекомбинантную ДНК вводили электротрансформацией в клетки штамма Е, coli MG1655, содержащего плазмиду pKD46 (Datsenko К.А., Wanner B.L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12):6640-6645).
Электрокомпетентные клетки штамма Ε. coli MG1655, содержащего плазмиду pKD46, получали как описано выше. Электропорацию проводили с использованием 70 мкл клеток и ~300 нг индивидуального ПЦР-продукта. После электропорации клетки инкубировали в 1 мл среды SOC (Sambrook et al, "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989) при 37°C в течение 2,5 часов, после чего высевали на чашки с L-агаром, содержащим 30 мкг/мл хлорамфеникола, и выращивали при 37°С для отбора CmR-рекомбинантов. Удаление плазмиды-помощника pKD46 осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с селекцией устойчивых к хлорамфениколу и чувствительных к ампициллину CmRApS вариантов.
Факт соответствия предполагаемой и полученной экспериментально структур хромосомы соответствующих CmRApS колоний подтверждали ПЦР анализом с помощью локус-специфичных праймеров Р30 (SEQ ID NO: 58) и Р31 (SEQ ID NO: 59). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MG1655 и праймеров Р30 и Р31 составляла 234 п.н. для интактной регуляторной области гена glk. Длина продукта ПЦР, полученного в результате реакции с использованием в качестве матрицы клеток мутантного штамма и праймеров Р30 и Р31, составляла 2015 п.н. для модифицированной регуляторной области гена glk. Также в хромосомах полученных клонов соответствие запланированной и экспериментально полученной нуклеотидной последовательности нового регуляторного элемента, введенного перед кодирующей областью гена glk, было подтверждено секвенированием.
На основе отобранного CmRАрS варианта штамма, в котором нативная регуляторная область гена glk заменена промотором PL фага лямбда, сопряженным с геном cat, фланкированным аттечмент сайтами фага лямбда, получен препарат соответствующего Ρ1-трансдуцирующего фага.
Штамм Е. coli с делетированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, и усиленной экспрессией генов galP и glk, получен переносом в хромосому штамма MSG0.2. (Е. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, Ptac-galP) фрагмента хромосомы, в котором нативная регуляторная область гена glk заменена промотором PL фага лямбда, сопряженным с геном cat, фланкированным аттечмент сайтами фага лямбда, с использованием препарата трансдуцирующего фага, несущего целевую маркированную генетическую модификацию, как описано выше. Очистку полученных трансдуктантов от остаточных фаговых частиц осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с последующей селекцией устойчивых к хлорамфениколу CmR вариантов. В хромосомах клонов, формирующих наиболее быстрорастущие колонии правильной формы, замену нативной регуляторной области гена glk промотором PL фага лямбда, сопряженным с геном cat, фланкированным аттечмент сайтами фага лямбда, подтверждали ПЦР анализом с помощью локус-специфичных праймеров Р30 (SEQ ID NO: 58) и Р31 (SEQ ID NO: 59). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MSG0.2, составляла 234 п.н. для интактной регуляторной области гена glk. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток полученных трансдуктантов, составляла 2015 п.н. п.н. для регуляторной области гена glk, замененной промотором PL фага лямбда, сопряженным с геном cat, фланкированным аттечмент сайтами фага лямбда. С целью удаления из хромосом трансдуктантов маркера устойчивости к антибиотику, отобранные клоны трансформировали плазмидой pMWts-Int/Xis. Селекция трансформированных клонов производилась с использованием среды LB, содержащей ампициллин (100 мкг/мл). Ген cat был удален из трансформированных клонов путем выращивания отдельных колоний штаммов на чашках с LB средой с селекцией чувствительных к хлорамфениколу и устойчивых к ампициллину CmSApR вариантов. Удаление гена cat из хромосом трансдуктантов и делецию в них генов оперона ackA-pta, гена рохВ, гена ldhA, гена adhE, и гена ptsG, а также факт наличия промотора Ptac, перед геном galP, и промотора PL фага лямбда перед геном glk подтверждали ПЦР с помощью соответствующих пар локус-специфичных праймеров Р3 (SEQ ID NO: 39) и Р4 (SEQ ID NO: 40), Р7 (SEQ ID NO: 41) и P8 (SEQ ID NO: 42), P11 (SEQ ID NO: 43) и P12 (SEQ ID NO: 44), P15 (SEQ ID NO: 45) и P16 (SEQ ID NO: 46), P19 (SEQ ID NO: 47) и P20 (SEQ ID NO: 48), P25 (SEQ ID NO: 53) и P26 (SEQ ID NO: 54), P30 (SEQ ID NO: 58) и P31 (SEQ ID NO: 59). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток исходного штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta, 1872 п.н. для интактного гена рохВ, 1299 п.н. для интактного гена ldhA, 2903 п.н.для интактного гена adhE, 1494 п.н. для интактного гена ptsG, 317 п.н. для интактной регуляторной области гена galP и 234 п.н. для интактной регуляторной области гена glk. Длина соответствующих продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток штамма с делетированными опероном ackA-pta, геном рохВ, геном ldhA, геном adhE, геном ptsG и содержащими промотор Ptac перед геном galP и промотор PL фага лямбда перед геном glk составляла 323 п.н., 255 п.н., 411 п.н., 329 п.н., 162 п.н., 248 п.н. и 418 п.н.. В результате излечивания клонов от плазмиды-помощника pMWts-Int/Xis, проведенного с помощью повторного рассева до отдельных колоний на чашках с LB средой и селекции CmSApS-вариантов, получен штамм Е. coli MG1655 (ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, Ptac-galP, PL-glk) с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, и усиленной экспрессией генов galP и glk, названный MSG1.0.
1.4. Конструирование штамма MSG1.1.
Штамм MSG1.1 (Е. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, ΔiclR, Ptac-galP, PL-glk) получен на основе штамма MSG1.0 (Ε. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, Ptac-galP, PL-glk) в результате инактивации в нем гена iclR.
Первоначально целевая хромосомная модификации была получена индивидуально с использованием в качестве реципиента штамма E.coli MG1655. На основе полученного штамма, несущего маркированную целевую хромосомную модификацию получен препарат соответствующего Р1-трансдуцирующего фага. Далее Р1-трансдукций полученная модификация внесена в хромосому целевого рекомбинантного штамма. После трансдукции, из хромосомы полученного штамма осуществляли удаление маркера устойчивости к антибиотику, фланкированного аттечмент сайтами фага лямбда, с использованием плазмиды pMWts-Int/Xis (WO 2007 013638; RU 2005 123423), включающей гены Int/Xis зависимой системы сайт-специфической рекомбинации фага лямбда.
Сначала был получен фрагмент ДНК для инактивации гена iclR.
Линейный фрагмент ДНК для делении целевого гена получен при помощи ПЦР с использованием праймеров Р32 (SEQ ID NO: 60) и Р33 (SEQ ID NO: 61) и плазмиды pMW118-attL-Cm-attR (Каташкина Ж.И. и др., Направленное изменение уровня экспрессии генов в бактериальной хромосоме. Мол. Биол., 2005, 39(5):823-831) в качестве матрицы.
Праймер Р32 содержит участок ДНК размером в 36 нуклеотидов, гомологичный участку ДНК, расположенному на 5'-конце гена iclR и участок ДНК размером 28 нуклеотидов, комплементарный участку ДНК, расположенному на 3'-конце области attR. Праймер Р33 содержит участок ДНК размером в 36 нуклеотидов, комплементарный участку ДНК, расположенному на 3'-конце гена iclR, а также участок ДНК размером 28 нуклеотидов, гомологичный участку ДНК, расположенному на 5'-конце области attL. Температурный профиль для ПЦР: денатурация при 95°С в течение 5 мин; последующие 25 циклов: 30 сек при 95°С, 30 сек при 52°С, 1 мин при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксирибонуклеозидтрифосфаты производства Fermentas (Литва).
Полученный ПЦР-продукт длиной 1700 п.н. для инактивации гена iclR очищали электрофорезом в агарозном геле и выделяли, в соответствии с рекомендациями производителя, с помощью Qiagen QIAquick Gel Extraction Kit (Qiagen, США). Итоговый фрагмент содержит ген устойчивости к хлорамфениколу (ген cat, кодирующий хлорамфениколацетилтрансферазу), фланкированный сайтами attL и attR фага лямбда, а также 36-ти звенные области фланговой гомологии с кодирующими областями целевого гена.
Интеграцию полученного линейного фрагмента ДНК в хромосому штамма Е. coli MG1655 осуществляли с использованием системы Red-зависимой гомологичной рекомбинации фага λ.
Для этого рекомбинантную ДНК вводили электротрансформацией в клетки штамма Е. coli MG1655, содержащего плазмиду pKD46 (Datsenko К.А., Wanner B.L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12):6640-6645).
Электрокомпетентные клетки штамма Ε. coli MG1655, содержащего плазмиду pKD46, получали как описано выше. Электропорацию проводили с использованием 70 мкл клеток и ~300 нг индивидуального ПЦР-продукта. После электропорации клетки инкубировали в 1 мл среды SOC (Sambrook et al, "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989) при 37°C в течение 2.5 часов, после чего высевали на чашки с L-агаром, содержащим 30 мкг/мл хлорамфеникола, и выращивали при 37°С для отбора CmR-рекомбинантов. Удаление плазмиды-помощника pKD46 осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с селекцией устойчивых к хлорамфениколу и чувствительных к ампициллину CmRАрS вариантов.
Факт соответствия предполагаемой и полученной экспериментально структур хромосом отобранных CmRАрS колоний подтверждали ПЦР анализом с помощью локус-специфичных праймеров Р34 (SEQ ID NO: 62) и Р35 (SEQ ID NO: 63). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С.
Длина продукта ПЦР, полученного в результате реакций с использованием в качестве матрицы клеток родительского штамма MG1655, составляла 946 п.н. для интактного гена iclR. Длина продукта ПЦР, полученного в результате реакции с использованием в качестве матрицы клеток мутантного штамма, составляла 1781 п.н. для инактивированного гена iclR.
На основе отобранного CmRАрS варианта штамма с замененными геном cat геном iclR был получен препарат соответствующего Ρ1-трансдуцирующего фага.
Штамм Е. coli с делетированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR, и усиленной экспрессией генов galP и glk, получен переносом в хромосому штамма MSG 1.0 (Ε. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, Ptac-galP, PL-glk) фрагмента хромосомы, с геном iclR, замененным геном cat, фланкированным аттечмент сайтами фага лямбда, с использованием препарата трансдуцирующего фага, несущего целевую маркированную генетическую модификацию, как описано выше. Очистку полученных трансдуктантов от остаточных фаговых частиц осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с последующей селекцией устойчивых к хлорамфениколу CmR вариантов. В хромосомах клонов, формирующих наиболее быстрорастущие колонии правильной формы, подтверждали замену гена iclR геном cat, фланкированным аттечмент сайтами фага лямбда, ПЦР анализом с помощью локус-специфичных праймеров Р34 (SEQ ID NO: 62) и Р35 (SEQ ID NO: 63). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MSG1.0, составляла 946 п.н. для интактного гена iclR. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток полученных трансдуктантов, составляла 1781 п.н. для гена iclR, замененного геном cat, фланкированным аттечмент сайтами фага лямбда. С целью удаления из хромосом трансдуктантов маркера устойчивости к антибиотику, отобранные клоны трансформировали плазмидой pMWts-Int/Xis. Селекция трансформированных клонов производилась с использованием среды LB, содержащей ампициллин (100 мкг/мл). Ген cat был удален из трансформированных клонов путем выращивания отдельных колоний штаммов на чашках с LB средой с селекцией чувствительных к хлорамфениколу и устойчивых к ампициллину CmSApR вариантов. Удаление гена cat из хромосом трансдуктантов и делецию в них генов оперона ackA-pta, гена рохВ, гена ldhA, гена adhE, гена ptsG, и гена iclR, а также факт наличия промотора Ptac, перед геном galP, и промотора PL фага лямбда перед геном glk подтверждали ПЦР с помощью соответствующих пар локус-специфичных праймеров Р3 (SEQ ID NO: 39) и Р4 (SEQ ID NO: 40), Р7 (SEQ ID NO: 41) и P8 (SEQ ID NO: 42), P11 (SEQ ID NO: 43) и P12 (SEQ ID NO: 44), P15 (SEQ ID NO: 45) и P16 (SEQ ID NO: 46), P19 (SEQ ID NO: 47) и P20 (SEQ ID NO: 48), P34 (SEQ ID NO: 62) и P35 (SEQ ID NO: 63), P25 (SEQ ID NO: 53) и P26 (SEQ ID NO: 54), P30 (SEQ ID NO: 58) и P31 (SEQ ID NO: 59). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток исходного штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta, 1872 п.н. для интактного гена рохВ, 1299 п.н. для интактного гена ldhA, 2903 п.н. для интактного гена adhE, 1494 п.н. для интактного гена ptsG, 946 п.н. для интактного гена iclR, 317 п.н. для интактной регуляторной области гена galP и 234 п.н. для интактной регуляторной области гена glk. Длина соответствующих продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток штамма с делетированными опероном ackA-pta, геном рохВ, геном ldhA, геном adhE, геном ptsG, геном iclR и содержащими промотор Ptac перед геном galP и промотор PL фага лямбда перед геном glk составляла 323 п.н., 255 п.н., 411 п.н., 329 п.н., 162 п.н., 184 п.н., 248 п.н. и 418 п.н.. В результате излечивания клонов от плазмиды-помощника pMWts-Int/Xis, проведенного с помощью повторного рассева до отдельных колоний на чашках с LB средой и селекции CmSApS-вариантов, получен штамм Е. coli MG1655 (ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, ΔiclR, Ptac-galP, PL-glk) с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR, и усиленной экспрессией генов galP и glk, названный MSG1.1.
1.5. Конструирование штамма MSG2.0.
Штамм MSG2.0 (Е. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, Ptac-galP, PL-glk, PL-aceEF-lpdA) получен на основе штамма MSG 1.0 (Ε. coli MG1655 ΔасkА, Δpta, ΔpoxB, ΔldhA, ΔadhE, ΔptsG, Ptac-galP, PL-glk) в результате замены в нем нативной регуляторной области оперона aceEF-lpdA промотором PL фага лямбда.
Первоначально целевая хромосомная модификации была получена индивидуально с использованием в качестве реципиента штамма E.coli MG1655. Для усиления экспрессии асеЕ, aceF и IpdA, составляющих оперон aceEF-lpdA, промотор PL фага лямбда, соединенный с природной последовательностью Shine-Dalgarno (последовательность SD) гена асеЕ, был интегрирован перед кодирующим участком гена асеЕ, расположенного первым в составе соответствующего оперона, в хромосому реципиентного штамма. На основе полученного штамма, несущего маркированную целевую хромосомную модификацию получен препарат соответствующего Ρ1-трансдуцирующего фага. Далее Р1-трансдукций полученная модификация была внесена в хромосому целевого рекомбинантного штамма. После трансдукции, из хромосомы полученного штамма осуществляли удаление маркера устойчивости к антибиотику, фланкированного аттечмент сайтами фага лямбда, с использованием плазмиды pMWts-Int/Xis (WO 2007 013638; RU 2005123423), включающей гены Int/Xis зависимой системы сайт-специфической рекомбинации фага лямбда.
Сначала был получен фрагмент ДНК для замены нативной регуляторной области aceEF-lpdA оперона
Получение вышеупомянутого искусственного фрагмента ДНК, для интеграции в соответствующий участок бактериальной хромосомы, осуществлялось в несколько стадий. На первой стадии, с помощью ПЦР получен фрагмент ДНК, содержащий в начале участок узнавания эндонуклеазы рестрикции BglII, промотор PL, последовательность SD гена асеЕ и, наконец, 36 нуклеотидов комплементарных 5'-концу кодирующей области гена асеЕ. Фрагмент получали в два этапа. На первом этапе, с использованием в качестве матрицы геномной ДНК фага лямбда (последовательность с инвентарным номером NC_001416.1 в базе данных GenBank, gi: 9626243), получен фрагмент ДНК, содержащий в начале участок узнавания BglII, промотор PL и последовательность SD гена асеЕ. ПЦР проводили с использованием праймеров Р27 (SEQ ID NO: 55) и Р36 (SEQ ID NO: 64). Праймер P27 содержит участок узнавания BglII и область гомологичную 5'-концу промотора PL. Праймер Р36 содержит последовательность SD гена асеЕ и область, комплементарную 3'-концу промотора PL. Температурный профиль для ПЦР: денатурация при 95°С в течение 5 мин; последующие 25 циклов: 30 сек при 95°С, 30 сек при 51°С, 60 сек при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Pfu ДНК полимеразу, соответствующий буфер и дезоксирибонуклеозидтрифосфаты производства Fermentas (Литва).
Полученный ПЦР-продукт, очищенный в агарозном геле и выделенный в соответствии с рекомендациями производителя с помощью Qiagen QIAquick Gel Extraction Kit, был использован в качестве матрицы в следующем раунде ПЦР. Использовали праймеры Р27 (SEQ ID NO: 55) и Р37 (SEQ ID NO: 65). Праймер P37 содержит область, комплементарную 3'-концу промотора PL, последовательность SD гена асеЕ и 36 нуклеотидов из рамки считывания гена асеЕ. Температурный профиль для ПЦР: денатурация при 95°С в течение 5 мин; последующие 25 циклов: 30 сек при 95°С, 30 сек при 53°С, 60 сек при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Pfu ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва).
Параллельно осуществляли вторую стадию конструирования фрагмента ДНК. Фрагмент ДНК, содержащий маркер CmR, кодируемый геном cat, получен при помощи ПЦР с использованием праймеров Р38 (SEQ ID NO: 66) и Р24 (SEQ ID NO: 52) и плазмиды pMW118-attL-Cm-attR (Каташкина Ж.И. и др., Направленное изменение уровня экспрессии генов в бактериальной хромосоме. Мол. Биол., 2005, 39(5):823-831) в качестве матрицы. Праймер Р38 содержит 36 нуклеотидов гомологичных участку ДНК предшествующему непосредственно кодирующей области гена асеЕ и участок ДНК размером 28 нуклеотидов, комплементарный участку ДНК, расположенному на 3'-конце области attR. Праймер Р24 содержит участок узнавания BglII и участок ДНК размером 28 нуклеотидов, гомологичный участку ДНК, расположенному на 5'-конце области attL. Температурный профиль для ПЦР: денатурация при 95°С в течение 5 мин; последующие 25 циклов: 30 сек при 95°С, 30 сек при 52°С, 1 мин при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва).
Полученные фрагменты ДНК очищали в агарозном геле и выделяли, в соответствии с рекомендациями производителя, с помощью Qiagen QIAquick Gel Extraction Kit, с последующим осаждением этанолом.
Два полученных фрагмента ДНК были обработаны эндонуклеазой рестрикции BglII с последующим лигированием с использованием Т4 ДНК-лигазы в соответствии со стандартной процедурой (Maniatis T., Fritsch E.F., Sambrook, J.: Molecular Cloning:A Laboratory Manual. 2nd edn. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press, 1989).
Продукт лигирования амплифицировали с помощью ПЦР с использованием праймеров Р37 (SEQ ID NO: 65) и Р38 (SEQ ID NO: 66). Температурный профиль для ПЦР: денатурация при 98°С в течение 1 мин; последующие 30 циклов: 15 сек при 98°С, 15 сек при 55°С, 1 мин при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Phusion ДНК полимеразу и соответствующий буфер производства Finnzymes; дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Полученный ПЦР-продукт длиной 1970 п.н., очищали электрофорезом в агарозном геле и выделяли, в соответствии с рекомендациями производителя, с помощью Qiagen QIAquick Gel Extraction Kit (Qiagen, США). Итоговый фрагмент содержал промотор PL, соединенный с природной последовательностью Shine-Dalgarno (последовательность SD) гена асеЕ, ген устойчивости к хлорамфениколу (ген cat, кодирующий хлорамфениколацетилтрансферазу), фланкированный сайтами attL и attR фага лямбда, а также 36-звенные области фланговой гомологии с участком ДНК предшествующем непосредственно кодирующей области гена асеЕ и 5'-регионом кодирующей области гена асеЕ.
Интеграцию полученного линейного фрагмента ДНК в хромосому штамма Е. coli MG1655 осуществляли с использованием системы Red-зависимой гомологичной рекомбинации фага λ.
Для этого рекомбинантную ДНК вводили электротрансформацией в клетки штамма Е. coli MG1655, содержащего плазмиду pKD46 (Datsenko К.Α., Wanner B.L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12):6640-6645).
Электрокомпетентные клетки штамма Ε. coli MG1655, содержащего плазмиду pKD46, получали как описано выше. Электропорацию проводили с использованием 70 мкл клеток и ~300 нг индивидуального ПЦР-продукта. После электропорации клетки инкубировали в 1 мл среды SOC (Sambrook et al, "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989) при 37°C в течение 2,5 часов, после чего высевали на чашки с L-агаром, содержащим 30 мкг/мл хлорамфеникола, и выращивали при 37°С для отбора CmR-рекомбинантов. Удаление плазмиды-помощника pKD46 осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с селекцией устойчивых к хлорамфениколу и чувствительных к ампициллину CmRApS вариантов.
Факт соответствия предполагаемой и полученной экспериментально структур хромосомы соответствующих CmRАрS колоний подтверждали ПЦР анализом с помощью пар локус-специфичных праймеров Р39 (SEQ ID NO: 67) и Р40 (SEQ ID NO: 68), P27 (SEQ ID NO: 55) и P40 (SEQ ID NO: 68). Длина продукта ПЦР, полученного в результате реакции с использованием в качестве матрицы клеток родительского штамма MG1655 и праймеров Р39 и Р40 составляла 201 п.н. для интактной регуляторной области оперона aceEF-lpdA. Длина продукта ПЦР, полученного в результате реакции с использованием в качестве матрицы клеток мутантного штамма и праймеров Р39 и Р40, составляла 2099 п.н. для модифицированной регуляторной области оперона aceEF-lpdA. При использовании пары праймеров Р27 и Р40 и хромосомы родительского штамма в качестве матрицы специфические фрагменты не наблюдались среди продуктов ПЦР в силу отсутствия в хромосоме штамма Е. coli дикого типа промотора PL фага лямбда. Длина продукта ПЦР, полученного в результате реакции с использованием в качестве матрицы клеток мутантного штамма и праймеров Р27 и Р40 составляла 377 п.н. Также в хромосомах полученных клонов соответствие запланированной и экспериментально полученной нуклеотидной последовательности нового регуляторного элемента, введенного перед кодирующей областью гена асеЕ, было подтверждено секвенированием.
На основе отобранного CmRApS варианта штамма, в котором нативная регуляторная область оперона aceEF-lpdA заменена промотором РL, соединенным с последовательностью SD гена асеЕ и сопряженным с геном cat, фланкированным аттечмент сайтами фага лямбда, получен препарат соответствующего Р1-трансдуцирующего фага.
Штамм Е. coli с делетированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, усиленной экспрессией генов galP и glk, и усиленной экспрессией генов асеЕ, aceF и lpdA получен переносом в хромосому штамма MSG1.0 (Е. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, Ptac-galP, PL-glk) фрагмента хромосомы, в котором нативная регуляторная область оперона aceEF-lpdA заменена промотором PL, соединенным с последовательностью SD гена асеЕ и сопряженным с геном cat, фланкированным аттечмент сайтами фага лямбда, с использованием препарата трансдуцирующего фага, несущего целевую маркированную генетическую модификацию, как описано выше. Очистку полученных трансдуктантов от остаточных фаговых частиц осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с последующей селекцией устойчивых к хлорамфениколу CmR вариантов. В хромосомах клонов, формирующих наиболее быстрорастущие колонии правильной формы, замену нативной регуляторной области оперона aceEF-lpdA искусственным регуляторным элементом, сопряженным с геном cat, фланкированным аттечмент сайтами фага лямбда, подтверждали ПЦР анализом с помощью локус-специфичных праймеров Р39 (SEQ ID NO: 67) и Р40 (SEQ ID NO: 68). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MSG 1.0, составляла 201 п.н. для интактной регуляторной области оперона aceEF-lpdA. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток полученных трансдуктантов, составляла 2099 п.н. для регуляторной области оперона aceEF-lpdA, замененной искусственным регуляторным элементом, сопряженным с геном cat, фланкированным аттечмент сайтами фага лямбда. С целью удаления из хромосом трансдуктантов маркера устойчивости к антибиотику, отобранные клоны трансформировали плазмидой pMWts-Int/Xis. Селекция трансформированных клонов производилась с использованием среды LB, содержащей ампициллин (100 мкг/мл). Ген cat был удален из трансформированных клонов путем выращивания отдельных колоний штаммов на чашках с LB средой с селекцией чувствительных к хлорамфениколу и устойчивых к ампициллину CmSApR вариантов. Удаление гена cat из хромосом трансдуктантов и делецию в них генов оперона ackA-pta, гена рохВ, гена ldhA, гена adhE, гена ptsG, а также факт наличия промотора Ptac, перед геном galP, промотора PL фага лямбда перед геном glk, и промотора PL фага лямбда перед генами оперона aceEF-lpdA подтверждали ПЦР с помощью соответствующих пар локус-специфичных праймеров Р3 (SEQ ID NO: 39) и Р4 (SEQ ID NO: 40), Р7 (SEQ ID NO: 41) и P8 (SEQ ID NO: 42), P11 (SEQ ID NO: 43) и P12 (SEQ ID NO: 44), P15 (SEQ ID NO: 45) и P16 (SEQ ID NO: 46), P19 (SEQ ID NO: 47) и P20 (SEQ ID NO: 48), P25 (SEQ ID NO: 53) и P26 (SEQ ID NO: 54), P30 (SEQ ID NO: 58) и P31 (SEQ ID NO: 59), P39 (SEQ ID NO: 67) и P40 (SEQ ID NO: 68). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток исходного штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta, 1872 п.н. для интактного гена рохВ, 1299 п.н. для интактного гена ldhA, 2903 п.н. для интактного гена adhE, 1494 п.н. для интактного гена ptsG, 317 п.н. для интактной регуляторной области гена galP, 234 п.н. для интактной регуляторной области гена glk и 201 п.н. для интактной регуляторной области оперона aceEF-lpdA. Длина соответствующих продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток штамма с делетированными опероном ackA-pta, геном рохВ, геном ldhA, геном adhE, геном ptsG, и содержащими промотор Ptac перед геном galP, промотор PL фага лямбда перед геном glk и промотор PL фага лямбда перед генами оперона aceEF-lpdA составляла 323 п.н., 255 п.н., 411 п.н., 329 п.н., 162 п.н., 248 п.н., 418 п.н. и 502 п.н.. В результате излечивания клонов от плазмиды-помощника pMWts-Int/Xis, проведенного с помощью повторного рассева до отдельных колоний на чашках с LB средой и селекции CmSАрS-вариантов, получен штамм E.coli MG1655 (ΔackA, Δpta, ApoxB, ΔldhA, ΔadhE, ΔptsG, Ptac-galP, PL-glk, PL-aceEF-lpdA) с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, усиленной экспрессией генов galP и glk, и усиленной экспрессией генов асеЕ, aceF и lpdA, названный MSG2.0.
1.6. Конструирование штамма MSG2.1.
Штамм MSG2.1 (E.coli MG1655 ΔackA, Δpta, ΔpoxB, ΔldhA, ΔadhE, ΔptsG, ΔiclR, Ptac-galP, PL-glk, PL-aceEF-lpdA) получен на основе штамма MSG2.0 (E.coli MG1655 ΔackA, Δpta, ΔpoxB, ΔldhA, ΔadhE, ΔptsG, Ptac-galP, PL-glk, PL-aceEF-lpdA) в результате инактивации в нем гена iclR.
Штамм E.coli с делетированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR, усиленной экспрессией генов galP и glk, и усиленной экспрессией генов асеЕ, aceF и IpdA получен переносом в хромосому штамма MSG2.0 (E.coli MG1655 ΔackA, Δpta, ΔpoxB, ΔldhA, ΔadhE, ΔptsG, Ptac-galP, PL-glk, PL-aceEF-lpdA) фрагмента хромосомы, с геном iclR, замененным геном cat, фланкированным аттечмент сайтами фага лямбда, с использованием препарата соответствующего трансдуцирующего фага, полученного ранее (Пример 1.4). Р1-трансдукцию осуществляли, как описано выше. Очистку полученных трансдуктантов от остаточных фаговых частиц осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с последующей селекцией устойчивых к хлорамфениколу CmR вариантов. В хромосомах клонов, формирующих наиболее быстрорастущие колонии правильной формы, подтверждали замену гена iclR геном cat, фланкированным аттечмент сайтами фага лямбда, ПЦР анализом с помощью локус-специфичных праймеров Р34 (SEQ ID NO: 62) и Р35 (SEQ ID NO: 63). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MSG2.0, составляла 946 п.н. для интактного гена iclR. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток полученных трансдуктантов, составляла 1781 п.н. для гена iclR, замененного геном cat, фланкированным аттечмент сайтами фага лямбда. С целью удаления из хромосом трансдуктантов маркера устойчивости к антибиотику, отобранные клоны трансформировали плазмидой pMWts-Int/Xis. Селекция трансформированных клонов производилась с использованием среды LB, содержащей ампициллин (100 мкг/мл). Ген cat был удален из трансформированных клонов путем выращивания отдельных колоний штаммов на чашках с LB средой с селекцией чувствительных к хлорамфениколу и устойчивых к ампициллину CmSApR вариантов. Удаление гена cat из хромосом трансдуктантов и делению в них генов оперона ackA-pta, гена рохВ, гена ldhA, гена adhE, гена ptsG, и гена iclR, а также факт наличия промотора Ptac, перед геном galP, промотора PL фага лямбда перед геном glk и промотора PL фага лямбда перед генами оперона aceEF-lpdA подтверждали ПЦР с помощью соответствующих пар локус-специфичных праймеров Р3 (SEQ ID NO: 39) и Р4 (SEQ ID NO: 40), Р7 (SEQ ID NO: 41) и P8 (SEQ ID NO: 42), P11 (SEQ ID NO: 43) и P12 (SEQ ID NO: 44), P15 (SEQ ID NO: 45) и P16 (SEQ ID NO: 46), P19 (SEQ ID NO: 47) и P20 (SEQ ID NO: 48), P34 (SEQ ID NO: 62) и P35 (SEQ ID NO: 63), P25 (SEQ ID NO: 53) и P26 (SEQ ID NO: 54), P30 (SEQ ID NO: 58) и P31 (SEQ ID NO: 59), P39 (SEQ ID NO: 67) и P40 (SEQ ID NO: 68). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток исходного штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta, 1872 п.н. для интактного гена рохВ, 1299 п.н. для интактного гена ldhA, 2903 п.н. для интактного гена adhE, 1494 п.н. для интактного гена ptsG, 946 п.н. для интактного гена iclR, 317 п.н. для интактной регуляторной области гена galP, 234 п.н. для интактной регуляторной области гена glk и 201 п.н. для интактной регуляторной области оперона aceEF-lpdA. Длина соответствующих продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток штамма с делетированными опероном ackA-pta, геном рохВ, геном ldhA, геном adhE, геном ptsG, геном iclR и содержащими промотор Рtac перед геном galP, промотор PL фага лямбда перед геном glk и промотор PL фага лямбда перед генами оперона aceEF-lpdA составляла 323 п.н., 255 п.н., 411 п.н., 329 п.н., 162 п.н., 184 п.н., 248 п.н., 418 п.н. и 502 п.н. В результате излечивания клонов от плазмиды-помощника pMWts-Int/Xis, проведенного с помощью повторного рассева до отдельных колоний на чашках с LB средой и селекции CmSАрS-вариантов, получен штамм Е. coli MG1655 (ΔackA, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, ΔiclR, Ptac-galP, PL-glk, PL-aceEF-lpdA) с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR, усиленной экспрессией генов galP и glk, и усиленной экспрессией генов асеЕ, aceF и lpdA, названный MSG2.1.
1.7. Конструирование штамма MSG3.0.
Штамм MSG3.0 (Ε. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, ΔpflB, Ptac-galP, PL-glk, PL-aceEF-lpdA) получен на основе штамма MSG2.0 (Ε. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, Ptac-galP, PL-glk, PL-aceEF-lpdA) в результате инактивации в нем гена pflB.
Первоначально целевая хромосомная модификации была получена индивидуально с использованием в качестве реципиента штамма E.coli MG1655. На основе полученного штамма, несущего маркированную целевую хромосомную модификацию получен препарат соответствующего Р1-трансдуцирующего фага. Далее Ρ1-трансдукций полученная модификация была внесена в хромосому целевого рекомбинантного штамма. После трансдукций, из хромосомы полученного штамма осуществляли удаление маркера устойчивости к антибиотику, фланкированного аттечмент сайтами фага лямбда, с использованием плазмиды pMWts-Int/Xis (WO 2007 013638; RU 2005123423), включающей гены Int/Xis зависимой системы сайт-специфической рекомбинации фага лямбда.
Сначала был получен фрагмент ДНК для инактивации гена pflB.
Линейный фрагмент ДНК для делеции целевого гена получен при помощи ПЦР с использованием праймеров Р41 (SEQ ID NO: 69) и Р42 (SEQ ID NO: 70) и плазмиды pMW118-attL-Cm-attR (Каташкина Ж.И. и др., Направленное изменение уровня экспрессии генов в бактериальной хромосоме. Мол. Биол., 2005, 39(5):823-831) в качестве матрицы.
Праймер Р41 содержит участок ДНК размером в 36 нуклеотидов, гомологичный участку ДНК, расположенному на 5'-конце гена pflB и участок ДНК размером 28 нуклеотидов, комплементарный участку ДНК, расположенному на 3'-конце области attR. Праймер Р42 содержит участок ДНК размером в 36 нуклеотидов, комплементарный участку ДНК, расположенному на 3'-конце гена pflB, а также участок ДНК размером 28 нуклеотидов, гомологичный участку ДНК, расположенному на 5'-конце области attL. Температурный профиль для ПЦР: денатурация при 95°С в течение 5 мин; последующие 25 циклов: 30 сек при 95°С, 30 сек при 52°С, 1 мин при 72°С; и заключительная полимеризация: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксирибонуклеозидтрифосфаты производства Fermentas (Литва).
Полученный ПЦР-продукт длиной 1700 п.н. для инактивации гена pflB очищали электрофорезом в агарозном геле и выделяли, в соответствии с рекомендациями производителя, с помощью Qiagen QIAquick Gel Extraction Kit (Qiagen, США). Итоговый фрагмент содержал ген устойчивости к хлорамфениколу (ген cat, кодирующий хлорамфениколацетилтрансферазу), фланкированный сайтами attL и attR фага лямбда, а также 36-звенные области фланговой гомологии с кодирующими областями целевого гена.
Интеграцию полученного линейного фрагмента ДНК в хромосому штамма Е. coli MG1655 осуществляли с использованием системы Red-зависимой гомологичной рекомбинации фага λ.
Для этого рекомбинантную ДНК вводили электротрансформацией в клетки штамма Е. coli MG1655, содержащего плазмиду pKD46 (Datsenko К.А., Wanner B.L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12):6640-6645).
Электрокомпетентные клетки штамма Ε. coli MG1655, содержащего плазмиду pKD46, получали как описано выше. Электропорацию проводили с использованием 70 мкл клеток и ~300 нг индивидуального ПЦР-продукта. После электропорации клетки инкубировали в 1 мл среды SOC (Sambrook et al, "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989) при 37°C в течение 2.5 часов, после чего высевали на чашки с L-агаром, содержащим 30 мкг/мл хлорамфеникола, и выращивали при 37°С для отбора CmR-рекомбинантов. Удаление плазмиды-помощника pKD46 осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с селекцией устойчивых к хлорамфениколу и чувствительных к ампициллину CmRApS вариантов.
Факт соответствия предполагаемой и полученной экспериментально структур хромосом отобранных CmRАрS колоний подтверждали ПЦР анализом с помощью локус-специфичных праймеров Р43 (SEQ ID NO: 71) и Р44 (SEQ ID NO: 72). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С.
Длина продукта ПЦР, полученного в результате реакций с использованием в качестве матрицы клеток родительского штамма MG1655, составляла 2566 п.н. для интактного гена pflB. Длина продукта ПЦР, полученного в результате реакции с использованием в качестве матрицы клеток мутантного штамма, составляла 1983 п.н. для инактивированного гена iclR.
На основе отобранного CmRApS варианта штамма с замененными геном cat геном pflB получен препарат соответствующего Р1-трансдуцирующего фага.
Штамм Е. coli с делегированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, усиленной экспрессией генов galP и glk, и усиленной экспрессией генов асеЕ, aceF и lpdA получен переносом в хромосому штамма MSG2.0 (Е. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, Ptac-galP, ΡL-glk, PL-aceEF-lpdA) фрагмента хромосомы, с геном pflB, замененным геном cat, фланкированным аттечмент сайтами фага лямбда, с использованием препарата трансдуцирующего фага, несущего целевую маркированную генетическую модификацию, как описано выше. Очистку полученных трансдуктантов от остаточных фаговых частиц осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с последующей селекцией устойчивых к хлорамфениколу CmR вариантов. В хромосомах клонов, формирующих наиболее быстрорастущие колонии правильной формы, подтверждали замену гена pflB геном cat, фланкированным аттечмент сайтами фага лямбда, ПЦР анализом с помощью локус-специфичных праймеров Р43 (SEQ ID NO: 71) и Р44 (SEQ ID NO: 72). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MSG2.0, составляла 2566 п.н. для интактного гена pflB. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток полученных трансдуктантов, составляла 1983 п.н. для гена pflB, замененного геном cat, фланкированным аттечмент сайтами фага лямбда. С целью удаления из хромосом трансдуктантов маркера устойчивости к антибиотику, отобранные клоны трансформировали плазмидой pMWts-Int/Xis (WO 2007 013638; RU 2005123423). Селекция трансформированных клонов производилась с использованием среды LB, содержащей ампициллин (100 мкг/мл). Ген cat был удален из трансформированных клонов путем выращивания отдельных колоний штаммов на чашках с LB средой с селекцией чувствительных к хлорамфениколу и устойчивых к ампициллину CmSApR вариантов. Удаление гена cat из хромосом трансдуктантов и делецию в них генов оперона ackA-pta, гена рохВ, гена ldhA, гена adhE, гена ptsG, и гена pflB, а также факт наличия промотора Ptac, перед геном galP, промотора PL фага лямбда перед геном glk и промотора PL фага лямбда перед генами оперона aceEF-lpdA подтверждали ПЦР с помощью соответствующих пар локус-специфичных праймеров Р3 (SEQ ID NO: 39) и Р4 (SEQ ID NO: 40), Р7 (SEQ ID NO: 41) и P8 (SEQ ID NO: 42), P11 (SEQ ID NO: 43) и P12 (SEQ ID NO: 44), P15 (SEQ ID NO: 45) и P16 (SEQ ID NO: 46), P19 (SEQ ID NO: 47) и P20 (SEQ ID NO: 48), P43 (SEQ ID NO: 71) и P44 (SEQ ID NO: 72), P25 (SEQ ID NO: 53) и P26 (SEQ ID NO: 54), P30 (SEQ ID NO: 58) и P31 (SEQ ID NO: 59), P39 (SEQ ID NO: 67) и P40 (SEQ ID NO: 68). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток исходного штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta, 1872 п.н. для интактного гена рохВ, 1299 п.н. для интактного гена ldhA, 2903 п.н. для интактного гена adhE, 1494 п.н. для интактного гена ptsG, 2566 п.н. для интактного гена pflB, 317 п.н. для интактной регуляторной области гена galP, 234 п.н. для интактной регуляторной области гена glk и 201 п.н. для интактной регуляторной области оперона aceEF-lpdA. Длина соответствующих продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток штамма с делетированными опероном ackA-pta, геном рохВ, геном ldhA, геном adhE, геном ptsG, геном pflB и содержащими промотор Ptac перед геном galP, промотор PL фага лямбда перед геном glk и промотор PL фага лямбда перед генами оперона aceEF-lpdA составляла 323 п.н., 255 п.н., 411 п.н., 329 п.н., 162 п.н., 386 п.н., 248 п.н., 418 п.н. и 502 п.н.. В результате излечивания клонов от плазмиды-помощника pMWts-Int/Xis, проведенного с помощью повторного рассева до отдельных колоний на чашках с LB средой и селекции CmSApS-вариантов, получен штамм Е. coli MG1655 (ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, ΔpflB, Ptac-galP, PL-glk, PL-aceEF-lpdA) с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, усиленной экспрессией генов galP и glk, и усиленной экспрессией генов асеЕ, aceF и lpdA, названный MSG3.0.
1.8. Конструирование штамма MSG3.1.
Штамм MSG3.1 (Е. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, ΔpflB, ΔiclR, Ptac-galP, РL-glk, PL-aceEF-lpdA) получен на основе штамма MSG3.0 (Ε. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, ΔpflB, Ptac-galP, PL-glk, PL-aceEF-lpdA) в результате инактивации в нем гена iclR.
Штамм Е. coli с делетированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, iclR, усиленной экспрессией генов galP и glk, и усиленной экспрессией генов асеЕ, aceF и lpdA получен переносом в хромосому штамма MSG3.0 (Е. coli MG1655 ΔасkА, Δpta, ΔрохВ, ΔldhA, ΔadhE, ΔptsG, ΔpflB, Ptac-galP, PL-glk, PL-aceEF-lpdA) фрагмента хромосомы, с геном iclR, замененным геном cat, фланкированным аттечмент сайтами фага лямбда, с использованием препарата соответствующего трансдуцирующего фага, полученного ранее (Пример 1.4). Р1-трансдукцию осуществляли, как описано выше. Очистку полученных трансдуктантов от остаточных фаговых частиц осуществляли рассевом клонов до отдельных колоний на агаризованной LB среде с последующей селекцией устойчивых к хлорамфениколу CmR вариантов. В хромосомах клонов, формирующих наиболее быстрорастущие колонии правильной формы, подтверждали замену гена iclR геном cat, фланкированным аттечмент сайтами фага лямбда, ПЦР анализом с помощью локус-специфичных праймеров Р34 (SEQ ID NO: 62) и Р35 (SEQ ID NO: 63). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Использовали Taq ДНК полимеразу, соответствующий буфер и дезоксинуклеозидтрифосфаты производства Fermentas (Литва). Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток родительского штамма MSG3.0, составляла 946 п.н. для интактного гена iclR. Длина продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток полученных трансдуктантов, составляла 1781 п.н. для гена iclR, замененного геном cat, фланкированным аттечмент сайтами фага лямбда. С целью удаления из хромосом трансдуктантов маркера устойчивости к антибиотику, отобранные клоны трансформировали плазмидой pMWts-Int/Xis. Селекция трансформированных клонов производилась с использованием среды LB, содержащей ампициллин (100 мкг/мл). Ген cat был удален из трансформированных клонов путем выращивания отдельных колоний штаммов на чашках с LB средой с селекцией чувствительных к хлорамфениколу и устойчивых к ампициллину CmSApR вариантов. Удаление гена cat из хромосом трансдуктантов и делецию в них генов оперона ackA-pta, гена рохВ, гена ldhA, гена adhE, гена ptsG, гена pflΒ, и гена iclR, а также факт наличия промотора Ptac, перед геном galP, промотора PL фага лямбда перед геном glk и промотора PL фага лямбда перед генами оперона aceEF-lpdA подтверждали ПЦР с помощью соответствующих пар локус-специфичных праймеров Р3 (SEQ ID NO: 39) и Р4 (SEQ ID NO: 40), Р7 (SEQ ID NO: 41) и P8 (SEQ ID NO: 42), P11 (SEQ ID NO: 43) и P12 (SEQ ID NO: 44), P15 (SEQ ID NO: 45) и P16 (SEQ ID NO: 46), P19 (SEQ ID NO: 47) и P20 (SEQ ID NO: 48), P43 (SEQ ID NO: 71) и P44 (SEQ ID NO: 72), P34 (SEQ ID NO: 62) и P35 (SEQ ID NO: 63), P25 (SEQ ID NO: 53) и P26 (SEQ ID NO: 54), P30 (SEQ ID NO: 58) и P31 (SEQ ID NO: 59), P39 (SEQ ID NO: 67) и P40 (SEQ ID NO: 68). Температурный профиль для ПЦР-проверки: денатурация при 95°С в течение 10 мин; профиль для 30 циклов: 30 сек при 95°С, 30 сек при 50°С, 2 мин при 72°С; заключительный шаг: 7 мин при 72°С. Длина продуктов ПЦР, полученных в результате реакций с использованием в качестве матрицы клеток исходного штамма MG1655, составляла 3351 п.н. для интактного оперона ackA-pta, 1872 п.н. для интактного гена рохВ, 1299 п.н. для интактного гена ldhA, 2903 п.н. для интактного гена adhE, 1494 п.н. для интактного гена ptsG, 2566 п.н. для интактного гена pflB, 946 п.н. для интактного гена iclR, 317 п.н. для интактной регуляторной области гена galP, 234 п.н. для интактной регуляторной области гена glk и 201 п.н. для интактной регуляторной области оперона aceEF-lpdA. Длина соответствующих продуктов ПЦР, полученных в результате реакции с использованием в качестве матрицы клеток штамма с делетированными опероном ackA-pta, геном рохВ, геном ldhA, геном adhE, геном ptsG, геном pflB, геном iclR и содержащими промотор Ptac перед геном galP, промотор PL фага лямбда перед геном glk и промотор PL фага лямбда перед генами оперона aceEF-lpdA составляла 323 п.н., 255 п.н., 411 п.н., 329 п.н., 162 п.н., 386 п.н., 184 п.н., 248 п.н., 418 п.н. и 502 п.н.. В результате излечивания клонов от плазмиды-помощника pMWts-Int/Xis, проведенного с помощью повторного рассева до отдельных колоний на чашках с LB средой и селекции CmSAps-вариантов, получен штамм E.coli MG1655 (ΔackA, Δpta, ΔpoxB, ΔldhA, ΔadhE, ΔptsG, ΔpflB, ΔiclR, Ptac-galP, PL-glk, PL-aceEF-lpdA) с инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, iclR, усиленной экспрессией генов galP и glk, и усиленной экспрессией генов асеЕ, aceFn lpdA, названный MSG3.1.
1.9. Получение штаммов MSG1.0 [pPYC], MSG1.1 [pPYC], MSG2.0 [pPYC], MSG2.1 [pPYC], MSG3.0 [pPYC], MSG3.1 [pPYC].
Штаммы бактерий Escherichia coli MSG1.0 [pPYC], MSG1.1 [pPYC], MSG2.0 [pPYC], MSG2.1 [pPYC], MSG3.0 [pPYC], MSG3.1 [pPYC] - продуценты янтарной кислоты - получены в результате трансформации штаммов MSG1.0, MSG1.1, MSG2.0, MSG2.1, MSG3.0, MSG3.1 плазмидой pPYC, содержащей ген русА, кодирующий функционально активную пируват карбоксилазу из Bacillus subtilis (RU 2466186), по стандартной методике (Sambrook et al, "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989).
Пример 2. Продукция янтарной кислоты заявляемыми штаммами бактерий Escherichia coli.
2.1. Характеристика коэффициентов конверсии глюкозы в янтарную кислоту заявляемыми штаммами бактерий Escherichia coli.
Клетки штамма MSG1.0 [pPYC] или MSG1.1 [pPYC] или MSG2.0 [pPYC] или MSG2.1 [pPYC] или MSG3.0 [pPYC] или MSG3.1 [pPYC] выращивают в течение ночи в среде М9 (Sambrook, J., Fritsch, E.F., and Maniatis, T., "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989), содержащей 2 г/л глюкозы и 1 г/л триптона, при 37°С. По 5 мл полученных ночных культур разбавляют в 10 раз, добавляют 45 мл среды М9, содержащей 5 г/л триптона и 10 г/л глюкозы. Полученные культуры выращивают в колбах объемом 750 мл закрытых ватными пробками при 37°С на роторной качалке при 250 об/мин в течение 7 часов. Полученные клеточные суспензии центрифугируют в течение 15 минут при 4000 об/мин при 4°С. Осадки ресуспендируют в 15 мл минимальной солевой среды М9, содержащей 5 г/л глюкозы и 5 г/л NaHCO3. Затем проводят инкубацию полученных клеточных культур в течение 24 часов в пробирках объемом 15 мл закрытых невентилируемыми пробками при 37°С на роторной качалке при 250 об/мин. Для поддержания плазмиды pPYC все среды содержат дополнительно 100 мг/л ампициллина. Концентрации органических кислот и остаточной глюкозы в культуральной жидкости, освобожденной от биомассы центрифугированием, определяют методом высокоэффективной жидкостной хроматографии с использованием системы Waters HPLC system (Waters, Milford, MA, USA). Для измерения концентраций органических кислот используют ион-эксклюзионную колонку Rezex ROA-Organic Acid Н+ (8%) (300×7,8 mm, 8 µm, Phenomenex, USA). Детекцию осуществляют при длине волны 210 нм. В качестве подвижной фазы используют водный раствор серной кислоты (2,5 мМ) со скоростью потока 0,5 мл/мин. Для измерения концентрации глюкозы, система Waters HPLC system комплектуют рефрактивным детектором Waters 2414 и колонкой Spherisorb-NH2 (4,6×250 mm, 5 µm, Waters, USA). В качестве подвижной фазы используют смесь ацетонитрил/этилацетат/вода (объемное соотношение 76/4/20) со скоростью потока 1 мл/мин. Вещества идентифицируют при сравнении времени их удерживания со временем удерживания соответствующих стандартов.
Молярные концентрации потребленной штаммами глюкозы, накопленных метаболитов и молярные выходы янтарной кислоты в результате соответствующих пробирочных ферментаций представлены в Таблице 1.
Коэффициенты конверсии глюкозы в янтарную кислоту демонстрируемые заявляемыми штаммами бактерий Escherichia coli MSG 1.0 [pPYC] и MSG 1.1 [pPYC] составляют 1,56 моль/моль и 1,59 моль/моль и превосходят аналогичные показатели штаммов ближайших аналогов SBS550MG [pHL413], SGM1.0 [pPYC] и SGM1.1 [pPYC] (1,3 моль/моль, 1,31 моль/моль и 1,32 моль/моль), достигая 97% и 99% от соответствующего теоретического максимума -1,6 моль/моль.
Коэффициенты конверсии глюкозы в янтарную кислоту демонстрируемые заявляемыми штаммами бактерий Escherichia coli MSG2.0 [pPYC] и MSG2.1 [pPYC] составляют 1,64 моль/моль и 1,65 моль/моль и превосходят аналогичные показатели штаммов ближайших аналогов SGM2.0 [pPYC] и SGM2.1 [pPYC] (1,42 моль/моль и 1,49 моль/моль), достигая 98% и 99% от соответствующего теоретического максимума - 1,6(6) моль/моль.
Коэффициент конверсии глюкозы в янтарную кислоту демонстрируемый заявляемыми штаммами бактерий Escherichia coli MSG3.0 [pPYC] и MSG3.1 [pPYC] составляет 1,7 моль/моль и превосходит аналогичные показатели штаммов ближайших аналогов NZ-041, SGM3.0 [pPYC] и SGM3.1 [pPYC] (1,31 моль/моль, 1,46 моль/моль и 1,66 моль/моль), достигая 99% от соответствующего теоретического максимума - 1,71 моль/моль.
2.2. Характеристика накопления янтарной кислоты заявляемыми штаммами бактерий Escherichia coli MSG3.0 [pPYC] и MSG3.1 [pPYC].
Клетки штамма MSG3.0 [pPYC] или MSG3.1 [pPYC] выращивают в течение ночи в среде М9 (Sambrook, J., Fritsch, E.F., and Maniatis, T., "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989), содержащей 2 г/л глюкозы и 1 г/л триптона, при 37°С. По 5 мл полученных ночных культур разбавляют в 10 раз, добавляют 45 мл среды М9, содержащей 10 г/л глюкозы и 4 мл раствора нейтрализованного до рН 7,0 кислотного гидролизата пшеничного глютена (Cargill, Ефремово, Россия), с содержанием растворенного сухого вещества 115 г/л. Полученные культуры выращивают в колбах объемом 750 мл закрытых ватными пробками при 37°С на роторной качалке при 250 об/мин в течение 7 часов. Затем, клеточные суспензии засевают в ферментационный аппарат (1L Microbial BioBundle System, Applikon Biotechnology, Netherlands), содержащий 450 мл нейтрализованной комбинированной среды (3 г/л КН2РO4, 6,8 г/л К2НРO4×3Н2O; 1 г/л NaCl; 5 г/л (NH4)2HPO4; 0,25 г/л MgSO4×7H2O; 0,01 г/л СаСl2×2Н2O; 5 мг/л тиамина и 40 мл/л кислотного гидролизата пшеничного глютена, 100 мг/л ампициллина, 2 г/л глюкозы). Аэробное накопление биомассы осуществляют при 37°С в течение 7 часов при оборотах мешалки 800 об/мин и потоке воздуха 0,6 л/л/мин. Анаэробную продуктивную стадию инициируют добавлением 100 мл 50% раствора глюкозы, до конечной концентрации 83,3(3) г/л, снижением оборотов мешалки до 250 об/мин и заменой входящего газа на СO2 со скоростью потока 0,5 л/мин. В течение анаэробной фазы рН среды поддерживают на значении 7,0 автоматическим добавлением 40% раствора NaOH (суммарный объем ~110 мл). Определение концентраций янтарной кислоты в культуральной жидкости осуществляют методом высокоэффективной жидкостной хроматографии, как описано выше (Пример 2.1).
Репрезентативные значения концентраций янтарной кислоты накопленной в результате соответствующих ферментаций с использованием штаммов бактерий Escherichia coli MSG3.0 [pPYC] и MSG3.1 [pPYC] представлены в Таблице 2.
Таким образом, заявляемые штаммы бактерий Eshcerichia coli являются высокоэффективными и перспективными для использовании в промышленности продуцентами, позволяющими получать янтарную кислоту из глюкозы с высокими коэффициентами конверсии, приближенными к максимально возможным значениям.
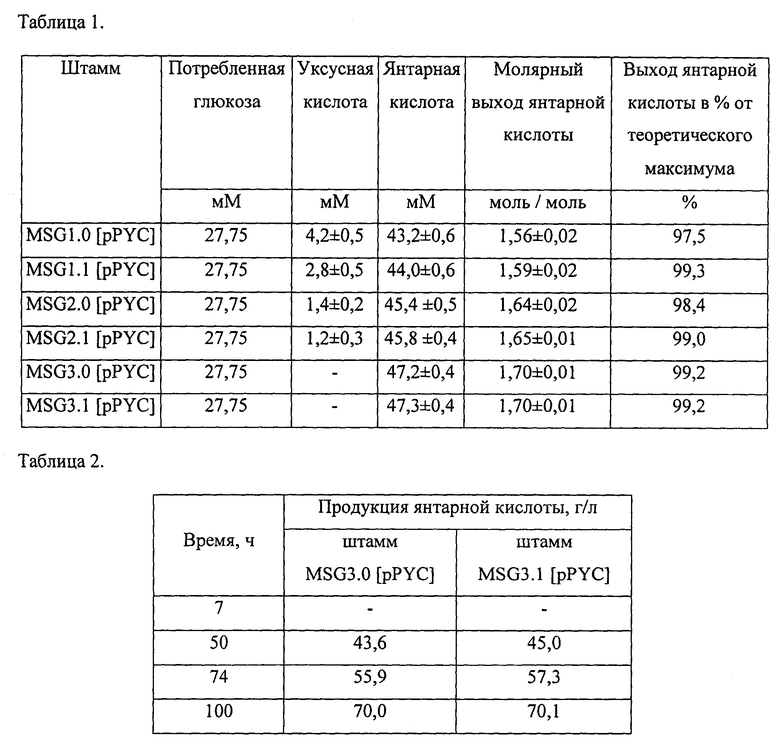
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ФУМАРОВОЙ КИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ ФУМАРОВОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ЭТОГО ШТАММА | 2014 |
|
RU2573936C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ БАКТЕРИЙ Escherichia coli - ПРОДУЦЕНТ ЯНТАРНОЙ КИСЛОТЫ (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ ЯНТАРНОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ЭТОГО ШТАММА | 2012 |
|
RU2528056C2 |
| БАКТЕРИЯ Escherichia coli - ПРОДУЦЕНТ ЯНТАРНОЙ КИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ ЯНТАРНОЙ КИСЛОТЫ | 2010 |
|
RU2466186C2 |
| МУТАНТ БАКТЕРИИ РУБЦА РОДА Mannheimia (ВАРИАНТЫ) - ПРОДУЦЕНТ ЯНТАРНОЙ КИСЛОТЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ЯНТАРНОЙ КИСЛОТЫ | 2004 |
|
RU2376369C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЯНТАРНОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ДРОЖЖЕЙ, ПРИНАДЛЕЖАЩИХ К РОДУ Yarrowia | 2009 |
|
RU2422526C2 |
| Способ получения 2,4-дигидроксимасляной кислоты | 2011 |
|
RU2626531C2 |
| НОВЫЙ СКОНСТРУИРОВАННЫЙ МИКРООРГАНИЗМ, ПРОДУЦИРУЮЩИЙ ГОМО-ЯНТАРНУЮ КИСЛОТУ, И СПОСОБ ПОЛУЧЕНИЯ ЯНТАРНОЙ КИСЛОТЫ С ЕГО ПРИМЕНЕНИЕМ | 2007 |
|
RU2415942C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,4-ДИГИДРОКСИБУТИРАТА | 2013 |
|
RU2645260C2 |
| РЕКОМБИНАНТНЫЙ МИКРООРГАНИЗМ ДЛЯ УЛУЧШЕННОГО ПОЛУЧЕНИЯ ХИМИЧЕСКИХ ВЕЩЕСТВ ТОНКОГО ОРГАНИЧЕСКОГО СИНТЕЗА | 2014 |
|
RU2712510C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ ESCHERICHIA COLI-ПРОДУЦЕНТ L-ТРЕОНИНА | 2013 |
|
RU2546237C1 |



























































Предложены варианты бактерий Escherichia coli, являющихся продуцентами янтарной кислоты. Бактерия Escherichia coli модифицирована таким образом, что гены асkА, pta, рохВ, ldhA, adhE, ptsG в ней инактивированы, экспрессия генов galP и glk усилена, и бактерия обладающий активностью пируват карбоксилазы. Также предложен вариант бактерии Escherichia coli, обладающий инактивированными генами ackA, pta, poxB, ldhA, adhE, ptsG, iclR, усиленной экспрессией генов galP и glk, и активностью пируват карбоксилазы. Также предложен вариант бактерии Escherichia coli, обладающий инактивированными генами ackA, pta, рохВ, ldhA, adhE, ptsG, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и активностью пируват карбоксилазы. Также предложен вариант бактерии Escherichia coli, обладающий инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, iclR, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и активностью пируват карбоксилазы. Также предложен вариант бактерии Escherichia coli, обладающий инактивированными генами асkА, pta, рохВ, IdhA, adhE, ptsG, pflB, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и активностью пируват карбоксилазы. Также предложен вариант бактерии Escherichia coli, обладающий инактивированными генами асkА, pta, рохВ, ldhA, adhE, ptsG, pflB, iclR, усиленной экспрессией генов galP и glk, усиленной экспрессией генов асеЕ, aceF и lpdA, и активностью пируват карбоксилазы. Предложен способ получения янтарной кислоты с использованием указанных вариантов. Группа изобретений обеспечивает увеличение выхода янтарной кислоты. 7 н. и 12 з.п. ф-лы, 2 табл., 2 пр.
1. Бактерия Escherichia coli - продуцент янтарной кислоты, модифицированная таким образом, что гены ackА, pta, рохВ, ldhA, adhE, ptsG в ней инактивированы, экспрессия генов galP и glk усилена, и бактерия обладает активностью пируват карбоксилазы.
2. Бактерия по п. 1, отличающаяся тем, что активность пируват карбоксилазы обеспечивается за счет введения в бактерию молекулы ДНК, содержащей ген, кодирующий фермент, обладающий активностью, классифицируемой как К.Ф. 6.4.1.1.
3. Бактерия по п. 1, отличающаяся тем, что экспрессия генов galP и glk усилена за счет замены в хромосоме бактерии нуклеотидных последовательностей природных промоторов, контролирующих экспрессию генов galP и glk, на более сильные промоторы.
4. Бактерия Escherichia coli - продуцент янтарной кислоты, модифицированная таким образом, что гены ackA, pta, poxB, IdhA, adhE, ptsG, iclR в ней инактивированы, экспрессия генов galP и glk усилена, и бактерия обладает активностью пируват карбоксилазы.
5. Бактерия по п. 4, отличающаяся тем, что активность пируват карбоксилазы обеспечивается за счет введения в бактерию молекулы ДНК, содержащей ген, кодирующий фермент, обладающий активностью, классифицируемой как К.Ф. 6.4.1.1.
6. Бактерия по п. 4, отличающаяся тем, что экспрессия генов galP и glk усилена за счет замены в хромосоме бактерии нуклеотидных последовательностей природных промоторов, контролирующих экспрессию генов galP и glk, на более сильные промоторы.
7. Бактерия Escherichia coli - продуцент янтарной кислоты, модифицированная таким образом, что гены аскА, pta, рохВ, ldhA, adhE, ptsG в ней инактивированы, экспрессия генов galP и glk усилена, экспрессия генов асеЕ, aceF и lpdA усилена, и бактерия обладает активностью пируват карбоксилазы.
8. Бактерия по п. 7, отличающаяся тем, что активность пируват карбоксилазы обеспечивается за счет введения в бактерию молекулы ДНК, содержащей ген, кодирующий фермент, обладающий активностью, классифицируемой как К.Ф. 6.4.1.1.
9. Бактерия по п. 7, отличающаяся тем, что экспрессия генов galP и glk, а также генов асеЕ, aceF и lpdA усилена за счет замены в хромосоме бактерии нуклеотидных последовательностей природных промоторов, контролирующих экспрессию генов galP и glk, а также генов оперона aceEF-lpdA, на более сильные промоторы.
10. Бактерия Escherichia coli - продуцент янтарной кислоты, модифицированная таким образом, что гены ackA, pta, poxB, ldhA, adhE, ptsG, iclR в ней инактивированы, экспрессия генов galP и glk усилена, экспрессия генов асеЕ, aceF и lpdA усилена, и бактерия обладает активностью пируват карбоксилазы.
11. Бактерия по п. 10, отличающаяся тем, что активность пируват карбоксилазы обеспечивается за счет введения в клетки бактерии молекулы ДНК, содержащей ген, кодирующий фермент, обладающий активностью, классифицируемой как К.Ф. 6.4.1.1.
12. Бактерия по п. 10, отличающаяся тем, что экспрессия генов galP и glk, а также генов асеЕ, aceF и lpdA усилена за счет замены в хромосоме бактерии нуклеотидных последовательностей природных промоторов, контролирующих экспрессию генов galP и glk, а также генов оперона aceEF-lpdA, на более сильные промоторы.
13. Бактерия Escherichia coli - продуцент янтарной кислоты, модифицированная таким образом, что гены ackA, pta, poxB, ldhA, adhE, ptsG, pflB в ней инактивированы, экспрессия генов galP и glk усилена, экспрессия генов асеЕ, aceF и lpdA усилена, и бактерия обладает активностью пируват карбоксилазы.
14. Бактерия по п. 13, отличающаяся тем, что активность пируват карбоксилазы обеспечивается за счет введения в бактерию молекулы ДНК, содержащей ген, кодирующий фермент, обладающий активностью, классифицируемой как К.Ф. 6.4.1.1.
15. Бактерия по п. 13, отличающаяся тем, что экспрессия генов galP и glk, а также генов асеЕ, aceF и lpdA усилена за счет замены в хромосоме бактерии нуклеотидных последовательностей природных промоторов, контролирующих экспрессию генов galP и glk, а также генов оперона aceEF-lpdA, на более сильные промоторы.
16. Бактерия Escherichia coli - продуцент янтарной кислоты, модифицированная таким образом, что гены ackА, pta, рохВ, ldhA, adhE, ptsG, pflB, iclR в ней инактивированы, экспрессия генов galP и glk усилена, экспрессия генов асеЕ, aceF и lpdA усилена, и бактерия обладает активностью пируват карбоксилазы.
17. Бактерия по п. 16, отличающаяся тем, что активность пируват карбоксилазы обеспечивается за счет введения в бактерию молекулы ДНК, содержащей ген, кодирующий фермент, обладающий активностью, классифицируемой как К.Ф. 6.4.1.1.
18. Бактерия по п. 16, отличающаяся тем, что экспрессия генов galP и glk, а также генов асеЕ, aceF и lpdA усилена за счет замены в хромосоме бактерии нуклеотидных последовательностей природных промоторов, контролирующих экспрессию генов galP и glk, а также генов оперона aceEF-lpdA, на более сильные промоторы.
19. Способ получения янтарной кислоты путем культивирования бактерии по п. 1, или 4, или 7, или 10, или 13, или 16 в питательной среде и выделения янтарной кислоты из культуральной жидкости.
| РЕКОМБИНАНТНЫЙ ШТАММ БАКТЕРИЙ Escherichia coli - ПРОДУЦЕНТ ЯНТАРНОЙ КИСЛОТЫ (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ ЯНТАРНОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ЭТОГО ШТАММА | 2012 |
|
RU2528056C2 |
| LIN H | |||
| ET AL | |||
| Metabolic engineering of aerobic succinate production systems in Escherichia coli to improve process productivity and achieve the maximum theoretical succinate yield // Metabolic Engineering, 2005, 7 pp | |||
| Способ получения бензидиновых оснований | 1921 |
|
SU116A1 |
| LU J | |||
| ET AL | |||
| Combinatorial modulation of galP and glk gene expression for improved alternative glucose utilization | |||
| // Appl Microbiol Biotechnol | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2016-11-20—Публикация
2015-07-02—Подача